Настоящая заявка испрашивает приоритет согласно дате подачи заявки на патент США №12/421144, поданной 9 апреля 2009 г.и озаглавленной "Способы и композиции, содержащие клонидин, предназначенные для лечения послеоперационных болей", и предварительной заявки США №61/046277, поданной 18 апреля 2008 г.и озаглавленной "Способы и композиции, содержащие клонидин, предназначенные для лечения послеоперационных болей", которые включены в настоящее описание посредством ссылки.
Область изобретения
Облегчение боли является первостепенной задачей при лечении пациентов, перенесших операции. Надлежащее облегчение боли приносит пациенту значительную пользу с точки зрения физиологии и психологии. Эффективное облегчение боли приводит не только к более мягкому и спокойному течению послеоперационного периода (например, улучшению настроения, сна, качества жизни и др.) и более ранней выписке из медицинских/хирургических/амбулаторных учреждений; оно также может замедлять развитие хронических болевых синдромов (например, фибромиалгии, миалгии и др.).
Боль обладает биологической функцией. Она часто сигнализирует о наличии повреждения или заболевания в организме и часто сопровождается воспалением (покраснением, припухлостью и/или жжением). В случае послеоперационной боли последняя может быть результатом операции или другого воздействия, как например, в случае терапии острых болей, возникших в результате ожогов или нехирургических травм. Целью терапии послеоперационной боли является ослабление или устранение боли и дискомфорта с применением лекарственных средств, вызывающих минимум побочных эффектов или не вызывающих таковых.
Сила послеоперационной боли, которой может страдать пациент, в значительной степени определяется тем, какая часть организма подверглась операции. Операции на грудной клетке и верхнем отделе брюшной полости обычно вызывают более сильные боли, чем операции на нижнем отделе брюшной полости, которые в свою очередь вызывают более сильные боли, чем периферические операции на конечностях. Тем не менее любую операцию, затрагивающую полости организма, поверхности крупных суставов, позвоночный столб или глубокие ткани, следует рассматривать как причиняющую боль. В частности, операции на грудной клетке и верхнем отделе брюшной полости могут вызвать сильные изменения легочной функции, повышение мышечного тонуса брюшной полости и связанное с ним снижение функции диафрагмы. Результатом является неспособность к отхаркиванию и отделению секретов, что может привести к коллапсу легких и пневмонии. Длительная боль может снижать физическую активность и приводить к венозному стазу и повышению риска тромбоза глубоких вен и последующей легочной эмболии. Кроме того, возможно проявление сильных воздействий на сократительную способность кишечного и мочевого тракта, что в свою очередь может привести к послеоперационной непроходимости кишечника, тошноте, рвоте и задержке мочи. Данные проблемы неприятны для пациента и могут увеличить срок пребывания в стационаре. Многие пациенты, испытывающие умеренные и сильные послеоперационные, посттравматические и послеожоговые боли, часто нуждаются в обезболивании по меньшей мере в течение первых 3 суток после травмы или операции.
Одним из известных классов лекарственных средств для лечения послеоперационных болей являются опиоиды. Хорошо известно, что данный класс соединений принадлежит к числу препаратов, наиболее эффективных для снятия послеоперационных болей. К сожалению, поскольку опиоиды применяют систематически, связанные с этим побочные эффекты вызывают существенные последствия, в том числе потерю пациентом дееспособности, угнетение дыхательной системы, запор и психоактивные эффекты, например, седативный эффект и эйфорию, что создает препятствия для выздоровления и восстановления подвижности. Кроме того, вследствие побочных эффектов врачи обычно ограничивают применение опиоидов первыми 24 сутками после операции. Поэтому предпочтительным является использование ненаркотических препаратов, обеспечивающих прямое локализованное снятие боли в месте проведения операции.
Одним из лекарственных средств, известных специалистам в области медицины, является клонидин, широко известный как антигипертензивное средство, действующее в качестве агониста альфа-2-адренергических рецепторов и агониста нервных рецепторов. В общем случае клонидин, также известный как 2,6-дихлор-N-2-имидазолидинилиденбензоламин (С9H9Сl2N3), может быть представлен следующей химической структурной формулой:
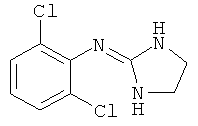
Однако до сегодняшнего дня в качестве эффективного средства против болей, в том числе послеоперационных болей или воспалений, он широко не рассматривался. Поэтому существует потребность в разработке эффективных составов на основе данного соединения для применения в данной области.
Краткое описание изобретения
Предложены новые способы и композиции для эффективной профилактики, лечения или ослабления послеоперационных болей или воспалений. В различных вариантах осуществления предложены композиции и способы, обладающие долговременными анальгетическим и противовоспалительным эффектами в течение по меньшей мере 3 суток после применения депо одного или нескольких лекарственных средств. Предложены новые композиции и способы, способные обеспечить легкую возможность аккуратной и точной имплантации депо лекарственного средства, содержащего антигипертензивное средство, при минимальных физических и психологических травмах для пациента. Депо лекарственного средства может быть легко доставлено к целевому участку тканей (например, в брюшную полость, синовиальное соединение, в позвоночный столб или в его область и др.) и может обеспечить облегчение и/или устранение боли в течение по меньшей мере 3-10 суток. Таким образом может быть осуществлена аккуратная и точная имплантация лекарственной формы при минимальной инвазивности процедуры.
В одном примере варианта осуществления изобретения предложено имплантируемое депо лекарственного средства, пригодное для ослабления, профилактики или лечения послеоперационных болей или воспалений у пациента, нуждающегося в подобном лечении. Имплантируемое депо лекарственного средства содержит терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли и полимер. Депо лекарственного средства имплантируют в участок под кожей с целью ослабления, профилактики или лечения послеоперационных болей. Депо лекарственного средства способно к высвобождению:
1) примерно от 5% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, в течение первого периода, составляющего до 48 часов, до 24 часов или примерно от 24 до 48 часов; 2) примерно от 55% примерно до 95% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, в течение последующего периода, составляющего по меньшей мере 3 суток, по меньшей мере 7 суток, от 3 до 30 суток или от 3 до 10 суток. Полимер содержит один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание. Полимер может быть биоразлагаемым. В различных вариантах осуществления, если первый период составляет до 24 ч или примерно 24-48 часов, депо лекарственного средства способно к высвобождению примерно от 5% примерно до 30% клонидина или его фармацевтически приемлемой соли.
В другом примерном варианте осуществления предложен способ изготовления имплантируемого депо лекарственного средства. Способ включает в себя смешение биосовместимого полимера с терапевтически эффективным количеством клонидина или его фармацевтически приемлемой соли и изготовление имплантируемого депо лекарственного средства из смеси.
В еще одном примерном варианте осуществления предложен способ лечения, профилактики или ослабления послеоперационных болей у пациента, нуждающегося в подобном лечении. Способ включает доставку одного или нескольких биоразлагаемых депо лекарственного средства, содержащих терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли, в целевой участок тканей подкожно до, во время или после операции, причем депо лекарственного средства способно к высвобождению в участок под кожей начальной болюсной дозы эффективного количества клонидина или его фармацевтически приемлемой соли с последующим замедленным высвобождением дозы эффективного количества клонидина или его фармацевтически приемлемой соли за период по меньшей мере 3 суток, по меньшей мере 7 суток, от 3 до 30 суток, от 3 до 10 суток или от 5 до 7 суток. Депо лекарственного средства может содержать полимер; при этом полимер может содержать один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, сложный полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание. Депо лекарственного средства способно к высвобождению примерно от 40 до 90% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, за период замедленного высвобождения, составляющий от 3 до 10 суток после применения депо лекарственного средства на целевом участке тканей. Начальная болюсная доза клонидина может составлять примерно от 15% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина, содержащемуся в депо лекарственного средства.
В другом примере варианта осуществления предложено имплантируемое депо лекарственного средства. Имплантируемая форма депо лекарственного средства содержит 1) терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли; 2) полимер. Депо лекарственного средства способно к высвобождению в участок под кожей начальной болюсной дозы клонидина или его фармацевтически приемлемой соли; депо лекарственного средства также способно к замедленному высвобождению дозы эффективного количества клонидина или его фармацевтически приемлемой соли за последующий период, составляющий от 3 до 30 суток, от 3 до 10 суток или от 7 до 10 суток. Депо лекарственного средства способно к высвобождению примерно от 55 до 85% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, за период замедленного высвобождения, составляющий от 3 до 30 суток, от 3 до 10 суток или от 7 до 10 суток после применения депо лекарственного средства. Полимер содержит один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание. Начальная болюсная доза клонидина может составлять примерно от 15% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина, помещенному в депо лекарственного средства.
В различных вариантах осуществления клонидин может иметь форму соли. Одним из примеров соли является хлористоводородная соль. В различных вариантах осуществления клонидин может иметь форму основания. Кроме того, клонидин или его фармацевтически приемлемая соль могут быть капсулированы во множество емкостей, в том числе в микрочастицы, микросферы, микрокапсулы и/или микроволокна, которые могут быть суспендированы в геле. Депо лекарственного средства может иметь форму лентообразной полоски. Депо лекарственного средства также может представлять собой состав в виде геля.
В различных вариантах осуществления полимер может составлять примерно от 60% примерно до 90% от общей массы депо лекарственного средстваы. Полимер является способным к деструкции или деструктирует в течение 30 суток или менее после имплантации лекарственной формы в участок ткани. В различных вариантах осуществления полимер может содержать сополимер молочной и гликолевой кислот;
сополимер молочной и гликолевой кислот содержит смесь полигликолида и полилактида. Смесь содержит больше полилактида, чем полигликолида.
В различных вариантах осуществления депо лекарственного средства может содержать рентгенографический маркер, способный содействовать диагностической визуализации. Рентгенографический маркер может содержать барий, висмут, вольфрам, тантал, йод, фосфат кальция и/или металлические шарики.
В различных вариантах осуществления депо лекарственного средства может содержать по меньшей мере одно дополнительное противовоспалительное или анальгетическое средство, по меньшей мере один анаболический или антикатаболический фактор роста или их сочетание.
Депо лекарственного средства способно к высвобождению от 0,05 микрограммов (мкг) до 3 миллиграммов (мг) клонидина или его фармацевтически приемлемой соли в сутки с целью ослабления послеоперационных болей.
Целевой участок тканей включает в себя по меньшей мере один из следующих органов: мышцу, связку, сухожилие, хрящ, позвоночный диск, межпозвоночное пространство в области корешка спинномозгового нерва, фасет или синовиальное соединение либо спинномозговой канал.
Боль может быть связанной с хирургической ампутацией, геринопластикой, ортопедической или спинальной операцией или их сочетанием. Операция может представлять собой артроскопическую операцию, иссечение массы, геринопластику, спинную фузию, торакальную, цервикальную или люмбальную операцию, ампутацию, операцию на органах таза или их сочетание.
Одно или несколько депо лекарственного средства согласно настоящему изобретению могут быть использованы для лечения состояний боли и/или воспаления в хронической форме, в том числе ревматоидного артрита, остеоартрита, ишиаса, синдрома запястного канала, боли внизу спины, болей нижних конечностей, болей верхних конечностей, болей, связанных с ампутацией и часто называемых "фантомными болями", рака, болей в тканях и болей, связанных с травмами или восстановлением цервикальных, торакальных и/или люмбальных позвонков или межпозвоночных дисков, мышц плечевого пояса, суставных сочленений, височно-нижнечелюстного сустава (TMJ), сухожилий, связок, мышц и т.д.
Дополнительные признаки и преимущества различных вариантов осуществления частично раскрываются в нижеследующем описании, частично явно следуют из него, либо могут быть изучены при реализации различных вариантов осуществления на практике. Цели и другие преимущества различных вариантов осуществления реализуются и достигаются при помощи элементов и сочетаний, которым в описании и прилагаемой формуле изобретения уделяется особое внимание.
Краткое описание фигур
Другие аспекты, признаки, выгоды и преимущества вариантов осуществления становятся ясными исходя из следующих далее описания, прилагаемой формулы изобретения и прилагаемых чертежей, на которых:
- на Фиг.1 показаны некоторые типичные для проведения операций области организма пациента, и области организма, где может применяться депо лекарственного средства, содержащее антигипертензивное средство или клонидин;
- на Фиг.2 показан схематический вид сзади позвоночного столба и областей организма, где может применяться депо лекарственного средства, содержащее антигипертензивное средство или клонидин;
- на Фиг.3 показан график, представляющий собой результат исследований среднего кумулятивного высвобождения в мкг клонидина клонидиновых имплантатов в виде полосок, описанных в Примере 1;
- на Фиг.4 показан график, представляющий собой результат исследований среднего процентного кумулятивного высвобождения клонидина клонидиновых имплантатов в виде полосок, описанных в Примере 1;
- на Фиг.5 показан график изменения порога термического отдергивания лап в граммах на сутки после операции для клонидиновых имплантатов из Примера 1;
- на Фиг.6 показан график изменения среднего процентного кумулятивного высвобождения клонидина для нескольких облученных имплантатов в виде полосок или лент на основе клонидина-НСl из Примера 2 в течение 1-8 суток;
- на Фиг.7 показан график изменения среднесуточного высвобождения клонидина рассчитанного в микрограммах в течение 1-8 суток для имплантатов в виде полосок или лент на основе клонидина-НСl из Примера 2;
- на Фиг.8 показан график изменения среднего процентного кумулятивного высвобождения клонидина для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.6;
- на Фиг.9 показан график изменения среднесуточного высвобождения клонидина в микрограммах в течение 1-8 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.8;
- на Фиг.10 показан график изменения среднего процентного кумулятивного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.6;
- на Фиг.11 показан график изменения среднесуточного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.10;
- на Фиг.12 показан график изменения среднего процентного кумулятивного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.6;
- на Фиг.13 показан график изменения среднесуточного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.12;
- на Фиг.14 показан график изменения профиля среднего кумулятивного высвобождения in vitro из клонидиновых имплантатов в виде полосок из исследования, приведенного в Примере 3;
- на Фиг.15 показан профиль среднего кумулятивного высвобождения in vitro из клонидиновых имплантатов в виде полосок из исследования, приведенного в Примере 4;
- на Фиг.16 показан график изменения процентного кумулятивного высвобождения клонидина для трех клонидиновых имплантатов в виде полосок из исследования, приведенного в Примере 5;
- на Фиг.17 показан график изменения среднего процентного кумулятивного высвобождения клонидина для полосовых клонидиновых имплантатов, показанных на Фиг.16;
- на Фиг.18 показан график изменения кумулятивного высвобождения клонидина in vitro в мкг для трех клонидиновых имплантатов в виде полосок из Примера 5;
- на Фиг.19 показан график изменения среднего кумулятивного высвобождения клонидина in vitro в мкг для клонидиновых имплантатов в виде полосок, показанных на Фиг.18;
- на Фиг.20 показан график изменения показателя болевых ощущений для клонидиновых депо, имплантированных после операции в месте хирургического надреза.
Следует заметить, что фигуры выполнены без соблюдения масштаба. Кроме того, соотношение размеров объектов на одной фигуре может быть приведено не в масштабе; на практике отношение размеров может быть обратным. Фигуры приведены для лучшего понимания и пояснения конструкции каждого показанного объекта, вследствие чего некоторые признаки с целью иллюстрации особого признака структуры могут быть преувеличены.
Подробное описание изобретения
В настоящем описании и прилагаемой формуле изобретения, если не указано иное, все числа, выражающие количества ингредиентов, процентные или обычные доли материалов и условия реакций, и другие численные значения, использованные в описании и формуле, во всех случаях следует рассматривать как дополненные термином "примерно". Соответственно, если не указано противоположное, численные параметры, приведенные в нижеследующем описании и прилагаемой формуле изобретения, являются приближенными значениями, которые могут изменяться в зависимости от требуемых свойств, которых ставится целью достичь в настоящем изобретении. По крайней мере, и не в качестве попытки ограничить применение доктрины эквивалентов к объему формулы изобретения, каждый численный параметр следует истолковывать по меньшей мере с учетом количества приведенных значащих цифр и с применением обычных методов округления.
Несмотря на то, что численные интервалы и параметры, приведенные в настоящем изобретении, в общем случае являются приближенными, численные значения, приведенные в конкретных примерах, являются насколько возможно точными. Однако любое численное значение по своей природе содержит некоторые ошибки, необходимо следующие из стандартного отклонения, сопутствующего соответствующим методикам измерений. Кроме того, следует понимать, что все интервалы, упомянутые в настоящем описании, охватывают все подинтервалы, включенные в них. Например, интервал "от 1 до 10" включает в себя все подинтервалы между минимальным значением, равным 1, и максимальным значением, равным 10 (и включая упомянутые значения), то есть все подинтервалы с минимальным значением, большим или равным 1, и максимальным значением, меньшим или равным 10, например, от 5,5 до 10.
Следует отметить, что, согласно использованному в настоящем описании и приложенной формуле, единственное число имен существительных охватывает их множественное число, если ясно и недвусмысленно не используется только единственное число. Так, например, упоминание "лекарственной формы" охватывает одну, две, три или более лекарственных форм.
Далее приводится детальное описание некоторых вариантов осуществления настоящего изобретения, примеры которых проиллюстрированы на прилагаемых чертежах. Хотя настоящее изобретение описывается в соответствии с проиллюстрированными вариантами осуществления, следует понимать, что это не ограничивает настоящее изобретения упомянутыми вариантами осуществления. Напротив, подразумевается, что настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения в том виде, в каком он определен прилагаемой формулой.
Подразумевается, что разделы, следующие далее, никоим образом не ограничивают настоящее описание; варианты осуществления, описанные в любом абзаце, могут быть использованы в сочетании с вариантами осуществления, описанными в любом другом абзаце.
Предложены новые композиции и способы, эффективно предупреждающие, лечащие или ослабляющие послеоперационные боли или воспаления. В различных вариантах осуществления предложены композиции и способы, обладающие долговременными анальгетическим и противовоспалительным действием в течение по меньшей мере 3 суток после применения одной или нескольких лекарственных форм.
Предложены новые композиции и способы, легко позволяющие обеспечить возможность аккуратной и точной имплантации лекарственной формы, содержащей клонидин, при минимальных физических и психологических травмах для пациента. Депо лекарственного средства может быть легко доставлено к целевому участку тканей (например, в брюшную полость, синовиальное соединение, позвоночный столб или в его область и т.д.) и облегчает и/или лечит боль в течение по меньшей мере 3-10 суток. Подобным путем может быть осуществлена аккуратная и точная имплантация лекарственной формы при минимальной инвазивности процедуры, а также непосредственно при операции.
Клонидин
В депо лекарственного средства может содержаться клонидин. Депо лекарственного средства имеет физическую конструкцию, облегчающую имплантацию в нужный участок тканей (например, в синовиальное соединение, дисковое пространство, спинномозговой канал, область брюшины, ткань пациента и т.д.) и удерживание в нем. Депо лекарственного средства также содержит лекарственное средство. Термин "лекарственное средство" используемое в настоящем описании, в общем случае означает любое вещество, влияющее на физиологию пациента. Термин "лекарственное средство" в настоящем описании является взаимозаменяемым по отношению к терминам "терапевтический агент", "терапевтически эффективное количество" и "активный фармацевтический ингредиент" или "API". Следует понимать, что состав "лекарственного средства" может включать в себя более одного терапевтического агента, причем примерные сочетания терапевтических агентов включают в себя сочетание двух или более лекарственных средств. Депо лекарственного средства обеспечивает высвобождение терапевтического агента на целевом участке с градиентом концентрации. В различных вариантах осуществления депо лекарственного средства обеспечивает оптимальный градиент концентрации терапевтического агента на расстоянии примерно до 1 см - примерно до 10 см от места имплантации.
"Терапевтически эффективное количество" или "эффективное количество" представляет собой такое количество, которое при введении лекарственного средства приводит к изменению биологической активности, в том числе, например, подавлению воспаления, ослаблению или облегчению боли, улучшению состояния и т.д. В различных вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 0,1 мкг/сут до 100 мг/сут. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 30 мкг до 1 мг клонидина в сутки. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 30 мкг до 2,4 мг клонидина в сутки. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 0,1 мг до 0,3 мг клонидина в сутки. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет 0,1 мкг, 0,2 мкг, 0,3 мкг, 0,4 мкг, 0,5 мкг, 0,6 мкг, 0,7 мкг, 0,8 мкг, 0,9 мкг, 1 мкг, 10 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг, 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 30 мг, 35 мг или 40 мг (и все интервалы и подинтервалы между ними) клонидина в сутки. В одном из вариантов осуществления дозировка для человека составляет от 0,1 мг до 0,3 мг клонидина в сутки. Следует понимать, что дозировка, применяемая к пациенту, может содержаться как в одном, так и в нескольких депо лекарственного средства в зависимости от многих факторов, в том числе фармакокинетических свойств применяемого лекарственного средства, пути применения, состояния и свойств пациента (пола, возраста, массы тела, здоровья, комплекции и т.д.), степени проявления симптомов, сопутствующей терапии, частоты лечения и требуемого эффекта. Например, при проведении сопутствующей терапии опиоидом (например, морфином) могут оказаться необходимыми более низкие суточные дозы клонидина; в другом случае для контроля над послеоперационными болями при снижении или прекращении применения опиоида (например, морфина) пациенту могут потребоваться более высокие дозы клонидина.
В различных вариантах осуществления терапевтически эффективное количество клонидина применяется для подавления, ослабления, лечения и/или профилактики послеоперационных болей или воспалений. В общем случае химическое название клонидина представляет собой 2,6-дихлор-N-имидазолидинилиденбензоламин (С9Н9Сl2N3). Клонидин обладает молекулярной массой 230,09 и имеет следующую общую структурную формулу:

Если иное не указано или не следует из контекста, в случае упоминания клонидина в описании и в следующей далее формуле изобретения следует понимать, что авторами изобретения также имеются в виду его фармацевтически приемлемые соли. Одной из хорошо известных коммерчески доступных солей клонидина является его хлористоводородная соль. Некоторые другие примеры потенциальных фармацевтически приемлемых солей включают в себя соли солеобразующих кислот и оснований, существенно не уменьшающих токсичность соединения, в том числе соли щелочных металлов, в том числе магния, калия и аммония, соли неорганических кислот, в том числе йодистоводородной, бромистоводородной, фосфорной, метафосфорной, азотной и серной кислот, а также соли органических кислот, в том числе винной, уксусной, лимонной, яблочной, бензойной, гликолевой, глюконовой, гулоновой, янтарной кислот, арилсульфоновых кислот, например, n-толуолсульфокислоты, и т.п.
Кроме того, в случае упоминания клонидина активный ингредиент может быть представлен не только в форме соли, но и в форме основания (например, свободного основания). В различных вариантах осуществления, если клонидин имеет форму основания, он может быть смешан с полимерами в условиях, при которых не происходит сильной деструкции полимера, способной иметь место при термической переработке ПМГК или ПМК или их переработке из раствора. В качестве примера, не являющегося ограничительным, следует указать, что при составлении клонидина с полиортоэфирами желательным является использование клонидина в виде основания. Напротив, при составлении смесей клонидина с ПМГК может оказаться желательным применение формы в виде соли с НСl. В различных вариантах осуществления клонидин может представлять собой сочетание соли и основания.
В дополнение к клонидину депо лекарственного средства может содержать один или несколько дополнительных терапевтических агентов. Примеры терапевтических агентов включают в себя агенты, являющиеся модуляторами провоспалительных цитокинов, в том числе TNF-α и ИЛ-1, прямого или местного действия, в том числе растворимые рецепторы фактора некроза опухолей α, все пегилированные растворимые рецепторы фактора некроза опухолей α, моноклональные или поликлональные антитела или фрагменты антител либо их сочетания, но не ограничиваясь таковыми. Примеры пригодных терапевтических агентов включают в себя антагонисты рецепторов, молекулы, сочетающиеся с рецепторами для связывания с целевой молекулой, антисмысловые полинуклеотиды и ингибиторы транскрипции ДНК, кодирующей целевой белок. Примеры пригодных агентов включают в себя адалимумаб, инфликсимаб, этанерцепт, пегсунерцепт (PEG sTNF-R1), sTNF-R1, CDP-870, CDP-571, CNI-1493, RDP58, ISIS 104838, 1→3-β-D-глюканы, ленерцепт, PEG-sTNFRII Fc-мутеин, D2E7, афелимомаб и их сочетания, но не ограничиваются таковыми. В других вариантах осуществления терапевтические агенты включает в себя ингибиторы металлопротеазы, антагонисты глутамата, глиальные нейротрофические факторы (GDNF), антагонисты рецептора В2, антагонисты рецепторов субстанции Р (NK-1), в том числе капсаицин и цивамид, антагонистический модулятор нажележащего регуляторного элемента (DREAM), iNOS, ингибиторы рецепторов тетродотоксин (ТТХ)-резистентных натриевых каналов подтипов PN3 и SNS2, ингибиторы интерлейкинов, в том числе ИЛ-1, ИЛ-6 и ИЛ-8, и противовоспалительные цитокины, TNF-связывающий белок, онерцепт (r-hTBP-1), рекомбинантные векторы на основе аденоассоциированного вируса (rAAV), кодирующие ингибиторы, энхансеры, потенциаторы или нейтрализаторы, антитела, в том числе, но не ограничиваясь таковыми, природные или синтетические, двухцепочечные, одноцепочечные, или их фрагменты. Например, пригодные терапевтические агенты включают в себя молекулы, основанные на одноцепочечных антителах и называемые Nanobodies™ (компания Ablynx, Гент, Бельгия), определяемые как самый малый функциональный фрагмент природных однодоменных антител. В другом варианте осуществления терапевтические агенты включают в себя агенты, воздействующие на киназы и/или ингибирующие клеточные сигнальные митоген-активируемые протеинкиназы (МАРК), р38 МАРК, Src или протеинтирозинкиназу (РТК). Терапевтические агенты включают в себя ингибиторы киназ, в том числе, например, гливек, герцептин, иресса, иматиниб (STI571), гербимицин А, тирфостин 47, эрбстатин, генистеин, ставроспорин, PD98059, SB203580, CNI-1493, VX-50/702 (компании Vertex/Kissei), SB203580, BIRB 796 (компания Boehringer Ingelheim), ингибитор Р38 МАР-киназы Glaxo, RWJ67657 (компания J&J), U0126, Gd, SCIO-469 (компания Scios), R03201195 (компания Roche), Семипимод (компания Cytokine PharmaSciences) или их производные.
В различных вариантах осуществления терапевтические агенты блокируют транскрипцию или трансляцию TNF-α или других белков воспалительного каскада. Пригодные терапевтические агенты включают в себя антагонисты интегрина, антагонисты альфа-4-бета-7-интегрина, ингибиторы клеточной адгезии, антагонисты интерферона-гамма, агонисты/антагонисты CTLA4-Ig (BMS-188667), антагонисты лиганда CD40, гуманизированные моноклональные антитела к ИЛ-6 (MRA, тоцилизумаб, компания Chugai), моноклональные антитела к HMGB-1 (компания Critical Therapeutics, Inc.), антитела к ИЛ-2К (даклизумаб, базиликсимаб), АВХ (антитела к ИЛ-8), человеческий рекомбинантный ИЛ-10 или HuMax IL-15 (антитела к ИЛ-15), но не ограничиваются таковыми.
Другие пригодные терапевтические агенты включают в себя ингибиторы ИЛ-1, в том числе Кинерет® (анакинра), представляющий собой рекомбинантную, не подвергнутую гликозилированию форму человеческого антагониста рецептора интерлейкина-1 (ИЛ-1 Ra) либо AMG 108, представляющий собой моноклональное антитело, блокирующее действие ИЛ-1. Терапевтические агенты также включают в себя возбуждающие аминокислоты, в том числе глутамат и аспартат, антагонисты ингибиторов связывания глутамата с NDMA-рецепторами, АМРА-рецепторами и/или каинатными рецепторами. В качестве терапевтических агентов для ослабления воспаления также могут быть полезны, например, антагонисты рецептора интерлейкина-1, талидомид (ингибитор секреции TNF-α), аналоги талидомида (снижающие продуцирование TNF-α макрофагами), костный морфогенетический белок (BMP) типа 2 и ВМР-4 (ингибиторы каспазы 8, активаторы TNF-α), кинаприл (ингибитор ангиотензина II, активирующий TNF-α), интерфероны, в том числе ИЛ-11 (модулирующий экспрессию рецептора TNF-α) и ауринтрикарбоновая кислота (ингибирующая TNF-α). Подразумевается, что при необходимости могут быть использованы пегилированные формы упомянутых агентов. Примеры других терапевтических агентов включают в себя ингибиторы NF-каппа-В, в том числе глюкокортикоиды, клонидин, антиоксиданты, в том числе дитиокарбаматы, и другие соединения, в том числе, например, сульфасалазин.
Конкретные примеры пригодных для применения терапевтических агентов включают в себя противовоспалительные агенты, анальгетические агенты, остеоиднуктивный фактор роста или их сочетание, но не ограничиваются таковыми. Противовоспалительные агенты включают в себя салицилаты, дифлунизал, сульфасалазин, индометацин, ибупрофен, напроксен, толметин, диклофенак, кетопрофен, фенаматы (мефенамовую кислоту, меклофенамовую кислоту), эноловые кислоты (пироксикам, мелоксикам), набуметон, целекоксиб, этодолак, нимесулид, апазон, золото, сулиндак или тепоксалин; антиоксиданты, в том числе дитиокарбаматы, и другие соединения, в том числе сульфасалазин (2-окси-5-[-4-[(С2-пиридиниламино)сульфонил]азо]бензойную кислоту), стероиды, в том числе флуоцинолон, кортизол, кортизон, гидрокортизон, флудрокортизон, преднизон, преднизолон, метилпреднизолон, триамцинолон, бетаметазон, дексаметазон, беклометазон, флутиказон, либо их сочетания, но не ограничиваются таковыми.
Пригодные анаболические или антикатаболические факторы роста включают в себя костный морфогенетический белок, фактор дифференциации роста, белок минерализации LIM, CDMP, прогениторные клетки или их сочетания, но не ограничиваются таковыми.
Депо лекарственного средства также может содержать дополнительные анальгетические агенты. Пригодные анальгетические агенты включают в себя ацетаминофен, бупивакаин, лидокаин, опиоидные анальгетики, в том числе бупренорфин, буторфанол, декстроморамид, дезоцин, декстропропоксифен, диаморфин, фентанил, алфентанил, суфентанил, гидрокодон, гидроморфон, кетобемидон, левометадил, мепиридин, метадон, морфин, налбуфин, опиум, оксикодон, папаверетум, пентазоцин, петидин, феноперидин, пиритрамид, декстропропоксифен, ремифентанил, тилидин, трамадол, кодеин, дигидрокодеин, мептазинол, дезоцин, эптазоцин, флупиртин или их сочетания, но не ограничиваются таковыми.
Пригодные анальгетики также включают в себя агенты, обладающие анальгетическими свойствами, в том числе, например, амитриптилин, карбамазепин, габапентин, прегабалин или их сочетание.
Депо лекарственного средства может содержать миорелаксант. Среди миорелаксантов в качестве примера и не в ограничительных целях следует назвать алкурония хлорид, атракурия безилат, баклофен, карболоний, каризопродол, хлорфенезина карбамат, хлорзоксазон, циклобензаприн, дантролен, декаметония бромид, фазадиний, галламина триэтиодид, гексафлуорений, меладразин, мефензин, метаксалон, метокарбамол, метокурина йодид, панкуроний, придинола мезилат, стирамат, суксаметоний, суксетоний, тиоколхикозид, тизанидин, толперизон, тубокурарин, векуроний или их сочетания.
Депо лекарственного средства, содержащее один или несколько терапевтических агентов, также может содержать другие неактивные ингредиенты. Подобные неактивные ингредиенты могут выполнять множество функций, в том числе носителя, стабилизатора и агента, контролирующего высвобождение терапевтического (-их) агента (-ов). Процесс замедленного высвобождения, например, может протекать по механизму растворения-диффузии либо управляться процессом, контролируемым эрозией. Депо лекарственного средства обычно представляет собой твердый или полутвердый состав, содержащий биосовместимый материал, который может быть биоразложимым. Под термином "твердый" подразумевается негелеподобный материал, тогда как под "полутвердым" подразумевается гелеподобный материал, обладающий определенной степенью текучести, что позволяет лекарственной форме изгибаться и приходить в соответствие требованиям, налагаемым окружающими тканями. Под термином "гель" подразумевается материал, являющийся мягким и способным к деформации в любой точке при применении в месте операции.
В различных вариантах осуществления материал депо лекарственного средства является стабильным внутри участка тканей в течение периода времени, близкого к запланированному периоду применения лекарственного средства (для биоразлагаемых компонентов) или превышающего таковой (для бионеразлагаемых компонентов). Например, материал лекарственной формы может обладать температурой плавления или температурой стеклования, близкой к температуре организма или превышающей ее, но меньшей температуры разложения или деструкции терапевтического агента. Однако для обеспечения возможности замедленного высвобождения содержащегося терапевтического (-их) агента (-ов) также может быть использовано предварительное задание эрозии материала лекарственной формы.
В различных вариантах осуществления депо лекарственного средства может быть выполнено таким образом, чтобы высвобождение клонидина начиналось по достижении некоторых контрольных точек (например, значений температуры, рН и др.) после имплантации in vivo. Например, депо лекарственного средства может содержать полимеры, которые высвобождают больше лекарственного средства по достижении температурой организма значения, большего, например, 102°F (38,9°C), особенно если лекарственное средство обладает жаропонижающими свойствами. В различных вариантах осуществления в зависимости от места имплантации депо лекарственного средства способно к высвобождению большего или меньшего количества лекарственного средства по достижении некоторого значения рН. Например, депо лекарственного средства может быть выполнено так, чтобы высвобождение лекарственного средства происходило при контакте депо с физиологической жидкостью, обладающей определенным значением рН (например, спинномозговой жидкости, рН которой равен примерно 7,35 - примерно 7,70, синовиальной жидкости, рН которой равен примерно 7,29 - примерно 7,45, мочи, рН которой равен примерно 4,6 - примерно 8,0, плевральных жидкостей, рН которых равен примерно 7,2 - примерно 7,4, крови, рН которой равен примерно'7,35 - примерно 7,45, и др.).
В различных вариантах осуществления депо лекарственного средства может обладать высоким содержанием лекарственного средства; при этом клонидин и/или другой терапевтический агент составляют примерно 0,5-90 мас.% лекарственной формы, или 1-50 мас.% лекарственной формы, или 1-25 мас.% лекарственной формы, или 1-10 мас.% лекарственной формы. В различных вариантах осуществления количество клонидина и/или другого терапевтического агента, присутствующих в депо лекарственного средства, лежит в интервале примерно от 0,1 мас.% примерно до 40 мас.% от массы депо (включая 0.1%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6%, 0.7%, 0.8%, 0.9%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40% и интервалы между любыми двумя из упомянутых точек, например, 0.5-5%, 5-10%, 10-20% и др.).
В различных вариантах осуществления депо лекарственного средства способно к высвобождению 0.1 мкг, 0.2 мкг, 0.3 мкг, 0.4 мкг, 0.5 мкг, 0.6 мкг, 0.7 мкг, 0.8 мкг, 0.9 мкг, 1 мкг, 10 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг, 0.1 мг, 0.2 мг, 0.3 мг, 0.4 мг, 0.5 мг, 0.6 мг, 0.7 мг, 0.8 мг, 0.9 мг, 1 мг, 1.1 мг, 1.2 мг, 1.3 мг, 1.4 мг, 1.5 мг, 1.6 мг, 1.7 мг, 1.8 мг, 1.9 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг или 50 мг клонидина в сутки за общий срок, составляющий по меньшей мере 3 суток, по меньшей мере 7 суток, по меньшей мере 8 суток, от 3 до 30 суток, от 3 до 10 суток, от 3 до 8 суток, от 5 до 7 суток или от 7 до 10 суток. В различных вариантах осуществления для ослабления, лечения или профилактики послеоперационных болей депо лекарственного средства способно к высвобождению от 0,5 до 1 мг клонидина в час за общий срок, составляющий по меньшей мере 3 суток, от 3 до 10 суток, от 5 до 7 суток или от 7 до 10 суток. В различных вариантах осуществления депо лекарственного средства высвобождает 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% клонидина за период, составляющий от 3 до 10 суток или от 5 до 7 суток после применения лекарственной формы на целевом участке тканей. Депо лекарственного средства может иметь "профиль скорости высвобождения", соответствующий процентной доле активного ингредиента, высвобождаемого за фиксированные промежутки времени, например, мг/ч, мг/сут, 10% в сутки за 10 суток и др. Специалисту в данной области техники известно, что профиль скорости высвобождения может быть, но не обязательно является линейным. В качестве примера, не являющегося ограничительным, следует указать, что депо лекарственного средства может представлять собой полоску либо лентообразные полоску или волокно, высвобождающие клонидин за некоторый период времени.
В различных вариантах осуществления депо лекарственного средства содержит примерно 1 мас.% - 10 мас.% клонидина, 75 мас.% - 94 мас.% полимера и 5 мас.% - 15 мас.% эксципиента. В качестве эксципиента или пластификатора для полимера может быть использован мПЭГ, поскольку он придает полученной композиции пластичность. В качестве эксципиента также может быть использован ПЭГ-300. Кроме того, в качестве эксципиента может быть использовано сочетание ПЭГ-300 и NMP.
Примеры эксципиентов, которые могут быть смешаны с клонидином в дополнение к биоразлагаемому полимеру, включают MgO (например, 1 мас.%), 5050 DLG 6E, 5050 DLG 1A, мПЭГ, ТВО-Ас, мПЭГ, Спан-65, Спан-85, плюроник F127, ТВО-Ас, сорбиталь, циклодекстрин, мальтодекстрин и их сочетания, но не ограничиваются таковыми. В некоторых вариантах осуществления эксципиент или эксципиенты могут составлять примерно от 0,001 мас.% примерно до 50 мас.% композиции. В некоторых вариантах осуществления эксципиент(ы) составляют примерно от 0,001 мас.% примерно до 40 мас.% композиции. В некоторых вариантах осуществления эксципиент(ы) составляют примерно от 0,001 мас.% примерно до 30 мас.% композиции. В некоторых вариантах осуществления эксципиент(ы) составляют примерно от 0,001 мас.% примерно до 20 мас.% композиции. В некоторых вариантах осуществления эксципиент(ы) составляют примерно от 0,5 мас.% примерно до 20 мас.% композиции. В некоторых вариантах осуществления эксципиент(ы) составляют примерно от 0,001 мас.% примерно до 10 мас.% композиции. В некоторых вариантах осуществления эксципиент(ы) составляют примерно от 0,001 мас.% примерно до 2 мас.% композиции.
В некоторых вариантах осуществления депо лекарственного средства может не быть биоразлагаемой. Депо лекарственного средства может содержать, например, полиуретан, полимочевину, полиэфирамид, ПЭБА, олефиновый термопластичный эластомер, сополиэфир, стирольный термопластичный эластомер, сталь, алюминий, нержавеющую сталь, титан, сплавы металлов с высоким содержанием цветных металлов и низкой относительной долей железа, углеродное волокно, стекловолокно, пластмассы, керамику и их сочетание. Обычно данные типы депо лекарственного средства могут потребовать извлечения по истечении некоторого промежутка времени.
В некоторых случаях может оказаться желательным избежать необходимости извлечения депо лекарственного средства после использования. В таких случаях депо лекарственного средства может содержать биоразлагаемый материал. Существует множество материалов, пригодных для данной цели и обладающих способностью к разрушению или разложению в течение продолжительного периода времени при помещении в целевую ткань или рядом с ней. В зависимости от химических свойств биоразлагаемого материала механизм процесса деструкции по природе может быть гидролитическим, ферментативным или смешанным. В различных вариантах осуществления деструкция может протекать либо на поверхности (гетерогенная, или поверхностная эрозия), либо равномерно по всему объему системы доставки лекарственных средств (гомогенная, или объемная эрозия).
Депо лекарственного средства может содержать полимерный или неполимерный материал, синтетический или природный материал или их сочетание. Неполимерные материалы включают в себя, например, холестерин, стигмастерин, глицерин, эстрадиол, сахарозу, дистеарат, сорбитан, сорбитана моноолеат, сорбитана монопальмитат, сорбитана тристеарат и т.п.
В различных вариантах осуществления депо лекарственного средства содержит полимер; при этом полимер подвергается деструкции in vivo за период, составляющий менее одного года, причем по меньшей мере 50% полимера претерпевает деструкцию в течение шести месяцев или менее. В некоторых вариантах осуществления полимер способен к деструкции или деструктирует за два месяца, один месяц или менее. В некоторых вариантах осуществления полимер значительно деструктирует в течение одного месяца, причем по меньшей мере 50% полимера деструктирует до нетоксичных продуктов, выводимых из организма, и причем в течение периода, составляющего две недели, высвобождается 100% лекарственного средства. Предпочтительной также является деструкция полимеров путем гидролиза и поверхностной эрозии по сравнению с объемной эрозией, так как при этом высвобождение является не только замедленным, но и линейным. Полимеры, отвечающие данным критериям, включают в себя некоторые полиангидриды, сополимеры молочной кислоты и гликолевой кислоты, массовое отношение молочной и гликолевой кислот в которых не превышает 4:1 (т.е. 80 мас.% молочной кислоты или менее и 20 мас.% гликолевой кислоты или более), и полиортоэфиры, содержащие катализатор деструкции или усиливающее деструкцию соединение, например, содержащие по меньшей мере 1 мас.% ангидридного катализатора наподобие малеинового ангидрида. Другие полимеры включают в себя белковые полимеры, в том числе желатин и фибрин, и полисахариды, в том числе гиалуроновую кислоту.
Термин "депо лекарственного средства" включает в себя капсулы, микросферы, микрочастицы, микрокапсулы, частицы микроволокна, наносферы, наночастицы, покрытия, матрицы, пластинки, пилюли, таблетки, эмульсии, липосомы, мицеллы, листы, полоски, лентообразные полоски или волокна, сетки, пасты, плитки, таблетки, гели и другие фармацевтические композиции для доставки лекарственных средств, но не ограничивается таковыми. Пригодные для изготовления лекарственной формы материалы в идеале представляют собой фармацевтически приемлемые биоразлагаемые и/или биоабсорбируемые материалы, предварительно одобренные Управлением по контролю пищевых продуктов и лекарственных средств США (FDA), или общепризнанно безопасные материалы. Подобные материалы могут быть полимерными или неполимерными, синтетическими или природными, либо представлять собой сочетание таковых.
Термин "биоразлагаемый" подразумевает, что все составные части лекарственной формы со временем подвергаются деструкции под действием ферментов, путем гидролиза и/или по другим сходным механизмам внутри организма человека. В различных вариантах осуществления термин "биоразлагаемый" подразумевает, что депо лекарственного средства (например, микрочастицы, микросферы, гель и др.) может разрушаться или деструктировать в организме до нетоксичных веществ до или с течением высвобождения терапевтического агента. Под "биоэродируемым" понимается, что депо лекарственного средства и/или гель эродирует или деструктирует с течением времени, причем эрозия или деструкция по меньшей мере частично происходит вследствие контакта с соединениями, находящимися в окружающих тканях или жидкостях, либо под действием клеток. Под "биоабсорбируемым" подразумевается, что депо лекарственного средства разрушается и поглощается в организме человека, например, клетками или тканями. Термин "биосовместимый" означает, что депо лекарственного средства не вызывает существенного повреждения или некроза тканей на целевом участке тканей.
В различных вариантах осуществления депо лекарственного средства может содержать биоабсорбируемый и/или биоразлагаемый биополимер, способный обеспечивать немедленное высвобождение, замедленное высвобождение или контролируемое высвобождение лекарственного средства. Примеры биополимеров, пригодных для применения при замедленном высвобождении, включают в себя поли(альфа-оксикислоты), сополимеры лактида с гликолидом (ПМГК, PLGA или DLG, включающие в себя сополимер лактида с гликолидом, сополимер D-лактида с гликолидом, сополимер L-лактида с гликолидом и сополимер D,L-лактида с гликолидом), полилактид (ПМК, PLA), поли(D,L-лактид), поли(D-лактид), поли(L-лактид), полигликолид (ПГ, PG), полиэтиленгликоль (ПЭГ, PEG), ПЭГ 200, ПЭГ 300, ПЭГ 400, ПЭГ 500, ПЭГ 550, ПЭГ 600, ПЭГ 700, ПЭГ 800, ПЭГ 900, ПЭГ 1000, ПЭГ 1450, ПЭГ 3350, ПЭГ 4500, ПЭГ 8000, конъюгаты поли(альфа-оксикислот), полиоксибутират, сополимер гликолида с триметиленкарбонатом, сополимер молочной кислоты с лизином, сополимеры лактида с уретанами, сополиэфирамиды, полиортоэфиры (ПОЭ, РОЕ), полиаспирины, полифосфазены, полиангидриды, поликетали, коллаген, крахмал, предварительно клейстеризированный крахмал, гиалуроновую кислоту, хитозаны, желатин, альгинаты, альбумин, фибрин, аналоги витамина Е, в том числе альфа-токоферилацетат, d-альфа-токоферилсукцинат, D-лактид, D,L-лактид, L-лактид, ε-капролактон, сополимер D,L-лактида с капролактоном (DL-CL или DLCL), сополимер D,L-лактида с гликолидом и капролактоном (DL-G-CL), поликапролактон (ПКЛ, PCL), декстраны, винилпирролидон, поливиниловый спирт (ПВС, PVA), PVA-g-PLGA (поливиниловый спирт, привитый сополимером лактид-гликолид), сополимер ПЭГТ-ПБТ (PEGT-PBT, полиактив), метакрилаты, поли(К-изопропилакриламид), блок-сополимеры ПЭО-ППО-ПЭО (РЕО-РРО-РЕО, плюроники), сополимеры ПЭО-ППО-ПАК (РЕО-РРО-РАА), ПМГК-ПЭО-ПМГК (PLGA-PEO-PLGA), ПЭГ-ПМГК (PEG-PLG), ПМК-ПМГК (PLA-PLGA), полоксамер 407, триблок-сополимеры ПЭГ-ПМГК-ПЭГ (PEG-PLGA-PEG), SAIB (ацетат-изобутират сахарозы), оксипропилцеллюлозу, оксипропилметилцеллюлозу, оксиэтилметилцеллюлозу, карбоксиметилцеллюлозу или ее соли, карбопол, полиоксиэтилметакрилат, полиметоксиэтилметакрилат, полиметоксиэтоксиэтилметакрилат, полиметилметакрилат (ПММА, РММА), метилметакрилат (ММА), желатин, поливиниловые спирты, пропиленгликоль или их сочетания, но не ограничиваются таковыми.
В различных вариантах осуществления молекулярная масса полимеров может лежать в широком ряду значений. Средняя молекулярная масса полимера может составлять примерно от 1000 примерно до 10000000, либо примерно от 1000 примерно до 1000000, либо примерно от 5000 примерно до 500000, либо примерно от 10000 примерно до 100000, либо примерно от 20000 примерно до 50000.
В некоторых вариантах осуществления полимер содержит ПМГК или ПОЭ или их сочетание. ПМГК может содержать смесь полигликолида и полилактида; в некоторых вариантах осуществления в смеси содержится больше полилактида, чем полигликолида. В некоторых вариантах осуществления мольное отношение полилактида к полигликолиду составляет от 50:50 до 100:0. В различных вариантах осуществления полимер содержит 100% полилактида и 0% полигликолида; 95% полилактида и 5% полигликолида; 90% полилактида и 10% полигликолида; 85% полилактида и 15% полигликолида; 80% полилактида и 20% полигликолида; 75% полилактида и 25% полигликолида; 70% полилактида и 30% полигликолида; 65% полилактида и 35% полигликолида; 60% полилактида и 40% полигликолида; 55% полилактида и 45% полигликолида; 50% полилактида и 50% полигликолида; 45% полилактида и 55% полигликолида; 40% полилактида и 60% полигликолида; 35% полилактида и 65% полигликолида; 30% полилактида и 70% полигликолида; 25% полилактида и 75% полигликолида; 20% полилактида и 80% полигликолида; 15% полилактида и 85% полигликолида; 10% полилактида и 90% полигликолида; 5% полилактида и 95% полигликолида; 0% полилактида и 100% полигликолида.
В различных вариантах осуществления, в которых применяются как полилактид, так и полигликолид, используют по меньшей мере 95% полилактида; по меньшей мере 90% полилактида; по меньшей мере 85% полилактида; по меньшей мере 80% полилактида; по меньшей мере 75% полилактида; по меньшей мере 70% полилактида; по меньшей мере 65% полилактида; по меньшей мере 60% полилактида; по меньшей мере 55%; по меньшей мере 50% полилактида; по меньшей мере 45% полилактида; по меньшей мере 40% полилактида; по меньшей мере 35% полилактида; по меньшей мере 30% полилактида; по меньшей мере 25% полилактида; по меньшей мере 20% полилактида; по меньшей мере 15% полилактида; по меньшей мере 10% полилактида; по меньшей мере 5% полилактида; остальная часть биополимера представляет собой полигликолид.
В некоторых вариантах осуществления полимер содержит DL-CL или их сочетание. DL-CL может содержать смесь лактида и капролактона. Мольное отношение лактида к капролактону может составлять от 10:90 до 90:10, включая любые значения в данном интервале (например, 20:80, 30:70, 45:55, 65:35, 67:33, 89:11 и др.).
В некоторых вариантах осуществления полимер содержит DL-G-CL или их сочетание. DL-G-CL может содержать смесь лактида, гликолида и капролактона. В некоторых вариантах осуществления мольное отношение лактида, гликолида и капролактона может составлять 30:20:50. В некоторых вариантах осуществления смесь может содержать 5-50% лактида, 5-50% гликолида и 20-80% капролактона.
В некоторых вариантах осуществления, если депо лекарственного средства содержит полимер, последний применяют в количестве примерно от 10 мас.% примерно до 90 мас.%, от 10 мас.% примерно до 50 мас.% или примерно от 20 мас.% примерно до 40 мас.% в расчете на массу лекарственной формы.
В некоторых вариантах осуществления по меньшей мере 75% частиц имеют размер примерно от 1 микрометра примерно до 200 микрометров. В некоторых вариантах осуществления по меньшей мере 85% частиц имеют размер примерно от 1 микрометра примерно до 200 микрометров. В некоторых вариантах осуществления по меньшей мере 95% частиц имеют размер примерно от 1 микрометра примерно до 200 микрометров. В некоторых вариантах осуществления все частицы имеют размер примерно от 1 микрометра примерно до 200 микрометров.
В некоторых вариантах осуществления по меньшей мере 75% частиц имеют размер примерно от 20 микрометров примерно до 100 микрометров. В некоторых вариантах осуществления по меньшей мере 85% частиц имеют размер примерно от 20 микрометров примерно до 100 микрометров. В некоторых вариантах осуществления по меньшей мере 95% частиц имеют размер примерно от 20 микрометров примерно до 100 микрометров. В некоторых вариантах осуществления все частицы имеют размер примерно от 20 микрометров примерно до 100 микрометров.
Депо лекарственного средства может содержать неактивные материалы, в том числе буферные агенты и агенты регулирования рН, в том числе бикарбонат калия, карбонат калия, гидроксид калия, ацетат натрия, борат натрия, бикарбонат натрия, карбонат натрия, гидроксид натрия или фосфат натрия, модификаторы деструкции/высвобождения, агенты, регулирующие высвобождение лекарственных средств, эмульгаторы, консерванты, в том числе бензалкония хлорид, хлорбутанол, ацетат фенилртути и нитрат фенилртути, бисульфит натрия, бисульфат натрия, тиосульфат натрия, тимерозал, метилпарабен и другие парабены, поливиниловый спирт и фенилэтиловый спирт, агенты, регулирующие растворимость, стабилизаторы и/или модификаторы когезии. Обычно все подобные неактивные материалы присутствуют в количестве, лежащем в интервале от 0 до 75 мас.%, предпочтительно - в интервале от О до 30 мас.%. Если депо лекарственного средства предназначена для размещения в спинальной или суставной области, в различных вариантах осуществления депо лекарственного средства может содержать стерильный материал, свободный от консервантов.
Депо лекарственного средства может иметь множество различных размеров, геометрических форм и конфигураций. При определении размера, формы и конфигурации лекарственной формы могут быть приняты в расчет несколько факторов. Например, размер и геометрическая форма могут обеспечить возможность легкого размещения лекарственной формы в целевом участке тканей, выбранном в качестве места имплантации или инъекции. Кроме того, геометрическую форму и размер системы следует выбирать с учетом сведения к минимуму или предотвращения смещения лекарственной формы после имплантации или инъекции. В различных вариантах осуществления депо лекарственного средства может быть выполнено в геометрической форме сферы, цилиндра, в том числе стержня или волокна, плоской поверхности, в том числе диска, пленки, полоски, ленты или листа, пасты, плитки, микрочастиц, наночастиц, таблетки, сетки и т.п.Для облегчения размещения лекарственной формы может быть принята в расчет гибкость. В различных вариантах осуществления депо лекарственного средства может иметь различные размеры, например, депо лекарственного средства может иметь длину примерно от 0,5 мм до 100 мм и диаметр или толщину примерно от 0,01 мм примерно до 5,0 мм. В различных вариантах осуществления депо лекарственного средства может иметь толщину одного слоя, составляющую примерно от 0,005 до 5,0 мм, в том числе, например, от 0,05 до 2,0 мм. В некоторых вариантах осуществления депо лекарственного средства может иметь геометрическую форму полоски или лентообразной полоски; полоска или лентообразная полоска обладает отношением ширины к толщине, лежащей в интервале от 2 до 20 или более.
На поверхность депо лекарственного средства или внутрь депо с целью обеспечения возможности точного размещения пользователем депо лекарственного средства внутри целевого участка организма пациента могут быть помещены рентгенографические маркеры. Подобные рентгенографические маркеры также обеспечивают пользователю возможность слежения за перемещением и деструкцией депо лекарственного средства на участке с течением времени. В данном варианте осуществления пользователь получает возможность точного размещения депо лекарственного средства на участке с применением любых из многочисленных способов диагностической визуализации. Подобные способы диагностической визуализации включают в себя, например, рентгенографию или флуороскопию. Примеры упомянутых рентгенографических маркеров включают в себя барий, висмут, йод, тантал, вольфрам, кальций и/или металлические шарики и/или частицы, но не ограничиваются таковыми. При наличии такового рентгенографический маркер обычно присутствует в количестве, составляющем примерно от 10% примерно до 40% (включая 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39% и 40%, а также интервалы между любыми двумя из упомянутых значений, например, 10-15%, 15-20%, 20-25%, 25-30%, 30-35%, 35-40% и т.д., причем интервал 15-30% является более предпочтительным, 20-25% - еще более предпочтительным). В различных вариантах осуществления рентгенографический маркер может иметь форму сферы или кольца, окружающего депо лекарственного средства.
В некоторых вариантах осуществления депо лекарственного средства содержит поры, обеспечивающие возможность высвобождения лекарственного средства из лекарственной формы. В этом случае депо лекарственного средства обеспечивает возможность вытеснения лекарственного средства из депо жидкостью. Однако проникновение клеток в лекарственную форму предотвращается вследствие размера пор лекарственной формы. Поэтому в некоторых вариантах осуществления депо лекарственного средства перестает действовать как основа для тканей и не позволяет последним расти. Можно утверждать, что в данном случае лекрственная форма депо используется только для доставки лекарственных средств. В некоторых вариантах осуществления размер пор лекарственной формы может составлять менее 250-500 мкм. Данный размер клеток позволяет предотвратить проникновение клеток в лекарственную форму и отложение их там с образованием основы для роста тканей. Поэтому в данном варианте осуществления лекарственное средство элюируется из лекарственной формы, в которую попадает жидкость, однако попадание туда клеток предотвращается. В некоторых вариантах осуществления при наличии мелких пор или при их отсутствии лекарственное средство элюируется из лекарственной формы под действием ферментов, путем гидролиза и/или по другим сходным механизмам, имеющим место в организме человека. В других вариантах осуществления депо лекарственного средства может иметь размер пор свыше 500 мкм, что обеспечивает возможность притока клеток и высвобождения лекарственного средства; в данном варианте осуществления депо лекарственного средства может служить основой для роста тканей.
В одном из примерных вариантов осуществления предложено депо лекарственного средства, предназначенное для доставки терапевтического агента к целевому участку тканей под кожей пациента, причем депо лекарственного средства содержит эффективное количество клонидина и причем целевой участок тканей содержит по меньшей мере один из следующих органов: мышцу, связку, сухожилие, хрящ, позвоночный диск, межпозвоночное пространство возле корешка спинномозгового нерва, фасет или синовиальное соединение либо спинномозговой канал.
В различных вариантах осуществления депо лекарственного средства содержит гель, который включает в себя вещество, обладающее гелеобразными, желеподобными или коллоидными свойствами при комнатной температуре. В различных вариантах осуществления гель может содержать клонидин и, возможно, один или несколько дополнительных терапевтических агентов, диспергированных или суспендированных в объеме геля. Распределение терапевтического агента в объеме геля может быть равномерным. В другом варианте осуществления концентрация терапевтического агента может изменяться по объему геля. При деструкции биоразлагаемого материала геля или лекарственной формы на месте применения происходит высвобождение терапевтического агента.
Если депо лекарственного средства представляет собой гель, в противоположность распыляемому гелю, в котором обычно используют полимер с низкой вязкостью, для других областей применения может потребоваться полимер с большей вязкостью; например, для применения при регенерации костей более предпочтительным может оказаться гель с консистенцией воска. В различных вариантах осуществления при применении полимера в составе геля полимерная композиция составляет примерно от 40 мас.% примерно до 99 мас.% или примерно от 90 мас.% примерно до 99 мас.% геля.
В другом примерном варианте осуществления в гель в вязком виде вводят в виде одного или нескольких депо лекарственного средства (например, микросфер, содержащих терапевтический агент), причем вязкий гель размещают в синовиальном соединении, дисковом пространстве, спинномозговом канале или в мягких тканях, окружающих спинномозговой канал пациента. В различных вариантах осуществления гель также может быть использован для заполнения или восстановления тканей. В еще одном примерном варианте осуществления настоящего изобретения гель представляет собой пригодный для инъекций и/или адгезионно-активный гель, затвердевающий при контакте с тканями. Например, гель может применяться в виде жидкости, образующей гель in situ на целевом участке тканей. В различных вариантах осуществления гель может содержать двухкомпонентную систему, причем вначале применяют жидкость, а затем добавляют гелеобразующий агент, вызывающий гелеобразование или затвердевание жидкости.
В различных вариантах осуществления гель представляет собой гель, способный к отверждению, причем после применения геля к целевому участку он затвердевает, и при контакте физиологической жидкости с гелем оказывается возможным высвобождение лекарственного средства.
В различных вариантах осуществления депо лекарственного средства содержит клонидин и, возможно, один или несколько дополнительных терапевтических агентов, и доставляется к требуемому целевому участку тканей (например, на место хирургического надреза, в воспаленную ткань, перерожденную ткань и др.); в различных вариантах осуществления депо лекарственного средства может удерживаться на месте шовным материалом, зубцами, скобками, адгезионно-активным гелем и др., предотвращающими смещение лекарственной формы с данного участка вследствие системного венозного кровообращения или слишком обширное распространение лекарственной формы, что снижает желаемый терапевтический эффект. Например, по истечении нескольких часов или суток депо лекарственного средства может деструктировать, что обеспечивает возможность начала высвобождения терапевтического агента лекарственной формой (например, полоской, лентообразной полоской и др.). Полоски могут быть изготовлены из нерастворимого или инертного вещества, однако они становятся растворимыми или активными, как только они приходят в контакт с целевым участком тканей. Сходным образом депо лекарственного средства может содержать вещество, растворяющееся или диспергирующееся в объеме тканей. Поскольку по истечении нескольких часов или суток депо лекарственного средства начинает растворяться, депонированные лекарственные формы (например, полоски) подвергаются действию физиологических жидкостей и начинают высвобождать свое содержимое. Состав лекарственной формы может быть таким, чтобы длительность воздействия на лекарственную форму и высвобождение терапевтического агента из лекарственной формы были оптимальными.
В различных вариантах осуществления депо лекарственного средства (например, гель) является текучей и может быть инъецирована, распылена, закапана и/или распределена в районе целевого участка тканей, в нем или на нем. Термин "текучий" означает, что состав в виде геля является удобным в обращении и может быть нанесен кистью, распылен, закапан, намазан, инъецирован, отформован и/или отлит в целевом участке тканей или рядом с ним в коагулированном состоянии. Термин "текучий" включает в себя ряд составов от низковязких и водоподобных по консистенции до высоковязких и пастообразных. В различных вариантах осуществления текучесть состава позволяет ему входить в соответствие с формой неровностей, трещин, разломов и/или пустот на целевом участке. Например, в различных вариантах осуществления гель может быть использован для заполнения одной или нескольких пустот при остеолитических повреждениях.
В различных вариантах осуществления депо лекарственного средства содержит поли(альфа-оксикислоты), PLGA, PLA, сополимер D,L-лактида с гликолидом и капролактоном, ПГ, полиоксибутират, сополимер гликолида с триметиленкарбонатом, сополимер молочной кислоты с лизином, сополимер лактида с уретаном, сополиэфирамид, ПЭГ-конъюгаты поли(альфа-оксикислот), полиортоэфиры, полиаспирины, полифосфазены, полиангидриды, поликетали, коллаген, крахмал, предварительно клейстеризованный крахмал, гиалуроновую кислоты, хитозаны, желатин, альгинаты, алюбумин, фибрин, аналоги витамина Е, в том числе альфа-токоферилацетат, d-альфа-токоферилсукцинат, ε-капролактон, D,L-лактид, D-лактид, L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, декстраны, винилпирролидон, поливиниловый спирт (ПВС, PVA), PVA-g-PLGA (поливиниловый спирт, привитый сополимером лактид-гликолид -), сополимер ПЭГТ-ПБТ (PEGT-PBT, полиактив), метакрилаты, поли(N-изопропилакриламид), блок-сополимеры ПЭО-ППО-ПЭО (РЕО-РРО-РЕО, плюроники), сополимеры ПЭО-ППО-ПАК (РЕО-РРО-РАА), ПМГК-ПЭО-ПМГК (PLGA-PEO-PLGA), ПЭГ-ПМГК (PEG-PLG (сополимер d,1-лактида с гликолидом)), ПМК-ПМГК (PLA-PLGA), полоксамер 407, триблок-сополимер ПЭГ-ПМГК-ПЭГ (PEG-PLGA-PEG), SAIB (ацетат-изобутират сахарозы) или их сочетания. Упомянутые один или несколько компонентов обеспечивают возможность высвобождения терапевтического агента из лекарственной формы контролируемым и/или замедленным путем. Например, депо лекарственного средства, содержащее терапевтический агент и полимерную матрицу, можно инъецировать в целевой участок тканей; при этом полимерная матрица разрушается с течением времени (например, нескольких часов или суток) внутри целевого участка тканей с высвобождением клонидина и, возможно, дополнительных терапевтических агентов. Таким путем оказывается возможной локализованное введение лекарственного средства и осуществление его воздействия в течение определенного периода времени (например, по меньшей мере от одних суток до примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30,40, 50, 60, 70, 80 и 90 суток).
Термины "замедленное высвобождение" или "медленное высвобождение" (синонимами которых являются "пролонгированное высвобождение" или "контролируемое высвобождение") используются в настоящем описании по отношению к одному или нескольким терапевтическим агентам, вводимым в тело человека или другого млекопитающего и непрерывно выделяющим поток одного или нескольких терапевтических агентов в течение заранее определенного периода времени в терапевтическом количестве, достаточном для достижения требуемого терапевтического эффекта в течение заранее определенного периода времени. Ссылка на непрерывный высвобождающийся поток сделана с целью охватить случаи высвобождения, происходящего в результате биоразложения лекарственной формы, ее матрицы или ее компонентов in vivo, или высвобождения, происходящего в результате метаболической трансформации или растворения терапевтического (-их) агента (-ов) или его (их) конъюгатов.
Термин "немедленное высвобождение" используется в настоящем описании по отношению к одному или нескольким терапевтическим агентам, вводимым в организм и свободно растворяющимся или поглощаемым на участке, к которому он или они применяются, при отсутствии целенаправленной задержки или целенаправленного продления растворения или поглощения лекарственного средства.
Оба типа составов (с замедленным высвобождением и с немедленным высвобождением) могут применяться совместно. Составы с замедленным и с немедленным высвобождением могут находиться в одной и той же лекарственной форме или в нескольких одинаковых лекарственных формах. В различных вариантах осуществления составы с замедленным и немедленным высвобождением могут являться частями различных лекарственных форм. Например, на целевом участке или рядом с ним может быть размещен болюсный состав (с немедленным высвобождением), содержащий клонидин; на том же участке или рядом с ним также может быть размещен состав с замедленным высвобождением. Таким путем даже по достижении полной доступности болюсной дозы состав с замедленным высвобождением может продолжать доставку активного ингредиента к нужной ткани.
В различных вариантах осуществления депо лекарственного средства изготавливается таким образом, чтобы в течение первых 48 часов или 24 часов после введения депо обеспечивало высвобождение начальной импульсной дозы терапевтического агента. Термины "начальный импульс", "импульсный эффект" или "болюсная доза" указывают на высвобождение терапевтического агента из лекарственной формы в течение первых 48 часов или 24 часов после приведения лекарственной формы в контакт с водной жидкостью (например, синовиальной жидкостью, спинномозговой жидкостью и др.). В некоторых вариантах осуществления депо лекарственного средства выполнено таким образом, чтобы данный начальный импульсный эффект отсутствовал.
В различных вариантах осуществления депо лекарственного средства содержит один или несколько различных высвобождающих слоев, осуществляющих высвобождение болюсной дозы клонидина или его фармацевтически приемлемой соли (например, от 100 до 300 мкг на целевом участке под кожей), и один или несколько слоев замедленного высвобождения, осуществляющих высвобождение эффективного количества клонидина или его фармацевтически приемлемой соли за период, составляющий от 3 до 30 суток, от 3 до 10 суток или от 7 до 10 суток. В различных вариантах осуществления один или несколько слоев немедленного высвобождения содержат ПМГК и деструктируют быстрее, чем один или несколько слоев замедленного высвобождения, содержащих ПМК, деструктирующую с меньшей скоростью, чем ПМГК.
В различных вариантах осуществления, если депо лекарственного средства содержит гель, последний может до применения характеризоваться вязкостью, лежащей в интервале примерно от 1 примерно до 2000 сантипуаз (сПз), примерно от 1 примерно до 500 сПз, примерно от 1 примерно до 200 сПз или примерно от 1 примерно до 100 сПз. После применения геля на целевом участке вязкость геля повышается, и гель приобретает модуль эластичности (модуль Юнга), лежащий в интервале примерно от 1×102 примерно до 6×105 дин/см2 (от 1 до 6000 кПа), или от 2×104 примерно до 5×105 дин/см2 (от 200 до 5000 кПа), или от 5×104 примерно до 5×105 дин/см2 (от 50 до 5000 кПа).
В одном из вариантов осуществления гель может представлять собой адгезионно-активный гель, содержащий терапевтический агент, равномерно распределенный по объему геля. Может применяться гель любого известного типа, как упомянуто выше, при этом гель должен быть достаточно вязким с тем, чтобы предотвратить миграцию геля с места направленной доставки после применения; таким образом, гель должен "наклеиваться" или налипать на целевой участок тканей. Гель может, например, затвердевать при контакте с целевой тканью или после выделения из системы направленной доставки. Система направленной доставки может представлять собой, например, шприц, катетер, иглу или канюлю либо любое другое пригодное устройство. Система направленной доставки способна обеспечивать инъекцию или распыление геля в целевой участок тканей или на него. Терапевтический агент может быть смешан с гелем до применения геля на целевом участке тканей. В различных вариантах осуществления гель может являться частью двухкомпонентной системы доставки; при смешении двух компонентов происходит активация химического процесса, приводящего к образованию геля и вызывающего его склеивание с целевой тканью или налипание на нее.
В различных вариантах осуществления концентрация полимера в составах в виде геля, содержащих полимер, может влиять на скорость затвердевания геля (например, гель с большей концентрацией полимера может коагулировать быстрее, чем гель с меньшей концентрацией полимера). В различных вариантах осуществления матрица, образующаяся при затвердевании геля, является твердой, но при этом способной принимать соответствие геометрической форме неровностей поверхности ткани (например, впадинам и/или выступам на кости).
Процентная доля полимера, содержащегося в геле, также может влиять на вязкость полимерной композиции. Например, композиция, содержащая большую массовую процентную долю полимера, обычно является более густой и более вязкой по сравнению с композицией, содержащей меньшую массовую процентную долю полимера. Более вязкая композиция имеет тенденцию к более медленному течению. Поэтому композиция с меньшей вязкостью в некоторых случаях, например, при применении состава путем распыления, может оказаться предпочтительной.
В различных вариантах осуществления молекулярная масса геля может быть изменена многими способами, известными в уровне техники. Выбор способа изменения молекулярной массы обычно определяется составом геля (например, наличием в нем полимера или неполимерного вещества). Например, в различных вариантах осуществления, если гель содержит один или несколько полимеров, степень полимеризации может контролироваться путем изменения количества инициаторов полимеризации (например, пероксида бензоила), органических растворителей или активаторов (например, N,N-диметил-п-толуидина (DMPT)), сшивающих агентов, полимеризующих агентов и/или времени реакции.
Пригодные гелеобразные полимеры могут быть растворимыми в органических растворителях. Растворимость полимера в растворителе изменяется в зависимости от кристалличности, гидрофобности, способности к образованию водородных связей и молекулярной массы полимера. Полимеры с более низкой молекулярной массой обычно растворяются в органических растворителях легче, чем полимеры с более высокой молекулярной массой. Полимерный гель, содержащий полимер с более высокой молекулярной массой, имеет тенденцию к более быстрым коагуляции или затвердеванию по сравнению с полимерной композицией, содержащий полимер с более низкой молекулярной массой. Полимерные гелевые составы, содержащие полимеры с более высокой молекулярной массой, также имеют тенденцию к наличию более высоких значений вязкости раствора по сравнению с полимерным гелем, содержащим полимер с более низкой молекулярной массой.
В различных вариантах осуществления гель обладает логарифмическим числом вязкости (сокращенно "IV" - inherent viscosity, размерность - децилитры/грамм), представляющей собой меру молекулярной массы геля и времени деструкции (например, гель, обладающий высоким логарифмическим числом вязкости, обладает более высокой молекулярной массой и более длительным временем деструкции). Обычно гель, обладающий более высокой молекулярной массой, обеспечивает образование более жесткой матрицы; деструкция последней занимает больше времени. Напротив, гель, обладающий более низкой молекулярной массой, деструктирует быстрее и приводит к образованию более мягкой матрицы. В различных вариантах осуществления гель обладает молекулярной массой, выраженной в единицах логарифмического числа вязкости, составляющей примерно от 0.10 дл/г примерно до 1.2 дл/г или примерно от 0.10 дл/г примерно до 0.40 дл/г.Другие интервалы IV включают в себя интервалы примерно от 0.05 примерно до 0.15 дл/г, примерно от 0.10 примерно до 0.20 дл/г, примерно от 0.15 примерно до 0.25 дл/г, примерно от 0.20 примерно до 0.30 дл/г, примерно от 0.25 примерно до 0.35 дл/г, примерно от 0.30 примерно до 0.35 дл/г, примерно от 0.35 примерно до 0.45 дл/г, примерно от 0.40 примерно до 0.45 дл/г, примерно от 0.45 примерно до 0.50 дл/г, примерно от 0.50 примерно до 0.70 дл/г, примерно от 0.60 примерно до 0.80 дл/г, примерно от 0.70 примерно до 0.90 дл/г и примерно от 0.80 примерно до 1.00 дл/г, но не ограничиваются таковыми.
В различных вариантах осуществления гель может обладать вязкостью, составляющей примерно от 300 примерно до 5000 сантипуаз (сПз). В других вариантах осуществления гель может обладать вязкостью примерно от 5 примерно до 300 сПз, примерно от 10 примерно до 50 сПз, примерно от 15 сПз примерно до 75 сПз при комнатной температуре, что обеспечивает возможность его распыления на целевом участке или рядом с ним.
В различных вариантах осуществления депо лекарственного средства может содержать материал, повышающий вязкость и контролирующий высвобождение лекарственного средства. Подобные материалы могут включать в себя, например, оксипропилцеллюлозу, оксипропилметилцеллюлозу, оксиэтилметилцеллюлозу, карбоксиметилцеллюлозу и ее соли, карбопол, полиоксиэтилметакрилат, полиметоксиэтилметакрилат, полиметоксиэтоксиэтилметакрилат, полиметилметакрилат (ПММА), метилметакрилат (ММА), желатин, поливиниловые спирты, пропиленгликоль, ПЭГ 200, ПЭГ 300, ПЭГ 400, ПЭГ 500, ПЭГ 550, ПЭГ 600, ПЭГ 700, ПЭГ 800, ПЭГ 900, ПЭГ 1000, ПЭГ 1450, ПЭГ 3350, ПЭГ 4500, ПЭГ 8000 или их сочетания. Например, в различных вариантах осуществления депо лекарственного средства содержит примерно от 2,5 мас.% до 5 мас.% клонидина, примерно от 85 мас.% до 87,5 мас.% ПМГК и примерно 10 мас.% мПЭГ.
Профиль высвобождения лекарственной формы также можно контролировать, среди прочего, путем контроля распределения по размеру частиц компонентов лекарственной формы. В различных вариантах осуществления распределение по размеру частиц компонентов лекарственной формы (например, клонидина, геля и др.) может лежать в интервале примерно от 10 мкМ до 200 мкМ с тем, чтобы обеспечить возможность легкой доставки лекарственной формы к целевому участку или рядом с ним путем инъекции, распыления, вливания и др. В различных вариантах осуществления размер частиц может составлять 10 кмМ, 13 мкМ, 85 мкМ, 100 мкМ, 151 мкМ, 200 мкМ или лежать в любых интервалах между упомянутыми значениями.
В различных вариантах осуществления депо лекарственного средства может содержать гидрогель, полученный из высокомолекулярных биосовместимых эластомерных полимеров синтетического или природного происхождения. Желательным свойством для гидрогеля является его способность к быстрому ответу на механические напряжения, в особенности сдвиг и нагружение, в организме человека.
Особенно привлекательными являются гидрогели, полученные из природных источников, поскольку они с большей вероятностью являются биоразлагаемыми и биосовместимыми при применении in vivo. Пригодные гидрогели включают в себя природные гидрогели, в том числе, например, желатин, коллаген, шелк, эластин, фибрин и полимерные производные полисахаридов, например, агарозу, хитозан, глюкоманнановый гель, гиалуроновую кислоту, полисахариды, в том числе сшитые карбоксилсодержащие полисахариды, или их сочетания. Синтетические гидрогели включают в себя гидрогели, полученные из поливинилового спирта, акриламидов, в том числе полиакриловой кислоты и сополимера акрилонитрила с акриловой кислотой, полиуретанов, полиэтиленгликолей (например, ПЭГ 3350, ПЭГ 4500, ПЭГ 8000), силиконов, полиолефинов, в том числе полиизобутилена и полиизопрена, сополимеров силикона и полиуретана, неопрена, нитрила, вулканизованной резины, поли (N-винил-2-пирролидона), акрилатов, в том числе поли(2-оксиэтилметакрилата) и сополимеров акрилатов с N-винилпирролидоном, N-виниллактамами, полиакрилонитрила и их сочетаний, но не ограничиваются таковыми. Материалы для получения гидрогеля при необходимости могут быть подвергнуты дальнейшему сшиванию с целью придания им большей прочности. Примеры различных типов полиуретанов включают в себя термопластичные или термореактивные полиуретаны, алифатические или ароматические полиуретаны, полиэфируретаны, поликарбонатуретаны или силиконсодержащие полиэфируретаны либо их сочетание.
В различных вариантах осуществления вместо прямого смешения терапевтического агента с гелем в объеме геля могут быть диспергированы микросферы, причем последние содержат клонидин. В одном из вариантов осуществления микросферы обеспечивают возможность замедленного высвобождения клонидина. В другом варианте осуществления гель, являющийся биоразлагаемым, предотвращает высвобождение клонидина из микросфер, при этом микросферы не производят высвобождение клонидина до их высвобождения из геля. Например, гель может быть применен вокруг целевого участка тканей (например, корешка нерва). В объеме геля диспергируют множество микросфер, в которых капсулирован нужный терапевтический агент.Некоторые из подобных микросфер деструктируют сразу после высвобождения из геля, при этом происходит высвобождение клонидина.
Микросферы, подобно жидкостям, могут распространяться относительно быстро в зависимости от типа окружающей ткани, и, таким образом, осуществлять распространение клонидина. В некоторых ситуациях это может быть желательным, в других ситуациях может оказаться более желательным сохранить клонидин для применения на строго определенном целевом участке. В настоящем изобретении для подобного ограничения распространения терапевтического агента также рассматривается применение адгезионно-активных гелей. Подобные гели могут применяться, например, в дисковом пространстве, в спинномозговом канале или в окружающих тканях.
Доставка лекарственных средств
Специалисту в данной области техники понятно, что применение лекарственной формы к целевому участку может осуществляться при помощи "канюли" или "иглы", которая может быть частью устройства доставки лекарственных средств, например, шприца, распылительного устройства доставки лекарственных средств или любого медицинского приспособления, пригодного для применения лекарственных средств к целевому органу или анатомической области. Канюля или игла устройства доставки лекарственного средства изготавливается так, чтобы свести к минимуму физические и психологические травмы для пациента.
Канюли или иглы содержат трубки, которые могут быть выполнены из таких материалов, как, например, полиуретан, полимочевина, полиэфирамиды, РЕВА, олефиновый термопластичный эластомер, сополиэфир, стирольный термопластичный эластомер, сталь, алюминий, нержавеющая сталь, титан, сплавы металлов с высоким содержанием цветных металлов и низкой относительной долей железа, углеродное волокно, стекловолокно, пластмассы, керамика или их сочетание. Канюля или игла при необходимости может содержать один или несколько конических участков. В различных вариантах осуществления канюля или игла может иметь скошенный край. Канюля или игла также могут иметь стандартную конструкцию, которая является существенной для правильного лечения пациентов в зависимости от места имплантации. Примеры стандартных конструкций включают в себя, например, трефин, иглу Курнана, иглу Вереша, иглу Хубера, иглу Зелдингера, иглу Чиба, иглу Francine, скошенную иглу, иглу Кроуфорда, иглы с отклоненным концом, иглу Hustead, ланцет или иглу Туохи. В различных вариантах осуществления канюля или игла также может не иметь внутреннего пространства и являться покрытой трубкой во избежание чрезмерного количества уколов.
Размеры полой канюли или иглы, среди прочего, зависят от места имплантации. Например, ширина эпидурального пространства составляет всего примерно 3-5 мм в торакальной области и примерно 5-7 мм в люмбальной области. Поэтому в различных вариантах осуществления может быть создана игла для применения на данных особых участках. В различных вариантах осуществления канюля или игла может быть введена трансфораминально в пространство спинномозгового отверстия, например, параллельно воспаленному корешку нерва; при этом происходит имплантация лекарственной формы на данном участке с целью лечения болезненного состояния. Трансфораминальный доступ обычно предусматривает доступ к межпозвоночному пространству через межпозвоночное отверстие.
Некоторые примеры длины канюли или иглы могут включать в себя, например, примерно от 50 до 150 мм в длину, например, примерно 65 мм для эпидурального педиатрического применения, примерно 85 мм для взрослых пациентов обычного телосложения и примерно 110 мм для взрослых пациентов, страдающих ожирением, но не ограничиваются таковыми. Толщина канюли или иглы также зависит от места имплантации. В различных вариантах осуществления значения толщины включают в себя примерно от 0,05 примерно до 1,655, но не ограничиваются таковыми. Калибр канюли или иглы может соответствовать наибольшему, наименьшему диаметру или промежуточному диаметру игл, предназначенных для введения в организм человека или животного. Наибольший диаметр обычно соответствует 14 калибру, тогда как наименьший - 22 калибру. В различных вариантах осуществления калибр иглы или канюли соответствует калибру примерно от 18 примерно до 22.
В различных вариантах осуществления, подобно лекарственной форме и/или гелю, канюля или игла содержит рентгенографические маркеры дозы, указывающие на их нахождение на участке под кожей или рядом с ним; тем самым пользователь имеет возможность точного размещения лекарственной формы на участке или рядом с ним с применением любого из способов диагностической визуализации. Подобные способы диагностической визуализации включают в себя, например, рентгенографию и флуороскопию. Примеры упомянутых рентгенографических маркеров включают в себя барий, висмут, тантал, вольфрам, йод, кальций и/или металлические шарики или частицы, но не ограничиваются таковыми.
В различных вариантах осуществления игла или канюля может содержать прозрачный или полупрозрачный участок, пригодный для визуализации ультразвуком, флуороскопией, рентгенографией или другими способами визуализации. В данных вариантах осуществления прозрачный или полупрозрачный участок может содержать рентгеноконтрастный материал или рельеф, обладающий откликом на ультразвук, что повышает контраст иглы или канюли относительно участков с отсутствием подобных материала или рельефа.
Депо лекарственного средства и/или медицинское устройство, предназначенное для введения лекарственного средства, могут быть пригодными для стерилизации. В различных вариантах осуществления один или несколько компонентов депо лекарственного средства и/или медицинское устройство, предназначенное для введения лекарственного средства, подвергаются радиационной стерилизации на заключительной стадии процесса производства в виде упакованного комплекта. Стерилизация изделия на заключительной стадии обеспечивает лучшее обеспечение стерильности по сравнению со способами, подобными асептическому, который требует раздельной стерилизации индивидуальных компонентов изделия с последующей сборкой и упаковкой комплекта в стерильной среде.
В различных вариантах осуществления на заключительной стадии стерилизации предпочтительно применение гамма-излучения, что подразумевает использование ионизирующей энергии гамма-лучей, глубоко проникающих в приспособления. Гамма-лучи являются высокоэффективными при уничтожении микроорганизмов, не приводят к образованию остаточных продуктов и не обладают энергией, достаточной для придания приспособлениям радиоактивности. Гамма-лучи могут быть использованы в случае, если приспособление находится в упаковке, причем гамма-стерилизация не требует условий высокого давления или вакуума; поэтому швы упаковки и другие компоненты не подвергаются нагружению. Кроме того, гамма-облучение устраняет необходимость в применении проницаемых упаковочных материалов.
В различных вариантах осуществления для стерилизации одной или нескольких деталей устройства может использоваться излучение электронного пучка. Последнее несет в себе форму ионизирующей энергии, в общем случае отличающуюся низкой проницающей способностью и высокими мощностями дозы. Облучение электронным пучком является сходным с гамма-обработкой в том, что оно разрушает различные химические и межмолекулярные связи, в том числе способные к воспроизводству клетки микроорганизмов, при контакте с ними. Пучки, получаемые для стерилизации электронным пучком, являются концентрированными, сильно заряженными потоками электронов, генерируемьми путем ускорения электронов и превращения электроэнергии. Стерилизация электронным пучком может быть использована, например, в том случае, если депо лекарственного средства находится в составе геля.
Для стерилизации депо лекарственного средства и/или одного или нескольких деталей устройства для введения также могут быть использованы другие способы, включая, но не ограничиваясь ими, стерилизацию в газовой среде, например, стерилизацию этиленоксидом, или стерилизацию паром.
В различных вариантах осуществления предложен набор, который может включать, помимо депо лекарственного средства и/или медицинского устройства, дополнительные компоненты, объединенные между собой с целью применения при имплантации депо лекарственного средства (например, таких как лентообразные полоски). Набор в первом отсеке может содержать устройство доставки лекарственной формы. Второй отсек может содержать емкость с депо лекарственного средства и все остальные инструменты, необходимые для локализованной доставки лекарственного средства. Третий отсек может содержать перчатки, хирургические салфетки, раневые повязки и другие процедурные средства поддержания стерильности в процессе имплантации, а также буклет с инструкцией. Четвертый отсек может содержать дополнительные канюли и/или иглы. Каждый инструмент может быть отдельно упакован в пластмассовый мешочек, подвергнутый радиационной стерилизации. Крышка набора может содержать иллюстрации процедуры имплантации; над отсеками для поддержания стерильности может быть размещена прозрачная пластмассовая оболочка.
В различных вариантах осуществления предложен способ доставки клонидина внутрь целевого участка тканей пациента. Способ включает в себя введение канюли или иглы в целевой участок тканей или рядом с ним и имплантацию лекарственной формы, содержащей клонидин, в целевой участок под кожей пациента. В различных вариантах осуществления для применения лекарственной формы на нужном участке вначале производят введение канюли или иглы через кожу и мягкие ткани вплоть до целевого участка тканей, затем лекарственную форму применяют (например, путем инъекции, имплантации, вливания, распыления и др.) к целевому участку или рядом с ним. В тех вариантах осуществления, в которых депо лекарственного средства находится отдельно от геля, вначале возможно введение канюли или иглы через кожу и мягкие ткани вплоть до места инъекции с последующим введением одного или нескольких слоев гелевой основы к целевому участку. Вслед за введением одного или нескольких слоев основы может быть проведена имплантация депо лекарственного средствана слой (слои) основы или в него (в них) с тем, чтобы гель мог удерживать депо лекарственного средства на месте или снижать его миграцию. В случае необходимости возможно нанесение дополнительных слоя или слоев геля на депо лекарственного средства с целью охвата ими депо лекарственного средства и его дополнительного закрепления. В другом варианте осуществления возможны имплантация или инъекция вначале депо лекарственного средства с последующим размещением (например, нанесением кистью, закапыванием, инъекцией, намазыванием и др.) геля вокруг депо лекарственного средства с целью удержания депо на месте. Путем применения геля достигается аккуратная и точная имплантация депо лекарственного средства с минимальными физическими и психологическими травмами для пациента. В различных вариантах осуществления депо лекарственного средства может быть пришито к целевому участку; в другом варианте осуществления депо лекарственного средства может быть имплантировано без пришивания. Например, в различных вариантах осуществления депо лекарственного средства может представлять собой форму в виде полоски или ленты и может быть размещено на целевом участке до, во время или после операции. Другим примером является возможность доставки к целевому участку депо лекарственного средства в виде геля посредством шприца или другого устройства доставки путем инъекций до, во время или после операции.
В различных вариантах осуществления, если целевой участок тканей включает в себя спинальную область, вначале может быть произведен отвод порции жидкости (например, ликвора и др.) из целевого участка через канюлю или иглу; затем производят введение (например, размещение, закапывание, инъекцию или имплантацию и др.) депо лекарственного средства. Целевой участок подвергается регидратации (например, путем восполнения жидкости); водная среда вызывает высвобождение лекарственного средства из лекарственной формы.
Термин "лечение" заболевания или болезненного состояния означает исполнение протокола, способного включать в себя введение пациенту (человеку, другим млекопитающим и иным животным) одного или нескольких лекарственных средств с целью подавления признаков или симптомов заболевания или болезненного состояния. Ослабление может иметь место как до проявления признаков или симптомов начинающегося заболевания или болезненного состояния, так и после их проявления. Таким образом, термин "лечение" может включать в себя "профилактику" заболевания или нежелательного состояния. Кроме того, "лечение" не требует полного подавления признаков или симптомов, не требует излечения и, в частности, включает в себя протоколы, оказывающие лишь ограниченное влияние на пациента. "Ослабление боли" включает в себя уменьшение боли, не требует полного подавления признаков или симптомов боли и не требует исцеления. В различных вариантах осуществления ослабление боли включает в себя в том числе ограниченное уменьшение боли. Например, для профилактики, лечения или смягчения симптомов послеоперационных болей, связанных с операциями, могут быть использованы одна или несколько эффективных дозировок клонидина.
"Локализованная" доставка включает в себя доставку, при которой одно или несколько лекарственных средств поступают внутрь определенной ткани, на ее поверхность или рядом с ней. Например, локализованная доставка включает в себя доставку к корешку нерва нервной системы, в определенную область мозга либо в непосредственной близости от них (например, на расстоянии примерно не более 10 см, предпочтительно не более 5 см). "Система направленной доставки" предусматривает доставку одной или нескольких лекарственных форм (например, геля или лекарственных форм, диспергированных в геле, и др.), содержащих некоторое количество терапевтического агента, способного к поступлению в целевой участок тканей или в его область, что необходимо для лечения болей и/или воспалений, сопутствующих операциям.
На Фиг.1 показаны некоторые области организма пациента, которые могут быть прооперированы; Следует понимать, что области организма, показанные на Фиг.1, приведены только в качестве примеров многочисленных областей организма пациента, которые могут быть прооперированы. Например, пациенту может потребоваться операция на коленях 21, бедрах 22, пальцах 23, большом пальце 24, шее 25, позвоночном столбе 26. В ходе подобных операций или после них пациент может испытывать послеоперационные боли и/или воспаления.
Термин "боль" включает в себя ноцицепцию и ощущение боли; оба явления могут быть рассмотрены объективно и субъективно, с применением показателей болевых ощущений и других способов, хорошо известных из уровня техники. В различных вариантах осуществления боль может включать в себя аллодинию (усиленный ответ на стимулы, в норме не являющиеся болевыми) или гиперальгезию (усиленный ответ на стимулы, в норме являющиеся болевыми или неприятными), которая в свою очередь может быть по своей природе термической или механической (тактильной). В некоторых вариантах осуществления боль отличается термической чувствительностью, механической чувствительностью и/или болью в состоянии покоя. В других вариантах осуществления боль включает в себя механически индуцированную боль или боль в состоянии покоя. В некоторых других вариантах осуществления боль включает в себя боль в состоянии покоя. Боль, как известно из уровня техники, может быть первичной или вторичной. Примеры видов боли, способных к ослаблению, предупреждению или лечению способами и композициями, описанными в настоящем изобретении, включают в себя послеоперационные боли, например, в области спины и в люмбальной области (боль внизу спины) или в цервикальной области (боль в шее), боль в ногах, корешковую боль (испытываемую внизу спины и в ногах после люмбальных операций и в шее и руках после цервикальных операций), боль в брюшной полости после абдоминальных операций, невропатическую боль в руках, шее, спине, внизу спины, ногах и связанное с ними распределение боли после операций на межпозвоночном диске или позвоночном столбе, но не ограничиваются таковыми. Невропатическая боль может включать в себя боль, возникающую после операций на корешках нервов, ганглии заднего корешка или периферическом нерве.
В различных вариантах осуществления боль возникает вследствие "постхирургических болей", или "послеоперационных болей", или "болей, вызванных операцией"; использование данных терминов в настоящей заявке является взаимозаменяемым и относится к болям, возникающим в восстановительный период за несколько секунд, минут, часов, суток или недель после хирургической процедуры (например, геринопластики, ортопедической или спинальной операции и др.). Хирургические процедуры включают в себя все процедуры, при которых происходит проникновение под кожу и которые вызывают у пациента боль и/или воспаление. Хирургические процедуры также включают в себя артроскопические операции, иссечение массы, спинную фузию, торакальные, цервикальные или люмбальные операции, операции в области таза или их сочетание.
Термин "средство регулирования боли" включает в себя один или несколько терапевтических агентов, применяемых для ослабления, профилактики, подавления или полного устранения боли. Подобные средства включают в себя противовоспалительные агенты, миорелаксанты, анальгетики, анестетики, наркотики и др., или их сочетание.
В различных вариантах осуществления постхирургические боли, или послеоперационные боли, или боли, вызванные операцией, сопровождаются воспалением. Воспаление может представлять собой острый ответ на травму или операцию. При повреждении тканей TNF-α соединяется с клетками и вызывает высвобождение ими других цитокинов, в свою очередь вызывающих воспаление. Целью воспалительного каскада является содействие заживлению поврежденной ткани, однако после заживления ткани воспалительный процесс не обязательно заканчивается.
При отсутствии контроля над ним он может привести к разложению окружающих тканей и к связанной с этим боли. Поэтому боль может сама по себе превратиться в болезненное состояние. Таким образом, результатом активации данного пути являются воспаление и боль. Часто возникает кажущийся бесконечным порочный круг повреждения, воспаления и боли.
Один из примерных вариантов осуществления, в котором депо лекарственного средства является пригодным для применения для регулирования боли и/или воспаления (например, регулирования послеоперационных болей и/или воспаления), проиллюстрирован на Фиг.2. На Фиг.2 схематически показан вид сзади позвоночного столба и участков, на которых с применением шприца, канюли или иглы может быть осуществлено введение депо лекарственного средства подкожно 34 к участку 32 спинальной области (например, дисковому пространству, спинномозговому каналу, мягким тканям, окружающим позвоночный столб, корешку нерва и др.); одно или несколько депо лекарственного средства28 и 32 доставляются к различным участкам параллельно позвоночному столбу. При этом, если подлежат имплантации несколько депо лекарственного средства, подобный способ имплантации оптимизирует определение положения, точное размещение и распределение лекарственного средства.
Хотя, как описано выше, на чертеже показана спинальная область, депо лекарственного средства может быть доставлено к любому участку под кожей, в том числе по меньшей мере к одному из следующих органов: мышце, связке, сухожилию, хрящу, позвоночному диску, межпозвоночному пространству, в область корешка спинномозгового нерва или к спинномозговому каналу, но не ограничиваясь таковыми. В различных вариантах осуществления депо лекарственного средства, содержащее клонидин, может быть введено пациенту интраоперационно, внутривенно, внутримышечно, путем непрерывной или периодической инфузии, интраперитонеально, интрастернально, подкожно, интратекально, интрадискально, перидискально, эпидурально, периспинально, путем интраартикулярной инъекции, парентерально или путем сочетания данных способов применения. В некоторых вариантах осуществления инъекция является интратекальной, что означает инъекцию через спинномозговой канал (интратекальное пространство, окружающее спинной мозг). Инъекция также может быть проведена в мышцы или другие ткани.
В некоторых вариантах осуществления является предпочтительным совместное применение клонидина и антагониста с целью противодействия нежелательным эффектам, например, снижению кровяного давления, которые может быть вызвано клонидином. Примеры антагонистов включают в себя фентоламин, йохимбин, толазолин и пипероксан, но не ограничиваются таковыми. Кроме того, для совместного применения пригодны такие соединения, как 5-фтордеоксиуридин (FUDR) и 3,4-дегидропролен. Данные соединения способны предупреждать или снижать образование глиальных и фибробластических рубцов, связанных с некоторыми видами операций.
Составы на основе клонидина, предложенные в настоящей заявке, могут быть использованы в качестве лекарственных средств в форме фармацевтических препаратов. Препараты могут быть получены путем применения вместе с пригодным фармацевтическим носителем, который может быть жидким или твердым, органическим или неорганическим и который может иметь форму, пригодную для парентерального или другого требуемого способа введения. Как известно специалистам в данной области техники, известные носители включают в себя воду, желатин, лактозу, крахмалы, стеариновую кислоту, стеарат магния, кремнийорганические ариловые спирты тальк, растительные масла, бензиловые спирты, камеди, воски, пропиленгликоль, полиалкиленгликоли и другие известные носители лекарственных средств, но не ограничиваются таковыми.
Парентеральное применение может дополнительно включать в себя, например, использование инфузионного насоса, предназначенного для применения фармацевтической композиции (например, сочетание анальгетика с противовоспалительным агентом) через катетер в районе позвоночного столба либо одного или нескольких воспаленных суставов, имплантируемого мини-насоса, способного к введению в целевой участок или рядом с ним, имплантируемого устройства контролируемого высвобождения или системы доставки с замедленным высвобождением, способной к высвобождению некоторого количества статина за час или периодическими болюсными дозами. Одним из примеров пригодного для применения насоса является насос SynchroMed® (компания Medtronic, Миннеаполис, Миннесота, США). Данный насос имеет три герметичные камеры. Одна из них содержит электронный модуль и батарею. Вторая емкость содержит перистальтический насос и емкость для лекарственных средств. Третья емкость содержит инертный газ, создающий давление, необходимое для подачи фармацевтической композиции в перистальтический насос. Для заполнения насоса фармацевтическую композицию вводят в расширяющуюся емкость через отверстие для заполнения емкости. Инертный газ создает в емкости давление; последнее проталкивает фармацевтическую композицию через фильтр в камеру насоса. Затем фармацевтическая композиция прокачивается из устройства через камеру насоса в катетер, который направляет ее для введения на целевом участке. Скорость доставки фармацевтической композиции контролируется микропроцессором. Это обеспечивает возможность применения насоса для доставки одинаковых или различных количеств фармацевтической композиции непрерывно, в заданное время или в определенные промежутки времени между процедурами доставки.
В различных вариантах осуществления, если целевой участок тканей содержит кровеносные сосуды, в депо лекарственного средстваможет быть использовано сосудосуживающее средство. При высвобождении сосудосуживающего средства оно удлиняет длительность анальгетического ответа и снижает системное поглощение агента. Анальгетик может представлять собой, например, клонидин; сосудосуживающим средством может являться, например, эпинефрин или фенилэфрин.
Термин "пациент" относится к организмам из таксономического класса "млекопитающие", в том числе людям, другим приматам, в том числе шимпанзе, человекообразным обезьянам, орангутанам, другим обезьянам, крысам, мышам, кошкам, собакам, коровам, лошадям и т.д.
Способ изготовления депо лекарственного средства клонидина
В различных вариантах осуществления депо лекарственного средства, содержащее клонидин, может быть изготовлено путем смешения биосовместимого полимера и терапевтически эффективного количества клонидина или его фармацевтически приемлемой соли и изготовления из данного сочетания имплантируемого депо лекарственного средства.
Для изготовления по меньшей мере части депо лекарственного средства из биосовместимого(-ых) полимера(-ов), терапевтического(-их) агента(-ов) и дополнительных материалов доступны различные технологии, в том числе технологии переработки из раствора и/или технологии переработки термопластов. При применении технологий переработки из раствора обычно выбирают систему растворителей, содержащую один или несколько видов растворителей. Система растворителей в общем случае представляет собой хороший растворитель по меньшей мере для одного целевого компонента, например, биосовместимого полимера и/или терапевтического агента. Конкретные виды растворителей, образующих систему растворителей, также могут быть выбраны на основе других свойств, в том числе скорости сушки и поверхностного натяжения.
Технологии переработки из раствора включают в себя технологии литья из раствора, нанесения покрытий в центрифуге, мокрого нанесения покрытий, распыления растворителя, макания, технологии, использующие нанесение покрытий из механической суспензии, в том числе из воздушной суспензии (например, нанесение покрытий распылением псевдоожиженного слоя), струйные и электростатические технологии. При необходимости технологии, подобные перечисленным выше, могут повторяться или сочетаться для получения депо лекарственного средства, обладающего требуемыми скоростью высвобождения и толщиной.
В различных вариантах осуществления раствор, содержащий растворитель и биосовместимый полимер, смешивают и помещают в форму желательных размера и конфигурации. При этом могут быть изготовлены полимерные части, в том числе барьерные слои, смазочные слои и т.д. При необходимости раствор также может содержать один или несколько следующих компонентов: клонидин, другой(-ие) терапевтический(-ие) агент(ы) и другие возможные добавки, в том числе рентгенографический(-ие) агент(ы) и др. в растворенном или диспергированном виде. Это приводит к тому, что определенная область полимерной матрицы после удаления растворителя содержит данные виды веществ. В других вариантах осуществления раствор, содержащий растворитель и растворенный или диспергированный терапевтический агент, наносят на уже существующий полимерный участок, который может быть изготовлен с применением множества технологий, в том числе технологий переработки из раствора и переработки термопластов, вследствие чего происходит поглощение терапевтического агента полимерным участком.
Технологии переработки термопластов, применяемые для изготовления депо лекарственного средства или его частей, включают в себя технологии формования (например, литья под давлением, ротационного формования и т.д.), экструзии (например, экструзию, соэкструзию, многослойную экструзию и т.д.) и литья.
В соответствии с различными вариантами осуществления, переработка термопластов включает в себя смешение или компаундирование в одну или несколько стадий биосовместимого полимера и одного или нескольких из следующих компонентов: клонидина, возможно, дополнительного (-ых) терапевтического (-их) агента (-ов), рентгенографического (-их) агента (-ов) и т.д. Полученной смеси затем придают определенную геометрическую форму с получением имплантируемой лекарственной формы. Технологические операции смешения и придания формы могут быть выполнены с применением любого из обычных устройств, предназначенных для данных целей и известных из уровня техники.
В ходе переработки термопластов существует возможность деструкции терапевтического агента, например, вследствие повышенной температуры и/или сдвиговых нагрузок, связанных с подобной переработкой. Например, клонидин может подвергаться существенной деструкции при обычных условиях переработки термопластов. Поэтому переработку предпочтительно проводят в специальных условиях, предупреждающих существенную деструкцию терапевтического(-их) агента(-ов). Несмотря на то, что некоторая степень деструкции при переработке термопластов, разумеется, является неизбежной, деструкция обычно ограничена 10% или менее. Среди условий переработки, контроль которых в ходе переработки с целью избежать существенной деструкции терапевтического(-их) агента(-ов) является возможным, следует назвать температуру, приложенную скорость сдвига, приложенное напряжение сдвига, время пребывания смеси, содержащей терапевтический агент, и технологию смешения полимерного материала с терапевтическим(-ими) агентом(-ами).
Смешение или компаундирование биосовместимого полимера с терапевтическим(-ими) агентом(-ами) и любыми дополнительными добавками с целью получения практически гомогенной смеси данных компонентов может быть осуществлено при помощи любого устройства, известного в уровне техники и обычно применяемого для смешения полимерных материалов с добавками.
В случае применения термопластичных материалов путем нагрева биосовместимого полимера может быть получен расплав полимера, который может быть смешан с различными добавками (например, с терапевтическим(-ими) агентом(-ами), неактивными ингредиентами и др.) с получением смеси. Обычный способ смешения состоит в приложении к смеси биосовместимого(-ых) полимера(-ов) с добавкой(-ами) сдвиговых нагрузок. Устройства, в которых возможно подобное смешение биосовместимого(-ых) полимера(-ов) с добавкой(-ами), включают в себя такие устройства, как одношнековые экструдеры, двухшнековые экструдеры, смесители Бенбери, скоростные смесители, смесители Росса и т.д.
При необходимости (например, среди прочих причин, с целью предотвращения существенной деструкции терапевтического агента) любой(-ые) биосовместимый(-ые) полимер(ы) и различные добавки могут быть подвергнуты предварительному смешению до проведения конечных процессов смешения термопластов и придания им формы.
Например, в различных вариантах осуществления биосовместимый полимер подвергают предварительному компаундированию с рентгенографическим агентом (например, рентгеноконтрастным агентом) в условиях температуры и сдвиговой нагрузки, которые могли бы привести к существенной деструкции терапевтического агента в случае присутствия последнего. Предварительно компаундированный материал затем смешивают с терапевтическим агентом в условиях меньших температуры и сдвиговой нагрузки; из полученной смеси изготавливают депо лекарственного средства, содержащее клонидин. Напротив, в другом варианте осуществления биосовместимый полимер может быть предварительно компаундирован с терапевтическим агентом в условиях пониженных температуры и сдвиговой нагрузки. Затем предварительно компаундированный материал смешивают, например, с рентгеноконтрастным агентом, также в условиях пониженных температуры и сдвиговой нагрузки; из полученной смеси изготавливают депо лекарственного средства.
Условия получения смеси биосовместимого полимера с терапевтическим агентом и другими добавками зависят от множества факторов, в том числе, например, вида использованного(-ых) биосовместимого(-ых) полимера(-ов) и добавки (добавок), а также от типа использованного смесительного устройства.
Например, различные бисовместимые полимеры с целью облегчения смешения при различных температурах обычно подвергают размягчению. В частности, при формовании лекарственной формы, содержащей полимерные ПМГК или ПМК, рентгеноконтрастный агент (например, основной карбонат висмута) и терапевтический агент, предрасположенный к деструкции при нагреве и/или сдвиговых нагрузках, в различных вариантах осуществления ПМГК или ПМК могут быть предварительно смешаны с рентгеноконтрастным агентом при температурах порядка, например, от 150°С до 170°С. Затем с предварительно смешанной композицией смешивают терапевтический агент и подвергают композицию дальнейшей переработке способами переработки термопластов в условиях температуры и сдвиговых нагрузок, существенно меньших обычно применяемых для композиций на основе ПМГК или ПМК. Например, при использовании экструдеров температуру цилиндра и объемную производительность обычно контролируют так, чтобы ограничить сдвиговые усилия и тем самым предотвратить существенную деструкцию терапевтического(-их) агента(- ов). В частности, терапевтический агент и предварительно смешанная композиция могут быть смешаны/компаундированы с применением двухшнекового экструдера при существенном меньших температурах (например, 100-105°С) и существенно меньшей объемной производительности (например, менее 30% полной мощности, что обычно соответствует объемной производительности менее 200 см/мин). Следует отметить, что данная температура переработки является существенно меньшей температуры плавления клонидина, поскольку переработка при температуре плавления клонидина или выше нее проводит к существенной деструкции терапевтического агента. Также следует отметить, что в некоторых вариантах осуществления температура переработки является меньшей, чем температура плавления любых биологически активных соединений, входящих в состав композиции, в том числе терапевтического агента. После компаундирования полученной лекарственной форме придают желаемую геометрическую форму, что также проводится в условиях пониженных температуры и сдвиговых нагрузок.
В других вариантах осуществления биоразлагаемый(-ые) полимер(ы) и один или несколько терапевтических агентов предварительно смешивают с применением технологий, отличающихся от технологий переработки термопластов. Например, биосовместимый полимер может быть растворен в системе растворителей, содержащей один или несколько видов растворителя. В системе растворителей также могут быть растворены или диспергированы любые необходимые агенты (например, рентгеноконтрастный агент, терапевтический агент или оба эти агента). Затем из полученных раствора/дисперсии удаляют растворитель с получением твердого материала. Полученный твердый материал затем в случае необходимости может быть подвергнут гранулированию для дальнейшей переработки с использованием технологий переработки термопластов (например, экструзии).
В другом примере терапевтический агент может быть растворен или диспергирован в системе растворителей, которую затем наносят на уже существующую лекарственную форму (последняя может быть получена с применением множества технологий, в том числе технологии переработки растворов и термопластов; она может содержать множество добавок, в том числе рентгеноконтрастный агент и/или агент повышения вязкости), вследствие чего происходит поглощение терапевтического агента на поверхности или в объеме лекарственной формы. Как и в предыдущем случае, полученный твердый материал затем в случае необходимости может быть подвергнут гранулированию для дальнейшей переработки.
Для получения депо лекарственного средства, содержащего биосовместимый(-ые) полимер(ы), терапевтический(-ие) агент(ы) и рентгеноконтрастный(-ые) агент(ы), обычно может применяться процесс экструзии. Также возможно применение соэкструзии, которая представляет собой процесс придания геометрической формы, пригодный для использования при получении лекарственной формы, содержащей одинаковые или различные слои или участки (например, структуры, содержащей один или несколько слоев или участков полимерной матрицы, обладающих проницаемостью в жидкостях, обеспечивающей возможность немедленного и/или замедленного высвобождения лекарственного средства). Депо лекарственного средства, содержащие множество участков, также могут быть получены с применением других технологий переработки и придания формы, в том числе по технологии совместного или последовательного литья под давлением.
В различных вариантах осуществления депо лекарственного средства, которое может быть получено в результате переработки термопластов (например, ленту, таблетку, полоску и др.) подвергают охлаждению. Примеры процессов охлаждения включают в себя воздушное охлаждение и/или погружение в охладительную баню. В некоторых вариантах осуществления для охлаждения экструдированного депо лекарственного средстваприменяют водяную баню. Однако, если терапевтический агент является водорастворимым, время погружения во избежание нежелательных потерь терапевтического агента в бане должно быть сведено к минимуму.
В различных вариантах осуществления немедленное удаление воды или влаги с применением струй комнатного или теплого воздуха после вынимания из бани также предотвращает рекристаллизацию лекарственного средства на поверхности депо лекарственного средства; тем самым достигается контроль или сведение к минимуму высокой "начальной импульсной дозы" или "болюсной дозы" при имплантации или введении, если подобный профиль высвобождения является нежелательным.
В различных вариантах осуществления депо лекарственного средства может быть изготовлено путем смешения лекарственного средства с полимером или его распыления в полимер и последующего формования депо лекарственного средства с приданием ему требуемой геометрической формы. В различных вариантах осуществления применяют клонидин, который смешивают с ПМГК, сополимером D,L-лактида с капролактоном и/или сополимером D,L-лактида с гликолидом и капролактоном или распыляют в них; при этом полученное депо лекарственного средства может быть формовано путем экструзии и высушено.
Примерный состав включает 0,1-10% клонидина, 75-94% ПМГК и 5-15% мПЭГ. Некоторые из подобных составов высвобождают от 10 до 30% активного ингредиента в течение первых суток и весь или практически весь активный ингредиент к десятым суткам. Некоторые из подобных составов высвобождают от 15 до 25% активного ингредиента в течение первых суток и весь или практически весь активный ингредиент к десятым суткам.
В другом примерном варианте осуществления предложена имплантируемая форма депо лекарственного средства, пригодная для ослабления, профилактики или лечения послеоперационных болей у пациента, нуждающегося в этом. Имплантируемая форма депо лекарственного средства содержит терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли; причем депо лекарственного средства является имплантируемым в участок под кожей с целью ослабления, профилактики или лечения послеоперационных болей. Депо лекарственного средства содержит: 1) один или несколько слоев немедленного высвобождения, способных к высвобождению примерно от 15 примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в лекарственной форме, в течение первого периода, составляющего до 48 часов; 2) один или несколько слоев замедленного высвобождения, способных к высвобождению примерно от 55% примерно до 85% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в лекарственной форме, в течение последующего периода, составляющего от 4 до 10 суток.
В другом примере варианта осуществления предложена имплантируемая форма депо лекарственного средства, причем указанное депо лекарственного средства содержит; 1) терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли; 2) один или несколько слоев немедленного высвобождения, способных к высвобождению болюсной дозы клонидина или его фармацевтически приемлемой соли в участке под кожей; 3) один или несколько слоев замедленного высвобождения, способных к высвобождению эффективного количества клонидина или его фармацевтически приемлемой соли за период, составляющий от 4 до 10 суток. Один или несколько слоев немедленного высвобождения содержат один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание; один или несколько слоев замедленного высвобождения содержит один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание.
Ниже следует более подробное описание настоящего изобретения посредством ссылок на следующие далее примеры, которые приводятся в целях иллюстрации и не ограничивают настоящее изобретение, если не оговаривается иное.
Примеры
Пример 1
Имплантаты, содержащие клонидин, были изготовлены согласно следующим методикам:
Материалы: Сополимер D,L-лактида с гликолидом, обладающий мольным отношением лактида к гликолиду 50:50 (PLGA50501A), молекулярной массой 8 кДа, характеристической вязкостью 0,12 дл/г и концами полимерной цепи, защищенными кислотными группами, был приобретен у компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Клонидин-НСl был приобретен у компании Spectrum Chemicals (Гардена (Gardena), Калифорния, США). Метоксиполиэтиленгликоль (мПЭГ) со средней молекулярной массой 550 был приобретен у компании Sigma-Aldrich. Метанол и ацетон также были получены от Sigm,a-Aldrich.
Использованные методики
Получение клонидина-НСl путем распылительной сушки. Клонидин-НСl растворяли в метаноле с получением 12 мас./мас.% раствора. Раствор подвергали распылительной сушке на распылительной сушилке Buchi B-290 (компания Buchi Laboratorium AG, Швейцария) с применением ультразвукового сопла Sono-Tek (компания Sono-Tek Corp., Милтон (Milton), Нью-Йорк, США) при частоте 120 кГц. Были использованы следующие параметры обработки: температура патрубка для поступающего газа - 70°С, аспиратор - 80%, длина патрубка для поступающего азота - 50 мм, объемная скорость распыления - 80 мл/ч, мощность ультразвукового генератора - 0,8 Вт. Подвергнутый распылительной сушке порошок собирали и дополнительно сушили 24 ч при 70°С и остаточном давлении 15 мм рт.ст.
Изготовление стержней экструзией расплава. Для экструзии из расплава были приготовлены два состава. Оба состава содержали PLGA50501A, размолотую в порошок с применением роторной мельницы Retsch (компания Retsch GmbH, Германия), снабженной сеточным фильтром с размером ячеек 80 мкм. Первый из упомянутых составов содержал 85 мас./мас.% размолотой PLGA50501A, 5 мас./мас.% подвергнутого распылительной сушке клонидина-НСl и 10 мас./мас.% мПЭГ. Второй состав содержал 87,5 мас./мас.% размолотой PLGA50501A, 2,5 мас./мас.% подвергнутого распылительной сушке клонидина-НСl и 10 мас./мас.% мПЭГ. Оба состава перемешивали шпателем в сухом состоянии и затем помещали в двухшнековый экструдер Haake Mini-Lab (компания Thermo Fischer Scientific, Уолтхем (Waltham), Массачусетс, США). Для составов, содержащих 2,5% и 5% клонидина, были использованы следующие параметры экструзии: 70°С и 30 об/мин. Оба состава экструдировали сквозь головку диаметром 1,5 мм.
Изготовление полосок. Экструдированные составы прессовали в листы нужной толщины с применением лабораторного пресса для горячего прессования Carver (компания Carver Inc., Уобаш (Wabash), Индиана, США) при 50°С. Листки разрезали бритвенным лезвием с получением полосок или лент нужного размера. Размеры пластинок или лент были следующими (Д×Ш×Т, Д - длина, Ш - ширина, Т - толщина): 9 мм × 1,5 мм × 0,5 мм для полосок или лент, содержащих 2,5% клонидина, 9 мм × 1,5 мм × 0,5 мм для полосок или лент, содержащих 2,5% клонидина. Следует отметить, что размер полосок или лент был выбран с целью изготовления имплантатов для применения на лапах крыс.
Исследование элюирования лекарственного средства in vitro. Каждый имплантат в виде полоски или ленты исследовали трижды; имплантаты помещали в сцинтилляционные виалы объемом 20 мл. Полоски или ленты, содержащие 5% и 2,5% клонидина, инкубировали в 5 мл физиологического раствора, содержащего фосфатный буфер и обладающего рН 7,4 (компания Hyclone) при 37°С и умеренном перемешивании. В заранее определенные моменты времени буфер отбирали для анализа и заменяли свежей буферной средой. Содержание лекарственного средства количественно определяли по полосе поглощения клонидина при 226 нм на планшет-ридере SpectraMax M2 (компания Molecular Devices, Саннивейл (Sunnyvale), Калифорния, США). На Фиг.3 и 4 показана средняя скорость высвобождения клонидина в микрограммах и процентах для имплантатов в виде полоски или ленты. В частности, на Фиг.3 видно, что полоски, содержащие 5% клонидина, высвобождают больше клонидина (более 450 мкг за 9 суток), чем полоски, содержащие 2,5% клонидина (более 200 мкг за 9 суток). Из Фиг.3 очевидно, что чем больше массовый процент содержания клонидина, тем сильнее высвобождается лекарственное средство. На Фиг.4 видно, что высвобождение из полосок, содержащих 2,5% клонидина, происходит быстрее, чем из полосок, содержащих 5% клонидина, однако высвобождение из полосок, содержащих 5% клонидина, является более равномерным, чем из полосок, содержащих 2,5% клонидина. В таблице 1, следующей далее, приведена совокупность результатов по исследованию профиля элюирования клонидина для полосок, содержащих 5% и 2,5% клонидина.
Исследования in vivo. Полученные клонидиновые имплантаты испытывали на крысах по Бреннану с целью определения их свойств in vivo. Совокупность результатов приведена ниже в Таблице 1.
Во всех имплантатах типа клонидин - 1 и клонидин-2 полимер подвергался деструкции в течение менее чем одного месяца; на ощупь имплантаты представляли собой пластичный и пригодный для формования продукт, пригодный для экструзии с получением продуктов в виде полосок или лент. Эффективность составов, составляющих имплантаты клонидин - 1 и клонидин - 2, испытывали на крысах в соответствии с моделью постинцизионной боли по Бреннану. В качестве поведенческого критерия, позволяющего утверждать о наличии/отсутствии боли у модельных животных после лечения упомянутыми лекарственными составами, использовали механическую гиперальгезию. Имплантаты клонидин - 1 показали статистически значимое ослабление механической гиперальгезии на 2-е и 3-е сутки после применения по сравнению с крысами по Бреннану, не получавшими лечения. При этом имплантаты клонидин - 2 показали статистически значимое прекращение механической гиперальгезии на 2-е, 3-е и 4-е сутки. Данные предварительные исследования in vivo показали, что имплантаты клонидин-1 и клонидин-2 являются эффективными для лечения постинцизионных болей у крыс по Бреннану в соответствии с поведенческим ответом крыс на механические стимулы после лечения клонидиновыми имплантатами. На Фиг.5 показано изменение термического порога отдергивания лап в граммах на сутки после операции (измеренного на - 1-е, 1-е, 2-е, 3-е, 4-е, 6-е, 8-е и 10-е сутки после операции) для имплантатов клонидин-1 и клонидин-2. Данные результаты измерений являются показателем механической гиперальгезии у животных, получавших лечение клонидином. Начиная со вторых суток после имплантации лекарственной формы происходило существенное снижение болевых ощущений (обозначено звездочкой).
Пример 2
Было изготовлено несколько имплантатов в виде полосок или лент, содержащих клонидин, причем тип полимера, содержание лекарственного средства и эксципиента изменяли (в том числе было изготовлено несколько составов без эксципиента). Составы имплантатов в виде полосок или лент описаны ниже в Табл. 2. На данных имплантатах в виде полосок или лент было выполнено определенное количество исследований, в том числе испытания высвобождения ni vitro, в которых измеряли высвобожденное количество в микрограммах и процентное кумулятивное высвобождение клонидина. Результаты упомянутых исследований показаны на Фиг.6-13.
Материалы: Сополимер D,L-лактида с гликолидом, обладающий мольным отношением лактида к гликолиду 50:50, молекулярной массой 18 кДа, логарифмическим числом вязкости 0,2 дл/г и концами полимерной цепи, защищенными кислотными группами (5050DLG2A), был приобретен у компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Сополимер D.L-лактида с капролактоном, обладающий мольным отношением лактида к капролактону 10:90, молекулярной массой 149 кДа, логарифмическим числом вязкости 1,0 дл/г и концами полимерной цепи, защищенными кислотными группами (1090 DLCL 10A), был приобретен у компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Сополимер D,L-лактида с капролактоном, обладающий мольным отношением лактида к капролактону 65:35, молекулярной массой 51 кДа, логарифмическим числом вязкости 0,4 дл/г и концами полимерной цепи, защищенными кислотными группами (6535 DLCL 4A), был получен от компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Сополимер D.L-лактида с капролактоном, обладающий мольным отношением лактида к капролактону 25:75, молекулярной массой 62 кДа, логарифмическим числом вязкости 0,5 дл/г и концами полимерной цепи, защищенными кислотными группами (2575 DLCL 5A), был приобретен у компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Клонидин-НСl был приобретен у компании Spectrum Chemicals (Гардена (Gardena), Калифорния, США). Плюроник F127, представляющий собой неионогенный поверхностно-активный блок-сополимер оксиэтилена с оксипропиленом (также известный как Полоксамер 407), был получен от компании BASF. Метанол и ацетон были получены от компании Sigma-Aldrich.
Способ изготовления имплантатов в виде полосок. Некоторые составы были изготовлены в соответствие с изложенным ниже способом; состав данных композиций приведен ниже в Таблице 2 в соответствии с номером партии. Для каждого состава полимер, клонидин и эксципиент (при наличии такового) взвешивали в стеклянных лиофилизационных колбах. В колбы добавляли ледяную уксусную кислоту и обрабатывали колбы ультразвуком примерно 45 мин с целью растворения всех компонентов (примерно 5 граммов твердых веществ на 80 мл уксусной кислоты). Затем раствор подвергали поверхностному замораживанию на бане с изопропиловым спиртом и сухим льдом. Замороженный материал после этого подвергали лиофильной сушке в течение 24-72 ч с целью удаления ледяной уксусной кислоты. Полученный промежуточный материал в виде блока затем прессовали с получением тонких пленок или листов с применением лабораторного пресса для горячего прессования Carver (компания Carver Inc., Уобаш (Wabash), Индиана, США). Пленки или листы получали с применением прокладки толщиной 0,25 мм при 65°С и прессовали в течение 1 мин при давлении 5000 фунтов/дюйм2 (34,47 МПа). Листы из каждого состава нарезали бритвенным лезвием с получением полосок или лент необходимого размера. Размеры всех полосок или лент составляли 10 мм в длину, 2 мм в ширину и 0,4 мм в толщину, что подходит по размерам для лапы крысы. Состав композиций, использованных для изготовления полосок или лент, приведен ниже в Таблице 2 в соответствии с номером партии; среднее количество клонидина, высвобожденное в сутки полосками или лентами, изготовленными из каждого вида состава, также представлены ниже в Таблице 2.
Были отмечены тактильные свойства полосок или лент из партий, номера которых приведены в Табл. 2. В частности, все полоски или ленты партий №00268-15, 00268-22, 00268-23 и 00268-24 оказались очень гибкими. Полоски партий №00268-15 оказались прочными, полоски из партии №00268-22 - мягкими, полоски из партий №00268-23 и 00268-24 - клейкими. Все полоски из партий №00268-31, 00268-32, 00268-33, 00268-34 и 00268-35 оказались очень гибкими.
Исследование элюирования лекарственного средства in vitro. Каждую полоску из партий, номера которых приведены в Табл. 2, испытывали трижды; для исследования элюирования лекарственного средства полоски помещали в сцинтилляционные виалы объемом 4 мл. Каждую полоску или ленту инкубировали в 2 мл физиологического раствора, содержащего фосфатный буфер и обладающего рН 7,4 (компания Hyclone) при 37°С и умеренном перемешивании. В заранее определенные моменты времени буфер отбирали для анализа и заменяли свежей буферной средой. Содержание лекарственного средства количественно определяли способом ВЭЖХ. На фиг.6 и 7 показан график изменения средней скорости высвобождения клонидина в процентах и микрограммах соответственно для полосок из партий, номера которых приведены в Табл. 2, в течение 1-8 суток. На Фиг.8 и 9 показан график изменения средней скорости высвобождения клонидина в процентах и микрограммах соответственно для полосок из партий №00268-15, 00268-24, 00268-31 и 00268-35 из Табл. 2 в течение 1-8 суток. На Фиг.10 и 11 показан график изменения средней скорости высвобождения клонидина в процентах и микрограммах соответственно для полосок из партий №00268-15, 00268-22, 00268-31, 00268-32 и 00268-33 из Табл. 2 в течение 1-14 суток. На Фиг.12 и 13 показан график изменения средней скорости высвобождения клонидина в процентах и микрограммах соответственно для полосок из партий №00268-24,00268-34,00268-35 и 00268-36 из Табл. 2 в течение 1-14 суток.
Авторам настоящего изобретения удалось достичь широкого интервала профилей высвобождения, в том числе получить несколько составов с импульсным начальным высвобождением и несколько составов с постоянным линейным высвобождением. Данные составы были с успехом применены для достижения высвобождения лекарственного средства по меньшей мере в течение 14 суток.
Пример 3
Было изготовлено несколько имплантатов на основе клонидина-HCl, в которых изменяли содержание лекарственного средства. Примерные составы имплантатов в виде полосок или лент приведены ниже в Табл. 3. На данных имплантатах в виде полосок или лент было выполнено определенное количество исследований, в том числе испытания высвобождения in vitro, в которых измеряли высвобожденное количество в микрограммах и процентное кумулятивное высвобождение клонидина. Результаты упомянутых исследований показаны на Фиг.14.
Материалы. Сополимер 0,1.-лактида с гликолидом, обладающий мольным отношением лактида к гликолиду 50:50, молекулярной массой 8 кДа, логарифмическим числом вязкости 0,12 дл/г и концами полимерной цепи, защищенными кислотными группами (5050 DLG 1А), был приобретен у компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Клонидин-НСl был приобретен у компании Spectrum Chemicals (Гардена (Gardena), Калифорния, США). Метоксиполиэтиленгликоль (мПЭГ) со средней молекулярной массой 550 был приобретен у компании Sigma-Aldrich. Метанол и ацетон также были приобретены у Sigma-Aldrich.
Обработка клонидина-НСl путем распылительной сушки. Клонидин-НСl растворяли в метаноле с получением 12 мас./мас.% раствора. Раствор подвергали распылительной сушке на распылительной сушилке Buchi B-290 (компания Buchi Laboratorium AG, Швейцария) с применением ультразвукового сопла Sono-Tek (компания Sono-Tek Corp., Милтон (Milton), Нью-Йорк, США) при частоте 120 кГц. Были использованы следующие параметры обработки: температура патрубка для поступающего газа - 70°С, аспиратор - 80%, длина патрубка для поступающего азота -50 мм, объемная скорость распыления - 80 мл/ч, мощность ультразвукового генератора - 0,8 Вт. Подвергнутый распылительной сушке порошок собирали и дополнительно сушили 24 ч при 70°С и остаточном давлении 15 мм рт.ст.
Изготовление стержней экструзией расплава. Для экструзии из расплава были приготовлены несколько составов. Все составы содержали 5050 DLG 1A, размолотый в порошок с применением роторной мельницы Retsch (компания Retsch GmbH, Германия), снабженной сеточным фильтром с размером ячеек 80 мкм. Все составы содержали 10 мас./мас.% мПЭГ. Остальная часть каждого состава содержала полимерный 5050 DLG 1A и клонидин-HCl в массовых процентных долях, приведенных ниже в Табл. 3. Составы перемешивали шпателем в сухом состоянии и затем помещали в двухшнековый экструдер Haake Mini-Lab (компания Thermo Fischer Scientific, Уолтхем (Waltham), Массачусетс, США). Для всех составов были использованы следующие параметры экструзии: 70°С и 30 об/мин. Все составы экструдировали сквозь головку диаметром 1,5 мм.
Изготовление полосок. Экструдированные составы прессовали в листы нужной толщины с применением лабораторного пресса для горячего прессования Carver (компания Carver Inc., Уобаш (Wabash), Индиана, США) при температуре 50°С. Листы разрезали бритвенным лезвием с получением имплантатов в виде полосок или лент размеров, подходящих для лапы крысы. Размеры полосок или лент, изготовленных из составов, приведены ниже в Табл. 3.
Исследование элюирования лекарственного средства in vitro. Клонидиновые имплантаты в виде полосок или лент, изготовленные из составов, приведенных в Табл. 3, испытывали трижды; для исследования элюирования лекарственного средства имплантаты помещали в сцинтилляционные виалы объемом 20 мл. Каждую полоску или ленту инкубировали в 5 мл физиологического раствора, содержащего фосфатный буфер и обладающего рН 7,4 (компания Hyclone) при 37°С и умеренном перемешивании. В заранее определенные моменты времени буфер отбирали для анализа и заменяли свежей буферной средой. Содержание лекарственного средства количественно определяли по полосе поглощения клонидина при 226 нм на планшет-ридере SpectraMax M2 (компания Molecular Devices, Саннивейл (Sunnyvale), Калифорния, США). Содержание лекарственного средства для полосок, изготовленных из составов, приведено в Табл. 3. На Фиг.14 показан график изменения средней процентной скорости высвобождения клонидина для полосок, изготовленных из составов №13335-76-4а, 13335-76-4d, 13335-76-5a, 13335-76-5(1 и 13335-76-6 из Табл. 3 в течение 1-12 суток. Были успешно получены составы, обладающие необходимым профилем высвобождения клонидина in vitro в течение по меньшей мере 11 суток (Фиг.14).
Пример 4
Был получен гелевый состав, содержащий клонидин-HCl. Измеренное среднее процентное кумулятивное высвобождение клонидина in vitro показано на Фиг.15.
Получение геля ПМК: деполимеризация полимолочной кислоты додеканолом
В круглодонную колбу объемом 100 мл помещали полимолочную кислоту (характеристическая вязкость 5,71, масса 15,0 г), 4-диметиламинопиридин (масса 9,16 г) и додеканол (масса 5,59 г), насыщали инертным газом, закрывали резиновой мембраной и помещали на масляную баню при 140°С. Вещества нагревали при данной температуре в течение 30 мин после полного плавления при беспрепятственном перемешивании магнитной мешалкой. После охлаждения в колбу добавляли 15 мл тетрагидрофурана с целью растворения веществ и осуществляли осаждение путем добавления гептана. После декатирования вещества растворяли в хлороформе (30 мл) и промывали соляной кислотой (1 М, 20 мл, трижды) и рассолом (один раз). Раствор сушили над безводным сульфатом натрия. После удаления растворителя в роторном испарителе получили масло желтого цвета (Мn примерно 800 г/моль, определено путем анализа концевых групп с применением Н-ЯМР).
Способ получения гелевых составов, содержащих клонидин-HCl. Был получен состав, содержащий 99 мас./мас.% геля ПМК и 1 мас./мас.% клонидина-HCl, подвергнутого распылительной сушке. Компоненты добавляли в чашку объемом 2 см3 и перемешивали в скоростном смесителе DAC 150 FVZ компании Flacktek Inc. в течение 2 мин. Перемешанный состав затем извлекали шприцем компании BD объемом 1 мл с иглой 18 калибра длиной 1,5 дюйма (3,81 см) с тупым концом.
Исследование элюирования лекарственного средства in vitro. С целью исследования элюирования лекарственного средства 100 мкл гелевого состава помещали в сцинтилляционный виал объемом 20 мл. Состав исследовали трижды; его инкубировали в 10 мл фосфатного буфера, содержащего 0,5 мас./мас.% додецилсульфата натрия, при рН 7,4, 37°С и умеренном перемешивании. В заранее определенные моменты времени буфер отбирали для анализа и заменяли свежей буферной средой. Содержание лекарственного средства количественно определяли по полосе поглощения клонидина при 226 нм на планшет-ридере SpectraMax M2 (компания Molecular Devices, Саннивейл (Sunnyvale), Калифорния, США). Полученный состав (№ состава 13699-13-2) содержал 1% клонидина-HCl. На Фиг.15 показано изменение среднего процентного кумулятивного высвобождения клонидина в сутки для трех исследованных образцов состава.
Пример 5
Был получен состав, содержащий клонидин-HCl; на полосках или лентах, изготовленных из данного состава, было выполнено определенное количество исследований, в том числе исследования высвобождения in vitro, в которых определяли высвобожденное количество в микрограммах и процентное кумулятивное высвобождение клонидина. Результаты упомянутых исследований приведены на Фиг.16-19.
Материалы. Сополимер D,L-лактида с гликолидом, обладающий мольным отношением лактида к гликолиду 50:50, молекулярной массой 8 кДа, логарифмическим числом вязкости 0,12 дл/г и концами полимерной цепи, защищенными кислотными группами (5050 DLG 1A), был приобретен у компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Сополимер D,L-лактида с гликолидом, обладающий мольным отношением лактида к гликолиду 50:50, молекулярной массой 58 кДа, логарифмическим числом вязкости 0,43 дл/г и концами полимерной цепи, защищенными кислотными группами (5050 DLG 4A), был приобретен у компании Lakeshore Biomaterials (Бирмингем (Birmingham), Алабама, США). Клонидин-НСl был приобретен у компании Spectrum Chemicals (Гардена (Gardena), Калифорния, США). Метоксиполиэтиленгликоль (мПЭГ) со средней молекулярной массой 550 был получен от компании Sigma-Aldrich. Метанол также был приобретен у Sigma-Aldrich.
Обработка клонидина-НСl путем распылительной сушки. Клонидин-НС! растворяли в метаноле с получением 12 мас./мас.% раствора. Раствор подвергали распылительной сушке на распылительной сушилке Buchi B-290 (компания Buchi Laboratorium AG, Швейцария) с применением ультразвукового сопла Sono-Tek (компания Sono-Tek Corp., Милтон (Milton), Нью-Йорк, США) при частоте 120 кГц. Были использованы следующие параметры обработки: температура патрубка для поступающего газа - 70°С, аспиратор - 80%, длина патрубка для поступающего азота -50 мм, объемная скорость распыления - 80 мл/ч, мощность ультразвукового генератора - 0,8 Вт. Подвергнутый распылительной сушке порошок собирали и дополнительно сушили 24 ч при 70°С и остаточном давлении 15 мм рт.ст.
Изготовление стержней экструзией расплава. Составы, содержащие 25 мас.% 5050 DLG 1A и 64,5 мас.% 5050 DLG 4A, размалывали в порошок с применением роторной мельницы Retsch (компания Retsch GmbH, Германия), снабженной сеточным фильтром с размером ячеек 80 мкм. Полимерный порошок смешивали шпателем в сухом состоянии с 10 мас.% мПЭГ и затем помещали в лабораторный смеситель для пластмасс (компания Dynisco, Франклин (Franklin), Массачусетс, США), работающий при 70°С и максимальном числе оборотов. Полимерную смесь подвергали смешению в расплаве в течение 5 мин. Затем к расплаву полимера добавляли 0,5 мас.% клонидина-НС1, подвергнутого распылительной сушке, и перемешивали 3 мин в смесителе для пластмасс при 70°С и максимальном числе оборотов.
Изготовление полосок. Перемешанные составы прессовали в листы толщиной 0,5 мм с применением лабораторного пресса для горячего прессования Carver (компания Carver Inc., Уобаш (Wabash), Индиана, США) при температуре 50°С.Листы разрезали бритвенным лезвием с получением полосок/лент необходимых размеров. Имплантаты в виде полосок, содержащие 25 мас.% 5050 DLG 1A, 64,5 мас.% 5050 DLG 4A, 10 мас.% мПЭГ и 0,5% клонидина-HCl, подвергнутого распылительной сушке, затем исследовали на предмет высвобождения in vitro.
Исследование элюирования лекарственного средства in vitro. С целью исследования элюирования лекарственного средства три клонидиновых имплантата в форме полосок, изготовленных способом, описанным в настоящем примере, и имеющих размеры 20 мм × 5 мм × 0,5 мм, помещали в сцинтилляционные виалы объемом 20 мл. Клонидиновые полоски инкубировали в 5 мл физиологического раствора, содержащего фосфатный буфер и обладающего рН 7,4 (компания Hyclone), при 37°С и умеренном перемешивании. В заранее определенные моменты времени буфер отбирали для анализа и заменяли свежей буферной средой. Содержание лекарственного средства количественно определяли по полосе поглощения клонидина при 226 нм на планшет-ридере SpectraMax M2 (компания Molecular Devices, Саннивейл (Sunnyvale), Калифорния, США).
Фиг.16 и 17 представляют собой графики изменения процентного кумулятивного высвобождения трех стерилизованных клонидиновых имплантатов в виде полосок. Как легко понять из упомянутых чертежей, каждая полоска высвобождала от 90% до 100% клонидина за 14 суток со среднесуточным высвобождением лекарственного средства, составляющим 5-10%. Среднее кумулятивное высвобождение трех полосок показано на Фиг.17, причем в течение 14 суток происходило высвобождение 95% лекарственного средства.
Фиг.18 и 19 представляют собой графики среднесуточного профиля высвобождения клонидина тремя стерилизованными клонидиновыми имплантатами в форме полосок и изменения их среднесуточного кумулятивного высвобождения в микрограммах в сутки. Как видно из упомянутых фигур, каждое депо лекарственного средства характеризовалось начальным импульсным эффектом, причем доза клонидина-HCl, высвобожденная в течение примерно одних суток, составляла примерно от 45 до 60 мкг. По истечении первых суток каждое депо лекарственного средства высвобождало примерно 5-35 мкг в сутки до исчерпания депо лекарственного средства на 14-е сутки.
Пример б. Оценка эффективности клонидиновых имплантатов in vivo путем модельных операций на свиньях
Индуцирование послеоперационных болей у поросят.Поросят обезболивали смесью изофлурана с кислородом, вводимой через маску на морде. На правом бедре у паховой области делали надрез кожи и оболочки мышц длиной 5 см; мышцы оставляли неповрежденными. Надрез на коже закрывали металлическими скрепками. Длительность анестезии составляла менее 10 мин. Немедленно после выполнения надреза внутрь области надреза животным вводили контрольные и содержащие лекарственное средство имплантаты. Животным, составившим морфиновую группу (положительный контроль), подкожно вводили морфин.
Оценка анальгезии. Анальгетическое действие клонидиновых имплантатов оценивали с использованием поведенческого показателя болевых ощущений. Система оценки боли являлась суммой следующих трех основных категорий:
1. Индивидуального поведения животных (ходьбы и голоса);
2. Поведения животных в группе;
3. Времени, в течение которого животным были наложены повязки.
Наблюдения над всеми животными проводили на исходном уровне (за 3 суток до операции), и через 1 и 3 ч после операции (нулевые сутки исследования). Затем ежедневно в течение еще 4 суток (1-е, 2-е, 3-е и 4-е сутки исследования) оценивали поведение, связанное с болью. Имплантаты вводили на поверхность хирургической раны в течение нулевых суток исследования непосредственно после проведения операции. Животным морфиновой группы (Мог) морфин вводили за час до оценки болевых ощущений.
Результаты. На Фиг.20 показана оценка эффективности in vivo клонидиновых имплантатов, содержащих повышенную (1500 мкг на лекарственную форму, предполагаемое высвобождение составляет 150 мкг/сут) дозу лекарственного средства, и клонидиновых имплантатов, содержащих пониженную (750 мкг на лекарственную форму, предполагаемое высвобождение составляет 75 мкг/сут) дозу лекарственного средства; эффективность имплантатов определяли по показателям болевых ощущений по истечении 0 ч (исходный уровень), 1 ч, 3 ч, 1 суток, 2 суток, 3 суток и 4 суток после начала лечения. Свиньи, получавшие клонидиновые имплантаты с пониженной дозой, отличались существенно меньшими болевыми показателями на нулевые сутки через 1 ч и 3 ч после начала лечения и на 1-е и 2-е сутки после начала лечения по сравнению со свиньями, получавшими контрольный полимер. Действие клонидиновых имплантатов с пониженной дозой на 3-е и 4-е сутки не был определен, поскольку в данной модели послеоперационная боль утихала примерно на 3-е - на 4-е сутки. Клонидиновые имплантаты с пониженной дозой продемонстрировали статистически значимое ослабление боли на 1-е и 2-е сутки по сравнению с контрольным полимером. На Фиг.20 также показано действие морфина во все исследованные моменты времени.
Свиньи, получавшие клонидиновый имплантат с повышенной дозой, отличались существенно меньшими показателями болевых ощущений через 1 ч и 3 ч после начала лечения и на 1-е и 2-е сутки после начала лечения по сравнению со свиньями, получавшими контрольный полимер. Из Фиг.20 также легко понять, что показатель болевых ощущений для свиней, получавших клонидиновый имплантат с повышенной дозой, также снижался во все моменты времени по сравнению с контрольным полимером.
Вывод. Из результатов, полученных в условиях данного исследования, следует, что лечение клонидиновыми имплантатами с повышенной и пониженной дозами оказалось эффективным при ослаблении послеоперационных болей у свиней.
Специалисту в данной области техники понятно, что различные варианты осуществления, описанные в настоящей заявке, могут быть подвергнуты различным модификациям и изменениям при отсутствии выхода за рамки смысла настоящего описания или его объема. Поэтому предполагается, что упомянутые различные варианты осуществления охватывают остальные модификации и изменения различных вариантов осуществления, входящие в объем настоящего изобретения.






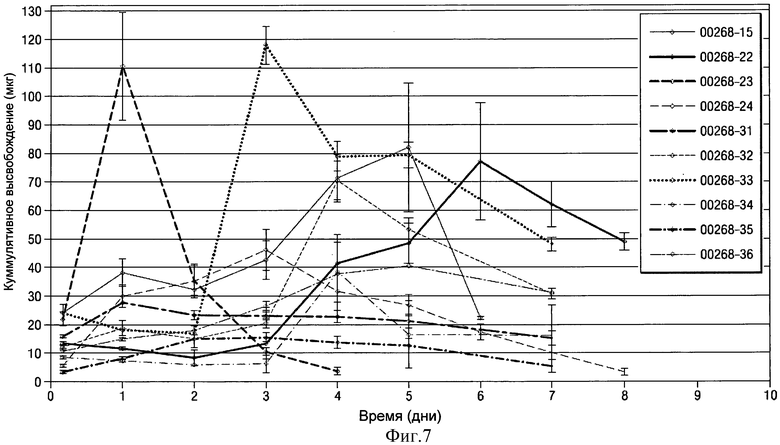

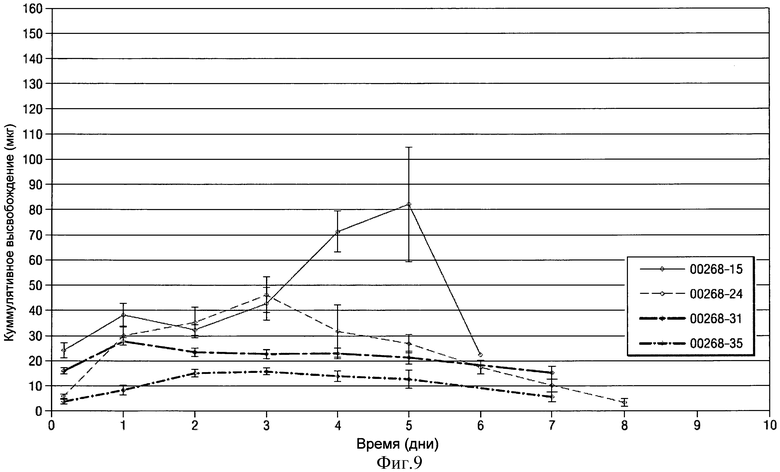
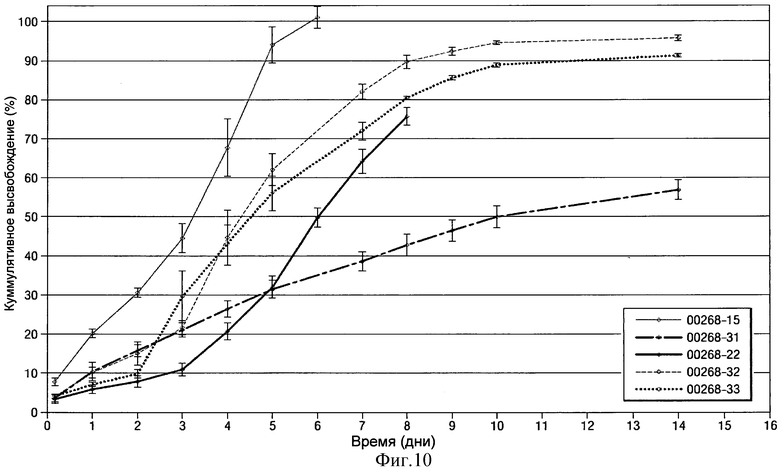
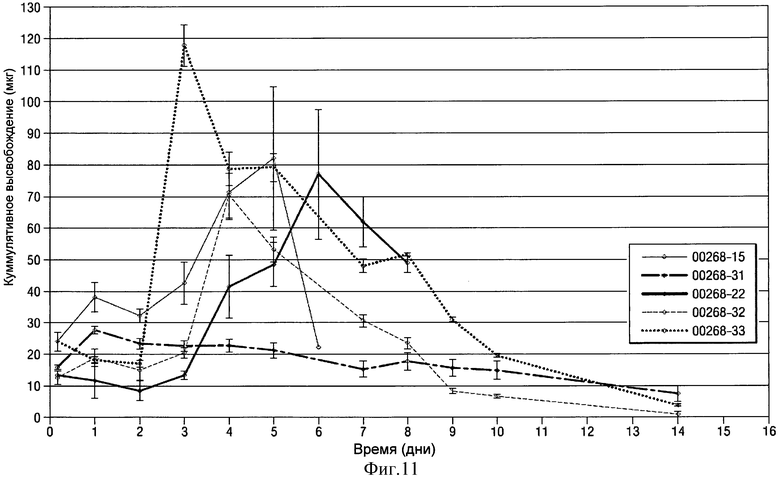

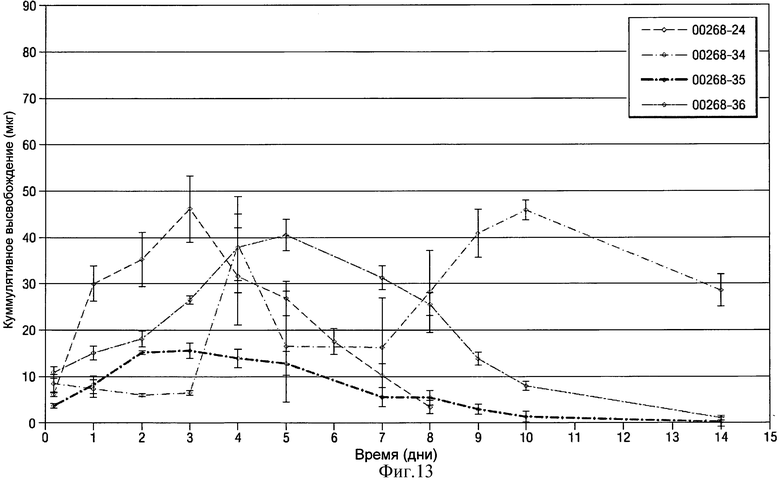



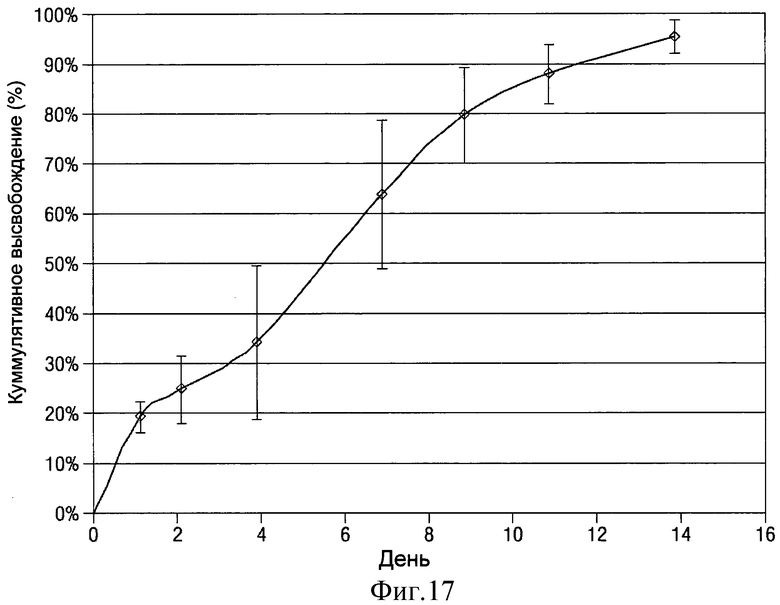

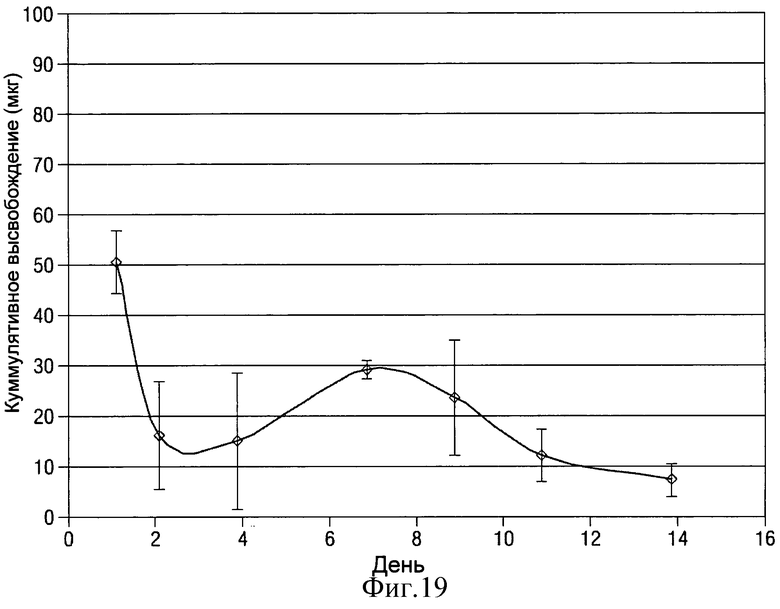
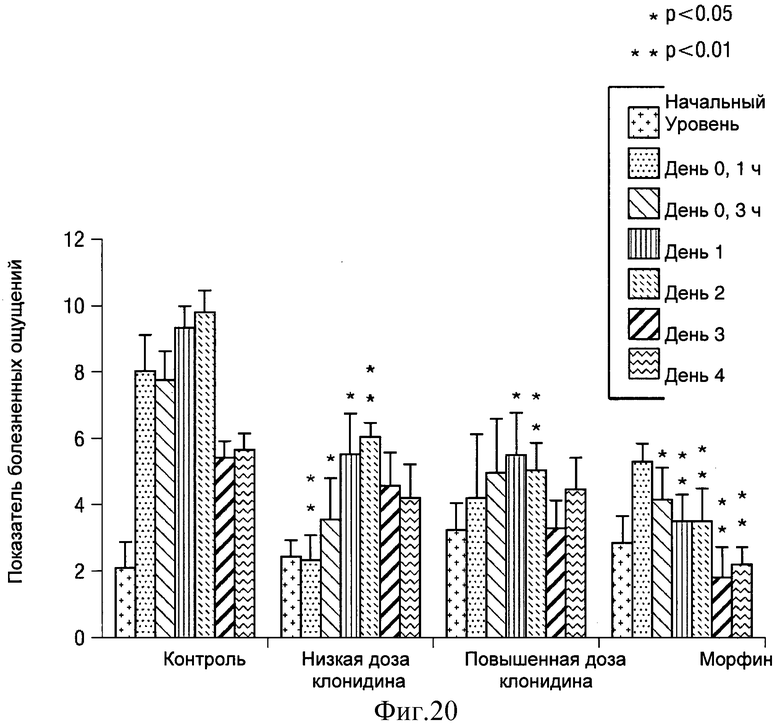
Изобретение относится к имплантируемой форме депо лекарственного средства, пригодной для ослабления, профилактики или лечения послеоперационной боли у пациента, нуждающегося в подобном лечении, причем имплантируемая форма депо лекарственного средства содержит терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли и полимер, причем депо лекарственного средства является имплантируемым в участок под кожей с целью ослабления, профилактики или лечения послеоперационных болей и при этом депо лекарственного средства способно к высвобождению: 1) примерно от 5% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо, в течение первого периода, составляющего до 48 часов; 2) примерно от 55% примерно до 95% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо, в течение последующего периода, составляющего по меньшей мере 3 суток. Имплантируемая форма обеспечивает легкую возможность аккуратной точной имплантации депо лекарственного средства при минимальных физических и психологический травмах для пациента. 3 н. и 12 з.п. ф-лы, 2 табл., 20 ил., 6 пр.
1. Имплантируемая форма депо лекарственного средства, пригодная для ослабления, профилактики или лечения послеоперационных болей у пациента, нуждающегося в подобном лечении, причем имплантируемая форма депо лекарственного средства содержит терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли в количестве от 0,1 вес.% до 10 вес.% от общего веса указанного депо и полимер, причем депо лекарственного средства является имплантируемым в участок под кожей с целью ослабления, профилактики или лечения послеоперационных болей, и указанное депо лекарственного средства обладает поверхностью для пикового высвобождения лекарственного средства и способно к высвобождению: 1) от 5% до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо, в течение первого периода, составляющего до 48 ч; 2) от 55% до 95% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо, в течение последующего периода, составляющего по меньшей мере 3 суток, где указанный полимер содержит поликапролактон, при этом указанный полимер обладает характеристической вязкостью от 0,45 дл/г до 1,00 дл/г.
2. Имплантируемая форма депо лекарственного средства по п.1, отличающаяся тем, что указанный клонидин присутствует в виде гидрохлорида клонидина.
3. Имплантируемая форма депо лекарственного средства по п.1, отличающаяся тем, что полимер составляет от 60% до 90% от общей массы лекарственной формы.
4. Имплантируемая форма депо лекарственного средства по п.1, отличающаяся тем, что полимер является способным к деструкции в течение 30 суток или менее после имплантации депо на место применения.
5. Имплантируемая форма депо лекарственного средства по п.1, отличающаяся тем, что количество высвобожденного клонидина составляет от 0,05 мкг до 3 мг в сутки за период от 3 до 10 суток.
6. Имплантируемая форма депо лекарственного средства по п.1, отличающаяся тем, что клонидин содержится в количестве от 0,1 до 10 вес.% от массы имплантируемого депо лекарственного средства, тем, что полимер содержится в количестве от 75 до 94 вес.% от массы имплантируемого депо лекарственного средства, и тем, что депо лекарственного средства также содержит от 5 до 15 вес.% наполнителя.
7. Имплантируемая форма депо лекарственного средства по п.1, отличающаяся тем, что клонидин содержится в количестве от 0,1 до 10 вес.% от массы имплантируемого депо лекарственного средства, тем, что полимер содержит поликапролактон в количестве от 75 до 94 вес.%, от массы имплантируемого депо лекарственного средства, и тем, что депо лекарственного средства также содержит от 5 до 15 вес.% мПЭГ.
8. Способ лечения или профилактики послеоперационных болей у пациента, нуждающегося в подобном лечении, включающий доставку одной или нескольких биоразлагаемых форм депо лекарственного средства, содержащих терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли, в целевой участок тканей под кожу до, во время или после операции, причем депо лекарственного средства способно к высвобождению в участок под кожей начальной пиковой дозы клонидина или его фармацевтически приемлемой соли с последующим замедленным высвобождением дозы эффективного количества клонидина или его фармацевтически приемлемой соли за период по меньшей мере в 3 суток, и причем депо лекарственного средства содержит поликапролактон.
9. Способ лечения или профилактики послеоперационных болей по п.8, отличающийся тем, что депо лекарственного средства осуществляет высвобождение от 55 до 85% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина, содержащемуся в депо, за период, составляющий от 3 до 10 суток после применения лекарственной формы к целевому участку тканей.
10. Способ лечения или профилактики послеоперационных болей по п.8, отличающийся тем, что депо лекарственного средства осуществляет высвобождение от 0,05 мкг/сут до 3 мг/сут клонидина или его фармацевтически приемлемой соли за период от 4 до 10 суток.
11. Имплантируемая форма депо лекарственного средства, пригодная для ослабления, профилактики или лечения послеоперационных болей у пациента, нуждающегося в подобном лечении, содержащая: 1) терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли; 2) полимер, причем депо лекарственного средства способно к высвобождению в участок под кожей начальной пиковой дозы клонидина или его фармацевтически приемлемой соли; причем депо лекарственного средства способно к замедленному высвобождению дозы эффективного количества клонидина или его фармацевтически приемлемой соли за последующий период, составляющий от 3 до 10 суток, а указанный полимер содержит поликапролактон.
12. Имплантируемая форма депо лекарственного средства по п.11, отличающаяся тем, что депо лекарственного средства осуществляет высвобождение от 55 до 85% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина, содержащемуся в депо, за период, составляющий от 3 до 10 суток после применения лекарственной формы.
13. Имплантируемая форма депо лекарственного средства по п.11, отличающаяся тем, что депо лекарственного средства осуществляет высвобождение от 0,05 мкг в сутки до 3 мг в сутки клонидина или его фармацевтически приемлемой соли.
14. Имплантируемая форма депо лекарственного средства по п.11, отличающаяся тем, что полимер составляет от 60% до 90% от общей массы депо.
15. Имплантируемая форма депо лекарственного средства по п.11, отличающаяся тем, что начальная болюсная доза составляет от 15% до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина, содержащемуся в депо.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ИМПЛАНТИРУЕМАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) И СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ | 2000 |
|
RU2271196C2 |
| FILOS К S ЕТ AL, Hemodynamic and analgesic profile after intrathecal clonidine in humans | |||
| A dose-response study, Anesthesiology | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Абсорбционная многоэтажная башня | 1923 |
|
SU3557A1 |
Авторы
Даты
2014-03-27—Публикация
2009-04-17—Подача