Изобретение относится к медицине, а именно к комбустиологии, хирургии, косметологии и может найти применение в качестве биопластического материала для замещения дефектов покровных тканей (защиты от испарения и проникновения инфекции) и стимуляции регенерации.
Разработка и изучение новых биодеградируемых, пластических и биосовместимых материалов, предназначенных для эффективной органоспецифической регенерации с высоким функциональным и эстетическим результатом, является актуальной проблемой современной регенеративной медицины и трансплантологии. Очевидно, что новые материалы должны отвечать требованиям соответствия специфической морфологии реципиентных тканей и способствовать их функциональному восстановлению (Bioartificial organs, 1999; Биосовместимость, 1999; Sudesh et al., 2000; 2004; Biopolymers for Medicinal and Pharmaceutical Applications, 2005).
В настоящее время активно развивается новейшее направление медицинской биоинженерии по созданию тканеинженерных конструкций и биоискусственных органов на основе биоматериалов с новыми функциональными свойствами, так называемые гистоэквивалент-биопластические материалы (ГЭБ) (Шумаков, 1995; Шумаков с соавт., 2003; Штильман, 2006). Ключевым свойством таких материалов является их способность к биодеградации естественными метаболическими путями в организме с включением промежуточных и конечных продуктов в биохимические циклы без их системного и локального накопления, как, например, молочная и гликолевая кислоты включаются в цикл Кребса. При этом такие продукты не должны быть токсичными, а их концентрация в кровяном русле не должна превышать предельно допустимый уровень (Волова Т.Г., 2003).
Физиологическая метаболизация биоматериалов, составляющих каркасную основу тканеинженерных конструкций, предопределяет сбалансированность репаративных процессов без выраженных явлений воспалительных реакций и предупреждает явление иммунного отторжения, избегая при этом ответа организма на инородное тело (Шишацкая Е., 2011).
Разработка новых гистоэквивалент-биопластических материалов (БМ) основывается на изучении кинетики биоразрушения и динамики его прочностных свойств, а также на оценке влияния и характер регенеративного процесса. Характер и степень выраженности этого воздействия определяются совокупностью физико-химических свойств собственно материала и интенсивностью ответных физиолого-биохимических реакций организма-реципиента.
Поэтому разработка новых биодеградируемых материалов с максимальной степенью биохимической комплементарности базируется на создании матриц, состоящих из макромолекулярных комплексов, доступных для собственных энзимных систем организма и других лизирующих агентов.
В связи с чем идеальный вариант биодеградируемого материала должен отвечать следующим требованиям.
1. Макромолекулярная конструкция с программированным периодом биодеградации естественными метаболическими путями, не являющаяся объектом иммуно-воспалительных реакций.
2. Включение промежуточных и/или конечных продуктов биометаболизации материала в механизмы регенерации на этапе сигнального хемотаксиса защитных клеток организма.
3. Максимальное соответствие временного периода биодеградации материала и длительности репаративного процесса.
Таким образом, с позиции оптимального иммуно-биохимического комплаэнса выполнение вышеуказанных требований по разработке новых биодеградируемых материалов обеспечивало бы оптимальный морфологический и функциональный результат органоспецифического гистогенеза.
Ранние исследования по разработке биодеградируемых материалов были сфокусированы на натуральных полимерах (коллаген, целлюлоза и др.), в последующем - на продуктах химического синтеза. Примерами таких биодеградируемых полимеров являются полиангидриды, полиэфиры, полиакрилы, поли (метилметакрилаты), полиуретаны. Было выделено несколько ключевых факторов, позволяющих контролировать растворение материала: гидрофильность/гидрофобность, аморфность/кристалличность, молекулярный вес, наличие гетероатомов (например, помимо углерода) (Хлусов И.А., 2007).
Естественно, что наиболее перспективными являются материалы, при расщеплении которых образуются природные мономеры. Например, полилактиды, полигликолиды, полиоксиалканоаты и их сополимеры расщепляются соответственно до молочной, гликолевой, оксимасляной кислот, из которых в цикле Кребса образуются вода и углекислый газ, выводящиеся из организма естественным путем.
Прототипом данного изобретения является наноструктурированный биопластический материал (Патент РФ№2425694 опубл. 10.08.11 г.), включающий в себя нативную форму гиалуроновой кислоты, а основой является наноструктурированная матрица, представляющая собой наноструктурированную гиалуроновую кислоту, полученную путем фотохимической сшивки, имеющую ячеистое строение в диапазоне от 50 до 100 нм.
Подобная структурная организация макромолекул гиалуроновой кислоты и коллагена придает биоматериалу эластичность, повышенную адгезию, дренажные качества, прозрачность.
Однако полученная таким образом макромолекулярная структура биопластического материала в клинических условиях является недостаточно эффективной.
1. По структуре данный материал является монофазным, вследствие чего в условиях раневого процесса он образует однородное покрытие, превращаясь, таким образом, в сухой струп (Рахматуллин P.P. Биопластический материал на основе гиалуроновой кислоты: биофизические аспекты фармакологических свойств. // Фармации. - 2011. - №4. - С.37-39). По отзывам клиницистов, однородный сухой биологический струп требует ежедневных перевязок с обязательным увлажнением струпа, что в итоге приводит к затягиванию сроков заживления и рубцовым изменениям с ограничением функций, например, в области суставов.
2. Сложная наноструктурная организация биоматериала значительно затрудняет процесс его биометаболизации в ране, т.е. по мере заживления он не рассасывается и становится причиной для присоединения вторичной инфекции и, как следствие, осложненного течения раневого процесса. Соответственно требуется удаление материала из раны при перевязках, а поскольку сухой струп прочно спаивается с подлежащими тканями, то данная процедура является травматичной для раны и болезненной для пациента.
3. Монофазная наноструктурная организация биоматериала не обеспечивает эффективного дренирования раневого отделяемого и приводит к скоплению жидкости под биоматериалом, из-за чего необходимо при перевязках дополнительно материал перфорировать скальпелем и формировать в нем дренажные окна (Рахматуллин P.P., Бурлуцкая О.И., Адельшина Л.Р., Бурцева Т.И. Эффективность нового метода восстановления дефекта кожи у больного с врожденным буллезным эпидермолизом: клиническое наблюдение. // Вопросы современной педиатрии. - 2011. - Том 10, №2, - С.190-192). Подобные манипуляции «тревожат» рану и болезненно переносятся пациентами, особенно детьми.
Таким образом, наноструктурирование биопластического материала обуславливает формирование оптимальных биоинженерных свойств (адгезия, прозрачность), но не обеспечивает благоприятного заживления ран и может стать причиной осложнений.
Технический результат - повышение эффективности заживления ран.
Задача решается тем, что в гистоэквивалент-биопластическом материале, включающем основу в виде матрицы, в качестве материала которой используют нативную форму гиалуроновой кислоты, согласно изобретению гистоэквивалент-биопластический материал содержит 1,5% раствор гиалуроновой кислоты и 5% раствор пептидного комплекса, смешанные до образования вязкого эластичного геля, помещенные в основу и подвергнутые ультрафиолетовой фотополимеризации в ламинарных шкафах в течение 5-7 часов при следующем количественном соотношении, мл:
- 1,5% раствор гиалуроновой кислоты - 80-90;
- 5% раствор пептидного комплекса - 10-20,
при этом готовый материал имеет перфорацию и насечки.
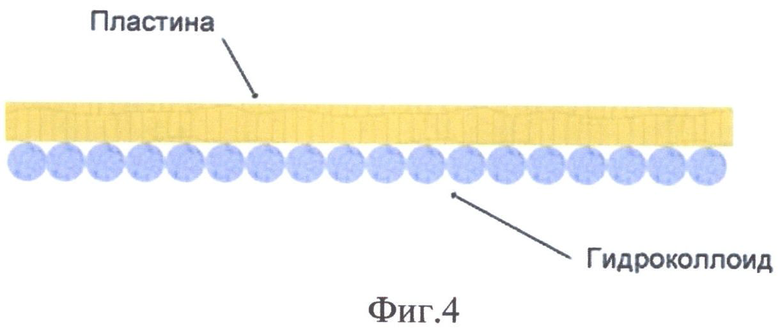
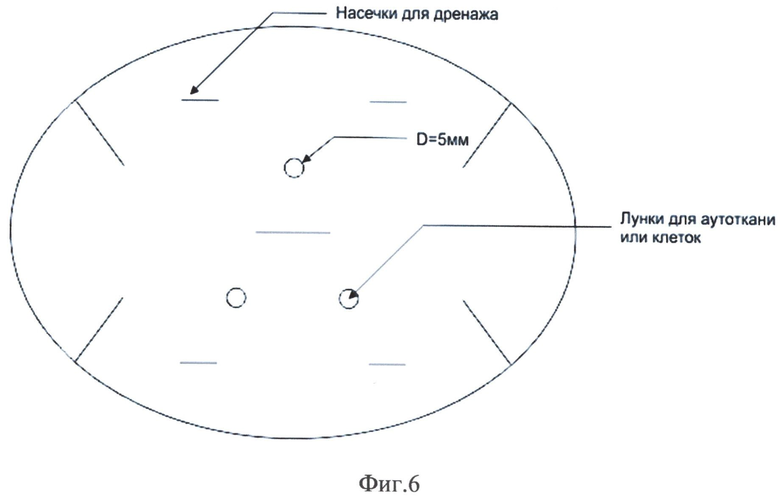
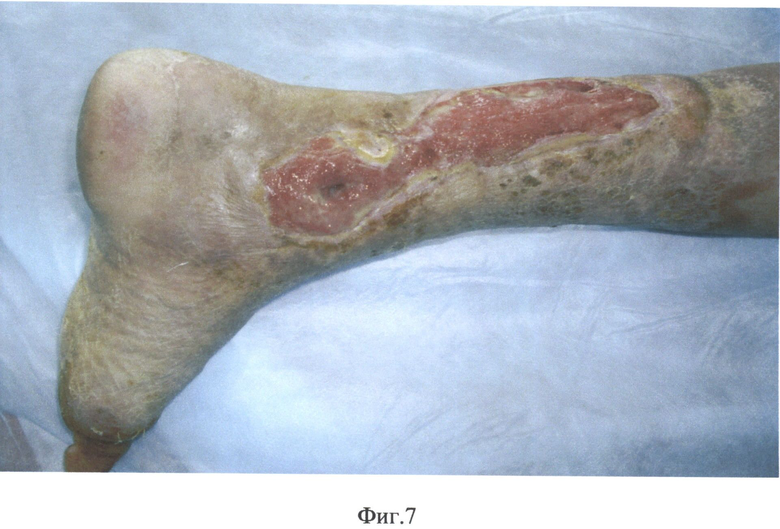
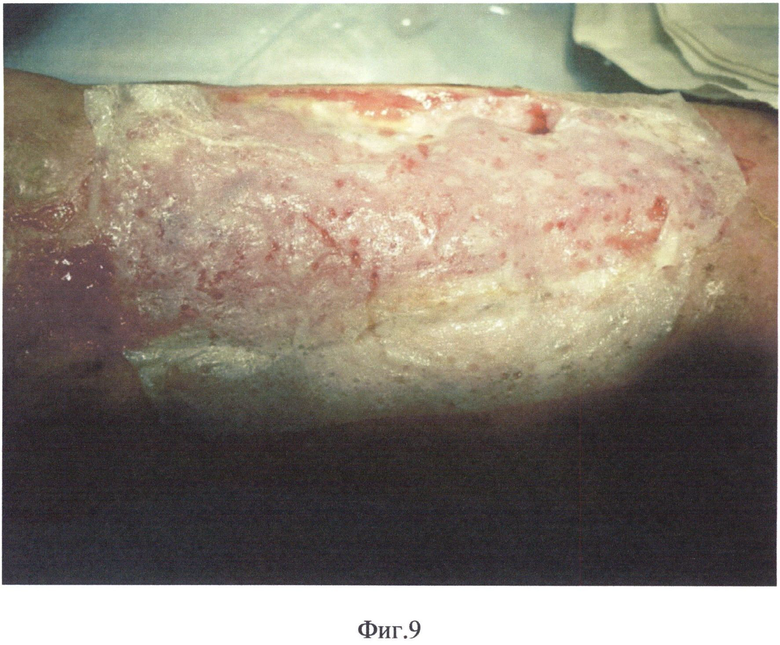
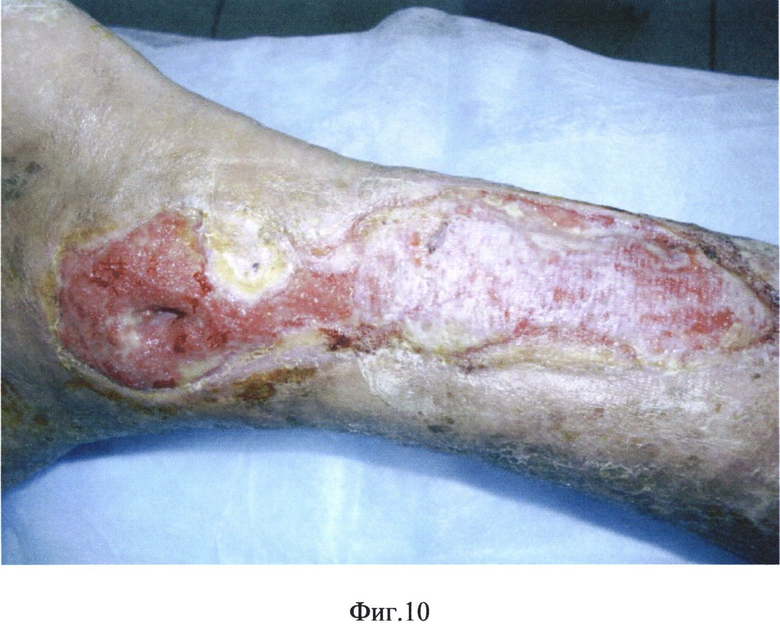
На фиг.1 представлена микрорельефность гистоэквивалент-биопластического материала, на фиг.2 - распределение сил адгезии на поверхности гистоэквивалент-биопластического материала, на фиг.3 - схожесть рельефа биоматериала с кожным рисунком человека, на фиг.4 - схема двухфазной структуры биоматериала, находящегося в области раны, на фиг.5 - атомно-спектрометрическое изображение биоматериала после клеточного культивирования, на фиг.6 - схема расположения насечек и отверстий гистоэквивалент-биопластического материала, на фиг.7 - вид трофической язвы левой голени больной сахарным диабетом, на фиг.8 и 9 - этапы биопластики язвы левой голени больной сахарным диабетом, на фиг.10 и 11 - этапы заживления язвы левой голени больной сахарным диабетом.
Состав пептидных комплексов, присутствующих в гидроколлоиде гиалуроновой кислоты, представлен в таблице, откуда видно, что пептидные комплексы имеют различный аминокислотный состав с варьирующей молекулярной массой 244-459 Да. В обнаруженных пептидах превалируют алифатические (лейцин, изолейцин, аланин, глицин) и полярные незаряженные аминокислотные остатки: треонин, пролин, гистидин, серин, а также полярные заряженные аминокислотные остатки: аргинин, глутамин, аспарагин, лизин, аргинин. Кроме того, присутствуют димеры изолейцинов и полимерные трипептиды, в том числе пептиды, содержащие ароматические аминокислотные остатки (триптофан) и полярные незаряженные аминокислотные остатки.
Важно, что в пептидной фракции присутствует десмозин (аминокислота, производная лизина). Благодаря своей разветвленной структуре, которая имеет четыре аминокислотных группы, одна молекула десмозина может входить одновременно в четыре пептидные цепи. Этим самым возможно формировать двухфазную структуру гистоэквивалент-биопластического материала.
Двухфазная структура нового биоматериала позволяет в ране формировать полноценный биологический струп, который снаружи является пластинкой, а стороной, обращенной к ране, принимает вид вязкого гидроколлоида.
Кроме того, двухфазная структура нового биоматериала благодаря разности сил натяжения придает биоматериалу уникальный макрорельефный рисунок. Макроповерхность гистоэквивалент-биопластического материала биоматериала имеет уникальную рельефность и внешне очень сходна с дерматоглификой кожи человека.
Благодаря разнополярности аминокислот создается эффект поверхностной энергии натяжения, что отражается на формировании уникальной микрорельефности.
На атомно-спектрометрических изображениях ультраструктура поверхности препарата представлена глобулярными образованиями однотипной морфологии с уникальной рельефностью.
Известно, что закрепление соматических клеток с большей вероятностью происходит на поверхности материала, обладающего высокой поверхностной энергией (на гидрофильной поверхности), в то же время на основные клеточные процессы (рост, дифференциация, миграция) в большей степени оказывает влияние геометрические и размерные особенности рельефа подложки [Hertz Н. Uber die Beruhrung Fester Elastischer Korper (On the contact of elastic solids) // J. Reine Angew. - 2011. - №92. - S. 156 171].
Оценивая гидрофильные/гидрофобные свойства предлагаемого биоматериала методом фиксации контактного угла воды, значение которого составило 83°, рассчитали на этой основе работу адгезии, которая с учетом коэффициента шероховатости оказалась равной 99,88 мН/м, что характеризует поверхность нового материала как умерено смачиваемую.
Дополнительно проведенная визуализация поверхности биополимера в режиме регистрации сил адгезии позволила локализовать области с повышенной адгезией.
Поверхностная энергия сил адгезии является фундаментальной характеристикой биопластических материалов для оценки эффективной миграции клеток на их поверхности при регенерации. Установлено, что наличие локальных областей с разной адгезией обеспечивают направленный таксис клеток и однородное их распределение по всей поверхности (Hallab N.J. Bundy K.J. O'Connor К. et al. Evaluation of metallic and polymeric biomaterial surface energy and surface roughness characteristics for directed cell adhesion // Tissue engineering. - 2001. - V.7. - №1. - P. 55-71).
Оценивая по краевому углу смачивания термодинамическую работу воды на поверхности гистоэквивалент-биопластического материала, зафиксированные значения сил сцепления характеризуют его двухфазный биоматериал, обладающий гидрофильными/гидрофобными свойствами. Это объясняется наличием разнополярных веществ (аминокислот пептидного комплекса), пространственно распределенных в структуре гидроколлоида гиалуроновой кислоты, выступающей в роли базисной матрицы материала.
Подтверждением этого стала прямая визуализация поверхности биоматериала в режиме адгезионно-контактной атомно-силовой микроскопии. Полученные результаты свидетельствуют о наличии значительных по отношению к визуализированной площади участков на поверхности биоматериала, демонстрирующих адгезивные свойства.
В свою очередь, культивирование мезенхимальных стромальных стволовых клеток с использованием гистоэквивалент-биопластического материла в качестве подложки и последующей атомно-силовой микроскопией поверхности позволили детектировать присутствие на ней клеток продолговатой формы, шириной 3,7 мкм. Последующее более детальное исследование выявило наличие на поверхности клетки переплетающихся фибриллярных волокон. Подобный характер их расположения является свидетельством наличия у культивируемых мезенхимальных стволовых клеток процессов миграции, при которых они активно взаимодействуют с поверхностью подложки, проникая в подлежащий матрикс.
Таким образом, наличие пептидного комплекса обеспечивает организацию двухфазной структуры биоматериала, которая является основой для формирования полноценного биологического струпа в ране (с наружной поверхности - пластинка, изнутри - гидроколлоид). Гистоэквивалент-биопластический материал имеет сквозные микроперфорации для эффективного дренажа раневого отделяемого.
Максимальная морфологическая схожесть структуры и внешнего вида биоматериала с покровными тканями (кожей) дает основания для введения в названия изобретения термина «гистоэквивалент-биопластический материал».
Гистоэквивалент-биопластический материал получают следующим образом.
В качестве сырья используют гиалуроновую кислоту нативной формы, имеющей волокнистое наноструктурированное строение, способное формировать эластичную пластину и пептидный комплекс. Нативная форма гиалуроновой кислоты создает оптимальные условия для миграции и пролиферации клеток, источником которых являются кусочки жизнеспособных тканей, помещенных в области микроперфораций (своего рода клеточные ячейки) гистоэквивалент-биопластического материала.
Готовят 1,5% раствор гиалуроновой кислоты 5% раствор пептидного комплекса при комнатной температуре. Затем их смешивают до образования вязкого эластичного геля.
Далее вязкий эластичный гель помещают на форму-основу и в специально сконструированных ламинарных шкафах подвергают ультрафиолетовой фотополимеризации.
Для этого в ламинарных шкафа создается определенный микроклимат (температура - 0-3 градуса Цельсия, влажность - 50-55%, с вентиляцией скорости воздушного потока - 0,50 м/с). Затем смесь подвергают ультрафиолетовому облучению в течение 5-7 часов. Готовый материал переносят на аппарат для перфорации и упаковки.
В итоге в формах образуется эластичная пленка белесоватого цвета, максимально схожая с дерматоглификой рисунка кожи человека.
Пластине путем вырезки придается овальная форма (большой диаметр - 15 см, малый диаметр - 11 см), площадь овальной пластины соответствует среднестатической площади ладони взрослого человека. В медицине принято считать, что ладонь взрослого человека составляет примерно 5% поверхности тела, например, таким образом, оценивается площадь ожогов.
Затем на пластине с помощью перфоратора наносятся круглые отверстия, а затем механически с помощью специального ножа. Равномерные распределенные насечки необходимы для дренирования раневого экссудата и более плотной связи биоматериала и подлежащей ткани. Круглые отверстия диаметром 3 мм служат посадочными лунками для эпителиальных тканей. Эти ткани являются собственными тканями пациента, которые иссекаются с краев раны при ее хирургической обработке. В дальнейшем они служат источниками клеток для эффективной эпителизации (заживления) раны.
В результате клинического применения у больных с дефектами покровных тканей установлено, что гистоэквивалент-биопластический материал формирует полноценный биологический струп и способствует ускоренному заживлению ран.
Важно отметить, что гистоэквивалент-биопластический материал оказался эффективным у больных, которым традиционная терапия не помогала.
Клинический пример.
Больная А., 59 лет, проживает в Кувандыке, поступила в 4 х/о НУЗ «ОКБ на ст. Оренбург» ОАО «РЖД» 16 декабря 2011 года с диагнозом: Гигантская циркулярная гнойно-некротическая трофическая язва левой голени. Сахарный диабет 2 типа, тяжелое течение. Аллергический дерматит нижних конечностей. Анемия.
Больна в течение 1 года, как образовалась язва после перенесенной некротической формы рожи. Размеры дефекта - циркулярная полоса шириной от 8 до 10 см от н/3 до с/3 голени с элементами фасций и сухожилий в дне раны. Все ранее применяемые методы лечения, включая перевязки с антисептиками, мазями и различными раневыми покрытиями эффекта не имели и крайне болезненно переносились пациентом.
При поступлении выполнена хирургическая обработка раны, иссечены некротические участки, с получение округлых кусочков жизнеспособной ткани кожи размером 0,5 на 1 мм. Затем на подготовленную рану накладывают гистоэквивалент-биопластический материал, имеющий в своей структуре микроперфорации диаметром 3 мм и насечки. После того как биоматериал прилипнет к ране и превратится в эластичную пластинку, в его перфорации укладываются извлеченные из физиологического раствора кусочки жизнеспособных тканей самого пациента. После того как все микроперфорации будут заполнены кусочками тканей, укладывается стерильная салфетка и повязка.
Проведен длительный курс комплексного консервативного лечения с коррекцией сопутствующей патологии. Наблюдалось образование двухфазной структуры биоматериала, находящегося в области раны: наружная пластинка - биологический струп, и внутренняя - гидроколлоид.
После очищения раны сформировался плоский гранулирующий циркулярный дефект с краевой эпителизацией.
При использовании гистоэквивалент-биопластического материала было установлено, что он оказывает наиболее мощное стимулирующее воздействие на фибробласты, активируя рецепторы CD44 на синтез уже собственной гиалуроновой кислоты, коллагена III типа и эластина, что предотвращает образование гипертрофических рубцов.
В результате проведенного лечения предлагаемым биоматериалом отмечено, что через 2-3 часа после наложения все пациенты отмечали, что исчезала боль. Впоследствии было отмечено отсутствие явления контрактурных изменений раневой области и полноценное восстановление кожных покровов. Надо отметить, что использование данного биоматериала позволило избежать воспалительной реакции (нагноения) и формирования гипертрофических рубцов в период реабилитации. Не зафиксировано ни одного случая аллергической и/или воспалительной реакции у больных.
Таким образом, по сравнению с прототипом, проведенные исследования показывают, что гистоэквивалент-биопластический материал способен формировать полноценный биологический струп и стимулировать заживление ран с хорошим эстетическим результатом без образования рубцов, а также обладает высокой биосовместимостью с покровными тканями человеческого организма.
Новизной разработанного гистоэквивалент-биопластического материала является оригинальный состав пептидного комплекса, с разнополярными аминокислотами. Наличие данного пептидного комплекса обеспечивает организацию двухфазной структуры биоматериала, которая является основой для формирования полноценного биологического струпа в ране (с наружной поверхности - пластинка, изнутри - гидроколлоид). Гистоэквивалент-биопластический материал имеет сквозные микроперфорации для эффективного дренажа раневого отделяемого.
Отличительной особенностью данного гистоэквивалент-биопластического материала является его способность образовывать двухфазное раневое покрытие и формировать таким образом полноценный биологический струп, эффективно дренировать рану, что в итоге обеспечивает оптимальную регенерацию дефекта покровных тканей без образования рубцов и деформаций. Кроме того, биоматериал имеет специальные посадочные лунки для собственных тканей пациента, из которых формируются ростковые зоны для заживления ран.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕХНОЛОГИЯ РЕГЕНЕРАТИВНОЙ БИОПЛАСТИКИ ДЕФЕКТОВ ПОКРОВНЫХ ТКАНЕЙ | 2013 |
|
RU2547386C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ ПОКРОВНЫХ ТКАНЕЙ | 2016 |
|
RU2644306C1 |
| КОЖА КОСМЕТИЧЕСКАЯ | 2013 |
|
RU2528899C1 |
| НАНОСТРУКТУРИРОВАННЫЙ БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ | 2010 |
|
RU2425694C1 |
| МИКРОНАНОСТРУКТУРИРОВАННЫЙ БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ | 2012 |
|
RU2481127C1 |
| СПОСОБ ЛЕЧЕНИЯ ДЕФЕКТОВ КОЖИ И МЯГКИХ ТКАНЕЙ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ И СПОСОБ ВВЕДЕНИЯ ПРЕПАРАТА ДЛЯ НЕГО | 2017 |
|
RU2679449C1 |
| БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ | 2008 |
|
RU2367476C1 |
| ОРГАНОСПЕЦИФИЧЕСКИЙ БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ НА ОСНОВЕ РАСТВОРИМОЙ ФОРМЫ СТАБИЛИЗИРОВАННОГО ВНЕКЛЕТОЧНОГО МАТРИКСА | 2019 |
|
RU2722744C1 |
| СПОСОБ ЛЕЧЕНИЯ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ У БОЛЬНЫХ С СИНДРОМОМ ДИАБЕТИЧЕСКОЙ СТОПЫ | 2016 |
|
RU2619257C1 |
| 3D БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ НА ОСНОВЕ ГИДРОКОЛЛОИДА ГИАЛУРОНОВОЙ КИСЛОТЫ | 2013 |
|
RU2565398C2 |






Изобретение относится к медицине, а именно к комбустиологии, хирургии, косметологии, и может найти применение в качестве биопластического материала для замещения дефектов покровных тканей. Описан гистоэквивалент-биопластический материал, включающий основу в виде матрицы, в качестве материала которой используют нативную форму гиалуроновой кислоты. Гистоэквивалент-биопластический материал получают путем смешивания 1,5% раствора гиалуроновой кислоты и 5% раствора пептидного комплекса при следующем количественном соотношении: 80-90 мл и 10-20 мл, соответственно, до образования вязкого эластичного геля, который помещают на форму-основу и подвергают ультрафиолетовой фотополимеризации в ламинарных шкафах в течение 5-7 часов, с последующим переносом на аппарат для перфорации, при этом готовый материал имеет перфорацию и насечки. Технический результат - повышение эффективности заживления ран. 1 табл., 11 ил., 1 пр.
Гистоэквивалент-биопластический материал, включающий основу в виде матрицы, в качестве материала которой используют нативную форму гиалуроновой кислоты, отличающийся тем, что указанный биопластический материал получают путем смешивания 1,5% раствора гиалуроновой кислоты и 5% раствора пептидного комплекса при следующем количественном соотношении: 80-90 мл и 10-20 мл, соответственно, до образования вязкого эластичного геля, который помещают на форму-основу и подвергают ультрафиолетовой фотополимеризации в ламинарных шкафах в течение 5-7 часов, с последующим переносом на аппарат для перфорации, при этом готовый материал имеет перфорацию и насечки.
| Каталог Профессиональная косметика ТЕТе Cosmeceutical, Гиалуроновая кислота+комплекс пептидов 30 ml (3х10ml), 10.11.12 09:02 [найдено 2013.10.17] | |||
| найдено из Интернет: | |||
| НАНОСТРУКТУРИРОВАННЫЙ БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ | 2010 |
|
RU2425694C1 |
| БИОИНЖЕНЕРНЫЙ КОНСТРУКТ ДЛЯ ИМПЛАНТАЦИИ ТКАНИ И СПОСОБ ИЗГОТОВЛЕНИЯ НАЗВАННОГО БИОИНЖЕНЕРНОГО КОНСТРУКТА (ВАРИАНТЫ) | 2008 |
|
RU2461622C2 |
| КОМПЛЕКСНОЕ КОСМЕТИЧЕСКОЕ СРЕДСТВО С ОМОЛАЖИВАЮЩИМ И ЛИФТИНГ-ЭФФЕКТОМ | 2010 |
|
RU2438648C1 |
Авторы
Даты
2014-04-20—Публикация
2013-02-21—Подача