ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка испрашивает приоритет предварительной заявки на патент США № 61/194576, зарегистрированной 29 сентября 2008 года, содержание которой приводится в описании посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Семейство генов регуляторов замалчивания информации (Silent Information Regulator (SIR)) представляет высококонсервативную группу генов, присутствующих в геномах организмов, в ряду от архебактерий до эукариотов. Кодированные белки SIR вовлечены в разнообразные процессы от регулирования сайленсинга гена до репарации ДНК. Белки, кодированные членами семейства генов SIR, демонстрируют сохранение последовательности в ядре домена из 250 аминокислот. Хорошо изученным геном в этом семействе является S. cerevisiae SIR2, который вовлечен в сайленсинг локуса HM, содержащего информацию, определяющую тип спаривания у дрожжей, эффекты положения теломера и старение клеток. Белок Sir2 дрожжей принадлежит к семейству гистон деацетилаз. Гомолог Sir2, CobB, в бактерии Salmonella typhimurium, выполняет функцию НАД(никотинамидадениндинуклеотид)-зависимой АДФ-рибозил трансферазы.
Белок Sir2 является деацетилазой класса III, которая использует НАД в качестве субстрата. В отличие от других деацетилаз, многие из которых вовлечены в сайленсинг гена, Sir2 является нечувствительным к ингибиторам гистоновых деацетилаз класса I и II, таким как трихостатин A (TSA).
Деацетилирование ацетил-лизина с помощью Sir2 тесно связано с гидролизом НАД, продуцирующим никотинамид и новое соединение ацетил-АДФ рибозы. Активность Sir2 в отношении НАД-зависимой деацетилазы является основополагающей для его функций, которые могут связывать его биологическую роль с клеточным метаболизмом в дрожжах. Гомологи Sir2 у млекопитающих имеют активность в отношении НАД-зависимой гистоновой деацетилазы.
Биохимические исследования показали, что Sir2 может легко деацетилировать аминотерминальные "хвосты" гистонов H3 и H4, что приводит к образованию 1-O-ацетил-АДФ-рибозы и никотинамида. Штаммы с дополнительными копиями SIR2 характеризуются повышенным сайленсингом рДНК и на 30% более продолжительным жизненным циклом. Недавно было показано, что дополнительные копии гомолога SIR2 C. elegans, sir-2.1, и гена dSir2 D. melanogaster значительно увеличивают продолжительность жизни этих организмов. Это дает основание предполагать, что SIR2-зависимый регуляторный путь старения возник в начале эволюции и был высококонсервативным. В настоящее время считают, что гены Sir2 появились в результате эволюции с целью улучшения здоровья организма и повышения его устойчивости к стрессу, чтобы повысить его шанс на выживание в неблагоприятной обстановке.
У людей имеется семь Sir2-подобных генов (SIRT1-SIRT7), которые делят между собой консервативный каталитический домен Sir2. SIRT1 является ядерным белком с самой высокой степенью сходства последовательности с Sir2. SIRT1 регулирует путем деацетилирования множество клеточных мишеней, включая супрессор опухолевого роста p53, фактор NF-κB клеточной сигнализации и фактор транскрипции FOXO.
SIRT3 является гомологом SIRT1, который является консервативным в прокариотах и эукариотах. Белок SIRT3 нацелен на митохондриальную кристу с помощью уникального домена, расположенного на N-концах. SIRT3 имеет NAD+-зависимую активность в отношении белка деацетилазы и повсеместно экспрессирует, в частности, в метаболически активных тканях. Считают, что при переносе в митохондрию SIRT3 расщепляется на более мелкую активную форму под действием матрикса митохондриальной процессирующей пептидазы (MPP).
Ограничение калорий уже известно в течение свыше 70 лет в качестве способа улучшения здоровья и увеличения продолжительности жизни млекопитающих. Продолжительность жизни дрожжей, таких как многоклеточные организмы, также увеличивается в результате вмешательств, которые напоминают ограничение калорий, таких как понижение глюкозы. Открытие того, что и дрожжи, и мухи с недостатком гена SIR2 не живут более продолжительное время при ограничении калорий, представляет доказательство, что гены SIR2 являются промежуточным звеном благотворного влияния диеты с ограничением калорий на состояние здоровья. Кроме того, мутации, которые понижают активность чувствительного к глюкозе цАМФ (аденозин 3',5'-монофосфат)-зависимого (PKA) пути дрожжей, увеличивают продолжительность жизни в клетках дикого типа, но не в мутантных штаммах sir2, тем самым демонстрируя, что SIR2 является, по-видимому, ключевым следующим далее компонентом пути ограничения калорий.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение предлагает новые модулирующие сиртуин соединения и способы их применения.
В одном аспекте изобретение предлагает модулирующие сиртуин соединения структурных формул (I)-(V), которые описаны подробно ниже.
В другом аспекте изобретение предлагает способы применения модулирующих сиртуин соединений или композиций, включающих модулирующие сиртуин соединения. В конкретных вариантах осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для различных терапевтических задач, включающих, например, увеличение продолжительности жизни клетки и лечение и/или предотвращение широкого спектра заболеваний и расстройств, включающих, например, заболевания и расстройства, связанные со старением или стрессом, диабет, ожирение, нейродегенеративные заболевания, вызванную химиотерапией невропатию, невропатию, связанную с явлением ишемии, глазные заболевания и/или расстройства, сердечно-сосудистое заболевание, нарушение свертываемости крови, воспаление и/или гиперемию и так далее. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы для лечения заболевания или расстройства у пациента, у которого лечебный эффект обеспечивается за счет повышенной митохондриальной активности, для усиления мышечной деятельности, для повышения уровня АТФ в мышцах, или для лечения или предотвращения повреждения мышечной ткани, связанного с гипоксией или ишемией. В других вариантах осуществления модулирующие сиртуин соединения, которые понижают уровень и/или активность белка сиртуина, могут быть использованы для различных терапевтических задач, включающих, например, увеличение чувствительности клеток к стрессу, усиление апоптоза, лечение рака, стимулирование аппетита и/или стимулирование увеличения массы тела и так далее. Описываемые дополнительно ниже способы включают введение пациенту, в случае, если это ему необходимо, фармацевтически эффективного количества модулирующего сиртуин соединения.
В конкретных аспектах модулирующие сиртуин соединения могут быть введены сами по себе или в комбинации с другими соединениями, включая другие модулирующие сиртуин соединения или другие терапевтические средства.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Определения
Используемые в описании следующие термины и фразы имеют приведенные ниже значения. Если не указано иначе, то все используемые в описании технические и научные термины имеют значения, обычные для специалиста в этой области.
Термин "средство" используют в описании для обозначения химического соединения, смеси химических соединений, биологической макромолекулы (такой как нуклеиновая кислота, антитело, белок или его часть, например пептид) или экстракта, полученного из биологических материалов, таких как бактерии, растения, грибы или клетки или ткани животных (в частности, млекопитающих). Активность таких средств позволяет применять их в качестве "терапевтического средства", которое является биологически, физиологически или фармакологически активным веществом (или веществами), которое воздействует местно или системно на пациента.
Термин "биодоступный" в отношении соединения является определением, принятым в данной области техники, и относится к форме соединения, которое позволяет ему или части вводимого количества соединения быть абсорбированным, включенным или иным способом физиологически доступным для субъекта или пациента, которым его вводят.
"Биологически активная часть сиртуина" относится к части белка сиртуина, имеющей биологическую активность, такую как способность к деацетилированию. Биологически активные части сиртуина могут включать ядерный домен сиртуинов. Биологически активные части SIRT1, депонированные как GenBank Accession No. NP_036370 (номер депонирования NP_036370 в базе данных GenBank), которые охватывают НАД+ связывающий домен и субстрат-связывающий домен, например, могут включать, без ограничения, аминокислоты 62-293, депонированные как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 237-932, депонированными как GenBank Accession No. NM_012238. Поэтому эту область иногда относят к ядерному домену. Другие биологически активные части SIRT1, также часто относимые к ядерным доменам, включают область аминокислот 261-447, депонированных как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 834-1394, депонированными как GenBank Accession No. NM_012238; область аминокислот 242-493, депонированных как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 777-1532, депонированными как GenBank Accession No. NM_012238; или область аминокислот 254-495, депонированных как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 813-1538, депонированными как GenBank Accession No. NM_012238.
Термин "домашние животные" относится к кошкам и собакам. Используемый в описании термин "собака(и)" обозначает любого представителя вида Canis familiaris (Собака домашняя), к которому относится большое количество различных пород. Термин "кошка(и)" относится к животному семейства кошачьих, включая домашних кошек и других представителей семейства Felidae (Кошачьих), рода Felis (Кошки).
Термин "диабет" относится к высокому содержанию сахара в крови или кетоацидозу, а также к хроническим, общим метаболическим аномалиям, возникающим в результате продолжительного состояния с высоким содержанием сахара в крови или снижения толерантности к глюкозе. "Диабет" охватывает как форму заболевания типа I, так и типа II (инсулиннезависимый сахарный диабет или NIDDM). Факторы риска возникновения диабета включают следующие факторы: размер талии более чем 40 дюймов (101,6 см) для мужчин или 35 дюймов (88,9 см) для женщин, кровяное давление 130/85 мм рт.ст. или выше, содержание триглицеридов выше 150 мг/децилитр, содержание глюкозы в крови натощак более чем 100 мг/децилитр или содержание липопротеина высокой плотности меньше чем 40 мг/децилитр у мужчин или 50 мг/децилитр у женщин.
Термин "ED50" относится к общепринятому показателю эффективной дозы. В конкретных вариантах осуществления ED50 означает дозу лекарственного средства, которая вызывает 50% его максимальной ответной реакции или воздействия, или, альтернативно, дозу, которая вызывает заданную ответную реакцию у 50% испытуемых субъектов или в случае 50% испытуемых препаратов. Термин "LD50" относится к общепринятому показателю летальной дозы. В конкретных вариантах осуществления LD50 означает дозу лекарственного средства, которое приводит к летальному исходу у 50% испытуемых субъектов. Термин "терапевтический индекс" является общепринятым термином, который относится к терапевтическому индексу лекарственного средства, определяемого как отношение LD50/ED50.
Термин "гиперинсулинемия" относится к состоянию человека, при котором уровень инсулина в крови превышает норму.
Термин "резистентность к инсулину" относится к состоянию, при котором нормальное количество инсулина вызывает недостаточную ответную биологическую реакцию по сравнению с ответной биологической реакцией у субъекта, который не имеет резистентности к инсулину.
Обсуждаемое в описании "инсулинрезистентное состояние" относится к любому заболеванию или состоянию, которое вызывается резистентностью к инсулину или которому способствует резистентность к инсулину. Примеры включают диабет, ожирение, метаболический синдром, синдромы инсулинрезистентности, синдром X, резистентность к инсулину, высокое кровяное давление, гипертензию, повышенное содержание холестерина в крови, дислипидемию, гиперлипидемию, атеросклеротическое заболевание, включая инсульт, заболевание коронарной артерии или инфаркт миокарда, гипергликемию, гиперинсулинемию и/или гиперпроинсулинемию, нарушение толерантности к глюкозе, замедленную секрецию инсулина, диабетические осложнения, включая ишемическую болезнь сердца, стенокардию, застойную сердечную недостаточность, удар, когнитивные функции при деменции, ретинопатию, периферическую нейропатию, нефропатию, гломерулонефриты, гломерулосклероз, нефротический синдром, гипертензивные нефросклеротические некоторые типы рака (такие как рак эндометрия, молочной железы, предстательной железы и толстой кишки), осложнения при беременности, неудовлетворительное состояние женского репродуктивного здоровья (такое как менструальные нарушения, бесплодие, нерегулярная овуляция, синдром поликистозных яичников (PCOS)), липодистрофию, связанные с холестерином расстройства, такие как камни желчного пузыря, холецистит и холелитиаз, подагру, обструктивное апноэ во сне и респираторные проблемы, остеоартриты, и потерю костной массы, например, в частности, остеопороз.
Термин "домашний скот" относится к одомашненным четвероногим животным, который включает животных, разводимых на мясо и различные субпродукты, например, жвачное животное, включая крупный рогатый скот и других представителей рода Bos (Настоящих быков), свиноподобное животное, включая домашнюю свинью и других представителей рода Sus (Свиней), овцеподобное животное, включая овцу и других представителей рода Ovis (Баранов), домашние козлы и другие представители рода Capra (Козлов); одомашненные четвероногие животные, разводимые для специальных задач, таких как использование в качестве вьючного животного, например лошадь, включая домашних лошадей и других представителей семейства Equidae (Лошадей) рода Equus (Лошади).
Термин "млекопитающее" является хорошо известным термином, и примеры млекопитающих включают людей, приматов, домашний скот (включая коров, свиней и так далее), домашних животных (например, собак, кошек и так далее) и грызунов (например, мышей и крыс).
"Полными" индивидуумами или индивидуумами, страдающими от ожирения, являются обычно индивидуумы, имеющие индекс массы тела (BMI), по меньшей мере, 25 или более. Ожирение может быть связано или может не быть связано с резистентностью к инсулину.
Термины "парентеральное введение" и "парентерально введенный" являются общепринятыми и относятся к способу введения, отличающемуся от энтерального и топического введения, обычно путем инъекции, и он включает, без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсулярную, интраорбитальную, интракардиальную, интрадермальную, интраперитонеальную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную и надчревную инъекцию и инфузию.
Термин "пациент", "субъект", "индивидуум" или "хозяин" относится либо к человеку, либо к не принадлежащему к человеческому роду животному.
Термин "фармацевтически приемлемый носитель" является общепринятым и относится к фармацевтически приемлемому материалу, композиции или среде, таким как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующий материал, участвующим при переносе или транспортировке любой обсуждаемой композиции или ее компонентов. Каждый носитель должен быть "приемлемым" с точки зрения его совместимости с обсуждаемой композицией и ее компонентов и не должен быть опасным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошок трагакантовой камеди; (5) солод; (6) желатин; (7) тальк; (8) вспомогательные средства, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических препаратах.
Термин "предотвращение" широко применяют в медицине, и при его использовании в отношении состояния, такого как местный рецидив (например, боль), заболевания, такого как рак, комплекса синдромов, такого как сердечная недостаточность, или любого другого медицинского состояния значение этого термина является совершенно очевидным, и оно включает введение композиции, которая снижает частоту или задерживает появление симптомов клинического состояния у субъекта по сравнению с субъектом, который не получает композицию. Таким образом, предотвращение рака включает, например, снижение числа обнаруживаемых злокачественных опухолей в группе пациентов, получающих профилактическое лечение по сравнению с не получающей лечение контрольной группой, и/или отсрочку появления обнаруживаемых злокачественных опухолей в группе пациентов, подвергаемых лечению, в сравнении с контрольной группой пациентов, не подвергающихся лечению, например, на статистически и/или клинически значимую величину. Предотвращение инфекционного заболевания включает, например, снижение числа диагнозов инфекционного заболевания в группе пациентов, подвергаемых лечению, в сравнении с контрольной группой пациентов, не подвергающихся лечению, и/или отсрочку появления симптомов инфекционного заболевания в группе пациентов, подвергаемых лечению, в сравнении с контрольной группой пациентов, не подвергающихся лечению. Предотвращение боли включает, например, снижение силы или, как вариант, отсрочку болевых ощущений, испытываемых пациентами в группе, подвергаемой лечению, в сравнении с контрольной группой пациентов, не подвергающихся лечению.
Термин "профилактическое" или "терапевтическое" лечение является общепринятым и относится к введению лекарственного средства в организм хозяина. Если его вводят до клинического обнаружения нежелательного состояния (например, заболевания или другого нежелательного состояния животного-хозяина), то лечение является профилактическим, то есть оно защищает организм хозяина от развития нежелательного состояния, но если его вводят после обнаружения нежелательно состояния, то лечение является терапевтическим (то есть, оно направлено на облегчение, улучшение или сохранение существующего нежелательного состояния или его побочных эффектов).
Термин "апирогенный", в отношении композиции, относится к композиции, которая не содержит пирогенное вещество в количестве, которое может вызвать у субъекта, которому ввели композицию, неблагоприятный эффект (например, раздражение, лихорадку, воспаление, диарею, угнетение дыхания, эндотоксический шок и так далее). Например, подразумевается, что этот термин охватывает композиции, которые не содержат, или практически не содержат, эндотоксин, такой как, например, липополисахарид (LPS).
"Репликативная продолжительность жизни" клетки относится к числу дочерних клеток, продуцируемых индивидуальной "материнской клеткой". С другой стороны, "календарный возраст" и "календарная продолжительность жизни" относится к периоду времени, в течение которого популяция неделящихся клеток остается жизнеспособной при отсутствии питательных веществ. "Увеличение продолжительности жизни клетки" или "продление продолжительности жизни клетки" применительно к клеткам или организмам относится к увеличению числа дочерних клеток, продуцируемых одной клеткой; повышению способности клеток или организмов справляться со стрессами и бороться с повреждениями, например, в случае ДНК, белков; и/или повышению способности клеток или организмов выживать и сохранять все жизненные функции в течение более длительного времени при конкретном состоянии, например, при стрессе (например, тепловом шоке, осмотическом стрессе, высокоэнергетическом излучении, стрессе, вызванным химическим веществом, повреждении ДНК, недостаточном солевом уровне, недостаточном уровне азота или недостаточном уровне питания). При применении описанных в описании способов продолжительность жизни может быть увеличена, по меньшей мере, примерно на 10%, 20%, 30%, 40%, 50%, 60% или от 20% до 70%, от 30% до 60%, от 40% до 60% или более.
"Активирующее сиртуин соединение" относится к соединению, которое повышает уровень белка сиртуина и/или, по меньшей мере, повышает только активность белка сиртуина. В примере варианта осуществления активирующее сиртуин соединение может повышать, по меньшей мере, только биологическую активность белка сиртуина, по меньшей мере, примерно на 10%, 25%, 50%, 75%, 100% или более. Примеры биологической активности белков сиртуина включают деацетилирование, например, гистонов и p53; увеличение продолжительности жизни; повышение геномной стабильности; сайленсинг транскрипции и контролирование сегрегации окисленных белков между материнскими и дочерними клетками.
"Белок сиртуин" относится к представителю семейства сиртуиновых белков деацетилазы, или, предпочтительно, к семейству sir2, которое включает белки Sir2 дрожжей (GenBank Accession No. P53685), C. elegans Sir-2.1 (GenBank Accession No. NP_501912), и человеческий SIRT1 (GenBank Accession No. NM_012238 и NP_036370 (или AF083106)) и SIRT2 (GenBank Accession No. NM_012237, NM_030593, NP_036369, NP_085096 и AF083107). Другие представители семейства включают четыре дополнительных похожих на Sir2 генов дрожжей, названных "HST гены" (гомологи Sir2) HST1, HST2, HST3 и HST4, и пять других человеческих гомологов hSIRT3, hSIRT4, hSIRT5, hSIRT6 и hSIRT7 (Brachmann et al. (1995) Genes Dev. 9:2888 and Frye et al. (1999) BBRC 260:273). Предпочтительными сиртуинами являются сиртуины, которые имеют как можно больше сходства с SIRT1, то есть hSIRT1 и/или Sir2, чем с SIRT2, такие как представители сиртуинов, имеющие, по меньшей мере, часть N-терминальной последовательности, присутствующей в SIRT1 и отсутствующей в SIRT2, такой как SIRT3.
"Белок SIRT1" относится к представителю семейства sir2 сиртуинов деацетилаз. В одном варианте осуществления белок SIRT1 включает дрожжевой Sir2 (GenBank Accession No. P53685), C. elegans Sir-2.1 (GenBank Accession No. NP_501912), человеческий SIRT1 (GenBank Accession No. NM_012238 или NP_036370 (или AF083106)), и его эквиваленты и фрагменты. В другом варианте осуществления белок SIRT1 включает полипептид, содержащий последовательность, состоящую, или состоящую в основном, из последовательности аминокислот, депонированных как GenBank Accession Nos. NP_036370, NP_501912, NP_085096, NP_036369 или P53685. Белки SIRT1 включают полипептиды, содержащие всю или часть последовательности аминокислот, депонированных как GenBank Accession Nos. NP_036370, NP_501912, NP_085096, NP_036369 или P53685; последовательность аминокислот, депонированных как GenBank Accession Nos. NP_036370, NP_501912, NP_085096, NP_036369 или P53685, с замещением консервативных аминокислот в положении от 1 до примерно 2, 3, 5, 7, 10, 15, 20, 30, 50, 75 или более; последовательность аминокислот, которая, по меньшей мере, на 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99% идентична депонированным GenBank Accession Nos. NP_036370, NP_501912, NP_085096, NP_036369 или P53685, и их функциональным фрагментам. Полипептиды изобретения также включают гомологи (например, ортологи и паралоги), варианты или фрагменты, депонированные как GenBank Accession Nos. NP_036370, NP_501912, NP_085096, NP_036369 или P53685.
Используемые в описании "белок SIRT2", "белок SIRT3", "белок SIRT4", "белок SIRT 5", "белок SIRT6 " и "белок SIRT7" относятся к другим белкам сиртуинам деацетилаз млекопитающего, например человека, которые являются гомологами белка SIRT1, в частности, в консервативном каталитическом домене из приблизительно 275 аминокислот. Например, "белок SIRT3 " относится к представителю семейства белков сиртуинов деацетилазы, который является гомологом белка SIRT1. В одном варианте осуществления белок SIRT3 включает человеческий SIRT3 (GenBank Accession No. AAH01042, NP_036371 или NP_001017524) или мышиный SIRT3 (GenBank Accession No. NP_071878) белки и его эквиваленты и фрагменты. В другом варианте осуществления белок SIRT3 включает полипептид, содержащий последовательность, состоящую, или состоящую в основном, из последовательности аминокислот, депонированных как GenBank Accession Nos. AAH01042, NP_036371, NP_001017524 или NP_071878. Белки SIRT3 включают полипептиды, содержащие всю или часть последовательности аминокислот, депонированных как GenBank Accession AAH01042, NP_036371, NP_001017524 или NP_071878; последовательность аминокислот, депонированных как GenBank Accession Nos. AAH01042, NP_036371, NP_001017524 или NP_071878, с замещением консервативных аминокислот в положении от 1 до примерно 2, 3, 5, 7, 10, 15, 20, 30, 50, 75 или более; последовательность аминокислот, которая, по меньшей мере, на 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99% идентична депонированным GenBank Accession Nos. AAH01042, NP_036371, NP_001017524 или NP_071878 и их функциональным фрагментам. Полипептиды изобретения также включают гомологи (например, ортологи и паралоги), варианты или фрагменты, депонированные как GenBank Accession Nos. AAH01042, NP_036371, NP_001017524 или NP_071878. В одном варианте осуществления белок SIRT3 включает фрагмент белка SIRT3, который продуцируется в результате расщепления с помощью митохондриальной матриксной пептидазы процессинга (MPP) и/или митохондриальной промежуточной пептидазы (MIP).
Термины "системное введение", "вводимое системно", "периферийное введение" и "периферийно вводимое" являются общепринятыми и относятся к введению обсуждаемой композиции, терапевтического или другого материала, но не непосредственно в центральную нервную систему, в результате чего композиция, терапевтический или другой материал входит в систему пациента и подвергается метаболизму и другим подобным процессам.
Термин "терапевтическое средство" является общепринятым и относится к любому химическому фрагменту, который является биологически, физиологически или фармакологически активным веществом, которое воздействует местно или системно на субъекта. Термин также обозначает любое вещество, предполагаемое для использования для диагностики, исцеления, облегчения, лечения или предотвращения заболевания или для усиления желаемого физического или умственного развития и/или состояний животного или человека.
Термин "терапевтический эффект" является общепринятым и относится к местному или системному воздействию на животных, в частности млекопитающих, и более конкретно, на людей, вызываемому фармакологически активным веществом. Фраза "терапевтически активное количество" означает количество такого вещества, которое вызывает некоторый желательный местный или системный эффект при приемлемом отношении выгода/риск, применяемом при любом лечении. Терапевтически эффективное количество такого вещества может зависеть от субъекта и болезненного состояния, подвергаемого лечению, массы и возраста субъекта, тяжести болезненного состояния, способа введения и других подобных факторов, которые могут быть легко определены обычным специалистом в этой области. Например, описанные в описании конкретные композиции могут быть введены в достаточном количестве для достижения требуемого эффекта при приемлемом отношении выгода/риск, применяемом для такого лечения.
"Лечение" состояния или заболевания относится к излечению, а также к облегчению, по меньшей мере, одного симптома состояния или заболевания.
Термин "нарушение зрения" относится к ухудшению зрения, которое часто только частично может быть восстановлено или не восстановлено при лечении (например, при хирургическом лечении). Особенно тяжелое нарушение зрения описывают терминами "слепота" или "потеря зрения", которые относятся к полной потере зрения, то есть зрению, хуже, чем 20/200, которое не может быть улучшено с помощью корригирующих линз, или полю зрения меньше чем 20 градусов, исходя из диаметра (10 градусов, исходя из радиуса).
2. Модуляторы сиртуина
В одном аспекте изобретение предлагает новые модулирующие сиртуин соединения для лечения и/или предотвращения широкого спектра заболеваний и расстройств, включающих, например, заболевания и расстройства, связанные со старением или стрессом, диабет, ожирение, нейродегенеративные заболевания, глазные заболевания и расстройства, сердечно-сосудистое заболевание, нарушение свертываемости крови, воспаление, рак и/или гиперемию и так далее. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы для лечения заболевания или расстройства у пациента, у которого лечебный эффект обеспечивается за счет повышенной митохондриальной активности, для усиления мышечной деятельности, для повышения уровня АТФ в мышцах или для лечения или предотвращения повреждения мышечной ткани, связанного с гипоксией или ишемией. Другие раскрытые в описании соединения могут быть использованы в фармацевтической композиции и/или в одном или более раскрытых в описании способах.
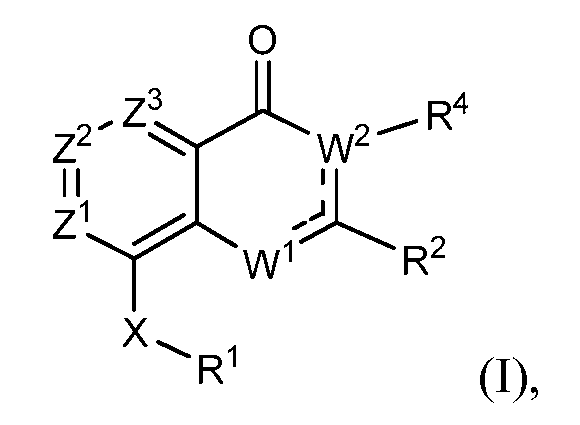
В одном варианте осуществления модулирующие сиртуин соединения изобретения представлены структурной формулой (I)
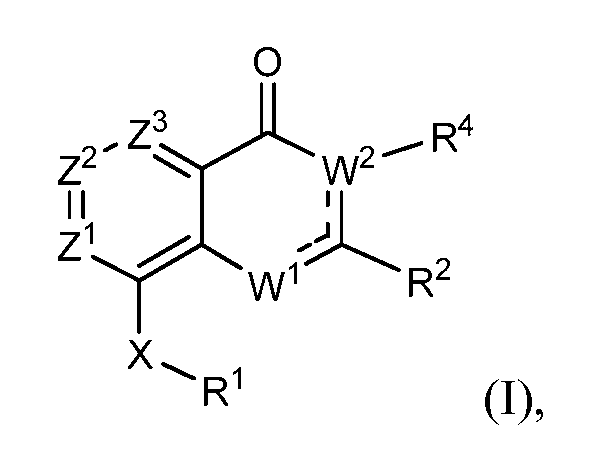
или их солью, где
каждый из Z1, Z2 и Z3 независимо выбирают из N и CR, где
не более чем один из Z1, Z2 и Z3 является N; и
R выбирают из водорода, галогена, -OH, -C≡N, фторзамещенного C1-C2 алкила, -O-(C1-C2) фторзамещенного алкила, -S-(C1-C2) фторзамещенного алкила, C1-C4 алкила, -O-(C1-C4) алкила, -S-(C1-C4) алкила и C3-C7 циклоалкила;
---- представляет необязательную химическую связь,
W1 выбирают из -O-, -NH- или -N=, так что когда W1 является -N=, W1 связан с C(R2) через двойную химическую связь,
W2 является -CR4=, когда W1 является -NH- или -O-, так что когда W2 является -CR4=, W2 связан с C(R2) через двойную химическую связь; и W2 является -NR4-, когда W1 является -N=;
R1 выбирают из карбоцикла и гетероцикла, где R1 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, =O, C3-C7 циклоалкила, фторзамещенного C1-C4 алкила, -O-R3, -S-R3, -(C1-C4 алкил)-N(R3)(R3), -N(R3)(R3), -O-(C1-C4 алкил)-N(R3)(R3), -(C1-C4 алкил)-O-(C1-C4 алкил)-N(R3)(R3), -C(O)-N(R3)(R3) и -(C1-C4 алкил)-C(O)-N(R3)(R3), и когда R1 является фенилом, R1 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси или фторзамещенным 3,4-этилендиокси, где
каждый R3 независимо выбирают из водорода и -C1-C4 алкила; или два R3 вместе с атомом азота, к которому они присоединены, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(=O)2 и O, где алкил необязательно замещен одним или более -OH, фтором, -NH2, -NH(C1-C4 алкилом), -N(C1-C4 алкилом)2, -NH(CH2CH2OCH3) или -N(CH2CH2OCH3)2 и насыщенным гетероциклом, необязательно замещенным на углеродном атоме -OH, -C1-C4 алкилом, фтором, -NH2, -NH(C1-C4 алкилом), -N(C1-C4 алкилом)2, -NH(CH2CH2OCH3) или -N(CH2CH2OCH3)2;
R2 выбирают из карбоцикла и гетероцикла, где R2 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, C3-C7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R3, -S-R3, -(C1-C4 алкил)-N(R3)(R3), -N(R3)(R3), -O-(C1-C4 алкил)-N(R3)(R3), -(C1-C4 алкил)-O-(C1-C4 алкил)-N(R3)(R3), -C(O)-N(R3)(R3), -(C1-C4 алкил)-C(O)-N(R3)(R3), -O-фенила, фенила и второго гетероцикла, и когда R2 является фенилом, R2 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси или фторзамещенным 3,4-этилендиокси, где любой фенил или второй гетероциклический заместитель в R2 необязательно замещен галогеном; -C≡N; C1-C4 алкилом, фторзамещенным C1-C2 алкилом, -O-(C1-C2) фторзамещенным алкилом, -O-(C1-C4) алкилом, -S-(C1-C4) алкилом, -S-(C1-C2) фторзамещенным алкилом, -NH-(C1-C4) алкилом и -N-(C1-C4)2 алкилом;
R4 выбирают из водорода, C1-C4 алкила, C1-C4 фторзамещенного алкила, C1-C4 алкил-N(R7)(R7), C1-C4 алкил-C(O)-N(R7)(R7), C1-C4 алкил-O-R7 и C1-C4 алкил-NR7-C(O)R7, где каждый R7 независимо выбирают из водорода и C1-C4 алкила; и
X выбирают из -NH-C(=O)-†, -C(=O)-NH-†, -NH-C(=S)-†, -C(=S)-NH-†, -NH-S(=O)-†, -S(=O)-NH-†, -S(=O)2-NH-†, -NH-S(=O)2-†, -NH-S(O)2-NR5-†, -NR5-S(O)2-NH-†, -NH-C(=O)O-†, -OC(=O)NH-†, -NH-C(=O)NR5-†, -NR5-C(=O)NH-†, -NH-NR5-†, -NR5-NH-†, -O-NH-†, -NH-O-†, -NH-CR5R6-†, -CR5R6-NH-†, -NH-C(=NR5)-†, -C(=NR5)-NH-†, -C(=O)-NH-CR5R6-†, -CR5R6-NH-C(O)-†, -NH-C(=S)-CR5R6-†, -CR5R6-C(=S)-NH-†, -NH-S(O)-CR5R6-†, -CR5R6-S(O)-NH-†, -NH-S(O)2-CR5R6-†, -CR5R6-S(O)2-NH-†, -NH-C(=O)-O-CR5R6-†, -CR5R6-O-C(=O)-NH-†, -NH-C(=O)-NR5-CR5R6-† и -CR5R6-NH-C(=O)-O-†, где
† обозначает место, в котором X соединен с R1; и
каждый R5 и R6 независимо выбирают из водорода, C1-C4 алкила, -CF3 и (C1-C3 алкил)-CF3.
В конкретных вариантах осуществления соединения структурной формулы (I) характеризуются одной или более из следующих характеристик:
когда каждый из Z1, Z2 и Z3 является CR; W1 является -O-, W2 является -C=, R4 является H; и X является -NH-CR5R6-† или -CR5R6-NH-†, тогда R2 не является необязательно замещенным пиридин-4-илом или незамещенным морфолин-4-илом;
когда каждый из Z1, Z2 и Z3 является CH; W1 является -O-; W2 является -C=; R4 является H или C1-C4 алкилом; R2 является фенилом; и X является -C(=O)-NH-†, тогда R1 не является 1H-бензимидазол-2-илом, 2,3-дигидро-2-оксо-1H-бензимидазол-5-илом, 4-метилпиперазин-1-илом, 6-(морфолин-4-ил)пиридин-3-илом, 5-(морфолин-4-ил)изохинолин-8-илом, 5-хлор-2-(4-метил-1-пиперазинил)фенилом, 7-фтор-3,4-дигидро-4-оксо-6-хиназолинилом, 1-метил-1H-пиразол-3-илом, 1H-пиразол-3-илом, тетразол-5-илом, 5-(1-метилэтил)-1,3,4-тиадиазол-2-илом, 5-(этилтио)-1,3,4-тиадиазол-2-илом, 5-этил-1,3,4-тиадиазол-2-илом или 4-(пирролидин-1-илметил)тиазол-2-илом; и
когда каждый из Z1, Z2 и Z3 является CH; W1 является -O-; W2 является -C=; R4 является H или C1-C4 алкилом; R2 является фенилом; и X является -C(=O)-NH-†, тогда R1 не является тетразол-5-илом.
В конкретных вариантах осуществления соединение структурной формулы (I) представлено следующей структурой:
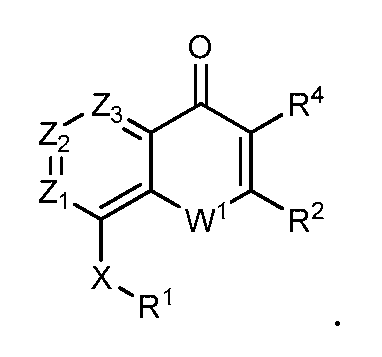
В конкретных вариантах осуществления каждый из Z1, Z2 и Z3 независимо являются CR. В конкретных вариантах осуществления один из Z1, Z2 или Z3 является N, например, Z1 является N, или Z2 является N, или Z3 является N. В некоторых из этих вариантов осуществления R является H, так что в конкретных вариантах осуществления каждый из Z1 и Z2 являются -CH-, каждый из Z1 и Z3 являются -CH-, каждый из Z2 и Z3 являются -CH- или все Z1, Z2 и Z3 являются -CH-.
В конкретных вариантах осуществления R выбирают из водорода, -(C1-C4) алкил-N(R7)(R7), -(C1-C4) алкил-C(O)-N(R7)(R7), -(C2-C4) алкил-O-R7 и -(C2-C4) алкил-N(R7)-C(O)-R7. В конкретных вариантах осуществления R является водородом.
В конкретных вариантах осуществления W1 выбирают из -O-, -NH- или -N=. В конкретных вариантах осуществления W2 выбирают из -NR4- или -CR4=. В других вариантах осуществления когда W1 является -N=, тогда W2 выбирают из -NR4- и -CR4=. В конкретных вариантах осуществления когда W1 является -O-, W2 является -CR4=. В конкретных вариантах осуществления когда W1 является -NH-, W2 выбирают из -NR4- и -CR4=.
В конкретных вариантах осуществления соединение структурной формулы (I) представлено следующей структурой:
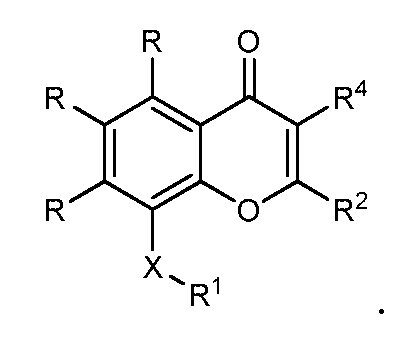
В конкретных вариантах осуществления соединение структурной формулы (I) представлено следующей структурой:
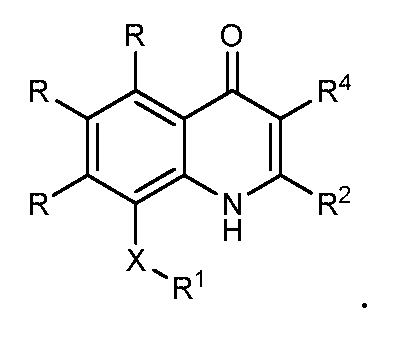
В конкретных вариантах осуществления R4 выбирают из водорода, -C=N, C1-C4 алкила и фторзамещенного C1-C4 алкила. В конкретных вариантах осуществления R4 является водородом. В конкретных вариантах осуществления где W1 является -O- и W2 является -CR4=, R4 является водородом. В конкретных вариантах осуществления когда Z1, Z2 и Z3 являются -CR-, R4 является водородом.
В конкретных вариантах осуществления X является -NH-C(=O)-† или -C(=O)-NH-†. В конкретных вариантах осуществления X является -NH-C(=O)-†. В примере варианта осуществления X является-NH-C(=O)-†, Z1, Z2 и Z3 являются CR, и R и R4, оба, являются H. В конкретных вариантах осуществления W1 является -O- и W2 является -CR4=, Z1, Z2 и Z3, все, являются CR, R и R4, оба, являются H и X является -NH-C(=O)-†.
В конкретных вариантах осуществления соединение структурной формулы (I) представлено следующей структурой:
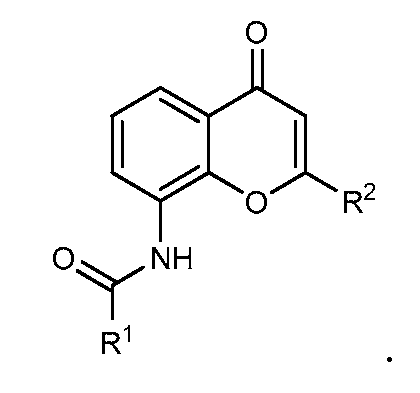
В конкретных вариантах осуществления R1 выбирают из гетероциклов (например, гетероарилов), включающих один или более гетероатомов, выбранных из N, O и S. В конкретных вариантах осуществления R1 выбирают из гетероциклов (например, гетероарилов), включающих один или два атома азота. В конкретных вариантах осуществления R1 выбирают из гетероциклов (например, гетероарилов), включающих до трех гетероатомов, выбранных из S и N. В других вариантах осуществления R1 выбирают из гетероциклов (например, гетероарилов), включающих до трех гетероатомов, выбранных из O и N.
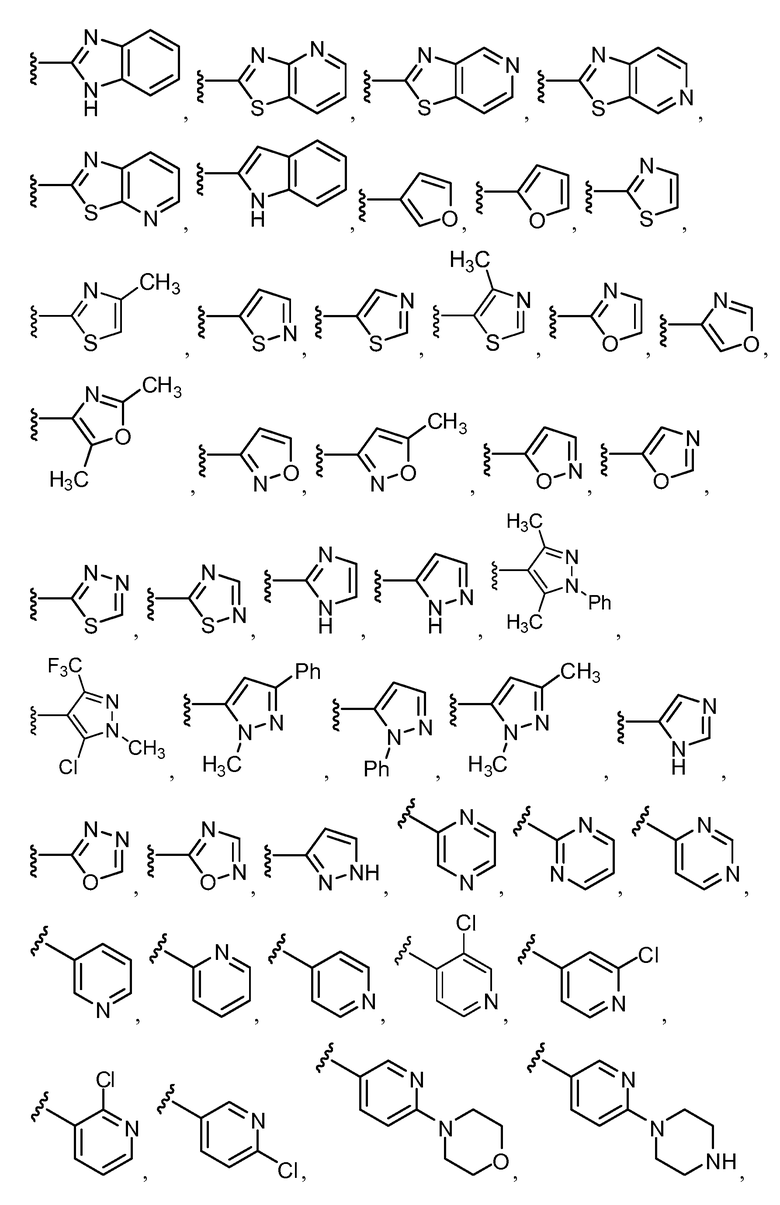
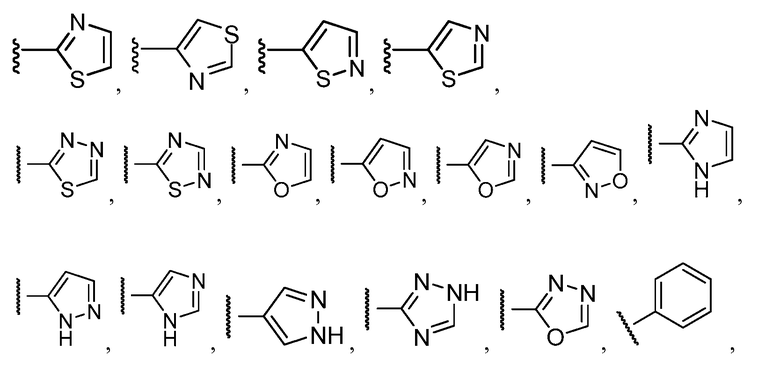
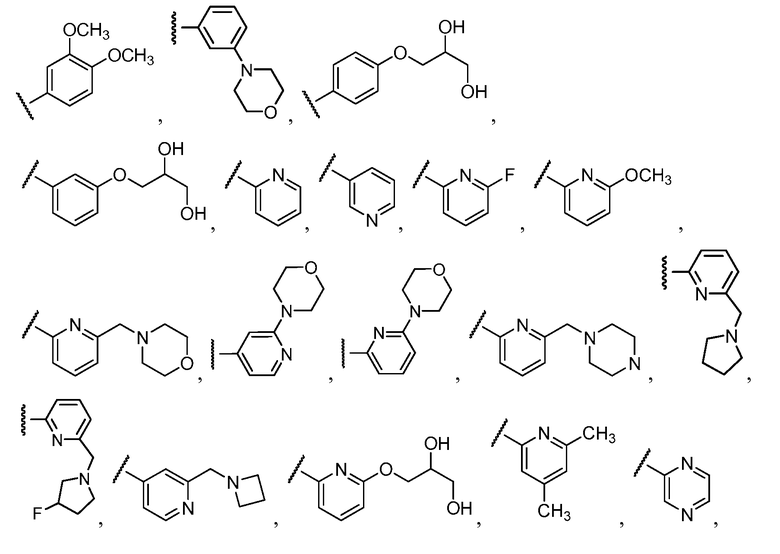
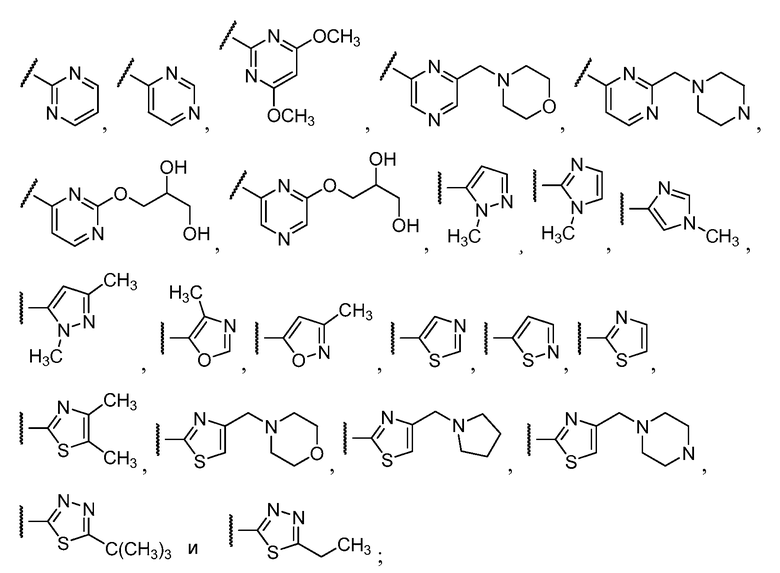
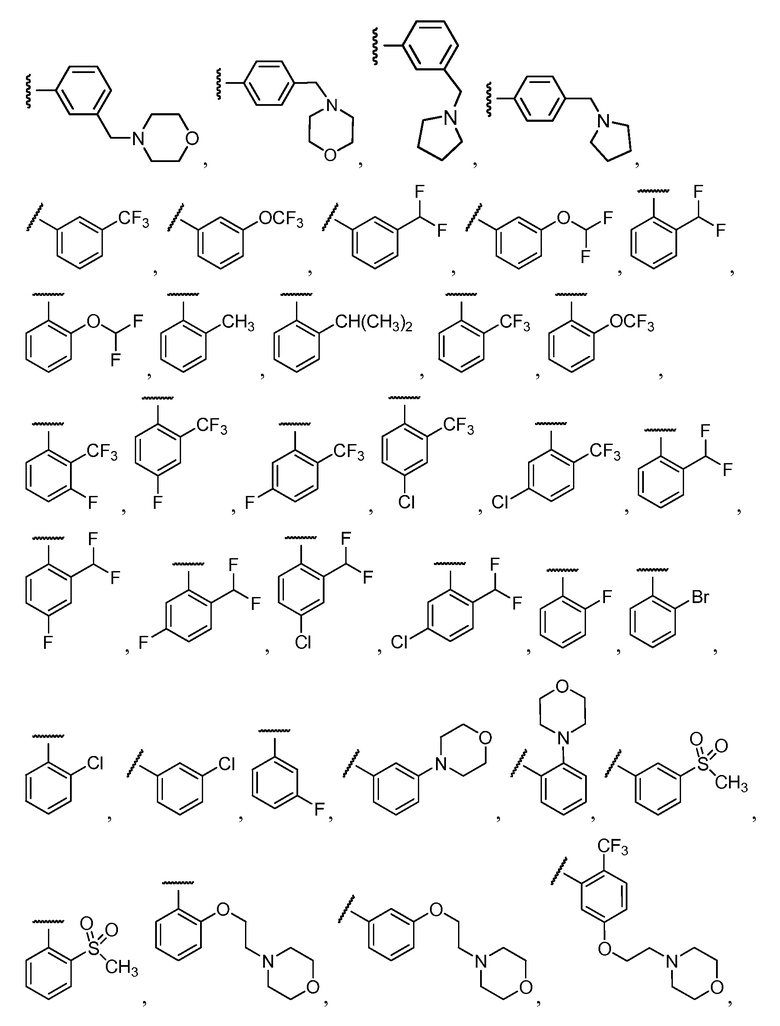
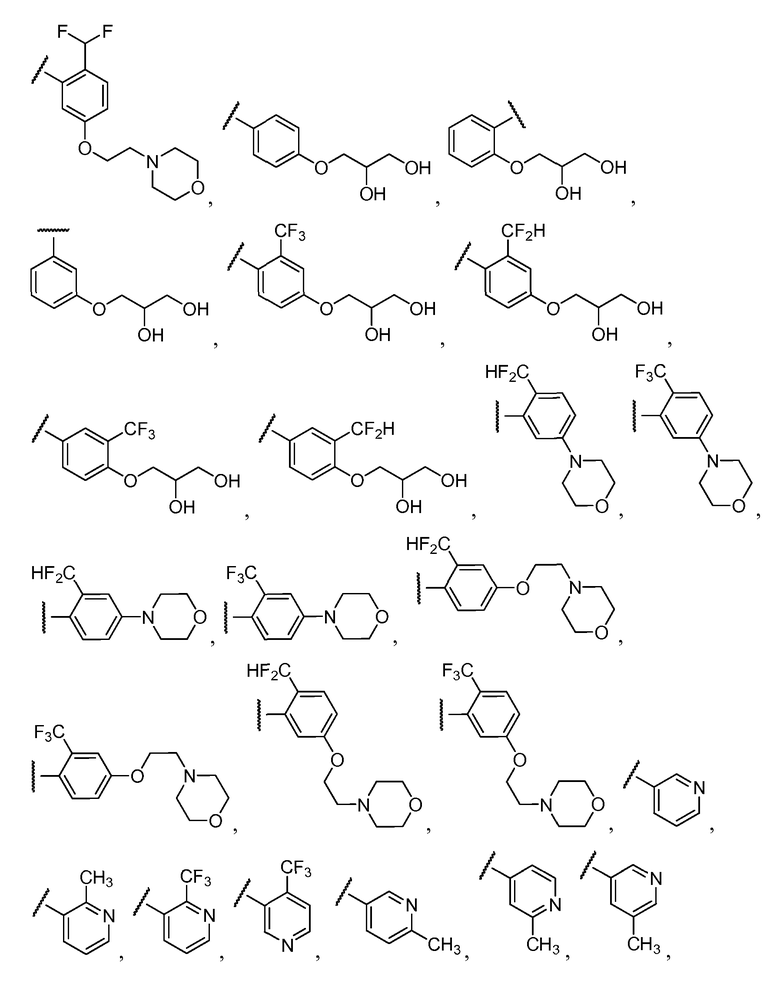
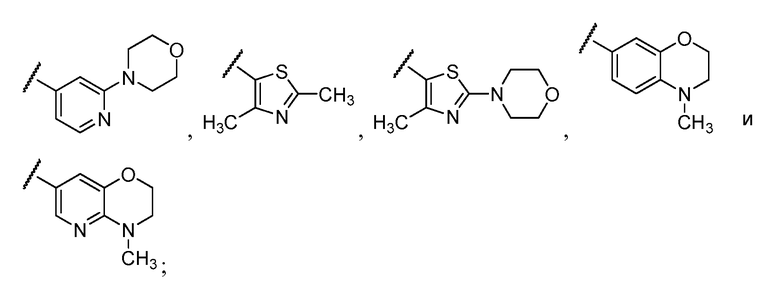
Примеры R1 включают
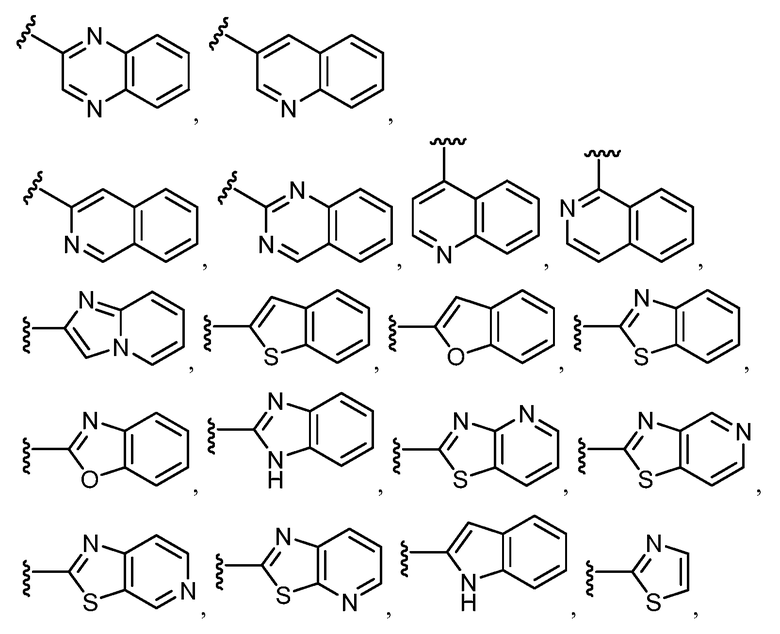
В конкретных таких вариантах осуществления R1 выбирают из
В приведенных выше вариантах осуществления R1 необязательно замещен 1 или 2 заместителями, независимо выбранными из галогена, (C1-C4) алкила и =O. В конкретных вариантах осуществления R1 является тиазолом или пиразином, необязательно замещенным одним или более заместителями, выбранными из галогена и (C1-C4) алкила. В конкретных вариантах осуществления R1 является необязательно замещенным тиазолом. В других вариантах осуществления R1 является необязательно замещенным пиразином, и X является -NH-C(=O)-†.
В конкретных вариантах осуществления R2 выбирают из арила и гетероарила. В конкретных вариантах осуществления R2 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, C1-C2 фторзамещенного алкила, -OR8, где R8 является алкилом, необязательно замещенным одним или более галогенами. В конкретных вариантах осуществления R2 является фенилом, необязательно замещенным одним или более заместителями, независимо выбранными из -Cl, -Br, -F, -C≡N, -CF3 и -OCF3.
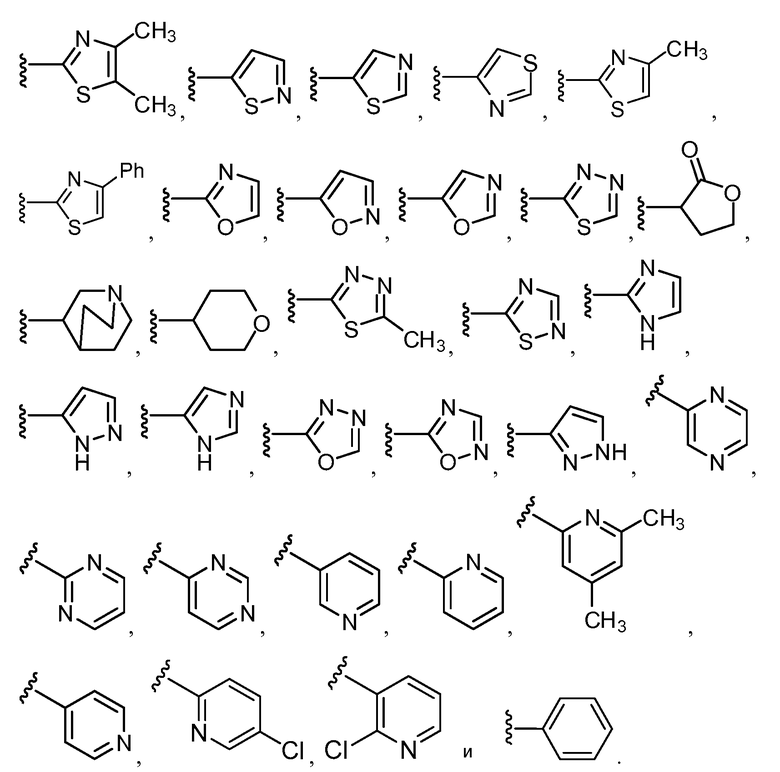
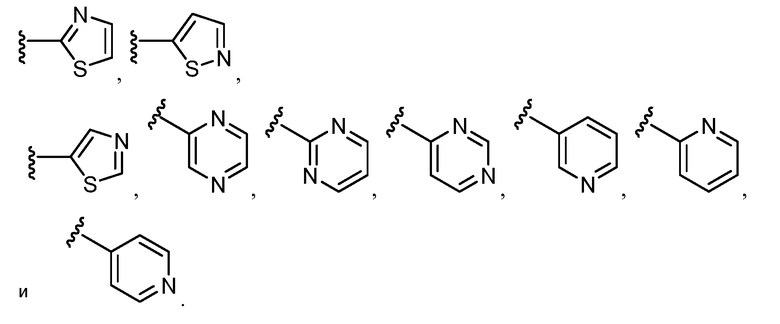
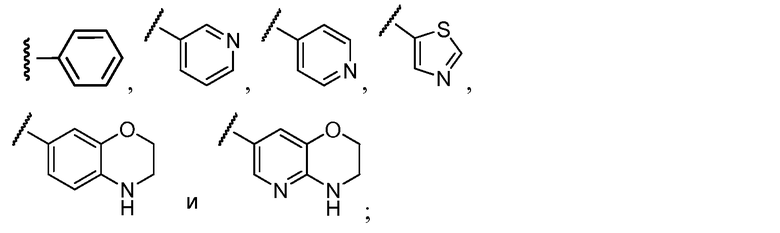
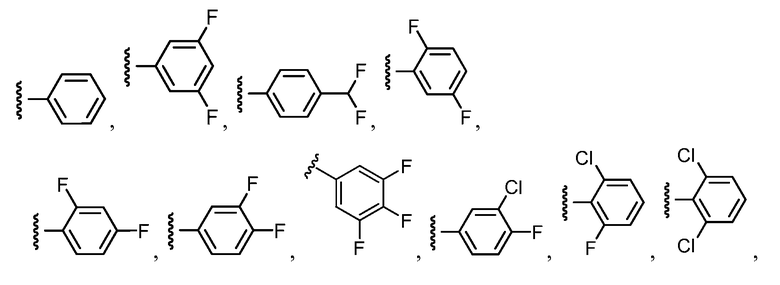
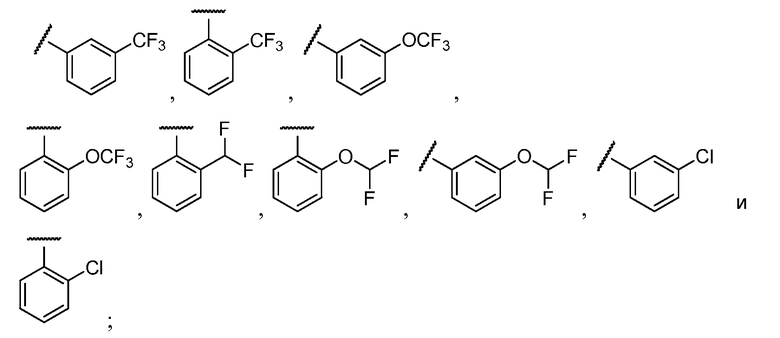
Примеры R2 включают
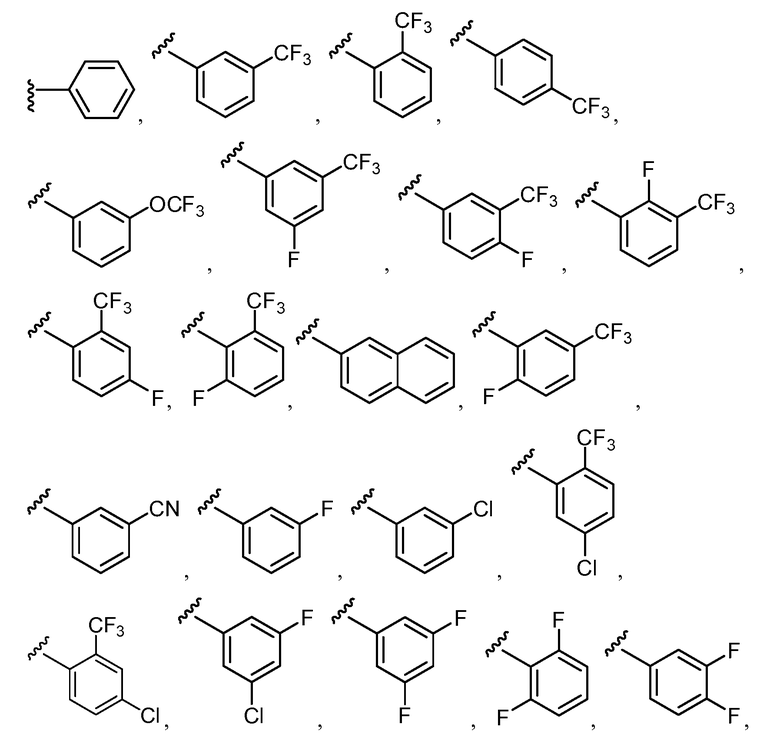

В конкретных вариантах осуществления R2 является мета-замещенным по отношению к месту присоединения R2 к остальной части соединения, и где R2 необязательно дополнительно замещен, как описано выше. В конкретных вариантах осуществления R2 выбирают из
В конкретных вариантах осуществления Z1, Z2 и Z3, каждый, независимо выбирают из CR, W1 выбирают из -O-, -N= и -N, W2 является -CR4= или -NR4-, X является -NH-C(=O)-†, R1 является необязательно замещенным тиазолом или пиразолом и R2 является необязательно замещенным фенилом. В конкретных вариантах осуществления R является H.
В конкретных вариантах осуществления модулирующие сиртуин соединения изобретения представлены структурной формулой (I)
или их солью, где W1, W2, R1, R4, Z1, Z2 и Z3 определены ранее, и
---- представляет необязательную химическую связь,
R2 выбирают из карбоцикла и гетероцикла, где R2 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, C3-C7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R3, -S-R3, -(C1-C4 алкил)-N(R3)(R3), -N(R3)(R3), -O-(C1-C4 алкил)-N(R3)(R3), -(C1-C4 алкил)-O-(C1-C4 алкил)-N(R3)(R3), -C(O)-N(R3)(R3), -(C1-C4 алкил)-C(O)-N(R3)(R3), -O-фенила, фенила и второго гетероцикла, и когда R2 является фенилом, R2 замещен, по меньшей мере, одним заместителем, таким как галоген, -C≡N, C1-C4 алкил, C3-C7 циклоалкил, C1-C2 фторзамещенный алкил, -O-R3, -S-R3, -(C1-C4 алкил)-N(R3)(R3), -N(R3)(R3), -О-(C1-C4 алкил)-N(R3)(R3), -(C1-C4 алкил)-O-(C1-C4 алкил)-N(R3)(R3), -C(O)-N(R3)(R3), -(C1-C4 алкил)-C(O)-N(R3)(R3), -O-фенил, фенил и второй гетероцикл, 3,4-метилендиокси, фторзамещенный 3,4-метилендиокси, 3,4-этилендиокси или фторзамещенный 3,4-этилендиокси, где любой фенил или второй гетероциклический заместитель в R2 необязательно замещен галогеном; -C≡N; C1-C4 алкилом, фторзамещенным C1-C2 алкилом, -O-(C1-C2) фторзамещенным алкилом, -O-(C1-C4) алкилом, -S-(C1-C4) алкилом, -S-(C1-C2) фторзамещенным алкилом, -NH-(C1-C4) алкилом и -N-(C1-C4)2 алкилом; и
X выбирают из -NH-C(=O)-†, -C(=O)-NH-†, -NH-C(=S)-†, -C(=S)-NH-†, -NH-S(=O)-†, -S(=O)-NH-†, -S(=O)2-NH-†, -NH-S(=O)2-†, -NH-S(O)2-NR5-†, -NR5-S(O)2-NH-†, -NH-C(=O)O-†, -OC(=O)NH-†, -NH-C(=O)NR5-†, -NR5-C(=O)NH-†, -NH-NR5-†, -NR5-NH-†, -O-NH-†, -NH-O-†, -NH-C(=NR5)-†, -C(=NR5)-NH-†, -C(=O)-NH-CR5R6-†, -CR5R6-NH-C(O)-†, -NH-C(=S)-CR5R6-†, -CR5R6-C(=S)-NH-†, -NH-S(O)-CR5R6-†, -CR5R6-S(O)-NH-†, -NH-S(O)2-CR5R6-†, -CR5R6-S(O)2-NH-†, -NH-C(=O)-O-CR5R6-†, -CR5R6-O-C(=O)-NH-†, -NH-C(=O)-NR5-CR5R6-† и -CR5R6-O-C(=O)-NH-†, где
† обозначает место, в котором X соединен с R1; и
каждый R5 и R6 независимо выбирают из водорода, C1-C4 алкила, -CF3 и (C1-C3 алкил)-CF3.
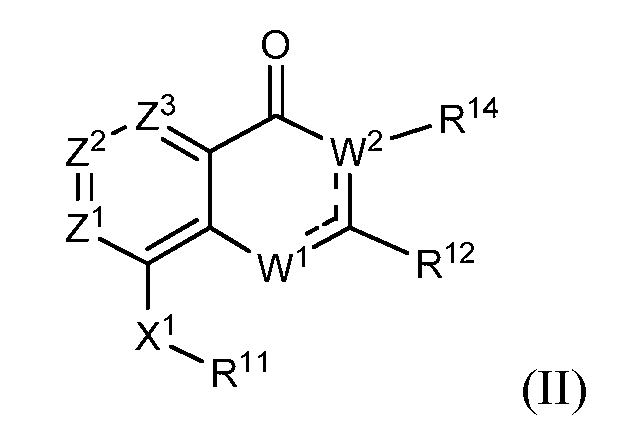
В другом варианте осуществления изобретение предлагает соединение, представленное структурной формулой (II)
или его соль, где
каждый из Z1, Z2 и Z3 независимо выбирают из N и C(R9), где
не более чем один из Z1, Z2 и Z3 является N;
каждый R9 независимо выбирают из водорода, галогена, -C≡N, фторзамещенного C1-C2 алкила, -O-(C1-C2) фторзамещенного алкила, -S-(C1-C2) фторзамещенного алкила, C1-C4 алкила, -S-(C1-C4) алкила, C3-C7 циклоалкила, -(C1-C2) алкил-N(R13)(R13), -O-CH2CH(OH)CH2OH, -O-(C1-C3) алкил-N(R13)(R13) и -N(R13)(R13); и
 представляет вторую химическую связь между либо W2 и C(R12), либо W1 и C(R12);
представляет вторую химическую связь между либо W2 и C(R12), либо W1 и C(R12);
W1 выбирают из -O-, -NH- или -N=, и
W2(R14) выбирают из -N(R14)- и -C(R14)=, при этом
когда W1 является -O-, один из Z1, Z2 и Z3 является N;
когда W1 является -O- или -NH-, W2(R14) является -C(R14)= и  представляет вторую химическую связь между W2 и C(R12);
представляет вторую химическую связь между W2 и C(R12);
когда W1 является -N=, W2(R14) является -N(R14)-, и  представляет вторую химическую связь между W1 и C(R12);
представляет вторую химическую связь между W1 и C(R12);
R11 выбирают из карбоцикла и гетероцикла, где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, =O, C3-C7 циклоалкила, фторзамещенного C1-C4 алкила, -O-R13, -S-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13), -O-(C1-C4 алкил)-N(R13)(R13), -(C1-C4 алкил)-O-(C1-C4 алкил)-N(R13)(R13), -C(O)-N(R13)(R13) и -(C1-C4 алкил)-C(O)-N(R13)(R13), и когда R11 является фенилом, R11 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4-этилендиокси, O-(насыщенным гетероциклом), фторзамещенным -O-(насыщенным гетероциклом) или C1-C4 алкилзамещенным O-(насыщенным гетероциклом), где
каждый R13 независимо выбирают из водорода и -C1-C4 алкила; или два R13 вместе с атомом азота, к которому они присоединены, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из NH, S, S(=O), S(=O)2 и O, где
когда R13 является алкилом, алкил необязательно замещен одним или более заместителями, выбранными из -OH, фтора, -NH2, -NH(C1-C4 алкила), -N(C1-C4 алкила)2, -NH(CH2CH2OCH3) и -N(CH2CH2OCH2)2, и
когда два R13 вместе с атомом азота, к которому они присоединены, образуют 4-8-членный насыщенный гетероцикл, насыщенный гетероцикл необязательно замещен на любом углеродном атоме -OH, -C1-C4 алкилом, фтором, -NH2, -NH(C1-C4 алкилом), -N(C1-C4 алкилом)2, -NH(CH2CH2OCH3) или -N(CH2CH2OCH3)2 и необязательно замещен на любом способном к замещению атоме азота -C1-C4 алкилом, фторзамещенным C1-C4 алкилом или -(CH2)2-O-CH3;
R12 выбирают из карбоцикла и гетероцикла, не являющегося тетразолилом, где R12 необязательно замещен одним или более заместителями, независимо выбранными из галогена, -C=N, C1-C4 алкила, C3-C7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R13, -S-R13, -S(O)-R13, -S(O)2-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13), -O-(C1-C4 алкил)-N(R13)(R13), -(C1-C4 алкил)-O-(C1-C4 алкил)-N(R13)(R13), -C(O)-N(R13)(R13), -(C1-C4 алкил)-C(O)-N(R13)(R13), -O-фенила, фенила и второго гетероцикла, и когда R12 является фенилом, R12 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси или фторзамещенным 3,4-этилендиокси или -O-(насыщенным гетероциклом), где любой фенил, второй гетероцикл или часть насыщенного гетероцикла заместителя R12 необязательно замещены галогеном; -C≡N; C1-C4 алкилом, фторзамещенным C1-C2 алкилом, -O-(C1-C2) фторзамещенным алкилом, -O-(C1-C4) алкилом, -S-(C1-C4) алкилом, -S-(C1-C2) фторзамещенным алкилом, -NH-(C1-C4) алкилом и -N-(C1-C4) алкилом;
R14 выбирают из водорода, C1-C4 алкила, C1-C4 фторзамещенного алкила, C1-C4 алкил-N(R13)(R13), C1-C4 алкил-C(O)-N(R13)(R13), C1-C4 алкил-O-R13 и C1-C4 алкил-NR13-C(O)R13; и
X1 выбирают из -NH-C(=O)-†, -C(=O)-NH-†, -NH-C(=S)-†, -C(=S)-NH-†, -NH-S(=O)-†, -S(=O)-NH-†, -S(=O)2-NH-†, -NH-S(=O)2-†, -NH-S(O)2-NR15-†, -NR15-S(O)2-NH-†, -NH-C(=O)O-†, -OC(=O)NH-†, -NH-C(=O)NR15-†, -NR15-C(=O)NH-†, -NH-NR15-†, -NR15-NH-†, -O-NH-†, -NH-O-†, -NH-CR15R16-†, -CR15R16-NH-†, -NH-C(=NR15)-†, -C(=NR15)-NH-†, -C(=O)-NH-CR15R16-†, -CR15R16-NH-C(O)-†, -NH-C(=S)-CR15R16-†, -CR15R16-C(=S)-NH-†, -NH-S(O)-CR15R16-†, -CR15R16-S(O)-NH-†, -NH-S(O)2-CR15R16-†, -CR15R16-S(O)2-NH-†, -NH-C(=O)-O-CR15R16-†, -CR15R16-O-C(=O)-NH-†, -NH-C(=O)-NR15-CR15R16-†, -NH-C(=O)-CR15R16-† и -CR15R16-NH-C(=O)-O-†, где
† обозначает место, в котором X1 соединен с R11; и
каждый R15 и R16 независимо выбирают из водорода, C1-C4 алкила, -CF3 и (C1-C3 алкил)-CF3.
В конкретных вариантах осуществления соединения структурной формулы (II) характеризуются с помощью одной или более следующих характеристик:
соединение структурной формулы (II) представлено структурной формулой (III), (IV) или (V)
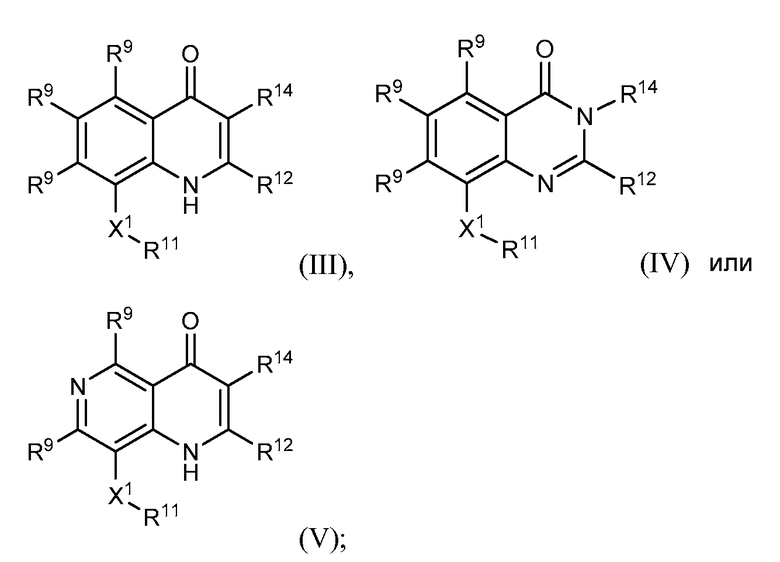
X1 выбирают из -NH-C(=O)-†, -C(=O)-NH-†, -NH-C(=S)-†, -C(=S)-NH-†, -NH-S(=O)-†, -S(=O)-NH-†, -S(=O)2-NH-†, -NH-S(=O)2-†, -NH-S(O)2-NR15-†, -NR15-S(O)2-NH-†, -NH-C(=O)O-†, -OC(=O)NH-†, -NH-C(=O)NR15-†, -NR15-C(=O)NH-†, -NH-NR15-†, -NR15-NH-†, -O-NH-†, -NH-O-†, -NH-C(=NR15)-†, -C(=NR15)-NH-†, -C(=O)-NH-CR15R16-†, -CR15R16-NH-C(O)-†, -NH-C(=S)-CR15R16-†, -CR15R16-C(=S)-NH-†, -NH-S(O)-CR15R16-†, -CR15R16-S(O)-NH-†, -NH-S(O)2-CR15R16-†, -CR15R16-S(O)2-NH-†, -NH-C(=O)-O-CR15R16-†, -CR15R16-O-C(=O)-NH-†, -NH-C(=O)-NR15-CR15R16-†, -NH-C(=O)-CR15R16-† и -CR15R16-NH-C(=O)-O-†;
X1 выбирают из -NH-C(O)-† и -C(O)-NH-†;
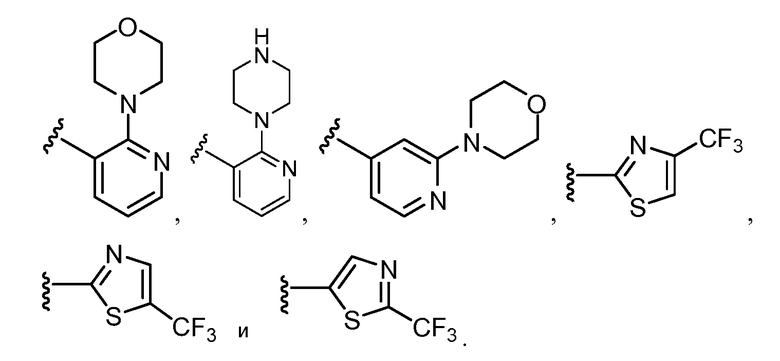
R11 выбирают из

R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, C1-C4 алкила, -(C1-C4 алкила)-N(R13)(R13), =О, -N(R13)(R13) и -O-R13;
R11 выбирают из
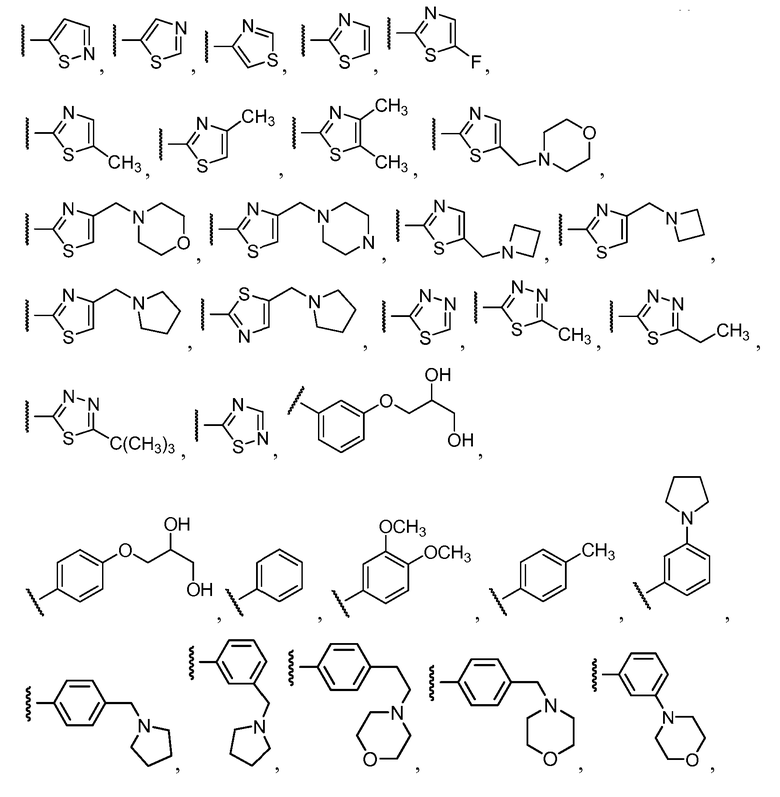

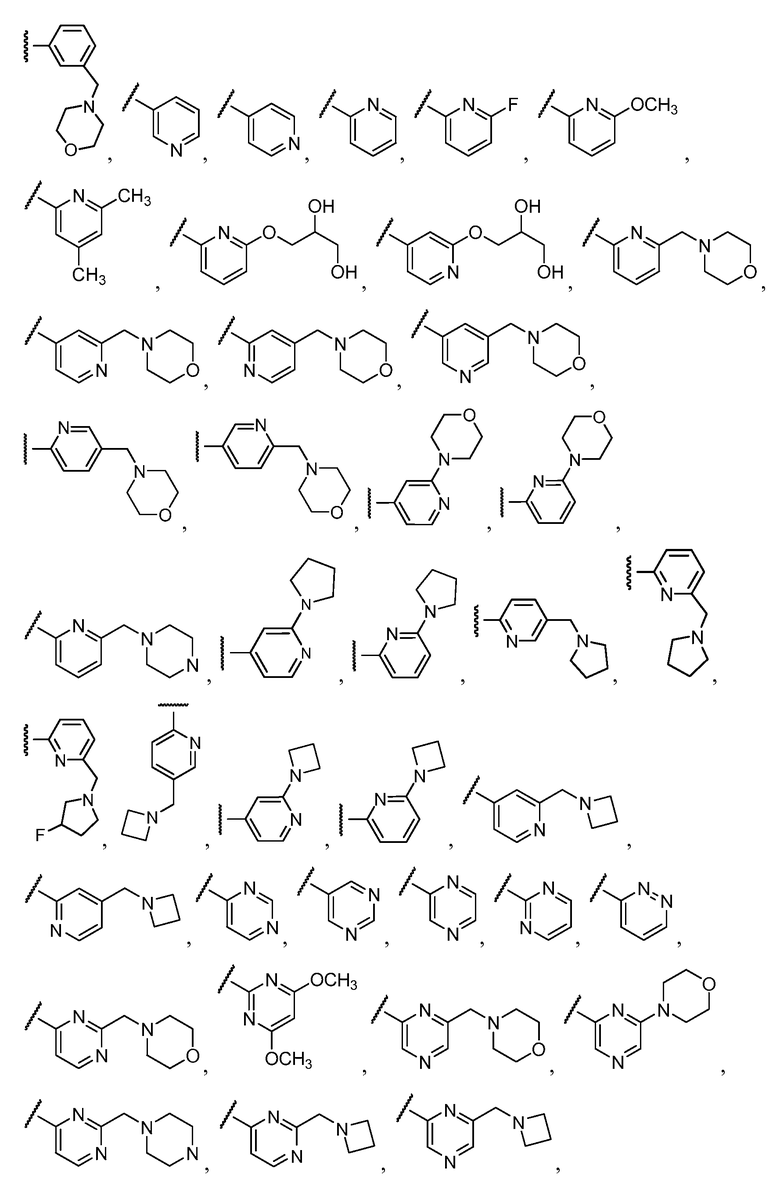
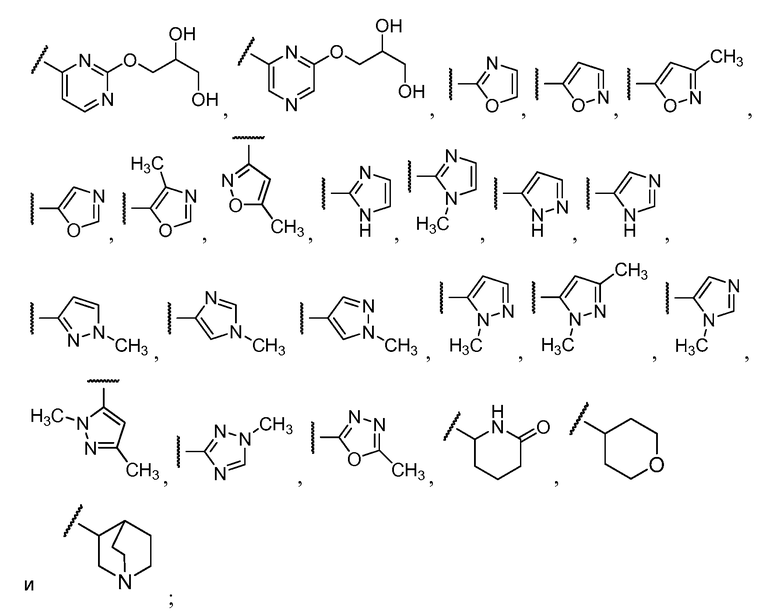
R11 выбирают из
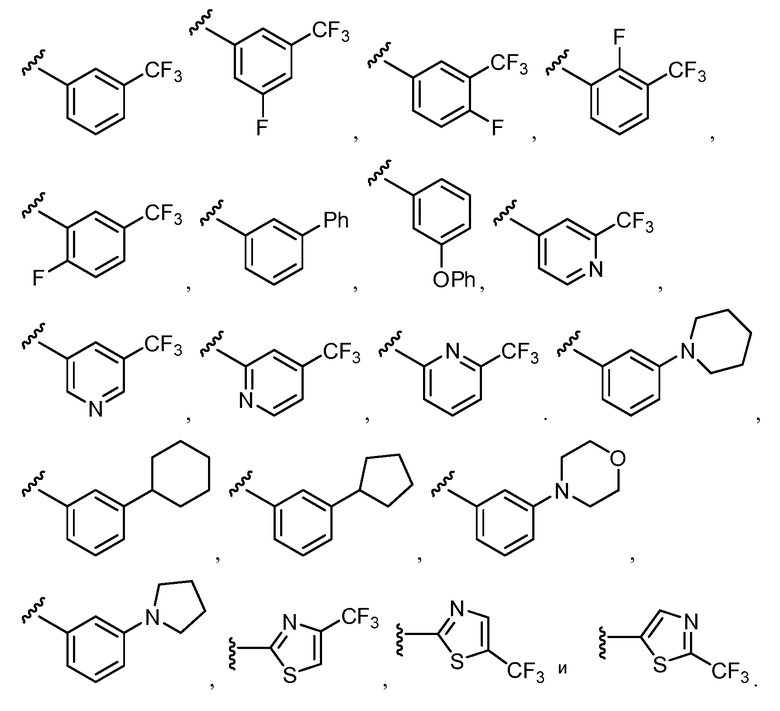
R12 выбирают из
R12 необязательно замещен одной или более группами, независимо выбранными из галогена, C1-C4 алкила, -(C1-C4 алкил)-N(R13)(R13), C1-C2 фторзамещенного алкила, -O-R13, -SO2-R13, -N(R13)(R13) и -O-(C1-C4 алкил)-N(R13)(R13);
R12 выбирают из
R12 выбирают из
R12 выбирают из карбоцикла и гетероцикла, имеющего от 1 до 3 гетероатомов;
R12 выбирают из карбоцикла и гетероцикла, имеющего от 0 до 3 атомов азота;
R12 связан с остальной частью молекулы через кольцевой углеродный атом;
R12 необязательно замещен одним-двумя заместителями;
когда R12 является фенилом, R12 замещен, по меньшей мере, одним заместителем;
W2(R14) является -N(R14)- и R14 выбирают из водорода и -(C1-C4) алкила;
W2(R14) является -C(R14)- и R14 является водородом;
каждый из Z1, Z2 и Z3 является C(R9); и
каждый из Z1, Z2 и Z3 является -CH=.
Соединения изобретения, включая новые соединения изобретения, могут также применяться в описанных способах.
Описанные в описании соединения и их соли также включают их соответствующие гидраты (например, полугидрат, моногидрат, дигидрат, тригидрат, тетрагидрат) и сольваты. Обычно подходящие растворители для получения сольватов и гидратов могут быть подобраны специалистом в этой области.
Соединения и их соли могут присутствовать в аморфной или кристаллической (включая сокристаллическую и полиморфную) формах.
Модулирующие сиртуин соединения изобретения успешно модулируют уровень и/или активность белка сиртуина, в частности активность деацетилазы белка сиртуина.
По отдельности или в дополнение к приведенным выше свойствам конкретные модулирующие сиртуин соединения изобретения практически не обладают одним или более видами следующей активности: ингибированием PI3-киназы, ингибированием альдоредуктазы, ингибированием тирозинкиназы, трансактивацией EGFR тирозинкиназы, коронарной дилатацией или спазмолитической активностью при концентрациях соединения, которые являются эффективными для модулирования активности белка сиртуина в отношении деацетилирования (например, такого как белок SIRT1 и/или SIRT3).
Карбоциклы включают 5-7-членные моноциклические и 8-12-членные бициклические кольца, где моноциклические или бициклические кольца выбирают из насыщенных, ненасыщенных и ароматических колец. Карбоцикл необязательно замещен одним или более заместителями, такими как галоген, -C≡N, C1-C3 алкил, C1-C2 фторзамещенный алкил, -O-(C1-C2) фторзамещенный алкил, -O-(C1-C3) алкил, -S-(C1-C3) алкил, -S-(C1-C2) фторзамещенный алкил, гидроксил, амино, -NH-(C1-C3) алкил и -N-(C1-C3)2 алкил. Примеры карбоциклов включают циклопентил, циклогексил, циклогексенил, адамантил, фенил и нафтил.
Гетероциклы включают 4-7-членные моноциклические и 8-12-членные бициклические кольца, содержащие один или более гетероатомов, выбранных, например, из атомов N, O и S. В конкретных вариантах осуществления гетероциклическую группу выбирают из насыщенной, ненасыщенной или ароматической группы. Гетероцикл необязательно замещен одним или более заместителями, такими как галоген, -C≡N, C1-C3 алкил, C1-C2 фторзамещенный алкил, -O-(C1-C2) фторзамещенный алкил, -O-(C1-C3) алкил, -S-(C1-C3) алкил, -S-(C1-C2) фторзамещенный алкил, гидроксил, амино, -NH-(C1-C3) алкил и -N-(C1-C3)2 алкил.
Моноциклические кольца включают 5-7-членный арил или гетероарил, 3-7-членный циклоалкил и 5-7-членный неароматический гетероциклил. Моноциклические кольца необязательно замещены с помощью одного или более заместителей, таких как галоген, циано, низший алкокси, низший алкил, гидроксил, амино, низший алкиламино и низший диалкиламино. Примеры моноциклических групп включают замещенные или незамещенные гетероциклы или карбоциклы, такие как тиазолил, оксазолил, оксазинил, тиазинил, дитианил, диоксанил, изоксазолил, изотиазолил, триазолил, фуранил, тетрагидрофуранил, дигидрофуранил, пиранил, тетразолил, пиразолил, пиразинил, пиридазинил, имидазолил, пиридинил, пирролил, дигидропирролил, пирролидинил, пиперидинил, пиперазинил, пиримидинил, морфолинил, тетрагидротиофенил, тиофенил, циклогексил, циклопентил, циклопропил, циклобутил, циклогептанил, азетидинил, оксетанил, тииранил, оксиранил, азиридинил и тиоморфолинил.
Ароматические (арильные) группы включают карбоциклические ароматические группы, такие как фенил, нафтил и антрацил, и гетероарильные группы, такие как имидазолил, тиенил, фурил, пиридил, пиримидил, пиранил, пиразолил, пирролил, пиразинил, тиазолил, оксазолил и тетразолил. Ароматические группы также включают конденсированные полициклические ароматические кольцевые системы, в которых карбоциклическое ароматическое кольцо или гетероарильное кольцо конденсировано с одним или более другими гетероарильными кольцами. Примеры включают бензотиенил, бензофурил, индолил, хинолинил, бензотиазол, бензоксазол, бензимидазол, хинолинил, изохинолинил и изоиндолил.
Азабицикло относится к бициклической молекуле, которая содержит атом азота в структуре кольца. Два кольца бицикла могут быть конденсированными в положении двух взаимно связанных атомов, например индол, через последовательность атомов, например азабицикло[2.2.1]гептан, и в положении одного атома, например спироцикл.
Мостиковый азабицикл относится к бициклической молекуле, которая содержит атом азота и два конденсированных кольца, где конденсирование происходит через последовательность атомов, то есть через атомы в голове мостика. Мостиковые бициклосоединения включают, по меньшей мере, один мостик из одного или более атомов, соединяющий два атома в голове мостика.
Фторзамещенное соединение включает от одного фторзаместителя до полного фторзамещения. Пример фторзамещенного C1-C2 алкила включает -CFH2, CF2H, -CF3, -CH2CH2F, -CH2CHF2, -CHFCH3 и -CF2CHF2. Перфторзамещенный C1-C2 алкил, например, включает -CF3 и -CF2CF3.
Предусматриваемые этим изобретением комбинации заместителей и переменных являются только теми комбинациями, которые дают в результате образование стабильных соединений. Используемый в описании термин "стабильные" относится к соединениям, которые обладают стабильностью, достаточной для получения соединения и для сохранения целостности соединения в течение достаточного периода времени, чтобы применять его для подробно описываемых в описании целей.
Раскрываемые в описании соединения также включают частично и полностью дейтерированные формы. В конкретных вариантах осуществления дейтерированные формы могут быть использованы для кинетических исследований. Любой специалист в этой области может выбрать места, в которых присутствуют такие атомы дейтерия.
В настоящее изобретение также входят соли, в частности фармацевтически приемлемые соли, описываемых в описании моделирующих сиртуин соединений. Соединения настоящего изобретения, которые обладают достаточно кислыми, достаточно основными или и теми и другими функциональными группами, могут реагировать с любым из ряда неорганических оснований и неорганических и органических кислот с образованием соли. Альтернативно, соединения, которые являются по своей природе несущими заряд, такие как соединения с четвертичным азотом, могут образовывать соль с соответствующим противоионом (например, галогенидом, таким как бромид, хлорид или фторид, в частности бромид).
Кислотами, обычно используемыми для образования кислотно-аддитивных солей, являются неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, фосфорная кислота и другие подобные кислоты, и органические кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и другие подобные кислоты. Примеры таких солей включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрогенфосфат, дигидрогенфосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гамма-гидроксибутират, гликолат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и другие подобные соли.
Основно-аддитивные соли включают соли, полученные из неорганических оснований, таких как гидроксиды аммония или щелочных или щелочноземельных металлов, карбонаты, бикарбонаты и другие подобные основания. Такие основания, подходящие для получения солей этого изобретения, таким образом, включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия и другие подобные основания.
Согласно другому варианту осуществления настоящее изобретение предлагает способы получения определенных выше модулирующих сиртуин соединений. Соединения могут быть синтезированы с помощью традиционных методик. Предпочтительно, чтобы эти соединения можно было достаточно просто получать из легкодоступных исходных материалов.
Трансформации и методики синтетической химии, применяемые при синтезе описываемых в описании модулирующих сиртуин соединений, известны в области техники и включают, например, трансформации и методики, описанные R. Larock, Comprehensive Organic Transformations (1989); T. W. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, 2d. Ed. (1991); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis (1994); и L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis (1995).
В примере варианта осуществления модулирующее сиртуин соединение может проникать через цитоплазматическую мембрану клетки. Например, соединение может иметь клеточную проницаемость, по меньшей мере, около 20%, 50%, 75%, 80%, 90% или 95%.
Описываемые в описании модулирующие сиртуин соединения могут также иметь одну или более из следующих характеристик: соединение может быть фактически нетоксичным по отношению к клетке или субъекту; модулирующее сиртуин соединение может быть органической молекулой или синтетической молекулой с массой 2000 атомных единиц или менее, 1000 атомных единиц или менее; соединение может иметь период полужизни при нормальных атмосферных условиях, по меньшей мере, около 30 дней, 60 дней, 120 дней, 6 месяцев или 1 года; соединение может иметь период полужизни в растворе, по меньшей мере, около 30 дней, 60 дней, 120 дней, 6 месяцев или 1 года; модулирующее сиртуин соединение может быть более стабильным в растворе, чем ресвератрол, по меньшей мере, примерно на 50%, в 2 раза, 5 раз, 10 раз, 30 раз, 50 раз или 100 раз; модулирующее сиртуин соединение может ускорять деацетилирование фактора Ku70 репарации ДНК; модулирующее сиртуин соединение может ускорять деацетилирование RelA/p65; соединение может увеличивать общие скорости цикла клеток и повышать чувствительность клеток к апоптозу, индуцированному TNF (фактором некроза опухолей).
В конкретных вариантах осуществления модулирующее сиртуин соединение не обладает никакой существенной способностью ингибировать гистондеацетилазу (HDAC) класса I, HDAC класса II или HDAC I и II, при концентрациях (например, in vivo), эффективных при модулировании деацетилазной активности сиртуина. Например, в предпочтительных вариантах осуществления модулирующим сиртуин соединением является активирующее сиртуин соединение, и его выбирают так, чтобы оно имело EC50 при активации деацетилазной активности сиртуина, по меньшей мере, в 5 раз меньше, чем EC50 при ингибировании HDAC I и/или HDAC II, и еще более предпочтительно, по меньшей мере, в 10 раз, 100 раз или даже в 1000 раз меньше. Способы оценки HDAC I и/или HDAC II активности хорошо известны в области техники, и наборы для проведения таких исследований могут поставляться соответствующими фирмами. См, например, сайт BioVision, Inc. (Mountain View, CA; www.biovision.com) и Thomas Scientific (Swedesboro, NJ; www.tomassci.com).
В конкретных вариантах осуществления модулирующее сиртуин соединение не обладают никакой существенной способностью модулировать гомологи сиртуина. В одном варианте осуществления активатор человеческого белка сиртуин может не обладать никакой существенной способностью активировать белок сиртуин низших эукариотов, в частности дрожжей или патогенов человека, при концентрациях (например, in vivo), эффективных при активации деацетилазной активности человеческого сиртуина. Например, активирующее сиртуин соединение может быть выбрано так, чтобы оно имело величину EC50 деацетилазной активности при активации человеческого сиртуина, такого как SIRT1 и/или SIRT3, по меньшей мере, в 5 раз меньше, чем величина EC50 при активации сиртуина дрожжей, такого как Sir2 (такого как Candida, S. cerevisiae и так далее), и еще более предпочтительно, по меньшей мере, в 10 раз, 100 раз или даже в 1000 меньше. В другом варианте осуществления ингибитор белка сиртуина низших эукариотов, в частности дрожжей или патогенов человека, не обладает никакой существенной способностью ингибировать белок сиртуин человека при концентрациях (например, in vivo), эффективных при ингибировании деацетилазной активности белка сиртуина низшего эукариота. Например, ингибирующее сиртуин соединение может быть выбрано так, чтобы оно имело величину IC50 при ингибировании деацетилазной активности человеческого сиртуина, такого как SIRT1 и/или SIRT3, по меньшей мере, в 5 раз меньше, чем величина IC50 при ингибировании сиртуин дрожжей, такого как Sir2 (такого как Candida, S. cerevisiae и так далее), и еще более предпочтительно, по меньшей мере, в 10 раз, 100 раз или даже в 1000 раз меньше.
В конкретных вариантах осуществления модулирующее сиртуин соединение может обладать способностью модулировать один или более гомологов белка сиртуина, таких как, например, один или более SIRT1, SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7 человека. В одном варианте осуществления модулирующее сиртуин соединение обладает способностью модулировать как белок SIRT1, так и белок SIRT3.
В других вариантах осуществления модулятор SIRT1 не обладает никакой существенной способностью модулировать другие гомологи белка сиртуина, такие как, например, один или более SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7 человека, при концентрациях (например, in vivo), эффективных при модулировании деацетилазной активности SIRT1 человека. Например, модулирующее сиртуин соединение может быть выбрано так, чтобы оно имело величину ED50 при модулировании деацетилазной активности SIRT1 человека, по меньшей мере, в 5 раз меньше, чем величина ED50 при модулировании одного или более SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7 человека, и еще более предпочтительно, по меньшей мере, в 10 раз, 100 раз или даже в 1000 меньше. В одном варианте осуществления модулятор SIRT1 не обладает никакой существенной способностью модулировать белок SIRT3.
В других вариантах осуществления модулятор SIRT3 не обладает никакой существенной способностью модулировать другие гомологи белка сиртуина, такие как, например, один или более SIRT1, SIRT2, SIRT4, SIRT5, SIRT6 или SIRT7 человека, при концентрациях (например, in vivo), эффективных при модулировании деацетилазной активности SIRT3 человека. Например, модулирующее сиртуин соединение может быть выбрано так, чтобы оно имело величину ED50 при модулировании деацетилазной активности SIRT3 человека, по меньшей мере, в 5 раз меньше, чем величина ED50 при модулировании одного или более SIRT1, SIRT2, SIRT4, SIRT5, SIRT6 или SIRT7 человека, и еще более предпочтительно, по меньшей мере, в 10 раз, 100 раз или даже в 1000 меньше. В одном варианте осуществления модулятор SIRT3 не обладает никакой существенной способностью модулировать белок SIRT1.
В конкретных вариантах осуществления модулирующее сиртуин соединение может иметь сродство к связыванию белка сиртуина около 10-9 M, 10-10 M, 10-11 M, 10-12 M или меньше. Модулирующее сиртуин соединение может понижать (активатор) или повышать (ингибитор) кажущуюся константу Km (константу Михаэлиса) белка сиртуина для его субстрата или NAD+ (или другого кофактора), по меньшей мере, примерно в 2, 3, 4, 5, 10, 20, 30, 50 или 100 раз. В конкретных вариантах осуществления значения Km определяют с помощью описываемого в описании масс-спектрометрического исследования. Предпочтительные активирующие соединения снижают Km сиртуина для его субстрата или кофактора в большей степени, чем вызванное ресвератролом при одинаковой концентрации, или снижают Km сиртуина для его субстрата или кофактора в такой же степени, что и вызванное ресвератролом, при более низкой концентрации. Модулирующее сиртуин соединение может увеличивать Vmax белка сиртуина, по меньшей мере, примерно в 2, 3, 4, 5, 10, 20, 30, 50 или 100 раз. Модулирующее сиртуин соединение может иметь величину ED50 при модулировании деацетилазной активности белка SIRT1 и/или белка SIRT3 меньше, чем примерно 1 нМ, меньше, чем примерно 10 нМ, меньше, чем примерно 100 нМ, меньше чем примерно 1 мкМ, меньше чем примерно 10 мкМ, меньше, чем примерно 100 мкМ, или примерно в интервале 1-10 нМ, примерно в интервале 10-100 нМ, примерно в интервале 0,1-1 мкМ, примерно в интервале 1-10 мкМ или примерно в интервале 10-100 мкМ. Модулирующее сиртуин соединение может модулировать деацетилазную активность белка SIRT1 и/или белка SIRT3, по меньшей мере, примерно в 5, 10, 20, 30, 50 или 100 раз, измеренную с помощью исследования на клетках или исследования на основе клеток. Активирующее сиртуин соединение может вызывать большее индуцирование деацетилазной активности белка сиртуина, по меньшей мере, примерно на 10%, 30%, 50%, 80%, в 2 раза, 5 раз, 10 раз, 50 раз или 100 раз по сравнению с такой же концентрацией ресвератрола. Модулирующее сиртуин соединение может иметь величину ED50 при модулировании SIRT5, которое, по меньшей мере, примерно в 10 раз, 20 раз, 30 раз, 50 раз больше, чем при модулировании SIRT1 и/или SIRT3.
3. Примеры применений
В конкретных аспектах изобретение предлагает способы модулирования уровня и/или активности белка сиртуина и способы его применения.
В конкретных вариантах осуществления изобретение предлагает способы применения модулирующих сиртуин соединений, в которых модулирующие сиртуин соединения активируют белок сиртуина, например повышают уровень и/или активность белка сиртуина. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для различных терапевтических применений, включая, например, увеличение продолжительности жизни клетки, и лечение и/или предотвращение широкого спектра заболеваний и расстройств, включающих, например, заболевания или расстройства, связанные со старением или стрессом, диабет, ожирение, нейродегенеративные заболевания, сердечно-сосудистое заболевание, нарушение свертываемости крови, воспаление, рак и/или гиперемию и так далее. Способы включают введение субъекту, в случае, если это ему необходимо, фармацевтически эффективного количества модулирующего сиртуин соединения, например активирующего сиртуин соединения.
Без теоретического обоснования предполагают, что активаторы настоящего изобретения могут взаимодействовать с сиртуином в том же самом месте расположения внутри белка сиртуина (например, активный сайт или сайт, оказывающий воздействие на Km или Vmax активного сайта). Считают, что это является причиной того, почему конкретные классы активаторов и ингибиторов сиртуина могут иметь значительное структурное сходство.
В конкретных вариантах осуществления описываемые в описании модулирующие сиртуин соединения могут применяться сами по себе или в комбинации с другими соединениями. В одном варианте осуществления смесь двух или более модулирующих сиртуин соединений может быть введена субъекту, в случае, если это ему необходимо. В другом варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено с одним или более из следующих соединений: ресвератрол, бутеин, физетин, пицеатаннол или кверцетин. В примере варианта осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено в комбинации с никотиновой кислотой. В другом варианте осуществления модулирующее сиртуин соединение, которое понижает уровень и/или активность белка сиртуина, может быть введено с одним или более из следующих соединений: никотинамид (NAM), сурамин; NF023 (антагонист G-белка); NF279 (антагонист пуринергического рецептора); тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота); (-)-эпигаллокатехин (гидрокси в положениях 3,5,7,3',4',5'); (-)-галлат эпигаллокатехина (гидрокси в положениях 5,7,3',4',5' и галлатный эфир в положении 3); хлорид цианидина (3,5,7,3',4'-пентагидроксифлавилия хлорид); хлорид дельфинидина (3,5,7,3',4',5'-гексагидроксифлавилия хлорид); мирицетин (каннабисцетин; 3,5,7,3',4',5'-гексагидроксифлавон); 3,7,3',4',5'-пентагидроксифлавон; госсипетин (3,5,7,8,3',4'-гексагидроксифлавон), сиртинол и сплитомицин. В еще одном варианте осуществления одно или более модулирующих сиртуин соединений может быть введено с одним или более терапевтическими средствами при лечении или предотвращении различных заболеваний, включающих, например, рак, диабет, нейродегенеративные заболевания, сердечно-сосудистое заболевание, нарушение свертываемости крови, воспаление, гиперемию, ожирение, старение, стресс и так далее. В различных вариантах осуществления комбинированные терапии, включающие модулирующее сиртуин соединение, могут относиться к (1) фармацевтическим композициям, которые включают одно или более модулирующих сиртуин соединений в комбинации с одним или более терапевтическими средствами (например, одним или более описанными в описании терапевтическими средствами); и (2) совместному введению одного или более модулирующих сиртуин соединений в комбинации с одним или более терапевтическими средствами, где модулирующее сиртуин соединение и терапевтическое средство не были приготовлены в формах одних и тех же композиций (но могут присутствовать в одном и том же наборе или упаковке, такой как блистерная упаковка или другая многоячеистая упаковка; в соединенных отдельно герметизированных контейнерах (например, пакетиках из фольги), которые могут быть разделены пользователем; или набор, где модулирующее сиртуин соединение(я) и другое терапевтическое средство(а) находятся в отдельных сосудах). При использовании раздельных форм модулирующее сиртуин соединение может быть введено одновременно, интермиттирующе, ступенчато, перед, после или в его комбинации с введением другого терапевтического средства.
В конкретных вариантах осуществления способы облегчения, предотвращения или лечения заболеваний или расстройств с помощью модулирующего сиртуин соединения могут также включать повышение уровня белка сиртуина, такого как SIRT1, SIRT2 и/или SIRT3 человека, или его гомологов. Повышение уровня белка может быть достигнуто путем введения в клетку одной или более копий нуклеиновой кислоты, которые кодируют сиртуин. Например, уровень сиртуина может быть повышен в клетке млекопитающего путем введения в клетку млекопитающего нуклеиновой кислоты, кодирующей сиртуин, например, повышая уровень SIRT1 путем введения нуклеиновой кислоты, кодирующей последовательность аминокислот, депонированной как GenBank Accession No. NP_036370, и/или повышая уровень SIRT3 путем введения нуклеиновой кислоты, кодирующей последовательность аминокислот, депонированной как GenBank Accession No. AAH01042.
Нуклеиновая кислота, которую вводят в клетку для повышения уровня белка сиртуина, может кодировать белок, который, по меньшей мере, примерно на 80%, 85%, 90%, 95%, 98% или 99% идентичен последовательности сиртуина, например белка SIRT1 и/или SIRT3. Например, нуклеиновая кислота, кодирующая белок, может быть, по меньшей мере, примерно на 80%, 85%, 90%, 95%, 98% или 99% идентична нуклеиновой кислоте, кодирующей белок SIRT1 (например, GenBank Accession No. NM_012238) и/или белок SIRT3 (например, GenBank Accession No. BC001042). Нуклеиновой кислотой может также являться нуклеиновая кислота, которая гибридизируется, предпочтительно при жестких условиях гибридизации, в нуклеиновую кислоту, кодирующую немутантный тип сиртуина, например белок SIRT1 и/или SIRT3. Жесткие условия гибридизации могут включать гибридизацию и промывку в 0,2 × SSC (растворе цитрата и хлорида натрия) при 65°C. При использовании нуклеиновой кислоты, которая кодирует белок, который отличается от белка сиртуина немутантного типа, такого как белок, который является фрагментом сиртуина немутантного типа, предпочтительно, чтобы белок являлся биологически активным, например способным к деацетилированию. Необходимо только экспрессировать в клетке часть сиртуина, которая является биологически активной. Например, предпочтительно, чтобы белок, который отличается от немутантного SIRT1, депонированного как GenBank Accession No. NP_036370, содержал его фибриллярный центр. Фибриллярный центр иногда относится к аминокислотам 62-293, депонированным как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 237-932, депонированными как GenBank Accession No. NM_012238, которые охватывают NAD связывающий, а также субстрат связывающий домены. Ядерный домен SIRT1 может также относиться к аминокислотам около 261-447, депонированным как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 834-1394, депонированными как GenBank Accession No. NM_012238; к аминокислотам около 242-493, депонированным как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 777-1532, депонированными как GenBank Accession No. NM_012238; или к аминокислотам около 254-495, депонированным как GenBank Accession No. NP_036370, которые кодированы нуклеотидами 813-1538, депонированными как GenBank Accession No. NM_012238. Сохраняет ли белок или не сохраняет биологическую функцию, например способность к деацетилированию, может быть определено с помощью известных в области техники методов.
В конкретных вариантах осуществления способы облегчения, предотвращения или лечения заболеваний или расстройств с помощью модулирующего сиртуин соединения могут также включать понижение уровня белка сиртуина, такого как SIRT1, SIRT2 и/или SIRT3 человека, или его гомологов. Понижение уровня белка сиртуина может быть достигнуто с помощью известных в области техники методов. Например, в клетке может быть экспрессирована синтетическая РНК, антисмысловая нуклеиновая кислота или рибозима, нацеленная на сиртуин. Может также быть использован доминантный отрицательный мутант сиртуина, например мутант, который не способен к деацетилированию. Например, может быть использован мутант H363Y SIRT1, описанный, например, в публикации Luo et al. (2001) Cell 107:137. Альтернативно могут быть использованы вещества, которые ингибируют транскрипцию.
Способы модулирования уровней белка сиртуина также включают способы модулирования транскрипции генов, кодирующих сиртуины, способы стабилизации/дестабилизации соответствующих информационных РНК, и другие известные в области техники способы.
Старение/стресс
В одном варианте осуществления изобретение предлагает способ увеличения продолжительности жизни клетки, увеличения пролиферативного потенциала клетки, замедления старения клетки, стимулирования выживания клетки, отсрочки клеточного старения в клетке, имитации эффектов ограничения калорий, повышения сопротивляемости клетки к стрессу или предотвращения апоптоза клетки, путем контактирования клетки с модулирующим сиртуин соединением изобретения, которое повышает уровень и/или активность белка сиртуина. В примере варианта осуществления способы включают контактирование клетки с активирующим сиртуин соединением.
Описываемые в описании способы могут быть использованы для увеличения продолжительности времени, в течение которого клетки, в частности первичные клетки (то есть клетки, полученные из организма, например, человека), могут оставаться живыми в клеточной культуре. Эмбриональные стволовые (ES) клетки и полипотентные клетки и клетки, дифференцируемые от них, могут также быть подвергнуты обработке с помощью модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина, для того чтобы сохранить клетки или их потомство в культуре в течение более длительных периодов времени. Такие клетки могут быть также использованы для трансплантации субъекту, например, после ex vivo модификации.
В одном варианте осуществления клетки, которые предполагается сохранить в течение длительных периодов времени, могут быть подвергнуты обработке с помощью модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина. Клетки могут находиться в суспензии (например, эритроциты, сыворотка, среда для биологического роста и так далее) или в тканях или органах. Например, кровь, взятая у индивидуума с целью трансфузии, может быть обработана с помощью модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина, для того чтобы сохранить эритроциты в течение более длительных периодов времени. Кроме того, кровь, которую используют для криминалистических целей, может быть также сохранена с помощью модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина. Другие клетки, которые могут быть подвергнуты обработке с целью удлинения их продолжительности жизни или защиты от апоптоза, включают клетки для потребления, например клетки млекопитающих, не относящихся к человеку (такие как клетки мяса), или клетки растений (такие как клетки овощей).
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также применяться во время фаз развития и роста у млекопитающих, растений, насекомых, микроорганизмов для того, чтобы, например, изменить, замедлить или ускорить процесс развития и/или роста.
В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для обработки клеток, применяемых для трансплантации или при клеточной терапии, включая, например, пересадки твердых тканей, трансплантации органов, суспензии клеток, стволовые клетки, клетки костного мозга и так далее. Клетки или ткань могут являться аутотрансплантатом, аллотрансплантатом, синграфтом или ксенотрансплантатом. Клетки или ткань могут быть обработаны с помощью модулирующего сиртуин соединения перед введением/имплантацией, одновременно с введением/имплантацией, и/или после введения/имплантации субъекту. Клетки или ткань могут быть обработаны перед удалением клеток у индивидуального донора, ex vivo после удаления клеток или ткани у индивидуального донора или после имплантации у реципиента. Например, индивидуальный донор или реципиент могут быть подвергнуты системному лечению с помощью модулирующего сиртуин соединения или могут иметь субпопуляцию клеток/ткани, подвергнутой местной обработке с помощью модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина. В конкретных вариантах осуществления клетки или ткань (или индивидуальные донор/реципиент) могут дополнительно быть подвергнуты обработке с помощью другого терапевтического средства, применяемого для продления срока жизнеспособности трансплантата, такого как, например, иммунодепрессивное средство, цитокин, ангиогенный фактор и так далее.
В еще одних вариантах осуществления клетки могут быть обработаны с помощью модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина, in vivo, например, для увеличения их срока жизни или предотвращения апоптоза. Например, может быть защищена от старения кожа (например, от образования морщин, потери эластичности и так далее) путем обработки кожи или эпителиальных клеток модулирующим сиртуин соединением, которое повышает уровень и/или активность белка сиртуина. В примере варианта осуществления кожу вводят в контакт с фармацевтической или косметической композицией, включающей модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина. Примеры болезней кожи или состояний кожи, которые могут быть подвергнуты лечению описываемыми в настоящем описании способами, включают расстройства и заболевания, связанные или вызванные воспалением, поражением от солнечных лучей или естественным старением. Например, композиции находят применение при предотвращении или лечении контактных дерматитов (включая раздражающий контактный дерматит и аллергический контактный дерматит), атопических дерматитов (также известных как аллергическая экзема), актинического кератоза, расстройств кератинизации (включая экзему), заболевания буллезным эпидермозом (включая пузырчатку), эксфолиативного дерматита, себорейного дерматита, эритем (включая полиморфную эритему и нодозную эритему), поражения, вызванного солнцем или другими источниками света, дисковидной красной волчанки, дерматомиозита, псориаза, рака кожи и эффектов естественного старения. В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы при лечении ран и/или ожогов для ускорения заживления, включая, например, ожоги первой, второй или третьей степени и/или термические, химические или электрические ожоги. Препараты могут быть топически нанесены на кожу или ткань слизистой оболочки.
Топические препараты, включающие одно или более модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы в качестве профилактических, например хемопревентивных, композиций. При использовании в хемопревентивном способе восприимчивую кожу подвергают обработке перед любым очевидным состоянием у конкретного индивидуума.
Модулирующие сиртуин соединения могут вводиться субъекту местно или системно. В одном варианте осуществления модулирующее сиртуин соединение вводят местно в ткань или орган субъекта с помощью инъекции, топического препарата и так далее.
В другом варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть использовано для лечения или предотвращения заболевания или состояния, вызываемых или отягощенных клеточным старением у субъекта; в способах снижения скорости старения субъекта, например после начала старения; способах увеличения продолжительности жизни субъекта; способах лечения или предотвращения заболевания или состояния, имеющего отношение к продолжительности жизни; способах лечения или предотвращения заболевания или состояния, относящихся к пролиферативному потенциалу клеток; и способах лечения или предотвращения заболевания или состояния, возникающих вследствие повреждения или гибели клетки. В конкретных вариантах осуществления способ не оказывает действие путем снижения частоты возникновения заболеваний, которые укорачивают продолжительность жизни субъекта. В конкретных вариантах осуществления способ не оказывает действие путем снижения случаев летальности, вызываемой заболеванием, таким как рак.
В еще одном варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено субъекту для того, чтобы увеличить в целом продолжительность жизни его клеток и защитить его клетки от стресса и/или от апоптоза. Считается, что лечение субъекта с помощью описываемого в описании соединения является аналогичным воздействию на субъекта гормезиса, то есть легкого стресса, который оказывает благоприятное действие на организмы и может увеличивать их продолжительность жизни.
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены субъекту с целью профилактики старения и связанных со старением последствий или заболеваний, таких как удар, заболевание сердца, сердечная недостаточность, артрит, высокое кровяное давление и болезнь Альцгеймера. Другие состояния, которые могут быть подвергнуты лечению, включают глазные заболевания, например связанные со старением глаз, такие как катаракты, глаукома и дегенерация желтого пятна. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть введены субъектам для лечения заболеваний, например хронических заболеваний, связанных с гибелью клеток, для того, чтобы защитить клетки от гибели. Примеры заболеваний включают заболевания, связанные с гибелью нервных клеток, нейрональной дисфункцией или с гибелью или дисфункцией мышечных клеток, такие как болезнь Паркинсона, болезнь Альцгеймера, множественный склероз, боковой амиотрофический склероз и мышечная дистрофия; СПИД; фульминантный гепатит; заболевания, связанные с деградацией мозга, такие как болезнь Крейтцфельдта-Якоба, пигментный ретинит и мозжечковая дегенерация; миелодисплазия, такая как апластическая анемия; ишемические заболевания, такие как инфаркт миокарда и удар; болезни печени, такие как алкогольный гепатит, гепатит B и гепатит C; заболевания суставов, такие как остеоартрит; атеросклероз; алопеция; повреждение кожи в результате УФ-излучения; красный плоский лишай; атрофия кожи; катаракта и отторжение трансплантата. Гибель клеток может быть также следствием хирургической операции, лекарственной терапии, химического или радиационного воздействия.
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть введены субъекту, страдающему от острого заболевания, например повреждения органа или ткани, например, субъекту, страдающему от удара или инфаркта миокарда, или субъекту, страдающему от травмы спинного мозга. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также использоваться для восстановления пораженной алкоголем печени.
Сердечно-сосудистое заболевание
В другом варианте осуществления изобретение предлагает способ лечения и/или предотвращения сердечно-сосудистого заболевания путем введения субъекту, в случае, если это ему необходимо, модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина.
Сердечно-сосудистые заболевания, которые могут быть подвергнуты лечению или предотвращению с помощью модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, включают кардиомиопатию или миокардит; такую как идиопатическая кардиомиопатия, метаболическая кардиомиопатия, алкогольная кардиомиопатия, лекарственная кардиомиопатия, ишемическая кардиомиопатия и гипертензивная кардиомиопатия. Кроме того, подвергаемыми лечению или предотвращению с помощью описываемых в описании соединений и способов являются атероматозные расстройства главных кровяных сосудов (макрососудистое заболевание), таких как аорта, коронарные артерии, сонные артерии, цереброваскулярные артерии, почечные артерии, подвздошные артерии, бедренные артерии и подколенные артерии. Другие сосудистые заболевания, которые могут быть подвергнуты лечению или предотвращению, включают заболевания, относящиеся к агрегации тромбоцитов, ретинальным артериолам, гломерулярным артериолам, vasa nervorum (малым артериям, обеспечивающим кровью периферические нервы), сердечным артериолам и связанным капиллярным руслам глаза, почек, сердца, и центральной и периферической нервных систем. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы для повышения уровней HDL (липопротеида высокой плотности) в плазме индивидуума.
Еще одни расстройства, которые могут быть подвергнуты лечению с помощью модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, включают рестеноз, например в результате коронарного вмешательства, и расстройства, относящиеся к аномальному уровню холестерина высокой и низкой плотности.
В одном варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено как часть комбинированного препарата с другим сердечно-сосудистым средством. В одном варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено как часть комбинированного препарата с противоаритмическим средством. В другом варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено как часть комбинированного препарата с другим сердечно-сосудистым средством.
Гибель клеток/рак
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены субъектам, которые недавно получили или вероятно получат дозу радиации или токсина. В одном варианте осуществления дозу радиации или токсина получают как часть связанной с работой процедуры или медицинской процедуры, например, введенную в качестве профилактической меры. В другом варианте осуществления воздействие радиации или токсина получают непреднамеренно. В таком случае предпочтительно, чтобы соединение вводилось как можно скорее после воздействия для того, чтобы воспрепятствовать апоптозу и последующему развитию острого лучевого синдрома.
Модулирующие сиртуин соединения могут также быть использованы для лечения и/или предотвращения рака. В конкретных вариантах осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения и/или предотвращения рака. Ограничение калорий приводило к снижению частоты возникновения возрастных расстройств, включая рак. Соответственно, повышение уровня и/или активности белка сиртуина может применяться при лечении и/или предотвращении возникновения возрастных расстройств, таких как, например, рак. Примерами видов рака, которые могут быть подвергнуты лечению с помощью модулирующего сиртуин соединения, являются рак мозга и рак почки; гормонально-зависимые раки, включая рак молочной железы, предстательной железы, яичек и яичников; лимфомы и лейкозы. При раках, относящихся к солидным опухолям, модулирующее соединение может быть введено непосредственно в опухоль. Рак клеток крови, например лейкоз, может быть подвергнут лечению путем введения модулирующего соединения в кровоток или в костный мозг. Может также подвергаться лечению рост доброкачественных клеток, например бородавки. Другие заболевания, которые могут быть подвергнуты лечению, включают аутоиммунные заболевания, например системную эритематозную волчанку, склеродермию, и артрит, при которых необходимо удалять аутоиммунные клетки. Кроме того, могут также быть подвергнуты лечению путем введения модулирующего сиртуин соединения вирусные инфекции, такие как герпес, ВИЧ, аденовирус и связанные с HTLV-1 (вирусом человеческого Т-клеточного лейкоза) злокачественные заболевания и доброкачественные заболевания. Альтернативно, клетки могут быть взяты у субъекта, подвергнуты обработке ex vivo для удаления конкретных нежелательных клеток, например раковых клеток, и введены обратно тому же субъекту или другому субъекту.
Химиотерапевтические средства могут быть совместно введены с описываемыми в описании модулирующими соединениями в качестве средств, имеющих противораковую активность, например, средств, которые индуцируют апоптоз, средств, которые снижают продолжительность жизни, или средств, которые придают клеткам восприимчивость к стрессу. Химиотерапевтические средства могут применяться сами по себе вместе с описываемым в описании модулирующим сиртуин соединением в качестве индуцирующих гибель клетки или уменьшающих продолжительность жизни или повышающих восприимчивость к стрессу и/или в комбинации с другими химиотерапевтическими средствами. Кроме использования с традиционными химиотерапевтическими средствами, описываемые в описании модулирующие сиртуин соединения могут также быть использованы с антисмысловой РНК, информационной РНК или другими полинуклеотидами для ингибирования экспрессии клеточных компонентов, которые способствуют нежелательной клеточной пролиферации.
Комбинированные терапии, включающие модулирующие сиртуин соединения и традиционное химиотерапевтическое средство, могут быть эффективными при применении известных в технике комбинированных терапий, так как комбинация позволяет достигать большего эффекта при меньшей дозе традиционного химиотерапевтического средства. В предпочтительном варианте осуществления эффективная доза (ED50) для химиотерапевтического средства или комбинации традиционных химиотерапевтических средств при использовании в комбинации с модулирующим сиртуин соединением, составляет, по меньшей мере, в 2 раза меньше, чем ED50 только для одного химиотерапевтического средства, и еще более предпочтительно, в 5 раз, в 10 раз или даже в 25 раз меньше. И наоборот, терапевтический индекс (TI) для такого химиотерапевтического средства или комбинации такого химиотерапевтического средства при использовании в комбинации с описываемым в описании модулирующим сиртуин соединением может составлять, по меньшей мере, в 2 раза больше, чем величина TI для схемы лечения только одним традиционным химиотерапевтическим средством, и еще более предпочтительно, в 5 раз, в 10 раз или даже в 25 раз больше.
Неврональные заболевания/расстройства
В конкретных аспектах модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения пациентов, страдающих от нейродегенеративных заболеваний и травматического повреждения или механической травмы центральной нервной системы (CNS), спинного мозга или периферической нервной системы (PNS). Нейродегенеративное заболевание обычно вызывает снижение массы и объема человеческого мозга, которое может быть следствием атрофии и/или гибели клеток мозга, которые протекают в значительно большей степени, чем в случае клеток здорового человека, изменения в которых относят к старению. Нейродегенеративные заболевания могут развиваться постепенно после долгого периода нормальной деятельности мозга вследствие нарастающей дегенерации (например, дисфункции и гибели нервных клеток) конкретных участков мозга. Альтернативно, нейродегенеративные заболевания могут иметь быстрое начало, такие как нейродегенеративные заболевания, связанные с травмой или токсинами. Клиническое проявление дегенерации мозга может возникать через многие годы после фактического начала дегенерации мозга. Примеры нейродегенеративных заболеваний включают, но этим не ограничиваясь, болезнь Альцгеймера (AD), болезнь Паркинсона (PD), болезнь Гентингтона (HD), боковой амиотрофический склероз (ALS; болезнь Лу Герига), болезнь диффузных телец Леви, хорею-акантоцитоз, первичный боковой склероз, глазные заболевания (глазные невриты), вызванные химиотерапией невропатии (например, от винкристина, паклитаксела, бортезомиба), вызванные диабетом невропатии и наследственную атаксию Фридрейха. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения этих расстройств и других расстройств, описанных ниже.
Болезнь Альцгеймера (AD) является расстройством центральной нервной системы, которое приводит к потере памяти, необычному поведению, изменениям личности и снижению интеллектуальных способностей. Эти потери связаны с гибелью конкретных типов клеток мозга и разрывом связей и их поддерживающей структуры (например, глиальные клетки) между ними. Самые ранние симптомы включают потерю кратковременной памяти, принятие ошибочных решений и изменения личности. Болезнь Паркинсона (PD) является расстройством центральной нервной системы, которое приводит к неконтролируемым движениям тела, ригидности, тремору и дискинезии и которое связано с гибелью клеток мозга в участке мозга, который продуцирует допамин. Боковой амиотрофический склероз (ALS) (заболевание мотонейрона) является расстройством центральной нервной системы, которое поражает мотонейроны, компоненты центральной нервной системы, которые осуществляют связь мозга со скелетными мышцами.
Болезнь Гентингтона (HD) является еще одним нейродегенеративным заболеванием, которое вызывает неконтролируемые движения, потерю умственных способностей и нарушение эмоциональной сферы. Болезнь Тея-Сакса и болезнь Сандгоффа являются заболеваниями накопления гликолипида, при которых GM2 ганглиозид и родственные субстраты гликолипидов для β-гексозаминидазы накапливаются в нервной системе и запускают острую нейродегенерацию.
Общеизвестно, что апоптоз играет некоторую роль в патогенезе ВИЧ в иммунной системе. Однако ВИЧ-1 также индуцирует неврологическое заболевание, которое может быть подвергнуто лечению с помощью модулирующих сиртуин соединений изобретения.
Потеря нейронов является также характерным признаком прионных заболеваний, таких как болезнь Крейтцфельда-Якоба у человека, губчатая энцефалопатия крупного рогатого скота (BSE) у крупного рогатого скота (коровье бешенство), почесуха у овец и коз и кошачья губчатая энцефалопатия (FSE) у кошек. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут применяться при лечении или предотвращении потери нейронов, вызванной этими первичными заболеваниями.
В другом варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть использовано для лечения или предотвращения любого заболевания или расстройства, включающего аксонопатию. Дистальная аксонопатия является типом периферической нейропатии, которая возникает в результате некоторого метаболического или токсического нарушения нейронов периферической нервной системы (PNS). Она является самой распространенной ответной реакцией нервов на метаболические или токсические нарушения и в силу этого может быть вызвана метаболическими заболеваниями, такими как диабет, почечная недостаточность, синдромами недостаточности, такими как недостаточность питания и алкоголизм, или воздействиями токсинов или лекарственных средств. Заболевания с дистальными аксонопатиями обычно проявляются в симметричных чувственно-моторных нарушениях по типу "перчаток-носков". В пораженных участках также утрачиваются или ослабевают глубокие сухожильные рефлексы и функции вегетативной нервной системы (ANS).
Диабетические нейропатии являются нейропатическими расстройствами, которые связаны с диабетом. Относительно общие состояния, которые могут быть связаны с диабетической нейропатией, включают паралич третьего нерва; мононевропатию; множественный мононеврит; диабетическую амиотрофию; болезненную полиневропатию; вегетативную нейропатию и торакоабдоминальную нейропатию.
«Периферическая нейропатия» является медицинским термином для повреждения нервов периферической нервной системы, которое может быть вызвано либо заболеваниями нервов, либо побочными эффектами системного заболевания. Главные причины периферической нейропатии включают эпилептические припадки, недостаточность питания и ВИЧ, хотя наиболее вероятной причиной является диабет.
В примере варианта осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть использовано для лечения или предотвращения множественного склероза (MS), включая рецидивирующий множественный склероз и моносимптоматический множественный склероз, и других демиелинизирующих состояний, таких как, например, хроническая воспалительная демиелинизирующая полиневропатия (CIDP) или связанные с ней симптомы.
В еще одном варианте осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть использовано для лечения травмы нервов, включая травму в результате заболевания, повреждения (включая хирургическое вмешательство) или травму в результате воздействия окружающей среды (например, нейротоксины, алкоголизм и так далее).
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы для предотвращения, лечения или облегчения симптомов различных расстройств периферической нервной системы. Термин "периферическая нейропатия" охватывает широкий спектр расстройств, при которых были повреждены периферические нервы, то есть нервы вне мозга и спинного мозга. Периферическую нейропатию могут также называть периферическим невритом, или в случае, когда затронуто большое количество нервов, могут использоваться термины «полиневропатия» или «полиневрит».
Заболевания периферической нервной системы, подвергаемые лечению с помощью модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, включают диабет, лепру, болезнь Шарко-Мари-Тута, синдром Гийома-Барре и нейропатии плечевого нервного сплетения (заболевания цервикального и первого торакального корешков, нервных стволов, хорд), и компонентов периферических нервов плечевого нервного сплетения.
В другом варианте осуществления активирующее сиртуин соединение может быть использовано для лечения или предотвращения полиглутаминового заболевания. Примеры полиглутаминовых заболеваний включают мышечную атрофию спинного и продолговатого мозга (болезнь Кеннеди), болезнь Хантингтона (HD), дентаторубрально-паллидолуизиановую атрофию (синдром реки Хо), спинально-церебеллярную атаксию типа 1, спинально-церебеллярную атаксию типа 2, спинально-церебеллярную атаксию типа 3 (болезнь Мачадо-Джозефа), спинально-церебеллярную атаксию типа 6, спинально-церебеллярную атаксию типа 7 и спинально-церебеллярную атаксию типа 17.
В конкретных вариантах осуществления изобретение предлагает способ лечения клеток центральной нервной системы для предотвращения их повреждения в результате снижения кровотока к клеткам. Обычно тяжесть предотвращаемого повреждения может зависеть в значительной мере от степени снижения кровотока к клеткам и длительности периода снижения. В одном варианте осуществления может быть предотвращена апоптотическая или некротическая гибель клеток. В еще одном варианте осуществления может быть предотвращено повреждение клеток в результате ишемии, такой как цитоксический отек или аноксемия ткани центральной нервной системы. В каждом варианте осуществления клетками центральной нервной системы могут быть спинномозговые клетки или клетки мозга.
Другой аспект охватывает введение активирующего сиртуин соединения субъекту для лечения ишемического состояния центральной нервной системы. Ряд ишемических состояний центральной нервной системы могут быть подвергнуты лечению с помощью описываемых в описании активирующих сиртуин соединений. В одном варианте осуществления ишемическим состоянием является инсульт, который в результате приводит к ишемическому повреждению центральной нервной системы любого типа, такому как апоптотическая или некротическая гибель клеток, цитоксический отек или аноксемия ткани центральной нервной системы. Инсульт может оказывать воздействие на любой участок мозга или может быть вызван любой общеизвестной этиологией, приводящей к возникновению инсульта. В одном альтернативном варианте этого осуществления инсультом является инсульт стволовой части мозга. В другом альтернативном варианте этого осуществления инсультом является церебеллярный инсульт. В еще одном варианте осуществления инсультом является эмболический инсульт. В еще одном варианте осуществления инсультом может быть геморрагический инсульт. В дополнительном варианте осуществления инсультом является тромботический инсульт.
В еще одном аспекте активирующее сиртуин соединение может быть введено для уменьшения размера инфаркта центральной массы ишемизированной ткани после ишемического состояния центральной нервной системы. Кроме того, активирующее сиртуин соединение может также успешно применяться для уменьшения размера ишемической пенумбры или переходной зоны после ишемического состояния центральной нервной системы.
В одном варианте осуществления схема комбинированного лекарственного лечения может включать лекарственные средства или соединения для лечения или предотвращения нейродегенеративных расстройств или вторичных состояний, связанных с этими расстройствами. Поэтому схема комбинированного лекарственного лечения может включать один или более активаторов сиртуина и одно или более средств против нейродегенеративных расстройств.
Расстройства свертываемости крови
В других аспектах модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения или предотвращения расстройств свертываемости крови (или гемостатических расстройств). Используемые в описании взаимозаменяемые термины "гемостаз", "коагуляция крови" и "свертываемость крови" относятся к контролированию кровотечения, включая физиологические свойства вазоконстрикции и коагуляции. Коагуляция крови содействует сохранению целостности кровотока млекопитающего после травмы, воспаления, заболевания, врожденной патологии, дисфункции или другого нарушения. Кроме того, образование сгустков крови не только ограничивает кровотечение в случае травмы (гемостаз), но и может приводить к серьезному повреждению и гибели органа в случае атеросклеротических заболеваний в результате закупоривания важной артерии или вены. Поэтому образованием сгустка крови в неподходящее время и в неподходящем месте является тромбозом.
Соответственно, настоящее изобретение предлагает антикоагуляционные и антитромботические терапии, направленные на подавление образования сгустков крови, для предотвращения или лечения расстройств свертываемости крови, таких как инфаркт миокарда, удар, потеря конечности в результате заболевания периферийной артерии или эмболия сосудов легких.
Используемые в описании взаимозаменяемые выражения "модулирование или модуляция гемостаза" и "регулирование или регуляция гемостаза" включают вызывание (например, стимуляцию или повышение) гемостаза, а также подавление (например, понижение или уменьшение) гемостаза.
В одном аспекте изобретение предлагает способ снижения или подавления гемостаза у субъекта путем введения модулирующего сиртуин соединения, которое повышает уровень и/или активность белка сиртуина. Раскрываемые в описании композиции и способы применяют для лечения или предотвращения тромботических расстройств. Используемый в описании термин "тромботическое расстройство" включает любое расстройство или состояние, характеризующееся избыточной или нежелательной коагуляцией или гемостатической активностью, или состояние гиперкоагуляции. Тромботические расстройства включают заболевания или расстройства, при которых происходит адгезия тромбоцитов и образование тромбов, и они могут проявляться в виде повышенной склонности к тромбообразованию, например повышенного числа тромбозов, тромбоза в раннем возрасте, семейной тенденции в отношении тромбоза и тромбоза в несвойственных местах.
В другом варианте осуществления схема комбинированного лекарственного лечения может включать лекарственные средства или соединения для лечения или предотвращения расстройств свертываемости крови или вторичных состояний, связанных с этими расстройствами. Поэтому схема комбинированного лекарственного лечения может включать один или более модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, и одно или более антикоагуляционных или противотромботических средств.
Контроль массы тела
В другом аспекте модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения или предотвращения увеличения массы тела или ожирения у субъекта. Например, модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы, например, для лечения или предотвращения наследственного ожирения, ожирения вследствие пищевого рациона, ожирения, связанного с гормонами, ожирения, связанного с введением медицинского препарата, для снижения массы тела субъекта или для снижения или предотвращения увеличения массы тела у субъекта. Субъект, которому необходимо такое лечение, может быть субъектом, который страдает ожирением, предрасположен к ожирению, имеет лишний вес и предрасположен иметь лишний вес. Субъекты, которые предрасположены к ожирению или наличию лишнего веса, могут быть выявлены, например, на основе семейного анамнеза, генетики, пищевого рациона, уровня активности, принимаемого медицинского препарата или их различных комбинаций.
В еще одних вариантах осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены субъектам, страдающим от ряда других заболеваний и состояний, которые могут быть подвергнуты лечению или предотвращены путем ускорения потери массы тела у субъекта. Такие заболевания включают, например, высокое кровяное давление, гипертензию, повышенное содержание холестерина в крови, дислипидемию, диабет типа 2, резистентность к инсулину, непереносимость глюкозы, гиперинсулинемию, ишемическую болезнь сердца, стенокардию, острую сердечную недостаточность, удар, желчные камни, холецистит и холелитиаз, подагру, остеоартрит, обструктивное апноэ во время сна и респираторные проблемы, некоторые типы рака (такие как рак эндометрия, молочной железы, предстательной железы и толстой кишки), осложнения при беременности, слабое женское репродуктивное здоровье (такое как менструальные нарушения, бесплодие, нерегулярная овуляция), проблемы контроля мочевого пузыря (такие как недержание мочи при напряжении); нефролитиаз мочевой кислоты; психологические расстройства (такие как депрессия, расстройства питания, искаженный телесный образ и заниженная самооценка). И наконец, у пациентов, больных СПИД, может развиваться липодистрофия или резистентность к инсулину в ответ на комбинированные терапии при лечении СПИД.
В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для подавления липогенеза или дифференциации жировых клеток, либо in vitro, либо in vivo. Такие способы могут быть использованы для лечения или предотвращения ожирения.
В других вариантах осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для снижения аппетита и/или повышения чувства сытости, тем самым вызывая потерю массы тела или предотвращение увеличения массы тела. Субъектом, которому необходимо такое лечение, может являться субъект, который имеет избыточный вес, ожирение, или субъект, который имеет предрасположенность к наличию избыточного веса или ожирению. Способ может включать введение субъекту ежедневно, или через день, или раз в неделю дозы, например, в форме пилюли. Дозой может являться "доза, снижающая аппетит".
В примере варианта осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены в качестве комбинированной терапии для лечения или предотвращения увеличения массы тела или ожирения. Например, одно или более модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, могут быть введены в комбинации с одним или более средствами против ожирения.
В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены для снижения прибавки массы тела, вызванного приемом лекарственного средства. Например, модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено в качестве комбинированной терапии с медицинскими препаратами, которые могут стимулировать аппетит или вызывать увеличение массы тела, в частности увеличение массы тела, не связанное с задержкой воды в организме.
Метаболические расстройства/диабет
В другом аспекте модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения или предотвращения метаболического расстройства, такого как резистентность к инсулину, предиабетическое состояние, диабет типа II и/или его осложнения. Введение модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, могут увеличивать чувствительность к инсулину и/или понижать уровни инсулина у субъекта. Субъектом, которому необходимо такое лечение, является субъект, который имеет резистентность к инсулину или другой предшествующий симптом диабета типа II, который имеет диабет типа II или который предрасположен к развитию любого из этих состояний. Например, субъектом может являться субъект, имеющий резистентность к инсулину, например, имеющий высокие уровни циркуляции инсулина, и/или связанные состояния, такие как гиперлипидемия, дислипогенез, гиперхолестеринемия, нарушение толерантности к глюкозе, высокий уровень глюкозы (сахара) в крови, другие проявления синдрома X, гипертензия, атеросклероз и липодистрофия.
В примере варианта осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены в качестве комбинированной терапии для лечения или предотвращения метаболического заболевания. Например, одно или более модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, могут быть введены в комбинации с одним или более противодиабетическими средствами.
Воспалительные заболевания
В других аспектах модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения или предотвращения заболевания или расстройства, связанного с воспалением. Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены до начала воспаления, во время воспаления или после начала воспаления. При использовании в целях профилактики предпочтительно вводить соединения раньше проявления воспалительной реакции или симптома. Введение соединений может предотвратить или смягчить воспалительные реакции или симптомы.
В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения или предотвращения аллергий и респираторных состояний, включая астму, бронхит, фиброз легких, аллергический ринит, отравление кислородом, эмфизему, хронический бронхит, синдром острой дыхательной недостаточности и любое хроническое обструктивное легочное заболевание (COPD). Соединения могут быть использованы для лечения хронического гепатита, включая гепатит B и гепатит C.
Кроме того, модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения аутоиммунных заболеваний и/или воспаления, связанного с аутоиммунными заболеваниями, такими как артрит, включая ревматоидный артрит, псориатический артрит и анкилозирующий спондилит, а также аутоиммунных заболеваний органов-тканей (например, синдрома Рейно), неспецифического язвенного колита, болезни Крона, мукозита слизистой оболочки полости рта, склеродермии, миастении гравис, отторжения трансплантата, эндотоксинового бактериально-токсического шока, сепсиса, псориаза, экземы, дерматита, множественного склероза, аутоиммунного тиреоидита, увеита, системной красной волчанки, болезни Аддисона, аутоиммунного полигландулярного заболевания (также известного как аутоиммунный полигландулярный синдром) и болезни Грейвса.
В конкретных вариантах осуществления одно или более модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, могут применяться сами по себе или в комбинации с другими соединениями, используемыми для лечения или предотвращения воспаления.
Гиперемия
В другом аспекте модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для снижения частоты возникновения или тяжести гиперемии и/или приступообразных ощущений жара, которые являются симптомами заболевания. Например, рассматриваемый способ включает использование модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, самих по себе или в комбинации с другими средствами, для снижения частоты возникновения или тяжести гиперемии и/или приступообразных ощущений жара у больных раком. В других вариантах осуществления способ предлагает использовать модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, для снижения частоты возникновения или тяжести гиперемии и/или приступообразных ощущений жара у женщин в период климакса и постклимактерический период.
В другом аспекте модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы в качестве терапевтического средства для снижения частоты возникновения или тяжести гиперемии и/или приступообразных ощущений жара, которые являются побочными эффектами применения других лекарственных терапий, например, гиперемии, вызванной применением лекарственного препарата. В конкретных вариантах осуществления способ лечения и/или предотвращения гиперемии, вызванной применением лекарственного препарата, включает введение пациенту в случае, если это ему необходимо, препарата, включающего, по меньшей мере, одно соединение, вызывающее гиперемию, и, по меньшей мере, одно модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина. В других вариантах осуществления способ лечения гиперемии, вызванной применением лекарственного препарата, включает раздельное введение одного или более соединений, которые вызывают гиперемию, и одного или более модулирующих сиртуин соединений, например, когда модулирующее сиртуин соединение и средство, вызывающее гиперемию, не были приготовлены в одних и тех же композициях. При использовании раздельных препаратов модулирующее сиртуин соединение может быть введено (1) одновременно с введением средства, вызывающего гиперемию, (2) периодически при введении средства, вызывающего гиперемию, (3) попеременно относительно введения средства, вызывающего гиперемию, (4) перед введением средства, вызывающего гиперемию, (5) после введения средства, вызывающего гиперемию, и (6) в их различных комбинациях. Примеры средств, вызывающих гиперемию, включают, например, ниацин, ралоксифен, антидепрессанты, нейролептики, химиотерапевтические средства, блокаторы кальциевых каналов и антибиотики.
В одном варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для уменьшения побочных эффектов в виде гиперемии в результате приема сосудорасширяющего средства или антилипемического средства (включая гипохолестеринемические средства и липотропные средства). В примере варианта осуществления модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть использовано для уменьшения гиперемии, связанной с введением ниацина.
В другом варианте осуществления изобретение предлагает способ лечения и/или предотвращения гиперлипидемии при уменьшении побочных эффектов в виде гиперемии. В другом характерном варианте осуществления способ включает использование модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, для уменьшения побочных эффектов в виде гиперемии от приема ралоксифена. В другом характерном варианте осуществления способ включает использование модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, для уменьшения побочных эффектов в виде гиперемии от приема антидепрессантов или нейролептического средства. Например, модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы в сочетании (при введении раздельно или вместе) с ингибитором обратного захвата серотонина или антагонистом 5HT2 рецептора.
В конкретных вариантах осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для уменьшения гиперемии в качестве части терапии с помощью ингибитора обратного захвата серотонина (SRI). В еще одном характерном варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для снижения побочных эффектов в виде гиперемии от применения химиотерапевтических средств, таких как циклофосфамид и тамоксифен.
В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для снижения побочных эффектов в виде гиперемии от применения блокаторов кальциевых каналов, таких как амлодипин.
В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для снижения побочных эффектов в виде гиперемии от приема антибиотиков. Например, модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы в комбинации с левофлоксацином.
Глазные расстройства
Одним аспектом настоящего изобретения является способ предотвращения, восстановления или же лечения нарушения зрения путем введения пациенту терапевтической дозы модулятора сиртуина, выбранного из раскрываемого в описании соединения, или его фармацевтически приемлемой соли, пролекарства или метаболической производной.
В конкретных аспектах изобретения нарушение зрения вызывается повреждением зрительного нерва или центральной нервной системы. В конкретных вариантах осуществления повреждение зрительного нерва вызвано высоким внутриглазным давлением, таким как давление, возникающее при глаукоме. В других конкретных вариантах осуществления повреждение зрительного нерва вызвано отеком нерва, который часто связан с инфекцией или иммунным (например, аутоиммунным) ответом, таким как при неврите зрительного нерва.
В конкретных аспектах изобретения нарушение зрения вызвано поражением сетчатки. В конкретных вариантах осуществления поражение сетчатки вызвано нарушениями кровотока к глазу (например, артериосклерозом, васкулитом). В конкретных вариантах осуществления поражение сетчатки вызвано разрушением макулы (например, экссудативной или неэкссудативной дегенерацией желтого пятна).
Примеры заболеваний сетчатки глаза включают экссудативную возрастную макулярную дегенерацию, неэкссудативную возрастную макулярную дегенерацию, электронное протезирование сетчатки и трансплантацию ретинального пигментного эпителия при возрастной макулярной дегенерации, острую многоочаговую плакоидную пигментную эпителиопатию, острый ретинальный некроз, болезнь Беста, окклюзию боковой ретинальной артерии, окклюзию боковой ретинальной вены, связанные и относящиеся к раку аутоиммунные ретинопатии, окклюзию центральной ретинальной артерии, окклюзию центральной ретинальной вены, центральную серозную хориоретинопатию, болезнь Илза, эпимакулярную мембрану, дегенерацию решетки сетчатки, макроаневризму, диабетический макулярный отек, макулярный отек Ирвина-Гасса, макулярное отверстие, субретинальные неоваскулярные мембраны, диффузный односторонний подострый нейроретинит, кистозный макулярный отек без артифакии, предполагаемый синдром окулярного гистоплазмоза, экссудативное отслоение сетчатки, послеоперационное отслоение сетчатки, пролиферативное отслоение сетчатки, регматогенное отслоение сетчатки, тракционное отслоение сетчатки, пигментный ретинит, цитомегаловирусный ретинит, ретинобластому, ретинопатию недоношенных, дробьевидную ретинопатию, сопутствующую диабетическую ретинопатию, пролиферативную диабетическую ретинопатию, ретинопатию вследствии гемоглобинопатий, ретинопатию Пурчера, ретинопатию Вальсальвы, ювенильный ретиношизис, сенильный ретиношизис, синдром Терсона и синдромы белых точек.
Другие примеры заболеваний включают глазные бактериальные инфекции (например, конъюнктивит, кератит, туберкулез, сифилис, гонорея), вирусные инфекции (например, глазной вирус простого герпеса, вирус ветряной оспы, цитомегаловирусный ретинит, вирус иммунодефицита человека (ВИЧ)), а также прогрессирующий внешний ретинальный некроз на фоне ВИЧ и другие связанные с ВИЧ и другие связанные с иммунодефицитом глазные заболевания. Кроме того, глазные заболевания включают грибковые инфекции (например, Candida choroiditis, гистоплазмоз), протозойные инфекции (например, токсоплазмоз) и другие, такие как окулярный токсокароз и саркоидоз.
Одним аспектом изобретения является способ предотвращения, восстановления или же лечения нарушения зрения у субъекта, подвергаемого лечению химиотерапевтическим лекарственным средством (например, нейротоксическим средством, лекарственным средством, которое поднимает внутриглазное давление, таким как стероид), путем введения субъекту, в случае, если ему необходимо такое лечение, терапевтической дозы раскрываемого в описании модулятора сиртуина.
Другим аспектом изобретения является способ предотвращения, восстановления или же лечения нарушения зрения у субъекта, подвергаемого хирургической операции, включая глазные или другие операции, осуществляемые в положении лежа на животе, такие как операции на спинном мозге, путем введения субъекту, в случае, если ему необходимо такое лечение, терапевтической дозы раскрываемого в описании модулятора сиртуина. Глазные операции включают катаракту, иридотомию и замены хрусталика.
Другим аспектом изобретения является лечение, включая предотвращение и профилактическое лечение возрастных глазных заболеваний, которые включают катаракты, сухость глаз, старческую дегенерацию желтого пятна (AMD), поражение сетчатки и другие подобные заболевания, путем введения субъекту, в случае, если ему необходимо такое лечение, терапевтической дозы раскрываемого в описании модулятора сиртуина.
Другим аспектом изобретения является предотвращение или лечение повреждения глаз, вызванного стрессом, химическим поражением или ионизирующим излучением, путем введения субъекту, в случае, если ему необходимо такое лечение, терапевтической дозы раскрываемого в описании модулятора сиртуина. Радиационное или электромагнитное повреждение глаз может включать повреждение, вызываемое излучением электронно-лучевых трубок или воздействием солнечного света или УФ-излучения.
В одном варианте осуществления схема комбинированного лекарственного лечения может включать лекарственные средства или соединения для лечения или предотвращения окулярных расстройств или вторичных состояний, связанных с этими расстройствами. Поэтому схема комбинированного лекарственного лечения может включать один или более активаторов сиртуина и одно или более терапевтических средств для лечения глазного расстройства.
В одном варианте осуществления модулятор сиртуина может быть введен в сочетании с терапевтическим средством для понижения внутриглазного давления. В другом варианте осуществления модулятор сиртуина может быть введен в сочетании с терапевтическим средством для лечения и/или предотвращения глаукомы. В еще одном варианте осуществления модулятор сиртуина может быть введен в сочетании с терапевтическим средством для лечения и/или предотвращения неврита зрительного нерва. В одном варианте осуществления модулятор сиртуина может быть введен в сочетании с терапевтическим средством для лечения и/или предотвращения цитомегаловирусной ретинопатии. В другом варианте осуществления модулятор сиртуина может быть введен в сочетании с терапевтическим средством для лечения и/или предотвращения множественного склероза.
Заболевания и расстройства, связанные с митохондриальной активностью
В конкретных вариантах осуществления изобретение предлагает способы лечения заболеваний или расстройств, на которые оказывает лечебный эффект повышенная митохондриальная активность. Способы включают введение субъекту, в случае, если это ему необходимо, терапевтически эффективного количества активирующего сиртуин соединения. Повышенная митохондриальная активность означает повышение активности митохондрии при сохранении общего числа митохондрий (например, митохондриальной массы), увеличению числа митохондрий, в результате чего возрастает митохондриальная активность (например, путем стимулирования митохондриального биогенеза) или их комбинации. В конкретных вариантах осуществления заболевания и расстройства, на которые оказывает лечебный эффект повышенная митохондриальная активность, включают заболевания и расстройства, связанные с митохондриальной дисфункцией.
В конкретных вариантах осуществления способы лечения заболеваний или расстройств, на которые оказывает лечебный эффект повышенная митохондриальная активность, могут включать выявление субъекта, страдающего митохондриальной дисфункцией. Способы диагностирования митохондриальной дисфункции могут включать молекулярно-генетические исследования, анализ патологии и/или биохимические исследования. Заболевания и расстройства, связанные с митохондриальной дисфункцией, включают заболевания и расстройства, при которых недостаточность активности дыхательной цепи митохондрий способствует развитию патофизиологии таких заболеваний или расстройств у млекопитающего. Заболевания или расстройства, на которые может оказывать лечебный эффект повышенная митохондриальная активность, обычно включают, например, заболевания, при которых окислительное повреждение, опосредованное свободными радикалами, приводит к дегенерации ткани; заболевания, при которых клетки в неприемлемо высокой степени подвергаются апоптозу; и заболевания, при которых клетки не способны подвергаться апоптозу.
В конкретных вариантах осуществления изобретение предлагает способы лечения заболевания или расстройства, на которое может оказывать лечебный эффект повышенная митохондриальная активность, которые включают введение субъекту, в случае, если это ему необходимо, одного или более активирующих сиртуин соединений в комбинации с другим терапевтическим средством, таким как, например, средство, применяемое для лечения митохондриальной дисфункции, или средство, применяемое для снижения проявления симптома, связанного с заболеванием или расстройством, включающим митохондриальную дисфункцию.
В примерах вариантов осуществления изобретение предлагает способы лечения заболеваний или расстройств, на которые может оказывать лечебный эффект повышенная митохондриальная активность, путем введения субъекту терапевтически эффективного количества активирующего сиртуин соединения. Примеры заболеваний или расстройств включают, например, нейромышечные расстройства (например, атаксию Фридрейха, мышечную дистрофию, множественный склероз и так далее), расстройства, связанные с нейронной неустойчивостью (например, эпилептические расстройства, мигрень и так далее), задержку в развитии, нейродегенеративные расстройства (например, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз и так далее), ишемию, почечный канальцевый ацидоз, старческую нейродегенерацию и когнитивное нарушение, чувство усталости при химиотерапии, возрастную или вызванную химиотерапией менопаузу или нарушения менструального цикла или овуляции, митохондриальные миопатии, митохондриальное повреждение (например, аккумуляцию кальция, эксайтотоксичность, воздействие оксида азота, гипоксию и так далее) и митохондриальную дерегуляцию.
Мышечная дистрофия относится к семейству заболеваний, включающих истощение нейромышечной структуры и функции, часто приводящих к атрофии скелетной мышцы и миокардиальной дисфункции, такой как мышечная дистрофия Дюшенна. В конкретных вариантах осуществления активирующие сиртуин соединения могут быть использованы для уменьшения степени истощения функциональных способностей мышц и для улучшения функционального состояния мышц у пациентов с мышечной дистрофией.
В конкретных вариантах осуществления модулирующие сиртуин соединения могут быть использованы для лечения митохондриальных миопатий. Митохондриальные миопатии включают ряд от умеренного медленно развивающегося ослабления внешних мышц глаза до тяжелых фатальных детских миопатий и мультисистемных энцефаломиопатий. Были определены некоторые симптомы, которые в некоторой степени перекрываются между собой. Установленные синдромы воздействия на мышцы включают прогрессирующую наружную офтальмоплегию, синдром Кирнса-Сейра (с офтальмоплегией, пигментной ретинопатией, дефектами сердечной проводимости, мозжечковой атаксией и нейросенсорной глухотой), MELAS-синдром (митохондриальная энцефаломиопатия, лактоцидоз и инсультоподобные приступы), MERFF-синдром (миоклонический эпилептический припадок и разорванные красные волокна), распределенную слабость мышц плечевого пояса и младенческую миопатию (доброкачественную или тяжелую и фатальную).
В конкретных вариантах осуществления активирующие сиртуин соединения могут быть использованы для лечения пациентов, страдающих от токсического повреждения митохондрии, такого как токсическое повреждение вследствие аккумуляции кальция, эксайтотоксичность, воздействие оксида азота, токсическое повреждение, вызванное лекарственным препаратом, или гипоксия.
В конкретных вариантах осуществления активирующие сиртуин соединения могут быть использованы для лечения заболеваний или расстройств, связанных с митохондреальной дерегуляцией.
Мышечная деятельность
В других вариантах осуществления изобретение предлагает способы усиления мышечной деятельности путем введения терапевтически эффективного количества активирующего сиртуин соединения. Например, активирующие сиртуин соединения могут быть использованы для повышения физической выносливости (например, способности выполнять задачу на выполнение физической работы, такой как физические упражнения, физический труд, занятия спортом и так далее), предотвращения или замедления физической усталости, повышения уровней кислорода в крови, повышения физической деятельности у здоровых людей, повышения работоспособности и выносливости, снижения мышечной усталости, уменьшения стресса, усиления сердечной и сердечно-сосудистой функции, повышения сексуальной способности, увеличения уровней АТФ в мышцах и/или снижения содержания молочной кислоты в крови. В конкретных вариантах осуществления способы включают введение количества активирующего сиртуин соединения, которое повышает митохондриальную активность, увеличивает митохондриальный биогенез и/или увеличивает митохондриальную массу.
Занятия спортом относятся к способности спортсмена к мышечной работе при участии в спортивных мероприятиях. Повышенную спортивную активность, силу, скорость и выносливость измеряют по увеличению силы мышечного сокращения, увеличению амплитуды мышечного сокращения, сокращению времени реакции мышц от момента возбуждения до момента сокращения. Спортсменом называют человека, который занимается спортом на любом уровне и который прилагает усилия для достижения повышенного уровня силы, скорости и выносливости в соревновании, такого человека, как, например, культуристы, велосипедисты, бегуны на длинные дистанции, бегуны на короткие дистанции и так далее. Повышенная спортивная активность характеризуется способностью преодолевать мышечное утомление, способностью поддерживать активность в течение более длительных периодов времени и наличием более эффективных тренировок.
Для мышечной деятельности спортсмена желательно создавать условия, которые позволяют проводить соревнования или тренировки при более высоких уровнях выносливости в течение продолжительного периода времени.
Предполагается, что способы настоящего изобретения будут также эффективными при лечении связанных с мышцами патологических состояний, включая острую саркопению, например, атрофию мышц и/или кахексию, связанную с ожогами, постельным режимом, фиксацией конечности путем наложения гипса; или главную торакальную, абдоминальную и/или ортопедическую хирургию.
В конкретных вариантах осуществления изобретение предлагает новые пищевые композиции, включающие модуляторы сиртуина, способ их приготовления и способ использования композиций для повышения результатов спортивной деятельности. Соответственно, предлагаются терапевтические композиции, продукты питания и напитки, которые обладают действием по повышению физической выносливости и/или предотвращению физической усталости людей, которые связаны, в широком смысле этого слова, с физическими упражнениями, включающими занятия спортом, требующими выносливости, и усилиями, требующими повторяющихся мускульных сокращений. Такие пищевые композиции могут дополнительно включать электролиты, кофеин, витамины, углеводы и так далее.
Другие применения
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для лечения или предотвращения вирусных инфекций (таких как инфекции в результате заражения вирусом гриппа, вирусом герпеса или папилломы) или в качестве противогрибковых средств. В конкретных вариантах осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены как часть комбинированной лекарственной терапии с другим терапевтическим средством для лечения вирусных заболеваний. В другом варианте осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть введены как часть комбинированной лекарственной терапии с другим противогрибковым средством.
Субъекты, которые могут быть подвергнуты описанному выше лечению, включают эукариотов, таких как млекопитающие, например людей, овец, быков, лошадей, свиней, собак, кошек, не принадлежащих к человеческому роду приматов, мышей и крыс. Клетки, которые могут быть подвергнуты лечению, включают эукариотические клетки, например клетки описанного выше субъекта, растительные клетки, дрожжевые клетки и прокариотные клетки, например бактериальные клетки. Например, модулирующие соединения могут быть введены сельскохозяйственным животным для повышения их способности выдерживать условия их содержания в сельском хозяйстве в течение более продолжительного периода.
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы для увеличения продолжительности жизни, устойчивости к стрессу и устойчивости к апоптозу растений. В одном варианте осуществления соединение наносят на растения, например периодически, или на грибки. В другом варианте осуществления растения генетически модифицируют с целью продуцирования ими соединения. В другом варианте осуществления растения и фрукты обрабатывают с помощью соединения перед сбором урожая и транспортировкой для повышения устойчивости к повреждению во время транспортировки. Семена растений могут также быть подвергнуты контактированию с описываемыми в описании соединениями, например, для их предохранения.
В других вариантах осуществления модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть использованы для модулирования продолжительности жизни дрожжевых клеток. Ситуации, при которых может быть желательным увеличение продолжительности жизни дрожжевых клеток, включают любой процесс, в котором используются дрожжи, например приготовление пива, йогурта и хлебобулочных изделий, например хлеба. Использование дрожжей, имеющих увеличенную продолжительность жизни, может приводить к использованию меньшего количества дрожжей или давать возможность сохранять активность дрожжей в течение более длительных периодов времени. Дрожжи или другие клетки млекопитающих, используемые для рекомбинантного получения белков, могут также быть подвергнуты описываемой в описании обработке.
Модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы для увеличения продолжительности жизни, устойчивости к стрессу и устойчивости к апоптозу насекомых. В этом варианте осуществления соединения могут быть нанесены на полезных насекомых, например пчел и других насекомых, которые участвуют в процессе опыления растений. В конкретном варианте осуществления соединение может быть нанесено на пчел, производящих мед. Обычно описываемые в описании способы могут быть применены к любому организму, например эукариоту, который может иметь промысловую ценность. Например, они могут быть применены к рыбе (в рыбоводческом хозяйстве) или птицам (например, к цыплятам и курам).
Более высокие дозы модулирующих сиртуин соединений, которые повышают уровень и/или активность белка сиртуина, могут также быть использованы в качестве пестицида, препятствующего регуляции "выключенных" генов и регуляции апоптоза в процессе развития. В этом варианте осуществления соединение может быть применено на растениях с помощью известного в технике способа, который обеспечивает биологическое усвоение соединения личинкой насекомого, но не растениями.
По меньшей мере, с точки зрения связи между репродукцией и продолжительностью жизни, модулирующие сиртуин соединения, которые повышают уровень и/или активность белка сиртуина, могут быть применены для нарушения репродукции организмов, таких как насекомые, животные и микроорганизмы.
4. Исследования
Еще одни предлагаемые в описании способы включают способы выявления соединений или лекарственных средств, которые модулируют сиртуины. Лекарственным средством может быть нуклеиновая кислота, такая как аптамер. Исследования могут проводиться в клеточном варианте или бесклеточном варианте. Например, исследование может включать инкубирование (или контактирование) сиртуина с испытуемым средством в условиях, при которых сиртуин может быть подвергнут модулированию с помощью средства, известного как способное модулировать сиртуин, и наблюдение или определение уровня модулирования сиртуина в присутствии испытуемого средства в сравнении со случаем отсутствия испытуемого средства. Уровень модулирования сиртуина может быть измерен путем определения его способности деацетилировать субстрат. Примерами субстратов являются ацетилированные пептиды, которые могут быть предоставлены фирмой BIOMOL (Plymouth Meeting, PA). Предпочтительные субстраты включают пептиды p53, такие как пептиды, включающие ацетилированный K382. Особенно предпочтительным субстратом является Fluor de Lys-SIRT1 (BIOMOL), то есть ацетилированный пептид Arg-His-Lys-Lys. Другими субстратами являются пептиды человеческих гистонов H3 и H4 или ацетилированная аминокислота. Субстраты могут быть флорогенетическими. Сиртуином может быть SIRT1, Sir2, SIRT3 или их часть. Например, рекомбинантный SIRT1 может быть предоставлен фирмой BIOMOL. Реакция может быть проведена в течение примерно 30 минут и остановлена, например, с помощью никотинамида. Для определения уровня ацетилирования может быть использован набор для исследования/выявления лекарственных средств по флуоресцентной активности HDAC (гистондеацетилазы) (AK-500, BIOMOL Research Laboratories). Аналогичные исследования описаны в публикации Bitterman et al. (2002) J. Biol. Chem. 277:45099. Уровень модулирования сиртуина при исследовании можно сравнить с уровнем модулирования сиртуина в присутствии одного или более (раздельно или одновременно) описываемых в описании соединений, которые могут служить в качестве положительного или отрицательного контроля. Сиртуины для использования в исследованиях могут быть непроцессированными белками сиртуинами или их частями. Так как в описании было показано, что активирующие соединения, по-видимому, реагируют с N-концом SIRT1, белки для использования в исследованиях включают N-концевые части сиртуинов, например, вблизи аминокислот 1-176 или 1-255 SIRT1; вблизи аминокислот 1-174 или 1-252 Sir2.
В одном варианте осуществления скрининговое исследование включает (i) контактирование сиртуина с испытуемым средством и ацетилированным субстратом при условиях, при которых сиртуин способен деацетилировать субстрат в отсутствие испытуемого средства; и (ii) определение уровня ацетилирования субстрата, где более низкий уровень ацетилирования субстрата в присутствии испытуемого средства в сравнении с уровнем ацетилирования в отсутствие испытуемого средства указывает, что испытуемое средство стимулирует деацетилирование под воздействием сиртуина, в то время как более высокий уровень ацетилирования субстрата в присутствии испытуемого средства в сравнении с уровнем ацетилирования в отсутствие испытуемого средства указывает, что испытуемое средство ингибирует деацетилирование под воздействием сиртуина.
Способы выявления средства, которое модулирует, например стимулирует, сиртуины in vivo, могут включать (i) контактирование клетки с испытуемым средством и субстратом, который способен проникать в клетку в присутствии ингибитора HDAC класса I и класса II при условиях, при которых сиртуин способен деацетилировать субстрат в отсутствие испытуемого средства; и (ii) определение уровня ацетилирования субстрата, где более низкий уровень ацетилирования субстрата в присутствии испытуемого средства в сравнении с уровнем ацетилирования в отсутствие испытуемого средства указывает, что испытуемое средство стимулирует деацетилирование под воздействием сиртуина, в то время как более высокий уровень ацетилирования субстрата в присутствии испытуемого средства в сравнении с уровнем ацетилирования в отсутствие испытуемого средства указывает, что испытуемое средство ингибирует деацетилирование под воздействием сиртуина. Предпочтительный субстрат представляет собой ацетилированный пептид, который является также, предпочтительно, флорогенетическим, как описано в описании далее. Способ может дополнительно включать лизирование клеток для определения уровня ацетилирования субстрата. Субстраты могут быть добавлены к клеткам при концентрации от примерно 1 мкМ до 10 мМ, предпочтительно, от примерно 10 мкМ до 1 мМ, еще более предпочтительно, от примерно 100 мкМ до 1 мМ, такой как примерно 200 мкМ. Предпочтительным субстратом является ацетилированный лизин, например, ε-ацетиллизин (Fluor de Lys, FdL) или Fluor de Lys-SIRT1. Предпочтительным ингибитором HDAC класса I и класса II является трихостатин A (TSA), который может быть использован при концентрациях в интервале от примерно 0,01 до 100 мкМ, предпочтительно, от примерно 0,1 до 10 мкМ, такой как 1 мкМ. Инкубирование клеток с испытуемым соединением и субстратом может быть проведено в течение от примерно 10 минут до 5 часов, предпочтительно, в течение примерно 1-3 часов. Так как TSA ингибирует все HDAC класса I и класса II, и в связи с тем, что конкретные субстраты, например Fluor de Lys, являются слабым субстратом для SIRT2 и еще более несущественным субстратом для SIRT3-7, такое исследование может быть использовано для выявления модуляторов SIRT1 in vivo.
5. Фармацевтические композиции
Из описываемых в описании модулирующих сиртуин соединений могут быть приготовлены традиционным способом лекарственные препараты с использованием одного или более физиологически или фармацевтически приемлемых носителей или вспомогательных веществ. Например, из модулирующих сиртуин соединений и их фармацевтически приемлемых солей и сольватов могут быть приготовлены лекарственные препараты для введения путем, например, инъекции (например, подкожно, внутримышечно, интраперитонеально), ингаляции или инсуффляции (либо через рот, либо через нос), или путем перорального, буккального, сублингвального, трансдермального, назального, парентерального или ректального введения. В одном варианте осуществления модулирующее сиртуин соединение может быть введено местно, то есть в том месте, где присутствуют клетки-мишени, то есть в конкретную ткань, орган или жидкость (например, кровь, спинномозговую жидкость и так далее).
Из модулирующих сиртуин соединений могут быть приготовлены лекарственные препараты для различных способов введения, включая системное и топическое или локализованное введение. В целом информацию о методах и лекарственных формах можно найти в Remington's Pharmaceutical Sciences, Meade Publishing Co., Easton, PA. В случае парентерального введения предпочтительной является инъекция, включающая внутримышечную, внутривенную, интраперитонеальную и подкожную инъекции. В случае инъекции соединения могут быть приготовлены в форме жидких растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Ханка или раствор Рингера. Кроме того, соединения могут быть приготовлены в твердой форме и повторно растворены или суспендированы непосредственно перед применением. К ним также относятся лиофилизированные формы.
В случае перорального введения фармацевтические композиции могут принимать форму, например, таблеток, пастилок или капсул, приготовленных традиционными способами с фармацевтически приемлемыми вспомогательными веществами, такими как связующие (например, предварительно желатизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрогенфосфат кальция); скользящие вещества (например, стеарат магния, тальк или оксид кремния); разрыхлители (например, картофельный крахмал или натрий-крахмалгликолят); или смачивающие средства (например, лаурилсульфат натрия). На таблетки могут быть нанесены покрытия с помощью хорошо известных в области техники способов. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут представлять собой сухой продукт для разведения в воде или другой подходящей среде перед использованием. Такие жидкие препараты могут быть приготовлены традиционными способами с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сорбитовый сироп, производные целлюлозы или гидрированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные среды (например, миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты могут также содержать буферные соли, вещество, корригирующее вкус и запах, окрашивающие и подслащивающие вещества, в случае необходимости. Препараты для перорального введения могут быть соответствующим образом приготовлены для контролируемого высвобождения активного соединения.
В случае введения путем ингаляции (например, пульмонального введения) модулирующие сиртуин соединения могут быть удобно введены в форме выпускаемой аэрозольной струи из баллончиков под давлением или небулайзера с помощью подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением разовая доза может быть определена путем установки клапана для подачи отмеренного количества. Для использования в ингаляторе или инсуффляторе могут быть приготовлены, например из желатина, капсулы и картриджи, содержащие порошкообразную смесь из соединения и подходящей порошкообразной основы, такой как лактоза или крахмал.
Из модулирующих сиртуин соединений могут быть приготовлены препараты для парентерального введения путем инъекции, например, путем болюсной инъекции или непрерывной инфузии. Препараты для инъекции могут представлять собой стандартную лекарственную форму, например в виде ампул или упаковки для многократного приема, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных средах, и могут содержать вспомогательные средства, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может находиться в порошкообразной форме для разведения перед использованием с помощью подходящей среды, например, стерильной апирогенной воды.
Из модулирующих сиртуин соединений могут быть также приготовлены ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие традиционные суппозиторные основы, такие как масло какао или другие глицериды.
В дополнение к описанным выше препаратам из модулирующих сиртуин соединений может также быть приготовлен препарат с депо-эффектом. Такие препараты пролонгированного действия могут быть введены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, модулирующие сиртуин соединения могут быть приготовлены с соответствующими полимерными или гидрофобными материалами (например, в виде эмульсии в соответствующем масле) или ионообменными смолами, или в виде постепенно растворимых производных, например в виде постепенно растворимой соли. Лекарственная форма с контролируемым высвобождением также включает пластыри.
В конкретных вариантах осуществления из описываемых в описании соединений могут быть приготовлены препараты для введения в центральную нервную систему (CNS) (описаны Begley, Pharmacology & Therapeutics 104: 29-45 (2004)). Традиционные подходы для введения лекарственных средств в центральную нервную систему включают нейрохирургические методы (например, интрацеребральная инъекция или интрацеребрально-вентрикулярная инфузия); манипуляцию с молекулой средства (например, продуцирование химерного слитого белка, который включает транспортный пептид, который имеет сродство к молекулам на поверхности эндотелиальных клеток в комбинации со средством, которое само по себе не способно проходить через гематоэнцефалический барьер (BBB)) при попытке использовать один из эндогенных транспортных путей BBB; фармакологические подходы, направленные на увеличение липидной растворимости средства (например, соединение водорастворимых средств с липидными или холестериновыми носителями); и кратковременное нарушение целостности BBB путем гиперосмотического разрушения (обусловленного инфузией раствора маннита в сонную артерию или использованием биологически активного средства, такого как ангиотензин-пептид).
Липосомы являются еще одной системой доставки лекарственного средства, которую легко инъецировать. Соответственно, в способе изобретения активные соединения могут также быть введены в форме липосомной системы доставки. Липосомы хорошо известны специалисту в этой области. Липосомы могут быть образованы из различных фосфолипидов, таких как холестерин, стеариламины фосфатидилхолинов. Используемые в способе изобретения липосомы охватывают все типы липосом, включая, но этим не ограничиваясь, мелкие моноламеллярные везикулы, крупные моноламеллярные везикулы и мультиламеллярные везикулы.
Другим способом приготовления препарата, в частности раствора модулятора сиртуина, такого как ресвератрол или его производная, является использование циклодекстрина. Под циклодекстрином подразумевают α-, β- или γ-циклодекстрин. Циклодекстрины подробно описаны в патентном документе Pitha et al., U.S. Pat. No. 4727064, содержание которого приводится в описании путем ссылки на него. Циклодектрины являются циклическими олигомерами глюкозы; эти соединения образуют комплексы включения с любым лекарственным средством, чья молекула может встраиваться в обладающие липофильным сродством полости молекулы циклодекстрина.
Быстро распадающиеся или растворяющиеся лекарственные формы применяют для быстрой абсорбции, в частности буккальной и сублингвальной абсорбции, фармацевтически активных средств. Быстро растворяющиеся лекарственные формы предпочтительны для пациентов, таких как пожилые люди и дети, у которых возникают сложности при проглатывании обычных твердых лекарственных форм, таких как капсулы и таблетки. Кроме того, быстрорастворимые лекарственные формы не имеют недостатков, характерных, например, для жевательных лекарственных форм, для которых от продолжительности нахождения активного средства во рту пациента сильно зависит определение количества вещества, корригирующего вкус и запах лекарственного средства, и степень непереносимости пациентом воздействия на горло крупности частиц активного средства.
Фармацевтические композиции (включая косметические препараты) могут содержать от примерно 0,00001 до 100%, например, от 0,001 до 10% или от 0,1% до 5% по массе одного или более описываемых в описании модулирующих сиртуин соединений. В других вариантах осуществления фармацевтическая композиция включает (i) от 0,05 до 1000 мг соединения изобретения или его фармацевтически приемлемой соли и (ii) от 0,1 до 2 граммов одного или более фармацевтически приемлемых вспомогательных веществ.
В одном варианте осуществления описываемое в описании модулирующее сиртуин соединение вводят в топический препарат, содержащий топический носитель, который обычно применяют для топического введения лекарственного препарата и который включает любой такой известный в области техники материал. Топический носитель может быть выбран таким образом, чтобы он давал возможность получить композицию в требуемой форме, например в виде мази, лосьона, крема, микроэмульсии, геля, масла, раствора, или в других подобных формах, и он может состоять из материала либо природного, либо искусственного происхождения. Предпочтительно, чтобы выбранный носитель не оказывал негативного воздействия на активное средство или другие компоненты топического препарата. Примеры подходящих для использования в описании топических носителей включают воду, спирты и другие нетоксичные органические растворители, глицерин, минеральное масло, силикон, вазелиновое масло, ланолин, жирные кислоты, растительные масла, парабены, воски и другие подобные материалы.
Препараты могут быть бесцветными не имеющими запаха мазями, лосьонами, кремами, микроэмульсиями и гелями.
Модулирующие сиртуин соединения могут быть введены в мази, которые обычно являются полутвердыми препаратами и которые обычно готовят на основе вазелинового масла или других производных нефти. Для специалистов в этой области является очевидным, что конкретной основой, которую следует использовать для мази, является основа, которая может обеспечить оптимальную доставку лекарственного средства и, предпочтительно, может обеспечить другие требуемые характеристики, а также, например, смягчение или другие подобные свойства. Как и в случае других носителей или сред, основа мази должна быть инертной, стабильной, нераздражающей и несенсибилизирующей.
Модулирующие сиртуин соединения могут быть введены в лосьоны, которые обычно являются препаратами для нанесения на поверхность кожи без растирания и являются обычно жидкими или полужидкими препаратами, в которых присутствуют твердые частицы, включая активное средство, в водной или спиртовой основе. Лосьоны обычно являются суспензиями твердых веществ, и они могут включать жидкую масляную эмульсию типа масло-в-воде.
Модулирующие сиртуин соединения могут быть введены в кремы, которые обычно являются вязкими жидкими или полужидкими эмульсиями, либо типа масло-в-воде, либо вода-в-масле. Основы кремов смываются водой и содержат масляную фазу, эмульгатор и водную фазу. Масляная фаза обычно состоит из вазелинового масла и жирного спирта, такого как цетиловый или стеариловый спирт; водная фаза обычно, хотя и необязательно, превышает масляную фазу по объему и обычно содержит влагоудерживающее вещество. Эмульгатором в рецептуре крема, как это описано в упомянутой выше монографии Remington's, обычно является неионное, анионное, катионное или амфотерное поверхностно-активное вещество.
Модулирующие сиртуин соединения могут быть введены в микроэмульсии, которые обычно являются термодинамически стабильными, изотопно чистыми дисперсиями двух несмешивающихся жидкостей, таких как масло и вода, стабилизированных с помощью межфазной пленки из молекул поверхностно-активного вещества (Encyclopedia of Pharmaceutical Technology (New York: Marcel Dekker, 1992), volume 9).
Модулирующие сиртуин соединения могут быть введены в гелеобразные препараты, которые обычно являются полутвердыми системами, состоящими либо из суспензий, приготовленных из мелких неорганических частиц (двухфазные системы), либо из крупных органических молекул, распределенных практически равномерно в жидком носителе (однофазные гели). Хотя обычно в гелях используют жидкий водный носитель, спирты и масла могут также быть использованы в качестве жидкого носителя.
Другие активные средства могут также быть включены в препараты, например, другие противовоспалительные средства, анальгетики, противомикробные средства, противогрибковые средства, антибиотики, витамины, антиоксиданты и солнцезащитные средства, обычно присутствующие в фотозащитных препаратах, включая, но этим не ограничиваясь, антранилаты, бензофеноны (в частности, бензофенон-3), производные камфоры, циннаматы (например, октилметоксициннамат), дибензоилметаны (например, бутилметоксидибензоилметан), п-аминобензойную кислоту (PABA) и ее производные и салицилаты (например, октилсалицилат).
В конкретных топических препаратах активное средство присутствует в количестве в интервале от примерно 0,25% масс. до 75% масс. от массы препарата, предпочтительно, в интервале от примерно 0,25% масс. до 30% масс. от массы препарата, более предпочтительно, в интервале от примерно 0,5% масс. до 15% масс. от массы препарата, и наиболее предпочтительно, в интервале от примерно 1,0% масс. до 10% масс. от массы препарата.
Состояния глаз могут быть подвергнуты лечению или предотвращения, например, путем системной, топической, внутриглазной инъекции модулирующего сиртуин соединения или путем введения устройства с замедленным высвобождением, которое высвобождает модулирующее сиртуин соединение. Модулирующее сиртуин соединение, которое повышает уровень и/или активность белка сиртуина, может быть введено в фармацевтически приемлемую офтальмическую среду, так что соединение поддерживается в контакте с глазной поверхностью в течение достаточного периода времени для того, чтобы соединение могло проникнуть в корнеальные и внутренние участки глаза, как например, переднюю камеру, заднюю камеру, стекловидное тело, внутриглазную жидкость, жидкую часть стекловидного тела, роговицу, радужную оболочку/ресницы, хрусталики, сосудистую оболочку/сетчатку и склеру. Фармацевтически приемлемой офтальмической средой может, например, быть мазь, растительное масло или инкапсулирующий материал. Альтернативно, соединения изобретения могут быть инъецированы непосредственно в стекловидное тело глаза и водянистую влагу глаза. В еще одном варианте соединения могут быть введены системно, например путем внутривенной инфузии или инъекции, для лечения глаза.
Описываемые в описании модулирующие сиртуин соединения могут храниться в несодержащей кислорода окружающей среде. Например, ресвератрол или его аналог может быть приготовлен в герметичной капсуле для перорального введения, такой как Capsugel фирмы Pfizer, Inc.
Клетки, например, подвергнутые обработке ex vivo, с помощью модулирующего сиртуин соединения, могут быть введены в соответствии со способами введения трансплантата субъекту, которые могут сопровождаться, например, введением иммунодепрессанта, например циклоспорина A. Что касается общих принципов создания лекарственного препарата, то они описаны в Cell Therapy: Stem Cell Transplantation, Gene Therapy, and Cellular Immunotherapy, G. Morstyn & W. Sheridan eds, Cambridge University Press, 1996; и Hematopoietic Stem Cell Therapy, E. D. Ball, J. Lister & P. Law, Churchill Livingstone, 2000.
Токсичность и терапевтическая эффективность модулирующих сиртуин соединений могут быть определены с помощью стандартных фармацевтических методик на клеточных культурах или экспериментальных животных. LD50 является летальной дозой для 50% субъектов. ED50 является дозой, которая является терапевтически эффективной для 50% субъектов. Отношение токсической дозы к терапевтической дозе (LD50/ED50) представляет собой терапевтический индекс. Модулирующие сиртуин соединения, которые характеризуются высокими терапевтическими индексами, являются предпочтительными. Поскольку могут быть использованы модулирующие сиртуин соединения, которые характеризуются токсическим побочным действием, должны быть приняты меры для создания системы доставки, которая нацеленно доставляет такие соединения на место пораженной ткани, для того, чтобы минимизировать возможное повреждение неинфицированных клеток и, тем самым, снизить побочные эффекты.
Данные, полученные при исследованиях на клеточных культурах и животных, могут быть использованы для определения интервала дозирования при использовании на людях. Дозирование таких соединений может находиться в интервале циркулирующих концентраций, которые включают ED50 с небольшой токсичностью или при отсутствии токсичности. Доза может изменяться внутри этого интервала в зависимости от используемой лекарственной формы и применяемого способа введения. Для любого соединения терапевтически эффективная доза может быть оценена исходно при исследованиях на клеточных культурах. Доза может быть определена на животных моделях с получением интервала циркулирующей концентрации в плазме, которая включает величину IC50 (то есть концентрацию испытуемого соединения, которая позволяет достигать половину максимального подавления симптомов), определенную на клеточной культуре. Такая информация может быть использована для более точного определения подходящих для людей доз. Уровни в плазме могут быть измерены, например, с помощью высокоэффективной жидкостной хроматографии.
6. Наборы
Кроме того, в описании предлагаются наборы, например наборы для терапевтических целей или наборы для модулирования продолжительности жизни клеток или модулирования апоптоза. Набор может включать одно или более модулирующих сиртуин соединений, например, в предварительно определенных дозах. Набор может необязательно включать устройства для контактирования клеток с соединениями и инструкции по использованию. Устройства включают шприцы, стенты и другие устройства для введения модулирующего сиртуин соединения субъекту (например, в кровеносный сосуд субъекта) или нанесения его на кожу субъекта.
В еще одном варианте осуществления изобретение предлагает композицию веществ, включающую модулятор сиртуина этого изобретения и другое терапевтическое средство (аналогичное тем, которые используют при комбинированных терапиях и в комбинированных композициях) в раздельных лекарственных формах, но связанных друг с другом. Используемый в описании термин "связанные друг с другом" означает, что раздельные лекарственные формы упакованы вместе или же присоединены друг к другу, так что не вызывает никаких сомнений, что раздельные лекарственные формы предназначены для продажи и введения в качестве части одной и той же схемы лечения. Предпочтительно, чтобы средство и модулятор сиртуина упаковывали вместе в блистерную упаковку или другую упаковку с множеством ячеек, или в случае, если они присоединены друг к другу, в раздельно герметизированные контейнеры (такие как пакетики из фольги или другие подобные упаковки), которые могут быть разъединены пользователем (например, путем разрыва по линиям надреза между двумя контейнерами).
В еще одном варианте осуществления изобретение предлагает набор, включающий в отдельных емкостях a) модулятор сиртуина этого изобретения; и b) другое терапевтическое средство, такое как терапевтические средства, которые описаны в любом месте описания заявки.
При осуществлении настоящих способов могут использоваться, если не указано иначе, традиционные методы цитологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые известны в области техники. Такие методы подробно описаны в литературе. См., например, Molecular Cloning A Laboratory Manual, 2nd Ed., ed. Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989); DNA Cloning, Volumes I and II (D. N. Glover ed., 1985); Oligonucleotide Synthesis (M. J. Gait ed., 1984); Mullis et al. U.S. Patent No: 4,683,195; Nucleic Acid Hybridization (B. D. Hames & S. J. Higgins eds. 1984); Transcription And Translation (B. D. Hames & S. J. Higgins eds. 1984); Culture Of Animal Cells (R. I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); the treatise, Methods In Enzymology (Academic Press, Inc., N. Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods In Enzymology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D.M. Weir and C.C. Blackwell, eds., 1986); Manipulating the Mouse Embryo (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y., 1986).
ПРИМЕРЫ
Описанное в общих чертах изобретение будет легче понять с помощью следующих примеров, которые приводятся только с целью иллюстрации конкретных аспектов и вариантов осуществления настоящего изобретения и которые никоим образом не ограничивают изобретение.
Пример 1. Синтез N-(3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-ил)пиколинамида (Соединение 239):
Стадия 1. Получение 8-нитро-2-(3-(трифторметил)фенил)-4H-бензо[d][1,3]оксазин-4-она (3):
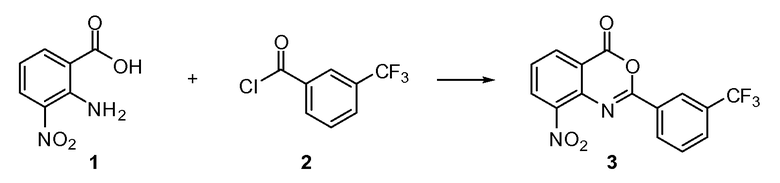
3-(трифторметил)бензоилхлорид 2 (4,5 мл, 30,2 ммоль) добавляли к суспензии 2-амино-3-нитробензойной кислоты 1 (5,0 г, 27,5 ммоль) в пиридине (65 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, затем выливали в охлаждаемую льдом H2O (300 мл). Полученный осадок отфильтровывали, промывали с помощью H2O и сушили под вакуумом с получением соединения 3 (5 г, 51% выход) в виде желтого твердого вещества, которое использовали без дополнительной очистки.
Стадия 2. Получение 3-метил-8-нитро-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она (4):
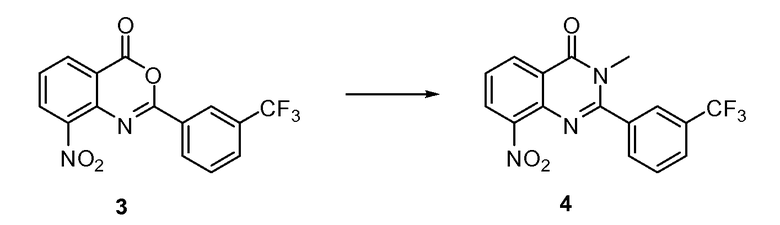
Раствор метиламина (6,3 мл, 12,5 ммоль) в THF добавляли к суспензии 8-нитро-2-(3-(трифторметил)фенил)-4H-бензо[d][1,3]оксазин-4-она 3 (1,5 г, 4,2 ммоль) в AcOH (18 мл). Реакционную смесь осторожно кипятили с обратным холодильником в течение 12 часов, затем охлаждали до комнатной температуры. Летучие компоненты удаляли под вакуумом, и остаток помещали в EtOAc, промывали с помощью насыщенного водного раствора NaHCO3, рассола, сушили (MgSO4) и концентрировали. Остаток очищали жидкостной хроматографией среднего давления, элюируя с помощью смеси пентан/EtOAc (0-75%) с получением соединения 4 (1,3 г, 89% выход) в виде желтого твердого вещества.
Стадия 3. Получение 8-амино-3-метил-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она (5):
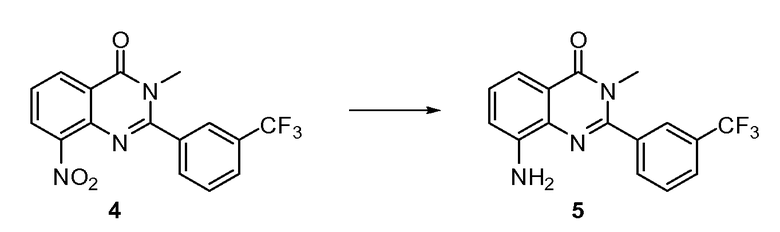
Pd/C 10% масс. (100 мг) добавляли к дегазированному раствору 3-метил-8-нитро-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она 4 (1,3 г, 3,7 ммоль) в THF (35 мл). Смесь гидрировали с помощью находящегося под давлением в баллоне водорода в течение 12 часов. Катализатор отфильтровывали и растворитель выпаривали. Остаток очищали жидкостной хроматографией среднего давления, элюируя с помощью пентан/EtOAc (0-50%), с получением соединения 5 (1,1 г, 90% выход) в виде желтого твердого вещества.
Стадия 4. Получение N-(3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-ил)пиколинамида (Соединение 239):
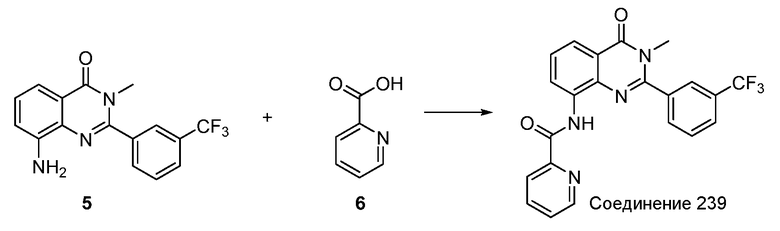
Смесь 8-амино-3-метил-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она 5 (106 мг, 0,33 ммоль), пиридин-2-карбоновой кислоты 6 (84 мг, 0,68 ммоль), HATU (263 мг, 0,69 ммоль) и DIPEA (208 мг) в DMF нагревали при 55°C в течение 2,5 часов, затем выливали в H2O. Полученный осадок отфильтровывали, промывали с помощью H2O, затем Et2O с получением соединения 239 в виде желтого твердого вещества (130 мг, 93% выход). MS (ESI) вычислено для C22H15F3N4O2: 424,11; обнаружено: 425 [M+H].
Пример 2. Синтез N-(3-метил-4-оксо-2-фенил-3,4-дигидрохиназолин-8-ил)пиридин-3-сульфонамида (Соединение 361):
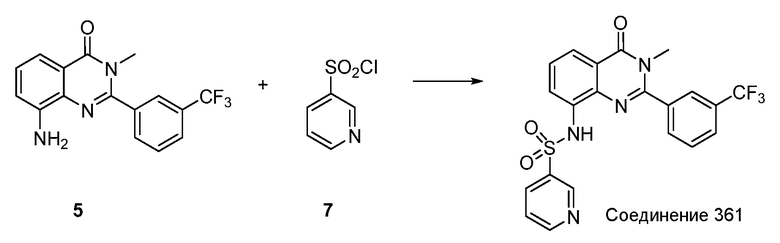
Пиридин-3-сульфонилхлорида гидрохлорид 7 (280 мг, 1,3 ммоль) добавляли к раствору 8-амино-3-метил-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она 5 (100 мг, 0,313 ммоль) в пиридине (5 мл). Реакционную смесь нагревали при 80°C в течение 12 часов. Пиридин удаляли под вакуумом. Остаток помещали в CH2Cl2, промывали с помощью насыщенного водного раствора NaHCO3, сушили (MgSO4) и концентрировали. Неочищенный остаток очищали жидкостной хроматографией среднего давления, элюируя с помощью смеси CH2Cl2/MeOH (0-10%), перекристаллизовывали из CH3CN с получением соединения 361 (77 мг, 53% выход). MS (ESI) вычислено для C21H15F3N4O3S: 460,08; обнаружено: 461[M+H].
Пример 3. Синтез N-(4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-ил)пиколинамида (Соединение 231):
Стадия 1. Получение 8-нитро-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она (8):
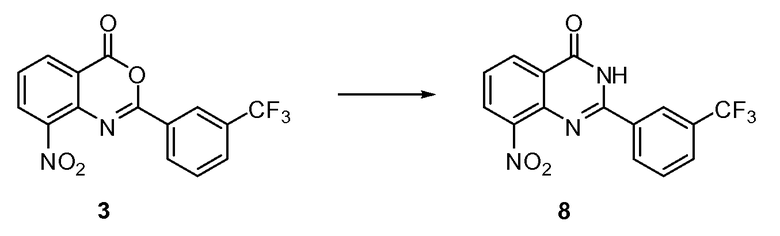
8-Нитро-2-(3-(трифторметил)фенил)-4H-бензо[d][1,3]оксазин-4-он 3 (150 мг, 0,45 ммоль) добавляли к раствору аммиака (5,0 мл, 10 ммоль) в IPA. Реакционную смесь осторожно кипятили с обратным холодильником в течение 12 часов, затем охлаждали до комнатной температуры. Реакционную смесь выливали в H2O и полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом. Неочищенный остаток перекристаллизовывали из EtOAc с получением соединения 8 (91 мг, 62% выход) в виде желтого твердого вещества.
Стадия 2. Получение 8-амино-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она (9):
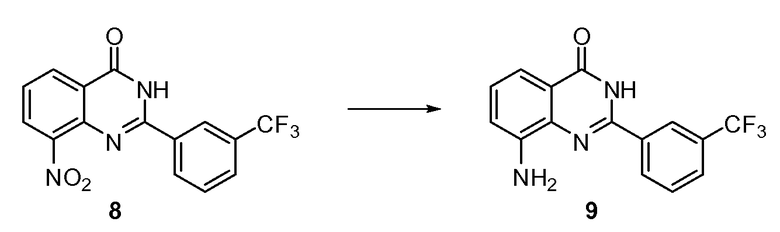
Соединение 9 получали с помощью методики, аналогичной методике, описанной для 8-амино-3-метил-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она 5, с 99% выходом.
Стадия 3. Получение N-(4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-ил)пиколинамида (Соединение 231):
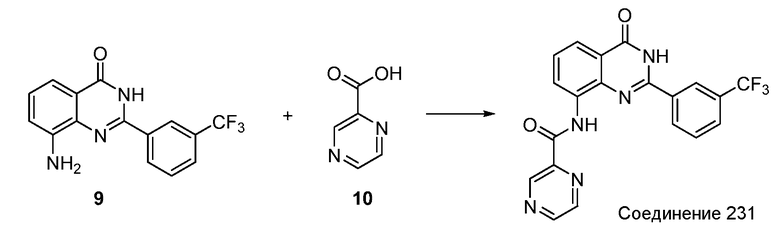
Смесь 8-амино-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она 9 (125 мг, 0,41 ммоль), пиразин-2-карбоновой кислоты 10 (102 мг, 0,82 ммоль), HATU (342 мг, 0,90 ммоль) и DIPEA (214 мкл, 1,2 ммоль) в DMAC (5 мл) нагревали при 70°C в течение 12 часов, затем выливали в H2O. Осадок отфильтровывали, промывали H2O, затем перекристаллизовывали из EtOH с получением соединения 231 (144 мг, 86% выход) в виде белого твердого вещества. MS (ESI) вычислено для C20H12F3N5O2: 411,09; обнаружено: 412 [M+H].
Пример 4. Синтез N-(2-(2,4-диметилтиазол-5-ил)-3-метил-4-оксо-3,4-дигидрохиназолин-8-ил)пиразин-2-карбоксамида (Соединение 287):
Стадия 1. Получение метил 2-амино-3-нитробензоата (11):
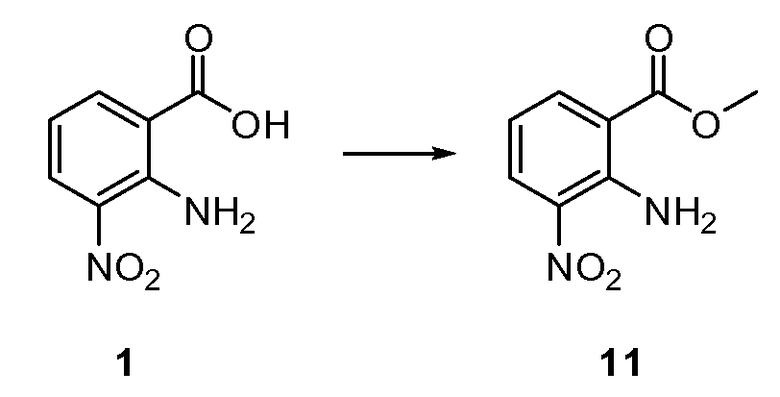
2-амино-3-нитробензойную кислоту 1 (5 г, 27,4 ммоль) растворяли в метаноле (100 мл), и добавляли концентрированную H2SO4. Смесь нагревали при 100°C в течение 12 часов, концентрировали досуха и суспендировали в H2O (50 мл). Смесь экстрагировали CH2Cl2 (50 мл), сушили (MgSO4) и концентрировали. Неочищенный остаток очищали флэш-хроматографией с получением соединения 11 (5,1 г, 95% выход).
Стадия 2. Получение метил 2-(бис(трет-бутоксикарбонил)амино)-3-нитробензоата (12):

(Boc)2O (5 г, 23 ммоль) добавляли к раствору метил 2-амино-3-нитробензоата 11 (4,5 г, 23 ммоль) и DMAP (5 г, 46 ммоль) в THF. Реакционную смесь перемешивали при комнатной температуре в течение 6 часов, концентрировали и очищали флэш-хроматографией с получением соединения 12 (6,4 г, 70% выход).
Стадия 3. Получение метил 3-амино-2-(бис(трет-бутоксикарбонил)амино)бензоата (13):
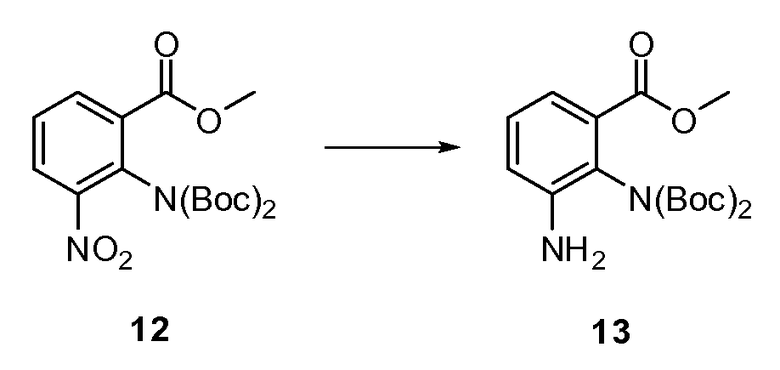
Ni Ренея (1 г) добавляли к раствору метил 2-(бис-(трет-бутоксикарбонил)амино)-3-нитробензоата 12 (6 г, 27,5 ммоль) в THF. Реакционную смесь гидрировали с помощью находящегося под давлением в баллоне водорода в течение 4 часов. Катализатор отфильтровывали и растворитель выпаривали с получением соединения 13 (4,4 г, 80% выход).
Стадия 4. Получение метил 2-(бис-трет-бутоксикарбонил)амино)-3-(пиразин-2-карбоксамидо)бензоата (14):
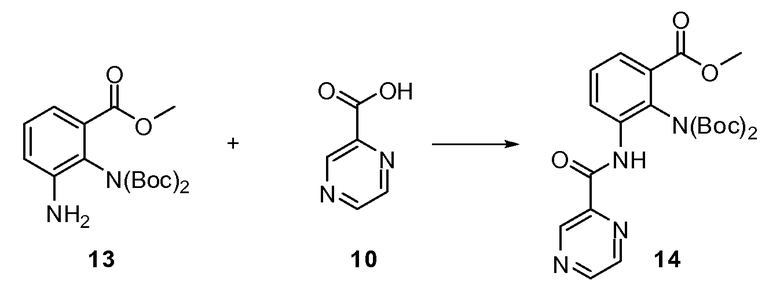
Раствор метил 3-амино-2-(бис(трет-бутоксикарбонил)амино)бензоата 13 (3,8 г, 10,4 ммоль), пиразин-2-карбоновой кислоты 10 (1,54 г, 12,5 ммоль), HATU (7,9 г, 20,8 ммоль) и DIPEA (2,68 г, 20,8 ммоль) в DMF нагревали при 50°C в течение 12 часов. Реакционную смесь выливали в H2O, и полученный осадок отфильтровывали и сушили под вакуумом. Неочищенный остаток очищали флэш-хроматографией с получением соединения 14 (2,87 г, 58% выход)
Стадия 5. Получение метил 2-амино-3-(пиразин-2-карбоксамидо)бензоата (15):
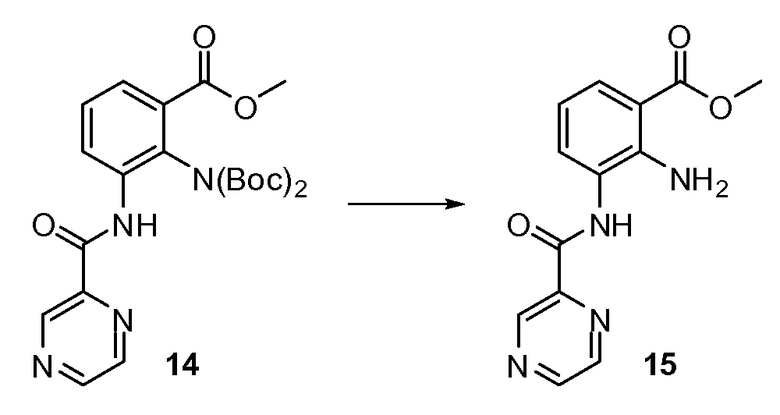
Газообразный HCl барботировали через раствор метил 2-(бис-(трет-бутоксикарбонил)амино)-3-(пиразин-2-карбоксамидо)бензоата 14 (2,8 г, 5,9 ммоль) в MeOH (50 мл) в течение 2 часов. Летучие компоненты удаляли под вакуумом и добавляли H2O (20 мл). pH корректировали до 7 водным раствором NaOH и полученный осадок отфильтровывали, промывали H2O, и сушили под вакуумом с получением соединения 15 (1,37 г, 85% выход).
Стадия 6. Получение 2-амино-3-(пиразин-2-карбоксамидо)бензойной кислоты (16):
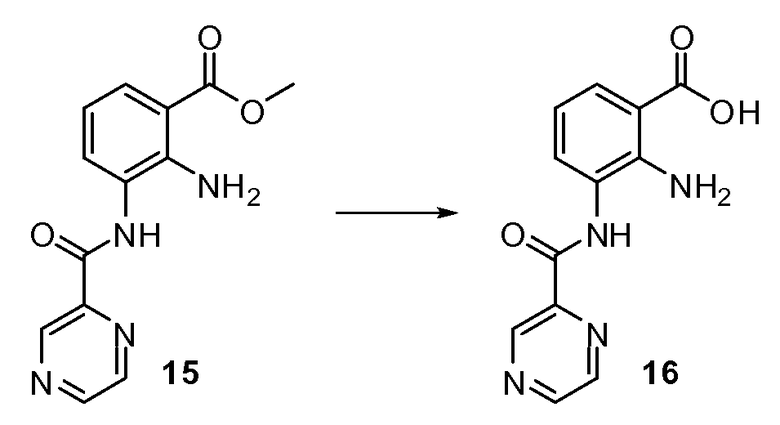
Смесь водного раствора NaOH (20 мл, 88,2 ммоль) и метил 2-амино-3-(пиразин-2-карбоксамидо)бензоата 15 (1,2 г, 4,41 ммоль) в THF (20 мл) перемешивали при комнатной температуре в течение 4 часов. Летучие компоненты испаряли и pH корректировали до 4 водным раствором HCl. Полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 16 (750 мг, 66% выход).
Стадия 7. Получение N-(2-(2,4-диметилтиазол-5-ил)-4-оксо-4H-бензо[d][1,3]оксазин-8-ил)пиразин-2-карбоксамида (18):
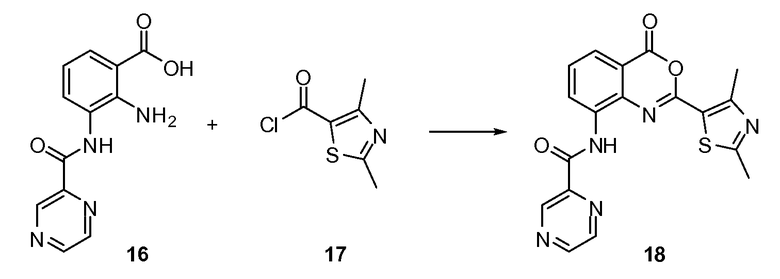
2,4-Диметилтиазол-5-карбонилхлорид 17 (104 мг, 0,58 ммоль) добавляли к суспензии 2-амино-3-(пиразин-2-карбоксамидо)бензойной кислоты 16 (100 мг, 0,39 ммоль) в пиридине (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, затем выливали в охлаждаемую льдом H2O (30 мл). Полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 18 (110 мг, 81% выход).
Стадия 8. Получение N-(2-(2,4-диметилтиазол-5-ил)-3-метил-4-оксо-3,4-дигидрохиназолин-8-ил)пиразин-2-карбоксамида (Соединение 287):
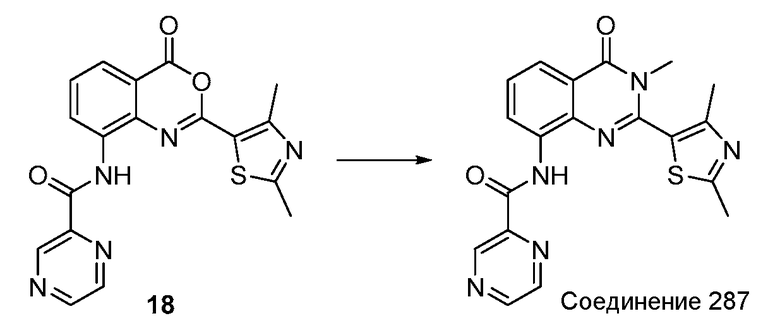
N-(2-(2,4-диметилтиазол-5-ил)-4-оксо-4H-бензо[d][1,3]-оксазин-8-ил)пиразин-2-карбоксамид 18 (100 мг, 0,26 ммоль) растворяли в 30% масс. растворе CH3NH2 в метаноле (10 мл). Реакционную смесь нагревали при 80°C в течение 12 часов. Полученный осадок отфильтровывали и промывали DME с получением соединения 287 (32 мг, 31% выход). MS (ESI) вычислено для C19H16F3N6O2S: 392,11; обнаружено: 393 [M+H].
Пример 5. Синтез N-(3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-ил)-5-оксопирролидин-2-карбоксамида (Соединение 339):
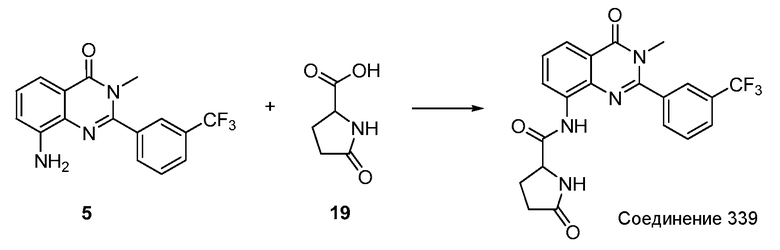
Тионилхлорид (83 мг, 0,7 ммоль) добавляли к раствору 5-оксопирролидин-2-карбоновой кислоты 19 (65 мг, 0,5 ммоль) в THF (5 мл) при 0°C. Добавляли DMF (1 каплю) и раствор подогревали до комнатной температуры в течение 3 часов, затем охлаждали до 0°C. Добавляли раствор 8-амино-3-метил-2-(3-(трифторметил)фенил)хиназолин-4(3H)-она 5 (65 мг, 0,2 ммоль) и триэтиламин (145 мг, 1,44 ммоль) в THF (1 мл), и реакционную смесь подогревали до комнатной температуры и перемешивали в течение 12 часов. Реакционную смесь концентрировали досуха и неочищенный остаток очищали препаративной тонкослойной хроматографией с получением соединения 339. MS (ESI) вычислено для C21H17F3N4O3: 430,1; обнаружено: 431 [M+H].
Пример 6. Синтез 3-метил-4-оксо-N-(пиридин-2-ил)-2-(2-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида (Соединение 212):
Стадия 1. Получение метил 2-амино-3-(пиридин-2-илкарбамоил)бензоата (22):
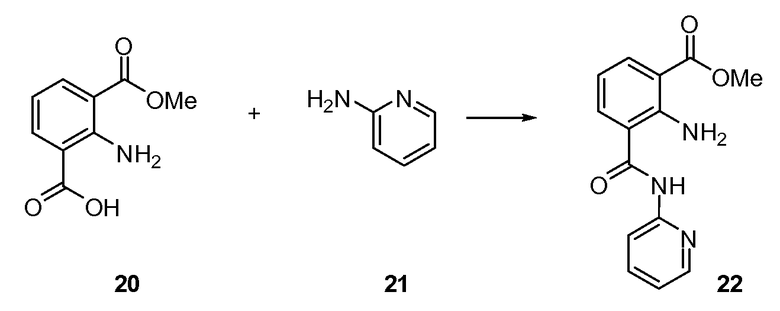
Раствор 2-амино-3-(метоксикарбонил)бензойной кислоты 20 (1 г, 5,1 ммоль), 2-аминопиридина 21 (723 мг, 7,7 ммоль), HOBT (1,39 г, 10,3 ммоль), EDCI (1,9 г, 10,3 ммоль) и DMAP (1,25 г, 10,3 ммоль) в DMF (40 мл) перемешивали при 70°С в течение 12 часов. Реакционную смесь выливали в H2O. Полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 22 (0,9 г, 58% выход).
Стадия 2. Получение 2-амино-3-(пиридин-2-илкарбамоил)бензойной кислоты (22):
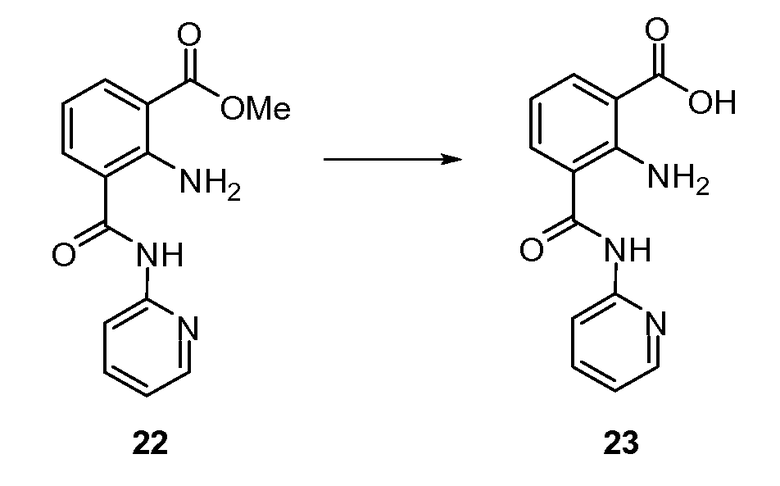
LiOH-H2O (1,8 г, 42,8 ммоль) добавляли к раствору метил 2-амино-3-(пиридин-2-илкарбамоил)бензоата 22 (2,9 г, 10,7 ммоль) в THF (30 мл) и H2O (30 мл). Реакционную смесь нагревали при 60° в течение 5 часов. THF удаляли под вакуумом и добавляли H2O (10 мл). pH корректировали до 4 водным раствором HCl и полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 23 (2,1 г, 76% выход).
Стадия 3. Получение 4-оксо-N-(пиридин-2-ил)-2-(2-(трифторметил)фенил)-4H-бензо[d][1,3]оксазин-8-карбоксамида (25):
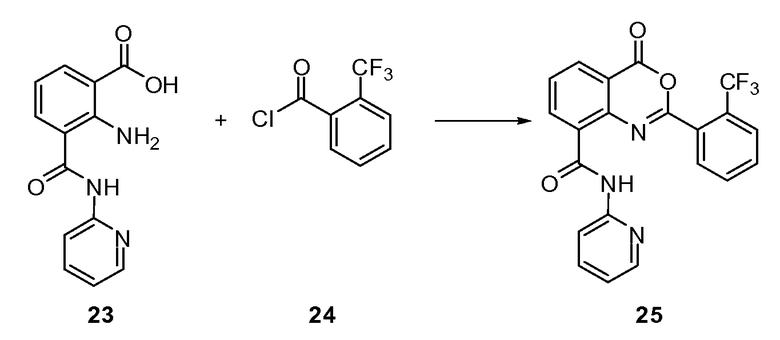
2-(Трифторметил)бензоилхлорид 24 (180 мг, 0,88 ммоль) добавляли к суспензии 2-амино-3-(пиридин-2-илкарбамоил)бензойной кислоты 23 (150 мг, 0,58 ммоль) в пиридине (8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, затем выливали в охлаждаемую льдом H2O. Полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 25 (90 мг, 38% выход) в виде белого твердого вещества.
Стадия 4. Получение 3-метил-4-оксо-N-(пиридин-2-ил)-2-(2- (трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида (Соединение 212):
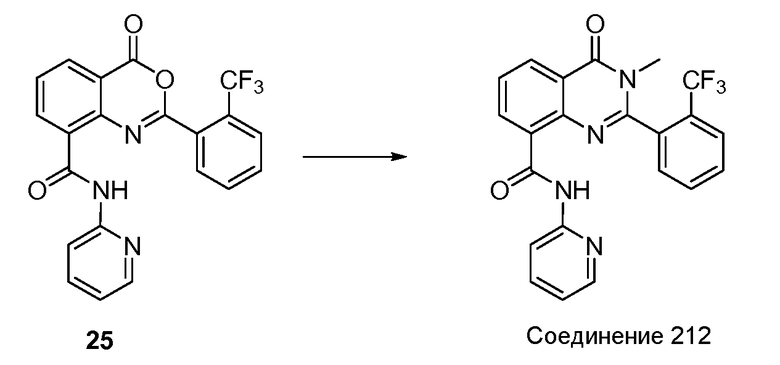
Раствор 30% масс. метиламина (7 мл) в MeOH и 4-оксо-N-(пиридин-2-ил)-2-(2-(трифторметил)фенил)-4H-бензо[d][1,3]-оксазин-8-карбоксамида 25 (90 мг, 0,22 ммоль) осторожно кипятили с обратным холодильником в течение 1 часа, затем охлаждали до комнатной температуры. Полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 212 (20 мг, 22% выход) в виде белого твердого вещества. MS (ESI) вычислено для C22H15F3N4O2: 424,11; обнаружено: 425 [M+H].
Пример 7. Синтез 3-метил-4-оксо-N-(пиридин-2-ил)-2-(4-(пирролидин-1-илметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида (Соединение 275):
Стадия 1. Получение 2-(4-бромфенил)-4-оксо-N-(пиридин-2-ил)-4H-бензо[d][l,3]оксазин-8-карбоксамида (27):
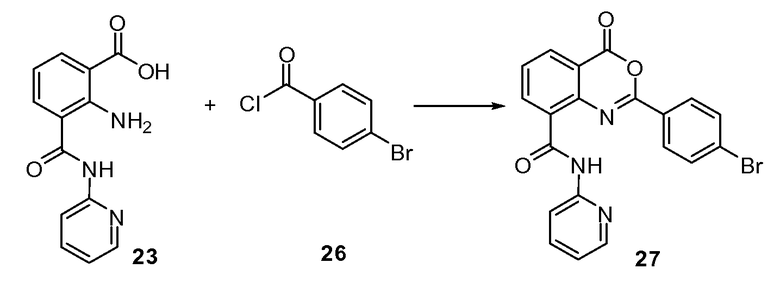
2-(4-Бромфенил)-4-оксо-N-(пиридин-2-ил)-4H-бензо[d][1,3]-оксазин-8-карбоксамид 27 получали с помощью методики, аналогичной методике, описанной для 4-оксо-N-(пиридин-2-ил)-2-(2-(трифторметил)фенил)-4H-бензо[d][1,3]оксазин-8-карбоксамида 25, с 91% выходом.
Стадия 2. Получение 2-(4-бромфенил)-3-метил-4-оксо-N-(пиридин-2-ил)-3,4-дигидрохиназолин-8-карбоксамида (28):
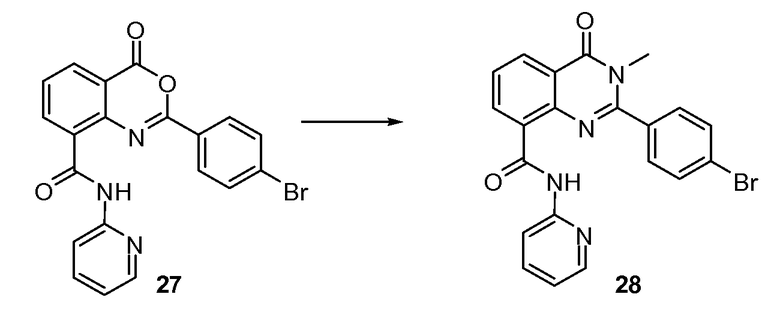
Соединение 28 получали с помощью методики, аналогичной методике, описанной для 3-метил-4-оксо-N-(пиридин-2-ил)-2-(2-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида соединения 212, с 76% выходом.
Стадия 3. Получение 3-метил-4-оксо-N-(пиридин-2-ил)-2-(4-(пирролидин-1-илметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида (Соединение 275):
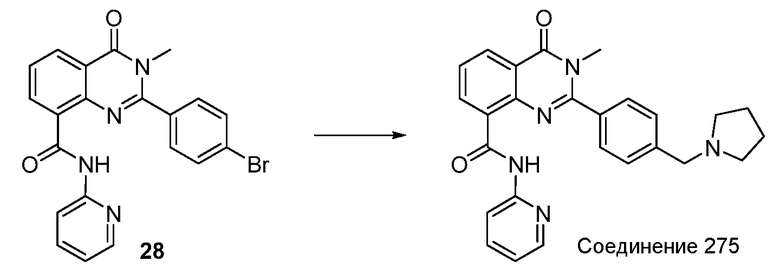
Дегазированную смесь THF/H2O (4 мл, 10:1) добавляли в сосуд для проведения реакций с помощью микроволнового излучения, содержащий 2-(4-бромфенил)-3-метил-4-оксо-N-(пиридин-2-ил)-3,4-дигидрохиназолин-8-карбоксамид 28 (100 мг, 0,23 ммоль), Cs2CO3 (224 мг, 0,69 ммоль), Pd(OAc)2 (1,5 мг, 0,007 ммоль), XPHOS (65 мг, 0,014 ммоль) и калия 1-трифторборатметилпирролидин (48 мг, 0,25 ммоль). Реакционную смесь нагревали при 150°C в микроволновом реакторе в течение 30 минут, выливали в H2O и экстрагировали EtOAc. Объединенные органические слои промывали рассолом, сушили, концентрировали и неочищенный остаток очищали жидкостной хроматографией среднего давления, элюируя смесью CH2Cl2/MeOH (0-10%), с получением соединения 275 (63 мг, 63% выход). MS (ESI) вычислено для C26H25N5O2: 439,20; обнаружено: 440 [M+H].
Пример 8. Синтез N-(3,4-диметоксифенил)-3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида (Соединение 220):
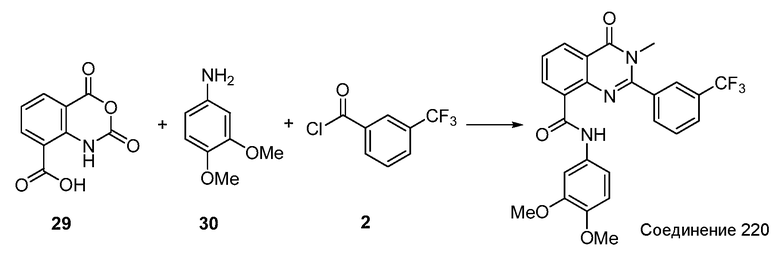
В сосуд для проведения реакций с помощью микроволнового излучения загружали N-карбоксиантраниловый ангидрид-2-карбоновой кислоты 29 (Clark, et al. J. Med. Chem. 1995, 38, 1493-1504) (115 мг, 0,555 ммоль), 3,4-диметоксианилин 30 (102 мг, 0,666 ммоль) и пиридин (2,0 мл). Реакционную смесь нагревали при 200°C с помощью микроволнового излучения в течение 2 часов. При охлаждении добавляли 3-(трифторметил)бензоилхлорид 2 (120 мл, 0,800 ммоль) и сосуд нагревали до 100°C в течение 1 часа. После охлаждения добавляли раствор метиламина (1,0 мл, 2,0 ммоль) в MeOH и реакционную смесь нагревали до 100°C в течение еще 1 часа. Летучие компоненты удаляли под вакуумом, и неочищенный остаток очищали жидкостной хроматографией среднего давления с получением соединения 220 (69 мг, 26% выход). MS (ESI) вычислено для C25H20F3N3O4: 483,14; обнаружено: 484 [M+H].
Пример 9. Синтез 3-метил-4-оксо-N-(6-(пирролидин-1-ил)пиридин-2-ил)-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида (Соединение 350):
Стадия 1. Получение 2-амино-3-(метилкарбамоил)бензойной кислоты (31):
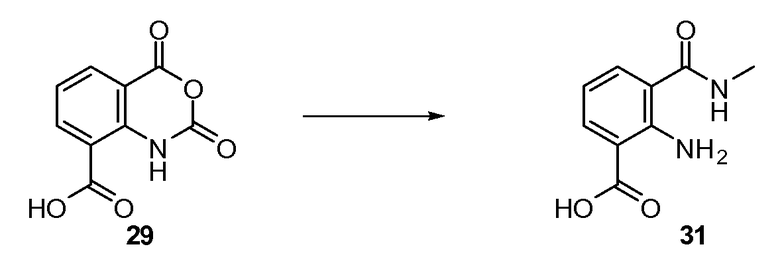
Водный раствор NaOH (23,4 мл, 46,8 ммоль) добавляли к раствору гидрохлорида метиламина (3,52 г, 53,7 ммоль) в H2O (37 мл). Добавляли порциями 2,4-диоксо-2,4-дигидро-1H-бензо-[d][1,3]оксазин-8-карбоновую кислоту 29 (3,23 г, 15,6 ммоль). После завершения добавления раствор перемешивали при температуре окружающей среды в течение 1,5 часов. Добавляли 6M HCl до тех пор, пока не устанавливалось pH=3. Полученный осадок отфильтровывали, промывали H2O и сушили с получением соединения 31 (2,60 г, 86% выход).
Стадия 2. Получение 3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоновой кислоты (33):
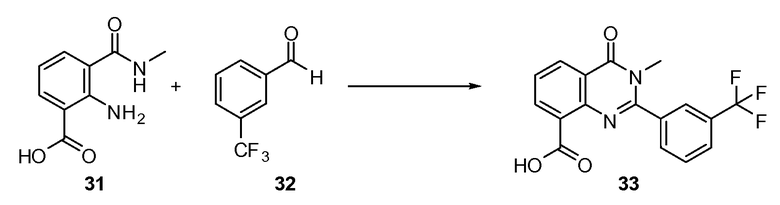
Метабисульфит натрия (3,56 г, 18,7 ммоль) добавляли к раствору 2-амино-3-(метилкарбамоил)бензойной кислоты 31 (2,80 г, 14,4 ммоль) и 3-(трифторметил)бензальдегида 32 (2,51 г, 14,4 ммоль) в DMAC (45 мл). Реакционную смесь перемешивали при 100°C в течение 21 часа. Добавляли H2O (150 мл), и полученный осадок отфильтровывали, промывали H2O и сушили с получением соединения 33 (4,31 г, 84% выход).
Стадия 3. Получение 3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбонилхлорида (34):
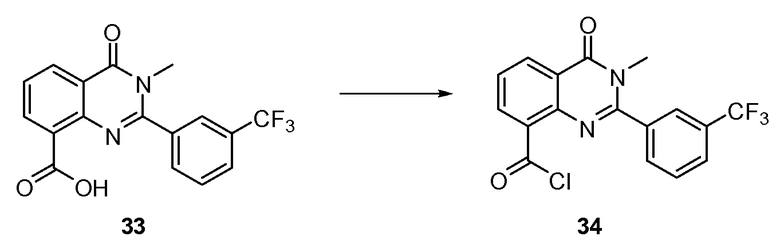
Раствор тионилхлорида (10 мл) и 3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоновой кислоты 33 (1,00 г, 2,87 ммоль) кипятили с обратным холодильником в течение 1 часа. После охлаждения до комнатной температуры все летучие компоненты удаляли под вакуумом с получением соединения 34 (1,05 г, 100% выход) в виде белого твердого вещества.
Стадия 4. Получение 3-метил-4-оксо-N-(6-(пирролидин-1-ил)пиридин-2-ил)-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбоксамида (Соединение 350):
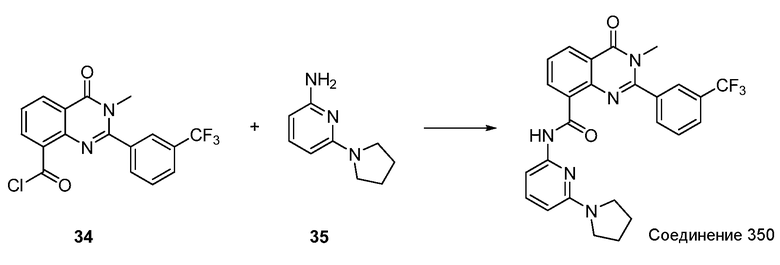
Триэтиламин (100 мкл) и 6-пирролидин-1-илпиридин-2-амин 35 (0,136 ммоль) добавляли к раствору 3-метил-4-оксо-2-(3-(трифторметил)фенил)-3,4-дигидрохиназолин-8-карбонилхлорида 34 (50 мг, 0,136 ммоль) в диоксане (1 мл). Реакционную смесь перемешивали при 70°C в течение 2 дней, после чего добавляли 1N HCl (4 мл). Полученный осадок отфильтровывали, промывали с помощью 5 мл H2O, 5 мл пентана и сушили под вакуумом с получением соединения 350 (40 мг, 56% выход). MS(ESI) вычислено для C26H22F3N5O2: 493,17; обнаружено: 494 [M+H].
Пример 10. Синтез N-(4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-8-ил)пиразин-2-карбоксамида (Соединение 409):
Стадия 1. Получение этил 8-нитро-4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-3-карбоксилата (36):
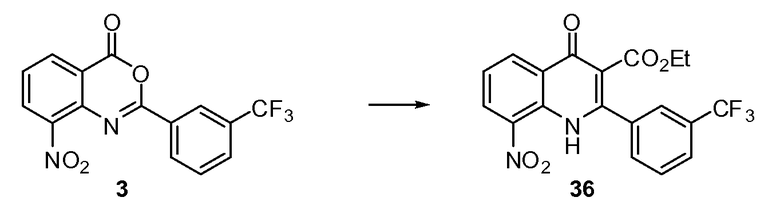
Раствор диизопропиламина (7,00 мл, 50,0 ммоль) в THF (100 мл) охлаждали до -78°C, и добавляли н-BuLi (20,0 мл, 2,5 M в гексанах, 50,0 ммоль). После перемешивания в течение 20 минут при -78°C, добавляли этилацетат (5,72 мл, 58,6 ммоль). Раствор перемешивали при -78°C в течение 10 минут, подогревали до 0°C и перемешивали в течение 10 минут, затем снова охлаждали до -78°C. Добавляли в течение 5 минут раствор 8-нитро-2-(3-(трифторметил)фенил)-4H-бензо[d][l,3]оксазин-4-она 3 (9,85 г, 29,3 ммоль) в THF (100 мл) к смеси LDA/EtOAc. Реакционную смесь перемешивали при -78°C в течение 1 часа, затем подогревали до комнатной температуры в течение 2 часов. Затем добавляли 1N NaOH (50 мл) и реакционную смесь интенсивно перемешивали в течение ночи. Добавляли рассол (50 мл) и отделяли органический слой. Водный слой экстрагировали этилацетатом (2×100 мл), и объединенные органические слои сушили MgSO4 и концентрировали под пониженным давлением. Остающийся материал очищали жидкостной хроматографией среднего давления (используя градиент от 20% до 50% EtOAc в пентане) с получением соединения 36 (5,00 г, 42% выход).
Стадия 2. Получение 8-нитро-2-(3-(трифторметил)фенил)хинолин-4(1H)-она (37):

В сосуд для проведения реакций с помощью микроволнового излучения загружали 8-нитро-4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-3-карбоксилат 36 (1,0 г, 2,46 ммоль), диоксан (8 мл) и 1N HCl (4 мл). Реакционную смесь нагревали при 190°C с помощью микроволнового излучения в течение 50 минут. Летучие компоненты испаряли и остаток сушили под вакуумом с получением соединения 37 (707 мг, 86% выход).
Стадия 3. Получение 8-нитро-2-(3-(трифторметил)фенил)хинолин-4-илацетата (38):
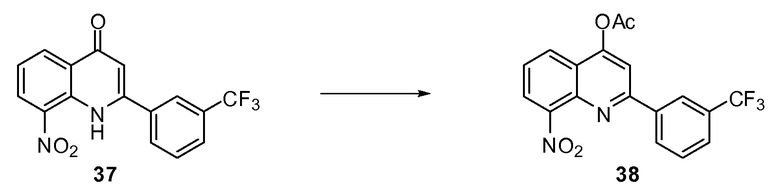
Раствор 8-нитро-2-(3-(трифторметил)фенил)хинолин-4(1H)-она 37 (707 мг, 2,11 ммоль), триэтиламина (1 мл) и Ac2O (0,7 мл) в CH2Cl2 (10 мл) перемешивали при комнатной температуре в течение 16 часов. Добавляли насыщенный водный раствор NaHCO3 (10 мл), и реакционную смесь экстрагировали с помощью CH2Cl2. Объединенные органические слои сушили (MgSO4) и концентрировали с получением соединения 38.
Стадия 4. Получение 8-амино-2-(3-(трифторметил)фенил)хинолин-4-илацетата (39):
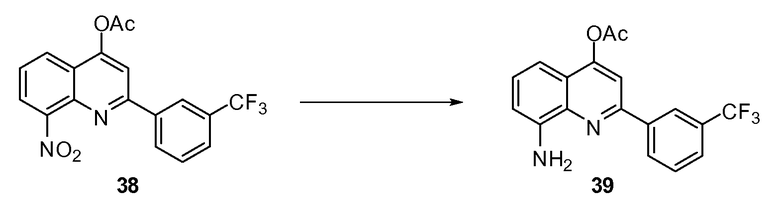
Pd/C (300 мг) добавляли к раствору 8-нитро-2-(3-(трифторметил)фенил)хинолин-4-илацетата 38 (2,11 ммоль) в этилацетате (10 мл). Через реакционную смесь барботировали газообразный водород в течение 10 минут и затем перемешивали реакционную смесь при давлении водорода 1 атм в течение 16 часов. Катализатор отфильтровывали через 10 г оксида кремния. Удаляли под вакуумом растворители с получением соединения 39 (400 мг, 55% выход для обеих стадий).
Стадия 5. Получение 8-(пиразин-2-карбоксамидо)-2-(3- (трифторметил)фенил)хинолин-4-илацетата (41):
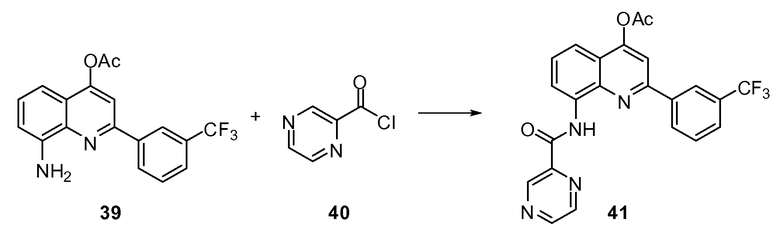
Пиразин-2-карбонилхлорид 40 (100 мг) добавляли к раствору 8-амино-2-(3-(трифторметил)фенил)хинолин-4-илацетата 39 (50 мг, 0,145 ммоль) и триэтиламина (0,20 мл) в дихлорметане (3 мл). Реакционную смесь перемешивали при 40°C в течение 16 часов. Реакционную смесь выливали в разбавленный раствор NaHCO3 (10 мл) и экстрагировали 3×30 мл дихлорметана. Объединенные органические слои сушили (MgSO4) и растворитель удаляли под вакуумом. Неочищенный остаток очищали жидкостной хроматографией среднего давления (97:3 дихлорметан:метанол) с получением соединения 41 (33 мг, 50% выход).
Стадия 6. Получение N-(4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-8-ил)пиразин-2-карбоксамида (Соединение 409):
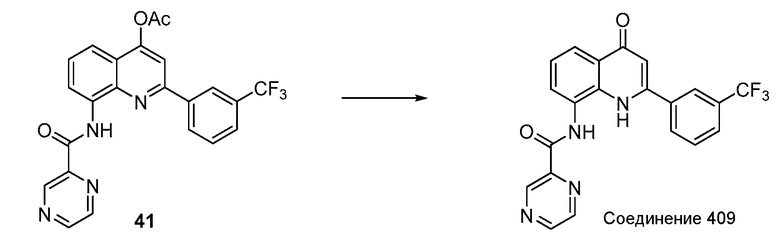
Раствор 8-(пиразин-2-карбоксамидо)-2-(3-(трифторметил)фенил)хинолин-4-илацетата 41 (33 мг, 0,073 ммоль) в THF (2 мл) и 1N NaOH (0,5 мл) нагревали при 60°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли 1N HCl (5 мл). Полученный осадок отфильтровывали, промывали 3 мл H2O и сушили под вакуумом с получением соединения 409 (21 мг, 70% выход). MS (ESI) вычислено для C21H13F3N4O2: 410,10; обнаружено: 411 [M+H].
Пример 11. Синтез 4-оксо-N-(пиридин-2-ил)-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-8-карбоксамида (Соединение 401):
Стадия 1. Получение метил 4-оксо-2-(3-(трифторметил)фенил)-4H-бензо[d][1,3]оксазин-8-карбоксилата (42):
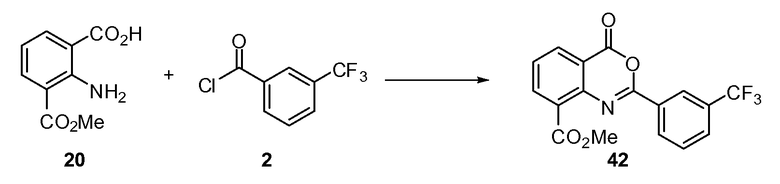
К раствору 2-амино-3-(метоксикарбонил)бензойной кислоты 20 (1,16 г, 5,94 ммоль) в пиридине (10 мл) добавляли 3-трифторметилбензоилхлорид 2 (0,90 мл, 5,94 ммоль). Реакционную смесь перемешивали в течение 16 часов, выливали в насыщенный водный раствор NaHCO3 (50 мл), экстрагировали дихлорметаном (3×50 мл), и объединенные органические слои сушили (MgSO4) и концентрировали. Добавляли толуол (10 мл) и раствор концентрировали под вакуумом. Неочищенный остаток очищали жидкостной хроматографией среднего давления, элюируя с помощью смеси пентан/EtOAc (10-50%), с получением соединения 42 (1,45 г, 70% выход).
Стадия 2. Получение 3-этил 8-метил 4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-3,8-дикарбоксилата (43):
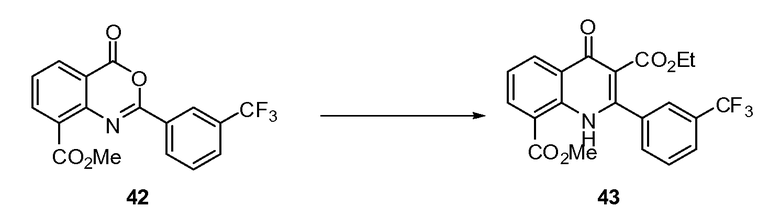
н-BuLi (4,4 мл, 2,5 M в гексанах, 11,0 ммоль) добавляли к раствору диизопропиламина (1,57 мл, 11,2 ммоль) в THF (30 мл) при -78°C. После перемешивания в течение 20 минут добавляли EtOAc (1,09 мл, 11,2 ммоль). Раствор перемешивали при -78°C в течение 10 минут, подогревали до 0°C, перемешивали в течение 10 минут, затем опять охлаждали до -78°C. К реакционной смеси добавляли в течение 5 минут раствор 4-оксо-2-(3-(трифторметил)фенил)-4H-бензо[d][1,3]оксазин-8-карбоксилата 42 (2,00 г, 5,72 ммоль) в THF (50 мл) и продолжали перемешивание при -78°C в течение 1 часа. Затем реакционную смесь подогревали до комнатной температуры в течение 2 часов. Добавляли MeOH (50 мл), затем твердый NaOMe (1,62 г, 30 ммоль) и реакционную смесь интенсивно перемешивали в течение 12 часов при комнатной температуре. Раствор концентрировали до суммарного объема 20 мл под вакуумом, добавляли H2O (100 мл) и смесь экстрагировали с помощью этилацетата (2×100 мл). Объединенные органические слои сушили (MgSO4) и концентрировали под вакуумом. Неочищенный остаток очищали жидкостной хроматографией среднего давления, элюируя смесью пентан/EtOAc (10-50%) с получением соединения 43 (950 мг, 39% выход).
Стадия 3. Получение 4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-8-карбоновой кислоты (44):
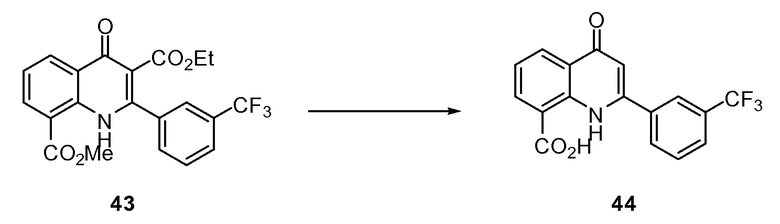
В сосуд емкостью 20 мл для проведения реакций с помощью микроволнового излучения загружали 3-этил 8-метил 4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-3,8-дикарбоксилат 43 (820 мг, 1,96 ммоль), диоксан (8 мл) и 1N HCl (4 мл). Реакционную смесь нагревали в микроволновом реакторе при 200°C в течение 25 минут, затем концентрировали досуха под вакуумом с получением соединения 44 (585 мг, 90% выход).
Стадия 4. Получение 4-оксо-N-(пиридин-2-ил)-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-8-карбоксамида (Соединение 401)
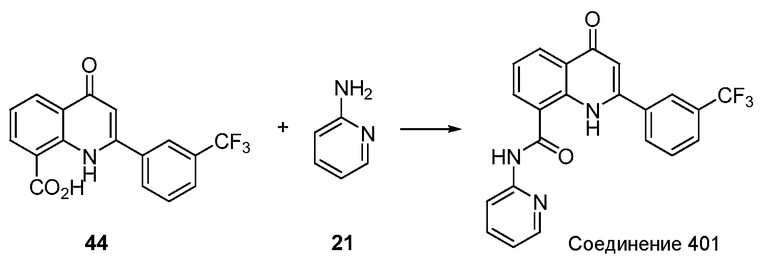
Смесь 4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидрохинолин-8-карбоновой кислоты 44 (250 мг, 0,750 ммоль), HATU (570 мг, 1,5 ммоль), 2-аминопиридин 21 (141 мг, 1,5 ммоль) и диизопропилэтиламин (392 мкл, 2,25 ммоль) в DMAC (5 мл) нагревали при 75°C в течение 16 часов. Реакционную смесь выливали в H2O (25 мл) и полученный осадок отфильтровывали. Неочищенный остаток очищали жидкостной хроматографией среднего давления с получением соединения 401 (102 мг, 33% выход). MS (ESI) вычислено для C22H14F3N3O2: 409,10; обнаружено: 410 [M+H].
Пример 12. Синтез 4-оксо-N-(тиазол-2-ил)-2-(3-(трифторметил)фенил)-1,4-дигидро-1,6-нафтиридин-8-карбоксамида (Соединение 449):
Стадия 1. Получение 4-амино-5-бромникотиновой кислоты (46):
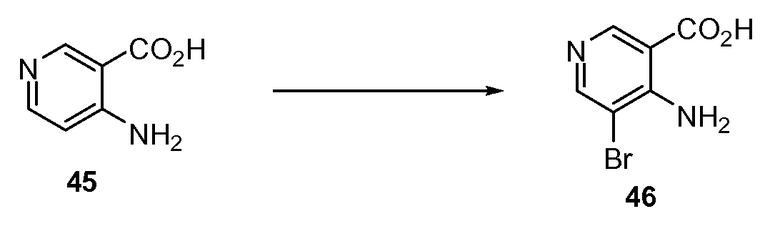
В пробирку с крышкой загружали 4-аминоникотиновую кислоту 45 (8,00 г, 57,9 ммоль), уксусную кислоту (75 мл) и воду (75 мл). Реакционную смесь нагревали при 75°C и интенсивно перемешивали до образования гомогенного раствора. После охлаждения до 50°C добавляли бром (10,0 мл, 195 ммоль) и продолжали перемешивание в течение 16 часов. После охлаждения до 0°C полученный оранжевый осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 46 (10,5 г, 84% выход).
Стадия 2. Получение 8-бром-2-(3-(трифторметил)фенил)-4H-пиридо[4,3-d][1,3]оксазин-4-она (47):
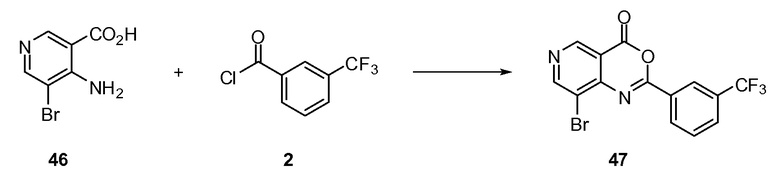
Смесь 5-бром-4-аминоникотиновой кислоты 46 (10,5 г, 48,4 ммоль) и пиридина (60 мл) нагревали при 60°C до образования гомогенного раствора. Добавляли 3-(трифторметил)бензоилхлорид 2 (8,0 мл, 53,0 ммоль) и продолжали перемешивание в течение 2 часов. Добавляли H2O (200 мл) и смесь охлаждали до 0°C. Полученный желтый осадок отфильтровывали, промывали H2O (100 мл), затем пентаном (100 мл), и сушили под вакуумом с получением соединения 47 (8,50 г, 47% выход).
Стадия 3. Получение этил 8-бром-4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидро-1,6-нафтиридин-3-карбоксилата (48):

Смесь THF (15 мл) и диизопропиламина (1,40 мл, 10,0 ммоль) охлаждали до -78°C, и добавляли н-BuLi (4,0 мл, 2,5 M в гексанах, 10,0 ммоль). После перемешивания при -78°C в течение 20 минут добавляли этилацетат (1,0 л, 10,2 ммоль) и перемешивание продолжали в течение 5 минут. Добавляли 8-бром-2-(3-(трифторметил)фенил)-4H-пиридо[4,3-d][1,3]оксазин-4-он 47 (990 мг, 2,67 ммоль). Через 1 час реакционную смесь постепенно подогревали до комнатной температуры. Добавляли 1N NaOH (15 мл), и реакционную смесь перемешивали в течение 24 часов. Смесь выливали в рассол (50 мл), экстрагировали этилацетатом (2×50 мл), сушили (MgSO4) и концентрировали под вакуумом. Полученное твердое вещество очищали жидкостной хроматографией среднего давления с получением соединения 48 (910 мг, 77% выход).
Стадия 4. Получение 4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидро-1,6-нафтиридин-8-карбоновой кислоты (49):

Смесь этил 8-бром-4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидро-1,6-нафтиридин-3-карбоксилата 48 (910 мг, 2,06 ммоль), ацетата палладия (22,4 мг, 0,100 ммоль), XPhos (48,8 мг, 0,102 ммоль), цианида меди(I) (450 мг, 5,02 ммоль) и карбоната натрия (636 мг, 6,00 ммоль) в DMF (7,0 мл) нагревали при 120°C в течение 16 часов. После охлаждения до комнатной температуры смесь выливали в метанол (100 мл), фильтровали через целит и концентрировали под вакуумом. Неочищенный остаток растворяли в диоксане (10 мл) и 1N HCl (5 мл). Реакционную смесь нагревали при 190°C в течение 50 минут в микроволновом реакторе. Летучие компоненты удаляли под вакуумом и остаток повторно растворяли в метаноле (10 мл) и 1N NaOH (5 мл). Этот раствор нагревали в микроволновом реакторе при 160°C в течение 1,5 часов, после чего добавляли 6N HCl (5 мл). Полученный осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением соединения 49 (400 мг, 58% выход.)
Стадия 5. Получение 4-оксо-N-(тиазол-2-ил)-2-(3-(трифторметил)фенил)-1,4-дигидро-1,6-нафтиридин-8-карбоксамида (Соединение 449):
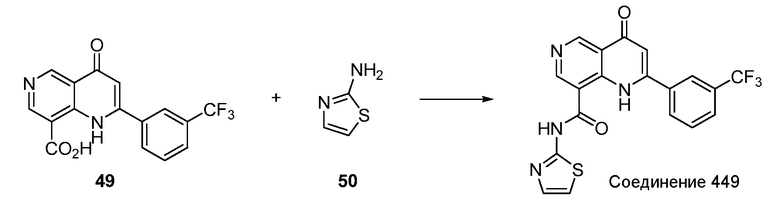
Смесь 4-оксо-2-(3-(трифторметил)фенил)-1,4-дигидро-1,6-нафтиридин-8-карбоновой кислоты 49 (100 мг, 0,299 ммоль) и карбонилдиимидазола (100 мг, 0,617 ммоль) в диоксане (2 мл) нагревали при 70°C в течение 1 часа. Добавляли 2-аминотиазол 50 (120 мг, 1,20 ммоль) и реакционную смесь перемешивали при 70°C в течение 16 часов. После охлаждения до комнатной температуры добавляли 1N HCl (5 мл), и полученный осадок отфильтровывали, промывали с помощью H2O (5 мл), и очищали препаративной высокоэффективной жидкостной хроматографией с получением соединения 449 в виде трифторацетатной соли (4,0 мг, 2,5% выход).
Дополнительные соединения изобретения синтезировали аналогичным образом путем реакции соответствующей карбоновой кислоты с соответствующим амином. Синтезы различных промежуточных соединений амина и карбоновой кислоты, из которых получают соединения этого изобретения, приведены в примерах 13-51 ниже.
Пример 13. Синтез 2-(дифторметил)бензоилхлорида 54:
Стадия 1. Получение метил 2-(дифторметил)бензоата (52):
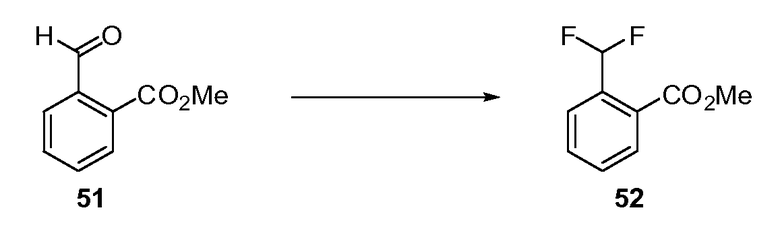
Раствор метил 2-формилбензоата 51 (10 г, 61 ммоль) и [бис-(2-метоксиэтил)амино]трифторида серы (40,4 г, 183 ммоль) в CH2Cl2 кипятили с обратным холодильником в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры, концентрировали и распределяли между EtOAc (500 мл) и H2O (300 мл). Добавляли NaHCO3 для корректировки значения pH до 8. Органическую фазу отделяли, промывали рассолом, сушили и концентрировали. Остаток очищали флэш-хроматографией с получением соединения 52 (7 г, 62% выход)
Стадия 2. Получение 2-(дифторметил)бензойной кислоты (53):
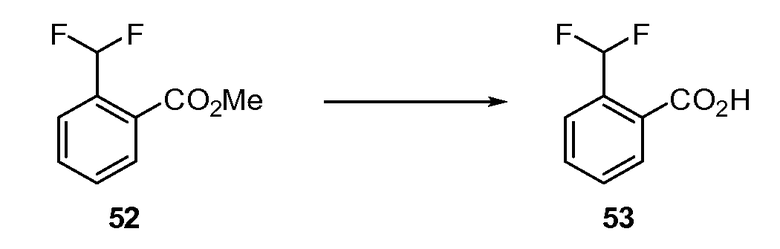
Смесь метил 2-(дифторметил)бензоата 52 (7 г, 38 ммоль) и 10% водного раствора NaOH (100 мл) в MeOH (50 мл) кипятили с обратным холодильником в течение 30 минут. Корректировали pH до 4 добавлением 3N HCl. Полученное твердое вещество отфильтровывали, промывали H2O и сушили с получением соединения 53 (6 г, 93% выход).
Стадия 3. Получение 2-(дифторметил)бензоилхлорида (54):

Раствор 2-(дифторметил)бензойной кислоты 53 (1,8 г, 10 ммоль) в тионилхлориде (25 мл) кипятили с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали и сушили под вакуумом с получением соединения 54. Неочищенный хлорангидрид использовали без дополнительной очистки.
Пример 14. Синтез 3-(дифторметил)бензоилхлорида (56):
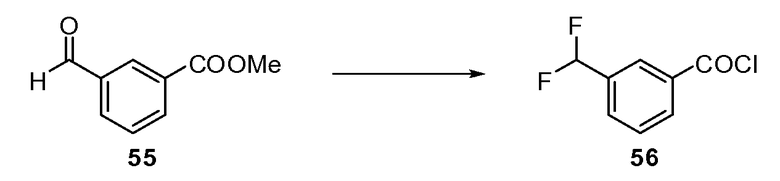
Соединение 56 получали с помощью методики, аналогичной методике, описанной для 2-(дифторметил)бензоилхлорида 54, с 32% выходом.
Пример 15. Синтез 6-((2,2-диметил-1,3-диоксолан-4-ил)метокси)пиколиновой кислоты (59):
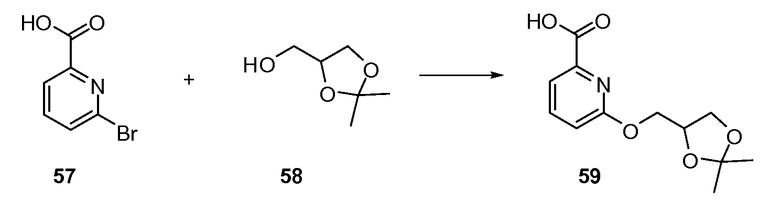
Солькеталь 58 (23,5 г, 178 ммоль) добавляли к суспензии NaH (7,1 г, 178 ммоль, 60% масс. дисперсия в минеральном масле) в THF (400 мл), охлажденной до 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и добавляли 6-бромпиколиновую кислоту 57 (12 г, 59,4 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры добавляли H2O (50 мл) и корректировали pH до 3 добавлением 3N HCl. Смесь выливали в рассол и экстрагировали EtOAc. Объединенные органические слои сушили (Na2SO4) и концентрировали. Неочищенный продукт перекристаллизовывали из смеси пентан/EtOAc с получением соединения 59 (10 г, 66% выход). Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 16. Синтез 2-((2,2-диметил-1,3-диоксолан-4-ил)метокси)никотиновой кислоты (61):
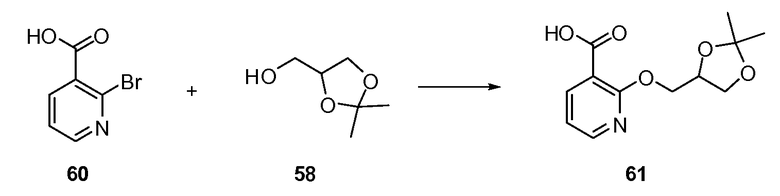
Соединение 61 получали с помощью методики, аналогичной методике, описанной для 6-((2,2-диметил-1,3-диоксолан-4-ил)метокси)пиколиновой кислоты 59 с 23% выходом. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 17. Синтез 6-(морфолинометил)пиколиновой кислоты 65:
Стадия 1. Получение 4-((6-бромпиридин-2-ил)метил)морфолина (64):
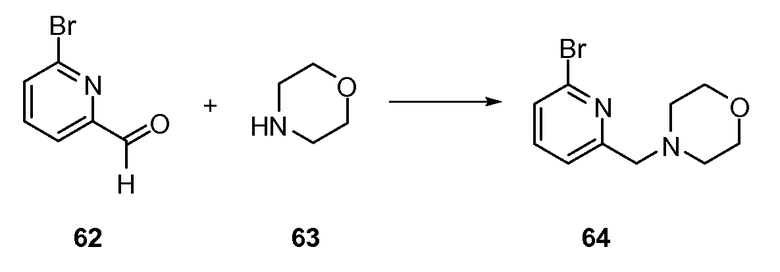
NaBH(OAc)3 (68,5 г, 0,323 моль) добавляли к раствору 6-бромпиколинальдегида 62 (40 г, 0,22 моль) и морфолина 63 (20,9 г, 0,24 моль) в 1,2-дихлорэтане (500 мл). Смесь перемешивали при комнатной температуре в течение 16 часов. Добавляли насыщенный раствор NaHCO3 (500 мл) и смесь экстрагировали EtOAc, промывали рассолом, сушили (Na2SO4) и концентрировали под вакуумом. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью петролейный эфир:этилацетат (10:1) с получением соединения 64 (38 г, 68% выход).
Стадия 2. Получение 6-(морфолинометил)пиколиновой кислоты (65):
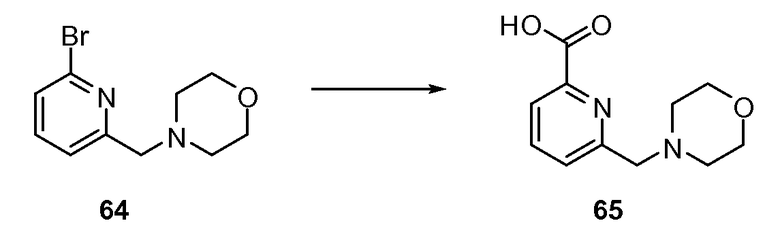
н-BuLi (56 мл, 0,140 моль) в THF добавляли к раствору 4-((6-бромпиридин-2-ил)метил)морфолина 64 (30 г, 0,12 моль) в THF (500 мл) при -78°C. Смесь перемешивали в течение 30 минут и через реакционную смесь барботировали CO2 (газ) в течение 30 минут. Летучие компоненты удаляли под вакуумом и остаток экстрагировали смесью CH2Cl2/MeOH (1:1). Растворитель выпаривали и остаток промывали CH2Cl2 с получением соединения 65 (11,0 г, 42% выход).
Пример 18. Синтез 6-(пирролидин-1-илметил)пиколиновой кислоты 70:
Стадия 1. Получение метил 6-(хлорметил)пиколината (67):
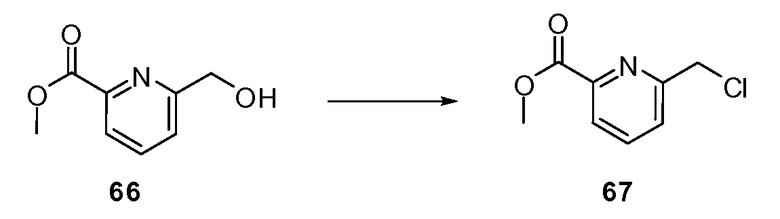
SOCl2 (57 г, 0,48 моль) добавляли к раствору метил 6-(гидроксиметил)пиколината 66 (40,0 г, 0,239 моль) (Chem. Eur. J. 2006, 12, 6393-6402) в дихлорметане (500 мл) при комнатной температуре. Смесь перемешивали при 40°C в течение 1 часа, и добавляли насыщенный водный раствор K2CO3 для корректировки величины pH до 9. Смесь экстрагировали CH2Cl2, и объединенные органические слои промывали рассолом, сушили (Na2SO4) и концентрировали под вакуумом с получением соединения 67 (45 г).
Стадия 2. Получение метил 6-(пирролидин-1-илметил)пиколината (69):
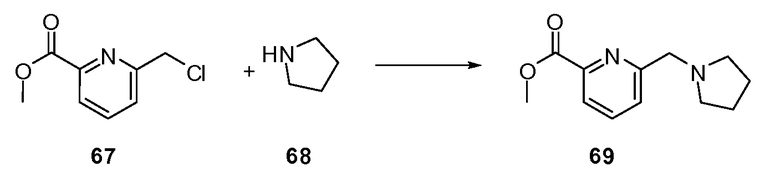
K2CO3 (66 г, 0,48 моль) добавляли к раствору метил 6-(хлорметил)пиколината 67 (45,0 г) и пирролидина 68 (34 г, 0,48 моль) в DMF (300 мл). Реакционную смесь нагревали при 80°C в течение 12 часов. Добавляли H2O (300 мл) и смесь экстрагировали с помощью EtOAc. Объединенные органические слои промывали рассолом, сушили (Na2SO4) и концентрировали под вакуумом с получением соединения 69 (36 г).
Стадия 3. Получение 6-(пирролидин-1-илметил)пиколиновой кислоты (70):
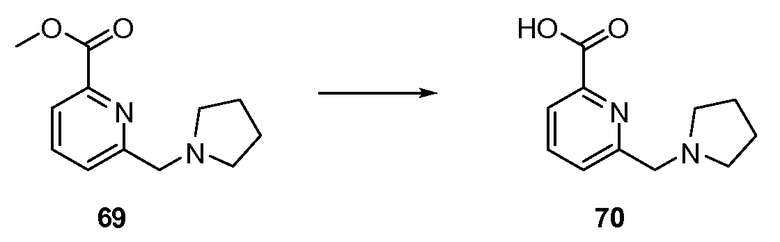
Смесь метил 6-(пирролидин-1-илметил)пиколината 69 (36 г) и NaOH (40 г, 1,0 моль) в смеси этанол/H2O (320 мл) перемешивали при 75°C в течение 16 часов. pH корректировали до 7 3N HCl и экстрагировали EtOAc. Водный слой концентрировали досуха и экстрагировали смесью дихлорметан/метанол (3:1 по объему). Органический слой сушили с получением соединения 70 (27 г, 55% выход).
Пример 19. Синтез N-метилпролина 72:
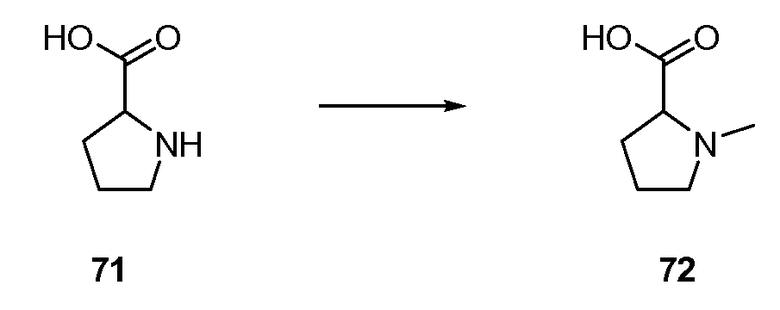
Соединение 72 получали с помощью методики, аналогичной методике, описанной в публикации J. Org. Chem. 2003, 66, 2652.
Пример 20. Синтез 1-метил-5-оксопирролидин-2-карбоновой кислоты 73:

Соединение 73 получали с помощью методики, аналогичной методике, описанной в публикации J. Heterocyclic. Chem. 1991, 28, 1143.
Пример 21. Синтез 3-(морфолинометил)анилина 74:
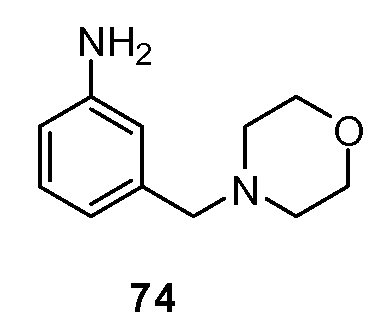
Соединение 74 получали с помощью методики, аналогичной методике, описанной в J. Med. Chem. 1990, 33(1), 327-36.
Пример 22. Синтез 6-(пирролидин-1-илметил)пиридин-2-амина 81:
Стадия 1. Получение этил 6-аминопиколината (76):
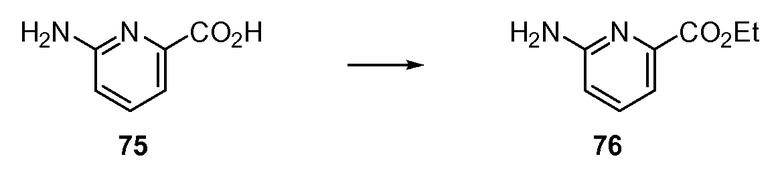
К раствору 2-амино-6-пиридинкарбоновой кислоты 75 (6,0 г, 43,5 ммоль) в этаноле (150 мл) добавляли тионилхлорид (12,0 г, 101 ммоль) при 0°C. Полученную реакционную смесь перемешивали при кипячении с обратным холодильником в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали под пониженным давлением. Добавляли насыщенный водный раствор Na2CO3 до тех пор, пока величина pH раствора не достигала 9. Смесь концентрировали под пониженным давлением и к полученному остатку добавляли дихлорметан (150 мл). Смесь интенсивно перемешивали при комнатной температуре в течение 30 минут и затем фильтровали. Фильтрат концентрировали под пониженным давлением с получением соединения 76 (5,5 г, 76% выход).
Стадия 2. Получение этил 6-(трет-бутоксикарбониламино)пиколината (77):
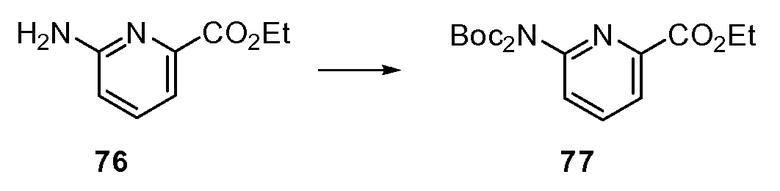
К раствору этил 6-аминопиколината 76 (5,5 г, 33 ммоль) в трет-BuOH (120 мл) и ацетоне (40 мл) добавляли 4-диметиламинопиридин (0,08 г, 0,66 ммоль) и ди-трет-бутилдикарбонат (10,8 г, 49,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Растворитель удаляли путем концентрирования под пониженным давлением и добавляли смесь гексан/дихлорметан (180 мл, 3:1). Полученную смесь охлаждали до -20°C в течение 2 часов. Полученные твердые вещества отфильтровывали и сушили с получением соединения 77 (11,0 г, 91% выход).
Стадия 3. Получение трет-бутил 6-(гидроксиметил)пиридин-2-илкарбамата (78):
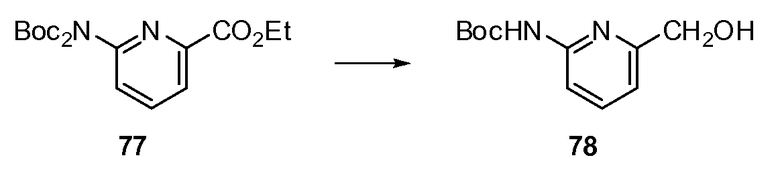
К перемешиваемому раствору этил 6-(бис(трет-бутоксикарбонил)амино)пиколината 77 (11,0 г, 33 ммоль) в THF (120 мл) в атмосфере азота добавляли LiAlH4 (3,80 г, 100 ммоль) в THF (60 мл) в течение 30 минут при 0°C. Реакционную смесь перемешивали при 0°C в течение 6 часов и останавливали реакцию путем осторожного добавления H2O (2,0 мл) и 10% раствора NaOH (4,0 мл) при 0°C. Реакционную смесь фильтровали и фильтрат сушили (Na2SO4) и концентрировали под пониженным давлением. Полученный остаток очищали хроматографией (1:1 петролейный эфир:этилацетат) с получением соединения 78 (3,0 г, 41% выход).
Стадия 4. Получение (6-(трет-бутоксикарбониламино)пиридин-2-ил)метил метансульфоната (79):
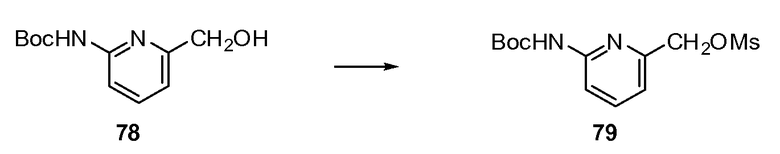
К раствору трет-бутил 6-(гидроксиметил)пиридин-2-илкарбамата 78 (3,0 г, 13,4 ммоль) и диизопропилэтиламина (5,0 г, 40 ммоль) в ацетонитриле (30 мл) добавляли метансульфонилхлорид (2,0 г, 17,4 ммоль) в течение 30 минут при 0°C и смесь перемешивали в течение 2 часов при комнатной температуре. Реакцию останавливали путем добавления насыщенного водного раствора NaHCO3 и экстрагировали этилацетатом (3×60 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4) и концентрировали под пониженным давлением с получением неочищенного соединения 79 с количественным выходом.
Стадия 5. Получение трет-бутил 6-(пирролидин-1-илметил)пиридин-2-илкарбамата (80):
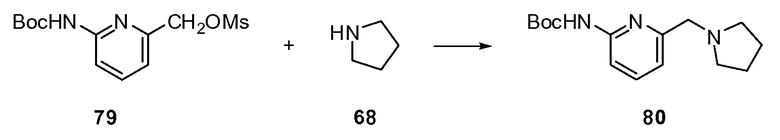
Смесь (6-(трет-бутоксикарбониламино)пиридин-2-ил)метил метансульфоната 79 (1,30 г, 3,2 ммоль), пирролидина 68 (0,46 г, 6,4 ммоль) и K2CO3 (1,30 г, 9,6 ммоль) в ацетонитриле (15 мл) перемешивали при комнатной температуре в течение 12 часов. Добавляли насыщенный водный раствор NaHCO3, смесь концентрировали под пониженным давлением. Полученный водный слой экстрагировали EtOAc. Объединенные органические слои сушили (Na2SO4) и концентрировали под пониженным давлением с получением соединения 80 (0,75 г, 62% выход).
Стадия 6. Получение 6-(пирролидин-1-илметил)пиридин-2-амина (81):
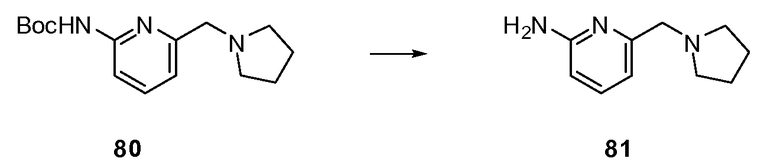
К раствору трет-бутил 6-(пирролидин-1-илметил)пиридин-2-илкарбамата 80 (750 мг, 2,71 ммоль) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (4,0 мл) при комнатной температуре. Полученную реакционную смесь перемешивали при комнатной температуре в течение 6 часов и затем концентрировали под пониженным давлением. К полученному остатку добавляли насыщенный водный раствор Na2CO3 до тех пор, пока значение pH раствора не достигало 9. Затем смесь экстрагировали с помощью этилацетата (3×25 мл). Объединенные органические слои сушили с помощью Na2SO4 и концентрировали под пониженным давлением с получением соединения 81 (440 мг, 92% выход).
Пример 23. Синтез 6-(морфолинометил)пиридин-2-амина 82:
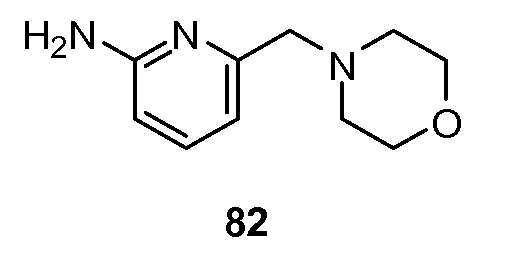
Соединение 82 получали с помощью методики, аналогичной методике, описанной для 6-(пирролидин-1-илметил)пиридин-2-амина 81.
Пример 24. Синтез (R)-6-((3-фторпирролидин-1-ил)метил)пиридин-2-амина 83:
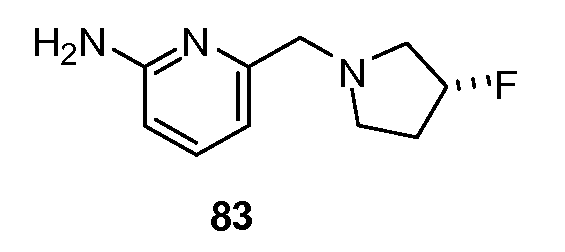
Соединение 83 получали с помощью методики, аналогичной методике, описанной для 6-(пирролидин-1-илметил)пиридин-2-амина 81.
Пример 25. Синтез (S)-6-((3-фторпирролидин-1-ил)метил)пиридин-2-амина 84:
Соединение 84 получали с помощью методики, аналогичной методике, описанной для 6-(пирролидин-1-илметил)пиридин-2-амина 81.
Пример 26. Синтез 6-(пиперазин-1-илметил)пиридин-2-амина 85:
Соединение 85 получали с помощью методики, аналогичной методике, описанной для 6-(пирролидин-1-илметил)пиридин-2-амина 81.
Пример 27. Синтез трет-бутил 4-((6-аминопиридин-2-ил)метил)пиперазин-1-карбоксилата 86:
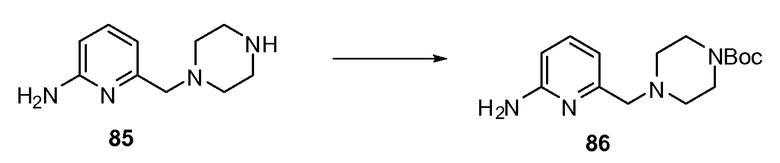
К раствору 6-(пиперазин-1-илметил)пиридин-2-амина 85 в THF добавляли ди-трет-бутилкарбонат (1 экв.) и 4-(диметил)аминопиридин (каталитическое количество). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Затем ее концентрировали под пониженным давлением. Добавляли пентан, и полученное твердое вещество отфильтровывали и сушили с получением соединения 86. Защитная группа Boc может быть удалена после реакции сочетания с соответствующей карбоновой кислотой путем обработки TFA/CH2Cl2 в течение 12 часов.
Пример 28. Синтез 4-(морфолинометил)тиазол-2-амин трифторацетата 91:
Стадия 1. Получение этил 2-(трет-бутоксикарбониламино)тиазол-4-карбоксилата (88):
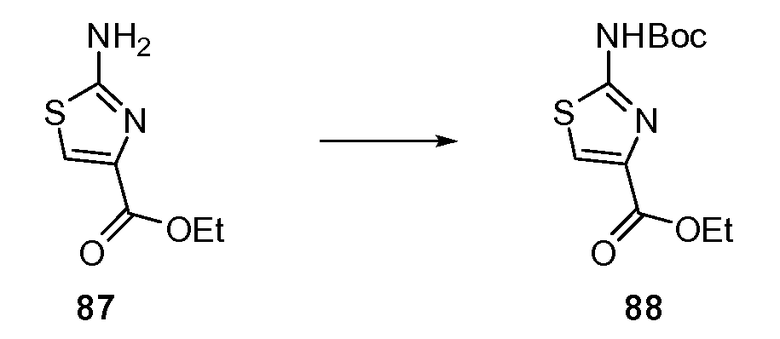
Этил 2-аминотиазол-4-карбоксилат 87 (10,0 г, 58,1 ммоль) помещали в 150 мл безводного THF вместе с ди-трет-бутилкарбонатом (12,67 г, 58,1 ммоль) и 4-(диметил)аминопиридином (DMAP) (10 мг, 0,082 ммоль). Реакционную смесь перемешивали при 50°C в течение 4 часов и затем при комнатной температуре в течение 18 часов. Затем ее концентрировали под пониженным давлением с получением вязкого масла. Добавляли пентан и полученные кристаллические вещества отфильтровывали и сушили с получением соединения 88 (10,5 г, 66% выход).
Стадия 2. Получение трет-бутил 4-(гидроксиметил)тиазол-2-илкарбамата (89):
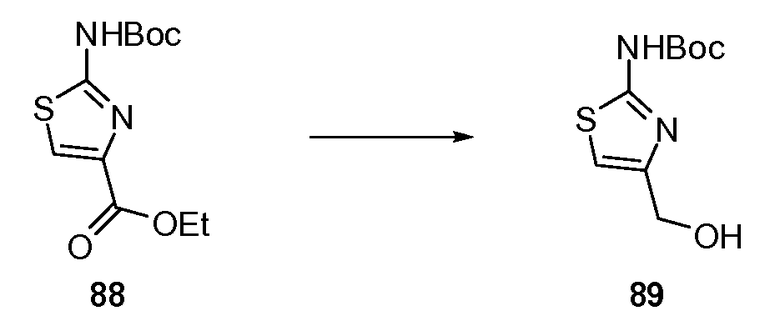
Этил 2-(трет-бутоксикарбониламино)тиазол-4-карбоксилат 88 (10,5 г, 38,6 ммоль) растворяли в 300 мл безводного THF и охлаждали на бане сухой лед-ацетонитрил. Затем добавляли раствор 1M Super Hydride™ в THF (85 мл) в течение 10 минут. Полученную реакционную смесь перемешивали при -45°C в течение 2 часов. Затем добавляли еще одну порцию 1M Super Hydride™ в THF (35 мл) и реакционную смесь перемешивали в течение еще 2 часов при -45°C. Реакцию останавливали при -45°C добавлением 50 мл рассола. После подогревания до комнатной температуры реакционную смесь концентрировали под пониженным давлением. Полученную смесь экстрагировали с помощью EtOAc. Объединенные органические слои промывали рассолом, сушили Na2SO4 и концентрировали под пониженным давлением. Полученный остаток очищали хроматографией с получением соединения 89 (6,39 г, 72% выход).
Стадия 3. Получение трет-бутил 4-(морфолинометил)тиазол-2-илкарбамата (90):

Трет-бутил 4-(гидроксиметил)тиазол-2-илкарбамат 89 (2,00 г, 8,68 ммоль) помещали в 25 мл CH2Cl2 вместе с Et3N (1,82 мл, 13,05 ммоль) и охлаждали до 0°C. Добавляли метансульфонилхлорид (0,85 мл, 10,88 ммоль) и полученную реакционную смесь перемешивали при 0°C в течение 60 минут. Затем добавляли морфолин 63 (3,0 мл, 35 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали под пониженным давлением. Полученный остаток помещали в EtOAc и промывали разбавленным водным раствором NaHCO3, рассолом, сушили Na2SO4 и концентрировали под пониженным давлением. Это вещество очищали путем фильтрации через короткую колонку с силикагелем. Фильтрат концентрировали с получением соединения 90 (1,88 г, 69% выход).
Стадия 4. Получение 4-(морфолинометил)тиазол-2-амин трифторацетата (91):
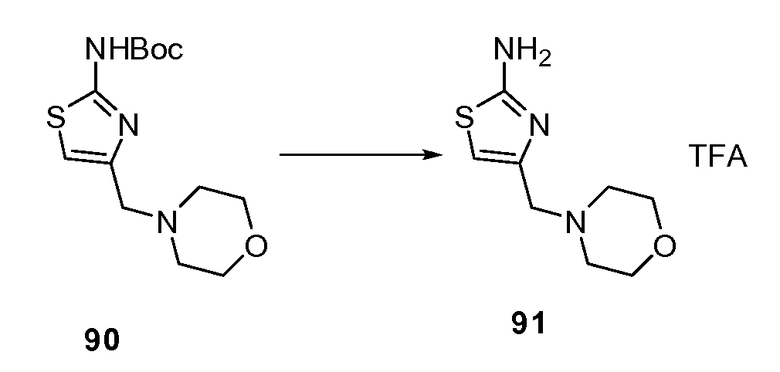
Трет-бутил 4-(морфолинометил)тиазол-2-илкарбамат 90 (1,88 г, 6,28 ммоль) обрабатывали с помощью 20 мл 25% трифторуксусной кислоты в CH2Cl2 в течение 18 часов при комнатной температуре. Затем был удален растворитель путем концентрирования и сушки под вакуумом, полученный остаток обрабатывали смесью пентан/EtOAc с получением соединения 91 (1,96 г, 100% выход) в виде белого твердого вещества.
Пример 29. Синтез 4-(пирролидин-1-илметил)тиазол-2-амин трифторацетата 92:

Соединение 92 получали с помощью методики, аналогичной методике, описанной для 4-(морфолинометил)тиазол-2-аминтрифторацетата 91.
Пример 30. Синтез 5-(морфолинометил)тиазол-2-аминтрифторацетата 93:
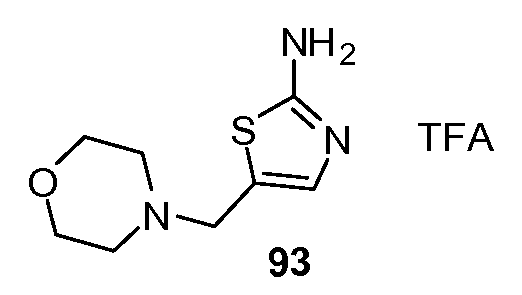
Соединение 93 получали с помощью методики, аналогичной методике, описанной для 4-(морфолинометил)тиазол-2-аминтрифторацетата 91.
Пример 31. Синтез 5-(пирролидин-1-илметил)тиазол-2-аминтрифторацетата 94:

Соединение 94 получали с помощью методики, аналогичной методике, описанной для 4-(морфолинометил)тиазол-2-аминтрифторацетата 91.
Пример 32. Синтез 4-(пиперазин-1-илметил)тиазол-2-аминтрифторацетата 95:
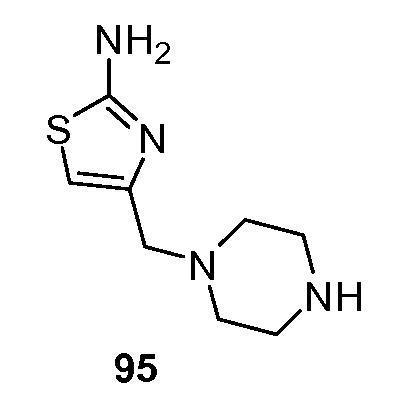
Соединение 95 получали с помощью методики, аналогичной методике, описанной для 4-(морфолинометил)тиазол-2-аминтрифторацетата 91.
Пример 33. Синтез трет-бутил 4-((2-аминотиазол-4-ил)метил)пиперазин-1-карбоксилата 96:
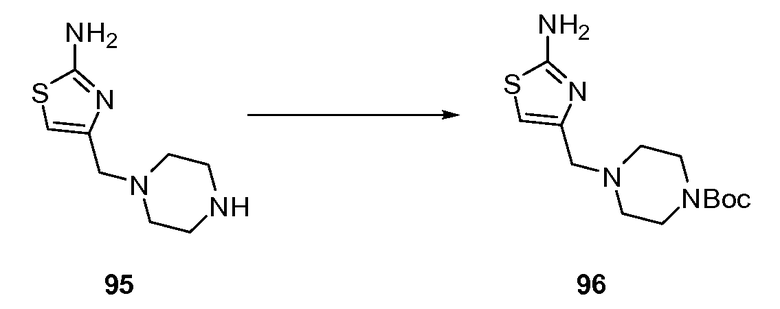
Соединение 96 получали с помощью методики, аналогичной методике, описанной для трет-бутил 4-((6-аминопиридин-2-ил)метил)пиперазин-1-карбоксилата 86. Защитная группа Boc может быть удавлена после реакции сочетания с соответствующей карбоновой кислотой путем обработки смесью TFA/CH2Cl2 в течение 12 часов.
Пример 34. Синтез 2-((2,2-диметил-1,3-диоксолан-4-ил)метокси)пиримидин-4-амина 98:
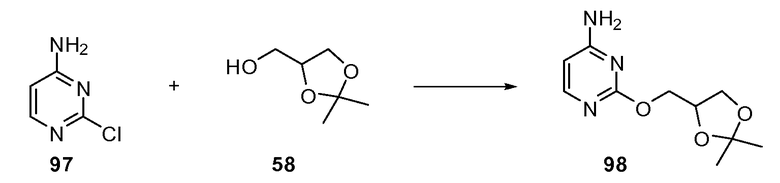
К раствору солькеталя 58 (34,4 г, 260 ммоль) в THF (150 мл) добавляли NaH (10,4 г, 260 ммоль) при комнатной температуре и смесь перемешивали в течение 1 часа. Затем добавляли 2-хлор-4-аминопиримидин 97 (15,0 г, 115 ммоль) и смесь перемешивали при 70°C в течение 48 часов. Реакционную смесь концентрировали и неочищенный остаток очищали флэш-хроматографией (дихлорметан:метанол = 15:1-10:1) с получением соединения 98 (18,2 г, 70% выход) в виде масла. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 35. Синтез 6-((2,2-диметил-1,3-диоксолан-4-ил)метокси)пиразин-2-амина 99:
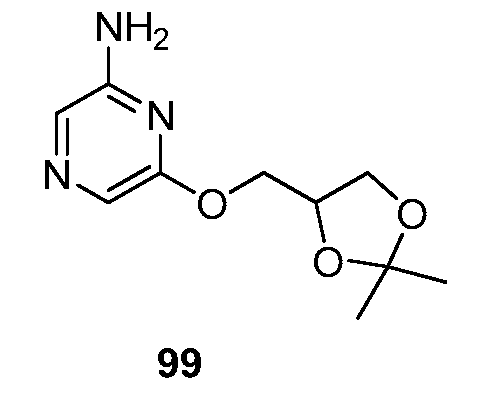
Соединение 99 получали с помощью методики, аналогичной методике, описанной для 2-((2,2-диметил-1,3-диоксолан-4-ил)метокси)пиримидин-4-амина 98. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 36. Синтез (S)-6-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-аминопиридина 100:
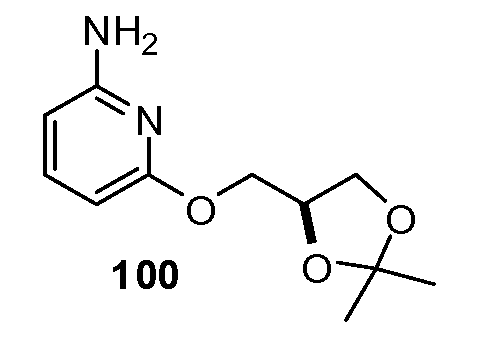
Соединение 100 получали с помощью методики, аналогичной методике, описанной для 2-((2,2-диметил-1,3-диоксолан-4-ил)метокси)пиримидин-4-амина 98. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 37. Синтез (R)-6-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-аминопиридина 101:
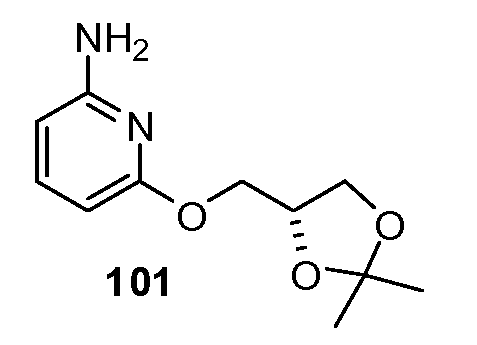
Соединение 101 получали с помощью методики, аналогичной методике, описанной для 2-((2,2-диметил-1,3-диоксолан-4-ил)метокси)пиримидин-4-амина 98. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 38. Синтез (R)-3-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина 105:
Стадия 1. Получение (R)-2,2-диметил-4-((3-нитрофенокси)метил)-1,3-диоксолана (104):
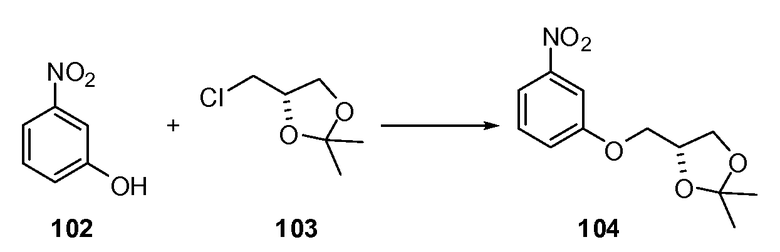
Смесь 3-нитрофенола 102 (2,00 г, 14,4 ммоль), карбоната калия (4,96 г, 35,9 ммоль) и (5)-4-(хлорметил)-2,2-диметил-1,3-диоксолана 103 (2,55 мл, 18,7 ммоль) в DMF (20 мл) нагревали в микроволновом реакторе при 160°C в течение 4 часов. Неочищенную реакционную смесь выливали в H2O и экстрагировали с помощью дихлорметана (3×15 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали под пониженным давлением. Неочищенный остаток очищали хроматографией, используя этилацетат:пентан, с получением (R)-2,2-диметил-4-((3-нитрофенокси)метил)-1,3-диоксолана 104 (1,90 г, 52% выход) в виде масла янтарного цвета.
Стадия 2. Получение (R)-3-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина (105):
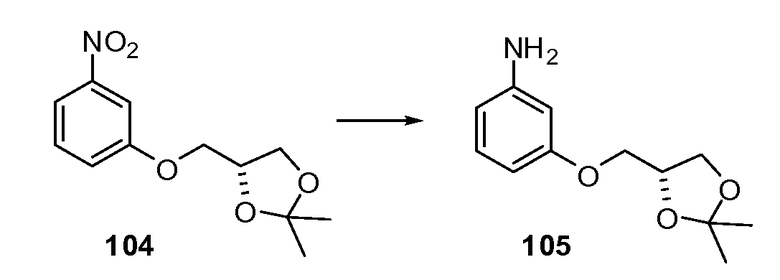
Смесь порошка Fe (2,38 г, 42,5 ммоль), NH4Cl (2,27 г, 42,5 ммоль) и (R)-2,2-диметил-4-((3-нитрофенокси)метил)-1,3-диоксолана 104 (1,80 г, 7,09 ммоль) в изопропаноле (30 мл)/H2O (10 мл) кипятили с обратным холодильником в течение 18 часов. Неочищенное вещество фильтровали через слой целита и фильтрат концентрировали под пониженным давлением. Полученный водный слой экстрагировали с помощью дихлорметана (3×15 мл). Объединенные органические слои сушили Na2SO4 и концентрировали под пониженным давлением с получением соединения 105 (1,25 г, 76% выход). Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 39. Синтез 3-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина 106:
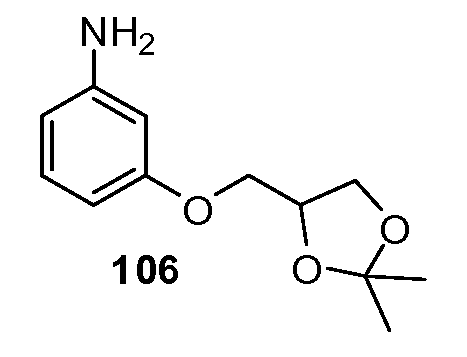
Соединение 106 получали с помощью методики, аналогичной методике, описанной для (R)-3-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина 105. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 40. Синтез (S)-3-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина 107:
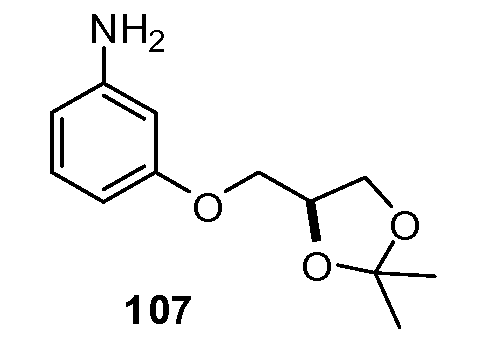
Соединение 107 получали с помощью методики, аналогичной методике, описанной для (R)-3-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина 105. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 41. Синтез 4-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина 108:
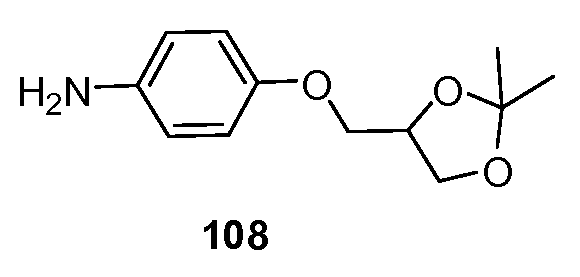
Соединение 108 получали с помощью методики, аналогичной методике, описанной для (R)-3-((2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина 105. Ацетонидная защитная группа может быть удалена после реакции сочетания с соответствующим анилином путем обработки EtOH/3N HCl (4:1) при кипячении с обратным холодильником в течение 12 часов.
Пример 42. Синтез 2-(пирролидин-1-ил)пиридин-4-амина 110:
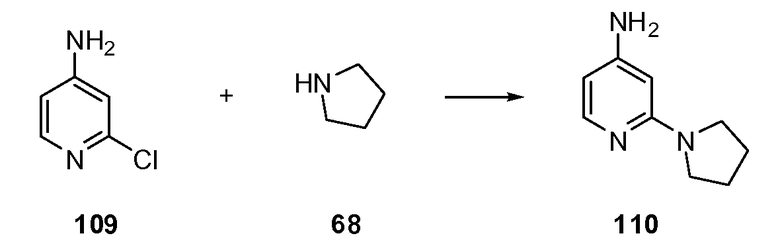
Смесь 2-хлор-4-аминопиридина 109 (2,29 г, 17,8 ммоль) и пирролидина 68 (5,0 мл) нагревали при 200°C в микроволновом реакторе в течение 10 минут. После охлаждения до комнатной температуры твердое вещество отфильтровывали и промывали с помощью дихлорметана (10 мл×3). Осадок на фильтре растворяли в водном растворе K2CO3 и экстрагировали CH2Cl2 (40 мл×3). Объединенные органические слои сушили над Na2SO4 и концентрировали с получением соединения 110 (2,30 г, 79% выход).
Пример 43. Синтез 2-морфолинопиридин-4-амина 111:
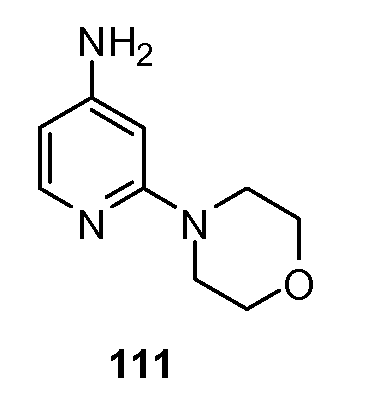
Соединение 111 получали с помощью методики, аналогичной методике, описанной для 2-(пирролидин-1-ил)пиридин-4-амина 110.
Пример 44. Синтез 6-морфолинопиридин-2-амина 112:
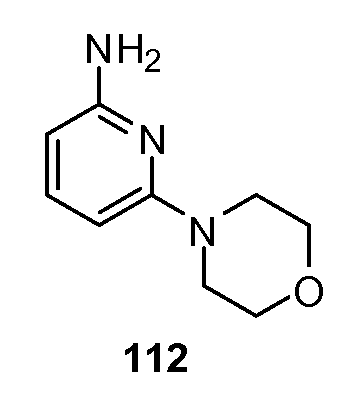
Соединение 112 получали с помощью методики, аналогичной методике, описанной для 2-(пирролидин-1-ил)пиридин-4-амина 110.
Пример 45. Синтез 6-(пирролидин-1-ил)пиридин-2-амина 35:
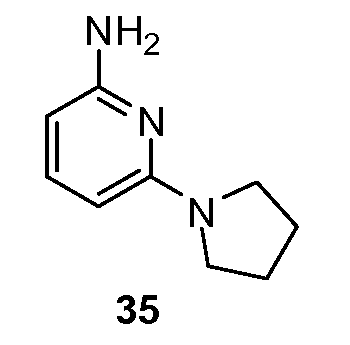
Соединение 35 получали с помощью методики, аналогичной методике, описанной для 2-(пирролидин-1-ил)пиридин-4-амина 110.
Пример 46. Синтез (S)-5-((3-фторпирролидин-1-ил)метил)пиридин-2-амина 120:
Стадия 1. Получение этил 6-аминоникотината (114):
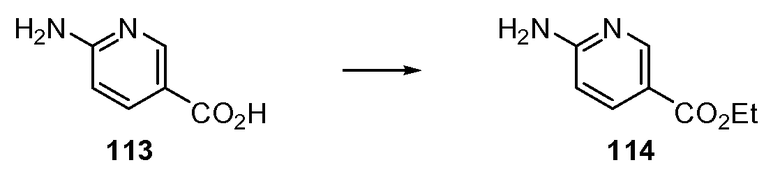
К раствору 2-амино-5-пиридинкарбоновой кислоты 113 (150 г, 1,09 моль) в этаноле (2 л) добавляли тионилхлорид (259 г, 2,18 моль) при 0°C. Смесь кипятили с обратным холодильником в течение 12 часов. Растворитель удаляли под пониженным давлением. Добавляли насыщенный водный раствор Na2CO3 для корректировки величины pH до 9, и полученное твердое вещество отфильтровывали, промывали H2O и сушили с получением соединения 114 (160 г, 88% выход).
Стадия 2. Получение этил 6-(бис(трет-бутоксикарбонил)амино)никотината (115):
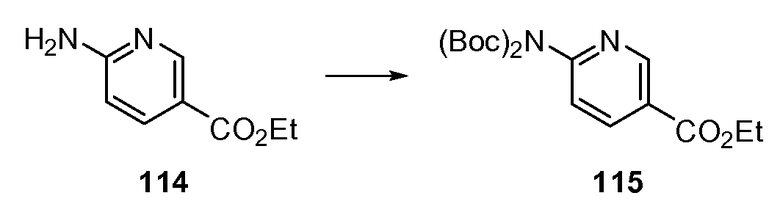
К раствору этил 6-аминоникотината 114 (160 г, 963 ммоль) в трет-BuOH (1,7 л) и ацетоне (560 мл) добавляли DMAP (2,38 г, 19,1 ммоль) и ди-трет-бутилкарбонат (420 г, 1,92 моль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли и добавляли гексан/дихлорметан (2,5 л, 3:1). Смесь охлаждали до -20°C в течение 2 часов. Твердое вещество отфильтровывали и сушили под вакуумом с получением соединения 115 (300 г, 85% выход).
Стадия 3. Получение трет-бутил 5-(гидроксиметил)пиридин-2-илкарбамата (116):
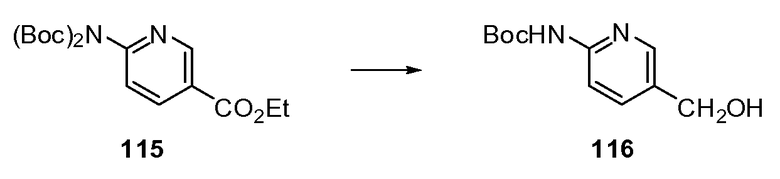
К перемешиваемому раствору этил 6-(бис(трет-бутоксикарбонил)амино)никотината 115 (300 г, 819 ммоль) в THF (1,2 л) добавляли LiAlH4 (57,6 г, 1,51 моль) в THF (3 л) в течение 30 минут при 0°C. Реакционную смесь перемешивали в течение 6 часов и добавляли H2O (30,0 мл) и 10% раствор NaOH (60,0 мл). Твердые вещества отфильтровывали и фильтрат сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали флэш-хроматографией (CH2Cl2:MeOH = 40:1) с получением соединения 116 (85,0 г, 46% выход).
Стадия 4. Получение трет-бутил 5-(хлорметил)пиридин-2-илкарбамата (117):
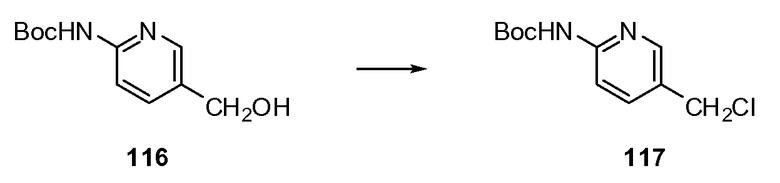
К раствору трет-бутил 5-(гидроксиметил)пиридин-2-илкарбамата 116 (85,0 г, 379 ммоль) и диизопропилэтиламина (296 г, 2,27 моль) в THF (850 мл) добавляли метансульфонилхлорид (130 г, 1,14 моль) в течение 30 минут при 0°C. Смесь перемешивали в течение 12 часов при комнатной температуре, затем промывали H2O (2×100 мл) и сушили над Na2SO4. Смесь концентрировали и неочищенный остаток очищали флэш-хроматографией (петролейный эфир:этилацетат=10:1) с получением соединения 117 (30 г, 63% выход).
Стадия 5. Получение (S)-трет-бутил 5-((3-фторпирролидин-1-ил)метил)пиридин-2-илкарбамата (119):
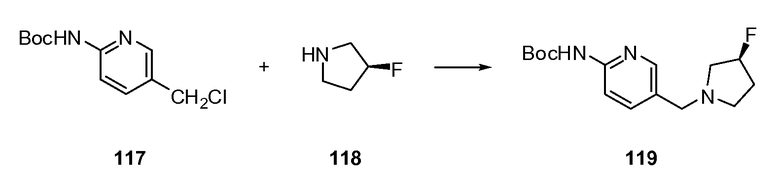
Смесь трет-бутил 5-(хлорметил)пиридин-2-илкарбамата 117 (9,5 г, 39,1 ммоль), (S)-3-фторпирролидина 118 (4,19 г, 47,0 ммоль), карбоната калия (16,2 г, 117 ммоль) и йодида натрия (0,586 г, 3,91 ммоль) в DMF (150 мл) перемешивали при 60°C в течение 2 часов. Реакционную смесь фильтровали и фильтрат концентрировали под вакуумом. Добавляли H2O (250 мл) и полученное твердое вещество отфильтровывали, промывали H2O и сушили с получением соединения 119 (7,00 г, 61% выход).
Стадия 6. Получение (S)-5-((3-фторпирролидин-1-ил)метил)пиридин-2-амина (120):
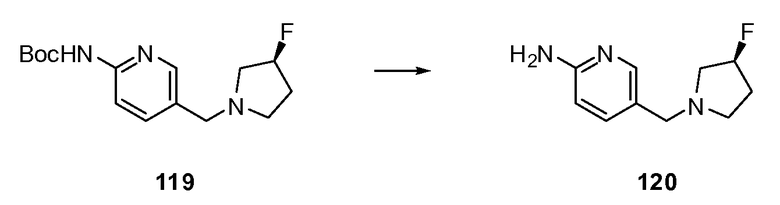
К раствору (S)-трет-бутил 5-((3-фторпирролидин-1-ил)метил)пиридин-2-илкарбамата 119 (7,00 г, 23,7 ммоль) в дихлорметане (70 мл) добавляли TFA (15,5 г, 142 ммоль). Смесь перемешивали в течение 12 часов при комнатной температуре. Растворитель удаляли под вакуумом и добавляли насыщенный водный раствор Na2CO3. Смесь экстрагировали дихлорметаном, сушили (MgSO4) и концентрировали с получением соединения 120 (4,50 г, 97% выход).
Пример 47. Синтез 5-(морфолинометил)пиридин-3-амина 121:
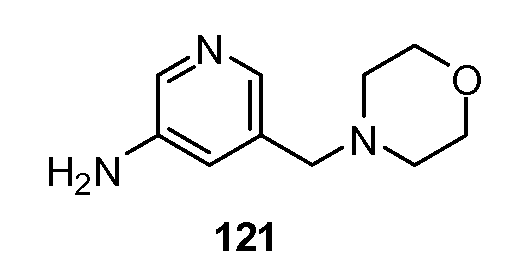
Соединение 121 получали с помощью методики, аналогичной методике, описанной для (S)-5-((3-фторпирролидин-1-ил)метил)пиридин-2-амина 120.
Пример 48. Синтез 6-(морфолинометил)пиридин-3-амина 122:
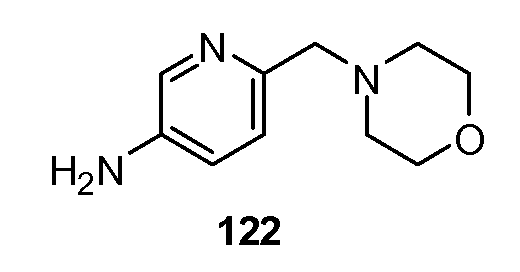
Соединение 122 получали с помощью методики, аналогичной методике, описанной для (S)-5-((3-фторпирролидин-1-ил)метил)пиридин-2-амина 120.
Пример 49. Синтез 2-(морфолинометил)пиримидин-4-амина 127:
Стадия 1. Получение дигидрохлорида 2-хлорацетимидамида (124):
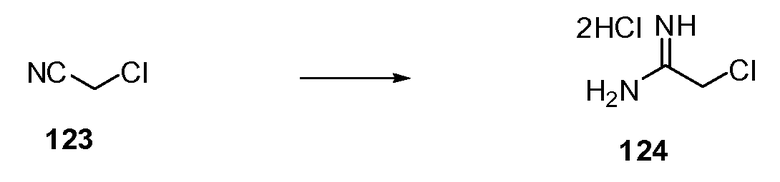
2-хлорацетонитрил 123 (300 г, 4,0 моль) добавляли к раствору натрия (10,0 г, 0,43 моль) в метаноле (1000 мл), поддерживая температуру ниже 20°C. Смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли NH4Cl (234 г, 4,37 моль) 5 порциями и продолжали перемешивание в течение еще 2 часов. Растворитель удаляли с получением соединения 124 (525 г, 79% выход), которое непосредственно использовали на следующей стадии без дополнительной очистки.
Стадия 2. Получение 2-(хлорметил)пиримидин-4-амина (126):
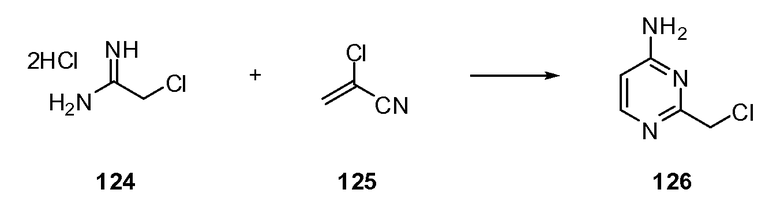
Раствор дигидрохлорида 2-хлорацетимидамида 124 (250,0 г, 1,51 моль), 2-хлоракрилонитрила 125 (171 г, 1,95 моль) и триэтиламина (490 г, 4,8 моль) в безводном этаноле (600 мл) кипятили с обратным холодильником в течение 30 минут. Растворитель удаляли под вакуумом и остаток очищали флэш-хроматографией (дихлорметан:метанол=30:1) с получением соединения 126 (39,0 г, 18% выход).
Стадия 3. Получение 2-(морфолинометил)пиримидин-4-амина (127):
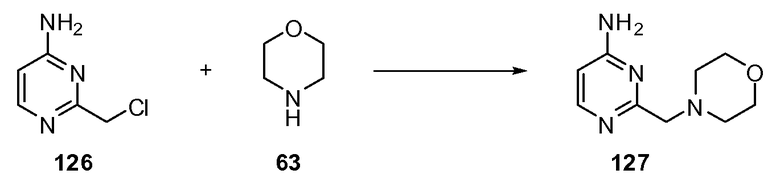
Раствор 2-(хлорметил)пиримидин-4-амина 126 (30,0 г, 209 ммоль), морфолина 63 (23,7 г, 272 ммоль) и триэтиламина (42,3 г, 418 ммоль) в безводном этаноле (250 мл) нагревали с обратным холодильником в течение 16 часов. Растворитель удаляли под вакуумом и добавляли метанол (400 мл), H2O (100 мл) и бикарбонат натрия (25,0 г). Перемешивание продолжали в течение 30 минут. Смесь концентрировали и очищали флэш-хроматографией (дихлорметан:метанол:триэтиламин=100:8:0,5) с получением соединения 127 (25,0 г, 62% выход).
Пример 50. Синтез трет-бутил 4-((4-аминопиримидин-2-ил)метил)пиперазин-1-карбоксилата 128:
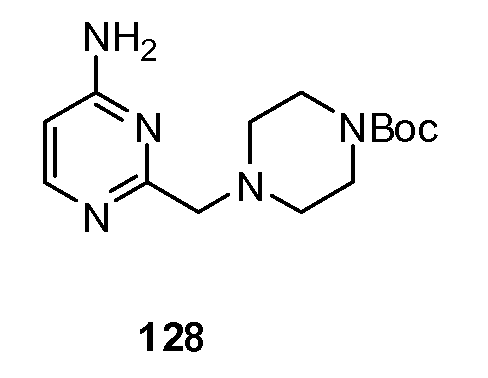
Соединение 128 получали с помощью методики, аналогичной методике, описанной для 2-(морфолинометил)пиримидин-4-амина 127. Защитная группа Boc может быть удалена после реакции сочетания с соответствующей карбоновой кислотой обработкой с TFA/CH2Cl2 в течение 12 часов.
Пример 51. Синтез 2-(пирролидин-1-илметил)пиримидин-4-амина 129:
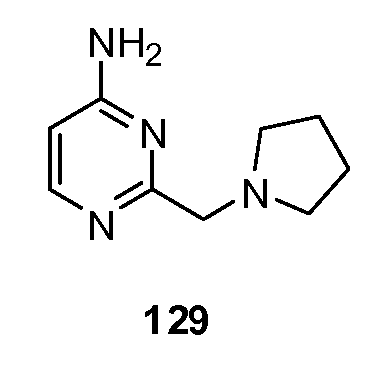
Соединение 129 получали с помощью методики, аналогичной методике, описанной для 2-(морфолинометил)пиримидин-4-амина 127.
Пример 52. Биологическая активность
Для выявления модуляторов активности SIRT1 использовали исследование на основе масс-спектрометрии. При исследовании на основе масс-спектрометрии применяют пептид, имеющий 20 следующих аминокислотных остатков: Ac-EE-K(биотин)-GQSTSSHSK(Ac)NleSTEG-K(5TMR)-EE-NH2 (SEQ ID NO: 1) где K(Ac) является ацетилированным лизиновым остатком и Nle является норлейцином. Пептид метят с помощью флуорофора 5TMR (возбуждение 540 нм/испускание 580 нм) на C-концах. Последовательность пептидного субстрата основывается на p53 с различными модификациями. Кроме того, метионинный остаток, по природе присутствующий в последовательности, заменяли на норлейцин, так как метионин может быть подвержен окислению в процессе синтеза и очистки.
Масс-спектрометрическое исследование проводят следующим образом: 0,5 мкМ пептидного субстрата и 120 мкМ βNAD+ инкубируют с 10 нМ SIRT1 в течение 25 минут при 25°C в реакционном буфере (50 мМ Tris-ацетат pH 8, 137 мМ NaCl, 2,7 мМ KCl, 1 мМ MgCl2, 5 мМ DTT, 0,05% BSA). Испытуемые соединения могут быть добавлены в описанную выше реакционную смесь. Ген SirT1 клонируют в T7-промотор, содержащий вектор, и трансформируют в BL21(DE3). После 25 минут инкубирования с SIRT1 добавляют 10 мкл 10% муравьиной кислоты для остановки реакции. Реакционные смеси герметизируют и замораживают для последующих масс-спектральных исследований. Определение массы пептидного субстрата позволяет точно определить степень ацетилирования (то есть исходного материала) по сравнению с деацетилированным пептидом (продуктом).
Контроль ингибирования активности сиртуина осуществляют путем добавления 1 мкл 500 мМ никотинамида в качестве негативного контроля в начале реакции (например, позволяет определить максимальное ингибирование сиртуина). Контроль активирования активности сиртуина осуществляют путем использования 10 нМ белка сиртуина с 1 мкл DMSO вместо соединения для определения степени деацетилирования субстрата в данный момент времени внутри линейной области исследования. Этот момент времени является таким же, как и момент времени, который используют для испытуемых соединений, и внутри линейной области конечная точка представляет изменение скорости.
Для приведенного выше исследования белок SIRT1 экспрессировали и очищали следующим образом. SirT1 ген клонировали в T7-промотор, содержащий вектор, и трансформировали в BL21(DE3). Белок экспрессировали путем индуцирования с помощью 1 мМ IPTG в качестве N-концевого гибридного белка His-tag при 18°C в течение ночи и собирали при 30000×g. Клетки лизировали с помощью лизозима в лизирующем буфере (50 мМ Tris-HCl, 2 мМ Tris[2-карбоксиэтил]фосфин (TCEP), 10 мкМ ZnCl2, 200 мМ NaCl) и затем обрабатывали ультразвуком в течение 10 минут для полного лизиса. Белок очищали на Ni-NTA колонке (Amersham), и фракции, содержащие чистый белок, объединяли, концентрировали и пропускали через классифицирующую колонку (Sephadex S200 26/60 global). Пик, содержащий растворимый белок, собирали и пропускали через ионообменную колонку (MonoQ). Градиентное элюирование (200 мМ - 500 мМ NaCl) давало чистый белок. Этот белок концентрировали и диализировали относительно диализного буфера (20 мМ Tris-HCl, 2 мМ TCEP) в течение ночи. Брали аликвоту белка и замораживали ее при -80°C до последующего использования.
С помощью описанного выше исследования были выявлены модулирующие сиртуин соединения, которые активировали SIRT1, и они приведены ниже в таблицах 1 и 2. Значения EC1,5 для активирующих соединений обозначены через A (EC1,5 <1,0 мкМ), B (EC1,5 1-25 мкМ), C (EC1,5 >25 мкМ). Процент максимального увеличения активации обозначен через A (увеличение активации >200%) или B (увеличение активации <200%).
Соединения, где W1 является -N= и W2 является N
№
мкМ
%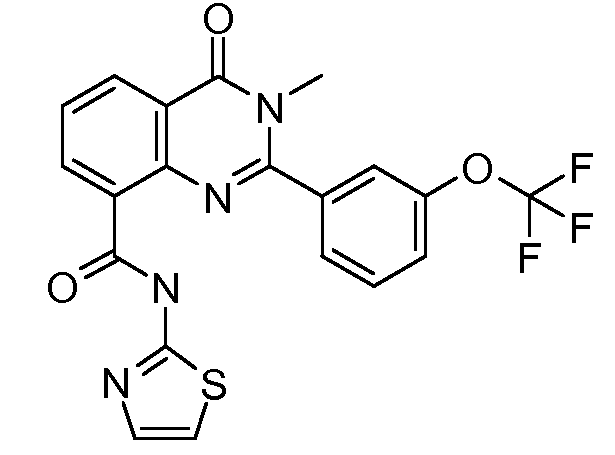
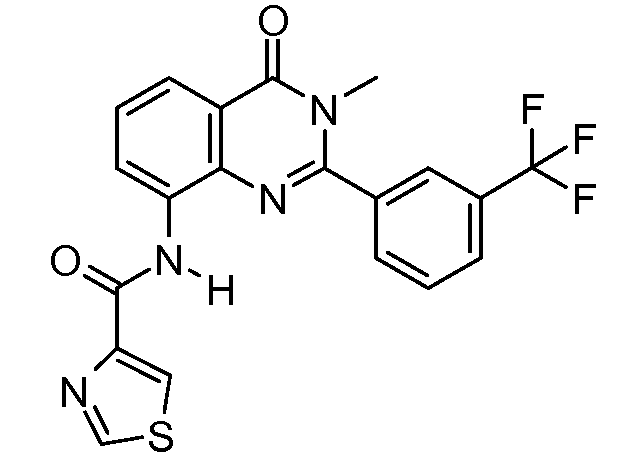
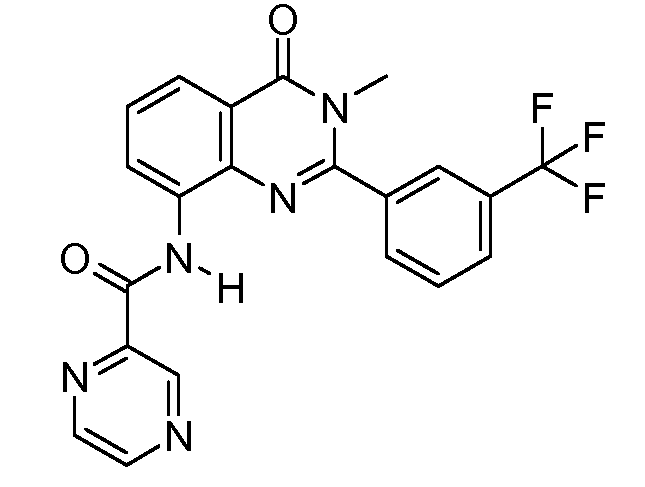
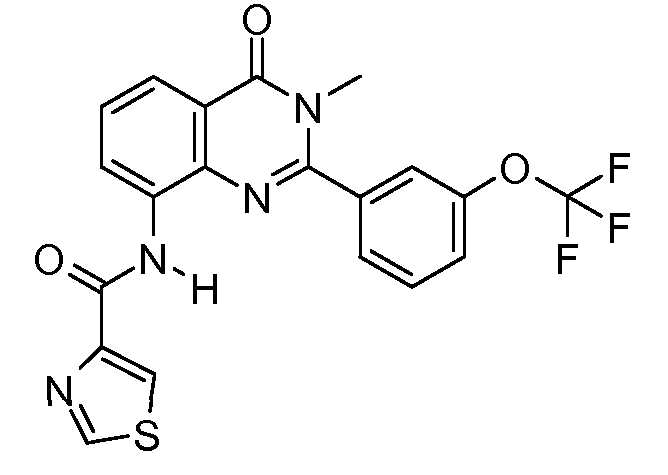
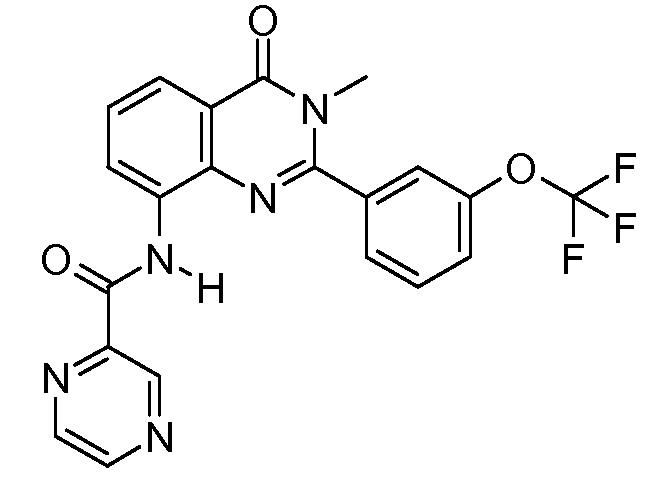

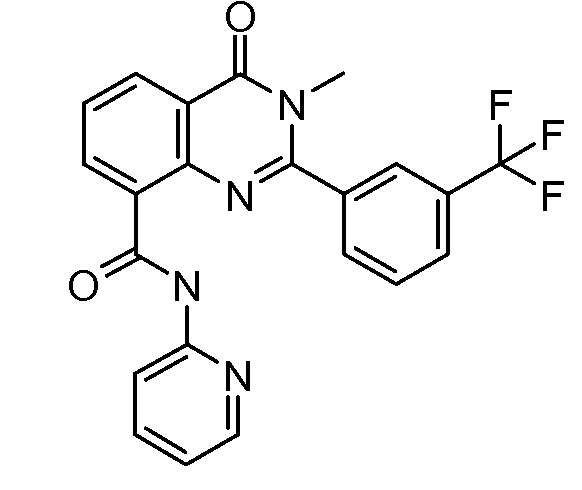
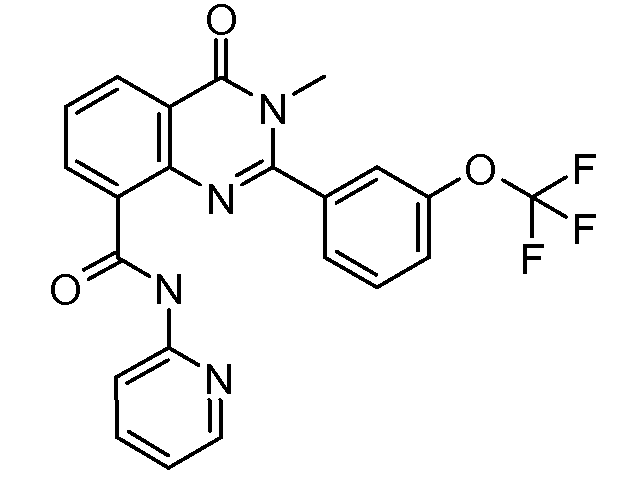
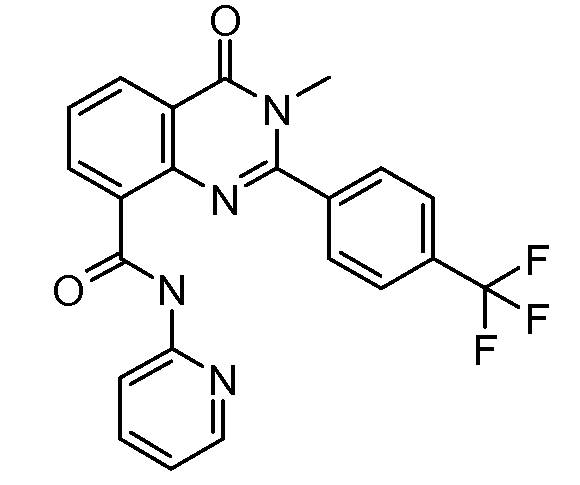
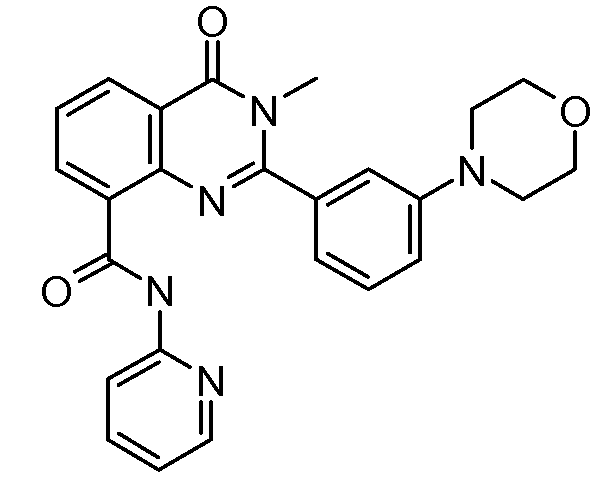
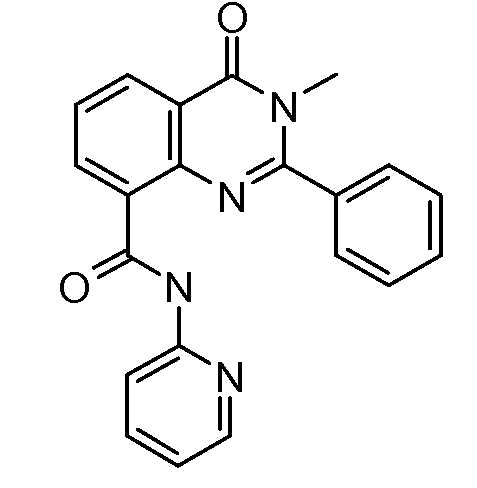

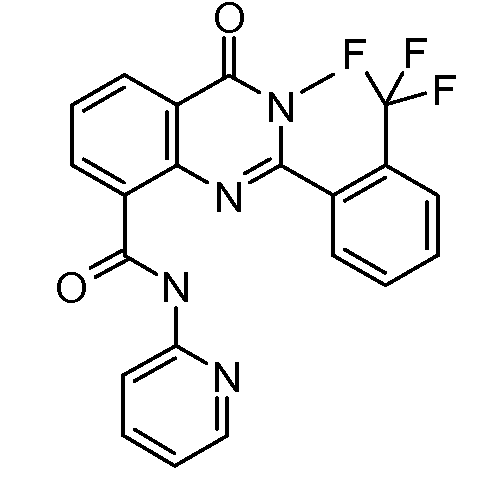
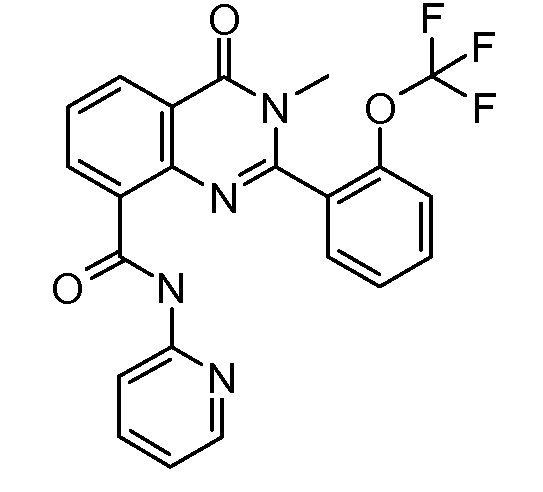
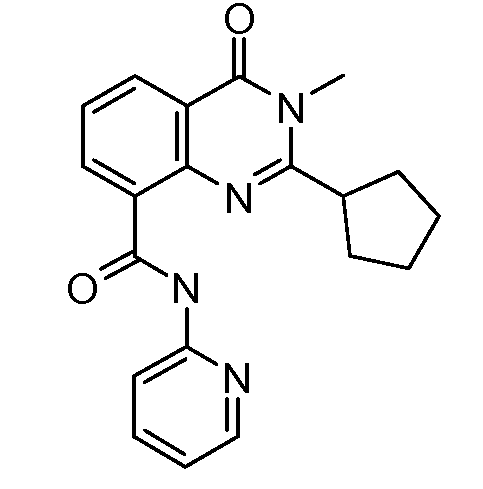
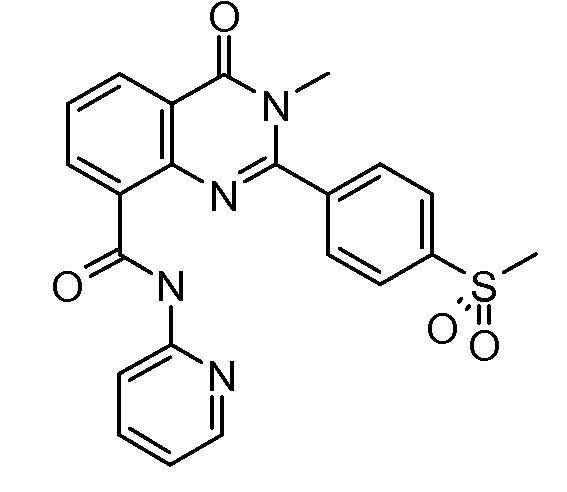
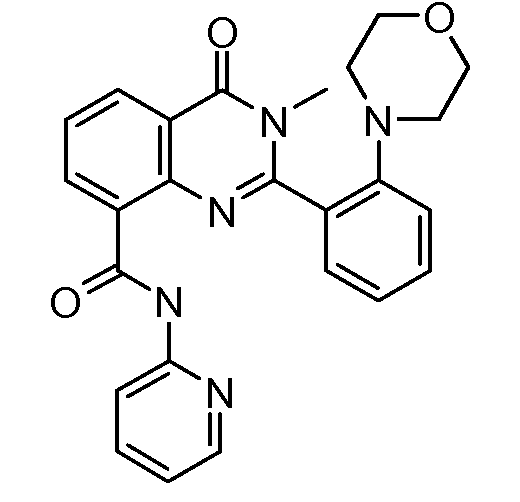
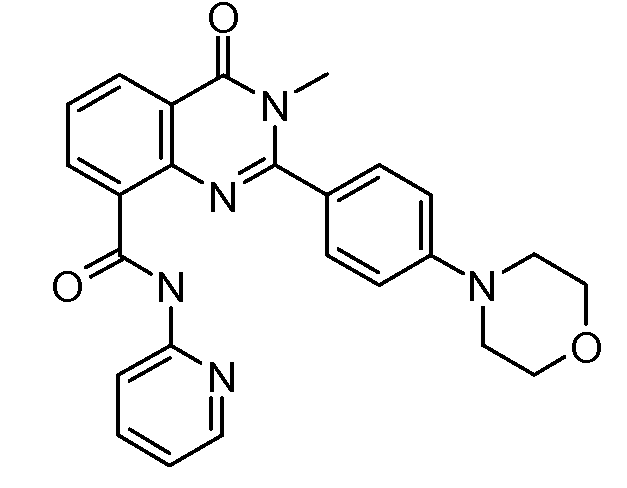
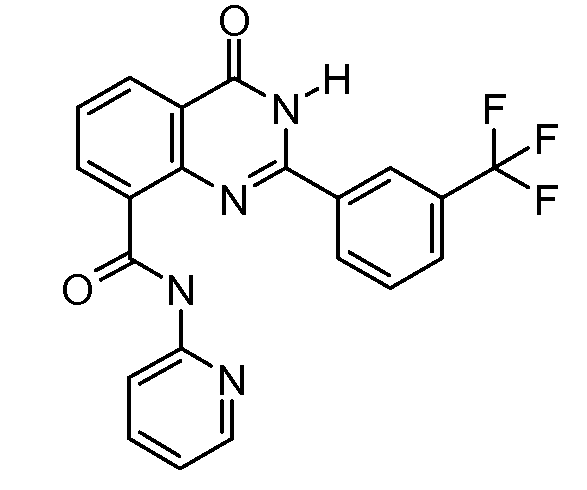
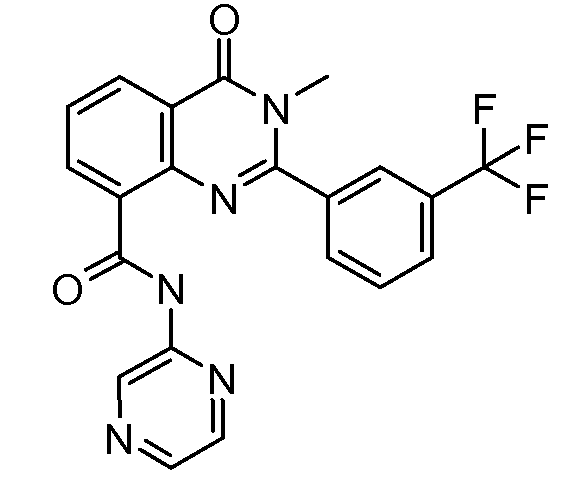
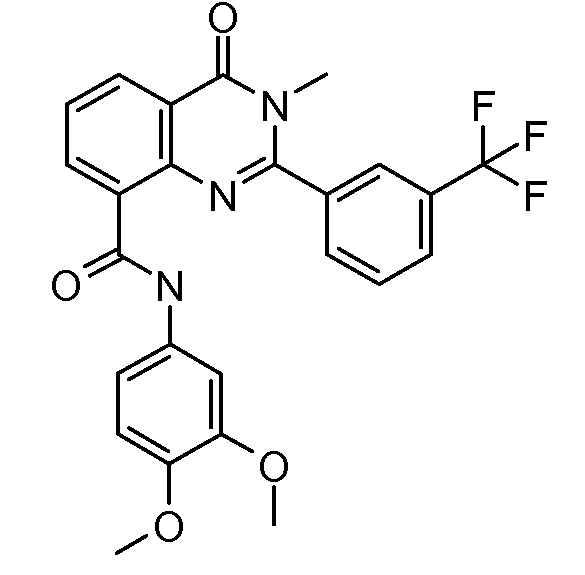
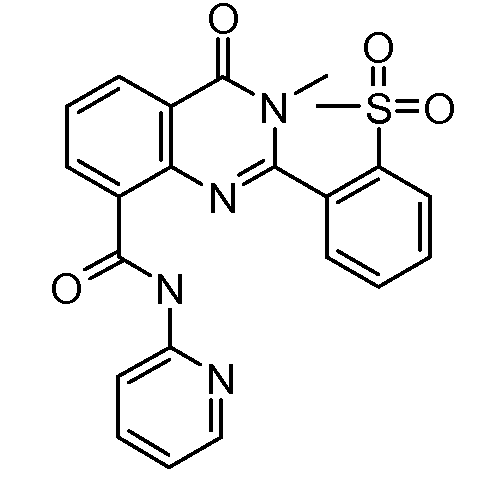
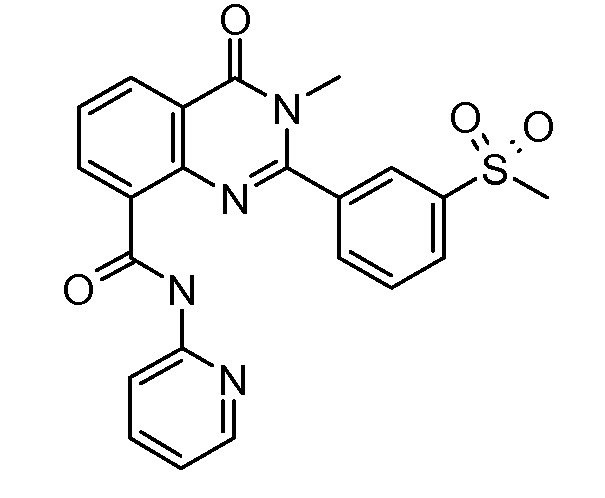
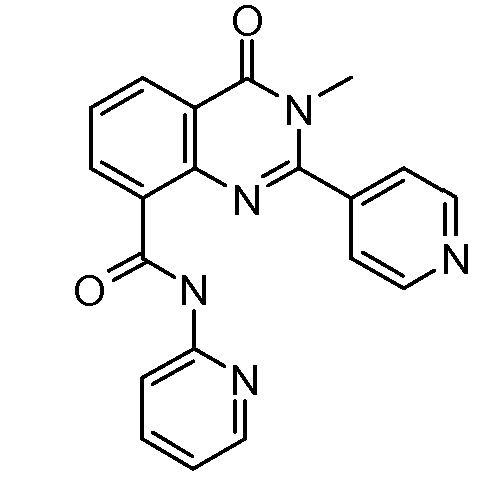
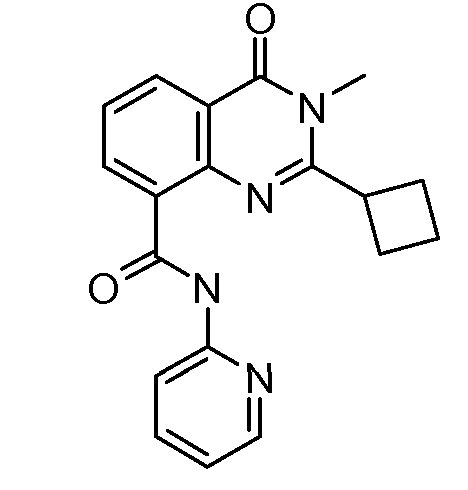
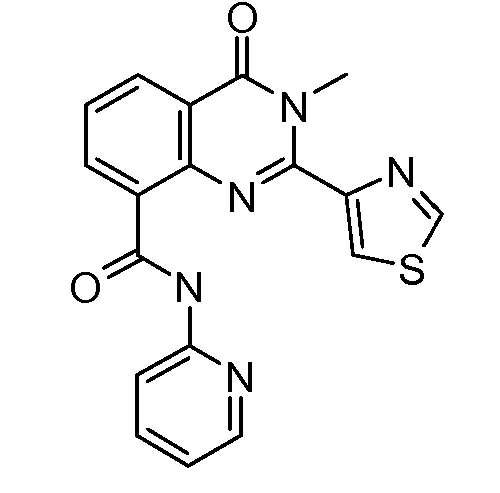
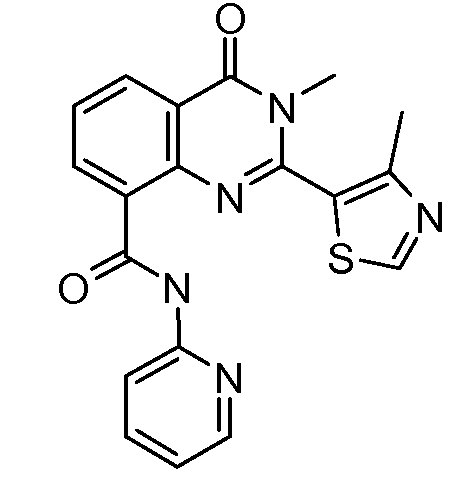

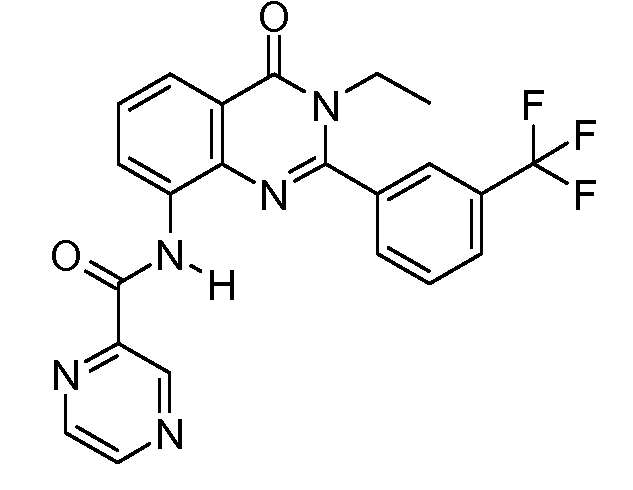
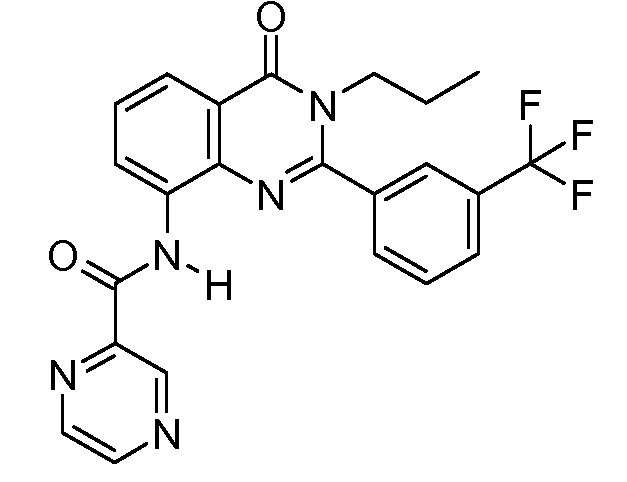
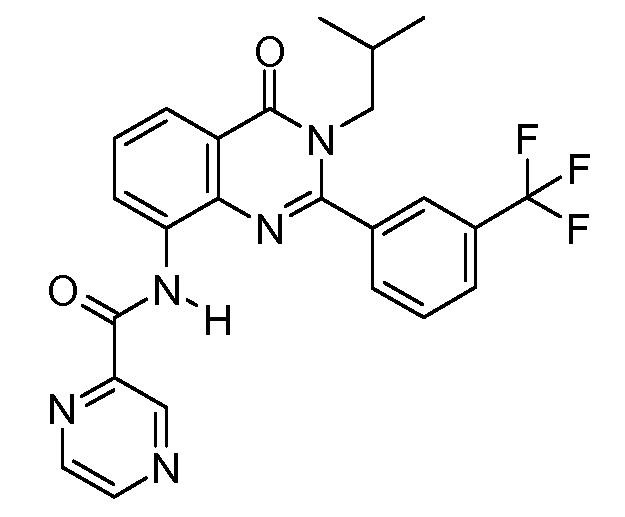
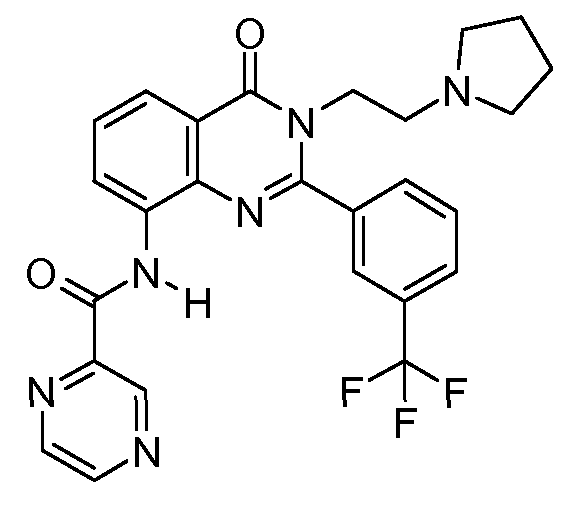
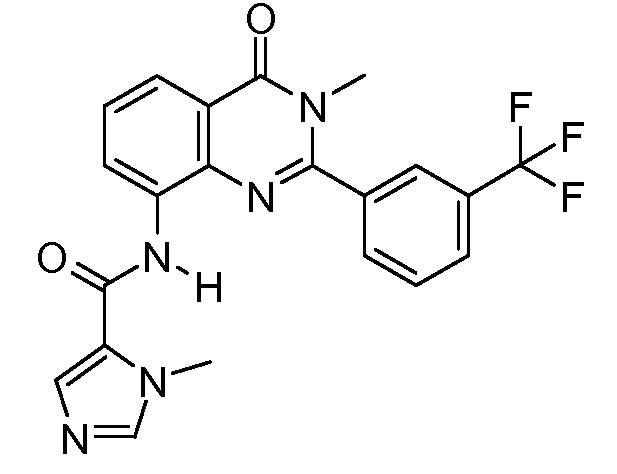
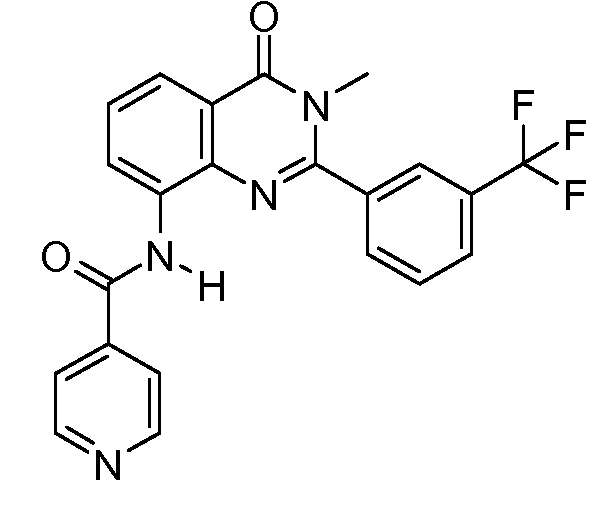
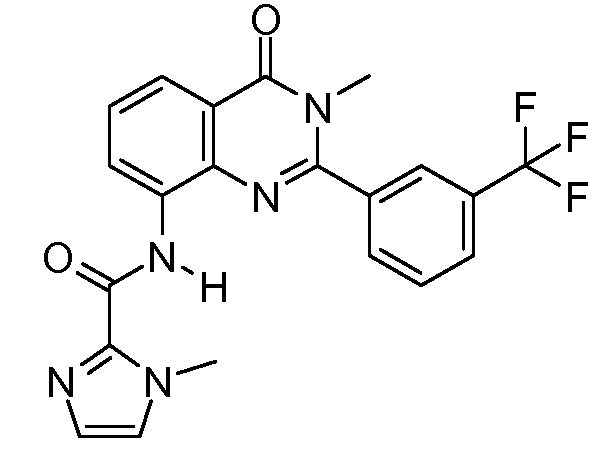
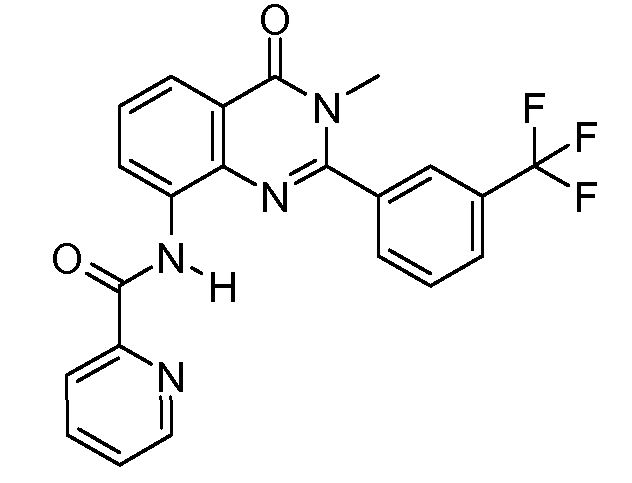
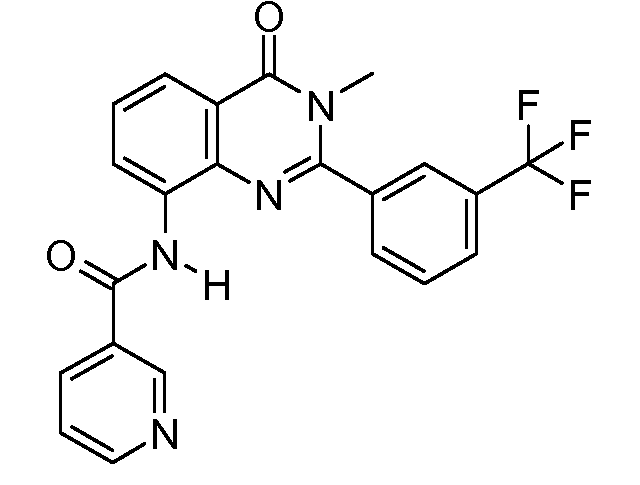
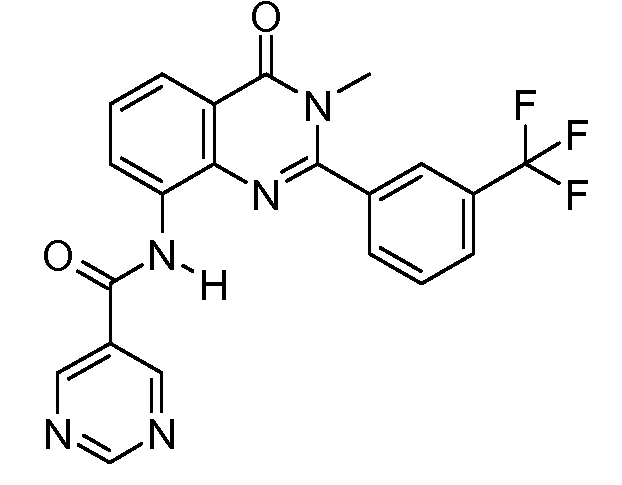
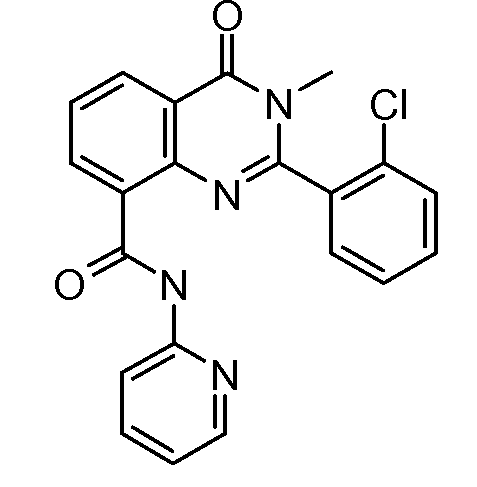
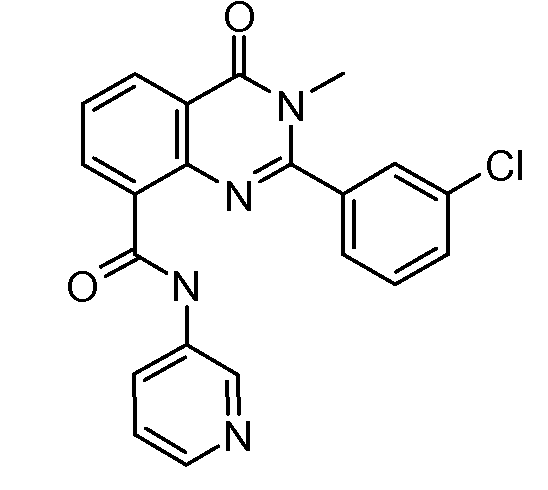
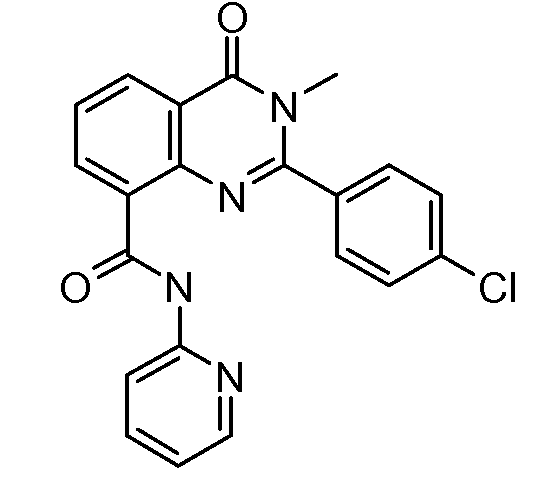
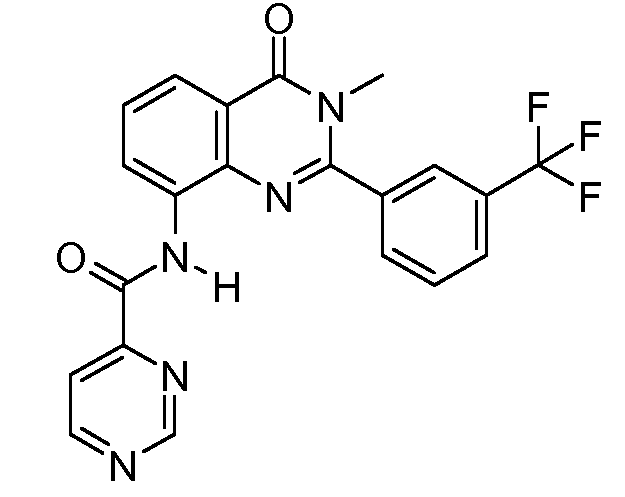
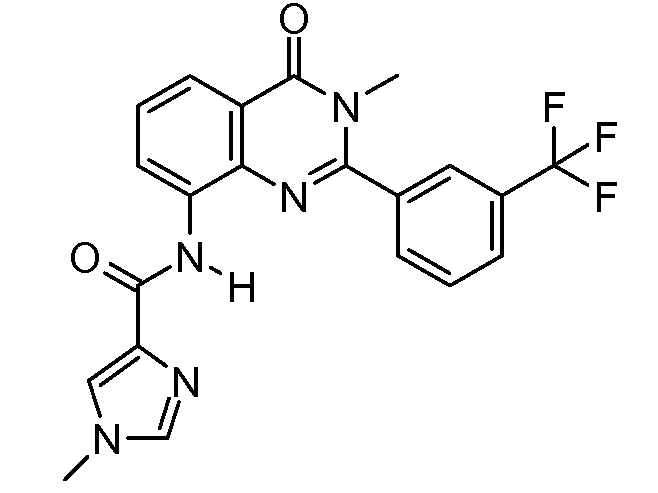
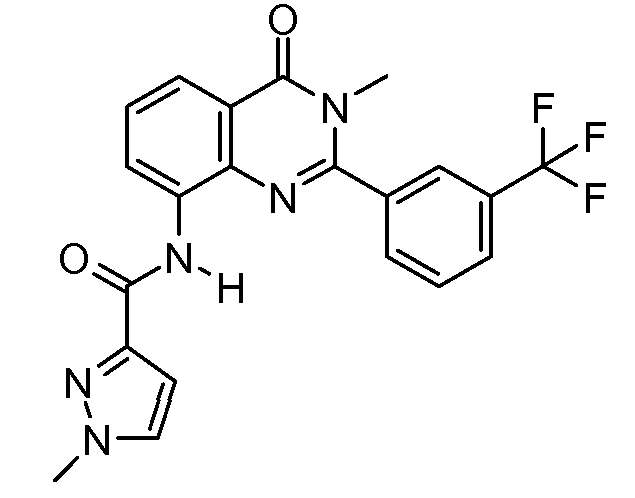
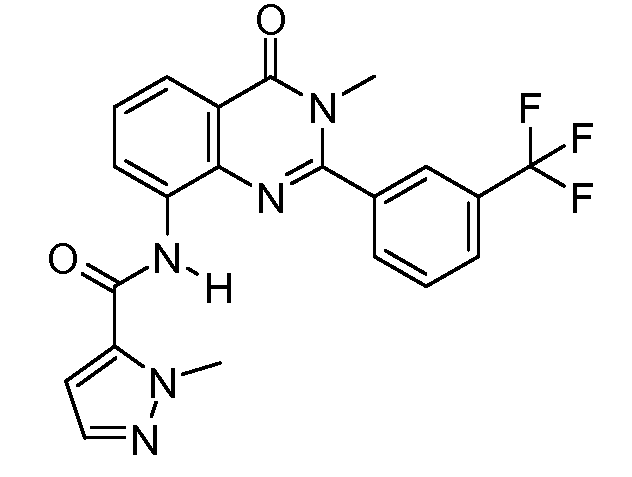
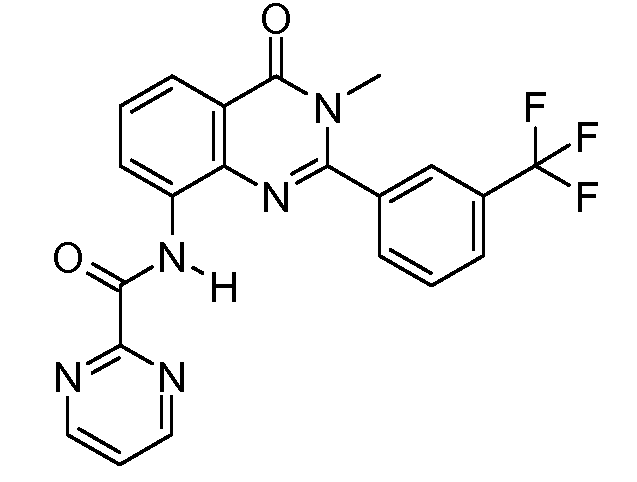
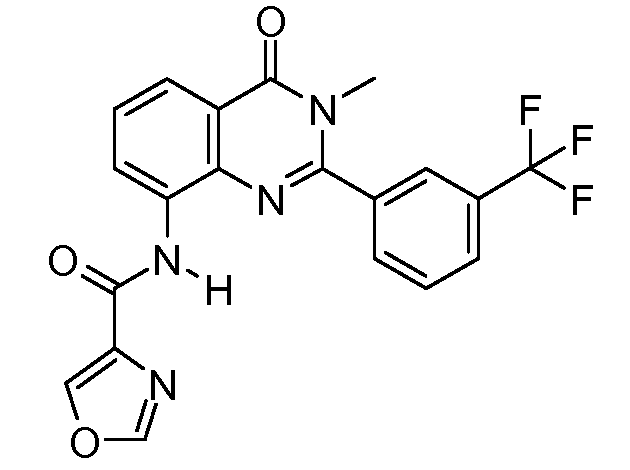
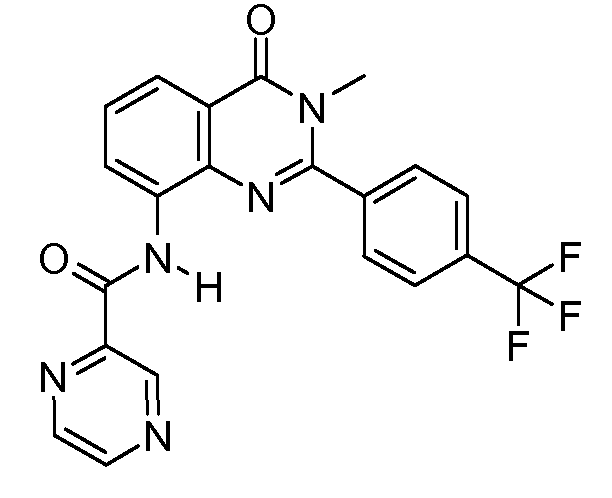
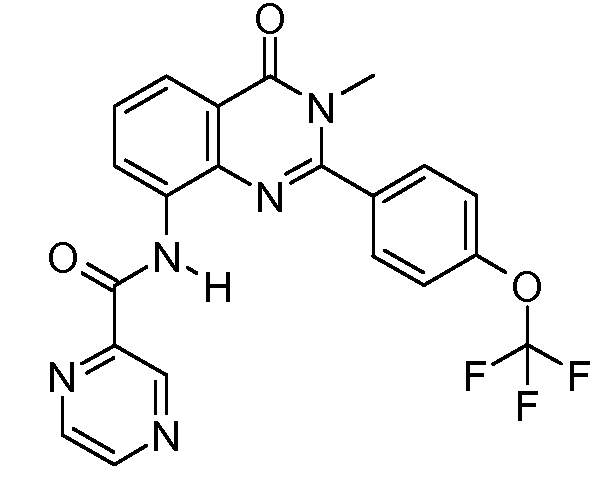

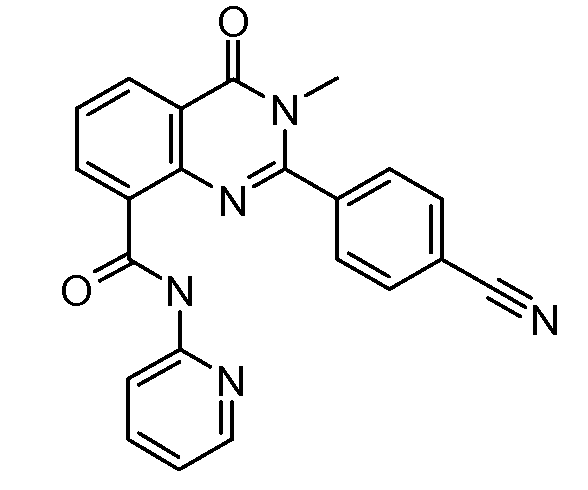

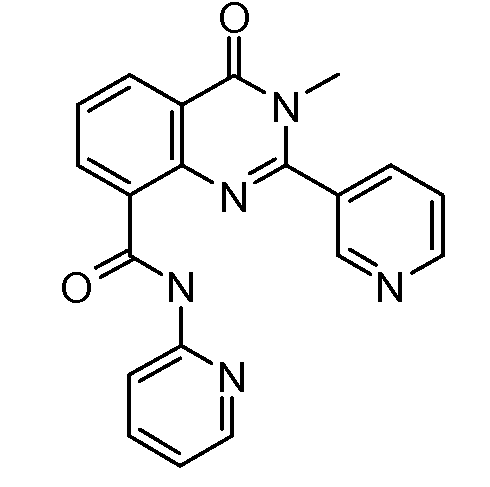
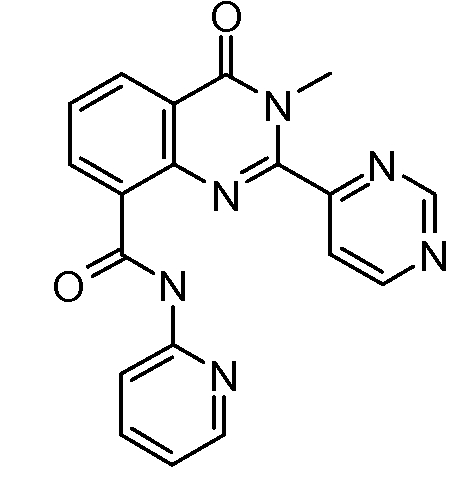

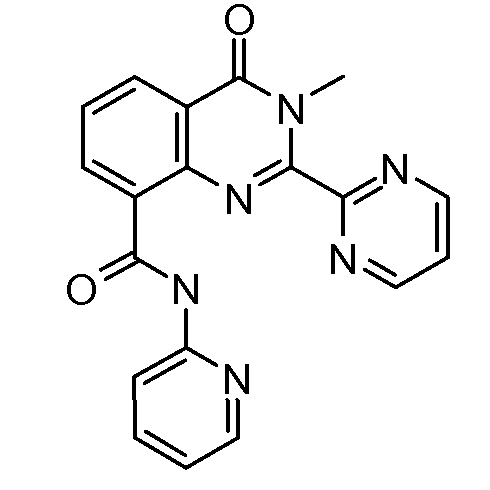

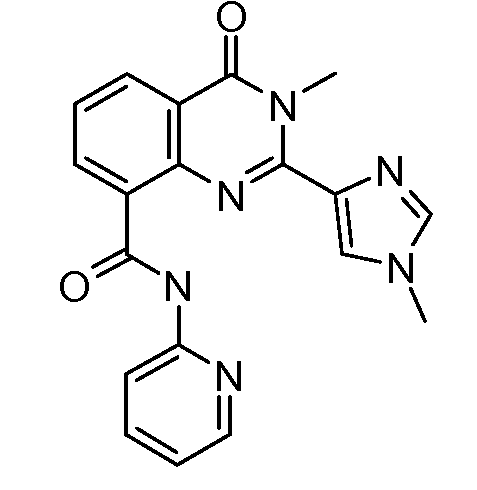
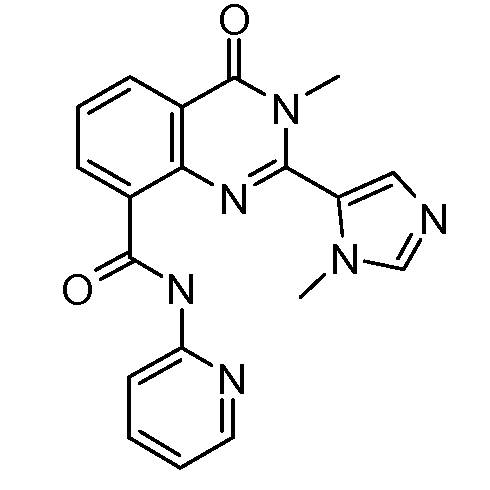
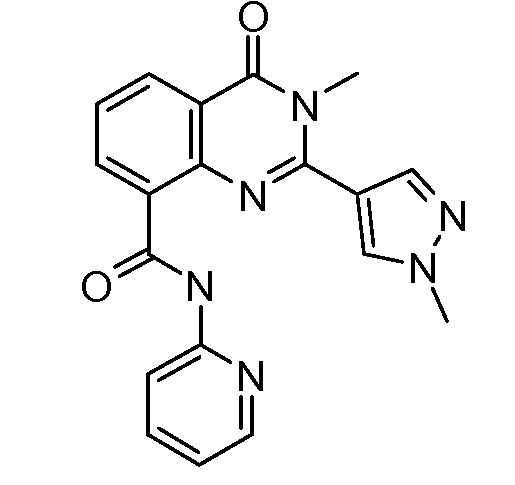
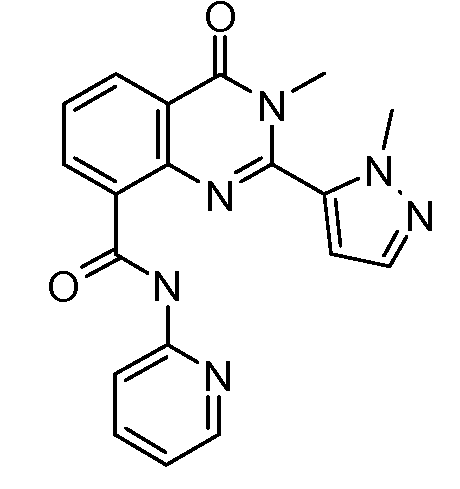

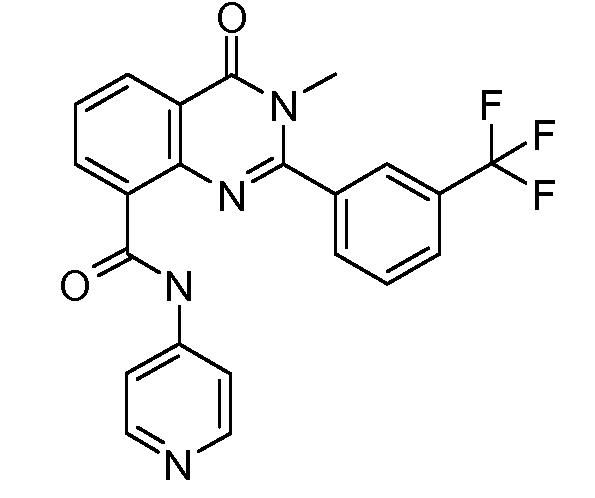
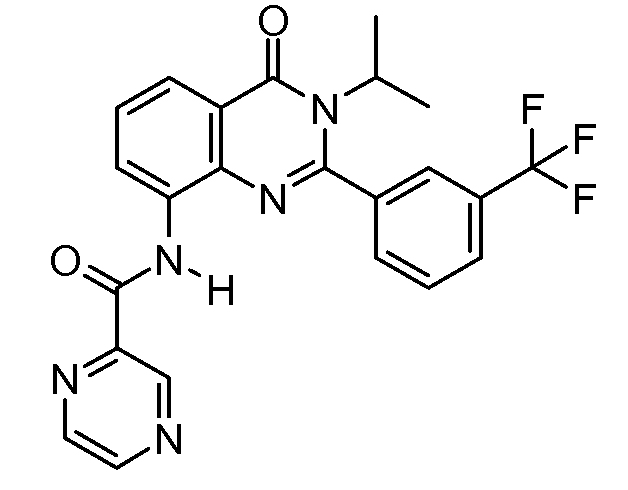
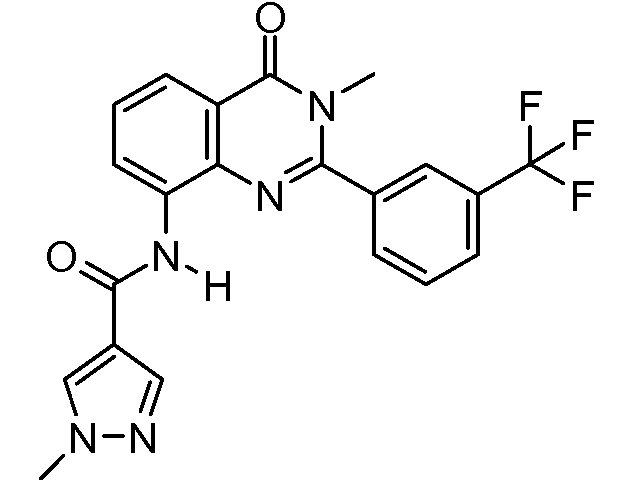
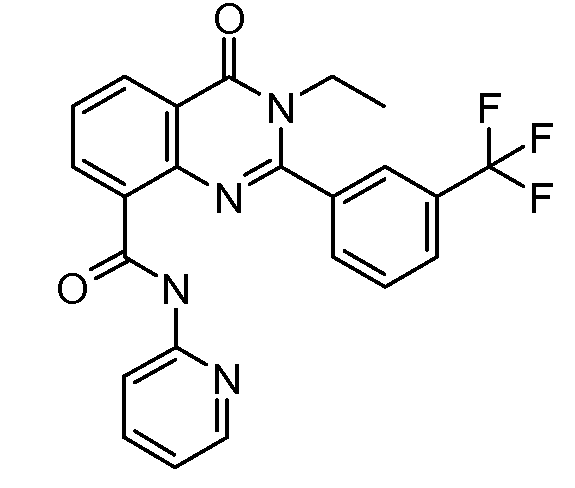
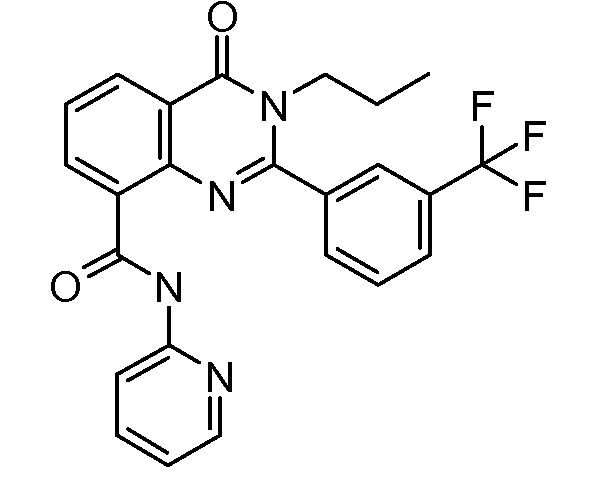
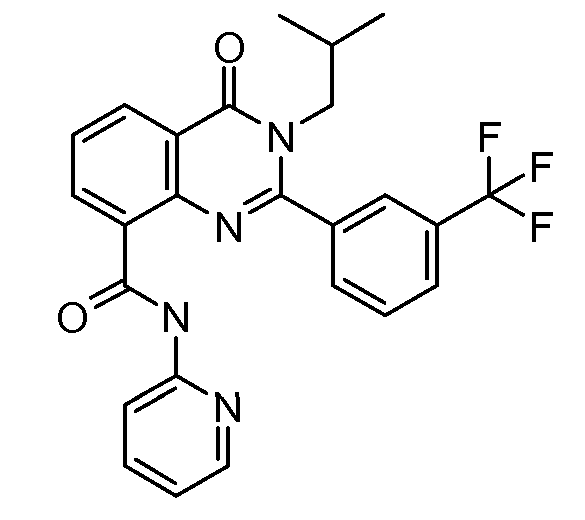
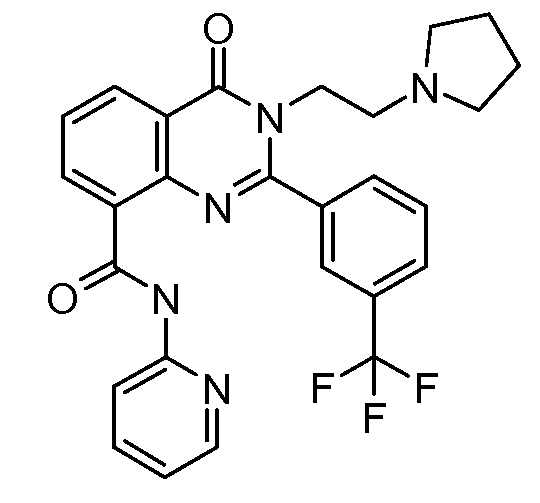
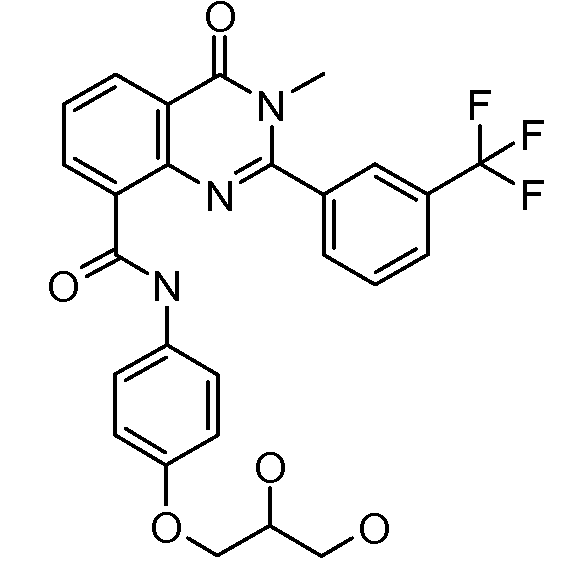
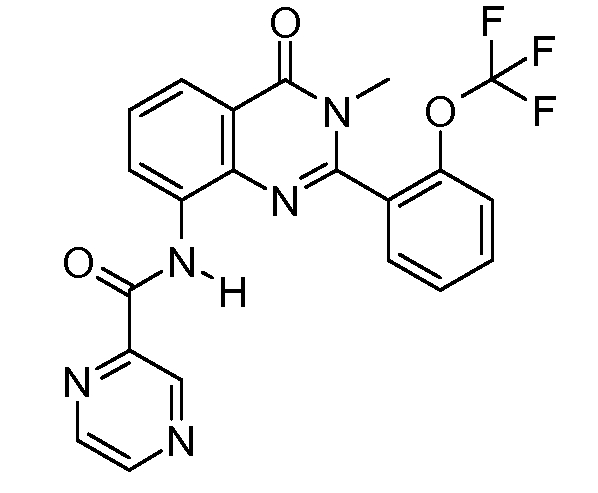
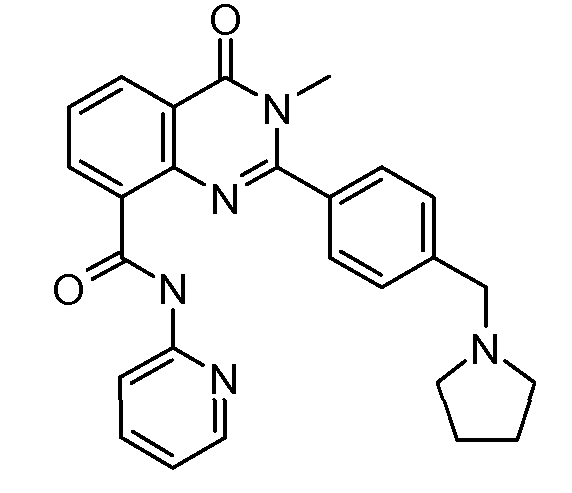
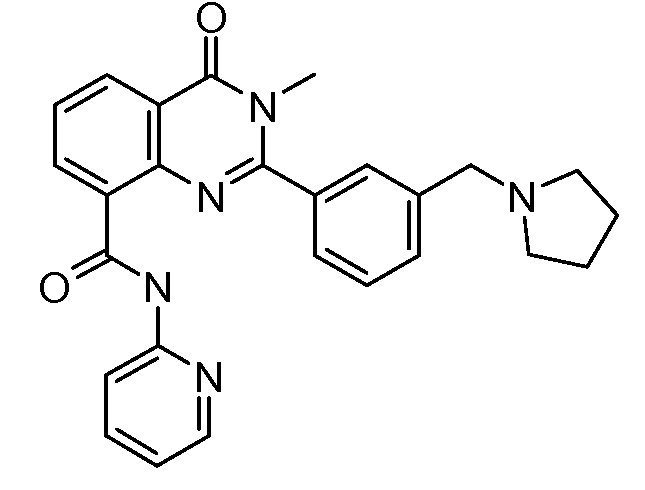

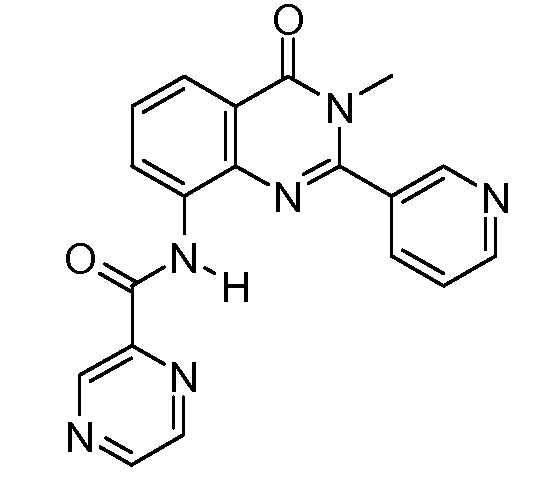


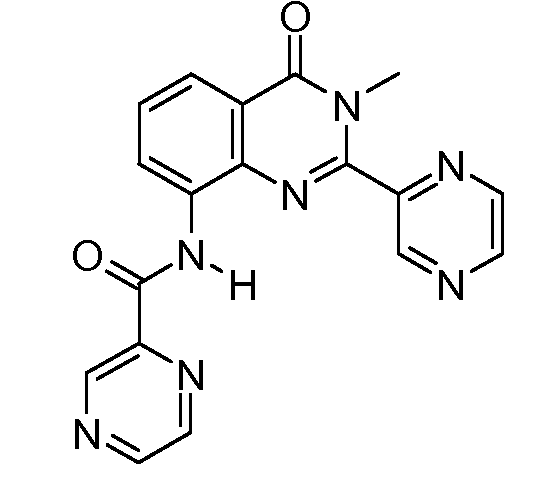
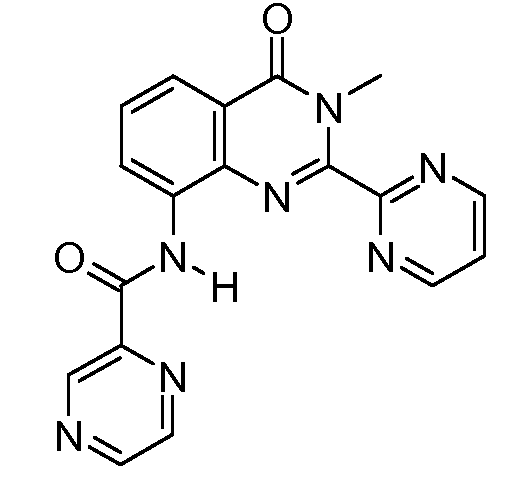
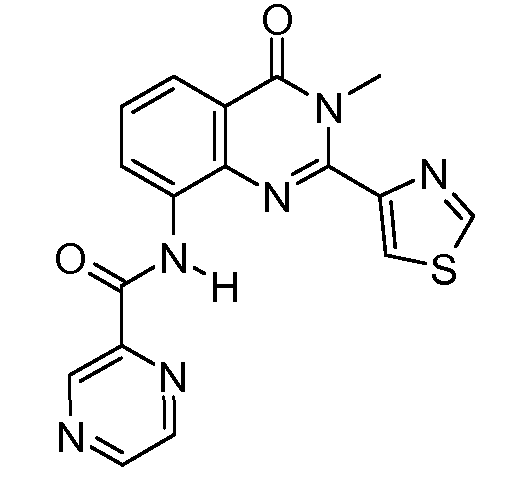
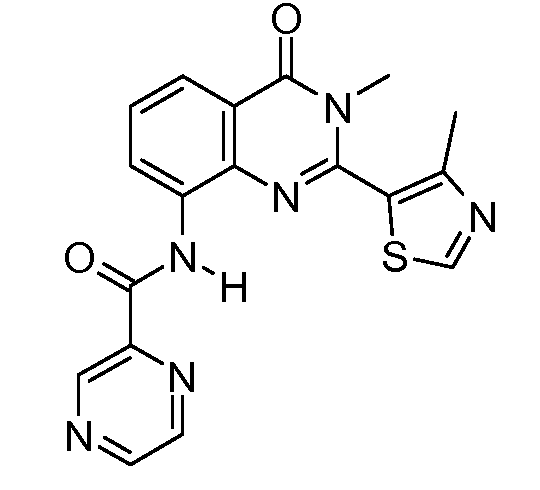
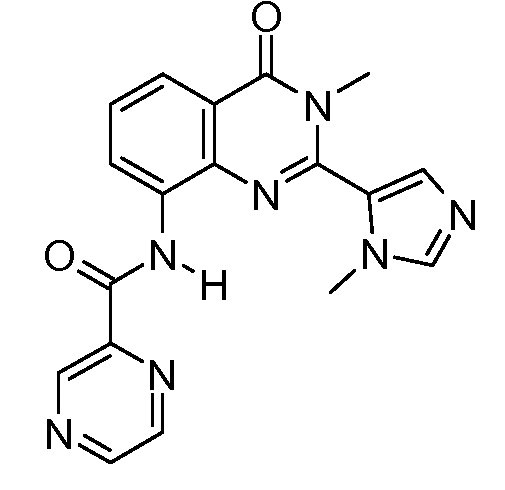
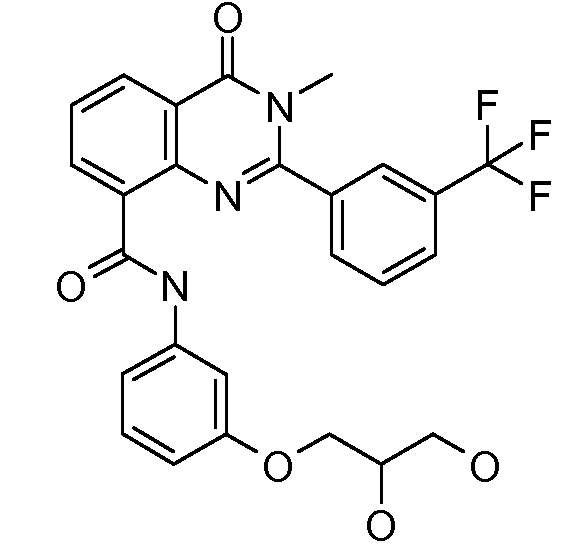
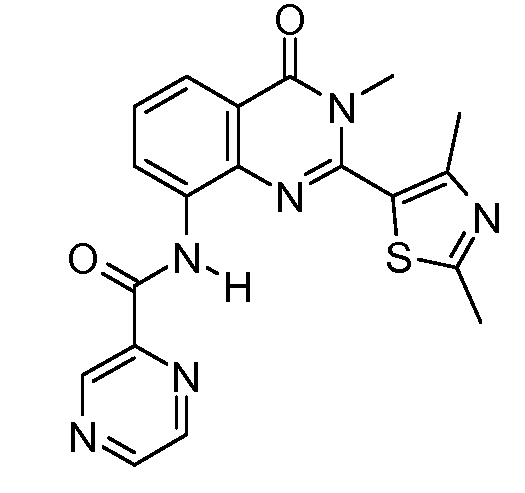
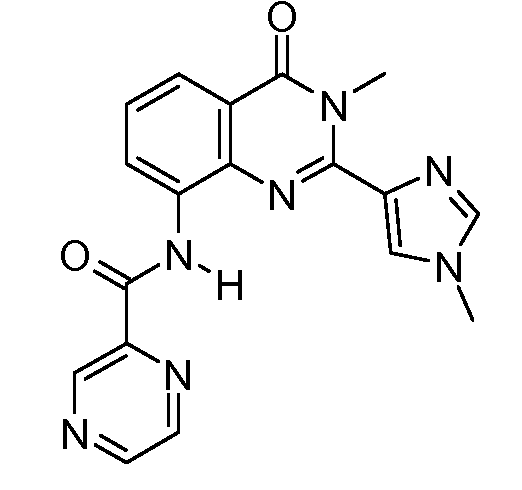
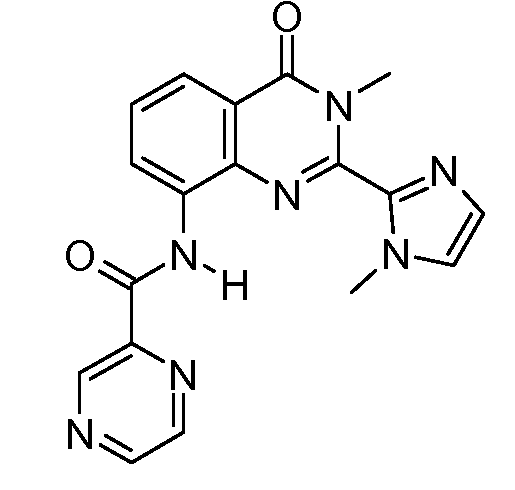

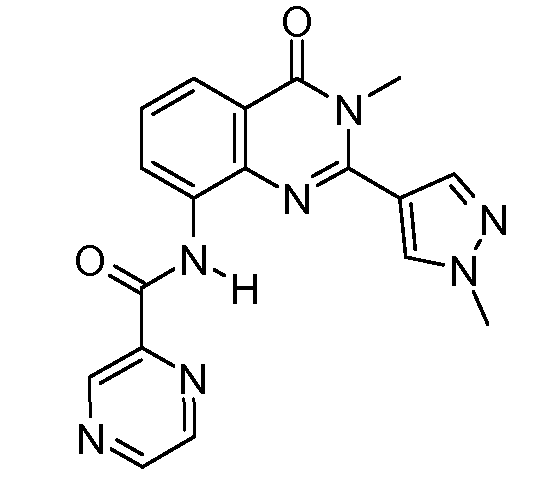
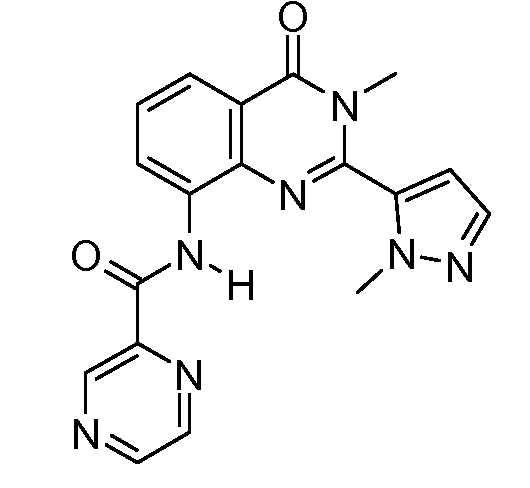

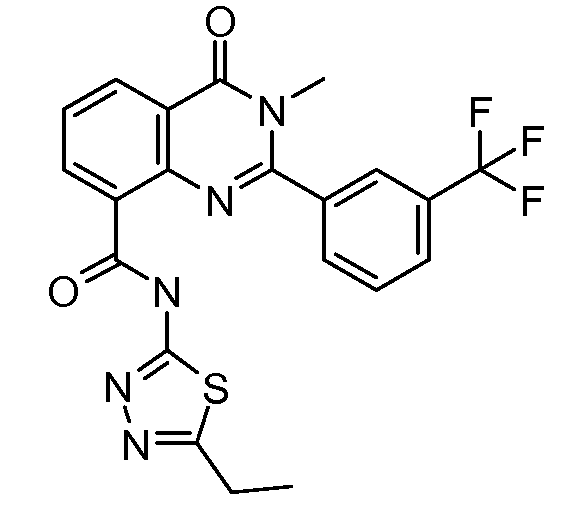
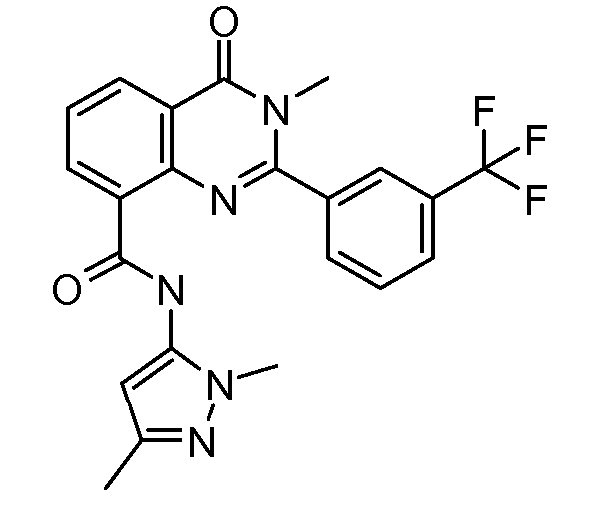
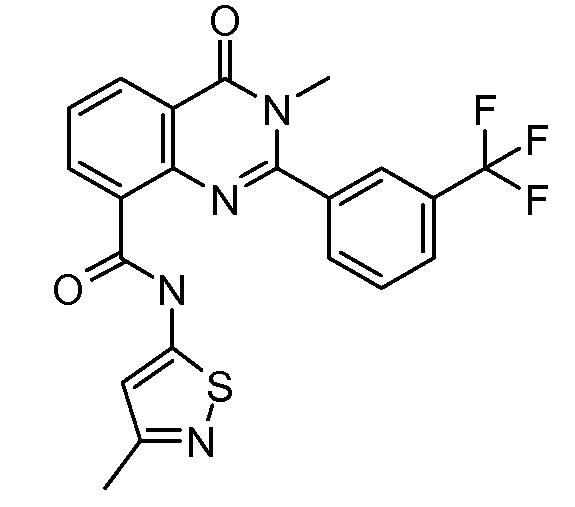
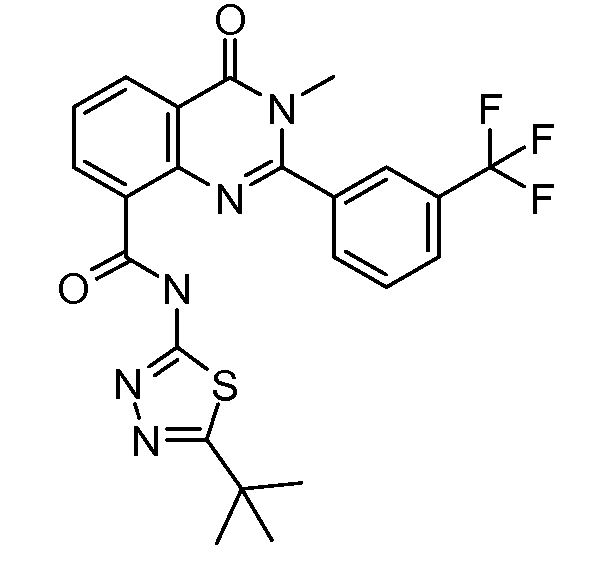
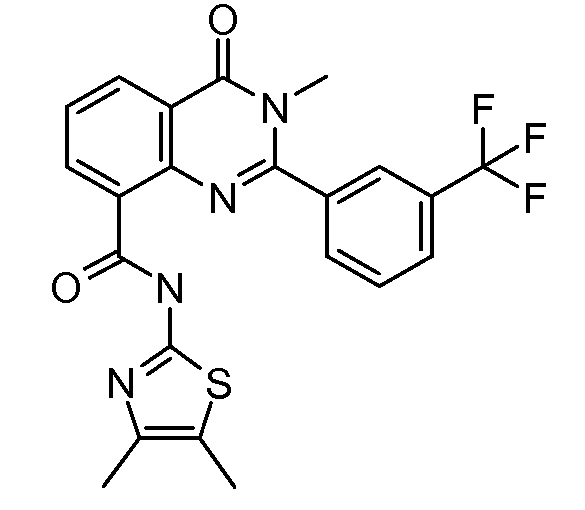
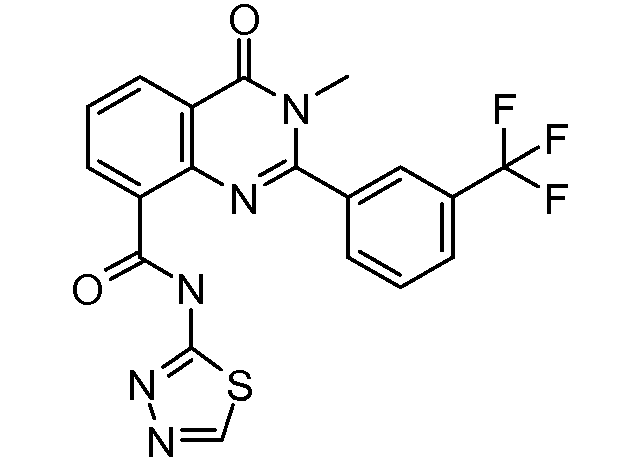
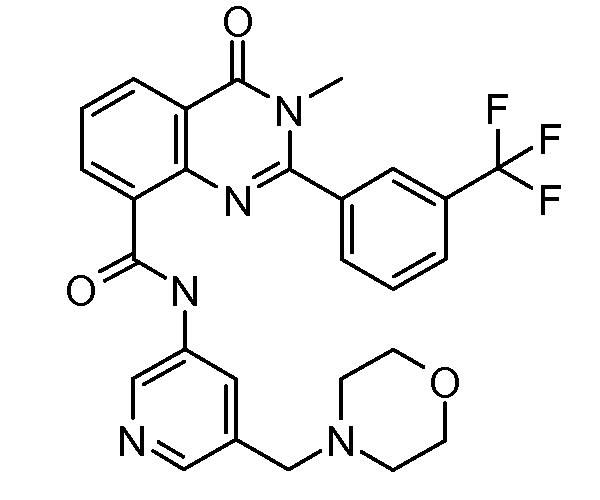
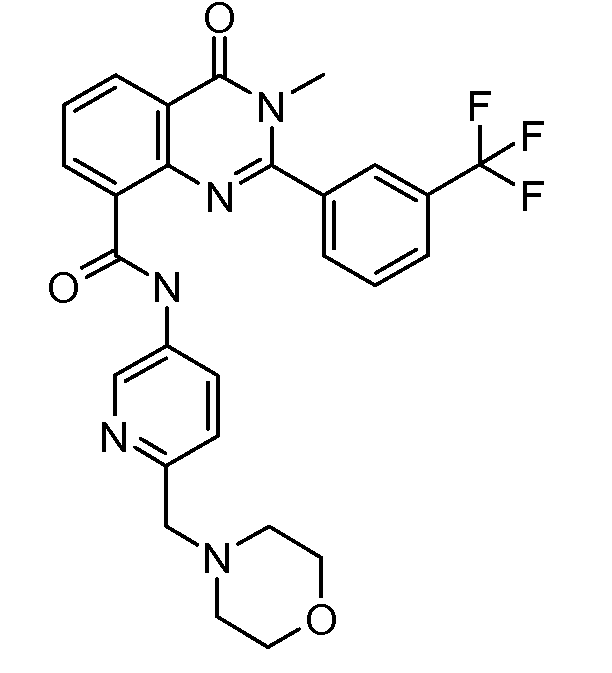
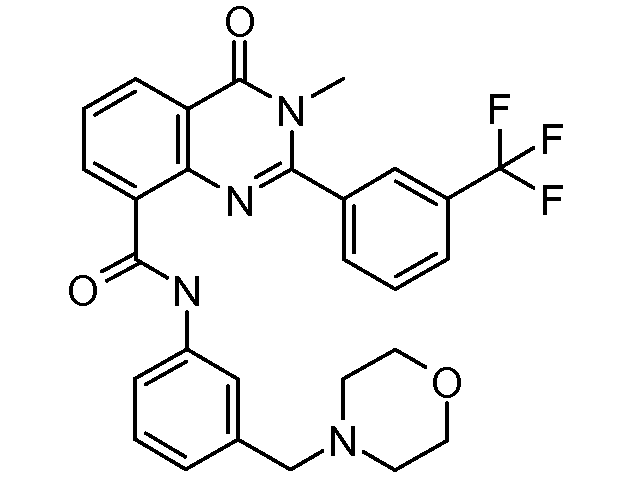
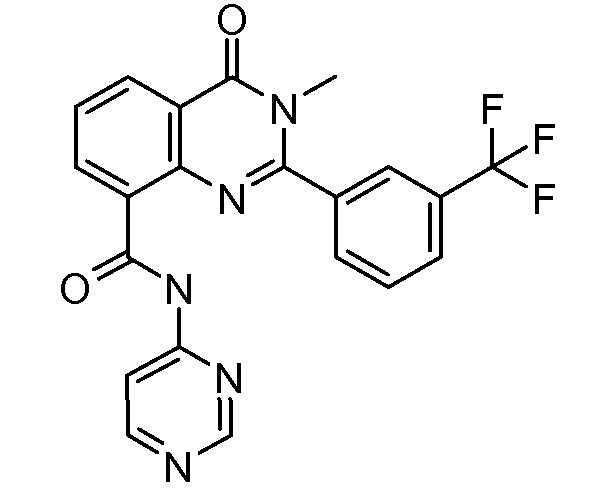
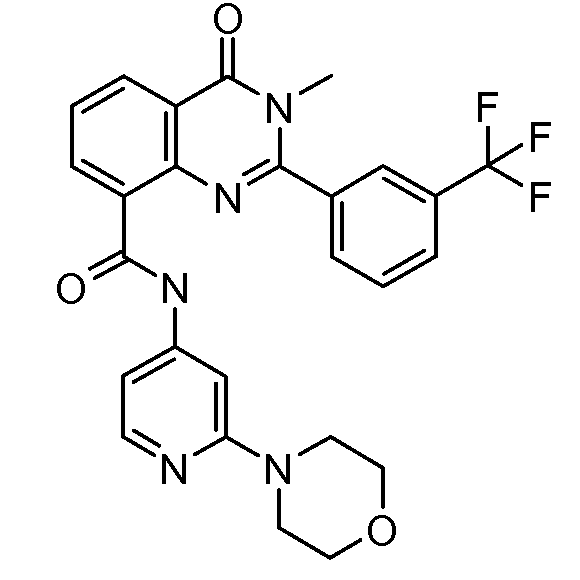
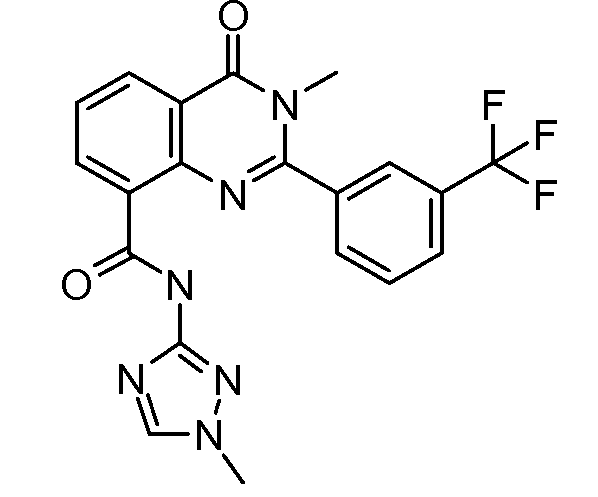
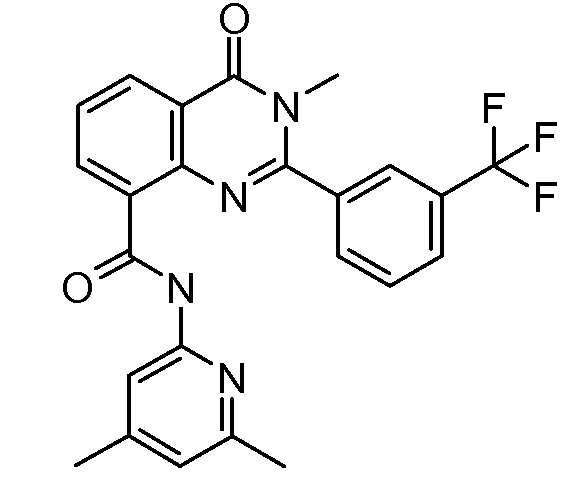
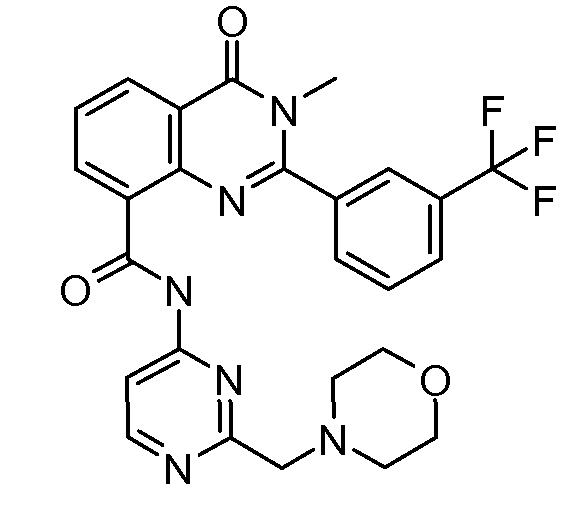
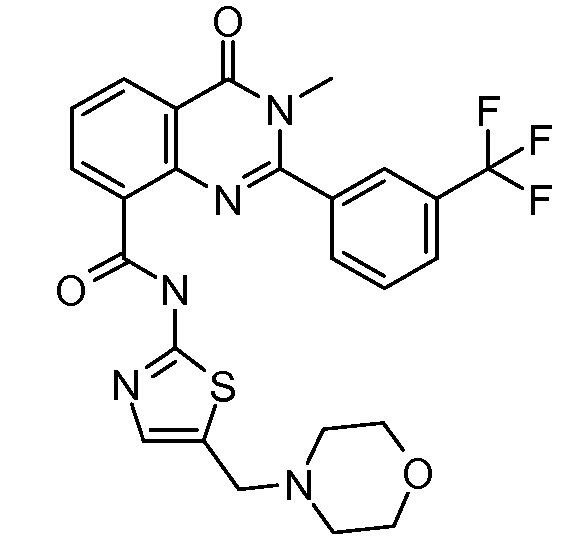
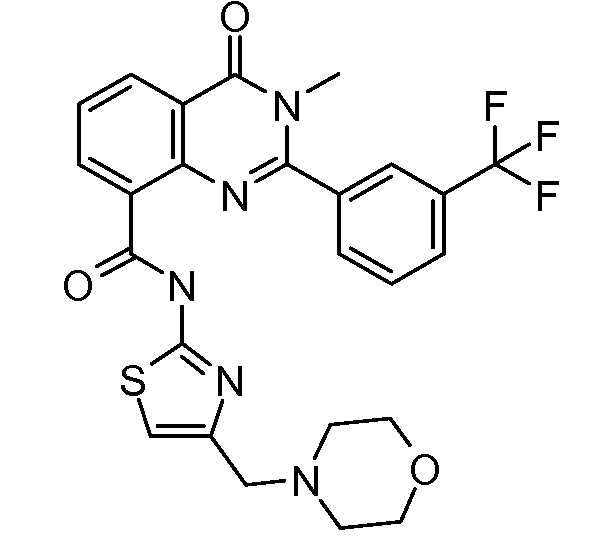
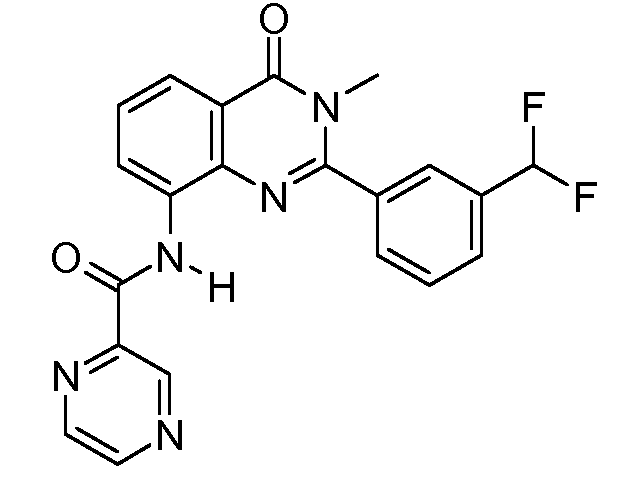
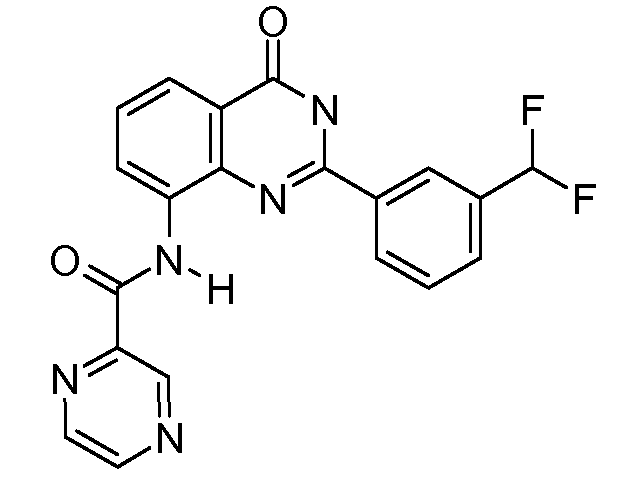
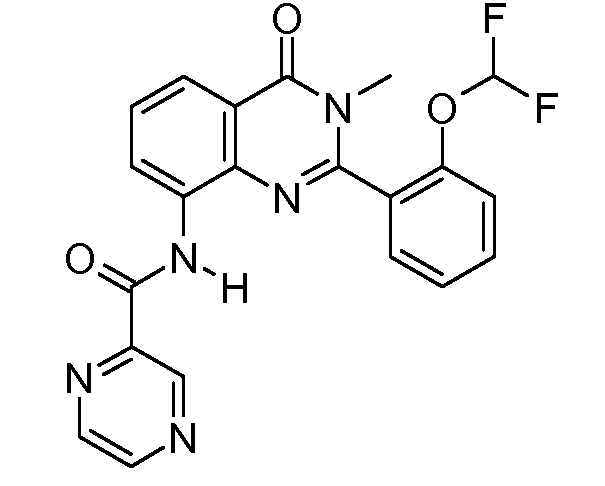
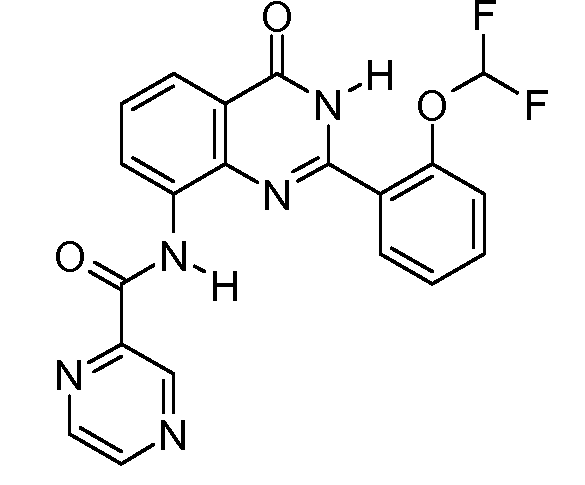
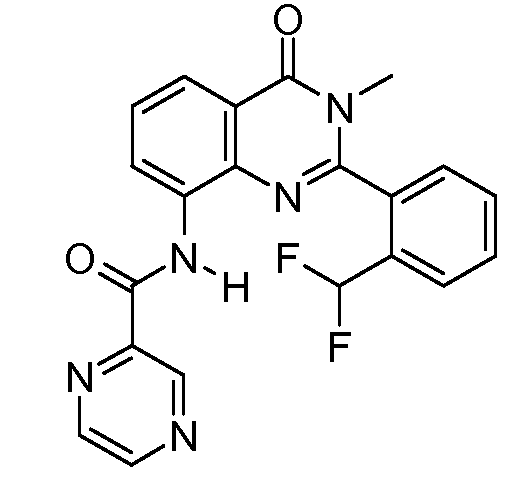
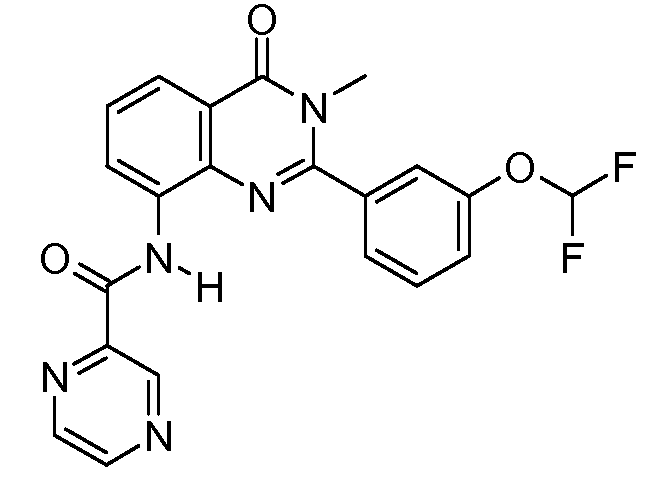
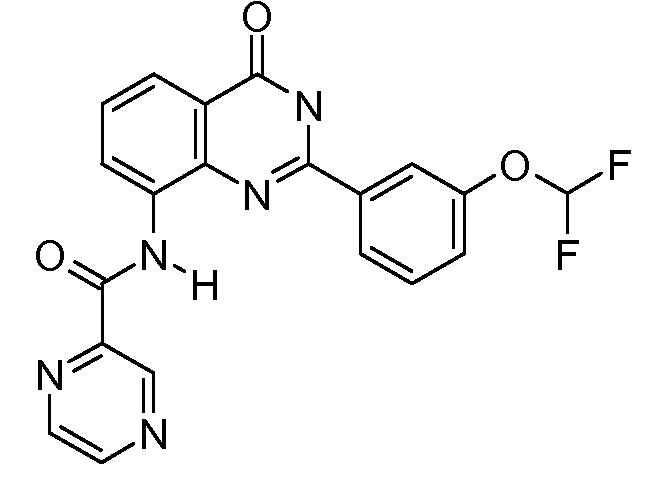
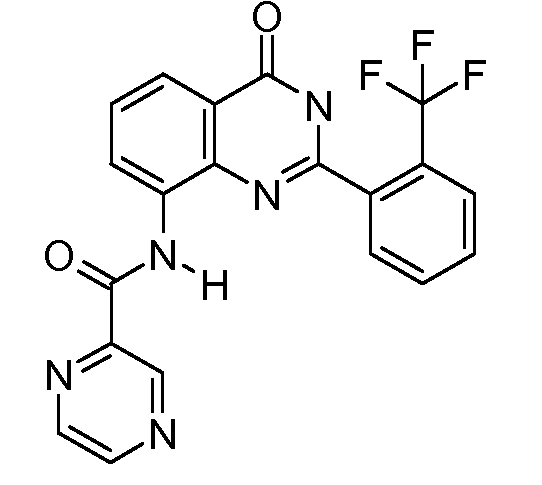
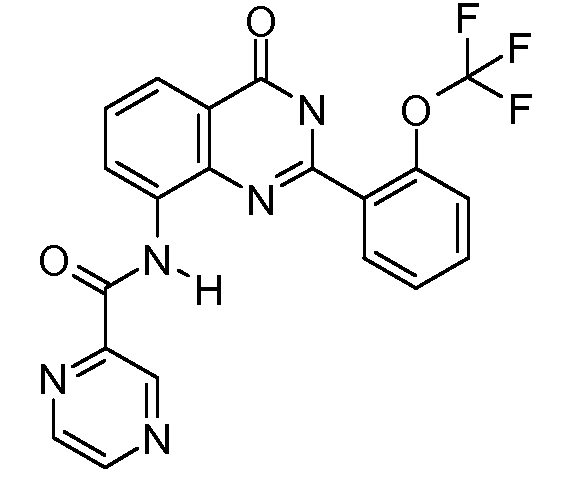
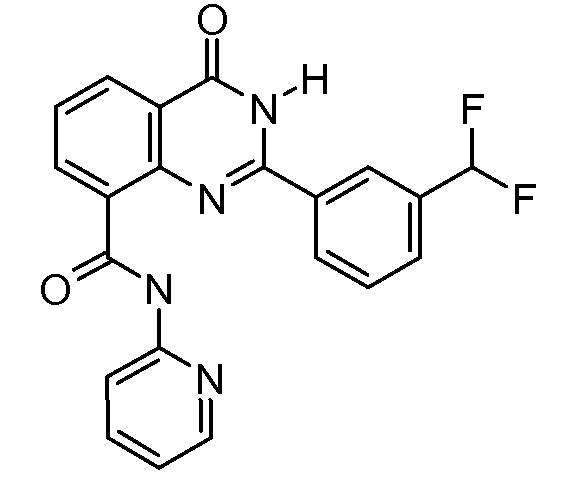
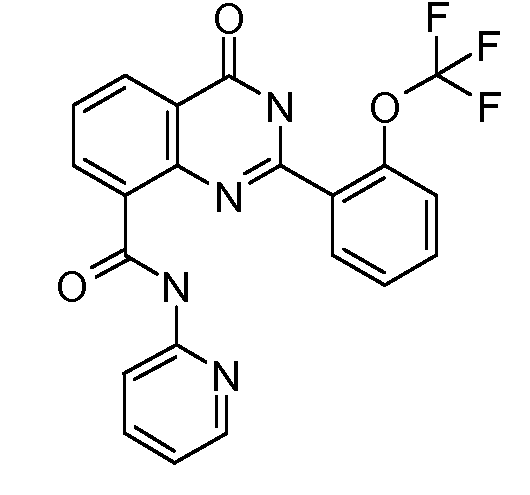
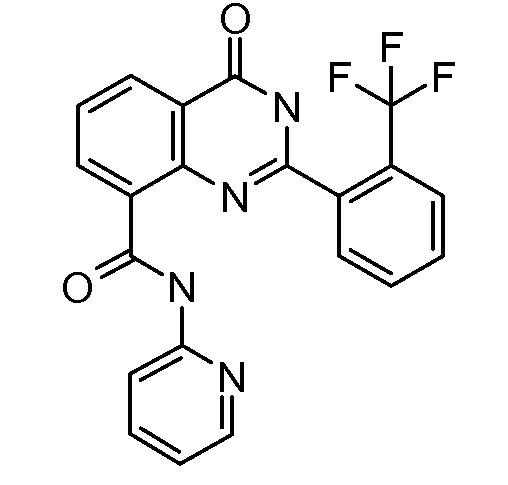
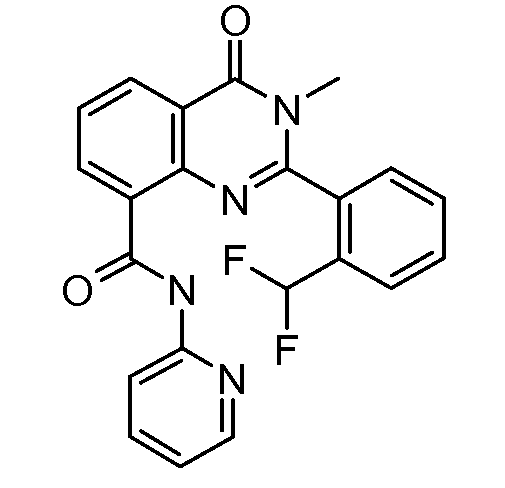
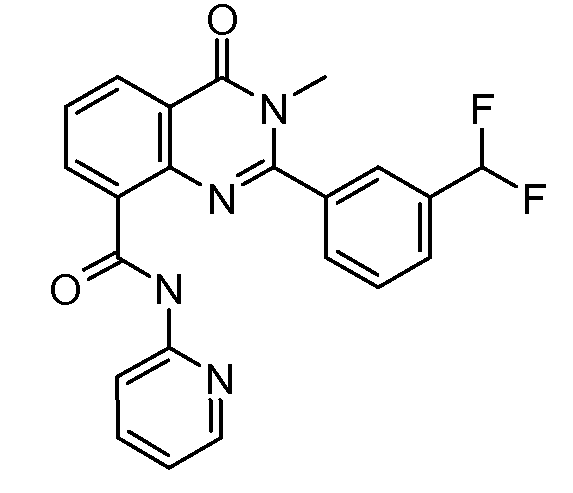
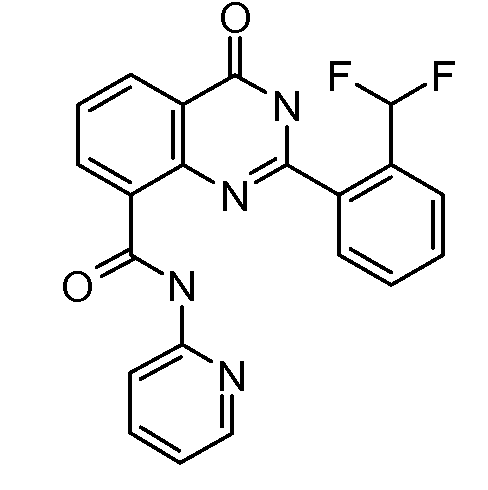
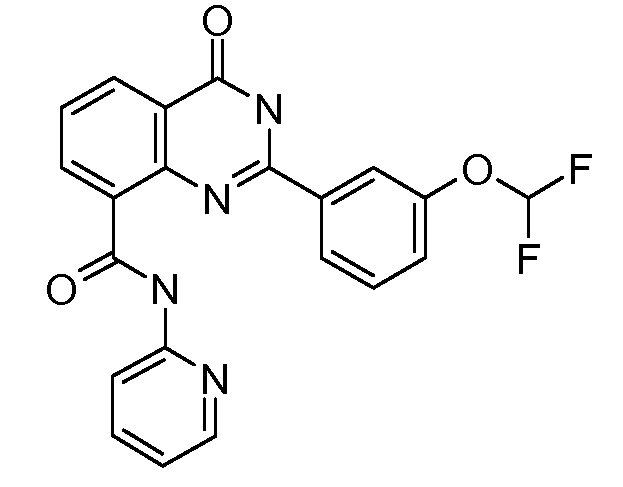
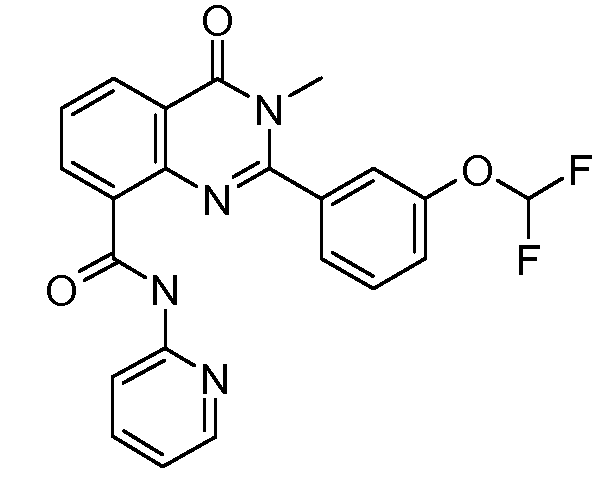
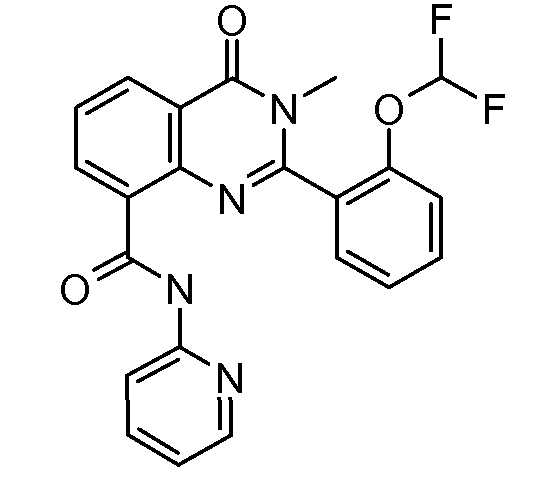
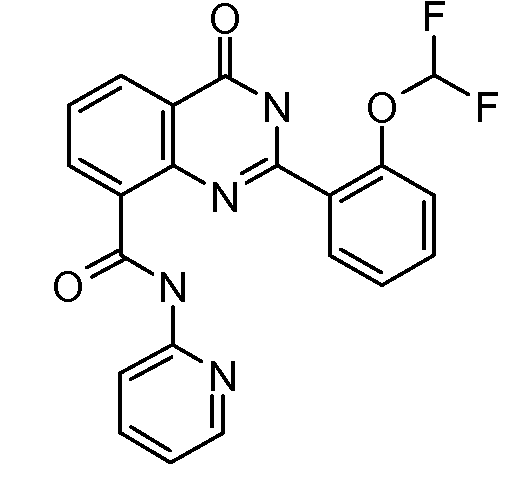
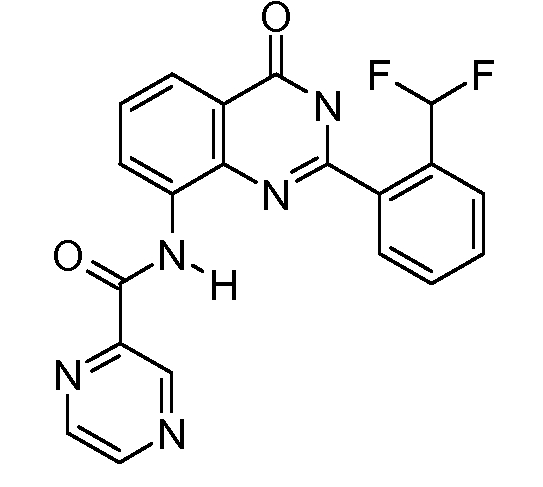
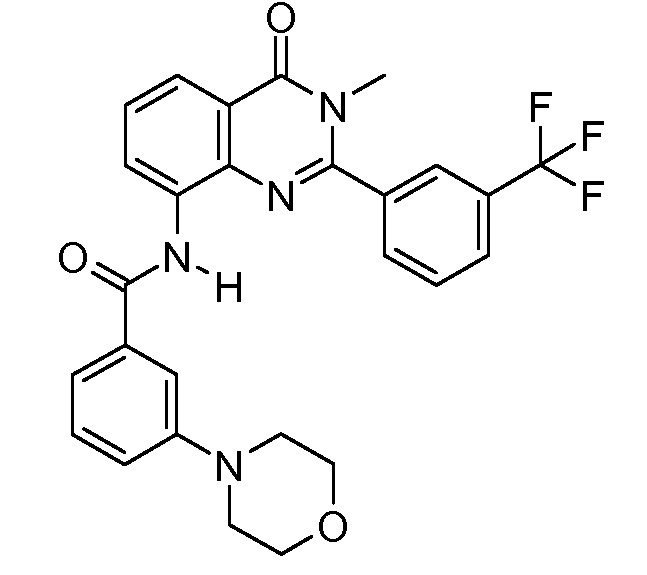
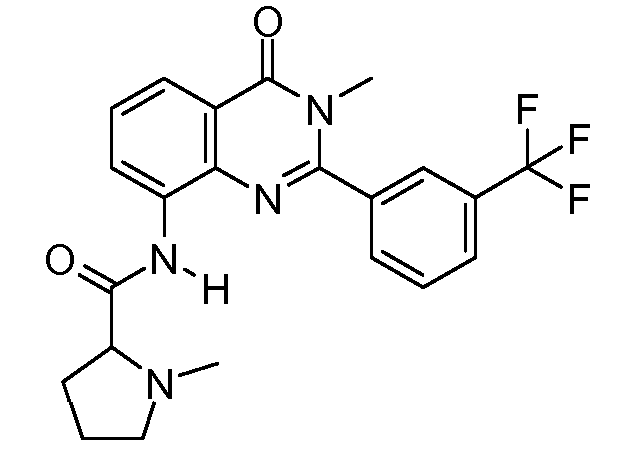
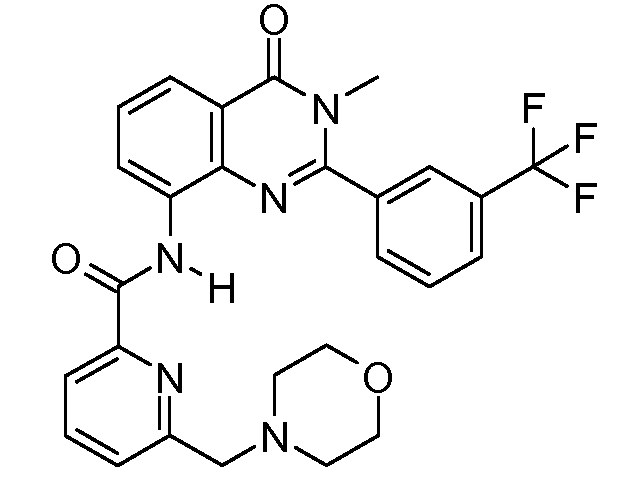
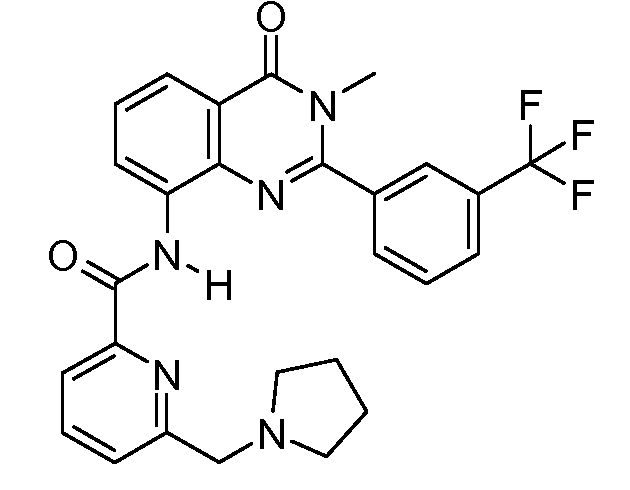
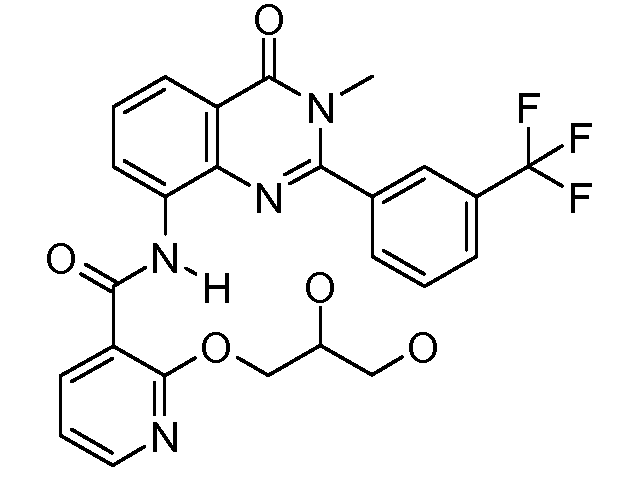
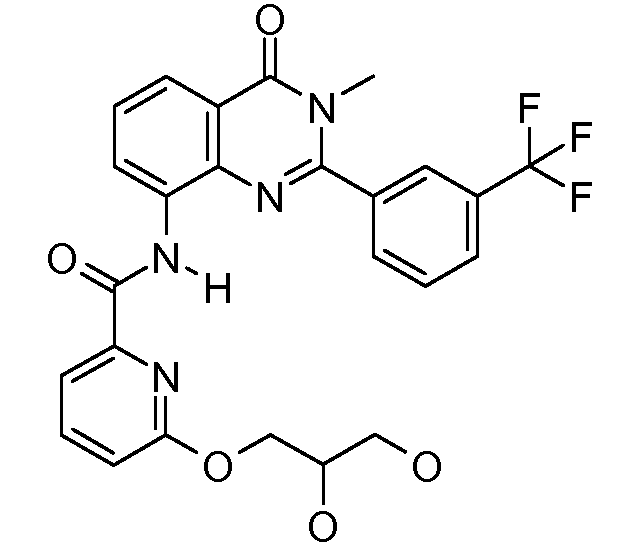
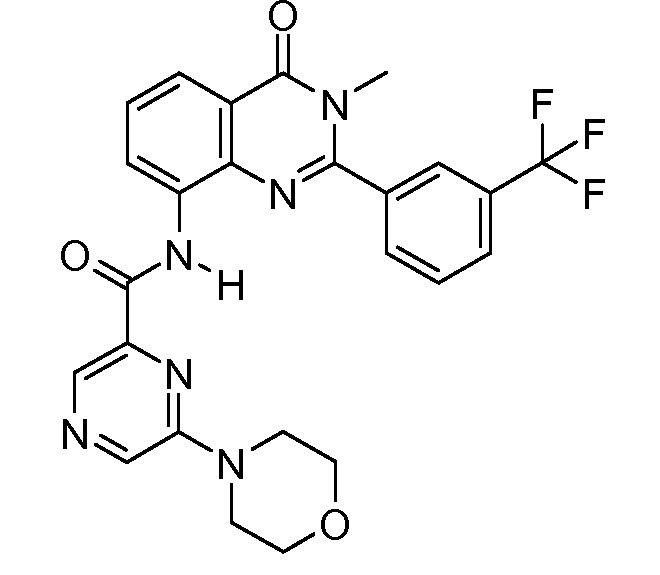
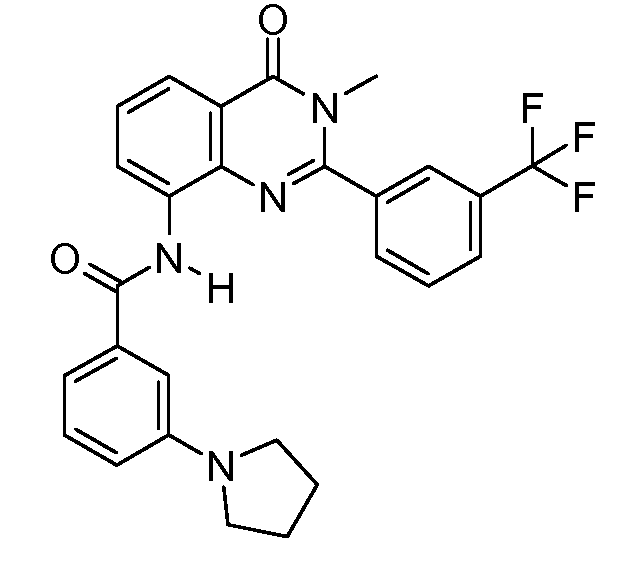
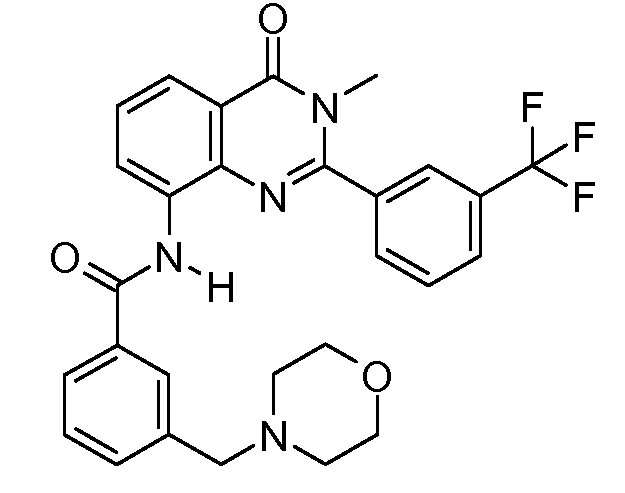
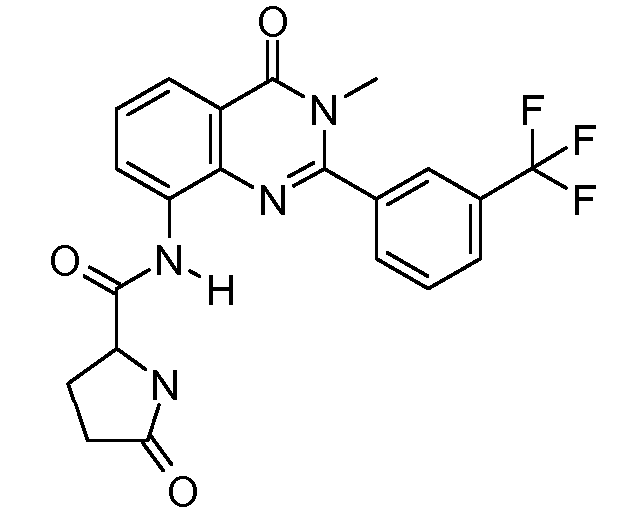
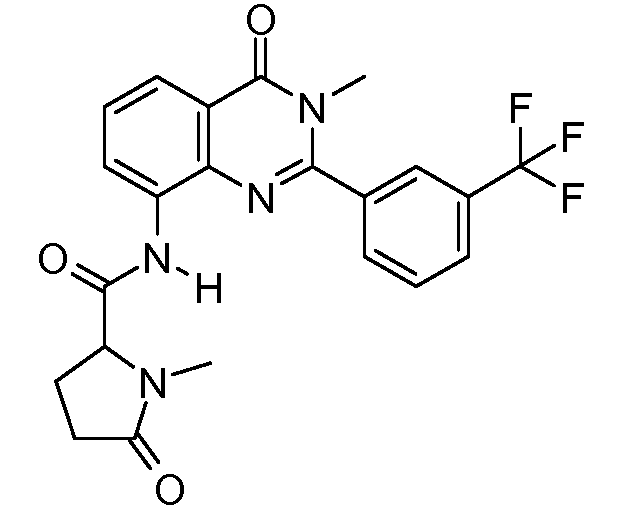
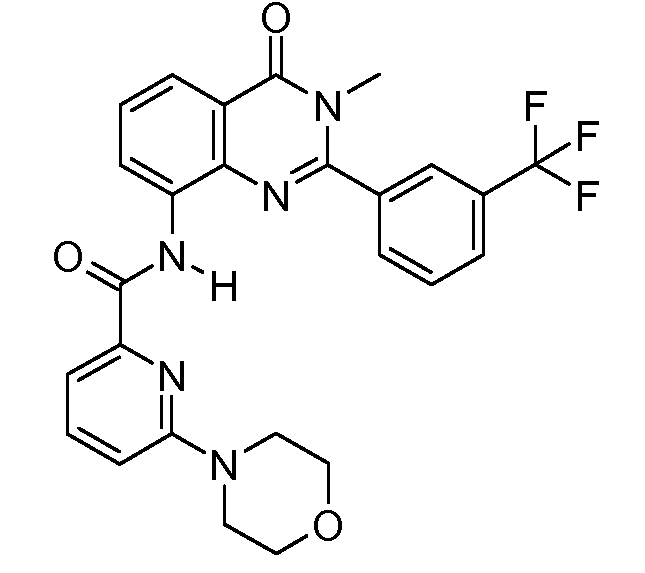
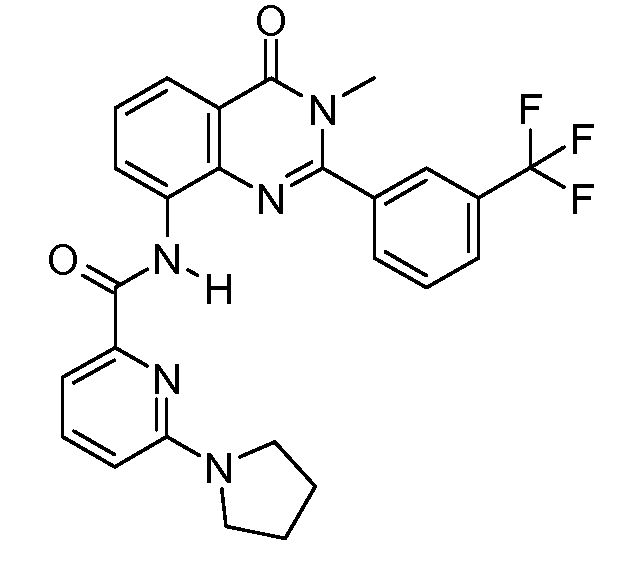
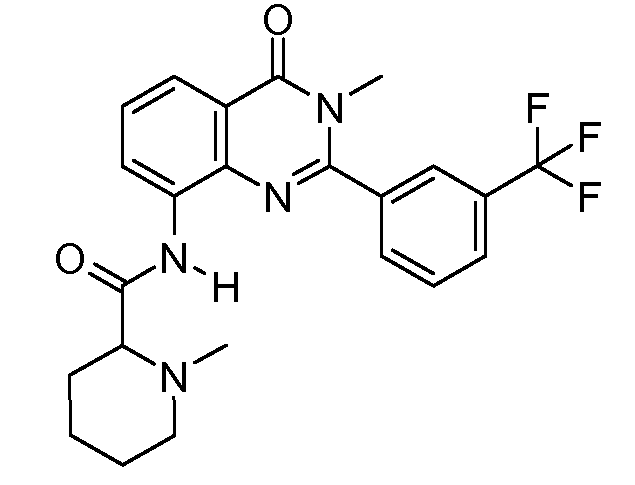
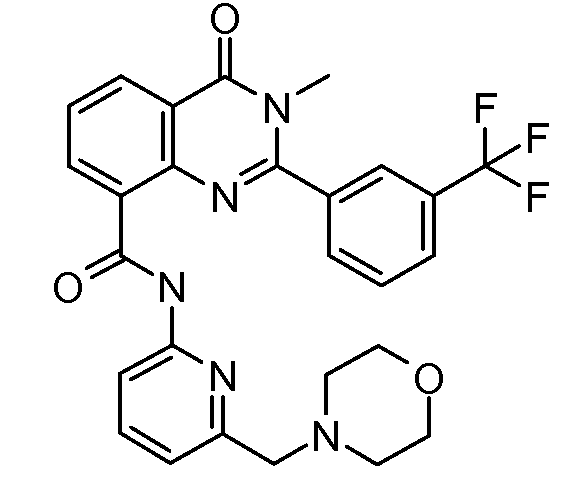
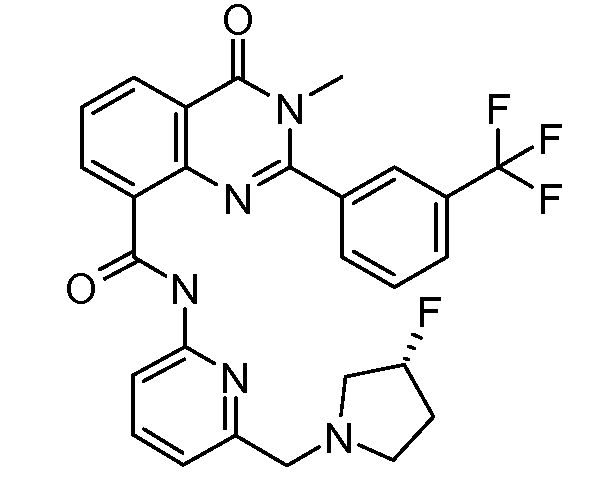
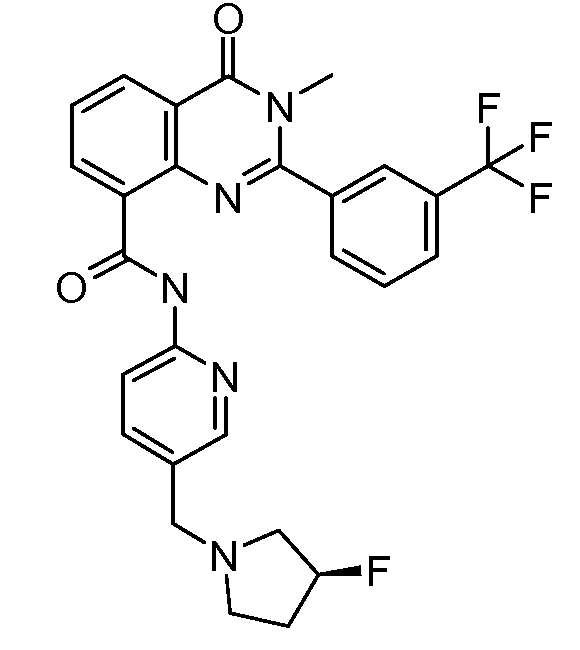
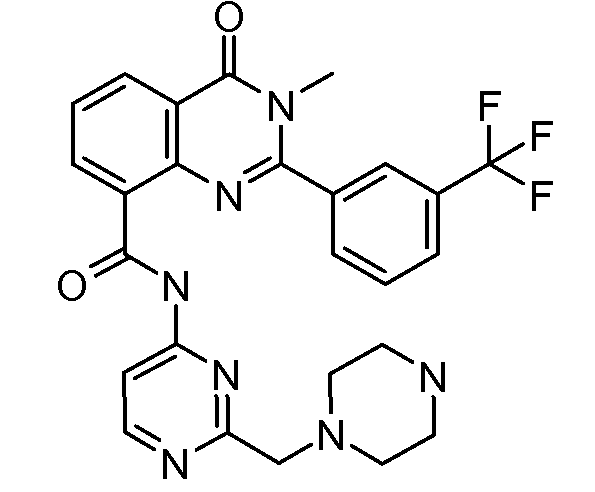
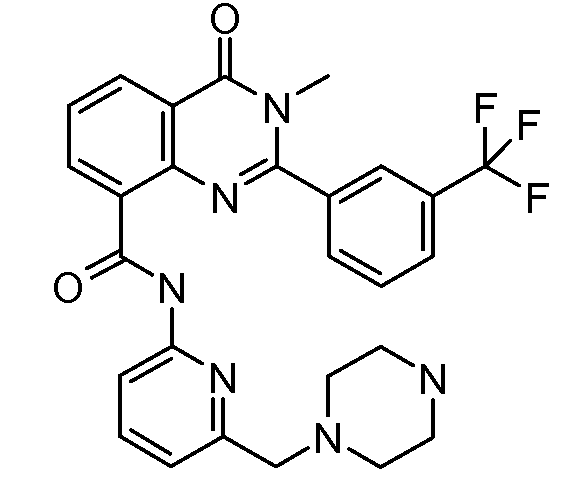

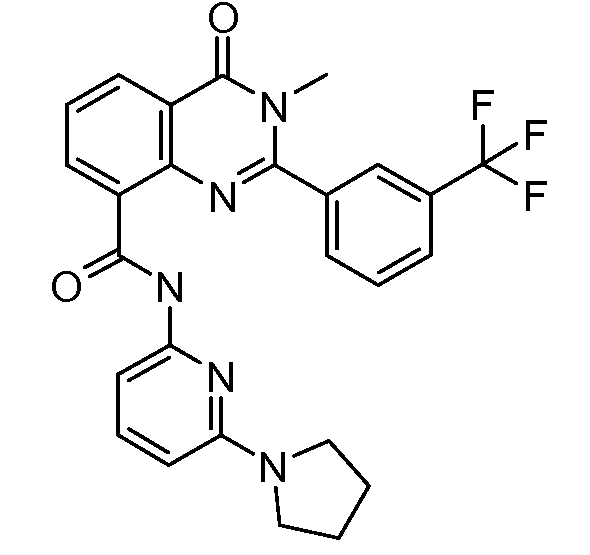
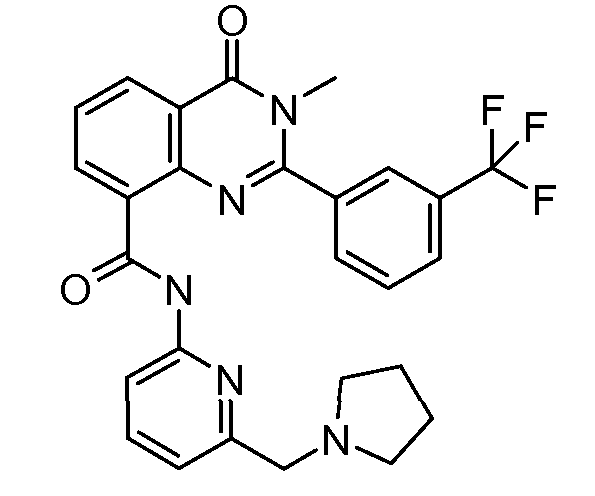
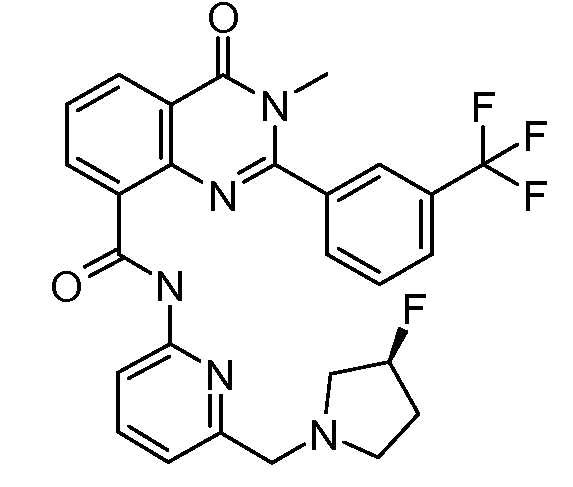
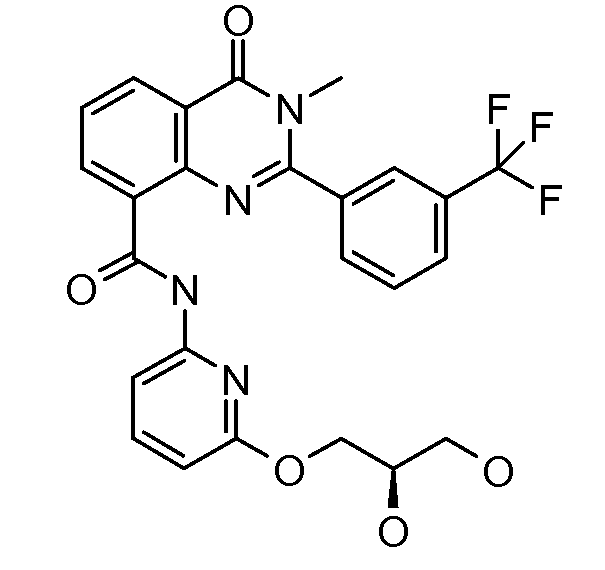
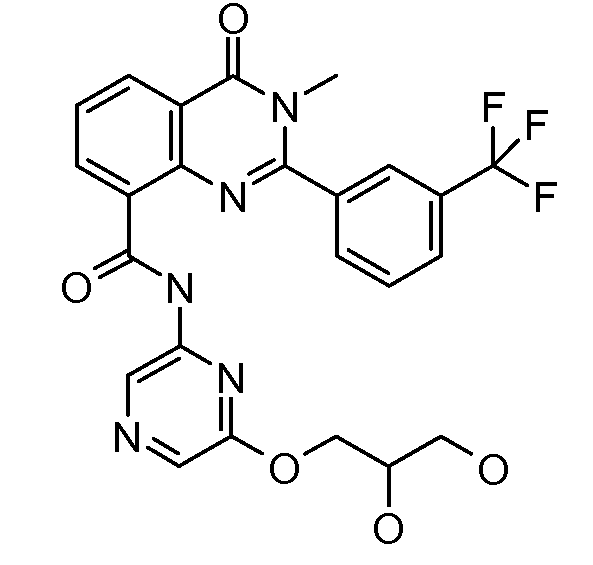
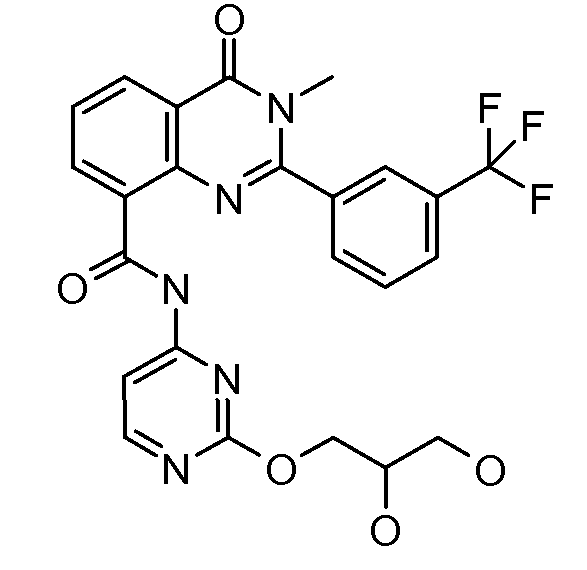
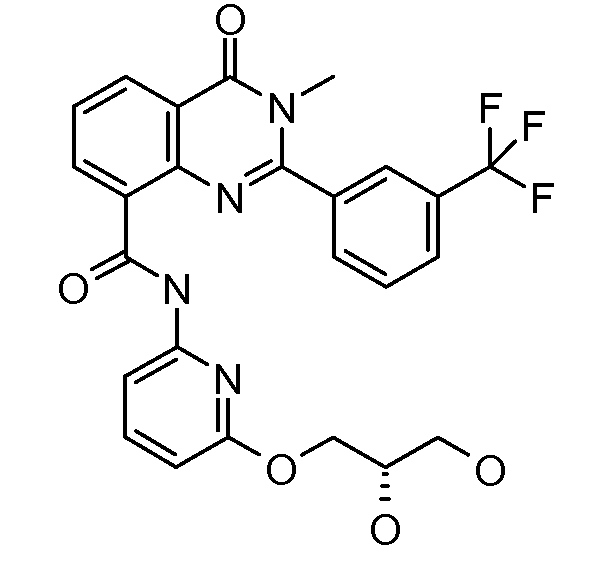
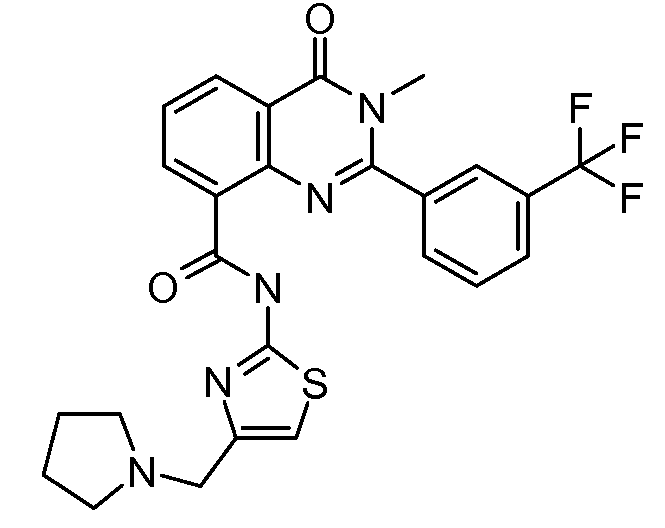
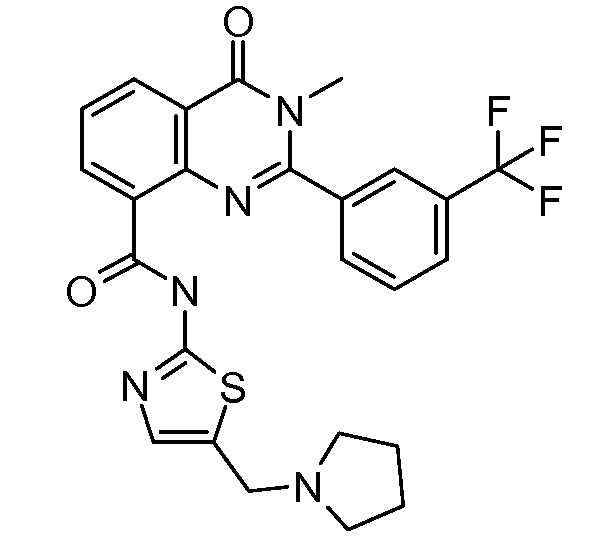
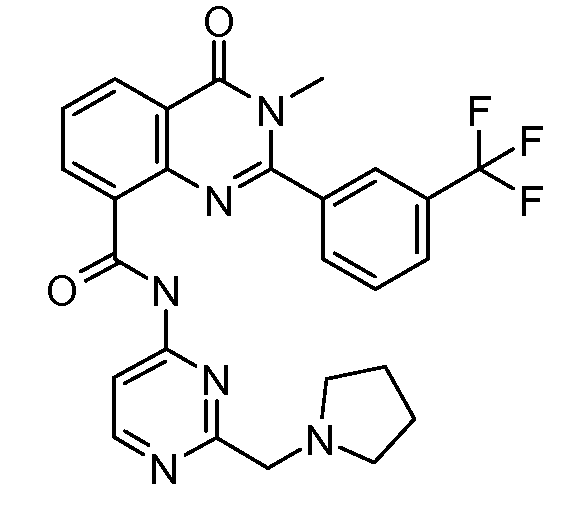
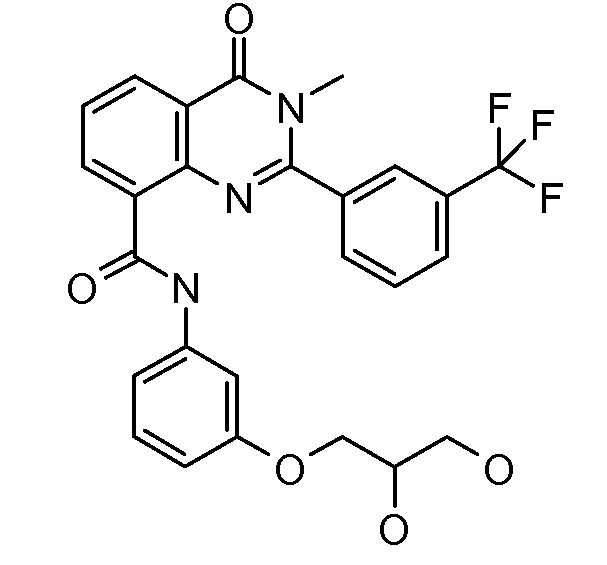
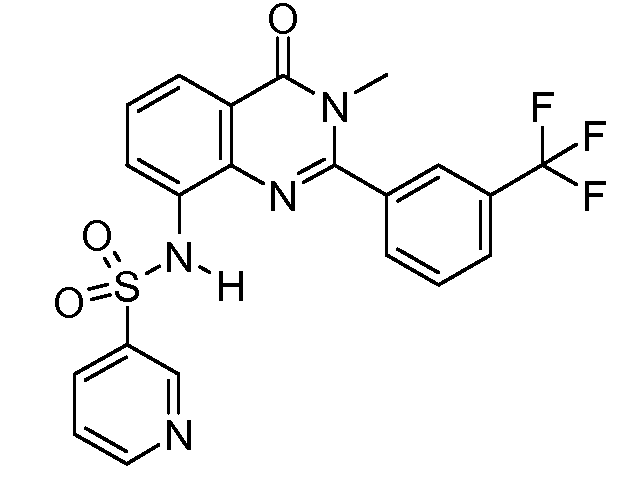
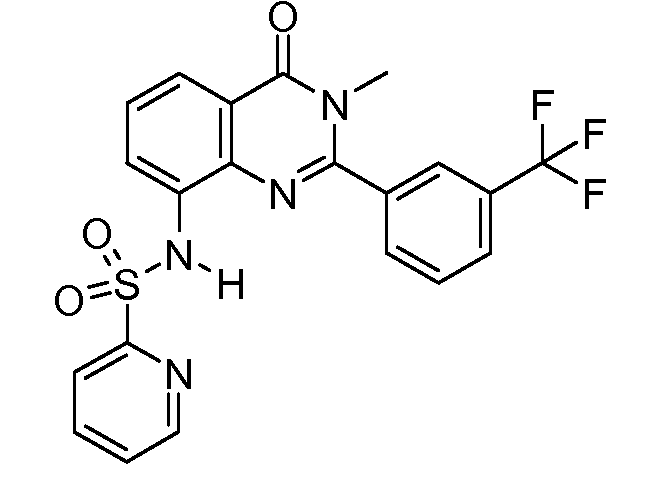
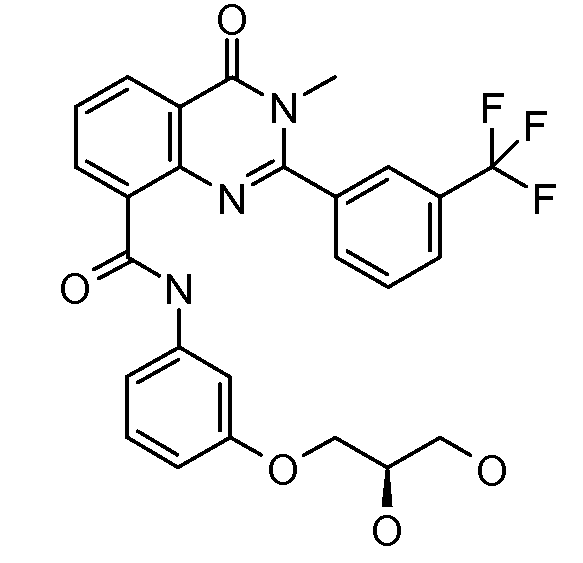
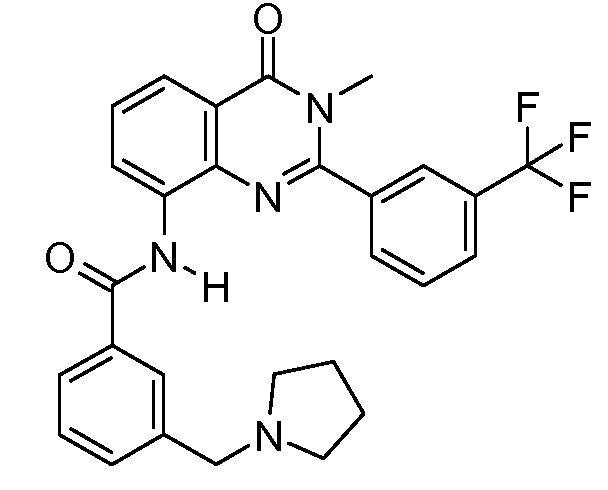
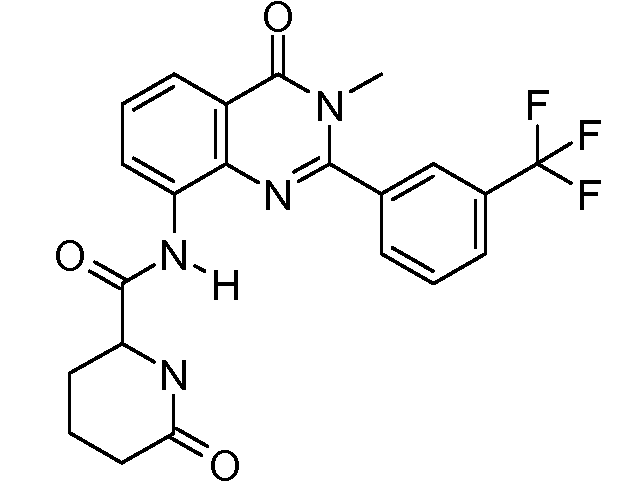
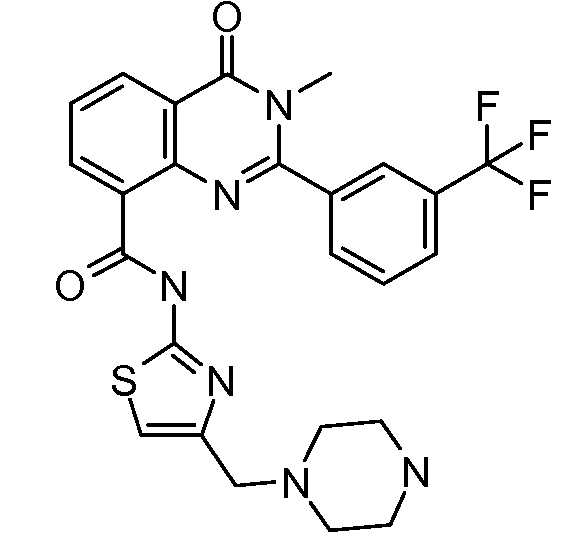
В конкретных вариантах осуществления соединение этого изобретения выбирают из любого одного из соединений 201, 202, 204, 206, 207, 218, 219, 220, 230, 232, 233, 234, 239, 245, 246, 248, 249, 267, 273, 274, 286, 293, 294, 297, 298, 302, 304, 306, 309, 310, 312, 313, 314, 315, 317, 318, 320, 324, 326, 329, 330, 332, 333, 335, 336, 338, 341, 342, 344, 345, 346, 347, 348, 349, 351, 352, 353, 354, 355, 356, 357, 360, 363 и 366 из таблицы 1. В одном аспекте соединение выбирают из любого одного из соединений 201, 202, 204, 218, 220, 230, 239, 245, 248, 249, 274, 286, 293, 309, 310, 312, 313, 314, 315, 317, 318, 329, 330, 332, 333, 335, 336, 341, 344, 345, 346, 349, 352, 354, 355, 357 и 360.
Соединения, где W1 является N и W2 является C
№
мкМ
%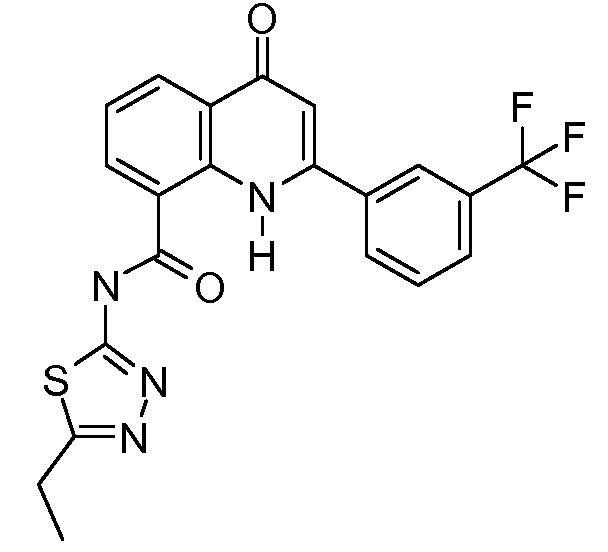
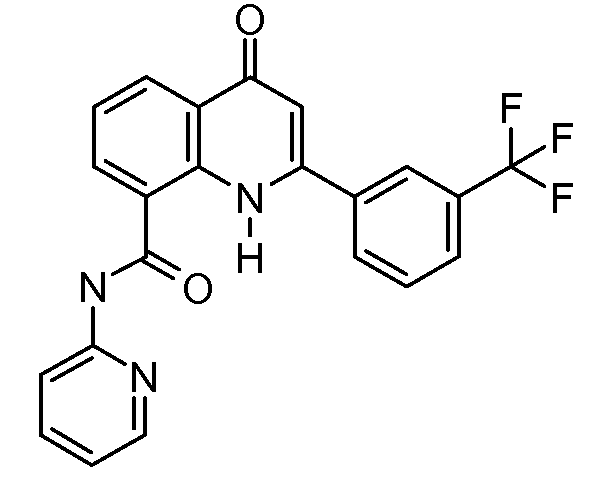
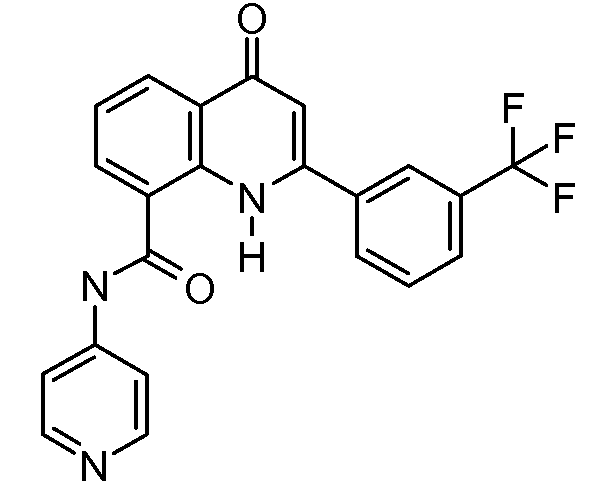
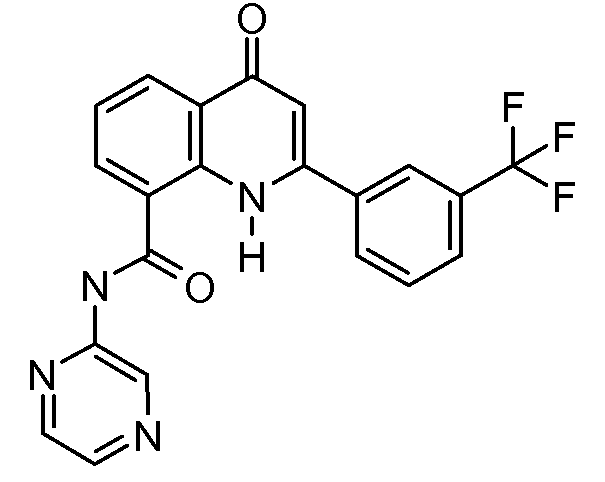
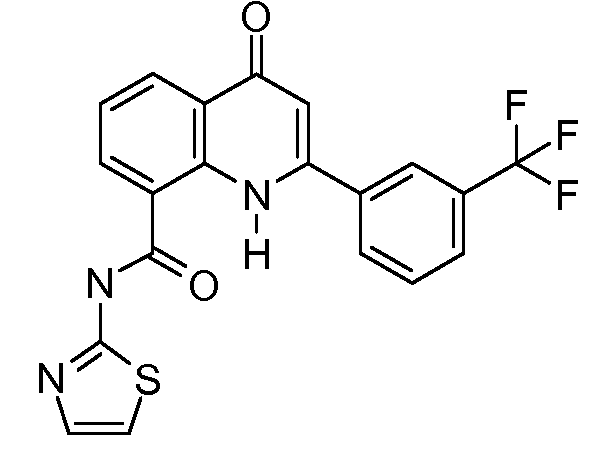
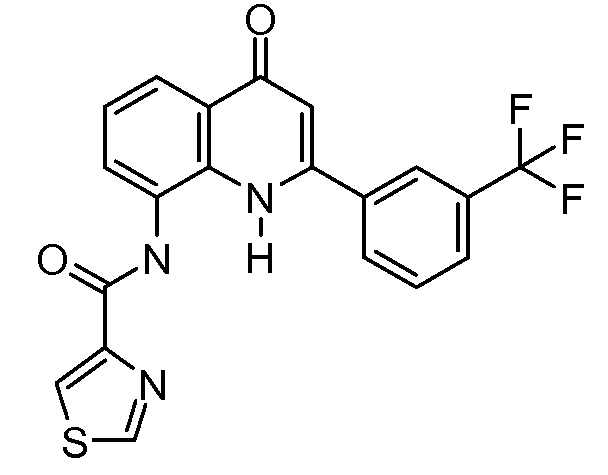
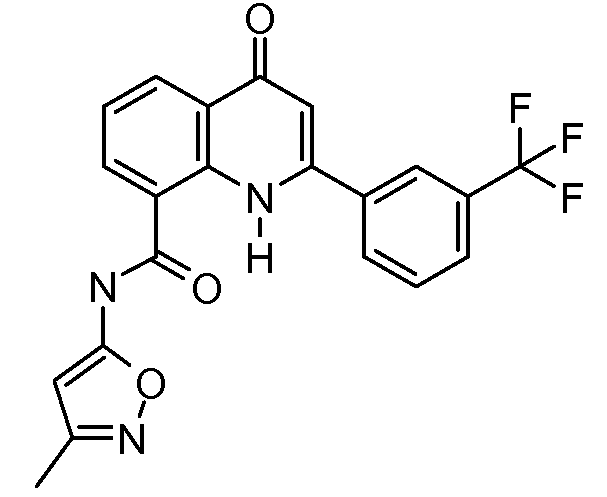
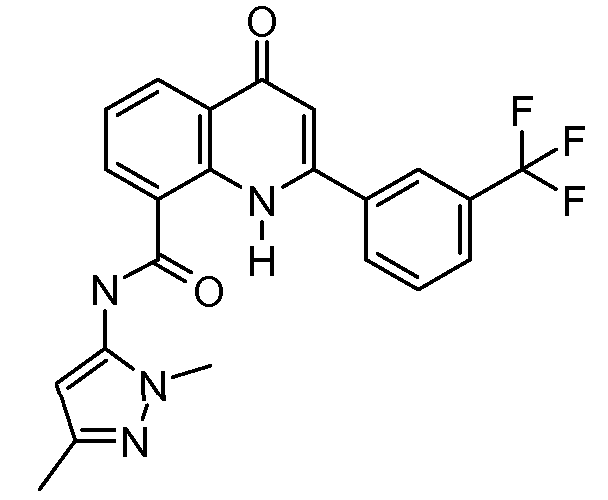
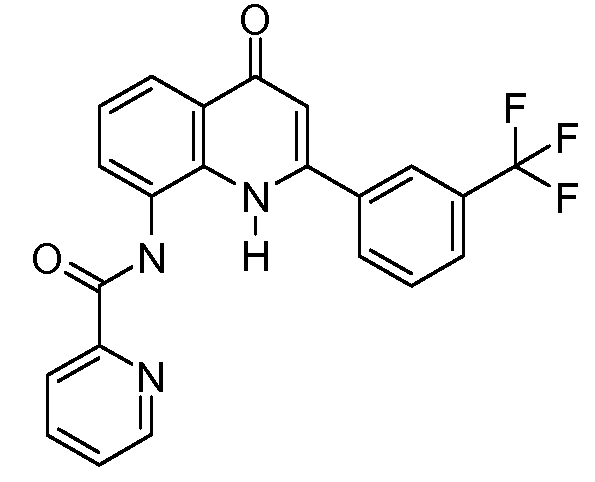
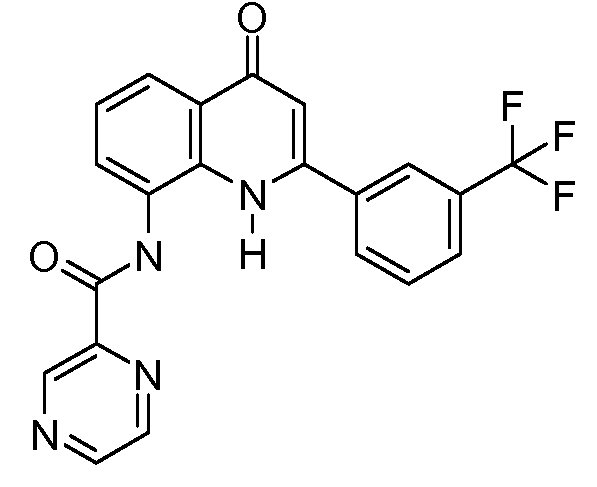
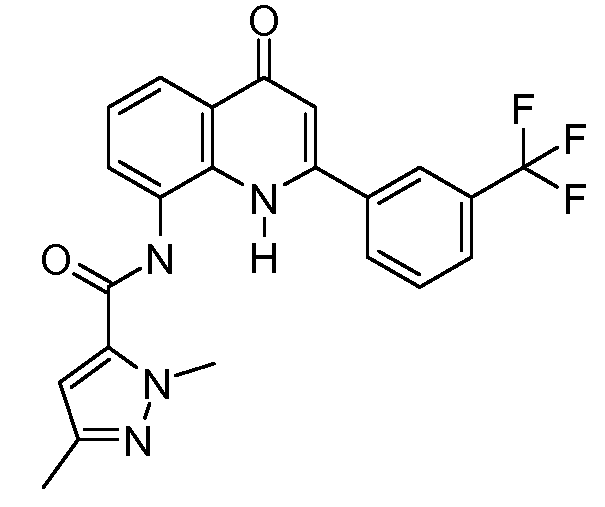
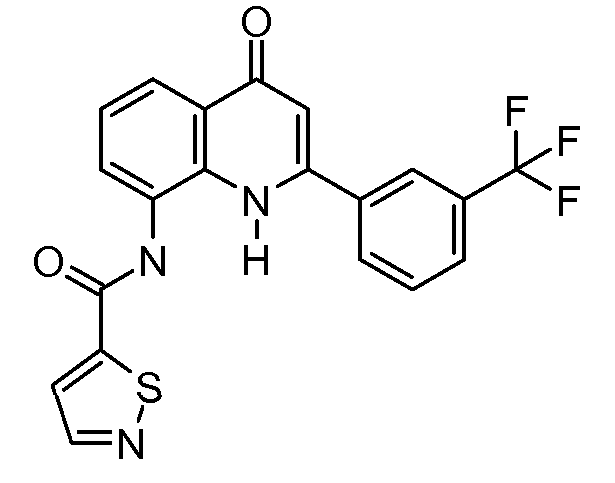
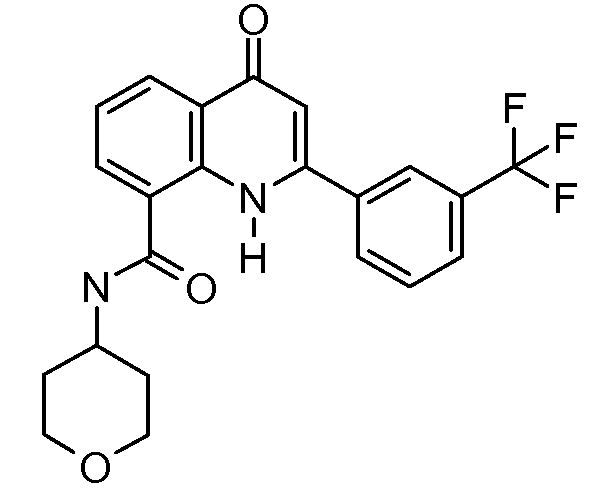
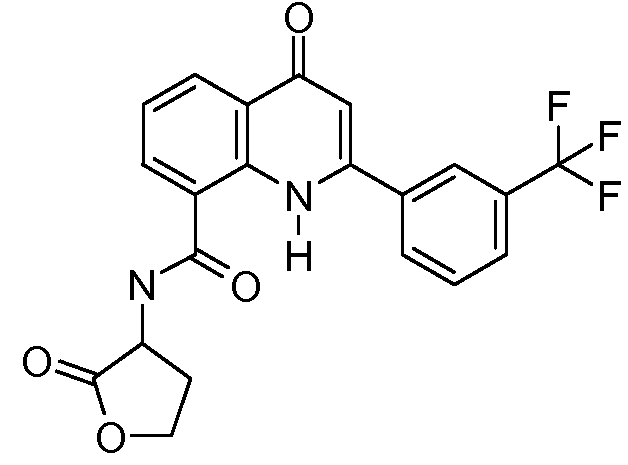
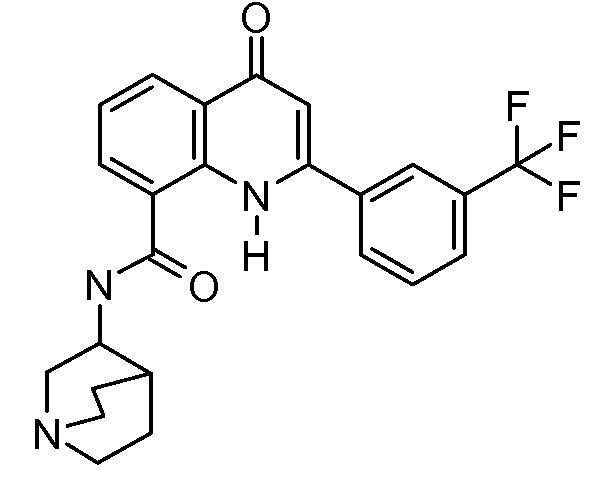
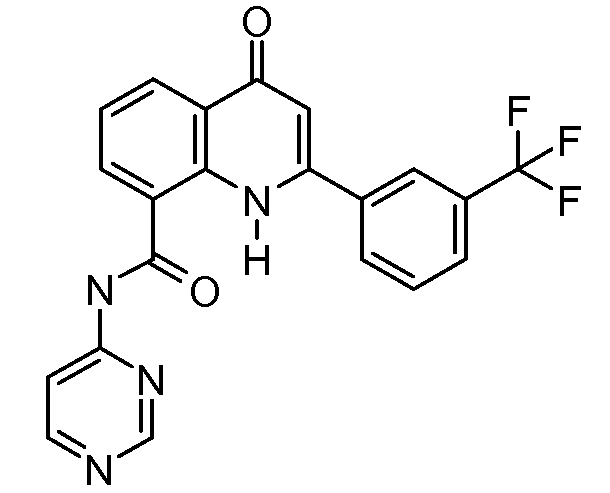
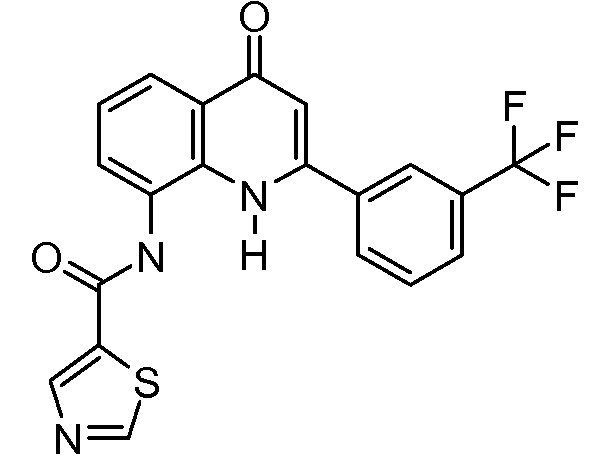

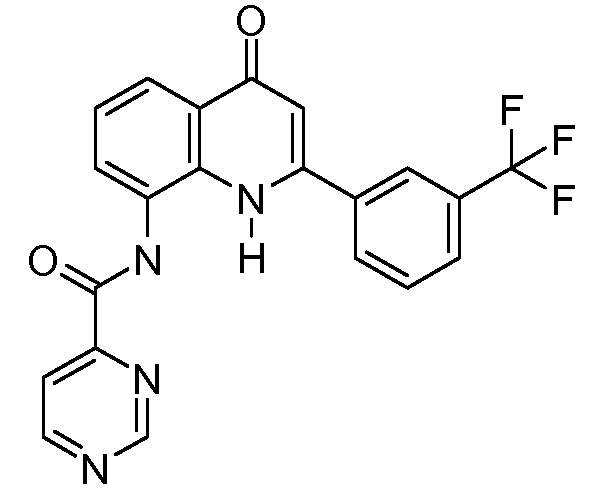
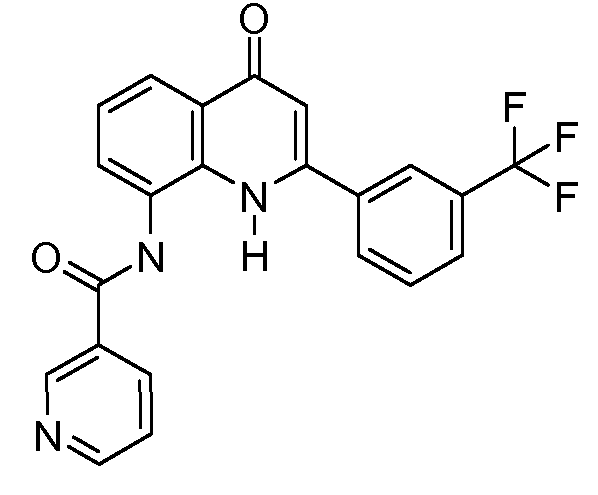
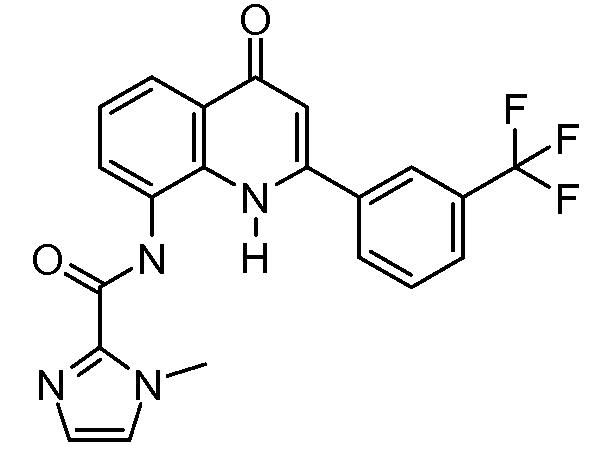
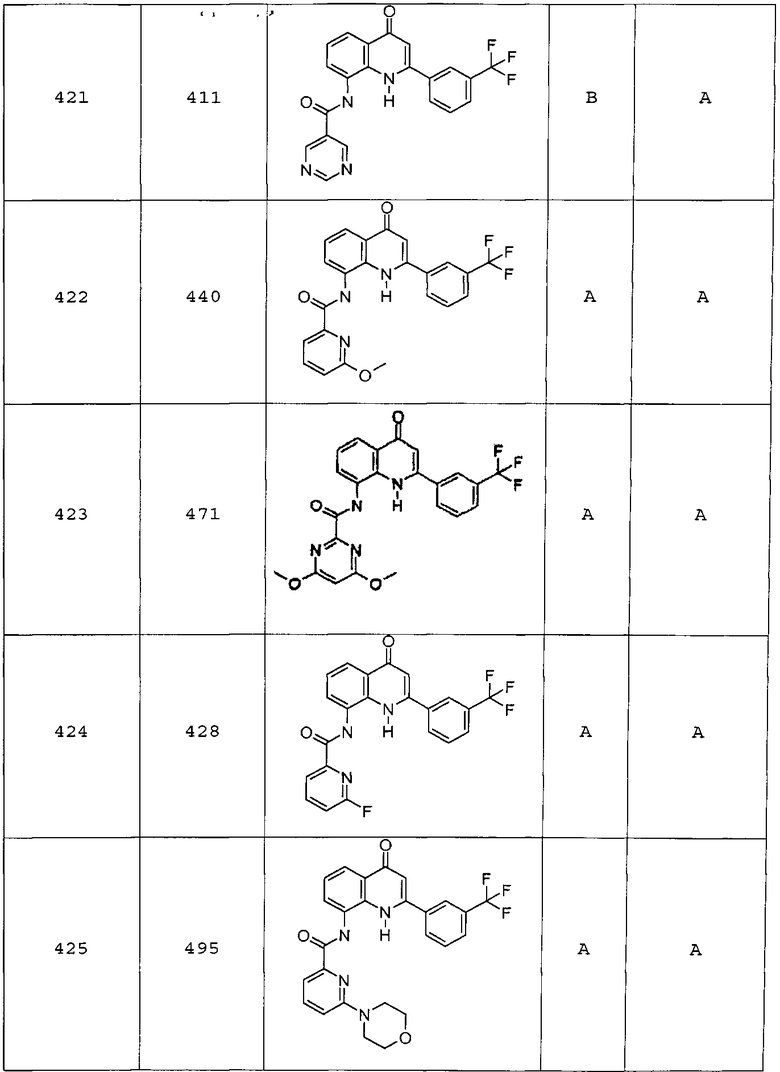
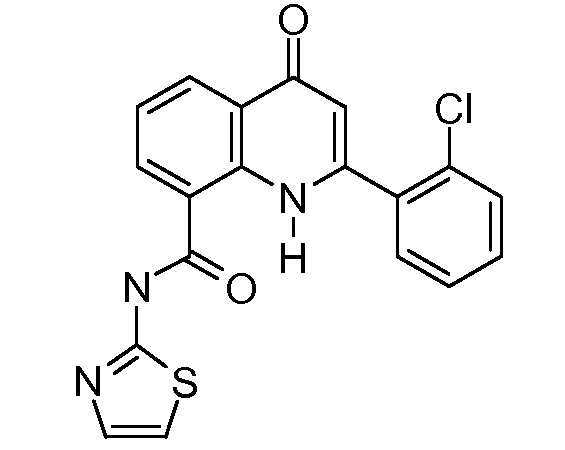
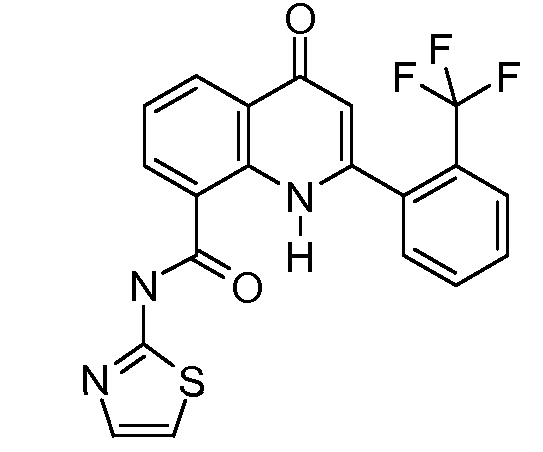
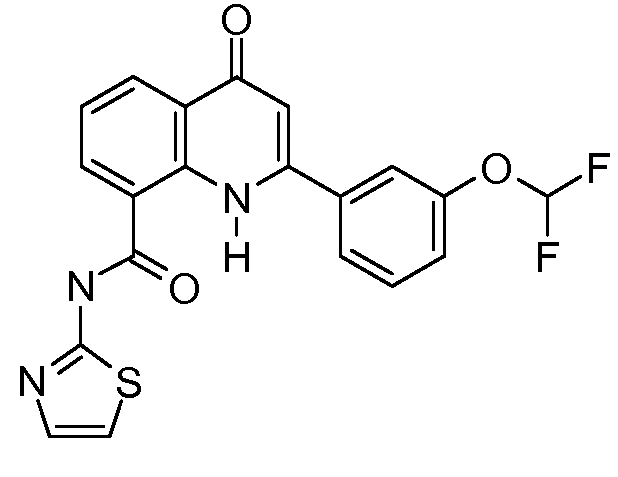
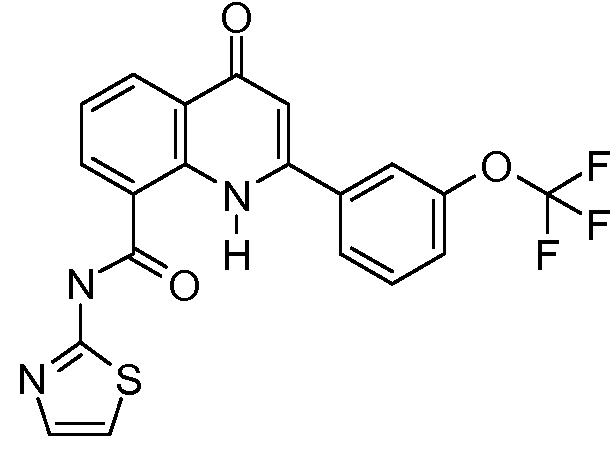
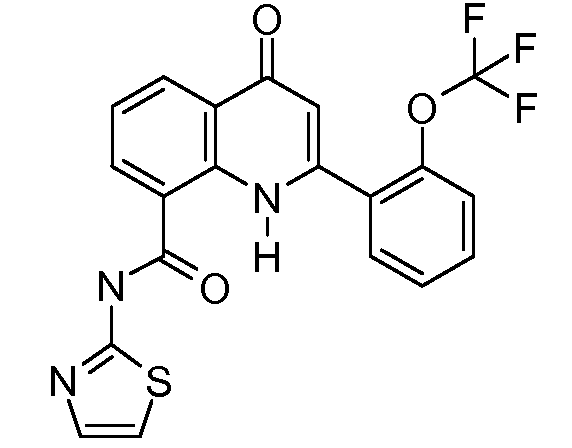
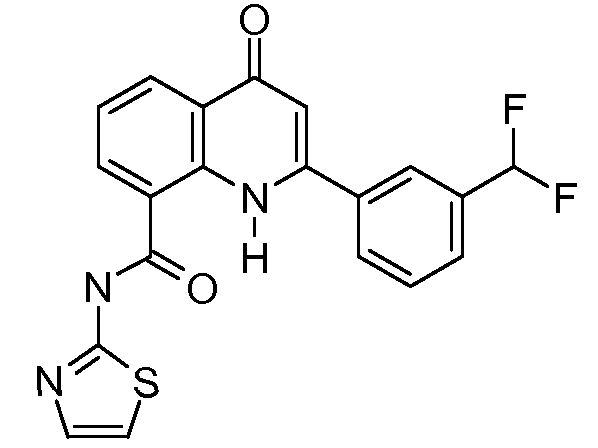
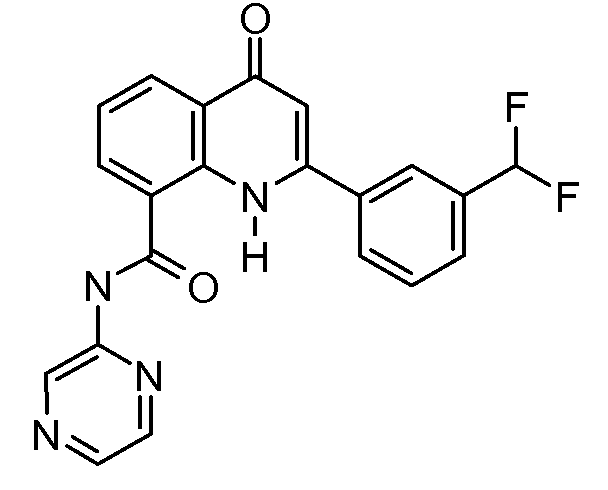
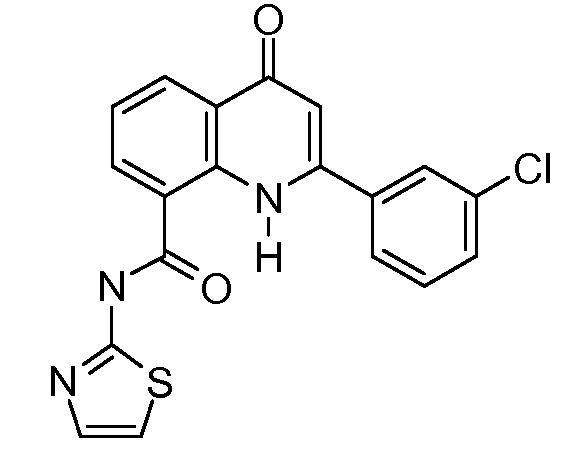
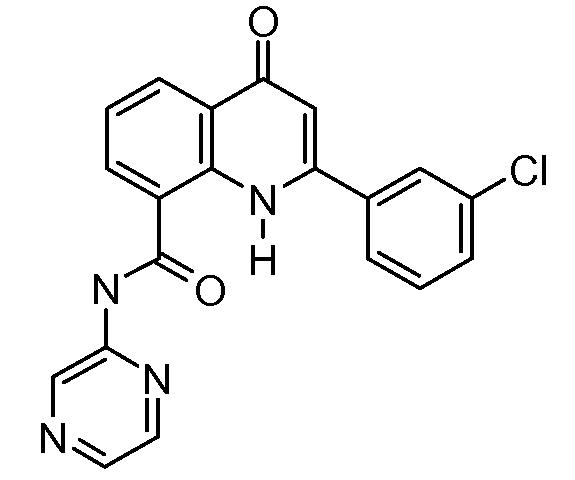
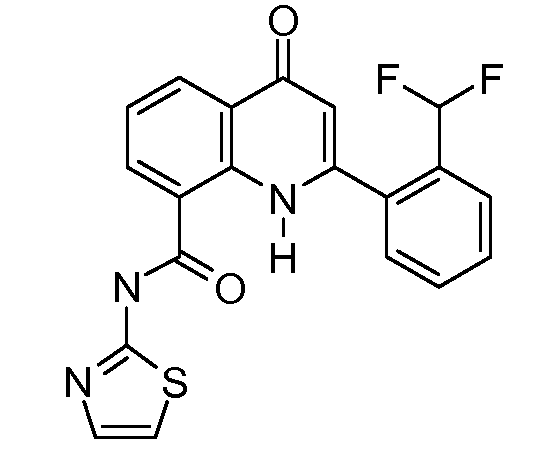
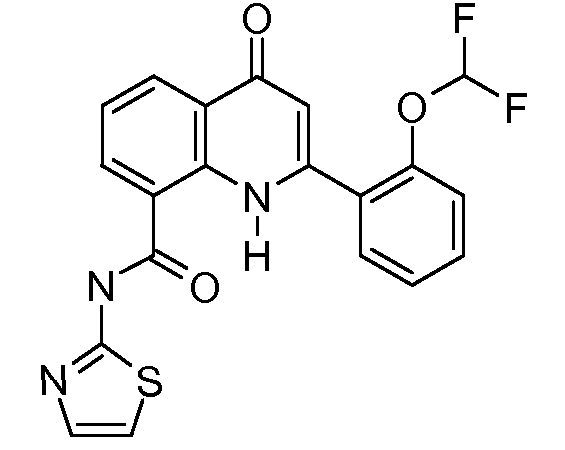
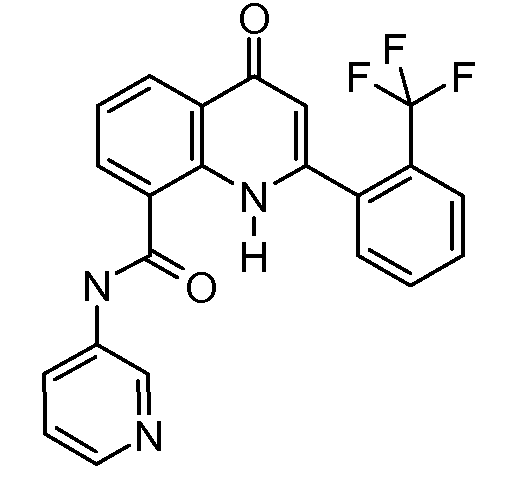
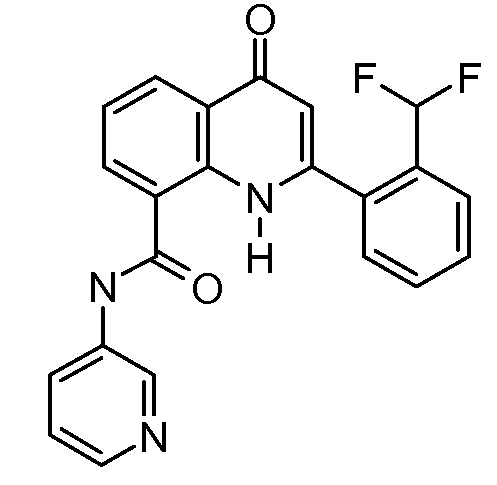
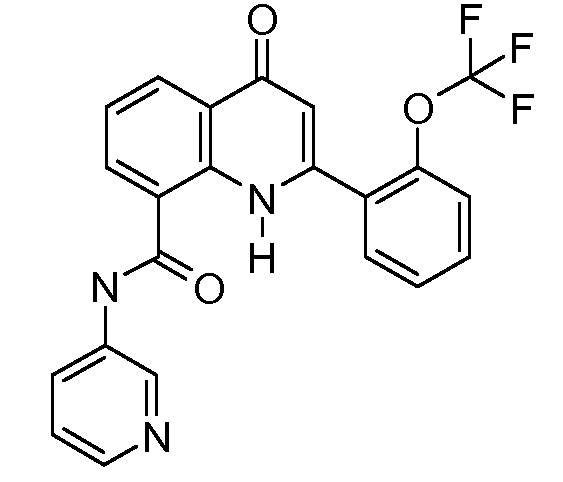
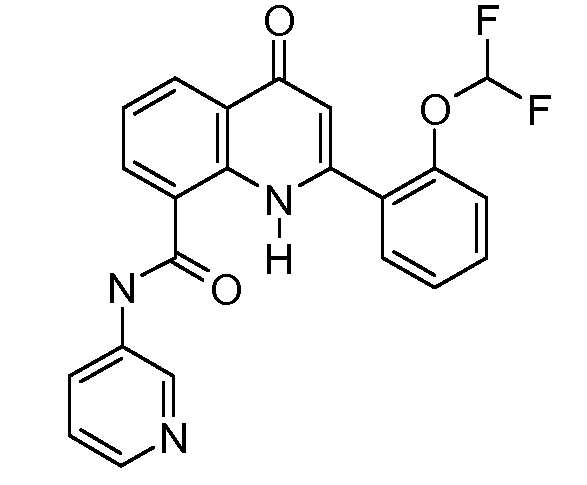
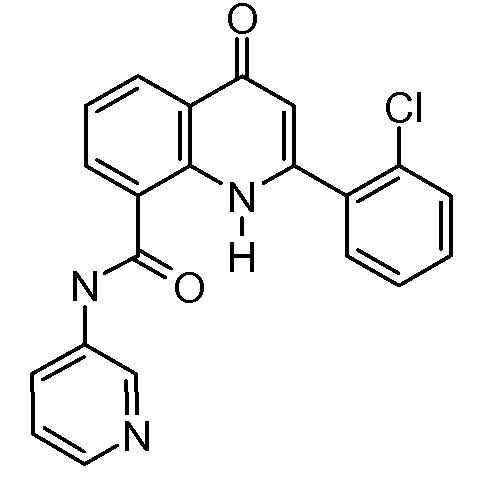
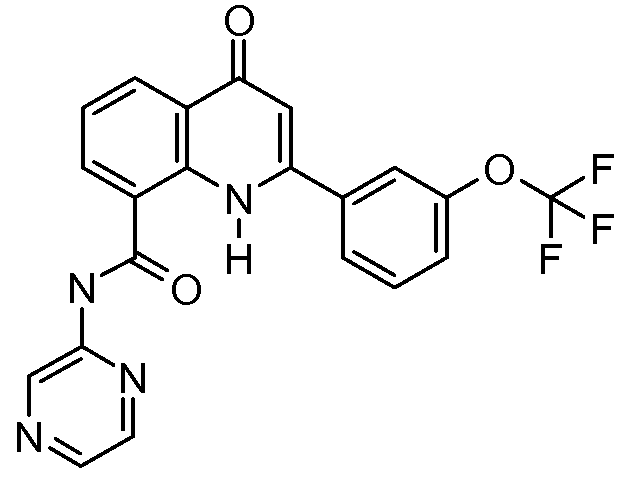
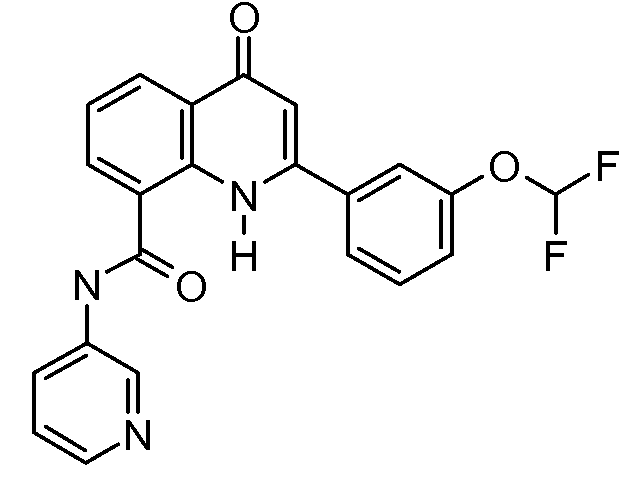
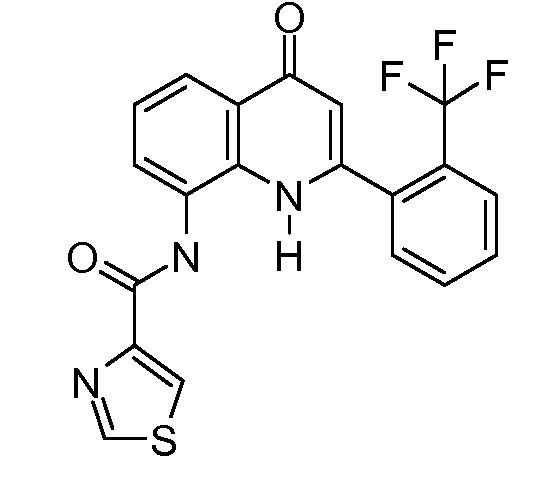
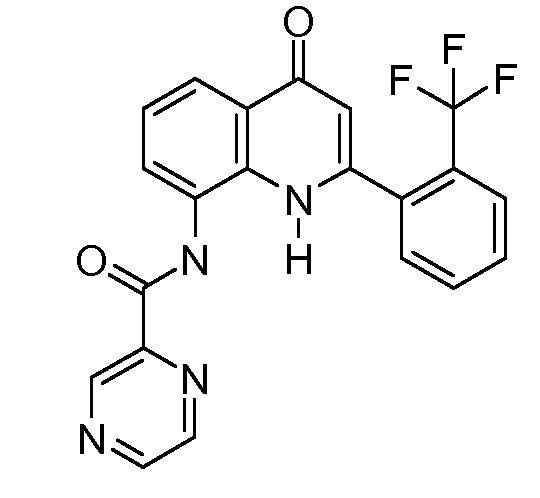
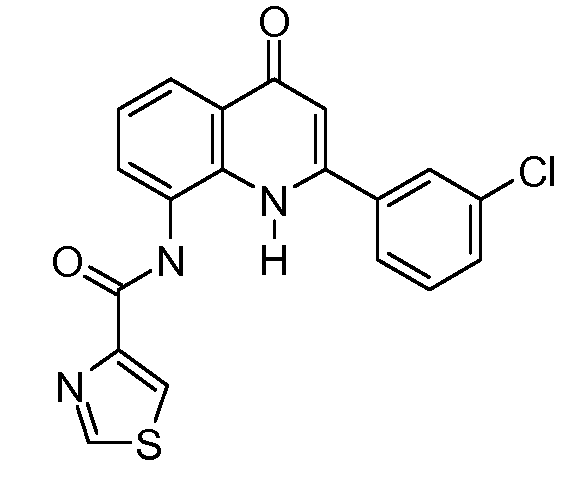
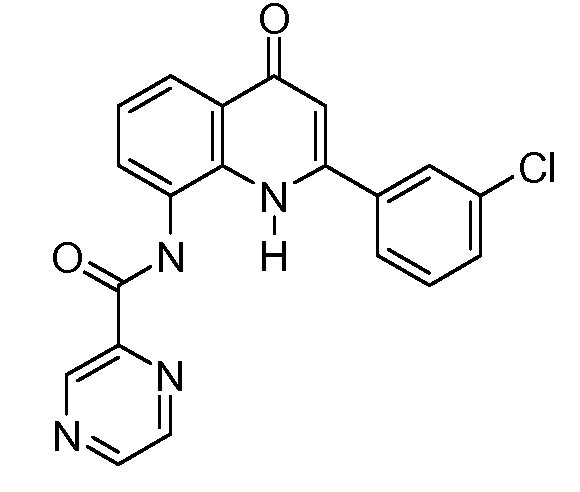
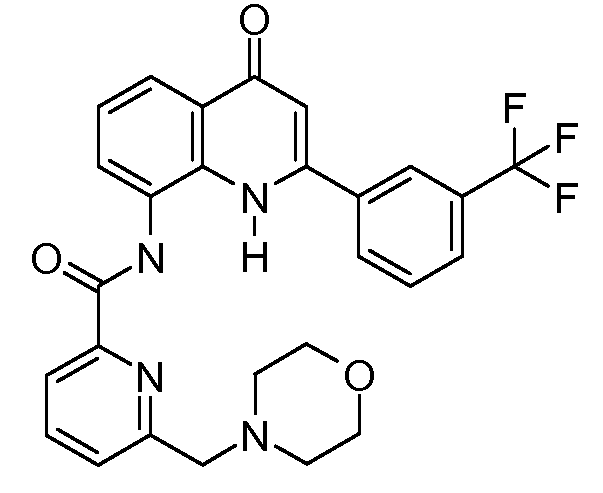
В конкретных вариантах осуществления соединение этого изобретения выбирают из любого одного из соединений 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 415, 416, 417, 418, 419, 420, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 436, 437, 439, 442, 443, 444, 445, 447, 448 и 449 из таблицы 2. В одном аспекте соединение этого изобретения выбирают из любого одного из соединений 400, 401, 402, 403, 404, 405, 406, 408, 409, 410, 415, 417, 418, 420, 423, 424, 425, 428, 431, 432, 434, 442, 443, 445 и 448.
ЭКВИВАЛЕНТЫ
Настоящее изобретение предлагает, в частности, активирующие сиртуин соединения и способы их применения. Несмотря на то что в описании заявки были обсуждены конкретные варианты осуществления настоящего изобретения, приведенное выше описание заявки является иллюстрацией, а не ограничением. При ознакомлении с описанием заявки для специалистов в этой области может стать очевидным наличие многих вариантов осуществления изобретения. Полный объем изобретения должен определяться, исходя из пунктов формулы изобретения вместе с их полным объемом эквивалентов и описания вместе с такими вариантами.
ВКЛЮЧЕНИЕ В ОПИСАНИЕ ИЗОБРЕТЕНИЯ СВЕДЕНИЙ ПУТЕМ ССЫЛКИ
Содержание всех упомянутых в описании публикаций и патентов, включая приведенный ниже перечень, приводятся в описании путем ссылки на них, как если бы содержание каждой индивидуальной публикации или патента было конкретно и индивидуально приведено в описании. В случае противоречия, настоящая заявка, включая любое в ней определение, будет приниматься во внимание в первую очередь.
Кроме того, в описании приводятся полинуклеотидные и полипептидные последовательности путем ссылки на номер их депонирования, взаимосвязанный с входом в общедоступные базы данных, такие как базы данных, поддерживаемые Институтом геномных исследований (Institute for Genomic Research (TIGR)) (www.tigr.org) и/или Национальным центром биотехнологической информации (National Center for Biotechnology Information (NCBI)) (www.ncbi.nlm.nih.gov).http://www.wipo.int/portal/en/scam_warning.html
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ ХРОМЕНОНА В КАЧЕСТВЕ МОДУЛЯТОРОВ СИРТУИНА | 2009 |
|
RU2527269C2 |
| БИЦИКЛИЧЕСКИЕ ПИРИДИНЫ И АНАЛОГИ В КАЧЕСТВЕ МОДУЛЯТОРОВ СИРТУИНА | 2010 |
|
RU2550821C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ | 2012 |
|
RU2631597C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С СИРТУИНОМ (SIRT), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К СИРТУИНУ (SIRT) | 2011 |
|
RU2693462C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ, АУТОИММУННЫХ РАССТРОЙСТВ И БОЛИ | 2014 |
|
RU2669800C2 |
| ЛЕЧЕНИЕ СИРТУИН 1 (SIRT1)-СВЯЗАННЫХ ЗАБОЛЕВАНИЙ ПУТЕМ ИНГИБИРОВАНИЯ НАТУРАЛЬНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА | 2009 |
|
RU2551234C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ИНГИБИРОВАНИЯ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ BCL С КОМПОНЕНТАМИ СВЯЗЫВАНИЯ | 2006 |
|
RU2424230C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ МОДУЛИРОВАНИЯ КИНАЗ И ПОКАЗАНИЯ К ПРИМЕНЕНИЮ УКАЗАННЫХ СОЕДИНЕНИЙ И СПОСОБОВ | 2008 |
|
RU2487121C2 |
| БИ- И ПОЛИЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА И ИЗОХИНОЛИНОНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ RHO-КИНАЗЫ | 2009 |
|
RU2532481C2 |
| 6-ЗАМЕЩЕННЫЕ ИЗОХИНОЛИНЫ И ИЗОХИНОЛИНОНЫ ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2009 |
|
RU2528229C2 |
Изобретение относится к соединению структурной формулы (II)
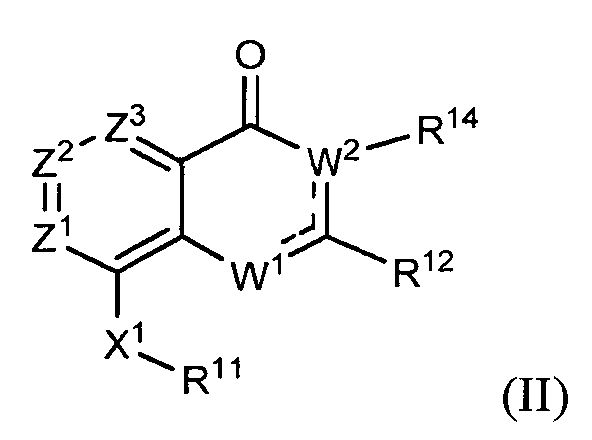
или к его соли, где каждый из Z1, Z2 и Z3 независимо выбирают из N и C(R9), где не более чем один из Z1, Z2 и Z3 является N; каждый R9 представляет собой водород; и  представляет вторую химическую связь между либо W2 и C(R12), либо W1 и C(R12); W1 представляет собой -N=, и W2(R14) выбирают из -N(R14)- и - C(R14)=, выбирая так, что когда W1 является -N=, W2(R14) является -N(R14)- и
представляет вторую химическую связь между либо W2 и C(R12), либо W1 и C(R12); W1 представляет собой -N=, и W2(R14) выбирают из -N(R14)- и - C(R14)=, выбирая так, что когда W1 является -N=, W2(R14) является -N(R14)- и  представляет вторую химическую связь между W1 и C(R12); R11 выбирают из фенила и гетероцикла, который выбирают из насыщенного или ароматического 5-6-членного моноциклического кольца, включающего один, или два, или три гетероатома, выбранного из N, O и S, или 8-членного бициклического кольца, включающего один или более гетероатомов, выбранных из N, O и S, где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, C1-C4 алкила, =O, -O-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13), где каждый R13 независимо выбирают из -C1-C4алкила; или два R13 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из NH и O, где когда R13 является алкилом, алкил необязательно замещен одним или более заместителями, выбранными из -OH, фтора, и когда два R13 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный насыщенный гетероцикл, насыщенный гетероцикл необязательно замещен на любом углеродном атоме фтором; R12 выбирают из фенила, 4-6-членного моноциклического насыщенного кольца и гетероцикла, который выбран из ароматического 5-6-членного моноциклического кольца, включающего один или два гетероатома, выбранных из N и S, где R12 необязательно замещен одним или более заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, C1-C2 фторзамещенного алкила, -O-R13, -S(O)2-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13); R14 выбирают из водорода, C1-C4 алкила, C1-C4 фторзамещенного алкила, C1-C4 алкил-N(R13)(R13), C1-C4 алкил-C(O)-N(R13)(R13); и X1 выбирают из -NH-C(=O)-†, -C(=O)-NH-†, -NH-S(=O)2-†, где † обозначает место, в котором X1 соединен с R11. Изобретение также относится к фармацевтической композиции, обладающей сиртуин моделирующей активностью, на основе указанных соединений. Технический результат: получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения субъекта, страдающего от или подверженного резистентности к инсулину, метаболическому синдрому, диабету или его осложнениям. 4 н. и 14 з.п. ф-лы, 2 табл., 52 пр.
представляет вторую химическую связь между W1 и C(R12); R11 выбирают из фенила и гетероцикла, который выбирают из насыщенного или ароматического 5-6-членного моноциклического кольца, включающего один, или два, или три гетероатома, выбранного из N, O и S, или 8-членного бициклического кольца, включающего один или более гетероатомов, выбранных из N, O и S, где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, C1-C4 алкила, =O, -O-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13), где каждый R13 независимо выбирают из -C1-C4алкила; или два R13 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из NH и O, где когда R13 является алкилом, алкил необязательно замещен одним или более заместителями, выбранными из -OH, фтора, и когда два R13 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный насыщенный гетероцикл, насыщенный гетероцикл необязательно замещен на любом углеродном атоме фтором; R12 выбирают из фенила, 4-6-членного моноциклического насыщенного кольца и гетероцикла, который выбран из ароматического 5-6-членного моноциклического кольца, включающего один или два гетероатома, выбранных из N и S, где R12 необязательно замещен одним или более заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, C1-C2 фторзамещенного алкила, -O-R13, -S(O)2-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13); R14 выбирают из водорода, C1-C4 алкила, C1-C4 фторзамещенного алкила, C1-C4 алкил-N(R13)(R13), C1-C4 алкил-C(O)-N(R13)(R13); и X1 выбирают из -NH-C(=O)-†, -C(=O)-NH-†, -NH-S(=O)2-†, где † обозначает место, в котором X1 соединен с R11. Изобретение также относится к фармацевтической композиции, обладающей сиртуин моделирующей активностью, на основе указанных соединений. Технический результат: получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения субъекта, страдающего от или подверженного резистентности к инсулину, метаболическому синдрому, диабету или его осложнениям. 4 н. и 14 з.п. ф-лы, 2 табл., 52 пр.
1. Соединение, имеющее структуру, описываемую структурной формулой (II):

или его соль, где
каждый из Z1, Z2 и Z3 независимо выбирают из N и C(R9), где
не более чем один из Z1, Z2 и Z3 является N;
каждый R9 представляет собой водород; и
 представляет вторую химическую связь между либо W2 и C(R12), либо W1 и C(R12);
представляет вторую химическую связь между либо W2 и C(R12), либо W1 и C(R12);
W1 представляет собой -N=, и
W2(R14) выбирают из -N(R14)- и - C(R14)=, выбирая так, что когда W1 является -N=, W2(R14) является -N(R14)- и  представляет вторую химическую связь между W1 и C(R12);
представляет вторую химическую связь между W1 и C(R12);
R11 выбирают из фенила и гетероцикла, который выбирают из насыщенного или ароматического 5-6-членного моноциклического кольца, включающего один, или два, или три гетероатома, выбранного из N, O и S, или 8-членного бициклического кольца, включающего один или более гетероатомов, выбранных из N, O и S, где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, C1-C4 алкила, =O, -O-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13), где
каждый R13 независимо выбирают из -C1-C4алкила; или два R13 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из NH и O, где
когда R13 является алкилом, алкил необязательно замещен одним или более заместителями, выбранными из -OH, фтора, и когда два R13 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный насыщенный гетероцикл, насыщенный гетероцикл необязательно замещен на любом углеродном атоме фтором;
R12 выбирают из фенила, 4-6-членного моноциклического насыщенного кольца и гетероцикла, который выбран из ароматического 5-6-членного моноциклического кольца, включающего один или два гетероатома, выбранных из N и S, где R12 необязательно замещен одним или более заместителями, независимо выбранными из галогена, -C≡N, C1-C4 алкила, C1-C2 фторзамещенного алкила, -O-R13, -S(O)2-R13, -(C1-C4 алкил)-N(R13)(R13), -N(R13)(R13);
R14 выбирают из водорода, C1-C4 алкила, C1-C4 фторзамещенного алкила, C1-C4 алкил-N(R13)(R13), C1-C4 алкил-C(O)-N(R13)(R13); и
X1 выбирают из -NH-C(=O)-†, -C(=O)-NH-†, -NH-S(=O)2-†, где
† обозначает место, в котором X1 соединен с R11.
2. Соединение по п.1, где соединение имеет структуру, представленную структурной формулой:
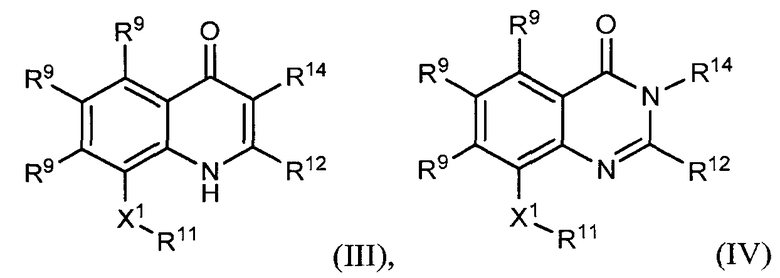 или
или
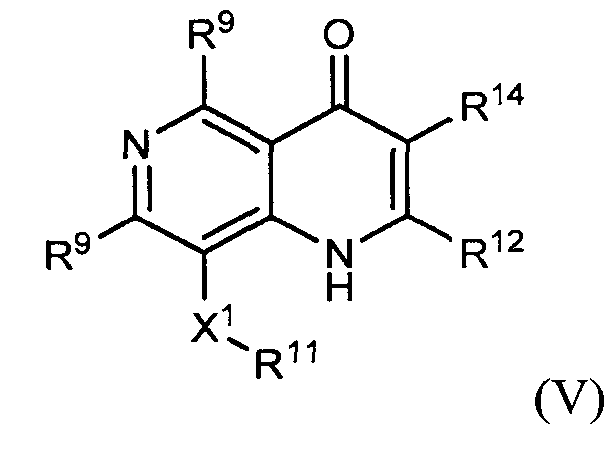 .
.
3. Соединение по п.1, где X1 выбирают из -NH-C(O)-† и -C(O)-NH-†.
4. Соединение по п.1, где R11 выбирают из
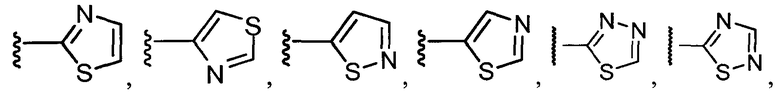
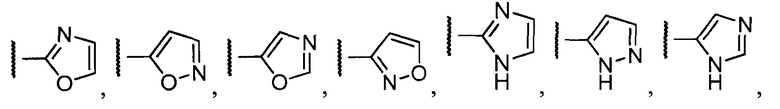
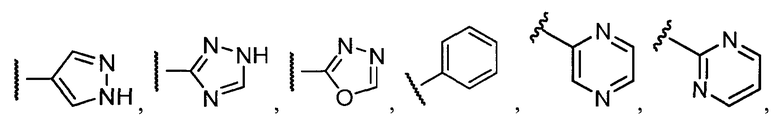

 и
и 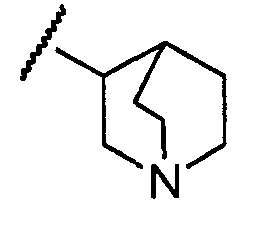
где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, C1-C4 алкила, -(C1-C4 алкил)-N(R13)(R13), =O, -N(R13)(R13) и -O-R13.
5. Соединение по п.4, где R11 выбирают из
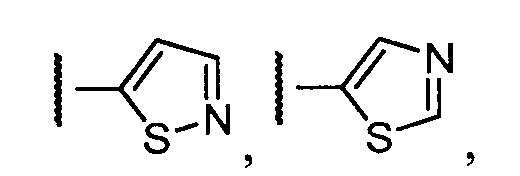
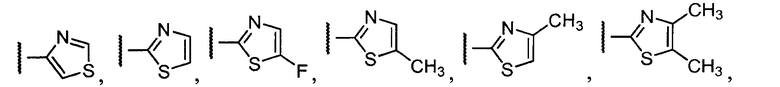
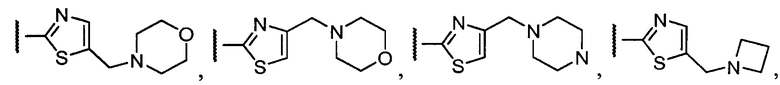
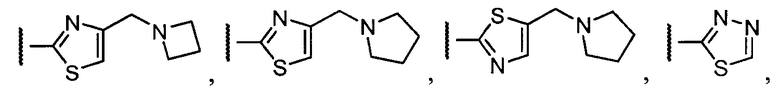
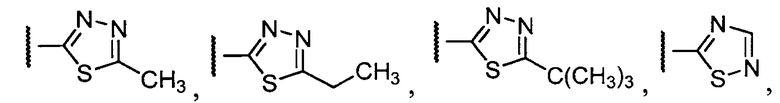
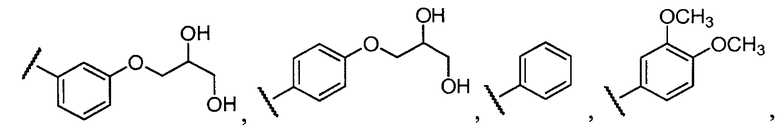
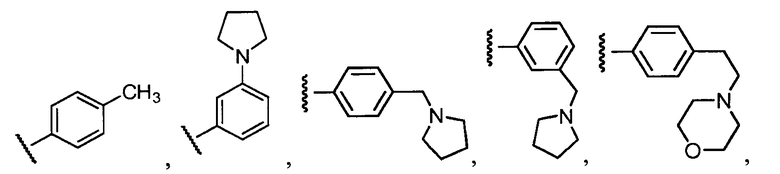
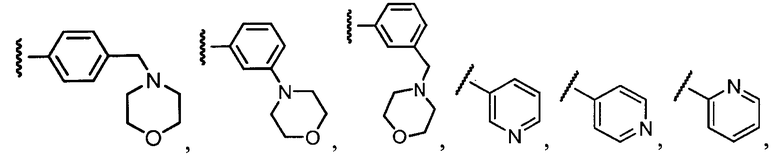
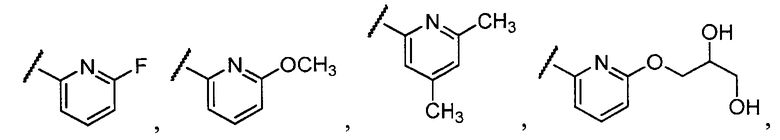
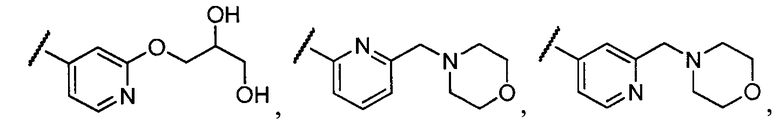
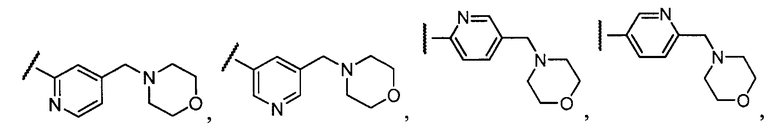
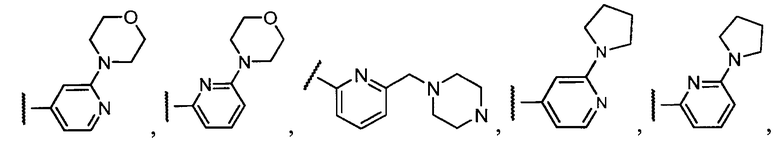
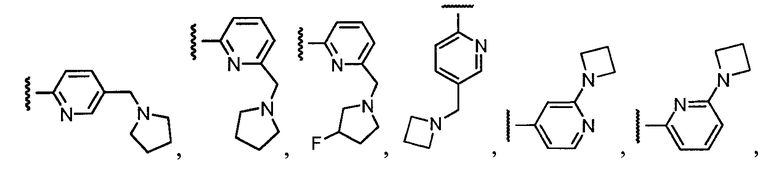
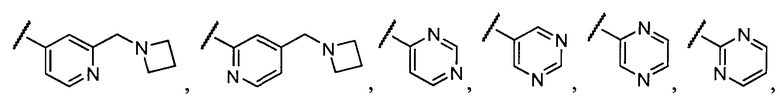
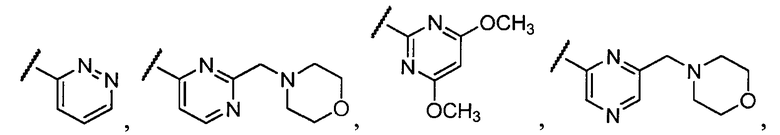
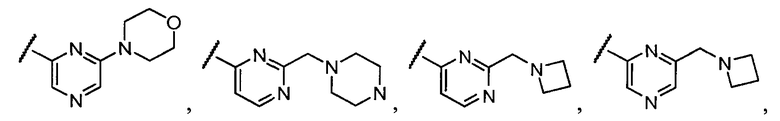
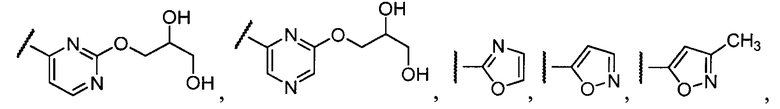
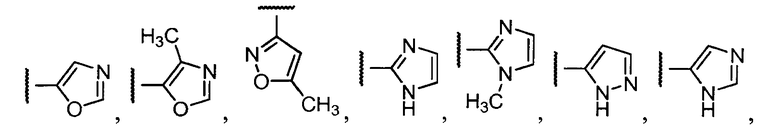
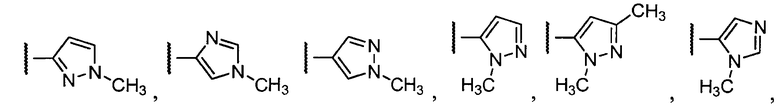
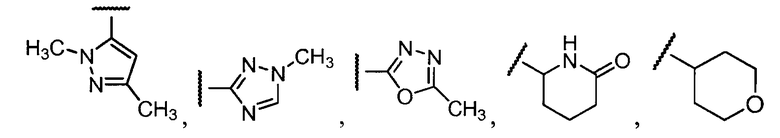
и 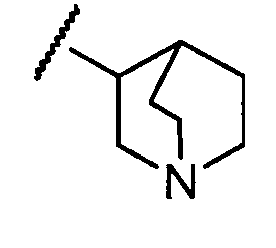 .
.
6. Соединение по п.5, где R11 выбирают из 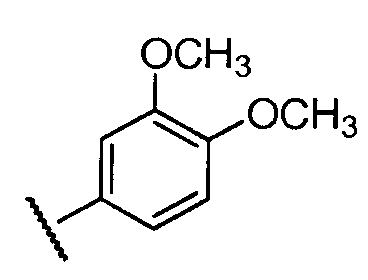
+
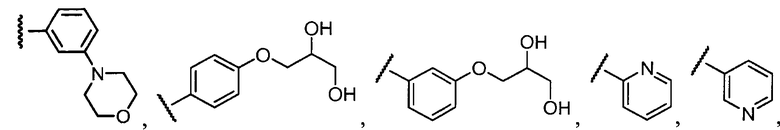
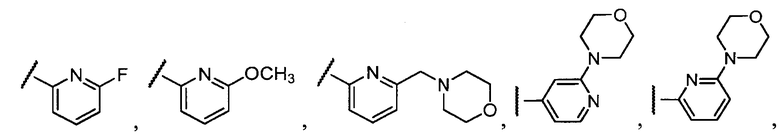
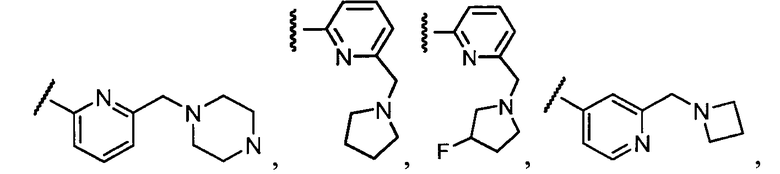
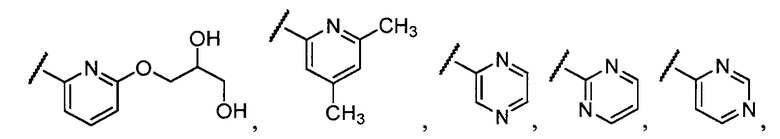
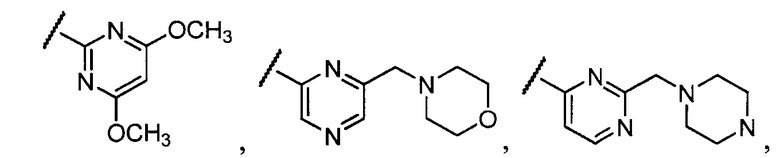
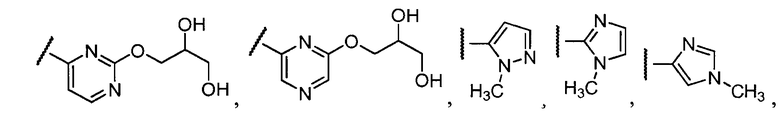
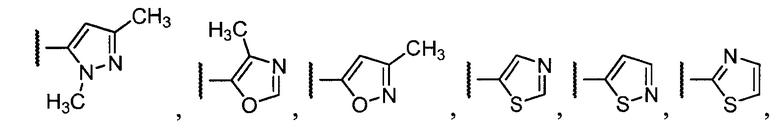
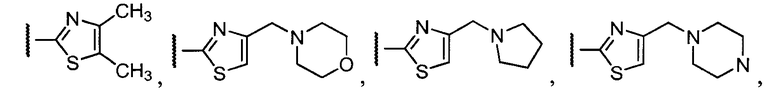
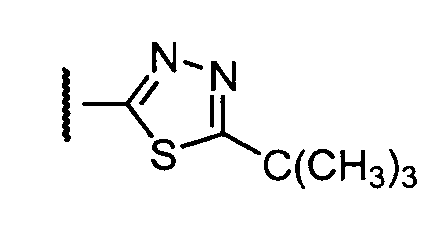 и
и 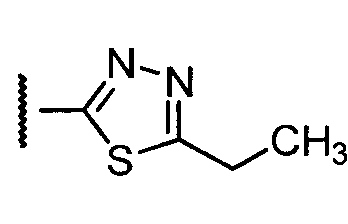 .
.
7. Соединение п.1, где R12 выбирают из
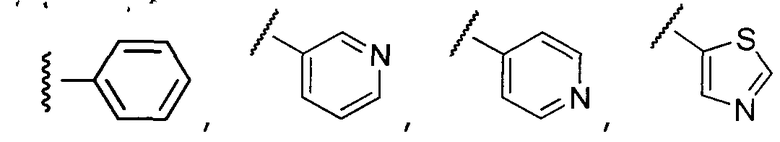 ,
,
где R12 необязательно замещен одной или более группами, независимо выбранными из галогена, C1-C4 алкила, -(C1-C4 алкил)-N(R13)(R13), C1-C2 фторзамещенного алкила, -O-R13, -SO2-R13, -N(R13)(R13).
8. Соединение по п.7, где R12 выбирают из
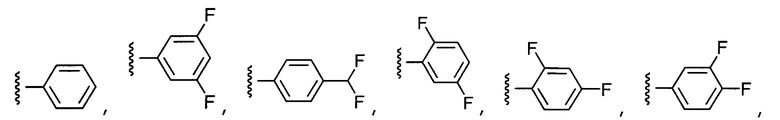
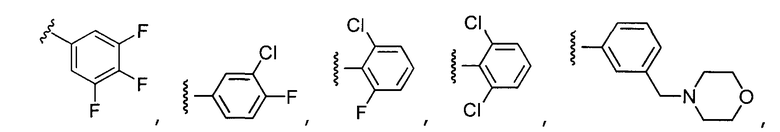
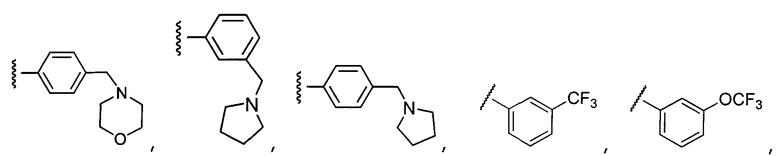
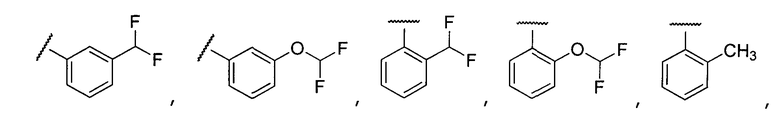
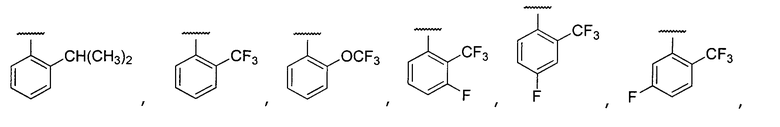
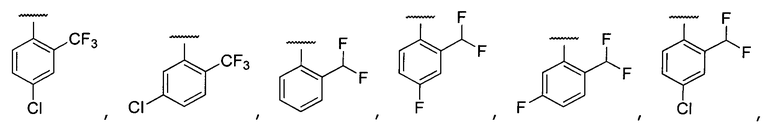
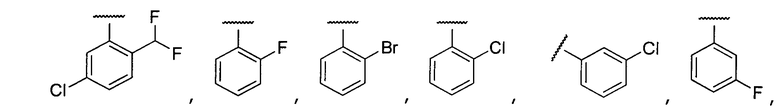
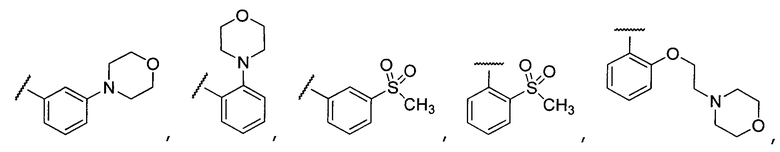
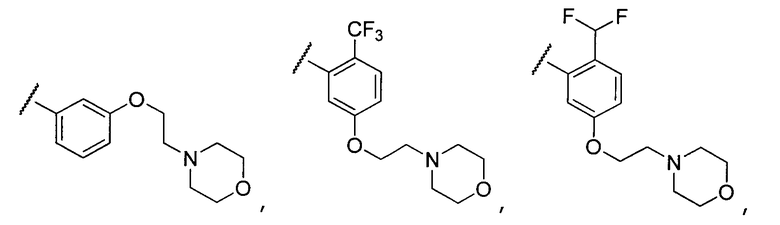
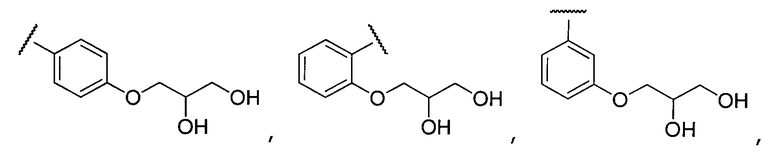
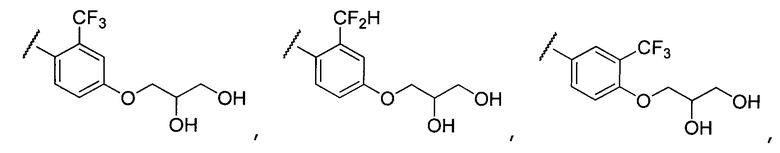
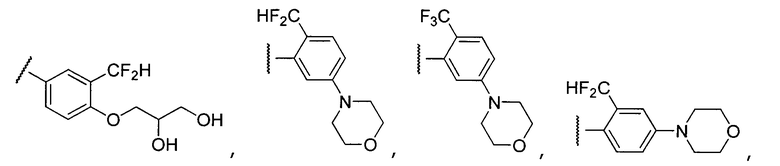
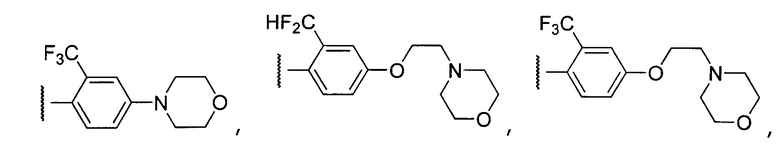
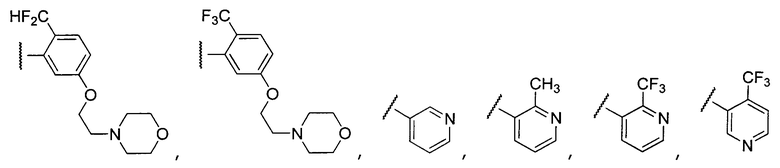 ,
,
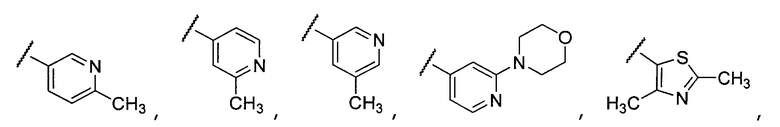
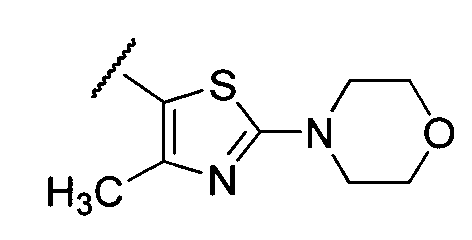
9. Соединение по п.8, где R12 выбирают из 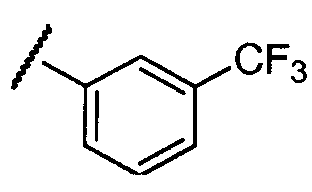 ,
,
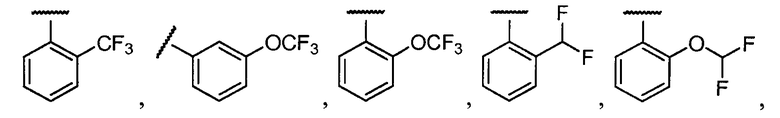
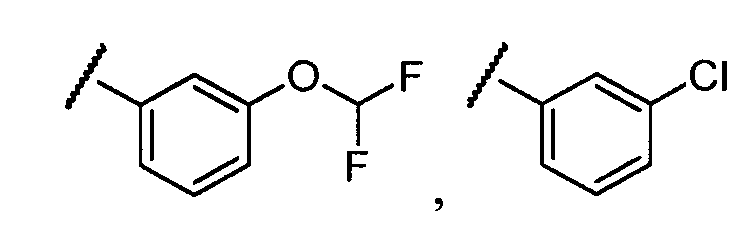 и
и  .
.
10. Соединение по п.1, где W2(R14) является -N(R14)- и R14 выбирают из водорода и -(C1-C4) алкила.
11. Соединение по п.1, где W2(R14) является -C(R14)- и R14 является водородом.
12. Соединение по п.1, где соединение выбирают из любого одного из соединений
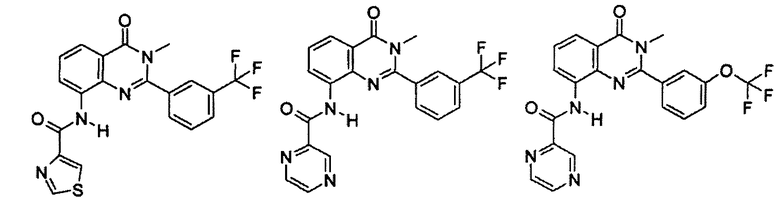
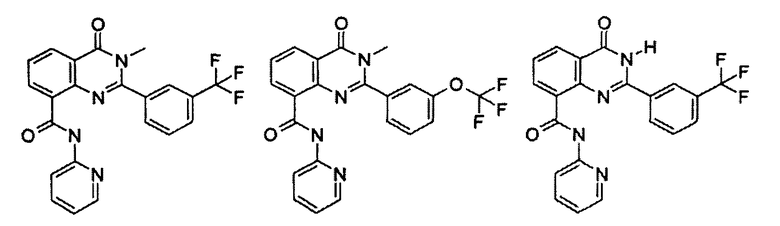
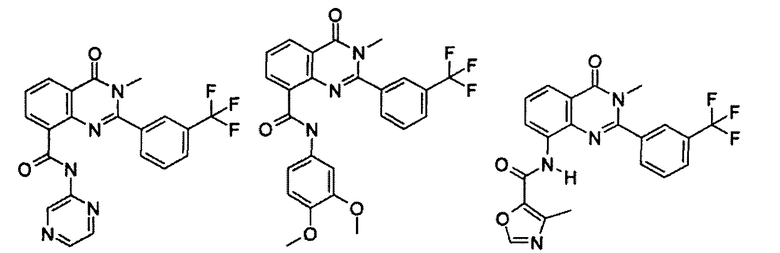
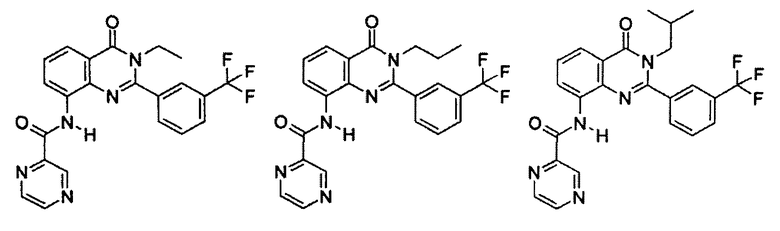
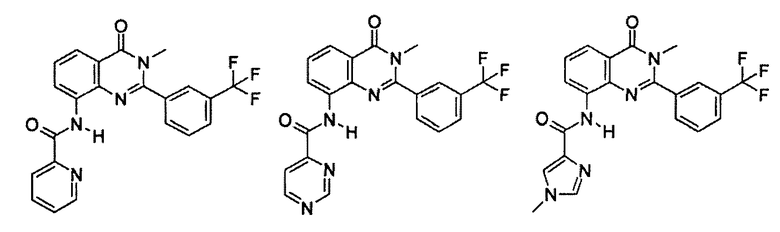
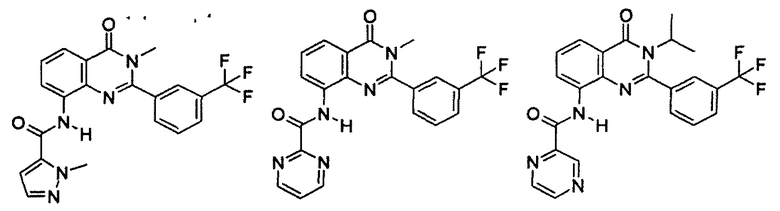
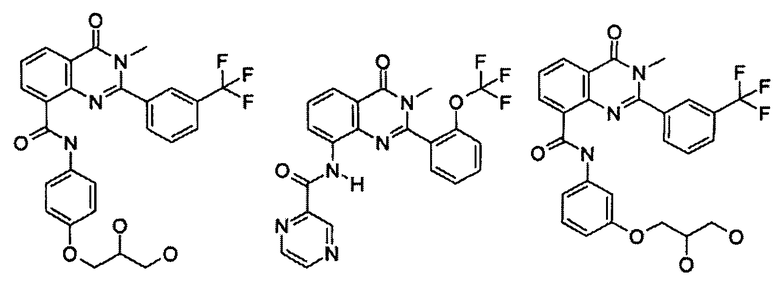
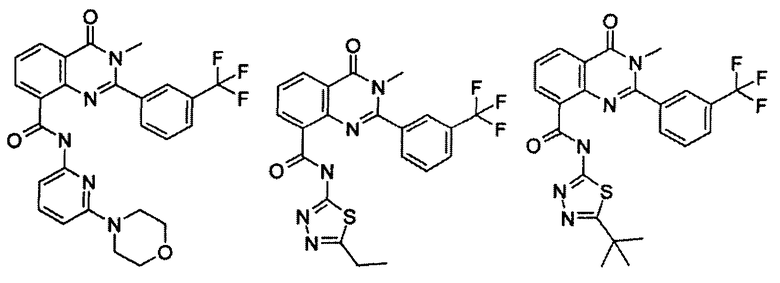
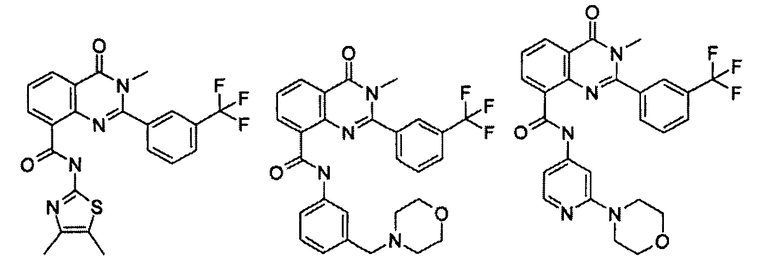
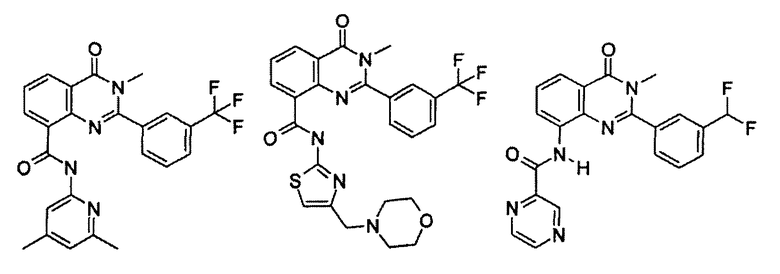
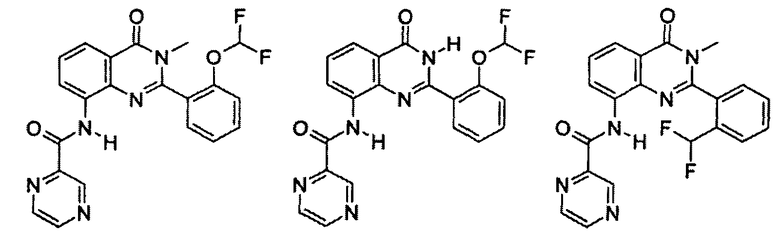
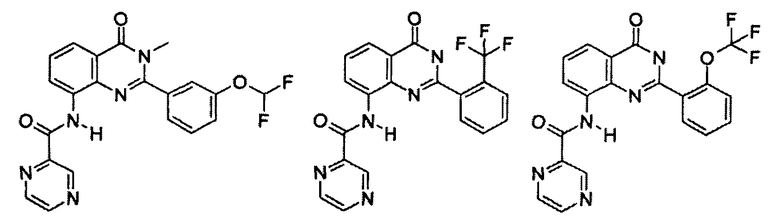
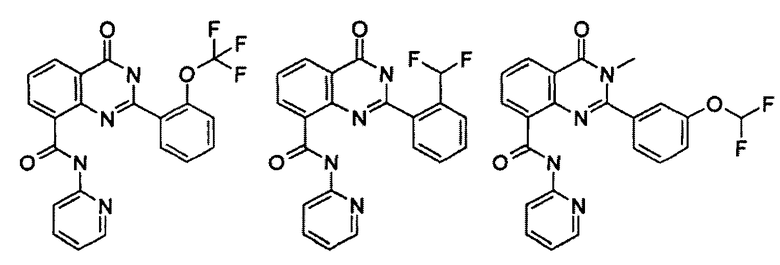
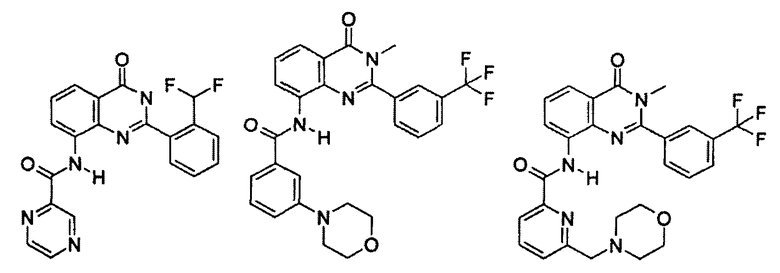
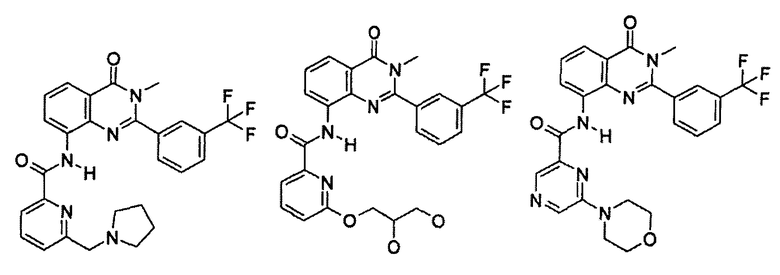
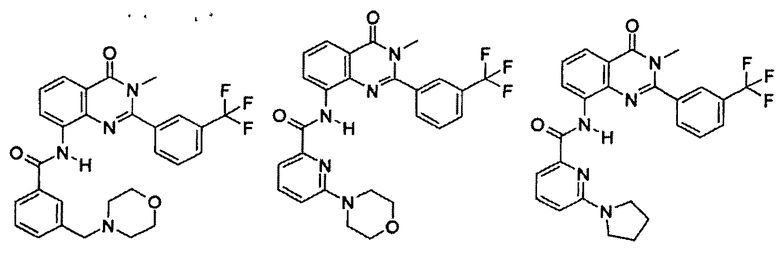
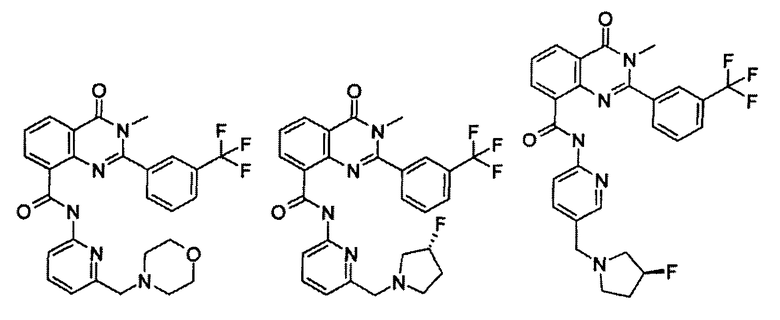
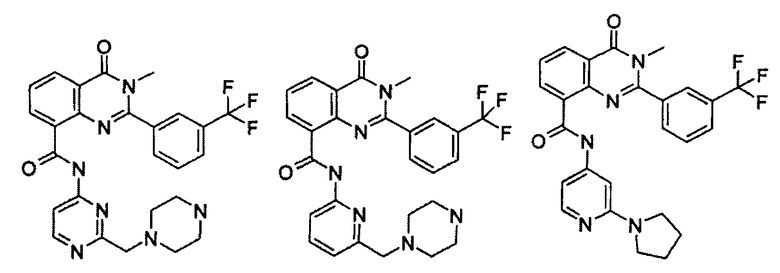
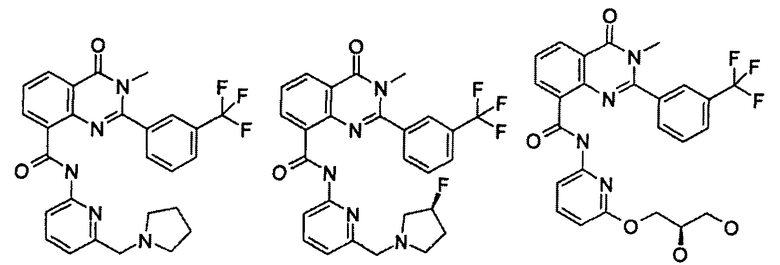

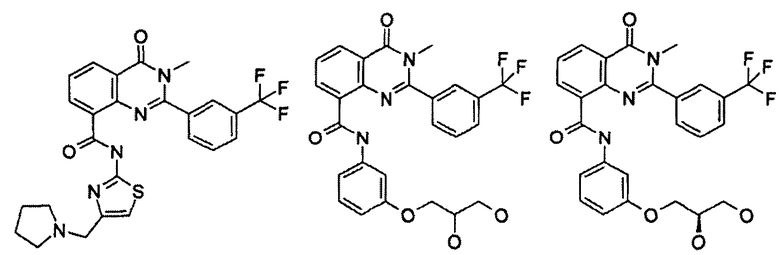 и
и
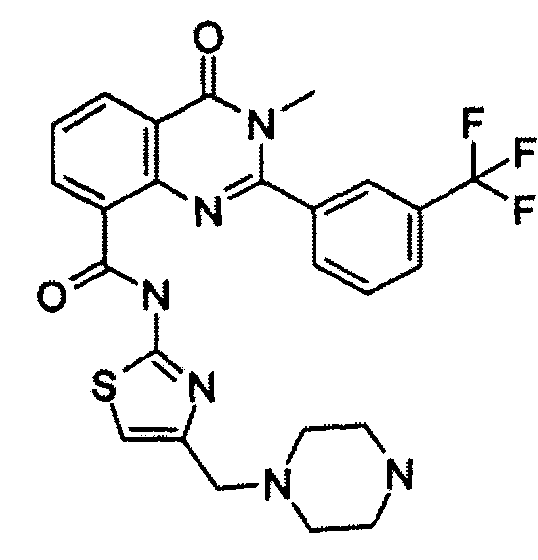 .
.
13. Соединение по п.12, где соединение выбирают из любого одного из соединений
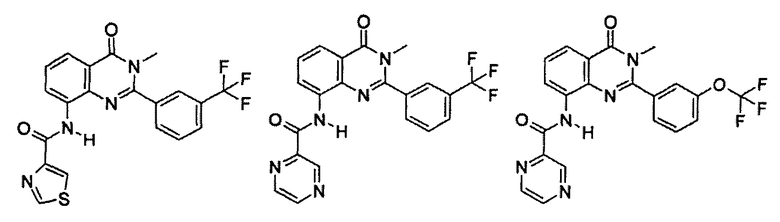
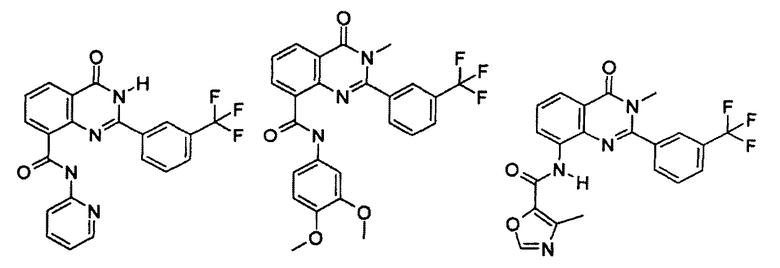
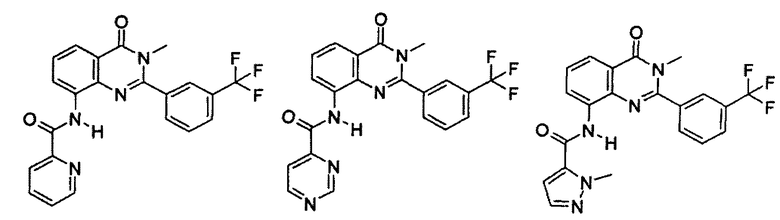
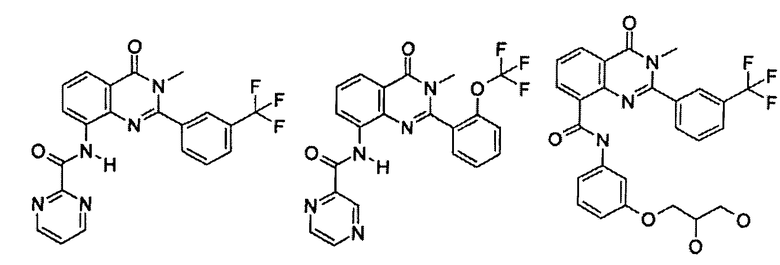
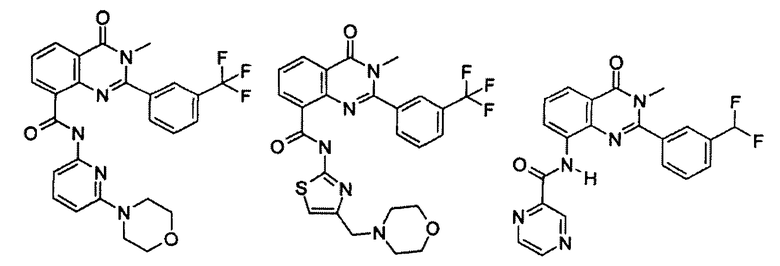
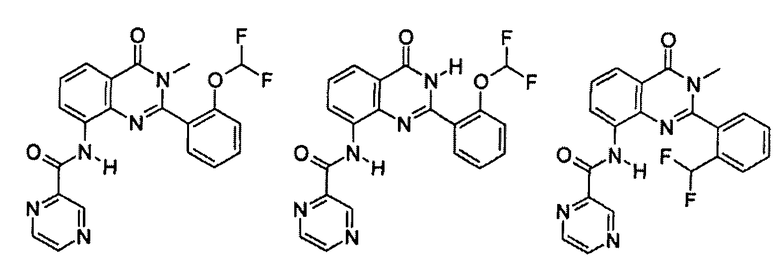
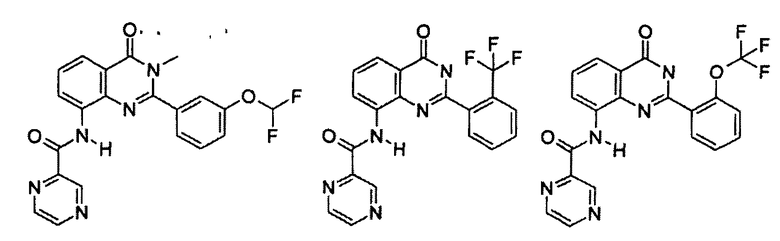
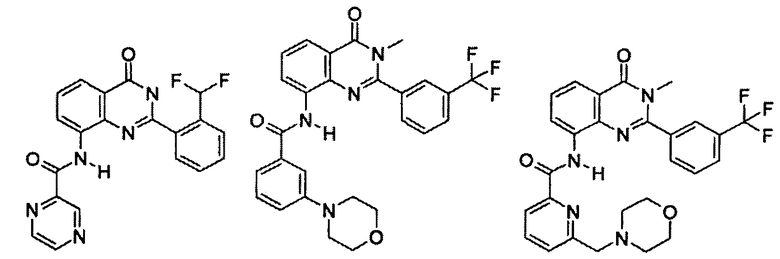
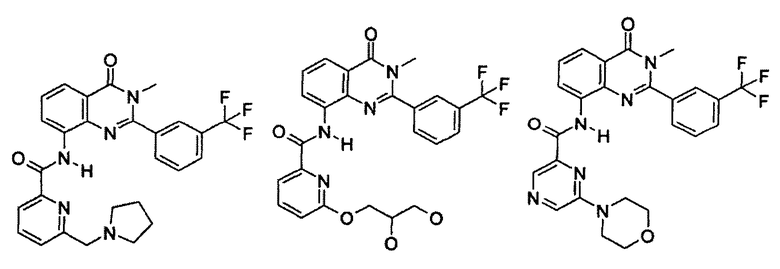
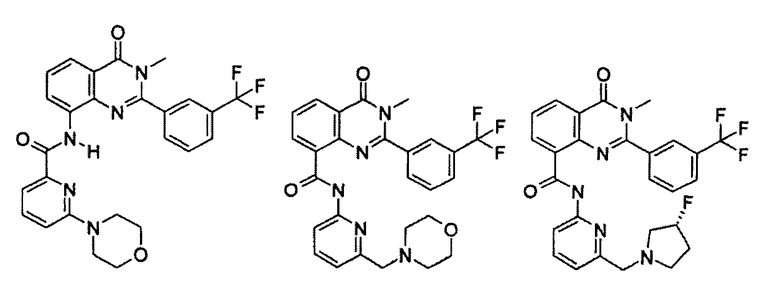
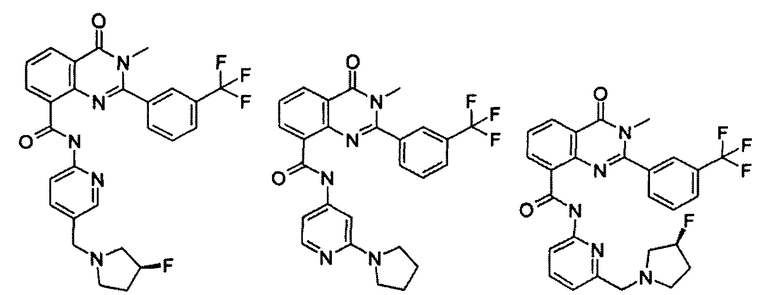
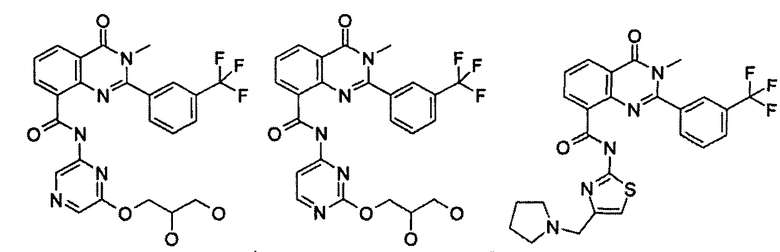 и
и
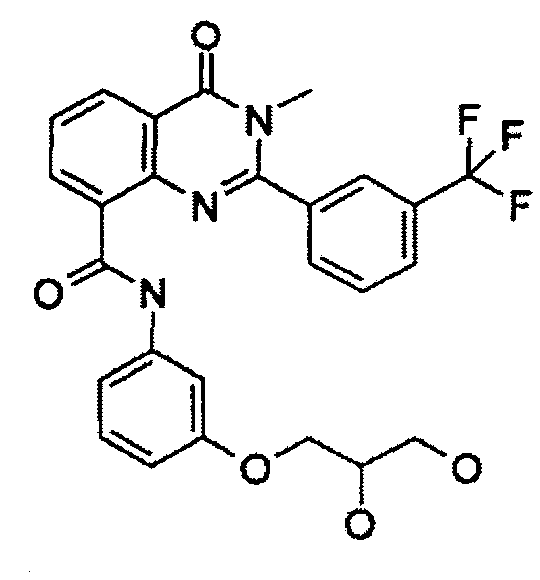 .
.
14. Соединение по п.1, где соединение выбирают из любого одного из соединений
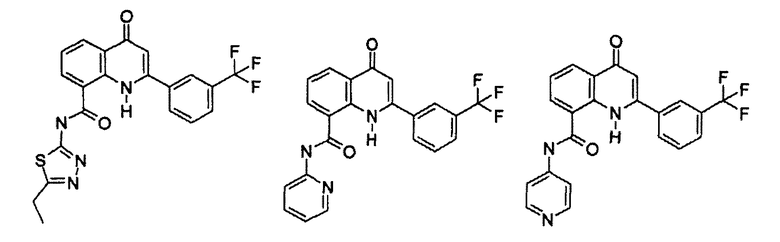
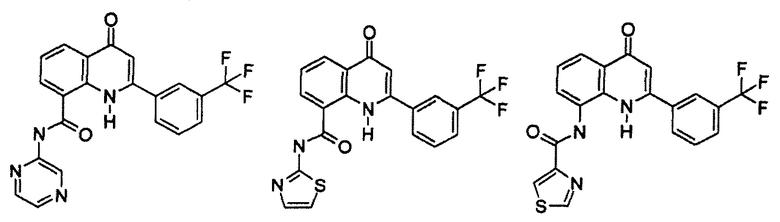

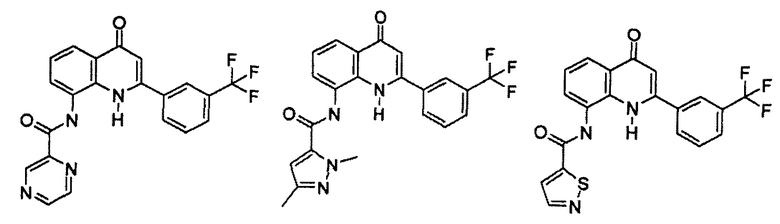
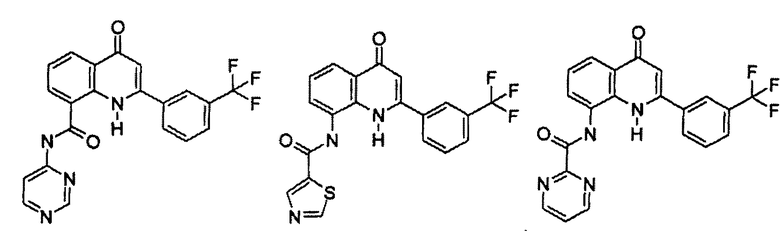
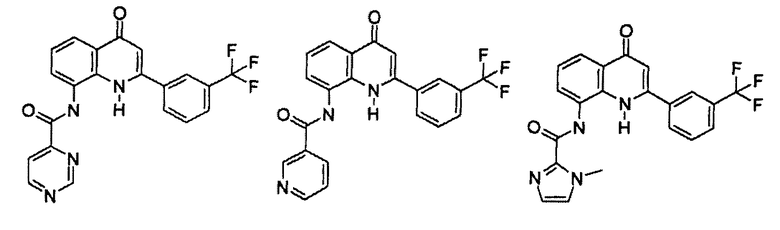
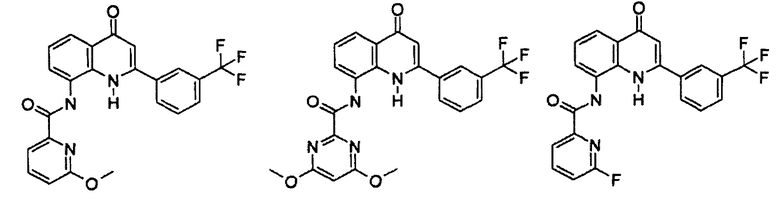
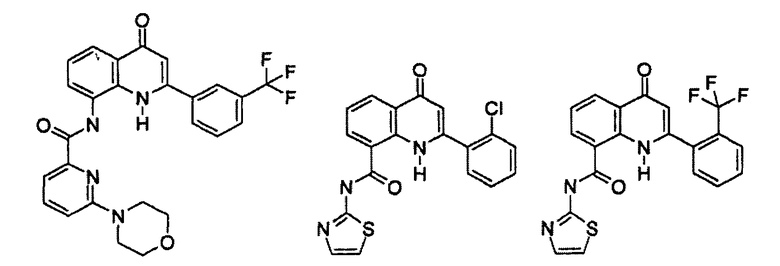
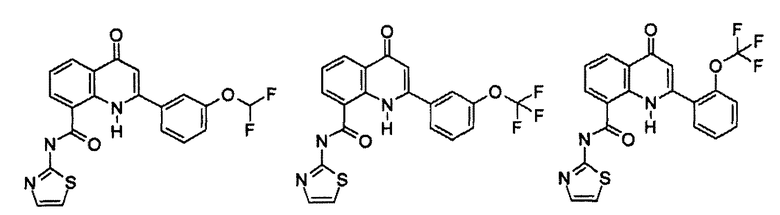
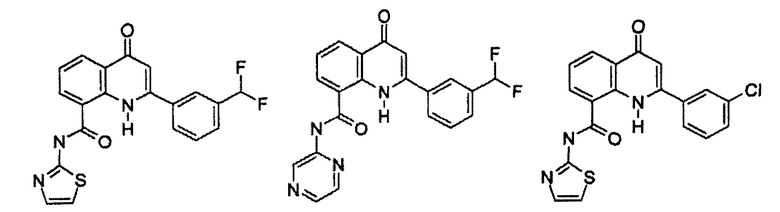
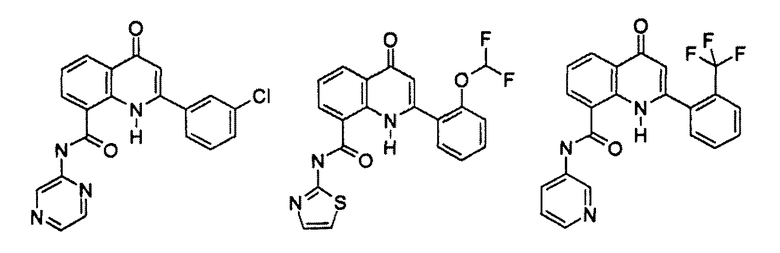
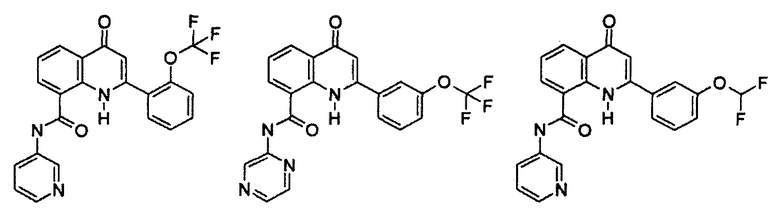
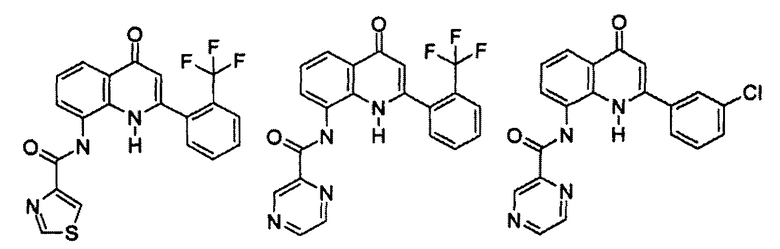
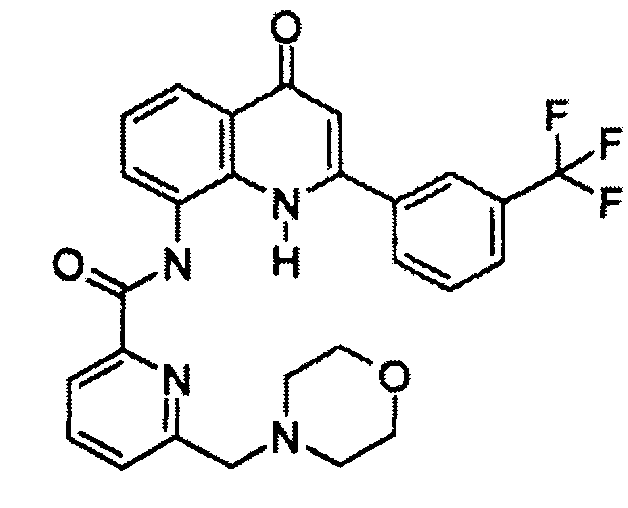 и
и 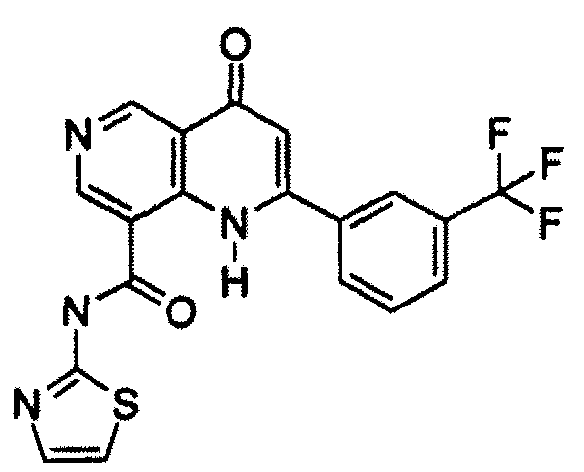 .
.
15. Соединение по п.14, где соединение выбирают из любого одного из соединений
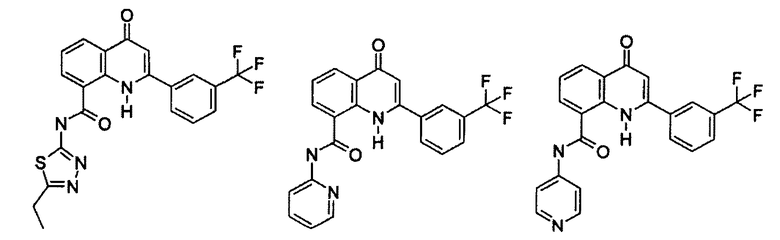

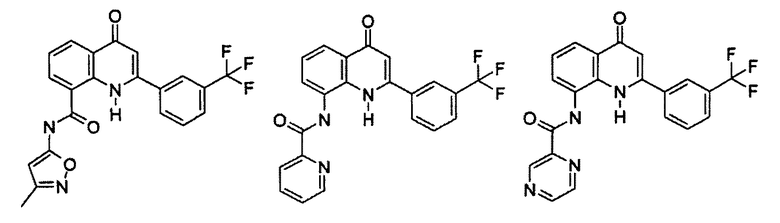
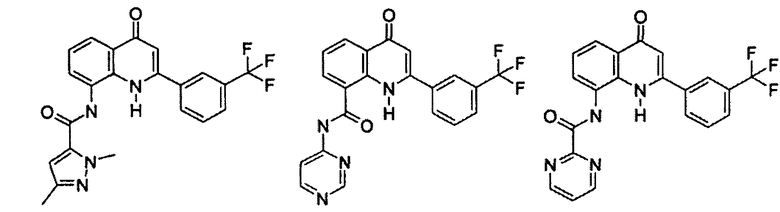

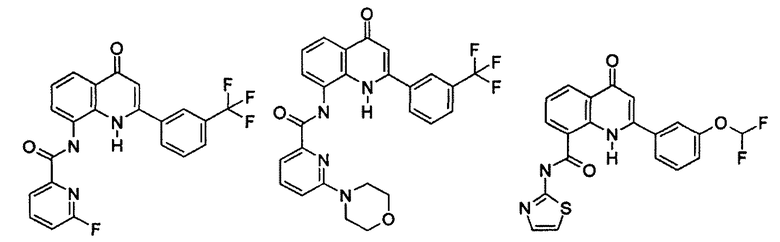
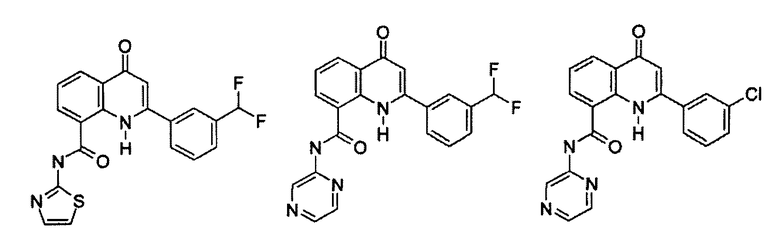

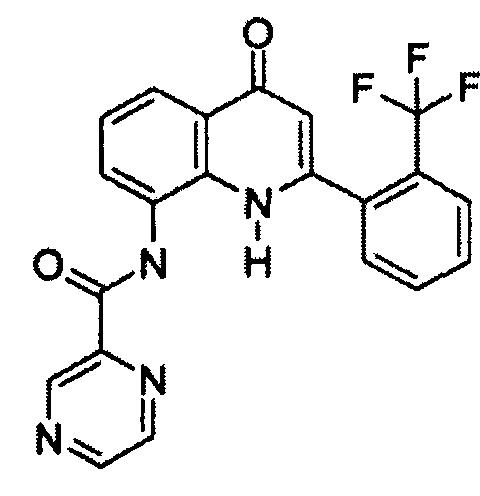 и
и 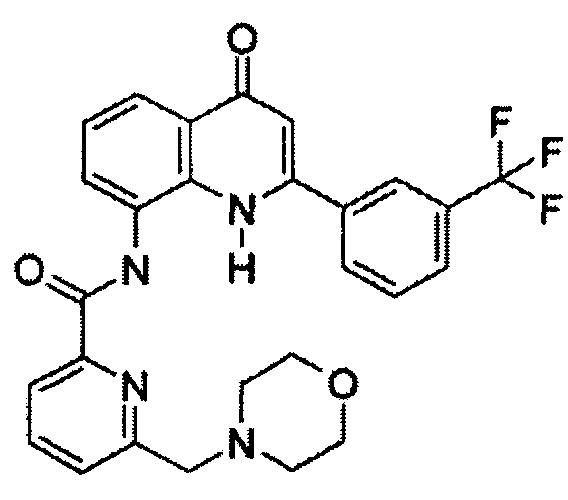 .
.
16. Апирогенная фармацевтическая композиция, обладающая сиртуин модулирующей активностью, включающая фармацевтически приемлемый носитель или разбавитель и соединение по любому одному из пп.1-15 или его фармацевтически приемлемую соль.
17. Способ лечения субъекта, страдающего от или подверженного резистентности к инсулину, метаболическому синдрому, диабету или его осложнениям, включающий введение субъекту, если это ему необходимо, композиции по п.16.
18. Способ повышения чувствительности к инсулину у субъекта, включающий введение субъекту, если это ему необходимо, композиции по п.16.
| WO 1994001408 A1, 20.01.1994 | |||
| US 6187779 B1, 13.02.2001 | |||
| MILNE J.C | |||
| ET AL, Current Opinion in Chemical Biology, vol.12, 2008, p.p | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2267489C2 |
Авторы
Даты
2014-06-20—Публикация
2009-09-29—Подача