Изобретение относится к способу получения вторичных аминов, в частности к новому способу гидрирования альдиминов и кетиминов водородом, который применим в условиях лаборатории и позволяет получать вторичные амины общей формулы
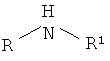
где R1=C6H5: R2=цикло-C6H11, цикло-C5H9, -CH2C6H5, (CH3)2CHCH2(CH3)CH-;
R1=-CH2C6H5: R2=цикло-C6H11, R1==C6H4OCH3: R2= цикло-C5H9,
которые находят применение в качестве полупродуктов в органическом синтезе.
Известен способ получения вторичных аминов каталитическим гидрированием иминов в присутствии родиевых или рутениевых комплексов, причем гидрирующим агентом является формиат триэтиламмония. [A Chiral Rhodium Complex for Rapid Asymmetric Transfer Hydrogenation of Imines with High Enantioselectivity / J. Мао, D. C. Baker // Org. Lett., Vol.1, No. 6, 1999; Asymmetric Transfer Hydrogenation of Imines / Nobuyuki Uematsu, Akio Fujii, Shohei Hashiguchi, Takao Ikariya, Ryoji Noyori // J. Am. Chem. Soc. 1996, 118, 4916-4917].
Недостатком данного метода является необходимость использования дорогостоящего и труднодоступного катализатора, применение формиата триэтиламмония, малоприменимого в крупнотоннажном синтезе. Данным способом не были получены соединения заявляемой структурной формулы.
Известен способ получения вторичных аминов каталитическим гидрированием иминов в присутствии комплекса никеля, причем гидрирующим агентом являются натриевая соль пентанола-3. [Transfer Hydrogenation of Imines Catalyzed by a Nickel(0)/NHC Complex / Sebastien Kuhl, Raphael Schneider, Yves Fort // Organometallics. - 2003, - 22, - pp.4184-4186].
Недостатком данного метода является необходимость приготовления каталитического комплекса, применение малоприменимой в крупнотоннажном синтезе натриевой соли пентанола-3 в качестве гидрирующего агента. Данным способом не были получены соединения заявляемой структурной формулы.
Известен способ получения вторичных аминов гидрированием иминов гидридтрихлорсиланом в присутствии органокатализаторов сложного строения [A Highly Enantioselective Lewis Basic Organocatalyst for Reduction ofN-Aryl Imines with Unprecedented Substrate Spectrum // Zhouyu Wang, Xiaoxia Ye, Siyu Wei, Pengcheng Wu, Anjiang Zhang, Jian Sun / Org. Lett., Vol.8, No. 5, 2006]. Очевидным недостатком данного метода является сложность получения и высокая стоимость катализатора. Данным способом не были получены вещества заявляемой структурной формулы.
Известен способ получения вторичных аминов гидрированием иминов водородом при 3 атм. в присутствии родиевых комплексов [Enantioselective Hydrogenation of Acyclic Aromatic N-Aryl Imines Catalyzed by an Iridium Complex of (S,S)-l,2-Bis(tert-butylmethylphosphino)ethane / Tsuneo Imamoto, Noriyuki Iwadate, Kazuhiro Yoshida // Org. Lett., Vol.8, No. 11, 2006]. Недостатком данного метода являются высокая стоимость и труднодоступность катализатора. Данным способом не были получены вещества заявляемой структурной формулы.
Известен способ получения вторичных аминов гидрированием иминов водородом при 2 атм в присутствии металлической платины [Ketimines. VI. Tolyl Alkyi Ketimines / P. L. PICKARD, S. H. JENKINS // J. Am. Chem. Soc. - 1953. - Vol.75 (23). - pp.5899-5901]. Недостатком данного метода является высокая стоимость платины, использование водорода под давлением. Данным способом не были получены вещества заявляемой структурной формулы.
Известен способ гидрирования иминов или смесей альдегид - амин гид-рирующим агентом, в качестве которого выступает смесь боргидрида натрия с борной кислотой. Процесс протекает при механическом растирании твердой смеси без растворителя с последующей обработкой реакционной смеси водным раствором соды и дальнейшим выделением вторичных аминов.
Недостатком данного метода является его нетехнологичность, а именно использование вместо водорода комплексного гидрида металла, необходимость разложения бороорганических интермедиатов водой с последующей экстракцией продукта и его выделением, то есть метод пригоден только для лабораторных условий. Данным способом было получено три вещества заявляемой структурной формулы.
Известен ряд способов получения вторичных аминов гидрированием иминов водородом при 1-100 атм. в присутствии различных комплексов родия, иридия, рутения и титана [Transition Metal-Catalyzed Enantioselective Hydrogenation of Enamines and Imines / Jian-Hua Xie, Shou-Fei Zhu, Qi-Lin Zhou // Chem. Rev. 2011, 111, 1713-1760]. Недостатком данных методов является высокая стоимость и труднодоступность катализаторов. Данным способом не были получены вещества заявляемой структурной формулы.
Известен способ получения вторичных аминов восстановительным аминированием карбонильных соединений с промежуточным образованием иминов в присутствии наночастиц никеля, при этом донором, водорода является изопропанол. [Hydrogen-Transfer Reductive Amination of Aldehydes Catalysed by Nickel Nanoparticles / Alonso F., Riente P., Yus M. // Synlett. -2008, - №9 - pp.1289-1292]. Недостатком данного метода является использование в качестве гидрирующего агента изопропилового спирта, использование значительных количеств (20% мольн.) наночастиц никеля. Данным способом было получено только одно вещество заявляемой структурной формулы.
Известен способ получения вторичных аминов гидрированием иминов водородом в присутствии в качестве катализатора никеля Ренея при давлении 7 атм и 100°C или хромита меди при давлении 68 атм и 150°C [Preparation of ketimines and the corresponding secondary amines / D. G. Korton, V. E. Haury, F. C. Davis, L. J. Mitchell, S. A. Ballard // J. Org. Chem. - 1954. - Vol 19, №7. - pp.1054-1066]. Недостатком данного метода является использование водорода под давлением. Данным способом не были получены вещества заявляемой структурной формулы.
Наиболее близким аналогом предполагаемого изобретения является способ получения вторичных аминов гидрированием иминов водородом при 3 атм. в присутствии иридиевых комплексов и изопропилата калия [RuHCl(diphosphme)(diamine): Catalyst Precursors for the Stereoselective Hydrogenation ofKetones and Imines / Kamaluddin Abdur-Rashid, Alan J. Lough, Robert H. Morris // Organometallics 2001, 20, pp.1047-1049]. Данным способом было получено только одно вещество заявляемой структурной формулы. Недостатком данного метода является его нетехнологичность, а именно, высокая стоимость и сложность получения катализатора, присутствие дополнительно к катализатору изопропилата калия, использование водорода под давлением, что делает метод малоприменимым для промышленного производства.
Задачей заявляемого способа является разработка технологичного метода гидрирования иминов газообразным водородом, не требующего использования дорогостоящих катализаторов и сложных технологических условий с использованием доступных реагентов, который будет позволять достигать высоких значений выхода по исходным иминам.
Техническим результатом является упрощение способа получения соединений заявляемой структурной формулы.
Поставленный результат достигается в способе получения вторичных аминов общей формулы

где R1=C6H5: R2=цикло-C6H11, цикло-C5H9, -CH2C6H5, (CH3)2CHCH2(CH3)CH-;
R1=-CH2C6H5: R2=цикло-C6H11, R1==C6H4OCH3: R2= цикло-C5H9 ,
заключающемся в гидрировании иминов газообразным водородом в присутствии катализатора, отличающемся тем, что в качестве иминов используют бензальанилин, бензальциклогексилимин, циклогексилиден-фенилимин, 4-метилпент-2-илиденфенилимин, циклопентилиден-4-метоксифенилимин, циклопентилиденфенилимин, а в качестве катализатора используют наночастицы никеля, получаемые in situ восстановлением хлорида никеля (II) боргидридом натрия в соотношении 1:2 соответственно и процесс проводят при атмосферном давлении водорода в среде изопропанола или трет-бутанола при температуре 60-70°C в течение 8-12 часов.
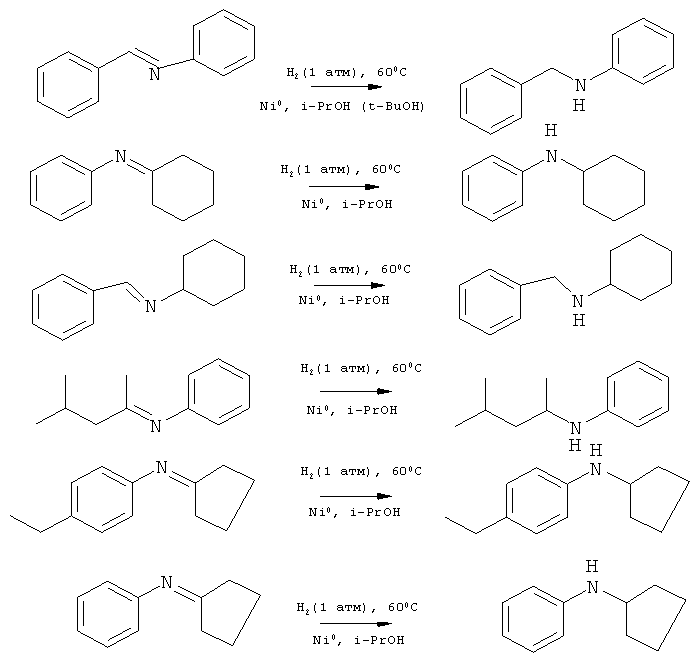
Сущностью метода является реакция гидрирования иминов из ряда:
бензальанилин, бензальциклогексиламин, циклогексилиденфенилимин, 4-метилпент-2-илиденфенилимин, циклопентилиден-4-метоксифенилимин, циклопентилиденфенилимин газообразным водородом в среде изопропанола или трет-бутанола в присутствии наночастиц никеля.
Способ осуществляется следующим образом.
В плоскодонную колбу загружается боргидрид натрия, изопропанол (или трет-бутанол) и безводный хлорид никеля (II) в мольном соотношении
боргидрид натрия: хлорид никеля (II), равном 2:1, и получают катализатор по реакции
NiCl2+2NaBH4+6(CH3)2CHOH=Ni0+2NaCl+2B(OCH(CH3)2)3+4H2.
Количество боргидрида натрия рассчитывается исходя из количества получаемого катализатора с незначительным избытком, и влияния гидридов бора на гидрирование имина не происходит. После получения черного, прозрачного в тонком слое коллоидного раствора металла загружается имин из ряда: бензальанилин, бензальциклогексиламин, циклогексилиден-фенилимин, 4-метилпент-2-илиденфенилимин, циклопентилиден-4-метоксифенилимин, циклопентилиденфенилимин и через реакционную массу барботируется газообразный водород, который предварительно пропускается через слой концентрированной серной кислоты для очистки от следов влаги, при атмосферном давлении в течение 8-12 часов при температуре 60-70°C. При этом гидрирующим агентом является водород, а не изопропанол, так как гидрирование протекает и в трет-бутаноле, не способном быть донором водорода. По окончании реакции, для коагуляции частиц катализатора в реакционную смесь добавляют несколько капель воды. Реакционную массу отфильтровывают. Из фильтрата выделяют целевой продукт перегонкой при атмосферном давлении или в вакууме. Свойства синтезированных вторичных аминов соответствуют литературным данным.
Стабилизации коллоидных растворов наночастиц металлов не требуется, это значительно упрощает и удешевляет предлагаемый способ гидрирования. Так как и при синтезе катализатора, и восстановлении заявленных веществ используются одинаковые условия, весь процесс сводится к одностадийному синтезу, при котором катализатор образуется in situ из доступного хлорида никеля.
Пример 1
Бензиланилин
В плоскодонную колбу, снабженную барботером и обратным холодильником, загружают суспензию 0.5 г (0.014 моль) боргидрида натрия в 20 мл изопропанола, после чего постепенно присыпают 0.9 г (0.007 моль) безводного хлорида никеля (II), при этом наблюдают образование черного коллоидного раствора. После этого включают барботаж водорода и добавляют 18.1 г (0.1 моль) бензальанилина. Реакцию проводят при 60°C в течение 8 часов. По окончании реакции смесь охлаждают, добавляют 1 мл воды для ускорения коагуляции катализатора. Осевший осадок отфильтровывают, отделяют органический слой фильтрата и отгоняют изопропанол. Остаток перегоняют, получают 13.2 г (0.072 моль, 72%) бензиланилина, бесцв. жидкость, кристаллизуется при стоянии, т.пл. 30-32°C, т.кип. 155-157°C/25 мм рт.ст. (лит. т.пл. 32°C, т.кип.306-307°C [13]). Спектр ЯМР1Н, δ, м.д.: 3.71 с (1H, NH); 4.06 с (2H, CH2-N); 6.32-7.14 м (10H, 2 C6H5).
Пример 2
Бензиланилин

Аналогично, из суспензии 0.4 г (0.010 моль) боргидрида натрия в 15 мл трет-бутанола и 0.65 г (0.005 моль) безводного хлорида никеля (II) получают коллоидный раствор катализатора. После этого включают барботаж водорода и добавляют 14.5 г (0.08 моль) бензальанилина. Реакцию проводят при 60°C в течение 8 часов. После выделения получают 10.2 г (0.056 моль, 70%) бензиланилина, бесцв. жидкость, кристаллизуется при стоянии, т.пл. 29-32°C, т.кип.154-156°C/25 мм рт.ст. (лит. т.пл. 32°C, т.кип. 306-307°C [13]). Спектр ЯМР1Н, δ, м.д.: 3.71 с (1H, NH); 4.06 с (2H, CH2-N); 6.32-7.15 м (10H, 2 C6H5).
Пример 3
Циклогексиланилин
Аналогично, из суспензии 0.3 г (0.008 моль) боргидрида натрия в 15 мл изопропанола, и 0.5 г (0.004 моль) безводного хлорида никеля (II) получают коллоидный раствор катализатора. После этого включают барботаж водорода и добавляют 10.4 г (0.06 моль) циклогексилиденфенилимина. Реакцию проводят при 70°C в течение 9 часов. По окончании реакции смесь охлаждают, добавляют 1 мл воды для ускорения коагуляции катализатора. Осевший осадок отфильтровывают, отделяют органический слой фильтрата и отгоняют изопропанол. Остаток перегоняют, получают 7.3 г (0.041 моль, 69%) бензиланилина, т.кип.165-167°C/25 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 1.12-2.30 м (10H, 5 5 CH2); 3.52 м (1H, CH-N); 3.70 с (1H, NH); 6.40-6.97 м (5H, C6H5).
Пример 4
Бензилциклогексиламин
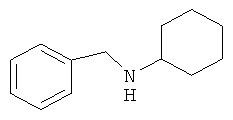
Аналогично, из суспензии 0.5 г (0.014 моль) боргидрида натрия в 20 мл изопропанола и 0.9 г (0.007 моль) безводного хлорида никеля (II) получают коллоидный раствор катализатора. После этого включают барботаж водорода и добавляют 14 г (0.075 моль) бензальциклогексилимина. Реакцию проводят при 70°C в течение 8 часов. После выделения получают 10.2 г (0.056 моль, 74%) бензилциклогексиламина, т.кип.168-171°C/25 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 1.03-2.35 м (10H, 5 CH2); 2.38 м (1H, CH-N); 3.05 д (2Н, CH2-N); 7.05-7.22 м (5H, C6H5).
Пример 5
2-Метил-4-фениламинопентан
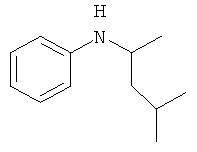
Аналогично, из суспензии 0.6 г (0.016 моль) боргидрида натрия в 25 мл изопропанола и 1.0 г (0.008 моль) безводного хлорида никеля (II) получают коллоидный раствор катализатора. После этого включают барботаж водорода и добавляют 17.5 г (0.1 моль) 4-метилпент-2-илиденфенилимина. Реакцию проводят при 70°C в течение 12 часов. По окончании реакции смесь охлаждают, добавляют 1 мл воды для ускорения коагуляции катализатора. Осевший осадок отфильтровывают, отделяют органический слой фильтрата и отгоняют изопропанол. Остаток перегоняют, получают 12.05 г (0.068 моль, 68%) 2-метил-4-фениламинопентана, бесцв. жидкость, т.кип.169-172°C/20 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 0.849 м (6H, 2CH3); 1.05 т (3H, CH3); 1.90-2.20 м (3H, CH3, CH); 3.24 уш. с (1Н, NH); 3.45 м (1H, CH-N); 6.40 д (2H, Ph); 6.55 т (1H, C6H5); 6.96 т (2H, C6H5).
Пример 6
4-Метоксифениламиноциклопентан
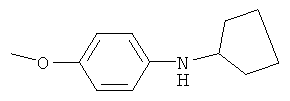
Аналогично, из суспензии 0.5 г (0.014 моль) боргидрида натрия в 20 мл изопропанола и 0.9 г (0.007 моль) безводного хлорида никеля (II) получают коллоидный раствор катализатора. После этого включают барботаж водорода и добавляют 9.5 г (0.05 моль) циклопентилиден-4-метоксифенилимина. Реакцию проводят при 70°C в течение 10 часов. По окончании реакции смесь охлаждают, добавляют 1 мл воды для ускорения коагуляции катализатора. Осевший осадок отфильтровывают, отделяют органический слой фильтрата и отгоняют изопропанол. Остаток перегоняют, получают 6.7 г (0.036 моль, 71%) 4-метоксифениламиноциклопентана, бесцв. жидкость, т.кип. 179-182°C/20 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 1.19-2.68 м (8H, 4CH2); 3.34 уш. с (1H, NH); 3.40 м (1H, CHN), 3.60 с (3H, OCH3); 6.32-6.66 м (4H, Ph).
Пример 7
Циклопентиланилин
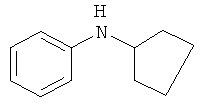
Аналогично, из суспензии 0.3 г (0.008 моль) боргидрида натрия в 20 мл изопропанола и 0.5 г (0.004 моль) безводного хлорида никеля (II) получают коллоидный раствор катализатора. После этого включают барботаж водорода и добавляют 6.4 г (0.04 моль) циклопентилиденфенилимина. Реакцию проводят при 60°C в течение 10 часов. По окончании реакции смесь охлаждают, добавляют 1 мл воды для ускорения коагуляции катализатора. Осевший осадок отфильтровывают, отделяют органический слой фильтрата и отгоняют изопропанол. Остаток перегоняют, получают 4.2 г (0.026 моль, 66%) циклопентиланилина, бесцв. жидкость, т.кип.160-1б2°C/20 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 1.36-2.45 м (8H, 4CH2); 3.58 м (1H, CH-N); 3.72 с (1H, NH); 6.38-6.95 м (5H, C6H5).
Таким образом, разработан новый способ синтеза вторичных аминов, который протекает при температуре 60-70°C в течение 8-12 часов с высоким выходом по исходным веществам, заключающийся в гидрировании иминов газообразным водородом в присутствии наночастиц никеля, получаемых in situ из хлорида никеля (II).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПЕРВИЧНЫХ ИЛИ ВТОРИЧНЫЙ СПИРТОВ | 2013 |
|
RU2519950C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕТИЧНЫХ АМИНОВ | 2012 |
|
RU2499793C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛБЕНЗОЛОВ | 2012 |
|
RU2495864C1 |
| СПОСОБ ГИДРИРОВАНИЯ α, β-НЕНАСЫЩЕННЫХ КЕТОНОВ | 2013 |
|
RU2529033C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ 2-АЦИЛ-3-ОКСО-БУТАНОВОЙ КИСЛОТЫ | 2021 |
|
RU2780515C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ НОРБОРНАНА | 2012 |
|
RU2504532C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИНЕЙНЫХ АЛКАНОВ | 2012 |
|
RU2495863C1 |
| СОСТАВ, СПОСОБНЫЙ К ПОЛИМЕРИЗАЦИИ | 1995 |
|
RU2168518C2 |
| СПОСОБ ГИДРИРОВАНИЯ АЛЬФА, БЕТА-НЕНАСЫЩЕННЫХ КЕТОНОВ | 2013 |
|
RU2529032C1 |
| КАТАЛИЗАТОР ГИДРОПЕРЕРАБОТКИ НЕФТЯНЫХ ФРАКЦИЙ (ВАРИАНТЫ) | 2016 |
|
RU2640210C1 |
Изобретение относится к способу получения вторичных аминов, в частности к новому способу гидрирования иминов, который позволяет получать вторичные амины общей формулы

где R1=C6H5: R2=цикло-C6H11, цикло-C5H9, -CH2C6H5, (CH3)2CHCH2(CH3)CH-;
R1=-CH2C6H5: R2=цикло-C6H11, R1= -C6H4OCH3: R2= цикло-C5H9.
Соединения находят широкое применение в органическом синтезе в качестве полупродуктов. Способ заключается в гидрировании иминов газообразным водородом в присутствии катализатора. В качестве иминов используют бензальанилин, бензальциклогексилимин, циклогексилиденфенилимин,4-метилпент-2-илиденфенилимин, циклопентилиден-4-метоксифенилимин, циклопентилиденфенилимин, а в качестве катализатора используют наночастицы никеля, получаемые in situ восстановлением хлорида никеля (II) боргидридом натрия в соотношении 1:2 соответственно. Процесс проводят при атмосферном давлении водорода в среде изопропанола или трет.бутанола при температуре 60-70°C в течение 8-12 часов. Техническим результатом является упрощение способа получения соединений заявляемой структурной формулы. 7 пр.
Способ получения вторичных аминов общей формулы

где R1=C6H5: R2=цикло-C6H11, цикло-C5H9, -CH2C6H5, (CH3)2CHCH2(CH3)CH-;
R1=-CH2C6H5: R2=цикло-C6H11, R1=-C6H4OCH3:R2=цикло-C5H9,
заключающийся в гидрировании иминов газообразным водородом в присутствии катализатора, отличающийся тем, что в качестве иминов используют бензальанилин, бензальциклогексилимин, циклогексилиден-фенилимин, 4-метилпент-2-илиденфенилимин, циклопентилиден-4-метоксифенилимин, циклопентилиденфенилимин, а в качестве катализатора используют наночастицы никеля, получаемые in situ восстановлением хлорида никеля (II) боргидридом натрия в соотношении 1:2 соответственно, и процесс проводят при атмосферном давлении водорода в среде изопропанола или трет-бутанола при температуре 60-70°C в течение 8-12 часов.
| BOTTA, MAURIZIO et al.,Alcohols and aluminum alkoxides in the presence of Raney nickel as alkylating agents | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Reduction of Schiff bases with isopropyl alcohol and aluminum isopropoxide in the presence of Raney nickel, Journal of Organic Chemistry (1985)50 (11) pp | |||
| Цоколь для электрических ламп накаливания с предохранителем от вывинчивания | 1924 |
|
SU1916A1 |
| SHAN , ZI-XING; et al.Chiral borate esters in asymmetric synthesis 3: | |||
Авторы
Даты
2014-07-20—Публикация
2013-03-05—Подача