Изобретение относится к медицине и фармацевтической промышленности, а именно к созданию лекарственных средств на основе новогаленового препарата, обладающего одновременно противовоспалительной, жаропонижающей и антимикробной активностью.
Поиск и разработка новых лекарственных средств, предназначенных для лечения и профилактики воспалительных заболеваний, обусловлены их широким распространением и особой тяжестью течения. В настоящее время доказана эффективность применения лекарственных препаратов из растительного сырья для терапии воспаления.
Среди препаратов из растительного сырья существуют средства, обладающие противовоспалительной активностью, такие как Ротокан, Плантаглюцид (Регистр лекарственных средств в России / Гл. ред. И.Ф. Крылов. Ред. кол. Ю.В. Буров (зам.гл. ред.), Г.П. Вышковский, З.В. Догбайло, В.П. Падалкин, Г.С. Чернов. - М.: ИНФАРМХИМ, 1993. - 1006 с.). Наиболее известным является препарат на основе экстракта подорожника большого (Машковский М.Д. Лекарственные средства, Москва, Медицина, 1993 г.). Однако активность данного препарата низкая. Аналог может использоваться только как противовоспалительное средство. Он не обладает антибактериальным и жаропонижающим действием.
Известен патент RU N 2054945, A61K 35/78, 28.06.95 г. "Средство "АБИСИЛ-1", обладающее противовоспалительной, антибактериальной и ранозаживляющей активностью на основе экстракта пихты сибирской. Однако описанное средство обладает недостаточно высокой противовоспалительной активностью и не имеет жаропонижающего действия.
Экстракт тысячелистника обыкновенного применяется в качестве кровоостанавливающего и противовоспалительного средства (Машковский М.Д. Лекарственные средства. В двух частях. - Харьков "Торсинг". - 1997. - изд. тринадцатое. - с.480). Однако использование экстракта тысячелистника имеет ряд противопоказаний, например, за счет действия, угнетающего работу яичников, в связи с чем его применение ограничено лицам женского пола.
Известно применение препарата Канефрон Н (Германия) на основе спиртового экстракта травы золототысячника, корней любистока и цветков розмарина, содержащего 19 об.% спирта этилового в 100 мл. Недостатком данного средства является менее выраженная противовоспалительная активность, а также отсутствие противомикробной и жаропонижающей активности.
Известно противовоспалительное средство на основе отвара сабельника болотного, применяемого в народной медицине (В.В. Телятьев. Целебные клады. Иркутск, 1991, стр.146-147). Однако отвар из лекарственного растительного сырья не обеспечивает максимального выхода биологически активных веществ в извлечение и обычно составляет 20-40%. В водное извлечение переходят преимущественно вещества гликозидных форм.
Известно средство на основе растительного сырья, обладающего противовоспалительной активностью, способ получения которого включает трехкратную экстракцию листьев толокнянки обыкновенной 45-55% этиловым спиртом при соотношении сырье/экстрагент 1:(10-14), упаривание объединенных экстрактов, очищение сепарированием и высушиванием (RU 2064301 C1, 27.07.1996). Однако сухой экстракт толокнянки, полученный по вышеописанному способу, содержит биологически активные вещества хинольного характера, основным. компонентом которых является арбутин и гидрохинон. Именно эти вещества оказывают выраженное антимикробное, мочегонное и противовоспалительное действие, что определяет применение сухого экстракта толокнянки только при воспалительных заболеваниях мочеполовой системы, вызванных бактериальной инфекцией.
Авран лекарственный (Gratiola officinalis L.) - травянистое растение семейства Норичниковые, широко распространенное в Евразии и Северной Америке. Растение ядовито. Использовалось в народной медицине в виде настоев, отваров, свежего сока, свежей травы, мазей, порошков, эссенций, сборов (http://narodrecept.ru/herbalist/gratiola-officinalis-l.html). Для отваров травы характерно сильное слабительное, мочегонное, рвотное и антигельминтное действие, используемое при хронических запорах, асците, гельминтозе. Было установлено действие спиртовой настойки листьев аврана на сердце, подобное действию наперстянки. Корневища в народной медицине использовались как рвотное, слабительное, диуретическое средство; при вялости кишечника, геморрое. Надземная часть входила в состав сбора Здренко - симптоматического средства при лечении папилломатоза мочевого пузыря, анацидных гастритов, для лечения язвы желудка и некоторых опухолей. Наружно авран использовался для лечения заболеваний кожи, при ее заболеваниях, для лечения ушибов, гнойных ран, хронических язв, панарициях.
Растение ядовито и все полученные ранее извлечения из сырья аврана обладали от средней степени токсичности до достаточно высокой, поэтому при внутреннем применении использовались вместе со слизистыми отварами, с большой осторожностью и под обязательным врачебным контролем (http:www.travolekar.ru/articles.php; http://www.ayzdorov.ru/tvtravnik_avran.php).
Известно средство из свежей травы аврана, применяемого ранее для лечения трофической язвы (авран лекарственный мяли, прикладывали к язве и забинтовывали; повязку меняли четыре раза в день; одновременно рекомендовалось принимать по 0,2 г порошка травы три раза в день).
Недостатками использования свежей травы и порошка являются, с одной стороны, ограничения при использовании данного средства, связанные с периодом вегетации только в летний период, а, с другой, - высокая токсичность порошка сухой травы за счет присутствия ядовитых соединений, а также недостаточный выход целевых продуктов (флавоноидов) и использование порошка из травы аврана только для перорального введения. Кроме того, указанные выше способы применения создают определенную трудность при расчете точной дозировки. Жаропонижающая активность применяемых ранее средств на основе аврана была неизвестна.
При различных способах извлечения из аврана лекарственного выходят и получаются различные биологически активные композиции, обладающие разными свойствами: слабительным, рвотным, спазмолитическим, диуретическим, а также дигиталисоподобным действием на сердце (http//www.dorogaistin.ru>index.php…), антиоксидантные свойства (Полуконова Н.В., Меркулова Е.П., Дурнова Н.А., Романтеева Ю.В., Бородулин В.Г. Изучение антиоксидантной активности экстракта аврана лекарственного на крысах с перевитой опухолью печени PC-1 // Тезисы докладов научно-практической конференции «Биологически активные вещества: фундаментальные и прикладные вопросы получения и применения». Новый Свет, Крым, Украина 23-28 мая 2011. Киев. 2011. С.585), противоопухолевым и иммуномодулирующим действиями, как было описано нами ранее (Navolokin N.A., Polukonova N.V., Maslyakova G.N., Bucharskaya А.В., Durnova N.A. / Effect of extracts of gratiola officinalis and zea mays on the tumor and the morphology of the internal organs of rats with trasplanted liver cancer // Russian Open Medical Journal. 2012. Т.1. №2. С.0203).
Технической задачей настоящего изобретения является расширение арсенала средств на основе природного растительного сырья комплексного действия, обладающих одновременно высокой противовоспалительной, антимикробной и жаропонижающей активностью и нетоксичных.
Преимуществами предлагаемого лекарственного экстракта служат низкая токсичность, доступность сырья, из которого получают средство, а также широкий спектр эффектов: противовоспалительного, жаропонижающего, антимикробного.
Нами впервые установлены свойства средства, представляющего собой упаренный экстракт листьев и цветков аврана лекарственного, полученного путем измельчения травы аврана лекарственного, экстракцией спиртом 96%, выпариванием экстракта, добавлением хлороформа, удалением хлороформа, причем экстракцию спиртом проводят на водяной бане до кипения и кипятят в течение 14-15 минут, выпаривают при температуре 55-60°С, выпаренный экстракт разводят сначала дистиллированной водой 40-50°С, затем добавляют хлороформ в пропорции 4/5 части воды и 1/5 части хлороформа, охлаждают до комнатной температуры и центрифугируют со скоростью 1500 оборотов в минуту в течение 15 минут, далее отделяют водную фракцию и высушивают ее. Полученная биологическая активная композиция обладает новыми свойствами: противовоспалительным, жаропонижающим и антимикробным.
Средство, полученное данным способом, имеет следующий химический состав полученной нами композиции из аврана лекарственного: 4-винил-2-метоксифенол; 2,3-дигидро-3,5-дигидрокси-6-метил-4Н-пиран-4-он; 2,3-дигидробензофуран; 3-фуранкарбоновая кислота; 5-гидроксиметил-2-фуральдегид; этил-α-d-рибозид; 4-пропилфенол; пирокатехин: L-луксоза (пентоза); 6-деоксигексоза L-галактоза; бензоилуксусной кислоты этиловый эфир; гексадекановая кислота (пальмитиновая кислота); гомованилиновая кислота; глюкоза; 1,4-ангидро-d-маннитол; бензойная кислота; кверцетин.
Полученный таким образом экстракт представляет собой биологически активную композицию с новыми фармакологическими свойствами (противовоспалительным, жаропонижающим, антимикробным), ранее не известными как для растения аврана лекарственного, так и для описанного выше средства.
Средство представляет собой упаренный вязкий экстракт желто-коричневого цвета, смешивается с водой и спиртом этиловым в любых соотношениях.
Параметры подлинности и качества средства
Подлинность препарата подтверждается качественными реакциями на содержание биофлавоноидов и отсутствие алкалоидов в водном растворе упаренного экстракта аврана.
Качественные реакции на флавоноиды: к 1 мл препарата добавили 1 мл воды очищенной, 10 мг кристаллического магния и 5 капель кислоты хлористоводородной концентрированной, нагрели на кипящей водяной бане 3 мин, появилось красно-коричневое окрашивание, положительная проба Синода, что говорит о содержании в полученном растворе флаваноидов.
Качественные реакции на алкалоиды: а) с реактивом Вагнера-Бушарда отрицательна (при наличии алкалоидов раствор должен пожелтеть); б) с раствором 1% пикриновой кислоты отрицательная (при наличии алкалоидов в растворе должно быть пожелтение); в) с раствором кислоты фосфорномолибденовой отрицательная (при наличии алкалоидов раствор мутнеет).
Проведенные все 3 качественные реакции отрицательные, следовательно, в полученном экстракте отсутствуют алкалоиды.
По сравнению с получаемыми ранее водными и спиртовыми извлечениями из травы аврана полученный нами упаренный экстракт листьев и цветков аврана нетоксичен, что обусловлено химическим составом и подтверждено ранее на крысах [N.A. Navolokin, N.V. Polukonova, G.N. Maslyakova, A.B. Bucharskaya, N.A. Durnova / Effect of extracts of Gratiola officinalis and Zea mays on the tumor and the morphology of the internal organs of rats with transplanted liver cancer // Russian Open Medical Journal 2012; 1:0203].
Нами была также проведена экспериментальная работа по установлению класса токсичности полученного нами водного раствора упаренного экстракта аврана на основе определения LD50 на лабораторных белых мышах. Каждая группа состояла из 6 мышей, весом 25-30 г, число групп вместе с контролем составило пять (табл.1). Водный раствор экстракта аврана вводили внутрибрюшинно, наблюдения за животными проводили в течение суток.
Таким образом, на основании полученных данных по LD50 и в соответствии с ГОСТом 12.1.007-76 и СанПиНом 2.1.4.1074-01 водный раствор упаренного экстракта аврана можно отнести к IV классу токсичности (малоопасные вещества).
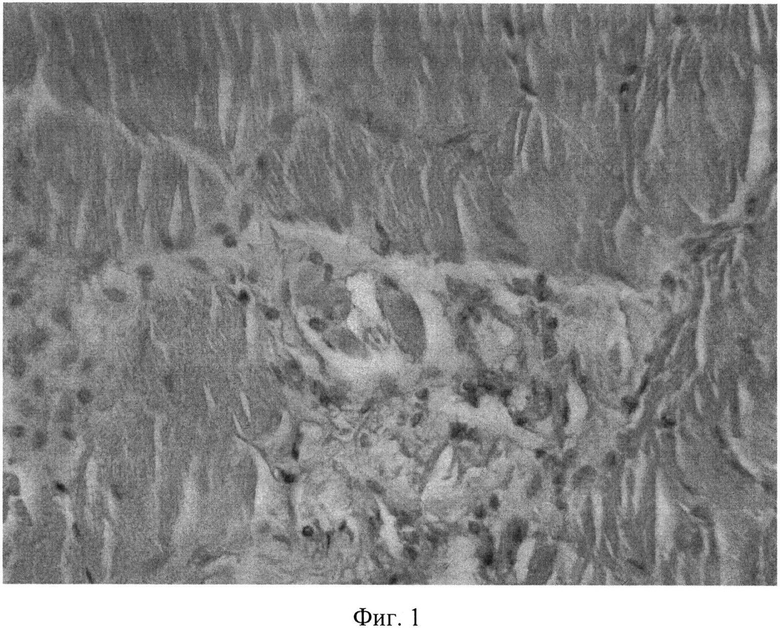
В месте введения экстракта аврана при дозировке 1323 мг/кг, которая превышала терапевтическую дозу (70 мг/кг) в 19 раз, определялись единичные участки некробиоза и выраженная инфильтрация мышцы и жировой клетчатки сегментоядерными нейтрофилами (фиг.1).
Все изменения обратимы и локальны, это позволяет сделать вывод, что при терапевтической дозировке изменения будут еще менее выражены или отсутствовать. Аналогичные изменения описываются и в инструкции применения Диклофенака натрия и считаются допустимыми при внутримышечном введении средств данной группы.
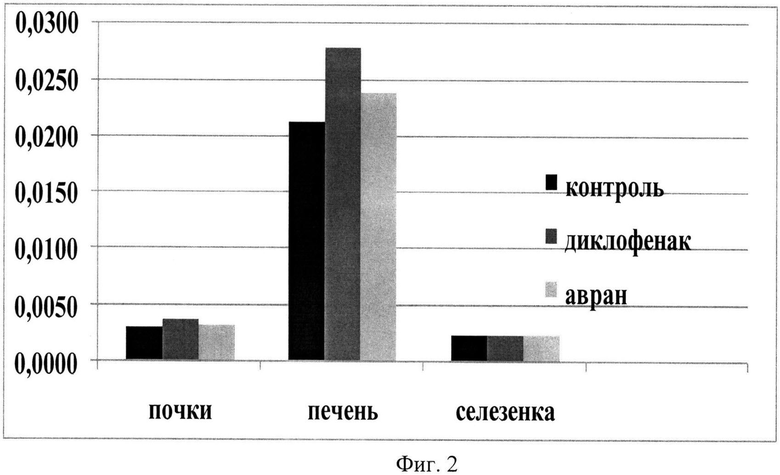
Для описания общей токсичности раствора экстракта после выведения животных из эксперимента (через 24 часа от его начала), также забирались внутренние органы, взвешивались и рассчитывался индекс К - индекс массы органа (К=mоргана/mживотного) для печени, почек и селезенки (фиг.2). Было выявлено, что введение диклофенака натрия вызывает значительное увеличение массы печени по сравнению с контролем на 30% в то время, как при введении экстракта аврана наблюдалось незначительное увеличение печени на 12% по сравнению с контролем, что свидетельствует о более низкой токсичности экстракта по сравнению с диклофенаком натрия и меньшей нагрузке на основной детоксикационной орган (печень).
а) Жаропонижающая и противовоспалительная активность экстракта
Согласно методическим указаниям Фармакологического комитета МЗ РФ в качестве экспериментальной была использована «формалиновая» модель воспаления [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / В.П. Фисенко, Е.В. Арзамасцев, Э.А. Бабаян [и др.]. - М. МЗ РФ, ЗАО «ИИА Ремедиум», 2000. 398 с.; Методические материалы Фармакологического комитета РФ по экспериментальному (доклиническому) изучению нестероидных противовоспалительных фармакологических веществ. - М., 1983. 18 с.;
Методы скрининга и фармакологического изучения противовоспалительных, анальгезирующих и жаропонижающих средств (методические рекомендации). Киев, 1974. 27 с.].
Материалы и методы: 30 белых беспородных крыс-самцов со средней массой тела 163,5±6,8 г.
Дизайн эксперимента: всем животным (30 штук) предварительно вводился субплантарно 0,1 мл 3.0% раствор формалина, затем животные были разделены на 3 группы, по 10 самцов белых беспородных крыс в каждой группе: 1-я - контрольная группа без лечения; 2-я группа - эталон сравнения: внутримышечно вводился раствор диклофенака натрия в дозировке 3 мг/кг; 3-я группа - опытная: внутримышечно вводился водный раствор упаренного экстракта аврана лекарственного в дозировке 70 мг/кг.
О жаропонижающем эффекте судили по снижению ректальной температуры, о противовоспалительном - по снижению степени выраженности отека стопы задней конечности животных через 1, 2, 3 и 24 часа после введения флогогенного агента [Ткаченко К.Г., 2003], а также по изменению лейкоцитарной формулы. В качестве флогогенного агента использовали 3.0% раствор формалина, который в объеме 0,1 мл и вводили субплантарно в апоневроз левой задней конечности крысы, правая лапа служила контролем. В качестве эталона противовоспалительной активности использовали диклофенак натрия. Диклофенак натрия вводили однократно внутримышечно в дозе 3,0 мг/кг также сразу же после введения формалина.
Анализ результатов проводили путем сравнения данных в опытных и контрольных группах между исходными и последующими показателями температуры, объема конечности, изменения лейкоцитарной формулы и морфологических изменений в мышцах. Статистическую обработку результатов осуществляли при помощи общепринятых методов медико-биологической статистики с вычислением медианы, максимума и минимума, значимость различий при непараметрическом распределении определяли при помощи критерия Мозеса.
Установлено, что средняя ректальная температура у крыс до начала эксперимента составила 35,0±0,5°С, что соответствует параметрам средней видовой нормы.
В контрольной группе без лечения на фоне введения флогогенного агента, температура начинала подниматься, достигая максимума 38°С, через 2 часа, и сохранялась до конца эксперимента.
В группе сравнения с введением диклофенака натрия на фоне введения флогогенного агента, температура изменялась зигзагообразно: максимальное снижение наблюдалось через 1 час после начала эксперимента, достигая практически нормальных цифр через 2 часа, после чего вновь наблюдалось снижение температуры, с постепенным восстановлением исходных значений к концу эксперимента.
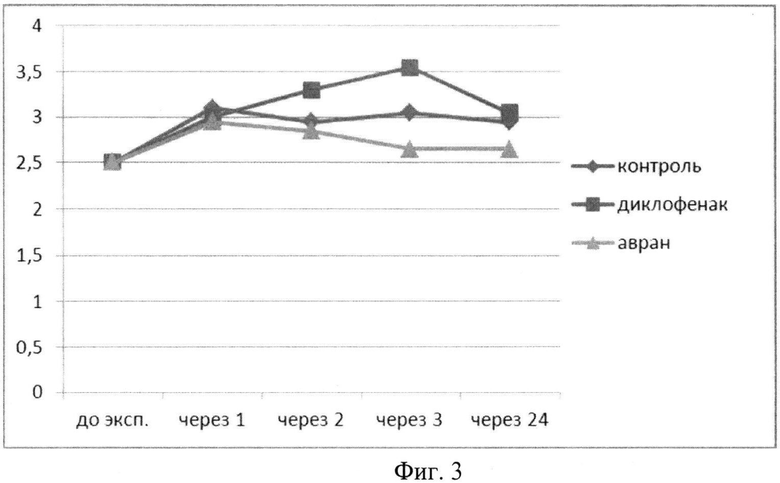
В группе с введением водного раствора экстракта аврана на фоне введения флогогенного агента было установлено, что температура животных в течение первых двух часов не менялась, затем к 3 часам происходило достоверное снижение температуры до тех же значений как при введении диклофенака и дальнейшая динамика температуры была аналогичной динамике изменения температуры в группе животных при введении диклофенака натрия (фиг.3, табл.2).
Таким образом, анализ динамики ректальной температуры животных в проведенном эксперименте позволяет сделать вывод о существенном жаропонижающем эффекте экстракта на фоне введения флогогенного агента. При этом экстракт начинает действовать с момента введения, сохраняет температуру нормальной в течение двух часов, с последующим снижением через три часа и сохранением эффекта до 24 часов.
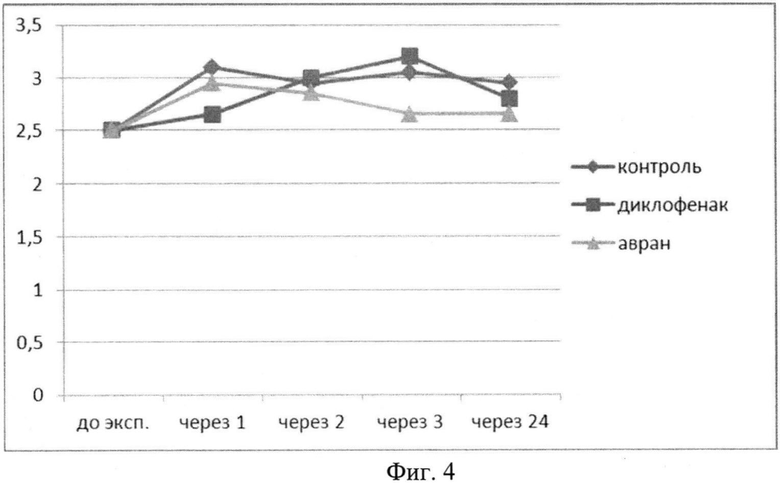
Также нами определялись темпы снижения отека конечности по сравнению с контрольной группой и группой сравнения (диклофенак натрия). После введения водного раствора экстракта аврана было установлено, что противоотечный эффект экстракта начинает проявляться через час после введения, достигая максимума через 3 часа, статистически достоверно отличаясь от группы контроля и группы сравнения (табл.3, фиг.4). Данный эффект экстракта стабильно сохраняется и через 24 часа от начала эксперимента.
Анализ динамики отека лапы животных в проведенном эксперименте позволяет сделать вывод о существенном и устойчивом противоотечном эффекте экстракта на фоне введения флогогенного агента, даже превышающем действие диклофенака натрия через 3 часа от начала введения.
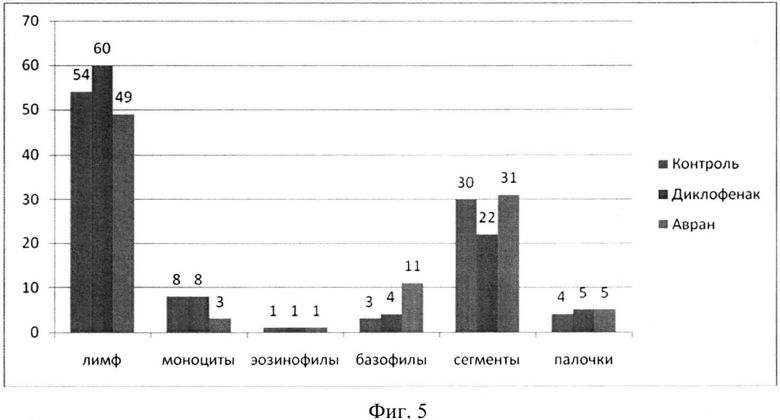
Были получены достоверные результаты по ряду показателей крови (табл.4, фиг.5). Содержание моноцитов у животных, получавших раствор экстракта аврана, снижено по сравнению с контрольной группой, что, вероятно, свидетельствует о быстрой миграции моноцитов в ткани. Так, известно, что моноциты, после созревания в красном костном мозге, выходят в периферическое русло кровотока и циркулируют в крови от 36 до 104 часов, после чего мигрируют в ткани, где и происходит их дальнейшая дифференцировка в тканевые макрофаги, выполняющие основные функции фагоцитарной защиты организма против микробной инфекции; участия в иммунном ответе организма и воспалении и др. То есть под действием экстракта аврана ускоряются процессы иммунного ответа организма и снижения воспаления.
Содержание базофилов в группе животных, получавших раствор экстракта аврана, возрастает по сравнению с другими группами.
Количество нейтрофилов как сегментов, так и палочек несущественно меняется во всех сравниваемых группах. Хотя в группе животных, получавших диклофенак, и наблюдается снижение сегментов, выраженной нейтропении, свидетельствующей о снижении иммунитета, нет. В целом же, как в группе, получавшей раствор экстракта аврана, так и диклофенака отмечается тенденция к возрастанию количества палочек, что отражает усиление защиты организма от начавшегося воспаления.
б) Антимикробная активность
Определение противомикробного действия препаратов проводили по методике, рекомендованной Государственной Фармакопеей (ГФ) 11 издания (ГФ СССР: Вып.2 - М.: Медицина, 1989. - 398 с. ил.). Антимикробную активность определяли в отношении трех стандартных штаммов: Staphylococcus aureus АТСС 6538Р, Pseudomonas aeruginosa АТСС 27835, Escherichia coli АТСС 25922, взятых из музея живых культур кафедры микробиологии, вирусологии и иммунологии ГБОУ ВПО Саратовского ГМУ им. В.И. Разумовского.
Определение чувствительности бактерий проводили методом двукратных серийных разведений в среде Мюллер-Хинтона. Готовили ряд последовательных разведений, с концентрацией препарата от 337.5 до 10.38 мг/мл в объеме 0.9 мл. Штаммы микроорганизмов предварительно культивировали в течение 24 ч в термостате на скошенном агаре. Из суточных культур исследуемых штаммов готовили взвесь по стандарту мутности McFarland 0.5, доводя до концентрации 2·106 КОЕ/мл. В каждую пробирку с разведением экстракта вносили по 0.1 мл приготовленной бактериальной взвеси. Опыт сопровождался контрольными посевами микроорганизмов - без содержания исследуемого экстракта. Для определения эффекта антимикробного действия из контрольных пробирок до начала инкубации проводили мерный высев на плотную питательную среду для подсчета выросших колоний. Посевы инкубировали в термостате при температуре 35°С в течение 20-24 часов. В ряду разведений препарата отмечали пробирку с наименьшей концентрацией экстракта, в которой отсутствовал рост бактерий. Количество вещества в этой пробирке расценивалось как минимальная подавляющая концентрация (МПК). Из пробирок, в которых отсутствовал видимый рост бактерий, производили мерный высев на плотные питательные среды и инкубировали в термостате 20-24 ч. Количество выросших колоний сравнивали с количеством, выросшим из контрольных пробирок. Если количество колоний было меньше в 2-3 раза по сравнению с контролем, характер антимикробного действия расценивался как бактерицидный, если количество колоний при высеве из контрольной и опытной пробирок было равным - как бактериостатический.
Установлено наличие антимикробного действия водного раствора экстракта в отношении всех испытуемых видов микроорганизмов (табл.5).
Наибольшую активность водный раствор экстракта аврана продемонстрировал в отношении S. aureus: МПК составила 20,45 мг/мл (при этом отмечался бактериостатический эффект). Более высокие концентрации экстракта (135 мг/мл и выше) обладали бактерицидным действием в отношении золотистого стафилококка. В отношении Р. aeruginosa МПК составила 75 мг/мл, при этом только максимальная концентрация (337.5 мг/мл) оказывала бактерицидное действие. Наименьшее антимикробное действие экстракт проявил в отношении Е. coli: МПК составила 337,5 мг/мл (в отношении кишечной палочки эта концентрация также обладала бактерицидным эффектом).
В результате установлена избирательная активность водного раствора экстракта аврана в отношении разных штаммов, при этом наименьшая активность была отмечена для условно патогенного штамма кишечной палочки.
Таким образом, полученный экстракт аврана лекарственного обладает одновременно комплексом новых свойств, ранее не известных для него: противовоспалительным, жаропонижающим и антимикробным действием, необходимых для профилактики и лечения гнойно-воспалительных заболеваний.
Пример 1
Траву аврана измельчали и просеивали через сито с размером ячеек не более 3 мм. Взвесили 10 г измельченного сырья, поместили его в колбу объемом 500 мл, добавили 100 мл этилового спирта 96%, на водяной бане довели до кипения и кипятили в течение 14-15 мин. Экстракт из колбы процедили в стеклянную емкость через 4 слоя широкого бинта, остаток растительного материала тщательно отжали, залили еще 100 мл этилового спирта 96%. Довели до кипения и снова профильтровали в ту же стеклянную емкость. Полученный экстракт выпарили досуха в термостате при температуре не выше 55-60°С. В стеклянную емкость с выпаренным экстрактом добавили 8 мл дистиллированной воды, затем с помощью шприца перенесли полученный раствор в пластиковую центрифужную пробирку объемом 11 мл, добавили 2 мл хлороформа, встряхнули несколько раз до однородности, остудили до комнатной температуры и центрифугировали в течение 15 мин (для удаления неполярных примесей (хлорофилла) и др.) при скорости 1500 оборотов в минуту. Водную фракцию собирали с помощью шприца, поместили в заранее взвешенную чашку Петри, высушили и в таком виде хранили до начала эксперимента. Вес сухого экстракта подсчитали как разницу между весом взвешенной чашкой Петри с сухим экстрактом и весом пустой чашки Петри. Получили 225 мг сухого экстракта аврана.
Полученные 225 мг сухого экстракта из травы аврана лекарственного исследовали методом хромато-масс-спектрометром, модели Trace GC - Trace DSQ (фирма ThermoFinnigan, США). В рамках выполненной работы были выделены органические вещества: 4-винил-2-метоксифенол; 2,3-дигидро-3,5-дигидрокси-6-метил-4Н-пиран-4-он; 2,3-дигидробензофуран; 3-фуранкарбоновая кислота; 5-гидроксиметил-2-фуральдегид; этил-α-d-рибозид; 4-пропилфенол; пирокатехин; L-луксоза (пентоза); 6-деоксигексоза L-галактоза; бензоилуксусной кислоты этиловый эфир; гексадекановая кислота (пальмитиновая кислота): гомованилиновая кислота; глюкоза; 1,4-ангидро-d-маннитол; бензойная кислота; кверцетин.
Была взята крыса массой 160 г, которой предварительно ввели субплантарно 0,1 мл 3,0% раствора формалина, затем внутримышечно вводился водный раствор упаренного экстракта аврана лекарственного в дозировке 70 мг/кг. Установлено, что ректальная температура у крысы до начала эксперимента составила 35,0 С°, что соответствует параметрам средней видовой нормы. Было установлено, что температура в течение первых двух часов не менялась, затем к 3 часам происходило снижение температуры до 33,3 С°, и дальнейшая динамика температуры не изменялась до 24 часов от начала эксперимента.
В процессе определения снижения отека конечности, при введении водного раствора экстракта аврана было установлено, что противоотечный эффект экстракта начинал наблюдаться у крысы через 1 час после введения (обхват задней лапы 3,15 мм), достигая максимума через 3 часа (обхват задней лапы 2,9 мм). Данный эффект экстракта стабильно сохраняется и через 24 часа от начала введения (обхват задней лапы 2,95 мм).
Пример 2
Средство, полученное в примере №1, было протестировано на антимикробную активность.
Из суточной культуры исследуемого штамма Staphylococciis aureus ATCC 6538P приготовили взвесь по стандарту мутности McFarland 0,5, доводя до концентрации 2·106 КОЕ/мл. Была взята пробирка, содержащая водный раствор сухого экстракта аврана. В пробирку с разведением экстракта внесли 0.1 мл приготовленной бактериальной взвеси S. aureus. Посевы инкубировали в термостате при температуре 35°С в течение 24 часов.
Был исследован водный раствор аврана в концентрации - 39,71 мг/мл. Из пробирки, в которой отсутствовал видимый рост бактерий, производи мерный высев на плотную питательную среду и инкубировали в термостате в течение 24 ч. Установлено наличие антимикробного действия водного раствора экстракта в отношении S. aureus: МПК составила 39,71 мг/мл (отмечался бактерицидный эффект), так как отсутствовал рост бактерий через 24 часа.
Таким образом, экстракт, полученный путем экстрагирования 96% этиловым спиртом листьев и цветков аврана лекарственного, при определенных условиях, с очисткой хлороформом от ядовитых веществ с их полным последующим удалением вместе с растворителем с помощью центрифугирования, затем упариванием водной фракции на водяной бани при температуре не более 60 С°, обладает комплексом новых свойств: противовоспалительным, жаропонижающим, противомикробным и не является токсичным, что необходимо для профилактики и лечения гнойно-воспалительных заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕВОЙ КАХЕКСИИ | 2015 |
|
RU2578440C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ РАНОЗАЖИВЛЯЮЩЕЙ АКТИВНОСТЬЮ | 2018 |
|
RU2714930C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВЫМ И ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ | 2013 |
|
RU2519769C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУХОГО ЭКСТРАКТА ИЗ РАСТИТЕЛЬНОГО СЫРЬЯ, ОБЛАДАЮЩЕГО БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2482863C1 |
| АНТИМИКРОБНОЕ, ПРОТИВОВОСПАЛИТЕЛЬНОЕ И АНАЛЬГЕЗИРУЮЩЕЕ СРЕДСТВО НА ОСНОВЕ N-4-НИТРОФЕНИЛБЕНЗАМИДИНА | 2012 |
|
RU2481104C1 |
| Способ получения средства, обладающего противовоспалительной активностью | 2020 |
|
RU2756009C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОТУБЕРКУЛЕЗНЫМ ДЕЙСТВИЕМ | 2014 |
|
RU2549477C1 |
| Способ комбинированной терапии рака печени РС-1 в эксперименте | 2020 |
|
RU2734143C1 |
| Анальгезирующее и противовоспалительное средство с противомикробной активностью | 2019 |
|
RU2693475C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ СУБСТАНЦИЙ ИЗ ЗМЕЕГОЛОВНИКА МОЛДАВСКОГО (Dracocephalum moldavica L.) | 2018 |
|
RU2695328C1 |
Изобретение относится к фармацевтической промышленности, в частности к средству, обладающему противовоспалительным, жаропонижающим и антимикробным действием. Средство, обладающее противовоспалительным, жаропонижающим и антимикробным действием, представляющее собой сухой экстракт листьев и цветков аврана лекарственного, полученный путем измельчения их, экстракции спиртом 96% на водяной бане до кипения и кипячения, выпаривания, разведения выпаренного остатка сначала дистиллированной водой, затем добавления хлороформа, охлаждения до комнатной температуры и центрифугирования, с последующим отделением водной фракции и высушиванием ее, при определенных условиях. Вышеописанное средство обладает выраженным противовоспалительным, жаропонижающим и антимикробным действием. 5 ил., 5 табл., 2 пр.
Средство, обладающее противовоспалительным, жаропонижающим и антимикробным действием, представляющее собой сухой экстракт листьев и цветков аврана лекарственного, полученный путем измельчения их, экстракции спиртом 96% на водяной бане до кипения и кипячения в течение 14-15 минут, выпаривания при температуре 55-60°C, разведения выпаренного остатка сначала дистиллированной водой при температуре 40-50°C, затем добавления хлороформа в пропорции 4/5 части воды и 1/5 части хлороформа, охлаждения до комнатной температуры и центрифугирования со скоростью 1500 оборотов в минуту в течение 15 минут, с последующим отделением водной фракции и высушиванием ее.
Авторы
Даты
2014-12-10—Публикация
2013-05-21—Подача