РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка является частичным продолжением заявки на патент США № 12/572344, поданной 2 октября 2009 года, которая притязает на приоритет предварительной заявки на патент США № 61/102349, поданной 2 октября 2008 года. Эта заявка также притязает на приоритет предварительной заявки на патент США № 61/183513, поданной 2 июня 2009 года, предварительной заявки на патент США № 61/262525, поданной 18 ноября 2009 года, предварительной заявки на патент США № 61/305854, поданной 18 февраля 2010 года, предварительной заявки на патент США № 61/306935, поданной 22 февраля 2010 года, предварительной заявки на патент США № 61/307417, поданной 23 февраля 2010 года, и предварительной заявки на патент США № 61/316796, поданной 23 марта 2010 года. Полное содержание каждой из вышеупомянутых заявок таким образом включено сюда в словесной форме посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Причиной печеночной энцефалопатии (HE) является обратимое снижение функции нервной системы, связанное с печеночной недостаточностью и портосистемными венозными анастомозами. HE встречается в 1 из каждых 3 случаев цирроза, в случаях молниеносной печеночной недостаточности, зарегистрированных в Соединенных Штатах (США), и налицо почти у половины пациентов, достигающих конечной стадии заболевания печени. Она может иметь место в любом возрасте, но пики соответствуют таковым молниеносного заболевания печени (пик равен периоду жизни между 40 и 50 годами) и цирроза (пик равен концу периода жизни между 50 и 60 годами).
Видимо, коэффициент заболеваемости НЕ увеличивается вместе с коэффициентом заболеваемости гепатитом C в общей популяции и циррозами у стареющих пациентов. Острая HE означает плохой прогноз с 40% вероятностью срока жизни в течение 1 года. В данной области техники существует потребность в композициях и способах для лечения и предупреждения HE.
Более того, также существует потребность в способах прогнозирования эпизода обострения HE во время лечения или определения, когда осуществлять профилактическое лечение субъекта до возникновения эпизода обострения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Здесь обеспечиваются композиции и способы для предупреждения и лечения печеночной энцефалопатии.
Одним вариантом осуществления является способ лечения или предупреждения печеночной энцефалопатии (HE) у субъекта, включающий введение субъекту специфического для заболевания желудочно-кишечного тракта (GI) антибиотика. В одном варианте осуществления специфическим для заболевания GI антибиотиком является рифаксимин. В другом варианте осуществления рифаксимином является вводимый в дозе 1100 мг/день рифаксимин.
Другим вариантом осуществления является способ снижения риска эпизода обострения печеночной энцефалопатии (HE) во время лечения у субъекта посредством введения специфического для заболевания GI антибиотика субъекту, страдающему HE.
Еще одним вариантом осуществления является способ сохранения ремиссии печеночной энцефалопатии у субъекта посредством введения специфического для заболевания GI антибиотика субъекту, страдающему HE.
Еще одним вариантом осуществления является способ снижения частоты посещений страдающим HE пациентом стационара, включающий введение специфического для заболевания GI антибиотика субъекту, страдающему HE.
В одном варианте осуществления специфический для заболевания GI антибиотик вводят субъекту вместе с лактулозой, до лечения лактулозой или после лечения лактулозой. В одном варианте осуществления субъекту или патронажному медицинскому работнику рекомендуется применение специфического для заболевания GI антибиотика вместе с лактулозой.
В одном варианте осуществления с помощью фармацевтической этикетки или вкладыша субъекту или патронажному медицинскому работнику рекомендуется применение специфического для заболевания GI антибиотика вместе с лактулозой для сохранения ремиссии HE или снижения риска эпизодов HE с явной клинической картиной.
В одном варианте осуществления субъекту или патронажному медицинскому работнику рекомендуется применение двух таблеток, содержащих 550 мг рифаксимина, дважды в день вместе с лактулозой. Применение лактулозы можно распределить во времени, чтобы у субъекта сохранялись 2-3 опорожнения кишечника в виде мягкого стула в день. В одном варианте осуществления лактулозу вводят в 15-мл дозах, причем каждая 15-мл доза содержит 10 мг лактулозы.
В одном варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих степень А или В по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком.
В другом варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих степень А или В по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком в комбинации с лактулозой.
В другом варианте осуществления субъектам, имеющим степень А или В по шкале Чайлд-Пью, или осуществляющему их патронаж медицинскому работнику, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком. Рекомендация и/или инструкции могут быть устными или письменными, например, на фармацевтической этикетке или вкладыше.
В другом варианте осуществления субъектам, имеющим степень А или В по шкале Чайлд-Пью, или осуществляющему их патронаж медицинскому работнику, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком в комбинации с лактулозой.
В одном варианте осуществления субъекта, нуждающегося в лечении по поводу HE и имеющего меньшую С степень по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком. В одном варианте осуществления субъекта, нуждающегося в лечении по поводу HE и имеющего меньшую С степень по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком и лактулозой.
В другом варианте осуществления субъектам, нуждающимся в лечении по поводу HE, или осуществляющему их патронаж медицинскому работнику, сообщают о риске анафилаксии до лечения специфическим для заболевания GI антибиотиком.
В одном варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих равную 25 или меньше оценку в модели конечной стадии заболевания печени (MELD), подвергают лечению специфическим для заболевания GI антибиотиком.
В другом варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих равную 25 или меньше оценку в MELD, подвергают лечению специфическим для заболевания GI антибиотиком в комбинации с лактулозой.
В другом варианте осуществления субъектам, имеющим равную 25 или меньше оценку в MELD, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком. Рекомендация может быть устной или письменной рекомендацией, например, на фармацевтической этикетке или вкладыше.
В другом варианте осуществления субъектам, имеющим равную 25 или меньше оценку в MELD, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком в комбинации с лактулозой.
В одном аспекте здесь обеспечиваются способы снижения уровней аммиака в крови у субъекта, включающие введение субъекту эффективного количества рифаксимина, снижая таким образом уровни аммиака в крови.
В одном варианте осуществления субъект страдает нарушением выведения аммиака.
В одном варианте осуществления нарушение выведения аммиака включает одно или более нарушений, выбираемых из незначительной, имеющей явную клиническую картину, эпизодической и/или персистирующей хронической печеночной энцефалопатии (HE).
В одном варианте осуществления субъект страдает незначительной, имеющей явную клиническую картину, эпизодической и/или персистирующей хронической печеночной энцефалопатией (HE).
Новые способы и устройства, представленные здесь, основываются отчасти на обнаружении корреляции между CFF (критической частотой мельканий) и/или концентрацией аммиака в венозной крови и возникновением эпизодов обострения HE во время лечения. Кроме того, новые способы и устройства также основываются на обнаружении того, что средневзвешенная во времени CFF и/или концентрация аммиака в венозной крови является точным прогностическим фактором эпизодов обострения HE во время лечения и прогнозом в отношении субъектов с HE.
Соответственно, в одном аспекте здесь обеспечиваются способы диагностирования печеночной энцефалопатии (HE) у субъекта посредством определения критической частоты мельканий (CFF) у субъекта в два или более моментов времени, причем снижение CFF указывает на то, что субъект имеет печеночную энцефалопатию. В связанном варианте осуществления CFF включает средневзвешенную во времени CFF. В другом связанном варианте осуществления средневзвешенная во времени CFF включает менее чем приблизительно 24 герц (Гц).
В другом аспекте здесь обеспечиваются способы определения риска эпизода обострения HE во время лечения у субъекта посредством определения критической частоты мельканий (CFF) у субъекта в два или более моментов времени, причем снижение CFF указывает на то, что субъект подвержен повышенную риску эпизода обострения НЕ во время лечения. В связанном варианте осуществления CFF включает средневзвешенную во времени CFF. В другом связанном варианте осуществления средневзвешенная во времени CFF включает менее чем приблизительно 24 герц (Гц). В другом варианте осуществления средневзвешенная во времени CFF, составляющая 10 Гц, указывает на то, что существует наибольшая вероятность эпизода обострения НЕ во время лечения у субъекта.
В другом аспекте здесь обеспечиваются способы определения прогноза в отношении субъекта, имеющего HE, посредством определения критической частоты мельканий (CFF) у субъекта в два или более моментов времени, причем снижение CFF указывает на то, что в отношении субъекта прогноз является плохим. В связанном варианте осуществления CFF включает средневзвешенную во времени CFF. В другом связанном варианте осуществления средневзвешенная во времени CFF включает менее чем приблизительно 24 Гц или менее чем приблизительно 20 Гц.
В другом аспекте здесь обеспечиваются способы лечения или предупреждения эпизода HE посредством определения критической частоты мельканий (CFF) у субъекта в два или более моментов времени, введения субъекту со снижением среднего значения CFF между двумя моментами времени эффективного количества специфического для заболевания GI антибиотика (например, рифаксимина), осуществляя таким образом лечение или предупреждение эпизода HE. В другом варианте осуществления субъекту вводят специфический для заболевания GI антибиотик, когда средневзвешенная во времени CFF составляет менее чем 20 Гц.
В одном варианте осуществления субъекту также вводят лактулозу. В другом варианте осуществления риск является повышенным по сравнению с контрольным субъектом без HE.
В связанных вариантах осуществления два или более моментов времени имеют место в пределах одной недели, четырех недель, шести недель или более.
В другом аспекте здесь обеспечиваются способы диагностирования печеночной энцефалопатии (HE) у субъекта посредством определения уровней аммиака в венозной крови субъекта в два или более моментов времени, причем увеличение уровней аммиака в венозной крови указывает на то, что субъект имеет печеночную энцефалопатию.
В одном варианте осуществления уровень аммиака в венозной крови включает средневзвешенные во времени уровни аммиака в венозной крови. В другом варианте осуществления средневзвешенный во времени уровень аммиака в венозной крови включает более чем приблизительно 100 мкмоль/л.
В другом аспекте здесь обеспечиваются способы определения риска эпизода обострения HE во время лечения у субъекта посредством определения уровней аммиака в венозной крови субъекта в два или более моментов времени, причем повышение уровней аммиака в венозной крови указывает на то, что субъект подвержен повышенному риску эпизода обострения HE во время лечения.
В одном варианте осуществления уровень аммиака в венозной крови включает средневзвешенные во времени уровни аммиака в венозной крови. В другом варианте осуществления средневзвешенный во времени уровень аммиака в венозной крови включает более чем приблизительно 100 мкмоль/л.
В другом аспекте здесь обеспечиваются способы определения прогноза в отношении субъекта, имеющего HE, посредством определения уровня аммиака в венозной крови субъекта в два или более моментов времени, причем повышение уровня аммиака в венозной крови указывает на то, что в отношении субъекта прогноз является плохим.
В одном варианте осуществления уровень аммиака в венозной крови включает средневзвешенные во времени уровни аммиака в венозной крови. В другом варианте осуществления средневзвешенный во времени уровень аммиака в венозной крови включает более чем приблизительно 100 мкмоль/л или более чем приблизительно 110 мкмоль/л.
В другом аспекте здесь обеспечиваются способы лечения или предупреждения эпизода HE посредством определения уровня аммиака в венозной крови субъекта в два или более моментов времени, введения субъекту с повышением уровня аммиака в венозной крови между двумя моментами времени эффективного количества рифаксимина, осуществляя таким образом лечение или предупреждение эпизода HE.
В одном варианте осуществления уровень аммиака в венозной крови включает средневзвешенные во времени уровни аммиака в венозной крови. В другом варианте осуществления средневзвешенный во времени уровень аммиака в венозной крови включает более чем приблизительно 100 мкмоль/л.
В другом варианте осуществления способы, кроме того, включают введение лактулозы.
В связанных вариантах осуществления два или более моментов времени имеют место в пределах одной недели, двух недель, трех недель, четырех недель, пяти недель, шести недель, восьми недель, шести месяцев или более. Также включены моменты времени в любое время между ними.
В другом аспекте здесь обеспечиваются способы лечения субъекта, имеющего HE, включающие введение субъекту эффективного количества специфического для заболевания GI антибиотика, например рифаксимина, осуществляя таким образом лечение субъекта.
В связанных вариантах осуществления специфический для заболевания GI антибиотик, например рифаксимин, вводят в течение более чем 365 дней, более чем 730 дней, более чем 1095 дней или в течение оставшейся части жизни субъекта.
В другом аспекте здесь обеспечиваются способы диагностирования неврологического заболевания у субъекта посредством определения критической частоты мельканий (CFF) у субъекта в два или более моментов времени, причем снижение CFF указывает на то, что субъект имеет неврологическое заболевание. Снижение может быть между любыми двумя моментами времени, например между первым и вторым моментами времени, между первым и третьим моментами времени, между первым и четвертым моментами времени, между вторым и третьим моментами времени, между вторым и четвертым моментами времени и т.п.
В связанном варианте осуществления CFF включает средневзвешенную во времени CFF. В другом варианте осуществления неврологическое заболевание или нарушение включает болезнь Альцгеймера или болезнь Паркинсона. Также включены заболевания, при которых CFF подвергается модуляции у субъекта. Термин «модуляция», как здесь используется, включает увеличение или снижение по сравнению с исходным уровнем или изменение по сравнению с любым измерением, даже если оно не является исходным уровнем для субъекта. Исходный уровень для субъекта можно определить, когда у субъекта не проявляется эпизод HE или эпизод другого неврологического заболевания, когда субъект излечился или находится в ремиссии HE или другого неврологического заболевания.
В другом аспекте здесь обеспечиваются способы определения прогноза в отношении субъекта, имеющего неврологическое заболевание, посредством определения критической частоты мельканий (CFF) у субъекта в два или более моментов времени, причем снижение CFF указывает на то, что в отношении субъекта прогноз является плохим. Плохой прогноз, как здесь используется, включает прогноз средней продолжительности жизни, которая меньше, чем в случае предшествующего прогноза.
В связанном варианте осуществления CFF включает средневзвешенную во времени CFF. В другом варианте осуществления неврологическое заболевание или нарушение включает болезнь Альцгеймера, болезнь Паркинсона, травму, мигрень, постоянную головную боль, бессонницу и другие нарушения сна, и/или эпилепсию.
В связанных вариантах осуществления два или более моментов времени имеют место в пределах одной недели, четырех недель, шести месяцев или более.
В другом аспекте здесь обеспечиваются компьютеризованные способы идентификации субъектов, имеющих неврологическое заболевание, посредством поддержания базы данных, относящихся к CFF у субъектов в различные моменты времени и на различных стадиях прогрессирования заболевания, сравнения результатов определения CFF у индивидуумов, полученных в два или более моментов времени, с базой данных, получения от компьютера диагноза неврологического заболевания, если субъект имеет результаты CFF, которые снижаются между измерениями.
В одном варианте осуществления CFF включает средневзвешенную во времени CFF. В другом варианте осуществления средневзвешенная во времени CFF или CFF во второй или последующий момент времени включает менее чем приблизительно 24 Гц. В другом варианте осуществления способы, кроме того, включают управление принтером для распечатки отчета, основанного на результатах способа.
В другом аспекте здесь обеспечиваются методы деловой деятельности для снижения расходов на здравоохранение, включающие определение CFF у субъекта в два или более моментов времени, хранение информации о пациенте в процессоре компьютера, определение, имеет ли субъект неврологическое заболевание, посредством определения, снизилось ли значение CFF между моментами времени, и лечение субъекта в соответствии с необходимостью для избегания или отсрочки госпитализации.
В другом аспекте здесь обеспечиваются методы деловой деятельности для снижения расходов на здравоохранение, включающие определение CFF у субъекта в два или более моментов времени, хранение информации о пациенте внутри процессора компьютера, определение, имеет ли субъект печеночную энцефалопатию, посредством определения, снизилось ли значение CFF между моментами времени, и лечение субъекта в соответствии с необходимостью для избегания или отсрочки госпитализации
Устройство для определения риска эпизода HE включает «фликкер-блок», измерительный прибор для CFF и компьютер с алгоритмом. В другом варианте осуществления способ, кроме того, включает запоминающее устройство, способное к сохранению данных, относящихся к CFF.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 представляет собой диаграмму в виде ломаных, на которой сравнивается суточное потребление лактулозы между субъектами, принимающими плацебо, и субъектами, принимающими рифаксимин.
Фиг.2 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до эпизода обострения HE во время лечения.
Фиг.3 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до первой связанной с НЕ госпитализации.
Фиг.4 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до первого увеличения оценок по Конну.
Фиг.5 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до первого увеличения степени «порхающего» тремора.
На фиг.6 отображено время до первого эпизода обострения HE с явной клинической картиной во время лечения (вплоть до 6 месяцев лечения, дня 170, в первом исследовании) (в случае сформированной в соответствии с назначенным лечением (ITT) популяции).
На фиг.7 демонстрируется сравнение времени до первого эпизода обострения HE с явной клинической картиной во время лечения в первом исследовании (в подвергнутой лечению рифаксимином группе в сравнении с подвергнутой лечению плацебо группой) и во втором исследовании (в новой по отношению к лечению рифаксимином группе).
На фиг.8 демонстрируется сравнение времени до первого эпизода обострения HE с явной клинической картиной во время подвергания воздействию плацебо (в первом исследовании) и после перехода на подвергание воздействию рифаксимина (во втором исследовании) среди подвергнутых лечению плацебо в первом исследовании субъектов, которые начали принимать рифаксимин во втором исследовании.
На фиг.9 отображено время до первой связанной с НЕ госпитализации (вплоть до 6 месяцев лечения, дня 170, в первом исследовании).
На фиг.10 отображено время до первой вызванной НЕ госпитализации в первом исследовании (в случае ITT популяции).
На фиг.11 отображено время до первого увеличения оценки по Конну (вплоть до 6 месяцев лечения, дня 170, первое исследование) (в случае ITT популяции).
На фиг.12 отображено время до первого увеличения степени «порхающего» тремора (вплоть до 6 месяцев лечения, дня 170, первое исследование) (в случае ITT популяции).
На фиг.13 отображены оценки по методу Каплана-Мейера распределения времени до первого обострения HE во время лечения для субъектов группы продолжения лечения рифаксимином, которые не проявили эпизод HE в первом исследовании, в сравнении с подвергнутыми лечению плацебо субъектами.
На фиг.14A-B отображен раздел полученных с помощью CLDQ результатов, что определено по Twa, между подвергнутыми лечению плацебо и рифаксимином группами в распределении по частоте представленных в виде Twa оценок проявления усталости и общих оценок.
На фиг.15 представлен патогенез HE.
На фиг.16 представлена клиническая картина HE. Классификация, основанная на Ferenci P, et al. Hepatology. 2002; 35: 716-721, представлена рабочей группой WCOG в 1998.
На фиг.17 представлена HESA-адаптация оценки по Конну.
На фиг.18 представлено влияние НЕ на пациента и того, кто ухаживает за ним.
На фиг.19 отображены госпитализации вследствие HE и влияние на экономику.
На фиг.20 продемонстрировано влияние печеночной недостаточности на фармакокинетику рифаксиминаю
На фиг.21 демонстрируется, что экспозиция рифаксимина значительно меньше экспозиции других антибиотиков (Well et al., Int J Antimicrob Agents 10 (1998) 31-38). У пациентов с наибольшей печеночной недостаточностью экспозиция рифаксимина в >200 раз меньше экспозиции рифампина, в >35 раз меньше экспозиции норфлоксацина и в ≥10 раз меньше экспозиции неомицина.
На фиг.22 демонстрируются взаимодействия между лекарственными средствами: мидазоламом и рифаксимином. Нет значительного ингибирования CYP-ферментов, P-гликопротеина или BSEP. Портосистемные анастомозы при печеночной недостаточности могут снизить уровень экспозиции в печени.
На фиг.23 демонстрируется эффект на уровни аммиака в крови. Рифаксимин, вводимый в дозе 1200 мг/день в течение 5-10 дней, снижал уровни аммиака в крови (p<0,0001). Отмечались соответствующие уменьшения степени HE (p<0,0001), улучшения неврологических, нейропсихиатрических и психометрических параметров. Была исследована корреляция между снижением уровня аммиака со временем и HE.
На фиг.24 отображены кривые без эпизодов обострения с оценками по методу Каплана-Мейера в исследовании НЕ (времени до первого эпизода обострения HE вплоть до 6 месяцев лечения, дня 170) (в случае ITT популяции).
На фиг.25 отображены кривые без эпизодов обострения с оценкой по методу Каплана-Мейера в основном исследовании НЕ (времени до первой связанной с НЕ госпитализации вплоть до 6 месяцев лечения, дня 170) (в случае ITT популяции).
Фиг.26 представляет собой диаграмму в виде ломаных, на которой демонстрируется время до первого эпизода обострения HE во время лечения.
Фиг.27 является схемой, демонстрирующей отношения рисков (риск в подвергнутой лечению рифаксимином группе, разделенный на риск в подвергнутой лечению плацебо группе) в случае риска проявления обострения HE с явной клинической картиной для каждой подгруппы.
Фиг.28 представляет собой диаграмму в виде ломаных, на которой демонстрируется время до первой связанной с НЕ госпитализации.
Фиг.29 является блок-схемой, иллюстрирующей, что применение лактулозы было одинаковым между контрольной группой и группой, принимающей рифаксимин.
Фиг.30 является схемой, иллюстрирующей наличие постоянства терапевтического эффекта по различным подгруппам, которым вводили рифаксимин.
На фиг.31 отображено распределение представленных в виде средневзвешенных во времени значений результатов исследования CFF в соответствии с состоянием обострения НЕ с явной клинической картиной.
На фиг.32 отображена рабочая характеристическая кривая (ROC-кривая) в случае использования результатов исследования CFF для прогнозирования обострения HE с явной клинической картиной.
На фиг.33 отображено распределение представленных в виде средневзвешенных во времени значений результатов, относящихся к концентрациям аммиака в венозной крови, в соответствии с состоянием обострения НЕ с явной клинической картиной.
На фиг.34 отображена рабочая характеристическая кривая (ROC-кривая) в случае использования уровней аммиака в венозной крови для прогнозирования обострения HE с явной клинической картиной.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Печеночная энцефалопатия, также известная как печеночная кома или портально-системная энцефалопатия (PSE), является серьезным, редким, сложным, эпизодическим, нейропсихиатрическим синдромом, связанным с прогрессирующим заболеванием печени. Печеночная энцефалопатия является огромным бременем для пациента, его семьи и системы здравоохранения; и современный стандарт обслуживания не соответствует требованиям. Эпизодическая HE с явной клинической картиной является широко распространенной среди пациентов с циррозом печени. Заболевание является редким среди индивидуумов в общей популяции. Эпизоды HE с явной клинической картиной вызывают деменцию, могут появляться без предвещающего симптома, делают пациента неспособным к самообслуживанию и часто приводят к госпитализации. Частота госпитализаций вследствие HE увеличилась с 1993 года до свыше 40000 пациентов в 2003 году; и 2004 году 50962 пациентов было госпитализировано с основным диагнозом - HE. HE, как здесь используется, включает, например, эпизодическую, персистирующую хроническую и незначительную HE.
Основной патогенез HE имеет отношение к азотсодержащим веществам, получаемым из кишки, которые оказывают неблагоприятное влияние на функцию головного мозга. Полагают, что самым влиятельным из этих соединений является аммиак, побочный продукт расщепления белков, который обычно обезвреживается печенью. Однако корреляция между уровнями в крови и психическим состоянием при циррозе является неточной, отчасти поскольку проницаемость гематоэнцефалического барьера в отношении аммиака увеличивается у пациентов с HE. Было также предположено, что другие получаемые из кишки токсины являются ответственными за HE.
У пациентов с хроническим заболеванием печени возникновение печеночной энцефалопатии сопровождается низким качеством жизни по сравнению с соответствующими по возрасту пациентами без HE. Эпизоды HE с явной клинической картиной вызывают деменцию, могут появляться без предвещающего симптома, делают пациента неспособным к самообслуживанию и часто приводят к госпитализации. У пациентов с HE проявляются симптомы, включающие усталость, дневную сонливость и отсутствие восприятия (оценка по Конну =1), и спутанность сознания и дезориентацию (оценка по Конну =2), которые значительно мешают повседневному функционированию, и сниженная способность к самообслуживанию. Часто этот недостаток самообслуживания приводит к неправильному питанию и несоблюдению указаний врача и в дальнейшем перерастает в более тяжелые симптомы, такие как повышенная сонливость, явная дезориентация и помрачение сознания (оценка по Конну =3) или кома (оценка по Конну =4).
Также было установлено, что история болезни, включающая эпизоды HE с явной клинической картиной, и тяжесть эпизодов HE предвещают уменьшенный срок жизни пациентов с хроническим заболеванием печени. У пациентов с циррозом печени и историей болезни, включающей эпизоды HE с явной клинической картиной, вероятность выживания составляла 42% через 1 год и 23% через 3 года после проявления эпизода НЕ. В другом анализе возникновение эпизода HE с оценкой по Конну =2 у пациентов с циррозом было связано с 4-кратным повышением риска смерти.
Авторы настоящего изобретения определили, что существует корреляция между CFF или концентрацией аммиака в венозной крови и возникновением эпизодов обострения HE во время лечения. Кроме того, авторы настоящего изобретения определили, что средневзвешенная во времени CFF или концентрация аммиака в венозной крови является точным прогностическим фактором эпизодов обострения HE во время лечения и прогнозом в отношении субъектов с HE. В другом варианте осуществления авторы настоящего изобретения определили, что у субъектов, продолжающих прием рифаксимина в течение продолжительного времени, например более 1,5 лет, продолжают обнаруживаться положительные эффекты, например пониженная частота эпизодов обострения HE во время лечения.
В определенных вариантах осуществления здесь обеспечиваются способы определения наличия у субъекта неврологического заболевания. Представленные здесь способы основываются на определении критической частоты мельканий или уровня аммиака в венозной крови.
Критическую частоту мельканий, также называемую CFF, можно определить, например, с помощью стандартных способов, известных в данной области техники. Кроме того, для измерения CFF имеются коммерческие приборы, которые хорошо известны квалифицированным в данной области техники специалистам.
В анализах критической частоты мельканий используется, например, корреляция между обработкой на уровне головного мозга колеблющихся визуальных стимулов и ухудшением деятельности CNS (центральной нервной системы) вследствие увеличения тяжести HE. В этом анализе определяется частота, на которой мелькающий свет воспринимается субъектом как не мелькающий свет. Снижение этой частоты было связано с увеличением тяжести HE. В одном примере циркулярные импульсы света с составляющим 1:1 соотношением между визуальными импульсами и интервалом были использованы с постепенным снижением частоты с 0,5 до 0,1 Гц/сек. Частоту белого света, который сначала генерируют как импульс высокой частоты (50 Гц) и который создает у пациента впечатление не мелькающего света, можно постепенно снизить до создания у субъекта впечатления, что не мелькающий свет сменился на мелькание. Субъект регистрирует эту смену посредством нажатия на ручной переключатель. Частоты мельканий можно определять многократно, и можно рассчитать средние значения для каждого субъекта.
В некоторых вариантах осуществления значения CFF отслеживают в динамике времени для каждого субъекта. На основе этих значений можно рассчитать площадь под кривой зависимости CFF от времени (AUC), используя расчеты, которые являются стандартными в данной области техники. Например, AUC можно рассчитать, используя формулу трапеций. Для применения формулы трапеций точки на графике соединяют участками прямой линии, устанавливают перпендикулярные линии от абсциссы до каждой точки на графике и вычисляют сумму областей треугольников и трапеций, созданных подобным образом, и она соответствует AUC.
Для точной характеристики вариации CFF в динамике времени для каждого субъекта можно вычислить средневзвешенное во времени значение (twa). Для вычисления twa результаты анализа CFF в динамике времени или уровни аммиака в венозной крови выражают в виде:
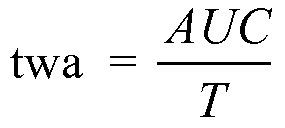 ,
,
где T представляет собой время подвергания воздействию. Таким образом, taw характеризует средний результат: CFF и/или уровень аммиака в венозной крови - между множеством моментов времени.
Корреляцию между twa и наличием или отсутствием эпизода обострения HE во время лечения можно проанализировать с помощью дисперсионного анализа и коэффициента корреляции рангов Спирмена. Кроме того, можно выполнить анализ ROC-кривой для оценки правильности применения twa для проведения различий между наличием и отсутствием эпизодов обострения во время лечения. Анализ ROC-кривой в случае данных, собранных в Примерах, показал, что эта методология является в высокой степени точным прогностическим фактором HE.
Эти токсичные соединения получают доступ в большой круг кровообращения в результате снижения функционирования печени или портосистемных венозных анастомозов. Оказавшись в ткани головного мозга, соединения порождают изменения нейротрансмиссии, которые оказывают влияние на сознание и поведение. HE объясняется общим снижением деятельности центральной нервной системы в результате присутствия азотсодержащих соединений, которые приводят к активации гамма-аминобутировой кислоты (GABA) и снижению нейротрансмиссии от глютамата.
Провоцирующие факторы включают азотемию (29%), седативные средства, транквилизаторы, анальгетики 24%), желудочно-кишечное кровотечение (18%), пищевой белок в избыточном количестве (9%), метаболический ацидоз (11%), инфекцию (3%), запор (3%). НЕ может также провоцировать хирургическое вмешательство, в частности процедура трансяремного внутрипеченочного портосистемного шунтирования (TIPS). HE по неизвестным причинам составляет лишь 2% случаев.
Первоначальные проявления являются субклиническими, и для их диагностирования требуется психометрическое тестирование. Существуют 4 прогрессирующие стадии ухудшения, известные как критерии Уэст-Хейвена (или оценка по Конну), которые простираются от стадии 0 (отсутствие выявляемых изменений личности) до стадии 4 (кома, децерабрационная поза, расширенные зрачки), как обсуждается подробнее ниже.
HE проявляется в виде череды явлений, состоящей из психомоторной дисфункции, ухудшения памяти, увеличенного времени реакции, анормальностей восприятия, плохой концентрации и в тяжелых формах комы. Могут отмечаться изменения личности, сознания, поведения и функции нервно-мышечной системы. Неврологические признаки могут включать гиперрефлексию, ригидность, миоклонию и «порхающий» тремор (широко «порхающее» дрожание мышц). Могут быть анормальными когнитивные задачи, такие как соединение номеров с линиями. Может присутствовать печеночное зловоние (сладковатый запах изо рта). Электроэнцефалограммы (EEG) демонстрируют неспецифическую трехфазную медленноволновую активность, в основном на протяжении лобных долей. Протромбиновый индекс может быть увеличенным и не допускать коррекцию с помощью витамина K. Полученное при компьютерной топографии изображение головы может быть нормальным или демонстрировать общую атрофию. В конце концов, могут отмечаться признаки заболевания печени, такие как желтуха и асцит.
Диагностирование НЕ осуществляют на основе истории болезни и исследований физического и психического состояния, при этом необходимые клинические элементы являются сведениями о существующем заболевании печени, провоцирующем факторе(ах) и/или предшествующей истории HE. EEG может демонстрировать медленноволновую активность, даже в легких случаях. Повышенный уровень аммиака в сыворотке является характерным, но не необходимым, и имеется слабая корреляция между ним и степенью энцефалопатии.
Лечение пациентов с хронической HE включает 1) обеспечение поддерживающего лечения, 2) идентификацию и исключение провоцирующих факторов, 3) уменьшение загрузки азотсодержащих веществ из кишки и 4) определение необходимости в длительной терапии. Загрузку азотсодержащих веществ из кишки обычно уменьшают, используя не абсорбируемый дисахарид (лактулозу) и/или антибиотики.
Лактулоза считается терапевтическим средством первой линии в Соединенных Штатах. Лактулоза метаболизируется кишечными бактериями толстой кишки, что приводит к уменьшению pH каловых масс, далее к слабительному эффекту и, наконец, к удалению каловых масс. Уменьшенный pH каловых масс приводит к ионизированию аммиака (NH3) до йона аммония (NH4 +), который используется бактериями для синтеза аминокислот и белков. Это приводит к снижению уровней аммиака в сыворотке и улучшению психической функции.
Общепринятая терапия нацелена на понижение продукции и абсорбции аммиака. Лактулозу обычно используют в суточных дозах, 30-60 г. Однако дозу можно снизить вплоть до 20-40 г TID-QID для порождения 2-3 опорожнений кишечника в виде полусформированного стула в день. Если лактулозу нельзя назначить перорально или через назагастральный зонд, например, пациентам со стадией 3 и 4 HE, его можно назначать в виде 300 см3 (200 г) удерживаемой клизмы.
В случае острой энцефалопатии лактулозу можно назначать либо перорально, принимая внутрь или через назагастральный зонд, либо через удерживающие клизмы. Обычная пероральная доза составляет 30 г с последующим введение доз каждые 1-2 часа до возникновения опорожнения. В этот момент времени введение доз регулируют для достижения двух или трех опорожнений кишечника в виде мягкого стула в день.
Лактулоза общедоступна без рецепта. Традиционный и относительно безвкусный препарат, часто называемый в коммерческой деятельности «лактулозным порошком, используемым для приготовления раствора для перорального применения», можно приобрести, например, у Bertek Pharmaceuticals, Sugarland, Tex. в виде KristaloseRTM в содержащих 10 и 20 г пакетиках. Лактулозные сиропы, обычно продаваемые как слабительные средства, включают CephulacRTM, ChronulacRTM, CholacRTM и EnuloseRTM. Эти сиропы могут использоваться вместо лактулозного порошка при использовании достаточного количества сиропа для обеспечения желаемой дозы лактулозы; обычно названные сиропы содержат приблизительно 10 г лактулозы в 15 мл сиропа.
Активные в желудочно-кишечном тракте антибиотики широко спектра действия, включающие неомицин, метронидазол, ванкомицин и паромомицин, использовались вместе с лактулозой или без нее. В современных руководствах рекомендуется прием внутрь неомицина в дозе 1-2 г/день с периодическим контролем почек и ежегодным контролем слуха или метронидазол в дозе 250. Лактулоза может вызывать диарею, приводящую к дегидратации, провоцирующему НЕ фактору. Кроме того, отвращение у пациента, вызванное чрезмерно сладким вкусом лактулозы, ограничивает соблюдение указаний врача в отношении приема лактулозы. Кроме того, схема введения доз, которая связана с ритмами опорожнений кишечника и побочными эффектами, состоящими из метеоризма, вздутия, диареи (которая приводит к дегидратации) и ацидоза, затрудняют длительное применение лактулозы.
Применению антибиотиков для лечения HE препятствует связанная с длительным применением токсичность. В частности, системная абсорбция неомицина, метронидазола и ампициллина приводила к редким случаям нефротоксичности, ототоксичности, S. enterocolitis и/или образованию резистентных бактериальных штаммов. Кроме того, неомицин ингибирует только аэробные бактерии. Метронидазол медленно метаболизируется у пациентов с дисфункцией печени, способен к взаимодействиям со спиртом (вызову дисульфирамоподобного эффекта), а высокие уровни в крови могут привести к судорогам.
Одним специфическим для заболевания желудочно-кишечного тракта антибиотиком является рифаксимин. Рифаксимин является не являющимся аминогликозидом, полусинтетическим антибиотиком, полученным на основе рифамицина O. Он является несистемным, не абсорбируемым антибиотиком широкого спектра действия для перорального применения, оказывающим специфический эффект на кишечные патогены желудочно-кишечного тракта. Установлено, что рифаксимин обладает при лечении HE преимуществом относительно ранее используемых антибиотиков; например, он демонстрирует незначительную системную абсорбцию (<0,4%) независимо от приема пищи или наличия заболевания желудочно-кишечного тракта и не демонстрирует аккумуляцию в плазме при использовании высоких или повторных доз. Отсутствие системной адсорбции делает рифаксимин безопасным и хорошо переносимым, таким образом улучшая соблюдение указаний врача пациентом и уменьшая побочные эффекты, связанные с известными в настоящее время лечениями.
Рифаксимин (INN; смотрите The Merck Index, XIII Ed., 8304) является антибиотиком, относящимся к классу антибиотиков - рифамицина, например пиридо-имидазо-рифамицину. Рифаксимин проявляют широкий спектр своей антибактериальной активности, например, в желудочно-кишечном тракте по отношению к локализованным в желудочно-кишечном тракте бактериям, которые вызывают инфекционную диарею, синдром разраженного кишечника, чрезмерно быстрый рост бактерий в тонкой кишке, болезнь Крона и/или панкреатическую недостаточность. Сообщалось, что рифаксимин характеризуется незначительной системной абсорбцией благодаря его химическим и физическим свойствам (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int. J. Clin Pharmacol Res, 14 (2), 51-56, (1994)).
Рифаксимин описан в итальянском патенте IT 1154655 и EP 0161534. В патенте EP 0161534 описан процесс производства рифаксимина с использованием рифамицина O в качестве исходного материала (The Merck Index, XIII Ed., 8301). В патенте США № 7045620 B1 описываются полиморфные формы рифаксимина. Упомянутые здесь заявки и патенты включены сюда посредством ссылки в их полном объеме для всех целей.
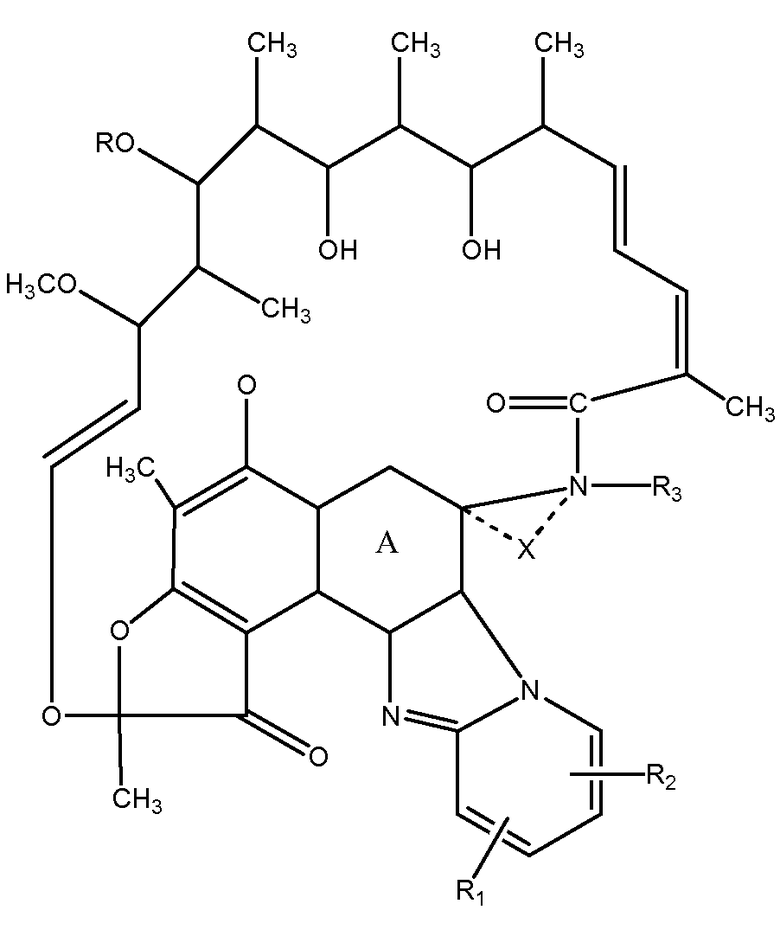
Антибиотиком класса рифаксимина является, например, соединение, имеющее структуру формулы I:
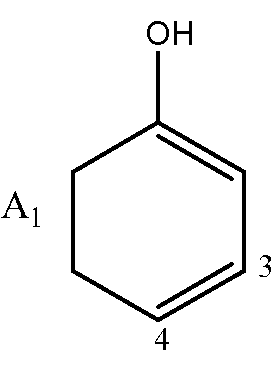
где A может быть структурой A1:
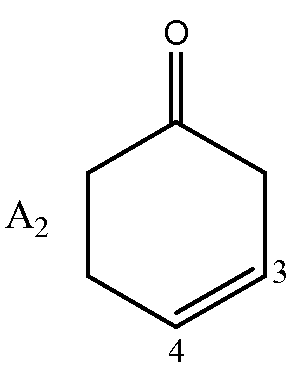
или структурой A2:
где -x- является ковалентной химической связью или ничем; R представляет собой водород или ацетил;
R1 и R2 независимо представляют собой водород, (C1-4)алкил, бензилокси, моно- и ди(C1-3)алкиламино(C1-4)алкил, (C1-3)алкокси(C1-4)алкил, гидроксиметил, гидрокси(C2-4)алкил, нитро, или R1 и R2 в своей совокупности с двумя следующими друг за другом атомами углерода пиридинового ядра образуют бензольное кольцо, незамещенное или замещенное одной или двумя метильными или этильными группами; R3 является атомом водорода или ничем; при условии, что когда A представляет собой A1, -x- является ничем, а R3 является атомом водорода; с дополнительным условием, что когда A представляет собой A2, -x- является ковалентной химической связью, а R3 является ничем.
Здесь также описывается определенное выше соединение, в котором A представляет собой структуру A1 или A2, указанную выше, -x- является ковалентной химической связью или ничем; R представляет собой водород или ацетил, R1 и R2 независимо представляют собой водород, (C1-4)алкил, бензилокси, гидрокси(C2-4)алкил, ди(C1-3)алкиламино(C1-4)алкил, нитро, или R1 и R2 в своей совокупности с двумя следующими друг за другом атомами углерода пиридинового ядра образуют бензольное кольцо, и R3 является атомом водорода или ничем; при условии, что когда A представляет собой A1, -x- является ничем, а R3 является атомом водорода; с дополнительным условием, что когда A представляет собой A2, -x- является ковалентной химической связью, а R3 является ничем.
Здесь также описывается определенное выше соединение, в котором A представляет собой структуру A1 или A2, указанную выше, -x- является ковалентной химической связью или ничем; R представляет собой ацетил, R1 и R2 независимо представляют собой водород, (C1-4)алкил, или R1 и R2 в своей совокупности с двумя следующими друг за другом атомами углерода пиридинового ядра образуют бензольное кольцо, и R3 является атомом водорода или ничем; при условии, что когда A представляет собой A1, -x- является ничем, а R3 является атомом водорода; с дополнительным условием, что, когда A представляет собой A2, -x- является ковалентной химической связью, а R3 является ничем.
Здесь также описывается определенное выше соединение, которое представляет собой 4-дезокси-4'-метил-пиридо[1',2'-1,2]имидазо[5,4-c]рифамицин SV. Здесь также описывается определенное выше соединение, которое представляет собой 4-дезокси-пиридо[1',2':1,2]имидазо[5,4-c]рифамицин SV.
Здесь также описывается определенное выше соединение, в котором A является описанной выше структурой, -x- является ковалентной химической связью или ничем; R представляет собой водород или ацетил; R1 и R2 независимо представляют собой водород, (C1-4)алкил, бензилокси, моно- и ди(C1-3)алкиламино(C1-4)алкил, (C1-3)алкокси(C1-4)алкил, гидроксиметил, гидрокси(C2-4)алкил, нитро, или R1 и R2 в своей совокупности с двумя следующими друг за другом атомами углерода пиридинового ядра образуют бензольное кольцо, незамещенное или замещенное одной или двумя метильными или этильными группами; R3 является атомом водорода или ничем; при условии, что когда A представляет собой A1, -x- является ничем, а R3 является атомом водорода; с дополнительным условием, что когда A представляет собой A2, -x- является ковалентной химической связью, а R3 является ничем.
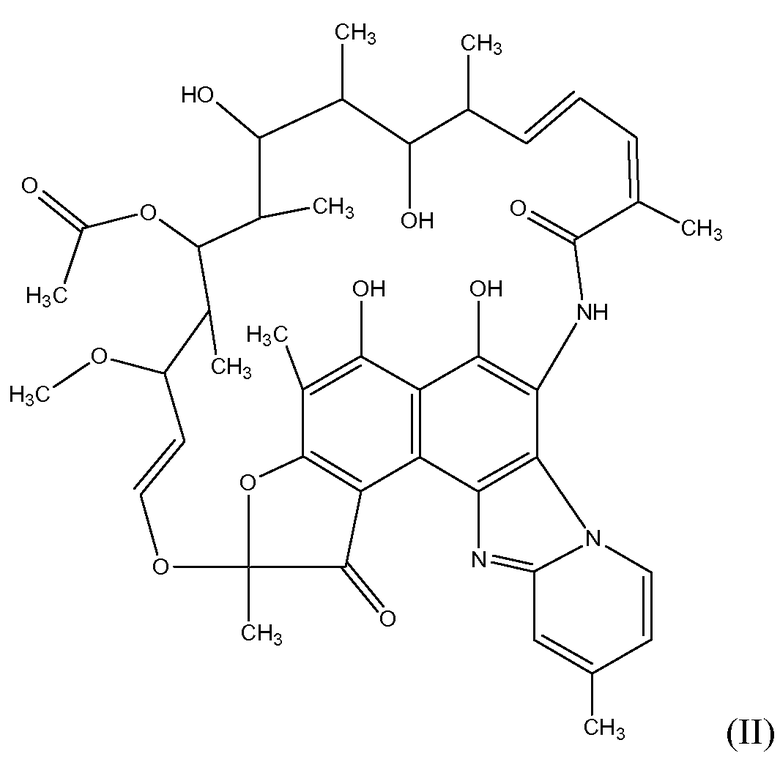
Рифаксимин является соединением, имеющим структуру формулы II:
В определенных вариантах осуществления антибиотик включает один или более антибиотиков следующих классов: рифамицина, аминогликозида, амфеникола, ансамицина, β-лактама, карбапенема, цефалоспорина, цефамицина, монобактама, оксацефема, линкосамида, макролида, полипептида, тетрациклина или 2,4-диаминопиримидина. Приводимые в качестве примеров антибиотики этих классов перечислены ниже.
Рифаксимин проявляют широкий спектр антибактериальной активности в желудочно-кишечном тракте по отношению к локализованным в желудочно-кишечном тракте бактериям, которые вызывают инфекционную диарею, в том числе анаэробным штаммам. Сообщалось, что рифаксимин характеризуется незначительной системной абсорбцией благодаря его химическим и физическим свойствам (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int J Clin Pharmacol Res, 14. (2), 51-56, (1994)).
При отсутствии желания ограничиваться какими-либо конкретными научными теориями, рифаксимин действует посредством связывания с бета-субъединицей бактериальной зависимой от дезоксирибонуклеиновых кислот РНК-полимеразы, приводя к ингибированию синтеза РНК в бактериях. Он является активным по отношению к многочисленным грамположительным и грамотрицательным бактериям, и аэробным, и анаэробным. In vitro данные показывают, что рифаксимин является активным по отношению к родам Staphylococcus, Streptococcus, Enterococcus и Enterobacteriaceae. Бактериальное восстановление или увеличение резистентности к противомикробным веществам в кишечной флоре не происходят часто и не имеют клинического значения. В настоящее время рифаксимин разрешен в 17 странах вне США и лицензирован Управлением по контролю за продуктами и лекарствами (FDA) для США в мае 2004 года.
Должно быть понятно, что как вышеприведенное общее описание, так и следующее подробное описание являются лишь примерными и поясняющими, а не ограничивающими заявленное изобретение. В этой заявке использование единственного числа включает множественное число, кроме особо оговоренных случаев. В этой заявке использование «или» означает «и/или», кроме оговоренных случаев. Кроме того, использование термина «включающий», а также других форм, таких как «включает» и «включенный», не является ограничением. Также такие термины, как «элемент» или «компонент», включают как элементы и компоненты, включающие одну единицу, так и элементы и компоненты, которые включают более чем одну субъединицу, кроме особо оговоренных случаев. Также использование термина «часть» может включать часть составляющей или всю составляющую.
Все документы, или части документов, приведенные в этой заявке, включающие, но без ограничения, патенты, заявки на патенты, статьи, книги и монографии, включены таким образом в словесной форме в их полном объеме посредством ссылки для любой цели.
Одним вариантом осуществления является способ лечения или предупреждения печеночной энцефалопатии (HE) посредством введения субъекту терапевтически эффективного количества специфического для заболевания желудочно-кишечного тракта (GI) антибиотика. Примеры специфических для заболеваний желудочно-кишечного тракта антибиотиков включают антибиотики класса рифамицина, такие как рифаксимин.
Представленные здесь варианты осуществления относятся к обнаружению эффективности специфических для заболеваний желудочно-кишечного тракта (GI) антибиотиков в случае лечения или предупреждения печеночной энцефалопатии. Варианты осуществления относятся к применению специфических для заболеваний GI антибиотиков для предотвращения возникновения симптомов HE, а также увеличения времени до первого эпизода обострения HE во время лечения. В одном варианте осуществления время до первого эпизода обострения HE во время лечения определяли по времени до увеличения оценки по Конну до степени ≥2 (например, с 0 или 1 до ≥2) или увеличения оценки по Конну и «порхающего» тремора, составляющего одну степень для каждой оценки, для тех пациентов, которые имели оценку по Конну на исходном уровне =0. В другом варианте осуществления время до первого эпизода обострения HE во время лечения определяли по времени до любого увеличения по сравнению с исходным уровнем либо оценки по Конну (степени психического состояния), либо степени «порхающего» тремора, с оценками по методу Каплана-Мейера кумулятивных процентов субъектов с любым увеличением в дни 28, 56, 84, 112, 140 и 168.
Другим вариантом было определение времени до первой связанной с HE госпитализации или времени до развития спонтанного бактериального перитонита (SBP). Другим вариантом было среднее изменение по сравнению с исходным уровнем концентрации аммиака в крови со временем или среднее изменение по сравнению с исходным уровнем значений критической частотой мельканий со временем. В качестве дополнительного варианта приводилось среднее суточное потребление лактулозы в динамике времени, смещения по сравнению с исходным уровнем оценок по Конну со временем или смещения по сравнению с исходным уровнем степеней «порхающего» тремора со временем. Кроме особо оговоренных случаев, смещением значения является изменение этой величины по сравнению со значением на исходном уровне.
Другие показатели эффективности описанных здесь лечений включали среднее изменение по сравнению с исходным уровнем оценок, проведенных с помощью вопросника для оценки хронического заболевания печени (CLDQ), со временем; среднее изменение по сравнению с исходным уровнем оценок по шкале сонливости Эпворса со временем и долю субъектов, которые имели оценку по шкале сонливости Эпворса, составляющую >10. Оценка тяжести персистирующей хронической печеночной энцефалопатии может также основываться, например, на оценках по Конну.
В другом варианте осуществления субъекту, страдающему печеночной энцефалопатией (НЕ), подверженному ей или находящемуся в ремиссии, можно назначать антибиотик класса рифамицина в течение приблизительно 24 недель - 24 месяцев. При лечении HE антибиотик класса рифамицина может назначаться субъекту в течение 12 месяцев или дольше, например в течение всей продолжительности жизни субъекта. В одном варианте осуществления антибиотик назначают ежедневно до смерти субъекта.
Один вариант осуществления относится к способу снижения у субъекта риска проявления эпизода обострения во время лечения посредством введения субъекту специфического для заболевания GI антибиотика. В одном варианте осуществления в случае субъектов, проявивших последний эпизод HE за ровно или более 90 дней до начала лечения, риск обострения во время лечения снижался на 58%. В другом варианте осуществления риск обострения во время лечения снижался на приблизительно 30-70%. В другом варианте осуществления риск снижается на приблизительно 40-70%. Один вариант осуществления относится к снижению риска эпизодов печеночной энцефалопатии с явной клинической картиной у пациентов, страдающих HE. В одном варианте осуществления пациентами являются пациенты возрастом старше 18 лет.
В одном варианте осуществления в случае субъектов, проявивших последний эпизод HE за более 90 дней до введения специфического для заболевания GI антибиотика, риск обострения во время лечения снижался на приблизительно 60%. В другом варианте осуществления риск обострения во время лечения снижался на приблизительно 2-80%.
В другом варианте осуществления в случае субъектов, имеющих два или меньше эпизодов HE в шестимесячный период до начала лечения, риск эпизода обострения НЕ во время лечения снижался на приблизительно 56%. В одном варианте осуществления риск эпизода обострения НЕ во время лечения снижался на приблизительно 20-70%.
В другом варианте осуществления в случае субъектов, имеющих более двух эпизодов HE в шестимесячный период до начала лечения, риск эпизода обострения НЕ во время лечения снижался на приблизительно 63%. В другом варианте осуществления риск снижался на приблизительно 30-80%.
В одном варианте осуществления терапевтически эффективное количество специфического для заболевания желудочно-кишечного тракта (GI) антибиотика включает от приблизительно 1000 мг до приблизительно 1200 мг/день.
В одном варианте осуществления терапевтически эффективное количество специфического для заболевания GI антибиотика включает от приблизительно 1100 мг до приблизительно 1200 мг/день.
В соответствии с одним вариантом осуществления терапевтически эффективное количество специфического для заболевания GI антибиотика включает приблизительно 1150 мг/день.
В другом варианте осуществления терапевтически эффективным количеством является схема назначения одной капсулы или таблетки препарата два раза каждый день, причем каждая таблетка включает приблизительно 550 мг специфического для заболевания GI антибиотика, такого как рифаксимин.
В одном варианте осуществления терапевтически эффективным количеством является схема назначения двух капсул или таблеток три раза каждый день, причем каждая капсула включает приблизительно 200 мг специфического для заболевания GI антибиотика.
В одном варианте осуществления терапевтически эффективным количеством является доза, составляющая 275 мг специфического для заболевания GI антибиотика, вводимая четыре раза в день. В другом варианте осуществления 275 мг специфического для заболевания GI антибиотика вводят в виде двух лекарственных форм два раза в день.
Другим вариантом осуществления является способ сохранения ремиссии НЕ у субъекта посредством введения субъекту специфического для заболевания GI антибиотика.
Другим вариантом осуществления является способ увеличения времени до госпитализации для лечения HE посредством введения субъекту специфического для заболевания GI антибиотика. В одном варианте осуществления введение специфического для заболевания GI антибиотика снижает частоту госпитализации на приблизительно 48%. В другом варианте осуществления специфический для заболевания GI антибиотик снижает частоту госпитализации на приблизительно 13-приблизительно 69%.
В одном варианте осуществления лечение специфическим для заболевания GI антибиотиком сохраняет ремиссию у субъекта.
В одном варианте осуществления специфический для заболевания GI антибиотик назначают субъекту в течение шести месяцев, одного года, двух-трех лет или ежедневно до смерти субъекта.
В одном варианте осуществления оценка по Конну для субъекта улучшается по сравнению с исходным уровнем после введения специфического для заболевания GI антибиотика.
В одном варианте осуществления качество жизни (QoL) улучшается по сравнению с исходным уровнем с помощью введения специфического для заболевания GI антибиотика в течение курса лечения рифаксимином. В одном варианте осуществления улучшенным качеством является улучшение AUC или TWA, определенное с помощью вопросника для оценки хронического заболевания печени (CLDQ).
В одном варианте осуществления специфический для заболевания GI антибиотик вводят субъекту вместе с лактулозой, до лечения лактулозой или после лечения лактулозой. В одном варианте осуществления субъекту или патронажному медицинскому работнику рекомендуется применение специфического для заболевания GI антибиотика вместе с лактулозой. В одном варианте осуществления с помощью фармацевтической этикетки или вкладыша субъекту или патронажному медицинскому работнику рекомендуется применение специфического для заболевания GI антибиотика вместе с лактулозой для сохранения ремиссии HE или снижения риска эпизодов HE с явной клинической картиной. В одном варианте осуществления субъекту или патронажному медицинскому работнику рекомендуется применение двух таблеток, содержащих 550 мг рифаксимина, дважды в день вместе с лактулозой. Применение лактулозы можно распределять в течение времени, чтобы у субъекта сохранялись 2-3 опорожнения кишечника в виде мягкого стула в день. В одном варианте осуществления лактулозу вводят в 15-мл дозах, причем каждая 15-мл доза содержит 10 мг лактулозы. При обычном распределении во времени субъект может начать с одной дозы, или неполной дозы, в день, а затем со временем перейти к 15-мл дозам до достижения им конечного показателя в виде 2-3 опорожнения кишечника в виде мягкого стула в день.
В одном варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих степень А или В по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком. В другом варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих степень А или В по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком в комбинации с лактулозой. В другом варианте осуществления субъектам, имеющим степень А или В по шкале Чайлд-Пью, или осуществляющему их патронаж медицинскому работнику, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком. Рекомендация может быть устной или письменной рекомендацией, например, на фармацевтической этикетке или вкладыше. В другом варианте осуществления субъектам, имеющим степень А или В по шкале Чайлд-Пью, или осуществляющему их патронаж медицинскому работнику, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком в комбинации с лактулозой. В одном варианте осуществления субъекта, нуждающегося в лечении по поводу HE и имеющего меньшую С степень по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком. В одном варианте осуществления субъекта, нуждающегося в лечении по поводу HE и имеющего меньшую С степень по шкале Чайлд-Пью, подвергают лечению специфическим для заболевания GI антибиотиком и лактулозой.
В другом варианте осуществления субъектам, нуждающимся в лечении по поводу HE, или осуществляющему их патронаж медицинскому работнику, сообщают о риске анафилаксии до лечения специфическим для заболевания GI антибиотиком.
В одном варианте осуществления специфический для заболевания GI антибиотик вводят с одним или несколькими соединениями, выбираемыми из Align, Alinia (нитазоксамида), лактулозы, пентазы, холестирамина, сандостатина, ванкомицина, лактозы, амитизы, флагила, зегерида, превацида и миралакса.
В одном варианте осуществления после лечения специфическим для заболевания GI антибиотиком уменьшается оценка по Конну (степень психического состояния) у субъекта.
В одном варианте осуществления после лечения специфическим для заболевания GI антибиотиком время до увеличения оценки по Конну по сравнению с исходным уровнем увеличивается.
В одном варианте осуществления после лечения специфическим для заболевания GI антибиотиком отсрочка во времени до увеличения оценки по Конну составляет приблизительно 54%. Например, отсрочка во времени в % до увеличения оценки по Конну может составлять от приблизительно 30% до приблизительно 70%.
В другом варианте осуществления введение специфического для заболевания GI антибиотика препятствует увеличению оценки по Конну. Например, введение специфического для заболевания GI антибиотика увеличивает время до увеличения оценки по Конну по сравнению с исходным уровнем.
В одном варианте осуществления введение специфического для заболевания GI антибиотика приводит к увеличению времени до увеличения по сравнению с исходным уровнем степени «порхающего» тремора.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к отсрочке во времени до увеличения степени «порхающего» тремора.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к увеличению времени до первой связанной с HE госпитализации.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к увеличению времени до развития спонтанного бактериального перитонита (SBP).
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к снижению концентрации аммиака в крови по сравнению с исходным уровнем после введения рифаксимина. Например, снижение концентрации аммиака в крови по сравнению с исходным уровнем к 170 дням может достигать приблизительно 6 мкг/дл.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к увеличению значений критической частотой мельканий по сравнению с исходным уровнем после введения рифаксимина.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к снижению со временем суточного потребления лактулозы по сравнению с исходным уровнем после введения рифаксимина.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к снижению суточного потребления лактулозы с приблизительно 7 доз лактулозы до приблизительно 2 доз лактулозы.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к применению лактулозы, которое увеличивается в начальной стадии по сравнению с исходным уровнем. Например, применение лактулозы может происходить приблизительно 1-30 дней.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к смещению со временем оценок по Конну на исходном уровне после введения рифаксимина. Например, смещение оценок по Конну на исходном уровне может быть составлять приблизительно 1 - приблизительно 2.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к смещению со временем по сравнению с исходным уровнем степеней «порхающего» тремора.
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к изменению со временем по сравнению с исходным уровнем оценок, проведенных с помощью вопросника для оценки хронического заболевания печени (CLDQ).
В другом варианте осуществления введение специфического для заболевания GI антибиотика приводит к изменению со временем по сравнению с исходным уровнем оценок по шкале сонливости Эпворса после введения рифаксимина.
Как известно, оценку в модели конечной стадии заболевания печени (MELD) можно использовать для прогнозирования тяжести заболевания печени на основе уровня креатина в сыворотке, уровня общего билирубина в сыворотке и международного нормализованного отношения для протромбинового индекса - INR. Установлено, что оценка в MELD применима для прогноза смертности пациентов с компенсированным и декомпенсированным циррозом. Максимальная оценка, которая дается в случае MELD, составляет 40. Всем значениям, превышающим 40, дается оценка =40.
В другом варианте осуществления субъекты с уровнем в MELD, составляющим от приблизительно 1 до 24, реагировали на лечение для HE при использовании введения специфических для заболеваний GI антибиотиков. В другом варианте осуществления субъекты с уровнем в MELD, составляющим менее 10 или равным 10, реагировали на лечение специфическими для заболеваний GI антибиотиками. В другом варианте осуществления субъекты с уровнем в MELD, составляющим от приблизительно 11 до 18, реагировали на лечение специфическими для заболеваний GI антибиотиками. В другом варианте осуществления субъекты с уровнем в MELD, находящимся между 19 и 24, реагировали на лечение специфическими для заболеваний GI антибиотиками. В одном варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих равную 25 или меньше оценку в MELD, подвергают лечению специфическим для заболевания GI антибиотиком. В другом варианте осуществления субъектов, нуждающихся в лечении по поводу HE и имеющих равную 25 или меньше оценку в MELD, подвергают лечению специфическим для заболевания GI антибиотиком в комбинации с лактулозой. В другом варианте осуществления субъектам, имеющим равную 25 или меньше оценку в MELD, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком. Рекомендация может быть устной или письменной рекомендацией, например, на фармацевтической этикетке или вкладыше. В другом варианте осуществления субъектам, имеющим равную 25 или меньше оценку в MELD, рекомендуется, чтобы они лечились специфическим для заболевания GI антибиотиком в комбинации с лактулозой.
Одним вариантом осуществления, представленным здесь, является способ лечения или предупреждения HE посредством введения пациенту 1100 мг рифаксимина в день в течение более 28 дней.
Другим вариантом осуществления является способ снижения применения лактутозы для субъекта. Этот способ включает ежедневное назначению рифаксимина субъекту, подвергаемого лечению лактулозой, и снижение потребления лактулозы. Например, потребление лактулозы может быть снижено на 1, 2, 3, 4, 5, 6 или более стаканчиков в виде стандартных доз лактулозы по сравнению с исходным уровнем. Альтернативно, применение лактулозы может быть снижено на 5, 10, 15, 20, 25, 30, 34, 40, 45, 50, 55, 60, 65 или 70 г лактулозы по сравнению с исходным уровнем. В одном варианте осуществления применением лактулозы на исходном уровне является ее неприменение.
Одним вариантом осуществления, представленным здесь, является способ сохранения ремиссии НЕ у субъекта, включающий введение субъекту 500 мг рифаксимина дважды в день (BID).
Другим вариантом осуществления является способ увеличения времени до госпитализации для лечения HE, включающий введение субъекту 500 мг рифаксимина дважды в день.
Термин «введение» или «назначение» включает способы введения субъекту специфических для заболеваний GI антибиотиков для выполнения намеченной для них функции. Примеры способов введения, которые могут использоваться, включают инъекцию (подкожно, внутривенно, парентерально, внутрибрюшинно, подоболочечно), пероральное применение, ингаляцию, ректальное и чрескожное введение. Фармацевтические препараты могут назначаться с использованием форм, подходящих для каждого способа введения. Например, эти препараты назначают в таблетках или капсульной форме, вводят посредством инъекции, ингаляции, назначают в виде глазной примочки, глазных капель, мази, суппозитория и т.д., вводят посредством инъекции, инфузии или ингаляции; применяют место, используя лосьон или мазь, и вводят ректально, используя суппозитории. Пероральное введение является предпочтительным. Инъекция может быть болюсной или может быть непрерывной инфузией. В зависимости от способа введения специфический для заболевания GI антибиотик можно покрыть выбранным материалом или поместить в него для его защиты от природных условий, которые могут оказывать вредное воздействие на его способность к выполнению намеченной для него функции. Специфический для заболевания GI антибиотик может вводиться отдельно или в сочетании или с другим агентом или агентами, описанными выше, или с фармацевтически приемлемым носителем, или и с тем, и с другим. Специфический для заболевания GI антибиотик может вводиться до введения другого агента, одновременно с этим агентом или после введения этого агента. Кроме того, специфический для заболевания GI антибиотик может также вводиться в форме пролекарства, которое превращается в свой активный метаболит или более активный метаболит in vivo.
Введение «в комбинации с» одним или несколькими дополнительными терапевтическими средствами включает одновременное и последовательное введение в любом порядке.
Как будет совершенно очевидно квалифицированному в данной области техники специалисту, применимая in vivo доза, которую назначают, и конкретный способ введения будут меняться в зависимости от возраста, веса и виде млекопитающего, подвергаемого лечению, конкретных используемых соединений и конкретного применения, для которого эти соединения используются. Определение уровней эффективных доз, т.е. уровней доз, необходимых для достижения желаемого результата, может быть выполнено квалифицированным в данной области техники специалистом с использованием фармакологических методов. Обычно клинические применения продуктов для людей начинают на низких уровнях доз с увеличением уровня доз до достижения желаемого эффекта.
Как здесь используется, «увеличение» или «уменьшение» значения измерения, кроме особо оговоренных случаев, обычно устанавливается в сравнении со значением на исходном уровне. Например, увеличение времени до госпитализации субъектов, подвергаемых лечению, можно установить в сравнении со значением на исходном уровне времени до госпитализации субъектов, которые не подвергаются такому лечению. В некоторых случаях увеличение или уменьшение значения измерения можно установить на основе контекста, в котором этот термин используется.
«Носители», как здесь используются, включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые являются нетоксичными по отношению к клетке или млекопитающему, которую(ое) подвергают их воздействию в используемых дозах и концентрациях. Часто физиологически приемлемым носителем является водный pH-забуференный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный и включающие другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту; низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, аргинин или лизин, моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахароспирты, такие как маннит или сорбит; солеобразующие противойоны, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEEN, полиэтиленгликоль (ПЭГ).
Термин «эффективное количество» включает количество, эффективное в необходимых дозах и в течение необходимых периодов времени для достижения желаемого результата, например, достаточное для лечения или предупреждения HE у пациента или субъекта. Эффективное количество специфического для заболевания GI антибиотика может меняться в соответствии с такими факторами, как картина заболевания, возраст и вес субъекта, и способностью специфического для заболевания GI антибиотика к вызову желаемой ответной реакции у субъекта. Схемы введения доз можно подвергать регуляции для обеспечения оптимального ответа на терапию. Эффективное количество также представляет собой такое количество, при котором терапевтически полезные эффекты перевешивают любые токсичные или вредные эффекты (например, побочные эффекты) специфического для заболевания GI антибиотика.
«Улучшать», «ослабление», «улучшение» или т.п. относятся, например, к выявляемому улучшению или выявляемому изменению, соответствующему улучшению, которое имеет место у субъекта или у по крайней мере меньшей части субъектов, например у по крайней мере приблизительно 2%, 5%, 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 98%, 100% или в диапазоне, границами которого являются любые две из этих величин. Такое улучшение или изменение может выявляться у подвергнутых лечению субъектов по сравнению с субъектами, не подвергнутыми лечению рифаксимином, где не подвергнутые лечению субъекты имеют, или подвержены развитию, такое же или схожее заболевание, состояние, симптом или т.п. Ослабление заболевания, состояния, симптома или улучшение параметра проверки можно определить субъективно или объективно, например, посредством самооценки субъектом(ами), оценки практикующим врачом или посредством проведения соответствующего анализа или измерения, в том числе, например, оценки качества жизни, такой как оценка с помощью вопросника для оценки хронического заболевания печени (CLDQ), по замедлению прогрессирования заболевания(й) или состояния(й), уменьшению тяжести заболевания(й) или состояния(й) или с помощью подходящего анализа(ов) уровня или активности(ей) биомолекул(ы), клеток(клетки), или по выявлению эпизодов НЕ у субъекта. Улучшение может быть кратковременным, длительным или неизменным, или оно может быть изменяющимся в соответствующие моменты времени во время или после введения субъекту специфического для заболевания GI антибиотика или его применения в анализе или другом методе, описанном здесь или в приведенной ссылке, например, во временных рамках, указанных ниже, или спустя приблизительно 1 час после введения или применения специфического для заболевания GI антибиотика до приблизительно 28 дней, или 1, 3, 6, 9 месяцев или более после того как субъект(ы) получил такое лечение.
«Модуляция», например симптома, уровня или биологической активности молекулы или т.п., говорит, например, о том, что симптом или активность или т.п. выявляемо увеличился или уменьшился. Такое увеличение или уменьшение может выявляться у подвергнутых лечению субъектов по сравнению с субъектами, не подвергнутыми лечению специфическим для заболевания GI антибиотиком, где не подвергнутые лечению субъекты имеют, или подвержены развитию, такое же или схожее заболевание, состояние, симптом или т.п. Такое увеличение или уменьшение может составлять по крайней мере приблизительно 2%, 5%, 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 98%, 100%, 150%, 200%, 250%, 300%, 400%, 500%, 1000% или более или находится в пределах любого диапазона, границами которого являются любые две из этих величин. Модуляцию можно определить субъективно или объективно, например, посредством самооценки субъектом, оценки практикующим врачом или посредством проведения соответствующего анализа или измерения, в том числе, например, оценки качества жизни или подходящих анализов уровня или активности молекул, клеток или миграции клеток у субъекта. Модуляция может быть кратковременной, длительной или неизменной, или она может быть изменяющейся в соответствующие моменты времени во время или после введения субъекту специфического для заболевания GI антибиотика или его применения в анализе или другом методе, описанном здесь или в приведенной ссылке, например, во временных рамках, указанных ниже, или спустя приблизительно 1 час после введения или применения специфического для заболевания GI антибиотика до приблизительно 3, 6, 9 месяцев или более после того как субъект(ы) получил специфический для заболевания GI антибиотик.
Термин «модулировать» может также относиться к увеличению или уменьшению активности клетки в ответ на подвергание воздействию специфического для заболевания GI антибиотика, например ингибированию пролиферации и/или индукции дифференциации по крайней мере субпопуляции клеток у животного, так что достигается желаемый конечный результат, например терапевтический эффект специфического для заболевания GI антибиотика, используемого для лечения, может быть увеличен или уменьшен в ходе конкретного лечения.
Предполагается, что термин «получение», как например «получение специфического для заболевания GI антибиотика», включает покупку, синтез или иное приобретение специфического для заболевания GI антибиотика.
Используемые здесь выражения «парентеральное введение» и «вводимый парентерально» включают, например, способы введения, отличные от энтерального введения и местного применения, обычно посредством инъекции и включают, без ограничения, внутривенную, внутримышечную, внутриартериальную, подоболочечную, интракапсулярную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, внутрисуставную, подкапсулярную, субарахноидальную, внутрипозвоночную и надчревную инъекцию и инфузию.
Фармацевтические препараты
Варианты осуществления также обеспечивают фармацевтические композиции, включающие эффективное количество рифаксимина, описанного здесь, и фармацевтически приемлемый носитель. В дальнейшем варианте осуществления эффективное количество является эффективным для лечения бактериальной инфекции, болезни Крона, печеночной энцефалопатии, связанного с антибиотиками колита и/или дивертикулеза у субъекта, страдающего, кроме того, печеночной недостаточностью.
Варианты осуществления также обеспечивают фармацевтические композиции, включающие рифаксимин и фармацевтически приемлемый носитель. Дозы можно выбрать, например, на основе желаемых степеней системной адсорбции, полупериода выведения, концентрации в сыворотке и т.п. Варианты фармацевтической композиции включают, кроме того, эксципиенты, например, один или более из разбавителя, связующего агента, смазывающего вещества, дезинтегранта, красителя, корригента или подсластителя. Одну композицию можно составить для таблеток с выбранным покрытием и без него, твердых и мягких желатиновых капсул, таблеток с сахарным покрытием, лепешек, вафельных листов, гранул и порошков в запечатанных пакетиках. Например, композиции можно составить для местного применения, например, в виде мазей, помад, кремов, гелей и лосьонов.
В варианте осуществления рифаксимин вводят субъекту, используя фармацевтически приемлемый препарат, например фармацевтически приемлемый препарат, который обеспечивает постоянную доставку субъекту рифаксимина в течение по крайней мере 12 часов, 24 часов, 36 часов, 48 часов, одной недели, двух недель, трех недель или четырех недель после введения субъекту фармацевтически приемлемого препарата.
В определенных вариантах осуществления эти фармацевтические композиции подходят для местного применения или перорального введения субъекту. В других вариантах осуществления, описанных подробнее ниже, представленные здесь фармацевтические композиции можно специально составить для введения в твердой или жидкой форме, включающей формы, подходящие для следующего: (1) перорального введения, например, в виде жидких лекарственных средств (водных или неводных растворов или суспензий), таблеток, болюсов, порошков, гранул, паст; (2) парентерального введения, например, посредством подкожной, внутримышечной или внутривенной инъекции в виде, например, стерильного раствора или суспензии; (3) местного применения, например, в виде крема, мази или аэрозоля, наносимого на кожу; (4) внутривлагалищного или интраректального применения, например, в виде пессария, крема или пены; или (5) аэрозоля, например, в виде водного аэрозоля, липосомного препарата или твердых частиц, содержащих соединение.
Выражение «фармацевтически приемлемые» относится к содержащим рифаксимин композициям и/или лекарственным формам, которые, по результатам тщательной медицинской проверки, подходят для приведения в контакт с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соответствуют допустимому соотношению между пользой и риском.
Выражение «фармацевтически приемлемый носитель» включает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, вовлеченный в перенос или транспортировку рассматриваемой химической формы из одного органа, или части тела, в другой орган, или часть тела. Каждый носитель является предпочтительно «приемлемым» в том смысле, что он является совместимым с другими ингредиентами препарата и не вредным для пациента. Некоторые примеры материалов, которые могут выполнять функцию фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузных крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как какао-масло и парафины для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы и (21) другие нетоксичные совместимые вещества, используемые в фармацевтических препаратах.
В композициях могут также присутствовать увлажнители, эмульгаторы и смазывающие вещества, такие как натрия лаурилсульфат и магния стеарат, а также красители, разделительные средства, покровные вещества, подсластители, корригенты и ароматизирующие добавки, консерванты и антиоксиданты.
Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеина гидрохлорид, натрия бисульфат, натрия метабисульфит, натрия сульфит и т.п.; (2) маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и т.п.; и (3) металлохелатирующие агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и т.п.
Композиции, содержащие раскрытые здесь формы рифаксимина, включают композиции, подходящие для перорального, интраназального введения, местного применения (в том трансбуккального и подъязычного), ректального, вагинального введения, аэрозольного применения и/или парентерального введения. Композиции могут быть в силу обычая представлены в форме стандартной дозы и могут быть приготовлены с помощью любых способов, хорошо известных в области фармации. Количество активного ингредиента, который можно объединить с материалом носителя для создания формы единичной дозы, будет варьировать в зависимости от подвергаемого лечению хозяина, конкретного способа введения. Количество активного ингредиента, который можно объединить с материалом носителя для создания формы единичной дозы, будет обычно составлять такое количество соединения, которое вызывает терапевтический эффект. Как правило, исходя из 100%, это количество будет колебаться от приблизительно 1% до приблизительно 99% активного ингредиента, предпочтительно от приблизительно 5% до приблизительно 70%, наиболее предпочтительно от приблизительно 10% до приблизительно 30%.
Способы приготовления этих композиций включают стадию соединения рифаксимина с носителем и, необязательно, одним или несколькими дополнительными ингредиентами. Как правило, препараты готовят посредством равномерного и непосредственного соединения рифаксимина с жидкими носителями или мелкодисперсными твердыми носителями, или с теми, и с другими, а затем, в случае необходимости, стадию формовки продукта.
Композиции, подходящие для перорального применения, могут быть в форме капсул, саше, пилюль, таблеток, лепешек (используя ароматизированную основу, обычно сахарозу и аравийскую камедь или трагакант), порошков, гранул или в виде раствора или суспензии в водной или неводной жидкости, или в виде эмульсии в жидкости типа «масло-в-воде» или «вода-в-масле», или в виде эликсира или сиропа, или пастилок (используя инертную основу, такую как желатин и глицерин, или сахарозу или аравийскую камедь) и/или в виде жидкостей для полоскания рта и т.п., при этом каждая из них содержит заданное количество рифаксимина в качестве активного ингредиента. Соединение может назначаться в виде болюса, лекарственной кашки или пасты.
Используемый здесь термин «фармацевтическая композиция» (или агент, или лекарственное средство) относится к химическому соединению, композиции, агенту или лекарственному средству, способному к вызову желаемого терапевтического эффекта при надлежащем введении пациенту. Для нее не требуются непременно более одного типа ингредиента.
Композиции могут быть в форме таблеток, капсул, порошков, гранул, лепешек, жидких или гелевых препаратов. Таблетки и капсулы для перорального применения могут быть в форме, подходящей для представления единичной дозы, и могут содержать общепринятые эксципиенты. Их примерами являются связующие вещества, такие как сироп, аравийская камедь, сорбит, трагакант и поливинилпирролидон; эксципиенты, такие как лактоза, сахар, кукурузный крахмал, кальция фосфат, сорбит или глицерин; смазывающие вещества для таблетирования, такие как магния стеарат, диоксид кремния, тальк, полиэтиленгликоль или кремнезем; дезинтегранты, такие как картофельный крахмал; или приемлемые смачивающие вещества, такие как натрия лаурилсульфат. Таблетки могут быть покрыты в соответствии со способами, хорошо известными из обычной фармацевтической практики. Жидкие препараты для перорального применения могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать общепринятые добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлозу, крахмальную патоку, желатин, гидрогенизированные пищевые жиры, эмульгаторы, например лецитин, сорбитмоноолеат или аравийскую камедь; неводные носители (включающие пищевые масла), например миндальное масло, фракционированное кокосовое масло, относящиеся к жирам сложные эфиры жирных кислот и, например, глицерина, пропиленгликоль, или этиловый спирт; консерванты, такие как метил- или пропил-пара-гидроксибензоат или сорбиновая кислота, и, при желании, общепринятые корригенты или красители.
Выражения «системное введение», «вводимый системно», «периферическое введение» и «вводимый периферически», как здесь используются, означают введение специфического для заболевания GI антибиотика, лекарственного средства или другого материала из условия, чтобы он проникал в систему субъекта и таким образом подвергался метаболизму и другим подобным процессам, например подкожное введение.
Формулировка «терапевтически эффективное количество» специфического для заболевания GI антибиотика относится к количеству специфического для заболевания GI антибиотика, которое является эффективным, после введения субъекту однократной дозы или многократных доз, в ингибировании бактериального роста и/или инвазии или в ослаблении симптомов, таких как эпизоды HE, имеющих отношение к бактериальному росту у субъекта. «Терапевтически эффективное количество» также относится к количеству терапии (например, композиции, включающей специфический для заболевания GI антибиотик), которое является достаточным для уменьшения тяжести HE у субъекта.
Используемые здесь термины «предупреждать (предотвращать)» и «предупреждение (предотвращение)» относятся к предупреждению рецидива, возникновения или развития эпизодов HE или одного или более симптомов HE. Предупреждение включает предохранение от возникновения и серьезности эпизодов HEs.
Используемый здесь термин «профилактически эффективное количество» относится к количеству терапии (например, композиции, включающей специфический для заболевания GI антибиотик), которое является достаточным, чтобы привести к предотвращению развития, рецидива или возникновения эпизодов НЕ или чтобы усилить или улучшить профилактический эффект(ы) другой терапии.
«Рифаксимин», как здесь используется, включает сольваты и полиморфные формы, включающие, например, α, β, γ, δ, ε, η, ζ и аморфные формы рифаксимина. Эти формы описываются подробнее, например, в USSN 11/873841; USSN 11/658702; EP 050046352, поданной 3 мая 2005; USPN 7045620; US 61/031329 и G. C. Viscomi, et al, CrystEngComm, 2008, 10, 1074-1081 (April 2008). Каждый из этих ссылочных документов, таким образом, включен посредством ссылки в полном объеме.
Формы рифаксимина могут преимущественно использоваться при производстве обладающих антибиотической активностью лекарственных препаратов, содержащих рифаксимин, для и перорального и местного применения. Лекарственные препараты для перорального применения могут содержать одну или более форм рифаксимина вместе с другими эксципиентами, например разбавителями, такими как маннит, лактоза и сорбит; связующими веществами, такими как крахмалы, желатины, сахара, производные целлюлозы, природные камеди и поливинилпирролидон; смазывающими веществами, такими как тальк, стеараты, гидрогенизированные растительные масла, полиэтиленгликоль и диоксид кремния коллоидный; дезинтегрантами, такими как крахмалы, целлюлозы, альгинаты, камеди и сеткообразные полимеры; красителями, корригентами и подсластителями.
Лекарственные препараты могут содержать специфические для заболеваний желудочно-кишечного тракта антибиотики вместе с обычными эксципиентами, такими как белый вазелин, белый парафин, ланолин и его производные, стеариловый спирт, оксид железа красный, пропиленгликоль, тальк, натрия лаурилсульфат, полиоксиэтиленовые эфиры жирных спиртов, динатрия эдентат, глицерина пальмитостеарат, полиоксиэтиленовые эфиры жирных кислот, сорбитмоностеарат, глицерилмоностеарат, пропиленгликольмоностеарат, гидромеллоза, полиэтиленгликоли, натрия крахмал гликолят, метилцеллюлоза, гидроксиметилпропилцеллюлоза, натрий-карбоксиметилцеллюлоза, микрокристаллическая целлюлоза, силикат алюминия и магния коллоидный, диоксид титана, пропиленгликоль, диоксид кремния коллоидный или натрия альгинат.
Как здесь используется, «обострение HE во время лечения» включает, например, увеличение оценки по Конну до степени ≥2 (например, с 0 или 1 до ≥2) или составляющее 1 степень увеличение каждой из оценок по Конну и «порхающего» тремора для тех субъектов, которые имеют оценку по Конну на исходном уровне =0.
Как здесь используется, «время до первого эпизода обострения HE во время лечения» включает, например, отрезок времени между датой первого введения рифаксимина и датой первого эпизода обострения HE.
Предполагается, что используемый здесь термин «эпизод обострения HE во время лечения» включает явное, клиническое значимое ухудшение функции нервной системы, вызванное токсичными веществами, аккумулирующими в крови, которое приводит к вредному эффекту при самолечении и часто приводит к госпитализации. Эпизод обострения HE во время лечения также определяют как увеличение оценки по Конну до ≥2 (т.е. с 0 или 1 до ≥2) или составляющее 1 степень увеличение каждой из оценок по Конну и «порхающего» тремора для тех субъектов, которые имеют оценку по Конну на исходном уровне =0.
Здесь обеспечиваются способы определения наличия у субъекта неврологического заболевания посредством определения CFF у субъекта в два или более моментов времени. В приводимых в качестве примеров вариантах осуществления моменты времени могут отстоять на 1, 2, 3, 4, 5, 6 или 7 дней; или 2, 3 или 4 недели; или 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или на любой момент времени, находящийся между любыми двумя указанными значениями. В других вариантах осуществления контроль субъекта может осуществляться с обычными интервалами в течение жизни.
В представленных здесь способах предусматривается, что снижение CFF между измерениями в два или более моментов времени указывает на приближение вероятности эпизода обострения HE во время лечения. Кроме того, если субъект имеет значение twa CFF в момент времени, составляющее меньше чем 24 Гц, это указывает на то, что существует увеличенная вероятность эпизода HE у этого субъекта. Следовательно, снижение CFF между измерениями в два или более моментов времени или twa, составляющее 24 Гц или меньше, указывает на то, что субъект имеет HE, имеется увеличенная вероятность эпизода обострения HE во время его лечения у субъекта, и/или что его следует лечить рифаксимином. Соответственно, на основе данных, собранных на сегодняшний день, в одном варианте осуществления здесь обеспечиваются способы определения наличия HE у субъекта, прогнозирования возникновения эпизода обострения HE или определения прогноза в отношении субъекта посредством определения того, что CFF у субъекта ниже 24 Гц, причем CFF ниже 24 Гц указывает на то, что субъект имеет HE, у него, вероятно, будет иметь место эпизод обострения HE во время лечения, или в отношении него прогноз является плохим. В определенных вариантах осуществления CFF, составляющая меньше чем 24 Гц, указывает на то, что должен вводиться специфический для заболевания GI антибиотик, например рифаксимин.
Здесь обеспечиваются прогностические способы, основанные на определении CFF или twa CFF, причем twa CFF, составляющее менее чем 24, служит признаком плохого прогноза, или снижение CFF или twa CFF между измерениями в различные моменты времени служит признаком плохого прогноза. Плохой прогноз включает продолжительность жизни субъекта в течение менее 2, 3, 4, 5, 6, 7, 8 или более лет, или как здесь описано, или по мнению работника здравоохранения, субъекта или человека, наблюдающего субъекта.
В других вариантах осуществления здесь обеспечиваются способы определения наличия у субъекта HE или его подверженности увеличенному риску проявления эпизода обострения HE во время лечения посредством измерения уровня аммиака в венозной крови у субъекта в два или более моментов времени, причем увеличение уровня аммиака в венозной крови указывает на наличие HE у субъекта, увеличенную вероятность эпизода обострения HE во время его лечения и/или на то, что его следует лечить специфическим для заболевания GI антибиотиком, например рифаксимином. В определенных вариантах осуществления уровнем аммиака в венозной крови является средневзвешенный во времени уровень аммиака в венозной крови.
Концентрацию аммиака в венозной крови можно определить, используя способы, известные квалифицированному в данной области техники специалисту. Точность определения аммиака зависит от отбора образцов. Предпочтительной является цельная кровь. В одном конкретном способе, описанном здесь, кровь берут из вены без закупорки в вакуумированную пробирку с EDTA. Образец помещают на лед сразу же после отбора и перемешивания. Образец помещают в холодные условия, например на лед, на приблизительно десять минут, а затем подвергают центрифугированию. Плазму отделяют от образца в пределах пятнадцати минут от момента отбора и замораживают. Гемолизированные образцы не должны использоваться для дальнейшего анализа.
Замороженный образец подвергают ферментативному анализу для определения количества аммиака, присутствующего в образце. Содержащий аммиак образец смешивают с α-кетоглютаратом и восстановленным никотинамидадениндинуклеотидфосфатом (NADPH) для образования L-глютамата и NADP и воды. Реакцию катализирует глютаматдегидрогеназа. Результат определяют спектрофотометрически посредством проверки снижения оптической плотности при 340 нм вследствие окисления NADPH. Это снижение пропорционально концентрации аммиака.
В других вариантах осуществления здесь обеспечиваются способы определения наличия у субъекта неврологического заболевания посредством измерения CFF между двумя или более моментами времени. Снижение CFF между моментами времени указывает на наличия у субъекта неврологического заболевания. В определенных вариантах осуществления CFF представляет собой twa результатов измерения CFF.
В соответствии с одним вариантом осуществления здесь обеспечивается база данных, имеющая структуру данных, которая содержит ряд CFF или уровней аммиака в венозной крови, от субъектов. Также по крайней мере одна база данных включает структуру данных, которая содержит ряд связей между CFF или уровнями аммиака в венозной крови и степенью заболевания у субъектов и которая определяет бизнес-правила для выполнения способов. Эти биснесс-правила могут включать установленные способы определения наличия HE у субъекта или его подверженности риску проявления эпизода обострения HE во время его лечения. Также биснесс-правила могут включать установленные способы определения наличия у субъекта неврологического заболевания. Диагноз или прогноз может быть необязательно выбран с использованием нового программного обеспечения для систем и способов, представленных здесь. В такой ситуации системы и способы, включающие новые конфигурации программ, будут автоматически выполнять способы, представленные здесь, без дополнительного ввода данных пользователем.
Здесь обеспечиваются способы определения наличия у субъекта неврологического заболевания посредством определения CFF у субъекта в два или более моментов времени.
В частности, один такой дополнительный способ, обеспечиваемый здесь, включает новое программное обеспечение, включающее ряд программных модулей или компонентов, находящихся на сервере внутри системы, для создания и наполнения базы данных для применения в диагностических и прогностических способах настоящего изобретения. Другими словами, в одном варианте осуществления системы и способы предусматривают создание и регулирование конкретных правил для конкретного клиента и интеллектуального централизованного управления. Специалисту со средним уровнем компетентности в данной области техники будет понятно по прочтения этого описания, что различные варианты осуществления включают новое программное обеспечение, включающее ряд программных модулей или компонентов, находящихся в управляемой ЭВМ системе или сети настоящего изобретения, например на серверах, у отправляющих удаленных клиентов и получающих удаленных клиентов, для облегчения способов настоящего изобретения.
Как здесь используется, «время до первой связанной с HE госпитализации» включает, например, отрезок времени между датой введения первой дозы рифаксимина и датой первой связанной с HE госпитализации.
Как здесь используется, «время до увеличения по сравнению с исходным уровнем оценки по Конну» включает, например, отрезок времени между датой введения первой дозы рифаксимина и датой первого увеличения оценки по Конну.
Как здесь используется, «время до увеличения по сравнению с исходным уровнем степени «порхающего» тремора» включает, например, отрезок времени между датой введения первой дозы рифаксимина и датой первого увеличения степени «порхающего» тремора.
Как здесь используется, «среднее изменение по сравнению с исходным уровнем оценки проявления усталости с помощью вопросника для оценки хронического заболевания печени (CLDQ) в конце лечения (EOT)» представляет собой среднюю оценку с исходным уровнем, установленным до первого введения рифаксимина.
Как здесь используется, «среднее изменение по сравнению с исходным уровнем концентрации аммиака в крови в EOT» включает среднюю оценку с исходным уровнем, установленным до первого введения рифаксимина.
Как здесь используется, «время до диагностирования спонтанного бактериального перитонита (SBP)» включает, например, отрезок времени между датой введения первой дозы рифаксимина и датой первого эпизода SBP.
Как здесь используется, «среднее изменение по сравнению с исходным уровнем на каждом последующем уровне значений критической частоты мельканий» определяют, например, по сравнению с исходным уровнем, установленным до первого введения рифаксимина.
«Специфический для заболевания GI антибиотик», как здесь используется, включает антибиотик, который, как известно, оказывает эффект на заболевание GI. Применимыми специфичными для заболеваний GI антибиотиками являются, например, антибиотик класса рифамицина (например, рифаксимин), неомицин, метронидазол, тейкопланин, ципрофлоксацин, доксициклин, тетрациклин, аугментин, цефалексин, пенициллин, ампициллин, канамицин, рифамицин, ванкомицин, рифаксимин и их комбинации. Даже более предпочтительными являются специфичные для заболеваний GI антибиотики с низкой системной адсорбцией, например рифаксимин. Низкая системная абсорбция включает, например, составляющую менее 10% абсорбцию, составляющую менее 5% адсорбцию, составляющую менее 1% адсорбцию и составляющую менее 0,5% адсорбцию. Низкая системная адсорбция также включает, например, составляющую приблизительно 0,01-1% абсорбцию, составляющую приблизительно 0,05-1% адсорбцию, составляющую приблизительно 0,1-1% адсорбцию, составляющую приблизительно 1-10% адсорбцию или составляющую приблизительно 5-20% адсорбцию.
Как здесь используется, «субъект» включает организмы, которые могут страдать заболеванием пищеварительного тракта или другим нарушением, подающимся лечению рифаксимином, или которым в ином отношении могло бы принести пользу введение рифаксимин, как здесь описано, такие как являющиеся людьми и не являющиеся людьми субъекты. Предпочтительные субъекты включают являющихся людьми субъектов. Термин «не являющиеся людьми животные» включает, например, всех позвоночных, например млекопитающих, например грызунов, например мышей, и не млекопитающих, таких как не являющиеся людьми приматы, например овцу, собаку, корову, кур, земноводных, рептилий и т.д. Подверженные заболеванию пищеварительного тракта, как подразумевается, включают субъектов, подверженных риску развития заболевания пищеварительного тракта или инфекционного заболевания пищеварительного тракта, например субъектов, страдающих печеночной энцефалопатией, печеночной недостаточностью или снижением функции печени, иммуносупрессией, субъектов, находившихся в контакте с другими субъектами с бактериальной инфекцией, врачей, средний медицинский персонал, субъектов, путешествующих в удаленные районы, в которых, как известно, скоплены бактерии, вызывающие диарею путешественников и т.д.
Формулировка «профилактически эффективное количество» соединения относится к количеству соединения формулы I, формулы II или соединению, иначе описанному здесь, которое является эффективным после введения однократной дозы или многократных доз субъекту в предупреждении или лечении печеночной энцефалопатии.
Другой вариант осуществления включает промышленные изделия, которые включают, например, контейнер, вмещающий фармацевтическую композицию, подходящую для перорального введения рифаксимина, в сочетании с напечатанными маркировочными инструкциями, в которых приведено обсуждение, когда конкретная лекарственная форма пролонгирует ремиссию HE или предотвращает или отсрочивает эпизоды HE в дальнейшем. Дозу можно модифицировать для введения субъекту, страдающему HE, или она включает маркировку в отношении введения субъекту, страдающем HE. Приводимые в качестве примеров лекарственные формы и протоколы введения описаны ниже. Композиция будет содержаться в любом подходящем контейнере, который способен вмещать и распределять по дозам лекарственную форму и который не будет в значительной степени воздействовать на композицию и будет, кроме того, физически связан с соответствующей маркировкой. Маркировочные инструкции могут соответствовать способам лечения, описанным здесь ранее. Маркировку можно соединить с контейнером с помощью любых способов сохранения их физического сближения, в качестве не ограничивающего примера, они оба могут содержаться в упаковочном материале, таком как коробка или целлофановая пленка, или ее можно соединить с инструкциями, присоединяемыми к контейнеру, например, с помощью клея, который не делает неясными маркировочные инструкции, или с помощью других способов соединения или удержания.
В одном варианте осуществления инструкции будут информировать и/или консультировать работника здравоохранения, прописывающего лекарственное средство врача, фармацевта или субъекта, который должен консультировать пациента, страдающего печеночной энцефалопатией, о том, что введение рифаксимина может индуцировать цитохром P450. В другом варианте осуществления инструкции будут информировать субъекта и/или поставщика медицинских услуг о том, что существует удлиненный период времени ремиссии или период времени до рецидива у субъектов, принимающих рифаксимин. В другом варианте осуществления инструкции будут информировать субъекта и/или работника здравоохранения или поставщика медицинских услуг о том, что рифаксимин не изменяет значительно Cmax, AUC0-t или AUC0-∞ мидазолама. В другом варианте осуществления инструкции будут информировать субъекта и/или работника здравоохранения или поставщика медицинских услуг о том, что рифаксимин не увеличивает риск удлинения QT.
Упакованные композиции также предусматриваются и могут включать терапевтически эффективное количество рифаксимина, содержащегося в таблетках или капсулах. Здесь также обеспечиваются наборы, например наборы для лечения HE у субъекта. Наборы могут содержать, например, рифаксимин и инструкции в отношении применения для лечения субъекта в случае HE. Инструкции в отношении применения могут содержать информацию о предписаниях, информацию о дозах, информацию о хранении и т.п.
Наборы могут включать фармацевтические препараты специфических для заболеваний GI антибиотиков вместе с фармацевтически приемлемыми растворами, носителями и эксципиентами.
Формы рифаксимина могут преимущественно использоваться при производстве обладающих антибиотической активностью лекарственных препаратов, содержащих рифаксимин, для и перорального, и местного применения. Лекарственные препараты для перорального применения могут содержать одну или более форм рифаксимина (например, α или β или γ) вместе с другими эксципиентами, например разбавителями, такими как маннит, лактоза и сорбит; связующими веществами, такими как крахмалы, желатины, сахара, производные целлюлозы, природные камеди и поливинилпирролидон; смазывающими веществами, такими как тальк, стеараты, гидрогенизированные растительные масла, полиэтиленгликоль и диоксид кремния коллоидный; дезинтегрантами, такими как крахмалы, целлюлозы, альгинаты, камеди и сеткообразные полимеры; красителями, корригентами и подсластителями.
Твердые препараты специфических для заболеваний желудочно-кишечного тракта антибиотиков, вводимые перорально, включают, например, таблетки с покрытием и без него, твердые и мягкие желатиновые капсулы, таблетки с сахарным покрытием, лепешки, вафельные листы, гранулы и порошки в запечатанных пакетиках.
Лекарственные препараты могут содержать специфические для заболеваний желудочно-кишечного тракта антибиотики вместе с обычными эксципиентами, такими как белый вазелин, белый парафин, ланолин и его производные, стеариловый спирт, оксид железа красный, пропиленгликоль, тальк, натрия лаурилсульфат, полиоксиэтиленовые эфиры жирных спиртов, динатрия эдентат, глицерина пальмитостеарат, полиоксиэтиленовые эфиры жирных кислот, сорбитмоностеарат, глицерилмоностеарат, пропиленгликольмоностеарат, гидромеллоза, полиэтиленгликоли, натрия крахмал гликолят, метилцеллюлоза, гидроксиметилпропилцеллюлоза, натрий-карбоксиметилцеллюлоза, микрокристаллическая целлюлоза, силикат алюминия и магния коллоидный, диоксид титана, пропиленгликоль, диоксид кремния коллоидный или натрия альгинат.
Критерии Уэст-Хейвена (оценка по Конну)
Определения изменения психического состояния можно осуществить, например, посредством оценки по Конну (также известной как оценка Уэст-Хейвена). Оценка по Конну широко использовалась в качестве показателя психического состояния в исследованиях HE и основывается на критериях Парсонса-Смита, модифицированных Конном. «Порхающий» тремор не принимается во внимание при оценке состояния субъекта с использованием критериев оценки по Конну, перечисленных ниже.
Ниже представлена шкала, используемая в системе оценки по Конну.
Степень 0 = нет выявляемых изменений личности или поведения
Степень 1 = небольшой недостаток осознания, эйфория или тревога; сокращенная продолжительность концентрации внимания; ухудшение способности к сложению или вычитанию
Степень 2 = летаргия; дезориентация во времени; очевидные изменения личности; несоответствующее поведение
Степень 3 = сонливость до полупомрачения сознания, реагирование на раздражители; спутанность сознания; явная дезориентация; неправильное поведение
Степень 4 = кома; невозможность проверки психического состояния
HE определяют как спектр нейропсихиатрических отклонений, наблюдаемых у пациентов с дисфункцией печени, диагностированной после исключения в заведенном порядке другого известного неврологического заболевания. HE является основным осложнением цирроза печени, поражающего 30-45% пациентов. В 2006 CDC (Центр по контролю и профилактике заболеваний) привел цирроз в качестве 12-ой ведущей причины смерти от заболевания в США. HE поражает сознание пациента, его личность, интеллект и функцию нервно-мышечной системы и может колебаться от незначительного нарушения познания до комы. HE, как здесь используется, включает, например, эпизодическую, персистирующую хроническую и незначительную HE.
В кишке кишечные бактерии действуют на азотсодержащие вещества с образованием аммиака. На фиг.15 представлена ситуация у не пораженных HE субъектов: аммиак удаляется из крови, по мере того как она проходит через печень, где он превращается в мочевину и выделяется почками. При циррозе аммиак из кишки обходит поврежденную печень в результате наличия сосудистых анастомозов. Это приводит к увеличению аммиака в крови, который проходит в головной мозг, порождая образование глютамина из аминокислоты глютамата. Избыточное количество глютамина приводит к множеству вредных эффектов на функцию головного мозга; он ингибирует нейротрансмиссию, вносит помехи в митохондриальный энергетический метаболизм и приводит к разбуханию астроцитов.
Клиническую картину HE классифицируют в соответствии со схемой, представленной на фиг.16. Связанная с циррозом HE - безусловно, самая распространения - относится к типу C. Тип С HE подразделяют на классы: эпизодическая, персистирующая хроническая и незначительная HE. Варианты в виде эпизодической и персистирующей хронической НЕ представляют собой совершенно очевидные по клинической картине состояния и поэтому обозначают как имеющие явную клиническую картину. Картина эпизодической HE включает нарушение всех функций нервной системы, отмеченных выше. Как предполагает термин «эпизодическая», существуют периоды между эпизодами, когда характерные симптомы не обнаруживаются. Эпизоды могут провоцировать такие факторы, как запор, инфекция, дегидратация, желудочно-кишечное кровотечение и некоторые лекарственные средства. Если причина не устанавливается сразу же, эпизод называют спонтанным.
Эпизоды HE обычно можно реверсировать с помощью лечения, но они часто являются рецидивирующими. HE является клиническим диагнозом, который ставят с помощью некоторых средств, включающих оценку Уэст-Хейвена или оценку по Конну. При использовании в течение приблизительно 30 лет алгоритм оценки HESA (фиг.17) является относительно новым средством, используемым для точного задания критериев по Конну. Нервно-мышечную дисфункцию можно определить по вызову «порхающего» тремора. Часто измеряют уровень аммиака в крови для подтверждения диагноза. Нейрофизиологические тесты, такие как критическая частота мельканий и электроэнцефалограмма, являются потенциально очень полезными для подтверждения клинических данных. В критериях по Конну используется увеличение степени для связи с увеличением неврологического нарушения (находящееся в диапазоне от 0 = нет нарушения до 4 = кома).
Степени 1, 2 и 3 представляют увеличение:
- нарушения создания - колеблющегося от небольшого недостатка осознания до сонливости;
- нарушения интеллектуальной способности и изменений личности.
Эту оценку можно провести быстро, для ее проведения требуется незначительное соучастие проводящего обследование врача или взаимодействие от пациента, и часто используется информация, полученная от семьи или тех, кто ухаживает за больными, для помощи в определении тяжести эпизодов HE, когда сознание пациента является спутанным.
Тогда как с пациентами с HE степени 1 могут справляться дома те, кто за ними ухаживает, при любом обострение до степени 2 или выше может потребоваться госпитализация или даже использование интенсивной терапии. В критериях по Конну используется увеличение степень для связи с увеличением неврологического нарушения, (находящееся в диапазоне от 0 = нет нарушения до 4 = кома). Степени 1, 2 и 3 представляют увеличение нарушения создания, интеллектуальной способности и изменений личности. Эту оценку можно провести быстро, для ее проведения требуется незначительное соучастие проводящего обследование врача или взаимодействие от пациента, часто используется информация, полученная от семьи или тех, кто ухаживает за больными, для помощи в определении тяжести эпизодов HE.
Тогда как с пациентами с HE степени 1 могут справиться дома те, кто за ними ухаживает, при любом обострение до степени 2 или выше может потребоваться госпитализация или даже использование интенсивной терапии.
Существует схожая классификационная система для «порхающего» тремора. Если пациента с НЕ попросить держать свои руки так, как нужно, будет наблюдаться толчкообразный, так называемый «порхающий» тремор. Подчитывают число толчков, и ему дают оценку от 0 = отсутствие толчков до 4 - почти непрерывный порхающий тремор. Это простой тест, но для него требуется готовый помочь и находящийся в сознании пациент.
HE представляет собой порочный круг дисфункции и нетрудоспособности, который оказывает драматический эффект на пациентов, их семьи и систему здравоохранения. Очень рано нарушения поведения, личности, интеллекта и сознание оказывают влияние на общественную и семейную жизнь пациента и способность к сохранению работы. По мере ухудшения состояния оно влияет на способность к самообслуживанию, соблюдение указаний врача, не соблюдение указаний врача усиливает далее симптомы HE и частоту эпизодов. В результате пациентам может потребоваться помощь на дому, и они часто попадают в ER (в службу экстренной медицинской помощи) или на госпитальные койки. Тяжелая HE может быть угрожающим жизни случаем, но она чаще истощает QOL (качество жизни) пациентов и их семей; некоторые из тех, кто ухаживает за больными, приравнивают свой опыт уходу за больными с непредсказуемо эпизодической болезнью Альцгеймера. Влияние на того, кто ухаживает за больным, представлено на фиг.18.
Исходя из влияния на здравоохранение, число выплат в связи HE увеличилось более чем двое с 1993 до 2007. Смотрите фиг.19. Затраты увеличились с приблизительно 13 тыс. до 30 тыс. при каждой госпитализации. Поэтому цели терапии HE включают, например, приведение острых эпизодов к быстрому разрешению и предотвращение повторяющихся эпизодов. Для достижения этих целей требуется безопасная и эффективная терапия, которая хорошо переносится в течение длительного лечения. Существуют серьезные ограничения в отношении длительного применения разрешенных в настоящее время терапий. Мишенью самого часто используемого не абсорбируемого дисахариды, лактулозы является кишечная флора, ответственная за продукцию аммиака. Он проявляет свои эффекты в основном посредством очистки с помощью частый опорожнений кишечника. Лечение лактулозой основывается на самостоятельном распределении дозы, целью является 2-3 жидких стула в день - к сожалению, эта цель является часто превышенной. В случае десяти непредсказуемых жидких стулов в день, уход из дома - даже в случае длящегося недолго ухода в магазин - может стать невозможным или стеснительным. У пациентов развивается нетрудоспособность из-за лактурозы, а не HE, ради которой она была прописана. Тяжелая диарея может вызвать дегидратацию и электролитные анормальности, которые могут даже провоцировать эпизод HE. Тошнота не является редкой. Понятно, что эти факторы могут привести к плохой адгезии и ограничить длительное применение.
Другим разрешенным лечением является неомицин. Однако длительное применение жестко ограничивается его повреждающими побочными эффектами, которые включают нефротоксичность и нейросенсорную тугоухость - которым пациенты с прогрессирующим заболеванием печени в наибольшей степени подвержены. Не удивительно, что профиль безопасности неомицина не способствует длительной терапии. Принимая во внимание недостатки, связанные и с лактулозой, и с неомицином - очевидно, что существует неудовлетворенная потребность в безопасной, эффективной и хорошо переносимой длительной терапии. Печеночная энцефалопатия является серьезным неврологическим осложнением прогрессирующего заболевания печени, которое подрывает качество жизни, способность к самообслуживанию и соблюдение указаний врача и приводит к частой госпитализации.
Существуют ограниченные варианты лечения HE, и остается неудовлетворенная потребность в безопасной, эффективной и хорошо переносимой терапии для длительного лечения. В течение 30 лет не было нового лечения этого вызывающего деменцию заболевания. Врачи были довольно поражены данными по эффективности, переносимости и безопасности рифаксимина и положительным опытом при применении ими этого лекарственного средства, даже до появления захватывающих данных нового испытания, которые представлены здесь и которые сделают рифаксимин, не исключено, самой широко используемой терапией на основе антибиотика для HE.
Исследование 3001 было предназначено для непрерывного слежения за пациентами, чтобы гарантировать достоверность и полноту сбора данных об обострении НЕ во время лечения. После скрининга пациенты входили в период лечения, который включал еженедельные посещения пациентов и тех, кто ухаживал за ними, и/или телефонную связь с ними. За субъектами следили в течение определенных протоколом 168 дней. Полный сбор данных об эпизодах обострения во время лечения, а также смертности обеспечил достоверность результата исследования. Изложения фактов, касающихся каждого пациента, проявляющего обострение HE во время лечения, неблагоприятные явления (AE), приводящие к окончанию лечения, SAE или смерть, были представлены в NDA (в заявке на одобрение нового лекарственного средства). Ключевые критерии входа в исследование включали:
- пациенты с прогрессирующим заболеванием печени;
- пациенты, проявляющие по крайней мере 2 эпизода HE в пределах 6 месяцев от момента скрининга, документированные в медицинской документации с тяжестью, равной оценке по Конну ≥2;
- и при скрининге, и на исходном уровне субъекты имели оценку по Конну = 0 или 1, оценку в MELD, меньшую или равную 25, и в их случае не требовалось согласия на участие пациента в исследовании того, кто ухаживает за ним;
- пациенты исключались, если они имели состояние, которое могло вносить помехи в оценки по протоколу, употребляли алкоголь в пределах 14 дней, седативные средства в пределах 7 дней или доказательство лекарственной зависимости в настоящем.
HESA объединяет как клинические компоненты Конна, так и нейрофизиологические тесты. Для администрирования необходимо приблизительно 45 минут. Оно использовалось в качестве средства для установления согласующейся количественной оценки по Конну по всем центрам исследования. Оно обеспечивало непрерывное усиление стандартов и пополнение определений.
Фиг.17 сжато включает в себя клинические оценки и нейрофизиологические тесты HESA. Рифаксимин обеспечивал значимый, предохранительный эффект, что демонстрируется снижением на 58% риска эпизода обострения HE во время лечения со значимым в высокой степени p-значением. Польза от рифаксимина поражает тем, что 78% пациентов теперь не имели эпизодов обострения в течение 6 месяцев. В отличие от них в группе, получавшей плацебо, лишь 54% сохраняли ремиссию HE. В популяции больных, страдающих частными побочными эффектами, с ограниченными средствами к существованию и укороченной продолжительностью жизни рифаксимин может обеспечить значимую пользу посредством предотвращения ухудшения их психического состоянии и двигательных навыков.
Всего было 104 эпизодов, зарегистрированных у 299 участвующих в исследовании пациентов. Для компонентов авторы настоящего изобретения используют описательную статистику с использованием анализа пропорций, удовлетворяющего состоянию. 86 эпизодов, или 83% от всех эпизодов, состояли из пациентов, проявляющих оценку по Конну ≥2, 37% пациентов, подвергнутых лечению плацебо, и 20% пациентов, подвергнутых лечению рифаксимином, что приводит к значимому в высокой степени p-значению.
Восемнадцать (18) эпизодов, или 17% от всех эпизодов, включены в следующую категорию пациентов, проявляющих ухудшение оценки по Конну и степени «порхающего» тремора, составляющее 1 каждое, 9% пациентов, подвергнутых лечению плацебо, и 2% пациентов, подвергнутых лечению рифаксимином, что также обеспечивает значимое в высокой степени p-значение.
Постоянство эффекта содействует определению того, приносится ли польза одной или некоторым подгруппам, или наблюдается ли эффект, как правило, во всех подгруппах пациентов. Важно, что было проведено исследование на взаимосвязь между терапевтическим эффектом и подгруппой для установки однородности ответа по всем подгруппам. Ни с одной из подгрупп не была установлена значительная связь. Отношения рисков, составляющие меньше 1, указывают на результат в пользу рифаксимина, а отношения рисков, превышающие 1, - в пользу плацебо. Результат, наблюдаемый во всех подгруппах, раз за разом отражает клиническую пользу рифаксимина. Это постоянство результата в сочетании с отсутствием связи между терапевтическим эффектом и подгруппой подтверждает прочность общего терапевтического эффекта.
Этот эффект сохранялся по всем подгруппам с варьирующей степенью тяжести, когда он относится к оценке в MELD и степени по шкале Чайлд-Пью. Снова здесь нет взаимосвязи между подгруппой и терапевтическим эффектом, и оценка терапевтического эффекта является приблизительно одинаковой по всем группам. В итоге, анализы подгрупп показывает поразительное постоянство снижения риска, наблюдаемого в анализе первичного (основного) конечного показателя по всем группам.
Анализ времени до связанной с HE госпитализации привел к снижению на 50% риска со значимым p-значением. Большая доля эпизодов HE либо приводила к прямой госпитализации, либо имела место во время госпитализации. Было установлено, что время до вызванной HE госпитализации (определяемое как время до госпитализации, являющейся прямым следствием HE) и время до госпитализации по всем причинам уменьшались с помощью рифаксимина, и эти анализы показывают уменьшения риска на 56% и 30%, соответственно.
Другие конечные показатели включали, например, время до первого ухудшения оценок по Конну или «порхающего» тремора независимо от того, привело ли это изменение к эпизоду обострения HE во время лечения; качество жизни по сообщению пациентов, в частности усталость, определяемую с помощью CLDQ; изменения аммиака в крови, который, как полагают, является основным нейротоксином, ответственным за HE; и критическую частоту мельканий. Время до первого ухудшения оценки по Конну отражает снижение риска на 54%. Время до ухудшения оценки «порхающего» тремора показывает снижение на 35% при анализе тенденций p-значения. Эти данные представляют изменения в каждой области проявления на всем протяжении испытания. Результаты показывают, что подвергнутые лечению рифаксимином пациенты чувствуют себя лучше. В вопроснике используется 7-пунктная шкала Лайкерта, при этом 1 = все время, а 7 = ни одного мгновения. Таким образом, более высокие значения отражают лучшее качество жизни. Изменение, наблюдаемое здесь в каждой подшкале, говорит об изменении по каждой шкале, являющимся улучшением на 1 пункт по сравнению с плацебо. Изменения, которые авторы настоящего изобретения наблюдают в уровне аммиака и CFF, являются статистически значимыми и отражают улучшения в пользу рифаксимина. Эти результаты служат подтверждением терапевтического эффекта рифаксимина.
Были предприняты исследования для оценки подверженности обострению НЕ во время лечения и его специфичности. В случае пациентов с более низкими оценками CFF и усталости и более высокой концентрацией аммиака в крови существовала большая вероятность проявления обострения НЕ во время лечения. Эти данные обеспечивают дополнительное доказательство того, что первичный конечный показатель является объективным и клинически значимым. В случае исследования 3002 были собраны данные об обострениях НЕ во время лечения для обеспечения подтверждающей информации, касающейся эффекта рифаксимина в виде предупреждения рецидива HE.
В исследовании 3002 лечению были подвергнуты три популяции, в том числе подвергнутые лечению рифаксимином пациенты исследования 3001; подвергнутые лечению плацебо в исследовании 3001 пациенты, перешедшие в это исследование, и новые пациенты с HE.
В случае подвергнутых лечению рифаксимином пациентов, у которых сохранялась ремиссия на всем протяжении исследования 3001, продемонстрирована длительная польза во время их участия в исследовании 3002. Частота обострения HE во время лечения в случае подвергнутых лечению рифаксимином пациентов была ниже, чем в группе, подвергнутой лечению плацебо в исследовании 3001, что демонстрирует снижение на 90% риска обострения HE во время лечения. Обратите внимание, что у приблизительно 60% этих пациентов не отмечается обострение спустя почти 3 года. 82 подвергнутых лечению плацебо субъектов в исследовании 3001 были включены в исследовании 3002, и у них отслеживали обострение. После включения в открытое исследование и получения рифаксимима у них наблюдается снижение риска на 79% по сравнению с проявлением у них обострений в испытании 3001.
Во всех подвергнутых лечению рифаксимином популяциях демонстрируется увеличенный в 2,6 раза риск смертности по всем причинам в случае субъектов, достигших оценки по Конну, составляющей по крайней мере 2.
В следующем примере будут обсуждаться новые и неизвестные аспекты рифаксимина:
- in vitro и in vivo фармакологические действия рифаксимина, которые могут вносить вклад в его клиническую пользу;
- связанные с ADME (всасыванием, распределением, метаболизмом и выведением) свойства рифаксимина, включающие фармакокинетику и его судьбу, связанную с выведением и метаболизмом; и
- исследования межлекарственных взаимодействий.
Относительно механизма действия, рифаксимин связывается с бета-субъединицей бактериальной ДНК-зависимой РНК-полимеразы, приводя к ингибированию синтеза РНК в бактериях. In vivo рифаксимин ослабляет интенсивность симптомов бактериальной диареи, и большая часть дозы не абсорбируется, а концентрируется в кишке, с высокими концентрациями в просвете кишечника, составляющими приблизительного 8000 мкг/г стула. Интересно, что лечение диареи путешественников происходит без значительного изменения общей массы патогенов в кишечнике.
In vitro рифаксимин оказывает множество эффектов в менее ингибирующих концентрациях, включающих, например, увеличение ликвидированных плазмид, уменьшение переноса плазмид и снижение вирулентности.
Было установлено, что эффекты рифаксимина на клетки млекопитающих, в том числе, например, пути обезвреживания, такие как P-gp и 3A4, могут быть увеличены в кишке. Рифаксимин придает эпителиальным клеткам устойчивость к бактериальной колонизации и интернализации в независимости от эффектов на бактерии и снижает продукцию и абсорбцию образуемых в кишке нейротоксинов, основным примером которых является аммиак, которые приводят к HE у пациентов с печеночной недостаточностью.
В этом примере 50 пациентов, подвергнутых лечению рифаксимином в дозе 1200 мг/день, продемонстрировали статистически значимое снижение уровня аммиака в крови. Это снижение сопровождалось значительным улучшением общей степени HE и отдельных показателей HE. В то время как обособленные концентрации аммиака в крови могут быть вариабельными, последовательные измерения у отдельных пациентов были связаны с тяжестью HE.
Рифаксимин является членом класса антибиотиков - рифамицина. Функциональная группа, показанная зеленым цветом, отличает рифаксимин от других рифамицинов и приводит к специфической для заболевания кишечника активности.
Рифаксимин относят к классу BCS 4; плохо растворимых и плохо абсорбируемых соединений. Он также является субстратом P-гликопротеина, эффлюксного переносчика. Эти свойства приводят к очень низкой абсорбции при пероральном введении. Небольшая фракция, которая абсорбируется, выводится с помощью трех механизмов: билиарного, метаболического и почечного. Рифаксимин подвергается элиминации при первом прохождении благодаря экскреции с желчью в виде неизмененного рифаксимина. Существует один известный метаболит; почти не выявляемый у здоровых субъектов, и на очень низком уровне у пациентов с НЕ, приблизительно 2,5% от исходной экспозиции. Как у здоровых субъектов, так у субъектов с заболеванием печени выведение рифаксимина почками составляет <0,4%. Вводимый перорально рифаксимин выводится почти полностью в виде неизмененного рифаксимина в фекалии. Фармакокинетика рифаксимина в стационарном состоянии была исследована у здоровых субъектов и у субъектов с печеночной недостаточностью. Экспозиция является довольно низкой во всех исследованных популяциях.
У здоровых добровольцев средняя Cmax составляет менее 4 нг/мл. Смотрите фиг.20. По мере увеличения печеночной недостаточности AUC и Cmax увеличиваются соответственно. Даже при их максимальных значениях экспозиции остаются низкими, в нг/мл диапазоне. Увеличение экспозиции у пациентов с печеночной недостаточностью полностью описано в литературе и может объясняться несколькими факторами, включающими, например, связывание с белками, уменьшенный кровоток через печень и сниженную способность к метаболизму. Ограниченный доступ к печени вследствие шунтирования кровотока в обход печени и сниженный метаболизм вследствие уменьшенной активности ферментов гепатоцитов могут уменьшить печеночный клиренс. Любой из двух или оба из двух названных факторов могут быть ответственны за уменьшенный клиренс рифаксимина и увеличение экспозиции у пациентов с печеночной недостаточностью.
Ради представления этой экспозиции в дополнительном контексте смотрите фиг.21, на которой представлены данные по рифаксимину в сравнении с другими антибиотиками, с использованием логарифмической шкалы из-за значительных различий.
Пациенты с наибольшей печеночной недостаточностью и набольшими уровнями экспозиции в плазме имеют уровни рифаксимина, которые в более чем 200 раз ниже уровней, достигаемых при использовании системного антибиотика, вроде рифампина, представлено синим цветом. Они также более чем в 10 раз ниже уровней экспозиций, наблюдаемых при пероральном применении неомицина, представленного здесь розовым цветом, который, как считается, является не абсорбируемым. В этой популяции также часто используется норфлоксацин для профилактики SBP; он является системным антибиотиком с уровнями экспозиции в плазме, превышающими в более чем 35 раз таковые рифаксимина. Здесь исследовалась способность рифаксимина к вызову межлекарственных взаимодействий. Рифаксимин не ингибирует в значительной степени какой-либо основной метаболизирующий лекарственное средство фермент P450, P-гликопротеин или BSEP у субъектов с нормальным функционированием печени. Зная, что другие члены этого класса могут являться причиной взаимодействий посредством активации важных метаболизирующих лекарственные средства ферментов, в частности CYP3A4, была исследована возможность этой индукции в клинических исследованиях. Эффект рифаксимина на мидазолам, классический субстрат CYP3A4, был исследован на здоровых добровольцах. Спустя 16 дней от введения 550 мг рифаксимина трижды в день, дозы, превышающей на 50% дозу, используемую в случае HE, AUC для мидазолама была уменьшена на 10%. Смотрите фиг.22. В отличие от этого, рифампин уменьшает AUC для мидазолама на 95% в схожих экспериментах. Это различие отражает не только различие в in vitro активности между рифампином и рифаксимином, но и различие в in vivo распределении между двумя соединениями исходя из низкого уровня экспозиции в печени и системной экспозиции рифаксимина. Основываясь на этих данных, авторы настоящего изобретения не ожидают клинически значимых лекарственных взаимодействий у субъектов с нормальным функционированием печени. В заключение, in vitro и in vivo данные означают, что рифаксимин обладает бактериостатическими механизмами, а также способностью к снижению бактериальной адгезии и вирулентности. Он снижает уровни аммиака (смотрите фиг.23), что связано с улучшением в состоянии пациентов с HE. Важнейшее отличие рифаксимина от других рифамицинов состоит в его чрезвычайно низкой растворимости и абсорбции при пероральном введении, что приводит к направленным на кишку терапевтическим эффектам и ограниченной системной экспозиции. Хотя заболевание печени приводит к увеличению системной экспозиции рифаксимина, наибольшие уровни экспозиции, обнаруживаемые при использовании рифаксимина, значительно ниже таковых, наблюдаемых при использовании других системных и не абсорбируемых антибиотиков для перорального применения. Вместе с этим низким уровнем системной экспозиции приходит минимизированный риск межлекарственных взаимодействий.
Представленные здесь варианты осуществления относятся ко всем препаратам для местного применения, например, в виде мазей, помад, кремов, гелей и лосьонов.
В случае твердых лекарственных форм рифаксимина для перорального введения (капсул, таблеток, пилюль, драже, порошков, гранул и т.п.), активный ингредиент обычно смешивают с одним или несколькими фармацевтически приемлемыми носителями, такими как натрия цитрат или дикальция фосфат, и/или любым из следующих: (1) наполнителей или разбавителей, таких как крахмалы, лактоза, сахароза, глюкоза, манит и/или кремниевая кислота; (2) связующих веществ, таких как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; (3) гигроскопических веществ, таких как глицерин; (4) дезинтегрантов, таких как агар-агар, кальция карбонат, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и натрия карбонат; (5) ингибиторов растворения, таких как парафин; (6) ускорителей абсорбции, таких как четвертичные аммониевые соединения; (7) смачивающих веществ, таких как, например, ацетиловый спирт и глицерина моностеарат; (8) адсорбентов, таких как каолин и бентонитовая глина; (9) смазывающих веществ, таких как тальк, кальция стеарат, магния стеарат, твердые полиэтиленгликоли, натрия лаурилсульфат и их смеси; и (10) красителей. В случае капсул, таблеток и пилюль фармацевтические композиции могут также включать буферные агенты. Твердые составы схожего типа могут также использоваться в качестве наполнителей в мягких и содержащих твердый наполнитель желатиновых капсулах, используя такие эксципиенты, как лактоза или молочной сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
Таблетку можно приготовить с помощью прессования или формовки, необязательно с использованием одного или нескольких вспомогательных ингредиентов. Прессованные таблетки можно приготовить с использованием связующего вещества (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, дезинтегранта (например, натрия крахмала гликолята или сшитой натрий-карбоксиметилцеллюлозы), поверхностно-активного вещества или диспергатора. Формованные таблетки можно приготовить с помощью формовки в подходящей машине смеси порошкообразных активных ингредиентов с инертным жидким разбавителем.
Таблетки и другие твердые лекарственные формы фармацевтических композиций, описываемых здесь, такие как драже, капсулы, пилюли и гранулы, можно необязательно сохранять или готовить с помощью покрытий и оболочек, таких как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области составления фармацевтических препаратов. Их можно также составить для обеспечения медленного или контролируемого высвобождения активного ингредиента, находящегося в них, используя, например, гидроксипропилметилцеллюлозу в различных пропорциях для обеспечения желаемого профиля высвобождения, других полимерных матриц, липосом и/или микросфер. Их можно стерилизовать посредством, например, фильтрации через удерживающий бактерии фильтр или посредством включения стерилизующих средств в форме стерильных твердых составов, которые можно растворить в стерильной воде или некоторых других стерильных инъецируемых средах непосредственно перед применением. Эти композиции могут также необязательно содержать опалесцирующие компоненты и могут иметь такой состав, что они высвобождают активный ингредиент(ы) лишь, или предпочтительно, в определенной части желудочно-кишечного тракта, необязательно, замедленным образом. Примеры заливочных составов, которые могут использоваться, включают полимерные вещества и парафины. Активный ингредиент может также находиться в микроинкапсулированной форме, если уместно, вместе с одним или несколькими описанными выше эксципиентами.
Жидкие лекарственные формы для перорального введения рифаксимина включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активного ингредиента, жидкие лекарственные формы могут содержать обычно используемые в данной области техники инертные разбавители, такие как, например, вода или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное масло, масло из завези, оливковое, касторое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и эфира сорбита и жирных кислот и их смеси.
Помимо инертных разбавителей, композиции для перорального введения могут включать вспомогательные средства, такие как смачивающие вещества, эмульгаторы и суспендирующие агенты, подсластители, корригенты, красители, ароматизирующие добавки и консерванты.
Суспензии, помимо рифаксимина, могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленовые эфиры сорбита и сложные эфиры сорбитана, микрокристаллическая целлюлоза, алюминия метагидроксид, бентонит, агар-агар и трагакант, и их смеси.
Фармацевтические композиции для интраректального или внутривлагалищного применения могут быть представлены в виде суппозитория, который можно приготовить посредством смешивания рифаксимина с одним или несколькими подходящими, не вызывающими раздражение эксципиентами или носителями, которые включают, например, какао-масло, полиэтиленгликоль, парафин для суппозиториев или салицилат, и которые являются твердыми при комнатной температуре, но жидкими при температуре тела и, следовательно, будут плавиться в полости прямой кишки или влагалища и высвобождать активный ингредиент.
Композиции, которые подходят для внутривлагалищного применения, также включают пессарии, тампоны, кремы, гели, пасты, пены или аэрозольные препараты, содержащие такие носители, которые, как известно в данной области техники, являются подходящими.
Дозированные формы для местного применения или чрескожного введения рифаксимина включают порошки, аэрозоли, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и лекарственные формы для ингаляции. Рифаксимин может быть смешан в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или газами-вытеснителями, которые могут потребоваться.
Мази, пасты, кремы и гели могут содержать, помимо рифаксимина, эксципиенты, такие как животные и растительные жиры, масла, воска, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка, или их смеси.
Порошки и распыляемые растворы могут содержать, помимо рифаксимина, такие эксципиенты, как лактоза, таль, кремниевая кислота, гидроксид алюминия, кальция силикаты и полиамидный порошок, или смеси этих веществ. Распыляемые растворы могут, кроме того, содержать обычные газы-вытеснители, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан.
В альтернативном случае рифаксимин можно вводить с помощью аэрозоля. Это успешно осуществляют посредством приготовления водного аэрозоля, липосомного препарата или твердых частиц, содержащих соединение. Может использоваться неводная суспензия (например, содержащая газ-вытеснитель в виде фторуглерода). Предпочтительными являются ультразвуковые аэрозольные аппараты, поскольку они минимизируют воздействие на агент поперечной силы, которая может привести к деградации соединения.
Водный аэрозоль готовят, например, посредством составления водного раствора или суспензии агента вместе с общепринятыми фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы меняются вместе с необходимыми условиями для конкретного соединения, но обычно включают неионные поверхностно-активные вещества (Tweens®), Pluronics® или полиэтиленгликоль), нетоксичные белки, вроде сывороточного альбумина, сложные эфиры сорбитана, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахароспирты. Аэрозоли обычно готовят из изотонических растворов.
Фармацевтические композиции, подходящие для парентерального введения, могут включать рифаксимин в сочетании одним или несколькими фармацевтически приемлемыми, стерильными, изотоническими водными или неводными растворами, дисперсионными системами, суспензиями или эмульсиями, или стерильными порошками, которые можно воссоздать в стерильные инъецируемые растворы или дисперсии непосредственно перед применением, которые могут содержать антиоксиданты, буферы, бактериостаты, растворенные вещества, которые придают препарату изотоничность с кровью намеченного реципиента, или суспендирующие агенты или загустители.
Примеры подходящих водных и неводных носителей, которые могут использоваться в фармацевтических композициях, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, такие как оливковое масло, и инъецируемые сложные эфиры органических кислот, такие как этилолеат. Надлежащее жидкое состояние может быть сохранено, например, посредством применения покровных материалов, таких как лецитин, посредством сохранения требуемого размера частиц в случае дисперсий и с помощью применения поверхностно-активных веществ.
Эти композиции могут также содержать вспомогательные средства, такие как консерванты, смачивающие средства, эмульгаторы и диспергаторы. Предупреждение действия микроорганизмов можно обеспечить посредством включения различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Желательным может быть также включение агентов для придания изотоничности, таких как сахара, натрия хлорид и т.п., в композиции. Кроме того, включение агентов, которые замедляют адсорбцию, таких как алюминия моностерат и желатин, может привести к удлиненной абсорбции инъецируемой фармацевтической формы.
В некоторых случаях, чтобы удлинить эффект лекарственного средства, желательным является изменение абсорбции лекарственного средства. Это можно выполнить посредством применения жидкой суспензии кристаллической соли или аморфного материала, имеющего очень плохую растворимость в воде. Степень абсорбции лекарственного средства может зависеть от его степени растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. В альтернативном случае замедленная абсорбция лекарственной формы достигается посредством растворения или суспендирования лекарственного средства в масляном носителе.
Инъецируемые депо-формы можно приготовить посредством создания микроинкапсулируемых матриц рифаксимина в биоразрушаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера и природы конкретного используемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразрушаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые препараты в депо-формах также готовят посредством захвата лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканью организма.
Когда рифаксимин назначают людям и животным в качестве лекарственного препарата, он может назначаться сам по себе или в виде фармацевтической композиции, содержащей, например, от 0,1 до 99,5% (более предпочтительно, от 0,5 до 90%) активного ингредиента в сочетании с фармацевтически приемлемым носителем.
Независимо от выбранного способа введения рифаксимин, который может использоваться в фармацевтических композициях настоящего изобретения, составляют в фармацевтически приемлемые лекарственные формы с помощью известных квалифицированным в данной области техники специалистам способов.
Можно изменять фактические уровни доз и динамику введения активных ингредиентов в фармацевтических композициях, чтобы получить количество активного ингредиента, которое является эффективным для достижения желаемого терапевтического ответа в случае конкретного субъекта, композиции и способа введения, без его токсичности для субъекта. Приводимый в качестве примера диапазон доз колеблется от приблизительно 25 до 3000 мг в день.
XIFAXAN, торговое название для рифаксимина, разрешен для следующих двух применений:
1) Диареи путешественников: 200 мг рифаксимина предписываются для лечения пациентов (возрастом ≥12 лет) с диареей путешественников, вызванной неинвазивными штаммами Escherichia coli. Содержащие рифаксимин таблетки не следует принимать пациентам с диареей, осложненной лихорадкой или кровью в испражнениях, или с диареей, обусловленной патогенами, отличными от Escherichia coli.
2) Печеночная энцефалопатия: Содержащие 550 мг рифаксимина таблетки предписываются для сохранения ремиссии печеночной энцефалопатии у пациентов возрастом ≥18 лет.
Чтобы уменьшить образование резистентных к лекарственному средству бактерий и сохранить эффективность рифаксимина и других антибактериальных средств, рифаксимин при применении для лечения инфекции следует применять только для лечения или предупреждения инфекций, которые, как доказано или при наличии сильного подозрения, вызваны чувствительными бактериями. При наличии информации о культуре и чувствительности ее следует учитывать при выборе или модификации антибактериальной терапии. В отсутствие таких данных местные эпидемиологические особенности и характеры чувствительности могут способствовать эмпирическому выбору терапии.
XIFAXAN, торговое название для рифаксимина, разрешен для следующих двух применений:
1) Диареи путешественников
200 мг рифаксимина предписываются для лечения пациентов (возрастом ≥12 лет) с диареей путешественников, вызванной неинвазивными штаммами Escherichia coli.
Рифаксимин не следует принимать пациентам с диареей, осложненной лихорадкой или кровью в испражнениях, или с диареей, обусловленной патогенами, отличными от Escherichia coli.
2) Печеночная энцефалопатия
550 мг рифаксимина предписываются для снижения риска рецидива печеночной энцефалопатии (НЕ) с явной клинической картиной у пациентов возрастом ≥?18 лет. В испытаниях рифаксимина для лечения HE 91% пациентов принимали одновременно лактулозу. Различия в терапевтическом эффекте у тех пациентов, которые не принимали одновременно лактулозу, невозможно было определить.
Рифаксимин не исследовался на пациентах с оценками в MELD (модели конечной стадии заболевания печени)>25, и лишь 8,6% пациентов в контролируемом испытании имели оценки в MELD выше 19. Существует увеличение системной экспозиции у пациентов с более тяжелой печеночной дисфункцией.
Рифаксимин можно принимать перорально с пищей или без нее. Для лечения диареи путешественников пациентам следует принимать одну 200-мг таблетку три раза в день в течение 3 дней. Для лечения печеночной энцефалопатии пациентам следует принимать одну 550-мг таблетку два раза в день.
Содержащие рифаксимин таблетки противопоказаны пациентам с гиперчувствительностью к рифаксимину, любому из противомикробных средств класса рифамицина или любому из компонентов в содержащих рифаксимин таблетках. Реакции гиперчувствительности включали эксфолиативный дерматит, ангионевротический отек и анафилаксию.
Не было установлено, что рифаксимин является эффективным у пациентов с диареей, осложненной лихорадкой и/или кровью в испражнениях, или с диареей, обусловленной патогенами, отличными от Escherichia coli.
Необходимо прекратить применение рифаксимина в случае ухудшения симптомов диареи или их сохранения в течение более 24-48 часов и следует учитывать альтернативные терапии на основе антибиотиков.
Рифаксимин не является эффективным в случаях диареи путешественников, обусловленной Campylobacter jejuni. Эффективность рифаксимина в случае диареи путешественников, вызванной Shigella spp. и Salmonella spp., не была доказана. Рифаксимин не следует принимать пациентам, у которых может возникнуть подозрение, что Campylobacter jejuni, Shigella spp. или Salmonella spp. являются вызывающими болезнь патогенами.
Об ассоциированной с Clostridium difficile диарее (CDAD) сообщалось при применении почти всех антибактериальных средств, включающих рифаксимин, и ее тяжесть может колебаться от слабого поноса до вызывающего смерть колита. Лечение антибактериальными средствами изменяет нормальную флору ободочной кишки, что может привести к чрезмерно быстрому росту C. difficile.
C. difficile продуцирует токсины A и B, которые вносят вклад в развитие CDAD. Продуцирующие гипертоксины штаммы C. difficile приводят к увеличению заболеваемости и смертности, поскольку эти инфекции могут быть резистентными к противомикробной терапии, и в их случае может потребоваться колэктомия. CDAD должна рассматриваться у всех пациентов, проявляющих диарею после применения антибиотиков. Необходим тщательный анамнез, поскольку CDAD, как сообщалось, возникает в течение двух месяцев после введения антибактериальных средств.
В случае подозрения иди подтверждения CDAD может потребоваться прекращение ведущегося применения антибиотиков, не направленных против C. difficile. Соответствующая инфузионная и электролитная терапия, пополнение белков, лечение антибиотиками C. difficile и оперативная оценка должны быть начаты в соответствии с клинической картиной.
Маловероятно, что предписание рифаксимина в случае диареи путешественников в отсутствие доказанной или сильно подозреваемой бактериальной инфекции или профилактически принесет пользу пациенту, но оно увеличивает риск образования резистентных к лекарственному средству бактерий.
У пациентов с тяжелой печеночной недостаточностью существует увеличение системной экспозиции. В исследованиях токсичности на животных не были достигнуты системные экспозиции, которые были выявлены у пациентов с тяжелой печеночной недостаточностью. Клинические испытания ограничивались пациентами с оценками в MELD <25. Следовательно, должна проявляться осторожность при введении рифаксимина пациентам с тяжелой печеночной недостаточностью (со степенью С по шкале Чайлд-Пью).
Безопасность приема 200 мг рифаксимина три раза в день оценивали на пациентах с диареей путешественников, состоящих из 320 пациентов, в двух плацебо-контролируемых клинических испытаниях, при этом 95% пациентов получали лечение рифаксимином в течение трех или четырех дней. Средний возраст исследуемой популяции составлял 31,3 (18-79) лет, при этом приблизительно 3% были возрастом ≥65 лет, 53% были мужчинами, и 84% были европеоидной расы, 11% были американоидной расы.
Прекращения лечения вследствие неблагоприятных реакций встречались у 0,4% пациентов. Неблагоприятными реакциями, ведущими к прекращению лечения, были утрата вкусовых ощущений, дизентерия, снижение веса, анорексия, тошнота и раздражение носового хода.
Все неблагоприятные реакции в случае приема 200 мг рифаксимина три раза в день, которые встречались с частотой ≥2% в двух плацебо-контролируемых испытаниях, которые были объединены, представлены в таблице 26. (Они включают неблагоприятные реакции, которые можно объяснить основным заболеванием.)
Следующие неблагоприятные реакции, проявляемые системой организма, также регистрировались у <2% пациентов, принимающих рифаксимин, в двух плацебо-контролируемых клинических испытаниях, в которых 200-мг таблетки принимались три раза в день в случае диареи путешественников. Следующие неблагоприятные реакции включают неблагоприятные реакции независимо от причинной связи с подверганием воздействию лекарственного средства:
Все неблагоприятные реакции, встречающиеся с частотой ≥2% среди пациентов, получающих таблетки XIFAXAN, 600 мг/день, в плацебо-контролируемых испытаниях
Нарушения, связанные с кровеносной и лимфатической системами: лимфоцитоз, моноцитоз, нейтропения.
Нарушения, связанные с ухом и внутренним ухом: боль в ухе, морская болезнь, шум в ушах.
Желудочно-кишечные нарушения: вздутие живота, диарея, не уточненная, сухое горло, отклонения в стуле, не уточненные, нарушения в деснах, не уточненные, паховая грыжа, не уточненная, сухие губы, дискомфорт в желудке.
Общие нарушения и состояния в месте введения: боль в груди, усталость, недомогание, боль, не уточненная, слабость.
Инфекции и заражение паразитами: дизентерия, не уточненная, инфекция дыхательных путей, не уточненная, инфекция верхних дыхательных путей, не уточненная.
Травма и отравление: солнечная эритема.
Анализы: аспартат-аминотрансфераза увеличенная, кровь в испражнениях, кровь в моче, сниженный вес.;
Метаболические нарушения и расстройства алиментарного происхождения: анорексия, дегидратация.
Нарушения, связанные с костно-мышечной системой, соединительной тканью и костями: боль в суставах, мышечные спазмы, миалгия, боль в шее.
Расстройства нервной системы: аномальные сновидения, головокружение, мигрень, не уточненная, обморок, утрата вкусовых ощущений.
Психиатрические расстройства: бессонница.
Нарушения, связанные с почками и мочевыми путями: холиурия, дизурия, истинная гематурия, полиурия, протеинурия, частота мочеиспускания.
Нарушения, связанные с дыханием, грудной клеткой и средостением: диспноэ, не уточненное, раздражение носового хода, ринофарингит, фарингит, глоточно-пищеводная боль, ринит, не уточненный, ринорея.
Кожные нарушения и заболевания подкожной ткани: липкость, сыпь, не установленная, увеличенное потоотделение; и
сосудистые нарушения: приливы.
Печеночная энцефалопатия
Представленные ниже данные отражают подвергание лечению 550 мг рифаксимина 348 пациентов, включающих 265 пациентов, подвергнутых лечению в течение 6 месяцев, и 202 пациента, подвергнутых лечению в течение более года (средняя продолжительность подвергания лечению составляла 364 дней). Безопасность приема 550 мг рифаксимина два раза в день для снижения риска рецидива печеночной энцефалопатии с явной клинической картиной оценивали в 6-месячном, плацебо-контролируемом клиническом испытании (n=140) и в длительном дополняющем изучении (n=280). Средний возраст исследуемой популяции составлял 56,26 (диапазон: 21-82) лет; приблизительно 20% пациентов были пациентами возраста ≥65 лет, 61% были мужчинами, 846 были европеоидной расы, и 4% были чернокожими. 91% пациентов в испытании принимали одновременно лактулозу. Все неблагоприятные реакции, которые встречались с частотой ≥5% и с более высокой частотой у субъектов, подвергнутых лечению 550 мг рифаксимина, чем в подвергнутой лечению плацебо группе в этом 6-месячном испытании, представлены в таблице 27. (Они включают неблагоприятные реакции, которые можно объяснить основным заболеванием).
Неблагоприятные реакции, встречающиеся у ≥5% пациентов, получающих XIFAXAN, и с большей частотой, чем в группе плацебо
Следующие неблагоприятные реакции, проявляемые системой организма, также регистрировались в плацебо-контролируемом клиническом испытании у более чем 2%, но менее чем 5% пациентов, принимающих перорально 550 мг рифаксимин дважды в день в случае печеночной энцефалопатии. Следующие неблагоприятные реакции включают неблагоприятные реакции, встречающиеся с большей частотой, чем в подвергнутой лечению плацебо группе, независимо от причинной связи с подверганием воздействию лекарственного средства.
Нарушения, связанные с ухом и внутренним ухом: головокружение.
Желудочно-кишечные нарушения: боль в нижней части живота, болезненность при надавливании на живот, сухой рот, кровотечение из варикозно-расширенных вен пищевода, дискомфорт в желудке.
Общие нарушения и состояния в месте введения: боль в груди, генерализованный отек, болезнь вроде гриппа, боль, не уточненная.
Инфекции и заражение паразитами: целлюлит, пневмония, ринит, инфекция верхних дыхательных путей, не уточненная.
Травма, отравление и связанные с процедурами осложнения: ушиб, падение; связанная с процедурой боль.
Анализы: увеличенный вес.
Метаболические нарушения и расстройства алиментарного происхождения: анорексия, дегидратация, гипергликемия, гиперкалиемия, гипогликемия, гипонатриемия.
Нарушения, связанные с костно-мышечной системой, соединительной тканью и костями: миалгия, боль в конечности.
Расстройства нервной системы: амнезия, нарушение внимания, гипестезия, ухудшение памяти, тремор.
Психиатрические расстройства: спутанность сознания.
Нарушения, связанные с дыханием, грудной клеткой и средостением: носовое кровотечение; и
сосудистые нарушения: гипотония.
Следующие неблагоприятные реакции были установлены во время применения рифаксимина после его разрешения. Поскольку сообщения об этих реакциях были получены в добровольном порядке от популяции неизвестного размера, невозможно провести оценки частоты. Эти реакции были выбраны для исключения вследствие либо их серьезности, частоты сообщения, либо причинной связи с рифаксимином.
Инфекции и заражение паразитами
Имелись сообщения о случаях ассоциированного с C. difficile колита.
Имелись сообщения о реакциях гиперчувствительности, включающих эксфолиативный дерматит, сыпь, ангионевротический отек (опухание лица и языка и глотательное затруднение), крапивницу, покраснение, зуд и анафилаксию. Эти реакции происходили уже в пределах 15 минут от введения лекарственного средства.
In vitro исследования показали, что рифаксимин не ингибировал изоферменты 1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 и CYP3A4 цитохрома Р450 в концентрациях, колеблющихся от 2 до 200 нг/мл. Не предполагается, что рифаксимин будет ингибировать эти ферменты при клиническом применении.
Результаты in vitro исследования говорили о том, что рифаксимин индуцирует CYP3A4. Однако не предполагается, что у пациентов с нормальным функционированием печени рифаксимин в рекомендуемой схеме введения доз будет индуцировать CYP3A4. Неизвестно, может ли рифаксимин оказывать значительное влияние на фармакокинетику сопутствующих субстратов CYP3A4 у пациентов со сниженным функционированием печени, которые имеют повышенные концентрации рифаксимина.
Результаты in vitro исследования говорили о том, что рифаксимин является субстратом P-гликопротеина. Неизвестно, могут ли сопутствующие лекарственные средства, которые ингибируют P-гликопротеин, увеличить системную экспозицию рифаксимина.
Рифаксимин был тератогенным у крыс в дозах, составляющих от 150 до 300 мг/кг (превышающих в приблизительно 2,5-5 раз клиническую дозу для диареи путешественников [600 мг/день] и в приблизительно 1,3-2,6 раз клиническую дозу для печеночной энцефалопатии [1100 мг/день], с приведением в соответствие с площадью поверхности тела). Рифаксимин был тератогенным у кроликов в дозах, составляющих от 62,5 до 1000 мг/кг (превышающих в приблизительно 2-33 раз клиническую дозу для диареи путешественников [600 мг/день] и в приблизительно 1,1-18 раз клиническую дозу для печеночной энцефалопатии [1100 мг/день], с приведением в соответствие с площадью поверхности тела). Эти эффекты включают расщелину неба, агнатию, укорочение нижней челюстной кости, кровоизлияние, не полностью открытый глаз, маленькие глаза, брахигнатию, неполную оссификацию и увеличенные пояснично-грудные позвонки.
Исследования способности к репродукции были выполнены на крысах в дозах, превышающих в вплоть до 2,5-5,0 раз (с приведением в соответствии с площадью поверхности тела) дозу для человека, и на кроликах в дозах, превышающих в вплоть до 2,0-33,0 раз (с приведением в соответствии с площадью поверхности тела) дозу для человека, и не выявили факты снижения фертильности или нанесение ущерба плоду, обусловленные рифаксимином.
Фармакокинетику рифаксимина оценивали в двух исследованиях у пациентов с печеночной недостаточностью. В первом исследовании максимальные концентрации в плазме, представленные в виде среднего значения (среднеквадратическое отклонение), составляющие 13,5 (14,8) нг/мл, были выявлены у пациентов с печеночной энцефалопатией спустя 3 часа после введения первой дозы рифаксимина, который вводили в дозе 800 мг три раза в день в течение 7 дней; менее чем 0,1% введенной дозы было выделено в мочу в течение 7 дней. Из-за ограниченной системной адсорбции рифаксимина специальные корректировки доз не рекомендуются в случае пациентов с печеночной недостаточностью. Во втором исследовании пациентам вводили рифаксимин в дозе 550 мг дважды в день. Значения системной экспозиции рифаксимина (Cmax) в стационарном состоянии, представленные в виде среднего значения (среднеквадратическое отклонение), у пациентов с печеночной недостаточностью со степенями А и В по шкале Чайлд-Пью составляли 19,5 (11,4) нг/мл и 25,1 (12,6) нг·ч/мл (в приблизительно 5,7 и 7,4 раз выше, соответственно, чем значения Cmax в стационарном состоянии у здоровых индивидуумов). В случае этого увеличения системной экспозиции рифаксимина у пациентов с печеночной недостаточностью не требуется корректировка доз рифаксимина вследствие его местного действия - действия в желудочно-кишечном тракте и низкой системной биодоступности.
Приводимые в качестве примеров дозы содержат рифаксимин, не являющийся аминогликозидом, полусинтетический, несистемный антибиотик, получаемый из рифамицина SV. Рифаксимин является структурным аналогом рифампина. Химическое название рифаксимина - (2S,16Z, 18E,20S,21S,22R,23R,24R,25S,26S,27S,28E)-5,6,21,23,25-пентагидрокси-27-метокси-2,4,11,16,20,22,24,26-октаметил-2,7-(эпоксипентадека-[1,11,13]триенимино)бензофуро[4,5-e]пиридо[1,2-a]-бензимидазол-1,15(2H)-дион,25-ацетат. Эмпирическая формула - C43H51N3O11, а его молекулярная масса составляет 785,9.
Приводимые в качестве примеров содержащие рифаксимин таблетки для перорального введения покрыты оболочкой и содержат 200 мг или 550 мг рифаксимина. Каждая таблетка содержит диоксид кремния коллоидный, динария эдетат, глицерина пальмитостеарат, гидромеллозу, микрокристаллическую целлюлозу, пропиленгликоль, оксид железа красный, натрия крахмал гликолят, тальк и диоксид титана.
Зависимость от дозы эффективности рифаксимина в уменьшении тяжести печеночной энцефалопатии (HE) была установлена в двойном слепом исследовании с использованием диапазона доз (составляющей 600, 1200 или 2400 мг суммарной суточной дозы в течение 7 дней) на пациентах со степенью 1, 2 или 3 HE, во всех группах отмечались улучшения по сравнению с исходным уровнем, определяемые по показателю множества симптомов HE; средние изменения (улучшения) оценок показателя симптомов составляли -0,064, -0,103 и -0,107 в группах, получающих суммарные суточные дозы, составляющие 600 мг, 1200 мг и 2400 мг, соответственно.
В таблице 28 суммированы средние фармакокинетические параметры рифаксимина в плазме 14 здоровых субъектов после одной пероральной 400-мг дозы, назначаемой в виде 2×200-мг доз, и 12 здоровых субъектов после одной 550-мг дозы в состояниях после приема пищи и натощак.
Эффект пищи на фармакокинетические параметры, представленные в виде среднего значение±среднеквадратическое отклонение, после одной 400-мг дозы рифаксимина (N=14)
Рифаксимин можно назначать с пищей или без нее. Поскольку системная адсорбция рифаксимина является низкой и при введении в состоянии натощак, и при введении в пределах 30 минут от завтрака с высоким содержанием жира, рифаксимин можно назначать с пищей или без нее.
14C-рифаксимин вводили в виде однократной дозы 4 здоровым мужчинам. Среднее общее выделение радиоактивности в мочу и фекалии 3 субъектов в течение 168 часов после введения составляло 96,94±5,64% дозы. Радиоактивность выводилась почти исключительно с фекалиями (96,62±5,67% дозы), при этом лишь небольшая доля дозы (среднее значение - 0,32% дозы) выводилась с мочой. Анализ экстрактов из фекалий показал, что рифаксимин выводится в виде неизмененного лекарственного средства. Количество радиоактивности в моче (<0,4% дозы) говорит о том, что рифаксимин плохо абсорбируется из желудочно-кишечного тракта и почти исключительно и полностью выводится с фекалиями в виде неизмененного лекарственного средства. Средними фармакокинетическими параметрами рифаксимина были Cmax 4,3±2,8 нг/мл и AUCt 19,5±16,5 нг·ч/мл с медианой Tmax=1,25 ч.
Диарея путешественников
Системную абсорбцию рифаксимина (200 мг трижды в день) оценивали у 13 субъектов, зараженных шигеллезом, в дни 1 и 3 трехдневного курса лечения. Концентрации рифаксимина в плазме и его экспозиции были низкими и вариабельными. Не было фактов аккумуляции рифаксимина после повторного введения в течение 3 дней (9 доз). Максимальные концентрации рифаксимина в плазме после введения 3 и 9 следующих друг за другом доз колебались от 0,81 до 3,4 нг/мл в день 1 и от 0,68 до 2,26 нг/мл в день 3. Так же оценки AUC0-последний момент времени составляли 6,95±5,15 нг·ч/мл в день 1 и 7,83±4,94 нг·ч/мл в день 3. Рифаксимин не подходит для лечения системных бактериальных инфекций из-за ограниченной экспозиции после перорального введения.
Печеночная энцефалопатия
После введения однократной дозы и многократных доз рифаксимина, составляющих 550 мг, здоровым субъектам среднее время до достижения максимальных концентраций в плазме составляло приблизительно час. Фармакокинетические (PK) параметры были в высокий степени вариабельными, а основанный на AUC коэффициент аккумуляция составлял 1,37.
Фармакокинетику у пациентов с печеночной недостаточностью (степенями А и В печеночной недостаточности по шкале Чайлд-Пью), принимающих 550 мг рифаксимина дважды в день, оценивали в открытом исследовании рифаксимина. Значения экспозиции рифаксимина (AUCτ) у субъектов с оценками А и В по шкале Чайлд-Пью (118 и 161 нг·ч/мл, соответственно) превышали в приблизительно 9,6 и 13,1 раз таковые, выявляемые у здоровых субъектов после перорального введения дважды в день доз, составляющих 550 мг (12,3 нг·ч/мл), соответственно. Межсубъектные вариабельности в фармакокинетике у здоровых субъектов были, как правило, схожими с таковыми, определяемыми у субъектов с печеночной недостаточностью.
Рифаксимин можно назначать с пищей или без нее.
Фармакокинетические исследования на животных показали, что 80-90% перорально вводимого рифаксимина концентрируются в кишке, при этом менее 0,2% концентрируется в печени и почках, и менее 0,01% - в других тканях. У взрослых с инфекционной диареей, подвергаемых лечению рифаксимином в дозе 800 мг еженедельно в течение трех дней, концентрации рифаксимина в испражнениях равнялись в среднем приблизительно 8000 мкг/г день после завершения лечения.
В исследовании баланса масс, после перорального введения 400 мг 14C-рифаксимина здоровым добровольцам, из 96,94% общего выхода 96,62% введенной радиоактивности выделялись с фекалиями почти исключительно в виде неизмененного лекарственного средства, и 0,32% выделялись с мочой в основном в виде метаболитов вместе с 0,03% в виде неизмененного лекарственного средства. Рифаксимин обусловливал 18% радиоактивности в плазме. Это говорит о том, что адсорбированный рифаксимин подвергается метаболизму вместе с незначительным выведением почками неизмененного лекарственного средства. Ферменты, ответственные за метаболизм рифаксимин, неизвестны.
В отдельном исследовании рифаксимин был обнаружен в желчи после холецистэктомии у пациентов с неповрежденной слизистой оболочкой желудочно-кишечного тракта, предполагая экскрецию рифаксимина с желчью.
Печеночная недостаточность
Системная экспозиция рифаксимина заметно увеличивалась у пациентов с печеночной недостаточностью по сравнению со здоровыми субъектами. Средняя AUC у пациентов с печеночной недостаточностью степени С по шкале Чайлд-Пью вдвое превышала таковую у пациентов с печеночной недостаточностью степени А по шкале Чайлд-Пью (смотрите таблицу 28).
In vitro исследования лекарственных взаимодействий показали, что рифаксимин в концентрациях, колеблющихся от 2 до 200 нг/мл, не ингибировал изоферменты 1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 и 3A4 цитохрома Р450 в печени человека. В in vitro модели индукции гепатоцитов установлено, что рифаксимин индуцирует изофермент 3А4 цитохрома P450 (CYP3A4), изофермент, который, как известно, индуцирует рифампин. Два клинических исследования межлекарственных взаимодействий с использованием мидазолама и контрацептива для перорального применения, содержащего этинилэстрадиол и норгестимат, показали, что рифаксимин (200 мг дважды в день в течение 3 дней) не изменял фармакокинетику этих лекарственных средств, а рифаксимин в дозе 550 мг трижды в день в течение 7 или 14 дней приводил лишь к немного уменьшенной экспозиции мидазолама после однократной пероральной дозы мидазолама.
В in vitro исследовании установлено, что рифаксимин индуцирует CYP3A4 в концентрации, составляющей 0,2 мкМ.
Результаты in vitro исследования говорят о том, что рифаксимин является субстратом P-гликопротеина. В присутствии ингибитора P-гликопротеина - верапамила коэффициент эффлюкса для рифаксимина был снижен более чем на 50% in vitro. Эффект ингибирования P-гликопротеина на рифаксимин не был определен in vivo.
Ингибиторный эффект рифаксимина на переносчика P-gp наблюдали в in vitro исследовании. Эффект рифаксимина на переносчика P-gp не был определен in vivo.
Эффект рифаксимина в дозе 200 мг, вводимого перорально каждые 8 часов в течение 3 дней и в течение 7 дней, на фармакокинетику мидазолама, вводимого однократно либо в дозе 2 мг внутривенно, либо в дозе 6 мг перорально, был определен у здоровых субъектов. Не было выявлено значимых различий в показателях системной экспозиции или элиминации вводимого внутривенно или перорально мидазолама или его основного метаболита, 1'-гидроксимидазолама, между мидазоламом самим по себе или вместе с рифаксимином. Следовательно, рифаксимин, как установлено, не оказывает значительное влияние на активность CYP3A4 в кишечнике или печени в случае схемы введения дозы 200 мг три раза в день.
После введения рифаксимина в дозе 550 мг три раза в день в течение 7 дней и 14 дней здоровым субъектам средняя AUC для мидазолама, однократно вводимого перорально в дозе 2 мг, была на 3,8% и 8,8% ниже, соответственно, чем после введения мидазолама самого по себе. Средняя Cmax мидазолама также уменьшалась на 4-5%, когда рифаксимин вводили в течение 7-14 дней по введения мидазолама. Эта степень взаимодействия не считается клинически значимой.
Эффект рифаксимина на CYP3A4 у пациентов со сниженным функционированием печени, которые имеют увеличенную системную экспозицию, не известен.
Контрацептивы для перорального применения, содержащие 0,07 мг этинилэстрадиола и 0,5 мг норгестимата
При исследовании контрацептивов для перорального применения использовали открытое перекрестное исследование на 28 здоровых являющихся женщинами субъектах, чтобы определить, изменяет ли рифаксимин, перорально вводимый в дозе 200 мг три раза в день в течение 3 дней (схема введения доз в случае диареи путешественников), фармакокинетику вводимого в однократной дозе контрацептива для перорального применения, содержащего 0,07 мг этинилэстрадиола и 0,5 мг норгестимата. Результаты показали, что рифаксимин не изменял фармакокинетику введенных в однократных дозах этинилэстрадиола и норгестимата.
Данные in vitro исследования говорят о том, что рифаксимин является субстратом P-гликопротеина. Рифаксимин является слабым ингибитором P-gp в концентрациях (50 мкМ), значительно превышающих таковые, которые ожидаются в плазме после перорального введения доз, рифаксимин лишь частично ингибировал перенос модельного субстрата P-gp. Поэтому не ожидаются клинически значимые взаимодействия с другими лекарственными средствами, на которые воздействует P-гликопротеин.
Рифаксимин выводится в основном с фекалиями. После перорального введения 400 мг рифаксимина 14C398 здоровым добровольцам приблизительно 97% дозы выводилось с фекалиями, почти полностью в виде неизмененного лекарственного средства, и 0,32% выводилось с мочой.
Рифаксимин является не являющимся аминогликозидом, полусинтетический антибиотик, получаемый из рифамицина SV, он является структурным аналогом рифампина. Механизм действия рифаксимина зависит от ингибирования ДНК-зависимой РНК-полимеразы являющихся мишенями микроорганизмов, приводящего к супрессии инициации образовании цепи при синтезе РНК.
Более низкая степень уничтожения фекальных патогенов у пациентов, подвергаемых лечению рифаксимином, по сравнению с фторхинолонами и аминогликозидами и отсутствие изменения кишечной флоры означает уникальный механизм действия. Рифаксимин может изменять факторы вирулентности энтеральных бактериальных патогенов без их уничтожения, что обнаружено при использовании субтерапевтический уровней лекарственных средств, и связанные с колонизацией фимбрии энтеротоксигенных E. coli. Рифаксимин вызывал морфологические изменения как у чувствительных, так и у резистентных бактериальных штаммов уже в концентрациях, составляющих 1/32 от MIC.1 Рифаксимин уменьшал жизнеспособность и вирулентность резистентных бактерий, что говорит о том, что в случае подвергания in vivo патогенов воздействию суб-MIC лекарственного средства будут подорваны не только их физиологические функции, но и не будут в полной мере выражены кодируемые генами вирулентность и резистентность к антибиотикам.
Рифаксимин обладает in vitro противомикробной активностью против многочисленных грамположительных и грамотрицательных бактерий, таких как Escherichia coli. Исследования на животных и людях свидетельствуют о незначительной системной абсорбции рифаксимина (< 1%) после перорального введения. Незначительная системная абсорбция рифаксимина из желудочно-кишечного тракта минимизирует потенциальные неблагоприятные реакции, связанные с системно абсорбируемыми антибиотиками. Рифаксимин доставляется в высоких концентрациях в желудочно-кишечный тракт, который является местом действия терапевтического средства.
Рифаксимин действует посредством связывания с бета-субъединицей бактериальной ДНК-зависимой РНК-полимеразы, приводя к ингибированию синтеза РНК в бактериях.
Установлено, что у Escherichia coli развивается резистентность к рифаксимину in vitro. Однако клиническая значимость такого эффекта не была изучена.
Рифаксимин является структурным аналогом рифампина. Организмы, характеризующиеся высокими значениями минимальной ингибиторной концентрации (MIC) рифаксимина, также характеризуются увеличенными значениями MIC рифампина. Перекрестная резистентность между рифаксимином и другими классами противомикробных средств не была изучена.
В клинических исследованиях инфекционной диареи, описываемых здесь, установлено, что рифаксимин является эффективным ассоциированным с ней патогеном.
В случае HE полагают, что рифаксимин оказывает эффект на флору желудочно-кишечного тракта.
In vitro исследование чувствительности было выполнено в соответствии со способом разведений в агаре Национального комитета по клиническим лабораторным стандартам (NCCLS) M7-A612. Однако корреляция между чувствительностью и клиническим результатом не была установлена.
Установлено, что у Escherichia coli развивается резистентность к рифаксимину in vitro. Однако клиническая значимость такого эффекта не была изучена. Рифаксимин является структурным аналогом рифампина. Организмы, характеризующиеся высокими значениями минимальной ингибиторной концентрации (MIC) рифаксимина, также характеризуются увеличенными значениями MIC рифампина. Перекрестная резистентность между рифаксимином и другими классами противомикробных средств не была изучена.
Злокачественные невриномы в сердце были значительно увеличенными у самцов крыс Crl:CD® (SD), которые получали рифаксимин с помощью зондового питания в течение двух лет в дозах 150-250 мг/кг/день (дозах, превышающих в 2,4-4 раза рекомендуемую в случае диареи путешественников дозу - 200 мг три раза в день и превышающих в 1,3-2,2 раз рекомендуемую в случае печеночной энцефалопатии дозу - 550 мг дважды в день, на основе сравнений относительно площади поверхности тела). Увеличения опухолей не было у мышей Tg.rasH2, которым перорально вводили рифаксимин в течение 26 недель в дозах, составляющих 150-2000 мг/кг/день (дозах, превышающих в 1,2-16 раз рекомендуемую в случае диареи путешественников суточную дозу и превышающих в 0,7-9 раз рекомендуемую в случае печеночной энцефалопатии суточную дозу, на основе сравнений относительно площади поверхности тела).
Канцерогенный потенциал рифаксимина изучали в проводимом в течение 2 лет исследовании с использованием крыс CD. Ежедневное пероральное введение на уровнях доз, колеблющихся от 20, 50, до 250 мг/кг/день, не принесло доказательство канцерогенного эффекта.
Также в исследовании с использованием мышей Tg.rasH2 ежедневное введение с помощью зондового кормления рифаксимина в дозах вплоть до 1500 мг/кг/день (в случае самцов) и 2000 мг/кг/день (в случае самок) в течение 26 недель не увеличило частоту опухолей по сравнению с являющимся носителем контролем.
Рифаксимин не был генотоксичным в анализе обратных мутаций у бактерий, анализе хромосомных аберраций, анализе микроядер в костном мозге крыс, анализе нерепаративного синтеза ДНК в гепатоцитах крыс или анализе мутаций CHO/HGPRT. Не было эффекта на фертильность у самцов или самок крыс после введения рифаксимина в дозах вплоть до 300 мг/кг (превышающих в приблизительно 5 раз клиническую дозу - 600 мг/день и в приблизительно 2,6 раз клиническую дозу - 1100 мг/день, с приведением в соответствие с площадью поверхности тела).
Результаты исследований токсичности при пероральном введении многократных доз на крысах, кроликах и собаках показали незначительный токсический эффект рифаксимина в дозах, превышающих в 6-68 раз клиническую дозу для диареи путешественников (600 мг/день), в течение вплоть до 39 недель.
В проводимом в течение 26 недель исследовании с использованием вводимого перорально мышам Tg.rasH2 рифаксимина в дозах вплоть до 1500 мг/кг/день (в случае самцов) и 2000 мг/кг/день (в случае самок) у 2/25 самок мышей при введении дозы 2000 мг/кг в день появлялись взъерошенная шерсть и изогнутый вид с низкой частотой, которая не достигала статистической значимости.
Пероральное введение рифаксимина в течение 3-6 месяцев вызывало пролиферацию соединительной ткани в печени крыс (50 мг/кг/день) и жировую дистрофию печени у собак (100 мг/кг/день). Однако уровни лекарственного средства в плазме не были определены в этих исследованиях. Впоследствии рифаксимин исследовали в дозах вплоть до 300 мг/кг/день на крысах в течение 6 месяцев и 1000 мг/кг/день на собаках в течение 9 месяцев, и не было выявлено признаков гепатотоксичности. Максимальные, относящиеся к плазме значения AUC0-8 ч на основе исследований токсичности в течение 6 месяцев у крыс и 9 месяцев у собак (диапазон: 42-127 нг·ч/мл) были ниже максимальных, относящихся к плазме значений AUC0-8 ч у пациентов с циррозом (диапазон: 19-306 нг·ч/мл).
Эффективность рифаксимина, принимаемого в дозе 200 мг перорально три раза в день в течение 3 дней, была оценена в 2 рандомизированных, проводимых во множестве центров, двойных слепых, плацебо-контролируемых исследованиях на взрослых субъектах с диареей путешественников. Одно исследование проводилось в клиниках в Мексике, Гватемале и Кении (исследование 1). Другое исследование проводилось в Мексике, Гватемале, Перу и Индии (исследование 2). Образцы экскрементов брали до лечения и в дни 1-3 после завершения лечения для определения кишечных патогенов. Преобладающим патогеном в обоих исследованиях была Escherichia coli.
Клиническую эффективность рифаксимина оценивали по времени до возврата к нормальным, оформленным стулам и исчезновения симптомов. Первичным конечным показателем эффективности было время до последнего не сформированного стула (TLUS), которое определяли как прошедший период времени до последнего не сформированного стула, после которого объявлялось клиническое выздоровление. В таблице 29 представлены среднее TLUS и число пациентов, достигших клинического выздоровления, для сформированной в соответствии с назначенным лечением (ITT) популяции исследования 1. Продолжительность диареи была значительно меньше у пациентов, подвергнутых лечению рифаксимином, чем у пациентов гриппы плацебо. К категории пациентов, достигших клинического выздоровления, было отнесено больше пациентов, подвергнутых лечению рифаксимином, чем пациентов группы плацебо.
Клиническая ответная реакция в исследовании 1 (у ITT популяции)
b Различие в степенях
Степени уничтожения микробов (определяемого как отсутствие исходного патогена в культуре экскрементов через 72 часов лечения) в случае исследования 1 представлены в таблице 30 для пациентов с любым патогеном на исходном уровне и для субпопуляции пациентов с Escherichia coli на исходном уровне. Escherichia coli был единственным патогеном, присутствующим в достаточных количествах, чтобы сделать возможными сравнения между группами лечения.
Несмотря на то, что рифаксимин обладал микробиологической активностью, схожей с таковой плацебо, он продемонстрировал клинически значимое уменьшение продолжительности диареи и большую степень клинического выздоровления, чем плацебо. Следовательно, вести пациентов следует исходя из клинической ответной реакции на терапию, а не микробиологической реакции.
Степени уничтожения микробов у субъектов с патогеном на исходном уровне в случае исследования 1
Результаты исследования 2 подтвердили результаты, представленные в случае исследования 1. Кроме того, с помощью этого исследования также были представлены факты, что подвергнутые лечению рифаксимином субъекты с лихорадкой и/или кровью в экскрементах на исходном уровне имели увеличенное TLUS. В случае этих субъектов степени клинического выздоровления были более низкими, чем в случае субъектов без лихорадки или крови в экскрементах на исходном уровне. Многие из пациентов с лихорадкой и/или кровью в экскрементах (диарейными синдромами, похожими на синдромы дизентерии) имели инвазивные патогены, в основном Campylobacter jejuni, выделенные из исходных экскрементов.
Также в этом исследовании в случае большей части подвергнутых лечению рифаксимином субъектов, у которых Campylobacter jejuni выделен в качестве единственного патогена на исходном уровне, лечение было не успешным, и результирующая степень клинического выздоровления в случае этих пациентов составила 23,5% (4/17). Помимо отсутствия отличия от плацебо, степени уничтожения микробов в случае субъектов с Campylobacter jejuni, выделяемом на исходном уровне, были намного ниже степеней уничтожения микробов, наблюдаемых в случае Escherichia coli.
В не связанном открытом, фармакокинетическом исследовании рифаксимина, принимаемого перорально в дозе 200 мг каждые 8 часов в течение 3 дней, заражению Shigella flexneri 2a подвергали 15 взрослых субъектов, у 13 из которых развилась диарея или дизентерия, и они были подвергнуты лечению рифаксимином. Хотя это открытое испытание с использованием заражения было недостаточным для оценки эффективности рифаксимина в лечении шигеллеза, были сделаны следующие наблюдения: восемь пациентов получили резервное лечение ципрофлоксацином либо вследствие отсутствия ответа на лечение рифаксимином в пределах 24 часов (2), либо поскольку у них развилась тяжелая дизентерия (5), или вследствие повторного появления Shigella flexneri в экскрементах (1); пять из 13 субъектов получили ципрофлоксацин, хотя в их случае не было данных о тяжелом заболевании или рецидиве.
Эффективность рифаксимина, принимаемого в дозе 550 мг перорально два раза в день, была оценена в рандомизированном, плацебо-контролируемом двойном слепом, проводимых во множестве центров в течение 6 месяцев испытании на взрослых субъектах из США, Канады и России, которые были определены как пациенты, находящиеся в ремиссии (составляющая 0 или 1 оценка по Конну) печеночной энцефалопатии (HE). Подходящие субъекты имели ≥2 эпизодов HE, связанной с хроническим заболеванием печени, в предшествующие 6 месяцев.
Всего 299 субъектов были подвергнуты рандомизации для получения либо рифаксимина (n=140), либо плацебо (n=159) в этом исследовании. Средний возраст пациентов составлял 56 лет (диапазон: 21-82); 81% пациентов были пациентами возраста <65 лет, 61% были мужчинами и 86% были европеоидной расы. На исходном уровне 67% пациентов имели оценку по Конну =0, и 68% имели степень «порхающего» тремора =0. Пациенты имели оценки в MELD, составляющие либо ≤10 (27%) или 11-18 (64%) на исходном уровне. Пациенты с оценкой в MELD>25 в исследование не включались. Девять процентов пациентов имели степень С по шкале Чайлд-Пью. 91% пациентов в каждой подвергаемой лечению группе исследования одновременно принимали лактулозу. В каждом протоке исследования пациенты исключались из исследования после проявления эпизода обострения HE во время лечения. Другие причины преждевременного прекращения исследования включали неблагоприятные реакции (рифаксимин 6%; плацебо 4%), требование прекращения пациентом (рифаксимин 4%; плацебо 6%) и другие (рифаксимин 7%; плацебо 5%).
Первичным конечным показателем было время до первого эпизода обострения HE с явной клинической картиной во время лечения. Эпизод обострения HE с явной клинической картиной во время лечения определяли как явное ухудшение функции нервной системы и увеличение оценки по Конну до степени ≥2. В случае пациентов с оценкой по Конну на исходном уровне =0, эпизод обострения HE с явной клинической картиной во время лечения определяли как достигающее 1 увеличение оценки по Конну и составляющую 1 степень «порхающего» тремора.
Эпизоды обострения HE с явной клинической картиной во время лечения проявили 31 из 140 субъектов (22%) в подвергаемой лечению рифаксимином группе и 73 из 159 субъектов (46%) в подвергаемой лечению плацебо группе во время 6-месячного периода лечения. Сравнение оценок по методу Каплана-Мейера кривых без эпизодов обострения показало, что рифаксимин значительно снижает риск обострения HE во время лечения на 58% во время 6-месячного периода лечения. Ниже на фиг.24 представлена кривая без эпизодов обострения с оценками по методу Каплана-Мейера для всех субъектов (n=299) этого исследования.
Терапевтический эффект рифаксимина в дозе 550 мг в снижении риска рецидива HE с явной клинической картиной во время лечения не был противоречивым, когда результаты были оценены в соответствии со следующими демографическими и исходными характеристиками: полом, оценкой по Конну на исходном уровне, продолжительностью имеющейся в данное время ремиссии и диабетом. Различия в терапевтическом эффекте нельзя было оценить из-за маленького объема выборки в следующих субпопуляциях: в субпопуляциях пациентов не европеоидной расы (n=42), с оценкой в MELD на исходном уровне >19 (n=26), со степенью С по шкале Чайлд-Пью (n=31) и пациентов, не принимающих одновременно лактулозу (n=26).
На фиг.25 представлены отношения рисков проявления HE с явной клинической картиной во время лечения (риск в подвергнутой лечению рифаксимином группе, разделенный на риск в подвергнутой лечению плацебо группе) для каждой подгруппы, 95% доверительный интервал, определяемый в соответствии с моделью пропорциональных рисков Кокса. P-значения для различий между подвергнутыми лечению рифаксимин и плацебо группами определяли с помощью логарифмического рангового критерия.
Связанные с HE госпитализации были зарегистрированы в случае 19 из 140 субъектов (14%) и 36 из 159 субъектов (23%) в подвергнутых лечению рифаксимином и плацебо группах соответственно. Рифаксимин вызывал значительное снижение риска связанных с HE госпитализаций во время 6-месячного периода лечения; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,500 (95% доверительный интервал: 0,287-0,873) (p=0,0129). У субъектов в подвергнутой лечению рифаксимином группе отмечалось снижение на 50% риска госпитализации вследствие HE во время 6-месячного периода лечения по сравнению с подвергнутой лечению плацебо группой. Смотрите фиг.26: Время до первой связанной с HE госпитализации в исследовании HE (вплоть до 6 месяцев лечения, день 170) (в случае сформированной в соответствии с назначенным лечением (ITT) популяции).
Связанные с HE госпитализации (госпитализации, являющиеся непосредственным следствием HE, или госпитализации, осложненные HE) были зарегистрированы в случае 19 из 140 субъектов (14%) и 36 из 159 субъектов (23%) в подвергнутых лечению рифаксимином и плацебо группах, соответственно. Рифаксимин вызывал значительное снижение риска связанных с HE госпитализаций во время 6-месячного периода лечения; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,500 (95% доверительный интервал: 0,287-0,873) (p=0,0129). У субъектов в подвергнутой лечению рифаксимином группе отмечалось снижение на 50% риска госпитализации вследствие HE во время 6-месячного периода лечения по сравнению с подвергнутой лечению плацебо группой. Смотрите фиг.26: Время до первой связанной с HE госпитализации в исследовании HE (вплоть до 6 месяцев лечения, день 170) (в случае ITT популяции).
Сравнение оценок по методу Каплана-Мейера кривых без госпитализаций показало, что рифаксимин значительно снижает риск связанных с HE госпитализаций на 50% во время 6-месячного периода лечения. Сравнение оценок по методу Каплана-Мейера кривых без госпитализаций представлено на фиг.25.
Исследования чувствительности к противомикробным средствам бактерий, которые растут аэробно, были выполнены в соответствии со способами разведений в агаре, описанными в Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. National Committee for Clinical Laboratory Standards, Sixth Edition, Wayne PA. Approved Standard NCCLS Document M7-A6 January 2003; 23 (2).
В высокой степени значимые предохранительные эффекты рифаксимина были отмечены в отношении времени до любого увеличения по сравнению с исходным уровнем оценки по Конну и времени до любого увеличения по сравнению с исходным уровнем степени «порхающего» тремора при их независимом анализе; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе - составляло 0,463 (95% доверительный интервал: 0,312-0,685) (p<0,0001) для риска проявления увеличения оценки по Конну (т.е. ухудшения психического состояния) и 0,646 (95% доверительный интервал: 0,414-1,008) (p=0,0523) для риска проявления увеличения степени «порхающего» тремора (т.е. ухудшения функции нервно-мышечной системы) во время 6-месячного периода лечения.
Поскольку лактулоза была чаще всего используемым одновременно терапевтическим средством, был предпринят анализ применения лактулозы на исходном уровне и во время исследования, чтобы гарантировать, что терапевтический эффект рифаксимина не модифицируется. На исходном уровне и во время испытания не было различий в применении лактулозы между подвергаемой лечению рифаксимином группой и контрольной группой. Таким образом, на результаты исследования, демонстрирующие эффективность рифаксимина, не влияло применение лактулозы.
Кроме того, подгруппы пациентов были подвергнуты анализам в MELD и по шкале Чайлд-Пью для определения каких-либо различий между подвергаемыми лечению рифаксимином группами. Было установлено, что положительные эффекты рифаксимина не ограничиваются тяжестью заболевания печени. Кроме того, также было установлено, что нет значительной связи между различными подгруппами и эффектом. Соответственно, все эти исследования показали снижение риска в пользу рифаксимина. На фиг.28 проиллюстрировано, что отмечалось постоянство терапевтического эффекта по всем различным подгруппам, которым вводили рифаксимин.
Об ассоциированной с Clostridium difficile диарее (CDAD) сообщалось при применении почти всех антибактериальных средств, включающих рифаксимин, и ее тяжесть может колебаться от слабого поноса до вызывающего смерть колита. Лечение антибиотиками изменяет нормальную флору ободочной кишки, что может привести к чрезмерно быстрому росту C. difficile. У пациентов может развиться водянистый и кровянистый стул (с желудочными спазмами и лихорадкой или без них) даже уже спустя два или более месяцев после приема последней дозы антибиотика. Если диарея имеет место во время терапии или не уменьшается или увеличивается во время терапии, посоветуйте пациентам связаться с врачом как можно быстрее.
Следует информировать пациентов об увеличении системной экспозиции рифаксимина у пациентов с тяжелой печеночной недостаточностью (степенью С по шкале Чайлд-Пью).
ПРИМЕРЫ
Следует в полной мере понимать, что варианты осуществления настоящего изобретения, как должно подразумеваться, не ограничиваются примерами, которые теперь будут описаны, а наоборот, настоящее изобретение, как должно подразумеваться, включает любые и все применения, предоставленные здесь, и все эквивалентные варианты в пределах квалификации специалиста со средним уровнем квалификации.
ПРИМЕР 1: Эффекты рифаксимина на субъектов с печеночной недостаточностью
Субъектов инструктировали принимать внутрь одну таблетку, содержащую 550 мг рифаксимина, 2 раза в день - приблизительно каждые 12 часов. Рифаксимин можно назначать вместе с другими лекарственными средствами, например лактулозой, антидепрессантами, противовоспалительными средствами, метадоном, отпускаемыми по рецептору и без рецепта снотворными (например, LunestaTM (эсзопиклоном) и Ambien® (золпидема тартратом), и антигистаминными средствами, мочегонными средствами, слабительными средствами или размягчителями стула, нейронтином (габапентином) и лирикой (прегабалином).
Применение лактулозы было необязательным для субъектов. В случае субъектов, принимающих лактулозу, ее распределяли в течение времени (3-7)-дневного периода наблюдения в соответствии с общепринятой медицинской практикой.
Степень «порхающего» тремора
«Порхающий» тремор определяли с использованием удерживания субъектом вытянутыми обеих рук и предплечий с тыльным сгибанием запястий и разомкнутыми пальцами в течение ≥30 секунд. «Порхающий» тремор определяли в соответствии чередой 5 степеней, например степеней 0 и 4 = нет анормального движения, в сравнении с почти непрерывными «порхающими» движениями, соответственно как представлено ниже:
Степень 0 = нет тремора;
Степень 1 = редкие «порхающие» движения;
Степень 2 = периодические, нерегулярные «порхающие» движения;
Степень 3 = частые «порхающие» движения; и
Степень 4 = почти непрерывные «порхающие» движения.
Эффективность относительно степени «порхающего» тремора определяли как время до любого увеличения по сравнению с исходным уровнем степени «порхающего» тремора. Время до увеличения степени «порхающего» тремора рассчитывали как число дней от введения первой дозы рифаксимина до зарождения увеличения по сравнению с исходным уровнем степени «порхающего» тремора.
Эпизод обострения HE во время лечения
Определяли относительный риск проявления эпизода обострения HE во время лечения (например, степень в соответствии с оценкой по Конну ≥2 (например, с 0 или 1 до ≥2) или увеличение на 1 степень каждой из оценок по Конну и «порхающего» тремора) для каждого субъекта в испытании, принимающего либо рифаксимин, либо плацебо. При анализе с использованием способов для анализа времени дожития сравнивали время до первого эпизода обострения HE во время лечения для подвергнутой лечению рифаксимином группы относительно подвергнутой лечению плацебо группы. Время до первого эпизода обострения HE во время лечения рассчитывали как число дней от введения первой дозы рифаксимина до зарождения обострения HE во время лечения (например, степень в соответствии с оценкой по Конну ≥2 или увеличение на 1 степень каждой из оценок по Конну и «порхающего» тремора).
Изменение психического состояния определяли с помощью оценки по Конну (также известной как оценка Уэст-Хейвена). Оценка по Конну широко использовалась в качестве показателя психического состояния при исследованиях HE и основывается на критериях Парсонса-Смита, модифицированных Конном. Шкала, используемая в системе оценки по Конну, описана выше.
Субъекты имели оценку по Конну, составляющую 0 или 1. Увеличение оценки по Конну до степени ≥2 считалось эпизодом обострения HE во время лечения.
Алгоритм для оценки печеночной энцефалопатии(HESA)
Алгоритм для оценки печеночной энцефалопатии (HESA) является способом, в котором используется как клинические, так и нейропсихологические оценки для определения психического состояния. Валидация алгоритма была выполнена ранее, и установлена его корреляция с критериями по Конну.
Исследование CFF общепризнано в качестве количественного определения дисфункции CNS, и в нем используется корреляция между обработкой на уровне головного мозга колеблющихся визуальных стимулов и ее последующим ухудшением вследствие увеличения тяжести HE. Исследование CFF было обеспечено, и статистически значимое большее улучшение результатов исследования CFF отмечалось у подвергнутых лечению рифаксимином субъектов по сравнению с подвергнутыми лечению плацебо субъектами (p=0,0320).
Критическую частоту мельканий (CFF) определяли в случае каждого субъекта при скрининге, на исходном уровне, при посещениях с 3 по 14 и в момент завершения исследования, используя слияние мельканий Lafayette (Lafayette Instrument Company, Inc). Циркулярные импульсы света с составляющим 1:1 соотношением между визуальными импульсами и интервалом были использованы с постепенным снижением частоты с 0,5 до 0,1 Гц/сек. Частоту белого света, который сначала генерировали как импульс высокой частоты (50 Гц) и который создает у пациента впечатление не мелькающего света, постепенно снижали до создания у пациента впечатления, что не мелькающий свет сменился на мелькание. Пациент регистрировал эту смену посредством нажатия на ручной переключатель. Частоты мельканий определяли 8 раз, и на основе этих данных рассчитывали средние значения для каждого пациента. Исследование выполняли в тихой полузатененной комнате без отвлекающего шума, и оно занимало приблизительно 10 минут.
Оценки критической частотой мельканий
Критическую частоту мельканий (CFF) определяли в случае каждого субъекта, используя специальный прибор для определения CFF. CFF является частотой, на которой субъект отмечает переход не мелькающего свет в мелькающий свет, и измеряется в Герцах (Гц). CFF является объективной оценкой психического состояния. Установлено, что значение CFF=39 Гц является границей раздела между субъектами, проявляющими HE (например, с оценкой по Конну ≥1), и субъектами без симптомов HE (например, с оценкой по Конну =0), при этом более низкое значение CFF указывает на более тяжелую HE(43).
CFF определяли по непрерывной шкале, и она представляло собой среднее значение 8 отдельных исследований переходов от слияния мельканий к мельканиям, выполненных в быстрой последовательности.
Концентрации аммиака
Отбирали образцы венозной крови (10 мл) и определяли концентрации аммиака с помощью методов, известных в данной области техники.
Время до увеличения по сравнению с исходным уровнем либо оценки по Конну (степени психического состояния), либо степени «порхающего» тремора
Чтобы проанализировать время до первого эпизода обострения HE во время лечения, использовали способы для анализа времени дожития для оценки эффекта лечения рифаксимина на время до увеличения по сравнению с исходным уровнем либо оценки по Конну (степени психического состояния), либо степени «порхающего» тремора. Время до увеличения либо оценки по Конну, либо степени «порхающего» тремора рассчитывали как число дней от введения дозы первой рифаксимина до зарождения увеличения по сравнению с исходным уровнем либо оценки по Конну, либо степени «порхающего» тремора. Анализ времени до увеличения либо оценки по Конну, либо степени «порхающего» тремора был основан на сравнении времени до указанного эпизода между подвергнутыми лечению рифаксимин и плацебо группами.
Время до первой связанной с HE госпитализации
Определяли эффект рифаксимина на время до первой связанной с HE госпитализации. Время до первой связанной с HE госпитализации рассчитывали как число дней от введения первой дозы рифаксимина до первой госпитализации по поводу относящегося с HE эпизода. Анализ времени до первой связанной с HE госпитализации был основан на сравнении времени до госпитализации между подвергнутыми лечению рифаксимин и плацебо группами.
Время до развития спонтанного бактериального перитонита
Определяли эффект рифаксимина на время до развития спонтанного бактериального перитонита (SBP). Время до развития SBP рассчитывали как число дней от введения первой дозы рифаксимина до времени отбора жидкости из брюшной полости, которая была положительной в тесте на наличие SBP. Анализ времени до развития SBP был основан на сравнении времени до указанного события между подвергнутыми лечению рифаксимин и плацебо группами.
Среднее изменение по сравнению с исходным уровнем концентрации аммиака в крови и значений критической частоты мельканий со временем
Были получены средние значения и средние изменения по сравнению с исходным уровнем концентрации аммиака в крови и значений критической частоты мельканий. Анализы концентраций аммиака в крови и значений критической частоты мельканий основывались на количественных значениях (а не на качественных степенях). Связанные с лечением различия среднего изменения по сравнению с исходным уровнем этих параметров оценивали, используя модель смешанных эффектов с использованием фиксированных эффектов (факторов) времени и значения на исходном уровне.
Среднее суточное потребление лактулозы в динамике времени
Суточное потребление субъектом лактулозы использовали для расчета среднего суточного потребления лактулозы в течение каждого месяца. Оценивались связанные с лечением различия среднего изменения по сравнению с исходным уровнем среднего суточного потребления лактулозы.
CLDQ
CLDQ включает 29 вопросов по следующим шести областям проявлений: абдоминальных симптомов (три вопроса), усталости (пять вопросов), системных симптомов (пять вопросов), активности (три вопроса), эмоционального состояния (восемь вопросов) и беспокойства (пять вопросов). Суммарные оценки по всему CLDQ и по каждой из шести областей проявлений рассчитывали и суммировали на исходном уровне и в дни 28, 56, 84, 112, 140 и 168, используя описательную статистику. Связанные с лечением различия среднего изменения общей оценки и оценок по отдельным областям проявлений по сравнению с исходным уровнем к дням 28, 56, 84, 112, 140 и 168 суммировали и сравнивали между лечениями.
Связанные с лечением различия среднего изменения по сравнению с исходным уровнем в конце лечения (EOT) определяли как изменение по сравнению с исходным уровнем в EOT оценки проявления усталости с помощью вопросника для оценки хронического заболевания печени (CLDQ). Также определяли среднее изменение по сравнению с исходным уровнем концентрации аммиака в крови в EOT.
Оценка качества жизни
SF-36, вопросник для оценки хронического заболевания печени (CLDQ) и шкалу сонливости Эпворса использовали для определения связанного со здоровьем качества жизни. Содержащий 29 вопросов вопросник CLDQ состоит из следующих областей проявлений: усталости, активности, эмоционального состояния, абдоминальных симптомов, системных симптомов и беспокойства.
Шкала сонливости Эпворса
Общие оценки по шкале сонливости Эпворса рассчитывали и суммировали на исходном уровне и в дни 28, 56, 84, 112, 140 и 168, используя описательную статистику. Связанные с лечением различия среднего изменения общих оценок по сравнению с исходным уровнем к дням 28, 56, 84, 112, 140 and 168 суммировали и сравнивали между лечениями.
Фиг.1 представляет собой диаграмму в виде ломаных, на которой сравнивается суточное потребление лактулозы между субъектами, принимающими плацебо, и субъектами, принимающими рифаксимин, как здесь описывается.
Фиг.2 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до эпизода обострения HE во время лечения для принимающей плацебо группы и принимающей рифаксимин группы. Как указано, отмечалось увеличение времени до эпизодов обострения HE во время лечения в случае субъектов, принимающих рифаксимин, по сравнению с субъектами, принимающими плацебо.
Фиг.3 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до первой связанной с НЕ госпитализации. Как указано, отмечалось увеличение времени до госпитализации в случае субъектов, принимающих рифаксимин, по сравнению с субъектами, принимающими плацебо.
Фиг.4 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до первого увеличения оценок по Конну. Как указано, отмечалось увеличение времени до первого увеличения оценок по Конну в случае субъектов, принимающих рифаксимин, по сравнению с субъектами, принимающими плацебо.
Фиг.5 представляет собой диаграмму в виде ломаных, на которой демонстрируются оценки по методу Каплана-Мейера распределения времени до первого увеличения степени «порхающего» тремора. Как указано, отмечалось увеличение времени до первого увеличения степени «порхающего» тремора в случае субъектов, принимающих рифаксимин, по сравнению с субъектами, принимающими плацебо.
ПРИМЕР 2
В следующих таблицах представлены дополнительные факты, подтверждающие преимущественное применение специфических для заболеваний GI антибиотиков, таких как рифаксимин, для лечения субъектов, страдающих HE.
Время до возникновения эпизода обострения HE во время лечения
женность риску
ва- емость
женность риску
ва- емость
95% доверительный интервал: (0,276, 0,641)
р-значение: <0,0001
Время до возникновения эпизода обострения HE во время лечения в соответствии с исходным уровнем оценки по Конну
женность риску
ва- емость
женность риску
ва- емость
95% доверительный интервал: (0,258, 0,754)
р-значение: 0,0028
Время до возникновения эпизода обострения HE во время лечения в соответствии с предварительным применением лактулозы
женность риску
женность риску
95% доверительный интервал: (0,274, 0,655)
р-значение: 0,0001
Время до возникновения первой связанной с НЕ госпитализации
женность риску
ва -емость
женность риску
ва- емость
95% доверительный интервал: (0,313, 0,868)
р-значение: 0,0107
Время до любого увеличения по сравнению с исходным уровнем оценки по Конну
женность риску
ва- емость
женность риску
ва- емость
95% доверительный интервал: (0,312, 0,685)
р-значение: <0,0001
Время до возникновения эпизода обострения HE во время лечения в соответствии с исходным уровнем оценки в MELD
женность риску
ва- емость
женность риску
ва- емость
95% доверительный интервал: (0,039, 0,754)
р-значение: 0,0197
Время до возникновения эпизода обострения HE во время лечения в соответствии с исходным уровнем оценки в MELD
женность риску
ва- емость
женность риску
ва-емость
95% доверительный интервал: (0,195, 0,556)
р-значение: <0,0001
Время до возникновения эпизода обострения HE во время лечения в соответствии с исходным уровнем оценки в MELD
женность риску
женность риску
95% доверительный интервал: (0,123, 1,313)
р-значение: 0,1315
Время до возникновения эпизода обострения HE во время лечения в соответствии с предварительным применением лактулозы
женность риску
женность риску
95% доверительный интервал: (0,2586, 0,618)
р-значение: <0,0001
Время до любого увеличения по сравнению с исходным уровнем степени «порхающего» тремора
женность риску
ва -емость
женность риску
ва -емость
95% доверительный интервал: (0,414, 1,008)
р-значение: 0,0523
Среднее изменение по сравнению с исходным уровнем концентрации аммиака в крови (мкг/дл)
Среднее изменение по сравнению с исходным уровнем в исследовании критической частотой мельканий (Гц)
Среднее изменение по сравнению с исходным уровнем в исследовании критической частотой мельканий (Гц)
Число субъектов на каждом уровне изменения по сравнению с исходным уровнем оценки по Конну
в соответствии с группой лечения
(550 мг рифаксимина дважды в день/плацебо)
Число субъектов на каждом уровне изменения по сравнению с исходным уровнем степени «порхающего» тремора в соответствии с группой лечения
(550 мг рифаксимина дважды в день/плацебо)
Среднее изменение по сравнению с исходным уровнем общей оценки по шкале сонливости Эпворса
Время до возникновения первой связанной с HE госпитализации
женность риску
ва- емость
женность риску
ва -емость
95% доверительный интервал: (0,287, 0,873)
р-значение: 0,0129
ПРИМЕР 3: Рифаксимин не индуцирует CYP3A4
Индукция CYP3A4 рифаксимином была отмечена исходя из снижения на приблизительно 25% AUC для мидазолама. Наибольшая системная экспозиция ожидается у большей части являющейся мишенью популяции пациентов.
Когда рифаксимин вводили перорально в высоких дозах (1650 мг/день) в течение по крайней мере 7 дней, средняя Cmax, AUC0-t и AUC0-∞ для мидазолама уменьшались на <25%. Рифаксимин является потенциальным индуктором CYP3A4, в in vitro исследованиях установлено, что он обладает меньшей индукционной активностью, чем рифампин. Расчетная концентрация рифаксимина в просвете кишечника составляет приблизительно 5 мкМ. В in vitro исследовании активность CYP3A4 была увеличена в 1,7 раз и 1,8 раз при концентрации рифаксимина, составляющей 1 мкМ и 10 мкМ; рифампин в этих же концентрациях увеличивал активность CYP3A4 в 3,7 раз и 4 раз, соответственно. Кроме того, полагают, что в результате направленного на кишку распределения рифаксимина его механизм индукции CYP3A4 ограничивается кишечником, обходясь без индукции в печени в результате его низкой системной экспозиции. Т.е. в случае рифаксимина существует разобщение индукции в кишечнике и печени. Это, как продемонстрировано в описанных здесь исследованиях на принимающих рифаксимин людях, подтверждается отсутствием индукции, когда либо внутривенно, либо перорально вводили мидазолам после введения рифаксимина в дозе 200 мг трижды в день в течение вплоть до 7.
Без желания ограничиваться какой-либо конкретной научной теорией полагают, что любой риск индукции CYP3A4 в печени, вероятно, в дальнейшем уменьшается у пациентов с печеночной недостаточностью, в случае которых значительные части портального кровотока идут в результате наличия анастомозов в обход печени;3 поэтому увеличенная системная экспозиция у них должна сопровождаться пропорциональным снижением воздействия на гепатоциты, и пациенты не должны подвергаться фактическому увеличению риска индукции CYP3A4 в печени.
ПРИМЕР 4: Исследования лекарственных взаимодействий
Два клинических исследования межлекарственных взаимодействий были проведены с использованием содержащей 200 мг рифаксимина таблетки, и одно исследование межлекарственных взаимодействий - с использованием содержащей 500 мг рифаксимина таблетки. Было проведено два исследования с использованием мидазолама, известного субстрата для CYP3A4, и 1 исследование с использованием контрацептива для перорального применения, содержащего этинилэстрадиол и норгестимат, для оценки эффекта рифаксимина на фармакокинетику этих лекарственных средств. На основе результатов этих исследований и in vitro исследований индукции и ингибирования с использованием фракций, выделенных из печени человека, не ожидаются клинически значимые лекарственные взаимодействия с рифаксимином.
Хотя in vitro исследования показали способность рифаксимина к взаимодействию с 3A4 цитохрома P450 (CYP3A4), клиническое исследование межлекарственных взаимодействий показало, что рифаксимин не оказывает значительное влияние на фармакокинетику мидазолама ни на пресистемном уровне, ни на системном уровне. Дополнительное клиническое исследование межлекарственных взаимодействий показало отсутствие эффекта рифаксимина на пресистемный метаболизм контрацептива для перорального применения, содержащего этинилэстрадиол и норгестимат. Поэтому клинически значимые взаимодействия с лекарственными средствами, метаболизируемыми изоферментами цитохрома P450 человека, не ожидаются.
Было проведено два исследования для оценки возможности взаимодействий лекарственного средства с мидазоламом. Первое исследование было открытым, рандомизированным, перекрестным, исследованием межлекарственных взаимодействий, предназначенным для оценки эффекта рифаксимина в дозе 200 мг, вводимого перорально каждые 8 часов (Q8H) в течение 3 дней и в течение 7 дней, на фармакокинетику мидазолама, вводимого либо в однократно в дозе 2 мг внутривенно, либо в дозе 6 мг перорально. Не было выявлено значимых различий в показателях системной экспозиции или элиминации вводимого внутривенно или перорально мидазолама или его основного метаболита, 1'-гидроксимидазолама, между мидазоламом самим по себе или вместе с рифаксимином. Следовательно, рифаксимин, как установлено, не оказывает значительное влияние на активность CYP3A4 в кишечнике или печени.
Во втором исследовании, открытом исследовании межлекарственных взаимодействий, изучали эффект на перорально вводимый мидазолам в дозе 2 мг рифаксимина в дозе 550 мг три раза в день при введении доз в течение 7 и 14 следующих друг за другом дней. В этом исследовании установлено, что рифаксимин является слабым индуктором CYP3A4; принимая во внимание низкую системную экспозицию рифаксимина, полагают, что это взаимодействие будет ограничиваться желудочно-кишечным трактом. Эта индукция является как дозозависимой, так и зависимой от продолжительности введения доз. Когда рифаксимин вводили перорально в высоких дозах (1650 мг/день) в течение по крайней мере 7 дней, средняя Cmax, AUC0-t и AUC0-∞ для мидазолама уменьшалась на <25%.
In vitro активность hERG и in vitro связывание рифаксимина с белком
В in vitro исследованиях hERG рифаксимину в концентрациях вплоть до 300 мкМ не удалось достичь 50% ингибирования тока в hERG калиевых каналах. Из-за преципитации рифаксимина при 300 мкМ IC50 по оценкам превышала 100 мкМ. В действительности, 50% ингибирования нельзя было достичь; при 100 мкМ среднее ингибирование составляло 34,5%. Наибольшая Cmax, отмеченная у пациентов с печеночной недостаточностью в этом исследовании, составляла 52,2 нг/мл (0,0664 мкМ); наибольшая доля свободной плазмы, отмеченная в подмножестве образцов плазмы от пациентов, вовлеченных в это исследование, составляла 44,7%. Используя эти числа, наибольшая ожидаемая экспозиция в свободной плазме могла бы составить 0,03 мкМ, что является ≥3000-кратным снижением по сравнению с наибольшей концентрацией, при которой рифаксимин мог бы быть исследован в экспериментах с использованием hERG. Эта степень безопасности значительно превышает 30-кратный раздел между IC50 для hERG и Cmax несвязанного соединения, который обычно связывают с минимизацией риска клинически значимого удлинения QT.
ПРИМЕР 5: Время до первого эпизода обострения во время лечения
Параметром эффективности для первого исследования было возникновение эпизода обострения HE с явной клинической картиной во время лечения. Эпизоды обострения HE с явной клинической картиной во время лечения определяли посредством использования оценки по Конну (или степени Уэст-Хейвена) и степени «порхающего» тремора. Эпизод обострения HE с явной клинической картиной во время лечения, определяемый в случае первого исследования, представлял собой явное, клиническое значимое ухудшение функции нервной системы, которое может приводить к вредному эффекту при самолечении и приводит к госпитализации. На основе конечного показателя эффективности, времени до первого эпизода обострения HE с явной клинической картиной во время лечения, установлен в высокой степени значимый предохранительный эффект рифаксимина (p<0,0001 для различия в относительном риске межу группами). Лечение рифаксиминои приводило к снижению на 57,9%, по сравнению с плацебо, риска проявления обострения HE с явной клинической картиной во время 6-месячного периода лечения.
Кроме того, это исследование также показало, что на основе времени до первого обострения HE с явной клинической картиной во время лечения также демонстрируется в высокой степени значимый предохранительный эффект рифаксимина при анализе в отдельных географический районах, Северной Америке в сравнении с Россией.
Лечение рифаксимином приводит к меньшему числу эпизодов HE с явной клинической картиной, которые иначе могут сделать пациента нетрудоспособным, может уменьшить бремя на членов семьи, которые вынуждены ухаживать за пациентом, и уменьшает расходы на госпитализацию в этой популяции пациентов и бремя на систему здравоохранения.
Схожие результаты были продемонстрированы во втором исследовании, например, в отношении времени до первого эпизода обострения HE с явной клинической картиной во время лечения: оценки по методу Каплана-Мейера времени до первого эпизода обострения HE с явной клинической картиной во время лечения были схожими между подвергнутой лечению рифаксимином группой в первом исследовании и новыми субъектами, подвергнутыми лечению рифаксимин, в этом втором исследовании. Также схожими были доли субъектов, которые проявили обострение HE с явной клинической картиной во время лечения в подвергнутой лечению рифаксимином группе первого исследования (22%, 31 из 140 пациентов [подвергнутой лечению рифаксимином группы]) и в новой подвергнутой лечению рифаксимином группе второго исследования (27,6%, 54 из 196).
Когда подвергнутые лечению плацебо в первом исследовании субъекты перешли на лечение рифаксимином в результате вхождения во второе исследование, отмечался предохранительный эффект рифаксимина: снижение на 70% риска проявления обострения HE с явной клинической картиной во время лечения рифаксимином во втором исследовании по сравнению с предшествующим проявлением у них во время лечения плацебо в первом исследовании. Это снижение имело место, несмотря на старение популяции с хроническим заболеванием печени и, вероятно, его прогрессирующий характер.
Результаты второго исследования также показали, что предохранительный эффект рифаксимина был длительным: оценка времени до первого обострения HE во время лечения продемонстрировала длительное сохранение отсутствия обострения HE, когда за подвергнутыми лечению рифаксимином субъектами, находящимися в ремиссии после участия в первом исследовании, следили во втором исследовании (вплоть до 680 дней лечения рифаксимином; средние продолжительности воздействий составляли 168 дней в первом исследовании и 253 дней во втором исследовании). Была ниже частота эпизода обострения HE для этих подвергнутых лечению рифаксимином субъектов относительно подвергнутых лечению плацебо в первом исследовании субъектов, указание на уменьшение числа эпизодов обострения HE с помощью лечения рифаксимином.
Оценка критической частоты мельканий (CFF), общепризнанного количественного показателя дисфункции CNS, была конечным показателем эффективности в первом исследовании. В исследованиях CFF используется, например, корреляция между обработкой на уровне головного мозга колеблющихся визуальных стимулов и ухудшением деятельности CNS (центральной нервной системы) вследствие увеличения тяжести HE. В этом исследовании определяется частота, на которой мелькающий свет воспринимается как не мелькающий. Снижение этой частоты было связано с увеличением тяжести HE. Также увеличение аммиака в крови, другой конечный показатель в первом исследовании, является количественной оценкой, связанной с эффектами на CNS, лежащими в основе HE с явной клинической картиной.
Сравнение изменений по сравнению с исходным уровнем в конце исследования результатов CFF и уровней аммиака в венозной крови показало статистически значимое большее улучшение в ходе исследования в подвергнутой лечению рифаксимином группе, чем в подвергнутой лечению плацебо группе (p=0,0320 для изменений в CFF и p=0,0391 для изменений в уровнях аммиака в венозной крови). В первом исследовании была отмечена корреляция между результатами для CFF и обострением HE с явной клинической картиной (первичным показателем эффективности). В первом исследовании было установлено, что существует корреляция между уровнями аммиака в венозной крови и возникновением обострения HE с явной клинической картиной во время лечения.
Результаты для других конечных показателей эффективности также продемонстрировали предохранительные эффекты рифаксимина. В частности, другой конечный показатель эффективности в виде времени до первой связанной с HE госпитализации показал снижение риска в случае подвергаемых лечению рифаксимином субъектов.
В первом исследовании анализ времени до первой связанной с HE госпитализации (например, госпитализации, являющийся непосредственным следствием HE, или госпитализации, осложненной HE) показал, что снижение риска госпитализации вследствие HE составляло 50% в подвергнутой лечению рифаксимином группе, по сравнению с подвергнутой лечению плацебо группой, во время 6-месячного периода лечения. Коэффициент связанной с HE госпитализации составлял 0,38 случаев/годы подвергания воздействию пациентов (PEY) в случае воздействия рифаксимином в сравнении с 0,78 случаев/PEY в случае воздействия плацебо после приведения к подверганию воздействию.
В первом исследовании риск вызванной HE госпитализации (например, лишь госпитализации, являющийся непосредственным следствием HE) снижался на 56% в подвергнутой лечению рифаксимином группе по сравнению с подвергнутой лечению плацебо группой. Коэффициент вызванной HE госпитализации составлял 0,30 случаев/PEY в подвергнутой лечению рифаксимином группе в сравнении с 0,72 случаев/PEY в подвергнутой лечению плацебо группе.
В первом исследовании риск госпитализации по всем причинам снизился на 30% в подвергнутой лечению рифаксимином группе по сравнению с подвергнутой лечению плацебо группой. Коэффициент госпитализации по всем причинам составлял 0,92 случаев/PEY в подвергнутой лечению рифаксимином группе в сравнении с 1,31 случаев/PEY в подвергнутой лечению плацебо группе.
Во втором исследовании низкий коэффициент вызванной HE госпитализации сохранялся на уровнях, соответствующих таковым в первом исследовании: коэффициент вызванной HE госпитализации составлял 0,29 случаев/PEY, а коэффициент госпитализации по всем причинам составлял 0,66 случаев/PEY во втором исследовании. Неизменно низкий коэффициент связанной с HE/вызванной HE госпитализации у подвергнутых лечению рифаксимином субъектов в первом исследовании и во втором исследовании был по крайней мере отчасти результатом сохранения ремиссии доказанной HE у субъектов с конечной стадией заболевания печени.
Печеночная энцефалопатия сопровождается низким качеством жизни по сравнению с соответствующими по возрасту пациентами без HE. У пациентов с HE проявляются симптомы, включающие усталость, дневную сонливость и отсутствие восприятия (оценка по Конну =1), и спутанность сознания и дезориентация (оценка по Конну =2), которые значительно мешают повседневному функционированию, и сниженная способность к самообслуживанию. Часто этот недостаток самообслуживания может приводить к неправильному питанию и несоблюдению указаний врача и может в дальнейшем перерасти в более тяжелые симптомы, такие как повышенная сонливость, явная дезориентация и помрачение сознание, в случае которых требуется госпитализация. Лечение рифаксимином предохраняет от связанной с HE/вызванной НЕ госпитализации, таким образом улучшая функциональное состояние пациента и помогая тому, кто ухаживает за пациентом; и снижая экономические затраты, связанные с циррозом печени и связанной с ним HE.
В Соединенных Штатах существуют ограниченные варианты лечения пациентов с рецидивирующей HE. Неомицина сульфат разрешен лишь для дополнительных лечебных мероприятий при печеночной коме. Общепринятая терапия нацелена на понижение продукции и абсорбции аммиака. Неадсорбируемые дисахариды, например лактулоза или лактитол, обычно используются в качестве терапии первой линии для HE. Существуют данные о том, что неадсорбируемые дисахариды снижают уровни аммиака в плазме посредством изменения метаболизма азота в кишечной флоре и увеличения выведения азота с фекалиями. Активные в GI антибиотики широкого спектра действия, включающие неомицин, метронидазол, ванкомицин и паромомицин, использовались вместе с лактулозой или без нее. Эти антибиотики, как представляется, действует опосредованно посредством ингибирования разложения мочевины деаминирующими бактериями, таким образом уменьшая продукцию аммиака и других потенциальных токсинов. В современных руководствах рекомендуется (не разрешенная FDA) терапия на основе антибиотиков с использованием неомицина или метронидазола в качестве альтернативы лечению неадсорбируемыми дисахаридами.
Часто встречающиеся побочные эффекты терапии с помощью неадсорбируемых дисахаридов (например, лактулозы) включают неприятный вкус, который может ограничить соблюдение указаний врача, схему введения доз, которая связана с ритмами опорожнений кишечника, и побочные эффекты на GI, такие как вздутие, спазмы в брюшном отделе и диарея. При использовании лактулозы была зарегистрирована диарея, которая приводит к дегидратации, значимому последствию для пациентов с HE, поскольку электролитные анормальности могут увеличить тяжесть HE и привести к почечной дисфункции.
Применению системно абсорбируемых антибиотиков, таких как неомицин, для лечения HE препятствует ототоксичность и нефротоксичность, которые связаны с длительным применением. Частота возникновения вызванной применением аминогликозидов нефротоксичности значительно выше у пациентов с прогрессирующим заболеваем печени, чем у пациентов без заболевания печени. Частота вызванной применением аминогликозидов нефротоксичности в общей популяции составляет 3-11%. Leitman сообщил, что нефротоксичность встречается у 73% пациентов с заболеванием печени в сравнении с 34% пациентами без заболевания печени, которым внутривенно вводили аминогликолиды во время госпитализации; а Cabrera сообщил, что повреждение почечных канальцев или функциональная почечная недостаточность отмечалось у 60% подвергнутых лечению аминогликозидами (внутривенному введению во время госпитализации) пациентов с циррозом. Кроме того, высокая степень смертности и постоянное повреждение почек отмечались у пациентов с циррозом, у которых произошло вызванное применением аминогликозидов повреждение почечных канальцев. Поэтому в настоящее время в различных местах считают, что аминогликозиды противопоказаны пациентам с прогрессирующим заболеванием печени.
Рифаксимин является привлекательной терапией для лечения пациентов с HE, поскольку он продемонстрировал эффективность, подходящий профиль безопасности, и из-за недостатков системных аминогликозидов и не абсорбируемых дисахаридов Рифаксимин обладает широким спектром in vitro антибактериальной активности против грамположительных и грамотрицательных бактерий и против аэробных и анаэробных изолятов.
Поскольку рифаксимин плохо абсорбируется после перорального введения, лекарственное средство является селективно активным в желудочно-кишечном тракте. Кроме того, существует низкий риск межлекарственных взаимодействий при использовании рифаксимина. Рифаксимин характеризуется меньшей степенью уничтожения патогенов в фекалиях по сравнению с другими обычно используемыми антибактериальными средствами и вызывает незначительные изменения в кишечной флоре, что говорит о том, что рифаксимин имеет механизм действия, отличный от других обычно используемых лекарственных средств при кишечной бактериальной инфекции, таких как фторхинолоны. Риск развития резистентности к антибиотику является низким во время постоянного лечения рифаксимином по сравнению с другими системными антибиотиками, такими как неомицин, возможно потому, что резистентность опосредуется мутацией в ДНК клетки-хозяина, а не основывается на плазмиде.
При ретроспективном анализе амбулаторных карт и историй болезней установлено, что число и продолжительность госпитализаций вследствие HE, общие затраты на лечение и конечные показатели HE (степень «порхающего» тремора, оценка по Конну) были сильно снижены по сравнению с лечением лактулозой в случае пациентов с HE, которые принимали лактулозу ежедневно в течение 6 месяцев, а затем принимали рифаксимин ежедневно в течение 6 месяце.
Первое исследование было разработано для преодоления недостатков предшествующих исследований, опубликованных в литературе (например, гетерогенных популяций субъектов, небольшого размера популяции, небольших продолжительностей и несоответствующих конечных показателей для психического состояния).
Сначала продолжительность лечения была увеличена до 6 месяцев. Надеялись, что эта большая продолжительность позволит проявиться эпизоду НЕ у большего числа субъектов, чем в случае ограничения исследования ≤6 неделями. Также большая продолжительность лечения давала возможность оценить безопасность рифаксимин в течение длительного срока у субъектов с хроническим циррозом печени и связанной с ним рецидивирующей, имеющей явную клиническую картину, эпизодической HE. В исследовании изучались последствия HE, что касается ухода за пациентом и экономических затрат, посредством оценки госпитализаций вследствие эпизодов HE в качестве ключевого вторичного конечного показателя эффективности.
Для оценки эпизодов HE с явной клинической картиной посредством использования клинически значимых критериев в первом исследовании и во втором исследовании ухудшение психического состояния определяли посредством использования оценки по Конну (критериев Уэст-Хейвена), а тяжесть нервно-мышечных патологий определяли с помощью степени «порхающего» тремора. Оценка по Конну колеблется от степени 0 (отсутствие выявляемых изменений личности) до степени 4 (комы, децеребрационной позы, расширенных зрачков). Оценка по Конну является рекомендованным и широко использованным золотым стандартом для определения степени тяжести ухудшения психического состояния при HE с явной клинической картиной. «Порхающий» тремор является связанным с нервно-мышечной системой симптомом HE с явной клинической картиной, который увеличивается в тяжести с ухудшением функции нервной системы.
В случае первого исследования контрольная группа получала соответствующие таблетки-плацебо параллельно лечениям рифаксимином в активной группе. Второе исследование представляло собой проводящееся в настоящее время, открытое исследование продления лечения для оценки безопасности в течение длительного срока рифаксимина в дозе 550 мг дважды в день на субъектах с рецидивирующей, эпизодической, имеющей явную клиническую картину НЕ в истории болезни. Помимо определений безопасности, в ходе исследования определяли оценки по Конну и степени «порхающего» тремора для определения предохранительного эффекта рифаксимина от обострения HE с явной клинической картиной во время лечения в течение вплоть до приблизительно 1 года у субъектов, которые завершили длившееся вплоть до 6 месяцев лечение рифаксимином, а затем вошли во второе исследование; у субъектов, которые получали плацебо в первом исследовании и перешли на лечение рифаксимином во втором исследовании; и у субъектов с HE в истории болезни, которые вошли во второе исследование в качестве новых субъектов.
Используемая схема введения доз (550 мг дважды в день) основывалась на прошлом клиническом опыте с рифаксимином на пациентах с HE и других популяциях субъектов. В нескольких предшествующих исследованиях рифаксимин был безопасным и эффективным у субъектов с HE в дозе, составляющей 1200 мг в день, с одновременно принимаемой лактулозой или без нее. В 6-месячном исследовании рифаксимина в сравнении с неомицином (14 дней лечения и 14 дней без лечения в месяц), рифаксимин в дозе 1200 мг/день и неомицин (3 г/день) имели соизмеримые эффективности у пациентов с HE. Группа антибиотиков - аминогликозиды противопоказана пациентам с прогрессирующим заболеванием печени из-за риска нефротоксичности.
Конечным показателем эффективности было время до первого эпизода обострения HE с явной клинической картиной во время лечения. Эпизод обострения HE с явной клинической картиной во время лечения определяли как и увеличение оценки по Конну до степени ≥2 (например, с 0 или 1 до ≥2) или достигающее 1 увеличение оценки по Конну и составляющую 1 степень «порхающего» тремора в случае субъектов, которые вошли в исследование с оценкой по Конну =0. Временем до эпизода обострения HE во время лечения был отрезок времени от введения первой дозы исследуемого лекарственного средства до первого эпизода обострения HE с явной клинической картиной во время лечения. Субъектов, которые завершили исследование и не проявили эпизод обострения HE с явной клинической картиной во время лечения, проверяли во время их 6-месячного посещения. С субъектами, которые завершили исследование раньше по причинам, отличным от обострения HE с явной клинической картиной во время лечения, устанавливали связь через 6 месяцев от рандомизации для установления, проявляли ли субъекты эпизод обострения HE с явной клинической или другое последствие (например, состояние смерти); и, если субъект не имел эпизода обострения HE с явной клинической картиной до связи с ним, его проверяли во время установления связи с ним. Следовательно, успешно выполняли полный сбор данных об эпизодах обострения HE с явной клинической картиной вплоть до 6 месяцев после рандомизации. Субъекты в исследовании имели ≥2 эпизодов HE с явной клинической картиной, эквивалентных оценке по Конну ≥2, в пределах 6 месяцев до скрининга (т.е. субъекты имели документально подтвержденную, рецидивирующую HE с явной клинической картиной). В момент оценки на исходном уровне субъекты находились в ремиссии с оценкой по Конну, равной 0 или 1. Эпизод обострения HE во время лечения, определенный выше, представлял собой явное ухудшение функции нервной системы.
Другие конечные показатели эффективности в первом исследовании включали, например:
1) время до первой связанной с HE госпитализации;
2) время до любого увеличения по сравнению с исходным уровнем оценки по Конну (степени психического состояния);
3) время до любого увеличения по сравнению с исходным уровнем степени «порхающего» тремора;
4) среднее изменение по сравнению с исходным уровнем оценок проявления усталости с помощью CLDQ в конце лечения; и
5) среднее изменение по сравнению с исходным уровнем концентрации аммиака в венозной крови в конце лечения.
Здесь представлены результаты первого исследования и второго исследования. Первое исследование было двойным слепым, рандомизированным, плацебо-контролируемым исследованием, в котором оценивались эффективность и безопасность рифаксимина в дозе 550 мг дважды в день по сравнению с плацебо. Субъектов, находящихся в ремиссии доказанной рецидивирующей, имеющей явную клиническую картину, эпизодической НЕ, связанной с хроническим циррозом печени, подвергали рандомизации в день 0 (при посещении 2) в соответствии с соотношением 1:1 для назначения рифаксимина в дозе 550 мг дважды в день или плацебо в течение 6 месяцев. Первичным конечным показателем эффективности было время до обострения HE с явной клинической картиной. Обострение HE с явной клинической картиной во время лечения определяли как увеличение оценки по Конну до степени ≥2 (например, с 0 или 1 до ≥2) или достигающее 1 увеличение оценки по Конну и составляющую 1 степень «порхающего» тремора в случае субъектов, которые вошли в исследование с оценкой по Конну =0. Субъектов исключали из исследования во время эпизода обострения HE с явной клинической картиной. После участия в первом исследовании субъекты могли участвовать в открытом исследовании продления лечения (втором исследовании).
Всего 299 субъектов были подвергнуты рандомизации для получения рифаксимина (140 субъектов) или плацебо (159 субъектов). Все подвергнутые рандомизации пациенты получили по крайней мере 1 дозу исследуемого лекарственного средства. Всего 251 (84%) (116 [подвергнутых лечению рифаксимином], 135 [подвергнутых лечению плацебо]) субъектов завершили исследование, как указано в протоколе (например, прошли лечение в течение 6 месяцев или были исключены из исследования во время обострения HE с явной клинической картиной).
Субъекты в исследовании имели ≥2 эпизодов HE с явной клинической картиной, эквивалентных оценке по Конну ≥2, в пределах 6 месяцев до скрининга (например, субъекты имели рецидивирующую HE с явной клинической картиной). В момент оценки на исходном уровне субъекты находились в ремиссии с оценкой по Конну, равной 0 или 1. Эпизод обострения во время лечения HE с явной клинической картиной представлял собой явное ухудшение функции нервной системы. Эпизоды обострения HE с явной клинической картиной во время лечения проявили 31 из 140 субъектов в подвергнутой лечению рифаксимином группе и 73 из 159 субъектов в подвергнутой лечению плацебо группе во время 6-месячного периода лечения (вплоть до дня 170). Сравнения оценок по методу Каплана-Мейера времени до обострения НЕ с явной клинической картиной между группами показало предохранительный эффект рифаксимина (p<0,0001). Эти данные показывают, что лечение рифаксимином приводило к снижению на 57,9% по сравнению с плацебо, риска проявления обострения HE с явной клинической картиной во время лечения. Лечение рифаксимином приводит к меньшему числу эпизодов HE с явной клинической картиной, которые иначе могут сделать пациента нетрудоспособным, может уменьшить бремя на членов семьи, которые вынуждены ухаживать за пациентом, и уменьшает расходы на госпитализацию в этой популяции пациентов и бремя на систему здравоохранения.
Установлено, что следующие прогностические факторы являются прогностическими факторами эпизодов обострения HE с явной клинической картиной во время лечения: возраст на исходном уровне (p=0,0160), оценка в MELD (p=0,0003), продолжительность подтвержденной ремиссии в настоящий момент (p=0,1089) и число предшествующих эпизодов HE (p=0,0022). Эти данные показывают, что лечение рифаксимином приводило к снижению на 60% по сравнению с плацебо, риска проявления эпизода обострения HE с явной клинической картиной в ходе этого исследования (p<0,0001).
Время до первой связанной с HE госпитализации и частоты связанных с HE госпитализаций и госпитализаций по всем причинам
Связанные с печеночной энцефалопатией госпитализации (госпитализация, являющаяся непосредственным следствием HE, или госпитализация, осложненная HE) были зарегистрированы в случае 19 из 140 субъектов и 36 из 159 субъектов в подвергнутых лечению рифаксимином и плацебо группах, соответственно. Рифаксимин оказывал предохранительный эффект от связанной с HE госпитализации во время 6-месячного периода лечения. В случае субъектов в подвергнутой лечению рифаксимином группе отмечалось снижение на 50% риска госпитализации вследствие HE во время 6-месячного периода лечения по сравнению с подвергнутой лечению плацебо группой. Коэффициент связанной с HE госпитализации составлял 0,38 случаев/PEY в случае подвергнутой лечению рифаксимином группы в сравнении с 0,78 случаев/PEY в случае подвергнутой лечению плацебо группы.
Госпитализации, вызванные печеночной энцефалопатией (только госпитализации, являющиеся непосредственным следствием HE), были зарегистрированы в случае 15 из 140 субъектов и 33 из 159 субъектов в подвергнутых лечению рифаксимином и плацебо группах соответственно. Рифаксимин оказывал предохранительный эффект от вызванной HE госпитализации во время 6-месячного периода лечения; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,438 (95% доверительный интервал: 0,238-0,807) (p=0,0064) для риска вызванной HE госпитализации. В случае субъектов в подвергнутой лечению рифаксимином группе отмечалось снижение на 56% риска госпитализации вследствие HE во время 6-месячного периода лечения по сравнению с подвергнутой лечению плацебо группой. Коэффициент вызванной HE госпитализации составлял 0,30 случаев/PEY в случае подвергнутой лечению рифаксимином группы в сравнении с 0,72 случаев/PEY в случае подвергнутой лечению плацебо группы.
Частота госпитализации по всем причинам была также ниже в подвергнутой лечению рифаксимином группе (46 из 140), чем в подвергнутой лечению плацебо группы (60 из 159) (снижение на 30% в подвергнутой лечению рифаксимином группе по сравнению с подвергнутой лечению плацебо группой). Коэффициент госпитализации по всем причинам, после приведения к подверганию субъектов воздействию, составлял 0,90 случаев/PEY в подвергнутой лечению рифаксимином группе и 1,26 случаев/PEY в подвергнутой лечению плацебо группе. Коэффициент связанной с HE госпитализации составлял 0,38 случаев/PEY в случае подвергнутой лечению рифаксимином группы и 0,78 случаев/PEY в случае подвергнутой лечению плацебо группы. Лечение рифаксимином предохраняет от связанной с HE госпитализации, таким образом улучшая качество жизни пациента и того, кто ухаживает за пациентом, и снижая экономические затраты, связанные с циррозом печени и связанной с ним HE.
Время до любого увеличения по сравнению с исходным уровнем оценки по Конну и время до любого увеличения по сравнению с исходным уровнем степени «порхающего» тремора
Предохранительные эффекты рифаксимина отмечались в отношении обоих этих конечных показателей при независимом анализе; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,463 (95% доверительный интервал: 0,312-0,685) (p<0,0001) для риска проявления увеличения оценки по Конну и 0,646 (95% доверительный интервал: 0,414-1,008) (p=0,0523) для риска увеличения степени «порхающего» тремора во время 6-месячного периода лечения.
Изменение по сравнению с исходным уровнем уровней аммиака в венозной крови в конце исследования
У субъектов в подвергнутой лечению рифаксимином группе отмечались большие снижения уровней аммиака в венозной крови, чем у подвергнутых лечению плацебо субъектов (p=0,0391).
Установлено, что существует высокая степень корреляции между уровнями аммиака в венозной крови, количественной оценкой, которая связана с эффектами на CNS, лежащими в основе HE с явной клинической картиной, и возникновением обострения HE с явной клинической картиной, определяемого с помощью клинической оценки по Конну (или комбинации из оценки по Конну и степени «порхающего» тремора).
Слежение за оценками по Конну и степенями «порхающего» тремора: изменения по сравнению с исходным уровнем оценок по Конну и степеней «порхающего» тремора
Отмечался благоприятный эффект лечения рифаксимином по сравнению с плацебо в отношении долей субъектов, у которых отмечались изменения, составляющие -1 (улучшение) или 0 (отсутствие изменения); или 1, 2 или 3 (ухудшение), оценки по Конну по сравнению с исходным уровнем в конце лечения (последней из оценок на последующих уровнях или оценки во время обострения HE). В подвергнутой лечению рифаксимином группе по сравнению с подвергнутой лечению плацебо группой, большие доли субъектов проявляли изменения оценок по Конну, составляющие -1, или не проявляли изменений (77,1% в сравнении с 53,9%), и меньшие доли субъектов имели изменения оценок по Конну, составляющие 1, 2, 3 или 4. Таким образом, лечение рифаксимином было эффективнее лечения плацебо в предотвращении ухудшения оценки по Конну (в 2,46 раз в сравнении с плацебо, p≤0,0001).
В случае изменений по сравнению с исходным уровне в конце лечения степени «порхающего» тремора, значительно большие доли субъектов в подвергнутой лечению рифаксимином группе в сравнении с подвергнутой лечению плацебо группой имели изменения по сравнению с исходным уровнем степеней «порхающего» тремора, составляющие -2, -1 и 0 (88,5% в сравнении с 77,0%), и значительно меньшие доли субъектов имели изменения, составляющие 1, 2, 3 или 4 (11,6% в сравнении с 23,2%). Таким образом, лечение рифаксимином было эффективнее лечения плацебо в предотвращении ухудшения степени «порхающего» тремора (в 1,92 раз в сравнении с плацебо, p=0,0262).
Изменения по сравнению с исходным уровнем результатов для CFF
Увеличения результатов CFF отражают улучшение функции нервной системы у пациентов с HE. Субъекты в подвергнутой лечению рифаксимином группе имели значительно большие увеличения результатов CFF по сравнению с исходным уровнем в конце лечения, чем субъекты в подвергнутой лечению плацебо группе. Средние изменения (± среднеквадратическое отклонение [SD]) результатов CFF составляли 0,945 (± 4,75) в подвергнутой лечению рифаксимином группе в сравнении с 0,355 (± 4,70) в подвергнутой лечению плацебо группе (p=0,0320 для различия между группами). Было установлено, что подобно уровням аммиака в венозной крови, CFF является высокопрогностическим фактором обострения HE.
Средняя продолжительность подвергания воздействию исследуемого лекарственного средства составляла 168 дней (диапазон: 10-178) в подвергнутой лечению рифаксимином группе и 110 дней (диапазон: 6-176) в подвергнутой лечению плацебо группе. Всего 64 субъекта (33 [в подвергнутой лечению рифаксимином группе] и 31 [в подвергнутой лечению плацебо группе]) получили лечение в течение 141-168 дней и 98 субъектов (57 [в подвергнутой лечению рифаксимином группе] и 41 [в подвергнутой лечению плацебо группе]) получили лечение в течение >168 дней. Связанные с продолжительностью подвергания воздействию результаты не противоречат данным, что меньшие доли субъектов в подвергнутой лечению рифаксимином группе, чем в подвергнутой лечению плацебо группе, проявляли обострение HE с явной клинической картиной, являющееся причиной прекращения исследовании (согласно протоколу субъекты исключались из исследования после обострения HE с явной клинической картиной).
Доли субъектов, которые имели являющиеся результатом лечения (ТЕ) неблагоприятные реакции (AE) (ТЕАЕ), тяжелые TEAE, связанные с лекарственным средством TEAE, являющиеся результатом лечения SAE, TEAE, приводящие к прекращению лечения, и субъектов, которые умерли, были схожими между подвергнутыми лечению рифаксимином и плацебо группами. Всего 79,9% субъектов (239 из 299) проявили TEAE в ходе исследования. Самыми часто встречающимися TEAE (например, у ≥10% от всех субъектов [объединенных групп: рифаксимин плюс плацебо]), проявляемыми субъектами, были следующие: диарея (10,7% [рифаксимин] в сравнении с 13,2% [плацебо]), тошнота (14,3% в сравнении с 13,2%), периферический отек (15% в сравнении с 8,2%), усталость (12,1% в сравнении с 11,3%), головокружение (12,9% в сравнении с 8,2%), асцит (11,4% в сравнении с 9,4%) и головная боль (10% в сравнении с 10,7%).
Второе исследование представляет собой проводящееся в настоящее время, открытое исследование продления лечения, в котором оценивается безопасность в течение длительного срока рифаксимина в дозе 550 мг дважды в день на субъектах с рецидивирующей, имеющей явную клиническую картину, эпизодической НЕ в истории болезни. Все подходящие субъекты имели в истории болезни эпизоды HE с явной клинической картиной с подтвержденной документально тяжестью, эквивалентной оценке по Конну ≥2, в пределах 12 месяцев до скрининга (требовалось ≥1 квалификационного эпизода), оценку по Конну ≤2 при оценке на исходном уровне, и они либо участвовали в первом исследовании, либо были новыми субъектами. В отличие от первого исследования не требовалось исключение субъектов из исследования после проявления эпизода обострения HE с явной клинической картиной во время лечения.
Всего 267 субъектов было включено в исследование, и 208 были активными во время промежуточной клинической отсечки. Собирались дополнительные данные для предварительного отчета вплоть до времени замораживания базы данных.
В ходе исследования определяли оценки по Конну и степени «порхающего» тремора. Поэтому было возможным определение времени до эпизода обострения HE с явной клинической картиной для субъектов, которые завершили 6-месячное лечение рифаксимином, а затем вошли во второе исследование, субъектов, которые получали плацебо в первом исследовании, а затем начали получать рифаксимин во втором исследовании, и для новых субъектов, которые начали лечение рифаксимином во втором исследовании. В случае субъектов, принимавших рифаксимин в течение вплоть до 680 дней (1,9 лет), эпизоды обострения HE с явной клинической картиной проявились у всего 72 из 266 субъектов (27,1%): 54 из 196 субъектов (27,6%) в группе начала лечения рифаксимином и 18 из 70 субъектов (25,7%) в группе продолжения лечения рифаксимином.
Профили времени до первого обострения HE были схожими между группой лечения рифаксимином в первом исследовании и группой начала лечения во втором исследовании. Был отмечен длительный предохранительный эффект рифаксимина у субъектов, которые начали получать рифаксимин в первом исследовании и продолжили его получение во втором исследовании (средние продолжительности подвергания воздействию рифаксимина составляли 168 дней в первом исследовании и 253 дней во втором исследовании).
Всего 133 из 266 субъектов было госпитализировано по какой-либо причине: 98 в группе начала лечения рифаксимином и 35 в группе продолжения лечения рифаксимином. После приведения к продолжительности подвергания субъектов воздействию это является коэффициентом госпитализации, составляющим 0,60 случаев/PEY. Всего 59 было госпитализировано вследствие эпизодов HE (например, вызванных HE). После приведения к продолжительности подвергания субъектов воздействию это является коэффициентом вызванной НЕ госпитализации, составляющим 0,29 случаев/PEY. Низким коэффициентом вызванной НЕ госпитализации был согласующимся между лечением рифаксимином во втором исследовании (0,29 случаев/PEY) и таковым в первом исследовании (0,30 случаев/PEY) по крайней мере отчасти в результате сохранения ремиссии доказанной HE у субъектов с конечной стадией заболевания печени. Слежение за оценками по Конну и степенями «порхающего» тремора: применение рифаксимина вплоть до 18 месяцев, как правило, не изменяло или улучшало по сравнению с исходным уровнем оценки по Конну и степени «порхающего» тремора. При последнем посещении 70,7% субъектов (188 из 266 субъектов) не имели изменений, и 20.3% (54 из 266) имели улучшения оценок по Конну по сравнению с исходным уровнем, что означает, что психическое состояние не изменялось или улучшалось у большей части субъектов (91%) в течение периода лечения. Из 84 субъектов (70 субъектов группы начала лечения рифаксимином и 14 субъектов группы продолжения лечения рифаксимином), которые вошли в исследование с оценками по Конну, составляющими 1, 2 или 3 (например, тех субъектов, в случае которых выявляемое улучшение было возможным), 54 субъекта (54/84=64,3%) продемонстрировали составляющее 1-степень (47 субъектов; 56,0%) или 2-степени (7 субъектов; 8,3%) улучшение по сравнению с исходным уровнем при последнем посещении, зарегистрированное для предварительного анализа. Все субъекты были способны к ухудшению со временем, и у 24/266 субъектов (9,0%) отмечалось ухудшение на 1 или 2 степени.
Применение рифаксимина вплоть до 18 месяцев, как правило, не изменяло или улучшало степени «порхающего» тремора, подобно оценкам по Конну. При последнем посещении 77,1% субъектов (205 из 266 субъектов) не имели изменений, и 16,2% (43 из 266) имели улучшения степеней «порхающего» тремора по сравнению с исходным уровнем, что означает, что связанные с нервно-мышечной системой симптомы, ассоциируемые с увеличением неврологической патологии, не изменялись у 83,3% субъектов в течение периода лечения. Из 67 субъектов (55 субъектов группы начала лечения рифаксимином и 12 субъектов группы продления лечения рифаксимином), которые вошли в исследование со степенями «порхающего» тремора =1, 2 или 3 (например, тех субъектов, в случае которых улучшение было возможным), 43 субъекта (43/67=64,2%) продемонстрировали составляющее 1 степень (34 субъектов; 50,7%), 2 степени (4 субъектов; 6,0%) или 3 степени (5 субъектов; 7,5%) улучшение по сравнению с исходным уровнем при последнем посещении, зарегистрированное для предварительного анализа. Все субъекты были способны к ухудшению со временем, и у 18/266 субъектов (6,8%) отмечалось ухудшение на 1, 2 или 4 степени; частоты ухудшения степеней «порхающего» тремора были схожими между группой начала лечения рифаксимином (12/196 субъектов; 6,1%) и группой продолжения лечения рифаксимином (6/70 субъектов; 8,6%).
Средние продолжительности подвергания воздействию лекарственного средства во втором исследовании составляли 253 дней (диапазон: 7-680) в группе начала лечения рифаксимином (субъектов, которые получали плацебо в первом исследовании, или субъектов, которые не участвовали в первом исследовании), 265,5 дней (диапазон: 10-673) в группе продолжения лечения рифаксимином (субъектов, которые получали рифаксимин в первом исследовании и во втором исследовании) и 255 дней (диапазон: 7-680) в группе всех подвергнутых лечению рифаксимином субъектов (всех субъектов, которые получали рифаксимин во втором исследовании). Во время этого предварительного анализа большинство субъектов получали рифаксимин в течение от 6 до <9 месяцев (21,4%) и от 9 до <12 месяцев (32,3%).
Во время этого предварительного анализа были зарегистрированы TEAE у 230 субъектов (86,5%). Самыми часто встречающими TEAE (например, у ≥10% от всех субъектов), проявляемыми субъектами, были следующие: периферический отек (15,8%); инфекция мочевых путей (12,8%) и тошнота (12,8%); и боль в животе (10,5%) и асцит (10,5%). Обратите внимание, что связанные с НЕ признаки и симптомы не считались AE кроме случаев, когда они соответствовали определению SAE, а значит число субъектов с HE, учтенных в анализе эффективности (72 субъектов; 27,1%), превышает число субъектов с HE, учтенных в анализах безопасности (57 субъектов; 21,4%).
Интенсивность большей части TEAE была слабой или средней, при этом 40,2% субъектов проявили по крайней мере 1 TEAE, которая по оценке исследователя была тяжелой. Частоты TEAE, которые, как считалось, являются связанными с исследуемым лекарственным средством, были соизмеримыми между группой начала лечения рифаксимином (7,7%) и группой продолжения лечения рифаксимином (7,1%). 47,4% субъектов проявили являющиеся результатом лечения SAE.
На фиг.1 проиллюстрированы оценки по методу Каплана-Мейера времени до первого эпизода обострения HE с явной клинической картиной в соответствии с группой лечения в сформированной в соответствии с назначенным лечением (ITT) популяции. В таблице 18 представлены оценки по методу Каплана-Мейера долей субъектов, которые проявили обострение HE с явной клинической картиной в течение периода лечения, и результаты статистических анализов. Субъектов, которые завершили исследование и не проявили эпизод обострения HE с явной клинической картиной, проверяли во время их 6-месячного посещения. С субъектами, которые завершили исследование раньше по причинам, отличным от обострения HE с явной клинической картиной во время лечения (например, пересадки печени, АЕ, требования субъекта), устанавливали связь через 6 месяцев от даты рандомизации для установления, проявляли ли субъекты эпизод обострения HE с явной клинической картиной или другое последствие (например, состояние смерти). Субъектов без обострения HE с явной клинической картиной проверяли во время установления связи с ними или смерти в то время, которое наступало раньше. Следовательно, успешно выполняли полный сбор данных об эпизодах обострения HE с явной клинической картиной вплоть до 6 месяцев.
Первое исследование: оценки по методу Каплана-Мейера и статистические анализы времени до первого обострения HE с явной клинической картиной (вплоть до 6 месяцев лечения, день 170) (в случае ITT популяции)
непроявления обострения НЕ с явной клинической картинойd
непроявления обострения НЕ с явной клинической картинойd
95% доверительный интервал: (0,276, 0,641)
a Число субъектов, подверженных риску в промежутке времени лечения, ожидаемое в соответствии со способом с использованием таблицы выживания. Исходя из того, что проверенные пациенты были подвержены риску в течение половины промежутка времени, лишь их половина учитывалась при выражении в цифрах числа субъектов, подверженных риску.
b Число эпизодов, возникающих в промежутке времени лечения.
c Оценка вероятности проявления обострения НЕ с явной клинической картиной в промежутке времени лечения. Среднеквадратическая ошибка (SE), установленная по формуле Greenwood.
d Оценка вероятности непроявления обострения НЕ с явной клинической картиной до по крайней мере начала следующего промежутка времени лечения.
e Оценка отношения рисков (риск обострения HE с явной клинической картиной в подвергнутой лечению рифаксимином группе по сравнению с таковым в подвергнутой лечению плацебо группе), установленная в соответствии с моделью пропорциональных рисков Кокса. P-значение, основанное на статистике вкладов.
Эпизоды обострения HE с явной клинической картиной во время лечения проявляли 31 из 140 субъектов в подвергнутой лечению рифаксимином группе и 73 из 159 субъектов в подвергнутой лечению плацебо группе во время 6-месячного периода после рандомизации (вплоть до дня 170). Сравнение оценок по методу Каплана-Мейера времени до обострения HE с явной клинической картиной между группами показало предохранительный эффект рифаксимина (p<0,0001). Эти данные указывают на то, что лечение рифаксимином приводило к снижению на 57,9% по сравнению с плацебо, риска проявления обострения НЕ с явной клинической картиной в ходе этого исследования. Лечение рифаксимином приводит к меньшему числу эпизодов HE с явной клинической картиной, которые иначе могут сделать пациента нетрудоспособным, может уменьшить бремя на членов семьи, которые вынуждены ухаживать за пациентом, и уменьшает расходы на госпитализацию в этой популяции пациентов и бремя на систему здравоохранения.
Для изучения возможного эффекта прогностических факторов на проявление эпизода обострения HE с явной клинической картиной во время лечения были изучены следующие прогностические факторы:
- Пол (мужской пол в сравнении с женским полом)
- Возраст
- Раса (европеоидная раса в сравнении с не европеоидной)
- Район изучения (Северная Америка в сравнении с Россией)
- Оценка в MELD
- Оценка по Конну (0 в сравнении с 1)
- Диабет на исходном уровне (наличие в сравнении с отсутствием)
- Продолжительность подтвержденной ремиссии в настоящий момент и
- Число эпизодов HE в пределах последних 6 месяцев до рандомизации.
Сильными независимыми прогностическими факторами эпизодов обострения HE с явной клинической картиной во время лечения были возраст на исходном уровне (p=0,0160), оценка в MELD (p=0,0003), продолжительность подтвержденной ремиссии в настоящий момент (p=0,1089) и число предшествующих эпизодов HE (p=0,0022).
Эти данные показывают, что лечение рифаксимином после приведения в соответствие со значимыми прогностическими факторами приводило к снижению на 60% по сравнению с плацебо, риска проявления эпизода обострения HE с явной клинической картиной в ходе этого исследования. Самыми важными прогностическими факторами были возраст (p=0,0315) и оценка в MELD на исходном уровне (p=0,0003).
Результаты указывают на то, что высокозначимый предохранительный эффект рифаксимина (p<0,0001) от эпизодов обострения HE с явной клинической картиной сохранялся в присутствии статистически значимых конкурирующих факторов.
Во втором исследовании средние продолжительности подвергания воздействию лекарственного средства составляли 253 дней (диапазон: 7-680) в группе начала лечения рифаксимином (субъектов, которые получали плацебо в первом исследовании, или субъектов, которые не участвовали в первом исследовании), 265,5 дней (диапазон: 10-673) в группе продолжения лечения рифаксимином (субъектов, которые получали рифаксимин в первом исследовании и во втором исследовании) и 255 дней (диапазон: 7-680) в группе всех подвергнутых лечению рифаксимином субъектов (всех субъектов, которые получали рифаксимин во втором исследовании).
В случае субъектов, принимавших рифаксимин в течение вплоть до 680 дней (1,9 лет), эпизоды обострения HE с явной клинической картиной проявились у всего 72 из 266 субъектов (27,1%): 54 из 196 субъектов (27,6%) в группе начала лечения рифаксимином и 18 из 70 субъектов (25.7%) в группе продолжения лечения рифаксимином. На фиг.2 сравниваются субъекты, которые принимали участие в двойном слепом рандомизированном первом исследовании с новыми подвергнутыми лечению рифаксимином субъектами в длительном открытом исследовании, втором исследовании.
Оценки по методу Каплана-Мейера времени до первого эпизода обострения HE с явной клинической картиной были схожими между субъектами подвергнутой лечению рифаксимином группы в первом исследовании и новыми подвергнутыми лечению рифаксимином субъектами во втором исследовании. Также схожие доли субъектов имели обострение HE с явной клинической картиной в подвергнутой лечению рифаксимином группе первого исследования (22%, 31 из 140 [группа лечения рифаксимином]) и в новой подвергнутой лечению рифаксимином группе второго исследования (27,6%, 54 из 196). После приведения в соответствии с продолжительностью подвергания воздействию коэффициенты эпизодов обострения HE составляли 0,62 случаев/PEY в подвергнутой лечению рифаксимином группе первого исследования по сравнению с 0,38 случаев/PEY для новых подвергнутых лечению рифаксимином субъектов во втором исследовании. Эти данные показывают, что предохранительный эффект от обострения HE с явной клинической картиной у субъектов, которые получали рифаксимином, был согласующимся между 2 исследованиями.
Примечание к фиг.7, оценка распределения выживания по y-оси представляет собой долю субъектов без обострения HE с явной клинической картиной во время лечения.
Данные первого исследования, относящиеся ко времени до первого эпизода обострения HE с явной клинической картиной во время лечения, представлены для подвергнутой лечению рифаксимином группы (мелкими штрихами) и подвергнутой лечению плацебо группы (прямой линией). Данные второго исследования, относящиеся ко времени до первого эпизода обострения HE с явной клинической картиной в новой подвергнутой лечению рифаксимином группе, представлены крупными штрихами.
На фиг.8 представлены результаты слежения за субъектами, подвергнутыми лечению плацебо в первом исследовании, после того, как они перешли на лечение рифаксимином во втором исследовании. Обострение HE с явной клинической картиной проявили 15 из 82 субъектов во время лечения рифаксиминои в сравнении с 39 из 82 субъектов во время лечения плацебо. Поразительный предохранительный эффект рифаксимина был отмечен при сравнении оценок по методу Каплана-Мейера времени до первого обострения HE с явной клинической картиной между лечением плацебо в первом исследовании и лечением рифаксимином во втором исследовании. Отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе - составляло 0,302 (95% доверительный интервал: 0,166-0,549, p<0,0001 для различия между группами в относительном риске). Это результат отражает снижением на 70% риска проявления обострения HE с явной клинической картиной во время лечения рифаксимином во втором исследовании по сравнению с предшествующим лечением плацебо в первом исследовании.
Примечание к фиг.8, оценка распределения выживания по y-оси представляет собой долю субъектов без обострения HE с явной клинической картиной во время лечения. Данные первого исследования, относящиеся ко времени до первого эпизода обострения HE с явной клинической картиной, представлены на левой панели для подвергнутой лечению плацебо группы. На правой панели представлено время до первого обострения HE с явной клинической картиной во втором исследовании среди субъектов, подвергнутых лечению плацебо в первом исследовании (n=82), которые перешли на лечение рифаксимином во втором исследовании. Вертикальная линия между левой и правой панелями служит отметкой конца двойного слепого исследования и начала открытого исследования.
На фиг.9 продемонстрировано время до первой связанной с госпитализации (например, госпитализации, являющейся непосредственным следствием HE, или госпитализации, вызванной HE) в соответствии с группой лечения в ITT популяции в первом исследовании. В таблице 19 представлены оценки долей субъектов, подвергшихся первой связанной с HE госпитализации во время периода лечения, и результаты статистических анализов. Субъектов, которые были исключены из исследования до госпитализации вследствие HE и до завершения 6-месячного периода лечения, проверяли во время исключения. Связанные с печеночной энцефалопатией госпитализации были зарегистрированы в случае 19 из 140 субъектов и 36 из 159 субъектов в подвергнутых лечению рифаксимином и плацебо группах, соответственно. Рифаксимин оказывал предохранительный эффект от связанной с HE госпитализации во время 6-месячного периода лечения; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,500 (95% доверительный интервал: 0,287-0,873, p=0,0129) для риска связанной с НЕ госпитализации. Это отношение рисков отражает снижением на 50% риска по сравнению с плацебо, риска госпитализации вследствие HE во время 6-месячного периода лечения. В соответствии с этими результатами, коэффициент связанной с HE госпитализации был на 51% ниже (0,38 случаев/PEY в случае подвергнутой лечению рифаксимином группы в сравнении с 0,78 случаев/PEY в случае подвергнутой лечению плацебо группы) в подвергнутой лечению рифаксимином группе в первом исследовании, после приведения к продолжительности подвергания воздействию.
Примечание к фиг.9, оценка распределения выживания по y-оси представляет собой долю субъектов без связанной с НЕ госпитализации. Пунктирная линия отражает подвергнутую лечению рифаксимином группу, а сплошная линия отражает подвергнутую лечению плацебо группу. Не закрашенные кружки и не закрашенные треугольники отражают проверенных субъектов. Субъектов, которые были исключены из исследования до госпитализации вследствие HE и до завершения 6-месячного периода лечения, проверяли во время исключения. Запись о связанной с печеночной энцефалопатией госпитализации делали в CRF (регистрационной карте пациента) при госпитализации, связанной с НЕ.
Первое исследование: оценки по методу Каплана-Мейера и статистические анализы времени до первой связанной с HE госпитализации (вплоть до 6 месяцев лечения, день 170) (в случае ITT популяции)
a Число субъектов, подверженных риску в промежутке времени лечения, ожидаемое в соответствии со способом с использованием таблицы выживания. Исходя из того, что проверенные пациенты были подвержены риску в течение половины промежутка времени, лишь их половина учитывалась при выражении в
b Число случаев, возникающих в промежутке времени лечения.
c Оценка вероятности случая связанной с НЕ госпитализации в промежутке времени лечения. Среднеквадратическая ошибка (SE), установленная по формуле Greenwood.
d Оценка вероятности отсутствия связанной с НЕ госпитализации до по крайней мере начала следующего промежутка времени лечения.
e Оценка отношения рисков (риск связанной с HE госпитализации в подвергнутой лечению рифаксимином группе по сравнению с таковым в подвергнутой лечению плацебо группе), установленная в соответствии с моделью пропорциональных рисков Кокса. P-значение, основанное на статистике вкладов.
Был также определен эффект лечения рифаксимином на вызванные НЕ госпитализации (например, только госпитализации, являющиеся непосредственным следствием HE). На фиг.5 отражено время до первой вызванной HE госпитализации в соответствии с группой лечения в первом исследовании.
Госпитализации, вызванные печеночной энцефалопатией, были зарегистрированы в случае 15 из 140 субъектов и 33 из 159 субъектов в подвергнутых лечению рифаксимином и плацебо группах, соответственно. Рифаксимин оказывал предохранительный эффект от вызванной HE госпитализации во время 6-месячного периода лечения; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,438 (95% доверительный интервал: 0,238-0,807, p=0,0064) для риска вызванной HE госпитализации. В случае субъектов в подвергнутой лечению рифаксимином группе отмечалось снижением на 56% риска госпитализации вследствие HE во время 6-месячного периода лечения по сравнению с плацебо. Коэффициент вызванной HE госпитализации составлял 0,30 случаев/PEY в случае подвергнутой лечению рифаксимином группы в сравнении с 0,72 случаев/PEY в случае подвергнутой лечению плацебо группы.
Примечание к фиг.10, оценка распределения выживания по y-оси представляет собой долю субъектов без госпитализаций, вызванных НЕ. Пунктирная линия отражает подвергнутую лечению рифаксимином группу, а сплошная линия отражает подвергнутую лечению плацебо группу. Не закрашенные кружки и не закрашенные треугольники отражают проверенных субъектов. Субъектов, которые были исключены из исследования до госпитализации, проверяли во время исключения.
Был также определен эффект лечения рифаксимином на госпитализации по всем причинам. В двойном слепом первом исследовании 46 из 40 подвергнутых лечению рифаксимином субъектов и 60 из 159 подвергнутых лечению плацебо были госпитализированы вследствие какой-либо SAE. Риск госпитализации по всем причинам был снижен на 30% в подвергнутой лечению рифаксимином группе по сравнению с подвергнутой лечению плацебо группой (p=0,0793 для различия между группами в относительном риске). Коэффициент госпитализации по всем причинам составлял 0,92 случаев/PEY в подвергнутой лечению рифаксимином группе в сравнении с 1,31 случаев/PEY в подвергнутой лечению плацебо группе. Эти данные свидетельствовали о том, что лечение рифаксимином снижало расходы на связанную с НЕ/вызванную НЕ госпитализацию по сравнению с лечением плацебо в первом исследовании. Также низкий коэффициент связанной с HE/вызванной HE госпитализации раз за разом отмечался во время лечения рифаксимином в первом исследовании (0,38 случаев/PEY) и во втором исследовании (0,29 случаев/PEY), по крайней мере отчасти в результате сохранения ремиссии доказанной HE у субъектов с конечной стадией заболевания печени.
На фиг.11 продемонстрировано время до любого увеличения по сравнению с исходным уровнем оценки по Конну в соответствии с группой лечения в сформированной в соответствии с назначенным лечением (ITT) популяции. В таблице 20 представлены оценки долей субъектов, которые имели какое-либо увеличение оценки по Конну во время периода лечения, и результаты статистических анализов. Субъектов, которые были исключены из исследования до проявления увеличения оценки по Конну и до завершения 6-месячного периода лечения, проверяли во время исключения. Посредством определения времени до любого увеличения по сравнению с исходным уровнем оценки по Конну можно было сравнить ухудшение в самое ближайшее время в психическом состоянии между субъектами в подвергнутых лечению рифаксимином и плацебо группах, даже если ухудшение не дотягивается до установления обострения HE (например, увеличения оценки по Конну с 0 до 1). Увеличения оценки по Конну были зарегистрированы в случае 37 из 140 субъектов и 77 из 159 субъектов в подвергнутых лечению рифаксимином и плацебо группах, соответственно. Отмечался высокозначимый предохранительный эффект рифаксимина; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,463 (95% доверительный интервал: 0,312-0,685, p=0,0001) для риска проявления увеличения оценки по Конну (например, ухудшения психического состояния) во время 6-месячного периода лечения.
Первое исследование: оценки по методу Каплана-Мейера и статистические анализы времени до первого увеличения оценки по Конну (вплоть до 6 месяцев лечения, день 170) (в случае ITT популяции)
a Число субъектов, подверженных риску в промежутке времени лечения, ожидаемое в соответствии со способом с использованием таблицы выживания.
b Число случаев, возникающих в промежутке времени лечения. Исходя из того, что проверенные пациенты
c Оценка по методу Каплана-Мейера вероятности проявления увеличения оценки по Конну в промежутке времени лечения. Среднеквадратическая ошибка (SE), установленная по формуле Greenwood.
d Оценка вероятности отсутствия увеличения оценки по Конну до по крайней мере начала следующего промежутка времени лечения.
e Оценка отношения рисков (риск появления увеличения оценки по Конну в подвергнутой лечению рифаксимином группе по сравнению с таковым в подвергнутой лечению плацебо группе), установленная в соответствии с моделью пропорциональных рисков Кокса. P-значение, основанное на статистике вкладов.
На фиг.12 продемонстрировано время до любого увеличения по сравнению с исходным уровнем степени «порхающего» тремора в соответствии с группой лечения в ITT популяции. В таблице 21 представлены оценки долей субъектов, которые имели какое-либо увеличение степени «порхающего» тремора во время периода лечения, и результаты статистических анализов. Субъектов, которые были исключены из исследования до проявления увеличения степени «порхающего» тремора и до завершения 6-месячного периода лечения, проверяли во время исключения.
Посредством определения времени до любого увеличения по сравнению с исходным уровнем степени «порхающего» тремора можно было сравнить ухудшение в самое ближайшее время в функционировании нервно-мышечной системы между субъектами в подвергнутых лечению рифаксимином и плацебо группах. Увеличения степени «порхающего» тремора были зарегистрированы в случае 32 из 140 субъектов и 50 из 159 субъектов в подвергнутых лечению рифаксимином и плацебо группах, соответственно. Отмечался предохранительный эффект рифаксимина от увеличения степени «порхающего» тремора (например, ухудшения в функционировании нервно-мышечной системы), который продемонстрировал тенденцию к статистической значимости; отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,646 (95% доверительный интервал: 0,414-1,008, p=0,0523) для риска проявления увеличения степени «порхающего» тремора во время 6-месячного периода лечения.
Первое исследование: оценки по методу Каплана-Мейера и статистические анализы времени до первого увеличения степени «порхающего» тремора (вплоть до 6 месяцев лечения, день 170) (в случае ITT популяции)
a Число субъектов, подверженных риску в промежутке времени лечения, ожидаемое в соответствии со
b Число случаев, возникающих в промежутке времени лечения.
c Оценка вероятности проявления увеличения степени «порхающего» тремора в промежутке времени лечения. Среднеквадратическая ошибка (SE), установленная по формуле Greenwood.
d Оценка вероятности отсутствия увеличения степени «порхающего» тремора до по крайней мере начала следующего промежутка времени лечения.
e Оценка отношения рисков (риск появления увеличения степени «порхающего» тремора в подвергнутой лечению рифаксимином группе по сравнению с таковым в подвергнутой лечению плацебо группе), установленная в соответствии с моделью пропорциональных рисков Кокса. P-значение, основанное на статистике вкладов.
Субъекты устанавливали уровень своей усталости посредством использования 7-пунктной шкалы от наихудшего ответа (1, высокая степень усталости) до наилучшего ответа (7, незначительная усталость). Были отмечены незначительные различия между подвергнутыми лечению плацебо и рифаксимином группами в изменениях по сравнению с исходным уровнем оценок усталости с помощью CLDQ. Средние оценки усталости (среднеквадратическое отклонение) составляли 3,34 (1,406) в сравнении с 3,28 (1,326) на исходном уровне и 3,51 (1,529) в сравнении с 3,57 (1,527) в подвергнутых лечению плацебо и рифаксимином группах, соответственно. Из-за измененного психического состояния и состояния нервно-мышечной системы субъекты не могли завершить оценку с помощью CLDQ во время эпизода обострения HE с явной клинической картиной.
В таблице 22 суммированы изменения по сравнению с исходным уровнем в конце лечения уровня аммиака в венозной крови в соответствии с группой лечения в первом исследовании.
В первом исследовании уровни аммиака в венозной крови были в высокой степени вариабельными в ходе исследования. Однако у субъектов в подвергнутой лечению рифаксимином группе отмечались значительно большие снижения уровней аммиака в венозной крови, чем у субъектов, подвергнутых лечению плацебо (p=0,0391). Установлено, что уровни аммиака в венозной крови, количественная оценка, которая связана с эффектами на CNS, лежащими в основе HE с явной клинической картиной, являются высоко прогностическим фактором возникновения обострения HE с явной клинической картиной, определяемого с помощью клинической оценки по Конну (или комбинации из оценки по Конну и степени «порхающего» тремора), что таким образом подчеркивает надежность и клиническую значимость первичного показателя эффективности. Значительная корреляция между первичным конечным показателем эффективности и уровнями аммиака в венозной крови свидетельствует о надежности и клинической значимости первичного показателя эффективности в первом исследовании.
Первое исследование: изменения в виде среднего значения (среднеквадратического отклонения) по сравнению с исходным уровнем уровня аммиака в венозной крови в соответствии с группой лечения (в случае ITT популяции)
Второе исследование
Во втором исследовании применение рифаксимина вплоть до 18 месяцев, как правило, не изменяло или улучшало оценки по Конну. При последнем посещении 70,7% субъектов (188 из 266 субъектов) не имели изменений, и 20,3% (54 из 266) имели улучшения оценок по Конну по сравнению с исходным уровнем, что означает, что психическое состояние не изменялось или улучшалось у большей части субъектов (91%) в течение периода лечения. Применение рифаксимина вплоть до 18 месяцев, как правило, не изменяло или улучшало степени «порхающего» тремора, подобно оценкам по Конну. При последнем посещении 77,1% субъектов (205 из 266 субъектов) не имели изменений, и 16,2% (43 из 266) имели улучшения степеней «порхающего» тремора по сравнению с исходным уровнем, что означает, что связанные с нервно-мышечной системой симптомы, ассоциируемые с увеличением неврологической патологии, не изменялись у 83,3% субъектов в течение периода лечения. В случае второго исследования последним посещением является последнее посещение, зарегистрированное для предварительного анализа.
Отсутствие изменений или улучшение оценок по Конну отмечалось в случае >85% субъектов во время лечения рифаксимином в течение вплоть до 840 дней; средняя продолжительность подвергания воздействию (± среднеквадратическое отклонение) для всего лечения рифаксимином составляла 273,8 (160,92) дней (результаты по подверганию воздействию представлены подробнее в ISS, модуль 5.3.5.3.2). Всего 65,5% субъектов (220 из 337) не имели изменений оценки по Конну, и 21,1% (71 из 337) имели улучшения оценки по Конну по сравнению с исходным уровнем при последнем посещении. Также отсутствие изменений или улучшения степеней «порхающего» тремора отмечались в случае >90% субъектов во время лечения рифаксимином. Отсутствие изменения по сравнению с исходным уровнем степени «порхающего» тремора было зарегистрировано в случае 75,2% субъектов (252 из 337), и 17,3% имели улучшения.
Из 118 субъектов, которые вошли в исследование с оценками по Конну ≥1, например, тех субъектов, в случае которых улучшение было возможным, 62,2% (71 из 118) продемонстрировали улучшение по сравнению с исходным уровнем до оценки по Конну =0 при последней оценке. Также из 99 субъектов, которые вошли в исследование со степенью «порхающего» тремора ≥1, т.е. тех субъектов, в случае которых улучшение степени «порхающего» тремора было возможным, 58,6% (58 из 99) продемонстрировали улучшение степени «порхающего» тремора по сравнению с исходным уровнем в конце исследования.
Изменения по сравнению с исходным уровнем оценок по Конну и степеней «порхающего» тремора при последнем посещении были схожими среди субъектов группы начала лечения рифаксимином во втором исследовании (например, тех, которые начали получать рифаксимин в исследовании 3002), субъектов группы продолжения лечения рифаксимином (например, тех, которые получали рифаксимин в первом исследовании и во втором исследовании), и всех субъектов, подвергнутых лечению рифаксимином (например, тех, которые получали рифаксимин в первом исследовании или во втором исследовании).
Эти результаты служат подтверждением результатов первого исследования, в котором лечение рифаксимином было значительно эффективнее лечения плацебо в предотвращении ухудшения оценки по Конну (в 2,46 раз в сравнении с плацебо, p<0,0001) и в предотвращении ухудшения степени «порхающего» тремора (в 1,92 раз в сравнении с плацебо, p=0,0262).
Изменения по сравнению с исходным уровнем результатов исследования CFF (первое исследование)
Увеличения результатов исследования CFF отражают улучшение функции нервной системы у пациентов с HE. У субъектов подвергнутой лечению рифаксимином группы отмечались значительно большие увеличения результатов для CFF по сравнению с исходным уровнем в конце лечения, чем у подвергнутых лечению плацебо субъектов (таблица 23). Средние изменения (± среднеквадратическое отклонение) результатов для CFF составляли 0,945 (± 4,75) в подвергнутой лечению рифаксимином группе в сравнении с 0,355 (± 4,70) в подвергнутой лечению плацебо группе (p=0,0320 для различия между группами).
Существовала высокая степень корреляции между количественной оценкой результатов CFF и возникновением обострения HE с явной клинической картиной подобно корреляции между последним и уровнями аммиака в венозной крови.
Изменения в виде среднего значения (среднеквадратического отклонения) по сравнению с исходным уровнем результатов исследования CFF в соответствии с группой лечения (в случае ITT популяции)
Был выполнен ретроспективный анализ амбулаторных карт и историй болезней 145 пациентов с HE, которые получали лактулозу в дозе 30 мл дважды в день в течение ≥6 месяцев, а затем были подвергнуты лечению рифаксимином в дозе 400 мг 3 раза/день в течение ≥6 месяцев. Поразительные различия отмечались в пользу лечения рифаксимином. Соблюдение указаний врача на ≥75% было значительно лучше во время лечения рифаксимином, чем во время лечения лактулозой; 92% в сравнении с 31% пациентов, получивших ≥75% запланированных доз рифаксимина и лактулозы, соответственно. Общее число госпитализаций, продолжительность госпитализаций, конечные показатели HE и затраты на лечение были сравнимыми между 2 схемами лечения. Значительно меньшее число госпитализаций (0,5 в сравнении с 1,6) и дней пребывания в больнице (2,5 в сравнении с 7,3 дней) было зарегистрировано в случае лечения рифаксимином в сравнении с лечением лактулозой (p<0,001), а связанные с госпитализацией расходы на каждого пациента составляли $14222 по сравнению с $56635 во время лечений рифаксимином и лактулозой, соответственно.
Что касается конечных показателей HE в конце периодов лечения, «порхающий» тремор был зарегистрирован в случае 63% (рифаксимин) в сравнении с 93% (лактулоза) пациентов (p<0,001), а оценки по Конну =3 или 4 были отмечены в случае 6% (рифаксимин) в сравнении с 25% (лактулоза) пациентов (p<0,001). Кроме того, значительно больше пациентов имели диарею, метеоризм и боль в животе во время лечения лактулозой, чем во время лечения рифаксимином (p<0,001).
Госпитализации и затраты на лечение были проанализированы при анализе амбулаторных карт и историй болезней 39 пациентов с пересадкой печени, которые продемонстрировали равняющиеся 2 оценки НЕ по Конну в промежутке времени с января 2004 по ноябрь 2005. Двадцать четыре пациента были подвергнуты лечению лактулозой, и 15 были подвергнуты лечению рифаксимином. Было зарегистрировано девятнадцать госпитализаций в случае подвергнутой лечению лактулозой группы и 3 госпитализации в случае подвергнутой лечению рифаксимином группы. Средняя продолжительность пребывания была значительно меньше в случае подвергнутой лечению рифаксимином группы, чем в случае подвергнутой лечению лактулозой группы (3,5 дней [диапазон, 3- 4] в сравнении с 5,0 днями [диапазон, 3-10] [p<0,001]). Средние ежегодные общие затраты на лечение (госпитализацию, посещение кабинета неотложной помощи и стоимость лекарственных средств) каждого пациента составляли $7958 в случае подвергнутой лечению рифаксимином группы и $13285 в случае подвергнутой лечению лактулозой группы. Хотя стоимость рифаксимина была существенно выше стоимости лактулозы, общие затраты на лечение (госпитализацию плюс стоимость лекарственного средства) были в 1,67 раз выше в случае пациентов, которые были подвергнуты лечению лактулозой.
Продолжительность терапевтического эффекта рифаксимина
Данные второго исследования обеспечивают информацию о длительной продолжительности эффекта рифаксимин в отношении предохранения от эпизодов обострения HE с явной клинической картиной во время лечения. За подвергнутыми лечению рифаксимином субъектами первого исследования, которые находились в ремиссии в конце первого исследования (лечения в течение 6 месяцев), следили во время открытого второго исследования (n=60). На фиг.15 представлено время до первого эпизода обострения HE во время лечения для субъектов группы возобновления лечения рифаксимином (первое исследование плюс второе исследование) и подвергнутых лечению плацебо в первом исследовании субъектов. Частоту обострения HE с явной клинической картиной в случае этих субъектов группы возобновления лечения рифаксимином сравнивали с таковой в случае подвергнутых лечению плацебо в первом исследовании субъектов. Частота эпизода обострения HE в случае подвергнутых лечению рифаксимином субъектов была значительно ниже, чем в случае подвергнутой лечению плацебо в первом исследовании группы (отношение: частота в группе возобновления лечения рифаксимином к таковой в группе лечения плацебо составляло 0,0797 после приведения в соответствие со временем подвергания воздействию, p<0,0001 для различия между рифаксимином и плацебо.
Эти результаты показывали, что рифаксимин имел долговременный эффект, начинающийся в первом исследовании и продолжающийся во втором исследовании (средние продолжительности подвергания воздействию рифаксимина составляли 168 дней в первом исследовании и 253 дней во втором исследовании).
Примечание к фиг.13, оценка распределения выживания по y-оси представляет собой долю субъектов без обострения НЕ с явной клинической картиной во время лечения. Пунктирные линии отражают подвергнутых лечению рифаксимином субъектов первого исследования, которые находились в ремиссии в конце первого исследования (лечения в течение 6 месяцев) и за которыми следили во время открытого второго исследования (n=60), а сплошная линия отражает подвергнутую лечению плацебо группу в первом исследовании. Вертикальная линия служит отметкой конца двойного слепого исследования и начала открытого исследования. Не закрашенные кружки отражают проверенных субъектов подвергнутой лечению плацебо в первом исследовании группы, а не закрашенные треугольники отражают проверенных субъектов группы продолжения лечения рифаксимином. Субъектов, которые были исключены из исследования до первого эпизода обострения HE с явной клинической картиной, проверяли во время исключения.
В отличие от первого исследования, в котором субъектов исключали из исследования после проявления у них первого эпизода обострения HE с явной клинической картиной, субъекты могли продолжить лечение рифаксимином во втором исследовании после проявления обострения HE с явной клинической картиной. Следовательно, оценивали частоту обострения HE с явной клинической картиной в динамике времени во время лечения рифаксимином. В таблице 24 представлены эпизоды обострения HE с явной клинической картиной в соответствии с общим числом эпизодов HE в ходе исследования.
В группе всех субъектов, подвергнутых лечению рифаксимином, 27,1% субъектов (72 из 266) имели ≥1 эпизода обострения HE с явной клинической картиной. Из 72 субъектов с обострением HE большая их часть имела 1 (44 субъектов) или 2 (18 субъектов) эпизода. Десять субъектов имели 3 или более эпизодов обострения HE во втором исследовании.
Второе исследование: эпизоды обострения HE с явной клинической картиной в соответствии с числом повторных эпизодов
a Число эпизодов HE. В случае каждого числа эпизодов НЕ с явной клинической картиной субъекты учитывались только один раз. Например, если субъект проявил 3 эпизода, его включали лишь в ряд, показывающий 3 эпизода, и не учитывали также в рядах для 2 и 1 эпизода.
Эффект рифаксимина на частоту эпизодов HE с явной клинической картиной (тяжесть HE)
Эффект лечения рифаксимином на частоту эпизодов HE с явной клинической картиной (например, тяжесть HE), число эпизодов HE в первом исследовании или во втором исследовании сравнили с числом эпизодов HE в отсутствие лечения рифаксимином. Составляющий 6 месяцев промежуток времени до первого исследования или составляющий 12 месяцев промежуток времени до второго исследования сравнивали с лечением рифаксимином в любом из двух исследований. Период времени участия в первом исследовании не отражался на сумме событий в отсутствие лечения рифаксимином, следовательно, в случае субъектов, которые перешли во второе исследование без эпизода HE в первом исследовании, составляющий 12 месяцев промежуток времени до второго исследования использовали для сравнения. Большая часть субъектов во втором исследовании (152 из 266) также участвовали в первом исследовании. Эпизоды HE с явной клинической картиной во втором исследовании объединяли с таковыми в первом исследовании, поскольку, в отличие от первого исследования, субъекты во втором исследовании могли остаться на лечении рифаксимином после проявления у них эпизода обострения HE. Число эпизодов HE с явной клинической картиной, проявляемых во время 6-месячных или 12-месячных промежутков времени до первого лечения или до второго лечения, было известно. Несмотря на то, что 30,8% субъектов имели >2 эпизодов HE во время 6-месячного или 12-месячного промежутка времени до лечения рифаксимином, лишь 3,6% субъектов имели >2 эпизодов HE во время лечения рифаксимином вплоть до 840 дней (средняя продолжительность подвергания воздействию =253 дней [приблизительно 8 месяцев]) в первом исследовании плюс второе исследование. Это различие в частоте эпизодов HE, когда субъекты получали рифаксимин, по сравнению с отсутствием лечения рифаксимином говорит о сильном эффекте рифаксимина в ослаблении предрасположенности к эпизодам НЕ с явной клинической картиной у пациентов с рецидивирующей HE с явной клинической картиной, связанной с тяжелым заболеванием печени.
Печеночная энцефалопатия является серьезным, редким, сложным, эпизодическим, нейропсихиатрическим синдромом, связанным с прогрессирующим заболеванием печени. Печеночная энцефалопатия является огромным бременем для пациента, его семьи и системы здравоохранения. Эпизоды HE с явной клинической картиной вызывают деменцию, делают пациента неспособным к самообслуживанию и часто приводят к госпитализации. Рифаксимину был предоставлен статус орфанного препарата по показанию HE, поскольку это заболевание является серьезным и постоянно вызывающим деменцию, и существует низкий коэффициент заболеваемости HE в общей популяции. Также существует неудовлетворенная потребность в лечения для пациентов с НЕ из-за недостатков современного стандарта обслуживания.
Без желания ограничиваться какими-либо конкретными научными теориями полагают, что механизм действия рифаксимина зависит от ингибирования ДНК-зависимой РНК-полимеразы являющихся мишенями микроорганизмов, приводящего к супрессии инициации образовании цепи при синтезе РНК. Рифаксимин характеризуется меньшей степенью уничтожения патогенов в фекалиях по сравнению с другими обычно используемыми антибактериальными средствами и вызывает незначительные изменения в кишечной флоре, что говорит о том, что рифаксимин имеет механизм действия, отличный от других обычно используемых лекарственных средств при кишечной бактериальной инфекции, таких как фторхинолоны. Антибактериальные свойства рифаксимина, как представляется, являются следствием бактерицидной активности в концентрациях рифаксимина, превышающих или равных MIC, и изменений морфологии и физиологического функционирования бактерий, которые отмечались в суб-MIC концентрациях.
Здесь было неожиданно обнаружено, что риск развития резистентности к антибиотику является низким во время постоянного лечения рифаксимином по сравнению с другими системными антибиотиками, такими как неомицин. Низкий риск развития резистентности к антибиотику во время лечения рифаксимином, возможно, обусловлен тем фактом, что резистентность к рифаксимину не опосредуется плазмидой, а вместо этого требуется стабильная мутация в ДНК клетки-хозяина; следовательно, распространение резистентности и перекрестная резистентность к другим антибиотикам посредством механизмов на основе плазмид исключаются. Также бактерии в местах вне желудочно-кишечного тракта не подвергаются существенному селективному давлению из-за незначительных системных концентраций рифаксимина. Кроме того, микробиологические данные исследования пациентов с неспецифическим язвенным колитом, которые получали высокие дозы рифаксимина, свидетельствовали о том, что резистентные к рифаксимину бактериальные колонии, образованные во время in vivo подвергания воздействию рифаксимина, были нестабильными, и чувствительность возвращалась после короткого периода прерывания лечения.
Лечение рифаксимином приводит к меньшему числу эпизодов HE с явной клинической картиной, которые иначе могут сделать пациента нетрудоспособным, может уменьшить бремя на членов семьи, которые вынуждены ухаживать за пациентом, и уменьшает расходы на госпитализацию в этой популяции пациентов и бремя на систему здравоохранения. Следующее является результатами второго исследования в отношении времени до первого эпизода обострения HE с явной клинической картиной.
Предохранительный эффект был воспроизводимым: результаты, относящиеся ко времени до первого эпизода обострения HE с явной клинической картиной, были схожими между подвергнутой лечению рифаксимином группой в первом исследовании и новыми подвергнутыми лечению рифаксимином субъектами во втором исследовании; и 22% и 27,6% субъектов проявили обострение HE с явной клинической картиной в подвергнутой лечению рифаксимином группе в первом исследовании и новой подвергнутой лечению рифаксимином группе во втором исследовании, соответственно. После приведения в соответствие с продолжительностью подвергания воздействию, коэффициенты эпизодов обострения HE составляли 0,62 случаев/PEY в случае подвергнутой лечению рифаксимином группы в первом исследовании по сравнению с 0,38 случаев/PEY в случае новых подвергнутых лечению рифаксимином субъектов во втором исследовании. Эти данные свидетельствуют о том, что предохранительный эффект от обострения HE с явной клинической картиной у субъектов, которые получали рифаксимин, был согласующимся между 2 исследованиями. Кроме того, когда подвергнутые лечению плацебо в первом исследовании субъекты перешли на лечение рифаксимином в результате вхождения во второе исследование, отмечался поразительный предохранительный эффект рифаксимина при сравнении оценок по методу Каплана-Мейера времени до первого обострения HE с явной клинической картиной между лечением плацебо в первом исследовании и лечением рифаксимином во втором исследовании. Отношение рисков: риска в подвергнутой лечению рифаксимином группе относительно риска в подвергнутой лечению плацебо группе составляло 0,302 (95% доверительный интервал: 0,166-0,549, p<0,0001 для различия между группами в относительном риске). Это результат отражает снижением на 70% риска проявления обострения HE с явной клинической картиной во время лечения рифаксимином во втором исследовании по сравнению с предшествующим их лечением плацебо в первом исследовании. Это снижение имело место, несмотря на старение популяции с хроническим заболеванием печени и, вероятно, его прогрессирующий характер.
Предохранительный эффект рифаксимина был длительным: оценка по методу Каплана-Мейера времени до первого обострения HE во время лечения продемонстрировала длительное сохранение отсутствие обострения HE, когда за подвергнутыми лечению рифаксимином субъектами, находящимися в ремиссии после участия в первом исследовании, следили во втором исследовании (вплоть до 680 дней лечения рифаксимином; средние продолжительности подвергания воздействию составляли 168 дней в первом исследовании и 253 дней во втором исследовании). Была значительно ниже частота эпизода обострения HE для этих подвергнутых лечению рифаксимином субъектов относительно подвергнутых лечению плацебо в первом исследовании субъектов, указание на уменьшение числа эпизодов обострения HE с помощью лечения рифаксимином (p<0,0001 для различия в относительном риске между подвергнутыми лечению рифаксимином и плацебо группами).
Результаты для других конечных показателей эффективности также свидетельствовали о статистически значимых предохранительных эффектах рифаксимина. В первом исследовании анализ времени до первой связанной с HE госпитализации (например, госпитализации, являющейся непосредственным следствием HE, или госпитализации, осложненной HE) показал, что снижение риска госпитализации вследствие HE составляло 50% в подвергнутой лечению рифаксимином группе по сравнению с подвергнутой лечению плацебо группой, во время 6-месячного периода лечения (p=0,0129 для различия в относительном риске между группами). В первом исследовании риск вызванной НЕ госпитализации НЕ (например, только госпитализации, являющейся непосредственным следствием HE) снижался на 56% (p=0,0064 для различия в относительном риске между группами), а риск госпитализации по всем причинам снижался на 30% в подвергнутой лечению рифаксимином группе по сравнению с подвергнутой лечению плацебо группой (p=0,0793 для различия в относительном риске между группами). В первом исследовании степень риска госпитализации по всем причинам снижалась на 30% в подвергнутой лечению рифаксимином группе по сравнению с в подвергнутой лечению плацебо группой (p=0,0793 для различия в относительном риске между группами). Коэффициент госпитализации по всем причинам составлял 0,92 случаев/PEY в подвергнутой лечению рифаксимином группе в сравнении с 1,31 случаев/PEY в подвергнутой лечению плацебо группе.
Во втором исследовании низкий коэффициент вызванной НЕ госпитализации сохранялся на уровнях, соответствующих таковым в первом исследовании: коэффициент вызванной НЕ госпитализации составлял 0,29 случаев/PEY, а коэффициент госпитализации по всем причинам составлял 0,66 случаев/PEY во втором исследовании. Неизменно низкий коэффициент связанной с HE/вызванной HE госпитализации у подвергнутых лечению рифаксимином субъектов в первом исследовании и во втором исследовании был по крайней мере отчасти результатом сохранения ремиссии доказанной HE у субъектов с заболеванием печени на конечной стадии.
Улучшение качества жизни субъектов с HE, которым вводили рифаксимин
HE проявляется в виде череды явлений, состоящей из ухудшения психического состояния, психомоторной дисфункции, ухудшения памяти, увеличенного времени реакции, анормальностей восприятия, плохой концентрации, дезориентации и в тяжелых формах комы. Симптомы проявления HE у пациентов имеют неблагоприятные последствия в отношении связанного со здоровьем пациента качества жизни и приводят к снижению способности к самообслуживанию. Вопросник для оценки хронического заболевания печени (CLDQ) является утвержденным средством для определения связанного со здоровьем качества жизни у субъектов с хроническим заболеванием печени. Среднее изменение по сравнению с исходным уровнем оценок проявления усталости с помощью CLDQ в конце лечения было 1 из 5 ключевых вторичных конечных показателей в этом исследовании. Кроме того, среднее изменение по сравнению с исходным уровнем оценок с помощью CLDQ (общей оценки и оценки в каждой области проявлений) при каждой последующей оценке и в конце лечения было одним из третичных конечных показателей эффективности, предварительно заданных в протоколе исследования.
CLDQ применяли на исходном уровне, в дни 28, 56, 84, 112 и 140, и в день 168 или в конце лечения. CLDQ включает 29 вопросов по следующим шести областям проявлений: абдоминальных симптомов (три вопроса), усталости (пять вопросов), системных симптомов (пять вопросов), активности (три вопроса), эмоционального состояния (восемь вопросов) и беспокойства (пять вопросов). Отмечалась высокая степень корреляции между оценками проявления усталости и тяжестью заболевания печени, определяемой с помощью клинических оценок. Поэтому проявление усталости было выбрано в качестве ключевого вторичного конечного показателя в случае этого исследования.
Субъекты устанавливали уровень своей усталости посредством использования 7-пунктной шкалы от наихудшего ответа (1, высокая степень усталости) до наилучшего ответа (7, незначительная усталость). Другие проявления и общая оценка также устанавливались по 7-пунктной шкале, при этом более высокие оценки указывают на лучшее качество жизни, а более низкие оценки отражают более низкое качестве жизни. Например, 1 из 5 вопросов по усталости был «Сколько времени в пределах последних 2 недель Вы находились в состоянии усталости?» Вариантами ответа были «все время», «большую часть времени», «значительную часть времени», «некоторую часть времени», «немного времени», «почти ни в какое время» и «ни в какое время». Для них устанавливали степени 1 (наибольшая степень усталости), 2, 3, 4, 5, 6 и 7 (отсутствие усталости), соответственно.
В отличие от анализа изменения по сравнению с исходным уровнем, представленный ниже анализ AUC включает результаты, полученные с помощью CLDQ в течение всего времени участия субъекта в исследовании.
Анализ площади под кривой и средневзвешенного во времени значения (Twa) результатов, полученных с помощью вопросника для оценки хронического заболевания печени
При первоначальном анализе данных исследования были отмечены незначительные различия между подвергнутыми лечению плацебо и рифаксимином группами в изменениях по сравнению с исходным уровнем оценок усталости с помощью CLDQ и оценок по другим областям проявлений с помощью CLDQ. Средние оценки усталости (среднеквадратическое отклонение) составляли 3,34 (1,406) в сравнении с 3,28 (1,326) на исходном уровне и 3,51 (1,529) в сравнении с 3,57 (1,527) при последней оценке в подвергнутых лечению плацебо и рифаксимином группах, соответственно.
В этом примере ответы на вопросы CLDQ прослеживали в динамике времени для каждого субъекта и определяли площадь под кривой (AUC). В случае тех субъектов, которые проявляли эпизоды обострения HE во время лечения, полученные с помощью CLDQ данные отражают сумму впечатлений до эпизода обострения. Поскольку не все субъекты оставались в исследовании в течение одного и того же периода времени, значение AUC приводили ко времени подвергания воздействию (T), получая значение, названное средневзвешенным во времени значением (Twa), как приведено ниже:
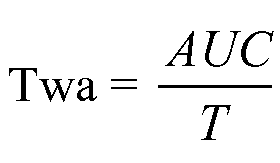
Таким образом, Twa характеризует среднее изменение полученного с помощью CLDQ ответа по сравнению с исходным уровнем на всем протяжении испытания, приведенное к продолжительности подвергания воздействию.
Как представлено ниже на фиг.14A-B, существует четкой раздел полученных с помощью CLDQ результатов, что определено по Twa, между подвергнутыми лечению плацебо и рифаксимином группами в распределении по частоте представленных в виде Twa оценок проявления усталости и общих оценок. Смещение распределения по частоте в сторону более высоких оценок у подвергнутых лечению рифаксимином субъектов указывает на лучшие ответы; т.е. улучшенные результаты качества жизни в целом и меньшую степень усталости в случае подвергнутой лечению рифаксимином группы по сравнению с подвергнутой лечению плацебо группой. Схожие различия между группами в пользу подвергнутой лечению рифаксимином группы были отмечены в распределениях по частоте в случае дополнительных, определенных с помощью CLDQ проявлений.
В таблице 25 суммированы представленные в виде Twa результаты для полученных с помощью CLDQ оценок по всем областям проявлений и полученных с помощью CLDQ оценок проявления усталости в соответствии с группой лечения в сформированной в соответствии с назначенным лечением (ITT) популяции. Средневзвешенные во времени оценки проявления усталости и общие оценки были значительно выше в подвергнутой лечению рифаксимином группе, чем в подвергнутой лечению плацебо группе (p=0,0087 [проявление усталости] и p=0,0093 [все проявления] для различий между группами в пользу подвергнутой лечению рифаксимином группы). Средневзвешенные во времени оценки, полученные с помощью CLDQ для других проявлений, были также значительно выше в подвергнутой лечению рифаксимином группе, чем в подвергнутой лечению плацебо группе (p=0,0090 [абдоминальные симптомы], p=0,0160 [системные симптомы], p=0,0022 [активность], p=0,0065 [эмоциональное состояние] и p=0,0436 [беспокойство] для различий между группами в пользу подвергнутой лечению рифаксимином группы.
Различия в средних представленных в виде Twa оценках между группами лечения (рифаксимин минус плацебо) составляли 0,72 для проявления усталости и 0,75 для всех проявлений. Различие, составляющее 0,5 пунктов, считается значительным, а различие, составляющее 0,8 пунктов, считается «большим» при использовании 7-пунктной шкалы для определений качества жизни.
Относящиеся к предмету обсуждения данные литературы, сравнивающие субъектов без цирроза, с заболеванием печени степени А по шкале Чайлд-Пью и степени C по шкале Чайлд-Пью, говорят о том, что составляющие 0,5-1,0 различия в полученных с помощью CLDQ оценках являются клинически значимыми. Средние различия в общих оценках проявлений у субъектов без цирроза по сравнению с субъектами со степенью А по шкале Чайлд-Пью (без цирроза минус степень А по шкале Чайлд-Пью) составляли 0,6 у субъектов в Соединенных Штатах и 0,3 при исследовании субъектов в Испании. Большие средние различия в общих оценках проявлений сообщались для перехода от состояния без цирроза к степени С по шкале Чайлд-Пью (без цирроза минус степень С по шкале Чайлд-Пью): составляющее 1,3 различие в проводимом в Соединенных Штатах исследовании и составляющее 1,0 различие в проводимом в Испании исследовании.
Площадь под кривой и средневзвешенное во времени значение для полученных с помощью CLDQ результатов (в случае ITT популяции)
Выводы из проведенных с помощью CLDQ анализов
Когда полученные с помощью CLDQ результаты исследования были проанализированы на всем протяжении подвергания воздействию исследуемого лекарственного средства посредством расчета Twa, субъекты в подвергнутой лечению рифаксимином группе имели значительно меньшую степень усталости и значительно более высокое качество жизни в целом, чем субъекты в подвергнутой лечению плацебо группе. Например, представленные в виде среднего значения (± среднеквадратическое отклонение) оценки усталости - Twa составляли 3,24 (1,76) в подвергнутой лечению рифаксимином группе и 2,42 (1,75) в подвергнутой лечению плацебо группе (p=0,0087 в пользу подвергнутой лечению рифаксимином группы). Значительные различия в полученных с помощью CLDQ результатах - Twa в пользу подвергнутой лечению рифаксимином группы также отмечались для полученной с помощью CLDQ общей оценки проявлений (p=0,0093) и для каждой из других областей проявлений, являющихся составными частями CLDQ, включающих абдоминальные симптомы (p=0,0090), системные симптомы (p=0,0160), активность (p=0,0022), эмоциональное состояние (p=0,0065) и беспокойство (p=0,0436).
Важно, что эти данные свидетельствуют о том, что лечение рифаксимином приводило к значительно улучшенному качеству жизни по сравнению с лечением плацебо в течение 6-месячного периода лечения у субъектов с циррозом печени и рецидивирующей HE с явной клинической картиной, до проявления вновь возникшей HE с явной клинической картиной, и с представлением без опровержения данных. Это свидетельствует о том, что у пациентов в этом исследовании зарегистрированы улучшения в каждой области проявления по сравнению с подвергнутой лечению плацебо группой. Отмеченное статистически значимое различие между подвергнутыми лечению рифаксимином и плацебо группами согласуется с клинически значимыми различиями, отмеченными в случае субъектов с увеличением тяжести заболевания печени, определяемой с помощью оценки по шкале Чайлд-Пью.
Корреляция между CFF и обострением HE с явной клинической картиной во время лечения
В качестве проверки надежности и клинической значимости первичного конечного показателя исследовали корреляция между количественными результатами для CFF и возникновением обострения HE с явной клинической картиной (первичным показателем эффективности), которое определяли на основе клинических симптомов с использованием оценки по Конну (или комбинации из оценки по Конну и степени «порхающего» тремора).
Значения CFF прослеживали в динамике времени для каждого субъекта, и было отмечено, что в среднем субъекты, которые проявили обострение НЕ, имели меньшие значения CFF, чем субъекты, которые не проявили эпизод обострение НЕ. И, кроме того, было отмечено, что площадь под кривой зависимости CFF от времени (AUC) можно использовать для точной характеристики вариации в CFF в динамике времени для каждого субъекта в виде средневзвешенного во времени значения (twa). Поскольку не все субъекты оставались в исследовании в течение одного и того же периода времени, twa приводили ко времени подвергания воздействию (T).
Результаты исследования CFF в динамике времени представляли в виде:
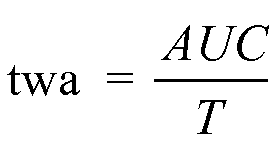
где T представляет собой время подвергания воздействию. Таким образом, twa характеризует средний результат CFF на всем протяжении испытания.
Корреляцию между twa и наличием или отсутствием эпизода обострения HE во время лечения можно проанализировать с помощью дисперсионного анализа и коэффициента корреляции рангов Спирмена. Кроме того, можно выполнить анализ ROC-кривой для оценки точности twa для проведения различий между наличием и отсутствием эпизодов обострения во время лечения. В случае ROC-кривой строят график зависимости относительного числа достоверно позитивных заключений (чувствительности) от относительного числа ложно позитивных заключений (1 -специфичности). Диагностическое исследование с идеальным разграничением имеет ROC-кривую, которая проходит через верхний левый угол (100% чувствительность, 100% специфичность). Следовательно, чем ближе ROC-кривая к верхнему левому углу, тем выше общая точность исследования.
На фиг.31 и 32 и в таблице 26 демонстрируется, что различие между распределениями по частоте twa, соответствующими наличию (среднее значение =12,5 Гц) и отсутствию эпизодов обострения НЕ во время лечения (среднее значение =32,7 Гц), было статистически значимым (p<0,0001). Также существовала корреляция между средним значением twa и наличием или отсутствием эпизода обострения НЕ во время лечения (коэффициент корреляции рангов Спирмена =-0,62; p<0,0001).
Площадь под кривой и средневзвешенное во времени значение для результатов исследования CFF (в случае ITT популяции)
a p-значение, рассчитанное, используя ковариационный анализ с использованием эффектов лечения и области исследования в качестве независимых переменных.
b Коэффициент корреляции рангов Спирмена между twa и наличием или отсутствием обострения HE =-0,62; p<0,0001.
Анализ ROC-кривой twa для диагностирования обострения HE по CFF показал, что значение площади под кривой =0,88 (95% доверительный интервал 0,84-0,92). Значения, близкие к 1, и нахождение ROC-кривой ближе к верхнему левому углу, считаются диагностически значимыми.
Таким образом, установлено, что CFF, который является признанным, физиологически релевантным количественным показателем, связанным с HE, является высоко прогностическим фактором обострения HE во время лечения, определяемого по увеличению оценки по Конну до степени ≥2 (т.е. с 0 или 1 до ≥?2) или составляющему 1 степень увеличению каждой из оценок по Конну и «порхающего» тремора в случае субъектов, которые вошли в исследование с оценкой по Конну =0. Тот факт, что этот количественный показатель позволяет проводить различие в высокой степени статистически значимым образом, свидетельствует о надежности и клинической значимости первичного показателя эффективности.
ПРИМЕР 6: Корреляция между уровнями аммиака в венозной крови и эпизодами обострения HE во время лечения
У субъектов, которым назначали рифаксимин, отмечены значительно большие снижения уровней аммиака в венозной крови, чем у подвергнутых лечению плацебо субъектов (p=0,0391, смотрите таблицу 27). Уровни аммиака в венозной крови определяли при скрининге, на исходном уровне, в день 28, день 84 и день 168/в конце лечения.
Представленные в виде средних значений (среднеквадратическое отклонение) изменения по сравнению с исходным уровнем уровня аммиака в венозной крови в соответствии
a p-значение было рассчитано, используя ковариационный анализ с использованием эффектов лечения и области исследования, и исходного уровня в качестве независимых переменных.
Установлено, что существует высокая степень корреляции между уровнями аммиака в венозной крови, количественной оценкой, которая связана с эффектами на CNS, лежащими в основе HE с явной клинической картиной, и возникновением обострения HE с явной клинической картиной, определяемого с помощью клинической оценки. Эта высокая степень корреляции находится в соответствии с корреляцией между результатами исследования CFF и возникновением обострения HE с явной клинической картиной.
Лабораторные значения аммиака в венозной крови прослеживали в динамике времени для каждого субъекта. Для приведения ко времени подвергания воздействию значение twa рассчитывали так же, как и при анализе CFF.
Корреляцию между twa аммиака и наличием или отсутствием эпизода обострения HE во время лечения исследовали, как описано для CFF.
На фиг.33 и в таблице 28 демонстрируется, что различие между распределениями по частоте twa, соответствующими наличию (среднее значение =102,4 мкмоль/л) и отсутствию эпизодов обострения НЕ во время лечения (среднее значение =85,4 мкмоль/л), было статистически значимым (p=0,0079). Также существовала корреляция между средним значением twa и наличием или отсутствием эпизода обострения НЕ во время лечения (коэффициент корреляции рангов Спирмена =0,22; p=0,0005).
Площадь под кривой и средневзвешенное во времени значение для концентраций аммиака в венозной крови (в случае ITT популяции)
a p-значение, рассчитанное, используя ковариационный анализ с использованием эффектов лечения и области исследования в качестве независимых переменных.
b Коэффициент корреляции рангов Спирмена между twa и наличием или отсутствием обострения HE=0,22; p=0,0005.
Анализ ROC-кривой twa для диагностирования обострения HE по уровням аммиака в венозной крови показал, что значение площади под кривой =0,64 (95% доверительный интервал 0,57-0,72) (смотрите фиг.34). Значения, близкие к 1, и нахождение ROC-кривой ближе к верхнему левому углу считаются диагностически значимыми.
Таким образом, установлено, что уровень аммиака в венозной крови, который является признанным, физиологически релевантным количественным показателем, связанным с HE, является высоко прогностическим фактором обострения HE во время лечения, определяемого по увеличению оценки по Конну до степени ≥2 (т.е. с 0 или 1 до ≥2) или составляющему 1 степень увеличению каждой из оценок по Конну и «порхающего» тремора в случае субъектов, которые вошли в исследование с оценкой по Конну =0. Тот факт, что этот количественный показатель позволяет проводить различие в высокой степени статистически значимым образом межу наличием или отсутствием обострения НЕ, свидетельствует о надежности и клинической значимости первичного показателя эффективности.
Включение посредством ссылки
Содержания всех ссылочных документов, патентов, находящихся в процессе рассмотрения заявок на патенты и опубликованных патентов, приведенных по всей этой заявки, включены таким образом в словесной форме посредством ссылки.
Эквиваленты
Квалифицированные в данной области техники специалисты различат, или будут способны установить, используя не более чем обычное проведение опытов, множество вариантов, эквивалентных конкретным вариантам осуществления настоящего изобретения, описанным здесь. Предполагается, что такие эквиваленты охватываются следующей формулой изобретения.
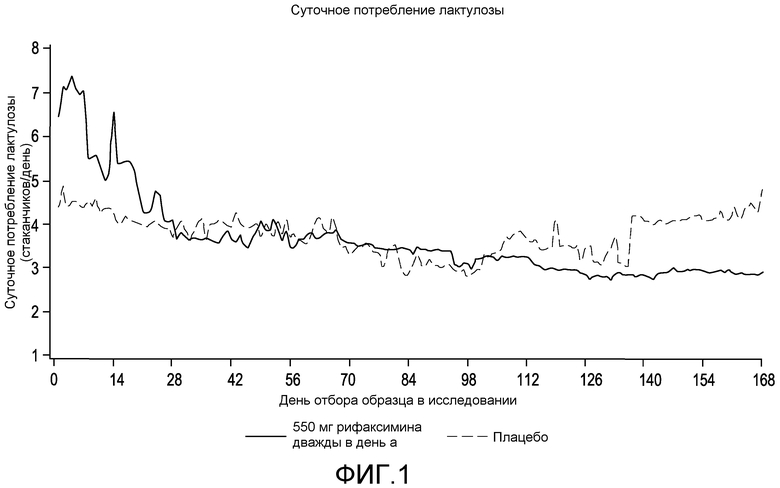
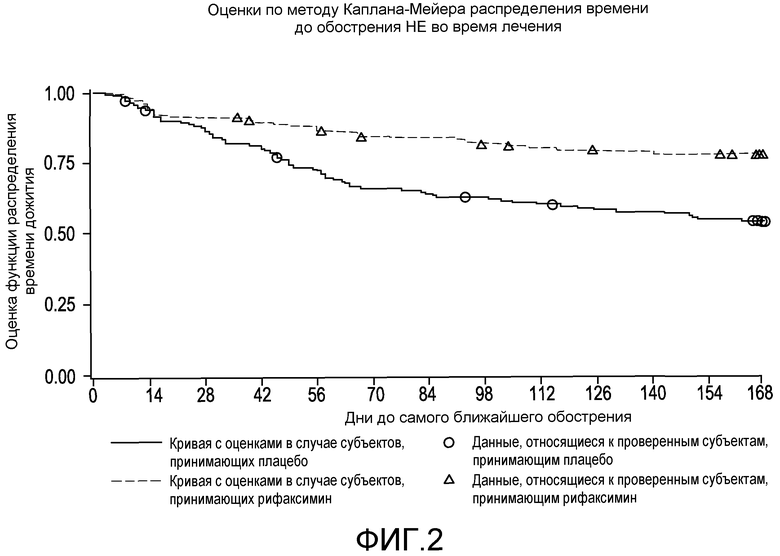
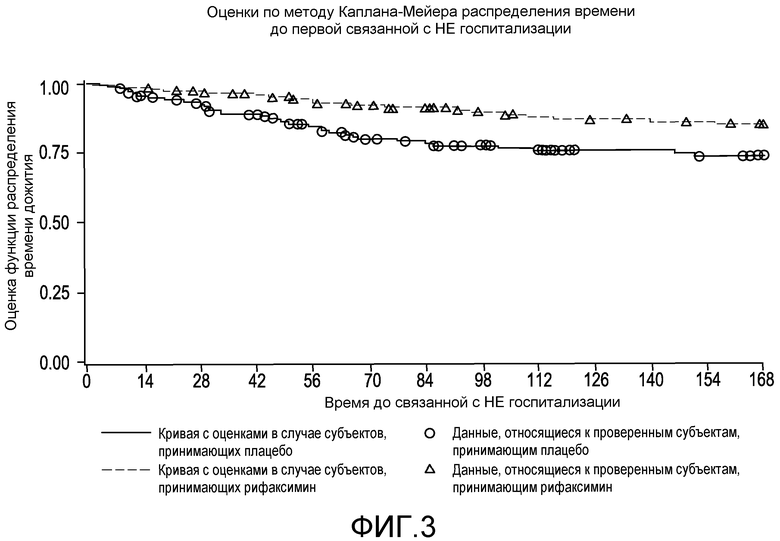
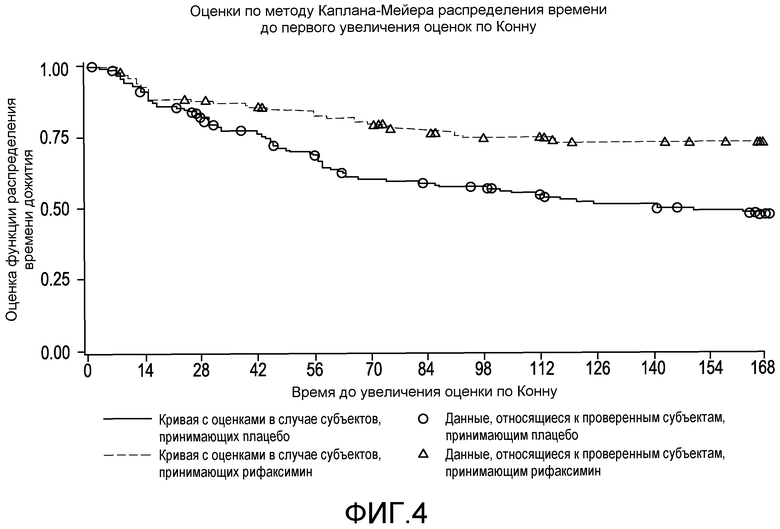
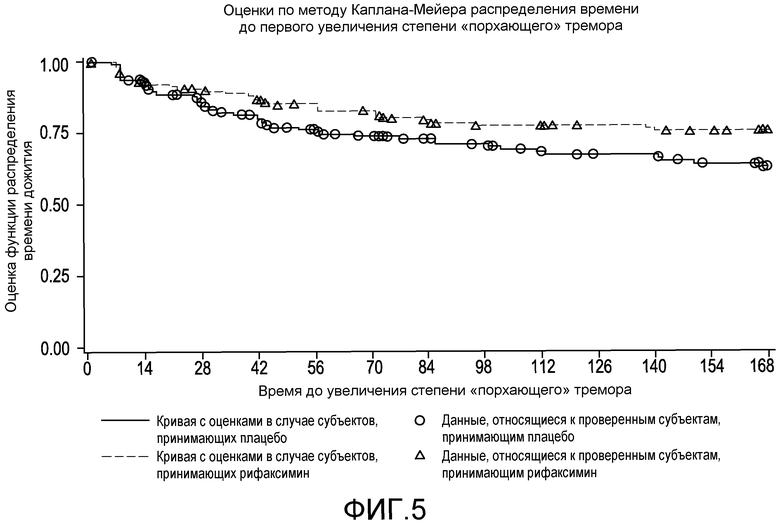
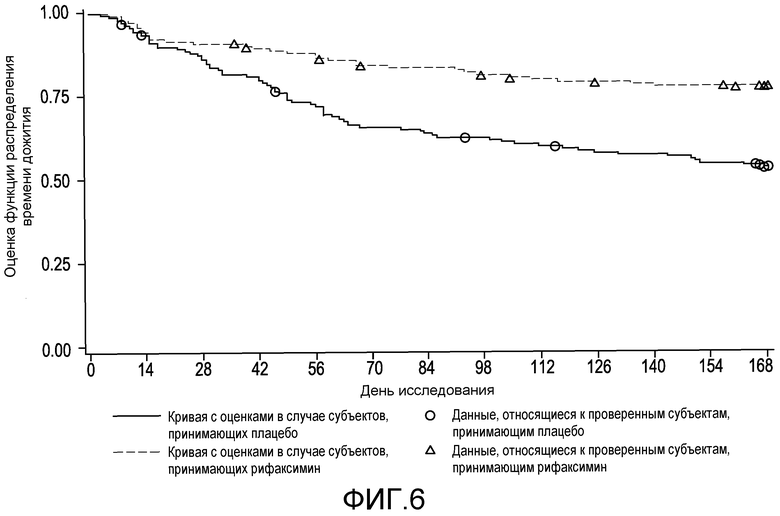
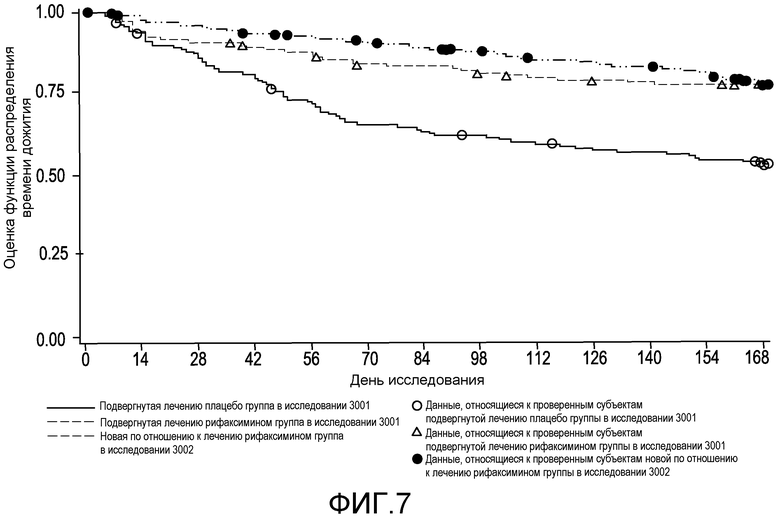
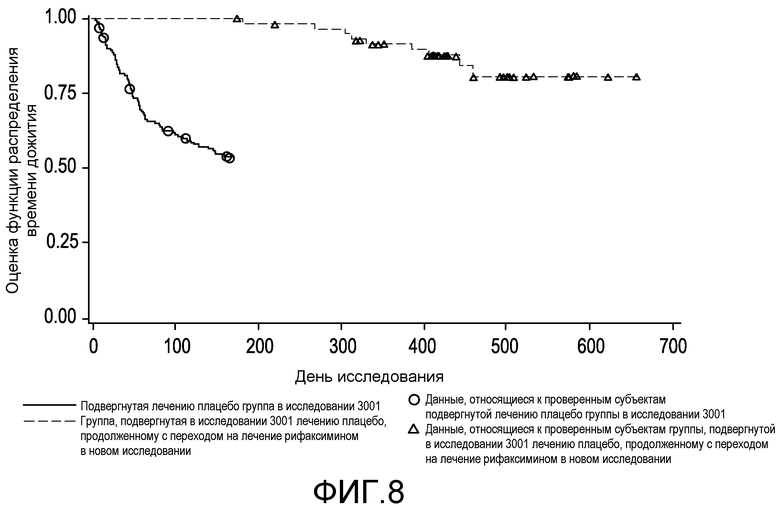
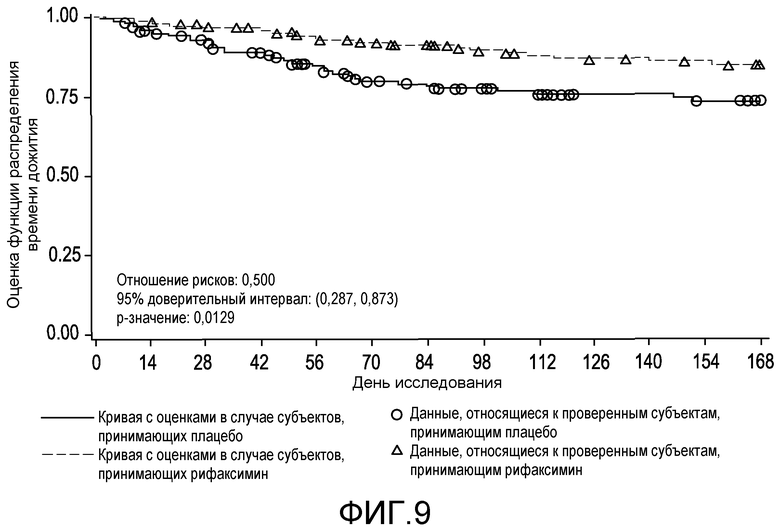
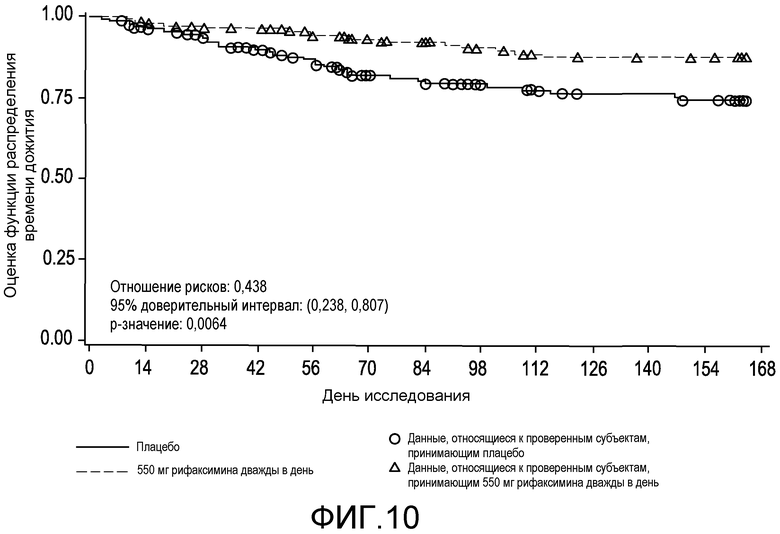
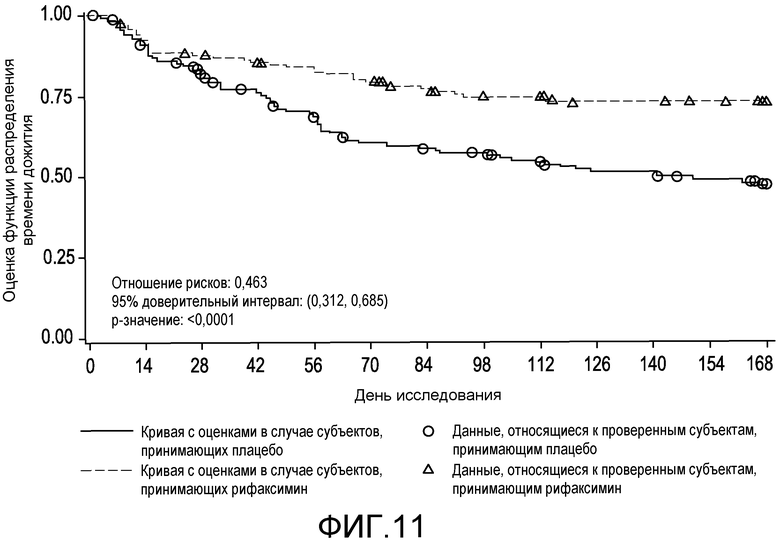
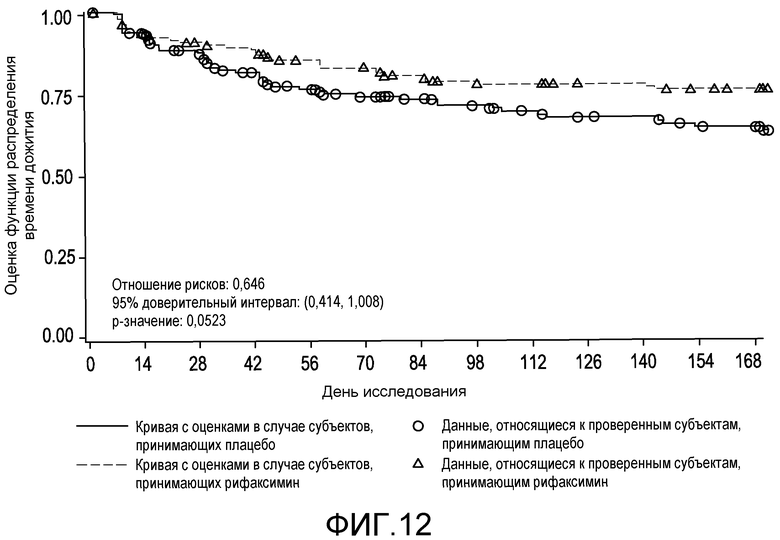
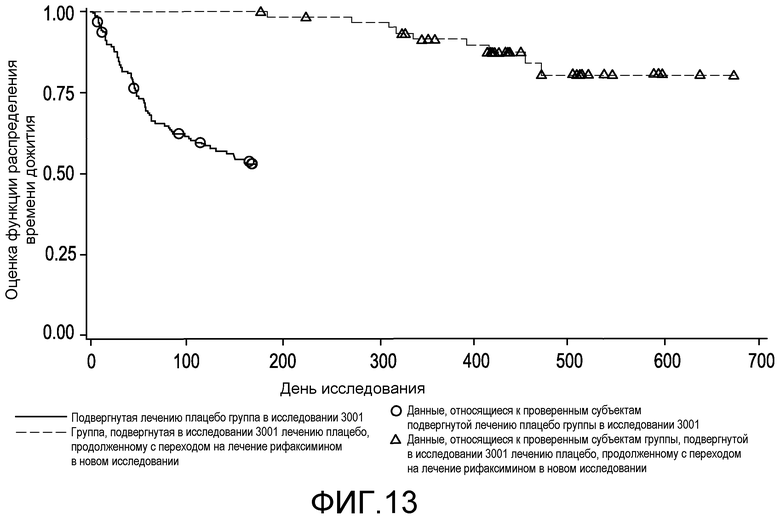
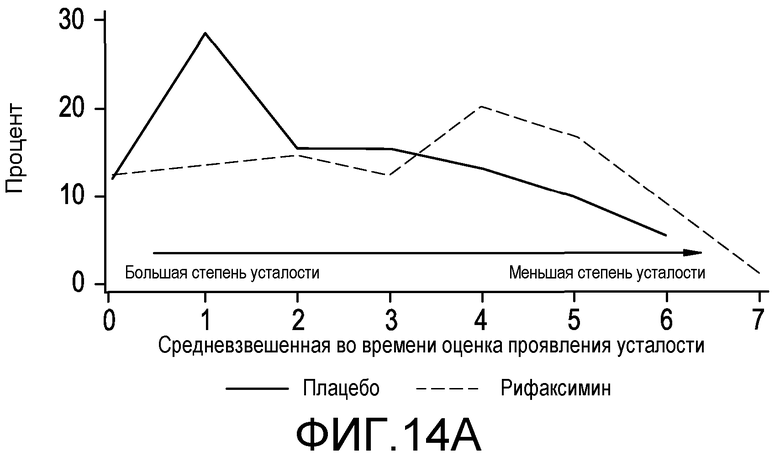
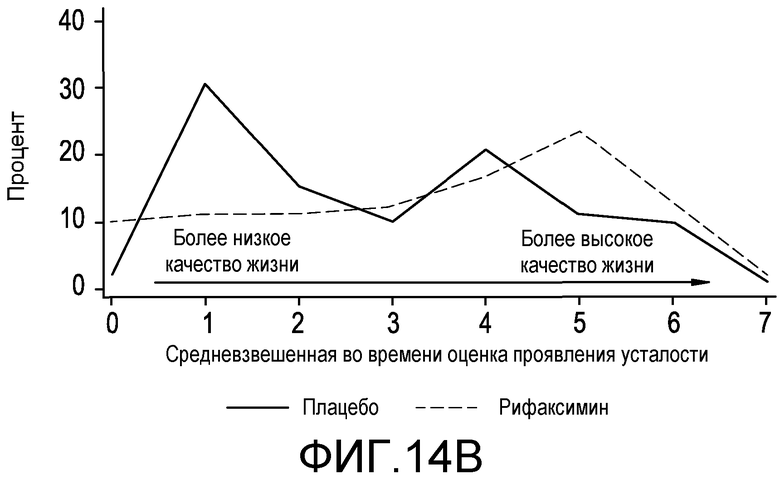
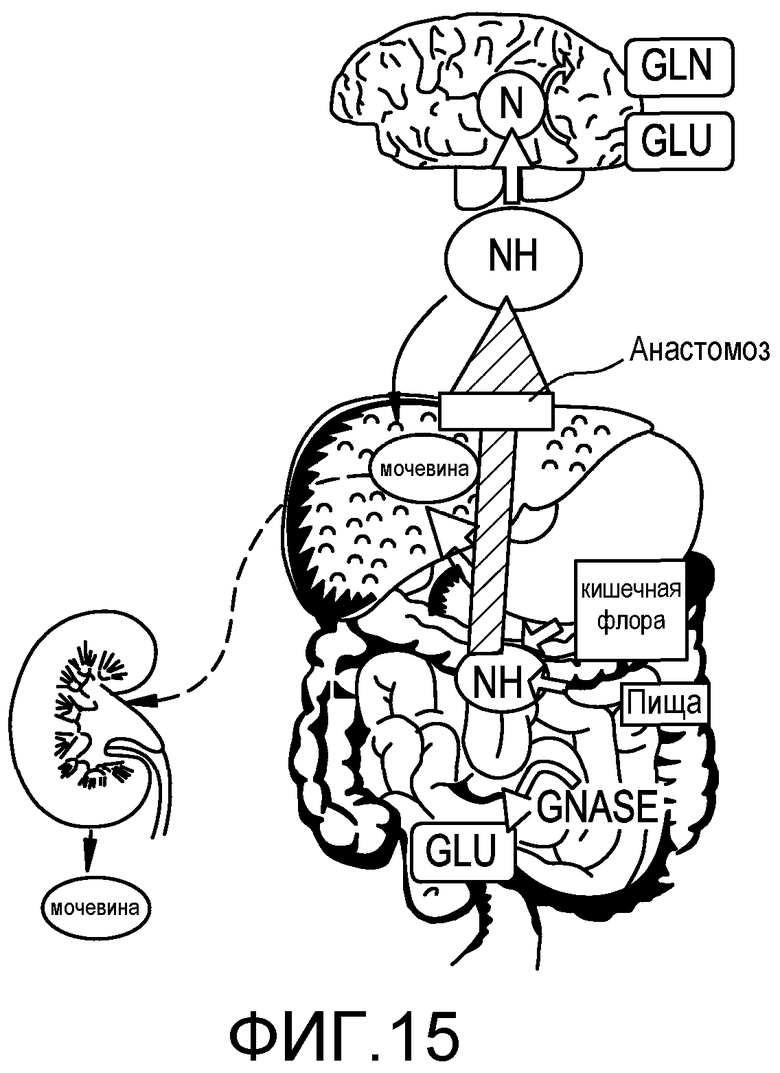
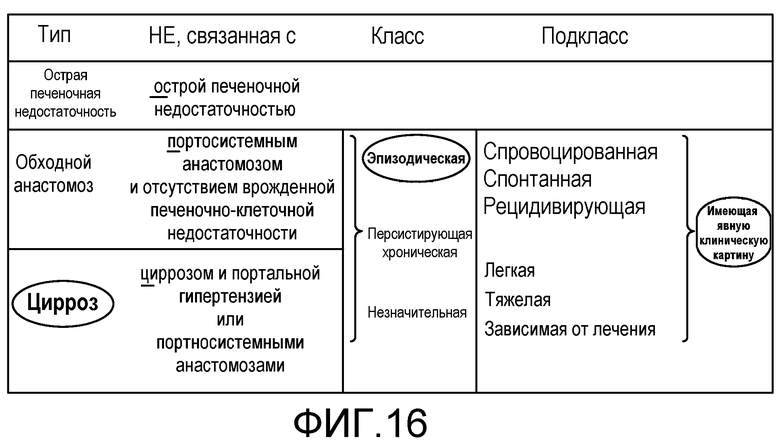
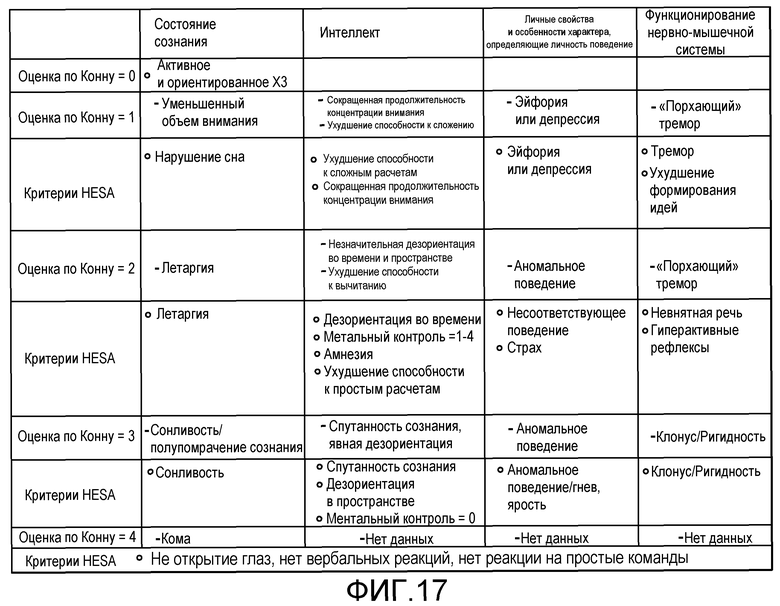
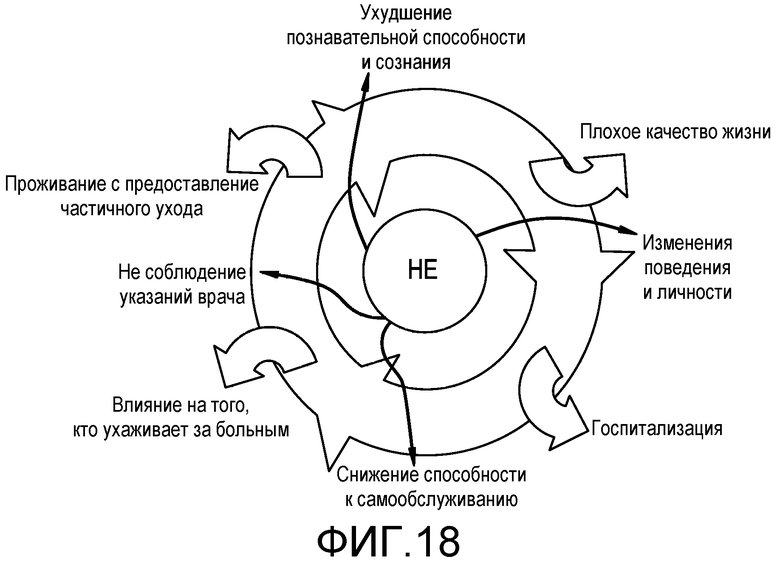
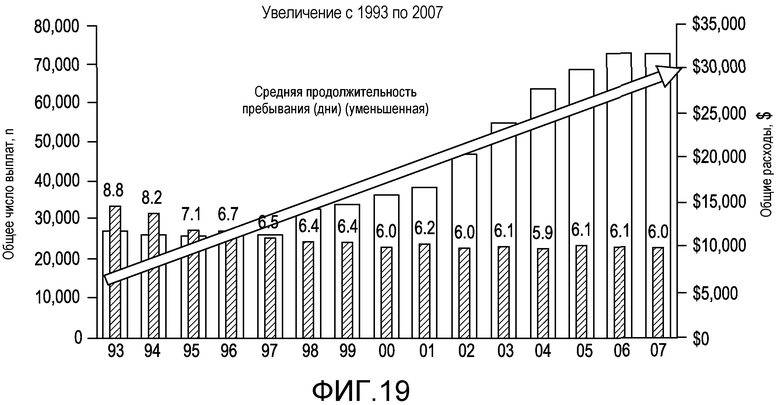
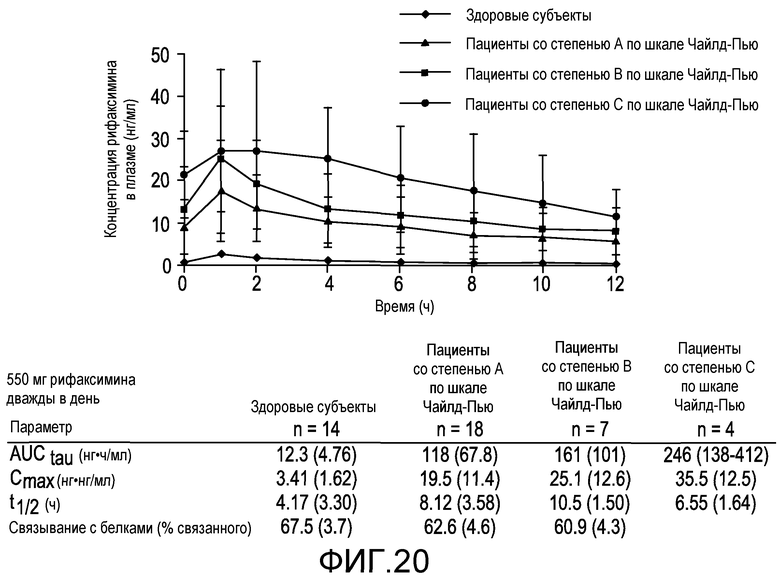
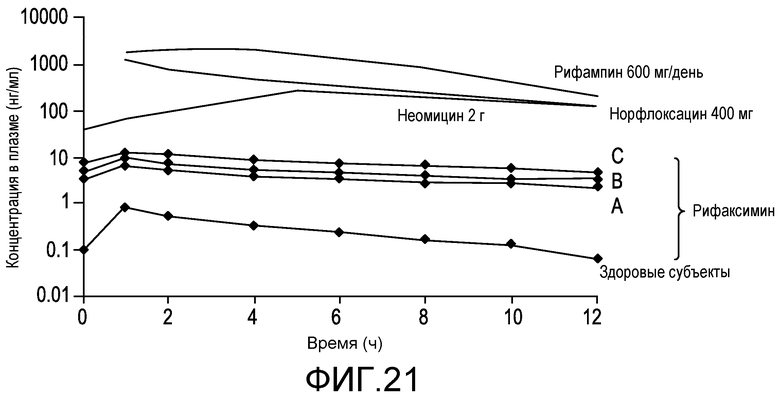

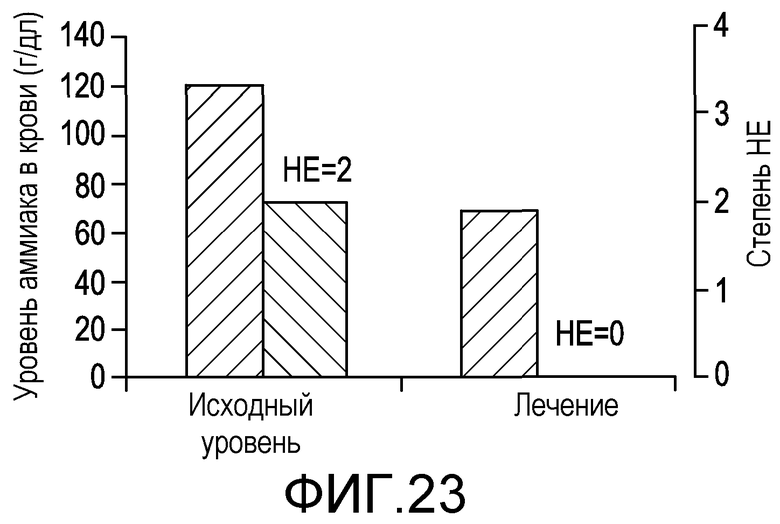
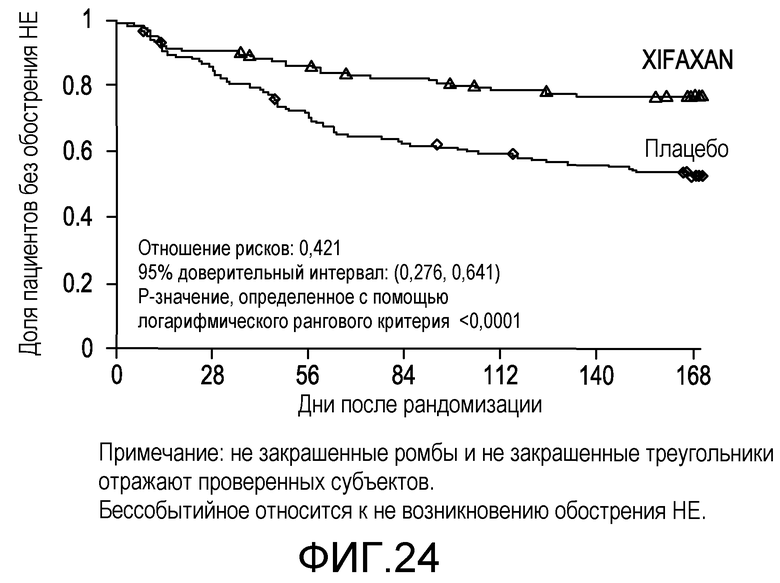
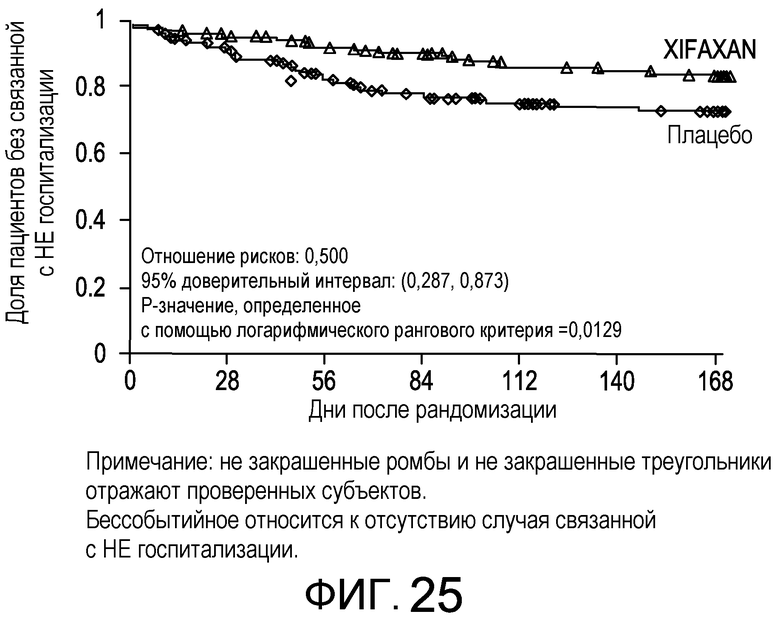
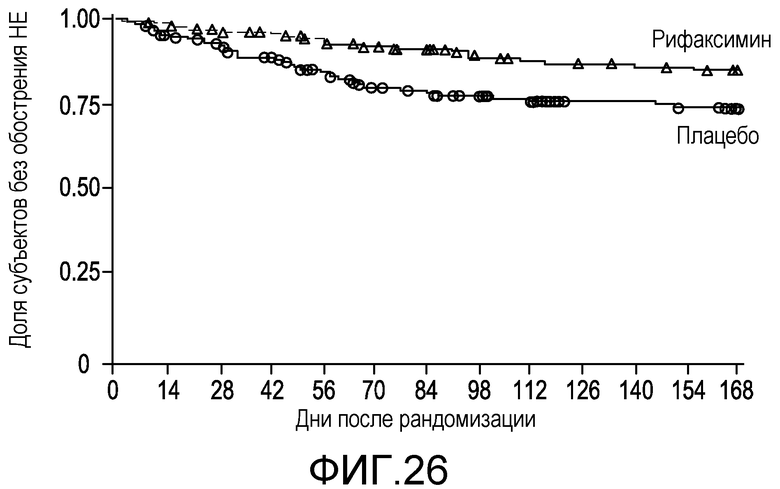
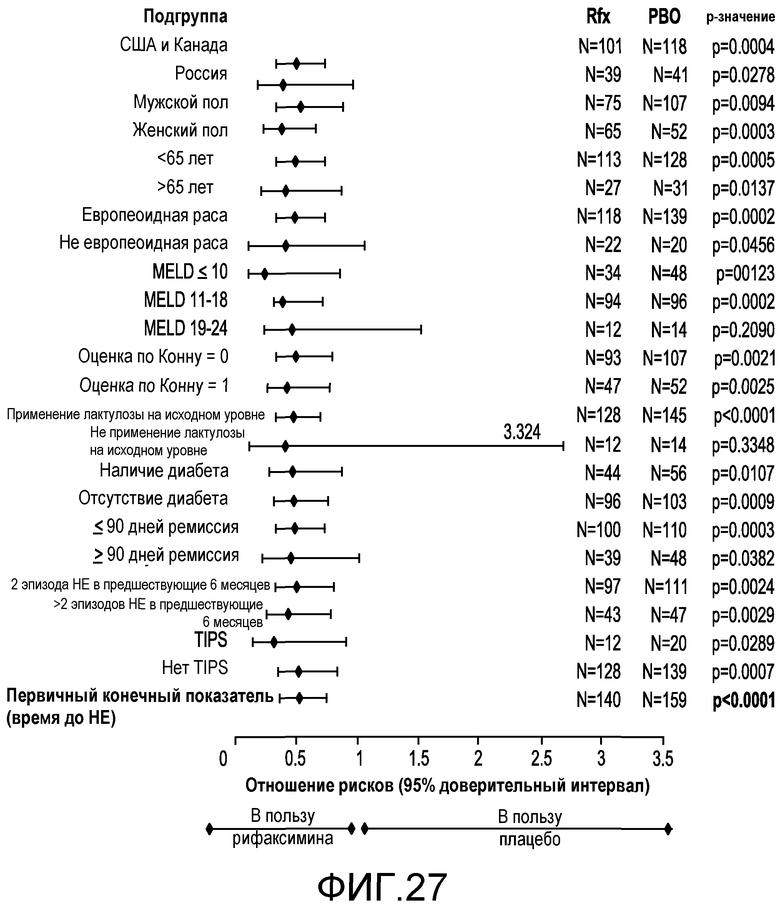
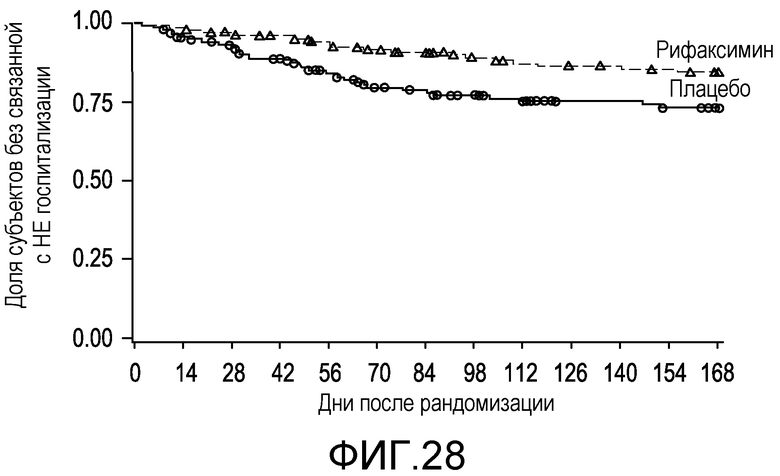
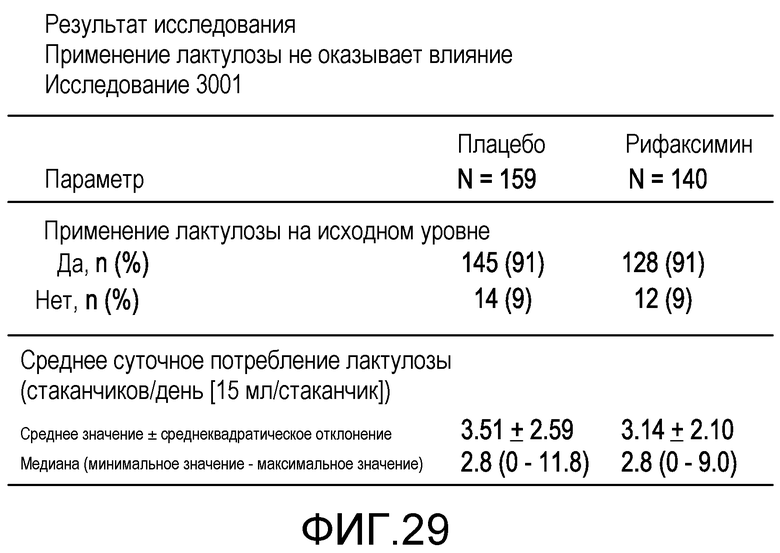
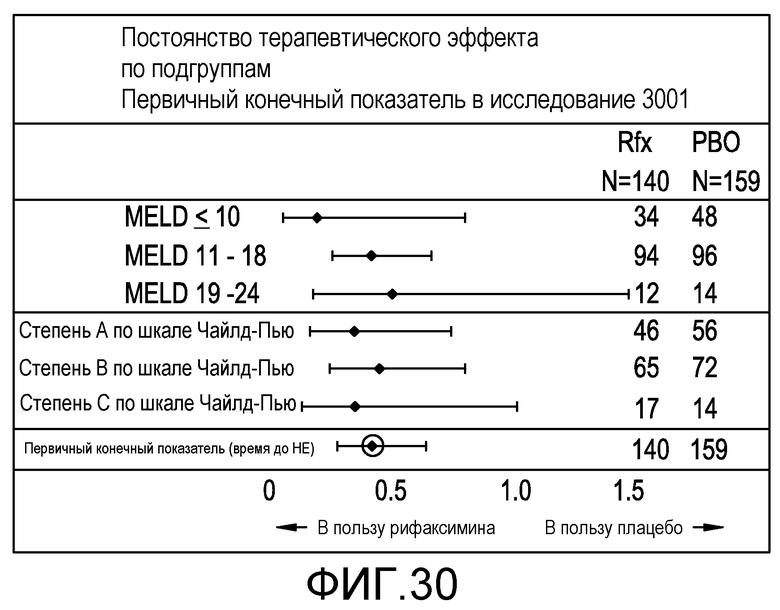
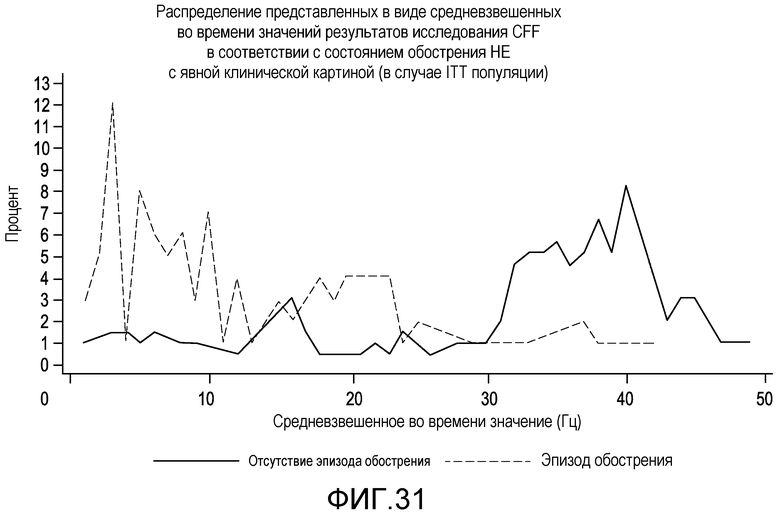
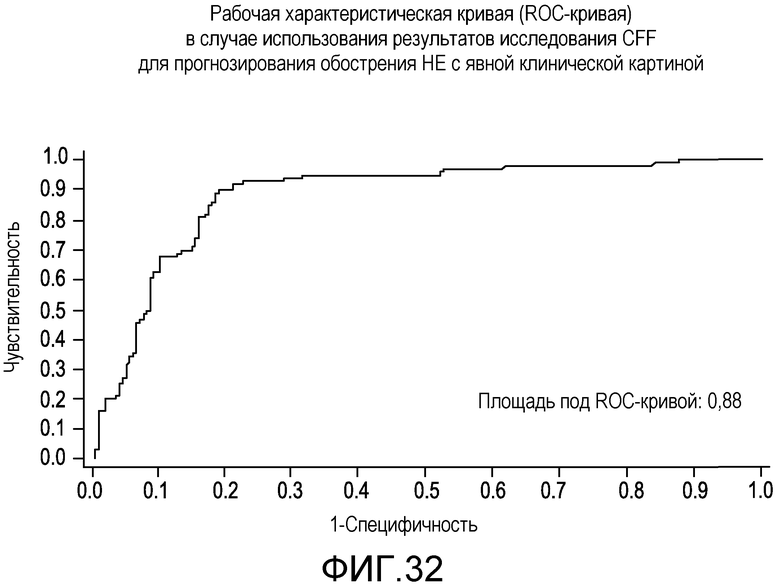
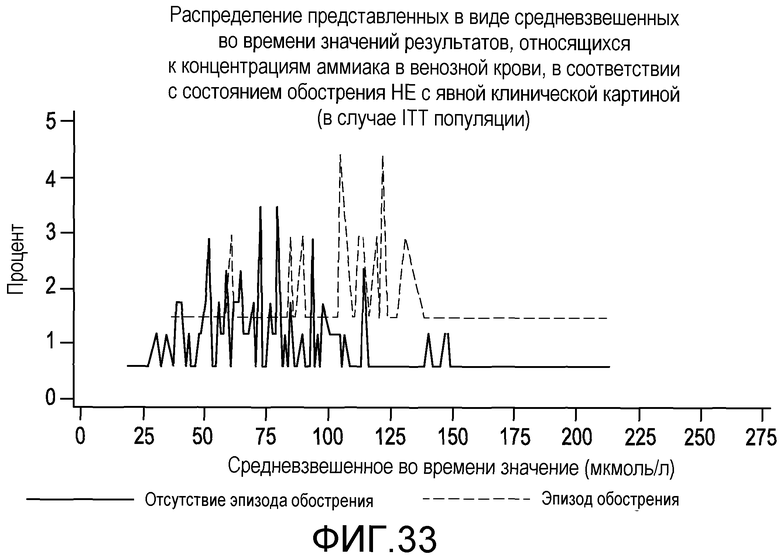

Группа изобретений относится к медицине, а именно к гепатологии и неврологии, и может быть использована для применения рифаксимина для получения лекарственного средства для сохранения ремиссии печеночной энцефалопатии (НЕ) у субъекта. Для этого ежедневно вводят рифаксимин субъекту в течение приблизительно 12 месяцев или более или приблизительно 1095 дней или дольше, тем самым сохраняя ремиссию НЕ. Группа изобретений обеспечивает устойчивую ремиссию НЕ, а также низкую резистентность бактериальной флоры пациента к антибиотику. 2 н. и 14 з.п. ф-лы, 34 ил., 28 табл. , 6 пр.
1. Применение рифаксимина для получения лекарственного средства для сохранения ремиссии печеночной энцефалопатии (НЕ) у субъекта, включающее ежедневное введение рифаксимина субъекту в течение приблизительно 12 месяцев или более, тем самым сохраняя ремиссию НЕ.
2. Применение по п.1, дополнительно включающее введение лактулозы.
3. Применение по п.1, в котором рифаксимин вводят субъекту в течение от приблизительно 12 до приблизительно 24 месяцев.
4. Применение по п.1, в котором рифаксимин вводят субъекту до смерти.
5. Применение по п.1, в котором субъекту вводят от приблизительно 1000 мг до приблизительно 1200 мг/день рифаксимина.
6. Применение по п.5, в котором субъекту вводят приблизительно 1100 мг рифаксимина в день.
7. Применение по п.6, в котором субъекту вводят 550 мг рифаксимина дважды в день (BID).
8. Применение по п.1, в котором субъект определен как находящийся в ремиссии НЕ до введения рифаксимина.
9. Применение по п.8, в котором ремиссия определена оценкой по Конну 0 или 1.
10. Применение рифаксимина для получения лекарственного средства от печеночной энцефалопатии (НЕ) у субъекта, включающее ежедневное введение рифаксимина субъекту в течение приблизительно 1095 дней или дольше, тем самым излечивая НЕ.
11. Применение по п.10, дополнительно включающее введение лактулозы.
12. Применение по п.10, в котором рифаксимин вводят субъекту до смерти.
13. Применение по п.10, в котором субъекту вводят от приблизительно 1000 мг до приблизительно 1200 мг/день рифаксимина.
14. Применение по п.13, в котором субъекту вводят приблизительно 1100 мг рифаксимина в день.
15. Применение по п.14, в котором субъекту вводят 550 мг рифаксимина дважды в день (BID).
16. Применение по п.1 или 10, в котором в течение периода лечения наблюдается низкий коэффициент вызванной/связанной с НЕ госпитализации.
| Вибрационный насос | 1987 |
|
SU1465626A1 |
| US 2008119554 A1, 22.05.2008 | |||
| US 20020028764 A1, 03.07.2002 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2015-02-10—Публикация
2010-06-02—Подача