РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет предварительной заявки США № 61/187251, зарегистрированной 15 июня 2009 года, и предварительной заявки США № 61/297696, зарегистрированной 22 января 2010 года. Полное описание каждой из них включено в настоящий документ путем ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рифаксимин (INN; см. справочник The Merck Index, XIII Ed., 8304) является антибиотиком, принадлежащим к рифамициновому классу антибиотиков, как, например, пиридо-имидазо-рифамицин. Было опубликовано, что рифаксимин характеризуется ничтожно малой системной абсорбцией вследствие его химических и физических свойств (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int J Clin Pharmacol Res, 14 (2), 51-56, (1994)).
Рифаксимин описан в итальянском патенте IT 1154655 и EP 0161534, оба из которых в полном объеме включены в настоящий документ путем ссылки во всех отношениях. EP 0161534 описывает способ получения рифаксимина с использованием рифамицина О в качестве исходного материала (The Merck Index, XIII Ed., 8301).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе представлено обнаружение того, что рифаксимин проявляет различную фармакокинетику у субъектов с печеночной недостаточностью при сравнении с субъектами с нормальной печеночной системой. Соответственно, в одном аспекте, в настоящем документе предусмотрены способы увеличения системного воздействия рифаксимина (AUCtau) у субъекта после перорального введения, путем отбора субъекта с печеночной недостаточностью, и перорального введения рифаксимина субъекту, где системное воздействие рифаксимина увеличено у субъекта с печеночной недостаточностью по сравнению с субъектом без печеночной недостаточности.
В соответствующем варианте осуществления изобретения субъект с печеночной недостаточностью имеет индекс модели терминальной стадии заболевания печени (MELD) менее 11 для данного субъекта. В другом соответствующем варианте осуществления изобретения субъект с печеночной недостаточностью имеет индекс модели терминальной стадии заболевания печени (MELD) в диапазоне от 11 до 18 для данного субъекта.
В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель A (легкое нарушение функции печени) согласно классификации по Чайлд-Пью (Child-Pugh А). В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель B (хроническое алкогольное поражение печени) согласно классификации по Чайлд-Пью (Child-Pugh В).
В другом варианте осуществления изобретения системное воздействие рифаксимина у субъекта, страдающего печеночной недостаточностью, включает воздействие, по меньшей мере, в 5 раз превышающее таковое у субъекта, не имеющего печеночной недостаточности. В другом варианте осуществления изобретения системное воздействие рифаксимина у субъекта, страдающего печеночной недостаточностью, включает воздействие, по меньшей мере, в 9,6 раза превышающее таковое у субъекта, не имеющего печеночной недостаточности. В другом варианте осуществления изобретения системное воздействие рифаксимина у субъекта, страдающего печеночной недостаточностью, включает воздействие, по меньшей мере, в 13,1 раза превышающее таковое у субъекта, не имеющего печеночной недостаточности. В другом варианте осуществления изобретения системное воздействие рифаксимина у субъекта, страдающего печеночной недостаточностью, включает воздействие, превышающее в от приблизительно 5 до приблизительно 13,1 раз таковое у субъекта, не имеющего печеночной недостаточности.
В одном частном варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет печеночную энцефалопатию.
В другом варианте осуществления изобретения способы, предусмотренные в настоящем документе, дополнительно включают введение рифаксимина с пищей.
В одном варианте осуществления изобретения прием пищи задерживает время достижения максимальной концентрации в плазме крови.
В другом варианте осуществления изобретения способы, предусмотренные в настоящем документе, дополнительно включают отбор субъекта, подверженного или страдающего диареей путешественников.
В другом соответствующем варианте осуществления изобретения способы, предусмотренные в настоящем документе, дополнительно включают информирование субъекта о том, что скорость элиминации рифаксимина снижена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности.
В другом аспекте, предусмотренными в настоящем документе являются способы увеличения концентраций рифаксимина в плазме крови (Cmax) у субъекта после перорального введения, путем отбора субъекта с печеночной недостаточностью, и перорального введения рифаксимина субъекту, имеющему печеночную недостаточность, где концентрации рифаксимина в плазме крови повышены у субъекта с печеночной недостаточностью по сравнению с субъектом без печеночной недостаточности.
В одном варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет повышенный уровень аланинаминотрансферазы (АЛТ).
В одном варианте осуществления изобретения концентрация рифаксимина в плазме крови у субъекта, страдающего печеночной недостаточностью, включает воздействие, по меньшей мере, в 2 раза превышающее таковое у субъекта, не имеющего печеночной недостаточности.
В другом варианте осуществления изобретения способы, предусмотренные в настоящем документе, дополнительно включают введение рифаксимина с пищей, тем самым задерживая время достижения максимальной концентрации в плазме крови.
В другом варианте осуществления изобретения способы дополнительно включают отбор субъекта, подверженного или страдающего диареей путешественников.
В другом соответствующем варианте осуществления изобретения способы, предусмотренные в настоящем документе, дополнительно включают информирование субъекта о том, что скорость элиминации рифаксимина снижена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности.
В другом аспекте, предусмотренными в настоящем документе являются способы снижения скорости элиминации рифаксимина у субъекта после перорального введения, путем отбора субъекта, имеющего печеночную недостаточность, и перорального введения рифаксимина субъекту, имеющему печеночную недостаточность, где скорость элиминации рифаксимина снижена у субъекта с печеночной недостаточностью по сравнению с субъектом без печеночной недостаточности.
В одном варианте осуществления изобретения скорость элиминации рифаксимина снижена, по меньшей мере, на 25% у субъекта с печеночной недостаточностью по сравнению с субъектом без печеночной недостаточности.
В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель A (легкое нарушение функции печени) согласно классификации по Чайлд-Пью (Child-Pugh А). В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель В (хроническое алкогольное поражение печени) согласно классификации по Чайлд-Пью (Child-Pugh B).
В другом варианте осуществления изобретения снижение скорости элиминации дополнительно включает увеличение биодоступности рифаксимина у субъекта с печеночной недостаточностью.
В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, представляет собой субъект, имеющий, по меньшей мере, один признак, симптом или эпизод печеночной энцефалопатии или, по меньшей мере, один портосистемный анастомоз. В другом варианте осуществления изобретения субъект подвержен или страдает диареей путешественников.
В другом соответствующем варианте осуществления изобретения способы, предусмотренные в настоящем документе, дополнительно включают информирование субъекта о том, что скорость элиминации рифаксимина снижена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности.
В другом аспекте, предусмотренными в настоящем документе являются способы определения терапевтически эффективной дозы рифаксимина для субъекта, путем выбора субъекта, имеющего печеночную энцефалопатию, и определения терапевтически эффективной дозы, принимая во внимание субъекта, имеющего печеночную энцефалопатию.
В одном варианте осуществления изобретения субъект имеет или подвержен диарее путешественников.
В другом варианте осуществления изобретения субъекту вводят дозу, которая является повышенной по сравнению с дозой, вводимой субъекту, который не имеет или не подвержен печеночной энцефалопатии.
В другом варианте осуществления изобретения субъекту вводят дозу, которая является пониженной по сравнению с дозой, вводимой субъекту, который не имеет или не подвержен печеночной энцефалопатии.
В другом варианте осуществления изобретения способы дополнительно включают информирование субъекта об одном или нескольких из следующего: скорость элиминации рифаксимина снижена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности; системное воздействие рифаксимина повышено в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности, концентрация рифаксимина в плазме крови повышена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности, и/или скорость клиренса рифаксимина снижена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности.
В другом аспекте, предусмотренными в настоящем документе являются способы определения терапевтически эффективной дозы рифаксимина для субъекта, путем выбора субъекта, имеющего или подверженного печеночной недостаточности, включающие
установление соотношения печеночной недостаточности, по меньшей мере, с одним из повышенного системного воздействия рифаксимина, повышенной концентрации рифаксимина в плазме крови или сниженной скорости клиренса рифаксимина, и
определение терапевтически эффективной дозы, принимая во внимание одно или несколько из повышенного системного воздействия рифаксимина, повышенной концентрации рифаксимина в плазме крови или сниженной скорости клиренса рифаксимина у субъекта, ассоциированного с печеночной недостаточностью.
В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель Child-Pugh A. В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель Child-Pugh B.
В соответствующем варианте осуществления изобретения субъект имеет индекс модели терминальной стадии заболевания печени (MELD) менее 11. В другом соответствующем варианте осуществления изобретения субъект, страдающий или подверженный печеночной недостаточности, имеет индекс модели терминальной стадии заболевания печени (MELD) в диапазоне от 11 до 18.
В другом аспекте, субъект имеет повышенный уровень АЛТ.
В другом аспекте, субъект имеет, по меньшей мере, один портосистемный анастомоз. В другом варианте осуществления изобретения субъект уже имел, по меньшей мере, один эпизод печеночной энцефалопатии. В другом варианте осуществления изобретения субъект уже имел, по меньшей мере, один эпизод печеночной энцефалопатии в предыдущие шесть месяцев. В другом варианте осуществления изобретения субъект уже имел, по меньшей мере, два эпизода печеночной энцефалопатии в предыдущие шесть месяцев.
В другом варианте осуществления изобретения способы дополнительно включают выбор субъекта, подверженного или страдающего диареей путешественников.
В другом аспекте, предусмотренными в настоящем документе являются способы определения терапевтически эффективной дозы рифаксимина для субъекта, включающие:
отбор субъекта, имеющего или подверженного печеночной недостаточности,
установление соотношения печеночной недостаточности, по меньшей мере, с одним из повышенного системного воздействия рифаксимина, повышенной концентрации рифаксимина в плазме крови или сниженной скорости клиренса рифаксимина, и
определение терапевтически эффективной дозы, принимая во внимание, по меньшей мере, одно из повышенного системного воздействия рифаксимина, повышенной концентрации рифаксимина в плазме крови или сниженной скорости клиренса рифаксимина у субъекта, ассоциированного с печеночной недостаточностью.
В другом аспекте, предусмотренными в настоящем документе являются способы лечения диареи путешественников (TD), путем выбора субъекта, страдающего или подверженного диарее путешественников, инструктирования субъекта по пероральному введению рифаксимина и информирования субъекта об одном или нескольких из: скорость элиминации рифаксимина снижена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности; системное воздействие рифаксимина повышено в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности; концентрации рифаксимина в плазме крови повышены в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности; и/или скорость клиренса рифаксимина снижена в популяции субъектов с печеночной недостаточностью по сравнению с популяцией субъектов без печеночной недостаточности.
В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель Child-Pugh A. В другом варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет показатель Child-Pugh B.
В соответствующем варианте осуществления изобретения субъект имеет индекс модели терминальной стадии заболевания печени (MELD) менее 11. В другом соответствующем варианте осуществления изобретения субъект, страдающий печеночной недостаточностью, имеет индекс модели терминальной стадии заболевания печени (MELD) в диапазоне от 11 до 18.
В соответствующем варианте осуществления изобретения печеночная недостаточность включает печеночную энцефалопатию.
В другом варианте осуществления изобретения способы дополнительно включают идентификацию субъектов, имеющих печеночную недостаточность. В соответствующем варианте осуществления изобретения способы дополнительно включают исследование субъектов на печеночную недостаточность.
В другом варианте осуществления изобретения способы дополнительно включают изменение количества вводимого рифаксимина на основе субъекта, имеющего печеночную недостаточность, по сравнению с субъектом без печеночной недостаточности.
В другом варианте осуществления изобретения способы дополнительно включают изменение режима дозирования рифаксимина на основе субъекта, имеющего печеночную недостаточность, по сравнению с субъектом без печеночной недостаточности.
В другом варианте осуществления изобретения способы дополнительно включают информирование субъекта о том, что системное воздействие рифаксимина и/или концентрации рифаксимина в плазме крови изменяются с приемом пищи.
В другом аспекте, предусмотренными в настоящем документе являются наборы, включающие рифаксимин, или его фармацевтическую композицию, и инструкцию по введению субъекту с печеночной недостаточностью. В одном варианте осуществления изобретения набор включает инструкции по введению рифаксимина субъекту, имеющему печеночную энцефалопатию.
Другие варианты осуществления изобретения и аспекты рассмотрены ниже.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 представляет собой график, демонстрирующий среднее значение+SD кривых зависимости концентрации рифаксимина в плазме крови от времени в линейном масштабе.
На фиг. 2 показано время до первого спонтанного выраженного эпизода HE в подгруппе.
На фиг. 3 отражены результаты Twa общего показателя и индивидуального домена CLDQ в лечебной группе (популяция ITT).
На фиг. 4 отражены результаты Twa общего показателя и индивидуального домена CLDQ по спонтанному выраженному статусу HE.
На фиг. 5 отражен сравнительный анализ оценки выживаемости по способу Каплана-Мейера по времени до первого спонтанного выраженного эпизода HE. Показано исследование плацебо по сравнению с исследованием рифаксимина у субъектов в перекрестном плацебо-исследовании вплоть до 6 месяцев лечения.
На фиг. 6 показаны средние величины значений PSE в начале и в конце курса лечения в клинических исследованиях.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Варианты осуществления изобретения, предусмотренные в настоящем документе, относятся к обнаружению различия по системному воздействию, концентрации в плазме крови и константе максимальной скорости элиминации рифаксимина у субъекта, страдающего печеночной недостаточностью, по сравнению с субъектом, имеющим нормальную функцию печени. Кроме того, изобретение относится к обнаружению влияния приема пищи на время достижения максимальных концентраций рифаксимина в плазме крови субъекта.
Основной патогенез HE связывают с азотсодержащими веществами кишечного происхождения, отрицательно воздействующими на мозговую функцию. Предполагают, что важнейшим из этих соединений является аммиак, побочный продукт расщепления белка, который в норме дезинтоксицируется в печени. Корреляция уровней в крови с психическим состоянием при циррозе, тем не менее, является недостоверной, отчасти, поскольку проницаемость гематоэнцефалического барьера для аммиака повышена у пациентов с HE. Другие токсины кишечного происхождения также были рассмотрены в качестве веществ, обусловливающих HE.
У пациентов с хроническим заболеванием печени возникновение печеночной энцефалопатии связано с низким качеством жизни по сравнению с подобранными по возрасту пациентами без HE. Выраженные эпизоды HE истощают организм, могут происходить внезапно, приводят пациента в состояние неспособности к самообслуживанию и зачастую приводят к госпитализации. У пациентов с HE проявляются симптомы, включающие утомляемость, дневную сонливость и отсутствие отчета в собственных действиях (показатель Conn равен 1); и спутанность сознания и дезориентация (показатель Conn равен 2), которые значительно мешают повседневной функции и снижают способность к самообслуживанию. Зачастую, это отсутствие способности к самообслуживанию приводит к неправильному питанию и несоблюдению терапии и в дальнейшем приводит к появлению более тяжелых симптомов, таких как повышенная сомнолентность, полная дезориентация и ступор (показатель Conn равен 3) или кома (показатель Conn равен 4).
Было обнаружено, что анамнез выраженных эпизодов HE и тяжесть эпизодов являются прогностическими факторами сниженной выживаемости пациентов с хроническим заболеванием печени. У пациентов с циррозом печени и анамнезом выраженных эпизодов HE выживаемость составляла 42% за 1 год и 23% за 3 года после проявления эпизода HE. В другом анализе, появление эпизода HE с показателем Conn, равным 2, у пациентов с циррозом было ассоциировано с 4-кратным увеличением риска смертельного исхода.
Эти токсичные соединения получают доступ к системной циркуляции в результате сниженной функции печени или портосистемных анастомозов. Оказавшись в мозговой ткани, данные соединения вызывают изменения нейротрансмиссии, что влияет на сознание и поведение. HE объясняется глобальным угнетением действия центральной нервной системы от азотсодержащих соединений, что приводит к возбуждению гамма-аминомасляной кислоты (GABA) и сниженной нейротрансмиссии глутамата.
Провоцирующие факторы включают азотемию (29%), седативные средства, транквилизаторы, анальгетики (24%), желудочно-кишечное кровотечение (18%), избыток пищевого белка (9%), метаболический алкалоз (11%), инфекцию (3%), запор (3%). Оперативное вмешательство, в частности, процедуры трансяремного внутрипеченочного портосистемного шунтирования (TIPS), также могут провоцировать HE. Возникновение HE по неизвестным причинам составляет только 2% случаев.
Начальные проявления являются субклиническими и требуют психометрического тестирования для постановки диагноза. Существуют 4 прогрессирующие стадии поражения, известные как критерии West Haven (или показатель Conn), начиная со стадии 0 (отсутствие детектируемых изменений у индивидуума) и заканчивая стадией 4 (кома, децеребрационная поза, расширенные зрачки), как обсуждается ниже более подробно.
HE проявляется в виде непрерывной психомоторной дисфункции, нарушенной памяти, увеличенного времени реакции, сенсорных нарушений, плохой концентрации и, в тяжелых формах, в виде комы. Изменения могут затрагивать индивидуальные особенности личности, сознание, поведение и нейромышечную функцию. Неврологические симптомы могут включать гиперрефлексию, ригидность, миоклонические судороги и астериксис (размашистый «хлопающий» мышечный тремор). Выполнение задач познавательного характера, таких как соединение чисел линиями, может быть нарушено. Может иметь место печеночный запах изо рта (сладкий запах выдыхаемого воздуха). Кривые электроэнцефалограммы (ЭЭГ) демонстрируют неспецифическую медленную, трехфазную волновую активность над лобными долями. Протромбиновое время может быть удлинено и не поддаваться корректировке витамином К. Компьютерная томография головы может показывать нормальную картину или общую атрофию. Наконец, могут быть замечены признаки заболевания печени, такие как желтуха и асцит.
Диагноз HE ставят на основе анамнеза и проверки физического и умственного состояния клиническими подразделениями, знающими о существующем заболевании печени, провоцирующем факторе(ах) и/или предыдущего анамнеза HE. ЭЭГ может демонстрировать коротковолновую активность даже при легкой степени заболевания. Повышенный уровень аммиака в сыворотке крови является характерной чертой, но не обязательным фактором, и слабо коррелирует с уровнем энцефалопатии.
Лечение пациентов с хронической HE включает 1) обеспечение симптоматической терапией, 2) идентификацию и устранение провоцирующих факторов, 3) снижение азотсодержащей нагрузки из кишечника и 4) оценку необходимости для длительной терапии. Азотсодержащую нагрузку из кишечника, как правило, снижают использованием невсасываемого дисахарида (лактулозы) и/или антибиотиков.
Лактулоза считается первоочередным лечением в Соединенных Штатах, но в настоящее время она не одобрена в США либо для лечения, либо для предотвращения HE. Лактулоза метаболизируется интестинальными бактериями толстой кишки, что приводит к пониженному значению рН фекалий, слабительному эффекту и, в конечном итоге, к высвобождению каловых масс. Пониженное значение рН ионизирует аммиак (NH3) до иона аммония (NH4 +), который используется бактериями для аминокислотного и белкового синтеза. Это снижает уровни аммиака в сыворотке крови и улучшает психическую функцию.
Общепринятая терапия нацелена на снижение продукции и абсорбции аммиака. Лактулоза, как правило, используется в дозах 30-60 г ежедневно. Однако доза может быть повышена до 20-40 г TID-QID, чтобы вызвать 2-3 полусформированных испражнений в день. Если лактулоза не может быть введена перорально или через назогастральный зонд, например, пациентам со стадией 3 или 4 HE, она может быть введена в виде 300 см3 (200 г) удерживающей клизмы.
При острой энцефалопатии лактулоза может быть введена либо перорально, через рот или через назогастральный зонд, либо посредством удерживающей клизмы. Стандартная доза для перорального применения составляет 30 г с последующим дозированием каждые 1-2 часа, пока не произойдет высвобождение каловых масс. С этого момента дозирование подбирается для достижения двух или трех мягких испражнений в день.
Лактулозу отпускают без рецепта. Удобная и относительно безвкусная лекарственная форма, часто упоминаемая в торговле как «порошок лактулозы для перорального раствора», может быть получена, например, от Bertek Pharmaceuticals, Sugarland, Tex. as KristaloseRTM в пакетах по 10 и 20 г. Сиропы лактулозы, обычно продаваемые как слабительные средства, включают CephulacRTM, ChronulacRTM, CholacRTM и EnuloseRTM. Этими сиропами можно заменить порошок лактулозы путем использования достаточного количества сиропа для обеспечения требуемой дозы лактулозы; обычно, перечисленные сиропы содержат приблизительно 10 г лактулозы в 15 мл сиропа.
Антибиотики широкого спектра действия, активные в отношении желудочно-кишечного тракта, включая неомицин, метронидазол, ванкомицин и паромомицин, были использованы с лактулозой и без нее. Действующие директивы рекомендуют неомицин в количестве от 1 до 2 г в день через рот с периодическим контролем функции почек и ежегодным контролем слуха или метронидазол в количестве 250. Лактулоза может вызывать диарею, приводя к обезвоживанию, провоцирующему фактору HE. Дополнительно, соблюдение приема лактулозы ограничивается отвращением пациентов к ее чрезмерно сладкому вкусу. Кроме того, режим дозирования, который связан с ритмом опорожнения кишечника и побочными эффектами в виде метеоризма, вздутия живота, диареи (которая ведет к обезвоживанию), и ацидоз затрудняют длительное использование лактулозы.
Использование антибиотиков при лечении HE затруднено в связи с токсичностью, связанной с длительным использованием. В частности, системная абсорбция неомицина, метронидазола и ампициллина приводила к редким случаям нефротоксичности, ототоксичности, стафилококковому энтероколиту (S. enterocolitis) и/или развитию резистентных бактериальных штаммов. Кроме того, неомицин ингибирует только аэробные бактерии. Метронидазол метаболизируется медленно у пациентов с печеночной дисфункцией, обладает возможностью взаимодействия со спиртами (дисульфирамоподобный эффект), и высокие уровни в крови могут приводить к пароксизмам.
Одним из антибиотиков, специфичных к желудочно-кишечному тракту, является рифаксимин. Рифаксимин не является аминогликозидом, является полусинтетическим антибиотиком, полученным из рифамицина О. Он не оказывает системного действия, не абсорбируется, обладает широким спектром действия, является антибиотиком для перорального применения, специфичным для кишечных патогенов желудочно-кишечного тракта. Было обнаружено, что рифаксимин является предпочтительным при лечении HE относительно ранее используемых антибиотиков; например, ничтожно малая системная абсорбция (<0,4%) относительно приема пищи или наличия желудочно-кишечного заболевания и отсутствие доказательств накопления в плазме крови при высоких или повторных дозах. Отсутствие системной абсорбции обусловливает безопасность и хорошую переносимость рифаксимина, тем самым, улучшая исполнительность больного и уменьшая побочные эффекты, связанные с известными на настоящий момент способами лечения.
Рифаксимин (INN; см. справочник The Merck Index, XIII Ed., 8304) является антибиотиком, принадлежащим к рифамициновому классу антибиотиков, как, например, пиридо-имидазо-рифамицин. Рифаксимин проявляет широкий спектр антибактериальной активности, например, в желудочно-кишечном тракте в отношении локализованных желудочно-кишечных бактерий, вызывающих инфекционную диарею, синдром раздраженного кишечника, избыточный бактериальный рост в тонкой кишке, болезнь Крона и/или недостаточность поджелудочной железы. Было опубликовано, что рифаксимин характеризуется ничтожно малой системной абсорбцией вследствие его химических и физических свойств (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int J Clin Pharmacol Res, 14 (2), 51-56, (1994)).
Рифаксимин описан в итальянском патенте IT 1154655 и EP 0161534. Патент ЕР 0161534 раскрывает способ производства рифаксимина с использованием рифамицина О в качестве исходного материала (The Merck Index, XIII Ed., 8301). US 7045620 B1 предоставляет информацию о полиморфных формах рифаксимина. Заявки и патенты, на которые ссылаются в настоящем документе, в полном объеме включены в настоящий документ путем ссылки во всех отношениях.
Варианты осуществления изобретения, предусмотренные в настоящем документе, также относятся к введению лекарственных препаратов субъекту, нуждающемуся в лечении композициями, такими как рифаксимин.
Рифаксимин является соединением рифамицинового класса антибиотиков. Рифаксимин является соединением, обладающим структурой Формулы I:
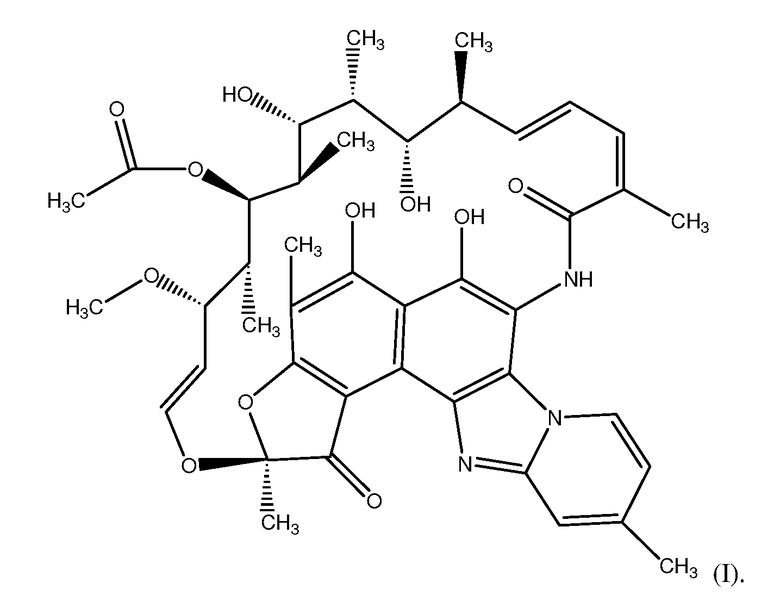
В одном варианте осуществления изобретения рифаксимин является плохо абсорбируемой молекулой у определенных субъектов. Это показано в клинических фармакокинетических исследованиях на нормальных субъектах после однократного и многократного перорального дозирования, демонстрирующих, что рифаксимин плохо абсорбируется из желудочно-кишечного тракта (например, <1% данного лекарственного средства абсорбируется после перорального введения). В то время как следовые количества исходного лекарственного средства и метаболиты были обнаружены в моче, было обнаружено выделение рифаксимина в больших количествах с каловыми массами, в основном, в неизменном виде. При повторном введении было незначительное или вовсе отсутствовало системное накопление лекарственного средства, и время достижения равновесного состояния было коротким. Непредвиденным было то, что введение ежедневной дозы в 1,5 раза выше по схеме приема лекарственных средств трижды в день не привело к пропорциональному увеличению общего суточного системного воздействия рифаксимина; AUCTotal только приблизительно на 13% был выше после дозирования трижды в день, чем после дозирования дважды в день.
«Рифаксимин», как используется в настоящем документе, включает сольваты и полиморфные формы молекулы, включая, например, α, β, γ, δ, ε, η, ξ и аморфные формы рифаксимина. Эти формы описаны более подробно, например, в USSN 11/873841; USSN 11/658702; EP 05004635.2, зарегистрированной 03 мая 2005; USPN 7045620; US 61/031329; и G. C. Viscomi, et al., CrystEngComm, 2008, 10, 1074-1081 (апрель 2008). Полное описание каждой из этих ссылок включено в настоящий документ путем ссылки.
«Полиморфизм», как используется в настоящем документе, относится к существованию различных кристаллических форм одного соединения в определенном гидратированном состоянии, например, свойству некоторых соединений и комплексов. Таким образом, полиморфы являются четко выраженными твердыми веществами, имеющими одинаковую молекулярную формулу, несмотря на то, что каждый полиморф может иметь определенные физические свойства. Таким образом, одно соединение может служить источником образования разнообразных полиморфных форм, где каждая форма имеет различные и определенные физические свойства, такие как профили растворимости, температуры точек плавления, гигроскопичность, форма частицы, плотность, текучесть, прессуемость и/или пики рентгеновской дифракции. Растворимость каждого полиморфа может варьировать, таким образом, идентификация существования фармацевтических полиморфов является существенно важным для обеспечения фармацевтических препаратов предсказуемыми профилями растворимости. Желательно исследовать все формы лекарственного средства в твердой фазе, включая все полиморфные формы, и определить стабильность, растворение и характеристики текучести каждой полиморфной формы. Полиморфные формы соединения могут быть различимы в лаборатории способом рентгенодифракционной спектроскопии и другими способами, такими как инфракрасная спектрометрия. Для общего обзора полиморфов и фармацевтического применения полиморфов см. G. M. Wall, Pharm Manuf. 3, 33 (1986); J. K. Haleblian and W. McCrone, J Pharm. Sci., 58, 911 (1969); and J. K. Haleblian, J. Pharm. Sci., 64, 1269 (1975), каждая из которых включена в настоящий документ путем ссылки.
Используемый в настоящем документе термин «системное воздействие» предназначен для обозначения воздействия рифаксимина на субъект путем его введения и последующего воздействия рифаксимина в плазме крови субъекта с последующим распределением по всему организму субъекта. Повышенное системное воздействие может быть измерено путем определения концентрации рифаксимина в плазме крови субъекта. В иллюстративных вариантах осуществления изобретения повышенное системное воздействие может быть результатом снижения клиренса рифаксимина.
Сочетание патофизиологических факторов может объяснить увеличение воздействия рифаксимина на субъекты с анамнезом HE по сравнению со здоровыми субъектами. Эпизоды печеночной энцефалопатии как результат накопления в центральной нервной системе азотсодержащих веществ кишечного происхождения (в основном аммиак) вследствие портосистемных анастомозов и портальной гипоперфузии связаны с циррозом печени. Субъекты, имеющие легкое и умеренное нарушение функции печени и документально подтвержденный анамнез эпизодов печеночной энцефалопатии, были включены в исследование. Печеночная энцефалопатия является осложнением цирроза в результате портальной гипертензии, церебральной вазодилатации и печеночной недостаточности. Недавние исследования показали высокую распространенность спонтанных портосистемных анастомозов при персистирующей печеночной энцефалопатии.
При хроническом заболевании печени значительная часть кровообращения в системе воротной вены не протекает через функциональные клетки печени из-за наличия внутрипеченочных функциональных анастомозов или внепеченочных анатомических анастомозов. В результате пресистемный клиренс перорально введенных веществ снижен, а системная биодоступность повышена. Более высокие показатели воздействия рифаксимина, по-видимому, были отчасти вследствие уменьшения пресистемного метаболизма при наличии портосистемных анастомозов и/или портальной гипоперфузии. Эта возможность подкреплена тем фактом, что хотя воздействие рифаксимина в плазме крови из желудочно-кишечного тракта ограничено (~0,32% дозы), существует гипотеза о том, что эта небольшая абсорбированная фракция подвергается метаболизму первого прохода у здоровых субъектов (~90,6%), поскольку только небольшая доля рифаксимина в неизмененном виде выделяется с мочой (0,03% дозы). Кроме того, поскольку терминальное t1/2 рифаксимина было клинически статистически значимо продолжительнее (приблизительно в 2 раза) у субъектов с HE относительно здоровых субъектов, более сильное воздействие, обнаруженное при HE, может быть результатом уменьшения системного клиренса лекарственного средства.
Как используется в настоящем документе, «субъект» включает организмы, способные страдать нарушением работы кишечника или другим нарушением, поддающимся лечению рифаксимином, или которые могли бы в других случаях получать положительный результат от введения продукта рифаксимина, как описано в настоящем документе, такие как человек и животные, отличные от человека. Термин «животные, отличные от человека», предусмотренные в настоящем документе, включает всех позвоночных, например, млекопитающих, например, грызунов, например, мышей, и не относящихся к млекопитающим, таким как отличные от человека приматы, например, овца, собака, корова, цыплята, амфибии, рептилии и т.д.
«Подверженный нарушениям работы кишечника», как используется в настоящем документе, включает субъектов, имеющих риск развития нарушения работы кишечника, например, субъекты, страдающие HE, угнетением иммунитета, субъекты, которые контактировали с другими субъектами с бактериальной инфекцией, субъекты с семейным анамнезом нарушения работы кишечника, субъекты с генным профилем, указывающим на наличие заболевания или риск развития нарушения работы кишечника, субъекты с известной предрасположенностью к возникновению нарушения работы кишечника, врачи, медсестры, субъекты, путешествующие в отдаленные районы, где распространены бактерии, вызывающие диарею путешественников, и т.д.
Субъект, «страдающий печеночной недостаточностью», как используется в настоящем документе, включает субъектов, у которых диагностировано клиническое снижение функции печени, например, вследствие печеночной энцефалопатии, гепатита или цирроза. Печеночная недостаточность может быть выражена количественно, используя любую из целого ряда шкал, включая индекс модели терминальной стадии заболевания печени (MELD), показатель Child-Pugh или показатель Conn.
Индекс MELD использует значения у пациента сывороточного билирубина, сывороточного креатинина и международное нормализованное отношение для протромбинового времени (INR) для обеспечения весового численного значения для корреляции с ожидаемой выживаемостью. Индекс 10-19 коррелирует с 27% смертностью в течение трех месяцев, а индекс <10 коррелирует с 4% смертностью в течение трех месяцев. Способы определения и анализа индексов MELD хорошо известны в данной области техники.
Показатель Child-Pugh (в ряде случаев, показатель Child-Turcotte-Pugh), используемый для оценки прогноза хронического заболевания печени, в основном цирроза, является совокупным показателем пяти клинических измерений, билирубина, сывороточного альбумина, INR, асцита и печеночной энцефалопатии. Каждому маркеру присваивается значение от 1 до 3, и общее значение используется для обеспечения показателя, классифицируемого как A (5-6 баллов), B (7-9 баллов) или C (10-15 баллов), который может коррелировать с одно- и двухлетней выживаемостью. Способы определения и анализа показателей Child-Pugh хорошо известны в данной области техники.
Измерения изменения психического статуса могут быть выполнены, например, с помощью показателя Conn (также известного как показатель West Haven). Показатель Conn был широко использован в качестве измерения психического статуса в исследовании HE и основан на критериях Parsons-Smith с изменениями Conn. Астериксис не рассматривается при оценке статуса субъекта, используя критерии оценки показателя Conn, перечисленные ниже.
Шкала, используемая в системе оценки показателя Conn, представлена ниже.
Степень 0=HE выявлены аномалии личностных свойств или поведения
Степень 1=Тривиальное отсутствие восприятия, эйфория или тревожность; укороченная продолжительность концентрации внимания; нарушение сложения или вычитания
Степень 2=летаргия; дезориентация во времени; очевидные изменения личности; неадекватное поведение
Степень 3=Сомнолентность вплоть до полуступора, реагирующий на стимулы; растерянный; выраженная дезориентация; причудливое поведение
Степень 4=Кома; отсутствие способности пройти тестирование состояния психики.
Степень астериксиса (хлопающего тремора) может быть определена у субъекта, держащего обе руки и предплечья вытянутыми с согнутыми вверх запястьями и растопыренными пальцами в течение ≥30 секунд. Астериксис был измерен по континууму 5 степеней, например, степени 0 и 4=отсутствие аномального движения в противовес почти непрерывным хлопающим движениям, соответственно, как показано ниже:
Степень 0=тремор отсутствует;
Степень 1=редкие хлопающие движения;
Степень 2=происходящие время от времени, нерегулярные хлопающие непроизвольные движения;
Степень 3=частые хлопающие непроизвольные движения; и
Степень 4=почти непрерывные хлопающие движения.
Активность действия относительно степени астериксиса может быть измерена как время какого-либо увеличения степени астериксиса от базового уровня. Время увеличения степени астериксиса было вычислено как число дней от первой дозы рифаксимина до первичного возникновения увеличения степени астериксиса от базового уровня.
Выражение «профилактически эффективное количество» соединения относится к количеству соединения, представленного в настоящем документе формулой (I) или по-другому описанного в настоящем документе, которое эффективно при однократном или многократном введении дозы субъекту для предотвращения или лечения бактериальной инфекции или HE.
Выражение «терапевтически эффективное количество» относится к количеству вещества, которое эффективно при однократном или многократном введении дозы субъекту для обеспечения благоприятного терапевтического эффекта субъекту. В другом варианте осуществления изобретения благоприятный терапевтический эффект заключается в ингибировании бактериальной инфекции или продлении выживаемости субъекта с такой бактериальной инфекцией сверх ожидаемого в отсутствие такого лечения.
Рифаксимин проявляет антибактериальную активность широкого спектра в желудочно-кишечном тракте в отношении локализованных желудочно-кишечных бактерий, которые вызывают инфекционную диарею, включая анаэробные штаммы. Было опубликовано, что рифаксимин характеризуется ничтожно малой системной абсорбцией вследствие его химических и физических свойств (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int J Clin Pharmacol Res, 14 (2), 51-56, (1994)).
Было обнаружено, что наличие печеночной недостаточности оказывает влияние на воздействие рифаксимина in vivo в плазме крови. Таким образом, это делается критерием для рассмотрения работником здравоохранения (например, врачом, ассистентом врача, фельдшером, фармацевтом) при назначении дозы рифаксимина для лечения нарушения работы кишечника, такого как диарея путешественников или IBS. Печеночная недостаточность приводит к клинически статистически значимому увеличению рифаксимина, адсорбируемого у субъектов, проходящих лечение. Одним вариантом осуществления изобретения, рассмотренным в настоящем документе, являются способы модуляции терапевтического действия рифаксимина, путем отбора субъекта, страдающего печеночной недостаточностью, и дополнительного обеспечения профилактики или лечения печеночной недостаточности.
Соответственно, одним вариантом осуществления изобретения является способ лечения диареи путешественников (TD) у субъекта. В данном способе рифаксимин вводят субъекту, страдающему заболеванием, поддающимся лечению рифаксимином. Субъекта информируют о том, что системное воздействие рифаксимина в плазме крови увеличено у субъектов, страдающих печеночной недостаточностью, по сравнению с субъектами, не страдающими печеночной недостаточностью. Эта информация повышает уровень безопасности введения рифаксимина субъекту. Примеры заболеваний, поддающихся лечению рифаксимином, включают диарею путешественников и печеночную энцефалопатию.
Как используется в настоящем документе, «информирование» или «консультирование», означают ссылку на или обеспечение опубликованного или устного материала. Например, снабжение активного вещества опубликованным материалом для пользователя; или представление информации в устной форме, например, путем презентации на семинаре, конференции или других образовательных презентациях, путем общения между торговым представителем фармацевтической компании и работником здравоохранения или путем общения между работником здравоохранения и пациентом; или демонстрация надлежащей информации пользователю для понимания. Примеры работников здравоохранения включают врачей, медсестер и фельдшеров.
Один аспект данного изобретения включает предоставление информации прописывающим лекарственное средство врачам и пациентам, получающим лечение рифаксимином, что полезно для сведения к минимуму проблемы безопасности рифаксимина. В этом варианте осуществления изобретения в данной информации сообщается о том, что системное воздействие рифаксимина в плазме крови повышено у субъектов, страдающих печеночной недостаточностью, по сравнению с субъектами, не страдающими печеночной недостаточностью. В одном варианте осуществления изобретения информация представлена на этикетке. В другом варианте осуществления изобретения информация представлена в информационном листе, который выдается пациенту, когда заполняется рецепт на рифаксимин.
Кроме того, способ может также включать стадию или стадии распределения назначаемых доз рифаксимина аптечными организациями или распределения учебных материалов среди аптечных организаций, включая фармацевтов с учебным материалом, включающим информацию о том, что необходимо знать пациенту и что должен предпринимать пациент, чтобы избежать любых побочных эффектов рифаксимина при приеме дозы.
Кроме того, способ может включать стадию или стадии обеспечения методическими рекомендациями фармацевтов для консультирования пациентов в отношении того, что пациенту необходимо знать и что должен предпринять пациент в целях безопасного применения им доз рифаксимина. Способ может дополнительно включать стадию, требующую подтверждения получения учебных материалов и методических рекомендаций от фармацевтов и дальнейшего подтверждения получения учебных материалов пациентом от фармацевтов.
Другим вариантом осуществления изобретения является способ использования рифаксимина для лечения состояния больного. Вариант осуществления изобретения включает обеспечение пациента рифаксимином и информирование пациента или работника здравоохранения о том, что системное воздействие рифаксимина в плазме крови повышено у пациентов, страдающих печеночной недостаточностью, и что введение рифаксимина пациенту с печеночной недостаточностью может влиять на концентрацию в плазме крови, безопасность или эффективность рифаксимина.
Еще один вариант осуществления изобретения включает способ лечения субъекта, страдающего заболеванием, поддающимся лечению рифаксимином. Этот способ включает введение рифаксимина субъекту и информирование субъекта о том, что системное воздействие рифаксимина в плазме крови повышено у субъектов, страдающих печеночной недостаточностью, по сравнению с субъектами, не страдающими печеночной недостаточностью.
Способы лечения
Предусмотренными в настоящем документе являются способы определения дозы рифаксимина для лечения, предотвращения или частичного снятия симптомов нарушений, связанных с работой кишечника, в частности, диареи путешественников, у субъекта, дополнительно страдающего печеночной недостаточностью, например, вследствие печеночной энцефалопатии. Нарушения, связанные с работой кишечника, включают одно или несколько из печеночной недостаточности, цирроза, поликистозной болезни печени, синдрома раздраженного кишечника, диареи, ассоциированной с микроорганизмами диареи, ассоциированную с Clostridium difficile диареи, диареи путешественников, избыточного бактериального роста в тонкой кишке, болезни Крона, хронического панкреатита, недостаточности поджелудочной железы, энтерита, колита, печеночной энцефалопатии (или других заболеваний, которые ведут к повышению уровней аммиака) или паучита.
Используемый в настоящем документе термин «печеночная недостаточность» включает заболевания и нарушения, при которых субъект имеет нарушенную функциональную активность печени. Клинически, субъекты, страдающие печеночной недостаточностью, имеют сниженную, например, статистически значимо сниженную, функцию печени. Печеночная недостаточность обычно приводит к нарушению работы печени. Иллюстративным заболеванием, которое служит доказательством наличия печеночной недостаточности, является печеночная энцефалопатия.
Используемый в настоящем документе термин «печеночная энцефалопатия» относится к обратимому нейропсихиатрическому расстройству в инициации хронической или острой печеночной недостаточности. При поражении печени у субъекта токсические вещества, которые в норме метаболизируются в печени, накапливаются в крови, тем самым нарушая функцию мозга. Эти токсические вещества, как правило, являются азотсодержащими веществами, главным образом, аммиаком. Появившись в мозговой ткани, соединения вызывают изменения нейротрансмиссии, которые влияют на сознание и поведение. Существуют 4 стадии поэтапного нарушения, ассоциированного с HE, которые определены с использованием критерия West Haven (или показателя Conn), начиная со стадии 0 (отсутствие детектируемых изменений у индивидуума) и заканчивая стадией 4 (кома, децеребрационная поза, расширенные зрачки). Типичные симптомы печеночной энцефалопатии могут включать нарушенную когнитивную деятельность, хлопающий тремор (астериксис) и сниженный уровень сознания, включая кому (например, печеночную кому), отек головного мозга и, с некоторой вероятностью, смерть. Печеночную энцефалопатию обычно называют в литературе печеночной комой или портосистемной энцефалопатией.
Используемый в настоящем документе термин «диарея путешественников» относится к желудочно-кишечному заболеванию обычно среди путешественников. Большинство случаев вызвано бактериальной, вирусной или протозойной инфекцией. Главным источником заражения является поглощение загрязненной фекалиями пищи или воды. Продолжительность лечения для определенного нарушения работы кишечника будет зависеть отчасти от данного нарушения. Например, HE можно лечить каждый день в течение остатка жизни субъекта, продолжительность лечения диареи путешественников может составить только от 12 до приблизительно 72 часов, в то время как продолжительность лечения болезни Крона может составить приблизительно от 2 дней до 3 месяцев. Дозы рифаксимина будут также варьировать в зависимости от течения заболевания.
Идентификация тех субъектов, которые нуждаются в профилактическом лечении нарушения работы кишечника, находится в рамках компетенции и знаний специалиста в данной области техники. Определенные способы идентификации субъектов, находящихся в группе риска развития нарушения работы кишечника, которое можно лечить рассматриваемым способом, высоко ценятся в медицинских областях техники, такие как семейный анамнез, хронология путешествия и предполагаемые планы путешествия, наличие факторов риска, связанных с развитием данного болезненного состояния у субъекта. Клиницист, специализирующийся в данной области техники, может без труда идентифицировать таких претендентов путем использования, например, клинических исследований, медицинского осмотра и история болезни/семьи/путешествия.
Способ оценки степени печеночной недостаточности у субъекта может включать использование любой из систем балльной оценки, представленных выше, таких как индекс MELD, показатель Child-Pugh, показателя Conn.
В еще одном аспекте способ лечения субъекта, страдающего или подверженного кишечному расстройству, включает введение нуждающемуся в этом субъекту терапевтически эффективного количества рифаксимина для лечения, тем самым, субъекта. После идентификации субъекта, страдающего или подверженного кишечному расстройству, вводят рифаксимин. Рифаксимин может быть введен, например, после диагностирования, после эпизода HE, во время эпизода HE, после установления диагноза минимальной HE или когда критическая частота мельканий достигает уровня, указывающего на эпизод HE, и т.д. Как обсуждается в настоящем документе, врач может изменить дозировку рифаксимина, введенного субъекту для лечения кишечного расстройства, если субъект также страдает печеночной недостаточностью. Эффективность лечения может быть измерена, например, как снижение избыточного бактериального роста. Эффективность может быть также измерена по ослаблению симптомов, связанных с кишечным расстройством, стабилизации симптомов или прекращению симптомов, связанных с кишечным расстройством, например, по ослаблению одного или нескольких из тошноты, вздутия живота, диареи, тяжести последующего эпизода HE и т.п., или по увеличению одного или нескольких временных периодов до следующего эпизода HE, когнитивной способности и т.п.
Одним из вариантов осуществления изобретения является способ лечения или предотвращения печеночной энцефалопатии (HE) путем введения терапевтически эффективного количества рифаксимина субъекту.
Варианты осуществления изобретения относятся к обнаружению эффективности рифаксимина для лечения и предотвращения печеночной энцефалопатии. Варианты осуществления изобретения относятся к использованию рифаксимина для предотвращения появления симптомов HE, а также для удлинения времени до первого спонтанного эпизода HE. В одном варианте осуществления изобретения время до первого спонтанного эпизода HE было измерено по увеличению показателя Conn до степени ≥2 (например, от 0 или 1 до ≥2) или по увеличению показателя Conn и степени астериксиса на одну ступень каждого для тех субъектов, которые имеют исходный показатель Conn, равный 0. В другом варианте осуществления изобретения время до спонтанного эпизода HE было измерено по времени до любого увеличения от исходного значения либо показателя Conn (уровень психического состояния), либо степени астериксиса, с использованием оценок выживаемости по способу Каплана-Мейера кумулятивных пропорций субъектов с любым увеличением на 28, 56, 84, 112, 140 и 168 дни.
Другим вариантом осуществления изобретения было среднее изменение от исходного уровня концентрации аммиака в крови в динамике по времени или среднее изменение от исходного уровня значений критической частоты мелькания в динамике по времени. Дополнительный вариант осуществления изобретения был выражен средним ежедневным потреблением лактулозы в динамике по времени, сдвигами от исходного уровня показателей Conn в динамике по времени; или сдвигами от исходного уровня степени астериксиса в динамике по времени. Если не указано иное, сдвигом значения является изменение этого значения от исходного уровня.
Другие измерения эффективности способов лечения, описанных в настоящем документе, включали среднее изменение от исходного уровня баллов опросного листа по хроническому заболеванию печени (CLDQ) в динамике по времени; среднее изменение от исходного уровня баллов шкалы сонливости Эпворса в динамике по времени; и пропорцию субъектов, у которых балл шкалы сонливости Эпворса был >10. Оценка тяжести персистирующей печеночной энцефалопатии может быть также основана, например, на показателях Conn.
В другом варианте осуществления изобретения субъекту, страдающему от, подверженному или находящемуся в стадии ремиссии печеночной энцефалопатии (HE), может быть введен рифаксимин на период приблизительно от 24 недель до 24 месяцев. При лечении HE рифаксимин может быть введен субъекту на 12 месяцев и дольше, например, на полный период жизни субъекта. В одном варианте осуществления изобретения рифаксимин вводят ежедневно до самой смерти субъекта.
В одном варианте осуществления изобретение относится к способу снижения риска появления спонтанного эпизода у субъекта путем введения субъекту рифаксимина. В одном варианте осуществления для субъектов, имеющих последний эпизод HE за 90 или более дней до начала лечения, риск возникновения неблагоприятного исхода был снижен на 58%. В другом варианте осуществления изобретения риск возникновения неблагоприятного исхода был снижен приблизительно на 30-70%. В другом варианте осуществления изобретения риск был снижен приблизительно на 40-70%.
В одном варианте осуществления изобретения для субъектов, имеющих последний эпизод HE более чем за 90 дней до введения рифаксимина, риск возникновения неблагоприятного исхода был снижен приблизительно в пределах 60%. В другом варианте осуществления изобретения риск возникновения неблагоприятного исхода был снижен приблизительно в пределах 2-80%.
В другом варианте осуществления изобретения для субъектов, имеющих два или несколько эпизодов HE в 6 месяцев до начала лечения, риск возникновения спонтанного эпизода HE был снижен приблизительно на 56%. В одном варианте осуществления изобретения риск возникновения спонтанного эпизода HE был снижен приблизительно на 20-70%.
В другом варианте осуществления изобретения для субъектов, имеющих более чем два эпизода HE в шесть месяцев до начала лечения, риск возникновения спонтанного эпизода HE был снижен приблизительно на 63%. В другом варианте осуществления изобретения риск был снижен приблизительно на 30-80%.
Используемый в настоящем документе термин «константа скорости терминальной элиминации» относится к константе скорости первого порядка, описывающей элиминацию рифаксимина из организма субъекта. Это суммарная константа скорости элиминации, описывающая удаление рифаксимина путем всех процессов элиминации, включая экскрецию и метаболизм.
Используемый в настоящем документе термин «концентрация в плазме крови» относится к концентрации рифаксимина в плазме крови субъекта. Концентрации рифаксимина в плазме крови могут быть определены, например, с использованием способа обращено-фазной высокоэффективной жидкостной хроматографии с тандемной квадрупольной масс-спектрометрией (LC/MS/MS), как указано в примерах. Максимальная концентрация в плазме крови в равновесном состоянии указывается в настоящем документе в виде Cmax, и минимальная концентрация в плазме крови указывается в настоящем документе как Cmin.
Используемый в настоящем документе термин «скорость клиренса» относится к объему биологической жидкости, полностью очищенной от метаболитов лекарственного препарата, что измеряется в единицу времени. Элиминация происходит в результате метаболических процессов в почках, печени, слюне, поту, кишечнике, сердце, головном мозге и в других местах.
Как используется в настоящем документе, аланинаминотрансфераза, также обозначаемая как ALT, относится к тесту, выполняемому с целью выявления повреждения печени или печеночной недостаточности. Уровень данного фермента, ALT, измеряется, чтобы определить, имеется ли у индивидуума повреждение или заболевание печени. В крови обнаруживают в норме низкие уровни ALT. Но при повреждении или заболевании печени ALT высвобождается в кровоток. Уровни ALT могут быть измерены способами, известными специалистам в данной области техники.
Фармацевтические препараты
Варианты осуществления изобретения также представляют фармацевтические композиции, содержащие эффективное количество рифаксимина, описанного в настоящем документе, и фармацевтически приемлемый носитель. В дополнительном варианте осуществления изобретения эффективное количество является эффективным в лечении бактериальной инфекции, например, избыточного бактериального роста в тонкой кишке, болезни Крона, печеночной энцефалопатии, ассоциированного с антибиотиком колита и/или дивертикулеза у субъекта, дополнительно страдающего печеночной недостаточностью.
Примеры использования рифаксимина для лечения диареи путешественников см.

каждая из которых включена в полном объеме в настоящий документ путем ссылки. Варианты осуществления изобретения также представляют фармацевтические композиции, содержащие рифаксимин и фармацевтически приемлемый носитель. Дозы могут быть выбраны, например, на основе требуемых величин системной абсорбции, скорости элиминации, концентрации в плазме и т.п. Варианты осуществления фармацевтической композиции дополнительно включают эксципиенты, например, один или несколько разбавителей, связующих веществ, смазывающих веществ, веществ для улучшения распадаемости лекарственных форм, окрашивающих веществ, ароматизаторов или подсластителей. Одна композиция может быть составлена для выбранных таблеток, покрытых и не покрытых оболочкой, твердых и мягких желатиновых капсул, покрытых сахаром пилюль, пастилок, облаток, пеллетов и порошков в герметизированной упаковке. Например, композиции могут быть составлены для местного использования, например, мази, помады, кремы, гели и лосьоны. В варианте осуществления изобретения рифаксимин вводят субъекту, используя фармацевтически приемлемую лекарственную форму, например, фармацевтически приемлемую лекарственную форму, которая обеспечивает непрерывную доставку рифаксимина субъекту в течение, по меньшей мере, 12 часов, 24 часов, 36 часов, 48 часов, одной недели, двух недель, трех недель или четырех недель после введения субъекту фармацевтически приемлемой лекарственной формы.
В определенных вариантах осуществления изобретения эти фармацевтические композиции являются подходящими для местного или перорального введения субъекту. В других вариантах осуществления изобретения, описанных подробно ниже, фармацевтические композиции, предусмотренные в настоящем документе, могут быть специально составлены для введения в твердой или жидкой форме, включая те, которые приспособлены для следующего: (1) перорального введения, например, кисели (водные и неводные растворы или суспензии), таблетки, болюсы, порошки, гранулы, пасты; (2) парентерального введения, например, путем подкожной, внутримышечной или внутривенной инъекции в виде, например, стерильного раствора или суспензии; (3) местного применения, например, в виде крема, мази или спрея, наносимых на кожу; (4) интравагинального или интраректального применения, например, в виде пессария, крема или пены; или (5) аэрозоля, например, в виде водного аэрозоля, липосомального препарата или твердых частиц, содержащих лекарственный препарат.
Фраза «фармацевтически приемлемый» относится к композициям рифаксимина, содержащим рифаксимин и/или лекарственные формы, которые, в рамках тщательной медицинской клинической оценки, пригодны для использования при контакте с тканями людей и животных без превышающей норму токсичности, раздражения, аллергической реакции или других проблем или осложнения, соразмерно с разумным соотношением пользы/риска.
Фраза «фармацевтически приемлемый носитель» включает фармацевтически приемлемое вещество, композицию или наполнитель, например, жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующее вещество, вовлеченные в переносе или транспорт испытуемого химического вещества от одного органа или части тела, к другому органу или части тела. Каждый носитель является предпочтительно «приемлемым» в смысле совместимости с другими ингредиентами лекарственной формы и отсутствия нанесения вреда субъекту. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетатцеллюлоза; (4) порошкообразный трагант; (5) ржаной солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и суппозиторий с воском; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера; и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических лекарственных формах.
В твердых лекарственных формах рифаксимина для перорального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы и т.п.) активный ингредиент обычно смешивают с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальцийфосфат, и/или с любым из следующего: (1) наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; (3) увлажнителями, такими как глицерин; (4) веществами, улучшающими распадаемость лекарственных форм, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия; (5) замедлителями для раствора, такими как парафин; (6) ускорителями абсорбции, такими как соединения четвертичного аммония; (7) смачивающими веществами, такими как, например, ацетиловый спирт и глицеринмоностеарат; (8) абсорбентами, такими как каолин и бентонитовая глина; (9) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) окрашивающими веществами. В случае капсул, таблеток и пилюль, фармацевтические композиции могут также содержать буферные вещества. Твердые композиции подобного типа могут также быть использованы в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п.
Таблетка может быть изготовлена путем прессования или формования, необязательно с одним или несколькими добавочными ингредиентами. Прессованные таблетки могут быть получены с использованием связующего вещества (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, натриевой соли гликолята крахмала или поперечно-связанной натриевой соли карбоксиметилцеллюлозы), поверхностно-активное или диспергирующее вещество. Формованные таблетки могут быть изготовлены путем формования в подходящих для этих целей машинах смеси порошкообразного активного ингредиента, увлажненного инертным жидким разбавителем.
Таблетки и другие твердые лекарственные формы фармацевтических композиций, описанные в настоящем документе, такие как драже, капсулы, пилюли и гранулы, могут необязательно иметь риску или быть получены с покрытием и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в фармацевтическом рецептурном производстве. Они могут также быть составлены таким образом, чтобы обеспечить замедленное или контролируемое высвобождение активного ингредиента, используя, например, гидроксипропилметилцеллюлозу в различных пропорциях для обеспечения желаемого профиля высвобождения, других полимерных матриц, липосом и/или микросфер. Они могут быть стерилизованы, например, фильтрацией через удерживающие бактерии фильтры или включением стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или некоторых других стерильных инъецируемых средах непосредственно перед использованием. Эти композиции могут также необязательно содержать контрастные вещества и могут быть в композиции, что они высвобождают активный ингредиент(ы) только, или предпочтительно, в определенной части желудочно-кишечного тракта, в некоторых случаях, пролонгированным способом. Примеры заливочных композиций, которые могут быть использованы, включают полимерные вещества и воски. Активный ингредиент может быть также в микроинкапсулированной форме, при необходимости, с одним или несколькими описанными выше эксципиентами.
Жидкие лекарственные формы для перорального введения рифаксимина включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активному ингредиенту, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгирующие вещества, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное масло, масло зародышей семян, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси.
В дополнение к инертным разбавителям, композиции для перорального применения могут включать адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие вещества, подсластители, ароматизаторы, красящие вещества, отдушки и консерванты.
Суспензии, в дополнение к рифаксимину, могут содержать суспендирующие вещества как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбитол и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси.
Фармацевтические композиции для ректального или вагинального введения могут быть представлены в виде суппозиториев, которые могут быть получены смешиванием рифаксимина с одним или несколькими подходящими, не вызывающими раздражение эксципиентами или носителями, включающими, например, масло какао, полиэтиленгликоль, суппозиторий с воском или салицилат, и которые являются твердыми веществами при комнатной температуре, но жидкими при температуре тела и, таким образом, будут плавиться в прямой кишке или влагалище и высвобождать активное вещество.
Композиции, подходящие для вагинального введения, также включают пессарии, тампоны, кремы, гели, пасты, пены или спреи, содержащие такие носители, которые известны в качестве подходящих средств в данной области техники.
Лекарственные формы для местного или трансдермального введения рифаксимина включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляторы. Рифаксимин может быть смешан в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут быть необходимы.
Мази, пасты, кремы и гели могут содержать, в дополнение к рифаксимину, эксципиенты, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка или их смеси.
Порошки и спреи могут содержать, в дополнение к рифаксимину, эксципиенты, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси этих веществ. Спреи могут дополнительно содержать стандартные пропелленты, такие как хлорфторуглеводороды и легкоиспаряющиеся незамещенные углеводороды, такие как бутан и пропан.
Рифаксимин может быть альтернативно введен в виде аэрозоля. Это выполняется приготовлением водного аэрозоля, липосомального препарата или твердых частиц, содержащих соединение. Может быть использована неводная (например, фторуглеродный пропеллент) суспензия. Звуковые распылители являются предпочтительными, поскольку они минимизируют воздействие агента сдвига, что может привести к распаду соединения.
Инъецируемые депо-формы изготавливают путем образования микроинкапсулированных матриксов рифаксимина в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера и природы определенного используемого полимера, скорость высвобождения лекарственного средства можно контролировать. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые лекарственные формы депо также получают включением лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканью организма.
При введении рифаксимина в виде фармацевтического препарата, людям и животным, он может быть введен в чистом виде или в виде фармацевтической композиции, содержащей, например, от 0,1 до 99,5% (более предпочтительно, от 0,5 до 90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Независимо от пути введения, выбранный рифаксимин, который может быть использован в фармацевтических композициях, предусмотренных в настоящем документе, составляют в фармацевтически приемлемые лекарственные формы способами, известными специалистам в данной области техники.
Фактические уровни дозирования и динамика введения активных ингредиентов в фармацевтических композициях может варьировать таким образом, чтобы получить количество активного ингредиента, которое является эффективным для достижения желаемого терапевтического ответа для определенного субъекта, композиции и способа введения, не являясь токсичным для субъекта. Типичный диапазон доз составляет от 25 до 3000 мг в день.
Предпочтительная доза рифаксимина является максимальной, которую субъект может выдержать без развития серьезных побочных эффектов. Предпочтительно, рифаксимин вводят в концентрации приблизительно от 1 мг до приблизительно 200 мг на килограмм массы тела, приблизительно от 10 до приблизительно 100 мг/кг или приблизительно от 40 мг до приблизительно 80 мг/кг массы тела. Диапазоны, являющиеся промежуточными для вышеперечисленных значений, также предназначены быть частью изобретения.
В иллюстративных вариантах осуществления изобретения субъектам вводят рифаксимин 1, 2, 3 или 4 раза в день. Типичные дозы включают дозы для перорального применения величиной 100, 200, 300, 400, 500, 550, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900 или 2000 мг рифаксимина. Диапазоны, являющиеся промежуточными для вышеперечисленных значений, также предназначены быть частью изобретения. В частном иллюстративном варианте осуществления изобретения субъектам вводят 600 мг рифаксимина в день. В дополнительном частном варианте осуществления изобретения субъектам вводят три 200 мг таблетки в день.
В комбинированном терапевтическом лечении рифаксимин и другое лекарственное средство(а) вводят млекопитающим (например, людям, мужского или женского пола) общепринятыми способами. Лекарственные средства можно вводить в дозированной форме для однократного введения или в дозированных формах для раздельного введения. Эффективные количества других терапевтических средств хорошо известны специалистам в данной области техники. Однако в компетенции специалиста в данной области техники находится определение других оптимальных эффективных количественных диапазонов терапевтического средства. В одном варианте осуществления изобретения, в котором иное терапевтическое средство вводят животному, эффективное количество рифаксимина меньше его эффективного количества в случае, если не вводят другое терапевтическое средство. В другом варианте осуществления изобретения эффективное количество общепринятого средства меньше его эффективного количества в случае, если не вводят рифаксимин. Таким образом, нежелательные побочные эффекты, связанные с высокими дозами любого средства, могут быть минимизированы. Другие потенциальные преимущества (включая, без ограничений, улучшенный режим дозирования и/или сниженную стоимость препарата) являются очевидными специалистам в данной области техники.
В различных вариантах осуществления изобретения способы лечения (например, профилактические или терапевтические средства) назначают с интервалом менее 5 минут, менее 30 минут, с интервалом в 1 час, с интервалом приблизительно в 1 час, с интервалом приблизительно от 1 часа до приблизительно 2 часов, с интервалом приблизительно от 2 часов до приблизительно 3 часов, с интервалом приблизительно от 3 часов до приблизительно 4 часов, с интервалом приблизительно от 4 часов до приблизительно 5 часов, с интервалом приблизительно от 5 часов до приблизительно 6 часов, с интервалом приблизительно от 6 часов до приблизительно 7 часов, с интервалом приблизительно от 7 часов до приблизительно 8 часов, с интервалом приблизительно от 8 часов до приблизительно 9 часов, с интервалом приблизительно от 9 часов до приблизительно 10 часов, с интервалом приблизительно от 10 часов до приблизительно 11 часов, с интервалом приблизительно от 11 часов до приблизительно 12 часов, с интервалом приблизительно от 12 часов до приблизительно 18 часов, с интервалом от 18 часов до 24 часов, с интервалом от 24 часов до 36 часов, с интервалом от 36 часов до 48 часов, с интервалом от 48 часов до 52 часов, с интервалом от 52 часов до 60 часов, с интервалом от 60 часов до 72 часов, с интервалом от 72 часов до 84 часов, с интервалом от 84 часов до 96 часов, или с интервалом от 96 часов до 120 часов. В предпочтительном варианте осуществления изобретения два или более способов лечения могут быть назначены в рамках одного и того же визита субъекта.
В определенных вариантах осуществления изобретения, одно или несколько соединений и один или несколько других способов лечения (например, профилактические или терапевтические средства) назначают циклически. Циклически повторяющаяся терапия включает назначение первого способа лечения (например, первое профилактическое или терапевтическое средство) на период времени с последующим назначением второго способа лечения (например, второго профилактического или терапевтического средства) на период времени, необязательно, с последующим назначением третьего способа лечения (например, профилактического или терапевтического средства) на период времени и так далее, и повторение этого последовательного назначения, например, цикл для снижения развития устойчивости к одному из способов лечения, для предотвращения или снижения побочных эффектов одного из способов лечения и/или для улучшения эффективности способов лечения.
В определенных вариантах осуществления изобретения введение одних и тех же соединений может быть повторено, и введения могут быть отделены друг от друга, по меньшей мере, 1 днем, 2 днями, 3 днями, 5 днями, 10 днями, 15 днями, 30 днями, 45 днями, 2 месяцами, 75 днями, 3 месяцами или, по меньшей мере, 6 месяцами. В других вариантах осуществления изобретения, назначение одного и того же способа лечения (например, профилактического или терапевтического средства), отличного от рифаксимина, может быть повторено, и назначения могут быть отделены друг от друга, по меньшей мере, 1 днем, 2 днями, 3 днями, 5 днями, 10 днями, 15 днями, 30 днями, 45 днями, 2 месяцами, 75 днями, 3 месяцами или, по меньшей мере, 6 месяцами.
По определенным показаниям может потребоваться более продолжительное время лечения. Например, лечение диареи путешественников может длиться приблизительно от 12 часов до приблизительно 72 часов, в то время как лечение болезни Крона может длиться приблизительно от 1 дня до приблизительно 3 месяцев. Лечение печеночной энцефалопатии может продолжаться, например, в течение всей оставшейся жизни субъекта. Лечение IBS может быть прерывистым в течение недель или месяцев за один раз или в течение всей оставшейся жизни субъекта.
Изделие
Другой вариант осуществления изобретения включает изделия, которые включают, например, контейнер, в котором находится фармацевтическая композиция, подходящая для перорального или местного введения рифаксимина, в сочетании с напечатанными инструкциями по применению, предоставляющими информацию о том, когда определенная лекарственная форма должна быть введена с пищей и когда она должна быть принята на пустой желудок. Рекомендуемая доза может быть изменена для введения субъекту, страдающему печеночной недостаточностью, или может включать инструкцию по введению субъекту, страдающему печеночной недостаточностью. Типичные лекарственные формы и протоколы введения описаны ниже. Композиция содержится в любом подходящем контейнере, способном хранить и дозировать лекарственную форму и который в значительной степени не взаимодействует с композицией и дополнительно находится в физическом контакте с соответствующей маркировкой. Инструкции по применению находятся в соответствии со способами лечения, как описано выше в данном документе. Маркировка может быть связана с контейнером любыми способами, которые сохраняют их физический контакт, посредством неограниченного примера, они могут находиться в упаковочном материале, таком как коробка или термоусадочная пластиковая пленка, или могут быть ассоциированы с инструкциями, связанными с контейнером, например, с помощью клея, что не затрудняет понимание инструкций по применению или других наклеек или средств хранения.
Другим аспектом является изделие, который включает контейнер, содержащий фармацевтическую композицию, включающую рифаксимин, где контейнер содержит предпочтительно композицию рифаксимина в стандартной лекарственной форме и связан с напечатанными инструкциями по применению, информирующими о различной абсорбции при введении фармацевтической композиции с пищей и без пищи.
В другом аспекте, предусмотренными в настоящем документе являются изделие или набор, включающий рифаксимин, или его фармацевтическую композицию, упакованные с инструкциями по введению субъектам, имеющим печеночную недостаточность. В одном варианте осуществления изобретения инструкции информируют назначающего препарат врача, фармацевта или субъекта, что у субъектов, имеющих печеночную энцефалопатию, системно происходит абсорбция большего количества рифаксимина, чем у субъекта с нормальными, например, полностью функциональными печеночными системами. В одном варианте осуществления изобретения инструкции информируют назначающих препарат врачей о том, что они должны определить, имел ли субъект печеночную недостаточность до назначения рифаксимина субъекту для лечения заболевания кишечника. В одном варианте осуществления изобретения инструкции информируют назначающих препарат врачей о том, что они должны учитывать изменение дозировки или схемы дозирования при назначении рифаксимина субъекту, имеющему печеночную энцефалопатию. Дополнительно, инструкции могут предоставлять указания по применению препарата для субъектов с печеночной недостаточностью. В другом варианте осуществления изобретения инструкции информируют субъекта и/или медицинского работника о существовании различия в воздействии рифаксимина в плазме крови между субъектами с HE и субъектами с нормальной функцией печени.
Упакованные композиции также предусмотрены и могут включать терапевтически эффективное количество рифаксимина. Рифаксимин и фармацевтически приемлемый носитель или разбавитель, где композиция составлена для лечения субъекта, страдающего или подверженного кишечному расстройству, и упакована вместе с инструкциями для лечения субъекта, страдающего или подверженного кишечному расстройству.
Наборы также предусмотрены в настоящем документе, например, наборы для лечения кишечного расстройства у субъекта. Наборы могут содержать, например, рифаксимин и инструкции по использованию при лечении субъекта с кишечным расстройством, который также страдает печеночной недостаточностью. Инструкции по использования могут содержать указания по применению, информацию по дозированию, информацию по хранению и т.п.
Упакованные композиции также предусмотрены и могут включать терапевтически эффективное количество рифаксимина и фармацевтически приемлемый носитель или разбавитель, где композиция составлена для лечения субъекта, страдающего или подверженного кишечному расстройству, и упакована вместе с инструкциями по лечению субъекта, страдающего или подверженного кишечному расстройству.
ПРИМЕРЫ
Варианты осуществления изобретения основаны отчасти на демонстрации того, что рифаксимин дифференциально абсорбируется у субъектов, имеющих другие клинические состояния, например, печеночную энцефалопатию. Следует учесть, что изобретение не должно быть истолковано ограниченными примерами, которые описаны далее; напротив, изобретение должно рассматриваться для включения любых и всех заявок, предусмотренных в настоящем документе, и всех эквивалентных вариантов в рамках квалификации обычного специалиста.
Пример 1
Клиническое исследование введения рифаксимина субъектам с нарушенной функцией печени
Для определения влияния нарушенной функции печени на эффективность рифаксимина были проведены исследования на субъектах, имеющих печеночную энцефалопатию (HE). HE, также известная как печеночная кома или портосистемная энцефалопатия, является серьезным, редким, сложным, потенциально обратимым, нейропсихиатрическим синдромом, связанным с прогрессирующим заболеванием печени. Азотсодержащие вещества, прежде всего аммиак, получают доступ к системной циркуляции вследствие сниженной функции печени или портосистемных анастомозов. Оказавшись в ткани головного мозга, данные соединения порождают изменения нейротрансмиссии, что влияет на сознание и поведение. Существуют 4 прогрессирующие стадии поражения, ассоциированные с HE, которые определены путем использования критерия West Haven (или показателя Conn), начиная со стадии 0 (отсутствие детектируемых изменений у индивидуума) и заканчивая стадией 4 (кома, децеребрационная поза, расширенные зрачки).
Лечение пациентов с хронической HE включает: 1) обеспечение симптоматической терапией, 2) идентификацию и устранение провоцирующих факторов, 3) снижение азотсодержащей нагрузки из кишечника и 4) оценку необходимости для длительной терапии. Азотсодержащую нагрузку из кишечника, как правило, снижают использованием невсасываемого дисахарида (лактулозы) и/или антибиотиков. Хотя лактулозу считают первоочередным лечением в Соединенных Штатах, на данный момент ее не утвердили к применению либо для лечения, либо для предотвращения HE. Рифаксимин является перспективной терапией для лечения пациентов с HE вследствие продемонстрированной ее эффективности и вследствие недостатков системных антибиотиков и неабсорбируемых дисахаридов. Недостатки хронической системной антибиотической терапии включают нефротоксичность и ототоксичность, и недостатки терапии лактулозой включают обезвоживание вследствие диареи (провоцирующий фактор HE), чрезмерно сладкий вкус и побочные эффекты со стороны желудочно-кишечного тракта.
В этом примере рифаксимин давали в амбулаторных условиях в дозировке 550 мг дважды в день (общая суточная доза составляла 1100 мг рифаксимина). Субъектам давали дозу в 550 мг рифаксимина дважды в день, по меньшей мере, в течение 7 последовательных дней до дня взятия образцов для фармакокинетического исследования.
Для обеспечения равновесных концентраций в плазме крови взятие образцов крови для фармакокинетического анализа было проведено, по меньшей мере, спустя 7 последовательных дней введения дозы рифаксимина в количестве 550 мг дважды в день. Образцы крови для фармакокинетического анализа были собраны в один день, по меньшей мере, после 7 последовательных дней 100% соблюдения режима дозирования рифаксимина в количестве 550 мг дважды в день. Серийные образцы для фармакокинетического анализа были собраны в течение 12 часов (например, перед введением дозы и спустя 1, 2, 4, 6, 8, 10 и 12 часов после введения дозы), чтобы дать возможность получить стационарную характеристику профиля концентрации рифаксимина в плазме крови во времени. Субъекты голодали ночь (никакого приема пищи приблизительно в течение 10 часов) до введения рифаксимина, и им была дана стандартная легкая пища спустя 1 час после введения изучаемого лекарственного препарата (после планируемого 1-часового забора плазмы крови).
Фармакокинетические параметры рифаксимина в плазме крови вычисляли, используя некомпартментные способы (например, стандартный внемодельный подход).
Взятие образца для фармакокинетического анализа проводили в один день, по меньшей мере, спустя 7 последовательных дней 100% соблюдения режима дозирования рифаксимина в количестве 550 мг дважды в день. В общей сложности 8 образцов крови были собраны в течение 12 часов (например, перед введением дозы и спустя 1, 2, 4, 6, 8, 10 и 12 часов после введения дозы), чтобы дать возможность получить характеристику индивидуального профиля концентрации рифаксимина в плазме крови во времени в течение 12-часового интервала дозирования.
Концентрации рифаксимина в плазме крови определяли способом обращенно-фазной высокоэффективной жидкостной хроматографии с тандемной квадрупольной масс-спектрометрией (LC/MS/MS), используя достоверный аналитический способ. Нижний предел количественного определения (LOQ), отклонение калибровочных стандартов от теоретического значения и точность были установлены с помощью стандартных способов.
Фармакокинетические параметры рифаксимина в плазме крови вычисляли, используя WinNonlin® Enterprise (версия 5.2).
Фармакокинетические параметры вычисляли, используя некомпартментные способы (например, стандартный внемодельный подход). Следующие равновесные фармакокинетические параметры рифаксимина в плазме крови вычисляли, используя фактические профили концентрации во времени для каждого субъекта:
Другие параметры, такие как кажущийся общий клиренс (CL/F) и конечный период полувыведения или период полураспределения (t1/2), были определены при наличии соответствующих данных. Помимо запланированного анализа, AUC от времени 0 (до введения дозы) до последней измеряемой концентрации (AUC0-τ) была также вычислена.
Индивидуальные концентрации в плазме крови и фармакокинетические параметры рифаксимина были суммированы для полной фармакокинетической популяции и по тяжести печеночной недостаточности, используя показатели Child-Pugh (А и В) с использованием описательной статистики (например, N, среднее, SD, CV%, медиана, минимум, максимум, геометрическое среднее).
Демографические и другие основные характеристики были суммированы для субъектов по тяжести печеночной недостаточности, используя показатели Child-Pugh (А и В) и индекс модели терминальной стадии заболевания печени (MELD), с помощью описательной статистики. Основные характеристики включали альбумин, щелочную фосфатазу, аланинаминотрансферазу (ALT), аспартатаминотрансферазу (AST), международное нормализованное отношение (INR), сывороточный креатинин и сывороточный общий билирубин, где исходный уровень был определен как последнее имеющееся измерение до введения первой дозы рифаксимина.
Фармакокинетические параметры рифаксимина AUCτ и Cmax у субъектов с показателями Child-Pugh А и В (например, легкая и умеренная формы печеночной недостаточности) сравнивали, используя модель дисперсионного анализа (ANOVA).
Парный ANOVA был использован для оценки значений концентрации рифаксимина, измеренных до введения дозы и через 12 часов после введения дозы для оценки возможных различий в равновесных концентрациях рифаксимина.
В общей сложности 25 субъектов были включены в популяцию по оценке фармакокинетических параметров и были исследованы на безопасность введения препарата.
Исходно восемнадцать (18) из 25 субъектов (72,0%) имели легкую форму печеночной недостаточности (например, показатель А Child-Pugh). Оставшиеся 7 субъектов (28,0%) исходно имели умеренную форму печеночной недостаточности (например, показатель В Child-Pugh).
Фармакокинетические параметры рифаксимина сравнивали с результатами отдельного исследования на здоровых субъектах с нормальной функцией печени.
Демографические и основные характеристики субъектов
В таблицу 1 сведены демографические характеристики для всех включенных в исследование субъектов. В общей сложности 25 субъектов было включено в исследование; 17 субъектов (68,0%) были мужского пола и 8 субъектов (32,0%) были женского пола. Средний возраст среди участвующих в исследовании субъектов составлял 58 лет (диапазон от 45 до 68 лет). Двадцать два субъекта (88,0%) были белокожими, а оставшиеся 3 субъекта (12,0%) были чернокожими. Семь из 25 субъектов (28,0%) принадлежали испаноговорящей этнической группе.
Восемнадцать (18) субъектов имели показатель А по классификации Child-Pugh, и семь субъектов имели показатель В по классификации Child-Pugh. Пятнадцать (15) субъектов имели исходный индекс MELD<11, и 10 субъектов имели исходный индекс MELD от 11 до 18 (включительно). Большинство субъектов, участвующих в исследовании, исходно имело показатель Conn, равный 0 (22/25; 88,0%) для фармакокинетического субисследования; 3 из 25 субъектов (12,0%) исходно имели показатель Conn, равный 1.
Демографические и основные характеристики субъектов - все включенные в исследование субъекты
В целом, демографические характеристики были сопоставимы для субъектов с показателями Child-Pugh А и В. Основные демографические характеристики были также, в основном, схожими для субъектов, которые имели исходный индекс MELD<11, и субъектов, которые имели исходный индекс MELD в диапазоне от 11 до 18 (включительно). Более высокую долю субъектов с индексом MELD в диапазоне от 11 до 18 составляли испаноговорящие субъекты (50,0% в сравнении с 13,3%) по сравнению с субъектами с индексом MELD≤10.
Основные лабораторные данные соответствовали нарушенной функции печени среди субъектов. Результаты основных тестов функции печени указывали на большую печеночную недостаточность среди субъектов, относящихся к категории Child-Pugh В, по сравнению с субъектами, относящимися к категории Child-Pugh А, и на большую печеночную недостаточность среди субъектов с индексом MELD в диапазоне от 11 до 18 по сравнению с субъектами с индексом MELD<11. В частности, субъекты категории Child-Pugh В и субъекты с индексом MELD, равным 11-18, исходно имели значительно более высокие исходные значения для щелочной фосфатазы, AST и прямого и общего билирубина.
В день, предшествующий сбору фармакокинетических данных, большинство субъектов получили их 2 дозы рифаксимина с интервалом приблизительно 12 часов. Самый короткий интервал между дозами для любого субъекта составлял 10 часов; самый длинный интервал для любого субъекта составлял 13,55 часов. Вторую дозу рифаксимина вводили без учета ужина либо до приема пищи (13 субъектов), либо после приема пищи (12 субъектов).
В день взятия образцов для фармакокинетического анализа утреннюю дозу рифаксимина вводили, по меньшей мере, после 10 часов ночного голодания. Всем субъектам давали легкую пищу спустя 1 час после введения дозы, вслед за 1-часовой временной точкой взятия образца плазмы крови для фармакокинетического анализа. Следующая доза рифаксимина была введена сразу после 12-часовой временной точкой взятия образца плазмы крови для фармакокинетического анализа, с 1 исключением.
Средние концентрации рифаксимина в плазме крови достигали максимального уровня спустя 1 час после введения лекарственного препарата и затем медленно падали в течение 12 часов (фиг. 1). Концентрации рифаксимина в плазме крови были выше нижнего предела количественного определения (LOQ) в течение всего 12-часового интервала взятия образцов у всех субъектов. В общей сложности у 5 субъектов были обнаружены двугорбые профили концентрации в плазме крови.
Фармакокинетические параметры рифаксимина в равновесном состоянии у субъектов с печеночной недостаточностью, классифицированных как Child-Pugh А и Child-Pugh В
В таблице 2 сведены фармакокинетические параметры рифаксимина, по меньшей мере, после 7 дней лечения субъектов с недостаточной функцией печени по показателям Child-Pugh и для всей фармакокинетической популяции. Колонка, содержащая значения, определенные для здоровых субъектов в отдельном исследовании, представлена для облегчения сравнения.
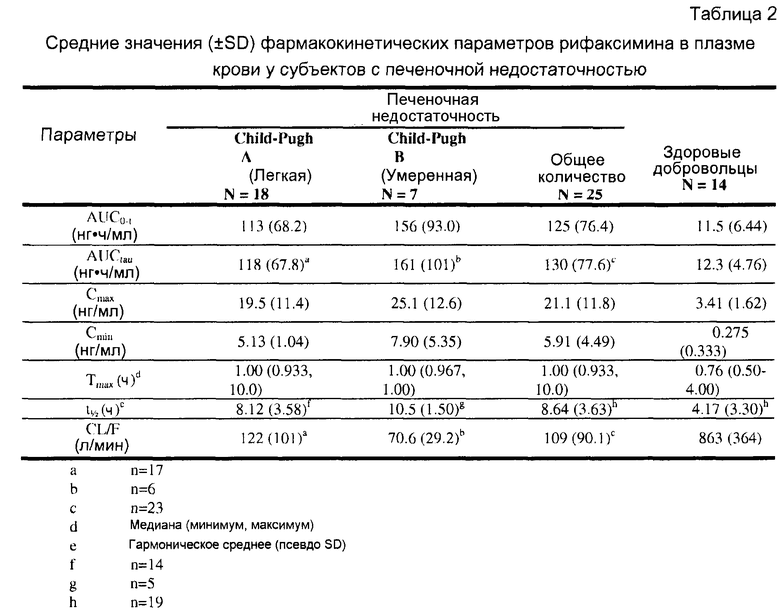
Сравнительный анализ среди субъектов с Child-Pugh A (легкая форма недостаточности) в сравнении с Child-Pugh В (умеренная форма недостаточности) и среди субъектов с индексом MELD <11 (легкая форма недостаточности) в сравнении с индексом от 11 до 18 (умеренная форма недостаточности)
Средние значения AUCτ и Cmax у субъектов с показателем Child-Pugh В (161 нг*ч/мл и 25,1 нг/мл, соответственно) были приблизительно на 36% и 29% выше таковых, наблюдаемых у субъектов с показателем Child-Pugh А (118 нг*ч/мл и 19,5 нг/мл, соответственно). Скорость элиминации рифаксимина у субъектов с показателем Child-Pugh В была на 29% продолжительнее таковой, наблюдаемой у субъектов с показателем Child-Pugh А (10,5 ч в сравнении с 8,12 ч). Фармакокинетические параметры рифаксимина характеризовались коэффициентом вариабельности между субъектами (CV%) для AUCτ и Cmax, лежащим в диапазоне приблизительно от 50 до 60%. Это находилось в соответствии с вариабельностью, ранее наблюдаемой у здоровых субъектов, например, CV% от 45% до 60%.
Фармакокинетические параметры рифаксимина AUCτ и Cmax у субъектов с показателями Child-Pugh А и В (легкая и умеренная формы печеночной недостаточности, соответственно) сравнивали, используя модель ANOVA. В случаях, когда невозможно было вычислить AUCτ, соответствующие значения AUC0-τ были использованы для статистики вывода.
Результаты однофакторного дисперсионного анализа ANOVA сведены в таблицу 3. Отношение геометрического LSM AUCτ для показателя Child-Pugh В к таковому для показателя Child-Pugh А составляло 151,2% с 90% доверительными интервалами от 98,8% до 231,5% (р=0,1092). Отношение геометрического LSM Cmax для показателя Child-Pugh В к таковому для показателя Child-Pugh А составляло 149,9% с 90% доверительными интервалами от 98,8% до 227,5% (р=0,1096). Доверительные интервалы для отношений LSM были очень большими, принимая во внимание вариабельность между субъектами по параметрам AUCτ и Cmax в обеих популяциях.

Ковариационный анализ показал, что биохимические маркеры недостаточной функции печени, например, повышенный альбумин, общий билирубин, и значения международного нормализованного отношения коррелировали с повышенным системным воздействием рифаксимина (AUCtau и Cmax) и сниженным клиренсом при пероральном приеме препарата (CL/F).
Фармакокинетику рифаксимина оценивали у субъектов с недостаточной функцией печени. После соблюдения одной и той же схемы дозирования (например, 550 мг два раза в день) значения системного воздействия рифаксимина (AUCtau) при равновесном состоянии у субъектов с Child-Pugh А и В были приблизительно в 9,6 и 13,1 раза выше, соответственно, таковых, наблюдаемых у здоровых субъектов при равновесном состоянии.
Системное воздействие сравнивали, используя особый способ оценки функции печени, индекс MELD. Отношения геометрических LSM и 90% CIs для AUCτ и Cmax были определены для субъектов с индексом MELD <11 (n=15) в сравнении с индексом MELD в диапазоне от 11 до 18 (n=10). Результаты этого анализа (см. таблицу 4) показали, что системное воздействие было статистически значимо выше (p<0,05) у субъектов с умеренной формой печеночной недостаточности при сравнении с легкой формой печеночной недостаточности, когда индекс MELD был использован для оценки функции печени. Отношение AUCτ для индекса MELD <11 в сравнении с индексом от 11 до 18 составляло 168,22% с 90% CIs, равными от 110,5% до 256,2% (р=0,0451); и отношение Cmax составляло 178,12% с 90% CIs, равными от 116,7% до 271,8% (р=0,0283). Корреляция между индексом MELD и категорией Child-Pugh у 25 субъектов, участвующих в субисследовании, была слабой (коэффициент корреляции: р=0,399).

Происходила быстрая абсорбция рифаксимина с максимальной концентрацией в плазме крови через 1 час после введения дозы у подавляющего большинства субъектов. В общей сложности 3 субъекта в группе Child-Pugh А имели замедленную абсорбцию рифаксимина с максимальной концентрацией в плазме крови, наблюдаемой в диапазоне от 6 до 10 часов после введения дозы.
Сравнение с субъектами с нормальной функцией печени
Результаты текущего исследования сравнивали с архивными данными по субъектам с нормальной функцией печени. Арифметическое среднее (±SD) фармакокинетических параметров многократного приема 550 мг рифаксимина два раза в день у здоровых субъектов представлено в таблице 5.
Значения воздействия рифаксимина (AUCτ) у субъектов с показателями Child-Pugh А и В (118 и 161 нг*ч/мл, соответственно) были приблизительно в 9,6 и 13,1 раза выше таковых, наблюдаемых у здоровых субъектов, после перорального введения доз 550 мг два раза в день (12,3 нг*ч/мл), соответственно. За исключением t1/2 межиндивидуальная вариабельность фармакокинетики здоровых субъектов была, в основном, схожей с таковой, измеренной у субъектов с печеночной недостаточностью.

Сравнение концентраций до введения дозы с 12-часовой временной точкой после введения дозы в день фармакокинетического субисследования
Результаты парного ANOVA для оценки концентраций препарата до введения дозы в 0- и 12-часовой временных точках представлены в таблице 6.
Эти результаты указывают на то, что значения концентрации рифаксимина в 12-часовой временной точке после введения препарата были снижены на 37,8% при сравнении с утренней концентрацией до введения препарата (р<0,0001). Было показано, что введение препарата вместе с пищей увеличило степень абсорбции рифаксимина приблизительно в 2-3 раза. Утреннюю дозу вводили натощак.

Ковариационный анализ
Многопараметрическая линейная регрессионная модель была разработана для оценки влияния различных ковариатов на AUCτ, Cmax и CL/F рифаксимина. Следующие ковариаты были исследованы в модели: показатель Child-Pugh и результаты лабораторных анализов (альбумин, щелочная фосфатаза, ALT, AST, клиренс креатинина, сывороточный креатинин, INR и общий билирубин). Ковариаты, выбранные для анализа, представляют собой известные индикаторы функции печени и почек. Визуальная оценка была проведена для определения потенциальной тенденции между анализируемыми ковариатами и AUCτ, Cmax и CL/F.
Результаты представлены ниже в таблицах 7-9.
Ковариационный анализ показал, что биохимические маркеры недостаточной функции печени, например, повышенные значения альбумина, общего билирубина и INR, коррелировали с повышенным системным воздействием рифаксимина (AUCτ и Cmax) и сниженным клиренсом при пероральном приеме препарата (CL/F) в данном исследовании.
Модель с наибольшим R2 включала альбумин, общий билирубин, INR и ALT (R2=53,6%, Ср=4,4101).
Исходя из результатов анализа моделей, было решено, что простая модель включает только альбумин, общий билирубин и INR. Окончательная модель для AUCτ представлена в таблице 7.

Модель с 3 параметрами, имеющая наибольший R2, включала общий билирубин, INR и ALT (R2=39,1%, Ср=3,7193). В рамках подмножества моделей с 4 параметрами модель с наибольшим R2 включала альбумин, общий билирубин, INR и ALT (R2=46,9%, Cp=3,0598). При условии, что R2 был выше для модели с 4 параметрами, было решено, что простая модель включает 4 параметра: альбумин, общий билирубин, INR и ALT. Окончательная модель представлена в таблице 8.
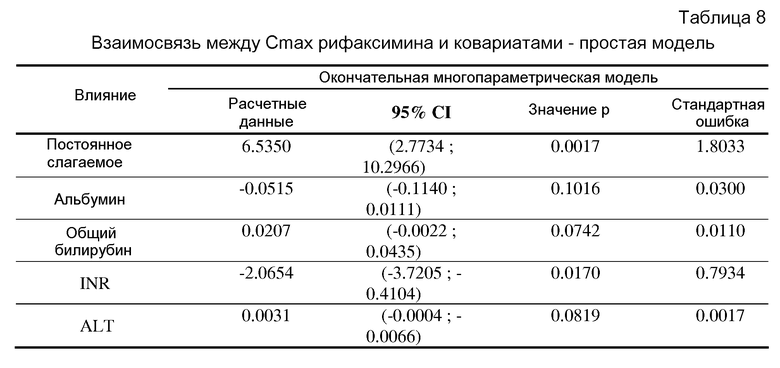
В рамках подмножества моделей с 4 параметрами модель с наибольшим R2 включала альбумин, общий билирубин, INR и ALT (R2=54,9%, Cp=3,4103). Результаты этой модели представлены в таблице 9.
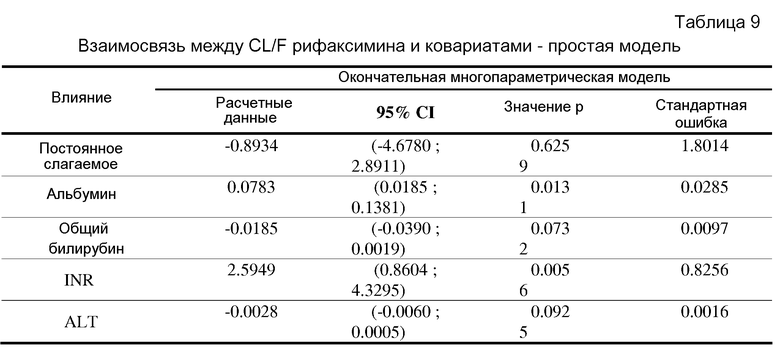
ПРИМЕР 2
Рандомизированное, двойное слепое исследование подбора дозы для оценки эффективности, переносимости и безопасности рифаксимина у пациентов с печеночной энцефалопатией I, II или III степени.
Фармакокинетический анализ был проведен у субъектов с HE в исследовании подбора дозы препарата. В общей сложности 54 субъекта (32 мужчины, 22 женщины, в возрасте от 32 до 82 лет) были включены в исследование, и они принимали 200, 400 или 800 мг рифаксимина три раза в день (таблетки по 200 мг), что соответствовало суточным дозам, равным 600, 1200 и 2400 мг, соответственно, в течение 7 последовательных дней. Концентрации рифаксимина в плазме крови и моче были измерены способом LC-MS/MS (LLOQ=0,5 нг/мл).
Выделение рифаксимина с мочой представлено в таблице 10.
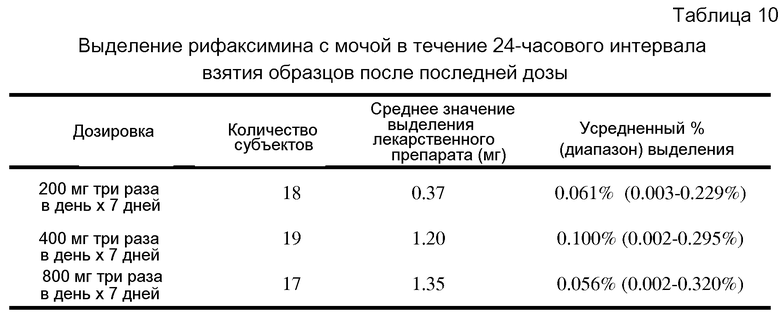
Отсутствовала взаимосвязь между введенной дозой и количеством рифаксимина, выделяемым с мочой. В 24-ч временной точке взятия образцов мочи после последней (третьей) дозы, равной 200, 400 и 800 мг, в последний день введения препарата, 7 день, среднее (SD) количество рифаксимина, выделяемое с мочой, находилось в диапазоне от 0,06% (±0,66%) до 0,1% (0,093%) дозы, и эти значения находятся в соответствии с рифаксимином, выделенным (например, 0,030%±0,020% дозы) после однократного введения радиоактивно меченной дозы, равной 400 мг.
Средние максимальные концентрации рифаксимина в плазме крови величиной 2,7, 10,5 и 13,5 нг/мл были измерены спустя 3 ч после первой однократной дозы величиной 200, 400 и 800 мг, соответственно.
ПРИМЕР 3
Абсорбция рифаксимина
Исследование было выполнено на субъектах с печеночной недостаточностью. Средние значения AUCtau и Cmax у субъектов с показателем Child-Pugh B (161 нг·ч/мл и 25,1 нг/мл, соответственно) были приблизительно на 36% и 29% выше таковых, наблюдаемых у субъектов с показателем Child-Pugh А (118 нг·ч/мл и 19,5 нг/мл, соответственно). Период полувыведения t1/2 рифаксимина у субъектов с показателем Child-Pugh B был приблизительно на 29% длиннее такового, наблюдаемого у субъектов с показателем Child-Pugh А (10,5 ч в сравнении с 8,12 ч). Фармакокинетические параметры рифаксимина имели процентное отношение межиндивидуального коэффициента вариабельности (CV%) для AUC0-tau и Cmax в диапазоне приблизительно от 50% до 60% в обеих субпопуляциях. Это находится в соответствии с вариабельностью, ранее выявленной у здоровых субъектов, например, CV% от 45% до 60%.
Рифаксимин быстро абсорбировался с максимальной концентрацией в плазме крови, выявляемой через 1 час после введения дозы, у подавляющего большинства субъектов. В общей сложности 3 субъекта в группе Child-Pugh A имели замедленную абсорбцию рифаксимина с максимальной концентрацией в плазме крови, выявляемой в диапазоне от 6 до 10 часов после введения дозы. У некоторых субъектов были обнаружены пологие или двугорбые профили концентрации рифаксимина в плазме крови. Отклонения от нормы двигательной активности желудочно-кишечного тракта и желчеотделения у субъектов с циррозом и HE потенциально могут объяснить замедленную/продолжительную абсорбцию рифаксимина, обнаруженную в данном исследовании.
Результаты моделей множественной линейной регрессии показали, что биохимические маркеры печеночной функции, например, повышенный альбумин, общий билирубин и международное нормализованное отношение, коррелировали с увеличенным системным воздействием рифаксимина (AUCtau и Cmax) и сниженным клиренсом при пероральном применении (CL/F). Была также обнаружена положительная корреляция между исходным уровнем аланинаминотрансферазы и Cmax.
В отдельном исследовании были исследованы фармакокинетические параметры. Данная популяция включала 18 субъектов (72%) с легкой формой печеночной недостаточности (Child-Pugh A) и 7 субъектов с умеренной формой печеночной недостаточности (Child-Pugh В). В исследовании здоровых субъектов было включено 28 субъектов.
Значения воздействия рифаксимина (AUCtau) у субъектов с показателем Child-Pugh A и В (118 и 161 нг·ч/мл, соответственно) были приблизительно в 9,6 и 13,1 раза выше, соответственно, таковых, обнаруженных у здоровых субъектов после приема пероральной дозы, равной 550 мг, два раза в день (12,3 нг·ч/мл). За исключением t1/2, межиндивидуальная вариабельность фармакокинетики у здоровых субъектов была, в целом, подобной таковой, измеренной у субъектов с печеночной недостаточностью.
Пример 4
Исследования 3 фазы
Было проведено рандомизированное, двойное слепое, плацебо-контролируемое, комплексное исследование 3 фазы (Исследование А) для оценки эффективности и безопасности рифаксимина у пациентов, находящихся на момент исследования в стадии ремиссии ранее обнаруженной HE. Исследование состояло из периода скрининга (4 дня), периода наблюдения (3 дня), визита исходного уровня и периода лечения (6 месяцев). После определения пригодности пациенты прошли период базовой оценки до рандомизации. Этот период длился 7 дней и был использован для определения пригодности пациентов, обеспечения адекватных инструкций для лиц, осуществляющих лечение, и установления исходного психического статуса и нейромышечной функции до вступления в двойной-слепой период. Пациенты были рандомизированы на получение 550-мг таблетки рифаксимина два раза в день или подобранной таблетки плацебо два раза в день в течение 6 месяцев. Субъекты имели возможность использовать лактулозу в качестве сопутствующей лекарственной терапии, и 91% субъектов в обеих группах принимали лактулозу в ходе исследования. Субъектам проводили тщательную оценку психического статуса (показатель Conn) и нейромышечной функции (степень астериксиса) для определения наступления спонтанного выраженного эпизода HE исследователями и обслуживающим персоналом при каждом личном исследовательском визите, из телефонных разговоров, отчетов лиц, осуществляющих уход за пациентами, и из дневников субъектов. Субъектов исключали из исследования во время спонтанного выраженного эпизода HE. После участия в исследовании субъекты имели возможность быть включенными в открытое, расширенное клиническое исследование (Исследование В).
Доза рифаксимина
Используемый режим дозирования (550 мг два раза в день) в Исследовании А был основан на прошлом клиническом опыте использования рифаксимина у пациентов с HE и других популяций субъектов. В ряде предыдущих исследований рифаксимин был безопасен и эффективен у субъектов с HE в дозе 1200 мг в день (2×200 мг таблетки три раза в день) с сопутствующей терапией лактулозой или без нее. В 6-месячном исследовании рифаксимина в сравнении с неомицином 1200 мг/день рифаксимина и неомицин (3 г/день) имели сравнимую эффективность у пациентов с HE. В 3-месячном исследовании рифаксимина в сравнении с лактитолом субъекты, получавшие 1200 мг/день рифаксимина (2×200 мг таблетки три раза в день) демонстрировали значительные улучшения конечных показателей HE.
В исследовании с целью определения оптимальной дозы препарата для субъектов с выраженными симптомами HE существовала дозозависимая тенденция улучшения индекса PSE вплоть до 1200 мг (2×200 мг таблетки три раза в день). Подобные результаты были получены для доз, равных 1200 мг и 2400 мг (4×200 мг таблетки три раза в день) (таблица 11). В анализе дозозависимого эффекта критерий Джонкхиера-Терпстра указывал на тенденцию улучшения индекса PSE для совокупности групп доз (р=0,0586).
Изменение индекса PSE (популяция ITT) относительно исходных значений
N=18
N=18
N=18
(0,137)
(0,137)
(0,149)
а индекс PSE был вычислен следующим образом: [Психическое состояние (показатель Conn)×3+степень астериксиса×1+степень NCT×1+оценка содержания аммиака×1+оценка EEG×1 (если имеются данные)/24 (или 28, если имеются данные EEG)]. (24 [или 28, если включены результаты EEG] является наивысшей возможной балльной оценкой, и более высокие баллы указывают на более тяжелые симптомы HE.
Популяция исследования
Для Исследования А субъекты мужского или женского пола в возрасте 18 лет и старше были пригодны для исследования, если они удовлетворяли следующим критериям:
- Показатель Conn 0 или 1
- История болезни в течение 6 месяцев с ≥2 эпизодами выраженной HE, связанной с хроническим заболеванием печени (например, циррозом или портальной гипертензией) с документированной тяжестью заболевания, эквивалентной показателю Conn ≥2 до скрининга (т.е. субъекты имели документированную, рецидивирующую, выраженную HE). По меньшей мере, 1 предшествующий эпизод был проверен по медицинской документации. Эпизоды печеночной энцефалопатии, в основном, приписанные GI-кровотечениям, лекарственным препаратам (например, наркотическим средствам, транквилизаторам, седативным средствам), почечной недостаточности, требующей диализа, или инсульту CNS, такому как субдуральная гематома, не считались как предыдущие, подлинные эпизоды HE.
- Индекс MELD≤25,
- Распределение TIPS или изменения >3 месяцев до скрининга (в случае наличия) и
- Имел дружную семью или другой персонал, продолжающий присмотр и доступный для субъекта в течение исследования.
Субъектов исключали из исследования, если были выполнены следующие критерии:
- Ожидание трансплантации печени в течение 1 месяца скрининга
- Потребление алкоголя в течение 14 дней скрининга, седативных препаратов в течение 7 дней или подтверждение лекарственная зависимость
- ВИЧ, как определено историей болезни
- История болезни об инфекции ТВ или лечении инфекции ТВ
- Активное SBP или ежедневная профилактическая антибиотическая терапия
- GI-кровотечение, требующее госпитализации и переливания крови ≤месяцев скрининга
- Наличие кишечной обструкции или воспалительного заболевания кишечника
- Почечная недостаточность (сывороточный Cr>2,0 мг/дл)
- Анемия (HgB<8 г/дл)
- Гиповолемия или отклонения от нормы содержания электролитов (Na+ <125 мэкв/л, Ca++ >10 мг/дл, К+ <2,5 мэкв/л
- Требуется запрещенная сопутствующая лекарственная терапия
Определение эффективности конечных показателей
Основным конечным показателем в Исследовании А было время до первого спонтанного выраженного эпизода HE. Спонтанный выраженный эпизод HE был определен как увеличение показателя Conn до степени ≥2 (т.е. 0 или 1 до ≥2) или увеличение степени Conn или астериксиса на 1 балл для тех субъектов, кто был включен в исследование с показателем Conn, равным 0. Временем до спонтанного выраженного эпизода HE была продолжительность от первой введенной дозы исследуемого лекарственного препарата до первого спонтанного выраженного эпизода HE.
Ключевые вспомогательные конечные показатели перечислены ниже:
1. Время до первой госпитализации, связанной с HE.
2. Время до любого увеличения от исходного значения степени Conn (уровень психического статуса).
3. Время до любого увеличения от исходного значения степени астериксиса.
4. Среднее значение изменения от исходного уровня степени проявления утомляемости в CLDQ в конце лечения.
5. Среднее значение изменения от исходного уровня концентрации аммиака в венозной крови в конце лечения.
Подробные характеристики лечебной группы для Исследования А представлены ниже в таблицах 12-13.
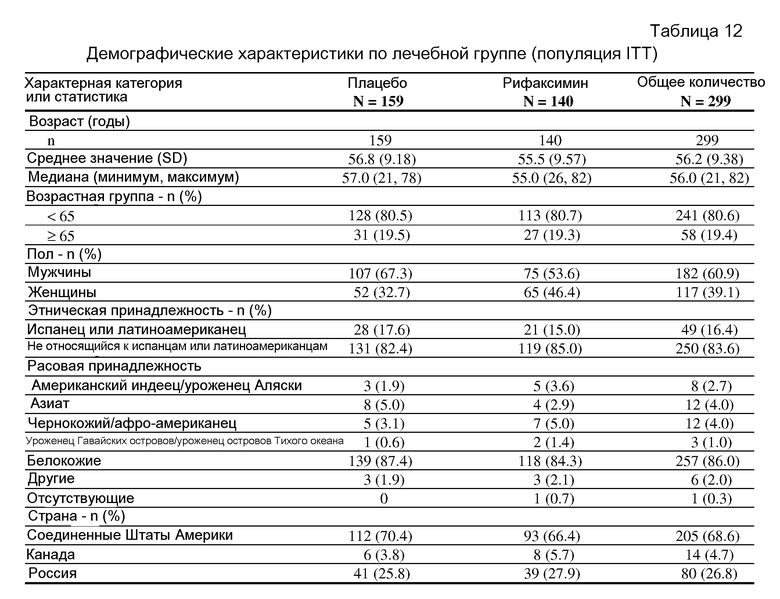

Основные характеристики
Основные характеристики печеночной энцефалопатии в популяции ITT, такие как тяжесть HE для недавних эпизодов выраженной HE (показатели Conn и степени астериксиса) и время с момента последнего эпизода HE, сведены в таблицу 14. Характеристики заболевания печени и другие исходные характеристики субъектов в популяции ITT, такие как тяжесть заболевания (индекс MELD), время с момента первого поставленного диагноза прогрессирующего заболевания печени и этиология заболевания печени, сведены в таблицы 15, 16 и 17. Основные характеристики в целом сопоставимы между лечебными группами.



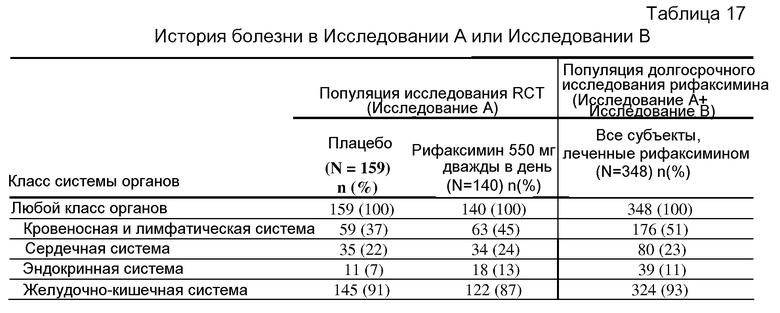
Схема исследования В
Исследование B является непрерывной фазой 3, многоцентровым, открытым, с продленным лечением исследованием, оценивающим долгосрочную безопасность рифаксимина в дозе 550 мг два раза в день у субъектов с анамнезом рецидивирующей, эпизодической, выраженной HE. Все пригодные субъекты имели анамнез выраженных эпизодов HE с документированной тяжестью заболевания с показателем Conn ≥2 в течение 12 месяцев до скрининга, показателем Conn ≤2 при внесении в список участников исследования, и они либо уже являлись участниками Исследования A, либо являлись новым субъектами. Лечение рифаксимином в виде таблеток по 550 мг два раза в день планировалось проводить, по меньшей мере, 24 месяца или вплоть до разрешения регуляторного органа. Сопутствующая терапия лактулозой является необязательной.
Хотя Исследование B в основном предназначалось для оценки долгосрочной безопасности 550 мг рифаксимина, дополнительные оценки эффективности показателя Conn и степени астериксиса были получены за время исследования. В Исследовании B спонтанная, выраженная HE была определена как увеличение показателя Conn до уровня ≥2, увеличение показателя Conn и степени астериксиса на 1 уровень каждый для тех субъектов, кто начал исследование с показателем Conn, равным 0, и увеличение показателя Conn до уровня ≥3 для субъектов, кто в самом начале исследования имел показатель Conn, равный 2.
Схема исследований C, D и E
Исследование C было двойным слепым исследованием с определением оптимальной дозы у субъектов со степенью 1-3 HE, включенных в исследование в 5 центрах Соединенного Королевства. Субъекты были рандомизированы на получение рифаксимина в суточной дозе, равной 600 мг (200 мг три раза в день), 1200 мг (400 мг три раза в день) или 2400 мг (800 мг три раза в день) в течение 7 дней. Планируемый список участников состоял из 54 субъектов (18 в группе).
Исследование D было двойным слепым, контролируемым с помощью двух плацебо, сравнительным исследованием 3 фазы рифаксимина в количестве 1200 мг/день и лактитола в количестве 60 г/день в течение периода длительностью до 10 дней лечения субъектов с гипераммониемией и циррозом печени со степенью 1-3 HE, включенных в исследование в 16 центрах в Испании. Планируемый список участников состоял из 120 субъектов (60 в группе).
Исследование E являлось международным, многоцентровым, рандомизированным, двойным слепым, плацебо-контролируемым, с параллельными группами исследованием 3 фазы, сравнивающим в течение 14 дней рифаксимин в количестве 400 мг три раза в день с плацебо у субъектов с циррозом печени, имеющих печеночную энцефалопатию, форма которой варьировала от легкой до умеренной, чувствительных к GI-побочным эффектам лактулозы или лактитола. Данное исследование было проведено в Соединенных Штатах Америки, Польше, Венгрии и Объединенном Королевстве. Планируемый список участников состоял из 112 субъектов (56 в группе).
Определение основных конечных критериев оценки эффективности
Была проведена оценка психического состояния (показатель Conn) и нейромышечной функции (степень астериксиса) в исследованиях C, D и E, используя те же критерии, которые описаны выше для исследований A и B.
Уровни аммиака в венозной крови, степень NCT и результаты EEG были ранжированы в соответствии с нарастающей тяжестью заболевания.
Исследование C: Основным конечным критерием оценки эффективности для исследования C был индекс PSE в конце исследования. Индекс PSE являлся составной оценкой, включающей оценки психического состояния (показатель Conn), астериксиса, уровней аммиака в венозной крови, NCT и EEG.
Различия в индексе PSE в конце исследования по лечебным группам с применением 600 мг, 1200 мг и 2400 мг рифаксимина ежедневно были оценены с помощью анализа ковариатов.
Исследование D: Были определены четыре основных конечных критериев оценки эффективности:
1. Улучшение психического состояния (показатель Conn)
2. Индекс PSE.
3. Снижение уровней аммиака в венозной крови
4. Уменьшение индекса PSE
Исследование E: Основным конечным критерием оценки эффективности являлась суммарная эффективность терапии, определяемая как доля субъектов, демонстрирующих улучшение психического состояния (показатель Conn), по меньшей мере, на 1 уровень (например, переход от показателя Conn, равного 2, к показателю Conn, равному 1 или 0) после завершения лечения по сравнению с исходным уровнем.
Демографические и основные характеристики
В исследовании C средний возраст составлял 55,2 лет, 52,3 лет и 55,3 лет в группах, применяющих 600 мг, 1200 мг и 2400 мг, соответственно. В исследовании D средний возраст составлял 61,6 лет и 62,9 лет в группах, применяющих рифаксимин и лактитол, соответственно. В исследовании E средний возраст составлял 53,6 лет и 53,3 лет в группах, применяющих рифаксимин и плацебо, соответственно.
Демографические характеристики были в основным схожими по лечебным группам в исследованиях C, D и E.
В таблице 8 представлены сводные данные по основным характеристикам для исследований C, D и E. Субъекты в исследовании D имели более тяжелые симптомы HE, определяемые показателями психического статуса/Conn, степенью астериксиса и индексом PSE, нежели субъекты в исследовании E. Также тяжесть заболевания была более выражена в D по сравнению с C. Например, доля субъектов с показателями психического статуса/Conn ≥2 до начала исследования составляла 70% (рифаксимин) и 60,3% (лактитол) в D, 14,6% (рифаксимин) и 4,4% в E и 16,7%, 31,6% и 23,5% в группах, принимавших 600 мг, 1200 мг и 2400 мг, в C. Время с момента постановки диагноза заболевания HE (т.е. продолжительность HE) было значительно более продолжительным в Исследовании D, чем в Исследовании E и Исследовании C (см. таблицу 18).
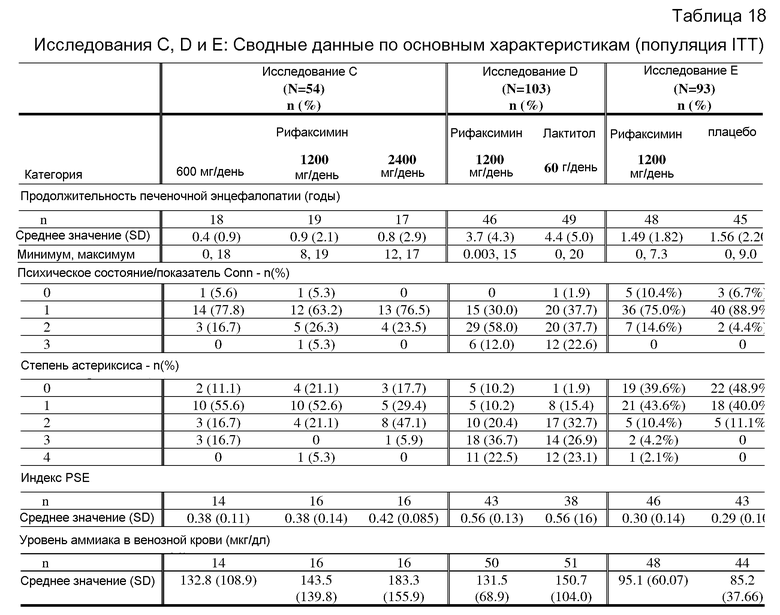
Распределение пациентов
Во время 120-дневного обновления безопасности 280 субъектов были включены в исследование в 60 центрах проведения клинических исследований. В общей сложности 152 (54,3%) этих субъектов переместились из начального исследования (Исследования А), и 128 (45,7%) были новыми субъектами. В общей сложности 187 субъектов (66,8%) все еще продолжали исследование. Девяносто три субъекта (33,2%) прекратили лечение раньше, и основными причинами были смерть, пересадка печени, просьба субъекта и нежелательные явления.
Основные характеристики
Основные характеристики были в основном схожими между субъектами в исследовании A и субъектами в Исследовании B. Демографические характеристики представлены и основные характеристики представлены для новых субъектов, применяющих рифаксимин, в Исследовании B.
Различия по основным характеристикам между субъектами исследования A и исследования B были связаны с различиями по критериям включения в исследование. Субъекты имели ≥1 подтвержденного эпизода HE в течение 12 месяцев до скрининга для исследования B в сравнении с ≥2 эпизодами в течение 6 месяцев до скрининга для Исследования A. В соответствии с этими различиями, при сравнении с Исследованием A, субъекты в Исследовании B имели более длительную продолжительность текущей подтвержденной ремиссии HE и более низкую долю субъектов с 2 или 3 подтверждаемыми эпизодами HE до начала исследования.
Анализ подгрупп на время до наступления спонтанного, явно выраженного эпизода HE
Лечение рифаксимином снижало риск проявления спонтанных, явно выраженных эпизодов HE для совокупности всех исследуемых субгрупп.
Отношение рисков проявления спонтанного, явно выраженного HE в группе, леченной рифаксимином, относительно группы, леченной плацебо (основной критерий оценки эффективности), 95% CIs и значения р из модели пропорциональных рисков Кокса представлены на фиг. 2. Отношение рисков меньше 1 указывают на то, что результат лечения говорит в пользу рифаксимина, а больше 1 - в пользу плацебо.
Результаты по времени до первого спонтанного, явно выраженного эпизода HE по всем классификациям Child-Pugh до начала исследования представлены в таблице 9. Элементы общего показателя Child-Pugh, общие показатели и классификации были получены после исследования. Лечение рифаксимином привело к значительному снижению риска проявления спонтанного, явно выраженного эпизода HE при сравнении с лечением плацебо по классам A, B или C Child-Pugh. Статистически значимый эффект лечения рифаксимином по уменьшению риска проявления спонтанного, явно выраженного HE был обнаружен в категориях Child-Pugh A (5-6), B (7-9) и C (10-15).

Исследование A - Вторичные анализы эффективности
Результатом лечения рифаксимином было 50% уменьшение, при сравнении с плацебо, риска госпитализации в связи с HE (т.е. госпитализации, непосредственно обусловленной HE или явлениями HE, происходящими во время госпитализации) в течение 6-месячного периода лечения (отношение рисков=0,500, 95% CI: от 0,287 до 0,873, р=0,0129). Случаи госпитализации в связи с печеночной энцефалопатией были зарегистрированы для 19 из 140 субъектов и 36 из 159 субъектов в группах, получавших рифаксимин и плацебо, соответственно. После нормализации воздействия препарата процент госпитализации в связи с HE был на 51% ниже (0,38 явления/PEY, рифаксимин в сравнении с 0,78 явления/PEY, плацебо) в группе, получавшей рифаксимин.
У субъектов в группе, получавшей рифаксимин, наблюдали 56% снижение риска госпитализации, обусловленной HE (т.е. госпитализации, непосредственно обусловленной только лишь HE), в течение 6-месячного периода лечения при сравнении с плацебо (отношение рисков=0,438, 95% CI: от 0,238 до 0,807, р=0,0064). Случаи госпитализации, обусловленной HE, были зарегистрированы для 15 из 140 субъектов и 33 из 159 субъектов в группах, получавших рифаксимин и плацебо, соответственно. Процент госпитализации, обусловленной HE, составил 0,30 явления/PEY в группе, получавшей рифаксимин, в сравнении с 0,72 явления/PEY в группе, получавшей плацебо.
Изменения показателей домена усталости CLDQ от исходного уровня в конце лечения в Исследовании A
Оценки связанного со здоровьем качества жизни были проведены посредством использования утвержденного опросного листа по хроническому заболеванию печени (CLDQ) для субъектов с хроническим заболеванием печени.
Обычно анализы CLDQ выполняют путем сравнения изменений от исходных показателей до последней оценки в общих показателях и показателей домена CLDQ между 2 лечебными группами. Однако, используя в этом исследовании простое изменение исходных показателей, анализ имеет следующие ограничения. Во-первых, опросный лист определяет статус качества жизни субъекта в течение 2 недель до заполнения опросного листа. Путем сравнения результатов 2 недель до последней оценки с результатами 2 недель до исходных показателей (изменение от исходного анализа) изменения в течение всего хода исследования не регистрируются в анализе. Во-вторых, большинство субъектов в исследовании также имели сопутствующие заболевания, ассоциированные с циррозом печени, которые могут потенциально искажать результаты в зависимости от времени осложнения, и если это произошло во время или незадолго до первой или последней оценки. Наконец, субъекты, у которых проявился спонтанный эпизод выраженной HE, были исключены из исследования в соответствии с протоколом, и им были проведены последние оценки CLDQ во время завершающего визита, который обычно имел место после разрешения явления HE. Таким образом, для этих субъектов результаты CLDQ могли быть подобны исходным показателям. Чтобы учесть эти ограничения, проводили анализ AUC, используя Twa (AUC с учетом времени воздействия в исследовании), поскольку он позволяет включить результаты CLDQ в течение полного временного периода участия субъекта в исследовании, в частности, до спонтанного эпизода HE.
Когда были проанализированы результаты CLDQ с использованием Twa, субъекты в группе, получавшей рифаксимин, имели значительно меньшую усталость и значительно лучшее качество жизни в целом, чем субъекты в группе, получавшей плацебо. Результаты CLDQ в пользу группы, получавшей рифаксимин, также были продемонстрированы для общего показателя домена CLDQ (p=0,0093) и для каждого из других составляющих доменов CLDQ, включая абдоминальные симптомы (р=0,0090), системные симптомы (р=0,0160), активность (р=0,0022), эмоциональную функцию (р=0,0065) и беспокойство (р=0,0436).
Было показано, что результаты CLDQ прогнозируют спонтанные выраженные эпизоды HE, как это определено основным конечным показателем (фиг. 4). Существовали значительные различия в распределении частот Twa (AUC, нормализованное по времени воздействия) для всех доменов CLDQ между субъектами, имеющими спонтанные выраженные эпизоды HE, и субъектами, не имеющими спонтанные выраженные эпизоды HE. Среднее значение Twa для каждого домена и общего показателя коррелировало с наличием или отсутствием спонтанного выраженного эпизода HE.
Длительная эффективность (исследование A и исследование B)
Хотя исследование B было в основном спланировано для оценки долгосрочной безопасности 550 мг рифаксимина, дополнительные оценки эффективности показателя Conn и степени астериксиса были получены при каждом визите и во время выраженного спонтанного эпизода HE. Анализ Каплана-Мейера времени до первого спонтанного выраженного эпизода HE показал постоянство, продолжительность и воспроизводимость защитного эффекта рифаксимина по сравнению с плацебо, как отмечается в Исследовании A.
Время до спонтанного выраженного эпизода HE в исследовании B - согласованность с результатами Исследования A
Оценочные показатели Каплана-Мейера времени до первого спонтанного выраженного эпизода HE были схожими между группой, получавшей рифаксимин в Исследовании А (PEY=50 рифаксимина), и новыми субъектами, получавшими рифаксимин в Исследовании B (PEY=80 рифаксимина) (р=0,800 для различия в относительных рисках). Также, аналогичные пропорции субъектов имели спонтанные выраженные эпизоды HE в получавшей рифаксимин группе Исследования A (22%, 31 из 140 [получавшая рифаксимин группа]) и в новой получавшей рифаксимин группе Исследования B (20,5%, 43 из 210). С учетом воздействия доля спонтанных выраженных эпизодов HE составляла 0,62 явлений/PEY в получавшей рифаксимин группе из Исследования A при сравнении с 0,5 явлениями/PEY для новых получавших рифаксимин субъектов в Исследовании B.
Время до спонтанного выраженного эпизода HE у получавших плацебо субъектов в Исследовании A, которые перешли к терапевтическому лечению рифаксимином в Исследовании B
Получавшие плацебо субъекты из исследования A, которые перешли в исследование B, наблюдались в течение открытого исследования (n=82). Сравнение оценочных показателей Каплана-Мейера времени до первого спонтанного выраженного эпизода HE между полученными данными по плацебо в Исследовании A и в течение первых 6 месяцев лечения рифаксимином в Исследовании B показано на фиг. 5. Отношение числа случаев спонтанного выраженного эпизода HE при лечении рифаксимином относительно лечения плацебо составляло 0,2112 (95% CI: от 0,1006 до 0,4432, р<0,0001 для межгруппового отличия в относительных рисках). Эти результаты означают 79% снижение риска проявления спонтанного выраженного эпизода HE во время лечения рифаксимином в Исследовании B при сравнении с их предшествующим воздействием плацебо в Исследовании A. Спонтанный выраженный эпизод HE проявлялся в 14 из 82 случаев в течение 6 месяцев лечения рифаксимином в Исследовании B по сравнению с 39 из 82 случаев во время лечения плацебо в Исследовании A. Доля спонтанных эпизодов HE составляла 1,5 явления/PEY в течение воздействия плацебо в Исследовании A и 0,4 явления/PEY в течение воздействия рифаксимина в Исследовании B.
В совокупности эти результаты демонстрируют, что получавшие ранее плацебо субъекты, перешедшие в Исследование B, испытывали аналогичный защитный эффект от возникновения спонтанных эпизодов HE при сравнении с леченными рифаксимином субъектами в Исследовании A и продолжающей лечение рифаксимином группой в Исследовании B.
Индекс PSE во время краткосрочного лечения
Улучшения (т.е. уменьшение) индекса PSE наблюдали во всех лечебных группах от начала до конца лечения в исследовании по подбору оптимальной дозы, Исследовании C. Средние изменения от исходного уровня в индексе PSE в конце лечения составили -6,4%, -10,3% и -10,7% в группах, получавших суточную дозу рифаксимина в количестве 600 мг, 1200 мг и 2400 мг, соответственно. В Исследовании D, в котором сравнивали суточную дозу рифаксимина 1200 мг с лактитолом, было обнаружено значительное снижение индекса PSE в получавшей рифаксимин группе при сравнении с получавшей лактитол группой (р=0,0103). Также в Исследовании D индекс эффективности PSE демонстрировал значительные улучшения в получавшей рифаксимин группе по сравнению с получавшей лактитол группой (р=0,0083). Изменения индекса PSE были аналогичными среди групп, получавших рифаксимин и плацебо, в Исследовании E.
На фиг. 6 представлены результаты индекса PSE в начале и в конце исследований C, D и E.
Положительная динамика показателя Conn в течение краткосрочного лечения
В исследовании C (исследование с целью определения оптимальной дозы) результаты свидетельствовали о статистической направленности, демонстрирующей большее относительное количество субъектов, имеющих улучшения психического состояния (показателя Conn) в получавшей 1200 мг группе по сравнению с получавшей 600 мг группой (р=0,099 при использовании модели пропорциональных шансов). Кроме того, в случае суточной дозы 2400 мг, более высокая доля субъектов демонстрировала улучшения показателя Conn при сравнении с суточной дозой 600 мг (31,3% в сравнении с 26,7% имел изменения показателя Conn, равные -1 или -2).
Улучшения психического состояния (показателя Conn) существенно не отличались между группами, получавшими рифаксимин и лактитол, в Исследовании D; однако 3 из основных конечных показателей эффективности в Исследовании D, уменьшение индекса PSE, улучшение индекса эффективности PSE и снижение уровней аммиака в венозной крови демонстрировали значительные, благоприятные эффекты рифаксимина. Отсутствие значимого эффекта рифаксимина в улучшении показателя Conn в Исследовании D может быть обусловлено короткой продолжительностью терапевтического лечения исследуемым лекарственным препаратом (10 дней).
В исследовании E отсутствие эффекта рифаксимина в улучшении показателя Conn может быть обусловлено короткой продолжительностью терапевтического лечения в этом исследовании (15 дней) и слабо выраженными симптомами HE к началу исследования. Субъекты в Исследовании E имели слабо выраженные симптомы HE, определяемые показателями психического состояния/Conn, степенью астериксиса и индексом PSE, при сравнении с субъектами в Исследовании D или Исследовании C.
Степень астериксиса, результаты NCT и общий ответ во время краткосрочного лечения
Процент субъектов, кто имел улучшения степени астериксиса, находясь на лекарственном препарате, увеличивался с применением более высоких доз рифаксимина в Исследовании C. В исследовании D (рифаксимин в сравнении с лактитолом) доля субъектов, имеющих улучшения степени астериксиса, была аналогичной среди групп. В исследовании рифаксимина в сравнении с плацебо, Исследовании E, большее количество субъектов имело улучшения степени астериксиса в получавшей рифаксимин группе по сравнению с получавшей лактитол группой (39,1% в сравнении с 9,3%; р=0,0097 для межгруппового отличия в пользу рифаксимина).
Изменения показателей NCT были в основном аналогичными по группам в каждом из 3 исследований.
Была проведена оценка суммарного общего ответа на лечение в Исследовании D. Процент субъектов, считающихся вылеченными (с приведенным в норму уровнем аммиака в венозной крови и показателем психического статуса/Conn, равным 0) к концу исследования, был выше в получавшей рифаксимин группе по сравнению с получавшей лактитол группой (53,1% в сравнении с 39,2%).
Заключение о результатах краткосрочного лечения в Исследованиях C, D и E
В исследовании C была выявлена дозозависимая направленность улучшения индекса PSE (р=0,056) и показателя психического состояния/Conn, и результаты этого исследования показали эффективность суточной дозы рифаксимина, равной 1200 мг (400 мг три раза в день). Эти данные, наряду с результатами из опубликованных исследований рифаксимина 1200 мг/день при лечении HE, предусматривают целесообразность отбора дозы для рассмотрения исследования A и исследования B фазы 3.
В исследовании D выявлены значительные межгрупповые отличия в изменениях индекса PSE и уровней аммиака в венозной крови (оба из которых являлись основными конечными показателями) в пользу получавшей рифаксимин группы при сравнении с лактитолом; и более высокая доля получавших рифаксимин субъектов считалась вылеченной к концу лечения (с приведенным в норму уровнем аммиака в венозной крови и показателем психического статуса/Conn, равным 0).
В исследовании E значительно более высокая доля получавших рифаксимин субъектов имела улучшения степени астериксиса при сравнении с получавшими плацебо субъектами; однако результаты для основного конечного показателя, доля субъектов, имеющих улучшения показателя Conn, значимо не отличались между группами. Субъекты в исследовании E имели мало выраженные симптомы HE при сравнении с субъектами в исследовании D.
Включение в документ путем ссылки
Полное содержание всех ссылок, патентов, находящихся на рассмотрении заявок на патент и опубликованных патентов, цитируемых в этой заявке, специально включены путем ссылки.
Эквиваленты
Специалисты в данной области техники признают или способны выявлять, используя стандартную постановку экспериментов, что многочисленные эквиваленты конкретных вариантов осуществления изобретения, предусмотренных в настоящем документе, описаны в настоящем документе. Такие эквиваленты охвачены следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ ЭНЦЕФАЛОПАТИИ | 2010 |
|
RU2540513C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ КРИТИЧЕСКОЙ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ НА ОСНОВАНИИ СЫВОРОТОЧНОГО УРОВНЯ СЕЛЕНА | 2014 |
|
RU2549963C1 |
| Способ оценки риска смерти при циррозе печени | 2021 |
|
RU2761729C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ АСЦИТА ПРИ ЦИРРОЗЕ ПЕЧЕНИ | 2024 |
|
RU2839904C1 |
| СПОСОБ ОЦЕНКИ РИСКА ТРАНСЮГУЛЯРНОГО ВНУТРИПЕЧЕНОЧНОГО ПОРТОСИСТЕМНОГО ШУНТИРУЮЩЕГО ХИРУРГИЧЕСКОГО ВМЕШАТЕЛЬСТВА У БОЛЬНЫХ С ПОРТАЛЬНОЙ ГИПЕРТЕНЗИЕЙ ЦИРРОТИЧЕСКОГО ГЕНЕЗА | 2011 |
|
RU2492479C2 |
| Способ комплексного лечения осложнений цирроза печени через один хирургический доступ | 2024 |
|
RU2838304C1 |
| Способ оценки риска неблагоприятного исхода для больного циррозом, находящегося в листе ожидания трансплантации печени | 2020 |
|
RU2737582C1 |
| СПОСОБ ТРЕХЭТАПНОГО МИНИ-ИНВАЗИВНОГО ЛЕЧЕНИЯ ОСЛОЖНЕНИЙ ЦИРРОЗА ПЕЧЕНИ | 2023 |
|
RU2816786C1 |
| Способ прогнозирования вероятности прогрессирования печеночной энцефалопатии через 6 месяцев наблюдения | 2024 |
|
RU2838803C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАСТУПЛЕНИЯ ЛЕТАЛЬНОГО ИСХОДА У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ ВИРУСНОЙ И АЛКОГОЛЬНОЙ ЭТИОЛОГИИ | 2008 |
|
RU2373533C1 |

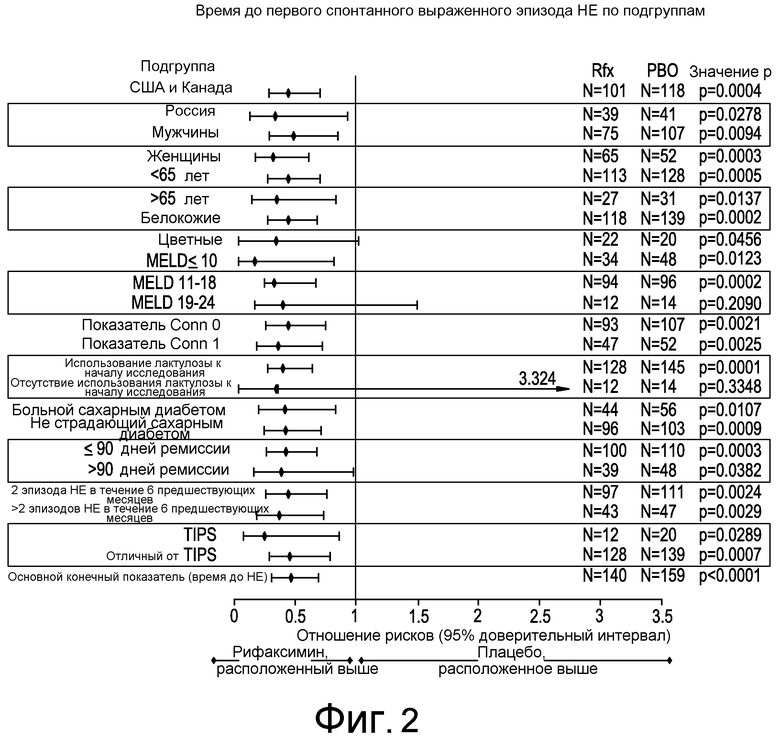

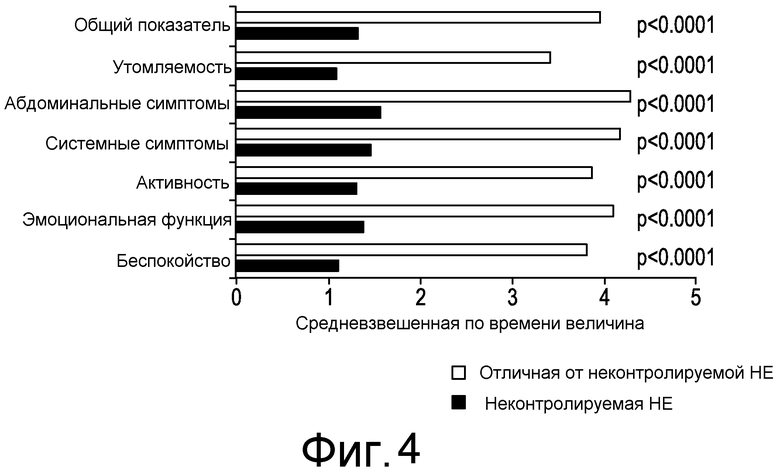
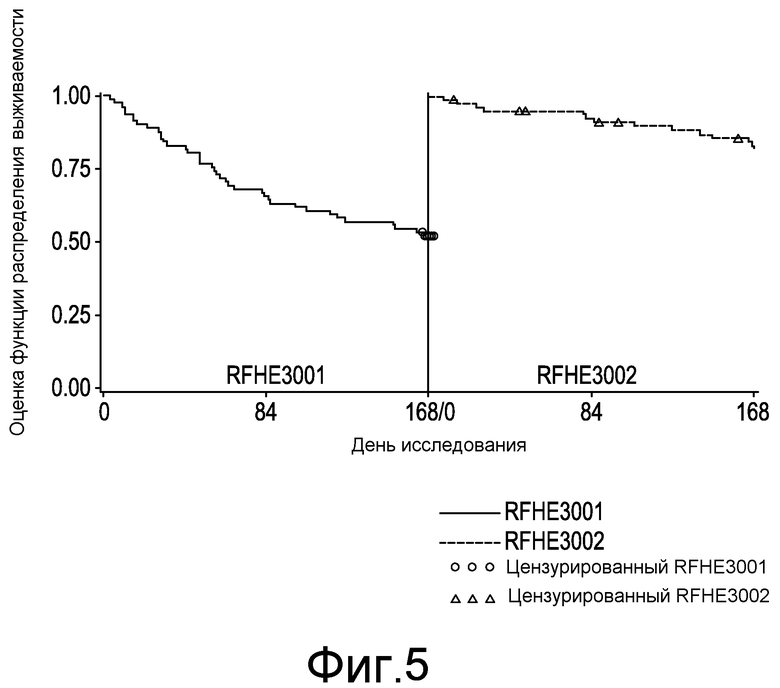
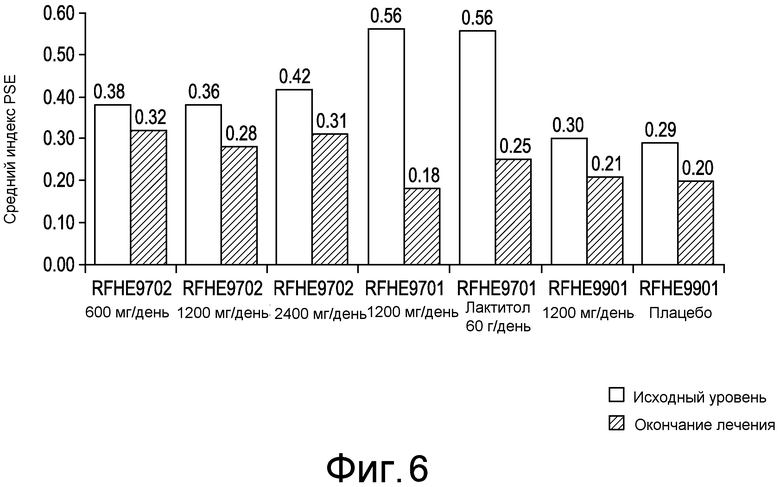
Изобретение относится к медицине, конкретно к влиянию печеночной недостаточности на фармакокинетику рифаксимина. Описано применение рифаксимина для получения лекарственного средства для лечения субъекта, страдающего от, подверженного или находящегося в стадии ремиссии печеночной энцефалопатии (НЕ), включающее введение рифаксимина в течение периода от примерно 24 недель до 24 месяцев в дозе 550 мг дважды в день ежедневно. Лекарственное средство позволяет снизить риск выраженной печеночной энцефалопатии у субъекта. 5 з.п. ф-лы, 19 табл., 6 ил., 4 пр.
1. Применение рифаксимина для получения лекарственного средства для лечения субъекта, страдающего от, подверженного или находящегося в стадии ремиссии печеночной энцефалопатии (НЕ), включающее введение рифаксимина в течение периода от примерно 24 недель до 24 месяцев в дозе 550 мг дважды в день ежедневно.
2. Применение по п. 1, где субъектом является человек.
3. Применение по п. 1, где скорость клиренса рифаксимина снижена у популяции субъектов с печеночной энцефалопатией по сравнению с популяцией субъектов без печеночной энцефалопатии.
4. Применение по п. 1, где скорость элиминации рифаксимина снижена у субъектов с печеночной энцефалопатией по сравнению с субъектами без печеночной энцефалопатии.
5. Применение по п. 1, где системное воздействие рифаксимина увеличено у популяции субъектов с печеночной энцефалопатией по сравнению с популяцией субъектов без печеночной энцефалопатии.
6. Применение по п. 1, где уровень в сыворотке рифаксимина увеличен у популяции субъектов с печеночной энцефалопатией по сравнению с популяцией субъектов без печеночной энцефалопатии.
| Колосоуборка | 1923 |
|
SU2009A1 |
| А.А | |||
| Шептулин, Современные подходы к лечению диареи путешественников, РЖГГК, 2008, т.18, N6, с.64-67 [найдено 2015.03.11] | |||
| Найдено из Интернет: URL: | |||
| Схема обмотки ротора для пуска в ход индукционного двигателя без помощи реостата, с применением принципа противосоединения обмоток при трогании двигателя с места | 1922 |
|
SU122A1 |
| Приспособление для покрывания пряников и других конфетных изделий сахарным сиропом | 1928 |
|
SU19433A1 |
Авторы
Даты
2015-12-20—Публикация
2010-06-15—Подача