1. Область техники
Предложенный способ относится к области медицины, биологии и биотехнологии и может быть использован при диагностике заболеваний пародонта в ротовой полости, прогнозирования тяжести и скорости прогрессии заболевания и алгоритма лечения заболевания в зависимости от индивидуального генетического профиля пациента.
На протяжении многих лет заболевания пародонта стабильно занимают по распространенности одно из ведущих мест в мире. Несмотря на широкое развитие инструментальных и лабораторных методов исследования, ранняя и точная диагностика различных стоматологических заболеваний до сих пор остается крайне актуальным вопросом.
Известно, что развитие и течение любого заболевания бактериальной природы определяется силой ответной реакции организма, которая, в свою очередь, зависит не только от приобретенного иммунитета, но в значительной степени определяется генотипом человека. За последние 10-15 лет получены первые результаты по идентификации генетических маркеров пародонтита. Установлена ассоциация с пародонтитом полиморфных локусов генов цитокинов, коллагена 1 типа, антигенов HLA, рецептора витамина D, ряда ферментов и регуляторных молекул (Brett P.M. et al., 2005; Agrawal A.A. et al., 2006; Tervonen T. et al., 2007; Wagner J. et al., 2007; Pirhan D. et al., 2007; Houshmand B. et al., 2009; Chai L. et al., 2009; Erciyas K. et al., 2010; Scarel-Caminaga R.M. et al., 2011).
Впервые выявлена взаимосвязь варианта - 1562Т (rs3918242) гена матриксной металлопротеиназы ММР9 с развитием хронического генерализованного пародонтита, что указывает на участие генетически детерминированной системы «протеолиз-антипротеолиз» в патогенезе заболеваний пародонта (Зорина, 2011).
2. Уровень техники
Широко распространен способ определения типа нуклеотида, находящегося в определенном месте ДНК, основанный на использовании аллель-специфичных праймеров с регистрацией результатов ПЦР по окончании реакции с помощью электрофореза. При использовании ПЦР с регистрацией результатов в ходе реакции известны различные способы определения генотипа исследуемого образца.
Существуют способы, позволяющие определить тип нуклеотида, находящегося в определенном месте ДНК, основанные на использовании аллель-специфичных праймеров с регистрацией результатов ПЦР непосредственно в ходе реакции с помощью использования флуоресцентно-меченых проб (олигонуклеотидов) (Andreas R. Tobler at all, "THE SNPlex Genotiping System: A Flexible and Scalable Platform for SNP Genotyping", Journal of Biomolecular Techniques, V.16, issue 4, Desember 2005).
Например, в наборах производства Applied Biosystems используют одну пару праймеров для каждого аллеля и два зонда с различными флуорецентными метками, в зависимости от генотипа аллеля фиксируют разгорание различных меток ("TaqMan SNP Genotyping Assays", Applied Biosistems, Prodakt Bulletin, USA, 06/2006). Недостатком способа, используемого в данных наборах, является сравнительно невысокая достоверность результатов исследования из-за небольшой разницы между получаемыми кривыми флуоресценции для разных аллелей.
Предлагаемым подходом к детекции генетического полиморфизма является использование двух аллель-специфичных и меченых разными флуоресцентными метками олигонуклеотидов, а также олигонуклеотида, несущего гаситель флуоресценции и гибридизирующегося на матрицу рядом с аллель-специфичным олигонуклеотидом. Гибридизация аллель-специфичного олигонуклеотида на матрицу ведет к переносу энергии с находящегося на нем флуорофора-донора на гаситель флуоресценции расположенного рядом «гасящего» олигонуклеотида. Регистрацию результатов амплификации ведут по окончании ПЦР путем снятия спектра флуоресценции при изменении температуры реакционной смеси в диапазоне от 25 до 80 градусов по Цельсию (так называемые «кривые плавления»). При получении графиков флуоресценции возможен как нагрев, так и охлаждение реакционной смеси в указанном интервале температур.
Предлагаемое изобретение делает определение вариабельных позиций в ДНК более надежным и удешевляет подобные исследования благодаря использованию стандартного оборудования.
3. Раскрытие изобретения
Техническим результатом, на достижение которого направлено предлагаемое изобретение, является повышение надежности и доступности подобных исследований, поскольку способ может быть осуществлен на стандартном известном оборудовании. Также он обеспечивает возможность проводить исследование в одной пробирке, что снижает затраты на исследование.
Использованный нами способ генотипирования является вариантом классического метода «примыкающих проб». При определении замен одиночных нуклеотидов вначале проводили ПЦР с праймерами, общими для обоих вариантов последовательности, затем температуру реакционной смеси снижали для гибридизации полученной матрицы с олигонуклеотидными пробами. Для определения варианта последовательности использовали два типа олигонуклеотидов, гибридизирующихся на матрицу рядом. Один из олигонуклеотидов метили флуорофором, другой - гасителем флуоресценции.
В реакции использовали один общий олигонуклеотид с гасителем флуоресценции и пару аллель-специфичных (сиквенс-специфичных) олигонуклеотидов, несущих флуорофор. Олигонуклеотидные пробы, соответствующие тому или иному варианту последовательности, метили различными флуорофорами, что позволило определять оба варианта в одной пробирке. Определение генотипа проводили после ПЦР и гибридизации путем измерения уровня флуоресценции в ходе температурной денатурации дуплексов олигонуклеотидов и полученных матриц (или, наоборот, гибридизации). Данное измерение проводили в режиме реального времени, его результатом являлись кривые плавления.
Условия реакции подбирали так, чтобы максимизировать разницу в температурах плавления совершенного и несовершенного дуплексов. Таким образом, если анализируемый образец содержал только один вариант последовательности, т.е. был гомозиготен по данному полиморфизму, температура плавления для пробы, образующей совершенный дуплекс, была существенно выше, нежели для пробы ,образующей несовершенный дуплекс. Если же анализировали гетерозиготный образец, температуры плавления были практически одинаковы.
Указанный результат достигается путем использования при постановке ПЦР флуоресцентно-меченых аллель-специфичных олигонуклеотидных проб и праймеров:
FAM - означает флуоресцентный краситель FAM, HEX - означает флуоресцентный краситель HEX, BHQ1 - означает присоединенный к 5'-концевому нуклеотиду темновой гаситель флуоресценции.
Состав амплификационной смеси (на одну реакцию):
* Состав буфера для проведения ПЦР
84 мМ Трис-HCl рН 8,6
21 мМ (NH4)2SO4
3,1 мМ MgCl2
0,003% Tween-20
0,003% NP-40
6,25% глицерин
4. Осуществление изобретения
В качестве материала для исследования рекомендуется использовать кровь, соскобы буккального эпителия, биоптаты мягких тканей человека или иной стандартный биологический материал. Выделение ДНК из биоматериала производится с использованием комплекта реагентов для выделения ДНК (не является предметом данного патента).
Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора «ДТпрайм» (000 «НПО ДНК-Технология», Россия). Использовали следующий температурный режим амплификации: 94°С - 10 с, 64°С - 30 с в течение 50 циклов. По завершении реакции амплификации реакционную смесь остужали до 25°С со скоростью 2°С/сек. Кривые плавления получали следующим образом: температуру реакционной смеси повышали с 25°С до 75°С с шагом ГС, измеряя уровень флуоресценции на каждом шаге.
Результаты, т.е. отнесение образца к гомозиготе или гетерозиготе по данному аллелю, оцениваются по форме кривых плавления ДНК (рис. 1).
Список литературы:
1. Agrawal A.A., Kapley A., Yeltiwar R.K. et al. Assessment of single nucleotide polymorphism at IL-1A14845 and IL-1B 13954 as genetic susceptibility test for chronic periodontitis in Maharashtrian ethnicity. // J.Periodontol. - 2006. - Vol.77. - P.1515-1521.
2. Brett P.M., Zygogianni P., Griffiths G.S. et al. Functional gene polymorphisms in aggressive and chronic periodontitis. // J.Dent. Res. - 2005. - Vol.84, №12. - P.1149-1153.
3. Pirhan D., Atilla G., Emingil G. et al. Effect of MMP-1 promoter polymorphisms on GCF MMP-1 levels and outcome of periodontal therapy in patients with severe chronic periodontitis. // J.Clin. Periodontol. - 2008. - Vol.35, №10. - P.862-870.
4. Scarel-Caminaga R.M., Trevilatto P.C., Souza A.P. et al. Investigation of IL4 gene polymorphism in individuals with different levels of chronic periodontitis in a Brazilian population. // J.Clin. Periodontol. - 2003. - Vol.30. - P.341-345.
5. Tervonen Т., Raunio Т., Knuuttila M. et al. Polymorphisms in the CD 14 and IL-6 genes associated with periodontal disease. // J.Clin. Periodontol. - 2007. - Vol.34. - P.377-383.
6. Wagner J., Kaminski W.E., Aslanidis C. Prevalence of OPG and IL-1 gene polymorphisms in chronic periodontitis. // J.Clin. Periodontol. - 2007. - Vol.34. - P.823-827.
7. Зорина О.А. Взаимосвязь качественного и количественного состава биоценозов ротовой полости и индивидуального генетического профиля на фоне воспалительных заболеваний пародонта. // Автореферат диссертации - M., 2011.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ КОЛЛАГЕНА II ТИПА COL2A1 C>A (RS1635529) | 2012 |
|
RU2518301C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФНОЙ ПОЗИЦИИ rs1613662 В ГЕНЕ GP6, КОДИРУЮЩЕМ ГЛИКОПРОТЕИН VI | 2013 |
|
RU2556808C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ 3 (ММР3) -11715А/6А | 2018 |
|
RU2699053C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ В ГЕНЕ ГАЛАКТОЗО-1-ФОСФАТУРИДИЛТРАНСФЕРАЗЫ ЧЕЛОВЕКА МУТАЦИИ Q188R, RS75391579 | 2017 |
|
RU2675324C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ ЦИТОХРОМА P450 CYP2D6∗3 (2549delA), rs35742686 | 2016 |
|
RU2651770C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ ЦИТОХРОМА Р450 CYP2D6*6 (1707delT) rs5030655 | 2016 |
|
RU2653492C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ ЦИТОХРОМА P450 CYP2D6*4 (1846G>A), RS3892097 | 2016 |
|
RU2651774C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ ЦИТОХРОМА P450 CYP2D6*9 (2615-2617delAAG) rs5030656 | 2016 |
|
RU2651773C2 |
| Способ диагностики мутации 167delT (rs80338942) гена GJB2 | 2020 |
|
RU2739943C1 |
| Способ диагностики мутации 35delG (rs80338939) гена GJB2 | 2020 |
|
RU2739889C1 |
Изобретение относится к области биотехнологии и может быть использовано для определения генотипа человека по полиморфизму в гене матриксной металлопротеиназы ММР9-1562 C>Т (rs3918242). Способ основан на снятии кривых плавления с флуоресцентно-мечеными аллель-специфичными олигонуклеотидными пробами. В способе используют общую для всех аллелей пару праймеров, отличающиеся для каждого аллеля флуоресцентно-меченые аллель-специфичные олигонуклеотидные пробы и универсальный олигонуклеотид, меченый гасителем флуоресценции следующего нуклеотидного состава: MMP9-1562s CGAAACCAGCCTGGTCAACG; ММР9-1562а TCTGCCTCCCGGGTTCAAGC; ММР9-1562р1 GGCGCACGCCTATAA-FAM; ММР9-1562р2 GGCGCATGCCTATAA-HEX; ММР9-1562pq BHQ1-ACCAGCTACTCGGGAGGC-3'-(P), где FAM - означает флуоресцентный краситель FAM, HEX - означает флуоресцентный краситель HEX, BHQ1 - означает присоединенный к 5'-концевому нуклеотиду темновой гаситель флуоресценции. Отнесение образца к гомозиготе или гетерозиготе по данному аллелю оценивается по форме кривых плавления ДНК - по максимуму первой производной графиков флуоресценции. Изобретение позволяет повысить надежность и доступность генотипирования. 1 ил.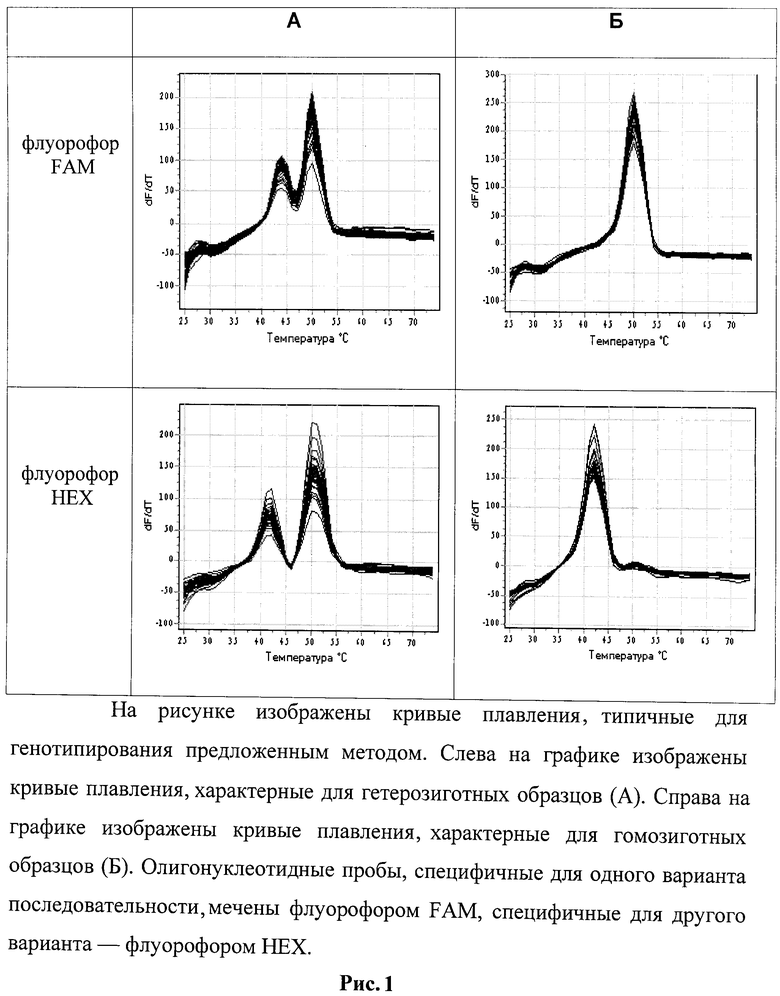
Способ определения генотипа человека по полиморфизму в гене матриксной металлопротеиназы ММР9-1562 C>Т (rs3918242), основанный на снятии кривых плавления с флуоресцентно-мечеными аллель-специфичными олигонуклеотидными пробами, отличающийся тем, что используют общую для всех аллелей пару праймеров, отличающиеся для каждого аллеля флуоресцентно-меченые аллель-специфичные олигонуклеотидные пробы и универсальный олигонуклеотид, меченый гасителем флуоресценции следующего нуклеотидного состава:
FAM - означает флуоресцентный краситель FAM, HEX - означает флуоресцентный краситель HEX, BHQ1 - означает присоединенный к 5'-концевому нуклеотиду темновой гаситель флуоресценции;
отнесение образца к гомозиготе или гетерозиготе по данному аллелю оцениваются по форме кривых плавления ДНК (по максимуму первой производной графиков флуоресценции).
| ЗОРИНА О.А., Взаимосвязь качественного и количественного состава биоценозов ротовой полости и индивидуального генетического профиля на фоне воспалительных заболеваний пародонта, Автореферат диссертации, 2011, с | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| ANDREAS R | |||
| TOBLER et al., THE SNPlex Genotiping System: A Flexible and Scalable Platform for SNP Genotyping, Journal of Biomolecular | |||
Авторы
Даты
2015-04-20—Публикация
2012-12-21—Подача