ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области иммунологии и, в частности, к области иммуногенных композиций и композиций вакцин. Оно относится к таким композициям для применения против респираторных заболеваний собак, включающих комплекс инфекционных респираторных заболеваний собак (CIRDC). Настоящее изобретение также относится к способам вакцинации против собачьих респираторных заболеваний, лечения или предупреждения собачьих респираторных заболеваний у представителя семейства псовых.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Комплекс инфекционных респираторных заболеваний собак (CIRDC) представляет собой высокозаразное заболевание, обычное у собак, содержащихся в скученных условиях, таких как центры по поиску новых хозяев, гостиницы или тренировочные центры для собак. Многие собаки страдают только легким кашлем и поправляются через короткий промежуток времени. Однако в некоторых случаях может развиваться тяжелая бронхопневмония.
Патогенез CIRDC считается многофакторым, включающим несколько вирусов и бактерий. Инфекционные агенты, известные в качестве возбудителей CIRDC, включают собачий респираторный коронавирус (CRCoV) (Erles et al., Virology, 310(2): 216-223, 2003), вирус собачьего гриппа (CIV) (Crawford et al., Science, 310(5747): 482-485, 2005), вирус собачьего парагриппа (CPIV) (Binn et al., Exp. Biol. Med., 126: 140-145, 1967), собачий аденовирус серотипа 2 (CAV-2) (Ditchfield et al., Can. Vet. J., 3: 238-247, 1962), Mycoplasma cynos (Chalker et al., Microbiology, 150: 3491-3497, 2004) и бактерию Bordetella bronchiseptica (Bemis et al., Lab. Anim. Sci., 29: 48-52, 1977).
CRCoV вызывает высокозаразную респираторную инфекцию, которая распространяется посредством прямого контакта собаки с собакой, аэрозолей респираторных выделений и контактов с зараженными окружающей средой или людьми. Некоторые собаки имеют легкое заболевание с симптомами, состоящими из кашля, чихания и выделений из носа. Некоторые собаки имеют субклиническую инфекцию без клинических признаков, тем не менее, они распространяют вирус, который может инфицировать других собак. У некоторых собак, инфицированных CRCoV, развивается пневмония, особенно если они соинфицированы другими респираторными патогенами.
Что касается CIV, вирус лошадиного гриппа признавали в качестве главного респираторного патогена у лошадей примерно с 1956 года. Симптомы заболевания, вызванного вирусом лошадиного гриппа, могут быть тяжелыми и часто сопровождаются вторичными бактериальными инфекциями. Распознают два подтипа вируса лошадиного гриппа, а именно подтип-1, прототипом которого является A/Equine/Prague/1/56 (H7N7), и подтип-2, прототипом которого является A/Equine/Miami/1/63 (H3N8). В настоящее время преобладающим подтипом вируса является подтип-2, штамм H3N8. Вирус гриппа - вирус лошадиного гриппа H3N8 - способен инфицировать представителей семейства псовых со смертностью, в некоторых случаях достигающей 36%. Одним объяснением является то, что межвидовой перенос целого вируса лошадиного гриппа или его части собаке привел к появлению нового специфичного для собак вируса гриппа, ассоциированного с острым респираторным заболеванием (Crawford et al., 2005).
Заболевание, вызванное CPIV, является обычным в верхнем респираторном тракте. Заболевание, вызванное одним CPIV, может быть легким или субклиническим с признаками, становящимися более тяжелыми, если случается сопутствующая инфекция другими респираторными патогенами.
CAV-2 вызывает респираторное заболевание, которое, в тяжелых случаях, может включать пневмонию и бронхопневмнию.
Сообщалось, что В. bronchiseptica является первичным возбудителем при респираторном заболевании трахеобронхите или «кашле псарен». Она предрасполагает собак к влиянию других респираторных агентов и часто существует одновременно с ними. Кашель псарен типично представляет собой состояние верхних дыхательных путей и характеризуется выделениями из носа и кашлем. К настоящему времени доступен ряд вакцин для лечения трахеобронхита, вызванного Bordetella bronchiseptica, включая Nobivac®, Bronchi-Shield®, Bronchicine® CAe, Vanguard® B, Univac 2, Recombitek® KC2, Naramune™-2 и Kennel-Jec™ 2. Однако для большинства существующих имеющихся в продаже вакцин требуется обременительное интраназальное введение, а также добавление адъювантов, что может приводить к вредным побочным эффектам, таким как жжение и раздражение. Viera Scheibner et al., Nexus Dec 2000 (Vol 8, No1). Были исследованы субъединичные вакцины, такие как вакцины, предполагающие применение белка p68 Bordetella bronchiseptica (пертактин), но до настоящего времени они не были включены в какие-либо имеющиеся в продаже вакцины для собак, возможно из-за недостаточной иммуногенности, побочных реакций и/или стабильности композиции.
Патология CIRDC указывает на то, что он участвует в повреждении легких и, в некоторых случаях, в бронхопневмонии, но он отличается от кашля псарен (первичный возбудитель - В. bronchiseptica), который главным образом включает изменения в верхнем респираторном тракте. Кашель псарен является более легким синдромом, чем CIRDC, и не демонстрирует широкий диапазон патологии, отмеченный при CIRDC. CIRDC также отличается повышенной тяжестью и смертностью.
CIRDC редко является смертельным, но он задерживает обретение новых хозяев собаками в спасательных центрах, нарушает график в тренировочных центрах для собак и приводит к значительным затратам на лечение и к проблемам благополучия. Доступны вакцины против некоторых инфекционных агентов, ассоциированных с CIRDC. Однако, несмотря на применение данных вакцин, CIRDC все еще широко распространен по всему миру, возможно из-за отсутствия эффективных вакцин против всех инфекционных агентов, участвующих в CIRDC.
Таким образом, сохраняется потребность в иммуногенной композиции, которую можно безопасно вводить представителю семейства псовых, которая обеспечивает длительно действующую иммунную защиту против агентов, вызывающих CIRDC, без вредных побочных эффектов или взаимодействия с другими антигенами в комбинированной вакцине. Настоящее описание удовлетворяет эти и другие связанные с ними потребности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в целом, относится к иммуногенным композициям, предоставляющим антигены, которые лечат или предупреждают CIRDC. В одном воплощении иммуногенная композиция содержит вирус собачьего гриппа (CIV) и собачий респираторный коронавирус (CRCoV). В другом воплощении иммуногенная композиция дополнительно содержит Bordetella bronchiseptica. В другом воплощении иммуногенная композиция дополнительно содержит выделенный пертактиновый антиген. В другом воплощении иммуногенная композиция содержит пертактиновый антиген p68. В другом воплощении пертактиновый антиген представляет собой рекомбинантный белок. В еще одном воплощении пертактиновый антиген присутствует в количестве от примерно 1 мкг до примерно 30 мкг. В другом воплощении указанный пертактиновый антиген получают путем солюбилизации телец включений пертактина в мочевине и возможно очистки колоночной хроматографией. Указанные пертактиновые антигены являются растворимыми и предпочтительно по существу не содержат агрегатов. В другом воплощении Bordetella bronchiseptica представляет собой бактерин или бактериальный экстракт.
В одном воплощении иммуногенная композиция содержит CIV, CRCoV, Bordetella bronchiseptica и один антиген, выбранный из вируса собачьего парагриппа (CPIV) и собачьего аденовируса типа 2 (CAV-2), или оба этих антигена. В другом воплощении указанная иммуногенная композиция дополнительно содержит пертактиновый антиген p68. В другом воплощении Bordetella bronchiseptica представляет собой бактерин или бактериальный экстракт.
Согласно другому воплощению предложена иммуногенная композиция, содержащая CIV, CRCoV, компонент на основе Bordetella bronchiseptica, содержащий Bordetella bronchiseptica и выделенный пертактиновый антиген, и один антиген, выбранный из вируса собачьего парагриппа (CPIV) и собачьего аденовируса типа 2 (CAV-2), или оба из них. В другом воплощении иммуногенная композиция содержит и CPIV, и CAV-2.
В другом воплощении иммуногенная композиция по любому из вышеупомянутых воплощений дополнительно содержит выделенный антиген Bsp22.
В другом воплощении иммуногенная композиция по любому из вышеупомянутых воплощений не является адъювантной. В другом воплощении иммуногенная композиция по любому из вышеупомянутых воплощений содержит адъювант.
В другом воплощении иммуногенная композиция по любому из вышеупомянутых воплощений не содержит нереспираторный антиген.
В еще одном воплощении иммуногенная композиция по любому из вышеупомянутых воплощений индуцирует иммунный ответ на собачий респираторный патоген у представителя семейства псовых. В другом воплощении указанный собачий респираторный патоген представляет собой по меньшей мере один из: CIV, CRCoV, CPIV, CAV-2, Bordetella bronchiseptica и Mycoplasma cynos.
Согласно другому воплощению настоящего изобретения предложено применение иммуногенной композиции по любому из вышеупомянутых воплощений для лечения или предупреждения инфекции собачьим респираторным патогеном у представителя семейства псовых. В другом воплощении указанный собачий респираторный патоген представляет собой по меньшей мере один из: CIV, CRCoV, CPIV, CAV-2, Bordetella bronchiseptica и М. cynos. В другом воплощении указанная композиция предупреждает указанную инфекцию в течение периода 6 месяцев или более. В другом воплощении указанная композиция предупреждает указанную инфекцию в течение периода примерно одного года. В другом воплощении согласно настоящему изобретению предложено применение иммуногенной композиции по любому из вышеупомянутых воплощений в изготовлении лекарственного средства для лечения или предупреждения инфекции собачьим респираторным патогеном у представителя семейства псовых.
Согласно другому воплощению настоящего изобретения предложена иммуногенная композиция по любому из вышеупомянутых воплощений, где указанная композиция лечит или предупреждает комплекс инфекционных респираторных заболеваний собак (CIRDC) у представителя семейства псовых. Согласно другому воплощению настоящего изобретения предложен способ лечения или предупреждения CIRDC у представителя семейства псовых, включающий введение указанному представителю семейства псовых иммуногеной композиции по любому из вышеупомянутых воплощений. В другом воплощении указанная композиция предупреждает CIRDC в течение периода примерно 6 месяцев или более. В другом воплощении указанная композиция предупреждает CIRDC в течение периода примерно одного года. Согласно другому воплощению предложено применение иммуногенной композиции по любому из вышеупомянутых воплощений в изготовлении лекарственного средства для лечения или предупреждения CIRDC у представителя семейства псовых.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1. Ответ сывороточных нейтрализующих антител против CRCoV. Измерение ответа сывороточных нейтрализующих антител против собачьего респираторного коронавируса (CRCoV) при вакцинировании собак физиологическим раствором, композицией с гидроксидом алюминия (AIOH) в качестве адъюванта или композицией с Emulsigen® в качестве адъюванта.
Фиг.2. Назальное выделение вируса после заражения. Измерение выделения CRCoV из носовых ходов при вакцинировании собак физиологическим раствором, композицией с AIOH в качестве адъюванта или композицией с Emulsigen® в качестве адъюванта, с последующим заражением CRCoV.
Фиг.3. Процент позитивных животных в отношении вируса CRCoV в ткани на сутки 4 после заражения. Оценка числа собак, позитивных в отношении CRCoV в респираторной ткани, при вакцинировании физиологическим раствором, композицией с AIOH в качестве адъюванта или композицией с Emulsigen® в качестве адъюванта, с последующим заражением CRCoV.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К данному описанию применяются приведенные ниже определения. Они заменяют собой любые противоречащие определения, содержащиеся в каждой индивидуальной ссылке, включенной сюда посредством ссылки. Не определенные слова имеют значение, обычно используемое специалистом в данной области. Кроме того, если контекст не требует иного, термины в единственном числе будут включать термины во множественном числе, и термины во множественном числе будут включать термины в единственном числе.
«Примерно» или «приблизительно» при использовании в связи с измеримой численной переменной относятся к указанному значению переменной и ко всем значениям переменной, которые находятся в пределах экспериментальной ошибки указанного значения (например, в пределах 95%-ного доверительного интервала среднего значения) или в пределах 10 процентов указанного значения, в зависимости от того, какое из этих значений больше. Если «примерно» используется в ссылке на интервал времени в неделях, «примерно 3 недели» составляет от 17 до 25 суток, и «от примерно 2 до примерно 4 недель» составляет от 10 до 40 суток.
Термин «адъювант» в том виде, как он здесь используется, относится к любому веществу, которое служит в качестве неспецифичного стимулятора иммунного ответа. Смотрите ниже дополнительное описание адъювантов.
Термин «животное» в том виде, как он здесь используется, включает любое животное, которое чувствительно к комплексу респираторных заболеваний собак, включая млекопитающих, как одомашненных, так и диких.
Термин «антитело» в том виде, как он здесь используется, представляет собой любой полипептид, содержащий антигенсвязывающий сайт, независимо от источника, способа получения или других характеристик. Он относится к молекуле иммуноглобулина или к ее фрагменту, который специфично связывается с антигеном в результате иммунного ответа на данный антиген. Иммуноглобулины представляют собой белки сыворотки, состоящие из «легких» и «тяжелых» полипептидных цепей, имеющих «константные» и «вариабельные» области, и они делятся на классы (например IgA, IgD, IgE, IgG, и IgM) на основе состава константных областей. Антитело, которое является «специфичным» в отношении данного антигена, означает, что вариабельные области этого антитела распознают и связываются исключительно с конкретным антигеном. Этот термин включает поликлональное антитело, моноклональное антитело, моноспецифичное антитело, полиспецифичное антитело, гуманизированное антитело, тетрамерное антитело, четырехвалентное антитело, мультиспецифичное антитело, одноцепочечное антитело, домен-специфичное антитело, однодоменное антитело, антитело с удаленным доменом, слитый белок, слитый белок ScFc, химерное антитело, синтетическое антитело, рекомбинантное антитело, гибридное антитело, мутировавшее антитело и антитела с пересаженными CDR (гипервариабельная область), но не ограничивается ими. Антитела могут быть интактными иммуноглобулинами, происходящими из природных источников или из рекомбинантных источников, или могут быть иммунореактивными частями интактных иммуноглобулинов. «Антитело» может быть превращено в антигенсвязывающий белок, который включает, без ограничения ими, фрагменты антител, которые включают, без ограничения ими: Fab, F(ab')2, фрагмент Fab', фрагмент Fv, одноцепочечный фрагмент Fv (ScFv), фрагмент Fd, фрагмент dAb, диатела, пептид CDR3, «ограниченный» пептид FR3-CDR3-FR4, нанотело, двухвалентное нанотело, малое модульное иммунофармацевтическое вещество (SMIP) и минитело, и любой из вышеупомянутых фрагментов или их аналогов, полученных в результате химической или генетической манипуляции, а также другие фрагменты антител, которые сохраняют антигенсвязывающую функцию. Типично такие фрагменты содержали бы антигенсвязывающий домен. Как будет понятно специалистам в данной области, любую из таких молекул можно конструировать (например возвращать им последовательность зародышевой линии) для уменьшения ее иммуногенности, увеличения ее аффинности, изменения ее специфичности или для других целей.
Термин «антиген» или «иммуноген» в том виде, как он здесь используется, относится к молекуле, содержащей один или более чем один эпитоп (линейный, конформационный или оба), которая, при воздействии на субъект, будет индуцировать иммунный ответ, который является специфичным в отношении данного антигена. Эпитоп представляет собой специфичный сайт антигена, который связывается с рецептором Т-клетки или специфичным антителом и типично содержит от примерно 3 аминокислотных остатков до примерно 20 аминокислотных остатков. Термин антиген относится к субъединичным антигенам - антигенам, отдельным и обособленным от целого организма, с которым антиген ассоциирован в природе, а также к умерщвленным, ослабленным или инактивированным бактериям, вирусам, грибкам, паразитам или другим микробам. Термин антиген также относится к антителам, таким как антиидиотипические антитела или их фрагменты, и к синтетическим пептидным мимотопам, которые могут имитировать антиген или антигенную детерминанту (эпитоп). Термин антиген также относится к олигонуклеотиду или полинуклеотиду, который экспрессирует антиген или антигенную детерминанту in vivo, как, например, в приложениях по ДНК иммунизации.
Термин «антигенность» в том виде, как он здесь используется, относится к способности белка или полипептида быть иммуноспецифично связанным антителом, индуцированным против белка или полипептида.
Термин "Bordetella bronchiseptica" или "B. bronchiseptica" относится к живой ослабленной бактерии Bordetella bronchiseptica, экстракту умерщвленных цельных клеток (бактерину) Bordetella bronchiseptica или клеточному бактериальному экстракту Bordetella bronchiseptica.
Термин «буфер» означает химическую систему, которая предотвращает изменение концентрации другого химического вещества. Системы доноров и акцепторов протонов служат в качестве буферов, предотвращая заметные изменения концентрации ионов водорода (pH). Другим примером буфера является раствор, содержащий смесь слабой кислоты и ее соли (сопряженное основание) или слабого основания и его соли (сопряженная кислота).
Термин «собачий» в том виде, как он здесь используется, включает то, что обычно называют собакой, но он включает и других членов семейства Canidae.
Термин «линия клеток» или «клетка-хозяин» в том виде, как он здесь используется, означает прокариотическую или эукариотическую клетку, в которой может реплицироваться или поддерживаться вирус.
Термин «культура» в том виде, как он здесь используется, означает популяцию клеток или микроорганизмов, растущую в отсутствие других видов или типов.
Термин «доза» относится к вакцине или иммуногенной композиции, которую дают субъекту. «Первая доза» или «примирующая доза» относится к дозе такой композиции, которую дают в Сутки 0. «Вторая доза» или «третья доза» или «ежегодная доза» относятся к количеству такой композиции, которое дают после первой дозы, причем эта композиция, может быть, однако не обязательно является той же вакциной или иммуногенной композицией, что и первая доза.
«Эпитоп» представляет собой специфичный сайт антигена, который связывается с рецептором Т-клетки или специфичным антителом и типично содержит от примерно 3 аминокислотных остатков до примерно 20 аминокислотных остатков.
Термин «эксципиент» в том виде, как он здесь используется, относится к компоненту вакцины или иммуногенной композиции в виде нереакционноспособного носителя, который не является антигеном.
Термин «фрагмент» относится к усеченной части белка или гена. Термины «функциональный фрагмент» и «биологически активный фрагмент» относятся к фрагменту, который сохраняет биологические свойства полноразмерного белка или гена.
Термин «гомология» или «процент гомологии» относится к процентной доле нуклеотидов или аминокислотных остатков в последовательности-кандидате, которые являются идентичными или аналогичными остаткам в сравниваемой(ых) последовательности(ях) после выравнивания последовательностей и, если необходимо, введения пробелов для достижения максимального процента гомологии последовательности, и также рассмотрения любых консервативных замен в качестве части гомологии последовательностей.
«Гомологи» или «видовые гомологи» включают гены, обнаруженные у двух или более чем двух разных видов, которые обладают существенной гомологией полинуклеотидной последовательности и обладают такими же или аналогичными биологическими функциями и/или свойствами. Предпочтительные полинуклеотидные последовательности, которые представляют собой видовые гомологи, будут гибридизоваться при умеренно жестких условиях, как описано здесь посредством примера, и обладают такими же или аналогичными биологическими активностями и/или свойствами. В другом аспекте полинуклеотиды, представляющие собой видовые гомологи, будут иметь больше, чем примерно 60% гомологии последовательности, больше, чем примерно 70% гомологии последовательности, больше, чем примерно 80% гомологии последовательности, больше, чем примерно 90% гомологии последовательности, больше, чем примерно 95% гомологии последовательности, больше, чем примерно 96% гомологии последовательности, больше, чем примерно 97% гомологии последовательности, больше, чем примерно 98% гомологии последовательности или больше, чем примерно 99% гомологии последовательности.
Термин «идентичность» или «процент идентичности» относится к процентной доле нуклеотидов или аминокислот в последовательности-кандидате, которые являются идентичными остаткам в сравниваемой последовательности после выравнивания обеих последовательностей и, если необходимо, введения пробелов для достижения максимального процента идентичности последовательности, и не рассматривая любые консервативные замены в качестве части идентичности последовательностей.
Термин «иммунный ответ» у субъекта в том виде, как он здесь используется, относится к развитию гуморального иммунного ответа, клеточного иммунного ответа или гуморального и клеточного иммунного ответа на антиген. Термин «гуморальный иммунный ответ» относится к иммунному ответу, который по меньшей мере частично опосредован антителами. «Клеточный иммунный ответ» представляет собой иммунный ответ, опосредованный T-лимфоцитами или другими белыми кровяными клетками, либо и теми, и другими, и включает продукцию цитокинов, хемокинов и аналогичных молекул, продуцируемых активированными T-клетками, белыми кровяными клетками, либо и теми, и другими. Иммунные ответы можно определять с использованием стандартных иммуноанализов и анализов нейтрализации, которые известны в данной области.
Термин «иммуногенность» в том виде, как он здесь используется, относится к способности белка или полипептида индуцировать иммунный ответ, специфично направленный против антигена.
«Иммуногенная композиция» представляет собой препарат, содержащий иммуноген, включающий, например, белок, пептид, цельную клетку, инактивированный, субъединичный или ослабленный вирус, или полисахарид, либо их комбинацию, вводимый для стимулирования гуморальной и клеточной иммунных систем реципиента к одному или более чем одному антигену, присутствующему в иммуногенной композиции. «Иммунизация» представляет собой процесс введения иммуногенной композиции и стимулирования иммунного или иммуногенного ответа на антиген у хозяина. Предпочтительными хозяевами являются млекопитающие, такие как собаки. Предпочтительно иммуногенной композицией является вакцина.
Фраза «иммунологически защищающее количество» в том виде, как она здесь используется, представляет собой эффективное количество антигена для индукции иммуногенного ответа у реципиента, который является адекватным для предупреждения или ослабления признаков или симптомов заболевания, включая вредные эффекты на здоровье или их осложнения. Могут быть индуцированы либо гуморальный иммунитет, либо клеточно-опосредованный иммунитет, либо оба. Иммуногенный ответ животного на композицию можно оценивать, например, опосредованно через измерение титров антител, анализы пролиферации лимфоцитов, либо непосредственно через отслеживание признаков и симптомов после заражения штаммом дикого типа. Защитный иммунитет, который дает композиция или вакцина, можно оценивать измерением, например, уменьшения выделения заражающих организмов, уменьшения клинических признаков, таких как смертность, заболеваемость, температура и общее физическое состояние, здоровье и поведение субъекта. Иммунный ответ может включать в себя, без ограничения, индукцию клеточного и/или гуморального иммунитета. Количество композиции или вакцины, которое является терапевтически эффективным, может варьировать, в зависимости от конкретного использованного организма или состояния животного, которое лечат или вакцинируют, и может быть определено ветеринаром.
Термин «интраназальное» введение в том виде, как он здесь используется, относится к введению вещества, такого как вакцина или другая композиция, в организм субъекта через или посредством носа и включает транспорт вещества прежде всего через слизистую носа.
Термин «выделенный» в том виде, как он здесь используется, означает удаленный из среды, в которой он встречается в природе, либо один, либо в гетерологичной клетке-хозяине, либо в хромосоме, либо в векторе (например, плазмиде, фаге и т.д.). Термины «выделенная бактерия», «выделенная анаэробная бактерия», «выделенный бактериальный штамм», «выделенный вирус», «выделенный вирусный штамм» и тому подобное относятся к композиции, в которой бактерия или вирус по существу не содержат других микроорганизмов, например, в культуре, как, например, при отделении от среды, в которой они встречается в природе. «Выделенный», при использовании для описания любого конкретно определенного вещества, такого как полинуклеотид или полипептид, относится к веществу, которое отделено от исходной клеточной среды, в которой обычно обнаруживается вещество, такое как полипептид или нуклеиновая килота. Следовательно, в том виде, в котором здесь используется данный термин, лишь в качестве примера, в линии рекомбинантных клеток, сконструированной с полинуклеотидом по изобретению, используется «выделенная» нуклеиновая кислота. В качестве альтернативы, если конкретный белок или конкретный иммуногенный фрагмент заявлен или используется в качестве вакцины или другой композиции, он рассматривался бы как выделенный, так как был идентифицирован, отделен и в некоторой степени очищен по сравнению с тем, как он может существовать в природе. Если белок или его конкретный иммуногенный фрагмент продуцируется в рекомбинантной бактерии или эукариотическом экспрессионном векторе, который продуцирует антиген, считается, что он существует в виде выделенного белка или нуклеиновой кислоты. Например, в рекомбинантной линии клеток, сконструированной с полинуклеотидом, используется «выделенная» нуклеиновая кислота.
Термин «медицинский агент» относится к любому агенту, который является полезным в предупреждении, лечении или улучшении медицинского состояния, или предупреждении некоторого физиологического состояния или проявления.
Термин «моноклональное антитело» в том виде, как он здесь используется, относится к антителам, продуцируемым отдельной линией гибридомных клеток, все из которых направлены к одному эпитопу на конкретном антигене. Антиген, используемый для получения моноклонального антитела, может быть предоставлен в виде выделенного белка патогена или цельного патогена. «Гибридома» представляет собой клональную линию клеток, которая состоит из гибридных клеток, образованных слиянием миеломной клетки и клетки, продуцирующей специфичные антитела. В общем, моноклональные антитела имеют мышиное происхождение. Однако, термин «моноклональное антитело» также относится к клональной популяции антител, полученных против конкретного эпитопа антигена, полученного технологией фагового дисплея или способом, который является эквивалентным фаговому дисплею, или к гибридным клеткам немышиного происхождения.
Термин «оральное» или «пероральное» введение в том виде, как он здесь используется, относится к введению вещества, такого как вакцина или другая композиция, в организм субъекта через или посредством рта, и включает в себя проглатывание или транспорт через слизистую рта (например, подъязычное или щечное поглощение), либо и то, и другое. Внутритрахеальное введение также является способом орального или перорального введения.
Термин «ороназальное» введение в том виде, как он здесь используется, относится к введению вещества, такого как композиция или вакцина, в организм субъекта через или посредством носа и рта, как происходило бы, например, при помещении одной или более чем одной капли в нос. Ороназальное введение включает транспортные процессы, ассоциированные с пероральным и интраназальным введением.
Термин «парентеральное введение» в том виде, как он здесь используется, относится к введению вещества, такого как композиция или вакцина, в организм субъекта через или посредством пути, который не включает пищеварительный тракт. Парентеральное введение включает подкожное, внутримышечное, внутриартериальное и внутривенное введение. Для целей данного описания парентеральное введение исключает пути введения, которые прежде всего включают в себя транспорт вещества через ткань слизистой во рту, носу, трахее и легких.
Термин «патоген» или «патогенный микроорганизм» в том виде, как он здесь используется, означает микроорганизм, например, CPIV, CAV-2, CRCoV, CIV или Bordetella bronchiseptica, который способен индуцировать или вызывать у его животного-хозяина заболевание, недомогание или ненормальное состояние.
Термин «пертактин» в том виде, как он здесь используется, относится к белку наружной мембраны Bordetella. Предпочтительно пертактин происходит из В. bronchiseptica, и наиболее предпочтительно представляет собой «p68» и кодируется геном prnA. Пертактин может быть выделен в его нативной форме из Bordetella bronchiseptica, или он может быть получен рекомбинантно. Последовательности и примеры пертактина приведены в патенте США №7736658, содержание которого тем самым включено посредством ссылки. Используемый здесь пертактиновый антиген включает липидированные формы белка.
Фраза «фармацевтически приемлемый» относится к веществам, которые, в рамках медицинской точки зрения, подходят для применения в контакте с тканями субъектов без чрезмерной токсичности, раздражения, аллергического ответа и тому подобного, соразмерно приемлемому отношению пользы к риску, и являются эффективными для их намеченного применения.
Термин «поликлональное антитело» в том виде, как он здесь используется, относится к смешанной популяции антител, полученных против конкретного патогена или антигена. В общем, данная популяция содержит множество групп антител, причем каждая группа направлена на конкретный эпитоп патогена или антигена. Для получения поликлональных антител цельный патоген или выделенный антиген вводится в хозяина посредством инокуляции или инфекции, что индуцирует хозяина к образованию антител против патогена или антигена.
Термин «полинуклеотид» в том виде, как он здесь используется, означает молекулу органического полимера, состоящую из нуклеотидных мономеров, ковалентно связанных в цепь. ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота) представляют собой примеры полинуклеотидов с различной биологической функцией.
Термин «полипептид» в том виде, как он здесь используется, означает молекулу органического полимера, состоящую из двух или более чем двух аминокислот, связанных в цепь.
Фраза «предупреждение инфекции» в том виде, как она здесь используется, означает предупреждение или ингибирование репликации бактерии или вируса, которые вызывают идентифицированное заболевание, для ингибирования передачи бактерии или вируса, для предотвращения колонизации хозяина бактерией или вирусом, или для облегчения симптомов заболевания, вызванного инфекцией. Лечение считается терапевтическим, если имеется уменьшение бактериальной или вирусной нагрузки.
Термины «защита», «осуществление защиты», «защитный иммунитет» и тому подобное в том виде, в котором они здесь используются в отношении вакцины или другой композиции, означают то, что вакцина или композиция предупреждает или ослабляет симптомы заболевания, вызванного организмом, из которого получен(ы) антиген(ы), используемый(е) в вакцине или композиции. Термины «защита», «осуществление защиты» и тому подобное также означают то, что вакцину или композицию можно использовать для «лечения» заболевания или одного или более чем одного симптома заболевания, которое уже существует у субъекта.
Термин «респираторное» введение в том виде, как он здесь используется, относится к введению вещества, такого как вакцина или другая композиция, в организм субъекта через или посредством ингаляции распыляемого (атомизированного) вещества. При респираторном введении механизм первичного транспорта включает поглощение атомизированного вещества через слизистую в трахеях, бронхах и легких и, следовательно, отличается от интраназального или перорального введения.
Термины «специфичное связывание», «связывается специфично» и тому подобное определяются как две или более чем две молекулы, которые образуют комплекс, который можно измерить при физиологических условиях или условиях анализа, и который является избирательным. Считают, что антитело или другой ингибитор «специфично связывается» с белком, если, при правильно выбранных условиях, такое связывание по существу не ингибируется, тогда как неспецифичное связывание в то же самое время ингибируется. Специфичное связывание характеризуется высокой аффинностью и является селективным в отношении соединения или белка. Неспецифичное связывание обычно имеет низкую аффинность. Связывание у антител IgG, например, обычно характеризуется аффинностью по меньшей мере примерно 10-7 М или выше, как, например, по меньшей мере примерно 10-8 М или выше, или по меньшей мере примерно 10-9 М или выше, или по меньшей мере примерно 10-10 М или выше, или по меньшей мере примерно 10-11 М или выше, или по меньшей мере примерно 10-12 М или выше. Данный термин также применим, когда, например, антигенсвязывающий домен является специфичным в отношении конкретного эпитопа, который не несут многочисленные антигены, причем в данном случае антитело, несущее данный антигенсвязывающий домен, обычно не будет связываться с другими антигенами.
Термин «специфичный иммуногенный фрагмент» в том виде, как он здесь используется, относится к части последовательности, которая распознается антителом или T-клеткой, специфичной в отношении данной последовательности.
Термин «субъект» в том виде, как он здесь используется, относится к любому животному, имеющему иммунную систему, что включает в себя млекопитающих, таких как собаки.
Фраза «по существу идентичный» в том виде, как она здесь используется, относится к степени идентичности последовательности по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 96%, по меньшей мере примерно 97%, по меньшей мере примерно 98% или по меньшей мере примерно 99%.
Термины «субъединичная вакцина» и «субъединичная композиция» в том виде, как они здесь используются, относятся к типу вакцины или композиции, которая включает один или более чем один антиген, но не обязательно все антигены в вакцине или композиции, которые получены из или являются гомологичными антигенам из интересующего патогена, такого как вирус, бактерия, паразит или грибок. Такая композиция или вакцина по существу не содержит интактных патогенных клеток или патогенных частиц, или лизат таких клеток или частиц. Таким образом, субъединичная вакцина или субъединичная композиция может быть получена из по меньшей мере частично очищенных или по существу очищенных иммуногенных полипептидов из патогена или из их аналогов. Способы получения антигена или антигенов в субъединичной вакцине или субъединичной композиции включают стандартные методики очистки, рекомбинантную продукцию или химический синтез. Термины «субъединичная вакцина» и «субъединичная композиция», таким образом, относятся к вакцине или композиции, состоящей из определенного антигенного компонента или компонентов вируса, бактерии или другого иммуногена.
Термин «TCID50» относится к «дозе заражения культуры ткани» и определяется как такое разведение вируса, которое требуется для заражения 50% данной партии инокулированных клеточных культур. Для расчета TCID50 можно использовать разные методы, включая метод Спирмена-Карбера, который используется во всей данной заявке. Для описания метода Спирмена-Карбера смотрите В.W. Many & Н.О. Kangro, Virology Methods Manual 25-46 (1996).
Термин «терапевтический агент» в том виде, как он здесь используется, относится к любой молекуле, соединению, вирусу или обработке, предпочтительно к ослабленному или умерщвленному вирусу, или к субъединице, или соединению, которое способствует лечению вирусной, бактериальной, паразитарной или грибковой инфекции, заболевания или вызванного ими состояния.
Термин «терапевтически эффективное количество» в том виде, как он здесь используется, относится к количеству антигена или вакцины, или композиции, которое индуцировало бы иммунный ответ у субъекта (например, собаки), получающего антиген или вакцину или композицию, которое является адекватным для предупреждения или облегчения признаков или симптомов заболевания, включая вредные для здоровья эффекты или их осложнения, вызванные инфекцией патогеном, таким как вирус, бактерия, паразит или грибок. Может индуцироваться гуморальный иммунитет или клеточно-опосредованный иммунитет, или как гуморальный, так и клеточно-опосредованный иммунитет. Иммуногенный ответ животного на антиген, вакцину или композицию можно оценивать опосредованно через измерение титров антитела, анализы пролиферации лимфоцитов, или непосредственно через отслеживание признаков и симптомов после заражения штаммом дикого типа. Защитный иммунитет, который дается вакциной или композицией, можно оценивать измерением уменьшения выделения инфицирующего организма и/или по уменьшению клинических признаков, таких как смертность, заболеваемость, температура и общее физическое состояние, здоровье и поведение субъекта. Количество вакцины или композиции, которое является терапевтически эффективным, может варьировать, в зависимости от конкретного использованного иммуногена или состояния субъекта, и оно может быть определено специалистом в данной области.
Термины «лечить» или «проведение лечения» в том виде, как они здесь используются, относятся к обращению, облегчению, ингибированию развития или предупреждению расстройства, состояния или заболевания, к которому применяется данный термин, или к предупреждению одного или более чем одного симптома такого расстройства, состояния или заболевания.
Термин «лечение» в том виде, как он здесь используется, относится к акту «проведения лечения», как было непосредственно определено выше.
Термин «вакцина» или «композиция вакцины» в том виде, как он здесь используется, относится к иммуногенной композиции, выбранной из вируса или бактерии, которые могут быть живыми модифицированными, ослабленными, или умерщвленными, либо к субъединичной вакцине, либо к любой комбинации вышеупомянутого. Введение вакцины субъекту приводит к иммунному ответу. Вакцину можно вводить непосредственно в субъекта любым известным путем введения, включая парентеральный, пероральный и тому подобное. Данные термины означают композицию, которая предупреждает или ослабляет инфекцию, или которая предупреждает или ослабляет один или более чем один признак или симптом инфекции. Защитные эффекты композиции вакцины против патогена обычно достигаются индуцированием иммунного ответа субъекта. В общих чертах, исчезнувшая или пониженная заболеваемость от инфекции, ослабление признаков или симптомов, или ускоренное устранение микроорганизма из инфицированных субъектов указывают на защитные эффекты композиции вакцины. Композиции вакцины по настоящему изобретению дают защитные эффекты против инфекций, вызванных патогенами собачьих респираторных заболеваний.
Фраза «ветеринарно приемлемый» в том виде, как она здесь используется, относится к веществам, которые, в рамках медицинской точки зрения, являются подходящими для применения в контакте с тканями ветеринарных субъектов без чрезмерной токсичности, раздражения, аллергического ответа и тому подобного, соразмерно приемлемому отношению пользы к риску, и являются эффективными для их намеченного применения.
Фраза «ветеринарно приемлемый носитель» в том виде, как она здесь используется, относится к среде-носителю, которая не препятствует эффективности биологической активности активного ингредиента и не является токсичной для ветеринарного субъекта, которому ее вводят.
Антигены, иммуногенные композиции и вакцины
Согласно настоящему описанию предложены иммуногенные композиции и вакцины, содержащие один или более чем один вирус и одну или более чем одну бактерию. Согласно настоящему описанию предложены иммуногенные композиции и вакцины, содержащие один или более чем один вирус и одну или более чем одну бактерию или субъединицы, которые подходят для введения представителю семейства псовых для лечения CIRDC.
Описанный здесь собачий респираторный коронавирус (CRCoV) можно охарактеризовать как коронавирус, присутствующий в респираторном тракте собак с инфекционным респираторным заболеванием. Филогенетически CRCoV является наиболее близкородственным бычьему коронавирусу (BCoV), человеческому коронавирусу (HCoV) штамма ОС43 и вирусу гемагглютинирующего энцефаломиелита (HEV); энтеральный собачий коронавирус (CCoV) является лишь отдаленно родственным CRCoV. Репрезентативный пример CRCoV, подходящего для применения в настоящем изобретении, включает штамм, идентифицированный как штамм CRCoV 4182 (Eries et al., Virus Res., 124: 78-87, 2007).
Антигеном вируса гриппа, охватываемым данным изобретением, может быть любой идентифицированный штамм вируса гриппа из любой птицы или млекопитающего, включающий вирус гриппа, имеющий гемагглютинин подтипа H3 и нейраминидазу подтипа N8, или подтип H3N8, чаще называемый вирусом H3N8, но не ограничивающийся им. Вирус гриппа может происходить из млекопитающего или птицы, включая, без ограничения ими, происхождение из свиньи, лошади или собаки. В одном воплощении используется антиген собачьего гриппа. В одном воплощении используется антиген лошадиного гриппа. В одном воплощении используется штамм, имеющий гликопротеины подтипа, обозначенного как H3 или N8. В одном воплощении используется штамм, имеющий гликопротеины обоих подтипов H3 и N8.
Антигены гриппа, охватываемые данным изобретением, могут быть выделены из собак, лошадей, свиней и птиц, как домашних, так и диких. Животные, выбранные для отбора образцов, должны демонстрировать острые и/или подострые клинические синдромы, которые могут включать респираторные симптомы и лихорадку от умеренной до тяжелой. Животные также могут демонстрировать признаки анорексии и вялости. Способы выделения вируса хорошо известны специалистам в данной области и включают: инокулирование культур клеток млекопитающих или птиц, инокулирование яиц с зародышами образцами назальной или глоточной слизи из клинических образцов, отбор посредством мазка носовых ходов или глотки, или посредством отбора таких тканей, как селезенка, легкое, миндалина, печень и легочный лаваж. Цитопатический эффект вируса можно наблюдать в культуре клеток. Аллантоисную жидкость или клеточные лизаты можно тестировать на их способность агглютинировать человеческие, куриные, индюшачьи эритроциты или эритроциты морской свинки, что является предположительным доказательством присутствия вируса гриппа.
Репрезентативный пример штамма вируса гриппа, подходящего для применения в настоящем изобретении, включает штамм, идентифицированный как A/canine/lowa/9A1/B5/08/D12, который был депонирован в Американскую коллекцию типовых культур (ATCC), 10801 University Boulevard, Manassas, VA 20110-2209, как PTA-7694 29 июня 2006 года в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры. Репрезентативным штаммом антигена CIV является штамм вируса CIV в имеющейся в продаже вакцине Vanguard® CIV (Pfizer). Данное изобретение также охватывает вакцины, содержащие штамм, идентифицированный как штамм лошадиного гриппа A/Equine/2/Miami/1/63. Данный штамм был депонирован в ATCC с номером доступа VR 317 в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры.
Дополнительные примеры вирусов гриппа для применения в настоящем изобретении представляют собой: A/canine/lowa/13628/2005, A/Equine/Kentucky/1998, A/Equine/Kentucky/15/2002, A/Equine/Ohio/1/2003, A/Equine/Kentucky/1/1994, A/Equine/Massachusetts/213/2003, A/Equine/Wisconsin/2003, A/Equine/NewYork/1999 и A/Equine/Newmarket/A2/1993. Другие предпочтительные штаммы и/или изоляты CIV включают штаммы и/или изоляты, раскрытые в патентах США №7959929 (особенно штаммы и последовательности НА, идентифицированные там как Jacksonville/2005, Miami/2005, FL/242/03 и Florida/43/04), 7384642, 7572620 и 7468187, содержание которых, включая все последовательности, особенно последовательности HA, и штаммы, тем самым включено посредством ссылки, как если бы оно здесь было полностью изложено. Дополнительно, штамм CIV, подходящий для применения здесь, включает изолят CIV Colorado, описанный в Barrell et al., J. Vet. Intern. Med., 24 (6), 1524-1527 (2010), имеющий номер доступа ADW41784.
Вирус собачьего парагриппа (CPIV), охватываемый данным изобретением, можно охарактеризовать как один из вирусов, известных в качестве возбудителя заболевания, ассоциированного с кашлем псарен. Репрезентативным штаммом антигена CPIV является штамм ослабленного вируса CPI в имеющейся в продаже вакцине Vanguard® Plus 5 (Pfizer). Другим репрезентативным штаммом антигена CPIV является штамм ослабленного вируса CPI, имеющий обозначение "NL-CPI-5" (National Veterinary Service Laboratory, Ames, IA).
Собачий аденовирус типа 2 (CAV-2), охватываемый данным изобретением, можно охарактеризовать как один из вирусов, также известных в качестве возбудителя заболевания, ассоциированного с кашлем псарен. Репрезентативным штаммом антигена CAV-2 является штамм ослабленного вируса CAV-2 в имеющейся в продаже вакцине Vanguard® Plus 5 (Pfizer).
Репрезентативным штаммом антигена CAV-2 является штамм ослабленного CAV-2, обозначенный как штамм "Manhattan" (National Veterinary Service Laboratory, Ames, IA).
Mycoplasma cynos (M. cynos), охватываемая данным изобретением, описана в Chalker et al., Microbiology, 150: 3491-3497, 2004 и представляет собой единственный вид микоплазмы, обычно ассоциированный с респираторным заболеванием. Иммуногенные композиции против M. cynos описаны в патенте США 2007/0098739, включенном сюда посредством ссылки.
Компонент в виде Bordetella bronchiseptica, охватываемый данным изобретением, может быть охарактеризован как бактериальный возбудитель заболевания, ассоциированного с кашлем псарен. Иммуногенные композиции и вакцины, охватываемые настоящим изобретением, могут представлять собой одно или более чем одно из следующего: живую ослабленную Bordetella bronchiseptica, бактерии Bordetella bronchiseptica или бактериальный экстракт Bordetella bronchiseptica. Дополнительно композиция предпочтительно также включает выделенный субъединичный антиген Bordetella bronchiseptica.
В одном воплощении Bordetella bronchiseptica получают в виде продукта разрушения цельных клеток ультразвуком, очищенного посредством колоночной хроматографии, как предложено в патентной заявке № FR 2571618, поданной 12 октября 1984 года. Другим репрезентативным примером Bordetella bronchiseptica является бактериальный экстракт Bronchicine™ CAe (Pfizer), который получают из антигенного материала, экстрагированного из клеток Bordetella bronchiseptica. Другим примером Bordetella bronchiseptica является живой ослабленный штамм B-C2 Bordetella bronchiseptica, присутствующий в Nobivac® и/или живой штамм bronchiseptica из Intra-Trac®, Bronchi-Shield®, Naramune™, Recombitek®, Univac и/или Kennel-Jec™.
Кроме того, в комбинации с компонентом в виде Bordetella bronchiseptica также предпочтительно присутствует субъединица (т.е. дополняет). Репрезентативным примером данной субъединицы является выделенный пертактиновый антиген, предпочтительно антиген p68 Bordetella bronchiseptica, в частности рекомбинантный антиген p68 Bordetella bronchiseptica, который распознается специфичным в отношении р68 моноклональным антителом Bord 2-7 (описано в патенте США 7736658, включенном сюда посредством ссылки), и в одном предпочтительном воплощении имеет аминокислотную последовательность, как изложено в патенте США 7736658, или имеет гомологию с ней.
Рекомбинантный пертактиновый антиген p68 предпочтительно получают в растворимой форме, так что структура, подобная нативной, сохраняется или восстанавливается во время переработки. Соответственно, согласно одному аспекту изобетения предложен рекомбинантный p68, который по существу не содержит (меньше, чем примерно 80%, 90%, 95% или даже 99%) агрегатов. В другом воплощении рекомбинантный пертактин p68 солюбилизируется мочевиной, предпочтительно примерно 0,1 М, 0,5 М, 1 М, 2 М, 3 М или 6 М раствором мочевины. Затем антиген p68 можно очищать, например, посредством колоночной хроматографии. Один такой способ солюбилизации описан в Surinder et al., J. Bioscience and Bioengineering, v.99(4), pgs 303-310 (2005).
Используемые здесь пертактиновые антигены также включают липидированные формы. Примеры получения липидированных белков приведены в Erdile et al., Infection and Immunity, (1993) v.61(1), p.81-90, включенной посредством ссылки. Раскрытые здесь способы можно использовать для получения посттрансляционно модифицированных пертактиновых белков, которые содержат присоединенную липидную группировку.
Кроме того, в другом воплощении иммуногенная композиция содержит Bordetella bronchiseptica и выделенный антиген Bsp22. В другом воплощении иммуногенная композиция содержит Bordetella bronchiseptica, выделенный пертактиновый антиген и выделенный антиген Bsp22. Антиген Bsp22 можно получать, как предложено в Medhekar et al., Molecular Microbiology (2009) 71(2), 492-504. Предпочтительно выделенный антиген Bsp22 присутствует в сочетании (т.е. наряду) с экстрактом Bordetella bronchiseptica и выделенным пертактиновым антигеном, конкретно рекомбинантным p68.
«Bsp22» также включает липидированные формы антигена. Примеры получения липидированных белков предложены в Erdile et al., Infection and Immunity, (1993) v.61(1), p.81-90, включенной посредством ссылки. Раскрытые там способы можно использовать для получения посттрансляционно модифицированных белков Bsp22, которые содержат присоединенную липидную группировку.
Вирусы, охватываемые настоящим изобретением, можно размножать в клетках, линиях клеток и клетках-хозяевах. Указанные клетки, линии клеток и клетки-хозяева могут, например, представлять собой клетки млекопитающих и клетки, не являющимися клетками млекопитающих, включая клетки насекомых и растительные клетки, но не ограничиваться ими. Клетки, линии клеток и клетки-хозяева, в которых можно размножать вирусы, охватываемые настоящим изобретением, хорошо известны и доступны для обычных специалистов в данной области.
В другом воплощении описанные здесь иммуногенные композиции не содержат нереспираторные антигены. Таким образом, согласно одному воплощению изобретения предложена композиция, как описано здесь, при условии, что она не включает нереспираторный антиген. Нереспираторные антигены не вызывают у субъекта респираторного заболевания. Неограничивающие примеры таких нереспираторных антигенов включают вирус бешенства, собачий парвовирус, энтеральный собачий коронавирус, виды Leptospira и Borrelia burgdorferi.
Бактерии, охватываемые настоящим изобретением, можно культивировать и размножать с использованием различных культуральных сред, известных обычным специалистам в данной области, включая как бульоны (жидкие среды), так и агаризованные (твердые; полутвердые) среды для культивирования. Некоторые бактерии также можно культивировать и размножать в клетках млекопитающих или в клетках, не являющихся клетками млекопитающих.
Вирусы и бактерии, охватываемые настоящим изобретением, могут быть ослабленными или инактивированными до применения в иммуногенной композиции или вакцине. Методы ослабления и инактивации хорошо известны специалистам в данной области. Методы ослабления включают серийное пассирование в культуре клеток на подходящей линии клеток (вирусы и некоторые бактерии), серийное пассирование в жидкой культуре (бактерии), облучение ультрафиолетом (вирусы и бактерии) и химический мутагенез (вирусы и бактерии), но не ограничиваются ими. Методы инактивации вирусов или бактерий включают обработку формалином, бета-проприолактоном (BPL) или бинарным этиленимином (BEI), или другие способы, известные специалистам в данной области, но не ограничиваются ими.
Инактивацию формалином можно проводить смешиванием суспензии, содержащей микроорганизм, с 37%-ным формальдегидом до конечной концентрации формальдегида 0,5%. Смесь микроорганизм-формальдегид непрерывно перемешивают в течение приблизительно 24 часов при комнатной темпратуре. Смесь инактивированного микроорганизма затем тестируют на присутствие остаточных живых организмов путем анализа роста на подходящей линии клеток или жидких средах.
Для некоторых антигенов можно проводить инактивацию BEI путем смешивания суспензии, содержащей микроорганизм по настоящему изобретению, с 0,1 М BEI (2-бром-этиламин в 0,175 н. NaOH) до конечной концентрации BEI 1 мМ. Для других антигенов конечная концентрация BEI составляет 2 мМ. Специалисту в данной области известна подходящая концентрация для применения. Смесь вирус-BEI непрерывно перемешивают в течение приблизительно 48 часов при комнатной температуре, с последующим добавлением 1,0 М тиосульфата натрия до конечной концентрации 0,1 мМ. Смешивание продолжают в течение еще двух часов. Смесь, содержащую инактивированный микроорганизм, тестируют на присутствие остаточного живого вируса путем анализа роста на подходящей линии клеток или жидких средах.
Иммуногенные композиции и вакцины, охватываемые настоящим изобретением, могут включать один или более чем один ветеринарно приемлемый носитель. Термин «ветеринарно приемлемый носитель» в том виде, как он здесь используется, включает любые растворители, диспергирующие среды, покрытия, адъюванты, стабилизирующие агенты, разбавители, консерванты, антибактериальные и противогрибковые агенты, изотоничные агенты, агенты, замедляющие/отсрочивающие поглощение и тому подобное. Разбавители могут включать воду, физиологический раствор, декстрозу, этанол, глицерин и тому подобное. Изотоничные агенты, среди прочих, известных специалистам в данной области, могут включать хлорид натрия, декстрозу, маннит, сорбит и лактозу. Стабилизаторы, среди прочих, известных специалистам в данной области, включают альбумин. Консерванты, среди прочих, известных специалистам в данной области, включают мертиолат.
Адъювант может быть метаболизируемым, причем данный термин относится к адъювантам, состоящим из компонентов, которые способны метаболизироваться намеченным видом, таким как адъюванты на основе растительного масла. Метаболизируемый адъювант может быть метаболизируемым маслом. Метаболизируемые масла представляют собой жиры и масла, которые типично встречаются в растениях и животных, и обычно состоят, главным образом, из смесей триацилглицеринов, также известных как триглицериды или нейтральные жиры. Эти неполярные нерастворимые в воде вещества представляют собой триэфиры жирных кислот и глицерина. Триацилглицерины различаются согласно типу и расположению их трех жирнокислотных остатков или боковых цепей.
Адъювант также может быть неметаболизируемым, причем данный термин относится к адъювантам, состоящим из компонентов, которые не могут быть метаболизированы в организме животного субъекта, которому вводится эмульсия. Неметаболизируемые масла, подходящие для применения в композициях по настоящему изобретению, включают алканы, алкены, алкины и их соответствующие кислоты и спирты, их простые и сложные эфиры и их смеси. Предпочтительно индивидуальные соединения в составе масла представляют собой легкие углеводородные соединения, т.е. такие компоненты, которые имеют от 6 до 30 атомов углерода. Масло может быть получено синтетически или очищено из нефтепродуктов. Предпочтительные Неметаболизируемые масла для применения в описанных здесь композициях включают, например, минеральное масло, парафиновое масло и циклопарафины. Термин «минеральное масло» относится к неметаболизируемому адъювантному маслу, которое представляет собой смесь жидких углеводородов, полученных из вазелина посредством методики перегонки. Данный термин является синонимичным «сжиженному парафину», «вазелиновому маслу» и «светлому минеральному маслу». Также подразумевается, что данный термин включает «легкое минеральное масло», т.е. масло, которое, аналогичным образом, получают перегонкой вазелина, но которое имеет слегка меньшую удельную плотность, чем светлое минеральное масло. Минеральное масло может быть получено из разных коммерческих источников, например, от J.T. Baker (Phillipsburg, PA), USB Corporation (Cleveland, ОН). Легкое минеральное масло имеется в продаже под наименованием DRAKEOL®.
Адъюванты включают адъювантную систему Emulsigen® (MVP Laboratories; Ralston, NE), адъювантную систему RIBI (Ribi Inc.; Hamilton, MT), квасцы, гель гидроксида алюминия, эмульсии типа «масло в воде», эмульсии типа «вода в масле», такие как, например, полный и неполный адъюванты Фрейнда, блок-сополимер (CytRx; Atlanta, GA), SAF-M (Chiron; Emeryville, CA), адъювант AMPHIGEN®, сапонин, Quil A, QS-21 (Cambridge Biotech Inc.; Cambridge, MA), GPI-0100 (Galenica Pharmaceuticals, Inc.; Birmingham, AL) или другие фракции сапонина, монофосфорил липид A, липид-аминный адъювант Avridine, термолабильный энтеротоксин из E. coli (рекомбинантный или иной), холерный токсин, мурамилдипептид, сквален/плюроновый блок-сополимер/поверхностно-активное вещество (SP-масло), сульфолипобета-циклодекстрин (SL-CD), липосомы, содержащие иммуномодулятор (например CpG или поли I:C), мурамилдипептид (MDP), искоматрикс (Quil А/фосфатидилхолин), CpG/DEAE-декстран/минеральное масло (TXO), CpG, тритерпеноиды (например, Quil A или другой очищенный или частично очищенный препарат сапонина), стеролы (например, холестерин), иммуномодулирующие агенты (например, диметилдиоктадециламмония бромид - DDA), полимеры (например, полиакриловая кислота, такая как CARBOPOL®), и стимуляторы Th2 (например, гликолипиды, такие как Bay R1005®) и их комбинации, среди многих других адъювантов, известных специалистам в данной области, но не ограничиваются ими.
Неограничивающие примеры различных комбинаций, которые можно использовать, включают тритерпеноид плюс стерол (например, Quil A/холестерин, также известный как QAC), тритерпеноид плюс стерол, иммуномодулирующий агент, и полимер (например, Quil A/холестерин/DDA/CARBOPOL®, также известный как QCDC), и тритерпеноид плюс стерол, иммуномодулирующий агент, полимер и стимулятор Th2 (например, Quil А/холестерин/DDA/CARBOPOL® и Bay R1005®, также известный как QCDCR).
Количества и концентрации адъювантов и добавок, полезных в контексте настоящего изобретения, могут быть легко определны специалистом. В одном воплощении согласно настоящему изобретению рассматриваются иммуногенные композиции и вакцины, содержащие от примерно 20 мкг до примерно 2000 мкг адъюванта. В другом воплощении адъювант включен в количестве от примерно 100 мкг до примерно 1500 мкг или от примерно 250 мкг до примерно 1000 мкг, или от примерно 350 мкг до примерно 750 мкг. В другом воплощении адъювант включен в количестве примерно 500 мкг на 2 мл дозу иммуногенной композиции или вакцины.
Иммуногенные композиции и вакцины также могут включать антибиотики. Такие антибиотики включают антибиотики из классов аминогликозидов, карбапенемов, цефалоспоринов, гликопептидов, макролидов, пенициллинов, полипептидов, хинолонов, сульфонамидов и тетрациклинов, но не ограничиваются ими. В одном воплощении согласно настоящему изобретению рассматриваются иммуногенные композиции и вакцины, содержащие от примерно 1 мкг/мл до примерно 60 мкг/мл антибиотика. В другом воплощении иммуногенные композиции и вакцины содержат от примерно 5 мкг/мл до примерно 55 мкг/мл антибиотика или от примерно 10 мкг/мл до примерно 50 мкг/мл антибиотика, или от примерно 15 мкг/мл до примерно 45 мкг/мл антибиотика, или от примерно 20 мкг/мл до примерно 40 мкг/мл антибиотика, или от примерно 25 мкг/мл до примерно 35 мкг/мл антибиотика. В еще одном воплощении иммуногенные композиции и вакцины содержат меньше, чем примерно 30 мкг/мл антибиотика.
Иммуногенные композиции и вакцины, охватываемые настоящим изобретением, могут включать одну или более чем одну полинуклеотидную молекулу, кодирующую вирус или бактерию, или вирусный или бактериальный белок. В иммуногенных композициях или вакцинах можно использовать молекулы ДНК или РНК. Молекулу ДНК или РНК можно вводить в отсутствие других агентов, или ее можно вводить вместе с агентом, облегчающим поглощение в клетку (например, липосомы или катионные липиды). Общая концентрация полинуклеотида в иммуногенной композиции или вакцине обычно составляет от примерно 0,1 мкг/мл до примерно 5,0 мг/мл. В другом воплощении общая концентрация полинуклеотида в иммуногенной композиции или вакцине может составлять от примерно 1 мкг/мл до примерно 4,0 мг/мл, или от примерно 10 мкг/мл до примерно 3,0 мг/мл, или от примерно 100 мкг/мл до примерно 2,0 мг/мл. Вакцины и методики вакцинации, в которых используются нуклеиновые кислоты (ДНК или мРНК), были описаны в данной области, например, в патенте США №5703055, патенте США №5580859, патенте США №5589466, все из которых включены сюда посредством ссылки.
Помимо вирусов или бактерий, описанных выше, иммуногенные композиции и вакцины, охватываемые настоящим изобретением, могут включать другие дополнительные антигены. Антигены могут находиться в форме препарата инактивированного цельного микроорганизма или его части, или в форме антигенных молекул, полученных методиками генной инженерии или химическим синтезом. Другие антигены, подходящие для применения согласно настоящему изобретению, включают антигены, происходящие из патогенных вирусов, таких как вирус собачей чумы, вирус собачьего герпеса, вирус собачьего гриппа, вирус бешенства, патогенных бактерий, таких как Bordetella bronchiseptica, Leptospira bratislava, Leptospira canicola, Leptospira grippotyphosa, Leptospira icterohaemorrhagiae, Leptospira pomona, Leptospira hardjobovis, Porphyromonas spp., Bacteriodes spp., Borrelia spp., Streptococcus spp., включая Streptococcus equi подвида zooepidemicus, Ehrlichia spp., Mycoplasma spp., включая Mycoplasma cynos и Microsporum canis, но не ограничиваются ими. Антигены также могут быть получены из патогенных грибков, таких как Candida, протистов, таких как Cryptosporidium parvum, Neospora caninum, Toxoplasma gondii, Eimeria spp., Babesia spp., Giardia spp., Leishmania spp., или гельминтов, таких как Taenia, Cuterebra, Echinococcus и Paragonimus spp.
Формы, дозировки, пути введения
Иммуногенные композиции и вакцины, охватываемые настоящим изобретением, можно вводить животным для индукции эффективного иммунного ответа против CIRDC. Соответственно, согласно настоящему изобретению предложены способы стимулирования эффективного иммунного ответа путем введения животному терапевтически эффективного количества описанной здесь иммуногенной композиции или вакцины.
Описанные здесь иммуногенные композиции и вакцины можно вводить животному для вакцинации животного субъекта против CIRDC. Иммуногенные композиции и вакцины можно вводить животному для предупреждения или лечения у животного CIRDC. Соответственно, здесь описаны способы вакцинирования животного против CIRDC и предупреждения или лечения CIRDC, включающие введение животному терапевтически эффективного количества описанной здесь иммуногенной композиции или вакцины.
Иммуногенные композиции и вакцины, охватываемые настоящим изобретением, можно получать в разных формах, в зависимости от пути введения. Например, иммуногенные композиции и вакцины можно получать в форме стерильных водных растворов или дисперсий, подходящих для применения посредством инъекции, или получать в лиофилизированных формах с использованием методик сублимационной сушки. Лиофилизированные иммуногенные композиции и вакцины типично хранят при примерно 4°C, и их можно растворять в стабилизирующем растворе, например, в физиологическом растворе или HEPES с адъювантом или без него. Иммуногенные композиции и вакцины также можно получать в форме суспензий или эмульсий.
Иммуногенные композиции и вакцины по настоящему изобретению включают терапевтически эффективное количество одного или более чем одного из вышеописанных микроорганизмов. Очищенные вирусы и/или бактерии можно использовать непосредственно в иммуногенной композиции или вакцине, или можно дополнительно ослаблять, либо инактивировать. Типично, иммуногенная композиция или вакцина содержит от примерно 1×102 до примерно 1×1012 вирусных или бактериальных частиц, или от примерно 1×103 до примерно 1×1011 частиц, или от примерно 1×104 до примерно 1×1010 частиц, или от примерно 1×105 до примерно 1×109 частиц, или от примерно 1×106 до примерно 1×108 частиц. Точное количество микроорганизма в иммуногенной композиции или вакцине, эффективное для обеспечения защитного эффекта, может быть определено специалистом в данной области.
Пертактиновый антиген присутствует в количестве от примерно 1 мкг до примено 30 мкг. Более конкретно, указанный пертактин присутствует в количестве от примерно 5 мкг и до примерно 20 мкг, еще более конкретно - от примерно 7 мкг до примерно 15 мкг, и даже более конкретно - примерно 5 мкг, 10 мкг, 15 мкг или 20 мкг.
Иммуногенные композиции и вакцины обычно содержат ветеринарно приемлемый носитель в объеме от примерно 0,5 мл до примерно 5 мл. В другом воплощении объем носителя составляет от примерно 1 мл до примерно 4 мл или от примерно 2 мл до примерно 3 мл. В другом воплощении объем носителя составляет примерно 1 мл или примерно 2 мл, или примерно 5 мл. Ветеринарно приемлемые носители, подходящие для применения в иммуногенных композициях и вакцинах, могут быть любыми из ветеринарно приемлемых носителей, описанных выше.
Специалисты в данной области легко могут определить, следует ли ослаблять или инактивировать вирус или бактерию перед введением. В другом воплощении настоящего изобретения вирус или бактерию можно вводить животному непосредственно без дальнейшего ослабления. Количество микроорганизма, которое является терапевтически эффективным, может варьировать, в зависимости от конкретного использованного микроорганизма, состояния животного и/или степени инфекции, и может быть определено специалистом.
Согласно способам по настоящему изобретению, животным можно вводить одну дозу или, альтернативно, могут осуществляться две или более чем две инокуляции с интервалами от примерно двух до примерно десяти недель. Могут потребоваться схемы бустер-иммунизации, и режим дозирования может корректироваться для обеспечения оптимальной иммунизации. Специалисты в данной области могут легко определять оптимальную схему введения.
Иммуногенные композиции и вакцины можно вводить непосредственно в кровоток, в мышцу, во внутренний орган или под кожу. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, внутримышечное и подкожное введение. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы и безыгольные инъекторы.
Парентеральные композиции типично представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы, белки и буферные агенты (предпочтительно корректирующие pH до интервала от примерно 3 до примерно 9 или от примерно 4 до примерно 8, или от примерно 5 до примерно 7,5, или от примерно 6 до примерно 7,5, или от примерно 7 до примерно 7,5), но, для некоторых применений, они могут быть более подходящим способом приготовлены в виде стерильного неводного раствора или высушенной формы для использования в сочетании с подходящим носителем, таким как стерильная апирогенная вода или физиологический раствор.
Получение парентеральных композиций при стерильных условиях, например, посредством лиофилизации, может быть легко выполнено с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области.
Растворимость веществ, используемых при получении парентеральных растворов, можно повышать путем использования соответствующих методик приготовления, известных специалисту в данной области, таких как включение агентов, увеличивающих растворимость, включая буферы, соли, поверхностно-активные вещества, липосомы, циклодекстрины и тому подобное.
Композиции для парентерального введения можно изготавливать в форме немедленного или модифицированного высвобождения. Композиции с модифицированным высвобождением включают композиции с отложенным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением. Таким образом, иммуногенные композиции и вакцины можно готовить в виде твердого, полутвердого вещества или тиксотропной жидкости для введения в виде имплантированного депо, обеспечивающего модифицированное высвобождение иммуногенных композиций и вакцин.
Другие способы введения иммуногенной композиции или вакцины включают доставку микроигольной или безыгольной (например, Powderject™, Bioject™ и т.д.) инъекцией.
В случаях, когда используется подкожная или внутримышечная инъекция, предпочтительной является изотоническая композиция. Обычно добавки для изотоничности могут включать хлорид натрия, декстрозу, маннит, сорбит и лактозу. В конкретных случаях используют изотоничные растворы, такие как фосфатно-солевой буферный раствор. Композиции могут дополнительно содержать стабилизаторы, такие как желатин и альбумин. В некоторых воплощениях в композицию добавляют сосудосуживающий агент. Фармацевтические препараты согласно настоящему изобретению обычно готовят в стерильной или апирогенной форме. Однако специалистам в данной области хорошо известно, что композиции для фармацевтически приемлемого носителя представляют собой те фармацевтические носители, которые одобрены правилами, обнародованными Министерством сельского хозяйства Соединенных Штатов или эквивалентным правительственным органом в иностранном государстве, таком как Канада или Мексика, либо в любом европейском государстве, для любой собачьей вакцины, полипептидных (антигенных) субъединичных иммуногенных композиций и вакцин, вакцин на основе рекомбинантного вирусного вектора и ДНК-вакцин. Следовательно, фармацевтически приемлемый носитель для коммерческого производства иммуногенных композиций или вакцин представляет собой носитель, который уже одобрен или будет одобрен подходящим правительственным органом в Соединенных Штатах Америки или иностранном государстве. Иммуногенные композиции и вакцины могут кроме того быть смешаны с адъювантом, который является фармацевтически приемлемым. В определенных препаратах иммуногенных композиций и вакцин иммуногенную композицию или вакцину объединяют с другими собачьими иммуногенными композициями или вакцинами для получения поливалентного продукта, который может защищать представителей семейства псовых от широкого спектра заболеваний, вызванных другими собачьими патогенами.
Описанные здесь иммуногенные композиции могут предупреждать инфекцию собачьим респираторным патогеном или могут предупреждать CIRDC у представителя семейства псовых в течение периода примерно трех месяцев или более. Композиции могут предупреждать инфекцию от указанного собачьего респираторного патогена или могут предупреждать CIRDC у указанной собаки в течение периода примерно шести месяцев или более. Композиции могут предупреждать инфекцию указанным собачьим респираторным патогеном или могут предупреждать CIRDC у указанного представителя семейства псовых в течение периода примерно одного года.
Способы детекции и диагностики
Степень и природу иммунных ответов, индуцированных у животного, можно оценивать с использованием множества методик. Например, у подвергавшихся инокуляции животных можно отобрать сыворотку и протестировать на присутствие или отсутствие антител, специфичных в отношении иммуногенов. Детекция отвечающих цитотоксических T-лимфоцитов (CTL) в лимфоидных тканях, указывающая на индукцию клеточного иммунного ответа, может достигаться такими анализами, как анализ пролиферации T-клеток. Релевантные методики хорошо описаны в данной области.
Наборы
Поскольку может быть желательным введение иммуногенной композиции или вакцины в комбинации с дополнительными композициями или соединениями, например, с целью лечения конкретного заболевания или состояния, в рамках настоящего изобретения находится то, что иммуногенную композицию или вакцину можно с удобством включать в набор или объединять в форме набора, подходящего для введения или совместного введения композиций.
Таким образом, наборы, охватываемые настоящим изобретением, могут включать одну или более чем одну отдельную фармацевтическую композицию, по меньшей мере одна из которых представляет собой иммуногенную композицию или вакцину согласно настоящему изобретению, и средства для раздельного содержания указанных композиций, такие как контейнер, разделенная бутыль или разделенная упаковка из фольги. Примером такого набора является шприц и игла, и тому подобное. Набор по настоящему изобретению является особенно подходящим для введения разных лекарственных форм, например, пероральной или парентеральной, для введения отдельных композиций с разными интервалами дозировки, или для титрования отдельных композиций относительно друг друга. Для помощи вводящему композицию, охватываемую настоящим изобретением, данный набор типично содержит руководства для введения.
Другой набор, охватываемый настоящим изобретением, может содержать один или более чем один реактив, полезный для детекции инфицированного животного. Данный набор может включать реактивы для анализа образца на присутствие цельных микроорганизмов, полипептидов, эпитопов или полинуклеотидных последовательностей. Присутствие вируса, бактерий, полипептидов или полинуклеотидных последовательностей можно определять с использованием антител, ПЦР (полимеразная цепная реакция), гибридизации и других методов детекции, известных специалистам в данной области.
В другом наборе, охватываемом настоящем изобретением, могут быть предложены реактивы для детекции антител против конкретных эпитопов. Такие реактивы являются полезными для анализа образца на присутствие антител и хорошо известны и доступны обычному специалисту в данной области. Присутствие антител можно определять с использованием стандартных методов детекции, известных специалистам в данной области.
В определенных воплощениях наборы могут включать комплект отпечатанных инструкций или этикетку, указывающую, что набор является пригодным для детекции инфицированных животных.
Антитела
Антитела могут быть моноклональными, либо поликлональными, либо рекомбинантными. Антитела можно получать против иммуногена или его части. Например, может быть выделен и использован в качестве иммуногена синтетический пептид на основе аминокислотной последовательности иммуногена или полученный рекомбинантно методиками клонирования, или природный генный продукт, и/или его части. Иммуногены можно использовать для продукции антител стандартной методикой получения антител, хорошо известной специалистам в данной области. Из антител также могут быть получены фрагменты антител способами, известными специалистам в данной области, и они включают фрагменты Fab, F(ab')2 и Fv.
При получении антител скрининг на желательное антитело можно проводить стандартными методами иммунологии, известными в данной области. В общем, ELISA и вестерн-блоттинг являются предпочтительными типами иммуноанализов. Оба анализа хорошо известны специалистам в данной области. В анализах можно использовать и поликлональные, и моноклональные антитела. Антитело может быть связано с субстратом в виде твердой подложки, конъюгировано с детектируемой группировкой, или и связано, и конъюгировано, как хорошо известно в данной области. Связывание антител с субстратом в виде твердой подложки также хорошо известно в данной области. Детектируемые группировки, рассматриваемые для применения в настоящем изобретении, могут включать флуоресцентные, металлические, ферментативные и радиоактивные маркеры, такие как биотин, золото, ферритин, щелочная фосфатаза, бета-галактозидаза, пероксидаза, уреаза, флуоресцеин, родамин, тритий, 14C и йодирование, но не ограничиваются ими.
Настоящее изобретение дополнительно проиллюстрировано, но ни в коей мере не ограничивается следующими примерами.
ПРИМЕРЫ
Пример 1. Оценка вакцин, содержащих CRCoV
В исследовании использовали шестьдесят собак породы бигль в возрасте 8-9 недель с хорошим общим состоянием здоровья. Всех животных подвергали физическому осмотру при прибытии и еще раз в сутки исследования - 2 или - 1. Животных осматривали один раз в сутки на предмет общего состояния здоровья с прибытия в сутки исследования - 8 и до суток исследования 39. Температуры барабанной перепонки измеряли, начиная с суток исследования - 1 до вакцинации. Образцы крови (примерно 5 мл) для серологии отбирали в пробирки SST в сутки исследования 0 и 21 до каждой вакцинации.
Штамм вакцины CRCoV был получен из штамма CRCoV.669, депонированного в ATCC как PTA-11444, в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры. Штамм вакцины CIV был получен из штамма, депонированного в ATCC как PTA-7694. Изоляты CPIV и CAV-2 были получены из посевов вирусов, использованных для приготовления вакцин в линейке вакцин Vanguard® (Pfizer). Антигены получали на максимальных пассажах вируса (Master Seed Virus + 5). Композиции вакцины содержали адъювант, состоящий из Quil A (20 мкг), холестерина (20 мкг), диметилдиоктадециламмония бромида (DDA; 10 мкг) и Carbopol® (полиакриловая кислота; 0,05% об./об.). Антиген CRCoV готовили для достижения целевых 1,3 относительных антигенных единиц (RAU) на дозу. Экспериментальные вакцины тестировали на стерильность.
В качестве заражающего материала использовали гетерологичный изолят CRCoV (штамм "Мах"; пассаж 1). Исходный вирусный материал размножали и титровали на клетках HRT18G, и определяли, что он имел титр 107.1 TCID50/мл. Этот заражающий материал тестировали, и подтверждали, что он является удовлетворительным в отношении стерильности и не содержит микоплазму или инородные для представителей семейства псовых/кошачьих агенты.
Одно животное вакцинировали в сутки 21; всех остальных животных вакцинировали в сутки исследования 22. Животных вакцинировали подкожно подходящей вакциной или плацебо согласно схеме исследования, показанной в Таблице 1. Первую вакцинацию вводили в область правого плеча (сутки исследования 0), а вторую вакцинацию вводили в область левого плеча (сутки исследования 22).
После первой вакцинации животных осматривали ежесуточно (от суток исследования 1 до 8) на предмет припухлости в месте инъекции после вакцинации. После второй вакцинации животных осматривали ежесуточно на предмет припухлости в месте инъекции после вакцинации до суток 29. Осмотры продолжали дважды в неделю для животных, которые имели припухлость/боль в месте инъекции после суток, перечисленных выше, пока припухлость/боль не исчезали. Температуры барабанной перепонки измеряли ежесуточно в течение одной недели после каждой вакцинации.
Образцы крови (приблизительно 8 мл) на серологию отбирали в пробирки SST в сутки исследования 42 до заражения. Температуры барабанной перепонки измеряли в сутки исследования 40, 41 и 42 до заражения. От каждой собаки до заражения в сутки исследования 42 брали два типа ротоглоточных мазков (VTM [транспортная среда для вируса] для выделения вируса и Amies - для выделения бактерии). Животных осматривали один раз в сутки до заражения в сутки исследования 40, 41 и 42 на клинические признаки респираторного заболевания для установления исходных значений.
В сутки исследования 42 всех животных интраназально (и.н.) заражали заражающим вирусом CRCoV в целевой заражающей дозе 106/мл/собаку. Всех животных усыпляли до введения заражения внутривенной инъекцией Domitor®. После усыпления каждое животное получало 1,0 мл заражающего вируса, который медленно вводили приблизительно в количестве 0,5 мл на ноздрю с использованием шприца без иглы. После введения заражения усыпление обращали внутримышечной инъекцией Antisedan®.
Температуры барабанной перепонки, клинические наблюдения и ротоглоточные мазки получали ежесуточно после заражения с суток исследования 42 до 56. Образцы крови (приблизительно 5 мл) на серологию отбирали в сутки исследования 46 и в сутки исследования 56 (до вскрытия).
При вскрытии целое легкое и трахею асептически удаляли и помещали на стерильную салфетку, и доли легкого макроскопически оценивали на поражения легкого (уплотнение). Для каждой доли легкого прводили оценку процентной доли уплотнения легкого. Один комплект легких имел неудовлетворительное кровотечение и не оценивался. Трахею рассекали, и полость оценивали на предмет макроскопической патологии, и любые показатели записывали.
После балльной оценки легких, правую каудальную долю легкого подвергали лаважу путем промывки приблизительно 30,0 мл среды для бактериологического анализа и выделения вируса. Из трахеи и полости носа отбирали пару образцов ткани: один для выделения вируса и второй - для гистопатологии. Правые краниальные доли легкого делили на три образца, включая один для отбора проб на бактериологию. Кровь на серологию отбирали в заранее определенные сутки исследования.
Результаты. Посредством тестирования IFA (непрямой метод флуоресцирующих антител) подтверждали, что все животные были негативными в отношении антител (титр IFA меньше 40) против CRCoV до суток исследования 0. Ротоглоточные мазки, оцененные на выделение вируса CRCoV, подтвердили, что все животные не содержали CRCoV в сутки исследования 0 до вакцинации. Контрольные животные, вакцинированные плацебо, оставались серонегативными в отношении CRCoV до суток исследования 42. Подтверждали, что группа не содержала CRCoV посредством выделения вируса в сутки исследования 42, указывая на отсутствие внешнего CRCoV в помещении. Подтверждали, что все собаки не содержали Bordetella bronchiseptica в сутки исследования 42.
Анализ ELISA (твердофазный иммуноферментный анализ) использовали для измерения концентрации антигена CRCoV в вакцине в виде относительных антигенных единиц (RAU) против конкретной партии CRCoV, назначенной эталонным антигеном. Определяли, что содержание антигена CRCoV составляет 0,5 RAU/дозу.
После вакцинации у большинства вакцинированных собак, включая группу, вакцинированную плацебо, развивались инъекционные припухлости в месте инъекции. Для группы, вакцинированной моновалентной вакциной, размеры припухлостей обычно были маленькими (2 см или менее в наибольшем измерении) у большинства вакцинированных. Для большинства собак данные припухлости рассасывались в пределах двух недель. Ни у одной из вакцинированных собак не было боли или системных реакций, связанных с вакциной. Не наблюдалось клинической лихорадки (температура большая или равная 39,5°C), за исключением одной собаки, однако повышенная температура у данной собаки не была связана с вакцинацией (температуру измеряли до второй вакцинации). Эти данные указывают на то, что моновалентная вакцина вызывает только припухлости в месте инъекции в пределах того, что ожидается для адъювантной вакцины.
Титры нейтрализующей сыворотки (SN) были сведены в таблицы и сравнены между группами. У всех собак, вакцинированных моновалентной вакциной (100%), через три недели после второй вакцинации развивались SN титры (GMT (среднее геометрическое титра) 371), указывающие на активную иммунизацию. Сильный ответ нейтрализующей сыворотки после заражения (анамнестический) измеряли в сутки 56 у собак, вакцинированных комбинированной вакциной (GMT 6915), по сравнению с собаками, вакцинированными плацебо (GMT 471). Данные результаты были статистически значимо отличными и указывают на то, что антиген вакцины CRCoV эффективно стимулировал и примировал иммунные ответы собак против инфекции CRCoV.
После заражения все животные, вакцинированные плацебо (100%), выделяли вирус в их ротоглоточных секретах в течение по меньшей мере одних суток между сутками 1 и сутками 6 после заражения, указывая на индукцию инфекции CRCoV. Моновалентная вакцина значимо уменьшала (p равно 0,0237) среднее число суток с ротоглоточным выделением (2,1 суток) по сравнению с плацебо (3,3 суток), указывая на эффективность вакцины в уменьшении инфекции CRCoV.
Все собаки, вакцинированные плацебо (100%), были позитивными в отношении выделения вируса в сутки 4 после заражения в их трахеях, полости носа и легких, указывая на инфекцию CRCoV респираторных органов. Не было выделено вируса из любого органа в сутки 14 после заражения, что свидетельствует о типичной респираторной вирусной инфекции, аналогичной собачьему гриппу. В отличие от этого, моновалентная вакцина предупреждала инфекцию в 90% и 50% легких (значение p меньше 0,0001) и трахей (значение p меньше 0,0237) вакцинированных собак соответственно. Это указывает на то, что моновалентная вакцина индуцировала достаточный иммунитет, который предупреждал вирусную инфекцию в данных критически важных органах. Отсутствовали значимые различия в уровне инфекции в полости носа между вакцинированными и контрольными животными.
Заражение CRCoV вызывало лишь умеренные клинические признаки при экспериментальных условиях. У собак в группах обработки сообщалось о выделениях из глаз и носа и о конъюнктивите. В течение периода после заражения сообщалось о 5 животных с клинической лихорадкой (температура большая или равная 39,5°C): двух в группах, вакцинированных плацебо, одном в группе, вакцинированной моновалентной вакциной, и двух в группах, вакцинированных комбинированной вакциной.
Макроскопическую оценку легких, трахей и носовых раковин проводили в сутки 4 и 14 после заражения. Не сообщалось о заметном макроскопическом поражении, за исключением того, что две собаки - одна в T05 и одна в T01 - имели низкие уровни уплотнения легкого; две собаки - одна в T01 и одна в T03 - имели области фокального некроза в носовых раковинах.
На предмет гистопатологии исследовали и подвергали балльной оценке легкое, трахею и ткани полости носа. В зависимости от степени наблюдаемых изменений, приписывали балл (от 0 до 4). Изменения, приписываемые заражению, были наиболее заметными в носовых раковинах, затем в трахеях и, наконец, в легких. Это согласуется с респираторным заражающим вирусом, который имеет его первичный эффект на верхние дыхательные пути (носовые раковины и трахею), с последующим и меньшим эффектом на нижние дыхательные пути (легкое). Это демонстрирует то, что инфекция CRCoV вызывала патологию тканей в респираторных органах.
Предыдущие исследования показали, что повреждение ресничного эпителия в трахее в сутки 4 после заражения является характерным патологическим последствием инфекции CRCoV. Данные показали, что моновалентная вакцина предупреждала повреждение трахеального ресничного эпителия у 60% животных, по сравнению с вакцинированными плацебо (30% нормальных животных), но уменьшение не было значимым (P равно 0,1538). Диагностический анализ бактериологии, проведенный на легких и легочном лаваже, подтвердил то, что все животные были негативными в отношении Bordetella bronchiseptica, Pasteurella spp., Staphlyococcus intermedius и Streptococcus canis. Легкое, легочный лаваж или и то, и другое были позитивными в отношении Mycoplasma spp. только у 4 животных. Эти данные свидетельствуют о том, что поражения были специфичными к вирусной инфекции или происходили из-за вирусной инфекции.
Таким образом, у всех собак, вакцинированных CRCoV (100%) в T03-T06, через три недели после второй вакцинации развивались титры нейтрализующей сыворотки, указывающие на активную иммунизацию. Моновалентная вакцина индуцировала иммунные ответы у вакцинированных животных, у которых уменьшалось выделение вируса в ротоглоточных секретах и в дыхательных органах. Она также уменьшала повреждение трахейного ресничного эпителия у вакцинированных животных, по сравнению с контрольными, вакцинированными плацебо. Гистопатологическая проверка показала, что моновалентная вакцина предупреждала повреждение трахейного ресничного эпителия у 60% животных по сравнению с животными, вакцинированными плацебо (30%).
Пример 2. Тестирование эффективности бивалентной вакцины CRCoV/CIV у собак
В исследовании использовали шестьдесят собак породы бигль в возрасте 7-8-недель с хорошим общим состоянием здоровья. Все животные подвергались физическому осмотру при прибытии в сутки исследования - 9. Все животные, за исключением одной собаки, которую удалили в сутки исследования - 7, подвергались второму физическому осмотру в сутки исследования - 2 и считались подходящими для исследования.
Животных осматривали один раз в сутки на предмет общего состояния здоровья от прибытия в сутки исследования - 7 до суток исследования 39. Образцы крови (приблизительно 6 мл) для серологии отбирали в пробирки для отделения сыворотки (SST) в сутки исследования 0 и 21 до каждой вакцинации. От каждой собаки до вакцинации в сутки 0 отбирали две серии назальных мазков: одну - для выделения вируса CRCoV и одну - для выделения вируса CIV, для подтверждения отсутствия CRCoV и CIV. Температуры барабанной перепонки измеряли и записывали в сутки - 1 и 0 до вакцинации для установления исходного уровня до вакцинации. Температуры барабанной перепонки измеряли до второй вакцинации в сутки 21. Животных прощупывали в области плеч в сутки исследования 0 и 21 до вакцинации для того, чтобы убедиться, что в области места инъекции отсутствовали предсуществующие поражения.
Одну собаку в T04 удалили из исследования из-за дыхательного расстройства в сутки исследования - 7. Одну собаку в T05 удалили из исследования из-за дыхательного расстройства в сутки исследования 0 до вакцинации. Дополнительно, двух животных удалили из исследования после включения из-за состояний, не связанных с проведением исследования. Одну собаку в T06 удалили из исследования в сутки исследования 21 до получения второй вакцинации из-за дыхательного расстройства. Одну собаку в T02 удалили из исследования в сутки 21 до получения второй вакцинации из-за нерассосавшегося кератоконъюнктивита и выпадения слезной железы.
Получали две бивалентные вакцины: вакцину на основе инактивированного CRCoV/инактивированного CIV с адъювантом Emulsigen® с содержанием 5% об./об. и вакцину на основе инактивированного CRCoV/инактивированного CIV с адъювантом Rehydragel™ с содержанием 5% об./об. (Таблица 2). Штамм вакцины CRCoV был получен из штамма, депонированного в ATCC как PTA-11444. Штамм вакцины CIV был получен из штамма, депонированного в ATCC как PTA-7694. Обе партии антигенов, использованных для получения вакцин, производили на максимальном пассаже вируса и клеток для удовлетворения требований иммуногенности. Антиген CRCoV готовили до целевого содержания 1,55 RAU/дозу. Антиген CIV готовили до целевого содержания 640 HA единиц/дозу.
Гетерологичный изолят CRCoV (штамм «Max»; пассаж 1) использовали в качестве заражающего материала. Исходный вирусный материал размножали и титровали на клетках HRT18G, и определяли, что он имеет титр 107.1 TCID50/мл. Этот заражающий материал тестировали и подтверждали то, что он является удовлетворительным при тестировании на стерильность, не содержит микоплазму и инородные для представителей семейства псовых/кошачьих агенты.
Животных вакцинировали подходящей вакциной или плацебо в сутки 0 и 21 (Таблица 2). Первую вакцинацию вводили в область правого плеча в сутки 0, а вторую вакцинацию вводили в область левого плеча в сутки 21.
Животных ежесуточно осматривали на предмет припухлости/боли в месте инъекции после первой вакцинации с суток исследования 0 до 8 и затем в сутки исследования 12, 15, 19, 21, 22 и 26. В сутки исследования 8 наблюдения на предмет припухлости для 18 животных по недосмотру не были записаны. В сутки исследования 21 для некоторых животных были записаны дополнительные наблюдения для правого плеча (первая доза вакцинации).
После вакцинации в сутки исследования 21 животных осматривали ежесуточно на предмет припухлости/боли в месте инъекции после вакцинации в сутки исследования 21-29 и затем в сутки исследования 33, 36 и 40. Все припухлости, образующиеся в результате второй вакцинации, рассасывались к суткам исследования 40. Температуры барабанной перепонки измеряли в сутки вакцинации 0-7 и 21-28, приблизительно через 3 часа после каждой вакцинации.
Образцы крови (приблизительно 6 мл) на серологию отбирали в SST пробирки в сутки исследования 42 до заражения. Также до заражения для установления исходных значений измеряли температуры барабанной перепонки в сутки исследования 40, 41 и 42. От каждой собаки до заражения в сутки исследования 42 отбирали два типа назальных мазков (VTM для выделения вируса CRCoV; Amies для выделения бактерий). Для установления исходных значений животных осматривали один раз в сутки до заражения в сутки исследования 40, 41 и 42 на предмет клинических признаков респираторного заболевания.
Каждой группе из шести собак из всех групп обработки вводили заражающий вирус путем распыления аэрозоля 19 мл заражающего материала в плексигласовой камере в течение приблизительно 30 минут. Объем заражающего вируса, распыляемого в камере, корректировали пропорционально при одномоментном заражении менее чем шести собак. Титрование вируса, проведенное на заражающих образцах CRCoV, отобранных после заражающего введения, подтвердило то, что количество живого заражающего вируса, распыленного в камере, содержало 105.1 TCID50/мл. После заражения у собак с суток исследования 42 по 56 ежесуточно получали температуры барабанной перепонки, клинические наблюдения и назальные мазки (Sterile Dacron Swabs, Puritan 25-806-1 PD) для выделения вируса (пробирки VTM). Образцы крови (приблизительно 6 мл) на серологию отбирали в сутки исследования 46 и в сутки исследования 56 до вскрытия.
При вскрытии асептически удаляли целое легкое и трахею и помещали на стерильную салфетку. Доли легкого оценивали макроскопически на поражения легкого (уплотнение). Для каждой доли легкого прводили оценку процентной доли уплотнения легкого. Комплекты легких от двух животных имели неудовлетворительное кровотечение и не могли быть оценены и подвергнуты балльной оценке. Трахею разрезали, полость оценивали на предмет макроскопической патологии, и любые показатели записывали. После балльной оценки легких каждую правую каудальную долю легкого подвергали лаважу путем промывки приблизительно 30,0 мл VTM (без антибиотика) для диагностического бактериологического анализа и для выделения вируса.
После балльной оценки легких из трахеи и полости носа отбирали образцы ткани, а целую левую среднюю долю легкого отбирали для гистопатологии. Из трахеи, полости носа и правой краниальной доли легкого отбирали образцы ткани для выделения вируса и для бактериологии.
Кровь на серологию отбирали в заранее определенные сутки исследования.
Назальные мазки (транспортная среда Amies без угля) отбирали у каждой собаки только в сутки исследования 42 (до заражения) для диагностической бактериологии. Данные мазки тестировали на присутствие Bordetella spp., Pasteurella spp., Staphylococcus spp., Mycoplasma spp. и Streptococcus canis.
Результаты. Посредством тестирования IFA подтверждали, что пятьдесят девять щенков породы бигль были негативными в отношении антител (титр IFA меньше 40) против CRCoV в сутки исследования 0 до вакцинации. Образцы сыворотки также тестировали посредством нейтрализации сыворотки и подтверждали, что они были негативными (титр SN меньше 20) в отношении антител против CRCoV. Назальные мазки, оцененные на выделение вируса CRCoV, подтвердили, что все животные не содержали вирус CRCoV в сутки исследования 0 до вакцинации. Тестирование на вирус CIV и антитела в сутки исследования 0 подтвердило, что животные не содержали вирус CIV и НА1 (подавляющие гемагглютинацию) антитела против CIV (титр HAI меньше 8). На основе этих двух критериев подтвердили, что животные являются чувствительными и, следовательно, подходящими для оценки эффктивности и безопасности вакцин CRCoV и CIV. Контрольные животные, вакцинированные физиологическим раствором, оставались серонегативными в отношении CRCoV до суток исследования 42. Подтвердили, что все животные не содержали вирус CRCoV путем выделения вируса в сутки исследования 42, указывая на отсутствие воздействия внешнего CRCoV в помещении. Подтвердили, что все собаки не содержали Bordetella bronchiseptica в сутки исследования 42 (до заражения).
Собак вакцинировали двумя композициями, содержащими антигены инактивированного CRCoV и инактивированного CIV с адъювантом в виде Emulsigen® или Rehydragel™. Эффективность антигена CRCoV в вакцине измеряли посредством сэндвич ELISA с двумя антителами, используя специфичное в отношении CRCoV сывороточное нейтрализующее моноклональное антитело 41.1.1. При измерении относительно назначенного эталонного антигена определили, что эффективность составляла 1,14 RAU/дозу. Титр HAI морской свинки в отношении CIV составлял 955. (Критерием прохождения был титр HAI, больший или равный 161).
У десяти из 19 животных, которые получали композицию на основе Emulsigen® (T05 и T06) развивалась измеримая припухлость в месте инъекции после первой вакцинации. Сразу после вакцинации у большинства собак сообщалось о почесывании. О боли в ответ на прикосновение сообщалось только у двух собак. За исключением одной собаки, все припухлости в данной группе рассасывались к следующим суткам. После второй вакцинации имело место небольшое численное увеличение размера припухлостей в месте инъекции и их частоты, но все они находились в пределах того, что ожидается в качестве типичной реакции на адъювантную вакцину. Ни у одной из вакцинированных собак не сообщалось о системной реакции, что подтверждается отсутствием клинической лихорадки (температура, меньшая или равная 39,5°C). Эти данные указывают на то, что данная композиция вакцины является безопасной для введения собакам в этой возрастной группе, и профиль безопасности находится в пределах того, что ожидается для адъювантной вакцины.
У большинства собак (T03 и T04), которые получали композицию на основе Rehydragel™, после каждой вакцинации развивалась припухлость в месте инъекции. Припухлости проявлялись через трое суток после первой вакцинации, причем большинство припухлостей рассасывалось к суткам исследования 19. Аналогичную реакцию наблюдали после второй вакцинации, когда большинство припухлостей рассасывалось к суткам исследования 36. Припухлости в месте инъекции обычно имели маленький размер и были типичными для реакций на адъювант на основе квасцов. Не сообщалось о боли или лихорадке, что подтверждет отсутствие системной реакции на вакцинацию. Эти данные указывают на то, что данная композиция вакцины является безопасной для введения собакам в данной возрастной группе, и профиль безопасности находится в пределах того, что ожидается для адъювантной вакцины.
Титры нейтрализующей сыворотки сводили в таблицу и сравнивали между группами (Фиг.1). Обе композиции вакцины индуцировали ответы сывороточных нейтрализующих антител (SN) у всех вакцинированных собак после первой дозы, указывая на активную иммунизацию (Фиг.1). Среднее геометрическое ответа SN (GMT для Rehydragel™ равно 552; GMT для Emulsigen® равно 2030) возрастало после второй вакцинации, указывая на бустерный эффект второй вакцинации. Обе композиции вакцины приводили к сильному анамнестическому ответу SN после заражения (GMT для Rehydragel™ равно 10725 и для Emulsigen® - 11584 в сутки исследования 56 для собак, остающихся в исследовании), указывая на эффективный иммунный ответ памяти. Важно отметить, что антительный ответ на CRCoV достигался в присутствии антигена CIV, указывая на отсутствие негативного взаимодействия между антигенами в бивалентной вакцине.
Пятьдесят шесть собак, остающихся в исследовании, заражали в сутки исследования 42 распылением аэрозоля. Назальное выделение вируса после заражения продемонстрировало, что все собаки, вакцинированные физиологическим раствором (100%), выделяли заражающий вирус в течение по меньшей мере трех суток от суток 1 до суток 6 после заражения, что указывает на инфекцию собак CRCoV со средним числом суток выделения 4,5 (Фиг.2). Две композиции вакцины значимо уменьшали выделение вируса до 2,6 суток (p меньше 0,0001) и 3,4 суток (p равно 0,0042) для Rehydragel™ и Emulsigen® соответственно. Эти данные указывают на то, что вакцины индуцировали эффективность, которая приводила к уменьшению вирусной инфекции.
Данные по выделению вируса из ткани показали, что 90-100% собак в группе, вакцинированной физиологическим раствором, были позитивными в отношении вируса в их полости носа, трахее и тканях легкого в сутки исследования 4 после заражения, что указывало на инфекции органов дыхания (Фиг.3). В отличие от этого обе вакцины значимо уменьшали процентную долю животных, позитивных в отношении выделения вируса в легких (p меньше 0,0001) и в полости носа (p меньше 0,002). В то время как обе вакцины уменьшали выделение вируса в трахее (вирус выделялся у 70% для группы Rehydragel™ и у 44% для группы Emulsigen®), только композиция на основе Emulsigen® приводила к значимому уменьшению выделения вируса по сравнению с контрольными животными, вакцинированными физиологическим раствором (p равно 0,0089). В сутки 14 после заражения не было выдедело вируса из каких-либо животных, что указывает на то, что инфекция CRCoV быстро поступает в дыхательные ткани и покидает их, демонстрируя сценарий, аналогичный собачьему гриппу. Данные по выделению вируса указывают на то, что обе композиции вакцины значимо уменьшали вирусную инфекцию у собак.
Заражение CRCoV вызывало лишь слабые респираторные клинические признаки при экспериментальных условиях. У собак в разных группах обработки сообщалось о выделениях из глаз и носа.
За исключением одного животного в сутки исследования 41 (одни сутки до заражения) в контрольной группе, вакцинированной физиологическим раствором, все животные имели нормальные температуры до заражения. В контрольной группе, вакцинированной физиологическим раствором, сообщалось о двух животных с клинической лихорадкой после заражения. Обе собаки имели температуру 39,6°C в сутки 2 после заражения (сутки исследования 44). Одна из этих собак вновь демонстрировала лихорадку (40°C) в сутки 4 после заражения. Данная собака получала лечение против сопутствующего гастроэнтерита. Это может объяснять ответ в виде лихорадки после заражения CRCoV у данной собаки, поскольку ранее не было показано, что этот вирус вызывает лихорадку в экспериментальных условиях. Ни у одной из вакцинированных собак не сообщалось о клинической лихорадке.
Макроскопическая оценка легких, трахеи и носовых раковин при вскрытии была проведена в сутки 4 и 14 после заражения. Не сообщалось о заметном макроскопическом поражении, за исключением уплотнения легкого у двух собак из T05, двух собак из T01 и одной собаки из T02. Причина данных поражений была не ясна, но вероятно не обусловлена CRCoV, поскольку поражения не были согласующимися, и не было показано, что CRCoV вызывает уплотнение легкого. Исследование диагностической бактериологии тканей не свидетельствовало об участии какого-либо другого патогена.
Исследовали и подвергали балльной оценке срезы ткани легкого, трахеи и полости носа. В зависимости от степени наблюдаемых изменений, приписывали балл (от 0 до 4). Предыдущие проведенные исследования показали, что повреждение ресничного эпителия трахеи в сутки 4 после заражения является характерным патологическим эффектом, ассоциированным с инфекцией CRCoV (Priestnall et al 2009). Данные гистопатологии выявили, что 70% собак, вакцинированных физиологическим раствором, претерпевали некоторую степень повреждения ресничного эпителия трахеи в сутки 4 после заражения. В отличие от этого, обе вакцины уменьшали число пораженных собак до 40% для Rehydragel™ (p равно 0,1184) и 0% для Emulsigen® (p равно 0,0003). Это указывает на то, что вакцины индуцировали эффективность у инфицированных собак, которая защищала от повреждения слизистого ресничного эпителия трахеи или уменьшала его, что является важным врожденным защитным механизмом.
Для оценки в исследовании потенциального участия других респираторных патогенов, животных тестировали на диагностическую бактериологию до заражения (назальные мазки) и после заражения (ткань легкого/лаваж). Полученные результаты продемонстрировали, что животные, главным образом, не содержали других респираторных патогенов, указывая на то, что клинический результат, измеренный после заражения, был конкретно обусловлен инфекцией CRCoV.
Таким образом, у всех собак, вакцинированных CRCoV-CIV (100%), через три недели после второй вакцинации развивались сывороточные титры нейтрализующих антител против CRCoV, указывающие на активную иммунизацию, с последующим сильным анамнестическим ответом после заражения, указывающим на хорошее примирование иммунной системы. Две композиции вакцины значимо уменьшали выделение вируса. Обе композиции вакцины значимо уменьшали процентную долю животных, позитивных в отношении выделения вируса в легких (p меньше 0,0001) и в полости носа (p меньше 0,002). Обе вакцины уменьшали выделение вируса в трахее, хотя только композиция на основе Emulsigen® приводила к значимому уменьшению выделения вируса по сравнению с таковым у контрольных животных, вакцинированных физиологическим раствором (p равно 0,0089). Обе вакцины также уменьшали число собак с пораженным ресничным эпителием трахеи. Эффективность антигена CRCoV в данных вакцинах достигалась в присутствии антигена CIV, что указывает на отсутствие негативного воздействия фракции CIV на CRCoV.
Пример 3. Безопасность и эффективность вакцин, содержащих Bordetella bronchiseptica, у собак
Для исследования отбирали пятьдесят (50) собак, разделенных на 5 групп обработки. То, что животные были пригодны для исследования, определяли на основе медицинского осмотра в сутки - 4.
Образцы крови (приблизительно 8 мл) для серологии отбирали у всех животных в пробирки SST в сутки исследования - 2, 21 и 28 до каждой вакцинации. Образцы сыворотки, отобранные в сутки - 2, использовали для подтверждения того, что животные не содержали В. bronchiseptica. Назальные мазки отбирали до вакцинации в сутки 0 и тестировали на присутствие В. bronchiseptica. Температуры барабанной перепонки замеряли, начиная с суток - 4, для установления исходного уровня до вакцинации.
Животных вакцинировали соответствующей вакциной в сутки 0, 21 и 28 согласно схеме исследования, показанной в Таблице 4. Вакцины вводили каждой собаке подкожно в область правого плеча для первой вакцинации и в область левого плеча для второй вакцинации.
Всех животных осматривали в сутки вакцинации 0, 21 и 28 на предмет реакций в месте инъекции после вакцинации. Их осматривали ежесуточно на предмет реакций на инъекцию после вакцинации в сутки 1-7 и 22-35. Температуру барабанной перепонки замеряли в сутки 0-7 и 21-35.
Образцы крови (приблизительно 6 мл) на серологию отбирали в сутки 55, за одни сутки до заражения. Температуру барабанной перепонки измеряли в сутки 54, 55 и 56 до заражения. Назальные мазки отбирали в сутки 55, за одни сутки до заражения и тестировали на присутствие В. bronchiseptica. Животных наблюдали дважды в сутки (до полудня и после полудня), приблизительно в течение 30 минут в каждый сеанс в сутки 54 и 55 и до полудня в сутки 56 на предмет клинических признаков респираторного заболевания, чтобы установить исходные значения.
Заражающий штамм Bordetella bronchiseptica использовали для получения намеченной заражающей дозы 109 CFU (колониеобразующая единица)/4 мл/собаку. В сутки 56 собак из всех групп обработки подвергали интраназальному заражению В. bronchiseptica путем распыления аэрозоля в плексигласовой камере всего в течение 30 минут для каждого зараженного вольера. За один раз заражали пять собак из того же самого вольера (одну из каждой группы обработки).
Температуры барабанной перепонки записывали один раз в сутки после заражения с суток 56 до суток 77. Клинические наблюдения проводили дважды в сутки (до полудня и после полудня), в течение приблизительно 30 минут в каждой комнате на каждую сессию, с суток 56 и до суток 76 и один раз (до полудня) в сутки 77. Кратко, наблюдали кашель, выделения из носа, чихание, выделения из глаз, позыв на рвоту и депрессию с использованием следующей системы баллов: отсутствует (0), слабый (1), умеренный (2) и сильный (3). Назальные мазки отбирали в сутки 59, 62, 66, 69, 74, 76 и 77 для определения выделения заражающих организмов.
Образцы крови (приблизительно 6 мл) для серологии отбирали в сутки 77. Назальные мазки для выделения В. bronchiseptica отбирали с использованием тампонов и транспортных сред.
Агглютинирующие антитела к 8. bronchiseptica определяли посредством теста микроагглютинации (МАТ). Образцы сыворотки из групп обработки T04 и T05, полученные в сутки 0, 28, 55 и 77, титровали на антитела против CRCoV посредством нейтрализации сыворотки и IFA, и против CIV - посредством HAI (подавление гемагглютинации). Выделение В. bronchiseptica из назальных мазков проводили согласно стандартной методике. Каждый образец качественно тестировали на присутствие или отсутствие бактерии.
Результаты. Посредством выделения культуры из назальных мазков подтвердили, что пятьдесят (50) здоровых щенков породы бигль в возрасте приблизительно 8 недель не содержали организмы В. bronchiseptica в сутки 0. Образцы сыворотки, оцененные на наличие агглютинирующих антител против В. bronchiseptica посредством МАТ подтвердили, что все щенки были чувствительными, с титрами МАТ, меньшими или равными 8 в сутки -2.
Все экспериментальные вакцины, оцененные в данном исследовании, давали либо слабые припухлости, либо не давали припухлостей в месте инъекции после первой вакцинации.Для большинства вакцинированных животных наличие припухлости в месте инъекции ограничивалось сутками исследования 0. После второй вакцинации также сообщалось о слабых припухлостях до их отсутствия в месте инъекции. При проявлении припухлостей в месте инъекции они рассасывались в течение одних-трех суток после второй вакцинации. О почесывании сообщалось преимущественно в группе, животным которой вводили 5-компонентную комбинированную вакцину (T04). После вакцинаций не сообщалось о клинической лихорадке. В группе, животным которой вводили физиологический раствор, не сообщалась о припухлостях в месте инъекции. Данные подтвердили безопасность вакцин.
Определение числа колоний, выполненное до и после заражающей инокуляции, подтвердило, что в среднем в камере было распылено 1,45×108 CFU Bordetella на собаку. Заражающая инокуляция индуцировала кашель у всех контрольных собак, которым вводили физиологический раствор (T02) со средней наблюдаемой процентной долей кашляющих 43,5% и 12,2 сутками кашля. У группы обработки T05, вакцинированной 4-компонентной вакциной, содержащей только вирусы (CRCoV/CIV/CPIV/CAV2), без антигена Bordetella развивался кашель, аналогичный кашлю у животных контрольной группы, которым вводили физиологический раствор со средней наблюдаемой процентной долей кашляющих 43,4% и 12,2 сутками кашля. Эти данные указывают на то, что заражение было достаточным и стойким для оценки тестируемых вакцин.
Собаки в группе обработки T01, вакцинированные Bordetella вакциной, были значимо защищенными от заражения (3,6 суток кашля, p меньше 0,0001) по сравнению с контрольной группой (12,2 суток кашля). Та же самая вакцина также значимо защищала собак в T03 при введении в режиме с 3-недельным интервалом (5,8 суток кашля, p равно 0,0004). Уменьшение балльной оценки кашля в этих двух группах (T01 относительно T03) не было значимо отличным (значение p равно 0,1883), что свидетельствует о том, что уровень защиты для вакцины, вводимой с 3- или 4-недельными интервалами, является аналогичным.
Собаки в T04, которые получали неадъювантную 5-компонентную комбинированную вакцину, были значимо (p равно 0,0016) защищены против заражения Bordetella (6,6 суток кашля) по сравнению с контрольными, которым вводили физиологический раствор (12,2 суток кашля), и по сравнению с собаками группы T05, получавшими 4-компонентную вирусную (CRCoV/CIV/CPIV/CAV2) комбинацию (12,1 суток кашля, p равно 0,0019), что указывает на эффективность фракции Bordetella в комбинированной вакцине, не содержащей адъювант.
Серологическая оценка вирусных фракций в 5-компонентной комбинированной вакцине была возможна только для двух фракций, CIV и CRCoV, где было подтверждено, что собаки были серонегативными в сутки исследования - 2. Ответ HAI на CIV в группе, животным которой вводили 4-компонентную вакцину (T04), в сутки исследования 56 был количественно сходным с ответом в группе, животным которой вводили 5-компонентную вакцину (T05), что указывает на отсутствие негативного воздействия фракции Bordetella на антиген CIV. Ответы SN на CRCoV в сутки исследования 56 были количественно сильнее в группе, животным которой вводили 4-компонентную вакцину (T04), чем в группе, животным которой вводили 5-компонентную вакцину (T05), что указывает на возможное негативное воздействие Bordetella на фракцию CRCoV. Однако эти данные не являются окончательными, поскольку данные вакцины не были адъювантными, композиция не была оптимизирована, и заражение CRCoV не было проведено для тестирования эффективности.
Было подтверждено, что моновалентная вакцина на основе Bordetella является безопасной и эффективной. Эффективность моновалентной вакцины продемонстрировали, когда вакцину вводили с 21- или 28-суточными интервалами. Также было показано, что фракция Bordetella является эффективной при введении в составе 5-компонентной неадъювантной комбинированной вакцины.
Пример 4. Мультивалентное серологическое исследование
Сорок собак в возрасте приблизительно 8 недель и с хорошим общим состоянием здоровья подвергали предварительному скринингу на наличие Bordetella bronchiseptica посредством теста микроагглютинации (МАТ) и на наличие собачьего респираторного коронавируса (CRCoV) посредством непрямого флуоресцентного анализа антител (IFA). Для оценки уровней антител также использовали нейтрализацию сыворотки (SN). В сутки 0 все собаки были негативными в отношении антител к Bordetella bronchiseptica, как было определено посредством МАТ (меньше или равно 16) и негативными в отношении антител к CRCoV, как было определено посредством IFA (меньше 40). Все собаки также не содержали Bordetella bronchiseptica и CRCoV, как было определено тестом по выделению назального мазка до первой вакцинации (Сутки 0).
Собак делили на 5 групп обработки по 8 собак в каждой и вакцинировали согласно схеме исследования, показанной в Таблице 1. Вакцины вводили каждой собаке в область правого плеча для первой вакцинации и в область левого плеча для второй вакцинации.
После второй вакцинации группы T04 и T05 были удалены из исследования из-за осложнений. Собак в оставшихся группах (T01, T02 и T03) осматривали ежесуточно на предмет реакции после вакцинации и отслеживали температуру тела (барабанной перепонки) в течение 7 суток после каждой вакцинации. Образцы крови отбирали у собак в сутки 0, 21, 42 и 56 для измерения антительных ответов.
Образцы сыворотки, полученные в сутки 0, 21, 42 и 56, тестировали на агглютинирующие антитела к Bordetella bronchiseptica посредством анализа МАТ. Образцы сыворотки, полученные в те же самые сутки, также титровали на антитела против CRCoV посредством нейтрализации сыворотки, против CIV - посредством HAI, и на антитела против CAV-2 и CPI - посредством нейтрализации сыворотки. Для каждой группы обработки были получены средние геометрические титров антител.
Тестируемые вакцины в группах T02 и T03 индуцировали антительные ответы у всех (100%) вакцинированных собак после второй дозы, что указывает на активную иммунизацию против вирусных антигенов. Антительный ответ увеличивался после второй вакцинации у большинства вакцинированных собак, что указывает на бустерный эффект второй вакцинации. Важно отметить, что антительные ответы среди вирусных фракций достигались в присутствии многочисленных вирусных и бактериальных (В. bronchiseptica) антигенов, что указывает на отсутствие иммунологического негативного взаимодействия. Серология МАТ не коррелирует с защитой против Bordetella, а скорее является ценным инструментом скрининга для включения в исследование подходящих животных. В заключение, на основе иммунологического ответа у вакцинированных собак предсказывается эффективность вирусных антигенов в 5-компонентной мультивалентной вакцине.
Пример 5. Исследование продолжительности иммунитета
Целью данного исследования является демонстрация продолжительности иммунитета мультивалентной комбинированной вакцины против респираторных заболеваний у собак. Данная вакцина содержит следующие антигенные компоненты: модифицированный живой CAV-2, модифицированный живой CPIV, инактивированный CIV, инактивированный CRCoV и экстракт Bordetella bronchiseptica, дополненный рекомбинантным антигеном, либо пертактином, либо Bsp22, либо ими обоими.
Все животные имеют хорошее общее состояние здоровья и не получали каких-либо вакцинаций в отношении любого из патогенов, для защиты против которых сконструирована вакцина. Собак делят на множественные серии групп обработки. Каждая серия состоит из двух групп обработки: контрольной группы, получающей плацебо вакцины, и вакцинируемой группы, получающей тестируемую вакцину. Животных вакцинируют дважды с интервалом приблизительно 2-4 недели. После каждой вакцинации их осматривают на предмет реакций в месте инъекции.
Приблизительно через 3-12 месяцев после вакцинации каждую серию из двух групп обработки (вакцинированные и контрольные) заражают одним из патогенов, для защиты против которых сконструирована вакцина. Клинические наблюдения проводятся ближе к заражению и после него. Назальные мазки для выделения заражающего патогена отбирают на протяжении периода после заражения. У каждого животного отбирают кровь для получения сыворотки, которую используют для последующего аналитического исследования. В качестве критериев для оценки эффективности вакцин используют клинические признаки респираторного заболевания, выделение патогена после заражения и серологические ответы.
Все вышеописанные ссылки включены сюда посредством ссылки, как если бы они были здесь полностью изложены.
Таким образом, после подробного описания разных воплощений настоящего изобретения следует понимать, что изобретение определено приложенной формулой изобретения и не должно ограничиваться конкретными деталями, изложенными в приведенном выше описании, поскольку возможны его многочисленные очевидные вариации без выхода за пределы сущности или объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ Bordetella bronchiseptica | 2012 |
|
RU2554480C2 |
| ВАКЦИНЫ И СПОСОБЫ ЛЕЧЕНИЯ СОБАЧЬЕГО ГРИППА | 2006 |
|
RU2396976C2 |
| ВАКЦИНЫ С ЖИВЫМИ БАКТЕРИАЛЬНЫМИ ИЗОЛЯТАМИ ДЛЯ СИСТЕМНОГО ВВЕДЕНИЯ | 2011 |
|
RU2593953C2 |
| СПОСОБ ЗАЩИТЫ ОТ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ВТОРИЧНЫМИ ПАТОГЕНАМИ | 2011 |
|
RU2586294C2 |
| АВИРУЛЕНТНАЯ АДЪЮВАНТНАЯ ЖИВАЯ ВАКЦИНА ПРОТИВ Mycoplasma hyopneumoniae | 2008 |
|
RU2489164C9 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИММУНИЗАЦИИ СВИНЕЙ ПРОТИВ СВИНОГО ЦИРКОВИРУСА | 2008 |
|
RU2493254C9 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2520081C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2711807C2 |
| НОВЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ | 2009 |
|
RU2510280C2 |
| ИММУНОЛОГИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2506094C2 |
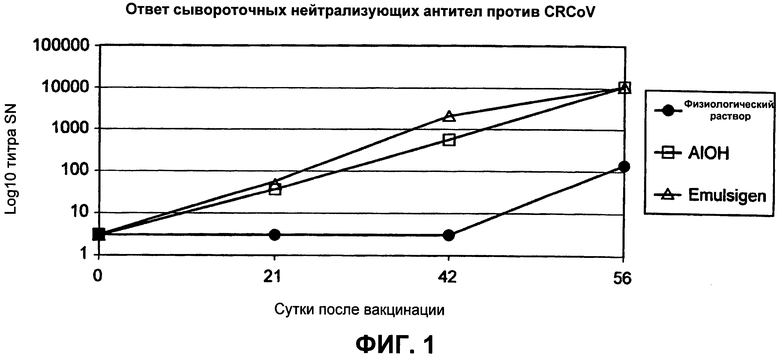
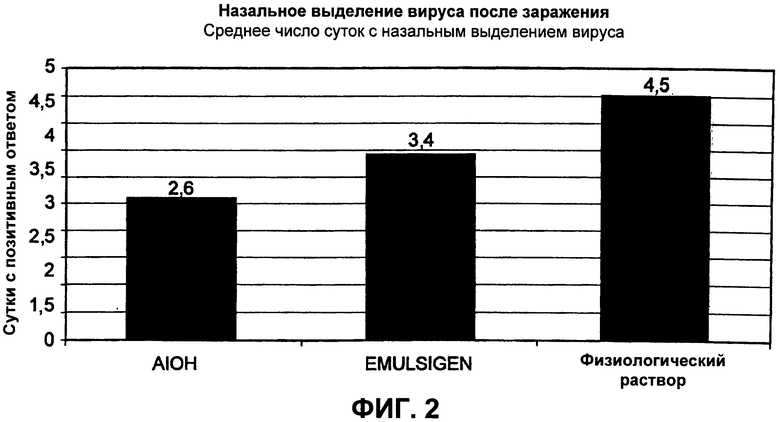
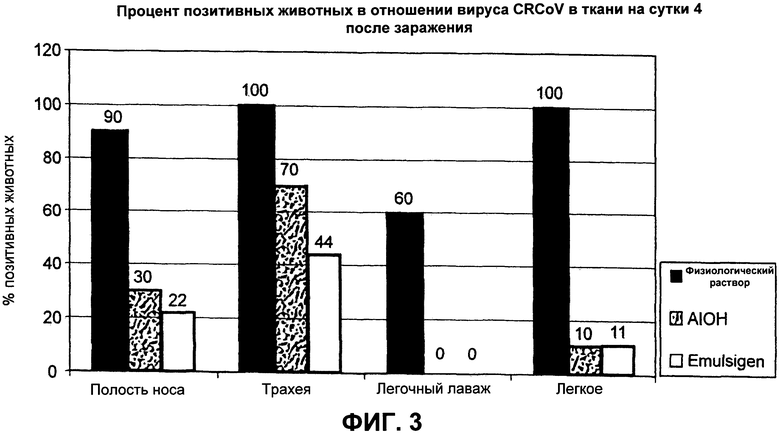
Группа изобретений относится к области ветеринарии и биотехнологии. Иммуногенные композиции, которые содержат вирус собачьего гриппа и собачий респираторный коронавирус, а также они могут дополнительно содержать Bordetella bronchiseptica, пертактин, вирус собачьего парагриппа и собачий аденовирус серотипа 2 являются эффективными для лечения или предупреждения комплекса инфекционных респираторных заболеваний собак. При использовании иммуногенных композиций не наблюдается иммунологически негативное взаимодействие между различными вирусными и бактериальными антигенами. 4 н. и 16 з.п. ф-лы, 3 ил., 4 табл., 5 пр.
1. Иммуногенная композиция для лечения и предупреждения комплекса инфекционных респираторных заболеваний собак (CIRDC), содержащая вирус собачьего гриппа (CIV) и собачий респираторный коронавирус (CRCoV).
2. Иммуногенная композиция по п. 1, дополнительно содержащая Bordetella bronchiseptica.
3. Иммуногенная композиция по п. 2, дополнительно содержащая пертактиновый антиген p68.
4. Иммуногенная композиция по п. 2, где указанная Bordetella bronchiseptica представляет собой бактерин или бактериальный экстракт.
5. Иммуногенная композиция по п. 2, дополнительно содержащая один антиген, выбранный из вируса собачьего парагриппа (CPIV) и собачьего аденовируса типа 2 (CAV-2), или оба из них.
6. Иммуногенная композиция по п. 5, где один или оба антигена представляют собой CPIV и CAV-2.
7. Иммуногенная композиция по п. 2, дополнительно содержащая выделенный антиген Bsp22.
8. Иммуногенная композиция по п. 1, которая не является адъювантной.
9. Иммуногенная композиция по п. 1, дополнительно содержащая адъювант.
10. Иммуногенная композиция по п. 1, которая не содержит нереспираторный антиген.
11. Иммуногенная композиция по любому из пп. 1-10, которая индуцирует иммунный ответ на собачий респираторный патоген у представителя семейства псовых.
12. Иммуногенная композиция по п. 11, где указанный собачий респираторный патоген представляет собой по меньшей мере один из CIV, CRCoV, CPIV, CAV-2, Bordetella bronchiseptica и Mycoplasma cynos (M. cynos).
13. Применение иммуногенной композиции по любому из пп. 1-10 для лечения и предупреждения комплекса инфекционных респираторных заболеваний собак (CIRDC).
14. Применение по п. 13, где указанный собачий респираторный патоген представляет собой по меньшей мере один из CIV, CRCoV, CPIV, CAV-2, Bordetella bronchiseptica и M. cynos.
15. Применение по п. 13 или 14, где указанная композиция предупреждает указанную инфекцию в течение периода примерно шести месяцев или более.
16. Применение по п. 13 или 14, где указанная композиция предупреждает указанную инфекцию в течение периода примерно одного года.
17. Применение иммуногенной композиции по любому из пп. 1-10 в изготовлении лекарственного средства для лечения и предупреждения комплекса инфекционных респираторных заболеваний собак (CIRDC).
18. Способ лечения или предупреждения CIRDC у представителя семейства псовых, включающий введение указанному представителю семейства псовых иммуногенной композиции по любому из пп. 1-10.
19. Способ по п. 18, где указанная композиция предупреждает CIRDC в течение периода примерно шести месяцев или более.
20. Способ по п. 18, где указанная композиция предупреждает CIRDC в течение периода примерно одного года.
| US 2007082012 A1, 12.04.2007 | |||
| MEDHEKAR BOB et al, Bordetella Bsp22 forms a filamentous type III secretion system trip complex and is immunoprotective in vitro and in vivo, Molecular Microbiology, vol | |||
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| PMID: 19040642 | |||
| WO 2007118206 A2, 18.10.2007 | |||
| WO 2004011651 A1, 05.02.2004 | |||
Авторы
Даты
2015-06-10—Публикация
2012-02-03—Подача