ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка является частичным продолжением заявки США с регистрационным номером 11/409416, поданной 21 апреля 2006 года; и эта заявка заявляет приоритет заявок США с регистрационными номерами 60/728449, поданной 19 октября 3005 года; 60/754991, поданной 29 декабря 2005 года; 60/759162, поданной 14 января 2006 года; 60/761451, поданной 23 января 2006 года и 60/779080, поданной 3 марта 2006 года, описание каждой из которых включено здесь в качестве ссылки в его полном объеме, включающем в себя краткое резюме, подробные описания этого изобретения, примеры, формулу изобретения, реферат, фигуры, таблицы, последовательности нуклеиновых кислот, аминокислотные последовательности и рисунки.
УРОВЕНЬ ТЕХНИКИ
«Питомниковый кашель» или инфекционный трахеобронхит собак (ITB) является острой, заразной респираторной инфекцией у собак, характеризующийся в основном кашлем (Ford et al., 1998). Собачий ITB считается одним из наиболее преобладающих инфекционных заболеваний собак во всем мире и вспышки этой инфекционной болезни могут достигать эпидемических размеров при содержании собак в условиях популяции высокой плотности, таких как собачьи питомники (псарни). Большинство вспышек обусловлены прямым контактом собаки с собакой или аэрозолизацией респираторных выделений (Ford et al., 2998). Клинические симптомы обусловлены инфекцией одним бактериальным или вирусным агентом или комбинацией бактериальных и вирусных агентов, которые колонизируют эпителий верхних и нижних дыхательных путей. Вирус парагриппа собачьих (CPiV) и бактерии Bordetella bronchiseptica являются наиболее обычными организмами, выделяемыми из пораженных собак, но несколько других вирусов, таких как вирус чумы собачьих (CDV) и аденовирус-1 и -2 (CAV-1, CAV-2), вместе с бактериями, такими как Streptococcus sp., Pasteurella multicoda и Escherichia coli, могут влиять на клиническое течение и исход болезни (Ford et al, 1998). Хотя вспышки встречаются наиболее эффективно и быстро в популяциях высокой плотности с высокой распространенностью, осложненные респираторные инфекции и смерть являются редко случающимися. Хотя может развиваться угрожающая жизни вторичная бактериальная пневмония, большинство случаев ITB являются самокупирующимися и устраняются без какого-либо лечения (Ford et al, 1998).
В июле 1992, респираторная инфекция, предположительно являющаяся «питомниковым кашлем», стала эпидемической в нескольких треках (дорожках для бегов) борзых в Новой Англии, Флориде, Западной Виргинии, Висконсине, Канзасе, Колорадо, Оклахоме и Аризоне. Согласно сообщениям ветеринаров, большинство пораженных собак имели слабый кашель, который исчезал, но более дюжины борзых развивали острую геморрагическую пневмонию с последующей быстрой смертью (Greyhound Daily News, 1999).
В поздних 1998-ых - ранних 1999-ых, несколько вспышек «питомникового кашля» встречались в питомниках (псарнях) гончих собак (борзых) по всей стране, что привело к принудительным закрытиям треков (дорожек для бегов) и карантину всех гончих борзых в США на несколько недель (Greyhound Daily News, 1999). В одном треке во Флориде (Palm Beach Kennel Club), кашель был зарегистрирован почти в 40% популяции собак за один день (Личное сообщение от доктора William Duggar). Аналогично вспышке в 1992 году, этот кашель проходил сам собой в большинстве борзых, но 10 собак во Флориде умерли от синдрома геморрагической пневмонии, нехарактерной для «питомникового кашля» (Putnam, 1999).
В марте-апреле 2003 года, другая вспышка «питомникового кашля» имела место в треках для борзых в восточных штатах США. Считается, что эта вспышка происходила из собачьих питомников при четырех треках во Флориде и вызвала приостановку собачьих бегов и карантин собак почти на три недели. Приблизительно 25% собак при треке в West Palm Beach были поражены, тогда как почти 50% из 1400 собак в Derby Lane в St. Petersburg развивали кашель. И в этом случае большинство собак выздоравливали, но несколько собак умерли от этой респираторной инфекции. Оцененный экономический результат респираторной вспышки в Derby Lane был равен 2 миллионам долларам.
Нет опубликованных сообщений, документирующих этиологию или клинико-патологию эпидемии «питомникового кашля» в собачьих питомниках гончих борзых в 1992, 1998-1999 или 2003 годах. Предполагалось, что эти инфекции вызывались CPiV и/или B. bronchiseptica, двумя наиболее частыми причинами питомникового кашля. Неподтвержденные сообщения, такие как веб-сайты, приписывали летальные геморрагические пневмонии, сообщаемые в некоторых кашляющих собаках, инфекции β-гемолитическими подвидами Streptococcus equi zooepidemicus, и этот синдром назывался «стрептококковым токсическим шоком собачьих».
Передача вируса от одного вида хозяина другому является критическим признаком экологии и эпидемиологии вируса гриппа (Webster, 1998). Возможными являются два основных механизма межвидовой передачи инфекции вируса гриппа (Webster et al, 1992; Lipatov et al, 2004). Один из них является прямым переносом по существу неизмененного вируса от одного вида другому. Примеры этого механизма включают в себя недавние инфекции человека подтипом H5N1 птичьего вируса гриппа (Subbarao et al, 1998; Peiris et al, 2004; Guan et al, 2004) и, возможно, пандемический грипп 1918 года, известный как испанский грипп (Reid et al, 2004). Вторым механизмом является результат сегментированной природы генома вируса гриппа. Коинфицирование хозяина вирусами из различных видов может приводить к генетической рекомбинации сегментированных вирусных генов и генерированию рекомбинанта со способностью инфицировать другие виды. Например, новые вирусы, генерированные рекомбинацией генов между вирусами гриппа птиц и человека привели к пандемиям гриппа человека в 1957 и 1968 годах (Webster et al, 1992; Lipatov et al, 2004; Kawaoka et al, 1989).
Наиболее прямые передачи вирусов гриппа от природных видов-хозяев другим видам являются критическими событиями, так как не может происходить пролонгированная передача между индивидуумами этих новых видов. Множественные взаимодействия вирус-хозяин необходимы для репликации и «горизонтальной» передачи инфекции от человека к человеку и обеспечивают значительный барьер сохранению вирусов гриппа в новом хозяине (Webby et al, 2004).Таким образом, установление новых хозяин-специфических линий дифференцировки вируса гриппа происходит редко и встречается только в домашней птице, свиньях, лошадях и людях (Webster et al, 1992; Lipatov et al, 2004).
Вследствие серьезного характера инфекции вируса гриппа остается потребность в способах диагностики, предотвращения и лечения инфекции вируса гриппа.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Представленное для рассмотрения изобретение относится к выделенному вирусу гриппа, который способен инфицировать собачьих и вызывать респираторное заболевание у собачьих. Данное изобретение относится также к композициям и способам индукцирования иммунного ответа против вируса гриппа по данному изобретению. Данное изобретение относится также к композициям и способам для идентификации вируса этого изобретения и диагностики инфекции животного вирусом этого изобретения.
Один аспект этого изобретения относится к вакцинам и способам для защиты собачьих от собачьего вируса, наборам, содержащим такие вакцины, и способам применения таких вакцин. Эта защита включает в себя уменьшение риска, задержку появления, уменьшение распространения, ослабления, подавления и/или уничтожения вируса гриппа и/или одного или нескольких (обычно двух или более) его симптомов. Считается, что вакцины, наборы и способы этого изобретения обычно пригодны для применения у собачьих. Собачьи включают в себя диких собачьих, собачьих зоопарка и домашних собачьих, таких как волки, койоты и лисы. Собачьи включают в себя также собак, в частности, домашних собак, таких как, например, чистопородные и/или нечистопородные (дворняжки) собаки-компаньоны, собаки для выставок, рабочие собаки, пастушьи собаки, охотничьи собаки, сторожевые собаки, полицейские собаки, гончие собаки и/или лабораторные собаки.
Это изобретение относится также, частично, к способу защиты собачьих от инфекции вируса гриппа {т.е., предотвращения, уменьшения риска или задержки появления, подавления, ослабления или устранения инфекции вируса гриппа). Этот способ предусматривает введение терапевтически эффективного количества вакцины, которая содержит по меньшей мере один антиген вируса лошадиного гриппа, по меньшей мере один антиген вируса гриппа Н3 и/или по меньшей мере один антиген вируса гриппа Н7.
Это изобретение относится также, частично, к способу защиты собачьих от респираторных повреждений (т.е., предотвращения, уменьшения риска или задержки появления, подавления, ослабления или устранения респираторных повреждений), вызванных вирусом гриппа собачьих. Этот способ предусматривает введение собачьим терапевтически эффективного количества вакцины, которая содержит по меньшей мере один антиген вируса лошадиного гриппа, по меньшей мере один антиген вируса гриппа Н3 и/или по меньшей мере один антиген вируса гриппа Н7.
Это изобретение относится также, частично, к способу защиты собачьих от наличия вируса гриппа собачьих в назальном выделении или выделении из полости рта (т.е., предотвращения, уменьшения риска или задержки появления, подавления, ослабления или устранения вируса гриппа собачьих в выделении из носа или полости рта), вызванных вирусом гриппа собачьих. Этот способ предусматривает введение собачьим терапевтически эффективного количества вакцины, которая содержит по меньшей мере один антиген вируса лошадиного гриппа, по меньшей мере один антиген вируса гриппа Н3 и/или по меньшей мере один антиген вируса гриппа Н7.
Это изобретение относится, частично, к вакцине против гриппа собачьих. В некоторых вариантах осуществления, например, эта вакцина содержит терапевтически эффективное количество по меньшей мере одного антигена вируса гриппа лошадиных, по меньшей мере одного антигена вируса гриппа Н3 и/или по меньшей мере одного антигена вируса гриппа Н7.
Это изобретение относится, частично, к набору для защиты собачьих от инфекции вируса гриппа. Этот набор содержит терапевтически эффективное количество вакцины, которая содержит по меньшей мере один антиген вируса гриппа лошадиных, по меньшей мере один антиген вируса гриппа Н3 и/или по меньшей мере один антиген вируса гриппа Н7. Кроме того, этот набор содержит по меньшей мере одно из следующих:
устройство для введения вакцины собачьим,
фармацевтически приемлемый наполнитель, который способствует введению этой вакцины собачьим,
фармацевтически приемлемый наполнитель, который усиливает иммунный ответ собачьих на эту вакцину,
корм для потребления собачьими одновременно с этой вакциной и/или
лакомство для потребления собачьими одновременно с этой вакциной.
Дополнительные преимущества изобретения заявителей будут очевидными квалифицированному в данной области специалисту при чтении этой заявки.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1A-1B показывают филогенетические связи среди генов гемагглютинина. Фиг.1A показывает древо генов НА из репрезентативных изолятов собачьих, человека, птиц, свиней и лошадей, в том числе A/Budgerigar/Hokkaido/1/77 (H4) в качестве внешней группы. Фиг.1B показывает древо генов вируса гриппа собачьих с современными и более старыми генами лошадиного НА с использованием A/Duck/Ukraine/63 (H3) в качестве внешней группы. Филогенетические древа выводят из нуклеотидных последовательностей по способу присоединения соседей и показаны величины bootstrap-анализа >90%. Стержень обозначает количество изменений нуклеотидов на единичную длину горизонтальных ветвей древа.
Фиг.2A-2B показывают иммуногистохимическое детектирование антигена гриппа Н3 в легких. Срезы ткани легкого зондировали мышиным моноклональным антителом к гемагглютинину Н3 и связывание детектировали иммунопероксидазной реакцией (коричневый осадок). Фиг.2A показывает бронхиальный эпителий из борзой со спонтанным заболеванием. Антиген вируса Н3 детектировали в цитоплазме бронхиальных эпителиальных клеток и в макрофагах в просветах дыхательных путей и в альвеолярных пространствах. Фиг.2B показывает бронхиальный эпителий из собаки спустя 5 дней после инокуляции A/canine/Florida/43/2004 (H3N8). Антиген вируса H3 детектировали в цитоплазме бронхиальных эпителиальных клеток. Масштабный стержень, 66 мкм.
Фиг.3 показывает характерные гистологические изменения в бронхах борзых, которые умерли от геморрагической пневмонии, ассоциированной с инфекцией вируса гриппа. Ткани окрашивали H&E. Верхняя панель: Здоровый бронх с реснитчатыми эпителиальными клетками, клетками слизистой оболочки и базальными клетками. Нижняя панель: Бронх из борзой со спонтанным гриппом. Имеются некроз и эрозия бронхиальных реснитчатых эпителиальных клеток. Масштабный стержень, 100 мкм.
Фиг.4A-4B показывают филогенетические связи из генов гемагглютинина Н3. Фиг.4A показывает филогенетическое древо генов вируса гриппа НА собачьих с современными и более старыми генами лошадиного вируса НА. Фиг.4B показывает филогенетическое древо белка вируса НА с современным и более старым лошадиным НА. Филогенетические древа выводили из генетических или аминокислотных последовательностей по способу присоединения соседей (способа выведения филогенетического древа на основе принципа минимальной эволюции (МЕ) и показаны величины bootstrap-анализа >80%. Стержень обозначает количество аминокислотных остатков на единичную длину горизонтальных ветвей древа.
Фиг.5 показывает белок вируса гриппа H3 в эпителиальных клетках бронхов и бронхиальных желез в легких собак, которые умерли от пневмонии, ассоциированной с инфекцией вируса гриппа. Верхние панели: Эрозия реснитчатых бронхиальных эпителиальных клеток в бронхах. Ткани окрашивали H&E. Нижние панели: белок вируса гриппа H3 в цитоплазме бронхиальных клеток (слева) и эпителиальных клеток бронхиальной железы (справа). Ткани окрашивали моноклональным антителом к гемагглютинину Н3 и связывание детектировали иммунопероксидазной реакцией (коричневый осадок) и контрастно окрашивали гематоксилином.
Фиг.6A-6D показывают графики амплификации гена H3 и матриксного гена (фиг.6A и фиг.6B), полученные из амплификации 10-кратно серийно разведенных in vitro транскрибированных РНК-стандартов. Калибровочные кривые гена Н3 и матриксного гена (фиг.6C и фиг.6D) получали построением log исходных концентраций РНК как функцию порогового цикла (Ct), полученного из каждого разведения.
Фиг.7 показывает чувствительность Directigen Flu A, которую исследовали с 10-кратно серийно разведенными исходными растворами вирусов, в том числе A/Wyoming/3/2003 и A/canine/FL/242/2003. Фиолетовый треугольник указывает положительный результат.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок PB2, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 2 является аминокислотной последовательностью, кодируемой SEQ ID NO: 1.
SEQ ID NO: 3 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок PBl, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 4 является аминокислотной последовательностью, кодируемой SEQ ID NO: 3.
SEQ ID NO: 5 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок PA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 6 является аминокислотной последовательностью, кодируемой SEQ ID NO: 5.
SEQ ID NO: 7 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок NS, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 8 является аминокислотной последовательностью, кодируемой SEQ ID NO: 7.
SEQ ID NO: 9 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок NP, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 10 является аминокислотной последовательностью, кодируемой SEQ ID NO: 9.
SEQ ID NO: 11 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок NA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 12 является аминокислотной последовательностью, кодируемой SEQ ID NO: 11.
SEQ ID NO: 13 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок МА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 14 является аминокислотной последовательностью, кодируемой SEQ ID NO: 13.
SEQ ID NO: 15 является нуклеотидной последовательностью вируса гриппа собачьих (Florida/43/04), кодирующей белок НА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 16 является аминокислотной последовательностью, кодируемой SEQ ID NO: 15.
SEQ ID NO: 17 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок PB2, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 18 является аминокислотной последовательностью, кодируемой SEQ ID NO: 17.
SEQ ID NO: 19 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок PB1, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 20 является аминокислотной последовательностью, кодируемой SEQ ID NO: 19.
SEQ ID NO: 21 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок PA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 22 является аминокислотной последовательностью, кодируемой SEQ ID NO: 21.
SEQ ID NO: 23 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок NS, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 24 является аминокислотной последовательностью, кодируемой SEQ ID NO: 23.
SEQ ID NO: 25 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок NP, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 26 является аминокислотной последовательностью, кодируемой SEQ ID NO: 25.
SEQ ID NO: 27 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок NA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 28 является аминокислотной последовательностью, кодируемой SEQ ID NO: 27.
SEQ ID NO: 29 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок МА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 30 является аминокислотной последовательностью, кодируемой SEQ ID NO: 29.
SEQ ID NO: 31 является нуклеотидной последовательностью вируса гриппа собачьих (FL/242/03), кодирующей белок НА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 32 является аминокислотной последовательностью, кодируемой SEQ ID NO: 31.
SEQ ID NO: 33 является зрелой формой белка НА, показанного в SEQ ID NO: 16, где N-концевая содержащая 16 аминокислот сигнальная последовательность была удалена.
SEQ ID NO: 34 является зрелой формой белка НА, показанного в SEQ ID NO: 32, где N-концевая содержащая 16 аминокислот сигнальная последовательность была удалена.
SEQ ID NO: 35 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 36 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 37 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 38 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 39 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 41 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 42 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 43 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 44 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 45 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 46 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 47 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок PB2, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 48 является аминокислотной последовательностью, кодируемой SEQ ID NO: 47.
SEQ ID NO: 49 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок PB1, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 50 является аминокислотной последовательностью, кодируемой SEQ ID NO: 49.
SEQ ID NO: 51 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок PA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 52 является аминокислотной последовательностью, кодируемой SEQ ID NO: 51.
SEQ ID NO: 53 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок NS, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 54 является аминокислотной последовательностью, кодируемой SEQ ID NO: 53.
SEQ ID NO: 55 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок NP, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 56 является аминокислотной последовательностью, кодируемой SEQ ID NO: 55.
SEQ ID NO: 57 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок NA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 58 является аминокислотной последовательностью, кодируемой SEQ ID NO: 57.
SEQ ID NO: 59 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок МА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 60 является аминокислотной последовательностью, кодируемой SEQ ID NO: 59.
SEQ ID NO: 61 является нуклеотидной последовательностью вируса гриппа собачьих (Miami/2005), кодирующей белок НА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 62 является аминокислотной последовательностью, кодируемой SEQ ID NO: 61.
SEQ ID NO: 63 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок PB2, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 64 является аминокислотной последовательностью, кодируемой SEQ ID NO: 63.
SEQ ID NO: 65 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок PB1, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 66 является аминокислотной последовательностью, кодируемой SEQ ID NO: 65.
SEQ ID NO: 67 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок PA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 68 является аминокислотной последовательностью, кодируемой SEQ ID NO: 67.
SEQ ID NO: 69 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок NS, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 70 является аминокислотной последовательностью, кодируемой SEQ ID NO: 69.
SEQ ID NO: 71 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок NP, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 72 является аминокислотной последовательностью, кодируемой SEQ ID NO: 71.
SEQ ID NO: 73 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок NA, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 74 является аминокислотной последовательностью, кодируемой SEQ ID NO: 73.
SEQ ID NO: 75 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок МА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 76 является аминокислотной последовательностью, кодируемой SEQ ID NO: 75.
SEQ ID NO:77 является нуклеотидной последовательностью вируса гриппа собачьих (Jacksonville/2005), кодирующей белок НА, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 78 является аминокислотной последовательностью, кодируемой SEQ ID NO: 77.
SEQ ID NO: 79 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 80 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 81 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 82 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 83 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 84 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 85 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 86 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 87 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
SEQ ID NO: 88 является олигонуклеотидом, который может быть использован в соответствии с данным изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к выделенному вирусу гриппа, который способен инфицировать собачьих и вызывать респираторное заболевание. В одном варианте осуществления, вирус гриппа этого изобретения содержит полинуклеотид, который кодирует белок, имеющий аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или его функциональный и/или иммуногенный фрагмент или вариант. В конкретном варианте осуществления, этот полинуклеотид содержит нуклеотидную последовательность, показанную в любой из SEQ ID No: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, или ее фрагмент или вариант. Вирус гриппа данного изобретения может иметь подтип НА H1, H2, H3, H4, H5, H6, H7, H8 и H9, H10, H11, H12, H13, H14, H15 или H16 или подтип NA N1, N2, N3, N4, N5, N6, N7, N8 или N9. В конкретном варианте осуществления, вирус гриппа данного изобретения является подтипом H3. Вирус может быть выделен из инфицированных собак и культивирован в клетках или яйцах в соответствии с описанными здесь опытами. В примерном варианте осуществления, этот вирус гриппа является вирусом гриппа А.
Представленное для рассмотрения изобретение относится также к полинуклеотидам, которые содержат весь ген или часть гена или генов или геномный сегмент вируса гриппа данного изобретения. В одном варианте осуществления, полинуклеотид этого изобретения содержит ген гемагглютинина гриппа (НА), ген нейраминидазы (NA), ген нуклеопротеина (NP), ген матриксного белка (МА или М), ген основного белка (РВ) полимеразы, ген кислого белка (РА) полимеразы, ген неструктурного белка (NS), или функциональный фрагмент или вариант любого из этих генов. В конкретном варианте осуществления, полинуклеотид этого изобретения содержит ген гемагглютинина (НА) или его функциональный фрагмент или вариант. В следующем варианте осуществления, ген НА кодирует белок гемагглютинин, имеющий один из следующих признаков: серин в положении 83; лейцин в положении 222; треонин в положении 328 и/или треонин в положении 483 в сравнении с аминокислотной последовательностью консенсусной последовательности лошадиного Н3. В одном варианте осуществления, ген НА кодирует полипептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 16, 32, 62 или 78, или ее функциональный и/или иммуногенный фрагмент или вариант. В конкретном варианте осуществления, ген НА содержит нуклеотидную последовательность, показанную в SEQ ID NO: 15, 31, 61 или 77.
В одном варианте осуществления, полинуклеотид этого изобретения кодирует полипептид, имеющий аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или ее функциональный и/или иммуногенный фрагмент или вариант. В конкретном варианте осуществления, полинуклеотид, кодирующий аминокислотную последовательность, показанную в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, содержит нуклеотидную последовательность, показанную в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, соответственно, или последовательность, кодирующую функциональный и/или иммуногенный фрагмент или вариант любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78. Таким образом, представленное изобретение относится к полинуклеотидным последовательностям, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, или фрагменту или варианту, в том числе вырожденному варианту, любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77. В следующем конкретном варианте осуществления, полинуклеотид этого изобретения может содержать: нуклеотиды 1-2271 SEQ ID NO: 3; нуклеотиды 1-2148 SEQ ID NO: 5; нуклеотиды 1-657 SEQ ID NO: 7; нуклеотиды 1-1494 SEQ ID NO: 9; нуклеотиды 1-1410 SEQ ID NO: 11; нуклеотиды 1-756 SEQ ID NO: 13; нуклеотиды 1-1695 SEQ ID NO: 15; нуклеотиды 1-2271 SEQ ID NO: 19; нуклеотиды 1-2148 SEQ ID NO: 21; нуклеотиды 1-657 SEQ ID NO: 23; нуклеотиды 14494 SEQ ID NO: 25; нуклеотиды 1-756 SEQ ID NO: 29; нуклеотиды 1-1695 SEQ ID NO: 31; нуклеотиды 1-2277 SEQ ID NO: 47; нуклеотиды 1-2271 SEQ ID NO: 49; нуклеотиды 1-2148 SEQ ID NO: 51; нуклеотиды 1-690 SEQ ID NO: 53; нуклеотиды 1-1494 SEQ ID NO: 55; нуклеотиды 1-1410 SEQ ID NO: 57; нуклеотиды 1-756 SEQ ID NO: 59; нуклеотиды 1-1695 SEQ ID NO: 61; нуклеотиды 1-2277 SEQ ID NO: 63; нуклеотиды 1-2271 SEQ ID NO: 65; нуклеотиды 1-2148 SEQ ID NO: 67; нуклеотиды 1-690 SEQ ID NO: 69; нуклеотиды 1-1494 SEQ ID NO: 71; нуклеотиды 1-1410 SEQ ID NO: 73; нуклеотиды 1-756 SEQ ID NO: 75 и нуклеотиды 1-1695 SEQ ID NO: 77. Нуклеотидные и аминокислотные последовательности вирусных полинуклеотидных и полипептидных последовательностей, обсуждаемые в рамках данного изобретения, были также депонированы GenBank при номерах доступа No. DQ124147 - DQ124161 и DQ124190, описание которых включено здесь в качестве ссылки.
Представленное изобретение относится также к полипептидам, кодируемым полинуклеотидами вируса гриппа данного изобретения. Представленное изобретение относится также к функциональным и/или иммуногенным фрагментам и вариантам рассматриваемых полипептидов. Рассматриваемые полипептиды включают в себя белок НА, белок NA, белок NS, нуклеопротеин, основный белок полимеразы, кислый белок полимеразы и матриксный белок вируса гриппа этого изобретения. В примерном варианте осуществления, полипептид этого изобретения имеет аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или ее функциональный и/или иммуногенный фрагмент или вариант.
Представленное изобретение относится также к конструкциям, содержащим полинуклеотидную последовательность данного изобретения. В одном варианте осуществления, экспрессионная конструкция этого изобретения содержит полинуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или ее функциональный и/или иммуногенный фрагмент или вариант. В конкретном варианте осуществления, полинуклеотид, кодирующий аминокислотную последовательность, показанную в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, содержит нуклеотидную последовательность, показанную в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, соответственно, или последовательность, кодирующую функциональный и/или иммуногенный фрагмент или вариант любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78. Таким образом, представленное изобретение относится к экспрессионным конструкциям, содержащим полинуклеотидную последовательность, содержащую нуклеотидную последовательность, показанную в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, или фрагмент или вариант, в том числе вырожденный вариант, любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77. В предпочтительном варианте осуществления, экспрессионная конструкция данного изобретения обеспечивает сверхэкспрессию функционально связанного полинуклеотида этого изобретения.
Экспрессионные конструкции этого изобретения обычно включают в себя регуляторные элементы, которые являются функциональными в предполагаемых клетках-хозяевах, в которых должна экспрессироваться эта экспрессионная конструкция. Таким образом, специалист с обычной квалификацией в этой области может выбрать регуляторные элементы для применения, например, в клетках-хозяевах человека, клетках-хозяевах млекопитающего, клетках-хозяевах насекомого, клетках-хозяевах дрожжей, бактериальных клетках-хозяевах и клетках-хозяевах растений. В одном варианте осуществления, эти регуляторные элементы являются регуляторными элементами, функциональными в клетках собачьих. Регуляторные элементы включают в себя промоторы, последовательности терминации транскрипции, последовательности терминации трансляции, усилители и элементы полиаденилирования. В данном контексте, термин «экспрессионная конструкция» относится к комбинации последовательностей нуклеиновых кислот, которая обеспечивает транскрипцию функционально связанной последовательности нуклеиновой кислоты. В данном контексте, термин «функционально связанные» относится к непосредственному соприкосновению описанных компонентов, где эти компоненты находятся в такой связи, которая позволяет им функционировать предназначенным для них образом. Обычно, функционально связанные компоненты находятся смежными относительно друг друга.
Экспрессионная конструкция этого изобретения может содержать промоторную последовательность, функционально связанную с полинуклеотидной последовательностью, кодирующей полипептид этого изобретения. Промоторы могут быть включены в полинуклеотид с использованием стандартных способов, известных в данной области. Множественные копии промоторов или множественные промоторы могут быть использованы в экспрессионной конструкции этого изобретения. В предпочтительном варианте осуществления, промотор может быть расположен на приблизительно том же самом расстоянии от сайта инициации транскрипции в этой экспрессионной конструкции, на котором он находится от сайта инициации транскрипции в его природном окружении. Допустима некоторая вариация в этом расстоянии без существенного уменьшения активности промотора. Сайт инициации транскрипции обычно включают в экспрессионную конструкцию. Предпочтительно, промотор, ассоциированный с экспрессионной конструкцией этого изобретения, обеспечивает сверхэкспрессию функционально связанного полинуклеотида этого изобретения.
Промоторы для использования с экспрессионной конструкцией этого изобретения в эукариотических клетках могут быть промоторами вирусного или клеточного происхождения. Вирусные промоторы включают в себя, но не ограничиваются ими, промоторы генов цитомегаловируса (CMV), ранние или поздние промоторы SV40 или промоторы генов вируса саркомы Рауса (RSV). Промоторы клеточного происхождения включают в себя, но не ограничиваются ими, промотор гена десмина и промотор гена актина. Промоторы, подходящие для использования с экспрессионной конструкцией этого изобретения в дрожжевых клетках, включают в себя, но не ограничиваются ими, промотор 3-фосфоглицераткиназы, промотор глицеральдегид-3-фосфатдегидрогеназы, промотор металлотионеина, промотор алкогольдегидрогеназы и промотор гексокиназы.
Если экспрессионная конструкция должна быть обеспечена в растительной клетке или должна вводиться в растительную клетку, могут быть использованы промоторы вирусов растений, такие как, например, вирус мозаики цветной капусты (CaMV) 35S (в том числе усиленный промотор CaMV 35S (см., например, Патент США №5106739 и An, 1997)) или промотор CaMV 19S. Другие промоторы, которые могут быть использованы для экспрессионных конструкций в растениях, включают в себя, например, промотор prolifera, промотор Ap3, промоторы белков теплового шока, 1′- или 2′-промотор Т-ДНК A.tumefaciens, промотор полигалактуроназы, промотор халконсинтазы A (CHS-A) из петуньи, промотор PR-1a табака, промотор убиквитина, промотор актина, промотор гена alcA, промотор pin2 (Xu et al., 1993), промотор WipI кукурузы, промотор гена trpA кукурузы (Патент США №5625136), промотор гена CDPK кукурузы и промотор RUBISCO SSU (Патент США №5034322). Специфические для корня промоторы, такие как любая из промоторных последовательностей, описанных в Патентах США с номерами 6455760 или 6696623 или в опубликованных заявках на патент США с номерами 20040078841; 20040067506; 20040019934; 20030177536; 20030084486 или 20040123349, могут быть использованы с экспрессионной конструкцией этого изобретения. Конститутивные промоторы (такие как промотор CaMV, убиквитина, актина или промотор NOS), регулируемые развитием промоторы и индуцируемые промоторы (такие как промоторы, которые могут быть индуцированы теплом, светом, гормонами или химикалиями), также обсуждаются для применения с полинуклеотидными экспрессионными конструкциями этого изобретения. Могут также использоваться тканеспецифические промоторы, например, специфические для фруктов промоторы, такие как промотор E8 томата (номер доступа: AF515784; Good et al. (1994)). Могут также использоваться специфические для семян промоторы, такие как промотор из гена β-фазеолина (например, фасоли обыкновенной) или гена глицинина (например, сои) и другие.
Для экспрессии в прокариотических системах, экспрессионная конструкция этого изобретения может содержать такие промоторы, как, например, промотор щелочной фосфатазы, промотор триптофана (trp), промотор лямбда PL, промотор β-лактамазы, промотор лактозы, промотор phoA, промотор T3, промотор T7 или промотор tac (de Boer et al., 1983).
Экспрессионные конструкции этого изобретения могут необязательно содержать последовательность терминации транскрипции, последовательность терминации трансляции, последовательность, кодирующую сигнальный пептид и/или усиливающие элементы. Районы терминации транскрипции могут быть обычно получены из 3′-нетранслируемого района последовательности эукариотического или вирусного гена. Последовательности терминации транскрипции могут быть расположены справа от кодирующей последовательности для обеспечения эффективной терминации. Последовательность сигнального пептида является короткой аминокислотной последовательностью, обычно присутствующей на амино-конце белка, которая является ответственной за перемещение функционально связанного зрелого полипептида в широкий диапазон посттрансляционных клеточных мест назначения, от компартмента специфической органеллы до мест действия белка и внеклеточной среды. Для использования с полипептидами этого изобретения обсуждается нацеливание генных продуктов на предполагаемое клеточное и/или внеклеточное место назначения посредством использования функционально связанной последовательности сигнального пептида. Классические усилители являются цис-действующими элементами, которые увеличивают транскрипцию генов и могут быть также включены в эту экспрессионную конструкцию. Классические усилительные элементы известны в данной области и включают в себя, но не ограничиваются ими, усилительый элемент CaMV 35S, нный элемент раннего промотора цитомегаловируса (CMV) и усилительный элемент SV40. В данной области известны также интрон-опосредованные усилительные элементы, которые усиливают экспрессию генов. Эти элементы должны присутствовать в транскрибируемом районе и являются зависимыми от ориентации.
Последовательности ДНК, которые управляют полиаденилированием мРНК, транскрибированной из этой экспрессионной конструкции, могут быть также включены в эту экспрессионную конструкцию и включают в себя, но не ограничиваются ими, сигнал октопинсинтазы или нопалинсинтазы.
Экспрессионные конструкции могут также включать в себя один или несколько доминантных генов селектируемых маркеров, в том числе, например, генов, кодирующих устойчивость к антибиотикам и/или устойчивости к гербицидам, для отбора трансформированных клеток. Устойчивые к антибиотикам гены могут обеспечивать устойчивость к одному или нескольким из следующих антибиотиков: гигромицина, канамицина, блеомицина, G41S, стрептомицина, паромомицина, неомицина и спектиномицина. Устойчивость к канамицину может быть обеспечена неомицинфосфотрансферазой (NPT II). Гены устойчивости к гербицидам могут обеспечивать устойчивость к фосфинотрицинацетилтрансферазе или глифозату. Другие маркеры, используемые для скрининга на трансформацию клеток, включают в себя, но не ограничиваются ими, гены, кодирующие β-глюкуронидазу (GUS), β-галактозидазу, люциферазу, нопалинсинтазу, хлорамфениколацетилтрансферазу (CAT), зеленый флуоресцентный белок (GFP) или усиленный GFP (Yang et al, 1996).
Представленное изобретение относится также к полинуклеотидным векторам, содержащим полинуклеотидную последовательность этого изобретения, которая кодирует полипептид этого изобретения. Сайты уникальных рестрикционных ферментов могут быть включены на 5′- и 3′-концах экспрессионной конструкции или полинуклеотида этого изобретения для создания возможности инсертирования в полинуклеотидный вектор. В данном контексте, термин «вектор» относится к любому генетическому элементу, в том числе, например, к плазмидам, космидам, хромосомам, фагу, вирусу и т.п., который способен к репликации при связывании с правильными регуляторными элементами и который может переносить полинуклеотидные последовательности между клетками. Векторы содержат нуклеотидную последовательность, которая позволяет вектору реплицироваться в выбранной клетке-хозяине. Ряд векторов являются доступными для экспрессии и/или клонирования и включают в себя, но не ограничиваются ими, pBR322, серию pUC, серию M13, серию pGEM и векторы pBLUESCREPT (Stratagene, La Jolla, CA и Promega, Madison, WI). Данное изобретение относится также к олигонуклеотидным зондам и праймерам, таким как праймеры полимеразной цепной реакции (PCR), которые могут гибридизоваться с кодирующей или некодирующей последовательностью полинуклеотида данного изобретения. Олигонуклеотидные зонды этого изобретения могут быть использованы в способах детектирования нуклеиновых кислот вируса гриппа. Олигонуклеотидные праймеры этого изобретения могут быть использованы в способах ПЦР и других способах, включающих в себя амплификацию нуклеиновых кислот. В предпочтительном варианте осуществления, зонд или праймер этого изобретения может гибридизоваться с полинуклеотидом этого изобретения при строгих условиях. Зонды и праймеры этого изобретения могут необязательно содержать детектируемую метку или репортерную молекулу, такую как флуоресцентные молекулы, ферменты, радиоактивная часть молекулы и т.п. Зонды и праймеры этого изобретения могут иметь любую подходящую длину для способа или анализа, в котором они используются. Обычно, зонды и праймеры этого изобретения будут иметь длину 10-500 или более нуклеотидов. Зонды и праймеры, которые имеют длину 10-20, 21-30, 31-40, 41-50, 51-60, 61-70, 71-80, 81-90, 91-100 или 101 или более нуклеотидов, обсуждаются в рамках этого изобретения. В одном варианте осуществления, зонды и праймеры имеют любую длину из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов. Зонды и праймеры этого изобретения могут иметь полную (100%) идентичность нуклеотидной последовательности с этой полинуклеотидной последовательностью, или идентичность последовательности может быть меньшей, чем 100%. Например, идентичность последовательности между зондом и праймером и этой последовательностью может быть 99%, 98%, 97%, 96%, 95%, 90%, 85%, 80%, 75%, 70% или любой другой процентной идентичностью последовательности, пока этот зонд или праймер может гибридизоваться при строгих условия с нуклеотидной последовательностью этого изобретения. Примеры зондов и праймеров этого изобретения включают в себя зонды и праймеры, имеющие нуклеотидную последовательность, показанную в любой из SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, и SEQ ID NO: 46, или функциональный фрагмент или вариант любой из SEQ ID NO: 35-46.
В данном контексте, термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» относятся к дезоксирибонуклеотиду, рибонуклеотиду или смешанному полимеру дезоксирибонуклеотида и рибонуклеотида в одноцепочечной или двухцепочечной форме и, если нет другого указания, могут включать в себя известные аналоги природных нуклеотидов, которые могут функционировать аналогично функционированию природно-встречающихся нуклеотидов. Полинуклеотидные последовательности включают в себя последовательность ДНК-цепи, которая может быть транскрибирована в РНК, и РНК-цепь, которая может быть транслирована в белок. Комплементарная последовательность любой нуклеиновой кислоты, любого полинуклеотида или олигонуклеотида этого изобретения также обсуждается в объеме этого изобретения. Полинуклеотидные последовательности включают в себя также как полноразмерные последовательности, так и более короткие последовательности, произведенные из этих полноразмерных последовательностей. Данное изобретение включает в себя также полинуклеотиды, которые комплементарны в их последовательности описанным здесь полинуклеотидам. Полинуклеотиды и полипептиды этого изобретения могут быть обеспечены в очищенной или выделенной форме.
Вследствие вырожденности генетического кода различные полинуклеотидные последовательности могут кодировать полипептид данного изобретения. Таблица, показывающая все возможные триплетные кодоны (где U стоит также для T) и аминокислоту, кодируемую каждым кодоном, описана в Lewin (1985). Кроме того, в рамках квалификации специалиста в данной области находится создание альтернативных полинуклеотидных последовательностей, кодирующих те же самые, или по существу те же самые, полипептиды данного изобретения. Эти вырожденные вариантные и альтернативные полинуклеотидные последовательности находятся в пределах объема рассматриваемого изобретения. В данном контексте, ссылки на «по существу ту же самую» последовательность относятся к последовательностям, которые кодируют аминокислотные замены, делеции, добавления или инсерции, которые фактически не изменяют функциональную и/или иммуногенную активность полипептида, кодируемого полинуклеотидами данного изобретения.
Представленное изобретение относится также к вариантам полинуклеотидов данного изобретения, которые кодируют полипептиды этого изобретения. Вариантные последовательности включают в себя последовательности, в которых один или несколько нуклеотидов этой последовательности были заменены, удалены и/или вставлены. Нуклеотиды, которые могут заменять природные нуклеотиды ДНК, имеют основание, которое может включать в себя, но не ограничивается ими, 5-фторурацил, 5-бромурацил, гипоксантин, 1-метилгуанин, 5-метилцитозин и тритилированные основания. Сахарная часть нуклеотида в последовательности может быть также модифицирована и включает в себя, но не ограничивается ими, арабинозу, ксилулозу и гексозу. Кроме того, основания аденин, цитозин, гуанин, тимин и урацил этих нуклеотидов могут быть модифицированы ацетильными, метильными и/или тиогруппами. Последовательности, содержащие нуклеотидные замены, удаление и/или вставки, могут быть получены и исследованы с использованием стандартных способов, известных в этой области.
Аминокислотные замены, другие, чем аминокислоты, конкретно приведенные в виде примеров или природно присутствующие в полипептиде этого изобретения, также обсуждается в объеме данного изобретения. Например, неприродные аминокислоты могут заменять аминокислоты полипептида, пока этот полипептид, имеющий аминокислотные замены, сохраняет по существу ту же самую функциональную активность, что и полипептид, в котором аминокислоты не были заменены. Примеры неприродных аминокислот включают в себя, но не ограничиваются ими, орнитин, цитруллин, гидроксипролин, гомосерин, фенилглицин, таурин, иодтирозин, 2,4-диаминомасляную кислоту, α-аминоизомасляную кислоту, 4-аминомасляную кислоту, 2-аминомасляную кислоту, γ-аминомасляную кислоту, ε-аминогексановую кислоту, 6-аминогексановую кислоту, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, норлейцин, норвалин, саркозин, гомоцитруллин, цистеиновую кислоту, τ-бутилглицин, τ-бутилаланин, фенилглицин, циклогексилаланин, β-аланин, фтораминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, C-метиламинокислоты, N-метиламинокислоты и аналоги аминокислот в целом. Неприродные аминокислоты включают в себя также аминокислоты, имеющие дериватизованные боковые группы. Кроме того, любые из аминокислот в белке могут находиться в D (правовращающей) форме или L (левовращающей) форме. Аллельные варианты последовательности белка полипептида данного изобретения также обсуждаются в объеме этого изобретения.
Аминокислоты могут быть обычно подразделены на следующие классы: неполярные, незаряженные полярные, основные и кислые. Консервативные замены, посредством которых полипептид данного изобретения, имеющий аминокислоту одного класса, заменяют полипептидом, имеющим другую аминокислоту того же самого класса, включены в объем этого изобретения, пока полипептид, имеющий эту замену все еще сохраняет по существу ту же самую функциональнуюактивность, что и полипептид, который не имеет этой замены. Полинуклеотиды, кодирующие полипептид, имеющий одну или несколько аминокислотных замен в последовательности, рассматриваются в объеме данного изобретения. Таблица 11 ниже обеспечивает перечень примеров аминокислот, принадлежащих к каждому классу. Однобуквенные аббревиатуры аминокислот определены в таблице 12.
Фрагменты и варианты полипептидов вируса гриппа данного изобретения могут быть получены с использованием стандартных способов, известных в этой области, и исследованы на присутствие функции или иммуногенности с использованием стандартных способов, известных в этой области. Например, для исследования фрагментов и/или вариантов полипептида нейраминидазы этого изобретения может быть анализирована нейраминидазная активность. Таким образом, специалист с обычной квалификацией в этой области может легко получать и исследовать фрагменты и варианты полипептида этого изобретения и определять, сохраняет ли этот фрагмент или вариант активность относительно полноразмерного или невариантного полипептида.
Полинуклеотиды и полипептиды, обсуждаемые в объеме данного изобретения, могут быть также определены в отношении более конкретных диапазонов идентичности и/или сходства с последовательностями этого изобретения, конкретно приведенными здесь в качестве примеров. Идентичность последовательности будет обычно большей, чем 60%, предпочтительно большей, чем 75%, более предпочтительно большей, чем 80%, даже более предпочтительно большей, чем 90%, и может быть большей, чем 95%. Идентичность и/или сходство последовательности может быть 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% в сравнении с приведенной здесь в качестве примера последовательностью. Если нет другого указания, указанные здесь идентичность и/или сходство последовательности могут быть определены с использованием алгоритма Karlin и Altschul (1990), модифицированного, как описано в Karlin и Altschul (1993). Такой алгоритм включен в программы NBLAST и XBLAST в Altschul et al (1990). BLAST-поиски могут выполняться с программой NBLAST, оценка = 100, длина слова = 12, с получением желаемой процентной идентичности последовательности. Для получения сопоставлений с гэпами для целей сравнения могут быть использованы программы Gapped BLAST, как описано в Altschul et al. (1997). При использовании программ BLAST и Gapped BLAST могут быть использованы параметры по умолчанию соответствующих программ (NBLAST and XBLAST). См. веб-сайт NCBI/NIH.
Данное изобретение рассматривает также полинуклеотидные молекулы, имеющие последовательности, которые являются достаточно гомологичными с полинуклеотидными последовательностями, приведенными здесь в качестве примеров, так что возможна гибридизация с этой последовательностью при стандартных строгих условиях и с использованием стандартных способов (Maniatis et al., 1982). В данном контексте, «строгие» условия для гибридизации являются условиями, при которых гибридизацию проводят обычно при 20-25°С ниже температуры плавления Tm гибрида ДНК в 6× SSPE, 5× растворе Денхардта, 0,1% ДСН, 0,1 мг/мл денатурированной ДНК. Температура плавления, Tm, описывается следующей формулой (Beltz et al, 1983):
Tm=81,5°С+16,6 Log[Na+]+0,41(%G+C)-0,61(% формамид) - 600/длина дуплекса в п.н.
Промывки обычно проводят следующим образом:
(1) Два раза при комнатной температуре в течение 15 минут в 1× SSPE, 0,1% ДСН (промывка низкой строгости).
(2) Один раз при Tm-20oC в течение 15 минут в 0,2× SSPE, 0,1% ДСН (промывка средней строгости).
Данное изобретение относится также к вирусным белкам и пептидам, кодируемым генами вируса гриппа этого изобретения. В одном варианте осуществления, этот вирусный белок является зрелым белком НА. В конкретном варианте осуществления, зрелый белок НА содержит один или несколько из следующих признаков: серин в положении 82; лейцин в положении 221; треонин в положении 327 и/или треонин в положении 482. В приведенном в качестве примера варианте осуществления, зрелый белок НА имеет аминокислотную последовательность, показанную в SEQ ID NO: 33 или SEQ ID NO: 34, или функциональный и/или иммуногенный фрагмент или вариант SEQ ID NO: 33 или SEQ ID NO: 34. В другом варианте осуществления, вирусным белком является белок NA, белок NS, белок PB, белок PA или белок MA. Вирусные белки и пептиды этого изобретения могут быть использованы для генерирования антител, которые связываются специфически с этим белком или пептидом. Вирусные белки и пептиды этого изобретения могут быть также использованы в качестве иммуногенов и в вакцинных композициях.
Данное изобретение относится также к композициям и способам для индуцирования иммунного ответа против вируса гриппа, который способен инфицировать чувствительного животного-хозяина и вызвать респираторное заболевание. Это изобретение может быть использовано для индуцирования иммунного ответа против вируса гриппа любого подтипа в чувствительном животном-хозяине. Например, вирусом гриппа может быть подтип НА H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 или H16 и подтип NA N1, N2, N3, N4, N5, N6, N7, N8 или N9. В одном варианте осуществления, подтипом HA является H3 или H5. В следующем варианте осуществления, подтипом NA является N7 или N8. В конкретном варианте осуществления, иммунный ответ индуцируют против вируса гриппа подтипа H3N8. В одном варианте осуществления, животным-хозяином является животное из семейства собачьих. Собачьи включают в себя диких животных, животных зоопарка и домашних животных, таких как волки, койоты и лисы. Собачьи включают в себя также собак, в частности, домашних собак, таких как, например, чистопородные и/или нечистопородные (дворняжки) собаки-компаньоны, собаки для выставок, рабочие собаки, пастушьи собаки, охотничьи собаки, сторожевые собаки, полицейские собаки, гончие собаки и/или лабораторные собаки. В конкретном варианте осуществления, животным-хозяином является домашняя собака, такая как борзая. В одном варианте осуществления, животному вводят эффективное количество иммуногенной композиции данного изобретения, достаточное для индуцирования иммунного ответа против вируса гриппа этого изобретения. Такой иммунный ответ может быть гуморальным и/или клеточным иммунным ответом. В конкретном варианте осуществления, такой иммунный ответ является защитной иммунной реакцией, который способен предотвращать или минимизировать вирусную инфекцию в иммунизированном животном-хозяине в течение некоторого периода времени после этой иммунизации. Таким образом, данное изобретение относится также к вакцинным композициям и способам, которые могут обеспечивать вакцинированное животное защитным иммунным ответом на вирус данного изобретения.
Как описано здесь, вакцинные или иммуногенные композиции данного изобретения могут содержать бесклеточный целый вирус, в том числе, аттенуированный или инактивированный вирус, или части вируса, в том числе частицы субвирионов (включающие в себя «субъединичную вакцину», где вирион обработан для удаления некоторых или всех вирусных липидов), вирусные белки (включающие в себя индивидуальные белки и макромолекулярные комплексы множественных белков), полипептиды и пептиды, а также инфицированные вирусом клеточные линии, или комбинации любых из них. Вакцинные или иммуногенные композиции, содержащие инфицированные вирусом клеточные линии, могут содержать множественные линии клеток, каждая из которых инфицирована отличающимся вирусным штаммом.
В одном варианте осуществления, животное семейства собачьих может быть иммунизировано одной или несколькими инактивированными (т.е. убитыми) и/или живыми аттенуированными вакцинами вируса гриппа или вакцинами, содержащими один или множество антигенов вируса гриппа из одного или нескольких изолятов вируса. В одном варианте осуществления, вирусом гриппа является вирус гриппа собачьих. В другом варианте осуществления, вирусом гриппа является вирус гриппа лошадиных, который кодирует или экспрессирует полипептид, который имеет по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95%, или по меньшей мере приблизительно 96% или 97%, или 98%, или 99% или большую идентичность аминокислотной последовательности с полипептидом вируса гриппа собачьих. В одном варианте осуществления, антиген гриппа, используемый в вакцине данного изобретения, имеет по меньшей мере приблизительно 96% идентичность последовательности с антигеном НА и/или антигеном NA вируса гриппа собачьих.
Примером инактивированной вакцины является EQUICINE II™, которая продавалась на рынке Intervet Inc. (Millsboro, DE, USA) в виде жидкой вакцины. EQUICINE II™ содержит инактивированный вирус гриппа A/Pennsylvania/63 ("A/Pa/63") и вирус гриппа A/equine/Kentucky/93 ("A/KY/93") с карбополом (i.e., HAVLOGEN® (Intervet Inc.)). Более конкретно, одна доза EQUICINE II™ содержит: инактивированный A/Pa/63 at 106,0 EID50, инактивированный A/KY/93 при 106,7 EID50, 0,25% по объему карбопол, и достаточное количество ЗФР для создания общего объема 1 мл.
Другим примером живой аттенуированной вакцины является вирус гриппа лошадиных А/equine/Ohio/03 ("Ohio 03"). В некоторых вариантах осуществления, такая вакцина содержит CARBIGEN™, который является эмульгированным адъювантом на основе полимера, коммерчески доступным из MVP Laboratories, Inc. (Ralston, NE). В таких вакцинах дозированная единица обычно содержит по меньшей мере приблизительно 250 единиц НА вируса, от приблизительно 250 до приблизительно 12500 единиц НА этого вируса или от приблизительно 1000 до приблизительно 6200 единиц НА этого вируса. Рекомендуемая концентрация CARBIGEN™ равна от приблизительно 5 до приблизительно 30% масс..
Примером живой аттенуированной вакцины является модифицированный живой лошадиный вирус equine/Kentucky/91 ("A/KY/91") гриппа в форме лиофилизированной вакцины, которая может быть восстановлена водой. В некоторых вариантах осуществления, такое восстановление проводят с использованием достаточного количества воды для вакцин для доведения дозы вакцины до общего объема 1 мл. Варианты таких вакцин обсуждаются, например, в Патентах США с номерами 6436408; 6398774 и 6177082, которые включены в качестве ссылки в их полном объеме в этот патент. После воссоздания доза такой вакцины может, например, содержать A/KY/91 при 107,2 TCID5O на мл, 0,015 граммов N-Z AMINE AS™ на мл, 0,0025 граммов желатина на мл и 0,04 грамма D-лактозы на мл. N-Z AMINE AS™ является очищенным источником аминокислот и пептидов, полученных ферментативным гидролизом казеина. N-Z AMINE AS™ продается Kerry Bio-Science (Norwich, NY, USA).
В предпочтительном варианте осуществления, эта вакцина содержит антиген вируса гриппа Н3, имеющего по меньшей мере приблизительно 93% гомологию с Florida/43/2004 в кодирующих НА последовательностях, такого как, например, штамм equine/New Market/79. Предпочтительная гомология равна по меньшей мере приблизительно 96%, например, имеющаяся в штаммах equine/Alaska/1/91 и equine/Santiago/85. В примерах, которые следуют далее, в вакцины включены антигены вируса гриппа equine/Kentucky/91, equine-2/Kentucky/93, equine-1/Pennsylvania/63 и антигены вируса гриппа equine/Ohio/03. Предпочтительные вакцины включают в себя также вакцины, содержащие equine/Wisconsin/03, equine/Kentucky/02, equine/Kentucky/93 и equine/New Market 2/93. В примерах, которые следуют далее, используют вирусы H3N8. Однако авторы считают, что могут использоваться другие вирусы гриппа Н3 в соответствии с этим изобретением.
Живые аттенуированные вакцины могут быть получены общепринятыми способами. Такие способы обычно включают в себя, например, модификацию патогенных штаммов пассированием in vitro, адаптацией к холоду, модификацией патогенности этого организма генетической манипуляцией, получением химер, включением антигенов в вирусные векторы, отбором невирулентных штаммов дикого типа и т.д.
В некоторых вариантах осуществления, живой аттенуированный штамм вируса получают серийным пассированием вируса дикого типа через культуру клеток, лабораторных животных, животных, не являющихся хозяевами или яйца. Аккумуляция генетической мутации во время такого пассажа (таких пассажей) обычно приводит к прогрессирующей потере вирулентности организма относительно исходного хозяина.
В некоторых вариантах осуществления, живой аттенуированный штамм вируса получают коинфекцией пермиссивных клеток аттенуированным мутантным вирусом и патогенным вирусом. Желаемый полученный рекомбинантный вирус имеет безопасность аттенуированного вируса с генами, кодирующими защитные антигены из патогенного вируса.
В некоторых вариантах осуществления, живой аттенуированный штамм вируса получают адаптацией к холоду. Адаптированный к холоду вирус имеет преимущество репликации только при температуре, обнаруживаемой в верхних дыхательных путях. Способ получения адаптированного к холоду вируса гриппа лошадиных было описано в Патенте США №6177082. Желаемый полученный адаптированный к холоду вирус придает один или несколько из следующих фенотипов: адаптацию к холоду, чувствительность к температуре, доминантную интерференцию и/или аттенуацию.
В некоторых вариантах осуществления, живой аттенуированный штамм вируса получают молекулярными средствами, такими как точковая мутация, удаление или включение, для превращения патогенного вируса в непатогенный или менее патогенный вирус в сравнении с исходным вирусом, при сохранении защитных свойств исходного вируса.
В некоторых вариантах осуществления, живой аттенуированный вирус получают клонированием кандидата из генов защитных антигенов в геном непатогенного или менее патогенного вируса или другого организма.
Инактивированные (т.е., "убитые") вирусные вакцины могут быть получены инактивацией этого вируса с использованием общепринятых способов. Обычно, такие вакцины включают в себя наполнители, которые могут усиливать иммунный ответ, а также другие наполнители, которые общепринятым способом используют в вакцинах. Например, в примерах, которые следуют далее, EQUICINE II™ содержит HAVLOGEN®. Инактивация этого вируса может выполняться обработкой этого вируса инактивирующими химикалиями (например, формалином, бета-пропиолактоном (“BPL”), бромэтиламином ("BEA") и бинарным этиленимином ("BEI")), или нехимическими способами (например, нагреванием, замораживанием/оттаиванием или обработкой ультразвуком) для подавления репликационной способности этого вируса.
В примерах, которые следуют далее, лошадиный вирус equine/Ohio/03 использовали в качестве вируса заражения. Известно, что он имеет приблизительно 99% гомологию с изолятами Florida/43/04, и было показано, что он индуцирует симптомы инфекции и сероконверсии в собаках. Пример 18 иллюстрирует эффективность вакцины лошадиного вируса гриппа в собаках, что можно видеть по ингибированию титров гемагглютинации (или "HI" или "HAI") в собаках, вакцинированных инактивированным антигеном Ohio 03 в вакцинной композиции, содержащей адъювант CARBIGEN™. Таблица 29 показывает титры перед вакцинацией, после вакцинации и после второй вакцинации, а также после заражения. Эти результаты показывают титры HI на каждой стадии после вакцинации для вакцинированных собак, с малым увеличением или без увеличения для контролей. Таблица 30 показывает клинические симптомы, выделение вируса хозяином и результаты гистопатологии из того же самого исследования. Хотя иммунизированные животные не обнаруживали клинических симптомов, выделения вируса или положительной гистопатологии, положительные титры HI (таблица 29) указывает на значительные титры антител в иммунизированных животных.
Следует отметить, что другие вакцины антигенов вируса гриппа Н3 также включены в это изобретение. Эти вакцины, описанные в этом описании и следующих примерах, обеспечены для иллюстрации этого изобретения и его предпочтительных вариантов, но не для ограничения объема заявленного изобретения.
Кроме того, следует отметить, что антигены гриппа, другие, чем антигены вируса гриппа Н3, могут быть использованы в соответствии с этим изобретением. Такие антигены включают в себя, например, антигены из equine/PA/63, который является лошадиным подтипом А1 (H7N7). Предполагается, что один или несколько таких антигенов могут быть использованы с одним или несколькими антигенами гриппа Н3 или без них.
Обычно, эту вакцину вводят в терапевтически эффективном количестве. «Терапевтически эффективным количеством» является количество, достаточное для индуцирования защитного ответа у пациента из семейства собачьих против вируса-мишени. Обычно, доза является «терапевтически эффективной», если она предотвращает, уменьшает риск, задерживает появление, уменьшает распространение, ослабляет, подавляет или устраняет грипп или один или несколько (обычно два или более) его симптомов. Типичные симптомы гриппа включают в себя, например, лихорадку (для собак обычно ≥103,0°F; ≥39,4°C), кашель, чихание, гистопатологические повреждения, выделение из глаз, выделение из носа, рвоту, диарею, депрессию, потерю массы, рвотные движения, кровохарканье и/или слышимые хрипы. Другие часто более серьезные симптомы могут включать в себя, например, кровотечение в легких, средостении или плевральной полости; трахеит; бронхит; бронхиолит; заместительную бронхопневмонию и/или инфильтрацию эпителиальной выстилки и дыхательных просветов легких нейтрофилами и/или макрофагами.
Эта вакцина может вводиться в виде части комбинированной терапии, т.е. терапии, которая включает в себя, кроме самой вакцины, введение одного или нескольких дополнительных активных агентов, адъювантов, терапевтических агентов и т.д. В этом случае, должно быть понятно, что количество вакцины, которое составляет «терапевтически эффективное» количество, может быть меньшим, чем количество вакцины, которое составляло бы «терапевтически эффективное» количество, если бы вводили только эту вакцину. Другие терапии могут включать в себя терапии, известные в этой области, такие как, например, антивирусные лекарственные средства, аналгезирующие средства, уменьшающие лихорадку лекарственные средства, отхаркивающие средства, противовоспалительные лекарственные средства, антигистаминные средства, антибиотики для лечения бактериальной инфекции, которая происходит из инфекции вируса гриппа, покой и/или введение жидкостей. В некоторых вариантах осуществления вакцину этого изобретения вводят в комбинации с вакциной против Bordetella, вакциной против аденовируса и/или вакциной против вируса парагриппа.
В некоторых вариантах осуществления, обычной дозой для живой аттенуированной вакцины является по меньшей мере приблизительно 103 бое/животное (Canidae); и более обычно приблизительно 103 - приблизительно 109 бое/животное (Canidae). В этом патенте, "бое" означает “бляшкообразующие единицы". В некоторых вариантах осуществления, типичной дозой для живой аттенуированной вакцины является по меньшей мере приблизительно 103 TCDD50/животное (Canidae) и более типично приблизительно 103 - приблизительно 109 TCID50/животное (Canidae). В некоторых вариантах осуществления, типичной дозой для живой аттенуированной вакцины является по меньшей мере приблизительно 103 EID50/животное (Canidae) и более типично приблизительно 103 - приблизительно 109 EID50/животное (Canidae). В некоторых вариантах осуществления, типичной дозой для убитой вакцины являются по меньшей мере приблизительно 40 единиц НА, обычно приблизительно 40 - приблизительно 10000 единиц НА и более часто приблизительно 500 - приблизительно 6200 единиц НА. В некоторых вариантах осуществления, эта доза равна приблизительно 6100 - приблизительно 6200 единиц НА.
В некоторых вариантах осуществления, эта вакцина содержит живую аттенуированную вакцину в концентрации, которая по меньшей мере на приблизительно 100,5 бое/животное (Canidae) больше, чем уровень иммуногенности. В некоторых вариантах осуществления, эта вакцина содержит живую аттенуированную вакцину в концентрации, которая по меньшей мере на приблизительно 100,5 TCID50/животное (Canidae) больше, чем уровень иммуногенности. В некоторых вариантах осуществления, эта вакцина содержит живую аттенуированную вакцину в концентрации, которая по меньшей мере на приблизительно 100,5 EID50/животное (Canidae) больше, чем уровень иммуногенности.
Уровень иммуногенности может быть определен экспериментально способами исследования с титрованием дозы иммунизации, обычно известными в этой области. Такие способы обычно включают в себя вакцинацию ряда представителей собачьих вакциной при разных дозах и затем заражение этих животных вирулентным вирусом для детектирования минимальной защитной дозы.
Факторы, влияющие на предпочтительную схему введения доз, могут включать в себя, например, тип (например, вид и породу), возраст, массу, пол, рацион, активность, размер легких и состояние субъекта; способ введения; эффективность, безопасность и профили продолжительности иммунитета конкретной используемой вакцины; использование системы доставки; введение вакцины в виде части лекарственной и/или вакцинной комбинации. Таким образом, фактически используемая доза может варьироваться для конкретных животных и, следовательно, может отклоняться от приведенных выше типичных доз. Определение таких корректировок дозы с использованием общепринятых средств обычно находится в пределах квалификации специалистов в этой области. Кроме того, следует отметить, что живые аттенуированные вирусы являются обычно саморазмножающимися; таким образом, конкретное количество такого введенного вируса необязательно является критическим.
Предполагается, что эта вакцина может вводиться в пациентов-собачьих один раз; или, альтернативно, два или более раз на протяжении дней, недель, месяцев или лет. В некоторых вариантах осуществления, эту вакцину вводят по меньшей мере два раза. В некоторых таких вариантах осуществления, вакцину вводят, например, дважды, причем вторую дозу (например, бустер) вводят по меньшей мере спустя 2 недели после первой дозы. В некоторых вариантах осуществления, вакцину вводят, например, дважды, причем вторую дозу (например, бустер) с интервалом не более, чем 8 недель, после первой дозы. В некоторых вариантах осуществления вторую дозу вводят при приблизительно 2 неделях - приблизительно 4 годах после первой дозы, приблизительно 2 - приблизительно 8 неделях после первой дозы или приблизительно 3 - приблизительно 4 неделях после первой дозы. В некоторых вариантах осуществления, вторую дозу вводят при приблизительно 4 неделях после первой дозы. В приведенных выше вариантах осуществления, первая и последующие дозы могут варьироваться, например, по количеству и/или по форме. Однако, часто эти дозы являются одинаковыми по количеству и по форме. При введении только единственной дозы количество вакцины в этой одной дозе обычно содержит терапевтически эффективное количество этой вакцины. Однако, при введении более, чем одной, дозы количества вакцины в этих дозах вместе могут составлять терапевтически эффективное количество.
В некоторых вариантах осуществления, эту вакцину вводят перед инфицированием реципиента семейства собачьих гриппом. В таких вариантах осуществления, эта вакцина может быть введена для предотвращения, уменьшения риска или задержки появления гриппа или одного или нескольких (обычно двух или более) симптомов гриппа.
В некоторых вариантах осуществления, эту вакцину вводят после инфицирования гриппом реципиента семейства собачьих. В таких вариантах осуществления, эта вакцина может, например, ослаблять, подавлять или устранять грипп или один или несколько (обычно два или более) симптомов гриппа.
Предпочтительная композиция вакцины зависит, например, от того, является ли эта вакцина инактивированной вакциной, живой аттенуированной вакциной или и той, и другой вакциной. Эта композиция зависит также от способа введения. Ожидается, что эта вакцина будет содержать один или несколько общепринятых фармацевтически приемлемых носителей, адъювантов, других усилителей иммунного ответа и/или носителей (вместе называемых «наполнителями»). Такие наполнители обычно выбраны таким образом, что они являются совместимыми с активным ингредиентом (активными ингредиентами) в этой вакцине. Применение наполнителей обычно известно квалифицированным в данной области специалистам.
Термин «фармацевтически приемлемые» используется в виде определения и означает, что модифицированное существительное является пригодным для использования в фармацевтическом продукте. Например, при использовании для описания наполнителя в фармацевтической вакцине этот термин характеризует наполнитель как совместимый с другими ингредиентами этой композиции и не является невыгодно вредным для предполагаемого реципиента семейства собачьих.
Эти вакцины могут вводиться общепринятыми способами, в том числе, например, введением через слизистую оболочку (например, интраназально, перорально, внутритрахеально и внутриглазно) и парентеральным введением. Введение через слизистую оболочку часто является особенно предпочтительным для живых аттенуированных вакцин. Парентеральное введение часто является особенно предпочтительным для инактивированных вакцин.
Мукозные вакцины могут быть, например, жидкими дозированными формами, такими как фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Наполнители, подходящие для таких вакцин включают в себя, например, инертные растворители, обычно используемые в этой области, такие как вода, солевой раствор, декстроза, глицерин, лактоза, сахароза, порошок крахмала, эфиры алкановых кислот целлюлозы, алкиловые эфиры целлюлозы, тальк, стеариновая кислота, стеарат магния, оксид магния, соли натрия и кальция фосфорной и серной кислот, желатин, аравийская камедь, альгинат натрия, поливинилпирролидон и/или поливиниловый спирт. Наполнители могут также содержать различные увлажняющие, эмульгирующие, суспендирующие, улучшающие вкус и запах (например, подслащивающие) и/или ароматизирующие агенты.
Пероральные мукозные вакцины могут быть также, например, таблетированы или инкапсулированы для удобного введения. Такие капсулы или таблетки могут содержать форму регулируемого высвобождения. В случае капсул, таблеток и пилюль, эти дозированные формы могут также содержать буферные агенты, такие как цитрат натрия или карбонат или бикарбонат магний или кальция. Таблетки и пилюли могут быть приготовлены с энтеросолюбильным покрытием.
Предполагается, что эта вакцина может вводиться через питьевую воду и/или корм пациента-представителя семейства собачьих. Кроме того, предполагается, что эта вакцина может вводиться в форме лакомства или игрушки.
“Парентеральное введение” включает в себя подкожные инъекции, инъекции под слизистую оболочку, внутривенные инъекции, внутримышечные инъекции, внутригрудинные инъекции, чрескожные инъекции и инфузию. Инъекционные препараты (например, стерильные инъекционные водные или масляные суспензии) могут быть приготовлены в соответствии с известными способами с использованием подходящих наполнителей, таких как носители, растворители, диспергирующие, увлажняющие агенты, эмульгирующие агенты и/или суспендирующие агенты. Они обычно включают в себя, например, воду, солевой раствор, декстрозу, глицерин, этанол, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, бензиловый спирт, 1,3-бутандиол, раствор Рингера, изотонический раствор хлорида натрия, безвкусные нелетучие масла (например, синтетические моно- или диглицериды), жирные кислоты (например, олеиновую кислоту), диметилацетамид, поверхностно-активные вещества (например, ионогенные и неионогенные детергенты), пропиленгликоль и/или полиэтиленгликоли. Наполнители могут также включать в себя небольшие количества других вспомогательных веществ, таких как pH-буферящие агенты.
Эта вакцина может включать в себя один или несколько наполнителей, которые усиливают иммунный ответ пациентов из семейства собачьих (которая может быть реакцией в виде антител, клеточной реакцией или и той, и другой), увеличивая посредством этого эффективность этой вакцины. Применение таких наполнителей (или «адъювантов») может быть особенно полезным при использовании инактивированной вакцины. Адъювант (адъюванты) могут быть веществом, которое оказывает прямое (например, цитокин или бацилла Кальмета-Герена (“BCG”, БЦЖ)) или непрямое действие (липосомы) на клетки иммунной системы пациента из семейства собачьих. Примеры часто подходящих адъювантов включают в себя масла (например, минеральные масла), соли металлов (например, гидроксид алюминия или фосфат алюминия), бактериальные компоненты (например, бактериальные липосахариды, адъюванты Фрейнда и/или MDP), растительные компоненты (например, Quil A) и/или одно или нескольких веществ, которые могут быть носителями (например, бентонит, частицы латекса, липосомы и/или Quil A, ISCOM). Как отмечалось выше, адъюванты включают в себя также, например, CARBIGEN™ и карбопол. Должно быть понятно, что это изобретение включает в себя как вакцины, которые содержат адъювант (адъюванты), так и вакцины, которые не содержат никаких адъювантов.
Предполагается, что эта вакцина может быть лиофилизирована (или иным образом уменьшена по объему жидкости) для хранения и затем восстановлена в жидкости перед моментом введения или во время введения. Такое воссоздание может достигаться с использованием, например, воды вакцинной категории.
Кроме того, данное изобретение обеспечивает наборы, которые пригодны для использования в выполнении вышеописанных способов. Набор содержит дозированную форму, содержащую вышеописанную вакцину. Этот набор содержит также по меньшей мере один дополнительный компонент и обычно инструкции для применения этой вакцины с дополнительным компонентом (компонентами). Этот дополнительный компонент (дополнительные компоненты) может быть, например, одним или несколькими дополнительными ингредиентами (такими как, например, один или несколько обсуждаемых выше наполнителей, корм и/или лакомство), которые могут быть смешаны с этой вакциной до или во время введения. Этот дополнительный компонент (компоненты) может альтернативно (или дополнительно) содержать одно или несколько устройств для введения этой вакцины пациенту-представителю собачьих. Таким устройством может быть, например, шприц, ингалятор, распылитель, пипетка, пинцет или любое применимое в медицине доставляющее устройство. В некоторых вариантах осуществления, это устройство пригодно для интраназального введения вакцины.
Могут быть также использованы другие наполнители и способы введения, известные в областях фармацевтики и биологии.
Вакцинные или иммуногенные композиции данного изобретения включают в себя также рекомбинантные конструкции на основе вирусных векторов, которые могут содержать, например, гены, кодирующие белок НА, белок NA, нуклеопротеин, основный белок полимеразы, кислый белок полимеразы и/или белок матрикса вируса гриппа данного изобретения. Любой подходящий вирусный вектор, который может быть использован для получения рекомбинантной конструкции вектор/вирус, предполагается для применения с данным изобретением. Например, вирусные векторы, произведенные из аденовируса, авипоксвируса, герпесвируса, вируса коровьей оспы, канарипоксвируса, энтомопоксвируса, вируса оспы свиней, вируса лихорадки Западного Нила и других, известных в этой области, могут быть использованы с композициями и способами данного изобретения. Рекомбинантные полинуклеотидные векторы, которые кодируют и экспрессируют эти компоненты, могут быть сконструированы с использованием стандартных способов генной инженерии, известных в этой области. Кроме того, различные вакцинные композиции, описанные здесь, могут быть использованы отдельно и в комбинации друг с другом. Например, первичные иммунизации животного могут использовать рекомбинантные конструкции на основе вектора, имеющие компоненты единственного штамма или множественных штаммов, с последующими вторичными бустер-иммунизациями вакцинными композициями, содержащими инактивированный вирус или инактивированные инфицированные вирусом клеточные линии. Другие протоколы иммунизации вакцинными композициями этого изобретения очевидны лицам с квалификацией в данной области, и предполагается, что они включены в объем этого изобретения.
Представленное изобретение относится также к химерному вирусу, содержащему по меньшей мере один ген или геномный сегмент вируса гриппа данного изобретения и остальные вирусные гены или геномные сегменты из отличающегося вируса гриппа этого изобретения или из вируса гриппа, другого, чем вирус данного изобретения. Химерный вирус может быть получен посредством генетической реассортации нуклеиновой кислоты донорного вируса гриппа данного изобретения с нуклеиновой кислотой реципиентного вируса гриппа и затем отбора химерного вируса, который включает нуклеиновую кислоту донорного вируса. Способы получения и выделения химерного вируса хорошо известны в этой области (Fields et al., 1996). В одном варианте осуществления, химерный вирус этого изобретения содержит гены или геномные сегменты вируса гриппа человека, птиц, свиней или лошадей. Химерный вирус этого изобретения может включать в себя любую комбинацию нуклеиновой кислоты из донорного и реципиентного вируса гриппа, пока этот химерный вирус содержит по меньшей мере один ген или геномный сегмент из донорного вируса гриппа этого изобретения. В одном варианте осуществления, реципиентным вирусом гриппа может быть вирус гриппа лошадей.
Природные, рекомбинантные или синтетические полипептиды вирусных белков и их пептидные фрагменты могут быть также использованы в качестве вакцинных композиций в соответствии с рассматриваемыми способами. В одном варианте осуществления, вакцинная композиция содержит полинуклеотид или полипептид вируса гриппа собачьих. В одном варианте осуществления, вакцинная композиция содержит полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или ее функциональный и/или иммуногенный фрагмент или вариант. В конкретном варианте осуществления, полинуклеотид, кодирующий аминокислотную последовательность, показанную в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, содержит нуклеотидную последовательность, показанную в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, соответственно, или последовательность, кодирующую функциональный и/или иммуногенный вариант любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78. В следующем конкретном варианте осуществления, полинуклеотид этого изобретения может содержать: нуклеотиды 1-2271 SEQ ID NO: 3; нуклеотиды 1-2148 SEQ ID NO: 5; нуклеотиды 1-657 SEQ ID NO: 7; нуклеотиды 1-1494 SEQ ID NO: 9; нуклеотиды 1-1410 SEQ ID NO: 11; нуклеотиды 1-756 SEQ ID NO: 13; нуклеотиды 1-1695 SEQ ID NO: 15; нуклеотиды 1-2271 SEQ ID NO: 19; нуклеотиды 1-2148 SEQ ID NO: 21; нуклеотиды 1-657 SEQ ID NO: 23; нуклеотиды 14494 SEQ ID NO: 25; нуклеотиды 1-756 SEQ ID NO: 29; нуклеотиды 1-1695 SEQ ID NO: 31; нуклеотиды 1-2277 SEQ ID NO: 47; нуклеотиды 1-2271 SEQ ID NO: 49; нуклеотиды 1-2148 SEQ ID NO: 51; нуклеотиды 1-690 SEQ ID NO: 53; нуклеотиды 1-1494 SEQ ID NO: 55; нуклеотиды 1-1410 SEQ ID NO: 57; нуклеотиды 1-756 SEQ ID NO: 59; нуклеотиды 1-1695 SEQ ID NO: 61; нуклеотиды 1-2277 SEQ ID NO: 63; нуклеотиды 1-2271 SEQ ID NO: 65; нуклеотиды 1-2148 SEQ ID NO: 67; нуклеотиды 1-690 SEQ ID NO: 69; нуклеотиды 1-1494 SEQ ID NO: 71; нуклеотиды 1-1410 SEQ ID NO: 73; нуклеотиды 1-756 SEQ ID NO: 75 и нуклеотиды 1-1695 SEQ ID NO: 77. В другом варианте осуществления, вакцинная композиция содержит полипептид, имеющий аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или ее функциональный и/или иммуногенный фрагмент или вариант. В следующем варианте осуществления, вакцинная композиция содержит полинуклеотид или полипептид вируса гриппа лошадиных, где этот полинуклеотид или полипептид имеет по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95%, или по меньшей мере приблизительно 96%, или 97%, или 98%, или 99% или большую идентичность последовательности с полинуклеотидом или полипептидом вируса гриппа собачьих. В одном варианте осуществления, вирусные полипептиды, произведенные из множественных штаммов, могут объединяться в вакцинной композиции и использоваться для вакцинации животного-хозяина. Например, полипептиды на основе вирусного белка НА по меньшей мере из двух разных штаммов вируса гриппа данного изобретения могут быть объединены в этой вакцине. Эти полипептиды могут быть гомологичными одному штамму или могут содержать «гибридные» или «химерные» полипептиды, аминокислотная последовательность которых произведена соединением или связыванием полипептидов по меньшей мере из двух разных штаммов. Процедуры для получения вирусных полипептидов хорошо известны в этой области. Например, вирусные полипептиды и пептиды могут быть синтезированы с использованием способов твердофазного синтеза (Merrifield, 1963). Вирусные полипептиды и пептиды могут быть также получены с использованием способов рекомбинантных ДНК, в которых полинуклеотидная молекула, кодирующая вирусный белок или пептид, экспрессируется в клетке-хозяине, такой как бактерии, дрожжи или клеточные линии млекопитающих, и экспрессированный белок очищают с использованием стандартных способов этой области.
Вакцинные композиции данного изобретения включают в себя также композиции «голых» ДНК. В одном варианте осуществления, нуклеиновая кислота может содержать нуклеотидную последовательность, кодирующую белок HA и/или белок NA вируса гриппа этого изобретения. Способы вакцинации нуклеиновыми кислотами известны в этой области и описаны, например, в Патентах США с номерами 6063385 и 6472375. Эта нуклеиновая кислота может быть в форме плазмиды или экспрессионной кассеты генов. В одном варианте осуществления, обеспечена эта нуклеиновая кислота, инкапсулированная в липосоме, которую вводят животному.
Вакцинные композиции и иммуногены, такие как полипептиды и нуклеиновые кислоты, которые могут быть использованы в соответствии с данным изобретением, могут быть получены с фармацевтически приемлемым носителем или разбавителем. Соединения и композиции, применимые в данном изобретении, могут быть приготовлены в соответствии с известными способами приготовления фармацевтически приемлемых композиций. Готовые формы описаны подробно в ряде литературных источников, которые хорошо известны и легко доступны квалифицированным в данной области специалистам. Например, Remington′s Pharmaceutical Science by E.W. Martin, Easton Pennsylvania, Mack Publishing Company, 19th ed., 1995, описывает готовые формы, которые могут быть использованы в связи с рассматриваемым изобретением. Обычно, композиции данного изобретения должны готовиться таким образом, что эффективное количество иммуногена объединяют с подходящим носителем для облегчения эффективного введения этой композиции, используемые в этих способах, могут также находиться в разнообразных формах. Они включают в себя, например, твердые, полутвердые и жидкие дозированные формы, такие как таблетки, пилюли, порошки, жидкие растворы или суспензии, суппозитории, инъецируемые или инфузируемые растворы и спреи. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Эти композиции предпочтительно включают в себя также общепринятые фармацевтически приемлемые носители и разбавители, которые известны квалифицированным в данной области специалистам. Примеры носителей и разбавителей для применения с представленными пептидомиметиками, включают в себя, но не ограничиваются ими, воду, солевой раствор, масла, в том числе минеральное масло, этанол, диметилсульфоксид, желатин, циклодекстраны, стеарат магния, декстрозу, целлюлозу, сахара, карбонат кальция, глицерин, оксид алюминия, крахмал и эквивалентные носители и разбавители или смеси любых из них. Готовые формы иммуногена этого изобретения могут также содержать суспендирующие агенты, защитные агенты, буферы, консерванты и стабилизаторы. Для обеспечения введения таких доз для желаемого терапевтического лечения фармацевтические композиции этого изобретения будут предпочтительно содержать приблизительно 0,1% масс. - 45% масс. и, в частности, 1% масс. - 15% масс. иммуногена или иммуногенов общей композиции, включающей в себя носитель или разбавитель.
Вакцинные и иммуногенные композиции данного изобретения могут быть приготовлены процедурами, хорошо известными в этой области. Например, эту вакцину или иммуногены обычно готовят в виде инъекционных форм, например, жидких растворов или суспензий. Эти вакцину или иммуногены вводят таким способом, который совместим с дозированной формой, и в таком количестве, которое будет терапевтически эффективным и иммуногенным в реципиенте. Оптимальные дозы и схемы введения для конкретной вакцины или препарата иммуногенов могут быть легко определены квалифицированным в данной области специалистом.
Пептиды и/или полипептиды данного изобретения могут быть также обеспечены в форме конструкции множественных антигенных пептидов (МАР). Получение конструкций МАР было описано в Tam (1988). Конструкции MAP используют сердцевинный матрикс из остатков лизина, на котором синтезируют множественные копии иммуногена (Posnett et al, 1988). Множественные конструкции МАР, каждая из которых содержит одинаковые или различные иммуногены, могут быть получены и введены в вакцинную композицию в соответствии со способами данного изобретения. В одном варианте осуществления, обеспечена конструкция МАР с одним и/или несколькими адъювантами, и/или вводимая с одним или несколькими адъювантами. Полипептиды вируса гриппа этого изобретения могут быть также получены и введены в виде макромолекулярных белковых структур, содержащих один или несколько полипептидов. Опубликованная Заявка на патент США US 2005/0009008 описывает способы получения вирусоподобных частиц в качестве вакцины для вируса гриппа.
Согласно способам данного изобретения, описанные здесь вакцинные и иммуногенные композиции вводят чувствительным хозяевам, обычно собачьим, и более часто домашним собакам, в эффективном количестве и эффективным способом для индукции защитного иммунитета против последующего заражения или инфицирования этого хозяина вирусом. В одном варианте осуществления, этим животным-хозяином является представитель семейства собачьих. Собачьи включают в себя диких собачьих, собачьих зоопарков и домашних собачьих, таких как, например, волки, койоты и лисы. Собачьи включают в себя также собак, в частности, домашних собак, таких как, например, чистопородные и/или нечистокровные (дворняжки) собаки-компаньоны, собаки для выставок, рабочие собаки, пастушьи собаки, охотничьи собаки, сторожевые собаки, полицейские собаки, гончие собаки и/или лабораторные собаки. В конкретном варианте осуществления, животным-хозяином является домашняя собака, такая как борзая. Эти вакцины или иммуногены обычно вводят парентерально, инъекцией, например, подкожно, внутрибрюшинно или внутримышечно. Другие подходящие способы введения включают в себя пероральное или назальное введение. Обычно, эти вакцины или иммуногены вводят животному по меньшей мере два раза, с интервалом одна или несколько недель между введениями. Однако, предполагаются и другие схемы для начального введения и бустер-введений вакцины или иммуногенов, и они могут зависеть от суждения практикующего врача и от конкретного подлежащего лечению животного-хозяина.
Вирусные и инфицированные вирусом клетки в вакцинном препарате могут быть инактивированными или аттенуированными с использованием известных в данной области способов. Например, целый вирус и инфицированные клетки могут быть инактивированы или аттенуированы воздействием параформальдегидом, формалином, бета-пропиолактоном (BPL), бромэтиламином (BEA), бинарным этиленимином (BEI), фенолом, ультрафиолетовым светом (УФ), повышенной температурой, замораживанием и оттаиванием, озвучением (в том числе обработкой ультразвуком), и т.п. Количество бесклеточного целого вируса в дозе вакцины может находиться в диапазоне приблизительно 0,1 мг - приблизительно 5 мг и более часто находится в диапазоне приблизительно 0,2 мг - приблизительно 2 мг. Доза для вакцинных препаратов, содержащих инфицированные вирусом клеточные линии, будет обычно содержать приблизительно 106 - приблизительно 108 клеток на дозу и более часто приблизительно 5×106 - приблизительно 7,5×107 клеток на дозу. Количество белкового или пептидного иммуногена в дозе для одного животного может варьироваться от приблизительно 0,1 мкг - приблизительно 10000 мкг, или приблизительно 1 мкг - приблизительно 5000 мкг, или приблизительно 10 мкг - приблизительно 1000 мкг, или приблизительно 25 мкг - приблизительно 750 мкг, или приблизительно 50 мкг - приблизительно 500 мкг, или 100 мкг - приблизительно 250 мкг, в зависимости от размера, возраста и т.д. животного, получающего эту дозу.
Иммуногенная или вакцинная композиция этого изобретения, такая как вирус или инфицированные вирусом клетки или вирусные белки или пептиды, может быть объединена с адъювантом, обычно непосредственно перед введением. Адъюванты, предполагаемые для применения в этих вакцинных формах, обычно включают в себя треонилмурамилдипептид (MDP) (Byars et al, 1987), сапонин, Cornebacterium parvum, полный адъювант Фрейнда и неполный адъювант Фрейнда, алюминий или смесь любых их них. Различные другие адъюванты, подходящие для использования со способами и вакцинами данного изобретения, такие как квасцы, хорошо известны в этой области и предполагаются для использования с данным изобретением.
Данное изобретение относится также к антителам, которые связываются специфически с белком или пептидом данного изобретения. Антитела данного изобретения включают в себя композиции моноклональных и поликлональных антител. Предпочтительно, антитела данного изобретения являются моноклональными антителами. В данном изобретении рассматриваются целые антитела и антигенсвязывающие фрагменты. Так, например, подходящие антигенсвязывающие фрагменты включают в себя фрагменты антител Fab2, Fab и Fv. Антитела этого изобретения могут быть помечены детектируемой частью молекулы, такой как флуоресцентная молекула (например, флуоресцеин или фермент).
Представленное изобретение относится также к способам и композициям для детектирования и идентификации вируса гриппа этого изобретения и для диагностики инфекции животного вирусом гриппа данного изобретения. Способы этого изобретения включают в себя детектирование присутствия гриппа собачьих в биологической пробе из животного. Детектирование гриппа собачьих в пробе применимо для диагностики гриппа собачьих в животном. В свою очередь, эта информация может обеспечить возможность определения прогнозирования животного на основе различающихся уровней вируса гриппа собачьих на протяжении времени и может способствовать выбору терапевтических агентов и способов лечения для этого животного и способствовать мониторингу терапии. Этот способ обеспечивает также возможность установления отсутствия гриппа собачьих в испытуемом животном.
Возможность детектирования гриппа собачьих в животном позволяет оценивать вспышки гриппа собачьих в различных географических местоположениях. Эта информация делает также возможным раннее детектирование, так что инфицированные животные могут быть изолированы для ограничения распространения заболевания, и делает возможным раннее вмешательство в отношении возможностей лечения. Кроме того, доступность этой информации может обеспечить мобилизацию медицинского персонала на лечение больших количеств больных животных, в том числе на сбор медицинского обеспечения и вакцин, если они доступны.
В одном варианте осуществления, способ данного изобретения включает в себя взятие биологической пробы из тест-животного, такого как представитель собачьих. Этой биологической пробой может быть любой биологический материал, в том числе клетки, ткань, шерсть, цельная кровь, сыворотка, плазма, аспират молочной железы, легочный лаваж, цереброспинальная жидкость, слюна, пот и слезы.
Тест-проба животного может происходить из животного, в котором предполагают присутствие вируса гриппа, независимо от того, проявляет или не проявляет это животное симптомы этого заболевания. Контрольные пробы могут быть также обеспечены или собраны из животных, о которых известно, что они не имеют гриппа собачьих. Дополнительные контроли могут также быть обеспечены, например, для уменьшения ложноположительных и ложноотрицательных результатов и подтверждения того, что реагенты в этом анализе активно детектируют вирус гриппа А собачьих.
Кроме детектирования присутствия или отсутствия гриппа собачьих в биологической пробе, способы детектирования, используемые в этом изобретении, могут детектировать мутации в вирусе гриппа собачьих, такие как изменения в последовательности нуклеиновой кислоты, которые могут происходить вследствие окружающей среды, лечения лекарственными средствами, генетических манипуляций или мутаций, повреждения, изменения в пищевом рационе, возраста или любой другой характеристики (любых других характеристик) животного. Мутации могут также делать вирус гриппа А собачьих устойчивым к лекарственному средству, которое ранее было эффективным, или делать вирус способным инфицировать разные виды животного и человека и размножаться в них. Например, было показано, что вирус птичьего гриппа А инфицирует других животных и человека.
В одном варианте детектирования вируса гриппа в животном диагностика облегчается сбором образцов высокого качества, их быстрой транспортировкой к тестирующему оборудованию и правильным хранением перед лабораторным исследованием. Вирус детектируется наилучшим образом в образцах, содержащих инфицированные клетки и выделения. В одном варианте осуществления, образцы для прямого детектирования вирусных антигенов и/или для выделения нуклеиновых кислот и/или вируса в клеточной культуре берут во время первых 3 дней после появления клинических симптомов. Ряд типов образцов являются пригодными для диагностики вирусных инфекций верхних дыхательных путей, в том числе, но не только, мазок из носа, мазок из носоглотки, аспират из носоглотки, назальный смыв и мазки из горла. Кроме мазков, могут быть взяты пробы ткани или сыворотки и могут быть также выполнены инвазивные процедуры.
В одном варианте осуществления, респираторные образцы собирают и транспортируют в 1-5 мл среды для транспортировки вирусов. Ряд сред, которые являются удовлетворительными для извлечения большого разнообразия вирусов, являются коммерчески доступными. Клинические образцы добавляют в среду для транспортировки. Мазки из носа или носоглоточные мазки могут также транспортироваться в среде для транспортировки вирусов. Одним примером среды для транспортировки является 10 г мясопептонного культурального бульона и 2 г фракции V бычьего альбумина, дополненные стерильной дистиллированной водой до 400 мл. Могут быть также добавлены антибиотики, такие как 0,8 мл раствора сульфата гентамицина (50 мг/мл) и 3,2 мл амфотерицина В (250 мкг/мл). Эту среду предпочтительно стерилизуют фильтрованием. Смывы из носа, например, стерильным солевым раствором (0,85% NaCl), могут быть также использованы для сбора образцов респираторных вирусов.
В одном варианте осуществления, сыворотку собирают в количестве 1-5 мл цельной крови из животного острой фазы, вскоре после появления клинических симптомов и предпочтительно не позднее, чем 7 дней. Может быть также взят образец фазы выздоровления, например, при приблизительно 14 днях после появления симптомов. Образцы сыворотки могут быть применимы для детектирования антител против респираторных вирусов в тесте нейтрализации.
В некоторых случаях могут быть собраны пробы из отдельных животных на протяжении некоторого периода времени (например, один раз в день, один раз в неделю, один раз в месяц, два раза в год или один раз в год). Получение многочисленных проб из отдельного животного, на протяжении времени, может быть использовано для подтверждения результатов более ранних детектирований и/или для идентификации реакции или устойчивости к конкретному лечению, например, к выбранному терапевтическому лекарственному средству.
Способы данного изобретения могут быть использованы для детектирования присутствия одного или нескольких патологических агентов в тест-пробе из животного и уровня каждого патологического агента. Может быть использован любой способ для детектирования патологического агента, в том числе, но не только, анализы антител, включающие в себя твердофазный иммуноферментный анализ (ELISA), непрямые флуоресцентные тесты антител (IFA), гемагглютинация и анализы ингибирования гемагглютинации (HI) и Вестерн-блоттинг. Могут быть также использованы известные способы с использованием культур клеток. Положительные культуры могут быть дополнительно идентифицированы с использованием иммунофлуоресценции клеточных культур или анализа HI среды клеточной культуры (супернатанта).
Кроме того, могут быть использованы способы детектирования нуклеиновой кислоты (ДНК или РНК) или белка. Такие способы включают в себя, но не ограничиваются ими, тесты полимеразной цепной реакции (ПЦР) и ПЦР с обратной транскриптазой (ОТ-ПЦР) и тесты ПЦР реального времени и количественные анализы с использованием нуклеазной защиты. Имеются коммерчески доступные тест-наборы для выполнения этих анализов. Например, QIAGEN (Valencia, CA) продает набор для одностадийной ОТ-ПЦР и набор для экстракции вирусной РНК.
В одном варианте осуществления, этот способ использует антитело, специфическое в отношении вируса или вирусного белка этого изобретения. В конкретном варианте осуществления, используют антитело, специфическое в отношении белка НА вируса этого изобретения. В другом варианте осуществления, используют антитело специфическое в отношении белка NP вируса этого изобретения. Подходящую пробу, например, из назальной или носоглоточной области, получают из животного и из нее выделяют вирус или вирусный белок. Затем эти вирусные компоненты подвергают скринингу на связывание антитела, специфического в отношении белка, такого как НА или NP, вируса этого изобретения. В другом варианте осуществления, из животного получают пробу сыворотки (или содержащую другое антитело пробу) и сыворотку подвергают скринингу на присутствие антитела, которое связывается с белком вируса этого изобретения. Например, может быть выполнен анализ ELISA, в котором стенки планшета имеют белок НА и/или NP, или его пептидный фрагмент, связанные с этой стенкой. Затем стенку планшета контактируют с сывороткой или антителом из тест-животного. Присутствие в животном антитела, которое связывается специфически с белком HA и/или NP, указывает на то, что это тест-животное инфицировано или было инфицировано вирусом гриппа данного изобретения.
В одном варианте осуществления, присутствие патологического агента детектируют определением присутствия или отсутствия антител против этого агента в биологической пробе. Может пройти некоторое время (например, месяцы) после инфицирования животного, прежде чем антитела смогут быть детектированы в анализе крови. После их образования, антитела обычно сохраняются в течение многих лет, даже после успешного лечения этого заболевания. Обнаружение антител к вирусу гриппа собачьих не может указывать, была ли эта инфекция недавно или когда-то в прошлом.
Исследование антител может также выполняться на жидкости (на жидкостях). Анализы антител включают в себя твердофазные иммуноферментные анализы (ELISA), непрямые флуоресцентные тесты антител (IFA) и Вестерн-блоттинг. Предпочтительно, исследование антител выполняют с использованием множественных анализов, например, ELISA или IFA с последующим Вестерн-блоттингом. ELISA считается более надежным и точным анализом, чем IFA, но IFA может быть использован, если не доступен ELISA. Вестерн-блот-анализ (который является более специфическим тестом) может выполняться во всех животных, особенно в животных, которые дали положительные или двойственные (неопределенные) результаты в анализе ELISA или IFA.
Другие тесты на основе антител, которые могут быть использованы для детектирования вируса гриппа, включают в себя анализы ингибирования гемагглютинации. Активность гемагглютинации может быть детектирована в биологической пробе из животного с использованием куриных или индюшачьих эритроцитов, как описано (Burleson et al., 1992 и Kendal et al., 1982). В одном варианте осуществления, вирус гриппа или белок или пептид НА этого изобретения контактируют с тест-пробой, содержащей сыворотку или антитело. Затем добавляют эритроциты (RBC) из животного, такого как птица. Если антитело к HA присутствует, то эти RBC будут агглютинироваться в присутствии НА. Вариации и модификации стандартных анализов ингибирования гемагглютинации известны в данной области и предполагаются в объеме данного изобретения.
Инфекция животного может быть также определена выделением вируса из пробы, такой как мазок из носа или носоглоточный мазок. Выделение вируса может выполняться с использованием стандартных способов, в том числе с использованием клеточной культуры и инокуляции яйца.
В следующем варианте осуществления, для детектирования вируса данного изобретения может быть использован анализ на основе нуклеиновых кислот. В одном варианте осуществления, пробу нуклеиновой кислоты получают из животного и эту нуклеиновую кислоту подвергают ПЦР с использованием праймеров, которые будут генерировать продукт амплификации, если эта нуклеиновая кислота содержит последовательность, специфическую в отношении вируса гриппа данного изобретения. В конкретном варианте осуществления, в анализе на данный вирус используют ОТ-ПЦР. В приведенном в качестве примера варианте осуществления, для анализа на вирус гриппа данного изобретения используют ОТ-ПЦР реального времени. Способы ПЦР, ОТ-ПЦР и ПЦР реального времени известны в этой области и были описаны в Патентах США с номерами 4683202; 4683195; 4800159; 4965188; 5994056; 6814934 и в Saiki et al. (1985); Sambrook et al. (1989); Lee et al (1993) и Livak et al. (1995). В одном варианте осуществления, анализ ПЦР использует олигонуклеотиды, специфические для гена матрикса вируса гриппа (МА) и/или гена НА. Продукт амплификации может быть также секвенирован для определения, имеет ли этот продукт последовательность вируса гриппа данного изобретения. Другие анализы на основе нуклеиновых кислот могут быть использованы для детектирования и диагностики вирусной инфекции вирусом этого изобретения, и такие анализы предполагаются в рамках данного изобретения. В одном варианте осуществления, пробу, содержащую нуклеиновую кислоту, подвергают амплификации на основе ПЦР с использованием прямого и обратного праймеров, где эти праймеры являются специфическими в отношении вирусного полинуклеотида или генной последовательности. Если нуклеиновая кислота в этой пробе является РНК, то может выполняться ОТ-ПЦР. Для ПЦР реального времени с этими праймерами используют детектируемый зонд.
Наборы праймеров, специфических для гена гемагглютинина (НА) многих циркулирующих в кровотоке вирусов гриппа, известны и непрерывно развиваются. Геном вируса гриппа представляет собой одноцепочечную РНК, и должна быть получена ДНК-копия (кДНК) с использованием полимеразы, являющейся обратной транскриптазой (RT). Амплификация РНК-генома, например, с использованием ОТ-ПЦР, требует пары олигонуклеотидных праймеров, обычно сконструированных на основе известной последовательности НА подтипов вируса гриппа А и нейраминидазы (NM)-I. Эти праймеры могут быть выбраны таким образом, что они будут специфически амплифицировать РНК только одного подтипа вируса. ДНК, генерированные с использованием подтип-специфических праймеров, могут быть дополнительно анализированы молекулярно-генетическими способами, такими как секвенирование. Этот тест предпочтительно выполняют с положительным контролем или продукты подтверждают секвенированием и сравнением с известными последовательностями. Отсутствие продуктов-мишеней ПЦР (т.е. «негативный (отрицательный) результат»)) может не исключать присутствие этого вируса. Затем результаты могут быть доступны в пределах нескольких часов либо из клинических мазков, либо из инфицированных культур клеток. Тесты ПЦР и ОТ-ПЦР для вируса гриппа А описаны Fouchier et at, 2000 и Maertzdorf et al., 2004.
Представленное изобретение относится также к способам скрининга на соединения или лекарственные средства, которые имеют антивирусную активность против вируса данного изобретения. В одном варианте осуществления, клетки, инфицированные вирусом данного изобретения, контактируют с тест-соединением или лекарственным средством. Затем определяют количество вируса или вирусную активность после контакта. Соединения или лекарственные средства, которые обнаруживают антивирусную активность, могут быть отобраны для дополнительного оценивания.
Представленное изобретение относится также к выделенным клеткам, инфицированным вирусом гриппа данного изобретения. В одном варианте осуществления, этими клетками являются клетки животного из семейства собачьих, например, эпителиальные клетки почки животного из семейства собачьих.
Представленное изобретение относится также к клеткам, трансформированным полинуклеотидом данного изобретения, кодирующим полипептид этого изобретения. Предпочтительно, эта полинуклеотидная последовательность обеспечена в экспрессионной конструкции этого изобретения. Более предпочтительно, эта экспрессионная конструкция обеспечивает сверхэкспрессию в клетке функционально связанного полинуклеотида этого изобретения. В одном варианте осуществления, эта клетка трансформирована полинуклеотидной последовательностью, содержащей последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или ее функциональный фрагмент или вариант. В конкретном варианте осуществления, эта клетка трансформирована полинуклеотидом, кодирующим аминокислотную последовательность, показанную в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, и содержит нуклеотидную последовательность, показанную в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, соответственно, или последовательность, кодирующую функциональный фрагмент или вариант любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78. Таким образом, представленное изобретение относится к клеткам, трансформированным полинуклеотидной последовательностью, содержащей нуклеотидную последовательность, показанную в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, или фрагмент или вариант, в том числе вырожденный вариант, любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77.
Эта трансформированная клетка может быть эукариотической клеткой, например, клеткой растения, в том числе протопластом, или эта трансформированная клетка может быть прокариотической клеткой, например, бактериальной клеткой, такой как E.coli или B.subtilis. Клетки животных включают в себя клетки человека, клетки млекопитающих, в частности, клетки собачьих, клетки птиц и клетки насекомых. Клетки растений включают в себя, но не ограничиваются ими, клетки двудольных, однодольных и хвойных растений.
Представленное изобретение относится также к растениям, в том числе трансгенным растениям, которые экспрессируют и продуцируют вирусный белок или полипептид данного изобретения. Данным изобретением рассматриваются растения, ткани растений и клетки растений, трансформированные или выведенные таким образом, что они содержат полинуклеотид этого изобретения. Предпочтительно, полинуклеотид этого изобретения сверхэкспрессируется в этом растении, в ткани растения или клетке растения. Растения могут быть использованы для получения вакцинных композиций данного изобретения и эти вакцины могут вводиться через потребление этого растения (см., например, Патенты США с номерами 5484719 и 6136320).
Представленное для рассмотрения изобретение относится также к наборам для детектирования вируса или диагностики инфицирования вирусом данного изобретения. В одном варианте осуществления, набор содержит антитело этого изобретения, которое специфически связывается с вирусом гриппа данного изобретения или его антигенной частью. В другом варианте осуществления, набор содержит один или несколько полипептидов или пептидов данного изобретения. В конкретном варианте осуществления, эти полипептиды имеют аминокислотную последовательность, показанную в любой из SEQ ID NO. 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или ее функциональный и/или иммуногенный фрагмент или вариант. В дополнительном варианте осуществления, набор содержит один или несколько полинуклеотидов или олигонуклеотидов данного изобретения. В конкретном варианте осуществления, эти полинуклеотиды имеют нуклеотидную последовательность, показанную в любой из SEQ ID NO. 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, или ее фрагмент или вариант. Набор может необязательно содержать одно или несколько контрольных антител, контрольных полипептидов или пептидов и/или контрольных полинуклеотидов или олигонуклеотидов. Антитело, полипептиды, пептиды, полинуклеотиды и/или олигонуклеотиды этого набора могут быть обеспечены в подходящем контейнере или подходящей упаковке.
Представленная заявка относится также к применению нечистопородных собак (дворняжек) в качестве модели для инфекции и патогенеза вируса гриппа. В одном варианте осуществления, нечистопородную собаку инокулируют вирусом гриппа, таким как вирус гриппа собачьих данного изобретения. Необязательно, этой собаке могут быть введены терапевтические агенты после инокуляции. Этой собаке может быть также введена композиция для генерирования иммунного ответа против вируса гриппа перед инокуляцией вирусом. Ткань, кровь, сыворотка и другие пробы могут быть получены до и/или после инокуляции и испытаны на присутствие вируса и патогенез ткани с использованием способов, известных в этой области, включающих в себя, но не ограничивающихся ими, ПЦР, ОТ-ПЦР, секвенирование нуклеиновых кислот и иммуногистохимию.
Штаммы вируса гриппа собачьих (обозначенные как “A/canine/Florida/43/2004” и “A/canine/Florida/242/2003”) были депонированы Американской Коллекцией Типовых Культур (ATCC), P.O. Box 1549, Manassas, VA 20108, 9 октября 2006 года. Штаммы вируса гриппа собачьих (обозначенные как “canine/Jax/05” и “canine/Miami/05”), были депонированы Американской Коллекцией Типовых Культур (ATCC), P.O. Box 1549, Manassas, VA 20108, 17 октября 2006 года. Представленные вирусные штаммы были депонированы при условиях, которые гарантируют, что доступ к этим культурам будет предоставлен во время нахождения на рассмотрении этой заявки на патент лицу, определенному Комиссаром по патентам и товарным знакам, которому дано право на это согласно 37 CFR 1.14 и 35 U.S.C. 122. Этот депозит будет доступным, как это требуется иностранными законами о патентах в странах, в которых регистрируются копии представленной заявки или ее продолжения. Однако, должно быть понятно, что доступность депозита не дает лицензии для применения на практике представленного на рассмотрение изобретения, умаляющего патентные права, предоставленные решением правительства.
Кроме того, предоставленные депозиты вируса будут храниться и будут доступными для общественности в соответствии с условиями Будапештского Договора по депонированию микроорганизмов, т.е. они будут храниться со всеми предосторожностями, необходимыми для сохранения их жизнеспособными и незагрязненными в течение периода по меньшей мере пяти лет после самого недавнего требования предоставления пробы депозита, и в любом случае, в течение периода по меньшей мере тридцати (30) лет после даты депонирования или в течение обеспеченного правовой санкцией срока действия любого патента, которая может оспорить раскрытие этой культуры. Депонент признает обязанность замены депозита, если депозитарий не способен предоставить затребованную пробу вследствие состояния депозита. Все ограничения в отношении доступности для общественности предоставленного депозита культуры будут безоговорочно устранены после выдачи патента, раскрывающего его.
Таблица 57 иллюстрирует сходства среди аминокислотных последовательностей, кодируемых генами гемагглютинина (или “HA”), нейраминидазы (или “NA”) и нуклеопротеина (NP) вируса гриппа собачьих, идентифицированного как A/canine/Florida/43/2004 (Ca/Fla/43/04), с изолятами H3N8 лошадиных, а также с изолятом canine/Florida/242/2003.
Любой элемент любого раскрытого здесь варианта осуществления может комбинироваться с любым другим элементом или вариантом осуществления, раскрытым здесь, и особо предполагается, что такие комбинации находятся в объеме данного изобретения.
Все патенты, заявки на патенты и публикации, на которые делаются ссылки и которые цитируются здесь, включены в качестве ссылки в их полном объеме, в том числе все фигуры и таблицы, до той степени, пока они не являются несовместимыми с точными утверждениями этой заявки.
МАТЕРИАЛЫ И СПОСОБЫ ДЛЯ ПРИМЕРОВ 1-6
Сбор крови и мазков из носа из борзых
Пробы крови в острой фазе и в фазе выздоровления собирали венопункцией яремной вены из клинически больных или здоровых борзых в собачьих питомниках (псарнях) для собачьих бегов, в которых происходили вспышки респираторного заболевания. Пробы в фазе выздоровления собирали спустя 4-12 недель после сбора проб острой фазы. Сыворотку собирали и хранили при -80°C. Мазки из носа собирали и помещали в среду Amies с углем для транспортировки (Becton Dickinson Biosciences) в ожидании предоставления для выделения бактерий.
Посмертное исследование борзых (аутопсия)
Полные посмертные (патологоанатомические) исследования выполнялись Anatomic Pathology Service at the University of Florida College of Veterinary Medicine (UF CVM) на 5 из 8 борзых, которые умерли во время вспышки в январе 2004 года в треке (дорожке для собачьих бегов) во Флориде. Посмертное исследование другой собаки выполняли в частной ветеринарной клинике с предоставлением тканей в UF CVM для гистопатологической диагностики. Ткани фиксировали в 10% нейтрально забуференном формалине, заливали в парафин и срезы 5 мкм либо окрашивали гематоксилином и эозином для гистопатологической диагностики, либо обрабатывали для иммуногистохимии, как описано ниже. Нефиксированные ткани предоставляли для бактериальной культуры и также хранили при - 80°C.
Серологические тесты на собачьи вирусные респираторные патогены
Парные пробы острой фазы и фазы выздоровления предоставляли в Animal Health Diagnostic Laboratory (AHDL) at the Cornell University College of Veterinary Medicine для анализов нейтрализации сыворотки против вируса чумы собачьих, аденовируса типа 2 и вируса парагриппа. Титры антител выражали в виде последнего разведения сыворотки, которое ингибировало вирусную инфекцию клеточных культур. Сероконверсия, определяемая как ≥4-кратное увеличение титра антител между пробами острой фазы и фазы выздоровления, указывала на вирусную инфекцию. Не были детектированы сероконверсии в отношении этих вирусных патогенов.
Микробные тесты на бактериальные респираторные патогены собачьих
Парные пробы мазков и посмертных тканей предоставляли в Diagnostic Clinical Microbiology/Parasitology/Serology Service at the UF CVM для выделения бактерий и идентификации. Эти пробы культивировали на неселективных средах, а также на средах, селективных в отношении видов Bordetella (Regan-Lowe; Remel) и видов Mycoplasma (Remel). Все культуры выдерживали в течение 21 дня перед сообщением об отсутствии роста. Мазки из носа некоторых из этих борзых также предоставляли в Department of Diagnostic Medicine/Pathobiology at the Kansas State University College of Veterinary Medicine для бактериальной культуры. Из 70 клинически больных испытанных собак, Bordetella bronchiseptica выделяли из полости носа 1 собаки, в то время как Mycoplasma spp. выделяли из полости носа 33 собак. Pasteurella multocida обычно выделяли из полости носа собак с гнойными назальными выделениями. Две из этих собак, которые умерли во время вспышки в январе 2004 года, имели ограниченный рост Escherichia coli в легких после смерти, одна собака имела ограниченный рост E.coli и Streptococcus canis, и другая имела ограниченный рост Pseudomonas aeruginosa и дрожжей. Ни Bordetella bronchiseptica, ни Mycoplasma не были выделены из трахеи или легких собак, которые умерли.
Выделение вируса из посмертных тканей
Замороженные ткани оттаивали и гомогенизировали в 10 объемах минимальной поддерживающей среды (MEM), дополненной 0,5% бычьим сывороточным альбумином (BSA) и антибиотиками. Твердые остатки клеток удаляли центрифугированием и супернатанты инокулировали на культивируемые клетки или в 10-дневные куриные яйца с развивающимися эмбрионами. Гомогенаты тканей из борзых, которые умерли, инокулировали в различные культуры клеток, которые поддерживали репликацию большого диапазона вирусных патогенов. Эти культуры клеток включали в себя клетки Vero (эпителиальные клетки почек Африканской зеленой мартышки, ATCC No. CCL-81), A-72 (фибробласты опухоли собачьих, CRL-1542), HRT-18 (эпителиальные ректальные клетки человека, CRL-11663), MDCK (эпителиальные клетки почек собачьих, CCL-34), первичные эпителиальные клетки почек собачьих (AHDL, Cornell University), первичные эпителиальные клетки легких собачьих (AHDL) и первичные тестикулярные бычьи клетки (AHDL). Клетки MDCK и HRT культивировали в МЕМ, дополненной 2,5 мкг/мл TPCK-обработанного трипсина (Sigma); остальные линии клеток культивировали в MEM, дополненной 10% фетальной телячьей сывороткой и антибиотиками. Клетки выращивали в колбах 25 см2 при 37°C в увлажненной атмосфере, содержащей 5% CO2. Контрольную культуру инокулировали с использованием дополненной МЕМ. Эти культуры наблюдали каждый день в отношении морфологических изменений и собирали при 5 днях после инокуляции. Собранные жидкости и клетки осветляли центрифугированием и инокулировали на свежие клетки, как описано для начальной инокуляции; выполняли два слепых пассажа. Активность гемагглютинации в осветленных супернатантах определяли с использованием куриных или индюшачьих эритроцитов, как описано (Burleson et al, 1992; Kendal et al, 1982). Для выделения вируса в куриных эмбрионах 0,1 мл гомогената ткани инокулировали в аллантоис и инкубировали в течение 48 часов при 35°C. После двух слепых пассажей активность гемагглютинации в аллантоисных жидкостях определяли, как описано (Burleson et al, 1992; Kendal et al, 1982).
ОТ-ПЦР, секвенирование нуклеотидов и филогенетические анализы
Тотальную РНК экстрагировали из супернатанта культуры ткани или аллантоисной жидкости с использованием набора RNeasy (Qiagen, Valencia, CA) в соответствии с инструкциями изготовителя. Тотальную РНК (10 нг) обратно-транскрибировали в кДНК с использованием набора для одностадийной ОТ-ПЦР (Qiagen, Valencia, CA) в соответствии с инструкциями изготовителя. ПЦР-амплификацию кодирующего района 8 генов вирусов гриппа в кДНК выполняли, как описано ранее (Klimov et al, 1992a), с использованием универсальных наборов геноспецифических праймеров. Эти полученные ДНК-ампликоны использовали в качестве матриц для автоматизированного секвенирования на автоматизированном синтезаторе Applied Biosystems 3100 с использованием химического способа циклического секвенирования с применением красителя в качестве терминатора (ABI). Нуклеотидные последовательности анализировали с использованием пакета программ GCG Package®, Version 10.0 (Accelyrs) (Womble, 2000). Пакет программ Phylogeny Inference Package Version 3.5 использовали для оценки филогений и расчета величин bootstrap из этих нуклеотидных последовательностей (Felsenstein, 1989). Филогенетические древа сравнивали с филогенетическими древами, полученными анализом присоединения соседей (способа построения филогенетического древа на основе принципа минимальной эволюции) с использованием модели Tamura-Nei gamma, воплощенной в программе MEGA® (Kumar et al, 2004), и подтверждали с использованием программы PAUP® 4.0 Beta (Sinauer Associates).
Экспериментальная инокуляция собак
Использовали четыре 6-месячных не содержащих специфических патогенов биглей (коротконогих гончих собак) [(2 самцов и 2 самок (Liberty Research)]. Физическое обследование и фоновые тесты крови, в том числе клинический анализ крови/определение лейкоцитарной формулы, панель химии сыворотки и анализ мочи определили, что эти животные были здоровыми. Их содержали вместе в BSL 2-усиленном оборудовании, предоставленном Association for Assessment and Accreditation of Laboratory Animal Care. Фоновые ректальные температуры регистрировали два раза в день в течение 7 дней. Собак анестезировали внутривенной инъекцией пропофола (Diprivan®, Zeneca Pharmaceuticals, 0,4 мг/кг массы тела для получения эффекта) для интубации эндотрахеальными трубками. Каждую собаку инокулировали общей дозой 106,6 средних инфицирующих культуру ткани доз (TCID50) вируса A/Canine/Florida/43/2004 (Canine/FL/04) (H3N8), причем половину этой дозы вводили в дистальную часть трахеи через эндотрахеальную трубку, а другую половину вводили в глубокий носовой ход через катетер. Физические обследования и регистрации ректальной температуры выполняли два раза в день в течение 14 дней после инокуляции (p.i.). Пробы крови (4 мл) собирали венопункцией яремной вены в дни 0, 3, 5, 7, 10 и 14 p.i. Образцы из носа и носоглотки собирали тампоном из полиэфирного волокна (Fisher Scientific) из каждой собаки в дни 0-5, 7, 10 и 14 p.i. Эти мазки помещали в среду для транспортировки вирусов medium (Remel) и хранили при -80°С. Двух собак (1 самца и 1 самку) эвтанизировали внутривенной инокуляцией раствора Beuthanasia-D® (1 мл/5 кг массы тела; Schering-Plough Animal Health Corp) в день 5 p.i. и остальных 2 собак в день 14 для посмертного обследования. Ткани для гистологического анализа обрабатывали, как описано. Ткани для культуры вируса хранили при -80°C. Это исследование было одобрено University of Florida Institutional Animal Care and Use Committee.
Выделение вируса хозяином из экспериментально инокулированных животных
Серийные разведения гомогенатов легких и экстрактов мазков, полученные осветлением сред для транспортировки мазков центрифугированием, помещали в MEM, дополненную 0,5% БСА и антибиотиками. Анализы бляшек выполняли, как описано (Burleson et al, 1992) с использованием монослоев клеток MDCK в 6-луночных чашках для культуры ткани. На монослои инокулированных клеток наслаивали дополненную МЕМ, содержащую 0,8% агарозу и 1,5 мкг/мл TPCK-трипсина. Клетки культивировали в течение 72 часов при 37°С в увлажненной атмосфере, содержащей 5% CO2, перед фиксацией и окрашиванием кристаллическим фиолетовым красителем. Концентрацию вируса выражали в виде бляшкообразующих единиц (БОЕ) на грамм ткани или на мазок.
Иммуногистохимия
Депарафинированные и повторно гидратированные срезы 5 мкм ткани легких из борзых и биглей наносили в виде препаратов на предметные стекла Bond-Rite™ (Richard-Allan Scientific, Kalamazoo, MI) и затем обрабатывали протеиназой К (DakoCytomation, Carpenteria, CA) и затем блокирующим пероксидазу реагентом (Dako® EnVision™ Peroxidase Kit, Dako Corp.). Эти срезы инкубировали с разведениями 1:500 моноклональных антител к вирусу чумы собачьих (VMRD, Inc.), аденовирусу типа 2 собачьих (VMRD, Inc.), вирусу парагриппа собачьих (VMRD, Inc.) или вирусу гриппа A H3 (Chemicon International, Inc.) в течение 2 часов при комнатной температуре. Контроли включали в себя инкубирование тех же самых срезов с мышиным IgG (1 мг/мл, Serotec, Inc.) и инкубирование этих моноклональных антител со срезами легких здоровых собачьих. После обработки первичными антителами эти срезы инкубировали с реагентами вторичной иммунопероксидазой и субстратом пероксидазы (Dako® EnVision™ Peroxidase Kit, Dako Corp.) в соответствии с инструкциями изготовителя. Эти срезы контрастно окрашивали гематоксилином, обрабатывали Clarifier #2 и Bluing Reagent (Richard-Allan Scientific, Kalamazoo, MI), дегидратировали и покровные стекла помещали с использованием пермаунта (ProSciTech).
Анализ ингибирования гемагглютинации (HI)
Пробы сыворотки инкубировали с разрушающим рецептор ферментом (RDE, Denka) (1 часть сыворотки: 3 части RDE) в течение 16 часов при 37°C перед инактивацией нагреванием в течение 60 минут при 56°C. Вирус A/Canine/FL/04 (H3N8) выращивали в клетках MDCK в течение 36-48 часов при 37°C. Супернатанты культур вирусов собирали, осветляли центрифугированием и хранили при -80°C. Анализ HI выполняли, как описано ранее (Kendal et al, 1982). Вкратце, 4 единицы гемагглютинации вируса в 25 мкл добавляли к равному объему серийно разведенной сыворотки в микротитрационных лунках и инкубировали при комнатной температуре в течение 30 минут. Добавляли равный объем 0,5% об./об. эритроцитов индейки и титры гемагглютинации определяли приближенно визуально после 30 минут. Конечный титр HI определяли как последнее разведение сыворотки, которое полностью ингибировало гемагглютинацию. Сероконверсию определяли как ≥ 4-кратное увеличение титра между парными пробами острой фазы и фазы выздоровления. Серопозитивную реакцию отдельной пробы определяли как титр HI-антитела ≥1:32.
Анализ микронейтрализации (MN)
Реакции нейтрализующих антител сыворотки на вирус A/Canine/FL/04 (H3N8) детектировали анализом MN, как описано ранее (Rowe et al, 1999), за исключением того, что сыворотки собачьих обрабатывали RDE, как описано выше, перед этим анализом. Конечный титр определяли как наивысшее разведение сыворотки, которое давало 50% нейтрализацию 100 TCID5O вируса. Сероконверсию определяли как ≥4-кратное увеличение титра MN между парными пробами острой фазы и фазы выздоровления. Серопозитивную реакцию отдельной пробы определяли как титр MN ≥1:80.
Далее описаны примеры, которые иллюстрируют процедуры для применения на практике этого изобретения. Эти примеры не должны рассматриваться как ограничивающие это изобретение. Все проценты являются % масс., а все соотношения смесей растворителей являются объемными, если нет других указаний.
ПРИМЕР 1
В январе 2004 года произошла вспышка респираторного заболевания в 22 гончих борзых, содержащихся в 2 псарнях при треке (дорожке для собачьих бегов) во Флориде и местной ферме, которая поставляла собак в эти псарни. В каждом здании псарни содержались приблизительно 60 собак и 300 собак имелись на ферме. Эта вспышка произошла на протяжении 6-дневного периода, после которого не были обнаружены новые случаи. Четырнадцать из 22 собак имели повышения температуры до 39,5-41,5°C, легкий кашель с рвотными движениями в течение 10-14 дней и в конечном счете выздоровление. Из остальных 8 собак 6 визуально здоровых собак умерли неожиданно с кровоточением изо рта и из носа. Двух остальных собак эвтаназировали в пределах 24 часов от появления кровотечения изо рта и из носа из-за быстрого ухудшения. Обе эти собаки имели температуру 41°C. Четыре смерти из 8 смертей произошли в зданиях псарни и 4 произошли на ферме. Пятьдесят процентов смертей произошли на 3-ий день вспышки инфекции (эпидемии). 22 собаки имели диапазон возраста от 17 месяцев до 4 лет, но 73% имели возраст 17 месяцев - 33 месяца.
Были очевидными два клинических синдрома: более легкое заболевание, отличающееся начальной лихорадкой и затем кашлем в течение 10-14 дней (14 собак) с последующим выздоровлением, или молниеносная смерть, связанная с кровотечением в дыхательных путях (8 собак с коэффициентом смертности 36%). Патологоанатомические исследования выполняли в 6 из 8 смертельных случаев. Все собаки имели обширное кровотечение в легких, средостении и плевральной полости. Гистологическое исследование дыхательных путей выявило, что, наряду с легочным кровотечением, все собаки имели трахеит, бронхит, бронхиолит и гнойную бронхопневмонию (фиг.3). Эпителиальная выстилка и дыхательные просветы в этих тканях были инфильтрированы нейтрофилами и макрофагами. Гомогенаты легких, полученные из этих собак, инокулировали в различные линии клеток обезьяны, человека, коровьих и собачьих для получения культуры вируса. Гомогенат легких из одной собаки вызывал цитопатические (показывающие поражение клеток) эффекты в эпителиальных клетках почек собак Madin-Darby (MDCK), культивированных в присутствии трипсина, и агглютинированных куриных эритроцитах супернатанта культуры клеток. Предварительное доказательство вируса гриппа типа А было получено коммерческим ELISA для детектирования нуклеопротеина вирусов гриппа А и В и анализом ПЦР с использованием праймеров, специфических для гена матрикса вирусов гриппа А. Кроме того, гемагглютинирующая активность ингибировалась ссылочными антисыворотками к подтипу Н3 лошадиного гриппа А, но не антисыворотками, специфическими в отношении подтипов H1-H11 и Н113 гриппа А человека (таблица 3). Для характеристики молекулярных свойств этого вируса авторы изобретения определяли нуклеотидные последовательности 8 РНК-сегментов этого вирусного генома. Сравнения последовательностей с известными генами вирусов гриппа и филогенетические анализы показали, что 8 генов изолята собачьих были наиболее сходными с генами из современных вирусов лошадиного гриппа А (H3N8), с которыми они имели ≥96-97% идентичность последовательности (фиг.1А, таблица 4). В отличие от этого, репрезентативные гены из изолятов гриппа А птиц, свиней и человека имели ≤94% идентичность с этим изолятом собачьих (таблица 4). Эти данные идентифицировали собачий изолят A/Canine/Florida/43/2004 (Canine/FL/04) как вирус H3N8 гриппа А, близкородственный современным линиям дифференцировки лошадиных вирусов гриппа. Поскольку все гены собачьего изолята происходили из вируса лошадиного гриппа, авторы изобретения сделали вывод, что весь геном вируса гриппа лошадиных был перенесен в собаку.
ПРИМЕР 2
Для исследования роли вируса Canine/FL/04 в клинических и патологических наблюдениях в борзых авторы изобретения выполняли иммуногистохимическое окрашивание (IHC) на тканях легких с использованием моноклонального антитела к Н3 вируса А. Вирусный антиген Н3 стойко детектировался в цитоплазме бронхиальных и бронхиолярных эпителиальных клеток, эпителиальных клетках бронхиальной железы и макрофагах в просветах дыхательных путей и альвеолярных пространствах (фиг.2А). Эти данные подтверждают диагноз легочной инфекции вирусом гриппа подтипа Н3 во множественных собаках.
ПРИМЕР 3
Для определения участия Canine/FL/04-подобного вируса в этиологии вспышки респираторного заболевания авторы изобретения анализировали парные сыворотки острой фазы и фазы выздоровления из 11 больных собак и 16 бессимптомных собак, подвергшихся действию этого вируса, анализами гемагглютинации (HI) и микронейтрализации (MN). Сероконверсия, определяемая как ≥4-кратное увеличение титра антител к Canine/FL/04 от острой фазы к фазе выздоровления, имела место в 8 из 11 (73%) больных собак в обоих анализах (таблица 1). Сероконверсия имела место в 6 из 16 (38%) бессимптомных находящихся в контакте собаках в анализе HI, тогда как 8 из 16 (50%) обнаруживали сероконверсию в анализе MN (таблица 1). Эти результаты сероконверсии продемонстрировали инфекцию собак Canine/FL/04-подобным вирусом, которая совпадала во времени с появлением респираторного заболевания в большинстве животных.
Единственные пробы сывороток собирали спустя 3 месяца после вспышки из дополнительных 46 бессимптомных собак, содержащихся с больными собаками. Из них 43 (93%) были серопозитивными в обоих анализах, в том числе 82% (9/11) больных собак и 95% (59/62) здоровых находящихся в контакте собак. Это высокое доминирование серотипа в собаках без истории респираторного заболевания показывает, что большинство инфекций вирусом гриппа собачьих являются субклиническими и предполагают эффективное распространение этого вируса среди собак. Известно, что субклинические инфекции способствуют распространению вируса.
ПРИМЕР 4
Для лучшего понимания способности вируса Canine/FL/04 инфицировать собак, четырех 6-месячных биглей племенного назначения инокулировали, каждую, 106,6 срединных (медиан) инфекционных доз в тканевой культуре (инфекционных единиц) (TCID50) интратрахеальным и интраназальным способами. Все собаки развивали лихорадку (ректальная температура ≥39°С) в течение первых 2 дней после инокуляции (p.i.), но ни одна не обнаруживала респираторных симптомов, таких как кашель или выделения из носа на протяжении 14-дневного периода времени. Выделение вируса в окружающую среду исследовали количественным определением вируса в мазках из носа и ротоглоточных мазках. Только 2 из 4 собак выделяли детектируемые количества вируса. Одна собака выделяла вирус в дни 1 и 2 p.i. (1,0-2,5 log10 БОЕ на мазок), тогда как другая собака выделяла вирус в течение 4 последовательных дней после инокуляции (1,4-4,5 log10 БОЕ на мазок). Патологоанатомическое исследование 2 собак в день 5 p.i. выявило некротизирующий и гиперпластический трахеит, бронхит и бронхиолит, сходные с трахеитом, бронхитом и бронхиолитом, обнаруживаемыми в спонтанном заболевании в борзых, но отсутствовали легочное кровотечение или бронхопневмония. Вирусный антиген Н3 детектировали в цитоплазме эпителиальных клеток бронхов, бронхиол и бронхиальных желез с использованием IHC (фиг.2B). Инфекционный вирус извлекали из легочной ткани одной из этих собак. Патологоанатомическое исследование остальных 2 собак в день 14 p.i. показало минимальные гистологические изменения в респираторных тканях, отсутствие вирусного антигена согласно IHC и отсутствие выделения вируса из гомогенатов легких. Сероконверсию в этих последних 2 собаках детектировали в анализах MN в день 7 p.i., с дополнительным 2-3-кратным увеличением титров антител в день 14. Эти результаты установили чувствительность собак к инфекции Canine/FL/04, что доказывалось лихорадочной реакцией, присутствием вирусного антигена и инфекционного вируса в паренхиме легких, гистопатологическими явлениями, типичными для гриппа, и сероконверсией. Отсутствие успеха в воспроизведении тяжелого заболевания и смерти в экспериментально инокулированных биглях не являются удивительными, так как большая доля природно инфицированных борзых была бессимптомной.
ПРИМЕР 5
Для исследования, циркулировал ли Canine/FL/04-подобный вирус гриппа среди популяций борзых во Флориде до вспышки (эпидемии) января 2004 года, архивные сыворотки из 65 гончих борзых испытывали на присутствие антител к Canine/FL/04 с использованием анализов HI и MN. Детектируемых антител не было в 33 собаках, у которых брали пробы, с 1996 по 1999 гг. Из 32 собак, у которых брали пробы в 2000-2003 годах, 9 были серопозитивными в обоих анализах: 1 в 2000 году, 2 в 2002 году и 6 в 2003 году (таблица 5). Серопозитивные собаки были обнаружены в дорожках для бегов (треках) во Флориде, при вспышках респираторного заболевания неизвестной этиологии в 1999-2003 годах, что позволяет предположить, что Canine/FL/04-подобный вирус может быть этиологическим фактором этих вспышек заболевания. Для дополнительного исследования этой возможности авторы изобретения испытывали архивные ткани из борзых, которые умерли от геморрагической бронхопневмонии в марте 2003 года. Гомогенаты легких из одной собаки, инокулированные в клетки MDCK и куриные эмбрионы, давали вирус гриппа H3N8, названный A/Canine/Florida/242/2003 (Canine/FL/03). Анализ последовательности полного генома Canine/FL/03 выявил >99% идентичность с Canine/FL/04 (таблица 4), что указывает на то, что Canine/FL/04-подобные вирусы инфицировали борзых и до 2004 года.
ПРИМЕР 6
С июня по август 2004 года, вспышки респираторного заболевания имели место в тысячах гончих борзых в 14 треках (дорожках для бегов) во Флориде, Техасе, Алабаме, Арканзасе, Западной Вирджинии и Канзасе.
Должностные лица при некоторых из этих треков определили приближенно, что по меньшей мере 80% их популяции собак имели клиническое заболевание. Большинство из этих собак имели клинические симптомы лихорадки (≥39°С) и кашель, сходные с симптомами собак в эпидемии в январе 2004 года, но многие собаки имели также слизисто-гнойное выделение из полости носа. Сообщались множественные смерти, но точный коэффициент смертности не мог быть определен.
Авторы данного изобретения собирали парные сыворотки острой фазы и фазы выздоровления из 94 собак, находящихся в 4 треках во Флориде: 56% из этих собак имели ≥4-кратные увеличения титров антител к Canine/FL/04 и 100% были серопозитивными (таблица 6). Сыворотки фазы выздоровления из 29 собак в Западной Вирджинии и Канзасе также имели антитела к Canine/FL/04. Авторы изобретения выделили вирус гриппа А (H3N8) из легких борзой, которая умерла от геморрагической бронхопневмонии в треке в Техасе. Анализ последовательности полного генома этого изолята, названного A/Canine/Texas/1/2004 (Canine/TX/04), выявил ≥99% идентичность Canine/FL/04 (таблица 4). Выделение трех близкородственных вирусов гриппа из смертельных случаев собачьих на протяжении 13-месяного периода времени и из разных географических местоположений, вместе с существенным серологическим доказательством широко распространенной инфекции среди участвующих в бегах борзых, предполагало поддерживаемую циркуляцию Canine/FL/04-подобного вируса в популяции собак.
Филогенетический анализ генов НА Canine/FL/03, Canine/FL/04 и Canine/TX/04 показал, что они состоят из монофилетической (моноцентрической) группы с мощной (устойчивой) bootstrap-поддержкой, которая явно отличается от современных генов Н3 вирусов лошадиных, выделенных в 2002 году и 2003 году (фигура 1В). Филогенетические анализы и парные сравнения нуклеотидных последовательностей других 7 геномных сегментов, поддержали сегрегацию генов собачьих в виде отличающейся сублинии дифференцировки, наиболее близкородственной линии дифференцировки вируса лошадиных (данные не показаны, и таблица 4). Образование кластеров генов гриппа собачьих в виде монофилетической группы, отдельной от вируса лошадиных, также подтверждается присутствием 4-сигнатурных аминокислотных изменений в НА (таблица 2). Вместе с серологическими результатами из 2003 года и 2004 года, эти данные согласуются с единственным событием передачи вируса от лошадей к собакам с последующим «горизонтальным» распространением этого вируса в популяции борзых. Однако повторяемые введения этой уникальной линии дифференцировки вируса гриппа из неидентифицированных вирусов-резервуаров формально не могут быть исключены, как это ни кажется невероятным.
Вирусный НА является критической детерминантой специфичности вида-хозяина вируса гриппа (Suzuki et al, 2000). Для идентификации остатков в НА, которые могут быть ассоциированы с адаптацией в хозяине-собачьем, авторы данного изобретения сравнивали расшифрованную аминокислотную последовательность НА собачьих с НА современных вирусов лошадиных. Четыре аминокислотных изменения дифференцируют зрелые консенсусные аминокислотные последовательности НА лошадиных и собачьих: N83S, W222L, I328T и N483T (см. таблицу 2). Вирусы собачьих имеют делецию аминокислоты в сравнении с консенсусом лошадиных. Таким образом, положение аминокислоты 7 в последовательности НА лошадиных является положением 6 в последовательности НА собачьих, положение аминокислоты 29 в последовательности НА лошадиных является положением 28 в последовательности НА собачьих, положение 83 является положением в последовательности НА лошадиных является положением 82 в последовательности НА собачьих, и т.д. Таким образом, эти четыре замененные аминокислоты находятся в положениях 82, 221, 327 и 482 аминокислотной последовательности, показанной в SEQ ID NO: 33 и SEQ ID NO: 34. Замена серином аспарагина в положении 83 консенсусной последовательности является изменением неизвестного функционального значения, так как разные полярные остатки обнаружены в молекулах Н3 из других видов. Строго сохраняемый изолейцин в положении 328 консенсусной последовательности вблизи сайта расщепления НА Н3, был заменен треонином. Центральная роль расщепления НА протеазами хозяина в патогенезе предполагает, что это изменение заслуживает дополнительного исследования. Замена лейцином триптофана в положении 222 консенсусной последовательности является важным, так как оно представляет собой неконсервативное изменение, смежное с карманом связывания сиаловых кислот, которое могло бы модулировать рецепторную функцию (Weis et al, 1988). Интересно, что лейцин в положении 222 не является уникальным для НА Н3 собачьих, так как он обычно обнаруживается в подтипах Н4, Н8, Н9 и Н12 НА (Nobusawa et al, 1991; Kovacova et al, 2002). Эта замена лейцином может быть более совместимой со специфичностью вируса в отношении хозяев-млекопитающих, так как сообщались инфекции свиней подтипом Н4 (Karasin et al, 2000) и людей и свиней подтипом H9 (Peiris et al, 1999) вирусов. Замена аспарагина треонином в положении 483 консенсусной последовательности приводила к потере сайта гликозилирования в субъединице НА2, которая является консервативной во всех подтипах НА (Wagner et al, 2002). Хотя важность этих аминокислотных изменений в НА для адаптации вируса лошадиных к собакам еще должна быть определена, сходные аминокислотные изменения наблюдали ранее в связи с межвидовым переносом (Vines et al, 1998; Matrosovich et al, 2000). Аминокислотные различия между другими вирусными белками гриппа этого изобретения и консенсусной последовательностью лошадиных показаны в таблицах 19-25.
Источник вируса гриппа лошадиных, который первоначально инфицировал гончих борзых, остается спекулятивным. Псарни при треках (дорожках для бегов) не расположены вблизи от ипподромов (дорожек для скачек), что предполагает, что контакт между борзыми и выделяющими вирус лошадьми не является достаточным объяснением для многочисленных вспышек инфекции в различных штатах в 2004 году. Потенциальным источником подвергания действию вируса лошадиных является кормление лошадиным мясом борзых, рацион которых дополняют сырым мясом, поставляемым мясоперерабатывающими предприятиями, которые перерабатывают туши, в том числе лошадей, которые могут нести вирус гриппа. Прецеденты этого способа инфицирования включают в себя сообщения о межвидовой передачи вируса птичьего гриппа H5N1 свиньям и кошачьим в зоопарках, которых кормят тушками кур (Webster, 1998; Keawcharoen et al, 2004; Kuiken et al, 2004). Хотя этот способ является вероятным способом первоначального введения вируса гриппа лошадиных в собак, он не объясняет недавние многочисленные вспышки гриппа в тысячах собаках в различных штатах. Экспериментальное исследование инокуляции этого изобретения показало присутствие вируса в носовых ходах и ротоглотке собак, хотя и в умеренных титрах. Тем не менее, эти результаты показывают, что выделение вируса в окружающую среду является возможным и что передача вируса от собаки к собаке аэрозолями с большими капельками, рвотными массами или прямым контактом слизистых оболочек могли бы играть роль в эпизоотиологии этого заболевания.
Межвидовой перенос целого вируса гриппа млекопитающего в неродственные виды млекопитающих является редким событием. Более ранние исследования обеспечили ограниченное серологическое или вирусологическое доказательство, но не оба вместе, транзиторной инфекции собак вирусами гриппа А человека (H3N2) (Nikitin et al., 1972, Kilbourne, et al, 1975; Chang et al, 1976; Houser et al, 1980). Однако, отсутствует доказательство устойчивой циркуляции в хозяине-собачьем. Хотя прямой перенос вирусов гриппа свиней из свиньи в человека хорошо документирован (Dacso et al, 1984; Kimura et al, 1998; Patriarca et al, 1984; Top et al, 1977), отсутствует доказательство адаптации вирусов свиней в хозяине-человеке. В этом сообщении авторы данного изобретения обеспечивают вирусологическое, серологическое и молекулярное доказательство межвидового переноса полного вируса гриппа А (H3N8) в другой вид млекопитающего, в собаку. Уникальные аминокислотные замены в НА вируса собачьих, сопряженные с серологическим подтверждением инфекции собак в многочисленных штатах в США, предполагают адаптацию этого вируса к хозяину семейства собачьих. Поскольку собаки являются прежде всего животным-компаньоном для людей, эти открытия имеют последствия для общественного здоровья; собаки могут создавать новый источник для переноса новых вирусов гриппа А людям.
b Количество бессимптомных собак, содержавшихся в контакте с клинически больными собаками.
c Анализ ингибирования агглютинации (HI) с использованием вируса A/Canine/Florida/43/2004.
d Анализ микронейтрализации (MN) с использованием вируса A/Canine/Florida/43/2004.
e Процент собак по меньшей мере с 4-кратным увеличением титра антител в парных сыворотках острой фазы и фазы выздоровления.
f Процент собак с позитивным титром антител (титр HI ≥32: титр MN ≥80) в сыворотках фазы выздоровления.
g Геометрический средний титр антител для сывороток фазы выздоровления.
b Поликлональные антисыворотки получали в хорьках, тогда как все остальные антисыворотки получали в овцах или козах.
Таблица 4
Гомология последовательности генов А/Canine/Florida/43/2004 (H3N8) со штаммами гриппа А лошадиных, птиц, свиньи и человека
a Процентная идентичность нуклеотидной и аминокислотной (в скобках) последовательностей генов Canine/Florida/43/2004 (H3N8) genes с наиболее гомологичным геном изолятов вируса гриппа из видов, с последующими номерами доступа базы данных последовательностей GenBank.
b Не применим: нейраминидаза N8 никогда не сообщалась в вирусах человека или свиньи.
b Титры антител с использованием анализа микронейтрализации для серопозитивных собак, в том числе диапазона для шести серопозитивных собак 2003 года.
b Процент собак с ≥4-кратным увеличением титра антител между сыворотками острой фазы и фазы выздоровления.
с. Процент собак с позитивным титром антител (титр HI >16) в сыворотках фазы выздоровления.
d Геометрический средний титр антител для сывороток фазы выздоровления.
МАТЕРИАЛЫ И СПОСОБЫ ДЛЯ ПРИМЕРОВ 7-11
Ткани собачьих
Патологоанатомические исследования выполнялись Anatomic Pathology Service at the University of Florida College of Veterinary Medicine на 6 собаках смешанных пород, которые умерли в апреле/мае 2005 года во время вспышки гриппа в закрытом сооружении в северо-восточной Флориде, и на домашней собаке Йоркширском терьере, который умер в мае 2005 года во время вспышки гриппа в ветеринарной клинике в юго-восточной Флориде. Ткани фиксировали 10% нейтральным забуференным формалином, заливали в парафин и срезы 5 мкм окрашивали гематоксилином и эозином для гистопатологической диагностики. Нефиксированные ткани хранили при -80°C в ожидании вирусологических анализов.
Экстракция РНК из проб тканей собачьих
Замороженные ткани легких из каждой из 7 собак оттаивали и гомогенизировали в минимальной поддерживающей среде (МЕМ), дополненной 0,5% бычьим сывороточным альбумином (БСА) и антибиотиками (гентамицином и ципрофлоксацином), с использованием доступного гомогенизатора ткани (Kendall, Lifeline Medical Inc., Danbury, CT). Тотальную РНК экстрагировали с использованием коммерческого набора (RNeasy® Mini Kit, QIAGEN Inc., Valencia, CA) в соответствии с инструкциями изготовителя и элюировали в конечном объеме 60 мкл буфера. Тотальную РНК экстрагировали также из ткани легких, собранной из собак без респираторного заболевания.
ОТ-ПЦР реального времени
Одностадийную количественную ОТ-ПЦР реального времени выполняли на тотальной РНК, экстрагированной из проб тканей собачьих, с использованием набора QuantiTect® Probe RT-PCR, содержащего ROX в качестве пассивного ссылочного красителя (QIAGEN Inc., Valencia, CA). Вкратце, 2 набора праймеров-зондов использовали для детектирования последовательностей гриппа А в каждой пробе (таблица 7). Один набор праймеров-зондов был селективным в отношении последовательностей генов гемагглютинина (Н3) собачьих. Другой набор праймеров-зондов был нацелен на высококонсервативный район гена матрикса (М) вируса гриппа типа А. Для каждой реакции ОТ-РЦР реального времени 5 мкл экстрагированной тотальной РНК добавляли в реакционную смесь, содержащую 12,5 мкл 2Х смеси QuantiTech® Probe RT-PCR Master Mix, 0,25 мкл смеси QuantiTech® RT Mix, прямой и обратный праймеры (0,4 мкМ конечная концентрация для каждого), зонд (0,1 мкМ конечная концентрация) и не содержащую РНКаз воду в конечном объеме 25 мкл. Контрольные реагенты рибосомных РНК TaqMan® (Applied Biosystems, Foster City, CA) использовали в соответствии с инструкциями изготовителя для детектирования рРНК 18S в качестве эндогенного внутреннего контроля на присутствие РНК, экстрагированной из проб ткани собачьих.
Количественную одностадийную ОТ-ПЦР реального времени выполняли на реакционных смесях в Mx3000P® QPCR System (Stratagene, La Jolla, CA). Условия проведения циклов включали в себя стадию обратной транскрипции при 50°C в течение 30 минут, начальную стадию денатурации при 95°C в течение 15 минут для активации ДНК-полимеразы HotStarTaq®, и амплификацию в течение 40 циклов. Каждый цикл амплификации включал в себя денатурацию при 94°C в течение 15 секунд с последующим отжигом/удлинением при 60°C в течение 1 минуты. Флуоресцентные сигналы FAM (длина волны испускания 518 нм) и VIC (длина волны испускания 554 нм) регистрировали в конце каждого цикла. Пороговый цикл (Ct) определяли установкой пороговой флуоресценции (dR) при 1000 в каждом отдельном эксперименте. Для получения и анализа данных использовали программу Mx3000P® version 2.0 (Stratagene, La Jolla, CA). Пробы считали позитивными в отношении вируса гриппа А, когда пороговый цикл (Ct) для гена Н3 или М был на 3 единицы меньшим, чем для легочной ткани из собак без респираторного заболевания. Этот позитивный контроль состоял из амплификации РНК, экстрагированной из вируса A/canine/FL/242/03 (H3N8).
Выделение вируса в клетках MDCK
Замороженные ткани легких из каждой из 7 собак оттаивали и гомогенизировали в 10 объемах модифицированной Дульбекко среде Игла, дополненной 0,5% бычьим сывороточным альбумином (БСА) и антибиотиками (гентамицином и ципрофлоксацином). Твердые остатки клеток удаляли центрифугированием и супернатанты инокулировали на клетки почек собачьих Madin-Darby (MDCK), культивируемых в DMEM, дополненной 1 мкг/мл TPCK-обработанного трипсина (Sigma-Aldrich Corp., St. Louis, MO) и антибиотиками (гентамицином и ципрофлоксацином). Клетки росли в колбах на 25 см2 при 37°C в увлажненной атмосфере, содержащей 5% CO2. Культуры наблюдали ежедневно на морфологические изменения и собирали при 5 днях после инокуляции. Собранные культуры осветляли центрифугированием и супернатанты инокулировали на свежие клетки MDCK, как описано для начальной инокуляции; выполняли два дополнительных пассажа для проб, которые не обнаруживали присутствия вируса гриппа посредством гемагглютинации или ОТ-ПЦР. Активность гемагглютинации в осветленных супернатантах определяли с использованием 0,5% индюшачьих эритроцитов, как описано ранее (Burleson et al, 1992; Kendal et al, 1982). ОТ-ПЦР выполняли, как описано ниже.
Выделение вируса в яйцах с развивающимися эмбрионами
Гомогенаты готовили из замороженных тканей легких, как описано выше для инокуляции клеток MDCK. Эти гомогенаты (0,2 мл) инокулировали в аллантоис 10-дневных куриных яиц с развивающимися эмбрионами. После 48 часов инкубации при 35°C, эти яйца охлаждали при 4°C в течение ночи перед сбором аллантоисной жидкости. Активность гемагглютинации в осветленных супернатантах определяли с использованием 0,5% индюшачьих эритроцитов, как описано ранее (Burleson, F. et al, 1992; Kendal, P. et al, 1982). ОТ-РЦР выполняли, как описано ниже. Выполняли два дополнительных пассажа для проб, которые не обнаруживали присутствия вируса гриппа после начальной инокуляции.
ОТ-ПЦР, секвенирование нуклеотидов и филогенетические анализы
Вирусную РНК экстрагировали из супернатанта MDCK или аллантоисной жидкости с использованием мининабора QIAamp® Viral RNA (QIAGEN Inc., Valencia, CA) в соответствии с инструкциями изготовителя. Эту вирусную РНК обратно-транскрибировали в кДНК с использованием набора QIAGEN® OneStep RT-PCR (QIAGEN Inc., Valencia, CA) в соответствии с инструкциями изготовителя. ПЦР-амплификацию кодирующего района из 8 генов вируса гриппа в этой кДНК выполняли, как описано ранее (Klimov, A. et al, 1992b), с использованием универсальных наборов геноспецифических праймеров (последовательностей праймеров, доступных по запросу). Полученные ДНК-ампликоны использовали в качестве матриц для автоматизированного секвенирования в автоматизированном ДНК-секвенаторе ABI PRISM® 3100 с использованием химического способа для циклического секвенирования с использованием красителя в качестве терминатора (Applied Biosystems, Foster City, CA). Нуклеотидные последовательности анализировали с использованием программного обеспечения Lasergene 6 Package® (DNASTAR, Inc., Madison, WI). Программу PHYLIP Version 3.5® использовали для приближенного определения филогений и расчета bootstrap-величин из этих нуклеотидных последовательностей (Felsenstein, J., 1989). Филогенетические древа сравнивали с филогентическими древами, полученными анализом присоединения соседей (способа построения филогенетического древа на основе принципа минимальной эволюции) с использованием модели Tamura-Nei, воплощенной в программе MEGA® (Kumar et al, 2004), и подтверждали с использованием программы PAUP® 4.0 Beta (Sinauer Associates, Inc., Sunderland, MA).
Анализ ингибирования гемагглютинации (HI)
Пробы сыворотки инкубировали с разрушающим рецептор ферментом (RDE, DENKA SEIKEN Co., Ltd., Tokyo, Japan) (1 часть сыворотки:3 части RDE) в течение 16 часов при 37°C перед инактивацией нагреванием в течение 30 минут при 56°C. Вирус гриппа A/Canine/Jacksonville/05 (H3N8) выращивали в клетках MDCK в течение 72 часов при 37°C в 5% CO2. Супернатанты культур вирусов собирали, осветляли центрифугированием и хранили при -80°C. Все другие использованные в анализе HI вирусы выращивали в 10-дневных куриных яйцах с развивающимися эмбрионами, из которых собирали аллантоисную жидкость и хранили при -80°C. Анализ HI выполняли, как описано ранее (Kendal et al, 1982). Вкратце, 4 единицы гемагглютинации вируса в 25 мкл добавляли к равному объему серийно разведенной сыворотки в микротитрационных 96-луночных пластиковых планшетах и инкубировали при комнатной температуре в течение 30 минут. Добавляли равный объем 0,5% эритроцитов индейки и титры гемагглютинации определяли приближенно визуально после 30 минут. Конечный титр HI определяли как последнее разведение сыворотки, которое полностью ингибировало гемагглютинацию.
ПРИМЕР 7 - КЛИНИЧЕСКИЕ СЛУЧАИ
В апреле и мае 2005 года имела место описанная ранее (Crawford, P.C. et al, 2005) вспышка респираторного заболевания в собаках, содержащихся в закрытом сооружении в северо-восточной Флориде. Эта вспышка включала в себя по меньшей мере 58 собак в возрасте от 3 месяцев до 9 лет и включала в себя как чистопородных собак, так и смешанные породы. Наиболее обычными клиническими признаками были гнойное выделение из носа и кашель в течение 7 дней - 21 дня. Из 43 собак, которые имели клиническое заболевание в течение ≥7 дней, 41 собака имела титры антител HI к canine/FL/04 (H3N8) в диапазоне 32 - >1024. По меньшей мере 10 собак прогрессировали до пневмонии, из которых 6 собак эвтанизировали. Эти 6 собак смешанных пород включали в себя 3 самцов и 3 самок в диапазоне возраста 2 дня - 10 дней в момент эвтаназии. При патологоанатомическом исследовании эти собаки имели легочный застой и отек. Гистологическое исследование дыхательных путей выявило ринит, трахеит, бронхит, бронхиолит и гнойную бронхопневмонию. Наблюдали некроз эпителиальных клеток и эрозию в трахее, бронхах, бронхиолах и бронхиальных железах. Респираторные ткани были инфильтрированы нейтрофилами и макрофагами.
В мае 2005 года вспышка респираторного заболевания имела место в 40 домашних собаках в ветеринарной клинике в юго-восточной Флориде. Наиболее обычными клиническими признаками были гнойное выделение из носа и кашель в течение 10-30 дней. Из 40 собак 17 были серопозитивными в отношении canine/FL/04 (H3N8), причем титры антител HI находились в диапазоне 32 - >1024. Сероконверсия имела место в 10 собаках, для которых были доступны парные сыворотки острой фазы и фазы выздоровления. Три собаки прогрессировали до пневмонии. Одна из этих собак, 9-летний самец Йоркширский терьер, умерла спустя 3 дня после появления клинических признаков. Эта собака имела трахеобронхит, отек и застой в легких и тяжелую бронхопневмонию. Подобно 6 собакам из закрытого сооружения, имелись некроз эпителиальных клеток и эрозия дыхательных путей и нейтрофильные инфильтраты в этих тканях.
ПРИМЕР 8 - ОТ-ПЦР РЕАЛЬНОГО ВРЕМЕНИ И ВЫДЕЛЕНИЕ ВИРУСОВ
Ткани легких из этих 7 собак анализировали количественными анализами ОТ-ПЦР реального времени, которые детектируют ген М вируса гриппа А и ген Н3 вируса гриппа А H3N8 собачьих. Легкие из всех 7 собак были позитивными как в отношении гена М гриппа А, так и в отношении гена Н3 вируса А собачьих (таблица 8). После 3 пассажей в клетках MDCK, вирус подтипа H3N8 гриппа А выделяли из легких собаки из крытого сооружения, которая умерла после 3 дней пневмонии. Этот вирус был назван A/canine/Jacksonville/05 (H3N8) (canine/Jax/05). После 2 пассажей в куриных яйцах с развивающимися эмбрионами, вирус подтипа H3N8 гриппа А извлекали из легких домашней собаки, которая также умерла после 3 дней пневмонии. Этот вирус был назван A/canine/Miami//05 (H3N8) (canine/Miami/05).
ПРИМЕР 9 - ГЕНЕТИЧЕСКИЕ АНАЛИЗЫ ИЗОЛЯТОВ ВИРУСА ГРИППА А H3N8 СОБАЧЬИХ
Анализы последовательностей canine/Jax/05 и canine/Miami/05 выявили, что их гены гемагглютинина (НА) были на 98% идентичны изолятам canine/FL/04, canine/TX/04 и canine/Iowa/05, выделенным из легких гончих борзых, которые умерли от пневмонии во время вспышек гриппа на треках в 2004 и 2005 годах (Crawford, P. C. et al, 2005; Yoon K-Y. et al, 2005). Кроме того, гены НА canine/Jax/05 и canine/Miami/05 были на 98% идентичны вирусам гриппа лошадиных того же времени, выделенных после 2000 года. Филогенетические сравнения генов НА показали, что вирусы canine/Jax/05 и canine/Miami/05 образовывали кластеры с изолятами canine/FL/04, canine/TX/04 и canine/Iowa/05 борзых и изолятами лошадиных того же времени, образуя отличающуюся группу в сравнении с более старыми вирусами лошадиных, выделенными в ранних 1990-ых (фиг.4). Кроме того, изоляты canine/Jax/05, canine/Miami/05 и canine/Iowa/05 были более близкородственными canine/Tx/04, чем canine/FL/04 или canine/FL/03. Эти изоляты 2005 года образовали подгруппу, которая, по-видимому, ответвляется от более ранних изолятов собачьих 2003 и 2004 годов с различиями в приблизительно 10 информативных в отношении экономичности сайтах. Эти различия подтверждают гипотезу, согласно которой вирус гриппа собачьих переносится горизонтально от собаки к собаке, в противоположность повторному периодическому введению из внешнего источника. Накопление мутаций с 2003 года до 2005 года иллюстрирует продолжающийся процесс адаптации, которому этот вирус должен подвергаться после переноса в нового хозяина, как это произошло, как и ожидалось, в отношении вирусов гриппа собачьих.
ПРИМЕР 10 - АНАЛИЗЫ АМИНОКИСЛОТ ИЗОЛЯТОВ ВИРУСА ГРИППА А H3N8 СОБАЧЬИХ
Во всех 6 собачьих изолятах имелись консервативные аминокислотные замены, которые отличали их от вирусов гриппа лошадиных того же времени (таблица 9). Этими консервативными заменами были I15M, N83S, W222L, I328T и N483T. Филогенетические сравнения зрелого белка НА показали, что вирусы canine/Jax/05, canine/Miami/05 и canine/Iowa/05 образовали подгруппу с изолятом canine/TX/04 (фиг.4). Имелись 3 аминокислотные изменения (Ll18V, K261N и G479E), которые отличали эту подгруппу от других вирусов собачьих (таблица 9). Имелись 2 аминокислотных изменения (F79L и G218E), которые отличали изоляты 2005 года от их прародителя canine/TX/04. Кроме того, изоляты 2005 года из собак, не являющихся борзыми, canine/Jax/05 и canine/Miami/05, отличались от изолята борзой canine/Iowa/05 одним изменением аминокислоты, R492K. Наконец, canine/Jax/05 отличался от canine/Miami/05 при единственной аминокислоте, S107P. Во всех других вирусах H3N8 лошадиных и собачьих, S сохранялся в положении 107, за исключением A/Equine/Jilin/1/89, который имел Т (Guo Y. et al, 1992).
ПРИМЕР 11 - АНАЛИЗЫ АНТИГЕНОВ ИЗОЛЯТОВ ВИРУСА ГРИППА А H3N8 СОБАЧЬИХ
Тесты ингибирования гемагглютинации (HI) выполняли с использованием панели более старых и современных вирусов гриппа лошадиных и вирусов гриппа собачьих и сыворотки собирали в 2005 году из лошадей и собак, которые были инфицированы вирусом гриппа (таблица 10). В этих анализах включали также сыворотку из хорьков, иммунизированных против canine/FL/04. Титры антител HI в лошадиной сыворотке были в 8-16 раз более высокими при исследовании с современными лошадиными вирусами в сравнении с более старыми изолятами, но они уменьшались по меньшей мере в 4 раза при исследовании с вирусами собачьих. Сыворотка собачьих была нереактивной с более старыми вирусами лошадиных, но эти титры антител увеличивались в 4 раза при исследовании с современными изолятами лошадиных и изолятами собачьих. Это наблюдали также для сывороток из хорьков, иммунизированных против вируса гриппа собачьих. Эти распределения серореактивности продемонстрировали антигенное сходство между вирусами гриппа собачьих и современными вирусами гриппа лошадиных и согласовались с филогенетическими анализами. Титры антител в сыворотках лошадиных, собачьих и хорьков в отношении изолята canine/Miami/05 были сходными с титрами в отношении изолятов собачьих 2003 и 2004 годов. Однако эти титры были в 2-4 раза более низкими для изолята canine/Jax/05. Это предполагает, что canine/Jax/05 является антигенно отличающимся от других изолятов собачьих, что может быть частично связано с изменением единственной аминокислоты в положении 107 в зрелом НА.
Таблица 7
Праймеры и зонды для количественного анализа ОТ-ПЦР реального времени на ген матрикса вируса гриппа А и ген Н3 вируса гриппа А(H3N8) собачьих

а Подчеркнутая буква r обозначает нуклеотид a или g, а подчеркнутая буква k обозначает нуклеотид g или t.
b Прописные буквы обозначают «запертые» остатки нуклеиновых кислот.
(Ct)
положительный контроль
Таблица 9
Сравнение аминокислот зрелых НА для вирусов гриппа собачьих и современных вирусов гриппа лошадиных
Таблица 10
Титры антител в сыворотке лошадиных, собачьих и хорьков в отношении более старых и современных вирусов гриппа лошадиных и вирусов гриппа собачьих
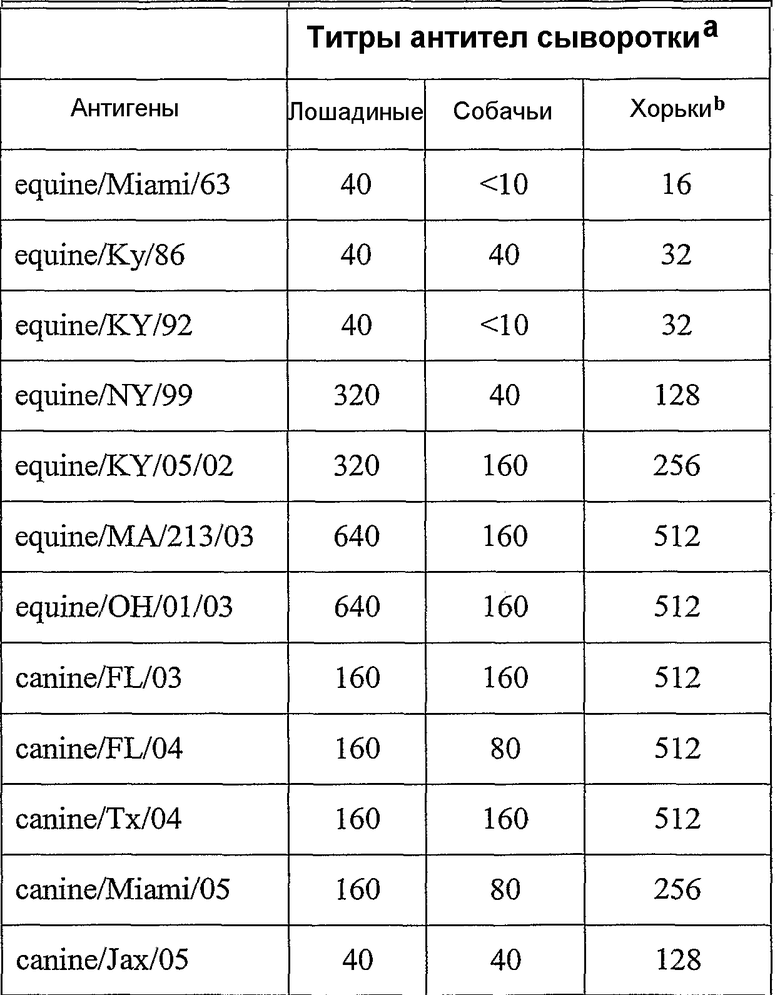
a Титры антител определяли в анализе ингибирования гемагглютинации, выполняемом с серийными разведениями сыворотки лошадиных, собачьих и хорьков, и эти вирусы перечислены в столбце антигенов.
b Сыворотка из хорьков, иммунизированных вирусом canine/FL/04.
МАТЕРИАЛЫ И ПРИМЕРЫ СПОСОБОВ ДЛЯ ПРИМЕРОВ 12-15
Инокулят вируса гриппа собачьих
Инокулят этого вируса получали инокуляцией эпителиальных клеток почек собачьих Madin-Darby (MDCK) исходным раствором A/canine/FL/43/04 (H3N8), представляющим собой 3-ий пассаж исходного изолята, описанного ранее (Crawford et al, 2005). Инокулированные клетки MDCK в минимальной поддерживающей среде Дульбекко (DMEM), дополненной 1 мкг/мл TPCK-обработанного трипсина (Sigma-Aldrich Corp., St. Louis, MO) и антибиотиками (гентамицином и ципрофлоксацином) выращивали в колбах 25 см2 при 37°C в увлажненной атмосфере, содержащей 5% CO2. Эти культуры наблюдали каждый день в отношении морфологических изменений и собирали при 5 днях после инокуляции. Собранные культуры осветляли центрифугированием и супернатанты хранили при -80°C в ожидании инокуляции собак. Аликвоту супернатанта использовали для определения титра вируса по способу Reed и Muench. Этот титр был равен 107 срединных инфекционных доз в тканевых культурах (TCID50) A/canine/Florida/43/2004 (canine/FL/04) на мл.
Экспериментальная инокуляция
Восемь 4-месячных разводимых в колонии нечистокровных собак (Marshall BioResources, North Rose, NY) (4 самца и 4 самки) использовали для исследования экспериментальной инокуляции, одобренного University of Florida Institutional Animal Care and Use Committee. Массы тела этих собак были в диапазоне 13-17 кг. Эти собаки были здоровыми на основе физического обследования, фоновых анализов крови и регистрации температур тела в течение 2 недель перед инокуляцией. Все собаки ранее не подвергались воздействию вируса гриппа собачьих на основе серологических тестов, выполненных на парных пробах сывороток, собранных в момент прибытия в это учреждение и спустя 2 недели. Собак анестезировали внутривенной инъекцией пропофола (Diprivan®, Zeneca Pharmaceuticals, 0,4 мг/кг массы тела до получения действия) для интубации эндотрахеальными трубками. Шесть собак (3 самца и 3 самки), каждую, инокулировали 107 TCID50 вируса canine/FL/04 в 5 мл стерильного солевого раствора, вводимого в дистальную часть трахеи через резиновый катетер малого диаметра, вставленный в эндотрахеальную трубку. Двух собак (1 самца и 1 самку) ложно-инокулировали равным объемом стерильного солевого раствора. Ложно-инокулированных контрольных собак содержали в другой комнате, отдельно от инокулированных вирусом собак и уход за ними выполнялся другим персоналом. Физические обследования и регистрации ректальной температуры выполняли два раза в день в течение 6 дней после инокуляции (p.i.).
Сбор фарингеальных и ректальных мазков
Для мониторинга выделения вируса, ротоглоточные образцы собирали два раза в день из каждой собаки в дни 0-6 p.i. с использованием тампонов из полиэфирного волокна (Fisher Scientific International Inc., Pittsburgh, PA). Эти мазки помещали в 1 мл стерильного забуференного фосфатом солевого раствора (ЗФР), содержащего 0,5% бычий сывороточный альбумин (БСА). Ректальные мазки брали из каждой собаки один раз в день со дня 0 до дня 6. Экстракты мазков готовили осветлением сред для транспортировки мазков центрифугированием. Аликвоту экстракта мазка исследовали немедленно на нуклеопротеин вируса гриппа А с использованием коммерческого набора для иммуноанализа Directigen™ (BD, Franklin Lakes, NJ) в соответствии с инструкциями изготовителя. Оставшийся экстракт хранили при -80°C в ожидании других вирусологических анализов.
Патологоанатомические исследования
В день 1 p.i., одну ложно-инокулированную собаку и одну инокулированную вирусом собаку эвтанизировали внутривенной инокуляцией раствора Beuthanasia-D® (1 мл/5 кг массы тела; Schering-Plough Animal Health Corp). Одну инокулированную вирусом собаку аналогичным образом эвтанизировали каждый день из дней 2-5 p.i. В день 6 p.i., эвтанизировали оставшуюся ложно-инокулированную и инокулированную вирусом собаку. Полные патологоанатомические исследования выполнялись одним из исследователей (WLC). Ткани фиксировали в 10% нейтрально забуференном формалине, заливали в парафин и срезы 5 мкм либо окрашивали гематоксилином и эозином для гистопатологической диагностики, либо обрабатывали для иммуногистохимии, как описано ниже. Нефиксированные ткани легких предоставляли в Diagnostic Clinical Microbiology/Parasitology/Serology Service at the University of Florida College of Veterinary Medicine для выделения и идентификации бактерий. Пробы культивировали на неселективных средах, а также средах, селективных в отношении видов Bordetella (Regan-Lowe; Remel, Lenexa, KS) и видов Mycoplasma (Remel). Все культуры выдерживали в течение 21 дня перед сообщением об отсутствии роста. Нефиксированные ткани также хранили при -80°C в ожидании вирусологических анализов.
Иммунохимия
Депарафинированные и повторно гидратированные срезы 5 мкм ткани трахеи и легких наносили в виде препаратов на предметные стекла Bond-Rite™ (Richard-Allan Scientific, Kalamazoo, MI) и затем обрабатывали протеиназой К (DakoCytomation, Carpenteria, CA) и затем блокирующим пероксидазу реагентом (Dako® EnVision™ Peroxidase Kit, Dako Corp., Carpenteria, CA). Эти срезы инкубировали разведением 1:500 моноклонального антитела к вирусу гриппа A H3 (Chemicon International, Inc.) в течение 2 часов при комнатной температуре. Контроли включали в себя инкубирование тех же самых срезов с мышиным IgG (1 мг/мл, Serotec, Inc. Releigh, NC) и инкубирование этого моноклонального антитела со срезами легких здоровых собачьих. После обработки первичным антителом эти срезы инкубировали с вторичными реагентами иммунопероксидазой и субстратом пероксидазы (Dako® EnVision™ Peroxidase Kit, Dako Corp.) в соответствии с инструкциями изготовителя. Эти срезы контрастно окрашивали гематоксилином, обрабатывали Clarifier #2 и Bluing Reagent (Richard-Allan Scientific, Kalamazoo, MI), дегидратировали и покровные стекла помещали с использованием пермаунта (ProSciTech, Queensland, Australia).
Экстракция RNA из мазков и тканей
Ткани легких и трахеи из каждой собаки оттаивали и гомогенизировали в минимальной поддерживающей среде (MEM), дополненной 0,5% бычьим сывороточным альбумином (БСА) и антибиотиками (гентамицином и ципрофлоксацином) с использованием доступного гомогенизатора ткани (Kendall, Lifeline Medical Inc., Danbury, CT). Тотальную РНК экстрагировали из гомогенатов тканей, а также экстрактов ротоглоточных и ректальных мазков с использованием коммерческого набора (RNeasy® Mini Kit, QIAGEN Inc., Valencia, CA) в соответствии с инструкциями изготовителя и элюировали в конечном объеме 60 мкл буфера.
ОТ-ПЦР реального времени
Одностадийную количественную ОТ-ПЦР реального времени выполняли на тотальной РНК с использованием набора QuantiTect® Probe RT-PCR, содержащего ROX в качестве пассивного ссылочного красителя (QIAGEN Inc., Valencia, CA), и набора праймеров-зондов, которые нацелены на высококонсервативный район гена матрикса (М) вируса гриппа типа А (Payungporn S. et al, 2006a; Payungporn S. et al, 2006b). Для каждой реакции ОТ-РЦР реального времени 5 мкл экстрагированной тотальной РНК добавляли в реакционную смесь, содержащую 12,5 мкл 2Х смеси QuantiTech® Probe RT-PCR Master Mix, 0,25 мкл смеси QuantiTech® RT Mix, прямой и обратный праймеры (0,4 мкМ конечная концентрация для каждого), зонд (0,1 мкМ конечная концентрация) и не содержащую РНКаз воду в конечном объеме 25 мкл. Контрольные реагенты рибосомных РНК TaqMan® (Applied Biosystems, Foster City, CA) использовали в соответствии с инструкциями изготовителя для детектирования GAPDH в качестве эндогенного внутреннего контроля на присутствие РНК, экстрагированной из проб мазков и тканей, и в качестве контроля для нормализации.
Количественную одностадийную ОТ-ПЦР реального времени выполняли на реакционных смесях в системе Mx3000P® QPCR (Stratagene, La Jolla, CA). Условия проведения циклов включали в себя стадию обратной транскрипции при 50oC в течение 30 минут, стадию денатурации при 95°C в течение 15 минут для активации ДНК-полимеразы HotStarTaq® и амплификации в течение 40 циклов. Каждый цикл амплификации включал в себя денатурацию при 94°C в течение 15 секунд с последующим отжигом/удлинением при 60°C в течение 1 минуты. Флуоресцентные сигналы FAM (длина волны испускания 518 нм) и VIC (длина волны испускания 554 нм) регистрировали в конце каждого цикла. Пороговый цикл (Ct) определяли установкой пороговой флуоресценции (dR) при 1000 в каждом отдельном эксперименте. Для получения и анализа данных использовали программу Mx3000P® version 2.0 (Stratagene, La Jolla, CA). Позитивный контроль состоял из амплификации РНК, экстрагированной из вируса A/canine/FL/242/03 (H3N8). Результаты нормализовали делением величины Ct M на соответствующую величину Ct GAPDH для каждой пробы.
Повторное выделение вируса из тканей
Замороженные ткани легкого и трахеи из инокулированных вирусом собак оттаивали и гомогенизировали в 10 объемах DMEM, дополненной 0,5% БСА и антибиотиками. Твердый остаток клеток удаляли центрифугированием и супернатанты инокулировали на клетки MDCK, культивируемые в DMEM, дополненной 1 мкг/мл TPCK-обработанным трипсином (Sigma-Aldrich Corp., St. Louis, MO) и антибиотиками, как описано выше. Культуры наблюдали ежедневно на морфологические изменения и собирали при 5 днях после инокуляции. Собранные культуры осветляли центрифугированием и супернатанты инокулировали на свежие клетки MDCK, как описано для начальной инокуляции; выполняли два дополнительных пассажа для проб, которые не обнаруживали присутствия вируса гриппа посредством гемагглютинации или ОТ-ПЦР. Активность гемагглютинации в осветленных супернатантах определяли с использованием 0,5% индюшачьих эритроцитов, как описано ранее (Crawford et al., 2005). ОТ-ПЦР выполняли, как описано ниже.
ОТ-ПЦР, секвенирование нуклеотидов и филогенетические анализы
Вирусную РНК экстрагировали из супернатанта MDCK с использованием мининабора QIAamp® Viral RNA (QIAGEN Inc., Valencia, CA) в соответствии с инструкциями изготовителя. Эту вирусную РНК обратно-транскрибировали в кДНК с использованием набора QIAGEN® OneStep RT-PCR (QIAGEN Inc., Valencia, CA) в соответствии с инструкциями изготовителя. ПЦР-амплификацию кодирующего района из 8 генов вируса гриппа в этой кДНК выполняли, как описано ранее (Crawford e 2005), с использованием универсальных наборов ген-специфических праймеров (последовательностей праймеров, доступных по запросу). Полученные ДНК-ампликоны использовали в качестве матриц для автоматизированного секвенирования в автоматизированном ДНК-секвенаторе ABI PRISM® 3100 с использованием химического способа для циклического секвенирования с использованием красителя в качестве терминатора (Applied Biosystems, Foster City, CA). Нуклеотидные последовательности анализировали с использованием программного обеспечения Lasergene 6 Package® (DNASTAR, Inc., Madison, WI). Нуклеотидные последовательности для вирусов, полученных из инфицированных собак, сравнивали с последовательностями вируса в этом инокуляте для определения, произошли ли какие-либо изменения во время репликации в дыхательных путях.
ПРИМЕР 12 - КЛИНИЧЕСКОЕ ЗАБОЛЕВАНИЕ
Все 6 инокулированных вирусом собак развивали транзиторную (временную) лихорадку (ректальную температуру ≥39°C) в течение первых 2 дней p.i., но ни одна из них не обнаруживала респираторные признаки, такие как кашель или выделение из носа, на протяжении 6-дневного периода наблюдения. Ложно-инокулированные собаки оставались клинически здоровыми.
ПРИМЕР 13 - ВЫДЕЛЕНИЕ ВИРУСА
Нуклеопротеин вируса гриппа А детектировали в ротоглоточном мазке, собранном из одной из инокулированных вирусом собак при 24 часах p.i. Ротоглоточные мазки, собранные из одной собаки при 72, 84 и 120 часах p.i., и другой собаки при 108, 120 и 132 часах p.i., были позитивными в отношении вируса согласно количественной ОТ-ПЦР реального времени (таблица 11). Абсолютное количество копий гена М вируса гриппа А на мкл экстракта мазка увеличивалось со временем от 3 дней до 6 дней p.i. В ректальных мазках вирус не детектировался.
ПРИМЕР 14 - ПАТОЛОГОАНАТОМИЧЕСКИЕ ИССЛЕДОВАНИЯ
В противоположность прежней экспериментальной инфекции с использованием специфических не содержащих патогенов биглей (коротконогих гончих собак) (Crawford et al, 2005), инокулированные вирусом нечистопородные собаки (дворняжки) имели пневмонию, как было показано макроскопическими и гистологическими анализами легких, от 1 до 6 дней p.i. Кроме пневмонии, эти собаки имели ринит, трахеит, бронхит и бронхиолит, аналогично описанию в отношении природно инфицированных собак (Crawford et al, 2005). Имелись эпителиальный некроз и эрозия выстилки дыхательных путей и бронхиальных желез с инфильтрацией нейтрофилами и макрофагами тканей подслизистой основы (фиг.5, верхние панели). Иммунохимия детектировала вирусный антиген Н3 в эпителиальных клетках бронхов, бронхиол и бронхиальных желез (фиг.5, нижние панели). Бактериальная сверхинфекция отсутствовала. Респираторные ткани из 2 ложно-инокулированных собак были нормальными.
ПРИМЕР 15 - РЕПЛИКАЦИЯ ВИРУСА В ТРАХЕЕ И ЛЕГКИХ
Трахея и легкие были позитивными в отношении вируса согласно количественной ОТ-ПЦР реального времени во всех собаках от 1 до 6 дней p.i. (таблица 12). Абсолютное количество копий гена М вируса гриппа А на мкл гомогената трахеи увеличивалось от 1 до 5 дней p.i., затем уменьшалось в день 6. Абсолютное количество копий гена М на мкл гомогената легкого уменьшалось от 1 до 6 дней p.i. Обычно, трахея содержала более, чем на ≥ один log1O, больше вируса, чем легкое, в каждый из 6 дней p.i.
Таблица 11
Детектирование выделения вируса в ротоглотке нечистокровных собак, инокулированных вирусом гриппа собачьих, посредством количественной ОТ-ПЦР реального времени
а Время, когда ротоглоточные мазки собирали из собак после инокуляции вирусом A/canine/FL/43/04 (H3N8).
b Отношения нормализации рассчитывали делением М (Ct) на GAPDH (Ct) для каждого экстракта мазка.
c Абсолютное количество копий гена матрикса на мкл экстракта мазка.
Таблица 12
Детектирование репликации вируса в трахее и легком нечистокровных собак, инокулированных вирусом гриппа собачьих, посредством количественной ОТ-ПЦР реального времени
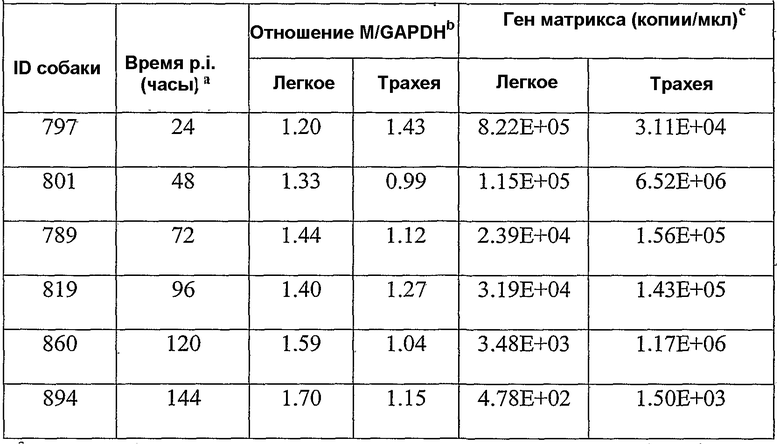
а Время, когда ротоглоточные мазки собирали из собак после инокуляции вирусом A/canine/FL/43/04 (H3N8).
b Отношения нормализации рассчитывали делением М (Ct) на GAPDH (Ct) для каждого экстракта мазка.
c Абсолютное количество копий гена матрикса на мкл экстракта мазка.
МАТЕРИАЛЫ И ПРИМЕРЫ СПОСОБОВ ДЛЯ ПРИМЕРА 16
Вирусные штаммы
Штаммы вируса гриппа собачьих, а также штаммы вируса гриппа птиц, лошадиных и человека (перечисленные в списке таблицы 15) размножали в яйцах с развивающимися эмбрионами или клетках MDCK и их инфективность титровали конечным разведением в куриных эмбрионах или анализом бляшкообразования. Быстрое количественное определение вируса выполняли анализом гемагглютинации с использованием эритроцитов индейки.
Диагностические образцы
В целом ткани легких 60 собачьих, собранных из предполагаемых случаев вирусного респираторного заболевания в 2005 году, исследовали на присутствие вируса гриппа собачьих.
Экстракция РНК из проб тканей собачьих
Блоки ткани легких с массой 20-30 мг гомогенизировали в доступном гомогенизаторе ткани (Kendal). Тотальную РНК экстрагировали с использованием коммерческого набора (RNeasy Mini Kit, Qiagen, Valencia, CA) и элюировали в конечном объеме 60 мкл в соответствии с рекомендациями изготовителя.
Конструкция праймеров и зондов
Множественные сопоставления последовательностей генов Н3 и М из различных подтипов и из разных видов выполняли с использованием программы CLUSTAL X (Версии 1.8). Праймеры и зонд гена матрикса (М) выбирали из консервативных районов на протяжении известных последовательностей, соответствующих различным подтипам вируса гриппа А, в то время как набор ген-специфических праймеров и зондов гена гемагглютинина Н3 выбирали таким образом, что они соответствовали генам вируса гриппа А лошадиных и собачьих и не соответствовали гомологичным генам птиц и человека (таблица 13). Программу конструирования праймеров (OLIGOS Version 9.1) и инструменты анализа на основе web, обеспечиваемые EXIQON (http://lnatools.com), использовали для расчета Tm и предсказания вторичной структуры, а также самогибридизации. Консервативный район гена рРНК 18S использовали в качестве эндогенного внутреннего контроля на присутствие РНК, экстрагированной из пробы ткани собачьих. Ранее развитые реагенты анализа TaqMan® на эукариотическую рРНК 18S (VIC/TAMRA) (Applied Biosystems) использовали для детектирования реального времени рРНК 18S в пробах тканей.
Условия ОТ-ПЦР реального времени
Одностадийную ОТ-ПЦР реального времени выполняли с использованием набора QuantiTect® Probe RT-PCR, содержащего ROX в качестве пассивного ссылочного красителя (QIAGEN Inc., Valencia, CA). В каждой реакции ОТ-РЦР реального времени 5 мкл пробы РНК использовали в качестве матрицы для объединения с реакционной смесью, содержащей 10 мкл 2Х смеси QuantiTech® Probe RT-PCR Master Mix, 0,25 мкл смеси QuantiTech® RT Mix, праймеры (0,4 мкМ конечная концентрация для гена Н3 или 0,6 мкМ конечная концентрация для гена М), зонд (0,1 мкМ конечная концентрация для гена Н3 или 0,2 мкМ конечная концентрация для гена М) и не содержащую РНКаз воду в конечном объеме 20 мкл. Одностадийную ОТ-ПЦР реального времени выполняли в системе Mx3000P® QPCR (Stratagene). Условия проведения циклов включали в себя стадию обратной транскрипции при 50°C в течение 30 минут. После начальной стадии денатурации при 95°C в течение 15 минут для активации ДНК-полимеразы HotStarTaq®, выполняли амплификацию в течение 40 циклов, включающую в себя денатурацию (94°C в течение 15 секунд) и отжиг/удлинение (60°C в течение 30 секунд). Флуоресцентные сигналы FAM (длина волны испускания 516 нм для детектирования Н3 и М) и VIC (длина волны испускания 555 нм для детектирования рРНК 18S) получали один раз на цикл в конце стадии удлинения. Получение и анализ данных ПЦР реального времени выполняли с использованием программы Mx3000P version 2.0 (Stratagene).
Специфичность набора праймеров/зонда Н3 для вируса гриппа (H3N8) собачьих и универсальность набора праймеров/зонда М для вируса гриппа А
Для исследования специфичности каждого набора праймеров/зонда, РНК, экстрагированную из нескольких известных подтипов вирусов гриппа А, использовали в качестве матрицы в анализе ОТ-ПЦР реального времени (таблица 15).
РНК-стандарт для определения эффективности ОТ-ПЦР реального времени
Гены вируса гриппа А собачьих (A/canine/Florida/242/2003(H3N8)) использовали для генерирования ПЦР-ампликонов для Н3 (нуклеотиды 1-487) и M (нуклеотиды 1-276) с использованием праймеров, связанных с промотором Т7 (таблица 13). Затем очищенные РЦР-ампликоны генов Н3 и М использовали в качестве матриц для in vitro транскрипции с использованием системы Riboprobe in vitro Transcription System-T7 (Promega) в соответствии с рекомендациями изготовителя. Концентрацию транскрибированных РНК рассчитывали измерением оптической плотности при 260 нм. Затем эти РНК серийно разводили 10-кратно, в диапазоне 108-10 копий/мкл для выполнения тестов чувствительности. Кроме того, получали калибровочную кривую построением log начальных концентраций РНК-матрицы (копии/мкл) в зависимости от порогового цикла (Ct), полученного из каждого разведения, для определения общей эффективности ОТ-ПЦР реального времени.
Сравнительные тесты чувствительности между ОТ-ПЦР реального времени и тест-набором Directigen Flu A
Исходные вирусы двух вирусных штаммов, включающих в себя A/Wyoming/3/2003 (H3N2) при 106,67 EID50/мл (HA=64) и A/canine/Florida/242/2003(H3N8) при 107,17 EID50/мл (HA=16), использовали для анализа детектирования порога. Логарифмическое разведение образцов в забуференном фосфатом солевом растворе (ЗФР) (125 мкл) использовали в наборе для быстрого детектирования антигена гриппа А, Directigen Flu A, (Becton, Dickinson and Company), в соответствии с инструкциями изготовителя. Каждое устройство теста Directigen Flu A имеет пятно антигена H1N1 вируса гриппа в центре мембраны, которое развивается в виде пурпурной точки и свидетельствует о целостности (чистоте) этого теста, который основан на моноклональном антителе к нуклеопротеину (NP). Развитие пурпурного треугольника, окружающего эту точку, свидетельствует о присутствии NP гриппа в тестируемом образце. Интенсивность развития пурпурного сигнала из этого треугольника оценивается как + (обрисовка треугольника в общем виде), ++ (слегка окрашенный треугольник), +++ (темно-пурпурный треугольник) и ++++ (очень темный пурпурный треугольник). Вирусную РНК экстрагировали аликвотами 125 мкл каждого разведения с использованием мининабора QIAamp Viral RNA Mini Kit (Qiagen, Valencia, CA) и элюции в конечном объеме 50 мкл. Объем 5 мкл экстрагированных вирусных РНК исследовали ОТ-ПЦР реального времени для сравнительного теста чувствительности с набором Directigen Flu A.
ПРИМЕР 16
Анализ ОТ-ПЦР реального времени на грипп собачьих основывается на информации из трех молекулярных зондов, которые нацелены на рРНК 18S из клетки-хозяина, а также М и Н3 из генома вируса гриппа А (таблица 14). Амплификация гена-хозяина является репортером качества и целостности образца. Ожидается, что клинические пробы, пробы аутопсии или лабораторные пробы, содержащие вирус гриппа собачьих (H3N8), дают сигнал амплификации с этими тремя зондами. Образцы, дающие сигнал амплификации с зондами М и рРНК 18S, но негативные в отношении Н3, будут указывать на подтип Н3 вируса гриппа из человека, свиней или птиц или не из подтипов Н3. Эти редкие случаи могли бы разрешаться ОТ-ПЦР, использующей универсальные праймеры НА для генерирования кДНК-ампликона, который может анализироваться секвенированием. Правильно собранные и продаваемые образцы, лишенные вируса гриппа А, дают только сигнал амплификации рРНК 18S. Ситуации, в которых только зонд рРНК 18S и зонды Н3 дают сигнал амплификации, свидетельствуют об имеющем недостатки способе, если не доказано обратное; или должны быть продемонстрированы либо ложно негативный результат в отношении М, либо ложно позитивный результат в отношении Н3. Наконец, образцы, не дающие сигналов амплификации с этими тремя зондами, свидетельствуют о дефектном сборе проб, деградации, ошибочной экстракции РНК или присутствии ингибиторов полимераз, используемых в ПЦР.
Для исследования специфичности набора праймеров/зондов Н3 для вируса гриппа А собачьих (H3N8) и универсальности набора праймеров/зондов М для гриппа типа А, несколько подтипов вирусов гриппа А исследовали в ОТ-ПЦР реального времени. Эти результаты показывают, что набор праймеров/зондов Н3 давал позитивный сигнал амплификации только с гриппом собачьих (H3N8). Не наблюдали значимых позитивных или неспецифических сигналов амплификации в других подтипах или штаммах Н3 человека. Набор праймеров/зондов М давал позитивный сигнал амплификации со всеми испытанными штаммами (таблица 15). Эти результаты показывают, что праймеры/зонд Н3 специфически детектируют вирус гриппа А (H3N8) собачьих, тогда как праймеры/зонд М детектируют многочисленные вирусы гриппа А.
Эффективность анализов ОТ-ПЦР реального времени оценивали конечным разведением транскрибированных in vitro РНК M и H3. Как и ожидалось, пороговый цикл (Ct) увеличивался в прямой корреляции с разведением РНК-стандартов. Сигналы флуоресценции могут детектироваться при таких низких разведениях РНК-стандартов М и Н3 как 103 и 102 копий/мкл, соответственно (фиг.6А и 6В). Калибровочные кривые генов M и H3 получали построением log исходных концентраций РНК в зависимости от порогового цикла (Ct), полученного из каждого разведения (фиг.6С и 6D). Наклон калибровочной кривой используют для определения эффективности реакции ПЦР, которая теоретически является экспоненциальной; 100% эффективность амплификации предполагает удвоение концентрации ампликонов каждого цикла. Калибровочные кривые с наклоном приблизительно -3,1 - -3,6 являются обычно приемлемыми для большинства применений, требующих точного количественного определения (90-110% эффективности реакции). Величина Rsq является подгонкой всех данных к этой калибровочной кривой. Если все данные точно лежат на этой линии, Rsq должна быть равна 1,00. Когда эти данные попадают далее от этой линии, Rsq уменьшается. Величина Rsq ≥0,985 является приемлемой для большинства анализов. Калибровочная кривая M выявила наклон -3,576 (эффективность=90,4%) и Rsq=1,00, тогда как калибровочная кривая Н3 давала наклон -3,423 (эффективность=95,9%) и Rsq=0,999. Эти величины свидетельствуют об удовлетворительной эффективности и общей работоспособности анализов ОТ-ПЦР реального времени. Авторы изобретения относят более низкую эффективность и чувствительность набора праймеров/зонда М в сравнении с набором праймеров/зонда Н3 к N-кратной вырожденности последовательностей праймеров М, требуемой для гарантии широкого охвата вариабельности последовательностей генов М во всех вирусах множественных подтипов, хозяев и линий дифференцировки.
Чувствительность анализа ОТ-ПЦР реального времени также сравнивали с коммерческим быстрым анализом детектирования антигенов (Directigen Flu A). Логарифмические разведения A/Wyoming/3/2003 (H3N2) и A/canine/Florida/242/2003(H3N8) анализировали с использованием Directigen Flu A и ОТ-ПЦР реального времени. Результаты Directigen Flu A показали, что чувствительности против обоих вирусных штаммов равны приблизительно 100-кратному разведению из исходных вирусов, используемых в этих экспериментах (фиг.7). Сигналы (пурпурная окраска), генерированные пробами вируса собачьих (A/canine/Florida/242/2003: 106,x БОЕ/мл), были гораздо более слабыми, чем сигналы, обнаруженные в вирусе человека (A/Wyoming/3/2003: 107,x БОЕ/мл), в соответствии с более низкой концентрацией в этих пробах. Альтернативно, более низкий сигнал в отношении вируса собачьих мог бы быть приписан молекулярной специфичности моноклональных антител против NP; т.е. слабому сохранению аминокислот в эпитопе NP вирусов гриппа А собачьих.
ОТ-ПЦР реального времени гена М давала величины Ct выше пороговых величин с 10 и 30 БОЕ-эквивалентами на реакцию с вирусами A/canine/Florida/242/2003 и A/Wyoming/3/2003, соответственно (таблица 16). Различия между величинами чувствительности 2 вирусных штаммов связаны с различиями исходных титров вирусов. Сравнение детектирования гена H3 между вирусами гриппа собачьих и человека не выполняли, так как праймеры/зонд Н3 в анализе ОТ-ПЦР авторов этого изобретения амплифицирует исключительно вирус гриппа собачьих. ОТ-ПЦР была в 105 раз более чувствительной, чем быстрый набор для детектирования антигенов.
Для оценки продуктивности ОТ-ПЦР-теста в образцах аутопсии из собак с острым респираторным заболеванием, шестьдесят проб тканей легких собак, предоставленных во время 2005 года, исследовали на присутствие вируса гриппа А собачьих при помощи ОТ-ПЦР реального времени. Всего 12 из 60 проб (20%) были позитивными как с геном М, так и с геном Н3, в то время как остальные 48 проб давали негативный результат как для гена М, так и для гена Н3. Попытки выделения вируса проводили посредством инокуляции яиц и клеток MDCK для оценки специфичности этого анализа реального времени; 2 из 12 проб, которые были позитивными в отношении гриппа собачьих при ОТ-ПЦР, обнаруживали вирус гриппа собачьих (данные не показаны, рукопись находится в процессе подготовки к печати). Хотя все из этих тканей собирали из собак с историей тяжелого респираторного заболевания, большинство из этих проб не обнаруживали вируса гриппа собачьих ни при использовании ПЦР реального времени, ни при общепринятом выделении, что предполагает высокую встречаемость других респираторных патогенов, таких как Bordetella bronchiseptica, вирус чумы собачьих или вирус парагриппа. Одностадийный анализ ОТ-ПЦР реального времени обеспечивает в данном изобретении быстрый, чувствительный и экономичный подход для детектирования вируса гриппа А (H3N8) собачьих. Быстрая лабораторная диагностика инфекций вируса гриппа А (H3N8) собачьих на ранней стадии этого заболевания может предоставлять информацию, релевантную для собак, содержащихся в ветеринарных клиниках и специальных сооружениях (псарнях).
Таблица 13
Праймеры и зонды, используемые для детектирования ОТ-РЦР реального времени и транскрипции in vitro

* Примечание: Прописные буквы = остатки LNA (Запертой нуклеиновой кислоты), r = a или g, k = g или t, подчеркнутые = последовательность промотора T7
Таблица 16
Сравнительные тесты чувствительности для детектирования вируса гриппа А между ОТ-ПЦР реального времени и Directigen Flu A
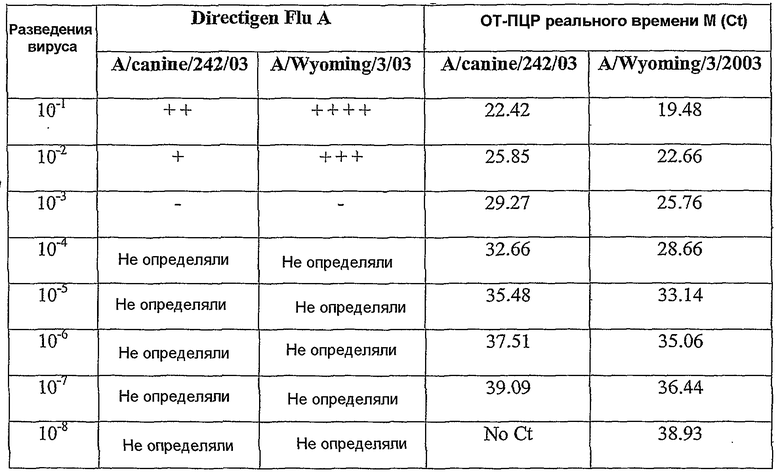
Таблица 17

Таблица 19
Аминокислотные различия между белками РВ2 вирусов гриппа H3N8 лошадиных и собачьих

Таблица 20
Аминокислотные различия между белками РВ1 вирусов гриппа H3N8 лошадиных и собачьих
Таблица 21
Аминокислотные различия между белками РА вирусов гриппа H3N8 лошадиных и собачьих
* на основе доступных генов вирусов, выделенных между 1963 годом и 1998 годом.
Таблица 22
Аминокислотные различия между белками NP вирусов гриппа H3N8 лошадиных и собачьих
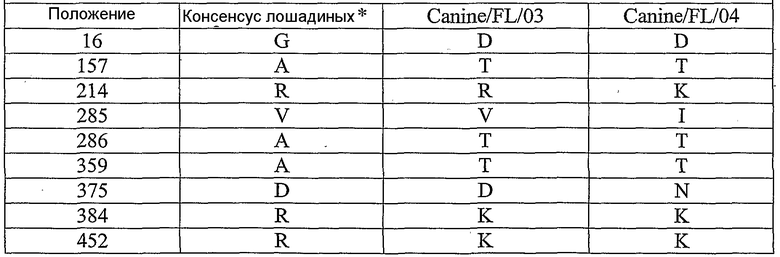
Таблица 23
Аминокислотные различия между белками NA вирусов гриппа H3N8 лошадиных и собачьих
Таблица 24
Аминокислотные различия между белками М1 вирусов гриппа H3N8 лошадиных и собачьих
* на основе доступных генов вирусов, выделенных между 1963 годом и 1998 годом.
Таблица 25
Аминокислотные различия между белками NS1 вирусов гриппа H3N8 лошадиных и собачьих
* на основе доступных генов вирусов, выделенных между 1963 годом и 1998 годом.
ПРИМЕР 17 - РАЗВИТИЕ МОДЕЛИ ЗАРАЖЕНИЯ ГРИППОМ СОБАЧЬИХ.
Наблюдали, что вирус гриппа собачьих (canine flu), который был выделен из вспышек гриппа во Флориде, является вирусом гриппа типа H3N8 и является близкородственным штамму вируса гриппа лошадиных, A/equine/Ohio/03 (статья Crawford et al, SCIENCE Vol. 309, September 2005, включенная в качестве ссылки в ее полном виде в этот патент). В этом исследовании исследовали потенциальную возможность использования штамма вируса гриппа лошадиных A/equine/Ohio/03 для индукции подобного гриппу заболевания в собаках.
Процедура: Десять 13-недельных биглей (коротконогих гончих собак) получали от коммерческого поставщика и содержали их в отдельных клетках в помещении BSL-2. Этих собак случайным образом относили к двум группам из 5 собак, каждая. Как показано в таблице 26, одну группу подвергали внутритрахеальному заражению, а другую группу подвергали ротоносовому заражению. Собак заражали при возрасте 14 недель.
Выращенный в клеточной культуре вирус гриппа лошадиных A/equine/Ohio/03 использовали в качестве вируса заражения. Для внутритрахеального заражения вирус заражения вводили через трубку для доставки, которая состояла из трахеальной интубационной трубки с надувной манжетой (Размер 4,0/4,5, Sheridan, USA) и питательной трубки (для зондового питания) (размер 5Fr, 1,7 мм, / 16 дюймов в длину, Kendall, USA) в объеме 0,5-1,0 мл. Для ротоносового заражения вирус заражения (107-108 TCID50 на собаку) вводили в виде аэрозоля («тумана») с использованием распылителя (ультразвукового распылителя DeVilbiss Ultra-Neb®99, Sunrise Medical, USA) в объеме 2-3 мл.
Этих собак наблюдали в отношении связанных с гриппом признаков в течение 14 дней после заражения. Пробы сыворотки собирали из каждой собаки в день 0 (перед заражением) и в дни 7 и 14 после заражения для определения титра HI с использованием вируса гриппа H3N8 лошадиных со стандартным протоколом (SAM 124, CVB, USDA, Ames, IA). Всех собак эвтанизировали гуманным образом и ткани легких собирали в 10% забуференном формалине для гистопатологического оценивания.
Результаты
Результаты этого эксперимента суммированы в таблице 27. Связанные с гриппом симптомы наблюдали в небольшом числе собак после заражения. Эти симптомы включали в себя лихорадку (>103°F; >39,4°C) и кашель. Две из 5 собак (т.е., 40%) имели лихорадку (>103°F; >39,4°C) в группе 1, в сравнении с 1 из 5 (т.е., 20%) в группе 2. Одна собака из группы ротоносового заражения имела чихание, а другая имела кашель после этого заражения. Для группы 1 наблюдали диапазон титра HI 10-80, с геометрическим средним титром (GMT) 20. Для группы 2 наблюдали диапазон титра HI 40-160, с геометрическим средним титром (GMT) 86. Одна собака из каждой группы имела гистопатологические повреждения, совместимые с гриппом или характерные для гриппа.
** Ректальная температура >103°F; >39,4°C
ПРИМЕР 18 - ЭФФЕКТИВНОСТЬ ВАКЦИНЫ ВИРУСА ГРИППА ЛОШАДИНЫХ В ОТНОШЕНИИ СОБАК
Наблюдали, что вирус гриппа собачьих (canine flu), выделенный из вспышек гриппа во Флориде, является вирусом гриппа типа H3N8 и является близкородственным штамму вируса гриппа лошадиных, A/equine/Ohio/03 на основании сходства последовательностей. Следующее исследование проводили для определения эффективности экспериментально инактивированной вакцины вируса гриппа лошадиных.
Процедура: Девять 7-недельных биглей (коротконогих гончих собак) получали от коммерческого поставщика и содержали их в отдельных клетках в помещении BSL-2. Этих собак случайным образом относили к двум группам, суммированным в таблице 28:
Первая группа состояла из 5 собак, которых вакцинировали инактивированной, дополненной адъювантом CARBIGEN™ вакциной вируса гриппа лошадиных A/equine/Ohio/03 при возрасте 8 и 12 недель подкожным (SQ) способом. A/equine/Ohio/03 инактивировали бинарным этиленимином (“BEI”) с использованием стандартного способа. Каждая доза этой вакцины содержала 5% масс. CARBIGEN™, 4096 HA-единиц инактивированного вируса, достаточное количество ЗФР для доведения общего объема этой дозы до 1 мл и достаточное количество NaOH для доведения pH до 7,2-7,4. Пробы сыворотки собирали из всех собак в день первой и второй вакцинации и перед заражением для определения титра HI с использованием вируса гриппа H3N8 лошадиных со стандартным протоколом (SAM 124, CVB, USDA, Ames, IA). При 3 неделях после второй вакцинации 5 вакцинированных собак и вторую группу (т.е. контрольную группу), состоящую из 4 собак такого же возраста, заражали ротоносовым способом выращенного в клеточной культуре вируса гриппа лошадиных A/equine/Ohio/03 (107-108 TCID50 на собаку) в объеме 1-2 мл на дозу. Этот вирус заражения вводили собакам в виде аэрозоля («тумана») с использованием распылителя (DeVilbiss Ultra-Neb®99 ультразвукового распылителя. Sunrise Medical, USA). Собак наблюдали в отношении связанных с гриппом клинических симптомов в течение 14 дней после заражения. Пять собак (3 вакцината и 2 контроля) спустя 7 дней после заражения и 4 собаки (2 контроля и 2 вакцината) спустя 14 дней после заражения эвтанизировали гуманным способом для сбора тканей легких в 10% забуференном формалине для гистопатологического оценивания.
Результаты
Результаты этого эксперимента суммированы в таблицах 29 и 30. Все вакцинированные собаки обнаруживали сероконверсию (т.е. видоизменяли серологическую специфичность) после вакцинации. Наблюдали диапазон титра HI 40-640 с GMT 129 во время периода после вакцинации вирусом гриппа лошадиных A/equine/Ohio/03 и диапазон титра HI 160-320, с геометрическим средним титром 211, с изолятом вируса собачьих, A/canine/Florida/242/03. Два из 6 вакцинатов имели лихорадку >103°F (>39,4°C) в течение одного дня и других симптомов не наблюдали ни в одной собаке после заражения.
Заключение
Все вакцинированные собаки отвечали на инактивированную, дополненную адъювантом CARBIGEN™ вакцину вируса гриппа лошадиных. Результаты титра HI с изолятом вируса гриппа собачьих предполагают, что эта инактивированная вакцина гриппа лошадиных не индуцировала детектируемый уровень перекрестно реактивного антитела к вирусу гриппа собачьих. Даже хотя вирус заражения, использованный в этом эксперименте, не индуцировал какого-либо заслуживающего внимания клинического заболевания в собаках-биглях, на основании титра HI с изолятом вируса гриппа собачьих, был сделан вывод, что инактивированная лошадиная вакцина могла бы использоваться в собаках для индукции перекрестно реактивных антител, которые могли бы потенциально защищать собак против заболевания «гриппа собачьих», вызываемого вирусами гриппа собачьих типа H3N8.
** Для вакцинации использовали дополненную адъювантом CARBIGEN™ инактивированную вакцину вируса гриппа лошадиных Ohio 03
*** Эвтанизировали спустя 7 дней после заражения
** Для вакцинации использовали дополненную адъювантом CARBIGEN™ инактивированную вакцину вируса гриппа лошадиных Ohio 03
ПРИМЕР 19 - ЭФФЕКТИВНОСТЬ ВАКЦИНЫ ВИРУСА ГРИППА ЛОШАДИНЫХ ДЛЯ СОБАК
Вирус гриппа собачьих, выделенный во время вспышек гриппа во Флориде, был охарактеризован и является близкородственным ряду изолятов вируса гриппа лошадиных типа H3N8. Посредством анализа сходства последовательностей ДНК и аминокислотных последовательностей было продемонстрировано, что вирус гриппа собачьих является очень сходным с вирусом гриппа лошадиных, A/equine/Ohio/03. Следующее исследование проводили в собаках для определения эффективности коммерчески доступных вакцин против вируса гриппа лошадиных в собаках.
Процедура
Приблизительно 16-месячных, 20 нечистопородных собак и 20 биглей смешанного пола использовали в этом исследовании. Собак случайным образом относили к 6 группам (таблица 31) из 6-7 собак, каждая. Собак в группах 1 и 4 вакцинировали коммерчески доступной инактивированной, дополненной адъювантом вакциной против гриппа лошадиных (EQUICINE™ Intervet Inc., Millsboro, DE) при возрасте 16 и 17 месяцев подкожным (SQ) способом. Собак в группах 2 и 5 вакцинировали модифицированной живой вакциной против гриппа equine/Kentucky/91 в объеме 1 мл интраназальным способом (в одну ноздрю). Пробы крови собирали в день вакцинации, в день 7 и день 14 после первой вакцинации (группы 1, 2, 4 и 5) и после второй вакцинации (группы 1 и 4) для определения титра HI с использованием вируса гриппа лошадиных и вируса гриппа собачьих с использованием стандартного протокола (SAM 124, CVB, USDA, Ames, IA).
Вакцинируемых собак (вакцинаты) (при 72 днях после конечной вакцинации) и контроли заражали ротоносовым способом выращенным в клеточной культуре штаммом вируса гриппа лошадиных A/equine/Ohio/03 (107-108 TCID50 на собаку) в объеме 1-2 мл. Вирус заражения вводили собакам в виде аэрозоля («тумана») с использованием распылителя (DeVilbiss Ultra-Neb®99 ультразвукового распылителя. Sunrise Medical, USA). Собак наблюдали в отношении связанных с гриппом клинических симптомов в течение 12 дней после заражения. Мазки из носа и ротоглоточные мазки собирали в среде MEM Эрла с антибиотиками (неомицином и полимиксином В) один раз в день со дня -1 до дня 12 после заражения для выделения вируса. Присутствие вируса в этих мазках свидетельствует о том, что данное животное экскретирует этот вирус в назальном/ротовом выделениях. Всех собак эвтанизировали гуманным образом в день 12 после заражения и ткани легких собирали в 10% забуференном формалине для гистологического оценивания.
** EQUICINE II™ продается Intervet Inc. в виде жидкой вакцины. EQUICINE II™ содержит инактивированный вирус гриппа A/Pennsylvania/63 (или "A/Pa/63") и вирус гриппа A/equine/Kentucky/93 (или "A/KY/93") с карбополом (i.e., HAVLOGEN® (Intervet Inc.)). Более конкретно, доза EQUICINE II™ содержит: инактивированный A/Pa/63 при 106,0 EID50, инактивированный A/KY/93 при 106,7 EID5O, 0,25% по объему карбопол и достаточное количество ЗФР для доведения общего объема до 1 мл.
*** A/KY/91 является высушенной вакциной, которую воссоздавали добавлением воды. Такое воссоздание проводили с использованием воды вакцинной категории в количестве, достаточном для доведения дозы вакцины до общего объема 1 мл. Эта вакцина содержала вирус гриппа equine/Kentucky/91 (или "A/KY/91"), и она обсуждается, например, в Патентах США с номерами 6436408; 6398774 и 6177082, которые включены в качестве ссылки в их полном виде в этот патент. При воссоздании, доза вакцины содержала A/KY/91 при 107,2 TCID5O на мл, 0,015 граммов N-Z AMINE AS™ на мл, 0,0025 граммов желатина на мл и 0,04 граммов D-лактозы на мл. N-Z AMINE AS™ является очищенным источником аминокислот и пептидов, полученным ферментативным гидролизом казеина. N-Z AMINE AS™ продается Kerry Bio-Science (Norwich, NY, USA).
Результаты
Все вакцинированные собаки обнаруживали сероконверсию (т.е. видоизменяли серологическую специфичность) после вакцинации, и титры HI находились в диапазоне 10-80 для собак группы вакцины EQUICINE II™ в сравнении с 10-40 для собак группы вакцины A/KY/91 при использовании вируса гриппа лошадиных (H3N8 type).
Пробы, собранные при 2 неделях после вакцинации (после второй вакцинации для вакцины EQUICINE II™), анализировали для определения титра HI с вирусом гриппа собачьих, а также с вирусом гриппа лошадиных (типа H3N8). Эти результаты HI показаны в таблице 32. Клинические симптомы включают в себя лихорадку (>103°F; >39,4°С), эпизодический кашель и слабое выделение из носа, наблюдаемые после заражения.
Среди биглей, 2 из 6 собак в группе вакцины EQUICINE II™ (группе 1), 1 из 7 собак в группе вакцины A/KY/91 (группе 2) и 2 из 6 собак в контрольной группе (группе 3) имели лихорадку. Одна из 6 собак группы 3 (контроля) была позитивной в отношении вируса в супернатанте клеточной культуры материала мазка из носа при анализе гемагглютинации с 0,25% куриными эритроцитами (CRBC). Одна из 6 собак в этой контрольной группе (группе 3) и 1 из 7 собак в группе вакцины A/KY/91 (группе 2) имела слабое выделение из носа во время периода наблюдения после заражения. Не было статистически значимого различия (Р>0,05) между контрольной группой и группами вакцин для собак-биглей.
Среди нечистокровных собак, 5 из 7 собак в группе вакцины EQUICINE II™ (группе 4), 1 из 7 собак в группе вакцины A/KY/91 (группе 5) и 5 из 6 собак в контрольной группе (группе 6) имели лихорадку. Одна собака из каждой из групп 4 и 6 имела слабое выделение из носа и одна собака из группы 5 имела эпизодический кашель. Две из 7 собак в группе вакцины EQUICINE II™ (группе 4) и 3 из 6 собак в контрольной группе (группе 6) были позитивными в отношении вируса гриппа в мазке из носа при НА-анализе. Ни одна из собак из группы A/KY/91 (группы 5) не была позитивной в отношении вируса гриппа в материалах мазков из носа.
Заключение
Посредством серологии было продемонстрировано, что вакцинация собак коммерчески доступными вакцинами против гриппа лошадиных стимулировала умеренный уровень реакции в виде антител против вируса гриппа. Может иметься некоторое различие между породами в развитии связанных с гриппом клинических симптомов в собаках после заражения вирусом гриппа типа H3N8. Живая аттенуированная вакцина гриппа лошадиных (A/KY/91) обеспечивала значимую (P<0,05) защиту от клинического развития заболевания по ректальной температуре в нечистопородных собаках. Эта живая аттенуированная вирусная вакцина предотвращала также выделение вируса гриппа в выделениях из носа.
ПРИМЕР 20 - РАЗВИТИЕ МОДЕЛИ ЗАРАЖЕНИЯ ГРИППОМ СОБАЧЬИХ
Ввиду сообщений о том, что индукция заболеваний в собачьих для целей исследования оказалась неуспешной, потенциальную возможность использования вируса гриппа собачьих, H3N8, для развития модели иммунизации вирусом гриппа собачьих в собаках исследовали в следующем исследовании.
Процедура
Десять нечистопородных собак смешанного пола получали от коммерческого поставщика и содержали в клетках в помещении BSL-2. Этих собак относили случайным образом к двум группам из 5 собак, каждая. Как показано в таблице 33, одну группу подвергали внутритрахеальному/интраназальному заражению, а другую группу подвергали ротоносовому заражению.
Этих собак заражали при возрасте приблизительно 12 недель. Выращенный в куриных яйцах с развивающимися эмбрионами вирус гриппа собачьих (A/canine/Florida/242/03) использовали в качестве вируса заражения. Каждая собака получала всего приблизительно 107,2 TCID50 вируса в объеме либо 2 мл (для ротоносового способа), либо 4 мл (для внутритрахеального/интраназального способа).
Для внутритрахеального/интраназального заражения 3 мл вируса заражения вводили сначала в трахею с последующим введением 5 мл ЗФР при помощи трубки для доставки, которая состояла из трахеальной интубационной трубки с надувной манжетой (размер 4,5/5,0, Sheridan, USA) и питательной трубки (размер 5Fr, 1,7 mm; 16 дюймов (41 см) в длину, Kendall, USA), и 1 мл вируса заражения с последующим введением 3 мл атмосферного воздуха вводили в ноздри с использованием шприца. Для ротоносового заражения, вирус заражения вводили в виде аэрозоля («тумана») при помощи распылителя (Nebulair™, DVM Pharmaceuticals, Inc., Miami, FL) в объеме приблизительно 2 мл. Этих собак наблюдали в отношении связанных с гриппом симптомов в течение 14 дней после заражения. Собак эвтанизировали в день 14 после заражения и пробы ткани (легкого и трахеи) собирали в 10% забуференном формалине для гистопатологического испытания.
Результаты
Все собаки в группах 1 и 2 развивали клинические симптомы гриппа собачьих в пределах 24-48 часов. Каждая собака имела 2 или более из следующих клинических симптомов: лихорадки (>103,0°F; >39,4°C), кашля, серозного или слизисто-гнойного выделения из глаз, серозного или слизисто-гнойного выделения из носа, рвоты, диареи, депрессии, потери массы, рвотных движений, кровохарканья и слышимых хрипов. Ткани легких из 5 из 5 собак из группы 1 и 4 и 4 из 5 из группы 2 имели гистопатологические повреждения, которые включали в себя один или несколько из следующих явлений: диффузной гнойной бронхопневмонии, бронхита/бронхиолита с пробками нейтрофильного экссудата в полости и заметной агрегации мононуклеарных клеток в слизистой оболочке и перибронхиолярной ткани, смешанного экссудата в альвеолах с большими количествами пенистых макрофагов, инфильтрации лимфоцитов и плазматических клеток, а также гранулоцитов и утолщения межальвеолярных перегородок с пролиферацией пневмоцитов типа II, совместимых с характерной для вируса гриппа инфекцией. Пробы ткани трахеи были нормальными.
Заключение
Изолят гриппа собачьих H3N8, такой как изолят, использованный в этом исследовании, может быть использован для индукции заболевания гриппа собачьих в собаках с использованием одного из способов, описанных в этом исследовании или аналогичного способа.
ПРИМЕР 21 - РАЗВИТИЕ МОДЕЛИ ЗАРАЖЕНИЯ ГРИППОМ СОБАЧЬИХ
Потенциальную возможность использования вируса гриппа собачьих, H3N8, для развития модели заражения гриппом собачьих в собаках исследовали дополнительно в следующем исследовании.
Процедура
Пятнадцать нечистопородных собак в возрасте 17-18 недель и пять биглей в возрасте 15 недель получали от коммерческих поставщиков и содержали в клетках в помещении BSL-2. Нечистопородных собак относили случайным образом к 3 группам (группы 1-3) из 5 собак, каждая. Всех биглей относили к одной группе (группе 4), как показано в таблице 34.
Этих собак заражали ротоносовым способом вирулентным вирусом гриппа собачьих, A/Canine/Florida/242/2003 (выделенным из легкого собаки (борзой) с заболеванием гриппом собачьих (предоставленным доктором Cynda Crawford в the University of Florida)). Этот вирус заражения вводили в виде аэрозоля («тумана») с использованием распылителя (Nebulair™) с объеме приблизительно 2 мл. Этих собак наблюдали в отношении связанных с гриппом симптомов в течение 14 часов после заражения.
Результаты
Восемьдесят процентов (4 из 5) собак в группе 1 и 4, 100% собак в группе 2 и 3 развивали клинические симптомы вируса гриппа собачьих в пределах 48 часов. Каждая собака имела один или несколько из следующих клинических симптомов: лихорадки (>103,0°F; >39,4°C), кашля, серозного или слизисто-гнойного выделения из глаз, серозного или слизисто-гнойного выделения из носа, рвоты, диареи, депрессии, потери массы, рвотных движений и хрипов. Эти клинические симптомы, наблюдаемые в биглях, были обычно более слабыми кратковременными в сравнении с нечистопородными собаками.
Заключение
Изолят гриппа собачьих H3N8, такой как изолят, использованный в этом исследовании, может быть использован для индукции заболевания, подобного гриппу собачьих или подобного питомниковому кашлю, в собаках с использованием способа, описанного в этом исследовании или аналогичного способа с диапазоном дозы заражения 104,8-106,8 TCID50. Имелись некоторые различия в клинических симптомах, наблюдаемых в нечистопородных собаках и биглях. Обычно бигли имеют тенденцию проявления более слабых связанных с гриппом клинических симптомов в сравнении с нечистопородными собаками.
ПРИМЕР 22 - ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПРОТИВ ГРИППА СОБАЧЬИХ.
Следующее исследование проводили для оценки эффективности вакцины гриппа лошадиных H3N8 в собаках против вируса гриппа собачьих.
Процедура
Семнадцать нечистопородных собак в возрасте 14 недель и десять биглей в возрасте 8 недель получали от коммерческих поставщиков. Этих собак относили случайным образом к 5 группам, как показано в таблице 35 и содержали в помещении для проведения исследований.
Вакциной, используемой в этом исследовании, была дополненная адъювантом HAVLOGEN®, инактивированная вакцина вируса гриппа лошадиных (A/equine/KY/02). Для получения этой вакцины вирус инактивировали бинарным этиленимином (BEI) с использованием стандартного способа. Каждая доза вакцины содержала HAVLOGEN® (10% об./об.), 6144 единиц HA инактивированного вируса, 0,1% (об./об.) 10% тимеросала, 0,1% (об./об.) фенолового красного, достаточное количество NaOH для доведения pH до 6,8-7,2 и достаточное количество ЗФР для доведения общего объема дозы до 1 мл.
Собак в группах 1 и 4 вакцинировали 2 дозами этой вакцины. Вторую дозу (т.е. бустер) вводили спустя 4 недели после первой. Собак в группе 2 вакцинировали 1 дозой при возрасте 18 недель. Пробы крови собирали для оценки титра YI с использованием стандартного протокола (например, SAM 124, CVB, USDA, Ames, IA) с изолятом гриппа H3N8 в дни 0 (перед вакцинацией), 7 и 14 после первой и второй вакцинаций. Приблизительно за 5 дней перед заражением этих собак перемещали в помещение BSL-2 и содержали в отдельных клетках.
Всех вакцинированных собак (вакцинаты) и контрольных собак того же возраста заражали ротоносовым способом вирулентным вирусом гриппа собачьих (107,7 TCID50 A/Canine/Florida/242/2003 на одну собаку) при 2 неделях после второй вакцинации групп 1 и 4 и первой вакцинации группы 2. Вирус заражения вводили в виде аэрозоля («тумана») с использованием распылителя (Nebulair™) при 2 мл на одну собаку. Этих собак наблюдали в отношении связанных с гриппом клинических симптомов в течение 17 дней после заражения. Мазки из носа и ротоглоточные мазки собирали в пробирках, содержащих 2 мл среды для транспортировки вирусов для выделения вируса со дня -1 (т.е. за один день перед заражением) до дня 17 после заражения. Всех собак эвтанизировали в день 17 и пробы легких и трахеи собирали в 10% забуференном формалине для гистопатологии. Пробы крови собирали в дни 7 и 14 после заражения для определения титра HI. Назначения оценок, используемых для клинических симптомов во время наблюдения после заражения, показаны в таблице 36.
Результаты
Все собаки в группах вакцинации с 2 дозами (группах 1 и 4) развивали реакции титра антител HI против изолята вируса гриппа собачьих (таблица 37). После заражения, приблизительно 4-кратное увеличение титра в день 14 после заражения во всех группах опосредованно показало, что все собаки были подвергнуты действию вируса заражения. Все собаки обнаруживали один или несколько из следующих симптомов гриппа собачьих: лихорадки (>103,0°F; >39,4°C), кашля, серозного или слизисто-гнойного выделения из глаз, серозного или слизисто-гнойного выделения из носа, рвоты, диареи, депрессии, потери массы и одышки. Вакцинаты имели менее тяжелые клинические симптомы в сравнении с контролями того же возраста (таблица 38). Имелось значимое уменьшение клинических симптомов вследствие вакцинации в виде 2 доз как в 8-недельных (P=0,040), так и в 14-недельных (P=0,003) собаках (группы 4 и 1, соответственно). В этом эксперименте однодозовая вакцинация не давала значимого (P=0,294) уменьшения клинических симптомов (группа 2).
Результаты выделения вируса показаны в таблице 39. Среди 14-недельных собак, вирус выделяли из проб в виде мазков, собранных из 2 из 7 собак (29%) из группы с 2 дозами вакцины (группы 1), 3 из 5 собак (60%) из группы с одной дозой вакцины (группы 2) и 5 из 5 собак (100%) из контрольной группы (группы 3). Среди 8-недельных собак, вирус выделяли из 1 из 5 собак (20%) из группы с 2 дозами вакцины (группы 4), и 4 из 5 собак (80%) из контрольной группы (группы 5). Имелось значимое уменьшение (P = 0,003) в количестве собак, позитивных в отношении вируса гриппа собачьих в пробах-мазках вследствие 2-дозовой вакцинации (группы 1 и 4) в сравнении с невакцинированными контролями (группами 3 и 5). Хотя имелось уменьшение количества собак (60% против 100%), позитивных в отношении вируса гриппа собачьих в пробах-мазках, между группой одноразовой вакцины (группой 2) и контрольной группой (группой 3), это различие не было статистически значимым (P=0,222).
Гистопатологическое оценивание проб тканей легких и трахеи в отношении повреждений проводили для идентификации повреждений, совместимых с заболеванием гриппом собачьих или патогномичных (характерных) для заболевания гриппа собачьих. Оно включает в себя, например, определение, присутствует ли одно или несколько из следующих признаков: зон с гноеродной бронхопневмонией; перибронхита/перибронхиолита с агрегацией мононуклеарных клеток (лимфоцитов, плазматических клеток); присутствия пробок гранулоцитарных клеточных остатков в просвете; гиперплазии респираторного эпителия; смешанного экссудата в альвеолах с большим количеством гранулоцитарных клеток и клеточных остатков; агрегатов (пенистых) макрофагов, плазматических клеток и лимфоцитов и утолщения межальвеолярных перегородок с пролиферацией пневмоцитов типа II.
Таблица 40 обеспечивает суммирование степени повреждений в этом эксперименте для испытанных собак. Среди 14-недельных собак, повреждения легких были менее обширными и менее тяжелыми в 5 из 7 собак в группе с 2-дозовой вакцинацией (группе 2) и 4 из 5 собак в группе с 1-дозовой вакцинацией (группе 1). Все контрольные собаки (группа 3) имели тяжелые и обширные повреждения, предполагающие отсутствие защиты. Не было различия в трахеальных повреждениях вследствие 1- или 2-дозовой вакцинации среди 14-недельных собак. Среди 8-недельных собак не было различия в повреждениях легких между вакцинатами с 2 дозами и контрольными собаками. Ни одна из этих собак не имела никаких трахеальных повреждений.
Заключение
Результаты из этого исследования демонстрируют, что: (1) инактивированный вирус гриппа лошадиных H3N8 может индуцировать перекрестно реактивные реакции антител HI с вирусом гриппа собачьих в вакцинированных собаках, (2) применение вакцины вируса лошадиных H3N8 может уменьшать тяжесть заболевания, вызываемого вирусом гриппа собачьих, в собаках, и (3) применение вакцины вируса гриппа лошадиных H3N8 может уменьшать экскрецию вируса в выделениях из носа и/или выделениях из полости рта.
Таблица 37
Серология - Титры ингибирования гемагглютинации
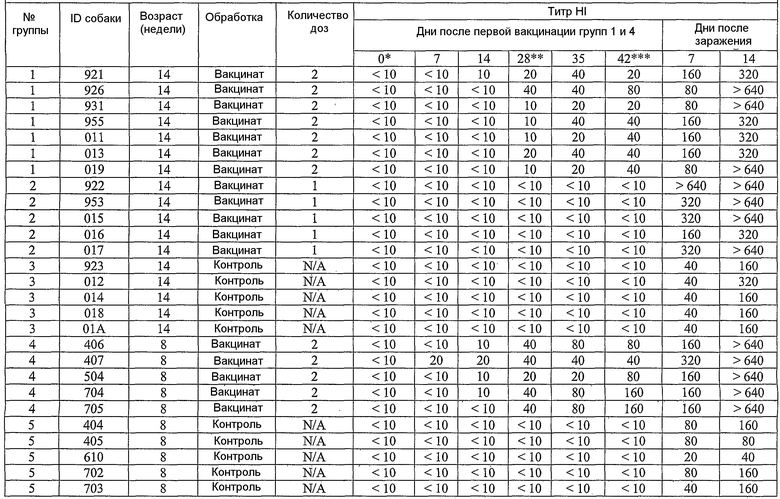
*Первая вакцинация - группы 1 и 4
**Вторая вакцинация - группы 1 и 4; Первая вакцинация - группа 2
***День заражения
Таблица 39
Выделение вируса хозяином
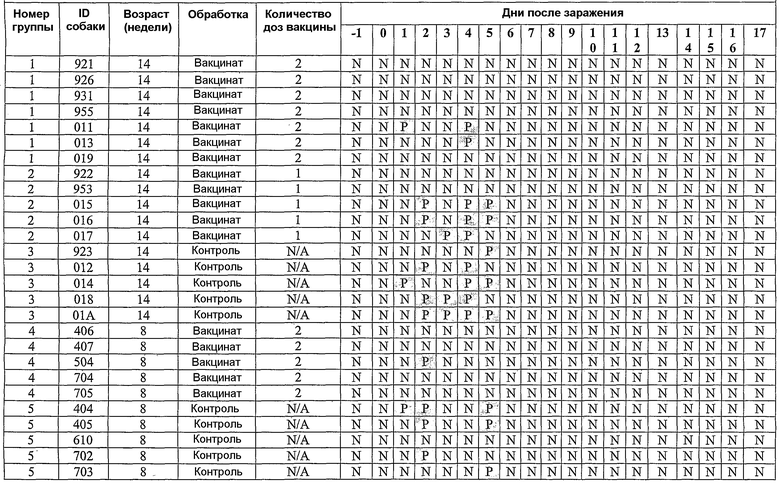
Таблица 40
Гистопатологическое оценивание проб тканей
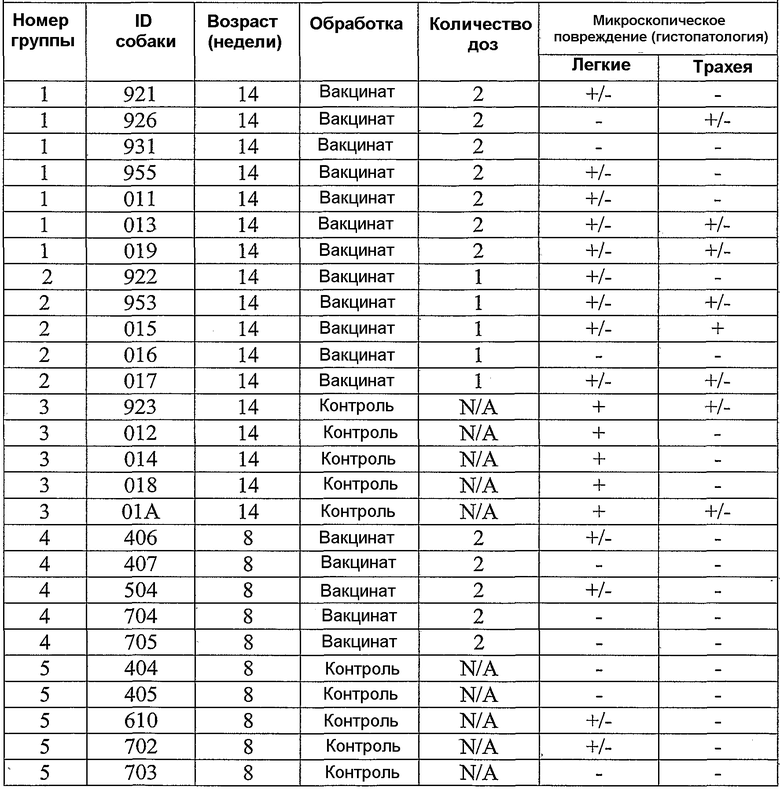
"+" Тяжелое повреждение, согласующееся с инфекцией гриппа или патогномичное для инфекции гриппа
"+/-" Легкое повреждение (неубедительное)
"-" Нормальное состояние
ПРИМЕР 23 - ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПРОТИВ ГРИППА СОБАЧЬИХ
Следующее исследование проводили для определения эффективности мультивалентной вакцины против гриппа лошадиных H3N8 против вируса гриппа собачьих в собаках.
Процедура
Семнадцать 15-недельных биглей получали от коммерческого поставщика. Этих собак случайным образом относили к 3 группам, как показано в таблице 41 и содержали в помещении для исследований.
Вакциной, используемой в этом исследовании, была дополненная адъювантом HAVLOGEN®, инактивированная вакцина против гриппа лошадиных (A/equine/KY/02, A/equine/KY/93 и A/equine/NM/2/93). Для получения этой вакцины вирусы инактивировали бинарным этиленимином (BEI) с использованием стандартного способа. Каждая доза вакцины содержала HAVLOGEN® (10% об./об.), 2048 единиц HA каждого из инактивированных вирусов, 0,1% (об./об.) 10% тимеросала, 0,1% (об./об.) фенолового красного, достаточное количество NaOH для доведения pH до 6,8-7,2 и достаточное количество ЗФР для доведения общего объема дозы до 1 мл.
Собак в группе 1 вакцинировали 2 дозами этой вакцины. Вторую дозу (т.е. бустер) вводили спустя 4 недели после первой дозы. Собак в группе 2 вакцинировали 1 дозой вакцины при возрасте 9 недель. Пробы крови собирали для оценивания титра HI с использованием стандартного протокола с изолятом гриппа собачьих H3N8 в дни 0 (перед вакцинацией), 7 и 14 после первой и второй вакцинациями. За 7 дней перед заражением этих собак перемещали в помещение BSL-2 и содержали в отдельных клетках.
Всех вакцинированных собак (вакцинаты) и контрольных собак того же возраста заражали ротоносовым способом вирулентным вирусом гриппа собачьих (107,3 TCID50 A/Canine/Florida/242/2003 на одну собаку) при 2 неделях после второй вакцинации группы 1 и первой вакцинации группы 2. Вирус заражения вводили в виде аэрозоля («тумана») с использованием распылителя (Nebulair™) при 2 мл на одну собаку. Этих собак наблюдали в отношении связанных с гриппом клинических симптомов в течение 14 дней после заражения. Всех собак эвтанизировали в день 14 и пробы легких и трахеи собирали в 10% забуференном формалине для гистопатологии. Пробы крови собирали в дни 7 и 14 после заражения для определения титра HI. Назначения оценок, используемых для клинических симптомов во время наблюдения после заражения, показаны в таблице 42.
Результаты
Все вакцинированные собаки развивали реакции титра антител HI против изолята вируса гриппа собачьих (таблица 43). После заражения, приблизительно 4-кратное увеличение титра в день 14 после заражения во всех группах опосредованно показало, что все собаки были подвергнуты действию вируса заражения. Все собаки обнаруживали один или несколько из следующих симптомов гриппа собачьих: лихорадки (>103,0°F; >39,4°C), кашля, серозного или слизисто-гнойного выделения из глаз, серозного или слизисто-гнойного выделения из носа, рвоты, диареи, депрессии, потери массы и одышки. Вакцинаты имели менее тяжелые клинические симптомы в сравнении с контролями того же возраста (таблица 44). Имелось значимое уменьшение клинических симптомов вследствие вакцинации в виде 2 доз (P=0,028) (группа 1). Однодозовая вакцинация не давала значимого (P=0,068) уменьшения клинических симптомов (группа 2).
Как и в примере 22, гистопатологическое оценивание проб легких и трахеи в отношении повреждений проводили для идентификации повреждений, совместимых с заболеванием гриппом собачьих или патогномичных для заболевания гриппа собачьих. Таблица 45 обеспечивает суммирование степени повреждений в этом эксперименте для этих собак. Среди 15-недельных собак вакцинация собак 1 дозой или 2 дозами предотвращала повреждения в легких во всех собаках. Четыре из 5 контрольных собак (80%) имели тяжелую гноеродную бронхопневмонию, соответствующую заболеванию гриппом. Одна из 7 собак из группы с 2-дозовой вакцинацией (группы 1) и 1 из 5 собак из контрольной группы (группы 3) имела легкие повреждения трахеи, предполагающие трахеит, которые могли быть приписаны заболеванию гриппом.
Заключение
Результаты из этого исследования демонстрируют, что: (1) инактивированный вирус гриппа лошадиных H3N8 может индуцировать перекрестно реактивные реакции антител HI с вирусом гриппа собачьих в вакцинированных собаках, (2) применение вакцины вируса лошадиных H3N8 может уменьшать тяжесть заболевания, вызываемого вирусом гриппа собачьих, в собаках, и (3) применение вакцины вируса гриппа лошадиных H3N8 может уменьшать экскрецию вируса в выделениях из носа и/или выделениях из полости рта.
Таблица 42. Клинические симптомы и система оценивания
Таблица 43
Серология - Титры ингибирования гемагглютинации
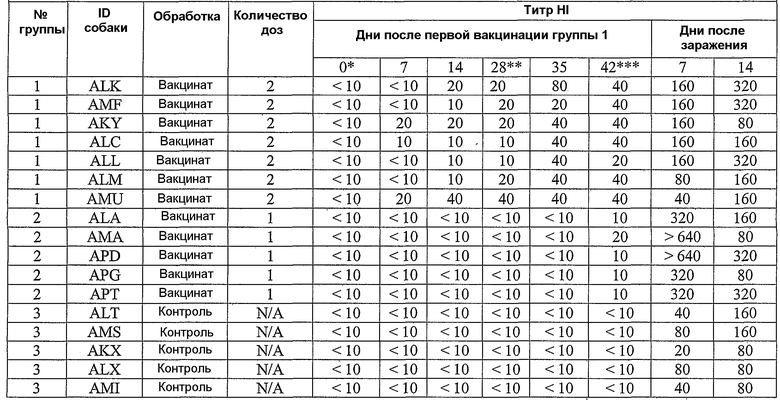
*Первая вакцинация - группа 1
**Вторая вакцинация - группа 1; Первая вакцинация - группа 2
***День заражения
(Группа 1 vs 3)
(Группа 2 vs 3)
Таблица 45
Гистопатологическое оценивание проб тканей
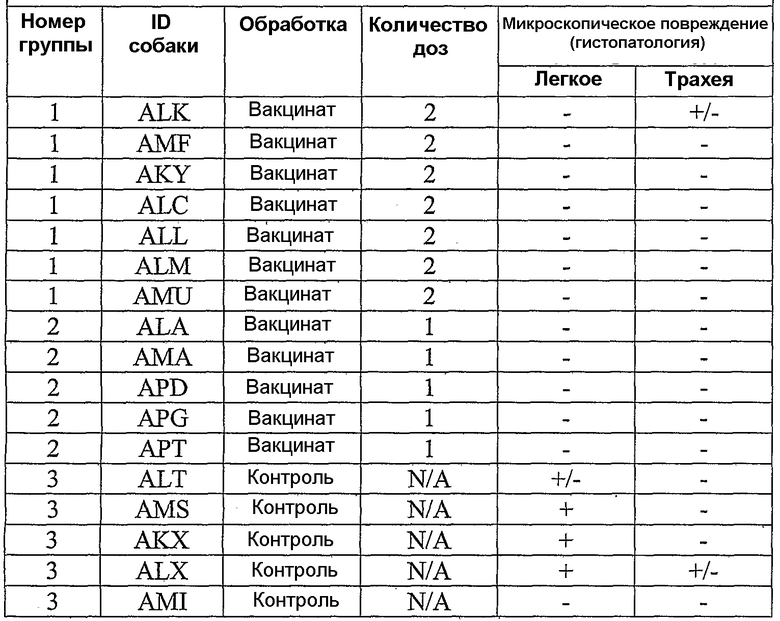
"+" Тяжелое повреждение, согласующееся с инфекцией гриппа или патогномичное для инфекции гриппа
"+/-" Легкие повреждения (неубедительные)
"-" Нормальное состояние
ПРИМЕР 24 - ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПРОТИВ ГРИППА СОБАЧЬИХ
Следующее исследование проводили для определения: (1) эффективности моновалентной вакцины в сравнении с мультивалентными вакцинами H3N8 гриппа лошадиных против вируса гриппа собачьих в собаках и (2) влияния способа введения на эффективность вакцины.
Процедура
Тридцать 1-недельных нечистопородных собак биглей получали от коммерческого поставшика. Этих собак случайным образом относили к 6 группам, как показано в таблице 46 и содержали в помещении для исследований.
Использовали три типа вакцин (VAX-1, VAX-2 и VAX-3). VAX-1 была дополненной адъювантом HAVLOGEN®, неинактивированной моновалентной вакциной вируса гриппа лошадиных (A/equine/KY/02), и каждая доза содержала HAVLOGEN® (10% об./об.), 6144 единиц HA инактивированного вируса, 0,1% (об./об.) 10% тимеросала, 0,1% (об./об.) фенолового красного, достаточное количество NaOH для доведения pH до 6,8-7,2 и достаточное количество ЗФР для доведения общего объема дозы до 1 мл. VAX-2 была дополненной адъювантом HAVLOGEN®, неинактивированной моновалентной вакциной вируса гриппа лошадиных (A/equine/KY/02), и каждая доза содержала HAVLOGEN® (10% об./об.), 4096 единиц HA инактивированного вируса, 0,1% (об./об.) 10% тимеросала, 0,1% (об./об.) фенолового красного, достаточное количество NaOH для доведения pH до 6,8-7,2 и достаточное количество ЗФР для доведения общего объема дозы до 1 мл. VAX-3 была дополненной адъювантом HAVLOGEN®, неинактивированной мультивалентной вакциной вируса гриппа лошадиных (A/equine/KY/02, A/equine/KY/93 and A/equine/NM/2/93) и содержала HAVLOGEN® (10% об./об.), 2048 единиц НА инактивированного вируса на штамм, 0,1% (об./об.) 10% тимеросала, 0,1% (об./об.) фенолового красного, достаточное количество NaOH для доведения pH до 6,8-7,2 и достаточное количество ЗФР для доведения общего объема дозы до 1 мл. Все вирусы гриппа, использованные для получения вакцинной композиции, инактивировали бинарным этиленимином (BEI) с использованием стандартного способа.
Эти вакцины и способы введения для каждой группы описаны в таблице 46. Всех собак в вакцинированных группах вакцинировали либо интраназальным (IN), либо подкожным (SQ) способом и каждая собака получала 2 дозы. Вторую, (т.е. бустерную) дозу вводили спустя 4 недели после первой дозы. Пробы крови собирали для оценивания титра HI с использованием стандартного протокола с изолятом гриппа собачьих H3N8 в дни 0 (перед вакцинацией), 7 и 14 после первой и второй вакцинациями. За 7 дней перед заражением этих собак перемещали в помещение BSL-2 и содержали в отдельных клетках.
Всех вакцинированных собак (вакцинаты) и контрольных собак того же возраста заражали ротоносовым способом вирулентным вирусом гриппа собачьих (107,4 TCID50 A/Canine/Florida/242/2003 на одну собаку) при 2 неделях после второй вакцинации. Вирус заражения вводили в виде аэрозоля («тумана») с использованием распылителя (Nebulair™) в объеме при 2 мл в день. Этих собак наблюдали в отношении связанных с гриппом клинических симптомов в течение 14 дней после заражения. Пробы крови собирали в дни 7 и 14 после заражения для определения титра HI. Всех собак эвтанизировали в день 14 и пробы легких и трахей собирали в 10% забуференном формалине для гистопатологии. Назначения оценок, используемых для клинических симптомов во время наблюдения после заражения, показаны в таблице 47.
Результаты
Все вакцинированные SQ-способом собаки развивали реакции титра антител HI против изолята вируса гриппа собачьих, независимо от типа вакцины (таблица 48). Ни одна из собак из групп с вакцинацией IN (т.е. групп 1, 3 и 5) не развивала реакции титра антител HI против изолята вируса гриппа собачьих, независимо от типа вакцины, во время периода после вакцинации. Однако имелось 4-кратное увеличение титра в день 14 после заражения во всех собаках при непрямом определении, что свидетельствовало о том, что все собаки были подвергнуты действию вируса заражения (таблица 47).
Все собаки обнаруживали один или несколько из следующих клинических симптомов гриппа собачьих: лихорадки (>103,0°F; >39,4°C), кашля, серозного или слизисто-гнойного выделения из глаз, серозного или слизисто-гнойного выделения из носа, рвоты, диареи, депрессии, потери массы и одышки. Вакцинаты имели менее тяжелые клинические симптомы в сравнении с контролями того же возраста (таблица 49). Имелось значимое уменьшение клинических симптомов в собаках, вакцинированных VAX-3 с использованием способа SQ (группа 4). В этом эксперименте, введение IN VAX-1, VAX-2, или VAX-3 не обнаруживало значимого уменьшения в клинических симптомах вируса гриппа собачьих.
Как в примерах 22 и 23, гистопатологическое оценивание проб легких и трахеи в отношении повреждений проводили для идентификации повреждений, совместимых с заболеванием гриппом собачьих или патогномичных для заболевания гриппа собачьих. Таблица 50 обеспечивает суммирование степени повреждений в этом эксперименте для этих собак. Пять из 5 контрольных собак (группа 6) имели соответствие повреждений легких с инфекцией гриппа. Две из 5 собак, вакцинированных VAX-2 способом SQ (группа 2) и 3 из 5 собак, вакцинированных VAX-3 способом SQ (группа 4) не имели каких-либо связанных с гриппом повреждений легких. Все собаки, которые получали вакцину интраназальным способом, независимо от типа вакцины, имели тяжелые повреждения легких, согласующиеся с инфекцией гриппа. Повреждения трахеи, наблюдаемые в этом исследовании, были очень слабыми.
Заключение
Результаты из этого исследования демонстрируют, что: (1) инактивированный вирус гриппа лошадиных H3N8 может индуцировать перекрестно реактивные реакции антител HI в собаках, вакцинированных SQ-способом, (2) интраназальное введение моновалентной (VAX-1 и VAX-2) или мультивалентной вакцины (VAX-3) не было эффективным в собаках, и (3) подкожное введение мультивалентной вакцины (VAX-3) обеспечивало значимое (Р=0,016) уменьшение тяжести заболевании вируса гриппа собачьих в собаках.
Таблица 48
Серология - Титры ингибирования гемагглютинации
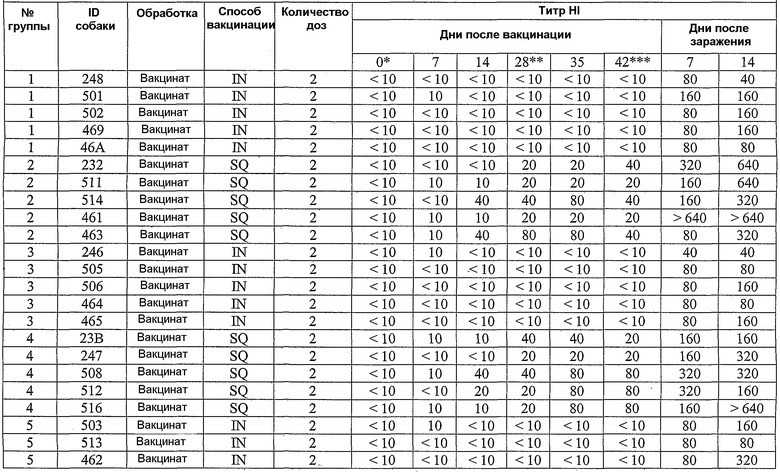
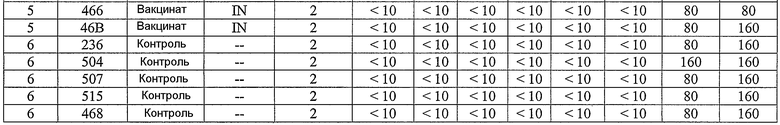
*Первая вакцинация
**Вторая вакцинация
***День заражения
Таблица 49
Анализ общих клинических оценок заболевания гриппа собачьих
Таблица 50
Гистопатологическое оценивание проб тканей
"+" Тяжелое повреждение, согласующееся с инфекцией гриппа или патогномичное для инфекции гриппа
"+/-" Легкое повреждения (неубедительное)
"-" Нормальное состояние
ПРИМЕР 25 - ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПРОТИВ ГРИППА СОБАЧЬИХ
Заболевание грипп собачьих вызывается вирусом гриппа H3N8 (CIV). CIV является очень близкородственным вирусам H3N8 лошадиных (Crawford et al, 2005) и инфицирует всех подвергнутых ему собак.
Приблизительно 80% подвергнутых его действию собак развивают клинические симптомы. В следующем исследовании определяли эффективность инактивированной вакцины вируса гриппа лошадиных H3N8 и вакцины вируса гриппа собачьих.
Процедура
В этом исследовании использовали тридцать пять биглей и пять нечистокровных собак. Биглей относили случайным образом к трем группам (таблица 51). Всех нечистокровных собак относили к контрольной группе (группе 3). Всех собак кормили стандартным рационом для роста и вода была доступна ad libitum.
Собак в группах 1 и 2 вакцинировали либо VAX-1, либо VAX-2 (таблица 51). VAX-1 была дополненной адъювантом HAVLOGEN®, инактивированной вакциной вируса гриппа лошадиных (A/equine/KY/02). Для получения вакцины вирус вакцины инактивировали бинарным этиленимином (BEI) с использованием стандартного способа. Каждая доза вакцины содержала HAVLOGEN® (10% об./об.), 6144 единиц HA инактивированного вируса, 0,1% (об./об.) 10% тимеросала, 0,1% (об./об.) фенолового красного, достаточное количество ЗФР для доведения общего объема дозы до 1 мл и достаточное количество NaOH для доведения pH до 6,8-7,2.
VAX-2 была инактивированной, дополненной адъювантом CARBIGEN™ вакциной вируса гриппа собачьих (A/canine/F1/43/2004). (A/canine/F1/43/2004) инактивировали бинарным этиленимином (BEI) с использованием стандартного способа. Каждая доза этой вакцины содержала 5%% масс. CARBIGEN™, приблизительно 1280 единиц НА инактивированного вируса, достаточное количество ЗФР для доведения общего объема дозы до 1 мл и достаточное количество NaOH для доведения pH до 7,2-7,4. Пробы сывороток собирали из всех собак в день первой и второй вакцинации, дни 7 и 14 после первой и второй вакцинаций и перед заражением для определения титров HI с использованием стандартного протокола для вируса гриппа лошадиных H3N8 (SAM 124, CVB, USDA, Ames, IA). За семь дней перед заражением этих собак перемещали в помещение ABSL-2 и содержали в отдельных клетках.
Всех вакцинированных собак и контрольных собак того же возраста заражали ротоносовым способом вирулентным вирусом гриппа собачьих (107,2 TCID50 A/Canine/Florida/242/2003 на одну собаку) при 2 неделях после второй вакцинации. Вирус заражения вводили в виде аэрозоля («тумана») (2 мл/собака) с использованием распылителя (Nebulair™). Этих собак наблюдали в отношении связанных с гриппом клинических симптомов в течение 14 дней после заражения. Мазки из носа и ротоглоточные мазки собирали один раз в день в пробирках, содержащих 2 мл среды для транспортировки вируса для выделения вируса от дня -1 (т.е. одного дня перед заражением) и до дня 14 после заражения. Пробы крови собирали в дни 7 и 14 после заражения для определения титра HI. Назначения оценок, используемых для клинических симптомов во время наблюдения после заражения, показаны в таблице 52.
Результаты
Все вакцинированные собаки (группы 1 и 2) развивали реакции титра антител HI против изолята вируса гриппа собачьих, независимо от типа вакцины (таблица 53). Все собаки обнаруживали один или несколько из следующих симптомов гриппа собачьих: лихорадки (>103,0°F; >39,4°C), кашля, серозного или слизисто-гнойного выделения из глаз, серозного или слизисто-гнойного выделения из носа, рвоты, диареи, депрессии, потери массы и анорексии. Вакцинаты имели менее тяжелые клинические симптомы в сравнении с контролями того же возраста (таблица 54). Имелось значимое (Р<0,001) уменьшение клинических симптомов в собаках, вакцинированных либо VAX-1 (группа 1), либо VAX-2 (группа 2).
Результаты выделения вируса показаны в таблицах 55 и 56. После заражения вирулентным вирусом гриппа собачьих, вирус гриппа собачьих выделяли из 5 из 15 (33%) собак из группы 1 (VAX-1), 0 из 5 (0%) собак из группы 2 (VAX-2) и 17 из 20 (85%) контролей (группа 3). Как вакцинированные инактивированной вакциной вируса гриппа лошадиных (VAX-1), так и вакцинированные вакциной вирусом гриппа собачьих (VAX-2) собаки показали значимое (P=0,004) уменьшение выделения вируса хозяином в выделениях из носа и из полости рта или в обоих случаях (таблица 55) в сравнении с контролями.
Заключение
Результаты из этого исследования демонстрируют, что: (1) инактивированные вакцины вируса гриппа лошадиных и вируса гриппа собачьих H3N8 могут индуцировать перекрестно реактивные реакции антител HI в вакцинированных собаках, (2) применение вакцины вируса гриппа лошадиных H3N8 или вируса гриппа собачьих может уменьшать тяжесть заболевания, вызываемого вирусом гриппа собачьих, в собаках и (3) применение вакцины вируса гриппа лошадиных H3N8 или вируса гриппа собачьих может уменьшать экскрецию вируса в выделениях из носа и/или выделениях из полости рта.
Таблица 53
Серология - Титры ингибирования гемагглютинации
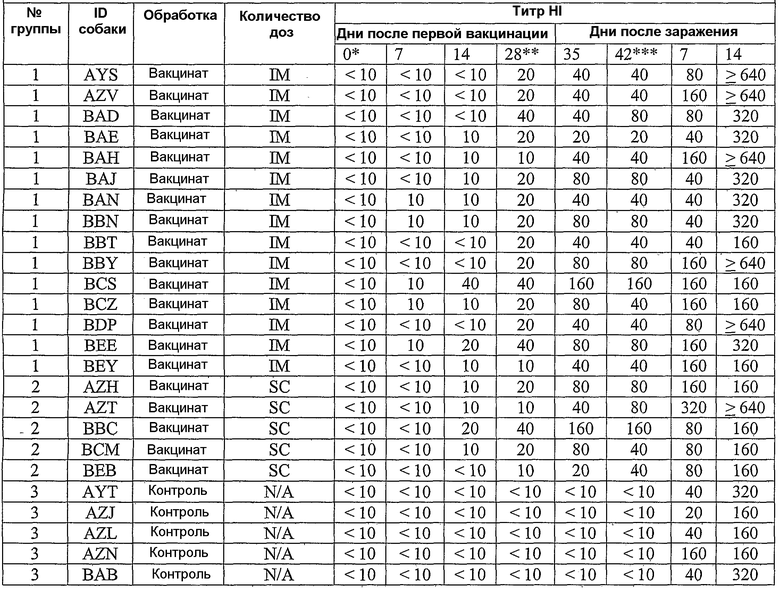
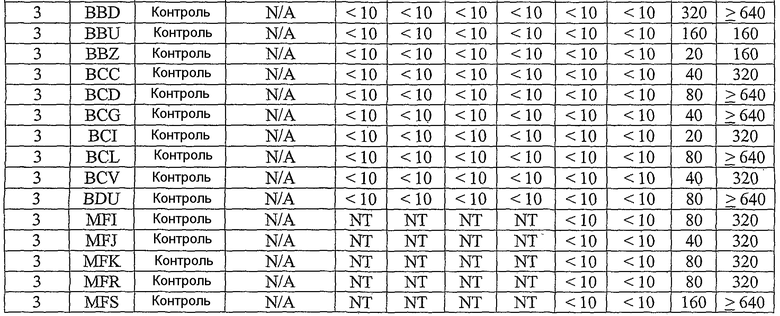
*Первая вакцинация
**Вторая вакцинация
***День заражения
Таблица 56
Серология - Титры ингибирования гемагглютинации
N - вирус не выделялся из мазков из полости рта носа или из носа
Р - вирус, выделенный из мазков из носа или мазков из полости рта или из мазков из носа и полости рта
Таблица 57
Сходства аминокислотных последовательностей генов гемагглютинина, нейраминидазы и нуклеопротеина среди вирусов гриппа
Слова «содержат», «содержит» и «содержащий» в этом патенте (в том числе в формуле изобретения) должны интерпретироваться как «включительно», а не как «исключительно». Имеется в виду, что эта интерпретация является такой же, что и интерпретация, которая придается этим словам согласно Патентному законодательству США.
Приведенное выше подробное описание предпочтительных вариантов осуществления предназначено только для ознакомления других квалифицированных специалистов в данной области с этим изобретением, его принципами и его практическим применением таким образом, чтобы другие квалифицированные специалисты в данной области могли адаптировать и использовать это изобретение в его многочисленных формах, так что они будут наилучшим образом соответствовать требованиям конкретного применения. Таким образом, это изобретение не ограничивается приведенными выше вариантами осуществления и может быть модифицировано разнообразным образом.
Должно быть понятно, что описанные здесь примеры и варианты осуществления приведены только для иллюстративных целей и что разнообразные модификации или изменения в свете данного описания будут подсказаны квалифицированным в данной области специалистам, и они должны находиться в пределах идеи и сферы действия этой заявки.
ССЫЛКИ
U.S. Patent No. 5,106,739
U.S. Patent No. 5,034,322
U.S. Patent No. 6,455,760
U.S. Patent No. 6,696,623
U.S. Patent No. 4,683,202
U.S. Patent No. 4,683,195
U.S. Patent No. 4,800,159
U.S. Patent No. 4,965,188
U.S. Patent No. 5,994,056
U.S. Patent No. 6,814,934
U.S. Patent No. 6,436,408
U.S. Patent No. 6,398,774
U.S. Patent No. 6,177,082
Published U.S. Application No. 20040078841
Published U.S. Application No. 20040067506
Published U.S. Application No. 20040019934
Published U.S. Application No. 20030177536
Published U.S. Application No. 20030084486
Published U.S. Application No. 20040123349
Greyhound Daily News, 1/28/99. National Greyhound Association (NGA), Abilene, Kansas. htφ://www.NGAgreyhounds.com.
Personal communication, Dr. William Duggar, veterinarian at Palm Beach Kennel Club, West Palm Beach, Florida.
Altschul, S.F. et al. (1990) "Basic Local Alignment Search Tool" J. MoI. Biol. 215:402-410.
Altschul, S.F. et al. (1997) "Gapped BLAST and PSI-BLAST: A New Generation of Protein Database Search Programs" Nucl. Acids Res. 25:3389-3402.
An, G. (1987) "Binary Ti vectors for plant transformation and promoter analysis" Methods Enzymol. 153:292-305.
Beltz, G.A., Jacobs, K.A., Eickbush, T.H., Cherbas, P.T., Kafatos, F.C. (1983) "Isolation of multigene families and determination of homologies by filter hybridization methods" Methods of Enzymology, R. Wu, L. Grossman and K. Moldave [eds.] Academic Press, New York 100:266-285.
Burleson, F. et al. (1992) Virology: A Laboratory Manual (Academic Press).
Byars, N.E., A.C. Allison (1987) "Adjuvant formulation for use in vaccines to elicit both cell- mediated and humoral immunity" Vaccine 5:223-228.
Crawford, P.C. et al. (2005) "Transmission of equine influenza virus to dogs" Science 310:482-485.
Chang, CP. et al. (1976) "Influenza virus isolations from dogs during a human epidemic in Taiwan" Int J Zoonoses 3:61-64.
Dacso, CC. et al. (1984) "Sporadic occurrence of zoonotic swine influenza virus infections" J Clin Microbiol 20:833-835.
de Boer, H.A., Comstock, L.J., Vasser, M. (1983) "The tac promoter: a functional hybrid derived from the trp and lac promoters" Proc. Natl. Acad. ScL USA 80(l):21-25.
Felsenstein, J. (1989) Cladistics 5:164.
Fields et al. (1946) Fields Virology, 3td ed., Lippincott-Raven publishers.
Ford, R.B., Vaden, S.L. (1998) "Canine infectious tracheobronchitis" In Infectious Diseases of the Dog and Cat, 2nd edition, CE. Greene, editor, W.B. Saunders Co., Philadelphia, PA, pp. 33-38.
Fouchier et al, (2000) Journal of Clinical Microbiology 38 (11):4096-4101.
Good, X. et al. (1994) "Reduced ethylene synthesis by transgenic tomatoes expressing S-adenosylmethionine hydrolase" Plant Molec. Biol. 26:781-790.
Guan, Y. et al. (2004) "H5N1 influenza: a protean pandemic threat" Proc Natl Acad Sd US A 101:8156-8161.
Guo, Y. et al. (1992) "Characterization of a new avian-like influenza A virus from horses in China" Virology 188:245-255.
Houser, R.E. et al. (1980) "Evidence of prior infection with influenza A/Texas/77 (H3N2) virus in dogs with clinical parainfluenza" Can J Conip Med 44:396-402.
Karasin, A.I. et al. (2000) "Isolation and characterization of H4N6 avian influenza viruses from pigs with pneumonia in Canada" J Virol 74:9322-9327.
Karlin S. and Altschul, S.F. (1990) "Methods for Assessing the Statistical Significance of Molecular Sequence Features by Using General Scoring Schemes" Proc. Natl. Acad. Sci. USA 87:2264-2268.
Karlin S. and Altschul, S.F. (1993) "Applications and Statistics for Multiple High-Scoring Segments in Molecular Sequences" Proc. Natl. Acad. Sci. USA 90:5873-5877.
Kawaoka, Y. et al, (1989) "Avian-to-human transmission of the PBl gene of influenza A viruses in the 1957 and 1968 pandemics" J Virol 63:4603-4608.
Keawcharoen, J. et al. (2004) "Avian influenza H5N1 in tigers and leopards" Emerg Infect Dis 10:2189-2191.
Kendal, A.P. et al. (1982) In Concepts and Procedures for Laboratory-based Influenza Surveillance. A.P. Kendal, M.S. Pereira, J.J. Skehel, Eds. (U.S. Department of Health and Human Services, Centers for Disease Control and Prevention and PanAmerican Health Organization, Atlanta, GA, United States) pp. B17-B35.
Kilbourne, E.D. et al. (1975) "Demonstration of antibodies to both hemagglutinin and neuraminidase antigens of H3N2 influenza A virus in domestic dogs" Intervirology 6:315-318.
Kimura, K. et al. (1998) "Fatal case of swine influenza virus in an immunocompetent host" Mayo Clin Proc 12>:2A3-2A5.
Klimov, A.I. et al. (1992a) "Sequence changes in the live attenuated, cold-adapted variants of influenza A/Leningrad/134/57 (H2N2) virus" Virology 186:795-797.
Klimov A. et al. (1992b) "Subtype H7 influenza viruses: comparative antigenic and molecular analysis of the HA-, M-, and NS-genes" Arch Virol. 122:143-161.
Kovacova, A. et al. (2002) "Sequence similarities and evolutionary relationships of influenza virus A hemagglutinins" Virus Genes 24:57-63.
Kuiken, T. et al. (2004) "Avian H5N1 influenza in cats" Science 306:241.
Kumar, S. et al. (2004) "MEGA3: Integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment" Brief Bioinform 5:150-163.
Lee, L.G. et al. (1993) "Allelic discrimination by nick-translation PCR with fluorogenic probes" Nucleic Acids Res. 21(16):3761-3766.
Lewin, B. (1985) Genes IL John Wiley & Sons, Inc., p. 96.
Lipatov, A.S. et al. (2004) "Influenza: emergence and control" J Virol 78:8951-8959.
Livak, K.J. et at (1995) "Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization" PCR Methods Appl 4(6):357-362.
Maniatis, T., E.F. Fritsch, J. Sambrook (1982) "Nuclease BaBl" Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
Matrosovich, M. et at (2000) "Early alterations of the receptor-binding properties of H1, H2, and H3 avian influenza virus hemagglutinins after their introduction into mammals" J Virol 74:8502-8512.
Maertzdorf et at, (2004) Clin Microbiol. 42(3):981-986.
Merrifield, R.B. (1963) "Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide" J. Amer. Chem. Soc. 85:2149-2154.
Nikitin, A. et at (1972) "Epidemiological studies of A-Hong Kong-68 virus infection in dogs" Bull World Health Organ 47:471-479.
Nobusawa, E. et at (1991) "Comparison of complete amino acid sequences and receptor-binding properties among 13 serotypes of hemagglutinins of influenza A viruses" Virology 182:475-485.
Patriarca, P.A. et at (1984) "Lack of significant person-to person spread of swine influenza-like virus following fatal infection in an immunocompromised child" Am J Epidemiol 119:152-158.
Payungporn S. et at (2006a) "Detection of canine influenza A virus (H3N8) RNA by real-time RT-PCR" (in preparation for Journal of Clinical Microbiology).
Payungporn S, et at (2006b) "Isolation and characterization of influenza A subtype H3N8 viruses from dogs with respiratory disease in a shelter and veterinary clinic in Florida" (in preparation for Emerging Infectious Diseases).
Peiris, M. et at (1999) "Human infection with influenza H9N2" Lancet 354:916-917.
Peiris, J.S. et at (2004) "Re-emergence of fatal human influenza A subtype H5N1 disease" Lancet 363:617-619.
Posnett, D.N. et at (1988) "A Novel Method for Producing Anti-peptide Antibodies" J. Biol. Chem. 263(4):1719-1725.
Putnam, Bob (February 10, 1999) "Two illnesses seen in death of dogs" St. Petersburg Times.
Reid, A.H. et at (2004) "Evidence of an absence: the genetic origins of the 1918 pandemic influenza virus" Nat Rev Microbiol 2:909-914.
Rowe, T. et al. (1999) "Detection of antibody to avian influenza A (H5N1) virus in human serum by using a combination of serologic assays" J Clin Microbiol 37: 937-943.
Saiki, R. (1985) "Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia" Science 230:1350-1354.
Sambrook, J. et al. (1989) "Plasmid Vectors" In: Molecular Cloning: A Laboratory Manual, 2d Edition, pp. 1.82-1.104. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
Subbarao, K. et al. (1998) "Characterization of an avian influenza A (H5N1) virus isolated from a child with a fatal respiratory illness" Science 279:393-396.
Suzuki, Y. et al. (2000) "Sialic acid species as a determinant of the host range of influenza A viruses" J Virol 74: 11825-11831.
Tam, J.P. (1988) "Synthetic Peptide Vaccine Design: Synthesis and Properties of a High-Density Multiple Antigenic Peptide System" PNAS USA 85(15):5409-5413.
Top, Jr., F.H. et al. (1977) "Swine influenza A at Fort Dix, New Jersey (January-February 1976). IV. Summary and speculation" J Infect Dis 136 Suppl:S376-S380.
Vines, A. et al. (1998) "The role of influenza A virus hemagglutinin residues 226 and 228 in receptor specificity and host range restriction" J Virol 72:7626-7631.
Wagner, R. et al. (2002) "N-Glycans attached to the stem domain of haemagglutinin efficiently regulate influenza A virus replication" J Gen Virol 83:601-609.
Webby, R. et al. (2004) "Molecular constraints to interspecies transmission of viral pathogens" Nat Med 10:S77-S81.
Webster, R.G. (1998) "Influenza: an emerging disease" Emerg Infect Dis. 4:436-441.
Webster, R.G. et al. (1992) "Evolution and ecology of influenza A viruses" Microbiol Rev. 56 :152-179.
Weis, W. et al. (1988) "Structure of the influenza virus haemagglutinin complexed with its receptor, sialic acid" Nature 333:426-431.
Womble, D.D. (2000) "GCG: The Wisconsin Package of sequence analysis programs" Methods Mol Biol 132:3-22.
Xu, D., McElroy, D., Thornburg, R. W., Wu, R. et al. (1993) "Systemic induction of a potato pin2 promoter by wounding, methyl jasmonate, and abscisic acid in transgenic rice plants" Plant Molecular Biology 22:573-588.
Yang, T.T. et al. (1996) "Optimized Codon Usage and Chromophore Mutations Provide Enhanced Sensitivity with the Green Fluorescent Protein" Nucleic Acid Research 24(22):4592-4593.
Yoon K-Y. et al. (2005) "Influenza virus infection in racing greyhounds" Emerg Infect Dis. 11:1974-1975.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2711807C2 |
| ШТАММ ВИРУСА ГРИППА А СОБАК (ВАРИАНТЫ), ИММУНОГЕННЫЙ ПОЛИПЕПТИД, ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ЕГО, ВЕКТОР ЭКСПРЕССИИ ПОЛИПЕПТИДА, ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПОЛИПЕПТИД, И СПОСОБ ИНДУКЦИИ ИММУННОГО ОТВЕТА У ЖИВОТНОГО | 2006 |
|
RU2449014C2 |
| МАТЕРИАЛЫ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СОБАК | 2011 |
|
RU2711791C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2802222C2 |
| МАТЕРИАЛЫ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СОБАК | 2020 |
|
RU2811752C2 |
| ВИРУС СОБАЧЬЕГО ГРИППА, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТОТ ВИРУС, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2410427C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ВИРУСНОГО ВЕКТОРА APMV-8 | 2010 |
|
RU2592544C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2583289C2 |
| ВАРИАНТЫ ГЕМАГГЛЮТИНИНА И НЕЙРАМИНИДАЗЫ ГРИППА | 2010 |
|
RU2535970C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2773402C2 |
































































































































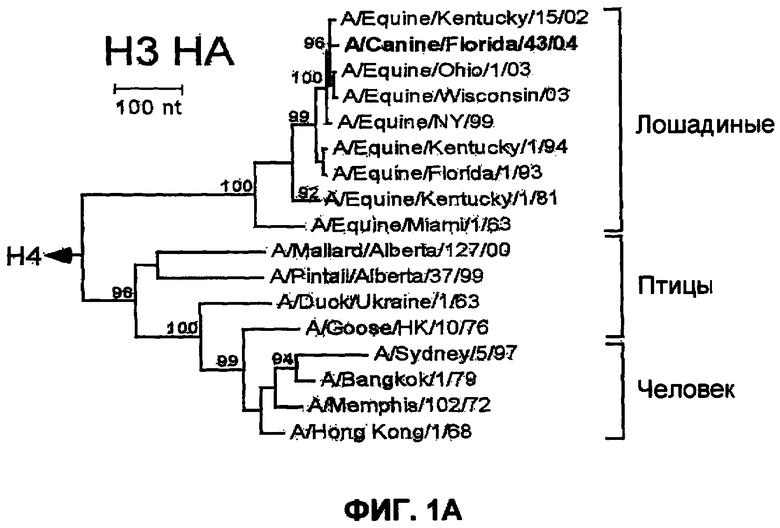
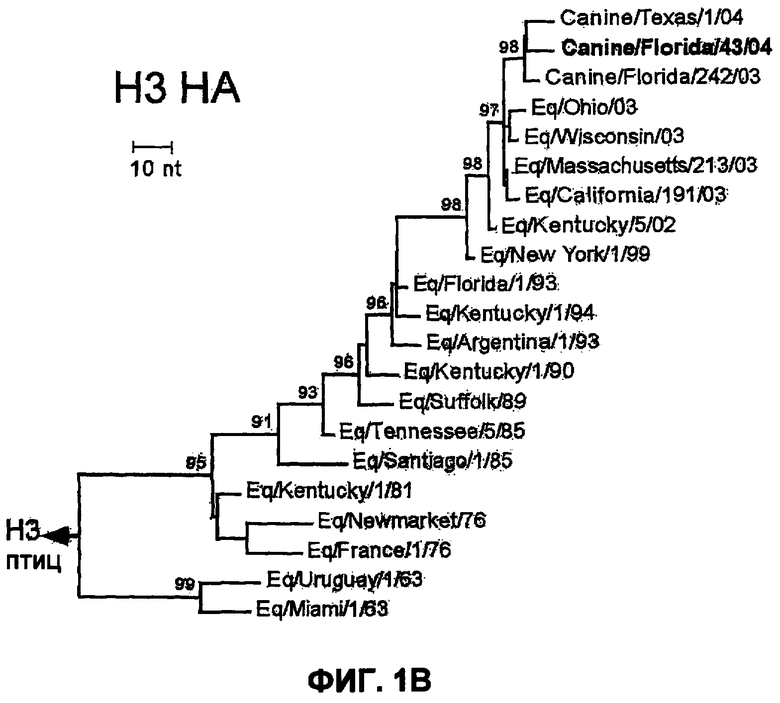







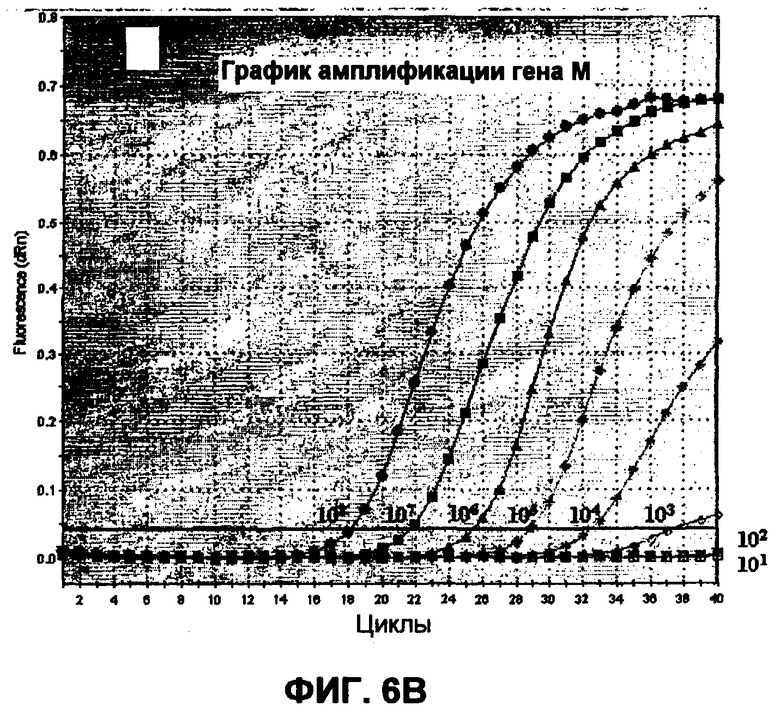
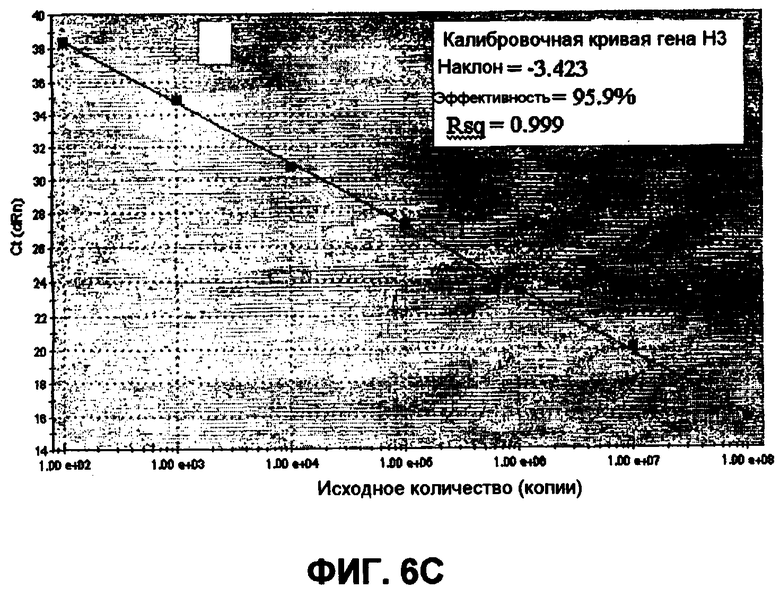
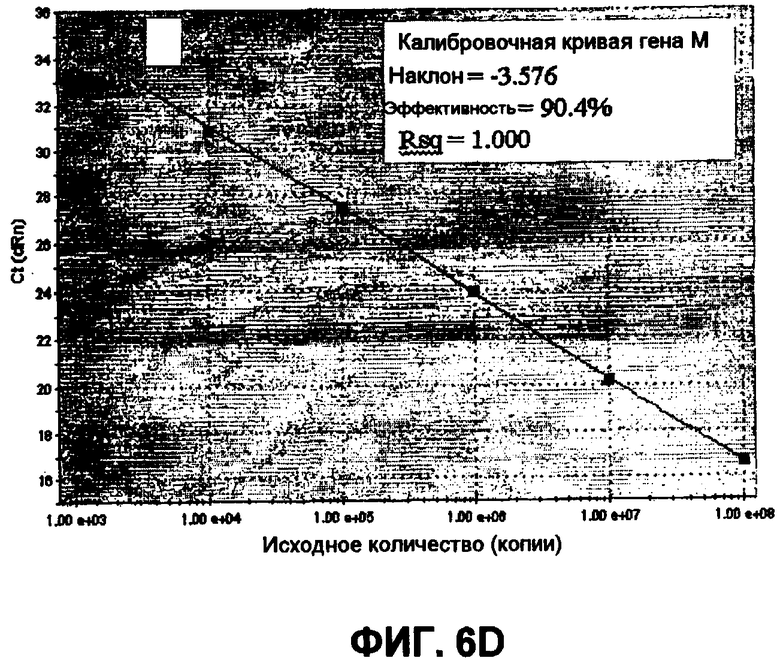
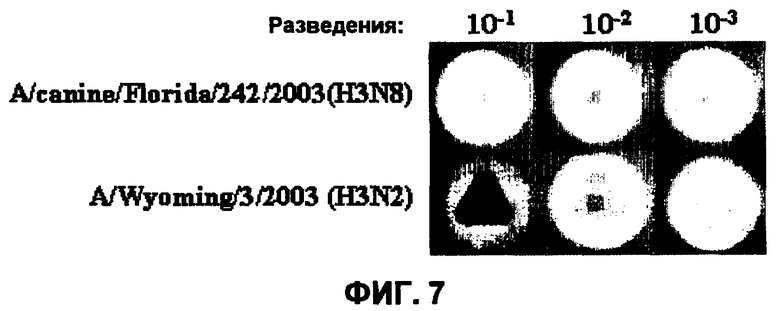
Изобретение относится к области биотехнологии и вирусологии. Представлены выделенные штаммы вируса гриппа, которые способны инфицировать собачьих и вызывать респираторное заболевание в собачьих. Описаны также композиции и способы для индукции иммунного ответа против вируса гриппа у собачьих. Также раскрыты композиции и способы для идентификации вируса изобретения и диагностики инфекции животного вирусом гриппа. 14 н. и 34 з.п. ф-лы, 14 ил., 57 табл., 25 пр.
1. Штамм A/canine/Florida/43/04 вируса гриппа собачьих A, подтипа H3N8, депонированный в АТТС под номером доступа РТА-7914, являющийся продуцентом полипептидов, индуцирующих иммунный ответ против вируса гриппа, который способен инфицировать животное семейства собачьих, при этом геном указанного вируса содержит полинуклеотид, который кодирует полипептид, имеющий аминокислотную последовательность, показанную в виде любой из SEQ ID No: 2, 4, 6, 8, 10, 12, 14, 16 или 33, или его функциональный и/или иммуногенный фрагмент, или указанный полинуклеотид кодирует полипептид, характеризующийся 99%-ной или большей идентичностью последовательности с аминокислотной последовательностью, показанной в виде любой из SEQ ID No: 2, 4, 6, 8, 10, 12, 14, 16 или 33, где указанный штамм является инактивированным или аттенуированным.
2. Штамм A/canine/Florida/242/2003 вируса гриппа собачьих A, подтипа H3N8, депонированный в АТТС под номером доступа РТА-7915, являющийся продуцентом полипептидов, индуцирующих иммунный ответ против вируса гриппа, который способен инфицировать животное семейства собачьих, при этом геном указанного вируса содержит полинуклеотид, который кодирует полипептид, имеющий аминокислотную последовательность, показанную в виде любой из SEQ ID No: 18, 20, 22, 24, 26, 28, 30, 32 или 34, или его функциональный и/или иммуногенный фрагмент, или указанный полинуклеотид кодирует полипептид, характеризующийся 99%-ной или большей идентичностью последовательности с аминокислотной последовательностью, показанной в виде любой из SEQ ID No: 18, 20, 22, 24, 26, 28, 30, 32 или 34, где указанный штамм является инактивированным или аттенуированным.
3. Штамм canine/Miami/05 вируса гриппа собачьих A, подтипа H3N8, депонированный в АТТС под номером доступа РТА-7940, являющийся продуцентом полипептидов, индуцирующих иммунный ответ против вируса гриппа, который способен инфицировать животное семейства собачьих, при этом геном указанного вируса содержит полинуклеотид, который кодирует полипептид, имеющий аминокислотную последовательность, показанную в виде любой из SEQ ID No: 48, 50, 52, 54, 56, 58, 60 или 62, или его функциональный и/или иммуногенный фрагмент, или указанный полинуклеотид кодирует полипептид, характеризующийся 99%-ной или большей идентичностью последовательности с аминокислотной последовательностью, показанной в виде любой из SEQ ID No: 48, 50, 52, 54, 56, 58, 60 или 62, где указанный штамм является инактивированным или аттенуированным.
4. Штамм canine/Jax/05 вируса гриппа собачьих A, подтипа H3N8, депонированный в АТТС под номером доступа РТА-7941, являющийся продуцентом полипептидов, индуцирующих иммунный ответ против вируса гриппа, который способен инфицировать животное семейства собачьих, при этом геном указанного вируса содержит полинуклеотид, который кодирует полипептид, имеющий аминокислотную последовательность, показанную в виде любой из SEQ ID No: 64, 66, 68, 70, 72, 74, 76 или 78, или его функциональный и/или иммуногенный фрагмент, или указанный полинуклеотид кодирует полипептид, характеризующийся 99%-ной или большей идентичностью последовательности с аминокислотной последовательностью, показанной в виде любой из SEQ ID No: 64, 66, 68, 70, 72, 74, 76 или 78, где указанный штамм является инактивированным или аттенуированным.
5. Выделенный полинуклеотид из вируса по любому из пп.1-4, где полинуклеотид кодирует иммуногенный полипептид, индуцирующий иммунный ответ против вируса гриппа, который способен инфицировать животное семейства собачьих, где указанный полипептид имеет аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или его функциональный и/или иммуногенный фрагмент, или указанный полинуклеотид кодирует полипептид, имеющий 99% или более высокую идентичность последовательности, показанной в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, и где указанный полинуклеотид приготовлен в фармацевтически приемлемом носителе или разбавителе.
6. Полинуклеотид по п.5, где указанный полинуклеотид содержит весь ген или часть гена гриппа, выбранного из группы, состоящей из гена нейраминидазы, гена нуклеопротеина, гена матриксного белка, гена основного белка полимеразы, гена кислого белка полимеразы, гена неструктурного белка и гена гемагглютинина.
7. Полинуклеотид по п.5, где указанный полинуклеотид имеет нуклеотидную последовательность, показанную в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77, или указанный полинуклеотид имеет 98% или более высокую идентичность последовательности с нуклеотидной последовательностью, показанной в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75 или 77.
8. Полинуклеотидная экспрессионная конструкция, содержащая полинуклеотид по п.5, дополнительно содержащая полинуклеотид, который обеспечивает экспрессию полинуклеотида вируса гриппа собачьих в клетке-хозяине.
9. Выделенный полипептид, индуцирующий иммунный ответ против вируса гриппа, который способен инфицировать животное семейства собачьих, кодируемый полинуклеотидом по п.5, где указанный полипептид приготовлен в фармацевтически приемлемом носителе или разбавителе.
10. Полипептид по п.9, где указанный полипептид выбран из группы, состоящей из белка гемагглютинина, белка нейраминидазы, нуклеопротеина, матриксного белка, основного белка полимеразы, кислого белка полимеразы и неструктурного белка.
11. Полипептид по п.9, где указанный полипептид содержит аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или его функциональный и/или иммуногенный фрагмент.
12. Иммуногенная композиция, содержащая эффективное количество полипептида по п.10 или 11, где указанный полипептид способен индуцировать иммунный ответ против вируса гриппа, который способен инфицировать животное семейства собачьих, и где указанная композиция приготовлена в фармацевтически приемлемом носителе или разбавителе.
13. Композиция по п.12, где указанный полипептид содержит аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78.
14. Способ индуцирования иммунного ответа в животном против вируса гриппа, способного инфицировать животное семейства собачьих, причем указанный способ предусматривает введение указанному животному эффективного количества композиции по п.12.
15. Способ по п.14, где указанная композиция содержит полипептид, содержащий аминокислотную последовательность, показанную в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 33, 34, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76 или 78, или его функциональный и/или иммуногенный фрагмент.
16. Способ по п.14, где указанная композиция содержит вирус гриппа или часть указанного вируса, которые способны инфицировать животное семейства собачьих.
17. Способ по п.14, где указанный иммунный ответ является защитным иммунным ответом, который предотвращает или ингибирует инфекцию указанного животного вирусом гриппа.
18. Способ по п.14, где указанный вирус гриппа имеет серотип НА, выбранный из Н3.
19. Способ по п.14, где указанный вирус гриппа имеет серотип H3N8.
20. Способ по п.14, где указанная композиция дополнительно содержит адъювант.
21. Способ по п.14, где указанное животное является животным семейства собачьих.
22. Способ по п.14, где указанным животным является домашняя собака.
23. Способ по п.14, где указанную композицию вводят парентерально.
24. Способ по п.14, где указанную композицию вводят подкожно, внутрибрюшинно или внутримышечно.
25. Способ по п.14, где указанную композицию вводят назально или перорально.
26. Способ по п.14, где указанная композиция содержит полинуклеотид, кодирующий полипептид гемагглютинина (ГА) имеющего 99% или выше идентичности аминокислотной последовательности к полипептиду ГА вирусного изолята обозначенного как canine/Jax/05 или к полипептиду ГА вирусного изолята обозначенного как canine/Miami/05.
27. Способ по п.14, где указанная композиция содержит полипептид гемагглютинина (ГА) имеющего 99% или выше идентичности аминокислотной последовательности к полипептиду ГА вирусного изолята обозначенного как canine/Jax/05 или к полипептиду ГА вирусного изолята обозначенного как canine/Miami/05.
28. Способ защиты собачьих от инфекции вируса гриппа Н3, где этот способ предусматривает введение собачьим терапевтически эффективного количества вакцины, содержащей один или несколько антигенов из одного или нескольких из следующих вирусных изолятов гриппа собачьих: A/canine/Florida/43/2004, A/canine/Florida/242/2003, canine/Jax/05 и canine/Miami/05, где указанные вирусные антигены содержат инактивированные или аттенуированные вирусы.
29. Способ по п.28, где вакцину вводят подкожно.
30. Способ по п.28, где вакцину вводят интраназально.
31. Способ по п.28, где вакцину вводят собачьим один раз.
32. Способ по п.28, где вакцину вводят собачьим по меньшей мере два раза.
33. Способ по п.32, где вторую дозу вакцины вводят собачьим от приблизительно 2 до приблизительно 8 недели после первой дозы.
34. Способ по п.28, где вакцину вводят в комбинации по меньшей мере с одной вакциной, выбранной из группы, состоящей из вакцины против Bordetella, вакцины против аденовируса и вакциной против вируса парагриппа.
35. Вакцина против вируса гриппа, который способен инфицировать животное семейства собачьих, содержащая вирус гриппа собачьих по любому из пп.1-4, или полинуклеотидную экспрессионную конструкцию по п.8, или полипептид по п.10 или 11, или композицию по п.12 или 13.
36. Вакцина по п.35, где вакцина содержит по меньшей мере один фармацевтически приемлемый наполнитель.
37. Способ защиты собачьих от инфекции посредством вируса гриппа собачьих, включающий введение животному семейства собачьих терапевтически эффективного количества вакцины по п.35 или 36.
38. Рекомбинантный вирусный вектор, содержащий полинуклеотид, кодирующий гемагглютинин (НА), содержащий аминокислотную последовательность SEQ ID NO: 33 или аминокислотную последовательность, имеющую более чем 95% идентичность аминокислотной последовательности с SEQ ID NO: 33, где указанный белок НА содержит серии в положении 82, лейцин в положении 221, треонин в положении 327 и треонин в положении 482 аминокислотной последовательности.
39. Рекомбинантный вирусный вектор по п.38, где указанный полинуклеотид кодирует гемагглютинин (НА), который содержит аминокислотную последовательность SEQ ID NO: 16 или аминокислотную последовательность, имеющую более чем 95% идентичности аминокислотной последовательности с SEQ ID NO: 16.
40. Рекомбинантный вирусный вектор по п.38, где указанный полинуклеотид содержит нуклеотидную последовательность SEQ ID NO: 15 или нуклеотидную последовательность, имеющую 98% или более идентичность последовательности с SEQ ID NO: 15.
41. Рекомбинантный вирусный вектор по п.38 или 39, где указанный вирусный вектор получен из аденовируса, авипоксвируса, герпесвируса, вируса коровьей оспы, канарипоксвируса, энтомопоксвируса, вируса оспы свиней или вируса лихорадки Западного Нила.
42. Рекомбинантный вирусный вектор по любому из пп.38-40, где указанный вирусный вектор представляет собой вектор канарипоксивируса.
43. Полинуклеотидный вектор, содержащий полинуклеотид, кодирующий гемагглютинин (НА), содержащий аминокислотную последовательность SEQ ID NO: 33 или аминокислотную последовательность, имеющую более чем 95% идентичность аминокислотной последовательности с SEQ ID NO: 33, где указанный белок НА содержит серии в положении 82, лейцин в положении 221, треонин в положении 327 и треонин в положении 482 аминокислотной последовательности.
44. Полинуклеотидный вектор по п.43, где указанный полинуклеотид кодирует гемагглютинин (НА), который содержит аминокислотную последовательность SEQ ID NO: 16 или аминокислотную последовательность, имеющую более чем 95% идентичность аминокислотной последовательности с SEQ ID NO: 16.
45. Полинуклеотидный вектор по п.43, где указанный полинуклеотид содержит нуклеотидную последовательность SEQ ID NO: 15 или нуклеотидную последовательность, имеющую 98% или более идентичность последовательности с SEQ ID NO: 15.
46. Полинуклеотидный вектор по любому из пп.43-45, где указанный полинуклеотид представляет собой вирусный вектор.
47. Полинуклеотидный вектор по п.46, где указанный вирусный вектор получен из аденовируса, авипоксвируса, герпесвируса, вируса коровьей оспы, канарипоксвируса, энтомопоксвируса, вируса оспы свиней или вируса лихорадки Западного Нила.
48. Полинуклеотидный вектор по п.46, где указанный вирусный вектор представляет собой вектор канарипоксивируса.
| PEEK S.F | |||
| et al., "Acute respiratory distress syndrome and fatal interstitial pneumonia associated with equine influenza in a neonatal foal", J Vet Intern Med | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| WO 2004057021 A, 08.07.2004 | |||
| WOOD J.M | |||
| et al., "The standardization of inactivated equine influenza vaccines by single-radial immunodiffusion", J Biol Stand | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
Авторы
Даты
2014-06-20—Публикация
2006-10-19—Подача