1. Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки на патент США №№ 61/156449, поданной 27 февраля 2009 г., и 61/170013, поданной 16 апреля 2009 г. Описания указанных выше заявок полностью включены в настоящую заявку путем ссылки.
2. Область техники
Настоящее изобретение относится к способам лечения онкологического заболевания у субъекта, имеющего сниженную активность BRCA2. В определенных вариантах осуществления способы включают введение субъекту терапевтически эффективного количества SNS-595.
3. Предшествующий уровень техники
Онкологические заболевания являются одной из ведущих причин смерти в США. Каждый год более полумиллиона американцев умирают от онкологических заболеваний, и более чем у одного миллиона вновь диагностируются эти заболевания. Онкологические опухоли могут возникнуть в результате того, что клетка избегает регуляторных механизмов ее нормального роста и пролиферирует неконтролируемым образом. Опухолевые клетки могут метастазировать во вторичные участки, если лечение первичной опухоли или неполное, или не начато перед значительным прогрессированием заболевания. Ранняя диагностика и эффективное лечение опухолей может быть существенным для выживания.
Белки, кодируемые генами восприимчивости к раку молочной железы (белки BRCA1 и BRCA2), связывали с предрасположенностью к раку молочной железы, яичников и другим видам рака. Указанные белки экспрессированы и причастны ко многим процессам, фундаментальным для всех клеток, включая репарацию и рекомбинацию ДНК, сверочные точки контроля клеточного цикла и транскрипцию.
BRCA1 и BRCA2 важны для репарации двухнитевого разрыва ДНК (DSB) гомологичной рекомбинацией (HR). Мутации в генах BRCA1 и BRCA2 могут предрасполагать субъектов к различным онкологическим заболеваниям. Мутации зародышевой линии в BRCA1 и BRCA2 ответственны приблизительно за 5-10% всех видов эпителиального рака яичников (см. Li and Karlan, Curr Oncol Rep, 2001 3:27-32). Было показано, что 20-60% случаев рака молочной железы связаны с мутацией зародышевой линии в любом из указанных генов в семьях, где указанным заболеванием страдают многие субъекты (примерно 2-6% всех случаев). Nathanson et al., Nature Med, 2001 7, 552-556, 2001. Носители мутаций BRCA1 и BRCA2 также восприимчивы к онкологическим поражениям предстательной железы, поджелудочной железы и мужской молочной железы. См., Venkitaraman, J. Cell Sci, 2001 114, 3591-98.
В связи со значением мутаций BRCA1 и BRCA2 при онкологических поражениях молочной железы, яичников и других видах рака, существует потребность в способах лечения страдающих онкологическими заболеваниями субъектов, имеющих мутации BRCA2, или у которых иным образом снижена активность BRCA2.
4. Краткое изложение сущности изобретения
Наблюдалось, что присутствие мутаций BRCA2 увеличивает реактивность злокачественных клеток у субъекта на лечение SNS-595, которая представляет собой (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту. Соответственно, один вариант осуществления относится к способу лечения субъекта, страдающего онкологическим заболеванием, такого как пациент с онкологическим заболеванием, имеющий мутацию BRCA2, которая нарушает активность BRCA2 (или в клетках которых активность BRCA2 подвергнута понижающей регуляции или снижена относительно нормальной, например, сниженная экспрессия), включающему введение субъекту терапевтически эффективного количества SNS-595.
В определенных вариантах осуществления способы по настоящему изобретению включают диагностику мутации BRCA2 у субъекта SNS-595. В определенных вариантах осуществления способы по настоящему изобретению включают диагностику понижающей регуляции или снижения активности BRCA2 у субъекта с онкологическим заболеванием и лечение субъекта SNS-595.
В определенных вариантах осуществления способы по настоящему изобретению включают введение дозы примерно 10-100 мг/м2 SNS-595 субъекту с онкологическим заболеванием, имеющему мутацию BRCA2, или у которого снижена активность (или экспрессия) BRCA2.
В определенных вариантах осуществления способы по настоящему изобретению включают обеспечение контакта злокачественной клетки, имеющей мутацию BRCA2, с некоторым количеством SNS-595, эффективным для вызова двухнитевых разрывов ДНК.
Способы по настоящему изобретению включают лечение онкологических заболеваний молочной железы, яичников, предстательной железы и других видов рака, где злокачественная клетка проявляет мутацию BRCA2.
В другом аспекте настоящее изобретение относится к способу идентификации субъекта для лечения SNS-595, включающему диагностику мутации BRCA2 у субъекта.
В определенных вариантах осуществления SNS-595 применяется отдельно, т.е. без других химиотерапевтических средств.
В других вариантах осуществления, SNS-595 вводится в комбинации с одним или более терапевтических средств, т.е. фармацевтических средств, обладающих активностью против онкологического заболевания или его симптомов. Примеры способов лечения в пределах объема способов включают без ограничения хирургическое вмешательство, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию, иммунотерапию и их комбинации. Комбинации включают одновременное, а также последовательное введение.
В некоторых вариантах осуществления дополнительное терапевтическое средство выбрано из алкилирующих агентов, антиметаболитов, ингибиторов Аврора-киназы, антагонистов пурина, антагонистов пиримидина, яда сверочной точки сборки веретена, митотических ингибиторов, ингибиторов и ядов топоизомеразы II, ингибиторов топоизомеразы I, антинеопластических антибиотиков, нитрозомочевин, комплексов неорганических ионов, ферментов, гормонов и аналогов гормонов, ингибиторов EGFR (рецепторов эпидермального фактора роста), антител и производных антител, IMID (иммуномодулирующих лекарственных средств), ингибиторов HDAC (деацетилазы гистонов), ингибиторов Bcl-2, ингибиторов тирозинкиназы, стимулируемой VEGF, ингибиторов VEGFR, ингибиторов протеасомы, ингибиторов циклинзависимой киназы, ингибиторов PARP (полимеразы I поли (АДФ-рибозы), ингибиторов ароматазы и дексаметазона.
В конкретном варианте осуществления, комбинированная терапия включает введение SNS-595 и по меньшей мере одного терапевтического средства, выбранного из доцетаксела, таксотера, винорелбина, капецитабина, доксорубицина, госерелина, золедроновой кислоты, паклитаксела, памидроната, анастрозола, экземестана, циклофосфамида, эпирубицина, фулвестранта, летрозола, гемцитабина, лейпролида, филграстима, G-CSF или фактора, стимулирующего колонии гранулоцитов, пегфилграстима, торемифена, тамоксифена, бевацизумаба, трастузумаба, 5-фторурацила, метотрексата, трабектидина, эпоэтина альфа и дарбепоэтина альфа. В другом варианте осуществления комбинированная терапия включает введение SNS-595 и средства поддерживающего лечения.
Изобретение также относится к схемам введения, курсам введения и способам применения SNS-595 у субъектов с онкологическими заболеваниями, имеющими нарушенную активность BRCA2.
В определенных вариантах осуществления изобретение относится к фармацевтическим композициям, содержащим SNS-595 и фармацевтически приемлемый носитель, адъювант или разбавитель, для лечения субъектов с онкологическими заболеваниями, имеющих сниженную активность BRCA2.
5. Краткое описание чертежей
Фиг.1 иллюстрирует ингибирование роста клеток китайского хомячка, которые мутантны в отношении BRCA2 (VC8) и комплементированы в отношении функционального BRCA2 (VC8-B2) в присутствии доксорубицина.
Фиг.2 иллюстрирует ингибирование роста клеток VC8 и VC8-B2 в присутствии SNS-595.
Фиг.3 иллюстрирует разрастание колонии клеток саркомы человека U-20S (клеток дикого типа и клеток с истощенным запасом BRCA2 при использовании миРНК (малой интерферирующей РНК)) после обработки доксорубицином.
Фиг.4 иллюстрирует разрастание колонии клеток саркомы человека U-20S (клеток дикого типа и клеток с истощенным запасом BRCA2 при использовании миРНК) после обработки SNS-595.
На фиг.5 представлен гель-электрофорез в пульсирующем поле (PFGE) для 18-часового периода обработки SNS-595 и доксорубицином, каждым отдельно и при совместной обработке с афидиколином в течение времени включения 240 секунд.
На фиг.6 представлен PFGE для 24-часового периода обработки SNS-595 и доксорубицином, каждым отдельно и при совместной обработке с афидиколином в течение времени включения от 60 до 240 секунд.
Фиг.7 иллюстрирует различия повреждающей ДНК активности SNS-595 и доксорубицина, как демонстрируется продукцией более мелких фрагментов ДНК после обработки доксорубицином, чем SNS-595, для 18-часового периода PFGE.
Фиг.8 иллюстрирует различия повреждающей ДНК активности SNS-595 и доксорубицина, как демонстрируется продукцией более мелких фрагментов ДНК после обработки доксорубицином, чем SNS-595, для 24-часового периода PFGE.
Фиг.9 иллюстрирует эффективность клонирования клеток SPD8 после обработка каждым из афидиколина, SNS-595 и доксорубицина, и каждым из SNS-595 и доксорубицина при совместной обработке с афидиколином.
Фиг.10 иллюстрирует частоту реверсии мутации HPRT (гена гипоксантин-гуанин фосфорибозилтрансферазы) клеток SPD8 после обработки афидиколином, SNS-595 и доксорубицином, и каждым из SNS-595 и доксорубицина при совместной обработке с афидиколином.
6. Подробное описание изобретения
6.1 Определения
Все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое обычно понятно среднему специалисту в данной области. Все патенты, заявки, опубликованные заявки и другие публикации полностью включены в настоящее описание путем ссылки. В случае, когда имеется множество определений для представленного в настоящем описании термина, то, если нет иных указаний, преобладающее значение имеют те, которые приведены в настоящем разделе.
Используемый в настоящем описании термин «SNS-595» означает (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту, в также любую ионную форму, соли, сольваты, например, гидраты или другие формы указанного соединения, включая их смеси. Таким образом, композиции, содержащие SNS-595, могут включать (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту или ее ионную форму, соль, сольват, например, гидрат, или другую форму соединения. В некоторых вариантах осуществления SNS-595 представлена в виде фармацевтически приемлемой соли. В некоторых вариантах осуществления SNS-595 включает композицию, состоящую по существу из (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, включая менее чем 0,5% масс. других соединений или примесей на основании общей массы композиции. Такие примеси включают соединения, имеющие остов тиазолил-оксо-нафтиридин-3-карбоновой кислоты, такие как (+)-1,4-дигидро-7-[(3S,4S)-гидрокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновая кислота, (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновая кислота и/или (+)-1,4-дигидро-7-[(3S,4S)-3-гидрокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновая кислота. Иллюстративные композиции SNS-595 описаны во временной заявке на патент США № 61/141856, полное содержание которой включено в настоящую заявку путем ссылки.
Используемый в настоящем описании термин «энантиомерно чистая SNS-595» относится к SNS-595, которая по существу не содержит (-)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты. Другими словами, энантиомерно чистая SNS-595 представляет энантиомерный избыток «-» формы. Термин «энантиомерно чистое» или «чистый энантиомер» обозначает, что соединение содержит более чем примерно 95%, 96%, 97%, 98%, 99%, 99,5%, 99,6%, 99,7%, 99,8% или 99,9% масс. SNS-595.
Используемые в настоящем описании, если нет других указаний, термины «лечить» и «лечение» относятся к облегчению или уменьшению тяжести заболевания или симптома, связанного с подвергаемым лечению заболеванием или состоянием.
Используемый в настоящем описании термин «предотвращать», «предотвращение» и другие формы указанного слова включают ингибирование начала или прогрессирования заболевания или расстройства или симптома конкретного заболевания или расстройства. В некоторых вариантах осуществления субъекты с семейным анамнезом онкологических заболеваний являются кандидатами для применения профилактических схем лечения. В целом, в контексте онкологических заболеваний, термин «предотвращение» относится к введению лекарственного средства перед началом признаков или симптомов онкологического заболевания, в частности, у субъектов, имеющих риск развития онкологического заболевания.
Используемый в настоящем описании, и если нет других указаний, термин «ведение пациента» включает предотвращение рецидива конкретного заболевания или расстройства у субъекта, который страдал им, удлинение времени ремиссии заболевания или расстройства, которым страдал субъект, снижение смертности субъектов и/или поддержание снижения тяжести или избегание симптома, связанного с заболеванием или состоянием у подлежащего ведению пациента.
Используемый в настоящем описании термин «субъект» означает животное, обычно млекопитающее, включая человека. Используемый в настоящем описании термин «пациент» означает человека.
Используемый в настоящем описании термин «образец» или «биологический образец» относится к ткани или экстракту, включая клетку и физиологическую жидкость, по которому можно получить информацию относительно статуса BRCA2 у субъекта с помощью способов анализа, известных в данной области. Обычно биологический образец представляет собой образец крови. Однако образец может быть взят из одного или более из разнообразных источников у субъекта, включая образцы биологических жидкостей или образцы ткани. Подходящие образцы ткани включают различные типы опухолевой или злокачественной ткани, ткани органов, такие как образцы, взятые при биопсии. Образец может обрабатываться перед использованием, например, как это происходит при получении плазмы из крови, разбавлении вязких жидкостей и тому подобных видах обработки. Способы обработки образца могут включать фильтрацию, перегонку, экстракцию, концентрацию, инактивацию создающих помехи компонентов, добавление реагентов и тому подобные.
Используемые в настоящем описании, если нет других указаний, термины «терапевтически эффективное количество» и «эффективное количество» соединения относятся к количеству, достаточному для обеспечения терапевтического благоприятного действия при лечении, профилактике заболевания и/или ведении пациента, имеющего данное заболевание, для задержки или минимизации одного или более симптомов, связанных с заболеванием или расстройством, подлежащим лечению. Термины «терапевтически эффективное количество» и «эффективное количество» могут включать количество, которое в целом улучшает терапию, уменьшает или устраняет симптомы или причины заболевания или расстройства или повышает терапевтическую эффективность другого терапевтического средства.
Используемые в настоящем описании, если нет других указаний, термин «фармацевтически приемлемая соль» включает без ограничения соль кислотной или основной группы, которая может присутствовать в соединениях по настоящему изобретению. В определенных кислотных условиях соединение может образовывать широкое разнообразие солей с различными неорганическими и органическими кислотами. Кислоты, которые могут использоваться для получения фармацевтически приемлемых солей таких основных соединений, представляют собой те, которые образуют соли, содержащие фармацевтически приемлемые анионы, включая без ограничения ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, кальция эдетат, камсилат, карбонат, хлорид, бромид, иодид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эсилат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидроксинафтоат, изетионат, лактат, лактобионат, малат, малеат, манделат, метансульфонат (мезилат), метилсульфат, мускат, напсилат, нитрат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, сукцинат, сульфат, таннат, тартрат, теоклат, триэтиодид и памоат. В определенных основных условиях, соединение может образовывать основные соли с различными фармакологически приемлемыми катионами. Неограничивающие примеры таких солей включают соли щелочных или щелочноземельных металлов и, в частности, соли кальция, магния, натрия, лития, цинка, калия и железа.
Используемый в настоящем описании, если нет других указаний, термин «гидрат» означает SNS-595 или ее соль, кроме того, включающую стехиометрическое или не стехиометрическое количество воды, связанной нековалентными межмолекулярными силами. Гидраты SNS-595 могут быть кристаллическими или не кристаллическими.
Используемый в настоящем описании, если нет других указаний, термин «сольват» означает сольват, образованный в результате ассоциации одной или более молекул растворителя с соединением по настоящему изобретению. Термин «сольват» включает гидраты (например, моногидрат, дигидрат, тригидрат, тетрагидрат и тому подобные). Сольваты SNS-595 могут быть кристаллическими или не кристаллическими.
Используемая в настоящем описании промежуточная фраза «состоящие по существу» ограничивает объем притязания определенными материалами, и дополнительные материалы существенным образом не воздействуют на основные и новые характеристики заявленного предмета изобретения.
Термины «совместное введение» или «в комбинации с» включают введение двух или более терапевтических средств (например, SNS-595 или композиции по настоящему изобретению и другого противоракового средства или другого активного средства) или одновременно, или совместно, или последовательно без определенных временных пределов. В одном варианте осуществления SNS-595 и по меньшей мере одно другое средство присутствуют в клетке или в организме субъекта в одно и то же время или оказывают свой биологический или терапевтический эффект в одно и то же время. В одном варианте осуществления терапевтические средства содержатся в одной и той же композиции или стандартной лекарственной форме. В другом варианте осуществления терапевтические средства находятся в отдельных композициях или стандартных лекарственных формах.
Термин «средство поддерживающего лечения» относится к любому активному средству, которое лечит, предотвращает, справляется или устраняет побочный или нежелательный эффект лечения SNS-595 отдельно или в комбинации с другими терапевтическими средствами. Примеры описаны в настоящей заявке.
6.2 SNS-595
Соединение для применения в способах по настоящему изобретению, включая комбинированную терапию, и в композициях по настоящему изобретению, представляет собой энантиомерно чистую (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту, которая также известна как SNS-595 или AG-7352. Советом по номенклатуре лекарственных средств, принятой в США (USANC) соединению присвоено название «ворелоксин».
SNS-595 имеет следующую химическую структуру:
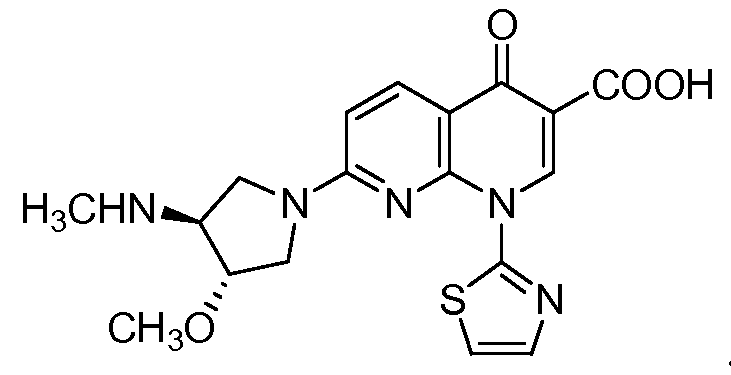
В определенных вариантах осуществления в способах и композициях по настоящему изобретению применяются фармацевтически приемлемые соли, сольваты, гидрат или пролекарства SNS-595.
В определенных вариантах осуществления SNS-595 вводится в виде композиции, состоящей по существу из энантиомерно чистой (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, включающей менее чем 0,5% масс. других соединений или примесей на основании общей массы композиции. Такие примеси включают соединения, имеющие остов тиазолил-оксо-нафтиридин-3-карбоновой кислоты, такие как (+)-1,4-дигидро-7-[(3S,4S)-гидрокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновая кислота, (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновая кислота и/или (+)-1,4-дигидро-7-[(3S,4S)-3-гидрокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновая кислота.
SNS-595 может быть получена способами, известными специалисту в данной области, например, в соответствии с процедурой, описанной в заявке на патент США № 12/650390, поданной 30 декабря 2009 г.; международной публикации № WO 2007/146335; патенте США № 5817669; и заявке на патент Японии № Hei 10-173986, полные содержания которых включены в настоящую заявку путем ссылки. Определенные иллюстративные фармацевтические композиции, содержащие SNS-595, и способы их применения описаны в заявках на патенты США №№ 2005/0203120; 2005/0215583; 2006/0025437; 2006/0063795, 2006/0247267 и временных заявках на патенты США №№ 61/240161, поданной 4 сентября 2009 г., 61/240113, поданной 4 сентября 2009 г., и 61/288213, поданной 18 сентября 2009 г., которые полностью включены в настоящее описание путем ссылки.
6.3 Способы лечения
Процесс гомологичной рекомбинационной репарации (HRR) представляет собой основной путь репарации ДНК, которая действует на двухнитевые разрывы (DSB) и межнитевые поперечные сшивки. HRR обеспечивает механизм безошибочного удаления повреждения, присутствующего в ДНК, которая была реплицирована. Таким образом, HRR действует решающим образом, в координации с механизмом сверочных точек контроля S и G2, для устранения хромосомных разрывов перед тем как происходит клеточное деление. См. публикацию Thompson et al., Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2001, 477, 131-153.
Злокачественные клетки с мутациями BRCA2, которая нарушает активность BRCA2, могут иметь нарушенную гомологичную рекомбинантную репарацию. Без предполагаемой связи с какой-либо конкретной теорией функции, такие клетки могут иметь более высокую чувствительность к лечению SNS-595, потому что лечение SNS-595 может привести к увеличению числа двухнитевых разрывов ДНК, которые не могут быть восстановлены ввиду недостаточной HRR в указанных клетках. Аналогичным образом, если активность BRCA2 в клетках снижена, по сравнению с нормальными уровнями, например, наличием понижающей регуляции экспрессии BRCA2, такие клетки могут иметь более высокую чувствительность к SNS-595. Таким образом, способы по настоящему изобретению включают лечение, профилактику или ведение субъекта с онкологическим заболеванием, например, пациента, имеющего мутацию BRCA2, введением терапевтически эффективного количества SNS-595. В определенных вариантах осуществления способы включают лечение онкологических заболеваний молочной железы, яичников, предстательной железы, поджелудочной железы и других онкологических заболеваний у субъекта, такого как пациент, у которого проявляется мутация BRCA2. В одном варианте осуществления онкологическое заболевание представляет собой рак молочной железы у субъекта, такого как пациентка, у которой проявляется мутация BRCA2.
В определенных вариантах осуществления способы включают лечение онкологических заболеваний молочной железы, яичников, предстательной железы, поджелудочной железы и других онкологических заболеваний, где в злокачественной клетке проявляется мутация BRCA2. В одном варианте осуществления онкологическое заболевание представляет собой рак молочной железы, где в злокачественной клетке проявляется мутация BRCA2.
В другом аспекте изобретение относится к способу идентификации субъекта для лечения SNS-595, включающему диагностику мутации BRCA2 у субъекта.
В определенных вариантах осуществления способы по настоящему изобретению включают обеспечение контакта злокачественной клетки у субъекта или полученной у субъекта, имеющей мутацию BRCA2, с терапевтически эффективным количеством SNS-595. В целом, количество используемой SNS-595 эффективно для вызова двухнитевых разрывов ДНК. Контакт может происходить in vitro, in vivo или ex vivo. В одном варианте осуществления способ включает обеспечение контакта злокачественной клетки in vivo.
В одном варианте осуществления изобретение относится к способу идентификации страдающего онкологическим заболеванием субъекта, подходящего для лечения SNS-595, включающему: (a) получение биологического образца у кандидата, страдающего онкологическим заболеванием; (b) скрининг биологического образца для выявления мутации BRCA2; и (c) если у кандидата имеется мутация BRCA2, идентификацию кандидата как страдающего онкологическим заболеванием субъекта, подходящего для лечения SNS-595. В другом варианте осуществления кандидаты, идентифицированные как страдающие онкологическими заболеваниями субъекты, подходящие для лечения SNS-595, получают лечение SNS-595.
В другом варианте осуществления изобретение относится к способу идентификации одного или более страдающих онкологическими заболеваниями субъектов, подходящих для лечения SNS-595, из множества страдающих онкологическими заболеваниями субъектов, являющихся кандидатами для лечения. Способ включает идентификацию одного или более страдающих онкологическими заболеваниями субъектов, имеющих мутацию BRCA2, из множества страдающих онкологическими заболеваниями субъектов, подходящих для лечения SNS-595. В одном варианте осуществления один или более подходящих субъектов получают лечение SNS-595.
В одном варианте осуществления один или более субъектов, у которых уровни активности BRCA2 находятся в нормальном диапазоне (или значимо не снижены), не получают лечение SNS-595. В определенных вариантах осуществления все субъекты, у которых уровни активности BRCA2 находятся в нормальном диапазоне (или значимо не снижены), не получают лечение SNS-595. Например, субъект, у которого уровень активности BRCA2 является нормальным (или значимо не снижен), может получать лечение с использованием альтернативного терапевтического средства, такого как химиотерапевтическое средство, на противораковую активность которого не воздействует статус BRCA2. Альтернативно, субъект, имеющий нормальную или почти нормальную активность BRCA2, может получать лечение SNS-595 с использованием другого протокола лечения, такого как схема лечения, при которой дозы SNS-595 вводятся чаще или используются более высокие дозы SNS-595, чем те, которые рассматривались бы для пациента, у которого активность BRCA2 снижена.
В одном варианте осуществления один или более субъектов, у которых не проявляется мутация BRCA2, не получают лечение SNS-595. В определенных вариантах осуществления все субъекты, у которых не проявляется мутация BRCA2, не получают лечение SNS-595. Например, субъект, не имеющий мутацию BRCA2, может лечиться с использованием альтернативного терапевтического средства, такого как химиотерапевтическое средство, на противораковую активность которого не воздействует мутацию BRCA2. Альтернативно, субъект, не имеющий мутацию BRCA2, может лечиться SNS-595 с использованием другого протокола лечения, такого как схема лечения, при которой дозы SNS-595 вводятся чаще или используются более высокие дозы SNS-595, чем те, которые рассматривались бы для пациента, имеющего мутацию BRCA2.
Мутацию BRCA2 в злокачественной клетке можно диагностировать любой подходящей методикой, известной в данной области, такой как генное секвенирование, включая тестирующий анализ BRACAnalysis® от компании Myriad Genetic Laboratories, Inc., мультиплексная зависимая от лигирования амплификация зондов (MLPA), высокоразрешающий анализ кривой расплава (см., Dufresne et al., Arch Pathol Lab Med, 2006, 130:185-187 и Takano et al., BMC Cancer, 2008, 8:59), тест усечения белка (PTT), денатурирующий градиентный гель-электрофорез (DGGE) и/или денатурирующая высокоэффективная жидкостная хроматография (DHPLC).
В определенных вариантах осуществления мутации в BRCA2 представляют собой мелкие делеции или вставки, которые могут быть обнаружены наряду с цельным протеином. Способы по настоящему изобретению включают лечение страдающих онкологическими заболеваниями субъектов с любой мутацией BRCA2, известной специалисту в данной области. Примеры таких мутаций включают, например, 999del5, 6174delT, 8803delC, 4486delG, 5445del5 и 2024del5, 763insAT, 763insAT, 983delACAG, A3058T, 3758delACAG, 3908delTG, 4706delAAAG, 5804delTTAA, C6137A, 6174delT, 6305insA, 9132delC, del2352ins12, dup9700, dell518 и другие, описанные, например, Loman et al., J Natl Cancer Inst, 2001, 93(16):1215-1223; Peto et al., J Natl Cancer Inst, 1999, 91(11):943-949; и Walsh et al., JAMA, 2006, 295(12): 1379-88.
Без связи с какой-либо определенной теорией, считается, что SNS-595 вызывает сайт-селективное повреждение ДНК селективным интеркалированием в ДНК и отравлением топоизомеразы II, приводящим к зависимому от репликации повреждению ДНК, необратимой остановке G2 и быстрому апоптозу. Напротив, схемы лечения на основе антрациклина, вызывают опосредованные топоизомеразой II двухнитевые разрывы (DSB) ДНК, а также повреждающую ДНК активность посредством не связанных с топоизомеразой II механизмов, включая генерирование аддуктов ДНК, образование поперечных сшивок ДНК и продукцию реактивных видов кислорода (ROS). См. Gewirtz D., Biochem Pharmacol 1999, 57:727-41.
Целевые взаимодействия ДНК-фермента при терапии SNS-595 отличаются от механистических более разнородными и высоко интеркаляционными антрациклинами, которые применяются клинически (O'Reilly et al., Biochemistry 2002, 41:7989-97; Wang J., Nat Rev Mol Cell Biol, 2002, 3:430-40). Указанные отличительные признаки указывают на то, что роль BRCA2 в репарации вызванного SNS-595 повреждения ДНК нельзя непосредственно перенести из данных, относящихся к антрациклинам, таким как доксорубицин, или ингибиторам топоизомеразы II, таким как этопозид. Данные, представленные в разделе «Примеры», которые демонстрируют сенсибилизацию клеток с мутацией BRCA2 к SNS-595, подтверждают роль BRCA2 в репарации повреждения ДНК, вызванного SNS-595.
В определенных вариантах осуществления способы лечения по настоящему изобретению включают введение субъекту дозы примерно от 10 до 100 мг/м2 SNS-595. В определенных вариантах осуществления способы лечения включают введение субъекту дозы примерно 10-100 мг/м2, примерно 20-90 мг/м2, примерно 30-90 мг/м2, примерно 40-90 мг/м2, примерно 30-80 мг/м2, примерно 40-80 мг/м2 или примерно 30-50 мг/м2.
В некоторых вариантах осуществления способы включают введение субъекту терапевтически эффективного количества SNS-595 в комбинации с терапевтически эффективным количеством второго активного средства. В некоторых вариантах осуществления второе активное средство представляет собой терапевтическое антитело к раковому антигену, гематопоэтический фактор роста, цитокин, противораковое средство, антибиотик, ингибитор cox-2, иммуномодулирующее средство, иммуносупрессивное средство, кортикостероид или его фармакологически активный мутант или производное. В других вариантах осуществления второе активное средство представляет собой алкилирующий агент, антинеопластический антибиотик, антиметаболит, платиновый координационный комплекс, ингибитор или яд топоизомеразы II, ингибитор CDK (циклинзависимой киназы), ингибитор Аврора-киназы, антагонист пурина, антагонист пиримидина, веретенный яд, митотический ингибитор, ингибитор топоизомеразы I, нитрозомочевину, комплекс неорганических ионов, фермент, гормон или аналог гормона, ингибитор EGFR, антитело или производное антитела, IMID, ингибитор HDAC, ингибитор Bcl-2, ингибитор тирозинкиназы, стимулируемой VEGF, ингибитор VEGFR, ингибитор протеасомы, ингибитор ароматазы, ингибитор PARP, дексаметазон или облучение.
6.3.1 Субъекты
В определенных вариантах осуществления способов по изобретению подлежащий лечению субъект представляет собой животное, например, млекопитающее или примата, не являющегося человеком. В конкретных вариантах осуществления субъект представляет собой человека-пациента. Субъект может относиться к мужскому или женскому полу.
В частности, субъекты, подлежащие лечению в соответствии со способами по настоящему изобретению, включают субъектов, страдающих раком молочной железы, яичников, поджелудочной железы или предстательной железы, и имеют сниженную активность BRCA2. В конкретном варианте осуществления, субъект страдает раком молочной железы. В определенных вариантах осуществления рак молочной железы был устойчив к предшествующему лечению и/или после предшествующего лечения произошел его рецидив. Снижение активности BRCA2 может быть связано с любой мутацией BRCA2, известной специалистам в данной области. Во многих вариантах осуществления, мутация BRCA2 представляет собой мутацию, которая нарушает активность BRCA2, которая может проявляться в различных механистических формах. Например, мутация может нарушить экспрессию BRCA2, т.е. количество протеина BRCA2, продуцируемого в клетках, или мутация может нарушить биологическую активность протеина, такую как взаимодействие BRCA2 с другим протеином или нуклеиновой кислотой, или ферментативную активность протеина BRCA2. Мутация или недостаточная активность BRCA2 может диагностироваться у субъекта любой методикой, считающейся подходящей специалистом в данной области. Иллюстративные методики описаны в публикациях Oncogene, 1998, 16(23): 3069-82, Kuznetsov et al., Nature Medicine, 2008, 14, 875-881, Dufresne et al., Arch Pathol Lab Med, 2006, 130:185-187 и Takano et al., BMC Cancer, 2008, 8:59.
Настоящее изобретение также включает способы лечения субъекта независимо от возраста субъекта, хотя некоторые заболевания и расстройства более распространены в определенных возрастных группах. В некоторых вариантах осуществления субъект представляет собой человека-пациента в возрасте по меньшей мере 18 лет. В некоторых вариантах осуществления возраст пациента составляет 10, 15, 18, 21, 24, 35, 40, 45, 50, 55, 65, 70, 75, 80 или 85 лет или более.
В некоторых вариантах осуществления способы по изобретению находят применение у пациентов в возрасте по меньшей мере 50 лет, хотя данные способы могут также оказать благоприятное воздействие на пациентов более молодого возраста. В других вариантах осуществления возраст пациентов составляет по меньшей мере 55, по меньшей мере 60, по меньшей мере 65 и по меньшей мере 70 лет. В определенных вариантах осуществления способы по изобретению могут применяться у пациентки, у которой имеется личный анамнез раннего начала рака молочной железы (до 50-летнего возраста) или раннего начала рака молочной железы и яичников в любом возрасте. В другом варианте осуществления пациентка представляет собой женщину, имеющую семейный анамнез рака молочной железы или рака молочной железы и яичников. В другом варианте осуществления пациент представляет собой мужчину с личным или семейным анамнезом рака молочной железы у мужчин.
В определенных вариантах осуществления способы по настоящему изобретению включают лечение субъектов, которые ранее не получали лечение по поводу онкологических заболеваний. В других вариантах осуществления способы включают лечение субъектов, которые ранее получали лечение, но не реагируют на стандартные способы лечения, а также субъектов, которые получают лечение в настоящее время по поводу онкологического заболевания. Например, возможно, субъекты ранее получали лечение или в настоящее время получают лечение по поводу онкологического заболевания с использованием стандартной схемы лечения, известной практикующему онкологу.
В некоторых вариантах осуществления субъект ранее не подвергался лечению SNS-595. В некоторых вариантах осуществления субъект ранее подвергался лечению SNS-595.
6.3.2 Дозировки
В определенных репрезентативных вариантах осуществления способ лечения, профилактики и ведения пациентов с онкологическими заболеваниями по настоящему изобретению включает введение субъекту эффективного количества SNS-595 любым приемлемым путем введения. В целом, способ включает введение субъекту на основании площади поверхности тела дозы примерно 10-100 мг/м2 SNS-595. В другом варианте осуществления способ по изобретению включает введение дозы примерно 20-90 мг/м2 SNS-595. В другом варианте осуществления способ по изобретению включает введение дозы примерно 40-90 мг/м2 SNS-595. В другом варианте осуществления способ включает введение дозы примерно 30-50 мг/м2 SNS-595. В другом варианте осуществления способ включает введение дозы примерно 30-90 мг/м2 SNS-595. В другом варианте осуществления способ включает введение дозы примерно 40-90 мг/м2 SNS-595. В другом варианте осуществления способ включает введение дозы примерно 30-80 мг/м2 SNS-595. В другом варианте осуществления способ включает введение дозы примерно 40-80 мг/м2 SNS-595.
В одном варианте осуществления SNS-595 вводится внутривенно и в количестве примерно 10, 15, 18, 21, 24, 25, 27, 30, 35, 40, 45, 48, 50, 55, 60, 63, 70, 72, 75, 80, 85, 90, 95 или 100 мг/м2 (которое может вводиться в одной или дробных дозах) в один день.
Опытный практикующий онколог при лечении онкологического заболевания обычно использует единицу дозировки, которая обеспечивает аппроксимацию воздействия на субъекта вводимого активного ингредиента. Может использоваться любая подходящая единица дозировки.
Например, используемая единица дозировки может аппроксимировать воздействие на основании расчета площади поверхности тела. Расчеты поверхности тела (BSA) для человека могут рассчитываться, например, с использованием формулы Mosteller:
BSA (м2) = [(рост (см) · масса тела (кг)/3600]1/2.
Такой наиболее распространенной единицей дозировки является миллиграмм активного соединения на квадратный метр площади поверхности тела (мг/м2).
В качестве другого примера, введенная доза SNS-595 может быть выражена в единицах, отличных от мг/м2. Например, дозы могут быть выражены в миллиграммах активного соединения на килограмм массы тела (мг/кг). Среднему специалисту в данной области вполне понятно, как превратить дозу для пациента из мг/м2 в мг/кг, обусловленную ростом и/или массой тела пациента (см., http://www.fda.gov/cder/cancer/animalframe.htm). Например, доза 1-30 мг/м2 для человека массой 65 кг приблизительно равна 0,026-0,79 мг/кг. Могут также использоваться другие единицы дозировки.
В определенных вариантах осуществления введенная доза SNS-595 может быть доставлена в виде одного болюса (например, внутривенной инъекции) или в течение более длительного периода времени (например, непрерывной инфузией или периодическим введением болюсных доз). Введение SNS-595 может повторяться до тех пор, пока у субъекта не проявится стабилизация течения или обратное развитие заболевания, или до тех пор, пока у субъекта не проявится прогрессирование заболевания или неприемлемая токсичность препарата. Стабильное течение заболевания или его отсутствие определяется способами, известными в данной области, такими как оценка симптомов, физикальное обследование и другие общепринятые параметры.
Количество SNS-595, вводимое в соответствии со способами по настоящему изобретению, зависит от различных факторов, таких как общее состояние здоровья подвергаемого лечению субъекта, тяжесть расстройства или симптом расстройства, вводимого активного ингредиента, пути введения, частоты введения, других присутствующих медикаментозных средств и суждения назначающего лечение врача. Подлежащее введению количество врач может определить эмпирически.
В некоторых вариантах осуществления частота введения находится в диапазоне от примерно одной дозы в сутки до одной дозы в месяц. В определенных вариантах осуществления препарат вводится один раз в день, через день, 3 дня подряд, 4 дня подряд, в 1-й и 4-й дни, в 1-й и 2-й дни, в 1-й и 3-й дни, один раз в неделю, дважды в неделю, три раза в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели. В одном варианте осуществления фармацевтическая композиция по настоящему изобретению вводится один раз в неделю в течение трех недель. В другом варианте осуществления фармацевтическая композиция по настоящему изобретению вводится один раз каждые три недели. В одном варианте осуществления фармацевтическая композиция по настоящему изобретению вводится один раз в три недели. В другом варианте осуществления фармацевтическая композиция по настоящему изобретению вводится один раз в четыре недели.
В определенных вариантах осуществления SNS-595 вводится субъекту в один или более циклов введения. Циклическая терапия включает введение одной или более доз SNS-595 с последующим периодом отдыха и повторение данного цикла введения/отдыха. Циклическая терапия может снизить развитие устойчивости к одному или более видов лечения, избежать или снизить побочные эффекты одного или более видов лечения и/или повысить эффективность или длительность лечения.
Следовательно, в одном варианте осуществления доза SNS-595 вводится один раз в неделю, в трех- или шестинедельном цикле при периоде отдыха от примерно 1 до примерно 30 дней между дозами. В некоторых вариантах осуществления период ожидания составляет 14 дней, причем первая доза вводится в 1-й день, а следующая доза вводится на 15-й день. Таким образом, можно сказать, что лечение в таких случаях может проводиться с использованием «14-дневного цикла». В некоторых вариантах осуществления дозы могут вводиться с интервалом 28 дней, т.е. в 28-дневном цикле.
В другом варианте осуществления способ введения включает цикл, где цикл включает введение дозы SNS-595 субъекту один раз в неделю в течение трех недель с последующим периодом, по меньшей мере 14 дней, в течение которого соединение или композиция не вводится субъекту, и где цикл повторяется множество раз. В другом варианте осуществления период, в течение которого не вводится соединение или композиция, составляет 18 дней. В другом варианте осуществления период, в течение которого соединение или композиция не вводится, составляет 21 день. В другом варианте осуществления период, в течение которого соединение или композиция не вводится, составляет 28 дней. Частота, число и длительность циклов введения могут увеличиваться или уменьшаться.
В одном варианте осуществления способ по настоящему изобретению включает: i) введение субъекту дозы SNS-595, например, примерно 40-90 мг/м2; ii) ожидание в течение периода, по меньшей мере шести дней, когда субъекту совсем не вводится SNS-595; и iii) введение субъекту другой дозы SNS-595, например, примерно 40-90 мг/м2 SNS-595. В одном варианте осуществления стадии ii)-iii) повторяются множество раз.
В одном варианте осуществления способ по изобретению включает: i) введение субъекту дозы SNS-595, например, примерно 30-50 мг/м2; ii) ожидание в течение периода, по меньшей мере шести дней, когда субъекту совсем не вводится SNS-595; и iii) введение субъекту другой дозы SNS-595, например, примерно 30-50 мг/м2. В одном варианте осуществления стадии ii)-iii) повторяются множество раз.
В другом варианте осуществления способ включает введение дозы примерно 40 мг/м2, примерно 45 мг/м2, примерно 48 мг/м2, примерно 50 мг/м2, примерно 60 мг/м2, примерно 72 мг/м2, примерно 75 мг/м2, примерно 80 мг/м2, или примерно 90 мг/м2 SNS-595 в каждой из предыдущих стадий i) и iii).
В другом варианте осуществления изобретение относится к способу лечения страдающего раком молочной железы субъекта, имеющего сниженную активность BRCA2, включающему введение субъекту дозы примерно 48 мг/м2 SNS-595 один раз в три недели. В другом варианте осуществления изобретение относится к способу лечения страдающего раком молочной железы субъекта, имеющего мутацию BRCA2, включающему введение субъекту дозы примерно 60 мг/м2 SNS-595 один раз в три недели. В другом варианте осуществления изобретение относится к способу лечения страдающего раком молочной железы субъекта, имеющего мутацию BRCA2, включающему введение субъекту дозы примерно 75 мг/м2 SNS-595 один раз в три недели.
В определенных вариантах осуществления способ введения включает введение субъекту дозы SNS-595 два раза в неделю в течение двух недель (введение в 1-й, 4-й, 8-й и 11-й дни). В другом варианте осуществления способ введения включает введение субъекту дозы SNS-595 один раз в неделю. В другом варианте осуществления способ введения включает введение субъекту дозы SNS-595 один раз в две недели. В другом варианте осуществления способ введения включает введение субъекту дозы SNS-595 один раз в три недели. В другом варианте осуществления способ введения включает введение субъекту дозы SNS-595 один раз в четыре недели.
В одном варианте осуществления доза примерно 40-80 мг/м2 SNS-595 вводится субъекту один раз в три недели, где трехнедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере один раз. В другом варианте осуществления доза примерно 40-80 мг/м2 SNS-595 вводится субъекту один раз в четыре недели, где четырехнедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере один раз. В другом варианте осуществления способ включает введение субъекту дозы примерно 48 мг/м2 SNS-595 один раз в три недели, где трехнедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере один раз. В другом варианте осуществления способ включает введение субъекту дозы примерно 60 мг/м2 SNS-595 один раз в четыре недели, где четырехнедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере один раз. В другом варианте осуществления способ включает введение субъекту дозы примерно 75 мг/м2 SNS-595 один раз в четыре недели, где четырехнедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере один раз.
В одном варианте осуществления способ включает введение субъекту дозы примерно 40-80 мг/м2 SNS-595 один раз в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере дважды или по меньшей мере три раза. В другом варианте осуществления способ включает введение субъекту дозы примерно 30-50 мг/м2 SNS-595 дважды в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере два раза. В другом варианте осуществления доза SNS-595 составляет примерно 50 мг/м2 один раз в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере три раза. В другом варианте осуществления доза SNS-595 составляет примерно 60 мг/м2 один раз в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере три раза. В другом варианте осуществления доза SNS-595 составляет примерно 72 мг/м2 один раз в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере три раза. В другом варианте осуществления способ включает введение субъекту дозы SNS-595 примерно 40 мг/м2 дважды в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяется по меньшей мере дважды.
Все способы и дозировки, указанные в настоящем описании, относятся к лечению или профилактики онкологических заболеваний или предракового состояния.
6.3.3 Дополнительные активные средства
Следует также понимать, что SNS-595 и фармацевтические композиции, содержащие SNS-595, могут использоваться при видах дополнительной комбинированной терапии с другими активными средствами или медицинскими процедурами.
SNS-595 и ее фармацевтические композиции могут вводиться одновременно, перед или после одного или более других желательных активных средств или медицинских процедур. Конкретная комбинация видов лечения (средств или процедур), подлежащая использованию в комбинированной схеме, должна подбираться с учетом совместимости желательных видов лечения и/или процедур и желательного терапевтического эффекта, который должен быть достигнут. Следует также понимать, что используемые способы лечения могут обеспечить достижение желательного эффекта в отношении того же расстройства (например, SNS-595 может вводиться одновременно с другим активным средством, применяемым для лечения того же расстройства), или они могут обеспечивать достижение различных эффектов (например, борьбу с любыми побочными эффектами). Неограничивающие примеры таких средств и процедур включают хирургические вмешательства, лучевую терапию (например, можно в качестве нескольких примеров привести гамма-облучение, лучевую терапию пучком нейтронов, лучевую терапию электронным лучом, протонную терапию, брахитерапию и системные радиоизотопы), эндокринную терапию, модификаторы биологической реакции (интерфероны, интерлейкины и фактор опухолевого некроза (TNF), гипертермию и криотерапию, средства для ослабления любых побочных эффектов (например, противорвотные средства) и другие утвержденные химиотерапевтические противораковые средства.
Примеры химиотерапевтических противораковых средств, которые могут применяться в качестве вторых активных средств в комбинации с SNS-595, включают без ограничения алкилирующие агенты (например, мехлоретамин, хлорамбуцил, циклофосфамид, мелфалан, ифосфамид), антиметаболиты (например, метотрексат), ингибиторы Аврора-киназы (например, SNS-314), антагонисты пурина и антагонисты пиримидина (например, 5-фторурацил (5-FU), гемцитабин), яды веретена (например, алкалоиды барвинка, такие как винбластин, винкристин, винорелбин), митотические ингибиторы (например, таксаны, такие как паклитаксел, доцетаксел, таксотер), ингибиторы или яды топоизомеразы II (например, эпиподофиллотоксины, такие как этопозид, тенипозид; антрациклины, такие как доксорубицин, даунорубицин, идарубицин), ингибиторы топоизомеразы I (например, иринотекан, топотекан, камптотецин), антинеопластические антибиотики (например, блеомицин, митомицин, афидиколин; антрацендионы, такие как митоксантрон), нитрозомочевины (например, кармустин, ломустин), неорганические ионы (например, платиновые комплексы, такие как цисплатин, карбоплатин, оксалиплатин), ферменты (например, аспарагиназа), гормоны и аналоги гормонов (например, тамоксифен, лейпролид, флутамид, мегестрол), ингибиторы EGFR (Her1, ErbB-1) (например, гефитиниб), антитела (например, бевацизумаб, ритуксимаб), производные антител (например, ранибизумаб), IMID (например, талидомид, леналидомид), ингибиторы HDAC (например, вориностат), ингибиторы Bcl-2 (например, облимерсен), ингибиторы стимулируемой VEGF тирозинкиназы (например, сорафениб, сунитиниб), ингибиторы VEGFR (например, трастузумаб), ингибиторы протеасомы (например, бортезомиб), ингибиторы циклинзависимой киназы (cdk) (например, SNS-032, селициклиб), ингибиторы PARP (например, BSI-201), ингибиторы ароматазы (например, анастрозол, экземестан, летрозол), трабектидин и дексаметазон.
В одном варианте осуществления примеры химиотерапевтических противораковых средств, которые могут применяться в качестве вторых активных средств в комбинации с SNS-595, включают доцетаксел, винорелбин, капецитабин, доксорубицин, госерелин, золедроновую кислоту, паклитаксел, памидронат, анастрозол, экземестан, циклофосфамид, эпирубицин, фулвестрант, летрозол, гемцитабин, лейпролид, филграстим (G-CSF или фактор, стимулирующий колонии гранулоцитов), торемифен, тамоксифен, дексразоксан, трастузумаб, пегфилграстим, эпоэтин альфа и дарбепоэтин альфа. В определенных вариантах осуществления SNS-595, в комбинации с одним или более из указанных терапевтических средств может применяться для лечения рака молочной железы.
В одном варианте осуществления терапевтическое средство выбрано из паклитаксела, цисплатина, карбоплатина, гемцитабина, топотекана, алтретамина, трабектидина и циклофосфамида. В определенных вариантах осуществления SNS-595 в комбинации с одним или более из указанных терапевтических средств может применяться для лечения рака яичников.
В одном варианте осуществления второе средство выбрано из митоксантрона, преднизона, паклитаксела, доцетаксела, эстрамустина, доксорубицина, госерелина, лейпролида и дегареликса. В определенных вариантах осуществления SNS-595 в комбинации с одним или более из указанных средств может применяться для лечения рака предстательной железы.
Некоторые определенные противораковые средства, которые могут применяться в комбинации с SNS-595, включают без ограничения карбоплатин, цисплатин, гемцитабин и комбинации любых двух или более из них.
В других вариантах осуществления дополнительное активное средство представляет собой средство поддерживающего лечения, такое как противорвотное средство или химиопротективное средство. Определенные противорвотные средства включают без ограничения фенотиазины, бутирофеноны, бензодиазепины, кортикостероиды, антагонисты серотонина, каннабиноиды и антагонисты NK1 рецепторов. Примеры фенотиазиновых противорвотных средств включают без ограничения прохлорперазин и триметобензамид. Примеры бутерофеноновых противорвотных средств включают без ограничения галоперидол. Примеры бензодиазепиновых противорвотных средств включают без ограничения лоразепам. Примеры кортикостероидных противорвотных средств включают без ограничения дексаметазон. Примеры противорвотных средств в виде антагонистов рецепторов серотонина (рецепторов 5-HT3) включают без ограничения доласетрона мезилат (например, Anzemet®), гранисетрон (например, Kytril®), итасетрон, ондасетрон (например, Zofran®), палоносетрон (например, Aloxi®), рамосетрон, трописетрон (например, Navoban®), батаноприд, дазоприд, рензаприд. Примеры каннабиноидных противорвотных средств включают без ограничения дронабинол. Примеры антагонистов NK1 рецепторов включают без ограничения апрепитант (например, Emend®).
Другие средства поддерживающего лечения включают химиопротективные средства, такие как амифостин (например, Ethyol®), дексразоксан (например, Zinecard®), лейковорин (фолиновая кислота) и месна (например, Mesnex®); тромбопоэтические факторы роста, такие как интерлейкин-11 (IL-11, опрелвекин, например, Neumega®); бисфосфонаты, такие как памидронат динатрия (например, Aredia®), этидронат динатрия (например, Didronel®) и золедроновая кислота (например, Zometa®); и антагонисты TNF, такие как инфликсимаб (например, Remicade®).
В определенных вариантах осуществления введение SNS-595 выполняется в комбинации с одним или более средств поддерживающей терапии для смягчения или предотвращения синдрома лизиса опухоли (TLS) или составляющих его симптомов. Средства лечения, подходящие для предотвращения или смягчения TLS (или любого из его симптомов, включая гиперкалиемию, гиперфосфатемию, гиперурикемию, гипокальцинемию и острую почечную недостаточность), включают, например, аллопуринол (например, Zyloprim®), расбуриказу (например, Elitek®) и полистиролсульфонат натрия (например, Kayexalate®). Лейкаферез может выполняться, например, до 72 часов после первого лечения SNS-595.
6.4 Комбинированная терапия с другими активными средствами
В определенных вариантах осуществления способ по изобретению включает введение SNS-595 или фармацевтических композиций по изобретению в комбинации с одним или более другими активными средствами и/или в комбинации с лучевой терапией или хирургическим лечением.
Введение субъекту SNS-595 и дополнительных активных средств может происходить одновременно или последовательно одним и тем же или различными путями введения. Пригодность конкретного пути введения, используемого для конкретного активного средства, зависит от самого активного средства (например, того, может ли оно вводиться перорально без разрушения перед поступлением в кровоток) и подвергаемого лечению заболевания. Рекомендуемые пути введения для того или иного активного средства известны средним специалистам в данной области. См., например, настольный врачебный справочник Physicians' Desk Reference, (63rd ed., 2009) (далее именуемый «Physicians ' Desk Reference»).
В одном варианте осуществления второе активное средство вводится внутривенно или подкожно и один или два раза в день в количестве от примерно 1 до примерно 1000 мг, от примерно 5 до примерно 500 мг, от примерно 10 до примерно 375 мг или от примерно 50 до примерно 200 мг.
В другом варианте осуществления изобретение относится к способам лечения, профилактики и/или ведения субъекта с онкологическим заболеванием, имеющего мутацию BRCA2, включающим введение SNS-595 в сочетании с (например, до, во время или после) обычным лечением, включающим без ограничения хирургическое лечение, иммунотерапию, биологическую терапию, лучевую терапию или другую немедикаментозную терапию, используемую в настоящее время для лечения, профилактики и ведения пациентов с онкологическими заболеваниями.
В одном варианте осуществления SNS-595 может водиться в количестве примерно 10-100 мг/м2, примерно 20-90 мг/м2, примерно 30-80 мг/м2, примерно 40-80 мг/м2, примерно 40-90 мг/м2, примерно 30-90 мг/м2 или примерно 30-50 мг/м2, отдельно или в комбинации со вторым активным средством, описанным в настоящей заявке, перед, во время или после применения обычного лечения.
В одном варианте осуществления второе средство выбрано из группы, состоящей из карбоплатина, цисплатина, гемцитабина и комбинаций любых двух или более из них.
В одном варианте осуществления комбинированное лечение включает введение SNS-595 и карбоплатина. В одном варианте осуществления комбинированное лечение включает введение SNS-595 и цисплатина. В одном варианте осуществления комбинированное лечение включает введение SNS-595 и гемцитабина.
В одном варианте осуществления способы по изобретению включают введение SNS-595 в комбинации с дозой от примерно 5 мг/м2 до примерно 200 мг/м2 цисплатина. Например, один вариант осуществления включает введение цисплатина в дозе примерно 50 или 70 мг/м2 один раз в 3-4 недели. Один вариант осуществления включает введение цисплатина в дозе примерно 50 или 70 мг/м2 один раз в 3 недели. Другой вариант осуществления включает введение цисплатина в дозе примерно 75 или 100 мг/м2 один раз в 3 недели. В другом варианте осуществления введение цисплатина проводится в дозе примерно 20 мг/м2 в день до 5 дней. Цисплатин может вводиться внутривенной инфузией, внутривенным болюсным вливанием, болюсной инъекцией или подкожной инъекцией. В одном варианте осуществления введение цисплатина проводится один раз в 3-4 недели, тогда как введение SNS-595 происходит один раз в неделю в течение трех недель или один раз в три недели. В одном варианте осуществления введение цислатина осуществляется ежедневно в течение 5 дней, тогда как введение SNS-595 происходит один раз в неделю в течение трех недель или один раз в три недели. В одном варианте осуществления введение цисплатина осуществляется один раз в неделю в течение 3 недель, тогда как введение SNS-595 происходит один раз в неделю в течение трех недель или один раз в три недели.
В одном варианте осуществления способы по изобретению включают введение SNS-595 в комбинации с карбоплатином в дозе от примерно 50 мг/м2 до примерно 400 мг/м2. Например, один вариант осуществления включает введение карбоплатина в дозе примерно 300 или примерно 360 мг/м2 один раз в 3 недели. Один вариант осуществления включает введение карбоплатина в дозе примерно 300 или 360 мг/м2 один раз в 4 недели. Карбоплатин может вводиться внутривенной инфузией, внутривенным болюсным вливанием, болюсной инъекцией или подкожной инъекцией. В одном варианте осуществления введение карбоплатина производится один раз в 3 недели, тогда как введение SNS-595 происходит один раз в неделю в течение трех недель иди один раз в три недели. В одном варианте осуществления введение карбоплатина производится один раз в неделю в течение 3 недель, тогда как введение SNS-595 происходит один раз в неделю в течение трех недель или один раз в три недели.
В одном варианте осуществления способы по изобретению включают введение SNS-595 в комбинации с дозой гемцитабина от примерно 100 мг/м2 до примерно 1500 мг/м2. Например, один вариант осуществления включает введение гемцитабина в дозе примерно 1000 или 1250 мг/м2 один раз в неделю в течение по меньшей мере 4 недель. Гемцитабин может вводиться внутривенной инфузией, внутривенным болюсным вливанием, болюсной инъекцией или подкожной инъекцией. В одном варианте осуществления введение гемцитабина производится один раз в неделю в течение периода до 4 недель, тогда как введение SNS-595 происходит один раз в неделю в течение трех недель или один раз в три недели. В одном варианте осуществления введение гемцитабина проводится дважды в неделю в течение 2 недель, тогда как введение SNS-595 происходит один раз в неделю в течение трех недель.
В определенных вариантах осуществления второе активное средство совместно вводится с SNS-595 или вводится с отсрочкой 1-50 часов. В определенных вариантах осуществления сначала вводится SNS-595 с последующим введением второго активного средства с отсрочкой 1-50 часов. В других вариантах осуществления, сначала вводится второе активное средство с последующим введением SNS-595 с отсрочкой 1-50 часов. В некоторых вариантах осуществления отсрочка составляет 24 часа.
В другом варианте осуществления способ по изобретению включает: a) введение субъекту с онкологическим заболеванием, имеющему мутацию BRCA2, SNS-595 в дозе примерно 10-100 мг/м2 и b) введение субъекту терапевтически эффективного количества средства поддерживающего лечения.
Средство поддерживающего лечения вводится в соответствии со схемой введения, целесообразной для данного вещества. Например, различные средства поддерживающего лечения для лечения тошноты имеют различные схемы введения. Хотя некоторые такие средства вводятся профилактически, другие вводятся совместно с соединением или композицией по изобретению, тогда как еще одни вводятся после введения SNS-595. Иллюстративные примеры средств поддерживающего лечения, их доз и схем введения можно найти в справочнике Physicians' Desk Reference. Некоторые иллюстративные средства для поддерживающего лечения описаны в заявке на патент США № 2006-0025437, содержание которой полностью включено в настоящую заявку путем ссылки.
6.5 Фармацевтические композиции и лекарственные формы
В способах по изобретению применяются фармацевтические композиции, содержащие SNS-595, и фармацевтически приемлемые носители, такие как разбавители или адъюванты, или в комбинации с другими активными ингредиентами, такими как другое противораковое средство. В клинической практике SNS-595 может вводиться любым обычным путем, включая без ограничения пероральное, парентеральное, ректальное или ингаляционное введение (например, в форме аэрозоля). Парентеральные лекарственные формы могут вводиться субъектам различными путями, включая без ограничения подкожный, внутривенный (включая болюсную инъекцию), внутримышечный и внутриартериальный. Ввиду того, что их введение обычно обходит естественные защитные механизмы субъекта против заражающих факторов, парентеральные формы являются стерильными или способными стерилизоваться перед введением субъекту. Примеры парентеральных лекарственных форм включают без ограничения растворы, готовые для инъекции, сухие продукты, готовые к растворению и суспендированию в фармацевтически приемлемом носителе для инъекции, суспензии, готовые для инъекции и эмульсии. В одном варианте осуществления SNS-595 вводится внутривенной инъекцией.
Фармацевтические композиции для парентерального введения могут представлять собой эмульсии или однородные растворы. Подходящие носители, которые могут использоваться для получения парентеральных лекарственных форм, хорошо известны специалистам в данной области. Примеры включают без ограничения воду для инъекции USP, водный носитель, такой как без ограничения раствор хлорида натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и лактированный раствор Рингера для инъекций, смешиваемые с водой носители, такие как без ограничения этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как без ограничения нефтяное масло, животное масло, масло растительного или синтетического происхождения, такое как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные; этилолеат, изопропилмиристат и бензилбензоат.
Указанные фармацевтические композиции могут также содержать адъюванты, в частности, смачивающие, изотонизирующие, эмульгирующие, диспергирующие и стабилизирующие агенты. Стерилизация может осуществляться несколькими путями, например, с использованием фильтра с размером пор 0,2 мкм, облучением или нагреванием. См. руководство Remington's Pharmaceutical Sciences, 21st ed., Mack Publishing, Easton, PA (2005) (далее именуемое «Remington's Pharmaceutical Sciences»). Они могут быть также получены в форме стерильных твердых фармацевтических композиций, которые могут растворяться во время применения в стерильной воде или любой другой инъецируемой стерильной среде.
Фармацевтические композиции могут применяться при получении отдельных, одиночных стандартных лекарственных форм. Фармацевтические композиции и лекарственные формы содержат соединение и один или более эксципиентов.
Фармацевтические композиции и лекарственные формы могут также содержать один или более дополнительных активных ингредиентов. Примеры возможных вторых или дополнительных активных ингредиентов описаны в настоящей заявке.
В определенных вариантах осуществления фармацевтическая композиция по изобретению представляет собой одну стандартную лекарственную форму. Фармацевтические композиции и стандартные лекарственные формы по изобретению содержат профилактически или терапевтически эффективное количество соединения или композиции и обычно один или более фармацевтически приемлемых носителей или эксципиентов. Термин «носитель» относится к разбавителю, адъюванту (например, адъюванту Фрейнда (полному и неполному)), эксципиенту или носителю, с которым вводится терапевтическое средство. Примеры подходящих фармацевтических носителей описаны в руководстве Remington's Pharmaceutical Sciences.
Типичные фармацевтические композиции и лекарственные формы содержат один или более эксципиентов. Подходящие эксципиенты хорошо известны специалистам в области фармации, и неограничивающие примеры подходящих эксципиентов включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропилен, гликоль, воду, этанол и тому подобное. То, подходит ли конкретный эксципиент для включения в фармацевтическую композицию или лекарственную форму, зависит от разнообразных факторов, хорошо известных в данной области, включая без ограничения путь, которым лекарственная форма будет вводиться субъекту, и определенные активные ингредиенты в лекарственной форме. При желании, фармацевтическая композиция или стандартная лекарственная форма может также содержать небольшие количества смачивающих или эмульгирующих агентов или агентов, забуферивающих pH.
Соединения, которые увеличивают растворимость одного или более из активных ингредиентов, описанных в настоящей заявке, могут быть также включены в парентеральные лекарственные формы. Например, циклодекстрин и его производные могут использоваться для увеличения растворимости активных ингредиентов. См., например, патент США № 5134127, полное содержание которого включено в настоящее описание путем ссылки.
pH фармацевтической композиции или лекарственной формы может также регулироваться для улучшения доставки одного или более активных ингредиентов. Аналогичным образом, могут регулироваться полярность растворителя-носителя, его ионная сила или тоничность для улучшения доставки. Соединения, такие как стеараты, могут также добавляться к фармацевтическим композициям или лекарственным формам для преимущественного изменения гидрофильности или липофильности одного или более активных ингредиентов с тем, чтобы улучшить доставку. В этом отношении, стеараты могут служить в качестве липидного носителя для препаративной формы, в качестве эмульгирующего агента или поверхностно-активного вещества и в качестве усиливающего доставку или усиливающего проникновение агента. Могут использоваться различные соли, гидраты или сольваты активных ингредиентов для дополнительной регулировки свойств получаемой в результате фармацевтической композиции.
Кроме того, настоящее изобретение относится к фармацевтическим композициям и лекарственным формам, которые содержат одно или более соединения, снижающие скорость, с которой будет разрушаться активный ингредиент. Такие композиции, которые именуются в настоящем описании «стабилизаторами», включают без ограничения антиоксиданты, такие как аскорбиновая кислота, буферы pH или солевые буферы.
Фармацевтические композиции и одиночные стандартные лекарственные формы могут принимать форму растворов, суспензий, эмульсии, порошка и тому подобных. Такие композиции и лекарственные формы содержат профилактически или терапевтически эффективное количество профилактического или терапевтического средства, в определенных вариантах осуществления в очищенной форме, вместе с подходящим количеством носителя с тем, чтобы обеспечить форму для соответствующего введения субъекту. Препаративная форма должна подходить для вида введения. В одном варианте осуществления фармацевтические композиции и одиночные стандартные лекарственные формы являются стерильными и в форме, подходящей для введения людям или другим субъектам.
Фармацевтическая композиция по настоящему изобретению составляется для совместимости с предполагаемым путем введения. Примеры путей введения включают без ограничения парентеральные пути (т.е. отличные от введения через пищеварительный тракт), например, внутривенное, интрадермальное, подкожное, внутримышечное, ингаляцию, интраназальное, трансдермальное, местное, трансмукозальное, внутриопухолевое и внутрисиновиальное введение. В определенном варианте осуществления композиция составляется в соответствии с обычными процедурами в виде фармацевтической композиции, приспособленной для внутривенного, подкожного, внутримышечного, интраназального или местного введения людям. В определенных вариантах осуществления фармацевтическая композиция составляется в соответствии с обычными процедурами для подкожного введения людям. В одном варианте осуществления фармацевтические композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости, фармацевтическая композиция может также включать солюбилизирующий агент и местный анестетик, такой как лигнокаин, для облегчения боли в участке инъекции.
Примеры лекарственных форм включают без ограничения жидкие лекарственные формы, подходящие для парентерального введения субъекту; и стерильные твердые лекарственные формы (например, кристаллические или аморфные твердые лекарственные формы), влагосодержание которых может восстанавливаться для обеспечения жидких лекарственных форм, подходящих для парентерального введения субъекту. Иллюстративной твердой формой является лиофилизированное твердое вещество.
Фармацевтическая композиция, форма и тип лекарственных форм по изобретению будут обычно варьироваться в зависимости от их применения. Например, лекарственная форма, применяемая при первоначальном лечении заболевания, может содержать бульшие количества одного или более активных ингредиентов, чем лекарственная форма, применяемая при поддерживающем лечении той же инфекции. Аналогичным образом, парентентальная лекарственная форма может содержать меньшие количества одного или более активных ингредиентов, чем пероральная лекарственная форма, применяемая для лечения того же заболевания или расстройства. Данные и другие аспекты, в которых определенные лекарственные формы по настоящему изобретению будут отличаться друг от друга, будут вполне понятны специалистам в данной области. См., например, Remington's Pharmaceutical Sciences.
В целом, ингредиенты фармацевтических композиций по настоящему изобретению поставляются или отдельно, или смешанные вместе в стандартной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметично запаянном контейнере, таком как ампула или саше, с указанием количества активного средства. Когда фармацевтическая композиция предназначена для введения путем инфузии, она может быть диспергирована, причем инфузионный флакон содержит стерильную воду или солевой раствор фармацевтической степени очистки. Когда фармацевтическая композиция вводится путем инъекции, то ампула стерильной воды или солевого раствора для инъекций может предоставляться с тем, чтобы ингредиенты могли смешиваться перед введением. В одном варианте осуществления лекарственные формы по изобретению содержат достаточное количество SNS-595 для обеспечения возможности введения доз SNS-595 в пределах диапазона примерно 10-100 мг/м2 в день, или в неделю, вводимых в виде одной однодневной дозы или в виде дробных доз в течение дня, возможно, принимаемые с пищей.
В определенных вариантах осуществления фармацевтические лекарственные формы по изобретению включают первичный контейнер, содержащий SNS-595. В определенных вариантах осуществления первичный контейнер находится внутри непрозрачного вторичного контейнера. В одном варианте осуществления первичный контейнер представляет собой стеклянный флакон, такой как флакон из прозрачного стекла, а вторичный контейнер представляет собой непрозрачный, выстланный фольгой пакет, включая выстланный металлической фольгой пакет, такой как выстланный алюминиевой фольгой пакет. В одном варианте осуществления фармацевтические лекарственные формы по изобретению содержат прозрачный стеклянный флакон, содержащий SNS-595, где прозрачный стеклянный флакон находится внутри непрозрачного пакета, выстланного алюминиевой фольгой. Кроме того, иллюстративные фармацевтические лекарственные формы включают те, которые описаны в документе WO 2008/016668, полностью включенном в настоящее описание путем ссылки. В одном варианте осуществления лекарственные формы по изобретению содержат примерно 1-2000, 1-1000, 1-500, 1-300, 1-100 или 1-50 мг SNS-595. Конкретные лекарственные формы по изобретению содержат примерно 10, 15, 18, 21, 24, 25, 30, 40, 48, 50, 60, 70, 72, 75, 80, 90, 100, 150, 200, 300 ил 500 мг SNS-595.
Понятно, что предшествующее детальное описание и сопровождающие примеры являются просто иллюстративными и не должны восприниматься как ограничения объема предмета изобретения. Различные изменения и модификации описанных вариантов осуществления будут очевидны для специалистов в данной области. Такие изменения и модификации, включая без ограничения те, которые относятся к способам применения по изобретению, могут быть внесены без отхода от его сущности и объема. Патенты, патентные публикации и другие публикации, приведенные в настоящем описании, включены в него путем ссылки.
7. Примеры
Определенные варианты осуществления заявленного предмета изобретения иллюстрируются следующими неограничивающими примерами.
Следующие линии клеток использовались в описанных в настоящей заявке примерах. Все линии клеток культивировали в модифицированной по способу Дульбекко среде Игла с добавлением 9% фетальной телячьей сыворотки и пенициллина-стрептомицина (90 ЕД/мл) (DMEM), при 37°C и атмосфере 5% CO2.
Линия клеток SPD8 несет спонтанно происходящую мутацию в гене hprt, и была выделена в виде устойчивого к 6-тиогуанину (6TG) клона из линии клеток фибробластов китайского хомячка V79. Мутация в пределах гена hprt представляет собой тандемную дупликацию экзона 7, интрона 6 и участка 3' экзона 6, которая приводит к экспрессии нефункционального протеина HPRT (Dare et al., Somat Cell Mol Genet, 1996, 22:201-210; и Helleday et al., J Mol Biol, 1998, 279(4):687-694). Указанная дупликация может быть утрачена посредством HR, возвращающая к дикому типу ген hprt, который может быть выбран в HAsT (50 мкМ гипоксантина, 10 мкМ L-азасерина, 5 мкМ тимидина) (Helleday et al. 1998). В DMEM добавляли 6TG (5 мкг/мл) для уничтожения клеток, которые подвергаются спонтанному возвращению в исходное состояние. Добавление 6TG в указанной концентрации не воздействует ни на скорость роста указанных мутантов, ни на процедуру анализа рекомбинации.
Линию клеток U-2 OS (остеосаркомы человека) получали из ATCC (HTB-96).
Линии клеток VC8 и VC8-B2 происходят из клеток фибробластического ряда V79 яичников китайского хомячка. VC8 имеет мутацию в гене brca2, и VC8-B2 представляет собой данную линию клеток, дополненную человеческой хромосомой 13 (содержащей ген brca2; Kraakman-van der Zwet et al., Mol Cell Biol, 2002, 22(2):669-679).
Следующие химические соединения использовались в анализах, описанных в настоящей заявке.
Порошок афидиколина (Sigma) растворяли в ДМСО до концентрации более чем 0,2%.
Доксорубицин (Sigma) и камптотецин (Sigma) растворяли в диметилсульфоксиде (ДМСО). Доза обработки не превышала 0,2% ДМСО. Аликвотные количества держали при -20°C.
Раствор SNS-595 (10 мг SNS-595 на мл водного раствора 4,5% D-сорбита доводили до pH 2,5 метансульфоновой кислотой) держали при комнатной температуре.
Разведения для обработки производили непосредственно перед обработкой в DMEM.
Гамма облучение выполняли в камере Cs137 (1,9 Гр/мин).
Пример 1: Анализ ингибирования роста
Влияние BRCA2 на чувствительность к SNS-595 оценивали анализом пролиферации мутантных клеток китайского хомячка (VC8) и комплементированных в отношении функционального BRCA2 (VC8-B2). Активность SNS-595 в данных анализах сравнивали с доксорубицином. Следующий протокол использовали для анализа:
День 1
1. 4000 клеток/лунку высевали в 96-луночный планшет так, что половина планшета содержала клетки VC8, а другая половина содержала клетки VC8-B2. Последнюю колонку оставляли свободной от клеток в качестве фонового контроля.
2. Планшет инкубировали при 37°C в атмосфере 5% CO2.
День 2
1. Среду удаляли и 50 мкл свежей среды добавляли в каждую лунку.
2. В первой колонке среду удаляли и добавляли 200 мкл или 0,5 мкМ доксорубицина, или 1,5 мкМ SNS-595.
3. 100 мкл из первой колонки переносили во вторую колонку и смешивали. 100 мкл из второй колонки переносили в третью колонку и смешивали, и так далее до конца планшета. Одну колонку оставляли необработанной. Планшет инкубировали при 37°C в атмосфере 5% CO2.
4. После 4-часовой обработки планшет промывали дважды 100 мкл PBS и добавляли 250 мкл среды. Планшет инкубировали при 37°C в атмосфере 5% CO2.
День 7
1. После инкубации в течение 120 ч планшет промывали 100 мкл PBS и 100 мкл резазурина (10 мкг/мл в полной среде DMEM, не содержащей фенола красного).
2. Планшет инкубировали при 37°C в атмосфере 5% CO2 в течение 1 ч, и флуоресценцию измеряли при Em (эмиссии) 530 нм/Ex (возбуждении) 590 нм.
На фиг.1 и 2 иллюстрируется ингибирование роста мутантых клеток китайского хомячка (VC8) и комплементированных в отношении функционального BRCA2 (VC8-B2) в присутствии, соответственно, доксорубицина и SNS-595. В клетках, мутантных в отношении BRCA2, было идентифицировано пятикратное увеличение чувствительности к SNS-595, по сравнению с клетками, экспрессирующими функциональный BRCA2 (IC50 0,14 мкМ в сравнении с 0,72 мкМ). Чувствительность к доксорубицину была увеличена приблизительно в 4 раза (IC50 0,05 мкМ в сравнении с 0,19 мкМ).
Пример 2: Анализ разрастания колоний
Влияние BRCA2 на чувствительность к SNS-595 оценивали анализом с использованием миРНК разрастания колоний у клеток U-2 OS, включающих клетки дикого типа, в сравнении с клетками с истощенным запасом BRCA2. Активность SNS-595 в указанных анализах оценивали клоногенным выживанием и сравнивали с доксорубицином. Следующий протокол использовали для анализа:
День 1
1. 200000 клеток высевали в каждую из 2 лунок в 6-луночном планшете и инкубировали в течение ночи при 37°C и атмосфере 5% CO2.
День 2
1. Получали следующие реагенты:
A: Тест: 50 мкл 2 мкМ siBRCA2 (si Genome SMARTpool, Dharmacon) + 150 мкл OptiMEM (Gibco)
B: Контроль (без миРНК): 200 мкл OptiMEM
C: 2 мкл DharmaFect 1 (Dharmacon) + 198 мкл OptiMEM
2. Реагентам давали возможность отстояться при комнатной температуре в течение 5 минут.
3. Реагенты A+C и B+C смешивали, и им давали возможность отстояться при комнатной температуре в течение 20 мин.
4. Среду в лунках заменяли 1,6 мл среды, не содержащей антибиотики (DMEM, Gibco).
5. Добавляли 400 мкл реагентов A+B или B+C и смешивали в лунках. Планшет инкубировали при 37°C.
День 3
1. После 24 ч обработки миРНК клетки трипсинизировали и подсчитывали.
2. Клетки высевали в чашки диаметром 100 мм при плотности 500 или 1000 клеток/чашку в 10 мл среды и инкубировали в течение 4 ч.
3. Через 4 ч добавляли тестируемые вещества, и планшеты инкубировали в течение 14 дней.
День 17
1. Клетки в планшетах собирали и фиксировали в метиленовом синем (4 г/л в метаноле), и подсчитывали колонии, содержащие более чем 50 клеток.
Разрастание колоний на фиг.3 и 4 иллюстрирует, что клетки U-2 OS с истощением запаса BRCA2, используя миРНК, в 4,6 раза более чувствительны к обработке SNS-595, чем клетки дикого типа.
Пример 3: Гель-электрофорез в пульсирующем поле (PFGE)
2 миллиона клеток (2·106) SPD8 высевали во флаконы (75 см3) и инкубировали в течение ночи. В последующем клетки обрабатывали SNS-595 (20 мкМ) или доксорубицином (3 мкМ) и подвергали совместной обработке афидиколином (3 мкМ) в течение 4 ч перед вплавлением в агарозную вставку (1·106 клеток/70 мкл 1% InCert Agarose, BMA). Вставки переносили в 0,5М EDTA 1% N-лаурилсаркозил и протеиназу K (1 мг/мл) и инкубировали при 50°C в течение 48 ч и затем промывали четыре раза в TE-буфере (2 ч между каждым промыванием) перед загрузкой на агарозный сепарационный гель (1% агароза хромосомного сорта, Bio-Rad). Сепарацию выполняли на системе CHEF DR III system (BioRad; угол поля 120°, время включения 240 секунд, 4 в/см) в течение 18 ч или в течение 24 часов при времени включения от 60 до 240 секунд. Гель окрашивали этидием бромидом в течение 5 ч и в последующем анализировали сканирующим ридером флуоресценции (Molecular Imager FX, BioRad) с использованием программного обеспечения Quantative One.
На фиг.5 и фиг. 6 представлены данные анализа PFGE клеток, обработанных SNS-595, доксорубицином и при совместной обработке с афидиколином. На фиг.5 представлен цикл PFGE в течение 18 ч при времени включения 240 секунд. На фиг.6 представлен сеанс PFGE в течение 24 ч при времени включения от 60 до 240 секунд. Данные демонстрируют продукцию более мелких фрагментов ДНК в клетках, обработанных доксорубицином, по сравнению с клетками, обработанными SNS-595.
На фиг.7 представлены данные, иллюстрирующие продукцию маленьких фрагментов ДНК после обработки доксорубицином и SNS-595 в течение 18-часового сеанса PFGE при времени включения 240 секунд. Различие повреждающей ДНК активности SNS-595 и доксорубицина демонстрируется продукцией маленьких фрагментов ДНК в клетках, обработанных доксорубицином, по сравнению с клетками, обработанными SNS-595.
На фиг.8 представлены данные, иллюстрирующие продукцию маленьких фрагментов ДНК после обработки доксорубицином и SNS-595 в течение 24-часового сеанса PFGE при времени включения от 60 до 240 секунд. И в данном случае клетки, обработанные доксорубицином, продуцируют меньшие фрагменты ДНК, чем клетки, обработанные SNS-595.
Пример 4: Анализ рекомбинации
Каждую колбу (75 см3) инокулировали 1,5·106 клеток SPD8 за 24 ч до обработки SNS-595 (2 мкМ) или доксорубицином (0,5 мкМ) и при совместной обработке с афидиколином (0,5 мкМ). После 4 ч обработки колбы дважды промывали PBS и добавляли 20 мл DMEM. Затем клетки инкубировали в течение 48 ч для извлечения перед высеванием на чашки Петри. Эффективность клонирования измеряли высеванием 500 клеток в 10 мл среды, по 2 чашки Петри на дозу. HPRT + ревертанты отбирали высеванием 3·105 клеток/чашку в присутствии HAsT (50 мкМ гипоксантина, 10 мкМ L-азасерина, 5 мкМ тимидина), по 3 чашки на дозу. Соответственно, через 7 и 10 дней клетки из чашек собирали, и колонии фиксировали и окрашивали с использованием метиленового синего в метаноле (4 г/л). Подсчитывали колонии, содержащие более чем 50 клеток.
На фиг.9 иллюстрируется эффективность клонирования клеток SPD8 после обработки афидиколином или SNS-595, или доксорубицином отдельно, или при совместной обработке с афидиколином. Как видно из представленных данных, обработка SNS-595 или доксорубицином значительно нарушала эффективность клонирования. Афидиколин (блокатор S-фазы) вызывал снижение цитотоксичности обоих лекарственных средств, причем это было более значимо для SNS-595 (p=0,007), чем для доксорубицина (p=0,04). Это демонстрирует, что компонент цитотоксичности SNS-595 вызывается во время S-фазы, и что большая часть цитотоксичности является независимой от S-фазы.
На фиг.10 иллюстрируется частота реверсии клеток SPD8 после обработки афидиколином или SNS-595 или доксорубицином отдельно и при совместной обработке с афидиколином. Обработка SNS-595 и доксорубицином увеличивала частоту реверсии у клеток SPD8, что отражает увеличенный уровень явлений гомологичной рекомбинации. Блок S-фазы (совместная обработка афидиколином) не оказывала эффект на частоту реверсии, вызванной SNS-595, но значительно уменьшал вызванные доксорубицином явления рекомбинации (p=0,04). Это демонстрирует, что вызванные SNS-595 явления рекомбинации HRR являются независимыми от S-фазы, в отличие от доксорубицина, при котором компонент вызванной HRR рекомбинации вызывается во время S-фазы. Эти данные, кроме того, дифференцируют молекулярный механизм действия SNS-595 от механизма действия доксорубицина.
Пример 5: Фармацевтическая композиция, подходящая для инъекции или внутривенной инфузии
Иллюстративный пример подходящей фармацевтической композиции включает: 10 мг SNS-595 и (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты (где количество SNS-595 составляет по меньшей мере 99,95%, а количество (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты составляет менее чем примерно 0,05%) на миллилитр (мл) водного 4,5% раствора D-сорбита, pH которого доводили до 2,5 метансульфоновой кислотой. Одна последовательность операций для приготовления такого раствора включает следующую для получения раствора с концентрацией 100 мг/10 мл: 100 мг активной композиции, которая состоит по существу из по меньшей мере 99,95% SNS-595 и менее чем 0,05% (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, и 450 мг D-сорбита, добавляли к дистиллированной воде; объем доводили до объема 10 мл; и pH полученного раствора доводили до 2,5 метансульфоновой кислотой. Полученная композиция подходила также для лиофилизации. Затем влагосодержание лиофилизированной формы восстанавливали стерильной водой до соответствующей концентрации перед использованием.
Пример 6: Фармацевтическая композиция, подходящая для инъекции или внутривенной инфузии
Иллюстративный пример подходящей фармацевтической композиции включает: 10 мг общего количества SNS-595 и примеси (где количество SNS-595 составляет по меньшей мере примерно 99,95% и общее количество примесей составляет менее чем примерно 0,05%) на 1 мл водного раствора 4,5% сорбита, pH которого доводится до pH 2,5 метансульфоновой кислотой. Одна последовательность операций для приготовления такого раствора включает следующую для получения раствора с концентрацией 100 мг/10 мл: 100 мг композиции, состоящей по существу из по меньшей мере 99,95% SNS-595 и менее чем 0,05% примесей, и добавляли 450 мг D-сорбита к дистиллированной воде; объем доводили до объема 10 мл; и pH полученного раствора доводили до pH 2,5 метансульфоновой кислотой. Полученная композиция подходила также для лиофилизации. Затем влагосодержание лиофилизированной формы восстанавливали стерильной водой до соответствующей концентрации перед использованием.
Варианты осуществления заявленного предмета изобретения, описанного выше, предназначены для рассмотрения лишь в качестве иллюстративных, и специалисты в данной области поймут или смогут не более чем посредством обычного экспериментирования установить многочисленные эквиваленты определенных соединений, материалов и процедур. Все такие эквиваленты считаются входящими в объем заявленного предмета изобретения и охватываются прилагаемой формулой изобретения.
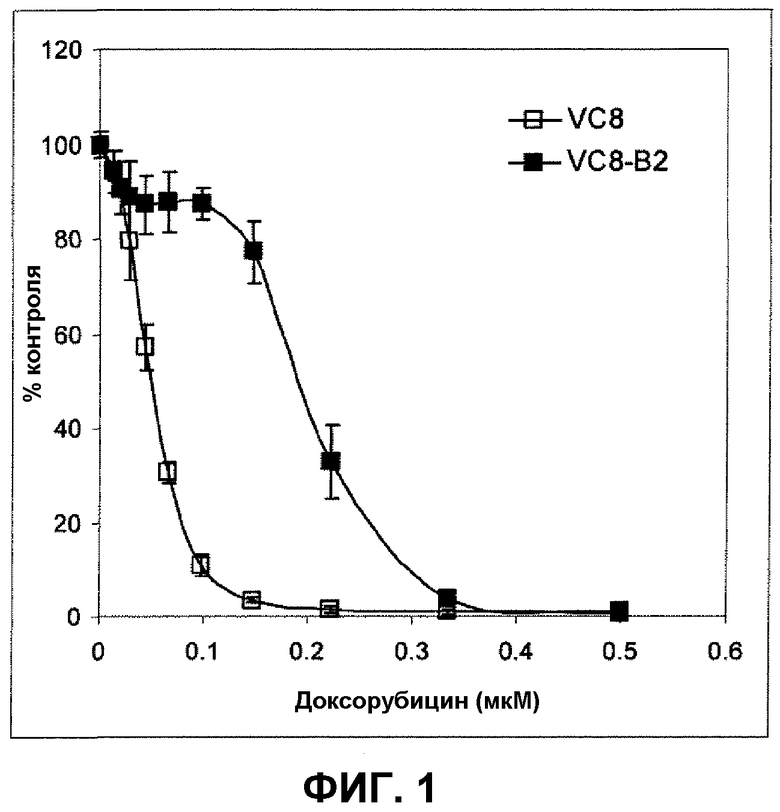
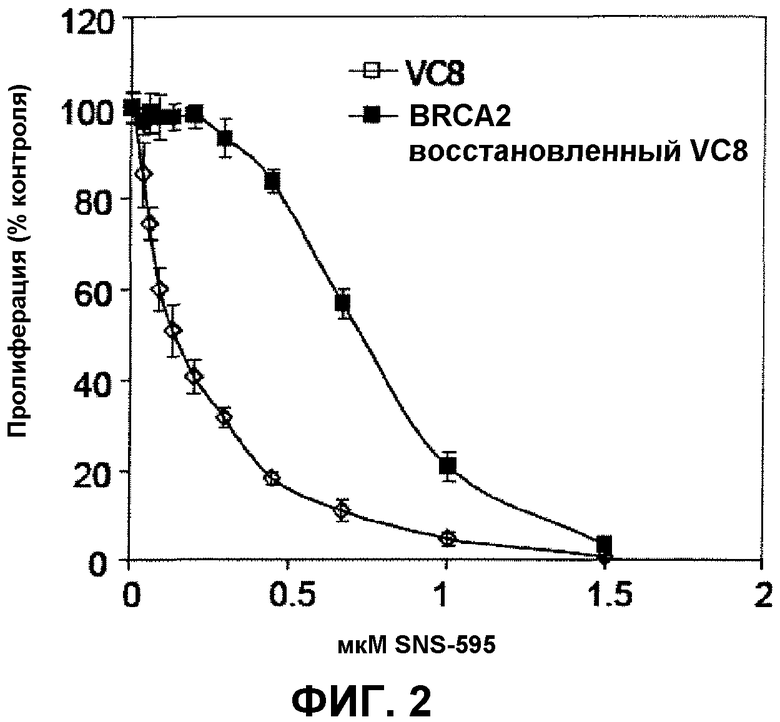
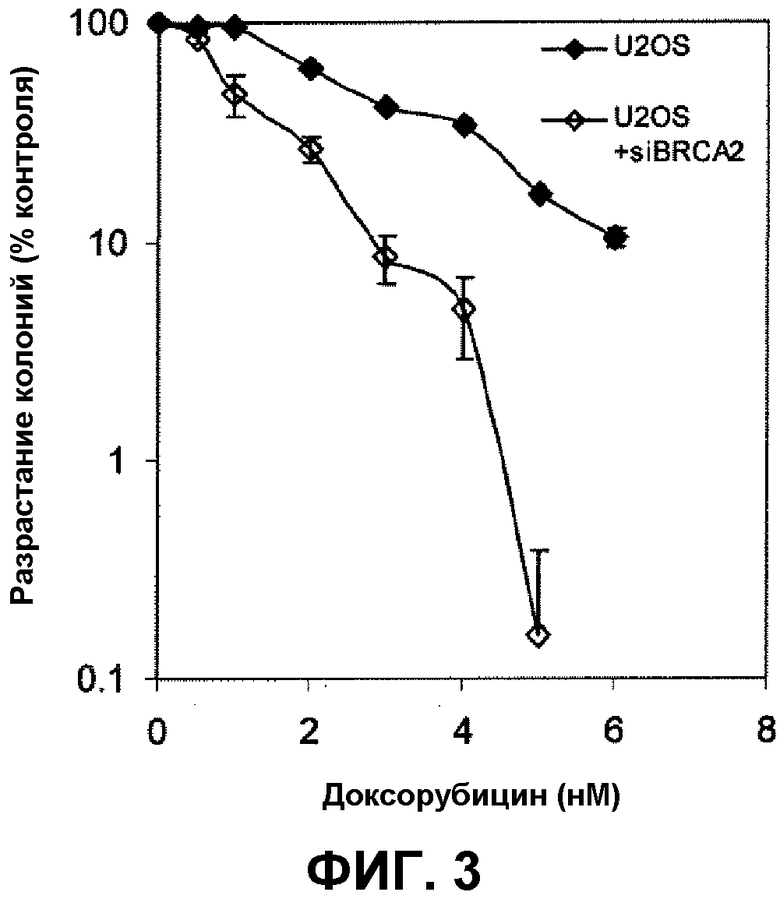
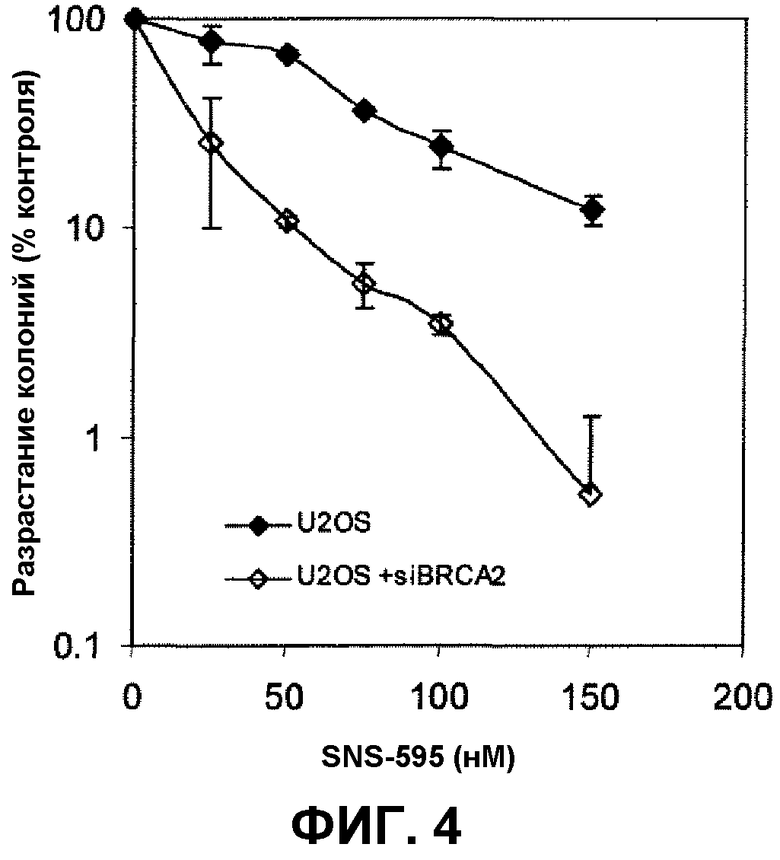

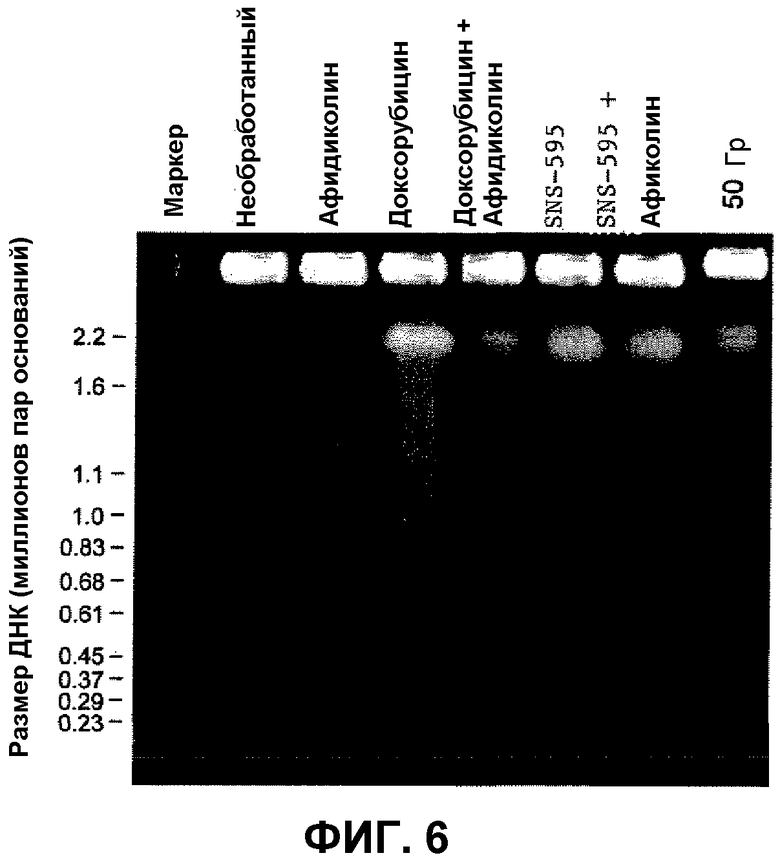


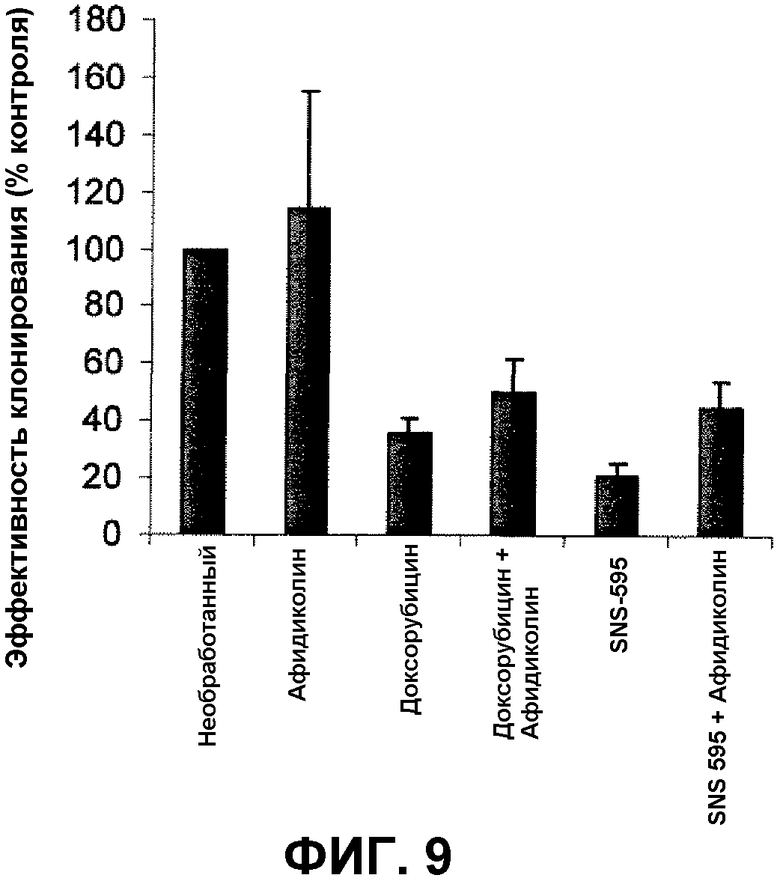
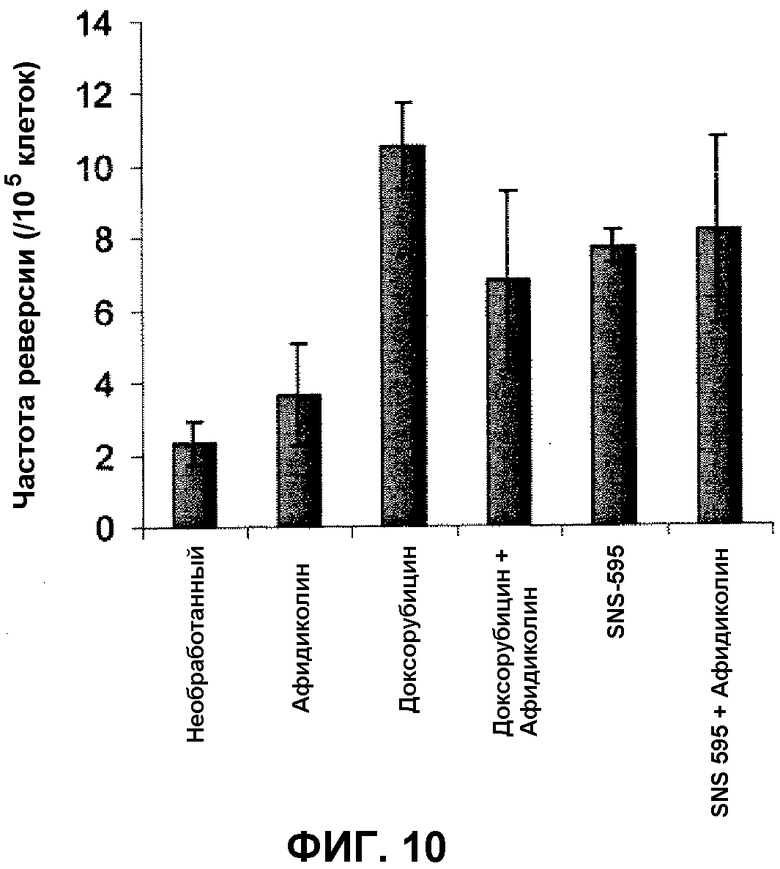
Группа изобретений относится к медицине, а именно к онкологии, и касается применения SNS-595 для лечения субъекта, имеющего рак, со сниженной активностью BRCA2. Для этого вводят SNS-595 в терапевтически эффективных количествах. Это обеспечивает эффективное лечение рака за счет высокой чувствительности мутантных клеток BRCA2 к вводимому препарату. 6 н. и 21 з.п. ф-лы, 10 ил., 6 пр.
1. Способ лечения рака у субъекта, имеющего мутацию BRCA2, которая снижает активность BRCA2, включающий введение субъекту (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты в дозе примерно 10-100 мг/м2.
2. Способ по п. 1, где рак представляет собой рак молочной железы, яичников, предстательной железы или поджелудочной железы.
3. Способ по п. 2, где рак представляет собой рак молочной железы.
4. Способ по п. 1, где субъект имеет мутацию BRCA2, выбранную из 999del5, 6174delT, 8803delC, 4486delG, 5445del5, 2024del5, 763insAT, 763insAT, 983delACAG, A3058T, 3758delACAG, 3908delTG, 4706delAAAG, 5804delTTAA, C6137A, 6174delT, 6305insA, 9132delC, del2352ins12, dup9700 и del1518.
5. Способ по любому из пп. 1-4, где (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту вводят в дозе примерно 40-90 мг/м2.
6. Способ по любому из пп. 1-4, где (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту вводят в дозе примерно 30-60 мг/м2.
7. Способ по любому из пп. 1-4, включающий: i) введение субъекту дозы (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту примерно 40-90 мг/м2; ii) ожидание в течение периода, по меньшей мере, шести дней, когда субъекту не вводят (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту; и iii) введение субъекту другой дозы примерно 40-90 мг/м2 (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты.
8. Способ по любому из пп. 1-4, где доза составляет примерно 10 мг/м2, примерно 15 мг/м2, примерно 18 мг/м2, примерно 21 мг/м2, 24 мг/м2, примерно 30 мг/м2, примерно 35 мг/м2, 4 0 мг/м2, примерно 4 5 мг/м2, примерно 4 8 мг/м2, примерно 50 мг/м2, примерно 60 мг/м2, примерно 72 мг/м2, примерно 75 мг/м2, примерно 80 мг/м2, примерно 85 мг/м2, примерно 90 мг/м2 или примерно 100 мг/м2.
9. Способ по п. 1, где дозу (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту вводят один раз в три недели.
10. Способ по п. 1, где дозу (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты вводят один раз в четыре недели.
11. Способ по п. 1, где (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту вводят в дозе примерно 48 мг/м2 один раз в три недели.
12. Способ по п. 1, где (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту вводят в дозе примерно 60 мг/м2 один раз в четыре недели.
13. Способ по п. 1, где (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту вводят в дозе примерно 75 мг/м2 один раз в четыре недели.
14. Способ по п. 1, где (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту вводят в виде внутривенной инъекции.
15. Способ по п. 1, дополнительно включающий введение терапевтически эффективной дозы, по меньшей мере, одного другого терапевтического средства.
16. Способ по п. 15, где указанное, по меньшей мере, одно другое терапевтическое средство выбрано из алкилирующих агентов, антиметаболитов, ингибиторов Аврора киназы, антагонистов пурина, антагонистов пиримидина, веретенных ядов, митотических ингибиторов, ингибиторов и ядов топоизомеразы II, ингибиторов топоизомеразы I, антинеопластических антибиотиков, нитрозомочевин, комплексов неорганических ионов, ферментов, гормонов и аналогов гормонов, ингибиторов EGFR, антител и производных антител, IMID, ингибиторов HDAC, ингибиторов Bcl-2, ингибиторов тирозинкиназы, стимулируемой VEGF, ингибиторов VEGFR, ингибиторов протеасомы, ингибиторов циклинзависимой киназы, ингибиторов PARP, ингибиторов ароматазы и дексаметазона.
17. Способ по п. 15, где терапевтическое средство представляет собой средство поддерживающего лечения.
18. Способ идентификации страдающего онкологическим заболеванием субъекта, подходящего для лечения посредством (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, включающий (а) получение биологического образца у кандидата, страдающего онкологическим заболеванием; (b) скрининг биологического образца для выявления мутации BRCA2; и (с) если у кандидата имеется мутация, которая снижает активность BRCA2, идентификацию кандидата как страдающего онкологическим заболеванием субъекта, подходящего для лечения (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислотой.
19. Способ лечения рака у субъекта включающий (а) получение биологического образца у кандидата, страдающего онкологическим заболеванием; (b) скрининг биологического образца для выявления мутации BRCA2; и (с) если у кандидата имеется мутация, которая снижает активность BRCA2, идентификацию кандидата как страдающего онкологическим заболеванием субъекта, подходящего для лечения (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислотой, и d) лечение субъекта страдающего онкологическим заболеванием (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислотой.
20. Способ идентификации одного или более субъектов, подходящих для лечения (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислотой, включающий: (а) получение биологических образцов у множества кандидатов, страдающих раком; (b) скрининг биологических образцов для выявления мутаций BRCA2; и (с) идентификации каждого кандидата, имеющего мутацию BRCA2, как субъекта, имеющего рак, подходящего для лечения (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислотой.
21. Способ по любому из пп. 18-20, где биологический образец включает образец биологической жидкости организма или образец ткани.
22. Способ, включающий контактирование злокачественной клетки, имеющей мутацию, которая снижает активность BRCA2 с количеством (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, которое эффективно для вызова двухнитевых разрывов ДНК в клетке.
23. Способ лечения рака у субъекта, имеющего сниженную активность BRCA2, включающий введение субъекту (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты в дозе примерно 10-100 мг/м2.
24. Способ по п. 15, где по меньшей мере одно другое терапевтическое средство выбрано из доцетаксела, винорелбина, капецитабина, доксорубицина, госерелина, золедроновой кислоты, паклитаксела, памидроната, анастрозола, экземестана, циклофосфамида, эпирубицина, фулвестранта, летрозола, гемцитабина, лейпролида, филграстима, торемифена, тамоксифена, дексразоксана, трастузумаба, пегфилграстима, эпоэтина альфа и дарбепоэтина альфа.
25. Способ по п. 15, где по меньшей мере одно другое терапевтическое средство выбрано из паклитаксела, цисплатина, карбоплатина, гемцитабина, топотекана, алтретамина, трабектидина и циклофосфамида.
26. Способ по п. 15, где по меньшей мере одно другое терапевтическое средство выбрано из митоксантрона, преднизона, паклитаксела, доцетаксела, эстрамустина, доксорубицина, госерелина, лейпролида и дегареликса.
27. Способ по п. 15, где по меньшей мере одно другое терапевтическое средство выбрано из карбоплатина, цисплатина, гемцитабина и комбинации любых двух или более из них.
| RU 2006121459 А 10.01.2008 | |||
| WO 2007028171 A1 08.03.2007 | |||
| WO 2008121132 A2 09.10.2008 | |||
| MILLS DA et al | |||
| ПРИБОР ДЛЯ ИЗМЕРЕНИЯ КОЛИЧЕСТВА ПРОХОДЯЩЕГО ПАРА В ТРУБАХ И НАГРУЗОК ПАРОВЫХ КОТЛОВ | 1921 |
|
SU595A1 |
| Curr Opin Investig Drugs, 2008 Jun;9(6):647-57 | |||
| EVANS JW et al | |||
| "Homologous recombination is the principal pathway for thq repair of DNA damage | |||
Авторы
Даты
2015-08-10—Публикация
2010-03-01—Подача