УРОВЕНЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к реактивам, которые могут генерировать сигнал, для использования в способах, композициях и комплектах для определения анализируемого вещества в образце.
В области клинической диагностики в последние годы наблюдается широкое продвижение как в отношении разнообразия рассматриваемых материалов, которые можно определять с легкостью и точностью, так и в отношении способов определения. Большинство способов охватывает создание сигнала, относящегося к присутствию и/или количеству одного или больше анализируемых веществ в образце. В области анализов нашли широкое применение люминесцентные соединения, такие как флуоресцентные соединения и хемилюминесцентные соединения, благодаря их способности к световой эмиссии. В анализах использовали частицы, такие как латексные частицы, липосомы и тому подобное. В частицы включались и абсорбирующие краски и краски, которые придают флуоресцентные или хемилюминесцентные свойства. В одном конкретном подходе для создания сигнала использовали частицы, которые содержат один или более хелатов металлов, такие как, например, хелаты лантанида.
В патентах США №№ 5340716 и 6251581, раскрытия которых включены в изобретение со ссылкой, описан иммунологический анализ индуцированной люминесценции. В одном подходе в анализе используется частица с включенным в нее фотосенсибилизатором и частица-метка с включенным в нее хемилюминесцентным соединением. Частица-метка конъюгирована к связывающему партнеру, который способен связываться с анализируемым веществом для образования комплекса или с другой функциональной группой для образования комплекса, относящегося к присутствию анализируемого вещества. В случае присутствия анализируемого вещества фотосенсибилизатор и хемилюминесцентное соединение входят в тесное сближение. Если обе метки находятся в непосредственной близости, фотосенсибилизатор продуцирует синглетный кислород и активирует хемилюминесцентное соединение. Активированное хемилюминесцентное соединение впоследствии генерирует свет. Количество генерированного света связано с количеством образованного комплекса, которое в свою очередь связано с количеством присутствующего анализируемого вещества. В одном конкретном подходе хемилюминесцентные частицы содержат один или больше хелатов металлов, такие как, например, хелаты лантанида.
В варианте способа индуцированной люминесценции используется дисперсная матрица, которая содержит и (a) фотосенсибилизатор, способный при облучении продуцировать синглетный кислород, и (b) хемилюминесцентное соединение, способное к активации синглетным кислородом. Способы позволяют генерировать отсроченную люминесценцию, которую можно получать при облучении матрицы. Способы применяются для определения анализируемого вещества в среде с предполагаемым содержанием анализируемого вещества. Один способ содержит воздействие условий на среду с предполагаемым содержанием анализируемого вещества, при которых образуется комплекс связанных партнеров, относящийся к присутствию анализируемого вещества, и определение факта образования комплекса посредством использования в качестве метки дисперсной композиции, имеющей и хемилюминесцентные, и фотосенсибилизирующие свойства. При активации фотосенсибилизирующих свойств образуется синглетный кислород и происходит активация хемилюминесцентных свойств. Такие композиции и способы описаны в патенте США № 5709994, соответствующее раскрытие которого включено со ссылкой в настоящее изобретение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одним вариантом осуществления настоящего изобретения является хемилюминесцентный реактив для определения присутствия и/или количества анализируемого вещества в образце с предполагаемым содержанием анализируемого вещества. Хемилюминесцентный реактив является недисперсным и содержит партнер по связыванию анализируемого вещества и хемилюминесцентное соединение, содержащее олефиновое соединение и хелат металла.
Другой вариант осуществления настоящего изобретения представляет собой способ определения присутствия и/или количества анализируемого вещества в образце с предполагаемым содержанием анализируемого вещества. Рассматривается комбинация, которая содержит образец, хемилюминесцентный реактив, описанный выше, и сенсибилизирующий реактив, способный продуцировать синглетный кислород. На комбинацию воздействуют условиями для связывания анализируемого вещества с партнером по связыванию анализируемого вещества. Происходит активация сенсибилизатора и определяется количество люминесценции, производимой с помощью хемилюминесцентной композиции, при этом количество люминесценции связано с количеством анализируемого вещества в образце.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой описание схемы получения хемилюминесцентного реактива согласно вариантам осуществления настоящего изобретения.
Фиг. 2 представляет собой график, изображающий калибровочную кривую для анализа тиреотропного гормона ТТГ с использованием хемилюминесцентного реактива согласно вариантам осуществления настоящего изобретения.
Фиг. 3 представляет собой описание в виде таблицы результатов анализа ТТГ с использованием хемилюминесцентного реактива согласно вариантам осуществления настоящего изобретения и показывает разделение полученного сигнала между калибраторами.
Фиг. 4 представляет собой график с результатами исследования стабильности хемилюминесцентного реактива согласно вариантам осуществления настоящего изобретения.
Фиг. 5 представляет собой график с результатами исследования стабильности хемилюминесцентного реактива согласно вариантам осуществления настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Общее обсуждение
Варианты осуществления настоящих способов и реактивов относятся к хемилюминесцентным реактивам для определения присутствия и/или количества анализируемого вещества в образце с предполагаемым содержанием анализируемого вещества. Реактив является недисперсным и содержит партнер по связыванию анализируемого вещества и хемилюминесцентную композицию, содержащую олефиновое соединение и хелат металла. Хемилюминесцентный реактив согласно представленным вариантам осуществления показывает хорошую растворимость в водной среде, например в водной среде для анализа. Недисперсный хемилюминесцентный реактив обладает повышенной стабильностью при его использовании в исследовании для обнаружения анализируемых веществ; кроме того, реактив показывает хороший ответный сигнал на изменения концентрации анализируемого вещества. Используемый в исследованиях недисперсный хемилюминесцентный реактив согласно настоящим вариантам осуществления растворим в водных средах для анализов и обеспечивает максимальные показатели эффективности, включающие в себя точность и чувствительность, а также стабильность производимого сигнала.
Можно контролировать показатели эффективности конкретного формата исследования в нижнем пределе диапазона медицинского заключения путем мониторинга разницы в количестве полученных для калибраторов сигналов, охватывающих предполагаемый диапазон концентрации рассматриваемого анализируемого вещества. Желательным является большое различие или разделение между сигналом для калибраторов, такое как, например, между калибратором L1 и калибратором L2 или калибратором L2 и калибратором L3. Например, можно использовать шесть калибраторов, произвольно называемых L1-L6. Соотношение сигнала к помехам можно оценивать путем количественного определения сигнала с помощью калибратора, который не содержит анализируемого вещества, произвольно называемого калибратором L1 (фон), и количества сигнала, полученного для калибратора, содержащего первое выше ноля известное количество анализируемого вещества, произвольно называемого калибратором L2. Эта оценка также может включать в себя количественное определение сигнала с помощью калибратора L1 и количественное определение сигнала для калибратора, содержащего второе выше ноля известное количество анализируемого вещества, с помощью калибратора, произвольно называемого L3. Такая оценка может также включать в себя указанное определение с использованием калибраторов L4, L5, L6 и т.д. Рассматриваемые в изобретении варианты осуществления обеспечивают более высокие показатели эффективности в исследовании анализируемого вещества по сравнению с реактивами, которые не соответствуют настоящим вариантам осуществления.
Желательным является большое различие между сигналом для калибраторов, например, между калибратором L1 и калибратором L2 или калибратором L1 и калибратором L6. Для хорошей чувствительности в диапазоне медицинского заключения различия сигналов, выявленные между калибратором L1 и калибратором L2, составляют по меньшей мере около 50%, по меньшей мере около 75%, по меньшей мере около 90%, по меньшей мере около 100%, по меньшей мере около 125%, по меньшей мере около 150%, по меньшей мере около 175%, по меньшей мере около 200%, по меньшей мере около 225%, по меньшей мере около 250%, по меньшей мере около 275%, по меньшей мере около 300%, по меньшей мере около 325%, по меньшей мере около 350%, по меньшей мере около 375%, по меньшей мере около 400%, по меньшей мере около 425% и т.д. В некоторых вариантах осуществления сигнал, выявленный для калибратора L6, превышает сигнал, выявленный для калибратора L1, по меньшей мере примерно в 10 раз, по меньшей мере примерно в 20 раз, по меньшей мере примерно в 30 раз, по меньшей мере примерно в 40 раз, по меньшей мере примерно в 50 раз, по меньшей мере примерно в 60 раз, по меньшей мере примерно в 70 раз, по меньшей мере примерно в 80 раз, по меньшей мере примерно в 90 раз, по меньшей мере примерно в 100 раз. В зависимости от формата исследования различие в сигнале может представлять собой увеличение сигнала или уменьшение сигнала. Обычно результаты исследования с использованием калибраторов представляются в формате графика, на котором изображено количество сигнала в зависимости от концентрации калибраторов. Согласно вариантам осуществления настоящего изобретения, между калибратором L1 и калибратором L2 выявляют обычно более крутой наклон линии по сравнению с результатами, полученными с реактивами для исследования, не соответствующими настоящим вариантам осуществления. Кроме того, наклон линии от калибратора L1 к калибратору L6 обычно является более крутым по сравнению с результатами, полученными с реактивами для исследования, не соответствующими настоящим вариантам осуществления.
Как упомянуто выше, в вариантах осуществления хемилюминесцентные реактивы настоящего изобретения являются недисперсными. Таким образом, эти реактивы отличаются от используемых в вышеупомянутых известных анализах индуцированной люминесценции, в которых задействованы дисперсные хемилюминесцентные реактивы. Настоящие хемилюминесцентные реактивы показывают хорошую растворимость в водных средах. В вариантах осуществления хемилюминесцентных реактивов партнер по связыванию анализируемого вещества ковалентно или нековалентно связан с хемилюминесцентной композицией, содержащей олефиновое соединение и хелат металла.
Партнер по связыванию анализируемого вещества может быть ковалентно связан с хемилюминесцентной композицией посредством связи. С другой стороны, партнер по связыванию анализируемого вещества может быть ковалентно связан с хемилюминесцентной композицией посредством связывающей группы. В некоторых вариантах осуществления связывающая группа является гидрофильной. Термин "гидрофильная" или "гидрофильность" относится к функциональной группе, обладающей полярностью, и поэтому предпочитающей полярные молекулы и предпочитающей полярные растворители. Гидрофильные молекулы проявляют аффинность к другим гидрофильным функциональным группам по сравнению с гидрофобными функциональными группами. Степень гидрофильности регулируется количеством гетероатомов в связывающей группе.
В некоторых вариантах осуществления связывающая группа представляет собой макромолекулу и может быть полимерной. Полимерная макромолекула обычно имеет длину от около 1 до около 10000 мономерных единиц или больше, или длину от около 10 около до 10000 мономерных единиц, или длину от около 100 до около 10000 мономерных единиц, или длину от около 500 до около 10000 мономерных единиц, или длину от около 1000 до около 10000 мономерных единиц, или длину от около 2000 до около 10000 мономерных единиц, или длину от около 3000 до около 10000 мономерных единиц, или длину от около 5000 до около 10000 мономерных единиц, или длину от около 10 до около 8000 мономерных единиц, или длину от около 100 до около 8000 мономерных единиц, или длину от около 1000 до около 8000 мономерных единиц, или длину от около 100 до около 7000 мономерных единиц и тому подобное. Число мономерных единиц зависит от числа атомов в цепи мономерной единицы, в композиции мономерной единицы и т.д.
Молекулярная масса полимерной макромолекулы составляет по меньшей мере около 2000. Молекулярная масса может составлять от около 2000 до около 10000000 или больше, или от около 2000 до около 8000000, или от около 2000 до около 6000000, или от около 2000 до около 5000000, или от около 2000 до около 4000000, или от около 2000 до около 3000000, или от около 2000 до около 2000000, или от около 2000 до около 1000000, или от около 5000 до около 10000000 или больше, или от около 5000 до около 8000000, или от около 5000 до около 6000000, или от около 5000 до около 5000000, или от около 5000 до около 4000000, или от около 5000 до около 3000000, или от около 5000 до около 2000000, или от около 5000 до около 1000000, или от около 10000 до около 10000000 или больше, или от около 10000 до около 8000000, или от около 10000 до около 6000000, или от около 10000 до около 5000000, или от около 10000 до около 4000000, или от около 10000 до около 3000000, или от около 10000 до около 2000000, или от около 10000 до около 1000000 и тому подобное.
Полимерная макромолекула может быть линейной или разветвленной или представлять собой комбинацию линейной и разветвленной формы. Линейный полимер содержит линейную цепь атомов, и разветвленный полимер содержит разветвленную цепь атомов. Каждый атом линейной цепи может иметь один или больше заместителей вместо водорода. В некоторых вариантах осуществления полимер может быть сополимером, содержащим больше одного типа мономерной единицы. Разные мономерные единицы в полимере могут находиться в чередующихся, рандомизированных, периодических и тому подобных взаимоотношениях и могут также быть организованы в блок-сополимеры, где блоки повторяющихся мономерных единиц образуют полимерную цепь.
В некоторых вариантах осуществления одна или больше мономерных единиц полимерной макромолекулы содержит атомы углерода и один или больше гетероатомов, таких как, например, кислород, сера, азот, фосфор и т.п. Мономерные единицы могут содержать от около 2 до около 50 атомов или больше, или от 5 около до 50 атомов, или от около 10 до около 50 атомов, или от около 20 до около 50 атомов, или от около 30 до около 50 атомов, или от около 2 до около 40 атомов или больше, или от 5 около до 40 атомов, или от около 10 около до 40 атомов, или от около 20 до около 40 атомов, или от около 30 до около 40 атомов, или от около 2 до около 30 атомов или больше, или от 5 до около 30 атомов, или от около 10 до около 30 атомов, или от около 20 до около 30 атомов, не считая водорода, и могут содержать цепь длиной от 2 до около 30 атомов, или от около 5 до около 30 атомов или больше, или от 10 до около 30 атомов, или от около 15 до около 30 атомов, или от около 20 до около 30 атомов, или от около 2 до около 25 атомов или больше, или от 5 около до 25 атомов, или от около 10 до около 25 атомов, или от около 15 до около 25 атомов, или от около 20 до около 25 атомов, или от около 2 до около 20 атомов или больше, или от 5 около до 20 атомов, или от около 10 до около 20 атомов, или от около 15 до около 20 атомов, или от около 2 от около 15 атомов, или от около 5 до около 15 атомов, или от около 10 до около 15 атомов, каждый из которых независимо выбирают из группы, обычно состоящей из углерода, кислорода, серы, азота и фосфора.
Число гетероатомов в мономерной единице полимерной макромолекулы может варьировать от около 0 до около 20, или от около 0 до около 15, или от около 0 до около 10, или от около 0 до около 5, или от около 1 до около 20, или от около 1 до около 15, или от около 1 до около 10, или от около 1 до около 5, или от около 2 до около 20, или от около 2 до около 15, или от около 2 до около 10, или от около 2 до около 5, или от около 5 до около 20, или от около 5 до около 15, или от около 5 до около 10 и тому подобное. В некоторых вариантах осуществления число гетероатомов является достаточным, чтобы придать гидрофильность связывающей группе и повысить растворимость хемилюминесцентного реактива согласно настоящим вариантам осуществления. В этом отношении число гетероатомов в мономерной единице полимерной макромолекулы может варьировать от около 1 до около 20, или от около 1 до около 15, или от около 1 до около 10, или от около 1 до около 5, или от около 2 до около 20, или от около 2 до около 15, или от около 2 до около 10, или от около 2 до около 5, или от около 5 до около 20, или от около 5 до около 15, или от около 5 до около 10 и тому подобное. При наличии гетероатомов кислород обычно присутствует в виде оксо- или окси-группы, связанной с углеродом, серой, азотом или фосфором, азот обычно присутствует в виде азо-, циано-, изоциано, нитро-, нитрозо-, амидо- или амино-группы, обычно связанной с углеродом, кислородом, серой или фосфором; сера является аналогом кислорода; тогда как фосфор связан с углеродом, серой, кислородом или азотом, обычно в виде фосфоната и фосфатного моно- или диэфира.
Общими функциональными группами, образующими ковалентную связь между связывающей группой и молекулой, которая будет конъюгирована, являются алкиламин, амидин, тиоамид, эфир, мочевина, тиомочевина, гуанидин, азо, тиоэфир и карбоксилат, сульфонат и фосфатные сложные эфиры, амиды и тиоэфиры. Если связывающая группа имеет связывающие функциональные группы (функциональные группы для реакции с функциональным остатком), такие как, например, неоксикарбоксильная группа, включающая в себя аналоги азота и серы, группу фосфата, группу амино-, алкилирующий агент, такой как гало- или тосилалкил, окси- (гидроксил или аналог серы, меркапто), оксокарбонил (например, альдегид или кетон), или активный олефин, такой как винилсулфон или α-, β-ненасыщенный сложный эфир, эти функциональные группы связаны в основном с амино-группами, карбоксильными группами, активными олефинами, алкилирующими агентами, например с бромацетилом. Если происходит связывание амина и карбоновой кислоты или ее азотного производного или производного фосфорной кислоты, соответственно, образуются амиды, амидины и фосфороамиды. Если происходит связывание меркаптана и активированного олефина, образуются тиоэфиры. Если происходит связывание меркаптана и алкилирующего агента, образуются тиоэфиры. Если происходит связывание альдегида и амина при восстанавливающих условиях, образуется алкиламин. Если происходит связывание кетона или альдегида и гидроксиламина (включающего в себя его производные, где вместо водорода гидроксильной группы находится заместитель), образуются функциональные группы оксима (=N-O-). Если происходит связывание карбоновой кислоты или фосфорной кислоты и спирта, образуются сложные эфиры.
В некоторых вариантах осуществления связывающая группа не является макромолекулой и имеет молекулярную массу меньше чем около 2000, или меньше чем около 1500, или меньше чем около 1000, или меньше чем около 500, или подобную массу. Такие связывающие группы могут содержать от около 2 до около 200 атомов, или от 4 до около 150 атомов, или от около 5 до около 100 атомов, не считая водорода, и могут содержать цепь длиной от 2 до около 100 атомов, или от 3 до около 90 атомов, или от около 4 до около 80 атомов, или от около 5 до около 70 атомов, или подобное количество атомов, каждую из которых независимо выбирают из группы, обычно состоящей из углерода, кислорода, серы, азота и фосфора. Число гетероатомов в таких связывающих группах зависит от размера связывающей группы и обычно варьирует от около 0 до около 50, от 1 до около 45, или от около 2 до около 40. Гетероатомы могут находиться в формах, указанных выше в обсуждении, относящемся к макромолекулярным связывающим группам. В некоторых вариантах осуществления число гетероатомов является достаточным, чтобы придать гидрофильность связывающей группе и повысить растворимость получаемой композиции согласно настоящим вариантам осуществления. В этом отношении, число гетероатомов в связывающей группе зависит от размера связывающей группы и может варьировать от около 5 до около 50, или от около 10 до около 50, или от около 15 до около 50, или от около 5 до около 40, или от около 10 до около 40, или от около 15 до около 40, или от около 5 до около 30, или от около 10 до около 30, или от около 15 до около 30, или от около 5 до около 25, или от около 10 до около 25 и тому подобное.
Полимерная макромолекула в качестве связывающей группы может быть материалом природного происхождения или синтетической конструкцией. В некоторых вариантах осуществления полимерная макромолекулярная связывающая группа представляет собой полипептид. Примеры полипептидов, приведенные для иллюстрации и без ограничения, включают в себя белки, такие как, например, альбумины, гаммаглобулины, иммуноглобулины, гемоцианины, синтетические полипептиды и т.п. Примеры других полимерных макромолекул, приведенных для иллюстрации и без ограничения, включают в себя дендримеры, полимерные карбоксилаты (например, полиаспарагиновая кислота, полиглутаминовая кислота, полигалактуроновая кислота, полиметакриловая кислота и т.д.), полимерные амины (например, полиэтиленамин, полилизин, полиглутамин, полиэтиленимин, полиаллиламин и т.д.), полимерные эфиры (полиэтиленгликоли или полиэтиленоксид и т.д.), полимерные тиоэфиры (например, полиэтилен-тиоэфиры и т.д.) Полимерные сульфгидрилы (например, полицистеин) и т.д.
Партнер по связыванию для анализируемого вещества может быть связан с хемилюминесцентной композицией многими разными способами, некоторые из которых рассматриваются ниже в качестве иллюстрации и не ограничивают объем изобретения. В некоторых вариантах осуществления связывающая группа представляет собой белок и компоненты хемилюминесцентной композиции, а именно олефиновое соединение и хелат металла, каждый из которых связан с белком, с которым также связан партнер по связыванию для анализируемого вещества. Этот вариант осуществления показан в следующей формуле:
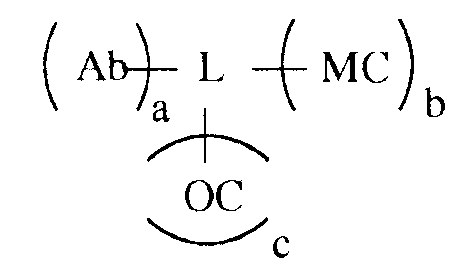
в которой Ab является партнером по связыванию для анализируемого вещества (в этом примере, для антитела), L является группой связывания белка, MC обозначает хелат металла, и OC обозначает олефиновое соединение, и a, b и c независимо представляют собой целые числа, например, от 1 до около 10, или от 1 до около 9, или от 1 до около 8, или от 1 до около 7, или от 1 до около 6, или от 1 до около 5, или от 1 до около 4, или от 1 до около 3, или от 1 до около 2, или от 2 до около 10, или от 2 до около 9, или от 2 до около 8, или от 2 до около 7, или от 2 до около 6, или от 2 до около 5, или от 2 до около 4, или от 2 до около 3, или от около 3 до около 10, или от около 3 до около 9, или от около 3 до около 8, или от около 3 до около 7, или от около 3 до около 6, или от около 3 до около 5, или от около 3 до около 4. Разные функциональные группы, такие как амин, карбоксил и т.п., присутствуют на белке для связывания с MC, OC и Ab и, как можно заметить, множественные молекулы MC, OC и Ab могут быть связаны с белком. Число молекул каждого из них, которое может быть связано, зависит от размера белка, размера MC и OC и размера антитела.
В некоторых вариантах осуществления связывающая группа представляет собой белок и компоненты хемилюминесцентной композиции, а именно олефиновое соединение и хелат металла, каждый из которых связан с той же молекулой белка. Белок имеет одну или больше молекул из одного элемента пары специфичного связывания, присоединенной к нему. Партнер по связыванию для анализируемого вещества имеет одну или больше молекул из другого элемента пары специфичного связывания, присоединенной к нему. Связывание элементов пары специфичного связывания приводит к нековалентному присоединению к белку партнера по связыванию для анализируемого вещества. Этот вариант осуществления показан в следующей формуле:
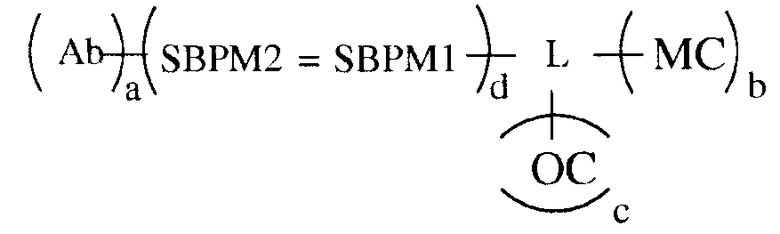
в которой Ab является партнером по связыванию для анализируемого вещества (в этом примере для антитела), L является группой связывания белка, MC обозначает хелат металла и OC обозначает олефиновое соединение, SBPM1 и SBPM2 представляют собой комплиментарные члены пары специфичного связывания, = является нековалентной связью, и a, b, c и d независимо представляют собой целые числа, например, от 1 до около 10, или от 1 до около 9, или от 1 до около 8, или от 1 до около 7, или от 1 до около 6, или от 1 до около 5, или от 1 до около 4, или от 1 до около 3, или от 1 до около 2, или от 2 до около 10, или от 2 до около 9, или от 2 до около 8, или от 2 до около 7, или от 2 до около 6, или от 2 до около 5, или от 2 до около 4, или от 2 до около 3, или от около 3 до около 10, или от около 3 до около 9, или от около 3 до около 8, или от около 3 до около 7, или от около 3 до около 6, или от около 3 до около 5, или от около 3 до около 4. Разные функциональные группы, такие как амин, карбоксил и им подобные, присутствуют на белке для связывания с MC, OC и SBPM1, и, как можно заметить, множественные молекулы MC, OC и SBPM1 могут быть связаны с белком. Число молекул каждого из них, которое может быть связано, зависит от размера белка, размера MC, OC, SBPM1 и SBPM2 и размера антитела.
В некоторых вариантах осуществления связывающая группа представляет собой белок и компоненты хемилюминесцентной композиции, а именно олефиновое соединение и хелат металла, каждый из которых связаны с той же молекулой белка. Белок имеет одну или больше молекул из одного элемента пары специфичного связывания, присоединенной к нему, а также одну или больше молекул антитела. Каждый из OC и MC независимо имеет одну или больше молекул другого элемента пары специфичного связывания, присоединенной к нему. Связывание элементов пары специфичного связывания приводит к нековалентному присоединению OC и MC к белку. Этот вариант осуществления показан в следующей формуле:
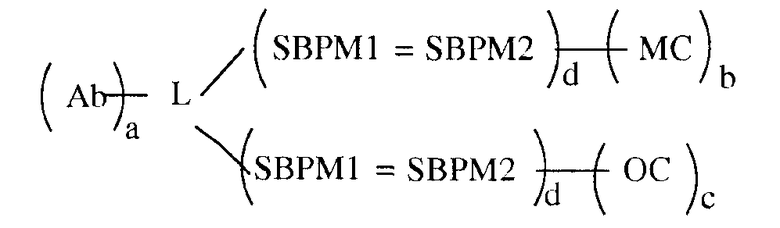
в которой Ab является партнером по связыванию для анализируемого вещества (в этом примере, для антитела), L является группой связывания белка, MC обозначает хелат металла и OC обозначает олефиновое соединение, SBPM1 и SBPM2 представляют собой комплиментарные члены пары специфичного связывания, = является нековалентной связью, и a, b, c и d независимо представляют собой целые числа, например, от 1 до около 10, или от 1 до около 9, или от 1 до около 8, или от 1 до около 7, или от 1 до около 6, или от 1 до около 5, или от 1 до около 4, или от 1 до около 3, или от 1 до около 2, или от 2 до около 10, или от 2 до около 9, или от 2 до около 8, или от 2 до около 7, или от 2 до около 6, или от 2 до около 5, или от 2 до около 4, или от 2 до около 3, или от около 3 до около 10, или от около 3 до около 9, или от около 3 до около 8, или от около 3 до около 7, или от около 3 до около 6, или от около 3 до около 5, или от около 3 до около 4. Разные функциональные группы, такие как амин, карбоксил и им подобные, присутствуют на белке для связывания с MC, OC и SBPM1 и, как можно заметить, множественные молекулы MC, OC и SBPM1 могут быть связаны с белком. Число молекул каждого из них, которое может быть связано, зависит от размера белка, размера MC, OC, SBPM1 и SBPM2 и размера антитела. Нужно отметить, что в вышеупомянутом варианте осуществления пара специфичного связывания, к которой относятся SBPM1 и SBPM2, может быть той же парой, что и для присоединения к OC и MC, или можно использовать две разных пары специфичного связывания, одну для OC и одну для MC.
В некоторых вариантах осуществления связывающая группа представляет собой белок и компоненты хемилюминесцентной композиции, а именно олефиновое соединение и хелат металла, каждый из которых связаны с той же молекулой белка. Белок имеет одну или больше молекул из одного элемента пары специфичного связывания, присоединенной к нему, а также одну или больше молекул антитела. Каждый из OC и MC независимо имеет одну или больше молекул другого элемента пары специфичного связывания, присоединенной к нему. Связывание элементов пары специфичного связывания приводит к нековалентному присоединению OC и MC к белку. Партнер по связыванию для анализируемого вещества также имеет одну или больше молекул другого элемента пары специфичного связывания, присоединенной к нему. Связывание элементов пары специфичного связывания приводит к нековалентному присоединению к белку партнера по связыванию для анализируемого вещества. Этот вариант осуществления показан в следующей формуле:
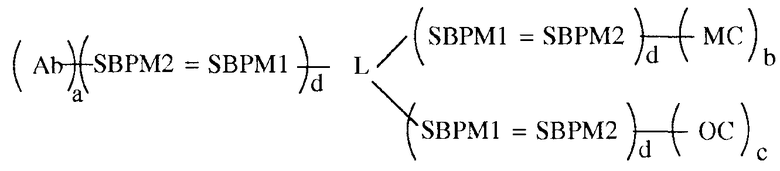
в которой Ab является партнером по связыванию для анализируемого вещества (в этом примере для антитела), L является группой связывания белка, MC обозначает хелат металла и OC обозначает олефиновое соединение, SBPM1 и SBPM2 представляют собой комплиментарные члены пары специфичного связывания, = является нековалентной связью, и a, b, c и d независимо представляют собой целые числа, например, от 1 до около 10, или от 1 до около 9, или от 1 до около 8, или от 1 до около 7, или от 1 до около 6, или от 1 до около 5, или от 1 до около 4, или от 1 до около 3, или от 1 до около 2, или от 2 до около 10, или от 2 до около 9, или от 2 до около 8, или от 2 до около 7, или от 2 до около 6, или от 2 до около 5, или от 2 до около 4, или от 2 до около 3, или от около 3 до около 10, или от около 3 до около 9, или от около 3 до около 8, или от около 3 до около 7, или от около 3 до около 6, или от около 3 до около 5, или от около 3 до около 4. Разные функциональные группы, такие как амин, карбоксил и им подобные, присутствуют на белке для связывания с SBPM1, и, как можно заметить, множественные молекулы SBPM1 могут быть связаны с белком. Число молекул каждого из них, которое может быть связано, зависит от размера белка, размера MC, OC, SBPM1 и SBPM2 и размера антитела. Нужно отметить, что в вышеупомянутом варианте осуществления пара специфичного связывания, к которой относятся SBPM1 и SBPM2, может быть той же парой, что и для присоединения к OC и MC и антителу, или можно использовать две или три разных пары специфичного связывания, одну для OC, одну для MC и одну для антитела.
В некоторых вариантах осуществления связывающая группа представляет собой белок и компоненты хемилюминесцентной композиции, а именно олефиновое соединение и хелат металла, каждый из которых связаны с той же молекулой белка. Белок имеет одну или больше молекул из одного элемента пары специфичного связывания, присоединенной к нему. Партнер по связыванию для анализируемого вещества имеет одну или больше молекул другого элемента пары специфичного связывания, присоединенной к нему. Связывание элементов пары специфичного связывания приводит к нековалентному присоединению к белку партнера по связыванию для анализируемого вещества. Этот вариант осуществления показан в следующей формуле:
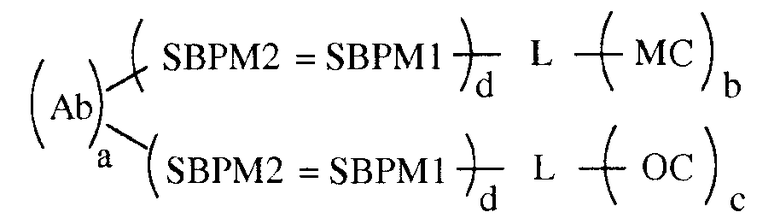
в которой Ab является партнером по связыванию для анализируемого вещества (в этом примере, для антитела), L является группой связывания белка, MC обозначает хелат металла и OC обозначает олефиновое соединение, SBPM1 и SBPM2 представляют собой комплиментарные члены пары специфичного связывания, = является нековалентной связью, и a, b, c и d независимо представляют собой целые числа, например, от 1 до около 10, или от 1 до около 9, или от 1 до около 8, или от 1 до около 7, или от 1 до около 6, или от 1 до около 5, или от 1 до около 4, или от 1 до около 3, или от 1 до около 2, или от 2 до около 10, или от 2 до около 9, или от 2 до около 8, или от 2 до около 7, или от 2 до около 6, или от 2 до около 5, или от 2 до около 4, или от 2 до около 3, или от около 3 до около 10, или от около 3 до около 9, или от около 3 до около 8, или от около 3 до около 7, или от около 3 до около 6, или от около 3 до около 5, или от около 3 до около 4. Разные функциональные группы, такие как амин, карбоксил и им подобные, присутствуют на белке для связывания с SBPM1, и, как можно заметить, множественные молекулы MC, OC и SBPM1 могут быть связаны с белком. Число молекул каждого из них, которое может быть связано, зависит от размера белка, размера MC, OC, SBPM1 и SBPM2 и размера антитела. Нужно отметить, что в вышеупомянутом варианте осуществления пара специфичного связывания, к которой относятся SBPM1 и SBPM2, может быть той же парой, что и для присоединения к OC и MC и антителу, или можно использовать две разных пары специфичного связывания, одну для OC и одну для MC. Также необходимо отметить, что в вышеупомянутом варианте осуществления L может быть одинаковым или разным для OC и MC.
В некоторых вариантах осуществления связывающая группа представляет собой белок и компоненты хемилюминесцентной композиции, а именно олефиновое соединение и хелат металла, и они соответственно связаны с разными молекулами белка посредством нековалентной связи. Белок имеет одну или больше молекул из одного элемента пары специфичного связывания, присоединенной к нему. Партнер по связыванию для анализируемого вещества имеет одну или больше молекул другого элемента пары специфичного связывания, присоединенной к нему. Связывание элементов пары специфичного связывания приводит к нековалентному присоединению к белку партнера по связыванию для анализируемого вещества. Каждый из OC и MC также независимо имеет одну или больше молекул другого элемента пары специфичного связывания, присоединенной к нему. Связывание элементов пары специфичного связывания приводит к нековалентному присоединению OC и MC к белку. Этот вариант осуществления показан в следующей формуле:
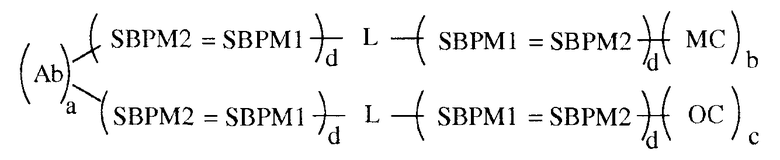
в которой Ab является партнером по связыванию для анализируемого вещества (в этом примере для антитела), L является группой связывания белка, MC обозначает хелат металла и OC обозначает олефиновое соединение, SBPM1 и SBPM2 представляют собой комплиментарные члены пары специфичного связывания, = является нековалентной связью, и a, b, c и d независимо представляют собой целые числа, например, от 1 до около 10, или от 1 до около 9, или от 1 до около 8, или от 1 до около 7, или от 1 до около 6, или от 1 до около 5, или от 1 до около 4, или от 1 до около 3, или от 1 до около 2, или от 2 до около 10, или от 2 до около 9, или от 2 до около 8, или от 2 до около 7, или от 2 до около 6, или от 2 до около 5, или от 2 до около 4, или от 2 до около 3, или от около 3 до около 10, или от около 3 до около 9, или от около 3 до около 8, или от около 3 до около 7, или от около 3 до около 6, или от около 3 до около 5, или от около 3 до около 4. Разные функциональные группы, такие как амин, карбоксил и им подобные, присутствуют на белке для связывания с MC, OC и SBPM1, и, как можно заметить, множественные молекулы MC, OC и SBPM1 могут связываться с белком. Число молекул каждого из них, которое может быть связано, зависит от размера белка, размера MC, OC, SBPM1 и SBPM2 и размера антитела. Нужно отметить, что в вышеупомянутом варианте осуществления пара специфичного связывания, к которой относятся SBPM1 и SBPM2, может быть той же парой, что и для присоединения к OC и MC и антителу, или можно использовать две или три разных пары специфичного связывания, одну для OC, одну для MC и одну для антитела. Также необходимо отметить, что в вышеупомянутом варианте осуществления L может быть одинаковым или разным для OC и MC.
Олефиновое соединение является соединением, способным реагировать с синглетным кислородом. В некоторых вариантах осуществления реакция олефинов с синглетным кислородом представляет собой присоединение 2+2, с образованием диоксетана. Подходящие олефиновые соединения обычно имеют ненасыщенную группу C-H, присоединенную к олефиновому углероду, кроме нереактивных атомов углерода на голове мостика и, в некоторых варианты осуществления, имеют одну или больше электрон-донорных групп, непосредственно присоединенных к олефиновому углероду или конъюгированных к олефину. Диоксетаны могут диссоциировать спонтанно или посредством нагревания при спонтанной хемилюминесценции, или образующиеся карбонильные группы могут быть образованы как часть флуоресцентной группы или могут обладать способностью к прохождению последующих реакций, которые приводят к образованию флуоресцентной молекулы. Альтернативно, эта реакция диссоциации может приводить к отделению гасящей группы по существу от флуоресцентной группы, что таким образом возвращает ее флуоресцентные свойства.
В некоторых вариантах осуществления реакция синглетного кислорода с олефинами представляет собой циклоприсоединение 4+2 с диенами, обычно с соединениями ароматического ряда, такими как нафталины, антрацены, оксазолы, фураны, индолы и т.п. Такая реакция вначале приводит к получению эндопероксида. В некоторых случаях эндопероксиды могут перестраиваться в активные сложные эфиры или ангидриды, которые способны реагировать с подходящим образом расположенной группой для получения лактона или лактама, которые могут быть флуоресцентными. Альтернативно, эндопероксиды способны окислять предшественник флуоресцентного или хемилюминесцентного соединения. Эндопероксиды могут также диссоциировать спонтанно или при нагревании с хемилюминесцентной эмиссией или окислять флуоресцентный лейко-краситель.
В некоторых вариантах осуществления реакция синглетного кислорода с олефинами представляет собой "еновую" реакцию, в которой получают аллилгидропероксид. Подходящие олефины имеют реактивный насыщенный C-H, присоединенный к олефиновому углероду. Этот продукт может реагировать с активным сложным эфиром в той же молекуле для образования диоксетанона, который может спонтанно или посредством нагревания диссоциировать с хемилюминесцентной эмиссией.
Рассматриваемые олефины обычно представляют собой соединения, которые подвергаются химической реакции после реакции с синглетным кислородом для образования метастабильного продукта реакции, обычно диоксетана или эндопероксида, которые способны к разложению с одновременной или последующей эмиссией света, обычно в пределах диапазона длины волны 250-1200 нм. Предпочтительными являются олефины с большим содержанием электронов, обычно содержащие электрон-донорные группы. Примерами таких богатых электронами олефинов являются энольные эфиры, энамины, 9-алкилиден-N-алкилакриданы, арилвинилэфиры, 1,4-диоксены, 1,4-тиоксены, 1,4-оксазины, арилимидазолы, 9-алкилиден-ксантаны и люцигенин.
Примеры подходящих богатых электронами хемилюминесцентных олефинов приведены в патенте США № 5709994, соответствующее раскрытие которого включено в изобретение со ссылкой. Такие олефины обычно имеют электрон-донорную группу в конъюгации с олефином.
Диоксетаны могут быть люминесцентными сами по себе или в соединении с флуоресцентным акцептором. Примерами таких олефинов являются энольные эфиры. В некоторых вариантах осуществления соединения энольных эфиров будут иметь по меньшей мере одну арильную группу, связанную с олефиновым углеродом, в которой арильное кольцо замещено электрон-донорной группой в положении, которое повышает реактивность олефина к синглетному кислороду и/или придает флюоресцентные свойства продукту диссоциации получаемого диоксетана. Электрон-донорная группа может представлять собой, например, гидроксил, алкокси, дизамещенную амино-, алкил-тио, фурильную, пурильную и т.д. группы. Предпочтительно, энольные эфиры имеют электрон-донорную группу, связанную непосредственно с олефиновым углеродом.
Энамины представляют собой другой пример таких олефинов. В общем, полезные энамины будут применяться согласно правилам, сформулированным выше для энольных эфиров. Другое семейство хемилюминисцентов представляет собой 2,4,5-трифенилимидазолы, с общим наименованием исходного продукта «лофин». Хемилюминесцентные аналоги включают в себя пара-диметиламино- и параметокси- заместители. Другие хемилюминесцентные олефины, которые соответствуют приведенным выше требованиям, можно найти в европейской патентной заявке № 0345776.
В дополнение к олефиновому соединению хемилюминесцентная композиция содержит комплекс металла и один или больше хелирующих агентов. Примеры металлов, которые являются частью комплекса, включают в себя, например, редкоземельные металлы, металлы Группы VIII и тому подобные. Редкоземельные металлы включают в себя лантаноиды (лантаноидные металлы) (15 элементов от лантана до лютеция с атомными числами 57-71). Рассматриваемые редкоземельные металлы включают в себя европий, тербий, диспрозий и самарий. Металлы Группы VIII, представляющие особый интерес, включают в себя осмий и рутений. В некоторых вариантах осуществления редкоземельные металлы находятся в состоянии окисления плюс три, рутений находится в состоянии окисления плюс два и осмий в состоянии окисления плюс два. В определенных вариантах осуществления металл выбирают из группы, состоящей из европия, тербия, диспрозия, самария, осмия и рутения. В некоторых вариантах осуществления металл является по меньшей мере гексакоординированным; вместе с тем металл может быть октакоординированным или более высоко координированным в зависимости от металл-хелирующего агента.
Металл-хелирующий агент представляет собой соединение, в котором два или больше атома той же молекулы могут координироваться с металлом для образования хелата металла. Эти два или больше атома могут представлять собой, например, атомы кислорода, азота, серы и т.п. Атомы могут быть в виде одной или больше функциональных групп, таких как, например, кетон, альдегид, гидроксил, амин, тиокетон, тиоальдегид, тиол и тому подобное. Функциональные группы могут быть частью бензильной группы или конденсированной ароматической кольцевой системы, происходящей, например, из нафталина, антрацена, фенантрена, акридина и т.д.
Один из вышеупомянутых металлов является координированным с одним или больше хелирующими агентами, частичные примеры которых включают в себя, например, 2-(1',1',1',2',2',3',3'-гептафтор-4',6'-гександион-6'-ил)-нафталин (NHA), 4,4'-bis(2",3",3"-гептафтор-4",6"-гександион-6"-ил)-o-терфенил (BHHT), 4,4'-bis(1",1",1",2",2",3",3"-гептафтор-4",6"-гександион-6"-ил)-хлорсульфо-o-терфенил (BHHCT), фенантролин (phen) и фенантролин-связанные соединения (производные фенантролина), такие как, например, фенантролин-карбоновая кислота, 4,7-дифенил-1,10-фенантролин (DPP) и тому подобное, 3-(2-тиеноил, 1,1,1-трифторацетон (TTA), тиофентрифторбутандион (TTB), 3-нафтоил-1,1,1-трифторацетон (NPPTA), нафтилтрифторбутандион (NTA), оксид триоктил-фосфина (TOPO), оксид трифенил-фосфина (TPPO), 3-бензоил-,1,1,1-трифторацетон (BFTA), 2,2-диметил-4-перфторбутиноил-3-бутанон (fod), 2,2'-дипиридил (bpy), салициловая кислота, бипиридилкарбоновая кислота, аза-краун эфиры триоктилфосфиноксида, аза криптанды и т.д., а также комбинации вышеупомянутых соединений. Как упомянуто выше, в некоторых вариантах осуществления металл в хелате металла является по меньшей мере гексакоординированным. Хелат металла не будет иметь заряд; таким образом, число кислых групп, предоставляемых хелирующим агентом, будет эквивалентно состоянию окисления металла. Примеры конкретных хелатов металлов в качестве иллюстрации и без ограничения включают в себя Eu(BHHCT)2DPP, Eu(TTA)3DPP, Eu(NTA)3DPP, Eu(NHA)3DPP, Eu(BHHT)2DPP и хелаты металла, рассмотренные в патенте США № 6916667 (например, колонки 5-9) и в патентной заявке США № 20060270063 (колонка 3-4), соответствующие раскрытия которых включены в изобретение со ссылкой, и в других.
Многие из хелирующих агентов и хелаты металлов известны в данной области техники, и многие являются коммерчески доступными. В общем, хелаты металлов можно изготовлять из металл-хелирующего агента путем соединения хлорида металла в желательном соотношении с молекулами метал-хелирующего агента в водном буферном растворителе и в достаточном количестве основания для поглощения соляной кислоты, образующейся в ходе реакции. Например, хелаты металлов можно изготовлять согласно методике, описанной, например, автором Shinha, A. P., "Fluorescences and laser action in rare earth chelates," Spectroscopy Inorganic Chemistry, Vol. 2, (1971), 255-288.
Хемилюминесцентный реактив может включать в себя функциональную группу, придающую гидрофильность или растворимость в воде, которая увеличивает смачиваемость твердых частиц водой и растворимость в водных системах соединений, с которыми она связана. На олефиновом соединении, или на хелате металла, или на обоих из них может находиться одна или больше таких функциональных групп. Такая функциональная группа или функциональность может представлять собой заместитель, имеющий от 1 до 50 или больше атомов, и может включать в себя сульфонат, сульфат, фосфат, амидин, фосфонат, карбоксилат, гидроксил, в частности полиолы, амин, эфир, амид и тому подобное. Примерами функциональных групп являются карбоксиалкил, сульфоноксиалкил, CONHOCH2COOH, CO-(глюкозамин), сахар, декстран, циклодекстрин, SO2NHCH2COOH, SO3H, CONHCH2CH2SO3H, PO3H2, OPO3H2, гидроксил, карбоксил, кетон и их комбинации. Такую группу или функциональность можно вводить в хелирующий агент посредством способов, известных в области техники, относящейся к введению в соединения таких групп или функциональностей.
После приготовления хемилюминесцентного реактива указанный хемилюминесцентный реактив можно помещать в подходящую среду для хранения до его использования в анализе. Во многих вариантах осуществления средой является водная среда, обычно водная буферная среда. Водная среда может представлять собой исключительно воду, или может включать в себя от 0,1 до около 40 процентов объема сорастворителя, такого как, например, органический растворитель, который может представлять собой спирт, эфир, сложный эфир, амин, амид и тому подобное. Уровень рН среды обычно будет находиться в диапазоне от около 4 до около 11, или в диапазоне от около 5 до около 10, или в диапазоне от около 6,5 до около 9,5. Можно применять разные буферы для достижения желательного уровня pH и поддержания уровня pH. Примеры буферов включают в себя борат, фосфат, карбонат, Трис, барбитал, буферы PIPES, HEPES, MES, ACES, MOPS, BICINE и тому подобное. Не имеет значения конкретно используемый буфер, но использование того или другого буфера с конкретным хемилюминесцентным реактивом может быть предпочтительным. В некоторых вариантах осуществления среда, в которой сохраняется хемилюминесцентный реактив, по существу сходна или аналогична среде для исследования анализируемого вещества, в которой хемилюминесцентный реактив является одним из используемых тестовых реактивов. Растворимость хемилюминесцентного реактива в водной среде при комнатной температуре составляет, например, по меньшей мере 50%, или по меньшей мере 55%, или по меньшей мере 60%, или по меньшей мере 65%, или по меньшей мере 70%, или по меньшей мере 75%, или по меньшей мере 80%, или по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% (веса к объему).
В конкретном варианте осуществления вышеупомянутого, в качестве иллюстрации и без ограничения хемилюминесцентный реактив содержит тиоксен и Eu(BHHCT)2DPP, оба из которых ковалентно связаны с BSA, с которым также связан партнер по связыванию для анализируемого вещества.
Элемент пары специфичного связывания ("элемент sbp") для использования в настоящих вариантах осуществления для нековалентного соединения представляет собой одну из двух разных молекул, имеющих на поверхности или в полости область, которая специфично связывается с конкретной пространственной и полярной структурой другой молекулы, и поэтому определяется как комплиментарная. Пару специфичного связывания для использования в настоящих вариантах осуществления выбирают из группы, состоящей из (i) малой молекулы и партнера по связыванию для малой молекулы и (ii) большой молекулы и партнера по связыванию для большой молекулы. В некоторых вариантах осуществления малая молекула имеет молекулярную массу меньше чем около 2000, или меньше чем около 1500, или меньше чем около 1000, или меньше чем около 500, или меньше чем около 400, или меньше чем около 300, или подобную массу. Примеры партнера по связыванию с малой молекулой для пар малых молекул, в качестве иллюстрации и без ограничения, включают в себя биотин-связывающий партнер для биотина (например, авидин, стрептавидин, антитело для биотина и т.д.), дигоксин-связывающий партнер для дигоксина (например, антитело для дигоксина и т.д.), флуоресцеин-связывающий партнер для флуоресцеина (антитело для флуоресцеина и т.д.), родамин-связывающий партнер для родамина (например, антитело для родамина), пептид-связывающий партнер для пептида (антитело для пептида и т.д.), партнеры, специфичные для связывания анализируемого вещества (например, собственный фактор для B12, фолат-связывающий фактор для фолата) и т.д.
В некоторых вариантах осуществления в отношении пары специфичного связывания для использования в настоящих вариантах осуществления молекулярная масса большой молекулы составляет больше чем около 2000, или больше чем около 5000, или больше чем около 10000, или больше чем около 50000, или больше чем около 100000, или больше чем около 500000, или больше чем около 1000000, или больше чем около 5000000 или больше чем около 10000000 или подобное. Примеры партнера по связыванию большой молекулы для пар больших молекул, в качестве иллюстрации и без ограничения, включают в себя элементы иммунологической пары, такие как антиген - антитело, гормон - гормональные рецепторы, дуплексы нуклеиновых кислот, IgG - белок A, полинуклеотидные пары, такие как ДНК-ДНК, РНК-ДНК, другие рецепторы и лиганды и тому подобное.
Природа партнера по связыванию для анализируемого вещества зависит прежде всего от природы анализируемого вещества. Партнер по связыванию для анализируемого вещества может представлять собой антитело, полинуклеотид, анализируемое вещество-белок специфичного связывания, отличный от антитела, и т.д. Антитело является иммуноглобулином, который специфично связывается со специфичной пространственной и полярной структурой другой молекулы и поэтому носит определение «комплиментарный». Антитело может быть моноклональным или поликлональным и может быть изготовлено способами, известными в данной области техники, такими как иммунизация хозяина и сбор сыворотки (поликлональное) или путем изготовления постоянных гибридных клеточных линий и сбора секретируемого белка (моноклональное), или путем клонирования и экспрессии нуклеотидных последовательностей или их мутагенизированных версий, кодирующих по меньшей мере аминокислотные последовательности, необходимые для специфичного связывания природных антител. Антитела могут включать в себя полный иммуноглобулин или его фрагмент, и упомянутые иммуноглобулины включают в себя разные классы и изотипы, такие как IgA, IgD, IgE, IgGl, IgG2a, IgG2b и IgG3, IgM и т.д. Их фрагменты могут включать в себя Fab, Fv и F(ab')2, Fab' и тому подобные. Дополнительно, в соответствующих случаях можно использовать агрегаты, полимеры и конъюгаты иммуноглобулинов или их фрагменты, при сохранении их связывающей аффинности к специфичной молекуле.
Анализируемое вещество может быть лигандом, который является моновалентным (моноэпитопным) или поливалентным (полиэпитопным), обычно антигенным или гаптеновым, и оно может быть единственным соединением или совокупностью соединений, которые имеют по меньшей мере один общий эпитопный или детерминантный участок. Анализируемое вещество может быть частью клетки, такой как бактерия или клетка, несущая антиген группы крови, такой как A, B, D и т.д., или антиген лейкоцитов человека HLA, или анализируемое вещество может представлять собой микроорганизм, например, бактерию, гриб, простейшее или вирус.
Поливалентные лиганды анализируемых веществ могут быть поли(аминокислотами), то есть полипептидами и белками, полисахаридами, нуклеиновыми кислотами и их комбинацией. Такие комбинации включают в себя компоненты бактерий, вирусов, хромосом, генов, митохондрий, ядер, клеточных мембран и тому подобное. Полиэпитопный лиганд по большей части имеет молекулярную массу по меньшей мере около 5000, чаще по меньшей мере около 10000. В категории поли(аминокислот) рассматриваемые поли(аминокислоты) могут иметь молекулярную массу примерно от 5000 до 5000000, чаще молекулярную массу от около 20000 до 1000000; показатели молекулярной массы рассматриваемых гормонов обычно варьируют от около 5000 до 60000.
Анализируемое вещество может представлять собой белок, такой как, например, иммуноглобулины, цитокины, ферменты, гормоны, раковые антигены, пищевые маркеры, тканеспецифичные антигены и т.д. Такие белки включают в себя в качестве иллюстрации и без ограничения протамины, гистоны, альбумины, глобулины, склеропротеины, фосфопротеины, мукопротеины, хромопротеины, липопротеины, нуклеопротеины, гликопротеины, T-клеточные рецепторы, протеогликаны, HLA, неклассифицированные белки, например соматотропин, пролактин, инсулин, пепсин, белки, обнаруживаемые в плазме человека, факторы свертывания крови, белковые гормоны, такие как, например, фолликуло-стимулирующий гормон, лютеинизирующий гормон, лютеотропин, пролактин, хорионический гонадотропин, тканевые гормоны, цитокины, раковые антигены, такие как, например, PSA, CEA, a-фетопротеин, кислая фосфатаза, CA19.9, CA15.3 и CA125, тканеспецифичные антигены, такие как, например, щелочная фосфатаза, миоглобин, CK-MB и кальцитонин, и пептидные гормоны. Другие рассматриваемые анализируемые вещества представляют собой мукополисахариды и полисахариды.
Моноэпитопные лиганды анализируемых веществ обычно имеют молекулярную массу от около 100 до 2000, чаще молекулярная масса составляет от около 125 до около 1000. Анализируемые вещества включают в себя лекарства (например, лекарства, вызывающие зависимость, терапевтические препараты и т.д.), метаболиты, пестициды, загрязняющие вещества и тому подобное. Представители лекарств, вызывающих зависимость (включающие в себя неправильно применяемые лекарства), в качестве примера и без ограничения, включают в себя (i) алкалоиды, такие как алкалоиды морфина, которые включают в себя морфин, кодеин, героин, декстрометорфан, их производные и метаболиты; алкалоиды кокаина, которые включают в себя кокаин и бензил экгонин, их производные и метаболиты; алкалоиды эргота, которые включают в себя диэтиламид лизергиновой кислоты; стероидные алкалоиды; алкалоиды иминазоила; алкалоиды квиназолина; алкалоиды изохинолина; алкалоиды хинолина, которые включают в себя хинин и хинидин; дитерпеновые алкалоиды, их производные и метаболиты; (ii) стероиды, которые включают в себя эстрогены, андрогены, адренокортикальные стероиды, желчные кислоты, кардиотонические гликозиды и агликоны, которые включают в себя дигоксин и дигоксигенин, сапонины и сапогенины, их производные и метаболиты; стероид-миметические вещества, такие как диэтилстильбэстрол; (iii) лактамы, имеющие от 5 до 6 кольцевых членов, которые включают в себя барбитураты, например, фенобарбитал и секобарбитал, дифенилгидантоин, примидон, этосукцимид и их метаболиты; (iv) аминоалкилбензолы с алкильной цепью от 2 до 3 атомов углерода, которые включают в себя амфетамины; катехоламины, которые включают в себя эфедрин, L-допу, эпинефрин; нарцеин; папаверин; и метаболиты вышеупомянутых веществ; (v) бензгетероциклические соединения, которые включают в себя оксазепам, хлорпромазин, тегретол, их производные и метаболиты, гетероциклические кольца, представляющие собой азепины, диазепины и фенотиазины; (vi) пурины, которые включают в себя теофиллин, кофеин, их метаболиты и производные; (vii) препараты, получаемые из марихуаны, которые включают в себя каннабинол и тетрагидроканнабинол; (viii) гормоны, такие как тироксин, кортизол, трийодтиронин, тестостерон, эстрадиол, эстрон, прогестерон, (ix) трициклические антидепрессанты, которые включают в себя имипрамин, десметилимипрамин, амитриптилин, нортриптилин, протриптилин, тримипрамин, хормипрамин, доксепин и десметилдоксепин; и (x) противоопухолевые средства, которые включают в себя метотрексат; и тому подобные.
Общее описание исследований на наличие анализируемого вещества с использованием реактивов настоящего изобретения
Варианты осуществления настоящего изобретения имеют применение в исследованиях на определение анализируемого вещества. В общем, в таких исследованиях реактивы среди прочего содержат партнер по связыванию для анализируемого вещества. Образец с предполагаемым содержанием анализируемого вещества объединяют в тестовой среде с партнером по связыванию для анализируемого вещества. Проводят определение степени связывания анализируемого вещества с партнером по связыванию для анализируемого вещества. В качестве реактива-метки для обнаружения такого эпизода связывания применяют хемилюминесцентный реактив согласно настоящим вариантам осуществления. Исследование можно проводить как без разделения (гомогенного), так и с разделением (гетерогенным) любого из тестовых компонентов или продуктов. Гетерогенные анализы обычно охватывают один или больше этапов разделения и могут быть конкурентными или неконкурентными.
В некоторых известных исследованиях используется система получения сигнала (sps), в которой применяют дисперсный хемилюминесцентный реактив, имеющий хелат металла, связанный с матрицей, и которая имеет по меньшей мере первые и вторые элементы sps. Обозначение "первый" и "второй" является полностью произвольным и не предназначено для предложения какого-либо порядка или классификации элементов sps или какого-либо порядка добавления элементов sps в способах настоящего изобретения. Элементы sps могут быть связаны таким образом, что при активации одного элемента sps получают продукт, такой как, например, свет, который приводит к активации другого элемента sps. В некоторых вариантах осуществления известных анализов элементы sps содержат сенсибилизатор и хемилюминесцентную композицию, и при этом активация сенсибилизатора производит продукт, который активирует хемилюминесцентную композицию. Второй элемент sps обычно генерирует обнаружимый сигнал, который имеет отношение к количеству связанного и/или несвязанного элемента sps, то есть к количеству определяемого элемента sps, связанного или несвязанного с анализируемым веществом, или к агенту, который отражает количество анализируемого вещества, которое будет обнаружено. Согласно настоящему изобретению, недисперсный хемилюминесцентный реактив, соответствующий настоящим вариантам осуществления и описанный выше, можно использовать вместо дисперсного хемилюминесцентного реактива, применяемого в известных способах.
В некоторых вариантах осуществления способов согласно настоящим вариантам осуществления первый элемент sps представляет собой сенсибилизатор, такой как, например, фотосенсибилизатор, и второй элемент sps является недисперсным хемилюминесцентным реактивом из вариантов осуществления настоящего изобретения, который активируется в результате активации первого элемента sps. Сенсибилизатором может быть любая функциональная группа, которая при активации производит продукт, активирующий хемилюминесцентный реактив, который в свою очередь генерирует обнаружимый сигнал. Во многих вариантах осуществления сенсибилизатор при активации способен продуцировать синглетный кислород.
В некоторых вариантах осуществления сенсибилизатор представляет собой фотосенсибилизатор для получения синглетного кислорода, обычно посредством светового возбуждения. Фотосенсибилизатор может быть фотоактивируемым (например, красители и соединения ароматического ряда) или хемиактивируемым (например, ферменты и соли металлов). При возбуждении светом фотосенсибилизатор обычно представляет собой соединение, состоящее из ковалентно связанных атомов, обычно посредством множественных конъюгированных двойных или тройных связей. Соединение должно абсорбировать свет в диапазоне длины волны от около 200 до около 1100 нм, или от около 300 до около 1000 нм, или от около 450 до около 950 нм, с коэффициентом экстинкции при его максимальной поглощательной способности больше чем около 500 М-1 см-1, или по меньшей мере около 5000 М-1 см-1, или по меньшей мере около 50000 М-1 см-1 длины волны возбуждения. Фотосенсибилизаторы, которые предназначены для возбуждения светом, должны быть относительно фотостабильными и не реагировать эффективно с синглетным кислородом. Наиболее полезные фотосенсибилизаторы обладают рядом структурных признаков. Большинство фотосенсибилизаторов имеет по меньшей мере один и часто три или больше конъюгированных двойных или тройных связей, находящихся в жесткой, часто ароматической структуре. Фотосенсибилизатор обычно содержит по меньшей мере одну группу, которая ускоряет межсистемное пересечение, такую как группа карбонила или имина, или тяжелый атом, выбираемый из 3-6 рядов периодической таблицы, в частности, йод или бром, или они могут иметь расширенные ароматические структуры. Обычные фотосенсибилизаторы включают в себя ацетон, бензофенон, 9-тиоксантон, эозин, 9,10-дибромантрацен, метиленовый синий, металлопорфирины, такие как гематопорфирин, фталоцианины, хлорофиллы, бенгальскую розу, бакминстерфуллерен и т.д., и производные указанных соединений, имеющих заместители размером от 1 до 50 атомов для придания указанным соединениям больше липофильных или больше гидрофильных свойств и/или в качестве групп присоединения, например, для присоединения элемента sps или элемента sbp.
Полезные для вышеупомянутых способов фотосенсибилизаторы включают в себя другие вещества и соединения, которые могут генерировать синглетный кислород при активации внешним источником света или, что менее предпочтительно, без активации. Таким образом, показано, например, что молибдатные соли и хлорпероксидаза и миелопероксидаза плюс ион бромида или хлорида (Kanofsky, J. Biol. Chem. (1983) 259 5596) катализируют превращение пероксида водорода в синглетный кислород и воду. Также в число фотосенсибилизаторов включают соединения, которые не являются истинными сенсибилизаторами, но которые при возбуждении высокой температурой, светом или при химической активации высвобождают молекулу синглетного кислорода. Наиболее известные члены этого класса соединений включают в себя эндопероксиды, такие как 1,4-бискарбоксиэтил-1,4-нафталин эндопероксид, 9,10-дифенилантрацен-9,10-эндопероксид и 5,6,11,12-тетрафенил-нафталин 5,12-эндопероксид. При нагревании или прямом поглощении света этими соединениями высвобождается синглетный кислород. Примерами других фотосенсибилизаторов, возможных для применения, являются приведенные в патентах США №№ 5340716 и 6251581, соответствующие раскрытия которых включены со ссылкой в настоящее изобретение.
В конкретном варианте осуществления настоящее изобретение имеет применение в иммуноанализе индуцированной люминесценции, упомянутом в патенте США № 5340716 (Ullman) под названием "Assay Method Utilizing Photoactivated Chemiluminescent Label" ("induced luminescence assay"), раскрытие которого включено в изобретении со ссылкой. В одном подходе согласно настоящим вариантам осуществления в анализе используется частица, включающая в себя фотосенсибилизатор и недисперсный хемилюминесцентный реактив, как описано выше. Партнер по связыванию для анализируемого вещества настоящего хемилюминесцентного реактива связывается с анализируемым веществом для образования комплекса или связывается со вторым элементом sbp для образования комплекса, относящегося к присутствию анализируемого вещества. В случае присутствия анализируемого вещества фотосенсибилизатор и хемилюминесцентное соединение входят посредством связывания в непосредственную близость с анализируемым веществом, с партнером по связыванию для анализируемого вещества на частице фотосенсибилизатора и с партнером по связыванию для анализируемого вещества, который составляет часть недисперсного хемилюминесцентного реактива согласно настоящим вариантам осуществления. Фотосенсибилизатор продуцирует синглетный кислород и активирует недисперсный хемилюминесцентный реактив, когда две метки находятся в непосредственной близости. После этого активированный хемилюминесцентный реактив генерирует свет. Количество генерируемого света связано с количеством образованного комплекса, которое в свою очередь связано с количеством присутствующего анализируемого вещества.
В некоторых вариантах осуществления анализа индуцированной люминесценции используется частица фотосенсибилизатора, конъюгированная к авидину. Также применяют биотинилированный партнер по связыванию для анализируемого вещества. Недисперсный хемилюминесцентный реактив согласно настоящим вариантам осуществления используется как часть системы обнаружения. Реакционную среду инкубируют для возможного связывания частиц фотосенсибилизатора с биотинилированным партнером по связыванию для анализируемого вещества посредством связывания между авидином и биотином, и также чтобы позволить связывание с анализируемым веществом партнера по связыванию для анализируемого вещества, который является частью фотосенсибилизирующего реактива, и партнера по связыванию для анализируемого вещества, который является частью недисперсного хемилюминесцентного реактива согласно настоящим вариантам осуществления. Затем среду облучают светом для возбуждения фотосенсибилизатора, который в возбужденном состоянии способен к активации кислорода в синглетное состояние. Поскольку в связи с присутствием анализируемого вещества хемилюминесцентный реактив находится теперь в непосредственной близости к фотосенсибилизатору, он активируется синглетным кислородом и испускает люминесценцию. Затем анализируют среду на присутствие люминисценции и/или количественно определяют люминесценцию или испускаемый свет, при этом их присутствие связывают с присутствием и/или количеством анализируемого вещества.
Образец, подвергаемый анализу, представляет собой образец с предполагаемым содержанием анализируемого вещества. Образцы забирают предпочтительно у людей или животных, и они включают в себя биологические жидкости, такие как цельная кровь, сыворотка, плазма, слюна, лимфатическая жидкость, сперма, влагалищная слизь, фекалии, моча, спинальная жидкость, слюна, кал, спинномозговая жидкость, слезы, слизь и т.п.; биологические ткани, такие как волосы, кожа, срезы или ткани, иссеченные из органов или других частей тела; и т.д. Часто образец представляет собой цельную кровь, плазму или сыворотку.
Образец можно приготовить в любой удобной среде. Удобным является подготовка образца в тестовой среде, которая более подробно рассмотрена в настоящем описании. В некоторых случаях образец можно подвергать предварительной обработке, такой как, например, лизис клеток крови и т.п. Такую предварительную обработку обычно осуществляют в среде, которая впоследствии не мешает проведению анализа. Для предварительной обработки предпочтительна водная среда.
Как коротко рассмотрено выше, анализ обычно проводят в водной буферной среде при умеренном уровне pH, в общем при котором обеспечивается оптимальная чувствительность анализа. Водная среда может быть исключительно водой или может включать в себя от 0,1 до около 40 процентов объема сорастворителя. Уровень рН среды обычно будет находиться в диапазоне от около 4 до около 11, чаще в диапазоне от около 5 до около 10, и предпочтительно в диапазоне от около 6,5 до около 9,5. Уровень pH обычно будет представлять собой компромисс между оптимальным связыванием элементов связывания любых пар специфичного связывания, оптимального уровня pH для других реактивов в анализе, таких как элементы системы получения сигнала, и другими. Можно использовать различные буферы для достижения желательного уровня рН и поддержания уровня pH в ходе анализа. Примеры буферов включают в себя борат, фосфат, карбонат, Трис, барбитал, буферы PIPES, HEPES, MES, ACES, MOPS, BICINE и тому подобное. Не имеет значения конкретно используемый буфер, но использование того или другого буфера в конкретном анализе может быть предпочтительным.
В вышеупомянутых способах можно использовать различные вспомогательные материалы. Например, в дополнение к буферам среда может содержать стабилизаторы для среды и для используемых реактивов. В некоторых вариантах осуществления в дополнение к этим добавкам можно включать в среду белки, такие как альбумины; органические растворители, такие как формамид; соли четвертичного аммония; полианионы, такие как декстрансульфат; усилители связывания, например полиалкиленгликоли; полисахариды, такие как декстран, трегалоза или подобное. Среда может также содержать агенты для предотвращения образования кровяных сгустков. Такие агенты известны в данной области техники и включают в себя, например, этилендиаминтетрауксусную кислоту ЭДТА, этиленгликольтетрауксусную кислоту ЭГТА, соль лимонной кислоты, гепарин и т.п. Среда может также содержать один или более консервантов, известных в данной области техники, таких как, например, азид натрия, неомицина сульфат, PROCLIN® 300, стрептомицин и т.п. Любой из вышеупомянутых материалов в случае его использования присутствует в концентрации или в количестве, достаточном для достижения желательного эффекта или функции.
Среда может находиться в одном или больше инкубационных периодах с одним или больше интервалами, включающими в себя любые интервалы между добавлениями различных упомянутых выше реактивов. Среду обычно инкубируют при температуре и в течение времени, достаточном, чтобы произошло связывание разных компонентов реактивов. Обычно для осуществления способа применяют умеренные температуры, обычно постоянную температуру, и во время периода измерения предпочтительно применяют комнатную температуру. Значения температуры инкубации обычно варьируют от около 5° до около 99°C, обычно от около 15°C до около 70°C, чаще от 20°C до около 45°C. Период времени инкубации составляет от около 0,2 секунды до около 24 часов, или от около 1 секунды до около 6 часов, или от около 2 секунд до около 1 часа, или от около 1 до около 15 минут. Период времени зависит от температуры среды и скорости связывания разных реактивов, которые определяются показателями константы скорости ассоциации, концентрации, константы связывания и константы скорости диссоциации. Показатели температуры во время измерений обычно находятся в диапазоне от около 10 до около 50°C, или от около 15 до около 40°C.
Концентрация анализируемого вещества, которую можно оценить, обычно варьирует от около 10-5 до около 10-17 М, чаще от около 10-6 до около 10-14 М. По оценке исследования, а именно является ли исследование качественным, полуколичественным или количественным (в отношении количества анализируемого вещества, присутствующего в образце), по конкретной методике обнаружения и концентрации анализируемого вещества обычно определяют концентрации разных реактивов.
Концентрации разных реактивов в тестовой среде обычно определяют по рассматриваемым диапазонам концентрации анализируемого вещества, по характеристикам анализа и т.п. Вместе с тем, конечную концентрацию каждого из реактивов в норме определяют эмпирически для оптимизации чувствительности анализа во всем диапазоне. Таким образом, значимое изменение концентрации анализируемого вещества должно обеспечить точно измеримую разницу в сигнале. По таким оценкам как природа системы получения сигнала и природа анализируемых веществ обычно определяют концентрации разных реактивов.
Как упомянуто выше, рассматриваются комбинации образца и реактивов в среде. Поскольку порядок добавления к среде может различаться, некоторые описанные в изобретении варианты осуществления форматов анализов исследования имеют определенные преимущества. Самым простым порядком добавления является одновременное добавление всех материалов и определение эффекта, который дает сигнал тестовой среды, как в гомогенном анализе. Альтернативно, каждый из реактивов, или группы реактивов, можно объединять последовательно. В некоторых вариантах осуществления можно вводить этап инкубации после каждого добавления, как рассмотрено выше.
Как упомянуто выше, варианты осуществления вышеупомянутого исследования используют дисперсный фотосенсибилизирующий реактив. Частица может состоять из органического или неорганического, твердого или жидкого, водонерастворимого материала, который может быть прозрачным или частично прозрачным. Обычно средний диаметр частиц составляет по меньшей мере около 0,02 микронов и не больше чем около 100 микронов. В некоторых вариантах осуществления средний диаметр частиц составляет от около 0,05 микронов до около 20 микронов, или от около 0,3 микронов до около 10 микронов. Частица может быть органической или неорганической, набухаемой или ненабухаемой, пористой или непористой, с предпочтительным значением плотности, близким к плотности воды, обычно от около 0,7 г/мл до около 1,5 г/мл, и состоять из материала, который может быть прозрачным, частично прозрачным или непрозрачным. Частицы могут представлять собой биологические материалы, такие как, например, клетки и микроорганизмы, эритроциты, лейкоциты, лимфоциты, гибридомы, стрептококки, Staphylococcus aureus, E. coli, вирусы и т.п. Частицы также могут быть частицами, состоящими из органических и неорганических полимеров, липосом, латексных частиц, магнитных или антимагнитных частиц, фосфолипидных пузырьков, хиломикронов, липопротеинов и т.п. В некоторых вариантах осуществления частицы представляют собой частицы хрома или латексные частицы.
Этап исследования
В следующем этапе способа анализа проводят исследование среды на присутствие комплекса, содержащего анализируемое вещество и партнер по связыванию для анализируемого вещества. Присутствие и/или количество комплекса указывает на присутствие и/или количество в образце анализируемого вещества.
Выражение "измерение количества анализируемого вещества" относится к количественному, полуколичественному и качественному определению анализируемого вещества. Считается, что способы, которые являются количественными, полуколичественными и качественными, а также все другие способы для определения анализируемого вещества, являются способами измерения количества анализируемого вещества. Например, предполагается, что способ, который просто обнаруживает присутствие или отсутствие анализируемого вещества в образце с предполагаемым содержанием анализируемого вещества, входит в объем настоящего изобретения. Термины "обнаружение" и "определение", а также другие общепринятые синонимы для измерения, считаются входящими в объем настоящего изобретения.
Во многих вариантах осуществления исследование среды охватывает обнаружение сигнала от среды, в которой генерирование сигнала обусловлено вовлечением хемилюминесцентной композиции согласно настоящим вариантам осуществления. Присутствие и/или количество сигнала связано с присутствием и/или количеством анализируемого вещества в образце. Конкретный способ обнаружения зависит от природы sps. Как рассмотрено выше, существуют многочисленные способы, посредством которых метка sps может производить сигнал, обнаружимый внешними средствами. Активация системы получения сигнала зависит от природы элементов системы получения сигнала. Что касается элемента sps, который представляет собой сенсибилизатор, активируемый светом, элемент sps облучается светом. Специалистам в данной области техники будут предложены другие способы активации в свете приведенных в изобретении раскрытий.
Применяемый фотосенсибилизатор служит для активации хемилюминесцентного реактива при облучении среды, содержащей вышеупомянутые реагенты. Среду облучают светом, имеющим длину волны с достаточной энергией для превращения фотосенсибилизатора в возбужденное состояние и придания ему способности к активации молекулярного кислорода в синглетный кислород. При связывании фотосенсибилизатора с партнером по связыванию для анализируемого вещества его концентрация может быть очень низкой, часто от около 10-6 до около 10-12 М или ниже. В целом, в вышеупомянутых вариантах осуществления с участием фотосенсибилизатора среду облучают светом с длиной волны от около 300 до около 1200 нм, или от около 450 до около 950, или от около 550 до около 800 нм.
Период облучения будет зависеть от времени жизни активированной хемилюминесцентной композиции из вариантов осуществления хемилюминесцентных реактивов настоящего изобретения, интенсивности света и желательной интенсивности эмиссии. Для короткоживущих активированных хемилюминесцентных композиций указанный период может составлять меньше 1 секунды, обычно около миллисекунды, а в случае применения интенсивной импульсной лампы или лазера может быть таким коротким, как 1 микросекунда. Для долгоживущих активированных хемилюминесцентных композиций период облучения может быть более продолжительным, и можно использовать менее интенсивный устойчивый источник света. В общем, суммарная интенсивность света за период облучения должна быть достаточной для возбуждения по меньшей мере 0,1% фотосенсибилизирующих молекул, предпочтительно по меньшей мере 30%, и наиболее предпочтительно, чтобы каждая фотосенсибилизирующая молекула была возбуждена по меньшей мере однократно.
Гелий-неоновый лазер представляет собой недорогой источник света для возбуждения при 632,6 нм. Фотосенсибилизаторы, которые поглощают свет при указанной длине волны, совместимы с линией эмиссии гелий-неонового лазера и поэтому являются особенно полезными в способах настоящего изобретения с использованием фотосенсибилизаторов. Другие источники света включают в себя, например, другие лазеры, такие как аргоновый, YAG, He/Cd и рубиновый; фотодиоды; ртутные, натриевые и ксеноновые лампы; лампы накаливания, такие как вольфрамовые и вольфрам/галогеновые; и импульсные лампы.
Показатели температуры во время измерений обычно находятся в диапазоне от около 10° до около 70°C, или от около 20° до около 45°C, или от около 20° до около 25°C. В одном подходе образуются стандартные кривые при использовании известных концентрации анализируемых веществ, скрининг которых выполняют. Как рассмотрено выше, также можно использовать калибраторы и другие средства контроля.
Люминесценцию или свет, генерируемый в любом из вышеупомянутых подходов, можно измерять визуальным, фотографическим, актинометрическим, спектрофотометрическим или любым другим удобным способом для определения количества люминесценции или света, которые связаны с количеством анализируемого вещества в среде. Исследование на присутствие и/или количество сигнала также включает в себя обнаружение сигнала, которое в общем является просто этапом чтения сигнала. Считывание сигнала обычно происходит с помощью инструмента, природа которого зависит от природы сигнала. Инструмент может представлять собой спектрофотометр, флюорометр, абсорбционный спектрометр, люминометр, хемолюминометр и т.п. Присутствие и количество обнаруженного сигнала связано с присутствием и количеством анализируемого вещества, присутствующего в образце.
Гелий-неоновый лазер представляет собой недорогой источник света для возбуждения при 632,6 нм. Фотосенсибилизаторы, которые поглощают свет при указанной длине волны, совместимы с линией эмиссии гелий-неонового лазера и, поэтому являются особенно полезными в способах настоящего изобретения с использованием фотосенсибилизаторов. Другие источники света включают в себя, например, другие лазеры, такие как аргоновый, YAG, He/Cd и рубиновый; фотодиоды; ртутные, натриевые и ксеноновые лампы; лампы накаливания, такие как вольфрамовые и вольфрам/галогеновые; и импульсные лампы.
Комплекты, содержащие реактивы для проведения анализов
Хемилюминесцентный реактив настоящего изобретения и другие реактивы для проведения конкретного анализа могут находиться в комплекте, полезном для удобства выполнения исследований по определению анализируемого вещества. В некоторых вариантах осуществления комплект содержит в упакованной комбинации конъюгат биотин-связывающего партнера для анализируемого вещества, стрептавидин-сенсибилизирующие частицы и недисперсный хемилюминесцентный реактив согласно настоящим вариантам осуществления, в котором партнер по связыванию для анализируемого вещества из хемилюминесцентного реактива распознает и связывается с другой антигенной детерминантой на анализируемом веществе, чем партнер по связыванию для анализируемого вещества, который является частью биотин-связывающего партнера для анализируемого конъюгата. Комплект может дополнительно включать в себя другие реактивы для осуществления анализа, природа которых зависит от конкретного формата исследования.
Каждый из реактивов может находиться в отдельных контейнерах, или разные реактивы могут объединяться в одном или больше контейнерах в зависимости от перекрестной реактивности и стабильности реактивов. Комплект может дополнительно включать в себя другие отдельно упакованные реактивы для проведения анализа, такие как дополнительные элементы sbp, вспомогательные реактивы, и т.д.
Относительное количество различных реактивов в комплектах может широко варьировать, чтобы обеспечить концентрации реактивов, в значительной степени оптимизирующие реакции, которые должны пройти в ходе настоящего способа, и дополнительно значительно оптимизировать чувствительность анализа. При соответствующих обстоятельствах один или больше реактивов в комплекте может быть представлен в виде сухого порошка, обычно лиофилизированного, включающего в себя наполнители, которые при растворении образуют раствор для реактива, имеющий соответствующие концентрации для осуществления способа или анализа согласно настоящему изобретению. Комплект может дополнительно включать в себя письменное описание способа согласно настоящему изобретению, как описано выше.
Выражение "по меньшей мере", используемое в изобретении, означает, что число указанных пунктов может быть равным указанному числу или превышать его. Понятие "около/примерно", используемое в изобретении, означает, что указанное число может отличаться на плюс или минус 10%; например, "около 5" означает диапазон от 4,5 до 5,5. Обозначения "первый" и "второй" использованы исключительно с целью дифференциации между двумя пунктами, такими как, например, "первый элемент" и "второй элемент" и не предназначены, чтобы подразумевать какую-либо последовательность или порядок или степень важности одного пункта перед другим.
Следующие примеры дополнительно описывают конкретные варианты осуществления изобретения посредством иллюстрации и без ограничения и предназначены для описания и не для ограничения области изобретения. Части и проценты, приведенные в изобретении, относятся к объему, если не указано иначе.
ПРИМЕРЫ
Материалы
Тестирование проводили с помощью анализатора DIMENSION® RxL, доступного от компании Siemens Healthcare Diagnostics Inc, Newark DE. Применяли инструмент с использованием технологии иммунологического анализа индуцированной люминесценции, оборудованный соответствующим ридером.
Если не указано иначе, реактивы приобретались в компании Sigma-Aldrich (Милуоки, Висконсин) и использовались в полученном виде, если не указано иначе. Синтезировали BHHCT, как описано авторами Yuan J. and Matsumoto K. (Anal. Biochem. 1998, 70: 596-601). Моноклональное анти-ТТГ антитело изготовляли с помощью известных технологий гибридизации соматических клеток; см., например, Kόhler and Milstein, Nature 265:495-497, 1975.
Чистоту образцов анализировали путем аналитической тонкослойной хроматографии (ТСХ), проводимой на стеклянной пластине с противоореольным покрытием Analtech Uniplate Gel GF (0,25 мм) с использованием указанного растворителя. Пятна ТСХ визуализировали посредством ультрафиолетового света (с короткой и/или длинной длиной волны) и/или паров йода. Флэш-хроматографию выполняли на силикагеле Whatman 60Å (меш 230-400). Спектры 1H-ЯМР регистрировали с помощью спектрометра Bruker Ultrashield™-400 (400 МГц). Химические сдвиги указаны в частях на миллион (промилле, ppm, δ) относительно тетраметиленсилана в качестве внутренней ссылки. Используемыми сокращениями в ЯМР являются s (синглетный), d (дуплетный), m (мультиплетный) и t (триплетный).
Приготовление соединения II (фиг. 1): N-метиланилин (I) (25 г, 233,3 ммоль) и этил 5-бромвалерат (25 г, 119,6 ммоль) добавляли в круглодонный флакон объемом 100 мл. Содержимое флакона нагревали с взбалтыванием при 100°C в течение 16 часов. Реакционную смесь оставляли для охлаждения до комнатной температуры и вливали в этилацетат (50 мл). Раствор этилацетата промывали 20% гидроокисью натрия (3×50 мл); объединенный раствор гидроксида натрия обратно экстрагировали этилацетатом (25 мл) и удаляли оставшийся водный раствор гидроксида натрия. Объединенный экстракт этилацетата промывали водой (10 мл) и высушивали над MgSO4. Прозрачный раствор этилацетата выпаривали досуха на ротационном испарителе. Остаточное масло, полученное таким путем, очищали дистилляцией в высоком вакууме (130-134° C, 0,5 мМ Hg), чтобы получить 21 г бесцветного жидкого соединения II. 11H-ЯМР (CDCl3) δ: 7,18 (м, 2H), 6,68 (м, 3H), 4,2 (кв, J=8,0 Гц, 2H), 3,36 (т, J=8,0 Гц, 2H), 2,92 (с, 3H), 2,33 (т, J=8,0 Гц, 2H), 1,64 (м, 4H), 1,24 (т, J=8,0 Гц, 3H).
Приготовление соединения III (фиг. 1): Оксихлорид фосфора (POCl3; 5 г, 33 ммоль) добавляли по капле в течение 10 минут через капельную воронку к перемешиваемому N,N-диметилформамиду (ДМФ; 8,8 г, 120 ммоль) при температуре от 0 до 4°C. Через 10 минут при 0-4°C быстро добавляли соединение II (3,7 г, 15,96 ммоль) одной порцией. Пробирку, используемую для соединения II, ополаскивали 1 мл ДМФ и добавляли раствор ДМФ к перемешиваемой реакционной смеси, которую нагревали с взбалтыванием при 100°C в течение 1 часа. Реакционную смесь оставляли для охлаждения до комнатной температуры и медленно вливали в смесь воды со льдом. Водную фазу нейтрализовали 20% гидроксидом натрия и экстрагировали этилацетатом (3×50 мл). Объединенный раствор этилацетата промывали водой (20 мл) и высушивали над MgSO4. Прозрачный органический раствор выпаривали досуха при пониженном давлении. Получаемый масляный остаток очищали колоночной флэш-хроматографией, используя этилацетат/дихлорметан (9/1; об./об.), для получения 2,46 г соединения III. 1H-ЯМР (CDCl3) δ: 9,72 (с, 1H), 7,18 (д, J=8,0 Гц, 2H), 6,68 (д, J=8,0 Гц, 2H), 4,22 (кв, J=8,0 Гц, 2H), 3,40 (м, 2H), 3,05 (с, 3H), 2,35 (т, J=8,0 Гц, 2H), 1,65 (м, 4H), 1,25 (т, J=8,0 Гц, 3H).
Приготовление соединения IV (фиг. 1): Цианид калия (1,0 г, 15,3 ммоль) добавляли к раствору соединения III (2,46 г, 9,34 ммоль) в 15 мл 60% этанола, перемешиваемого в атмосфере азота. Смесь нагревали с обратным холодильником в течение 15 минут. К дефлегмированной реакционной смеси в течение 45 минут добавляли бензальдегид (1,05 г), растворенный в 10 мл этанола. Через 15 минут охлажденную реакционную смесь вливали в этилацетат (30 мл). Водную фазу отделяли и экстрагировали обратно с этилацетатом (3×30 мл). Объединенный раствор этилацетат высушивали над MgSO4, и прозрачный раствор выпаривали досуха при пониженном давлении. Сырую реакционную смесь растворяли в 10 мл сухого этанола, смешивали с 0,25 мл триметилсилил-хлорида и взбалтывали в течение 16 часов при комнатной температуре. Реакционную смесь вливали в смесь насыщенного бикарбоната натрия (120 мл) и дихлорметана (30 мл). Водную фазу отделяли и экстрагировали дихлорметаном (2×30 мл). Объединенную органическую фазу промывали насыщенным бикарбонатом натрия (60 мл) и высушивали над MgSO4. Прозрачный органический раствор выпаривали досуха при пониженном давлении. Масляный остаток очищали колоночной флэш-хроматографией, используя этилацетат/гексан (1/5; об./об.) для получения 196 мг соединения IV. 1H-ЯМР (CDCl3) δ: 7,84 (д, J=8 Гц, 2H), 7,34 (м, 5H), 6,54 (д, J=8 Гц, 2H), 5,86 (д, J=4 Гц, 1H), 4,86 (д, J=4 Гц, 1H), 4,14 (кв, J=8,0 Гц, 2H), 3,38 (т, J=8,0 Гц, 2H), 3,00 (с, 3H), 2,34 (т, J=8,0 Гц, 2H), 1,64 (м, 4H), 1,25 (т, J=8,0 Гц, 3H).
Приготовление соединения V (фиг. 1): Перемешиваемый раствор соединения IV (176 мг, 0,476 ммоль) в 8 мл сухого толуола смешивали с тиоэтанолом (0,28 мл, 312 мг, 4,0 ммоль) и триметилсилил-хлоридом (0,51 мл, 436 мг, 4,0 ммоль). После нагревания с обратным холодильником в течение 24 часов в атмосфере азота охлажденную реакционную смесь вливали в насыщенный бикарбонат натрия (15 мл). Органическую фазу отделяли и промывали насыщенным бикарбонатом натрия (10 мл). Объединенную водную фазу обратно экстрагировали дихлорметаном (3×30 мл) и экстракт дихлорметана промывали водой (20 мл). Объединенный раствор дихлорметана высушивали над MgSO4, фильтровали и выпаривали досуха. Масляный остаток очищали препаративной тонкослойной хроматографией с использованием этилацетата/дихлорметана (5/95; об./об.) для получения 93 мг соединения V. 1H-ЯМР (CDCl3) δ: 7,20-7,04 (м, 7H), 6,50 (д, J=8,0 Гц, 2H), 4,48 (м, 2H), 4,12 (кв, J=8,0 Гц, 2H), 3,28 (м, 2H), 3,20 (м, 2H), 2,87 (с, 3H), 2,32 (т, J=8,0 Гц, 2H), 1,60 (м, 4H), 1,25 (т, J=8,0 Гц, 3H).
Приготовление соединения VI (фиг. 1): Гидроксид натрия (30 мг, 0,75 ммоль) добавляли к перемешиваемому раствору соединения V (28 мг, 0,068 ммоль) в MeOH (1 мл)-тетрагидрофуран ТГФ (2 мл) - вода (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем анализ ТСХ показывал отсутствие какого-либо исходного продукта. Реакционную смесь смешивали с 1,5 мл воды и регулировали уровень pH до 3,0 медленным добавлением 1N HCl. Реакционную смесь выпаривали досуха под вакуумом. Масляный остаток растворяли в дихлорметане (50 мл) и промывали 10 мл воды. Прозрачный органический раствор высушивали над MgSO4, фильтровали и выпаривали досуха для получения 23,6 мг соединения VI. FAB-MS (отрицательный способ) m/z: 382 [(M-H)-, 100); 1H-ЯМР (CD3OD) δ: 7,15-7,09 (м, 7H), 6,81 (д, J=8,0 Гц, 2H), 4,47 (м, 2H), 3,35 (м, 2H), 3,22 (м, 2H), 2,97 (с, 3H), 2,31 (т, J=8,0 Гц, 2H), 1,58 (м, 4H).
Синтез БСА-сцепленного тиоксенкарбоксилата: тиоксенкарбоксилат VI (12,2 мг; 32 ммоль) растворяли в 0,5 мл ДМФ. Смесь смешивали с раствором N-гидроксисукцинимида (NHS) (16 мг; 140 ммоль) в 0,1 мл ДМФ и раствором дициклогексилкарбодиимида (16 мг; 79 ммоль) в 0,1 мл ДМФ. После взбалтывания в течение 16 часов при температуре окружающей среды органическую реакционную смесь медленно добавляли к 5 мл раствора бычьего сывороточного альбумина (БСА) (55 мг; 0,82 ммоль) в 100 мМ фосфата натрия - 0,2 мМ хлорида европия, уровень pH 7,60. Через 4 часа преципитированный осадок отделяли центрифугированием и удаляли. Прозрачный раствор пропускали через эквилиброванную колонку Sephadex G25 (2,6×30 см) и элюировали 100 мМ бикарбоната натрия - 0,2 мМ хлорида европия, уровень pH 8,20. Белок-содержащие фракции объединяли. Проводили подсчет полученного таким образом БСА-тиоксена на содержание 31 тиоксенового остатка на 1 моль белка, с использованием коэффициента экстинкции 1,33×104 моль-1см-1 при 330 нм.
Приготовление активированного БСА-тиоксена: Раствор БСА-тиоксена объемом 12 мл (белок 2 мг/мл; 0,36 ммоль) смешивали с 1,2 мл раствора 10 мг/мл сульфоSMPB (сульфосукцинимидил[4-[-малеимидофенил]бутират]); 26,2 ммоль). Через 3 часа при температуре окружающей среды раствор белка сепарировали от лишних реактивов путем пропускания через эквилиброванную колонку Sephadex G25 (2,6×30 см) и элюировали 100 мМ бикарбоната натрия - 200 мкМ хлорида европия, уровень pH 6,0.
Приготовление IgG-БСА-тиоксена: Сцепление активированного БСА-тиоксена из рассмотренного выше примера с редуцированным антителом осуществляли путем смешивания раствора 3,0 мл анти-ТТГ антитела (называемого "IgG" в вышеупомянутом конъюгате) с 0,33 мл 100 мМ раствора дитиотреитола в 100 мМ фосфата натрия - 5,0 мМ ЭДТА, уровень pH 6,0. После нагревания при 37°C в течение одного часа раствор белка пропускали через эквилиброванную колонку Sephadex G25 (1,6×30 см) и элюировали 100 мМ бикарбоната натрия - 200 мкМ хлорида европия, уровень pH 6,0. Проводили подсчет редуцированных антител, чтобы оно содержало 7,2 молей свободных сульфгидрилов на моль белка. 7,3 мл раствора указанного редуцированного антитела, содержащего 19 мг (136 мкмолей) белка, смешивали с 28 мл активированного БСА-тиоксена, содержащего 31 мг (463 мкмолей) белка, и реакционную смесь выпаривали до 3 мл после доведения уровня pH до 7,0. После 16 часов при 4°C реакционную смесь гасили 50 мкл водного раствора 20 мг/мл N-этилмалеимида. Раствор белка затем очищали гель-фильтрацией на эквилиброванной колонке AcA-34 (1,6×70 см) и элюировали 50 мМ Hepes-300 мМ NaCl - 0,2% полиэтиленгликолем (PEG8000) - 0,2 мМ хлоридом европия, уровень pH 8,0. Фракции белка, соответствующие первому пику белка, элюированного из колонки, объединяли и сохраняли в присутствии 0,25 мг/мл неомицина сульфата.
Реакция IgG-БСА-тиоксена с BHHCT: 5 мл раствора IgG-БСА-тиоксена из рассмотренного выше примера, содержащего около 1 мг/мл белка, смешивали с 0,5 мл ДМФ - раствора BHHCT, содержащего 4,5 мг BHHCT. Реакционную смесь взбалтывали при температуре окружающей среды в течение 16 часов и центрифугировали при 3000 оборотов в минуту в течение 10 минут, и прозрачный раствор пропускали через эквилиброванную колонку Sephadex G50 (2,6×30 см) и элюировали 50 мМ Hepes - 300 мМ NaCl - 0,2% полиэтиленгликоля (PEG8000) - 0,2 мМ хлорида европия, уровень pH 8,0. Содержащие белок фракции объединяли и сохраняли в присутствии 0,25 мг/мл неомицина сульфата для получения IgG-БСА-(тиоксена) (BHHCT).
Анализ с использованием IgG-БСА-(тиоксена) (BHHCT): IgG-БСА-(тиоксен) - (BHHCT) из рассмотренного выше примера разводили 1:100 в 50 мМ буфера HEPES, содержащего 0,2% PEG8000 2 мг/мл БСА, 50 мкмоль EuCl3, 1 мкмоль DPP, 0,15% PROCLIN300® и 0,2 мг/мл неомицина сульфата. Таким путем BHHCT из вышеупомянутого реактива образовывал Eu(BHHCT)2DPP in situ. Удаляли содержимое лунок 5-8 из Dimension Vista® TSH FLEX® (№ в каталоге K6412, Партия 06229AB) и лунки ополаскивали деионизированной водой и заново наполняли растворенным реактивом (IgG-BSA-(тиоксен) - (Eu (BHHCT)2DPP) из примера выше. Лунки, содержащие биотинилированное анти-ТТГ антитело (R1, лунки 1-4) и чувствительные шарики стрептавидина (Sensibeads) (шарики фотосенсибилизатора) (R3, лунки 9-12), оставляли интактными. 6-уровневый калибратор LOCI® 1 (№ в каталоге KC660, партия 6BD036) тестировали на VISTA® с использованием указанных в методиках FLEX® и VISTA® ТТГ параметров (программное обеспечение VISTA® 2.0). Калибровочная кривая показана на фиг. 2, на которой kcounts обозначают количество х 1000 и ТТГ является сокращением тиреостимулирующего гормона. Разделение сигнала LOCI® было 2,2-кратным между уровнем B и A и 101-кратным между уровнем F и A. N=3 в пределах одной серии %CV и варьирует от 1,1% до 6,3% для калибраторов от B до F. Результаты показаны в фиг. 3.
FLEX® с разведением 1:100 (IgG-БСА(тиоксен) - (Eu (BHHCT)2DPP) сохраняли при температуре от 2 до 8ºC и периодически тестировали с использованием калибратора LOCI® 1. В течение 16 дней сигнал LOCI® для всех отличных от нуля калибраторов (от B до F) находились в пределах 10% от значения в день 0. Результаты показаны в фиг. 4 и 5.
Все публикации и патентные заявки, цитируемые в настоящем описании, включены в него со ссылкой, как если бы конкретно и отдельно было указано на включение со ссылкой каждой отдельной публикации или патентной заявки.
Приведенное выше изобретение описано с некоторыми подробностями посредством иллюстрации и примера в целях ясности понимания, вместе с тем, рядовым специалистам в данной области техники в свете учения настоящего изобретения будет очевидно, что можно осуществлять некоторые его изменения и модификации, не отступая от сущности или объема прилагаемой формулы изобретения. Кроме того, в целях пояснения в предшествующем описании использована конкретная номенклатуру для обеспечения полного понимания изобретения. Однако, специалисту в данной области техники будет очевидно, что для осуществления изобретения не требуются конкретные подробности. Таким образом, предшествующее описание конкретных вариантов осуществления настоящего изобретения представлено в целях иллюстрации и описания; они не предназначены, чтобы быть исчерпывающими или ограничивать изобретение раскрытыми точными формами. Возможны множество модификаций и вариантов в свете вышеизложенного учения. Варианты осуществления были выбраны и описаны для объяснения принципов изобретения и его практических применений, чтобы таким образом позволить использовать изобретение другим специалистам в данной области техники.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБНАРУЖЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКОГО СВЯЗЫВАЮЩЕГО АГЕНТА | 2013 |
|
RU2636822C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2778411C2 |
| СПОСОБЫ, НАБОРЫ, СРЕДСТВА И УСТРОЙСТВА ДЛЯ ТРАНСДУКЦИИ | 2016 |
|
RU2761555C2 |
| ПРИМЕНЕНИЕ ГЛИКОЗАМИНОГЛИКАНОВ ДЛЯ СНИЖЕНИЯ НЕСПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ В ИММУНОЛОГИЧЕСКИХ АНАЛИЗАХ | 2008 |
|
RU2490648C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2761557C2 |
| УСТРОЙСТВА И СПОСОБЫ ДЛЯ АНАЛИЗА ОБРАЗЦА | 2016 |
|
RU2712610C2 |
| СВЯЗЫВАЮЩИЕ IL-1 БЕЛКИ | 2011 |
|
RU2615173C2 |
| АГГЛЮТИНАЦИЯ ЧАСТИЦ В НАКОНЕЧНИКЕ | 2009 |
|
RU2498310C2 |
| IL-1 АЛЬФА И БЕТА БИСПЕЦИФИЧЕСКИЕ ИММУНОГЛОБУЛИНЫ С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2627171C2 |
| Комплекс для детекции и направленного разрушения клеток | 2019 |
|
RU2743993C1 |
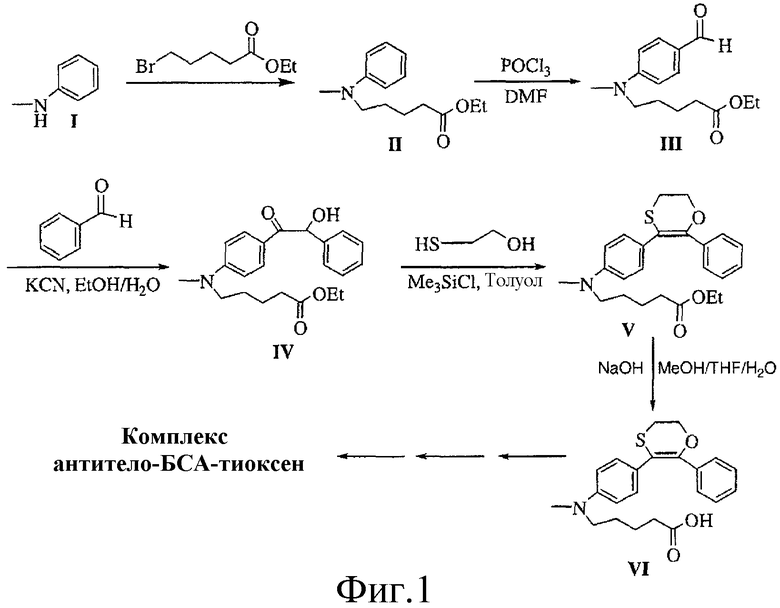
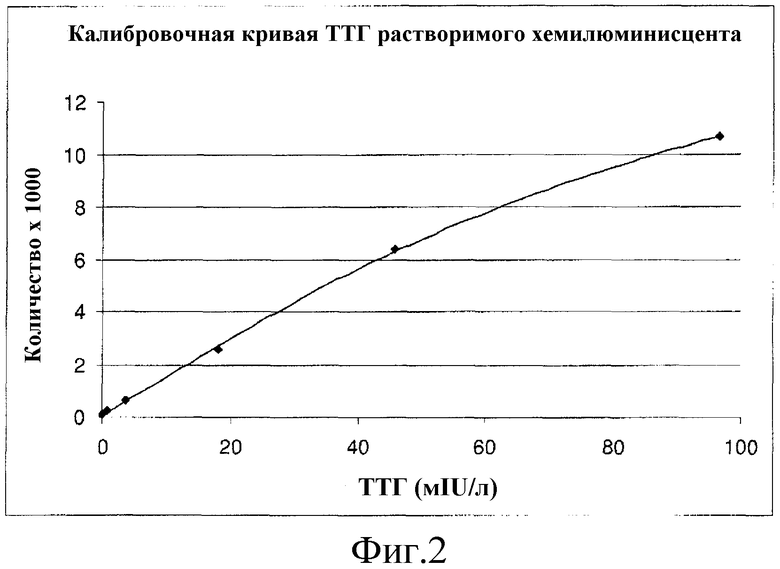
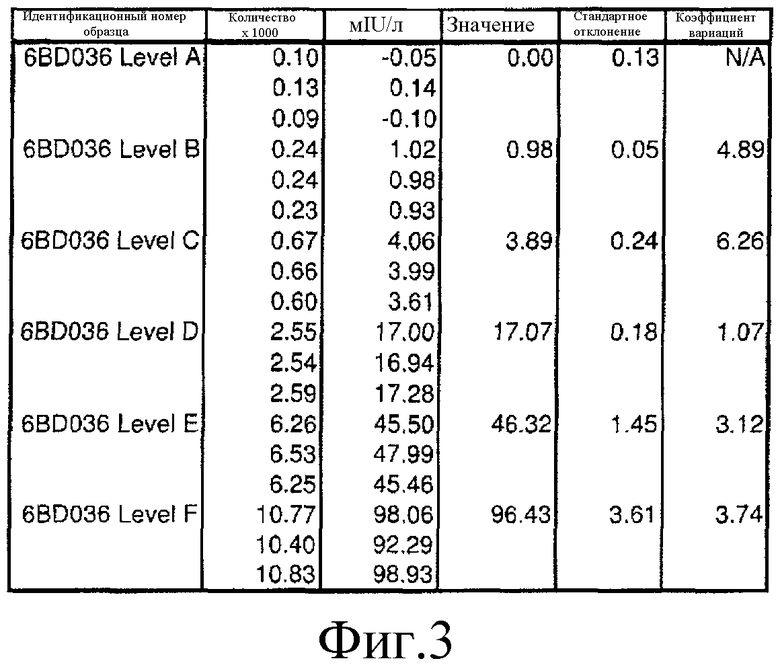
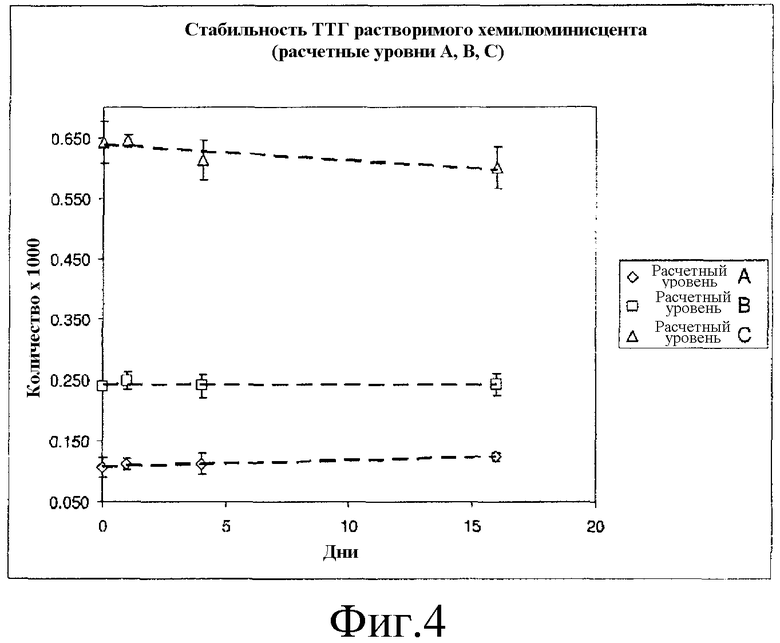
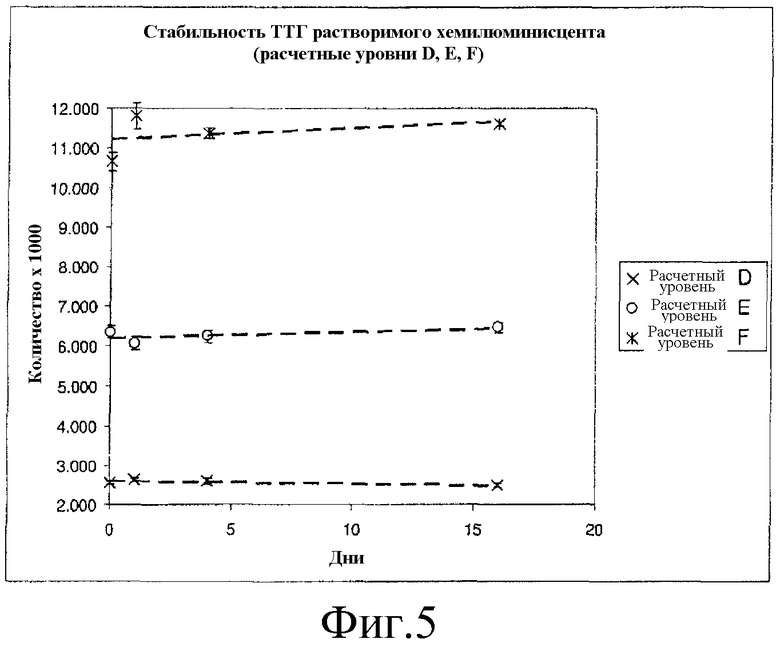
Изобретение относится к медицине и описывает хемилюминесцентный реактив для определения присутствия и/или количества анализируемого вещества в образце с предполагаемым содержанием анализируемого вещества, при этом реактив является недисперсным и растворимым в водной среде и содержит партнера по связыванию для анализируемого вещества и хемилюминесцентную композицию, содержащую олефиновое соединение и хелат металла, где олефиновое соединение является соединением, которое способно реагировать с синглетным кислородом присоединением 2+2 с образованием диоксетана или которое способно реагировать с синглетным кислородом с циклоприсоединением 4+2 с диенами, и где металл или хелат металла представляет собой редкоземельный металл или металл Группы VIII, и где металл координирован с двумя или более атомами той же молекулы или хелирующего агента, где два или более атомов выбраны из группы, состоящей из кислорода, азота и серы. 2 н. и 19 з.п. ф-лы, 5 ил., 11 пр.
1. Хемилюминесцентный реактив для определения присутствия и/или количества анализируемого вещества в образце с предполагаемым содержанием анализируемого вещества, при этом реактив является недисперсным и растворимым в водной среде и содержит партнера по связыванию для анализируемого вещества и хемилюминесцентную композицию, содержащую олефиновое соединение и хелат металла, где олефиновое соединение является соединением, которое способно реагировать с синглетным кислородом присоединением 2+2 с образованием диоксетана или которое способно реагировать с синглетным кислородом с циклоприсоединением 4+2 с диенами, и где металл или хелат металла представляет собой редкоземельный металл или металл Группы VIII, и где металл координирован с двумя или более атомами той же молекулы или хелирующего агента, где два или более атомов выбраны из группы, состоящей из кислорода, азота и серы.
2. Хемилюминесцентный реактив по п. 1, в котором партнер по связыванию для анализируемого вещества ковалентно связан с хемилюминесцентной композицией посредством связи или связывающей группы.
3. Хемилюминесцентный реактив по п. 2, в котором партнер по связыванию для анализируемого вещества ковалентно связан с хемилюминесцентной композицией посредством связывающей группы и в котором связывающая группа содержит гидрофильную макромолекулу.
4. Хемилюминесцентный реактив по п. 3, в котором олефиновое соединение и хелат металла связаны с той же молекулой связывающей группы, с которой ковалентно связан партнер по связыванию для анализируемого вещества.
5. Хемилюминесцентный реактив по п. 3, в котором соединены олефиновое соединение и хелат металла для разделения молекул связывающей группы, с которой ковалентно связан партнер по связыванию для анализируемого вещества, и в котором связывающая группа может быть одинаковой или разной.
6. Хемилюминесцентный реактив по п. 3, в котором гидрофильную макромолекулу выбирают из группы, состоящей из полипептидов, дендримеров, поликарбоксилатов, полиаминов, полисульфгидрилов и полиэтиленгликолей.
7. Хемилюминесцентный реактив по п. 1, в котором партнер по связыванию для анализируемого вещества нековалентно связан с хемилюминесцентной композицией с помощью пары специфичного связывания, в котором один элемент пары специфичного связывания связан с партнером по связыванию для анализируемого вещества, и другой элемент пары специфичного связывания связан с хемилюминесцентной композицией посредством связи или связывающей группы.
8. Хемилюминесцентный реактив по п. 7, в котором партнер по связыванию для анализируемого вещества нековалентно связан с хемилюминесцентной композицией посредством пары специфичного связывания, в которой один элемент пары специфичного связывания связан с партнером по связыванию для анализируемого вещества и другой элемент пары специфичного связывания связан с хемилюминесцентной композицией с помощью связывающей группы, при этом связывающая группа является белком.
9. Хемилюминесцентный реактив по п. 8, в котором олефиновое соединение и хелат металла связаны с той же молекулой связывающей группы, с которой нековалентно связан партнер по связыванию для анализируемого вещества.
10. Хемилюминесцентный реактив по п. 8, в котором соединены олефиновое соединение и хелат металла для разделения молекул связывающей группы, с которой нековалентно связан партнер по связыванию для анализируемого вещества, и в котором связывающая группа может быть одинаковой или разной.
11. Хемилюминесцентный реактив по п. 3, в котором гидрофильная макромолекула является белком.
12. Хемилюминесцентный реактив по п. 7, в котором пару специфичного связывания выбирают из группы, состоящей из (i) малой молекулы и партнера по связыванию для малой молекулы и (ii) большой молекулы и партнера по связыванию для большой молекулы.
13. Хемилюминесцентный реактив по п. 1, в котором металл из хелата металла является редкоземельным металлом, выбранным из группы, состоящей из европия, тербия, диспрозия и самария.
14. Хемилюминесцентный реактив по п. 1, в котором металл выбирают из группы, состоящей из европия, тербия, диспрозия, осмия, самария и рутения.
15. Хемилюминесцентный реактив по п. 1, в котором хелат металла содержит хелирующий агент, выбираемый из группы, состоящей из NHA, ВННТ, ВННСТ, DPP, ТТА, NPPTA, NTA, ТОРО, ТРРО, BFTA, 2,2-диметил-4-перфторбутиоил-3-бутанона (fod), 2,2′-дипиридила (bpy), бипиридилкарбоновой кислоты, аза-краун эфиров, аза криптандов и триоктилфосфиноксида.
16. Хемилюминесцентный реактив по п. 1, в котором олефиновое соединение выбирают из группы, состоящей из тиоксенов, диоксенов, энольных эфиров, энаминов, 9-алкилиденксантанов, 9-алкилиден-N-алкилакриданов, арилвиниловых эфиров, арилимидазолов и люцигенина.
17. Хемилюминесцентный реактив по п. 1, в котором металлом является европий, хелирующим агентом является ВННСТ и олефиновое соединение представляет собой карбоксильное производное тиоксена.
18. Способ определения присутствия и/или количества анализируемого вещества в образце с предполагаемым содержанием анализируемого вещества, при этом указанный способ содержит:
(a) наличие в водной среде комбинации из:
(i) образца,
(ii) хемилюминесцентного реактива, при этом реактив является недисперсным и растворимым в водной среде и содержит партнера по связыванию для анализируемого вещества, связанного с хемилюминесцентной композицией, которая содержит хелат металла и олефиновое соединение, и
(iii) сенсибилизирующий реактив, способный генерировать синглетный кислород,
(b) воздействие на комбинацию условий для связывания анализируемого вещества с партнером по связыванию для анализируемого вещества, и
(c) активацию сенсибилизатора и обнаружение количества люминесценции, генерируемой хемилюминесцентной композицией, при этом количество люминесценции связано с количеством анализируемого вещества в образце.
19. Способ по п. 18, в котором партнер по связыванию для анализируемого вещества ковалентно связан с хемилюминесцентной композицией посредством связывающей группы и в котором связывающая группа содержит гидрофильную макромолекулу.
20. Способ по п. 18, в котором партнер по связыванию для анализируемого вещества нековалентно связан с хемилюминесцентной композицией с помощью пары специфичного связывания, в которой один элемент пары специфичного связывания связан с партнером по связыванию для анализируемого вещества и другой элемент пары специфичного связывания связан с хемилюминесцентной композицией посредством связывающей группы, при этом связывающая группа содержит гидрофильную макромолекулу.
21. Способ по п. 18, в котором партнер по связыванию для анализируемого вещества связан с сенсибилизирующим реактивом и сенсибилизирующий реактив содержит частицу.
| US 6406667 B1, 18.01.2002 | |||
| US 3817837 A, 18.06.1974 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ОДНОВРЕМЕННОГО ОПРЕДЕЛЕНИЯ НЕСКОЛЬКИХ АНАЛИТОВ | 2002 |
|
RU2213974C1 |
Авторы
Даты
2015-08-10—Публикация
2010-02-25—Подача