Перекрестная ссылка на родственные заявки
[0001] По данной заявке испрашивают приоритет предварительной заявки США №62/245,265, поданной 22 октября 2015 года, которая озаглавлена «Methods, Kits and Apparatus for Transducing a Population of Cells», предварительной заявки США №62/305,989, поданной 09 марта 2016 года, которая озаглавлена «Methods, Kits and Apparatus for Transducing a Population of Cells», и предварительной заявки США №62/369,020, поданной 29 июля 2016 года, которая озаглавлена «Methods and Agents for Promoting Transduction», содержание каждой из которых включено по ссылке в полном объеме.
Включение списка последовательностей по ссылке
[0002] Настоящая заявка подана со списком последовательностей в электронном формате. Список последовательностей предоставлен в виде файла, озаглавленного Списки последовательностей.txt, который создан 25 апреля 2018 года и имеет размер 40734 байта. Информация в электронном формате о списке последовательностей включена по ссылке в полном объеме.
Область изобретения
[0003] Настоящее раскрытие относится в некоторых аспектах к трансдукции композиции клеток, такой как популяция лимфоцитов. Способы включают использование реактивов, таких как олигомерные белковые реактивы, которые содействуют трансдукции и которые также в некоторых случаях могут содержать связывающие средства, обратимо связанные с ними, где такое связывание в целом является обратимым посредством добавления определенного вещества. В некоторых аспектах раскрытие предусматривает способы и реактивы для трансдукции популяций клеток, которые включают связывание средств с молекулой на поверхности клеток, тем самым предоставляя инкубируемую композицию, содержащую трансдуцированные клетки. В некоторых случаях реактивы представляют собой реактивы мультимеризации и одно или более средств мультимеризуют посредством обратимого связывания с реактивом. В некоторых аспектах мультимеризованное средство может обеспечивать трансдукцию популяции клеток и затем такие средства можно удалять посредством разрушения обратимой связи. В некоторых вариантах осуществления предоставленные способы можно использовать для трансдукции клеток и, кроме того, в некоторых случаях, для обогащения, активации, стимуляции и/или размножения трансдуцированных клеток. Также предусмотрены композиции, устройство и способы для их использования.
Предпосылки
[0004] Доступны различные стратегии для трансдукции популяций T-клеток in vitro, в том числе для трансдукции антиген-специфических T-клеток in vitro для использования в адоптивной клеточной иммунотерапии или терапии злокачественных опухолей. Показано, что в некоторых аспектах инфузии при терапии T-клетками, такими как те, которые сконструированы или трансдуцированы с использованием рекомбинантного рецептора, например, химерного антигенного рецептора, обладают противоопухолевой реактивностью у опухоленесущего организма-хозяина или при использовании для лечения вирусных инфекций. Необходимы усовершенствованные стратегии трансдукции популяций клеток in vitro, в том числе для исследовательских, диагностических и терапевтических целей. Предоставлены реактивы, способы, промышленные изделия и наборы, которые отвечают таким потребностям.
Краткое изложение
[0005] В настоящем описании в некоторых вариантах осуществления предусмотрен способ трансдукции клеток, в том числе инкубация множества клеток, содержащего клетки-мишени, с олигомерным белковым реактивом; и вирусной частицей, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0006] В некоторых из любых таких вариантов осуществления олигомерный реактив содержит множество полипептидных мономерных единиц, в котором каждая единица составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину и/или имеет молекулярную массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа; и/или олигомерный реактив имеет молекулярную массу по меньшей мере или приблизительно 100 и/или между или приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа или приблизительно от 1500 кДа приблизительно до 2000 кДа.
[0007] В некоторых из любых таких вариантов осуществления, реактив содержит множество мультимерных субъединиц единиц, которые индивидуально содержат мономерные единицы. В некоторых аспектах мультимерные субъединицы являются тетрамерными.
[0008] В некоторых из любых таких вариантов осуществления олигомерный белковый реактив содержит стрептавидин, авидин, аналог или мутеин стрептавидина или аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных.
[0009] Также в настоящем описании в некоторых вариантах осуществления предусмотрен способ трансдукции клеток, в том числе инкубация множества клеток, содержащих клетки-мишени, с белковым реактивом, содержащим стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных; и вирусной частицей, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0010] В некоторых из любых таких вариантов осуществления инкубация включает смешивание клетки с реактивом и с вирусной частицей, одновременно или последовательно, в любом порядке. В некоторых вариантах осуществления, во время по меньшей мере части инкубации, реактив и вирусная частица находятся в присутствии или в контакте с клеткой одновременно.
[0011] Также в настоящем описании в некоторых вариантах осуществления предусмотрен способ трансдукции клеток, способ включает приведение вирусной частицы в контакт с олигомерным белковым реактивом, тем самым создавая смесь, содержащую вирусные частицы, ассоциированные с реактивом; и инкубацию смеси с множеством клеток, содержащим клетки-мишени, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0012] В некоторых вариантах осуществления способ включает приведение вирусной частицы в контакт с белковым реактивом, содержащим стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных, тем самым создавая смесь, содержащую вирусные частицы, ассоциированные с реактивом; и инкубацию смеси с множеством клеток, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0013] В некоторых из любых таких вариантов осуществления, реактив имеет суммарный положительный заряд или общий положительный заряд. В некоторых случаях реактив является голым.
[0014] В некоторых из любых таких вариантов осуществления реактив не содержит и/или не конъюгирован или обратимо связан со связывающим средством; реактив не содержит и/или не конъюгирован или связан с молекулой со связывающим доменом, специфичным к маркеру клеточной поверхности; реактив не содержит и/или не конъюгирован или связан с компонентом внеклеточного матрикса, молекулой адгезии, интегрином, лектином, интегрин-связывающим белком, хемокинами, цитокином, фактором роста, связывающей внеклеточный матрикс молекулой, ECM компонентом, вирусным белком, рецептором клеточной поверхности, способствующим проникновению вируса, гепарином, гепараном, гликанами; и/или реактив не содержит гепарин-связывающий домен и/или не содержит интегрин-связывающий домен и/или не содержит VLA4-связывающий домен и/или не содержит VLA5-связывающий домен; и/или реактив не содержит и/или не конъюгирован или сопряжен или связан с вирусным связывающим средством или средством отбора клеток.
[0015] В некоторых из любых таких вариантов осуществления реактив дополнительно содержит и/или обратимо связан с множеством из одного или нескольких связывающих средств, каждое из которых способно к специфическому связыванию с молекулой на поверхности вирусной частицы и/или поверхности клетки-мишени.
[0016] В настоящем описании в некоторых вариантах осуществления предусмотрены способы трансдукции клеток, которые включают инкубацию множества клеток-мишеней с олигомерным белковым реактивом вирусной частицей, где: олигомерный белковый реактив включает множество полипептидных мономерных единиц, в котором каждая единица составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину и/или имеет молекулярную массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа; и/или олигомерный белковый реактив имеет молекулярную массу или имеет усредненную молекулярную массу по меньшей мере или приблизительно 100 кДа, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0017] В некоторых вариантах осуществления любого из способов, предусмотренных в настоящем описании, олигомерный белковый реактив включает множество полипептидных единиц, индивидуально включающих стрептавидин, авидин, биотин-связывающий полипептид, Strep-tag связывающий пептид, мутеин стрептавидина, аналог стрептавидина, мутеин авидина, аналог авидина и/или биологически активный фрагмент любого из вышеуказанных.
[0018] В некоторых вариантах осуществления любого из способов, предусмотренных в настоящем описании, олигомерный белковый реактив включает мультимерные субъединицы, каждая индивидуально содержит две или больше полипептидных единиц, или их множество.
[0019] В настоящем описании в некоторых вариантах осуществления предусмотрены способы трансдукции клеток, включающие инкубацию множества клеток-мишеней с (1) белковым реактивом, включающим стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных; и (2) вирусной частицей, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0020] В некоторых вариантах осуществления любого из способов, предусмотренных в настоящем описании, (i) инкубация включает смешивание клеток-мишеней с реактивом и/или смешивание клеток-мишеней с вирусной частицей, последовательно, в любом порядке, необязательно где смешивание в (a) и смешивание в (b) осуществляют в пределах периода не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа и/или смешивание в (a) осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов помимо смешивания в (b); (ii) инкубация включает смешивание клеток-мишеней, реактива и вирусной частицы, указанное смешивание осуществляют одновременно или по существу одновременно; (iii) инкубация включает смешивание композиции, которая содержит клетки-мишени и вирусные частицы, и не содержит реактив, в которой необязательно: не больше чем 5%, 10%, 20%, 30% или 40% клеток-мишеней в композиции, содержащей клетки-мишени и реактив, представляют собой активированные клетки, экспрессируют маркер поверхности, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включает внутриклеточную экспрессию цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α, и/или способны к пролиферации; и/или смешивание осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов после смешивания клеток-мишеней и вирусных частиц в композиции; (iv) инкубация включает смешивание композиции, которая содержит клетки-мишени и реактив и не содержит вирусную частицу, с вирусной частице, необязательно в где: не больше чем 5%, 10%, 20%, 30% или 40% клеток-мишеней в композиции, содержащей клетки-мишени и реактив, представляют собой активированные клетки, экспрессируют маркер поверхности, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включает внутриклеточную экспрессию цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α, и/или способны к пролиферации; и/или смешивание осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов после смешивания клеток-мишеней и вирусных частиц в композиции; и/или (v) инкубация включает смешивание композиции, содержащей вирусные частицы и реактив, с композицией, которая содержит клетки-мишени и не вирусную частицу и/или не реактив, необязательно где: не больше чем 5%, 10%, 20%, 30% или 40% клеток-мишеней в композиции, содержащей клетки-мишени и реактив, представляют собой активированные клетки экспрессируют маркер поверхности, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включает внутриклеточную экспрессию цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α и/или способны к пролиферации.
[0021] В некоторых вариантах осуществления олигомерный белковый реактив включает множество отдельных единиц, включая или более из биотин-связывающего полипептида, стрептавидина, авидина, аналога стрептавидина, мутеина стрептавидина, аналога авидина, мутеина авидина и биологически активного фрагмента.
[0022] В некоторых вариантах осуществления реактив включает множество мультимерных субъединиц единиц, каждая из которых индивидуально содержит две или больше мономерных единиц. В некоторых вариантах осуществления мультимерные субъединицы являются тетрамерными и/или каждая индивидуально содержит четыре мономерные единицы.
[0023] В некоторых вариантах осуществления инкубация включает смешивание клетки с реактивом и с вирусной частицей, одновременно или последовательно, в любом порядке. В некоторых вариантах осуществления во время по меньшей мере части инкубации, реактив и вирусная частица находятся в присутствии или в контакте с клеткой одновременно.
[0024] В настоящем описании в некоторых вариантах осуществления предусмотрены способы трансдукции клеток, которые включают: (a) приведение вирусной частицы в контакт с олигомерным белковым реактивом, тем самым создавая композицию, содержащую вирусные частицы и реактив, в которой вирусные частицы необязательно ассоциированы с реактивом; и (b) инкубацию композиции в (a) с множеством клеток, содержащим клетки-мишени, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0025] В настоящем описании в некоторых вариантах осуществления предусмотрены способы трансдукции клеток, которые включают смешивание композиции, содержащей вирусные частицы и олигомерный белковый реактив, с множеством клеток, содержащим клетки-мишени, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0026] В настоящем описании в некоторых вариантах осуществления предусмотрены способы трансдукции клеток, которые включают (a) приведение вирусной частицы в контакт с белковым реактивом, включающим стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных, тем самым создавая композицию, содержащую вирусные частицы и реактив, в котором вирусные частицы необязательно ассоциированы с реактивом; и (b) инкубацию композиции в (a) с множеством клеток, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0027] В настоящем описании в некоторых вариантах осуществления предусмотрены способы трансдукции клеток, которые включают смешивание композиции, содержащей вирусные частицы и белковый реактив, с множеством клеток, содержащим клетки-мишени, где: белковый реактив включает стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных; и способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей. В некоторых вариантах осуществления реактив и/или каждая из мономерных единиц и/или каждая из мультимерных единиц имеет суммарный положительный заряд или общий положительный заряд.
[0028] В некоторых вариантах осуществления реактив не содержит и/или не конъюгирован или обратимо связан со связывающим средством, содержащим антитело или его фрагмент, или не содержит связывающее средство, содержащее молекулу клеточной поверхности человека или ее связывающий фрагмент; реактив не содержит и/или не конъюгирован или связан с молекулой со связывающим доменом, специфичным к маркеру клеточной поверхности человека, необязательно маркеру T-клетки; реактив не содержит и/или не конъюгирован или связан с компонентом внеклеточного матрикса, молекулой адгезии, интегрином, лектином, интегрин-связывающим белком, хемокинами, цитокином, фактором роста, связывающей внеклеточный матрикс молекулой, ECM компонентом, вирусным белком, рецептором клеточной поверхности, способствующим проникновению вируса, гепарином, гепараном, гликанами; и/или реактив не содержит гепарин-связывающий домен и/или не содержит интегрин-связывающий домен и/или не содержит VLA4-связывающий домен и/или не содержит VLA5-связывающий домен.
[0029] В некоторых вариантах осуществления реактив также содержит и/или обратимо связан с множеством из одного или нескольких связывающих средств, каждое из которых способно к специфическому связыванию с молекулой на поверхности вирусной частицы и/или поверхности клетки-мишени.
[0030] В настоящем описании в некоторых вариантах осуществления предусмотрен способ трансдукции клеток, включающий инкубацию множества клеток, содержащего клетки-мишени, с 1) олигомерным белковым реактивом, содержащим множество сайтов связывания, способных к обратимому связыванию со связывающим средством, где один или более сайтов связывания обратимо связывают со связывающим средством; и 2) вирусной частицей, где по меньшей мере часть инкубации в 1) происходит одновременно с 2) и где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей. В некоторых случаях реактив содержит множество сайтов связывания, способных к обратимому связыванию с каждым из связывающих средств, множество сайтов связывания включает один или более сайтов связывания, Z, которые способны к связыванию с партнером связывания, C; и связывающее средство дополнительно содержит один или более партнеров связывания, C.
[0031] В некоторых вариантах осуществления связывающее средство представляет собой или содержит рецептор-связывающее средство. В некоторых случаях реактив дополнительно содержит дополнительное связывающее средство, которое представляет собой средство отбора, которое специфически связывается с молекулой, экспрессируемой на поверхности клетки-мишени. В некоторых аспектах, связывающее средство представляет собой средство отбора, которое специфически связывается с молекулой, экспрессируемой на поверхности одной или нескольких клеток-мишеней. В некоторых случаях, связывающее средство представляет собой вирусное связывающее средство, которое специфически связывается с молекулой на поверхности вирусной частицы.
[0032] В некоторых вариантах осуществления предусмотрен способ трансдукции клеток, способ включает приведение в контакт композиции, содержащей множество клеток, содержащее клетки-мишени, и связывающего средства, которое представляет собой средство отбора, которое способно специфически связываться с молекулой, экспрессируемой одной или несколькими из клеток-мишеней, и обратимо связано с реактивом, содержащим множество сайтов связывания, способных к обратимому связыванию со средством отбора; инкубацию по меньшей мере множества клеток в присутствии одной или нескольких вирусных частиц, где приведение в контакт и инкубацию осуществляют одновременно или последовательно, в любом порядке, где способом создают выходную композицию, содержащую клетки, трансдуцированные вирусной частицей.
[0033] В некоторых случаях, вирусные векторные частицы обратимо связывают с реактивом, указанный реактив содержит множество сайтов связывания, способных к обратимому связыванию, непосредственно или опосредованно, с молекулой на поверхности вирусной частицы. В некоторых аспектах вирусные частицы обратимо связывают с реактивом через связывающее вирусную частицу средство, которое специфически связывается с молекулой на поверхности вирусной частицы, указанный реактив содержит множество сайтов связывания, способных к обратимому связыванию связывающего вирусную частицу средства.
[0034] В некоторых вариантах осуществления реактив содержит множество сайтов связывания, Z1, способных к обратимому связыванию со средством отбора, и/или реактив содержит множество сайтов связывания, Z2, способных к обратимому связыванию с одной или несколькими вирусными частицами через вирусное связывающее средство.
[0035] В некоторых вариантах осуществления предусмотрен способ трансдукции клеток, способ включает приведение в контакт композиции, содержащей одну или более вирусных частиц, и связывающего средства, которое является вирусным связывающим средством, которое способно к специфическому связыванию с молекулой на поверхности вирусной частицы, и которое обратимо связывают с реактивом, содержащим множество сайтов связывания, способных к обратимому связыванию с вирусным связывающим средством; и инкубацию по меньшей мере множества клеток, содержащих клетки-мишени, в присутствии одной или нескольких вирусных частиц, где приведение в контакт и инкубацию в осуществляют одновременно или последовательно, в любом порядке, где способом создают выходную композицию, содержащую множество клеток, трансдуцированных вирусной частицей.
[0036] В некоторых вариантах осуществления любого из способов, предусмотренных в настоящем описании, приведение в контакт в (1) и инкубацию в (2) осуществляют в пределах периода не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа и/или смешивание в (a) осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов помимо инкубации в (b).
[0037] В некоторых из любых таких вариантов осуществления, связывающее средство представляет собой или содержит антитело, фрагмент антитела, одновалентный фрагмент антитела, белковую связывающую молекулу с антителоподобными связывающими свойствами, молекулу, содержащую домены Ig, цитокин, хемокин, аптамер и молекулу MHC или их связывающие фрагменты. В некоторых случаях фрагмент антитела содержит фрагмент, выбранный из группы, состоящей из Fab фрагмента, Fv-фрагмента, (Fab')2-фрагмента и двухвалентного одноцепочечного Fv (scFv) фрагмента.
[0038] В некоторых из любых таких вариантов осуществления, реактив представляет собой или содержит олигомерный белковый реактив. В некоторых случаях, олигомерный белковый реактив содержит стрептавидин, авидин, аналог или мутеин стрептавидина или аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных. В некоторых из любых таких вариантов осуществления реактив является растворимым.
[0039] В некоторых из любых таких вариантов осуществления, реактив не является и не связан с или ассоциирован с твердым носителем, стационарной фазой, бусиной, микрочастицей, магнитной частицей и/или матрицей во время указанной инкубации; и/или реактив является гибким, не содержит металлическую или магнитную сердцевину, полностью или в первую очередь состоит из органического мультимера, не является сферическим, по существу не является сферическим или однородным по геометрической форме и/или не является жестким.
[0040] В некоторых из любых таких вариантов осуществления, реактив иммобилизуют, или он способен к иммобилизации, на основе, непосредственно или опосредованно; и по меньшей мере часть инкубации происходит на основе. В некоторых аспектах, реактив иммобилизуют, или он способен к иммобилизации, на основе, непосредственно или опосредованно, в соответствии с чем средство отбора иммобилизуют, или оно способно к иммобилизации, на основе; и, при дальнейшем комбинировании основы, в соответствии с чем одну или более клеток-мишеней из по меньшей мере множества иммобилизуют на основе через средство отбора во время по меньшей мере части инкубации.
[0041] Также в настоящем описании в некоторых вариантах осуществления предусмотрен способ трансдукции клеток, способ включает приведение в контакт композиции, содержащей множество клеток, содержащих клетки-мишени, средства отбора, которое способно специфически связываться с селективным маркером, экспрессируемым одной или несколькими из клеток-мишеней, и которое иммобилизуют, или которое способно к иммобилизации, на основе, непосредственно или опосредованно; и основы, в соответствии с чем одну или более клеток-мишеней из по меньшей мере множества иммобилизуют на основе через средство отбора; и инкубацию по меньшей мере множества клеток в присутствии композиции, содержащей множество вирусных частиц, в которой одна или более из множества вирусных частиц способны к иммобилизации на основе, непосредственно или опосредованно. В некоторых случаях, приведение в контакт и инкубацию осуществляют одновременно или последовательно, в любом порядке; одну или более клеток-мишеней и одну или более вирусных частиц иммобилизуют на основе во время по меньшей мере части инкубации; и способом создают выходную композицию, содержащую множество клеток, трансдуцированных вирусной частицей.
[0042] В некоторых из любых таких вариантов осуществления, основа представляет собой или содержит стационарную фазу; и/или основа представляет собой или содержит твердый носитель. В некоторых аспектах, в которых реактив иммобилизуют или он способен к иммобилизации на основе, указанный реактив содержит множество сайтов связывания, Z1, способных к обратимому связыванию со средством отбора, и множество сайтов связывания, Z2, способных к обратимому связыванию с одной или несколькими вирусными частицами через вирусное связывающее средство. В некоторых случаях, стадия приведения в контакт дополнительно включает объединение реактива, при котором реактив иммобилизуют на основе. В некоторых аспектах, реактив и основу объединяют перед комбинированием с ними средства отбора и/или композиции, содержащей множество клеток.
[0043] В некоторых из любых таких вариантов осуществления, средство отбора представляет собой первое средство отбора, молекула представляет собой первую молекулу и инкубацию дополнительно осуществляют в присутствии второго средства отбора, которое способно к специфическому связыванию с второй молекулой, экспрессируемой на поверхности одной или нескольких клеток-мишеней. В некоторых случаях, второе средство отбора обратимо связывают с реактивом или со вторым реактивом, реактив или второй реактив содержит множество сайтов связывания, способных к обратимому связыванию со вторым средством отбора, в соответствии с чем второе средство отбора обратимо связывают с ним.
[0044] В некоторых из любых таких вариантов осуществления, клетки-мишени содержат клетки крови; клетки-мишени содержат лейкоциты; клетки-мишени содержат лимфоциты; клетки-мишени содержат B-клетки; клетки-мишени содержат популяцию B-клеток; клетки-мишени содержат T-клетки; клетки-мишени содержат популяцию T-клеток; и/или клетки-мишени содержат естественные киллеры (NK); клетки-мишени содержат дендритные клетки; клетки-мишени содержат макрофаги.
[0045] В некоторых случаях, клетки-мишени содержат антиген-специфические T-клетки или их популяцию, T-хелперные клетки или их популяцию, цитотоксические T-клетки или их популяцию, T-клетки памяти или их популяцию, регуляторные T-клетки или их популяцию или NK клетки или их популяцию, антиген-специфические B-клетки или их популяцию, B-клетки памяти или их популяцию или регуляторные B-клетки или их популяцию.
[0046] В некоторых из любых таких вариантов осуществления, клетки-мишени содержат T-клетки. В некоторых случаях, T-клетки содержат CD4+ и/или CD8+ T-клетки и/или их субпопуляцию или подмножество и/или они обогащены популяцией любых из вышеуказанных.
[0047] В некоторых из любых таких вариантов осуществления, молекула представляет собой корецептор B-клетки или T-клетки; молекула представляет собой или содержит элемент комплекса антигенного рецептора T-клетки или B-клетки; молекула представляет собой или содержит цепь CD3; молекула представляет собой или содержит ζ-цепь CD3; молекула представляет собой или содержит CD8; молекула представляет собой или содержит CD4. В некоторых вариантах осуществления молекула, специфически связываемая средством отбора, представляет собой или содержит CD25, CD28, CD62L, CCR7, CD27, CD127, CD3, CD4, CD8, CD45RA и/или CD45RO.
[0048] В некоторых из любых таких вариантов осуществления специфическое связывание между средством отбора и молекулой не индуцирует сигнал или не индуцирует стимуляторный или активирующий или пролиферативный сигнал в клетках-мишенях. В некоторых вариантах осуществления во время по меньшей мере части инкубации, средство отбора связывается с молекулой, экспрессируемой на поверхности клетки-мишени, тем самым облегчая ассоциирование между реактивом и клеткой-мишенью. В некоторых случаях, ассоциирование между реактивом и клеткой-мишенью усиливает трансдукцию клетки-мишени по сравнению с трансдукцией не клетки-мишени, которая не экспрессирует молекулу или не связана специфически средством отбора.
[0049] В некоторых из любых таких вариантов осуществления, множество клеток содержит покоящиеся или наивные T-клетки. В некоторых из любых таких вариантов осуществления, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% T-клеток в множестве клеток не имеют на поверхности маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; и/или не имеют внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α; и/или способны к пролиферации. В некоторых вариантах осуществления не больше чем 10% T-клеток в множестве клеток содержат маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; и/или не имеют внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α; и/или способны к пролиферации.
[0050] В некоторых из любых таких вариантов осуществления, перед указанной инкубацией, способ не включает стимуляцию клеток из множества клеток в условиях, которые способствуют активации T-клеток.
[0051] В некоторых из любых таких вариантов осуществления множество клеток перед указанной инкубацией не подвергали стимуляции ex vivo, включая инкубацию приблизительно при 37°C и/или инкубацию в присутствии средства или средств, выбранных из группы, состоящей из средств, способных к активации, индукции сигнала через TCR комплекс в T-клетках, CD4+ T-клетках и/или CD8+ T-клетках; средства, способного к индукции пролиферации T-клеток, CD4+ T-клеток и/или CD8+ T-клеток; CD3-связывающих молекул; CD28-связывающих молекул. В некоторых вариантах осуществления множество клеток содержит активированные клетки.
[0052] В некоторых из любых таких вариантов осуществления, до или во время инкубации с реактивом, способ включает активацию клеток в присутствии стимулирующего средства в условиях, в соответствии с которыми одну или более клеток-мишеней стимулируют или активируют с помощью стимулирующего средства. В некоторых случаях клетки-мишени содержат T-клетки и указанные стимулирующие условия включают присутствие средства, способного к активации одного или нескольких внутриклеточных сигнальных доменов одного или нескольких компонентов TCR комплекса. В некоторых аспектах указанное средство содержит первичное средство, которое специфически связывается с элементом TCR комплекса, и вторичное средство, которое специфически связывается с костимулирующей молекулой T-клетки.
[0053] В некоторых примерах первичное средство специфически связывается с CD3; и/или костимулирующую молекулу выбирают из группы, состоящей из CD28, CD137 (4-1-BB), OX40 или ICOS. В некоторых аспектах указанные первичное и вторичное средства содержат антитела и/или присутствуют на поверхности твердого носителя.
[0054] В некоторых из любых таких вариантов осуществления способ дополнительно включает культивирование по меньшей мере множества клеток в присутствии рецептор-связывающего средства, которое специфически связывает рецептор, экспрессируемый на поверхности одной или нескольких клеток-мишеней, для того, чтобы доставлять стимулирующий сигнал, и обратимо связано с реактивом или вторым реактивом, реактив или второй реактив содержит множество сайтов связывания, каждый способен к обратимому связыванию с рецептор-связывающим средством, тем самым индуцируя или модулируя сигнал в клетках. В некоторых случаях указанное культивирование осуществляют и/или инициируют перед указанной инкубацией.
[0055] В некоторых вариантах осуществления реактив представляет собой второй реактив, где второй реактив не связывают с или ассоциируют с твердым носителем, стационарной фазой, бусиной, микрочастицей, магнитной частицей и/или матрицей во время указанной инкубации и/или второй реактив является гибким, не содержит металлическую или магнитную сердцевину, полностью или в первую очередь состоит из органического мультимера, не является сферическим, не является по существу сферическим или однородным по геометрической форме и/или не является жестким. В некоторых случаях реактив представляет собой второй реактив и второй реактив иммобилизуют на основе.
[0056] В некоторых вариантах осуществления стимулирующее средство содержит комплекс MHC I: пептид или его функциональную часть, комплекс MHC II : пептид или его функциональную часть и/или способно доставлять стимулирующий сигнал через комплекс TCR/CD3 в T-клетку, CD3-содержащий комплекс в T-клетку и/или ITAM-содержащую молекулу в T-клетку.
[0057] В некоторых из любых таких вариантов осуществления рецептор-связывающее средство специфически связывается с элементом комплекса TCR/CD3 или специфически связывается с CD3. В некоторых случаях, рецептор-связывающее средство представляет собой первое рецептор-связывающее средство и культивирование дополнительно осуществляют в присутствии второго рецептор-связывающего средства, указанное второе рецептор-связывающее средство представляет собой вспомогательное связывающее средство, способное к специфическому связыванию со вторым рецептором на поверхности одной или нескольких T-клеток, тем самым индуцируя второй сигнал в клетках для того, чтобы усиливать, ослаблять или модифицировать сигнал, доставленный через первый рецептор.
[0058] В некоторых примерах, второе рецептор-связывающее средство обратимо связывают с реактивом, вторым реактивом или третьим реактивом; и реактив, второй реактив или третий реактив содержит множество сайтов связывания, способных к обратимому связыванию со вторым рецептор-связывающим средством, в соответствии с чем второе рецептор-связывающее средство обратимо связывают с ним. В некоторых случаях второй рецептор представляет собой костимулирующую молекулу, вспомогательную молекулу, цитокиновый рецептор, хемокиновый рецептор, молекулу иммунной контрольной точки или представляет собой элемент семейства TNF или семейства рецепторов TNF.
[0059] В некоторых из любых таких вариантов осуществления первое и второе рецептор-связывающие средства связываются с молекулой, экспрессируемой на поверхности клетки, которая представляет собой или содержит CD3 и/или CD28, соответственно. В некоторых аспектах первое и второе рецептор-связывающее средство содержит антитело или фрагмент против CD3 и/или против CD28, соответственно.
[0060] В некоторых из любых таких вариантов осуществления, инкубацию и культивирование осуществляют в отдельных сосудах, которые соединяют функционально, необязательно с помощью трубки. В некоторых вариантах осуществления инкубацию и культивирование осуществляют в закрытой системе.
[0061] В некоторых вариантах осуществления способ включает извлечение клеток, обратимо связанных с и стимулированных рецептор-связывающим средством, которое может представлять собой первое и/или второе рецептор-связывающее средство, тем самым получая культивируемые клетки, где культивируемые клетки представляют собой или содержат множество клеток, содержащее клетки-мишени.
[0062] В некоторых из любых из таких вариантов осуществления, после указанного приведения в контакт, способ дополнительно включает отделение и/или удаление, от иммобилизованных клеток-мишеней, других клеток из множества клеток. В некоторых случаях отделение и/или удаление осуществляют посредством выполнения стадии промывания. В некоторых случаях указанное отделение и/или указанную стадию промывания осуществляют перед инициацией указанной инкубации.
[0063] В некоторых из любых таких вариантов осуществления указанную инкубацию осуществляют и/или инициируют перед указанным приведением в контакт; или указанную инкубацию осуществляют и/или инициируют после указанного приведения в контакт. В некоторых из любых таких вариантов осуществления указанное приведение в контакт осуществляют во время по меньшей мере части указанной инкубации.
[0064] В некоторых вариантах осуществления вирусное связывающее средство связывается с молекулой на поверхности вирусной частицы, которую выбирают из гликопротеина оболочки, варианта гликопротеина оболочки, химерного гликопротеина оболочки, белка вирусного капсида, варианта белка вирусного капсида, вирусного матриксного белка, варианта вирусного матриксного белка, синтетического фрагмента, пептида и метки. В некоторых случаях, гликопротеин оболочки выбирают из гликопротеина VSV (VSV-G), гликопротеина Sindbis, необязательно SIN, гликопротеина MMLV, гликопротеина HSV, гликопротеина MMTV, гликопротеина вируса кори, гликопротеина HTLV, гликопротеина SIV, гликопротеинов GALV, гликопротеина HIV, необязательно gp160, gp120 или gp41, и гликопротеина RSV, необязательно gp85 или gp37, или они представляют собой вариант, часть, достаточную для связывания с помощью связывающего вирусную частицу средства, или их химерную молекулу. В некоторых аспектах, вирусное связывающее средство связывается с молекулой на поверхности вирусной частицы, которая является не вирусной рекомбинантной молекулой, гетерологичной вирусу.
[0065] В некоторых вариантах осуществления молекула представляет собой синтетический фрагмент, пептид или метку, которые выбирают из глутатион-S-трансферазы (GST), хитин-связывающего белка (CBP), кальмодулин-связывающего пептида (CBP), FLAG-пептида, пептида гемагглютинина, VSV-G-метки, HSV-метки, эпитопа T7, мальтоза-связывающего белка (MBP), эпитопа HSV, эпитопа myc, V5-метки и стрептавидин-связывающего пептида. В некоторых случаях, молекула представляет собой стрептавидин-связывающий пептид. В некоторых аспектах, молекула представляет собой синтетический фрагмент, пептид или метку, и вирусную частицу конструируют для того, чтобы экспрессировать синтетический фрагмент, пептид или метку на ее поверхности.
[0066] В некоторых вариантах осуществления стрептавидин-связывающий пептид содержит последовательность аминокислот, приведенную в любой из SEQ ID №7, 8, 13, 14 и 15-19. В некоторых случаях, молекула представляет собой или содержит лиганд-связывающий домен. В некоторых примерах, молекула представляет собой или содержит антигенный рецептор. В некоторых случаях, антигенный рецептор представляет собой химерный антигенный рецептор (CAR). В некоторых аспектах вирусный связывающий антиген представляет собой антитело или антигенсвязывающий фрагмент, который специфически связывает внеклеточную область CAR. В некоторых случаях, внеклеточная область представляет собой антиген-связывающий домен или шарнирную область.
[0067] В некоторых из любых таких вариантов осуществления, связывающее вирусную частицу средство выбирают из протамина, POLYBRENE® и RETRONECTIN®. В некоторых вариантах осуществления вирусная частица содержит партнер связывания C1 или C2; и реактив содержит множество сайтов связывания, Z1 или Z2, способных к связыванию с партнером связывания, C1 или C2, для того, чтобы формировать обратимую связь между вирусной частицей и реактивом. В некоторых аспектах, вирусную частицу конструируют для того, чтобы экспрессировать синтетический фрагмент, пептид или метку на ее поверхности, где синтетический фрагмент, пептид или метка представляет собой или содержит партнер связывания C1 или C2. В некоторых случаях, пептид представляет собой стрептавидин-связывающий пептид. В некоторых примерах, стрептавидин-связывающий пептид содержит последовательность аминокислот, приведенную в любой из SEQ ID №7, 8, 13, 14 и 15-19.
[0068] В некоторых из любых таких вариантов осуществления, вирусная частица ассоциируется с или связывается с реактивом. В некоторых вариантах осуществления геном вирусного вектора содержит гетерологичную молекулу нуклеиновой кислоты, кодирующую рекомбинантный белок. В некоторых случаях, рекомбинантный белок представляет собой антигенный рецептор. В некоторых примерах, рекомбинантный белок представляет собой химерный антигенный рецептор.
[0069] В некоторых из любых таких вариантов осуществления, вирусная частица представляет собой ретровирусную векторную частицу. В некоторых аспектах, вирусная частица представляет собой лентивирусную векторную частицу. В некоторых случаях, лентивирусная векторная частица содержит геном, который извлекают из HIV-1. В некоторых из любых таких вариантов осуществления, ретровирусная векторная частица представляет собой гаммаретровирусную частицу. В некоторых примерах, гаммаретровирусная частица представляет собой частицу вируса мышиного лейкоза (MLV). В некоторых вариантах осуществления вирусная векторная частица является псевдотипированной с использованием гликопротеина вирусной оболочки. В некоторых случаях, гликопротеин вирусной оболочки представляет собой VSV-G.
[0070] В некоторых из любых таких вариантов осуществления, химерный антигенный рецептор (CAR) содержит внеклеточный домен распознавания антигена, который специфически связывается с антигеном-мишенью, и внутриклеточный сигнальный домен, содержащий ITAM. В некоторых случаях, внутриклеточный сигнальный домен содержит внутриклеточный домен ζ-цепи CD3 (CD3ζ). В некоторых аспектах, включен трансмембранный домен, соединяющий внеклеточный домен и внутриклеточный сигнальный домен. В некоторых случаях, трансмембранный домен содержит трансмембранную часть CD28. В некоторых вариантах осуществления внутриклеточный сигнальный домен дополнительно содержит внутриклеточный сигнальный домен костимулирующей молекулы T-клетки. В некоторых примерах, костимулирующую молекулу T-клетки выбирают из группы, состоящей из CD28 и 41BB.
[0071] В некоторых из любых таких вариантов осуществления, нуклеиновая кислота дополнительно содержит промотор, функционально связанный с нуклеиновой кислотой, кодирующей рекомбинантный антигенный рецептор.
[0072] В некоторых из любых таких вариантов осуществления, множество клеток содержит мононуклеарные клетки периферической крови (PBMC) или обогащенное или выделенное подмножество их клеток. В некоторых вариантах осуществления множество клеток содержит клетки крови, лейкоциты, лимфоциты, B-клетки, T-клетки или NK клетки.
[0073] В некоторых вариантах осуществления множество клеток содержит антиген-специфические T-клетки или их популяцию, T-хелперные клетки или их популяцию, цитотоксические T-клетки или их популяцию, T-клетки памяти или их популяцию, регуляторные T-клетки или их популяцию, NK клетки или их популяцию, антиген-специфические B-клетки или их популяцию, B-клетки памяти или их популяцию или регуляторные B-клетки или их популяцию. В некоторых вариантах осуществления множество клеток являются эмбриональными клетками. В некоторых вариантах осуществления множество клеток содержит T-клетки. В некоторых аспектах, T-клетки представляют собой не фракционированные T-клетки, обогащенные или выделенные CD3+ T-клетки, обогащенные или выделенные CD4+ T-клетки или обогащенные или выделенные CD8+ T-клетки.
[0074] В некоторых из любых таких вариантов осуществления, реактив является не токсичным для множества клеток или по меньшей мере приблизительно 75%, 85%, 90%, 95% или больше из множества клеток являются жизнеспособными после приведения в контакт или инкубации. В некоторых из любых таких вариантов осуществления, токсичность клеток после приведения в контакт и/или инкубации составляет меньше чем или меньше чем приблизительно 1,2-кратную, 1,5-кратную, 2,0-кратную, 3,0-кратную, 4,0-кратную, 5,0-кратную или 10-кратную токсичность клеток, когда приводят в контакт или инкубируют с поликатионным адъювантом трансдукции при тех же условиях; и/или жизнеспособность клеток после приведения в контакт и/или инкубации составляет больше чем или больше чем приблизительно 1,2 раза, 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раза или 10 раз по сравнению с жизнеспособностью клеток, когда приводят в контакт или инкубируют с поликатионным адъювантом трансдукции при тех же условиях. В некоторых случаях, поликатионный адъювант трансдукции представляет собой протамина сульфат, получаемый из фибронектина адъювант трансдукции или RetroNectin.
[0075] В некоторых из любых таких вариантов осуществления, реактив представляет собой или содержит стрептавидин, авидин, аналог или мутеин стрептавидина, который обратимо связывает биотин, аналог биотина или их биологически активный фрагмент; аналог или мутеин авидина или стрептавидина, который обратимо связывает стрептавидин-связывающий пептид; реактив, который содержит по меньшей мере две хелатирующие группы K, где по меньшей мере две хелатирующие группы способны к связыванию с ионом переходного металла; средство, способное к связыванию с олигогистидиновой аффинной меткой, средство, способное к связыванию с глутатион-S-трансферазой; кальмодулин или его аналог; средство, способное к связыванию с кальмодулин-связывающим пептидом (CBP); средство, способное к связыванию с FLAG-пептидом; средство, способное к связыванию с HA-меткой; средство, способное к связыванию с мальтоза-связывающим белком (MBP); средство, способное к связыванию с эпитопом HSV; средство, способное к связыванию с эпитопом myc; или средство, способное к связыванию с биотинилированным белком-переносчиком
[0076] В некоторых из любых таких вариантов осуществления, реактив представляет собой олигомер или полимер стрептавидина, авидина, аналога или мутеина стрептавидина, который обратимо связывает биотин или биологически активный фрагмент; аналог или мутеин стрептавидина или авидина, который обратимо связывает стрептавидин-связывающий пептид; реактив, который содержит по меньшей мере две хелатирующие группы K, где по меньшей мере две хелатирующие группы способны к связыванию с ионом переходного металла; средство, способное к связыванию с олигогистидиновой аффинной меткой; средство, способное к связыванию с глутатион-S-трансферазой; кальмодулин или его аналог; средство, способное к связыванию с кальмодулин-связывающим пептидом (CBP); средство, способное к связыванию с FLAG-пептидом; средство, способное к связыванию с HA-меткой; средство, способное к связыванию с мальтоза-связывающим белком (MBP); средство, способное к связыванию с эпитопом HSV; средство, способное к связыванию с эпитопом myc; или средство, способное к связыванию с биотинилированным белком-переносчиком.
[0077] В некоторых из любых таких вариантов осуществления, реактив содержит олигомер или полимер стрептавидина, авидина, аналога или мутеина стрептавидина или и аналога или мутеина авидина. В некоторых аспектах, отдельные молекулы олигомера или полимера сшивают с помощью полисахарида или бифункционального линкера. В некоторых из любых таких вариантов осуществления, реактив представляет собой или содержит аналог или мутеин стрептавидина или аналог или мутеин авидина, который обратимо связывается с биотином или биологически активным фрагментом; реактив представляет собой или содержит аналог или мутеин стрептавидина или аналог или мутеин авидина, который обратимо связывается с аналогом биотина или биологически активным фрагментом; и/или реактив представляет собой или содержит аналог или мутеин стрептавидина или аналог или мутеин авидина, который обратимо связывается со стрептавидин-связывающим пептидом.
[0078] В некоторых аспектах, стрептавидин-связывающий пептид выбирают из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID № 18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID № 19).
[0079] В некоторых из любых таких вариантов осуществления, реактив содержит SEQ ID №1 или SEQ ID №2 или последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательностей с SEQ ID №1 или SEQ ID №2. В некоторых из любых таких вариантов осуществления, реактив содержит аналог или мутеин стрептавидина, содержащий аминокислотную последовательность Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1; или аналог или мутеин стрептавидина содержит аминокислотную последовательность Va144-Thr45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
[0080] В некоторых из любых таких вариантов осуществления, аналог или мутеин стрептавидина содержит a) последовательность аминокислот, приведенную в любой из SEQ ID №№3-6, 27 и 28; b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с любыми из SEQ ID №№3-6, 27 и 28 и содержит аминокислотную последовательность, соответствующую Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47, и которая обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
[0081] В некоторых вариантах осуществления аналог или мутеин стрептавидина дополнительно содержит замену или замены аминокислот в положении, соответствующем 117, 120 и/или 121 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1. В некоторых примерах, замену или замены аминокислот выбирают из Glu117, Asp117, Arg117, Ser120, Ala120, Gly120, Trp121, Tyr121 или Phe121; или замену или замены аминокислот выбирают из одной или нескольких из Glu117, Gly120 или Tyr121; или замены аминокислот выбирают из Glu117, Gly120 или Tyr121.
[0082] В некоторых из любых таких вариантов осуществления, аналог или мутеин стрептавидина содержит a) последовательность аминокислот, приведенную в SEQ ID №27 или 28; b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с SEQ ID №№28 и содержит аминокислотную последовательность, соответствующую Va144, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121, и обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
[0083] В некоторых из любых таких вариантов осуществления, связывающее средство содержит партнер связывания C, который представляет собой стрептавидин-связывающий пептид. В некоторых примерах, партнер связывания C содержит стрептавидин-связывающий пептид, выбранный из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys ((SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19).
[0084] В некоторых из любых таких вариантов осуществления, способ включает разрушение обратимого связывания между одним или несколькими связывающими средствами и реактивом. В некоторых случаях, указанное разрушение включает введение в клетки вещества, способного к обращению связи между одним или несколькими связывающими средствами и реактивом. В некоторых аспектах, вещество представляет собой свободный партнер связывания и/или представляет собой конкурентное средство. В некоторых случаях, вещество в композиции не является вредоносным для T-клеток или для клеток-мишеней и/или где добавление указанного вещества не снижает процентную долю выживших клеток-мишеней до меньше чем 90%, 80%, 70%, 60%, или 50% по сравнению с инкубацией клеток-мишеней, соответственно, при сравнимых или тех же условиях, без вещества.
[0085] В некоторых из любых таких вариантов осуществления, реактив представляет собой или содержит стрептавидин, авидин, аналог или мутеин стрептавидина или и аналог или мутеин авидина или их биологически активные фрагменты; и вещество содержит стрептавидин-связывающий пептид, биотин или биологически активный фрагмент, необязательно D-биотин или аналог биотина или биологически активный фрагмент. В некоторых примерах, вещество представляет собой стрептавидин-связывающий пептид выбирают из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys ((SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19); и/или вещество представляет собой C1 или его аналог или представляет собой C2 или его аналог.
[0086] В некоторых из любых таких вариантов осуществления, способ включает, после указанного разрушения, извлечение клеток. В некоторых из любых таких вариантов осуществления, способ включает дополнительную инкубацию клеток. В некоторых случаях дополнительную инкубацию осуществляют в условиях для размножения клеток. В некоторых аспектах инкубацию и дополнительную инкубацию осуществляют в одном и том же сосуде; и/или дополнительную инкубацию осуществляют в присутствии вещества; и/или способ не включает удаление вещества, средства отбора, стимулирующего средства, связывающего вирусную частицу средства и/или реактива из инкубируемой композиции перед дополнительной инкубацией. В некоторых вариантах осуществления реактив не удаляют из композиции перед дополнительной инкубацией, не удаляют из композиции во время дополнительной инкубации или не удаляют из композиции в течение по меньшей мере половины дополнительной инкубации.
[0087] В некоторых вариантах осуществления дополнительную инкубацию осуществляют при или приблизительно при 37°C±2°C; и/или дополнительную инкубацию осуществляют в присутствии дополнительного средства, которое способно доставлять сигнал в T-клетки во время по меньшей мере части инкубации и/или дополнительной инкубации. В некоторых случаях, дополнительное средство способно усиливать или индуцировать пролиферацию T-клеток, CD4+ T-клеток и/или CD8+ T-клеток. В некоторых вариантах осуществления дополнительное средство представляет собой цитокин, выбранный из IL-2, IL-15 и IL-7. В некоторых аспектах, дополнительную инкубацию осуществляют в течение времени, которое составляет не больше чем 14 суток, не больше чем 12 суток, не больше чем 10 суток, не больше чем 8 суток или не больше чем 6 суток.
[0088] В некоторых из любых таких вариантов осуществления, основа содержит смолу или матрицу; основа содержит гель-фильтрационную матрицу; основа содержит хроматографическую матрицу; и/или основа содержит мембрану, основанную на целлюлозе или основанную на органическом полимере. В некоторых из любых таких вариантов осуществления, основа содержит микрочастицу, жесткую частицу, магнитную частицу или бусину. В некоторых случаях хроматографическая матрица присутствует в колонке и/или где хроматография представляет собой колоночную хроматографию или плоскостную хроматографию. В некоторых вариантах осуществления основа представляет собой стационарную фазу, присутствующую в контейнере во время целых или частичных указанной инкубации и/или указанного приведения в контакт.
[0089] В некоторых из любых таких вариантов осуществления, контейнер включает контейнер, выбранный из группы, состоящей из: колонок, контейнеров, подходящих для двунаправленного потока, наконечников пипетки, пробирок и колонок, подходящих для протекания жидкого образца.
[0090] В некоторых из любых таких вариантов осуществления, одна или более трансдуцированных клеток в выходной композиции экспрессируют рекомбинантный белок, кодируемый гетерологичной нуклеиновой кислотой, содержащейся в вирусных частицах. В некоторых из любых таких вариантов осуществления, трансдукцию клеток увеличивают в больше чем или приблизительно 1,2 раза, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз или больше по сравнению с трансдукцией с использованием вирусной частицы в отсутствие реактива.
[0091] В некоторых из любых таких вариантов осуществления, способ ведет к избирательной трансдукции клеток-мишеней, экспрессирующих молекулу, связанную средством отбора. В некоторых случаях, трансдукция выше по меньшей мере в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или больше в клетках-мишенях, которые экспрессируют молекулу, чем в не клетках-мишенях, которые не экспрессируют молекулу.
[0092] В некоторых из любых таких вариантов осуществления, по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток из множества клеток трансдуцируют указанным вирусным вектором с помощью способа; и/или по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток в указанной дополнительной инкубируемой композиции трансдуцируют указанным вирусным вектором; и/или по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток в указанной инкубируемой композиции и/или дополнительной инкубируемой композиции экспрессируют продукт гетерологичной нуклеиновой кислоты, содержащейся в указанном вирусном векторе.
[0093] В некоторых из любых таких вариантов осуществления, способ осуществляют ex vivo. В некоторых из любых таких вариантов осуществления, способ дополнительно включает извлечение или выделение трансдуцированных клеток, получаемых способом.
[0094] Также предусмотрена трансдуцированная клетка, полученная любым из способов, как раскрыто в настоящем описании. В некоторых случаях, также предусмотрена композиция, содержащая трансдуцированную клетку.
[0095] Также в настоящем описании предусмотрена композиция, содержащая связывающее вирусную векторную частицу средство, обратимо связанное с реактивом, где связывающее вирусную частицу средство способно к специфическому связыванию с молекулой на поверхности вирусной частицы; или вирусную векторную частицу, обратимо связанную с реактивом. В некоторых аспектах, реактив содержит множество сайтов связывания, каждый способен к обратимому связыванию со связывающим вирусную частицу средством. В некоторых случаях, композиция дополнительно содержит средство отбора, которое обратимо связывают с реактивом и которое способно к специфическому связыванию с молекулой на поверхности клетки-мишени. В некоторых примерах, реактив представляет собой или содержит стрептавидин, авидин, аналог или мутеин стрептавидина или аналог или мутеин авидина или биологически активный фрагмент любого из вышеуказанных, или представляет собой олигомер, содержащий множество единиц любого из вышеуказанных.
[0096] В некоторых из любых таких вариантов осуществления, вирусное связывающее средство связывается с молекулой на поверхности вирусной частицы, которая представляет собой не вирусную рекомбинантную молекулу, гетерологичную молекуле вируса; или связывается с молекулой на поверхности вирусной частицы, которую выбирают из гликопротеина оболочки, варианта гликопротеина оболочки, химерного гликопротеина оболочки, белка вирусного капсида, варианта белка вирусного капсида, вирусного матриксного белка, варианта вирусного матриксного белка, синтетического фрагмента, пептида и метки.
[0097] В некоторых случаях, гликопротеин оболочки выбирают из гликопротеина VSV (VSV-G), гликопротеина Sindbis, необязательно SIN, гликопротеина MMLV, гликопротеина HSV, гликопротеина MMTV, гликопротеина вируса кори, гликопротеина HTLV, гликопротеина SIV, гликопротеинов GALV, гликопротеина HIV, необязательно gp160, gp120 или gp41, и гликопротеина RSV, необязательно gp85 или gp37, или представляют собой вариант, часть, достаточную для связывания с помощью связывающего вирусную частицу средства, или их химерную молекулу; или молекула представляет собой синтетический фрагмент, пептид или метку, которые выбирают из глутатион-S-трансферазы (GST), хитин-связывающего белка (CBP), кальмодулин-связывающего пептида (CBP), FLAG-пептида, пептида гемагглютинина, VSV-G-метки, HSV-метки, эпитопа T7, мальтоза-связывающего белка (MBP), эпитопа HSV, эпитопа myc, V5-метки и стрептавидин-связывающего пептида
[0098] В некоторых примерах, не вирусная рекомбинантная молекула представляет собой или содержит лиганд-связывающий домен. В некоторых случаях, молекула представляет собой или содержит антигенный рецептор. В некоторых аспектах, антигенный рецептор представляет собой химерный антигенный рецептор (CAR). В некоторых случаях, вирусный связывающий антиген представляет собой антитело или антигенсвязывающий фрагмент, который специфически связывает внеклеточную область CAR. В некоторых вариантах осуществления внеклеточная область представляет собой антиген-связывающий домен или шарнирную область.
[0099] Также в настоящем описании предусмотрено промышленное изделие, содержащее композицию, как раскрыто в настоящем описании, и основу, где реактив иммобилизуют на основе. В некоторых случаях, основа представляет собой или содержит стационарную фазу и/или твердый носитель. В некоторых примерах, основа представляет собой стационарную фазу, которая представляет собой или содержит хроматографическую матрицу, где промышленное изделие дополнительно содержит контейнер, который содержит хроматографическую матрицу целиком или частично. В некоторых случаях, контейнер представляет собой колонку.
[0100] Также в настоящем описании предусмотрен устройство, содержащее один или более контейнеров, содержащих один или более компонентов, выбранных из одного или нескольких из олигомерного белкового реактива, множества клеток, содержащего клетки-мишени и вирусные частицы, и основы, содержащей по меньшей мере одну стационарную фазу, которая представляет собой или содержит хроматографическую матрицу. В некоторых случаях, по меньшей мере один олигомерный белковый реактив обратимо связывают со связывающим вирусную частицу средством, средством отбора и/или с рецептор-связывающим средством. В некоторых аспектах, один или более контейнеров находятся в соединении по текучей среде, в соответствии с чем один или более из компонентов проходят из одного контейнера в другой внутри устройства.
[0101] В некоторых из любых таких вариантов осуществления, промышленное изделие или устройство, описанные в настоящем описании, дополнительно содержат выпуск образца, соединенный по текучей среде с одной из по меньшей мере одной стационарной фазы для хроматографии. В некоторых вариантах осуществления промышленное изделие или устройство представляет собой функционально закрытую или стерильную систему.
[0102] В некоторых из любых таких вариантов осуществления, промышленное изделие или устройство дополнительно содержит одно или более средств управления, способных регулировать или корректировать pH, pO2, pCO2, и/или термостатическое средство управления для одного или нескольких контейнеров или их компонентов или по меньшей мере для одной из по меньшей мере одной стационарной фазы для хроматографии. В определенном случае, промышленное изделие или устройство дополнительно содержит соединение по текучей среде с контейнером, содержащим среду и/или одно или более питательных веществ и/или один или более источников углерода, в соответствии с чем соединение позволяет доставлять такую среду, питательные вещества и/или источники углерода к клеткам внутри устройства, необязательно когда указанные клетки иммобилизуют на стационарной фазе для хроматографии. В некоторых вариантах осуществления по меньшей мере один из компонентов и/или контейнер, содержащий его, можно отсоединять от устройства стерильным или асептическим образом.
[0103] Также в настоящем описании предусмотрена вирусная векторная частица, содержащая стрептавидин-связывающий пептид. В некоторых случаях, стрептавидин-связывающий пептид представляет собой слитый белок с гликопротеином оболочки. В некоторых примерах, гликопротеин оболочки представляет собой VSV-G.
[0104] В некоторых из любых таких вариантов осуществления, вирусный вектор представляет собой ретровирусный вектор, необязательно лентивирусный вектор. В некоторых аспектах, стрептавидин-связывающий пептид выбран из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19). В некоторых случаях, вирусная векторная частица содержит геном, кодирующий рекомбинантный антигенный рецептор, необязательно химерный антигенный рецептор.
[0105] Также в некоторых вариантах осуществления предусмотрен набор, содержащий вирусную векторную частицу, описанную в настоящем описании, реактив, содержащий один или множество сайтов связывания, способных к обратимому связыванию вирусной векторной частицы; и необязательно инструкции для использования. В некоторых случаях, набор дополнительно содержит средство отбора, способное к связыванию селективного маркера на поверхности клеток-мишеней, где реактив содержит один или множество сайтов связывания, способных к обратимому связыванию средства отбора.
[0106] Также предусмотрена композиция, содержащая олигомерный белковый реактив, ассоциированный с вирусной частицей. В некоторых вариантах осуществления олигомерный реактив содержит множество полипептидных мономерных единиц, где каждая единица составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину и/или имеет массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа; и/или олигомерные реактивы имеют молекулярную массу по меньшей мере или приблизительно 100 и/или между или приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа или приблизительно от 1500 кДа приблизительно до 2000 кДа.
[0107] В некоторых вариантах осуществления олигомерный белковый реактив содержит олигомер, содержащий множество мультимерных субъединиц. В некоторых примерах, мультимерные субъединицы представляют собой тетрамерные единицы и индивидуально содержат мономерную единицу. В некоторых аспектах, олигомерный белковый реактив содержит стрептавидин, авидин, аналог или мутеин стрептавидина или аналог или мутеин авидина или биологически активный фрагмент любого из вышеуказанных и/или мультимер любого из вышеуказанных, и необязательно содержит множество их единиц.
[0108] В некоторых вариантах осуществления вирусные частицы содержат последовательность нуклеотидов, кодирующую гетерологичную нуклеиновую кислоту.
[0109] В некоторых из любых таких вариантов осуществления реактив является голым; реактив не содержит и/или не конъюгирован или обратимо связан со связывающим средством; реактив не содержит и/или не конъюгирован или связан с молекулой со связывающим доменом, специфичным к маркеру клеточной поверхности, необязательно выбранному из молекул адгезии, интегринов, хемокинов, цитокинов, факторов роста, связывающих внеклеточный матрикс молекул, вирусных белков, способствующих проникновению вируса рецепторов клеточной поверхности, гепарина, гепарана, гликанов маркера поверхности T-клеток, CD3, CD28 CD4 и/или CD8; реактив не содержит и/или не конъюгирован или связан с маркером поверхности клетки млекопитающего, компонентом внеклеточного матрикса, молекулой адгезии, интегрином, лектином, интегрин-связывающим белком, хемокинами, цитокином, фактором роста, связывающей внеклеточный матрикс молекулой, ECM компонентом, вирусным белком, рецептором клеточной поверхности, способствующим проникновению вируса, гепарином, гепараном, гликанами; и/или реактив не содержит гепарин-связывающий домен и/или не содержит интегрин-связывающий домен и/или не содержит VLA4-связывающий домен и/или не содержит VLA5-связывающий домен; и/или реактив не содержит и/или не конъюгирован или сопряжен или связан с вирусным связывающим средством или средством отбора клеток.
[0110] В некоторых вариантах осуществления реактив дополнительно содержит и/или обратимо связан с множеством из одного или нескольких связывающих средств. В некоторых примерах связывающее средство представляет собой связывающее вирусную частицу средство, которое специфически связывается с молекулой на поверхности вирусной частицы, средство отбора, которое специфически связывается с молекулой на поверхности клетки-мишени, или рецептор-связывающее средство, которое специфически связывается с рецептором для того, чтобы доставлять стимулирующий сигнал в клетку-мишень.
[0111] В некоторых вариантах осуществления связывающее средство представляет собой или содержит антитело, фрагмент антитела, одновалентного фрагмента антитела, белковую связывающую молекулу с антителоподобными связывающими свойствами, молекулу, содержащую домены Ig, цитокин, хемокин, аптамер и молекулу MHC или их связывающие фрагменты. В некоторых случаях, фрагмент антитела содержит фрагмент, выбранный из группы, состоящей из Fab-фрагмента, Fv-фрагмента, (Fab')2-фрагмента и двухвалентного одноцепочечного Fv (scFv) фрагмента.
[0112] В некоторых из любых таких вариантов осуществления, реактив содержит SEQ ID №1 или SEQ ID №2 или последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичность последовательностей с SEQ ID №1 или SEQ ID №2. В некоторых вариантах осуществления реактив содержит аналог или мутеин стрептавидина, содержащий аминокислотную последовательность Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1; или аналог или мутеин стрептавидина, содержащий аминокислотную последовательность Va144-Thr45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
[0113] В некоторых из любых таких вариантов осуществления, реактив содержит аналог или мутеин стрептавидина, который содержит a) последовательность аминокислот, приведенную в любой из SEQ ID №№3-6, 27 и 28; b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с любой из SEQ ID №№3-6, 27 и 28 и содержит аминокислотную последовательность, соответствующую Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47, и которая обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
[0114] В некоторых вариантах осуществления аналог или мутеин стрептавидина дополнительно содержит замену или замены аминокислот в положении, соответствующем 117, 120 и/или 121 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1. В некоторых примерах, замену или замены аминокислот выбирают из Glu117, Asp117, Arg117, Ser120, Ala120, Gly120, Trp121, Tyr121 или Phe121; или замену или замены аминокислот выбирают из одной или нескольких из Glu117, Gly120 или Tyr121; или замены аминокислот выбирают из Glu117, Gly120 или Tyr121.
[0115] В некоторых из любых таких вариантов осуществления, реактив содержит аналог или мутеин стрептавидина, который содержит a) последовательность аминокислот, приведенную в SEQ ID №27 или 28; b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с SEQ ID №№28 и содержит аминокислотную последовательность, соответствующую Va144, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121, и обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
[0116] В некоторых из любых таких вариантов осуществления, геном вирусного вектора содержит молекулу нуклеиновой кислоты, кодирующую рекомбинантный белок. В некоторых случаях, рекомбинантный белок представляет собой антигенный рецептор. В некоторых вариантах осуществления вирусная частица представляет собой ретровирус. В некоторых случаях, ретровирус представляет собой лентивирус. В некоторых случаях, ретровирус представляет собой гаммаретровирус. В некоторых вариантах осуществления вирусная частица имеет дефект репликации.
[0117] В некоторых из любых таких вариантов осуществления, реактив является растворимым.
[0118] В настоящем описании в некоторых вариантах осуществления предусмотрен способ трансдукции клеток. В настоящем описании предусмотрен способ трансдукции клеток, который включает инкубацию, такую как приведение в контакт, множества клеток, содержащих одну или более клеток-мишеней, таких как присутствующие во входной композиции, содержащей множество клеток, с (1) олигомерным реактивом; и (2) вирусной частицей, где необязательно способом получают выходную композицию, содержащую одну или более трансдуцированных клеток.
[0119] В настоящем описании предусмотрен способ трансдукции клеток, способ включает: (a) приведение в контакт вирусной частицы с олигомерным реактивом, тем самым создавая смесь, содержащую вирусные частицы, ассоциированные с реактивом; и (b) приведение в контакт смеси со входной композицией, содержащей множество клеток, где необязательно способом получают выходную композицию, содержащую одну или более трансдуцированных клеток. В некоторых вариантах осуществления реактив представляет собой или содержит олигомер. В некоторых вариантах осуществления приведение в контакт включает смешивание клетки с реактивом и с вирусной частицей, одновременно или последовательно, в любом порядке. В некоторых вариантах осуществления во время по меньшей мере части приведения в контакт, реактив и вирусная частица находятся в присутствии или в контакте с клеткой одновременно.
[0120] В некоторых из любых вариантов осуществления олигомерный реактив представляет собой олигомерный белковый реактив; и/или олигомерный реактив содержит множество полипептидных мономерных единиц, где каждая единица необязательно составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину, необязательно по меньшей мере или приблизительно 50, 60, 65, 70, 80, 90, 100, 125 или 150 аминокислот в длину и/или имеет массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа, где необязательно реактив содержит олигомер, состоящий из множества мультимерных субъединиц, которые необязательно представляют собой тетрамерные единицы и индивидуально содержат мономерную единицу; и/или олигомерные реактивы имеют молекулярную массу по меньшей мере или приблизительно 100 и/или между или приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа или приблизительно от 1500 кДа приблизительно до 2000 кДа.
[0121] В некоторых из любых вариантов осуществления, реактив, такой как олигомерный белковый реактив, содержит стрептавидин, авидин, аналог или мутеин стрептавидина или аналог или мутеин авидина или биологически активный фрагмент любого из вышеуказанных и/или мультимер любого из вышеуказанных, и необязательно содержит множество их единиц.
[0122] В некоторых вариантах осуществления, в которых приведение в контакт включает смешивание клетки с реактивом и с вирусной частицей, одновременно или последовательно, в любом порядке. В некоторых вариантах осуществления во время по меньшей мере части приведения в контакт, реактив и вирусная частица находятся в присутствии или в контакте с клеткой одновременно.
[0123] В некоторых вариантах осуществления одна или более трансдуцированных клеток в выходной композиции экспрессируют рекомбинантный белок, кодируемый гетерологичной нуклеиновой кислотой, которую содержат вирусные частицы. В некоторых вариантах осуществления вирусная частица представляет собой ретровирус, такой как лентивирус или гаммаретровирус.
[0124] В некоторых вариантах осуществления предусмотренные способы увеличивают эффективность трансдукции по сравнению с трансдукцией, которую осуществляли без реактива или с альтернативным адъювантом, таким как Retronectin или протамина сульфат. В некоторых вариантах осуществления эффективность трансдукции увеличивают больше чем или больше чем приблизительно в 1,2 раза, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз или больше.
[0125] В некоторых вариантах осуществления реактив обратимо связывают со связывающим средством. В некоторых вариантах осуществления связывающее средство на клетках может облегчать одно или более из отбора, выделения, активации, стимуляции и/или размножения клеток или субпопуляции клеток. В некоторых вариантах осуществления связывание представляет собой любое связывающее средство, как описано.
[0126] Также предусмотрены композиции, содержащие реактив, такой как любой олигомерный белковый реактив, такой как любой, описанный в качестве вирусной частицы. В некоторых вариантах осуществления вирусная частица представляет собой ретровирус, такой как лентивирус или гаммаретровирус.
[0127] Также предусмотрен набор, содержащий реактив, такой как любой олигомерный белковый реактив, такой как любой описанный в качестве вирусной частицы. В некоторых вариантах осуществления вирусная частица представляет собой ретровирус, такой как лентивирус или гаммаретровирус.
Краткое описание фигур
[0128] На фиг. 1 приведена схема предоставленного способа трансдукции, который включает инкубацию или приведение в контакт множества клеток, содержащих клетку-мишень, с олигомерным белковым реактивом (например, олигомером мутеина стрептавидина) и вирусной частицей.
[0129] На фиг. 2 приведено схематическое представление образцовых вариантов осуществления способа вирусной трансдукции с использованием обратимых систем в соответствии с предоставленными способами.
[0130] На фиг. 2A представлен реактив, обратимо связанный с первым и вторым средством. Первое средство способно к специфическому связыванию с молекулой на вирусной частице. Второе средство способно к специфическому связыванию с молекулой на клетке. Реактив имеет множество сайтов связывания Z1 и Z2, которые могут представлять собой одно и то же или различное, каждый способен к обратимому связыванию со средством. Первое средство содержит по меньшей мере один партнер связывания C1, который может связываться с по меньшей мере одним сайтом связывания Z1 реактива, и второе средство содержит по меньшей мере один партнер связывания C2, который может специфически связываться с по меньшей мере одним сайтом связывания Z2 реактива. В некоторых случаях, C1 и C2 различны. В некоторых случаях, C1 и C2 представляют собой одно и то же или по существу одно и то же. Первое средство содержит по меньшей мере один сайт связывания V1, который может специфически связываться с молекулой на поверхности вирусной частицы. Второе средство содержит по меньшей мере один сайт связывания B2, который может специфически связываться с молекулой на поверхности клетки. В некоторых вариантах осуществления первое и/или второе средство могут представлять собой средства отбора. Здесь, первое средство связывают с молекулой на поверхности вирусной частицы и второе средство связывают с молекулой на поверхности клетки.
[0131] На фиг. 2B представлен реактив, обратимо связанный с вирусной частицей и средством. Средство способно к специфическому связыванию с молекулой на клетке. Реактив имеет множество сайтов связывания Z1 и Z2, которые могут представлять собой одно и то же или различное, каждый способен к обратимому связыванию. Вирусная частица содержит по меньшей мере один партнер связывания C1, который может специфически связываться с по меньшей мере одним сайтом связывания Z1 реактива. Средство содержит по меньшей мере один партнер связывания C2, который может специфически связываться с по меньшей мере одним сайтом связывания Z2 реактива. В некоторых случаях, C1 и C2 различны. В некоторых случаях, C1 и C2 представляют собой одно и то же или по существу одно и то же. Средство содержит по меньшей мере один сайт связывания B2, который может специфически связываться с молекулой на поверхности клетки. В некоторых вариантах осуществления средство может представлять собой средство отбора. На фиг. 2B изображена вирусная частица, содержащая партнер связывания в вирусном оболочечном белке на поверхности вирусной частицы, и средство, связанное с молекулой на поверхности клетки.
[0132] На фиг. 2C представлен реактив, связанный с основой, например, твердым носителем и/или стационарной фазой, и обратимо связанный с первым и вторым средством. Первое средство способно к специфическому связыванию с молекулой на вирусной частице. Второе средство способно к специфическому связыванию с молекулой на клетке. Реактив имеет множество сайтов связывания Z1 и Z2, которые могут представлять собой одно и то же или различное, каждый способен к обратимому связыванию со средством. Первое средство содержит по меньшей мере один партнер связывания C1, который может связываться с по меньшей мере одним сайтом связывания Z1 реактива, и второе средство содержит по меньшей мере один партнер связывания C2, который может специфически связываться с по меньшей мере одним сайтом связывания Z2 реактива. В некоторых случаях, C1 и C2 различны. В некоторых случаях, C1 и C2 представляют собой одно и то же или по существу одно и то же. Первое средство содержит по меньшей мере один сайт связывания V1, который может специфически связываться с молекулой на поверхности вирусной частицы. Второе средство содержит по меньшей мере один сайт связывания B2, который может специфически связываться с молекулой на поверхности клетки. В некоторых вариантах осуществления первое и/или второе средство могут представлять собой средства отбора. Здесь, первое средство связывают с молекулой на поверхности вирусной частицы и второе средство связывают с молекулой на поверхности клетки.
[0133] На фиг. 2D представлен реактив, связанный с основой, например, твердым носителем и/или стационарной фазой, и обратимо связанный с вирусной частицей и средством. Средство способно к специфическому связыванию с молекулой на клетке. Реактив имеет множество сайтов связывания Z1 и Z2, которые могут представлять собой одно и то же или различное, каждый способен к обратимому связыванию. Вирусная частица содержит по меньшей мере один партнер связывания C1, который может специфически связываться с по меньшей мере одним сайтом связывания Z1 реактива. Средство содержит по меньшей мере один партнер связывания C2, который может специфически связываться с по меньшей мере одним сайтом связывания Z2 реактива. В некоторых случаях, C1 и C2 различны. В некоторых случаях, C1 и C2 представляют собой одно и то же или по существу одно и то же. Средство содержит по меньшей мере один сайт связывания B2, который может специфически связываться с молекулой на поверхности клетки. В некоторых вариантах осуществления средство может представлять собой средство отбора. На фиг. 2D представлена вирусная частица, содержащая партнер связывания в вирусном оболочечном белке на поверхности вирусной частицы, и средство, связанное с молекулой на поверхности клетки.
[0134] На фиг. 3 приведены схематические представления образцовых вариантов осуществления.
[0135] На фиг. 3A приведено схематическое представление реактива (или его репрезентативной части) с множеством сайтов связывания для обратимого связывания со средствами. В этом случае, реактив показан способным к обратимому связыванию с двумя средствами, каждое из которых способно к специфическому связыванию с молекулой на клетке. Реактив имеет множество сайтов связывания, в том числе множество сайтов связывания, Z1, каждый способен к обратимому связыванию со средствами. Каждое из первого и второго средств, которые, в некоторых случаях, могут представлять собой одно и то же, в приведенном схематическом представлении содержит по меньшей мере один партнер связывания C1. Партнер связывания C1 обратимо связывается с сайтом связывания Z1. Каждое из первого и второго средства также содержит сайт связывания, B2, который может специфически связываться с молекулой на поверхности клетки, которая, в некоторых случаях, может быть на той же клетке. Здесь, первое и второе средства показаны специфически связывающимися с молекулами на одной и той же клетке.
[0136] На фиг. 3B приведено схематическое представление реактива с множеством сайтов связывания, способных к обратимому связыванию с первым и вторым средством, каждое из этих средств способно к специфическому связыванию с молекулой на первой и второй клетке, соответственно. Реактив имеет множество сайтов связывания Z1, каждый способен к обратимому связыванию со средством. Каждое из первого и второго средств, которые, в некоторых случаях, могут представлять собой одно и то же, содержит партнер связывания C1, который обратимо связывается с сайтом связывания Z1. Каждый из первого и второго средства содержит сайт связывания B2, который может специфически связываться с молекулой на поверхности клетки, которая, в некоторых случаях, может быть на одной и той же клетке или другой клетке. Здесь, первое средство связывают с молекулой на поверхности первой клетки и второе средство связывают с молекулой на поверхности второй клетки.
[0137] На фиг. 3C представлен реактив, способный к обратимому связыванию с первым и вторым средствами, каждое из этих средств способно к специфическому связыванию с молекулой на первой и второй клетке, соответственно. Реактив имеет множество сайтов связывания Z1 и Z2, которые могут представлять собой одно и то же или различное, каждый способен к обратимому связыванию с одним или обоими средствами. Первое средство содержит партнер связывания C1, который обратимо связывается с Z1; второе средство содержит партнер связывания C2, который может обратимо связываться с Z2. В некоторых случаях, C1 и C2 различны. В некоторых случаях, C1 и C2 представляют собой одно и то же или по существу одно и то же. Первое средство содержит сайт связывания B1, которое может специфически связываться с молекулой на поверхности клетки, и второе средство содержит по меньшей мере один сайт связывания B3, который может специфически связываться с молекулой на поверхности клетки. Сайты связывания B1 и B3 в некоторых случаях связываются с двумя различными молекулами клеточной поверхности, или различными эпитопами на одной молекуле, или одними и теми же или различными молекулами на поверхности различных клеток. Здесь, первое средство показано связанным, через B1, с молекулой на поверхности первой клетки, и второе средство связывают с молекулой на поверхности второй клетки.
[0138] На фиг. 3D представлен реактив, способный к обратимому связыванию с первым и вторым средством, такими как средства отбора, каждое из которых способно к специфическому связыванию с молекулой на клетке. Реактив имеет множество сайтов связывания, в том числе Z1 и Z2, которые могут представлять собой одно и то же или различное, каждый способен к обратимому связыванию со средством. Первое средство содержит партнер связывания C1, который может специфически связываться с сайтом связывания Z1, и второе средство содержит по меньшей мере один партнер связывания C2, который может специфически связываться с сайтом связывания Z2. В некоторых случаях, C1 и C2 различны. В некоторых случаях, C1 и C2 представляют собой одно и то же или по существу одно и то же. Первое средство содержит сайт связывания B1, который может специфически связываться с молекулой на поверхности клетки, и второе средство содержит сайт связывания B3, который может специфически связываться с молекулой на поверхности клетки. В некоторых вариантах осуществления первое средство и второе средство может представлять собой средство отбора. Сайты связывания B1 и B3 могут связывать одни и те же или различные молекулы (например, рецептор) на поверхности клетки, одни и те же или различные эпитопы на молекуле, или одни и те же или различные молекулы на поверхности различных клеток. Здесь, первое средство связывают с первой молекулой на поверхности клетки и второе средство связывают со второй молекулой на поверхности той же клетки.
[0139] На фиг. 3E представлен реактив, обратимо связанный с первым и вторым средством, каждое из этих средств способно к специфическому связыванию с молекулой на клетке. Реактив имеет множество сайтов связывания, в том числе Z1 и Z2, которые могут представлять собой одно и то же или различное, каждый способен к обратимому связыванию со средством. Первое средство содержит партнер связывания C1, который может обратимо связываться с Z1 реактива, и второе средство содержит партнер связывания C2, который может обратимо связываться с Z2. В некоторых случаях, C1 и C2 различны. В некоторых случаях, C1 и C2 представляют собой одно и то же или по существу одно и то же. Первое средство содержит по меньшей мере один сайт связывания B2, который может специфически связываться с молекулой на поверхности клетки, и второе средство содержит по меньшей мере один сайт связывания B4, который может специфически связываться с молекулой на поверхности клетки. В некоторых вариантах осуществления первое средство и второе средство могут представлять собой стимулирующие средства. Сайты связывания B2 и B4 могут связывать одни и те же или различные молекулы на поверхности клетки, одни и те же или различные эпитопы на молекуле или одни и те же или различные молекулы на поверхности различных клеток. Здесь, первое средство связывают с первой молекулой на поверхности клетки и второе средство связывают со второй молекулой на поверхности той же клетки.
[0140] На фиг. 4, которая содержит фиг. 4A-4E, приведены схематические представления образцовых вариантов осуществления, как показано на фиг. 3A-3E, соответственно, за исключением того, что изображенные реактивы показаны иммобилизованными на основе, такой как стационарная фаза.
[0141] На фиг. 5 приведено схематическое представление образцовых вариантов осуществления, в которых олигомерные реактивы используют для того, чтобы мультимеризовать стимулирующие средства, и получаемые комплексы инкубируют с клетками для того, чтобы доставлять сигналы к клеткам, после чего следует обращение связывания. В части A показан олигомерный реактив 1, который показан не связанным с какой-либо основой и гибким. Стимулирующие средства 2, которые представлены здесь в виде Fab-фрагментов и способны к специфическому связыванию с молекулой на поверхности клетки, объединяют с реактивом. Средства содержат партнер связывания (например, партнер связывания C), который способен к обратимому связыванию с сайтом связывания (например, сайтом связывания Z) на реактиве, мультимеризующем средства. В части B показан партнер связывания, обратимо связывающийся с сайтом связывания на реактиве. Клетки 3 добавляют в систему. В части C показаны мультимеризованные средства (Fab-фрагменты), специфически связывающиеся с молекулами 4 на поверхности клетки 3. В части C изображенные средства представляют собой стимулирующие рецептор-связывающие средства, (например, первое рецептор-связывающее средство и/или второе рецептор-связывающее средство), которые могут индуцировать или модулировать сигнал в клетке при связывании средства, с молекулой на клетке. Как показано в части D, в композицию добавляют вещество 5, такое как конкурентный реактив (например, биотин), который может представлять собой вещество, которое проявляет более высокую аффинность связывания к сайту связывания на реактиве, чем к партнеру связывания на средстве, тем самым разрушая обратимое связывание между реактивом 1 и средством 2. В некоторых случаях, средство, например, Fab-фрагмент, также может диссоциировать из его взаимодействия с молекулой 4 на клетке 3. В некоторых случаях, это может разрушать, уменьшать и/или прерывать передачу сигнала в клетке.
[0142] На фиг. 6 приведено схематическое представление образцовых вариантов осуществления обратимой системы, прикрепленной к основе, такой как твердый носитель или поверхность, в том числе стационарная фаза. В части A показана основа 6, содержащая реактив 1. Средства 2, такие как Fab-фрагменты, способные к специфическому связыванию с молекулой на поверхности клетки, добавляют в систему. Средства 2, такие как Fab-фрагменты, содержат партнер связывания (например, партнер связывания C), который способен к обратимому связыванию с сайтом связывания (например, сайтом связывания Z) на реактиве. В части B показан партнер связывания, обратимо связывающийся с сайтом связывания на реактиве. Клетки 3 добавляют в систему. В части C показаны средства 2, например, Fab-фрагменты, связывающиеся с молекулами 4 на поверхности клетки 3. В некоторых вариантах осуществления scFv содержат рецептор-связывающее средство или средство отбора. В некоторых вариантах осуществления средства, например, Fab-фрагменты, могут представлять собой рецептор-связывающее средство или средство отбора. В части C показано образцовое рецептор-связывающее средство или средства (например, первое рецептор-связывающее средство и/или второе рецептор-связывающее средство), которые могут индуцировать или модулировать сигнал в клетке при связывании средства, например, Fab-фрагмента, с молекулой на клетке. Добавляют вещество 5, такое как конкурентный реактив (например, биотин), которое может представлять собой вещество, которое проявляет более высокую аффинность связывания с сайтом связывания на реактиве, чем с партнером связывания на средстве, например, Fab-фрагменте, тем самым разрушая связывание между реактивом и средством. В части D показано разрушение связывания между средством 2, например, Fab-фрагментом, и реактивом, что приводит к диссоциации реактива и средства и, тем самым, клетки. В некоторых случаях, средство, например, Fab-фрагмент, также может диссоциировать из его взаимодействия с молекулой 4 на клетке 3. В некоторых случаях, это может разрушать, уменьшать и/или прерывать передачу сигнала в клетке.
[0143] На фиг. 7A-7C представлены результаты эксперимента, в котором CD3+ T-клетки-респонденты пролиферировали после стимуляции с использованием αCD3 и αCD28 Fab-фрагментов, которые обратимо иммобилизованы на бусах, покрытых мутеином стрептавидина Strep-tactin®. На фиг. 7A представлена гистограмма, показывающая распределение размеров (прямое рассеяние) стимулированных клеток, на фиг. 7B представлены гистограммы, показывающие степень пролиферации в соответствии с числом клеток на клеточное деление, которые показаны в верхней части на фиг. 7B (0 означает клетки без деления; 5 означает клетки, которые прошли по меньшей мере через 5 делений), и на фиг. 7C представлено изображение культуральной чашки после 4 суток стимуляции.
[0144] На фиг. 8A-8E представлены результаты эксперимента, в котором CD3+ T-клетки-респонденты пролиферировали после стимуляции in vitro с использованием обратимых αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина, действующем растворимым реактивом. Для экспериментов, результаты которых представлены на фиг. 8A-8E, 300000 CD3+ T-клеток-респондентов (Tresp) метили с использованием 2 мкМ сложного сукцинимидилового эфира карбоксифлуоресцеина (CFSE) и стимулировали с использованием различных количеств препарата растворимого олигомерного мутеина стрептавидина, на котором иммобилизовали комбинацию αCD3 Fab-фрагмента и αCD28 Fab, оба несут Strep-tag в качестве стрептавидин-связывающего пептида на тяжелой цепи. («1×» соответствует 3 мкг олигомерного мутеина стрептавидина, функционализированного с использованием 0,5 мкг αCD3- и 0,5 мкг αCD28 Fab; числа показывают количество, кратное «1×»). Клетки Tresp или оставались без стимуляции или их стимулировали с использованием пустых олигомерных мутеинов стрептавидина (без Fab), которые служили в качестве отрицательного контроля. Клетки Tresp высевали в двух повторениях в 48-луночные планшеты вместе с 300000 CD3-отрицательных аутологических клеток-кормушек (облучали с использованием 30 Гр) в 1 мл клеточной культуральной среды с добавлением 20 Ед/мл интерлейкина 2 (IL-2). Клетки инкубировали при 37°C без замены среды и пролиферацию анализировали в соответствии с разведением CFSE после 5 суток посредством FACS анализа (фиг. 8B). На фиг. 8A показано распределение размеров клеток после 5 суток в культуре. Гистограммы показывают живые CD3+ клетки, тогда как на фиг. 8C представлены клетки после культуры, которые освобождали с помощью стимулирующих реактивов после обработки 1 мМ D-биотином и промывания. Диссоциацию и удаление мономерных Fab-фрагментов анализировали посредством повторного окрашивания с использованием олигомерного мутеина стрептавидина, меченного фикоэритрином (ST-PE) в качестве флуоресцентной метки, и представлена репрезентативная гистограмма. На фиг. 8D показано абсолютное число живых (отрицательных по трипановому синему) клеток после 5 суток, которые считали с использованием счетной камеры Neubauer и наносили на диаграмму в зависимости от соответствующих условий стимуляции. Медианы числа клеток представлены на фиг. 8D; планки ошибки показывают стандартное отклонение (SD). На фиг. 8E представлено изображение культуральной чашки после 5 суток стимуляции.
[0145] На фиг. 9A и 9B представлена кинетика размножения при пролиферации очищенных CD4+ и CD8+ T-клеток-респондентов (Tresp), которые стимулировали in vitro или с использованием αCD3/αCD28 Fab-фрагментов или с использованием αCD3/αCD28/αCD8, которые обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина двух типов, действующем в качестве растворимого реактива. Олигомерный мутеин стрептавидина первого типа представлял собой фракцию олигомерного мутеина стрептавидина (n≥3), полученную в примере 3, (также обозначаемую в настоящем описании как «стандартный» или «меньший» остов олигомерного мутеина стрептавидина, проиллюстрированный символом треугольника верхушкой вниз на фиг. 9A и 9B), олигомерный мутеин стрептавидина второго типа, используемый в качестве растворимого реактива, представлял собой олигомер, который получали посредством проведения реакции растворимого олигомерного мутеина стрептавидина с биотинилированным сывороточным альбумином человека (HSA). Этот растворимый реактив, основанный на HSA также обозначают в настоящем описании как «больший» остов олигомерного мутеина стрептавидина). В экспериментах с фиг. 9A и 9B размножение осуществляли без замены среды. Результаты для CD4+ T-клеток-респондентов представлены на фиг. 9A, результаты для CD8+ T-клеток-респондентов представлены на фиг. 9B. В этом контексте, следует отметить, что экспериментально используемые растворимые реактивы, которые функционализированы посредством обратимого связывания первых средств и необязательно вторых и третьих средств, обозначают как «мультимеры Streptamer®».
[0146] На фиг. 10A и 10B представлена кинетика размножения при пролиферации очищенных CD4+ и CD8+ T-клеток-респондентов (Tresp), которые стимулировали in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые представляли собой обратимо иммобилизованные фрагменты, которые обратимо иммобилизовали с использованием растворимых олигомерных мутеинов стрептавидина двух типов, действующих в качестве растворимого реактива. Олигомерный Strep-tactin® первого типа представлял собой фракцию олигомерного мутеина стрептавидина (n≥3), полученную в примере 3 (также обозначаемую в настоящем описании как «стандартный остов олигомерного мутеина стрептавидина», проиллюстрированную символом треугольника верхушкой вниз на фиг. 10A и 10B), олигомерный мутеин стрептавидина второго типа, используемый в качестве растворимого реактива, представлял собой растворимый реактив, основанный на HSA, указанный выше «большой остов»). В экспериментах с фиг. 10A и 10B размножение осуществляли с заменой среды. Результаты CD4+ T-клеток-респондентов представлены на фиг. 10A, результаты для CD8+ T-клеток-респондентов представлены на фиг. 10B.
[0147] На фиг. 11A и 11B представлены комбинированные данные из результатов, полученных на фиг. 9A-B и 10A-B, для кинетики размножения при пролиферации очищенных CD4+ и CD8+ T-клеток-респондентов, где на фиг. 11A представлены результаты для CD4+ T-клеток и на фиг. 11B представлены результаты для CD8+ T-клеток. Прямые линии используют для культивирования с заменой среды в сутки 3, тогда как штриховые линии изображают значения, полученные для степени размножения без замены среды в сутки 3. Данные, представленные на фиг. 11A и 11B, нормализованы по входному числу клеток. Представлены только данные для Tresp, стимулированных олигомерным мутеином стрептавидина (n≥3), Tresp, стимулированных коммерчески доступными бусами против CD3/против CD28 (положительный контроль), и не стимулированных T-клеток (отрицательный контроль), но не данные о реактиве с «большим остовом».
[0148] На фиг. 12A-12C представлена кинетика размножения и фенотип CD3+ центральных T-клеток памяти (Tcm) (CD3+CD62L+CD45RA-Tcm), поликлонально стимулированных in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина (с n≥3), описанном в примере 3. Графики, приведенные на фиг. 12A и 12B, представляют степень пролиферации в соответствии с числом клеток, собранных на момент времени, где на фиг. 12A представлена пролиферация в средах с добавлением только IL-2 и на фиг. 12B представлена пролиферация в средах с добавлением IL-2 и IL-15. На фиг. 12C представлен проточный цитометрический анализ поверхностной экспрессии CD62L и CD127 после 14 суток культуры в этих переменных средах цитокинов.
[0149] На фиг. 13A и 13B представлен выход и фенотип при размножении очищенных CD8+ T-клеток-респондентов, стимулируемых in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимых олигомерных мутеинах стрептавидина двух типов, действующих растворимым реактивом. Олигомерный мутеин стрептавидина первого типа представлял собой фракцию олигомерного мутеина стрептавидина (полученную в примере 3 (стандартный остов), олигомерный мутеин стрептавидина второго типа, используемый в качестве растворимого реактива, представлял собой растворимый олигомер, описанный выше и называемый в настоящем описании как «большой» остов. В этих экспериментах, фракцию олигомерного стандартного мутеина стрептавидина (n≥3) также использовали в качестве реактива, который функционализировали или с использованием отдельных Fab-фрагментов (третий столбец на фиг. 13A и фиг. 13B) или с использованием комбинации αCD3 и αCD28 Fab-фрагментов. В дополнение к комбинированной стимуляции с использованием αCD3/αCD28 Fab-фрагментов, также дополнительный αCD8 Fab-фрагмент (коммерчески доступный в IBA GmbH, Gottingen, Germany) иммобилизовали для того, чтобы тестировать, возможно ли предпочтительно стимулировать конкретную субпопуляцию T-клеток. На фиг. 13A представлена столбчатая диаграмма, которая представляет степень пролиферации в соответствии с числом клеток, собранных в сутки 6, по сравнению с отрицательными контролями (не стимулированные очищенные CD8+ T-клетки-респонденты), и нормализованных по положительному контролю (очищенные CD8+ T-респонденты, стимулированные коммерчески доступными бусами против CD3/против CD28 (бусы, на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28). На фиг. 13B представлен проточный цитометрический анализ поверхностной экспрессии CD8 и молекулы поверхности T-клеток CD45RO (которая указывает на пролиферацию и активацию T-клеток) после клеточной культуры. Различные стимулирующие условия сравнивали с использованием однофакторного дисперсионного анализа и не обнаруживали значимые различия (n.s.).
[0150] На фиг. 14A и 14B представлен выход и фенотип для размножения очищенных CD8+ T-клеток-респондентов, стимулированных in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина, действующем в качестве растворимого реактива, которые функционализировали или с использованием отдельных Fab-фрагментов или с использованием комбинации Fab-фрагментов (как уже описано выше). В этих экспериментах CD8+ T-клетки-респонденты стимулировали растворимым реактивом (растворимым олигомерным мутеином стрептавидина (1 мг/мл) из примера 3), который функционализировали с использованием различных количеств αCD3 и αCD28 Fab-фрагментов, необязательно вместе с αCD8 Fab-фрагментом, описанным выше. Термин «1×» соответствует 1,5 мкг олигомерного мутеина стрептавидина, функционализированного с использованием 0,5 мкг только αCD3 Fab-фрагмента, и 1,5 мкг олигомерного мутеина стрептавидина, функционализированного с использованием 0,5 мкг только αCD28 Fab), или 3 мкл препарата олигомерного мутеина стрептавидина, нагруженного с использованием 0,5 мкг αCD3 Fab-фрагмента и 0,5 мкг αCD28 Fab, или 4,5 мкл препарата олигомерного мутеина стрептавидина, нагруженного с использованием 0,5 мкг strep-меченного αCD3, 0,5 мкг strep-меченного αCD8 и 0,5 мкг strep-меченного αCD28 Fab. Соответственно, термин «2×» соответствует 3,0 мкг олигомерного мутеина стрептавидина, функционализированного с использованием 1 мкг только αCD3 Fab-фрагмента, и 3,0 мкг олигомерного мутеина стрептавидина, функционализированного с использованием 1 мкг только αCD28 Fab, что обозначает, что использовали двойное количество иммобилизованного αCD3 Fab-фрагмента. Необработанные клетки Tresp служили в качестве отрицательного контроля и очищенные CD8+ T-респонденты, стимулированные коммерчески доступными бусами против CD3/против CD28 (бусы, на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28) в качестве положительного контроля. На фиг. 14A представлен график, на котором столбцы представляют степень пролиферации в соответствии с числом клеток, собранных в сутки 5, по сравнению с отрицательными контролями, и нормализованных по положительному контролю. На фиг. 14B представлен FACS анализ поверхностной экспрессии CD8 и CD45RO после клеточной культуры.
[0151] На фиг. 15A и 15B представлено размножение очищенных CD3+ T-клеток-респондентов, стимулированных in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина из примера 3, который служил в качестве растворимого реактива. В одном эксперименте, в дополнение к αCD3/αCD28 Fab-фрагментам, также αCD8 Fab-фрагмент, коммерчески доступный в IBA GmbH, Gottingen, Germany (№ по каталогу 6-8000-203), иммобилизовали на растворимом олигомере мутеина стрептавидина для того, чтобы тестировать, возможно ли предпочтительно стимулировать in vitro CD8+ субпопуляцию T-клеток в общей CD3+ культуре с использованием реактива, на котором также обратимо иммобилизован αCD8 Fab-фрагмент. Более подробно, 500000 очищенных CD3+ T-клеток-респондентов (Tresp) стимулировали с использованием 3 мкл препарата олигомерного мутеина стрептавидина (1 мг/мл), нагруженного комбинацией из 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab. В качестве альтернативного подхода, 4,5 мкл олигомерного мутеина стрептавидина нагружали с использованием 0,5 мкг αCD3, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab, описанных выше. Не стимулированные клетки Tresp служили в качестве отрицательного контроля, и Tresp, которые стимулировали бусами против CD3/против CD28 (бусами, на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28), служили в качестве положительного контроля. На фиг. 15A показано, что реактив, содержащий αCD8 Fab-фрагмент, приводил к самому высокому числу размноженных CD3+ клеток. На фиг. 15B показано, что количество CD8+ T-клеток было самым высоким в композиции клеток, которые размножали с использованием реактива, содержащего αCD8 Fab-фрагмент.
[0152] На фиг. 16A и 16B показаны результаты дифференциальной мобилизации внутриклеточного кальция в клетках Jurkat, которые или метили αCD3 антителом OKT3 или Fab-фрагментами из OKT3, мультимеризованными с использованием Strep-tactin® (также обозначаемыми в настоящем описании как Fab мультимеры). На фиг. 16A: клетки Jurkat нагружали кальций-чувствительным красителем Indo-1-AM, и высвобождение кальция запускали посредством инъекции или αCD3 mAb (черные квадраты) или αCD3 OKT3 Fab мультимеров (полученных из родительской клеточной линии OKT3) с предшествующим разрушением D-биотином или без него (темные серые треугольники и светлые серые круги, соответственно) по сравнению с инъекцией PBS (перевернутые белые треугольники). Применение иономицина служило в качестве положительного контроля. Осуществляли мониторинг изменений внутриклеточной концентрации Ca2+ с разрешением по времени посредством проточной цитометрии на основании изменения соотношения FL6/FL7. На фиг. 16B: Indo-1-AM-меченные клетки Jurkat активировали с помощью различных αCD3 стимулов, как описано в примере 11; OKT3: верхний график и αCD3 Fab-мультимер: средний график), после чего следовало последующее (t=140 с) опосредованное D-биотином разрушение передачи сигнала αCD3 Fab-мультимера. Инъекция PBS (нижний график) и иономицина служила в качестве отрицательного или положительного контроля. Данные представляют три различных эксперимента.
[0153] На фиг. 17 представлен результат обратимого окрашивания клеток с использованием OKT3 Fab-мультимеров против CD3. Свежие выделенные PBMC окрашивали или моноклональным антителом (левая точечная диаграмма, родительский клон для Fab-мультимеров) или когнатными PE-меченными Fab-мультимерами и анализировали или до (вторая колонка слева) или после обработки D-биотином (средняя колонка). Затем остающиеся Fab мономеры обнаруживали после последующих стадий промывания с использованием свежего PE-меченного Strep-Tactin® (вторая колонка справа). Окрашивание обратимо окрашенных клеток вторичным Fab-мультимером служило в качестве контроля (правая колонка). Показаны только живые (PIотрицательные) клетки. Числа на точечных диаграммах показывают процентную долю клеток в гейтах.
[0154] На фиг. 18 представлено выделение клеток посредством обратимого связывания Fab-фрагментов против CD28, мультимеризованных с использованием Strep-Tactin®, меченного фикоэритрином в качестве флуоресцентной метки. CD28+ клетки отбирали/выделяли посредством магнитного отбора клеток с использованием Fab-мультимеров из свежих выделенных PMBC, как описано в международной патентной заявке WO 2013/011011. Перед отбором осуществляли контрольное окрашивание клеток или с использованием когнатных флуоресцентных aCD28-мультимеров (левая точечная диаграмма) или с использованием антитела, направленного против легкой цепи иммуноглобулина κ (вторая точечная диаграмма слева, α-Ig κ mAb). После отбора, клетки обрабатывали D-биотином и впоследствии промывали для того, чтобы удалять магнитные бусы и Fab-мономеры. Высвобожденные CD28+ клетки впоследствии (повторно) окрашивали или с использованием CD28 Fab-мультимеров (вторая точечная диаграмма справа) или с использованием α-Ig κ mAb (правая точечная диаграмма) для того, чтобы обнаруживать потенциально остающиеся Fab-мономеры. Показаны только живые (PIотрицательные) CD3+ клетки. Числа на точечных диаграммах показывают процентную долю клеток в гейтах.
[0155] На фиг. 19A и 19B показано раннее формирование кластера T-клеток после активации очищенных CD4+ и CD8+ T-клеток-респондентов, стимулированных in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина (n≥3), описанном в примере 3. На фиг. 19A изображены результаты для CD4+ T-клеток и на фиг. 19B изображены результаты для CD8+ T-клеток. Показаны данные для Tresp, стимулированных растворимым реактивом мультимеризации (олигомерным мутеином стрептавидина), Tresp, стимулированных коммерчески доступными бусами против CD3/против CD28, (положительный контроль) и не стимулированных T-клеток (отрицательный контроль).
[0156] На фиг. 20A-F показана кинетика избирательного антиген-специфического (Аг-специфического) размножения из общей популяции очищенных CD3+CD62L+CD45RA-Tcm клеток-респондентов, которые стимулировали in vitro с использованием как комплекса пептид : молекула MHC (который выполняет функцию первого средства, которое обеспечивает первичный сигнал активации для клеток), так и αCD28 Fab-фрагмента (который выполняет функцию второго средства, которое связывает вспомогательную молекулу на поверхности клеток), и не стимулированных T-клеток (отрицательный контроль). Как комплекс антиген-специфического пептида с молекулой MHC, так и αCD28 Fab-фрагмент обратимо иммобилизовали на одном и том же растворимом олигомерном мутеине стрептавидина (с n≥3), описанном в примере 3. Пептид, используемый для антиген-специфического размножения на фиг. 20A, представлял собой пептид CRVLCCYVL (SEQ ID №38), аминокислоты 309-317 предраннего белка 1, ограниченный молекулой MHC HLA-C702 (описано в Ameres et al, PLOS Pathogens, May 2013, том 9, выпуск 5, e1003383), представляющий эпитоп HLA-C7/IE-1, который специфичен для цитомегаловируса (CMV). Молекула MHCI, которая представляет пептид, несет на C-конце ее тяжелой цепи стрептавидин-связывающий пептид (SAWSHPQFEK(GGGS)2GGSAWSHPQFEK (SEQ ID №16), который коммерчески доступен в виде «Twin-Strep-tag®» в IBA GmbH, Gottingen, Germany). На фиг. 20A показан образцовый проточный цитометрический анализ для фракции Аг-специфических клеток, которые пролиферировали при использовании комплекса пептид:MHC-I, специфичного для этого эпитопа HLA-C7/IE-1, в качестве первого средства, которое обеспечивает первичный сигнал активации для клеток, обратимо иммобилизованных на растворимом олигомерном мутеине стрептавидина. Графики на фиг. с 20B до 20E иллюстрируют кинетику размножения дополнительных Аг-специфичностей в соответствии с числом положительных по специфичному пептиду:MHCI и мультимеру клеток, собранных на момент времени по аналогии с фиг. 20A, используя отдельные комплексы антиген-специфического пептида с молекулой MHCI в качестве первого средства, которое обеспечивает первичный сигнал активации для клеток, обратимо иммобилизованных на растворимом олигомерном мутеине стрептавидина. Более подробно, на фиг. 20B показано размножение Аг-специфических клеток, которые размножали с использованием комплекса пептид : MHC-I, специфичного для эпитопа pp65 из CMV (аминокислоты 341-350 (QYDPVAALF)(SEQ ID №39), ограниченные с помощью HLA-A2402), на фиг. 2°C показано размножение Аг-специфических клеток, которые размножали с использованием другого комплекса пептид : MHC-I, специфичного для эпитопа pp65 из CMV (аминокислоты 265-274 (RPHERNGFTV)(SEQ ID №40), ограниченного с помощью HLA-B702), на фиг. 20D показано размножение Аг-специфических клеток, которые пролиферировали при использовании комплекса пептид : MHC-I, специфичного для эпитопа гексона 5 аденовирусов (аминокислоты 114-124 (CPYSGTAYNSL)(SEQ ID №41), ограниченного с помощью HLA-B702), на фиг. 20E показано размножение Аг-специфических клеток, которые пролиферировали при использовании комплекса пептид : MHC-I, специфичного для эпитопа HLA-B7/IE-1309-317 из CMV (данные образцовой FACS см. выше, фиг. 20A). Все пептид : молекулы MHC, несущие метку Twin Strep®, коммерчески доступны в IbaGmbH. В этом контексте аминокислотные последовательности молекул HLA-A*2402, HLA-B*0702 и HLA-C*0702, которые несут «Twin-Strep-tag®» в качестве своего C-конца, представлены в виде SEQ ID №42, 43 и 44 в сопроводительных списках последовательностей, тогда как аминокислотная последовательность микроглобулина β2 (который формирует вместе с α цепью, что обозначает кодируемые молекулы HLA, соответствующие молекуле MHCI) представлена в виде SEQ ID №45 в сопроводительном списке последовательностей. Кроме того, на фиг. 20F показан образцовый проточный цитометрический анализ поверхностной экспрессии CD62L и CD127 после 14 суток культуры для HLA-B7/Hexon5114-124-стимулированных/размноженных клеток с фиг. 20D.
[0157] На фиг. 21 представлена кинетика избирательного Аг-специфического размножения из очищенных CD3+CD62L+CD45RA-Tcm клеток-респондентов, которые стимулировали in vitro с использованием a) антиген-специфических пептидных комплексов MHCI и b) αCD28 Fab-фрагментов, которые обратимо иммобилизовали в качестве первого и второго средства на растворимых олигомерных мутеинах стрептавидина. С этой целью 500000 CD3+CD62L+CD45RA-Tcm клеток-респондентов (Tresp) стимулировали Аг-специфически с использованием 3 мкл препарата реактива мультимеризации Streptactin, функционализированного с использованием 0,5 мкг комплексов пептидов : MHC класса I, оснащенных стрептавидин-связывающим пептидом (специфичный пептид представляет аминокислоты 114-124 (CPYSGTAYNSL, SEQ ID №41) белка гексон 5 аденовируса, который ограничен с помощью HLA-B0702, см. выше), и 0,5 мкг αCD28 Fab. В качестве альтернативы, 4,5 мкл препарата реактива мультимеризации Streptactin, нагруженного с использованием 0,5 мкг этого комплекса пептида : MHC класса I, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab. Для сравнения, поликлональную стимуляцию осуществляли, используя 3 мкл препарата реактива мультимеризации Streptactin (1 мг/мл), загруженного с использованием или комбинации 0,5 мкг αCD3 Fab и 0,5 мкг αCD28 Fab. Снова, в качестве альтернативных условий стимуляции, описанных выше, использовали 4,5 мкл препарата мультимеров Streptactin, нагруженных с использованием 0,5 мкг αCD3 Fab, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab. Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля и клетки Tresp, стимулированные поликлонально бусами против CD3/против CD28, в качестве положительного контроля. Клетки Tresp высевали в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2 и 5 нг/мл IL-15. Клетки инкубировали при 37°C с заменой среды каждые 3 суток и число клеток анализировали после 7 и 14 суток. Фотографии, приведенные на фиг. 21, представляют степень формирования кластера в сутки 5 для Аг-специфической стимуляции, как показано на примере для HLA-B7/эпитопа гексона 5 аденовируса.
[0158] На фиг. 22A и 22B показана активация внутриклеточных сигнальных каскадов трансдуцированных клеток Jurkat, которые модифицировали для того, чтобы экспрессировать αCD19 химерный антигенный рецептор (CAR), и которые стимулировали с использованием олигомерного Strep-tactin® из примера 3 в качестве растворимого реактива мультимеризации. Специфичность CAR обычно извлекают из scFv-области, собранной из антигенсвязывающей области моноклонального антитела (mAb), которое специфически связывает целевой/опухолеассоциированный антиген, такой как CD19, и связывает его со специфической передачей сигналов T-клеток (описано в Hudecek et al, Clin Cancer Res. 2013 June 15; 19(12): 3153-3164. В экспериментах внеклеточный домен (ECD) из CD19, который содержит естественный лиганд αCD19 CAR, а также поликлональный αIgG F(ab)2 фрагмент, который распознает спейсер IgG4 (F(ab)2 осла против человека, коммерчески доступный в Jackson Immuno Research) в αCD19-CAR, также использовали в этом эксперименте в качестве первого средства, которое обеспечивает первичный сигнал активации для клеток Jurkat. Обратимую иммобилизацию на растворимом олигомерном мутеине стрептавидина обеспечивали с помощью пептида стрептавидина SAWSHPQFEK(GGGS)2GGSAWSHPQFEK (SEQ ID №16), который сливали с C-концом ECD из CD19, или с помощью биотинилированного (Fab)2 фрагмента из αIgG (поскольку мутеин стрептавидина «m2» связывает биотин со сниженной аффинностью, это связывание является обратимым и, например, может быть вытеснено посредством добавления избытка свободного биотина). В контрольном эксперименте с фиг. 22A 300000 CD3+ клеток-респондентов Jurkat (Jresp) стимулировали различными количествами смеси препаратов олигомерного Streptactin (1 мг/мл), который функционализировали с использованием αCD3 Fab и αCD28 Fab («1×» соответствует 3 мкг мультимеризованного Streptactin, функционализированного с использованием 0,5 мкг aCD3- и 0,5 мкг aCD28 Fab - поликлонального мультимера Streptamer). В эксперименте с фиг. 22B 3 мкл препарата олигомерного Streptactin функционализировали с использованием 0,5 мкг (×1) или 1 мкг (×2) внеклеточного домена (ECD) из CD19 или с использованием 3 мкл препарата олигомерного Streptactin, нагруженного с использованием 0,5 мкг (×1) или 1 мкг (×2) αIgG, которое распознает спейсер IgG4, (оба они являются CAR-специфическими мультимерами Streptamer®). Jresp, стимулированные бусами против CD3/против CD28 (бусами, на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28) или PMA и иономицином, служили в качестве положительных контролей. Клетки Jresp высевали в 1,5 мл пробирки Eppendorf в 200 мкл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C и помещали на лед и лизировали после от 0 мин до 20 мин стимуляции.
[0159] На фиг. 23 представлены точечные диаграммы для экспрессии маркера поверхности CD4+ (ось y) и CAR (ось x) на живых T (гейт CD3+), трансдуцированных вирусными векторами в присутствии (1) магнитных бус против CD3/против CD28 и адъюванта протамина сульфата, (2) магнитных бус против CD3/против CD28 и олигомерного белкового реактива, имеющего обратимо связанный Fab против CD8, или (3) только олигомерного белкового реактива, имеющего обратимо связанные Fab против CD3/против CD28.
Подробное описание
[0160] В настоящем описании предусмотрен способ трансдукции клеток посредством приведения в контакт, например, культивирования или инкубации, клетки-мишени, такой как композиция клеток, с олигомерным белковым реактивом и вирусной векторной частицей. В некоторых вариантах осуществления олигомерный белковый реактив представляет собой реактив мультимеризации, имеющий обратимо связанное с ним множество связывающих средств, таких как вирусное связывающее средство или средство отбора. В некоторых вариантах осуществления способ относится к системам обратимых реактивов, в которых реактив мультимеризации инкубируют в присутствии клеток-мишеней и вирусных частиц в условиях, в которых реактив мультимеризации связывается с одной или несколькими молекулами на поверхности клетки-мишени и/или вирусных частиц, тем самым создавая композицию, содержащую множество клеток-мишеней, трансдуцированных вирусным вектором. Также предусмотрены композиции и промышленные изделия, такие как наборы, содержащие вирусные векторы и олигомерный реактив, и устройства и системы для использования в связи с предоставленным способом. В некоторых вариантах осуществления композиции и наборы можно использовать в способах и использованиях в соответствии с предоставленным раскрытием.
[0161] Все публикации, в том числе патентные документы, научные статьи и базы данных, упоминаемые в данной заявке, включены в данное описание посредством ссылки в полном объеме для всех целей в той же степени, как если бы каждую индивидуальную публикацию индивидуально включили по ссылке. Если определение, приведенное в настоящем описании, противоречит или иным образом не соответствует определению, приведенному в патентах, заявках, опубликованных заявках и других публикациях, которые включены в настоящее описание посредством ссылки, определение, приведенное в в настоящем описании, преобладает над определением, которое включено в настоящее описание посредством ссылки. Например, содержание международной заявки PCT № PCT/EP 2015/058339 включено посредством ссылки в полном объеме.
[0162] Заголовки разделов, используемые в настоящем описании, служат только организационным целям и не подлежат толкованию в качестве ограничения описанного объекта изобретения.
I. ОБЗОР СПОСОБОВ ТРАНСДУКЦИИ КЛЕТОК
[0163] В настоящем описании предусмотрен способ трансдукции клеток посредством приведения в контакт, например, культивирования или инкубации, композиции клеток с олигомерным белковым реактивом и вирусной векторной частицей. В некоторых вариантах осуществления клетки приводят в контакт или инкубируют с олигомерным белковым реактивом и вирусными частицами одновременно или отдельно. В некоторых вариантах осуществления вирусные частицы и олигомерные реактивы смешивают и смесь приводят в контакт или инкубируют с клетками. В некоторых вариантах осуществления предоставленные способы обеспечивают более эффективную трансдукцию клеток по сравнению со способами, использующим трансдукцию со стандартными адъювантами (такими как Retronectin® или поликатионы).
[0164] В некоторых вариантах осуществления предоставленные способы основаны на обнаружении того, что мутеины стрептавидина, такие как олигомерная форма мутеина стрептавидина, облегчают вирусную трансдукцию. В некоторых аспектах, результаты показывают, что реактив олигомерного мутеина стрептавидина согласованно ведет к более высокой эффективности трансдукции клеток по сравнению со способами с использованием других активирующих реактивов или по сравнению с трансдукцией, выполняемой с другими адъювантами. В некоторых вариантах осуществления олигомерный белок (например, стрептавидин) способен к ассоциации, например, связыванию или взаимодействию, с вирусными частицами. В некоторых вариантах осуществления олигомерный белковый реактив (например, олигомерный мутеин стрептавидина) имеет суммарный положительный заряд.
[0165] В некоторых аспектах, увеличенной эффективности трансдукции достигают с использованием голого олигомерного белкового реактива (например, мутеина стрептавидина), который не или не должен быть конъюгирован или ассоциирован с другим связывающим фрагментом или средством для связывания с молекулой на поверхности клетки или вируса. В некоторых вариантах осуществления олигомерный белковый реактив (например, мутеин стрептавидина) не содержит или не конъюгирован с вирусным связывающим средством. В некоторых вариантах осуществления олигомерный белковый реактив (например, мутеин стрептавидина) не содержит или не конъюгирован со связывающим средством, специфичным для молекулы на поверхности клетки, такой как клетка иммунной системы, например, средством отбора или стимулирующим средством. Понятно, что хотя такие связывающие средства могут не быть необходимыми для увеличения эффективности трансдукции, в некоторых аспектах, олигомерный белковый реактив (например, мутеин стрептавидина) может содержать, например, может быть конъюгирован (например, обратимо конъюгирован) со связывающим средством, таким как вирусное связывающее средство, средство отбора или стимулирующее средство. В некоторых вариантах осуществления добавление связывающего средства, например, вирусного связывающего средства или средства отбора, связанного с олигомерным белковым реактивом, может усиливать, модулировать и/или избирательно направленно воздействовать на трансдукцию клеток.
[0166] В некоторых вариантах осуществления в способах используют реактивы, которые могут представлять собой реактив мультимеризации, с которым связано одно или более средств, например, первое средство, второе средство и т. д., которые способны к специфическому связыванию с молекулой на поверхности вирусной частицы и/или на поверхности одной или нескольких клеток-мишеней. В некоторых вариантах осуществления реактив мультимеризации имеет связанное с ним вирусное связывающее средство, которое связывается с молекулой на поверхности вирусной частицы, такой как молекула, присутствующая на вирусной оболочке или в качестве ее части. В некоторых вариантах осуществления реактив, например, реактив мультимеризации может таким образом иметь связанную с ним одну или более вирусных частиц, которые могут быть связаны с реактивом через связывающее вирусную частицу средство. В некоторых вариантах осуществления реактив мультимеризации имеет связанное с ним средство отбора, которое связывается с молекулой на поверхности клеток, например, селективным маркером, экспрессируемым одной или несколькими из по меньшей мере множества клеток-мишеней. В некоторых аспектах, средства, например, первое средство, второе средство и т.д., могут или быть связаны обратимо или также необратимо с реактивом мультимеризации.
[0167] Таким образом, реактив мультимеризации предусматривает обычно больше чем один сайт связывания, например, Z1, в котором, в некоторых случаях, множество средств может быть обратимо связано для того, чтобы представлять первое средство, второе средство и/или другие средства с достаточной плотностью для популяции клеток. В некоторых вариантах осуществления реактив мультимеризации содержит по меньшей мере один сайт связывания Z, например, Z1, для обратимого связывания первого средства, и первое средство также содержит по меньшей мере один партнер связывания C, например, C1, где партнер связывания C, например, C1, способен к обратимому связыванию с сайтом связывания Z, например, Z1, реактива мультимеризации. В некоторых аспектах, следует отметить, что средство мультимеризации может по существу иметь множество сайтов связывания, например, Z1, например, мутеин стрептавидина (который является гомотетрамером) в своем нативном состоянии имеет четыре таких сайта связывания, например, Z1, и дополнительно может быть олигомеризован. В некоторых случаях реактив может иметь только один сайт связывания, например, Z1, для обратимого связывания партнера связывания, например, C1. Таким примером является мультимерный кальмодулин. Кальмодулин по существу имеет только один сайт связывания для кальмодулин-связывающих пептидов. Однако кальмодулин можно биотинилировать и затем проводить реакцию с олигомерами стрептавидина (см. также далее), тем самым предоставляя реактив мультимеризации, в котором множество молекул кальмодулина представлены с высокой плотностью на «каркасе», тем самым предоставляя мультимерный кальмодулин.
[0168] Таким образом, первое средство, когда приводят в контакт или инкубируют с реактивом мультимеризации, может быть обратимо связано с реактивом мультимеризации через обратимую связь, образуемую между партнером связывания C, например, C1, и сайтом связывания Z, например, Z1. Кроме того, второе средство может содержать партнер связывания C, например, C2, где партнер связывания C2 способен к обратимому связыванию с сайтом связывания Z, например, Z2, соответственно, реактива мультимеризации. В некоторых вариантах осуществления второе средство, когда его приводят в контакт или инкубируют со средством мультимеризации, обратимо связывают с реактивом мультимеризации через обратимую связь, образуемую между партнером связывания C, например, C1, и сайтом связывания Z, например, Z2. В некоторых случаях, C1 и C2 могут представлять собой одно и то же или по существу одно и то же и/или содержать один и тот же или по существу один и тот же фрагмент. В некоторых случаях, Z1 и Z2 могут представлять собой одно и то же или по существу одно и то же и/или содержать один и тот же или по существу один и тот же фрагмент.
[0169] В некоторых вариантах осуществления диссоциацию или разрушение связывания между реактивом мультимеризации и средством, например, вирусным связывающим средством, средством отбора или другим средством, как описано, можно обращать или разрушать посредством инкубации в присутствии конкурентного реактива или вещества. В некоторых вариантах осуществления, использование в качестве партнеров связывания C1 и C2, фрагментов, которые связываются с одним и тем же сайтом связывания средства мультимеризации, имеет такое преимущество, что один и тот же конкурентный реактив (первого партнера связывания C1 и также второго партнера связывания C2) или его аналога можно использовать для того, чтобы разрушать, и в некоторых случаях прерывать, высвобождение связывания популяции клеток-мишеней (например, T-клеток) из реактива мультимеризации и, таким образом, в зависимости от конкретного связывающего средства, прерывать трансдукцию, отбор, стимуляцию или активацию и/или размножение популяции клеток-мишеней (например, T-клеток).
[0170] В некоторых аспектах, связывающее средство, например, вирусное связывающее средство, средство отбора или другое средство, как описано, представляет собой антитело или антигенсвязывающий фрагмент. В некоторых вариантах осуществления аффинность связывания молекул антител в направлении их антигена, в том числе, например, молекулы рецептора клеточной поверхности, обычно находится в диапазоне аффинностей KD от 10-7 M до 10-13 M. Таким образом, стандартные моноклональные антитела можно использовать в качестве средства (первого или второго, рецептор-связывающего, например, стимулирующего средства или средства отбора). В некоторых вариантах осуществления во избежание любых нежелательных эффектов авидности, которые ведут к более сильному связыванию, моноклональные антитела также можно использовать в форме их одновалентных фрагментов антитела, таких как Fab-фрагменты или одноцепочечные Fv-фрагменты.
[0171] В некоторых случаях для получения связывающих средств (например, первого средства, второго средства и т.д., таких как вирусное связывающее средство, средство отбора или рецептор-связывающие средства, например, стимулирующие средства), которые содержат партнер связывания C, партнер связывания C, например, C1 или C2, можно предоставлять с помощью соответствующего экспрессирующего вектора, используемого для рекомбинантного получения средства (например, фрагмента антитела) с тем, чтобы партнер связывания C, например, C1 или C2, представлял собой часть пептида слияния со средством на N-конце или C-конце. В некоторых вариантах осуществления в контексте средства, которое представляет собой антитело или антигенсвязывающий фрагмент, партнер связывания C, например, C1 или C2, может присутствовать на C-конце легкой или тяжелой цепи. Также этот способ клонирования рекомбинантного белка, такого как вариабельные домены молекулы антитела, и рекомбинантного получения соответствующего белка, например, фрагмента антитела, хорошо известен специалисту в данной области, см. например, Skerra, A. (1994). В некоторых вариантах осуществления молекулу антитела можно создавать из искусственных связывающих молекул с антителоподобными свойствами против заданной мишени, такой как CD3 или CD28 или другие молекулы вспомогательных или стимулирующих средств, как описано, например, в общеизвестных эволюционных способах, таких как фаговый дисплей (рассмотрен, например, в Kay, B.K. et al. (1996) Phage Display of Peptides and Proteins - A Laboratory Manual, 1-е изд., Academic Press, New York NY; Lowman, H.B. (1997) Annu. Rev. Biophys. Biomol. Struct. 26, 401-424, или Rodi, D.J., and Makowski, L. (1999) Curr. Opin. Biotechnol. 10, 87-93), рибосомный дисплей (рассмотрен в Amstutz, P. et al. (2001) Curr. Opin. Biotechnol. 12, 400-405) или мРНК дисплей, как сообщалось в Wilson, D.S. et al. (2001) Proc. Natl. Acad. Sci. USA 98, 3750-3755.
[0172] В некоторых вариантах осуществления предоставленные реактивы и способы с использованием таких реактивов включают признаки, которые ведут увеличенной трансдукции клеток иммунной системы и/или определенных их популяций и/или субпопуляций, в том числе тех, которые желательны для использования в адоптивной иммунотерапии. В некоторых вариантах осуществления способы предусматривают способность к трансдукции клеток с той же или более высокой эффективностью трансдукции по сравнению с доступными способами, такими как способы, в которых трансдукцию осуществляют с использованием стандартного адъюванта, например, реактивов Retronectin® или поликатионных адъювантов (например, протамина сульфата). В некоторых вариантах осуществления, несмотря на то, что другие такие адъюванты могут облегчать контакт между вирусом и клеткой-мишенью, подлежащей инфицированию, также они могут вести к токсическим эффектам в клетках. Например, существующие протоколы, в которых используют Retronectin® в качестве адъюванта трансдукции, рекомендуют незамедлительную замену среды после стадии трансдукции. В некоторых случаях, это может ограничивать концентрацию стандартных адъювантов, которые можно использовать, и таким образом общую эффективность трансдукции.
[0173] В отличие от этого, предоставленные олигомерные реактивы, такие как реактивы, содержащие мутеины стрептавидина, в том числе реактивы мультимеризации, можно сохранять в клеточной культуре в течение длительных периодов времени без токсического эффекта. В некоторых вариантах осуществления предоставленные способы трансдукции можно осуществлять без удаления олигомерного реактива, такого как реактив мультимеризации, из клетки до или во время приведения в контакт с вирусными частицами и клетками. В некоторых вариантах осуществления нет необходимости удалять олигомерный реактив, такой как реактив мультимеризации, во время по меньшей мере части дополнительной инкубации клеток, такой как дополнительная инкубация для размножения трансдуцированных клеток.
[0174] В некоторых вариантах осуществления клетки содержат одну или более нуклеиновых кислот, введенных генетической инженерией в соответствии с предоставленными способами, и тем самым экспрессируют рекомбинантные или генетически сконструированные продукты таких нуклеиновых кислот. В некоторых вариантах осуществления нуклеиновые кислоты являются гетерологичными, т. е., обычно не присутствуют в клетке или образце, полученном из клетки, таком как тот, который получен из другого организма или клетки, который, например, как правило, не находят в клетке, подлежащей генетическому конструированию, и/или организме, из которого такую клетку извлекают. В некоторых вариантах осуществления нуклеиновые кислоты не являются встречающимися в природе, такими как нуклеиновая кислота, которую не находят в природе, в том числе так, которая содержит химерные комбинации нуклеиновых кислот, кодирующих различные домены из нескольких различных типов клеток.
[0175] В некоторых вариантах осуществления предоставленные способы ведут к эффективности трансдукции, которая увеличена по меньшей мере или приблизительно по меньшей мере в 1,2 раза, 1,5 раза, 2,0 раза, 3 раза, 4 раза, 5 раз или больше по сравнению с трансдукцией, выполняемой в присутствии стандартного адъюванта, например, реактива Retronectin® или поликатионного адъюванта. В некоторых вариантах осуществления увеличенную эффективность трансдукции, такую как усиление или содействие трансдукции в конкретных клетках, оценивают посредством измерения уровня экспрессии рекомбинантного белка, такого как гетерологичный белок, кодируемый нуклеиновой кислотой, содержащейся в геноме ретровирусного вектора, после трансдукции или другой формы переноса вектора в клетку, такую как T-клетка. Усиление можно измерять посредством определения относительной степени такой экспрессии по сравнению с трансдукцией, которую осуществляют способом, не включающим олигомерный белковый реактив или реактив мультимеризации, таким как способ, выполняемый вместо него в присутствии стандартного адъюванта. Можно использовать множество общеизвестных способов оценки уровня экспрессии рекомбинантных молекул, таких как обнаружение с помощью способов, основанных на аффинности, например, способов, основанных на иммуноаффинности, например, в контексте белков клеточной поверхности, например, посредством проточной цитометрии. В некоторых примерах, экспрессию измеряют посредством обнаружения маркера трансдукции и/или конструкции репортера. В некоторых вариантах осуществления в вектор включают нуклеиновую кислоту, кодирующую усеченный белок поверхности, которую используют в качестве его маркера экспрессии и/или усиления.
[0176] В некоторых аспектах, реактив, такой как олигомерный белковый реактив, представляет собой средство мультимеризации, которое обратимо связывают или ассоциируют со средством отбора, способным к специфическому связыванию с молекулой на поверхности клетки для того, чтобы предпочтительно направленно осуществлять трансдукцию клеток, экспрессирующих маркер. В некоторых вариантах осуществления конкретную субпопуляцию клеток в большей популяции можно избирательно трансдуцировать по сравнению с одной или несколькими другими клетками в популяции. В некоторых случаях, эффективность трансдукции конкретной субпопуляции клеток можно увеличивать больше чем или больше чем приблизительно в 1,2 раза, 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раза, 6,0 раза, 7,0 раза, 8,0 раза, 9,0 раза, 10 раз или больше по сравнению с другими клетками в смешанной популяции клеток. В некоторых вариантах осуществления направленное воздействие на субпопуляцию в смешанной культуре может обеспечивать существенный эффект. В некоторых вариантах осуществления такие процессы могут просто такой процесс изготовления, в котором уменьшены ресурсы, необходимые для заблаговременной очистки популяции клеток. В некоторых вариантах осуществления предоставленные способы генетического конструирования клеток не включают стадию отбора клеток перед приведением клеток в контакт с олигомерным белковым реактивом (мутеином стрептавидина) для трансдукции вирусной частицей, где такой олигомерный белковый реактив обратимо связывают со средством отбора, направленно воздействующим на трансдукцию конкретной популяции клеток.
[0177] В некоторых вариантах осуществления предоставленные реактивы и способы имеют дополнительные преимущества. В целом, можно использовать векторы, основанные на ретровирусах для стабильного встраивания генов, представляющих интерес, в клетки. В целом, трансдукция T-клеток с использованием существующих ретровирусных векторов требует активации T-клеток посредством вовлечения T-клеточного рецептора (TCR) или посредством цитокиновой стимуляции. В некоторых случаях, доступные процедуры для получения генетически сконструированных T-клеток для адоптивной иммунотерапии могут требовать последовательных стадий отбора, активации, трансдукции и размножения ex vivo. Однако такие стадии обработки могут не всегда быть желаемыми для получения клеток для определенных способов адоптивной иммунотерапии, например, из-за сложности множественных стадий обработки, стоимости и воспроизводимости. В некоторых аспектах, предоставленные способы допускают одновременное, а не последовательное, осуществление одной или нескольких из этих стадий.
[0178] В некоторых вариантах осуществления способы включают другие стадии обработки, в том числе одну или более из отбора, выделения, стимуляции, активации и/или размножения клеток. В некоторых вариантах осуществления один и тот же олигомерный реактив, такой как реактив мультимеризации, используемый для того, чтобы модулировать трансдукцию, можно использовать в одной или нескольких из этих других стадий обработки, например, который можно использовать для того, чтобы отбирать клетки и/или активировать клетки и/или модулировать трансдукцию клеток. В некоторых вариантах осуществления олигомерный реактив может представлять собой реактив мультимеризации, с которым связано связывающее средство, специфичное для молекулы на поверхности клеток, чтобы содействовать одному или нескольким из отбора, активации, стимуляции и/или размножения клеток. В некоторых вариантах осуществления одно или более из отбора клеток, активации клеток, модуляции трансдукции клеток и/или размножения клеток, осуществляют в присутствии одного и того же олигомерного реактива, такого как один и тот же мультимерный реактив, что, в некоторых случаях, можно осуществлять в качестве части непрерывного или полунепрерывного процесса, необязательно в закрытой системе. В некоторых вариантах осуществления предоставленные способы можно использовать в способах, связанных с обработкой клеток, в том числе получением клеток для терапевтических использований, например, для адоптивной клеточной терапии. В частности, раскрытие относится к способам, обеспечивающим преимущества над доступными способами обработки, такими как доступные способы для крупномасштабной обработки. Такие преимущества включают, например, сниженную стоимость, оптимизацию, увеличенный эффект, увеличенную безопасность и увеличенную воспроизводимость для различны субъектов и условий.
[0179] В целом, векторы, основанные на ретровирусах, можно использовать для стабильного встраивания генов, представляющих интерес, в клетки. Используя существующие ретровирусные векторы, не всегда возможно эффективно стабильно генетически конструировать устойчивые и/или не циклирующие клетки, например, для использования в клеточной терапии. Например, может не быть возможным эффективно трансдуцировать не циклирующие клетки иммунной системы, такие как не циклирующие миелоидные клетки или покоящиеся T-клетки, с использованием ретровирусного вектора и доступных способов. В некоторых случаях, чтобы трансдукция происходила в T-клетках, может быть необходима активация T-клеток посредством вовлечения T-клеточного рецептора (TCR) или посредством цитокиновой стимуляции. В некоторых случаях, доступные процедуры для получения генетически сконструированных T-клеток для адоптивной иммунотерапии могут требовать последовательных стадий отбора, активации, трансдукции и размножения ex vivo.
[0180] Например, включение стадии(й) активации и/или стимуляции, например, после отбора клеток, может увеличивать время, стоимость, реактивы и/или вовлечение пользователя в получение клеток для адоптивной клеточной терапии. Такие результаты могут увеличивать риск вариабельности между различными процессами и/или клетками от различных субъектов. Таким образом, в некоторых вариантах осуществления предоставленные способы благоприятны за счет одновременного отбора или обогащения популяции клеток, экспонирования популяции клеток для ретровирусной векторной частицы по сравнению с другими способами и/или активации или стимуляции таких клеток.
[0181] В некоторых аспектах, реактив, такой как олигомерный белковый реактив, можно обратимо связывать или ассоциировать со стимулирующим средством (например, против CD3 и/или против CD28) для того, чтобы модулировать трансдукцию и вызывать активацию клеток, которые можно осуществлять, в некоторых случаях, одновременно во время по меньшей мере части приведения в контакт или инкубации. В некоторых вариантах осуществления предоставленных способов трансдукции, клетки, например, T-клетки, в популяциях, подлежащих трансдукции, не или не должны быть стимулированы и/или активированы перед приведением в контакт или инкубацией клеток с предоставленным реактивом и вирусной частицей. В некоторых вариантах осуществления предоставленные способы с использованием олигомерного реактива, такого как олигомерный белковый реактив (например, мутеин стрептавидина), который представляет собой реактив мультимеризации, обратимо связанный или ассоциированный со стимулирующим средством (например, против CD3 и/или против CD28) ведут по меньшей мере к 1,2-кратному, 1,5-кратному, 2,0-кратному, 3-кратному, 4-кратному, 5-кратному или больше увеличению эффективности трансдукции по сравнению со способами, выполняемыми посредством сначала активации клеток с использованием другого активирующего реактива (например, покрытых магнитных частиц против CD3/против CD28), после которой следует трансдукция с использованием стандартного адъюванта. В некоторых аспектах, это является преимуществом над другими системами или способами, в которых отсутствует реактив трансдукции, который способен дополнительно доставлять сигнал специфической активации. Аналогичным образом, не существует известного активирующего реактива, который способен дополнительно действовать в качестве адъюванта трансдукции.
[0182] В некоторых вариантах осуществления стимулирующее средство, например, первое или второе стимулирующее средство, представляет собой то, которое способно к связыванию с молекулами на поверхности клеток-мишеней, тем самым предоставляя сигнал клеткам, который, в некоторых случаях, может представлять собой первичный сигнал активации и/или вспомогательный или костимулирующий сигнал. В некоторых вариантах осуществления первичного сигнала активации может по существу быть достаточно для того, чтобы активировать клетки для размножения/пролиферации. Реактив мультимеризации может быть связан также со вторым средством, которое стимулирует вспомогательную молекулу на поверхности клеток. Второе средство, при связывании со вспомогательной молекулой на поверхности на поверхности клеток, может тем самым стимулировать активированные клетки к размножению. Также это второе средство может быть связано или обратимо или также необратимо с реактивом мультимеризации.
[0183] В некоторых аспектах, способ, раскрытый в настоящем описании, может включать последовательное размножение популяции клеток, где полную популяцию лимфоцитов стимулируют/размножают, реактивы, необходимые для размножения, затем удаляют посредством хроматографии на подходящей стационарной фазе. В некоторых вариантах осуществления размноженные/стимулированные клетки, которые представляют собой культивируемые клетки, необязательно трансфицируют, например, T-клеточным рецептором или химерным антигенным рецептором (CAR) в соответствии с предоставленными способами и, в некоторых аспектах, их можно подвергать второму стимулированному размножению с использованием другой стимулирующей молекулы, которая связывается со введенным T-клеточным рецептором или химерным антигенным рецептором.
[0184] В некоторых вариантах осуществления, поскольку дозу клеток при адоптивной клеточной терапии определяют по числу клеток, которые экспрессируют рекомбинантный рецептор, более высокая эффективность трансдукции позволяет уменьшать время культивирования, необходимое для получения дозы продукта. Таким образом, в некоторых случаях, длительность процесса или процессов размножения популяции трансдуцированных клеток, например, дополнительная инкубация клеток со стимулирующим средством после трансдукции, уменьшают с помощью предоставленных способов, например, снижают по меньшей мере или приблизительно по меньшей мере на 20%, 30%, 40%, 50%, 60%, 70% или больше. В некоторых вариантах осуществления длительность процесса или процессов размножения популяции для достижения терапевтически эффективной дозы трансдуцированных клеток уменьшают больше чем или больше чем приблизительно на 2 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа или 96 часов. В некоторых вариантах осуществления общее время изготовления при конструировании терапевтически эффективной дозы генетически сконструированных клеток для адоптивной клеточной терапии уменьшают по меньшей мере или приблизительно по меньшей мере на 20%, 30%, 40%, 50%, 60%, 70% или больше.
[0185] В некоторых вариантах осуществления предоставленные способы можно осуществлять в закрытой системе, например, автоматизированным образом. Олигомерный белковый реактив, такой как реактив мультимеризации, может быть или иммобилизованным на твердом носителе или растворимым. В некоторых вариантах осуществления приведение в контакт или инкубацию клеток и/или вирусных частиц с олигомерным белковым реактивом (например, мутеином стрептавидина), таким как реактив мультимеризации, осуществляют в присутствии основы, такой как стационарная фаза или твердая фаза, которая в некоторых случаях представляет собой стационарную фазу или твердую фазу, с которой связывают средства отбора. В некоторых вариантах осуществления клетки и/или вирусные частицы, используемые для трансдукции, и необязательно клетки, отобранные, стимулированные и/или активированные, ассоциируют с предоставленными реактивами в стационарной фазе, например, в некоторых случаях, иммобилизованными, в целом опосредованно, например, в некоторых случаях, иммобилизованными, в целом опосредованно, на ней.
[0186] Также предусмотрены композиции, наборы и устройства для осуществления способа в соответствии с предоставленным раскрытием, например, для получения генетически сконструированных клеток для адоптивной клеточной терапии. В некоторых аспектах, клетки выделяют у субъекта, конструируют в соответствии с предоставленным способом и вводят тому же субъекту. В других аспектах, их выделяют у одного субъекта, конструируют в соответствии с предоставленным способом и вводят другому субъекту.
II. СИСТЕМЫ РЕАКТИВОВ ДЛЯ ТРАНСДУКЦИИ КЛЕТОК
[0187] В настоящем описании предусмотрены способы, в которых используют реактивы, такие как олигомерные реактивы, в качестве адъюванта трансдукции. В некоторых вариантах осуществления тот же олигомерный реактив или, в некоторых случаях, другой олигомерный реактив также можно предоставлять в качестве реактива мультимеризации, с которым подлежит связыванию одно или более связывающих средств для использования в способах активации или стимуляции клеток перед трансдукцией, чтобы отбирать или предпочтительно направленно воздействовать на конкретные подмножества клеток для трансдукции и/или для стимуляции или размножения клеток.
[0188] В некоторых вариантах осуществления реактив представляет собой олигомерный белковый реактив. В некоторых вариантах осуществления реактив содержит одну или более полипептидных последовательностей из по меньшей мере или приблизительно по меньшей мере 10, 20, 30, 40 аминокислот в длину, например, по меньшей мере или приблизительно по меньшей мере или приблизительно 50, 60, 65, 70, 80, 90, 125, 150, 200, 250, 300 или больше аминокислот в длину. В некоторых вариантах осуществления олигомерный реактив содержит множество полипептидных мономерных единиц, где каждая мономерная единица содержит полипептидные последовательности из по меньшей мере или приблизительно по меньшей мере 10, 20, 30, 40 аминокислот в длину, например, по меньшей мере или приблизительно по меньшей мере или приблизительно 50, 60, 65, 70, 80, 90, 125, 150, 200, 250, 300 или больше аминокислот в длину. В некоторых вариантах осуществления олигомерный белок представляет собой димер, тример, тетрамер или олигомер высокого порядка. В некоторых вариантах осуществления олигомерный белковый реактив содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 60 или больше мономерных единиц. В некоторых вариантах осуществления каждая мономерная единица представляет собой одно и то же. В некоторых вариантах осуществления олигомерный реактив содержит вплоть до двух, трех, четырех или больше различных мономерных единиц. В некоторых вариантах осуществления реактив имеет суммарный положительный заряд или общий положительный заряд.
[0189] В некоторых вариантах осуществления способы, предоставленные в настоящем описании, включают инкубацию множества клеток-мишеней с олигомерным белковым реактивом и вирусной частицей, где олигомерный белковый реактив содержит множество полипептидных мономерных единиц, где каждая единица составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину и/или имеет молекулярную массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа; и/или олигомерный белковый реактив имеет молекулярную массу или имеет усредненную молекулярную массу по меньшей мере или приблизительно 100 кДа, и способами получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0190] В некоторых вариантах осуществления олигомерный реактив имеет молекулярную массу или реактивы в композиции имеют усредненную молекулярную масса по меньшей мере или приблизительно по меньшей мере 50 кДа, по меньшей мере или приблизительно по меньшей мере 100 кДа, по меньшей мере или приблизительно по меньшей мере 300 кДа, по меньшей мере или приблизительно по меньшей мере 500 кДа, по меньшей мере или приблизительно по меньшей мере 1000 кДа, по меньшей мере или приблизительно по меньшей мере 1250 кДа, по меньшей мере или приблизительно по меньшей мере 1500 кДа, по меньшей мере или приблизительно по меньшей мере 2000 кДа,
[0191] В некоторых вариантах осуществления олигомерный реактив имеет молекулярную массу или реактивы в композиции имеют усредненную молекулярную масса между или приблизительно от 50 кДа приблизительно до 2000 кДа, приблизительно от 50 кДа приблизительно до 1000 кДа, приблизительно от 50 кДа приблизительно до 500 кДа, приблизительно от 100 кДа до 2000 кДа, приблизительно от 100 кДа приблизительно до 1000 кДа, приблизительно от 100 кДа приблизительно до 500 кДа, приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа, приблизительно от 1500 кДа приблизительно до 2000 кДа, приблизительно от 50 кДа до 100 кДа, от 50 кДа до 500 кДа или от 100 кДа до 500 кДа.
[0192] В некоторых вариантах осуществления реактив представляет собой или содержит стрептавидин или авидин или их мутеины. В некоторых вариантах осуществления стрептавидин может представлять собой стрептавидин дикого типа, мутеины или аналоги стрептавидина, такие как стрептавидиноподобные полипептиды. Аналогичным образом, авидин, в некоторых аспектах, включает авидин дикого типа или мутеины или аналоги авидина, такие как нейтравидин, дегликозилированный авидин с модифицированными аргининами, который обычно демонстрирует более нейтральную pi и доступен в качестве альтернативы нативному авидину. В целом, дегликозилированные, нейтральные формы авидина включают те коммерчески доступные формы, такие как «Extravidin», который доступен в Sigma Aldrich, или «Neutravidin», который доступен в Thermo Scientific или Invitrogen, например.
[0193] В некоторых вариантах осуществления реактив содержит последовательность аминокислот, приведенную в SEQ ID №1, 2, 3, 4, 5, 6, 27 или 28, или последовательность аминокислот, которая обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокой идентичностью последовательностей с любой из SEQ ID №№1, 2, 3, 4, 5, 6, 27 или 28.
A. Системы обратимых реактивов
[0194] В некоторых вариантах осуществления в способах используют обратимые системы, в которых по меньшей мере одно средство (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство), способное к связыванию с молекулой на поверхности биологической частицы, например, клетки, микроорганизма или вирусной частицы, обратимо ассоциировано с реактивом. В некоторых случаях реактив содержит множество сайтов связывания, способных к обратимому связыванию со средством. В некоторых случаях реактив представляет собой реактив мультимеризации. В некоторых вариантах осуществления по меньшей мере одно средство (например, рецептор-связывающее средство, средство отбора, связывающее вирусную частицу средство) содержит по меньшей мере один сайт связывания (B или V), который может специфически связывать эпитоп или область молекулы и также содержит партнер связывания C, который специфически связывается с по меньшей мере одним сайтом связывания Z реактива. В некоторых случаях, взаимодействие связывания между партнером связывания C и по меньшей мере одним сайтом связывания Z представляет собой нековалентное взаимодействие. В некоторых вариантах осуществления взаимодействие связывания, такое как нековалентное взаимодействие, между партнером связывания C и по меньшей мере одним сайтом связывания Z является обратимым.
[0195] В некоторых вариантах осуществления обратимое ассоциирование может быть опосредовано присутствием вещества, такого как конкурентный реактив (также называемый реактив-элюент), который представляет собой или содержит сайт связывания, который также способен к связыванию с по меньшей мере одним сайтом связывания Z. В целом, вещество (например, конкурентный реактив) может действовать в качестве конкурента из-за более высокой аффинности связывания для сайта связывания Z, присутствующего в реактиве и/или из-за присутствия в более высоких концентрациях, чем партнер связывания C, тем самым отсоединяя и/или диссоциируя партнер связывания C от реактива. В некоторых вариантах осуществления аффинность вещества (например, конкурентного реактива) к по меньшей мере одному сайту связывания Z больше аффинности партнера связывания C средства (например, рецептор-связывающего средства, средства отбора или связывающего вирусную частицу средства) к по меньшей мере одному сайту связывания Z. Таким образом, в некоторых случаях, связь между сайтом связывания Z реактива и партнером связывания C средства (например, рецептор-связывающего средства, средства отбора или связывающего вирусную частицу средства) можно разрушать посредством добавления вещества (например, конкурентного реактива), тем самым делая ассоциирование средства (например, рецептор-связывающего средства, средства отбора или связывающего вирусную частицу средства) и реактива обратимым.
[0196] Реактивы, которые можно использовать в таких обратимых системах, описаны и известны в данной области, см. например, патенты США №№5168049; 5506121; 6103493; 7776562; 7981632; 8298782; 8735540; 9023604; и международные опубликованные заявки PCT №№ WO 2013/124474 и WO 2014/076277. Неограничивающие примеры реактивов и партнеров связывания, способных к формированию обратимого взаимодействия, а также веществ (например, конкурентных реактивов), способных к обращению такого связывания, описаны далее.
1. Реактив
[0197] В некоторых вариантах осуществления реактив содержит один или множество сайтов связывания Z, которые способны к обратимому связыванию с партнерами связывания C, содержащимися в средстве (например, рецептор-связывающем средстве, средстве отбора или связывающем вирусную частицу средстве). В некоторых вариантах осуществления реактив содержит множество сайтов связывания Z, каждый из которых способен к специфическому связыванию с партнером связывания C, который содержится в средстве, так что реактив способен к обратимому связыванию с множеством средств (например, множеством рецептор-связывающих средств, средством отбора и/или связывающими вирусную векторную частицу средствами), например, представляет собой реактив мультимеризации. В некоторых вариантах осуществления реактив представляет собой олигомер или полимер индивидуальных молекул (например, мономеров) или представляет собой олигомер или полимер комплексов субъединиц, которые образуют индивидуальную молекулу (например, тетрамер), где такой олигомер или полимер содержит по меньшей мере один сайт связывания Z. В некоторых вариантах осуществления реактив содержит по меньшей мере два сайта связывания Z, по меньшей мере три сайта связывания Z, по меньшей мере четыре сайта связывания Z, например, по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72 или больше сайтов связывания Z. Все сайты связывания могут представлять собой одно и то же или множество сайтов связывания может содержать один или более различных сайтов связывания (например, Z1, Z2, Z3 и т.д.).
[0198] В некоторых вариантах осуществления одно или более средств, например, два или больше средств, (например, рецептор-связывающее средство, средство отбора и/или связывающее вирусную векторную частицу средство) ассоциируют с, например, обратимо связывают с, реактивом, например, через один или множество сайтов связывания Z, присутствующих на реактиве. В некоторых случаях, это ведет к средствам (например, рецептор-связывающему средству(ам), средству(ам) отбора и/или связывающему вирусную векторную частицу средству(ам)), которые расположены близко друг к другу, так что эффект авидности может иметь место, если биологическую частицу (например, клетку-мишень), имеющую (по меньшей мере две копии) молекулу (например, молекулу клеточной поверхности), приводят в контакт со средством, которое имеет один или более сайтов связывания (B или V), способных связывать конкретную молекулу.
[0199] В некоторых вариантах осуществления два или больше различных средств (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство), которые содержат один и тот же сайт связывания (B или V), можно обратимо связывать с реактивом. В некоторых вариантах осуществления возможно использовать по меньшей мере два различных средства (типа средств) и, в некоторых случаях, три или четыре различных средства (типа средств), например, два или больше различных рецептор-связывающих средств, средств отбора и/или связывающих вирусную векторную частицу средств. Например, в некоторых вариантах осуществления реактив можно обратимо связывать с первым средством (например, рецептор-связывающим средством или средством отбора), содержащим сайт связывания B1, B2, B3 или B4, и т.д., и вторым средством (например, рецептор-связывающим средством или средством отбора), содержащим другой сайт связывания, например, другой сайт связывания B1, B2, B3, B4. В некоторых случаях, сайт связывания первого средства и второго средства может представлять собой одно и то же. Например, в некоторых аспектах, каждое из по меньшей мере двух средств (например, рецептор-связывающих средств или средств отбора) можно связывать с одной и той же молекулой. В некоторых случаях, сайт связывания первого средства и второго средства может различаться. В некоторых аспектах, каждое из по меньшей мере двух средств (например, рецептор-связывающих средств, средств отбора) может связываться с отличающейся молекулой, такой как первая молекула, вторая молекула и так далее. В некоторых случаях, различные молекулы, такие как молекулы клеточной поверхности, могут присутствовать на одной и той же клетке-мишени. В других случаях, различные молекулы, такие как молекулы клеточной поверхности, могут присутствовать на различных клетках-мишенях, которые присутствуют в одной и той же популяции клеток. В определенном случае, третье, четвертое и так далее средство (например, рецептор-связывающее средство или средство отбора) можно обратимо ассоциировать с одним и тем же реактивом, каждое средство содержит дополнительный отличающийся сайт связывания. В некоторых вариантах осуществления реактив можно обратимо связывать с по меньшей мере первым средством (например, рецептор-связывающим средством или средством отбора), содержащим один или более сайтов связывания, B (например, B1, B2, B3), и также связывающим вирусную векторную частицу средством, содержащим один или более сайтов связывания V (например, V1, V2, V3).
[0200] В некоторых вариантах осуществления одно или более средств, такие как два или больше различных средств, (например, рецептор-связывающих средств, средств отбора и/или связывающих вирусную векторную частицу средств) содержат один и тот же партнер связывания C. В некоторых вариантах осуществления два или больше различных средств (например, рецептор-связывающих средств или средств отбора) содержат различные партнеры связывания. В некоторых аспектах, первое средство (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство) может иметь партнер связывания C1, который может специфически связываться с сайтом связывания Z1, представленным на реактиве, и второе средство (например, рецептор-связывающие средства, средство отбора или связывающее вирусную векторную частицу средство) может иметь партнер связывания C2, который может специфически связываться с сайтом связывания Z1 или с сайтом связывания Z2, присутствующим на реактиве. Таким образом, в некоторых случаях, множество сайтов связывания Z, которое содержит реактив, включает сайты связывания Z1 и Z2, которые способны к обратимому связыванию с партнерами связывания C1 и C2, соответственно, которые содержит средство (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство). В некоторых вариантах осуществления C1 и C2 представляют собой одно и то же и/или Z1 и Z2 представляют собой одно и то же. В других аспектах, один или более из множества сайтов связывания Z могут отличаться. В других случаях, один или более из множества партнеров связывания C могут отличаться. Специалист в данной области способен выбрать любую комбинацию различных партнеров связывания C, которые совместимы с реактивом, содержащим сайты связывания Z, до тех пор пока каждый из партнеров связывания C способен взаимодействовать, например, специфически связываться, с одним из сайтов связывания Z.
[0201] В некоторых вариантах осуществления любого из способов, предусмотренных в настоящем описании, олигомерный белковый реактив включает множество полипептидных единиц, индивидуально включая стрептавидин, авидин, биотин-связывающий полипептид, связывающий Strep-метку пептид, мутеин стрептавидина, аналог стрептавидина, мутеин авидина, аналог авидина и/или биологически активный фрагмент любого из вышеуказанных. Например, в некоторых вариантах осуществления способы, предусмотренные в настоящем описании, включают инкубацию множества клеток-мишеней с (1) белковым реактивом, включающим стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных и/или множество субъединиц любого из вышеуказанных; и (2) вирусной частицей, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0202] В некоторых вариантах осуществления реактив представляет собой стрептавидин, мутеин или аналог стрептавидина, авидин, мутеин или аналог авидина (такой как нейтравидин) или их смесь, где такой реактив содержит один или более сайтов связывания Z для обратимого ассоциирования с партнером связывания C. В некоторых вариантах осуществления партнер связывания C может представлять собой биотин, производное или аналог биотина или стрептавидин-связывающий пептид или другую молекулу, которая способна к специфическому связыванию со стрептавидином, мутеином или аналогом стрептавидина, авидином или мутеином или аналогом авидина. В некоторых вариантах осуществления реактив представляет собой или содержит стрептавидин, авидин, аналог или мутеин стрептавидина, или аналог или мутеин или авидин, который обратимо связывает биотин, аналог биотина или его биологически активный фрагмент. В некоторых вариантах осуществления реактив представляет собой или содержит аналог или мутеин стрептавидина или аналог или мутеин авидина, который обратимо связывает стрептавидин-связывающий пептид. В некоторых вариантах осуществления вещество (например, конкурентный реактив) может представлять собой биотин, производное или аналог биотина или стрептавидин-связывающий пептид, способный к конкуренции за связывание с партнером связывания C с одним или несколькими сайтами связывания Z. В некоторых вариантах осуществления партнер связывания C и вещество (например, конкурентный реактив) являются различными, и вещество (например, конкурентный реактив) проявляет более высокую аффинность связывания с одним или несколькими сайтами связывания Z по сравнению с аффинностью партнера связывания.
[0203] В некоторых вариантах осуществления стрептавидин может представлять собой стрептавидин дикого типа, мутеины или аналоги стрептавидина, такие как стрептавидиноподобные полипептиды. Аналогичным образом, авидин, в некоторых аспектах, включает авидин дикого типа или мутеины или аналоги авидина, такие как нейтравидин, дегликозилированный авидин с модифицированными аргининами, который обычно демонстрирует более нейтральный pi и доступен в качестве альтернативы нативному авидину. В целом, дегликозилированные нейтральные формы авидина включают коммерчески доступные формы, такие как «Extravidin», доступный в Sigma Aldrich, или «Neutravidin», доступный в Thermo Scientific или Invitrogen, например.
[0204] В некоторых вариантах осуществления реактив представляет собой стрептавидин или мутеин или аналог стрептавидина. В некоторых вариантах осуществления стрептавидин дикого типа (wt-стрептавидин) имеет аминокислотную последовательность, раскрытую в Argarana et al, Nucleic Acids Res. 14 (1986) 1871-1882 (SEQ ID №1). В целом, стрептавидин в природе встречается в виде тетрамера из четырех идентичных субъединиц, т. е. он представляет собой гомотетрамер, где каждая субъединица содержит один сайт связывания для биотина, производного или аналога биотина или имитатора биотина. Образцовая последовательность субъединицы стрептавидина представляет собой последовательность аминокислот, приведенную в SEQ ID №1, но такая последовательность также может включать последовательность, присутствующую в ее гомологах из других видов Streptomyces. В частности, каждая субъединица стрептавидина может проявлять высокую аффинность связывания с биотином с равновесной константой диссоциации (KD) порядка приблизительно 10-14 M. В некоторых случаях, стрептавидин может существовать в виде одновалентного тетрамера, в котором только один из четырех сайтов связывания функционален (Howarth et al. (2006) Nat. Methods, 3:267-73; Zhang et al. (2015) Biochem. Biophys. Res. Commun., 463:1059-63)), двухвалентного тетрамера, в котором два из четырех сайтов связывания являются функциональными (Fairhead et al. (2013) J. Mol. Biol., 426:199-214), или может присутствовать в мономерной или димерной форме (Wu et al. (2005) J. Biol. Chem., 280:23225-31; Lim et al. (2010) Biochemistry, 50:8682-91).
[0205] В некоторых вариантах осуществления стрептавидин может быть в любой форме, например, дикого типа или немодифицированный стрептавидин, такой как стрептавидин из видов Streptomyces или его функционально активный фрагмент, который содержит по меньшей мере одну функциональную субъединицу, содержащую сайт связывания для биотина, производного или аналога биотина или имитатора биотина, например, в целом содержит по меньшей мере одну функциональную субъединицу стрептавидина дикого типа из Streptomyces avidinii, приведенную в SEQ ID №1, или ее функционально активный фрагмент. Например, в некоторых вариантах осуществления стрептавидин может содержать фрагмент стрептавидина дикого типа, который укорочен с N- и/или C-конца. Такие минимальные стрептавидины включают любой, который начинается на N-конце с области аминокислотных положений с 10 до 16 в SEQ ID №1 и заканчивается на C-конце в области аминокислотных положений с 133 до 142 в SEQ ID №1. В некоторых вариантах осуществления функционально активный фрагмент стрептавидина содержит последовательность аминокислот, приведенную в SEQ ID № 2. В некоторых вариантах осуществления стрептавидин, например, приведенный в SEQ ID №2, дополнительно может содержать N-концевой метионин в положении, соответствующем Ala13 по нумерации, приведенной в SEQ ID №1. Указание положения остатков в стрептавидине или мутеинах стрептавидина приведено в отношении нумерации остатков в SEQ ID №1.
[0206] В некоторых аспектах, мутеины стрептавидина включают полипептиды, которые отличаются от последовательности немодифицированного стрептавидина или стрептавидина дикого типа одной или несколькими заменами, делециями или добавлениями аминокислот, но которые содержат по меньшей мере одну функциональную субъединицу, содержащую сайт связывания для биотина, производного или аналога биотина или стрептавидин-связывающего пептида. В некоторых аспектах, стрептавидиноподобные полипептиды и мутеины стрептавидина могут представлять собой полипептиды, которые по существу иммунологически эквивалентны стрептавидину дикого типа и способны к специфическому связыванию биотина, производных биотина или аналогов биотина с той же аффинностью, что у wt-стрептавидина, или другой. В некоторых случаях, стрептавидиноподобные полипептиды или мутеины стрептавидина могут содержать аминокислоты, которые не являются частью стрептавидина дикого типа, или они могут содержать только часть стрептавидина дикого типа. В некоторых вариантах осуществления стрептавидиноподобные полипептиды представляют собой полипептиды, которые не идентичны стрептавидину дикого типа, поскольку организм-хозяин не имеет ферменты, которые необходимы для того, чтобы трансформировать продуцируемый организмом-хозяином полипептид в структуру стрептавидина дикого типа. В некоторых вариантах осуществления стрептавидин также может быть представлен в виде тетрамеров стрептавидина и димеров стрептавидина, в частности, гомотетрамеров стрептавидина, гомодимеров стрептавидина, гетеротетрамеров стрептавидина и гетеродимеров стрептавидина. В целом, каждая субъединица обычно имеет сайт связывания для биотина или аналогов биотина или для стрептавидин-связывающих пептидов. Примеры стрептавидинов или мутеинов стрептавидина указаны, например, в WO 86/02077, DE 19641876 A1, US 6022951, WO 98/40396 или WO 96/24606.
[0207] В некоторых вариантах осуществления мутеин стрептавидина может содержать аминокислоты, которые не являются частью немодифицированного стрептавидина или стрептавидина дикого типа или могут содержать только часть стрептавидина дикого типа или немодифицированного стрептавидина. В некоторых вариантах осуществления мутеин стрептавидина содержит по меньшей мере одну субъединицу, которая может иметь одну или более замен аминокислот по сравнению с субъединицей немодифицированного стрептавидина или стрептавидина дикого типа, например, по сравнению с субъединицей стрептавидина дикого типа, приведенной в SEQ ID №1, или ее функционально активный фрагмент, например, приведенный в SEQ ID №2. В некоторых вариантах осуществления по меньшей мере одна субъединица мутеина стрептавидина может иметь по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных различий по сравнению со стрептавидином дикого типа или немодифицированным стрептавидином и/или содержит по меньшей мере одну субъединицу, которая содержит аминокислотную последовательность, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с последовательностью аминокислот, приведенной в SEQ ID №1 или 2, где такой мутеин стрептавидина демонстрирует функциональную активность по связыванию биотина, производного или аналога биотина или имитатора биотина. В некоторых вариантах осуществления замены аминокислот представляют собой консервативные или неконсервативные мутации. Примеры мутеинов стрептавидина известны в данной области, см., например, патенты США №№5168049; 5506121; 6022951; 6156493; 6165750; 6103493; или 6368813; или международную опубликованную заявку PCT № WO 2014/076277.
[0208] В некоторых вариантах осуществления стрептавидин или мутеин стрептавидина включает белки, содержащие одну или больше чем одну функциональную субъединицу, содержащую один или более сайтов связывания Z для биотина, производного или аналога биотина или стрептавидин-связывающего пептида, например, две или больше, три или больше, четыре или больше и, в некоторых случаях, 5, 6, 7, 8, 9, 10, 11, 12 или больше функциональных субъединиц. В некоторых вариантах осуществления стрептавидин или мутеин стрептавидина может включать мономер; димер, в том числе гетеродимер или гомодимер; тетрамер, в том числе гомотетрамер, гетеротетрамер, одновалентный тетрамер или двухвалентный тетрамер; или может включать его мультимеры или олигомеры более высокого порядка.
[0209] В некоторых вариантах осуществления аффинность связывания стрептавидина или мутеина стрептавидина с партнером связывания пептидного лиганда составляет меньше чем 1×10-4 M, 5×10-4 M, 1×10-5 M, 5×10-5 M, 1×10-6 M, 5×10-6 M или 1×10-7 M, но в целом больше чем 1×10-13 M, 1×10-12 M или 1×10-11 M. Например, пептидные последовательности (Strep-метки), такие как раскрыто в патенте США №5506121, могут действовать в качестве имитаторов биотина и демонстрировать аффинность связывания со стрептавидином, например, с KD приблизительно между 10-4 M и 10-5 M. В некоторых случаях, аффинность связывания дополнительно можно усовершенствовать, создавая мутацию в молекуле стрептавидина, см., например, патент США №6103493 или международную опубликованную заявку PCT № WO 2014/076277. В некоторых вариантах осуществления аффинность связывания можно определять известными в данной области способами, такими как любые описанные далее.
[0210] В некоторых вариантах осуществления реактив, такой как стрептавидин или мутеин стрептавидина, демонстрирует аффинность связывания с партнером связывания пептидного лиганда, этот партнер связывания пептидного лиганда может представлять собой партнер связывания C, присутствующий в средстве (например, рецептор-связывающем средстве или средстве отбора). В некоторых вариантах осуществления пептидная последовательность содержит последовательность с общей формулой, приведенной в SEQ ID №9, например, содержит последовательность, приведенную в SEQ ID №10. В некоторых вариантах осуществления пептидная последовательность имеет общую формулу, приведенную в SEQ ID №11, например, приведенную в SEQ ID №12. В одном из примеров, пептидная последовательность представляет собой Trp-Arg-His-Pro-Gln-Phe-Gly-Gly (также называемую Strep-tag®, которая приведена в SEQ ID №7). В одном из примеров, пептидная последовательность представляет собой Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (также называемую Strep-tag® II, которая приведена в SEQ ID №8). В некоторых вариантах осуществления пептидный лиганд содержит последовательную компоновку из по меньшей мере двух стрептавидин-связывающих модулей, в которой расстояние между двумя модулями составляет по меньшей мере 0 и не больше чем 50 аминокислот, где один связывающий модуль имеет от 3 до 8 аминокислот и содержит по меньшей мере последовательность His-Pro-Xaa (SEQ ID №9), где Xaa представляет собой глутамин, аспарагин или метионин, и где другой связывающий модуль имеет тот же или отличающийся пептидный лиганд стрептавидина, например, приведенный в SEQ ID №11 (см., например, международную опубликованную заявку PCT № WO 02/077018; патент США №7981632). В некоторых вариантах осуществления пептидный лиганд содержит последовательность, имеющую формулу, приведенную в любой из SEQ ID №13 или 14. В некоторых вариантах осуществления пептидный лиганд имеет последовательность аминокислот, приведенную в любой из SEQ ID №№15-19.
[0211] В некоторых вариантах осуществления реактив представляет собой или содержит мутеин стрептавидина. В некоторых вариантах осуществления мутеины стрептавидина содержат одну или более мутаций (например, замены аминокислот) по сравнению со стрептавидином дикого типа, приведенным в SEQ ID №1, или его биологически активной частью. Например, биологически активные части стрептавидина могут включать варианты стрептавидина, укороченные на N- и/или C-конце, которые в некоторых случаях называют минимальным стрептавидином. В некоторых вариантах осуществления укороченный на N-конце минимальный стрептавидин, в котором можно выполнять любую из мутаций, начинается на N-конце в области аминокислотных положений с 10 до 16 и заканчивается на C-конце в области аминокислотных положений с 133 до 142 по сравнению с последовательностью, приведенной в SEQ ID №1. В некоторых вариантах осуществления укороченный на N-конце стрептавидин, в котором можно выполнять любые из мутаций, содержит аминокислотную последовательность, приведенную в SEQ ID №2. В некоторых вариантах осуществления минимальный стрептавидин содержит аминокислотную последовательность от положения Ala13 до Ser139 и необязательно имеет N-концевой остаток метионина вместо Ala13. Для целей настоящего описания нумерация аминокислотных положений относится на всем протяжении к нумерации wt-стрептавидина, приведенного в SEQ ID №1 (например, Argarana et al., Nucleic Acids Res. 14 (1986), 1871-1882, см. также фиг. 3).
[0212] В некоторых вариантах осуществления мутеин стрептавидина представляет собой мутант, как описано в патенте США №6103493. В некоторых вариантах осуществления мутеин стрептавидина содержит по меньшей мере одну мутацию в области аминокислотных положений с 44 до 53, на основании аминокислотной последовательности стрептавидина дикого типа, например, приведенной в SEQ ID №1. В некоторых вариантах осуществления мутеин стрептавидина содержит мутацию в одном или нескольких остатках 44, 45, 46 и/или 47. В некоторых вариантах осуществления мутеин стрептавидина содержит замену Glu в положении 44 стрептавидина дикого типа на гидрофобную алифатическую аминокислоту, например, Val, Ala, Ile или Leu, любую аминокислоту в положении 45, алифатическую аминокислоту, такую как гидрофобная алифатическая аминокислота, в положении 46 и/или замену Val в положении 47 на основную аминокислоту, например, Arg или Lys, например, обычно Arg. В некоторых вариантах осуществления Ala находится в положении 46 и/или Arg находится в положении 47 и/или Val или Ile находится в положении 44. В некоторых вариантах осуществления мутант стрептавидина содержит остатки Val44-Thr45-Ala46-Arg47, такие как изложено в образцовых мутеинах стрептавидина, содержащих последовательность аминокислот, приведенную в SEQ ID №3 или SEQ ID №4 (также известной как мутант стрептавидина 1, SAM1). В некоторых вариантах осуществления мутеин стрептавидина содержит остатки Ile44-Gly45-Ala46-Arg47, такие как изложено в образцовых мутеинах стрептавидина, содержащих последовательность аминокислот, приведенную в SEQ ID №5 или 6 (также известной как SAM2). В некоторых случаях, такие мутеины стрептавидина описаны, например, в патенте США 6103493, и коммерчески доступны под торговой маркой Strep-Tactin®.
[0213] В определенном варианте осуществления, мутеин стрептавидина представляет собой мутант, как описано в международной опубликованной заявке PCT № WO 2014/076277. В некоторых вариантах осуществления мутеин стрептавидина содержит по меньшей мере два остатка цистеина в области аминокислотных положений с 44 до 53 относительно аминокислотных положений, приведенных в SEQ ID №1. В некоторых вариантах осуществления остатки цистеина присутствуют в положениях 45 и 52 для того, чтобы создавать дисульфидный мостик, соединяющий эти аминокислоты. В таком варианте осуществления, аминокислота 44 обычно представляет собой глицин или аланин и аминокислота 46 обычно представляет собой аланин или глицин и аминокислота 47 обычно представляет собой аргинин. В некоторых вариантах осуществления мутеин стрептавидина содержит по меньшей мере одну мутацию или аминокислотное различие в области аминокислотных остатков с 115 до 121 относительно аминокислотных положений, приведенных в SEQ ID №1. В некоторых вариантах осуществления мутеин стрептавидина содержит по меньшей мере одну мутацию в аминокислотном положении 117, 120 и 121 и/или делецию аминокислот 118 и 119 и замену по меньшей мере аминокислотного положения 121.
[0214] В некоторых вариантах осуществления мутеин стрептавидина содержит мутацию в положении, соответствующем положению 117, эта мутация может представлять собой мутацию в большой гидрофобный остаток, такой как Trp, Tyr или Phe, или заряженный остаток, такой Glu, Asp или Arg, или гидрофильный остаток, такой как Asn или Gln, или, в некоторых случаях, гидрофобные остатки Leu, Met или Ala, или полярные остатки Thr, Ser или His. В некоторых вариантах осуществления мутацию в положении 117 комбинируют с мутацией в положении, соответствующем положению 120, эта мутация может представлять собой мутацию в небольшой остаток, такой как Ser или Ala или Gly, и мутацией в положении, соответствующем положению 121, эта мутация может представлять мутацию в гидрофобный остаток, такой как объемный гидрофобный остаток, такой как Trp, Tyr или Phe. В некоторых вариантах осуществления мутацию в положении 117 комбинируют с мутацией в положении, соответствующем положению 120 стрептавидина дикого типа, приведенного в SEQ ID №1, или его биологически активного фрагмента, эта мутация может представлять собой гидрофобный остаток, такой как Leu, Ile, Met или Val, или, обычно, Tyr или Phe, и мутацией в положении, соответствующем положению 121, по сравнению с положениями стрептавидина дикого типа, приведенного в SEQ ID №1, или его биологически активного фрагмента, эта мутация может представлять собой мутацию в небольшой остаток, такой как Gly, Ala или Ser, или с Gln или с гидрофобным остатком, таким как Leu, Val, Ile, Trp, Tyr, Phe или Met. В некоторых вариантах осуществления такие мутеины также могут содержать остатки Val44-Thr45-Ala46-Arg47 или остатки Ile44-Gly45-Ala46-Arg47. В некоторых вариантах осуществления мутеин стрептавидина содержит остатки Val44, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121. В некоторых вариантах осуществления мутеин стрептавидина содержит последовательность аминокислот, приведенную в SEQ ID №27 или SEQ ID №28, или последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с последовательностью аминокислот, приведенной в SEQ ID №27 или SEQ ID №28, содержит остатки Val44, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121 и демонстрирует функциональную активность по связыванию с биотином, аналогом биотина или стрептавидин-связывающим пептидом.
[0215] В некоторых вариантах осуществления мутеин стрептавидина может содержать любые из вышеуказанных мутаций в любой комбинации и получаемый мутеин стрептавидина может демонстрировать аффинность связывания, которая составляет меньше чем 2,7×10-4 M для пептидного лиганда (Trp Arg His Pro Gln Phe Gly Gly; также называемого Strep-tag®, который приведен в SEQ ID №7) и/или меньше чем 1,4×10-4 M для пептидного лиганда (Trp Ser His Pro Gln Phe Glu Lys; также называемого Strep-tag® II, который приведен в SEQ ID №8) и/или составляет меньше чем 1×10-4 M, 5×10-4 M, 1×10-5 M, 5×10-5 M, 1×10-6 M, 5×10-6 M или 1×10-7 M, но в целом больше чем 1×10-13 M, 1×10-12 M или 1×10-11 M для любого из пептидных лигандов, приведенных в любой из SEQ ID №№7-19.
[0216] В некоторых вариантах осуществления мутеин стрептавидина имеет последовательность аминокислот, приведенную в любой из SEQ ID №№3-6, 27 или 28, или последовательность аминокислот, которая проявляет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с последовательностью аминокислот, приведенной в любой из SEQ ID №3-6, 27 или 28, и демонстрирует аффинность связывания, которая меньше чем 2,7×10-4 M для пептидного лиганда (Trp Arg His Pro Gln Phe Gly Gly; также называемого Strep-tag®, который приведен в SEQ ID №7) и/или меньше чем 1,4×10-4 M для пептидного лиганда (Trp Ser His Pro Gln Phe Glu Lys; также называемого Strep-tag® II, который приведен в SEQ ID №8) и/или составляет меньше чем 1×10-4 M, 5×10-4 M, 1×10-5 M, 5×10-5 M, 1×10-6 M, 5×10-6 M или 1×10-7 M, но в целом больше чем 1×10-13 M, 1×10-12 M или 1×10-11 M для любого из пептидных лигандов, приведенных в любой из SEQ ID №№7-19.
[0217] В некоторых вариантах осуществления мутеин стрептавидина также демонстрирует связывание с другими лигандами стрептавидина, такими как, но не ограничиваясь этим, биотин, иминобиотин, липоевая кислота, дестиобиотин, диаминобиотин, HABA (гидроксиазобензолбензойная кислота) и/или диметил-HABA. В некоторых вариантах осуществления мутеин стрептавидина демонстрирует аффинность связывания с другим лигандом стрептавидина, таким как биотин или дестиобиотин, которая больше аффинности связывания мутеина стрептавидина с пептидным лигандом имитатора биотина, например, который приведен в любой из SEQ ID №№7-19. Таким образом, в некоторых вариантах осуществления биотин или аналог или производное биотина (например, дестиобиотин) можно использовать в качестве конкурентного реактива в предоставленных способах. Например, в качестве примера, взаимодействие мутеина стрептавидина, обозначаемого Strep-tactin® (например, содержащего последовательность, приведенную в SEQ ID №4), с пептидным лигандом, обозначаемым Strep-tag® II (например, приведенным в SEQ ID №8), характеризуют аффинностью связывания с KD приблизительно 10-6 M по сравнению с приблизительно 10-13 M для взаимодействия биотин-стрептавидин. В некоторых случаях, биотин, которой может связываться с высокой аффинностью с Strep-tactin® с KD между или между приблизительно 10-10 и 10-13 M, может конкурировать с Strep-tag® II за сайт связывания.
[0218] В некоторых случаях, реактив содержит по меньшей мере две хелатирующие группы K, которые могут быть способны к связыванию с ионом переходного металла. В некоторых вариантах осуществления реактив может быть способен к связыванию с олигогистидиновой аффинной меткой, глутатион-S-трансферазой, кальмодулином или его аналогом, кальмодулин-связывающим пептидом (CBP), FLAG-пептидом, HA-меткой, мальтоза-связывающим белком (MBP), эпитопом HSV, эпитопом myc и/или биотинилированным белком-переносчиком.
[0219] В некоторых вариантах осуществления белковый реактив представляет собой олигомерный белковый реактив, который может содержать одну или множество мультимерных субъединиц, каждая индивидуально содержит две или больше полипептидных единиц. В некоторых вариантах осуществления олигомерный белковый реактив содержит множество отдельных единиц, включая или больше из биотин-связывающего полипептида, стрептавидина, авидина, аналога стрептавидина, мутеина стрептавидина, аналога авидина, мутеина авидина и биологически активного фрагмента.
[0220] В некоторых вариантах осуществления реактив представляет собой олигомер или полимер. В некоторых вариантах осуществления олигомер или полимер можно создавать, соединяя непосредственно или опосредованно индивидуальные молекулы белка, как он существует в природе, непосредственно или опосредованно соединяя индивидуальные молекулы мономера или комплекса субъединиц, которые образуют индивидуальную молекулу (например, непосредственно или опосредованно соединяя димеры, тримеры, тетрамеры и т. д. белка, как он существует в природе). Например, тетрамерный гомодимер или гетеродимер стрептавидина или авидин можно обозначать как индивидуальную молекулу или наименьший строительный блок соответствующего олигомера или полимера. В некоторых вариантах осуществления олигомер или полимер может содержать связь для по меньшей мере 2 индивидуальных молекул белка (например, представляет собой 2-мер) или может представлять собой по меньшей мере 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер, 10-мер, 11-мер, 12-мер, 13-мер, 14-мер, 15-мер, 16-мер, 17-мер, 18-мер, 19-мер, 20-мер, 25-мер, 30-мер, 35-мер, 40-мер, 45-мер или 50-мер из индивидуальных молекул белка (например, мономеры, тетрамеры).
[0221] Олигомеры можно создавать с использованием любых известных в данной области способов, например, любых описанных в опубликованной патентной заявке США № US 2004/0082012. В некоторых вариантах осуществления олигомер или полимер содержит две или больше индивидуальные молекулы, которые можно сшивать, например, с помощью полисахарида или бифункционального линкера.
[0222] В некоторых вариантах осуществления олигомер или полимер получают посредством сшивки индивидуальных молекул или комплекса субъединиц, которые образуют индивидуальную молекулу, в присутствии полисахарида. В некоторых вариантах осуществления олигомеры или полимеры можно получать посредством введения карбоксильных остатков в полисахарид, например, декстран. В некоторых аспектах, индивидуальные молекулы реактива (например, мономеры, тетрамеры) можно сопрягать через первичные аминогруппы внутренних остатков лизина и/или свободный N-конец с карбоксильными группами в остове декстрана с использованием стандартных реакций с карбодиимидом. В некоторых вариантах осуществления реакцию сочетания осуществляют при молярном соотношении приблизительно 60 молей индивидуальных молекул реактива (например, мономеров, тетрамеров) на моль декстрана.
[0223] В некоторых вариантах осуществления реактив представляет собой олигомер или полимер одного или нескольких из стрептавидина или авидина или любого аналога или мутеина стрептавидина (например, Strep-Tactin® или Strep-Tactin® XT) или аналога или мутеина авидина (например, нейтравидина). В некоторых вариантах осуществления сайт связывания Z представляет собой природный сайт связывания биотина в авидине или стрептавидине, для которого может быть вплоть до четырех сайтов связывания в индивидуальной молекуле (например, тетрамер содержит четыре сайта связывания Z), в соответствии с чем гомотетрамер может содержать вплоть до 4 сайтов связывания, которые представляют собой одно и то же, т. е. Z1, тогда как гетеротетрамер может содержать вплоть до 4 сайтов связывания, которые могут быть различными, например, содержать Z1 и Z2. В некоторых вариантах осуществления олигомер создают или получают из множества индивидуальных молекул (например, множества гомотетрамеров) одного и того же стрептавидина, мутеина стрептавидина, авидина или мутеина авидина, и в этом случае каждый сайт связывания Z, например, Z1, олигомера представляет собой одно и то же. Например, в некоторых случаях, олигомер может содержать множество сайтов связывания Z1, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 40, 45, 50 или больше сайтов связывания Z1. В некоторых вариантах осуществления олигомер создают или получают из множества индивидуальных молекул, которые могут представлять собой гетеротетрамеры стрептавидина, мутеина стрептавидина, авидина или мутеина авидина, и/или из множества из двух или больше различных индивидуальных молекул (например, различные гомотетрамеры) стрептавидина, мутеина стрептавидина, авидина или мутеина авидина, которые различаются своими сайтами связывания Z, например, Z1 и Z2, и в этом случае в олигомере может присутствовать множество различных сайтов связывания Z, например, Z1 и Z2. Например, в некоторых случаях, олигомер может содержать множество сайтов связывания Z1 и множество сайтов связывания Z, которые, в комбинации, могут включать по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 40, 45, 50 или больше комбинированных сайтов связывания Z1 и Z2.
[0224] В некоторых вариантах осуществления олигомер или полимер получают посредством сшивки индивидуальных молекул или комплекса субъединиц, которые образуют индивидуальную молекулу, используя бифункциональный линкер или другой химический линкер, такой как глутардиальдегид, или посредством других известных в данной области способов. В некоторых аспектах, сшитые олигомеры или полимеры стрептавидина или авидина или любого мутеина или аналога стрептавидина или авидина можно получать посредством сшивки индивидуальных молекул стрептавидина или авидина через бифункциональные молекулы, служащие в качестве линкера, такие как глутардиальдегид, или другими способами, описанными в данной области. например, возможно создавать олигомеры мутеинов стрептавидина посредством введения тиоловых групп в мутеин стрептавидина (это можно выполнять, например, посредством реакции мутеина стрептавидина с 2-иминотиоланом (реактивом Трота) и посредством активации, например, в отдельной реакции, аминогрупп, доступных в мутеине стрептавидина. В некоторых вариантах осуществления этой активации аминогрупп можно достичь посредством реакции мутеина стрептавидина с коммерчески доступным гетеробифункциональным сшивателем, таким как сульфосукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат (сульфо-SMCC) или сукцинимидил-6-[(β-малеимидопропионамидо)гексаноат (SMPH). В некоторых таких вариантах осуществления два продукт реакции, полученные таким образом, смешивают вместе, что обычно ведет к реакции тиоловых групп, содержащихся в одной партии модифицированного мутеина стрептавидина, с активированными (например, с помощью малеимидных функций) аминокислот другой партии модифицированного мутеина стрептавидина. В некоторых случаях, с помощью этой реакции формируют мультимеры/олигомеры мутеина стрептавидина. Эти олигомеры могут иметь любое подходящее число индивидуальных молекул, такое как по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 40, 45, 50 или больше, и степень олигомеризации может варьировать в соответствии с условиями реакции.
[0225] В некоторых вариантах осуществления олигомерный или полимерный реактив можно выделять с помощью эксклюзионной хроматографии, и любую желаемую фракцию можно использовать в качестве реактива. Например, в некоторых вариантах осуществления, после реакции модифицированного мутеина стрептавидина, в присутствии 2-иминотиолана и гетеробифункционального сшивателя, такого как сульфо-SMCC, олигомерный или полимерный реактив можно выделять с помощью эксклюзионной хроматографии, и любую желаемую фракцию можно использовать в качестве реактива. В некоторых вариантах осуществления олигомеры не имеют (и не должны иметь) единую молекулярную массу, но они могут иметь статистическое распределение масс, такое как распределение Гаусса. В некоторых случаях, любой олигомер с больше чем тремя тетрамерами стрептавидина или мутеина, например, гомотетрамерами или гетеротетрамерами, можно использовать в качестве растворимого реактива, например, обычно от 3 до 50 тетрамеров, например, гомотетрамеров или гетеротетрамеров, от 10 до 40 тетрамеров, например, гомотетрамеров или гетеротетрамеров, или от 25 до 35 тетрамеров, например, гомотетрамеров или гетеротетрамеров. Олигомеры могут иметь, например, от 3 до 25 тетрамеров мутеина стрептавидина, например, гомотетрамеров или гетеротетрамеров. В некоторых аспектах, при молекулярной массе приблизительно 50 кДа для мутеинов стрептавидина, растворимые олигомеры могут иметь молекулярную массу приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа или приблизительно от 1500 кДа приблизительно до 2000 кДа. В целом, поскольку каждая молекула стрептавидина/мутеина имеет четыре сайта связывания биотина, такой реактив может предоставлять от 12 до 160 сайтов связывания Z, например, от 12 до 100 сайтов связывания Z.
[0226] В некоторых вариантах осуществления реактив не содержит и/или не конъюгирован или обратимо связан со связывающим средством, содержащим антитело или его фрагмент, или не содержит связывающее средство, содержащее молекулу клеточной поверхности человека или ее связывающий фрагмент; реактив не содержит и/или не конъюгирован или связан с молекулой со связывающим доменом, специфичным для маркера клеточной поверхности человека, необязательно маркера T-клетки; реактив не содержит и/или не конъюгирован или связан с компонентом внеклеточного матрикса, молекулой адгезии, интегрином, лектином, интегрин-связывающим белком, хемокинами, цитокином, фактором роста, связывающей внеклеточный матрикс молекулой, ECM компонентом, вирусным белком, рецептором клеточной поверхности, способствующим проникновению вируса, гепарином, гепараном, гликанами; и/или реактив не содержит гепарин-связывающий домен и/или не содержит интегрин-связывающий домен и/или не содержит VLA4-связывающий домен и/или не содержит VLA5-связывающий домен.
[0227] В некоторых вариантах осуществления реактив также содержит и/или обратимо связан с множеством из одного или нескольких связывающих средств, каждое из которых способно к специфическому связыванию с молекулой на поверхности вирусной частицы и/или поверхности клетки-мишени.
2. Формат реактива
a. Основа
[0228] В некоторых вариантах осуществления трансдукцию и/или одну или более других стадий обработки (например, отбор, активацию или размножение) можно осуществлять на твердом носителе, например, с использованием матриц, таких как магнитные бусы, агарозные частицы, чашки для клеточной культуры или другая матрица с твердой поверхностью, на которой олигомерный белковый реактив или реактив мультимеризации иммобилизован, конъюгирован или связан. В некоторых вариантах осуществления реактив содержится на основе, такой как твердый носитель или поверхность, например, бусине или стационарной фазе (хроматографической матрице). В некоторых таких вариантах осуществления, реактив обратимо иммобилизуют на основе. В некоторых случаях реактив иммобилизуют на основе через ковалентные связи. В некоторых аспектах, реактив обратимо иммобилизуют на основе нековалентно. В некоторых аспектах, клетки-мишени и/или вирусные частицы, последовательно или одновременно, экспонируют или приводят в контакт с реактивом на твердом носителе, например, присутствующем в виде стационарной фазы (например, хроматографической матрицы).
[0229] В некоторых вариантах осуществления основа представляет собой твердый носитель. Любой твердый носитель (поверхность) можно использовать для обратимой иммобилизации реактива. Иллюстративные примеры твердых носителей, на которых можно иммобилизовать реактив, включают магнитную бусину, полимерную бусину, планшет для клеточной культуры, микротитровальный планшет, мембрану или полое волокно. В некоторых аспектах, полые волокна можно использовать в качестве биореактора в Quantum® Cell Expansion System, доступной в TerumoBCT Inc. (Lakewood, CO, USA). В некоторых вариантах осуществления реактив ковалентно прикрепляют к твердому носителю. В других вариантах осуществления нековалентные взаимодействия также можно использовать для иммобилизации, например, на пластмассовых подложках.
[0230] В некоторых вариантах осуществления реактив может представлять собой, например, стрептавидин или мутеин авидина, который обратимо связывает стрептавидин-связывающий пептид. Такие мутеины стрептавидина можно ковалентно прикреплять к любой поверхности, например, смоле (бусы), используемой для хроматографической очистки, и коммерчески доступны в такой форме в IBA GmbH, Gottingen, например, в виде сефарозы Strep-Tactin®, Strep-Tactin® Superflow®, Strep-Tactin® Superflow® высокой емкости или Strep-Tactin® MacroPrep®.
[0231] Другие иллюстративные примеры, которые легко коммерчески доступны, представляют собой иммобилизованные металлические смолы для аффинной хроматографии (IMAC), такие как смолы TALON® (Westburg, Leusden, The Netherlands), которые можно использовать для обратимой иммобилизации белков с олигогистидиновыми метками (гистидиновыми метками), например, для обратимого связывания средства (например, рецептор-связывающего средства или средства отбора), которое содержит в качестве партнера связывания C олигогистидиновую метку, такую как пента- или гексагистидиновая метка. Другие примеры включают кальмодулиновую сефарозу, доступную в GE Life Sciences, которую можно использовать вместе со средством (например, рецептор-связывающим средством или средством отбора), которое содержит кальмодулин-связывающий пептид в качестве партнера связывания C, или сефарозу, с которой связан глутатион. В некоторых таких случаях, партнер связывания C представляет собой глутатион-S-трансферазу.
[0232] В некоторых вариантах осуществления твердый носитель, используемый в представленных способах, может включать магнитно-притягиваемое вещество, такое как одна или более магнитно-притягиваемых частиц или ферротекучее вещество. Соответствующая магнитно-притягиваемая частица может содержать реактив с сайтом связывания, который способен к связыванию клетки-мишени или вирусной частицы. В некоторых случаях, магнитно-притягиваемые частицы могут содержать диамагнитный, ферромагнитный, парамагнитный или суперпарамагнитный материал. В целом, суперпарамагнитный материал реагирует на магнитное поле индуцированным магнитным полем без результирующей постоянной намагниченности. Магнитные частицы, основанные на оксиде железа, например, коммерчески доступны в виде Dynabeads® в Dynal Biotech, в виде магнитных MicroBeads в Miltenyi Biotec, в виде магнитных пористых стеклянных бус в CPG Inc., а также в различных других источниках, таких как Roche Applied Science, BIOCLON, BioSource International Inc., Micromod, AMBION, Merck, Bangs Laboratories, Polysciences или Novagen Inc., среди прочих. Магнитные наночастицы, основанные на суперпарамагнитном Co и FeCo, а также ферромагнитных нанокристаллах Co, описаны, например, в Hutten, A. et al. (J. Biotech. (2004), 112, 47-63). В некоторых вариантах осуществления клетки и популяции клеток разделяют или выделяют с использованием иммуномагнитных (или аффинных магнитных) способов разделения (рассмотренных в Methods in Molecular Medicine, том 58: Metastasis Research Protocols, том 2: Cell Behavior In Vitro and In Vivo, стр. 17-25, под редакцией: S.A. Brooks и U. Schumacher © Humana Press Inc., Totowa, NJ).
[0233] В некоторых вариантах осуществления основа содержит стационарную фазу. Таким образом, в некоторых вариантах осуществления реактив содержится на стационарной фазе (также называемой хроматографической матрицей). В некоторых таких вариантах осуществления, реактив обратимо иммобилизуют на стационарной фазе. В некоторых случаях реактив обратимо иммобилизуют на стационарной фазе через ковалентные связи. В некоторых аспектах, реактив обратимо иммобилизуют на стационарной фазе нековалентно.
[0234] Любой материал можно использовать в качестве хроматографической матрицы. В целом, подходящий хроматографический материал является по существу безвредным, т. е. не вредоносным для жизнеспособности клеток, например, когда используют в набитой хроматографической колонке при желаемых условиях. В некоторых вариантах осуществления стационарная фаза остается в предварительно определяемом местоположении, таком как предварительно определяемое положение, тогда как местоположение образца изменяют. Таким образом, в некоторых вариантах осуществления стационарная фаза представляет собой часть хроматографической системы, через которую подвижная фаза течет (в проточном или порционном режиме) и где происходит распределение компонентов, содержащихся в жидкой фазе, (растворенных или диспергированных) между фазами.
[0235] В некоторых вариантах осуществления хроматографическая матрица имеет форму твердой или полутвердой фазы, тогда как образец, который содержит клетку-мишень, подлежащую выделению/отделению, представляет собой текучую фазу. Хроматографическая матрица может представлять собой материал в виде частиц (любого подходящего размера и геометрической формы) или монолитный хроматографический материал, в том числе бумажную подложку или мембрану. Таким образом, в некоторых аспектах, хроматография может представлять собой как колоночную хроматографию, так и плоскостную хроматографию. В некоторых вариантах осуществления в дополнение к стандартным хроматографическим колонкам, колонки, допускающие двунаправленный поток, такие как колонки PhyTip®, доступные в PhyNexus, Inc. San Jose, CA, U.S.A., или наконечники пипетки можно использовать для способов, основанных на колонках/основанных на проточном режиме. Таким образом, в некоторых случаях, наконечники пипетки или колонки, допускающие двунаправленный поток, также содержатся хроматографическими колонками, которые можно использовать в представленных способах. В некоторых случаях, например, когда используют материал матрицы в виде частиц, материал матрицы в виде частиц может иметь, например, средний размер частицы приблизительно от 5 мкм приблизительно до 200 мкм, или приблизительно от 5 мкм приблизительно до 400 мкм, или приблизительно от 5 мкм приблизительно до 600 мкм. В некоторых аспектах, хроматографическая матрица может, например, представлять собой или содержать полимерную смолу или оксид металла или оксид металлоида. В некоторых аспектах, например, когда используют плоскостную хроматографию, материал матрицы может представлять собой любой материал, подходящий для плоскостной хроматографии, такой как стандартные мембраны, основанные на целлюлозе или основанные на органическом полимере (например, бумажная мембрана, нитроцеллюлозная мембрана или поливинилидендифторидная (PVDF) мембрана), или стеклянные пластины, покрытые диоксидом кремния. В одном из вариантов осуществления хроматографическая матрица/стационарная фаза представляет собой немагнитный материал или ненамагничиваемый материал.
[0236] В некоторых вариантах осуществления немагнитные или ненамагничиваемые хроматографические стационарные фазы, которые подходят для представленных способов, включают производные диоксида кремния или сшитый гель. В некоторых аспектах, сшитый гель может быть основан на природном полимере, например, класса полимеров, который встречается в природе. Например, природный полимер, на котором может быть основана хроматографическая стационарная фаза, представляет собой полисахарид. В некоторых случаях, соответствующий полисахарид обычно сшивают. Пример полисахаридной матрицы включает, но не ограничиваясь этим, агарозный гель (например, агароза Superflow™ или материал Sepharose®, такой как Superflow™ Sepharose®, которые коммерчески доступны при различных размерах бусин и пор) или гель сшитого декстрана(ов). Дополнительный иллюстративный пример представляет собой матрицу из сшитой агарозы в виде частиц, с которой ковалентно связывают декстран, которая коммерчески доступна (при различных размерах бусин и при различных размерах пор) в виде Sephadex® или Superdex®, оба доступны в GE Healthcare. Другой иллюстративный пример такого хроматографического материала представляет собой Sephacryl®, который также доступен при различных размерах бусин и пор в GE Healthcare.
[0237] В некоторых вариантах осуществления сшитый гель также может быть основан на синтетическом полимере, например, на классе полимеров, которые не встречаются в природе. В некоторых аспектах, такой синтетический полимер, на котором основана хроматографическая стационарная фаза, представляет собой полимер, который имеет полярные мономерные единицы и который, следовательно, сам является полярным. Таким образом, в некоторых случаях, такой полярный полимер является гидрофильным. Гидрофильные молекулы, также называемые липофобными, в некоторых аспектах содержат фрагменты, которые могут формировать диполь-дипольные взаимодействия с молекулами воды. В целом, гидрофобные молекулы, также называемые липофильными, имеют склонность к отделению от воды.
[0238] Иллюстративные примеры подходящих синтетических полимеров представляют собой полиакриламид(ы), стирол-дивинилбензоловый гель и сополимер акрилата и диола или акриламида и диола. Иллюстративный пример представляет собой полиметакрилатный гель, коммерчески доступный в виде Fractogel®. Дополнительным примером является сополимер этиленгликоля и метакрилата, коммерчески доступный в виде Toyopearl®. В некоторых вариантах осуществления хроматографическая стационарная фаза также может содержать природные и синтетические полимерные компоненты, такие как композитная матрица или композит или сополимер полисахарида и агарозы, например, композит полиакриламида/агарозы, или полисахарида и N,N'-метиленбисакриламида. Иллюстративным примером сополимера декстрана и N,N'-метиленбисакриламида является указанный выше материал серии Sephacryl®. В некоторых вариантах осуществления производное диоксида кремния может включать частицы диоксида кремния, которые связаны с синтетическим или природным полимером. Примеры таких вариантов осуществления включают, но не ограничиваясь этим, диоксид кремния с привитым полисахаридом, диоксид кремния с привитым поливинилпирролидоном, диоксид кремния с привитым полиэтиленоксидом, диоксид кремния с привитым поли(2-гидроксиэтиласпартамидом) и диоксид кремния с привитым поли(N-изопропилакриламидом).
[0239] В некоторых вариантах осуществления хроматографическая матрица, используемая в представленных способах, также может включать магнитно-притягиваемое вещество, такое как одна или более магнитно-притягиваемых частиц или ферротекучее вещество. Соответствующая магнитно-притягиваемая частица может содержать реактив с сайтом связывания, который способен к связыванию клетки-мишени. В некоторых случаях, магнитно-притягиваемые частицы могут содержать диамагнитный, ферромагнитный, парамагнитный или суперпарамагнитный материал. В целом, суперпарамагнитный материал реагирует на магнитное поле индуцированным магнитным полем без результирующей постоянной намагниченности. Магнитные частицы на основании оксида железа, например, коммерчески доступны в виде Dynabeads® в Dynal Biotech, в виде магнитных MicroBeads в Miltenyi Biotec, в виде магнитных пористых стеклянных бус в CPG Inc., а также в различных других источниках, таких как Roche Applied Science, BIOCLON, BioSource International Inc., Micromod, AMBION, Merck, Bangs Laboratories, Polysciences или Novagen Inc., среди прочих. Магнитные наночастицы, основанные на суперпарамагнитном Co и FeCo, также ферромагнитных нанокристаллах Co, описаны, например, в Hutten, A. et al. (J. Biotech. (2004), 112, 47-63). В других вариантах осуществления хроматографическая матрица, используемая в представленных способах не содержит какие-либо магнитно-притягиваемые вещества.
b. Растворимое
[0240] В некоторых вариантах осуществления реактив не связывают с твердым носителем, т. е. он присутствует в растворимой форме или является растворимым. В принципе, тот же реактив можно использовать, как в случае реактива, который иммобилизуют на основе, такой как твердый носитель или стационарная фаза. Например, любые из образцовых реактивов, описанных выше, можно использовать без иммобилизации или прикрепления такого реактива к основе, например, твердому носителю или стационарной фазе. В некоторых вариантах осуществления реактив содержит множество сайтов связывания, Z, для обратимого связывания со связывающим средством через взаимодействие с партнером связывания, C. В некоторых случаях реактив представляет собой олигомер или полимер индивидуальных молекул или олигомер или полимер комплекса субъединиц, которые образуют индивидуальную молекулу (например, олигомеры или полимеры димерного, тримерного или тетрамерного белка). В некоторых вариантах осуществления реактив может представлять собой, например, олигомер мутеина стрептавидина, олигомер кальмодулина, соединение (олигомер), которое предусматривает наименьшие две хелатирующие группы K, где по меньшей мере две хелатирующие группы способны к связыванию с ионом переходного металла, тем самым делая реактив способным к связыванию с олигогистидиновой аффинной меткой, мультимерной глутатион-S-трансферазой или биотинилированным белком-переносчиком.
[0241] В некоторых вариантах осуществления реактив отличается отсутствием твердого носителя (поверхности), прикрепленного к реактиву. Например, в некоторых вариантах осуществления реактив не содержит или его не прикрепляют (непосредственно или опосредованно) к частице, бусине, наночастице, микросфере или другому твердому носителю. В некоторых вариантах осуществления реактив не является жестким, негибким или ригидным или не содержит или его не прикрепляют к жесткой, негибкой или ригидной поверхности. В некоторых вариантах осуществления реактив является гибким или по существу гибким. В некоторых случаях реактив способен корректироваться или адаптироваться к форме поверхности клетки. В некоторых вариантах осуществления реактив не или не имеет геометрическую форму, которая является сферической или по существу сферической.
[0242] В некоторых вариантах осуществления по существу весь, т. е. больше чем 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше реактива, состоит из органического материала или содержит его. Например, в некоторых вариантах осуществления больше чем 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше реактива состоят из липидов, углеводов, белков, пептидов или их смесей или содержат их. В некоторых вариантах осуществления реактив состоит из или содержит неотъемлемое отсутствие неорганического материала, неорганической сердцевины, например, металла, например, железа, синтетических или неорганических полимеров, таких как стироловые полимеры, например, полистирола, латекса, диоксида кремния или магнитных сердцевин. Например, в некоторых вариантах осуществления относительная процентная доля неорганического материала реактива или которая содержится в качестве части реактива составляет меньше чем 20%, 15%, 10%, 5% или меньше.
[0243] В некоторых вариантах осуществления большинство (т. е. больше чем 50%), например, больше чем 60%, 70%, 80%, 90%, 95%, 99% или больше от общего объема реактива в водном растворе содержит индивидуальные белковые молекулы, которые содержат реактив, например, олигомеры или полимеры индивидуальных молекул или комплекс субъединиц, которые образуют индивидуальную молекулу (например, тетрамерную молекулу). В некоторых вариантах осуществления общая плотность растворимого реактива составляет меньше чем 1,2 г/см3, 1,1 г/см3, 1,0 г/см3 или меньше.
[0244] В некоторых вариантах осуществления растворимый реактив, например, не прикрепляемый к основе или твердому носителю (например, не прикрепляют к бусине), имеет относительно малый размер, например, обычно меньше чем или приблизительно меньше чем 20 нм в размере, например, меньше чем или приблизительно меньше чем 15 нм, меньше чем или приблизительно меньше чем 10 нм, меньше чем или приблизительно меньше чем 5 нм или меньше.
[0245] В некоторых вариантах осуществления растворимый реактив, например, не прикрепляемый к основе или твердому носителю (например, не прикрепляют к бусине), является биологически инертным, т. е. является нетоксичным для живых клеток. В некоторых вариантах осуществления реактив может быть биоразрушаемым, например, его можно разрушать с помощью ферментативной активности или выводить с помощью фагоцитарных клеток.
[0246] В некоторых вариантах осуществления возможно проводить реакцию реактива (например, стрептавидина или мутеина, такого как тетрамерные мутеины стрептавидина) с носителем, таким как органический носитель. В некоторых аспектах, в дополнение к реакции с полисахаридом, также возможно использовать физиологически или фармацевтически приемлемые белки, такие как сывороточный альбумин (например, сывороточный альбумин человека (HSA) или бычий сывороточный альбумин (BSA)) в качестве белка-переносчика. В таком случае, реактив, такой как стрептавидин или мутеин стрептавидина (в виде индивидуального тетрамера или также в форме олигомеров), можно сопрягать с белком-переносчиком через нековалентное взаимодействие. В некоторых таких вариантах осуществления, биотинилированный BSA (который коммерчески доступен у различных поставщиков, таких как ThermoFisher Scientific, Sigma Aldrich или Vectorlabs, среди прочих) может вступать в реакцию с реактивом (например, мутеином стрептавидина). В некоторых аспектах, некоторые олигомеры реактива (например, олигомеры стрептавидина) могут нековалентно связываться через один или более сайтов связывания Z с биотинилированным белком-переносчиком, оставляя большинство сайтов связывания Z олигомера доступными для связывающего средства (например, рецептор-связывающего средства или средства отбора) и любого дополнительного средства, как раскрыто в настоящем описании. Таким образом, с помощью такого подхода можно получать растворимый реактив с множеством сайтов связывания Z.
[0247] В других вариантах осуществления реактив, такой как мутеин стрептавидина (в виде индивидуального тетрамера или также в форме олигомера) можно ковалентно связывать с синтетическим носителем, таким как молекула полиэтиленгликоля (PEG). Например, любую подходящую PEG молекулу можно использовать с этой целью, и молекула PEG и соответствующий реактив могут быть растворимыми. Обычно, молекулы PEG вплоть до молекулярной массы 1000 Да растворимы в воде или средах для культивирования, которые можно использовать в представленных способах. В некоторых случаях, такой реактив, основанный на PEG, можно получать с использованием коммерчески доступных активированных молекул PEG (например, производных PEG-NHS, доступных в NOF North America Corporation, Irvine, California, USA, или активированных производных PEG, доступных в Creative PEGWorks, Chapel Hills, North Carolina, USA) с аминогруппами мутеина стрептавидина.
3. Удаление или разрушение компонентов
[0248] В некоторых вариантах осуществления после инкубации или другого подходящего времени, за которое трансдукцию и/или один или более других процессов (например, отбор, активация, стимуляция и/или размножения) желают нарушить, связывание между партнером связывания C, например, C1, обратимо связанного средства и сайта связывания Z, например, Z1, реактива мультимеризации разрушают посредством разрушения соответствующей обратимой связи. В некоторых случаях, разрушения можно достигать посредством добавления конкурента в инкубацию/реакционную смесь, содержащую популяцию клеток, связываемых реактивом мультимеризации. Для конкурентного разрушения (которое можно понимать как конкурентное элюирование) обратимой связи между партнером связывания C, например, C1, обратимо связанного средства и сайтом связывания Z, например, Z1, реактива мультимеризации, инкубационную смесь/популяцию клеток можно приводить в контакт со свободным первым партнером связывания C, например, C1, или аналогом указанного первого партнера связывания C, который способен разрушать связь между первым партнером связывания и сайтом связывания Z, например, Z1. В примере партнера связывания C, например, C1, представляющего собой стрептавидин-связывающий пептид, который связывается с сайтом связывания биотина в стрептавидине, первый свободный партнер может представлять собой соответствующий свободный стрептавидин-связывающий пептид или аналог, который связывается конкурентно. Такой аналог, например, может представлять собой биотин или производное биотина, такое как дестиобиотин.
[0249] В некоторых аспектах, обратимости можно достичь, поскольку связь между стрептавидин-связывающим пептидом (например, Strep-tag) и связывающим реактивом мутеина стрептавидина высока, но меньше аффинности связывания связывающего реактива стрептавидина к биотину или аналогу биотина. Таким образом, в некоторых вариантах осуществления биотин (витамин H) или аналог биотина можно добавлять для конкуренции за связывание с разрушением взаимодействия связывания между связывающим реактивом мутеина стрептавидина, например, присутствующим на твердом носителе (например, бусине или хроматографической матрице), и стрептавидин-связывающим пептидом (например, Strep-tag). В некоторых вариантах осуществления взаимодействие можно обращать в присутствии низких концентраций биотина или аналога, например, в присутствии от 0,1 мМ до 10 мМ, от 0,5 мМ до 5 мМ или от 1 мМ до 3 мМ, например, обычно по меньшей мере или приблизительно по меньшей мере 1 мМ или по меньшей мере 2 мМ, например, или приблизительно 2,5 мМ. В некоторых вариантах осуществления инкубация в присутствии конкурентного средства, такого как биотин или аналог биотина, высвобождает отобранную клетку из твердого носителя, такого как хроматографическая матрица или бусина.
[0250] В некоторых вариантах осуществления из-за диссоциации обратимо связанного средства или средств от молекулы клеточной поверхности, предоставленный способ имеет такое дополнительное преимущество, что стимулированная популяция клеток не содержит связывающие средства (например, вирусное связывающее средство, средство отбора или стимулирующее средство) в конце периода стимуляции. Также, в некоторых вариантах осуществления, все другие реактивы, используемые в способе, а именно средства (например, первое или второе, рецептор-связывающие средства, например, стимулирующие средства или средства отбора), а также конкурентный реактив партнера связывания C, например, C1, или его аналог, можно легко удалять из стимулированной популяции клеток.
[0251] В некоторых вариантах осуществления выделение/удаление компонентов (например, конкурентного реактива) можно осуществлять с использованием второй стационарной фазы. С этой целью, смесь, содержащую клетки-мишени и/или вирусные частицы и один или более остающихся компонентов, экспонируют, например, до или после нанесения на первую стационарную фазу, описанную выше, для хроматографии на подходящей второй стационарной фазе. Эта вторичная стационарная фаза может представлять собой гель-фильтрационную матрицу и/или матрицу аффинной хроматографии, где гель-фильтрационная матрица и/или матрица аффинной хроматографии содержит аффинный реактив. Аффинный реактив, содержащийся на хроматографической смоле, содержит партнер связывания D, который (специфически) связывается с сайтом связывания Z реактива (например, мутеина стрептавидина, такого Strep-Tactin), тем самым иммобилизуя связывающий молекулу реактив на стационарной фазе. В некоторых вариантах осуществления аффинный реактив может представлять собой, например, стрептавидин, мутеин стрептавидина, авидин, мутеин авидина или их смесь. В некоторых вариантах осуществления средство (например, первое или второе, рецептор-связывающие средства, например, стимулирующие средства или средства отбора) и/или конкурентный реактив, связанный с аффинным реактивом, тем самым иммобилизуют на хроматографической матрице. В некоторых аспектах, если используют реактив связывающей молекулы, основанные на стрептавидине, такой как Strep-Tactin) и средство, связанное с ним содержит стрептавидин-связывающий пептид (например, Strep-tag), партнер связывания D, который содержится в аффинном реактиве этой второй стационарной фазы, может представлять собой биотин. Любой остающийся стрептавидин или мутеин стрептавидина в композиции затем связывается с биотином, который обычно ковалентно связывают с хроматографической матрицей, такой как биотин-сефароза™, которая коммерчески доступна.
[0252] В некоторых таких вариантах осуществления, клетки-мишени (например, генномодифицированные, например, трансдуцированные, T-клетки) можно извлекать из реактива.
[0253] Как результат, образец, содержащий культивируемые клетки, такие как популяция выделенных, отобранных, трансдуцированных, активированных и/или размноженных клеток, обедняют по средству (например, первому средству, второму средству и т.д., такому как вирусное связывающее средство, средство отбора или рецептор-связывающие средства, например, стимулирующие средства или средства отбора) и/или конкурентному веществу. В некоторых вариантах осуществления культивируемая композиция не содержит любые реагенты, что в некоторых аспектах благоприятно для использования в связи с определенными применениями, такими как любые терапевтические применения, основанные на клетках.
[0254] В некоторых вариантах осуществления конкурентное вещество, используемое для разрушения или обращения связывания между средством и реактивом, можно легко удалять из стимулированной популяции клеток через «картридж удаления» (см., например, описанное в международной патентной заявке WO 2013/124474). В некоторых случаях, например, когда реактив иммобилизуют на твердом носителе, таком как поверхность биореактора или магнитная бусина, его удерживают. Таким образом, использование картриджа удаления для удаления свободного средства и конкурентного реактива, может включать загрузку элюированного образца (например, образца, полученного после разрушения обратимого связывания) на вторую хроматографическую колонку. В некоторых вариантах осуществления эта хроматографическая колонка имеет подходящую стационарную фазу, которая является матрицей аффинной хроматографии и одновременно может действовать в качестве гельпроникающей матрицы. В некоторых аспектах, эта матрица аффинной хроматографии имеет аффинный реактив, иммобилизованный на ней. В некоторых вариантах осуществления аффинный реактив может представлять собой, например, стрептавидин, мутеин стрептавидина, авидин, мутеин авидина или их смесь.
[0255] В некоторых вариантах осуществления хроматографическая матрица представляет собой гельфильтрационную матрицу, например, когда используют в картридже удаления, как раскрыто в настоящем описании. В целом, гель-фильтрацию можно охарактеризовать таким свойством, что она разработана для того, чтобы подвергаться. Таким образом, гельфильтрационная матрица в некоторых аспектах допускает разделение клеток или других биологических объектов, главным образом, на основании их размера. В некоторых таких аспектах, соответствующая хроматографическая матрица обычно представляет собой пористый материал в виде частиц, как указано выше. Хроматографическая матрица может иметь определенный эксклюзионный предел, который обычно определяют в отношении молекулярной массы, выше которой полностью исключено попадание молекул в поры. В некоторых вариантах осуществления соответствующую молекулярную массу, определяющую эксклюзионный предел размера, можно выбирать так, чтобы она была ниже массы, соответствующей массе клетки-мишени. В таком варианте осуществления предотвращено попадание клетки-мишени в поры эксклюзионной хроматографической матрицы. Аналогичным образом, стационарная фаза может иметь поры, которые имеют размер, который меньше размера выбранной клетки-мишени. В иллюстративных вариантах осуществления хроматографическая матрица имеет средний размер пор от 0 приблизительно до 500 нм.
[0256] В некоторых вариантах осуществления компоненты, присутствующие в образце, такие как средства (например, вирусное связывающее средство, рецептор-связывающие средства или средства отбора) или конкурентный реактив, могут иметь размер, который ниже эксклюзионного предела пор и, таким образом, могут проходить в поры хроматографической матрицы. В некоторых аспектах, среди таких компонентов, которые способны частично или полностью проходить в объем поры, большие молекулы с меньшим доступом в объем поры можно элюировать первыми, тогда как наименьшие молекулы обычно элюируют последними. В некоторых вариантах осуществления эксклюзионный предел хроматографической матрицы выбирают так, чтобы он был ниже максимальной ширины клетки-мишени. Таким образом, в некоторых аспектах, компоненты, которые имеют доступ в объем поры, могут оставаться дольше на/в хроматографической матрице, чем клетка-мишень. Таким образом, в некоторых случаях, клетки-мишени можно собирать в элюате хроматографической колонки отдельно от другого вещества/компонентов образца. Следовательно, в некоторых аспектах, компоненты, такие как средство (например, рецептор-связывающее средство или средство отбора) или, где применимо, конкурентный реактив, можно элюировать в боле поздний момент времени из гельфильтрационной матрицы, чем клетку-мишень. В некоторых вариантах осуществления этот эффект дополнительно можно увеличивать, например, если гельпроникающая матрица содержит реактив (например, ковалентно связанный с ней), который содержит сайты связывания Z, которые способны к связыванию средств (например, рецептор-связывающих средств или средств отбора) и/или конкурентного реактива, присутствующих в образце. В некоторых случаях, средство (например, рецептор-связывающее средство или средство отбора) и/или конкурентный реактив можно связывать с помощью сайтов связывания Z реактива и, тем самым, иммобилизовать на матрице. В некоторых аспектах, этот способ осуществляют в картридже удаления.
[0257] В некоторых вариантах осуществления предусмотрено устройство, которое содержит по меньшей мере одну компоновку первой и второй стационарной фазы, такую как хроматографическая колонка для отбора клеток (картридж отбора) и вторую хроматографическую колонку (картридж удаления) для удаления реактивов. Устройство может содержать множество компоновок первой и второй стационарных фаз (хроматографических колонок), соединенных по текучей среде последовательно. Устройство может содержать впуск образца, соединенный по текучей среде с первой стационарной фазой первой компоновки первой и второй стационарных фаз. В некоторых вариантах осуществления устройство также может содержать выпуск образца для клеток, выпуск образца соединен по текучей среде со второй стационарной фазой последней из по меньшей мере одной компоновки первой и второй стационарных фаз для хроматографии. В некоторых аспектах, устройство также может содержать контейнер конкурентного реактива, который соединяют по текучей среде с по меньшей мере одной из первых стационарных фаз компоновок первой и второй стационарных фаз.
[0258] В некоторых вариантах осуществления способность удалять реактив и другие компоненты из композиции имеет дополнительное преимущество в виде возможности избегать какого-либо твердого носителя, такого как магнитные бусы. В некоторых вариантах осуществления это обозначает отсутствие риска или минимальный риск контаминации клеток-мишеней (например, генномодифицированных, например, трансдуцированных, T-клеток) такими магнитными бусами. В некоторых вариантах осуществления это также обозначает, что процесс, который соответствует стандартам GMP, можно создать более легко по сравнению с другими способами, такими как использование Dynabeads®, где нужно принимать дополнительные меры для того, чтобы гарантировать, что конечная популяция T-клеток не содержит магнитные бусы.
B. Связывающие средства
[0259] В некоторых вариантах осуществления средство (например, рецептор-связывающее средство, средство отбора, связывающее вирусную векторную частицу средство) имеет один или сайты связывания для связывания с молекулой на поверхности биологической частицы, такой как клетка, микроорганизм или вирус. В некоторых вариантах осуществления средство (например, рецептор-связывающее средство или средство отбора) имеет один или более сайтов связывания, B, для связывания с молекулой на поверхности клетки, например, молекулой клеточной поверхности. В некоторых вариантах осуществления средство (например, связывающее вирусную векторную частицу средство) имеет один или более сайтов связывания, V, для связывания с молекулой на поверхности вирусной частицы. Таким образом, в некоторых случаях, средство (например, рецептор-связывающее средство или средство отбора) содержит сайт связывания (например, B или V) или множество сайтов связывания (например, множество сайтов связывания B или V), где специфическое связывание между средством и молекулой на поверхности биологической частицы (например, клеток или вирусной частицы) включает взаимодействие между одним или несколькими сайтами связывания (например, B или V) и молекулой.
[0260] В некоторых вариантах осуществления средство содержит только один сайт связывания, т. е. является одновалентным. В некоторых вариантах осуществления средство имеет по меньшей мере два, например, множество сайтов связывания, в том числе три, четыре или пять сайтов связывания, способных к связыванию с молекулой. В некоторых случаях, сайт связывания представляет собой B, и средство (например, рецептор-связывающее средство или средство отбора) содержит множество сайтов связывания B, в том числе, два, три, четыре или пять сайтов связывания B, способных к связыванию с молекулой клеточной поверхности (например, B1, B2, B3 и т. д.). В некоторых таких аспектах, по меньшей мере два или множество сайтов связывания B могут быть идентичными. В некоторых вариантах осуществления один или более из по меньшей мере двух или множества сайтов связывания B могут быть различными (например, B1 и B2). В некоторых вариантах осуществления сайт связывания представляет собой V, и средство (например, связывающее вирусную частицу средство) содержит множество сайтов связывания V, в том числе два, три, четыре или пять сайтов связывания V, способных к связыванию с молекулой на поверхности вирусной векторной частицы (например, V1, V2, V3 и т. д.). В некоторых таких аспектах, по меньшей мере два или множество сайтов связывания V могут быть идентичными. В некоторых вариантах осуществления один или более из по меньшей мере двух или множества сайтов связывания V могут различаться (например, V1 и V2). В некоторых вариантах осуществления сайт связывания (например, B или V) содержит связывающий участок антитела (например, одну или более определяющих комплементарность областей (CDR)) или по меньшей мере два из таких связывающих участков антитела.
[0261] В некоторых вариантах осуществления одно или более различных средств (например, одно или более различных рецептор-связывающих средств, средств отбора или других средств, которые связываются с молекулой на клетке) обратимо связывают с реактивом. В некоторых вариантах осуществления по меньшей мере 2, 3, 4 или больше различных средств обратимо связывают с одним и тем же реактивом. В некоторых вариантах осуществления по меньшей мере два различных средства обратимо связывают с одним и тем же реактивом, в соответствии с чем каждый реактив содержит сайт связывания B или множество сайтов связывания B для специфического связывания между средством и молекулой. В некоторых вариантах осуществления по меньшей мере два или больше средств содержат один и тот же сайт связывания B, например, для связывания одной и той же или по существу одной и той же молекулы. В некоторых вариантах осуществления по меньшей мере два или больше средств содержат различные сайты связывания B, например, для связывания с различными молекулами. В некоторых вариантах осуществления первое средство (например, первое рецептор-связывающее средство или первое средство отбора) содержит сайт связывания B1, B2, B3, B4 и т. д. и второе средство (например, второе рецептор-связывающее средство или второе средство отбора) содержит другой из сайтов связывания B1, B2, B3, B4 и т. д. В некоторых вариантах осуществления первое средство (например, первое средство отбора) содержит сайт связывания B1 и второе средство (например, второе средство отбора) содержит сайт связывания B3. В некоторых вариантах осуществления первое средство (например, первое рецептор-связывающее средство) содержит сайт связывания B2 и второе средство (например, второе рецептор-связывающее средство) содержит сайт связывания B4. В любом из таких вариантов осуществления первое средство и второе средство могут содержать партнер связывания, C1 или C2. В некоторых вариантах осуществления C1 и C2 могут представлять собой одно и то же. В некоторых вариантах осуществления C1 и C2 различны. В некоторых вариантах осуществления первое средство и второе средство содержат один и тот же партнер связывания, C1.
[0262] В некоторых случаях, константа диссоциации (KD) связывания между средством (например, через сайт связывания B) и сайтом связывания Z реактива может иметь значение в диапазоне приблизительно от 10-2 M приблизительно до 10-13 M или приблизительно от 10-3 M приблизительно до 10-12 M или приблизительно от 10-4 M приблизительно до 10-11 M, или приблизительно от 10-5 M приблизительно до 10-10 M. В некоторых вариантах осуществления константа диссоциации (KD) для связывания между связывающим средством и молекулой низкой аффинности, например, в диапазоне KD приблизительно от 10-3 приблизительно до 10-7 M. В некоторых вариантах осуществления константа диссоциации (KD) для связывания между связывающим средством и молекулой высокой аффинности, например, в диапазоне KD приблизительно от 10-7 приблизительно до 1×10-10 M.
[0263] В некоторых вариантах осуществления диссоциация связывания средства через сайт связывания, B или V, и молекулы происходит достаточно быстро, например, чтобы сделать возможным только временное окрашивание или ассоциирование биологической частицы (например, клетки-мишени или вирусной частицы) со средством после разрушения обратимой связи между реактивом и средством. В некоторых случаях, при выражении в единицах koff (также называемой константой скорости диссоциации для связывания между средством (через сайт связывания B) и молекулой, koff составляет приблизительно 0,5×10-4 с-1 или больше, приблизительно 1×10-4 с-1 или больше, приблизительно 2×10-4 с-1 или больше, приблизительно 3×10-4 с-1 или больше, приблизительно 4×10-4 с-1 или больше, приблизительно 5×10-4 с-1 или больше, приблизительно 1×10-3 с-1 или больше, приблизительно 1,5×10-3 с-1 или больше, приблизительно 2×10-3 с-1 или больше, приблизительно 3×10-3 с-1 или больше, приблизительно 4×10-3 с-1, приблизительно 5×10-3 с-1 или больше, приблизительно 1×10-2 с или больше, или приблизительно 5×10-1 с-1 или больше. Специалист в данной области сможет эмпирически определять диапазон koff, подходящий для конкретного взаимодействия средства и молекулы клетки (см., например, опубликованную заявку США № US 2014/0295458). Например, средство с довольно высокой koff, например, больше 4,0×10-4 с-1 можно использовать с тем, чтобы, после разрушения связанных комплексов, основную часть средства можно было удалять или диссоциировать в пределах одного часа. В других случаях, средство с более низкой koff, например, 1,0×10-4 с-1, можно использовать, с тем, чтобы после разрушения связанных комплексов, основную часть средства можно было удалять или диссоциировать из клетки в пределах приблизительно 3 с половиной часов.
[0264] В некоторых вариантах осуществления KD этой связи, а также KD, KA, koff и kon связи, образуемой между сайтом связывания (B или V) средства (например, рецептор-связывающего средства, средства отбора или связывающего вирусную векторную частицу средства) и молекулы, можно было определять с помощью любого подходящего средства, например, с помощью флуоресцентного титрования, равновесного диализа или поверхностного плазмонного резонанса.
[0265] В некоторых аспектах, молекула, против которой может быть направлено средство (например, рецептор-связывающее средство или средство отбора), представляет собой молекулу клеточной поверхности. В некоторых вариантах осуществления молекула клеточной поверхности представляет собой пептид или белок, такой как рецептор, например, мембранный рецепторный белок. В некоторых вариантах осуществления рецептор представляет собой липид, полисахарид или нуклеиновую кислоту. В некоторых вариантах осуществления молекула клеточной поверхности, которая является белком, может представлять собой периферический мембранный белок или интегральный мембранный белок. Молекула клеточной поверхности может в некоторых вариантах осуществления иметь один или более доменов, которые пронизывают мембрану. В качестве некоторых иллюстративных примеров, мембранный белок с трансмембранным доменом может представлять собой сопряженный с G-белком рецептор, такой как рецепторы пахучих веществ, родопсиновый рецептор, родопсиновый феромоновый рецептор, рецептор пептидных гормонов, вкусовой рецептор, GABA рецептор, опиатный рецептор, серотониновый рецептор, Ca2+ рецептор, меланопсин, рецептор нейротрансмиттеров, такой как лиганд-зависимый, потенциал-зависимый или механический рецептор, в том числе ацетилхолиновый, никотиновый, адренергический, норэпинефриновый, катехоламиновый, L-DOPA-, дофаминовый и серотониновый (биогенного амина, эндорфиновый/энкефалиновый) нейропептидный рецептор, рецепторная киназа, такая как серин/треониновая киназа, тирозинкиназа, порин/канал, такой как хлоридный канал, калиевый канал, натриевый канал, OMP белок, ABC переносчик (АТФ-связывающий кассетный переносчик), такой как аминокислотный переносчик, Na-глюкозный переносчик, Na/йодидный переносчик, ионный переносчик, такой как светособирающий комплекс, оксидаза цитохрома C, АТФаза Na/K, H/K, Ca, рецептор клеточной адгезии, такой как металлопротеаза, интегрин или катерин.
[0266] В некоторых вариантах осуществления молекула клеточной поверхности может представлять собой антиген, определяющий желаемую популяцию или субпопуляцию клеток, например, популяцию или субпопуляцию клеток крови, например, лимфоцитов (например, T-клеток, T-хелперных клеток, например, CD4+ T-хелперных клеток, B-клеток или естественных киллерных клеток), моноцитов или стволовых клеток, например, CD34-положительных периферических стволовых клеток или стволовых клеток, экспрессирующих Nanog или Oct-4. Примеры T-клеток включают клетки, такие как CMV-специфические CD8+ T-лимфоциты, цитотоксические T-клетки, T-клетки памяти и регуляторные T-клетки (Treg). Иллюстративным примером Treg являются CD4 CD25 CD45RA регуляторные T-клетки и иллюстративным примером T-клеток памяти являются CD62L CD8+ специфические центральные T-клетки памяти. Молекула клеточной поверхности также может представлять собой маркер опухолевой клетки.
[0267] В некоторых вариантах осуществления молекула, против которой может быть направлено средство (например, связывающее вирусную векторную частицу средство), представляет собой молекулу на поверхности вируса. Образцы таких молекул описаны далее.
[0268] Как описано выше, в некоторых вариантах осуществления в дополнение к сайту связывания, B или V, средство (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство) партнер связывания C. В некоторых аспектах, этот партнер связывания C способен к связыванию с сайтом связывания Z реактива, где реактив имеет один или более сайтов связывания для партнера связывания C. В некоторых вариантах осуществления нековалентная связь, которую можно формировать между партнером связывания C, который содержится в средстве (например, рецептор-связывающем средстве или средстве отбора), и сайтом(ами) связывания Z реактива, может быть любой желаемой силы и аффинности, и может быть разрушаемой или обратимой в условиях, при которых осуществляют способ. Средство (например, рецептор-связывающее средство, средство отбора и/или связывающее вирусную частицу средство) может содержать по меньшей мере один, в том числе два, три или больше дополнительных партнеров связывания C и реактив может содержать по меньшей мере два, например, три, четыре, пять, шесть, семь, восемь или больше сайтов связывания Z для партнера связывания C, который содержится в средстве (например, рецептор-связывающем средстве или средстве отбора). Как описано в патенте США 7776562, патенте США 8298782 или международной патентной заявке WO 2002/054065, можно выбирать любую комбинацию партнера связывания C и реактива с одним или несколькими соответствующими сайтами связывания Z, например, такую, что партнер связывания C и сайт связывания Z способны обратимо связываться в комплексе, например, чтобы вызывать эффект авидности.
[0269] Партнер связывания C, содержащийся в средстве (например, рецептор-связывающем средстве, средстве отбора или связывающем вирусную векторную частицу средстве), например, может быть основан на углеводороде (в том числе полимерном) и содержать группы азота, фосфора, серы, карбена, галогена или псевдогалогена. В некоторых аспектах, он может представлять собой спирт, органическую кислоту, неорганическую кислоту, амин, фосфин, тиол, дисульфид, алкан, аминокислоту, пептид, олигопептид, полипептид, белок, нуклеиновую кислоту, липид, сахарид, олигосахарид или полисахарид. В качестве дополнительных примеров, также он может представлять собой катион, анион, поликатион, полианион, поликатион, электролит, полиэлектролит, углеродную нанотрубку или углеродную нанопену. В целом, такой партнер связывания C имеет более высокую аффинность к сайту связывания реактива, чем к другому веществу. Примеры соответствующего партнера связывания C включают, но не ограничиваясь этим, краун-эфир, иммуноглобулин, его фрагмент и белковую связывающую молекулу с антителоподобными функциями.
[0270] В некоторых вариантах осуществления партнер связывания C, который содержится в средстве (например, рецептор-связывающем средстве, средстве отбора или связывающем вирусную векторную частицу средстве), включает биотин и реактив включает аналог стрептавидина или аналог авидина, который обратимо связывается с биотином. В некоторых вариантах осуществления партнер связывания C, который содержится в средстве, включает аналог биотина, который обратимо связывается со стрептавидином или авидином, и реактив включает стрептавидин, авидин, аналог стрептавидина или аналог авидина, который обратимо связывается с соответствующим аналогом биотина. В некоторых вариантах осуществления партнер связывания C, который содержится в средстве, включает стрептавидин- или авидин-связывающий пептид, и реактив включает стрептавидин, авидин, аналог стрептавидина или аналог авидина, который обратимо связывается с соответствующим стрептавидин- или авидин-связывающим пептидом.
[0271] В некоторых вариантах осуществления реактив представляет собой стрептавидин, такой как мутеин стрептавидина, включая любое описанное выше (например, приведенное в SEQ ID №№3-6), и партнер связывания C, который содержится в средстве (например, рецептор-связывающем средстве или средстве отбора), может включать стрептавидин-связывающий пептид. В некоторых вариантах осуществления стрептавидин-связывающий пептид может содержать последовательность с общей формулой, приведенной в SEQ ID №9, например, содержит последовательность, приведенную в SEQ ID №10. В некоторых вариантах осуществления пептидная последовательность имеет общую формулу, приведенную в SEQ ID №11, например, приведенную в SEQ ID №12. В одном из примеров, пептидная последовательность представляет собой Trp-Arg-His-Pro-Gln-Phe-Gly-Gly (также называемую Strep-tag®, приведенную в SEQ ID №7). В одном из примеров, пептидная последовательность представляет собой Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (также называемый Strep-tag® II, приведенный в SEQ ID №8). В некоторых вариантах осуществления пептидный лиганд содержит последовательную компоновку из по меньшей мере двух стрептавидин-связывающих модулей, где расстояние между двумя модулями составляет по меньшей мере 0 и не больше чем 50 аминокислот, где один связывающий модуль имеет от 3 до 8 аминокислот и содержит по меньшей мере последовательность His-Pro-Xaa (SEQ ID №9), где Xaa представляет собой глутамин, аспарагин или метионин, и где другой связывающий модуль имеет тот же или другой пептидный лиганд стрептавидина, например, приведенный в SEQ ID №11 (см., например, международную опубликованную заявку PCT № WO 02/077018; патент США №7981632). В некоторых вариантах осуществления пептидный лиганд содержит последовательность, имеющую формулу, приведенную в любой из SEQ ID №13 или 14. В некоторых вариантах осуществления пептидный лиганд имеет последовательность аминокислот, приведенную в любой из SEQ ID №№15-19. В большинстве случаев, все эти стрептавидин-связывающие пептиды связываются с одним и тем же сайтом связывания, а именно сайтом связывания биотина в стрептавидине. Если один или более таких стрептавидин-связывающих пептидов используют в качестве партнеров связывания C, например, C1 и C2, реактив мультимеризации обычно представляет собой мутеин стрептавидина.
[0272] В некоторых вариантах осуществления стрептавидин-связывающий пептид дополнительно можно модифицировать. В некоторых вариантах осуществления стрептавидин-связывающий пептид может содержать пептидную последовательность Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (также называемую Strep-tag® II, которая приведена в SEQ ID №8), конъюгированную с заряженной никелем trisNTA (также называемой His-STREPPER или His/Strep-tag®II Adapter).
[0273] В определенном варианте осуществления партнер связывания C средства (например, рецептор-связывающего средства, средства отбора и/или связывающего вирусную векторную частицу средства) содержит фрагмент, известный специалисту в данной области как аффинная метка. В таком варианте осуществления, реактив может содержать соответствующий партнер связывания, например, антитело или фрагмент антитела, который, как известно, связывается с аффинной меткой. В качестве некоторых иллюстративных примеров известных аффинных меток, партнер связывания C, который содержится в средстве (например, рецептор-связывающем средстве или средстве отбора), может включать динитрофенол или дигоксигенин, олигогистидин, полигистидин, домен иммуноглобулина, мальтоза-связывающий белок, глутатион-S-трансферазу (GST), хитин-связывающий белок (CBP) или тиоредоксин, кальмодулин-связывающий пептид (CBP), FLAG-пептид, HA-метку (последовательность: Tyr-Pro-Tyr-Asp-Val-Pro-Asp-Tyr-Ala) (SEQ ID №20), VSV-G-метку (последовательность: Tyr-Thr-Asp-Ile-Glu-Met-Asn-Arg-Leu-Gly-Lys) (SEQ ID №21), HSV-метку (последовательность: Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp) (SEQ ID №22), эпитоп T7 (Ala-Ser-Met-Thr-Gly-Gly-Gln-Gln-Met-Gly) (SEQ ID №23), мальтоза-связывающий белок (MBP), эпитоп HSV последовательности Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp (SEQ ID №24) гликопротеина D вируса простого герпеса, эпитоп «myc» фактора транскрипции c-myc последовательности Glu-Gln-Lys-Leu-Ile-Ser-Glu-Glu-Asp-Leu (SEQ ID №25), V5-метку (последовательность: Gly-Lys-Pro-Ile-Pro-Asn-Pro-Leu-Leu-Gly-Leu-Asp-Ser-Thr) (SEQ ID №26) или глутатион-S-трансферазу (GST). В таких вариантах осуществления, комплекс, образуемый между одним или несколькими сайтами связывания Z реактива, который может представлять собой антитело или фрагмент антитела, и антигеном, можно разрушать конкурентно посредством добавления свободного антигена, т. е. свободного пептида (эпитопной метки) или свободного белка (такого как MBP или CBP). В некоторых вариантах осуществления аффинная метка также может представлять собой олигонуклеотидную метку. В некоторых случаях, такую олигонуклеотидную метку, например, можно использовать для гибридизации с олигонуклеотидом с комплементарной последовательностью, связанной с реактивом или включенной в него.
[0274] Дополнительные примеры подходящего партнера связывания C включают, но не ограничиваясь этим, лектин, белок A, белок G, металл, ион металла, производные нитрилотриуксусной кислоты (NT A), мотивы RGD, декстран, полиэтиленимин (PEI), окислительно-восстановительный полимер, гликопротеины, аптамеры, краситель, амилозу, мальтозу, целлюлозу, хитин, глутатион, кальмодулин, желатин, полимиксин, гепарин, NAD, NADP, лизин, аргинин, бензамидин, поли-U или олиго-dT. Известно, что лектины, такие как конкавалин A, связываются с полисахаридами и гликозилированными белками. Иллюстративным примером красителя является триазиновый краситель, такой как цибракон синий F3G-A (CB) или красный HE-3B, который специфически связывает NADH-зависимые ферменты. Обычно, зеленый A связывается с CoA белками, сывороточным альбумином человека и дегидрогеназами. В некоторых случаях, красители 7-аминоактиномицин D и 4',6-диамидино-2-фенилиндол связываются с ДНК. В целом, катионы металлов, таких как Ni, Cd, Zn, Co или Cu, обычно используют для связывания аффинных меток, таких как олигогистидин-содержащая последовательность, в том числе гексагистидиновая или His-Asn-His-Arg-His-Lys-His-Gly-Gly-Gly-Cys метка (MAT-метка)(SEQ ID №35), и сложный N-метакрилоил-(L)-цистеинметиловый эфир.
[0275] В некоторых вариантах осуществления связывание между партнером связывания C, который содержится в средстве (например, рецептор-связывающем средстве, средстве отбора или связывающем вирусную векторную частицу средстве), и одним или несколькими сайтами связывания Z реактива происходит в присутствии двухвалентного, трехвалентного или четырехвалентного катиона. В связи с этим, в некоторых вариантах осуществления реактив содержит двухвалентный, трехвалентный или четырехвалентный катион, обычно удерживаемый, например, в комплексе, подходящим хелатором. В некоторых вариантах осуществления партнер связывания C, который содержится в средстве (например, рецептор-связывающем средстве или средстве отбора), может содержать фрагмент, который включает, например, комплексы, двухвалентный, трехвалентный или четырехвалентный катион. Примеры соответствующего хелатора металлов, включают, но не ограничиваясь этим, этилендиамин, этилен-диаминтетрауксусную кислоту (EDTA), этиленгликольтетрауксусную кислоту (EGTA), диэтилентриаминпентауксусную кислоту (DTPA), N,N-бис(карбоксиметил)глицин (также называемый нитрилотриуксусной кислотой, NTA), 1,2-бис(o-аминофенокси)этан-N,N,N',N'-тетрауксусную кислоту (BAPTA), 2,3-димеркапто-1-пропанол (димеркапрол), порфин и гем. В качестве примера, EDTA образует комплекс с большинством одновалентных, двухвалентных, трехвалентных и четырехвалентных ионов металла, таких как, например, серебро (Ag+), кальций (Ca2+), марганец (Mn2+), медь (Cu2+), железо (Fe2+), кобальт (Co+) и цирконий (Zr4+), тогда как BAPTA является специфичной для Ca2+. В качестве иллюстративного примера, стандартный способ, используемый в данной области, представляет собой формирование комплекса между олигогистидиновой меткой и ионами меди (Cu2+), никеля (Ni2+), кобальта (Co2+) или цинк (Zn2+), которые представлены хелатором нитрилотриуксусной кислотой (NTA).
[0276] В некоторых вариантах осуществления партнер связывания C, который содержится в средстве (например, рецептор-связывающем средстве, средстве отбора и/или связывающем вирусную векторную частицу средстве), содержит кальмодулин-связывающий пептид, и реактив содержит мультимерный кальмодулин, как описано, например, в патенте США 5985658. В некоторых вариантах осуществления партнер связывания C, который содержится в средстве (например, рецептор-связывающем средстве, средстве отбора и/или связывающем вирусную векторную частицу средстве), включает FLAG-пептид и реактив включает антитело, которое связывается с FLAG-пептидом, например, FLAG-пептидом, который связывается с моноклональным антителом 4E11, как описано в патенте США 4851341. В одном из вариантов осуществления партнер связывания C, который содержится в средстве (например, рецептор-связывающем средстве, средстве отбора и/или связывающем вирусную векторную частицу средстве), включает олигогистидиновую метку и реактив включает антитело или ион переходного металла, связывающий олигогистидиновую метку. В некоторых случаях, разрушение всех этих связанных комплексов можно выполнять посредством хелатирования иона металла, например, хелатирования кальция, например, посредством добавления EDTA или EGTA. В некоторых вариантах осуществления кальмодулин, антитела, такие как 4E11, или хелатированные ионы металла или свободные хелаторы можно мультимеризовать стандартными способами, например, посредством биотинилирования и комплексообразования со стрептавидином или авидином или их олигомерами или посредством введения карбоксильных остатков в полисахарид, например, декстран, по существу как описано в Noguchi, A, et al. Bioconjugate Chemistry (1992) 3132-137 на первой стадии и связывания кальмодулина или антител или хелатированных ионов металла или свободных хелаторов через первичные аминогруппы с карбоксильными группами в полисахаридном, например, декстрановом, остове с использованием стандартной реакции с карбодиимидом на второй стадии. В некоторых таких вариантах осуществления связывание между партнером связывания C, который содержится в средстве (например, рецептор-связывающем средстве или средстве отбора), и одним или несколькими сайтами связывания Z реактива можно разрушать посредством хелатирования иона металла. Хелатирование металла можно выполнять, например, посредством добавления EGTA или EDTA.
[0277] В некоторых вариантах осуществления один или более сайтов связывания, B или V, средства, которое специфически связывается с молекулой, например, могут содержаться в антителе, его фрагменте или белковой связывающей молекуле с антителоподобными функциями. В некоторых вариантах осуществления сайт связывания, B или V, средства представляет собой связывающий участок антитела, например, представляет собой или содержит одну или более определяющих комплементарность областей (CDR) антитела. Примеры (рекомбинантных) фрагментов антител включают, но не ограничиваясь этим, Fab-фрагменты, Fv фрагменты, одноцепочечные Fv фрагменты (scFv), двухвалентный фрагмент антитела, такой как an (Fab)2'-фрагмент, диатела, триатела (Iliades, P., et al, FEB S Lett (1997) 409, 437-441), декатела (Stone, E., et al, Journal of Immunological Methods (2007) 318, 88-94) и другие доменные антитела (Holt, L.J., et al, Trends Biotechnol. (2003), 21, 11, 484-490). В некоторых вариантах осуществления средство (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство) может содержать двухвалентную белковую искусственную связывающую молекулу, такую как димерный мутеин липокалина, который также известен как «дуокалин».
[0278] В некоторых вариантах осуществления средство (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство) может иметь один сайт связывания, B или V, т. е., оно может быть одновалентным. Примеры одновалентных средств включают, но не ограничиваясь этим, одновалентный фрагмент антитела, белковую связывающую молекулу с антителоподобными связывающими свойствами или молекулу MHC. Примеры фрагментов одновалентного антитела включают, но не ограничиваясь этим, Fab-фрагмент, Fv фрагмент, и одноцепочечный Fv фрагмент (scFv), в том числе двухвалентный одноцепочечный Fv фрагмент.
[0279] В некоторых вариантах осуществления средство представляет собой антитело или его антигенсвязывающий фрагмент, такой как Fab-фрагменты, Fv-фрагменты, одноцепочечные Fv-фрагменты (scFv), двухвалентный фрагмент антитела, такой как (Fab)2'-фрагмент. В некоторых вариантах осуществления средство представляет собой или извлекают из исходного антитела, для которого известно, что оно связывается с молекулой клетки, представляющей интерес. Различные молекулы антител или их фрагменты против молекул клеточной поверхности хорошо известны в данной области, и любые из их множества можно использовать в качестве средств в способах в настоящем описании. В некоторых вариантах осуществления средство представляет собой антитело или его фрагмент, которое содержит одну или более замен аминокислот в вариабельной тяжелой цепи исходного или эталонного антитела, например, чтобы создавать антитело с измененной аффинностью или которое демонстрирует достаточно высокую скорость диссоциации, как описано выше. Например, образцы таких мутаций известны в контексте мутантов антитела 13B8.2 против CD4 (см., например, патент США №7482000, заявку на патент США № US 2014/0295458 или международную патентную заявку № WO 2013/124474), и любые из таких мутаций можно создавать в другом исходном или эталонном антителе.
[0280] В некоторых аспектах, средство (например, рецептор-связывающее средство, средство отбора или связывающее вирусную векторную частицу средство), которое может быть одновалентным, например, содержать одновалентный фрагмент антитела или одновалентную искусственную связывающую молекулу (белковую или другую), такую как мутеин, основанный на полипептиде семейства липокалина (также известном как «Антикалин®»), или двухвалентной молекулой, такой как антитело или фрагмент, в которой оба сайта связывания сохранены, например, F(ab')2 фрагмент.
[0281] Пример белковой связывающей молекулы с антителоподобными функциями включает мутеин, основанный на полипептиде семейства липокалина (см., например, WO 03/029462, Beste et al, Proc. Natl. Acad. Sci. U.S.A. (1999) 96, 1898-1903). В целом, липокалины, такие как билин-связывающий белок, липокалин, ассоциированный с желатиназой нейтрофилов человека, аполипопротеин D человека или липокалин слез человека, содержат естественные лиганд-связывающие сайты, которые можно модифицировать с тем, чтобы они связывали заданную мишень. Дополнительные примеры белковой связывающей молекулы с антителоподобными связывающими свойствами, которые можно использовать в качестве средства (например, рецептор-связывающего средства или средства отбора), которое специфически связывается с молекулой клеточной поверхности, включают, но не ограничиваясь этим, так называемые глутела («glubody») (см., например, международную патентную заявку WO 96/23879), белки, основанные на анкириновом каркасе (Mosavi, L.K., et al, Protein Science (2004) 13, 6, 1435-1448) или кристаллиновом каркасе (например, международная патентная заявка WO 01/04144) белки, описанные в Skerra, J. Mol. Recognit. (2000) 13, 167-187, аднектины, тетранектины и авимеры. В целом, авимеры, в том числе поливалентные авимерные белки, полученные посредством перетасовки экзонов семейства рецепторных доменов человека, содержат так называемые A-домены, которые встречаются в виде нитей из множества доменов в нескольких рецепторах клеточной поверхности (Silverman, J., et al, Nature Biotechnology (2005) 23, 1556-1561). Аднектины, в целом получаемые из домена фибронектина человека, обычно содержат три петли, которые можно конструировать для иммуноглобулиноподобного связывания с мишенями (Gill, D.S. & Damle, N.K., Current Opinion in Biotechnology (2006) 17, 653-658). Тетранектины, в целом получаемые из соответствующего гомотримерного белка человека, аналогичным образом обычно содержат области петель в домене лектина C-типа, которые можно конструировать для желаемого связывания. Пептоиды, которые, в некоторых случаях, могут действовать в качестве белковых лигандов, обычно представляют собой олиго(N-алкил)глицины, которые отличаются от пептидов тем, что боковая цепь соединена с амидным азотом вместо атома углерода. Пептоиды обычно устойчивы к протеазам и другим модифицирующим ферментам и могут иметь значительно более высокую проницаемость в клетки, чем пептиды (см., например, Kwon, Y.-U., and Kodadek, T., J. Am. Chem. Soc. (2007) 129, 1508-1509).
[0282] Дополнительные примеры подходящих белковых связывающих молекул включают, но не ограничиваясь этим, EGF-подобный домен, Kringle-домен, домен фибронектина I типа, домен фибронектина II типа, домен фибронектина III типа, домен PAN, домен Gla, домен SRCR, домен ингибитора панкреатического трипсина быка/Куница, тендамистат, домен ингибитора сериновой протеазы типа Kazal, домен трилистника (P-типа), домен фактора фон Виллебранда типа C, анафилатоксинподобный домен, домен CUB, повтор тироглобулина I типа, домен LDL-рецептора класса A, домен Sushi, домен Link, домен тромбоспондина I типа, домен иммуноглобулина или иммуноглобулиноподобный домен (например, доменные антитела или антитела тяжелых цепей верблюда), домен лектина C-типа, домен MAM, домен фактора фон Виллебранда типа A, домен соматомедина B, домен WAP-типа ядра с четырьмя дисульфидными связями, домен C типа F5/8, домен гемопексина, домен SH2, домен SH3, EGF-подобный домен ламининового типа, домен C2, «каппатела» (Ill et al. Protein Eng (1997) 10, 949-57, так называемое «миниантитело» (Martin et al, EMBO J (1994) 13, 5303-5309), диатело (Holliger et al, PNAS USA (1993)90, 6444-6448), так называемый «Janusis» (Traunecker et al, EMBO J (1991) 10, 3655-3659, или Traunecker et al, Int J Cancer (1992) Suppl 7, 51-52), нанотело, микротело, аффилин, аффитело, ноттин, убиквитин, белок с цинковым пальцем, аутофлуоресцентный белок или белок с повтором, богатым лейцином. В некоторых вариантах осуществления молекула нуклеиновой кислоты с антителоподобными функциями может представлять собой аптамер. В целом, аптамер укладывается в определенных трехмерный мотив и демонстрирует высокую аффинность к заданной структуре-мишени.
1. Рецептор-связывающие средства
[0283] В некоторых вариантах осуществления средство представляет собой рецептор-связывающее средство. В некоторых вариантах осуществления рецептор-связывающее средство связывается с молекулой (например, рецептором) на поверхности клетки, это связывание между средством и молекулой способно к индукции или модулированию сигнала в клетках. В некоторых случаях, молекула клеточной поверхности (например, рецептор) представляет собой сигнальную молекулу. В некоторых таких случаях, рецептор-связывающее средство способно к специфическому связыванию с сигнальной молекулой, экспрессируемой одной или несколькими клетками. В некоторых случаях, рецептор-связывающее средство представляет собой стимулирующее средство, которое может представлять собой любое средство, которое способно к индукции сигнала в клетке (например, T-клетке) при связывании с молекулой клеточной поверхности, такой как рецептор. В некоторых вариантах осуществления сигнал может быть иммуностимулирующим, и в этом случае рецептор-связывающее средство или стимулирующее средство способно к индукции или модулированию сигнала, который участвует в или который стимулирует иммунный ответ посредством клетки (например, T-клетки), например, увеличивает пролиферацию или размножение иммунных клеток, активацию клеток иммунной системы, дифференцировку клеток иммунной системы, секрецию цитокинов, цитотоксическую активность или одну или более других функциональных активностей клетки иммунной системы. В определенном варианте осуществления, сигнал может быть ингибирующим, и в этом случае рецептор-связывающее средство или стимулирующее средство способно к индукции или модулированию сигнала в клетке (например, T-клетке), который вовлечен в или который ингибирует иммунный ответ, например, ингибирует или снижает пролиферацию или размножение иммунных клеток, активацию клеток иммунной системы, дифференцировку клеток иммунной системы, секрецию цитокинов, цитотоксическую активность или одну или более других функциональных активностей клетки иммунной системы.
[0284] В некоторых вариантах осуществления рецептор-связывающее средство представляет собой первое рецептор-связывающее средство. В некоторых аспектах, первое рецептор-связывающее средство связывается с молекулой рецептора на поверхности клеток. Таким образом, в некоторых случаях, первое рецептор-связывающее средство индуцирует или модулирует сигнал. В некоторых аспектах, индуцирование или модулирование сигнала с помощью первого рецептор-связывающего средства влияет на активацию, стимуляцию и/или размножение (пролиферацию) клеток. Таким образом, в некоторых случаях, первое рецептор-связывающее средство обеспечивает первичный сигнал активации для клеток, тем самым активируя клетки.
[0285] В некоторых вариантах осуществления популяция клеток может представлять собой популяцию лимфоцитов, включающую, но без ограничения, популяцию B-клеток, популяцию T-клеток или популяцию естественных киллерных клеток. Иллюстративные примеры популяций клеток представляют собой B-клетки, несущие CD40 или CD137 (обе популяции клеток могут пролиферировать при связывании только первого средства, которое обеспечивает сигнал активации, например, лиганда 4-1BB; или молекулы антитела αCD40 или молекулы антитела αCD137 (см., например, Zhang et al., 2010, J Immunol, 184:787-795)). Другие иллюстративные примеры для средств (первого или второго), которые можно использовать для размножения B-клеток, представляют собой средства, которые связываются с IgG, CD19, CD28 или CD14, например, молекулы антител αCD19, αIgG, αCD28 или αCD14. Также предусмотрено, что первое или второе средства для размножения B-клеток могут содержать лиганды для Toll-подобных рецепторов или интерлейкинов, таких как IL-21 (см., например, Dienz O, et al. 2009. J. Exp. Med. 206:69). Следует отметить, что липополисахарид-зависимая активация B-клеток также предусмотрена в настоящем изобретении, поскольку липополисахарид также можно использовать в качестве первого средства и оснащать партнером связывания C1, как используют в настоящем описании.
[0286] Другие иллюстративные примеры подходящих популяций клеток включают популяцию T-клеток, которая размножается после активации посредством связывания первого средства с TCR/CD3 и связывания второго средства со вспомогательной молекулой на T-клетке, такой как CD28. В этом случае, первое средство стимулирует ассоциированный с комплексом TCR/CD3 сигнал в T-клетках и второе средство обеспечивает вторичный стимул посредством связывания CD28 в качестве вспомогательной молекулы. Средства, которые можно использовать для размножения T-клеток, также могут включать интерлейкины, такие как IL-2, IL-7, IL-15 или IL-21 (см., например, Cornish et al. 2006, Blood. 108(2):600-8, Bazdar and Sieg, 2007, Journal of Virology, 2007, 81(22):12670-12674, Battalia et al, 2013, Immunology, 139(1):109-120). Другие иллюстративные примеры средств, которые можно использовать для размножения T-клеток, представляют собой средства, которые связываются с CD8, CD45 или CD90, такие как антитела αCD8, αCD45 или αCD90. Иллюстративные примеры популяции T-клеток, включая антиген-специфические T-клетки, T-хелперные клетки, цитотоксические T-клетки, T-клетки памяти (иллюстративным примером T-клеток памяти являются CD62L+CD8+ специфические центральные T-клетки памяти) или регуляторные T-клетки (иллюстративным примером Treg являются CD4+CD25+CD45RA+ регуляторные T-клетки).
[0287] Другой иллюстративный пример подходящей популяции клеток включает естественные киллерные клетки (NK клетки), которые, например, можно размножать с использованием средств, которые связываются с CD16 или CD56, например, таких как антитела αCD16 или αCD56. Иллюстративным примером такого антитела αCD16 является антитело 3G8 с последовательностью VH, приведенной в SEQ ID №36, и последовательностью VL, приведенной в SEQ ID №37 (см., например, Hoshino et al, Blood. 1991 Dec 15; 78(12):3232-40.). Другое средство, которое можно использовать для размножения NK клеток, может представлять собой IL-15 (см., например, Vitale et al. 2002. Anatomical Record. 266:87-92). Еще один другой иллюстративный пример подходящей популяции клеток включает моноциты, которые, например, можно размножать с использованием средства, которое связывается с CD14, такого как молекула антитела αCD14.
[0288] В некоторых вариантах осуществления первое рецептор-связывающее средство может стимулировать ассоциированный с комплексом TCR/CD3 сигнал в клетках, например, T-клетках. В некоторых аспектах, первое рецептор-связывающее средство может представлять собой связывающее средство, которое специфически связывает CD3. В некоторых случаях, первое рецептор-связывающее средство, которое специфически связывает CD3, можно выбирать из группы, состоящей из антитела против CD3, двухвалентного фрагмента антитела из антитела против CD3, одновалентного фрагмента антитела из антитела против CD3 и белковой CD3-связывающей молекулы с антителоподобными связывающими свойствами. Двухвалентный фрагмент антитела может представлять собой (Fab')2-фрагмент или двухвалентный одноцепочечный Fv-фрагмент, тогда как одновалентный фрагмент антитела можно выбирать из группы, состоящей из Fab-фрагмента, Fv-фрагмента и одноцепочечного Fv-фрагмента (scFv). В некоторых случаях, белковая CD3-связывающая молекула с антителоподобными связывающими свойствами может представлять собой аптамер, мутеин, основанный на полипептиде семейства липокалина, глутело, белок, основанный на анкириновом каркасе, белок, основанный на кристаллиновом каркасе, аднектин или авимер.
[0289] В некоторых вариантах осуществления Fab-фрагмент против CD3 можно получать из CD3-связывающего моноклонального антитела, продуцируемого гибридомной клеточной линией OKT3 (ATCC® CRL-8001™; см. также патент США №4361549). Вариабельный домен тяжелой цепи и вариабельный домен легкой цепи антитела против CD3 OKT3 описаны в Arakawa et al J. Biochem. 120, 657-662 (1996) и содержат аминокислотные последовательности, приведенные в SEQ ID № 31 и 32, соответственно.
[0290] В некоторых аспектах, рецептор-связывающее средство представляет собой второе рецептор-связывающее средство. В некоторых случаях, второе рецептор-связывающее средство связывается с молекулой на поверхности клеток, такой как молекула клеточной поверхности, например, молекула рецептора. В некоторых вариантах осуществления второе рецептор-связывающее средство способно усиливать, ослаблять или модифицировать сигнал, доставляемый через первую молекулу. В некоторых вариантах осуществления второе рецептор-связывающее средство индуцирует или модулирует сигнал, например, второй или дополнительный сигнал. В некоторых аспектах, второе рецептор-связывающее средство может усиливать или потенцировать сигнал, индуцированный первым рецептор-связывающим средством. В некоторых вариантах осуществления второе рецептор-связывающее средство связывается со вспомогательной молекулой и/или может стимулировать или индуцировать вспомогательный или вторичный сигнал в клетке. В некоторых аспектах, второе рецептор-связывающее средство связывается с костимулирующей молекулой и/или обеспечивает костимулирующий сигнал.
[0291] В некоторых вариантах осуществления рецептор-связывающее средство, которое может представлять собой второе рецептор-связывающее средство, связывается, например, специфически связывается, со второй молекулой, которая может представлять собой костимулирующую молекулу, вспомогательную молекулу, цитокиновый рецептор, хемокиновый рецептор, молекулу иммунной контрольной точки или элемент семейства TNF или семейства рецепторов TNF.
[0292] В некоторых вариантах осуществления молекула на клетке, например, T-клетке, может представлять собой CD28, и рецептор-связывающее средство (например, которое может представлять собой второе рецептор-связывающее средство) специфически связывает CD28. В некоторых аспектах, рецептор-связывающее средство (например, которое может представлять собой второе рецептор-связывающее средство), которое специфически связывает CD28, можно выбирать из группы, состоящей из антитела против CD28, двухвалентного фрагмент антитела из антитела против CD28, одновалентный фрагмент антитела из антитела против CD28 и белковую CD28-связывающую молекулу с антителоподобными связывающими свойствами. Двухвалентный фрагмент антитела может представлять собой (Fab')2-фрагмент или двухвалентный одноцепочечный Fv-фрагмент, тогда как одновалентный фрагмент антитела можно выбирать из группы, состоящей из Fab-фрагмента, Fv-фрагмента и одноцепочечного Fv-фрагмента (scFv). Белковая CD28-связывающая молекула с антителоподобными связывающими свойствами может представлять собой аптамер, мутеин, основанный на полипептиде семейства липокалина, глутело, белок, основанный на анкириновом каркасе, белок, основанный на кристаллиновом каркасе, аднектин и авимер.
[0293] В некоторых вариантах осуществления Fab-фрагмент против CD28 можно получать из антитела CD28.3 (депонировано в виде синтетической одноцепочечной Fv конструкции под номером доступа GenBank AF451974.1; см. также Vanhove et al, BLOOD, 15 июля 2003 года, том 102, №2, страницы 564-570), тяжелая и легкая цепи которого содержат SEQ ID №33 и 34, соответственно.
[0294] В некоторых вариантах осуществления молекула на клетке, например, T-клетке или B-клетке, может представлять собой CD137 и рецептор-связывающее средство (например, которое может представлять собой второе рецептор-связывающее средство) специфически связывает CD137. В некоторых аспектах, рецептор-связывающее средство (например, которое может представлять собой второе рецептор-связывающее средство), которое специфически связывает CD137, можно выбирать из группы, состоящей из антитела против CD137, двухвалентного фрагмента антитела из антитела против CD137, одновалентного фрагмента антитела из антитела против CD137 и белковой CD137 связывающей молекулы с антителоподобными связывающими свойствами.
[0295] В некоторых вариантах осуществления молекула на клетке, например, B-клетке, может представлять собой CD40 и рецептор-связывающее средство (например, которое может представлять собой второе рецептор-связывающее средство) специфически связывает CD40. В некоторых аспектах, рецептор-связывающее средство (которое может представлять собой второе рецептор-связывающее средство), которое специфически связывает CD40, можно выбирать из группы, состоящей из антитела против CD40, двухвалентного фрагмент антитела из антитела против CD40, одновалентного фрагмента антитела из антитела против CD40 и белковой CD40 связывающей молекулы с антителоподобными связывающими свойствами.
[0296] В любых из приведенных выше примеров, двухвалентный фрагмент антитела может представлять собой (Fab')2-фрагмент или двухвалентный одноцепочечный Fv-фрагмент, тогда как одновалентный фрагмент антитела можно выбирать из группы, состоящей из Fab-фрагмента, Fv-фрагмента и одноцепочечного Fv-фрагмента (scFv). В любых из приведенных выше примеров, белковая связывающая молекула с антителоподобными связывающими свойствами может представлять собой аптамер, мутеин, основанный на полипептиде семейства липокалина, глутело, белок, основанный на анкириновом каркасе, белок, основанный на кристаллиновом каркасе, аднектин и авимер.
[0297] В некоторых аспектах, рецептор-связывающее средство, например, стимулирующее средство, специфически направленно воздействует на молекулу, экспрессируемую на поверхности клеток-мишеней, где молекула представляет собой TCR или химерный антигенный рецептор. Например, молекулу, экспрессируемую на поверхности клетки-мишени, выбирают из комплекса антигенного рецептора T-клетки или B-клетки, цепи CD3, CD3 дзета, антигенсвязывающей части T-клеточного рецептора или B-клеточного рецептора, или химерного антигенного рецептора. В некоторых случаях, рецептор-связывающее средство направленно воздействует на комплексы пептидов:MHC класса I.
[0298] В некоторых вариантах осуществления стимулирующее средство связывается с внеклеточным доменом молекулы с гистидиновой меткой, экспрессируемой на поверхности клеток-мишеней. В некоторых случаях, стимулирующее средство содержит пептидную последовательность Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (также называемую Strep-tag® II, которая приведена в SEQ ID №8), конъюгированную с заряженной никелем trisNTA (также называемой His-STREPPER или His/Strep-tag®II Adapter). В некоторых вариантах осуществления молекула, экспрессируемая на поверхности клеток-мишеней, которая имеет гистидиновую метку, представляет собой CD19.
[0299] В некоторых аспектах, рецептор-связывающее средство, например, стимулирующее средство, специфически связывается с антительной частью рекомбинантного рецептора, например, CAR. В некоторых случаях, антительная часть рекомбинантного рецептора содержит по меньшей мере часть константной области иммуноглобулина, такую как шарнирная область, например, шарнирная область IgG4, и/или CH1/CL и/или Fc-область. В некоторых вариантах осуществления константная область или часть представляет собой IgG человека, такой как IgG4 или IgG1. В некоторых случаях реактив нагружают с использованием αIgG, которое распознает спейсер IgG4.
2. Средства отбора
[0300] В некоторых вариантах осуществления средство представляет собой средство отбора. В некоторых вариантах осуществления средство отбора связывается с молекулой на поверхности клетки, такой как молекула клеточной поверхности. В некоторых случаях, молекула клеточной поверхности представляет собой селективный маркер. В некоторых таких случаях, средство отбора способно к специфическому связыванию с селективным маркером, экспрессируемым одной или несколькими клетками. В некоторых вариантах осуществления средство или средства отбора, которые обратимо связываются с реактивом, можно использовать для того, чтобы содействовать отбору или выделению клеток.
[0301] В некоторых аспектах, молекула клеточной поверхности, например, селективный маркер, может представлять собой антиген, определяющий желаемую популяцию или субпопуляцию клеток, например, популяцию или субпопуляцию клеток крови, например, лимфоцитов (например, T-клеток, T-хелперных клеток, например, CD4+ T-хелперных клеток, B-клеток или естественных киллерных клеток), моноцитов или стволовых клеток, например, CD34-положительных периферических стволовых клеток или стволовых клеток, экспрессирующих Nanog или Oct-4. В некоторых вариантах осуществления селективный маркер может представлять собой маркер, экспрессируемый на поверхности T-клеток или подмножества T-клеток, такого как CD25, CD28, CD62L, CCR7, CD27, CD127, CD3, CD4, CD8, CD45RA и/или CD45RO. Примеры T-клеток включают клетки, такие как CMV-специфические CD8+ T-лимфоциты, цитотоксические T-клетки, T-клетки памяти и регуляторные T-клетки (Treg). Иллюстративный пример Treg включает CD4 CD25 CD45RA регуляторные T-клетки и иллюстративный пример T-клеток памяти включает CD62L CD8+ специфические центральные T-клетки памяти. Молекула клеточной поверхности, например, селективный маркер, также может представлять собой маркер опухолевой клетки.
[0302] В некоторых вариантах осуществления селективный маркер может представлять собой CD4 и средство отбора специфически связывает CD4. В некоторых аспектах, средство отбора, которое специфически связывает, CD4 можно выбирать из группы, состоящей из антитела против CD4, двухвалентного фрагмент антитела из антитела против CD4, одновалентного фрагмента антитела из антитела против CD4 и белковой CD4-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления антитело против CD4, такое как двухвалентный фрагмент антитела или одновалентный фрагмент антитела (например, CD4 Fab-фрагмент), можно получать из антитела 13B8.2 или функционально активного мутанта 13B8.2, который сохраняет специфическое связывание с CD4. Например, образцовые мутанты антитела 13B8.2 или m13B8.2 описаны в патенте США №7482000, заявке на патент США № US 2014/0295458 или международной патентной заявке № WO 2013/124474; и Bes, C, et al. J Biol Chem 278, 14265-14273 (2003). Мутантный Fab-фрагмент, называемый «ml3B8.2», несет вариабельный домен CD4-связывающего мышиного антитела 13B8.2 и константный домен, содержащий константный домен CH1 человека типа γ, для тяжелой цепи и константный домен легкой цепи человека типа κ, как описано в патенте США 7482000. В некоторых вариантах осуществления антитело против CD4, например, мутант антитела 13B8.2, содержит замену аминокислоты H91A в вариабельной легкой цепи, замену аминокислоты Y92A в вариабельной легкой цепи, замену аминокислоты H35A в вариабельной тяжелой цепи и/или замену аминокислоты R53A в вариабельной тяжелой цепи, каждая по нумерации Кабат. В некоторых аспектах, по сравнению с вариабельными доменами Fab-фрагмента 13B8.2 в ml3B8.2, остаток His в положении 91 легкой цепи (положение 93 в SEQ ID №30) мутирован в Ala и остаток Arg в положении 53 тяжелой цепи (положение 55 в SEQ ID №29) мутирован в Ala. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD4 или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8000-206 или 6-8000-205 или 6-8002-100; IBA GmbH, Gottingen, Germany).
[0303] В некоторых вариантах осуществления селективный маркер может представлять собой CD8 и средство отбора специфически связывает CD8. В некоторых аспектах средство отбора, которое специфически связывает CD8, можно выбирать из группы, состоящей из антитела против CD8, двухвалентного фрагмента антитела из антитела против CD8, одновалентного фрагмента антитела из антитела против CD8 и белковой CD8-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления антитело против CD8, такое как двухвалентный фрагмент антитела или одновалентный фрагмент антитела (например, CD8 Fab-фрагмент) можно получать из антитела OKT8 (например, ATCC CRL-8014) или его функционально активного мутанта, который сохраняет специфическое связывание с CD8. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD8 или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8003 или 6-8000-201; IBA GmbH, Gottingen, Germany).
[0304] В некоторых вариантах осуществления селективный маркер может представлять собой CD3 и средство отбора специфически связывает CD3. В некоторых аспектах, средство отбора, которое специфически связывает CD3, можно выбирать из группы, состоящей из антитела против CD3, двухвалентного фрагмента антитела из антитела против CD3, одновалентного фрагмента антитела из антитела против CD3 и белковой CD3-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления антитело против CD3, такое как двухвалентный фрагмент антитела или одновалентный фрагмент антитела (например, CD3 Fab-фрагмент) можно получать из антитела OKT3 (например, ATCC CRL-8001; см., например, Stemberger et al. PLoS One. 2012; 7(4): e35798) или его функционально активного мутанта, который сохраняет специфическое связывание с CD3. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD3 или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8000-201, 6-8001-100; IBA GmbH, Gottingen, Germany).
[0305] В некоторых вариантах осуществления селективный маркер может представлять собой CD25 и средство отбора специфически связывает CD25. В некоторых аспектах, средство отбора, которое специфически связывает CD25, можно выбирать из группы, состоящей из антитела против CD25, двухвалентного фрагмента антитела из антитела против CD25, одновалентного фрагмента антитела из антитела против CD25 и белковой CD25-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления антитело против CD25, такое как двухвалентный фрагмент антитела или одновалентный фрагмент антитела (например, CD25 Fab-фрагмент), можно получать из антитела FRT5 (см., например, Stemberger et al. 20128) или его функционально активного мутанта, который сохраняет специфическое связывание с CD25. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD4 или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8000-205 или 6-8000-207 или 6-8004-050; IBA GmbH, Gottingen, Germany).
[0306] В некоторых вариантах осуществления селективный маркер может представлять собой CD62L и средство отбора специфически связывает CD62L. В некоторых аспектах, средство отбора, которое специфически связывает CD62L, можно выбирать из группы, состоящей из антитела против CD62L, двухвалентного фрагмент антитела из антитела против CD62L, одновалентного фрагмента антитела из антитела против CD62L и белковой CD62L-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления антитело против CD62L, такое как двухвалентный фрагмент антитела или одновалентный фрагмент антитела (например, CD62L Fab-фрагмент) можно получать из антитела DREG56 (например, ATCC HB300; см., например, Stemberger et al. 2012) или его функционально активного мутанта, который сохраняет специфическое связывание с CD62L. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD62L или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8000-204 или 6-8005-050; IBA GmbH, Gottingen, Germany).
[0307] В некоторых вариантах осуществления селективный маркер может представлять собой CD45RA и средство отбора специфически связывает CD45RA. В некоторых аспектах, средство отбора, которое специфически связывает CD45RA, можно выбирать из группы, состоящей из антитела против CD45RA, двухвалентного фрагмента антитела из антитела против CD45RA, одновалентного фрагмента антитела из антитела против CD45RA и белковой CD45RA-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления антитело против CD45RA, такое как двухвалентный фрагмент антитела или одновалентный фрагмент антитела (например, CD45RA Fab-фрагмент), можно получать из антитела MEM56 (например, Millipore 05-1413; см., например, Stemberger et al. 2012) или его функционально активного мутанта, который сохраняет специфическое связывание с CD45RA. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD45RA или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8000-208 или 6-8007-050; IBA GmbH, Gottingen, Germany).
[0308] В некоторых вариантах осуществления селективный маркер может представлять собой CD45RO и средство отбора специфически связывает CD45RO. В некоторых аспектах, средство отбора, которое специфически связывает CD45RO, можно выбирать из группы, состоящей из антитела против CD45RO, двухвалентного фрагмента антитела из антитела против CD45RO, одновалентного фрагмента антитела из антитела против CD45RO и белковой CD45RO-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD45RO или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8000-209 или 6-8012-020; IBA GmbH, Gottingen, Germany).
[0309] В некоторых вариантах осуществления селективный маркер может представлять собой CD154 и средство отбора специфически связывает CD154. В некоторых аспектах, средство отбора, которое специфически связывает CD154, можно выбирать из группы, состоящей из антитела против CD154, двухвалентного фрагмента антитела из антитела против CD154, одновалентного фрагмента антитела из антитела против CD154 и белковой CD154-связывающей молекулы с антителоподобными связывающими свойствами. В некоторых вариантах осуществления реактив, который обратимо связывают со средством против CD154 или его фрагментом, коммерчески доступен или его получают из реактива, который коммерчески доступен (например, № по каталогу 6-8000-202 или 6-5510-050; IBA GmbH, Gottingen, Germany).
3. Связывающее вирусную векторную частицу средство
[0310] В некоторых вариантах осуществления средство представляет собой связывающее вирусную векторную частицу средство (также называемое связывающим вирусную частицу средством или их сходными вариациями), которое связывается с молекулой на поверхности вирусной частицы. В некоторых вариантах осуществления реактив, который может представлять собой олигомер или полимер, например, реактив мультимеризации, обратимо связывают со связывающим вирусную частицу средством через партнер связывания. В некоторых вариантах осуществления партнер связывания представляет собой партнер связывания C (например, C1), который обратимо связывается с сайтом связывания Z (например, Z1), присутствующим на реактиве. В некоторых вариантах осуществления связывающее вирусную частицу средство содержит сайт связывания V (например, V1), который связывается с молекулой на поверхности вирусной частицы.
[0311] В некоторых вариантах осуществления связывающее вирусную частицу средство не необходимо, так что вирусную частицу можно непосредственно обратимо связывать с реактивом. В некоторых вариантах осуществления вирусная частица содержит партнер связывания C (например, C1), который экспрессирован непосредственно на поверхности вируса, который может обратимо связываться с сайтом связывания Z (например, Z1), присутствующим на реактиве.
[0312] В некоторых вариантах осуществления реактив, с которым обратимо связывают связывающее вирусную векторную частицу средство, дополнительно можно обратимо связывать с помощью другого средства, такого как рецептор-связывающее средство и/или средство отбора, которое способно к связыванию с молекулой на поверхности клетки, которую желают трансдуцировать вирусной векторной частицей. Таким образом, в некоторых вариантах осуществления реактив способен к приведению вирусной частицы, связанной связывающим вирусную векторную частицу средством, в тесный контакт с клеткой, связанной рецептор-связывающим средством или средством отбора, тем самым содействуя трансдукции клетки.
[0313] В некоторых вариантах осуществления молекула на поверхности вирусной частицы связывается с сайтом связывания V1, присутствующим на связывающей вирусную частицу средстве.
[0314] В некоторых вариантах осуществления молекула на поверхности вирусной частицы содержит вирусный оболочечный белок или вариант или часть вирусного оболочечного белка вируса или химерный оболочечный белок. В некоторых вариантах осуществления вирусная частица представляет собой ретровирусную частицу, такую как лентивирусная частица. В некоторых вариантах осуществления вирусный оболочечный белок, такой как вирусный гликопротеин, представляет собой тот, который является природным или нативным для конкретного штамма или вида вируса, например, является ассоциированным со штаммом ретровируса (например, лентивируса) в природе. В некоторых вариантах осуществления вирусный оболочечный белок, такой как вирусный гликопротеин, представляет собой тот, который не является природным или нативным для конкретного штамма вируса. Например, в некоторых вариантах осуществления вирусная частица, такая как ретровирусная частица (например, лентивирусная частица) является псевдотипированной для того, чтобы содержать гликопротеин оболочки, полученный у другого вируса, например, для увеличения или изменения клеточного тропизма вируса. Например, в некоторых случаях, ретровирусы, в том числе лентивирусы, обычно имеют узкий тропизм, поскольку поверхностный гликопротеин, кодируемый геном env, только способен к связыванию с рецептором на клетках ограниченного числа типов. Таким образом, в некоторых вариантах осуществления ретровирусный вектор (например, лентивирусный вектор) является псевдотипированным с использованием оболочечного белка, такого как гликопротеин оболочки или химерный гликопротеин, который получен у вируса везикулярного стоматита (VSV), вируса лейкоза гиббонов (GALV), вируса мышиного лейкоза (MLV), вируса мышиного лейкоза Молони (MoMuLV или MMLV), вируса Синдбис, вируса мышиной саркомы Харви (HaMuSV или HSV), вируса опухолей молочных желез мышей (MuMTV или MMTV), вируса иммунодефицита человека (HIV), вируса саркомы Рауса (RSV), вируса RD114 или лимфотропного вируса T-клеток человека 1 типа (HTLV-1), или другой гликопротеин вирусной оболочки, известный в данной области (см., например, Frecha et al. 2008 и WO 2015/036713).
[0315] Таким образом, в некоторых вариантах осуществления молекула на поверхности вирусной частицы может представлять собой или содержать вирусный оболочечный белок (например, гликопротеин вирусной оболочки) или его вариант, часть или химеру, для которых вирусная частица псевдотипирована. Образцовые вирусные оболочечные белки (например, гликопротеины вирусной оболочки) включают или получают, например, из гликопротеинов VSV (VSVG или VSV-G), гликопротеина Sindbis (например, SIN), гликопротеина MMLV, гликопротеинов HSV, гликопротеинов MMTV, гликопротеинов GALV, гликопротеина HIV, в том числе gp160, gp120 и/или gp41, или гликопротеинов RSV, в том числе gp85 и/или gp37, или их вариантов, частей или химер. В некоторых вариантах осуществления вирусная частица, содержащая вирусный оболочечный белок, представляет собой лентивирусную частицу.
[0316] В некоторых вариантах осуществления вирусный оболочечный белок представляет собой белок вируса везикулярного стоматита G (VSVG или VSV-G) или его варианты. В некоторых вариантах осуществления VSVG является модифицированным полиэтиленгликолем (пегилированным) или ковалентно модифицированным с использованием монометоксиполи(этилена).
[0317] В некоторых вариантах осуществления молекула на поверхности вирусной частицы представляет собой белок вирусного капсида или его вариант. Образцовые белки капсида включают белок капсида p24.
[0318] В некоторых вариантах осуществления молекула на поверхности вирусной частицы представляет собой вирусный матриксный белок или его вариант. Образцовые матриксные белки включают матриксный белок p17.
[0319] В некоторых вариантах осуществления связывающее вирусную частицу средство не нейтрализует или по существу не нейтрализует вирусную частицу, т. е. является не нейтрализующим связывающим вирусную частицу средством. В некоторых вариантах осуществления связывающее вирусную частицу средство не или по существу не препятствует связыванию вириона с клеточными рецепторами для захвата, захвату вириона в клетках, сбрасыванию оболочки с геномов в эндосомах, агрегированию вирусных частиц и/или лизису вирусов, заключенных в оболочки, например, например, изменяет или меняет такой признак не больше чем 2-кратно или не больше чем 1,5-кратно по сравнению с соответствующим признаком, как он имеет место в отсутствие связывающего вирусную частицу средства. В некоторых вариантах осуществления степень связывания вириона с клеточными рецепторами для захвата и/или захвата вирионов в клетки не снижена или по существу не снижена в присутствии связывающего вирусную частицу средства по сравнению со связыванием вирионов с рецепторами и/или захватом вирионов клетками, происходящим в отсутствие присутствия связывающего вирусную частицу средства. В некоторых вариантах осуществления степень или уровень связывания вирионов с клеточными рецепторами для захвата и/или захвата вирионов в клетки составляет по меньшей мере 50% или больше, например, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или больше от степени или уровня связывания вирионов с клеточными рецепторами для захвата и/или захватом вирионов в клетки в отсутствие связывающего вирусную частицу средства.
[0320] В некоторых вариантах осуществления связывающее вирусную частицу средство представляет собой антитело или его антиген-связывающий фрагмент. В некоторых вариантах осуществления связывающее вирусную частицу средство может являться одновалентной (например, одновалентный фрагмент антитела или одновалентная искусственная связывающая молекула (белковая или другая), такая как мутеин, основанный на полипептиде семейства липокалина (также известный как «Антикалин®), или двухвалентной молекулой, такой как антитело или фрагмент, в котором оба сайта связывания сохранены, например, F(ab')2 фрагмент.
[0321] В некоторых вариантах осуществления связывающее вирусную частицу средство может представлять собой антитело против VSV-G, антитело против гликопротеина Sindbis (например, антитело против SIN) и антитело против гликопротеина MMLV, антитело против гликопротеина HSV, антитело против гликопротеина MMTV, антитело против гликопротеина GALV, антитело против гликопротеина HIV или антитело против гликопротеина RSV или их антигенсвязывающие фрагменты, такие как двухвалентный фрагмент антитела, например, F(ab')2 фрагмент или двухвалентный одноцепочечный Fv-фрагмент, или одновалентный фрагмент антитела, например, Fab-фрагмент, Fv-фрагмент и одноцепочечный Fv-фрагмент (scFv). В некоторых вариантах осуществления связывающее вирусную частицу средство может представлять собой антитело против gp160, антитело против gp120, антитело против gp41, антитело против gp85 или антитело против pg37, или их антигенсвязывающие фрагменты, такие как двухвалентный фрагмент антитела, например, F(ab')2 фрагмент или двухвалентный одноцепочечный Fv-фрагмент, или одновалентный фрагмент антитела, например, Fab-фрагмент, Fv-фрагмент и одноцепочечный Fv-фрагмент (scFv). В некоторых вариантах осуществления антитело представляет собой Fab-фрагмент.
[0322] В некоторых вариантах осуществления антитело представляет собой антитело против VSV-G или его антигенсвязывающий фрагмент, такой как двухвалентный фрагмент антитела, например, F(ab')2 фрагмент или двухвалентный одноцепочечный Fv-фрагмент, или одновалентный фрагмент антитела, например, Fab-фрагмент, Fv-фрагмент и одноцепочечный Fv-фрагмент (scFv). В некоторых вариантах осуществления антитело против VSV-G или его антигенсвязывающий фрагмент представляет собой или его получают из антитела против VSV-G, описанного в Lefrancois, J Virol. 1984 Jul; 51(1):208-14, или другого антитела против VSV-G, известного специалисту в данной области.
[0323] В некоторых вариантах осуществления антитело представляет собой антитело против gp120 или его антигенсвязывающий фрагмент, такой как двухвалентный фрагмент антитела, например, F(ab')2 фрагмент или двухвалентный одноцепочечный Fv-фрагмент, или одновалентный фрагмент антитела, например, Fab-фрагмент, Fv-фрагмент и одноцепочечный Fv-фрагмент (scFv). В некоторых вариантах осуществления антитело представляет собой антитело против gp41 или его антигенсвязывающий фрагмент, такой как двухвалентный фрагмент антитела, например, F(ab')2 фрагмент или двухвалентный одноцепочечный Fv-фрагмент, или одновалентный фрагмент антитела, например, Fab-фрагмент, Fv-фрагмент и одноцепочечный Fv-фрагмент (scFv). В некоторых вариантах осуществления антитело представляет собой антитело против gp160 или его антигенсвязывающий фрагмент, такой как двухвалентный фрагмент антитела, например, F(ab')2 фрагмент или двухвалентный одноцепочечный Fv-фрагмент, или одновалентный фрагмент антитела, например, Fab-фрагмент, Fv-фрагмент и одноцепочечный Fv-фрагмент (scFv). В некоторых вариантах осуществления антитело против gp120, антитело против gp160 или антитело против gp41 или их антигенсвязывающие фрагменты представляют собой или их получают из антител, которые связываются с gp120, gp41 и gp160, описанных в Holl et al., J Virol. 2006 Jun; 80(12):6177-81 или известных специалисту в данной области.
[0324] В некоторых вариантах осуществления связывающие вирусную частицу средства связывается с молекулой на поверхности вирусной частицы, которая представляет собой не вирусную рекомбинантную молекулу, гетерологичную вирусу. В некоторых вариантах осуществления способы модификации поверхности вирусных частиц включают, например, псевдотипирование, создание слитых белков, посттрансляционную модификацию белков липофильными остатками, такую как модификация гликозилфосфатидилинозитоловым якорем, использование адаптерных молекул или непосредственная химическая модификация (Metzner and Dangerfield, гл. 3 «Surface Modification of Retroviral Vectors for Gene Therapy, в «Viral Gene Therapy», опубликованном 20 июля 2011 года).
[0325] В некоторых аспектах, модификации поверхности вирусных частиц достигают с помощью тех же процессов, которые используют для того, чтобы получать и производить вирусные частицы. В некоторых случаях, совместная трансфекция плазмидных векторов, несущих гены для получения вирусной частицы, с использованием конструкций, содержащих нуклеиновую кислоту, кодирующую не вирусную рекомбинантную молекулу, представляющую интерес, может вести к формированию вирусных частиц, несущих не вирусную рекомбинантную молекулу, представляющую интерес, (Metzner and Dangerfield). Наблюдения показывают, что клетки, используемые для того, чтобы получать вирусные частицы, например, вирусные частицы для трансдукции клеток-мишеней, чтобы экспрессировать рекомбинантную молекулу, представляющую интерес, могут экспрессировать рекомбинантную молекулу (например, химерный антигенный рецептор) во время получения вирусных частиц. Соответственно, предусмотрено, что вирусные частицы, получаемые в таких клетках-продуцентах (например, клетках-продуцентах для получения вирусных частиц, содержащих гетерологичную нуклеиновую кислоту, кодирующую антигенный рецептор, такой как химерный антигенный рецептор (CAR)), могут нести рекомбинантную молекулу (например, CAR) на поверхности вирусной частицы. Таким образом, в некоторых аспектах, связывающее вирусную частицу средство может представлять собой то, которое специфически связывается с самим антигенным рецептором (например, CAR) на поверхности вирусной частицы, используемой для трансдукции клеток для экспрессии антигенного рецептора. В некоторых вариантах осуществления связывающее вирусную частицу средство представляет собой или содержит антитело или антигенсвязывающий фрагмент, направленный на внеклеточную область антигенного рецептора (например, CAR). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент специфически связывает антигенсвязывающий фрагмент (например, scFv) в CAR). В некоторых вариантах осуществления связывающее вирусную частицу средство представляет собой антиидиотипическое антитело. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент специфически связывается с шарнирной областью антигенного рецептора (например, CAR), такой как шарнирная область IgG, включая любое, как описано или известно. Схожие способы можно использовать для других рекомбинантных гетерологичных молекул.
[0326] В некоторых вариантах осуществления поверхность вирусной частицы содержит синтетический фрагмент, такой как пептид, который, в некоторых случаях, может представлять собой метку (например, аффинную метку). В некоторых вариантах осуществления вирусную векторную частицу конструируют для того, чтобы экспрессировать такой фрагмент, например, пептид или метку (например, аффинную метку), на ее поверхности. Например, в некоторых аспектах, молекулу на поверхности вируса, такую как вирусный гликопротеин, конструируют в виде слитого белка для экспрессии синтетического фрагмента, такого как пептид или метка (например, аффинная метка). В таком варианте осуществления, связывающее вирусную частицу средство содержит сайт связывания V (например, V1), который специфически связывается с синтетическим фрагментом, пептидом или меткой, экспрессируемыми на поверхности вирусной частицы.
[0327] Образцовые синтетические фрагменты, пептиды или метки (например, аффинные метки) могут включать: динитрофенол или дигоксигенин, олигогистидин, полигистидин, домен иммуноглобулина, мальтоза-связывающий белок, глутатион-S-трансферазу (GST), хитин-связывающий белок (CBP) или тиоредоксин, кальмодулин-связывающий пептид (CBP), FLAG-пептид, пептид гемагглютинина (HA-метку) (YPYDVPDYA, SEQ ID №20), VSV-G-метку, HSV-метку, эпитоп T7, мальтоза-связывающий белок (MBP), эпитоп HSV, эпитоп «myc», V5-метку, глутатион-S-трансферазу (GST), стрептавидин-связывающий пептид (например, Strep-tag®), олигонуклеотид, краситель, катион, поликатион.
[0328] В качестве некоторых иллюстративных примеров известных аффинных меток включены, например, динитрофенол или дигоксигенин, олигогистидин, полигистидин, домен иммуноглобулина, мальтоза-связывающий белок, глутатион-S-трансфераза (GST), хитин-связывающий белок (CBP) или тиоредоксин, кальмодулин-связывающий пептид (CBP), FLAG-пептид, HA-метка (последовательность: Tyr-Pro-Tyr-Asp-Val-Pro-Asp-Tyr-Ala) (SEQ ID №20), VSV-G-метка (последовательность: Tyr-Thr-Asp-Ile-Glu-Met-Asn-Arg-Leu-Gly-Lys) (SEQ ID №21), HSV-метка (последовательность: Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp) (SEQ ID №22), эпитоп T7 (Ala-Ser-Met-Thr-Gly-Gly-Gln-Gln-Met-Gly) (SEQ ID №23), мальтоза-связывающий белок (MBP), эпитоп HSV последовательности Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp (SEQ ID №24) гликопротеина D вирус простого герпеса, эпитоп «myc» фактора транскрипции c-myc последовательности Glu-Gln-Lys-Leu-Ile-Ser-Glu-Glu-Asp-Leu (SEQ ID №25), V5-метка (последовательность: Gly-Lys-Pro-Ile-Pro-Asn-Pro-Leu-Leu-Gly-Leu-Asp-Ser-Thr) (SEQ ID №26) или глутатион-S-трансфераза (GST).
[0329] Образцовые соответствующие связывающие средства, которые представляют собой связывающее вирусную частицу средство в этом контексте, включают любые из известных антител или антиген-связывающий фрагментов против таких синтетических фрагментов, таких как пептиды или метки (например, аффинные метки).
[0330] В некоторых вариантах осуществления реактив непосредственно связывают с синтетическим фрагментом, таким как пептид или метка (например, аффинная метка), присутствующим на поверхности вирусной векторной частицы. Таким образом, в некоторых вариантах осуществления отсутствует связывающее вирусную частицу средство, которое содействует взаимодействию между вирусной векторной частицей и реактивом. В некоторых вариантах осуществления молекула на поверхности вирусной частицы содержит партнер связывания C1. В некоторых вариантах осуществления реактив обратимо связывают непосредственно с частицей через взаимодействие между сайтом связывания Z (например, Z1) и партнером связывания C (например, C1), присутствующим на поверхности вирусной частицы.
[0331] В некоторых вариантах осуществления молекула на поверхности вирусной частицы содержит вирусный оболочечный белок, его вариант или его часть, которые конъюгируют, непосредственно или опосредованно, с синтетическим фрагментом, таким как пептид или метка (например, аффинная метка), которая способна к обратимому связыванию с сайтом связывания Z (например, Z1) на реактиве. В некоторых вариантах осуществления синтетический фрагмент, такой как пептид, представляет собой стрептавидин-связывающий пептид. Образцовые вирусные оболочечные белки рассмотрены выше и включают комплекс гликопротеина env лентивирусной частицы, в том числе gp160, gp120 или gp41, белки вируса везикулярного стоматита-G (VSVG или VSV-G), оболочки вируса Синдбис, вируса мышиного лейкоза Молони (MoMuLV или MMLV), вируса мышиной саркомы Харви (HaMuSV или HSV), вируса опухолей молочных желез мышей (MuMTV или MMTV), вируса лейкоза гиббонов (GaLV или GALV), вируса иммунодефицита человека (HIV) или вируса саркомы Рауса (RSV) или их варианты.
[0332] В некоторых вариантах осуществления реактив представляет собой стрептавидин, такой как мутеин стрептавидина, включая любое описанное выше (например, приведенное в SEQ ID №№3-6), и партнер связывания C (например, C1), который содержится в вирусной частице и/или вирусном оболочечном белке или его варианте, может представлять собой стрептавидин-связывающий пептид. В некоторых вариантах осуществления стрептавидин-связывающий пептид может содержать последовательность с общей формулой, приведенной в SEQ ID №9, например, содержит последовательность, приведенную в SEQ ID №10. В некоторых вариантах осуществления пептидная последовательность имеет общую формулу, приведенную в SEQ ID №11, например, приведенную в SEQ ID №12. В одном из примеров, пептидная последовательность представляет собой Trp-Arg-His-Pro-Gln-Phe-Gly-Gly (также называемую Strep-tag®, которая приведена в SEQ ID №7). В одном из примеров, пептидная последовательность представляет собой Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (также называемую Strep-tag® II, которая приведена в SEQ ID №8). В некоторых вариантах осуществления пептидный лиганд содержит компоновку последовательней из по меньшей мере двух стрептавидин-связывающих модулей, где расстояние между двумя модулями составляет по меньшей мере 0 и не больше чем 50 аминокислот, где один связывающий модуль имеет от 3 до 8 аминокислоты и содержит по меньшей мере последовательность His-Pro-Xaa (SEQ ID №9), где Xaa представляет собой глутамин, аспарагин или метионин, и где другой связывающий модуль имеет тот же или отличающийся пептидный лиганд стрептавидина, например, приведенный в SEQ ID №11 (см., например, международную опубликованную заявку PCT № WO 02/077018; патент США №7981632). В некоторых вариантах осуществления пептидный лиганд содержит последовательность, имеющую формулу, приведенную в любой из SEQ ID №13 или 14. В некоторых вариантах осуществления пептидный лиганд имеет последовательность аминокислот, приведенную в любой из SEQ ID №№15-19.
[0333] Способы конструирования молекулы, присутствующей на поверхности вирусной частицы, в том числе, лентивирусных частиц, для того, чтобы она содержала синтетический фрагмент или метку (например, аффинную метку), известны в данной области. В некоторых вариантах осуществления молекула, присутствующая на поверхности вирусной частицы, представляет собой белок (например, гликопротеин), который представляет собой слитый белок, содержащий аффинную метку и вирусный оболочечный белок или его вариант. Синтетический фрагмент, такой как пептид или метка (например, аффинная метка), может присутствовать на карбокси-конце вирусного оболочечного белка или его варианта, амино-конце вирусного оболочечного белка или его варианта и/или содержаться внутри последовательности вирусного оболочечного белка или его варианта.
[0334] Стандартные рекомбинантные молекулярные способы можно использовать для введения таких фрагментов в последовательности вирусного оболочечного белка, в том числе VSV-G, для экспрессии на вирусных частицах, в том числе лентивирусных частицах. Например, в некоторых вариантах осуществления VSV-G содержит VSV-G-метку «YTDIEMNRLGK» (SEQ ID №46), нативную для белка VSV-G. В некоторых вариантах осуществления VSV-G содержит синтетический фрагмент или метку, вставленную в сайте, соответствующем аминокислотному положению 24 нативной молекулы VSV-G (см., например, Guibinga et al. Molecular Therapy (2004) 9, 76-84, где приведен пример инсерции метки из 10 аминокислот «WREPGRMELN» (SEQ ID №47) из коллаген-связывающего домена фактора фон Виллебранда). В некоторых вариантах осуществления синтетический фрагмент, такой как пептид или метка (например, аффинный фрагмент), можно сливать с N-концом VSV-G (см., например, Kameyama et al., J Virol Methods. 2008 Oct; 153(1):49-54.). В качестве другого примера, ген env MLV и получаемый белок можно модифицировать посредством слияния аффинной метки или белка в +1 положении поверхностной субъединицы, как описано в Verhoeyen et al., Blood. 2003 Mar 15; 101(6): 2167-2174. В некоторых вариантах осуществления трансмембранный домен E2 гликопротеина вируса Синдбис (SIN) можно конструировать для того, чтобы он содержал синтетический пептид или метку, которые, в некоторых случаях, можно вставлять между аминокислотами 70 и 74 белка E2 (см., например, Yang et al., Proc Natl Acad Sci U S A. 2006 Aug 1; 103(31):11479-84, и Morizono et al., J Gene Med. 2009 Aug; 11(8): 655-663). В некоторых вариантах осуществления метка представляет собой HA-метку, расположенную между аминокислотами 71-74 белка E2 (см. Yang). В некоторых вариантах осуществления метка представляет собой биотиновый адаптерный пептид, вставленный в аминокислоту 70 в E2 (см. Morizono). В некоторых вариантах осуществления синтетический фрагмент, такой как пептид или метка (например, аффинная метка), дополнительно может содержать один или более линкерных пептидов, в том числе гибких линкерных пептидов, в том числе линкерных пептидов с последовательностью «GGGS» (SEQ ID №48) (см. Morizono). Схожие способы можно использовать для создания слитых белков из гликопротеина вируса с любым желаемым синтетическим фрагментом, таким как пептид или метка (например, аффинная метка).
[0335] В некоторых вариантах осуществления связывающее вирусную частицу средство представляет собой или содержит поликатион или катионный липид, который может облегчать, например, усиливать, вирусную трансдукцию. Образцовые поликатионы включают протамин (например, протамина сульфат), гексадиметрина бромид (POLYBRENE®, Abbott Laboratories Corp) и CH-296 (RETRONECTIN®, Clontech). В некоторых вариантах осуществления поликатион связывают, непосредственно или опосредованно, с партнером связывания C (например, C1) для обратимого связывания с сайтом связывания Z (например, Z1) на реактиве. В некоторых вариантах осуществления поликатион может служить в качестве электростатического мостика между вирусом и клетками. В некоторых вариантах осуществления поликатион не содержит сайт связывания V (например, V1), который специфически связывается с молекулой на поверхности вирусной частицы, но тем не менее способен взаимодействовать с поверхностью вирусной частицы, чтобы опосредовать взаимодействие с клетками.
III. СПОСОБЫ ТРАНСДУКЦИИ КЛЕТОК
[0336] Предоставлены способы переноса вирусных векторов в клетки с использованием олигомерного белкового реактива (например, мутеина стрептавидина). В некоторых вариантах осуществления олигомерный белковый реактив, используемый в соответствии с предусмотренными способами трансдукции, представляет собой реактив мультимеризации. В некоторых вариантах осуществления клетки предназначены для использования в клеточной терапии, например, эмбриональные клетки, полученные для аутологического или аллогенного переноса, например, при адоптивной клеточной терапии. В некоторых вариантах осуществления реактив также можно использовать в способах содействия одной или нескольким другим стадиям обработки, ассоциированным с получением композиции сконструированных клеток, таким как одна или более из отбора, активации и/или стимуляции клеток. Способы могут включать дополнительные стадии обработки клеток, такие как промывание, выделение, разделение, формулирование клеток или другие стадии, связанные с получением композиции клеток.
[0337] В некоторых вариантах осуществления предусмотренные способы используют для введения вирусных векторных частиц, таких как ретровирусные векторные частицы, в клетки, такие клетки иммунной системы, в том числе T-клетки. В некоторых вариантах осуществления вирусные векторные частицы имеют геном, который содержит нуклеиновую кислоту, кодирующую антигенный рецептор, такой как химерный антигенный рецептор (CAR) или трансгенный T-клеточный рецептор (TCR). Таким образом, в некоторых вариантах осуществления предоставленные способы можно использовать для экспрессии в клетках иммунной системы, таких как T-клетки, генетически сконструированного антигенного рецептора, такого как трансгенный TCR или CAR. Также предусмотрены клетки, трансдуцированные с помощью таких частиц и способов, и композиции, содержащие такие клетки, а также способы их использования.
[0338] В некоторых вариантах осуществления ретровирусные векторные частицы и способы включают признаки, которые ведут к увеличенной трансдукции клеток иммунной системы и/или определенных их популяций и/или субпопуляций, желательных для использования в адоптивной иммунотерапии. В некоторых вариантах осуществления предусмотренных способов трансдукции и вирусных векторных частиц, клетки, например, T-клетки, в популяциях, подлежащих трансдукции, не являются или не должны быть стимулированными и/или активированными до и/или в сочетании с приведением в контакт или инкубацией клеток с предоставленной ретровирусной векторной частицей.
A. Инкубация клеток с вирусными векторными частицами
[0339] В некоторых вариантах осуществления предоставленные способы включают способы трансдукции клеток посредством приведения в контакт, например, инкубации, композиции клеток, содержащей множество клеток, (далее в настоящем описании также называемой «входной композицией») с (1) олигомерным белковым реактивом (например, мутеином стрептавидина), таким как реактив мультимеризации, и (2) вирусной частицей. В некоторых вариантах осуществления способ включает смешивание клеток с реактивом и с вирусными частицами одновременно или последовательно. В некоторых вариантах осуществления способ включает предварительное смешивание вирусных частиц и реактива вместе и затем приведение композиции клеток в контакт со смесью вирусных частиц, ассоциированных с реактивом. В некоторых вариантах осуществления приведение в контакт происходит в течение от 30 минут до 72 часов, например, от 30 минут до 48 часов, от 30 минут до 24 часов или от 1 часа до 24 часов, например, по меньшей мере или приблизительно по меньшей мере 30 минут, 1 час, 2 часа, 6 часов, 12 часов, 24 часа, 36 часов или больше.
[0340] В некоторых вариантах осуществления любого из способов, предусмотренных в настоящем описании, (i) инкубация включает смешивание клеток-мишеней с реактивом и/или смешивание клеток-мишеней с вирусной частицей, последовательно, в любом порядке, необязательно где смешивание в (a) и смешивание в (b) осуществляют в пределах периода не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа и/или смешивание в (a) осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов помимо смешивания в (b); (ii) инкубация включает смешивание клеток-мишеней, реактива и вирусной частицы, указанное смешивание осуществляют одновременно или по существу одновременно; (iii) инкубация включает смешивание композиции, которая содержит клетки-мишени и вирусные частицы и не содержит реактив, необязательно где: не больше чем 5%, 10%, 20%, 30% или 40% клеток-мишеней в композиции, содержащей клетки-мишени и реактив, представляют собой активированные клетки, экспрессируют маркер поверхности, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включает внутриклеточную экспрессию цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α, и/или способны к пролиферации; и/или смешивание осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов после смешивания клеток-мишеней и вирусных частиц в композиции; (iv) инкубация включает смешивание композиции, которая содержит клетки-мишени и реактив и не содержит вирусную частицу, с вирусной частицей, необязательно где: не больше чем 5%, 10%, 20%, 30% или 40% клеток-мишеней в композиции, содержащей клетки-мишени и реактив, представляют собой активированные клетки, экспрессируют маркер поверхности, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включая внутриклеточную экспрессию цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α, и/или способны к пролиферации; и/или смешивание осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов после смешивания клеток-мишеней и вирусных частиц в композиции; и/или (v) инкубация включает смешивание композиции, содержащей вирусные частицы и реактив, с композицией, которая содержит клетки-мишени и не вирусную частицу и/или не реактив, необязательно где: не больше чем 5%, 10%, 20%, 30% или 40% клеток-мишеней в композиции, содержащей клетки-мишени и реактив, представляют собой активированные клетки, экспрессируют маркер поверхности, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включает внутриклеточную экспрессию цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α, и/или способны к пролиферации.
[0341] В некоторых вариантах осуществления инкубация включает смешивание клетки с реактивом и с вирусной частицей, одновременно или последовательно, в любом порядке. В некоторых вариантах осуществления во время по меньшей мере части инкубации, реактив и вирусная частица находятся в присутствии или в контакте с клеткой одновременно.
[0342] В некоторых вариантах осуществления предоставленные способы включают (a) приведение в контакт вирусной частицы с олигомерным белковым реактивом, тем самым создавая композицию, содержащую вирусные частицы и реактив, где вирусные частицы необязательно ассоциированы с реактивом; и (b) инкубацию композиции в (a) с множеством клеток, включающим клетки-мишени, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0343] В некоторых вариантах осуществления предоставленные способы включают смешивание композиции, содержащей вирусные частицы и олигомерный белковый реактив, с множеством клеток, включающим клетки-мишени, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0344] В некоторых вариантах осуществления предоставленные способы включают (a) приведение в контакт вирусной частицы с белковым реактивом, включающим стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных, и/или множество субъединиц любого из вышеуказанных, тем самым создавая композицию, содержащую вирусные частицы и реактив, где вирусные частицы необязательно ассоциированы с реактивом; и (b) инкубацию композиции в (a) с множеством клеток, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0345] В некоторых вариантах осуществления предоставленные способы включают смешивание композиции, содержащей вирусные частицы и белковый реактив, с множеством клеток, включающим клетки-мишени, где: белковый реактив включает стрептавидин, авидин, аналог или мутеин стрептавидина, аналог авидина, мутеин или биологически активный фрагмент любого из вышеуказанных, и/или множество субъединиц любого из вышеуказанных; и способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей. В некоторых вариантах осуществления реактив и/или каждая из мономерных единиц и/или каждая из мультимерных единиц имеет суммарный положительный заряд или общий положительный заряд.
[0346] В некоторых вариантах осуществления предоставленные способы включают инкубацию множества клеток, включающего клетки-мишени, с: 1) олигомерным белковым реактивом, содержим множество сайтов связывания, способных к обратимому связыванию со связывающим средством, где один или более сайтов связывания обратимо связывают со связывающим средством; и 2) вирусной частицей, где по меньшей мере часть инкубации в (1) происходит одновременно с (2) и где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
[0347] В некоторых вариантах осуществления предоставленные способы включают (1) приведение в контакт (a) композиции, содержащей одну или более вирусных частиц, и (b) связывающего средства, которое представляет собой вирусное связывающее средство, которое (i) способно к специфическому связыванию с молекулой на поверхности вирусной частицы и ii) обратимо связывается с реактивом, содержащим множество сайтов связывания, способных к обратимому связыванию с вирусным связывающим средством; и (2) инкубацию по меньшей мере множества клеток, включающего клетки-мишени, в присутствии одной или нескольких вирусных частиц, где приведение в контакт в (1) и инкубацию в (2) осуществляют одновременно или последовательно, в любом порядке, где способом создают выходную композицию, содержащую множество клеток, трансдуцированных вирусной частицей.
[0348] В некоторых вариантах осуществления любого из способов, предусмотренных в настоящем описании, приведение в контакт в (1) и инкубацию в (2) осуществляют в пределах периода не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа и/или смешивание в (a) осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов 12 часов, 18 часов, 24 часа, 36 часов или 48 часов помимо инкубации в (b). В некоторых вариантах осуществления вирусная векторная частица содержит геном, кодирующий рекомбинантный антигенный рецептор, необязательно химерный антигенный рецептор.
[0349] Композиция, которая содержит вирусные векторные частицы и клетки во время стадии трансдукции, дополнительно может содержать одно или более дополнительных средств, таких как те, которые способствуют эффективности трансдукции, например, поликатионов, включая протамин (например, протамина сульфат), гексадиметрина бромид (POLYBRENE®, Abbott Laboratories Corp) и CH-296 (RETRONECTIN®, Clontech). В некоторых вариантах осуществления поликатион может присутствовать во входной композиции в конечной концентрации от 1 мкг/мл до 100 мкг/мл, такой как от 5 мкг/мл до 50 мкг/мл. Композиция также может содержать среды, в том числе клеточную культуральную среду, включая среду, разработанную для культуры клеток того типа, который подлежит обработке, например, среду гематопоэтических стволовых клеток, например, бессывороточную среду.
[0350] В некоторых вариантах осуществления концентрация клеток во входной композиции составляет от или приблизительно от 1,0×105 клеток/мл до 1,0×108 клеток/мл, например, по меньшей мере или приблизительно по меньшей мере или приблизительно 1,0×105 клеток/мл, 5×105 клеток/мл, 1×106 клеток/мл, 5×106 клеток/мл, 1×107 клеток/мл, 5×107 клеток/мл или 1×108 клеток/мл.
[0351] В некоторых вариантах осуществления вирусные частицы предоставляют при определенном соотношении копий вирусных векторных частиц или их инфекционных единиц (IU), на общее число клеток (IU/клетка) во входной композиции или общее число клеток, подлежащих трансдукции. Например, в некоторых вариантах осуществления вирусные частицы присутствуют во время приведения в контакт по или приблизительно или по меньшей мере или приблизительно 0,5, 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50, или 60 IU вирусных векторных частиц на одну из клеток.
[0352] В некоторых вариантах осуществления титр вирусных векторных частиц составляет между или между приблизительно 1×106 IU/мл и 1×108 IU/мл, например, между или между приблизительно 5×106 IU/мл и 5×107 IU/мл, например, по меньшей мере 6×106 IU/мл, 7×106 IU/мл, 8×106 IU/мл, 9×106 IU/мл, 1×107 IU/мл, 2×107 IU/мл, 3×107 IU/мл, 4×107 IU/мл или 5×107 IU/мл.
[0353] В некоторых вариантах осуществления трансдукции можно достичь при множественности заражения (MOI) меньше чем 100, например, обычно меньше чем 60, 50, 40, 30, 20, 10, 5 или меньше.
[0354] В некоторых вариантах осуществления приведение в контакт осуществляют в растворе, например, с использованием растворимого олигомерного белкового реактива (например, мутеина стрептавидина) или реактива мультимеризации. В некоторых вариантах осуществления клетки, олигомерный реактив и вирусные частицы приводят в контакт в объеме от или приблизительно от 0,5 мл до 500 мл, например, от или приблизительно от 0,5 мл до 200 мл, от 0,5 мл до 100 мл, от 0,5 мл до 50 мл, от 0,5 мл до 10 мл, от 0,5 мл до 5 мл, от 5 мл до 500 мл, от 5 мл до 200 мл, от 5 мл до 100 мл, от 5 мл до 50 мл, от 5 мл до 10 мл, от 10 мл до 500 мл, от 10 мл до 200 мл, от 10 мл до 100 мл, от 10 мл до 50 мл, от 50 мл до 500 мл, от 50 мл до 200 мл, от 50 мл до 100 мл, от 100 мл до 500 мл, от 100 мл до 200 мл или от 200 мл до 500 мл.
[0355] В некоторых вариантах осуществления, когда приведение в контакт осуществляют в растворе, например, с использованием растворимого олигомерного белкового реактива (например, мутеина стрептавидина), можно осуществлять приведение в контакт, где по меньшей мере часть приведения в контакт происходит при центрифугировании, например, спинокуляции (например, центробежной инокуляции). В некоторых вариантах осуществления композицию, содержащую клетки, вирусные частицы и реактив, можно вращать в целом с относительно низкой силой или скоростью, такой как скорость ниже той, что используют для осаждения клеток, например, от или приблизительно от 600 об./мин до 1700 об./мин (например, составляет или приблизительно или по меньшей мере составляет 600 об./мин, 1000 об./мин или 1500 об./мин или 1700 об./мин). В некоторых вариантах осуществления вращение осуществляют при силе, например, относительной центробежной силе, от или приблизительно от 100 g до 3200 g (например, составляет или приблизительно или по меньшей мере или приблизительно составляет 100 g, 200 g, 300 g, 400 g, 500 g, 1000 g, 1500 g, 2000 g, 2500 g, 3000 g или 3200 g), как измеряют, например, на внутренней или внешней стенке камеры или полости. Термин «относительная центробежная сила» или RCF в целом понимают как эффективную силу, прикладываемую к объекту или веществу (такому как клетка, образец или пеллет и/или точка в камере или другом контейнере, который вращают), относительно гравитационной силы Земли, в конкретной точке пространства по сравнению с осью вращения. Значение можно определять с использованием общеизвестных формул, учитывая гравитационную силу, скорость вращения и радиус вращения (расстояние до оси вращения и объект, вещество или частицу, на которых измеряют RCF).
[0356] В некоторых вариантах осуществления олигомерный реактив, такой как реактив мультимеризации, не связывают с основой, например, не связывают с твердой поверхностью или стационарной фазой.
[0357] В некоторых вариантах осуществления олигомерный реактив, такой как реактив мультимеризации, иммобилизуют на основе, такой как твердая поверхность или стационарная фаза. В некоторых вариантах осуществления приведение в контакт осуществляют в стационарной фазе, например, с использованием хроматографической матрицы, на которой иммобилизуют белок (мутеин стрептавидина), такой как олигомерный белковый реактив (например, мутеин стрептавидина). Образцы таких форматов для использования в связи с предоставленными способами описаны в настоящем описании. Таким образом, в некоторых вариантах осуществления трансдукцию на колонке можно осуществлять в соответствии с предоставленными способами.
[0358] В некоторых вариантах осуществления входная композиция, которую приводят в контакт с клетками, содержит активированные клетки. В некоторых вариантах осуществления по меньшей мере 40%, 50%, 60%, 70%, 80%, 90% или больше клеток, например, T-клеток, во входной композиции являются активированными, например, в некоторых случаях, имеют поверхность, положительную по одному или нескольким из HLA-DR, CD25, CD69, CD71, CD40L и/или 4-1BB. В некоторых вариантах осуществления клетки активируют с использованием активирующего средства, например, в присутствии средства против CD3/против CD28, перед инициацией приведения в контакт, например, перед инициацией трансдукции. Способы размножения популяций T-клеток in vitro в отсутствие экзогенных факторов роста или низких количеств экзогенных факторов роста известны в данной области (см., например, патент США 6352694 B1 и европейский патент EP 0700430 B1). В целом, в таких способах используют поверхности твердой фазы больше 1 мкМ, на которых иммобилизуют различные связывающие средства (например, антитело против CD3 и/или антитело против CD28). Например, Dynabeads® CD3/CD28 (Invitrogen) представляют собой коммерчески доступные реактивы для размножения T-клеток, которые представляют собой однородные, 4,5 мкм суперпарамагнитные, стерильные, не пирогенные полистироловые бусы, покрытые смесью аффинно-очищенных моноклональных антител против молекул CD3 и CD28 клеточной поверхности на T-клетках человека. В некоторых вариантах осуществления активирующее средство, например, средство против CD3 и/или против CD28, можно иммобилизовать на бусах, таких как магнитные бусы.
[0359] В некоторых вариантах осуществления активацию клеток также осуществляют в присутствии IL-2 (например, от или приблизительно от 50 IU/мл до 200 IU/мл, такой как или приблизительно 100 IU/мл). В некоторых вариантах осуществления активацию осуществляют между или между приблизительно 1 часом и 96 часами, 1 часом и 72 часами, 1 часом и 48 часами, 4 часами и 36 часами, 8 часами и 30 часами или 12 часами и 24 часами, например, по меньшей мере или приблизительно по меньшей мере 6 часов, 12 часов, 18 часов, 24 часа, 36 часов или 72 часа. В некоторых вариантах осуществления активацию осуществляют при температуре больше чем или больше чем приблизительно 25°C, например, обычно больше чем или больше чем приблизительно 32°C, 35°C или 37°C, например, при или приблизительно 37°C±2°C, например, при температуре, равной или приблизительно 37°C.
[0360] В некоторых вариантах осуществления клетки не активируют с использованием активирующего средства, например, в присутствии средства против CD3/против CD28, перед инициацией приведения в контакт, например, перед инициацией трансдукции. В некоторых вариантах осуществления входная композиция, которую приводят в контакт с клетками, содержит множество покоящихся клеток. В некоторых вариантах осуществления по меньшей мере 40%, 50%, 60%, 70%, 80%, 90% или больше T-клеток в популяции представляют собой покоящиеся T-клетки, такие как T-клетки, которые не содержат маркер активации T-клеток, такой как маркер поверхности или внутриклеточный цитокин или другой маркер, и/или T-клетки, которые находятся в фазе G0 или G0G1a клеточного цикла.
[0361] В конкретных аспектах, предоставленные способы делают возможной протекание трансдукции в T-клетках без необходимости активации перед приведением в контакт и/или инкубацией с использованием олигомерного белкового реактива, такого как реактив мультимеризации. В некоторых вариантах осуществления способы включают трансдукцию популяции T-клеток, которая содержит покоящиеся или наивные T-клетки, вирусным вектором в присутствии олигомерного белкового реактива (например, стрептавидина) в соответствии с предоставленными способами, без предшествующей, т. е. перед трансдукцией, активации и/или стимуляции T-клеток. В некоторых таких вариантах осуществления, для того, чтобы получать клетки иммунной системы, такие как T-клетки, для адоптивной терапии, можно использовать предоставленные способы, которые не включают стадию активации и/или стимуляции T-клеток.
[0362] В некоторых вариантах осуществления олигомерный белок (например, мутеин стрептавидина) является голым.
[0363] В некоторых вариантах осуществления олигомерный белок (например, мутеин стрептавидина) представляет собой реактив мультимеризации, с которым связано одно или более связывающих средств, которые способны к связыванию с молекулой на поверхности клеток-мишеней (например, T-клеток) или, в некоторых случаях, на поверхности вирусных частиц в композиции. В некоторых вариантах осуществления связывающее средство обратимо связывают с реактивом, содержащим множество сайтов связывания, способных к обратимому связыванию со средством. В некоторых вариантах осуществления инкубацию осуществляют в условиях, в которых средство связывается, например, специфически связывается, с молекулой на клетке или вирусной частице. В некоторых вариантах осуществления, как описано, олигомерный реактив имеет обратимо иммобилизованное на нем (связанное с ним) средство или средства (например, первое или второе или третье и т. д.), которые могут включать рецептор-связывающее, например, стимулирующее средство или вспомогательные средства, средство отбора или вирусные связывающие средства, которые можно использовать для отбора, стимуляции, размножения и/или дифференцировки клеток или модуляции трансдукции клеток.
[0364] В некоторых случаях, для определенных рецептор-связывающих средств (например, стимулирующих средств или вспомогательных средств), такое связывание может индуцировать или модулировать сигнал в клетках-мишенях (например, T-клетках) в композициях, такой как первичный сигнал или вспомогательный сигнал, как описано. В некоторых вариантах осуществления связывание средства с молекулой ведет к одному или нескольким из стимуляции, активации, размножения (пролиферации) и/или дифференцировки клеток-мишеней в композиции. В некоторых вариантах осуществления реактив содержит стимулирующее средство, которое обеспечивает первичный сигнал активации для клеток, где стимулирующее средство содержит по меньшей мере один партнер связывания C (например, C1, C2 или C3 и т. п.), где партнер связывания C способен к обратимому связыванию с сайтом связывания Z1 олигомерного реактива реактив для обратимого связывания средства. В некоторых вариантах осуществления реактив содержит вспомогательное средство, которое обеспечивает вспомогательный сигнал для клеток, где вспомогательное средство содержит по меньшей мере один партнер связывания C (например, C1, C2 или C3 и т.п.), где партнер связывания C способен к обратимому связыванию с сайтом связывания Z1 олигомерного реактива реактив для обратимого связывания средства. В некоторых вариантах осуществления реактив содержит средство отбора, которое специфически направленно воздействует на связывание с конкретной молекулой клеточной поверхности или маркером, где средство отбора содержит по меньшей мере один партнер связывания C (например, C1, C2 или C3 и т. п.), где партнер связывания C способен к обратимому связыванию с сайтом связывания Z1 олигомерного реактива реактив, для обратимого связывания средства.
[0365] В некоторых вариантах осуществления активацию клеток во входной композиции инициируют во время приведения в контакт клеток входной композиции с олигомерным белковым реактивом и/или вирусной частицей. В таких случаях, олигомерный белковый реактив может иметь иммобилизованное на нем рецептор-связывающее средство, например, стимулирующее средство и/или вспомогательное средство, способное к индукции или модулированию сигнала в клетках, таких как T-клетки. В некоторых вариантах осуществления стимулирующее средство содержит комплекс MHC I : пептид или его функциональную часть, комплекс MHC II : пептид или его функциональную часть и/или способно доставлять стимулирующий сигнал через комплекс TCR/CD3 в T-клетке, CD3-содержащий комплекс в T-клетке и/или ITAM-содержащую молекулу в T-клетке. В некоторых вариантах осуществления олигомерный реактив может иметь иммобилизованное на нем вспомогательное средство, способное обеспечивать вспомогательный сигнал для клеток, таких как T-клетки. В некоторых вариантах осуществления рецептор-связывающее средство, например, стимулирующее средство и/или вспомогательное средство, представляет собой любое средство, как раскрыто в настоящем описании, такое как антитело против CD3 и/или против CD28 (например, Fab). Альтернативно, также возможно использовать в качестве стимулирующего средства лиганд, такой как естественный лиганд, рецептора, который запускает размножение клеток. Например, внеклеточный домен CD19 можно использовать для того, чтобы вызывать активацию внутриклеточных сигнальных каскадов клеток, трансдуцированных для того, чтобы экспрессировать химерный CD19-связывающий антигенный рецептор (CAR). В некоторых вариантах осуществления олигомерный белковый реактив (например, стрептавидин) способен как модулировать трансдукцию клетки, так и активировать, например, стимулировать клетки, во время приведения в контакт и, необязательно, дополнительной инкубации. В некоторых вариантах осуществления связывание олигомерного реактива, содержащего стимулирующее средство, является обратимым, например, в присутствии конкурентного средства, например, биотина.
[0366] В некоторых вариантах осуществления предоставленный способ можно использовать для избирательной индукции трансдукции и/или размножения ex vivo конкретной популяции клеток, такой как B-клетки, T-клетки или естественные киллерные клетки. В некоторых вариантах осуществления олигомерный белковый реактив (например, мутеин стрептавидина) представляет собой реактив мультимеризации, который может включать по меньшей мере одно средство отбора, обратимо связанное с одним и тем же реактивом, используемым для модулирования трансдукции. В некоторых вариантах осуществления олигомерный (например, мутеин стрептавидина) реактив представляет собой реактив мультимеризации, который может содержать средство отбора и одно или оба из первого или второго рецептор-связывающих средств (например, стимулирующее средство или вспомогательное средство) на одном и том же реактиве. В некоторых вариантах осуществления олигомерный белковый реактив (например, стрептавидин), такой как реактив мультимеризации, способен как модулировать трансдукцию клетки, так и предпочтительно направленно воздействовать на трансдукцию в конкретной субпопуляции отобранных или клеток-мишеней. В некоторых вариантах осуществления олигомерный белковый реактив (например, стрептавидин), такой как реактив мультимеризации, способен модулировать трансдукцию клетки, например, предпочтительно трансдукцию мишени в конкретной субпопуляции отобранных или клеток-мишеней, и активировать, например, стимулировать клетки, во время приведения в контакт и, необязательно, дополнительной инкубации.
[0367] В некоторых вариантах осуществления связывание олигомерного реактива, содержащего связывающие средства, например, средство отбора и/или стимулирующее средство, является обратимым, например, в присутствии конкурентного средства, например, биотина. Как описано ниже, в некоторых аспектах, способ включает добавление или инкубацию композиции, содержащей клетки, вирусные частицы и олигомерный реактив (например, реактив мультимеризации, связанный с одним или несколькими связывающими средствами) с конкурентным веществом для того, чтобы обращать, диссоциировать или разрушать связывание одного или нескольких связывающих средств с клеткой или вирусными частицами. В некоторых вариантах осуществления после обращения, диссоциации или разрушения, можно удалять один или более компонентов композиции, например, диссоциировавший олигомерный реактив, одно или более из связывающего средства и/или конкурентного вещества. Образцы таких способов описаны далее.
[0368] В некоторых вариантах осуществления клетки, получаемые предоставленным способом, (далее в настоящем описании также называемые «выходной композицией» или «инкубируемой композицией») включают те, которые трансдуцированы вирусным вектором, таким как вирусный вектор, содержащий нуклеотиды, кодирующие гетерологичный белок, такой как рекомбинантный рецептор, например, CAR. Под гетерологичным в этом контексте понимают белок, который обычно не экспрессирован вирусом и/или не закодирован вирусным геномом. В некоторых вариантах осуществления встраивание вирусного вектора в геном организма-хозяина можно оценивать посредством измерения уровня экспрессии рекомбинантного белка, такого как гетерологичный белок, кодируемый нуклеиновой кислотой, содержащейся в геноме вирусной векторной частицы, после инкубации. Можно использовать многие общеизвестные способы оценки уровня экспрессии рекомбинантных молекул, такие как обнаружение с помощью способов, основанных на аффинности, например, способов, основанных на иммуноаффинности, например, в контексте белков клеточной поверхности, например, посредством проточной цитометрии. В некоторых примерах, экспрессию измеряют посредством обнаружения маркера трансдукции и/или конструкции репортера. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая усеченный белок поверхности, включена в вектор, и ее используют в качестве маркера экспрессии и/или ее усиления.
Клетки
[0369] В некоторых вариантах осуществления композицию, содержащую клетки-мишени, трансдуцируют вирусной векторной частицей, например, в соответствии с описанными способами.
[0370] В некоторых вариантах осуществления клетки в целом представляют собой эукариотические клетки, такие как клетки млекопитающих и обычно представляют собой клетки человека. В некоторых вариантах осуществления клетки получают из крови, костного мозга, лимфы или лимфоидных органов, или они представляют собой клетки иммунной системы, такие как клетки врожденного или приобретенного иммунитета, например, миелоидные или лимфоидные клетки, в том числе лимфоциты, обычно T-клетки и/или NK клетки. Другие образцовые клетки включают стволовые клетки, такие как мультипотентные и плюрипотентные стволовые клетки, в том числе индуцированные плюрипотентные стволовые клетки (iPSC). Клетки обычно представляют собой эмбриональные клетки, такие как те, которые выделяют непосредственно у субъекта и/или выделяют у субъекта и замораживают. В некоторых вариантах осуществления клетки включают одно или более подмножеств T-клеток или клеток других типов, например, популяции не сортированных T-клеток, CD4+ клетки, CD8+ клетки и их субпопуляции, такие как те, которые определяют по функции, состоянию активации, зрелости, потенциалу к дифференцировке, размножению, рециркуляции, локализации и/или способности к персистенции, антигенной специфичности, типу антигенного рецептора, присутствию в конкретном органе или компартменте, маркеру или профилю секреции цитокинов и/или степени дифференцировки. В отношении субъекта, подлежащего лечению, клетки могут быть аллогенными и/или аутологическими. Способы включают типовые способы. В некоторых аспектах, например, для типовых технологий, клетки являются плюрипотентными и/или мультипотентными, например, стволовыми клетками, например, индуцированными плюрипотентными стволовыми клетками (iPSC). В некоторых вариантах осуществления способы включают выделение клеток у субъекта, их подготовку, обработку, культивирование и/или конструирование, как раскрыто в настоящем описании, и повторное их введение тому же пациенту, до или после криосохранения.
[0371] Среди подтипов и субпопуляций T-клеток и/или CD4+ и/или CD8+ T-клеток - наивные T (TN) клетки, эффекторные T-клетки (TEFF), T-клетки памяти и их подтипы, такие как стволовая T-клетка памяти (TSCM), центральная T-клетка памяти (TCM), эффекторная T-клетка памяти (TEM) или окончательно дифференцированные эффекторные T-клетки памяти, опухоль-инфильтрирующие лимфоциты (TIL), незрелые T-клетки, зрелые T-клетки, хелперные T-клетки, цитотоксические T-клетки, ассоциированные со слизистой инвариантные T-клетки (MAIT), встречающиеся в природе и адаптивные регуляторные T-клетки (Treg), хелперные T-клетки, такие как TH1 клетки, TH2 клетки, TH3 клетки, TH17 клетки, TH9 клетки, TH22 клетки, фолликулярные хелперные T-клетки, α/β T-клетки и δ/γ T-клетки.
[0372] В некоторых вариантах осуществления клетки представляют собой естественные киллерные (NK) клетки. В некоторых вариантах осуществления клетки представляют собой моноциты или гранулоциты, например, миелоидные клетки, макрофаги, нейтрофилы, дендритные клетки, тучные клетки, эозинофилы и/или базофилы.
[0373] В некоторых вариантах осуществления получение клеток включает одну или более стадий культивирования и/или получения. Клетки можно выделять из образца, такого как биологический образец, например, тот, что получен или извлечен у субъекта. В некоторых вариантах осуществления субъектом, у которого выделяют клетки, является тот, кто имеет заболевание или состояние или нуждается в клеточной терапии или кому будут вводить клеточную терапию. Субъект в некоторых вариантах осуществления представляет собой человека, нуждающегося в конкретном терапевтическом вмешательстве, таком как адоптивная клеточная терапия, для которой клетки выделяют, обрабатывают и/или конструируют.
[0374] Соответственно, клетки в некоторых вариантах осуществления представляют собой эмбриональные клетки, например, эмбриональные клетки человека. Образцы включают ткань, текучее вещество и другие образцы, взятые непосредственно у субъекта, а также образцы, являющиеся результатом одной или нескольких стадий обработки, таких как разделение, центрифугирование, генетическая инженерия (например, трансдукция вирусным вектором), промывание и/или инкубация. Биологический образец может представлять собой образец, полученный непосредственно из биологического источника, или образец, который обработан. Биологические образцы включают, но не ограничиваясь этим, текучие вещества организма, такие как кровь, плазма, сыворотка, цереброспинальная жидкость, синовиальная жидкость, моча и пот, образцы тканей и органов, в том числе обработанные образцы, полученные из них.
[0375] В некоторых аспектах, образец, из которого получают или выделяют клетки, представляет собой кровь или образец, полученный из крови, или он представляет собой или его извлекают из продукта афереза или лейкафереза. Образцовые образцы включают цельную кровь, мононуклеарные клетки периферической крови (PBMC), лейкоциты, костный мозг, тимус, тканевой биоптат, опухоль, лейкоз, лимфому, лимфатический узел, ассоциированную с кишечником лимфоидную ткань, ассоциированную со слизистой лимфоидную ткань, селезенку, другие лимфоидные ткани, печень, легкое, желудок, кишечник, ободочную кишку, почку, поджелудочную железу, молочную железу, кость, предстательную железу, шейку матки, яички, яичники, миндалину или другой орган и/или клетки, полученные из него. Образцы включают, в контексте клеточной терапии, например, адоптивной клеточной терапии, образцы из аутологических и аллогенных источников.
[0376] В некоторых вариантах осуществления клетки получают из клеточных линий, например, линий T-клеток. Клетки в некоторых вариантах осуществления получают из ксеногенного источника, например, от мыши, крысы, не являющегося человеком примата или свиньи.
[0377] В некоторых вариантах осуществления выделение клеток включает одну или более стадий получения и/или разделения клеток не на основании аффинности. В некоторых примерах, клетки промывают, центрифугируют и/или инкубируют в присутствии одного или нескольких реактивов, например, чтобы удалять нежелательные компоненты, обогащать желаемые компоненты, лизировать или удалять клетки, чувствительные к конкретным реактивам. В некоторых примерах клетки разделяют на основании одного или нескольких свойств, таких как плотность, адгезивные свойства, размер, чувствительность и/или устойчивость к конкретным компонентам.
[0378] В некоторых примерах, клетки из циркулирующей крови субъекта получают, например, посредством афереза или лейкафереза. Образцы, в некоторых аспектах, содержат лимфоциты, в том числе T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие белые клетки крови, красные клетки крови и/или тромбоциты и в некоторых аспектах содержат клетки, отличные от красных клеток крови и тромбоцитов.
[0379] В некоторых вариантах осуществления клетки крови, собранные у субъекта, промывают, например, чтобы удалять фракцию плазмы и помещать клетки в подходящий буфер или среды для последующих стадий обработки. В некоторых вариантах осуществления клетки промывают фосфатно-солевым буфером (PBS). В некоторых вариантах осуществления промывающий раствор не содержит кальций и/или магний и/или многие или все двухвалентные катионы. В некоторых аспектах, стадию промывания выполняют в полуавтоматической «проточной» центрифуге (например, клеточный процессор Cobe 2991, Baxter) по инструкциям производителя. В некоторых аспектах, стадию промывания выполняют посредством тангенциального поточного фильтрования (TFF) по инструкциям производителя. В некоторых вариантах осуществления клетки ресуспендируют в различных биосовместимых буферах после промывания, например, таких как PBS, не содержащий Ca++/Mg++. В определенных вариантах осуществления компоненты образца клеток крови удаляют и клетки ресуспендируют непосредственно в культуральных средах.
[0380] В некоторых вариантах осуществления способы включают способы разделения клеток на основании плотности, такие как получение белых клеток крови из периферической крови посредством лизиса красных клеток крови и центрифугирования через градиент Percoll или Ficoll.
[0381] В некоторых вариантах осуществления нет необходимости обогащать или отбирать клетки перед осуществлением предоставленного способа. В некоторых вариантах осуществления реактив, такой как олигомерный реактив, например, реактив мультимеризации, может содержать обратимо связанное с ним одно или более средств отбора, которые способны к связыванию с или которые связываются с молекулой на поверхности клетки. В некоторых вариантах осуществления такой реактив представляет собой тот же реактив, который используют для опосредования трансдукции, или представляет собой другой реактив. В некоторых вариантах осуществления, выполнение по меньшей мере части инкубации клеток и вирусных частиц в присутствии такого реактива может вести к избирательной трансдукции популяции клеток без предшествующего отбора или обогащения клеток.
[0382] В некоторых вариантах осуществления способы выделения включают разделение клеток различных типов на основании экспрессии или присутствия в клетке одной или нескольких конкретных молекул, таких как маркеры поверхности, например, белки поверхности, внутриклеточные маркеры или нуклеиновая кислота. В некоторых вариантах осуществления можно использовать любой известный способ разделения на основании таких маркеров. Способы разделения могут включать любые из тех, что раскрыты в настоящем описании, в том числе способы с использованием систем обратимых реактивов, например, средств (таких как рецептор-связывающие средства или средства отбора) и реактивов, как раскрыто в настоящем описании.
[0383] В некоторых вариантах осуществления разделение представляет собой разделение на основании аффинности или иммуноаффинности. Например, выделение в некоторых аспектах включает разделение клеток и популяций клеток на основании экспрессии или уровня экспрессии клеток для одного или нескольких маркеров, обычно поверхностных клеточных маркеров, например, посредством инкубации с антителом или партнером связывания, которые специфически связываются с такими маркерами, за чем обычно следуют стадии промывания и отделения клеток, с которым связано антитело или партнер связывания, от тех клеток, с которыми не связано антитело или партнер связывания.
[0384] Такие стадии разделения могут быть основаны на положительном отборе, при котором клетки, с которыми связаны реактивы, сохраняют для дальнейшего использования, и/или отрицательном отборе, при котором сохраняют клетки, с которыми не связано антитело или партнер связывания. В некоторых примерах, обе фракции сохраняют для дальнейшего использования. В некоторых аспектах, отрицательный отбор может быть особенно эффективным, когда не доступно антитело, которое специфически идентифицирует тип клеток в гетерогенной популяции, так что разделение лучше всего осуществляют на основании маркеров, экспрессируемых клетками, отличными от желаемой популяции.
[0385] Разделение не обязательно ведет к 100% обогащению или удалению конкретной популяции клеток или клеток, экспрессирующих конкретный маркер. Например, положительный отбор или обогащение клеток конкретного типа, таких как те, которые экспрессируют маркер, относится к увеличению числа или процентной доли таких клеток, но не обязано вести к полному отсутствию клеток, не экспрессирующих маркер. Аналогичным образом, отрицательный отбор, удаление или истощение клеток конкретного типа, таких как те, которые экспрессируют маркер, относится к снижению числа или процентной доли таких клеток, но не обязано вести к полному удалению всех таких клеток.
[0386] В некоторых примерах, осуществляют несколько раундов стадий разделения, где положительно или отрицательно отобранную фракцию с одной стадии подвергают другой стадии разделения, такой как последующий положительный или отрицательный отбор. В некоторых примерах, одна стадия разделения позволяет истощать клетки, экспрессирующие несколько маркеров одновременно, например, посредством инкубации клеток с множеством антител или партнеров связывания, каждый обладает специфичностью к маркеру, направленному на отрицательный отбор. Аналогичным образом, несколько типов клеток можно одновременно отбирать положительно посредством инкубации клеток с множеством антител или партнеров связывания, экспрессируемых на клетках различных типов.
[0387] Например, в некоторых аспектах, конкретные субпопуляции T-клеток, такие как клетки, положительные или экспрессирующие высокие уровни одного или нескольких маркеров поверхности, например, CD28+, CD62L+, CCR7+, CD27+, CD127+, CD4+, CD8+, CD45RA+ и/или CD45RO+ T-клетки, выделяют с помощью способов положительного или отрицательного отбора.
[0388] Например, CD3+, CD28+ T-клетки можно отбирать положительно с использованием CD3/CD28 конъюгированных магнитных бус (например, DYNABEADS® M-450 CD3/CD28 T Cell Expander).
[0389] В некоторых вариантах осуществления выделение осуществляют посредством обогащения по конкретной популяции клеток с помощью положительного отбора, или истощения конкретной популяции клеток, с помощью отрицательного отбора. В некоторых вариантах осуществления положительный или отрицательный отбор выполняют посредством инкубации клеток с одним или несколькими антителами или другим связывающим средством, которое специфически связывается с одним или несколькими маркерами поверхности, экспрессируемыми или экспрессируемыми (маркер+) на относительно высоком уровне (маркервысок.) на положительно или отрицательно отобранных клетках, соответственно.
[0390] В некоторых вариантах осуществления T-клетки выделяют из образца PBMC с помощью отрицательного отбора маркеров, экспрессируемых на не T-клетках, таких как B-клетки, моноциты или другие белые клетки крови, например, CD14. В некоторых аспектах, стадию отбора по CD4+ или CD8+ используют для того, чтобы выделять CD4+ хелперные и CD8+ цитотоксические T-клетки. Такие CD4+ и CD8+ популяции дополнительно можно сортировать по субпопуляциям посредством положительного или отрицательного отбора по маркерам, экспрессируемым или экспрессируемым с относительно высокой степенью на одной или нескольких субпопуляциях наивных, эффекторных T-клеток и/или T-клеток памяти.
[0391] В некоторых вариантах осуществления CD8+ клетки дополнительно обогащают по или истощают по наивным, центральным клеткам памяти, эффекторным клеткам памяти и/или центральным стволовым клеткам памяти, например, с помощью положительного или отрицательного отбора на основании антигенов поверхности, ассоциированных с соответствующей субпопуляцией. В некоторых вариантах осуществления обогащение по центральным T-клеткам памяти (TCM) осуществляют для увеличения эффекта, например, для усовершенствования долгосрочной выживаемости, размножения и/или приживления после введения, что в некоторых аспектах является особенно прочным в таких субпопуляциях. См. Terakuraet al. (2012) Blood, 1:72-82; Wang et al. (2012) J Immunother. 35(9):689-701. В некоторых вариантах осуществления объединение TCM-обогащенных CD8+ T-клеток и CD4+ T-клеток дополнительно усиливает эффект.
[0392] В определенных вариантах осуществления, T-клетки памяти присутствуют как в CD62L+, так и в CD62L- подмножестве CD8+ лимфоцитов периферической крови. PBMC можно обогащать или истощать по CD62L-CD8+ и/или CD62L+CD8+ фракциям, например, с использованием антител против CD8 и против CD62L.
[0393] В некоторых вариантах осуществления обогащение по центральным T-клеткам памяти (TCM) основано на положительной или высокой поверхностной экспрессии CD45RO, CD62L, CCR7, CD28, CD3 и/или CD127; в некоторых аспектах, оно основано на отрицательном отборе клеток, экспрессирующих или высоко экспрессирующих CD45RA и/или гранзим B. В некоторых аспектах, выделение CD8+ популяции, обогащенной TCM клетками, осуществляют посредством истощения клеток, экспрессирующих CD4, CD14, CD45RA, и положительного отбора или обогащения по клетка, экспрессирующим CD62L. В одном из аспектов, обогащение центральных T-клеток памяти (TCM) осуществляют, начиная от отрицательной фракции клеток, отобранных на основании экспрессии CD4, которую подвергают отрицательному отбору на основании экспрессии CD14 и CD45RA и положительному отбору на основании CD62L. Такие отборы в некоторых аспектах осуществляют одновременно и в других аспектах осуществляют последовательно, в любом порядке. В некоторых аспектах, ту же стадию отбора на основании экспрессии CD4, используемую при получении CD8+ популяции или субпопуляции клеток, также используют для того, чтобы создавать CD4+ популяцию или субпопуляцию клеток, так что положительную и отрицательную фракции из разделения на основании CD4 сохраняют и используют в последующих стадиях способов, необязательно после одной или нескольких дополнительных стадий положительного или отрицательного отбора.
[0394] В конкретном примере образец PBMC или другой образец белых клеток крови подвергают отбору CD4+ клеток, где сохраняют как отрицательную, так и положительную фракции. Затем отрицательную фракцию подвергают отрицательному отбору на основании экспрессии CD14 и CD45RA или CD19 и положительному отбору на основании характеристики маркеров центральных T-клеток памяти, таких как CD62L или CCR7, где положительный и отрицательный отбор осуществляют в любом порядке.
[0395] CD4+ T-хелперные клетки сортируют на наивные, центральные клетки памяти и эффекторные клетки посредством идентификации популяций клеток, которые имеют антигены клеточной поверхности. CD4+ лимфоциты можно получать стандартными способами. В некоторых вариантах осуществления наивные CD4+ T-лимфоциты представляют собой CD45RO-, CD45RA+, CD62L+, CD4+ T-клетки. В некоторых вариантах осуществления центральные CD4+ клетки памяти представляют собой CD62L+ и CD45RO+. В некоторых вариантах осуществления эффекторные CD4+ клетки представляют собой CD62L- и CD45RO-.
[0396] В одном из примеров, для обогащения CD4+ клеток с помощью отрицательного отбора, коктейль моноклональных антител обычно содержит антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. В некоторых вариантах осуществления антитело или партнер связывания связывают с твердым носителем или матрицей, такой как магнитная бусина или парамагнитная бусина, чтобы сделать возможным разделение клеток для положительного и/или отрицательного отбора. Например, в некоторых вариантах осуществления клетки и популяции клеток разделяют или выделяют с использованием иммуномагнитных (или аффинномагнитных) способов разделения (рассмотренных в Methods in Molecular Medicine, том 58: Metastasis Research Protocols, том 2: Cell Behavior In Vitro and In Vivo, стр. 17-25, под редакцией: S.A. Brooks и U. Schumacher © Humana Press Inc., Totowa, NJ).
[0397] В некоторых аспектах, образец или композиция клеток, подлежащие разделению, инкубируют с небольшим, намагничиваемым или магнитно-чувствительным материалом, таким как магнитно-чувствительные частицы или микрочастицы, такие как парамагнитные бусы (например, такие как бусы Dynalbeads или MACS). Магнитно-чувствительный материал, например, частицу, в целом непосредственно или опосредованно прикрепляют к партнеру связывания, например, антителу, который специфически связывается с молекулой, например, маркером поверхности, присутствующей на клетке, клетках или популяции клеток, которые желают отделять, например, которые желают отбирать отрицательно или положительно.
[0398] В некоторых вариантах осуществления магнитная частица или бусина содержит магнитно-чувствительный материал, связанный со специфическим связывающим элементом, таким как антитело или другой партнер связывания. Существует множество общеизвестных магнитно-чувствительных материалов, используемых в магнитных способах разделения. Подходящие магнитные частицы включают те, которые в Molday, патент США №4452773, и в описании европейского патента EP 452342 B, которые включены, таким образом, посредством ссылки. Частицы коллоидных размеров, такие как те, что описаны у Owen, патент США №4795698, и Liberti et al., патент США №5200084, представляют собой другие примеры.
[0399] Инкубацию в целом осуществляют в условиях, в соответствии с которыми антитела или партнеры связывания, или молекулы, такие как вторичные антитела или другие реактивы, которые специфически связываются с такими антителами или партнерами связывания, которые прикрепляют к магнитной частице или бусине, специфически связываются с молекулами клеточной поверхности, если они присутствуют на клетках в образце.
[0400] В некоторых аспектах, образец помещают в магнитное поле, и те клетки, которые имеют магнитно-чувствительные или намагничиваемые частицы, прикрепленные к ним, притягивают к магниту и отделяют от не меченных клеток. Для положительного отбора, сохраняют клетки, которые притягивают к магниту; для отрицательного отбора, сохраняют клетки, которые не притягивают (не меченные клетки). В некоторых аспектах, комбинацию положительного и отрицательного отбора осуществляют во время одной и той же стадии отбора, где положительные и отрицательные фракции сохраняют и дополнительно обрабатывают или подвергают дополнительным стадиям разделения.
[0401] В определенных вариантах осуществления магнитно-чувствительные частицы покрывают первичными антителами или другими партнерами связывания, вторичными антителами, лектинами, ферментами или стрептавидином. В определенных вариантах осуществления магнитные частицы прикрепляют к клеткам через покрывание первичными антителами со специфичностью к одному или нескольким маркерам. В определенных вариантах осуществления клетки, вместо бус, метят первичным антителом или партнером связывания и затем добавляют магнитные частицы, покрытые вторичным антителом со специфичностью к клеткам определенного типа или другим партнером связывания (например, стрептавидином). В определенных вариантах осуществления покрытые стрептавидином магнитные частицы используют в сочетании с биотинилированными первичными или вторичными антителами.
[0402] В некоторых вариантах осуществления магнитно-чувствительные частицы оставляют прикрепленными к клеткам, которые впоследствии подлежат инкубации, культивированию и/или конструированию; в некоторых аспектах, частицы оставляют прикрепленными к клеткам для введения пациенту. В некоторых вариантах осуществления намагничиваемые или магнитно-чувствительные частицы удаляют из клеток. Способы удаления намагничиваемых частиц из клеток известны и включают, например, использование конкурентных не меченных антител, намагничиваемых частиц или антител, конъюгированных с расщепляемыми линкерами, и т.д. В некоторых вариантах осуществления намагничиваемые частицы являются биоразрушаемыми.
[0403] В некоторых вариантах осуществления отбор на основании аффинности происходит через магнитно-активированную сортировку клеток (MACS) (Miltenyi Biotech, Auburn, CA). Системы магнитно-активированной сортировки клеток (MACS) допускают отбор высокой чистоты для клеток, имеющих намагниченные частицы, прикрепленные к ним. В определенных вариантах осуществления MACS работает в режиме, в котором не целевые и целевые частицы последовательно элюируют после наложения внешнего магнитного пола. То есть, клетки, прикрепленные к намагниченным частицам, удерживают на месте, тогда как не прикрепленные частицы элюируют. Затем, после завершения этой первой стадии элюирования, частицы, которые удерживало магнитное поле и которые не могли быть элюированы, высвобождают каким-либо образом так, что их можно элюировать и извлекать. В определенных вариантах осуществления не клетки-мишени метят и истощают в гетерогенной популяции клеток.
[0404] В определенных вариантах осуществления выделение или разделение осуществляют с использованием системы, устройства или аппарата, который осуществляет одну или более из стадий выделения, подготовки клеток, разделения, обработки, инкубации, культивирования и/или формулирования в способах. В некоторых аспектах, систему используют для того, чтобы осуществлять каждую из этих стадий в замкнутом или стерильном окружении, например, чтобы минимизировать ошибки, пользовательское вмешательство и/или контаминацию. В одном из примеров, система представляет собой систему, как описано в публикации международной патентной заявки № WO 2009/072003 или US 20110003380 A1.
[0405] В некоторых вариантах осуществления система или устройство осуществляет одну или более, например, все, из стадий выделения, обработки, конструирования и формулирования в интегрированной или автономной системе и/или автоматизированным или программируемым образом. В некоторых аспектах, система или устройство содержит компьютер и/или компьютерную программу в связи с системой или устройством, который позволяет пользователю программировать, управлять, оценивать результат и/или корректировать различные аспекты стадий обработки, выделения, конструирования и формулирования.
[0406] В некоторых аспектах, разделение и/или другие стадии осуществляют с использованием системы CliniMACS (Miltenyi Biotic), например, для автоматизированного разделения клеток на уровне клинического масштаба в закрытой и стерильной системе. Компоненты могут включать встроенный микрокомпьютер, блок магнитного разделения, перистальтический насос и различные клапаны с зажимами. Встроенный компьютер в некоторых аспектах контролирует все компоненты прибора и управляет системой для того, чтобы осуществлять повторные процедуры в стандартизированной последовательности. Блок магнитного разделения в некоторых аспектах содержит перемещаемый постоянный магнит и держатель для колонки для отбора. Перистальтический насос управляет скоростью потока на всем протяжении комплекта трубок и, вместе с клапанами с зажимами, обеспечивает управляемый поток буфера через систему и непрерывную суспензию клеток.
[0407] В системе CliniMACS, в некоторых аспектах, используют связанные с антителами намагничиваемые частицы, которые поставляют в стерильном, не пирогенном растворе. В некоторых вариантах осуществления, после мечения клеток магнитными частицами, клетки промывают для того, чтобы удалять избыток частиц. Затем мешок подготовки клеток соединяют с комплектом трубок, который в свою очередь соединяют с мешком, содержащим буфер, и мешком для сбора клеток. Комплект трубок состоит из предварительно собранных стерильных трубок, в том числе перед колонкой, и разделительной колонки и предназначен только для одного использования. После инициации программы разделения, система автоматически вносит образец клеток на разделительную колонку. Меченные клетки удерживают в колонке, тогда как не меченные клетки удаляют с помощью ряда стадий промывания. В некоторых вариантах осуществления популяции клеток для использования в способах описанных в настоящем описании являются не меченными, и их не удерживают в колонке. В некоторых вариантах осуществления популяции клеток для использования в способах, описанных в настоящем описании, метят и удерживают в колонке. В некоторых вариантах осуществления популяции клеток для использования в способах, описанных в настоящем описании, элюируют из колонки после удаления магнитного поля и собирают в мешок для сбора клеток.
[0408] В определенных вариантах осуществления разделение и/или другие стадии осуществляют с использованием системы CliniMACS Prodigy (Miltenyi Biotec). Система CliniMACS Prodigy в некоторых аспектах оснащена блоком обработки клеток, который делает возможным автоматизированное промывание и фракционирование клеток посредством центрифугирования. Система CliniMACS Prodigy также может содержать встроенную камеру и программное обеспечение распознавания образов, которое определяет оптимальную конечную точку фракционирования клеток посредством различения макроскопических слоев исходного клеточного продукта. Например, периферическую кровь можно автоматически разделять на слои эритроцитов, белых клеток крови и плазмы. Система CliniMACS Prodigy также может содержать встроенную камеру культивирования клеток, которая выполняет протоколы клеточной культуры, такие как, например, дифференцировка и размножение клеток, загрузка антигеном и долгосрочная клеточная культура. Входные порты могут предусматривать стерильное удаление и восполнение сред, и можно осуществлять мониторинг клеток с использованием встроенного микроскопа. См., например, Klebanoff et al. (2012) J Immunother. 35(9): 651-660, Terakuraet al. (2012) Кровь.1:72-82, и Wang et al. (2012) J Immunother. 35(9):689-701.
[0409] В некоторых вариантах осуществления популяцию клеток, описанную в настоящем описании, собирают и обогащают (или истощают) через проточную цитометрию, при которой поток текучего вещества несет клетки, окрашенные по нескольким поверхностным клеточным маркерам. В некоторых вариантах осуществления популяцию клеток, описанную в настоящем описании, собирают и обогащают (или истощают) через сортировку (FACS) в препаративном масштабе. В определенных вариантах осуществления популяцию клеток, описанную в настоящем описании, собирают и обогащают (или истощают) с использованием чипов микроэлектромеханических систем (MEMS) в комбинации с системой обнаружения на основании FACS (см., например, WO 2010/033140, Cho et al. (2010) Lab Chip 10, 1567-1573; и Godin et al. (2008) J Biophoton. 1(5):355-376. В обоих случаях клетки можно метить с использованием нескольких маркеров, допускающих выделение четко определенных подмножеств T-клеток с высокой чистотой.
[0410] В некоторых вариантах осуществления антитела или партнеры связывания метят с использованием одного или нескольких поддающихся обнаружению маркеров, чтобы содействовать разделению для положительного и/или отрицательного отбора. Например, разделение может быть основано на связывании с флуоресцентно меченными антителами. В некоторых примерах, разделение клеток на основании связывания антител или других партнеров связывания со специфичностью к одному или нескольким поверхностным клеточным маркерам осуществляют в текучем потоке, например, посредством активируемой флуоресценцией сортировки клеток (FACS), в том числе препаративного масштаба (FACS), и/или чипов микроэлектромеханических систем (MEMS), например, в комбинации с системой обнаружения проточной цитометрией. Такие способы делают возможным положительный и отрицательный отбор на основании нескольких маркеров одновременно.
[0411] В некоторых вариантах осуществления способы получения включают стадии заморозки, например, криосохранения, клеток, до или после выделения, инкубации и/или конструирования. В некоторых вариантах осуществления стадией заморозки и последующего оттаивания удаляют гранулоциты и, в определенной степени, моноциты в популяции клеток. В некоторых вариантах осуществления клетки суспендируют в растворе для заморозки, например, после стадии промывания для того, чтобы удалять плазму и тромбоциты. В некоторых аспектах, можно использовать любые из различных известных растворов для заморозки и параметров. Один из примеров включает использование PBS, содержащего 20% DMSO и 8% сывороточного альбумина человека (HSA), или других подходящих сред для заморозки клеток. Затем его разводят 1:1 с использованием сред с тем, чтобы конечная концентрация DMSO и HSA составляла 10% и 4%, соответственно. Затем клетки замораживают до -80°C. со скоростью 1° в минуту и хранят в паровой фазе в резервуаре для хранения в жидком азоте.
[0412] В некоторых вариантах осуществления клетки инкубируют и/или культивируют до или в связи с генетической инженерией, например, до или в связи с трансдукцией в соответствии с предоставленными способами. Стадии инкубации могут включать культуру, культивирование, стимуляцию, активацию и/или размножение. В некоторых вариантах осуществления композиции или клетки инкубируют в присутствии стимулирующих условий или стимулирующего средства. Такие условия включают те, которые разработаны для того, чтобы индуцировать пролиферацию, размножение, активацию и/или выживаемость клеток в популяции, чтобы имитировать антигенную экспозицию и/или подготавливать клетки для генетической инженерии, например, для введения рекомбинантного антигенного рецептора.
[0413] Условия могут включать одно или более из конкретных сред, температуры, содержания кислорода, содержания диоксида углерода, времени, средств, например, питательных веществ, аминокислот, антибиотиков, ионов и/или стимулирующих факторов, таких как цитокины, хемокины, антигены, партнеры связывания, слитые белки, рекомбинантные растворимые рецепторы и любые другие средства, разработанные для того, чтобы активировать клетки.
[0414] В некоторых вариантах осуществления стимулирующие условия или средства включают одно или более средств, например, лиганд, который способен к активации внутриклеточного сигнального домена комплекса TCR. В некоторых аспектах, средство включает или инициирует внутриклеточный сигнальный каскад TCR/CD3 в T-клетке. Такие средства могут включать антитела, такие как те, которые обладают специфичностью к TCR компоненту и/или костимулирующему рецептору, например, против CD3, против CD28, например, связанные с твердым носителем, таким как бусина, и/или один или более цитокинов. Необязательно, способ размножения дополнительно может включать стадию добавления антитела против CD3 и/или против CD28 в среду для культивирования (например, в концентрации по меньшей мере приблизительно 0,5 нг/мл). В некоторых вариантах осуществления стимулирующие средства включают IL-2 и/или IL-15, например, концентрация IL-2 составляет по меньшей мере приблизительно 10 Ед/мл.
[0415] В некоторых аспектах, инкубацию осуществляют в соответствии со способами, такими как те, которые описаны в патенте США №6,040,177 на Riddell et al., Klebanoff et al.(2012) J Immunother. 35(9): 651-660, Terakuraet al. (2012) Blood.1:72-82, и/или Wang et al. (2012) J Immunother. 35(9):689-701.
[0416] В некоторых вариантах осуществления T-клетки размножают посредством добавления в инициирующую культивирование композицию клеток-кормушек, таких как не делящиеся мононуклеарные клетки периферической крови (PBMC), (например, так, что получаемая популяция клеток содержит по меньшей мере приблизительно 5, 10, 20, или 40 или больше PBMC клеток-кормушек на каждый T-лимфоцит в начальной популяции, подлежащей размножению); и инкубации культуры (например, в течение периода времени, достаточного для размножения определенного числа T-клеток). В некоторых аспектах, не делящиеся клетки-кормушки могут содержать γ-облученные PBMC клетки-кормушки. В некоторых вариантах осуществления PBMC облучают γ-лучами в диапазоне приблизительно от 3000 до 3600 рад для того, чтобы предотвращать клеточное деление. В некоторых аспектах, клетки-кормушки добавляют в среду для культивирования перед добавлением популяций T-клеток.
[0417] В некоторых вариантах осуществления стимулирующие условия включают температуру, подходящую для роста T-лимфоцитов человека, например, по меньшей мере приблизительно 25 градусов по Цельсию, в целом по меньшей мере приблизительно 30 градусов и в целом ровно или приблизительно 37 градусов по Цельсию. Необязательно, инкубация дополнительно может включать добавление не делящихся EBV-трансформированных лимфобластоидных клеток (LCL) в качестве клеток-кормушек. LCL можно облучать γ-лучами в диапазоне приблизительно от 6000 до 10000 рад. LCL клетки-кормушки в некоторых аспектах предоставляют в любом подходящем количестве, например, в соотношении LCL клеток-кормушек и начальных T-лимфоцитов по меньшей мере приблизительно 10:1.
[0418] В определенных вариантах осуществления, антиген-специфические T-клетки, такие как антиген-специфические CD4+ и/или CD8+ T-клетки, получают посредством стимуляции наивных или антиген-специфических T-лимфоцитов с использованием антигена. Например, можно создавать антиген-специфические линии или клоны T-клеток для цитомегаловирусных антигенов посредством выделения T-клеток у инфицированных субъектов и стимуляции клеток in vitro с использованием того же антигена.
[0419] В некоторых случаях, можно использовать вирусную векторную частицу, которая не требует активировать клетки, например, T-клетки. В некоторых таких случаях, клетки можно отбирать и/или трансдуцировать перед активацией и/или в отсутствие активации.
B. Обратимое связывание или разрушение и удаление компонентов
[0420] В некоторых вариантах осуществления способ дополнительно включает приведение в контакт клеток, которые приводили в контакт, инкубировали или культивировали с олигомерным белковым реактивом, таким как реактив мультимеризации, с (i) конкурентным реактивом (например, свободным партнером связывания C, например, C1) или его аналогом, способным разрушать связь между первым партнером связывания, например, C1, и сайтом связывания Z, например, Z1, и/или (например, в случае необходимости). Можно использовать любые из образцовых конкурентных реактивов, как раскрыто в настоящем описании. В некоторых вариантах осуществления можно добавлять один или более дополнительных вторых конкурентных реактивов, в зависимости от свойств конкретного партнера связывания C и его взаимодействия с сайтом связывания Z. Поступая таким образом, разрушают обратимую связь между указанным партнером связывания и указанным сайтом связывания олигомерного реактива, тем самым высвобождая в элюат клетки, например, T-клетки, связанные с олигомерным реактивом (например, выходная композиция).
[0421] В некоторых вариантах осуществления добавление свободного партнера или его аналога ведет к вымещению партнера связывания C, например, C1, из реактива мультимеризации и, таким образом, поскольку партнер связывания содержится в обратимо связанном средстве, достигают вымещения такого средства из реактива мультимеризации. Это вымещение средства, в свою очередь, ведет к диссоциации первого средства и молекулы клеточной поверхности, в частности, если аффинность связывания связи между первым средством и рецептором клеточной поверхности имеет константу диссоциации (KD) в диапазоне от 10-2 M до 10-13 M и, таким образом, также является обратимой. Из-за этой диссоциации, в некоторых аспектах, также завершают трансдукцию, отбор, активацию, стимуляцию и/или активацию популяции клеток.
[0422] В некоторых вариантах осуществления способ дополнительно может включать удаление одного или нескольких компонентов после обратимой диссоциации или разрушения. Для разрушения и/или удаления компонентов можно использовать любые из способов, как раскрыто в настоящем описании выше. В некоторых вариантах осуществления любой несвязанный или остаточный конкурентный реактив (например, биотин) в культивируемых клетках-мишенях (например, T-клетках) можно отделять или удалять. В некоторых вариантах осуществления реактив олигомеризации удаляют, уменьшают или отделяют от клеток в композиции клеток (например, выходной композиции). В некоторых вариантах осуществления одно или более связывающих средств удаляют, уменьшают или отделяют от клеток в композиции клеток (например, выходной композиции). В некоторых вариантах осуществления конкурентное вещество удаляют или уменьшают или отделяют от клеток в композиции (например, выходной композиции). В некоторых вариантах осуществления в способах используют растворимый реактив олигомеризации, например, такой реактив мультимеризации, что реактив и один или более других компонентов можно легко удалять из композиции клеток, поскольку клетки можно просто осаждать посредством центрифугирования и выбрасывать супернатант, в том числе растворимое средство мультимеризации и/или другие компоненты. Альтернативно, растворимое средство мультимеризации можно так удалять из композиции клеток в гельпроникающей матрице картриджа удаления, как раскрыто в настоящем описании (например, международная патентная заявка WO 2013/124474).
[0423] Например, в некоторых вариантах осуществления разделение/удаление можно осуществлять с использованием второй стационарной фазы. С этой целью, смесь, содержащую клетки-мишени (например, T-клетки) и такой реактив олигомеризации, который может сохранять присутствие в выходной композиции, экспонируют, для подходящей стационарной фазы, которая может представлять собой вторую стационарную фазу. Эта стационарная фаза может представлять собой гельфильтрационную матрицу и/или матрицу аффинной хроматографии, где гельфильтрационная матрица и/или матрица аффинной хроматографии содержит аффинный реактив. Аффинный реактив, содержащийся на хроматографической смоле, содержит партнер связывания D, который (специфически) связывается с сайтом связывания Z1 и/или сайтом связывания Z2, если присутствует, олигомерного реактива, тем самым иммобилизуя олигомерный реактив на стационарной фазе. Если используют олигомерный реактив, основанный на стрептавидине, и связывающие средства имеют стрептавидин-связывающий пептид в качестве партнера связывания C1 или C2, партнер связывания D, который содержится в аффинном реактиве этой стационарной фазы, может представлять собой биотин. Растворимый олигомер стрептавидина или мутеина стрептавидина, который используют в качестве реактива олигомеризации, затем связывается с биотином, который обычно ковалентно связывают с хроматографической матрицей, такой как биотин-сефароза™, которая доступна коммерчески. В некоторых таких вариантах осуществления, клетки (например, выходную композицию) можно извлекать из реактива олигомеризации.
[0424] В некоторых вариантах осуществления способность удалять реактив и другие компоненты из композиции имеет дополнительное преимущество в виде возможности не использовать какой-либо твердый носитель, такой как магнитные бусы. В некоторых вариантах осуществления это обозначает, что имеет место нулевой или минимальный риск контаминации активированных T-клеток такими магнитными бусами. В некоторых вариантах осуществления это также обозначает, что процесс, который соответствует стандартам GMP, можно создавать более легко по сравнению с другими способами, такими как использование Dynabeads®, в которых нужно принимать дополнительные меры, чтобы гарантировать, что конечная размноженная популяция T-клеток не содержит магнитные бусы. В некоторых вариантах осуществления, поскольку твердая фаза (например, магнитные бусы) отсутствует, настоящее изобретение также относится к автоматизированной закрытой системе для размножения клеток, которую можно встраивать в известные системы размножения клеток, такие как Xuri Cell Expansion System W25 и WAVE Bioreactor 2/10 System, доступные в GE Healthcare (Little Chalfont, Buckinghamshire, United Kingdom), или Quantum® Cell Expansion System, доступная в TerumoBCT Inc. (Lakewood, CO, USA).
C. Дополнительная обработка
[0425] В некоторых вариантах осуществления стадии обработки для трансдукции, такие как в связи с конструированием клеток, могут дополнительно включать культуру, культивирование, стимуляцию, активацию и/или размножение клеток. В некоторых вариантах осуществления входная и/или выходная композиции или клетки инкубируют в присутствии стимулирующих условий или стимулирующего средства. Такие условия включают те, которые разработаны, чтобы индуцировать пролиферацию, размножение, активацию и/или выживаемость клеток в популяции, чтобы имитировать антигенную экспозицию и/или подготавливать клетки для генетической инженерии, например, для активации клеток для трансдукции вирусным вектором.
[0426] В некоторых вариантах осуществления необязательно способ включает инкубацию, при которой дополнительная часть инкубации, например, дополнительная часть после приведения в контакт клеток с олигомерным реактивом, таким как реактив мультимеризации, и вирусными векторными частицами. В некоторых вариантах осуществления дополнительную инкубацию осуществляют после разрушения связывающего вирусную частицу средства и реактива и/или средства отбора и реактива. В некоторых вариантах осуществления дополнительную инкубацию осуществляют без вращения или центрифугирования, которое в целом осуществляют после выполнения по меньшей мере части инкубации при вращении, например, в связи с центрифугированием или спинокуляцией. В некоторых вариантах осуществления дополнительную инкубацию осуществляют вне стационарной фазы, например, вне хроматографической матрицы, например, в растворе. В некоторых таких вариантах осуществления, дополнительную инкубацию осуществляют в условиях, которые ведут к встраиванию вирусного вектора в геном организма-хозяина в одной или нескольких клетках.
[0427] Специалист в данной области сможет оценивать или определять, привела ли инкубация ко встраиванию вирусных векторных частиц в геном организма-хозяина, и, таким образом, эмпирически определять условия для дополнительной инкубации. В некоторых вариантах осуществления встраивание вирусного вектора в геном организма-хозяина можно оценивать посредством измерения уровня экспрессии рекомбинантного белка, такого как гетерологичный белок, который кодирует нуклеиновая кислота, содержащаяся в геноме вирусной векторной частицы, после инкубации. Можно использовать множество общеизвестных способов оценки уровня экспрессии рекомбинантных молекул, таких как обнаружение способами на основании аффинности, например, способами на основании иммуноаффинности, например, в контексте белков клеточной поверхности, например, посредством проточной цитометрии. В некоторых примерах, экспрессию измеряют посредством обнаружения маркера трансдукции и/или конструкции репортера. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая усеченный белок поверхности, содержится в векторе, и ее используют в качестве маркера его экспрессии и/или усиления.
[0428] В некоторых вариантах осуществления дополнительную инкубацию осуществляют в том же контейнере или устройстве, в котором происходило приведение в контакт. В некоторых вариантах осуществления дополнительную инкубацию осуществляют в другом контейнере или устройстве, нежели те, в которых происходило приведение в контакт, например, посредством переноса, например, автоматического переноса, композиции клеток в другой контейнер или устройство после приведения в контакт с вирусными частицами и реактивом. В некоторых вариантах осуществления дополнительную инкубацию осуществляют без удаления реактива из входной композиции перед инкубацией. В некоторых вариантах осуществления дополнительную инкубацию осуществляют без удаления реактива во время дополнительной инкубации. В некоторых вариантах осуществления реактив содержится во время по меньшей мере части дополнительной инкубации, например, в течение по меньшей мере половины дополнительной инкубации, но затем его удаляют из композиции перед одной или несколькими стадиями дополнительной обработки. В некоторых вариантах осуществления после дополнительной инкубации процесс получения клеток дополнительно может включать промывание или формулирование клеток.
[0429] В некоторых вариантах осуществления дополнительную инкубацию осуществляют в условиях для стимуляции и/или активации клеток, эти условия могут включать одно или более из конкретных сред, температуры, содержания кислорода, содержания диоксида углерода, времени, средств, например, питательных веществ, аминокислот, антибиотиков, ионов и/или стимулирующих факторов, таких как цитокины, хемокины, антигены, партнеры связывания, слитые белки, рекомбинантные растворимые рецепторы и любые другие средства, разрабатываемые для того, чтобы активировать клетки.
[0430] В некоторых вариантах осуществления стимулирующие условия или средства включают одно или более средств (например, стимулирующих и/или вспомогательных средств), например, лиганд, который способен к активации внутриклеточного сигнального домена комплекса TCR. В некоторых аспектах, средство включает или инициирует внутриклеточный сигнальный каскад TCR/CD3 в T-клетке, такое как средства, подходящие для того, чтобы доставлять первичный сигнал, например, чтобы инициировать активацию ITAM-индуцированного сигнала, например, специфичного для компонента TCR, и/или средство, которое содействует костимулирующему сигналу, например, специфичному для костимулирующего рецептора T-клетки, например, средство против CD3, против CD28 или против 41-BB, например, связанное с твердым носителем, таким как бусина, и/или один или более цитокинов. Среди стимулирующих средств имеют место бусы против CD3/против CD28 (например, DYNABEADS® M-450 CD3/CD28 T Cell Expander и/или бусы ExpACT®). Необязательно, способ размножения дополнительно может включать стадию добавления антитела против CD3 и/или против CD28 в среду для культивирования. В некоторых вариантах осуществления стимулирующие средства включают IL-2 и/или IL-15, например, концентрация IL-2 составляет по меньшей мере приблизительно 10 Ед/мл. В некоторых вариантах осуществления инкубацию осуществляют в соответствии со способами, такими как те, которые описаны в патенте США №6040177 на Riddell et al., Klebanoff et al.(2012) J Immunother. 35(9): 651-660, Terakura et al. (2012) Blood.1:72-82, и/или Wang et al. (2012) J Immunother. 35(9):689-701.
[0431] В некоторых вариантах осуществления дополнительную инкубацию осуществляют в присутствии стимулирующего средства (например, цитокина, такого как IL-2).
[0432] В некоторых вариантах осуществления дополнительную инкубацию осуществляют при температурах больше комнатной температуры, например, больше чем или больше чем приблизительно 25°C, например, обычно больше чем или больше чем приблизительно 32°C, 35°C или 37°C. В некоторых вариантах осуществления дополнительную инкубацию осуществляют при температуре, равной или приблизительно 37°C±2°C, например, при температуре, равной или приблизительно 37°C.
[0433] В некоторых вариантах осуществления общая длительность инкубации, такой как инкубация с одним или несколькими стимулирующими средствами, составляет между или между приблизительно 1 часом и 96 часами, 1 часом и 72 часами, 1 часом и 48 часами, 4 часами и 36 часами, 8 часами и 30 часами или 12 часами и 24 часами, например, по меньшей мере или приблизительно по меньшей мере 6 часов, 12 часов, 18 часов, 24 часа, 36 часов или 72 часа. В некоторых вариантах осуществления дополнительная инкубация происходит в течение времени между или приблизительно между 1 часом и 48 часами, 4 часами и 36 часами, 8 часами и 30 часами или 12 часами и 24 часами, включительно.
[0434] В некоторых вариантах осуществления дополнительная инкубация протекает в закрытой системе. В некоторых вариантах осуществления после элюирования клеток из реактива, например, в контейнер, например, мешок, пробирку или сосуд, контейнер, содержащий элюированную композицию, инкубируют в течение дополнительной части времени. В некоторых вариантах осуществления контейнер инкубируют при температуре, равной или приблизительно 37°C±2°C, в течение времени между или приблизительно между 1 часом и 48 часами, 4 часами и 36 часами, 8 часами и 30 часами или 12 часами и 24 часами, включительно.
D. Образцовый признак трансдуцированных клеток
[0435] В некоторых вариантах осуществления способы ведут к трансдукции определенного числа или процентной доли клеток в выходной композиции (например, элюированной композиции) или ее подмножестве. Например, в некоторых вариантах осуществления по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% всех клеток (или клеток-мишеней конкретного типа, таких как T-клетки) в выходной композиции, например, элюированной композиции, трансдуцируют указанным вирусным вектором, и/или они экспрессируют рекомбинантный продукт гена, кодируемый им. В некоторых вариантах осуществления способы трансдукции ведут к выходной композиции, например, элюированной композиции, в которой по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% всех клеток, таких как T-клетки, в композиции трансдуцируют вирусным вектором, и/или они экспрессируют рекомбинантный продукт гена, кодируемый им. Трансдукцию клеток можно обнаруживать посредством обнаружения присутствия рекомбинантной нуклеиновой кислоты, например, трансгена, включенного в вектор, или ее продукта в клетке. В некоторых вариантах осуществления на поверхности клетки обнаруживают продукт, который указывает, что клетка успешно трансдуцирована. В некоторых вариантах осуществления обнаружение трансдукции включает обнаружение маркера трансдукции, такого как другой трансген или продукт, включенный для целей получения трансдуцированных клеток, и/или другой селективный маркер.
[0436] В некоторых вариантах осуществления способы позволяют достигать такой по меньшей мере конкретной эффективности трансдукции при определенных условиях. Например, в некоторых вариантах осуществления, когда входная композиция содержит вирус и клетки в соотношении от или приблизительно от 1 инфекционной единицы (IU) на одну из клеток до 10 IU на одну из клеток, например, по меньшей мере или равном или приблизительно 1 инфекционная единица (IU) на одну из клеток, или по меньшей мере или равном или приблизительно 2 IU на одну из клеток, по меньшей мере или равном или приблизительно 5 IU на одну из клеток, или по меньшей мере или равном или приблизительно 10 IU на одну из клеток, способ позволяет получать выходную композицию, в которой по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% клеток в композиции, созданных способом, содержат рекомбинантный вирусный вектор, например, трансдуцированы им.
[0437] В некоторых вариантах осуществления выходная композиция, например, элюированная композиция, являющаяся результатом способов трансдукции, содержит конкретное усредненное или среднее число копий трансдуцированного вектора на клетку (число копий вектора (VCN)). VCN можно выражать в единицах числа копий в одной клетке. Альтернативно, его можно выражать в виде усредненного числа на общую популяцию клеток или композицию, такую как выходная или трансдуцированная композиция (включая любые не трансдуцированные клетки в композиции, которые не содержат никакие копии вектора). Альтернативно, VCN можно выражать в единицах усредненного числа копий только среди трансдуцированных клеток. В некоторых вариантах осуществления среди всех клеток в трансдуцированной или элюированной композиции, полученной с помощью способов, усредненное VCN составляет не больше чем или приблизительно 10, 5, 4, 2,5, 1,5 или 1. В некоторых вариантах осуществления среди клеток в трансдуцированной или элюированной композиции, которая содержит рекомбинантный вирусный вектор или экспрессирует рекомбинантный продукт гена, усредненное VCN составляет не больше чем или приблизительно 4, 3, 2, 2,5, 1,5 или 1.
[0438] В некоторых аспектах, используя предоставленные способы, можно усиливать или увеличивать трансдукцию в подмножестве клеток, таких как T-клетки, которые можно обратимо отбирать в присутствии по меньшей мере одного или нескольких средств отбора при инкубации или культивировании, которые происходят во время по меньшей мере части приведения в контакт (например, трансдукции) клеток с олигомерным реактивом и вирусными частицами. В некоторых вариантах осуществления трансдукцию можно увеличивать по меньшей мере 1,5-кратно, по меньшей мере 2,0-кратно, по меньшей мере 3,0-кратно, по меньшей мере 4,0-кратно, по меньшей мере 5,0-кратно, по меньшей мере 6,0-кратно, по меньшей мере 7,0-кратно, по меньшей мере 8,0-кратно, по меньшей мере 9,0-кратно, по меньшей мере 10-кратно или больше в подмножестве клеток, таких как T-клетки, в выходной композиции, которые являются положительными по селективному маркеру, когда приводят в контакт, например, инкубируют, в присутствии средства отбора, которое специфически связывается с селективным маркером, по сравнению с приведением в контакт, например, инкубацией, в присутствии реактива, не содержащего средство отбора. В некоторых вариантах осуществления селективный маркер может представлять собой любой селективный маркер, как раскрыто в настоящем описании. В некоторых вариантах осуществления селективный маркер выбирают из CD25, CD28, CD62L, CCR7, CD27, CD127, CD3, CD4, CD8, CD45RA и/или CD45RO. В некоторых вариантах осуществления способность избирательно или предпочтительно направленно воздействовать на трансдукцию клеток обозначает, что трансдукцию можно осуществлять в смешанной популяции клеток без предварительного выделения или отбора клеток перед инициацией процессов конструирования клеток, например, активации и/или трансдукции клеток. В некоторых вариантах осуществления предоставленные способы не включают стадию отбора или выделения клеток с помощью способов на основании иммуноаффинности перед активацией клеток или перед инициацией трансдукции клеток.
[0439] Также предусмотрены композиции, полученные любым из вышеуказанных способов. В некоторых вариантах осуществления композиции содержат по меньшей мере 1×107 клеток или 5×107 клеток, например, по меньшей мере 1×108 клеток, 2×108 клеток, 4×108 клеток, 6×108, 8×108 клеток или 1×109 клеток, в которой по меньшей мере множество клеток трансдуцированы рекомбинантным вирусным вектором. В некоторых вариантах осуществления клетки представляют собой T-клетки.
IV. ВИРУСНЫЕ ВЕКТОРНЫЕ ЧАСТИЦЫ
[0440] В некоторых вариантах осуществления способы включают приведение в контакт композиции клеток, такой как входная композиция, с вирусной частицей (также обозначаемой как «вирусные векторные частицы») в присутствии олигомерного реактива, такого как реактив мультимеризации, как описано. В некоторых аспектах, композицию клеток, содержащую множество вирусных векторных частиц, приводят в контакт со связывающим вирусную частицу средством, обратимо связанным с реактивом, или с реактивом, с которым вирусные векторные частицы могут обратимо связываться.
[0441] В некоторых вариантах осуществления вирусные векторные частицы представляют собой ретровирусные векторные частицы, такие как лентивирусные или гаммаретровирусные векторные частицы, содержащие нуклеиновую кислоту, кодирующую рекомбинантную и/или гетерологичную молекулу, например, рекомбинантный или гетерологичный белок, такой как рекомбинантный и/или гетерологичный рецептор, такой как химерный антигенный рецептор (CAR) или другой антигенный рецептор, в геноме вирусного вектора. Геном вирусной векторной частицы обычно содержит последовательности в дополнение к нуклеиновой кислоте, кодирующей рекомбинантную молекулу. Такие последовательности могут включать последовательности, которые позволяют упаковывать геном в вирусную частицу, и/или последовательности, которые содействуют экспрессии нуклеиновой кислоты, кодирующей рекомбинантный рецептор, такой как CAR.
[0442] В некоторых вариантах осуществления ретровирусная векторная частица представляет собой HIV-1 лентивирусную векторную частицу. В некоторых вариантах осуществления вирусная векторная частица, такая как ретровирусная векторная частица, является псевдотипированной с использованием VSV-G или другого гликопротеина вирусной оболочки. В некоторых вариантах осуществления вирусная векторная частица содержит на своей поверхности синтетический фрагмент, такой как пептид или метка (например, аффинная метка), слитый или конъюгированный с гликопротеином вирусной оболочки, как описано.
A. Вирусный вектор
[0443] Предоставленные вирусные векторные частицы содержат геном, полученный из вектора, основанного на ретровирусном геноме, например, полученный из вектора, основанного на гаммаретровирусном или лентивирусном геноме. Известно большое число таких различных подходящих векторных геномов ((см., например, Koste et al. (2014) Gene Therapy, 3 апреля 2014 года. doi: 10.1038/gt.2014.25; Carlens et al. (2000) Exp Hematol 28(10): 1137-46; Alonso-Самино et al. (2013) Mol Ther Nucl Acids 2, e93; Park et al., Trends Biotechnol. 2011 November 29(11): 550-557; Pfeifer and Verma (2001) Annu. Rev. Genomics Hum. Genet., 2:177-211). В некоторых аспектах предоставленных вирусных векторов, гетерологичная нуклеиновая кислота, кодирующая рекомбинантный рецептор, такой как антигенный рецептор, такой как CAR, содержится и/или расположена между последовательностями 5′ LTR и 3′ LTR векторного генома.
[0444] В некоторых вариантах осуществления вирусный векторный геном представляет собой лентивирусный геном, такой как геном HIV-1 или геном SIV. Например, лентивирусные векторы создают посредством многократного ослабления генов вирулентности, например, можно удалять гены env, vif, vpu и nef, делая вектор безопаснее для терапевтических целей. Лентивирусные векторы известны. См. Naldini et al., (1996 и 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США №№6013516; и 5994136). В некоторых вариантах осуществления эти вирусные векторы основаны на плазмидах или основаны на вирусах и выполнены с возможностью нести неотъемлемые последовательности для встраивания чужеродной нуклеиновой кислоты, для отбора и для переноса нуклеиновой кислоты в клетку-хозяина. Известные лентивирусы можно без труда получать из депозитариев или коллекций, таких как the American Type Culture Collection («ATCC»; 10801 University Blvd., Manassas, Va. 20110-2209), или выделять из известных источников с использованием обычно доступных способов.
[0445] Неограничивающие примеры лентивирусных векторов включают те, которые получают из лентивируса, такого как вирус иммунодефицита человека 1 (HIV-1), HIV-2, вирус иммунодефицита обезьян (SIV), T-лимфотропный вирус человека 1 (HTLV-1), HTLV-2 или вирус инфекционной анемии лошадей (E1AV). Например, лентивирусные векторы создавали посредством многократного ослабления генов вирулентности HIV, например, удаляли гены env, vif, vpr, vpu и nef, делая вектор безопаснее для терапевтических целей. Лентивирусные векторы известны в данной области, см. Naldini et al., (1996 и 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США №№6013516; и 5994136). В некоторых вариантах осуществления эти вирусные векторы основаны на плазмидах или основаны на вирусах и выполнены с возможностью нести неотъемлемые последовательности для встраивания чужеродной нуклеиновой кислоты, для отбора и для переноса нуклеиновой кислоты в клетку-хозяина. Известные лентивирусы можно легко получать из депозитариев или коллекций, таких как the American Type Culture Collection («ATCC»; 10801 University Blvd., Manassas, Va. 20110-2209), или выделять из известных источников, используя обычно доступные способы.
[0446] В некоторых вариантах осуществления вирусный геномный вектор может содержать последовательности 5' и 3' LTR ретровируса, такого как лентивирус. В некоторых аспектах, вирусная геномная конструкция может содержать последовательности из 5' и 3' LTR лентивируса и, в частности, может содержать R и U5 последовательности из 5' LTR лентивируса и инактивированный или самоинактивирующийся 3' LTR из лентивируса. Последовательности LTR могут представлять собой последовательности LTR из любого лентивируса любого вида. Например, они могут представлять собой последовательности LTR из HIV, SIV, FIV или BIV. Обычно, последовательности LTR представляют собой последовательности LTR HIV.
[0447] В некоторых вариантах осуществления нуклеиновая кислота вирусного вектора, такого как HIV вирусный вектор, не содержит дополнительные транскрипционные единицы. Векторный геном может содержать инактивированный или самоинактивирующийся 3' LTR (Zufferey et al. J Virol 72: 9873, 1998; Miyoshi et al., J Virol 72:8150, 1998). Например, делецию в U3 области 3' LTR нуклеиновой кислоты, используемой для получения РНК вирусного вектора, можно использовать для того, чтобы создавать самоинактивирующиеся (SIN) векторы. Затем эту делецию можно переносить в 5' LTR провирусной ДНК во время обратной транскрипции. Самоинактивирующийся вектор в целом имеет делецию последовательностей энхансера и промотора из 3' длинного концевого повтора (LTR), которая скопирована в 5' LTR во время встраивания вектора. В некоторых вариантах осуществления можно устранять достаточную последовательность, включая удаление TATA-бокса, для устранения транскрипционной активности в LTR. Это может препятствовать образованию РНК полноразмерного вектора в трансдуцированных клетках. В некоторых аспектах, элемент U3 из 3' LTR содержит делецию его энхансерной последовательности, TATA-бокс, сайты Sp1 и NF-κB. В качестве результата самоинактивирующегося 3' LTR, провирус, который образуется после проникновения и обратной транскрипции, содержит инактивированный 5' LTR. Это позволяет повышать безопасность посредством снижения риска мобилизации векторного генома и влияния LTR на близлежащие клеточные промоторы. Самоинактивирующийся 3' LTR можно сконструировать любым способом, известным в данной области. В некоторых вариантах осуществления это не влияет на титры вектора или свойства вектора in vitro или in vivo.
[0448] Необязательно, последовательность U3 из лентивирусного 5' LTR можно заменять на промоторную последовательность в вирусной конструкции, такую как гетерологичная промоторная последовательность. Это может увеличивать титр вируса, извлекаемого из пакующей клеточной линии. Энхансерная последовательность также может быть включена. Можно использовать любую комбинацию энхансера/промотора, которая увеличивает экспрессию вирусного РНК генома в пакующей клеточной линии. В одном из примеров используют последовательность энхансера/промотора CMV (патент США №5385839 и патент США №5168062).
[0449] В определенных вариантах осуществления риск инсерционного мутагенеза можно минимизировать посредством конструирования ретровирусного векторного генома, такого как лентивирусный векторный геном, который имеет дефект встраивания. Можно использовать различные подходы для получения генома не интегрирующего вектора. В некоторых вариантах осуществления мутацию(и) можно конструировать в компоненте фермента интегразы в гене pol так, чтобы он кодировал белок с неактивной интегразой. В некоторых вариантах осуществления сам векторный геном можно модифицировать для того, чтобы предотвращать встраивание, например, посредством мутации или делеции одного или обоих сайтов прикрепления или делая 3′ LTR-проксимальный полипуриновый тракт (PPT) не функциональным через делецию или модификацию. В некоторых вариантах осуществления доступны не генетические подходы; они включают фармакологические средства, которые ингибируют одну или более функций интегразы. Подходы не являются взаимоисключающими; то есть, больше чем один из них можно использовать за раз. Например, и интеграза и сайты прикрепления могут быть не функциональными, или интеграза и сайт PPT могут быть не функциональными, или сайты прикрепления и сайт PPT могут быть не функциональными, или все они могут быть не функциональными. Такие способы и вирусные векторные геномы известны и доступны (см. Philpott and Thrasher, Human Gene Therapy 18:483, 2007; Engelman et al. J Virol 69:2729, 1995; Brown et al J Virol 73:9011 (1999); WO 2009/076524; McWilliams et al., J Virol 77:11150, 2003; Powell and Levin J Virol 70:5288, 1996).
[0450] В некоторых вариантах осуществления вектор содержит последовательности для размножения в клетке-хозяине, такой как прокариотическая клетка-хозяин. В некоторых вариантах осуществления нуклеиновая кислота вирусного вектора содержит один или более участков начала репликации для размножения в прокариотической клетке, такой как бактериальная клетка. В некоторых вариантах осуществления векторы, которые содержат прокариотический участок начала репликации, также могут содержать ген, экспрессия которого дает поддающийся обнаружению или селективный маркер, такой как устойчивость к лекарственному средству.
B. Нуклеиновая кислота
1. Рекомбинантный рецептор, например, химерный антигенный рецептор
[0451] В некоторых вариантах осуществления вирусный вектор содержит нуклеиновую кислоту, которая кодирует гетерологичную рекомбинантную молекулу. В некоторых вариантах осуществления, гетерологичная рекомбинантная молекула представляет собой или включает рекомбинантный рецептор, например, антигенный рецептор, SB-транспозоны, например, для сайленсинга генов, окруженные капсидом транспозоны, гомологичную двухцепочечную нуклеиновую кислоту, например, для геномной рекомбинации, или репортерные гены (например, флуоресцентные белки, такие как GFP) или люцифераза).
[0452] В некоторых вариантах осуществления гетерологичная рекомбинантная молекула представляет собой рекомбинантный рецептор, такой как химерный рецептор. Рекомбинантный рецептор, такой как гетерологичный рецептор, может включать антигенные рецепторы, такие как функциональные не TCR антигенные рецепторы, в том числе химерные антигенные рецепторы (CAR), и другие антигенсвязывающие рецепторы, такие как трансгенные T-клеточные рецепторы (TCR). Рецепторы также могут включать другие рецепторы, такие как другие химерные рецепторы, такие как рецепторы, которые связываются с конкретными лигандами и имеют трансмембранные и/или внутриклеточные сигнальные домены, схожие с теми, которые присутствуют в CAR.
[0453] В любом из таких примеров, нуклеиновую кислоту вставляют или располагают в области вирусного вектора, например, обычно в не неотъемлемой области вирусного генома. В некоторых вариантах осуществления нуклеиновую кислоту вставляют в вирусный геном вместо определенных вирусных последовательностей для получения вируса, который имеет дефект репликации.
[0454] В некоторых вариантах осуществления кодируемый рекомбинантный антигенный рецептор, например, CAR, представляет собой тот, который способен к специфическому связыванию с одним или несколькими лигандами на клетке или заболевании, подлежащих направленному воздействию, таком как злокачественная опухоль, инфекционное заболевание, воспалительное или аутоиммунное заболевание или другое заболевание или состояние, в том числе те, которые описаны в настоящем описании для направленного воздействия с использованием предоставленных способов и композиций. Образцовые антигены представляют собой сиротский рецептор тирозинкиназы RORl, tEGFR, Her2, Ll-CAM, CD19, CD20, CD22, мезотелин, CEA и антиген поверхности гепатита B, антифолатный рецептор, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, EGP-2, EGP-4, 0EPHa2, ErbB2, 3 или 4, FBP, фетальный рецептор ацетилхолина e, GD2, GD3, HMW-MAA, IL-22R-α, IL-13R-α2, kdr, легкую цепь κ, Льюиса Y, молекулу адгезии клетки L1, MAGE-A1, мезотелин, MUC1, MUC16, PSCA, лиганды NKG2D, NY-ESO-1, MART-1, gp100, онкофетальный антиген, ROR1, TAG72, VEGF-R2, эмбриональный опухолевый антиген (CEA), специфичный антиген предстательной железы, PSMA, Her2/neu, рецептор эстрогена, рецептор прогестерона, эфрин B2, CD123, CS-1, c-Met, GD-2 и MAGE A3, CE7, опухоль Вильмса 1 (WT-1), циклин, такой как циклин A1 (CCNA1) и/или биотинилированные молекулы и/или молекулы, экспрессируемые и/или характеризующие или специфичные для HIV, HCV, HBV, HPV и/или других патогенов и/или их онкогенные варианты.
[0455] Антигенные рецепторы, в том числе CAR и рекомбинантные TCR, и их получение и введение, в некоторых вариантах осуществления, включают то, что описано, например, в публикациях международных патентных заявок №№ WO 200014257, WO 2013126726, WO 2012/129514, WO 2014031687, WO 2013/166321, WO 2013/071154, WO 2013/123061, публикациях патентных заявок США №№ US 2002131960, US 2013287748, US 20130149337, патентах США №№6451995, 7446190, 8252592,, 8339645, 8398282, 7446179, 6410319, 7070995, 7265209, 7354762, 7446191, 8324353 и 8479118 и европейской патентной заявке № EP 2537416, и/или то, что описано в Sadelain et al., Cancer Discov. 2013 April; 3(4): 388-398; Davila et al. (2013) PLoS one 8(4): e61338; Turtle et al., Curr. Opin. Immunol., 2012 October; 24(5): 633-39; Wu et al., Cancer, 2012 March 18(2): 160-75.
a. Химерные антигенные рецепторы
[0456] В некоторых вариантах осуществления нуклеиновая кислота, содержащаяся в геноме вирусного вектора, кодирует химерный антигенный рецептор (CAR). CAR в целом представляет собой генетически сконструированный рецептор с внеклеточным лиганд-связывающим доменом, таким как внеклеточная часть, содержащая антитело или его фрагмент, который связан с одним или несколькими внутриклеточными сигнальными компонентами. В некоторых вариантах осуществления химерный антигенный рецептор содержит трансмембранный домен и/или внутриклеточный домен, соединяющий внеклеточный домен и внутриклеточный сигнальный домен. Такие молекулы обычно имитируют или аппроксимируют сигнал через природный антигенный рецептор и/или сигнал через такой рецептор в комбинации с костимулирующим рецептором.
[0457] В некоторых вариантах осуществления конструируют CAR со специфичностью к конкретному маркеру, такому как маркер, экспрессируемый клетками конкретного типа, подлежащими направленному воздействию посредством адоптивной терапии, например, маркер злокачественной опухоли и/или любые из описанных антигенов. Таким образом, CAR обычно содержит один или более из антигенсвязывающего фрагмента, домена или части антитела или одного или нескольких вариабельных доменов антител и/или молекул антител. В некоторых вариантах осуществления CAR содержит антигенсвязывающую часть или части молекулы антитела, такую как вариабельная тяжелая цепь (VH) или ее антигенсвязывающая часть, или одноцепочечный фрагмент антитела (scFv), полученный из вариабельной тяжелой (VH) и вариабельной легкой (VL) цепей моноклонального антитела (mAb).
[0458] В некоторых вариантах осуществления внеклеточная часть CAR, такая как его антительная часть, дополнительно содержит спейсер, такой как спейсерная область между компонентом распознавания антигена, например, scFv, и трансмембранным доменом. Спейсер может представлять собой или содержать по меньшей мере часть константной области иммуноглобулина или ее вариант или модифицированный вариант, такой как шарнирная область, например, шарнирная область IgG4, и/или CH1/CL и/или Fc-область. В некоторых вариантах осуществления константная область или часть относится к IgG человека, такому как IgG4 или IgG1. Спейсер может иметь длину, которая обеспечивает увеличенную восприимчивость клетки после связывания антигена, по сравнению с отсутствием спейсера. В некоторых примерах, спейсер равен или составляет приблизительно 12 аминокислот в длину или не больше чем 12 аминокислот в длину. Образцовые спейсеры включают те, которые имеют по меньшей мере приблизительно от 10 до 229 аминокислот, приблизительно от 10 до 200 аминокислот, приблизительно от 10 до 175 аминокислот, приблизительно от 10 до 150 аминокислот, приблизительно от 10 до 125 аминокислот, приблизительно от 10 до 100 аминокислот, приблизительно от 10 до 75 аминокислот, приблизительно от 10 до 50 аминокислот, приблизительно от 10 до 40 аминокислот, приблизительно от 10 до 30 аминокислот, приблизительно от 10 до 20 аминокислот или приблизительно от 10 до 15 аминокислот, и включая любое целое между конечными точками любого из перечисленных диапазонов. В некоторых вариантах осуществления спейсерная область составляет приблизительно 12 аминокислот или меньше, приблизительно 119 аминокислот или меньше или приблизительно 229 аминокислот или меньше. Образцовые спейсеры включают отдельно шарнир IgG4, шарнир IgG4, соединенный с доменами CH2 и CH3, или шарнир IgG4, соединенный с доменом CH3. Образцовые спейсеры включают, но не ограничиваясь этим, те, которые описаны в Hudecek et al. (2013) Clin. Cancer Res., 19:3153 или публикации международной патентной заявки № WO 2014031687.
[0459] Связывание внеклеточного лиганда, такое как домен распознавания антигена, в целом соединено с одним или несколькими внутриклеточными сигнальными компонентами, такими как сигнальные компоненты, которые имитируют активацию через комплекс антигенного рецептора, такой как комплекс TCR, в случае CAR, и/или сигнал через другой рецептор клеточной поверхности. В некоторых вариантах осуществления трансмембранный домен соединяет связывание внеклеточного лиганда и внутриклеточные сигнальные домены. В некоторых вариантах осуществления CAR содержит трансмембранный домен, слитый с внеклеточным доменом. В одном из вариантов осуществления используют трансмембранный домен, который в природе ассоциирован с одним из доменов в рецепторе, например, CAR. В некоторых случаях, трансмембранный домен выбирают или модифицируют посредством замены аминокислоты для того, чтобы избегать связывания таких доменов с трансмембранными доменами тех же или других поверхностных мембранных белков для того, чтобы минимизировать взаимодействия с другими элементами рецепторного комплекса.
[0460] Трансмембранный домен в некоторых вариантах осуществления получают из природного или синтетического источника. Когда источник является природным, домен в некоторых аспектах получают из любого связанного с мембраной или трансмембранного белка. Трансмембранные области включают те, которые получают из (т. е. содержат по меньшей мере трансмембранную область(и) из) α-, β- или ζ-цепи T-клеточного рецептора, CD28, CD3ε, CD45, CD4, CD5, CDS, CD9, CD 16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. Трансмембранный домен в некоторых вариантах осуществления является синтетическим. В некоторых аспектах, синтетический трансмембранный домен содержит преимущественно гидрофобные остатки, такие как лейцин и валин. В некоторых аспектах, триплет из фенилаланина, триптофана и валина находят на каждом конце синтетического трансмембранного домена. В некоторых вариантах осуществления связь опосредована линкерами, спейсерами и/или трансмембранным доменом(ами).
[0461] В некоторых вариантах осуществления короткий олиго- или полипептидный линкер, например, линкер от 2 до 10 аминокислот в длину, например, тот, который содержит глицины и серины, например, дублет глицин-серин, присутствует и образует связь между трансмембранным доменом и цитоплазматическим сигнальным доменом CAR.
[0462] Рецептор, например, CAR, в целом содержит по меньшей мере один внутриклеточный сигнальный компонент или компоненты. В некоторых вариантах осуществления рецептор содержит внутриклеточный компонент комплекса TCR, такой как TCR цепь CD3, которая опосредует активацию T-клеток и цитотоксичность, например, ζ-цепь CD3. Таким образом, в некоторых аспектах, антигенсвязывающая часть связана с одной или несколькими модулями клеточной сигнализации. В некоторых вариантах осуществления модули клеточной сигнализации включают трансмембранный домен CD3, внутриклеточные сигнальные домены CD3 и/или другие трансмембранные домены CD. В некоторых вариантах осуществления рецептор, например, CAR, дополнительно содержит часть одной или нескольких дополнительных молекул, таких как Fc рецептор γ, CD8, CD4, CD25, или CD16. Например, в некоторых аспектах, CAR или другой химерный рецептор содержит химерную молекулу между CD3-дзета (CD3-ζ) или Fc рецептором γ и CD8, CD4, CD25 или CD16.
[0463] В некоторых вариантах осуществления при лигировании CAR или другого химерного рецептора, цитоплазматический домен или внутриклеточный сигнальный домен рецептора активирует по меньшей мере одну из нормальных эффекторных функций или ответов клетки иммунной системы, например, T-клетки, сконструированной для того, чтобы экспрессировать CAR. Например, в некоторых контекстах CAR содержит функцию T-клетки, такую как цитолитическая активность или T-хелперная активность, например, секреция цитокинов или других факторов. В некоторых вариантах осуществления усеченную часть внутриклеточного сигнального домена антигенного рецепторного компонента или костимулирующей молекулы используют вместо интактной иммуностимулирующей цепи, например, если она преобразует сигнал эффекторной функции. В некоторых вариантах осуществления внутриклеточный сигнальный домен или домены содержат цитоплазматические последовательности T-клеточного рецептора (TCR), и в некоторых аспектах также те корецепторы, которые в естественном контексте действуют согласованно с такими рецепторами для того, чтобы инициировать сигнальную трансдукцию после вовлечения антигенного рецептора, и/или любое производное или вариант таких молекул и/или любую синтетическую последовательность, которая имеет ту же функциональную способность.
[0464] В контексте природного TCR, полная активация в целом требует не только передачи сигнала через TCR, но также костимулирующего сигнала. Таким образом, в некоторых вариантах осуществления для содействия полной активации, компонент для генерации вторичного или костимулирующего сигнала также включен в CAR. В других вариантах осуществления CAR не содержит компонент для создания костимулирующего сигнала. В некоторых аспектах, дополнительный CAR экспрессируют в той же клетке, и он предусматривает компонент для генерации вторичного или костимулирующего сигнала.
[0465] Активацию T-клеток в некоторых аспектах описывают как опосредованную цитоплазматическими сигнальными последовательностями двух классов: те, которые инициируют антиген-зависимую первичную активацию через TCR (первичные цитоплазматические сигнальные последовательности), и те, которые действуют антиген-независимым образом для того, чтобы способствовать вторичному или костимулирующему сигналу (вторичные цитоплазматические сигнальные последовательности). В некоторых аспектах, CAR содержит один или оба таких сигнальных компонента.
[0466] В некоторых аспектах, CAR содержит первичную цитоплазматическую сигнальную последовательность, которая регулирует первичную активацию комплекса TCR. Первичные цитоплазматические сигнальные последовательности, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы или ITAM. Примеры ITAM-содержащих первичных цитоплазматических сигнальных последовательностей включают те, которые получают из TCRζ, FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CDS, CD22, CD79a, CD79b и CD66d. В некоторых вариантах осуществления цитоплазматическая сигнальная молекула(ы) в CAR содержит(содержат) цитоплазматический сигнальный домен, его часть или последовательность, полученную из CD3ζ.
[0467] В некоторых вариантах осуществления CAR содержит сигнальный домен и/или трансмембранную часть костимулирующего рецептора, например, CD28, 4-1BB, OX40, CD27, DAP10 и ICOS. В некоторых аспектах, тот же CAR содержит как активирующие, так и костимулирующие компоненты.
[0468] В некоторых вариантах осуществления активирующий домен включен в один CAR, тогда как костимулирующий компонент предусмотрен другим CAR, распознающим другой антиген. В некоторых вариантах осуществления CAR включают активирующие или стимулирующие CAR и костимулирующие CAR, и те и другие экспрессирует одна и та же клетка (см. WO 2014/055668). В некоторых аспектах, CAR представляет собой стимулирующий или activating CAR; в других аспектах, он представляет собой костимулирующий CAR. В некоторых вариантах осуществления клетки дополнительно включают ингибирующие CAR (iCAR, см. Fedorov et al., Sci. Transl. Medicine, 5(215) (декабрь 2013 года), такие как CAR, распознающие другой антиген, в соответствии с чем активирующий сигнал, доставляемый через CAR, распознающий первый антиген, уменьшают или ингибируют посредством связывания ингибирующего CAR со своим лигандом, например, чтобы снижать эффекты вне мишени.
[0469] В определенных вариантах осуществления внутриклеточный сигнальный домен содержит трансмембранный и сигнальный домен CD28, связанный с внутриклеточным доменом CD3. В некоторых вариантах осуществления внутриклеточный сигнальный домен содержит химерные костимулирующие домены CD28 и CD137, связанные с внутриклеточным доменом CD3.
[0470] В некоторых вариантах осуществления CAR также может содержать маркер трансдукции (например, tEGFR). В некоторых вариантах осуществления внутриклеточный сигнальный домен CD8+ цитотоксических T-клеток является таким же, как внутриклеточный сигнальный домен CD4+ хелперных T-клеток. В некоторых вариантах осуществления внутриклеточный сигнальный домен CD8+ цитотоксических T-клеток отличен от внутриклеточного сигнального домена CD4+ хелперных T-клеток.
[0471] В некоторых вариантах осуществления CAR охватывает один или более, например, два или больше, костимулирующих доменов и активирующий домен, например, первичный активирующий домен, в цитоплазматической части. Образцовые CAR включают внутриклеточные компоненты из CD3-ζ, CD28 и 4-1BB.
[0472] В некоторых вариантах осуществления рекомбинантный рецептор(ы), например, CAR, кодируемые нуклеиновой кислотой(ами) в предусмотренных вирусных векторах дополнительно включают один или более маркеров, например, для целей подтверждения трансдукции или конструирования клетки для экспрессии рецептора и/или отбора и/или направленного воздействия на клетки, экспрессирующие молекулу(ы), кодируемые полинуклеотидом. В некоторых аспектах, такой маркер можно кодировать с помощью другой нуклеиновой кислоты или полинуклеотида, которые также можно вводить во время процесса генетической инженерии, обычно тем же способом, таким как трансдукция с помощью того же вектора или вектора того же типа.
[0473] В некоторых аспектах, маркер, например, маркер трансдукции, представляет собой белок и/или молекулу клеточной поверхности. Образцовые маркеры представляют собой усеченные варианты встречающихся в природе, например, эндогенных маркеров, таких как встречающиеся в природе молекулы клеточной поверхности. В некоторых аспектах, варианты имеют уменьшенную иммуногенность, сниженную функцию направленной миграции и/или сниженную сигнальную функцию по сравнению с природной или эндогенной молекулой клеточной поверхности. В некоторых вариантах осуществления маркер представляет собой усеченный вариант рецептора клеточной поверхности, такой как усеченный EGFR (tEGFR). В некоторых аспектах, маркер содержит целиком или частично (например, усеченную форму) CD34, NGFR или рецептор эпидермального фактора роста (например, tEGFR). В некоторых вариантах осуществления нуклеиновая кислота, кодирующая маркер, функционально связана с полинуклеотидом, кодирующим линкерную последовательность, такую как расщепляемая линкерная последовательность, например, T2A. См. WO 2014031687.
[0474] В некоторых вариантах осуществления маркер представляет собой молекулу, например, белок клеточной поверхности, не встречающуюся в природе на T-клетках или не встречающуюся в природе на поверхности T-клеток или их частях.
[0475] В некоторых вариантах осуществления молекула представляет собой не собственную молекулу, например, не собственный белок, т. е. тот, который не распознается в качестве «собственного» иммунной системой организма-хозяина, в который осуществляют адоптивный перенос клеток.
[0476] В некоторых вариантах осуществления маркер не выполняет терапевтическую функцию и/или не вызывает эффекта, отличного от того, который подлежит использованию в качестве маркера для генетической инженерии, например, для отбора успешно сконструированных клеток. В других вариантах осуществления маркер может представлять собой терапевтическую молекулу или молекулу, иным образом проявляющую некоторый желаемый эффект, например, лиганд для клеток, встречающихся in vivo, например, костимулирующая молекула или молекула иммунной контрольной точки, для усиления и/или ослабления ответов клеток при адоптивном переносе и встрече с лигандом.
[0477] В некоторых случаях, CAR обозначают как CAR первого, второго и/или третьего поколения. В некоторых аспектах, CAR первого поколения представляет собой тот, который обеспечивает только индуцированный CD3-цепью сигнал при связывании антигена; в некоторых аспектах, CAR второго поколения представляет собой тот, который обеспечивает такой сигнал и костимулирующий сигнал, такой как тот, который содержит внутриклеточный сигнальный домен из костимулирующего рецептора, такого как CD28 или CD137; в некоторых аспектах, CAR третьего поколения в некоторых аспектах представляет собой тот, который содержит несколько костимулирующих доменов различных костимулирующих рецепторов.
[0478] В некоторых вариантах осуществления химерный антигенный рецептор содержит внеклеточную лиганд-связывающую часть, такую как антигенсвязывающая часть, такую как антитело или его фрагмент, и во внутриклеточный домен. В некоторых вариантах осуществления антитело или фрагмент включает scFv или однодоменное VH антитело и внутриклеточный домен содержит ITAM. В некоторых аспектах внутриклеточный сигнальный домен содержит сигнальный домен ζ-цепи из цепи CD3-ζ (CD3ζ). В некоторых вариантах осуществления химерный антигенный рецептор содержит трансмембранный домен, связывающий внеклеточный домен и внутриклеточный сигнальный домен. Внеклеточный и трансмембранный домен можно соединять непосредственно или опосредованно. В некоторых вариантах осуществления внеклеточный и трансмембранный домен соединяют с помощью спейсера, такого как любой, описанный в настоящем описании. В некоторых вариантах осуществления химерный антигенный рецептор содержит внутриклеточный домен костимулирующей молекулы T-клетки, например, между трансмембранным доменом и внутриклеточным сигнальным доменом. В некоторых аспектах, костимулирующая молекула T-клетки представляет собой CD28 или 41BB.
[0479] В некоторых вариантах осуществления трансмембранный домен рецептора, например, CAR представляет собой трансмембранный домен человека CD28 или его вариант, например, 27-аминокислотный трансмембранный домен CD28 человека (№ доступа P10747.1). В некоторых вариантах осуществления внутриклеточный домен содержит внутриклеточный костимулирующий сигнальный домен CD28 человека или его функциональный вариант, такой как его домен из 41 аминокислоты и/или такой домен с заменой LL на GG в положениях 186-187 нативного белка CD28. В некоторых вариантах осуществления внутриклеточный домен содержит внутриклеточный костимулирующий сигнальный домен 41BB или его функциональный вариант, такой как 42-аминокислотный цитоплазматический домен 4-1BB человека (№ доступа Q07011.1). В некоторых вариантах осуществления внутриклеточный сигнальный домен содержит стимулирующий сигнальный домен CD3ζ человека или его функциональный вариант, такой как 112 а. о. цитоплазматический домен изоформы 3 CD3ζ человека (№ доступа P20963.2) или сигнальный домен CD3ζ, как описано в патенте США №7446190. В некоторых аспектах, спейсер содержит только шарнирную область IgG, например, только шарнир IgG4 или IgG1. В других вариантах осуществления спейсер представляет собой шарнир Ig, например, и шарнир IgG4, связанный с доменами CH2 и/или CH3. В некоторых вариантах осуществления спейсер представляет собой шарнир Ig, например, шарнир IgG4, связанный с доменами CH2 и CH3. В некоторых вариантах осуществления спейсер представляет собой шарнир Ig, например, шарнир IgG4, связанный только с доменом CH3. В некоторых вариантах осуществления спейсер представляет собой или содержит богатую глицином-серином последовательность или другой гибкий линкер, например, известные гибкие линкеры.
[0480] Например, в некоторых вариантах осуществления CAR содержит: внеклеточную лиганд-связывающую часть, такую как антигенсвязывающая часть, такая как антитело или его фрагмент, в том числе sdAb и scFv, которая специфически связывает антиген, например, антиген, описанный в настоящем описании; спейсер, такой как любой из спейсеров, содержащих Ig-шарнир; трансмембранный домен, который представляет собой часть CD28 или ее вариант; внутриклеточный сигнальный домен, содержащий сигнальную часть CD28 или ее функциональный вариант; и сигнальную часть сигнального домена CD3ζ или ее функциональный вариант. В некоторых вариантах осуществления CAR содержит: внеклеточную лиганд-связывающую часть, такую как антигенсвязывающая часть, такая как антитело или его фрагмент, в том числе sdAb и scFv, которая специфически связывает антиген, например, антиген, описанный в настоящем описании; спейсер, такой как любой из спейсеров, содержащих Ig-шарнир; трансмембранный домен, который представляет собой часть CD28 или ее вариант; внутриклеточный сигнальный домен, содержащий сигнальную часть 4-1BB или ее функциональный вариант; и сигнальную часть сигнального домена CD3ζ или ее функциональный вариант. В некоторых вариантах осуществления такие конструкции CAR дополнительно содержат элемент рибосомного перепрыгивания T2A и/или последовательность tEGFR, например, ниже CAR.
b. T-клеточные рецепторы (TCR)
[0481] В некоторых вариантах осуществления рекомбинантная молекула(ы), кодируемая нуклеиновой кислотой(ами), представляет собой или содержит рекомбинантный T-клеточный рецептор (TCR). В некоторых вариантах осуществления рекомбинантный TCR обладает специфичностью к антигену, обычно к антигену, присутствующему на клетке-мишени, такому как опухолеспецифичный антиген, антиген, экспрессируемый на клетках конкретного типа, ассоциированных с аутоиммунным или воспалительным заболеванием, или антиген, полученный из вирусного патогена или бактериального патогена.
[0482] В некоторых вариантах осуществления TCR представляет собой тот, который колировали из встречающихся в природе T-клеток. В некоторых вариантах осуществления высокоаффинный T-клеточный клон для антигена-мишени (например, антигена злокачественной опухоли) идентифицируют и выделяют у пациента. В некоторых вариантах осуществления TCR клон для антигена-мишени создают в трансгенных мышах, сконструированных с использованием генов иммунной системы человека (например, системы лейкоцитарных антигенов человека или HLA). См., например, опухолевые антигены (см., например, Parkhurst et al. (2009) Clin Cancer Res. 15:169-180 и Cohen et al. (2005) J Immunol. 175:5799-5808. В некоторых вариантах осуществления фаговый дисплей используют для выделения TCR против антигена-мишени (см., например, Varela-Rohena et al. (2008) Nat Med. 14:1390-1395 и Li (2005) Nat Biotechnol. 23:349-354.
[0483] В некоторых вариантах осуществления после T-клеточного клона, α и β цепи TCR выделяют и клонируют в вектор экспрессии гена. В некоторых вариантах осуществления α и β гены TCR соединяют через пептид рибосомного перепрыгивания 2A пикорнавирусов с тем, чтобы совместно экспрессировать обе цепи. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая TCR, дополнительно включает маркер для того, чтобы подтверждать трансдукцию или конструирование клетки для экспрессии рецептора.
2. Другие регуляторные элементы
[0484] В некоторых вариантах осуществления последовательность нуклеиновой кислоты, содержащаяся в вирусном векторном геноме, кодирующая рекомбинантный рецептор, такой как антигенный рецептор, например, CAR, функционально связана в функциональных взаимоотношениях с другими генетическими элементами, например, транскрипционными регуляторными последовательностями, включая промоторы или энхансеры, чтобы регулировать экспрессию последовательности, представляющей интерес, конкретным образом. В определенных случаях такие транскрипционные регуляторные последовательности представляют собой те, которые находятся под временной и/или пространственной регуляцией в отношении активности. Экспрессионные управляющие элементы, которые можно использовать для регуляции экспрессии компонентов, известны и включают, но не ограничиваясь этим, индуцибельные промоторы, конститутивные промоторы, сигналы секреции, энхансеры и другие регуляторные элементы.
[0485] В некоторых вариантах осуществления последовательность нуклеиновой кислоты, кодирующая рекомбинантный рецептор, такой как антигенный рецептор, например, CAR, функционально связана с внутренними промоторными/энхансерными регуляторными последовательностями. Используемые промоторы могут быть конститутивными, тканеспецифическими, индуцибельными и/или эффективными при подходящих условиях для того, чтобы управлять высокоуровневой экспрессией введенного сегмента ДНК. Промотор может быть гетерологичным или эндогенным. В некоторых вариантах осуществления промотор и/или энхансер получают синтетически. В некоторых вариантах осуществления промотор и/или энхансер получают с использованием рекомбинантного клонирования и/или технологии амплификации нуклеиновых кислот.
[0486] В некоторых вариантах осуществления промотор и/или энхансер может представлять собой тот, который в природе ассоциирован с последовательностью нуклеиновой кислоты, как можно получать посредством выделения 5' не кодирующих последовательностей, расположенных выше кодирующего сегмента и/или экзона. Альтернативно, в некоторых вариантах осуществления кодирующий сегмент нуклеиновой кислоты может быть расположен под управлением рекомбинантного и/или гетерологичного промотора и/или энхансера, который обычно не ассоциирован с кодирующей последовательностью нуклеиновой кислоты в природном окружении. Например, образцовые промоторы, используемые в рекомбинантной ДНК конструкции, включают, но не ограничиваясь этим, промоторы β-лактамазы (пенициллиназы), лактозы, триптофана (trp), РНК полимеразы (pol) III, в том числе промоторы U6 pol III человека и мыши, а также промоторы H1 РНК полимеразы III человека и мыши; промоторы РНК полимеразы (pol) II; предранний промотор цитомегаловируса (pCMV), промоторные системы фактора элонгации-1α (EF-1α) и промоторов длинных концевых повторов вируса саркомы Рауса (pRSV). В некоторых вариантах осуществления промотор можно получать, например, из геномов вирусов, таких как вирус полиомы, вирус куриной оспы, аденовирус, бычий вирус папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита B и вирус обезьян 40 (SV40). Промотор также может представлять собой, например, гетерологичный промотор млекопитающих, например, промотор актина или промотор иммуноглобулина, промотор теплового шока или промотор, обычно ассоциированный с нативной последовательностью, при условии, что такие промоторы совместимы с клеткой-мишенью. В одном из вариантов осуществления промотор представляет собой встречающийся в природе вирусный промотор в вирусной экспрессирующей системе.
[0487] В некоторых вариантах осуществления промотор может быть конститутивно активным. Неограничивающие примеры конститутивных промоторов, которые можно использовать, включают промотор для убиквитина (патент США №5510474; WO 98/32869), CMV (Thomsen et al., PNAS 81:659, 1984; патент США №5168062), β-актина (Gunning et al. 1989 Proc. Natl. Acad. Sci. USA 84:4831-4835) и pgk (см., например, Adra et al. 1987 Gene 60:65-74; Singer-Sam et al. 1984 Gene 32:409-417; и Dobson et al. 1982 Nucleic Acids Res. 10:2635-2637).
[0488] В некоторых вариантах осуществления промотор может представлять собой тканеспецифический промотор и/или специфический промотор клеток-мишеней. В некоторых вариантах осуществления промоторы можно выбирать для того, чтобы сделать возможной индуцируемую экспрессию последовательности, представляющей интерес. Известно множество систем индуцируемой экспрессии, в том числе, тетрациклин-чувствительная система, система оператора-репрессора lac, а также промоторы, чувствительные к различным изменениям окружения или физиологии, в том числе тепловой шок, ионы металла, например, промотор металлотионеина, интерферонов, гипокси, промотор стероидных, например, прогестероновых или глюкокортикоидных рецепторов, промотор облучения, например, VEGF. В некоторых вариантах осуществления регулируемую тетрациклином (tet) систему, которая основана на ингибирующем действии tet-репрессии (tetr) Escherichia coli, оказываемом на последовательность оператора tet (TECO), можно модифицировать для использования в системах млекопитающих и использовать в качестве регулируемого элемента для экспрессирующих кассет. Эти системы хорошо известны. (См., Goshen and Badgered, Proc. Natl. Acad. Sci. USA 89: 5547-51 (1992), Shockett et al., Proc. Natl. Acad. Sci. USA 92:6522-26 (1996), Lindemann et al., Mol. Med. 3:466-76 (1997)).
[0489] Комбинацию промоторов также можно использовать для достижения желаемой экспрессии гена, представляющего интерес. Средний специалист сможет выбирать промотор на основании желаемого профиля экспрессии гена в организме или клетке-мишени, представляющей интерес.
[0490] В некоторых вариантах осуществления энхансер также может присутствовать в вирусной конструкции для увеличения экспрессии гена, представляющего интерес. Энхансеры обычно представляют собой цис-действующие элементы нуклеиновых кислот, обычно приблизительно от 10 до 300 в длину, которые действуют на промотор для увеличения его транскрипции. Известны многие энхансеры в вирусных геномах, например, HIV или CMV. Например, можно использовать энхансер CMV (Boshart et al. Cell, 41:521, 1985). Другие примеры включают, например, энхансер SV40 на поздней стороне сайта начала репликации (п.о. 100-270), энхансер раннего промотора цитомегаловирус, энхансер полиомы на поздней стороне сайта начала репликации и энхансеры аденовирусов. В некоторых случаях, энхансер происходит из гена млекопитающего, например, энхансер из глобина, эластазы, альбумина, α-фетопротеина или инсулина). Энхансер можно использовать в комбинации с гетерологичным промотором. Энхансер можно сплайсировать в вектор в положении 5' или 3' относительно полинуклеотидной последовательности, кодирующей ген, представляющий интерес, но в целом его располагают в сайте 5′ от промотора. Специалист в данной области сможет выбирать подходящий энхансер на основании желаемого профиля экспрессии.
[0491] Вирусный векторный геном также может содержать дополнительные генетические элементы. Типы элементов, которые можно включать в конструкции, не ограничены каким-либо образом, и их может выбирать специалист в данной области.
[0492] Например, может содержаться сигнал, который содействует проникновению вирусного генома в ядро клетки-мишени. Примером такого сигнала является флэп-сигнал HIV-1. Кроме того, векторный геном может содержать один или более генетических элементов, разработанных для усиления экспрессии гена, представляющего интерес. В некоторых вариантах осуществления геном содержит посттранскрипционный регуляторный элемент (PRE) или его модифицированную форму, которые демонстрируют посттранскрипционную активность. Например, в некоторых вариантах осуществления в конструкцию можно помещать посттранскрипционный чувствительный элемент (WPRE) вируса гепатита сурков (Zufferey et al. 1999. J. Virol. 74:3668-3681; Deglon et al. 2000. Hum. Gene Ther. 11:179-190).
[0493] В некоторых случаях, можно включать больше чем одну открытую рамку считывания, кодирующую отдельные гетерологичные белки. Например, в некоторых вариантах осуществления, если в экспрессионную конструкцию включают репортер и/или поддающийся обнаружению и/или селективный ген, можно включать последовательность внутреннего участка посадки рибосомы (IRES). Обычно, дополнительные генетические элементы функционально связывают с независимым промотором/энхансером, и они находятся под его управлением. Дополнительный генетический элемент может представлять собой репортерный ген, селективный маркер или другой желаемый ген.
[0494] В некоторых вариантах осуществления различные другие регуляторные элементы могут включать область инициации транскрипции и/или область терминации. Экспрессирующие векторы также могут содержать последовательности для терминации транскрипции и для стабилизации мРНК. Такие последовательности известны и часто встречаются в природе в 5', и иногда 3', нетранслируемых областях эукариотической или вирусной ДНК или кДНК. Примеры области терминации транскрипции включают, но не ограничиваясь этим, полиаденилированные сигнальные последовательности. Примеры полиаденилированных сигнальных последовательностей включают, но не ограничиваясь этим, последовательности поли(A) бычьего гормона роста (BGH), позднего поли(A) SV40, поли(A) β-глобина кролика (RBG), поли(A) тимидинкиназы (TK) и любые их варианты.
C. Получение вирусных векторных частиц
[0495] Вирусный векторный геном обычно конструируют в форме плазмиды, которую можно трансфицировать в пакующую или продуцирующую клеточную линию. Любые из различных известных способов можно использовать для получения ретровирусных частиц, геном которых содержит РНК копию вирусного векторного генома. В некоторых вариантах осуществления по меньшей мере два компонента участвуют в создании системы доставки генов на вирусной основе: первый, пакующие плазмиды, охватывающие структурные белки, а также ферменты, необходимые для того, чтобы создавать вирусную векторную частицу, и второй, сам вирусный вектор, т. е. генетический материал, подлежащий переносу. Средства обеспечения биологической безопасности можно вносить в схему одного или обоих из этих компонентов.
[0496] В некоторых вариантах осуществления пакующая плазмида может содержать все ретровирусные, например, HIV-1, белки, отличные от оболочечных белков (Naldini et al., 1998). В других вариантах осуществления вирусные векторы могут не содержать дополнительные вирусные гены, такие как те, которые ассоциированы с вирулентностью, например, vpr, vif, vpu и nef, и/или Tat, основной трансактиватор HIV. В некоторых вариантах осуществления лентивирусные векторы, такие как лентивирусные векторы, основанные на HIV, содержат только три гена исходного вируса: gag, pol и rev, которые снижают или устраняют возможность восстановления вируса дикого типа через рекомбинацию.
[0497] В некоторых вариантах осуществления вирусный векторный геном вводят в пакующую клеточную линию, которая содержит все компоненты, необходимые для упаковки вирусной геномной РНК, транскрибированной с вирусного векторного генома, в вирусные частицы. Альтернативно, вирусный векторный геном может содержать один или более генов, кодирующих вирусные компоненты, в дополнение к одной или нескольким последовательностям, например, рекомбинантные нуклеиновые кислоты, представляющие интерес. Однако в некоторых аспектах, для предотвращения репликации генома в клетке-мишени, эндогенные вирусные гены, необходимые для репликации удаляют и предоставляют отдельно в пакующей клеточной линии.
[0498] В некоторых вариантах осуществления пакующую клеточную линию трансфицируют одним или несколькими плазмидными векторами, содержащими компоненты, необходимые для того, чтобы создавать частицы. В некоторых вариантах осуществления пакующую клеточную линию трансфицируют плазмидой, содержащей вирусный векторный геном, в том числе LTR, цис-действующую упаковочную последовательность и последовательность, представляющую интерес, т. е. нуклеиновую кислоту, кодирующую антигенный рецептор, такой как CAR; и одну или более плазмид-помощников, кодирующих ферментативные и/или структурные компоненты вируса, такие как Gag, pol и/или rev. В некоторых вариантах осуществления несколько векторов используют для разделения различных генетических компонентов, которые создают ретровирусные векторные частицы. В некоторых таких вариантах осуществления, предоставление отдельных векторов в упаковывающей клетке снижает шанс событий рекомбинации, которые иначе могут создавать вирусы, способные к репликации. В некоторых вариантах осуществления можно использовать один плазмидный вектор, имеющий все ретровирусные компоненты.
[0499] В некоторых вариантах осуществления ретровирусная векторная частица, такая как лентивирусная векторная частица, является псевдотипированной для увеличения эффективности трансдукции клеток-хозяев. Например, ретровирусная векторная частица, такая как лентивирусная векторная частица, в некоторых вариантах осуществления является псевдотипированной с использованием гликопротеина VSV-G, который предусматривает широкий спектр клеток-хозяев, охватывающий типы клеток, которые могут быть трансдуцированы. В некоторых вариантах осуществления пакующую клеточную линию трансфицируют плазмидой или полинуклеотидом, кодирующими не нативный гликопротеин оболочки, например, чтобы включать ксенотропные, политропные или амфотропные оболочки, такие как оболочка вируса Синдбис, GALV или VSV-G.
[0500] В некоторых вариантах осуществления пакующая клеточная линия предусматривает компоненты, в том числе вирусные регуляторные и структурные белки, которые необходимы в транс для упаковки вирусной геномной РНК в лентивирусные векторные частицы. В некоторых вариантах осуществления пакующая клеточная линия может представлять собой любую клеточную линию, которая способна экспрессировать лентивирусные белки и продуцировать функциональные лентивирусные векторные частицы. В некоторых аспектах, подходящие пакующие клеточные линии включают клетки 293 (ATCC CCL X), 293T, HeLA (ATCC CCL 2), D17 (ATCC CCL 183), MDCK (ATCC CCL 34), BHK (ATCC CCL-10) и Cf2Th (ATCC CRL 1430).
[0501] В некоторых вариантах осуществления пакующая клеточная линия стабильно экспрессирует вирусный белок(белки). Например, в некоторых аспектах, можно сконструировать пакующую клеточную линию, содержащую gag, pol, rev и/или другие структурные гены, но без LTR и упаковочных компонентов. В некоторых вариантах осуществления пакующую клеточную линию можно временно трансфицировать молекулами нуклеиновой кислоты, кодирующими один или более вирусных белков, наряду с вирусным векторным геномом, содержащим молекулу нуклеиновой кислоты, кодирующую гетерологичный белок, и/или нуклеиновую кислоту, кодирующую гликопротеин оболочки.
[0502] В некоторых вариантах осуществления вирусные векторы и упаковочные и/или плазмиды-помощники вводят через трансфекцию или инфекцию в пакующую клеточную линию. Пакующая клеточная линия продуцирует вирусные векторные частицы, которые содержат вирусный векторный геном. Способы трансфекции или инфекции хорошо известны. Неограничивающие примеры включают способы с фосфатом кальция, DEAE-декстран и липофекцию, электропорацию и микроинъекцию.
[0503] Когда рекомбинантную плазмиду и ретровирусный LTR и упаковочные последовательности вводят в конкретную клеточную линию (например, с помощью преципитации с фосфатом кальция), упаковочные последовательности могут допускать упаковку РНК транскрипта рекомбинантной плазмиды в вирусные частицы, которые затем могут быть секретированы в среды для культивирования. Среды, содержащие рекомбинантные ретровирусы, в некоторых вариантах осуществления после этого собирают, необязательно концентрируют и используют для переноса генов. Например, в некоторых аспектах, после совместной трансфекции пакующих плазмид и вектора переноса в пакующую клеточную линию, вирусные векторные частицы извлекают из сред для культивирования и титруют стандартными способами, используемыми специалистами в данной области.
[0504] В некоторых вариантах осуществления ретровирусный вектор, такой как лентивирусный вектор, можно получать в пакующей клеточной линии, такой как образцовая клеточная линия HEK 293T, посредством введения плазмид, чтобы сделать возможным создание лентивирусных частиц. В некоторых вариантах осуществления упаковывающую клетку трансфицируют и/или она содержит полинуклеотид, кодирующий gag и pol, и полинуклеотид, кодирующий рекомбинантный рецептор, такой как антигенный рецептор, например, CAR. В некоторых вариантах осуществления пакующая клеточная линия необязательно представляет собой и/или ее дополнительно трансфицируют с использованием и/или она содержит полинуклеотид, кодирующий белок rev. В некоторых вариантах осуществления пакующую клеточную линию необязательно и/или дополнительно трансфицируют с использованием и/или она содержит полинуклеотид, кодирующий не нативный гликопротеин оболочки, такой как VSV-G. В некоторых таких вариантах осуществления, приблизительно через двое суток после трансфекции клеток, например, клеток HEK 293T, клеточный супернатант содержит рекомбинантные лентивирусные векторы, которые можно извлекать и титровать.
[0505] Извлеченные и/или полученные ретровирусные векторные частицы можно использовать для того, чтобы трансдуцировать клетки-мишени с использованием способов, как описано. Находясь в клетках-мишенях, вирусная РНК подвергается обратной транскрипции, импорту в ядро и стабильному встраиванию в геном организма-хозяина. Через одни или двое суток после встраивания вирусной РНК, можно обнаруживать экспрессию рекомбинантного белка, например, антигенного рецептора, такого как CAR.
V. КОМПОЗИЦИИ, СОСТАВЫ И СПОСОБЫ ВВЕДЕНИЯ
[0506] Также предусмотрены композиции, содержащие сконструированный рецептор (например, сконструированный антигенный рецептор), такой как CAR или TCR, и композиции, содержащие сконструированные клетки, в том числе фармацевтические композиции и составы. Также предусмотрены способы использования и использование композиций, например, при лечении заболеваний, состояний и нарушений, при которых экспрессирован антиген, или в способах обнаружения, диагностических и прогностических способах.
A. Композиции/составы
[0507] Термин «фармацевтический состав» относится к препарату, который имеет такую форму, которая дает возможность биологической активности активного ингредиента, содержащегося в ней, быть эффективной и которая не содержит дополнительные компоненты, которые неприемлемо токсичны для субъекта, которому вводят состав.
[0508] «Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтическом составе, отличному от активного ингредиента, который является не токсичным для субъекта. Фармацевтически приемлемый носитель включает, но не ограничиваясь этим, буфер, эксципиент, стабилизатор или консервант.
[0509] В некоторых аспектах, выбор носителя отчасти зависит от конкретной клетки и/или способа введения. Соответственно, существуют различные подходящие составы. Например, фармацевтическая композиция может содержать консерванты. Подходящие консерванты могут включать, например, метилпарабен, пропилпарабен, бензоат натрия и хлорид бензалкония. В некоторых аспектах, используют смесь двух или больше консервантов. Консерванты или их смеси обычно присутствуют в количестве приблизительно от 0,0001% приблизительно до 2% по массе общей композиции. Носители описаны, например, в Remington's Pharmaceutical Sciences, 16-е изд., ред. Osol, A. (1980). Фармацевтически приемлемые носители в целом не токсичны для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваясь этим: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензилхлорид аммония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (меньше приблизительно 10 остаток) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексные соединения с металлами (например, Zn-белковые комплексы); и/или неионные поверхностно-активные средства, такие как полиэтиленгликоль (PEG).
[0510] Буферные средства в некоторых аспектах включены в композиции. Подходящие буферные средства включают, например, лимонную кислоту, цитрат натрия, фосфорную кислоту, фосфат калия и различные другие кислоты и соли. В некоторых аспектах, используют смесь двух или больше буферных средств. Буферное средство или их смеси обычно присутствуют в количестве приблизительно от 0,001% приблизительно до 4% по массе общей композиции. Известны способы получения вводимых фармацевтических композиций. Образцовые способы описаны более подробно, например, в Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins; 21-е изд. (May 1, 2005).
[0511] Состав или композиция также может содержать больше одного активного ингредиента, которые можно использовать для конкретного показания, заболевания или состояния, подлежащего лечению с использованием клеток, предпочтительно тех, которые имеют активности, комплементарные клетке, где соответствующие активности не оказывают нежелательного влияния друг на друга. Такие активные ингредиенты подходящим образом присутствуют в комбинации в количествах, которые эффективны для предполагаемой цели. Таким образом, в некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит другие фармацевтически активные средства или лекарственные средства, такие как химиотерапевтические средства, например, аспарагиназу, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевину, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.д. В некоторых вариантах осуществления клетки или антитела вводят в форме соли, например, фармацевтически приемлемой соли. Подходящие фармацевтически приемлемые кислотно-аддитивные соли включают те, которые получают из неорганических кислот, таких как соляная, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислоты, и органических кислот, таких как винная, уксусная, лимонная, яблочная, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная и арилсульфоновая кислоты, например, п-толуолсульфоновая кислота.
[0512] Активные ингредиенты можно заключить в микрокапсулы, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. В определенных вариантах осуществления фармацевтическую композицию формулируют в виде комплекса включения, такого как циклодекстриновый комплекс включения, или в виде липосомы. Липосомы могут служить для направленного воздействия на клетки-хозяева (например, T-клетки или NK клетки) в конкретной ткани. Доступны многие способы получения липосом, такие как те, которые описаны, например, в Szoka et al., Ann. Rev. Biophys. Bioeng., 9: 467 (1980), и патентах США 4235871, 4501728, 4837028 и 5019369.
[0513] В фармацевтической композиции в некоторых аспектах можно использовать системы доставки с медленным высвобождением, отсроченным высвобождением и замедленным высвобождением так, что доставка композиции происходит до и в течение достаточного времени для того, чтобы вызывать сенсибилизацию места, подлежащего лечению. Доступны и известны системы доставки с высвобождением многих типов. Такие системы позволяют избегать повторного введения композиции, тем самым увеличивая удобство для субъекта и врача.
[0514] Фармацевтическая композиция в некоторых вариантах осуществления содержит клетки в количествах эффективных для лечения или предотвращения заболевания или состояния, таких как терапевтически эффективное или профилактически эффективное количество. Терапевтический или профилактический эффект в некоторых вариантах осуществления мониторинг осуществляют посредством периодической оценки субъектов, которых лечат. Для повторных введений в течение нескольких суток или долее, в зависимости от состояния, лечение повторяют до желаемой супрессии возникающих симптомов заболевания. Однако, можно использовать и можно определять другие схемы дозирования. Желаемую дозу можно доставлять с помощью введения одного болюса композиции, посредством введения нескольких болюсов композиции или посредством непрерывного инфузионного введения композиции.
[0515] Клетки можно вводить с использованием стандартных способов введения, составов и/или устройств. Предусмотрены составы и устройства, такие как шприцы и флаконы, для хранения и введения композиций. Введение клеток может быть аутологическим или гетерологичным. Например, иммунореактивные клетки или предшественники можно получать у одного субъекта и вводить тому же субъекту или другому, совместимому субъекту. Иммунореактивные клетки, полученные из периферической крови, или их потомство (например, полученные in vivo, ex vivo или in vitro) можно вводить через локализованную инъекцию, в том числе катетерное введение, системную инъекцию, локализованную инъекцию, внутривенную инъекцию или парентеральное введение. При введении, терапевтическую композицию (например, фармацевтическую композицию, содержащую генетически модифицированную иммунореактивную клетку), в целом формулируют в инъецируемой форме стандартной дозы (раствор, суспензия, эмульсия).
[0516] Составы включают те, которые для орального, внутривенного, интраперитонеального, подкожного, легочного, трансдермального, внутримышечного, интраназального, буккального, сублингвального или суппозиторного введения. В некоторых вариантах осуществления популяции клеток вводят парентерально. Термин «парентеральное», как используют в настоящем описании, включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное и интраперитонеальное введение. В некоторых вариантах осуществления популяции клеток вводят субъекту с использованием периферической системной доставки посредством внутривенной, интраперитонеальной или подкожной инъекции.
[0517] Композиции в некоторых вариантах осуществления предоставляют в виде стерильных жидких препаратов, например, изотонических водных растворов, суспензий, эмульсий, дисперсий, или вязких композиций, которые в некоторых аспектах могут быть буферными с выбранным pH. Жидкие препараты обычно получать легче, чем гели, другие вязкие композиции и твердые композиции. Кроме того, жидкие композиции несколько удобнее вводить, в частности, посредством инъекции. Вязкие композиции, с другой стороны, можно формулировать в подходящем диапазоне вязкости, чтобы обеспечивать более длинные периоды контакта с конкретными тканями. Жидкие или вязкие композиции могут содержать носители, которые могут представлять собой растворители или диспергирующие среды, содержащие, например, воду, физиологический раствор, фосфатно-солевой буфер, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и их подходящие смеси.
[0518] Стерильные инъецируемые растворы можно получать посредством внедрения клеток в растворитель, такой как смесь с подходящим носителем, разбавителем или эксципиентом, таким как стерильная вода, физиологический раствор, глюкоза, декстроза или тому подобное. Композиции также могут быть лиофилизированными. Композиции могут содержать вспомогательные вещества, такие как увлажняющие, диспергирующие или эмульгирующие средства (например, метилцеллюлоза), pH буферные средства, гелеобразующие или увеличивающие вязкость добавки, консерванты, ароматизаторы, красители и т.п., в зависимости от пути введения и желаемого препарата. В некоторых аспектах можно обращаться к текстам стандартов для того, чтобы получать подходящие препараты.
[0519] Можно добавлять различные добавки, которые увеличивают стабильность и стерильность композиций, в том числе антимикробные консерванты, антиоксиданты, хелатирующие средства и буферы. Предотвращение действия микроорганизмов можно обеспечивать с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты и т.п. Пролонгированную абсорбцию инъецируемой фармацевтической формы можно осуществлять с помощью средств, задерживающих абсорбцию, например, моностеарата алюминия и желатина.
[0520] Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, эти матрицы имеют форму профилированных изделий, например, пленок или микрокапсул.
[0521] Составы, подлежащие использованию для введения in vivo, обычно стерильны. Стерильность легко можно обеспечивать, например, посредством фильтрования через стерилизующие фильтровальные мембраны.
B. Способы введения
[0522] Предоставлены способы введения клеток, популяции и композиции, а также использования таких клеток, популяций и композиций для лечения или предотвращения заболеваний, состояний и нарушений, в том числе злокачественных опухолей. В некоторых вариантах осуществления клетки, популяции и композиции вводят субъекту или пациенту, имеющему конкретное заболевание или состояние, подлежащее лечению, например, через адоптивную клеточную терапию, такую как адоптивная T-клеточная терапия. В некоторых вариантах осуществления клетки и композиции, получаемые с помощью предоставленных способов, такие как сконструированные композиции и послепроизводственные композиции после инкубации и/или других стадий обработки, вводят субъекту, такому как субъект, имеющий заболевание или состояние или его риск. В некоторых аспектах, способами, тем самым лечат, например, улучшают заболевание или состояние, например, один или более симптомов, посредством уменьшения опухолевой нагрузки в злокачественной опухоли, экспрессирующей антиген, распознаваемый сконструированной T-клеткой.
[0523] Известны способы введения клеток для адоптивной клеточной терапии, которые можно использовать в связи с предоставленными способами и композициями. Например, описаны способы адоптивной T-клеточной терапии, например, в публикации патентной заявки США №2003/0170238 на Gruenberg et al; патенте США №4690915 на Rosenberg; Rosenberg (2011) Nat Rev Clin Oncol. 8(10):577-85). См., например, Themeli et al. (2013) Nat Biotechnol. 31(10): 928-933; Tsukahara et al. (2013) Biochem Biophys Res Commun 438(1): 84-9; Davila et al. (2013) PLoS one 8(4): e61338.
[0524] Как используют в настоящем описании, «субъект» представляет собой млекопитающее, такое как человек или другое животное, и обычно представляет собой человека. В некоторых вариантах осуществления субъект, например, пациент, которому вводят клетки, популяции клеток или композиции, представляет собой млекопитающее, обычно примата, такого как человек. В некоторых вариантах осуществления приматом является мартышка или человекообразная обезьяна. Субъектом может быть самец или самка любого подходящего возраста, в том числе детеныши, молодые, подростковые, взрослые и старческие субъекты. В некоторых вариантах осуществления субъектом является млекопитающее, не относящееся к приматам, такое как грызун.
[0525] Как используют в настоящем описании, «лечение» (и его грамматические вариации, такие как «лечить» или «лечащий») относится к полному или частичному уменьшению интенсивности или уменьшению заболевания или состояния или нарушения, или симптома, нежелательного эффекта или исхода, или фенотипа, ассоциированного с ними. Желательные эффекты лечения включают, но не ограничиваясь этим, предотвращение возникновения или повторного возникновения заболевания, облегчение симптомов, уменьшение любых прямых или опосредованных патологических последствий заболевания, предотвращение метастазов, снижение скорости прогрессирования заболевания, уменьшение интенсивности или облегчение состояния заболевания, и ремиссию или улучшенный прогноз. Термины не подразумевают полное излечение заболевания или полное устранение любого симптома или эффекта(ов) при всех симптомах или исходах.
[0526] Как используют в настоящем описании, «замедление развития заболевания» обозначает откладывание, препятствование, замедление, задержку, стабилизацию, супрессию и/или отсрочивание развития заболевания (такого как злокачественная опухоль). Эта задержка может иметь переменную длительность по времени, в зависимости от анамнеза заболевания и/или индивидуума, подлежащих лечению. Специалисту в данной области очевидно, что достаточная или значимая задержка, по эффекту, может включать предотвращение у того индивидуума, у которого не развивается заболевание. Например, можно отсрочивать позднюю стадию злокачественной опухоли, например, развитие метастазов.
[0527] «Предотвращение», как используют в настоящем описании, включает обеспечение профилактики в отношении возникновения или повторного возникновения заболевания у субъекта, который может быть предрасположен к заболеванию, но у которого пока не диагностировано заболевание. В некоторых вариантах осуществления предоставленные клетки и композиции используют для задержки развития заболевания или для замедления прогрессирования заболевания.
[0528] Как используют в настоящем описании, «супрессируют» функцию или активность представляет снижение функции или активности по сравнению условиями, в остальном схожими, за исключением условия или параметра, представляющего интерес, или альтернативно, по сравнению с другим состоянием. Например, клетки, которые супрессируют опухолевый рост, снижают скорость роста опухоли по сравнению со скоростью роста опухоли в отсутствие клеток.
[0529] «Эффективное количество» средства, например, фармацевтического состава, клеток или композиции в контексте введения относится к количеству, эффективному, в дозах/количествах и в течение необходимых периодов времени, для достижения желаемого результата, такого как терапевтический или профилактический результат.
[0530] «Терапевтически эффективное количество» средства, например, фармацевтического состава или клеток, относится к количеству, эффективному, в дозах и в течение необходимых периодов времени, для достижения желаемого терапевтического результата, например, для лечения заболевания, состояния или нарушения, и/или фармакокинетического или фармакодинамического эффекта лечения. Терапевтически эффективное количество может варьировать в соответствии с такими факторами, как состояние заболевания, возраст, пол и масса субъекта, и вводимых популяций клеток. В некоторых вариантах осуществления предоставленные способы включают введение клеток и/или композиций в эффективных количествах, например, терапевтически эффективных количествах.
[0531] «Профилактически эффективное количество» относится к количеству, эффективному, в дозах и в течение необходимых периодов времени, для достижения желаемого профилактического результата. Обычно, но не обязательно, поскольку профилактическую дозу используют у субъектов до заболевания или на его ранней стадии, профилактически эффективное количество будет меньше терапевтически эффективного количества.
[0532] Заболевание или состояние, которое лечат, может представлять собой любое, при котором экспрессия антигена ассоциирована с и/или вовлечена в этиологию заболевания, состояния или нарушения, например, вызывает, усиливает или иным образом участвует в таком заболевании, состоянии или нарушении. Образцовые заболевания и состояния могут включать заболевания или состояния, ассоциированные со злокачественным новообразованием или трансформацией клеток (например, злокачественной опухоли), аутоиммунным или воспалительным заболеванием или инфекционным заболеванием, например, обусловленные бактериальным, вирусным или другим патогеном. Образцовые антигены, которые включают антигены, ассоциированные с различными заболеваниями и состояниями, которые можно лечить, описаны выше. В конкретных вариантах осуществления химерный антигенный рецептор или трансгенный TCR специфически связывается с антигеном, ассоциированным с заболеванием или состоянием.
[0533] Таким образом, предоставленные способы и использования включают способы и использования для адоптивной клеточной терапии. В некоторых вариантах осуществления способы включают введение клеток или композиций, содержащих клетки, субъекту, в ткань или клетку, например, ту, которая имеет или имеет риск, или которую подозревают в наличии заболевания, состояния или нарушения. В некоторых вариантах осуществления клетки, популяции и композиции вводят субъекту, имеющему конкретное заболевание или состояние, подлежащее лечению, например, через адоптивную клеточную терапию, такую как адоптивная T-клеточная терапия. В некоторых вариантах осуществления клетки или композиции вводят субъекту, такому как субъект, у которого присутствует или который имеет риск заболевания или состояния, улучшать один или более симптомов заболевания или состояния.
[0534] В некоторых вариантах осуществления клеточную терапию, например, адоптивную T-клеточную терапию, осуществляют посредством аутологического переноса, при котором клетки выделяют и/или иным образом получают у субъекта, который будет принимать клеточную терапию, или из образца, извлеченного у такого субъекта. Таким образом, в некоторых аспектах, клетки получают у субъекта, например, пациента, нуждающегося в лечении, и клетки, после выделения и обработки вводят тому же субъекту.
[0535] В некоторых вариантах осуществления клеточную терапию, например, адоптивную T-клеточную терапию, осуществляют посредством аллогенного переноса, при котором клетки выделяют и/или иным образом получают у субъекта, отличного от субъекта, который будет принимать или который в конечном итоге принимает клеточную терапию, например, первого субъекта. В таких вариантах осуществления, клетки затем вводят другому субъекту, например, второму субъекту, того же биологического вида. В некоторых вариантах осуществления первый и второй субъекты генетически идентичны. В некоторых вариантах осуществления первый и второй субъекты генетически схожи. В некоторых вариантах осуществления второй субъект экспрессирует HLA того же класса или супертипа, что и первый субъект. Клетки можно вводить с помощью любых подходящих средств. Дозирование и введение может зависеть отчасти от того, является ли введение коротким или хроническим. Различные режимы дозирования включают, но не ограничиваясь этим, однократное или множественные введения в различные моменты времени, введение болюса и импульсную инфузию.
[0536] В определенных вариантах осуществления клетки или индивидуальные популяции подтипов клеток вводят субъекту в диапазоне приблизительно от одного миллиона приблизительно до 100 миллиардов клеток и/или это количество клеток на килограмм массы тела, например, таком как от 1 миллиона приблизительно до 50 миллиардов клеток (например, приблизительно 5 миллионов клеток, приблизительно 25 миллионов клеток, приблизительно 500 миллионов клеток, приблизительно 1 миллиард клеток, приблизительно 5 миллиардов клеток, приблизительно 20 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 40 миллиардов клеток или диапазон, который определяют любые два из вышеуказанных значений), таком как приблизительно от 10 миллионов приблизительно до 100 миллиардов клеток (например, приблизительно 20 миллионов клеток, приблизительно 30 миллионов клеток, приблизительно 40 миллионов клеток, приблизительно 60 миллионов клеток, приблизительно 70 миллионов клеток, приблизительно 80 миллионов клеток, приблизительно 90 миллионов клеток, приблизительно 10 миллиардов клеток, приблизительно 25 миллиардов клеток, приблизительно 50 миллиардов клеток, приблизительно 75 миллиардов клеток, приблизительно 90 миллиардов клеток или диапазон, который определяют любые два из вышеуказанных значений), и в некоторых случаях приблизительно от 100 миллионов клеток приблизительно до 50 миллиардов клеток (например, приблизительно 120 миллионов клеток, приблизительно 250 миллионов клеток, приблизительно 350 миллионов клеток, приблизительно 450 миллионов клеток, приблизительно 650 миллионов клеток, приблизительно 800 миллионов клеток, приблизительно 900 миллионов клеток, приблизительно 3 миллиарда клеток, приблизительно 30 миллиардов клеток, приблизительно 45 миллиардов клеток) или любое значение между этими диапазонами и/или на килограмм массы тела. Дозы также могут варьировать в зависимости от конкретных атрибутов заболевания или нарушения и/или пациента и/или другого лечения. В некоторых вариантах осуществления клетки вводят в качестве части комбинированного лечения, например, одновременно с или последовательно с, в любом порядке, другим терапевтическим вмешательством, таким как антитело или сконструированная клетка или рецептор или средство, такое как цитотоксическое или терапевтическое средство. Клетки в некоторых вариантах осуществления вводят совместно с одним или несколькими дополнительными терапевтическими средствами или в связи с другим терапевтическим вмешательством, одновременно или последовательно, в любом порядке. В некоторых контекстах, клетки вводят совместно с другой терапией достаточно близко по времени так, что популяции клеток усиливают эффект одного или нескольких дополнительных терапевтических средств, или наоборот. В некоторых вариантах осуществления клетки вводят до одного или нескольких дополнительных терапевтических средств. В некоторых вариантах осуществления клетки вводят после одного или нескольких дополнительных терапевтических средств. В некоторых вариантах осуществления одно или более дополнительных средств включают цитокин, такой как IL-2, например, для усиления персистенции. В некоторых вариантах осуществления способы включают введение химиотерапевтического средства.
[0537] После введения клеток, в некоторых вариантах осуществления, измеряют биологическую активность популяции сконструированных клеток, например, с помощью любых из множества известных способов. Параметры оценки включают специфическое связывание сконструированной или природной T-клетки или другой клетки иммунной системы с антигеном, in vivo, например, посредством визуализации, или ex vivo, например, посредством ELISA или проточной цитометрии. В определенных вариантах осуществления способность сконструированных клеток уничтожать клетки-мишени можно измерять с использованием любого подходящего способа, известного в данной области, такого как анализы цитотоксичности, описанные, например, в Kochenderfer et al., J. Immunotherapy, 32(7): 689-702 (2009), и Herman et al. J. Immunological Methods, 285(1): 25-40 (2004). В определенных вариантах осуществления биологическую активность клеток измеряют посредством анализа экспрессии и/или секреции одного или нескольких цитокинов, таких как CD107a, IFNγ, IL-2 и TNF. В некоторых аспектах биологическую активность измеряют посредством оценки клинического исхода, такой как снижение опухолевой нагрузки или массы.
[0538] В определенных вариантах осуществления сконструированные клетки дополнительно модифицируют любым числом путей так, что увеличивают их терапевтический или профилактический эффект. Например, сконструированный CAR или TCR, экспрессируемый популяцией, можно конъюгировать непосредственно или опосредованно через линкер с направленным фрагментом. Практика конъюгации соединений, например, CAR или TCR, с направленными фрагментами известна в данной области. См., например, Wadwa et al., J. Drug Targeting 3: 1 1 1 (1995) и патент США 5087616.
VI. ПРОМЫШЛЕННЫЕ ИЗДЕЛИЯ И НАБОРЫ
[0539] В некоторых вариантах осуществления также предусмотрены системы, устройства и наборы, которые можно использовать при осуществлении предоставленных способов. В некоторых вариантах осуществления предусмотрены промышленные изделия, такие как наборы или устройства, содержащие вирусные частицы и олигомерный белковый реактив (например, мутеин стрептавидина) и необязательно инструкции по использованию. В некоторых вариантах осуществления наборы можно использовать в способах трансдукции клеток, например, в соответствии с получением генетически сконструированных клеток для адоптивной клеточной терапии.
[0540] В некоторых вариантах осуществления промышленные изделия включают один или более контейнеров, обычно множество контейнеров, упаковочный материал и этикетку или вкладыш в упаковку на или ассоциированные с контейнером или контейнерами и/или упаковкой, которые обычно содержат инструкции для трансдукции клеток, такой как трансдукция клеток от субъекта.
[0541] Промышленные изделия, предусмотренные в настоящем описании, содержат упаковочные материалы. Упаковочные материалы для использования в упаковке предоставленных материалов хорошо известны специалистам в данной области. См., например, патенты США №№5323907, 5052558 и 5033252, каждый из которых включен в настоящее описание в полном объеме. Примеры упаковочных материалов включают, но не ограничиваясь этим, блистерные упаковки, бутылки, пробирки, ингаляторы, насосы, мешки, флаконы, контейнеры, шприцы или бутылки. Промышленные изделия могут содержать иглу или другое инъекционное устройство с тем, чтобы содействовать дозированию материалов. Обычно упаковка не вступает в реакцию с композициями, которые она содержит.
[0542] В некоторых вариантах осуществления вирусные частицы и олигомерный белковый реактив (например, стрептавидин) упаковывают отдельно. В некоторых вариантах осуществления каждый контейнер может иметь один компартмент. В некоторых вариантах осуществления контейнер, содержащий вирусные частицы, представляет собой тот, который допускает добавление олигомерного реактива пользователем, например, через отверстие в компартменте, или наоборот. Предусмотрен любой контейнер или другое промышленное изделие, которое может иметь определенное пространство для вмещения вирусных частиц и/или олигомерного белкового реактива и которое допускает простые манипуляции, чтобы сделать возможным добавление конечных компонентов, необходимых для смеси, чтобы получать композицию, содержащую вирусные частицы, ассоциированные с олигомерным белковым реактивом. В некоторых вариантах осуществления олигомерный белок (например, стрептавидиновый реактив) добавляют к вирусным частицам до контакта с клетками, например, не более чем за 1 час до контакта с клетками.
[0543] В некоторых вариантах осуществления такие материалы упаковывают отдельно в одном и том же контейнере, например, так, что компоненты можно смешивать или комбинировать в контейнере. В некоторых аспектах, примеры таких контейнеров включают те, которые имеют окруженное, определенное пространство, которое содержит вирусные частицы, и отдельное окруженное, определенное пространство, содержащее олигомерный белковый реактив так, что два пространства разделяют легко удаляемой мембраной, что, после удаления, допускает смешивание компонентов. Предусмотрен любой контейнер или другое промышленное изделие, в которых компоненты можно держать раздельно. В некоторых вариантах осуществления промышленное изделие может содержать каждый компонент в смежном компартменте, отделенном разделительным элементом, таким как мембрана, которая, при сжатии промышленного изделия рвется, допуская смешивание разделенных компонентов. В качестве подходящих вариантов осуществления см., например, контейнеры, описанные в патентах США №№3539794 и 5171081.
[0544] В некоторых вариантах осуществления также предусмотрена система или устройство, которые можно использовать для трансдукции таких клеток. В некоторых вариантах осуществления системы или устройства можно использовать для выбора и/или активации клеток и трансдукции клеток. В некоторых аспектах, систему используют для того, чтобы осуществлять каждую из этих стадий в закрытом или стерильном окружении, например, чтобы минимизировать ошибку, пользовательское вмешательство и/или контаминацию.
[0545] В некоторых вариантах осуществления система представляет собой или содержит стационарную фазу для хроматографии, т. е. представляет собой или содержит хроматографическую матрицу. В некоторых вариантах осуществления стационарная фаза подходит для одного или нескольких из активации, трансдукции и/или стимуляции клеток. В некоторых вариантах осуществления первая стационарная фаза представляет собой гельфильтрационную матрицу и/или матрицу аффинной хроматографии, где гельфильтрационная матрица и/или матрица аффинной хроматографии содержит белковый реактив (например, мутеин стрептавидина), такой как олигомерный белковый реактив (например, мутеин стрептавидина). В некоторых вариантах осуществления белковый реактив (например, мутеин стрептавидина), такой как олигомерный белковый реактив (например, мутеин стрептавидина), содержит сайт связывания Z1, способный к специфическому связыванию с партнером связывания C1, содержащимся в связывающем средстве, которое может представлять собой первое связывающее средство (например, средство отбора и/или стимулирующее средство). В некоторых вариантах осуществления белковый реактив (например, мутеин стрептавидина), такой как олигомерный белковый реактив (например, мутеин стрептавидина), также содержит сайт связывания Z2, способный к специфическому связыванию с партнером связывания C2, содержащимся во втором связывающем средстве (например, средстве отбора и/или стимулирующем средстве). В некоторых вариантах осуществления стационарная фаза способна к ассоциации с вирусными векторными частицами, и, если содержит связывающее средство со специфичностью к клеткам, также способна к обратимому связыванию с одной или несколькими молекулами, присутствующими на поверхности клетки. В этой компоновке стационарная фаза содержится или в хроматографической колонке или представляет собой плоскую стационарную фазу.
[0546] В некоторых вариантах осуществления стационарная фаза представляет собой первую стационарную фазу, которая функционально соединена со второй или третьей стационарной фазой, например, выполненной аналогично описанному выше. В некоторых вариантах осуществления одну или более, например, каждую из, стационарных фаз соединяют функционально с камерой удаления, которая содержит средство удаления, которое способно к связыванию с высокой аффинностью с реактивом элюирования, используемым для обратимой диссоциации олигомерного белкового реактива от одной или нескольких клеток, связанных с ним через партнер связывания C1 или C2 связывающего средства. В некоторых вариантах осуществления устройство, такое как стационарная фаза, может содержать впуск образца, подходящий для нанесения вирусных частиц и/или клеток на стационарную фазу.
[0547] В некоторых вариантах осуществления стационарная фаза предусмотрена в качестве системы в компоновке с или функциональной связи с биореактором. В некоторых вариантах осуществления биореактор подходит для размножения клеток, и стационарная фаза подходит для отбора клеток, активации клеток или стимуляции и/или трансдукции клеток. В некоторых вариантах осуществления биореактор и стационарную фазу соединяют по текучей среде. Эту компоновку можно использовать при последовательном размножении, как изложено выше, и ее можно встраивать в известные системы размножения клеток, такие как Quantum® Cell Expansion System) или Xuri Cell Expansion System W25.
[0548] В некоторых вариантах осуществления закрытая система автоматизирована. В некоторых вариантах осуществления компоненты, ассоциированные с системой, могут включать встроенный микрокомпьютер, перистальтический насос и различные клапаны, такие как клапаны с зажимами или запорные краны, чтобы управлять потоком текучего вещества между различными частями системы. Встроенный компьютер в некоторых аспектах управляет всеми компонентами прибора и управляет системой для того, чтобы осуществлять повторные процедуры в стандартизированной последовательности. В некоторых вариантах осуществления перистальтический насос управляет скоростью потока на всем протяжении комплекта трубок и, вместе с клапанами с зажимами, обеспечивает управляемый поток буфера через систему. В некоторых вариантах осуществления устройство можно разрабатывать в виде функционально закрытой системы.
VII. ОПРЕДЕЛЕНИЯ
[0549] Пока не определено иное, все термины данной области, обозначения и другие технически и научные термины или терминология, используемые в настоящем описании, предназначены для того, чтобы иметь то же значение, в каком их обычно понимает специалист в области, к которой относится заявленный объект изобретения. В некоторых случаях, термины с общепринятыми значениями определены в настоящем описании для прозрачности и/или удобства обращения, и включение таких определений в настоящее описание не обязательно толковать как отражение существенного отличия от того, что обычно понимают в данной области.
[0550] Как используют в настоящем описании, формы единственного числа включают множественное число, пока контекст явно не диктует иное. Например, форма единственного числа обозначает «по меньшей мере один» или «один или более». Понятно, что аспекты и вариации, описанные в настоящем описании, включают аспекты и вариации «состоит» и/или «состоит по существу из».
[0551] На всем протяжении этого раскрытия, различные аспекты заявленного объекта изобретения представлены в формате диапазона. Следует понимать, что описание в формате диапазона служит лишь удобству и краткости, и его не следует толковать в качестве негибкого ограничения объема заявленного объекта изобретения. Соответственно, описание диапазона следует рассматривать как включающее конкретно раскрытые все возможные поддиапазоны, а также индивидуальные числовые значения в этом диапазоне. Например, где предоставлен диапазон значений, понятно, что каждое промежуточное значение между верхним и нижним пределом этого диапазона и любым другим указанным или промежуточным значением в этом указанном диапазоне предусмотрено в заявленном объекте изобретения. Верхние и нижние пределы этих меньших диапазонов можно независимо включать в меньшие диапазоны, и они также включены в заявленный объект изобретения, с учетом любого конкретно исключенного предела в указанном диапазоне. Когда указанный диапазон включает один или оба предела, диапазоны, исключающие любой или оба из этих пределов, также включены в заявленный объект изобретения. Это применимо независимо от ширины диапазона.
[0552] Термин «приблизительно», как используют в настоящем описании, относится к обычному диапазону ошибки для соответствующего значения, который известен специалисту в данной области техники. Упоминание о «приблизительном» значении или параметре в настоящем описании включает (и описывает) варианты осуществления, которые направлены на это значение или параметр per se. Например, описание, касающиеся «приблизительно X», включает описание «X».
[0553] Термин «вектор», как используют в настоящем описании, относится к молекуле нуклеиновой кислоты, способной размножать другую нуклеиновую кислоту, с которой она соединена. Термин включает вектор в качестве самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую его введи. Определенные векторы способны управлять экспрессией нуклеиновых кислот, с которыми их функционально связывают. Такие векторы обозначают в настоящем описании как «экспрессирующие векторы». Среди векторов присутствуют вирусные векторные частицы, например, ретровирусные, например, гаммаретровирусные и лентивирусные векторы.
[0554] Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используют взаимозаменяемо, и они относятся к клеткам, в которые вводили экзогенную нуклеиновую кислоту, в том числе потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают эмбриональную трансформированную клетку и потомство, полученное из нее, независимо от числа пассирований. Потомство может быть не полностью идентичным, по содержанию нуклеиновых кислот, исходной клетке, но может содержать мутации. Мутантное потомство, которое имеет ту же функцию или биологическую активность, как при скрининге или отборе исходно трансформированной клетки, включено в настоящее описание.
[0555] Как используют в настоящем описании, композиция относится к любой смеси двух или больше продуктов, веществ или соединений, в том числе клеток. Она может быть раствором, суспензией, жидкостью, порошком, пастой, водной, не водной или любым их сочетанием.
[0556] Как используют в настоящем описании, «обогащение» в отношении клеток одного или нескольких конкретных типов или популяции клеток относится к увеличению числа или процентной доли типа клеток или популяции, например, по сравнению с общим числом клеток в объеме композиции, или относительно клеток других типов, например, с помощью положительного отбора на основании маркеров, экспрессируемых популяцией или клеткой, или с помощью отрицательного отбора на основании маркера, не присутствующего в популяции клеток или клетке, подлежащей истощению. Термин не требует полного удаления других клеток, типа клеток или популяций для композиции и не требует, чтобы клетки, обогащенные таким образом, присутствовали в или даже около 100% в обогащенной композиции.
[0557] Как используют в настоящем описании, утверждение о том, что клетка или популяция клеток является «положительной» по конкретному маркеру, относится к поддающемуся обнаружению присутствию на или в клетке конкретного маркера, обычно маркера поверхности. В отношении маркера поверхности, термин относится к присутствию поверхностной экспрессии, как обнаруживают посредством проточной цитометрии, например, посредством окрашивания антителом, которое специфически связывается с маркером, и обнаружения указанного антитела, где окрашивание поддается обнаружению посредством проточной цитометрии на уровне по существу выше окрашивания, обнаруживаемого при осуществлении той же процедуры с использованием контроля с совпадающим изотипом при в остальном идентичных условиях, и/или на уровне, по существу схожем с таковым для клетки, о которой известно, что она положительна по маркеру, и/или на уровне по существу выше такового для клетки, о которой известно, что она отрицательна по маркеру.
[0558] Как используют в настоящем описании, утверждение, что клетка или популяция клеток является «отрицательной» по конкретному маркеру, относится к отсутствию существенного поддающегося обнаружению присутствия на или в клетке конкретного маркера, обычно маркера поверхности. В отношении маркера поверхности, термин относится к отсутствию поверхностной экспрессии, как обнаруживают посредством проточной цитометрии, например, посредством окрашивания антителом, которое специфически связывается с маркером, и обнаружения указанного антитела, где окрашивание не обнаруживают посредством проточной цитометрии на уровне по существу выше окрашивания, обнаруживаемого при осуществлении той же процедуры с использованием контроля с совпадающим изотипом при в остальном идентичных условиях, и/или на уровне по существу ниже такового для клетки, о которой известно, что она положительна по маркеру, и/или на уровне, по существу схожем по сравнению с таковым для клетки, о которой известно, что она отрицательна по маркеру.
[0559] Термин «экспрессия», как используют в настоящем описании, относится к процессу, с помощью которого происходит продуцирование полипептида на основании кодирующей последовательности молекулы нуклеиновой кислоты, такой как ген. Процесс может включать транскрипцию, посттранскрипционный контроль, посттранскрипционную модификацию, трансляцию, посттрансляционный контроль, посттрансляционную модификацию или любое их сочетание.
[0560] Как используют в настоящем описании, контроль относится к образцу, который по существу идентичен тестовому образцу, за исключением того, что его не обрабатывают с использованием тестового параметра, или, если он представляет собой образец плазмы, он может быть от нормального добровольца, не пораженного состоянием, представляющим интерес. Контроль также может представлять собой внутренний контроль.
VIII. ОБРАЗЦОВЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[0561] Среди вариантов осуществления в настоящем описании предусмотрены:
1. Способ трансдукции клеток, который включает приведение в контакт входной композиции, содержащей множество клеток, с (1) олигомерным реактивом; и (2) вирусной частицей,
необязательно где способом получают выходную композицию, содержащую одну или более трансдуцированных клеток.
2. Способ по варианту осуществления 1, в котором:
олигомерный реактив представляет собой олигомерный белковый реактив; и/или
олигомерный реактив содержит множество полипептидных мономерных единиц, где каждая единица необязательно составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину, необязательно по меньшей мере или приблизительно 50, 60, 65, 70, 80, 90, 100, 125 или 150 аминокислот в длину и/или имеет массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа, необязательно где реактив содержит олигомер, состоящий из множества мультимерных субъединиц, которые необязательно представляют собой тетрамерные единицы и индивидуально содержат мономерную единицу; и/или
олигомерные реактивы имеют молекулярную массу по меньшей мере или приблизительно 100, и/или между или приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа или приблизительно от 1500 кДа приблизительно до 2000 кДа.
3. Способ по варианту осуществления 1 или варианту осуществления 2, в котором олигомерный белковый реактив содержит и необязательно содержит множество единиц стрептавидина, авидина, аналога или мутеина стрептавидина или аналога или мутеина авидина или биологически активный фрагмент любого из вышеуказанных и/или мультимер любого из вышеуказанных.
4. Способ трансдукции клеток, который включает приведение в контакт множества клеток с (1) белковым реактивом, содержащим и необязательно содержащим множество единиц стрептавидина, авидина, аналога или мутеина стрептавидина, аналога или мутеина авидина или биологически активного фрагмента любого из вышеуказанных и/или мультимера любого из вышеуказанных; и (2) вирусной частицей,
необязательно где способом получают выходную композицию, содержащую одну или более трансдуцированных клеток.
5. Способ по варианту осуществления 4, в котором реактив представляет собой или содержит олигомер.
6. Способ по любому из вариантов осуществления 1-5, в котором приведение в контакт включает смешивание клетки с реактивом и вирусной частицей, одновременно или последовательно, в любом порядке.
7. Способ по любому из вариантов осуществления 1-6, в котором во время по меньшей мере части приведения в контакт, реактив и вирусная частица находятся в присутствии или в контакте с клеткой одновременно.
8. Способ по любому из вариантов осуществления 1-7, в котором одна или более трансдуцированных клеток в выходной композиции экспрессируют рекомбинантный белок, кодируемый гетерологичной нуклеиновой кислотой, которую содержат вирусные частицы.
9. Способ по любому из вариантов осуществления 1-8, который дополнительно включает впоследствии инкубацию клеток, приведенных в контакт с вирусной частицей, тем самым получая выходную композицию, содержащую одну или более трансдуцированных клеток.
10. Способ трансдукции клеток, способ включает:
(a) приведение в контакт вирусной частицы с олигомерным реактивом, тем самым создавая смесь, содержащую вирусные частицы, ассоциированные с реактивом; и
(b) приведение в контакт смеси с входной композицией, содержащей множество клеток,
необязательно где способом получают выходную композицию, содержащую одну или более трансдуцированных клеток.
11. Способ по варианту осуществления 10, в котором:
олигомерный реактив представляет собой олигомерный белковый реактив; и/или
олигомерный реактив содержит множество полипептидных мономерных единиц, где каждая единица необязательно составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину, необязательно по меньшей мере или приблизительно 50, 60, 65, 70, 80, 90, 100, 125 или 150 аминокислот в длину и/или имеет массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа, необязательно где реактив содержит олигомер, состоящий из множества мультимерных субъединиц, которые необязательно представляют собой тетрамерные единицы и индивидуально содержат мономерную единицу; и/или
олигомерные реактивы имеют молекулярную массу по меньшей мере или приблизительно 100 и/или между или приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа или приблизительно от 1500 кДа приблизительно до 2000 кДа.
12. Способ по варианту осуществления 10 или варианту осуществления 11, в котором олигомерный белковый реактив содержит и необязательно содержит множество единиц стрептавидина, авидина, аналога или мутеина стрептавидина или аналога или мутеина авидина или биологически активного фрагмента любого из вышеуказанных и/или мультимера любого из вышеуказанных.
13. Способ трансдукции клеток, способ включает:
(a) приведение в контакт вирусной частицы с белковым реактивом, содержащим и необязательно содержащим множество единиц стрептавидина, авидина, аналога или мутеина стрептавидина, аналога или мутеина авидина или биологически активного фрагмента любого из вышеуказанных и/или мультимера любого из вышеуказанных, тем самым создавая смесь, содержащую вирусные частицы, ассоциированные с реактивом; и
(b) приведение в контакт смеси со входной композицией, содержащей множество клеток,
необязательно где способом получают выходную композицию, содержащую одну или более трансдуцированных клеток.
14. Способ по варианту осуществления 13, в котором реактив представляет собой или содержит олигомер.
15. Способ по любому из вариантов осуществления 10-14, который дополнительно включает впоследствии инкубацию клеток, приведенных в контакт со смесью, тем самым получая выходную композицию, содержащую одну или более трансдуцированных клеток.
16. Способ по любому из вариантов осуществления 9 или 15, в котором инкубацию осуществляют и в котором реактив не удаляют из композиции перед инкубацией, не удаляют из композиции во время инкубации или не удаляют из композиции во время по меньшей мере половины инкубации.
17. Способ по любому из вариантов осуществления 1-16, в котором:
реактив является голым;
реактив не содержит и/или не конъюгирован или обратимо связан со связывающим средством;
реактив не содержит и/или не конъюгирован или связан с молекулой со связывающим доменом со специфичностью к маркеру клеточной поверхности, необязательно выбранному из молекул адгезии, интегринов, хемокинов, цитокинов, факторов роста, связывающих внеклеточный матрикс молекул, вирусных белков, способствующих проникновению вируса рецепторов клеточной поверхности, гепарина, гепарана, гликанов маркера поверхности T-клеток, CD3, CD28 CD4 и/или CD8;
реактив не содержит и/или не конъюгирован или связан с маркером поверхности клетки млекопитающего, компонентом внеклеточного матрикса, молекулой адгезии, интегрином, лектином, интегрин-связывающим белком, хемокинами, цитокином, фактором роста, связывающей внеклеточный матрикс молекулой, ECM компонентом, вирусным белком, рецептором клеточной поверхности, способствующим проникновению вируса, гепарином, гепараном, гликанами; и/или
реактив не содержит гепарин-связывающий домен и/или не содержит интегрин-связывающий домен и/или не содержит VLA4-связывающий домен и/или не содержит VLA5-связывающий домен; и/или
реактив не содержит и/или не конъюгирован или сопряжен или связан с вирусным связывающим средством или средством отбора клеток.
18. Способ по любому из вариантов осуществления 1-17, где до или во время приведения в контакт с реактивом и необязательно дополнительной инкубации, активация клеток в присутствии стимулирующего средства и/или в котором приведение в контакт и инкубацию или ее часть осуществляют в условиях, в соответствии с которыми клетки стимулируют или активируют с помощью стимулирующего средства, которое необязательно представляет собой связывающее средство, обратимо связанное с реактивом.
19. Способ по любому из вариантов осуществления 1-18, в котором реактив дополнительно содержит и/или обратимо связан с множеством из одного или нескольких связывающих средств, каждое из которых способно к специфическому связыванию с молекулой на поверхности вирусной частицы и/или поверхности клетки-мишени, которая необязательно представляет собой клетку млекопитающего, необязательно клетку человека.
20. Способ трансдукции клеток, который включает инкубацию входной композиции, содержащей множество клеток, с:
1) олигомерным белковым реактивом, содержащим множество сайтов связывания, способных к обратимому связыванию со связывающим средством, в котором один или более сайтов связывания обратимо связывают со связывающим средством; и
2) вирусной частицей,
в которой по меньшей мере часть инкубации в (1) происходит одновременно с (2) и
необязательно где способом получают выходную композицию, содержащую одну или более трансдуцированных клеток.
21. Способ по любому из вариантов осуществления 9, 15, 16 и 20, в котором:
инкубацию и/или дополнительную инкубацию осуществляют при или приблизительно при 37°C±2°C; и/или
инкубацию и/или дополнительную инкубацию осуществляют в присутствии дополнительного средства, которое способно доставлять сигнал в T-клетки во время по меньшей мере части инкубации и/или дополнительной инкубации.
22. Способ по варианту осуществления 21, в котором дополнительное средство способно усиливать или индуцировать пролиферацию CD3+ T-клеток, CD4+ T-клеток и/или CD8+ T-клеток.
23. Способ по варианту осуществления 21, в котором дополнительное средство представляет собой цитокин, выбранный из IL-2, IL-15, IL-7 и IL-21.
24. Способ по любому из вариантов осуществления 21-23, в котором инкубацию или дополнительную инкубацию осуществляют в течение времени, которое составляет не больше чем 14 суток, не больше чем 12 суток, не больше чем 10 суток, не больше чем 8 суток или не больше чем 6 суток.
25. Способ по любому из вариантов осуществления 10-24, в котором связывающее средство представляет собой стимулирующее средство и/или способно доставлять стимулирующий сигнал через комплекс TCR/CD3 в T-клетке, CD3-содержащий комплекс в T-клетке и/или ITAM-содержащую молекулу в T-клетке.
26. Способ по любому из вариантов осуществления 19-25, в котором:
реактив содержит множество сайтов связывания, способных к обратимому связыванию с каждым из связывающих средств, множество сайтов связывания содержит один или более сайтов связывания, Z, которые способны к связыванию с партнером связывания, C; и
связывающее средство дополнительно содержит один или более партнеров связывания, C.
27. Способ по любому из вариантов осуществления 19-26, в котором связывающее средство представляет собой или содержит рецептор-связывающее средство.
28. Способ по варианту осуществления 27, в котором рецептор-связывающее средство содержит:
стимулирующее средство, способное доставлять стимулирующий сигнал через комплекс TCR/CD3 в T-клетке, CD3-содержащий комплекс в T-клетке и/или ITAM-содержащую молекулу в T-клетке; или
специфически связывается с элементами или комплексом TCR/CD3 или специфически связывается с CD3.
29. Способ по варианту осуществления 28, в котором рецептор-связывающее средство представляет собой первое рецептор-связывающее средство и реактив содержит множество сайтов связывания, способных к обратимому связыванию второго рецептор-связывающего средства, указанное второе рецептор-связывающее средство представляет собой вспомогательное связывающее средство, способное к специфическому связыванию со второй молекулой на поверхности одной или нескольких клеток, эта вторая молекула необязательно способна к индукции или усилению, ослаблению или модификации сигнала, доставленного через первое рецептор-связывающее средство.
30. Способ по варианту осуществления 29, в котором:
первое рецептор-связывающее средство содержит партнер связывания C1, который способен к обратимому связыванию с сайтом связывания Z1 на реактиве; и
второе рецептор-связывающее средство содержит партнер связывания C2, который способен к обратимому связыванию с сайтом связывания Z2 на реактиве.
31. Способ по варианту осуществления 30, в котором:
C1 и C2 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот фрагмент; и/или
Z1 и Z2 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент.
32. Способ по любому из вариантов осуществления 19-31, в котором связывающее средство представляет собой средство отбора, способное к специфическому связыванию с молекулой, экспрессируемой на поверхности клетки-мишени.
33. Способ по любому из вариантов осуществления 29-32, в котором реактив содержит дополнительное связывающее средство, которое представляет собой средство отбора, способное к специфическому связыванию с молекулой, экспрессируемой на поверхности клетки-мишени.
34. Способ по варианту осуществления 33, в котором:
первое рецептор-связывающее средство содержит партнер связывания C1, который способен к обратимому связыванию с сайтом связывания Z1 на реактиве;
второе рецептор-связывающее средство содержит партнер связывания C2, который способен к обратимому связыванию с сайтом связывания Z2 на реактиве;
средство отбора содержит партнер связывания C3, который способен к обратимому связыванию с сайтом связывания Z3 на реактиве.
35. Способ по варианту осуществления 34, в котором:
C1, C2 и C3 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент; и/или
Z1, Z2 и Z3 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент.
36. Способ по любому из вариантов осуществления 31-35, в котором молекула представляет собой или содержит CD25, CD28, CD62L, CCR7, CD27, CD127, CD3, CD4, CD8, CD45RA, CD45RO и/или CD56.
37. Способ по любому из вариантов осуществления 31-36, в котором, во время по меньшей мере части способа, приведения в контакт и/или инкубации, связывающее средство связывается с молекулой, экспрессируемой на поверхности клетки-мишени, тем самым содействуя ассоциированию между реактивом и клеткой-мишенью.
38. Способ по варианту осуществления 37, в котором ассоциирование между реактивом и клеткой-мишенью способно усиливать трансдукцию клетки-мишени, по сравнению с трансдукцией не клетки-мишени, которая не экспрессирует молекулу или специфически не связана связывающим средством на реактиве или связанным с ним.
39. Способ по любому из вариантов осуществления 18-38, в котором связывающее средство представляет собой или содержит антитело, фрагмент антитела, одновалентный фрагмент антитела, белковую связывающую молекулу с антителоподобными связывающими свойствами, молекулу, содержащую домены Ig, цитокин, хемокин, аптамер и молекулу MHC или их связывающие фрагменты.
40. Способ по варианту осуществления 39, в котором фрагмент антитела содержит фрагмент, выбранный из группы, состоящей из Fab-фрагмента, Fv-фрагмента, (Fab')2-фрагмента и двухвалентного одноцепочечного Fv (scFv) фрагмента.
41. Способ по любому из вариантов осуществления 19-40, в котором множество связывающих средств содержит по меньшей мере 2, 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 72 или больше.
42. Способ по любому из вариантов осуществления 18-41, в котором связывающее средство, необязательно стимулирующее средство, связывается с молекулой, экспрессируемой на поверхности клетки, которая представляет собой или содержит CD3 и/или CD28.
43. Способ по варианту осуществления 42, в котором связывающее средство, необязательно стимулирующее средство, содержит антитело или фрагмент против CD3 и/или против CD28.
44. Способ по любому из вариантов осуществления 1-43, в котором входная композиция содержит T-клетки.
45. Способ по варианту осуществления 44, в котором T-клетки содержат CD4+ и/или CD8+ T-клетки и/или их субпопуляцию или подмножество и/или обогащены по популяции любых из вышеуказанных.
46. Способ по любому из вариантов осуществления 1-45, в котором входная композиция содержит покоящиеся или наивные клетки и/или их субпопуляцию или подмножество и/или обогащена по популяции любых из вышеуказанных.
47. Способ по варианту осуществления 1-46, в котором не больше чем 10% T-клеток во входной композиции содержат маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; и/или не имеют внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α; и/или способны к пролиферации.
48. Способ по любому из вариантов осуществления 1-47, в котором, перед указанным приведением в контакт, способ не включает стимуляцию клеток популяции в условиях, которые способствуют активации T-клеток.
49. Способ по любому из вариантов осуществления 1-48, в котором клетки во входной композиции, перед указанным приведением в контакт, не подвергали: (a) стимуляции ex vivo, включая инкубацию приблизительно при 37°C и/или (b) инкубации в присутствии средства или средств, выбранных из группы, состоящей из средств, способных к активации, индукции сигнала через комплекс TCR в T-клетках, CD4+ T-клетках и/или CD8+ T-клетках; средств, способных к индукции пролиферации T-клеток, CD4+ T-клеток и/или CD8+ T-клеток; CD3-связывающих молекул; CD28-связывающих молекул.
50. Способ по любому из вариантов осуществления 1-45, в котором входная композиция содержит активированные клетки.
51. Способ по любому из вариантов осуществления 1-50, в котором вирусная частица ассоциирует с реактивом.
52. Способ по любому из вариантов осуществления 1-51, в котором реактив не токсичен для клеток или по меньшей мере или по меньшей мере приблизительно 75%, 85%, 90%, 95% или больше клеток жизнеспособны после приведения в контакт или необязательно дополнительной инкубации.
53. Способ по любому из вариантов осуществления 1-52, в котором:
токсичность клеток после приведения в контакт и/или дополнительной инкубации снижают больше чем или больше чем приблизительно в 1,2 раза, 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раза или 10 раз по сравнению с токсичностью клеток, когда приводят в контакт или инкубируют с поликатионным адъювантом трансдукции, необязательно протамина сульфатом, или получаемым из фибронектина адъювантом трансдукции, необязательно RETRONECTIN, при тех же условиях; и/или
жизнеспособность клеток после приведения в контакт и/или дополнительной инкубации снижают больше чем или больше чем приблизительно в 1,2 раза, 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раза или 10 раз по сравнению с токсичностью клеток, когда приводят в контакт или инкубируют с поликатионным адъювантом трансдукции, необязательно протамина сульфатом, или получаемым из фибронектина адъювантом трансдукции, необязательно RETRONECTIN, при тех же условиях.
54. Способ по любому из вариантов осуществления 1-53, в котором индивидуальные молекулы олигомера сшивают с помощью полисахарида или бифункционального линкера.
55. Способ по любому из вариантов осуществления 1-54, в котором реактив содержит SEQ ID №1 или SEQ ID №2 или последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательностей с SEQ ID №1 или SEQ ID №2.
56. Способ по любому из вариантов осуществления 1-55, в котором:
реактив содержит аналог или мутеин стрептавидина, содержащий аминокислотную последовательность Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1; или
аналог или мутеин стрептавидина содержит аминокислотную последовательность Va144-Thr45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
57. Способ по любому из вариантов осуществления 1-56, в котором реактив содержит аналог или мутеин стрептавидина, который содержит:
a) последовательность аминокислот, приведенную в любой из SEQ ID №№3-6, 27 и 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с любой из SEQ ID №№3-6, 27 и 28 и содержит аминокислотную последовательность, соответствующую Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47, и которая обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагмент или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
58. Способ по варианту осуществления 56 или варианту осуществления 57, в котором аналог или мутеин стрептавидина дополнительно содержит замену или замены аминокислот в положении, соответствующем 117, 120 и/или 121 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
59. Способ по варианту осуществления 58, в котором:
замену или замены аминокислот выбирают из Glu117, Asp117, Arg117, Ser120, Ala120, Gly120, Trp121, Tyr121 или Phe121; или
замену или замены аминокислот выбирают из одной или нескольких из Glu117, Gly120 или Tyr121; или
замены аминокислот выбирают из Glu117, Gly120 или Tyr121.
60. Способ по любому из вариантов осуществления 1-59, в котором реактив содержит аналог или мутеин стрептавидина, который содержит:
a) последовательность аминокислот, приведенную в SEQ ID №27 или 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с SEQ ID №№28 и содержит аминокислотную последовательность, соответствующую Va144, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121, и обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
61. Способ по любому из вариантов осуществления 19-60, в котором связывающее средство содержит стрептавидин-связывающий пептид.
62. Способ по любому варианту осуществления 61, в котором стрептавидин-связывающий пептид выбирают из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19).
63. Способ по любому из вариантов осуществления 19-61, который включает разрушение обратимого связывания между связывающим средством и реактивом.
64. Способ по варианту осуществления 63, в котором указанное разрушение включает введение в клетки композиции, содержащей вещество, способное к обращению связи между вторым рецептор-связывающим средством и реактивом, который может представлять собой второй реактив.
65. Способ по любому из вариантов осуществления 1-64, в котором трансдукцию клеток увеличивают больше чем или приблизительно в 1,2 раза, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раза, 10 раз или больше по сравнению с трансдукцией вирусной частицей в отсутствие реактива.
66. Способ по любому из вариантов осуществления 1-65, в котором геном вирусного вектора содержит молекулу нуклеиновой кислоты, кодирующую рекомбинантный белок.
67. Способ по варианту осуществления 66, в котором рекомбинантный белок представляет собой антигенный рецептор.
68. Способ по любому из вариантов осуществления 1-67, в котором вирусная частица представляет собой ретровирус.
69. Способ по варианту осуществления 68, в котором ретровирус представляет собой лентивирус.
70. Способ по варианту осуществления 68, в котором ретровирус представляет собой гаммаретровирус.
71. Способ по любому из вариантов осуществления 1-70, в котором вирусная частица имеет дефект репликации.
72. Способ по любому из вариантов осуществления 1-71, в котором клетки включают клетки крови, лейкоциты, лимфоциты, B-клетки, T-клетки или NK клетки.
73. Способ по любому из вариантов осуществления 1-72, в котором клетки включают антиген-специфические T-клетки или их популяцию, T-хелперные клетки или их популяцию, цитотоксические T-клетки или их популяцию, T-клетки памяти или их популяцию, регуляторные T-клетки или их популяцию, NK клетки или их популяцию, антиген-специфические B-клетки или их популяцию, B-клетки памяти или их популяцию или регуляторные B-клетки или их популяцию.
74. Способ по любому из вариантов осуществления 1-73, в котором клетки представляют собой эмбриональные клетки.
75. Способ по любому из вариантов осуществления 1-74, в котором клетки содержат T-клетки.
76. Способ по любому из вариантов осуществления 1-75, в котором T-клетки представляют собой не фракционированные T-клетки, обогащенные или выделенные CD3+ T-клетки, обогащенные или выделенные CD4+ T-клетки или обогащенные или выделенные CD8+ T-клетки.
77. Способ по любому из вариантов осуществления 1-76, в котором реактив является растворимым.
78. Способ по любому из вариантов осуществления 1-77, в котором реактив связывают с основой во время по меньшей мере части приведения в контакт или дополнительной инкубации.
79. Способ по варианту осуществления 78, в котором основа представляет собой твердый носитель или стационарную фазу.
80. Композиция, содержащая олигомерный реактив, ассоциированный с вирусной частицей.
81. Набор, который содержит олигомерный реактив, способный к ассоциации с вирусной векторной частицей, вирусную векторную частицу и, необязательно, инструкции по использованию.
82. Композиция по варианту осуществления 80 или набор по варианту осуществления 81, где:
олигомерный реактив представляет собой олигомерный белковый реактив; и/или
олигомерный реактив содержит множество полипептидных мономерных единиц, где каждая единица необязательно составляет по меньшей мере или приблизительно 10, 20, 30 или 40 аминокислот в длину, необязательно по меньшей мере или приблизительно 50, 60, 65, 70, 80, 90, 100, 125 или 150 аминокислот в длину и/или имеет массу по меньшей мере или приблизительно 20, 30, 40 или 50 кДа, необязательно где реактив содержит олигомер, состоящий из множества мультимерных субъединиц, которые необязательно представляют собой тетрамерные единицы и индивидуально содержат мономерную единицу; и/или
олигомерные реактивы имеют молекулярную массу по меньшей мере или приблизительно 100 и/или между или приблизительно от 150 кДа приблизительно до 2000 кДа, приблизительно от 150 кДа приблизительно до 1500 кДа, приблизительно от 150 кДа приблизительно до 1250 кДа, приблизительно от 150 кДа до 1000 кДа, приблизительно от 150 кДа приблизительно до 500 кДа или приблизительно от 150 кДа приблизительно до 300 кДа, приблизительно от 300 кДа приблизительно до 2000 кДа, приблизительно от 300 кДа приблизительно до 1500 кДа, приблизительно от 300 кДа приблизительно до 1250 кДа, приблизительно от 300 кДа до 1000 кДа, приблизительно от 300 кДа приблизительно до 500 кДа, приблизительно от 500 кДа приблизительно до 2000 кДа, приблизительно от 500 кДа приблизительно до 1500 кДа, приблизительно от 500 кДа приблизительно до 1250 кДа, приблизительно от 500 кДа до 1000 кДа, приблизительно от 1000 кДа приблизительно до 2000 кДа, приблизительно от 1000 кДа приблизительно до 1500 кДа, приблизительно от 1000 кДа приблизительно до 1250 кДа, приблизительно от 1250 кДа приблизительно до 2000 кДа или приблизительно от 1500 кДа приблизительно до 2000 кДа.
83. Композиция по любому из вариантов осуществления 80-92, в которой олигомерный белковый реактив содержит и необязательно содержит множество единиц стрептавидина, авидина, аналога или мутеина стрептавидина или аналога или мутеина авидина или биологически активного фрагмента любого из вышеуказанных и/или мультимера любого из вышеуказанных.
84. Композиция, которая содержит реактив, ассоциированный с вирусной векторной частицей, где реактив представляет собой или содержит и необязательно содержит множество единиц стрептавидина, авидина, аналога или мутеина стрептавидина или и аналога или мутеина авидина или их биологически активных фрагментов и/или мультимера любого из вышеуказанных.
85. Набор, который содержит реактив, способный к ассоциации с вирусной векторной частицей, вирусную векторную частицу и, необязательно, инструкции по использованию, где реактив представляет собой или содержит и необязательно содержит множество единиц стрептавидина, авидина, аналога или мутеина стрептавидина или и аналога или мутеина авидина или их биологически активных фрагментов и/или мультимера любого из вышеуказанных
86. Композиция или набор по любому из вариантов осуществления 80-85, где вирусные частицы содержат последовательность нуклеотидов, кодирующую гетерологичную нуклеиновую кислоту.
87. Композиция или набор по любому из вариантов осуществления 80-86, 17. Способ по любому из вариантов осуществления 1-16, в котором:
реактив является голым;
реактив не содержит и/или не конъюгирован или обратимо связан со связывающим средством;
реактив не содержит и/или не конъюгирован или связан с молекулой со связывающим доменом со специфичностью к маркеру клеточной поверхности, необязательно выбранному из молекул адгезии, интегринов, хемокинов, цитокинов, факторов роста, связывающих внеклеточный матрикс молекул, вирусных белков, способствующих проникновению вируса рецепторов клеточной поверхности, гепарина, гепарана, гликанов маркера поверхности T-клеток, CD3, CD28 CD4 и/или CD8;
реактив не содержит и/или не конъюгирован или связан с маркером поверхности клетки млекопитающего, компонентом внеклеточного матрикса, молекулой адгезии, интегрином, лектином, интегрин-связывающим белком, хемокинами, цитокином, фактором роста, связывающей внеклеточный матрикс молекулой, ECM компонентом, вирусным белком, рецептором клеточной поверхности, способствующим проникновению вируса, гепарином, гепараном, гликанами; и/или
реактив не содержит гепарин-связывающий домен и/или не содержит интегрин-связывающий домен и/или не содержит VLA4-связывающий домен и/или не содержит VLA5-связывающий домен; и/или
реактив не содержит и/или не конъюгирован или сопряжен или связан с вирусным связывающим средством или средством отбора клеток.
88. Композиция или набор по любому из вариантов осуществления 80-87, где реактив дополнительно содержит и/или обратимо связан с множеством из одного или нескольких связывающих средств, каждое из которых способно к специфическому связыванию с молекулой на поверхности вирусной частицы и/или поверхности клетки-мишени, которая необязательно представляет собой клетку млекопитающего, необязательно клетку человека.
89. Композиция или набор по варианту осуществления 88, где:
реактив содержит множество сайтов связывания, способных к обратимому связыванию с каждым из связывающих средств, множество сайтов связывания содержат один или более сайт связывания, Z, которые способны к связыванию с партнером связывания, C; и
связывающее средство дополнительно содержит один или более партнеров связывания, C.
90. Композиция или набор по варианту осуществления 88 или варианту осуществления 89, в которой связывающее средство представляет собой или содержит рецептор-связывающее средство.
91. Композиция или набор по варианту осуществления 90, в котором рецептор-связывающее средство содержит:
стимулирующее средство, способное доставлять стимулирующий сигнал через комплекс TCR/CD3 в T-клетке, CD3-содержащий комплекс в T-клетке и/или ITAM-содержащую молекулу в T-клетке; или
специфически связывается с элементами или комплексом TCR/CD3 или специфически связывается с CD3.
92. Композиция или набор по варианту осуществления 91, где рецептор-связывающее средство представляет собой первое рецептор-связывающее средство и реактив содержит множество сайтов связывания, способных к обратимому связыванию второго рецептор-связывающего средства, указанное второе рецептор-связывающее средство представляет собой вспомогательное связывающее средство, способное к специфическому связыванию со второй молекулой на поверхности одной или нескольких клеток, эта вторая молекула необязательно способна к индукции или усилению, ослаблению или модификации сигнала, доставленного через первый рецептор-связывающее средство.
93. Композиция или набор по варианту осуществления 92, где:
первое рецептор-связывающее средство содержит партнер связывания C1, который способен к обратимому связыванию с сайтом связывания Z1 на реактиве; и
второе рецептор-связывающее средство содержит партнер связывания C2, который способен к обратимому связыванию с сайтом связывания Z2 на реактиве.
94. Композиция или набор по варианту осуществления 93, где:
C1 и C2 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент; и/или
Z1 и Z2 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент.
95. Композиция или набор по варианту осуществления 88 или варианту осуществления 89, где связывающее средство представляет собой средство отбора, способное к специфическому связыванию с молекулой, экспрессируемой на поверхности клетки-мишени.
96. Композиция или набор по любому из вариантов осуществления 90-95, где реактив содержит дополнительное связывающее средство, которое представляет собой средство отбора, способное к специфическому связыванию с молекулой, экспрессируемой на поверхности клетки-мишени.
97. Композиция или набор по варианту осуществления 96, в которой:
первое рецептор-связывающее средство содержит партнер связывания C1, который способен к обратимому связыванию с сайтом связывания Z1 на реактиве;
второе рецептор-связывающее средство содержит партнер связывания C2, который способен к обратимому связыванию с сайтом связывания Z2 на реактиве;
средство отбора содержит партнер связывания C3, который способен к обратимому связыванию с сайтом связывания Z3 на реактиве.
98. Композиция или набор по варианту осуществления 97, где:
C1, C2 и C3 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент; и/или
Z1, Z2 и Z3 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент.
99. Композиция или набор по любому из вариантов осуществления 95-98, где молекула представляет собой или содержит CD25, CD28, CD62L, CCR7, CD27, CD127, CD3, CD4, CD8, CD45RA, CD45RO и/или CD56.
100. Композиция или набор по любому из вариантов осуществления 88-99, где связывающее средство представляет собой или содержит антитело, фрагмент антитела, одновалентный фрагмент антитела, белковую связывающую молекулу с антителоподобными связывающими свойствами, молекулу, содержащую домены Ig, цитокин, хемокин, аптамер и молекулу MHC или их связывающие фрагменты.
101. Композиция или набор по варианту осуществления 100, где фрагмент антитела содержит фрагмент, выбранный из группы, состоящей из Fab-фрагмента, Fv-фрагмента, (Fab')2-фрагмента и двухвалентного одноцепочечного Fv (scFv) фрагмента.
102. Композиция или набор по любому из вариантов осуществления 88-10, где множество связывающих средств содержит по меньшей мере 2, 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 72 или больше.
103. Способ по любому из вариантов осуществления 88-102, в котором связывающее средство, необязательно стимулирующее средство, связывается с молекулой, экспрессируемой на поверхности клетки, которая представляет собой или содержит CD3 и/или CD28.
104. Композиция или набор по варианту осуществления 103, где связывающее средство, необязательно стимулирующее средство, содержит антитело или фрагмент против CD3 и/или против CD28.
105. Композиция или набор по любому из вариантов осуществления 80-104, где индивидуальные молекулы олигомера сшивают с помощью полисахарида или бифункционального линкера.
106. Композиция или набор по любому из вариантов осуществления 80-105, где реактив содержит SEQ ID №1 или SEQ ID №2 или последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательностей с SEQ ID №1 или SEQ ID №2.
107. Композиция или набор по любому из вариантов осуществления 80-106, где:
реактив содержит аналог или мутеин стрептавидина, содержащий аминокислотную последовательность Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1; или
аналог или мутеин стрептавидина содержит аминокислотную последовательность Va144-Thr45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
108. Композиция или набор по любому из вариантов осуществления 80-107, где реактив содержит аналог или мутеин стрептавидина, который содержит:
a) последовательность аминокислот, приведенную в любой из SEQ ID №№3-6, 27 и 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с любой из SEQ ID №№3-6, 27 и 28 и содержит аминокислотную последовательность, соответствующую Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47, и которая обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
109. Композиция или набор по любому из вариантов осуществления 80-108, где аналог или мутеин стрептавидина дополнительно содержит замену или замены аминокислот в положении, соответствующем 117, 120 и/или 121 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
110. Композиция или набор по варианту осуществления 109, где:
замену или замены аминокислот выбирают из Glu117, Asp117, Arg117, Ser120, Ala120, Gly120, Trp121, Tyr121 или Phe121; или
замену или замены аминокислот выбирают из одной или нескольких из Glu117, Gly120 или Tyr121; или
замены аминокислот выбирают из Glu117, Gly120 или Tyr121.
111. Композиция или набор по любому из вариантов осуществления 80-110, где реактив содержит аналог или мутеин стрептавидина, который содержит:
a) последовательность аминокислот, приведенную в SEQ ID № 27 или 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с SEQ ID №№28 и содержит аминокислотную последовательность, соответствующую Va144, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121 и обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
112. Композиция или набор по любому из вариантов осуществления 88-111, где связывающее средство содержит стрептавидин-связывающий пептид.
113. Композиция или набор по варианту осуществления 112, где стрептавидин-связывающий пептид выбирают из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19).
114. Композиция или набор по любому из вариантов осуществления 80-113, где геном вирусного вектора содержит молекулу нуклеиновой кислоты, кодирующую рекомбинантный белок.
115. Композиция или набор по варианту осуществления 114, где рекомбинантный белок представляет собой антигенный рецептор.
116. Композиция или набор по любому из вариантов осуществления 80-115, где вирусная частица представляет собой ретровирус.
117. Композиция или набор по варианту осуществления 116, где ретровирус представляет собой лентивирус.
118. Композиция или набор по варианту осуществления 116, где ретровирус представляет собой гаммаретровирус.
119. Композиция или набор по любому из вариантов осуществления 80-118, где вирусная частица имеет дефект репликации.
120. Композиция или набор по любому из вариантов осуществления 80-119, где реактив является растворимым.
121. Композиция или набор по любому из вариантов осуществления 80-120, где реактив связывают с основой во время по меньшей мере части приведения в контакт или дополнительной инкубации.
122. Композиция или набор по варианту осуществления 121, где основа представляет собой твердый носитель или стационарную фазу.
123. Способ трансдукции клеток, способ включает:
(1) объединение (a) композиции, содержащей множество клеток-мишеней, и (b) средства отбора, которое (i) способно к специфическому связыванию с селективным маркером, экспрессируемым одной или несколькими из по меньшей мере множества клеток-мишеней, и ii) обратимо связывают с реактивом, содержащим множество сайтов связывания, способных к обратимому связыванию со средством отбора; и
(2) инкубацию по меньшей мере множества клеток-мишеней в присутствии композиции, содержащей вирусные частицы, содержащие геном, содержащий молекулу нуклеиновой кислоты, кодирующую рекомбинантный антигенный рецептор, где приведение в контакт в (1) и инкубацию в (2) осуществляют одновременно или последовательно, в любом порядке, где способом получают инкубируемую композицию, содержащую множество клеток-мишеней, трансдуцированных вирусным вектором.
124. Способ по варианту осуществления 123, в котором вирусные векторные частицы обратимо связывают с реактивом, указанный реактив содержит множество сайтов связывания, способных к обратимому связыванию, непосредственно или опосредованно, с молекулой на поверхности вирусной частицы.
125. Способ по варианту осуществления 123 или варианту осуществления 124, в котором:
реактив не является и не связан с или ассоциирован с твердым носителем, стационарной фазой, бусиной, микрочастицей, магнитной частицей и/или матрицей во время указанной инкубации; и/или
реактив является гибким, не содержит металлическую или магнитную сердцевину, полностью или в первую очередь состоит из органического мультимера, не является сферическим, по существу не является сферическим или однородным по геометрической форме и/или не является жестким.
126. Способ по любому из вариантов осуществления 123-125, в котором:
реактив иммобилизуют, или он способен к иммобилизации, на основе, непосредственно или опосредованно, в соответствии с чем средство отбора иммобилизуют или оно способно к иммобилизации на основе; и
в (1) дополнительное объединение (c) основы, в соответствии с чем одну или более клеток-мишеней из по меньшей мере множества иммобилизуют на основе через средство отбора во время по меньшей мере части инкубации.
127. Способ по варианту осуществления 126, в котором одну или более вирусных векторных частиц иммобилизуют на основе через прямое или опосредованное связывание с молекулой во время по меньшей мере части инкубации.
128. Способ по любому из вариантов осуществления 123-127, в котором реактив содержит множество сайтов связывания, Z1, способных к обратимому связыванию со средством отбора и/или реактив содержит множество сайтов связывания, Z2, способных к обратимому связыванию с одной или несколькими вирусными частицами.
129. Способ трансдукции клеток, способ включает:
(1) объединение (a) композиции, содержащей множество клеток-мишеней, (b) средства отбора, которое (i) способно к специфическому связыванию с селективным маркером, экспрессируемым одной или несколькими из по меньшей мере множества клеток-мишеней и ii) иммобилизуют или способно к иммобилизации на основе, непосредственно или опосредованно; и (c) основы, в соответствии с чем одну или более клеток-мишеней из по меньшей мере множества иммобилизуют на основе через средство отбора; и
(2) инкубацию по меньшей мере множества клеток-мишеней в присутствии композиции, содержащей множество вирусных частиц, содержащих геном, содержащий молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, где одна или более из множества вирусных частиц способны к иммобилизации на основе, непосредственно или опосредованно, где:
приведение в контакт в (1) и инкубацию в (2) осуществляют одновременно или последовательно, в любом порядке;
одну или более клеток-мишеней и одну или более вирусных векторных частиц иммобилизуют на основе во время по меньшей мере части инкубации; и
способом получают инкубируемую композицию, содержащую множество клеток-мишеней, трансдуцированных вирусным вектором.
130. Способ по любому из вариантов осуществления 126-129, в котором:
основа представляет собой или содержит стационарную фазу; и/или
основа представляет собой или содержит твердый носитель.
131. Способ по варианту осуществления 128 или варианту осуществления 130, в котором реактив иммобилизуют или он способен к иммобилизации на основе, указанный реактив содержит множество сайтов связывания, Z1, способных к обратимому связыванию со средством отбора, и множество сайтов связывания, Z2, способных к обратимому связыванию с одной или несколькими вирусными частицами.
132. Способ по варианту осуществления 131, который включает в (1) дополнительное объединение (d) реактива, где реактив иммобилизуют на основе.
133. Способ по варианту осуществления 132, в котором реактив и основу объединяют перед их объединением со средством отбора и/или композицией, содержащей множество клеток.
134. Способ по любому из вариантов осуществления 128 и 131-133, в котором:
средство отбора содержит партнер связывания C1; и
множество сайтов связывания содержит два или больше сайтов связывания, Z1, каждый из которых способен к связыванию с партнером связывания C1 для того, чтобы формировать обратимую связь между средством отбора и реактивом.
135. Способ по любому из вариантов осуществления 124-6 и 131-134, в котором вирусные векторные частицы обратимо связывают с реактивом через связывающее вирусную частицу средство.
136. Способ по варианту осуществления 135, в котором:
связывающее вирусную частицу средство содержит партнер связывания C2; и
множество сайтов связывания содержит два или больше сайтов связывания, Z2, каждый из которых способен к связыванию с партнером связывания C2 для того, чтобы формировать обратимую связь между связывающим вирусную частицу средством и реактивом.
137. Способ по варианту осуществления 128 и любому из вариантов осуществления 131-136, в котором:
C1 и C2 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент; и/или
Z1 и Z2 представляют собой одно и то же или по существу одно и то же или содержат один и тот же или по существу один и тот же фрагмент.
138. Способ по любому из вариантов осуществления 123-137, в котором средство отбора дополнительно содержит сайт связывания B1, где специфическое связывание между средством отбора и селективным маркером на клетках-мишенях включает взаимодействие между B1 и маркером.
139. Способ по любому из вариантов осуществления 123-138, в котором селективный маркер представляет собой первый селективный маркер и средство отбора дополнительно способно к связыванию со вторым селективным маркером, который экспрессируют на поверхности по меньшей мере множества клеток-мишеней.
140. Способ по любому из вариантов осуществления 123-139, в котором средство отбора представляет собой первое средство отбора, селективный маркер представляет собой первый селективный маркер и инкубацию дополнительно осуществляют в присутствии второго средства отбора, которое способно к специфическому связыванию со вторым селективным маркером, который экспрессирован на поверхности по меньшей мере множества клеток-мишеней.
141. Способ по варианту осуществления 140, в котором реактив содержит множество сайтов связывания, способных к обратимому связыванию со вторым средством отбора, в соответствии с чем второе средство отбора обратимо связывают с реактивом.
142. Способ по варианту осуществления 141, в котором множество сайтов связывания, способных к обратимому связыванию с первым средством отбора, и множество сайтов связывания, способных к обратимому связыванию со вторым средством отбора, могут представлять собой одно и то же или различное.
143. Способ по варианту осуществления 142, в котором:
второе средство отбора содержит один или более партнеров связывания, C1; и/или
второе средство отбора содержит один или более партнеров связывания, C2, которые способны к связыванию с сайтом связывания, Z1; и/или
второе средство отбора содержит один или более партнеров связывания, C2, которые способны к связыванию с сайтом связывания, Z2, и реактив дополнительно содержит один или более сайтов связывания Z2.
144. Способ по любому из вариантов осуществления 139-143, в котором второе средство отбора содержит один или более сайтов связывания, B3, которые содействуют специфическому связыванию между вторым средством отбора и вторым селективным маркером.
145. Способ по любому из вариантов осуществления 123-138, в котором:
селективный маркер, который может представлять собой первый селективный маркер и/или второй селективный маркер, экспрессируемый на поверхности клеток-мишеней, представляет собой белок или полипептид; и/или
селективный маркер, который может представлять собой первый селективный маркер и/или второй селективный маркер, представляет собой белок или полипептид.
146. Способ по любому из вариантов осуществления 123-145, в котором:
клетки-мишени содержат клетки крови;
клетки-мишени содержат лейкоциты;
клетки-мишени содержат лимфоциты;
клетки-мишени содержат B-клетки;
клетки-мишени содержат популяцию B-клеток
клетки-мишени содержат T-клетки;
клетки-мишени содержат популяцию T-клеток; и/или
клетки-мишени содержат естественные киллерные (NK) клетки;
клетки-мишени содержат дендритные клетки;
клетки-мишени содержат макрофаги.
147. Способ по варианту осуществления 146, в котором клетки-мишени содержат антиген-специфические T-клетки или их популяцию, T-хелперные клетки или их популяцию, цитотоксические T-клетки или их популяцию, T-клетки памяти или их популяцию, регуляторные T-клетки или их популяцию или NK клетки или их популяцию, антиген-специфические B-клетки или их популяцию, B-клетки памяти или их популяцию или регуляторные B-клетки или их популяцию.
148. Способ по любому из вариантов осуществления 123-147, в котором клетки-мишени содержат T-клетки.
149. Способ по варианту осуществления 148, в котором по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, или по меньшей мере 90% T-клеток не имеют на поверхности маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; и/или не имеют внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α; и/или способны к пролиферации.
150. Способ по любому из вариантов осуществления 123-149, который включает стимуляцию одной или нескольких из множества клеток-мишеней, необязательно одной или нескольких из множества T-клеток, до и/или во время указанной инкубации, указанная стимуляция включает экспонирование указанных клеток для стимулирующих условий, тем самым индуцируя одну или более клеток-мишеней или T-клеток к пролиферации.
151. Способ по варианту осуществления 150, в котором указанные стимулирующие условия включают присутствие средства, способного к активации одного или нескольких внутриклеточных сигнальных доменов одного или нескольких компонентов комплекса TCR.
152. Способ по варианту осуществления 151, в котором указанное средство содержит первичное средство, которое специфически связывается с элементом комплекса TCR, и вторичное средство, которое специфически связывается с костимулирующей молекулой T-клетки.
153. Способ по варианту осуществления 152, в котором первичное средство специфически связывается с CD3; и/или
костимулирующую молекулу выбирают из группы, состоящей из CD28, CD137 (4-1BB), OX40, CD27 или ICOS.
154. Способ по варианту осуществления 152 или варианту осуществления 153, в котором указанные первичное и вторичное средства содержат антитела и/или присутствуют на поверхности твердого носителя.
155. Способ по любому из вариантов осуществления 123-154, который дополнительно включает:
(3) культивирование по меньшей мере множества клеток в присутствии стимулирующего средства, обратимо связанного с реактивом, который необязательно представляет собой второй реактив, (второй) реактив содержит множество сайтов связывания, каждый способен к обратимому связыванию со стимулирующим средством, в условиях, в соответствии с которыми стимулирующее средство специфически связывается с молекулой, экспрессируемой на поверхности клеток, тем самым индуцируя или модулируя сигнал в клетках.
156. Способ по варианту осуществления 155, в котором указанное культивирование осуществляют и/или инициируют перед указанной инкубацией.
157. Способ по варианту осуществления 155 или варианту осуществления 156, в котором:
второй реактив не является и не связан с или ассоциирован с твердым носителем, стационарной фазой, бусиной, микрочастицей, магнитной частицей и/или матрицей во время указанной инкубации, и/или
второй реактив является гибким, не содержит металлическую или магнитную сердцевину, полностью или в первую очередь состоит из органического мультимера, не является сферическим, не является по существу сферическим или однородным по геометрической форме и/или не является жестким.
158. Способ по варианту осуществления 155 или варианту осуществления 156, в котором второй реактив иммобилизуют на основе, которая необязательно представляет собой твердый носитель или стационарную фазу.
159. Способ по любому из вариантов осуществления 155-158, в котором стимулирующее средство содержит комплекс MHC I : пептид или его функциональную часть, комплекс MHC II : пептид или его функциональную часть и/или способно доставлять стимулирующий сигнал через комплекс TCR/CD3 в T-клетке, CD3-содержащий комплекс в T-клетке и/или ITAM-содержащую молекулу в T-клетке.
160. Способ по любому из вариантов осуществления 155-159, в котором стимулирующее средство представляет собой первое стимулирующее средство и культивирование дополнительно осуществляют в присутствии второго стимулирующего средства, которое способно к специфическому связыванию со второй молекулой, которая экспрессирована на поверхности по меньшей мере множества клеток-мишеней, тем самым индуцируя второй сигнал в клетках для того, чтобы усиливать, ослаблять или модифицировать сигнал, доставляемый через первую молекулу.
161. Способ по варианту осуществления 160, в котором реактив (второй) реактив содержит множество сайтов связывания, способных к обратимому связыванию со вторым стимулирующим средством, в соответствии с чем второе стимулирующее средство обратимо связывают с реактивом.
162. Способ по варианту осуществления 160 или варианту осуществления 161, в котором вторая молекула представляет собой костимулирующую молекулу, вспомогательную молекулу, цитокиновый рецептор, хемокиновый рецептор, молекулу иммунной контрольной точки или элемент семейства TNF или семейства рецепторов TNF.
163. Способ по любому из вариантов осуществления 155-162, в котором инкубацию и культивирование осуществляют в отдельных сосудах, которые соединяют функционально, необязательно с помощью трубки.
164. Способ по любому из вариантов осуществления 123-163, в котором инкубацию и культивирование осуществляют в закрытой системе.
165. Способ по любому из вариантов осуществления 155-164, который включает извлечение клеток, обратимо связанных с и стимулированных с помощью стимулирующего средства, которое может представлять собой первое стимулирующее средство и/или второе стимулирующее средство, тем самым получая культивируемые клетки, где культивируемые клетки представляют собой или содержат множество клеток-мишеней.
166. Способ по любому из вариантов осуществления 123-148, в котором по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% T-клеток в популяции, культивируемой таким образом:
не имеют на поверхности маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; и/или
не имеют внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α; и/или
находятся в фазе G0 или G0G1a клеточного цикла.
167. Способ по любому из вариантов осуществления 123-166, в котором:
селективный маркер представляет собой корецептор B-клетки или T-клетки;
селективный маркер представляет собой или содержит элемент комплекса антигенного рецептора T-клетки или B-клетки;
селективный маркер представляет собой или содержит цепь CD3;
селективный маркер представляет собой или содержит ζ-цепь CD3;
селективный маркер представляет собой или содержит CD8;
селективный маркер представляет собой или содержит CD4 и/или
специфическое связывание между средством отбора и селективным маркером не индуцирует сигнал или не индуцирует стимуляторный или активирующий или пролиферативный сигнал в клетках-мишенях.
168. Способ по любому из вариантов осуществления 123-167, который после указанного объединения дополнительно включает разделение и/или удаление других клеток композиции от иммобилизованных клеток-мишеней.
169. Способ по варианту осуществления 167 или 168, который дополнительно включает выполнение стадии промывания.
170. Способ по варианту осуществления 168 или варианту осуществления 169, в котором указанное разделение и/или указанную стадию промывания осуществляют перед инициацией указанной инкубации.
171. Способ по любому из вариантов осуществления 123-170, в котором:
указанную инкубацию осуществляют и/или инициируют перед указанным объединением; или
указанную инкубацию осуществляют и/или инициируют после указанного объединения.
172. Способ по любому из вариантов осуществления 123-171, в котором указанное объединение осуществляют во время по меньшей мере части указанной инкубации.
173. Способ по любому из вариантов осуществления 123-172, в котором иммобилизация средства отбора на основе обратима.
174. Способ по любому из вариантов осуществления 135-173, в котором связывающее вирусную частицу средство дополнительно содержит сайт связывания V1, где связывание между молекулой на поверхности вируса и связывающим вирусную частицу средством включает взаимодействие между B1 и молекулой.
175. Способ по варианту осуществления 174, в котором молекулу на поверхности вирусной частицы выбирают из гликопротеина оболочки, варианта гликопротеина оболочки, химерного гликопротеина оболочки, белка вирусного капсида, варианта белка вирусного капсида, вирусного матриксного белка, варианта вирусного матриксного белка, синтетического фрагмента, пептида и метки.
176. Способ по варианту осуществления 175, в котором гликопротеин оболочки выбирают из гликопротеина VSV (VSV-G), гликопротеина Sindbis, необязательно SIN, гликопротеина MMLV, гликопротеина HSV, гликопротеина MMTV, гликопротеина вируса кори, гликопротеина HTLV, гликопротеина SIV, гликопротеинов GALV, гликопротеина HIV, необязательно gp160, gp120 или gp41, и гликопротеина RSV, необязательно gp85 или gp37, или представляют собой вариант, часть, достаточную для связывания с помощью связывающего вирусную частицу средства или его химерной молекулы.
177. Способ по варианту осуществления 175, в котором синтетический фрагмент, пептид или метку выбирают из глутатион-S-трансферазы (GST), хитин-связывающего белка (CBP), кальмодулин-связывающего пептида (CBP), FLAG-пептида, пептида гемагглютинина, VSV-G-метки, HSV-метки, эпитопа T7, мальтоза-связывающего белка (MBP), эпитопа HSV, эпитопа myc, V5-метки и стрептавидин-связывающего пептида.
178. Способ по варианту осуществления 175 или варианту осуществления 177, в котором молекула представляет собой синтетический фрагмент, пептид или метку, и вирусную частицу конструируют для того, чтобы экспрессировать синтетический фрагмент, пептид или метку на ее поверхности.
179. Способ по варианту осуществления 177 или варианту осуществления 178, в котором стрептавидин-связывающий пептид содержит последовательность аминокислот, приведенную в любой из SEQ ID №7, 8, 13, 14 и 15-19.
180. Способ по вариантам осуществления 135-174, в котором связывающее вирусную частицу средство выбирают из протамина, POLYBRENE® и RETRONECTIN®.
181. Способ по любому из вариантов осуществления 123-134 и 136-173, в котором:
вирусная частица содержит партнер связывания C1 или C2; и
реактив содержит множество сайтов связывания, Z1 или Z2, способных к связыванию с партнером связывания, C1 или C2, чтобы формировать обратимую связь между вирусной частицей и реактивом.
182. Способ по варианту осуществления 181, в котором вирусную частицу конструируют для того, чтобы экспрессировать синтетический фрагмент, пептид или метку на ее поверхности, где синтетический фрагмент, пептид или метка представляет собой или содержит партнер связывания C1 или C2.
183. Способ по варианту осуществления 182, в котором пептид представляет собой стрептавидин-связывающий пептид.
184. Способ по варианту осуществления 183, в котором стрептавидин-связывающий пептид содержит последовательность аминокислот, приведенную в любой из SEQ ID №7, 8, 13, 14 и 15-19.
185. Способ по любому из вариантов осуществления 123-184, в котором вирусная частица представляет собой ретровирусную векторную частицу.
186. Способ по любому из вариантов осуществления 123-185, в котором вирусная частица представляет собой лентивирусную векторную частицу.
187. Способ по варианту осуществления 186, в котором лентивирусная векторная частица содержит геном, который извлекают из HIV-1.
188. Способ по любому из вариантов осуществления 123-185, в котором ретровирусная векторная частица представляет собой гаммаретровирусную частицу.
189. Способ по варианту осуществления 188, в котором гаммаретровирусная частица представляет собой частицу вируса мышиного лейкоза (MLV).
190. Способ по любому из вариантов осуществления 123-189, в котором вирусная векторная частица псевдотипирована с использованием гликопротеина вирусной оболочки.
191. Способ по варианту осуществления 190, в котором гликопротеин вирусной оболочки представляет собой VSV-G.
192. Способ по любому из вариантов осуществления 123-191, в котором рекомбинантный антигенный рецептор представляет собой химерный антигенный рецептор (CAR), который содержит внеклеточный домен распознавания антигена, который специфически связывается с антигеном-мишенью, и внутриклеточный сигнальный домен, содержащий ITAM.
193. Способ по варианту осуществления 192, в котором внутриклеточный сигнальный домен содержит внутриклеточный домен цепи CD3-ζ (CD3 дзета).
194. Способ по варианту осуществления 192 или варианту осуществления 193, который дополнительно предусматривает трансмембранный домен, соединяющий внеклеточный домен и внутриклеточный сигнальный домен.
195. Способ по варианту осуществления 194, в котором трансмембранный домен содержит трансмембранную часть CD28.
196. Способ по любому из вариантов осуществления 192-195, в котором внутриклеточный сигнальный домен дополнительно содержит внутриклеточный сигнальный домен костимулирующей молекулы T-клетки.
197. Способ по варианту осуществления 196, в котором костимулирующую молекулу T-клетки выбирают из группы, состоящей из CD28 и 41BB.
198. Способ по любому из вариантов осуществления 123-197, в котором нуклеиновая кислота дополнительно содержит промотор, функционально связанный с нуклеиновой кислотой, кодирующей рекомбинантный антигенный рецептор.
199. Способ по любому из вариантов осуществления 123-198, в котором:
обратимое связывание между средством отбора и реактивом, который может представлять собой первый реактив, можно разрушать посредством добавления вещества; и/или
обратимое связывание между вторым средством отбора и реактивом, который может представлять собой первый реактив и/или второй реактив, можно разрушать посредством добавления вещества; и/или
обратимое связывание между молекулой на поверхности вируса и реактивом, который может представлять собой первый реактив, можно разрушать посредством добавления вещества; и/или
обратимое связывание между связывающим вирусную частицу средством и реактивом, который может представлять собой первый реактив, можно разрушать посредством добавления вещества; и/или
обратимое связывание между стимулирующим средством, которое может представлять собой первое стимулирующее средство, и вторы реактивом, можно разрушать посредством добавления вещества; и/или
обратимое связывание между вторым стимулирующим средством и вторым средством можно разрушать посредством добавления вещества.
200. Способ по варианту осуществления 199, в котором указанное разрушение включает введение в клетки композиции, содержащей вещество.
201. Способ по варианту осуществления 199 или варианту осуществления 200, в котором вещество представляет собой свободный партнер связывания и/или представляет собой конкурентное средство.
202. Способ по любому из вариантов осуществления 199-201, в котором вещество в композиции не является вредоносным для T-клеток или клеток-мишеней и/или в котором добавление указанного вещества не снижает процентную долю выживающих T-клеток или клеток-мишеней до меньше чем 90%, 80%, 70%, 60% или 50%, по сравнению с инкубацией T-клеток или клеток-мишеней, соответственно, при сравнимых или тех же условиях, без вещества.
203. Способ по любому из вариантов осуществления 123-202, в котором:
реактив представляет собой или содержит стрептавидин, авидин, аналог или мутеин стрептавидина или и аналог или мутеин авидина или их биологически активные фрагменты; и
вещество содержит стрептавидин-связывающий пептид, биотин или биологически активный фрагмент, необязательно D-биотин, или аналог биотина или биологически активный фрагмент.
204. Способ по варианту осуществления 203, в котором:
вещество представляет собой стрептавидин-связывающий пептид выбирают из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19); и/или
вещество представляет собой C1 или его аналог или представляет собой C2 или его аналог.
205. Способ по любому из вариантов осуществления 123-204, в котором:
каждое средство отбора, которое может представлять собой первое средство отбора и/или второе средство отбора, индивидуально выбирают из фрагмента антитела, одновалентного фрагмента антитела, белковой связывающей молекулы с антителоподобными связывающими свойствами, молекулы, содержащей домены Ig, цитокина, хемокина, аптамера и молекулы MHC и их связывающих фрагментов; и/или
каждое стимулирующее средство, которое может представлять собой первое стимулирующее средство и/или второе стимулирующее средство, индивидуально выбирают из фрагмента антитела, одновалентного фрагмента антитела, белковой связывающей молекулы с антителоподобными связывающими свойствами, молекулы, содержащей домены Ig, цитокина, хемокина, аптамера и молекулы MHC и их связывающих фрагментов; и/или
связывающее вирусную частицу средство выбирают из фрагмента антитела, одновалентного фрагмента антитела, белковой связывающей молекулы с антителоподобными связывающими свойствами, молекулы, содержащей домены Ig, цитокина, хемокина, аптамера и молекулы MHC и их связывающих фрагментов.
206. Способ по любому из вариантов осуществления 123-205, в котором:
средство отбора, стимулирующее средство и/или связывающее вирусную частицу средство содержит фрагмент антитела;
средство отбора, стимулирующее средство и/или связывающее вирусную частицу средство содержит Fab-фрагмент;
средство отбора, стимулирующее средство и/или связывающее вирусную частицу средство представляет собой двухвалентный фрагмент антитела, выбранный из (Fab')2-фрагмента и двухвалентного одноцепочечного Fv (scFv) фрагмента;
средство отбора, стимулирующее средство и/или связывающее вирусную частицу средство представляет собой одновалентный фрагмент антитела, выбранный из Fab-фрагмента, Fv-фрагмента и scFv-фрагмента; и/или
средство отбора, стимулирующее средство и/или связывающее вирусную частицу средство представляет собой белковую связывающую молекулу с антителоподобными связывающими свойствами, выбранную из аптамеров, мутеинов, основанных на полипептиде семейства липокалина, глутел, белков, основанных на анкириновом каркасе, белков, основанных на кристаллиновом каркасе, аднектинов и авимеров.
207. Способ по любому из вариантов осуществления 123-206, в котором реактив представляет собой или содержит стрептавидин, авидин, аналог или мутеин стрептавидина, который обратимо связывает биотин, аналог биотина или его биологически активный фрагмент; аналог или мутеин авидина или стрептавидина, который обратимо связывает стрептавидин-связывающий пептид; реактив, который содержит по меньшей мере две хелатирующие группы K, где по меньшей мере две хелатирующие группы способны к связыванию с ионом переходного металла; средство, способное к связыванию с олигогистидиновой аффинной меткой; средство, способное к связыванию с глутатион-S-трансферазой; кальмодулин или его аналог; средство, способное к связыванию с кальмодулин-связывающим пептидом (CBP); средство, способное к связыванию с FLAG-пептидом; средство, способное к связыванию с HA-меткой; средство, способное к связыванию с мальтоза-связывающим белком (MBP); средство, способное к связыванию с эпитопом HSV; средство, способное к связыванию с эпитопом myc; или средство, способное к связыванию с биотинилированным белком-переносчиком.
208. Способ по любому из вариантов осуществления 123-207, в котором:
реактив представляет собой или содержит аналог или мутеин стрептавидина или аналог или мутеин авидина, который обратимо связывается с биотином или биологически активным фрагментом;
реактив представляет собой или содержит аналог или мутеин стрептавидина или аналог или мутеин авидина, который обратимо связывается с аналогом биотина или биологически активным фрагментом; и/или
реактив представляет собой или содержит аналог или мутеин стрептавидина или аналог или мутеин авидина, который обратимо связывается со стрептавидин-связывающим пептидом.
209. Способ по любому из вариантов осуществления 123-208, в котором реактив представляет собой олигомер или полимер стрептавидина, авидина, аналога или мутеина стрептавидина, который обратимо связывает биотин или биологически активный фрагмент; стрептавидин или аналог или мутеин авидина, который обратимо связывает стрептавидин-связывающий пептид; реактив, который содержит по меньшей мере две хелатирующие группы K, где по меньшей мере две хелатирующие группы способны к связыванию с ионом переходного металла; средство, способное к связыванию с олигогистидиновой аффинной меткой; средство, способное к связыванию с глутатион-S-трансферазой; кальмодулин или его аналог; средство, способное к связыванию с кальмодулин-связывающим пептидом (CBP); средство, способное к связыванию с FLAG-пептидом; средство, способное к связыванию с HA-меткой; средство, способное к связыванию с мальтоза-связывающим белком (MBP); средство, способное к связыванию с эпитопом HSV; средство, способное к связыванию с эпитопом myc; или средство, способное к связыванию с биотинилированным белком-переносчиком.
210. Способ по любому из вариантов осуществления 123-209, в котором реактив содержит олигомер или полимер стрептавидина, авидина, аналога или мутеина стрептавидина или и аналог или мутеин авидина.
211. Способ по варианту осуществления 209 или варианту осуществления 210, в котором индивидуальные молекулы олигомера или полимера сшивают с помощью полисахарида или бифункционального линкера.
212. Способ по любому из вариантов осуществления 123-211, в котором множество сайтов связывания содержит по меньшей мере 2, 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 72 или больше сайтов связывания.
213. Способ по любому из вариантов осуществления 207-212, в котором стрептавидин-связывающий пептид выбирают из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19).
214. Способ по любому из вариантов осуществления 123-213, в котором:
реактив содержит аналог или мутеин стрептавидина, содержащий аминокислотную последовательность Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1; или
аналог или мутеин стрептавидина содержит аминокислотную последовательность Va144-Thr45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
215. Способ по любому из вариантов осуществления 123-214, в котором аналог или мутеин стрептавидина содержит:
a) последовательность аминокислот, приведенную в любой из SEQ ID №№3-6, 27 и 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с любой из SEQ ID №№3-6, 27 и 28 и содержит аминокислотную последовательность, соответствующую Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47, которая обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент a) или b), который обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
216. Способ по варианту осуществления 214 или варианту осуществления 215, в котором аналог или мутеин стрептавидина дополнительно содержит замену или замены аминокислот в положении, соответствующем 117, 120 и/или 121 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID №1.
217. Способ по варианту осуществления 216, в котором:
замену или замены аминокислот выбирают из Glu117, Asp117, Arg117, Ser120, Ala120, Gly120, Trp121, Tyr121 или Phe121; или
замену или замены аминокислот выбирают из одной или нескольких из Glu117, Gly120 или Tyr121; или
замены аминокислот выбирают из Glu117, Gly120 или Tyr121.
218. Способ по любому из вариантов осуществления 123-217, в котором аналог или мутеин стрептавидина содержит:
a) последовательность аминокислот, приведенную в SEQ ID №27 или 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с SEQ ID №№28 и содержит аминокислотную последовательность, соответствующую Va144, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121, и обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент a) или b), который обратимо связывается с биотином или биологически активным фрагментом, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
219. Способ по любому из вариантов осуществления 123-218, в котором партнер связывания C1 и/или партнер связывания C2, независимо, содержит стрептавидин-связывающий пептид, выбранный из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19).
220. Способ по любому из вариантов осуществления 123-219, который включает, после указанного разрушения, извлечение клеток и дополнительную инкубацию композиции, содержащей инкубируемые клетки, тем самым создавая дополнительную инкубируемую композицию.
221. Способ по варианту осуществления 220, в котором:
инкубацию и дополнительную инкубацию осуществляют в одном и том же сосуде; и/или
дополнительную инкубацию осуществляют в присутствии вещества; и/или
способ не включает удаление вещества, средства отбора, стимулирующего средства, связывающего вирусную частицу средства и/или реактива из инкубируемой композиции перед дополнительной инкубацией.
222. Способ по варианту осуществления 220 или варианту осуществления 221, в котором дополнительную инкубацию осуществляют в условиях для размножения клеток.
223. Способ по любому из вариантов осуществления 124-222, в котором:
основа содержит смолу или матрицу;
основа содержит гельфильтрационную матрицу;
основа содержит хроматографическую матрицу; и/или
основа содержит мембрану, основанную на целлюлозе или основанную на органическом полимере.
224. Способ по варианту осуществления 222, в котором хроматографическая матрица присутствует в колонке и/или в котором хроматография представляет собой колоночную хроматографию или плоскостную хроматографию.
225. Способ по любому из вариантов осуществления 124-222, в котором основа содержит микрочастицу, жесткую частицу, магнитную частицу или бусину.
226. Способ по любому из вариантов осуществления 124-222, в котором основа представляет собой стационарную фазу, присутствующую в контейнере во время целых или частичных указанной инкубации и/или указанного приведения в контакт.
227. Способ по варианту осуществления 226, в котором контейнер содержит контейнер, выбранный из группы, состоящей из: колонок, контейнеров, подходящих для двунаправленного потока, наконечников пипетки, пробирок и колонок, подходящих для протекания жидкого образца.
228. Способ по любому из вариантов осуществления 123-227, где способ ведет к избирательной трансдукции клеток, экспрессирующих селективный маркер, который может представлять собой первый селективный маркер и/или второй селективный маркер.
229. Способ по варианту осуществления 228, в котором трансдукция по меньшей мере в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 или более раз выше в клетках, которые экспрессируют селективный маркер (первый и/или второй селективный маркер), чем в клетках, присутствующих в композиции, которая не экспрессирует селективный маркер (первый и/или второй селективный маркер).
230. Способ по любому из вариантов осуществления 123-229, в котором:
по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток в указанной инкубируемой композиции трансдуцируют указанным вирусным вектором с помощью способа; и/или
по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток в указанной дополнительной инкубируемой композиции трансдуцируют указанным вирусным вектором; и/или
по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток в указанной инкубируемой композиции и/или дополнительной инкубируемой композиции экспрессируют продукт гетерологичной нуклеиновой кислоты, содержащейся в указанном вирусном векторе.
231. Способ по любому из вариантов осуществления 123-230, который осуществляют ex vivo.
232. Способ по любому из вариантов осуществления 123-231, который дополнительно включает извлечение или выделение трансдуцированных клеток, полученных с помощью способа.
233. Трансдуцированная клетка, полученная способом по любому из вариантов осуществления 123-232.
234. Композиция, которая содержит трансдуцированную клетку по варианту осуществления 233.
235. Композиция, которая содержит:
связывающее вирусную векторную частицу средство, обратимо связанное с реактивом, где связывающее вирусную частицу средство способно к специфическому связыванию с молекулой на поверхности вирусной частицы; или
вирусная векторная частица обратимо связана с реактивом.
236. Композиция по варианту осуществления 235, в которой реактив содержит множество сайтов связывания, каждый способен к обратимому связыванию со связывающим вирусную частицу средством.
237. Композиция по варианту осуществления 235 или варианту осуществления 236, которая дополнительно содержит средство отбора, которое способно к обратимому связыванию с реактивом и способно к специфическому связыванию с селективным маркером на клетке-мишени.
238. Композиция по варианту осуществления 237, в которой средство отбора обратимо связывают с реактивом.
239. Композиция по любому из вариантов осуществления 235-238, где композиция дополнительно содержит основу, и реактив иммобилизуют на основе.
240. Композиция по варианту осуществления 239, в которой основа представляет собой или содержит стационарную фазу и/или твердый носитель.
241. Композиция по любому из вариантов осуществления 235-240, которая дополнительно содержит:
вирусную частицу; и/или
клетку-мишень, где клетка-мишень необязательно содержит рекомбинантную молекулу или нуклеиновую кислоту, экспрессирующую рекомбинантную молекулу, которая необязательно представляет собой химерный рецептор.
242. Композиция по любому из вариантов осуществления 235-241, которая дополнительно содержит вещество, способное разрушать обратимое связывание между реактивом и связывающим вирусную частицу средством и/или способное разрушать между реактивом и средством отбора.
243. Промышленное изделие для трансдукции клеток-мишеней, промышленное изделие содержит:
(a) связывающее вирусную частицу средство, способное к специфическому связыванию с молекулой на поверхности вирусной частицы;
(b) реактив, который содержит множество сайтов связывания, каждый способен к обратимому связыванию со связывающим вирусную частицу средством.
244. Промышленное изделие по варианту осуществления 243, которое дополнительно содержит средство отбора, которое способно к обратимому связыванию с реактивом и способно к специфическому связыванию с селективным маркером на клетке-мишени.
245. Промышленное изделие по варианту осуществления 244, в котором средство отбора обратимо связывают с реактивом.
246. Промышленное изделие по любому из вариантов осуществления 243-245, в котором композиция дополнительно содержит основу, и реактив иммобилизуют на основе.
247. Промышленное изделие по варианту осуществления 246, в котором основа представляет собой или содержит стационарную фазу и/или твердый носитель.
248. Промышленное изделие по варианту осуществления 247, в котором основа представляет собой стационарную фазу, которая представляет собой или содержит хроматографическую матрицу, где промышленное изделие дополнительно содержит контейнер, который необязательно представляет собой первый контейнер, который целиком или частично содержит хроматографическую матрицу, этот (первый) контейнер необязательно представляет собой колонку.
249. Устройство, содержащее композицию по любому из вариантов осуществления 235-242 или промышленное изделие по любому из вариантов осуществления 243-248 и необязательно дополнительно содержащее впуск текучего вещества, соединяемое по текучей среде с композицией или с одним или несколькими компонентами устройства, и/или выпуск текучего вещества, соединяемый по текучей среде с композицией и/или с одним или несколькими компонентами устройства.
250. Устройство, которое содержит:
(a) связывающее вирусную частицу средство, способное к специфическому связыванию с молекулой на поверхности вирусной частицы, и которое способно к обратимому связыванию с реактивом;
(b) средство отбора, которое способно к обратимому связыванию с реактивом и способно к специфическому связыванию с селективным маркером на клетке-мишени;
(c) реактив, который способен к обратимому связыванию со связывающим вирусную частицу средством и средством отбора; и
(d) основу.
251. Устройство по варианту осуществления 250, в котором компоненты в (a)-(d) присутствуют в множестве контейнеров, по меньшей мере некоторые из которых находятся в соединении по текучей среде, необязательно в закрытой или стерильной системе, в соответствии с чем один или более компонентов проходят из одного контейнера в другой внутри устройства.
252. Промышленное изделие или устройство по любому из вариантов осуществления 243-251, которые дополнительно содержат выпуск образца, соединенный по текучей среде с одной из по меньшей мере одной стационарной фазы для хроматографии.
253. Промышленное изделие или устройство по любому из вариантов осуществления 243-252, где устройство представляет собой функционально закрытую систему.
254. Промышленное изделие или устройство по любому из вариантов осуществления 243-253, которые дополнительно содержат одно или более средств управления, способных регулировать или корректировать pH, pO2, pCO2, и/или термостатическое средство управления одного или нескольких контейнеров или их компонентов и необязательно по меньшей мере одной из по меньшей мере одной стационарной фазы для хроматографии.
255. Промышленное изделие или устройство по любому из вариантов осуществления 243-254, которые дополнительно содержат соединение по текучей среде с контейнером, содержащим среду и/или одно или более питательных веществ и/или один или более источников углерода, в соответствии с чем соединение позволяет доставлять такую среду, питательные вещества и/или источники углерода клеткам внутри устройства, необязательно когда указанные клетки иммобилизуют на стационарной фазе для хроматографии.
256. Промышленное изделие или устройство по любому из вариантов осуществления 243-255, в котором по меньшей мере один из перечисленных компонентов и/или контейнер, содержащий их, можно отсоединять от устройства стерильным или асептическим образом.
257. Вирусная векторная частица, которая содержит стрептавидин-связывающий пептид.
258. Вирусная векторная частица по варианту осуществления 257, в которой стрептавидин-связывающий пептид представляет собой слитый белок с гликопротеином оболочки.
259. Вирусная векторная частица по варианту осуществления 258, в которой гликопротеин оболочки представляет собой VSV-G.
260. Вирусная векторная частица по любому из вариантов осуществления 257-259, где вирусный вектор представляет собой ретровирусный вектор, необязательно лентивирусный вектор.
261. Вирусная векторная частица по любому из вариантов осуществления 257-260, в которой стрептавидин-связывающий пептид выбран из группы, состоящей из Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №8), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №17), Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №18) и Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID №19).
262. Набор, который содержит:
вирусную векторную частицу по любому из вариантов осуществления 257-261; и
реактив, содержащий один или множество сайтов связывания, способных к обратимому связыванию вирусной векторной частицы.
263. Набор по варианту осуществления 262, который дополнительно содержит средство отбора, способное к связыванию селективного маркера на поверхности клеток-мишеней, где реактив содержит один или множество сайтов связывания, способных к обратимому связыванию средства отбора.
264. Вирусная векторная частица или набор по любому из вариантов осуществления 257-263, где вирусная векторная частица содержит геном, кодирующий рекомбинантный антигенный рецептор, необязательно химерный антигенный рецептор.
IX. ПРИМЕРЫ
[0562] Следующие примеры приведены только в иллюстративных целях и не предназначены для ограничения объема изобретения.
ПРИМЕР 1 - Создание растворимого стимулирующего реактива, содержащего мультимеризованные Fab-фрагменты против CD3 и против CD28, обратимо связанные с реактивом олигомерного мутеина стрептавидина
[0563] Стимулирующие средства (Fab-фрагменты против CD3 и против CD28) мультимеризовали посредством обратимого связывания с реактивом мультимеризации, который представлял собой олигомерный мутеин стрептавидина. Реактив содержал множество сайтов связывания для пептидных меток, которые присутствовали на Fab-фрагментах. Олигомерный мутеин стрептавидина получали посредством полимеризации мутеина стрептавидина, обозначаемого Strep-tactin® m1 (гомотетрамер стрептавидина, содержащий аминокислотную последовательность мутеина, приведенную в SEQ ID №6, см., например, патент США №6103493 и Voss и Skerra (1997) Protein Eng., 1:975-982) с сульфо-SMCC (сульфосукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат, продукт №22122 Thermo Scientific) и иминотиоланом (продукт №26101 Thermo Scientific) по инструкциям производителя (Thermo Scientific). Молекулы олигомерного мутеина стрептавидина отделяли от мономерного (не прореагировавшего) и димерного мутеина стрептавидина посредством эксклюзионной хроматографии.
[0564] Fab-фрагменты против CD3 и против CD28 обратимо связывали с олигомерным мутеином стрептавидина через партнер связывания пептида стрептавидина, слитый с каждым Fab-фрагментом. Fab-фрагмент против CD3 получали из CD3-связывающего моноклонального антитела, продуцируемого гибридомной клеточной линией OKT3 (ATCC® CRL-8001™; см. также патент США №4361549), и он содержал вариабельный домен тяжелой цепи и вариабельный домен легкой цепи антитела против CD3 OKT3, описанного в Arakawa et al J. Biochem. 120, 657-662 (1996). Эти последовательности приведены в SEQ ID №№31 и 32, соответственно. Fab-фрагмент против CD28 получали из антитела CD28.3 (депонировано в виде синтетической одноцепочечной Fv конструкции под номером доступа GenBank AF451974.1; см. также Vanhove et al, BLOOD, 15 июля 2003 года, том 102, №2, страницы 564-570), и он содержал вариабельные домены тяжелой и легкой цепей антитела против CD28 CD28.3, приведенные в SEQ ID №№33 и 34, соответственно. Fab-фрагменты индивидуально сливали на карбокси-конце их тяжелой цепи со связывающей пептид стрептавидина последовательностью, содержащей последовательную компоновку двух стрептавидин-связывающих модулей, имеющих последовательность аминокислот SAWSHPQFEK(GGGS)2GGSAWSHPQFEK (SEQ ID №16). Меченные пептидами Fab-фрагменты получали рекомбинантно (см. международные патентные заявки, публикации №№ WO 2013/011011 и WO 2013/124474).
[0565] Чтобы вызывать обратимое связывание, меченные пептидами Fab-фрагменты против CD3 и против CD28 смешивали с мультимеризующим реактивом, приблизительно при комнатной температуре, тем самым обратимо связывая их с реактивом через взаимодействие между Twin-Strep-tag на Fab-фрагментах, которые представляли собой партнеры связывания, способные к обратимому связыванию с сайтами связывания на реактиве, В частности, в этом исследовании приблизительно 0,5 мкг меченного пептидами Fab-фрагмента против CD3 и приблизительно 0,5 мкг меченного пептидами Fab-фрагмента против CD28 добавляли приблизительно к 3 мкг растворимого олигомерного Strep-tactin® при комнатной температуре. В некоторых случаях, меченные пептидами Fab-фрагменты предварительно смешивали перед иммобилизацией на растворимом олигомерном остове мутеина стрептавидина, что, в некоторых случаях, может вести к более однородному распределению различных молекул Fab. Получаемое растворимое мультимеризованное средство против CD3/против CD28 использовали для того, чтобы стимулировать T-клетки. В некоторых случаях, получаемое растворимое мультимеризованное средство против CD3/против CD28 хранили на льду перед стимуляцией клеток.
Пример 2: Стимуляция/размножение CD3+ T-клеток-респондентов с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на бусах, покрытых мутеином стрептавидина Strep-tactin®.
[0566] 300000 CD3+CD62L-T-клеток-респондентов (Tresp, выделенных с помощью последовательного магнитного обогащения из не мобилизованного донорского продукта афереза) метили с использованием 3 мкМ CFSE и стимулировали с использованием 5 мкл из 15 мкл препарата бус Streptactin® (10 мг магнитных частиц/мл, нагруженных 35 мкг бус Streptactin®/мг), нагруженных с использованием только 0,5 мкг αCD3 Fab-фрагмента, только 0,5 мкг αCD28 Fab-фрагмента или смеси 0,5 мкг αCD3 Fab-фрагмента и 0,5 мкг αCD28 Fab.
[0567] Используемый αCD3 Fab-фрагмент получали из CD3-связывающего моноклонального антитела, продуцируемого гибридомной клеточной линией OKT3. Гибридомная клеточная линия OKT3 и антитело OKT3 описаны в патенте США 4361549, клеточная линия депонирована под номером доступа ATCC® CRL-8001™). Используемый CD28 Fab получали из моноклонального антитела человека против CD28 CD28.3 (Vanhove et al, BLOOD, 15 июля 2003 года, том 102, №2, страницы 564-570). Нуклеотидная последовательность вариабельных доменов этого антитела CD28.3 депонирована в GenBank в форме синтетической одноцепочечной Fv конструкции scFv28.3 антитела человека против CD28 под номером доступа Genbank AF451974.1).
[0568] Оба Fab-фрагмента получали рекомбинантно в E. coli, как описано в международных патентных заявках WO 2013/011011 и WO 2013/124474, которые несут консенсусную последовательность константных доменов IgG1 (CH1 и Cκ). Тяжелые цепи обоих Fab-фрагментов сливали на карбокси-конце с последовательной компоновкой из двух стрептавидин-связывающих модулей (SAWSHPQFEK(GGGS)2GGSAWSHPQFEK) (SEQ ID №16), которые коммерчески доступны в виде «Twin-Strep-tag® в IBA GmbH, Gottingen, Germany). αCD3 Fab-фрагмент использовали в качестве первого средства со стрептавидин-связывающим пептидом, служащим в качестве партнера связывания C1, и αCD28 Fab-фрагмент использовали в качестве второго средства со стрептавидин-связывающим пептидом, служащим в качестве партнера связывания C2. (Тетрамерный) мутеин стрептавидина «Strep-tactin® служит в качестве реактива, на котором обратимо иммобилизовали оба Fab-фрагмента.
[0569] В эксперименте по размножению, клетки Tresp, стимулированные с использованием пустых бус (без Fab), служили в качестве отрицательного контроля. Клетки Tresp высевали в трех повторениях в 48-луночные планшеты наряду с 300000 CD3 клеток аутологических клеток-кормушек (облучали с использованием 30 Гр) в 3 мл полной клеточной культуральной среды (RPMI (Gibco) с добавлением 10% (об./об.) эмбриональной телячьей сыворотки, L-глутамина, b-меркаптоэтанола, HEPES, пенициллина, стрептомицина и гентамицина) с добавлением 10 Ед/мл интерлейкина 2 (IL-2). Клетки инкубировали при 37°C без замены среды и анализировали после 4 суток с помощью FACS анализа. FACS окрашивание и анализ выполняли после 10 мин инкубации с 100 мкМ D-биотина. Один репрезентативный график для каждого условия представлен на фиг. 7A. Графики показывают живые CD3+ клетки, которые окрашивали йодидом пропидия (PI) для различения живых/погибших. На фиг. 7A представлена гистограмма, показывающая распределение размеров (прямое рассеяние) стимулированных клеток. На фиг. 7A показано, что конкретную популяцию клеток из Tresp клеток стимулировали и размножали (увеличение размера/числа по сравнению с не стимулированным контролем «только бусы»), при инкубации в присутствии бус, на которых иммобилизовали смесь 0,5 мкг αCD3 Fab-фрагмента и 0,5 мкг αCD28 Fab, после стимуляции in vitro αCD3/αCD28 Fab-фрагментами, которые обратимо иммобилизовали на бусах, покрытых мутеином стрептавидина Strep-tactin®. На фиг. 7B изображены гистограммы разведения пролиферационного красителя CFSE, представляющие степень пролиферации в соответствии с числом клеток на клеточное деление (указано вверху на фиг. 7B, 0 обозначает клетки без деления; 5 обозначает клетки, которые прошли через по меньшей мере 5 делений). На фиг. 7B можно видеть, что популяция T-клеток, стимулированная бусами, на которых иммобилизовали смесь 0,5 мкг αCD3 Fab-фрагмента и 0,5 мкг αCD28 Fab, прошла главным образом через три клеточных делений и представляет более однородный паттерн пролиферации, чем при использовании только одного стимула (небольшое число клеток в не делившемся пике «0»). Увеличенное абсолютное количество пролиферации (больше клеток пролиферировало единообразно после 4 суток стимуляции с использованием бус, функционализированных αCD3 и αCD28) также представлено более интенсивным потреблением сред, как показывает изменение цвета индикатора на желтый (изображено в виде более светлой жидкости в лунках на фиг. 7C).
ПРИМЕР 3: Стимуляция/размножение CD3+ T-клеток-респондентов с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом Strep-tactin
[0570] В этом примере CD3+ T-клетки-респонденты (выделенные с помощью магнитного отбора из образца свежих PBMC, полученных из градиента Ficoll) размножали после стимуляции in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом олигомерном Strep-tactin®, действующем в качестве растворимого реактива. Олигомерный мутеин стрептавидина получали по существу, как описано в примере 1, посредством полимеризации Strep-tactin® с сульфо-SMCC (сульфосукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат, продукт №22122 Thermo Scientific) и иминотиоланом (продукт №26101 Thermo Scientific) в соответствии с протоколом производителя (Thermo Scientific). Олигомерные мутеины стрептавидина отделяли мономерных (не прореагировавших) и димерных мутеинов стрептавидина посредством эксклюзионной хроматографии, и полученную таким образом фракцию олигомерного мутеина стрептавидина (n≥3) использовали в качестве растворимого реактива.
[0571] Для размножения in vitro 300000 CD3+ T-клеток-респондентов (Tresp) метили с использованием 2 мкМ сложного сукцинимидилового эфира карбоксифлуоресцеина (CFSE) и стимулировали различными количествами препарата растворимого олигомерного мутеина стрептавидина, на котором иммобилизовали комбинацию описанного выше αCD3 OKT3 Fab-фрагмента и αCD28 Fab-фрагмента антитела 28.3 (оба несут указанный выше Twin-Strep-tag® в качестве стрептавидин-связывающего пептида на тяжелой цепи). («1×» соответствует 3 мкг олигомерного мутеина стрептавидина, функционализированного с использованием 0,5 мкг αCD3- и 0,5 мкг αCD28 мономерного Fab-фрагмента, числа «0,5×», «2×» и «5×» обозначают соответствующее n-кратное количество «1×»). Клетки Tresp или оставляли не стимулированными или стимулировали пустым олигомерным мутеином стрептавидина (без Fab), который служил в качестве отрицательного контроля. Клетки Tresp высевали в двух повторениях в 48-луночные планшеты вместе с 300000 CD3-отрицательными аутологическими клетками-кормушками (облучали с использованием 30 Гр) в 1 мл клеточной культуральной среды с добавлением 20 Ед/мл IL-2. Клетки инкубировали при 37°C без замены среды и анализировали пролиферацию в соответствии с разведением CFSE после 5 суток посредством FACS анализа. На фиг. 8A представлено увеличение распределения размеров пролиферирующих клеток после 5 суток в культуре по сравнению с отрицательными контролями. На фиг. 8B показано, что CD3+ клетки Tresp должным образом стимулировали и подвергались энергичной пролиферации при инкубации с растворимым олигомерным мутеином стрептавидина (по сравнению с твердыми магнитными частицами Streptactin на фиг. 7A-7C), на котором иммобилизовали смесь αCD3 Fab и αCD28 Fab-фрагментов. Результаты на фиг. 8A и 8B показывают, что при этих условиях in vitro большинство CD3+ T-клеток-респондентов, делившихся (от 2 до 5 клеточных делений) после вовлечения поверхностного CD28 и комплекса TCR/CD3 с использованием αCD3 и αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина. После размножения in vitro растворимые мультимеризованные средства диссоциировали и удаляли после обработки D-биотином. Диссоциацию и удаление мономерных Fab-фрагментов анализировали проточной цитометрией посредством повторного окрашивания клеток фикоэритриновой меткой Strep-Tactin®) (ST-PE). Репрезентативная гистограмма (темно-серая гистограмма) представлена в сравнении с подходящим отрицательным контролем только с ST-PE (светло-серая гистограмма). На фиг. 8C можно видеть, что оба Fab-фрагмента полностью диссоциировали и полностью были удалены из размноженных клеток. На фиг. 8D представлено абсолютное число живых (отрицательных по трипановому синему) клеток после 5 суток. Число подсчитывали с использованием счетной камеры Neubauer и наносили на график в зависимости от соответствующих условий стимуляции. Медиана числа клеток представлена на фиг. 8D; планки ошибки показывают стандартное отклонение (SD). На фиг. 8D показано, что все эти смеси αCD3 Fab-фрагментов и αCD28 Fab-фрагментов, которые иммобилизовали на растворимом реактиве олигомерного мутеина стрептавидина, в равной мере эффективны при размножении CD3+ клеток и приводили приблизительно к 4-кратному увеличению абсолютного числа клеток.
ПРИМЕР 4: Кинетика пролиферации очищенных CD4+ и CD8+ T-клеток-респондентов, стимулированных in vitro обратимыми αCD3/αCD28 Fab-мультимерами Streptamer без замены среды
[0572] В этом примере исследовали кинетику размножения при пролиферации очищенных CD4+ и CD8+ T-клеток-респондентов (Tresp), которые стимулировали in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимых олигомерных мутеинах стрептавидина. С этой целью, растворимый олигомерный мутеин Strep-tactin® двух различных размеров служил в качестве растворимого реактива. Олигомерный Strep-tactin® первого типа представлял собой фракцию олигомерного мутеина стрептавидина (n≥3), полученную в примере 3 (также обозначаемую в настоящем описании как «стандартный остов олигомерного мутеина стрептавидина», проиллюстрированный символом треугольника верхушкой вверх на фиг. 9A и 9B). Олигомерный мутеин стрептавидина второго типа, используемый в качестве растворимого реактива, представлял собой олигомерный мутеин стрептавидина (n≥3), который использовали в реакции с биотинилированным сывороточным альбумином человека (также обозначаемый в настоящем описании как «большой остов олигомерного мутеина стрептавидина).
[0573] В этом примере 500000 очищенных CD4+ или CD8+ T-клеток-респондентов (Tresp) отдельно стимулировали этими двумя различными мультимерами Streptamer, как изложено выше, т. е. или с использованием остова олигомерного мутеина стрептавидина из примера 3 (используя раствор с концентрацией 1 мг олигомерного мутеина стрептавидина/мл)) или с использованием большого остова олигомерного мутеина стрептавидина (0,1 мг/мл). 3 мкл обоих различных остовов нагружали комбинацией 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab, которую использовали в предыдущих примерах, которые несли стрептавидин-связывающий пептид SAWSHPQFEK(GGGS)2GGSAWSHPQFEK (SEQ ID №16) на C-конце тяжелой цепи Fab-фрагмента. Кроме того, 4,5 мкл стандартного остова олигомерного мутеина стрептавидина загружали с использованием 0,5 мкг αCD3 Fab-фрагмента, 0,5 мкг αCD8 Fab-фрагмента (IBA GmbH Gottingen, который также несет на C-конце Fab-фрагмента стрептавидин-связывающий пептид SAWSHPQFEK(GGGS)2GGSAWSHPQFEK (SEQ ID №16) и 0,5 мкг αCD28 Fab-фрагмента. Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля и клетки Tresp, стимулированные коммерчески доступными бусами против CD3/против CD28 (бусы, на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28) в качестве положительного контроля. Клетки Tresp высевали в двух повторениях в 48-луночные планшеты в 1 мл клеточной культуральной среды (RPMI 1640 (Gibco) с добавлением 10% (об./об. эмбриональной телячьей сыворотки, 0,025% (масс./об.) L-глутамина, 0,025% (масс./об.) L-аргинина, 0,1% (масс./об.) HEPES, 0,001% (масс./об.) гентамицина, 0,002% (масс./об.) стрептомицина, 0,002% (масс./об.) пенициллина) с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C без замены среды и число клеток анализировали после 1, 3 и 6 суток. В экспериментах с фиг. 9A и 9B размножение осуществляли без замены среды. Результаты для CD4+ T-клеток-респондентов представлены на фиг. 9A, результаты для CD8+ T-клеток-респондентов представлены на фиг. 9B, где графики представляют степень пролиферации в соответствии с числом клеток, собранных на момент времени, для CD4+ Tresp (фиг. 9A) и для CD8+ Tresp на фиг. 9B.
[0574] Как можно видеть на фиг. 9A, «меньший» растворимый реактив, на котором обратимо иммобилизовали αCD3 и αCD28 Fab-фрагменты, обеспечивал то же количество размножения CD4+ T-клеток, что и бусы против CD3/против CD28 (которые являются до сих пор стандартным реактивом для размножения T-клеток), тогда как «большее» растворимое мультимеризованное средство обеспечивало даже более хорошее размножение по сравнению с Dynabead. Это усовершенствование может быть обусловлено растворимым «большим» мультимером, который способен к связыванию с большим числом T-клеток одновременно, чем «меньшее» мультимеризованное средство, и тем самым способен стимулировать больше CD4+ T-клеток, чем «меньшее» мультимеризованное средство.
[0575] Как видно на фиг. 9B, используя растворимые мультимеризованные средства, раскрытые в настоящем описании, можно размножать CD8+ T-клетки в первые 3 суток по меньшей мере также эффективно, как и в случае бус против CD3/против CD28. Стоит отметить, что в этот период времени эксперимент по размножению, в котором использовали растворимый реактив, который в дополнение к αCD3 и αCD28 Fab-фрагментам (в качестве первого и второго средства) нес обратимо иммобилизованный на нем αCD8 Fab-фрагмент, показал наилучшую степень размножения при этих условиях культивирования. Это указывает на то, что возможно, используя стимул, который специфичен для конкретной субпопуляции клеток (здесь αCD8 Fab-фрагмент), увеличивать или модулировать избирательность размножения и тем самым можно получать более высокие количества (суб)популяции желаемых клеток.
[0576] Таким образом, резюмируя изложенное выше, в примере 4 показано, что функциональность растворимого мультимеризованного средства в отношении запуска размножения T-клеток сравнима с существующими стандартными способами с использованием бус против CD3/против CD28 с этой целью. Однако, поскольку стимуляцией можно управлять (и прерывать, по желанию) посредством добавления конкурента, такого как биотин, в случае обратимого взаимодействия, основанного на стрептавидине, между первым и вторым средством и реактивом, композиции и способы, описанные в настоящем описании, обеспечивают значимое преимущество над технологией бус против CD3/против CD28, поскольку условия размножения можно оптимизировать (например, возможно останавливать стимуляцию в эксперименте на фиг. 9B после 3 суток). Кроме того, поскольку растворимый реактив можно легко удалять из реакции (например, посредством иммобилизации реактива на биотинилированной колонке после реакции размножения), способы размножения, раскрытые в настоящем описании, можно осуществлять и автоматизировать в закрытых системах, которые, например, необходимы для GMP производства клеток для терапевтических целей, не имея дела с удалением бус, таких как бусы против CD3/против CD28.
ПРИМЕР 5: Кинетика пролиферации очищенных CD4+ и CD8+ T-клеток-респондентов, стимулированных in vitro обратимыми aCD3/aCD28 Fab-мультимерами Streptamer с заменой среды
[0577] В этом примере исследовали кинетику размножения при пролиферации очищенных CD4+ и CD8+ T-клеток-респондентов (Tresp), которые стимулировали in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимых олигомерных мутеинах стрептавидина. С этой целью, растворимый олигомерный мутеин Strep-tactin® различных размеров служил в качестве растворимого реактива. Олигомерный Strep-tactin® первого типа представлял собой фракцию олигомерного мутеина стрептавидина (n≥3), полученную в примере 3 (также обозначаемую в настоящем описании как «стандартный остов олигомерного мутеина стрептавидина», который проиллюстрирован символом треугольника верхушкой вниз на фиг. 10A и 10B). Олигомерный мутеин стрептавидина второго типа, используемый в качестве растворимого реактива, получали посредством реакции олигомерного Strep-tactin (n≥3), полученного в примере 3, с биотинилированным сывороточным альбумином человека. Этот растворимый олигомерный реактив также обозначают в настоящем описании как «большой остов олигомерного мутеина стрептавидина.
[0578] В этом примере 400000 очищенных CD4+ или CD8+ T-клеток-респондентов (Tresp) отдельно стимулировали этими двумя различными олигомерными мутеинами стрептавидина, как изложено выше, т. е. с использованием или остова олигомерного мутеина стрептавидина из примера 3 (1,0 мг/мл) или большого остова олигомерного мутеина стрептавидина (0,1 мг/мл). 3 мкл обоих различных остовов нагружали комбинацией из 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab-фрагментов, описанных выше. Кроме того, 4,5 мкл остова олигомерного мутеина стрептавидина из примера 3 нагружали с использованием 0,5 мкг αCD3, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab-фрагмента, как описано выше. Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля, и клетки Tresp стимулировали бусами против CD3/против CD28 (на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28) в качестве положительного контроля. Клетки Tresp высевали в двух повторениях в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C с заменой среды в сутки 3, и число клеток анализировали после 1, 3 и 6 суток. Результаты для CD4+ T-клеток-респондентов представлены на фиг. 10A, результаты для CD8+ T-клеток-респондентов представлены на фиг. 10B, где графики представляют степень пролиферации в соответствии с числом клеток, собранных на момент времени, для CD4+ Tresp (фиг. 10A) и для CD8+ Tresp на фиг. 10B.
[0579] Как можно видеть на фиг. 10A, растворимые реактивы, на которых обратимо иммобилизовали αCD3 и αCD28 Fab-фрагменты (мультимеризованные средства), обеспечивали более хорошее размножение CD4+ T-клеток, чем бусы против CD3/против CD28.
[0580] Как видно на фиг. 10B, используя мультимеризованные средства, CD8+ T-клетки можно размножать в пределах первых 6 суток по меньшей мере также эффективно, как и в случае бус против CD3/против CD28. Стоит отметить, что в этот период времени, эксперимент по размножению, в котором использовали больший растворимый реактив, который нес αCD3 и αCD28 Fab-фрагменты (в качестве первого и второго средства), показывал наилучшую степень размножения при этих условиях культивирования. Это также может быть обусловлено растворимым «большим» мультимеризованным средством, способным к связыванию большим числом T-клеток одновременно, чем «меньшее» мультимеризованное средство, тем самым способным стимулировать больше CD4+ T-клеток, чем «меньшее» мультимеризованное средство.
ПРИМЕР 6: Кинетика размножения очищенных CD4+ и CD8+ T-клеточных культур с заменой среды или без нее
[0581] В этом примере комбинированные данные из примеров 4 и 5 нормализовали по входному числу клеток для «меньшего» мультимеризованного средства и положительного и отрицательного контроля. Нормализованные данные не получали для «большего» мультимеризованного средства. Как изложено в примерах 4 и 5, от 400000 до 500000 CD4+ или CD8+ T-клеток-респондентов (Tresp) стимулировали с использованием 3 мкл препарата мультимеризованного средства (1 мг/мл; на котором иммобилизовали 0,5 мкг αCD3 Fab-фрагмента и 0,5 мкг αCD28 Fab-фрагмента). Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля и клетки Tresp, стимулированные бусами против CD3/против CD28 в качестве положительного контроля. Клетки Tresp высевали в двух повторениях в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C с заменой среды (прямые линии на фиг. 11A и 11B) или без замены среды (штриховые линии на фиг. 11A и 11B) в сутки 3, и анализировали число клеток после 1, 3 и 6 суток. Как видно из нормализованных данных с фиг. 11A, «меньший» растворимый реактив, на котором обратимо иммобилизовали αCD3 и αCD28 Fab-фрагменты, давал приблизительно 2,5-кратное размножение CD4+ T-клеток, тогда как размножение с использованием бус против CD3/против CD28 давало приблизительно 1,8-кратный уровень размножения. Таким образом, использование мультимеризованного средства даже обеспечивает усовершенствование размножения CD4+ T-клеток по сравнению с бусами против CD3/против CD28. Аналогичным образом, фиг. 11B подтверждает, что CD8+ T-клетки можно размножать с использованием мультимеризованных средств в первые 3 суток по меньшей мере также эффективно, как и в случае бус против CD3/против CD28.
ПРИМЕР 7: Кинетика размножения и фенотип поликлональных активированных/размноженных не сортированных CD3+ центральных T-клеток памяти (Tcm)
[0582] В этом примере 500000 CD3+CD62L+CD45RA-Tcm клеток-респондентов (Tresp) стимулировали с использованием 3 мкл препарата растворимого олигомерного мутеина стрептавидина из примера 3 (1 мг/мл), который нагружали комбинацией из 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab. Кроме того, 4,5 мкл препарата олигомерного мутеина стрептавидина, нагруженного с использованием 0,5 мкг αCD3, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab, использовали в качестве дополнительного условия стимуляции. Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля, и клетки Tresp, стимулированные бусами против CD3/против CD28 (на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28) в качестве положительного контроля. Клетки Tresp высевали в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением только 30 Ед/мл IL-2 или 30 Ед/мл IL-2 и 5 нг/мл IL-15. Клетки инкубировали при 37°C с заменой среды каждые 3 суток и анализировали число клеток после 7 и 14 суток. Графики представляют степень пролиферации в соответствии с числом клеток, собранных на момент времени, на фиг. 12A среды с добавлением только IL-2 и на фиг. 12B среды с добавлением IL-2 и IL-15. Как можно видеть как на фиг. 12A, так и фиг. 12B, растворимый реактив, который имеет обратимо связанный с ним CD3 Fab-фрагмент и αCD28 Fab-фрагмент, дает более хорошее размножение клеток, чем бусы против CD3/против CD28. Как дополнительно показано с помощью проточного цитометрического анализа поверхностной экспрессии CD62L и CD127 после 14 суток культуры в различных цитокиновых средах с фиг. 12C, экспериментальные подходы с использованием мультимеризованных средств сохраняют, при обоих условиях, выбранных здесь, более высокое содержащие CD127-экспрессирующих долгоживущих T-клеток памяти, чем размножение с использованием бус против CD3/против CD28. Это иллюстрирует дополнительное преимущество способов для данных композиций и способов, описанных в настоящем описании.
ПРИМЕР 8: Выход и фенотип размноженных CD8+ T-клеток - вариация размера растворимого реактива и добавление αCD8-Fab для стимуляции
[0583] В этом примере исследовали размножение очищенных CD8+ T-клеток-респондентов, стимулированных in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимых олигомерных мутеинах стрептавидина. Кроме того, исследовали эффект добавления αCD8-Fab к реактиву для увеличения специфичности размножения для CD8+ T-клеток.
[0584] С этой целью, 300000 очищенных CD8+ T-клеток-респондентов (Tresp) отдельно стимулировали двумя различными реактивами, основанными на Streptactin, а именно или малым мультимеризованным средством из примера 3 (1 мг/мл) или большим мультимеризованным средством, описанным выше (0,1 мг/мл). 3 мкл обоих остовов реактивов олигомерного мутеина стрептавидина нагружали комбинацией из 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab-фрагментов, описанных выше, чтобы формировать мультимеризованные средства. Кроме того, 4,5 мкл меньшего остова олигомерного мутеина стрептавидина нагружали с использованием 0,5 мкг αCD3, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab-фрагментов, описанных выше. Кроме того, использовали 3 мкл «меньшего» остова олигомерного мутеина стрептавидина, функционализированного только с использованием 0,5 мкг одного αCD3 Fab-фрагмента или 0,5 мкг одного αCD28 Fab-фрагмент. Не стимулированные клетки Tresp служили в качестве отрицательного контроля, и Tresp, стимулированные бусами против CD3/против CD28, служили в качестве положительного контроля. Клетки Tresp высевали в двух повторениях в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C с заменой среды после 3 суток и анализировали после 6 суток. На фиг. 13A изображена степень пролиферации в соответствии с числом клеток, собранных в сутки 6, по сравнению с отрицательными контролями и нормализованная по положительному контролю. На фиг. 13A показано, что размножение CD8+ T-клеток с использованием мультимеризованных средств ведет к более высокому выходу CD8+ T-клеток, чем размножение с использованием бус против CD3/против CD28. FACS анализ поверхностной экспрессии CD8 и поверхностной экспрессии CD45RO (фиг. 13B) после клеточной культуры показывает, что один и тот же фенотип CD8+ T-клеток размножали с помощью или мультимеризованных средств или бус против CD3/против CD28 (различные стимулирующие условия сравнивали с использованием однофакторного дисперсионного анализа и не обнаруживали значимые различия (n.s.)). Усовершенствованный выход CD8+ клеток при использовании способов размножения, раскрытых в настоящем описании, по сравнению с бусами против CD3/против CD28 может быть обусловлен тем фактом, что растворимые мультимеризованные средства могут лучше достигать своих рецепторов-мишеней на клеточной поверхности, чем антитела, которые иммобилизуют на бусах против CD3/против CD28. Этот усовершенствованный выход может быть очень благоприятным при размножении популяции редких клеток из начального образца.
[0585] Кроме того, сравнивая выход размножения, которого достигали с использованием реактива, на котором совместно иммобилизовали 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab-фрагментов (вторая колонка слева на фиг. 13B) с выходом с использованием двух реактивов, которые функционализировали только с использованием одного αCD3 Fab-фрагмента или одного αCD28 Fab-фрагмент (третья колонка слева на фиг. 13B), можно видеть, что оба эксперимента имели одинаковую эффективность размножения. Таким образом, эти эксперименты показывают, что использование одного реактива, на котором совместно иммобилизуют первое средство и второе средство, функционально эквивалентно использованию для размножения двух отдельных реактивов, которые нагружали только первым средством и вторым средством, соответственно.
ПРИМЕР 9: Выход и фенотип размноженных CD8+ T-клеток - титрование отдельных растворимых реактивов с различными соотношениями αCD3- и αCD28 Fab-фрагмента, иммобилизованного на них
[0586] В этом примере исследовали выход и фенотип размноженных CD8+ T-клеток-респондентов (Tresp), которые стимулировали in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали в различных количествах на растворимых олигомерных мутеинах стрептавидина.
[0587] С этой целью 300000 CD8+ T-клеток-респондентов (Tresp) стимулировали различными количествами смеси препаратов «малых» олигомерных мутеинов стрептавидина (1 мг/мл), функционализированных с использованием только αCD3 Fab и только αCD28 Fab («1×» соответствует 1,5 мкг олигомерного мутеина стрептавидина, функционализированного с использованием 0,5 мкг только αCD3, и 1,5 мкг олигомерного мутеина стрептавидина, функционализированного 0,5 мкг только αCD28 Fab-фрагмента), или 3 мкл препарата олигомерного мутеина стрептавидина, нагруженного с использованием 0,5 мкг αCD3 и α0,5 мкг CD28 Fab, или 4,5 мкл препарата олигомерного мутеина стрептавидина, нагруженного с использованием 0,5 мкг αCD3, 0,5 мкг strep-меченного αCD8 и 0,5 мкг αCD28 Fab. Необработанные клетки Tresp служили в качестве отрицательного контроля, и Tresp, стимулированные бусами против CD3/против CD28, в качестве положительного контроля. Клетки Tresp высевали в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C без замены среды и анализировали после 5 суток. На фиг. 14A изображена степень пролиферации в соответствии с числом клеток, собранных в сутки 5, по сравнению с отрицательными контролями, и нормализованных по положительному контролю. На фиг. 14A показано, что размножение CD8+ T-клеток с использованием различных мультимеризованных средств ведет к более высокому выходу CD8+ T-клеток, чем размножение с использованием бус против CD3/против CD28 (в частности, кумулятивное общее количество реактива в условии 5× вело к оптимальному размножению клеток, в частности, с течением времени/увеличению всех клеток посредством начального клеточного деления). FACS анализ поверхностной экспрессии CD8 и поверхностной экспрессии CD45RO (фиг. 14B) после клеточной культуры показывает, что тот же фенотип CD8+ T-клеток размножали с помощью или мультимеризованных средств или с помощью коммерчески доступных бус против CD3/против CD28.
ПРИМЕР 10: Выход и композиция подмножества размноженных CD3+ T-клеток с добавлением αCD8-Fab для стимуляции
[0588] Эксперимент показывает размножение очищенных CD3+ T-клеток-респондентов, стимулированных in vitro с использованием αCD3/αCD28 Fab-фрагментов, которые обратимо иммобилизовали на растворимых олигомерных мутеинах стрептавидина из примера 3, которые служили в качестве растворимого реактива. В одном эксперименте, в дополнение к αCD3/αCD28 Fab-фрагментам, αCD8 Fab-фрагмент, коммерчески доступный в IBA GmbH, Gottingen, Germany (№ по каталогу 6-8000-203), иммобилизовали на растворимом олигомерном мутеине стрептавидина для того, чтобы тестировать, возможно ли предпочтительно стимулировать конкретную субпопуляцию T-клеток in vitro с использованием обратимых aCD3/aCD28 мультимеризованных средств. Более подробно, 500000 очищенных CD3+ T-клеток-респондентов (Tresp) стимулировали с использованием 3 мкл препарата олигомерных мутеинов стрептавидина (1 мг/мл), нагруженных комбинацией из 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab. В качестве альтернативного подхода, 4,5 мкл олигомерных мутеинов стрептавидина нагружали с использованием 0,5 мкг αCD3, 0,5 мкг strep-меченного αCD8 Fab и 0,5 мкг strep-меченного αCD28 Fab. Не стимулированные клетки Tresp служили в качестве отрицательного контроля, и Tresp, стимулированные бусами против CD3/против CD28 (бусы, на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28), служили в качестве положительного контроля. Как можно видеть на фиг. 15A, реактив, который обратимо нагружали αCD3 Fab-фрагментом, αCD28 Fab-фрагментом и также αCD8 Fab-фрагментом, обеспечивал самое высокое число размноженных CD3+ T-клеток. При использовании 1×, 1×106, выход числа размноженных клеток составлял приблизительно на 30% выше, чем для размножения этих T-клеток с использованием коммерчески доступных бус против CD3/против CD28. Вдобавок и, что более важно, как показано на фиг. 15B, при использовании этого реактива, который несет αCD3 Fab-фрагмент, αCD28 Fab-фрагмент и αCD8 Fab-фрагмент, количество CD8+ T-клеток было самым высоким, по сравнению как с размножением с использованием бус против CD3/против CD28, так и растворимого реактива, который несет только αCD3 Fab-фрагмент и αCD28 Fab-фрагмент в качестве первого и второго средства, как раскрыто в настоящем описании. Таким образом, также этот эксперимент показывает такое преимущество композиций и способов, описанных в настоящем описании, что в дополнение к первому средству, которое обеспечивает первичный сигнал активации для желаемой популяции клеток, и необязательно второму средству, которое обеспечивает костимулирующий сигнал, дополнительное средство, которое специфично для активации желаемой популяции клеток, можно иммобилизовать на реактиве. Таким образом, поступая так, композиции и способы, описанные в настоящем описании, предусматривают возможность предпочтительного размножения или избирательного обогащения любой желаемой популяции или субпопуляции клеток из образца, который, например, содержит множество различных субпопуляций.
ПРИМЕР 11: Анализ дифференциальной мобилизации внутриклеточного кальция в клетках Jurkat
[0589] Здесь реальном времени исследовали проточный цитометрический анализ дифференциальной мобилизации внутриклеточного кальция, заключенного в клетках Jurkat, которые метили с использованием αCD3 антитела клона OKT3 или Fab-фрагментов OKT3, мультимеризованных с использованием Strep-tactin®.
[0590] С этой целью, клетки Jurkat нагружали кальций-чувствительным красителем Indo-1-AM и высвобождение кальция запускали посредством инъекции моноклонального антитела αCD3 OKT3 (продуцируемого гибридомной клеточной линией OKT3, см. выше, черные квадраты) или αCD3 Fab-фрагментов (полученных из родительской клеточной линии OKT3), которые мультимеризовали посредством обратимого связывания этого стрептавидин-связывающего пептида с растворимым Strep-Tactin, флуоресцентно конъюгированным с фикоэритрином. В случае интактных мультимерных OKT3 Fab-Strep-Tactin комплексов, высвобождение кальция запускали через идентичный период времени, как и в случае исходного клона антитела (темные серые треугольники). Активации клеток можно полностью избегать посредством инъекции обработанных D-биотином, предварительно диссоциированных Fab-Strep-Tactin комплексов (светлые серые круги), идентичной инъекции PBS отрицательного контроля (перевернутые белые треугольники). Применение иономицина служило в качестве положительного контроля для притока кальция. Мониторинг изменений внутриклеточной концентрации Ca2+ с разрешением по времени осуществляли посредством проточной цитометрии на основании изменения соотношения FL6/FL7. На фиг. 16A можно видеть, что как исходное антитело OKT3, так и мультимеризованный одновалентный Fab-фрагмент OKT3 вызывали высвобождение кальция, что обозначает, что мультимеризованный одновалентный Fab-фрагмент OKT3 по существу так же функционален, как и исходное антитело. Стоит отметить, что мультимерный OKT3 Fab-фрагмент не был способен запускать высвобождение кальция, если биотин добавляли к Strep-tactin, на котором иммобилизовали OKT3 Fab-фрагмент перед добавлением Streptactin-OKT3 Fab-фрагмента. В этом случае, биотин нарушал обратимую связь, образуемую между Strep-tactin в качестве средства мультимеризации и OKT3 Fab-фрагментом. Следовательно, одновалентный Fab-фрагмент вымещали из средства мультимеризации, и после диссоциации он не был способен запускать высвобождение кальция посредством связывания с CD3 клеток Jurkat.
[0591] В экспериментах, представленных на фиг. 16B, Indo-1-AM-меченные клетки Jurkat активировали с помощью полученных из OKT3 αCD3 Fab-Strep-Tactin-комплексов, как описано на фиг. 16A. Инъекция интактных (верхний график) или предварительно диссоциированных комплексов (нижний график) служила в качестве положительного или отрицательного контролей, соответственно. Кроме того, стимуляция клеток интактными Fab-Strep Tactin-комплексами, за которой следовала последующая инъекция D-биотина (около пиковой активации в t=140 с), вела к неожиданному нарушению передачи сигнала αCD3 Fab-мультимера (средний график). Инъекция иономицина в группе предварительно диссоциированного Fab комплекса служила в качестве положительного контроля. Данные представляют три различных эксперимента. Что важно, на фиг. 16B показано, что добавление D-биотина к образцу быстро вымещает Fab-фрагмент из средства мультимеризации Strep-tactin, тем самым эффективно прерывая высвобождение кальция даже при продолжающейся кальциевой стимуляции и демонстрируя, что диссоциированный OKT3 Fab-фрагмент более биологически не активен. Аналогичным образом, мультимерный OKT3 Fab-фрагмент также не способен запускать высвобождение кальция при добавлении биотина в мультимер Strep-tactin-OKT3 Fab-фрагмента перед добавлением образца Streptactin-OKT3 Fab в клетки Jurkat.
ПРИМЕР 12: Обратимое окрашивание клеток с помощью CD3 Fab-мультимеров
[0592] В этом примере исследуют обратимое окрашивание клеток с помощью CD3 Fab-мультимеров. Свежие выделенные PBMC окрашивали с использованием или αCD3 моноклонального антитела клона OKT3 (левая точечная диаграмма, родительский клон для Fab-мультимеров) или когнатных меченных фикоэритрином (PE) OKT3 Fab-мультимеров и анализировали или до (вторая колонка слева) или после обработки D-биотином (средняя колонка). Затем остающиеся Fab мономеры обнаруживали после последующих стадий промывания с использованием свежего PE-меченного Strep-Tactin® (вторая колонка справа). Вторичное окрашивание Fab-мультимером обратимо окрашиваемых клеток служило в качестве контроля (правая колонка). Только живые CD3 клетки, которые являются отрицательными по окрашиванию йодидом пропидия (PI), для различения живых/погибших, представлены на фиг. 17. Числа на точечных диаграммах показывают процентную долю клеток в гейтах. Этот эксперимент показывает, что окрашивание CD3+ PBMC Fab-фрагментом против CD3, мультимеризованным с использованием Streptactin в качестве реактива мультимеризации, полностью обратимо посредством добавления D-биотина и что отдельно одновалентный Fab-фрагмент не связывается с молекулой CD3, присутствующей на PBMC.
ПРИМЕР 13: Обратимое выделение клеток с помощью CD28 Fab-мультимеров
[0593] В этом примере показано выделение клеток посредством обратимого связывания Fab-фрагментов против CD28, мультимеризованных с использованием магнитных частиц Strep-Tactin® (магнитные частицы доступны в IBA GmbH Gottingen, Germany). Fab-фрагменты, полученные из антитела CD28.3, описанного выше в примере 2, использовали с этой целью. Клетки CD28+ отбирали/выделяли с помощью магнитного отбора клеток с Fab-мультимером из свежих выделенных PMBC, как по существу описано в международной патентной заявке WO 2013/011011. Перед отбором осуществляли контрольное окрашивание клеток или когнатными флуоресцентными αCD28-мультимерами (левая точечная диаграмма) или антителом, направленным против легкой цепи κ иммуноглобулина (вторая точечная диаграмма слева, α-Ig κ mAb) в качестве контрольного окрашивания. После отбора, CD28+ клетки обрабатывали D-биотином и впоследствии промывали для того, чтобы удалять магнитные бусы и Fab-мономеры. Высвобожденные CD28+ клетки впоследствии (повторно) окрашивали с использованием или CD28 Fab-мультимеров (вторая точечная диаграмма справа) или α-Igκ mAb (правая точечная диаграмма), чтобы обнаруживать потенциально остающиеся Fab-мономеры. Показаны только живые (PI-отрицательные) CD3+ клетки. Числа на точечных диаграммах показывают процентную долю клеток в гейтах. На фиг. 18 показано, что CD28+ клетки можно выделять из PMBC с использованием такого мультимеризованного Fab-фрагмента против CD28 и что все реактивы для выделения, в том числе Fab-мономеры против CD28, можно удалять после отбора.
ПРИМЕР 14: Раннее формирование кластера после активации очищенных CD4+ и CD8+ T-клеток-респондентов, стимулированных in vitro с использованием обратимых aCD3/aCD28 Fab-мультимеров Streptamer
[0594] В этом примере 400000 CD4+ или CD8+ T-клеток-респондентов (Tresp) стимулировали с использованием 3 мкл препарата олигомерного реактива мультимеризации Streptactin (1 мг/мл), нагруженного комбинацией из 0,5 мкг αCD3- и 0,5 мкг αCD28 Fab. Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля, и клетки Tresp, стимулированные бусами против CD3/против CD28, в качестве положительного контроля. Клетки Tresp высевали в двух повторениях в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C и анализировали под микроскопом после 1 и 2 суток. Стимуляция CD4+ Tresp (фиг. 19A) и CD8+ Tresp (фиг. 19B) показана для бус против CD3/против CD28 (средний ряд) и мультимеров Streptamer (нижний ряд), соответственно. Фотографии представляют степень формирования кластера: для лучшей видности образцовые кластеры обозначены кругами для стимуляции растворимыми олигомерами мутеина стрептавидина на фиг. 19A и фиг. 19B. Кластеры для стимуляции Dynabead легко виды по накоплению темных стимулирующих частиц. Как видно, и для CD4+ и для CD8+ T-клеток ранние кластеры сформировались при использовании способа размножения по изобретению, в котором используют растворимый олигомерный реактив мультимеризации.
ПРИМЕР 15: Избирательное антиген-специфическое размножение Tcm клеток-респондентов из не сортированных CD3+ центральных T-клеток памяти (кинетика и фенотип)
[0595] В этом примере исследовали кинетику и фенотип избирательного антиген-специфического (Аг-специфического) размножения из очищенных CD3+CD62L+CD45RA-Tcm клеток-респондентов.
[0596] Более подробно, CD3+CD62L+CD45RA-Tcm клетки-респонденты стимулировали in vitro с использованием как комплекса пептид : молекула MHC (который выполняет функцию первого средства, которое обеспечивает первичный сигнал активации клеток), так и αCD28 Fab-фрагмента (который выполняет функцию второго реактива, который стимулирует вспомогательную молекулу на поверхности клеток). Комплекс антиген-специфического пептида с молекулой MHC и αCD28 Fab-фрагмент обратимо иммобилизовали на растворимом олигомерном мутеине стрептавидина (с n≥3), описанном в примере 3. Пептид, который использовали для антиген-специфического размножения, представлял собой пептид CRVLCCYVL (SEQ ID №38), аминокислоты 309-317 предраннего белка 1 (описано в Ameres et al, PLOS Pathogens, май 2013 года, том 9, выпуск 5, e1003383), которые представляют эпитоп HLA-C7/IE-1, который специфичен для цитомегаловируса (CMV). Молекула MHCI, которая представляет пептид, несет на C-конце α цепи (тяжелой цепи) стрептавидин-связывающий пептид (SAWSHPQFEK(GGGS)2GGSAWSHPQFEK, (SEQ ID №16), который коммерчески доступен в «Twin-Strep-tag®» из IBA GmbH, Gottingen, Germany).
[0597] С этой целью, 500000 CD3+CD62L+CD45RA-Tcm клеток-респондентов (Tresp) стимулировали Аг-специфически с использованием 3 мкл препарата растворимого олигомерного реактива мультимеризации Streptactin, функционализированного с использованием 0,5 мкг комплексов пептидов : MHC класса I, оснащенных стрептавидин-связывающим пептидом, и 0,5 мкг αCD28 Fab, описанного выше. В качестве альтернативы, 4,5 мкл препарата реактива мультимеризации Streptactin нагружали с использованием 0,5 мкг этих комплексов пептидов:MHC класса I, 0,5 мкг CD8 αFab и 0,5 мкг αCD28 Fab. Для сравнения, поликлональную стимуляцию осуществляли, используя 3 мкл препарата реактива мультимеризации Streptactin (1 мг/мл), нагруженного комбинацией из 0,5 мкг αCD3 Fab и 0,5 мкг αCD28 Fab. Снова, в качестве альтернативных условий стимуляции, описанных выше, использовали 4,5 мкл препарата реактива мультимеризации Streptactin, обратимо нагруженного с использованием 0,5 мкг αCD3 Fab, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab. Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля, и клетки Tresp, стимулированные поликлонально бусами против CD3/против CD28 (бусами, на которых необратимо иммобилизованы моноклональные антитела αCD3 и αCD28), в качестве положительного контроля. Клетки Tresp высевали в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2 и 5 нг/мл IL-15. Клетки инкубировали при 37°C с заменой среды каждые 3 суток и анализировали число клеток после 7 и 14 суток. Образцовый проточный цитометрический анализ для фракции Аг-специфических клеток, которые стимулировали/размножали через растворимый олигомер strept-tactin, на котором иммобилизовали комплекс пептид:MHC-I для эпитопа HLA-C7/IE-1 (для CMV) (фиг. 20A), показывает, что эти антиген-специфические T-клетки размножались специфически. Графики на фиг. с 20B до 20E (которые представляют степень размножения отдельных Аг-специфичностей в соответствии с числом положительных по пептиду : MHCI и мультимеру клеток, собранных на момент времени, по аналогии с экспериментом по размножению, представленным на фиг. 20A) показывают, что реактив мультимеризации, который использует соответствующий комплекс Аг-специфического пептида и молекулы MHC 1 обеспечивал самое высокое число размноженных клеток (в диапазоне от двадцатикратного увеличения числа клеток для Аг-специфических клеток, которые распознают эпитоп pp65 из CMV (аминокислоты 341-350 (QYDPVAALF, (SEQ ID №39)), ограниченный с помощью HLA-A2402) (см. фиг. 20B) до 98-кратного увеличения числа Аг-специфических клеток, которые распознают эпитоп HLA-B7/IE-1309-317 (CRVLCCYVL (SEQ ID №38)) из CMV (см. фиг. 20E), тем самым показывая, что способ размножения по настоящему изобретению полностью применим к размножению Аг-специфических клеток. Наконец, образцовый проточный цитометрический анализ поверхностной экспрессии CD62L и CD127 после 14 суток культуры для эпитопа HLA-B7/Hexon5 (для аденовируса), представленный на фиг. 20F, дополнительно подтверждает, что экспериментальные подходы с использованием растворимых реактивов мультимеризации по настоящему изобретению сохраняют более высокое содержание CD127-экспрессирующих долгоживущих T-клеток памяти в поликлональных и Аг-специфических стимулирующих условиях.
ПРИМЕР 16: кинетика избирательного Аг-специфического размножения и фенотип не сортированных центральных T-клеток памяти
[0598] В этом примере исследуют кинетику избирательного Аг-специфического размножения из очищенных CD3+CD62L+CD45RA-Tcm клеток-респондентов, которое стимулировали in vitro с использованием a) антиген-специфических пептидных комплексов MHCI и b) αCD28 Fab-фрагментов, которые обратимо иммобилизовали в качестве первого и второго средства на растворимых олигомерных мутеинах стрептавидина.
[0599] С этой целью 500000 CD3+CD62L+CD45RA-Tcm клеток-респондентов (Tresp) стимулировали Аг-специфически с использованием 3 мкл препарата реактива мультимеризации Streptactin, функционализированного с использованием 0,5 мкг комплексов пептидов : MHC класса I, оснащенных стрептавидин-связывающим пептидом (специфичный пептид представляет аминокислоты 114-124 (CPYSGTAYNSL, SEQ ID №41) белка гексон 5 аденовируса), ограниченные с помощью HLA-B07) и 0,5 мкг αCD28 Fab. В качестве альтернативы, 4,5 мкл препарата реактива мультимеризации Streptactin, нагруженного с использованием 0,5 мкг этого комплекса пептида : MHC класса I, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab. Для сравнения, поликлональную стимуляцию осуществляли, с использованием 3 мкл препарата реактива мультимеризации Streptactin (1 мг/мл), нагруженного комбинацией из 0,5 мкг αCD3 Fab и 0,5 мкг αCD28 Fab. Снова, в качестве альтернативных условий стимуляции, описанных выше, использовали 4,5 мкл препарата мультимеров Streptactin, нагруженных с использованием 0,5 мкг αCD3 Fab, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab. Не обработанные (не стимулированные) клетки Tresp служили в качестве отрицательного контроля, и клетки Tresp, стимулированные поликлонально бусами против CD3/против CD28, в качестве положительного контроля. Клетки Tresp высевали в 48-луночных планшетах в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2 и 5 нг/мл IL-15. Клетки инкубировали при 37°C с заменой среды каждые 3 суток и анализировали число клеток после 7 и 14 суток. Изображения, приведенные на фиг. 21, представляют степень формирования кластера в сутки 5, образцовая Аг-специфическая стимуляция проиллюстрирована для HLA-B7/эпитопа гексона 5 аденовируса. Как можно видеть на фиг. 21, такие клетки, специфичные к антигену аденовируса, можно специфически размножать из исходной популяции CD3+CD62L+CD45RA-Tcm респондентов.
ПРИМЕР 17: Активация внутриклеточных сигнальных каскадов после стимуляции aCD19-CAR трансдуцированных клеток Jurkat мультимерами Streptamer
[0600] В этом примере исследовали активацию внутриклеточных сигнальных каскадов трансдуцированных клеток Jurkat, которые модифицировали для того, чтобы экспрессировать опухолеспецифичный химерный антигенный рецептор (CAR), а именно здесь CD19, и которые стимулировали с использованием олигомерного Strep-tactin® из примера 3 в качестве растворимого реактива мультимеризации.
[0601] С этой целью, 300000 клеток-респондентов Jurkat (Jresp) стимулировали (A) различными количествами смеси препаратов реактива мультимеризации Streptactin (1 мг/мл), функционализированного с использованием αCD3 Fab и αCD28 Fab-фрагментов, описанных здесь («×1» соответствует 3 мкг реактива мультимеризации Streptactin, функционализированного с использованием 0,5 мкг αCD3- и 0,5 мкг αCD28 Fab - это обеспечивает «поликлональный реактив мультимеризации, основанный на Streptactin»), или (B) 3 мкл препарата реактива мультимеризации Streptactin, функционализированного с использованием 0,5 мкг (×1) или 1 мкг (×2) внеклеточного домена (ECD) CD19 (естественный лиганд для αCD19-CAR - это обеспечивает «CAR-специфический реактив мультимеризации, основанный на Streptactin»), или 3 мкл препарата реактива мультимеризации Streptactin, нагруженного с использованием 0,5 мкг (×1) или 1 мкг (×2) αIgG, распознающего спейсер IgG4 в αCD19-CAR - это также обеспечивает «CAR-специфический реактив мультимеризации, основанный на мутеине стрептавидина). ECD из CD19, который оснащен гексагистидиновой меткой, получали из Sino Biological/Life Technologies (SEQ ID №49) и функционализировали для связывания с реактивом мультимеризации, основанном на стрептавидине, посредством смешивания ECD из CD19 с адаптерной молекулой His-STREPPER (IBA GmbH, Germany, номер заказа 2-0920-005) в молекулярном соотношении 1:1 и инкубации в течение 15 мин при комнатной температуре. Адаптерная молекула His-STREPPER содержит хелатирующую часть, которая связывается с гексагистидиновой меткой, и стрептавидин-связывающий пептид, тем самым временно предоставляя молекулу-мишень, здесь ECD из CD19 со стрептавидин-связывающим пептидом, которая может обратимо связываться с реактивом мультимеризации, основанным на мутеине стрептавидина. Jresp, стимулированные бусами против CD3/против CD28 (бусами, имеющими необратимо иммобилизованные на них αCD3- и αCD28 - моноклональные антитела) или PMA и иономицином, служили в качестве положительных контролей. Клетки Jresp высевали в 1,5 мл пробирки Eppendorf в 200 мкл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубировали при 37°C и помещали на лед и лизировали после 0-20 мин стимуляции. Обнаружение фосфорилированного ERK указывает активную MAPK передачу сигналов, окрашивание β-актина домашнего хозяйства указывает на загрузку равных количеств общего белка на условие и момент времени. Как можно видеть из сравнения фиг. 22A, где представлена активация клеток Jurkat через «поликлональный реактив мультимеризации Streptactin», и фиг. 22B, где представлена активация клеток Jurkat через два «CAR-специфических реактива мультимеризации, основанных на Streptactin», клетки Jurkat можно активировать/размножать через связывание внеклеточного домена CD19 с CD19-специфическим химерным антигенным рецептором. Поскольку последующую генетическую обработку T-клеток выполняли почти исключительно на предварительно отобранных популяциях клеток, родовая активация через сшивку введенных CAR через домен спейсера IgG4 (это сохраняли в различных CAR с различными специфичностями) расширяет применимость для обратимой стимуляции/размножения клеток в этих ситуациях обработки клеток in vitro.
[0602] Таким образом, этот эксперимент показывает, что в принципе любую популяцию клеток, которую активируют посредством связывания средства (лиганда), который обеспечивает первичный сигнал активации для популяции клеток, можно размножать с использованием первого средства, обратимо иммобилизованного на реактиве мультимеризации, как описано здесь.
ПРИМЕР 18: Параллельное антиген-специфическое размножение Tcm клеток-респондентов из одного пула
[0603] В этом примере исследуют кинетику параллельного антиген-специфического (Аг-специфического) размножения из одного пула T-клеток-респондентов, стимулированных in vitro несколькими обратимыми мультимерами Streptamer пептид : MHC/αCH28 Fab.
[0604] 500000 CD3+CD62L+CD45RA-Tcm клеток-респондентов (Tresp) одновременно стимулируют по нескольким Аг-специфичностям, используя для каждой специфичности 3 мкл мультимеров Streptactin, функционализированных с использованием 0,5 мкг соответствующих комплексов пептидов : MHC класса I, которые несут стрептавидин-связывающий пептид, и 0,5 мкг αCD28 Fab, который также несет стрептавидин-связывающий пептид. В качестве альтернативного подхода, как описано здесь, для каждой специфичности используют 4,5 мкл реактива мультимеризации, основанного на Streptactin, функционализированного с использованием 0,5 мкг комплексов пептидов : MHC класса I, несущего стрептавидин-связывающий пептид, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab. Для сравнения осуществляют поликлональную стимуляцию с использованием 3 мкл препарата реактива мультимеризации, основанного на Streptactin (1 мг/мл), обратимо нагруженного комбинацией из 0,5 мкг αCD3 Fab и 0,5 мкг αCD28 Fab. Также, в качестве альтернативных условий стимуляции, описанных выше, можно использовать 4,5 мкл препарата реактива мультимеризации, основанного на Streptactin, обратимо нагруженного с использованием 0,5 мкг αCD3 Fab, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab (каждый из них несет стрептавидин-связывающий пептид. Не обработанные (не стимулированные) клетки Tresp служат в качестве отрицательного контроля, и клетки Tresp, стимулированные поликлонально бусами против CD3/против CD28 (бусами, покрытыми αCD3- и αCD28-mAb), в качестве положительного контроля. Клетки Tresp высевают в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2 и 5 нг/мл IL-15. Клетки инкубируют при 37°C с заменой среды каждые 3 суток и число клеток анализируют после 7 и 14 суток.
ПРИМЕР 19: Предпочтительная пролиферация CD8+ T-клеток среди CD3+ T-клеток-респондентов, стимулированных in vitro реактивами мультимеризации, основанными на стрептавидине, которые обратимо функционализированы αCD3/αCD8/αCD28 Fab-фрагментами
[0605] 300000 CD3+ T-клеток-респондентов (Tresp) стимулируют с использованием 3 мкл препарата мультимеризации Streptactin (1 мг/мл) или препарата реактива мультимеризации с использованием большого остова Streptactin (0,1 мг/мл), нагруженного с использованием комбинации из 0,5 мкг αCD3 и 0,5 мкг αCD28 Fab, или 4,5 мкл препарата реактив мультимеризации, основанного на Streptactin, нагруженного с использованием 0,5 мкг αCD3, 0,5 мкг αCD8 Fab и 0,5 мкг αCD28 Fab, или 3 мкл смеси препаратов реактива мультимеризации, основанного на Streptactin, с 0,5 мкг только αCD3 Fab и 0,5 мкг толко αCD28 Fab (каждый Fab-фрагмент также несет стрептавидин-связывающий пептид). Необработанные клетки Tresp служат в качестве отрицательного контроля, и Tresp, стимулированные бусами против CD3/против CD28 (бусами, покрытыми αCD3- и αCD28-mAb), в качестве положительного контроля. Клетки Tresp высевают в двух повторениях в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубируют при 37°C с заменой среды после 3 суток и анализируют после 6 суток.
ПРИМЕР 20: Предпочтительная пролиферация CD8+ T-клеток среди CD3+ T-клеток-респондентов, стимулированных in vitro реактивами мультимеризации, основанными на стрептавидине, которые обратимо функционализированы с использованием αCD3 и αCD28 Fab-фрагментов
[0606] 300000 CD3+ T-клеток-респондентов (Tresp) стимулируют различными количествами смеси препаратов реактива мультимеризации, основанного на Streptactin (1 мг/мл), функционализированного с использованием отдельно αCD3 Fab-фрагмента и отдельно αCD28 Fab-фрагмент (1,5 мкг реактива мультимеризации, основанного на Streptactin, функционализированного с использованием 0,5 мкг только αCD3 Fab-фрагмента, и 1,5 мкг реактива мультимеризации, основанного на Streptactin, функционализированного с использованием 0,5 мкг только αCD28 Fab-фрагмента), или различными количествами смеси препаратов реактива мультимеризации, основанного на Streptactin, функционализированного с использованием αCD3 Fab-фрагмента и αCD28 Fab-фрагмента с αCD8 Fab-фрагментом или без него (каждый Fab-фрагмент также несет стрептавидин-связывающий пептид) (3 мкг реактива мультимеризации, основанного на Streptactin, функционализированного с использованием 0,5 мкг αCD3- и 0,5 мкг αCD28 Fab-фрагмента - без αCD8 Fab-фрагмента, или 4,5 мкл препарата реактива мультимеризации Streptactin, нагруженного с использованием 0,5 мкг αCD3 Fab-фрагмента, 0,5 мкг αCD8 Fab-фрагмента и 0,5 мкг αCD28 Fab-фрагмента, где Fab-фрагмент также несет стрептавидин-связывающий пептид). Необработанные клетки Tresp служат в качестве отрицательного контроля, и Tresp, стимулированные бусами против CD3/против CD28 (бусами, покрытыми αCD3- и αCD28-mAb), в качестве положительного контроля. Клетки Tresp высевают в 48-луночные планшеты в 1 мл клеточной культуральной среды с добавлением 30 Ед/мл IL-2. Клетки инкубируют при 37°C с заменой среды после 3 суток и анализируют после 6 суток.
Пример 21: Использование реактива олигомерного мутеина стрептавидина в качестве адъюванта трансдукции
[0607] Создавали реактивы олигомерного мутеина стрептавидина, которые проявляли активность адъюванта трансдукции в исследованиях, демонстрирующих увеличенную трансдукцию T-клеток в присутствии этих реактивов, по сравнению с присутствием доступных усиливающих трансдукцию адъювантов.
Получение реактивов олигомерного мутеина стрептавидина
[0608] Олигомерную форму мутеина стрептавидина получали по существу, как описано в примере 1, посредством полимеризации мутеина стрептавидина, обозначаемого Strep-tactin® m1 (гомотетрамер стрептавидина, содержащий аминокислотную последовательность мутеина, приведенную в SEQ ID №6, см., например, патент США №6103493 и Voss и Skerra (1997) Protein Eng., 1:975-982) с использованием сульфо-SMCC (сульфосукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилата, продукт №22122 Thermo Scientific) и иминотиолана (продукт №26101 Thermo Scientific) по инструкциям производителя (Thermo Scientific). Молекулы олигомерного мутеина стрептавидина отделяли от мономерных (не прореагировавших) и димерных мутеинов стрептавидина посредством эксклюзионной хроматографии.
[0609] В этом исследовании реактивы олигомерного мутеина стрептавидина обратимо связывали с одним или несколькими Fab-фрагментами, которые содержали связывающие домены со специфичностью к молекуле(ам), экспрессируемой на поверхности T-клеток, и содержали стрептавидин-связывающие пептидные метки на карбокси-концах их тяжелых цепей. В этом исследовании использовали два различных реактива олигомерного мутеина стрептавидина, с которыми обратимо связаны: (1) Fab-фрагменты против CD3 и против CD28 и (2) Fab-фрагменты против CD8, соответственно. В этом исследовании, метки имели последовательную компоновку из двух стрептавидин-связывающих модулей, имеющих последовательность аминокислот SAWSHPQFEK(GGGS)2GGSAWSHPQFEK (SEQ ID №16), которые допускали обратимое связывание Fab-фрагментов с индивидуальными частями мутеина стрептавидина реактива олигомерного мутеина стрептавидина. Чтобы вызывать обратимое связывание, меченные пептидами Fab-фрагменты смешивали с олигомерным мутеином стрептавидина, приблизительно при комнатной температуре, обратимо связывая их с реактивом через взаимодействие между метками и сайтами связывания на олигомерном реактиве.
Отбор и стимуляция T-клеток антитело-конъюгированными магнитными частицами
[0610] T-клетки выделяли через отбор на основании иммуноаффинности из образца мононуклеарных клеток периферической крови (PBMC) человека. Отобранные клетки стимулировали посредством культивирования с магнитными бусами, покрытыми фрагментами антител против CD3 и против CD28, при 37°C в течение приблизительно 72 часов, перед трансдукцией.
Трансдукция и размножение
[0611] Клетки получаемой стимулированной популяции подвергали трансдукции при различных условиях следующим образом.
[0612] Приблизительно 2,1×106 стимулированных T-клеток добавляли в индивидуальные лунки 24-луночного планшета в объеме 200 мкл. Гаммаретровирусные векторные частицы, содержащие нуклеиновую кислоту, кодирующую гетерологичную молекулу (в этом случае образцовый химерный антигенный рецептор (CAR)) смешивали с поликатионным адъювантом трансдукции (в этом случае, протамина сульфатом) (1) и получаемым из фибронектина адъювантом трансдукции, в этом случае RETRONECTIN® (адъювант трансдукции, основанный на фрагменте рекомбинантного фибронектина) (2) или одним из двух реактивов, основанных на олигомерном мутеине стрептавидина, обратимо связанным, соответственно, с Fab-фрагментами против CD3/CD28 (3) или Fab-фрагментами против CD8 (4). Каждую из соответствующих смесей после этого добавляли к клеткам стимулированной популяции T-клеток, в концентрации 3,6 инфекционной единицы (IU) вирусных векторных частиц на клетку, с тем же или приблизительно тем же клетки/объем жидкости при различных условиях. Конечный объем на лунку корректировали до 1,1 мл. Каждую получаемую композицию подвергали центрифугированию в течение приблизительно 1 часа и затем инкубировали в течение 24 часов при 37°C. Затем клетки размножали при 37°C в присутствии сред и IL-2. Среды заменяли в 24 и 72 часа после трансдукции и клетки пассировали до 1×106 клеток-мишеней на мл посредством добавления объема.
[0613] В сутки 8 после активации (после приблизительно 5,7 удвоения популяции) определяли общее число ядросодержащих клеток в каждой композиции. В качестве меры эффективности трансдукции использовали анализ, основанный на проточной цитометрии, чтобы определять процентную долю жизнеспособных CD3+ клеток в композиции также были положительными по поверхностной экспрессии CAR (в этом случае обнаруживали с использованием меченного антитела козы против мыши, которое специфически связывается с частями вариабельных областей мыши во внеклеточном домене (ECD) CAR).
[0614] Результаты для условий (1)-(4), приведенных в таблице 1, показывали, что присутствие реактива олигомерного мутеина стрептавидина во время трансдукции вело к увеличенной эффективности трансдукции по сравнению с присутствием поликатионного адъюванта или адъюванта, основанного на фибронектине, что соответствует полезности таких реактивов в качестве нетоксичных адъювантов трансдукции. Схожие эффективности трансдукции наблюдали при использовании олигомерного реактива, обратимо связанного с Fab против CD3/против CD28 (3), по сравнению с олигомерным реактивом, обратимо связанным с Fab-фрагментами против CD8 (4). Это наблюдение показывало, что увеличенная процентная доля живых T-клеток в сутки 8, экспрессирующих гетерологичные CAR, являлось результатом усиления трансдукции и/или сниженных токсических эффектов по сравнению с другими адъювантами трансдукции, а не активирующих или стимулирующих эффектов, опосредованных с помощью CD3 и CD28 Fab, обратимо связанных с реактивом в (3).
Таблица 1:
Пример 22: Использование одного реактива олигомерного мутеина стрептавидина для активации T-клеток и усиления вирусной трансдукции
[0615] При другом наборе условий (5), отобранные T-клетки стимулировали в течение 24-48 часов по существу как описано для (1)-(4) в примере 21, за тем исключением, что стимуляцию осуществляли в присутствии реактива олигомерного мутеина стрептавидина, имеющего обратимо связанные с ним Fab-фрагменты против CD3/против CD28 вместо покрытых магнитных частиц против CD3/против CD28. Для этого условия трансдукцию гаммаретровирусными частицами осуществляли, как описано в примере 21, за исключением использования соотношения 1,0 IU вируса/клетка и без добавления дополнительного адъюванта трансдукции (помимо олигомерного реактива, используемого во время стимуляции).
[0616] Эффективность трансдукции в сутки 8 измеряли посредством оценки процентной доли живых T-клеток, имевших на поверхности CAR, которую анализировали, как описано в примере 21. Результаты (по сравнению с таковыми для (1) и (2) в таблице 1 представлены в таблице 2. Результаты показывали эффективную трансдукцию T-клеток после стимуляции клеток в присутствии реактива олигомерного мутеина стрептавидина против CD3/против CD28, без удаления реактива и без добавления отдельного или дополнительного адъюванта трансдукции. Кроме того, несмотря на приблизительно 70% снижение количества вируса (числа инфекционных единиц на клетку), используемого в этом условии (5), наблюдали сравнимую эффективность трансдукции, по сравнению с условиями (1 и 2), включающими стимуляцию с использованием покрытых магнитных бус против CD3/против CD28 и добавление других усиливающих трансдукцию адъювантов при инициации трансдукции. Таким образом, даже когда олигомерный реактив добавляли за сутки перед инициацией трансдукции (и без добавления любого дополнительного или добавочного адъюванта до или во время трансдукции), использование реактива олигомера мутеина стрептавидина увеличивало эффективность трансдукции до степени, сравнимой с другими усиливающими трансдукцию адъювантами.
[0617] В других исследованиях активация T-клеток с использованием различных стимулирующих реактив, после чего следовала трансдукция в присутствии различных адъювантов трансдукции, показывала, что при использовании реактивов олигомерного мутеина стрептавидина против CD3/против CD28 для активации T-клеток перед трансдукцией, наблюдали повышенную эффективность трансдукции (измеренную в виде процентной доли живых клеток, экспрессирующих кодируемый вирусным вектором гетерологичный белок) в выходной композиции, что соответствует заключению о том, что олигомерный реактив может усиливать трансдукцию даже при внедрении за часы или сутки до инициации трансдукции и что эффект может быть аддитивным усилению другими усиливающими трансдукцию адъювантами, такими как усиливающие трансдукцию средства, основанные на фрагменте фибронектина, или поликатионные усиливающие трансдукцию средства. Результаты показывали, что отдельные олигомерные реактивы можно использовать для активации и усиления или содействия вирусной трансдукции T-клеток, в этом исследовании при добавлении в один момент времени перед трансдукцией.
Таблица 2
Пример 23: Оценка усиленной трансдукции целевого подмножества клеток с использованием реактива олигомерного мутеина стрептавидина
[0618] Реактивы олигомера мутеина стрептавидина, как описано в примере 21, обратимо связанного с Fab-фрагментом со специфичностью к CD8, маркеру клеточной поверхности, экспрессируемому на T-клеточном подмножестве T-клеток, внедряли во время трансдукции не сортированных T-клеточных композиций. Композицию, содержащую не сортированные (CD4+ и CD8+) T-клетки, которую выделяли посредством отбора на основании иммуноаффинности из образцов, полученных из крови человека, стимулировали как описано в примере 21, в присутствии магнитных бус против CD3/против CD28, в течение 24-48 часов.
[0619] После стимуляции инициировали трансдукцию. Гаммаретровирусные векторные частицы, кодирующие CAR, смешивали с реактивом олигомерного мутеина стрептавидина против CD8 или поликатионным адъювантом трансдукции. Смеси вирусов/адъювантов добавляли к образцам стимулированных T-клеток для содействия трансдукции, после чего следовало размножение, по существу как описано в примере 21. Проточную цитометрию использовали для того, чтобы оценивать маркеры поверхности и поверхностную экспрессию CAR, как в примере 21. Для каждого условия процентную долю живых T-клеток с поверхностной экспрессией CAR сравнивали с процентной долей живых CD4+ T-клеток, на поверхности которых находился CAR.
[0620] Результаты представлены на фиг. 23, где показаны уровни поверхностной экспрессии CD4 (ось y) против CAR (ось x) в живых T-клетках гейта CD3+. Результаты показывали предпочтительно увеличенную эффективность трансдукции (как измеряют по процентной доле живых клеток, экспрессирующих гетерологичных продукт (CAR)) в CD8+ T-клетках (по сравнению с CD4+ T-клетками), по сравнению с эффективностью, наблюдаемой при осуществлении трансдукции в присутствии поликатионного адъюванта трансдукции.
[0621] В этом исследовании для клеток в контроле имитации трансдукции не наблюдали поддающуюся обнаружению экспрессию CAR, что указывает на специфичность анализа для оценки трансдукции гетерологичной нуклеиновой кислотой.
[0622] Результаты показывали, что, в дополнение к способности реактивов олигомерного мутеина стрептавидина увеличивать эффективность трансдукции, специфичность этих реактивов, обусловленную Fab, обратимо иммобилизованными на реактиве олигомерного мутеина стрептавидина, можно использовать для того, чтобы избирательно усиливать трансдукцию CD8+ клеток в смешанной популяции клеток. Результаты находятся в соответствии с полезностью олигомерных реактивов, содержащих обратимо связанные антитела со специфичностью к молекулам-мишеням, для предпочтительного усиления или содействия трансдукции клеток-мишеней, например, в смешанных популяциях клеток, в которых присутствует одна или более других популяций клеток, которые не содержат или не экспрессируют молекулу-мишень.
[0623] Не предусмотрено, что объем настоящего изобретения ограничен конкретными раскрытыми вариантами осуществления, которые предоставлены, например, чтобы иллюстрировать различные аспекты изобретения. Различные модификации в описанных композициях и способах будут видны из описания и положений в настоящем описании. Такие вариации можно осуществлять на практике, не отступая от истинных объема и сущности раскрытия, и они предназначены для того, чтобы входить в объем настоящего раскрытия.
ТАБЛИЦА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Вид: Streptomyces avidinii
UniProt №P22629
Вид: Streptomyces avidinii
Вид: Streptomyces avidinii
Вид: Streptomyces avidinii
Вид: Streptomyces avidinii
Вид: Streptomyces avidinii
Xaa выбирают из глутамина, аспарагина и метионина
Xaa1 представляет собой Trp, Lys или Arg;
Xaa2 представляет собой любую аминокислоту; Xaa3 представляет собой Gly или Glu
Xaa4 представляет собой Gly, Lys или Arg
Xaa1 представляет собой любую аминокислоту;
Xaa2 представляет собой Gly или Glu
Xaa3 представляет собой Gly, Lys или Arg
Xaa представляет собой любую аминокислоту; n представляет собой 8 или 12
n представляет собой 2 или 3
Вид: Streptomyces avidinii
Вид: Streptomyces avidinii
ICNVNHKPSN TKVDKKVEPK SCGSAWSHPQ FEKGGGSGGG SGGSAWSHPQFEK
QGLSSPVTKS FNRGECGS
Gly Arg Gly Glu Pro Arg Phe Ile Ala Val Gly Tyr Val Asp Asp Thr
Gln Phe Val Arg Phe Asp Ser Asp Ala Ala Ser Gln Arg Met Glu Pro Arg Ala Pro Trp Ile Glu Gln Glu Gly Pro Glu Tyr Trp Asp Glu Glu Thr Gly Lys Val Lys Ala His Ser Gln Thr Asp Arg Glu Asn Leu Arg Ile Ala Leu Arg Tyr Tyr Asn Gln Ser Glu Ala Gly Ser His Thr Leu Gln Met Met Phe Gly Cys Asp Val Gly Ser Asp Gly Arg Phe Leu Arg Gly Tyr His Gln Tyr Ala Tyr Asp Gly Lys Asp Tyr Ile Ala Leu Lys Glu Asp Leu Arg Ser Trp Thr Ala Ala Asp Met Ala Ala Gln Ile Thr Lys Arg Lys Trp Glu Ala Ala His Val Ala Glu Gln Gln Arg Ala Tyr Leu Glu Gly Thr Cys Val Asp Gly Leu Arg Arg Tyr Leu Glu Asn Gly Lys Glu Thr Leu Gln Arg Thr Asp Pro Pro Lys Thr His Met Thr His His Pro Ile Ser Asp His Glu Ala Thr Leu Arg Cys Trp Ala Leu Gly Phe Tyr Pro Ala Glu Ile Thr Leu Thr Trp Gln Arg Asp Gly Glu Asp Gln Thr Gln Asp Thr Glu Leu Val Glu Thr Arg Pro Ala Gly Asp Gly Thr Phe Gln Lys Trp Ala Ala Val Val Val Pro Ser Gly Glu Glu Gln Arg Tyr Thr Cys His Val Gln His Glu Gly Leu Pro Lys Pro Leu Thr Leu Arg Trp Glu Pro Pro Pro Ser Gly Ser Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Ser Ala Trp Ser His Pro Gln Phe Glu Lys
Gly Arg Gly Glu Pro Arg Phe Ile Ser Val Gly Tyr Val Asp Asp Thr
Gln Phe Val Arg Phe Asp Ser Asp Ala Ala Ser Pro Arg Glu Glu Pro
Arg Ala Pro Trp Ile Glu Gln Glu Gly Pro Glu Tyr Trp Asp Arg Asn
Thr Gln Ile Tyr Lys Ala Gln Ala Gln Thr Asp Arg Glu Ser Leu Arg
Asn Leu Arg Gly Tyr Tyr Asn Gln Ser Glu Ala Gly Ser His Thr Leu
Gln Ser Met Tyr Gly Cys Asp Val Gly Pro Asp Gly Arg Leu Leu Arg Gly His Asp Gln Tyr Ala Tyr Asp Gly Lys Asp Tyr Ile Ala Leu Asn Glu Asp Leu Arg Ser Trp Thr Ala Ala Asp Thr Ala Ala Gln Ile Thr Gln Arg Lys Trp Glu Ala Ala Arg Glu Ala Glu Gln Arg Arg Ala Tyr Leu Glu Gly Glu Cys Val Glu Trp Leu Arg Arg Tyr Leu Glu Asn Gly
Lys Asp Lys Leu Glu Arg Ala Asp Pro Pro Lys Thr His Val Thr His
His Pro Ile Ser Asp His Glu Ala Thr Leu Arg Cys Trp Ala Leu Gly
Phe Tyr Pro Ala Glu Ile Thr Leu Thr Trp Gln Arg Asp Gly Glu Asp
Gln Thr Gln Asp Thr Glu Leu Val Glu Thr Arg Pro Ala Gly Asp Arg Thr Phe Gln Lys Trp Ala Ala Val Val Val Pro Ser Gly Glu Glu Gln Arg Tyr Thr Cys His Val Gln His Glu Gly Leu Pro Lys Pro Leu Thr Leu Arg Trp Glu Pro Pro Pro Ser Gly Ser Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Ser Ala Trp Ser His Pro Gln Phe Glu Lys
Asp Thr Ala Val Ser Arg Pro Gly Arg Gly Glu Pro Arg Phe Ile Ser
Val Gly Tyr Val Asp Asp Thr Gln Phe Val Arg Phe Asp Ser Asp Ala Ala Ser Pro Arg Gly Glu Pro Arg Ala Pro Trp Val Glu Gln Glu Gly Pro Glu Tyr Trp Asp Arg Glu Thr Gln Lys Tyr Lys Arg Gln Ala Gln Ala Asp Arg Val Ser Leu Arg Asn Leu Arg Gly Tyr Tyr Asn Gln Ser Glu Asp Gly Ser His Thr Leu Gln Arg Met Ser Gly Cys Asp Leu Gly Pro Asp Gly Arg Leu Leu Arg Gly Tyr Asp Gln Ser Ala Tyr Asp Gly Lys Asp Tyr Ile Ala Leu Asn Glu Asp Leu Arg Ser Trp Thr Ala Ala Asp Thr Ala Ala Gln Ile Thr Gln Arg Lys Leu Glu Ala Ala Arg Ala Ala Glu Gln Leu Arg Ala Tyr Leu Glu Gly Thr Cys Val Glu Trp Leu Arg Arg Tyr Leu Glu Asn Gly Lys Glu Thr Leu Gln Arg Ala Glu Pro Pro Lys Thr His Val Thr His His Pro Leu Ser Asp His Glu Ala Thr Leu Arg Cys Trp Ala Leu Gly Phe Tyr Pro Ala Glu Ile Thr Leu Thr Trp Gln Arg Asp Gly Glu Asp Gln Thr Gln Asp Thr Glu Leu Val Glu Thr Arg Pro Ala Gly Asp Gly Thr Phe Gln Lys Trp Ala Ala Val Val Val Pro Ser Gly Gln Glu Gln Arg Tyr Thr Cys His Met Gln His Glu Gly Leu Gln Glu Pro Leu Thr Leu Ser Trp Glu Pro Ser Ser Gln Pro Thr Ile Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
Glu Asn Gly Lys Ser Asn Phe Leu Asn Cys Tyr Val Ser Gly Phe His Pro Ser Asp Ile Glu Val Asp Leu Leu Lys Asn Gly Glu Arg Ile Glu Lys Val Glu His Ser Asp Leu Ser Phe Ser Lys Asp Trp Ser Phe Tyr Leu Leu Tyr Tyr Thr Glu Phe Thr Pro Thr Glu Lys Asp Glu Tyr Ala Cys Arg Val Asn His Val Thr Leu Ser Gln Pro Lys Ile Val Lys Trp Asp Arg Asp Met
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Juno Therapeutics GmbH
Keenan BASHOUR
Semih U. TAREEN
<120> СПОСОБЫ, НАБОРЫ, СРЕДСТВА И УСТРОЙСТВА ДЛЯ ТРАНСДУКЦИИ
<130> 735042002840
<140> Не присвоено
<141> Параллельно с данной
<150> 62/245,265
<151> 2015-10-22
<150> 62/305,989
<151> 2016-03-09
<150> 62/369,020
<151> 2016-07-29
<160> 49
<170> FastSEQ для Windows версии 4.0
<210> 1
<211> 159
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Стрептавидин
<300>
<308> UniProt № P22629
<309> 1991-08-01
<400> 1
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser Ala Val Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 2
<211> 126
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Минимальный стрептавидин
<400> 2
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser
20 25 30
Ala Val Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 3
<211> 159
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Мутеин стрептавидина Val44-Thr45-Ala46-Arg47
<400> 3
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr Ala Arg Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 4
<211> 126
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Мутеин стрептавидина Val44-Thr45-Ala46-Arg47
<400> 4
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr
20 25 30
Ala Arg Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 5
<211> 159
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Мутеин стрептавидина Ile44-Gly45-Ala-46-Arg47
<400> 5
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Ile Gly Ala Arg Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 6
<211> 126
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Мутеин стрептавидина Ile44-Gly45-Ala-46-Arg47
<400> 6
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Ile Gly
20 25 30
Ala Arg Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 7
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Стрептавидин-связывающий пептид, Strep-tag
<400> 7
Trp Arg His Pro Gln Phe Gly Gly
1 5
<210> 8
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Strep-tag II
<400> 8
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 9
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Стрептавидин-связывающий пептид
<220>
<221> Вариант
<222> (3)...(3)
<223> Xaa представляет собой Gln, Asp или Met
<400> 9
His Pro Xaa
1
<210> 10
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> Стрептавидин-связывающий пептид
<400> 10
His Pro Gln Phe
1
<210> 11
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Стрептавидин-связывающий пептид
<220>
<221> Вариант
<222> (1)...(1)
<223> Xaa представляет собой Trp, Lys или Arg
<220>
<221> Вариант
<222> (2)...(2)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> Вариант
<222> (7)...(7)
<223> Xaa представляет собой Gly или Glu
<220>
<221> Вариант
<222> (8)...(8)
<223> Xaa представляет собой Gly, Lys или Arg
<400> 11
Xaa Xaa His Pro Gln Phe Xaa Xaa
1 5
<210> 12
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Стрептавидин-связывающий пептид
<220>
<221> Вариант
<222> (2)...(2)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> Вариант
<222> (7)...(7)
<223> Xaa представляет собой Gly или Glu
<220>
<221> Вариант
<222> (8)...(8)
<223> Xaa представляет собой Gly, Lys или Arg
<400> 12
Trp Xaa His Pro Gln Phe Xaa Xaa
1 5
<210> 13
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательные модули стрептавидин-связывающего пептида
<220>
<221> Вариант
<222> (9)...(9)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> Повтор
<222> (9)...(9)
<223> Повторяется 8 или 12 раз
<400> 13
Trp Ser His Pro Gln Phe Glu Lys Xaa Trp Ser His Pro Gln Phe Glu
1 5 10 15
Lys
<210> 14
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательные модули стрептавидин-связывающего пептида
<220>
<221> Повтор
<222> (9)...(12)
<223> Повторяется 2 или 3 раза
<400> 14
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Trp Ser His Pro
1 5 10 15
Gln Phe Glu Lys
20
<210> 15
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Twin-Strep-tag
<400> 15
Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Ser Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25 30
<210> 16
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Twin-Strep-tag
<400> 16
Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Ser Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
20 25 30
<210> 17
<211> 28
<212> Белок
<213> Искусственная последовательность
<220>
<223> Twin-Strep-tag
<400> 17
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 18
<211> 24
<212> Белок
<213> Искусственная последовательность
<220>
<223> Twin-Strep-tag
<400> 18
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Trp Ser His Pro Gln Phe Glu Lys
20
<210> 19
<211> 28
<212> Белок
<213> Искусственная последовательность
<220>
<223> Twin-Strep-tag
<400> 19
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 20
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HA-tag
<400> 20
Tyr Pro Tyr Asp Val Pro Asp Tyr Ala
1 5
<210> 21
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> VSV-G-метка
<400> 21
Tyr Thr Asp Ile Glu Met Asn Arg Leu Gly Lys
1 5 10
<210> 22
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HSV-метка
<400> 22
Gln Pro Glu Leu Ala Pro Glu Asp Pro Glu Asp
1 5 10
<210> 23
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эпитоп T7
<400> 23
Ala Ser Met Thr Gly Gly Gln Gln Met Gly
1 5 10
<210> 24
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эпитоп HSV
<400> 24
Gln Pro Glu Leu Ala Pro Glu Asp Pro Glu Asp
1 5 10
<210> 25
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эпитоп Myc
<400> 25
Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
1 5 10
<210> 26
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> V5-метка
<400> 26
Gly Lys Pro Ile Pro Asn Pro Leu Leu Gly Leu Asp Ser Thr
1 5 10
<210> 27
<211> 126
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Мутеин стрептавидина Val44-Thr45-Ala46-Arg47 и
Glu117, Gly120, Try121 (мутеин m1-9)
<400> 27
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr
20 25 30
Ala Arg Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Glu Asn Ala Gly Tyr Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 28
<211> 139
<212> Белок
<213> Streptomyces avidinii
<220>
<223> Мутеин стрептавидина Val44-Thr45-Ala46-Arg47 и
Glu117, Gly120, Try121 (мутеин m1-9)
<400> 28
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr Ala Arg Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Glu Asn Ala Gly Tyr Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
130 135
<210> 29
<211> 253
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная тяжелая цепь Fab-фрагмента m13B8.2
<400> 29
Ala Met Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro
1 5 10 15
Ser Gln Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr
20 25 30
Thr Phe Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Gly Val Ile Trp Ala Ser Gly Ile Thr Asp Tyr Asn Val Pro
50 55 60
Phe Met Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val
65 70 75 80
Phe Phe Lys Leu Asn Ser Leu Gln Pro Asp Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Ala Lys Asn Asp Pro Gly Thr Gly Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala Gly Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Gly Ser
210 215 220
Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly
225 230 235 240
Ser Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
245 250
<210> 30
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная легкая цепь Fab-фрагмента m13B8.2
<400> 30
Ala Met Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser
1 5 10 15
Val Gly Glu Thr Val Thr Phe Thr Cys Arg Ala Ser Glu Met Ile Tyr
20 25 30
Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu
35 40 45
Leu Val His Asp Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Gly Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Thr Leu
65 70 75 80
Gln Pro Glu Asp Phe Gly Thr Tyr Tyr Cys Gln Ala His Tyr Gly Asn
85 90 95
Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Gly Ile
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys Gly Ser
210 215
<210> 31
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная тяжелая цепь антитела против CD3 OKT3
<400> 31
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Thr Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 32
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная легкая цепь антитела против CD3 OKT3
<400> 32
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala His Phe Arg Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Gly Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn
100 105
<210> 33
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная тяжелая цепь антитела против CD28 CD28.3
<400> 33
Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Arg
1 5 10 15
Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Glu Tyr Ile Ile His
20 25 30
Trp Ile Lys Leu Arg Ser Gly Gln Gly Leu Glu Trp Ile Gly Trp Phe
35 40 45
Tyr Pro Gly Ser Asn Asp Ile Gln Tyr Asn Ala Lys Phe Lys Gly Lys
50 55 60
Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Val Tyr Met Glu Leu
65 70 75 80
Thr Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys Ala Arg Arg
85 90 95
Asp Asp Phe Ser Gly Tyr Asp Ala Leu Pro Tyr Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val
115
<210> 34
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная легкая цепь антитела против CD28 CD28.3
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Thr Asn Glu Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Ala Ala Thr His Leu Val Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Asn Tyr Tyr Cys Gln His Phe Trp Gly Thr Pro Cys
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 35
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Метка MAT
<400> 35
His Asn His Arg His Lys His Gly Gly Gly Cys
1 5 10
<210> 36
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH антитела против CD16 3G8
<400> 36
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Arg Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Gln Ile Asn Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 37
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL антитела против CD16 3G8
<400> 37
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Phe Asp
20 25 30
Gly Asp Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Thr Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Ala Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 38
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> антиген-специфичный пептид
<400> 38
Cys Arg Val Leu Cys Cys Tyr Val Leu
1 5
<210> 39
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эпитоп pp65 из CMV (аминокислоты 341-350)
<400> 39
Gln Tyr Asp Pro Val Ala Ala Leu Phe
1 5
<210> 40
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эпитоп pp65 из CMV (аминокислоты 265-274)
<400> 40
Arg Pro His Glu Arg Asn Gly Phe Thr Val
1 5 10
<210> 41
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Эпитоп гексона 5 аденовируса (аминокислоты 114-124)
<400> 41
Cys Pro Tyr Ser Gly Thr Ala Tyr Asn Ser Leu
1 5 10
<210> 42
<211> 314
<212> Белок
<213> Искусственная последовательность
<220>
<223> HLA-A*2402
<400> 42
Met Gly Ser His Ser Met Arg Tyr Phe Ser Thr Ser Val Ser Arg Pro
1 5 10 15
Gly Arg Gly Glu Pro Arg Phe Ile Ala Val Gly Tyr Val Asp Asp Thr
20 25 30
Gln Phe Val Arg Phe Asp Ser Asp Ala Ala Ser Gln Arg Met Glu Pro
35 40 45
Arg Ala Pro Trp Ile Glu Gln Glu Gly Pro Glu Tyr Trp Asp Glu Glu
50 55 60
Thr Gly Lys Val Lys Ala His Ser Gln Thr Asp Arg Glu Asn Leu Arg
65 70 75 80
Ile Ala Leu Arg Tyr Tyr Asn Gln Ser Glu Ala Gly Ser His Thr Leu
85 90 95
Gln Met Met Phe Gly Cys Asp Val Gly Ser Asp Gly Arg Phe Leu Arg
100 105 110
Gly Tyr His Gln Tyr Ala Tyr Asp Gly Lys Asp Tyr Ile Ala Leu Lys
115 120 125
Glu Asp Leu Arg Ser Trp Thr Ala Ala Asp Met Ala Ala Gln Ile Thr
130 135 140
Lys Arg Lys Trp Glu Ala Ala His Val Ala Glu Gln Gln Arg Ala Tyr
145 150 155 160
Leu Glu Gly Thr Cys Val Asp Gly Leu Arg Arg Tyr Leu Glu Asn Gly
165 170 175
Lys Glu Thr Leu Gln Arg Thr Asp Pro Pro Lys Thr His Met Thr His
180 185 190
His Pro Ile Ser Asp His Glu Ala Thr Leu Arg Cys Trp Ala Leu Gly
195 200 205
Phe Tyr Pro Ala Glu Ile Thr Leu Thr Trp Gln Arg Asp Gly Glu Asp
210 215 220
Gln Thr Gln Asp Thr Glu Leu Val Glu Thr Arg Pro Ala Gly Asp Gly
225 230 235 240
Thr Phe Gln Lys Trp Ala Ala Val Val Val Pro Ser Gly Glu Glu Gln
245 250 255
Arg Tyr Thr Cys His Val Gln His Glu Gly Leu Pro Lys Pro Leu Thr
260 265 270
Leu Arg Trp Glu Pro Pro Pro Ser Gly Ser Ser Ala Trp Ser His Pro
275 280 285
Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
290 295 300
Ser Ala Trp Ser His Pro Gln Phe Glu Lys
305 310
<210> 43
<211> 314
<212> Белок
<213> Искусственная последовательность
<220>
<223> HLA-B*0702
<400> 43
Met Gly Ser His Ser Met Arg Tyr Phe Tyr Thr Ser Val Ser Arg Pro
1 5 10 15
Gly Arg Gly Glu Pro Arg Phe Ile Ser Val Gly Tyr Val Asp Asp Thr
20 25 30
Gln Phe Val Arg Phe Asp Ser Asp Ala Ala Ser Pro Arg Glu Glu Pro
35 40 45
Arg Ala Pro Trp Ile Glu Gln Glu Gly Pro Glu Tyr Trp Asp Arg Asn
50 55 60
Thr Gln Ile Tyr Lys Ala Gln Ala Gln Thr Asp Arg Glu Ser Leu Arg
65 70 75 80
Asn Leu Arg Gly Tyr Tyr Asn Gln Ser Glu Ala Gly Ser His Thr Leu
85 90 95
Gln Ser Met Tyr Gly Cys Asp Val Gly Pro Asp Gly Arg Leu Leu Arg
100 105 110
Gly His Asp Gln Tyr Ala Tyr Asp Gly Lys Asp Tyr Ile Ala Leu Asn
115 120 125
Glu Asp Leu Arg Ser Trp Thr Ala Ala Asp Thr Ala Ala Gln Ile Thr
130 135 140
Gln Arg Lys Trp Glu Ala Ala Arg Glu Ala Glu Gln Arg Arg Ala Tyr
145 150 155 160
Leu Glu Gly Glu Cys Val Glu Trp Leu Arg Arg Tyr Leu Glu Asn Gly
165 170 175
Lys Asp Lys Leu Glu Arg Ala Asp Pro Pro Lys Thr His Val Thr His
180 185 190
His Pro Ile Ser Asp His Glu Ala Thr Leu Arg Cys Trp Ala Leu Gly
195 200 205
Phe Tyr Pro Ala Glu Ile Thr Leu Thr Trp Gln Arg Asp Gly Glu Asp
210 215 220
Gln Thr Gln Asp Thr Glu Leu Val Glu Thr Arg Pro Ala Gly Asp Arg
225 230 235 240
Thr Phe Gln Lys Trp Ala Ala Val Val Val Pro Ser Gly Glu Glu Gln
245 250 255
Arg Tyr Thr Cys His Val Gln His Glu Gly Leu Pro Lys Pro Leu Thr
260 265 270
Leu Arg Trp Glu Pro Pro Pro Ser Gly Ser Ser Ala Trp Ser His Pro
275 280 285
Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
290 295 300
Ser Ala Trp Ser His Pro Gln Phe Glu Lys
305 310
<210> 44
<211> 321
<212> Белок
<213> Искусственная последовательность
<220>
<223> HLA-C*0702
<400> 44
Met Ala Leu Thr Glu Thr Trp Ala Cys Ser His Ser Met Arg Tyr Phe
1 5 10 15
Asp Thr Ala Val Ser Arg Pro Gly Arg Gly Glu Pro Arg Phe Ile Ser
20 25 30
Val Gly Tyr Val Asp Asp Thr Gln Phe Val Arg Phe Asp Ser Asp Ala
35 40 45
Ala Ser Pro Arg Gly Glu Pro Arg Ala Pro Trp Val Glu Gln Glu Gly
50 55 60
Pro Glu Tyr Trp Asp Arg Glu Thr Gln Lys Tyr Lys Arg Gln Ala Gln
65 70 75 80
Ala Asp Arg Val Ser Leu Arg Asn Leu Arg Gly Tyr Tyr Asn Gln Ser
85 90 95
Glu Asp Gly Ser His Thr Leu Gln Arg Met Ser Gly Cys Asp Leu Gly
100 105 110
Pro Asp Gly Arg Leu Leu Arg Gly Tyr Asp Gln Ser Ala Tyr Asp Gly
115 120 125
Lys Asp Tyr Ile Ala Leu Asn Glu Asp Leu Arg Ser Trp Thr Ala Ala
130 135 140
Asp Thr Ala Ala Gln Ile Thr Gln Arg Lys Leu Glu Ala Ala Arg Ala
145 150 155 160
Ala Glu Gln Leu Arg Ala Tyr Leu Glu Gly Thr Cys Val Glu Trp Leu
165 170 175
Arg Arg Tyr Leu Glu Asn Gly Lys Glu Thr Leu Gln Arg Ala Glu Pro
180 185 190
Pro Lys Thr His Val Thr His His Pro Leu Ser Asp His Glu Ala Thr
195 200 205
Leu Arg Cys Trp Ala Leu Gly Phe Tyr Pro Ala Glu Ile Thr Leu Thr
210 215 220
Trp Gln Arg Asp Gly Glu Asp Gln Thr Gln Asp Thr Glu Leu Val Glu
225 230 235 240
Thr Arg Pro Ala Gly Asp Gly Thr Phe Gln Lys Trp Ala Ala Val Val
245 250 255
Val Pro Ser Gly Gln Glu Gln Arg Tyr Thr Cys His Met Gln His Glu
260 265 270
Gly Leu Gln Glu Pro Leu Thr Leu Ser Trp Glu Pro Ser Ser Gln Pro
275 280 285
Thr Ile Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly
290 295 300
Ser Gly Gly Gly Ser Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu
305 310 315 320
Lys
<210> 45
<211> 100
<212> Белок
<213> Искусственная последовательность
<220>
<223> B2 микроглобулин
<400> 45
Met Ile Gln Arg Thr Pro Lys Ile Gln Val Tyr Ser Arg His Pro Ala
1 5 10 15
Glu Asn Gly Lys Ser Asn Phe Leu Asn Cys Tyr Val Ser Gly Phe His
20 25 30
Pro Ser Asp Ile Glu Val Asp Leu Leu Lys Asn Gly Glu Arg Ile Glu
35 40 45
Lys Val Glu His Ser Asp Leu Ser Phe Ser Lys Asp Trp Ser Phe Tyr
50 55 60
Leu Leu Tyr Tyr Thr Glu Phe Thr Pro Thr Glu Lys Asp Glu Tyr Ala
65 70 75 80
Cys Arg Val Asn His Val Thr Leu Ser Gln Pro Lys Ile Val Lys Trp
85 90 95
Asp Arg Asp Met
100
<210> 46
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Метка VSV-G
<400> 46
Tyr Thr Asp Ile Glu Met Asn Arg Leu Gly Lys
1 5 10
<210> 47
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Метка из 10 аминокислот из коллаген-связывающего домена
фактора фон Виллебранда
<400> 47
Trp Arg Glu Pro Gly Arg Met Glu Leu Asn
1 5 10
<210> 48
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> Линкерный пептид
<400> 48
Gly Gly Gly Ser
1
<210> 49
<211> 283
<212> Белок
<213> Искусственная последовательность
<220>
<223> Внеклеточный домен CD19 человека с His-меткой
<400> 49
Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val
1 5 10 15
Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr
20 25 30
Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly
35 40 45
Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe
50 55 60
Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro
65 70 75 80
Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val
85 90 95
Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly
100 105 110
Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro
115 120 125
Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg
130 135 140
Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Leu Pro Pro Arg Asp Ser
145 150 155 160
Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr
165 170 175
Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro
180 185 190
Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser
195 200 205
Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu
210 215 220
Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr
225 230 235 240
Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr
245 250 255
Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys
260 265 270
Ala His His His His His His His His His His
275 280
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2761557C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2778411C2 |
| ОЛИГОМЕРНЫЕ РЕАГЕНТЫ В ВИДЕ ЧАСТИЦ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2777989C2 |
| РЕАГЕНТЫ ДЛЯ РАЗМНОЖЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЕ РЕЦЕПТОРЫ | 2018 |
|
RU2783956C2 |
| БЕЛКИ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ CD137 | 2016 |
|
RU2736312C2 |
| НОВЫЕ ПОЛИПЕПТИДЫ СО СПЕЦИФИЧЕСКИМ СВЯЗЫВАНИЕМ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2723034C2 |
| ВАРИАНТЫ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА-2 (IL2R) И ИНТЕРЛЕЙКИНА-2 (IL2) ДЛЯ СПЕЦИФИЧЕСКОЙ АКТИВАЦИИ ИММУННЫХ ЭФФЕКТОРНЫХ КЛЕТОК | 2020 |
|
RU2832154C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА С АФФИННОСТЬЮ В ОТНОШЕНИИ ГЛИПИКАНА-3 (GPC3) | 2016 |
|
RU2756318C2 |
| НОВЫЙ СЛИТЫЙ БЕЛОК, СПЕЦИФИЧНЫЙ ДЛЯ CD137 И PD-L1 | 2019 |
|
RU2818349C2 |
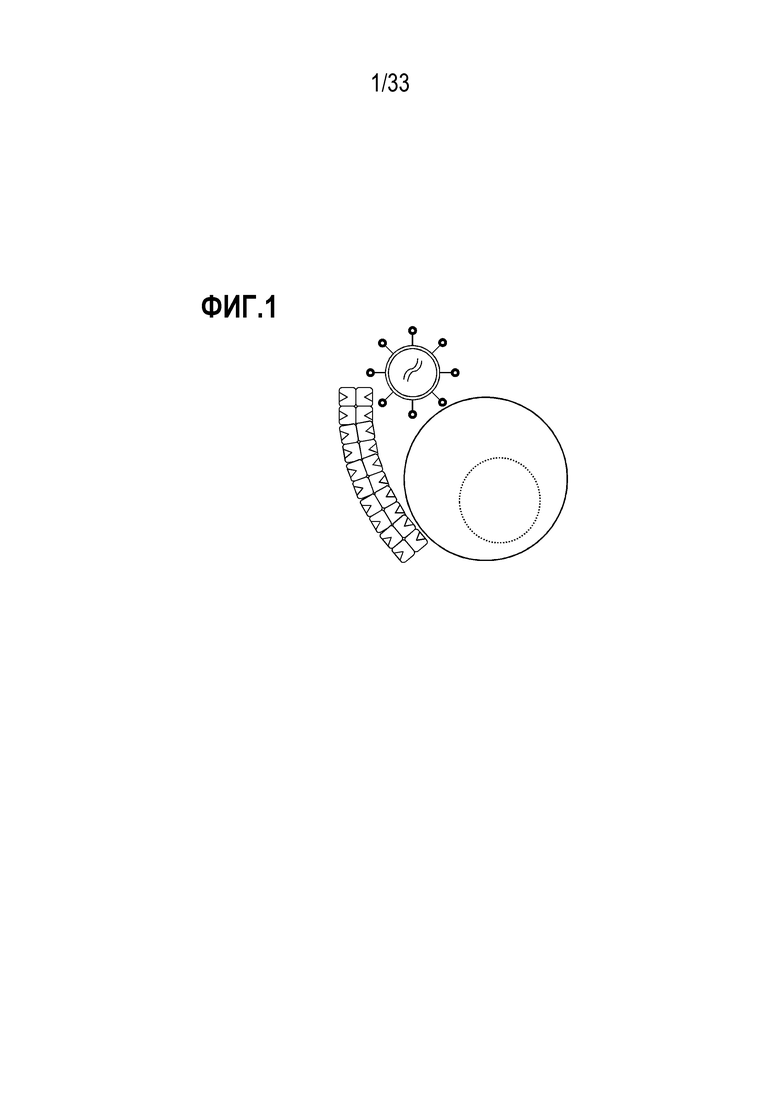
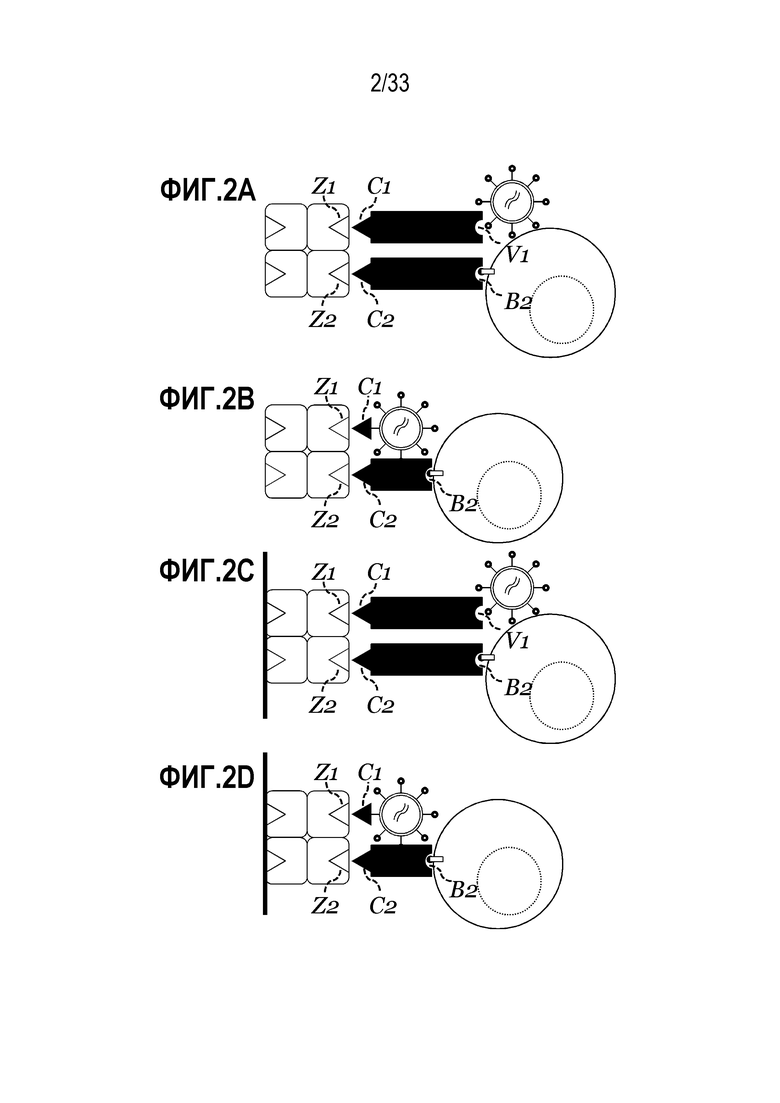

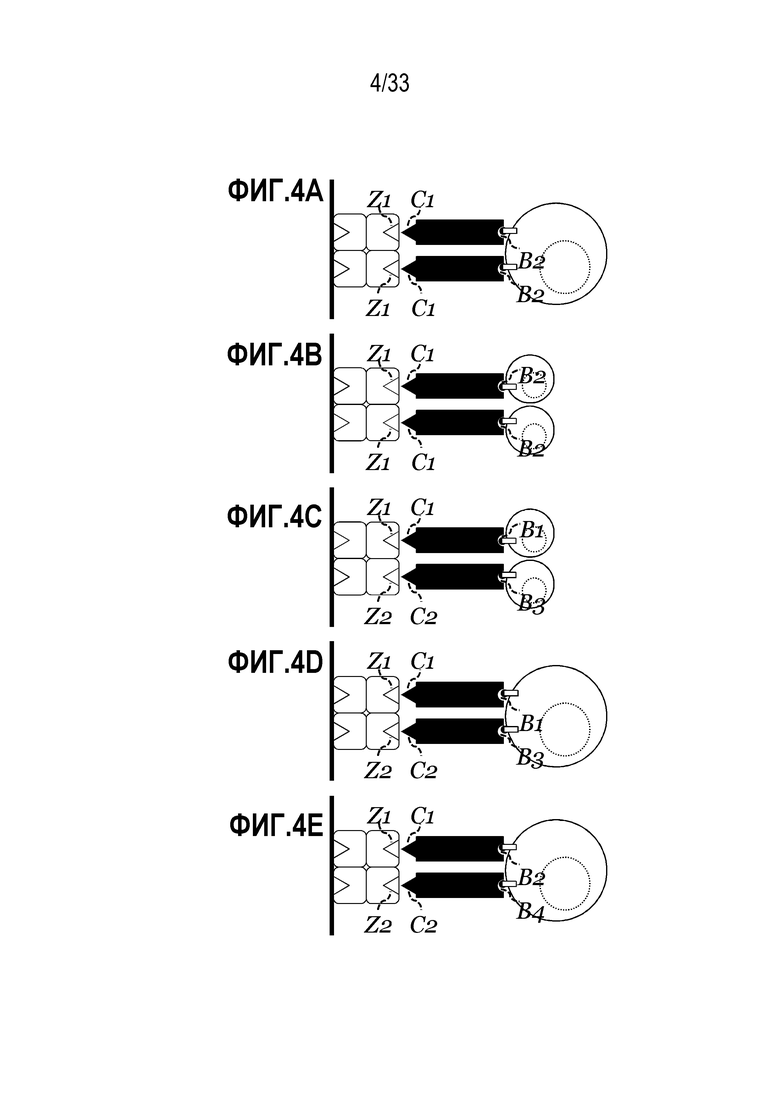
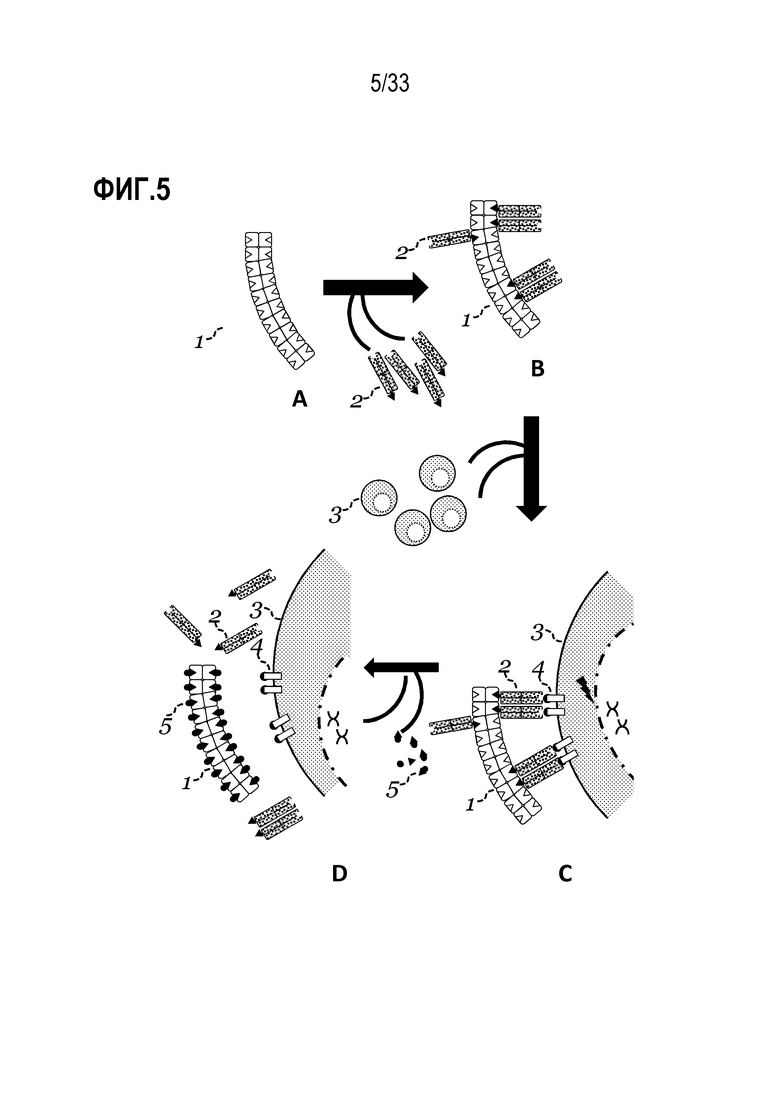
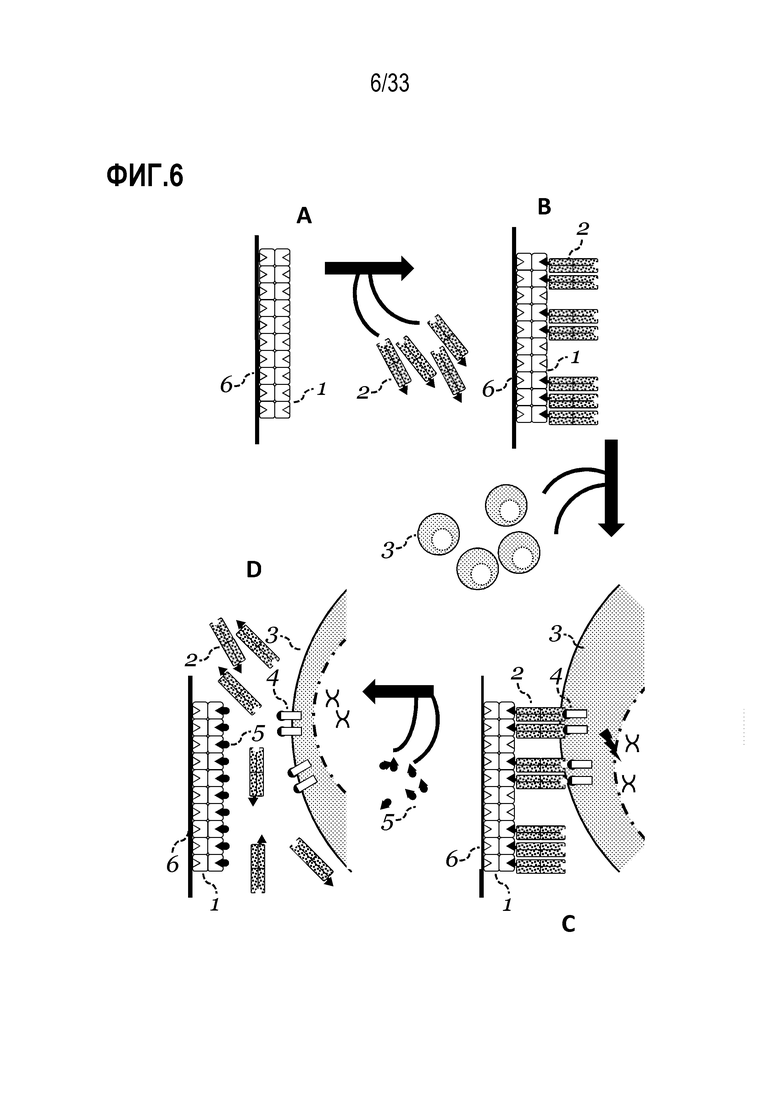
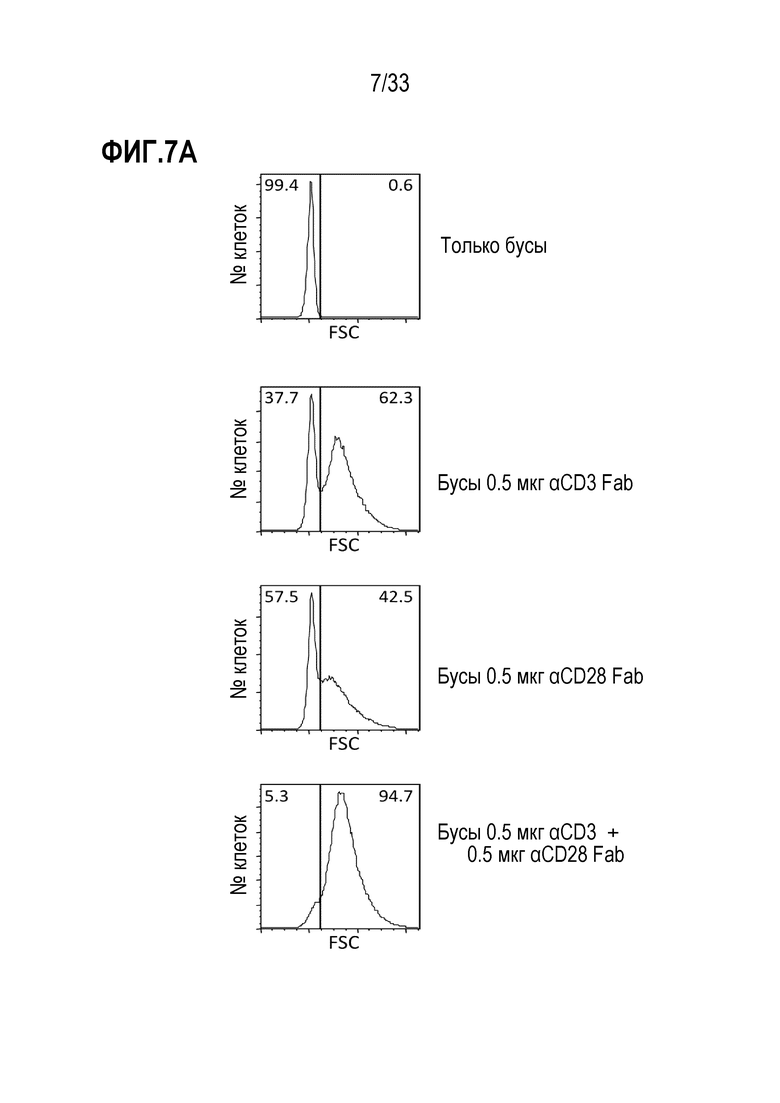
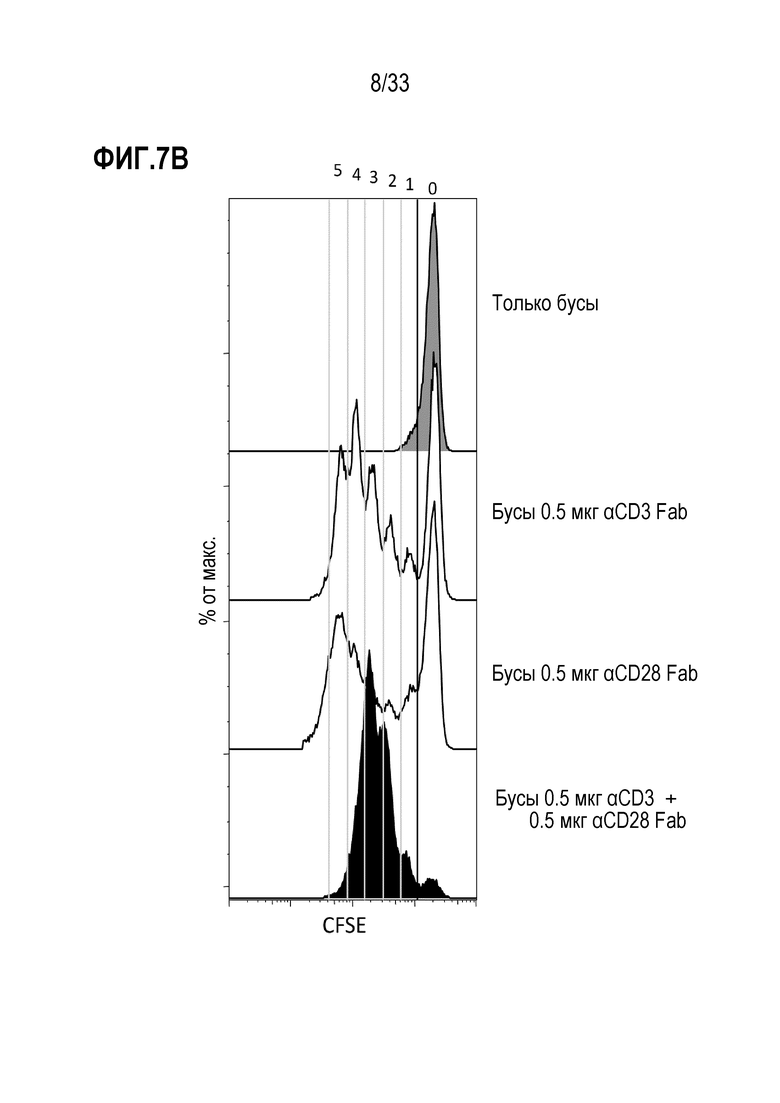
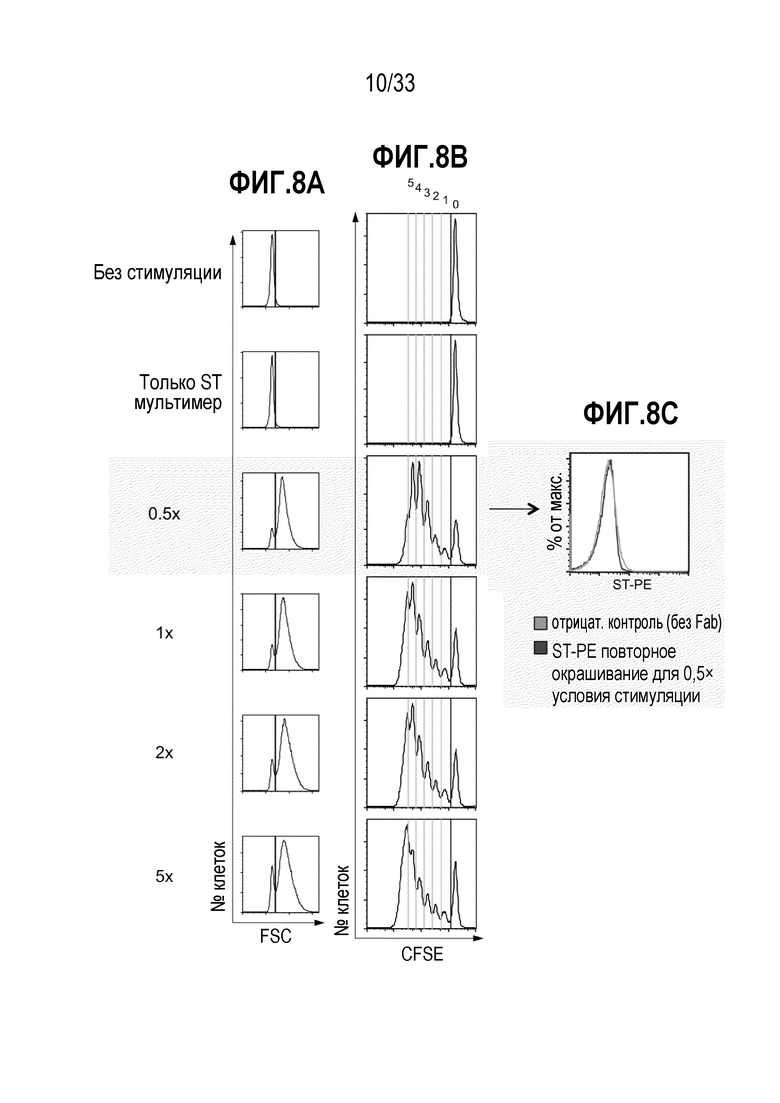
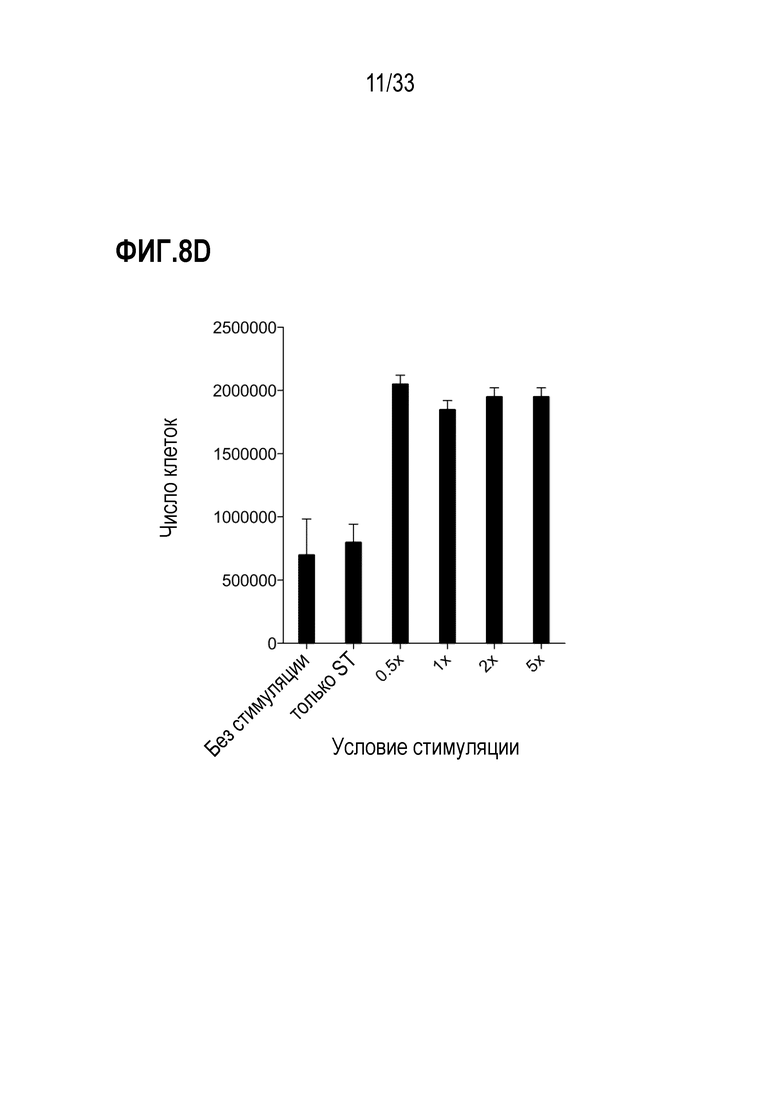

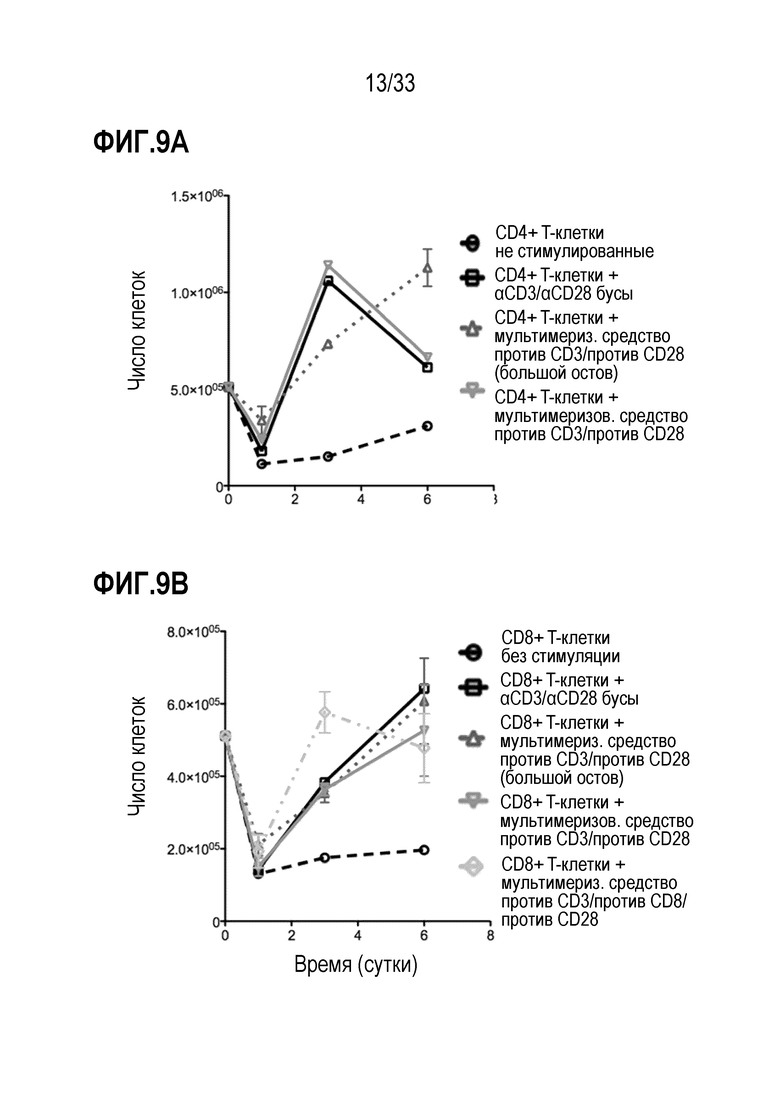
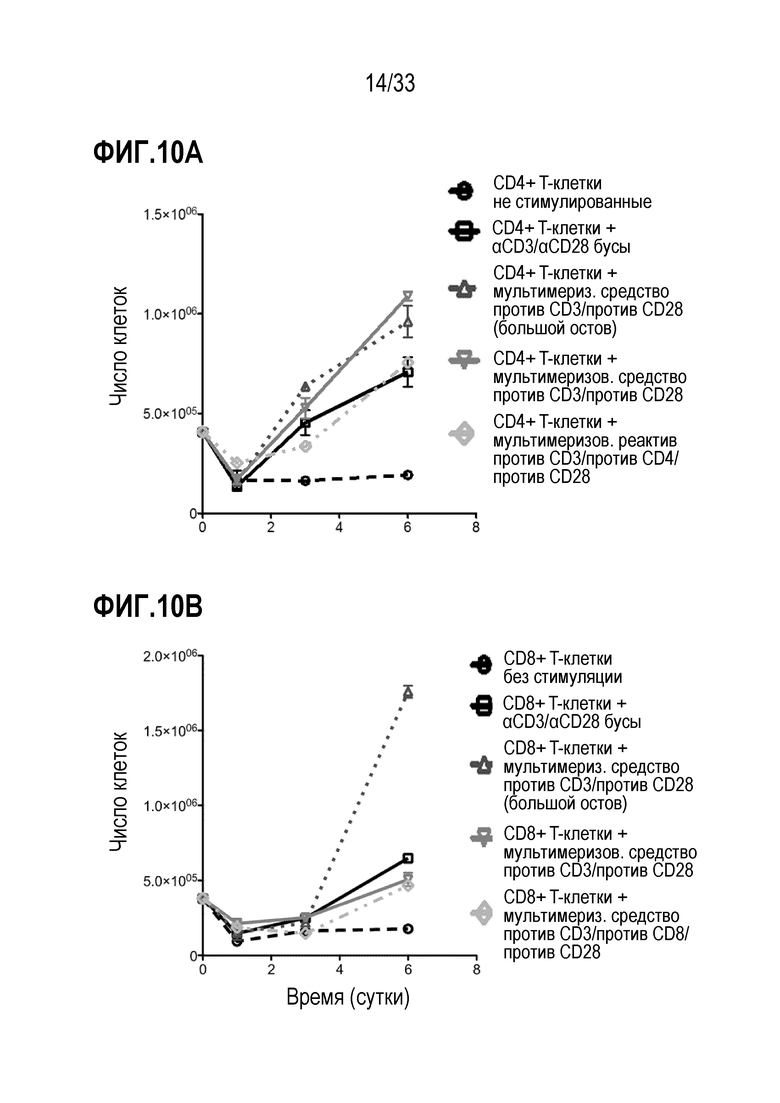
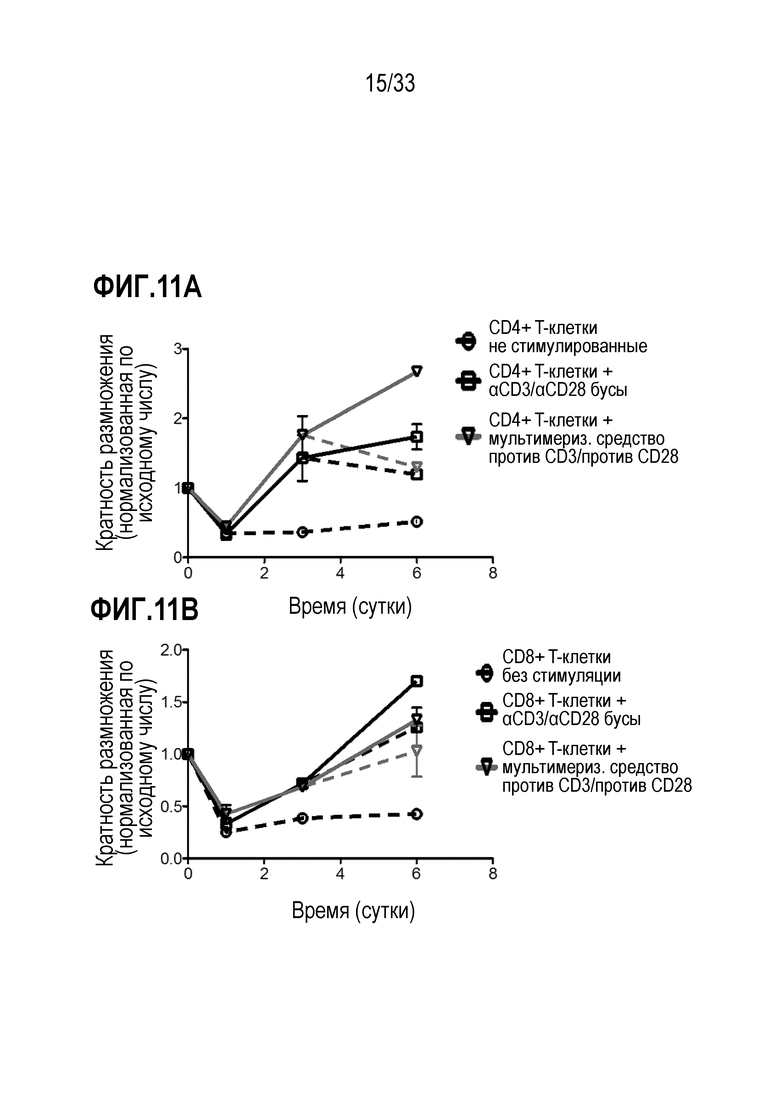
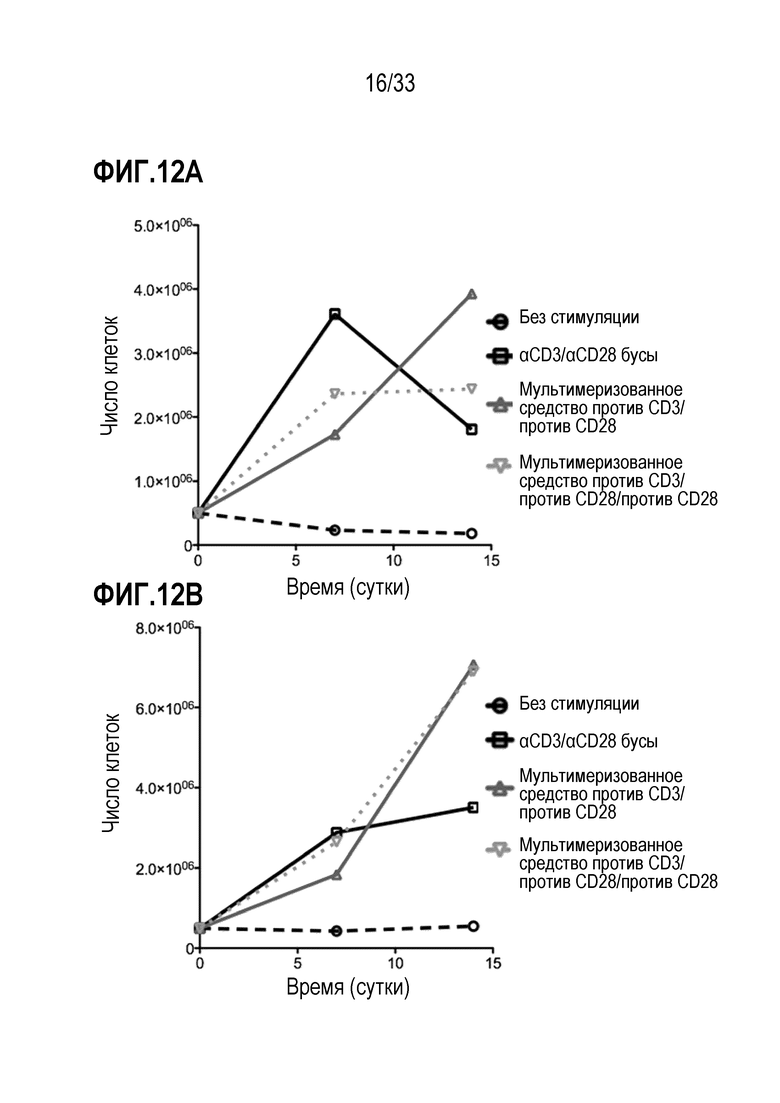
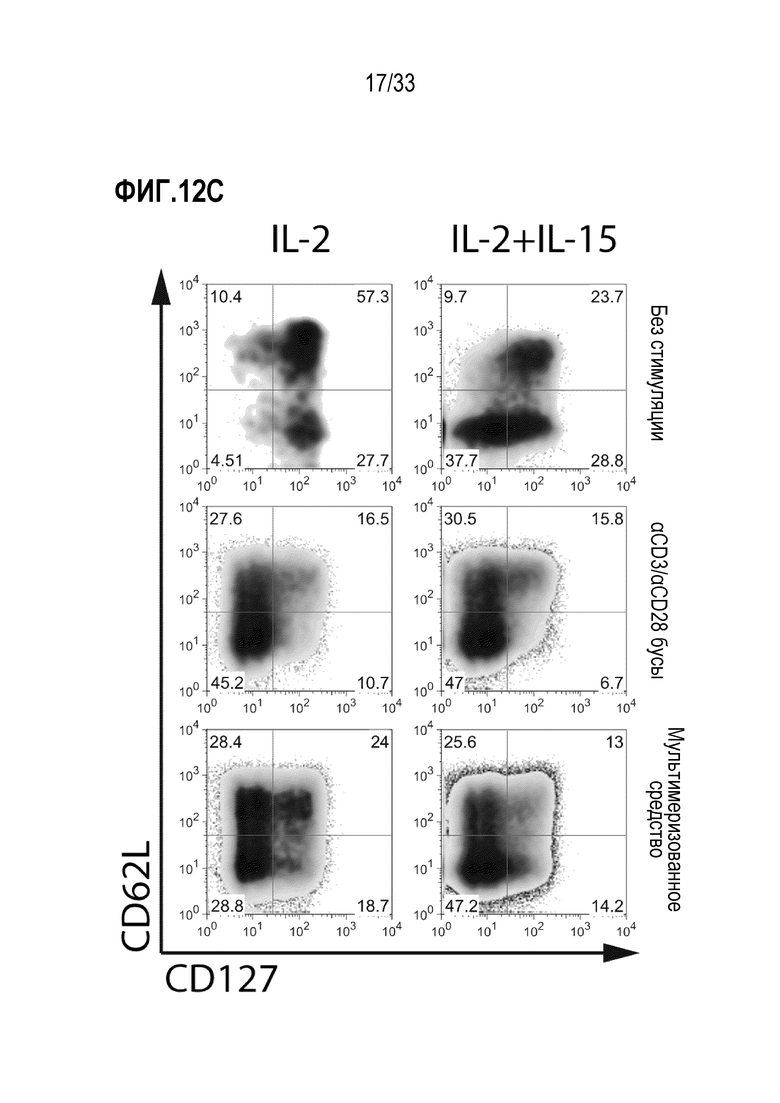
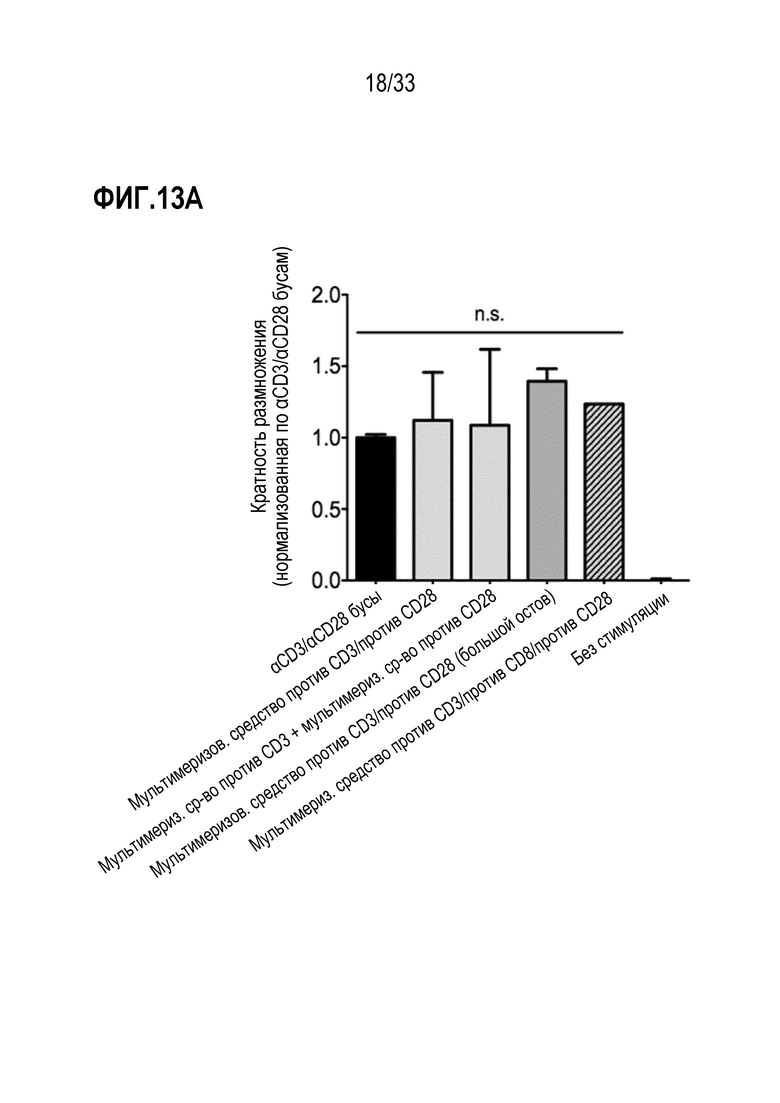
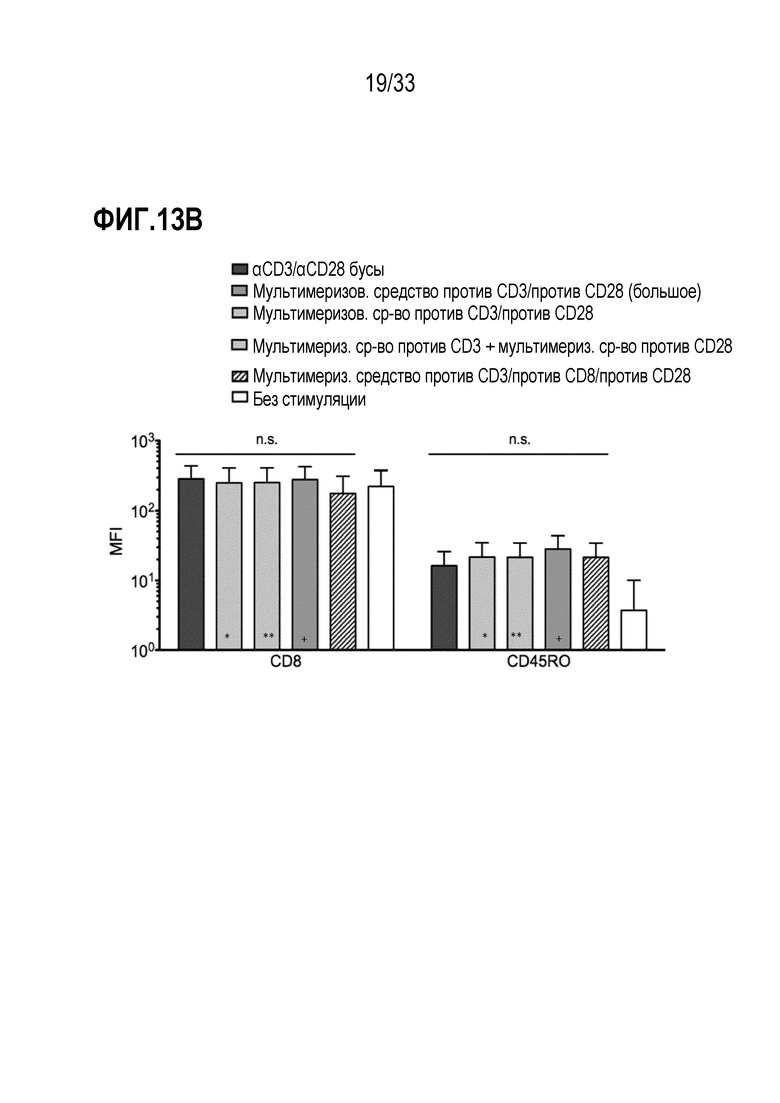
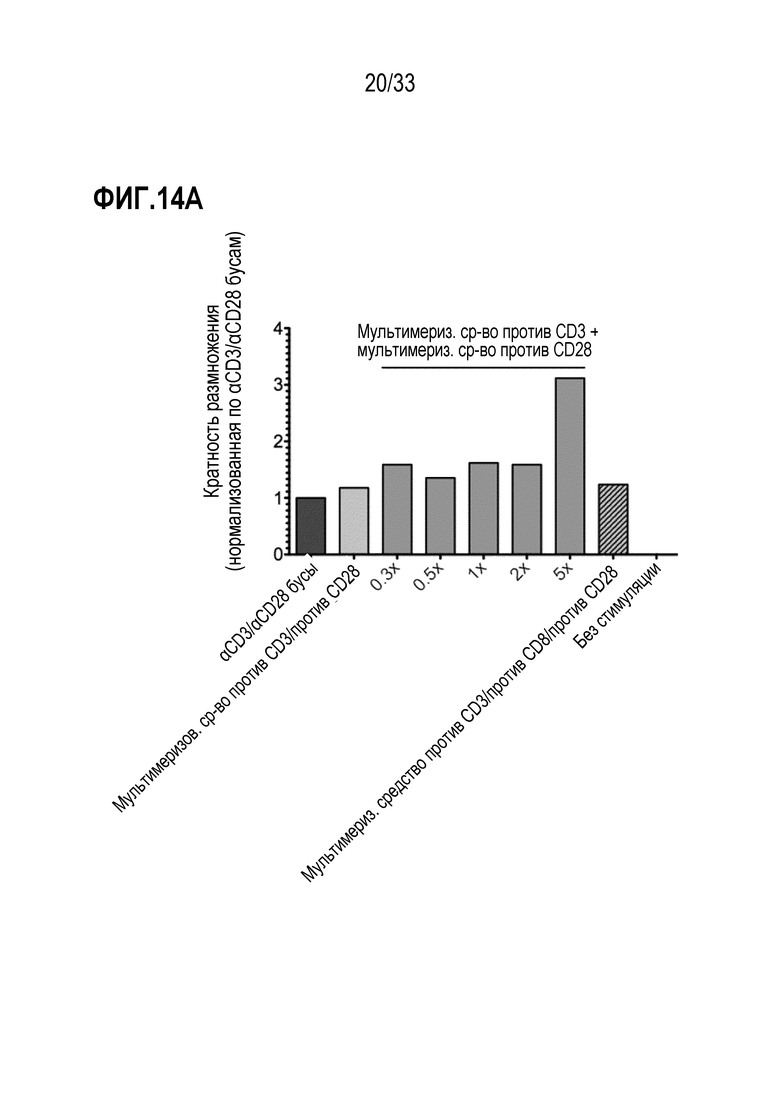
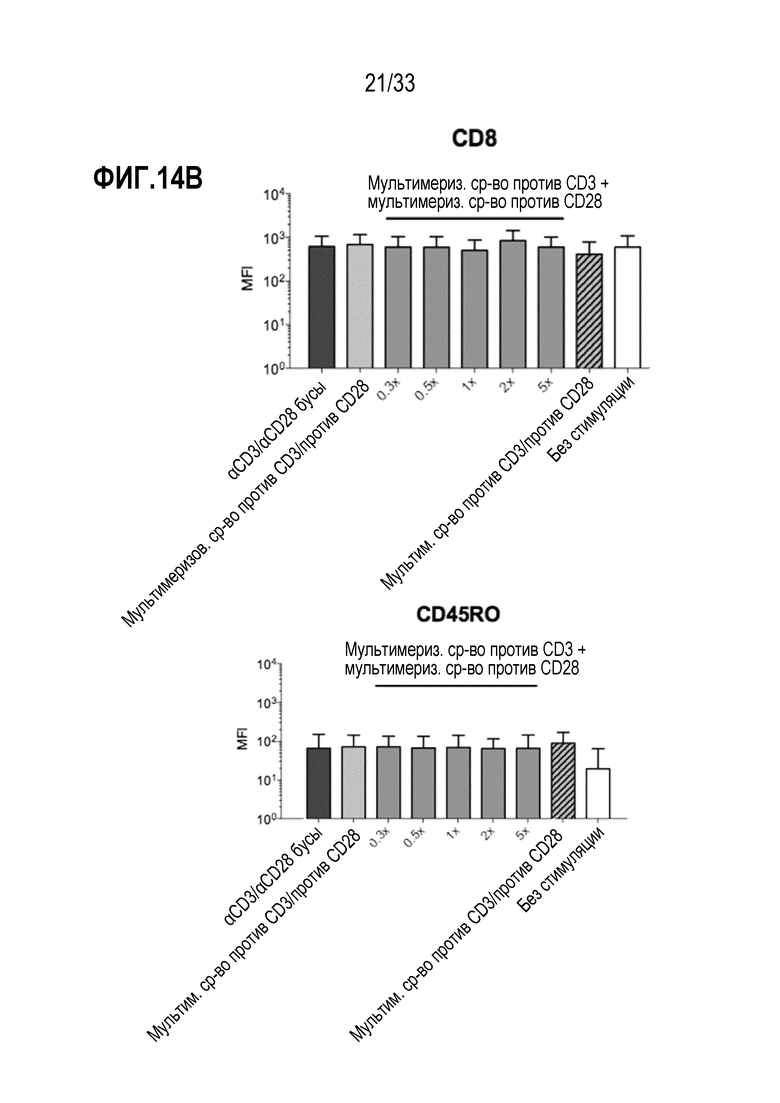
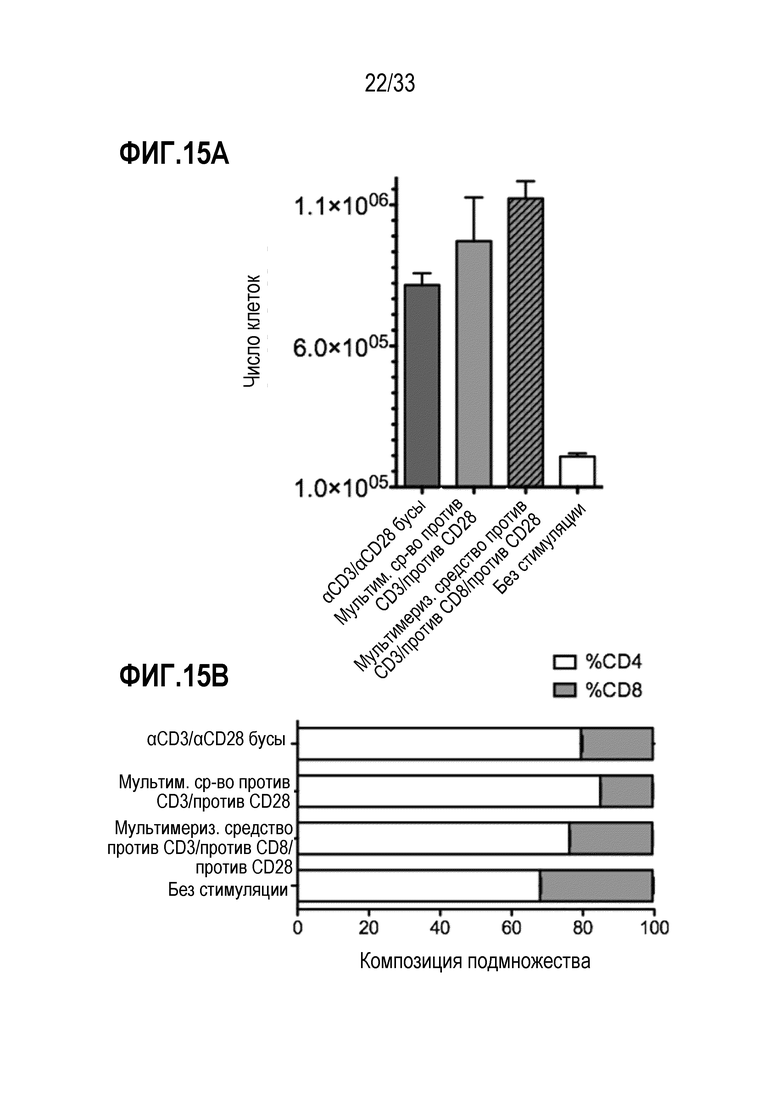
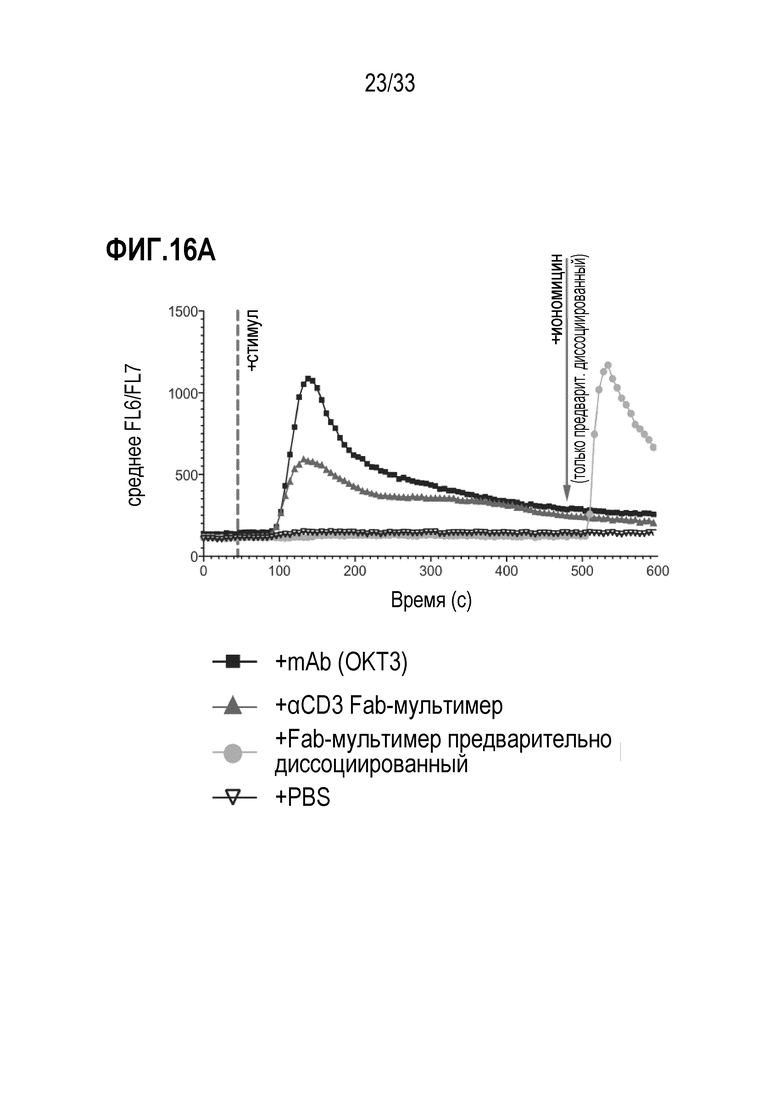
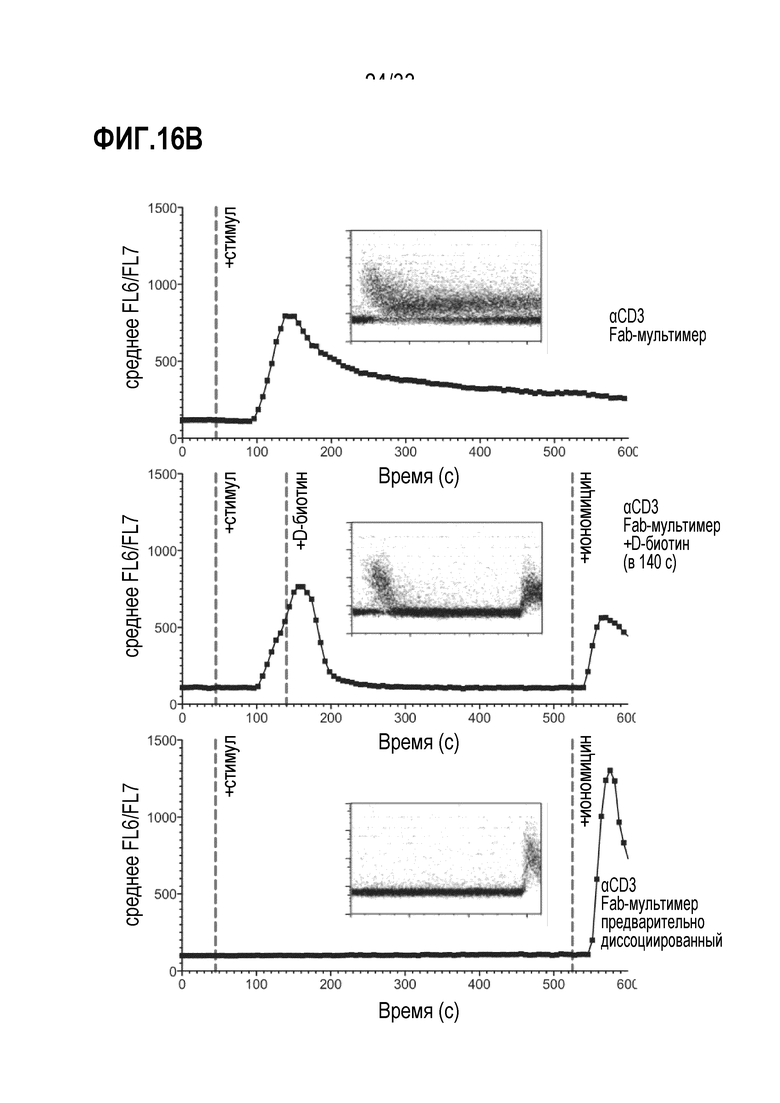
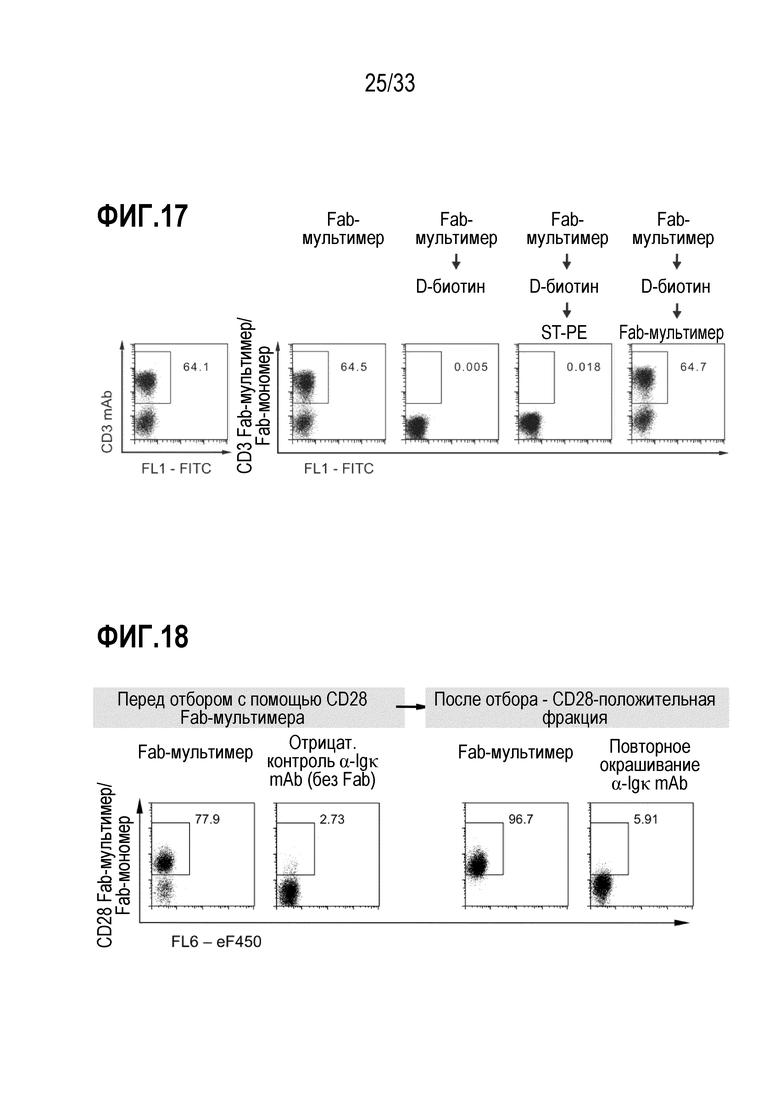
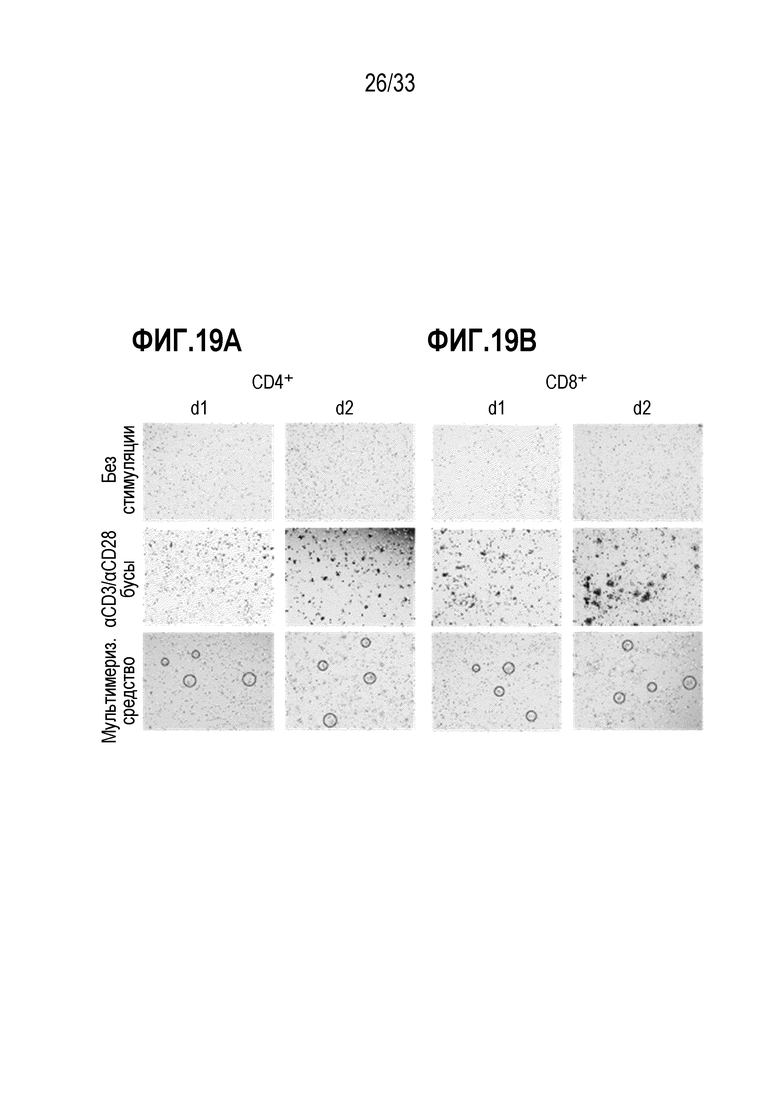
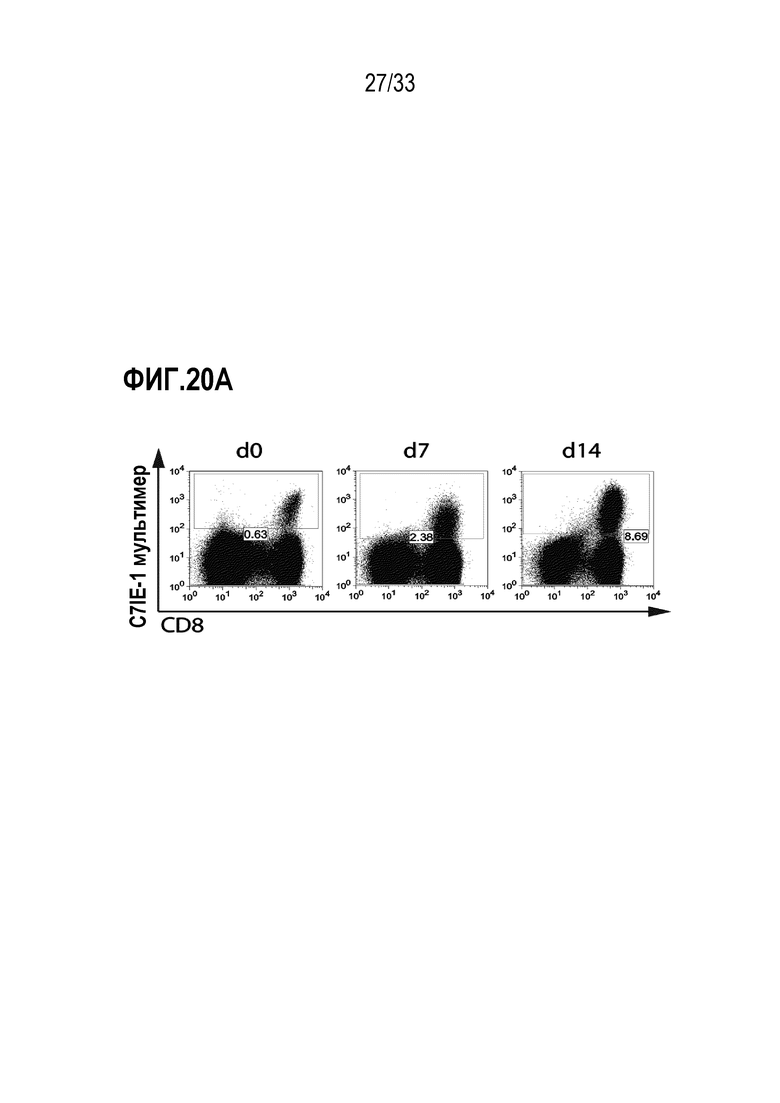
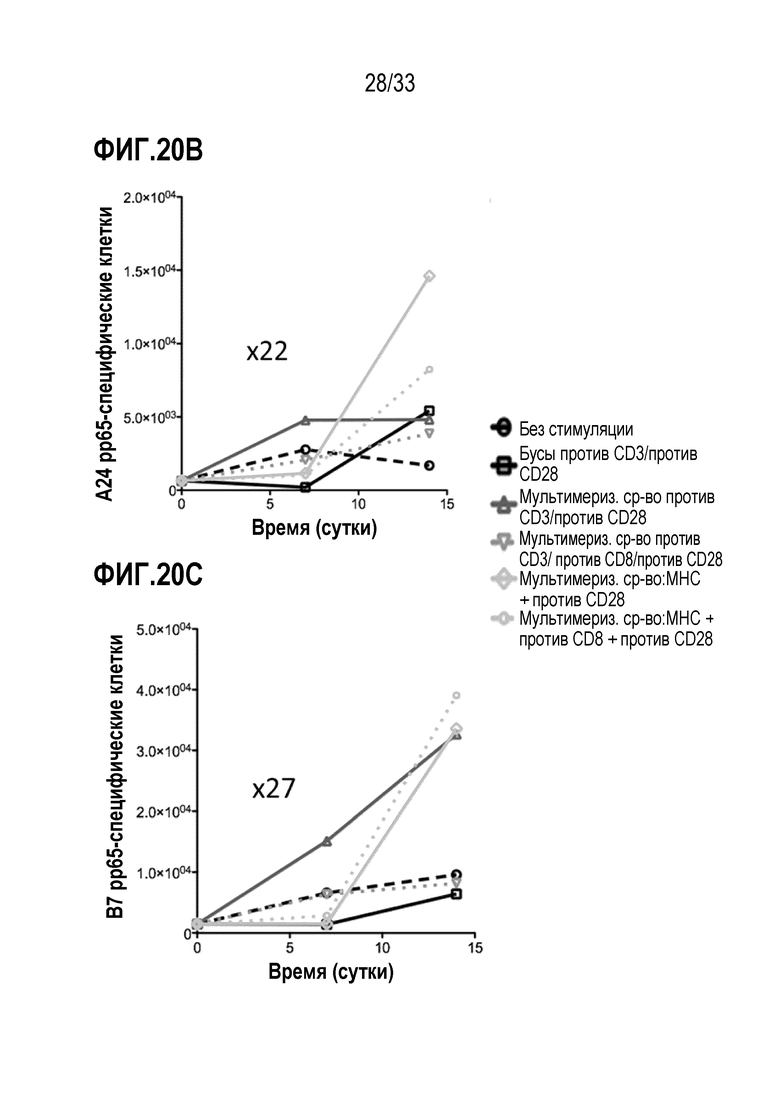
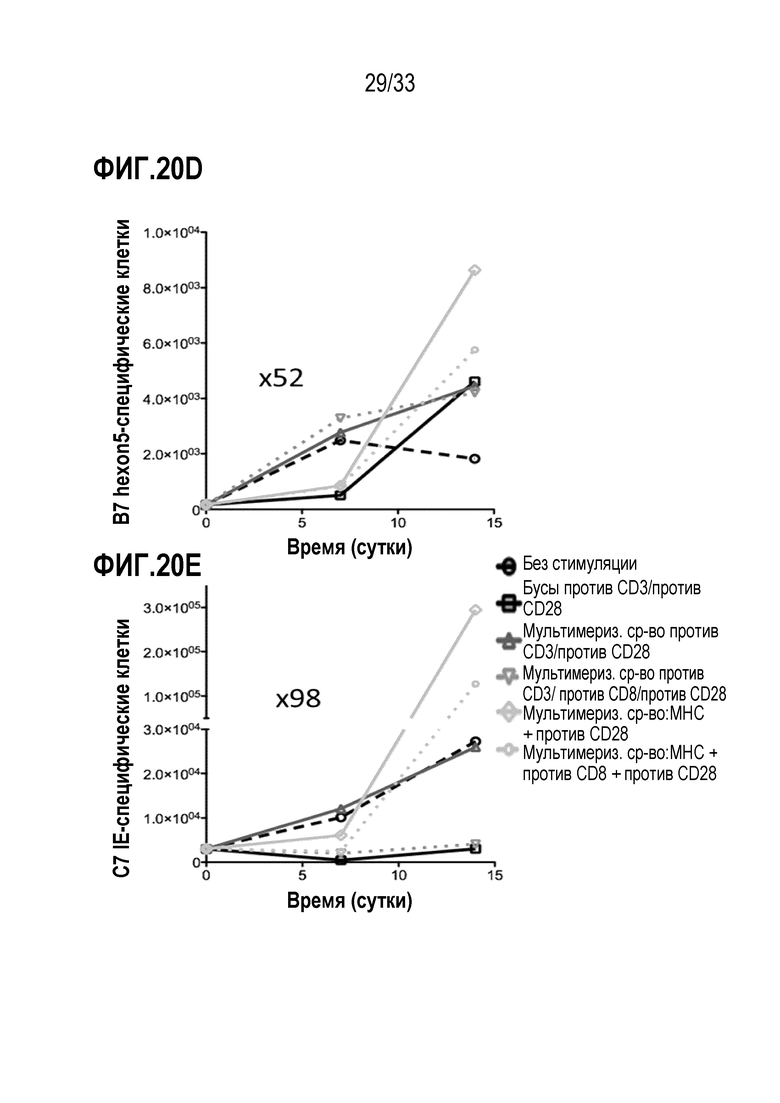

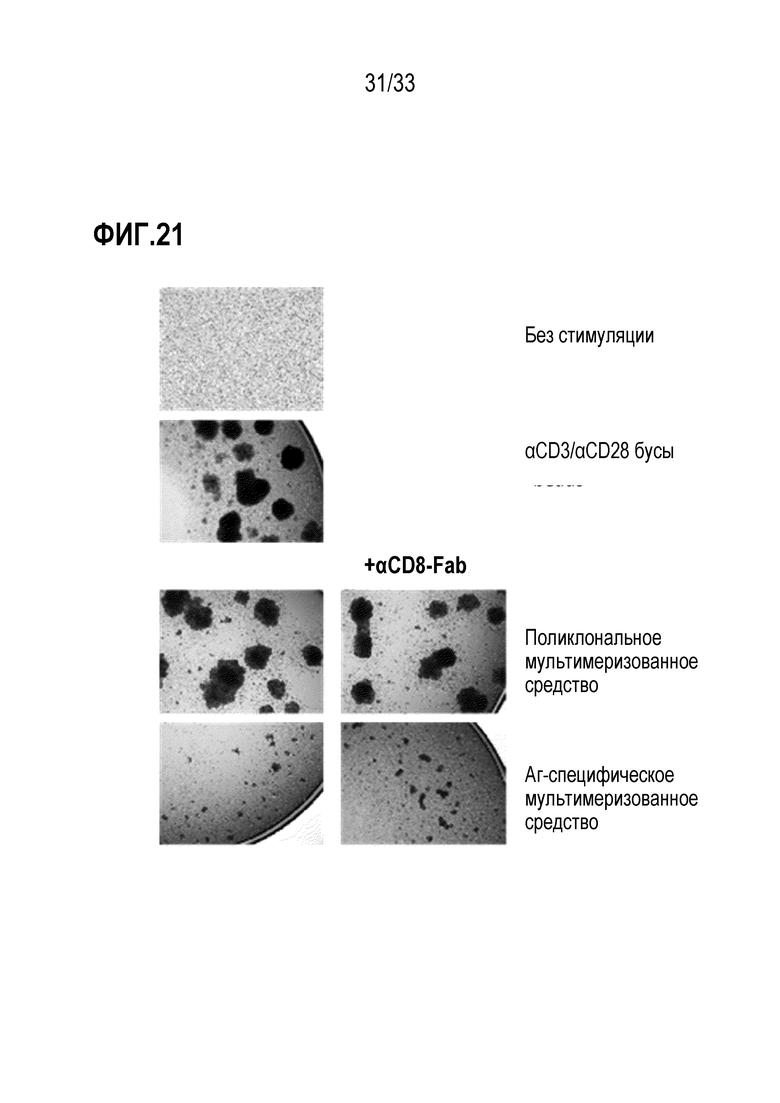
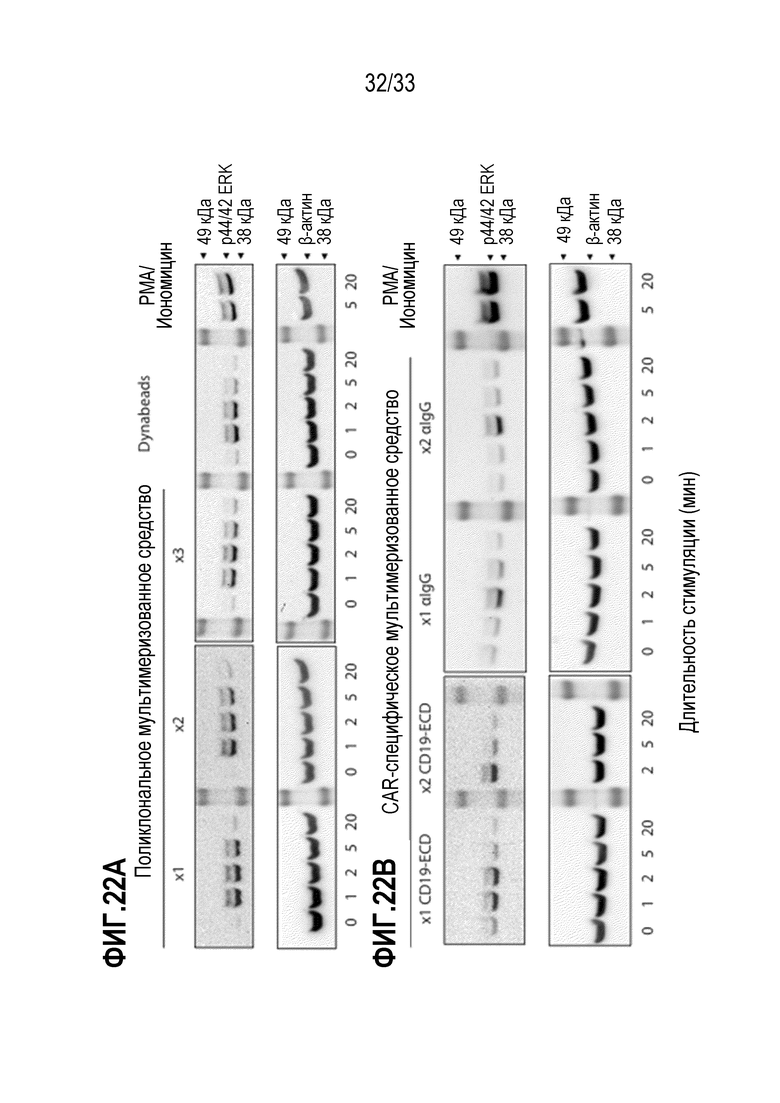
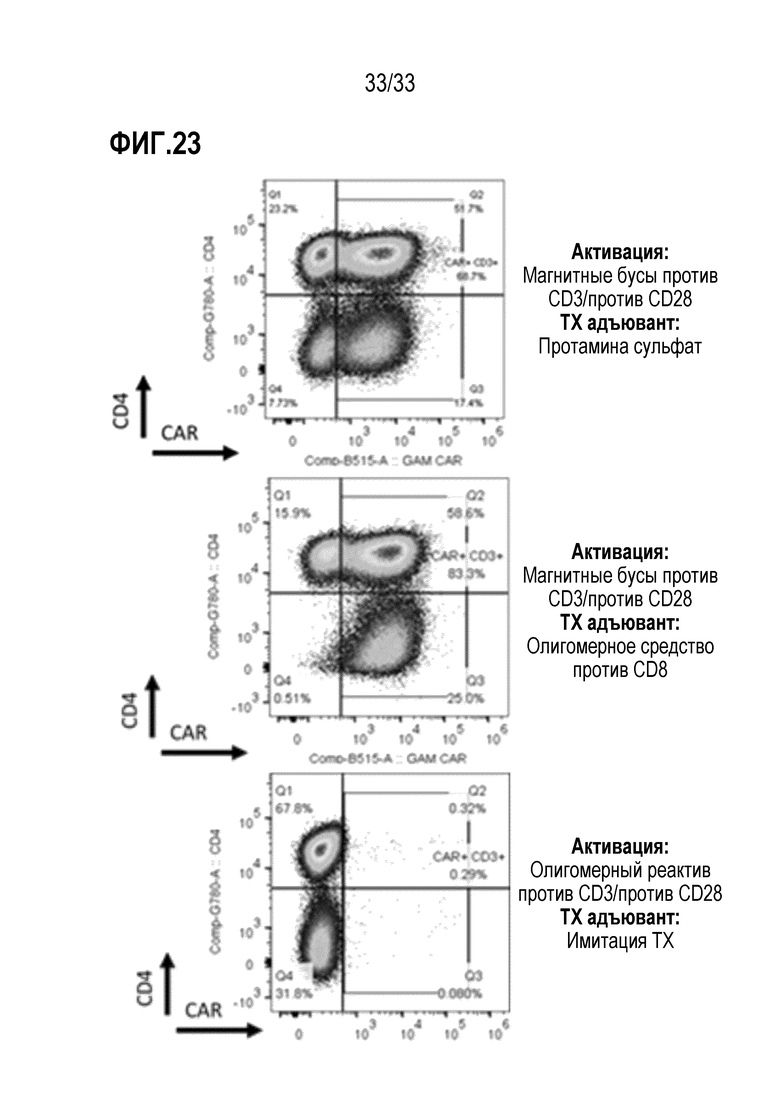
Настоящее изобретение относится к области биотехнологии и генетической инженерии, в частности к способам трансдукции клеток. Для осуществления способов инкубируют множество клеток-мишеней с растворимым олигомерным реактивом и вирусной частицей. Растворимый олигомерный реактив содержит олигомер или полимер из по меньшей мере трех тетрамеров мутеина стрептавидина. В результате получают выходную композицию, содержащую клетки, трансдуцированные вирусной частицей. Настоящее изобретение позволяет усовершенствовать стратегии трансдукции популяций клеток in vitro, в том числе для исследовательских, диагностических и терапевтических целей. 7 н. и 141 з.п. ф-лы, 56 ил., 3 табл., 23 пр.
1. Способ трансдукции клеток, причем способ включает инкубацию множества клеток-мишеней с олигомерным белковым реактивом и вирусной частицей, в котором:
олигомерный белковый реактив содержит множество полипептидных мономерных единиц, где каждая единица составляет по меньшей мере 10, 20, 30 или 40 аминокислот в длину и/или имеет молекулярную массу по меньшей мере 20, 30, 40 или 50 кДа; и/или
олигомерный белковый реактив имеет молекулярную массу или имеет усредненную молекулярную массу по меньшей мере или приблизительно 100 кДа,
где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
2. Способ по п. 1, в котором олигомерный белковый реактив содержит множество полипептидных единиц, индивидуально содержащих стрептавидин, авидин, биотин-связывающий полипептид, связывающий Strep-метку пептид, мутеин стрептавидина, аналог стрептавидина, мутеин авидина, аналог авидина и/или биологически активный фрагмент любого из вышеуказанных.
3. Способ по п. 2, в котором олигомерный белковый реактив содержит одну или множество мультимерных субъединиц, причем каждая индивидуально содержит две или больше полипептидные единицы.
4. Способ трансдукции клеток, который включает инкубацию множества клеток-мишеней с (1) растворимым олигомерным белковым реактивом, содержащим олигомер или полимер с по меньшей мере тремя тетрамерами мутеина стрептавидина; и (2) вирусной частицей,
где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
5. Способ по любому из пп. 1-4, в котором:
(i) инкубация включает (а) смешивание клеток-мишеней с реактивом и/или (b) смешивание клеток-мишеней с вирусной частицей последовательно, в любом порядке,
(ii) инкубация включает смешивание клеток-мишеней, реактива и вирусной частицы, указанное смешивание осуществляют одновременно или по существу одновременно;
(iii) инкубация включает смешивание композиции, содержащей клетки-мишени и вирусные частицы и не содержащей реактив; и/или
(iv) инкубация включает смешивание композиции, содержащей клетки-мишени и реактив и не содержащей вирусную частицу, с вирусной частицей;
(v) инкубация включает смешивание композиции, содержащей вирусные частицы и реактив, с композицией, содержащей клетки-мишени и не вирусную частицу и/или не реактив.
6. Способ по п. 5, где:
смешивание в (a) и смешивание в (b) осуществляют в пределах периода не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа и/или смешивание в (a) осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов или 48 часов помимо смешивания в (b); и/или
не больше чем 5%, 10%, 20%, 30% или 40% клеток-мишеней в композиции, содержащей клетки-мишени и реактив, представляют собой активированные клетки, экспрессируют маркер поверхности, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; имеют внутриклеточную экспрессию цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α, и/или способны к пролиферации; и/или
смешивание осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов или 48 часов после смешивания клеток-мишеней и вирусных частиц в композиции.
7. Способ по любому из пп. 1-6, в котором инкубация включает смешивание клеток с реактивом и с вирусной частицей одновременно или последовательно, в любом порядке.
8. Способ по любому из пп. 1-7, в котором во время по меньшей мере части инкубации реактив и вирусная частица находятся в присутствии или в контакте с клетками одновременно.
9. Способ трансдукции клеток, причем способ включает:
(a) приведение в контакт вирусной частицы с растворимым олигомерным белковым реактивом, содержащим олигомер или полимер с по меньшей мере тремя тетрамерами мутеина стрептавидина, тем самым создавая композицию, содержащую вирусные частицы и реактив; и
(b) инкубацию композиции в (a) с множеством клеток, содержащим клетки-мишени,
где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
10. Способ по п. 9, где вирусные частицы ассоциированы с реактивом.
11. Способ трансдукции клеток, причем способ включает смешивание композиции, содержащей вирусные частицы и растворимый олигомерный белковый реактив, содержащий олигомер или полимер с по меньшей мере тремя тетрамерами мутеина стрептавидина, с множеством клеток, содержащим клетки-мишени, где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
12. Способ по любому из пп. 1-11, в котором реактив имеет суммарный положительный заряд или общий положительный заряд.
13. Способ по любому из пп. 1-12, в котором:
реактив не содержит и/или не конъюгирован или обратимо связан со связывающим средством, содержащим антитело или его фрагмент, или не содержит связывающее средство, содержащее молекулу клеточной поверхности человека или ее связывающий фрагмент;
реактив не содержит и/или не конъюгирован или связан с молекулой со связывающим доменом со специфичностью к маркеру клеточной поверхности человека, необязательно маркеру T-клетки;
реактив не содержит и/или не конъюгирован или связан с компонентом внеклеточного матрикса, молекулой адгезии, интегрином, лектином, интегрин-связывающим белком, хемокинами, цитокином, фактором роста, связывающей внеклеточный матрикс молекулой, ECM компонентом, вирусным белком, рецептором клеточной поверхности, способствующим проникновению вируса, гепарином, гепараном или гликанами; и/или
реактив не содержит гепарин-связывающий домен, и/или не содержит интегрин-связывающий домен, и/или не содержит VLA4-связывающий домен, и/или не содержит VLA5-связывающий домен.
14. Способ по любому из пп. 1-12, в котором реактив дополнительно содержит и/или обратимо связан с множеством из одного или нескольких связывающих средств, каждое из которых способно к специфическому связыванию с молекулой на поверхности вирусной частицы и/или поверхности клетки-мишени.
15. Способ трансдукции клеток, причем способ включает инкубацию множества клеток, содержащего клетки-мишени, с:
1) растворимым олигомерным белковым реактивом, содержащим олигомер или полимер с по меньшей мере тремя тетрамерами мутеина стрептавидина и множество сайтов связывания, способных к обратимому связыванию со связывающим средством, в котором один или более сайтов связывания обратимо связывают со связывающим средством; и
2) вирусной частицей,
где по меньшей мере часть инкубации в (1) происходит одновременно с (2) и
где способом получают выходную композицию, содержащую одну или более клеток, трансдуцированных вирусной частицей.
16. Способ по п. 14 или 15, в котором:
реактив содержит множество сайтов связывания, способных к обратимому связыванию со связывающим средством, множество сайтов связывания содержит один или более сайтов связывания, Z, которые способны к связыванию с партнером связывания, C; и
связывающее средство дополнительно содержит один или более партнеров связывания, C.
17. Способ по любому из пп. 14-16, в котором связывающее средство представляет собой или содержит рецептор-связывающее средство.
18. Способ по п. 17, в котором реактив дополнительно содержит дополнительное связывающее средство, которое представляет собой средство отбора, которое специфически связывается с молекулой, экспрессируемой на поверхности клетки-мишени.
19. Способ по любому из пп. 14-16, в котором связывающее средство представляет собой средство отбора, которое специфически связывается с молекулой, экспрессируемой на поверхности одной или нескольких клеток-мишеней.
20. Способ по любому из пп. 14-16, в котором связывающее средство представляет собой вирусное связывающее средство, которое специфически связывается с молекулой на поверхности вирусной частицы.
21. Способ трансдукции клеток, причем способ включает:
(1) приведение в контакт (a) композиции, содержащей множество клеток, содержащее клетки-мишени, и (b) связывающего средства, которое представляет собой средство отбора, которое (i) способно к специфическому связыванию с молекулой, экспрессируемой одной или несколькими из клеток-мишеней, и ii) обратимо связывают с растворимым олигомерным белковым реактивом, содержащим олигомер или полимер с по меньшей мере тремя тетрамерами мутеина стрептавидина и множество сайтов связывания, способных к обратимому связыванию со средством отбора; и
(2) инкубацию по меньшей мере множества клеток в присутствии одной или нескольких вирусных частиц, где приведение в контакт в (1) и инкубацию в (2) осуществляют одновременно или последовательно, в любом порядке, где способом создают выходную композицию, содержащую клетки, трансдуцированные вирусной частицей.
22. Способ по п. 21, в котором вирусные частицы обратимо связывают с реактивом, указанный реактив содержит множество сайтов связывания, способных к обратимому связыванию, непосредственно или опосредованно, с молекулой на поверхности вирусной частицы.
23. Способ по п. 22, в котором вирусные частицы обратимо связывают с реактивом через вирусное связывающее средство, которое специфически связывается с молекулой на поверхности вирусной частицы, указанный реактив содержит множество сайтов связывания, способных к обратимому связыванию вирусного связывающего средства.
24. Способ по п. 23, в котором реактив содержит множество сайтов связывания, Z1, способных к обратимому связыванию со средством отбора, и/или реактив содержит множество сайтов связывания, Z2, способных к обратимому связыванию с одной или несколькими вирусными частицами через вирусное связывающее средство.
25. Способ трансдукции клеток, причем способ включает:
(1) приведение в контакт (a) композиции, содержащей одну или более вирусных частиц, и (b) связывающего средства, которое представляет собой вирусное связывающее средство, которое (i) способно к специфическому связыванию с молекулой на поверхности вирусной частицы и (ii) обратимо связывают с растворимым олигомерным белковым реактивом, содержащим олигомер или полимер с по меньшей мере тремя тетрамерами мутеина стрептавидина и множество сайтов связывания, способных к обратимому связыванию с вирусным связывающим средством; и
(2) инкубацию по меньшей мере множества клеток, содержащего клетки-мишени, в присутствии одной или нескольких вирусных частиц, где приведение в контакт в (1) и инкубацию в (2) осуществляют одновременно или последовательно, в любом порядке, где способом создают выходную композицию, содержащую множество клеток, трансдуцированных вирусной частицей.
26. Способ по любому из пп. 21-25, в котором приведение в контакт в (1) и инкубацию в (2) осуществляют в пределах периода не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа и/или смешивание в (a) осуществляют не больше чем 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 18 часов, 24 часа, 36 часов или 48 часов помимо инкубации в (b).
27. Способ по любому из пп. 14-26, в котором связывающее средство представляет собой или содержит антитело, фрагмент антитела, одновалентный фрагмент антитела, белковую связывающую молекулу с антителоподобными связывающими свойствами, молекулу, содержащую домены Ig, цитокин, хемокин, аптамер, молекулу MHC или их связывающие фрагменты.
28. Способ по п. 27, в котором фрагмент антитела содержит фрагмент, выбранный из группы, состоящей из Fab-фрагмента, Fv-фрагмента, F(ab')2-фрагмента и двухвалентного одноцепочечного Fv (scFv) фрагмента.
29. Способ по любому из пп. 1-28, в котором реактив является гибким, не содержит металлическую или магнитную сердцевину, полностью или в первую очередь состоит из органического мультимера, не является сферическим, по существу не является сферическим или однородным по геометрической форме и/или не является жестким.
30. Способ по любому из пп. 18, 19, 21-24, в котором средство отбора представляет собой первое средство отбора, молекула представляет собой первую молекулу и инкубацию дополнительно осуществляют в присутствии второго средства отбора, которое способно к специфическому связыванию со второй молекулой, экспрессируемой на поверхности одной или нескольких клеток-мишеней.
31. Способ по п. 30, в котором второе средство отбора обратимо связывают с реактивом или со вторым реактивом, где реактив или второй реактив содержит множество сайтов связывания, способных к обратимому связыванию со вторым средством отбора, в соответствии с чем второе средство отбора обратимо связывают с ним.
32. Способ по любому из пп. 1-31, в котором:
клетки-мишени содержат клетки крови;
клетки-мишени содержат лейкоциты;
клетки-мишени содержат лимфоциты;
клетки-мишени содержат B-клетки;
клетки-мишени содержат T-клетки;
клетки-мишени содержат естественные киллерные (NK) клетки;
клетки-мишени содержат дендритные клетки; и/или
клетки-мишени содержат макрофаги.
33. Способ по п. 32, в котором клетки-мишени содержат антиген-специфические T-клетки или их популяцию, T-хелперные клетки или их популяцию, цитотоксические T-клетки или их популяцию, T-клетки памяти или их популяцию, регуляторные T-клетки или их популяцию или NK-клетки или их популяцию, антиген-специфические B-клетки или их популяцию, B-клетки памяти или их популяцию или регуляторные B-клетки или их популяцию.
34. Способ по любому из пп. 1-33, в котором клетки-мишени содержат T-клетки.
35. Способ по п. 34, в котором T-клетки содержат CD4+, и/или CD8+ T-клетки, и/или их субпопуляцию или подмножество и/или обогащены по популяции любых из вышеуказанных.
36. Способ по любому из пп. 1-35, в котором:
молекула представляет собой корецептор B-клетки или T-клетки;
молекула представляет собой или содержит элемент комплекса антигенного рецептора T-клетки или B-клетки;
молекула представляет собой или содержит цепь CD3;
молекула представляет собой или содержит ζ-цепь CD3;
молекула представляет собой или содержит CD8; и/или
молекула представляет собой или содержит CD4.
37. Способ по любому из пп. 18, 19, 21-24 и 26, в котором молекула, специфически связанная средством отбора, представляет собой или содержит CD25, CD28, CD62L, CCR7, CD27, CD127, CD3, CD4, CD8, CD45RA и/или CD45RO.
38. Способ по любому из пп. 18, 19, 21-24 и 26-37, в котором специфическое связывание между средством отбора и молекулой не индуцирует сигнал или не индуцирует стимуляторный, или активирующий, или пролиферативный сигнал в клетках-мишенях.
39. Способ по любому из пп. 18, 19, 21-24 и 26-38, в котором во время по меньшей мере части инкубации средство отбора связывается с молекулой, экспрессируемой на поверхности клетки-мишени, тем самым содействуя ассоциированию между реактивом и клеткой-мишенью.
40. Способ по п. 39, в котором ассоциирование между реактивом и клеткой-мишенью усиливает трансдукцию клетки-мишени по сравнению с трансдукцией не клетки-мишени, которая не экспрессирует молекулу или не связана специфически средством отбора.
41. Способ по любому из пп. 1-40, в котором множество клеток или множество клеток-мишеней содержит покоящиеся или наивные T-клетки.
42. Способ по любому из пп. 1-54, в котором по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% T-клеток в множестве клеток или множестве клеток-мишеней не имеют на поверхности маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; и/или не имеют внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFNγ, TNF-α; и/или способны к пролиферации.
43. Способ по любому из пп. 1-42, в котором не больше чем 10% T-клеток в множестве клеток или множестве клеток-мишеней содержат маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB.
44. Способ по любому из пп. 1-43, в котором перед указанной инкубацией способ не включает стимуляцию клеток из множества клеток или множества клеток-мишеней в условиях, которые способствуют активации T-клеток.
45. Способ по любому из пп. 1-44, в котором множество клеток или множество клеток-мишеней перед указанной инкубацией не подвергали: (a) стимуляции ex vivo, включающей инкубацию при 37°C±2ºC, и/или (b) инкубации в присутствии средства или средств, выбранных из группы, состоящей из средств, способных к активации или индукции сигнала через комплекс TCR в T-клетках, CD4+ T-клетках и/или CD8+ T-клетках; средств, способных к индукции пролиферации T-клеток, CD4+ T-клеток и/или CD8+ T-клеток; CD3-связывающих молекул и CD28-связывающих молекул.
46. Способ по любому из пп. 1-40, в котором множество клеток или множество клеток-мишеней содержит активированные клетки.
47. Способ по любому из пп. 1-40 и 46, в котором до или во время инкубации с реактивом, способ также включает активирование клетки в присутствии стимулирующего средства в условиях, в соответствии с которыми одну или более клеток-мишеней стимулируют или активируют с помощью стимулирующего средства.
48. Способ по п. 47, в котором клетки-мишени содержат T-клетки и указанные стимулирующие условия включают присутствие средства, способного к активации одного или нескольких внутриклеточных сигнальных доменов одного или нескольких компонентов комплекса TCR.
49. Способ по п. 48, в котором указанное средство содержит первичное средство, которое специфически связывается с элементом комплекса TCR, и вторичное средство, которое специфически связывается с костимулирующей молекулой T-клетки.
50. Способ по п. 49, в котором:
первичное средство специфически связывается с CD3; и/или
костимулирующую молекулу выбирают из группы, состоящей из CD28, CD137 (4-1BB), CD27, OX40 и ICOS.
51. Способ по п. 49 или 50, в котором указанные первичное и вторичное средства содержат антитела и/или присутствуют на поверхности твердого носителя.
52. Способ по любому из пп. 1-40 и 46-51, который дополнительно включает
культивирование по меньшей мере множества клеток в присутствии рецептор-связывающего средства, которое (i) специфически связывает рецептор, экспрессируемый на поверхности одной или нескольких клеток-мишеней для того, чтобы доставлять стимулирующий сигнал, и (ii) обратимо связывают с реактивом или вторым реактивом, реактив или второй реактив содержит множество сайтов связывания, каждый способен к обратимому связыванию с рецептор-связывающим средством, тем самым индуцируя или модулируя сигнал в клетках.
53. Способ по п. 52, в котором указанное культивирование осуществляют и/или инициируют перед указанной инкубацией.
54. Способ по п. 52 или 53, в котором рецептор-связывающее средство обратимо связывают со вторым реактивом, где: второй реактив не связывают с или ассоциируют с твердым носителем, стационарной фазой, бусиной, микрочастицей, магнитной частицей и/или матрицей во время указанной инкубации, и/или
второй реактив является гибким, не содержит металлическую или магнитную сердцевину, полностью или в первую очередь состоит из органического мультимера, не является сферическим, не является по существу сферическим или однородным по геометрической форме и/или не является жестким.
55. Способ по п. 52 или 53, в котором рецептор-связывающее средство обратимо связывают со вторым реактивом и второй реактив иммобилизуют на основе.
56. Способ по любому из пп. 52-55, в котором рецептор-связывающее средство содержит комплекс MHC I:пептид или его функциональную часть, содержит комплекс MHC II:пептид или его функциональную часть и/или способно доставлять стимулирующий сигнал через комплекс TCR/CD3 в T-клетке, CD3-содержащий комплекс в T-клетке и/или ITAM-содержащую молекулу в T-клетке.
57. Способ по любому из пп. 52-56, в котором рецептор-связывающее средство специфически связывается с элементом комплекса TCR/CD3 или специфически связывается с CD3.
58. Способ по любому из пп. 52-57, в котором рецептор-связывающее средство представляет собой первое рецептор-связывающее средство и культивирование дополнительно осуществляют в присутствии второго рецептор-связывающего средства, указанное второе рецептор-связывающее средство представляет собой вспомогательное связывающее средство, способное к специфическому связыванию со вторым рецептором на поверхности одной или нескольких T-клеток, тем самым индуцируя второй сигнал в клетках для того, чтобы усиливать, ослаблять или модифицировать сигнал, доставленный через первый рецептор.
59. Способ по п. 58, в котором:
второе рецептор-связывающее средство обратимо связывают с реактивом, вторым реактивом или третьим реактивом; и
реактив, второй реактив или третий реактив содержит множество сайтов связывания, способных к обратимому связыванию со вторым рецептор-связывающим средством, в соответствии с чем второе рецептор-связывающее средство обратимо связывают с ним.
60. Способ по п. 58 или 59, в котором второй рецептор представляет собой костимулирующую молекулу, вспомогательную молекулу, цитокиновый рецептор, хемокиновый рецептор, молекулу иммунной контрольной точки или элемент семейства TNF или семейства рецепторов TNF.
61. Способ по любому из пп. 58-60, в котором первое и второе рецептор-связывающие средства связываются с CD3 и CD28 соответственно.
62. Способ по п. 61, в котором первое и второе рецептор-связывающие средства содержат антитело против CD3 или его фрагмент и антитело против CD28 или его фрагмент соответственно.
63. Способ по любому из пп. 52-62, в котором инкубацию и культивирование осуществляют в отдельных сосудах, которые соединяют функционально, необязательно с помощью трубки.
64. Способ по любому из пп. 52-63, в котором инкубацию и культивирование осуществляют в закрытой системе.
65. Способ по любому из пп. 52-64, который также включает извлечение клеток, обратимо связанных с и стимулированных рецептор-связывающим средством, которое может представлять собой первое и/или второе рецептор-связывающее средство, тем самым получая культивируемые клетки, где культивируемые клетки представляют собой или содержат множество клеток, содержащих клетки-мишени.
66. Способ по любому из пп. 9-14 и 21-65, в котором
указанную инкубацию осуществляют и/или инициируют перед указанным приведением в контакт.
67. Способ по любому из пп. 9-14 и 21-65, где указанную инкубацию осуществляют и/или инициируют после указанного приведения в контакт.
68. Способ по любому из пп. 1-67, в котором указанное приведение в контакт осуществляют во время по меньшей мере части указанной инкубации.
69. Способ по любому из пп. 20 и 25-68, в котором вирусное связывающее средство связывается с молекулой на поверхности вирусной частицы, которую выбирают из гликопротеина оболочки, варианта гликопротеина оболочки, химерного гликопротеина оболочки, белка вирусного капсида, варианта белка вирусного капсида, вирусного матриксного белка, варианта вирусного матриксного белка, синтетического фрагмента, пептида и метки.
70. Способ по п. 69, в котором гликопротеин оболочки выбирают из гликопротеина VSV (VSV-G), гликопротеина Sindbis, необязательно SIN, гликопротеина MMLV, гликопротеина HSV, гликопротеина MMTV, гликопротеина вируса кори, гликопротеина HTLV, гликопротеина SIV, гликопротеинов GALV, гликопротеина HIV, необязательно gp160, gp120 или gp41, и гликопротеина RSV, необязательно gp85 или gp37, или вариантов, или их частей, достаточных для связывания вирусным связывающим средством.
71. Способ по любому из пп. 20 и 25-68, в котором вирусное связывающее средство связывается с молекулой на поверхности вирусной частицы, которая представляет собой не вирусную рекомбинантную молекулу, гетерологичную вирусу.
72. Способ по п. 71, в котором молекула представляет собой синтетический фрагмент, пептид или метку, которые выбирают из глутатион-S-трансферазы (GST), хитин-связывающего белка (CBP), кальмодулин-связывающего пептида (CBP), FLAG-пептида, пептида гемагглютинина, VSV-G-метки, HSV-метки, эпитопа T7, мальтоза-связывающего белка (MBP), эпитопа HSV, эпитопа myc, V5-метки и стрептавидин-связывающего пептида.
73. Способ по п. 72, в котором молекула представляет собой стрептавидин-связывающий пептид.
74. Способ по любому из пп. 71-73, в котором молекула представляет собой синтетический фрагмент, пептид или метку и вирусную частицу конструируют для того, чтобы экспрессировать синтетический фрагмент, пептид или метку на ее поверхности.
75. Способ по любому из пп. 72-74, в котором стрептавидин-связывающий пептид содержит последовательность аминокислот, приведенную в любой из SEQ ID NO: 7, 8, 13, 14 и 15-19.
76. Способ по п. 71, в котором молекула представляет собой или содержит лиганд-связывающий домен.
77. Способ по п. 76, в котором молекула представляет собой или содержит антигенный рецептор.
78. Способ по п. 77, в котором антигенный рецептор представляет собой химерный антигенный рецептор (CAR).
79. Способ по п. 78, в котором вирусное связывающее средство представляет собой антитело или антигенсвязывающий фрагмент, который специфически связывает внеклеточную область CAR.
80. Способ по п. 79, в котором внеклеточная область представляет собой антигенсвязывающий домен.
81. Способ по п. 79, где внеклеточная область представляет собой шарнирную область.
82. Способ по любому из пп. 20 и 25-81, в котором вирусное связывающее средство выбирают из протамина, POLYBRENE® и RETRONECTIN®.
83. Способ по любому из пп. 20 и 25-82, в котором:
вирусная частица содержит партнер связывания C1 или C2; и
реактив содержит множество сайтов связывания Z1 или Z2, способных к связыванию с партнером связывания C1 или C2, чтобы формировать обратимую связь между вирусной частицей и реактивом.
84. Способ по п. 83, в котором вирусную частицу конструируют для того, чтобы экспрессировать синтетический фрагмент, пептид или метку, на ее поверхности, где синтетический фрагмент, пептид или метка представляет собой или содержит партнер связывания C1 или C2.
85. Способ по п. 84, в котором синтетический пептид представляет собой партнер связывания C1, где партнер связывания C1 представляет собой стрептавидин-связывающий пептид.
86. Способ по п. 84, в котором синтетический пептид представляет собой партнер связывания C2, где партнер связывания C2 представляет собой стрептавидин-связывающий пептид.
87. Способ по п. 85 или 86, в котором стрептавидин-связывающий пептид содержит последовательность аминокислот, приведенную в любой из SEQ ID NO: 7, 8, 13, 14 и 15-19.
88. Способ по любому из пп. 1-87, в котором вирусная частица ассоциирует с или связывает реактив.
89. Способ по любому из пп. 1-88, в котором геном вирусного вектора содержит гетерологичную молекулу нуклеиновой кислоты, кодирующую рекомбинантный белок.
90. Способ по п. 89, в котором рекомбинантный белок представляет собой антигенный рецептор.
91. Способ по п. 90, в котором рекомбинантный белок представляет собой химерный антигенный рецептор.
92. Способ по любому из пп. 1-91, в котором вирусная частица представляет собой ретровирусную векторную частицу.
93. Способ по любому из пп. 1-92, в котором вирусная частица представляет собой лентивирусную векторную частицу.
94. Способ по п. 93, в котором лентивирусная векторная частица содержит геном, который извлекают из HIV-1.
95. Способ по любому из пп. 1-94, в котором ретровирусная векторная частица представляет собой гамма-ретровирусную частицу.
96. Способ по п. 95, в котором гамма-ретровирусная частица представляет собой частицу вируса мышиного лейкоза (MLV).
97. Способ по любому из пп. 1-96, в котором вирусная частица псевдотипирована гликопротеином вирусной оболочки.
98. Способ по п. 97, в котором гликопротеин вирусной оболочки представляет собой VSV-G.
99. Способ по любому из пп. 91-98, в котором химерный антигенный рецептор (CAR) содержит внеклеточный домен распознавания антигена, который специфически связывается с антигеном-мишенью, и внутриклеточный сигнальный домен, содержащий ITAM.
100. Способ по п. 99, в котором внутриклеточный сигнальный домен содержит внутриклеточный домен цепи CD3-ζ (CD3ζ).
101. Способ по п. 99 или 100, который дополнительно включает трансмембранный домен, связывающий внеклеточный домен и внутриклеточный сигнальный домен.
102. Способ по п. 101, в котором трансмембранный домен содержит трансмембранную часть CD28.
103. Способ по любому из пп. 99-102, в котором внутриклеточный сигнальный домен дополнительно содержит внутриклеточный сигнальный домен костимулирующей молекулы T-клетки.
104. Способ по п. 103, в котором костимулирующую молекулу T-клетки выбирают из группы, состоящей из CD28 и 41BB.
105. Способ по любому из пп. 89-104, в котором нуклеиновая кислота дополнительно содержит промотор, функционально связанный с нуклеиновой кислотой, кодирующей рекомбинантный антигенный рецептор.
106. Способ по любому из пп. 1-105, в котором множество клеток или множество клеток-мишеней содержат мононуклеарные клетки периферической крови (PBMC) или их обогащенное или выделенное подмножество клеток.
107. Способ по любому из пп. 1-106, в котором множество клеток или множество клеток-мишеней содержат клетки крови, лейкоциты, лимфоциты, B-клетки, T-клетки или NK-клетки.
108. Способ по любому из пп. 1-107, в котором множество клеток или множество клеток-мишеней содержит антиген-специфические T-клетки или их популяцию, T-хелперные клетки или их популяцию, цитотоксические T-клетки или их популяцию, T-клетки памяти или их популяцию, регуляторные T-клетки или их популяцию, NK-клетки или их популяцию, антиген-специфические B-клетки или их популяцию, B-клетки памяти или их популяцию или регуляторные B-клетки или их популяцию.
109. Способ по любому из пп. 1-108, в котором множество клеток или множество клеток-мишеней представляют собой эмбриональные клетки.
110. Способ по любому из пп. 1-109, в котором множество клеток или множество клеток-мишеней содержат T-клетки.
111. Способ по п. 110, в котором T-клетки представляют собой не фракционированные T-клетки, представляют собой обогащенные или выделенные CD3+ T-клетки, представляют собой обогащенные или выделенные CD4+ T-клетки или представляют собой обогащенные или выделенные CD8+ T-клетки.
112. Способ по любому из пп. 1-111, в котором реактив не является токсичным для множества клеток или множества клеток-мишеней или по меньшей мере 75%, 85%, 90%, 95% или больше из множества клеток или множества клеток-мишеней являются жизнеспособными после приведения в контакт или инкубации.
113. Способ по любому из пп. 1-112, в котором:
токсичность клеток после приведения в контакт и/или инкубации составляет меньше чем 1,2 раза, 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раза или 10 раз, чем токсичность клеток, когда приводят в контакт или инкубируют с поликатионным адъювантом трансдукции при тех же условиях; и/или
жизнеспособность клеток после приведения в контакт и/или инкубации составляет больше чем 1,2 раза, 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раза или 10 раз по сравнению с жизнеспособностью клеток, когда приводят в контакт или инкубируют с поликатионным адъювантом трансдукции при тех же условиях.
114. Способ по п. 113, в котором поликатионный адъювант трансдукции представляет собой протамина сульфат, получаемый из фибронектина адъювант трансдукции или RETRONECTIN.
115. Способ по любому из пп. 1-114, в котором индивидуальные молекулы олигомера или полимера сшивают с помощью полисахарида или бифункционального линкера.
116. Способ по любому из пп. 1-115, в котором
мутеин стрептавидина обратимо связывается со стрептавидин-связывающим пептидом.
117. Способ по п. 116, в котором стрептавидин-связывающий пептид содержит последовательность аминокислот, представленную в любой из SEQ ID NO: 7, 8 и 13-19.
118. Способ по любому из пп. 1-117, в котором мутеин стрептавидина содержит SEQ ID NO: 1 или SEQ ID NO: 2 или последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательностей с SEQ ID NO: 1 или SEQ ID NO: 2.
119. Способ по любому из пп. 1-118, в котором:
реактив мутеин стрептавидина содержит аминокислотную последовательность Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47 в положениях последовательности, соответствующих положениям с 44 до 47 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID NO: 1.
120. Способ по любому из пп. 1-119, в котором мутеин стрептавидина содержит:
a) последовательность аминокислот, приведенную в любой из SEQ ID NO: 3-6, 27 и 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с любой из SEQ ID NO: 3-6, 27 и 28 и содержит аминокислотную последовательность, соответствующую Va144-Thr45-Ala46-Arg47 или lle44-Gly45-Ala46-Arg47, и которая обратимо связывается с биотином или его биологически активной формой, аналогом биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент a) или b), который обратимо связывается с биотином или его биологически активной формой, аналогом или мутеином биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
121. Способ по п. 119 или 120, в котором мутеин стрептавидина дополнительно содержит замену или замены аминокислот в положении, соответствующем 117, 120 и/или 121 относительно положений в стрептавидине в последовательности аминокислот, приведенной в SEQ ID NO: 1.
122. Способ по п. 121, в котором:
замену или замены аминокислот выбирают из Glu117, Asp117, Arg117, Ser120, Ala120, Gly120, Trp121, Tyr121 или Phe121; или
замену или замены аминокислот выбирают из одной или нескольких из Glu117, Gly120 или Tyr121; или
замены аминокислот выбирают из Glu117, Gly120 или Tyr121.
123. Способ по любому из пп. 1-122, в котором мутеин стрептавидина содержит:
a) последовательность аминокислот, приведенную в SEQ ID NO: 27 или 28;
b) последовательность аминокислот, которая проявляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокую идентичность последовательностей с SEQ ID NO: 28 и содержит аминокислотную последовательность, соответствующую Va144, Thr45, Ala46, Arg47, Glu117, Gly120 и Tyr121, и обратимо связывается с биотином или биологически активным фрагментом, аналогом биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом; или
c) функциональный фрагмент из a) или b), который обратимо связывается с биотином или биологически активным фрагментом, аналогом биотина или его биологически активным фрагментом или стрептавидин-связывающим пептидом.
124. Способ по любому из пп. 14-123, в котором связывающее средство содержит партнер связывания C, который представляет собой стрептавидин-связывающий пептид.
125. Способ по п. 124, в котором партнер связывания C содержит стрептавидин-связывающий пептид, где стрептавидин-связывающий пептид содержит последовательность аминокислот, представленную в любой из SEQ ID NO: 7, 8 и 13-19.
126. Способ по любому из пп. 14-125, включающий разрушение обратимого связывания между одним или несколькими связывающими средствами и реактивом.
127. Способ по п. 126, в котором указанное разрушение включает введение в клетки вещества, способного к обращению связи между связывающим средством и реактивом.
128. Способ по п. 127, в котором вещество представляет собой свободный партнер связывания и/или конкурентное средство.
129. Способ по п. 127 или 128, в котором вещество в композиции не является вредоносным для T-клеток или для клеток-мишеней и/или в котором добавление указанного вещества не снижает процентную долю выживших клеток-мишеней до меньше чем 90%, 80%, 70%, 60% или 50% по сравнению с инкубацией клеток-мишеней, соответственно, при сравнимых или тех же условиях, без вещества.
130. Способ по любому из пп. 127-129, в котором
вещество содержит стрептавидин-связывающий пептид, биотин или биологически активный фрагмент или аналог биотина или биологически активный фрагмент.
131. Способ по любому из пп. 127-130, где вещество содержит D-биотин.
132. Способ по любому из пп. 127-130, в котором:
вещество представляет собой стрептавидин-связывающий пептид, где стрептавидин-связывающий пептид содержит последовательность аминокислот, представленную в любой из SEQ ID NO: 7, 8 и 13-19; и/или
вещество представляет собой C1 или его аналог или представляет собой C2 или его аналог.
133. Способ по любому из пп. 1-132, который включает после указанного разрушения извлечение клеток.
134. Способ по любому из пп. 1-133, который включает дополнительную инкубацию клеток.
135. Способ по п. 134, в котором дополнительную инкубацию осуществляют в условиях для размножения клеток.
136. Способ по п. 134 или 135, в котором:
инкубацию и дополнительную инкубацию осуществляют в одном и том же сосуде; и/или
дополнительную инкубацию осуществляют в присутствии вещества; и/или
способ не включает удаление вещества, средства отбора, стимулирующего средства, вирусного связывающего средства и/или реактива из инкубируемой композиции перед дополнительной инкубацией.
137. Способ по любому из пп. 134-136, в котором реактив не удаляют из композиции перед дополнительной инкубацией, не удаляют из композиции во время дополнительной инкубации или не удаляют из композиции в течение по меньшей мере половины дополнительной инкубации.
138. Способ по любому из пп. 134-137, в котором:
дополнительную инкубацию осуществляют при 37°C±2°C; и/или
дополнительную инкубацию осуществляют в присутствии дополнительного средства, которое способно доставлять сигнал в T-клетки во время по меньшей мере части инкубации и/или дополнительной инкубации.
139. Способ по п. 138, в котором дополнительное средство способно усиливать или индуцировать пролиферацию T-клеток, CD4+ T-клеток и/или CD8+ T-клеток.
140. Способ по п. 138 или 139, в котором дополнительное средство представляет собой цитокин, выбранный из IL-2, IL-15, IL-7 и IL-21.
141. Способ по любому из пп. 134-140, в котором дополнительную инкубацию осуществляют в течение времени, которое составляет не больше чем 14 суток, не больше чем 12 суток, не больше чем 10 суток, не больше чем 8 суток или не больше чем 6 суток.
142. Способ по любому из пп. 1-141, в котором одна или более трансдуцированных клеток в выходной композиции экспрессируют рекомбинантный белок, кодируемый гетерологичной нуклеиновой кислотой, содержащейся в вирусных частицах.
143. Способ по любому из пп. 1-142, в котором трансдукцию клеток увеличивают больше чем в 1,2 раза, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз или больше по сравнению с трансдукцией вирусной частицей в отсутствие реактива.
144. Способ по любому из пп. 18, 19, 21-24 и 26-143, где способ ведет к избирательной трансдукции клеток-мишеней, экспрессирующих молекулу, связанную средством отбора.
145. Способ по п. 144, в котором трансдукция выше по меньшей мере в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или выше в клетках-мишенях, которые экспрессируют молекулу, чем в не клетках-мишенях, которые не экспрессируют молекулу.
146. Способ по любому из пп. 1-145, в котором:
по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток среди множества клеток или множества клеток-мишеней трансдуцируют указанной вирусной частицей с помощью способа; и/или
по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток в указанной дополнительной инкубируемой композиции трансдуцируют указанной вирусной частицей; и/или
по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% указанных клеток в указанной инкубируемой композиции и/или дополнительной инкубируемой композиции экспрессируют продукт гетерологичной нуклеиновой кислоты, содержащейся в указанной вирусной частице.
147. Способ по любому из пп. 1-146, который осуществляют ex vivo.
148. Способ по любому из пп. 1-147, который дополнительно включает извлечение или выделение трансдуцированных клеток, полученных способом.
| WO 2010080032 A2, 15.07.2010 | |||
| KR 20080076622 A, 20.08.2008 | |||
| MOHAMMAD HASSAN QURESHI et al., Development and characterization of a series of soluble tetrameric and monomeric streptavidin muteins with differential biotin binding affinities, The journal of biological chemistry, 2001, Vol | |||
| СПОСОБ СОСТАВЛЕНИЯ ЗВУКОВОЙ ЗАПИСИ | 1921 |
|
SU276A1 |
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| СПОСОБ ПОЛУЧЕНИЯ СТОЙКИХ ФРУКТОВЫХ БЕЗАЛКОГОЛЬНЫХ НАПИТКОВ | 1934 |
|
SU46422A1 |
| XUN SUN et | |||
Авторы
Даты
2021-12-09—Публикация
2016-10-20—Подача