Изобретение относится к области медицины, в частности к средствам для иммунологических исследований биологических материалов, и может найти применение в клинических и биологических лабораториях.
Известны белковые биочипы, которые применяются в таких областях исследований, как фундаментальные биологические научные исследования для характеристики ассоциированных с заболеваниями белковых каскадов; для оценки токсичности лекарственных препаратов; для медицинской диагностики и др., что значительно повышает производительность и биологическую значимость экспериментов по анализу экспрессии белков [1].
Для клинической медицинской диагностики большой интерес представляют биочипы с иммобилизованными аффинными захватывающими агентами (антителами, антигенами, аптамерами). Для иммобилизации захватывающих агентов используется субстрат с нанесенной на него подложкой. К подложке предъявляется ряд требований, выполнение которых необходимо для корректного выполнения иммунологических исследований. Подложка должна иметь высокую связывающую способность и способность сохранять функциональную активность антител, а также высокое соотношение сигнал-шум при последующем сканировании связанных материалов.
В качестве субстрата могут применяться стекло, силиконовые материалы, а также синтетические полимеры, такие как полистирол, нитроцеллюлоза, поливинилиденфторид. В качестве подложки используется широкий спектр материалов, способных образовывать со связываемыми белками химические связи; это могут быть гидрогель на основе декстрана, агароза, пористый акриламидный гидрогель, гидрофильные полимеры или полиаминокислоты, тонкие полоски металлов и т.п.
Известна подложка для биочипа, у которой область, предназначенная для иммобилизации антител, ограничена по периметру бортиком, который может быть выполнен съемным или отламывающимся [2]. Известное устройство позволяет сокращать непроизводительные расходы исследуемого материала и реактивов, но оно сложно в исполнении, имеет недостаточно высокий предел обнаружения, так как не достигает оптимального соотношения сигнал-шум, так как не исключает перетекания антител через бортики и связывания их с субстратом подложки.
Известна подложка для биочипа, имеющая, по крайней мере, один контрольный участок, «обеспечивающий прочность связывания клеток, заведомо меньшую, чем прочность их специфического связывания в области любого из участков с иммобилизованными антителами, но заведомо большую, чем прочность неспецифического связывания клеток с подложкой» [3]. Известная подложка позволяет повысить точность анализа за счет контроля качества отмывки биочипа, однако это решение не влияет на соотношение сигнал-шум, свойственное используемой подложке.
Известна подложка для биочипа [4], наиболее близкая по решаемой технической задаче и совокупности существенных признаков к заявляемому изобретению, которая представляет собой стеклянную пластину с нанесенным на нее функциональным покрытием из халькогенидного стекла. Пластина для микроскопических исследований фирмы «Chemints» выполнена из покровного боросиликатного стекла, обладающего гидролитической устойчивостью и высокой устойчивостью к химически агрессивным средам, и содержит покрытие из халькогенидного стекла, полученное напылением с помощью излучения XeCl эксимерного лазера. Тем самым достигается повышение адсорбирующей способности и возможность избирательного травления поверхности, что позволяет формировать заданную геометрию распределения активного слоя на поверхности подложки.
Недостатком известной подложки для биочипа является низкая чувствительность и низкий предел обнаружения проводимого с ее использованием анализа за счет отсутствия усиления полезного сигнала.
Заявляемое изобретение свободно от указанного недостатка.
Технический результат, достигаемый в заявляемом изобретении, заключается в увеличении чувствительности анализа в несколько десятков раз за счет усиления полезного сигнала люминесценции благодаря использованию эффекта плазменного резонанса на металлических наночастицах.
Указанный технический результат достигается тем, что в халькогенидной подложке для биочипа на стеклянной основе, в соответствии с заявленным изобретением, функциональный слой из халькогенидного стекла имеет дополнительное покрытие толщиной не более 200 нм, которое состоит из гомогенных частиц металлов, входящих в группу, включающую серебро, золото, платину, размер которых не более 50 нм.
В качестве стеклянной основы использовали покровные стекла для микроскопических исследований фирмы «Chemints», выполненные из боросиликатного стекла, обладающего гидролитической устойчивостью и высокой устойчивостью к химически агрессивным средам. Указанные стекла наиболее подходят для флуоресцентной микроскопии, так как падающие УФ-лучи с длиной волны не менее 320 нм не вызывают автофлуоресценцию стекол.
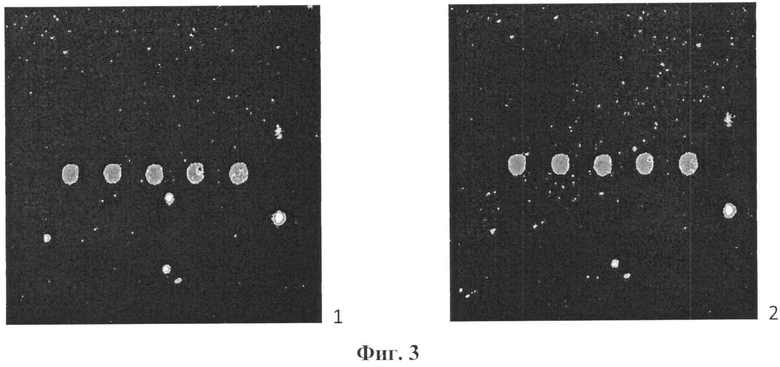
Сущность заявляемого изобретения иллюстрируется Фиг.1-4. На Фиг.1 представлена схема подложки биочипа. Заявленная подложка содержит пластинку из оксидного стекла 1, на которой находится слой халькогенидното стекла 2. На халькогенидном стекле расположен слой 3 металлических частиц, имеющих неплотную упаковку. Толщина слоя (L) не превосходит 200 нм. Размер металлических частиц (d) не превышает 50 нм. На Фиг.2 приведены электронномикроскопические фотографии подложки для биочипа с нанесенным слоем металлических частиц различной толщины. Продолжительность нанесения металлических наночастиц составляет 1 минуту (на Фиг.2 такая продолжительность составляет 1 и 10 минут и на Фиг.2 соответственно 2 минуты. Благодаря рыхлой упаковке металлических наночастиц остаются участки слоя халькогенидного стекла, открытые для доступа раствора антител. Это обеспечивает высокую адгезию последних, характерную для взаимодествия антител с халькогенидным стеклом. Это подтверждается Фиг.3, на которой представлено изображение пленки с напечатанными белками (крысиные моноклональные антитела, полученные к иммуноглобулинам мыши), полученное на флуоресцентном сканере (активировался краситель Су3) до (1) и после промывки в буферном растворе в течение 5 минут с перемешиванием при комнатной температуре (2). Вместе с тем присутствующие на подложке металлические наночастицы благодаря эффекту плазменного резонанса усиливают интенсивность сигнала люминесценции в 70-80 раз, что повышает чувствительность анализа (повышает отношение сигнал-шум). Это показано на Фиг.4, где приведены спектры люминесценции антител, нанесенных на подложки биочипа: 1 - без нанесенного слоя металлических наночастиц (увеличен на вставке); 2 - с нанесенным в течение 5 минут слоем металлических наночастиц; 3 - с нанесенным в течение 15 минут слоем металлических наночастиц.
Заявленное изобретение было испытано в лабораторных условиях в ФБГУ НИИ гриппа Минздравсоцразвития РФ (Санкт-Петербург), в режиме реального времени.
Результаты апробации представлены в виде примера конкретной реализации
Пример.
Халькогенидные стекла получали охлаждением соответствующих расплавов в вакуумированных кварцевых ампулах. Исходными веществами служили галлий, германий медь, индий, мышьяк, сера и селен чистоты выше 99.999%.
Халькогенидное стекло (соединения или сплавы) наносили на стеклянную основу следующим образом.
Покровные стекла мыли мыльным раствором, после чего выдерживали в растворе перманганата калия в течение 15 мин, ополаскивали дистиллированной водой и высушивали.
Напыление халькогенидного стекла производилось в вакуумной камере при базовом давлении 10-5 мм рт.ст. Образец халькогенидного стекла облучался XeCl эксимерным лазером, генерирующим 20 нс импульсы на длине волны 308 нм с энергией импульса 10-40 мДж. Лазерный луч фокусировали на мишени (образце халькогенидного стекла) под углом 45°. Поток формирующейся плазмы направляли на предметное стекло, где происходило формирование пленки.
Формирование гетерометаллических наночастиц проводилось с помощью лазерно-индуцированного синтеза из раствора. В качестве источника лазерного излучения использовался гелий-кадмиевый лазер с длиной волны 325 нм, работающий в непрерывном режиме. Свежеприготовленным раствором металлорганического комплекса покрывалась поверхность подложки биочипа, которая подвергалась затем лазерному облучению. Продолжительность лазерного воздействия не превышала 15 минут. После проведения синтеза подложки с полученными наночастицами промывались ацетоном и высушивались.
Для проведения лазерно-индуцированного синтеза наночастиц из раствора использовались светочувствительные металлорганические комплексы, например [Au12Ag12(C2Ph)18Br3(PPh2(C6H4)3PPh2)3](PF6)3. В качестве растворителя использовался 1,2-дихлорэтан.
Способность полученной подложки к адсорбции белка определяли с помощью зеленого флуоресцирующего белка. Печать проводилась на споттере SpotArray 24 при 50% влажности и температуре 25°C с использованием одной иглы SMP3 (Telechem, USA). Данная игла при установленных по умолчанию параметрах забирает 250 нл образца за один раз и наносит по 0.6 нл на каждый спот. После печати слайды были оставлены на 1 час при комнатной температуре.
Сканирование биочипов проводилось путем рассеивающего сканирования на длине волны 570 нм на сканере ScanArray Express (PerkinElmer, USA) с разрешением 10 µm и РМТ=70 по задаваемому протоколу сканирования.
Обработка получаемых изображений проводилась с использованием программного обеспечения ScanArray и QuantArray 3.0. Microanalysis Software (Perkin Elmer, USA).
На Фиг.3 представлены результаты сканирования напечатанного на подложку белка (крысиные моноклональные антитела, полученные к иммуноглобулинам мыши) до и после отмывки в буферном растворе в течение 5 минут с перемешиванием при комнатной температуре. Как показывают результаты апробации, белок превосходно адсорбируется, о чем свидетельствует сохранение интенсивности люминесценции после промывки.
Технико-экономическая эффективность заявленного изобретения состоит в том, что наряду со свойственными прототипу высокой адсорбирующей способностью и возможностью избирательного травления поверхности для формирования заданной геометрии распределения активного слоя на поверхности подложки, преимуществом данной подложки является (как видно из Фиг.4) усиление полезного сигнала люминесценции в несколько десятков раз за счет эффекта плазменного резонанса на металлических наночастицах. Это дает возможность повысить предел обнаружения анализируемых белков и использовать более простую аппаратуру для считывания сигнала. Заявленное изобретение может стать эффективной основой для изготовления диагностических систем, доступных для широкого использования стандартно оснащенными лабораториями, в частности биохимическими, иммунологическими, микробиологическими и др.
Список использованных источников информации
1. Hall E.A.H. In Handbook of Biosensors and Biochips. Eds. Wiley, Chichester, 2007, v.2, ch.72, p.1111-1129.
2. Патент РФ №86091, МПК A61B 10/00, 2009.
3. Патент РФ №86090, МПК A61B 10/00, 2009.
4. Патент РФ №121081, МПК G01N 33/48, 2012] (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАПИСИ ИНФОРМАЦИИ НА ХАЛЬКОГЕНИДНОЙ ПЛЕНКЕ | 2005 |
|
RU2298839C1 |
| Способ количественного определения селективно связанных белков-маркеров заболеваний в планарных ячейках биочипа и устройство для его осуществления | 2021 |
|
RU2776889C1 |
| ПОДЛОЖКА ДЛЯ БИОЧИПА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2009 |
|
RU2411180C1 |
| Способ изготовления сенсорного модуля, основанного на эффекте гигантского комбинационного рассеяния, для микрофлюидных устройств (варианты) | 2018 |
|
RU2695916C1 |
| СУБСТРАТ ДЛЯ УСИЛЕННОЙ ПОВЕРХНОСТЬЮ СПЕКТРОСКОПИИ КОМБИНАЦИОННОГО РАССЕЯНИЯ СВЕТА | 2021 |
|
RU2763861C1 |
| СПОСОБ АНАЛИЗА МЕМБРАНОСВЯЗАННОГО ГЕМОГЛОБИНА В ЭРИТРОЦИТАХ С ПОМОЩЬЮ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕИВАНИЯ НА НАНОСТРУКТУРИРОВАННЫХ ПОКРЫТИЯХ | 2013 |
|
RU2546518C2 |
| СПОСОБ ЛАЗЕРНОГО НАНЕСЕНИЯ МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ И ПРОВОДНИКОВ НА ДИЭЛЕКТРИКИ | 2010 |
|
RU2444161C1 |
| ОПТИЧЕСКИЙ ДАТЧИК С МНОГОСЛОЙНОЙ ПЛАЗМОННОЙ СТРУКТУРОЙ ДЛЯ УСОВЕРШЕНСТВОВАННОГО ОБНАРУЖЕНИЯ ХИМИЧЕСКИХ ГРУПП ПОСРЕДСТВОМ SERS | 2005 |
|
RU2361193C2 |
| ПЛАНАРНЫЙ ТВЕРДОФАЗНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОПРЕДЕЛЕНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ МЕТОДОМ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДЕТЕКТИРОВАНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ | 2016 |
|
RU2659987C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ АНАЛИЗА ВЗАИМОДЕЙСТВИЙ БИОЛОГИЧЕСКИХ МОЛЕКУЛ НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ НА ОСНОВЕ ФЛУОРЕСЦЕНЦИИ АМИНОКИСЛОТНЫХ ОСТАТКОВ ТРИПТОФАНА | 2014 |
|
RU2588816C2 |



Изобретение относится к средствам для анализа белков и может найти применение в клинических и биологических лабораториях. Подложка для биочипа в соответствии с настоящим изобретением выполнена из халькогенидного стекла на стеклянной основе и имеет функциональное покрытие из неорганического материала. В качестве функционального покрытия из неорганического материала подложка содержит слой металлических наночастиц толщиной не более 200 нм. Наночастицы имеют размер не более 50 нм и состоят из инертного металла или смеси нескольких инертных металлов, выбранных из группы, включающей золото, серебро, платину. Изобретение характеризуется высокой чувствительностью и высоким пределом обнаружения. 4 ил., 1 пр.
Халькогенидная подложка для биочипов на стеклянной основе, отличающаяся тем, что функциональный слой из халькогенидного стекла имеет дополнительное покрытие толщиной не более 200 нм, которое состоит из гомогенных частиц металлов, входящих в группу, включающую серебро, золото, платину, размер которых не более 50 нм.
| Высоконапорная водосбросная галерея | 1958 |
|
SU121081A1 |
| БИОЧИП И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2005 |
|
RU2298797C2 |
| ПОДЛОЖКА ДЛЯ БИОЧИПА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2009 |
|
RU2411180C1 |
| WO 2003104808 A1, 18.12.2003 | |||
Авторы
Даты
2015-08-10—Публикация
2013-11-27—Подача