УРОВЕНЬ ТЕХНИКИ
Документально доказано наличие симбиоза между грамотрицательными почвенными бактериями, Rhizobiaceae и Bradyrhizobiaceae, и бобовыми растениями, такими как соя. Биохимическая основа этих взаимосвязей включает обмен молекулярными сигналами, причем соединения, передающие сигналы от растений к бактериям, включают флавоны, изофлавоны и флаваноны, и соединения, передающие сигналы от бактерий к растениям, включают конечные продукты экспрессии брадиризобиальных и ризобиальных генов nod, известных, как липохитоолигосахариды (ЛХО). Симбиоз между этими бактериями и бобовыми растениями позволяет бобовым растениям связывать атмосферный азот, необходимый для роста растений, и тем самым устранять необходимость в азотных удобрениях. Поскольку азотные удобрения могут значительно повысить стоимость сельскохозяйственных культур и сопровождаются целым рядом загрязняющих воздействий, в сельском хозяйстве продолжаются исследования по использованию этой биологической взаимосвязи и разработке новых средств и способов улучшения урожайности растений без увеличения использования удобрений на основе азота.
В патенте U.S. 6979664 описан способ улучшения прорастания семян или появления ростков сельскохозяйственных культур, включающий стадии приготовления композиции, которая включает эффективное количество по меньшей мере одного липохитоолигосахарида и сельскохозяйственно подходящего носителя, и внесение композиции в непосредственной близости от семян или ростков в количестве, эффективном для улучшения прорастания семян или появления ростков по сравнению с необработанными семенами или ростками.
Дальнейшее развитие этого подхода представлено в WO 2005/062899, относящейся к комбинациям по меньшей мере одного индуктора растения, а именно, ЛХО, в комбинации с фунгицидом, инсектицидом или их комбинацией для улучшения таких характеристик растения, как густота стояния, рост, мощность и/или урожайность растения. Указано, что композиции и способы применимы для бобовых и небобовых растений и могут использоваться для обработки семян (непосредственно перед посевом), ростков, корней или растений.
Аналогичным образом, в WO 2008/085958 описаны композиции для усиления роста растений и повышения урожайности культур бобовых и небобовых растений, которые содержат ЛХО в комбинации с другим активным средством, таким как хитин или хитозан, флавоноид или гербицид, и которые можно наносить на семена и/или растения одновременно или последовательно. Как и в случае публикации WO 2005/062899, в публикации WO 2008/085958 описана обработка семян непосредственно перед посевом.
Недавно Halford, "Smoke Signals" в Chem. Eng. News (April 12, 2010) на стр. 37-38 сообщили, что каррикины или бутенолиды, которые содержатся в дыме, после лесного пожара действуют, как стимуляторы роста и активаторы прорастания семян и могут активировать семена, такие как семена кукурузы, томатов, латука и лука, которые находились на хранении. Эти молекулы являются объектом патента U.S. 7576213.
Однако все еще сохраняется необходимость в системах для улучшения или усиления роста растений.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Первым объектом настоящего изобретения является способ усиления роста растений, включающий a) обработку (например, нанесение) семян растения или растения, которое прорастает из семян, эффективным количеством по меньшей мере одного хитоолигосахарида (ХО), где после уборки растение характеризуется по меньшей мере одним из следующих: увеличенной урожайностью растений, измеренной в единицах бушель/акр, увеличенным количеством корней, увеличенной длиной корней, увеличенной массой корней, увеличенным объемом корней и увеличенной площадью листвы по сравнению с необработанными растениями или растениями, выросшими из необработанных семян.
В некоторых вариантах осуществления используют по меньшей мере два ХО. В некоторых вариантах осуществления обработка семян включает непосредственное нанесение по меньшей мере одного ХО на семена, которые затем можно высеять или хранить в течение некоторого времени до высевания. Обработка семян может включать непрямую обработку, например, путем внесения по меньшей мере одного ХО в почву (которое известно в данной области техники, как внесение в борозды). В других вариантах осуществления по меньшей мере один ХО можно нанести на растения, которые прорастают из семян, например, путем некорневого опрыскивания. Методики дополнительно могут включать применение других агрономически полезных средств, таких как питательные микроэлементы, жирные кислоты и их производные, сигнальные молекулы растений ((кроме ХО), такие как липохитоолигосахариды, хитиновые соединения (кроме ХО), флавоноиды, жасмоновая кислота, линолевая кислота и линоленовая кислота и их производные и каррикины), гербициды, фунгициды и инсектициды, солюбилизирующие фосфат микроорганизмы, диазотрофы (ризобиальные инокуляты) и/или микоризные грибы.
Способы, предлагаемые в настоящем изобретении, в равной степени применимы для бобовых и небобовых растений. В некоторых вариантах осуществления семенами бобовых являются семена сои. В некоторых других вариантах осуществления, семенами, которые обрабатывают, являются семена небобовых растений, такие как семена полевой культуры, например, злаков, таких как кукуруза, или семена овощной культуры, такой как картофель.
Как показывают рабочие примеры, в которых обобщаются данные экспериментов, проведенных в теплицах и в поле, результаты, полученные способами, предлагаемыми в настоящем изобретении, показывают, что нанесение по меньшей мере одного ХО на семена или растения, которые прорастают из семян, приводит к усиленному росту растений. Эти результаты представляется неожиданными, в особенности с учетом точки зрения, согласно которой ХО участвуют в системной приобретенной устойчивости (СПО), но не обязательно участвуют в непосредственном усилении роста растений. Результаты, описанные в настоящем изобретении, показывают, что в некоторых случаях способы, предлагаемые в настоящем изобретении, приводят по существу к такому же эффекту или, в некоторых других случаях, приводят к более значительному усилению роста растений, чем обеспечиваемый с помощью ЛХО. В этом отношении особенно важны результаты, полученные с помощью экспериментов в теплицах, поскольку они проведены при условиях, когда практически отсутствуют болезни.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1a и 2a приведены химические структуры хитоолигосахаридов (ХО), применимых при практическом осуществлении настоящего изобретения.
На фиг. 1b и 2b приведены химические структуры липохитоолигосахаридов (ЛХО), которые соответствуют ХО, приведенным на фиг. 1a и 2a, и которые также применимы при практическом осуществлении настоящего изобретения.
На фиг. 3a и 4a приведены химические структуры других ХО, применимых при практическом осуществлении настоящего изобретения.
На фиг. 3b и 4b приведены химические структуры Myc-факторов, которые соответствуют ХО, приведенным на фиг. 3a и 3b, и которые также применимы при практическом осуществлении настоящего изобретения.
На фиг. 5 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, предлагаемого в настоящем изобретении (представленного на фиг. 2a), при трех разных концентрациях (10-7, 10-8 и 10-9 M) по сравнению с двумя другими источниками ЛХО, представленными на фиг. 1b, и контролем при обработке семян томатов, выраженное с помощью средней длины корней ростка.
На фиг. 6 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, предлагаемого в настоящем изобретении (представленного на фиг. 2a), при трех разных концентрациях (10-7, 10-8 и 10-9 M) по сравнению с двумя другими источниками ЛХО, представленными на фиг. 1b, и контролем при обработке семян томатов, выраженное с помощью средней массы корней ростка в сыром виде.
На фиг. 7 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, предлагаемого в настоящем изобретении (представленного на фиг. 2a), при средней концентрации (трех концентраций) по сравнению с двумя другими источниками ЛХО, представленными на фиг. 1b, при обработке семян томатов, выраженное с помощью средней длины корней ростка.
На фиг. 8 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, предлагаемого в настоящем изобретении (представленного на фиг. 2a), при средней концентрации (трех концентраций) по сравнению с двумя другими источниками ЛХО, представленными на фиг. 1b, при обработке растений томатов, выраженное с помощью средней массы корней ростка в сыром виде.
На фиг. 9 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, предлагаемого в настоящем изобретении (представленного на фиг. 2a), по сравнению с ЛХО, представленным на фиг. 2b, и контролем при обработке растений хлопчатника, выраженное с помощью средней массы каждого ростка в сухом состоянии после обработки.
На фиг. 10 (эксперимент 1) и 11 (эксперимент 2) приведены столбцовые диаграммы, которые иллюстрирует влияние ХО, представленного на фиг. 2a, по сравнению с ЛХО, представленным на фиг. 2b, и смеси (не предлагаемых в настоящем изобретении) хитиновых соединений выработанных с помощью хитиназы, при обработке семян кукурузы, выраженное с помощью средней массы в сухом состоянии побегов, корней и полной массы в сухом состоянии (суммарной массы в сухом состоянии побегов и корней).
На фиг. 12 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по сравнению с ЛХО, представленным на фиг. 2b, смесью ХО выработанных с помощью хитиназы, изофлавоноидом и контролем при обработке семян сои, выраженное с помощью площади поверхности листьев.
На фиг. 13 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, ЛХО, представленного на фиг. 1b, изофлавоноида и смеси не предлагаемых в настоящем изобретении хитиновых соединений (полученных из хитозана посредством ферментативного процесса) при обработке семян сои, выраженное с помощью средней массы растений сои в сухом состоянии.
На фиг. 14 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной или двумя жирными кислотами, по сравнению с ЛХО, представленным на фиг. 2b, и водой на деформацию корневых волосков сиратро, выраженное в процентах.
На фиг. 15 приведена диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной или двумя жирными кислотами, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян канолы, выраженное с помощью степени прорастания семян в процентах.
На фиг. 16 приведена диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной или двумя жирными кислотами, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян пшеницы, выраженное с помощью степени прорастания семян в процентах.
На фиг. 17 приведена диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной или двумя жирными кислотами, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян люцерны, выраженное с помощью степени прорастания семян в процентах.
На фиг. 18 приведена секторная диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из двух разных жирных кислот, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян кукурузы, выраженное с помощью степени прорастания семян в процентах.
На фиг. 19 приведена диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из двух разных жирных кислот, по сравнению с ЛХО, представленным на фиг. 2b, каждой из жирных кислот по отдельности и контролем при обработке семян кукурузы, выраженное с помощью степени прорастания семян в процентах.
На фиг. 20 приведена диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из двух разных жирных кислот, ХО вместе с обеими жирными кислотами, по сравнению с ЛХО, представленным на фиг. 2b, и контролем при обработке семян пшеницы, выраженное с помощью степени прорастания семян в процентах.
На фиг. 21 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из четырех разных жирных кислот, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян Vicia sativa, выраженное с помощью степени прорастания семян в процентах.
На фиг. 22 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из двух разных жирных кислот, по сравнению с ЛХО, представленным на фиг. 2b, и контролем при обработке корней Vicia sativa, выраженное с помощью средней длины корней.
На фиг. 23 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из двух разных жирных кислот, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян фасоли золотистой, гиацинтовых бобов, красной чечевицы и красного клевера, выраженное с помощью степени прорастания семян в процентах.
На фиг. 24 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из двух разных жирных кислот, по сравнению с ЛХО, представленным на фиг. 2b, и водой на рост ростков томатов, выраженное с помощью средней длины корней.
На фиг. 25 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с одной из двух разных жирных кислот, по сравнению с ЛХО, представленным на фиг. 1b, на семена сои, выраженное с помощью средней длины корешков.
На фиг. 26 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян хлопчатника, выраженное с помощью средней массы растения в сухом состоянии.
На фиг. 27 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по сравнению с ЛХО, представленным на фиг. 1b, и смесь ХО выработанных с помощью хитиназы, при обработке растений сои, выраженное с помощью средней биомассы растения в сухом состоянии.
На фиг. 28 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с ЛХО, представленным на фиг. 2b, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян кукурузы, выраженное с помощью средней массы растения в сухом состоянии.
На фиг. 29 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с ЛХО, представленным на фиг. 2b, по сравнению с ЛХО, представленным на фиг. 2b, и водой при обработке семян сорго, выраженное с помощью средней длины корней ростка.
На фиг. 30 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с питательным микроэлементом, по сравнению с водой при обработке растений хлопчатника, выраженное с помощью среднего содержания хлорофилла.
На фиг. 31 приведена столбцовая диаграмма, которая иллюстрирует влияние ХО, представленного на фиг. 2a, по отдельности или в комбинации с питательным микроэлементом, по сравнению с водой при обработке растений хлопчатника, выраженное с помощью средней массы растения в сухом состоянии.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Хитоолигосахариды
ХО известны в данной области техники, как β-1-4-связанные N-ацетилглюкозаминовые структуры, идентифицированные, как олигомеры хитина, также как N-ацетилхитоолигосахариды. ХО обладают особыми и различными структурами боковых цепей, которые делают их отличными от молекул хитина [(C8H13NO5)n, CAS No. 1398-61-4] и молекул хитозана [(C5H11NO4)n, CAS No. 9012-76-4]. См., например, Hamel, et al., Planta 232:787-806 (2010)(например, фиг. 1, на котором представлены структуры хитина, хитозана, Nod-факторов (ЛХО) и соответствующих ХО (в котором отсутствуют 18C, 16C или 20C ацильные группы)). ХО, предлагаемые в настоящем изобретении, также относительно хорошо растворимы в воде по сравнению с хитином и хитозаном и в некоторых вариантах осуществления, описанных ниже в настоящем изобретении, являются пентамерными. Типичной литературой, в которой описаны структура и получение ХО, которые могут быть подходящими для применения в настоящем изобретении, является следующая: Muller, et al., Plant Physiol. 124:733-9 (2000)(например, фиг. 1 в этой публикации); Van der Holst, et al., Current Opinion in Structural Biology, 11:608-616 (2001)(например, фиг. 1 в этой публикации); Robina, et al., Tetrahedron 58:521-530 (2002); D′Haeze, et al., Glycobiol. 12(6):79R-105R (2002); Rouge, et al. Chapter 27, "The Molecular Immunology of Complex Carbohydrates" в Advances in Experimental Medicine and Biology, Springer Science; Wan, et al., Plant Cell 21:1053-69 (2009); PCT/F100/00803 (9/21/2000); и Demont-Caulet, et al., Plant Physiol. 120(1):83-92 (1999).
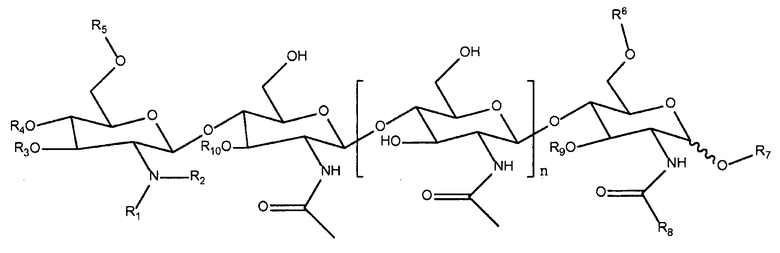
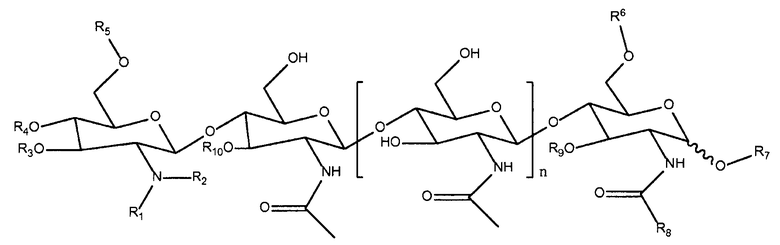
ХО по структуре отличаются от ЛХО в основном тем, что в них отсутствует боковая группа жирной кислоты. Образующиеся из микориза ХО и отсутствующие в природе их синтетические производные, которые можно использовать при практическом осуществлении настоящего изобретения, можно представить следующей формулой:
 ,
,
в которой R1 и R2 каждый независимо означает водород или метил; R3 означает водород, ацетил или карбамоил; R4 означает водород, ацетил или карбамоил; R5 означает водород, ацетил или карбамоил; R6 означает водород, арабинозил, фукозил, ацетил, сульфат, 3-0-S-2-0-MeFuc, 2-0-MeFuc и 4-0-AcFuc; R7 означает водород, маннозил или глицерин; R8 означает водород, метил или -CH2OH; R9 означает водород, арабинозил или фукозил; R10 означает водород, ацетил или фукозил; и n равно 0, 1, 2 или 3. Структуры соответствующих ризобиальных ЛХО описаны в публикации D′Haeze, et al., см. выше.
Два ХО, подходящие для применения в настоящем изобретении, представлены на фиг. 1a и 2a. Они соответствуют ЛХО, вырабатывающимся Bradyrhizobium japonicum и Rhizobium leguminosarum biovar viciae соответственно, которые симбиотически взаимодействуют с соей и горохом соответственно, но в них отсутствуют боковые цепи жирных кислот. Соответствующие ЛХО, вырабатывающиеся этими микоризами (и которые также применимы при практическом осуществлении настоящего изобретения), представлены на фиг. 1b и 2b.
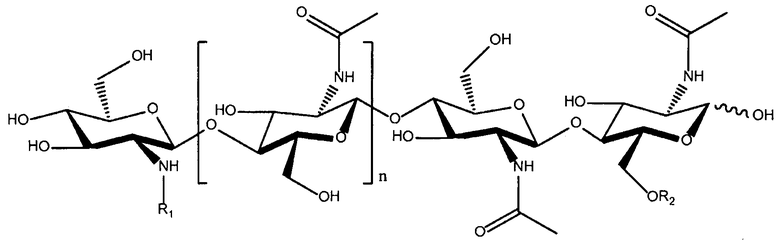
Структуры других ХО, которые могут быть подходящими для применения при практическом осуществлении настоящего изобретения, легко образовать из ЛХО, полученных (т.е. выделенных и/или очищенных) из микоризных грибов, таких как грибы группы Glomerocycota, например, Glomus intraradices. См., например, WO 2010/049751 и Maillet, et al., Nature 469:58-63 (2011) (описанные в ней ЛХО также называют "Myc-факторами"). Типичные ХО, образованные из микоризных грибов, описываются следующей структурой:
 ,
,
в которой n=1 или 2; R1 означает водород или метил; и R2 означает водород или SO3H. Два других ХО, подходящие для применения в настоящем изобретении, один из которых сульфатирован и другой не сульфатирован, представлены на фиг. 3a и 4a соответственно. Они соответствуют двум разным ЛХО, вырабатывающимся микоризными грибами Glomas intraradices, которые представлены на фиг. 3b и 4b (и которые также применимы при практическом осуществлении настоящего изобретения).
ХО могут быть синтетическими или рекомбинантными. Способы получения синтетических ХО описаны, например, в публикации Robina, см. выше. Способы получения рекомбинантных ХО, например, с использованием E. coli в качестве хозяина, известны в данной области техники. См., например, Dumon, et al., ChemBioChem 7:359-65 (2006), Samain, et al., Carbohydrate Res. 302:35-42 (1997); Cottaz, et al., Met. Eng. 7(4):311-7 (2005) и Samain, et al., J. Biotechnol. 72:33-47 (1999)(например, фиг. 1 в этой публикации, на котором представлены структуры ХО, которые можно образовать рекомбинантно в E. coli, содержащих различные комбинации генов nodBCHL). Для задач настоящего изобретения по меньшей мере один ХО структурно отличается от хитинов, хитозанов и других хитоолигосахаридов, получаемых ферментативным путем с использованием хитина в качестве исходного вещества.
Для задач настоящего изобретения по меньшей мере один рекомбинантный ХО обладает чистотой, составляющей не менее 60%, например, чистотой, составляющей не менее 60%, чистотой, составляющей не менее 65%, чистотой, составляющей не менее 70%, чистотой, составляющей не менее 75%, чистотой, составляющей не менее 80%, чистотой, составляющей не менее 85%, чистотой, составляющей не менее 90%, чистотой, составляющей не менее 91%, чистотой, составляющей не менее 92%, чистотой, составляющей не менее 93%, чистотой, составляющей не менее 94%, чистотой, составляющей не менее 95%, чистотой, составляющей не менее 96%, чистотой, составляющей не менее 97%, чистотой, составляющей не менее 98%, чистотой, составляющей не менее 99%, вплоть до чистоты, составляющей 100%.
Семена можно обработать по меньшей мере одним ХО по различным методикам, таким как распыление или разбрызгивания. Обработку распылением и разбрызгиванием можно проводить путем приготовления эффективного количества по меньшей мере одного ХО в сельскохозяйственно приемлемом носителе, обычно водном по природе, и распыления или разбрызгивания композиции на семена с помощью непрерывной системы для обработки (которую калибруют для нанесения обрабатывающего средства с заранее заданной скоростью в соответствии с непрерывным потоком семян), такой как протравливатель барабанного типа. В этих методиках предпочтительно используются относительно небольшие объемы носителя, чтобы обеспечить относительно быструю сушку обработанных семян. Таким образом можно эффективно обработать большие объемы семян. Также можно использовать системы периодического действия, в которых в смеситель подаются заранее заданные количества семян и композиций сигнальных молекул. Системы и аппаратуру для проведения такой обработки продают многочисленные поставщики, например, Bayer CropScience (Gustafson).
В другом варианте осуществления обработка включает нанесение на семена покрытия по меньшей мере из одного ХО. Одна такая методика включает нанесение композиции на внутреннюю стенку круглого контейнера, добавление семян и последующее вращение контейнера, так чтобы семена соприкасались со стенкой и композицией, эта методика известна в данной области техники, как "контейнерное нанесение покрытия". Наносить покрытия на семена с помощью комбинации методик нанесения покрытий. Замачивание обычно включает использование водного раствора, содержащего средство для усиления роста растений. Например, семена можно замачивать в течение от примерно 1 мин до примерно 24 ч (например, в течение не менее 1 мин, 5 мин, 10 мин, 20 мин, 40 мин, 80 мин, 3 ч, 6 ч, 12 ч, 24 ч). Некоторые типы семян (например, семена сои) чувствительны к влаге. Тогда замачивание таких семян в течение длительного периода времени может быть нежелательным и в этом случае замачивание обычно проводят в течение от примерно 1 мин до примерно 20 мин.
В тех вариантах осуществления, которые включают хранение семян после нанесения по меньшей мере одного ХО, адгезия ХО к семенам в течение любой части времени хранения не является критически важной. Если не ограничиваться какой-либо конкретной теорией, то заявители полагают, что, несмотря на то, что обработка может не обеспечить соприкосновение сигнальной молекулы растения с поверхностью семени после обработки и в течение любой части времени хранения, ХО может оказать предназначенное воздействие вследствие явления, известного, как память семян, или восприятие семян. См. Macchiavelli, et al., J. Exp. Bot. 55(408):1635-40 (2004). Заявители также полагают, что после обработки ХО диффундирует по направлению к молодому развивающемуся корешку и активирует гены, связанные с симбиозом и развитием, что приводит к изменению структуры корней растения. Тем не менее, композиции, содержащие ХО, могут дополнительно содержать желательное количество агента, придающего липкость, или образующего покрытие. По эстетическим соображениям композиции могут дополнительно содержать образующий покрытие полимер и/или краситель.
Количество по меньшей мере одного ХО эффективно для усиления роста, так что после уборки растение характеризуется по меньшей мере одним из следующих: увеличенной урожайностью растений, измеренной в единицах бушель/акр, увеличенным количеством корней, увеличенной длиной корней, увеличенной массой корней, увеличенным объемом корней и увеличенной площадью листвы по сравнению с необработанными растениями или растениями, выросшими из необработанных семян (любым активным веществом). Эффективное количество по меньшей мере одного ХО, использующегося для обработки семян, выраженное в единицах концентрации, обычно находится в диапазоне от примерно 10-5 до примерно 10-14 M (молярная концентрация), и в некоторых вариантах осуществления от примерно 10-5 до примерно 10-11 M, и в некоторых других вариантах осуществления от примерно 10-7 до примерно 10-8 M. Выраженное в единицах массы эффективное количество обычно находится в диапазоне от примерно 1 до примерно 400 мкг/центнер (ц) семян и в некоторых вариантах осуществления от примерно 2 до примерно 70 мкг/ц, и в некоторых других вариантах осуществления, от примерно 2,5 до примерно 3,0 мкг/ц семян.
Для непрямой обработки семян, т.е. обработки внесением в борозды, эффективное количество по меньшей мере одного ХО обычно находится в диапазоне от примерно 1 мкг/акр до примерно 70 мкг/акр, и в некоторых вариантах осуществления от примерно 50 мкг/акр до примерно 60 мкг/акр. Для нанесения на растения эффективное количество ХО обычно находится в диапазоне от примерно 1 мкг/акр до примерно 30 мкг/акр, и в некоторых вариантах осуществления от примерно 11 мкг/акр до примерно 20 мкг/акр.
Семена можно обработать по меньшей мере одним ХО непосредственно перед высеванием или во время высевания. Обработка по время высевания может включать прямое нанесение на семена, как это описано выше, или в некоторых других вариантах осуществления, путем внесения активных веществ в почву, известного в данной области техники, как обработка внесением в борозды. В тех вариантах осуществления, которые включают обработку семян после хранения, после этого семена можно упаковать, например, в 50-фунтовые или 100-фунтовые мешки, или большие мешки, или контейнеры в соответствии со стандартными методиками. Семена можно хранить в течение не менее 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев и даже дольше, например, в течение 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 месяцев или даже дольше при подходящих условиях хранения, которые известны в данной области техники. Хотя семена сои можно высевать в следующем сезоне, семена сои можно хранить в течение намного более длительных периодов времени, включая превышающие 3 года.
Другие агрономически полезные агенты
Настоящее изобретение может дополнительно включать обработку семян или растений, которые прорастают из семян, по меньшей мере одним сельскохозяйственно/агрономически полезным агентом. При использовании в настоящем изобретении и в данной области техники термин "сельскохозяйственно или агрономически полезный" означает агенты, которые при нанесении на семена или растения приводят к улучшению (которое может быть статистически значимым) характеристик растения, таких как густота стояния растений, рост (например, как это определено в связи с ХО) или мощность, по сравнению с необработанными семенами или растениями. Эти агенты можно приготовить вместе по меньшей мере с одним ХО или нанести на семена или растения с помощью отдельного состава. Типичные примеры таких агентов, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают питательные микроэлементы (например, витамины и микроэлементы), жирные кислоты и их производные, сигнальные молекулы растений (кроме ХО), гербициды, фунгициды и инсектициды, солюбилизирующие фосфат микроорганизмы, диазотрофы (ризобиальные инокуляты) и/или микоризные грибы.
Питательные микроэлементы
Типичные витамины, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают пантотенат кальция, фолиевую кислоту, биотин и витамин C. Типичные примеры микроэлементов, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают бор, хлор, марганец, железо, цинк, медь, молибден, никель, селен и натрий.
Количество по меньшей мере одного питательного микроэлемента, использующееся для обработки семян, выраженное в единицах концентрации, обычно находится в диапазоне от 10 част./млн до 100 част./млн и в некоторых вариантах осуществления от примерно 2 част./млн до примерно 100 част./млн. Выраженное в единицах массы эффективное количество в одном варианте осуществления обычно находится в диапазоне от примерно 180 мкг до примерно 9 мг/центнер (ц) семян и в некоторых вариантах осуществления при некорневом внесении от примерно 4 мкг до примерно 200 мкг/растение. Другими словами, при обработке семян эффективное количество по меньшей мере одного питательного микроэлемента обычно находится в диапазоне от 30 мкг/акр до примерно 1,5 мг/акр и в некоторых вариантах осуществления при некорневом внесении от примерно 120 мг/акр до примерно 6 г/акр.
Жирные кислоты
Типичные жирные кислоты, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают жирные кислоты, которые являются заместителями в природных ЛХО, такие как стеариновая и пальмитиновая кислоты. Другие жирные кислоты, которые можно использовать, включают насыщенные C12-C18 жирные кислоты, которые (кроме стеариновой и пальмитиновой кислот) включают лауриновую кислоту и миристиновую кислоту, и ненасыщенные C12-C18 жирные кислоты, такие как миристоленовую кислоту, пальмитоленовую кислоту, сапиеновую кислоту, олеиновую кислоту, элаидиновую кислоту, вакценовую кислоту, линолевую кислоту, линоленовую кислоту и линоэлаидиновую кислоту. Линолевая кислота и линоленовая кислота образуются при биосинтезе жасмоновой кислоты (которая, как это описано ниже, также является агрономически полезным агентом для задач настоящего изобретения). Сообщают, что линолевая кислота и линолевая кислота (и их производные) являются индукторами экспрессии гена nod или продуцирования ЛХО ризобактериями. См., например, Mabood, Fazli, "Linoleic and linolenic acid induce the expression of nod genes in Bradyrhizobium japonicum," USDA 3, May 17, 2001.
Полезные производные жирных кислот, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают эфиры, амиды, гликозиды и соли. Типичными эфирами являются соединения, в которых карбоксигруппа жирной кислоты, например, линолевой кислоты и линоленовой кислоты, заменена группой --COR, в которой R означает группу --OR1, в которой R1 означает: алкильную группу, такую как неразветвленная или разветвленная C1-C8 алкильная группа, например, метильная, этильная или пропильная группа; алкенильную группу, такую как неразветвленная или разветвленная C2-C8 алкенильная группа; алкинильную группу, такую как неразветвленная или разветвленная C2-C8 алкинильная группа; арильную группу, содержащую, например, от 6 до 10 атомов углерода; или гетероарильную группу, содержащую, например, от 4 до 9 атомов углерода, где геетроатомами в гетероарильной группе могут быть, например, N, O, P или S. Типичными амидами являются соединения, в которых карбоксигруппа жирной кислоты, например, линолевой кислоты и линоленовой кислоты, заменена группой --COR, в которой R означает группу NR2R3, в которой R2 и R3 независимо означают: водород; алкильную группу, такую как неразветвленная или разветвленная C1-C8 алкильная группа, например, метильная, этильная или пропильная группа; алкенильную группу, такую как неразветвленная или разветвленная C2-C8 алкенильная группа; алкинильную группу, такую как неразветвленная или разветвленная C2-C8 алкинильная группа; арильную группу, содержащую, например, от 6 до 10 атомов углерода; или гетероарильную группу, содержащую, например, от 4 до 9 атомов углерода, где геетроатомами в гетероарильной группе могут быть, например, N, O, P или S. Сложные эфиры можно получить по известным методикам, таким как катализируемое кислотой нуклеофильное присоединение, при котором карбоновая кислота взаимодействует со спиртом в присутствии каталитического количества неорганической кислоты. Амиды также можно получить по известным методикам, например, по реакции карбоновой кислоты с соответствующим амином в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (ДЦК), в нейтральной среде. Подходящие соли жирных кислот, например, линолевой кислоты и линоленовой кислоты, включают, например, соли присоединения с основаниями. Основания, которые можно использовать в качестве реагентов для получения метаболически приемлемых солей этих соединений с основаниями, включают образованные из катионов, таких как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, кальция и магния). Эти соли можно легко получить смешиванием раствора жирной кислоты с раствором основания. Соль можно осадить из раствора и собрать фильтрованием или можно извлечь другими средствами, такими как выпаривание растворителя.
Количества жирной кислоты или ее производного обычно составляют от примерно 10% до примерно 30% и в некоторых вариантах осуществления примерно 25% в пересчете на количество по меньшей мере одного ХО.
Сигнальные молекулы растений
Настоящее изобретение также может включать обработку семян или растения сигнальной молекулой растения, не представляющей собой ХО. Для задач настоящего изобретения термин "сигнальная молекула растения", который можно использовать взаимозаменяемым образом с термином "средство для усиления роста растений", в широком смысле означает любой агент, в природе содержащийся в растениях или микробах, и синтетический (и который может быть не находящимся в природе), который прямо или косвенно активирует биохимический путь растения, что приводит к усиленному росту растений, который можно измерить с помощью по меньшей мере одного из следующих: увеличенной урожайности растений, измеренной в единицах бушель/акр, увеличенного количества корней, увеличенной длины корней, увеличенной массы корней, увеличенного объема корней и увеличенной площади листвы по сравнению с необработанными растениями или растениями, выросшими из необработанных семян. Типичные примеры сигнальных молекул растений, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают липохитоолигосахариды, хитиновые соединения (кроме ХО), флавоноиды, жасмоновую кислоту, линолевую кислоту и линоленовую кислоту и их производные (см. выше) и каррикины.
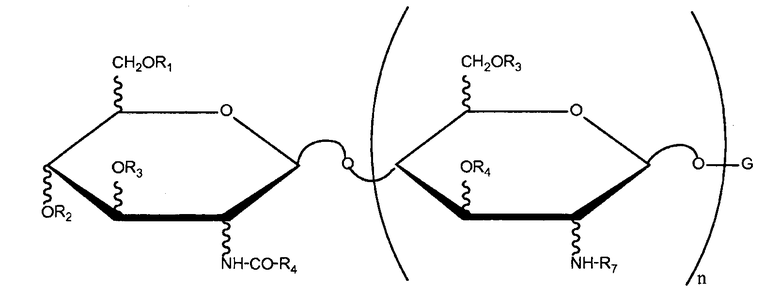
Липохитоолигосахариды (ЛХО), также известные в данной области техники, как симбиотические Nod-сигналы или Nod-факторы, состоят из олигосахаридной главной цепи β-1,4-связанных N-ацетил-D-глюкозаминовых ("GIcNAc") остатков с присоединенной к атому N жирной ацильной цепью, сконденсированной на невосстанавливающем конце. ЛХО различаются по количеству остатков GIcNAc в главной цепи, по длине и степени насыщенности жирной ацильной цепи и степени замещения восстанавливающими и невосстанавливающими сахарными остатками. См., например, Denarie, et al., Ann. Rev. Biochem. 65:503-35 (1996), Hamel, et al., см. выше., Prome, et al., Pure Appl. Chem. 70(1):55-60 (1998). Пример ЛХО приведен ниже в виде формулы I
 ,
,
в которой:
G означает гексозамин, который может быть замещен, например, ацетильной группой по атому азота, сульфатной группой, ацетильной группой и/или простой эфирной группой по атому кислорода,
R1, R2, R3, R5, R6 и R7, которые могут быть одинаковыми или разными, означают H, CH3 CO--, Cx Hy CO--, где x является целым числом, равным от 0 до 17, и y является целым числом, равным от 1 до 35, или любую другую ацильную группу, такую как, например, карбамоил,
R4 означает моно-, ди- или триненасыщенную алифатическую цепь, содержащую по меньшей мере 12 атомов углерода, и n является целым числом, равным от 1 до 4.
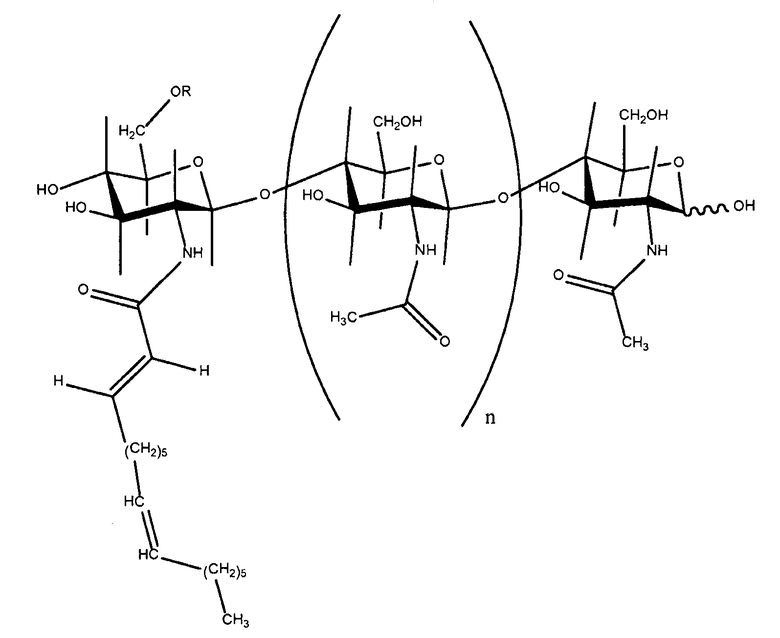
ЛХО можно получить (выделить и/или очистить) из бактерий, таких как Rhizobia, например, Rhizobium sp., Bradyrhizobium sp., Sinorhizobium sp. и Azorhizobium sp. Структура ЛХО характеристична для каждого такого вида бактерий и каждый штамм может продуцировать множество ЛХО, обладающих разными структурами. Например, конкретные ЛХО из S. meliloti также были описаны в патенте U.S. 5549718, как обладающие формулой II:
 ,
,
в которой R означает H или CH3 CO-- и n равно 2 или 3.
Еще более специфические ЛХО включают NodRM, NodRM-1, NodRM-3. В случае ацетилирования (R=CH3 CO--) они превращаются в AcNodRM-1 и AcNodRM-3 соответственно (патент U.S. 5545718).
ЛХО из Bradyrhizobium japonicum описаны в патентах U.S. 5175149 и 5321011. В широком смысле они являются пентасахаридными фитогормонами, содержащими метилфукозу. Описан целый ряд этих образованных из B. japonicum ЛХО: BjNod-V (C18:1); BjNod-V (AC, C18:1), BjNod-V (C16:1); и BjNod-V (AC, C16:0), где "V" указывает на наличие пяти N-ацетилглюкозаминов; "Ac" на ацетилирование; число после "C" указывает количество атомов углерода в боковой цепи жирной кислоты; и число после ":" количество двойных связей.
ЛХО, использующиеся в вариантах осуществления настоящего изобретения, можно получить (т.е. выделить и/или очистить) из штаммов бактерий, которые продуцируют ЛХО, таких как штаммы Azorhizobium, Bradyrhizobium (включая B. japonicum), Mesorhizobium, Rhizobium (включая R. leguminosarum), Sinorhizobium (включая S. meliloti) и штаммов бактерий, которым с помощью генной инженерии придана способность продуцировать ЛХО.
ЛХО являются первичными детерминантами специфичности по отношению к хозяину в симбиозе бобовых (Diaz, et al., Mol. Plant-Microbe Interactions 13:268-276 (2000)). Таким образом, в семействе бобовых специфические роды и виды микоризы образуют симбиотическую связывающую азот взаимосвязь со специфическим бобовым-хозяином. Эти комбинации растение-хозяин/бактерии описаны в публикации Hungria, et al., Soil Biol. Biochem. 29:819-830 (1997). Примеры этого симбиотического партнерства бактерии/бобовые включают S. meliloti/люцерна и донник белый; R. leguminosarum biovar viciae/горох и чечевица; R. leguminosarum biovar phaseoli/фасоль; Bradyrhizobium japonicum/соя; и R. leguminosarum biovar trifolii/красный клевер. В публикации Hungria также перечислены эффективные индукторы флавоноидного гена Nod ризобиальных видов и специфические структуры ЛХО, которые продуцируются различными ризобиальными видами. Однако специфичность ЛХО необходима только для образования образование клубеньков в бобовых растений. При практическом осуществлении настоящего изобретения, применение данного ЛХО не ограничивается обработкой семян его симбиотического бобового партнера для обеспечения повышенной урожайности растения, измеренной в единицах бушель/акр, увеличенного количества корней, увеличенной длины корней, увеличенной массы корней, увеличенного объема корней и увеличенной площади листвы по сравнению с растениями, выросшими из необработанных семян, или по сравнению с растениями, выросшими из семян, обработанных сигнальными молекулами непосредственно перед высеванием или в течение недели или меньшего количества времени после высевания.
Таким образом, в качестве дополнительных примеров, ЛХО и не встречающиеся в природе их синтетические производные, которые можно использовать при практическом осуществлении настоящего изобретения, описываются следующей формулой:
 ,
,
в которой R1 означает C14:0, 3OH-C14:0, изо-C15:0, C16:0, 3-OH-C16:0, изо-C15:0, C16:1, C16:2, C16:3, изо-C17:0, изо-C17:1, C18:0, 3OH-C18:0, C18:0/3-OH, C18:1, OH-C18:1, C18:2, C18:3, C18:4, C19:1 карбамоил, C20:0, C20:1, 3-OH-C20:1, C20:1/3-OH, C20:2, C20:3, C22:1 и C18-26(ω-1)-OH (которые в соответствии с публикацией D′Haeze, et al., см. выше, включают C18, C20, C22, C24 и C26 гидроксилированные соединения и C16:1Δ9, C16:2 (Δ2,9) и C16:3 (Δ2,4,9)); R2 означает водород или метил; R3 означает водород, ацетил или карбамоил; R4 означает водород, ацетил или карбамоил; R5 означает водород, ацетил или карбамоил; R6 означает водород, арабинозил, фукозил, ацетил, сульфат, 3-0-S-2-0-MeFuc, 2-0-MeFuc и 4-0-AcFuc; R7 означает водород, маннозил или глицерин; R8 означает водород, метил или -CH2OH; R9 означает водород, арабинозил или фукозил; R10 означает водород, ацетил или фукозил; и n равно 0, 1, 2 или 3. Структуры природных ризобиальных ЛХО, описывающиеся этой структурой, описаны в публикации D′Haeze, et al., см. выше.
В качестве других дополнительных примеров ЛХО, полученный из B. japonicum, представленный на фиг. 1b, можно использовать для обработки семян бобовых растений, не являющихся соей, и семян небобовых растений, таких как кукуруза. В качестве другого примера, ЛХО, который можно получить из R. leguminosarum, представленный на фиг. 2b (обозначенный, как ЛХО-V (C18:1), SP104) можно использовать для обработки семян бобовых растений, не являющихся горохом, и также небобовых растений.
В объем настоящего изобретения также входит применение ЛХО, полученных (т.е. выделенных и/или очищенных) из микоризных грибов, таких как грибы группы Glomerocycota, например, Glomus intraradices. Структуры типичных ЛХО, полученных из этих грибов, описаны в WO 2010/049751 и WO 2010/049751 (описанные в ней ЛХО также называют "Myc-факторами"). Типичные ХО, образованные из микоризных грибов, и не встречающиеся в природе их производные описываются следующей структурой:
 ,
,
в которой n=1 или 2; R1 означает C16, C16:0, C16:1, C16:2, C18:0, C18:19Z или C18:111Z; и R2 означает водород или SO3H. В некоторых вариантах осуществления используются ЛХО, продуцируемые микоризными грибами, представленные на фиг. 3b и 4b.
В объем настоящего изобретения также входит применение синтетических соединений ЛХО, таких как описанные в WO 2005/063784, и рекомбинантных ЛХО, полученных с помощью генной инженерии. Основная структура природных ЛХО может содержать модификации или заместители, обнаруживаемые в природных ЛХО, такие как описанные в публикациях Spaink, Crit. Rev. Plant Sci. 54:257-288 (2000) и D′Haeze, et al., Glycobiology 12:79R-105R (2002). Молекулы олигосахаридов-предшественников (ХО, которые, как это описано ниже, также применимы в качестве сигнальных молекул растений в настоящем изобретении), использующиеся для получения ЛХО, также могут синтезировать полученные с помощью генной инженерии микроорганизмы, например, как это описано в публикациях Samain, et al., Carbohydrate Res. 302:35-42 (1997); Cottaz, et al., Met. Eng. 7(4):311-7 (2005) и Samain, et al., J. Biotechnol. 72:33-47 (1999)(например, фиг. 1 в этой публикации, на котором представлены структуры ЛХО, которые можно образовать рекомбинантно в E. coli, содержащих различные комбинации генов nodBCHL).
Можно использовать ЛХО разной чистоты и их можно использовать в чистом виде или в форме культуры продуцирующих ЛХО бактерий или грибов. Например, OPTIMIZE® (продающийся фирмой Novozymes BioAg Limited) содержит культуру B. japonicum, который продуцирует ЛХО (ЛХО-V(C18:1, MeFuc), MOR116), который представлен на фиг. 1b. Методики получения в основном чистых ЛХО включают простое удаление микробных клеток из смеси ЛХО и микробов или продолжение выделения и очистки молекул ЛХО путем отделения содержащей ЛХО фазы растворителя с последующей очисткой с помощью ВЭЖХ (высокоэффективная жидкостная хроматография), как это описано, например, в патенте U.S. 5549718. Очистку можно улучшить путем повторения ВЭЖХ и для длительного хранения очищенные молекулы ЛХО можно высушить вымораживанием. Хитоолигосахариды (ХО), описанные выше, можно использовать в качестве исходных веществ для получения синтетических ЛХО. Для задач настоящего изобретения рекомбинантные ЛХО обладают чистотой, составляющей не менее 60%, например, чистотой, составляющей не менее 60%, чистотой, составляющей не менее 65%, чистотой, составляющей не менее 70%, чистотой, составляющей не менее 75%, чистотой, составляющей не менее 80%, чистотой, составляющей не менее 85%, чистотой, составляющей не менее 90%, чистотой, составляющей не менее 91%, чистотой, составляющей не менее 92%, чистотой, составляющей не менее 93%, чистотой, составляющей не менее 94%, чистотой, составляющей не менее 95%, чистотой, составляющей не менее 96%, чистотой, составляющей не менее 97%, чистотой, составляющей не менее 98%, чистотой, составляющей не менее 99%, вплоть до чистоты, составляющей 100%.
Хитины и хитозаны, которые являются основными компонентами стенок клеток грибов и экзоскелетов насекомых и ракообразных, также состоят из остатков GIcNAc. Хитиновые соединения включают хитин (IUPAC: N-[5-[[3-ацетиламино-4,5-дигидрокси-6-(гидроксиметил)оксан-2-ил]метоксиметил]-2-[[5-ацетиламино-4,6-дигидрокси-2-(гидроксиметил)оксан-3-ил]метоксиметил]-4-гидрокси-6-(гидроксиметил)оксан-3-ил]этанамид) и хитозан (IUPAC: 5-амино-6-[5-амино-6-[5-амино-4,6-дигидрокси-2(гидроксиметил)оксан-3-ил]окси-4-гидрокси-2-(гидроксиметил)оксан-3-ил]окси-2(гидроксиметил)оксан-3,4-диол). Эти соединения можно приобрести, например, у фирмы Sigma-Aldrich, или получить из насекомых, панцирей ракообразных или стенок клеток грибов. Методики получения хитина и хитозана известны в данной области техники и описаны, например, в патенте U.S. 4536207 (получение из панцирей ракообразных), Pochanavanich, et al., Lett. Appl. Microbiol. 35:17-21 (2002) (получение из стенок клеток грибов), и в патенте U.S. 5965545 (получение из панцирей крабов и гидролизом имеющегося в продаже хитозана). См. также Jung, et al., Carbohydrate Polymers 67:256-59 (2007); Khan, et al., Photosynthetica 40(4):621-4 (2002). Можно получить деацетилированные хитины и хитозаны, степень деацетилирования которых составляет от менее 35% до более 90%, и которые характеризуются широким спектром молекулярных масс, например, низкомолекулярные олигомеры хитозана, обладающие молекулярными массами, равными менее 15 кДа, и олигомеры хитина, обладающие молекулярными массами, равными от 0,5 до 2 кДа; "практическую марку" хитозана, обладающего молекулярной массой, равной примерно 150 кДа; и высокомолекулярный хитозан, обладающий молекулярной массой, равной до 700 кДа. Композиции хитина и хитозана, приготовленные для обработки семян, также имеются в продаже. Имеющиеся в продаже продукты включают, например, ELEXA® (Plant Defense Boosters, Inc.) и BEYOND™ (Agrihouse, Inc.).
Флавоноиды являются фенольными соединениями, в общей структуре которых содержатся два ароматических кольца, соединенные мостиком из трех атомов углерода. Флавоноиды продуцируются растениями и выполняют множество функций, например, являются превосходными сигнальными молекулами и средствами защиты от насекомых, животных, грибов и бактерий. Классы флавоноиды включают халконы, антоцианидины, кумарины, флавоны, флаванолы, флавонолы, флаваноны и изофлавоны. См. публикации Jain, et al., J. Plant Biochem. Biotechnol. 11:1-10 (2002); Shaw, et al., Environmental Microbiol. 11:1867-80 (2006).
Типичные флавоноиды, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают генистеин, дайдзеин, формононетин, нарингенин, гесперитин, лутеолин и апигенин. Флавоноидные соединения имеются в продаже, например, у фирмы Natland International Corp., Research Triangle Park, NC; MP Biomedicals, Irvine, CA; LC Laboratories, Woburn MA. Флавоноидные соединения можно выделить из растений или семян, например, как это описано в патентах U.S. 5702752; 5990291; и 6146668. Флавоноидные соединения также могут продуцировать полученные с помощью генной инженерии микроорганизмы, такие как дрожжи, как это описано в публикации Ralston, et al., Plant Physiology 137:1375-88 (2005).
Жасмоновую кислоту (JA, [1R-[1α,2β(Z)]]-3-оксо-2-(пентенил)циклопентануксусную кислоту) и ее производные (которые включают линолевую кислоту и линоленовую кислоту (которые описаны выше в связи с жирными кислотами и их производными) можно использовать при практическом осуществлении настоящего изобретения. Жасмоновая кислота и ее метиловый эфир, метилжасмонат (MeJA), совместно известные, как жасмонаты, являются соединениями на основе октадеканоида, которые в природе встречаются в растениях. Жасмоновую кислоту вырабатывают корни ростков пшеницы и грибы-микроорганизмы, такие как Botryodiplodia theobromae и Gibbrella fujikuroi, дрожжи (Saccharomyces cerevisiae) и патогенные и непатогенные штаммы Escherichia coli. Линолевую кислоту и линоленовую кислоту получают во время биосинтеза жасмоновой кислоты. Сообщают, что, как и линолевая кислота и линоленовая кислота, жасмонаты (и их производные) являются индукторами экспрессии гена nod или продуцирования ЛХО ризобактериями. См., например, публикацию Mabood, Fazli, Jasmonates induce the expression of nod genes in Bradyrhizobium japonicum, May 17, 2001.
Полезные производные жасмоновой кислоты, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают эфиры, амиды, гликозиды и соли. Типичными эфирами являются соединения, в которых карбоксигруппа жасмоновой кислоты заменена группой --COR, в которой R означает группу --OR1, в которой R1 означает: алкильную группу, такую как неразветвленная или разветвленная C1-C8 алкильная группа, например, метильная, этильная или пропильная группа; алкенильную группу, такую как неразветвленная или разветвленная C2-C8 алкенильная группа; алкинильную группу, такую как неразветвленная или разветвленная C2-C8 алкинильная группа; арильную группу, содержащую, например, от 6 до 10 атомов углерода; или гетероарильную группу, содержащую, например, от 4 до 9 атомов углерода, где геетроатомами в гетероарильной группе могут быть, например, N, O, P или S. Типичными амидами являются соединения, в которых карбоксигруппа жасмоновой кислоты заменена группой --COR, в которой R означает группу NR2R3, в которой R2 и R3 независимо означают: водород; алкильную группу, такую как неразветвленная или разветвленная C1-C8 алкильная группа, например, метильная, этильная или пропильная группа; алкенильную группу, такую как неразветвленная или разветвленная C2-C8 алкенильная группа; алкинильную группу, такую как неразветвленная или разветвленная C2-C8 алкинильная группа; арильную группу, содержащую, например, от 6 до 10 атомов углерода; или гетероарильную группу, содержащую, например, от 4 до 9 атомов углерода, где геетроатомами в гетероарильной группе могут быть, например, N, O, P или S. Сложные эфиры можно получить по известным методикам, таким как катализируемое кислотой нуклеофильное присоединение, при котором карбоновая кислота взаимодействует со спиртом в присутствии каталитического количества неорганической кислоты. Амиды также можно получить по известным методикам, например, по реакции карбоновой кислоты с соответствующим амином в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (ДЦК), в нейтральной среде. Подходящие соли жасмоновой кислоты включают, например, соли присоединения с основаниями. Основания, которые можно использовать в качестве реагентов для получения метаболически приемлемых солей этих соединений с основаниями, включают образованные из катионов, таких как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, кальция и магния). Эти соли можно легко получить смешиванием раствора линолевой кислоты, линоленовой кислоты или жасмоновой кислоты с раствором основания. Соль можно осадить из раствора и собрать фильтрованием или можно извлечь другими средствами, такими как выпаривание растворителя.
Каррикины являются винилогическими 4H-пиронами например, 2H-фуро[2,3-c]пиран-2-онами, включая их производные и аналоги. Примеры этих соединений описываются следующей структурой:
 ,
,
в которой: Z означает O, S или NR5; R1, R2, R3 и R4 все независимо означают H, алкил, алкенил, алкинил, фенил, бензил, гидроксигруппу, гидроксиалкил, алкоксигруппу, фенилоксигруппу, бензилоксигруппу, CN, COR6, COOR=, галоген, NR6R7 или NO2; и R5, R6 и R7 все независимо означают H, алкил или алкенил, или его биологически приемлемую соль. Примеры биологически приемлемых солей этих соединений могут включать соли присоединения с кислотами, образованные с биологически приемлемыми кислотами, примеры которых включают гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат, глюконат; метансульфонат, бензолсульфонат и п-толуолсульфонат. Дополнительные биологически приемлемые соли металлов могут включать соли щелочных металлов с основаниями, примеры которых включают соли натрия и калия. Примеры соединений, описывающихся этой структурой и которые могут быть подходящими для применения в настоящем изобретении, включают следующие: 3-метил-2H-фуро[2,3-c]пиран-2-он (где R1=CH3, R2, R3, R4=H), 2H-фуро[2,3-c]пиран-2-он (где R1, R2, R3, R4=H), 7-метил-2H-фуро[2,3-c]пиран-2-он (где R1, R2, R4=H, R3=CH3), 5-метил-2H-фуро[2,3-c]пиран-2-он (где R1, R2, R3=H, R4=CH3), 3,7-диметил-2H-фуро[2,3-c]пиран-2-он (где R1, R3=CH3, R2, R4=H), 3,5-диметил-2H-фуро[2,3-c]пиран-2-он (где R1, R4=CH3, R2, R3=H), 3,5,7-триметил-2H-фуро[2,3-c]пиран-2-он (где R1, R3, R4=CH3, R2=H), 5-метоксиметил-3-метил-2H-фуро[2,3-c]пиран-2-он (где R1=CH3, R2, R3=H, R4=CH2OCH3), 4-бром-3,7-диметил-2H-фуро[2,3-c]пиран-2-он (где R1, R3=CH3, R2=Br, R4=H), 3-метилфуро[2,3-c]пиридин-2(3H)-он (где Z=NH, R1=CH3, R2, R3, R4=H), 3,6-диметилфуро[2,3-c]пиридин-2(6H)-он (где Z=N--CH3, R1=CH3, R2, R3, R4=H). См. патент U.S. 7576213. Эти молекулы также известны, как каррикины. См. указанную выше публикацию Halford.
Количество по меньшей мере одной сигнальной молекулы растения, использующееся для обработки семян, выраженное в единицах концентрации, обычно находится в диапазоне от примерно 10-5 до примерно 10-14 M (молярная концентрация), и в некоторых вариантах осуществления от примерно 10-5 до примерно 10-11 M, и в некоторых других вариантах осуществления от примерно 10-7 до примерно 10-8 M. Выраженное в единицах массы эффективное количество обычно находится в диапазоне от примерно 1 до примерно 400 мкг/центнер (ц) семян и в некоторых вариантах осуществления от примерно 2 до примерно 70 мкг/ц, и в некоторых других вариантах осуществления, от примерно 2,5 до примерно 3,0 мкг/ц семян.
Для непрямой обработки семян, т.е. обработки внесением в борозды, эффективное количество по меньшей мере одной сигнальной молекулы растения обычно находится в диапазоне от 1 мкг/акр до примерно 70 мкг/акр, и в некоторых вариантах осуществления от примерно 50 мкг/акр до примерно 60 мкг/акр. Для нанесения на растения эффективное количество по меньшей мере одной сигнальной молекулы растения обычно находится в диапазоне от 1 мкг/акр до примерно 30 мкг/акр и в некоторых вариантах осуществления от примерно 11 мкг/акр до примерно 20 мкг/акр.
Гербициды, фунгициды и инсектициды
Подходящие гербициды включают бентазон, ацифлюорфен, хлоримурон, лактофен, кломазон, флуазифоп, глуфосинат, глифосат, сетоксидим, имазетапир, имазамокс, фомесаф, флумиклорак, имазахин и клетодим. Имеющиеся в продаже продукты, содержащие каждое из этих соединений, легко доступны. Концентрация гербицида в композиции обычно соответствует указанной на этикетке норме расхода конкретного гербицида.
"Фунгицид" при использовании в настоящем изобретении и в данной области техники, означает агент, который уничтожает грибы или подавляет рост грибов. При использовании в настоящем изобретении фунгицид "обладает активностью по отношению к" конкретному виду грибов, если обработка фунгицидом приводит к уничтожению или подавлению роста популяции грибов (например, в почве) по сравнению с необработанной популяцией. Эффективные фунгициды в соответствии с настоящим изобретением будут обладать надлежащей активностью по отношению к широкому спектру патогенов, включая, но не ограничиваясь только ими, Phytophthora, Rhizoctonia, Fusarium, Pythium, Phomopsis или Selerotinia и Phakopsora и их комбинации.
Имеющиеся в продаже фунгициды могут быть подходящими для применения в настоящем изобретении. Подходящие имеющиеся в продаже фунгициды включают PROTÉGÉ, RIVAL или ALLEGIANCE FL или LS (Gustafson, Plano, TX), WARDEN RTA (Agrilance, St. Paul, MN), APRON XL, APRON MAXX RTA или RFC, MAXIM 4FS или XL (Syngenta, Wilmington, DE), КАПТАН (Arvesta, Guelph, Ontario) и PROTREAT (Nitragin Argentina, Buenos Ares, Argentina). Активные ингредиенты в этих и других имеющихся в продаже фунгицидах включают, но не ограничиваются только ими, флудиоксонил, мефеноксам, азоксистробин и металаксил. Имеющиеся в продаже фунгициды наиболее предпочтительно использовать в соответствии с инструкциями изготовителей при рекомендованных концентрациях.
При использовании в настоящем изобретении инсектицид "обладает активностью по отношению к" конкретному виду насекомых, если обработка инсектицидом приводит к уничтожению или подавлению роста популяции насекомых по сравнению с необработанной популяцией. Эффективные инсектициды в соответствии с настоящим изобретением будут обладать надлежащей активностью по отношению к широкому спектру насекомых, включая, но не ограничиваясь только ими, проволочников, совок, личинок, кукурузного жука, личинки мухи ростковой, земляных блошек, земляных клопов, тлей, листоедов и щитников.
Имеющиеся в продаже инсектициды могут быть подходящими для применения в настоящем изобретении. Подходящие имеющиеся в продаже инсектициды включают CRUISER (Syngenta, Wilmington, DE), GAUCHO и PONCHO (Gustafson, Plano, TX). Активные ингредиенты в этих и других имеющихся в продаже инсектицидах включают тиаметоксам, клотианидин и имидаклоприд. Имеющиеся в продаже инсектициды наиболее предпочтительно использовать в соответствии с инструкциями изготовителей при рекомендованных концентрациях.
Солюбилизирующие фосфат микроорганизмы, диазотрофы (ризобиальные инокуляты) и/или микоризные грибы
Настоящее изобретение может дополнительно включать обработку семян солюбилизирующими фосфат микроорганизмами. При использовании в настоящем изобретении "солюбилизирующий фосфат микроорганизм" означает микроорганизм, который способен увеличить количество фосфора, доступного для растения. Солюбилизирующие фосфат микроорганизмы включают штаммы грибов и бактерий. В варианте осуществления солюбилизирующим фосфат микроорганизмом является спорообразующий микроорганизм.
Неограничивающие примеры солюбилизирующих фосфат микроорганизмов включают виды рода, выбранные из группы, включающей Acinetobacter, Arthrobacter, Arthrobotrys, Aspergillus, Azospirillum, Bacillus, Burkholderia, Candida Chryseomonas, Enterobacter, Eupenicillium, Exiguobacterium, Klebsiella, Kluyvera, Microbacterium, Mucor, Paecilomyces, Paenibacillus, Penicillium, Pseudomonas, Serratia, Stenotrophomonas, Streptomyces, Streptosporangium, Swaminathania, Thiobacillus, Torulospora, Vibrio, Xanthobacter и Xanthomonas.
Неограничивающие примеры солюбилизирующих фосфат микроорганизмов выбраны из группы, включающей Acinetobacter calcoaceticus, Acinetobacter sp, Arthrobacter sp., Arthrobotrys oligospora, Aspergillus niger, Aspergillus sp., Azospirillum halopraeferans, Bacillus amyloliquefaciens, Bacillus atrophaeus, Bacillus circulans,Bacillus licheniformis, Bacillus subtilis, Burkholderia cepacia, Burkholderia vietnamiensis, Candida krissii, Chryseomonas luteola, Enterobacter aerogenes, Enterobacter asburiae, Enterobacter sp., Enterobacter taylorae, Eupenicillium parvum, Exiguobacterium sp., Klebsiella sp., Kluyvera cryocrescens, Microbacterium sp., Mucor ramosissimus, Paecilomyces hepialid, Paecilomyces marquandii, Paenibacillus macerans, Paenibacillus mucilaginosus, Pantoea aglomerans, Penicillium expansum, Pseudomonas corrugate, Pseudomonas fluorescens, Pseudomonas lutea, Pseudomonas poae, Pseudomonas putida, Pseudomonas stutzeri, Pseudomonas trivialis, Serratia marcescens, Stenotrophomonas maltophilia, Streptomyces sp., Streptosporangium sp., Swaminathania salitolerans, Thiobacillus ferrooxidans, Torulospora globosa, Vibrio proteolyticus, Xanthobacter agilis и Xanthomonas campestris.
В предпочтительном варианте осуществления солюбилизирующим фосфат микроорганизмом является штамм грибов Penicillium. Штаммы грибов Penicillium, которые могут быть применимы при практическом осуществлении настоящего изобретения, включают P. bilaiae (ранее известный, как P. bilaii), P. albidum, P. aurantiogriseum, P. chrysogenum, P. citreonigrum, P. citrinum, P. digitatum, P. frequentas, P. fuscum, P. gaestrivorus, P. glabrum, P. griseofulvum, P. implicatum, P. janthinellum, P. lilacinum, P. minioluteum, P. montanense, P. nigricans, P. oxalicum, P. pinetorum, P. pinophilum, P. purpurogenum, P. radicans, P. radicum, P. raistrickii, P. rugulosum, P. simplicissimum, P. solitum, P. variabile, P. velutinum, P. viridicatum, P. glaucum, P. fussiporus и P. expansum.
В одном предпочтительном варианте осуществления видом Penicillium является P. bilaiae. В другом предпочтительном варианте осуществления штаммы P. bilaiae выбраны из группы, включающей ATCC 20851, NRRL 50169, ATCC 22348, ATCC 18309, NRRL 50162 (Wakelin, et al., 2004. Biol Fertil Soils 40:36-43). В другом предпочтительном варианте осуществления видом Penicillium является P. gaestrivorus, например, NRRL 50170 (см. выше публикацию Wakelin).
В некоторых вариантах осуществления используют более одного солюбилизирующего фосфат микроорганизма, например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, включая любую комбинацию Acinetobacter, Arthrobacter, Arthrobotrys, Aspergillus, Azospirillum, Bacillus, Burkholderia, Candida Chryseomonas, Enterobacter, Eupenicillium, Exiguobacterium, Klebsiella, Kluyvera, Microbacterium, Mucor, Paecilomyces, Paenibacillus, Penicillium, Pseudomonas, Serratia, Stenotrophomonas, Streptomyces, Streptosporangium, Swaminathania, Thiobacillus, Torulospora, Vibrio, Xanthobacte и Xanthomonas, включая один вид, выбранный из следующей группы: Acinetobacter calcoaceticus, Acinetobacter sp, Arthrobacter sp., Arthrobotrys oligospora, Aspergillus niger, Aspergillus sp., Azospirillum halopraeferans, Bacillus amyloliquefaciens, Bacillus atrophaeus, Bacillus circulans,Bacillus licheniformis, Bacillus subtilis, Burkholderia cepacia, Burkholderia vietnamiensis, Candida krissii, Chryseomonas luteola, Enterobacter aerogenes, Enterobacter asburiae, Enterobacter sp., Enterobacter taylorae, Eupenicillium parvum, Exiguobacterium sp., Klebsiella sp., Kluyvera cryocrescens, Microbacterium sp., Mucor ramosissimus, Paecilomyces hepialid, Paecilomyces marquandii, Paenibacillus macerans, Paenibacillus mucilaginosus, Pantoea aglomerans, Penicillium expansum, Pseudomonas corrugate, Pseudomonas fluorescens, Pseudomonas lutea, Pseudomonas poae, Pseudomonas putida, Pseudomonas stutzeri, Pseudomonas trivialis, Serratia marcescens, Stenotrophomonas maltophilia, Streptomyces sp., Streptosporangium sp., Swaminathania salitolerans, Thiobacillus ferrooxidans, Torulospora globosa, Vibrio proteolyticus, Xanthobacter agilis и Xanthomonas campestris.
В некоторых вариантах осуществления два разных штамма одного вида также можно объединить, например, используют по меньшей мере два разных штамма Penicillium. Применение комбинации по меньшей мере двух разных штаммов Penicillium обладает следующими преимуществами. При нанесении на почву, уже содержащую нерастворимые (или умеренно растворимые) фосфаты, применение объединенных штаммов грибов приведет к увеличению количества фосфора, доступного для усвоения растениями, по сравнению со случаем применения только одного штамма Penicillium. В свою очередь, это может привести к увеличению усвоения фосфата и/или повышению урожайности растений, растущих на этой почве, по сравнению со случаями применения только отдельных штаммов. Комбинация штаммов также позволяет использовать нерастворимые фосфориты в качестве эффективного удобрения для почв, которые содержат недостаточные количества доступного фосфора. Таким образом, в некоторых вариантах осуществления используют один штамм P. bilaiae и один штамм P. gaestrivorus. В других вариантах осуществления этими двумя штаммами являются NRRL 50169 и NRRL 50162. В других вариантах осуществления этими по меньшей мере двумя штаммами являются NRRL 50169 и NRRL 50170. В других вариантах осуществления этими по меньшей мере двумя штаммами являются NRRL 50162 и NRRL 50170.
Солюбилизирующие фосфат микроорганизмы можно получить по любой подходящей методике, известной специалисту в данной области техники, такой как, твердофазная или жидкостная ферментация с использованием подходящего источника углерода. Солюбилизирующий фосфат микроорганизм предпочтительно получают в виде стабильной споры.
В одном варианте осуществления солюбилизирующим фосфат микроорганизмом является грибы Penicillium. Грибы Penicillium, соответствующие настоящему изобретению, можно выращивать с помощью твердофазной или жидкостной ферментации и подходящего источника углерода. Изоляты Penicillium можно выращивать по любой подходящей методике, известной специалисту в данной области техники. Например, грибы можно выращивать в твердой среде для выращивания, такой как картофельный агар с декстрозой или агар с солодовым экстрактом, или в матрацах, содержащих подходящие жидкие среды, такие как среда Чапека-Докса или картофельно-декстрозный бульон. Эти методики выращивания можно использовать для получения инокулята Penicillium spp. для обработки (например, нанесения покрытия) семян и/или нанесения на агрономически приемлемый носитель для внесения в почву. Термин "инокулят" при использовании в настоящем описании означает любую форму солюбилизирующего фосфат микроорганизма, клетки грибов, мицелий или споры, бактериальные клетки или бактериальные споры, которые способны размножаться на или в почве, когда значения температуры, влажности и т.п. благоприятны для роста грибов.
Твердофазное получение спор Penicillium можно провести путем посева в твердую среду, такую как субстрат на основе торфа или вермикулита, или зерна, включая, но не ограничиваясь только ими, овес, пшеницу, ячмень или рис. В стерилизованную среду (стерилизацию проводят с помощью обработки в автоклаве или путем облучения) высевают суспензию спор (1×102-1×107 КОЕ/мл) подходящего Penicillium spp. и в зависимости от субстрата устанавливают влажность, равную от 20 до 50%. Материал инкубируют в течение от 2 до 8 недель при комнатной температуре. Споры также можно получить жидкостной ферментацией (Cunningham et al., 1990. Can J Bot. 68:2270-2274). Жидкостное получение можно провести путем выращивания грибов в любых подходящих средах, таких как картофельно-декстрозный бульон или среды с сахарозой и дрожжевым экстрактом, при подходящих значениях pH и температуры, которые можно определить по стандартным процедурам, использующимся в данной области техники.
Полученный материал можно использовать без обработки или споры можно собрать, сконцентрировать центрифугированием, приготовить композицию и затем высушить по методикам сушки на воздухе, сушки вымораживанием или сушки в псевдоожиженном слое (Friesen, et al., 2005, Appl. Microbiol. Biotechnol. 68:397-404) и получить смачивающийся порошок. Затем смачивающийся порошок суспендируют в воде, наносят на поверхность семян и перед высеванием ему дают высохнуть. Смачивающийся порошок можно использовать вместе с другими средствами для обработки семян, такими как, но не ограничиваясь только ими, химические средства для обработки семян, носители (например, тальк, глина, каолин, силикагель, каолинит) или полимеры (например, метилцеллюлоза, поливинилпирролидон). Альтернативно, суспензию спор подходящего Penicillium spp. можно нанести на подходящий совместимы с почвой носитель (например, порошок или гранулы на основе торфа) с обеспечением подходящей конечной влажности. До использования материал можно инкубировать при комнатной температуре, обычно в течение от примерно 1 дня до примерно 8 недель.
Кроме ингредиентов, использующихся для выращивания солюбилизирующего фосфат микроорганизма, включая, например, ингредиенты, указанные выше для выращивания Penicillium, при приготовлении солюбилизирующего фосфат микроорганизма можно использовать другие агрономически приемлемые носители. При использовании в настоящем изобретении в связи с "носителем" термин "агрономически приемлемый" означает любой материал, который можно использовать для доставки активных веществ в семена, почву или растение, и предпочтительно, чтобы носитель можно было добавлять (к семенам, почве или растению) без неблагоприятного влияния на рост растений, структуру почвы, дренаж почвы и т.п. Подходящие носители включают, но не ограничиваются только ими, пшеничную мякину, отруби, измельченную пшеничную солому, порошки или гранулы на основе торфа, гранулы на основе гипса и глины (например, каолин, бентонит, монтмориллонит). При добавлении спор в почву гранулированный состав является предпочтительным. Составы в виде жидкости, с использованием торфа или смачивающегося порошка являются подходящими для нанесения на семена. При использовании для нанесения на семена материал можно смешать с водой, нанести на семена и дать высохнуть. Пример еще одного носителя включает увлажненный торф, высушенный, просеянный и нанесенный на семена до нанесения клея, например, гуммиарабика. В тех вариантах осуществления, которые включают приготовление активных веществ виде единой композиции, агрономически приемлемый носитель может быть водным.
Количество по меньшей мере одного солюбилизирующего фосфат микроорганизма меняется в зависимости от типа семян или почвы, типа культурного растения, количеств источников фосфора и/или питательных микроэлементов, содержащихся в почве или добавленных к ней и т.п. В каждом конкретном случае подходящее количество можно определить с помощью простых методик последовательных приближений. Обычно, например, для Penicillium наносимое количество находится в диапазоне 0,001-1,0 кг спор грибов и мицелия (масса в сыром виде) на гектар, или 102-106 колониеобразующих единиц (КОЕ) в пересчете на одно семя (когда используют семена с покрытием), или на гранулированном носителе наносят от 1×106 до 1×1011 колониеобразующих единиц на гектар. Грибковые клетки, например, в форме спор и носителя можно вносить в грядку с семенами в почву на уровне корней или можно использовать для нанесения на семена до высадки.
В вариантах осуществления, в которых, например, используют по меньшей мере два штамма солюбилизирующего фосфат микроорганизма, например, два штамма Penicillium, имеющиеся в продаже удобрения можно внести в почву вместо (или даже вместе) с природным фосфоритом. Источник фосфора может содержать источник фосфора, находящийся в почве. В других вариантах осуществления источник фосфора можно добавить в почву. В одном варианте осуществления источником является фосфорит. В другом варианте осуществления источником является готовое удобрение. В продаже имеется много типов готовых фосфатных удобрении. Некоторыми обычными являются содержащие моноаммонийфосфат (МАФ), тройной суперфосфат (ТСП), диаммонийфосфат, обычный суперфосфат и полифосфат аммония. Все эти удобрения получают химической обработкой нерастворимых природных фосфоритов на крупномасштабных предприятиях по производству удобрений и продукт является дорогостоящим. С помощью настоящего изобретения можно уменьшить количество этих удобрений, вносимых в почву, при сохранении такого же количества фосфора, усваиваемого из почвы.
В другом варианте осуществления источник или фосфор является органическим. Органическое удобрение означает добавку к почве, полученную из природных источников, которое гарантирует по меньшей мере минимальное содержание азота, фосфата и калия. Примеры включают растительные и животные субпродукты, порошковые породы, водоросли, бактериальные удобрения и кондиционеры. Конкретные типичные примеры включают костяную муку, мясную муку, навоз, компост, осадки сточных вод или гуано.
Разумеется другие удобрения, такие как источники азота или другие улучшители почвы также можно добавить к почве примерно в то же время, что и солюбилизирующий фосфат микроорганизм, или в другое время, если эти другие материалы нетоксичны для грибов.
Диазотрофы являются бактериями и архибактериями, которые связывают атмосферный азот в более удобной форме, такой как аммиак. Примеры диазотрофов включают бактерии родов Rhizobium spp. (например, R. cellulosilyticum, R. daejeonense, R. etli, R. galegae, R. gallicum, R. giardinii, R. hainanense, R. huautlense, R. indigoferae, R. leguminosarum, R. loessense, R. lupini, R. lusitanum, R. meliloti, R. mongolense, R. miluonense, R. sullae, R. tropici, R. undicola и/или R. yanglingense), Bradyrhizobium spp. (например, B. bete, B. canariense, B. elkanii, B. iriomotense, B. japonicum, B. jicamae, B. liaoningense, B. pachyrhizi и/или B. yuanmingense), Azorhizobium spp. (например, A. caulinodans и/или A. doebereinerae), Sinorhizobium spp. (например, S. abri, S. adhaerens, S. americanum, S. aboris, S. fredii, S. indiaense, S. kostiense, S. kummerowiae, S. medicae, S. meliloti, S. mexicanus, S. morelense, S. saheli, S. terangae и/или S. xinjiangense), Mesorhizobium spp., (M. albiziae, M. amorphae, M. chacoense, M. ciceri, M. huakuii, M. loti, M. mediterraneum, M. pluifarium, M. septentrionale, M. temperatum и/или M. tianshanense) и их комбинации. В предпочтительном варианте осуществления диазотроф выбран из группы, включающей B. japonicum, R leguminosarum, R meliloti, S. meliloti и их комбинации. В другом варианте осуществления диазотрофом является B. japonicum. В другом варианте осуществления диазотрофом является R leguminosarum. В другом варианте осуществления диазотрофом является R meliloti. В другом варианте осуществления диазотрофом является S. meliloti.
Микоризные грибы образуют симбиотическое ассоциации с корнями сосудистого растения и обеспечивают, например, способность поглощать воду и минеральные питательные вещества вследствие сравнительно большой площади поверхности мицелия. Микоризные грибы включают эндомикоризные грибы (также называющиеся везикулярно-арбускулярными микоризами, VAM, арбускулярными микоризами, или AM), эктомикоризные грибы или их комбинацию. В одном варианте осуществления микоризные грибы являются эндомикоризами типа Glomeromycota и рода Glomus и Gigaspora. В еще одном варианте осуществления эндомикоризами являются штаммы Glomus aggregatum, Glomus brasilianum, Glomus clarum, Glomus deserticola, Glomus etunicatum, Glomus fasciculatum, Glomus intraradices, Glomus monosporum или Glomus mosseae, Gigaspora margarita или их комбинация.
Примеры микоризных грибов включают эндомикоризы типа Basidiomycota, Ascomycota и Zygomycota. Другие примеры включают штамм Laccaria bicolor, Laccaria laccata, Pisolithus tinctorius, Rhizopogon amylopogon, Rhizopogon fulvigleba, Rhizopogon luteolus, Rhizopogon villosuli, Scleroderma cepa, Scleroderma citrinum или их комбинацию.
Микоризные грибы включают эрикоидные микоризы, арбутоидные микоризы или монотропоидные микоризы. Арбускулярные и эктомикоризы образуют эрикоидные микоризы со многими растениями, относящимися к отряду Ericales, а некоторые Ericales образуют арбутоидные и монотропоидные микоризы. В одном варианте осуществления микориза может быть эрикоидной микоризой, предпочтительно типа Ascomycota, такой как Hymenoscyphous ericae или Oidiodendron sp. В другом варианте осуществления микориза также может быть арбутоидной микоризой, предпочтительно типа Basidiomycota. В еще одном варианте осуществления микориза может быть монотропоидной микоризой, предпочтительно типа Basidiomycota. В еще одном варианте осуществления микориза может быть орхидной микоризой, предпочтительно рода Rhizoctonia.
Способы, предлагаемые в настоящем изобретении, применимы для семян бобовых растений, типичные примеры которых включают сою, люцерну, арахис, горох, чечевицу, фасоль и клевер. Способы, предлагаемые в настоящем изобретении, также применимы для семян небобовых растений, например, Poaceae, Cucurbitaceae, Malvaceae, Asteraceae, Chenopodiaceae и Solonaceae. Типичные примеры семян небобовых растений включают семена полевых сельскохозяйственных культур, таких как кукуруза, рис, овес, рожь, ячмень и пшеницу, хлопчатник и канолу, и овощных сельскохозяйственных культур, таких как картофель, томаты, огурцы, свекла, латук и канталупы.
Настоящее изобретение будет описано с помощью приведенных ниже неограничивающих примеров. Если не указано иное, в качестве контроля использовали воду (указано, как "контроль" или "CHK").
Примеры
1-17: Эксперименты в теплице
Пример 1: Биологическое исследование in vitro роста корней ростков томата
Семена гибридного томата сорта Royal Mounty стерилизовали на поверхности с помощью 10% отбеливающего раствора в течение 10 мин и затем 3 раза промывали стерилизованной дистиллированной водой. Затем семена в течение 3 ч сушили в воздушной камере с ламинарным потоком. Затем семена помещали в чашки Петри на среду из затвердевшего агара, содержащие различные источники ЛХО, представленного на фиг. 1b (выпускает фирма Darmstadt, Germany and Grenoble, France) (также называющийся в примерах, как "ЛХО сои"), и предлагаемого в настоящем изобретении ХО, представленного на фиг. 2a (также называющийся в примерах, как "ХО гороха" или "ХО-V"), в разных концентрациях. Корни ростков измеряли вручную линейкой и массу корней в сыром виде определяли с помощью микровесов в день 7. Исследование роста проводили в ростовой камере при 22C.
Как показывало сопоставление ХО гороха (вариант осуществления настоящего изобретения) и ЛХО (не предлагаемые в настоящем изобретении и использующиеся для сопоставления) по данным измерения длины корней ростка ХО гороха приводили к, результатам лучшим (при 10-7 M и 10-9 M) или равным (при 10-8 M) результатам для ЛХО (фиг. 5). По данным для массы корней ростка в сыром виде ХО гороха приводит к лучшим результатам, чем ЛХО, при всех трех концентрациях (фиг. 6). И ЛХО, и ХО приводили к лучшим результатам по увеличению длины корней и массы корней в сыром виде, чем для контрольных ростков. По данным зависимости для среднего роста корней при всех 3 концентрациях представляется, что ХО усиливает рост корней томатов значительно лучше, чем ЛХО (фиг. 7 и 8).
Пример 2: Исследование некорневой обработки хлопчатника
Семена хлопчатника высевали и выращивали до стадии V4 (стадия 4 листьев) и затем опрыскивали с помощью 10-8 M ЛХО, представленного на фиг. 2b (также называющийся в примерах, как "ЛХО гороха") и ХО гороха и затем их оставляли расти до 4 недель и время от времени поливали раствором Hoagland. Контрольные растения опрыскивали водой.
Результаты, полученные с помощью варианта осуществления настоящего изобретения (ХО), показывали, что и ХО, и ЛХО (не предлагаемый в настоящем изобретении и использующийся для сопоставления) приводили к значительному увеличению массы растения в сыром виде по сравнению с контролем, но ХО приводил к на 1,14% большему увеличению массы растения в сыром виде, чем ЛХО (фиг. 9).
Пример 3: Обработка семян кукурузы
В теплице проводили два эксперимента по обработке семян с использованием только ЛХО гороха, ХО гороха и смесей ХО, полученных из хитозана с помощью ферментативной методики (структурно отличающихся от ХО гороха и также называющихся в примерах, как "China ХО"). Семена гибридной кукурузы (92L90, Peterson Farm, USA) обрабатывали раствором для обработки (10-8 M) при расходе, составляющем 3 жидкостных унции/100 фунтов семян. Семена высевали в пластмассовые горшки, содержащие смесь 1:1 песок:перлит. Семенам давали расти в течение примерно 3-4 недель и затем их собирали и измеряли их массу в сухом состоянии.
Результаты, полученные в обоих экспериментах, показывали, что предлагаемый в настоящем изобретении (ХО гороха) приводил к большему увеличению биомассы ростков, корней и суммарной биомассы, чем не предлагаемый в настоящем изобретении и использующийся для сопоставления ЛХО. В первом эксперименте ХО приводил к увеличению массы в сухом состоянии, на 11,84% большему, чем ЛХО (фиг. 10). Во втором эксперименте ХО приводил к увеличению массы в сухом состоянии, на 12,63% большему, чем ЛХО (фиг. 11). China ХО, который также можно рассматривать, как заменяющий источник ХО гороха, также приводил к большему увеличению массы в сухом состоянии по сравнению с не предлагаемым в настоящем изобретении ЛХО.
Пример 4: Обработка сои различными активными веществами
Семена сои (семена Jung, сорт 8168NRR) обрабатывали различными активными молекулами. Семена обрабатывали жидкостью при расходе, составляющем 3 жидкостных унции/100 фунтов семян. Семенам давали сохнуть в течение 2 ч и в теплице высевали в пластмассовые горшки, содержащие смесь 1:1 песок:перлит. Ростки выращивали в течение 4 недель и время от времени вносили жидкие удобрения и затем растения собирали. Отделяли центральный листочек из второго трилистника (снизу вверх) и с помощью сканера WinRhizo измеряли площадь его поверхности. Остальную часть растения использовали для определения массы растения в сухом состоянии (МС).
Результаты, полученные в эксперименте, показывали, что не предлагаемый в настоящем изобретении ЛХО гороха, предлагаемый в настоящем изобретении ХО гороха и China ХО приводили к значительному увеличению площади поверхности листьев. Однако из этих трех активных веществ ХО гороха приводил к наибольшей площади поверхности листьев (значительно большей, чем в случае контроля (вода)) и относительно большей, чем Chinese ХО (фиг. 12). В другом эксперименте ХО приводил к наибольшим массам растений в сухом состоянии при оценке по биомассе ростков или корней и суммарной биомассе растений. Таким образом, было очевидно, что увеличение биомассы при использовании ХО было более значительным, чем при использовании ЛХО сои или любой другой обработки, включая воду в качестве контроля и изофлавоноиды в качестве отдельной сигнальной молекулы растения (фиг. 13).
Пример 5: Биологическое исследование деформации корневых волосков
Семена сиратро (Macroptelium atropurpureum) проращивали на влажной фильтровальной бумаге в чашках Петри. Когда длина корней ростков становилась равной примерно 1 дюйм, их отделяли от ростков и в пробирках обрабатывали с помощью 2 мл 10-8 M раствора для обработки в течение 4 ч в темноте. После окончания обработки растворы окрашивали с помощью конго красного в течение 10 мин. Затем сегменты корней изучали с помощью биологического микроскопа для подсчета количества деформированных корневых волосков в самой чувствительной зоне сегмента корня. Биологическое исследование деформации корневых волосков также проводили с использованием красного клевера таким же образом, как выше было проведено для сиратро и проводили только визуальные наблюдения и результаты регистрировали в текстовом виде.
Растворы и ЛХО, и ХО приводили к деформации корневых волосков в сегментах корней (фиг. 14). Комбинации ХО и жирная кислота (стеариновая кислота или пальмитиновая кислота) также приводили к деформации корневых волосков, причем ХО с добавлением пальмитиновой кислоты и ХО с добавлением и пальмитиновой кислоты, и стеариновой кислоты приводили к численно более значительной деформации корневых волосков, чем ЛХО или ХО. В целом по степени деформации корневых волосков ХО был эквивалентен ЛХО. Пальмитиновая кислота приводила к лучшей реакции на деформацию. Контроль или CHK обрабатывали дистиллированной водой.
Картина деформации корневых волосков красного клевера при использовании ХО была намного более значительной и выраженной, чем в случае ЛХО. ХО с добавлением пальмитиновой кислоты или стеариновой кислоты приводили к картине деформации, сходной со случаем использования ЛХО. В целом ХО приводил к более значительной деформации корневых волосков красного клевера.
Пример 6: Прорастание семян канолы и пшеницы
В чашках Петри на фильтровальной бумаге, увлажненной 10-9 M раствором для обработки, семена канолы и пшеницы помещали в чашки для проращивания. Через 18 ч после помещения в чашки ХО гороха приводили к более значительному прорастанию семян канолы и пшеницы, чем ЛХО гороха. В течение периода от 21 до 24 ч степени прорастания семян в случае ЛХО и ХО сближались. Эксперименты показали, что ХО приводил к более раннему прорастанию, чем ЛХО (фиг. 15 и 16).
Пример 7: Прорастание семян люцерны
Семена люцерны (Medicago sativa) проращивали в чашках Петри на фильтровальной бумаге, увлажненной предназначенными для обработки растворами ЛХО гороха и ХО гороха (10-8 M) и чашки Петри выдерживали в темноте при комнатной температуре (22C). Через 20 и 27 ч исследовали прорастание семян. Через 20 ч для ЛХО и ХО не обнаруживалось различия степени прорастания по сравнению с контролем, однако через 27 ч ХО приводил к на 6% большему прорастанию, чем контроль и ЛХО. Обнаружено, что ЛХО гороха может не быть эффективным для прорастания семян люцерны, но ХО гороха может благоприятно повлиять на прорастание семян по сравнению с контролем и ЛХО гороха (фиг. 17).
Пример 8: Прорастание семян кукурузы и пшеницы в чашках Петри
Семена кукурузы и пшеницы помещали в чашки Петри, содержащие 5 мл раствора для обработки на фильтровальной бумаге. Семена кукурузы помещали на увлажненную фильтровальную бумагу для проращивания. Аналогичным образом, семена пшеницы (яровой пшеницы) помещали в чашки Петри. Через 5 дней после помещения в чашки исследовали проращивание кукурузы и пшеницы. Корни собирали и с помощью системы WinRhizo измеряли их длину.
В случае кукурузы ЛХО гороха, ХО гороха и ХО с добавлением пальмитиновой кислоты приводили к усиленному проращиванию (фиг. 18) и они также приводили к значительно увеличенной длине корней ростков по сравнению с контролем. Различия их воздействий не были статистически значимыми, ХО с добавлением пальмитиновой кислоты приводил к наибольшим степени проращивания и длине корней. Добавление пальмитиновой кислоты к ХО, видимо, было немного более благоприятным (статистически незначимо) по сравнению с ЛХО или ХО (фиг. 19). В случае пшеницы ХО приводил к более длинным корням, чем ЛХО. Увеличение длины корней пшеницы при использовании ЛХО и ХО не было статистическим значимым, но существенно более значительным (фиг. 20).
Пример 9: Прорастание семян вики посевной (Vicia sativa)
Семена вики посевной помещали в чашки Петри, содержащие 5 мл раствора для обработки на фильтровальной бумаге. Прорастание семян при 22°C оценивали через 24 ч и длину корней ростков измеряли в день 5 с помощью системы WinRhizo.
В эксперименте по проращиванию использовали ЛХО гороха и ХО гороха в комбинации с 4 разными жирными кислотами. Установлено, что ХО по отдельности или с добавлением пальмитиновой кислоты или стеариновой кислоты приводили к более раннему прорастанию семян. Через день после помещения в чашки Петри ХО приводил к на 25% более значительному прорастанию по сравнению с контролем и ЛХО (фиг. 21). При измерении длин корней установлено, что только ЛХО и ХО с добавлением пальмитиновой кислоты приводили к увеличению длины корней ростков по сравнению с контролем (фиг. 22).
Пример 10: Прорастание семян нескольких сельскохозяйственных культур
Аналогично указанному выше эксперименту по прорастанию семян, семена разных сельскохозяйственных культур помещали на влажную фильтровальную бумагу в чашки Петри, каждая из которых содержала 5 мл жидкости. Затем чашки Петри с семенами выдерживали в темноте при 22C. Через 24 ч (исключая гиацинтовые бобы, для которых этот период составлял 30 ч) определяли прорастание семян.
В целом прорастание семян при воздействии ХО гороха было лучшим, чем при использовании ЛХО гороха. Из четырех сельскохозяйственных культур (фасоли золотистой, гиацинтовых бобов, красной чечевицы и красного клевера) ХО приводил к наилучшему прорастанию для трех сельскохозяйственных культур за исключением красной чечевицы (фиг. 23). ХО с добавлением пальмитиновой кислоты приводил к наиболее значительному прорастанию фасоли золотистой и красного клевера. ЛХО действовал лучше, чем ХО или ХО с добавлением пальмитиновой кислоты, только в случае красной чечевицы.
Пример 11: Рост корней ростков томатов
В процессе прорастания семян в чашке Петри семена томатов сорта Royal Mounty помещали на фильтровальную бумагу, увлажненную с помощью 5 мл раствора для обработки. После 5 дней выдерживания в темноте при 22C корни ростков томатов измеряли с помощью системы WinRhizo.
ЛХО гороха, ХО гороха и ХО вместе с жирными кислотами все приводили к увеличенной длине корней по сравнению с контролем - водой. ХО приводил к увеличенной средней длине корней ростков по сравнению с ЛХО, но увеличение не было статистически значимым. ХО с добавлением пальмитиновой или стеариновой кислоты приводил к значительному увеличению длины корней ростков томатов (фиг. 24).
Пример 12: Обработка семян сои
Семена сои (Pioneer 9oM80) помещали в чашки Петри на увлажненную фильтровальную бумагу для проращивания, пропитанную с помощью 5 мл раствора для обработки, содержащего воду или ЛХО сои, ХО гороха и ХО с добавлением жирных кислот. Корешки ростков отделяли через 48 ч и измеряли их длину.
ЛХО приводил к лучшему усилению роста корешков семян по сравнению с контролем и ХО, но ХО с добавлением пальмитиновой кислоты или стеариновой кислоты приводил к значительному увеличению длины корешков. Сам ХО был эффективнее, чем ЛХО для сои, но добавление к ХО жирной кислоты, пальмитиновой или стеариновой кислоты, могло дополнительно усилить рост корешков ростков (фиг. 25).
Пример 13: Обработка семян хлопчатника
Семена хлопчатника обрабатывали с помощью содержащих ЛХО и ХО 10-8 M растворов для обработки при расходе, составляющем 3 жидкостных унции/100фунтов семян. На следующий день семена помещали в пластмассовые горшки, содержащие смесь 1:1 песок:перлит. Семена выращивали в теплице в течение 4 недель и затем их собирали.
Не обнаружено значительных различий масс растений хлопчатника в сухом состоянии для контроля и при использовании ЛХО и ХО. Однако ХО приводил к относительно большей массе растений в сухом состоянии, чем для контроля и при использовании ЛХО. При использовании ХО полная масса растений в сухом состоянии по сравнению с контролем увеличивалась на 3,29% (фиг. 26).
Пример 14: Некорневая обработка сои различными активными веществами
Семена сои (семена Jung, сорт 8168NRR) обрабатывали различными активными молекулами на стадии роста V4. Растения выращивали из семян в теплице в пластмассовых горшках, содержащих смесь 1:1 песок:перлит. Ростки выращивали в течение 4 недель и время от времени вносили жидкие удобрения и затем растения собирали.
Некорневое внесение ЛХО сои, ХО гороха или China-ХО не приводило к значительному влиянию на увеличение биомассы растений в сухом состоянии (фиг. 27). При использовании ЛХО, ХО и China-ХО биомасса была относительно большей, чем для контроля, и активные вещества были одинаково эффективны.
Пример 15: Нанесение на семена кукурузы
Семена кукурузы обрабатывали различными комбинациями ХО гороха (10-8 M) и ЛХО гороха (10-8, 10-9 M). Семена высевали в теплице в пластмассовые горшки, содержащие смесь 1:1 песок:перлит. Ростки собирали через 10 дней после высадки, тщательно промывали и затем сушили в сушильном шкафу при 60C в течение 48 ч.
Как показано на фиг. 28, и ХО (10-8 M) (обозначен, как CO8), и ЛХО (10-8 M) (обозначен, как SP8) при использовании по отдельности увеличивали массу ростков кукурузы в сухом состоянии. Только комбинация ЛХО 10-9/ХО при 10-8 увеличивали массу ростков кукурузы в сухом состоянии в большей степени, чем ЛХО гороха (SP) или ХО гороха.
Пример 16: Прорастание сорго семян в чашках Петри
Семена сорго проращивали в чашках Петри, содержащих жидкие растворы для обработки. Ростки собирали через 5 дней и их корни измеряли с помощью сканера WinRHIZO. Как показано на фиг. 29, и ХО гороха (10-8 M), и ЛХО гороха (10-8 M) приводили к увеличению длины корней ростков и комбинация ХО при 10-8 и ЛХО при 10-9 приводила к увеличению длины корней ростков, более значительному, чем увеличение при использовании ХО или ЛХО по отдельности.
Пример 17: Некорневая обработка хлопчатника
Растения хлопчатника выращивали из семян в теплице в пластмассовых горшках, содержащих смесь 1:1 песок:перлит. Когда ростки достигали стадии V, их опрыскивали с помощью ХО гороха (10-8 M) и ХО с добавлением питательных микроэлементов (Ca-пантотенат и борная кислота), каждого в минимальных количествах.
Растения собирали через 4 недели после обработки. Перед уборкой зеленость листьев измеряли с помощью хлорофиллометра SPAD. Как показано на фиг. 30 и 31, ХО значительно увеличивал зеленость листьев и приводил к численному увеличению средней массы растений в сухом состоянии по сравнению с контролем, и комбинированная обработка с помощью ХО и питательных микроэлементов приводила к еще большему увеличению.
18-20: Исследования в полевых условиях
Пример 18: Соя
Для оценки вариантов осуществления настоящего изобретения применительно к урожайности зерен при некорневом нанесении на сою проведены 19 исследований в полевых условиях. Исследования в полевых условиях проводили в 8 штатах на разных почвах и при разных условиях окружающей среды.
При исследованиях обработку проводили водой (контроль), чистым ХО (хитоолигосахарид) - ХО-V (представлен на фиг. 2a) и чистым ЛХО (липохитоолигосахарид) - SP104 (представлен на фиг. 2b). Обработку с помощью ХО и ЛХО проводили при молярной концентрации равной 8×10-8, что соответствовало внесению 12 мкг/акр. Использовали различные имеющиеся в продаже сорта сои. Средства добавляли к гербициду глифосату и разбрызгивали на листья растений на стадии вегетативного развития V4-V5. По 4 унции/акр средства для обработки, объединенного с гербицидом и водой, вносили при расходе, равном от 5 до 10 галлонов на акр. Сою выращивали до созревания и собирали и определяли массу зерен.
Результаты приведены в таблице 1.
Как показывает сопоставление контроля с ХО, при некорневой обработке с помощью ХО урожайность повышалась на 1,7 бушель/акр, что соответствовало составляющему 3% повышению по сравнению с контролем, и повышение урожайности происходило в 68,4% исследований.
По сравнению с повышением при некорневой обработке с помощью ЛХО, в случае ХО среднее повышение составляло 0,1 бушель/акр, что меньше, но представляет собой такое же выраженное в процентах повышение урожайности по сравнению с контролем и такую же выраженную в процентах долю исследований, при которых повышалась урожайность. Поэтому при некорневой обработке и ХО, и ЛХО приводили к примерно одинаковому повышению урожайности.
Пример 19: Кукуруза
Для оценки вариантов осуществления настоящего изобретения применительно к урожайности зерен при некорневом нанесении на кукурузу проведены шестнадцать (16) исследований в полевых условиях. Исследования в полевых условиях проводили в 8 штатах на разных почвах и при разных условиях окружающей среды.
При исследованиях обработку проводили водой (контроль), чистым ХО (хитоолигосахарид) - ХО-V (представлен на фиг. 2a) и чистым ЛХО (липохитоолигосахарид) - SP104 (представлен на фиг. 2b). Использовали различные имеющиеся в продаже гибриды кукурузы. Средства добавляли к гербициду глифосату и разбрызгивали на листья растений в обычный период нанесения гербицида. По 4 унции/акр средства для обработки, объединенного с гербицидом и водой, вносили при расходе, равном от 5 до 10 галлонов на акр. Кукурузу выращивали до созревания и собирали и определяли массу зерен.
Как показывает сопоставление контроля с ХО, при некорневой обработке с помощью ХО урожайность повышалась на 9,2 бушель/акр, что соответствовало составляющему 4,8% повышению по сравнению с контролем, и повышение урожайности происходило в 93,8% исследований.
По сравнению с повышением при некорневой обработке с помощью ЛХО, в случае ХО средняя урожайность была на 5,0 бушель/акр больше, что приводило к на 2,6% большему повышению урожайности и доля исследований, при которых повышалась урожайность, была на 18,8% больше.
Поэтому при некорневой обработке и ХО, и ЛХО приводили к повышению урожайности, но ХО был не менее, чем вдвое более эффективным, чем ЛХО.
Пример 20: Кукуруза
Для оценки вариантов осуществления настоящего изобретения применительно к урожайности зерен при нанесении на зерна кукурузы до высевания проведены 10 исследований в полевых условиях. 5 Исследований в полевых условиях проводили в 5 штатах и 5 исследований проводили в Аргентине.
При исследованиях обработку проводили водой (контроль), чистым ХО (хитоолигосахарид) - ХО-V (представлен на фиг. 2a) и чистым ЛХО (липохитоолигосахарид) - SP104 (представлен на фиг. 2b). Обработку с помощью ХО и ЛХО проводили при молярной концентрации равной 1×10-8, что соответствовало внесению 1 мкг/акр. Использовали различные имеющиеся в продаже гибриды кукурузы. Перед высеванием на пятьдесят (50) фунтов семян наносили 3 жидкостные унции средства для обработки. Кукурузу выращивали до созревания и собирали и определяли массу зерен.
Результаты приведены в таблице 3.
Как показывает сопоставление контроля с ХО, при нанесении ХО на семена урожайность повышалась на 6,5 бушель/акр, что соответствовало составляющему 3,6% повышению по сравнению с контролем, и повышение урожайности происходило в 80,0% исследований.
При сопоставлении ХО с ЛХО, видно, что в случае ХО средняя урожайность была на 4,6 бушель/акр меньше, что приводило к на 2,5% меньшему увеличению урожайности по сравнению с контролем, и в этих 10 исследованиях доля исследований, при которых повышалась урожайность, была на 10,0% меньше.
Обработка с помощью и ХО, и ЛХО при нанесении на семена кукурузы приводила к повышению урожайности по сравнению с контролем и ЛХО приводил к наибольшему повышению.
Все патентные и непатентные публикации, цитированные в настоящем описании, характерны для уровня подготовки специалистов в области техники, к которой относится настоящее изобретение. Все эти публикации включены в качестве ссылки в такой степени, как если бы для каждой отдельной публикации или заявки на патент было специально и по отдельности указано о включении в качестве ссылки.
Хотя настоящее изобретение описано с помощью конкретных вариантов осуществления, следует понимать, что эти варианты осуществления только иллюстрируют принципы и области применения настоящего изобретения. Поэтому необходимо понимать, что в эти иллюстративные варианты осуществления можно внести многочисленные изменения, и что можно образовать другие сочетания без отклонения от сущности и объема настоящего изобретения, определяемых прилагаемой формулой изобретения.
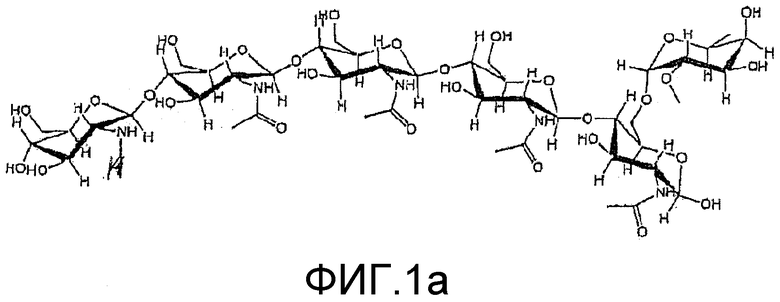
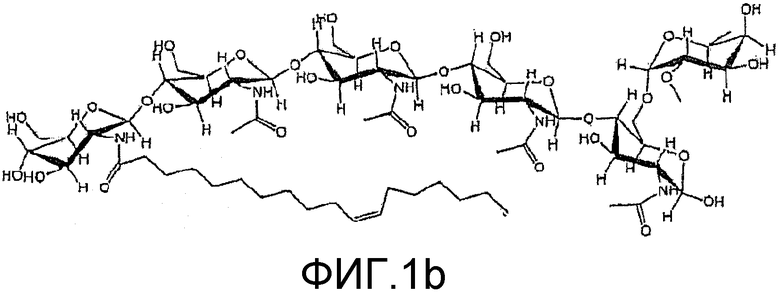
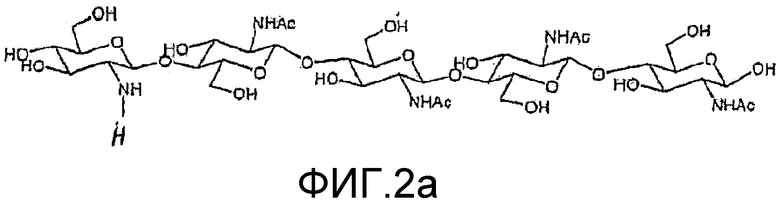
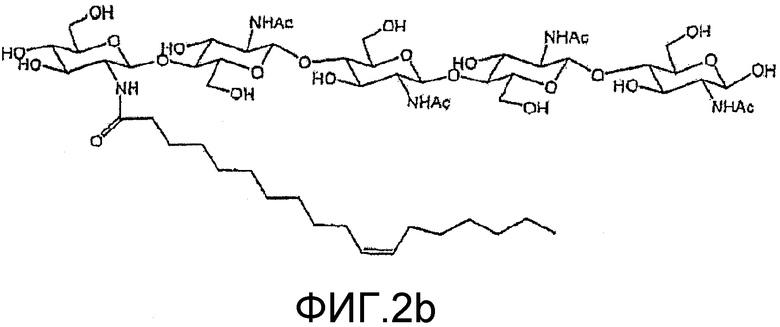
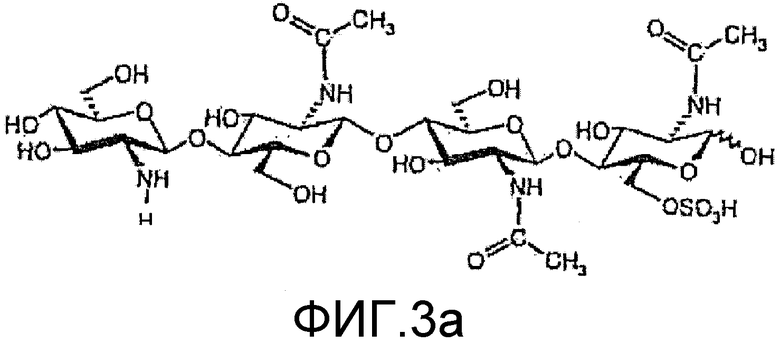
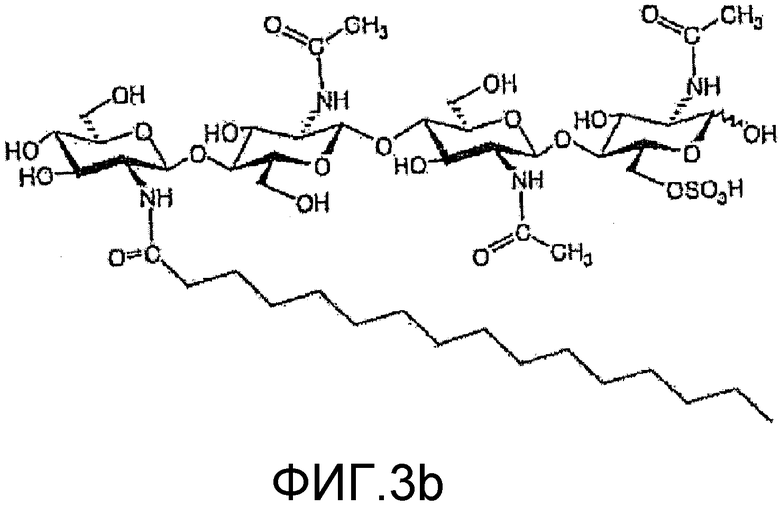
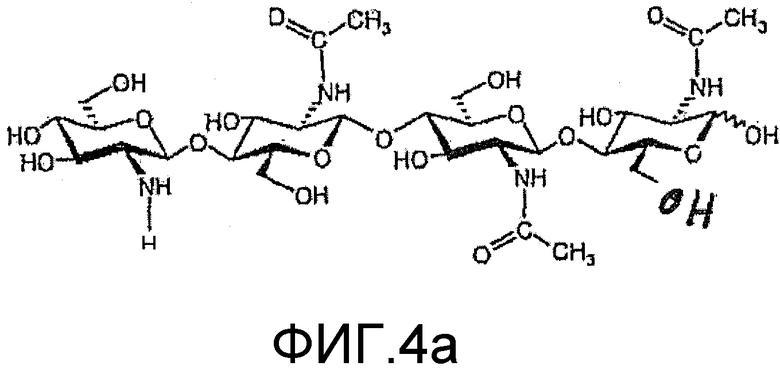
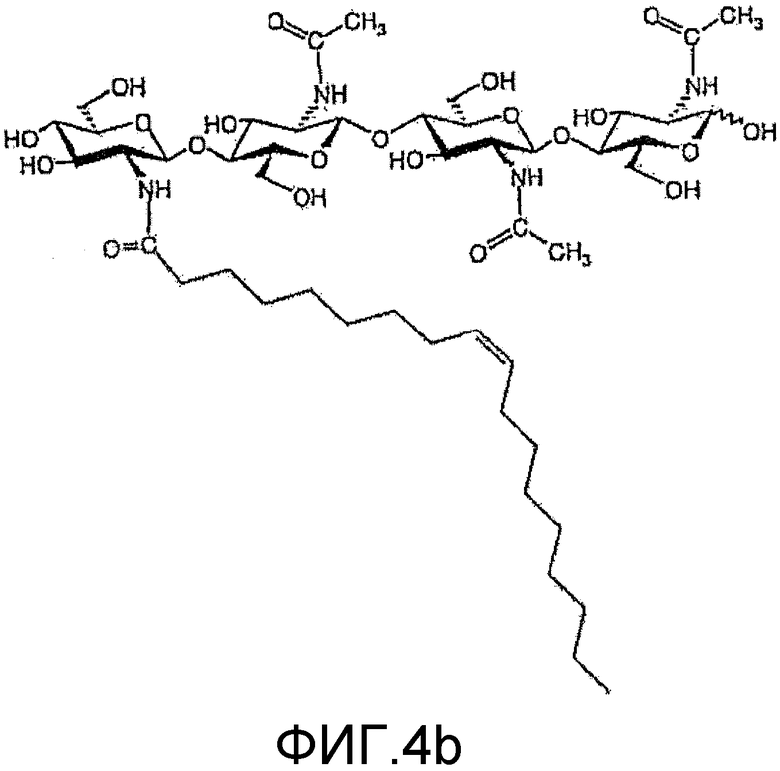
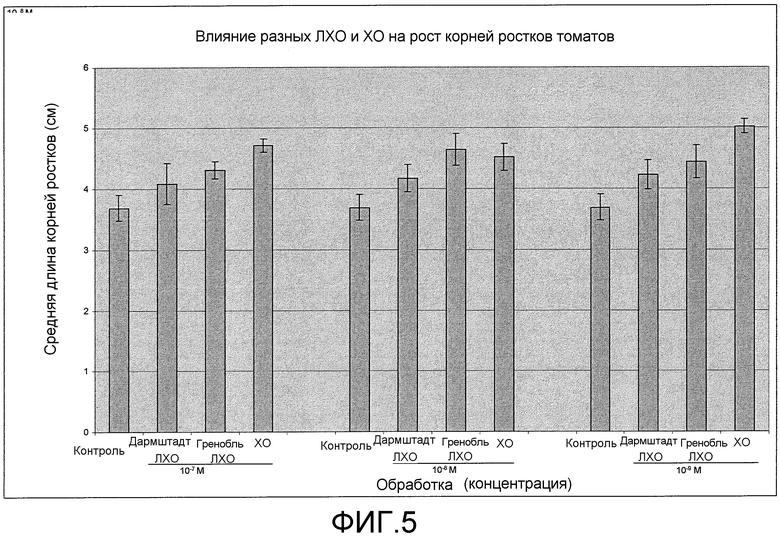
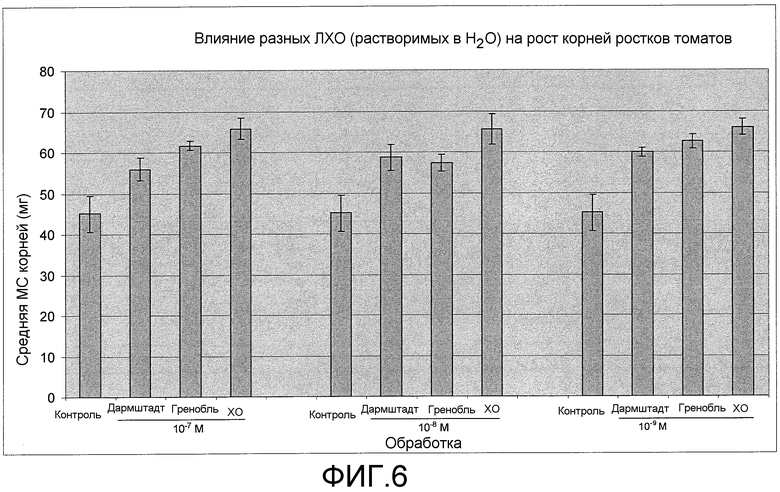

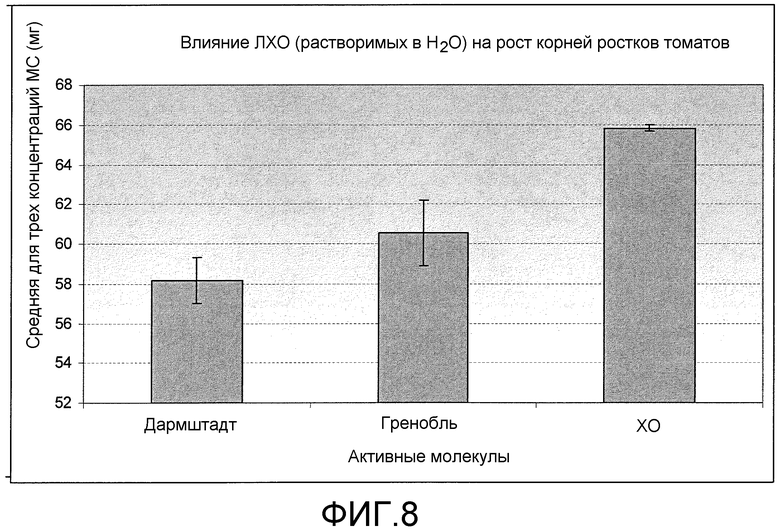
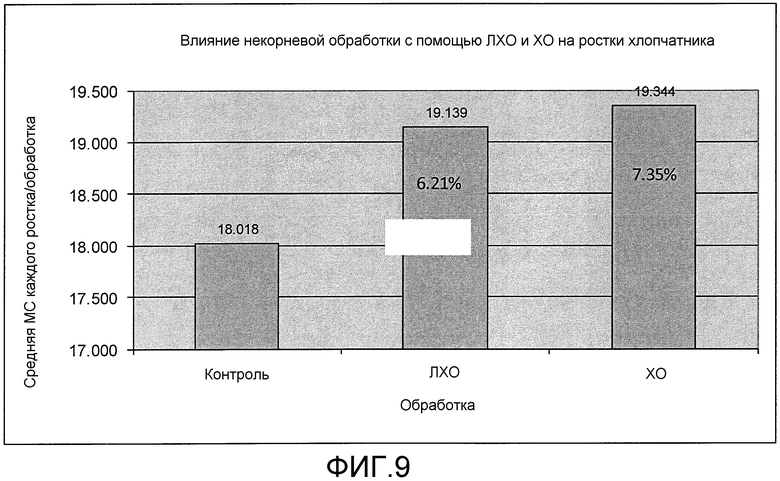
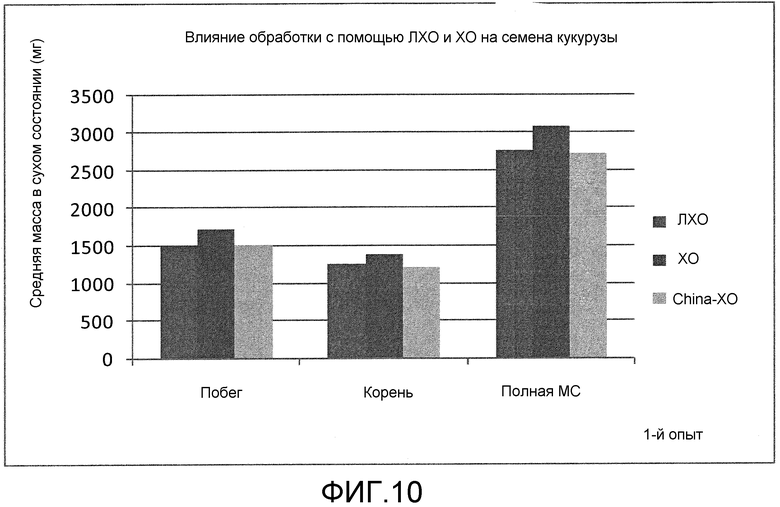
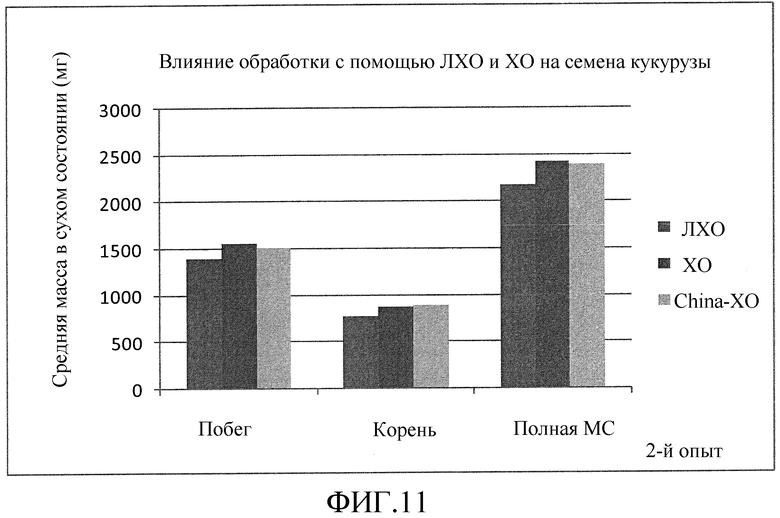
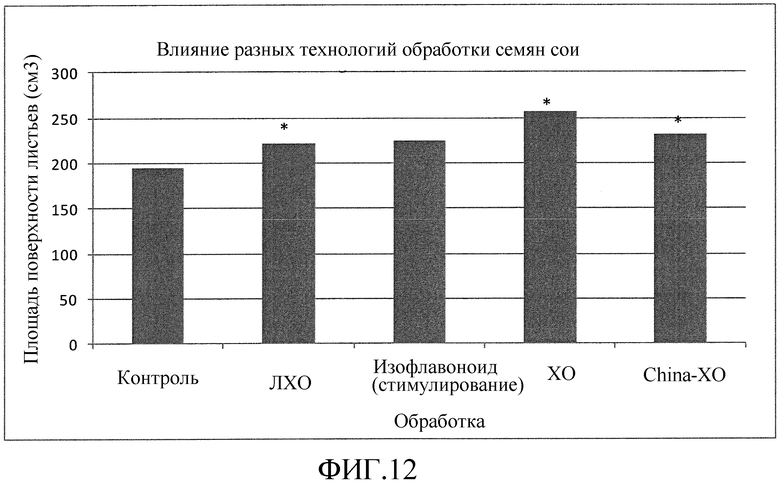


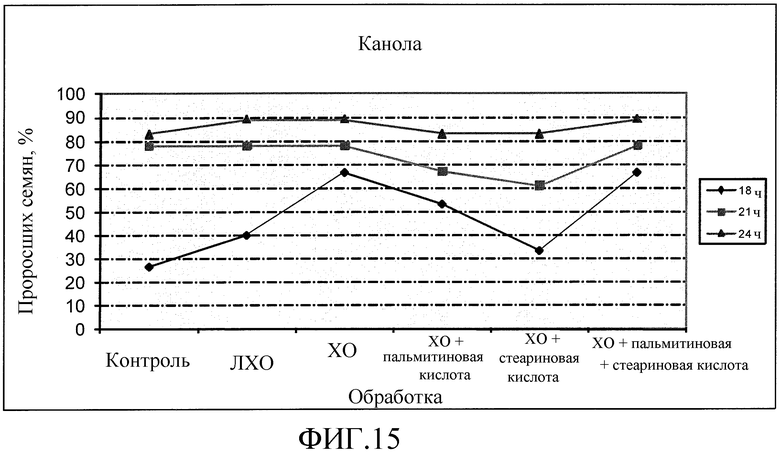
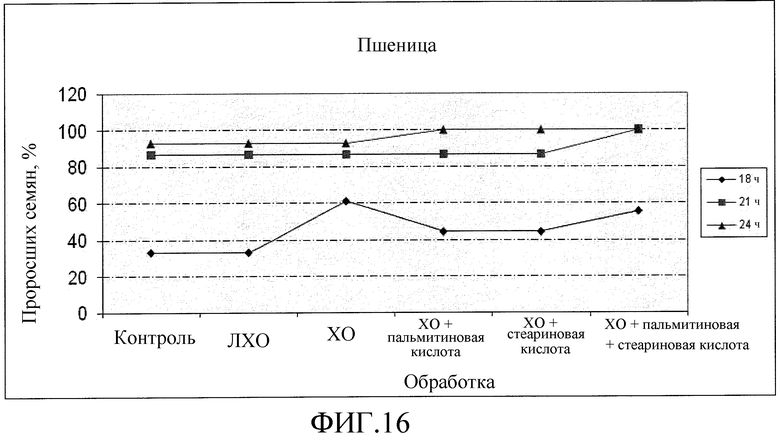
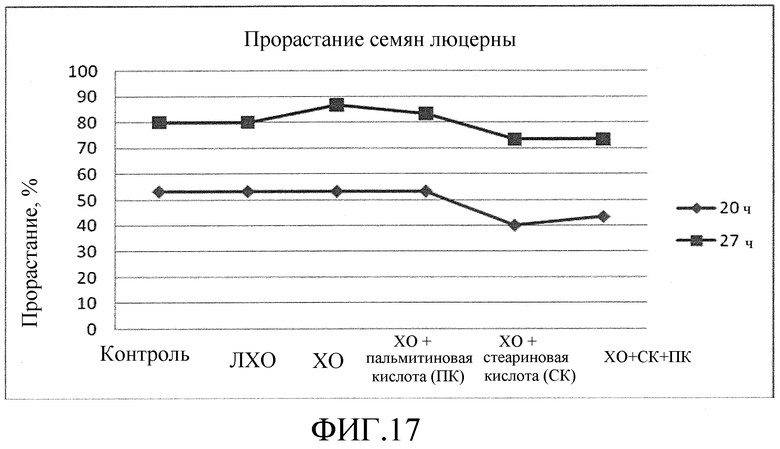
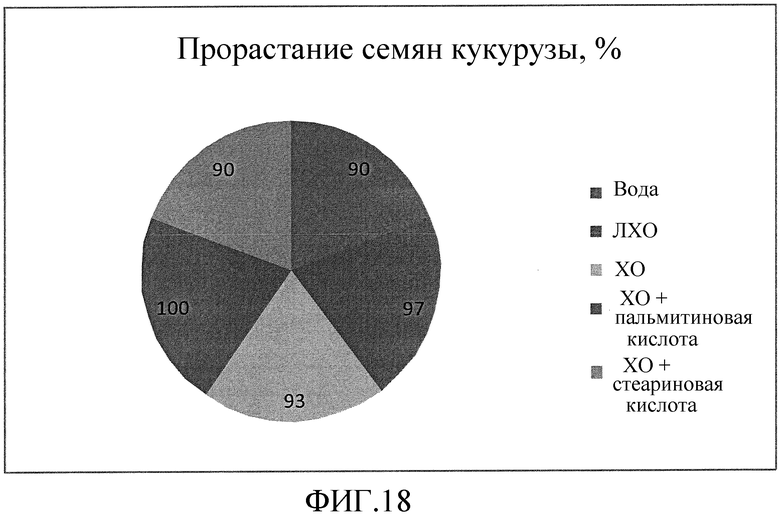

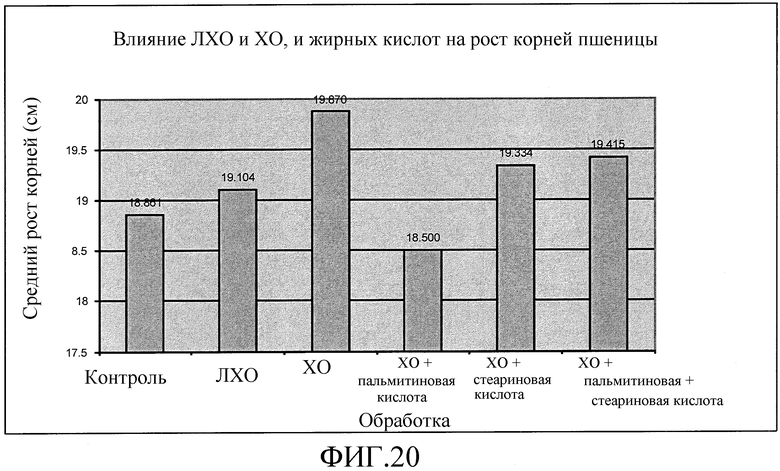

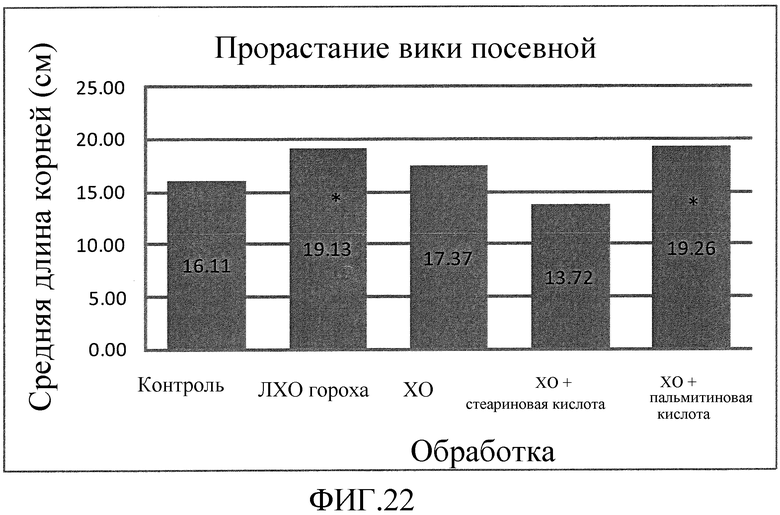
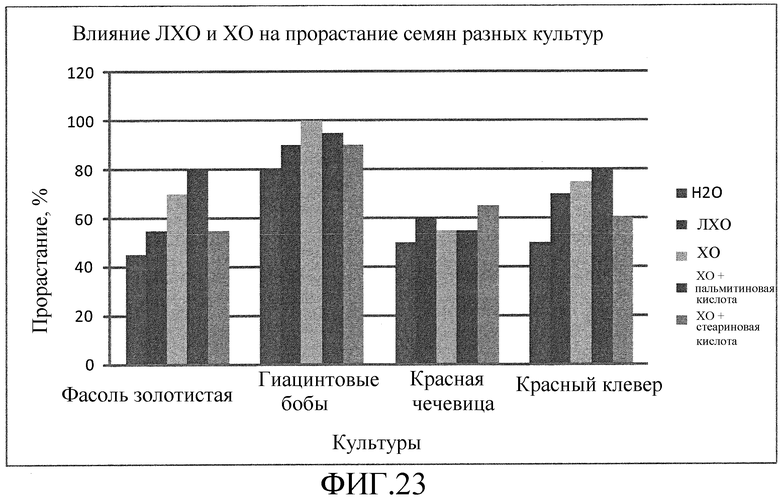
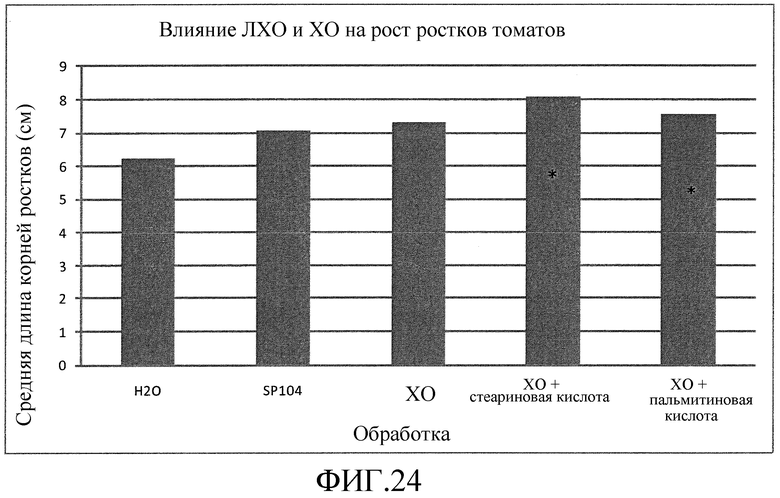

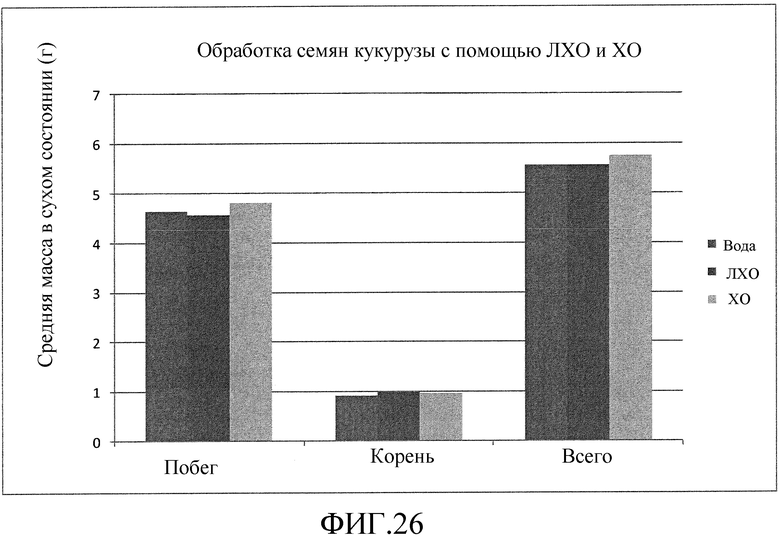
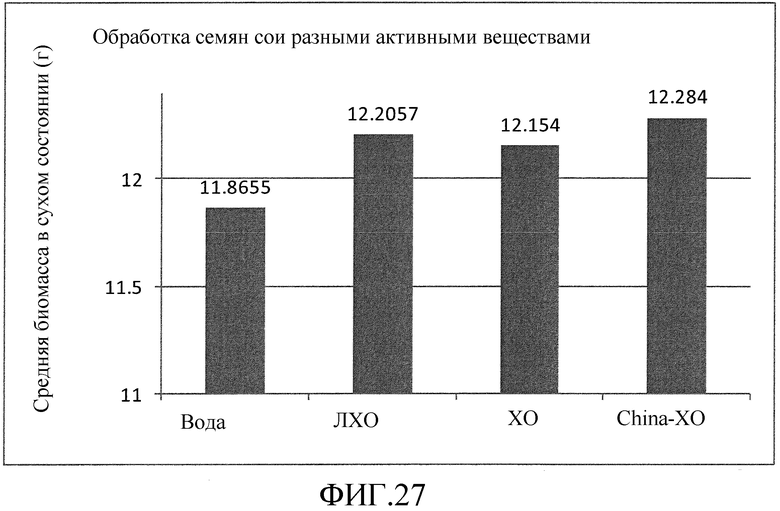

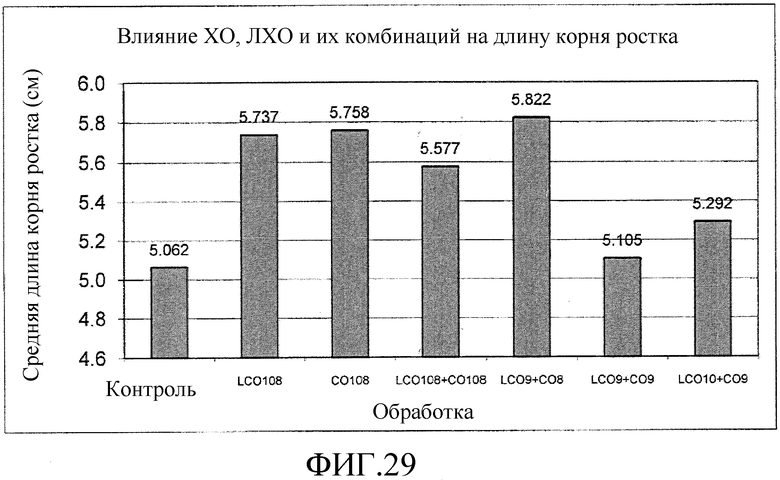
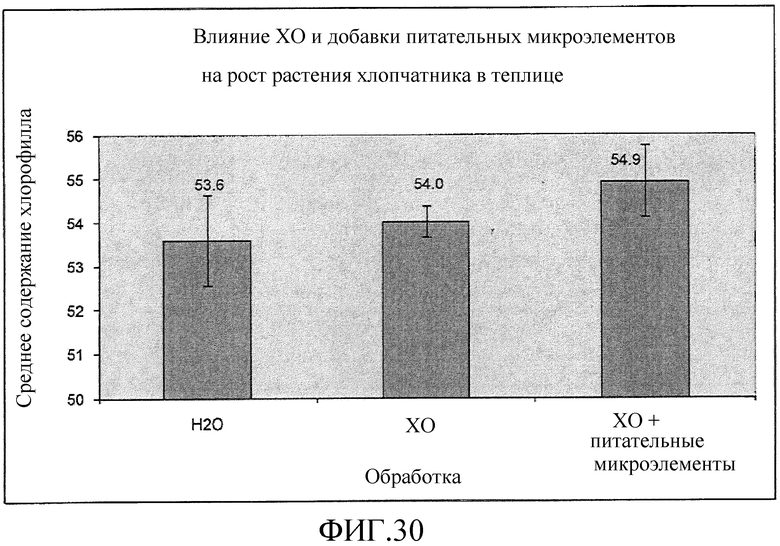

Изобретение относится к сельскому хозяйству. Осуществляют усиление роста растений путем обработки семян растения или растения, которое прорастает из семян, эффективным количеством по меньшей мере одного хитоолигосахарида (ХО), представленного формулой:

в которой R1 означает водород или метил; R2 означает водород или метил; R3 означает водород, ацетил или карбамоил; R4 означает водород, ацетил или карбамоил; R5 означает водород, ацетил или карбамоил; R6 означает водород, арабинозил, фукозил, ацетил, сульфат, 3-0-S-2-0-MeFuc, 2-0-MeFuc или 4-0-AcFuc; R7 означает водород, маннозил или глицерин; R8 означает водород, метил или -CH2OH; R9 означает водород, арабинозил или фукозил; R10 означает водород, ацетил или фукозил; и n равно 0, 1, 2 или 3. Изобретение позволяет повысить урожайность растений. 71 з.п. ф-лы, 31 ил., 3 табл., 20 пр.
1. Способ усиления роста растений, включающий обработку семян растения или растения, которое прорастает из семян, эффективным количеством по меньшей мере одного хитоолигосахарида (ХО), представленного формулой:

в которой
R1 означает водород или метил;
R2 означает водород или метил;
R3 означает водород, ацетил или карбамоил;
R4 означает водород, ацетил или карбамоил;
R5 означает водород, ацетил или карбамоил;
R6 означает водород, арабинозил, фукозил, ацетил, сульфат, 3-0-S-2-0-MeFuc, 2-0-MeFuc или 4-0-AcFuc;
R7 означает водород, маннозил или глицерин;
R8 означает водород, метил или -CH2OH;
R9 означает водород, арабинозил или фукозил;
R10 означает водород, ацетил или фукозил; и
n равно 0, 1, 2 или 3, и
где после уборки растение характеризуется по меньшей мере одним из следующих: увеличенной урожайностью растений, измеренной в единицах бушель/акр, увеличенным количеством корней, увеличенной длиной корней, увеличенной массой корней, увеличенным объемом корней и увеличенной площадью листвы по сравнению с необработанными растениями или растениями, выросшими из необработанных семян.
2. Способ по п. 1, в котором по меньшей мере один ХО включает ХО, представленный структурой:
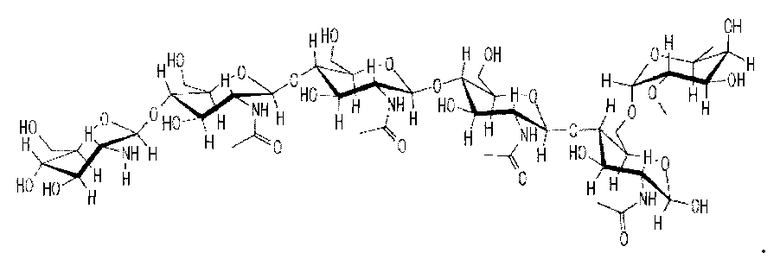
3. Способ по п. 1, в котором по меньшей мере один ХО включает ХО, представленный структурой:
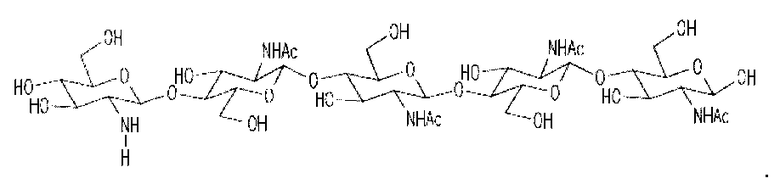
4. Способ по п. 1, в котором по меньшей мере один ХО включает ХО, представленный формулой:
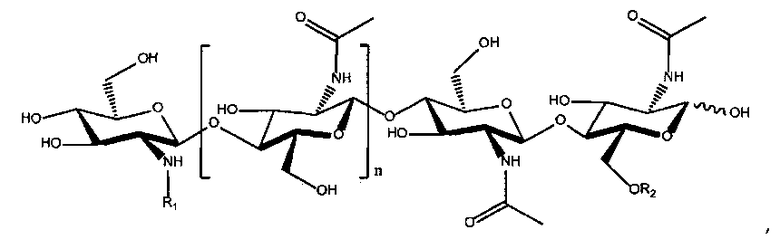
в которой n=1 или 2; R1 означает водород или метил; и R2 означает водород или SO3H.
5. Способ по п. 1, в котором по меньшей мере один ХО включает ХО, представленный структурой:

6. Способ по п. 1, в котором по меньшей мере один ХО включает ХО, представленный структурой:

7. Способ по п. 1, в котором по меньшей мере один ХО включает синтетический ХО.
8. Способ по п. 1, в котором по меньшей мере один ХО включает рекомбинантный ХО.
9. Способ по п. 8, в котором рекомбинантный ХО обладает по меньшей мере 60% чистотой.
10. Способ по п. 8, в котором рекомбинантный ХО обладает по меньшей мере 70% чистотой.
11. Способ по п. 8, в котором рекомбинантный ХО обладает по меньшей мере 80% чистотой.
12. Способ по п. 8, в котором рекомбинантный ХО обладает по меньшей мере 90% чистотой.
13. Способ по п. 1, в котором по меньшей мере один ХО наносят на семена перед высеванием и/или примерно во время высевания.
14. Способ по п. 1, в котором по меньшей мере один ХО наносят на семена по меньшей мере за один месяц до высевания.
15. Способ по п. 1, в котором по меньшей мере один ХО наносят на семена по меньшей мере за два месяца до высевания.
16. Способ по п. 1, в котором по меньшей мере один ХО наносят на семена по меньшей мере за три месяца до высевания.
17. Способ по п. 1, в котором по меньшей мере один ХО наносят на семена по меньшей мере за шесть месяцев до высевания.
18. Способ по п. 1, в котором по меньшей мере один ХО наносят на семена по меньшей мере за один год до высевания.
19. Способ по п. 1, в котором по меньшей мере один ХО наносят на семена в бороздах.
20. Способ по п. 1, в котором по меньшей мере один ХО наносят на растения с помощью некорневой обработки.
21. Способ по п. 1, в котором эффективное количество по меньшей мере одного ХО составляет от приблизительно 10-5 до приблизительно 10-14 М.
22. Способ по п. 1, в котором эффективное количество по меньшей мере одного ХО составляет от приблизительно 10-5 до приблизительно 10-11 М.
23. Способ по п. 1, в котором эффективное количество по меньшей мере одного ХО составляет от приблизительно 10-7 до приблизительно 10-8 М.
24. Способ по п. 1, в котором эффективное количество по меньшей мере одного ХО составляет от примерно 1 мкг/акр до примерно 70 мкг/акр.
25. Способ по п. 1, в котором эффективное количество по меньшей мере одного ХО составляет от примерно 1 мкг/акр до примерно 30 мкг/акр.
26. Способ по п. 1, в котором эффективное количество по меньшей мере одного ХО составляет от примерно 11 мкг/акр до примерно 20 мкг/акр.
27. Способ по п. 1, в котором эффективное количество по меньшей мере одного ХО составляет от примерно 50 мкг/акр до примерно 60 мкг/акр.
28. Способ по п. 1, дополнительно включающий нанесение на растение или его семена и/или растение, проросшее из семян, по меньшей мере одного питательного микроэлемента.
29. Способ по п. 28, в котором по меньшей мере один питательный микроэлемент включает один или несколько витаминов и/или минералов.
30. Способ по п. 1, дополнительно включающий нанесение на растение или его семена и/или растение, проросшее из семян, жирной кислоты или ее производной.
31. Способ по любому из пп. 1-30, дополнительно включающий нанесение на растение или его семена и/или растение, проросшее из семян, по меньшей мере одной сигнальной молекулы растения.
32. Способ по п. 31, в котором по меньшей мере одна сигнальная молекула растения включает по меньшей мере один липохитоолигосахарид (ЛХО).
33. Способ по п. 32, в котором по меньшей мере один ЛХО включает ЛХО, представленный структурой:

34. Способ по п. 32, в котором по меньшей мере один ЛХО включает ЛХО, представленный структурой:

35. Способ по п. 32, в котором по меньшей мере один ЛХО включает ЛХО, представленный структурой:
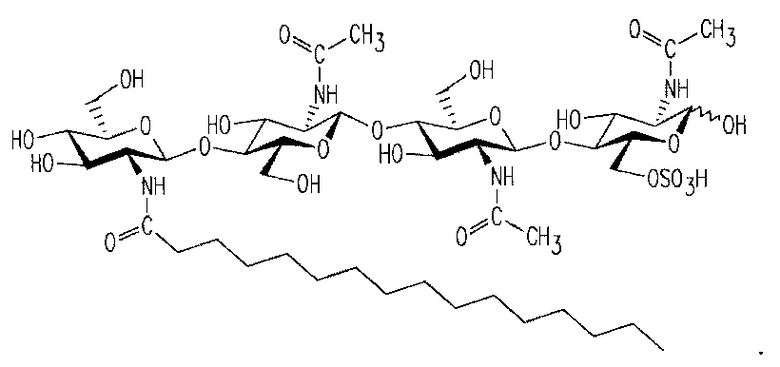
36. Способ по п. 32, в котором по меньшей мере один ЛХО включает ЛХО, представленный структурой:
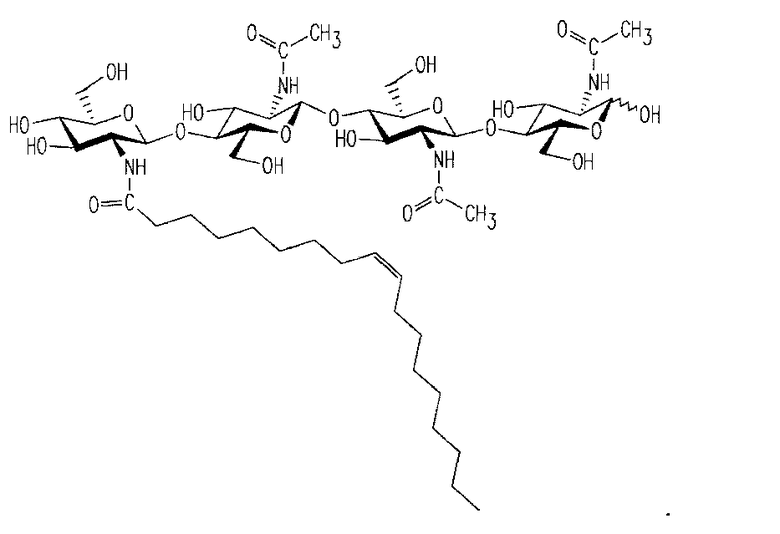
37. Способ по п. 32, в котором по меньшей мере один ЛХО включает по меньшей мере один ЛХО, полученный из штамма Rhizobium, Sinorhizobium, Azorrhizobium, Mesorhizobium или Bradyrhizobium.
38. Способ по п. 32, в котором по меньшей мере один ЛХО включает по меньшей мере один ЛХО, полученный из штамма Bradyrhizobium japonicum.
39. Способ по п. 32, в котором по меньшей мере один ЛХО включает по меньшей мере один ЛХО, полученный из штамма Sinorhizobium meliloti.
40. Способ по п. 32, в котором по меньшей мере один ЛХО включает по меньшей мере один ЛХО, полученный из штамма Rhizobium leguminosarum.
41. Способ по п. 32, в котором по меньшей мере один ЛХО включает по меньшей мере один ЛХО, полученный из микоризных грибов.
42. Способ по п. 32, в котором по меньшей мере один ЛХО включает по меньшей мере один ЛХО, полученный из штамма Glomerocycota.
43. Способ по п. 32, в котором по меньшей мере один ЛХО включает по меньшей мере один ЛХО, полученный из штамма Glomus intraradices.
44. Способ по п. 31, в котором по меньшей мере одна сигнальная молекула растения включает сигнальную молекулу растения, выбранную из группы, состоящей из хитиновых соединений, флавоноидов, жасмоновой кислоты и ее производных, линолевой кислоты и ее производных, линоленовой кислоты и ее производных и каррикинов и их производных.
45. Способ по п. 31, в котором по меньшей мере одна сигнальная молекула растения включает хитин и/или хитозан.
46. Способ по п. 1, дополнительно включающий нанесение на растение или его семена и/или растение, проросшее из семян, одного или нескольких гербицидов, инсектицидов и/или фунгицидов.
47. Способ по п. 1, дополнительно включающий нанесение на растение или его семена и/или растение, проросшее из семян, по меньшей мере одного солюбилизирующего фосфат микроорганизма.
48. Способ по п. 47, в котором по меньшей мере один солюбилизирующий фосфат микроорганизм включает по меньшей мере один штамм Penicillium.
49. Способ по п. 47, в котором по меньшей мере один солюбилизирующий фосфат микроорганизм включает по меньшей мере один штамм P. bilaiae.
50. Способ по п. 49, в котором по меньшей мере один штамм Р. bilaiae включает NRRL 50162, NRRL 50169, АТСС 20851, АТСС 22348, и/или АТСС 18309.
51. Способ по п. 47, в котором по меньшей мере один солюбилизирующий фосфат микроорганизм включает по меньшей мере один штамм P. gaestrivorus.
52. Способ по п. 51, в котором по меньшей мере один штамм Р. gaestrivorus включает NRRL 50170.
53. Способ по п. 47, в котором по меньшей мере один солюбилизирующий фосфат микроорганизм включает по меньшей мере один штамм Streptomyces.
54. Способ по п. 1, дополнительно включающий нанесение на растение или его семена и/или растение, проросшее из семян, по меньшей мере одного диазотрофа.
55. Способ по п. 54, в котором указанный диазотроф ключает один или несколько штаммов Rhizobium, Sinorhizobium, Azorrhizobium, Mesorhizobium и/или Bradyrhizobium.
56. Способ по п. 54, в котором указанный по меньшей мере один диазотроф включает по меньшей мере один штамм Bradyrhizobium japonicum.
57. Способ по п. 54, в котором указанный по меньшей мере один диазотроф включает по меньшей мере один штамм Sinorhizobium meliloti.
58. Способ по п. 54, в котором указанный по меньшей мере один диазотроф включает по меньшей мере один штамм Rhizobium leguminosarum.
59. Способ по п. 54, в котором указанный по меньшей мере один диазотроф включает по меньшей мере один штамм Mesorhizobium ciceri.
60. Способ по п. 1, дополнительно включающий нанесение на растение или его семена и/или растение, проросшее из семян, по меньшей мере одного из микоризных грибов.
61. Способ по п. 60, в котором указанный по меньшей мере один из микоризных грибов включает по меньшей мере один штамм Glomerocycota.
62. Способ по любому из пп. 1-61, в котором семена являются бобовыми.
63. Способ по любому из пп. 1-61, в котором семена являются небобовыми.
64. Способ по любому из пп. 1-61, в котором семенами являются семена Poaceae, Cucurbitaceae, Malvaceae, Asteraceae, Chenopodiaceae или Solanaceae.
65. Способ по любому из пп. 1-61, в котором семенами являются семена пшеницы.
66. Способ по любому из пп. 1-61, в котором семенами являются семена ячменя.
67. Способ по любому из пп. 1-61, в котором семенами являются семена сорго.
68. Способ по любому из пп. 1-61, в котором семенами являются семена овса.
69. Способ по любому из пп. 1-61, в котором семенами являются семена гороха.
70. Способ по любому из пп. 1-61, в котором семенами являются семена кукурузы.
71. Способ по любому из пп. 1-61, в котором семенами являются семена чечевицы.
72. Способ по любому из пп. 1-61, в котором семенами являются семена фасоли.
| CN 101092315 A 26.12.2007 | |||
| CN 101248797 A 27.08.2008 | |||
| CN 101601410 A 16.12.2009 | |||
| ПРИМЕНЕНИЕ ЛИПОХИТООЛИГОСАХАРИДОВ ДЛЯ ИНИЦИИРОВАНИЯ РАННЕГО ЦВЕТЕНИЯ И РАЗВИТИЯ ПЛОДОВ У РАСТЕНИЙ | 2004 |
|
RU2356226C2 |
Авторы
Даты
2015-10-10—Публикация
2012-09-24—Подача