ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам приготовления белков растительного происхождения. Более конкретно, настоящее изобретение обеспечивает способы для получения белков, включающих белковые супраструктуры, из растений и растительных тканей.
УРОВЕНЬ ТЕХНИКИ
В современных стратегиях рекомбинантной экспрессии в клетках-хозяевах, таких как Е. coli, культура клеток насекомых и культура клеток млекопитающих экспрессируют и выделяют белки в очень высокой степени в культуральную среду. При использовании этих систем высоких степеней экспрессии, достигается правильная укладка белка и посттрансляционная модификация белков. Более того, очистка экспрессированного белка упрощается, так как внутриклеточные белки могут быть быстро выделены из других компонентов (ДНК, пузырька, мембран, пигментов и так далее). В случае растительных или дрожжевых систем экспрессии оболочка клетки предотвращает выделение экспрессированного белка в культуральную среду.
Для получения клеточных экстрактов в науке широко используются различные подходы. Механические подходы с разрушением оболочки клетки и высвобождения ее содержимого обычно не являются селективными для конкретного класса белков или клеточных компонентов. При направлении экспрессии целевого белка в клеточную культуральную среду, становится возможным удаление внутриклеточных загрязняющих веществ центрифугированием или путем фильтрованием, что позволяет простое и быстрое обогащение целевого белка. Также может потребоваться разделение целевого белка или целевой белковой супраструктуры, включающей белковые розетки, наночастицы, большие белковые комплексы, антитела или вирусоподобные частицы (ВПЧ) и подобное от некоторых или всех белков, ДНК, фрагментов мембраны, пузырьков, пигментов, углеводов и т.д., присутствующих в растении или растительном материале до того, как целевая белковая супраструктура будет использоваться в составе вакцины.
Иммуноглобулины (IgGs) представляют собой комплексные гетеромультимерные белки с характерным сродством к специфическим антигенным аналогам различной природы. На сегодняшний день стандартное выделение IgG-продуцирующих клеточных линий и появляющиеся методики IgG-направленного развития и молекулярной инженерии оказали глубокое воздействие на их развитие в качестве биотерапевтических препаратов и на рынке общей медико-биологической науки. Терапевтические моноклональные IgG (моноклональные антитела, MAT) доминируют в настоящее время на рынке новых противовоспалительных и противораковых лекарственных средств, и сотни новых возможных средств в настоящее время находятся в стадии разработки и клинического развития для улучшенного или нового применения. Ежегодно на рынке требуются MAT в количестве от нескольких грамм (диагностические средства), нескольких килограмм (антитоксин) до вплоть одной или нескольких сотен килограмм (биозащита, противораковые, противоинфекционные и противовоспалительные средства). Способы производства модифицированных гликопротеинов из растений описаны в WO 2008/151440 (которая включена в настоящее описание посредством отсылки).
Способ экстрагирования белка из межклеточного пространства растений, включающий процесс вакуумирования и центрифугирования для того, чтобы получить экстракт межтканевой жидкости, включающей целевой белок, описан в публикации РСТ WO 00/09725 (Turpen et al.). Этот подход является подходящим для небольших белков (50 кДа или менее), которые проходят сквозь сеть микрофибр при вакуумировании и центрифугировании, но не подходит для больших белков, суперструктурных белков, белковых розеток, наночастиц, больших белковых комплексов, таких как антитела и ВПЧ.
В McCormick et al 1999 (Ргос Nati Acad Sci USA 96:703-708) раскрывается применение сигнального пептида амилазы риса, сшитого с одноцепочечным Fv-эпитопом (scFv), для направления экспрессированного белка во внеклеточное пространство с последующей вакуумной инфильтрацией ткани листа и стебля для выделения scFv-полипептидов. В Moehnke et al., 2008 (Biotechnol Lett 30:1259-1264) описывается применение способа вакуумной инфильтрации по McCormick для получения рекомбинантного растительного аллергена из табака с использованием апопластовой экстракции. В публикации РСТ WO 2003/025124 (Zhang et al) раскрывается экспрессия scFv-иммуноглобулинов в растениях, направленная на образование пространства апопласта, при использовании мышиных сигнальных последовательностей.
Вирусоподобные частицы (ВПЧ) могут применяться для приготовления противогриппозных вакцин. Супраструктуры, такие как ВПЧ, имитируют структуру вирусного капсида, но теряют геном и, таким образом, не могут реплицировать или обеспечить путь для повторного инфицирования. ВПЧ предлагают усовершенствованную альтернативу изолированным (растворимым) рекомбинантным антигенам для стимулирования сильного иммунного ответа. ВПЧ собираются в результате экспрессии специфических белков вируса и находятся на внешней поверхности, наподобие их когнатного вируса, но в отличие от истинной вирусной частицы не внедряют генетический материал. При нахождении антигенов в конкретной и мультивалентной структуре подобно исходному вирусу достигается улучшенное стимулирование иммунного ответа при сбалансированных гуморальных и клеточных компонентах. Такое улучшение стимулирования изолированными антигенами, как полагают, является особенно верным для вирусов с оболочкой, так как ВПЧ с оболочкой присутствуют на поверхности антигенов в их естественном мембраносвязанном состоянии (Grgacic and Anderson, 2006, Methods 40, 60-65). Более того, ВПЧ гриппа с их наноструктурной организацией показали, что они являются лучшими кандидатами для вакцины по сравнению с рекомбинантным гемагглютинином ГА (то есть мономерным ГА или ГА, сформированным в розетки; сборкой из 3-8 тримеров ГА), и они способны активировать как гуморальный, так и клеточный иммунный ответ (Bright, R.A., et. al., 2007, Vaccine 25, 3871-3878).
ВПЧ гриппа были получены в культивируемых клетках млекопитающих при совместной экспрессии всех 10 белков гриппа (Меnа et al., 1996, J. Virol. 70, 5016-5024). Несколько белков вируса являются не обязательными для образования ВПЧ, и ВПЧ гриппа для программ развития вакцин получают при совместной экспрессии 2 главных антигенных белков с оболочкой (ГА и НА) с Ml или при совместной экспрессии только ГА и M1 (Kang et al., 2009, Virus Res. 143,140-146). В Chen et al. (2007, J. Virol. 81, 7111-7123) было показано, что ГА в отдельности способен запускать образование и отпочковывание ВПЧ, и совместная экспрессия Ml может быть исключена в их системе. Однако поскольку было обнаружено, что ГА связывается с сиалированными гликопротеинами на поверхности клеток млекопитающих, образующих ВПЧ, сиалидаза вируса подвергалась совместной экспрессии для того, чтобы допустить высвобождение ВПЧ из продуцирующих клеток после отпочковывания.
В публикации РСТ WO 2006/119516 (Williamson и Rybicki) раскрывается экспрессия полного и процессированного человеческого кодона, оптимизированного Н5 ГА Гриппа A/Vietnam/1194/2004 в растениях. В процессированном конструкте отсутствует фиксирующий мембрану домен. Наибольшая концентрация белка ГА была получена с конструктами, которые направлены на ЭР. Конструкты, не имеющие направленного на мембраны домена, не образуют обнаруживаемого ГА. Об образовании ВПЧ не сообщалось.
Образование ВПЧ ГА гриппа, которые включают липидную оболочку, были ранее описаны изобретателями в WO 2009/009876 и WO 2009/076778 (tD'Aoust et al.; обе из которых включены в настоящее описание посредством отсылки). В случае вирусов с оболочкой может быть предпочтительным сохранять липидный слой или мембрану вируса. Состав липидного слоя может варьироваться в системе (например, полученный из растения вирус с оболочкой будет включать растительные липиды растений или фитостеролы в оболочке) и может вносить вклад в улучшение иммунного ответа.
Сборка ВПЧ с оболочками в трансгенном табаке, экспрессирующая поверхностный антиген вируса гепатита В (HBsAg), была описана в Mason et al.(1992, Proc. Natl. Acad. Sci. USA 89, 11745-11749). Показали, что полученные из растений ВПЧ вируса гепатита В вызывают сильные иммунные ответы В- и Т-клеток у мышей при парентеральном введении (Huang et al., 2005, Vaccine 23,1851 -1858), но пероральная иммунизация при исследованиях с введением препарата в пищу вызывала только умеренный иммунный ответ (Smith et al., 2003, Vaccine 21,4011-4021). В Greco (2007, Vaccine 25, 8228-8240) показано, что эпитопы вируса иммунодефицита человека (ВИЧ) при слиянии с HBsAg, накапливались в качестве ВПЧ при экспрессии в трансгенном табаке и Arabidopsis с образованием бивалентной вакцины ВПЧ.
Экспрессия вирусного капсидного белка (NVCP) в трансгенном табаке и картофеле привело к сборке ВПЧ без оболочек (Mason et al., 1996, Proc. Natl. Acad. Sci. USA 93, 5335-5340). ВПЧ NVCP образовывались в агроинфильтрованных листьях N. benthamiana (Huang et al. 2009, Biotechnol. Bioeng. 103, 706-714), и их иммуногенность при пероральном введении продемонстрирована на мышах (Santi et al., 2008, Vaccine 26,1846-1854). Введение 2 или 3 доз сырых картофелин, содержащих 215-751 мкг NVCP в виде ВПЧ здоровьм взрослым добровольцам привело к появлению иммунного ответа у 95% иммунизированных добровольцев (Tacket et al. 2000, J. Infect. Dis. 182, 302-305). ВПЧ без оболочки также были получены из экспрессии корового антигена вируса гепатита В (HBcAg; Huang et al., 2009, Biotechnol. Bioeng. 103,706-714) и главного капсидного белка LI вируса папилломы человека (HPV) (Varsani et al., 2003, Arch Virol. 148, 1771-1786).
Требуется более простой белок или система продуцирования белковой супраструктуры, например, та, которая основывается на экспрессии только одного или нескольких белков. Продуцирование белков или белковых супраструктур, например, но не ограничиваясь, белковых розеток, наночастиц, больших белковых комплексов, таких как антитела или ВПЧ, в растительных системах является предпочтительным, в том, что растения можно вырастить в теплице или на поле, и не требуется асептических способов выращивания и обработки тканевой культуры.
Необходимы способы приготовления белков или белков, или супраструктурных белков, которые по существу не содержат растительных белков или легко от них отделяются, сохраняя, тем не менее, структуру и характеристики белка.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам приготовления белков растительного происхождения. Более конкретно настоящее изобретение обеспечивает способы получения белков, включающих белковые супраструктуры, из растений и растительных тканей.
Объектом изобретения является обеспечение улучшенного способа приготовления белков растительного происхождения.
Настоящее изобретение обеспечивает способ (А) приготовления белков растительного происхождения или белков, или супраструктурных белков, включающий получение растения или растительного материала, включающего белки растительного происхождения или супраструктурных белков, локализованные в апопласте; получение протопласта и фракции апопласта, причем фракция апопласта включает белки растительного происхождения или супраструктурные белки; и выделение фракции апопласта. Способ может далее включать стадию очистки белков растительного происхождения, или белков, или супраструктурных белков из фракции апопласта. Белки растительного происхождения, или белки, или супраструктурные белки могут быть химерными белками растительного происхождения или супраструктурным белком. Белки растительного происхождения, или белки, или супраструктурные белки могут быть гетерологичными по отношению к растению. Белки растительного происхождения, или белки, или супраструктурные белки могут включать белковую розетку, белковый комплекс, протеасому, метаболон, транскрипционный комплекс, рекомбинантный комплекс, фотосинтетический комплекс, комплекс переноса через мембрану, комплекс ядерной поры, белковую наночастицу, гликопротеин, антитело, поликлональное антитело, моноклональное антитело, одноцепочечное моноклональное антитело, вирусоподобную частицу, белок оболочки вируса, структурный белок вируса, вирусный капсидный белок и белок вирусной оболочки, химерный белок, химерный белковый комплекс, химерную белковую наночастицу, химерный гликопротеин, химерное антитело, химерное моноклональное антитело, химерное одноцепочечное моноклональное антитело, химерный гемагглютинин, белок оболочки вируса, структурный белок вируса, вирусный капсидный белок и белок вирусной оболочки. Моноклональное антитело растительного происхождения может содержать химерное моноклональное антитело мыши, человека, например, но не ограничиваясь С2 В8. ВПЧ растительного происхождения могут включать гемагглютинин гриппа.
Фракции апопласта и протопласта могут быть получены путем обработки растения или растительного материала ферментной композицией. Ферментная композиция может включать одну или более чем одну пектиназу, одну или более чем одну целлюлазу или одну или более чем одну пектиназу и одну или более чем одну целлюлазу. Более того, если требуется, ферментная композиция не включает липазу или протеазу или композиция не включает добавленную липазу или протеазу.
Растение или растительный материал могут быть получены путем выращивания, сбора или выращивания и сбора. Растительный материал может включать несколько или все из растений, одну или более чем одну клетку растения, листья, стебли, корни или культивированные клетки растений.
Настоящее изобретение обеспечивает способ приготовления белков растительного происхождения или белков, или супраструктурных белков, как описано выше (Способ А), где нуклеиновая кислота, кодирующая белки или супраструктурные белки, вводится в растение транзиторным образом. В качестве альтернативы нуклеиновая кислота стабильно интегрируется в геном растения.
Настоящее изобретение обеспечивает способ приготовления белков растительного происхождения или супраструктурных белков, как описано выше (Способ А), далее включающий стадию очистки белков растительного происхождения или супраструктурных белков из фракции апопласта. Стадия очистки может включать фильтрование фракции апопласта с образованием осветленного экстракта с последующей хроматографией осветленного экстракта с использованием катионнобменной смолы, аффинной хроматографии, размерно-эксклюзионной хроматографии или их комбинаций.
Не желая быть связанными с теорией, белки, полученные из апопласта являются более гомогенными чем промежуточные формы посттрансляционных модифицированных белков или белки других видов обработки, которые встречаются в различных внутриклеточных пространствах, например, митохондриях, хлоропласте и других органеллах не подвергаются совместной экстракции. Наибольшая степень гомогенности рекомбинантного белка, как правило, приводит к более высокому качеству состава, содержащего белок, и может привести к продукту с полезными свойствами, включающими более высокий потенциал, больший период полураспада или улучшенную иммуногенную способность. Например, белки крови, содержащие высокоманнозное гликолизирование, расщепляются в кровотоке более быстро, чем белки, включающие комплексное гликолизирование. При получении гликолизированного белка во фракции апопласта в большей степени проявляется тип комплексного гликолизирования. Таким образом, полученный из апопласта протеин, приготовленный с использованием способов, описанных в настоящей заявке, включающих расщепление оболочки клетки, проявляет, например, улучшенный период полураспада в кровотоке.
Белки растительного происхождения или супраструктурные белки могут включать белковые розетки, белковые комплексы, белковые наночастицы, антитела, моноклональные антитела, ВПЧ. ВПЧ могут включать один или более полипептидов ГА гриппа. Супраструктурный белок может быть химерным супраструктурным белком, например, моноклональное антитело может быть химерным моноклональным антителом, или полипептид ГА гриппа может быть химерным полипептидом ГА. Если супраструктурный белок представляет собой ВПЧ, тогда ВПЧ растительного происхождения может также иметь гемагглютинирующую активность. Растение или растительный материал могут быть получены путем выращивания, сбора или выращивания и сбора растения. Растительный материал может включать несколько или все растенияй, одну или более чем одну растительную клетку, листья, стебли, корни или культивированные клетки растений.
Настоящее изобретение также обеспечивает способ (В) приготовления белков растительного происхождения или супраструктурных белков, включающий получение растения или растительного материала, включающего белки растительного происхождения или супраструктурные белки, расщепление растительного материала с использованием разрушающей оболочку клетки ферментной композиции с образованием расщепленной фракции, и фильтрование расщепленной фракции с получением отфильтрованной фракции, и выделение белков растительного происхождения или супраструктурных белков из отфильтрованной фракции.
Ферментная композиция может включать одну или более чем одну пектиназу, одну или более чем одну целлюлозу или одну или более чем одну пектиназу и одну или более чем целлюлазу. Более того, если требуется, ферментная композиция не включает липазу или протеазу или композиция не включает добавленную липазу или протеазу. Супраструктурный белок растительного происхождения может быть химерным супраструктурным белком растительного происхождения. Супраструктурный белок растительного происхождения может включать белковую розетку, белковый комплекс, протеасому, метаболой, транскрипционный комплекс, рекомбинантный комплекс, фотосинтетический комплекс, комплекс переноса через мембрану, комплекс ядерной поры, белковую наночастицу, гликопротеин, антитело, поликлональное антитело, моноклональное антитело, одноцепочечное моноклональное антитело, вирусоподобную частицу, белок оболочки вируса, структурный белок вируса, вирусный капсидный белок и белок вирусной оболочки, химерный белок, химерный белковый комплекс, наночастицу химерного белка, химерный гликопротеин, химерное антитело, химерное моноклональное антитело, химерное одноцепочечное моноклональное антитело, химерный гемагглютинин, белок оболочки вируса, структурный белок вируса, вирусный капсидный белок и белок вирусной оболочки. Моноклональное антитело растительного происхождения может включать химерное мышиночеловеческое моноклональное антитело, например, но не ограничиваясь, С2 В8. ВПЧ растительного происхождения могут включать гемагглютинин гриппа.
Настоящее изобретение обеспечивает способ приготовления белков растительного происхождения или супраструктурных белков, как описано выше (Способ В), где нуклеиновая кислота, кодирующая белки или супраструктурные белки, вводится в растение транзиторным методом. В качестве альтернативы нуклеиновая кислота стабильно встраивается в геном растения.
Настоящее изобретение обеспечивает способ приготовления ВПЧ растительного происхождения, как описано выше (Способ В), далее включающий стадию разделения белков или супраструктурных белков в отфильтрованной фракции от продуктов распада клетки и нерастворимых материалов. Стадия разделения может быть проведена путем центрифугирования, глубинной фильтрации или как центрифугированием, так и глубинной фильтрацией с получением осветленной фракции. Белки растительного происхождения или супраструктурные могут быть далее очищены хроматографией, например, осветленный экстракт может быть очищен с использованием катионообменной смолы, аффинной смолы, размерно-эксклюзионной хроматографии или их комбинаций.
Белки растительного происхождения или супраструктурные белки могут включать белковые розетки, белковые комплексы, белковые наночастицы, антитела, моноклональные антитела, ВПЧ. ВПЧ могут включать один или более полипептидов ГА гриппа. Супраструктурный белок может быть химерным супраструктурным белком, например, моноклональное антитело может быть химерным моноклональным антителом или полипептид ГА гриппа может быть химерным полипептидом ГА. Если супраструктурный белок представляет собой ВПЧ, тогда ВПЧ растительного происхождения может также иметь гемагглютинирующую активность.
Не желая быть связанными с теорией, полученные из растений ВПЧ, содержащие липиды растительного происхождения, могут вызывать более сильную иммунную реакцию, чем ВПЧ, полученные в других системах производства, и указанная иммунная реакция, вызываемая этими полученными из растений ВПЧ, является более сильной по сравнению с имунной реакцией, вызванной вакцинами живого или ослабленного цельного вируса.
Композиция белкового экстракта, полученная из клетки-хозяина, представляет собой комплекс и, как правило, включает, межклеточные и внутриклеточные компоненты наряду с белком или целевой супраструктурой, которые необходимо выделить. Приготовление фракции апопласта с последующей стадией разделения внутриклеточных белков и компонентов является предпочтительным, так как целевые белок или супраструктура могут быть обогащены, и увеличена эффективность в ходе процесса производства. Имея более простой способ, включающий меньшее количество эффективных стадий, это может привести к значительному увеличению выхода и снижению стоимости. Также было обнаружено, что при процессе расщепления оболочки клетки с применением расщепляющих оболочку клетки ферментов увеличивается выход супраструктурного белка даже, если протопласты не остаются интактными в ходе процедуры экстракции. Не желая быть связанными с теорией, на стадии расщепления клеточной оболочки полимерные компоненты клеточной оболочки могут разрыхляться и способствовать высвобождению белков или супраструктурных белков, в иных случаях объединенных внутри оболочки клетки. При указанной процедуре также может минимизироваться загрязнение белков или супраструктурных белков межклеточными компонентами.
Способы расщепления оболочек растительных клеток являются известными, и смеси ферментов, которые расщепляют оболочки клеток, могут варьироваться. Настоящее изобретение не ограничивается используемьм методом расщепления оболочки клетки.
Способы, описанные в настоящей заявке, приводят к меньшему разрушению и загрязнению экстракта супраструктурного белка растительного происхождения по сравнению с методами приготовления супраструктурного белка растительного происхождения, включающими гомогенизацию, смешивание или перемалывание. В способах, описанных в настоящей заявке, обеспечивается фракция апопласта растительной ткани, и, тем самым, может сохраняться целостность протопластов и их компонентов. Способ, как он описан в настоящей заявке, является эффективным при очищении белков или супраструктурных белков, даже если протопласты или часть протопластов теряют свою целостность и больше не являются интактными.
Эти способы обеспечивают более высокий выход белков или супраструктурных белков по сравнению со способами экстракции супраструктурных белков, включающими стандартные методики разрушения ткани, например, гомогенизацию, смешивание или перемалывание. Больший выход может быть получен отчасти благодаря снижению сил сдвига, которые разрушают структурную целостность белков или супраструктурных белков, и в случае ВПЧ, липидную оболочку. Приготовление белков или супраструктурных белков из фракции апопласта может быть предпочтительным, так как во фракциях апопласта значительно уменьшены или отсутствуют цитоплазматические белки. Таким образом, отделение супраструктурного белка от других белков и материалов, включающих мономеры, димеры, тримеры или фрагменты супраструктурных белков, во фракции апопласта осуществляется легко. Однако увеличенные выходы белков или супраструктурных белков также могут быть получены с использованием способов, описанных в настоящей заявке, даже если приготовление протопласта или приготовление части протопласта не является интактным.
Гликопротеины, включающие супраструктурыне гликопротеины, например, моноклональные антитела, которые секретируют в апопласт, включают больший процент N-гликанов, у которых завершено деление, включают терминальные N-ацетилглюкозаминнные или галактозные остатки (комплекс N-гликанов) по сранению с экстракционными способами, при которых не расщепляется оболочка клетки, например, смешивание экстрагированных растений. Обнаружено, что супраструктурные гликопротеины, например, моноклональные антитела, включающие комплекс N-гликанов, проявляют полезное свойство увеличенного периода полураспада в кровотоке по сравнению с моноклональными антителами, включающими терминальные остатки маннозы (незрелые N-гликаны).
При использовании ферментного расщепления оболочки клеток может быть возможным высвобождение пула антител апопласта, включающих N-гликаны, у которых завершено деление. Этот способ экстракции может позволить выделение обогащенную популяции или гомогенной популяции гликозилированных антител, содержащих комплекс N-гликанов, при выделении незрелых форм гликолизированных антител во фракции протопласта. Если требуется пул антител, содержащих комплекс N-гликанов, фракция протопласта может быть сохранена, а антитела выделены из фракции протопласта.
ВПЧ по настоящему изобретению также характеризуются как проявляющие более высокую гемагглютининовую активность, чем те, которые получены при использовании стандартных методик разрушения ткани. Эта улучшенная гемагглютинирующая активность может быть результатом большего выхода интактных ВПЧ (меньше свободных мономеров или тримеров ГА в растворе), большего выхода интактных ВПЧ с интактными липидными оболочками или их комбинации.
Вакцины, полученные с применением ВПЧ, обеспечивают преимущество по сравнению с вакцинами, полученными из цельных вирусов, которые являются неинфекционными. Таким образом, биологическое сдерживание не является проблемой, и это не требуется для производства. Полученные из растения ВПЧ обеспечивают еще одно преимущество, позволяющее выращивать систему экспрессии расти в теплице или на поле, будучи тем самьм значительно более экономичными и подходящими для увеличеннных масштабов.
В дополнение к этому, растения не включают ферменты, связанные с синтезом и добавлением остатков сиаловой кислоты к белкам. ВПЧ могут быть получены в отсутствие нейраминидазы (НА), и нет необходимости в совместной экспрессии НА или в обработке продуцирующих клеток или экстракта сиалидазой (нейраминидазой) для гарантированного производства ВПЧ в растениях.
Это краткое описание изобретения не обязательно описывает все признаки изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие признаки изобретения будут более понятными из следующего описания, в котором сделана ссылка на приложенные чертежи, где:
На Фигуре 1 показано схематическое изображение основанной на CPMVHT экспрессионной кассеты (конструкт 685) для экспрессии гемагглютинина Н5 A/Indonesia/5/05.
На Фигуре 2А изображена нуклеиновокислотная последовательность (SEQ ID NO. 1) части конструкта для экспрессии H5/Indo (конструкт номер 685) от РасI (против хода промотора 35S) до AscI (непосредственно по ходу терминатора NOS). Кодирующая последовательность Н5 из A/Indonesia/5/2005 подчеркнута. На Фигуре 2В изображена аминокислотная последовательность (SEQ ID NO. 2) гемагглютинина Н5 A/Indonesia/5/05, кодированного конструктом номер 685.
На Фигуре 3 изображена характеристика содержащих гемагглютинин (ГА) структур, полученная эксклюзионной хроматографией (SEC). После центрифугирования расщепленного растительного экстракта пеллет ресуспендировали и разделяли на фракции с помощью SEC. На Фигуре 3А показано общее содержание растворимого белка на фракцию (сплошные треугольники; % от максимального, левая ось Y; определено с использованием метода Брэдфорд). Также показана гемагглютинирующая активность собранных фракций (сплошные полоски, правая ось Y). На Фигуре 3В показан анализ с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) элюированных с помощью SEC фракций. Фракции были осаждены ацетоном и ресуспендированы в 1/40 объем восстанавливающего буфера для нанесенияобразца до анализа. Гель был окрашен 0.1% раствором Кумасси R-250. Очищенные ВПЧ использовались в качестве контроля. Полоса, соответствующая мономеру ГАО, указана стрелкой. MM - Молекулярная масса стандартов (кДа); С - Очищенные ВПЧ (контроль); полосы от 7 до 10 и от 14 до 16 соответствуют номеру фракций, элюированных при анализе SEC, показаны на Фигуре 3А.
На Фигуре 4 показано сравнение профилей белков, полученных после ферментного расщепления и путем механической гомогенизации с использованием гомогенизатора Comitrol. Образцы обрабатывали в денатурирующем буфере для нанесения образца, и белки разделялись с помощью анализа SDS-PAGE элюированных фракций. Гели были окрашены 0.1% раствором Кумасси R-250. MM - Молекулярная масса стандартов (кДа); полоса 1-25 мкл ферментной смеси; полоса 2-25 мкл ферментного расщепления растительной ткани и полоса 3-35 мкл экстракта, полученного в гомогенизаторе Comitrol.
На Фигуре 5 изображена нуклеотидная последовательность (SEQ ID NO: 9) экспрессионной кассеты ГА, включающей промотер пластоцианина люцерны и 5' UTR, гемагглютинин, кодирующий последовательность Н5 из A/Indonesia/5/2005 (Конструкт №660), 3' UTR пластоцианина люцерны и терминирующей последовательности.
На Фигуре 6 изображен захват ГА-ВПЧ на катионообменной смоле, непосредственно образующий выделение ГА-ВПЧ во фракцию апопласта. Образцы были обработаны в невосстанавливающем денатурирующем буфере для нанесения образца, и белки выделяли SDS-PAGE. Гели были окрашены 0.1% раствором Кумасси R-250. Полоса 1: Фракция апопласта после центрифугирования, Полоса 2-3: Фракция апопласта после успешной микрофильтрации; Полоса 4: Загрузка катионообменной смолы; Полоса 5: Поток через фракцию катионообменной смолы; Полоса 6: элюирование из катионообменника, сконцентитрованна 10Х; Полоса 7: Молекулярная масса стандартов (кДа).
На Фигуре 7 изображен профиль, полученный способом Nanoparticles Tracking analysis (NTA), ВПЧ H5/Indo (Фигура 7А) и ВПЧ Hl/Cal (Фигура 7В) после осветления без добавления NaCl к расщепляющему буферу и ВПЧ Hl/Cal (Фигура 7С) с таким добавлением. Эксперименты NTA проводили с NanoSight LM20 (NanoSight, Amesbury, UK). Инструмент оборудован синим лазером (405 нм), камерой для проб и фторопластовым уплотнительным кольцом Viton. При комнатной температуре были записаны видеоролики и проанализированы с использованием программного обеспечения NTA 2.0. Образцы записывались в течение 60 сек. Выдержку и диафрагму выбирали вручную таким образом, чтобы получить оптимальное разрешение частиц.
На Фигуре 8 показан Вестерн-блоттинг экстракта ВПЧ НЗ/Brisbane, полученного при ферментном расщеплении с использованием различных буферов. Полоса 1) Стандарт чистого рекомбинантного ГА (5 мкг из Immune Technology Corp.IT-003-0042p), Полоса 2-5 содержит 7 мкл центрифугированного ферментного экстракта, полученного в следующих буферах:
Полоса 2) 600 мМ маннита+125 мМ цитрата+75 мМ NaPO4+25 мМ ЭДТА+0.04% бисульфита рН 6.2, Полоса 3) 600 мМ маннита+125 мМ цитрата+75 мМ NaPO4+50 мМ ЭДТА+0.04% бисульфита рН 6.2, Полоса 4) 200 мМ маннита+125 мМ цитрата+75 мМ NaPO4+25 мМ ЭДТА+0.03% бисульфита рН 6.2, Полоса 5) 200 мМ маннита+125 мМ цитрата+75 мМ NaPO4+50 мМ ЭДТА+0.03% бисульфита рН 6.2. Стрелка показывает сигнал иммунодетекции ГАО.
На Фигуре 9 изображена последовательность фрагмента ДНК, синтезированного для сборки конструкта №590 (фрагмент LC; (SEQ ID NO.15).
На Фигуре 10 изображена последовательность фрагмента ДНК, синтезированного для сборки конструкта №592 (фрагмент НС; (SEQ ID NO.16).
На Фигуре 11А и Фигуре 11В показано схематическое изображение конструктов №595 (Фигура 11А) и №R472 (Фигура 11В) соответственно.
Фигура 12 SDS-PAGE сравнение антител, очищенных из экстрактов, образованных в результате механического разрушения (экстракция в измельчителе) и ферментного расщепления оболочек клетки. Для каждого способа экстракции, получали и очищали две партии независимо друг от друга.
На Фигуре 13А показано сравнение части олигоманнозных N-гликанов на С2 В8, очищенных с помощью механического разрушения (экстракция в измельчителе) и ферментного расщепления оболочек клеток.
На Фигуре 13В показано сравнение части комплекса N-гликанов на С2 В8, очищенных с помощью механического разрушения (экстракция в измельчителе) и ферментного расщепления оболочек клеток.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам приготовления белков растительного происхождения. Более конкретно настоящее изобретения обеспечивает способы получения белков, или белков, или белков, или супраструктурных белков из растений и растительных тканей.
Нижеследующее описание является предпочтительным воплощением.
Настоящее изобретение обеспечивает способ получения целевых белка или белковой супраструктуры. Целевой белок может находиться в апопласте или внеклеточном пространстве, соответствующем части растительной клетки, не включающей пространство протопласта/сферопласта. Способ включает удаление, расщепление или как расщепление, так и удаление целлюлозной оболочки клетки, которая окружает растительные клетки. При расщеплении оболочки клетки полимерные компоненты оболочки клетки разрыхляются, и целевые белок или белки, или белки, или супраструктурные белки могут более легко высвобождаться. При использовании этого способа целевые белок или белки, или белки, или супраструктурные белки обогащаются, так как пространство протопласта/сферопласта, которое содержит большую часть белков и компонентов клеток-хозяев, выделяется из апопласта. Как отмечено ниже, способ в соответствии с настоящей заявкой, все равно является эффективным при получении целевого белка или белковой супраструктуры, если в ходе процесса нарушается целостность пространства протопласта/сферопласта, если пространство протопласта/сферопласта не является интактным, и если часть белков и компонентов клетки-хозяина пространства протопласта/сферопласта находятся во фракции апопласта. При использовании способов, описанных ниже, если нарушается целостность пространства протопласта/сферопласта, белок или белковую супраструктуру все равно можно отделить от интактных органелл, включающих митохондрию, хлоропласт и другие органеллы, и по-прежнему могут быть получены благоприятные результаты.
Под «белком» или «целевым белком» (эти термины используются взаимозаменяемо) понимается белок или белковая субъединица, закодированная нуклеотидной последовательностью, или кодирующим участком таким образом, чтобы быть экспрессированным в растении или части растения. Белки могут иметь молекулярную массу от около 1 до около 100 кДа или какую угодно между ними, например, 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 кДа или какую угодно между ними. Белок может быть мономерным, двумерным, трехмерным или мультимерным.
Белковая супраструктура, также называемая супраструктурным белком, белковой суперструктурой или суперструктурным белком, представляет собой белковую структуру, состоящую из двух или более полипептидов. Полипептиды могут быть одинаковыми или разными; если разные, они могут присутствовать в соотношении от около 1:1 до около 10:1 или больше. Супраструктурные белки могут включать, но не ограничиваясь, белковые розетки, белковые комплексы, белковые наночастицы, гликопротеины, антитела, поликлональные антитела, моноклональные антитела, одноцепочечные моноклональные антитела или вирусоподобные частицы, протеасомы, метаболоны, транскрипционные комплексы, рекомбинантные комплексы, фотосинтетические комплексы, комплексы переноса через мембрану, комплексы ядерной поры, химерные белки, химерные белковые комплексы, наночастицы химерного белка, химерные гликопротеины, химерные антитела, химерные моноклональные антитела, химерные одноцепочечные моноклональные антитела или химерный гемагглютинин (ГА). Если белковая супраструктура представляет собой ВПЧ, ВПЧ может быть выбрана из группы белков оболочки вируса, структурных белков вируса, вирусных капсидных белков и белков вирусной оболочки. ВПЧ растительного происхождения могут включать вирус гриппа (ГА).
Как правило, белковая супраструктура (белковая суперструктура) при объединении является большой, например, имеющей молекулярную массу более чем 75 кДа, например, от около 75 до около 1500 кДа или любую молекулярную массу между ними. Например, белковая супраструктура может иметь молекулярную массу от около 75, 80, 85, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 200, 220, 240, 260, 280, 300, 320, 340, 360, 380, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 850, 900, 950, 1000, 1100, 1150, 1200, 1250, 1300, 1350, 1400, 1450, 1500 или какую угодно между ними. Субъединицы, которые объединяются друг с другом с образованием белковой супраструктуры могут иметь меньший молекулярный вес, например, каждая субъединица имеет молекулярную массу от около 1 кДа до около 500 кДа или какую угодно между ними. Белковая супрастркутура может включать белок, проявляющий вторичную структуру с одним или более аминокислотным водородом, связанным, например, с остатками в белковых спиралях, третичную структуру, имеющую 3-мерную конфигурацию, или четвертичную структуру, имеющую конфигурацию многократно сложенных белков или свернутых спиралью белковых молекул, которые образуют мультисубъединичный комплекс.
Мультибелковый комплекс (или белковый комплекс) может включать группу из двух или более связанных полипептидных цепей. Если различные полипептидные цепи содержат разные белковые домены, тогда образующийся мультибелковый комплекс может иметь множественные каталитические функции. Белковый комплекс также может представлять собой мультиферментный полипептид, включающий множественные каталитические домены с одной полипептидной цепью. Белковые комплексы находятся, как правило, в форме четвертичной структуры. Примеры белковых комплексов, которые, как правило, могут не оставаться интактными при использовании стандартных протоколов выделения белка, но которые могут быть получены с использованием способов, описанных в настоящей заявке, включают протеасомы (для разрушения пептидов и белков), метаболоны (для окислительной выработки энергии), рибосомы (для белкового синтеза, например, как описано в Pereira-LealJ.B.; et. al., 2006, Philos Trans R Soc Lond В Biol Sci,361(1467):507-517), транскрипционные комплексы, рекомбинантные комплексы, фотосинтетические комплексы, комплексы переноса через мембрану, комплексы ядерной поры. Настоящий способ может быть использован для получения белковых комплексов, которые характеризуются, как имеющие стабильные или более слабые взаимодействия домен белка - домен белка.
Примеры белка или белковой супраструктуры включают, например, но не ограничиваясь, используемый в промышленности фермент, например, целлюлазу, ксиланазу, протеазу, пероксидазу, субтилизин, белковую добавку, нутрицевтик, дополнительный продукт или фрагмент указанных для кормового, пищевого или как для кормового, так и пищевого использования, фармацевтически активный белок, например, но не ограничиваясь, факторы роста, регуляторы роста, антитела, антигены и фрагменты указанных или их производные, пригодные для иммунизации или вакцинации, и подобные. Дополнительные целевые белки могут включать, но не ограничиваясь, интерлейкины, например, один или более чем один из IL-1-IL-24, IL-26 и IL-27, цитокины, Эритропоэтин (ЕРО), инсулин, G-CSF, GM-CSF, hPG-CSF, M-CSF или комбинации указанных, интерфероны, например, интерферон-альфа, интерферон-бета, интерферон-гамма, факторы свертываемости крови, например. Фактор VIII, Фактор IX или tPA hGH (гормон роста человека), рецепторы, агонисты рецепторов, антитела, нейрополипептиды, инсулин, вакцины, факторы роста, например, но не ограничиваясь, эпидермальный фактор роста, кератиноцитарный фактор роста, трансформирующий фактор роста, регуляторы роста, антигены, аутоантигены, фрагменты указанных или комбинации указанных.
Неограничивающим примером белковой супраструктуры является антитело. Антитела представляют собой гликопротеины, которые имеют молекулярную массу от около 100 до около 100 кДа или какую угодно между ними. Антитела включают четыре полипептидные цепи, две легкие цепи и две тяжелые цепи, которые соединены дисульфидными связями. Например, что не должно считаться ограничением, каждая легкая цепь может иметь молекулярную массу приблизительно 25 кДа, например, от около 20 до около 30 кДа или какую угодно между ними, или более, например, от около 20 до около 300 кДа или какую угодно между ними, и состоит из двух доменов: одного вариабельного домена (VL) и одного постоянного домена (СL). Каждая тяжелая цепь может иметь молекулярную массу приблизительно 50 кДа, например, от около 30 до около 75 кДа или какую угодно между ними, или более, например, от около 30 до около 500 кДа или какую угодно между ними, и состоит из постоянного и вариабельного участка. Тяжелые и легкие цепи содержат ряд гомологичных областей, состоящих из похожих, но не идентичных групп последовательностей аминокислот.Эти гомологичные единицы состоят из около 110 аминокислот и называются иммуноглобулиновыми доменами. Тяжелая цепь содержит один вариабельный домен (VH) и либо три или четыре константных доменов (Сн1, Сн2, Сн3, и Сн4, в зависимости от класса или изотипа антитела). Участок между доменами Сн1 и Сн2 называется шарнирным участком и обуславливает подвижность между двумя Fab-фрагментами Y-образной молекулы антитела, позволяя им открываться и закрываться для обеспечения связывания двух антигенных детерминант, разделенных фиксированным расстоянием.
Другой неограничивающий пример белковой супраструктуры представляет собой ВПЧ. ВПЧ может включать форму предшественника ГАО, или доменов ГА1, или ГА2, зафиксированных друг с другом формой дисульфидных мостиков. ВПЧ может иметь средний размер от около 20 нм до 1 мкм или какой угодно между ними, например, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 нм, или какой угодно между ними, например, 100 нм и может включать липидную мембрану.
Белки или супраструктурные белки могут далее включать один или более липидов, фосфолипидов, нуклеиновых кислот, мембран или подобное. Два или более полипептидов могут быть связаны ковалентной связью, дисульфидным мостиком, зарядовьм взаимодействием, гидрофобным притяжением, ван-дер-ваальсовыми силами, водородными связями или подобным. Примером белковой супраструктуры является моноклональное антитело, химерное моноклональное антитело, одноцепочечное моноклональное антитело или вирусоподобная частица (ВПЧ), которая может быть в оболочке или без оболочки, например, белок оболочки вируса, вирусный структурный белок, вирусный капсидный белок или белок вирусной оболочки.
Белки или супраструктурные белки могут быть получены в подходящих клетках-хозяинах, включающих растительные клетки-хозяины, и, если требуется, далее очищены. В то время как в настоящей заявке в качестве примеров приведены химерное моноклональное антитело, ВПЧ гриппа и химерная ВПЧ гриппа, способы, описанные в настоящей заявке, могут быть использованы для любого цитозольного белка или супраструктурного белка растительного происхождения или любого белка или супраструктурного белка растительного происхождения, которые локализуются или секретируются в апопласте.
Настоящее изобретение обеспечивает также способ приготовления белков или супраструктурных белков растительного происхождения. Способ включает получение растения или растительной ткани, включающей белки растительного происхождения или супраструктурные белки, локализованные внутри апопласта; получение фракции протопласта/сферопласта и фракции апопласта из растительного материала, причем фракция апопласта включает белки растительного происхождения или супраструктурные белки, и выделение фракции апопласта. Если требуется, белки растительного происхождения или супраструктурные белки могут быть очищены от фракции апопласта.
Настоящее изобретение также обеспечивает способ приготовления белка или супраструктурного белка, где белок или супраструктурный белок включает липидную оболочку растительного происхождения, например, ВПЧ, включающую липидную оболочку растительного происхождения. Способ включает получение растения или растительного материала, включающего целевой супраструктурный белок, например, ВПЧ, обработку растения или растительного материала ферментной композицией для того, чтобы получить один или более чем одни белковый комплекс апопласта и фракцию протопласта/апопласта, и отделение одного или более чем одного белкового комплекса апопласта от фракции протопласта. Один или более чем один белковый комплекс апопласта включает супраструктурный белок или ВПЧ, включающую липидную оболочку растительного происхождения.
Настоящее изобретение также обеспечивает способ приготовления белков растительного происхождения или супраструктурных белков, включающий получение растения или растительного материала, которые включают белки растительного происхождения или супраструктурные белки, расщепление растительного материала с использованием разрушающей оболочку клетки ферментной композиции с получением расщепленной фракции, и фильтрование расщепленной фракции с образованием отфильтрованной фракции, и отделение белков растительного происхождения или супраструктурных белков от отфильтрованной фракции. В этом способе может не требоваться целостность протопластов.
Протопласт представляет собой растительную клетку, у которой полностью или частично удалена оболочка клетки. Сферопласт может иметь частично удаленную оболочку клетки. Протопласт, сферопласт или как протопласт, так и сферопласт (протопласт/сферопласт) могут быть использованы, как описано в настоящей заявке, и указанные термины используются в настоящей заявке взаимозаменяемо. Оболочка клетки может быть разрушена и удалена механически (например, путем гомогенизации, перемешивания), оболочка клетки может быть полностью или частично расщеплена ферментными способами, или оболочка клетки может быть удалена с использованием комбинации механического и ферментного способов, например, гомогенизацией с последующей обработкой ферментами для расщепления оболочки клетки. Протопласты могут также быть получены из культивируемых клеток растений, например, жидких культивированных клеток растений или твердых культивированных клеток растений.
Стандартные справочные работы, устанавливающие общие принципы культуры тканей растений, культивированных растительных клеток и производства протопластов, сферопластов и подобныхе, включают: Introduction to Plant Tissue Culture, by MK Razdan 2nd Ed. (Science Publishers, 2003; которая включена в настоящее описание посредством отсылки), или смотри, например, следующий URL-адрес: molecular-plant-biotechnology.info/plant-tissue-culture/protoplast-isolation.htm. Способы и методики, относящиеся к получению и обработке протопласта (или сферопласта) изложены, например, в Davey MR et al., 2005 (Biotechnology Advances 23:131-171; которая включена в настоящее описание посредством отсылки). Стандартные справочные работы, устанавливающие общие способы и принципы биохимии белков, молекулярной биологии и подобное, включают, например, Ausubel et al. Current Protocols In Molecular Biology, John Wiley & Sons, New York (1998 and Supplements to 2001; которая включена в настоящее описание посредством отсылки); Sambrook et al, Molecular Cloning: A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory Press, Plainview, New York, 1989 (которая включена в настоящее описание посредством отсылки); Kaufman et al, Eds., Handbook Of Molecular And Cellular Methods In Biology And Medicine, CRC Press, Boca Raton, 1995 (которая включена в настоящее описание посредством отсылки); McPherson, Ed., Directed Mutagenesis: A Practical Approach, IRL Press, Oxford, 1991 (которая включена в настоящее описание посредством отсылки).
Ферменты, пригодные для расщепления или разрушения оболочек растительных клеток для высвобождения протопластов или сферопластов, известны специалисту в данной области техники, и могут включать целлюлазу (КФ 3.2.1.4), пектиназу (КФ 3.2.1.15), ксиланазу (КФ 3.2.1.8), хитиназы (КФ 3.2.1.14), гемицеллюлазу или комбинацию указанных. Неограничивающие примеры подходящих ферментов включают многокомпонентную ферментную смесь, включающую целлюлазу, гемицеллюлазу и пектиназу, например, MACEROZYME™ (содержащую приблизительно: Целлюлазы: 0.1 U/мг, Гемицеллюлазы: 0.25 U/мг и Пектиназы: 0.5 U/мг). Другие примеры коммерчески доступных ферментов, ферментных смесей и поставщиков перечислены в Таблице 1 (см: Introduction to Plant Tissue Culture, by MK Razdan 2nd Ed., Science Publishers, 2003).
Другие названия и типы целлюлаз включают: эндо-1,4-Р-O-глюканазу; β-1,4-глюканазу; (3-1,4-эндоглюкан гидролазу; целлюлазу А; целлюлозин АР; эндоглюканазу D; щелочную целлюлазу; целлюлазу А 3; целлюдекстриназу; 9.5 целлюлазу; авицелазу; панцеллазу SS и 1,4-(1,3;1,4)-р-В-глюкан 4-глюканогидролазу. Другие названия и типы пектиназ (полигалактуроназ) включают пектин деполимеразу; пектиназу; эндополигалактуроназу; пектолазу; пектин гидролазу; пектин полигалактуроназу; эндо-полигалактуроназу; поли-а-1,4-галактуронид глюканогидролазу; эндогалактуроназу; эндо-D-галактуроназу и поли(1,4-а-O-галактуронид) глюканогидролазу. Другие названия и типы ксиланаз включают гемицеллюлазу, эндо-(1→4)-β-ксилан 4-ксиланогидролазу; эндо-1,4-ксиланазу; ксиланазу; β-1,4-ксиланазу; эндо-1,4-ксиланазу; эндо-β-1,4-ксиланазу; эндо-1,4-β-D-ксиланазу; 1,4-β-ксилан ксиланогидролазу; R-ксиланазу; β-1,4-ксилан ксиланогидролазу; эндо-1,4-β-ксиланазу; β-D-ксиланазу. Другие названия и типы хитиназ включают хитодекстриназу; β-поли-N-ацетилглюкозаминидазу; поли-β-глюкозаминидазу; β-1,4-поли-N-ацетил глюкозаминидазу; поли[1,4-(N-вцетил-β-D-глюкозаминид)] глюканогидролазу.
Выбор конкретного фермента или комбинации ферментов, и концентрации и условий реакции может зависеть от типа используемой растительной ткани, из которой получают протопласт и фракцию апопласта, включающую ВПЧ. Смесь целлюлазы, гемицеллюлазы и пектиназы, например, пектиназы MACEROZYME™ или Multifect, может быть использована в концентрации, варьирующейся от 0.01% до 2.5% (об./об.), например, 0.01, 0.02, 0.04, 0.06, 0.08, 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.1., 1.2, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8, 1.9, 2.0, 2.1, 2.2, 2.3, 2.4, или 2.5% (об./об.) или какой угодно между ними. MACEROZYME™ или Multifect могут использоваться отдельно или в комбинации с другими ферментами, например, целлюлозой, пектиназой, гемицеллюлазой или их комбинацией. Целлюлаза может использоваться в концентрации, варьирующейся от 0.1% до 5%, например, 0.1, 0.25, 0.5, 0.75, 1.0, 1.25, 1.5, 1.75, 2.0, 2.25, 2.5, 2.75. 3.0. 3.25, 3.5, 3.75,4.0, 4.25, 4.5, 4.75, 5.0% (мас./об.) или какой угодно между ними.
Ферментный раствор (иначе называемый разрушающей оболочку клетки композицией, расщепляющим раствором) будет обычно включать буфер или буферную систему, осмотически активное вещество и одну или более чем одну соль, дивалентные катионы или другие добавки. Буфер или буферная система выбирается так, чтобы сохранять рН в диапазоне, подходящем для ферментной активности и стабильности белка(ов) или ВПЧ, выделять, например, в диапазоне рН от около 5.0 до около 8.0 или каком угодно значении между ними. Выбранный примененный рН может изменяться в зависимости от ВПЧ, которую необходимо выделить, например, рН может быть 5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 6.2, 6.4, 6.6, 6.8, 7.0, 7.2, 7.4, 7.6, 7.8, 8.0 или любым рН между ними. Примеры буферов и буферных систем включают, но не ограничиваясь, МЭС, фосфат, цитрат и подобные. Один или более буферов или буферных систем могут быть скомбинированы в ферментный раствор (расщепляющийм раствор); один или более буферов могут присутствовать в концентрации от 0 мМ до около 200 мМ или какой угодно между ними, например, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180 или 190 мМ или какой угодно между ними. В зависимости от пригодности, если требуется, может быть добавлено осмотически активное вещество. Осмотически активное вещество и его концентрация выбирается таким образом, чтобы увеличить осмотическую силу ферментного раствора. Примеры осмотически активных веществ включают манит, сорбитол или другие сахароспирты, полиэтиленгликоль (ПЭГ) различной длины полимера и подобные. Диапазоны концентраций осмотически активного вещества могут варьироваться в зависимости от видов растений, типа используемого осмотически активного вещества и типа выбранной растительной ткани (вида или исходного органа, например, листа или стебля) - обычно варьируется от 0 М до около 0.8 М, например, 0.05, 0.1, 0.15, 0.2, 0.25, 0.3, 0.35, 0.4, 0.5, 0.6, 0.7 или 0.75 М или какое угодно значение между ними, например, 0, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600 нМ маннита или какое угодно значение между ними. Концентрация осмотически активного вещества может быть также выражена в процентах (масс./об.). Для некоторых растений или растительных тканей может быть полезным применять слегка гипертонический состав, который может облегчать отделение цитоплазматической мембраны растительной клетки от оболочки клетки. Осмотическое активное вещество также может отсутствовать в ходе расщепления.
Другим параметром, необходимым для регулирования расщепления растения, является температура. Температуру можно контролировать, если требуется, в ходе процесса расщепления. Продходящий диапазон температуры должен быть между 4°С и 40°С или любой температурой между ними, например, от около 4°С до около 15°С или какой угодно между ними, или от около 4°С до около 22°С, или любой температурой между ними. В зависимости от выбранной температуры другие экспериментальные параметры расщепления могут быть установлены таким образом, чтобы сохранить оптимальные условия экстракции.
Катионы, соли или те и другие могут быть добавлены для улучшения стабильности цитоплазматической мембраны, например, дивалентные катионы, такие как Са2+ или Mg2+ при 0.5-50 мМ или каком угодно значении между ними, соли, например, СаСl2, NaCl, CuSO4, КNO3 и подобные от около 0 до 750 мМ или любое значение между ними, например, 10,20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700 или 750 мМ. Другие добавки также могут быть добавлены, включающие хелатирующий агент, например, но не ограничиваясь, ЭДТА, ЭГТА от 0 до 200 мМ или любом количестве между ними, например, 5, 10, 15, 20, 25, 50, 75,100, 125, 150, 175, 200 мМ или сколько угодно между ними, восстанавливающий агент для предотвращения окисления, такой как, но не ограничиваясь, бисульфит натрия или аскорбиновая кислота при 0.005-0.4% или любом значении между ними, например, 0.01, 0.02, 0.03, 0.04, 0.05, 0.06, 0.07, 0.08, 0.09, 0.1, 0.15, 0.2, 0.25, 0.3, 0.35, 0.4% или любом значении между ними, конкретные ингибиторы ферментов (смотри ниже), и, если требуется, ингибитор листового старения, например, циклогексимид, кинетин или один или более полиаминов.
Расщепляющий раствор может также включать один или более из маннита от около 0 до около 600 мМ, NaCl от около 0 до около 500 мМ, ЭДТА от около 0 до около 50 мМ, целлюлозы от около 1% до около 2% об./об., пектиназы от около 0 до около 1% об./об., метабисульфита натрия от около 0.03 до около 0.04%, цитрата от около 0 до 125 мМ или NaPO4 от около 0 до 75 мМ.
Растительный материал может быть обработан для увеличения проникновения ферментов или ферментной композиции в оболочку растительной клетки. Например, эпидермис листа может быть удален или «снят» до обработки ферментной композицией. Растительный материал может быть порезан на маленькие кусочки (вручную или с помощью измельчающего или режущего прибора, такого как нож Urschel); разрезанный растительный материал может быть далее инфильтрован с ферментной композицией при частичном вакууме (Nishimura and Beevers 1978, Plant Physiol 62:40-43; Newell et al., 1998, J. Exp Botany 49:817-827). Также может быть применено механическое воздействие на растительные ткани (Giridhar et al., 1989. Protoplasma 151:151-157) до или в ходе обработки ферментной композицией. Более того, культивированные растительные клетки, либо жидкие, либо твердые культуры, могут быть использованы для приготовления протопластов или сферопластов.
Может требоваться применение ферментной композиции, в которой отсутствуют или в которой инактивированы липазы или протеазы. В некоторых воплощениях один или более ингибиторов протеазы или липазы могут быть включены в ферментную композицию. Примеры ингибиторов липазы включают RHC80267 (SigmaAldrich); примеры ингибиторов протеазы включают Е-64, Nа2ЭДТА, Пепстатин, апротинин, ПМФС, Пефаблок, Лейпептин, бестатин и подобные.
Может использоваться любой подходящий способ смешивания или взбалтывания растительного материала в ферментной композиции. Например, растительный материал можно немного покрутить или потрясти в ванночке или лотке или с помощью роторного встряхивателя, обработать в роторном или вибрационном барабане. Необходимо принять меры предосторожности для того, чтобы минимизировать повреждение протопласта (и/или сферопласта) до того, как они будут удалены из расщепляющего бульона. В соответствии с этим необходимо выбирать сосуд для расщепления.
В качестве неограничивающего примера может быть использована ферментная композиция, включающаясодержащая 1.5% целлюлазы (Onozuka R-10) и 0.375% MACEROZYME™ в 500 мМ маннита, 10 м CaCl2 и 5 мМ МЭС (рН 5.6), для производства протопласта (или сферопласта) из некоторых тканей Nicotiana. Как описывается в настоящей заявке, концентрация маннита может также варьироваться от около 0 до около 500 мМ или как угодно между ними. Квалифицированный специалист в данной области техники, снабженный информацией, описанной в данной заявке, будет способен определить подходящую ферментную композицию для возраста и штамма Nicotiana sp, или для другого вида, использованного для получения ВПЧ.
Вследствие разрушения оболочки клетки или частичного расщепления оболочки клетки образуются фракция протопласта (включающая протопласты и/или сферопласты) и «фракция апопласта». В качестве альтернативы может быть получена «расщепленная фракция». Как указано ниже, целостность фракции протопласта может не потребоваться для получения высоких выходов белка, как описано в настоящей заявке, вследствие чего фракция апопласта или расщепленная фракция может быть использована для экстракции белков, например, но не ограничиваясь, ВПЧ, белков оболочки вируса, структурных белков вируса, вирусных капсидных белков, белков вирусной оболочки.
Под «фракцией апопласта» понимается фракция, которая получена после ферментного расщепления или частичного ферментного расщепления с использованием разрушающих оболочку клетки растительного материала ферментов в присутствии осмотически активного вещества и/или других ингредиентов, которые могут быть использованы для содействия в сохранении целостности протопласта. Фракция апопласта может включать некоторые компоненты, вытекающие из разрушенных протопластов (или сферопластов). Например, фракция апопласта может включать от около 0 до около 50% (об./об.) или сколько угодно между ними компонентов из фракции протопласта, или 0, 0.1, 0.5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50% (об./об.) или сколько угодно между ними компонентов из фракции протопласта.
Под «расщепленной фракцией» понимается фракция, которая остается после ферментного расщепления или частичного ферментного расщепления с применением расщепляющих оболочку клетки растительного материала ферментов, однако целостности протопласта не требуется, и расщепленная фракция может включать интактные, разрушенные или как интактные, так и разрушенные протопласты. Композиция, включающая разрушающие оболочку клетки ферменты, используемые для получения расщепленной фракции, может включать осмотически активное вещество, или осмотически активное вещество может присутствовать в сниженном количестве по сравнению с количеством, имеющемся при стандартных методиках, используемых для получения протопластов, или осмотически активное вещество может отсутствовать в композиции. Расщепленная фракция включает фракцию апопласта и фракцию протопласта/сферопласта, однако фракция протопласта/сферопласта может быть или не быть интактной. Расщепленная фракция включает внутриклеточные компоненты и внеклеточные компоненты. Внутриклеточные компоненты могут находиться в форме протопластов/сферопластов, если осмотически активное вещество используется для сохранения протопласта/сферопласта интактным. Если осмотически активное вещество не используется в расщепляющем растворе, тогда протопласты/сферопласты могут быть разрушенными и внутриклеточные и внеклеточные компоненты могут смешиваться в расщепленной фракции. Как описано в настоящей заявке, целевые белки или целевые белковые структуры могут быть отделены от компонентов расщепленной фракции с использованием любой подходящей методики. Не желая быть связанными с теорией, стадия расщепления оболочки клетки может разрыхлять полимерные компоненты оболочки клеток и способствовать высвобождению белков или супраструктурных белков, так или иначе удержанных внутри оболочки клетки. Этот протокол также минимизирует загрязнение белков или супрасутруктурных белков внутриклеточными компонентами. Белки или целевые супраструктурные белки могут быть выделены из продукта распада клеток после ферментного разложения с использованием низкоскоростного центрифугирования с последующей фильтрацией, глубинной фильтрацией, седиментацией, осаждением, например, но не ограничиваясь, осаждением сульфатом аммония, или комбинации указанных для того, чтобы получить выделенную фракцию, включающую белки или целевые супраструктурные белки.
Если используется осмотически активное вещество, фракция протопласта/сферопласта или фракция, включающая протопласты, может быть отделена от фракции апопласта с использованием любой подходящей методики, например, но не ограничиваясь, центрифугированием, фильтрацией, глубинной фильтрацией, седиментацией, осаждением или комбинацией указанных для того, чтобы получить выделенную фракцию, включающую белки или целевые супраструктурные белки и/или включающую протопласты/сферопласты, которые включают белки или целевые супраструктурные белки.
Выделенная фракция может быть, например, супернатантом (если центрифугирована, седиментирована или осаждена) или фильтратом (если отфильтрована), и обогащена белками или супраструктурными белками. Выделенная фракция может быть в дальнейшем подвержена обработке для того, чтобы выделить, очистить, сконцентрировать или их комбинации, белки или супрастурктурные белки путем, например, дополнительных стадий центрифугирования, осаждения, хроматографических стадих (например, размерно-эксклюзионной, ионообменной, аффинной хроматографией), тангенциальной поточной фильтрацией или комбинацией указанных. Наличие очищенных белков или супраструктурных белков может быть подтверждено, например, нативным электрофарезом или электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), Вестерн-блоттингом с использованием подходящего антитела обнаружения, капиллярным электрофорезом или любьм другим способом, который будет очевиден специалисту в данной области техники.
Апопласт представляет собой часть растительной клетки вне цитоплазматической мембраны и включает оболочку клетки и межклеточные пространства растения. В то время как является предпочтительным, чтобы во время расщепления и дальнейших процедур сохранялась целостность протопластов (и/или сферопластов), не требуется, чтобы протопласты оставались интактными для того, чтобы обогатить белки или супраструктурные белки.
В ходе синтеза белки или супрастурктурные белки могут выделяться за цитоплазматическую мембрану. Если супраструктурный белок представляет собой ВПЧ, они имеют средний размер от около 20 нм до 1 мкм, или какой угодно между ними. Если супраструктурный белок представляет собой антитело, они имеют молекулярную массу от около 100 кДа до около 1000 кДа или любое значение между ними. Из-за их размера, после того как синтезировались, белки или супраструктурные белки могут оставаться захваченными между цитоплазматической мембраной и оболочкой клетки и могут быть недоступны для выделения или дальнейшего очищения с использованием стандартных механических способов, используемых для получения растительных белков. Для того чтобы увеличить выходы, снизить загрязнение фракции супраструктурного белка клеточными белками, сохранить целостность белков или супраструктурных белков и, где необходимо, ассоциированную липидную оболочку или мембрану, могут быть пригодными способы разрушения оболочки клетки для того, чтобы высвободить белки или супраструктурные белки, которые снижают механическое повреждение протопласта и/или сферопластов, такие как ферментные методы, описанные в настоящей заявке. Однако не требуется, чтобы целостность всех протопластов сохранялась в ходе процедуры.
Супраструктурный белок, например, ВПЧ, образующийся в растении может образовывать комплекс с липидами растительного происхождения. Липиды растительного происхождения могут быть в форме липидного бислоя и могут также включать оболочку, окружающую ВПЧ. Липиды растительного происхождения могут включать липидные компоненты цитоплазматической мембраны растения, в которой образуется ВПЧ, включающие, но не ограничиваясь, фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), гликосфинголипиды, фитостеролы или комбинацию указанных. Липид растительного происхождения может иначе называться «растительным липидом». Примеры фитостеролов известны из уровня техники и включают, например, стигмастерол, ситостерол, 24-метилхолестерол и холестерол (Mongrand et al., 2004, J. Biol Chem 279:36277-86).
Экспрессия полипептида может быть направлена на любое внутриклеточное или внеклеточное пространство, органеллу или ткань растения, как требуется. Для того чтобы локализовать экспрессированный полипептид в конкретном месте, нуклеиновая кислота, кодирующая полипептид, может быть связана с нуклеиновокислотной последовательностью, кодирующей сигнальный пептид или лидерную последовательность. Сигнальный пептид может иначе называться транзитным пептидом, сигнальной последовательностью или лидерной последовательностью. Сигнальные пептиды или пептидные последовательности для направления локализации экспрессированного полипептида к апопласту включают, но не ограничиваясь, исходную (по отношению к белку) сигнальную или лидерную последовательность или гетерологическую сигнальную последовательность, например, но не ограничиваясь, сигнальный пептид амилазы риса (McCormick 1999, Proc Nati Acad Sci USA 96:703-708), сигнальный пептид протеин-дисульфидизомеразы (ПДИ), имеющий аминокислотную последовательность: MAKNVAIFGLLFSLLLLVPSQIFAEE; SEQ ID NO. 10, белок, связанный с патогенезом растения (PRP; Szyperski et al. PNAS 95:2262-2262), например, белок 2, связанный с патогенезом Табака (PRP), сигнальный пептид моноклонального антитела человека (SP или лидерная последовательность) или любой сигнальный пептид, который является нативным по отношению к белку.
В некоторых примерах экспрессированный полипептид может аккумулироваться в конкретном межклеточном или внеклеточном пространстве (таком как апопласт), органелле или ткани, например, когда полипептид экспрессируется и выделяется в отсутствие сигнального пептида или транзитного пептида.
Термин «вирусоподобная частица» (ВПЧ), или «вирусоподобные частицы», или «ВПЧ» относятся к структурам, которые самоорганизуются и включают вирусные поверхностные белки, например, белок ГА гриппа или химерный белок ГА гриппа. ВПЧ и химерные ВПЧ являются обычно морфологически или антигенно подобными вирионам, образовавшимся в инфекции, но не имеют генетической информации, достаточной для реплицирования, и таким образом, являются неинфекционными.
Под «химерным белком» или «химерным полипептидом» понимается белок или полипептид, который включает аминокислотные последовательности из двух или более чем двух источников, например, но не ограничиваясь, двумя или более типами или подтипами гриппа, которые слиты как единый полипептид. Химерный белок или полипептид может включать сигнальный пептид, который является одинаковьм с (то есть нативным) или гетерологичным с остатком полипептида или белка. Химерный белок или химерный полипептид может быть образован как транскрипт из химерной нуклеотидной последовательности и оставаться интактным или, если требуется, химерный белок или химерный полипептид может быть расщеплен после синтеза. Интактный химерный белок или расщепленные части химерного белка могут ассоциировать с образованием мультимерного белка. Химерный белок или химерный полипептид может также включать белок или полипептид, включающий субъединицы, которые связаны посредством дисульфидных мостиков (то есть, мультимерный белок). Например, химерный полипептид, включающий аминокислотные последовательности из двух или более чем двух источников, может процессировать до субъединиц и субъединиц, связанных посредством дисульфидных мостиков с образованием химерного белка или химерного полипептида. Неограничивающим примером химерного белка является химерное моноклональное антитело, например, С2 В8, или химерная ВПЧ, например, но не ограничиваясь, белками и ВПЧ, образовавшими конструкты под номерами 690, 691, 696, 734, 737, 745 или 747 (Таблица 2), как описано в предварительной заявке США 61/220, 161 и РСТ/СА2010/000983 (которые включены в настоящее описание посредством отсылки).
Белок или супраструктурный белок может быть гликопротеином, и способ, как описан в настоящей заявке, включающий экстракцию путем расщепления оболочки клетки, может быть применен к растениям, совместно экспрессирующим гликопротеин и один или более ферментов для модифицирования профиля N-гликолизирования, как описано в WO 2008/151440 (Модифицированное образование гликопротеина в растениях; которая включена в настоящее описание посредством отсылки), для содействия выделению гликопротеинов, несущих модифицированные зрелые N-гликаны. Например, зрелые N-гликаны могут быть свободными от ксилозных и фукозных остатков или содержать сниженное количество фукозилированных, ксилозилированных или как фукозилированных, так и ксилозилированных N-гликанов. В качестве альтернативы может быть получен целевой белок, включающий модицифированную гликолизированную структуру, в которой белок не подвергается фукозилированию, ксилозилированию или и тому и другому, и включает повышенное галатозилирование.
Модифицированный профиль N-гликолизирования может быть получен путем совместной экспрессии в растении, части растения или растительной клетке нуклеотидной последовательности, кодирующей первую нуклеотидную последовательность, кодирующую гибридный белок (GNTl-GalT), включающий домен CTS (то есть, цитоплазматический концевой сегмент, трансмембранный домен, участок «стебель») N-ацетилглюкозаминил трансферазы (GNT1), слитый с каталитическим доменом бета-1,4 галактозилтрансферазы (GalT), причем первая нуклеотидная последовательность функционально связана с первьм регуляторным участком, который является активным в растении, и второй нуклеотидной последовательности для кодирования целевого супраструктурного белка, причем вторая нуклеотидная последовательность функционально связана со вторьм регуляторным участком, который является активным в растении, и совместной экспрессии первой и второй нуклеотидной последовательностей для того, чтобы синтезировать целевой супраструктурный белок, включающий гликаны с модифицированным профилем N-гликозилирования, как описано в WO 2008/151440.
Супраструктурный белок может представлять собой гемагглютинин (ГА) гриппа, и каждая из двух или более чем двух аминокислотных последовательностей, которые образуют полипептид, может быть получена из различных ГА с образованием химерного ГА или химерного ГА гриппа. Химерный ГА может также включать аминокислотную последовательность, включающую гетерологичный сигнальный пептид (химерный пред-белок ГА), который является расщепленным после синтеза. Примеры белков ГА, которые могут быть использованы в изобретении, описанном в настоящей заявке, могут быть найдены в WO 2009/009876; WO 2009/076778; WO 2010/003225 (которые включены в настоящее описание посредством отсылки). Нуклеиновая кислота, кодирующая химерный полипептид, может быть описана как «химерная нуклеиновая кислота» или «химерная нуклеотидная последовательность». Вирусоподобная частица, состоящая из химерного ГА, может быть описана как «химерная ВПЧ». Химерные ВПЧ далее описаны в заявке РСТ №РСТ/СА2010/000983, поданной 25 июня 2010, и предварительной заявке США№61/220,161 (поданной 24 июня 2009; которая включена в настоящее описание посредством отсылки). ВПЧ могут быть получены из экспрессии нативного или химерного ГА.
ГА ВПЧ, полученных в соответствии со способом, обеспеченном настоящим изобретением, включает известные последовательности и вариантные последовательности ГА, которые могут быть разработаны или идентифицированы. Более того, ВПЧ, полученные как описано в настоящей заявке, не включают нейраминидазу (НА) или другие компоненты, например, Ml (белок М), М2, NS и подобные. Однако НА и Ml могут совместно экспрессировать с ГА, если будут требоваться ВПЧ, включающие ГА и НА.
Обычно термин «липид» относится к жирорастворимым (липофильным) встречающимся в природе молекулам. Химерная ВПЧ, полученная в растении в соответствии с некоторыми аспектами изобретения, может быть связана в комплекс с липидами растительного происхождения. Липиды растительного происхождения могут быть в форме липидного бислоя, и могут далее включать оболочку, окружающую ВПЧ. Липиды растительного происхождения могут содержать липидные компоненты цитоплазматической мембраны растения, где образуется ВПЧ, включающие фосфолипиды, три-, ди- и моноглицериды, а также жирорастворимый стерол или метаболиты, включающие стеролы. Примеры включают фосфатадилхолин (ФХ), фосфатидилэтаноламин (ФЭ), фосфатидилиноситол, фосфатидилсерин, гликосфинголипиды, фитостеролы или их комбинацию. Липид растительного происхождения может иначе называться «растительным липидом». Примеры фитостеролов включают кампестерол, стигмастерол, эргостерол, брассикастерол, дельта-7-стигмастерол, дельта-7-авенастерол, дауностерол, ситостерол, 24-метилхолестерол, холестерол или бета-ситостерол (Mongrand et al., 2004, J. Biol Chem 279:36277-86). Как специалист в данной области техники легко будет понимать, липидная композиция цитоплазматической мембраны клетки может изменяться с условиями культивирования и выращивания клетки или организма или видов, из которых получена клетка.
Клеточные мембраны обычно включают липидные бислои, а также белки для разнообразных функций. Локализованные концентрации конкретных липидов могут находиться в липидном бислое, именуемом «липидными рафтами». Эти микродомены липидного рафта могут быть обогащены сфинголипидами и стеролами. Без намерения быть ограниченым с теорией, липидные рафты могут играть значительные роли при эндо- и экзоцитозе, входе или выходе вирусов или других инфекционных агентов, межклеточной сигнальной трансдукции, взаимодействии с другими структурными компонентами клетки или организма, такими как внутриклеточные и внеклеточные матрицы.
ВПЧ, содержащие липидную оболочку, были ранее описаны в WO 2009/009876; WO 2009/076778, и WO 2010/003225 (которые включены в настоящее описание посредством отсылки). По отношению к вирусу гриппа термин «гемагглютинин» или «ГА», как используется в настоящей заявке, относится к структурному гликопротеину частиц вируса гриппа. ГА по настоящему изобретению может быть получен из любого подтипа. Например, ГА может представлять собой подтип H1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, Н11, Н12, Н13, Н14, Н15 или Н16, или типы гриппа В или С.Рекомбинантный ГА по настоящему изобретению может также включать аминокислотную последовательность, основанную на последовательности любого гемагглютинина. Структура гемагглютинина гриппа является хорошо изученной и проявляет высокую степень сохранения во вторичной, третичной и четвертичной структуре. Эта структурная сохранность наблюдается даже, если аминокислотная последовательность может изменяться (смотри, например, Skehel and Wiley, 2000 Ann Rev Biochem 69:531 -69; Vaccaro et al 2005; которая включена в настоящее описание посредством отсылки). Нуклеотидные последовательности, кодирующие ГА, являются хорошо известными и являются доступными, например, из BioDefense and Public Health Database (сейчас Influenza Research Database; Squires et al., 2008 Nucleic Acids Research 36:D497-D503), например, по URL: biohealthbase.org/GSearch/home.do?decorator=Influenza) или из баз данных, поддерживаемых National Center for Biotechnology Information (NCBI; например, по URL: ncbi.nlm.nih.gov/sites/entrez?db=nuccore&cmd=search&term=influenza), обе из которых включены в настоящее описание посредством отсылки.
Настоящее изобретение также относится к способам приготовления, выделения или как приготовления, так и выделения ВПЧ, включающих ВПЧ вирусов гриппа, которые инфицируют людей, или животных-хозяев, например, приматов, лошадей, свиней, птиц, овцу, водоплавающую птицу, перелетных птиц, перепела, утку, гусей, домашних птиц, цыплят, верблюда, псовых, собак, кошачьих, кошек, тигра, леопарда, циветту, норку, каменную куницу, хорьков, домашних животных, домашний скот, мышей, крыс, морского котика, кита и подобных. Некоторые вирусы гриппа могут инфицировать более чем одно животное-хозяина. Может допускаться аминокислотная изменчивость в гемагглютининах вирусов гриппа. Эта изменчивость обеспечивает новые цепи, которые в настоящее время идентифицируются. Инфективность между новьми цепями может варьироваться. Однако сохраняется образование триммеров гемагглютинина, которые последовательно образуют ВПЧ. Настоящее изобретение также включает способы приготовления любых ВПЧ растительного происхождения независимо от подтипа или последовательности ГА или химерного ГА, содержащего ВПЧ, или происхождения видов.
Правильная укладка супраструктурного белка может быть важным для стабильности белка, образования мультимеров, образования и функционирования белка. На фолдинг белка может влиять один или более факторов, включающих, но не ограничиваясь, последовательность белка, относительное содержание белка, степень внутриклеточного роста, доступность кофакторов, которые могут связывать или быть временно ассоциированными с уложенным, частично уложенным или неуложенным белком, наличие одного или более белков-шаперонов или подобных.
Белки теплового шока (Hsp) или белки стрессов являются примерами белков-шаперонов, которые могут участвовать в различных клеточных процессах, включающих синтез белка, внутриклеточную миграцию, предотвращение неправильного сворачивания, предотвращение агрегации белков, ассоциирование и распад белковых комплексов, укладку белка и дезагрегацию белка. Примеры таких белков-шаперонов включают, но не ограничиваясь, Hsp60, Hsp65, Hsp 70, Hsp90, Hsp100, Hsp20-30, Hsp10, Hsp100-200, Hsp100, Hsp90, Lon, TF55, FKH.O.s, циклофилины, CIpP, GrpE, убиквитин, калнексин и протеиндисульфидизомеразы (смотри, например, Macario, A.J.L., Cold Spring Harbor Laboratory Res. 25:59-70.1995; Parsell, D.A. & Lindquist, S. Ann. Rev. Genet. 27:437-496 (1993);
U.S. Patent No. 5,232,833). Белки-шапероны, например, но не ограничиваясь, Hsp40 и Hsp70 могут использоваться для того, чтобы гарантировать укладку химерного ГА (Заявка РСТ №РСТ/СА2010/000983, поданная 25 июня 2010, и Предварительная заявка США №61 /220,161, поданная 24 июня 2009; WO 2009/009876 и WO 2009/076778, все из которых включены в настоящее описание посредством отсылки). Протеиндисульфидизомераза (PDI; №доступа Z11499) также может использоваться.
Сразу после выделения белки или супраструктурные белки могут быть оценены по структуре, размеру потенции или активности с помощью, например, но не ограничиваясь, электронной микроскопии, светорассеяния, размерно-эксклюзионной хроматографии, ВЭЖХ, Вестерн-блоттинга, электрофореза, ELISA, анализов, основанных на активности, например, анализа гемагглютинации или любых других подходящих анализов. Эти и другие способы для оценки размера, концентрации, активности и состава ВПЧ известны из уровня техники.
Для препаративной эксклюзионной хроматографии, состав, содержащий белки или супраструктурные белки, может быть получен с помощью методов, описанных в настоящей заявке, причем нерастворимый материал удаляется с помощью центрифугирования. Осаждение с ПЭГ или сульфатом аммония также может быть пригодным. Выделенный белок может быть количественно определен с использованием стандартных способов (например, метод Бредфорд, с использованием бицинхониновой кислоты (ВСА)), и экстракта, прошедшего через размерно-эксклюзионную колонку с использованием, например, SEPHACRYL™, SEPHADEX™ или подобной среды, хроматографией с использованием ионообменной колонки или хроматографией с использованием аффинной колонки, и собранных активных фракций. Белковые комплексы могут быть также получены с использованием основанного на сродстве магнитного разделения, например, с Dynabeads™ (Invitrogen), и выделения белкового комплекса из Dynabeads™. Комбинация хроматографического метода и метода разделения также может быть использована. После хроматографии или разделения, фракции могут быть в дальнейшем проанализированы с помощью белкового электрофореза, иммуноблота, ELISA, анализов, основанных на активности, как требуется, для того, чтобы подтвердить наличие супраструктурного белка.
Если супраструктурный белок представляет собой ВПЧ, тогда анализ гемагглютинации может быть использован для оценки гемагглютинирующей активности ВПЧ-содержащих фракций с использованием методов, хорошо известных в данной области техники. Без намерения быть ограниченым с теорией, способность ГА связываться с RBC («красными кровяными тельцами») из различных животных вытекает из сродства ГА к сиаловым кислотам а2,3 или а2,3 и присутствия этих сиаловых кислот на поверхности RBC. Лошадиный и птичий ГА из вирусов гриппа агглютинируют эритроциты из нескольких видов, включающих индеек, цыплят, уток, морских свинок, людей, овец, лошадей и коров; тогда как ГА человека будут связываться с эритроцитами индейки, цыплят, уток, морских свинок, людей и овцы (Ito Т. et al., 1997, Virology, 227:493-499; Medeiros R et al., 2001. Virology 289:74-85).
Анализ подавления гемагглютинации (Ш или HAI) может быть также использован для того, чтобы продемонстрировать эффективность антител, вызванных вакциной или вакцинной композицией, включающей химерный ГА или химерную ВПЧ, которая может ингибировать агглютинацию красных кровяных телец (RBC) с помощью рекомбинантного ГА. Титры ингибирующего гемагглютинацию антитела, из образцов сыворотки, могут быть оценены с помощью микротитра HAI (Aymard et al., 1973). Эритроциты из любых нескольких видов могут быть использованы-например, лошади, индейки, цыпленка или подобных. Этот анализ дает непрямую информацию об образовании тримера ГА на поверхности ВПЧ, подтверждающую правильное представление антигенных сайтов на ГА.
Титры перекрестной реактивности HAI также могут быть использованы для того, чтобы продемонстрировать эффективность иммунного ответа к другим штаммам вируса, относящегося к подтипу вакцины. Например, сыворотка из субъекта, иммунизированного вакцинной композицией, содержащей химерный гемагглютинин, содержащий HDC первого типа или подтипа гриппа, может быть использована в анализе HAI со вторьм штаммом целого вируса или вирусных частиц, и определяться титр HAI.
ВПЧ гриппа, приготовленные с помощью способов по настоящему изобретению, могут быть использованы в сочетании с существующими противогриппозными вакцинами для того, чтобы дополнять вакцину, делая ее более эффективной, или для того, чтобы снижать необходимые вводимые дозировки. Как будет известно специалисту в данной области техники, вакцина может быть направлена против одного или более чем одного вируса гриппа. Примеры подходящих вакцин включают, но не ограничиваясь, коммерчески доступные от Sanofi-Pasteur, ID Biomedical, Merial, Sinovac, Chiron, Roche, Medlmmune, GlaxoSmithKline, Novartis, Sanofi-Aventis, Serono, Shire Pharmaceuticals и подобные. Если требуется, ВПЧ по настоящему изобретению могут быть смешаны с подходящими адъювантами, как будет известно специалисту в данной области техники. Более того ВПЧ, полученная в соответствии с настоящем изобретением, может быть совместно экспрессирована с другими белковыми компонентами или воспроизведена с другими ВПЧ или белковыми компонентами гриппа, например, нейраминидазой (НА), Ml и М2. Она также может быть совместно экспрессирована или воспроизведена с другой ВПЧ, образованной из вакцинных белков, таких как антигенов малярии, антигенов ВИЧ, антигенов респираторно-синцитиального вируса (РСВ) и подобных.
Способы трансформации и регенерации трансгенных растений, растительных клеток, растительного материала или семян, включающих белки или супраструктурные белки, существуют в данной области техники и известны специалисту в данной области техники. Способ получения трансформированных и регенерированных растений не является существенным для настоящего изобретения.
Под «трансформацией» понимается межвидовой перенос генетической информации (нуклеотидной последовательности), который проявляется генотипически, фенотипически или и так, и так. Межвидовой перенос генетической информации из химерного конструкта к хозяину может быть наследственным (то есть, интегрированным в геном хозяина), и перенос генетической информации считается стабильным, или перенос может быть транзиторным, и перенос генетической информации не является ненаследственным.
Под термином «растительный материал» понимается любой материал, имеющий происхождение из растения. Растительный материал может включать целое растение, ткань, клетки или любую часть указанных. Также растительный материал может включать внутриклеточные растительные компоненты, внеклеточные растительные компоненты, жидкие или твердые экстракты растений или комбинацию указанных. Также растительный материал может включать растения, растительные клетки, ткань, жидкий экстракт или комбинацию указанных из листьев, стеблей, плода, корней растений или их комбинации. Растительный материал может включать растение или его часть, которая не была подвержена каким-либо технологическим операциям. Часть растения может включать растительный материал. Растения или растительный материал могут быть собраны или получены любым способом, например, может быть использовано целое растение, или листья, или другие ткани, специально удаленные для использования в описанных способах. Трансгенные растения, экспрессирующие и секретирующие ВПЧ, могут также быть использованы в качестве исходного материала для обработки, как описано в настоящей заявке.
Конструкты по настоящему изобретению могут быть введены в растительные клетки с применением Ti-плазмид, Ri-плазмид, векторов вируса растения, прямой трансформации ДНК, микро-инъекции, электропорации, инфильтрации и подобного. Для обзоров таких методик смотри, например, Weissbach and Weissbach, Methods/or Plant Molecular Biology, Academy Press, New York VIII, pp.421 -463 (1988); Geierson and Corey, Plant Molecular Biology, 2d Ed. (1988); and Miki and lyer. Fundamentals of Gene Transfer in Plants. In Plant Metabolism, 2d Ed. DT. Dennis, DH Turpin, DD Lefebrve, DB Layzell (eds), Addison-Wesley, Langmans Ltd. London, pp.561 -579 (1997). Другие способы включают прямое поглощение ДНК, применение липосом, электропорацию, например, с использованием протопластов, микро-инъекцию, бомбардировку микрочастицами или усами и вакуумную инфильтрацию. Смотри, например, Bilang, et al. (Gene 100: 247-250 (1991), Scheid et al. (Mol. Gen. Genet. 228: 104-112, 1991), Guerche et al. (Plant Science 52: 111-116,1987), Neuhause et al. (Theor. Appi Genet. 75: 30-36, 1987), Klein et al., Nature 327:70-73 (1987); Howell et al. (Science 208:1265,1980), Horsch et al. (Science 227:1229-1231,1985), DeBlocketal, Plant Physiology91:694-701,1989), Methods for Plant Molecular Biology (Weissbach and Weissbach, eds., Academic Press Inc., 1988), Methods in Plant Molecular Biology (Schuler and Zielinski, eds., Academic Press Inc., 1989), Liu and Lomonossoff (J. Virol Meth, 105:343-348, 2002), Патенты США №4,945,050; 5,036.006; 5,100,792; 6,403,865; 5,625,136 (все из которых включены в настоящее описание посредством отсылки).
Способы транзиторной экспрессии могут быть использованы для того, чтобы экспрессировать конструкты по настоящему изобретению (смотри Liu and Lomonossoff, 2002, Journal of Virological Methods, 105:343-348; которая включена в настоящее описание посредством отсылки). В качестве альтернативы может быть использован способ вакуумной транзиторной экспрессии, такой как описан в Публикациях РСТ WO 00/063400, WO 00/037663 (включенных в настоящее описание посредство ссылки). Эти способы могут включать, например, но не ограничиваясь, способ Агро-инокуляции или Агро-инфильтрации, однако другие транзиторные способы также могут быть использованы, как указано выше. При Агро-инокуляции или Агро-инфильтрации смесь Agrobacteria, включающая требуемую нуклеиновую кислоту, внедряется в межклеточные пространства ткани, например, листьев, надземной части растения (включающую стебель, листья и соцветие), другой части растения (стебля, корня, соцветия) или целого растения. После прохождения эпидермиса Agrobacterium инфицируют и переносят копии т-ДНК в клетки. Т-ДНК эписомально транскрибируется, а мРНК транслируется, приводя к образованию целевого белка в инфицированных клетках, однако перемещение т-ДНК внутрь ядра является транзиторным.
Последовательности, описанные в настоящей заявке, обобщены ниже.
TGAAGATCGCTCACGCAAGAAAGACAAGAGA
Настоящее изобретение будет далее проиллюстрировано в последующих примерах. Однако необходимо понимать, что эти примеры представлены только для иллюстративных целей и не должны быть использованы для ограничения объема настоящего изобретения в любом виде.
Сборка экспрессионных кассет
Конструкты, которые могут быть использованы для образования ВПЧ, описаны в Предварительной заявке США №US 6 1 /220,161 и РСТ/СА2010/000983 (которые включены в настоящее описание посредством отсылки), WO 2009/009876, WO 2009/076778 и WO 2010/003225 (все из которых включены в настоящее описание посредством отсылки). Конструкты могут также включать те, которые перечислены в Таблице 2. Сборка этих конструктов описанав WO 2009/009876, WO 2009/076778, W02010/003225 и US 61/220,161. Однако другие конструкты, содержащие известные ГА, включающие, но не ограничиваясь, те, указанные в Таблице 2 и объединенные со сходными или различными регулирующими элементами или промоторами, также могут быть использованы для образования ВПЧ, как описано в настоящей заявке.
Экспрессионные кассеты CPMV-ЯГ включали промотор 35S для того, чтобы контролировать экспрессию мРНК, включающую целевую кодирующую последовательность, фланкированную по 5' нуклеотидами 1-512 из вируса мозаики Коровьего гороха (CPMV) RNA2 с мутированным АТГ в позициях 115 и 161, и по 3' нуклеотидами 3330-3481 из CPMV RNA2 (соответствующему нетранслируемой области 3') с последующим терминатором NOS. Плазмид pBD-C5-l LC (Sainsbury et al. 2008; Plant Biotechnology Journal 6:82-92 и Публикация РСТ WO 2007/135480) использовался для сборки основанных на CPMV-ЯТ гемагглютининовых экспрессионных кассетах. Мутация АТГ в позиции 115 и 161 CPMV RNA2 была произведена с использованием основанного на ПНР способа лигирования, представленного в Darveau et al. (Methods in Neuroscience 26: 77-85 (1995)). Были проведены две отдельные ПЦР с использованием pBD-C5-l LCa качестве матрицы. Праймеры для первой амплификации представляли собой pBinPlus.2613c (SEQ ID NO: 3) и Mut-ATGl 15.r (SEQ ID NO: 4). Праймеры для второй амплификации представляли собой Mut-ATGl 61.с (SEQ ID NO: 5) и LC-C5-1.11 Or (SEQ ID NO: 6). Два фрагмента затем смешивали и использовали в качестве матрицы для третьей амплификации с использованием pBinPlus.2613c (SEQ ID NO: 3) и LC-C5- 1.11 Or (SEQ ID NO: 6) в качестве праймеров. Конечный фрагмент был расщеплен с Расl и Apal и клонирован в pBD-C5-l LC, расщепленный с тем же самьм ферментом. Полученная экспрессионная кассета была названа 828.
Сборка Н5 A/Indonesia/5/2005 в экспрессионной кассете CPMV-ЯГ (конструкт номер 685).
Сборка этой кассеты описана в WO 2009/009876, WO 2009/076778 и WO 2010/003 325, которые включены в настоящее описание посредством отсылки.
Кратко, кодирующая последовательность Н5 из A/Indonesia/5/2005 была клонирована в CPMV-ЯГ следующим образом: рестрикционные сайты Apal (непосредственно против хода начального АТГ) и StuI (непосредственно по ходу терминирующего кодона) были добавлены к кодирующей гемагглютинин последовательности путем проведения ПЦР-амплификации с праймерами ApaI-H5 (A-Indo).lc (SEQ ID NO: 7) и Н5 (A-Indo)-StuI.1707r (SEQ ID NO: 8) с использованием конструкта номер 660 (D'Aoust et al., Plant Biotechnology Journal 6:930-940 (2008)) в качестве матрицы. Конструкт 660 включает промотор пластоцианина люцерны и 5нетранслируемую область (UTR), кодирующую гемагглютинин последовательность Н5 из A/Indonesia/5/2005 (Конструкт №660), 3' нетранслируемую область пластоцианина люцерны и терминирующие последовательности (SEQ ID NO: 9; Фиг.5). Конечный фрагмент был расщеплен рестрикционными ферментами Apal и StuI и клонирован в конструкт номер 828, ранее расщепленный теми же ферментами. Конечная кассета была названа конструктом номер 685 (Фиг.1,2).
Супрессоры сайленсинга.
Посттранскрипционный сайленсинг гена (PTGS) может быть применен для ограничения экспрессии трансгенов в растениях и совместной экспрессии супрессора сайленсинга из картофельного вируса Y (НсРго), может быть использован для предотвращения специфичной деградации трансгенных мРНК (Brigneti et al., 1998). Варианты супрессоров сайленсинга широко известны в уровне техники и могут быть использованы, как описано здесь (Chiba et al., 2006, Virology 346:7-14; которая включена в настоящее описание посредством отсылки), например, но не ограничиваясь, TEV-pl/HC-Pro (вирус гравировки табака pl/HC-Pro), BYV -р21, р19 вируса кустистой карликовое™ томата (TBSV р19), капсидный белок вируса морщинистости томата (TCV -СР), 2b вируса мозаики огурца (CMV-2b), р25 вируса Х картофеля (PVX-p25), pi 1 вируса М картофеля (PVM-pl I), pi 1 вируса S картофеля (PVS-pll), pl6 вируса ожога черники (BScV -pl6), p23 вируса тристеца цитрусовых CTV-p23), p24 вируса-2 скручивания листьев виноградной лозы (GLRaV-2 p24), р10 вируса А виноградной лозы (GVA-pIO), pl4 вируса В виноградной лозы (GVB-pl4), p10 лантентного вируса борщевика (HLV-pl 0) или pi 6 общего латентного вируса чеснока (GCLV-р16). Таким образом, супрессор сайленсинга, например, но не ограничиваясь, HcPro, TEV -pl/HC-Pro, BYV-p21, TBSV pl9, TCV-CP, CMV-2b, PVX-p25, PVM-pl 1, PVS-pl 1, BScV-pl6, CTV-p23, GLRaV-2 p24, GBV-pl4, HLV-pIO, GCLV-pl6 или GVA-p 10 может быть совместно экспрессирован вместе с нуклеотидной последовательностью, кодирующей целевой белок для того, чтобы в дальнейшем обеспечить высокие уровни образования белка в растении.
Образование pl9 описано в WO 2010/0003225 (которая включена в настоящее описание посредством отсылки). Кратко, кодирующая последовательность pl9 белка вируса кустистой карликовое™ томата (TBSV) была связана с экспрессионной кассетой пластоцианина люцерны с помощью основанного на ПЦР способа лигирования, представленного в Darveau et al. (Methods in Neuroscience 26: 77-85(1995)). В первом цикле ПЦР, сегмент промотора пластоцианина был амплифицирован с использованием праймеров Plasto-443c:
GTATTAGTAATTAGAATTTGGTGTC (SEQ ID NO:11)
и supP19-plasto.r
CCTTGTATAGCTCGTTCCATTTTCTCTCAAGATG (SEQ ID NO:12)
с конструктом 660 (описанным в WO 2010/0003225, которая включена в настоящее описание посредством отсылки) в качестве матрицы. Параллельно другой фрагмент, содержащий кодирующую последовательность pl9, был амплифицирован с праймерами supP19-1c
ATGGAACGAGCTATACAAGG (SEQ ID NO:13)
и SupP19-SacI.r
AGTCGAGCTCTTACTCGCTTTCTTTTTCGAAG (SEQ ID NO:14)
с использованием конструкта 35S:p19, как описано в Voinnet et al. (The Plant Journal 33: 949-956 (2003)), в качестве матрицы. Продукты амплификации затем были смешаны и использованы в качестве матрицы для второго цикла амплификации (реакции сборки) с праймерами Plasto-443c и SupP19-SacI.r. Конечный фрагмент был расщеплен BamHI (в промоторе пластоцианина) и Sad (на конце кодирующей последовательности pl9) и клонирован в конструкт номер 660, ранее расщепленный теми же рестрикционными ферментами, с получением конструкта номер R472. Плазмиды были использованы для того, чтобы трансформировать Agrobacteium tumefaciens (AGL1; АТСС, Manassas, VA 20108, USA) путем электропорации (Mattanovich et al., 1989). Целостность всех штаммов A. Tumefaciens была подтверждена с помощью рестрикционного картирования. Штамм A. Tumefaciens, включающий R472 (Фигура 11В), называется «AGL1/R472».
Конструкт НсРrо (35НсРrо) был получен, как описано в Hamilton et al. (2002). Все клоны были секвенированы для того, чтобы подтвердить целостность конструктов. Плазмиды использовались для того, чтобы трансформировать Agrobacteium tumefaciens (AGL 1; АТСС, Manassas, VA 20108, USA) путем электропорации (Mattanovich et al., 1989). Целостность всех штаммов A. tumefaciens была подтверждена с помощью рестрикционного картирования.
Приготовление растительной биомассы, инокулята, агроинфильтрация и сбор урожая.
Растения Nicotiana benthamiana бьши выращены из зерен в лотках, заполненных коммерчески доступным субстратом из торфяного мха. Растениям давали вырасти в теплице при световом периоде 16/8 и температурном режиме 25°С днем/20°С ночью. Три недели спустя после посева семян индивидуальные ростки были отобраны, пересажены в горшки и оставлены для роста в теплице еще на три дополнительные недели при тех же самых условиях окружающей среды. По истечении шести недель растения имели среднюю массу 80 г и были 30 см в высоту.
Штамм Agrobacterium AGL1 был трансфицирован (электропорацией) с конструктами, как определено ниже, с использованием способов, описанных в D'Aoust et al 2008 (Plant Biotechnology Journal 6:930-940). Тряасфтщароъанные Agrobacterium бьши выращены в среде YEB с добавлением 10 мМ 2-(М-морфолино)этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина рН 5.6 до ООбооот 0.6 до 1.6. Суспензии Agrobacterium центрифугировали перед применением и ресуспендировали в инфильтрационной среде (10 мМ MgCl и 10 мМ MES рН 5.6).
Растения были агроинфильтрованы, как описано в D'Aoust et al (supra). Кратко, для вакуумной инфильтрации, суспензии A tumefaciens центрифугировали, ресуспендировали в инфильтрационной среде и хранили в течение ночи при 4°С. В день инфильтрации культуры клеток, выращенные в замкнутом объеме, бьши разбавлены в 2.5 объемах культуры и подвергнуты нагреванию перед использованием. Целые растения N. benthamiana бьши помещены в перевернутом положении в бактериальную суспензию в воздухонепроницаемый нержавеющий стальной контейнер под вакуум 20-40 Торр на 2 мин. Если не указано иначе, все инфильтрации были проведены как совместные инфильтрации с бактериальным трансформированным R472 (штамм AGL1/R472) в соотношении 1:1. После вакуумной инфильтрации растения были возвращены в теплицу для 4-6-дневного инкубационного периода до сбора урожая.
Взятие образца листа и полная экстракция белка (механическая гомогенизация)
После инкубирования в течение 4, 5, 6, 7 и 8 дней надземные части растения были собраны и немедленно использованы. Все растворимые белки были экстрагированы с помощью гомогенизации растительной ткани в 3 объемах холодного 50 мМ Трис рН 8.0,0.15 M Nad, содержащего 1% Тритона Х-100 и 0.004% метабисульфита натрия. Растительная ткань была механически гомогенизирована с использованием POLYTRON™, измельчена с помощью ступки и пестика или с COMITROL™ в 1 объеме холодного 50 мМ Трис рН 8,0.15 M NaCl. Буфер, использованный с COMITROL™, также содержал 0.04% метабисульфита натрия. После гомогенизации жидкая масса основного растительного материала была центрифугирована при 5000 g в течение 5 мин при 4°С, и сырые экстракты (супернатант) сохранялись для анализа. Общее содержание белка в осветленном сыром экстракте было определено путем анализа Брэдфорда (Bio-Rad, Hercules, CA) с использованием альбумина бычьей сыворотки в качестве стандарта.
Экстракция ВПЧ и расщепление оболочки клетки
Листовая ткань из растений Nicotiana benthamiana была собрана и разрезана на кусочки в ~1 см2. Кусочки листа были выдержаны в 500 мМ маннита в течение 30 мин при комнатной температуре (КТ). Раствор маннита затем был удален и заменен на ферментную смесь (смесь целлюлаз из Trichoderma viride (Onozuka R-10; 3% об./об.) и смесь пектиназ из Rhizopus sp.(MACEROZYME™; 0.75% об./об.; обе от Yakult Pharmaceuticals) в растворе протопласта (500 мМ маннита, 10 мМ CaCl2 и 5 мМ МЭС/КОН (рН 5.6)). Используемое соотношение составило 20 г кусочков листа на 100 мл раствора. Этот состав был равномерно распределен по неглубокому сосуду (~ 11 х 18 см) и выдержан в течение 16 ч на роторном встряхивателе при 40 об/мин и 26°С.
В качестве альтернативы экстракция ВПЧ могла быть проведена следующим образом:
растения были агроинфильтрованы с AGL1/#685, как описано в примере 1. Была собрана ткань листа из растений N. benthamiana на 6-й день после инфильтрации и порезана на кусочки в ~1 см2. Multifect Pectinase FE, Multifect CX CG и Multifect CX В (Genencor) были добавлены по 1.0% (об./об.) каждой в 600 мМ маннита, 75 мМ цитрата, 0.04% бисульфита натрия рН буфера 6.0 с использованием соотношения 1:2.5 (вес./об.) свежая биомасса; буфер для расщепления. Биомасса была расщеплена в течение 15 ч при комнатной температуре в орбитальном встряхивателе.
После инкубирования остатки билета были удалены с помощью фильтрации (нейлоновый фильтр 250 или 400 мкм меш). Протопласты в суспензии были собраны с помощью центрифугирования при 200xg (15 мин) с последующим центрифугированием супернатанта при 5000xg (15 мин) для того, чтобы в дальнейшем осветлить супернатант. В качестве альтернативы может быть применена единственная стадия центрифугирования при 5000xg в течение 15 мин. Затем центрифугировали 70 мл супернатанта при 70000xg в течение 30 мин. Конечный пеллет был ресуспендирован в 1.7 мл ФСБ и незамедлительно проанализирован или заморожен.
Анализ белка
Анализ гемагглютинации Н5 был основан на способе, описанном в Nayak and Reichi (2004). Кратко, последовательные двойные разбавления тестируемых образцов (100 мкл) были проведены в 96-луночных микротитрационных планшетах с V-образными лунками, содержащими 100 мкл ФСБ, оставляя 100 мкл разбавленного образца на лунку. Сто микролитров 0.25% ярко-красной суспензии кровяных телец (Bio Link Inc., Syracuse, NY) было добавлено к каждой лунке, и планшеты инкубировали в течение 2 ч при комнатной температуре. Обратная величина наибольшему разбавлению, показавшему полную гемагглютинацию, была записана как гемагглютинирующая активность. Параллельно с этим стандарт рекомбинантного НА5 (A/Vietnam/1203/2004 H5N1) (Protein Science Corporation, Meriden, CT) был разбавлен в ФСБ и выступал в качестве контроля на каждом планшете.
ELISA
Стандарт НА5 был приготовлен с очищенными вирусоподобными частицами, которые были разрушены при обработке 1% Тритона Х-100 с последующим механическим перемешиванием в Tissue Lyser™ (Qiagen) в течение 1 мин. 96-луночные микротитрационные планшеты с U-образными лунками были покрыты 10 мкг/мл захватывающего антитела (Immune Technology Corporation, #IT-003-005I) в 50 мМ карбонатно-бикарбонатного покрывающего буфера (рН 9.6) в течение 16-18 ч при 4°С. Все промывания проводили с помощью 0.01 М ФСБ (фосфатно-солевого буфера), рН 7.4, содержащего 0.1% Твин-20. После инкубирования планшеты были трижды промыты и заблокированы с помощью 1% казеина в ФСБ в течение 1 ч при 37°С. После стадии блокирования планшеты были трижды промыты. Стандарт НА5 был разбавлен в контрольном экстракте (приготовленном из ткани листа, инфильтрованной только с AGL1/R472) для того, чтобы получить стандартную кривую от 500 до 50 нг/мл. Образцы для количественной оценки были обработаны в 1% Тритона X-100 перед загрузкой в микропланшет. Планшеты затем был инкубированы в течение 1 ч при 37°С.После промывания было добавлено поликлональное антитело овцы, индуцированное против НА5 (CBER/FDA), разбавленное 1:1000, и планшеты выдерживали в течение 1 ч при 37°С. После промывания было добавлено анти-овечье антитело кролика, конъюгированное с пероксидазой хрена, разбавленное 1:1000, и планшеты выдерживали в течение 1 ч при 37°С. После последних промываний, планшеты инкубировали с субстратом пероксидазы (KPL) SureBlue TMB в течение 20 мин при комнатной температуре. Реакция была остановлена путем добавления 1н. НС1, и были измерены значения A^so с использованием планшет - ридера Multiskan Ascent (Thermo Scientific).
Пример 1: Ферментная экстракция растительной ткани больших количеств ГА, имеющего повышенную относительную активность.
Количество и относительная активность ГА, полученного по данному способу ферментной экстракции, сравнивали с количеством и относительной активностью ГА, полученного при общих способах механической экстракции. Растения N. Benthamiana были инфильтрованы с AGL1/685, и после 5-6-дневного периода инкубации были собраны листья. Листовые гомогенаты были приготовлены следующим образом: Два грамма листьев были гомогенизированы в гомогенизаторе Polytron; 4 г листьев были перетерты пестиком в ступке; и 25 кг листьев были гомогенизированы в приборе COMITROLTM (Urschel Laboratories) в экстракционном буфере (50 мМ Трис, 150 мМ NaCl рН 8.0, соотношение 1:1 мас./об.). Ферментная экстракция проводилась следующим образом: 20 г собранных листьев были подвергнуты расщеплению с пектиназами Macerozyme и целлюлазами Onozuka R-10, как описано выше. После расщепления остатки листа были удалены фильтрованием (нейлоновый фильтр, 250 мкм меш). Протопласты из суспензии были удалены с помощью центрифугирования при 200xg (15 мин), и супернатант затем осветлен при центрифугировании при 5000xg (15 мин).
Относительная активность и количество ГА в каждом из этих растительных экстрактов показана в Таблице 3. Количество ГА, высвободившегося при ферментном расщеплении оболочки клетки, является значительно превосходящим по сравнению с другими использованными методиками.
* Количество оценивали с помощью анализа ELISA
Для основанных на активности и ELISA сравнений, данные были нормализованы в соответствии с относительным объемом жидкого экстракта свежей биомассы. Белок, полученный при использовании экстракции Comitrol, был принят за 100%, а остальные способы сравнивались с этим значением.
Пример 2: Ферментное расщепление растительной ткани высвобождает ГА, организованный в ВПЧ.
Комбинирование дифференциального центрифугирования и эксклюзионной хроматографии (SEC) было использовано для того, чтобы продемонстрировать, что ГА, полученный способом ферментной экстракции, описанным в данной заявке, организуется как ВПЧ. Растения N. Benthamiana были агроинфильтрованы с AGL 1/685, как описано в Примере 1. На 6-й день после инфильтрации были собраны листья из растений и разрезаны на кусочки ~1 см2, затем расщеплены, грубо отфильтрованы и центрифугированы, как описано в Примере 1.
Осветленные образцы были затем центрифугированы при 70000xg для того, чтобы провести выделение ВПЧ. Пеллет от центрифугирования, содержащий ВПЧ, был аккуратно ресуспендирован в 1/50 объема Фосфатно-солевого буфера (ФСБ; 0.1 М фосфата натрия, 0.15 M NaCl pH 7.2) до загрузки в колонку SEC.
Колонки SEC с SEPHACRYL™ S-500 высокого разрешения (S-500 HR: GE Healthcare, Uppsala, Sweden, Cat. No. 17-0613-10) объемом 32 мл были приготовлены с уравновешивающим элюирующим буфером (50 мМ Трис, 150 мМ NaCl, pH 8). Хроматография SEC проводилась при загрузке 1.5 мл образца ВПЧ в уравновешанную колонку и его элюировании с 45 мл уравновешивающего элюирующего буфера. Элюат собирали по фракциям по 1.7 мл, и содержание белка в каждой фракции оценивали путем смешивания 10 мкл фракции элюата с 200 мкл разбавленного для окрашивания белка реагента Bio-Rad (Bio-Rad, Hercules, CA). Каждому разделению предшествовала калибровка с Blue Dextran 2000 (GE Healthcare Bio-Science Corp., Piscataway, NJ, USA). Сравнение профилей элюирования как Blue Dextran 2000, так и белков хозяина проводили для каждого разделения для того, чтобы убедиться в единообразии разделений.
Анализ белков из элюированных фракций SEC
Общее содержание белка в осветленных сырых экстрактах определялось с помощью анализа Брэдфорда (Bio-Rad, Hercules, CA) с использованием альбумина бычьей сыворотки в качестве справочного стандарта. Белки, имеющиеся во фракциях элюата SEC, были осаждены ацетоном (Bollag et al., 1996), ресуспендированы в либо 0.25 объема или 0.05 объема денатурирующего буфера для нанесения образца (0.1 M Трис pH 6.8, 0.05% бромфенолового синего, 12.5% глицерола, 4% ДСН и 5% бета-меркаптоэтанола) для анализа методом SDS-PAGE или иммуноблот-анализом соответственно. Разделение с помощью SDS-PAGE проводили в восстановительных условиях, и использовали Coomassie Brillant Blue R-250 для контрастирования белка.
Анализ гемагглютинации для Н5 проводили на основе способа, описанного в Nayak and Reichi (2004). Кратко, последовательные двойные разбавления тестируемых образцов (100 мкл) были проведены в 96-луночных микротитрационных планшетах с V-образными лунками, содержащих 100 мкл ФСБ, с оставшимися 100 мкл разбавленного образца на лунку. Сто микролитров 25% ярко-красной суспензии кровяных телец (Bio Link Inc., Syracuse, NY) было добавлено к каждой лунке, и планшеты инкубировали в течение 2 ч при комнатной температуре. Обратная величина наибольшему разбавлению, показавшему полную гемагглютинацию, была записана как гемагглютинирующая активность. Параллельно с этим рекомбинантный Н5 стандарт (A/Vietnam/I 203/2004 H5N1) (Protein Science Corporation, Meriden, CT) был разбавлен ФСБ и выступал в качестве контроля на каждом планшете.
На Фигуре 3 показано, что гемагглютинирующая активность сконцентрирована во фракциях, соответствующих объему пустот колонки, подтверждая, что гемагглютинирующая активность возникает в высокомолекулярной структурной организации. Анализ методом SDS-PAGE (Фиг.3В) показывает, что в тех фракциях одинакового объема пустот (фракции 7-10) также присутствует ГА в наибольшем количестве в диапазоне, соответствующем мономеру ГАО, обнаруживаемому при приблизительно 75 кДа.
Пример 3: Ферментное расщепление растительной ткани высвобождает ГА-ВПЧ с меньшим количеством загрязняющих веществ.
Растения N. benthamiana были агроинфильтрованы с AGL1/685, как описано в Примере 1. На 6-й день после инфильтрации из растений были собраны листья, разрезаны на кусочки ~1 см2, расщеплены, грубо отфильтрованы и центрифугированы, как описано в Примере 1.
При контролируемом ферментном расщеплении листьев, удалялись оболочки клетки, по крайней мере, частично, таким образом, давая возможность высвобождению белков и компонентов, присутствующих в пространстве между оболочкой клетки и цитоплазматической мембраной, в экстракционную среду. Так как большинство внутриклеточных белков и компонентов оставались до сих пор неповрежденными и содержали, по большей части, интактные протопласты, позволялось проводить начальную стадию центрифугирования для их удаления, таким образом, приводя к конечному раствору, содержащему разрушающие оболочку клетки ферменты в дополнение к внеклеточным растительным белкам и компонентам (фракция апопласта), как показано на Фигуре 4.
На Фигуре 4 показан анализ SDS-PAGE конечного раствора, полученного после контролируемого ферментного расщепления ткани листьев, как описано ранее, причем на полосе 1 показана использованная ферментная смесь, а на полосе 2 показан конечный раствор после ферментного расщепления. Содержание белка в сыром экстракте из Comitrol™ представлено на полосе 3 для сравнения. Соотношение биомасса:буфер для экстракта, представленного на полосе 2, составило 1:5 (мас./об.), тогда как оно составило 1:1 (мас./об.) для экстракта на полосе 3. Следовательно, каждая из полос 2 и 3 содержит белки, полученные из эквивалентного количества исходного материала. Для приблизительного такого же соотношения буфер:растение механический растительный экстракт содержал белок в концентрации приблизительно 3.5-4 мг/мл, в то время как в ферментном растительном экстракте, полученном в соответствии с настоящим способом, белок присутствовал в концентрации приблизительно 1 мг/мл.
Наибольшее загрязнение, присутствующее на полосе 3, как было обнаружено, представляет собой RubisCo (Рибулоза-1,5-бифосфаткарбоксилаза: оксигеназа), которая составлена из двух типов белковых субъединиц: с большой цепью (L, около 55 кДа) и с маленькой цепью (S, около 13 кДа). Все из восьми димеров с большой цепью и восьми с маленькой цепью обычно ассемблируются друг с другом в больший комплекс RubisCo 540 кДа. В то время как это загрязнение растительного белка находится в большом количестве в растительных экстрактах, полученных по способу механической экстракции (см. стрелку на Фигуре 4), оно практически отсутствует в растительных экстрактах, полученных по способу ферментного расщепления, описанного в настоящей заявке. Таким образом, настоящий способ позволяет исключить этот главный среди других белковый загрязнитель на ранней стадии процесса.
Пример 4: Ферментное расщепление растительной ткани высвобождает ГА-ВПЧ в условиях, где он может непосредственно быть захвачен катионообменной смолой.
Растения N. benthamiana были агроинфильтрованы с AGL1/685, как описано в Примере 1. На 6-й день после инфильтрации листья были собраны из растений, разрезаны на кусочки ~1 см и расщеплены в течение 15 ч при комнатной температуре в орбитальном встряхивателе. Буфер для расщепления содержал 1.0% (об./об.) Multifect Pectinase FE, 1.0% (об./об.) Multifect CX CG orand, 1.0% (об./об.) Multifect CX В (все от Genencor), каждый в растворе с 600 мМ маннита, 75 мМ цитрата, 0.04% бисульфита натрия рН буфера 6.0 с использованием соотношения биомасса: буфер для расщепления 1:2.5 (мас./об.).
После расщепления фракция апопласта была отфильтрована через 400 мкм нейлоновый фильтр для того, чтобы удалить грубую нерасщепленную растительную ткань (<5% от исходной биомассы). Отфильтрованный экстракт затем центрифугировали при комнатной температуре в течение 15 мин при 5000xg для того, чтобы удалить протопласты и внутриклеточные загрязнители (белки, ДНК, мембраны, везикулы, пигменты и т.д.) Далее супернатант был глубоко отфильтрован (для осветления) с использованием 0.65 мкм стекловолоконного фильтра (Sartopore2/Sartorius Stedim) и 0.45/0.2 мкм фильтра до проведения хроматографии.
Осветленная фракция апопласта затем была загружена в колонку с катионообменной смолой (Poros HS Applied Biosystems), уравновешенной уравновешивающим элюирующим буфером (50 мМ NaP04, 100 мМ NaCl, 0.005% Твин 80 рН 6.0). Как только показание УФ возвратилось назад на ноль, экстракт был постепенно элюирован равновесным/элюирующим буфером, содержащим повышенные концентрации NaCl (500 мМ). Где необходимо, хроматографические фракции концентрировали 10 раз с использованием приборов Amicon™, снабженных НОММ 10 кДа. Анализ белка был проведен таким образом, как описано в предыдущих примерах.
При указанных выше условиях большинство ферментов и растительных белков не связываются с катионообменной смолой, тогда как ГА-ВПЧ связываются, таким образом, обеспечивая значительное обогащение ГА-ВПЧ в элюированной фракции (Фигура 6). В дополнение, как показано на Фигуре 6, полоса 4 и 5, целлюлазы и пектиназы, не связываются с катионообменной колонкой при рН ниже 7. Следовательно, выделение ГА-ВПЧ, основанное на гемагглютинирующей активности ГА, составило 92% до загрузки в катионообменную колонку и 66% в элюированной фракции. Фактор очистки 194 был измерен на элюированной фракции из катионообменной смолы.
Пример 5: Добавление NaCl к расщепляющему буферу
Растения N. benthamiana были агроинфильтрованы штаммами Agrobacterium AGL1, несущими конструкт, экспрессирующий целевой гемагглютинин (Hl/Cal WT, B/Flo, H5/Indo или Н 1 /Cal X 179А), как описано в Примере 1. На 6-й день после инфильтрации были собраны листья из растений, разрезаны на кусочки ~1 см2 и расщеплены в соответствии с Примером 4, за исключением случаев, указанных ниже. Фильтрацию, центрифугирование и осветление проводили, как описано в Примере 4.
NaCl добавили к расщепляющему буферу для того, чтобы оценить возможное влияние на скорость выделения ГА-ВПЧ. Ожидаемыми преимуществами были возможное предотвращение неспецифического ассоциирования ГА с растительными клетками или с частицей в суспензии, которые удаляются в ходе осветления, и возможное влияние на достижение, и/или сохранение, и/или улучшение коллоидной стабильности ГА-ВПЧ.
Добавление 500 мМ NaCl к расщепляющему буферу привело к увеличению выхода извлечения ГА-ВПЧ на 1 г биомассы после удаления протопластов и клеточных остатков центрифугированием. Однако это увеличение было заметно только для штаммов H1/Cal WT и B/Flo, в то время как выход извлечения для Н5 значительно не увеличивался при этом подходе (Таблица 4).
1 Выход (разб/г) с NaCl, разделенный на Выход (разб/г) без NaCl
Добавление 500 мМ NaCl в ходе расщепления также привело к увеличению высвобождения ГА-ВПЧ в ходе расщепления, что в свою очередь привело к повышенной скорости извлечения после осветления как для штамма Hl/Cal WT, так и для штамма Hl/Cal X-179A (Таблица 5), но не для штамма H5/Indo.
1Извлечение выражено в процентах гемагглютинирующей активности, полученной после глубинной фильтрации, по сравнению с активностью, обнаруженной в расщепленном экстракте после центрифугирования.
Ассоциированное состояние ГА-ВПЧ с или без добавления NaCl в ходе ферментного расщепления было изучено с использованием способа Nanoparticle Tracking Analysis (NTA) для H5/Indo и Hl/Cal WT (Фигура 7А и 7В соответственно). Наблюдали моно дисперсный состав частиц для Н5, когда расщепление проводили в отсутствие NaCl, тогда как состав Hl/Cal показал намного большую группу типов частиц. Добавление NaCl к расщепляющему буферу снизило самоорганизацию ГА-ВПЧ для Hl/Cal, как показывает достаточно монодисперсное распределение частиц, указанное на Фигуре 7С.Число частиц в 150 нм для Hl/Cal WT-VLPs было увеличено (в около 5 раз) при добавлении 500 мМ NaCl к расщепляющему буферу.
Пример 6: Контроль высвобождения пигментов
Растения N. benthamiana были агроинфильтрованы штаммами Agrobacterium AGL1, несущими конструкт, экспрессирующий целевой гемагглютинин (H5/Indo), как описано в Примере 1. На 6-й день после инфильтрации листья были собраны, разрезаны на кусочки ~1 см и расщеплены, как описано в Примере 4, с добавлением либо 500 мМ NaCl или 500 мМ NaCl и 25 мМ ЭДТА к расщепляющему буферу. Фильтрацию, центрифугирование и осветление проводили, как описано в Примере 4.
Высвобождение компонентов, имеющих зеленый цвет, в ходе стадии ферментного расщепления, привело к очистке состава ВПЧ, имеющего зеленоватую окраску. Композиция расщепляющего оболочку клетки раствора затем была исследована и приготовлена для получения очищенного состава ВПЧ, имеющего сниженную зеленую окраску, и таким образом, повышенную чистоту. Без намерения быть ограниченым, поскольку Са2+грает решающую роль в сохранении компонентов срединной пластинки оболочки клетки вместе, и принимая тот факт, что обычно Са2+рисутствует в высокой концентрации в растительной оболочке клетки, добавление хелатора Са2+ - ЭДТА может способствовать ферментной деполимеризации оболочки клетки, тем самым сохраняя интактными внутриклеточные рганеллы, такие как хлоропласты, и предотвращая высвобождение компонентов зеленых пигментов.
Как показано в Таблице 6, добавление 25 мМ ЭДТА к расщепляющему буферу приводит к снижению зеленого окрашивания очищенного состава ГА-ВПЧ, которое оценивается путем измерения различия в абсорбции состава (ОD672nm-ОD650nm). Когда зеленые компоненты высвобождались в большом количестве или не удалялись подходящим образом, у состава ВПЧ проявлялось OD>0.040.
Пример 7: Альтернативные композиции расщепляющего буфера
Растения N. benthamiana были агроинфильтрованы штаммами Agrobacterium АGL1, несущими конструкт, экспрессирующий целевой гемагглютинин (Н5/Indo), как описано в Примере 1. На 6-й день после инфильтрации листья были собраны, разрезаны на кусочки ~1 см2 и расщеплены в соответствии с Примером 4 при модификации расщепляющего раствора путем включения 0%, 0.25%, 0.5%, 0.75% или 1% об./об. Multifect .Ресtinasе РЕ, Multifect СХ-СО сеllulasе и Multifect СХ В целлюлазы, как указано в Таблицах 7-9. Фильтрацию, центрифугирование и осветление проводили, как описано в Примере 4.
Как показано в нижеследующих Таблицах 7 и 8, было продемонстрировано, что пектиназа не является существенной в расщепляющем буфере. Похожие уровни ВПЧ Н5/Indo или Н1/Са1 АЛТ могли быть экстрагированы по настоящему способу либо в присутствии, либо в отсутствие пектиназы. Более того, было обнаружено, что при снижении концентрации целлюлазы по сравнению с предыдущими примерами, не оказало значительного влияния на качество экстракции (Таблица 9).

*Multifect CX GC
* 1% каждой из Multifect CX GC и Multifect CX В
Пример 8: Ферментное расщепление в условиях, близких к нейтральному рН
Контролирование рН в ходе расщепления может быть решающим для экстракции некоторых ВПЧ. Принимая во внимание, что при деполимеризации оболочки клетки, происходящей в ходе стадии расщепления, могут высвобождаться сахарокислоты, которые могут подкислять раствор (то есть рН от 6 до 5) в присутствии подходящих буферов, и что некоторые ВПЧ (такие, которые включают ГА Н3/Bris и В/По) уже продемонстрировали сильную чувствительность к умеренно кислым условиям, было исследовано влияние такого возможного подкисления на выход полученных ВПЧ.
Растения N. benthamiana были агроинфильтрованы штаммами Agrobacterium AGL1, несущими конструкт, экспрессирующий целевой гемагглютинин (B/Flo, H5/Indo, НЗ/Bns), как описано в Примере 1. На 6-й день после инфильтрации листья были собраны, разрезаны на кусочки ~1 см2 и расщеплены в соответствии с Примером 4 при модификации условий расщепления путем включения 500 мМ Nad; 25 или 50 мМ ЭДТА; 0.03 или 0.04% бисульфита натрия; 0,100,200 или 600 мМ маннита, 75,125 или 150 мМ цитрата; и/или 75 мМ NaPO4; с рН расщепляющего буфера, уставленного, как указано в Таблицах 10-14. Фильтрацию, центрифугирование и осветление проводили, как описано в Примере 4.
Были протестированы различные композиции расщепляющего буфера для того, чтобы достичь рН приблизительно 5.5 к концу ферментного расщепления, включающие повышенную концентрацию цитрата (влияние буфера при рН от 3.0 до 5.4) и добавление фосфата натрия (влияние буфера при рН выше 6.0). В Таблице 10 показано, что ВПЧ из штамма В были экстрагированы более эффективно, когда рН после расщепления было близко к рН 6.0.
Далее было протестировано влияние начала расщепления при более высоких рН для того, чтобы достичь конечного значения рН, близкого к рН 6.0. Как показано в Таблице 11, было возможным расщепление оболочки растительной клетки при таких условиях, близких к нейтральным, и экстракционный выход для ВПЧ H5/Indo не снижался.
1 Все расщепляющие буферы содержали 600 мМ маннита, метабисульфит натрия 0.04%, 125 мМ цитрата+75 мМ NaP04+500 мМ NaCl+25 мМ ЭДТА
Другие компоненты расщепляющего раствора также показали, что могут изменяться без негативного влияния на экстракционный выход ВПЧ. В Таблице 12 проиллюстрированы изменения, которые могут быть применены к расщепляющему раствору для того, чтобы увеличить экстракционный выход ВПЧ B/Flo, наряду с получением после расщепления рН 5.4-5.7. Такие изменения включают увеличение концентрации цитрата и добавление Р04 буфера. Было обнаружено, что увеличение концентрации ЭДТА обычно приводит к более подкисленным экстрактам и более низким экстракционным выходам ВПЧ.
Все буферы содержали 500 мМ NaCl и метабисульфит натрия 0.04%.
Композиция буфера была затем модифицирована для того, чтобы улучшить экстракционный выход ВПЧ Н3/Brisbane (Таблица 13).
1Все буферы содержат 125 мМ цитрата, 75 мМ NaPO4, 500 мМ Nad,
Как показано в Таблицах 12 и 13, концентрация маннита может быть снижена до 200 мМ без значительного влияния на экстракционный выход ВПЧ. Дальнейшее снижение концентраций маннита до 100 мМ и даже полное исключение маннита из расщепляющего раствора значительно не влияло на уровень полученного ГА-ВПЧ (Таблица 14).
2 Два испытания были проведены для того, чтобы сравнить экстракционные выходы ВПЧ без маннита (испытание 1) и со 100 мМ маннита (Испытание 2) против 600 мМ маннита.
Пример 9: Пригодность ферментного расщепления для широкого спектра ГА-ВПЧ.
Способ ферментного расщепления для растительной биомассы, описанный в настоящей заявке, возможно применить к экстрагированию широкого спектра ГА-ВПЧ. В дополнение к экстракции ГА-ВПЧ, включающих H5Ando, Hl/Cal WT VLP, Н3/Bris и В/Flo, показанной в предыдущих примерах, способ, описанный в настоящей заявке, как было показано, пригоден для экстракции ГА-ВПЧ из сезонных Hl/Bris и H1/NC, как показано в Таблице 15.
Пример 10: Приготовление антитела, экспрессия и анализ
Сборка экспрессионных кассет С2 В8 (конструкт №595)
С2 В8 представляет собой химерное (мышиное/человеческое) моноклональное антитело, направленное против В-клеточного специфического антигена CD20, экспрессированного на не-Ходжкинской лимфоме (НХЛ). С2 В8 опосредует комплемент-и антитело-зависимую клеточноопосредованную цитотоксичность и имеет прямые антипролиферативные эффекты против злокачественных линий В-клетки ш vitro (N Selenko et. al., Leukemia, October 2001, 15 (10); 1619-1626).
Был синтезирован фрагмент ДНК, включающий 84 п.о. промотора пластоцианина люцерны, полную легкую цепь С2 В8, кодирующую последовательность, и полный терминатор пластоцианина люцерны (фрагмент LC). Фрагмент LC был фланкирован рестрикционным сайтом DraIII (обнаруженном в промоторе пластоцианина) и сайтом EcoRI по ходу терминатора пластоцианина. Последовательность фрагмента LC представлена на Фигуре 9 (SEQ ID NO: 15). Плазмида, содержащая фрагмент LC, была расщеплена с DraIII и EcoRI и клонирована в конструкт №660 (D'Aoust et al.. Plant Biotechnol. J. 2008,6: 930-940), ранее расщепленный теми же ферментами. Конечная плазмидя была названа конструктом номер 590. Был синтезирован второй фрагмент ДНК, который включает 84 п.о. промотора пластоцианина люцерны, полную тяжелую цепь С2 В8, кодирующую последовательность, и полный терминатор пластоцианина люцерны (фрагмент НС). Фрагмент НС был фланкирован рестрикционным сайтом DraIII (обнаруженным в промоторе пластоцианина) и сайтом EcoRI по ходу терминатора пластоцианина. Последовательность фрагмента НС представлена на Фигуре 16 (SEQ ID NO:16). Плазмида, содержащая фрагмент НС, была расщеплена DraIII и EcoRI и клонирована в конструкт №660 (D'Aoust et al., Plant Biotechnol. J. 2008,6: 930-940), ранее расщепленный теми же ферментами. Конечная плазмида была названа конструктом номер 592. Штамм A. Tumefacians, включающий 592, называется «AGL1/592».
Плазмида, включающая двойную экспрессионную кассету для экспрессии С2 В8 (конструкт №595) была собрана следующим образом. Конструкт номер 592 был расщеплен EcoRI, обработан фрагментом Кленова для того, чтобы образовать тупые концы, и расщеплен Sbf1. Конечные фрагменты, включающие полную кассету для экспрессии тяжелой цепи С2 В8, фланкированной сайтом Sbf1 и тупым концом, были внедрены в конструкт №590, ранее расщепленный Sbf1 и Smal. На Фигуре 11А представлено схематическое изображение конструкта №595, использованного для экспрессии С2 В8 в растениях.
Сборка экспрессионной кассеты Р19 (конструкт №R472)
Конструкт R472, кодирующий белок р19, описан выше («Супрессоры сайленсинга»; смотри Фигуру 11В)
Приготовление растительной биомассы, бактериального токулята, агроинфильтрация и сбор урожая
Растения Nicotiana benthamiana были выращены, как описано выше («Приготовление растительной биомассы, инокулята, агроинфильтрация и сбор урожая»), в теплице при световом периоде 16/8 и температурном режиме 25°С днем/20°С ночью. Три недели спустя после посева семян индивидуальные ростки были отобраны, пересажены в горшки и оставлены для роста в теплице еще на три дополнительные недели при тех же самых условиях окружающей среды.
Agrobacteria, несущая конструкт №595 или №R472, была выращена в бульонной среде LB BBL Select APS с добавлением 10 мМ 2-[N-морфолино]этансульфоновой кислоты (МЭС), 50 мкг/мл канамицина и 25 мкг/мл карбенициллинарН 5.6 до достижения OD600>2.0. Суспензии Agrobacterium центрифугировали перед применением и ресуспендировали в инфильтрационной среде (10 мМ MgCl2 и 10 мМ MES рН 5.6) и хранили в течение ночи при 4°С. В день инфильтрации культуры клеток, выращенных в замкнутом объеме, были разбавлены в 6.7 объемах культуры и нагреты перед использованием. Целые растения N. benthamiana были помещены в перевернутом положении в бактериальную суспензию в воздухонепроницаемый нержавеющий стальной контейнер под вакуум 20-40 Top на 1 мин. После инфильтрации растения были возвращены в теплицу для 5-дневного инкубационного периода до сбора урожая. Инфильтрации были проведены как совместные инфильтрации со штаммами AGL1/595 и AGL1/R472 в соотношении 1:1.
Взятие образца листа и полная экстракция белка (механическая экстракция)
После инкубации надземные части растения были собраны и немедленно использованы. Все растворимые белки были экстрагированы с помощью гомогенизации растительной ткани в домашнем измельчителе в течение 3 мин с 1.5 объемами холодного 20 мМ NaPO4 рН 6.0, 0.15 М NaCl и 2 мМ метабисульфита натрия. После гомогенизации жидкая масса основного растительного материала была отфильтрована на Miracloth для удаления больших нерастворимых остатков. рН экстракта был установлен как 4.8 путем добавления 1М НСl, и нерастворимые материалы были удалены центрифугированием 18000 g в течение 15 мин (4°С). Был собран супернатант, и рН был установлен как 8.0 с помощью 2 М основания Трис. Нерастворимые материалы были удалены центрифугированием 18000 g в течение 15 мин при 4°С, и был собран сырой экстракт (супернатант). Общее содержание белка в осветленных грубых экстрактах было определено с помощью спосба Брэдфорд (Bio-Rad, Hercules, CA) с использованием альбумина бычьей сыворотки в качестве калибровочного стандарта.
Экстракция белка путем расщепления оболочки клетки
Ткань листа была собрана из растений Nicotiana benthamiana и порезана на кусочки ~1 см. Кусочки листа были помещены в 2.425 объема расщепляющего раствора (75 мМ цитрата рН 6.9, 600 мМ маннита, 1% Multifect Pectinase FE, 1% Multifect CXG, 1% Multifect В). Этот состав был равномерно распределен по неглубокому сосуду и выдержан в течение 16 ч на орбитальном встряхивателе при 120 об/мин и 18°С.После инкубирования остатки листьев были удалены путем фильтрации через нейлоновый фильтр (250 мкм меш). Экстракт центрифугировали при 5000 g в течение 15 мин (22°С), и супернатант был собран и отфильтрован через стекловолокно 0.65 мкм. Экстракт довели до рН 6.0 при помощи 0.5 М основания Трис, отфильтровали на PES мембране 0.45/0.22 мкм.
Осаждение с сульфатом аммония и очистка антитела
Сульфат аммония медленно добавляли к белковым экстрактам до достижения 45% насыщения. Экстракт выдерживали на льду в течение 60 мин и центрифугировали при 18000 g в течение 20 мин (4°С). Супернатант был удален, а пеллет замораживали (-80°С) до использования.
Замороженный белковый пеллет размораживали и ресуспендировали в 1/10 объема (по сравнению с объемом до осаждения) белкового ресуспендирующего раствора (50 мМ Трис рН 7.4, 150 мМ NaCl). Белковый раствор центрифугировали при 12000 g в течение 20 мин (4°С) для того, чтобы удалить нерастворимые материалы. Белковый раствор был загружен на смолу MabSelect Sure (GE Healthcare, Baie d'Urie, Canada). Колонку промывали 10 CV из 50 мМ Трис рН 7.4, 150 мМ NaCl, и антитело было элюировано с 6 CV из 100 мМ цитрата натрия рН 3.0. Элюирующий объем был собран во фракциях 1 CV в пробирки, содержащие 1/10 CV из 2 М Трис рН 7.4, 150 мМ NaCl. Были выбраны элюированные фракции, основываясь на содержании в них белка (измерены методом Брэдфорд), и выбранные фракции были объединены и заморожены (-80°С) перед анализом.
Количественный анализ белка и анализ с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата nampwi(SDS-PAGE)
Общее содержание белка было определено с помощью метода Брэдфорд (Bio-Rad, Hercules, CA) с использованием либо альбумина бычьей сыворотки (для сырых белковых экстрактов), либо коммерчески доступного ритуксимаба (Rituxan®, Hoffmann-La Roche, Mississauga, Canada) (для очищенных антител) в качестве калибровочного стандарта. Был проведен SDS-PAGE с окрашиванием Кумасси, как описано в Laemmli (Nature 1970,227:680-685).
Количественное определение С2 В8 с помощью ELISA
Многолуночные планшеты (Immulon 2HB, ThermoLab System, Franklin, MA) были покрыты 2.0 мкг/мл моноклонального мышиного античеловеческого IgG (Abeam, Ab9243) в 50 мМ карбонатного буфера (рН 9.6) при 4°С в течение 16-18 ч. Многолуночные планшеты затем были блокированы посредством 1 ч инкубации в 1% казеина в фосфатно-солевом буфере (ФСБ) (Pierce Biotechnology, Rockford, II) при 37°С.Стандартная кривая была получена с разбавлениями Ритуксимаба (Rituxan®, Hoffmaim-La Roche, Mississauga, Canada). При проведении иммуноанализов все разбавления (контрольное и образцов) проводились в растительном экстракте, полученном из инфильтрованной и инкубированной с суррогатом инокулята (только AGL1/R472) растительной ткани для того, чтобы исключить матричный эффект. Планшеты инкубировали с образцами белка и стандартной кривой разбавлений в течение 1 ч при 37°С. После трех промывок 0.1% Твин-20 в ФСБ (ФСБ-Т) планшеты выдерживали с конъюгированным с пероксидазой ослиным античеловеческим IgG антителом (разбавление 1/4000 в блокирующем растворе) (Jackson ImmunoResearch 709-035-149) в течение 1 ч при 37°С.Повторили промывания с ФСБ-Т, и планшеты выдерживали с 3,3', 5,5'-тетраметилбензидиновым (ТМВ пероксидазным субстратом) Sure Blue (KPL, Gaithersburg, MD). Реакция была остановлена путем добавления 1 н. НС1, и абсорбция измерялась при 450 нм. Каждый образец был проанализирован трижды, и концентрации были интерполированы в линейный участок на стандартной кривой.
Анализ N-гликана
Образцы, содержащие С2 В8 (Rituxan™; 50 мкг) были разделены на 15% SDS/PAGE. Тяжелые и легкие цепи были обнаружены Кумасси синим, и белковая зона, соответствующая тяжелой цепи, была вырезана и порезана на маленькие фрагменты. Фрагменты были 3 раза промыты 600 мкл раствора 0.1 М NH4HCO3/CH3CN (1/1) в течение 15 мин каждый раз и высушены.
Сокращение дисульфидных мостиков, возникшее при инкубировании гелевых фрагментов в 600 мкл раствора 0.1 М ДТТ в 0.1 М NH4HCO3 при 56°С в течение 45 мин. Было проведено алкилирование путем добавления 600 мкл раствора 55 мМ йодоацетамида в 0.1 М NH4HCO3 при комнатной температуре в течение 30 мин. Супернатанты были удалены и полиакриламидные фрагменты были снова один раз промыты в 0.1 М ТР4HCO3/CH3CN (1/1).
Затем белки были расщеплены с 7.5 мкг трипсина (Promega) в 600 мкл 0.05 М NH4HCO3 при 37°С в течение 16 ч. Было добавлено двести мкл CH3CN, и был собран супернатант. Гелевые фрагменты затем были промыты с 200 мкл 0.1 М NH4HCO3, затем снова с 200 мкл СН3СN и в заключение с 200 мкл 5% муравьиной кислоты. Все супернатанты были объединены и лиофилизированы.
Гликопептиды были отделены от пептидов с помощью хроматографии на картридже Sep-Pack С 18. Гликопептиды были специфически элюированы с 10% CH3CN в воде и затем проанализированы с помощью MALDI-TOF-MS на инструменте Voyager DE-Pro MALDI-TOF (Applied Biosystems, USA), оборудованном 337-нм азотным лазером. Был проведен масс-спектральный анализ в экстракционном режиме замедленного отражения с использованием дигидробензойной кислоты (Sigma-Aldrich) в качестве матрицы.
Пример 11: Сравнение экстракционных выходов антитела С2 В8
Сравнивали ферментное расщепление с механической экстракцией для экстракции антитела С2 В8. Растения N.benthamiana были агроинфильтрованы с AGL1/595 и AGL1/R472. После 6 дней инкубирования были собраны листья, и белки были экстрагированы с помощью ферментного расщепления или механической экстракции. Экстрагирования проводили дважды, и конечные экстракты сравнивали по объему, концентрации белка и содержанию антитела (С2 В8). Результаты представлены в Таблице 16.
Из 700 г биомассы при механической экстракции образовалось в среднем 1440 мл экстракта белка, тогда как при расщеплении образовалось 2285 мл экстракта белка. Процент антитела С2 В8 был выше в экстракте при расщеплении (среднее значение 479% экстрагированных белков), чем в экстракте, полученном в измельчителе (среднее значение 3.49% экстрагированного белка). Также обнаружены больший объем экстракта и большая концентрация антитела, что привело на 37% большему экстракционному выходу для расщепления (240.75 мг С2 В8/кг сырого веса), чем для механической экстракции (175.95 мг С2 В8/кг сырого веса).
Пример 13: Сравнение очищенного антитела С2 В8 (содержание белка)
Антитело С2 В8 было очищено от экстрактов с помощью аффинной хроматографией на белке А, как описано в Примере 10. Продукты, очищенные от экстрактов, полученных путем механической экстракции или расщепления, сравнивали на основании содержания в них белка. Электрофоретический профиль антител, очищенных от каждой экстракционной партии, показан на Фигуре 12. Результаты показывают, что профили продуктов, очищенных либо из экстракции в измельчителе, либо из расщепления оболочки клетки, являются похожими.
Пример 14: Сравнение очищенного антитела С2 В8 (N-гликолизирование)
N-гликолизирование белков состоит в добавлении комплексной структуры гликана на аспарагине выделенных белков, несущей последовательность N-X-S/T, где N представляет собой аспарагин, Х представляет собой любую аминокислоту за исключением пролина, и S/T представляет собой серин или треонин. Предшественник гликана рано присоединяется в эндоплазматическом ретикулюме в ходе трансляции белка и в ходе его перемещения вдоль направления выделения N-гликаны претерпевают созревание. Из высокоманнозного ranaN-гликана в эндоплазматическом ретикулюме (ЭР) созревание N-гликанов в растениях включает добавление и удаление глюкозных остатков, удаление манноз в дистальных положениях и добавление N-ацетилглюкозамина, ксилозных, фукозных и галактозных остатков. Созревание N-гликанов в растениях описано в Gomord et al. in Post-translational modification of therapeutic proteins inplants (Curr. Opin. Plant Biol. 2004,7:171-181). Ферменты пути N-гликолизирования располагаются в точных позициях в каждой ячейке пути выделения, а именно в эндоплазматическом ретикулюме, цис-Гольджи, среднем Гольджи и транс-Гольджи. Таким образом, образец N-гликолизирования белка будет разным в зависимости от его положения в момент экстракции. Мы ранее обнаружили, что конкретная часть антитела, полученного с использованием агроинфильтрации N. benthamiana, зарождает N-гликаны высокоманнозного типа, несмотря на то, что нацелены на апопласт (Vezina et al., Plant Biotechnol. J. 2009 7:442-455). О похожем наблюдении сообщалось в других источниках (Sriraman et al., Plant Biotechnol. J. 2004, 2, 279-287). В обоих случаях наличие незрелых N-гликанов в конкретной части антител объяснялось как следствие присутствия антител в ранних участках пути выделения в момент экстракции.
Следующее испытание исследовало, экстрагируются ли предпочтительно рекомбинантные белки, содержащие комплекс N-гликанов, при экстракции секретированных гликопротеинов путем расщепления оболочки клетки. Ожидали, что антитела и другие гликопротеины, секретированные в апопласт, содержат N-гликаны, завершившие свое созревание. Зрелые N-гликаны в большинстве случаев содержат терминальный N-ацетилглюкозамин или галактозные остатки и также называются комплексом N-гликанов. В противоположность этому незрелые N-гликаны, в большинстве случаев обнаруженные на белках en route в секреторном пути, включают терминальные маннозные остатки. Высокоманнозное содержание N-гликанов на С2 В8 (Rituxan™) связано с пониженным периодом полувыведения из кровотока (Kanda et al., Glycobiology 2006,17: 104-118). В этом контексте будет желателен экстракционный способ, способный содействовать экстракции апопластных гликопротеинов, содержащих комплекс N-гликанов, из растений.
Сравнительный анализ N-гликолизирования на очищенных антителах С2 В8 был проведен, как описано в Примере 10. Результаты демонстрируют, что антитела, очищенные из расщепленной биомассы, зарождают значительно меньший процент олигоманнозных N-гликанов (Фигура 13А) и, как следствие, значительно больший процент комплекса N-гликанов (Фигура 13В).
Экстракция путем расщепления оболочки клетки может быть также применена к растениям, совместно экспрессирующим гликопротеин и один или более ферментов для модифицирования профиля N-гликолизирования, как описано в WO 2008/151440 (Образование модифицированного гликопротеина в растениях; которая включена в настоящее описание посредством отсылки), для содействия выделению гликопротеинов, несущих модифицированные зрелые N-гликаны. Например, зрелые N-гликаны содержать пониженное количество или могут быть свободными от ксилозных и фукозных остатков.
Способ модифицирования N-гликолизирования может включать совместное экспрессирование целевого белка вдоль нуклеотидной последовательности, кодирующей бета-1.4 галактозилтрансферазу (GalT; указанный как SEQ ID NO:14 в WO 2008/151440), например, но не ограничиваясь, GalT млекопитающего или GalT человека, однако также может быть использована GalT из других источников. Каталитический домен GalT (например, нуклеотиды 370-1194 SEQ ID NO:14, как описано в WO 2008/151440) может быть также связан с доменом CTS N-ацетилглюкозаминилтрансферазы (GNT1; например, содержащем нуклеотиды 34-87 SEQ ID NO:17, как описано в WO 2008/151440), для того, чтобы образовать гибридный фермент GNT1-GalT. Гибридный фермент может быть совместно экспрессирован с последовательностью, кодирующей целевой супраструктурный белок. В дополнение к этому, последовательность, кодирующая целевую супраструктуру, может быть совместно экспрессирована с нуклеотидной последовательностью, кодирующей N-ацетилглюкозаминилтрансферазу III (GnT-III; SEQ ID NO:16, как описано в WO 2008/151440). Также может быть использован GnT-III млекопитающего или GnT-III человека, GnT-III из других источников. В дополнение к этому также может быть использован гибридный фермент GNTl-GnT-III (SEQ ID NO:26; как описано в WO 2008/151440), включающий CTS GNT1, связанный с GnT-III.
Все цитирования включены в настоящее описание посредством отсылки, как если бы каждая отдельная публикация была конкретно и отдельно указана, как включенная посредством отсылки в настоящее описание, и как будто они были полностью изложены в настоящем описании. Цитирование ссылок в настоящем описании не должно расцениваться или считаться как признание того, что такие ссылки являются предшествующим уровнем техники для настоящего изобретения.
Один или более предпочтительных в настоящее время воплощения изобретения были описаны с помощью примеров. Изобретение включает все воплощения, модификации и вариации по существу, как описано ранее в настоящем описании и со ссылками на примеры и фигуры. Это будет очевидным для специалистов в данной области техники, что ряд вариаций и модификаций может быть сделан без отклонения от объема изобретения, как определено в формуле изобретения. Примеры таких модификаций включают замену известных эквивалентов для любого аспекта изобретения для того, чтобы достигнуть по существу такого же результата тем же путем.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВИРУСОПОДОБНЫХ ЧАСТИЦ РАСТЕНИЙ | 2010 |
|
RU2579903C2 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГРИППА В РАСТЕНИЯХ | 2014 |
|
RU2742607C1 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГРИППА В РАСТЕНИЯХ | 2014 |
|
RU2705555C2 |
| ПОЛУЧЕНИЕ ПИКОРНАВИРУСОПОДОБНЫХ ЧАСТИЦ В РАСТЕНИЯХ | 2013 |
|
RU2693431C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНОЙ ЛИНИИ РАСТИТЕЛЬНЫХ КЛЕТОК | 2011 |
|
RU2573927C2 |
| ХИМЕРНЫЕ ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ, СОДЕРЖАЩИЕ ГЕМАГГЛЮТИНИН, СХОДНЫЕ С ЧАСТИЦАМИ ВИРУСА ГРИППА | 2010 |
|
RU2569195C9 |
| Получение вирусоподобной частицы вируса бешенства в растениях | 2012 |
|
RU2655433C2 |
| ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ, СОДЕРЖАЩИЕ БЕЛКИ-МИШЕНИ, СЛИТЫЕ С БЕЛКАМИ ОБОЛОЧКИ РАСТИТЕЛЬНЫХ ВИРУСОВ | 2010 |
|
RU2571223C2 |
| ИММУНОГЕННЫЙ ЭПИТОП ВИРУСА ГРИППА | 2009 |
|
RU2546872C2 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ В РАСТЕНИЯХ | 2011 |
|
RU2655431C2 |













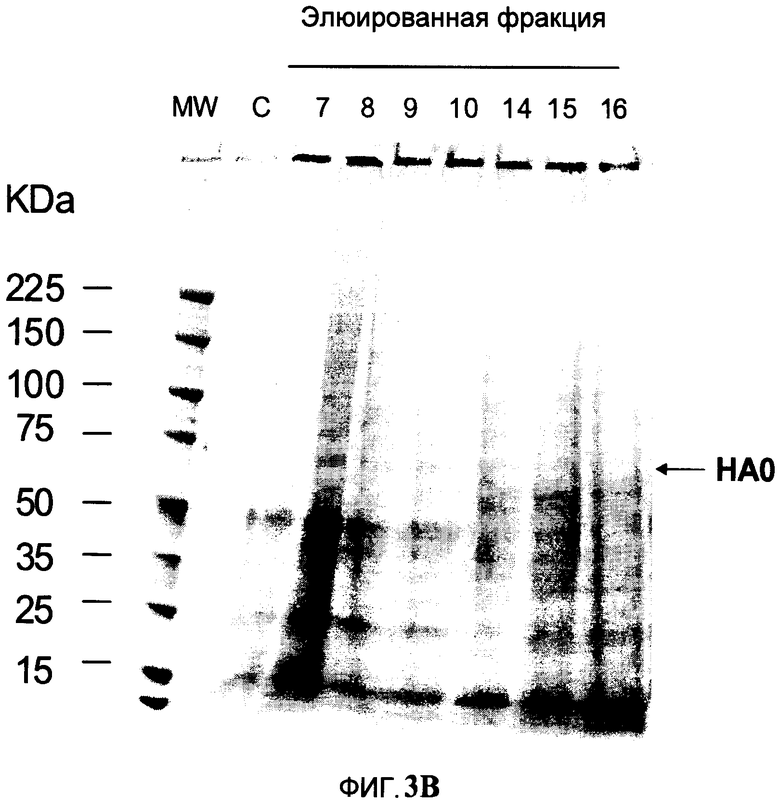
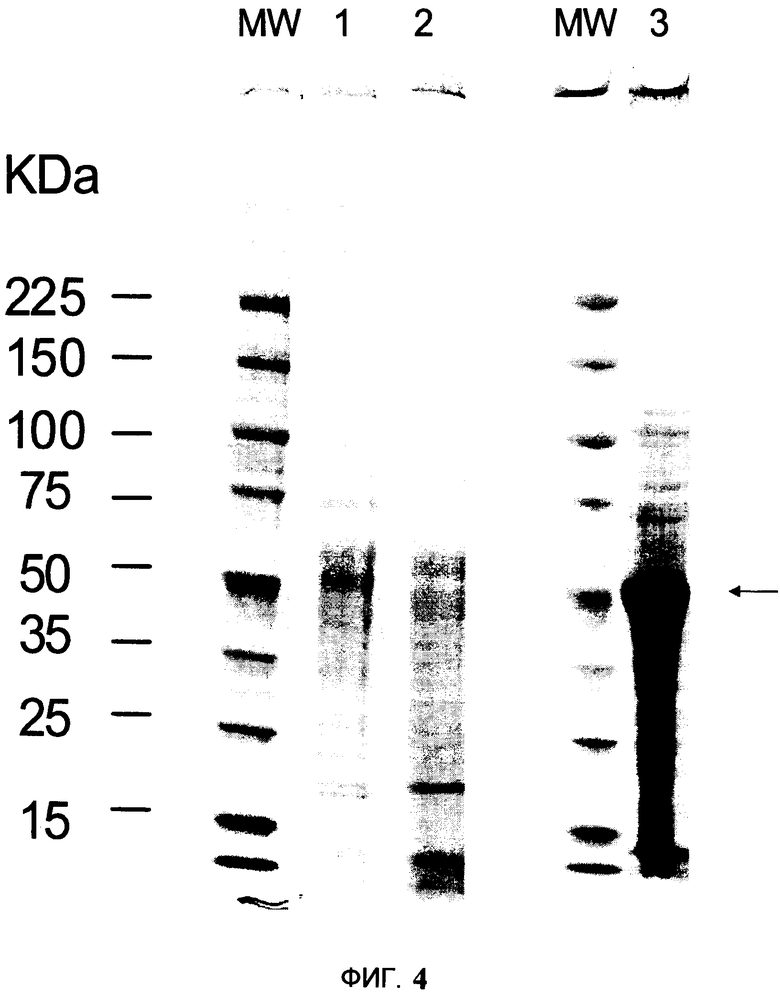

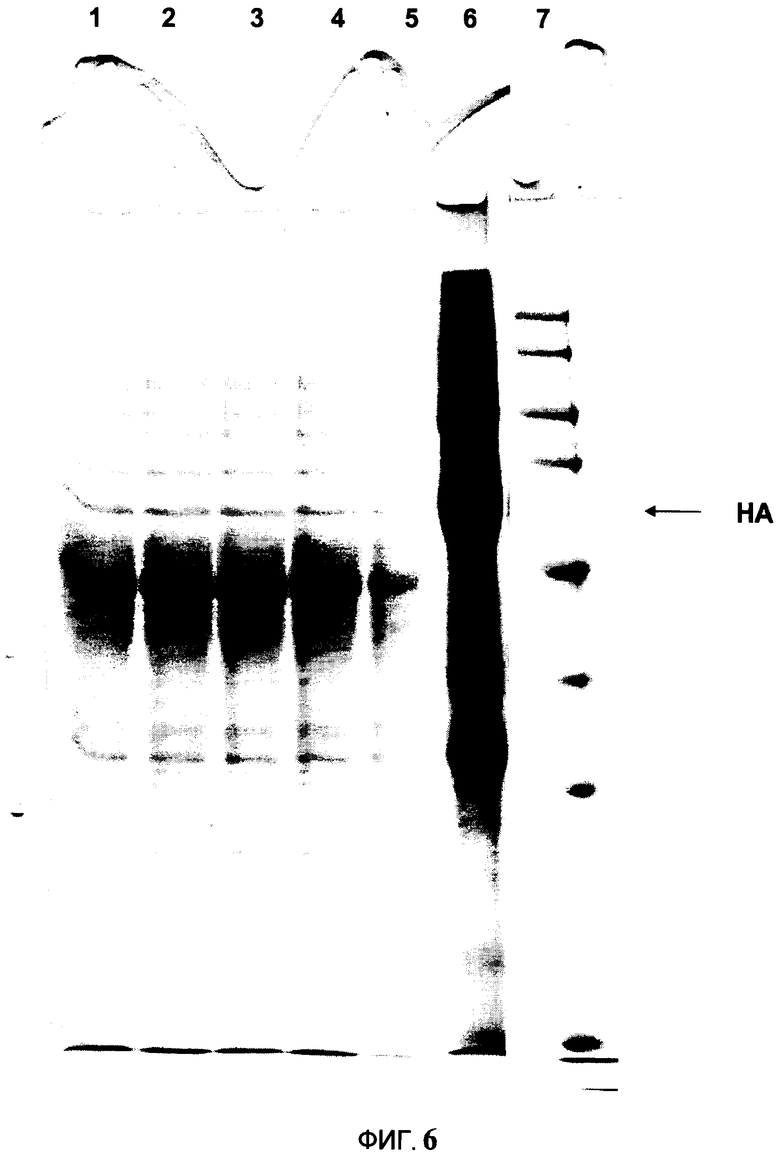
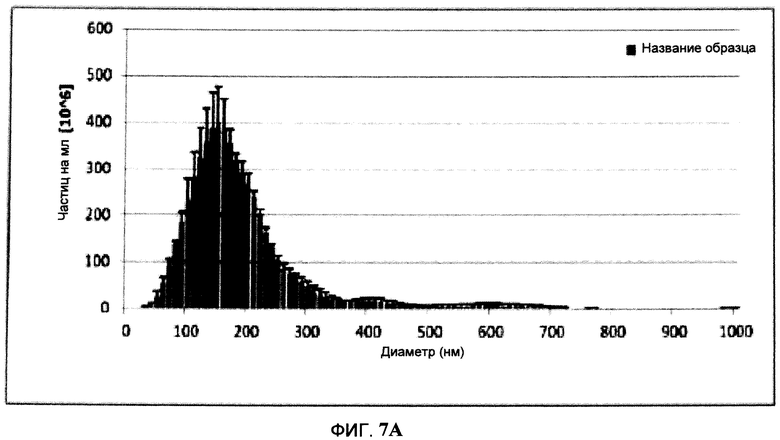

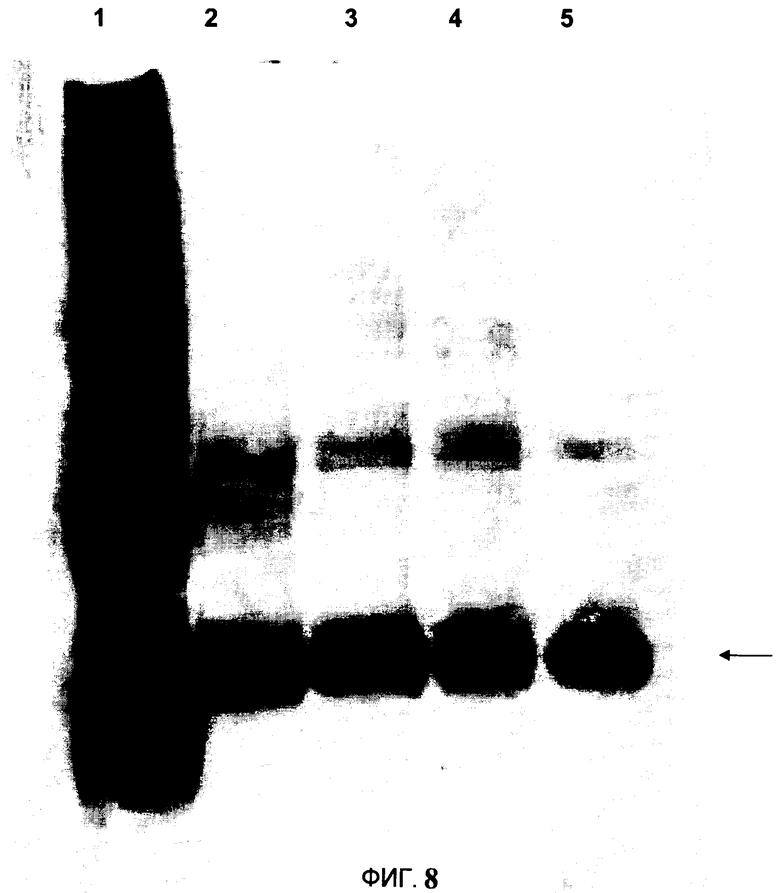

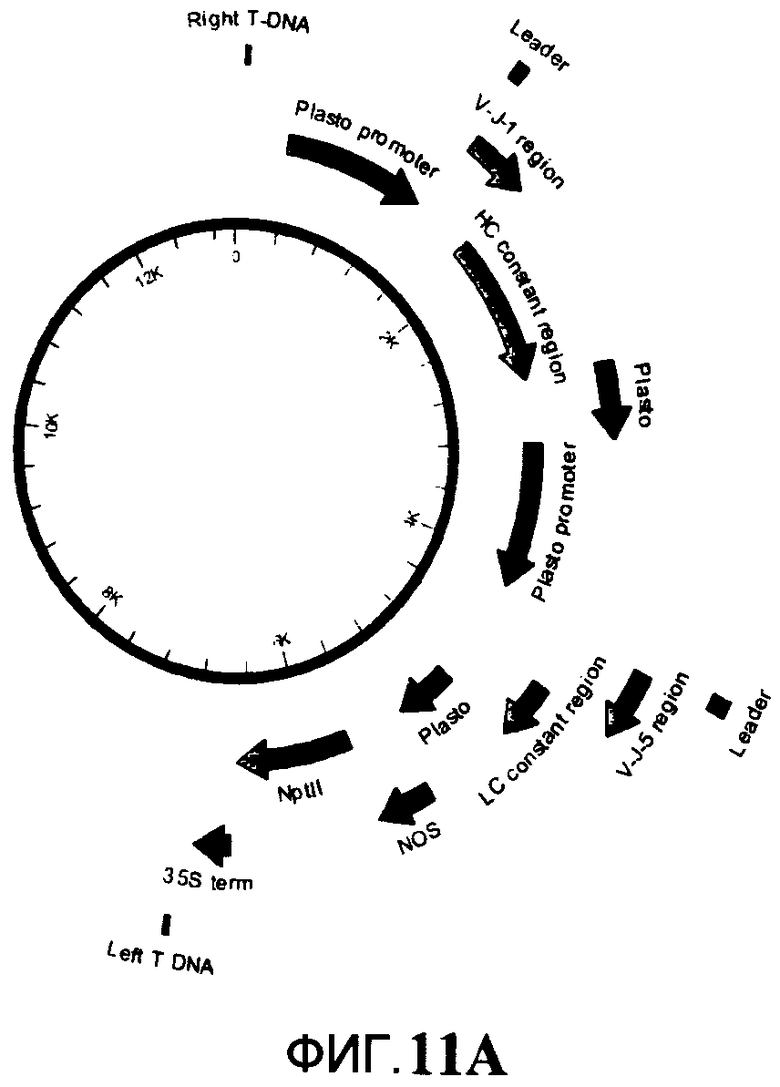

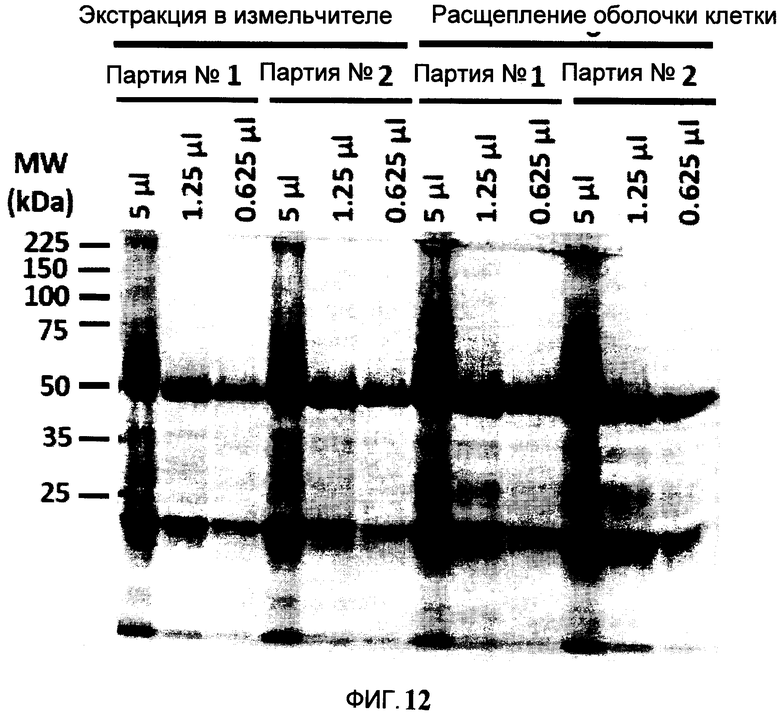
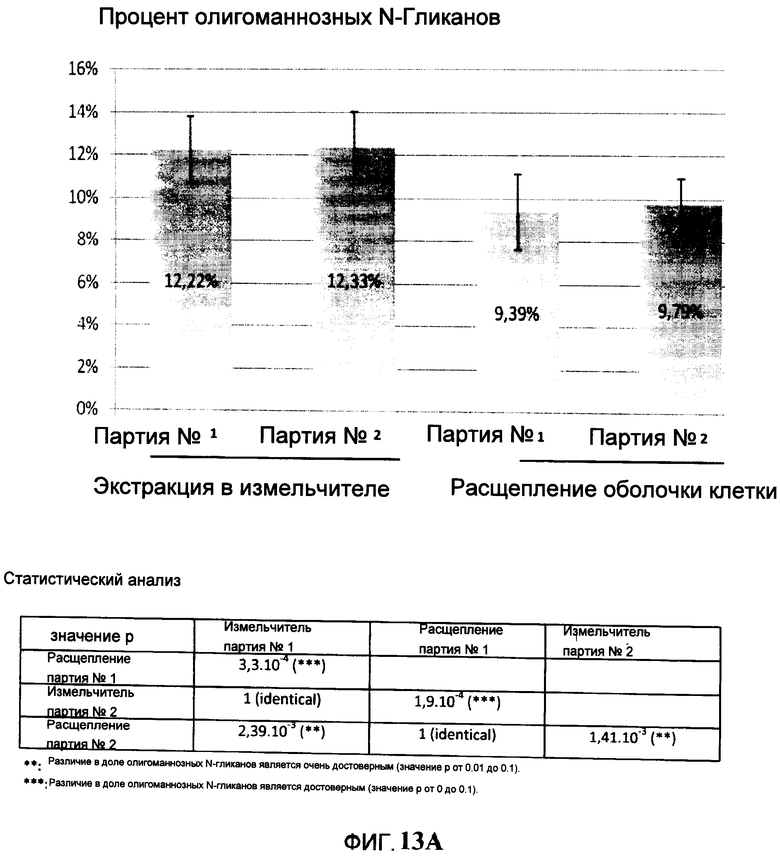
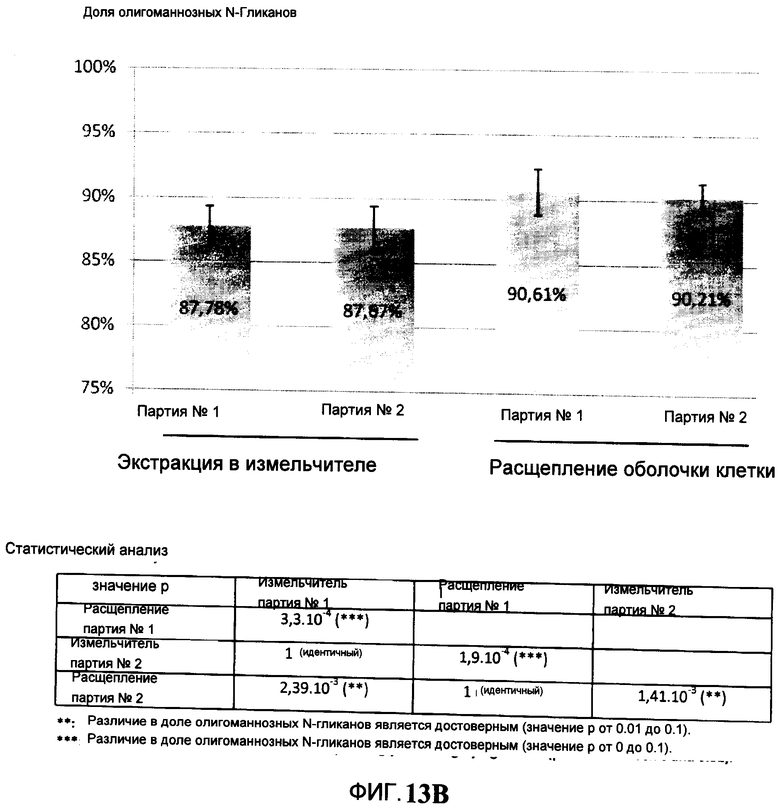
Изобретение относится к биохимии. Обеспечиваются способы получения белков растительного происхождения или супраструктур белков. Способ может включать получение растения или растительного материала, включающего локализованные в апопласте белки или супраструктуры белков, образование фракции протопласта/сферопласта и фракции апопласта из растения или растительного материала и выделение фракции апопласта. Фракция апопласта включает белки растительного происхождения или супраструктуры белков. В качестве альтернативы белки или супраструктуры белков могут быть получены из растения или растительного материала с использованием разрушающей оболочку клетки ферментной композиции с образованием расщепленной фракции. Расщепленную фракцию фильтруют с образованием отфильтрованной фракции, и белки растительного происхождения или супраструктуры белков выделяются из отфильтрованной фракции. Изобретение расширяет ассортимент способов получения белков растительного происхождения. 2 н. и 27 з.п. ф-лы, 13 ил., 16 табл., 14 пр.
1. Способ получения белков или супраструктур белков растительного происхождения, включающий:
a. получение растения или растительного материала, включающего локализованные в апопласте белки или супраструктуры белков;
b. получение фракции протопласта/сферопласта и фракции апопласта обработкой разрушающей оболочку клетки многокомпонентной ферментной смесью, содержащей одну или более чем одну целлюлазу; и
c. выделение фракции апопласта, причем фракция апопласта включает белки или супраструктуры белков растительного происхождения, причем супраструктуры белков имеют молекулярную массу от около 75 до около 1500 кДа.
2. Способ по п. 1, где разрушающая оболочку клетки многокомпонентная ферментная смесь дополнительно включает одну или более чем одну пектиназу.
3. Способ по п. 1, где разрушающая оболочку клетки многокомпонентная ферментная смесь не включает одну или более из липазы, протеазы или пектиназы.
4. Способ по п. 2, в котором концентрация одной или более чем одной пектиназы составляет от 0,01 об.% до 2,5 об.%.
5. Способ по п. 1, в котором концентрация одной или более чем одной целлюлазы составляет от 0,1 об.% до 5 об.%.
6. Способ по п. 1, где на стадии получения (стадия а) растение трансформируют нуклеотидной последовательностью, кодирующей белки или супраструктуры белков, выбранные из пептида, белка, белковой розетки, белкового комплекса, протеасомы, метаболона, транскрипционного комплекса, рекомбинантного комплекса, фотосинтетического комплекса, комплекса переноса через мембрану, комплекса ядерной поры, белковой наночастицы, гликопротеина, антитела, поликлонального антитела, моноклонального антитела, одноцепочечного моноклонального антитела, белка оболочки вируса, структурного белка вируса, вирусного капсидного белка и белка вирусной оболочки, химерного белка, химерного белкового комплекса, химерной белковой наночастицы, химерного гликопротеина, химерного антитела, химерного моноклонального антитела, химерного одноцепочечного моноклонального антитела, химерного гемагглютинина, белка оболочки вируса, структурного белка вируса, вирусного капсидного белка и белка вирусной оболочки, и растение или растительный материал собирают.
7. Способ по п. 6, где нуклеиновую кислоту вводят в растение транзиторным образом.
8. Способ по п. 6, где нуклеиновая кислота стабильно интегрирована в геном растения.
9. Способ по п. 1, где на стадии получения (стадия а), растение выращивается, и растение или растительный материал собирают.
10. Способ по п. 6, где нуклеиновая кислота кодирует моноклональное антитело или гемагглютинин гриппа.
11. Способ по п. 1, где белки или супраструктуры белков растительного происхождения не включают нейраминидазу или белок М.
12. Способ по п. 1, где растительный материал выбирают из группы листьев и культивированных растительных клеток.
13. Способ по п. 1, дополнительно включающий стадию d) очистки белков или супраструктур белков растительного происхождения из фракции апопласта.
14. Способ по п. 13, где стадия очистки включает фильтрование фракции апопласта с использованием глубинной фильтрации для получения осветленного экстракта с последующей хроматографией осветленного экстракта с использованием эксклюзионной хроматографии, катионообменной смолы или аффинной хроматографии, или их комбинации.
15. Способ получения белков или супраструктур белков растительного происхождения или белков, включающий:
a. получение растения или растительного материала, включающего белки или супраструктуры белков растительного происхождения,
b. расщепление растительного материала с использованием разрушающей оболочку клетки многокомпонентной ферментной смеси, содержащей одну или более чем одну целлюлазу с образованием расщепленной фракции;
c. фильтрование расщепленной фракции с образованием отфильтрованной фракции и выделение белков или супраструктур белков растительного происхождения из отфильтрованной фракции, причем супраструктуры белков имеют молекулярную массу от около 75 до около 1500 кДа.
16. Способ по п. 15, где разрушающая оболочку клетки ферментная смесь дополнительно включает одну или более чем одну пектиназу.
17. Способ по п. 15, где разрушающая оболочку клетки многокомпонентная ферментная смесь не включает одну или более из липазы, протеазы или пектиназы.
18. Способ по п. 16, в котором концентрация одной или более чем одной пектиназы составляет от 0,01 об.% до 2,5 об.%.
19. Способ по п. 15, в котором концентрация одной или более чем одной целлюлазы составляет от 0,1 об.% до 5 об.%.
20. Способ по п. 15, где на стадии получения (стадия а) растение трансформируют нуклеотидной последовательностью, кодирующей белки или супраструктуры белков, выбранные из пептида, белка, белковой розетки, белкового комплекса, протеасомы, метаболона, транскрипционного комплекса, рекомбинантного комплекса, фотосинтетического комплекса, комплекса переноса через мембрану, комплекс ядерной поры, белковой наночастицы, гликопротеина, антитела, поликлонального антитела, моноклонального антитела, одноцепочечного моноклонального антитела, белка оболочки вируса, структурного белка вируса, вирусного капсидного белка и белка вирусной оболочки, химерного белка, химерного белкового комплекса, химерной белковой наночастицы, химерного гликопротеина, химерного антитела, химерного моноклонального антитела, химерного одноцепочечного моноклонального антитела, химерного гемагглютинина, белка оболочки вируса, структурного белка вируса, вирусного капсидного белка и белка вирусной оболочки, и растение или растительный материал собирают.
21. Способ по п. 20, где нуклеиновую кислоту вводят в растение транзиторным образом.
22. Способ по п. 20, где нуклеиновая кислота стабильно интегрирована в геном растения.
23. Способ по п. 20, где белки или супраструктуры белков растительного происхождения включают моноклональное антитело или гемагглютинин гриппа.
24. Способ по п. 15, где растительный материал выбирают из группы листьев и культивированных растительных клеток.
25. Способ по п. 15, дополнительно включающий стадию d) отделения белков или супраструктур белков в отфильтрованной фракции от клеточного дебриса и нерастворимых материалов.
26. Способ по п. 25, где стадию отделения проводят путем центрифугирования.
27. Способ по п. 25, где стадию отделения проводят путем глубинной фильтрации.
28. Способ по п. 15, дополнительно включающий стадию d) очистки белков или супраструктур белков растительного происхождения из отфильтрованной фракции.
29. Способ по п. 28, где стадия очистки включает глубинную фильтрацию отфильтрованной фракции с образованием осветленного экстракта с последующей хроматографией осветленного экстракта с использованием катионообменной смолы, эксклюзионной смолы, аффинной смолы или их комбинации.
| из FISCHER R и др., Affinity-purification of a TMV-specific recombinant full-size antibody from a transgenic tobacco suspension culture, J | |||
| Immunol | |||
| Methods, 1999, vol.226, p 1-10, особенно р 3-9 | |||
| из FISCHER R и др., Affinity-purification of a TMV-specific recombinant full-size antibody from a transgenic tobacco suspension culture, J | |||
| Immunol. |
Авторы
Даты
2015-10-27—Публикация
2010-09-21—Подача