ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к каркасному материалу для лечения ран и/или других видов применения при лечении ран и к способам их получения. Каркасный материал включает децеллюляризованную внеклеточную матрицу из кожи рыб.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Разнообразные человеческие, животные и синтетические материалы в настоящее время описаны или применяются в медицинских процедурах для срастания, восстановления или коррекции тканевых дефектов.
Например, в опубликованной заявке на патент США № 2003/0059460 описан гибридный полимерный материал, включающий синтетические и натуральные полимеры, которые могут использоваться при регенерации ткани живого организма. Гибрид включает поперечно сшитый естественно встречающийся полимер и биологически разлагаемый абсорбируемый синтетический полимер. Однако для получения гибридного материала необходимо выполнить серию сложных стадий процесса. Кроме того, полученный гибридный материал содержит синтетические, а также естественно встречающиеся материалы.
В патенте США № 6541023 описано применение пористых коллагеновых гелей, полученных из рыбьей кожи, для использования в качестве каркасов для тканевой инженерии. Получение коллагеновых гелей включает измельчение рыбьей кожи. Кроме того, в патенте Китая № 1068703 описан способ получения рыбьей кожи для перевязки ожоговых ран, включающий отделение рыбьей кожи от тела рыб и помещение кожи в консервирующий раствор йодной настойки, этанола, борнеола, сульфадиазина цинка и хлористоводородной кислоты в количествах, достаточных для установления величины pH 2,5-3. Однако с данными продуктами может быть трудно манипулировать, поскольку продукт патента США № 6541023 представлен в форме геля, а продукт патента Китая № 1068703 хранится в растворе.
Кроме того, ряд продуктов из внеклеточной матрицы для медицинского применения был получен из человеческой кожи (Регенеративная тканевая матрица ALLODERM® (LifeCell)); фетальной телячьей дермы (Каркас для восстановления дермы PRIMATRIX™ (TEI Biosciences)); свиного мочевого пузыря (Внеклеточная матрица для покрытия ран MATRISTEM™ (Medline Industries, Inc.)); и подслизистой оболочки свиной тонкой кишки (Раневая матрица OASIS® (Healthpoint Ltd.)). Однако имеется потребность в усовершенствованных продуктах и способах для усиления заживления ран и восстановления ткани. Настоящее изобретение удовлетворяет эту потребность.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Внеклеточная матрица (ECM) позвоночных представляет собой сложный структурный элемент, окружающий и поддерживающий клетки. ECM составлена из сложных смесей структурных белков, наиболее многочисленным из которых является коллаген и другие специализированные белки и протеогликаны. Каркасный материал, описанный в настоящей заявке, представляет собой в значительной степени интактный бесклеточный каркас из компонентов натуральной биологической ECM из рыбьей кожи. Каркас может также включать естественно встречающиеся липиды из рыбьей кожи. Нативная трехмерная структура, композиция и функция дермальной ECM является по существу неизмененной и обеспечивает каркас для поддержки клеточной миграции, адгезии, пролиферации и дифференциации, таким образом, содействуя репарации и/или замещению ткани. Настоящее изобретение также относится к способам получения и применения такого каркасного материала.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 показан иллюстративный пример продукта в виде децеллюляризованной ECM (каркасного материала) полученного из рыбьей кожи, в соответствии со способом, описанным в настоящей заявке.
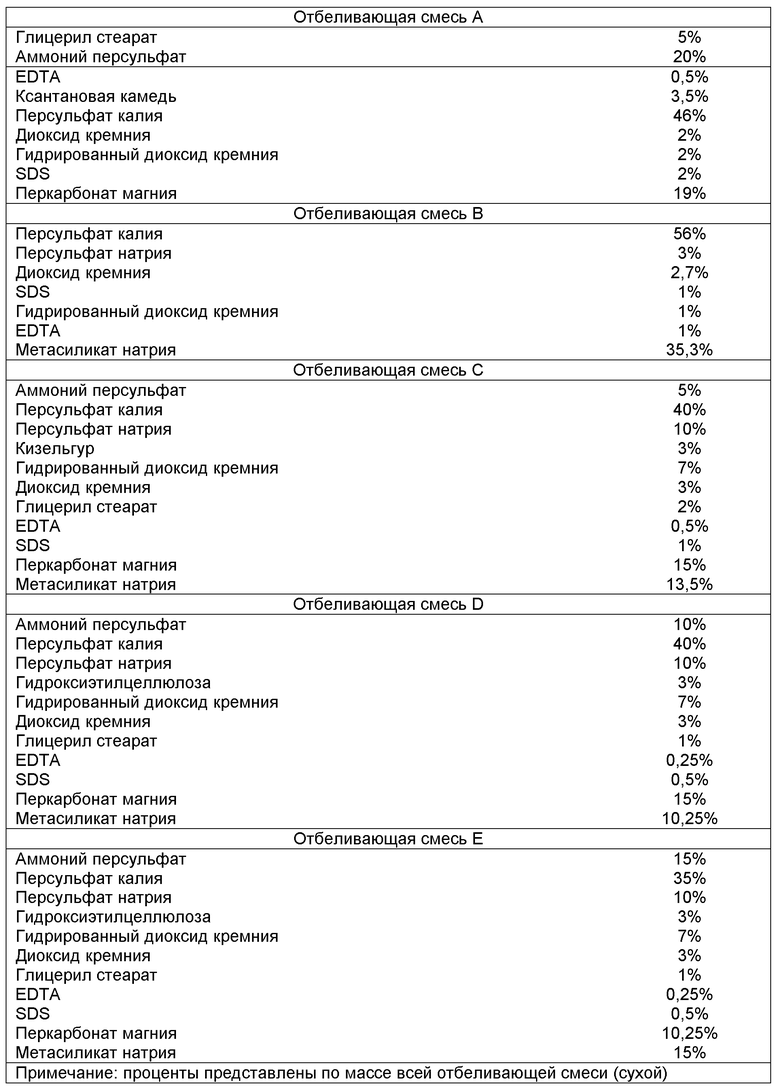
На фиг. 2 показаны оптические изображения срезов каркасного материала при увеличении в l00 (2A) и 400 (2B) раз.
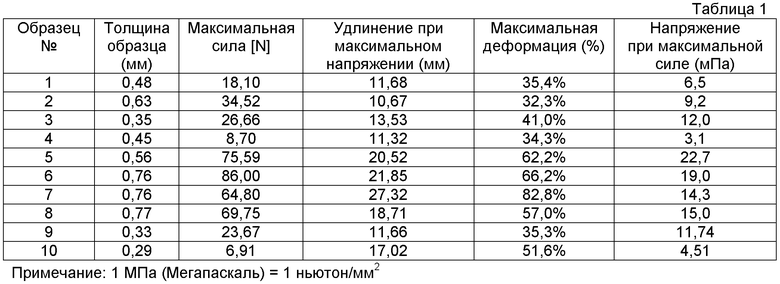
На фиг. 3 показаны изображения срезов каркасного материала при увеличении в 300 (3A) и 600 (3B) раз, полученные сканирующим электронным микроскопом (SEM).
ОПИСАНИЕ
Каркасный материал в соответствии с изобретением получают из интактной рыбьей кожи. Иллюстративный пример, показывающий внешний вид образца каркасного материала, представлен на фиг. 1. Любой вид рыб, включая костистых или хрящевых рыб, могут использоваться в качестве источника рыбьей кожи. Например, источником может быть круглая рыба, подобная треске, пикше и сомовые; плоская рыба, подобная палтусу, камбале и морскому языку; лососевые, подобные лососю и форели; скумбриевые, подобные тунцу; или мелкая рыба, подобная сельди, анчоусам, макрели и сардинам. В определенных вариантах осуществления, рыбью кожу получают из холодноводной рыбы и/или рыбы, которая, как известно, содержит большие количества омега-3 масла. Примерами рыбы с высоким содержанием омега-3 масла являются лосось, сардинопсы, тунец, сельдь, треска, сардины, макрель, волосохвост, корюшка, сиг, макруронус и некоторые разновидности форели.
Рыбью кожу удаляют с рыбы перед переработкой. Если рыбья кожа получена у вида рыбы, которые имеют чешую, то рыбью кожу следует очистить от чешуи с тем, чтобы существенная часть чешуи была удалена или, по меньшей мере, гидроксиапатит удаляется из чешуи. Фраза «существенная часть чешуи удалена» или «по существу лишенная чешуи» означает, что удалено, по меньшей мере, 95%, предпочтительно, по меньшей мере, 99%, а предпочтительнее, 100% чешуи на рыбьей коже. «По существу лишенная чешуи» рыбья кожа может также относиться к рыбьей коже от видов рыб без чешуи. Чешуя удаляется или перед переработкой исключительно механическим давлением (например, с помощью ножа, встряхивания с абразивными материалами, водой под давлением специальным устройством для удаления чешуи, которое использует такую же механическую силу как ножи или другое создающее давление устройство, подобную шлифовке керамикой или пластиком) или после некоторой химической обработки (например, децеллюляризации) и затем механическим давлением для смывания чешуи. Если рыбья кожа сначала обрабатывается химически и/или ферментативно (например, обработкой TRITON® X-100), механическое давление в целом должно быть несильным, поскольку кожа более подвержена разрывам после децеллюляризации. Чешуя может удаляться более чем в один этап, например, с частичным удалением перед децеллюляризацией, за которым следует дальнейшее удаление во время и/или после децеллюляризации. Альтернативно, чешуя может удаляться одной химической обработкой.
После удаления чешуи, рыбья кожа необязательно замораживается перед децеллюляризацией. Рыбья кожа может замораживаться быстро инкубацией кожи в жидком азоте или с использованием другого специального замораживающего оборудования, которое может заморозить кожу до -70°C или ниже, для сохранения коллагеновой структуры каркаса. Альтернативно, рыбья кожа может замораживаться в морозилке обычного типа, которая обычно имеется на рыбном заводе. Процесс замораживания может лизировать или частично лизировать клетки, содержащиеся в интактной рыбьей коже, и содействовать децеллюляризации рыбьей кожи. Если рыбья кожа была заморожена, то она может позднее оттаиваться для дальнейшей переработки.
В независимости от того, была или не была заморожена рыбья кожа, она может промываться буферным раствором перед дальнейшей переработкой. Например, рыбья кожа может промываться 1-3 раза буферным раствором, необязательно содержащим один или более антиоксидантов (например, аскорбиновую кислоту (например, 50 мМ аскорбиновой кислоты), витамины A, C, E и бета-каротин), антибиотики (например, стрептомицин и пенициллин), протеазы (например, диспазу II) и ингибиторы протеазы (например, антипаин, апротинин, бензамидин, бестатин, DFP (диизопропилфторфосфат), EDTA (этилендиаминтетрауксусную кислоту), EGTA (этиленгликольтетрауксусную кислоту), лейпептин, пепстатин, фосфорамидон и PMSF (фенилметансульфонилфторид) Для содействия дезинфекции и стабилизации рыбьей кожи. Буферный раствор может иметь pH, по меньшей мере, 5,5, такой как 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0 или более. В определенных вариантах осуществления, pH составляет от 7,0 до 9,0, например, от 7,5 до 8,5. Буферный раствор может также использоваться в качестве среды, в которой рыбья кожа может храниться в течение периода от нескольких дней до нескольких недель или более. В определенных вариантах осуществления, рыбья кожа хранится в буферном растворе при температуре примерно 4°C.
После замораживания и/или промывания, и/или хранения в буферном растворе, рыбья кожа обрабатывается одним или более децеллюляризирующих растворов для удаления клеточного материала, включая антигенный материал, из рыбьей кожи с минимальным или отсутствующим повреждением механической и структурной целостности и биологической активности естественно встречающейся внеклеточной матрицы.
Термины «внеклеточная матрица» или «ECM», используемые в настоящем описании, относятся к неклеточному тканевому материалу, присутствующему внутри рыбьей кожи, который обеспечивает структурную опору для клеток кожи, в дополнение к выполнению различных других важных функций. ECM, описанная в настоящей заявке, не включает матричный материал, который был составлен или реформирован из экстрагированных, очищенных или разделенных компонентов ECM (например, коллагена).
Термины «бесклеточная», «децеллюляризированная», «децеллюляризированная рыбья кожа» и топу подобные, используются в настоящем описании для обозначения рыбьей кожи, из которой было удалено существенное количество клеточного и нуклеиновокислотного содержимого, оставляя сложную трехмерную интерстициальную структуру ECM. «Децеллюляризированные агенты» представляют собой те агенты, которые эффективны при удалении существенного количества клеточного и нуклеиновокислотного содержимого из ECM. ECM является «децеллюляризированной» или «по существу лишенной» клеточного и нуклеиновокислотного содержимого (т.е., было удалено «существенное количество»), когда, по меньшей мере, из ECM было удалено 50% жизнеспособных и не жизнеспособных нуклеиновых кислот и другого клеточного материала. В определенных вариантах осуществления, удаляются примерно 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% жизнеспособных и не жизнеспособных нуклеиновых кислот и клеточного материала. Децеллюляризация может быть верифицирована, например, для тестирования обработанной рыбьей кожи на содержание ДНК. Удаление нуклеиновых кислот из ECM можно определить, например, гистологическим исследованием ECM и/или биохимическим анализом, таким как анализ PICOGREEN®, дифениламиновый анализ или ПЦР.
Децеллюляризация разрушает клеточные мембраны и высвобождает клеточное содержимое. Децеллюляризация может включать одну или более физических обработок, одну или более химических обработок, одну или более ферментных обработок или любую их комбинацию. Примерами физических обработок являются обработка ультразвуком, механическое перемешивание, механический массаж, механическое давление и сублимация. Примерами химических децеллюляризирующих агентов являются ионные соли (например, азид натрия), основания, кислоты, детергенты (например, неионные и ионные детергенты), окисляющие агенты (например, пероксид водорода и пероксикислоты), гипотонические растворы, гипертонические растворы, хелатирующие агенты (например, EDTA и EGTA), органические растворители (например, три(н-бутил)-фосфат), аскорбиновая кислота, метионин, цистеин, малеиновая кислота, и полимеры, которые связываются с ДНК (например, поли-L-лизин, полиэтилимин (PEI) и полиамидоамин (PAMAM)). Неионные детергенты включают 4-(1,1,3,3-Тетраметилбутил)фенилполиэтиленгликоль, т-Октилфеноксиполиэтоксиэтанол, простой трет-октилфениловый эфир полиэтиленгликоля (TRITON® X-100) (Dow Chemical Co.). Ионные детергенты включают додецилсульфат натрия (SDS), деоксихолат натрия, TRITON® X-200 и цвиттерионные детергенты (например, CHAPS). Другие подходящие децеллюляризирующие детергенты включают полиоксиэтилен (20) сорбитан моноолеат и полиоксиэтилен (80) сорбитан моноолеат (Твин 20 и 80), 3-[(3-хлорамидопропил)-диметиламино]-l-пропансульфонат, октилглюкозид и додецилсульфат натрия. Примерами ферментных децеллюляризирующих агентов являются протеазы, эндонуклеазы и экзонуклеазы. Протеазы включают серин-протеазы (например, трипсин), треониновые протеазы, цистеиновые протеазы, аспартатные протеазы, металлопротеазы (например, термолизин) и протеазы глутаминовой кислоты. Децеллюляризация в целом проводится при pH, по меньшей мере, 5,5, таком как 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0 или более. В определенных вариантах осуществления, pH составляет от 7,0 до 9,0, например, от 7,5 до 8,5.
Примером стадии децеллюляризации является инкубация рыбьей кожи в растворе, содержащем 1M NaCl, 2% деоксихолевую кислоту, 0,02% азид натрия и 500 частей на миллион (м.д.) стрептомицина. В другом примере, рыбью кожу инкубируют с первым децеллюляризирующим раствором, содержащим протеазу (например, 2,5 ЕД/мл диспазы II) и другие компоненты (например, 0,02% азид натрия). Первый децеллюляризирующий раствор выливают, и затем рыбью кожу обрабатывают вторым децеллюляризирующим раствором, таким как раствор, содержащий детергент (например, 0,5% TRITON® X-100) и другие компоненты (например, 0,02% азид натрия). В другом примере, рыбью кожу сначала обрабатывают децеллюляризирующим раствором, содержащим детергент (например, 0,5% TRITON® X-100) с другими компонентами (например, 0,02% EDTA, азидом натрия и/или деоксихолевой кислотой), и затем инкубируют во втором децеллюляризирующем растворе, содержащем детергент, такой как SDS.
Рыбья кожа может инкубироваться в условиях встряхивания или без него. Стадия (стадии) децеллюляризации могут при необходимости повторяться выливанием любого остающегося децеллюляризирующего раствора, необязательным промыванием рыбьей кожи буферным раствором (например, сбалансированным солевым раствором Хенкса), и затем снова обработкой рыбьей кожи на другой стадии децеллюляризации. После удаления достаточного количества клеточного материала, децеллюляризирующий раствор может быть удален (например, аспирацией или осторожным выливанием раствора).
После децеллюляризации, рыбья кожа может необязательно промываться водой, буферным раствором и/или солевым раствором. Примеры подходящего промывного раствора включают солевой раствор с фосфатным буфером Дульбекко (DPBS), сбалансированным солевым раствором Хенкса (HBSS), Соеда 199 (M199, SAFC Biosciences, Inc.) и/или L-глутамин. Этап(ы) промывания в целом проводятся при pH, по меньшей мере, 5,5, таком как 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0 или более. В определенных вариантах осуществления, pH составляет от 7,0 до 9,0, например, от 7,5 до 8,5.
Рыбья кожа может необязательно отбеливаться для улучшения внешнего вида конечного продукта. Отбеливание может проводиться перед, после и/или одновременно с децеллюляризацией. Например, один или более отбеливающих агентов могут быть включены в один или более децеллюляризирующий раствор(ы) и/или в один или более буферный раствор(ы). Примеры отбеливающих агентов включают сульфит натрия, пероксид водорода, персульфат аммония, персульфат калия и персульфат натрия. В определенных вариантах осуществления, если используется сильный отбеливающий агент, подобный персульфату, отбеливание и децеллюляризация могут комбинироваться в одной стадии, включающей инкубацию рыбьей кожи в смеси одного или более отбеливающих агентов, загустителей и источников пероксида. Например, может быть получена сухая отбеливающая смесь (см., например, «отбеливающие смеси», описанные в примере 5), с последующим добавлением воды, пероксида водорода или их комбинации к сухой смеси для образования отбеливающего раствора, который может быть также достаточен для децеллюляризации. Отбеливающие агенты (например, сульфит натрия, пероксид водорода, персульфат аммония, персульфат калия и персульфат натрия) должны составлять примерно 40-60% масс./масс. сухой смеси. Комбинация EDTA и персульфатов может добавляться к смеси для ускорения отбеливания, а также децеллюляризации. В определенных вариантах осуществления, концентрация EDTA в сухой смеси составляет примерно 0,25-5% масс./масс. Пероксид водорода может составлять примерно 15-25% смеси; источник пероксида может представлять собой перкарбонат натрия и перкарбонат калия. Пергидрат фосфат натрия и карбонат натрия или метасиликат магния и силикат кремния могут также использоваться в качестве источника пероксида. Сухая смесь может также включать диоксид кремния и гидрат оксида кремния в количестве, например, 1-10% масс./масс., и, необязательно, один или более стеаратов (например, стеарат аммония, стеарат натрия и/или стеарат магния). Кроме того, сухая смесь может необязательно включать загустители, такие как гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, альгин (т.е., альгинат), органические смолы (например, целлюлозу, ксантановую камедь), метасиликат натрия и их комбинации для увеличения вязкости отбеливающего/децеллюляризирующего раствора и защиты белковых волокон от повреждения. Отбеливание и/или отбеливание плюс децеллюляризация, в целом, проводится при pH, по меньшей мере, 5,5, таком как 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0 или более. В определенных вариантах осуществления, pH составляет от 7,0 до 9,0, например, от 7,5 до 8,5. После отбеливания и/или отбеливания плюс децеллюляризации рыбья кожа необязательно промывается раствором, содержащим L-глутамин, в условиях pH, описанных выше.
В определенных вариантах осуществления, рыбья кожа обрабатывается переваривающим ферментом. Аналогично отбеливанию, переваривание может проводиться перед, после и/или одновременно с децеллюляризацией. Подходящие ферменты включают протеазы, например серинпротеазы, треонинпротеазы, цистеинпротеазы, аспаратпротеазы, металлопротеазы и протеазы глутаминововй кислоты. В определенных вариантах осуществления, переваривающий фермент представляет собой серинпротеазу, такую как трипсин. Переваривающий фермент может представлять собой фермент, который функционирует в щелочной среде, ограничивает поперечную сшивку внутри ECM, и размягчает рыбью кожу. Переваривание в целом проводится при pH, по меньшей мере, 5,5, таком как 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0 или более. В определенных вариантах осуществления, pH составляет от 7,0 до 9,0, например, от 7,5 до 8,5.
Децеллюляризированная рыбья кожа может быть необязательно криоконсервирована. Криоконсервация может включать погружение рыбьей кожи в раствор криопротектора перед замораживанием. Раствор криопротектора в целом содержит соответствующий буфер, один или более криопротекторов и, необязательно, растворитель, например, органический растворитель, который в комбинации с водой подвергается минимальному расширению и сокращению. Примеры криопротекторов включают сахарозу, раффинозу, декстран, трегалозу, диметилацетамид, диметилсульфоксид, этиленгликоль, глицерол, пропиленгликоль, 2-метил-2,4-пентандиол, определенные антифризные белки и пептиды и их комбинации. Альтернативно, если децеллюляризированная рыбья кожа быстро заморожена (подвержена флэш-замораживанию) перед сублимацией для минимизации кристаллов льда, образующихся во время стадии замораживания, кожа может необязательно замораживаться в буферном растворе, который не включает криопротекторы. Криоконсервация в целом проводится при pH, по меньшей мере, 5,5, таком как 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0 или более. В определенных вариантах осуществления, pH составляет от 7,0 до 9,0, например, от 7,5 до 8,5.
Децеллюляризированная рыбья кожа может быть упакована внутрь стерильного контейнера, такого как стеклянный флакон или мешок. В одном варианте осуществления, используется мешок TYVEK®. Например, рыбья кожа может инкубироваться в растворе криопротектора, упаковываться в мешок TYVEK® и затем помещаться в лиофилизатор и замораживаться со скоростью, которая совместима с криопротектором.
Децеллюляризированная рыбья кожа может лиофилизироваться, т.е., замораживаться при низкой температуре и в условиях вакуума с тем, чтобы вода последовательно удалялась из каждой кристаллической фазы льда без перекристаллизации льда. Во время лиофилизации, вода в целом удаляется сначала посредством сублимации, а затем при необходимости посредством десорбции. Другой способ удаления избыточной воды после переработки и перед стерилизацией представляет собой вакуумное прессование.
В определенных вариантах осуществления, децеллюляризированная рыбья кожа стерилизуется перед и/или после замораживания. Способы стерилизации хорошо известны в данной области. Например, децеллюляризированная рыбья кожа может быть помещена в камеру с этиленоксидом и обработана подходящими циклами подачи этиленоксида. Другие способы стерилизации включают стерилизацию озоном, диоксидом углерода, газообразным формальдегидом или облучением (например, гамма-излучением, рентгеновским излучением, обработкой электронными лучами и субатомными частицами).
В качестве альтернативы или в дополнение к замораживанию, лиофилизации и/или вакуумному прессованию воды, децеллюляризированная рыбья кожа может консервироваться в неводном растворе, таком как спирт.
Полученный продукт (каркасный материал) представляет собой стерильную матрицу на основе коллагена, обладающую свойствами, которые могут содействовать регенерации, восстановлению и/или замещению ткани (например, восстановлению, регенерации и/или росту эндогенной ткани). Термин «каркасный материал» относится к материалу, содержащему рыбью кожу, которая была децеллюляризирована и, необязательно, отбелена, переварена, лиофилизирована и т.д., как обсуждено выше. Каркасный материал может обеспечить интактный каркас для поддержания эндотелиальных и/или эпителиальных клеток, может интегрироваться организмом хозяина, является биосовместимым, значимо не обызвествляется и может храниться и транспортироваться при окружающей температуре. Фраза «интегрироваться организмом хозяина» означает в настоящем описании, что клетки и ткани пациента, обработанные каркасным материалом, могут врастать в каркасный материал, и что каркасный материал действительно интегрируется/абсорбируется в организм пациента. Термин «биосовместимый» относится к материалу, который является по существу нетоксичным в среде in vivo его предполагаемого применения, и который по существу не отторгается физиологической системой пациента (т.е., является не антигенным). Это может оцениваться способностью материала проходить тесты биосовместимости, изложенные в Стандарте № 10993 Международной Организации Стандартов (ISO) и/или 23 Фармакопее США (USP), и/или в меморандуме № G95-1 синей книги Управления по контролю пищевых продуктов и лекарственных средств США (FDA), озаглавленном «Использование Международного стандарта ISO-10993, Биологическая оценка медицинских устройств часть 1: Оценка и тестирование». Обычно, указанные тесты измеряют токсичность, инфективность, пирогенность, возможность вызова раздражения, реактивность, гемолитическую активность, канцерогенность и/или иммуногенность материала. Биосовместимая структура или материал при введении в организм большинства пациентов не вызывает значительной побочной, длительно существующей или нарастающей биологической реакции или ответа, и отличается от легкого, преходящего воспаления, которое обычно сопровождает хирургическое вмешательство или имплантацию инородных объектов в живой организм.
Стойко высокие уровни матричных металлопротеаз (MMP) могут способствовать хроническому течению раневого процесса. Каркасный материал, описанный в настоящей заявке, может абсорбировать матричные металлопротеазы (MMP), таким образом, способствуя заживлению ран и переходу от хронической к острой ране.
Каркасный материал содержит белки из внеклеточной матрицы (ECM) рыбьей кожи. Компоненты ECM в каркасном материале могут включать, например, структурные белки; адгезивные гликопротеины; протеогликаны; не протеогликановые полисахариды и матриклеточные белки. Примеры структурных белков включают коллагены (самый многочисленный белок в ECM), такие как фибриллярные коллагены (типы I, Π, III, V и XI); FACIT коллагены (связанные с фибриллами коллагены с прерывистыми тройными спиралями, типы IX, XII и XIV), короткоцепочечные коллагены (типы VIII и X), коллаген основной мембраны (тип IV) и другие коллагены (типы VI, VII и XIII); эластин и ламинин. Примеры адгезивных гликопротеинов включают фибронектин; тенасцины и тромбоспондин. Примеры протеогликанов включают гепарин сульфат, хондроитин сульфат и кератан сульфат. Примером не протеогликанового полисахарида является гиалуроновая кислота. Матриклеточные белки представляют собой структурно разнообразную группу внеклеточных белков, которые регулируют клеточную функцию посредством взаимодействий с рецепторами клеточной поверхности, цитокинами, факторами роста, протеазами и ECM. Примеры включают тромбоспондины (TSP) 1 и 2; тенасцины и SPARC (секретируемый кислый белок богатый цистеином).
В определенных вариантах осуществления, децеллюляризация (и другие необязательные стадии обработки) не удаляет все естественно встречающиеся липиды из липидного слоя рыбьей кожи. Таким образом, каркасный материал может содержать один или более липидов из рыбьей кожи, в частности, из липидного слоя рыбьей кожи. Например, каркасный материал может включать до примерно 25% масс./масс. липидов (сухой массы всего каркасного материала после лиофилизации), например, 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6% 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23% или 24% масс./масс. липидов. Присутствие липидов в каркасном материале может верифицироваться, например, экстракцией органическим растворителем с последующей хроматографией. Примеры подходящих органических растворителей включают ацетон и хлороформ.
Липиды в каркасном материале могут включать, например, жирные ацилы (т.е., жирные кислоты, их конъюгаты и производные); глицеролипиды; глицерофосфолипиды (т.е., фосфолипиды); сфинголипиды; сахаролипиды; поликетиды; стериновые липиды (т.е., стерины); определенные жирорастворимые витамины; преноловые липиды и/или поликетиды. Примеры жирных ацилов включают насыщенные жирные кислоты, такие как полиненасыщенные жирные кислоты; сложные эфиры жирных кислот; жирные амиды и эйкозаноиды. В определенных вариантах осуществления, жирные кислоты включают омега-3 жирные кислоты, такие как эйкозапентаеноевая кислота (EPA) и докозагексаеноевая кислота (DHA) (обнаруживаемая в высокой концентрации в рыбьем жире). Другие жирные кислоты, обнаруживаемые в рыбьем жире, включают арахидоновую кислоту, гадолевую кислоту, арахидоновую кислоту, масляную кислоту, капроновую кислоту, каприловую кислоту, каприновую кислоту, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, пальмитолеиновую кислоту, стеариновую кислоту, олеиновую кислоту, вакценовую кислоту, линолевую кислоту, альфа-линоленовую кислоту, гамма-линоленовую кислоту, бегеновую кислоту, эруциновую кислоту и лигноцириновую кислоту. Примеры глицеролипидов включают моно-, ди- и три-замещенные глицеролы, такие как моноацилглицеролы, диацилглицеролы и триацилглицеролы (т.е., моноглицериды, диглицериды и триглицериды). Примеры глицерофосфолипидов включают фосфатидилхолин; фосфатидилэтаноламиин и фосфатидилсерин. Примеры сфинголипидов включают фосфосфинголипиды и гликосфинголипиды. Примеры стериновых липидов включают холестерин; стероиды и секостероиды (различные формы витамина D). Примеры преноловых липидов включают изопреноиды; каротеноиды и хиноны и гидрохиноны, такие как витамины E и K.
Каркасный материал может содержать один или более добавленных активных агентов (т.е., агент, который добавляется во время или после обработки каркасного материала), таких как антибиотики, антисептики, противомикробные средства, противовирусные средства, противогрибковые средства, противопаразитарные средства и противовоспалительные средства. Активный ингредиент может представлять собой соединение или композицию, которая содействует лечению ран и/или заживлению ткани, такой как антиоксидант или лекарственное средство. Он может также представлять собой белок или белки и/или другие биологические агенты. Антибиотики, антисептики и противомикробные средства могут добавляться в количестве, достаточном для обеспечения каркасному материалу эффективных противомикробных свойств. В определенных вариантах осуществления, противомикробное средство представляет собой один или более противомикробных металлов, таких как серебро, золото, платина, медь, цинк или их комбинация. Например, серебро может добавляться к каркасному материалу во время обработки в ионной, металлической, элементной и/или коллоидной форме. Серебро может также быть представлено в комбинации с другими противомикробными средствами. Противовоспалительные средства могут добавляться в количестве, достаточном для уменьшения и/или ингибирования воспаления в области раны или ткани, куда накладывается каркасный материал.
Каркасный материал может использоваться в сушеной форме. Альтернативно, каркасный материал может регидратироваться перед использованием. В определенных вариантах осуществления, один или более каркасных материалов ламинируются вместе для образования более толстого каркасного материала.
В целом, каркасный материал имеет толщину примерно от 0,1 до 4,0 мм (т.е., в разрезе), такую как толщина 0,5, 1,0, 1,5, 2,0, 2,5, 3,0 или 3,5 мм. Толщина может зависеть от ряда факторов, включая вид рыбы, используемой в качестве исходного материала, обработки, лиофилизации и/или регидратации (см. пример 14). Конечно, толщина пропорционально больше, когда продукт включает более чем один каркасный материал.
Каркасный материал, описанный в настоящей заявке, может использоваться для разнообразных видов медицинского применения. Например, каркасный материал может использоваться в качестве раневой повязки и/или в качестве шовного материала, где каркасный материал накладывается на область раны или ткани или на ее часть. Термин «рана» относится к любой травме в результате повреждения ткани, нарушения целостности ткани, рваных ран или повреждений. Раны, подлежащие лечению каркасным материалом, включают травмы, которые могут локализоваться в любом участке, включая внутренние, наружные, интерстициальные, экстракорпоральные и/или интракорпоральные. Примеры ран, подходящих для покрытия каркасным материалом, включают порезы, глубокие раны, открытые раны, разрыв ткани, пролежни, дерматит, повреждения, хронические раны, раны, полученные при боевых действиях, некротические раны, острые, хронические, травматические раны, рваные раны, абразии, контузии, некротизирующий фасциит, токсический эпидермальный некролиз, раны вследствие давления, язвы вследствие венозной недостаточности, артериальные язвы, диабетические или нейропатические язвы, язвы вследствие давления, смешанные язвы, ожоговые раны, мукормикоз, васкулитные раны, гангренозная пиодермия и эквиваленты и/или их комбинации, известные специалистам в данной области. Предусматривается лечение ран у людей и животных.
В определенных вариантах осуществления, каркасный материал используется для реконструкции брюшной стенки, например, пластики грыж. Например, при пластике грыж, хирурги делают разрез около локализации грыжи. По поводу паховой грыжи, разрез делается непосредственно над складкой, где брюшная стенка переходит в бедро. Для пластики пупочной грыжи, разрез делается вблизи пупка. Если грыжа возникла в участке предыдущей операции, то разрез в результате операции повторно открывается. Операция продолжается в значительной степени таким же образом, независимо от того, где сделан разрез. Грыжевой мешок осторожно вскрывается, и кишечник или другая ткань помещается назад в брюшную полость. Пластика и усиление ослабленной области производится синтетической сеткой или шовным материалом, который снова сближает брюшную мышечную ткань.
Каркасный материал, описанный в настоящей заявке, может использоваться в качестве сетчатого материала или шовного материала, или использоваться для усиления сетчатого материала или шва. Каркасный материал может использоваться для укрепляющего или усиливающего излечение ран или заживление ткани продукта, такого как раневой перевязочный материал, сетчатый материал, повязка или шовный материал. Например, каркасный материал может использоваться около или может переплетаться с раневой повязкой, сетчатым материалом или шовным материалом. При использовании в качестве сетчатого материала или шовного материала или для укрепления сетчатого материала или шовного материала каркасный материал может быть обработан для увеличения поперечной сшивки компонентных материалов ECM, с использованием, например, химических поперечно сшивающих агентов, таких как глутаровый альдегид или хром. Каркасный материал может также использоваться для замещения утраченной десенной ткани вследствие заболевания периодонта, формирования поддерживающей фиксации мочевого пузыря и содействия реконструкции тазового дна.
Пока контекст ясно диктует иное, используемые в настоящем описании формы единственного числа, обозначаемые неопределенным и определенным артиклем, включают соответствующие формы множественного числа.
Публикации, приведенные в настоящем описании, представлены исключительно для их раскрытия перед датой подачи настоящей заявки. Ничто в данном описании не должно рассматриваться как допущение, что настоящее описание не предназначено для предвосхищения такой публикации в силу предшествующего раскрытия. Кроме того, представленные даты публикации могут отличаться от действительных дат публикации, которые могут требовать независимого подтверждения. Все публикации, патенты, патентные заявки и другие ссылки, приведенные в настоящем описании, полностью включены в него путем ссылки.
Хотя изобретение было подробно описано со ссылкой на его определенные варианты осуществления, для специалиста в данной области будет очевидно, что различные изменения могут быть внесены и эквиваленты использованы без отхода от объема описания. Кроме того, следующие примеры являются лишь иллюстративными и ни в коей мере не должны рассматриваться как ограничивающие раскрываемое изобретение.
ПРИМЕРЫ
Пример 1
Удаление кожи
Кожу удаляли с рыбьего филе вместе с насколько возможно большим количеством эпидермального жира. Рыбью кожу очищали от чешуи на разделочной доске соскабливанием с поверхности рыбьей кожи ножом.
Дезинфекция и стабилизация
Очищенную от чешуи кожу промывали два раза в течение 1 ч при 4°C стерильным солевым раствором с фосфатным буфером, содержащим соответственно 50 мМ аскорбиновой кислоты, 500 м.д. стрептомицина.
Децеллюляризация
a) Рыбью кожу помещали в 1M NaCl на 8 ч с последующей инкубацией в 2% деоксихолевой кислоте, содержащей 0,02% азида натрия и 500 м.д. стрептомицина.
b) Раствор с подстадии a) выливали. Рыбью кожу помещали в сбалансированный солевой раствор Хенкса на 10 мин при 40 об/мин при комнатной температуре. Эту стадию повторяли, и рыбью кожу помещали в контейнере в вытяжной шкаф с ламинарным потоком, контейнер открывали и раствор удаляли аспирацией. Процедуру повторяли еще два раза.
c) Рыбью кожу обрабатывали децеллюляризирующим раствором, содержащим 0,5% SDS, и контейнер помещали на ротатор при 40 об/мин на 1 ч при комнатной температуре.
d) Децеллюляризирующий раствор удаляли, как описано в пункте b), аспирацией. Рыбью кожу промывали 50 мл забуференного фосфатом солевого раствора Дульбекко.
Переваривание
Рыбью кожу инкубировали в течение 18 ч при комнатной температуре в переваривающем растворе, который состоял из 1M Трис-HCl, трипсина при 0,05 мкг/мл, при pH 8,5.
Криопротекция
Рыбью кожу погружали в раствор для обработки перед замораживанием, содержащий 7% декстрана, 6% сахарозы, 6% раффинозы и 1 мМ EDTA в сбалансированном солевом растворе Хенкса.
Промывание
Рыбью кожу промывали раствором для обработки перед замораживанием и помещали в ротатор при 40 об/мин на 120 мин при комнатной температуре.
Упаковка
Рыбью кожу помещали в мешок, который герметично укупоривали нагреванием. Мешок представлял собой мешок из пористой мембраны TYVEK® медицинского сорта, выпускаемой компанией DuPont, подходящей для стерилизации этиленоксидом (EtOx).
Лиофилизация
Мешок, содержащий рыбью кожу, помещали в лиофилизатор и лиофилизировали.
Стерилизация
Мешок, содержащий рыбью кожу, помещали в камеру, заполненную этиленоксидом, и обрабатывали 1-5 циклами воздействия этиленоксидом для стерилизации рыбьей кожи.
Пример 2
Удаление кожи
Кожу удаляли с рыбьего филе вместе с насколько возможно большим количеством эпидермального жира. Рыбью кожу очищали от чешуи на разделочной доске соскабливанием с поверхности рыбьей кожи ножом.
Дезинфекция и стабилизация
Очищенную от чешуи кожу промывали два раза в течение 1 ч при 4°C стерильным солевым раствором с фосфатным буфером, содержащим соответственно 50 мМ аскорбиновой кислоты, 500 м.д. стрептомицина.
Децеллюляризация
a) Рыбью кожу помещали в солевой раствор с фосфатным буфером, содержащим 2,5 ЕД/мл диспазы II (или проназы) и 0,02% азида натрия и инкубировали при 4°C в течение 8 ч при постоянном встряхивании. Затем раствор выливали, и образец инкубировали при легком встряхивании во втором растворе 0,5% TRITON® X-100 и 0,02% азида натрия в течение 24 ч.
b) Второй раствор со стадии a) выливали. Рыбью кожу помещали в сбалансированный солевой раствор Хенкса на 10 мин при 40 об/мин при комнатной температуре. Эту стадию повторяли и рыбью кожу помещали в контейнер в вытяжной шкаф с ламинарным потоком, открывали и раствор удаляли аспирацией. Процедуру повторяли еще два раза.
c) Рыбью кожу обрабатывали децеллюляризирующим раствором, содержащим 0,5% SDS, и контейнер помещали на ротатор при 40 об/мин на 1 ч при комнатной температуре.
d) Децеллюляризирующий раствор со стадии c) удаляли, как описано в пункте b), аспирацией. Рыбью кожу промывали 50 мл забуференного фосфатом солевого раствора Дульбекко.
Переваривание
Рыбью кожу инкубировали в течение 18 ч при комнатной температуре в переваривающем растворе, который состоял из 1M Трис-HCl, 0,05 мкг/мл трипсина, при pH 8,5.
Криопротекция
Рыбью кожу погружали в раствор для обработки перед замораживанием, содержащий 7% декстрана, 6% сахарозы, 6% раффинозы и 1 мМ EDTA в сбалансированном солевом растворе Хенкса.
Промывание
Рыбью кожу промывали раствором для обработки перед замораживанием и помещали в ротатор при 40 об/мин на 120 мин при комнатной температуре.
Упаковка
Рыбью кожу помещали в мешок из мембраны TYVEK®в, который герметично укупоривали нагреванием.
Лиофилизация
Мешок, содержащий рыбью кожу, помещали в лиофилизатор и лиофилизировали.
Стерилизация
Мешок, содержащий рыбью кожу, помещали в камеру, заполненную этиленоксидом, и обрабатывали 1-5 циклами воздействия этиленоксидом для стерилизации рыбьей кожи.
Пример 3
Удаление кожи
Кожу удаляли с рыбьего филе вместе с насколько возможно большим количеством эпидермального жира. Рыбью кожу очищали от чешуи на разделочной доске соскабливанием с поверхности рыбьей кожи ножом.
Замораживание
Рыбью кожу замораживали в стандартном замораживателе быстрого замораживания рыбного завода. Во время процесса замораживания, клетки лизировались. Замораживание подавляет микробный рост.
Оттаивание
Рыбью кожу оттаивали при 4°C.
Дезинфекция и стабилизация
Очищенную от чешуи кожу промывали два раза в течение 1 ч при 4°C стерильным солевым раствором с фосфатным буфером, содержащим соответственно 50 мМ аскорбиновой кислоты, 500 м.д. стрептомицина.
Децеллюляризация
a) Рыбью кожу обрабатывали децеллюляризирующим раствором, содержащим 0,5% SDS, и контейнер помещали на ротатор при 40 об/мин на 1 ч при комнатной температуре.
b) Децеллюляризирующий раствор удаляли аспирацией. Рыбью кожу промывали 50 мл забуференного фосфатом солевого раствора Дульбекко.
Переваривание
Рыбью кожу инкубировали в течение 18 ч при комнатной температуре в переваривающем растворе 1M Трис-HCl, 0,05 мкг/мл трипсина, при pH 8,5.
Криопротекция
Рыбью кожу погружали в раствор для обработки перед замораживанием, содержащий 7% декстрана, 6% сахарозы, 6% раффинозы и 1 мМ EDTA в сбалансированном солевом растворе Хенкса.
Промывание
Рыбью кожу промывали раствором для обработки перед замораживанием и помещали в ротатор при 40 об/мин на 120 мин при комнатной температуре.
Упаковка
Рыбью кожу помещали в мешок из мембраны TYVEK®в и герметично укупоривали нагреванием.
Лиофилизация
Мешок, содержащий рыбью кожу, помещали в лиофилизатор и лиофилизировали.
Стерилизация
Мешок, содержащий рыбью кожу, помещали в камеру, заполненную этиленоксидом, и обрабатывали 1-5 циклами воздействия этиленоксидом для стерилизации рыбьей кожи.
Пример 4
Рыбью кожу обрабатывали, как описано в каждом из примеров 1-3, за исключением того, что в раствор для обработки перед замораживанием также добавляли отбеливающий агент (сульфит натрия) в концентрации 0,5% на стадии промывания для получении отбеленной каркасной матрицы.
Пример 5
Отбеленные/децеллюляризованные матрицы получали следующим образом:
Пример 6
Удаление кожи
Кожу удаляли из рыбьего филе. Рыбью кожу по существу очищали от чешуи путем соскабливания поверхности рыбьей кожи щеткой со стальной проволокой и ножом.
Замораживание
Рыбью кожу замораживали в быстром замораживателе (т.е., помещали непосредственно в морозилку при -80°C). Затем кожу извлекали из морозилки и оттаивали при комнатной температуре в течение примерно 2 ч.
Децеллюляризация
a) Ткань инкубировали в растворе 0,5% TRITON® X-100 и 0,02% азида натрия в забуференном фосфатом солевом растворе (DPBS), встряхивали при 40 об/мин в течение 2 ч при комнатной температуре, и раствор выливали.
b) Процесс удаления чешуи продолжали ножом. В результате получали лишенный чешуи продукт (без видимых чешуй).
c) Затем ткань помещали в 2 мМ L-Глутамин в сбалансированном солевом растворе Хенкса (HBSS) на 10 мин при 40 об/мин и комнатной температуре, и раствор выливали.
d) Ткань помещали в раствор 0,5% додецилсульфата натрия (SDS) в HBSS на l ч при комнатной температуре, встряхивали при 40 об/мин, и раствор выливали.
Переваривание
Ткань инкубировали в течение 18 ч при комнатной температуре в переваривающем растворе 1 мМ EDTA и 0,05 г/мл трипсина при pH 8,5.
Отбеливание
Ткань отбеливали отбеливающей смесью C и 2% пероксидом водорода в течение 30 минут.
Промывание
Ткань промывали в постоянном потоке воды в течение 48 часов при 6°C.
Рыбью кожу погружали в раствор для обработки перед замораживанием, содержащий 7% декстрана, 6% сахарозы, 6% раффинозы и 1 мМ EDTA в забуференном фосфатом солевом растворе Хенкса (DPBS).
Упаковка
Рыбью кожу помещали в мешок из мембраны TYVEK®в и герметично укупоривали нагреванием.
Лиофилизация
Мешок, содержащий рыбью кожу, помещали в лиофилизатор и лиофилизировали.
Стерилизация
Мешок, содержащий рыбью кожу, помещали в камеру, заполненную этиленоксидом, и обрабатывали 1-5 циклами воздействия этиленоксидом для стерилизации каркаса.
Пример 7
Продукт получали как в примере 6, кроме стадии замораживания после удаления кожи. Вместо стадии замораживания, ткань промывали два раза в течение 1 ч при 4°C стерильным забуференным фосфатом солевым раствором, содержащим соответственно 50 мМ аскорбиновой кислоты, 500 м.д. стрептомицина.
Пример 8
Удаление кожи
Кожу удаляли из рыбьего филе. Рыбью кожу очищали от чешуи путем соскабливания поверхности рыбьей кожи щеткой со стальной проволокой и ножом.
Замораживание
Рыбью кожу замораживали в быстром замораживателе при -80°C. Затем кожу извлекали из морозилки и оттаивали при комнатной температуре в течение примерно 2 ч.
Децеллюляризация
a) Ткань инкубировали в растворе 0,5% TRITON® X-100 и 0,02% EDTA в забуференном фосфатом солевом растворе Дульбекко (DPBS), встряхивали при 40 об/мин в течение 24 ч при комнатной температуре, и раствор выливали.
b) Процесс удаления чешуи продолжали ножом. В результате получали лишенный чешуи продукт (без видимых чешуй).
c) Затем ткань помещали в раствор 0,5% додецилсульфата натрия (SDS) в HBSS на l ч при комнатной температуре, встряхивали при 40 об/мин, и раствор выливали.
d) Затем ткань помещали в 2 мМ L-Глутамин в сбалансированном солевом растворе Хенкса (HBSS) на 10 мин при 40 об/мин и комнатной температуре, и раствор выливали.
Отбеливание
Ткань отбеливали отбеливающей смесью C и 2% пероксидом водорода в течение 30 минут.
Промывание
Ткань промывали в непрерывном потоке воды в течение 48 часов при 6°C.
Криопротекция
Рыбью кожу погружали в раствор для обработки перед замораживанием, содержащий 7% декстрана, 6% сахарозы, 6% раффинозы и 1 мМ EDTA в забуференном фосфатом солевом растворе Дульбекко (DPBS).
Упаковка
Рыбью кожу помещали в мембранный мешок TYVEK® и герметично укупоривали нагреванием.
Лиофилизация
Мешок, содержащий рыбью кожу, помещали в лиофилизатор и лиофилизировали.
Стерилизация
Мешок, содержащий рыбью кожу, помещали в камеру, заполненную этиленоксидом, и обрабатывали 1-5 циклами воздействия этиленоксидом для стерилизации каркаса.
Пример 9
Продукт получали как в примере 8, кроме стадии замораживания после удаления кожи. Вместо стадии замораживания, ткань промывали два раза в течение 1 ч при 4°C стерильным забуференным фосфатом солевым раствором, содержащим соответственно 50 мМ аскорбиновой кислоты, 500 м.д. стрептомицина.
Пример 10
Удаление кожи
Кожу удаляли из рыбьего филе. Рыбью кожу очищали от чешуи путем соскабливания поверхности рыбьей кожи щеткой со стальной проволокой и ножом.
Замораживание
Рыбью кожу замораживали в быстром замораживателе при -80°C. Затем кожу извлекали из морозилки и оттаивали при комнатной температуре в течение примерно 2 ч.
Децеллюляризация
a) Ткань инкубировали в растворе 0,5% TRITON® X-100 и 0,02% EDTA в забуференном фосфатом солевом растворе Дульбекко (DPBS), встряхивали при 40 об/мин в течение 48 ч при комнатной температуре, и раствор выливали.
b) Затем ткань помещали в 2 мМ L-Глутамин в сбалансированном солевом растворе Хенкса (HBSS) на l0 мин при 40 об/мин и комнатной температуре, и раствор выливали.
Отбеливание
Ткань отбеливали отбеливающей смесью C Керециса и 2% пероксидом водорода в течение 30 минут.
Промывание
Ткань промывали в непрерывном потоке воды в течение 12 часов при 6°C.
Криопротекция
Рыбью кожу погружали в раствор для обработки перед замораживанием, содержащий 7% декстрана, 6% сахарозы, 6% раффинозы и 1 мМ EDTA в забуференном фосфатом солевом растворе Дульбекко (DPBS).
Упаковка
Рыбью кожу помещали в мембранный мешок TYVEK® и герметично укупоривали нагреванием.
Лиофилизация
Мешок, содержащий рыбью кожу, помещали в лиофилизатор и лиофилизировали.
Стерилизация
Мешок, содержащий рыбью кожу, помещали в камеру, заполненную этиленоксидом, и обрабатывали 1-5 циклами воздействия этиленоксидом для стерилизации каркаса.
Пример 11
Продукт получали как в примере 10, кроме стадии замораживания после удаления кожи. Вместо стадии замораживания, ткань промывали два раза в течение 1 ч при 4°C стерильным забуференным фосфатом солевым раствором, содержащим соответственно 50 мМ аскорбиновой кислоты, 500 м.д. стрептомицина.
Пример 12
Удаление кожи
Кожу удаляли из рыбьего филе. Рыбью кожу очищали от чешуи путем соскабливания с поверхности рыбьей кожи щеткой со стальной проволокой и ножом. В результате получали продукт, лишенный чешуи.
Замораживание
Рыбью кожу замораживали в быстром замораживателе при -80°C. Затем кожу извлекали из морозилки и оттаивали при комнатной температуре в течение примерно 2 ч.
Децеллюляризация и отбеливание
a) Ткань инкубировали с отбеливающей смесью C и 2% пероксидом водорода в течение 30 минут.
b) Ткань помещали в раствор 0,5% додецилсульфата натрия (SDS) в HBSS на l ч при комнатной температуре, встряхивали при 40 об/мин и раствор выливали.
c) Затем ткань помещали в 2 мМ L-Глутамин в сбалансированном солевом растворе Хенкса (HBSS) на 10 мин при 40 об/мин при комнатной температуре, и раствор выливали.
Промывание
Ткань промывали в непрерывном потоке воды в течение 12 часов при 6°C.
Криопротекция
Рыбью кожу погружали в раствор для обработки перед замораживанием, содержащий 7% декстрана, 6% сахарозы, 6% раффинозы и 1 мМ EDTA в забуференном фосфатом солевом растворе Дульбекко (DPBS).
Упаковка
Рыбью кожу помещали в мембранный мешок TYVEK® и герметично укупоривали нагреванием.
Лиофилизация
Мешок, содержащий рыбью кожу, помещали в лиофилизатор и лиофилизировали.
Стерилизация
Мешок, содержащий рыбью кожу, помещали в камеру, заполненную этиленоксидом, и обрабатывали 1-5 циклами воздействия этиленоксидом для стерилизации каркаса.
Пример 13
Продукт получали как в примере 12, кроме стадии замораживания после удаления кожи. Вместо стадии замораживания, ткань промывали два раза в течение 1 ч при 4°C стерильным забуференным фосфатом солевым раствором, содержащим соответственно 50 мМ аскорбиновой кислоты, 500 м.д. стрептомицина.
Пример 14
Толщину продукта измеряли до и после лиофилизации. Толщину измеряли цифровым штангенциркулем. Средняя толщина до и после лиофилизации составила соответственно 0,29 мм и 0,46 мм. Продукт может регидратироваться (например, в водном растворе соли) после лиофилизации и перед наложением на рану. Когда тестировался лиофилизированный и регидратированный продукт, то средняя толщина составила 0,30 мм. По расчетам, потеря воды (на основании разницы массы до и после лиофилизации) составила примерно 80-82%.
Пример 15
Проницаемость продукта измеряли в условиях атмосферного давления и вакуума (0,2 атм.). Средняя проницаемость при атмосферном давлении составила 3,73 мг воды на квадратный мм образца за 24 ч. Средняя проницаемость в вакууме составила 4,93 мг воды на квадратный мм образца за 180 сек.
Пример 16
Предварительные тесты биоразлагаемости выполняли инкубацией образцов продукта или в изотоническом растворе соли в воде, или в модифицированной по Дульбекко среде Игла (DMEM) (Gibco) при 32°C. Примерно через 6-10 дней образцы разрушились более чем на 50% (по массе).
Пример 17
Предварительные тесты цитотоксичности выполняли инкубацией образцов продукта с фибробластными клетками крайней плоти человека (линия клеток Hs27, ATCC CRL-1634) в DMEM, глюкозе и 10% фетальной телячьей сыворотке. Образцы не вывали никаких выявляемых фенотипических изменений, уменьшения или гибели клеток.
Пример 18
Продукт тестировали для определения предела текучести, прочности на растяжение и удлинения. Однородные образцы, имеющие размер 33 мм на 6 мм, регидратировали и фиксировали в губках тисков при давлении 0,4 бар в динамометрическом элементе 500 N. Образцы поддерживали во влажном состоянии в течение тестирования. Результаты показаны ниже в таблице 1.
Каркасный материал, описанный в настоящей заявке, прочнее и растягивается значительно больше, чем трансплантаты бесклеточной матрицы из мочевых пузырей крыс, свиней и людей (см. Dahms et al., Composition and biomechanical properties of the bladder acellular matrix graft: comparative analysis in rat, pig and human. British Journal of Urology. 1998;82(3):411-419) и утвержденного FDA материала ALLODERMDERM ® (см. Bottino et al., Freeze-dried acellular dermal matrix graft: Effects of rehydration on physical, chemical, and mechanical properties. Dental Materials. 2009;25(9):1109-1115).
Были предприняты попытки тестирования прочности на растяжение OASIS® (подслизистой оболочки тонкой кишки свиней) и MATRISTEM™ (свиного мочевого пузыря), но образцы обоих продуктов разрушались перед тем как можно было произвести какие-либо измерения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДЕЦЕЛЛЮЛЯРИЗИРОВАННЫХ МАТРИКСОВ ПАРЕНХИМАТОЗНЫХ ОРГАНОВ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2016 |
|
RU2653489C2 |
| СПОСОБ УСКОРЕННОЙ ДЕЦЕЛЛЮЛЯРИЗАЦИИ БИОЛОГИЧЕСКОЙ ТКАНИ ИЛИ ОРГАНА | 2019 |
|
RU2714327C1 |
| Тканеспецифический матрикс для тканевой инженерии паренхиматозного органа и способ его получения | 2016 |
|
RU2693432C2 |
| СПОСОБ ПОЛУЧЕНИЯ МАТРИКС-СВЯЗАННЫХ ВЕЗИКУЛ ИЗ МОНОСЛОЙНЫХ КУЛЬТУР КЛЕТОК И КЛЕТОЧНЫХ СФЕРОИДОВ | 2021 |
|
RU2785136C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТКАНЕСПЕЦИФИЧЕСКОГО МАТРИКСА ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ ПАРЕНХИМАТОЗНОГО ОРГАНА | 2013 |
|
RU2539918C1 |
| Способ получения тканеспецифического матрикса для тканевой инженерии хряща | 2019 |
|
RU2716577C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ДЕРМЫ ДЛЯ ПОСЛЕДУЮЩЕЙ РЕКОНСТРУКЦИИ ОБШИРНЫХ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ | 2018 |
|
RU2704489C1 |
| Способ децеллюляризации гомографта сердечно-сосудистой системы сверхкритическим диоксидом углерода | 2022 |
|
RU2802349C1 |
| Способ оценки качества децеллюляризированных матриксов для получения биоинженерных трансплантатов | 2016 |
|
RU2619642C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕЛЛЮЛЯРНОГО ДЕРМАЛЬНОГО МАТРИКСА | 2021 |
|
RU2769248C1 |

Изобретение относится к фармацевтической промышленности, а именно к каркасному материалу для лечения ран. Каркасный материал для лечения ран, содержащий интактную децеллюляризированную рыбью кожу, которая содержит внеклеточный матричный материал и до 25% (масс./масс.) липидов из интактной рыбьей кожи. Способ получения каркасного материала, включающий получение рыбьей кожи, децеллюляризацию рыбьей кожи, где каркасный материал содержит внеклеточный матричный материал из интактной рыбьей кожи. Применение каркасного материала для лечения раны. Вышеописанный способ позволяет получить каркасный материал, эффективный для лечения ран и позволяет расширить арсенал бесклеточных матричных трансплантатов. 4 н. и 9 з.п. ф-лы, 3 ил., 1 табл., 18 пр.
1. Каркасный материал для лечения ран, содержащий интактную децеллюляризированную рыбью кожу, которая содержит внеклеточный матричный материал и до 25% (масс./масс.) липидов из интактной рыбьей кожи.
2. Каркасный материал по п. 1, где каркасный материал содержит 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6% 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23% или 24% масс./масс. липидов из интактной рыбьей кожи.
3. Каркасный материал по п. 1, где каркасный материал представлен в форме раневой повязки, перевязочного материала, шовного материала и/или сетчатого материала.
4. Каркасный материал по п. 1, где каркасный материал получен из по существу лишенной чешуи рыбьей кожи.
5. Каркасный материал по п. 1, где каркасный материал является биосовместимым.
6. Каркасный материал по п. 1, где каркасный материал, кроме того, содержит один или более добавленных активных агентов, выбранных из группы, состоящей из антибиотиков, антисептиков, противомикробных средств, противовирусных средств, противогрибковых средств, противопаразитарных средств, противовоспалительных средств, антиоксидантов, белков, пептидов и их комбинаций.
7. Способ получения каркасного материала по любому из пп. 1-6, включающий:
(a) получение рыбьей кожи; и
(b) децеллюляризацию рыбьей кожи,
где каркасный материал содержит внеклеточный матричный материал из интактной рыбьей кожи.
8. Способ по п. 7, дополнительно включающий удаление чешуи, промывание, замораживание, отбеливание, переваривание и/или криопротекцию рыбьей кожи.
9. Способ по п. 7, где децеллюляризация включает одну или более физическую обработку, одну или более химическую обработку, одну или более ферментную обработку или любую их комбинацию.
10. Способ по п. 9, где химическая обработка включает обработку рыбьей кожи одним или более децеллюляризирующими агентами, выбранными из группы, состоящей из ионных солей, оснований, кислот, детергентов, окисляющих агентов, гипертонических растворов, хелатирующих агентов, органических растворителей, метионина, цистеина, малеиновой кислоты, полимеров, которые связываются с ДНК, и их комбинаций.
11. Способ по п. 9, где ферментная обработка включает обработку рыбьей кожи одним или более ферментом, выбранным из группы, состоящей из протеаз, эндонуклеаз и экзонуклеаз.
12. Каркасный материал, полученный с использованием способа по пп. 7-11.
13. Применение каркасного материала по любому из пп. 1-6 для лечения раны.
| EP 753313 А1, 15.01.1997 | |||
| Ikama T., et al | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| ПЕЧНОЙ ЖЕЛЕЗНЫЙ РУКАВ (ТРУБА) | 1920 |
|
SU199A1 |
| US 20090036656 A1, 05.02.2009 | |||
| DE 10196235 B4, 06.12.2001. | |||
Авторы
Даты
2015-11-20—Публикация
2010-10-06—Подача