Область техники, к которой относится изобретение
Настоящее изобретение относится к применению по меньшей мере одной органической молекулы, замещенной в каком-либо положении по меньшей мере одной нитрооксигруппой, для снижения количества метана, образующегося за счет пищеварительной активности жвачных животных, и/или для повышения продуктивности жвачных животных.
Кроме того, настоящее изобретение относится к корму для животных или к композиции корма для животных и к кормовым добавкам, содержащим указанные выше молекулы. Термин «корм или кормовая композиция» означает любые соединения, препараты, смеси или композиции, подходящие или предназначенные для потребления животными.
В рамках настоящего изобретения жвачные животные представляют собой млекопитающие отряда парнокопытных, которые переваривают растительную пищу путем первоначального размягчения пищи внутри первого отдела желудка животного, известного как рубец, последующего срыгивания полупереваренной массы, известной как жвачка, и ее повторного пережевывания. Процесс повторного пережевывания жвачки с целью дополнительного разложения и стимулирования пищеварения называется "жевание жвачки".
Ферментация в рубце приводит к некоторым неудобствам. В качестве естественного результата анаэробной ферментации образуется метан, что означает энергетические потери для данного животного. Углеводы составляют до 70-80% от сухой массы в типичном рационе молочного скота, и, несмотря на это, поглощение углеводов из желудочно-кишечного тракта обычно весьма ограничено. Причина этого явления заключается в том, что экстенсивная ферментация углеводов в рубце приводит к образованию в качестве основных продуктов ацетата, пропионата и бутирата. Указанные продукты составляют часть так называемых летучих жирных кислот (ЛЖК).
Кроме указанных энергетических потерь, метан также является парниковым газом, эффективность которого во много раз выше, чем у CO2. Концентрация метана в атмосфере за последние 100 лет удвоилась, и этот угрожающий рост продолжается. Жвачные животные обеспечивают основной вклад в биогенное образование метана, причем по имеющимся оценкам предотвращение образования метана жвачными животными могло бы практически стабилизировать концентрацию метана в атмосфере.
Кроме того, Киотским протоколом с последующим климатическим саммитом в Копенгагене в 2009 установлен повышенный приоритет проблемы снижения выделения метана как части стратегии по учету множества газов. В настоящее время наиболее эффективные добавки, применяемые для снижения образования метана, содержат антибиотики, которые подавляют быстрое размножение микроорганизмов, продуцирующих водород (Н2) для метан-продуцирующих бактерий (Sauer и др. 1998. American Society of Animal Science; 76: 906-914). Однако регулировка образования метана с помощью антибиотиков имеет некоторые недостатки, связанные с быстрой адаптацией микрофлоры и/или развития резистентности, что приводит к полной потере желательного эффекта в течение короткого периода времени (от 2 до 3 недель), а также с тем, что в Европе запрещено применять антибиотики для нетерапевтических целей.
Недавно были описаны неантибиотические продукты (производные желчных кислот), обеспечивающие уменьшение выделения метана при испытании с использованием имитационной модели рубца in vitro (WO 2010072584). Однако количество, необходимое для достижения сколько-нибудь заметного уменьшения выделения метана, не совместимо с ограничениями, имеющимися в вопросе стоимости кормов для жвачных животных.
Кроме того, в научной литературе описан ряд природных растительных экстрактов (чеснок: WO 2009150264, юкка, корица, ревень…), используемых в качестве растворов, способных, как следует из экспериментов in vitro, снизить выделение метана жвачными животными. Однако ни один из указанных растворов так и не достиг рынка по причине побочных эффектов (осадок в молоке), низкой эффективности при испытании in vivo или в связи с очень большим количеством добавки, которое необходимо ввести животному для достижения сколько-нибудь значительного снижения выделения метана.
В указанных обстоятельствах существует необходимость в разработке новых веществ, снижающих образование метана, которые соответствуют требованиям надежной и общепринятой практики, и при этом не являются медикаментом. В дополнение к снижению выделения метана, такие вещества также могут давать вклад в улучшение продуктивности жвачных животных в результате повышения степени превращения корма, снижения потребления корма, повышения привеса, и/или улучшения туши, или увеличения выхода молока.
Авторы настоящего изобретения неожиданно обнаружили, что указанные ниже соединения обладают большим потенциалом для использования в кормах для животных с целью значительного уменьшения образования метана без какого-либо вредного для животного-хозяина влияния на микробную ферментацию. Более того, соединения по настоящему изобретению также обеспечивают значительное увеличение общей продуктивности животного, измеренной по степени превращения корма, потреблению корма, привесу, выходу туши или выходу молока. Кроме того, указанные соединения являются более стабильными, чем соединения, описанные в уровне техники, они более безопасны для животных и людей, приводят к устойчивому эффекту снижения метана, не влияют на вкусовые качества и могут производиться в промышленном масштабе, причем их стоимость соответствует требованиям производства животных кормов. Более того, эти соединения не провоцируют накопление каких-либо метаболитов в молоке или мясе животных, которым дают такие соединения, и они обладают активностью при весьма низкой концентрации в рубце.
В частности, авторы настоящего изобретения обнаружили, что введение жвачным животным по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой, является весьма эффективным для снижения образования метана, выделяющегося за счет пищеварительной активности жвачных животных, без отрицательного влияния на общее образование ЛЖК, и/или для улучшения продуктивности жвачных животных. Более того, авторы настоящего изобретения обнаружили, что при замене нитрооксигруппы на другие химические группы с аналогичными физико-химическими свойствами, технический эффект изобретения в отношении продуцирования метана теряется; это демонстрирует, что нитрооксигруппа является ключевой для эффекта настоящего изобретения, т.е. для уменьшения продуцирования метана.
Из заявки на международный патент № РСТ/ЕР 2010/069338 известно, что производные нитроокси-карбоновых кислот являются сильными ингибиторами метан-продуцирующих бактерий в рубце in vitro, а также in vivo. Поэтому указанные молекулы специально исключены из формулы настоящего изобретения.
Таким образом, настоящее изобретение раскрывает применение по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой и соответствующих формуле (I), или их солей, в качестве активного соединения при кормлении животных для снижения образования метана, выделяющегося за счет пищеварительной активности жвачных животных, и/или для повышения продуктивности жвачных животных.
Кроме того, изобретение относится к способу снижения образования метана, выделяющегося за счет пищеварительной активности жвачных животных, и/или повышения продуктивности жвачных животных, включающему в себя введение животному достаточного количества по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигрупп и соответствующих формуле (I), или их солей. Следует понимать, что оральное введение означает простое кормление или введение пищевого комка вручную.
Во всех вариантах осуществления настоящего изобретения органические молекулы, замещенные в каком-либо положении по меньшей мере одной нитрооксигруппой, или их соли определяются соединениями формулы (I)
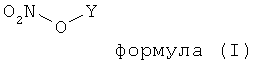 ,
,
в которой Y означает органическую молекулу следующего состава: CaHbOdNeSg, где
а включает в себя числа между 1 и 25, предпочтительно между 1 и 10,
b включает в себя числа между 2 и 51, предпочтительно между 2 и 21,
d включает в себя числа между 0 и 8, предпочтительно между 0 и 6,
е включает в себя числа между 0 и 5, предпочтительно между 0 и 3,
g включает в себя числа между 0 и 3, предпочтительно между 0 и 1,
причем из объема формулы (I) исключены нитрооксиалкановые кислоты, и/или их производные, соответствующие формуле (II)
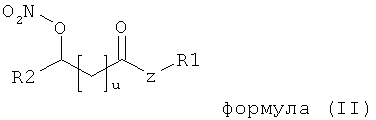 ,
,
в которой
u включает в себя числа между 0 и 23, причем если u≠0, то соответствующая углеродная цепочка является линейной, циклической, или разветвленной линейной или циклической алифатической углеродной цепочкой, которая может быть моно- или полиненасыщенной и может находиться в любой изомерной форме,
Z независимо означает О, NH или N-R3, причем если R1≠Н, Z-R1 означает сложный эфир или производное вторичного амида,
R1 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой, циклической или разветвленной цепочкой, содержащей от 1 до 10 атомов углерода,
R2 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой или разветвленной цепочкой, содержащей от 1 до 23 атомов углерода, и
R3 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой, циклической или разветвленной цепочкой, содержащей от 1 до 10 атомов углерода.
В другом варианте осуществления предпочтительные соединения формулы (I) по настоящему изобретению являются соединениями, в которых а включает числа между 1 и 10, предпочтительно числа между 3 и 8.
В другом варианте осуществления, предпочтительные соединения формулы (I) согласно настоящему изобретению являются соединениями формулы (III)
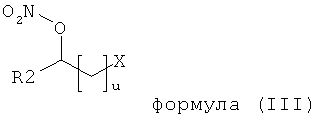 ,
,
в которой
n включает числа между 0 и 12, предпочтительно между 0 и 6, причем если n≠0, то соответствующая углеродная цепочка является линейной, циклической или разветвленной алифатической углеродной цепочкой, которая может быть незамещенной или замещенной тремя или меньшим числом гидроксильных, алкоксильных, амино-, алкиламино-, диалкиламино- или нитрооксигрупп, или алкенильной или алкинильной углеродной цепочкой, которая может быть моно- или полиненасыщенной и может находиться в любой изомерной форме,
R4 независимо означает водород или насыщенную прямую, циклическую или разветвленную цепочку алкильной или алкенильной группы, содержащей от 1 до 12, предпочтительно от 1 до 6 атомов углерода,
Х означает водород, R5, R5≡N, -OR5, -OCOR5, -NR5R6, -ONO2, -COOR5, -CONR5R6, -NHSO2R5 или -SO2NHR5,
R5 и R6 независимо означают водород, С1-С12 прямую, циклическую или разветвленную алкильную цепочку, незамещенную или замещенную тремя или меньшим числом гидроксильных, алкоксильных, амино-, алкиламино-, диалкиламино- или нитрооксигрупп, в которых алкенильная или алкинильная углеродная цепочка может быть моно- или полиненасыщенной и может находиться в любой изомерной форме.
Во всех вариантах осуществления настоящего изобретения следует понимать, что соединения формулы (I) и соединения формулы (III) могут находиться в любой изомерной форме.
Следует понимать, что когда в приведенном выше определении соединений формулы (III) n>2, соответствующая углеродная цепочка может быть линейной или разветвленной в каком-либо положении вдоль углеродной цепочки. Кроме того, эта углеродная цепочка может иметь множество разветвлений в различных положениях вдоль углеродной цепочки. Более того, когда n>3, алифатическая углеродная цепочка может образовывать циклическую группу. Указанная циклическая группа может включать в каком-либо положении (2, 3, 4) нитрооксигруппу, и, кроме того, она может иметь множество разветвлений в различных положениях любой из алифатических групп. Предпочтительными разветвленными алифатическими группами являются метил, этил или пропил. Более того, углеродная цепочка может быть дополнительно замещена тремя или меньшим числом гидроксильных, алкоксильных, амино-, алкиламино-, диалкиламино- или нитрооксигрупп.
В указанном выше определении производных формулы (III) предпочтительной алкильной группой является метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, пентил, неопентил, гексил, циклогексил, 2-этилгексил и октил. Более того, любая алкильная или алкенильная группа, содержащая три или более атомов углерода может иметь прямую, разветвленную или циклическую цепочку. Кроме того, подразумевается, что С2-С10-алкениленовая группа с прямой или разветвленной цепочкой, включает в себя алкениленовые группы с одной или несколькими (начиная с C4) двойными связями; примерами таких алкенильных групп являются группы с формулами -СН=СН-, -СН=СН-СН2-, -СН=СН-(СН2)3- и -(СН=СН)2-.
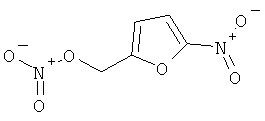
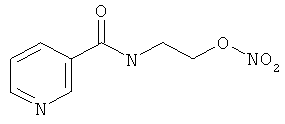
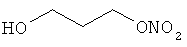
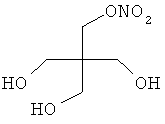
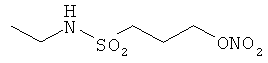
В другом варианте осуществления предпочтительные соединения формулы (I) согласно настоящему изобретению выбирают из перечня соединений (и их солей), включающего 3-нитрооксипропанол, рацематный 4-фенилбутан-1,2-диилдинитрат, 2-(гидроксиметил)-2-(нитрооксиметил)-1,3-пропандиол, сульфониламид N-этил-3-нитрооксипропионовой кислоты, 5-нитрооксипентаннитрил, 5-нитрооксипентан, 3-нитрооксипропилпропионат, 1,3-бис-нитрооксипропан, 1,4-бис-нитрооксибутан, 1,5-бис-нитрооксипентан, 3-нитрооксипропилбензоат, 3-нитрооксипропилгексаноат, 3-нитроокси-пропил-5-нитроокси-гексаноат, бензилнитрат, динитрат изосорбита и N-[2-(нитроокси)этил]-3-пиридинкарбоксамид, 2-нитро-5-нитрооксиметилфуран и бис-(2-нитрооксиэтиловый) эфир, и приведенного в таблице 1.
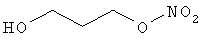

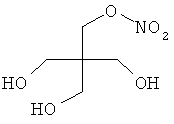
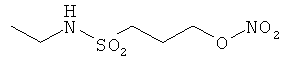


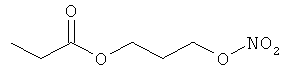


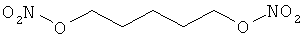
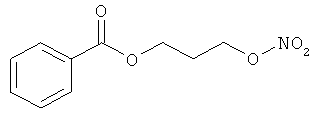
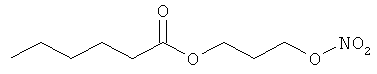
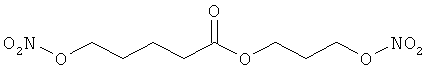
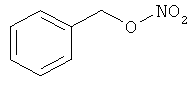
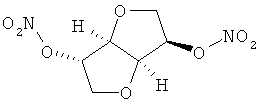
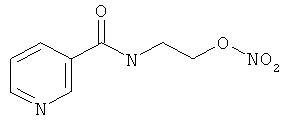
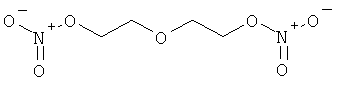
В другом варианте осуществления еще более предпочтительные соединения формулы (III) выбирают на основе интенсивности эффекта снижения выделения метана из перечня соединений (и их солей), включающего 3-нитрооксипропанол, 5-нитрооксипентаннитрил, 5-нитрооксипентан, 3-нитрооксипропилпропионат, 1,3-бис-нитрооксипропан, 1,4-бис-нитрооксибутан, 1,5-бис-нитрооксипентан, 3-нитроокси-пропилбензоат, 3-нитрооксипропилгексаноат, 3-нитрооксипропил-5-нитрооксигексаноат, динитрат изосорбита, N-[2-(нитроокси)этил]-3-пиридинкарбоксамид и бис-(2-нитрооксиэтиловый) эфир, и приведенного в таблице 2.












В другом варианте осуществления наиболее предпочтительным соединением формулы (I), по интенсивности влияния на снижение выделения метана и по способу производства, является смесь 3-нитрооксипропанола и 1,3-бис-нитрооксипропана. Предпочтительно, отношение 3-нитрооксипропанол/1,3-бис-нитрооксипропан находится между 1/10 и 1000/1, более предпочтительно между 1/5 и 100/1, наиболее предпочтительно между 1/1 и 10/1.
Соединения по настоящему изобретению также включают соли нитрооксиорганических молекул. Для препарата в виде соли предпочтительные катионы могут быть выбраны из группы, состоящей из натрия (Na+), калия (К+), лития (Li+), магния (Mg2+), кальция (Са2+), бария (Ва2+), стронция (Sr2+) и аммония (NH4 +). Кроме того, эти соли можно приготовить из щелочных металлов или щелочноземельных металлов.
В принципе, соединения по настоящему изобретению могут быть получены в соответствии с уже известными способами получения нитрооксиорганических молекул и/или в соответствии со способами, описанными в примерах.
Во всех указанных случаях специалист в данной области техники может выбрать подходящие методы очистки продукта (соединения формулы (I)), например, с помощью хроматографической колонки. В альтернативном варианте соединение формулы (I) может быть выделено и очищено по существу известными методами, например путем добавления растворителя, такого как диэтиловый эфир или этилацетат, с целью выделения сырого продукта из реакционной смеси, и последующей сушки собранного сырого продукта над Na2SO4.
Выделение метана жвачными животными можно легко измерить для отдельных животных в камере обмена веществ методом, известным из уровня техники (Grainger и др., 2007. J. Dairy Science; 90: 2755-2766). Более того, метан можно измерить в пределах коровника с помощью разработанной технологии с использованием лазерных лучей (McGinn и др., 2009, Journal of Environmental Quality; 38: 1796-1802). В альтернативном варианте метан, продуцируемый животными на молочной ферме, можно оценить путем измерения концентрации ЛЖК в молоке в соответствии с WO 2009/156453.
Продуктивность жвачных животных можно оценить с использованием методов, хорошо известных из уровня техники, и обычно ее характеризуют степенью превращения корма, потреблением корма, привесом, выходом туши или выходом молока.
Кроме того, настоящее изобретение также относится к применению по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой и соответствующих формуле (I), или их солей в сочетании с по меньшей мере одним дополнительным активным веществом, обладающим аналогичным эффектом в отношении образования метана в рубце, которое выбирают из группы, состоящей из диаллилдисульфида, чесночного масла, аллилизотиоцианата, дезоксихолевой кислоты, хенодезоксихолевой кислоты и их производных.
Дополнительные компоненты, которые можно давать вместе с соединением по настоящему изобретению, представляют собой, например, дрожжи, эфирные масла, и ионофоры типа Монензина и Рубензина.
Предполагается, что диаллилдисульфид, чесночное масло, аллилизотиоцианат, дезоксихолевая кислота, хенодезоксихолевая кислота и их производные могут независимо вводиться с дозировкой в диапазоне, например, 0,01-500 мг активного вещества на 1 кг корма (м.д.). Указанные соединения или доступны на рынке, или могут быть легко приготовлены специалистом в данной области техники с использованием методик и способов, хорошо известных из уровня техники.
Согласно настоящему изобретению жвачные млекопитающие включают крупный рогатый скот, коз, овец, жирафов, американского бизона, европейского бизона, яков, азиатского буйвола, оленей, верблюдов, альпаки, лам, антилоп-гну, антилоп, вилорогов и нильгау.
Во всех вариантах осуществления настоящего изобретения, домашний крупный рогатый скот, овцы и козы являются более предпочтительными видами. Для целей настоящего изобретения наиболее предпочтительным видом является домашний крупный рогатый скот. Этот термин включает в себя все породы домашнего крупного рогатого скота и все продуктивные разновидности крупного рогатого скота, особенно молочных коров и мясной крупный рогатый скот.
Кроме того, настоящее изобретение относится к применению по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой и соответсвующих формуле (I), или их солей, в результате которого продуцирование метана жвачными животными, рассчитанное в литрах на 1 кг потребляемого сухого вещества, снижается по меньшей мере на 10% при измерении в камере обмена веществ. Предпочтительно, уменьшение продуцирования метана составляет по меньшей мере 15%, более предпочтительно по меньшей мере 20%, еще более предпочтительно по меньшей мере 25%, наиболее предпочтительно по меньшей мере 30%. Также могут быть использованы альтернативные методы измерения выделения метана, например с использованием лазерного луча для молочных жвачных животных, или корреляция продуцирования метана с концентрацией ЛЖК в молоке.
Настоящее изобретение также относится к применению по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой и соответствующих формуле (I), или их солей, в результате которого степень потребления кормов для жвачных животных снижается по меньшей мере на 1% при измерении в традиционном испытании продуктивности. Предпочтительно степень потребления кормов снижается по меньшей мере на 2%, более предпочтительно по меньшей мере на 2,5%, еще более предпочтительно по меньшей мере на 3%, наиболее предпочтительно по меньшей мере на 3,5%.
Настоящее изобретение также относится к применению по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой и соответствующих формуле (I), или их солей, в результате которого количество по меньшей мере одного активного соединения формулы (I), введенного жвачным животным, составляет от 1 мг до 10 г на 1 кг корма, предпочтительно от 10 мг до 1 г на 1 кг корма, более предпочтительно от 50 мг до 500 мг на 1 кг корма. Однако при применении органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигрупп и соответствующих формуле (I), или их солей в корме для животных, необязательно, чтобы они были чистыми; например, они могут содержать другие соединения и производные.
Как указано выше, соединения по настоящему изобретению полезны в качестве соединений для кормовых добавок и композиций корма для жвачных животных, и в соответствии с этим, они полезны в качестве активных компонентов в указанных кормах для уменьшения образования метана в пищеварительном тракте животного и/или для улучшения продуктивности жвачных животных.
Для реализации назначения соединений в качестве таких компонентов для корма жвачных животных эти соединения могут быть включены в корм с использованием методов, по существу известных из уровня техники в области составления и переработки кормовых составов.
Дополнительным аспектом настоящего изобретения являются составы, то есть композиции кормовых добавок и кормов для животных, содержащие указанные выше соединения. Таким образом, настоящее изобретение также относится к кормовой композиции или к кормовым добавкам, содержащим по меньшей мере одно соединение формулы (I) или его соль. Предпочтительно, кормовая композиция или кормовая добавка представляет собой базовую смесь для жвачных животных. В предпочтительном варианте осуществления композиция представляет собой минеральный премикс, витаминный премикс, включая витамины и минералы или кормовой комок.
Нормальная дневная дозировка соединения по настоящему изобретению, которую дают животному вместе с потребляемым кормом, зависит от породы животного и его состояния. Обычно эта дозировка находится в диапазоне от приблизительно 1 мг до приблизительно 10 г, предпочтительно от приблизительно 10 мг до приблизительно 1 г, более предпочтительно от 50 мг до 500 мг соединения на 1 кг корма.
Органические молекулы по меньшей мере одного типа, замещенные в каком-либо положении по меньшей мере одной нитрооксигруппой и соответствующие формуле (I), или их соли могут быть использованы в сочетании с традиционными компонентами кормовых композиций для животных (питание), такими как карбонат кальция, электролиты, такие как хлорид аммония, белки, такие как мука соевых бобов, пшеница, крахмал, мука подсолнечника, кукурузы, мяса и костяная мука, аминокислоты, животный жир, витамины и следовые минералы.
Конкретными примерами композиций изобретения являются следующие:
- кормовая добавка для животных, содержащая (а) по меньшей мере одно соединение, выбранное из таблицы 1 и (b) по меньшей мере один жирорастворимый витамин, (с) по меньшей мере один водорастворимый витамин, (d) по меньшей мере один следовый минерал и/или (е) по меньшей мере один макроминерал;
- кормовая композиция для животных, содержащая по меньшей мере одно соединение, выбранное из таблицы 1 и сырой белок с содержанием от 50 до 800 г/кг корма.
Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к кормовой композиции для жвачных животных или к кормовым добавкам.
Так называемые премиксы представляют собой примеры кормовых добавок для животных по изобретению. Термин премикс означает предпочтительно однородную смесь одного или нескольких микрокомпонентов с разбавителями и/или носителями. Премиксы используют для облегчения равномерного диспергирования микрокомпонентов в большом объеме смеси.
Кроме активных компонентов по изобретению премикс изобретения содержит по меньшей мере один жирорастворимый витамин и/или по меньшей мере один водорастворимый витамин, и/или по меньшей мере один следовый минерал, и/или по меньшей мере один макроминерал. Другими словами, премикс изобретения содержит по меньшей мере одно соединение по изобретению вместе с по меньшей мере одним дополнительным соединением, которое выбирают из группы, состоящей из жирорасторимых витаминов, водорастворимых витаминов, следовых минералов и макроминералов.
Макроминералы можно добавлять в корм отдельно. Таким образом, в конкретном варианте осуществления премикс содержит активные компоненты изобретения вместе с по меньшей мере одним дополнительным компонентом, выбираемым из группы, состоящей из жирорастворимых витаминов, водорастворимых витаминов и следовых минералов.
Ниже приведен неограничивающий перечень примеров этих компонентов.
- Примерами жирорастворимых витаминов являются витамин А, витамин D3, витамин Е и витамин K, например витамин K3.
- Примерами водорастворимых витаминов являются витамин В12, биотин и холин, витамин В1, витамин В2, витамин В6, ниацин, фолиевая кислота и пантотенат, например Ca-D-пантотенат.
- Примерами следовых минералов являются марганец, цинк, железо, медь, йод, селен и кобальт.
- Примерами макроминералов являются кальций, фосфор и натрий.
Что касается кормовых композиций для жвачных животных (таких как коровы), а также их компонентов, обычно питание жвачных животных состоит из легко разлагаемой фракции (называемой концентрат) и обогащенной волокном трудно разлагаемой фракции (называемой сено, фураж, или грубый корм).
Сено получают из высушенной травы, бобов или цельных злаков. Травы включают, среди прочего, тимофеевку, плевел, овсяницу. Бобовые растения включают, среди прочего, клевер, люцерну, горох, фасоль и вику. Цельные злаки включают, среди прочего, ячмень, маис (кукурузу), овес, сорго. Другие фуражные культуры включают сахарный тростник, кормовую капусту, рапс и капусту. Кроме того, для кормления жвачных животных используют корнеплоды, такие как турнепс, брюква, плоды мангрового дерева, кормовая свекла и сахарная свекла (в том числе стружка сахарной свеклы и свекольная меласса). Другой дополнительной культурой являются клубни, такие как картофель, маниока и сладкий картофель. Силос представляет собой продукт силосования волокнистых остатков (например, трав, бобовых или цельных злаков), в процессе которого материал с высоким содержанием воды обрабатывается в условиях контролируемой анаэробной ферментации (естественная ферментация или с обработкой добавками).
Концентрат, главным образом, состоит из злаков (таких как ячмень, в том числе «пивное зерно», и побочные продукты производства виски, маис, пшеницу, сорго), но часто также содержит кормовые компоненты, богатые белком, такие как соевые бобы, семена рапса, сердцевина пальмы, хлопковое семя и подсолнечник.
Кроме того, коров можно кормить общим смешанным рационом (ОСР), в котором все компоненты питания, например фураж, силос и концентрат, смешиваются перед применением.
Как указано выше, премикс представляет собой пример кормовой добавки, которая может содержать активные соединения по изобретению. Понятно, что соединения по изобретению можно вводить животным и в различных других формах, например соединения по изобретению также могут быть заключены в комок, который может быть расположен в рубце и который может непрерывно выделять определенное количество активных соединений в точно заданной дозировке в течение конкретного периода времени.
Кроме того, настоящее изобретение относится к способу снижения образования метана, выделяющегося за счет пищеварительной активности жвачных животных, и/или улучшения продуктивности жвачных животных, включающий оральное введение достаточного количества органических молекул по меньшей мере одного типа, замещенных в каком-либо положении по меньшей мере одной нитрооксигрупп и соответствующих формуле (I), или их солей, где предпочтительные варианты описаны выше.
Кроме того, настоящее изобретение дополнительно относится к описанному выше способу, в котором соединение формулы (I) вводится животному в сочетании с по меньшей мере одним дополнительным активным веществом, выбранным из группы, состоящей из диаллилдисульфида, чесночного масла, аллилизотиоцианата, дезоксихолевой кислоты, хенодезоксихолевой кислоты и их производных.
Кроме того, изобретение относится также к описанному выше способу, в котором жвачные животные выбраны из группы, состоящей из: крупного рогатого скота, коз, овец, жирафов, американских бизонов, европейских бизонов, яков, азиатских буйволов, оленей, верблюдов, альпаки, лам, антилоп-гну, антилоп, вилорогов и нильгау, и более предпочтительно - из группы, состоящей из крупного рогатого скота, коз и овец.
Кроме того, настоящее изобретение относится к описанному выше способу, в котором количество по меньшей мере одного активного соединения формулы (I), введенное животному, составляет от приблизительно 1 мг до приблизительно 10 г на 1 кг корма, предпочтительно от приблизительно 10 мг до приблизительно 1 г, более предпочтительно от 50 мг до 500 мг соединения на 1 кг корма.
Кроме того, настоящее изобретение относится к описанному выше способу, в котором продуцирование метана жвачными животными, рассчитанное в литрах на килограмм потребляемого сухого вещества, снижается по меньшей мере на 10% при измерении в камере обмена веществ. Предпочтительно, уменьшение продуцирования метана составляет по меньшей мере 15%, более предпочтительно по меньшей мере 20%, еще более предпочтительно по меньшей мере 25%, наиболее предпочтительно по меньшей мере 30%. Также могут быть использованы альтернативные методы измерения выделения метана, например с использованием лазерного луча для молочных жвачных животных или корреляции продуцирования метана с концентрацией ЛЖК в молоке.
Настоящее изобретение также относится к описанному выше способу, в котором степень превращения кормов для жвачных животных снижается по меньшей мере на 1% при измерении в соответствии с традиционным испытанием продуктивности. Предпочтительно степень потребления кормов снижается по меньшей мере на 2%, более предпочтительно по меньшей мере на 2,5%, еще более предпочтительно по меньшей мере на 3%, наиболее предпочтительно по меньшей мере на 3,5%.
Настоящее изобретение далее описано с помощью следующих примеров, которые не следует рассматривать как ограничение объема изобретения.
Примеры
Пример 1: Испытание продуцирования метана in vitro
Для тестирования влияния конкретных соединений на функции рубца была использована модифицированная версия теста ценности фуража ("Hohenheim forage value Test"), имитирующая указанные функции системой in vitro.
Принцип исследования
Корм вводится в шприц с композицией жидкости рубца и соответствующей смесью буферов. Раствор выдерживают при 39°С. Через 8 часов измеряют количество (и состав) образовавшегося метана и вставляют в формулу расчета степени превращения.
Реагенты
Раствор основных элементов;
- 6,2 г дигидрофосфата калия (KH2PO4)
- 0,6 г гептагидрата сульфата магния (MgSO4*7H2O)
- 9 мл концентрированной фосфорной кислоты (1 моль/л)
- растворяют в 1 л дистиллированной воды (рН около 1,6)
Буферный раствор:
- 35,0 г гидрокарбоната натрия (NaHCO3)
- 4,0 г гидрокарбоната аммония ((NH4)HCO3)
- растворяют в 1 л дистиллированной воды
Раствор следовых элементов:
- 13,2 г дигидрата хлорида кальция (CaCl2*2H2O)
- 10,0 г тетрагидрата хлорида марганца(II) (MnCl2*4H2O)
- 1,0 г гексагидрата хлорида кобальта(II) (CoCl2*6Н2О)
- 8,0 г хлорное железо(III) (FeCl3*6H2O)
- растворяют в 100 мл дистиллированной воды
Раствор соли натрия:
- 100 мг натриевой соли
- растворяют в 100 мл дистиллированной воды
Восстановительный раствор:
- к 71,25 мл воды сначала добавляют 3 мл гидроксида натрия (концентрация 1 моль/л), а затем 427,5 мг гидрата сульфида натрия (Na2S*H2O)
- раствор должен быть приготовлен непосредственно перед его добавлением в раствор среды.
Методика
Взвешивание
Кормовой состав просеивают до размера 1 мм - обычный ОСР (44% концентрат, 6% сено, 37% маисовый силос и 13% травяной силос) - и точно отвешивают в 64 шприца. Из них 4 шприца представляют собой субстратный контроль, который демонстрируют продуцирование газа без влияния испытуемых соединений. Другие 4 шприца представляют собой положительный контроль - в них добавлен 0,1 ммоль/л бромэтансульфонат. В случае необходимости 4 шприца содержат контроль носителя (если для испытуемых соединений необходим носитель). В остальных шприцах содержатся испытуемые соединения, в группах по 4 шприца.
Приготовление раствора, среды
Компоненты смешивают в колбе Вульфа в следующей последовательности:
- 711 мл воды
- 0,18 мл раствора следовых элементов
- 355,5 мл буферного раствора
- 355,5 мл раствора основных элементов
Приготовленный раствор нагревают до 39°С с последующим добавлением 1,83 мл раствора соли натрия и добавлением восстановительного раствора при 36°С. Когда индикатор станет бесцветным, добавляют жидкость рубца.
Экстракция жидкости рубца
Жидкость рубца (750 мл) добавляют приблизительно к 1400 мл раствора среды при непрерывном перемешивании и пропускании газообразного СО2.
Заполнение шприцов, выдерживание и определение объема газов и значений ЛЖК
В стеклянный шприц добавляют разбавленную жидкость рубца (24 мл). Затем шприцы выдерживают в течение 8 часов при 39°С при осторожном перемешивании. Спустя 8 часов измеряют объем образовавшегося газа и определяют долю метана (в %) в газовой фазе методом хроматографии.
Результаты
Ферментируемый корм представляет собой искусственный ОСР (44% концентрат, 6% сено, 37% маисовый силос и 13% травяной силос). Соединения, полученные в соответствии с примерами 2-14, добавляют к ферментационным шприцам в концентрации от 2 до 0,005% сухого вещества (СВ). Результаты представлены в следующей таблице.

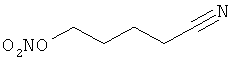

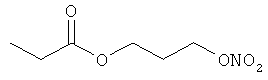

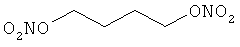
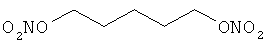


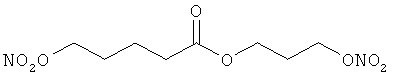


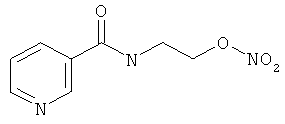

Пример 2. Сравнительный пример: продуцирование метана в испытании in vitro
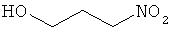
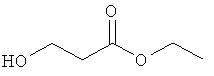
Проводят такое же испытание in vitro, как описано в примере 1, для ряда молекул, в которых нитрооксигруппы замещены различными органическими группами. Более того была также испытана неорганическая соль NaNO3. Результаты приведены в таблице 4. Эти данные демонстрируют, что активность (значительное уменьшение продуцирования метана) наблюдается только при наличии в соединении нитрооксигруппы.



Пример 3: Синтез 3-нитрооксипропанола
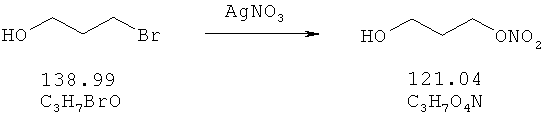
3-Бромпропанол (50,1 ммоль), растворенный в 100 мл ацетонитрила, и 125,25 ммоль нитрата серебра добавляют в защищенную от света колбу. Эту суспензию перемешивают в течение 21 часа при 70°С. После охлаждения до комнатной температуры суспензию фильтруют и концентрируют в вакууме. Остаток растворяют в воде и экстрагируют два раза с использованием ТМВЕ. Органические фазы промывают водой и рассолом, объединяют, сушат над Na2SO4, и растворитель удаляют в вакууме, получая в остатке 5,63 г. Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя смесь гептан/этилацетат 2:1. Выход: 4,82 г (38,8 ммоль, 77,4%).
Пример 4: Синтез 2-(гидроксиметил)-2-(нитрооксиметил)-1,3-пропандиола:
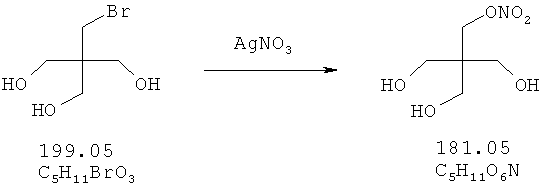
2-(Бромметил)-2-(гидроксиметил)-1,3-пропандиол (5 ммоль), растворенный в 20 мл ацетонитрила, и 15 ммоль нитрата серебра добавляют в защищенную от света колбу. Эту суспензию перемешивают в течение 24 часов при 70°С. После охлаждения до комнатной температуры суспензию фильтруют, и растворитель удаляют в вакууме, получая в остатке 3,05 г.
Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя смесь дихлорметан/метанол 50:1; Выход: 0,36 г (1,99 ммоль, 40,2%).
Пример 5: Синтез рацемического 4-фенилбутан-1,2-диилдинитрата

4-Фенил-1-бутен (7,5 ммоль), растворенный в 40 мл ацетонитрила (ACN), 20,3 ммоль нитрата серебра и 7,5 ммоль йода добавляют в защищенную от света колбу. Эту суспензию перемешивают в течение 30 минут при 25°С и затем в течение 16 часов при 79°С. После охлаждения до комнатной температуры суспензию фильтруют и промывают этилацетатом. Фильтрат экстрагируют три раза водой и промывают рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме, получая в остатке 1,92 г.
Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя смесь гексан/этилацетат 10:1. Выход: 0,52 г (2,03 ммоль, 27%).
Пример 6: Синтез сульфониламида N-этил-3-нитрооксипропионовой кислоты
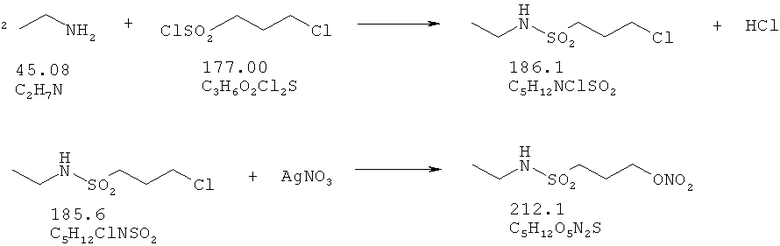
В колбе в 5 мл тетрагидрофурана растворяют 17 ммоль сульфонилхлорида 3-хлорпропионовой кислоты. Добавляют этиламин (33,3 ммоль) в течение 45 минут. После этого растворитель удаляют в вакууме. Остаток растворяют в воде, и экстрагируют три раза этилацетатом. Объединенные органические фазы промывают рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме.
Остаток растворяют в 50 мл ацетонитрила, и в колбу, защищенную от света, добавляют 60 ммоль нитрата серебра. Эту суспензию перемешивают в течение 41 часа при 70°С. После охлаждения до комнатной температуры суспензию фильтруют и концентрируют в вакууме. Остаток растворяют в дихлорметане и экстрагируют водой. Водную фазу снова промывают два раза дихлорметаном. Объединенные органические фазы промывают водой и рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме. Выход: 3,05 г (14,5 ммоль; 84,5%).
Пример 7: Синтез 3-нитроокси-пропилпропионата
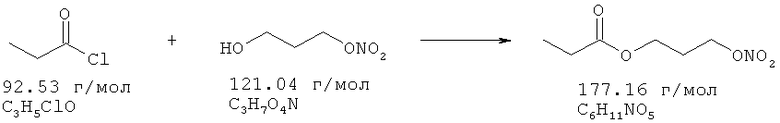
Хлористый пропионил (9,1 ммоль) растворяют в 10 мл ТМВЕ и охлаждают до 3°С. Добавляют по каплям 8,25 ммоль 3-нитрооксипропанола и 9,1 ммоль триэтиламина в 5 мл ТМВЕ в течение 5 минут при температуре от 3 до 6°С. Через 2 часа и 30 минут перемешивания без охлаждения реакционную смесь экстрагируют 1 н. раствором HCl, два раза водой, промывают рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме, получая в остатке 1,35 г.
Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя смесь гексан/этилацетат 4:1. Выход: 1,14 г (6,4 ммоль, 78,0%).
Пример 8: Синтез 3-нитроокси-пропилбензоата
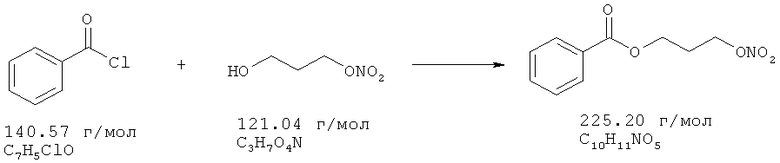
3-Нитрооксипропанол (16,5 ммоль), растворенный в 10 мл ТМВЕ и 18,2 ммоль триэтиламина, охлаждают до 3°С. Добавляют по каплям 18,2 ммоль бензоилхлорида в 5 мл ТМВЕ в течение 7 минут при температуре от 3 до 6°С. После перемешивания в течение 24 часов и 30 минут без охлаждения реакционную смесь экстрагируют насыщенным раствором NaHCO3, водой, 1 н. HCl, два раза водой; промывают рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме, получая в остатке 3,3 г.
Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя градиентную смесь гексан/этилацетат от 1:0 до 2:1. Выход: 0,66 г (2,9 ммоль, 17,7%).
Пример 9: Синтез 3-нитроокси-пропилгексаноата
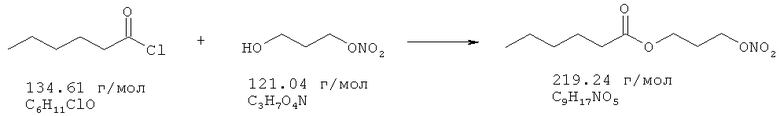
3-Нитрооксипропанол (20 ммоль), растворенный в 10 мл диэтилового эфира и 20 ммоль триэтиламина, охлаждают до 0°С. Добавляют по каплям 18,2 ммоль гексоилхлорида в течение 5 минут при температуре от 0 до 5°С. После перемешивания 19 часов без охлаждения реакционную смесь экстрагируют 1 н. HCl, два раза водой, промывают рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме, получая в остатке 3,1 г.
Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя смесь гептан/этилацетат 4:1. Выход: 2,4 г (10,9 ммоль, 60,0%).
Пример 10: Синтез 3-нитрооксипропил-5-нитрооксигексаноата
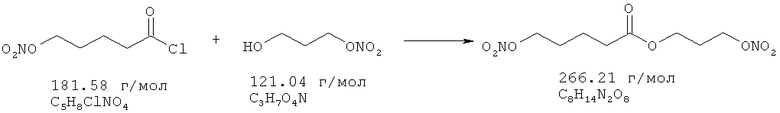
3-Нитрооксипропанол (20 ммоль), растворенный в 10 мл диэтилового эфира и 20 ммоль триэтиламина, охлаждают до 0°С. Добавляют по каплям 18,2 ммоль хлористого 5-нитрооксипентоила в течение 5 мин при температуре от 0 до 5°С. После перемешивания в течение ночи без охлаждения реакционную смесь экстрагируют 1 н. HCl, дважды водой, рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме.
Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя смесь гептан/этилацетат 4:1. Выход: 2,4 г (9,1 ммоль, 50,0%).
Пример 11: Синтез бензилнитрата
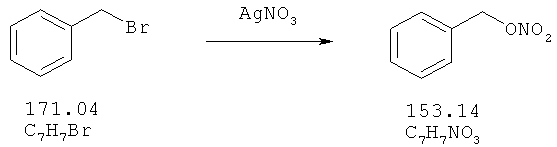
Бензилбромид (10 ммоль), растворенный в 80 мл ацетонитрила, и 25 ммоль нитрата серебра добавляют в защищенную от света колбу. Эту суспензию перемешивают в течение 5 часов при 70°С. После охлаждения до комнатной температуры суспензию фильтруют и концентрируют в вакууме. Остаток растворяют в дихлорметане и экстрагируют водой. Водную фазу снова промывают два раза дихлорметаном. Объединенные органические фазы промывают водой и рассолом, сушат над Na2SO4, и растворитель удаляют в вакууме. Выход: 1,55 г (10,1 ммоль; 100%).
Пример 12: Синтез 1,3-бис-нитрооксипропана
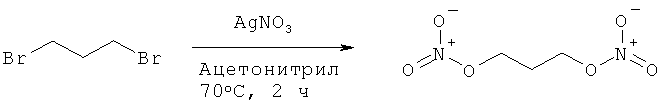
К раствору 1,3-дибромпропана (2,00 г, 1,0 эквивалент) в 20,0 мл осушенного ацетонитрила добавляют нитрат серебра (3,70 г, 2,2 эквивалента). Реакционную смесь нагревают при 70°С в течение 2 часов в темноте. Образовавшуюся смесь фильтруют через целит и фильтрат концентрируют. Остаток растворяют в воде (50,0 мл), экстрагируют дихлорметаном (2 раза по 50,0 мл), сушат над сульфатом магния, и выпаривают растворители в вакууме, чтобы получить 1,44 г соединения в виде бесцветной жидкости (Выход = 87%).
Пример 13: Синтез 1,4-бис-нитрооксибутана
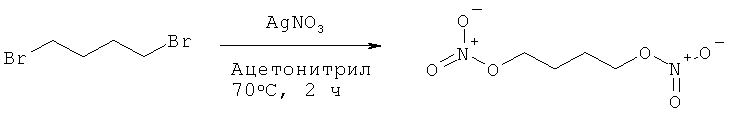
В раствор 1,4-дибромбутана (2,00 г, 1,0 эквивалент) в 20,0 мл осушенного ацетонитрила добавляют нитрат серебра (3,50 г, 2,2 эквивалента). Реакционную смесь нагревают при 70°С в течение 2 часов в темноте. Образовавшуюся смесь фильтруют через целит и фильтрат концентрируют. Остаток растворяют в воде (50,0 мл), экстрагируют дихлорметаном (2×50,0 мл) и сушат над сульфатом магния. Растворители выпаривают в вакууме, чтобы получить 1,49 г соединения в виде бесцветной жидкости (Выход = 89%).
Пример 14: Синтез 1,5-бис-нитрооксипентана
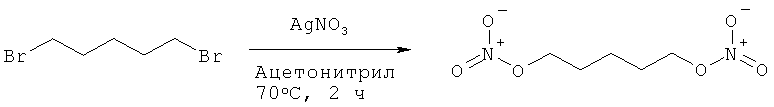
К раствору 1,5-дибромпентана (2,00 г, 1,0 эквивалент) в 20,0 мл осушенного ацетонитрила добавляют нитрат серебра (3,30 г, 2,2 эквивалента). Реакционную смесь нагревают при 70°С в течение 2 часов в темноте. Образовавшуюся смесь фильтруют через целит, и фильтрат концентрируют. Остаток растворяют в воде (50,0 мл), экстрагируют дихлорметаном (2×50,0 мл) и сушат над сульфатом магния. Растворители выпаривают в вакууме, чтобы получить 1,38 г соединения в виде бесцветной жидкости (Выход = 82%).
Пример 15: Синтез 5-нитрооксипентаннитрила
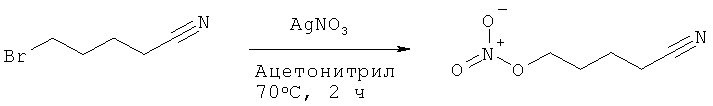
К раствору 5-бромвалеронитрила (4,00 г, 1,0 эквивалента) в 40,0 мл осушенного ацетонитрила добавляют нитрат серебра (4,60 г, 1,1 эквивалента). Реакционную смесь нагревают при 70°C в течение 2 часов в темноте. Образовавшуюся смесь фильтруют через целит и фильтрат концентрируют. Остаток растворяют в воде (50,0 мл), экстрагируют дихлорметаном (2×50,0 мл) и сушат над сульфатом магния. Растворители выпаривают в вакууме, чтобы получить 3,56 г соединения в виде бесцветной жидкости (Выход = 99%).
Пример 16: Синтез бис-(2-нитрооксиэтилового) эфира
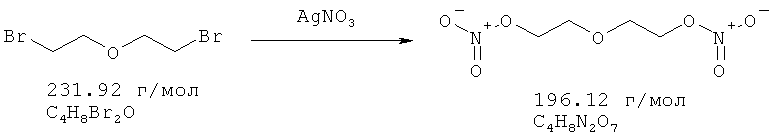
Растворенный в 30 мл ацетонитрила бис-(2-бромэтиловый) эфир (16,05 ммоль) и 40,13 ммоль нитрата серебра добавляют в защищенную от света колбу. Эту суспензию перемешивают в течение 16 часов при 70°C. После охлаждения до комнатной температуры суспензию фильтруют и концентрируют в вакууме. Остаток растворяют в воде и экстрагируют два раза ТМВЕ. Органические фазы промывают водой и рассолом; объединяют, сушат над Na2SO4, и растворитель удаляют в вакууме, получая остаток массой 3,06 г. Сырой продукт фильтруют через силикагель, используя смесь гептан/этилацетат 1:1. Выход: 2,94 г (15,0 ммоль, 93.4%).
Пример 17: In vivo эффективность 3-нитрооксипропанола по сравнению с этил-3-нитрооксипропионатом
Материалы и методы
10 овцам в рубец вставляют катетер. Испытание начинается через один месяц после хирургической операции. Используют три режима: контроль, добавка 1 и добавка 2, обе вводятся в однократной дозе. Добавка 1 является этил-3-нитрооксипропионатом, а добавка 2 представляет собой 3-нитрооксипропанол по настоящему изобретению. План эксперимента подразумевал латинский квадрат 3×3, по три овцы на каждый режим в каждом периоде с тремя следующими друг за другом периодами. Каждый период состоял из 28 дней адаптации к обработке плюс два последующих дня измерений метана в камерах и собирания проб рубца. В середине фазы адаптации, на 14-й день, осуществляли однодневное измерение метана. Кроме того, в течение 22-го и 23-го дней образцы сена из люцерны и овса в нейлоновых мешках выдерживали в рубце овцы с целью определения разложения сухих веществ в рубце. В течение двух дней измерений метана в камерах (29-й и 30-й дни) пробы содержимого рубца собирали через 2 часа после утреннего кормления, пробы разделяли на части и сразу замораживали с последующей экстракцией ДНК и определением летучих жирных кислот и концентрации аммиачного азота. Экспериментальных животных случайно распределяли по трех подгруппам по 3 животных в каждой подгруппе и случайно назначали им один из трех режимов обработки (контроль, добавка 1 и добавка 2). Животные в трех подгруппах начинали адаптироваться к рациону с промежутком в два дня для того, чтобы они находились в одинаковой степени адаптации за день до измерения метана в камерах. Животных содержали отдельно в клетках с постоянным доступом к свежей воде. Рацион, состоящий из сена люцерны, измельченного на куски 15-20 см, и овса в соотношении 60:40, с добавкой минералов-витаминов, предоставляли животным в количестве приблизительно в 1,1 раза больше того уровня, который необходим для поддержания энергетического баланса, в двух равных приемах пищи в 9:00 и 14:00 часов. Потребление свежего корма каждым животным контролировали ежедневно в течение всего испытания.
Добавку вводили два раза в день через катетер в рубце во время кормления. Соответствующее количество каждой добавки (для обеих добавок - 100 мг в день каждому животному) вводили пипеткой в 10 г измельченного овса и обертывали целлюлозной пленкой непосредственно перед введением в рубец. Поскольку активные вещества обладали летучестью, указанную выше процедуру проводили в холодильной камере при 4°С.
Измерения метана и сбор образцов
Используют набор из четырех метановых камер. На 14-й, 29-й и 30-й день животных размещают в камерах для измерения метана. Каждая камера имела ширину 1,8 м × глубину 1,8 м × и высоту 1,5 м. В камере поддерживали температуру воздуха между 15 и 20°С. Внутри каждой камеры животные содержатся отдельно, помещенными в те же клетки, что и во время адаптации. Ежедневно в 09:00 часов происходили перерывы, когда мыли пол камеры и кормили животных. Эти перерывы оказывали незначительное воздействие на ежедневные выделения метана, поскольку потоки рассчитывали три раза в день и затем усредняли для того, чтобы получить величину выделения за 23 часа. Поток воздуха и концентрацию метана измеряли во входном и выходном трубопроводах каждой камеры. Скорость потока воздуха контролировали непрерывно в течение суток во входном и выходном трубопроводах каждой камеры. В каждом из 4 трубопроводах (камеры 1, 2 и 3 и фон) отбирали часть проб воздуха, и непрерывно измеряли концентрацию метана с использованием газового анализатора ADM MGA3000 (фирма Spurling works, Herts, UK). Для последовательного отбора проб потока воздуха во всех входных и выходных трубопроводах в камерах требовалось 11 минут (3 мин в камерах 1, 2, 3; 2 мин для фона). В итоге рассчитывали поток метана для каждой камеры, для каждого дня измерений по разности притока свежего воздуха и концентрации метана на выходе из камер, и по средней скорости потока воздуха.
Анализ проб из рубца
Пробы содержимого рубца подвергали лиофильной сушке и тщательно перемешивали путем физического разрушения с использованием шарового барабана (барабан с мини-шарами; фирма BioSpec Products, Bartlesville, OK, USA) с последующей экстракцией ДНК, которую осуществляли для проб приблизительно 50 мг с использованием набора QIAamp® DNA Stool Mini Kit (Qiagen Ltd, West Sussex, UK), следуя инструкциям изготовителя с той лишь модификацией, что для разрушительного выдерживания использовали более высокую температуру (95°С). Образцы ДНК использовали в качестве шаблонов для количественной амплификации методом полимеразной цепной реакции (qPCR) в реальном времени. Относительное содержание всех бактерий, всех простейших и всех метан-продуцирующих бактерий Archaea количественно определяли методом qPCR в реальном времени. Различные наборы праймеров использовали для амплификации 16S рибосомной рибонуклеиновой кислоты (рРНК), специфичной для всех бактерий (Maeda и др., 2003), и 18S рРНК, специфичной для всех простейших (Sylvester et al., 2005). Праймеры, предназначенные для детектирования метан-продуцирующих бактерий Archaea, были нацелены на ген метил-кофермента-М редуктазы (mcrA) (Denman и др., 2007). Смеси для амплификации содержали 11,5 мкл 2Х RT-PCR суперсмеси BioRad (Bio-Rad Laboratories Inc., Hercules, CA, USA), 0,4 мкл каждого праймера и 0,5 мкл пробы в окончательном объеме 23 мкл. Эффективность амплификации оценивали для каждой пары праймеров по следующей программе: цикл 5 мин при 95°С, 40 циклов при 95°С в течение 15 с, при 60°С в течение 30 с, при 72°С в течение 55 с, и при 75°С в течение 6 с для измерения флуоресцентной эмиссии. Кривая плавления была построена путем повышения температуры от 55°С до 95°С с регистрацией показаний через каждые 5°С. Амплификацию каждой целевой группы проводили по следующей программе: 5 мин при 95°С, 40 циклов при 95°С в течение 15 с, 15 секунд при 60°С и 72°С в течение 45 с (в том числе для измерения флуоресцентной эмиссии) и кривая плавления с заданным значением начальной температуры 45°С и конечной температуры 95°С. Абсолютное количество бактерий, простейших и метан-продуцирующих бактерий Archaea, выраженное в виде числа копий ДНК, определялось с использованием в качестве стандарта плазмиды pCR®4-TOPO (Invitrogen™, Carlsbad, CA, USA). Продукт PCR, полученный с использованием соответствующего набора праймеров, очищали и затем клонировали в pCR® 4-TOPO® плазмиде (Invitrogen™, Carlsbad, CA, USA), чтобы получить рекомбинантные плазмиды. Отдельная колония, с желаемой вставкой, подтвержденной с помощью PCR, выращивалась в плотной питательной среде с антибиотиками и 5-бром-4-хлор-3-индоил-бета-D-галактопиранозидом (X-gal) в течение ночи. После этого проводили скрининг трансформированных колоний Е.coli, и некоторые из положительные колонии случайным образом отбирали. После проверки наличия вставленного фрагмента в колониях методом PCR осуществляли культивирование массы положительных колоний в жидкой среде в течение ночи. Плазмиды, принадлежащие указанным культурам, экстрагировали с использованием набора Pure Link™ Miniprep (Invitrogen™, Carlsbad, CA, USA) и затем подвергали секвенированию, чтобы подтвердить наличие вставленного фрагмента. Число копий гена 16S рРНК, присутствующих в плазмидных экстрактах, рассчитывали с использованием концентрации ДНК плазмиды и молекулярной массы вектора со вставкой. Концентрированную плазмиду последовательно разбавляли (10-кратно), чтобы получить число копий в диапазоне от 108 до 102 для построения стандартной кривой.
Осуществляли количественное определение относительного содержания метан-продуцирующих бактерий Archaea и простейших, как описали Denman и McSweeny (2006), применяя в качестве стандартного гена 16sPHK. Летучие жирные кислоты анализировали методом газовой хроматографии, а концентрацию аммиачного азота - методом колориметрии по протоколу, разработанному в лаборатории авторов (Martin-Garcia и др., 2004).
Способность рубца к разложению
Корм, измельченный до размера 2 мм (3 г), помещали в нейлоновые мешки 5 см × 10 см с размером пор 50 мкм (мешки #R510 Ankom in situ, Macedon NY). Были испытаны два компонента, используемые в рационе животных: овес и сено люцерны. Мешки с овсом выдерживали в рубце в течение 24 часов, тогда как мешки с сеном из люцерны - в течение 48 часов. Время выдерживания выбирали на основе среднего времени пребывания в рубце различных видов корма. На 22 и 23 дни животным давали по два мешка корма в день. Мешки вводили в рубец непосредственно до утреннего кормления. Через 24 или 48 часов мешки вынимали из рубца, промывали холодной водой и замораживали при -20°С. В конце каждого периода замороженные мешки промывали в стиральной машине с использованием краткого режима с холодной водой, в том числе два мешка каждого корма, которые не выдерживали в рубце, чтобы учесть его растворимость. После промывки мешки помещали в шкаф при 60°С на 48 часов. Способность рубца к разложению (%) рассчитывали как потерю сухого вещества в процессе выдерживания.
Уход за экспериментальными животными
Все процедуры по содержанию и экспериментам с овцами проводили квалифицированные специалисты в этой области в строгом соответствии с испанским законодательством (Act №1201/2005 от 10 октября 2005) по защите животных в экспериментах. Температуру, влажность и воздухообмен в камерах тщательно контролировали с учетом состояния здоровья животных. Кроме того, непрерывно контролировали концентрацию CO2 для того, чтобы поддерживать ее в диапазоне, обеспечивающем хорошее качество воздуха и степень обновления. Во время пребывания в камерах никаких признаков стресса у животных не отмечалось.
Статистический анализ
Для анализа влияния добавки на индивидуальное выделение метана определяли концентрацию ЛЖК, отношение ацетата к пропионату, концентрацию аммиачного азота, десятичный логарифм от общей концентрации бактерий, всех простейших и метан-продуцирующих бактерий Archaea, а также их относительное содержание. Для каждого анализа рассчитывали стандартную ошибку средней величины (SEM). Кроме того, средние величины сравнивали с использованием на наименьшую достоверную разность (LSD).
Результаты
Под влиянием обработок потребление сухого вещества не изменялось (Р>0,05), наблюдалось лишь незначительное уменьшение потребления, когда животных вводили в метановые камеры на 14-й и 30-й день.
Как описано для потребления, масса тела (как средняя масса, регистрируемая до и после измерений в камере) не отличалась (Р>0,05) для различных режимов обработки (Таблица 5). Выделение метана, выраженное в литрах на 1 кг потребления свежего корма, значительно (Р=0,020) снижается на 14-й день, когда обе добавки вводятся в рацион. Наблюдаемое уменьшение относительно контроля составляет 14% и 23%, соответственно для добавок 1 и 2. При регистрации выделения метана еще через две недели, на 29-й и 30-й день, все еще наблюдалось заметное уменьшение, хотя оно не являлось статистически значимым (Р=0,061 и 0,183 на 29-й и 30-й день, соответственно). Если зарегистрированные в течение последних двух дней измерения объединить, то отмечается аналогичная тенденция по влиянию добавки (Р=0,092), как и в случае, когда эти измерения рассматриваются по отдельности.
Исследование параметров ферментации в рубце по анализу проб, собранных на 29-й и 30-й день, демонстрирует изменение пути ферментации (Таблица 6) в направлении большей концентрации пропионата в рубце животных, получающих обе добавки, по сравнению с контролем. В результате, для обеих добавок отношение ацетата к пропионату значительно снижается (Р=0,002). Концентрация аммиачного азота является одной и той же для различных режимов обработки и находится внутри ожидаемого диапазона для рациона, который получают животные.
При исследовании разложения в мешках на 22-й и 23-й день влияние обработки добавками на способность рубца к разложению сена из люцерны, а также овса, не обнаружено.
Не обнаружено различия (Р>0,05) между общей и относительной концентрацией анализируемых групп микробов в рубце для различных режимов обработки. Когда относительное содержание простейших, а также метан-продуцирующих бактерий Archaea выражается относительно бактерий, эффект также не наблюдается.
Выводы
Применение обеих добавок приводит к значительному снижению продуцирования метана, как следует из концентрации ЛЖК, также происходит изменение маршрутов обмена веществ, вовлеченных в перенос Н2 под действием добавок. Целью указанного испытания являлось подтверждение того, будут ли результаты, наблюдаемые в течение двухнедельной обработки животных, устойчивы при обработке в течение месяца. Это является существенным для оценки пригодности практического использования кормовых добавок. В этом исследовании обе добавки продемонстрировали влияние на выделение метана в течение месяца обработки, что дополнительно подтверждается изменением характера ферментации.
С другой стороны, изменение характера ферментации может быть вызвано не только уменьшением продуцирования метана, но также снижением степени разложения волокон, что, в свою очередь, могло бы снизить образование ацетата и поэтому уменьшить отношение ацетата к пропионату. С целью исключения такой возможности проведено исследование способности рубца к разложению путем выдерживания нейлоновых мешков с овсом и с сеном из люцерны в рубце животных. Результаты показали отсутствие такого влияния на разложение сухого вещества, что также подтверждается одинаковой биомассой бактерий и простейших, зарегистрированной для животных, получивших добавки, по сравнению с животными без обработки.
Пример 18: Влияние 3-нитрооксипропанола на молочных коров in vivo
Материалы и методы
Животные: В исследовании использовали шесть молочных коров Holstein X Friesian, массой от 550 до 800 кг, с фистулированным рубцом, в период лактации после второго (или более) отела. В начале исследования коровы находились в середине периода лактации.
Экспериментальный рацион: В период исследования всем коровам давали один общий смешанный рацион (ОСР). В течение испытания коровы питались по желанию (5% отказов).
План эксперимента: Начиная с середины периода лактации (с выходом молока 30 литров или больше), шести коровам случайно назначали одну из трех дополнительных обработок по латинскому квадрату 3×3 (Таблица 8). Длительность периодов обработки составляла 5 недель.
Дозирование 3-нитрооксипропанола или плацебо: дозы 3-нитрооксипропанола или плацебо вводили животным в рубец через катетер во время кормления утром и вечером.
Период планирования: поскольку только две коровы можно было разместить в непрямых калориметрах, то в каждый момент времени коров находились в парах, со смещением на 1 неделю. В конце недели 4 животных перемещали в непрямые калориметры и держали на привязи в отдельных стойлах, где регистрировали четыре полных 24-часовых измерения дыхательного газообмена (образование метана и диоксида углерода и потребление кислорода) (Cammell и др., 2000).
Результаты
Потребления корма: Значительного влияния продукта (3-нитрооксипропанола) на ежедневное потребление сухого вещества (DMI) (см. таблицу 9) не наблюдалось.
Продуцирование метана: Продуцирование метана (л в сутки) и выход метана (л/кг DMI) значительно снижаются под действием 3-нитрооксипропанола. Продуцирование метана составляло 93 и 90% от контрольных значений при введении, соответственно, доз 500 и 2500 мг/сутки (см. таблицу 9). Что касается выхода метана, то соответствующие величины составляют 96 и 93% от контрольного выхода метана, соответственно, для малой и большой доз.
Наблюдались значительные вариации между животными: некоторые животные демонстрировали больший отклик, чем другие. Эти результаты демонстрируют возможности соединений по настоящему изобретению по снижению продуцирования метана молочными коровами и проливают свет на дальнейшее улучшение режима кормления.
Изобретение относится к способу снижения образования метана, выделяющегося за счет пищеварительной активности жвачных животных и/или повышения продуктивности жвачных животных за счет использования в качестве активного соединения по меньшей мере одного типа органических молекул, соответствующих определённой формуле, замещенных в любом положении по меньшей мере одной нитрооксигруппой, или солей указанных соединений. Указанные соединения вводят животному вместе с кормом. Кроме того, изобретение относится к применению указанных соединений в кормах и кормовых добавках для жвачных животных. Скармливание указанных соединений жвачным животным обеспечивает снижение образования метана в процессе пищеварения и улучшает продуктивность жвачных животных. 3 н. и 14 з.п. ф-лы, 9 табл., 18 пр.
1. Применение по меньшей мере одного типа органических молекул, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой и соответствующих формуле (I),
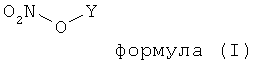
в которой Y означает органическую молекулу следующего состава: CaHbOdNeSg, где
а включает в себя числа между 1 и 25,
b включает в себя числа между 2 и 51,
d включает в себя числа между 0 и 8,
е включает в себя числа между 0 и 5,
g включает в себя числа между 0 и 3,
или их соли в качестве активного соединения в корме животных для снижения образования метана, выделяющегося за счет пищеварительной активности жвачных животных, и/или для повышения продуктивности жвачных животных,
где исключены нитрооксиалкановые кислоты и/или их производные, которые определены формулой (II),

в которой
u включает в себя числа между 0 и 23, причем если u≠0, то углеродная цепочка является линейной, циклической или разветвленной линейной или циклической алифатической углеродной цепочкой, которая может быть моно- или полиненасыщенной и находится в любой изомерной форме,
Z независимо означает О, NH или N-R3, причем если R1≠H, Z-R1 означает сложный эфир или производное вторичного амида,
R1 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой, циклической или разветвленной цепочкой, содержащей от 1 до 10 атомов углерода,
R2 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой или разветвленной цепочкой, содержащей от 1 до 23 атомов углерода, и
R3 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой, циклической или разветвленной цепочкой, содержащей от 1 до 10 атомов углерода.
2. Применение по п. 1, в котором
а включает в себя числа между 1 и 10,
b включает в себя числа между 2 и 21,
d включает в себя числа между 0 и 6,
е включает в себя числа между 0 и 3,
g включает в себя числа между 0 и 1.
3. Применение по п. 1, в котором по меньшей мере одним типом органических молекул формулы (I) является соединение формулы (III),
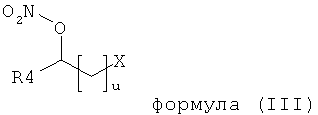
в которой
n включает числа между 0 и 12, предпочтительно между 0 и 6, причем если n≠0, то углеродная цепочка является линейной, циклической или разветвленной алифатической углеродной цепочкой, которая может быть незамещенной или замещенной тремя или меньшим числом гидроксильных, алкоксильных, амино-, алкиламино-, диалкиламино- или нитрооксигрупп, или алкенильной или алкинильной углеродной цепочкой, которая может быть моно- или полиненасыщенной и может находиться в любой изомерной форме,
R4 независимо означает водород или насыщенную прямую, циклическую или разветвленную цепочку алкильной или алкенильной группы, содержащей от 1 до 12, предпочтительно от 1 до 6 атомов углерода,
Х означает водород, R5, R5≡N, -OR5, -OCOR5, -NR5R6, -ONO2, -COOR5, -CONR5R6, -NHSO2R5 или -SO2NHR5,
R5 и R6 независимо означают водород, С1-С12 прямую, циклическую или разветвленную алкильную цепочку, незамещенную или замещенную тремя или меньшим числом гидроксильных, алкоксильных, амино-, алкиламино-, диалкиламино- или нитрооксигрупп, алкенильную или алкинильную углеродную цепочку, которая может быть моно- или полиненасыщенной и может находиться в любой изомерной форме.
4. Применение по п. 1, в котором по меньшей мере один тип органических молекул формулы (I) или их соль выбирают из 3-нитрооксипропанола, рацемата 4-фенилбутан-1,2-диилдинитрата, 2-(гидроксиметил)-2-(нитрооксиметил)-1,3-пропандиола, сульфониламида N-этил-3-нитрооксипропионовой кислоты, 5-нитрооксипентаннитрила, 5-нитрооксипентана, 3-нитрооксипропилпропионата, 1,3-бис-нитрооксипропана, 1,4-бис-нитрооксибутана, 1,5-бис-нитрооксипентана, 3-нитрооксипропилбензоата, 3-нитрооксипропилгексаноата, 3-нитроокси-пропил-5-нитрооксигексаноата, бензилнитрата, динитрата изосорбита, N-[2-(нитроокси)этил]-3-пиридинкарбоксамида, 2-нитро-5-нитрооксиметилфурана и бис-(2-нитрооксиэтилового) эфира.
5. Применение по п. 1, в котором по меньшей мере один тип органических молекул формулы (I) или их соль выбирают из 3-нитрооксипропанола, 5-нитрооксипентаннитрила, 5-нитрооксипентана, 3-нитрооксипропилпропионата, 1,3-бис-нитрооксипропана, 1,4-бис-нитрооксибутана, 1,5-бис-нитрооксипентана, 3-нитрооксипропилбензоата, 3-нитрооксипропилгексаноата, 3-нитрооксипропил-5-нитрооксигексаноата, динитрата изосорбита, N-[2-(нитроокси)этил]-3-пиридинкарбоксамида и бис-(2-нитрооксиэтилового)эфира.
6. Применение по п. 1, в котором по меньшей мере одним типом органических молекул формулы (I) является смесь 3-нитрооксипропанола и 1,3-бис-нитрооксипропана.
7. Применение по п. 1, в котором по меньшей мере один тип органических молекул формулы (I) или их соль объединяют с по меньшей мере одним дополнительным активным веществом, выбранным из группы, состоящей из диаллилдисульфида, чесночного масла, аллилизотиоцианата, дезоксихолевой кислоты, хенодезоксихолевой кислоты и их производных.
8. Применение по п. 1, в котором жвачное животное выбирают из группы, состоящей из: крупного рогатого скота, коз, овец, жирафов, американских бизонов, европейских бизонов, яков, азиатских буйволов, оленей, верблюдов, альпаки, лам, антилоп-гну, антилоп, вилорогов и нильгау.
9. Применение по п. 1, в котором продуцирование метана жвачными животными, рассчитанное в литрах на 1 кг потребляемого сухого вещества, снижается по меньшей мере на 10% при измерении в камере обмена веществ.
10. Применение по п. 1, в котором количество по меньшей мере одного активного соединения формулы (I), введенного жвачным животным, составляет от 1 мг до 10 г на 1 кг корма.
11. Кормовая композиция или кормовая добавка, содержащая по меньшей мере один тип органических молекул формулы (I) по любому из пп. 1-6.
12. Композиция по п. 11, представляющая собой минеральный премикс, витаминный премикс или премикс, включающий витамины и минералы, или кормовой комок.
13. Способ снижения образования метана, выделяющегося за счет пищеварительной активности жвачных животных, и/или улучшения продуктивности жвачных животных, включающий оральное введение животному достаточного количества органических молекул по меньшей мере одного типа, замещенных в каком-либо положении по меньшей мере одной нитрооксигруппой и соответствующих формуле (I),
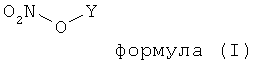
в которой Y является органической молекулой следующего состава: CaHbOdNeSg,
в которой
а включает в себя числа между 1 и 25,
b включает в себя числа между 2 и 51,
d включает в себя числа между 0 и 8,
е включает в себя числа между 0 и 5,
g включает в себя числа между 0 и 3,
или их соли, где исключены нитрооксиалкановые кислоты и/или их производные, которые определены формулой (II),

в которой
u включает в себя числа между 0 и 23, причем если u≠0, то углеродная цепочка является линейной, циклической или разветвленной линейной или циклической алифатической углеродной цепочкой, которая может быть моно- или полиненасыщенной и может находиться в любой изомерной форме,
Z независимо означает О, NH или N-R3, причем если R1≠H, Z-R1 означает сложный эфир или производное вторичного амида,
R1 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой, циклической или разветвленной цепочкой, содержащей от 1 до 10 атомов углерода,
R2 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой или разветвленной цепочкой, содержащей от 1 до 23 атомов углерода, и
R3 независимо означает водород или насыщенную алкильную или алкенильную группу с прямой, циклической или разветвленной цепочкой, содержащей от 1 до 10 атомов углерода.
14. Способ по п. 13, в котором органические молекулы по меньшей мере одного типа вводят животному в сочетании с по меньшей мере одним дополнительным активным веществом, выбранным из группы, состоящей из диаллилдисульфида, чесночного масла, аллилизотиоцианата, дезоксихолевой кислоты, хенодезоксихолевой кислоты и их производных.
15. Способ по п. 13, в котором жвачное животное выбирают из группы, состоящей из: крупного рогатого скота, коз, овец, жирафов, американских бизонов, европейских бизонов, яков, азиатских буйволов, оленей, верблюдов, альпаки, лам, антилоп-гну, антилоп, вилорогов и нильгау.
16. Способ по п. 13, в котором количество органического соединения по меньшей мере одного типа, определенного формулой (I) и введенного жвачным животным, составляет от 1 мг до 10 г на 1 кг корма.
17. Способ по п. 13, в котором продуцирование метана жвачными животными, рассчитанное в литрах на 1 кг потребляемого сухого вещества, снижается по меньшей мере на 10% при измерении в камере обмена веществ.
| ANDERSON R C ET AL "Effects of select nitrocompounds on in vitro ruminal fermentation during conditions of limiting or excess added reductant" Bioresource technology, Elsevier BV, GB, vol | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Устройство присоединения ломовых систем водяного отопления низкого давления к городской системе насосно-водяного отопления высокого давления | 1927 |
|
SU8655A1 |
| ТЕЛЕФОННАЯ ТРАНСЛЯЦИЯ ДЛЯ ПОСЛЕДОВАТЕЛЬНОГО ВКЛЮЧЕНИЯ В ЛИНИЮ | 1921 |
|
SU3582A1 |
Авторы
Даты
2016-03-27—Публикация
2011-12-20—Подача