Изобретение, в целом, относится к электротерапевтическим схемам и, в частности, к дефибриллятору, который анализирует физиологические данные пациента и определяет, должна ли проводиться электрошоковая терапия или терапия сердечно-легочной реанимации (СЛР). Более конкретно, классификация ритма АВД, такая, как так называемый показатель vRhythm, определяет оптимальный протокол для СЛР, по которому принимается решение, должна ли, например, работником "скорой помощи" выполняться СЛР только с компрессиями или традиционная СЛР (компрессии + искусственное дыхание). Тренд показателя vRhythm может быть использован для коррекции протокола СЛР во время спасения. Кроме того, классификация ритма с помощью АВД может использоваться во время СЛР, чтобы помочь определить, остановить ли СЛР период раньше, чтобы провести немедленный дефибриляционный шок.
Дефибрилляторы подают высоковольтный импульс к сердцу для восстановления нормального ритма и сократительной функции у пациентов, испытывающих аритмию, такую как желудочковая фибрилляция ("VF") или желудочковая тахикардия ("VT"), которые не сопровождаются естественным кровообращением. Существуют несколько классов дефибрилляторов, в том числе ручные дефибрилляторы, имплантируемые дефибрилляторы и автоматические внешние дефибрилляторы (АВД). АВД отличаются от ручных дефибрилляторов тем, что АВД могут автоматически анализировать ритм по электрокардиограмме (ECG), чтобы определить, необходима ли дефибрилляция. Почти во всех конструкциях АВД, когда АВД рекомендует электрошок, пользователя просят нажать кнопку электрошока, чтобы выполнить дефибрилляционный шок для пациента.
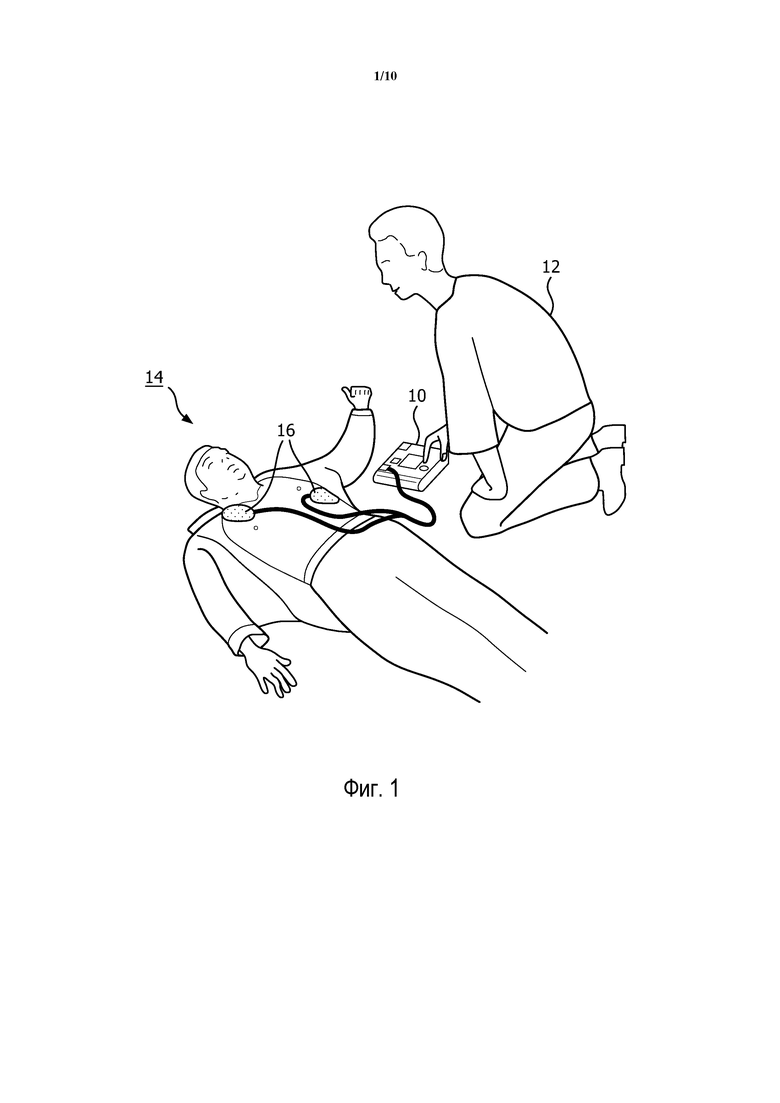
На фиг. 1 представлен дефибриллятор 10, применяемый пользователем 12 для реанимации пациента 14, испытывающего остановку сердца. При внезапной остановке сердца пациент сталкивается с опасным для жизни прерыванием нормального сердечного ритма, обычно в форме VF или VT, который не сопровождается естественным кровообращением (то есть VT, при котором необходим электрошок). При VF нормальные ритмические желудочковые сокращения меняются на быстрые нерегулярные судорожные сокращения, которые приводят в результате к неэффективному и опасно пониженному сердцебиению. Если нормальный ритм не восстанавливается в пределах некоторого периода времени, который, как обычно считают, должен быть в пределах приблизительно 8-10 минут, то пациент умирает. Напротив, чем быстрее сможет быть восстановлено кровообращение (посредством СЛР и дефибрилляции) после начала VF, тем выше шанс, что пациент 14 переживет этот приступ. Дефибриллятор 10 может быть выполнен в форме АВД, пригодного для использования работниками "скорой помощи". Дефибриллятор 10 может также быть выполнен в форме ручного дефибриллятора для использования работниками службы спасения или другим хорошо обученным медицинским персоналом.
Пара электродов 16 накладывается на грудную клетку пациента 14 пользователем 12, чтобы получить сигнал ЭКГ от сердца пациента. Дефибриллятор 10 затем анализирует сигнал ЭКГ на наличие симптомов аритмии. Если обнаруживается VF, дефибриллятор 10 сигнализирует пользователю 12, что рекомендуется электрошок. После обнаружения VF или другого ритма, при котором необходим электрошок, пользователь 12 нажимает кнопку электрошока на дефибрилляторе 10, чтобы подать дефибрилляционный импульс для реанимации пациента 14.
Последние исследования показали, что различные пациенты могут быть реанимированы более эффективно при различных режимах лечения в зависимости от различных факторов. Одним из факторов, влияющих на вероятность успеха дефибрилляции, является время, прошедшее с момента, когда пациент испытал аритмию. Это исследование указало, что, в зависимости от продолжительности остановки сердца, пациент будет иметь большую вероятность выздоровления по одному протоколу по сравнению с другим. Если АВД настраивается на менее эффективный протокол для реанимации конкретного пациента, то вероятность реанимации этого пациента может уменьшаться. Эти исследования показали, что некоторые из таких пациентов имеют лучший шанс реанимации, если сначала выполняется СЛР, которая должна начинаться с обеспечения осуществляемого внешним образом кровообращения, что может привести пациента в состояние, когда применение электрошока будет успешным для восстановления естественного кровообращения.
Были предприняты различные попытки сделать это определение автоматизированным способом на основе показателей жизненно важных функций пациента. Поскольку определение того, рекомендуется ли шок, начинается с анализа формы сигнала ЭКГ пациента, попытки сделать это определение были сосредоточены на анализе формы сигнала ЭКГ. Одно направление исследований брало за основу амплитуду сигнала ЭКГ и обнаружило, что пациенты с более сильным (с более высокой амплитудой) сигналом ЭКГ имеют лучший шанс реанимации с помощью дефибрилляционного шока, чем пациенты с более низкой амплитудой ЭКГ. Так как амплитуда ЭКГ будет обычно уменьшаться со временем после начала VF, этот результат понятен. Однако этот критерий не является безусловным предсказателем успеха реанимации. Другой характеристикой ЭКГ, которая была изучена в качестве предсказателя успеха, является частотный состав сигнала ЭКГ, когда содержание более высокочастотных составляющих, как обнаружено, коррелируется с успехом реанимации. Этот анализ делается посредством выполнения спектрального анализа сигнала ЭКГ, используя процессор быстрого преобразования Фурье для выполнения спектрального анализа ЭКГ. Это, однако, также не было признано абсолютно точным показателем успеха. Другие исследователи перемножали амплитудную и частотную информацию ЭКГ друг с другом, чтобы создать взвешенный высокочастотный результат измерения в качестве показателя успеха, обладающего преимуществами обеих характеристик. Соответственно, желательно иметь дефибриллятор, автоматически и с высокой точностью определяющий режим лечения с высокой вероятностью успеха.
Дополнительно, желательно определять режим лечения быстро, как только АВД прикреплен к пациенту. Неспособность это сделать может привести к нескольким проблемам. Если, например, работник "скорой помощи" прибывает на место действия с АВД, настроенным на выполнение сначала СЛР (то есть перед дефибрилляцией) и обнаруживает, что уже происходит хорошая СЛР, дефибрилляционный шок будет напрасно задержан. С другой стороны, если работник "скорой помощи" прибывает на месте действия с АВД, настроенным на то, чтобы провести сначала шок (то есть до СЛР), и обнаруживает, что пациент длительное время не имеет СЛР, СЛР может быть задержана. В каждой из этих ситуаций менее оптимальный протокол реанимации может уменьшить вероятность выживания.
Кроме того, фиксированные интервалы сердечно-легочной реанимации (СЛР) без паузы для анализа ЭКГ уменьшают время отсутствия помощи, но рискуют задержать дефибрилляцию в случаях неудачных электрошоков и повторной фибрилляции с неизвестным последствием для состояния пациента. Некоторые пациенты с ритмами, при которых необходим электрошок, во время СЛР могут получить пользу от раннего электрошока, но прерывание СЛР для анализа может подвергнуть пациентов большему риску. Таким образом, необходимым является алгоритм анализа для обнаружения ритмов, при которых необходим электрошок, с высокой вероятностью восстановления естественной циркуляции крови (ROSC), который оптимизирует продолжительность СЛР. Настоящее изобретение использует комбинацию двух существующих алгоритмов: алгоритм рекомендации электрошока посредством АВД, разработанный для случая высокой специфичности, и индекс скорости изменения ЭКГ, который указывает на вероятность ROSC после электрошока при дефибрилляции. Варианты осуществления алгоритма анализа описываются в совместно поданной и совместно рассматриваемой патентной заявке США № 11/917,272 под названием "Defibrillator with Automatic Shock First/CPR First Algorithm", содержащейся здесь посредством ссылки.
Кроме того, известно, что работники "скорой помощи" часто испытывают затруднения при выполнении искусственного дыхания во время СЛР и что эффективной может быть только ручная СЛР. Также известно, что непрерывные компрессии с минимальными прерываниями (например, для искусственного дыхания) могут привести к лучшей реанимации. Проблема, свойственная существующим реанимационным дефибрилляторам, состоит в том, что дефибриллятор неспособен определить, какому протоколу СЛР следовать (компрессии и искусственного дыхания или только компрессии) для оптимального выживания.
Поскольку СЛР вызывает артефакт в ЭКГ, достоверное определение начала повторной фибрилляции во время СЛР при существующей технологии невозможно. Существующие руководства по сердечно-легочной реанимации рекомендуют периоды беспрерывной СЛР, следовательно, пауза в СЛР для анализа ЭКГ является нежелательной и может оказать негативное влияние на выживание пациента. С другой стороны, у пациентов, испытывающих повторную фибрилляцию во время СЛР, продолжающаяся СЛР может оказать негативное влияние на выживание. Поскольку доля пациентов, которые могли бы получить пользу от паузы в СЛР, чтобы подтвердить ритм, при котором необходим электрошок, мала по сравнению с большинством, для которых продолжающаяся СЛР полезна, алгоритм, который может определить высокую вероятность наличия ритма, при котором необходим электрошок, во время артефакта СЛР, (то есть без паузы) мог бы позволить идентифицировать пациентов, которые могут получить пользу от электрошока, не ставя под угрозу реанимации для большинства пациентов. Эта задача решалась, например, в совместно поданной патентной публикации США № 2010/0076510 под названием "AED having CPR Period with Pause for ECG Acquisition", автор Lyster. Lyster раскрывает анализ данных сигнала ЭКГ во время спокойных периодов, которые могут возникнуть во время паузы по протоколу СЛР, и использование этих данных для определения, должен ли период паузы СЛР заканчиваться раньше для проведения дефибрилляции.
В соответствии с принципами настоящего изобретения, описывается дефибриллятор, который автоматически анализирует форму сигнала ЭКГ и оценивает вероятность возвращения к показателю естественного кровообращения (ROSC). Показатель ROSC сравнивается с порогом, чтобы рекомендовать режим лечения, который, более вероятно, будет успешен. Режимом лечения может быть сначала электрошок пациента, затем дополнительный анализ ЭКГ и, возможно, обеспечение СЛР. Другой возможный режим лечения заключается в предоставлении СЛР пациенту до того, как использовать электрошок.
Настоящее изобретение дополнительно использует сделанное изобретателями открытие, что показатель ROSC хорошо коррелируется с вероятностью выживания пациента. В частности, изобретатели обнаружили, что показатель ROSC, который улучшается во время спасения, обычно указывает более высокую вероятность выживания пациента. Таким образом, тренд показателя ROSC во время реанимации может использоваться для коррекции протокола СЛР во время реанимации, чтобы улучшить результат для пациента.
Настоящее изобретение дополнительно признает тот факт, что если пациент находится в состоянии VF, оптимальным может быть использование только ручной СЛР. Если пациент находится в состоянии ритма, при котором нет необходимости в электрошоке, оптимальным может быть использование компрессий плюс искусственное дыхание. Показатель ROSC может улучшить это путем добавления значения, в котором "жизнеспособность" при VF указывается показателем ROSC. Если показатель ROSC указывает более длительное время остановки (меньшая жизнеспособность), может случиться так, что должны выполняться только компрессии или искусственное дыхание и компрессии. В случае ритма, при котором нет необходимости в электрошоке, может случиться так, что должны использоваться искусственное дыхание и компрессии. Для некоторых ритмов (например, брадикардия с менее чем 40 ударами/мин) может быть показано искусственное дыхание. В соответствии с принципами изобретения, одной из задач изобретения является описание дефибриллятора и способа для проведения электротерапии, которая использует показатель ROSC для выбора одного из множества режимов работы СЛР. Например, дефибриллятор может выбрать режим работы СЛР только с компрессиями для показателей ROSC выше порога или может выбрать режим работы СЛР с компрессиями плюс искусственное дыхание для показателей ROSC ниже порога. Порог может регулироваться, чтобы соответствовать конкретному протоколу местных властей, ответственных за ведение реанимаций.
Другой задачей изобретения является дефибриллятор и способ, в котором сравниваются последовательные показатели ROSC, чтобы определить, может ли переход от первого режима работы СЛР ко второму режиму работы СЛР быть полезен для пациента. Например, если в ходе кардиальной реанимации показатель ROSC ухудшается, дефибриллятор может изменить режим работы СЛР с режима "только компрессии" на режим "компрессии плюс искусственное дыхание".
Еще одной задачей изобретения являются дефибриллятор и способ, в котором вычисляют последовательные показатели ROSC до и сразу после дефибрилляционного электрошока и, основываясь на сравнении, дополняют режим работы электрошока дополнительным электрошоком. Например, может быть полезным немедленно использовать второй электрошок в ситуации, когда в ином случае мог бы быть протокол с одиночным электрошоком, если последующая оценка ROSC выше, чем предшествующая оценка ROSC.
Еще одной задачей изобретения являются дефибриллятор и способ, в котором вычисляют последовательные оценки ROSC и выдают пользователю обратную связь, основываясь на сравнении. Например, слуховая или визуальная обратная связь в виде "Good CPR" (хорошая СЛР) или "improving patient" (пациенту лучше) может выдаваться дефибриллятором, если последующий показатель ROSC выше, чем предшествующий показатель ROSC.
И еще одной задачей изобретения являются дефибриллятор и способ, в котором вычисляют оценку ROSC во время компрессий СЛР и определяют, должен ли СЛР быть прерван для проведения немедленного терапевтического электрошока. Чтобы минимизировать вредный эффект ошибочного определения, например, из-за артефакта СЛР, в одном из вариантов осуществления изобретения подтверждают определение после того, как СЛР прервана, и после этого корректируют критерии определения, если определение было ошибочным. Корректировка может заключаться в том, чтобы запретить признак прерывания в целом.
Еще одним объектом изобретения является дефибриллятор, который эффективно реализует процессор определения показателя ROSC и который определяет показатель ROSC быстро и удобно.
Краткое описание чертежей
Фиг. 1 - дефибриллятор, приложенный к пациенту, страдающему остановкой сердца.
Фиг. 2 - блок-схема дефибриллятора, созданного в соответствии с принципами настоящего изобретения.
Фиг. 3 - подробная блок-схема предсказателя ROSC, созданного в соответствии с принципами данного изобретения.
Фиг. 4 - график данных пациента, показывающий определение порога, который может использоваться в предсказателе ROSC, показанном на фиг. 3.
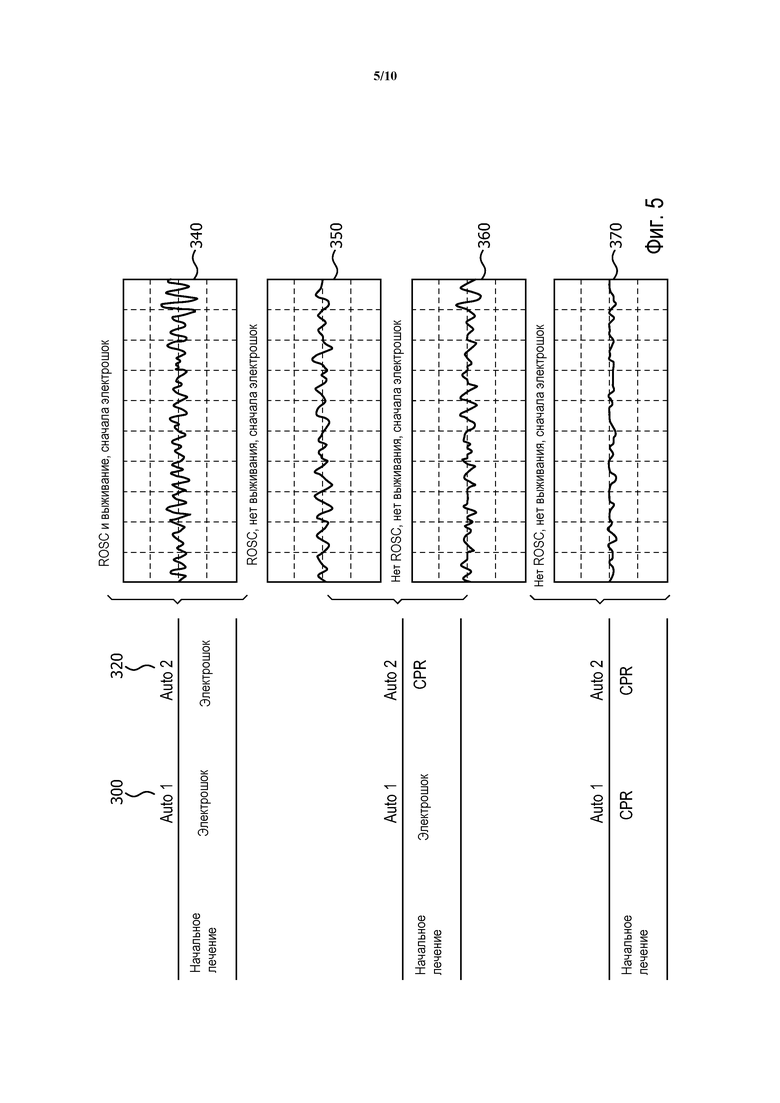
Фиг. 5 - результаты, полученные созданной системой для четырех сигналов ЭКГ с различными установками чувствительности.
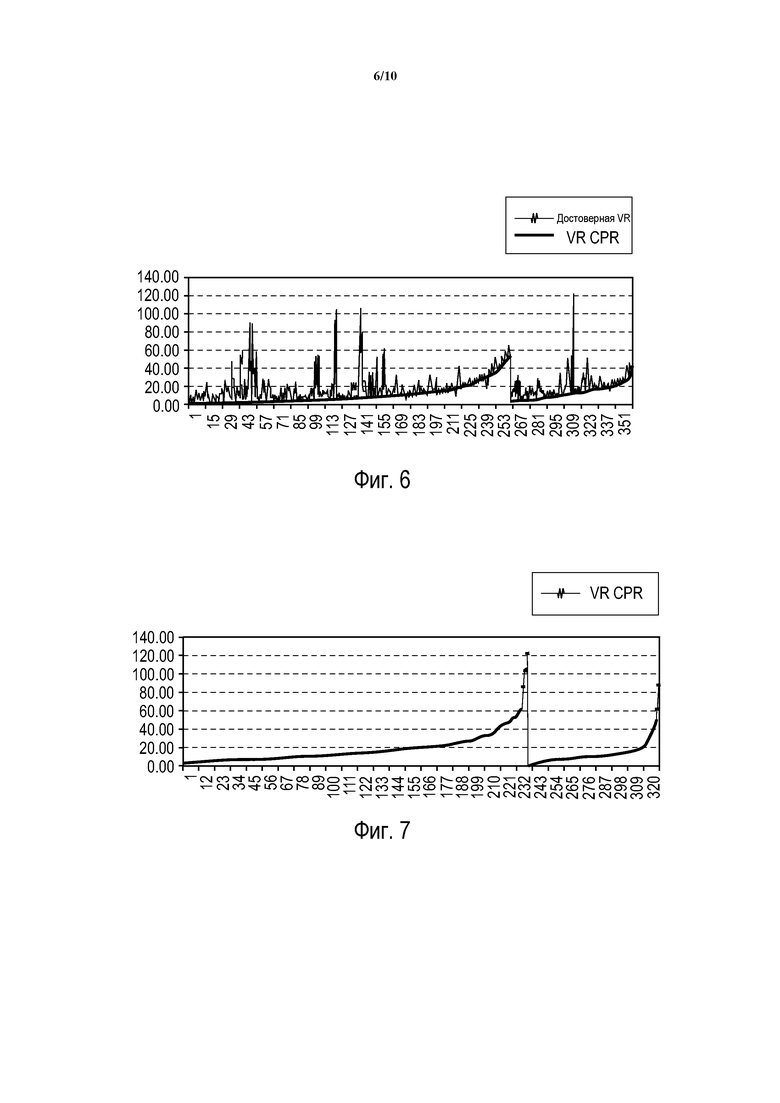
Фиг. 6 - показатель vRhythm во время достоверных данных (vRclean) и во время искаженных данных (vRcpr) СЛР.
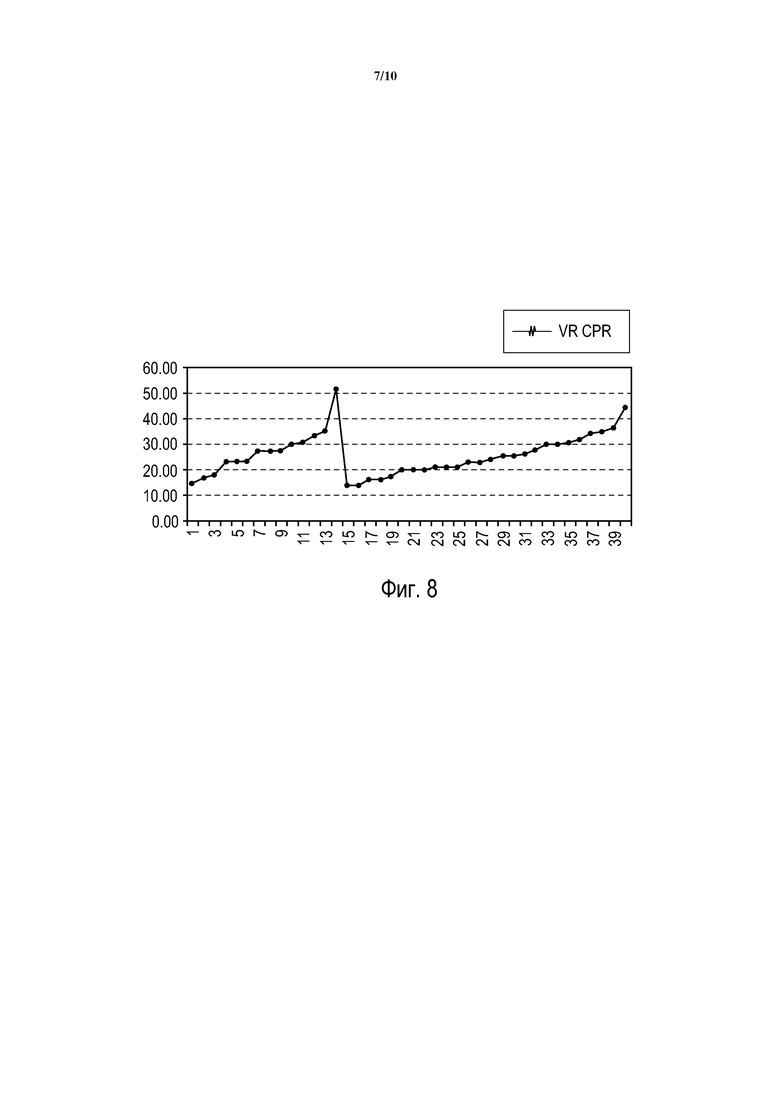
Фиг. 7 - показатель vRhythm во время СЛР (vRcpr) для случаев "Истинное продолжение СЛР", показанных на фиг. 6.
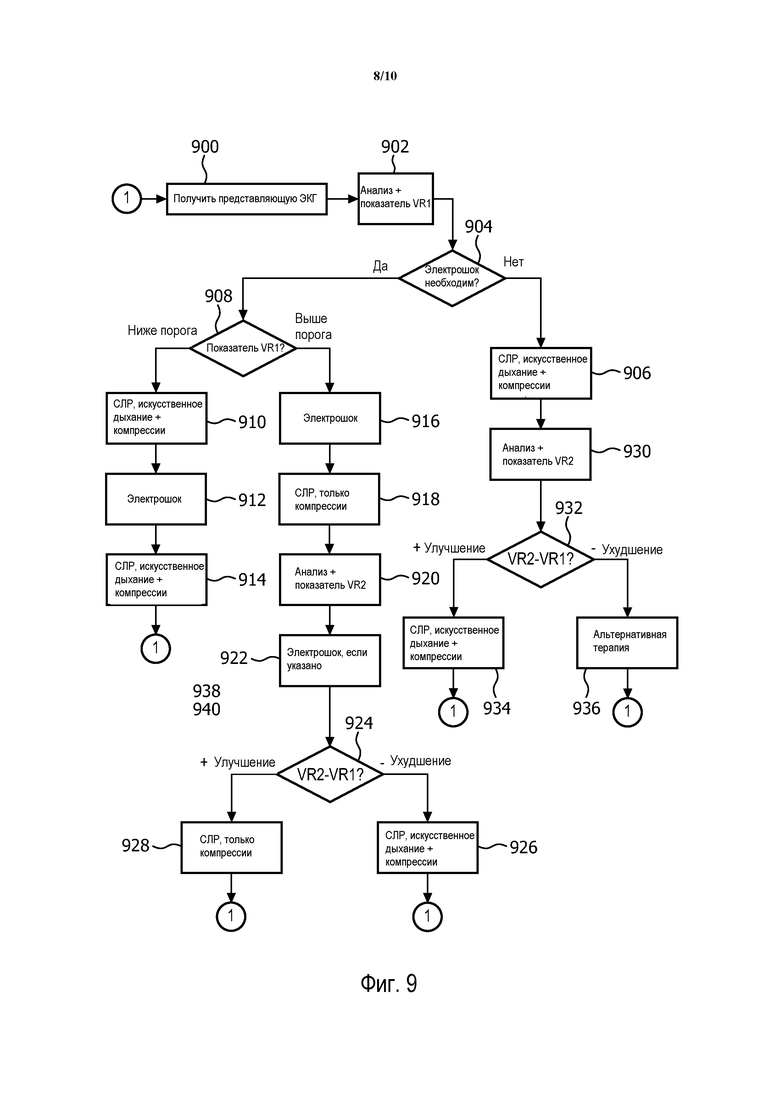
Фиг. 8 - показатель vRcpr для случаев "Истинное прекращение СЛР", показанных на фиг. 6.
Фиг. 9 - блок-схема последовательности выполнения операций принятия решения для СЛР и дефибрилляции во время кардиальной реанимации, используя тренды показателя vRhythm и алгоритм определения электрошока.
Фиг. 10 - блок-схема последовательности выполнения операций принятия решения в отношении того, использовать ли дополнительный дефибрилляционный электрошок, основываясь на тренде показателя vRhythm от момента непосредственно перед и до момента сразу после первого электрошока.
Фиг. 11 - блок-схема последовательности выполнения операций принятия решения, показывающая использование показателя vRhythm во время периода СЛР. В варианте осуществления, показанном на фиг. 11, показатель ROSC вычисляется во время СЛР и вызывает прерывание СЛР, если показатель указывает, что немедленный электрошок полезен. В противном случае, СЛР продолжается до окончания периода СЛР.
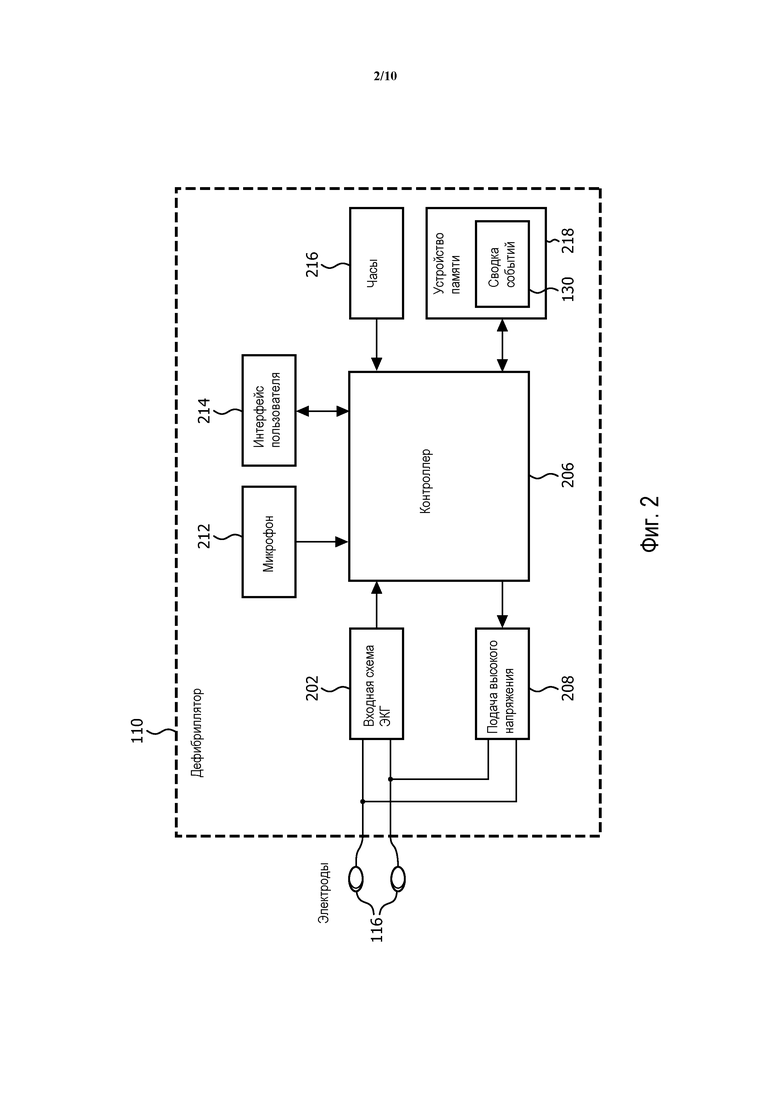
На фиг. 2 показан дефибриллятор 110, созданный в соответствии с принципами настоящего изобретения. Для целей последующего обсуждения дефибриллятор 110 выполнен как АВД и сконструирован с малыми габаритами, малым весом и относительно простым интерфейсом пользователя, с которым может работать персонал без высоких уровней обучения или те, кто лишь нечасто используют дефибриллятор 110. Напротив, дефибриллятор для работников "скорой помощи" или клинический дефибриллятор такого типа, который обычно возит с собой сотрудник службы "скорой помощи" (EMS), имеет тенденцию быть более крупногабаритным, более тяжелым, и иметь более сложный интерфейс пользователя, способный поддерживать большее количество функций ручного мониторинга и анализа. Хотя настоящий вариант осуществления изобретения описывается в отношении применения в АВД, другие варианты осуществления содержат его применение в различных типах дефибрилляторов, например, в ручных дефибрилляторах и дефибрилляторах медицинских работников "скорой помощи" или клинических дефибрилляторах.
Входная схема 202 ЭКГ соединяется с парой электродов 116, которые прикрепляются на грудной клетке пациента 14. Входная схема 202 ЭКГ усиливает, буферирует, фильтрует и оцифровывает электрический сигнал ЭКГ, создаваемый сердцем пациента, чтобы сформировать поток оцифрованных выборок ЭКГ. Оцифрованные выборки ЭКГ подаются на контроллер 206, который выполняет анализ для обнаружения VF, VT, при которой необходим электрошок, или другого ритма, при котором необходим электрошок, и который, в соответствии с настоящим изобретением, выполняет анализ, чтобы определить режим лечения, который, вероятно, будет успешным. Если обнаруживается ритм, при котором необходим электрошок, то вместе с определением режима лечения, который указывает немедленное использование дефибрилляционного шока, контроллер 206 посылает сигнал на схему 208 подачи высокого напряжения (HV), чтобы накопить заряд при подготовке к подаче электрошока, и кнопка электрошока на интерфейсе 214 пользователя активируется, чтобы начать мигать. Когда пользователь нажимает кнопку электрошока на интерфейсе 214 пользователя, дефибрилляционный электрошок подается от схемы 208 подачи высокого напряжения к пациенту 14 через электроды 116.
Контроллер 206 соединен так, чтобы дополнительно принимать входной сигнал от микрофона 212 и записывать речевую дорожку. Аналоговый аудиосигнал от микрофона 212 предпочтительно оцифровывается, чтобы создать поток оцифрованных аудиовыборок, которые могут храниться как часть сводки 130 событий в устройстве 218 памяти. Интерфейс 214 пользователя может состоять из дисплея, громкоговорителя и кнопок управления, таких как кнопка включения-выключения и кнопка электрошока для обеспечения его управления пользователем, а также визуальных и звуковых подсказок. Часы 216 обеспечивают данные часов реального времени для контроллера 206, чтобы вводить отметку времени в информацию, содержащуюся в сводке 130 событий. Устройство 218 памяти, реализуемое как встроенная RAM, съемная карта памяти или как комбинация различных технологий устройств памяти, действует, чтобы сохранять сводку 130 событий в цифровой форме, по мере того, как она составляется при лечении пациента 14. Сводка 130 событий может содержать потоки оцифрованных ЭКГ, аудиовыборок и другие данные событий, как описано ранее.
АВД, показанный на фиг. 2, имеет несколько реанимационных протоколов лечения или режимов лечения, которые могут быть выбраны во время настройки АВД, когда его первоначально получает служба "скорой помощи". Одним из типов протокола является протокол "сначала электрошок". Когда АВД настроен на этот протокол, АВД после подключения к пациенту и активации будет сразу анализировать сердечный ритм по ЭКГ пациента, чтобы произвести классификацию сердечного ритма. Если анализ определяет наличие аритмии, излечимой посредством электрической дефибрилляции, обычно желудочковой фибрилляции (VF) или беспульсной желудочковой тахикардии (VT), об этом сообщается работнику "скорой помощи" и разрешается использовать электрошок. Если решено, что аритмия не подлежит лечению дефибрилляционным электрошоком, то АВД перейдет в режим "паузы", в котором может выполняться СЛР.
Вторым типом протокола является протокол "сначала СЛР". Когда АВД настроен на этот протокол, АВД начнет работать, давая работнику "скорой помощи" инструкции по проведению СЛР для пациента. После того, как СЛР проводится во время заданного промежутка времени, АВД начинает анализировать данные ЭКГ, чтобы увидеть, присутствует ли аритмия, излечимая с помощью электрической дефибрилляции.
В соответствии с принципами настоящего изобретения, АВД 110 имеет третью настройку, которая должна первоначально рекомендовать протокол лечения, либо "сначала электрошок", либо "сначала СЛР". Это делает АВД, который начинает работу с анализа формы сигнала ЭКГ пациента, вычисляя и оценивая показатель ROSC, как описано ниже. Исходя из оценки показателя ROSC, рекомендуется протокол лечения. Рекомендованный протокол может сразу выполняться АВД или быть рекомендацией, предоставленной работнику "скорой помощи" для его или ее окончательного решения в отношении протокола лечения, который должен выполняться.
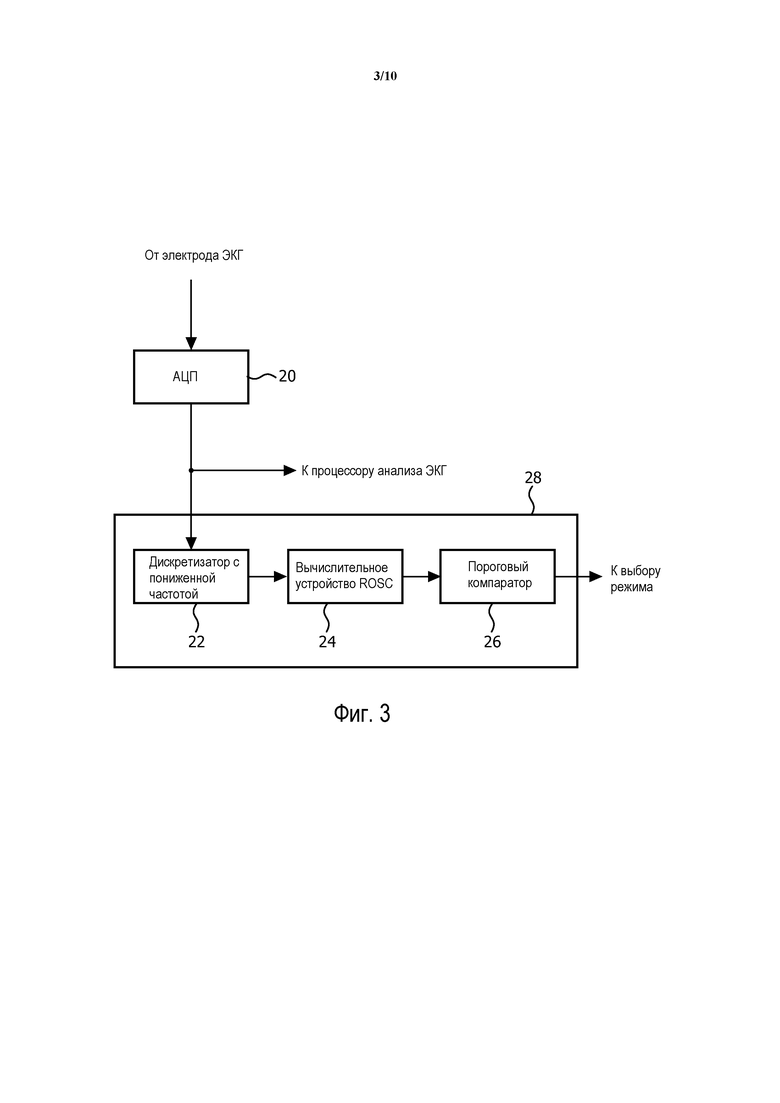
На фиг. 3 показана часть входной схемы 202 и контроллера 206 ЭКГ, которые действуют в соответствии с принципами настоящего изобретения. Как ранее упомянуто, электроды 116 подают от пациента сигналы ЭКГ, которые подвергнуты выборке (оцифровке) аналого-цифровым (A/D) преобразователем 20. Оцифрованные сигналы ЭКГ связаны со схемой процессора анализа электрокардиограммы в контроллере, который анализирует форму сигнала ЭКГ, чтобы определить, рекомендуется ли использование электрошока. Выборки ЭКГ также связаны с процессором 28 принятия решения о лечении, состоящему из необязательного дискретизатора 22 с пониженной частотой, вычислительного устройства 24 для определения ROSC и порогового компаратора 26. Необязательный дискретизатор 22 с пониженной частотой создает выборки потока ЭКГ с более низкой скоростью передачи данных. Например, поток данных 200 выборок/с может субдискретизироваться до 100 выборок/с. Выборки данных ЭКГ передаются вычислительному устройству 24 для определения ROSC, которое из данных ЭКГ определяет показатель ROSC. Показатель ROSC сравнивается с порогом пороговым компаратором 26, чтобы определить режим лечения, которое, наиболее вероятно, приведет к успешной реанимации. Результат этого определения режима связан с участком выбора режима контроллера, который либо выбирает требуемый режим автоматически, либо представляет режим как рекомендацию работнику "скорой помощи", который может затем решить, следовать ли рекомендованному режиму или альтернативному режиму лечения. Хотя процессор 28 принятия решения о лечении показан как элемент, отдельный от контроллера 206, понятно, что процессор 28 принятия решения о лечении и схема процессора анализа электрокардиограммы могут быть частью контроллера 206.
Вычислительное устройство 24 для определения ROSC может действовать несколькими способами. Например, показатель ROSC вычисляется как средняя величина первой производной, ограниченной шириной полосы (или первая разность, являющаяся аналогом дискретного времени) ЭКГ за несколько секунд. Так как первая производная, ограниченная шириной полосы, может быть уже вычислена для обнаружения аритмии контроллером 206, дополнительное вычисление может содержать только дополнительное вычисление среднего абсолютного значения. Этот процесс может быть осуществлен как измерение в реальном времени посредством скользящего среднего значения, требующего только одного добавления и одного вычета на выборку. Например, разность последовательных выборок может быть взята для потока выборок, принятых за период 4,5 секунд со скоростью 100 выборок/с. Знаки разностей отбрасываются, чтобы создать абсолютные значения, которые суммируются за 4,5-секундный период. Это создает значение показателя ROSC, эквивалентное взвешенной по частоте средней амплитуде сигнала ЭКГ. Показатель может быть масштабирован или дополнительно обработан в соответствии с архитектурой и требованиями данной системы.
Так как спектр первой производной пропорционален частоте, показатель ROSC в значительной степени не затрагивается артефактом СЛР, большинство из которых будут на очень низкой частоте. Таким образом, показатель ROSC, вычисленный таким образом, способен предоставить значимую информацию о жизнеспособности сердца пациента во время СЛР.
Другой альтернативный способ вычисления среднего значения состоит в возведении в квадрат разности последовательных выборок с последующим суммированием результатов произведений и извлечением квадратного корня из суммы. Таким образом создается RMS (среднеквадратичное значение) показателя ROSC.
Как альтернатива вычислению среднего значения, другой подход должен использовать медианную величину первой производной. Этот подход в вычислительном отношении является более напряженным, но предпочтительно может быть более устойчивым к шуму. Следует уделить внимание тому, чтобы избежать компенсации сигнала, который дает в качестве измерения его отличительную мощность. В другом варианте осуществления вычисление усеченного среднего значения или минимакса может предложить благоприятный компромисс. Исключая наибольшие выбросы, может быть обеспечена более высокая устойчивость к импульсным артефактам (например, к физическим нарушениям электродных накладок). Исключая наибольшие выбросы, случайный артефакт с высокой амплитудой, который может возникать относительно редко, может устраняться без значительного ослабления отличительной мощности, связанной с данными от кардиального источника.
АВД был создан, чтобы действовать в соответствии с настоящим изобретением. Изобретатели обнаружили, что реализованный процессор определения показателя ROSC идентифицирует ритмы ЭКГ, которые приводят в результате к показателю ROSC, сопровождаемому немедленной дефибрилляцией, с высокой чувствительностью, например, приблизительно 90%, и специфичностью более 60%. Чувствительность (Sn) является процентом числа пациентов, которые могли бы достигнуть ROSC в ответ на немедленный дефибрилляционный электрошок, которые правильно идентифицируются показателем ROSC. Специфичность является процентом числа пациентов, которые могут не достигнуть ROSC в ответ на немедленный дефибрилляционный электрошок, которые правильно идентифицируются показателем ROSC. Чувствительность и специфичность в отношении ROSC могут балансироваться приблизительно в равном соотношении.
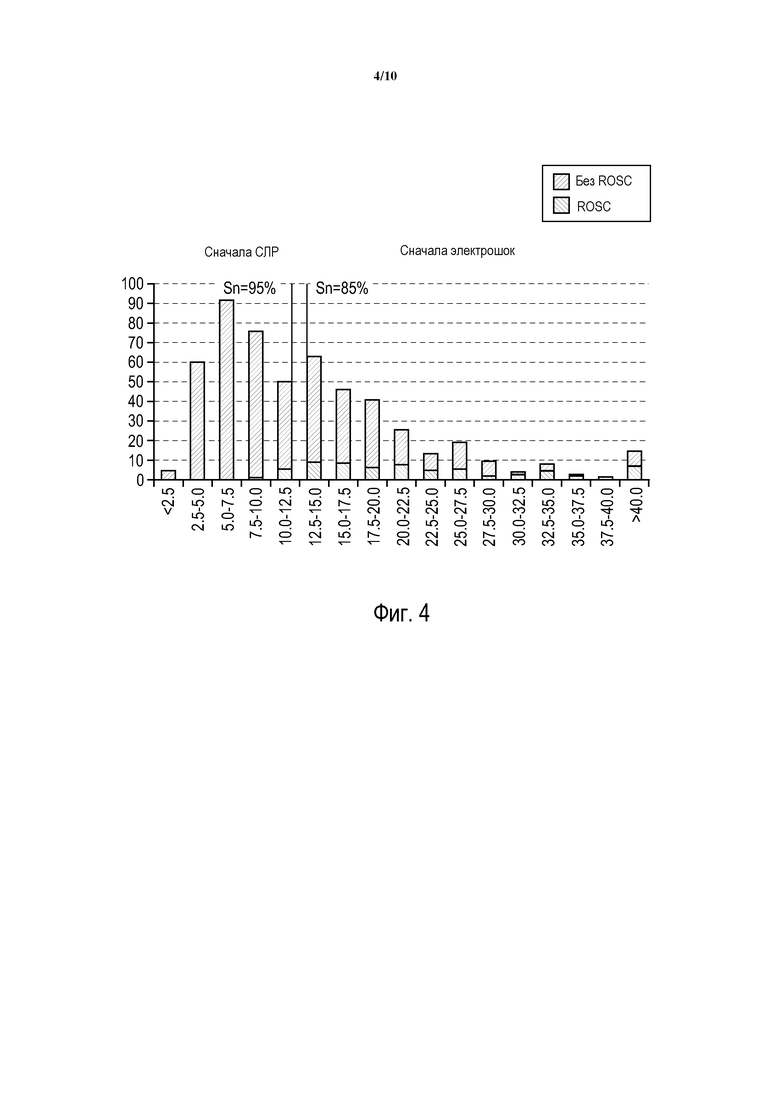
Реализация, посредством которой альтернативная настройка чувствительности была сделана доступной пользователю, показана на графике на фиг. 4. База данных собрана на основе результатов пациентов, лечившихся посредством дефибрилляции, некоторые из которых достигли ROSC в ответ на начальный дефибрилляционный электрошок, а некоторые из которых его не достигли. Пациенты лечились после различных продолжительностей остановки сердца. Показатель ROSC, вычисленный реализованной системой, был в пределах от 2,5 до 40,0 единиц, где каждая единица соответствует 0,25 мВ/с. Более светлые заштрихованные участки столбцов на графике указывают пациентов в базе данных, которые продемонстрированы ROSC после использования электрошока. Более темные заштрихованные участки столбцов указывают пациентов, которые не продемонстрировали ROSC после лечения. График показывает результаты получения показателей ROSC системой, которая показала 95%-ую чувствительность к ROSC после начального электрошока для пациентов с показателем ROSC больше 3,0 мВ/с (то есть 12,0 единиц), и чувствительность 85% для пациентов с показателем ROSC больше 3,6 мВ/с (то есть 14,4 единиц). При показателе ROSC ниже приблизительно 2,5 мВ/с (то есть 10 единиц), 100% совокупности пациентов не смогли достигнуть ROSC в результате первого электрошока и смогли получить пользу от режима лечения по протоколу "сначала СЛР". В реализованной системе использованы два различных порога чувствительности, один с 95%-ой чувствительностью, и другой - с 85%-ой чувствительностью. Пользователь, таким образом, имеет возможность выбрать желаемую чувствительность во время настройки АВД и может способствовать большему использованию протокола "сначала электрошок" с выбором более высокой (95%-ой) чувствительности или большему использованию протокола "сначала СЛР" с более низкой чувствительностью (85%).
Реализованная система, как было также обнаружено, пригодна для идентификации совокупности с хорошим результатом для пациентов, лечившихся по протоколу "сначала электрошок", достигшими 53% (95% CI [40%, 67%]) неврологически здорового выживания. Реализованная система также идентифицировала группу с плохим результатом, только 4%, (95% CI [0,1%, 20%]), которая достигла неврологически здорового выживания и которая могла бы поэтому получить пользу от реанимации по протоколу "сначала СЛР".
На фиг. 5 представлены результаты, полученные созданной системой для четырех сигналов ЭКГ с различными настройками чувствительности. При автоматической установке 300 Auto 1 (повышенной) чувствительности, в ответ на первые три сигнала ЭКГ 340, 350 и 360 рекомендуется протокол "сначала электрошок", а для четвертой ЭКГ 370 рекомендуется протокол "сначала СЛР". При автоматической установке 320 Auto 2 (пониженной) чувствительности для первого сигнала ЭКГ 340 рекомендуется протокол "сначала электрошок", а для других трех сигналов ЭКГ 350, 360 и 370 рекомендуется протокол "сначала СЛР".
Альтернативный вариант осуществления изобретения использует алгоритм рекомендации электрошока АВД, разработанный для высокой специфичности, и индекса скорости изменения ЭКГ (названного vRhythm, как описано в патентной заявке США № 11/917,272), который указывает вероятность ROSC после дефибрилляционного электрошока. В свободной от артефактов ЭКГ при первом представлении пациента с VF эти два алгоритма используются для рекомендации либо немедленного электрошока, либо начального интервала СЛР. В этом случае, если алгоритм рекомендации электрошока АВД указывает ритм, при котором необходим электрошок, показатель vRhythm сравнивается с пороговым значением и если он больше или равен порогу, рекомендуется электрошок, а если он меньше, чем порог, рекомендуется СЛР. База данных реанимаций показала, что для начальных ритмов, при которых необходим электрошок, с показателем vRhythm ниже порога 14,5 единиц, очень маловероятно, что пациенты выживут, если немедленно применить электрошок, и поэтому пользу может принести начальный период СЛР.
По мере прогресса реанимации после того, как был применен дефибрилляционный электрошок, существующие протоколы рекомендуют непрерывный интервал непрерывающейся СЛР (обычно 2 минуты). Обычно, однако, во время интервала СЛР у пациента возникает повторная фибрилляция. Присутствие мощного сигнала VF в ЭКГ может указывать на высокую вероятность ROSC, если электрошок должен быть использован сразу, тогда как для того же самого пациента продолжающаяся СЛР может привести в результате к снижению вероятности ROSC. Поскольку доля пациентов, которые могут получить пользу от немедленного электрошока, намного меньше тех, которые могли бы получить пользу от непрерываемой СЛР, пауза в СЛР, чтобы точно оценить ритм пациента, может прервать СЛР и для гораздо большего числа пациентов может уменьшить возможность выживания, вместо того, чтобы помочь им.
Этот вариант осуществления применяет алгоритм рекомендации электрошока АВД и показатель vRhythm во время искаженной ЭКГ с СЛР после начального или последующего электрошока, чтобы оценить вероятность мощного ритма, при котором необходим электрошок, не прекращая СЛР. Если существует высокая вероятность ритма, при котором необходим электрошок, на что указывает высокий показатель vRhythm, СЛР должна быть остановлена, и после подтверждения анализа в свободной от артефактов ЭКГ должен быть применен электрошок. Будущие улучшения алгоритма, при которых идентифицируется очень высокая вероятность ритма, при котором необходим электрошок, во время СЛР, могут позволить использование электрошока без промежуточного подтверждающего анализа. Этот вариант осуществления поэтому может позволить использовать немедленный электрошок пациентам, выживаемость которых может быть улучшена немедленным электрошоком, не ставя под угрозу реанимацию других пациентов, которые могут получить больше пользы от продолжения СЛР.
Обращаясь теперь к фиг. 6, реализация настоящего изобретения была оценена, используя алгоритм рекомендации электрошока системы анализа пациентов (PAS) Philips в сочетании с показателем vRhythm компании Philips. Улучшение характеристик для описываемого варианта осуществления может быть получено простой модификацией каждого из этих алгоритмов в рамках объема этого описания. Для оценки характеристик база данных ЭКГ, адаптированная из базы данных "Sister", скомпилированной Laerdal Medical, Wappinger Falls, New York, содержит данные ЭКГ реанимаций с большим разнообразием ритмов, представляющих те, которые ожидаются на практике. База данных содержит 20-секундные записи ЭКГ, первые 10 секунд, записанные во время СЛР, с последующими 10 секундами после прекращения СЛР. Измерения и результаты использования алгоритмов для этих двух фрагментов данных будут помечены в этом описании нижними индексами "cpr" и "clean".
Результаты PAS и показатель vRhythm были использованы на данных, взятых из достоверного сегмента ЭКГ, чтобы установить "заключение об истинности " для каждого случая в базе данных. В соответствии с предыдущим изобретением vRhythm компании Philips, случаи, для которых результат PAS, указывающий "рекомендуется электрошок", и для которых показатель vRhythm был больше или равным 14,5, были заявлены как "истинные" с высокой вероятностью пользы от прекращения СЛР для проведения дефибрилляционного электрошока (упоминаемого здесь далее как "Истинное прекращение СЛР"). Поскольку сегменты СЛР и достоверных данных непрерывны во времени, это заключение об истинности, определенной в достоверных данных, также предполагается являющимся истинным для искаженных данных СЛР (то есть основополагающий ритм предполагается неизменным во время 20-секундной записи). Следовательно, эта база данных позволяет нам оценивать характеристики в искаженных данных СЛР и сравнивать их с "истинными" данными, определенными, исходя из достоверных данных ЭКГ.
На фиг. 6 представлен показатель vRhythm для достоверных данных (vRclean) и искаженных данных СЛР (vRcpr) во всех 363 случаях, имеющихся в базе данных. Случаи были отсортированы для увеличения vRclean и решения PAS в сегменте достоверных данных (PASclean). Для случаев 1-263 PASclean не был электрошоком, и для случаев 264-363 PASclean был электрошоком (100 случаев). Случаи 324-363 (40 случаев), удовлетворявшие критериям для "Истинного прекращения СЛР", то есть ритмам, для которых пациент может оцениваться, как, вероятно, получающий пользу от немедленного электрошока вместо продолжающейся СЛР. Остальные случаи (1-323) являются "Ложным прекращением СЛР" или также упоминаемыми как "Истинное продолжение СЛР".
На фиг. 6 также показан показатель vRcpr в прямом сравнении со значением показателя vRclean. Данные показывают, что артефакт СЛР смещает показатель vRhythm в сторону больших значений. Чтобы учесть это смещение для vRhythm, оцененного во время СЛР, эта реализация поднимает порог для указания немедленного электрошока при значениях, больших или равных 19 (вместо порога 14,5 для достоверных данных). Также заметим, что существуют несколько экстремумов vRcpr, нехарактерных для значений vRclean. Следовательно, эта реализация содержит порог vRcpr, равный 50, выше которого СЛР не будет прерываться.
Обратимся теперь к фиг. 7, на которой показан показатель vRhythm во время СЛР (vRcpr) для случаев "Истинное продолжение СЛР" на фиг. 6. На фиг. 7 данные сортируются по vRcpr и по решению PAS для искаженного сегмента данных СЛР (PAScpr). Эти данные позволяют определять ложно положительный и истинно отрицательный результат для "Прекращения СЛР". Существуют 11 ложно положительных случаев (310-320), для которых (PAScpr=электрошок) и (19 < vRcpr ≤ 50). Существуют 312 истинно отрицательных случаев: (1-309) и (321-323).
На фиг. 8 показан показатель vRcpr для случаев "Истинное прекращение СЛР", показанных на фиг. 6. На фиг. 8 данные сортируется по vRcpr и по решению PAS для искаженного сегмента данных СЛР. Эти данные позволяют определить истинно положительный и ложно отрицательный результат для "Прекращения СЛР". Имеются 19 ложных отрицательных случаев: случаи 1-14, потому что PAScpr = нет электрошока, и случаи 15-19, потому что vRcpr < 19. Имеются 21 случай истинно положительных прекращений СЛР (20-40).
Объединенные данные, полученные из фиг. 7 и 8, могут использоваться для вычисления чувствительности, специфичности и положительной предсказуемости критериев, которые во время СЛР предсказывают взятые из этой базы данных случаи, для которых прерывание СЛР для применения реанимационного дефибрилляционного электрошока, было бы потенциально полезным. Данные указывают следующее: чувствительность = 53%; специфичность = 97%; положительная предсказуемость = 66%.
Во время периодов СЛР для дефибрилляторов, соответствующих предшествующему уровню техники, СЛР должна быть либо непрерывной для всех пациентов, либо прерываться для всех пациентов, чтобы оценить необходимость использования дефибрилляционного электрошока. Для непрерывной СЛР 323 случая из этого набора данных могут получить, наиболее вероятно, оптимальную терапию (89%) и 40 случаев, которые могут получить пользу от первоначального электрошока, могут получить субоптимальную терапию (11%). Прерывание всех реанимаций для оценки необходимости в использовании электрошока может привести в результате к субоптимальной терапии для 323 случаев (89%) и более оптимальной терапии для 40 случаев (11%). В соответствии с настоящим изобретением, однако, СЛР могла бы быть прервана для 32 случаев (21 истинно положительных и 11 ложно положительных, 9%); и СЛР могла бы быть непрерывной для 331 случая (19 ложно отрицательных и 312 истинно отрицательных). Терапия могла бы быть оптимальной в 333 случаях (21 истинно положительных и 312 истинно отрицательных, 92%), и субоптимальной только в 30 случаях (11 ложно положительных и 19 ложно отрицательных, 8%). Таким образом, общая характеристика алгоритма с vRhythm в соответствии с изобретением, который определяет показатель ROSC во время СЛР, дает в результате лучшие характеристики, чем протоколы СЛР на предшествующем уровне техники. Для ясности, термин "показатель ROSC" используется здесь и далее как относящийся к показателю vRhythm, определенному по алгоритму vRhythm, как описано выше.
Специалистам в данной области техники хорошо известно, что корректировки критериев алгоритма будут менять статистику этих характеристик. Также хорошо известно, что критерии характеристик зависят от относительной доли ритмов в базе данных, по которой они вычисляются. Эта база данных представляется репрезентативной для многих систем оказания скорой помощи во всем мире, для которых выживание при остановке сердца является очень низким, следовательно, мала доля случаев, для которых прекращение СЛР могло бы быть предпочтительным. Для других систем с более короткими временами реакции и, следовательно, более высокими показателями выживаемости, доля случаев, при которых прекращение СЛР могло бы быть полезным, будет выше и преимущество алгоритма будет соответственно больше.
В альтернативном варианте осуществления изобретения, например, алгоритм мог бы быть скорректирован, чтобы вычислять показатели только во время обнаруженных коротких перерывах при компрессиях при СЛР, то есть когда возникают низкие уровни помех, связанных с артефактом. Обнаружение может быть произведено посредством вторичных индикаторов движения, таких как наложенный на грудь акселерометр, ток в синфазном режиме, изменения трансторакального импеданса или посредством анализа сигнала ЭКГ. Во время достаточного количества этих коротких перерывов может накопиться достаточно много данных, чтобы указать вероятность, что повторная фибрилляция возникла во время СЛР. Когда это указывается, АВД может предписать паузу для дальнейшего анализа. Если ложно отрицательный случай ненадлежащим образом заставил АВД сократить СЛР, то для последующих периодов СЛР анализ может быть дополнительно скорректирован, отфильтрован или отключен полностью.
Настоящий вариант осуществления изобретения оценил один набор критериев. Другие варианты осуществления могут изменять эти критерии или модифицировать эти два алгоритма, с которыми связаны критерии. Например, алгоритм с рекомендацией электрошока может быть скорректирован, чтобы создавать меньше ложно отрицательных случаев, изменяя критерии внутри него, и вычисление vRhythm также может быть модифицировано (например, изменена ширина полосы), чтобы дополнительно подавить влияние артефакта СЛР на показатель ROSC. Предыдущие показатели ROSC, в том числе представляемый показатель ROSC, также могут использоваться в качестве входных данных для решения, прерывать или не прерывать СЛР для дефибрилляционного электрошока. Дополнительно, этот вариант осуществления изобретения использовал в своей оценке необходимости использования дефибрилляционного электрошока только данные ЭКГ. Другие сигналы, собранные одновременно с ЭКГ (например, малосигнальный импеданс пациента, ток в синфазном режиме и ускорение стенки грудной клетки во время СЛР), могут позволить дальнейшую оптимизацию варианта осуществления.
На фиг. 9 представлена блок-схема последовательности выполнения операций с критериями для автоматического принятия решений в АВД. Существующие организации продолжают делать упор на более простую СЛР в попытках повысить выживаемость и призывают присутствующих при сердечном приступе действовать таким образом. Если бы только ручная СЛР являлась лучшей альтернативой (для конкретного ритма), то тогда это помогло бы упростить СЛР. Если искусственное дыхание не будет необходимостью, то это минимизирует прерывания для подачи воздуха и будет способствовать выживанию. Протокол реанимации, описанный в блок-схеме последовательности выполнения операций, учитывает эти принципы, чтобы, когда это возможно, предложить более простую и более эффективную СЛР.
Как показано на фиг. 9, когда электроды прикреплены к пациенту с остановкой сердца, АВД на этапе 900 получает ЭКГ. На этапе 902 АВД использует свой алгоритм анализа, чтобы определить, является ли ЭКГ такой, при которой необходим электрошок, и использует свой алгоритм vRhythm, как описано ранее, чтобы вычислить показатель ROSC VR1. Если ритм не требует применения электрошока, что определяется на этапе 904, АВД на этапе 906 вводит первый режим работы СЛР, определенный как СЛР для реанимации с компрессиями и искусственным дыханием. Если ЭКГ указывает на необходимость использования электрошока, то показатель ROSC VR1 на этапе 908 сравнивается с пороговым показателем. Если показатель ROSC VR1 низкий, то АВД вводит протокол "сначала электрошок" и сразу предписывает первый режим работы СЛР на этап 910, с последующим дефибрилляционным электрошоком в этапе 912, и к следующему периоду первого режима работы СЛР на этапе 914.
Если ЭКГ такова, что необходим электрошок, с показателем ROSC на этапе 908 выше порога, то АВД сразу предписывает электрошок на этапе 916 с последующим вторым режимом работы СЛР на этапе 918. Здесь, второй режим работы СЛР определяется как СЛР только с компрессиями. Причина этого решения состоит в том, что пациент, имеющий высокий показатель ROSC VR2, может получить больше пользы от СЛР только с компрессиями.
На фиг. 9 также показано, что вслед за сначала электрошок/интервал в СЛР снова анализируется ЭКГ на этапе 920. АВД вычисляет второй показатель ROSC VR2 и на этапе 924 принятия решения сравнивает VR2 с первым показателем ROSC VR1. Увеличение показателя ROSC указывает на "хорошую" СЛР и/или повышающийся шанс выживания. Таким образом, после электрошока, если показатель ROSC увеличивается, то АВД на этапе 928 продолжает второй режим работы СЛР. Уменьшение показателя ROSC, однако, указывает на снижение шанса выживания, возможно осложненное "плохой" СЛР. Если показатель ROSC падает, то АВД на этапе 926 предписывает переход на первый режим СЛР.
Для ЭКГ, при которой нет необходимости в электрошоке, АВД на этапе 906 применяет первый режим работы СЛР без дефибрилляционного шока. После периода СЛР АВД повторяет анализ электрокардиограммы и на этапе 930 вычисляет следующий показатель ROSC VR2. Затем на этапе 932 принятия решения АВД сравнивает VR2 с первым показателем ROSC VR1. Увеличение показателя ROSC указывает на "хорошую" СЛР и/или на повышающийся шанс выживания. Таким образом, если показатель ROSC увеличивается, то АВД на этапе 934 продолжает второй режим работы СЛР. Уменьшение показателя ROSC, однако, указывает на уменьшающийся шанс выживания, то есть что СЛР, возможно, неэффективна. Таким образом, падение показателя ROSC в этой ветви заставляет АВД на этапе 936 переходить от первого режима работы СЛР к альтернативной терапии. Альтернативная терапия может быть вторым режимом работы СЛР или предписание использования фармацевтической терапии, такой как адреналин, гипотермической терапии или на другие известные способы кардиальной реанимации.
В конце любой из ветвей протокола, указанных на фиг. 9 цифрой "1", обведенной окружностью, кардиальная реанимация может прогрессировать в соответствии с протоколами предшествующего уровня техники. Более предпочтительно, способ изобретения может быть продолжен, возвращаясь к этапу 900 для дальнейшего последовательного анализа. Повторение способа на протяжении всей реанимации позволяет проводить непрерывную корректировку протокола реанимации, следуя за изменениями в ЭКГ пациента. Дальнейшая корректировка порогов показателя ROCS или критериев решения может происходить, например, когда этап 900 вводится повторно после подтвержденного применения альтернативной терапии на этапе 936.
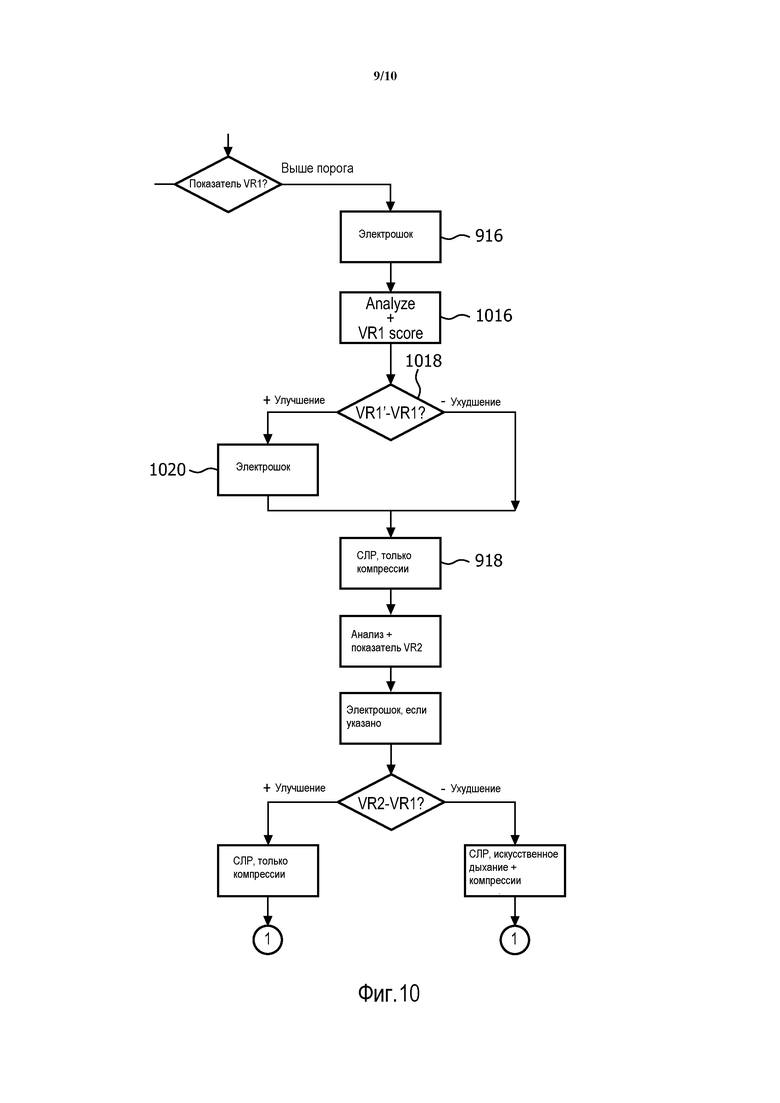
Другой вариант осуществления изобретения показан на блок-схеме последовательности выполнения операций на фиг. 10. На фиг. 9 показан традиционный протокол использования электрошока, имеющий заданное количество электрошоков, которые должны быть применены до следующего периода СЛР; в этом примере показан протокол с одиночным электрошоком. Изобретатели обнаружили, что показатель ROSC, который вычисляется сразу после электрошока, может указать, может ли дополнительный электрошок принести пользу пациенту до вхождения в период СЛР. В действительности, этот вариант осуществления использует показатель ROSC, чтобы корректировать количество электрошоков, которые должны подаваться серией до продолжения реанимации.
На фиг. 10 показан модифицированный процесс принятия решения, который вставляется между этапом 916 на фиг. 9 и этапом 918 на фиг. 9. Сразу после электрошока на этапе 916, АВД получает данные ЭКГ и на этапе 1016 вычисляет следующий показатель ROSC VR1'. Далее на этапе 1018 принятия решения АВД сравнивает VR1' с первым показателем ROSC VR1. Увеличение показателя ROSC указывает на повышенный шанс выживания, даже если ритм ЭКГ не был преобразован электрошоком, так что может быть назначен дополнительный электрошок. АВД, таким образом, приводится в состояние готовности и предписывает дополнительный электрошок, который должен быть применен до инициирования периода СЛР на этапе 918. Ухудшение показателя ROSC, обнаруженное на этапе 1018, однако, может указать, что немедленная СЛР лучше для пациента. В этом случае АВД на этапе 918 без дальнейшей задержки инициирует СЛР.
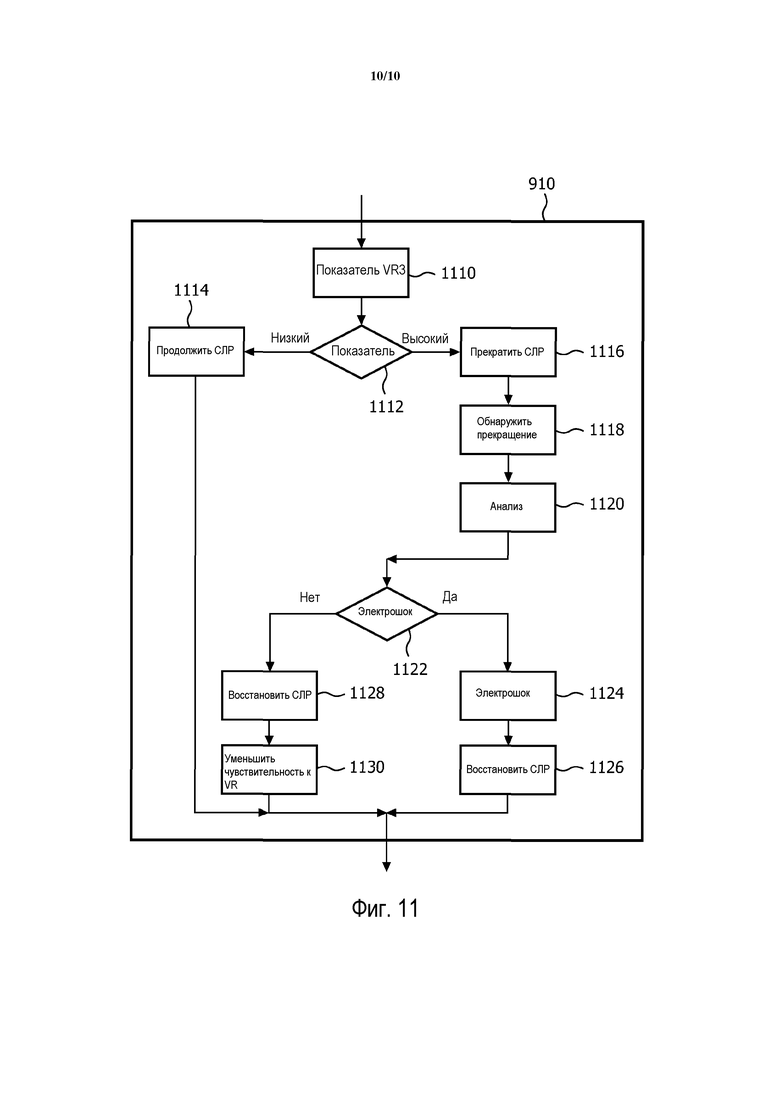
Еще один вариант осуществления изобретения показан на блок-схеме последовательности выполнения операций на фиг. 11. На фиг. 11 показано использование во время периода СЛР показателя ROSC VR3, чтобы оптимизировать терапию в соответствии с результатами, показанными на фиг. 7 и 8. Здесь показан период СЛР этапа 910 на фиг. 9, хотя понятно, что способ изобретения может быть введен в любой из описанных здесь периодов СЛР.
Вариант осуществления, показанный на фиг. 11, показывает процессор АВД принятия решения о лечении, который получает данные ЭКГ во время периода 910 СЛР. АВД на этапе 1110 вычисляет показатель ROSC VR3 и на этапе 1112 сравнивает VR3 с порогом. Показатель ROSC VR3 ниже порога указывает низкую вероятность ритма, при котором необходим электрошок. АВД в этом случае, таким образом, предписывает на этапе 1114 продолжающуюся СЛР.
Показатель ROSC VR3 выше порога, однако, указывает высокую вероятность ритма, при котором необходим электрошок, то есть достаточно мощного, чтобы быть преобразованным немедленным электрошоком. АВД в этом случае предписывает на этапе 1116 прерывание СЛР посредством звуковых и/или визуальных выходных сигналов интерфейса 214 пользователя. Затем АВД на этапе 1118 обнаруживает прекращение СЛР любым из ранее описанных способов, используя, в том числе ток в синфазном режиме, импеданс пациента или вторичные датчики компрессий стенки грудной клетки. Затем на этапе 1120 АВД анализирует данные ЭКГ, чтобы подтвердить наличие ритма, при котором необходим электрошок.
Если ритм, при котором необходим электрошок, подтверждается на этапе 1122 на фиг. 11, АВД приводится в состояние готовности и на этапе 1124 предписывает применение дефибрилляционного электрошока. После того, как электрошок проведен, на этапе 1126 СЛР возобновляется до конца периода СЛР.
Этап 1120 анализа может вместо этого указать, что показатель ROSC VR3 является ложно положительным результатом, вызванным артефактом СЛР. В этом случае, важно, чтобы ложно положительный результат не возникал снова в последующих периодах СЛР, чтобы обеспечивать непрекращающиеся компрессии. Таким образом, АВД реагирует на ложно положительный показатель ROSC VR3, предписывая на этапе 1128 непосредственное возобновление СЛР. Кроме того, АВД на этапе 1130 предпочтительно уменьшает чувствительность использованного на этапе 1112 порога показателя ROSC.
Настоящее изобретение предполагает альтернативы описанной выше процедуре. Например, режим работы СЛР, предписанный АВД, при наличии требующего проведения электрошока низкого начального показателя ROSC может быть первым режимом работы СЛР вместо второго режима работы СЛР. Режим работы СЛР, предписанный АВД, после электрошока и при наличии ухудшения (то есть падения) показателя vRhythm, может быть вторым режимом работы СЛР вместо первого режима работы СЛР. Эти альтернативы могут использоваться, основываясь на оцененном качестве СЛР.
Другая альтернатива заключается в использовании порогового показателя как критерия принятия решения для изменения первого режима работы СЛР на второй режим работы СЛР, вместо использования простого увеличения или уменьшения критериев показателей. Этот способ, вероятно, может привести в результате к меньшему количеству корректировок в режиме работы СЛР, что может в некоторой степени уменьшить путаницу во время реанимации. Кроме того, использование порога отчасти больше соответствует аналитической основе изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДЕФИБРИЛЛЯТОР С ДИНАМИЧЕСКИМ НЕПРЕРЫВНЫМ CPR ПРОТОКОЛОМ | 2011 |
|
RU2573046C2 |
| АВТОМАТИЧЕСКИЙ ВНЕШНИЙ ДЕФИБРИЛЛЯТОР С УВЕЛИЧЕННЫМ ВРЕМЕНЕМ ПРОВЕДЕНИЯ СЛР | 2006 |
|
RU2393887C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОЦЕНКИ НАДЕЖНОСТИ РЕКОМЕНДАЦИИ ОТНОСИТЕЛЬНО РАЗРЯДА ПРИ СЕРДЕЧНО-ЛЕГОЧНОЙ РЕАНИМАЦИИ | 2014 |
|
RU2672521C2 |
| АВТОМАТИЧЕСКИЙ ВНЕШНИЙ ДЕФИБРИЛЛЯТОР С СОКРАЩЕННОЙ ПАУЗОЙ ДЛЯ АНАЛИЗА РИТМА | 2017 |
|
RU2741468C2 |
| НЕМАГНИТНАЯ ВЫСОКОВОЛЬТНАЯ СИСТЕМА ЗАРЯДКИ ДЛЯ ИСПОЛЬЗОВАНИЯ В УСТРОЙСТВАХ ДЛЯ СТИМУЛЯЦИИ СЕРДЦА | 2010 |
|
RU2562852C2 |
| Способ общедоступной автоматической наружной дефибрилляции | 2018 |
|
RU2673373C1 |
| УНИВЕРСАЛЬНЫЙ ОБУЧАЮЩИЙ АДАПТЕР АВД | 2012 |
|
RU2603425C2 |
| Терминал системы общедоступной дефибрилляции | 2018 |
|
RU2662900C1 |
| ФУТЛЯР ДЛЯ ДЕФИБРИЛЛЯТОРА И ВСПОМОГАТЕЛЬНЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ КРОНШТЕЙН ДЛЯ ИЗМЕРИТЕЛЯ КПР | 2011 |
|
RU2573958C2 |
| ПРЕДОТВРАЩЕНИЕ НЕПРЕДНАМЕРЕННОГО РАЗРЯДА ЛИТИЕВОЙ БАТАРЕИ АВТОМАТИЧЕСКОГО ВНЕШНЕГО ДЕФИБРИЛЛЯТОРА | 2014 |
|
RU2677533C2 |
Группа изобретений относится к медицинской технике. Дефибриллятор для обнаружения ритма сердца, при котором необходим электрошок, содержит схему подачи высокого напряжения для проведения электротерапии; входную схему электрокардиограммы (ЭКГ), соединенную с источником сигналов ЭКГ; контроллер, соединенный с входной схемой ЭКГ. Контроллер содержит анализатор сердечно-легочной реанимации (СЛР) для идентификации периодов отсутствия активности СЛР. Процессор принятия решения о лечении, реагирующий на сигналы ЭКГ, действует для оценки вероятности ритма, при котором необходим электрошок, и использует сигналы ЭКГ, полученные только во время периодов отсутствия активности СЛР, идентифицированных анализатором СЛР, основываясь на сигналах ЭКГ, накопленных за два периода отсутствия активности СЛР, разделенных периодом активности СЛР. Интерфейс пользователя, реагирующий на определение процессора принятия решения о лечении, предоставляет команду вывода на прекращение СЛР и последующую команду вывода на проведение электротерапии через схему высокого напряжения. Раскрыт способ управления командами вывода от дефибриллятора. Изобретения позволяют повысить эффективность реанимации за счет автоматического определения ритма сердца, при котором необходим электрошок. 2 н. и 10 з.п. ф-лы, 11 ил.
1. Дефибриллятор для обнаружения ритма сердца, при котором необходим электрошок, во время сердечно-легочной реанимации (СЛР) и для предоставления в ответ команд для прекращения СЛР и проведения электротерапии через схему высокого напряжения, содержащий:
схему (208) подачи высокого напряжения для проведения электротерапии;
входную схему (202) электрокардиограммы (ЭКГ), соединенную с источником сигналов ЭКГ;
контроллер (206), соединенный с возможностью связи с входной схемой ЭКГ, содержащий
анализатор СЛР для идентификации периодов отсутствия активности СЛР;
процессор принятия решения о лечении, реагирующий на сигналы ЭКГ, который действует для оценки вероятности ритма, при котором необходим электрошок, существующего во время периода СЛР, и который определяет, должна ли СЛР быть прервана до окончания периода СЛР, чтобы провести электротерапию, при этом процессор принятия решения о лечении использует сигналы ЭКГ, полученные только во время периодов отсутствия активности СЛР, идентифицированных анализатором СЛР, и дополнительно при этом определение процессора принятия решения о лечении основывается на сигналах ЭКГ, накопленных за два периода отсутствия активности СЛР, идентифицированных анализатором СЛР, разделенных периодом активности СЛР, идентифицированным анализатором СЛР; и
интерфейс пользователя (214), реагирующий на определение процессора принятия решения о лечении, который предоставляет команду вывода на прекращение СЛР и последующую команду вывода на проведение электротерапии через схему высокого напряжения.
2. Дефибриллятор по п. 1, дополнительно содержащий второй источник сигналов, соединенный с контроллером, и в котором анализатор СЛР идентифицирует периоды отсутствия активности СЛР, основываясь на сигналах от второго источника сигналов.
3. Дефибриллятор по п. 2, в котором сигналы от второго источника сигналов выбираются из одного из группы: токовый сигнал в синфазном режиме, сигнал импеданса пациента и сигнал ускорения тела пациента.
4. Дефибриллятор по п. 1, в котором контроллер дополнительно содержит:
схему анализа данных ЭКГ, которая анализирует сигналы ЭКГ, полученные во время периодов отсутствия активности СЛР, идентифицированных анализатором СЛР, чтобы определить, рекомендуется электрошок или не рекомендуется электрошок.
5. Дефибриллятор по п. 4, в котором контроллер дополнительно выполнен с возможностью запрета определения в последующих периодах СЛР, если процессор принятия решения о лечении определяет, что период СЛР должен быть прерван, а схема анализа данных ЭКГ впоследствии определяет, что электрошок не рекомендуется.
6. Дефибриллятор по п. 4, в котором контроллер дополнительно выполнен с возможностью коррекции параметра определения, используемого процессором принятия решения о лечении, в последующих периодах СЛР, если процессор принятия решения о лечении определяет, что период СЛР должен быть прерван, а схема анализа данных ЭКГ впоследствии определяет, что электрошок не рекомендуется.
7. Дефибриллятор по п. 6, в котором параметр определения, используемый процессором принятия решения о лечении, выбирается из группы, содержащей параметр фильтра и пороговый параметр.
8. Способ управления командами вывода от дефибриллятора, содержащий этапы, на которых:
предоставляют источник (900) сигналов ЭКГ пациента, принимаемых во время периода СЛР;
оценивают по сигналам ЭКГ пациента вероятность ритма, при котором необходим электрошок, существующего во время периода (920, 930) СЛР;
определяют, должна ли СЛР быть прервана до окончания периода СЛР, основываясь на этапе (924, 932) оценки; и
предоставляют команду вывода от дефибриллятора на прекращение СЛР (1116), основываясь на этапе определения:
обнаруживают период отсутствия активности (1118) СЛР;
анализируют (1120) сигналы ЭКГ, полученные во время периода отсутствия активности СЛР, чтобы определить, рекомендуется электрошок или не рекомендуется электрошок;
корректируют (1130) параметр на этапе определения, если ритм, при котором необходим электрошок, определяется на этапе определения, а на этапе анализа электрошок не рекомендуется; и
выдают команду вывода на восстановление СЛР (1128).
9. Способ по п. 8, дополнительно содержащий этапы, на которых:
обнаруживают период отсутствия активности СЛР во время периода СЛР;
анализируют сигналы ЭКГ, полученные во время периода отсутствия активности СЛР во время периода СЛР, чтобы определить, рекомендуется электрошок или не рекомендуется электрошок; и
выдают команду вывода на проведение электротерапии, основываясь на этапе анализа.
10. Способ по п. 9, в котором этап обнаружения происходит после этапа предоставления команды вывода.
11. Способ по п. 8, в котором параметр этапа коррекции выбирается из группы, содержащей параметр фильтра и параметр порогового сравнения.
12. Способ по п. 8, в котором этап коррекции содержит запрещение этапа определения, если и на этапе определения определяют ритм, при котором необходим электрошок, и на этапе анализа электрошок не рекомендуется.
| US 2010076510 A1, 25.03.2010, | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 2004172068 A1), 02.09.2004 | |||
| Способ нанесения покрытия на плоские изделия | 1988 |
|
SU1595575A1 |
| АВТОМАТИЧЕСКИЙ ВНЕШНИЙ ДЕФИБРИЛЛЯТОР | 2004 |
|
RU2316363C2 |
Авторы
Даты
2016-09-10—Публикация
2012-03-15—Подача