Область изобретения
Настоящее изобретение относится к пробиотикам и, в частности, но не исключительно, способам и композициям для сохранения стабильности пробиотиков во время одного или нескольких из производства, хранения и/или транспортировки, а также введения субъекту-млекопитающему, такому как субъект-человек.
Предпосылки изобретения
Пробиотики представляют собой живые микробные пищевые добавки, которые благоприятно воздействуют на хозяина путем поддержки естественной флоры кишечника, противодействия вредным микроорганизмам в желудочно-кишечном тракте, содействия полезным метаболическим процессам и усиления устойчивости организма-хозяина к токсичным веществам. Благоприятные эффекты, которые могут вызывать пробиотики, являются многочисленными. Несколько примеров представляют собой снижение непереносимости лактозы, подавление патогенных бактерий и паразитов, снижение диареи, противодействие Helicobacter pylori, предупреждение рака толстой кишки, улучшение или предупреждение запора, in situ образование витаминов, модуляция жиров крови и модуляция иммунных функций хозяина. У одомашненных или водных животных они могут также увеличивать рост, выживаемость и стрессоустойчивость, связанную с заболеваниями и неблагоприятными условиями культивирования. Таким образом, существует значительный интерес к включению пробиотиков в продукты питания человека и корм для животных.
Пробиотические организмы должны оставаться живыми в течение срока годности продукта, чтобы быть действенными. Пробиотические организмы обычно вводят в молочные продукты, такие как йогурты.
Пробиотические организмы также обычно применяют в качестве безрецептурного лекарственного средства, такого как Mutaflor, пробиотическое лекарственное средство, содержащее в качестве активного ингредиента штамм Е. coli Nissle 1917. Необходимость в таких пробиотиках особенно усиливается после лечения антибиотиками, во время которого естественная микрофлора, существующая в нижнем отделе ЖК тракта, может быть сильно повреждена. Однако в этом случае полезные микроорганизмы должны доставляться в нижний отдел ЖК тракта и, особенно, в толстую кишку.
При большинстве видов медикаментозного лечения, в которые включено применение антибиотиков, обычно, в кишечнике уничтожаются все или большинство полезных бактерий.
Во время курса антибиотиков и в течение продолжительного периода после него чаще всего рекомендуется защита кишечника с помощью приема пробиотиков.
Альтернативным подходом, в частности, если после лечения антибиотиками развилась вредная Candida, является прием защитных добавок, включающих соответствующий пробиотик, который должен быть доставлен в нижний отдел ЖК тракта. Это лечение, как полагают, вытесняет Candida и других вредных бактерий.
Независимо от того, вводятся ли пробиотики как безрецептурное лекарственное средство, или как защитная добавка, наиболее важным является обеспечение специфической доставки пробиотиков в толстую кишку. По этой причине пробиотики должны быть покрыты соответствующим пленочным покрывающим полимером, чтобы препятствовать высвобождению пробиотиков в верхнем отделе ЖК тракта для специфической доставки в толстую кишку.
На активность и долгосрочную стабильность пробиотических бактерий может воздействовать ряд факторов окружающей среды, например, температура, pH, наличие воды/влажности и кислорода или окисляющих или восстанавливающих средств. Хорошо известно, что многие чувствительные к высокой температуре пробиотики сразу же теряют свою активность во время хранения даже при температуре окружающей среды (AT). Как правило, пробиотические бактерии должны быть высушены перед или во время смешивания с другими ингредиентами продуктов питания. Процесс высушивания зачастую может приводить к значительной потере активности вследствие температурных, механических, химических или осмотических стрессов, запускаемых процессом сушки. Потеря активности может происходить на многих отдельных этапах, в том числе при сушке, во время первоначального производства, при получении конечного продукта (в том числе при процессах капсулирования и нанесения покрытия, если пробиотики предназначены для лечения с помощью лекарственных препаратов) (при воздействии высокой температуры, высокой влажности и кислорода), транспортировке, долгосрочном хранении и после употребления и прохождения через желудочно-кишечный (ЖК) тракт (воздействие низкого рН, протеолитических ферментов и солей желчных кислот). Производство пищи или кормов с живыми клеточными организмами или пробиотиками является особенно сложным, поскольку пробиотики очень чувствительны к кислороду, температуре и влажности, которые фактически представляют собой нормальный режим для продуктов питания.
Многие пробиотики проявляют свой полезный эффект преимущественно, когда они живы. Следовательно, они должны выжить в течение производственного процесса и срока хранения. Подобным образом они должны выжить в условиях желудочно-кишечного тракта, таких как очень низкий pH, существующий в желудке, непосредственно после употреблении пищи до достижения ими мест колонизации. Хотя для употребления животными или человеком доступны множество коммерческих пробиотических продуктов, большинство из них теряют свою жизнеспособность во время процесса производства, транспортировки, хранения, а также в ЖК тракте животного/человека.
Для восполнения такой потери в продукт включают избыточное количество пробиотиков в ожидании того, что часть выживет и достигнет своей цели. Не говоря о вызывающей сомнение жизнеспособности этих продуктов при хранении, такая практика, конечно же, не является рентабельной.
В области техники с переменным успехом применялись различные защитные агенты. Они включают белки, некоторые полимеры, обезжиренное молоко, глицерин, полисахариды, олигосахариды и дисахариды. Дисахариды, такие как сахароза и трегалоза, являются особенно привлекательными криозащитными веществами, поскольку они обычно помогают растениям и микробным клеткам оставаться в состоянии анабиоза во время периодов засухи. Как было показано, трегалоза была эффективным защитным веществом для различных биологических материалов, как при сушке в атмосферном воздухе, так и при лиофилизации.
В качестве альтернативы, пробиотические микроорганизмы можно инкапсулировать с помощью методик нанесения энтеросолюбильного покрытия, в том числе нанесения пленкообразующего вещества, обычно путем распыления жидкостей, содержащих энтеросолюбильный полимер и, как правило, другие добавки, такие как сахар и белки, на сухие пробиотики (Ko and Ping, WO 02/058735). Однако процесс нанесения энтеросолюбильного покрытия сам по себе предусматривает нагревание и высокий уровень влажности, оба из которых действуют разрушительно на жизнеспособность пробиотиков.
Краткое описание изобретения
Многие пробиотики могут быть чувствительными к температуре и, следовательно, им нельзя обеспечить длительный срок хранения. Таким образом, для сохранения жизнеспособности им необходима защита во время обработки, транспортировки и хранения, а также во время доставки в желудочно-кишечный тракт. Известный уровень техники не смог предоставить решение этой проблемы сохранения жизнеспособности пробиотика во время производства, хранения и/или транспортировки и приема внутрь, и в то же время обеспечения пробиотиков в форме, которая подходит для приема внутрь субъектом-млекопитающим, например, таким как субъект-человек.
Настоящее изобретение преодолевает эти недостатки известного уровня техники путем обеспечения слоистой композиции для заключения пробиотиков, в которой слои специфичны в отношении температуры, содержащей материалы, которые подходят для приема внутрь человеком. Также подразумевается, что термин «человек» относится к млекопитающим в целом в соответствии по меньшей мере с несколькими вариантами осуществления настоящего изобретения. Также представлены ее способы применения и получения. Только с целью обсуждения и без каких-либо ограничений, композицию, предпочтительно, получают в форме слоистых микрокапсул, как описано в данном документе.
Слоистые микрокапсулы могут содержать различные покрывающие слои, которые имеют специфический порядок размещения, где каждый слой может состоять по меньшей мере из одного материала с фазовым переходом, который способен поглощать тепло из окружающей среды и все еще поддерживать постоянную температуру или незначительно увеличивать температуру вследствие процесса расплавления, происходящего при определенной температуре (например, точке плавления), и основу ядра, которая имеет термочувствительный компонент, заключенный в ней. Структура слоистого микроинкапсулирования разработана таким образом, что слои размещаются изнутри наружу в порядке возрастания точки плавления. Необязательно, затем композицию покрывают слоем энтеросолюбильного покрытия.
Неограничивающий пример способа микроинкапсулирования, необязательно, включает сухое холодное гранулирование чувствительного активного материала с применением расплавленного материала, дающего в результате основу ядра, и наслаивание с применением теплопоглощающих материалов с возрастающими точками плавления. Необязательно, дополнительно или альтернативно, для некоторых слоев можно применять способ нанесения покрытия из расплава, для таких как, например, внешний энтеросолюбильный покрывающий слой.
Основу ядра можно покрывать различными слоями материала с фазовым переходом с различными точками плавления, что дает в результате слоистую микрокапсульную структуру. После процесса наслаивания слоистую микрокапсулу можно, необязательно, покрывать энтеросолюбильным покрывающим слоем, который растворим в ЖК тракте.
Не желая ограничиваться закрытым списком, неожиданно было обнаружено, что пробиотические бактерии защищены в течение длительного периода времени при температуре окружающей среды, если хранятся в определенной защитной композиции. Дополнительными характеристиками защитной композиции являются быстрый и рентабельный способ получения и защита во многих типах твердых лекарственных форм.
Настоящее изобретение, по меньшей мере в нескольких вариантах осуществления, предусматривает способ и композицию для получения термоустойчивых пробиотических бактерий для продукта, приемлемого с пищевой или нутрицевтической или фармацевтической точки зрения, содержащего: (a) композицию ядра в форме частиц, содержащих пробиотические бактерии и по меньшей мере одну основу, содержащую, необязательно, по меньшей мере одно соединение сахара, такое как мальтодекстрин, трегалоза, лактоза, галактоза, сахароза, фруктоза и тому подобное, стабилизатор, такой как акцептор кислорода (антиоксидант), такой как L-цистеина основание или L-цистеина гидрохлорид, по меньшей мере одно связующее с точкой плавления ниже 50°C и выше 25°C, предпочтительно, ниже 45°C и выше 25°C и, наиболее предпочтительно, ниже 40°C и выше 25°C, необязательно, заполнитель, такой как микрокристаллическая целлюлоза, и, необязательно, другие пищевые ингредиенты, где общее количество пробиотиков в смеси составляет от приблизительно 10% до приблизительно 90% по весу композиции ядра; (b) первый покрывающий слой, который представляет собой самый внутренний покрывающий слой, содержащий по меньшей мере один первый материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками; (c) второй покрывающий слой, содержащий по меньшей мере один второй материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых первым покрывающим слоем, при этом второй РСМ имеет точку плавления, которая выше точки плавления первого РСМ; (d) необязательно, третий покрывающий слой, содержащий по меньшей мере один третий материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых вторым покрывающим слоем, при этом третий РСМ имеет точку плавления, которая выше точки плавления второго РСМ; (e) необязательно, после этого, дополнительное количество покрывающих слоев, где каждый слой содержит по меньшей мере один материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующих стабильную пленку вокруг частиц ядра с пробиотиками, покрытых предыдущим покрывающим слоем, где каждый РСМ имеет точку плавления, которая выше точки плавления РСМ, составляющего предыдущий слой (нижележащий слой); (d) необязательно и предпочтительно самый внешний слой, содержащий полимер, который растворяется в ЖК тракте, тем самым, с получением слоистой структуры, обеспечивающей гранулы или микрокапсулы со стабилизированными пробиотиками для получения лекарственной формы для перорального введения. Необязательно, частицы, содержащие пробиотики, имеют форму гранулированного материала или материала из более мелких частиц, например, такого как порошок.
Оба РСМ слоя, а также самый внешний слой, необязательно, могут также содержать по меньшей мере один наполнитель, такой как, например, пластификатор, скользящее вещество, в том числе без ограничения диоксид кремния, смазывающее вещество и антиадгезивы, в том числе без ограничения микрокристаллическую целлюлозу, тальк или диоксид титана. Стабилизированные бактерии способны оставаться устойчивыми во время процесса производства или получения, или последующего процесса обработки, такого как процесс нанесения покрытий, где имеется воздействие высокой температуры. Полученные стабилизированные бактерии также способны оставаться устойчивыми при режиме хранения при температуре окружающей среды.
Полученные гранулы или микрокапсулы со стабилизированными пробиотиками необязательно и предпочтительно подходят для примешивания/добавления в пищевые продукты, такие как шоколад, сыр, сливки, соусы, майонез и заполнитель для печенья, при этом частицы с пробиотиками содержат устойчивые к воздействию кислорода, к температуре окружающей среды и влагоустойчивые пробиотические бактерии. Стабилизированные бактерии способны оставаться устойчивыми во время процесса производства или получения, где имеется воздействие высокой температуры. Стабилизированные бактерии также способны оставаться устойчивыми при режиме хранения при температуре окружающей среды даже после добавления их в пищевой продукт.
Краткое описание графических материалов
Настоящее изобретение, описанное в данном документе в соответствии с несколькими иллюстративными вариантами осуществления, будет понято и оценено более подробно из следующего подробного описания в сочетании с графическими материалами, в которых:
Фиг. 1(a) и 1(b) представляют собой схематические изображения графиков, показывающих теплосодержание Q в зависимости от температуры T.
Фиг. 2 представляет собой схематическое изображение графика, который демонстрирует эффект медленного охлаждения на точку плавления PEG с различными молекулярными массами.
Фиг. 3 представляет собой схематическое изображение графика, который демонстрирует эффект быстрого охлаждения на точку плавления PEG с различными молекулярными массами.
Фиг. 4 представляет собой схематическое изображение графика, который демонстрирует эффект медленного охлаждения на точку плавления смеси, содержащей PEG 1500 и PEG 6000.
Фиг. 5 представляет собой схематическое изображение графика, который демонстрирует эффект быстрого охлаждения на точку плавления смеси, содержащей PEG 1500 и PEG 6000.
Фиг. 6 представляет собой схематическое изображение графика, который демонстрирует эффект быстрого охлаждения на точку плавления смеси, содержащей PEG 1000 и PEG 6000.
Фиг. 8 представляет собой схематическое изображение термограммы многослойной структуры, содержащей PEG 1000 и PEG 2000.
Фиг. 9 представляет собой схематическое изображение термограммы многослойной структуры, содержащей PEG 1000, PEG 2000 и PEG 4000.
Фиг. 10 представляет собой схематическое изображение термограммы многослойной структуры, содержащей PEG 1000, PEG 2000 и PEG 8000.
Фиг. 11 представляет собой схематическое изображение термограммы многослойной структуры, содержащей PEG 1000, PEG 4000 и PEG 8000.
Фиг. 12 представляет собой схематическое изображение термограммы многослойной структуры, содержащей PEG 1500, PEG 6000 и PEG 8000.
Подробное описание предпочтительных вариантов осуществления
Для многих чувствительных пробиотических бактерий, а также фармацевтически или нутрицевтически активных материалов очень важным является поддержание температуры ниже критической температуры, при которой они могут потерять значительную часть жизнестойкости, жизнеспособности и/или биологической активности. Существует множество соображений, как такие продукты на основе чувствительных пробиотических бактерий, а также фармацевтически или нутрицевтически активные материалы, могут подвергаться воздействию повышенных температур, в том числе без ограничения воздействию повышенных температур во время производства, транспортировки и хранения.
В настоящее время было обнаружено, что пробиотические бактерии можно неожиданно эффективно стабилизировать для применения в приготовлении пищи и процессе получения фармацевтических, нутрицевтических и пищевых продуктов с помощью процесса наслаивания с использованием требуемой комбинации покрывающих слоев из материала с фазовым переходом, имеющих определенный порядок размещения. Бактерии вводили в состав ядра или гранулы, покрытых покрывающими слоями, тем самым, получали композиции с пробиотиками, обеспечивающие жизнеспособные пробиотические организмы даже после продолжительного времени хранения при температуре окружающей среды, при этом композиция также является стабильной при хранении и сроке хранения продукта питания или фармацевтических, нутрицевтических и пищевых продуктов, содержащих защищенные пробиотики в соответствии с настоящим изобретением, и способна обеспечивать жизнеспособные бактерии в желудочно-кишечном тракте после перорального введения.
Материалы каждого слоя выбирали таким образом, что температура процесса производства является более низкой для слоев, находящихся ближе к ядру, содержащему пробиотики, но более высокой при отдалении от ядра, содержащего пробиотики. Такая комбинация обеспечивает защиту пробиотика, а также обеспечивает полученной композиции требуемые характеристики с точки зрения прочности и стабильности покрытого продукта в целом, возможности применения требуемых материалов на внешних слоях, для которых предусмотрены высокие температуры, возможности применения требуемых производственных процессов для внешних слоев, которым требуются высокие температуры и так далее.
Настоящее изобретение, по меньшей в нескольких вариантах осуществления, направлено на способ получения пробиотиков, защищенных от высоких температур, для включения в продукты питания, такие как сливки, крема для печенья, заполнитель для печенья, виды шоколада, соусы, сыр, майонез и т.д., или фармацевтические, нутрицевтические и пищевые продукты в виде твердой лекарственной формы, такой как частицы, шарики, микросферы, гранулы, минитаблетки, таблетки, капсуловидные таблетки, капсулы, MUPS, и жидкой лекарственной формы, такой как сиропы, напитки и тому подобное.
В предпочтительном варианте осуществления настоящего изобретения лекарственная форма, содержащая гранулы или микрокапсулы со стабилизированными пробиотиками, также, необязательно и предпочтительно, покрыта энтеросолюбильным полимером, который может также обеспечивать защиту от разрушающих действий на протяжении ЖК тракта, таких как среды с низким рН и ферменты.
Самый внешний слой содержит полимер, который также обеспечивает защиту либо от кислорода, либо от влажности, или одновременно от кислорода и влажности, и, который растворим в ЖК тракте, тем самым, получают слоистую структуру, обеспечивающую гранулы или микросферы со стабилизированными пробиотиками для получения лекарственной формы для перорального введения. В предпочтительном варианте осуществления настоящего изобретения лекарственную форму, содержащую гранулы или микрокапсулы со стабилизированными пробиотиками, также, необязательно и предпочтительно, покрывают энтеросолюбильным полимером, который может также обеспечивать защиту от разрушающих действий на протяжении ЖК тракта, таких как среды с низким рН и ферменты. Необязательно, продукт можно также получать без нанесения вреда пробиотикам в ходе способа, который включает способ гранулирования из расплава.
В соответствии с настоящим изобретением предусмотрен способ получения пробиотических бактерий, стойких к высоким температурам, для обеспечения высокой стабильности и продолжительного срока хранения при температуре окружающей среды для пищевого продукта или продукта, приемлемого с пищевой или нутрицевтической или фармацевтической точки зрения, включающий, в соответствии с предпочтительным вариантом осуществления, способ получения микрокапсул, материала в виде гранул или частиц с пробиотиками, имеющих: i) ядро с пробиотическими бактериями, которое может содержать по меньшей мере одно стабилизирующее средство, антиоксидант, основу, заполнитель, связующее и другие наполнители, и также имеющих: ii) первый покрывающий слой, который является самым внутренним покрывающим слоем, содержащий по меньшей мере один первый материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, и также имеющих: iii) второй покрывающий слой, содержащий по меньшей мере второй материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых первым покрывающим слоем, при этом второй РСМ имеет точку плавления, которая выше точки плавления первого РСМ, и также, необязательно, имеющие: iv) третий покрывающий слой, содержащий по меньшей мере один третий материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых вторым покрывающим слоем, при этом третий РСМ имеет точку плавления, которая выше точки плавления второго РСМ, и также, необязательно, после этого, имеющие: v) дополнительное количество покрывающих слоев, где каждый слой содержит по меньшей мере один материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых предыдущим покрывающим слоем, где каждый РСМ имеет точку плавления, которая выше точки плавления РСМ, составляющего предыдущий слой (нижележащий слой), где первый, второй, третий и любые другие РСМ, применяемые в процессе нанесения слоев, могут быть химически аналогичными или отличаться друг от друга, и также, необязательно и предпочтительно, имеющие: vi) самый внешний слой, содержащий полимер, который растворяется в ЖК тракте, тем самым, с получением слоистой структуры, обеспечивающей гранулы или микросферы со стабилизированными пробиотиками для получения лекарственной формы для перорального введения.
Каждый РСМ слой, а также самый внешний слой, необязательно, также могут содержать по меньшей мере один наполнитель, такой как, например, пластификатор, скользящее вещество, в том числе без ограничения диоксид кремния, смазывающее вещество и антиадгезивы, в том числе без ограничения микрокристаллическую целлюлозу, тальк или диоксид титана. Стабилизированные бактерии способны оставаться устойчивыми во время процесса производства или получения, или последующего процесса обработки, такого как процесс нанесения покрытия, где имеется воздействие высокой температуры. Стабилизированные бактерии также способны оставаться устойчивыми при режиме хранения при температуре окружающей среды.
В соответствии с настоящим изобретением предусмотрен способ получения пробиотических бактерий, стойких к высоким температурам, для обеспечения высокой стабильности и продолжительного срока хранения при температуре окружающей среды для продукта здорового питания или продукта, приемлемого с пищевой, или нутрицевтической, или фармацевтической точки зрения, включающий, в соответствии с предпочтительным вариантом осуществления, способ получения микрокапсул, материала в виде гранул или частиц с пробиотиками, имеющих: i) ядро с пробиотическими бактериями, которое может содержать по меньшей мере одно стабилизирующее средство, антиоксидант, основу, заполнитель, связующее и другие наполнители, и также имеющие: ii) первый покрывающий слой, который является самым внутренним покрывающим слоем, содержащий по меньшей мере один первый материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, и также имеющие: iii) второй покрывающий слой, содержащий по меньшей мере один второй материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых первым покрывающим слоем, где второй РСМ имеет точку плавления, которая выше точки плавления первого РСМ, и, необязательно, также имеющие: iv) третий покрывающий слой, содержащий по меньшей мере один третий материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых вторым покрывающим слоем, при этом третий РСМ имеет точку плавления, которая выше точки плавления второго РСМ, и также, необязательно, после этого, имеющие: v) дополнительное количество покрывающих слоев, где каждый слой содержит по меньшей мере один материал с фазовым переходом (РСМ) с точкой плавления ниже 60°C и выше 20°C, предпочтительно, ниже 55°C и выше 20°C и, наиболее предпочтительно, ниже 50°C и выше 20°C, формирующий стабильную пленку вокруг частиц ядра с пробиотиками, покрытых предыдущим покрывающим слоем, при этом каждый РСМ имеет точку плавления, которая выше точки плавления РСМ, образующего предыдущий слой (нижележащий слой), где первый, второй, третий и любые другие РСМ, применяемые в процессе нанесения слоев, могут быть химически аналогичными, но отличаться друг от друга своими молекулярными массами, так что первый РСМ имеет самую низкую молекулярную массу, а самый внешний РСМ имеет более высокую молекулярную массу, и также, необязательно и предпочтительно, имеющие: vi) самый внешний слой (наружный слой), содержащий полимер, который растворяется в ЖК тракте, тем самым, с получением слоистой структуры, обеспечивающей гранулы или микросферы со стабилизированными пробиотиками для получения лекарственной формы для перорального введения. Как РСМ слои, так и самый внешний слой, необязательно, могут также содержать по меньшей мере один наполнитель, такой как, например, пластификатор, скользящее вещество, в том числе без ограничения диоксид кремния, смазывающее вещество и антиадгезивы, в том числе без ограничения микрокристаллическую целлюлозу, тальк или диоксид титана. Стабилизированные бактерии способны оставаться устойчивыми во время процесса производства или получения, или последующего процесса обработки, такого как процесс нанесения покрытия, где имеется воздействие высокой температуры. Стабилизированные бактерии также способны оставаться устойчивыми при режиме хранения при температуре окружающей среды.
В предпочтительном варианте осуществления настоящего изобретения пробиотические бактерии включают по меньшей мере одних термочувствительных пробиотических бактерий, гранула ядра или смесь ядра со стабилизированными пробиотиками в соответствии с настоящим изобретением представляет собой покрытую гранулу, содержащую по меньшей мере две слоистые фазы, например, ядро и два покрытия, или ядро и три или более покрытий. Обычно два покрытия состоят из двух РСМ с различными точками плавления, при этом внутренний слой имеет самую низкую точку плавления, и способствует, в основном, защите от высоких температур, обычно от температуры окружающей среды, другие покрытия представляют собой дополнительное количество РСМ слоев, которые отвечают за защиту от более высоких температур, внешнее покрытие представляет собой наружный покрывающий слой, который отвечает за предупреждение пропускания влажности и/или кислорода внутрь ядра во время хранения и срока хранения и/или за защиту от разрушающих действий на протяжении ЖК тракта, таких как среды с низким рН и ферменты. Обычно имеется два слоя, которые вносят максимальный вклад в стойкость к высокой температуре, однако, гранула со стабилизированными пробиотиками по настоящему изобретению может содержать дополнительное количество слоев, которые вносят вклад в процесс стабилизации бактерий при более высоких температурах, а также их стабильности в время хранения пищи, фармацевтического, нутрицевтического или пищевого продукта и при безопасной доставке бактерий в кишечник. Подобным образом, два или более РСМ слоев, составляющих слоистую структуру гранулы или микрокапсулы со стабилизированными пробиотиками, могут представлять собой химически одинаковые полимеры, но с различной вязкостью и молекулярной массой.
В предпочтительном способе производства продукта здорового питания с пробиотиками или продукта, приемлемого с пищевой, или нутрицевтической, или фармацевтической точки зрения, пробиотические бактерии смешивают по меньшей мере с одной основой, содержащей по меньшей мере один сахар и/или по меньшей мере один олигосахарид или полисахарид (в качестве добавочного средства для бактерий) и, необязательно, другие пищевые добавки, такие как стабилизаторы, заполнители, связующие, антиоксидант и т.д., тем самым, с получением смеси ядра; при этом частицы из смеси ядра покрывают внутренним покрывающим слоем, содержащим РСМ с точкой плавления ниже 60°C, формирующим стабильную пленку или матрицу, которая заключает пробиотик, тем самым, с получением частиц, покрытых первым РСМ слоем; при этом частицы, покрытые первым РСМ слоем, покрывают вторым слоем, содержащим по меньшей мере один РСМ, точка плавления которого выше точки плавления первого РСМ слоя, где второй РСМ слой может также обеспечивать стойкость пробиотиков к более высокой температуре, тем самым, с получением частиц, покрытых вторым РСМ слоем, при этом частицы, покрытые вторым РСМ слоем, покрывают дополнительным количеством внешних РСМ слоев, при этом внешние РСМ слои имеют точку плавления выше точки плавления второго РСМ слоя, придавая бактериям стабильность к более высоким температурам при хранении и сроке хранения при температуре окружающей среды, где каждый внешний РСМ слой имеет точку плавления выше точки плавления нижележащего РСМ слоя, тем самым, с получением слоистых частиц, покрытых несколькими РСМ слоями, при этом слоистые частицы, покрытые несколькими РСМ слоями, покрывают наружным покрывающим слоем, содержащим по меньшей мере один полимер, который растворяется в ЖК тракте, придавая бактериям стабильность при хранении и сроке хранения при температуре окружающей среды в условиях наличия кислорода и влажности и/или защиту от разрушающих действий ЖК тракта, таких как среды с низким рН и ферменты, или дополнительную обработку во время способа получения, такого как нанесение покрытия твердой лекарственной формы, содержащей слоистые частицы, где по меньшей мере один сахар может включать лактозу, галактозу или их смесь, по меньшей мере один олигосахарид или полисахариды могут включать галактан, мальтодекстрин и трегазозу, стабилизатор включает L-цистеина основание, заполнитель включает лактозу DC и/или микрокристаллическую целлюлозу, связующее включает полиэтиленгликоль 1000 (PEG 1000), первый покрывающий РСМ слой может включать PEG 1000, второй покрывающий РСМ слой может включать полиэтиленгликоль 1500 (PEG 1500), дополнительное количество внешних РСМ слоев может включать полиэтиленгликоль 2000 (PEG 2000), полиэтиленгликоль 4000 (PEG 4000) и полиэтиленгликоль 6000 (PEG 6000), соответственно, наружный покрывающий слой может включать карбоксиметилцеллюлозу (CMC) 7LFPH и/или карбоксиметилцеллюлозу (CMC) 7L2P. Как РСМ слои, так и самый внешний слой, необязательно, могут также содержать по меньшей мере один наполнитель, такой как, например, пластификатор, скользящее вещество, в том числе без ограничения диоксид кремния, смазывающее вещество и антиадгезивы, в том числе без ограничения микрокристаллическую целлюлозу, тальк или диоксид титана.
Другой предпочтительный способ производства пробиотических бактерий в виде слоистых микрокапсул включает следующие этапы:
1. Высушивание массы смеси пробиотиков по меньшей мере с одним сахаром и по меньшей мере одним олигосахаридом, и, необязательно, другими пищевыми добавками, такими как стабилизаотры, заполнители, антиоксиданты и т.д., тем самым, с получением смеси ядра.
2. Гранулирование смеси ядра с применением расплава связующего или в воздушной, или в азотной среде, тем самым, с получением гранулы ядра.
3. Нанесение покрытия на частицы гранулы ядра с помощью внутреннего покрывающего слоя, содержащего РСМ, тем самым, с получением гранул ядра, покрытых первым РСМ слоем.
4. Нанесение покрытия на гранулы ядра, покрытые первым РСМ слоем с помощью второго РСМ слоям, тем самым, с получением гранул ядра, покрытых вторым РСМ слоем.
5. Нанесение покрытия на гранулы ядра, покрытые вторым РСМ слоем с помощью дополнительного количества внешних РСМ слоев, тем самым, с получением слоистых гранул или микрокапсул с бактериями.
6. Нанесение покрытия с помощью наружного покрывающего слоя, который растворяется в ЖК тракте, тем самым, с получением слоистых частиц, содержащих пробиотики, которые демонстрируют превосходную стабильность в отношении высокой температуры и наличия кислорода и/или влажности в период хранения и во время срока хранения, и дополнительной обработки во время процесса получения, такой как нанесение покрытия твердой лекарственной формы, содержащей слоистые частицы, таким образом, они демонстрируют более высокую жизнеспособность и жизнестойкость.
Смесь, которая содержит пробиотический материал, получают и/или затем преобразовывают в гранулы, например, с помощью технологии псевдоожиженного слоя, такой как Glatt или Turbojet, Glatt или установки для нанесения покрытий/гранулятора Innojet, или установки для нанесения покрытий/гранулятора Huttlin или Granulex. Полученные гранулы микроинкапсулируют первым слоем, который представляет собой РСМ, затем вторым слоем с РСМ, имеющим точку плавления выше точки плавления первого слоя, затем покрывают другими РСМ, где каждый слой имеет точку плавления выше точки плавления предыдущего слоя, а затем, наконец, покрывают самым внешним слоем, обеспечивающим также защиту от влажности и кислорода. Затем полученные слоистые микроинкапсулированные пробиотики в соответствии с вышеизложенными этапами вводят в пищевой продукт, который можно также подвергать этапу нагрева во время процесса его приготовления. В качестве альтернативы, вышеизложенные полученные микроинкапсулированные пробиотики можно добавлять в фармацевтическую, или нутрицевтическую, или пищевую лекарственную форму, такую как частицы, шарики, микросферы, гранулы, минитаблетки, таблетки, капсуловидные таблетки, капсулы, MUPS, сиропы, напитки и тому подобное, которые могут подвергаться воздействию температуры окружающей среды во время процесса их получения, такого как процесс нанесения покрытия или упаковки. В условиях воздействия температуры окружающей среды на вышеуказанные полученные микроинкапсулированные пробиотики во время процесса получения пищевого продукта или фармацевтической, или нутрицевтической, или пищевой лекарственной формы РСМ слои, которые состоят из различных РСМ, отличающихся своими точками плавления, формируют защитные слои вокруг гранулы ядра с пробиотиками, предупреждая передачу тепла к пробиотикам. Кроме того, после помещения пищевого продукта или лекарственных форм фармацевтических, или нутрицевтических, или пищевых продуктов, содержащих инкапсулированные конкретные пробиотики, полученные описанным выше способом, на хранение или полку при температуре окружающей среды пробиотики демонстрируют более высокую выживаемость и жизнеспособность при хранении, таким образом, обеспечивается более продолжительный срок хранения. Таким образом, изобретение предусматривает пищевой продукт, такой как сливки, крема для печенья, заполнитель для печенья, виды шоколада, соусы, майонез, молочные продукты и тому подобное, или лекарственные формы фармацевтических, или нутрицевтических, или пищевые продуктов, такие как частицы, шарики, микросферы, гранулы, минитаблетки, таблетки, капсуловидные таблетки, капсулы, MUPS, сиропы, напитки и тому подобное, содержащие пробиотики, которые выживают во время этапа нагрева, необходимого при получении продукта для использования человеком. Также продукт будет характеризоваться более высокой жизнестойкостью и жизнеспособностью пробиотиков и, таким образом, будет демонстрировать продолжительный срок хранения. Пищевой продукт или фармацевтические, или нутрицевтические, или пищевые лекарственные формы продукта состоят из: a) инкапсулированных гранул, изготовленных из смеси, которая содержит пробиотический материал, который высушивают и преобразуют в гранулы ядра, подлежащие микроинкапсулированию первым слоем, который представляет собой РСМ, затем вторым слоем с РСМ, имеющим точку плавления выше точки плавления первого слоя, затем покрывают другими РСМ, где каждый слой имеет точку плавления выше точки плавления предыдущего слоя, а затем, наконец, покрывают самым внешним слоем, также обеспечивающим защиту от влажности и кислорода; и b) пищевого продукта или фармацевтических, или нутрицевтических, или пищевых лекарственных форм продукта, в которые предварительно добавлены микроинкапсулированные гранулы в соответствии с настоящим изобретением. Такой пищевой продукт может содержать пробиотики с высокой жизнеспособностью и жизнестойкостью даже после длительного периода хранения при температуре окружающей среды и, таким образом, может демонстрировать длительный срок хранения.
В соответствии с несколькими иллюстративными вариантами осуществления предусматривается способ получения пробиотических бактерий с высокой степенью выживаемости, которые допускают нагревание во время производства ниже 60°C или при приготовлении пищи или лекарственных форм фармацевтических, или нутрицевтических, или пищевых продуктов. В соответствии с одним вариантом осуществления настоящего изобретения первым этапом в получении пищи с пробиотиками или лекарственных форм фармацевтических или нутрицевтических или пищевых продуктов является получение ядра или гранул, содержащих высушенные пробиотические бактерии. Затем эти гранулы микроинкапсулируют с помощью различных РСМ слоев. Первый слой содержит по меньшей мере один РСМ с самой низкой точкой плавления. Затем создается второй слой, содержащий по меньшей мере один РСМ с точкой плавления выше точки плавления первого слоя. Затем создается третий слой, содержащий по меньшей мере один РСМ с точкой плавления выше точки плавления второго слоя. После этого, кроме того, можно создать дополнительные РСМ слои, где каждый слой имеет точку плавления, которая превышает точку плавления предыдущего слоя. Инкапсулированные пробиотики в виде гранул/в виде частиц затем добавляют в пищевой продукт или лекарственные формы фармацевтических, или нутрицевтических, или пищевых продуктов перед окончательным приготовлением. Пищевой продукт или лекарственная форма фармацевтических, или нутрицевтических, или пищевых продуктов, содержащая инкапсулированные пробиотики в виде гранул/в виде частиц, может содержать пробиотики с высокой жизнеспособностью и жизнестойкостью даже после последующих процессов получения, которые могут включать процесс нагрева и длительный период хранения при температуре окружающей среды, и, таким образом, может демонстрировать длительный срок хранения.
Наслаивание имеет важное значение, поскольку температура окружающей среды может меняться и не обязательно является постоянной. Микроинкапсулирование с нанесением слоев может гарантировать, что ядро будет в значительной степени защищено, если оно подвергается воздействию переменных температурных условий, где каждый слой со своей собственной специфической точкой плавления, может обеспечить ядру максимальную защиту при каждой температуре окружающей среды.
Чтобы воспрепятствовать вредному эффекту температуры и, таким образом, повышению температуры продукта, содержащего чувствительные пробиотические бактерии, в соответствии с настоящим изобретением была применена технология микроинкапсулирования с нанесением слоев с применением теплопоглощающего полимера.
Как правило, теплопоглощающий материал (НАМ) может представлять собой разновидность материала с фазовым переходом (РСМ), имеющего способность поглощать энергию в тепловой форме при определенной температуре, когда его состояние меняется. Поглощение тепла осуществляется во время процесса плавления РСМ, поскольку процесс плавления термодинамически представляет собой эндотермический процесс, при котором энергия из окружающей среды поглощается материалом, вызывая охлаждающий эффект.
Это тепло также может захватываться материалом для аккумулирования энергии. НАМ представляет собой оптимальный материал для аккумулирования энергии, который поглощает такое избыточное тепло. Это избыточное тепло плавит НАМ.
Эта особенность НАР не позволяет температуре продукта повышаться до тех пор, пока НАР не расплавиться полностью. Таким образом, температура может полностью поддерживаться в течение конкретного периода времени (до тех пор, пока РСМ не расплавиться полностью).
В целом, существует три режима аккумулирования тепловой энергии материалами. Это аккумулирование физической тепла (SHS), аккумулирование скрытого тепла (LHS) и аккумулирование энергии связей (BES). SHS относится к энергосистемам, которые аккумулируют тепловую энергию без фазового перехода. SHS происходит путем подведения тепла к энергоносителю и увеличения его температуры. Тепло подводится из источника тепла к жидкому или твердому материалу для аккумулирования. Нагревание материала, который подвергается фазовому переходу (РСМ), обычно плавится, называется LHS. Количество энергии, поглощенной в HLS, зависит от массы и скрытого тепла материала. В LHS поглощение осуществляется изометрически при фазовом переходе материала.
Аккумулирование физического тепла
Каждый материал по мере нагревания аккумулирует энергию внутри себя, и в данном случае является «материалом для аккумулирования физического тепла». Аккумулированную энергию можно определять количественно по показателю теплоемкости С, изменения температуры А ΔT = конечная температура - начальная температура и количеству дополнительного аккумулированного тепла ΔQ в соответствии со вторым законом термодинамики, как изложено ниже:
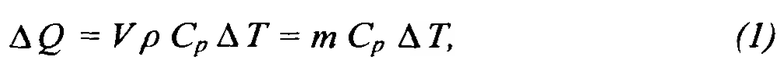
где
ΔQ = физическое тепло, аккумулированное материалом (Дж, британская тепловая единица)
V = объем вещества (м3, фут3)
ρ = плотность вещества (кг/м3, фунт/фут3)
m = масса вещества (кг, фунт)
Cp = удельная теплоемкость вещества (Дж/кг °C, британская тепловая единица/фунт °F)
ΔT = изменение температуры (°C, °F)
Очевидно, что при прочих равных условиях, чем выше теплоемкость (С) материала, тем большей будет аккумулированная энергия (ΔQ) для указанного повышения температуры (ΔT).
Материалы с фазовым переходом (РСМ)
Материал с фазовым переходом представляет собой материал для аккумулирования скрытого тепла, но может также аккумулировать физическое тепло. Для поглощения тепла они используют химические связи. Перемещение тепловой энергии происходит, когда материал переходит из твердой формы в жидкую форму или из жидкой формы в твердую форму. Это называется переходом состояния или «фазы». Различные фазовые переходы, которые могут происходить, представляют собой плавление, изменение решетки и т.д.
Сначала эти твердые-жидкие РСМ ведут себя как традиционные материалы для аккумулирования; их температура поднимается по мере поглощения тепла из окружающей среды. В отличие от традиционных материалов для аккумулирования (физического) тепла, когда РСМ достигают температуры, при которой они меняют фазу (своей точки плавления), они поглощают большие количества тепла без нагревания.
РСМ поглощают тепло, при этом сохраняют почти постоянную температуру. Они поглощают в 5-14 раз больше тепла на единицу объема, чем материалы для аккумулирования физического тепла. Тепловая энергия, как правило, поглощается в виде скрытого тепла посредством перехода фазы среды. В результате температура среды остается постоянной, поскольку она подвергается эндотермическому фазовому изменению.
Каждый РСМ имеет точку плавления, при которой он будет изменяться из твердой формы в жидкость, удерживая скрытое тепло расплавления, произведенное в эндотермическом процессе. Если температура превышает эту точку плавления, тогда материал будет превращаться в жидкость, поглощая тепловую энергию из окружающей среды с постоянной скоростью.
Каждый материал фактически представляет собой материалом с фазовым переходом (РСМ), поскольку при определенных комбинациях давления и температуры каждый материал может менять свое агрегатное состояние (твердое, жидкое, газообразное). При изменении агрегатного состояния может поглощаться большое количество энергии, так называемого скрытого тепла, при практически постоянной температуре.
Хотя все материалы увеличивают свое теплосодержание Q по мере увеличения температуры, очень большое увеличение Q происходит, когда материалы подвергаются фазовому переходу. Например, теплосодержание воды значительно увеличивается, когда она испытывает фазовый переход из льда в жидкость; это известный процесс плавления. Скачком в Q при фазовом переходе является скрытое тепло, связанное с превращением, обычно обозначаемое как Δtrs H. Скачок в Q при превращении является дополнением к аккумулирующей способности материала в отношении физического тепла.
На фигуре 1 изображено теплосодержание Q в зависимости от температуры Т. (a) Q увеличивается с увеличением температуры, даже если фазовое превращение не происходит, как в материале для аккумулирования физического тепла, (b) если материал подвергается фазовому превращению при температуре Ttrs, то происходит значительное увеличение Q; его скачок соответствует значению скрытого тепла превращения Δtrs H, как указано на диаграмме. Это большое увеличение в Q можно использовать для получения преимущества при аккумулировании тепла материалами с фазовым переходом.
Фазовый переход может привести к намного большему количеству поглощения энергии по сравнению с аккумулированием только физического тепла. Сопоставление с водой является достаточно полезным. Чистая вода имеет теплоемкость 4,2 Дж K-1 г-1, так что при увеличении температуры на 1°C, 1 грамм воды может аккумулировать 4,2 Дж. Однако скрытое тепло, связанное с плавлением льда, составляет 330 Дж г-1. Таким образом, если взять 1 г льда с температурой чуть ниже точки плавления и чуть выше (с общей разницей температуры 1°C), то поглощается 334 Дж (скрытое тепло плюс 4,2 Дж при аккумулировании физического тепла), что примерно в 80 раз больше, чем при аккумулирующей способности в отношении физического тепла отдельно.
Твердые-твердые РСМ поглощают и высвобождают тепло таким же образом, как и твердые-жидкие РСМ. Эти материалы переходят в жидкое состояние при нормальных условиях. Они становятся чуть мягче или тверже. Относительно немного твердых-твердых РСМ, которые были обнаружены, подходят для применения в аккумулировании тепла.
Для того чтобы РСМ были применимы в наслаивании в структуре микрокапсул в соответствии с настоящим изобретением, РСМ-кандидаты должны соответствовать ряду необходимых критериев и обладать подходящими свойствами для их применения.
Во-первых, важно, чтобы температуры фазового превращения РСМ (т.е. для охлаждения) находились в требуемом температурном диапазоне, подходящем для их применения. Их температура фазового превращения должна находиться в диапазоне температур, действию которых будут подвергаться чувствительные активные материалы. Этот диапазон температур определяет диапазон температур, при котором должна осуществляться защита. В соответствии с настоящим изобретением точка плавления РСМ должна быть ниже 90°C, предпочтительно ниже 80°C, более предпочтительно ниже 70°C и наиболее предпочтительно ниже 60°C.
Например, при обычном давлении водного столба, если система для аккумулирования тепла была необходима для обеспечения защиты (охлаждающего эффекта) в диапазоне температур 40-60°C, РСМ, который имеет точку плавления в 80°C, может действовать только как материал для аккумулирования физического тепла, а не как материал с фазовым переходом. В зависимости от выбора материала рабочий диапазон температур для РСМ может быть достаточно большим.
Другими важными характеристиками РСМ, которые могут быть применимы в настоящем изобретении, является скрытое тепло расплавления материала. Процесс плавления должен давать высокое скрытое тепло расплавления на единицу объема. Чем выше скрытое тепло расплавления, тем большим будет количество энергии, поглощенной РСМ во время процесса фазового перехода (процесса плавления). Количество энергии (Е), поглощенной РСМ, в этом случае зависит от массы (m) и скрытого тепла расплавления материала (ΔН). Таким образом,
E=mΔH
При температуре плавления материала поглощение осуществляется изотермически. Если изотермическая операция при температуре фазового перехода является затруднительной, то система будет работать в диапазоне температур Т1-Т2, который включает точку плавления. Следует учитывать вклад физического тепла, и количество поглощенной энергии при фазовом переходе описывается следующим образом:
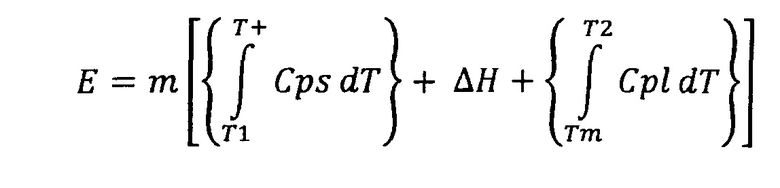 ,
,
где Cps и Cpl представляют собой удельную теплоемкость твердой и жидкой фаз, а Tm представляет собой точку плавления. Кроме поглощенного скрытого тепла также должно поглощаться значительное физическое тепло, вырабатываемое при фазовом переходе. Причинами, по которым в настоящем изобретении предлагаемым материалом является РСМ, является то, что теплоаккумулирующая способность на единицу массы и единицу объема в случае небольших температурных отличий является достаточно высокой для обеспечения термочувствительного активного материала максимальной защитой от нагрева благодаря его охлаждающему эффекту.
Также важно выбрать материал с фазовым переходом, имеющий высокую скорость роста кристаллов для того, чтобы в ходе процесса нанесения покрытий РСМ мог иметь высокую степень кристалличности, следовательно, для максимального охлаждающего эффекта можно было бы получить максимальное скрытое тепло расплавления. Способ улучшения кристаллизации РСМ в ходе процесса нанесения покрытия включает введение зародышей кристаллизации в качестве катализаторов в смесь РСМ, чтобы помочь увеличить скорость роста кристаллов.
Термические свойства РСМ, в том числе точка плавления и скрытое тепло расплавления, могут быть полностью изучены перед выбором наиболее подходящего РСМ для наслаивания и микроинкапсулирования. Способами, которые наиболее часто применяют для оценки термических характеристик РСМ, являются дифференциальный термический анализ (DTA) и дифференциальная сканирующая калориметрия (DSC). Обе эти методики предусматривают измерение характеристик скрытого тепла расплавления и температуры плавления РСМ. В анализе используется рекомендованный эталонный материал, Al2O3, и образец РСМ, оба которых нагревают с постоянной скоростью. Температурная разница, зафиксированная между двумя материалами, пропорциональна скорости теплового потока в каждом материале. Результат представлен на графике DSC, где скрытое тепло расплавления вычисляют исходя из площади под кривой; а температуру плавления оценивают исходя из градиента в самой крутой точке кривой.
Другой важной характеристикой РСМ в соответствии с настоящим изобретением является промежуток времени, в течение которого энергия может сохраняться поглощенной. Чем дольше совершается расплавление, тем выше будет эффективность РСМ в процессе поглощения. Этот промежуток времени определяется толщиной покрывающего слоя, количеством скрытого тепла расплавления на единицу массы, а также удельной теплоемкостью РСМ. Другими важными характеристиками РСМ является его объемная энергоемкость или количество энергии, поглощенной на единицу объема. Чем меньше объем, тем лучшей является система поглощения. Следовательно, оптимальный РСМ должен иметь высокое тепло расплавления на единицу массы, длительное время поглощения и небольшой объем на единицу поглощенной энергии.
Если удельная массовая теплоемкость не является небольшой, то более плотные материалы имеют меньшие объемы и соответственно преимущество большей энергоемкости на единицу объема.
Другие соображения включают соответствие требованием и совместимость материалов, используемых для пищевых, фармацевтических и нутрицевтических применений. Вещество должно быть совместимо с окружающими материалами, которые используются в составе внутреннего ядра.
РСМ для способа наслаивания
Существует широкий диапазон полимерных и неполимерных органических материалов, которые можно применять в качестве подходящего РСМ в композиции для микроинкапсулирования в соответствии с настоящим изобретением. Различные РСМ, имеющие либо различную, либо одинаковую химическую структуру, но отличающиеся точками плавления, применяются в способе наслаивания и микроинкапсулирования. Таким образом, охватывается широкий диапазон температур, в пределах которого может обеспечиваться охлаждающий эффект.
Наиболее подходящими материалами, которые могут действовать как подходящий РСМ в соответствии с настоящим изобретением, являются алкены, воски, сложные эфиры, жирные кислоты, спирты и гликоли, каждый с отличающимися параметрами и свойства независимо друг от друга.
Пример материалов, которые можно применять в качестве материала с фазовым переходом, выбран из группы, состоящей из алкенов, таких как твердый парафин, который составляет алкеновая цепь, нормальных парафинов типа CnH2n+2, представляющих собой семейство насыщенных углеводородов, которые являются воскообразными твердыми веществами с точкой плавления в диапазоне 23-67°C (в зависимости от числа атомов в алкановой цепи); как натуральных восков (которые, как правило, представляют собой сложные эфиры жирных кислот и длинноцепочечных спиртов), так и синтетических восков (которые представляют собой длинноцепочечные углеводороды без функциональных групп), таких как пчелиный воск, карнаубский воск, японский воск, костный воск, парафиновый воск, китайский воск, ланолин (шерстяной воск), шеллачный воск, спермацет, воск восковницы, канделильский воск, касторовый воск, воск эспарто, масло жожоба, воск урикури, воск из рисовых отрубей, соевый воск, церезиновые воски, горный воск, озокерит, торфяные воски, микрокристаллический воск, вазелин, полиэтиленовые воски, воски Фишера-Тропша, химически модифицированные воски, воски из замещенных амидов; полимеризованных α-олефинов; гидрогенизированного растительного масла, гидрогенизированного касторового масла, жирных кислот, таких как лауриновая кислота, миристиновая кислота, пальмитиновая кислота, пальмитат, пальмитолеат, гидроксипальмитат, стеариновая кислота, арахидиновая кислота, олеиновая кислота, стеариновая кислота, стеарат натрия, стеарат кальция, стеарат магния, гидроксистеарат гидроксиоктакозанола, олеатные сложные эфиры с длинной цепью, сложные эфиры жирных кислот, жирные спирты, этерифицированные жирные диолы, гидроксилированные жирные кислоты, гидрогенизированные жирные кислоты (насыщенные или частично насыщенные жирные кислоты), алифатические спирты, фосфолипиды, лецитин, фосфатидилхолин, триэфиры жирных кислот, например, триглицериды, полученные из жирных кислот и глицерина (1,2,3-тригидроксипропан), в том числе жиры и масла, такие как кокосовое масло, гидрогенизированное кокосовое масло, масло какао (также называемое какао-масло или какао); эвтектик, таких как жирнокислотные эвтектики, которые представляют собой смесь двух и более веществ, оба которые обладают надежными параметрами плавления и отвердения;
гликолей, таких как полиэтиленгликоль, полиэтиленоксиды, полоксамеры, которые являются блок-сополимерами полиэтиленоксида и полипропиленгликоля (Lutrol F), блок-сополимерами полиэтиленгликоля и сложных полиэфиров и их комбинации.
В качестве соответствующего РСМ можно также использовать смешанный полимер. Смесь может быть смешиваемой или несмешиваемой, при этом в первом случае, как правило, получается только одна точка плавления, тогда как, во втором случае, могут обнаруживаться отдельные точки плавления, свойственные чистым полимерам.
Промежуточные слои
В соответствии с несколькими иллюстративными вариантами осуществления настоящего изобретения слоистые микрокапсулы, полученные в соответствии с настоящим изобретением, необязательно и предпочтительно, могут быть отделены друг от друга слоем полимерной пленки, который может растворяться в ЖК тракте. Примеры материалов, которые можно применять для самого внешнего покрывающего слоя, выбраны из группы, состоящей из водорастворимых или поддающихся эрозии полимеров, таких как, например, повидон (PVP: поливинилпирролидон), коповидон (сополимер винилпирролидона и винилацетата), поливиниловый спирт, Kollicoat Protect (BASF), который представляет собой смесь Kollicoat IR (привитого сополимера поливинилового спирта, (PVA)-полиэтиленгликоля (PEG)) и поливинилового спирта (PVA), опадрай АМВ (Colorcon), который представляет собой смесь на основе PVA, Aquarius MG, который представляет собой полимер на основе целлюлозы, содержащим натуральный воск, лецитин, ксантановую камедь и тальк, низкомолекулярная НРС (гидроксипропилцеллюлоза), низкомолекулярная НРМС (гидроксипропилметилцеллюлоза), такая как гидроксипропилцеллюлоза (НРМС Е3 или Е5) (Colorcon), метилцеллюлоза (МС), низкомолекулярная карбоксиметилцеллюлоза (CMC), низкомолекулярная карбоксиметилэтилцеллюлоза (СМЕС), низкомолекулярная гидроксиэтилцеллюлоза (НЕС), низкомолекулярная гидроксилэтилметилцеллюлоза (НЕМС), низкомолекулярная гидроксиметилцеллюлоза (НМС), низкомолекулярная гидроксиметилгидроксиэтилцеллюлоза (НМНЕС), низковязкая этилцеллюлоза, низкомолекулярная метилэтилцеллюлоза (МЕС), желатин, гидролизованный желатин, полиэтиленоксид, водорастворимые камеди, водорастворимые полисахариды, аравийская камедь, декстрин, крахмал, модифицированная целлюлоза, водорастворимые полиакрилаты, полиакриловая кислота, полигидроксиэтилметакрилат (РНЕМА) и полиметакрилаты и их сополимеры, pH-чувствительных полимеров, например, энтеросолюбильных полимеров, в том числе фталатных производных, таких как кислый фталат углеводов, ацетатфталат амилозы, ацетатфталат целлюлозы (CAP), другие фталаты сложных эфиров целлюлозы, фталаты простых эфиров целлюлозы, фталат гидроксипропилцеллюлозы (НРСР), фталат гидроксипропилэтилцеллюлозы (НРЕСР), фталат гидроксипропилметилцеллюлозы (НРМСР), ацетатсукцинат гидроксипропилметилцеллюлозы (HPMCAS), фталат метилцеллюлозы (МСР), фталат поливинилацетата (PVAcP), фталат поливинилацетата водорода, CAP натрия, кислый фталат крахмала, ацетат-тримеллитат целлюлозы (CAT), сополимер стирола-дибутилфталата малеиновой кислоты, сополимер стирола-малеиновой кислоты/поливинилацетатфталата, сополимеры стирола и малеиновой кислоты, производных полиакриловой кислоты, таких как сополимеры акриловой кислоты и сложного эфира акриловой кислоты, полиметакриловая кислота и ее сложные эфиры, сополимеры полиакриловой и метакриловой кислоты, шеллак и сополимеры винилацетата и кротоновой кислоты. Предпочтительные pH-чувствительные полимеры включают шеллак, фталатные производные, CAT, HPMCAS, производные полиакриловой кислоты, в частности, сополимеры, содержащие акриловую кислоту и по меньшей мере один сложный эфир акриловой кислоты, Eudragit S™ (поли(метакриловая кислота, метилметакрилат) 1:2); Eudragit L™, который представляет собой анионный полимер, синтезированным из метакриловой кислоты и метилового сложного эфира метакриловой кислоты, Eudragit L100™ (поли(метакриловая кислота, метилметакрилат) 1:1); Eudragit L30D™ (поли(метакриловая кислота, этилакрилат) 1:1) и Eudragit L100-55™ (поли(метакриловая кислота, этилакрилат) 1:1); полиметилметакрилат, смешанный с сополимерами акриловой кислоты и сложного эфира акриловой кислоты, альгиновая кислота и альгинаты, такие как альгинат аммония, альгинат натрия, калия, магния или кальция, сополимеры винилацетата, поливинилацетат 30D (30% дисперсия в воде), поли(диметиламиноэтилакрилат), который представляет собой нейтральный метакриловый сложный эфир, доступным от Rohm Pharma (Degusa) под названием «Eudragit E™», и/или любой их комбинации.
Наружный покрывающий слой
В соответствии с дополнительными признаками в любом из вариантов осуществления настоящего изобретения слоистые микрокапсулы, полученные в соответствии с настоящим изобретением, необязательно и предпочтительно, также могут включать самый внешний (наружный) покрывающий слой, который предпочтительно растворяется в ЖК тракте. Наружный покрывающий слой может обеспечивать также дополнительную защиту против проникновения или влажности, или кислорода, или того и другого одновременно в ядро во время как процесса производства, так и срока хранения конечного продукта.
Пример материалов, которые можно применять для самого внешнего покрывающего слоя, выбран из группы, состоящей из водорастворимых или поддающихся эрозии полимеров, таких как, например, повидон (PVP: поливинилпирролидон), коповидон (сополимер винилпирролидона и винилацетата), поливиниловый спирт, Kollicoat Protect (BASF), который представляет собой смесь Kollicoat IR (привитого сополимера поливинилового спирта (PVA)-полиэтиленгликоля (PEG)) и поливинилового спирта (PVA), опадрай АМВ (Colorcon), который представляет собой смесь на основе PVA, Aquarius MG, который представляет собой полимер на основе целлюлозы, содержащий натуральный воск, лецитин, ксантановую камедь и тальк, низкомолекулярная НРС (гидроксипропилцеллюлоза), низкомолекулярная НРМС (гидроксипропилметилцеллюлоза), такая как гидроксипропилцеллюлоза (НРМС Е3 или Е5) (Colorcon), метилцеллюлоза (МС), низкомолекулярная карбоксиметилцеллюлоза (CMC), низкомолекулярная карбоксиметилэтилцеллюлоза (СМЕС), низкомолекулярная гидроксиэтилцеллюлоза (НЕС), низкомолекулярная гидроксилэтилметилцеллюлоза (НЕМС), низкомолекулярная гидроксиметилцеллюлоза (НМС), низкомолекулярная гидроксиметилгидроксиэтилцеллюлоза (НМНЕС), низковязкая этилцеллюлоза, низкомолекулярная метилэтилцеллюлоза (МЕС), желатин, гидролизованный желатин, полиэтиленоксид, водорастворимые камеди, водорастворимые полисахариды, аравийская камедь, декстрин, крахмал, модифицированная целлюлоза, водорастворимые полиакрилаты, полиакриловая кислота, полигидроксиэтилметакрилат (РНЕМА) и полиметакрилаты и их сополимеры, pH-чувствительных полимеров, например, энтеросолюбильных полимеров, в том числе фталатных производных, таких как кислый фталат углеводов, ацетатфталат амилозы, ацетатфталат целлюлозы (CAP), другие фталаты сложных эфиров целлюлозы, фталаты простых эфиров целлюлозы, фталат гидроксипропилцеллюлозы (НРСР), фталат гидроксипропилэтилцеллюлозы (НРЕСР), фталат гидроксипропилметилцеллюлозы (НРМСР), ацетатсукцинат гидроксипропилметилцеллюлозы (HPMCAS), фталат метилцеллюлозы (МСР), фталат поливинилацетата (PVAcP), фталат поливинилацетата водорода, CAP натрия, кислый фталат крахмала, ацетат-тримеллитат целлюлозы (CAT), сополимер стирола-дибутилфталата малеиновой кислоты, сополимер стирола-малеиновой кислоты/поливинилацетатфталата, сополимеры стирола и малеиновой кислоты, производных полиакриловой кислоты, таких как сополимеры акриловой кислоты и сложного эфира акриловой кислоты, полиметакриловая кислота и ее сложные эфиры, сополимеры полиакриловой и метакриловой кислоты, шеллак и сополимеры винилацетата и кротоновой кислоты. Предпочтительные pH-чувствительные полимеры включают шеллак, фталатные производные, CAT, HPMCAS, производные полиакриловой кислоты, в частности, сополимеры, содержащие акриловую кислоту и по меньшей мере один сложный эфир акриловой кислоты, Eudragit S™ (поли(метакриловая кислота, метилметакрилат) 1:2); Eudragit L™, который представляет собой анионный полимер, синтезированный из метакриловой кислоты и метилового сложного эфира метакриловой кислоты, Eudragit L100™ (поли(метакриловая кислота, метилметакрилат) 1:1); Eudragit L30D™ (поли(метакриловая кислота, этилакрилат) 1:1) и Eudragit L100-55™ (поли(метакриловая кислота, этилакрилат) 1:1); полиметилметакрилат, смешанный с сополимерами акриловой кислоты и сложного эфира акриловой кислоты, альгиновая кислота и альгинаты, такие как альгинат аммония, альгинат натрия, калия, магния или кальция, сополимеры винилацетата, поливинилацетат 30D (30% дисперсия в воде), поли(диметиламиноэтилакрилат), который представляет собой нейтральным метакрилат, доступный от Rohm Pharma (Degusa) под названием «Eudragit E™», и/или любые их смеси.
Основа: В соответствии с предпочтительным вариантом осуществления настоящего изобретения термочувствительный активный материал (в том числе пробиотические бактерии) в ядре гранулы смешан с основой. Основа предпочтительно включает по меньшей мере один материал, который может также служить добавочным средством и/или стабилизатором для пробиотических бактерий. Основа может включать моносахариды, такие как триозы, в том числе кетотриозы (дигидроксиацетон) и альдотриозы (глицеральдегид), тетрозы, такие как кетотетроза (эритрулоза), альдотетрозы (эритроза, треоза) и кетопентоза (рибулоза, ксилулоза), пентозы, такие как альдопентозы (рибоза, арабиноза, ксилоза, ликсоза), дезоксисахар (дезоксирибоза) и кетогексозу (псикоза, фруктоза, сорбоза, тагатоза), гексозы, такие как альдогексоза (аллоза, альтроза, глюкоза, манноза, гулоза, идоза, галактоза, талоза), дезоксисахар (фукоза, фукулоза, рамноза), и гептозу, такую как (седогептулоза), а также октозу и нонозу (нейраминовую кислоту). Основа может включать составные сахариды, такие как 1) дисахариды, такие как сахароза, лактоза, мальтоза, трегалоза, тураноза и целлобиоза, 2) трисахариды, такие как раффиноза, мелезитоза и мальтотриоза, 3) тетрасахариды, такие как акарбоза и стахиоза, 4) другие олигосахариды, такие как фруктоолигосахарид (FOS), галактоолигосахариды (GOS) и маннанолигосахариды (MOS), 5) полисахариды, такие как полисахариды на основе глюкозы/глюкан, в том числе гликоген, крахмал (амилоза, амилопектин), целлюлоза, декстрин, декстран, бета-глюкан (зимозан, лентинан, сизофиран) и мальтродекстрин, полисахариды на основе фруктозы/фруктан, в том числе инулин, леван бета 2-6, полисахариды на основе маннозы (маннан), полисахариды на основе галактозы (галактан) и полисахариды на основе N-ацетилглюкозамина, в том числе хитин. Могут быть включены и другие полисахариды, в том числе камедь, такая как аравийская камедь (камедь акации).
В соответствии с предпочтительными вариантами осуществления настоящего изобретения ядро также включает антиоксидант. Предпочтительно, антиоксидант выбран из группы, состоящей из цистеина гидрохлорида, цистеина основания, 4,4-(2,3-диметилтетраметилендипирокатехина), богатого токоферолом экстракта (натурального витамина Е), α-токоферола (синтетического витамина Е), β-токоферола, γ-токоферола, δ-токоферола, бутилгидроксинона, бутилгидрокеианизола (ВНА), бутилгидрокситолуола (ВНТ), пропилгаллата, октилгаллата, додецилгаллата, третичного бутилгидрохинона (TBHQ), фумаровой кислоты, яблочной кислоты, аскорбиновой кислоты (витамина С), аскорбата натрия, аскорбата кальция, аскорбата калия, аскорбилпальмитата и аскорбилстеарата. В ядро можно включать лимонную кислоту, лактат натрия, лактат калия, лактат кальция, лактат магния, аноксомер, эриторбовую кислоту, эриторбат натрия, эриторбиновую кислоту, эриторбин натрия, этоксихин, глицин, гваяковую камедь, цитраты натрия (мононатрий цитрат, двунатрий цитрат, тринатрий цитрат), цитраты калия (монокалий цитрат, трикалий цитрат), лецитин, полифосфат, винную кислоту, тартраты натрия (мононатрий тартрат, двунатрий тартрат), тартраты калия (монокалий тартрат, двукалий тартрат), натрий-калий тартрат, фосфорную кислоту, фосфаты натрия (мононатрий фосфат, двунатрий фосфат, тринатрий фосфат), фосфаты калия (монокалий фосфат, двукалий фосфат, трикалий фосфат), кальций-двуантрий этилендиаминтетраацетат (кальций-двунатрий EDTA), молочную кислоту, тригидроксибутирофенон и тиодипропионовую кислоту и их смеси. В соответствии с одним предпочтительным вариантом осуществления антиоксидант представляет собой цистеина основание.
В соответствии с некоторыми вариантами осуществления настоящего изобретения ядро также содержит заполнитель и связующее. Примеры заполнителей включают, например, микрокристаллическую целлюлозу, сахар, такой как лактоза, глюкоза, галактоза, фруктоза или сахароза; дикальций фосфат; сахарные спирты, такие как сорбит, маннит, маннит, лактит, ксилит, изомальт, эритрит и гидрогенизированные гидролизаты крахмала, кукурузный крахмал, картофельный крахмал, карбоксиметилцеллюлозу натрия, ацетат целлюлозы и этилцеллюлозы или их смеси. Наиболее предпочтительно, заполнитель представляет собой лактозу.
Примеры связующих включают повидон (PVP: поливинилпирролидон), коповидон (сополимер винилпирролидона и винилацетата), поливиниловый спирт, низкомолекулярную НРС (гидроксипропилцеллюлозу), низкомолекулярную НРМС (гидроксипропилметилцеллюлозу), низкомолекулярную карбоксиметилцеллюлозу, низкомолекулярную гидроксиэтилцеллюлозу, низкомолекулярную гидроксиметилцеллюлозу, желатин, гидролизованный желатин, полиэтиленоксид, аравийскую камедь, декстрин, крахмал, а также водорастворимые полиакрилаты и полиметакрилаты, низкомолекулярную этилцеллюлозу, жирные кислоты, воски, гидрогенизированные масла, полиэтиленгликоль, блок-сополимер полиэтиленгликоля и полипропиленгликоля (полоксамер) или их смесь.
В соответствии с предпочтительными вариантами осуществления настоящего изобретения РСМ слои, а также самый внешний слой, необязательно, могут также включать по меньшей мере один наполнитель, такой как, например, пластификатор, скользящее вещество, в том числе без ограничения диоксид кремния, смазывающее вещество и антиадгезивы, в том числе без ограничения микрокристаллическую целлюлозу, тальк или диоксид титана, или их комбинации.
В соответствии с предпочтительными вариантами осуществления настоящего изобретения лекарственную форму, содержащую гранулы или микрокапсулы со стабилизированными пробиотиками, также, необязательно и предпочтительно, покрывают энтеросолюбильным полимером, который также может обеспечивать защиту от разрушающих действий на протяжении ЖК тракта, таких как среды с низким pH и ферменты.
Пример материалов, которые можно применять для нанесения покрытия на лекарственную форму, выбран из группы, состоящей из pH-чувствительных полимеров, например, кислого фталата углеводов, ацетатфталата амилозы, ацетатфталата целлюлозы (CAP), других фталатов сложных эфиров целлюлозы, фталатов простых эфиров целлюлозы, фталата гидроксипропилцеллюлозы (НРСР), фталата гидроксипропилэтилцеллюлозы (НРЕСР), фталата гидроксипропилметилцеллюлозы (НРМСР), ацетатсукцината гидроксипропилметилцеллюлозы (HPMCAS), фталата метилцеллюлозы (МСР), фталата поливинилацетата (PVAcP), фталата поливинилацетата водорода, CAP натрия, кислого фталата крахмала, ацетат-тримеллитата целлюлозы (CAT), сополимера стирола и малеиновой кислоты, сополимера стирола-дибутилфталата малеиновой кислоты, сополимера стирола-малеиновой кислоты/поливинилацетатфталата, производных полиакриловой кислоты, таких как сополимеры акриловой кислоты и сложного эфира акриловой кислоты, полиметакриловая кислота и ее сложные эфиры, сополимеры полиакриловой и метакриловой кислоты, производных полиакриловой кислоты, таких как, в частности сополимеры, содержащие акриловую кислоту и по меньшей мере один сложный эфир акриловой кислоты, Eudragit S™ (поли(метакриловая кислота, метилметакрилат) 1:2); Eudragit L™, который представляет собой анионный полимер, синтезированный из метакриловой кислоты и метилового сложного эфира метакриловой кислоты, Eudragit L100™ (поли(метакриловая кислота, метилметакрилат) 1:1);
Eudragit L30D™ (поли(метакриловая кислота, этилакрилат) 1:1) и Eudragit L100-55™ (поли(метакриловая кислота, этилакрилат) 1:1); полиметилметакрилат, смешанный с сополимерами акриловой кислоты и сложного эфира акриловой кислоты, альгиновую кислоту и альгинаты, такие как альгинат аммония, альгинат натрия, калия, магния или кальция.
Пример 1
Во-первых, исследовали эффект плавления и перекристаллизации PEG с различной молекулярной массой. С этой целью PEG с различной молекулярной массой расплавляли и охлаждали для перекристаллизации, за которой снова следовало плавление. Охлаждение осуществляли как медленно, так и быстро. Эффект скорости охлаждения определяли с применением способа дифференциальной сканирующей калориметрии (DSC).
В случае медленного охлаждения полимерный расплав оставляли при комнатной температуре для медленной перекристаллизации, а для быстрого охлаждения оставляли в морозильной камере.
DSC выполняли с помощью нагрева со скоростью 10°C/мин в температурном диапазоне 10-100°C.
Для тестов DSC использовали образец 5-10 мг. В качестве контроля для анализа DSC использовали пустую алюминиевую ванночку.
Результаты эффекта скорости охлаждения на точку плавления PEG с различной молекулярной массой обобщены в следующей таблице и показаны на следующих термограммах.
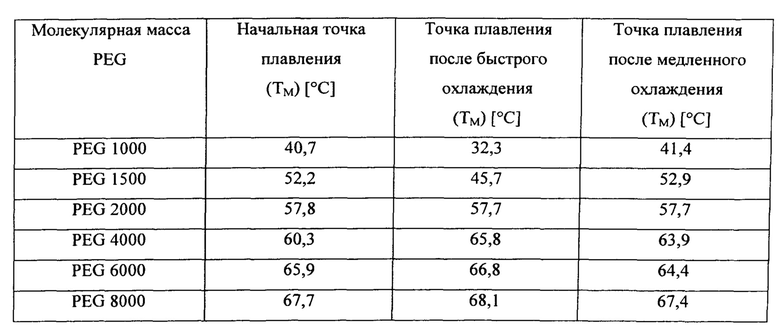
На фиг. 2 проиллюстрирован эффект медленного охлаждения на точку плавления PEG с различными молекулярными массами, в том числе PEG 1000, PEG 1500, PEG 6000 и PEG 8000.
На фиг. 3 проиллюстрирован эффект быстрого охлаждения на точку плавления PEG с различными молекулярными массами, в том числе PEG 1000, PEG 1500, PEG 6000 и PEG 8000.
Пример 2
Чтобы определить связь между слоями и, главным образом, природу межфазной связи между слоями многослойную пленочную структуру получали с использованием PEG (полиэтиленгликолей) с различными молекулярными массами. Эту многослойную структуру (пластинчатое вещество) сравнивали со смесями, полученными с использованием PEG с одинаковыми молекулярными массами.
Для этого проводили определение термических характеристик многослойной структуры по сравнению со смешанными композициями с использованием способа дифференциальной сканирующей калориметрии (DSC).
Для получения различных смесей полимеры вначале расплавляли и смешивали, а затем им обеспечивали возможность перекристаллизации при различной скорости охлаждения. В случае медленного охлаждения конечную смесь оставляли при комнатной температуре для медленной перекристаллизации, а в случае быстрого охлаждения помещали в морозильную камеру. Результаты действия скорости охлаждения на точку плавления каждого PEG (с различной молекулярной массой) в смеси показаны на следующих термограммах.
На фиг. 4 проиллюстрирован эффект медленного охлаждения на точку плавления смеси,
содержащей PEG 1500 и PEG 6000.
На фиг. 5 проиллюстрирован эффект быстрого охлаждения на точку плавления смеси,
содержащей PEG 1500 и PEG 6000.
На фиг. 6 проиллюстрирован эффект быстрого охлаждения на точку плавления смеси,
содержащей PEG 1000 и PEG 6000.
На фиг. 7 проиллюстрирован эффект быстрого охлаждения на точку плавления смеси,
содержащей PEG 1000 и PEG 2000.
Пример 3
Для получения различных многослойных структур полимеры вначале расплавляли и выливали слой на слой в порядке увеличения молекулярной массы PEG, при этом каждому слою обеспечивали возможность в достаточной степени перекристаллизоваться (в морозильной камере) перед выливанием следующего слоя.
Затем определяли точки плавления каждого PEG (с различными молекулярными массами) путем тестирования конечной многослойной структуры с помощью способа DSC. DSC термограммы различных многослойных структур показаны следующим образом:
На фиг. 8 проиллюстрирована термограмма многослойной структуры, содержащей PEG 1000 и PEG 2000.
На фиг. 9 проиллюстрирована термограмма многослойной структуры, содержащей PEG 1000, PEG 2000 и PEG 4000.
На фиг. 10 проиллюстрирована термограмма многослойной структуры, содержащей PEG 1000, PEG 2000 и PEG 8000.
На фиг. 11 проиллюстрирована термограмма многослойной структуры, содержащей PEG 1000, PEG 4000 и PEG 8000.
На фиг. 12 проиллюстрирована термограмма многослойной структуры, содержащей PEG 1500, PEG 6000 и PEG 8000.
Пример 4
Полиэтиленгликоль с различными молекулярными массами применяли в качестве РСМ для создания слоев на гранулах ядра с пробиотиками. Молекулярную массу и точки плавления этой серии PEG, которые использовали в этом эксперименте, обобщены в таблице 2.
Сначала смесь трегалозы (80 г), пробиотических бактерий L. gasseri 57C (Biomed) (60 г), цистеин-HCl (3 г) и мальтодекстрина (157 г) помещали в Innojet Ventilus (Innojet IEV2.5 V2). Затем PEG 1000 (135 г) расплавляли при 50°C и в расплавленный PEG добавляли микрокристаллическую целлюлозу (МСС РН 105) (13,5 г) и гомогенизировали для получения однородной дисперсии. Затем полученную гомогенную дисперсию распыляли на вышеуказанную сухую смесь в инертной атмосфере с использованием азота. Для температуры головки насоса, жидкости и давления при распылении устанавливали значение комнатная температура. С помощью этого получали грануляты на основе гранулирования из расплава. Затем полученные гранулы покрывали гомогенной дисперсией расплава PEG 1000 (43,5 г) и МСС РН 105 (4,4 г) в инертной атмосфере с использованием азота для получения гранул, покрытых первым покрывающим РСМ слоем. PEG 1500 (47,9 г) расплавляли и затем добавляли МСС РН 105 (4,8 г) и гомогенизировали для получения гомогенной дисперсии. Затем последнюю гомогенную дисперсию распыляли на вышеуказанные гранулы, покрытые первым покрывающим РСМ слоем для получения гранул, покрытых вторым покрывающим РСМ слоем. PEG 2000 (52,6 г) расплавляли и затем добавляли МСС РН 105 (5,3 г) и гомогенизировали для получения гомогенной дисперсии. Затем последнюю гомогенную дисперсию распыляли на вышеуказанные гранулы, покрытые вторым покрывающим РСМ слоем, для получения гранул, покрытых третьим покрывающим РСМ слоем. Полученные гранулы, покрытые третьим покрывающим РСМ слоем, разгружали и выдерживали в морозильной камере в течение 2 часов. Затем замороженные гранулы, покрытые третьим покрывающим РСМ слоем, снова загружали в Innojet Ventilus (Innojet IEV2.5 V2). PEG 4000 (40,9 г) расплавляли и затем добавляли МСС РН 105 (4,1 г) и гомогенизировали для получения гомогенной дисперсии. Затем последнюю гомогенную дисперсию распыляли на вышеуказанные гранулы, покрытые третьим покрывающим РСМ слоем, для получения гранул, покрытых четвертым покрывающим РСМ слоем. PEG 6000 (56 г) расплавляли и затем добавляли МСС РН 105 (5,6 г) и гомогенизировали для получения гомогенной дисперсии. Затем последнюю гомогенную дисперсию распыляли на вышеуказанные гранулы, покрытые четвертым покрывающим РСМ слоем, для получения гранул, покрытых пятым покрывающим РСМ слоем.
Пример 5
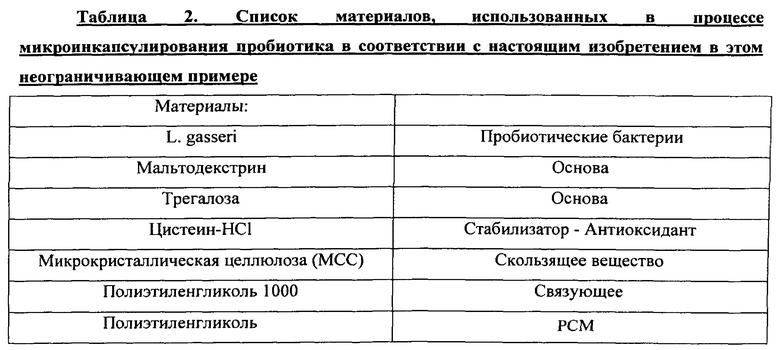
Полиэтиленгликоль с различными молекулярными массами применяли в качестве РСМ для создания слоев на гранулах ядра с пробиотиками. Молекулярную массу и точки плавления этой серии PEG, которые использовали в этом эксперименте, обобщены в таблице 3.
Сначала смесь трегалозы (80 г), пробиотических бактерий L. gasseri 57C (Biomed) (60 г), цистеин-HCl (3 г) и мальтодекстрина (157 г) помещали в Innojet Ventilus (Innojet IEV2.5 V2). Затем PEG 1000 (115 г) расплавляли при 50°C и в расплавленный PEG добавляли микрокристаллическую целлюлозу (МСС РН 105) (11,5 г) и гомогенизировали для получения однородной дисперсии. Затем полученную гомогенную дисперсию распыляли на вышеуказанную сухую смесь в инертной атмосфере с использованием азота. Для температуры головки насоса, жидкости и давления при распылении устанавливали значение комнатная температура. С помощью этого получали грануляты на основе гранулирования из расплава. Затем полученные гранулы покрывали гомогенной дисперсией расплава PEG 1000 (30 г) и МСС РН 105 (3 г) в инертной атмосфере с использованием азота для получения гранул, покрытых первым покрывающим РСМ слоем. PEG 2000 расплавляли и затем добавляли МСС РН 105 (10% вес/вес MCC/PEG) и гомогенизировали для получения гомогенной дисперсии. Затем последнюю гомогенную дисперсию распыляли на вышеуказанные гранулы, покрытые вторым покрывающим РСМ слоем, для достижения 10% увеличения массы, таким образом, получая гранулы, покрытые третьим покрывающим РСМ слоем. Полученные гранулы, покрытые третьим покрывающим РСМ слоем, разгружали и выдерживали в морозильной камере в течение 2 часов. Затем замороженные гранулы, покрытые третьим покрывающим РСМ слоем, снова загружали в Innojet Ventilus (Innojet IEV2.5 V2). PEG 4000 расплавляли и гомогенизировали для получения гомогенной дисперсии. Затем последнюю гомогенную дисперсию распыляли на вышеуказанные гранулы, покрытые третьим покрывающим РСМ слоем, для достижения 10% увеличения массы, таким образом, получая гранулы, покрытые четвертым покрывающим РСМ слоем. PEG 6000 расплавляли и затем добавляли МСС РН 105 (10% вес/вес MCC/PEG) и гомогенизировали для получения гомогенной дисперсии. Затем последнюю гомогенную дисперсию распыляли на вышеуказанные гранулы, покрытые четвертым покрывающим РСМ слоем, для достижения 20% увеличения массы, таким образом, получая гранулы, покрытые пятым покрывающим РСМ слоем. Затем готовили раствор гидроксипропилцеллюлозы (НРС) в воде (7% вес/вес) и распыляли на вышеуказанные полученные гранулы, покрытые пятым покрывающим РСМ слоем, для достижения 10% увеличения массы (вес/вес).
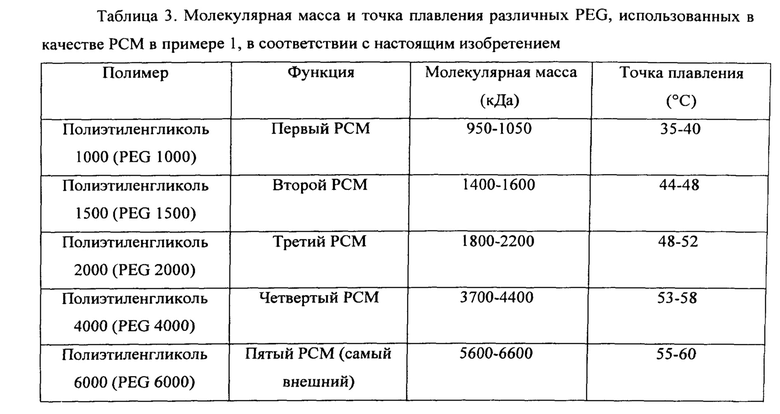
Несмотря на то, что настоящее изобретение было описано в отношении ограниченного числа вариантов осуществления, следует понимать, что можно осуществлять множество вариаций, модификаций и других применений настоящего изобретения.
Следует понимать, что различные признаки изобретения, которые для ясности описывались в контексте отдельных вариантов осуществления, могут также предусматриваться в комбинации в одном варианте осуществления. Наоборот, различные признаки настоящего изобретения, которые для краткости описывались в контексте одного варианта осуществления, могут также предусматриваться отдельно или в любой подходящей подкомбинации. Специалистам в данной области техники также будет понятно, что настоящее изобретение не ограничивается тем, что было конкретно показано и описано выше в данной заявке.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕПЛОУСТОЙЧИВЫЕ ПРОБИОТИЧЕСКИЕ КОМПОЗИЦИИ И СОДЕРЖАЩИЕ ИХ ПРОДУКТЫ ЗДОРОВОГО ПИТАНИЯ | 2010 |
|
RU2549098C2 |
| КРОЮЩИЙ МАТЕРИАЛ ДЛЯ САМОКЛЕЯЩИХСЯ ТЕРМОПЛАВКИХ КЛЕЕВ | 2016 |
|
RU2700513C2 |
| ЖЕЛУДОЧНО-РЕЗИСТЕНТНАЯ ФАРМАЦЕВТИЧЕСКАЯ ИЛИ НУТРИЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С УСТОЙЧИВОСТЬЮ К ВОЗДЕЙСТВИЮ ЭТАНОЛА | 2012 |
|
RU2649806C2 |
| ПОКРЫВАЮЩАЯ КОМПОЗИЦИЯ, ПОДХОДЯЩАЯ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ ИЛИ НУТРИЦЕВТИЧЕСКИХ ЛЕКАРСТВЕННЫХ ФОРМ | 2011 |
|
RU2599023C2 |
| ШТАММ ПРОБИОТИЧЕСКИХ БАКТЕРИЙ LACTOBACILLUS PLANTARUM И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЕГО, И ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ВОСПАЛЕНИЯ | 2017 |
|
RU2729420C2 |
| ГИБКИЕ ЛИСТОВЫЕ МАТЕРИАЛЫ ИЗ РСМ | 2015 |
|
RU2670894C9 |
| ПРОБИОТИЧЕСКАЯ ДОБАВКА СО ВКУСОМ ШОКОЛАДА | 2010 |
|
RU2537913C2 |
| МИКРОИНКАПСУЛИРОВАННАЯ ПРОБИОТИЧЕСКАЯ СУБСТАНЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2593327C2 |
| КОМПОЗИЦИЯ ПОКРЫТИЯ, ПОДХОДЯЩАЯ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ ИЛИ НУТРИЦЕВТИЧЕСКИХ ДОЗИРОВАННЫХ ФОРМ | 2011 |
|
RU2606588C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ИЛИ НУТРИЦЕВТИЧЕСКИЙ СОСТАВ | 2010 |
|
RU2604861C2 |
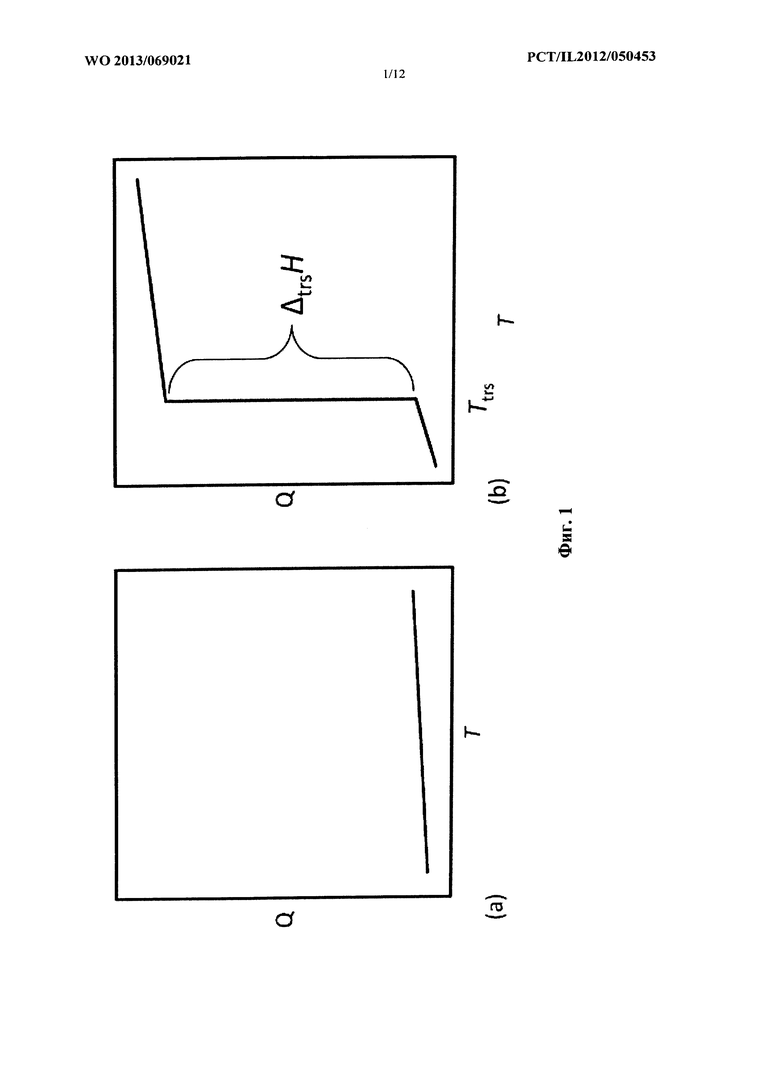
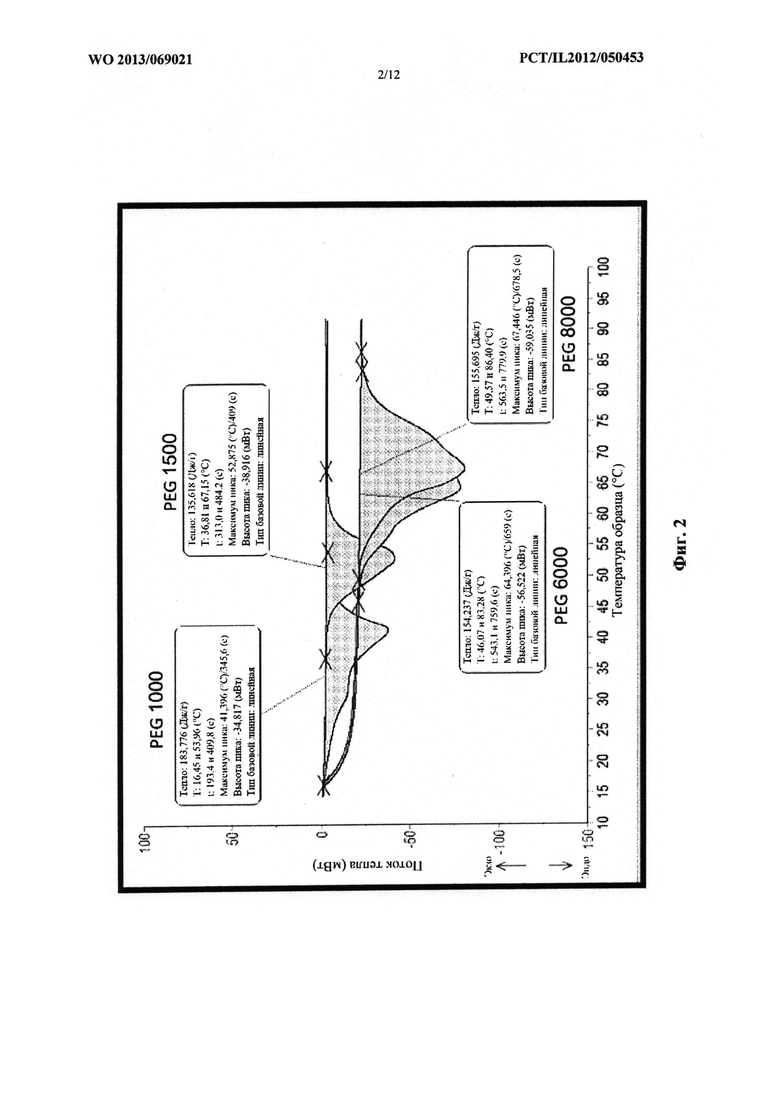
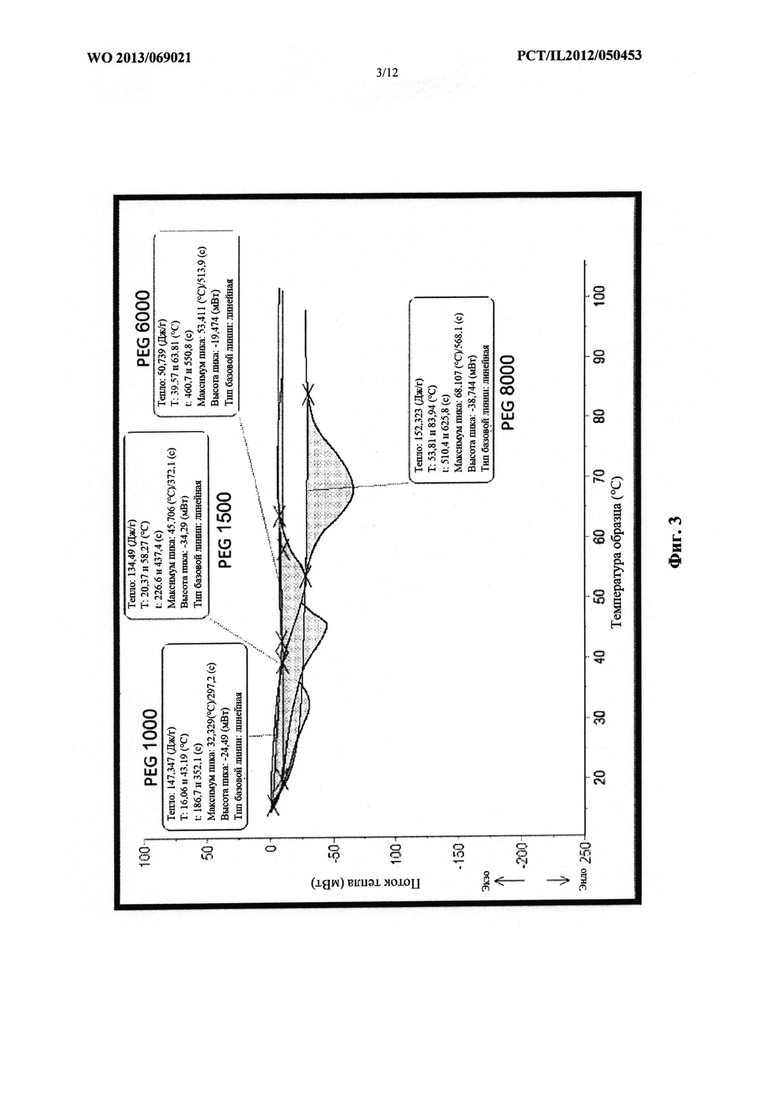
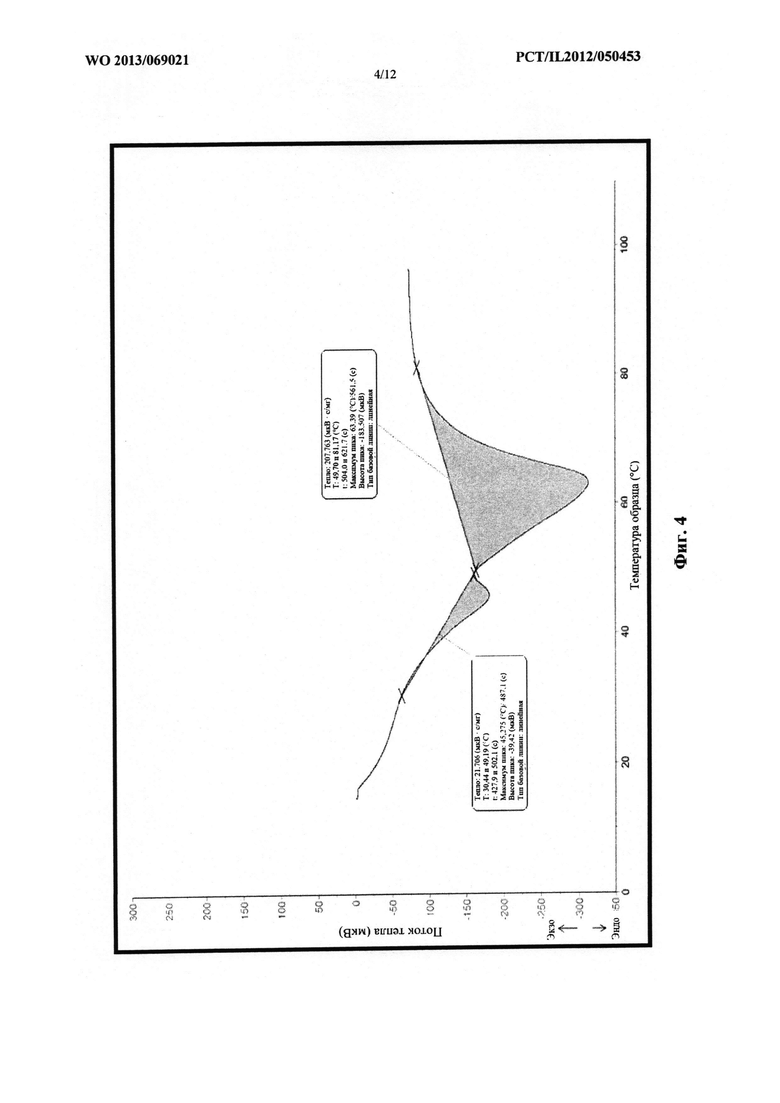
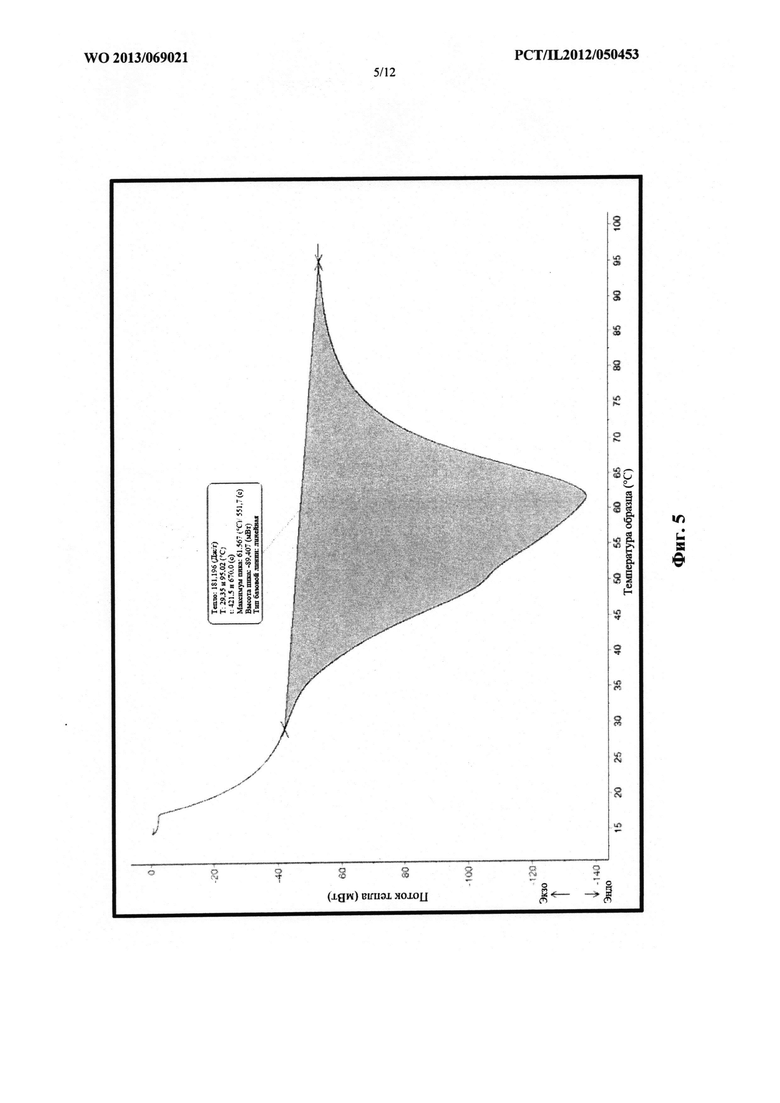
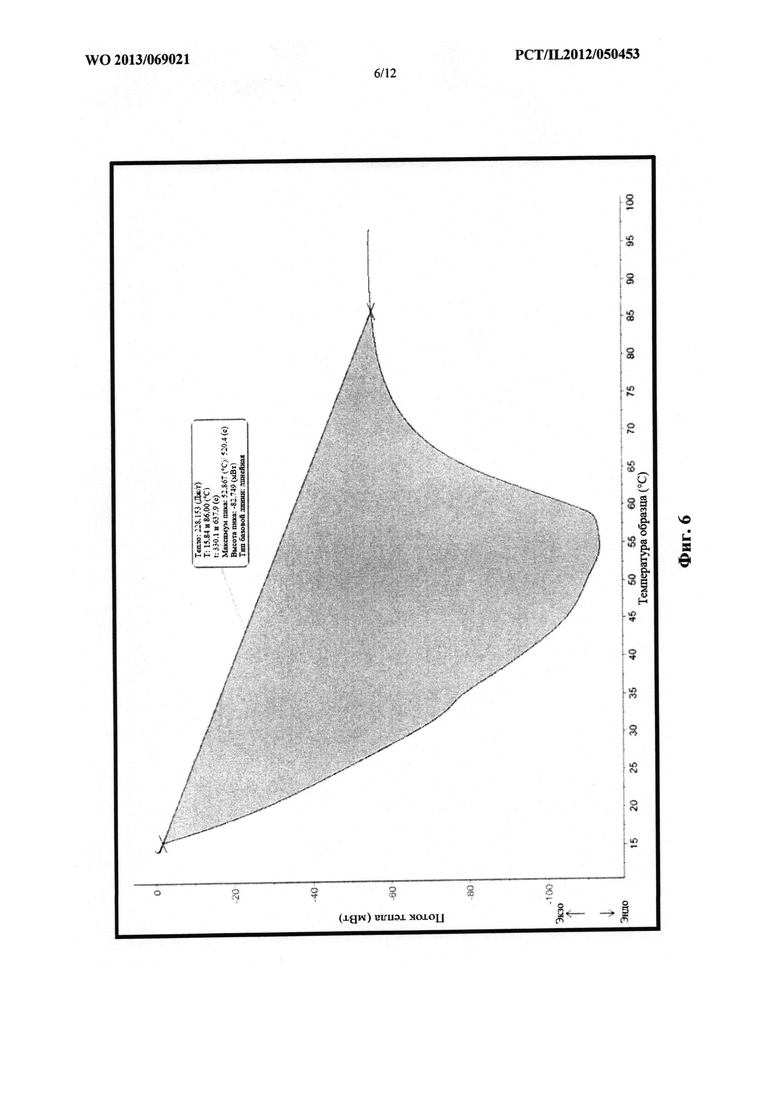
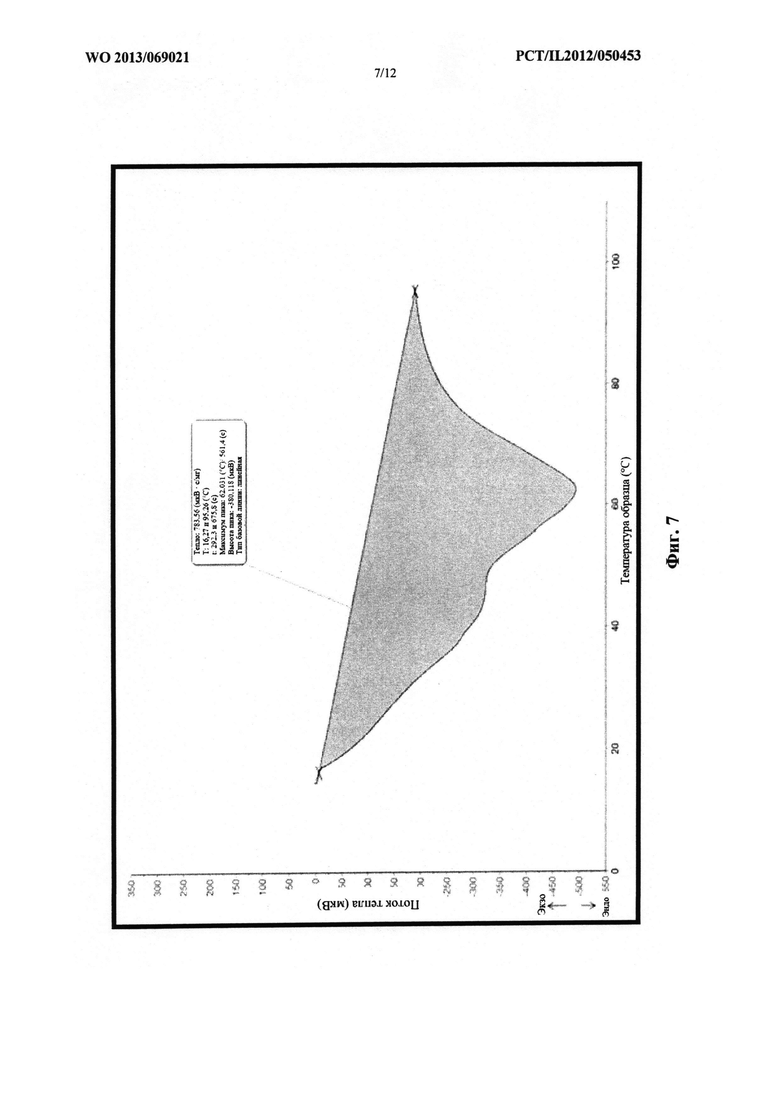
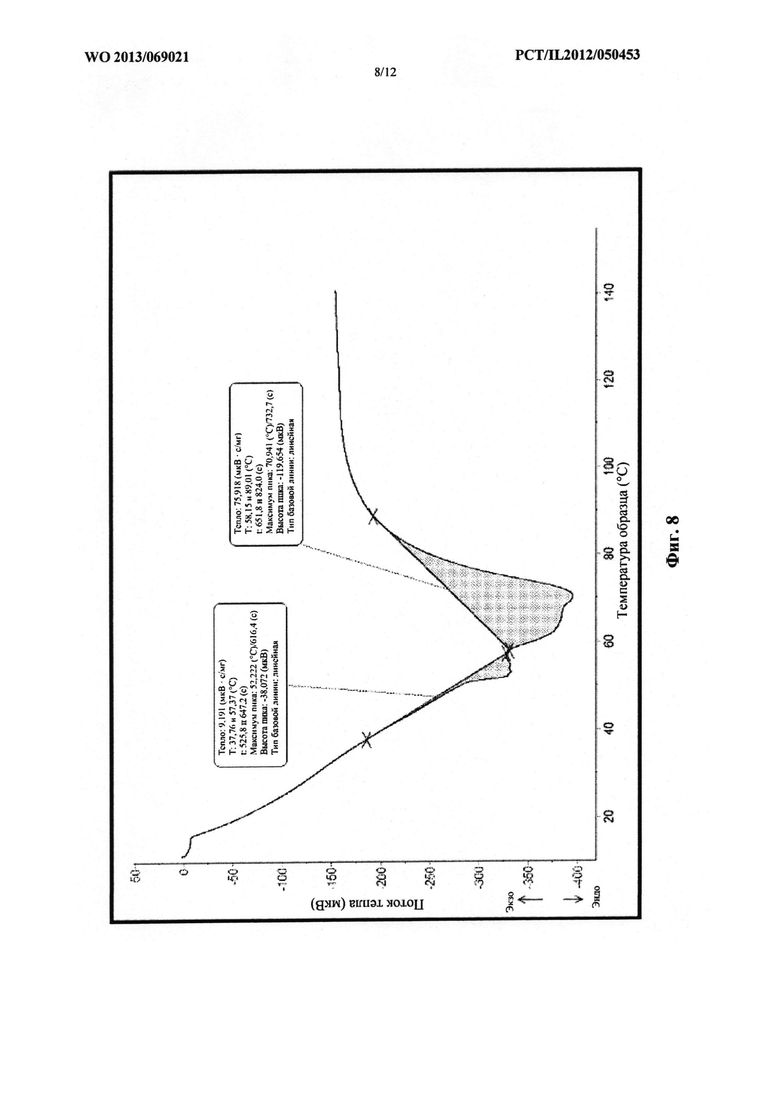
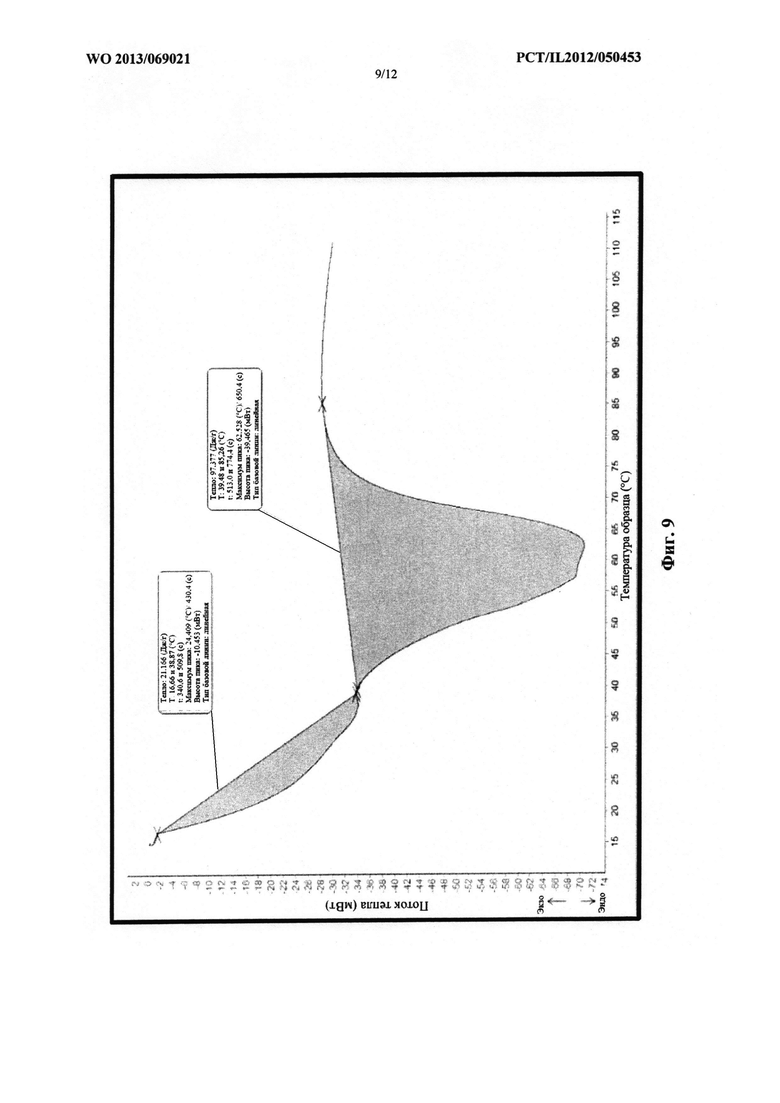
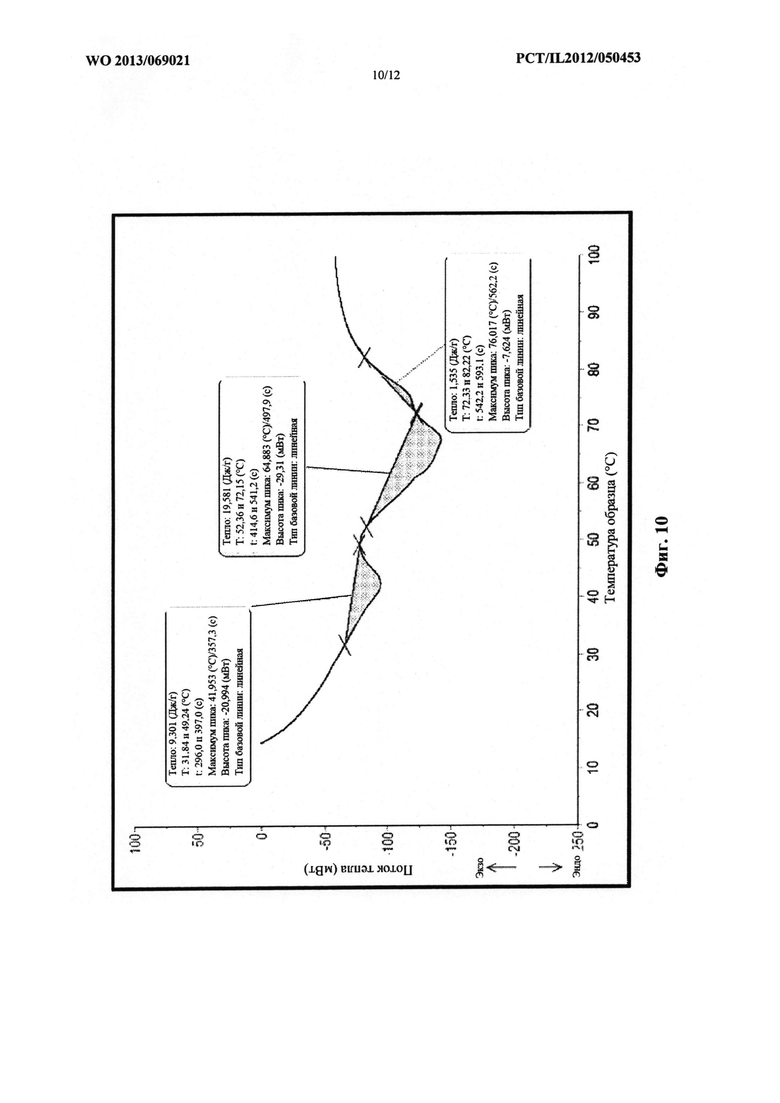
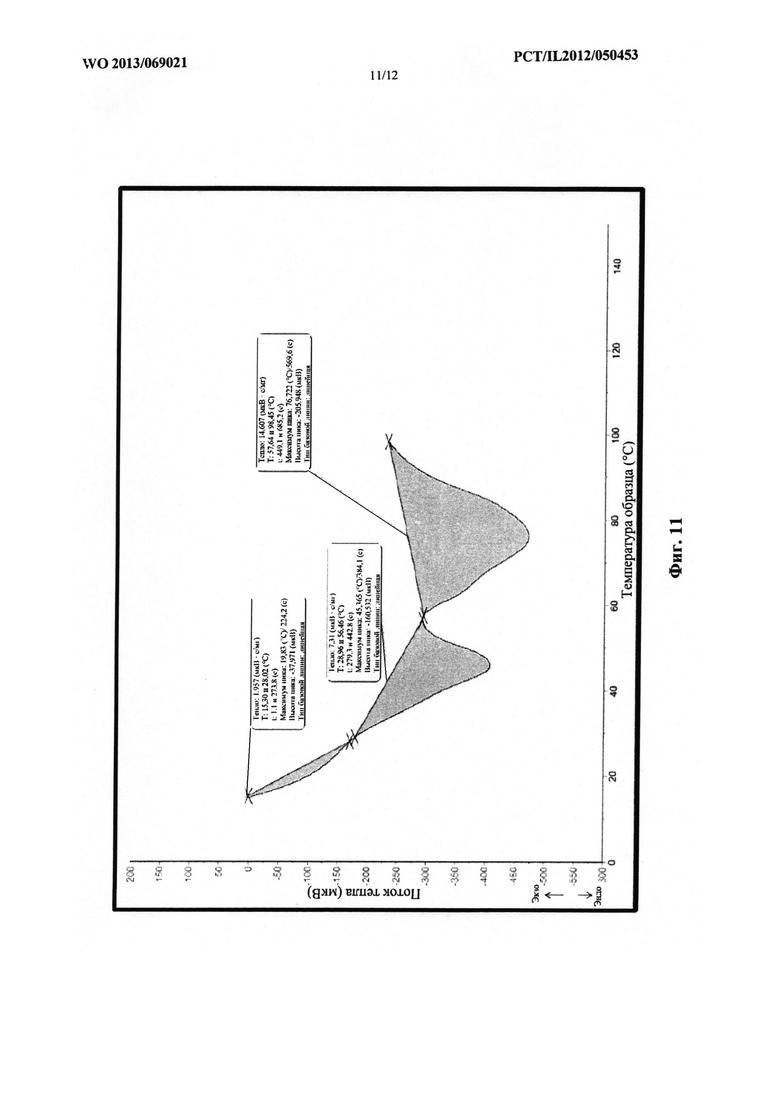
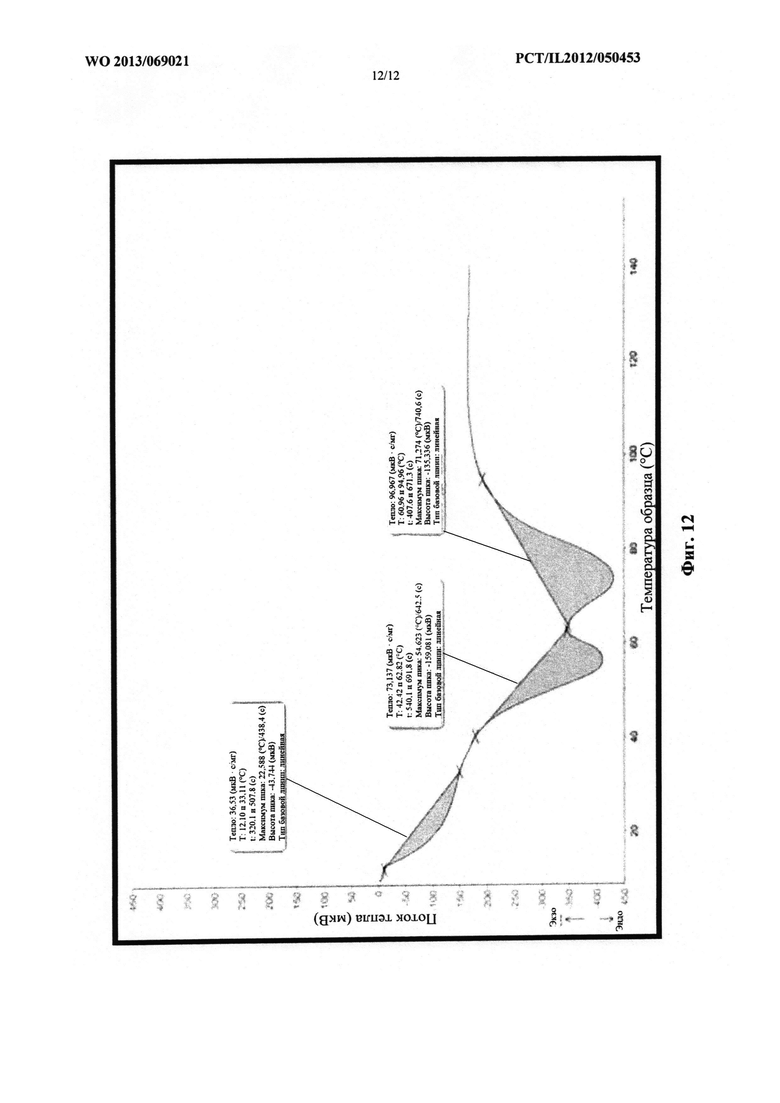
Изобретение относится к слоистой композиции для микроинкапсулирования термочувствительного биологически активного материала. Слоистая композиция для чувствительного активного материала содержит ядро для заключения активного материала и несколько слоев, окружающих указанное ядро. При этом каждый слой является специфичным в отношении температуры, и каждый слой содержит один или несколько материалов, которые подходят для приема внутрь. Причем указанные несколько слоев включают слой ядра для по меньшей мере частичного окружения указанного ядра и по меньшей мере один дополнительной слой для по меньшей мере частичного окружения указанного слоя ядра. При этом каждый слой содержит полимер с точкой плавления и точка плавления указанного полимера указанного слоя ядра является самой низкой из всех точек плавления всех слоев. При этом точка плавления указанного полимера по меньшей мере одного указанного дополнительного слоя выше указанной точки плавления указанного слоя ядра. Причем указанные слои включают первый покрывающий слой, который представляет собой указанный слой ядра и прилегает к указанному ядру, содержащий по меньшей мере один первый материал с фазовым переходом (РСМ) с точкой плавления ниже 60°С и выше 20°С; второй покрывающий слой, содержащий по меньшей мере один второй материал с фазовым переходом (РСМ) с точкой плавления ниже 60°С и выше 20°С, который по меньшей мере частично покрывает ядро, покрытое первым покрывающим слоем. При этом второй РСМ имеет точку плавления, которая выше точки плавления первого РСМ, и точка плавления полимера каждого дополнительного слоя выше точки плавления полимера предыдущего слоя в порядке нанесения указанных слоев. Слоистую композицию используют в качестве добавки к продукту питания. Изобретение обеспечивает длительный срок хранения термочувствительного биологически активного материала, например пробиотиков. 2 н. и 11 з.п. ф-лы, 12 ил., 4 табл., 5 пр.
1. Слоистая композиция для чувствительного активного материала, содержащая ядро для заключения активного материала и несколько слоев, окружающих указанное ядро, при этом каждый слой является специфичным в отношении температуры и каждый слой содержит один или несколько материалов, которые подходят для приема внутрь, при этом указанные несколько слоев включают слой ядра для по меньшей мере частичного окружения указанного ядра и по меньшей мере один дополнительной слой для по меньшей мере частичного окружения указанного слоя ядра, при этом каждый слой содержит полимер с точкой плавления, и при этом точка плавления указанного полимера указанного слоя ядра является самой низкой из всех точек плавления всех слоев, и при этом точка плавления указанного полимера по меньшей мере одного указанного дополнительного слоя выше указанной точки плавления указанного слоя ядра; при этом указанные слои включают первый покрывающий слой, который представляет собой указанный слой ядра и прилегает к указанному ядру, содержащий по меньшей мере один первый материал с фазовым переходом (РСМ) с точкой плавления ниже 60°С и выше 20°С; второй покрывающий слой, содержащий по меньшей мере один второй материал с фазовым переходом (РСМ) с точкой плавления ниже 60°С и выше 20°С, который по меньшей мере частично покрывает ядро, покрытое первым покрывающим слоем, при этом второй РСМ имеет точку плавления, которая выше точки плавления первого РСМ; и при этом точка плавления полимера каждого дополнительного слоя выше точки плавления полимера предыдущего слоя в порядке нанесения указанных слоев.
2. Композиция по п. 1, отличающаяся тем, что каждый слой содержит полимер, обладающий свойством фазового перехода, так что указанный полимер поглощает тепло из окружающей среды с небольшим изменением температуры или без изменения температуры.
3. Композиция по п. 1, отличающаяся тем, что указанный РСМ указанного первого слоя имеет точку плавления ниже 55°С и выше 20°С, и при этом указанный РСМ указанного второго слоя имеет точку плавления ниже 55°С и выше 20°С.
4. Композиция по п. 1, также содержащая третий покрывающий слой, содержащий по меньшей мере один третий материал с фазовым переходом (РСМ) с точкой плавления ниже 60°С и выше 20°С, который по меньшей мере частично покрывает второй покрывающий слой, при этом третий РСМ имеет точку плавления, которая выше точки плавления второго РСМ.
5. Композиция по п. 1, отличающаяся тем, что каждый РСМ в каждом слое имеет различную молекулярную массу.
6. Композиция по п. 1, отличающаяся тем, что указанный активный материал представляет собой пробиотические бактерии.
7. Композиция по п. 1, отличающаяся тем, что указанное ядро содержит стабилизатор и по меньшей мере одно связующее, которое имеет точку плавления ниже 50°С и выше 25°С.
8. Композиция по п. 1, отличающаяся тем, что указанное ядро также содержит источник питания для указанного пробиотика.
9. Композиция по п. 1, дополнительно содержащая энтеросолюбильное покрытие для нанесения покрытия на композицию снаружи, отличающаяся тем, что указанное энтеросолюбильное покрытие растворяется, распадается или подвергается эрозии в желудочно-кишечном тракте субъекта-млекопитающего.
10. Композиция по п. 1 в форме композиции для микроинкапсулирования.
11. Композиция по п. 1 в форме частиц, порошка или гранул.
12. Композиция по любому из предыдущих пунктов, дополнительно содержащая фармацевтическое, нутрицевтическое или пищевое вещество.
13. Применение композиции по любому из предыдущих пунктов в качестве добавки к продукту питания.
| WO 2008035332 A1, 27.03.2008 | |||
| WO 2004022031 A2, 18.03.2004 | |||
| WO 2011004375 A1, 13.01.2011 | |||
| WO 2009089115 A1, 16.07.2009. |
Авторы
Даты
2017-01-10—Публикация
2012-11-11—Подача