Данная заявка притязает на приоритет предварительных заявок на патенты США №№61/527821, поданной 26 августа 2011 г., 61/488666, поданной 20 мая 2011 г., и №61/438879, поданной 2 февраля 2011 г., посредством чего их содержание включено посредством ссылки.
Данная заявка включает посредством ссылки нуклеотидные и/или аминокислотные последовательности, присутствующие в файле, названном «120202_5056_81583_A_PCT_Sequence_Listing_BI.txt», размер которого составляет 62 килобайта, созданном 1 февраля 2012 г. в формате компьютера IBM-PC, совместимого с операционной системой MS-Windows, представленном в форме в текстового файла, поданном 2 февраля 2012 г. как часть данной заявки.
В данной заявке приведены ссылки на различные патенты и публикации. Таким образом, описания этих патентов и публикаций полностью включены в данную заявку посредством ссылки для более полного описания состояния области техники, к которой относится данное изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способам предотвращения образования или способам лечения фиброзных поражений, включая рубцы кожи, такие как келоиды или гипертрофические рубцы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Антисмысловые соединения являются эффективным средством снижения экспрессии продуктов определенных генов и могут быть исключительно полезны в ряде терапевтических применений, например, для модуляции экспрессии белков, вовлеченных в фиброз, таких как фактор роста соединительной ткани (CTGF). (См. патент США №6965025 В2, Gaarde et al.)
Антисмысловые соединения представляют собой олигомерные соединения, способные гибридизоваться с нуклеиновой кислотой-мишенью (например, молекулой-мишенью мРНК (матричная РНК)) и ингибировать экспрессию нуклеиновой кислоты-мишени.
Антисмысловые соединения, композиции и способы модуляции экспрессии CTGF и лечения заболеваний, связанных с экспрессией CTGF, раскрыты в патенте США №6965025 В2. Тем не менее, сохраняется потребность в дополнительных таких соединениях, способных обеспечивать усиленное ингибирование экспрессии CTGF, а также другие полезные свойства.
Фактор роста соединительной ткани (CTGF; также известный как ctgrofact, индуцируемый секретируемый белок фибробластов, fisp-12, NOV2, белок-2, родственный белку, связывающему инсулиноподобный фактор роста, IGFBP-rP2, IGFBP-8, HBGF-0.8, Hcs24 и экогенин (ecogenin)) является представителем семейства модульных CCN-белков (CTGF/CYR61/NOV), названных по первым идентифицированным представителям семейства, фактору роста соединительной ткани, белку, богатому цистеином (CYR61), и белку, сверхэкспрессированному в нефробластоме (NOV), но семейство также включает белки ELM-1 (экспрессированный в клетках с низким метастатическим потенциалом), WISP-3 (Wnt-1 - индуцируемый секретируемый белок) и СОР-1 (WISP-2). Установлено, что CCN-белки являются секретируемыми внеклеточными матрикс-ассоциированными белками, регулирующими такие клеточные процессы, как адгезия, миграция, митогенез, дифференцировка, выживание, ангиогенез, атеросклероз, хондрогенез, заживление ран, развитие опухолей и сосудистые и фиброзные заболевания, такие как склеродермия (Lau and Lam, Exp. Cell Res., 1999, 248, 44-57). Показано, что белок фактора роста соединительной ткани стимулирует синтез ДНК и хемотаксис фибробластов (Bradham et al., J. Cell Biol., 1991, 114, 1285-1294).
Фактор роста соединительной ткани экспрессируется в фибробластах в процессе нормальной дифференцировки, включающей образование и ремоделирование внеклеточного матрикса (ЕСМ). Фактор роста соединительной ткани также часто сверхэкспрессирован при фиброзных кожных расстройствах, таких как системный склероз, местный склероз кожи, келоиды, рубцевание, эозинофильный фасцит, узелковый фасцит и контрактура Дюпюитрена. Уровни мРНК или белка фактора роста соединительной ткани повышены в фиброзных поражениях основных органов и тканей, включая печень, почку, легкое, сердечно-сосудистую систему, поджелудочную железу, кишечник, глаз и десну. В опухолях молочной и поджелудочной железы и фиброгистиоцитарных опухолях, для которых характерно значительное вовлечение соединительной ткани, фактор роста соединительной ткани сверхэкспрессирован в стромальном компартменте.
Роль CTGF при келоидных заболеваниях
Келоидное заболевание (KD) представляет собой доброкачественную фибропролиферативную опухоль кожи, для которой характерно избыточное накопление белков внеклеточного матрикса, приводящее к избытку образования коллагена. Аномальное рубцевание кожи может происходить после повреждений у генетически предрасположенных индивидов. KD может также быть наследственным состоянием, что чаще встречается у этнических групп с темной кожей. Установлено, что частота келоидов максимальна у чернокожего населения, при этом, согласно оценкам, она составляет приблизительно от 4-6% до 16% в случайных выборках чернокожих африканцев. Были высказаны предположения о различных типах наследования KD, варьирующие от аутосомно-рецессивных до аутосомно-доминантных с неполной клинической пенетрантностью и различной экспрессией. Большинство келоидов могут приводить к существенным косметическим дефектам, но также могут вырастать достаточно большими и приводить к симптомам, вызывая деформации или ограничивая подвижность суставов.
Несмотря на низкие уровни экспрессии CTGF в нормальной коже, после повреждения кожи происходит активация CTGF с его устойчивой сверхэкспрессией при выраженном рубцевании, как при келоидах или системном склерозе. У фибробластов, культивированных из гипертрофических рубцов, келоидов и склеродермических очагов, повышена базальная экспрессия CTGF (Exp. Cell Res. 2000, 259: 213-224), и было показано, что в клетках, культивированных из гипертрофических рубцов и келоидов, повышена базальная экспрессия CTGF и они также вырабатывают еще больше CTGF в ответ на стимуляцию трансформирующим фактором роста-β (TGF-β) (Plast. Reconstr. Surg. 2005, 116: 1387-90). Сходным образом, в келоиде транскрипция CTGF после стимуляции сывороткой была значительно выше, чем в нормальных фибробластах в клеточной культуре (Ann. Surg. 2007, 246(5): 886-95).
Было обнаружено, что в келоидной ткани фибробласты, экспрессирующие мРНК CTGF, распределены по всему очагу, особенно в периферических областях (J. Invest. Derm. 1996, 106: 729-733). Было проведено сравнение уровней экспрессии мРНК CTGF в нормальной коже, келоидных рубцах, гипертрофических рубцах и зрелых рубцах. мРНК CTGF была уверенно выявлена во всех случаях келоидов, но не в зрелых рубцах. Уровни, обнаруженные в келоидах и в нормальной коже, существенно отличались (J. Japan Soc. Plastic Reconstr. Surg. 2002, 22: 560-565). Недавние данные также показывают, что, по сравнению с нормальными фибробластами, фибробласты келоидных рубцов синтезируют в 100-150 раз больше CTGF в ответ на экзогенный трансформирующий фактор роста-β1 (TGF-β1), чем нормальные фибробласты (Plast. Reconstr. Surg. 2005, 116: 1387-1390). При сравнении с нормальной кожей усиленную локализацию CTGF наблюдали в базальном слое келоидного эпидермиса, и в экстракте келоидной ткани наблюдали повышенную экспрессию CTGF (J. Cell Physiol. 2006, 208(2): 336-43). До настоящего времени не было получено данных, которые подтверждали бы роль CTGF в келоидном заболевании, демонстрируя, что ингибирование экспрессии CTGF ингибирует рост келоида.
На сегодняшний день не разработано ни одной эффективной терапевтической схемы для лечения келоидов или предотвращения роста келоидов после хирургических вмешательств. Существующие способы лечения включают окклюзионные повязки, компрессионную терапию, инъекции стероидов внутрь очагов, криохирургическое вмешательство, хирургическое удаление, лечение лазером, лучевую терапию, кеналог (триамцинолон), терапию интерфероном, блеомицин, 5-фторурацил, верапамил, крем с имиквимодом и их комбинации. Как силиконовый, так и несиликоновый окклюзионный перевязочный материал является широко применяемым клиническим вариантом для лечения келоидов на протяжении последних 30 лет, но все эти способы имеют очень ограниченную эффективность, и срочная потребность в новых способах лечения келоидов общепризнана.
Были предприняты попытки применять различные формы лучевой терапии в качестве монотерапии для лечения келоидов, но они остаются весьма противоречивыми из-за эпизодических сообщений о канцерогенезе после лечения. В течение последних 40 лет неоднократно предпринимались попытки применять лечение лазером с использованием аргонового лазера, CO2-лазера и импульсного лазера на красителях, но ни одна из них не была эффективной. Все три формы лечения лазером, согласно многочисленным исследованиям, имеют частоту рецидивов более 90%, демонстрируя незначительный полезный эффект или его отсутствие. Криотерапию применяли в качестве монотерапии. Однако побочные эффекты, связанные с данным способом, включают боль в месте лечения и гипо- или гиперпигментацию. Инъекции ацетонида триамцинолона, разновидности кортикостероида, внутрь очагов часто применяют в качестве терапии первой линии для лечения келоидов, но снова, согласно сообщениям, фактическая клиническая эффективность сильно варьирует. Кроме того, необходимость многократных инъекций, а также побочные эффекты в форме боли при инъекции, атрофии кожи, телеангиэктазий и измененной пигментации вынудили клиницистов и исследователей продолжать поиски других способов лечения.
В результате, сохраняется назревшая потребность в дополнительных способах и агентах для эффективного предотвращения образования келоидов, гипертрофических рубцов и других типов фиброзных поражений, а также для лечения келоидов, гипертрофических рубцов и фиброзного поражения для их устранения или уменьшения и/или для предотвращения их рецидивирования. Клинические результаты, описанные здесь, впервые ясно демонстрируют способность антисмыслового олигонуклеотида, направленно действующего на CTGF, уменьшать рост и выраженность келоидов после хирургического вмешательства.
Введение антисмысловых соединений в кожу
Также впервые продемонстрировано, что антисмысловые олигонуклеотиды не подвержены сильной боковой диффузии после введения в кожу (см. Пример 2), что могло бы приводить к непостоянным эффектам лекарственных средств данного класса на линейный разрез/заживающий рубец или келоид при осуществлении введения в форме однократного введения болюсного типа, приводя к различным концентрациям антисмыслового соединения по длине развивающегося рубца. Для преодоления данного недостатка был разработан способ доставки антисмысловых олигонуклеотидов методикой продольной внутрикожной инъекции. Эта методика обеспечивает эффективную доставку постоянного количества антисмыслового лекарственного средства по всей длине рубца и приводит к эффективному и стойкому уменьшению рубца по всей длине рубца или келоида.
Продольная внутрикожная инъекция заключается во введении иглы в дерму, по возможности параллельно коже, и продвижении иглы внутрь и вдоль дермы на расстояние, обычно составляющее от 1 до 5 см. В этот момент иглу извлекают и во время извлечения иглы лекарственное средство вводят в дерму по всей длине пути, пройденного иглой, что приводит к введению равного количества и объема лекарственного средства по всей длине пути, пройденного иглой.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно данному изобретению предложен способ лечения келоида или предотвращения образования, повторного образования или роста келоида после повреждения кожи у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте келоида или повреждения кожи, одной или более инъекций композиции, содержащей модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований присутствует в области, выбранной из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2728-2797, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9, или его соль или эфир в количестве, эффективном для лечения или для предотвращения образования, повторного образования или роста келоида, где эффективное количество составляет от 0,1 до 50 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр келоида или повреждения кожи.
Согласно данному изобретению также предложен способ лечения гипертрофического рубца или предотвращения образования, повторного образования или роста гипертрофического рубца после повреждения кожи у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте гипертрофического рубца или повреждения кожи, одной или более инъекций композиции, содержащей модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований присутствует в области, выбранной из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2728-2797, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9, или его соль или эфир в количестве, эффективном для лечения или для предотвращения образования, повторного образования или роста гипертрофического рубца, где эффективное количество составляет от 0,1 до 25 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр гипертрофического рубца или повреждения кожи.
Согласно изобретению также предложен способ уменьшения образования, повторного образования или роста рубца или келоида в месте повреждения кожи или лечения уже имеющегося рубца или келоида у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте повреждения или уже имеющегося рубца или келоида, одной или более продольных инъекций композиции, содержащей модифицированный олигонуклеотид или его соль или эфир, направленно действующие на нуклеиновую кислоту, кодирующую белок, вовлеченный в фиброз, в количестве, эффективном для ингибирования экспрессии белка и, посредством этого, уменьшения образования, повторного образования или роста рубца или келоида в месте повреждения или лечения уже имеющегося рубца или келоида.
Кроме того, согласно данному изобретению предложен способ уменьшения образования, повторного образования или роста фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте повреждения или уже имеющегося фиброзного поражения, одной или более продольных инъекций композиции, содержащей модифицированный олигонуклеотид или его соль или эфир, направленно действующие на нуклеиновую кислоту, кодирующую белок, вовлеченный в фиброз, в количестве, эффективном для ингибирования экспрессии белка и, посредством этого, уменьшения образования, повторного образования или роста фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ.1 показано, что антисмысловые олигонуклеотиды, содержащие 2’-МОЕ (2’-метоксиэтил), диффундируют на относительно небольшие расстояния (~0,5-1,0 см) в коже кролика при введении внутрикожной инъекцией (описано в Примере 2).
На ФИГ.2 показано, что лечение келоидов в модели на животных антисмысловым олигонуклеотидом CTGF приводило к снижению экспрессии мРНК как CTGF (Фиг.2А), так и Col3a1 (альфа-1-колагена III типа) (Фиг.2Б) в интактной человеческой келоидной ткани, трансплантированной мышам (описано в Примере 3).
На ФИГ.3 показано, что лечение антисмысловым олигонуклеотидом CTGF (ЕХС 001 или SEQ ID NO: 39) ингибирует рост гипертрофических рубцов и келоидов на 24 неделе после хирургической коррекции рубцов у людей. Показатели под каждой группой изображений отражают степень улучшения при сравнении келоидов при введении плацебо и ЕХС 001. Отрицательный показатель отражает улучшение рубцевания в результате введения ЕХС 001. На ФИГ.3А показаны гипертрофические рубцы при введении плацебо и ЕХС 001 через 24 недели после хирургической коррекции рубцов. На ФИГ.3Б показаны келоидные рубцы при введении плацебо и ЕХС 001 через 24 недели после хирургической коррекции рубцов (описано в Примере 4).
На ФИГ.4 показано, что лечение антисмысловым олигонуклеотидом CTGF (ЕХС 001 или SEQ ID NO: 39) ингибирует образование и рост гипертрофического рубца через 12 недель после хирургической абдоминопластики. Показатели под изображениями отражают степень улучшения при сравнении рубца при введении плацебо и ЕХС 001. Отрицательный показатель отражает улучшение рубцевания в результате введения ЕХС 001 (описано в Примере 5).
На ФИГ.5 показана ограниченная диффузия ЕХС 001 при введении рядом с рубцом (описано в Примере 5). Рядом с правой частью рубца после абдоминопластики (справа от вертикальной линии) вводили ЕХС 001, в то время как рядом с рубцом слева от вертикальной линии введений не проводили. Очевидно, выраженность рубца справа меньше, чем слева. Этот пример демонстрирует, что полезный терапевтический эффект ЕХС 001 ограничен областью рубца, расположенной в непосредственной близости к месту доставки лекарственного средства продольной внутрикожной инъекцией. Таким образом, лекарственное средство, по-видимому, подвержено ограниченной диффузии от места введения, и необходимо введение в непосредственной близости и по всей длине места возможного рубца, например, продольной внутрикожной инъекцией.
На ФИГ.6 показан пример способности ЕХС 001 уменьшать рост и образование гипертрофических рубцов (описано в Примере 6). В данном примере показаны два сопоставимых абдоминальных рубца длиной 2 см, один при введении 5 мг/см EXC 001 и один при введении плацебо. Выраженность рубца при введении EXC 001 меньше, чем рубца при введении плацебо. Гистологический анализ этих двух рубцов также выявил опосредованное EXC 001 снижение экспрессии белка CTGF (при иммуногистохимическом исследовании), ясно демонстрируя, что EXC 001 действует, снижая экспрессию его предполагаемой мишени (CTGF).
На ФИГ.7 показаны эффекты EXC 001 на экспрессию мРНК различных генов в абдоминальных рубцах в разные моменты времени после лечения (описано в Примере 6). На ФИГ.7А показан эффект EXC 001 в подавлении экспрессии мРНК CTGF. На ФИГ.7Б показан эффект EXC 001 в подавлении экспрессии мРНК α1-колагена III типа (Col3A1). На ФИГ.7В показан эффект EXC 001 в подавлении экспрессии мРНК эластина (ELASF). На ФИГ.7Г и Д показано отсутствие значимого ингибирования экспрессии мРНК SMAD3 или TGF-β1 посредством EXC 001, по сравнению с плацебо.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно данному изобретению предложен способ лечения келоида или предотвращения образования, повторного образования или роста келоида после повреждения кожи у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте келоида или повреждения кожи, одной или более инъекций композиции, содержащей модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований присутствует в области, выбранной из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2728-2797, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9, или его соль или эфир в количестве, эффективном для лечения или для предотвращения образования, повторного образования или роста келоида, где эффективное количество составляет от 0,1 до 50 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр келоида или повреждения кожи.
Согласно данному изобретению также предложен способ лечения гипертрофического рубца или предотвращения образования, повторного образования или роста гипертрофического рубца после повреждения кожи у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте гипертрофического рубца или повреждения кожи, одной или более инъекций композиции, содержащей модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований присутствует в области, выбранной из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2728-2797, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9, или его соль или эфир в количестве, эффективном для лечения или для предотвращения образования, повторного образования или роста гипертрофического рубца, где эффективное количество составляет от 0,1 до 25 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр гипертрофического рубца или повреждения кожи.
Согласно данному изобретению также предложен способ уменьшения образования, повторного образования или роста рубца или келоида в месте повреждения кожи или лечения уже имеющегося рубца или келоида у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте повреждения или уже имеющегося рубца или келоида, одной или более продольных инъекций композиции, содержащей модифицированный олигонуклеотид или его соль или эфир, направленно действующие на нуклеиновую кислоту, кодирующую белок, вовлеченный в фиброз, в количестве, эффективном для ингибирования экспрессии белка и, посредством этого, уменьшения образования, повторного образования или роста рубца или келоида в месте повреждения или лечения уже имеющегося рубца или келоида. Кроме того, согласно данному изобретению предложен способ уменьшения образования, повторного образования или роста фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте повреждения или уже имеющегося фиброзного поражения, одной или более продольных инъекций композиции, содержащей модифицированный олигонуклеотид или его соль или эфир, направленно действующие на нуклеиновую кислоту, кодирующую белок, вовлеченный в фиброз, в количестве, эффективном для ингибирования экспрессии белка и, посредством этого, уменьшения образования, повторного образования или роста фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения.
В одном воплощении указанных выше способов одна или более продольных инъекций включают многократные продольные внутрикожные инъекции на рубец.
В указанных выше способах белок, вовлеченный в фиброз, может представлять собой фактор роста соединительной ткани, трансформирующий фактор роста бета-1, гомолог-3 белка MAD (mothers against decapentaplegic), белок раннего ответа (early growth response-1), моноцитарный хемотаксический белок-1, коллаген или эластин. Примерами подходящих коллагенов являются коллаген 3А1, коллаген 1А2 и коллаген 1А1.
В определенных воплощениях способов по данному изобретению эффективное количество составляет от 0,1 до 50 мг, например, от 0,1 до 25 мг, модифицированного олигонуклеотида на инъекцию на линейный сантиметр места повреждения кожи или уже имеющегося рубца.
В определенных воплощениях модифицированный олигонуклеотид вводят по меньшей мере один раз каждые две недели на протяжении по меньшей мере четырех недель, то есть по меньшей мере дважды.
В других воплощениях модифицированный олигонуклеотид вводят по меньшей мере один раз каждые три недели на протяжении по меньшей мере шести недель, то есть по меньшей мере дважды.
В других воплощениях модифицированный олигонуклеотид вводят по меньшей мере один раз каждые четыре недели на протяжении по меньшей мере восьми недель. В других воплощениях модифицированный олигонуклеотид вводят по меньшей мере один раз каждые восемь недель на протяжении по меньшей мере шестнадцати недель.
В настоящее время подразумевают, что может быть предпочтительным вводить модифицированный олигонуклеотид на протяжении периода продолжительностью по меньшей мере девять недель, например, на протяжении периода продолжительностью 26 недель.
В определенных воплощениях модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований присутствует в области, выбранной из группы, состоящей из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2728-2797, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9.
В определенных воплощениях по меньшей мере часть последовательности из 12 нуклеотидных оснований модифицированного олигонуклеотида присутствует в последовательности нуклеотидных оснований, изложенной в любой из последовательностей SEQ ID NO: 28, 30, 39, 40, 43, 44, 45, 50, 51, 52, 56, 78, 125 или 166.
В определенных воплощениях модифицированный олигонуклеотид состоит из по меньшей мере 14, например, 20, связанных нуклеозидов.
В определенных воплощениях модифицированный олигонуклеотид представляет собой одноцепочечный олигонуклеотид. В других воплощениях модифицированный олигонуклеотид представляет собой двухцепочечный олигонуклеотид.
В других воплощениях модифицированный олигонуклеотид содержит по меньшей мере один олигодезоксирибонуклеотид или по меньшей мере один олигорибонуклеотид.
В определенных воплощениях модифицированный олигонуклеотид имеет последовательность, на 100% идентичную по всей ее длине части любой из последовательностей, изложенных в SEQ ID NO: 28, 30, 39, 40, 43, 44, 45, 50, 51, 52, 56, 78, 125 или 166.
В определенных воплощениях модифицированный олигонуклеотид содержит по меньшей мере одну модифицированную межнуклеозидную связь, например, фосфотиоатную межнуклеозидную связь, таким образом, что некоторые или все межнуклеозидные связи могут представлять собой фосфотиоатные межнуклеозидные связи.
В определенных воплощениях по меньшей мере один нуклеозид модифицированного олигонуклеотида содержит модифицированный сахар, такой как бициклический сахар. В некоторых таких воплощениях по меньшей мере один модифицированный сахар содержит 2’-O-метоксиэтил.
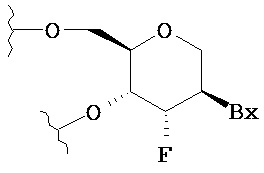
В других воплощениях модифицированный олигонуклеотид содержит по меньшей мере один тетрагидропиран-модифицированный нуклеозид, где фуранозное кольцо заменено тетрагидропирановым кольцом.
В некоторых таких воплощениях каждый из по меньшей мере одного тетрагидропиран-модифицированного нуклеозида имеет структуру:
 ,
,
где Вх представляет собой возможно защищенную гетероциклическую основную группировку.
В определенных воплощениях по меньшей мере один нуклеозид содержит модифицированное нуклеотидное основание, например, модифицированный дезоксинуклеозид, рибонуклеозид или 5’-метилцитозин.
В определенных воплощениях модифицированный олигонуклеотид содержит:
а) промежуточный сегмент, состоящий из связанных дезоксинуклеозидов;
б) 5’-концевой сегмент, состоящий из связанных модифицированных нуклеозидов; и
в) 3’-концевой сегмент, состоящий из связанных модифицированных нуклеозидов;
где промежуточный сегмент расположен между 5’-концевым сегментом и 3’-концевым сегментом и где каждый модифицированный нуклеозид в каждом концевом сегменте содержит модифицированный сахар.
В определенных предпочтительных в настоящее время воплощениях модифицированный олигонуклеотид содержит:
а) промежуточный сегмент, состоящий из тринадцати связанных дезоксинуклеозидов;
б) 5’-концевой сегмент, состоящий из двух связанных модифицированных нуклеозидов; и
в) 3’-концевой сегмент, состоящий из пяти связанных модифицированных нуклеозидов;
где промежуточный сегмент расположен между 5’-концевым сегментом и 3’-концевым сегментом, где каждый модифицированный нуклеозид в каждом концевом сегменте содержит 2’-O-метоксиэтиловый сахар и где каждая межнуклеозидная связь представляет собой фосфотиоатную связь.
В определенных воплощениях последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 39.
В других воплощениях последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 40.
В других воплощениях последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 45.
В других воплощениях последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 52.
В других воплощениях последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 166.
В определенных воплощениях композиция содержит модифицированный олигонуклеотид или его соль и фармацевтически приемлемый носитель или разбавитель.
В определенных воплощениях модифицированный олигонуклеотид непосредственно или косвенно ингибирует экспрессию коллагена или эластина или и того, и другого, для лечения келоида, предотвращения образования, повторного образования или роста келоида, лечения гипертрофического рубца, предотвращения образования, повторного образования или роста гипертрофического рубца, уменьшения образования рубца в месте повреждения, лечения уже имеющегося рубца, уменьшения образования фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения.
В настоящее время подразумевают, что указанные выше способы дополнительно включают введение субъекту второго соединения.
В определенных воплощениях второе соединение может представлять собой антисмысловое соединение, направленно действующее на ту же или другую последовательность, и модифицированный олигонуклеотид и второе соединение можно вводить одновременно или последовательно.
В определенных воплощениях модифицированный олигонуклеотид представлен в конъюгате с группировкой, усиливающей проникновение соединения в субъект и/или увеличивающей время удержания соединения в субъекте, где время удержания составляет предпочтительно от 7 до 60 суток. Конъюгированная группировка представляет собой полиэтиленгликоль, гиалуроновую кислоту, холестерин, адамантануксусную кислоту, 1-пиренмасляную кислоту, дигидротестостерон, 1,3-бис-O-(гексадецил)глицерин, гексадецилглицерин, гексадециламин, геранилоксигексил, пальмитиновую кислоту, миристиновую кислоту, спермин, спермидин, фолиевую кислоту, витамин Е, углеводную группировку, пептид (включая спираль Antennapedia, фрагменты Tat вируса иммунодефицита человека (HIV), интегринсвязывающий пептид), транспортин или порфирин.
В определенных воплощениях модифицированный олигонуклеотид вводят в системе доставки, усиливающей проникновение соединения в субъект и/или увеличивающей время удержания соединения в субъекте, где время удержания составляет предпочтительно от 7 до 60 суток. Система доставки включает катионный липид, липосому, микрочастицу, наночастицу, жидкую композицию со взвешенными частицами с лекарственным средством или без него в растворе для немедленного высвобождения или с депо лекарственного средства в частицах (в частности, частицах PLGA (сополимер молочной и гликолевой кислот) и поли-Arg), жидкую композицию, образующую гель после инъекций, такую как термореактивные/чувствительные жидкости (например, плюрониковые гели), жидкости, содержащие полимер и лекарственное средство в биологически совместимом растворителе, выпадающие в осадок при разведении растворителя биологическими жидкостями (например, атригель), гель, полутвердую композицию, такую как гидрогель (с матричным каркасом или в форме распыляемого раствора), порошок для нанесения во время хирургического вмешательства, рассасывающийся шовный материал, быстрорастворимый гель или полимерную полоску.
В определенных воплощениях модифицированный олигонуклеотид вводят субъекту после хирургического удаления келоида, рубца или фиброзного поражения.
В определенных воплощениях повреждение кожи является результатом хирургического разреза, биопсии, прокола кожи, удаления кожи, ожога или раны.
В определенных воплощениях эффективное количество составляет приблизительно 5 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр келоида, гипертрофического рубца, повреждения кожи, места повреждения, уже имеющегося рубца или уже имеющегося фиброзного поражения.
В определенных воплощениях модифицированный олигонуклеотид вводят на протяжении до 6 месяцев. В других воплощениях модифицированный олигонуклеотид вводят на протяжении до 1 года.
В определенных воплощениях указанные выше способы дополнительно включают введение субъекту другого терапевтического агента, который может представлять собой стероид, силиконовую повязку, трансформирующий фактор роста-β3 (TGF-β3) (то есть ювисту (Juvista)), коллагеназу (то есть ксифлекс (Xyflex)), 17β-эстрадиол (то есть зестим (Zesteem)), интерлейкин-10 (IL-10) (то есть преваскар (Prevascar)), манноза-6-фосфат (то есть ювидекс (Juvidex)), агент, расслабляющий гладкие мышцы (то есть AZX100, синтетический пептид из 24 аминокислот), терапию стволовыми клетками (то есть GBT009), сывороточный амилоидный белок, антитела против интегрина αvβ6, CTGF, трансформирующего фактора роста-β (TGF-β) или молекулы, ингибирующие активность ALK-4 и/или ALK-5 (рецепторов TGF-бета), любой ингибитор, разработанный для блокады активности TNF (фактор некроза опухоли) (например, этанерцепт), окклюзионный перевязочный материал, компрессионную терапию, криохирургическое вмешательство, хирургическое удаление, лечение лазером, лучевую терапию, терапию интерфероном, блеомицин, 5-фторурацил, верапамил, крем с имиквимодом, способный стимулировать заживление ран, такой как дермаграфт (Dermagraft), аплиграф (Apligraf), тромбоцитарный фактор роста (PDGF) (то есть регранекс (Regranex)), электрическую стимуляцию, «факторы роста» как группу, перевязочный материал как группу, подслизистую основу тонкой кишки (SIS), промогран (Promogran), гипербарический кислород или их комбинации.
В определенных воплощениях модифицированный олигонуклеотид вводят посредством композиции, ультразвука, электропорации, ионофореза или микроиглы.
В определенных воплощениях модифицированный олигонуклеотид вводят рядом с келоидом, гипертрофическим рубцом, повреждением кожи, местом повреждения, уже имеющимся рубцом или уже имеющимся фиброзным поражением.
В других воплощениях модифицированный олигонуклеотид вводят по всей длине келоида, гипертрофического рубца, повреждения кожи, места повреждения, уже имеющегося рубца или уже имеющегося фиброзного поражения.
В других воплощениях модифицированный олигонуклеотид вводят вдоль каждой стороны келоида, гипертрофического рубца, повреждения кожи, места повреждения, уже имеющегося рубца или уже имеющегося фиброзного поражения.
В других воплощениях модифицированный олигонуклеотид вводят непосредственно в келоид, гипертрофический рубец, повреждение кожи, место повреждения, уже имеющийся рубец или уже имеющееся фиброзное поражение.
В определенных воплощениях субъект генетически предрасположен к образованию келоидов или гипертрофических рубцов или и того, и другого.
В определенных воплощениях модифицированный олигонуклеотид вводят внутрикожно.
В других воплощениях модифицированный олигонуклеотид вводят внутрикожно методикой продольной инъекции.
В других воплощениях модифицированный олигонуклеотид вводят подкожно.
В других воплощениях модифицированный олигонуклеотид вводят местно.
Согласно данному изобретению также предложен набор, содержащий:
а) устройство, предварительно заполненное композицией, содержащей модифицированный олигонуклеотид; и
б) инструкцию по применению.
В определенном воплощении антисмысловой олигонуклеотид комплементарен части области CTGF, на которую направленно действуют активные олигонуклеотиды, расположенной в положениях-мишенях 1396-1424. Она является областью последовательности, на которую направленно действуют олигонуклеотиды 418899, 412295 и 412294/ЕХС 001 (SEQ ID NO: 166, 40 и 39, соответственно).
Согласно данному изобретению также предложен модифицированный олигонуклеотид, содержащий по меньшей мере 12, предпочтительно по меньшей мере 14 связанных нуклеозидов, последовательность нуклеотидных оснований которого представляет собой часть одной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO: 28, 30, 39, 40, 43, 44, 45, 50, 51, 52, 56, 78, 125 и 166.
Антисмысловые соединения, описанные здесь, могут содержать олигонуклеотид, имеющий от 12 до 30, от 12 до 20 и, предпочтительно, от 14 до 20 связанных нуклеозидов.
В одном воплощении изобретения модифицированный олигонуклеотид представляет собой одноцепочечный или двухцепочечный олигонуклеотид.
В настоящем изобретении использованы олигомерные соединения, в частности антисмысловые олигонуклеотиды, для применения в модуляции функционирования молекул нуклеиновых кислот, кодирующих белки, вовлеченные в фиброз, с модуляцией, в конечном счете, количества образуемого белка. Этого достигают, предоставляя антисмысловые соединения, специфично гибридизующиеся с одной или более нуклеиновыми кислотами, кодирующими белки, вовлеченные в фиброз. При использовании здесь термины «нуклеиновая кислота-мишень» и «нуклеиновая кислота, кодирующая фактор роста соединительной ткани», включают ДНК, кодирующую белок, вовлеченный в фиброз, РНК (включая пре-мРНК и мРНК), образуемую при транскрипции такой ДНК, и также кДНК, имеющую происхождение от такой РНК.
Специфичная гибридизация олигомерного соединения с его нуклеиновой кислотой-мишенью препятствует нормальному функционированию нуклеиновой кислоты. Эту модуляцию функционирования нуклеиновой кислоты-мишени соединениями, специфично гибридизующимися с ней, обычно называют «антисмысловым воздействием». Подавляемые таким образом функции ДНК включают репликацию и транскрипцию. Подавляемые таким образом функции РНК включают все жизненно важные функции, такие как, например, транслокация РНК к месту трансляции белка, трансляция РНК с образованием белка, сплайсинг РНК с образованием одной или более разновидностей мРНК и каталитическая активность, в которую может быть вовлечена РНК, или которой способствует РНК. Суммарным эффектом такого подавления функционирования нуклеиновой кислоты-мишени является модуляция экспрессии фактора роста соединительной ткани. В контексте настоящего изобретения «модуляция» обозначает повышение (стимуляцию) или снижение (ингибирование) экспрессии гена. В контексте настоящего изобретения ингибирование является предпочтительной формой модуляции экспрессии гена, и мРНК является предпочтительной мишенью.
Нуклеиновые кислоты-мишени, области-мишени и нуклеотидные последовательности
Предпочтительно, мишенями антисмыслового воздействия являются определенные нуклеиновые кислоты. В контексте данного изобретения «направленное действие» антисмыслового соединения на определенную нуклеиновую кислоту является многостадийным процессом.
Подразумевают, что последовательность, изложенная в каждой SEQ ID NO в Примерах, представленных здесь, не зависит ни от какой модификации сахарной группировки, межнуклеозидной связи или нуклеотидного основания. Как таковые, антисмысловые соединения, определенные SEQ ID NO, могут независимо содержать одну или более чем одну модификацию сахарной группировки, межнуклеозидной связи или нуклеотидного основания. Антисмысловые соединения, описываемые Isis-номером (Isis №), указывают на комбинацию последовательности и мотива нуклеотидных оснований.
В одном воплощении область-мишень представляет собой структурно определенную область нуклеиновой кислоты. Например, область-мишень может включать 3’-нетранслируемую область (3’-UTR), 5’-нетранслируемую область (5’-UTR), экзон, интрон, кодирующую область, область инициации трансляции, область терминации трансляции или другую определенную область нуклеиновой кислоты. Структурно определенные области нуклеиновой кислоты могут быть получены по регистрационному номеру из баз данных последовательностей, таких как NCBI (Национальный центр биотехнологической информации), и такая информация включена сюда посредством ссылки. В других воплощениях область-мишень может содержать последовательность от 5’-положения-мишени одного сегмента-мишени в области-мишени до 3’-положения-мишени другого сегмента-мишени в области-мишени.
Направленное действие включает определение по меньшей мере одного сегмента-мишени, с которым гибридизуется антисмысловое соединение с оказанием желаемого эффекта. В определенных воплощениях желаемый эффект представляет собой снижение уровней мРНК нуклеиновой кислоты-мишени. В других воплощениях желаемый эффект представляет собой снижение уровней белка, кодируемого нуклеиновой кислотой-мишенью, или изменение фенотипа, связанное с нуклеиновой кислотой-мишенью.
Область-мишень может содержать один или более сегментов-мишеней. Множественные сегменты-мишени в области-мишени могут быть перекрывающимися. Альтернативно, они могут быть неперекрывающимися. В одном воплощении сегменты-мишени в области-мишени разделены не более чем 300 нуклеотидами. В других воплощениях сегменты-мишени в области-мишени разделены не более чем приблизительно 250, 200, 150, 100, 90, 80, 70, 60, 50, 40, 30, 20 или 10 нуклеотидами нуклеиновой кислоты-мишени. В другом воплощении сегменты-мишени в области-мишени разделены не более чем приблизительно 5 нуклеотидами нуклеиновой кислоты-мишени. В дополнительных воплощениях сегменты-мишени являются смежными.
Подходящие сегменты-мишени могут быть обнаружены в 5’-UTR, кодирующей области, 3’-UTR, интроне или экзоне. Сегменты-мишени, содержащие старт-кодон или стоп-кодон, также являются подходящими сегментами-мишенями. Подходящий сегмент-мишень может специально исключать определенную структурно определенную область, такую как старт-кодон или стоп-кодон.
Определение подходящих сегментов-мишеней может включать сравнение последовательности нуклеиновой кислоты-мишени с другими последовательностями генома. Например, для определения сходных областей у разных нуклеиновых кислот может быть применен алгоритм BLAST. Такое сравнение может предотвратить селекцию последовательностей антисмысловых соединений, способных к неспецифичной гибридизации с последовательностями, отличными от выбранной нуклеиновой кислоты-мишени (то есть последовательностями, не являющимися последовательностями-мишенями, или последовательностями, расположенными вне последовательностей-мишеней).
Активность антисмысловых соединений в активной области-мишени (например, определенная по процентному снижению уровней нуклеиновой кислоты-мишени) может варьировать. В одном воплощении снижения уровней мРНК CTGF указывают на ингибирование экспрессии CTGF. Снижения уровней белка CTGF также указывают на ингибирование экспрессии мРНК-мишени. Кроме того, на ингибирование экспрессии CTGF указывают изменения фенотипа.
Антисмысловые соединения
В контексте данного изобретения термин «олигонуклеотид» относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или их миметикам. Данный термин включает олигонуклеотиды, состоящие из встречающихся в природе нуклеотидных оснований, сахаров и ковалентных межнуклеозидных (каркасных) связей, а также олигонуклеотиды с не встречающимися в природе частями, функционирующие сходным образом. Такие модифицированные или замещенные олигонуклеотиды часто предпочтительны по сравнению с нативными формами ввиду таких желательных свойств, как, например, усиленный захват клетками, повышенная аффинность в отношении нуклеиновой кислоты-мишени и повышенная устойчивость в присутствии нуклеаз.
В то время как антисмысловые олигонуклеотиды являются предпочтительной формой антисмыслового соединения, настоящее изобретение включает другие олигомерные антисмысловые соединения, включая, без ограничения, миметики олигонуклеотидов.
Антисмысловое соединение означает олигомерное соединение, способное проходить гибридизацию с нуклеиновой кислотой-мишенью посредством образования водородных связей. Антисмысловые соединения включают, без ограничения, олигонуклеотиды, олигонуклеозиды, аналоги олигонуклеотидов, миметики олигонуклеотидов, антисмысловые олигонуклеотиды, малые интерферирующие РНК (siRNA), РНК-интерференцию (RNAi), рибозимы, олигонуклеотиды внешней вспомогательной последовательности (EGS) (олигозимы) и другие олигонуклеотиды, гибридизующиеся с нуклеиновой кислотой-мишенью и модулирующие ее экспрессию.
В определенных воплощениях антисмысловое соединение имеет последовательность нуклеотидных оснований, которая, при написании в 5’-3’-направлении, содержит обратный комплемент сегмента-мишени нуклеиновой кислоты-мишени, на которую оно направленно действует. В таких определенных воплощениях антисмысловой олигонуклеотид имеет последовательность нуклеотидных оснований, которая, при написании в 5’-3’-направлении, содержит обратный комплемент сегмента-мишени нуклеиновой кислоты-мишени, на которую он направленно действует.
В определенных воплощениях длина антисмыслового соединения, направленно действующего на нуклеиновую кислоту, составляет от 12 до 30 субъединиц. Иными словами, антисмысловые соединения состоят из 12-30 связанных субъединиц. В других воплощениях антисмысловое соединение состоит из 8-80, 12-50, 15-30, 18-24, 19-22 или 20 связанных субъединиц. В таких определенных воплощениях длина антисмысловых соединений составляет 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 связанных субъединиц или входит в диапазон, определенный любыми двумя из указанных выше значений. В некоторых воплощениях антисмысловое соединение представляет собой антисмысловой олигонуклеотид, и связанные субъединицы представляют собой нуклеотиды.
В одном предпочтительном воплощении изобретения соединение содержит 20 или по меньшей мере 14 связанных нуклеозидов, где модифицированный олигонуклеотид имеет последовательность, на 100% идентичную одной из последовательностей, изложенных в SEQ ID NO: 28, 30, 39, 40, 45, 52, 56, 78, 125 и 166. В другом предпочтительном воплощении основное соединение, представляющее интерес, имеет последовательность, изложенную в SEQ ID NO: 39 (ISIS 412294).
В определенных воплощениях в укороченном или процессированном антисмысловом соединении, направленно действующем на нуклеиновую кислоту, удалена одна субъединица с 5’-конца (5’-процессинг) или, альтернативно, с 3’-конца (3’-процессинг). В укороченном или процессированном антисмысловом соединении, направленно действующем на нуклеиновую кислоту, могут быть удалены две субъединицы с 5’-конца или, альтернативно, могут быть удалены две субъединицы с 3’-конца антисмыслового соединения. Альтернативно, удаляемые нуклеозиды могут быть распределены по всей длине антисмыслового соединения, например, в антисмысловом соединении, в котором один нуклеозид удален с 5’-конца и один нуклеозид удален с 3’-конца.
В случае присутствия одной дополнительной субъединицы в удлиненном антисмысловом соединении дополнительная субъединица может быть расположена на 5’- или 3’-конце антисмыслового соединения. В случае присутствия двух или более дополнительных субъединиц дополнительные субъединицы могут быть расположены рядом друг с другом, например, в антисмысловом соединении, в котором добавлены две субъединицы с 5’-конца (5’-присоединение) или, альтернативно, с 3’-конца (3’-присоединение) антисмыслового соединения. Альтернативно, дополнительные субъединицы могут быть распределены по всей длине антисмыслового соединения, например, в антисмысловом соединении, в котором одна субъединица добавлена с 5’-конца и одна субъединица добавлена с 3’-конца.
Возможно увеличение или уменьшение длины антисмыслового соединения, такого как антисмысловой олигонуклеотид, и/или введение ошибочно спариваемых оснований без потери активности. Например, в Woolf et al. (Proc. Natl. Acad. Sci. USA 89: 7305-7309, 1992) проведено исследование серии антисмысловых олигонуклеотидов длиной 13-25 нуклеотидных оснований на предмет их способности индуцировать расщепление РНК-мишени в модели инъекции в ооцит. Антисмысловые олигонуклеотиды длиной 25 нуклеотидных оснований с 8 или 11 ошибочно спариваемыми основаниями вблизи концов антисмысловых олигонуклеотидов были способны приводить к специфичному расщеплению мРНК-мишени, хотя и в меньшей степени, чем антисмысловые олигонуклеотиды, не содержавшие ошибочно спариваемых оснований. Сходным образом, специфичное расщепление мишени было получено с использованием антисмысловых олигонуклеотидов из 13 нуклеотидных оснований, включая олигонуклеотиды с 1 или 3 ошибочно спариваемыми основаниями.
Gautschi et al (J. Natl. Cancer Inst. 93: 463-471, March 2001) продемонстрировали способность олигонуклеотида, на 100% комплементарного мРНК bcl-2 и имеющего 3 ошибочно спариваемых основания относительно мРНК bcl-xL, снижать экспрессию как bcl-2, так и bcl-xL in vitro и in vivo. Кроме того, данный олигонуклеотид продемонстрировал сильную противоопухолевую активность in vivo.
Maher and Dolnick (Nuc. Acid. Res. 16: 3341-3358, 1988) исследовали серию тандемных антисмысловых олигонуклеотидов из 14 нуклеотидных оснований и антисмысловые олигонуклеотиды из 28 и 42 нуклеотидных оснований, состоявшие из последовательностей двух или трех тандемных антисмысловых олигонуклеотидов, соответственно, на предмет их способности останавливать трансляцию человеческой дигидрофолатредуктазы (DHFR) в анализе с кроличьими ретикулоцитами. Каждый из трех антисмысловых олигонуклеотидов из 14 нуклеотидных оснований сам по себе был способен ингибировать трансляцию, хотя и в меньшей степени, чем антисмысловые олигонуклеотиды из 28 или 42 нуклеотидных оснований.
Bhanot et al. (PCT/US 2007/068401) были предложены короткие антисмысловые соединения, включая соединения, содержащие химически модифицированные высокоаффинные мономеры, длиной от 8 до 16 мономеров. Было показано, что эти короткие антисмысловые соединения с повышенной активностью и улучшенным терапевтическим индексом полезны для снижения содержания нуклеиновых кислот-мишеней и/или белков-мишеней в клетках, тканях и организмах животных. Короткие антисмысловые соединения были эффективными в меньших дозах, чем описанные ранее антисмысловые соединения, позволяя уменьшать токсичность и стоимость лечения. Кроме того, описанные короткие антисмысловые соединения обладают большим потенциалом для перорального введения.
Гибридизации
После определения одного или более сайтов-мишеней выбирают олигонуклеотиды, в достаточной степени комплементарные мишени, то есть гибридизующиеся достаточно хорошо и с достаточной специфичностью, для получения желаемого эффекта.
В контексте данного изобретения «гибридизация» означает образование водородных связей, которое может представлять собой образование водородных связей по Уотсону-Крику, Хугстину (Hoogsteen) или образование обратных водородных связей по Хугстину между комплементарными нуклеозидными или нуклеотидными основаниями. Например, аденин и тимин являются комплементарными нуклеотидными основаниями, образующими пару посредством образования водородных связей.
Идентичность
Антисмысловые соединения, предложенные здесь, могут также иметь определенный процент идентичности определенной нуклеотидной последовательности, SEQ ID NO или соединению, представленному определенным номером олигонуклеотида (Isis). При использовании здесь антисмысловое соединение идентично последовательности, раскрытой здесь, если оно обладает такой же способностью к образованию пар нуклеотидных оснований. Например, РНК, содержащую урацил вместо тимидина в раскрытой ДНК-последовательности, будут рассматривать как идентичную ДНК-последовательности, поскольку как урацил, так и тимидин образуют пару с аденином. Также включены укороченные и удлиненные варианты антисмысловых соединений, описанных здесь, а также соединения, имеющие неидентичные основания, по сравнению с антисмысловыми соединениями, предложенными здесь. Неидентичные основания могут быть расположены рядом друг с другом или распределены по всей длине антисмыслового соединения. Процент идентичности антисмыслового соединения вычисляют по числу оснований, образующих идентичные пары оснований, относительно последовательности, с которой его сравнивают.
В одном воплощении антисмысловые соединения по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны одному или более антисмысловым соединениям, SEQ ID NO или их частям, описанным здесь.
Модификации
В определенном воплощении изобретения модификации антисмысловых соединений включают замены или изменения межнуклеозидных связей, сахарных группировок или нуклеотидных оснований.
В одном воплощении изобретения соединение содержит по меньшей мере одну модификацию, выбранную из группы, состоящей из модифицированной межнуклеозидной связи, модифицированного сахара или модифицированного нуклеотидного основания.
Несмотря на возможность использования антисмысловых олигонуклеотидов, содержащих множество модифицированных межнуклеозидных связей, предпочтительной в настоящее время модифицированной межнуклеозидной связью является фосфотиоатная связь между одним или более нуклеозидами, или где все межнуклеозидные связи представляют собой фосфотиоатные межнуклеозидные связи.
В целом, также предпочтительно, чтобы антисмысловой олигонуклеотид содержал по меньшей мере один и обычно более одного модифицированного сахара, где модифицированный сахар представляет собой бициклический сахар. Несмотря на возможность использования различных модифицированных сахаров, в настоящее время предпочтительно использовать 2’-O-метоксиэтиловый сахар.
Кроме того, по меньшей мере одно и обычно более одного нуклеотидного основания, входящие в состав антисмыслового олигонуклеотида, представляют собой модифицированный нуклеотид, такой как 5-метилцитозин.
Нуклеозид представляет собой комбинацию основания и сахара. Часть нуклеозида, представленная нуклеотидным основанием (также известным как основание), обычно представляет собой гетероциклическую основную группировку. Нуклеотиды представляют собой нуклеозиды, дополнительно содержащие фосфатную группу, ковалентно связанную с сахарной частью нуклеозида. В нуклеозидах, содержащих пентофуранозильный сахар, фосфатная группа может быть связана с 2’-, 3’- или 5’-гидроксильной группировкой сахара. Образование олигонуклеотидов происходит посредством ковалентного связывания соседних нуклеозидов друг с другом с образованием линейного полимерного олигонуклеотида. В структуре олигонуклеотида фосфатные группы обычно называют образующими межнуклеозидные связи олигонуклеотида.
Модификации антисмысловых соединений включают замены или изменения межнуклеозидных связей, сахарных группировок или нуклеотидных оснований. Модифицированные антисмысловые соединения часто предпочтительны по сравнению с нативными формами ввиду таких желательных свойств, как, например, усиленный захват клетками, повышенная аффинность в отношении нуклеиновой кислоты-мишени, повышенная устойчивость в присутствии нуклеаз или повышенная ингибирующая активность.
Химически модифицированные нуклеозиды могут также быть использованы для повышения аффинности связывания укороченного или процессированного антисмыслового олигонуклеотида в отношении его нуклеиновой кислоты-мишени. Вследствие этого, сопоставимые результаты могут часто быть получены с использованием более коротких антисмысловых соединений, имеющих такие химически модифицированные нуклеозиды.
Модифицированные межнуклеозидные связи
Встречающаяся в природе межнуклеозидная связь РНК и ДНК представляет собой 3’-5’-фосфодиэфирную связь. Антисмысловые соединения, имеющие одну или более модифицированных, то есть не встречающихся в природе, межнуклеозидных связей, часто предпочтительны по сравнению с антисмысловыми соединениями, имеющими встречающиеся в природе межнуклеозидные связи, ввиду таких желательных свойств, как, например, усиленный захват клетками, повышенная аффинность в отношении нуклеиновых кислот-мишеней и повышенная устойчивость в присутствии нуклеаз.
Олигонуклеотиды, имеющие модифицированные межнуклеозидные связи, содержат межнуклеозидные связи, в которых сохранен атом фосфора, а также межнуклеозидные связи, не имеющие атома фосфора. Типичные фосфорсодержащие межнуклеозидные связи включают, без ограничения, фосфодиэфиры, фосфотриэфиры, метилфосфонаты, фосфорамидаты и фосфоротиоаты. Способы получения фосфорсодержащих связей и связей, не содержащих фосфор, хорошо известны.
В одном воплощении антисмысловые соединения, действующие на нуклеиновую кислоту CTGF, содержат одну или более модифицированных межнуклеозидных связей. В некоторых воплощениях модифицированные межнуклеозидные связи представляют собой фосфоротиоатные связи. В других воплощениях каждая межнуклеозидная связь антисмыслового соединения представляет собой фосфоротиоатную межнуклеозидную связь.
Как известно в данной области техники, нуклеозид представляет собой комбинацию основания и сахара. Часть нуклеозида, представленная основанием, обычно представляет собой гетероциклическое основание. Двумя наиболее распространенными классами таких гетероциклических оснований являются пурины и пиримидины. Нуклеотиды представляют собой нуклеозиды, дополнительно содержащие фосфатную группу, ковалентно связанную с сахарной частью нуклеозида. В нуклеозидах, содержащих пентофуранозильный сахар, фосфатная группа может быть связана с 2’-, 3’- или 5’-гидроксильной группировкой сахара. При образовании олигонуклеотидов происходит ковалентное связывание соседних нуклеозидов друг с другом фосфатными группами с образованием линейного полимерного соединения. В свою очередь, соответствующие концы этой линейной полимерной структуры могут быть дополнительно соединены с образованием кольцевой структуры, тем не менее, обычно предпочтительны открытые линейные структуры. В структуре олигонуклеотида фосфатные группы обычно называют образующими межнуклеозидный каркас олигонуклеотида. Обычной связью или каркасом РНК и ДНК является 3’-5’-фосфодиэфирная связь.
Конкретные примеры предпочтительных антисмысловых соединений, полезных в данном изобретении, включают олигонуклеотиды, содержащие модифицированные каркасы или искусственные межнуклеозидные связи. Как определено в данном описании, олигонуклеотиды, имеющие модифицированные каркасы, включают олигонуклеотиды, в каркасах которых сохранен атом фосфора, а также олигонуклеотиды, не имеющие атома фосфора в каркасе. В целях данного описания, и как их иногда называют в данной области техники, модифицированные олигонуклеотиды, не имеющие фосфора в их межнуклеозидном каркасе, можно также рассматривать как олигонуклеозиды.
Предпочтительные модифицированные олигонуклеотидные каркасы включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, включая 3’-алкиленфосфонаты, 5’-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3’-аминофосфорамидаты и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры, селенофосфаты и боранофосфаты, имеющие нормальные 3’-5’-связи, их аналоги с 2’-5’-связями и олигонуклеотидные каркасы с обратной полярностью, где одна или более межнуклеотидных связей представляют собой 3’-3’-, 5’-5’- или 2’-2’-связь. Предпочтительные олигонуклеотиды с обратной полярностью содержат одну 3’-3’-связь и 3’-межнуклеотидную связь, то есть один обратный нуклеозидный остаток, который может не содержать основания (нуклеотидное основание отсутствует, или вместо него присутствует гидроксильная группа). Также включены формы различных солей, смешанных солей и свободных кислот.
Репрезентативные патенты США, в которых описано получение указанных выше фосфорсодержащих связей, включают, без ограничения, патенты США №№3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361; 5194599; 5565555; 5527899; 5721218; 5672697 и 5625050; некоторые из которых принадлежат авторам данной заявки, и каждый из которых включен сюда посредством ссылки.
Предпочтительные модифицированные олигонуклеотидные каркасы, не содержащие атом фосфора, включают каркасы, образованные межнуклеозидными связями с короткоцепочечным алкилом или циклоалкилом, смешанными межнуклеозидными связями с гетероатомом и алкилом или циклоалкилом, или одной или более короткоцепочечными гетероатомными или гетероциклическими межнуклеозидными связями. Они включают каркасы, имеющие морфолиновые связи (образованные отчасти сахарной частью нуклеозида); силоксановые каркасы; сульфидные, сульфоксидные и сульфоновые каркасы; формацетиловые и тиоформацетиловые каркасы; метиленформацетиловые и тиоформацетиловые каркасы; рибоацетиловые каркасы; алкиленсодержащие каркасы; сульфаматные каркасы; метилениминовые и метиленгидразиновые каркасы; сульфонатные и сульфонамидные каркасы; амидные каркасы; и другие, имеющие смешанные N-, O-, S- и CH2-компонентные части.
Репрезентативные патенты США, в которых описано получение указанных выше олигонуклеозидов, включают, без ограничения, патенты США №№5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; 5792608; 5646269 и 5677439; некоторые из которых принадлежат авторам данной заявки, и каждый из которых включен сюда посредством ссылки.
В других предпочтительных миметиках олигонуклеотидов как сахар, так и межнуклеозидная связь, то есть каркас нуклеотидных единиц заменен новыми группами. Основные единицы сохранены для гибридизации с подходящим соединением-мишенью, представляющим собой нуклеиновую кислоту. Одно такое олигомерное соединение, миметик олигонуклеотидов, который, как было показано, обладает отличными гибридизационными свойствами, называют пептид-нуклеиновой кислотой (PNA). В PNA-соединениях, сахарный каркас олигонуклеотида заменен амидсодержащим каркасом, в частности аминоэтилглициновым каркасом. Нуклеотидные основания сохранены и связаны непосредственно или косвенно с азаатомами азота амидной части каркаса. Репрезентативные патенты США, в которых описано получение PNA-соединений, включают, без ограничения, патенты США №№5539082; 5714331; и 5719262, каждый из которых включен сюда посредством ссылки. Дополнительную информацию о PNA-соединениях можно обнаружить в Nielsen et al., Science, 1991, 254, 1497-1500.
Наиболее предпочтительными воплощениями изобретения являются олигонуклеотиды с фосфоротиоатными каркасами и олигонуклеозиды с гетероатомными каркасами, и в частности -CH2-NH-O-CH2-, -СН2-N(СН3)-O-СН2-[известный как метиленметилиминовый или MMI-каркас], -СН2-O-N(СН3)-СН2-, -CH2-N(CH3)-N(CH3)-CH2- и -O-N(СН3)-СН2-СН2- [где нативный фосфодиэфирный каркас представлен как -O-Р-O-СН2-] по указанному выше патенту США №5489677 и амидные каркасы по указанному выше патенту США №5602240. Также предпочтительны олигонуклеотиды, имеющие морфолиновые каркасные структуры по указанному выше патенту США №5034506.
Модифицированные сахарные группировки
Модифицированные олигонуклеотиды могут также содержать одну или более замещенных сахарных группировок. Например, фуранозильное сахарное кольцо может быть модифицировано несколькими способами, включая замещение группой-заместителем, образование связей с получением бициклической нуклеиновой кислоты («BNA») и замещение 4’-O гетероатомом, таким как S или N(R), как описано в патенте США №7399845, Seth et al., таким образом, он полностью включен сюда посредством ссылки. Другие примеры BNA описаны в опубликованной международной заявке на патент № WO 2007/146511, таким образом, она полностью включена сюда посредством ссылки.
Антисмысловые соединения по изобретению могут возможно содержать один или более нуклеотидов, имеющих модифицированные сахарные группировки. Модификации сахаров могут придавать антисмысловым соединениям устойчивость к нуклеазам, аффинность связывания или какое-либо другое полезное биологическое свойство. Фуранозильное сахарное кольцо нуклеозида может быть модифицировано несколькими способами, включая, без ограничения: введение группы-заместителя, в частности в 2’-положение; связывание двух негеминальных атомов кольца с образованием бициклической нуклеиновой кислоты (BNA); и замещение кислорода кольца в 4’-положении атомом или группой, такими как -S-, -N(R)- или -C(R1)(R2). Модифицированные сахара включают, без ограничения, замещенные сахара, особенно 2’-замещенные сахара, имеющие группу-заместителя 2’-F, 2’-OCH2 (2’-ОМе) или 2’-O(СН2)2-ОСН3 (2’-O-метоксиэтил или 2’-МОЕ); и бициклические модифицированные сахара (BNA), имеющие связывающую группу 4’-(СН2)n-O-2’, где n=1 или n=2. Способы получения модифицированных сахаров хорошо известны специалистам в данной области техники.
В определенных воплощениях 2’-модифицированный нуклеозид имеет бициклическую сахарную группировку. В таких определенных воплощениях бициклическая сахарная группировка представляет собой D-caxap в альфа-конфигурации. В таких определенных воплощениях бициклическая сахарная группировка представляет собой D-caxap в бета-конфигурации. В таких определенных воплощениях бициклическая сахарная группировка представляет собой L-caxap в альфа-конфигурации. В таких определенных воплощениях бициклическая сахарная группировка представляет собой L-caxap в бета-конфигурации.
В определенных воплощениях бициклическая сахарная группировка содержит связывающую группу между 2’- и 4’-атомами углерода. В таких определенных воплощениях связывающая группа содержит от 1 до 8 связанных бирадикальных групп. В определенных воплощениях бициклическая сахарная группировка содержит от 1 до 4 связанных бирадикальных групп. В определенных воплощениях бициклическая сахарная группировка содержит 2 или 3 связанные бирадикальные группы. В определенных воплощениях бициклическая сахарная группировка содержит 2 связанные бирадикальные группы. В определенных воплощениях связанная бирадикальная группа выбрана из -O-, -S-, -N(R1)-, -C(R1)(R2)-, -C(R1)=C(R1)-, -C(R1)=N-, -C(=NR1)-, Si(R1)(R2)-, -S(=O)2-, -S(=O)-, -C(=O)- и -C(=S)-; где каждый R1 и R2 независимо представляет собой Н, гидроксил, С1-С12алкил, замещенный С1-С12алкил, С2-С12алкенил, замещенный С2-С12алкенил, С2-С12алкинил, замещенный С2-С12алкинил, С5-С20арил, замещенный С5-С20арил, гетероциклический радикал, замещенный гетероциклический радикал, гетероарил, замещенный гетероарил, С5-С7алициклический радикал, замещенный С5-С7алициклический радикал, галоген, замещенный окси (-O-), амино, замещенный амино, азидо, карбоксил, замещенный карбоксил, ацил, замещенный ацил, CN, тиол, замещенный тиол, сульфонил (S(=O)2-H), замещенный сульфонил, сульфоксил (S(=O)-H) или замещенный сульфоксил; и каждая группа-заместитель независимо представляет собой галоген, С1-С12алкил, замещенный С1-С12алкил, С2-С12алкенил, замещенный С2-С12алкенил, С2-С12алкинил, замещенный С2-С12алкинил, амино, замещенный амино, ацил, замещенный ацил, C1-С12аминоалкил, С1-С12аминоалкокси, замещенный С1-С12аминоалкил, замещенный С1-С12аминоалкокси или защитную группу.
В некоторых воплощениях 2’- и 4’-атомы углерода бициклической сахарной группировки связаны бирадикальной группой, выбранной из -O-(СН2)p-, -O-СН2-, -O-СН2СН2-, -О-СН(алкил)-, -NH-(CH2)p-, N(алкил)-(СН2)p-, -О-СН(алкил)-, -(СН(алкил))-(СН2)p-, -NH-O-(CH2)p-, -N(алкил)-O-(СН2)p- или -O-N(алкил)-(СН2)p-, где p представляет собой 1, 2, 3, 4 или 5 и каждая алкильная группа может быть дополнительно замещена. В определенных воплощениях p представляет собой 1, 2 или 3.
В одном аспекте каждая из указанных связывающих групп независимо представляет собой [C(R1)(R2)]n-, -[C(R1)(R2)]n-O-, -C(R1R2)-N(R1)-O- или -C(R1R2)-O-N(R1)-. В другом аспекте каждая из указанных связывающих групп независимо представляет собой 4’-(СН2)3-2’, 4’-(СН2)2-2’, 4’-СН2-O-2’, 4’-(СН2)2-O-2’, 4’-CH2-O-N(R1)-2’ и 4’-CH2-N(R1)-O-2’, где каждый R1 независимо представляет собой Н, защитную группу или С1-С12алкил.
В нуклеотидах, имеющих модифицированные сахарные группировки, группировки нуклеотидных оснований (природные, модифицированные или их комбинации) сохранены для гибридизации с подходящей нуклеиновой кислотой-мишенью.
В одном воплощении антисмысловые соединения, направленно действующие на нуклеиновую кислоту, содержат один или более нуклеотидов, имеющих модифицированные сахарные группировки. В предпочтительном воплощении модифицированная сахарная группировка представляет собой 2’-МОЕ. В других воплощениях 2’-МОЕ-модифицированные нуклеотиды образуют гэпмер-мотив (gapmer motif).
Предпочтительные в настоящее время олигонуклеотиды содержат одно из следующего в 2’-положении: ОН; F; O-, S- или N-алкил; O-, S- или N-алкенил; O-, S- или N-алкинил; или О-алкил-O-алкил, где алкил, алкенил и алкинил могут представлять собой замещенные или незамещенные C1-С10алкил или C2-С10алкенил и алкинил. Особенно предпочтительны O[(СН2)nO]mCH3, O(СН2)nOCH3, O(СН2)nNH2, O(СН2)nCH3, O(CH2)nONH2 и O(СН2)nON[(СН2)nCH3)]2, где n и m составляют от 1 до приблизительно 10. Другие предпочтительные олигонуклеотиды содержат в 2’-положении одно из следующего: низший C1-С10алкил, замещенный низший алкил, алкенил, алкинил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, РНК-расщепляющую группу, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида, или группу для улучшения фармакодинамических свойств олигонуклеотида, и другие заместители со сходными свойствами. Предпочтительная модификация включает 2’-метоксиэтокси (2’-O-CH2CH2OCH3, также известный как 2’-O-(2-метоксиэтил) или 2’-МОЕ) (Martin et al., Helv. Chim. Acta, 1995, 78, 486-504), то есть алкоксиалкоксигруппу. Другая предпочтительная модификация включает 2’-диметиламинооксиэтокси, то есть группу O(СН2)2ON(СН3)2, также известную как 2’-DMAOE, и 2’-диметиламиноэтоксиэтокси (также известную в данной области техники как 2’-O-диметиламиноэтоксиэтил или 2’-DMAEOE), то есть 2’-O-СН2-O-СН2-N(СН2)2. Другая предпочтительная модификация включает бициклическую нуклеиновую кислоту (также называемую закрытой нуклеиновой кислотой (locked nucleic acid, LNA)), в которой 2’-гидроксильная группа связана с 3’- или 4’-атомом углерода сахарного кольца, образуя посредством этого бициклическую сахарную группировку. Связывающая группа предпочтительно представляет собой метиленовую группу (-СН2-)n, связывающую 2’-атом кислорода с 4’-атомом углерода, где n представляет собой 1 или 2, включая α-L-метиленокси(4’-СН2-O-2’)BNA, β-D-метиленокси(4’-СН2-O-2’)BNA и этиленокси(4’-(СН2)2-O-2’)BNA. Бициклические модифицированные сахара также включают (6’S)-6’-метил-BNA, аминоокси(4’-СН2-O-N(R)-2’)BNA, оксиамино(4’-СН2-N(R)-O-2’)BNA, где R независимо представляет собой Н, защитную группу или С1-С12алкил. LNA также образуют дуплексы с комплементарной ДНК, РНК или LNA с высокотемпературной аффинностью. Спектры кругового дихроизма (CD-спектры) демонстрируют, что дуплексы, содержащие полностью модифицированную LNA (особенно LNA:PHK), структурно сходны с дуплексом «А-форма РНК:РНК». Ядерное магнитно-резонансное (NMR) исследование дуплекса LNA:ДНК подтвердило 3’-эндо конформацию мономера LNA. Также было продемонстрировано распознавание двухцепочечной ДНК, позволяя предположить встраивание LNA в цепь ДНК. Исследования несовпадающих последовательностей, показывают, что LNA образуют пары оснований по правилам Уотсона-Крика, обычно с большей селективностью, по сравнению с соответствующими немодифицированными контрольными цепями.
LNA, в которых 2’-гидроксильная группа связана с 4’-атомом углерода сахарного кольца с образованием посредством этого 2’-С,4’-С-оксиметиленовой связывающей группы с образованием посредством этого бициклической сахарной группировки. Связывающая группа может представлять собой метиленовую группу (-СН2-)n, связывающую 2’-атом кислорода с 4’-атомом углерода, где n представляет собой 1 или 2 (Singh et al., Chem. Commun., 1998, 4, 455-456). LNA и аналоги LNA демонстрируют очень высокую температурную устойчивость дуплекса с комплементарной ДНК или РНК (Tm от +3 до +10°С), устойчивость к расщеплению 3’-экзонуклеазами и хорошие свойства растворимости. Другие предпочтительные связывающие группы включают связывающую группу 2’-дезокси-2’-CH2OCH2-4’. LNA и их получение описаны в опубликованных международных заявках на патенты №№ WO 98/39352 и WO 99/14226.
Другие предпочтительные модификации включают 2’-метокси (2’-O-СН3), 2’-аминопропокси (2’-OCH2CH2CH2NH2), 2’-аллил(2’-СН2-СН=СН2), 2’-O-аллил (2’-O-СН2-СН=СН2) и 2’-фтор (2’-F). 2’-модификация может присутствовать в арабиноположении (верхнем) или рибоположении (нижнем). Предпочтительной 2’-арабиномодификацией является 2’-F. Сходные модификации могут также быть проведены в других положениях олигонуклеотида, в частности в 3’-положении сахара 3’-концевого нуклеотида или в олигонуклеотидах с 2’-5’-связями и в 5’-положении 5’-концевого нуклеотида. Олигонуклеотиды могут также иметь миметики или суррогаты сахаров (иногда называемые аналогами ДНК), такие как циклобутильные группировки вместо пентафуранозильного сахара. Репрезентативные патенты США, в которых описано получение таких модифицированных сахарных структур, включают, без ограничения, патенты США №№4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; 5792747; и 5700920; некоторые из которых принадлежат авторам данной заявки, и каждый из которых полностью включен сюда посредством ссылки. В определенных воплощениях нуклеозиды модифицированы заменой рибозильного кольца суррогатной кольцевой системой, такой как морфолиновое кольцо, циклогексенильное кольцо, циклогексильное кольцо или тетрагидропиранильное кольцо, такой как, например, имеющей одну из формул:
 .
.
В данной области техники также известны многие другие бициклические и трициклические сахарные суррогатные кольцевые системы, которые могут быть использованы для модификации нуклеозидов для включения в антисмысловые соединения (см., например, обзорную статью Leumann, Christian J.). В таких кольцевых системах возможно проведение различных дополнительных замен для усиления активности.
В одном воплощении изобретения соединение содержит по меньшей мере один тетрагидропиран-модифицированный нуклеозид, где фуранозное кольцо заменено тетрагидропирановым кольцом.
В другом воплощении изобретения каждый из по меньшей мере одного тетрагидропиран-модифицированного нуклеозида имеет структуру:
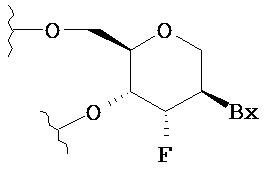 ,
,
где Вх представляет собой возможно защищенную гетероциклическую основную группировку.
Модифицированные нуклеотидные основания
Олигонуклеотиды могут также содержать модификации или замены нуклеотидных оснований (часто называемых в данной области техники просто «основаниями»). Модификации или замены нуклеотидных оснований структурно отличаются от встречающихся в природе или синтетических немодифицированных нуклеотидных оснований, но функционально они взаимозаменяемы. Как природные, так и модифицированные нуклеотидные основания способны участвовать в образовании водородных связей. Такие модификации нуклеотидных оснований могут придавать антисмысловым соединениям устойчивость к нуклеазам, аффинность связывания или какое-либо другое полезное биологическое свойство. Модифицированные нуклеотидные основания включают синтетические и природные нуклеотидные основания, такие как, например, 5-метилцитозин (5-me-С). Определенные замены нуклеотидных оснований, включая замены 5-метилцитозином, особенно полезны для повышения аффинности связывания антисмыслового соединения с нуклеиновой кислотой-мишенью. Например, показано, что замены 5-метилцитозином повышают устойчивость дуплекса нуклеиновых кислот на 0,6-1,2°С (Sanghvi, Y.S., Crooke, S.T. and Lebleu, В., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp.276-278).
Дополнительные немодифицированные нуклеотидные основания включают 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метиловые и другие алкиловые производные аденина и гуанина, 2-пропиловые и другие алкиловые производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил(-С≡С-СН3)урацил и цитозин и другие алкиниловые производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген-, 8-амино-, 8-тио-, 8-тиоалкил-, 8-гидрокси- и другие 8-замещенные аденины и гуанины, 5-галоген-, в частности, 5-бром-, 5-трифторметил- и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-фтораденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин.
Гетероциклические основные группировки могут также включать группировки, в которых пуриновое или пиримидиновое основание заменено другими гетероциклами, например, 7-деазааденином, 7-деазагуанозином, 2-аминопиридином и 2-пиридоном. Нуклеотидные основания, особенно полезные для повышения аффинности связывания антисмысловых соединений, включают 5-замещенные пиримидины, 6-азапиримидины и N-2-, N-6- и O-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин.
В одном воплощении антисмысловые соединения, направленно действующие на нуклеиновую кислоту CTGF, содержат одно или более модифицированных нуклеотидных оснований. В дополнительном воплощении антисмысловые олигонуклеотиды с расширенным промежуточным сегментом, направленно действующие на нуклеиновую кислоту CTGF, содержат одно или более модифицированных нуклеотидных оснований. В некоторых воплощениях модифицированное нуклеотидное основание представляет собой 5-метилцитозин. В других воплощениях каждый цитозин представляет собой 5-метилцитозин.
При использовании здесь «немодифицированные» или «природные» нуклеотидные основания включают пуриновые основания аденин (А) и гуанин (G) и пиримидиновые основания тимин (Т), цитозин (С) и урацил (U). Модифицированные нуклеотидные основания включают другие синтетические и природные нуклеотидные основания, такие как 5-метилцитозин (5-me-С), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метиловые и другие алкиловые производные аденина и гуанина, 2-пропиловые и другие алкиловые производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил(-С≡С-СН3)урацил и цитозин и другие алкиниловые производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген-, 8-амино-, 8-тио-, 8-тиоалкил-, 8-гидрокси- и другие 8-замещенные аденины и гуанины, 5-галоген-, в частности 5-бром-, 5-трифторметил- и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-фтораденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Другие модифицированные нуклеотидные основания включают трициклические пиримидины, такие как феноксазинцитидин (1Н-пиримидо[5,4-b][1,4]бензоксазин-2(3Н)-он), фенотиазинцитидин (1Н-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), G-тиски (G-clamps), такие как замещенный феноксазинцитидин (например, 9-(2-аминоэтокси)-Н-пиримидо[5,4-b][1,4]бензоксазин-2(3Н)-он), карбазолцитидин (2Н-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин (Н-пиридо[3’,2’:4,5]пирроло[2,3-d]пиримидин-2-он). Модифицированные нуклеотидные основания могут также включать нуклеотидные основания, в которых пуриновое или пиримидиновое основание заменено другими гетероциклами, например, 7-деазааденином, 7-деазагуанозином, 2-аминопиридином и 2-пиридоном. Другие нуклеотидные основания включают нуклеотидные основания, раскрытые в патенте США №3687808, нуклеотидные основания, раскрытые в The Concise Encyclopedia Of Polymer Science And Engineering, pages 858-859, Kroschwitz, J.I., ed. John Wiley & Sons, 1990, нуклеотидные основания, раскрытые Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и нуклеотидные основания, раскрытые Sanghvi, Y.S., Chapter 15, Antisense Research and Applications, pages 289-302, Crooke, S.T. and Lebleu, B. ed., CRC Press, 1993. Некоторые из этих нуклеотидных оснований особенно полезны для повышения аффинности связывания олигомерных соединений по изобретению. Они включают 5-замещенные пиримидины, 6-азапиримидины и N-2-, N-6- и O-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Показано, что замены 5-метилцитозином повышают устойчивость дуплекса нуклеиновых кислот на 0,6-1,2°С (Sanghvi, Y.S., Crooke, S.Т. and Lebleu, В., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp.276-278), и в настоящее время они являются предпочтительными заменами оснований, особенно в комбинации с 2’-O-метоксиэтиловыми модификациями сахаров.
Репрезентативные патенты США, в которых описано получение некоторых указанных выше модифицированных нуклеотидных оснований, а также других модифицированных нуклеотидных оснований, включают, без ограничения, указанный выше патент США №3687808, а также патенты США №№4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121; 5596091; 5614617; 5645985; 5830653; 5763588; 6005096; и 5681941; некоторые из которых принадлежат авторам данной заявки, и каждый из которых включен сюда посредством ссылки; и патент США №5750692, собственник которого является одним из авторов настоящей заявки, и который также включен сюда посредством ссылки.
Мотивы антисмысловых соединений
В определенном воплощении изобретения соединение содержит модифицированный олигонуклеотид содержащий: (а) промежуточный сегмент, состоящий из связанных дезоксинуклеозидов, предпочтительно состоящий из тринадцати связанных модифицированных дезоксинуклеозидов; (б) 5’-концевой сегмент, состоящий из связанных модифицированных нуклеозидов, предпочтительно, состоящий из двух связанных модифицированных нуклеозидов; и (в) 3’-концевой сегмент, состоящий из связанных модифицированных нуклеозидов, предпочтительно состоящий из пяти связанных нуклеозидов; где промежуточный сегмент расположен между 5’-концевым сегментом и 3’-концевым сегментом, где каждый модифицированный нуклеозид в каждом концевом сегменте содержит модифицированный сахар, предпочтительно, содержит 2’-O-метоксиэтиловый сахар и где каждая межнуклеозидная связь представляет собой фосфотиоатную связь.
Эти паттерны модифицированных нуклеотидов в антисмысловом соединении называют мотивом. Эти мотивы придают антисмысловым соединениям свойства, такие как усиление ингибирующей активности, повышение аффинности связывания с нуклеиновой кислотой-мишенью или повышение устойчивости к расщеплению нуклеазами in vivo.
В определенных воплощениях антисмысловые соединения, действующие на нуклеиновую кислоту CTGF, содержат химически модифицированные субъединицы, расположенные паттернами, или мотивами, для придания антисмысловым соединениям таких свойств, как усиленная ингибирующая активность, повышенная аффинность связывания с нуклеиновой кислотой-мишенью или устойчивость к расщеплению нуклеазами in vivo.
Химерные антисмысловые соединения обычно содержат по меньшей мере одну область, модифицированную для придания повышенной устойчивости к расщеплению нуклеазами, усиленного захвата клетками, повышенной аффинности связывания с нуклеиновой кислотой-мишенью и/или повышенной ингибирующей активности. Вторая область химерного антисмыслового соединения может возможно служить субстратом для клеточной эндонуклеазы РНКазы Н, расщепляющей РНК-цепь дуплекса РНК-ДНК.
Антисмысловые соединения, имеющие гэпмер-мотив, считают химерными антисмысловыми соединениями. В гэпмере внутренняя область, имеющая множество нуклеотидов, поддерживающая расщепление РНКазой Н, расположена между внешними областями, имеющими множество нуклеотидов, химически отличных от нуклеозидов внутренней области. В случае антисмыслового олигонуклеотида, имеющего гэпмер-мотив, промежуточный сегмент обычно служит субстратом для расщепления эндонуклеазой, в то время как концевые сегменты содержат модифицированные нуклеозиды. В предпочтительном воплощении области гэпмера отличаются типами сахарных группировок, составляющих каждую отдельную область. Типы сахарных группировок, используемые для различения областей гэпмера, могут в некоторых воплощениях включать β-D-рибонуклеозиды, β-D-дезоксирибонуклеозиды, 2’-модифицированные нуклеозиды (такие 2’-модифицированные нуклеозиды могут содержать, среди прочего, 2’-МОЕ и 2’-O-СН3) и модифицированные нуклеозиды с бициклическими сахарами (такие модифицированные нуклеозиды с бициклическими сахарами могут включать нуклеозиды, имеющие связывающую группу 4’-(СН2)n-O-2’, где n=1 или n=2). Предпочтительно, каждая отдельная область содержит одинаковые сахарные группировки. Мотив «концевой сегмент-промежуточный сегмент-концевой сегмент» часто обозначают «X-Y-Z», где «X» отражает длину 5’-концевой области, «Y» отражает длину промежуточной области и «Z» отражает длину 3’-концевой области. Любые из антисмысловых соединений, описанных здесь, могут иметь гэпмер-мотив. В некоторых воплощениях Х и Z одинаковы, в других воплощениях они различны. В предпочтительном воплощении Y представляет собой от 8 до 15 нуклеотидов. X, Y или Z могут представлять собой любое из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30 или более нуклеотидов. Таким образом, гэпмеры по настоящему изобретению включают, без ограничения, например, 2-13-5, 5-10-5, 4-8-4, 4-12-3, 4-12-4, 3-14-3, 2-16-2, 1-18-1, 3-10-3, 2-10-2, 1-10-1 или 2-8-2.
В некоторых воплощениях антисмысловое соединение имеет «вингмер»-мотив ("wingmer" motif), имеющий конфигурацию «концевой сегмент-промежуточный сегмент» или «промежуточный сегмент-концевой сегмент», то есть конфигурацию X-Y или Y-Z, как описано выше для конфигурации гэпмера. Таким образом, конфигурации вингмеров по настоящему изобретению включают, без ограничения, например, 5-10, 8-4, 4-12, 12-4, 3-14, 16-2, 18-1, 10-3, 2-10, 1-10 или 8-2.
В одном воплощении антисмысловые соединения, направленно действующие на нуклеиновую кислоту, имеют гэпмер-мотив 2-13-5.
В некоторых воплощениях антисмысловое соединение, направленно действующее на нуклеиновую кислоту CTGF, имеет мотив расширенного промежуточного сегмента. В других воплощениях антисмысловой олигонуклеотид, направленно действующий на нуклеиновую кислоту CTGF, имеет мотив расширенного промежуточного сегмента.
В одном воплощении антисмысловой олигонуклеотид с расширенным промежуточным сегментом, направленно действующий на нуклеиновую кислоту CTGF, имеет промежуточный сегмент из четырнадцати 2’-дезоксирибонуклеотидов, расположенный между концевыми сегментами из трех химически модифицированных нуклеозидов. В одном воплощении химическая модификация включает 2’-модификацию сахара. В другом воплощении химическая модификация включает 2’-МОЕ-модификацию сахара.
Антисмысловые соединения, имеющие гэпмер-мотив, считают «химерными» антисмысловыми соединениями или «химерами», содержащими две или более химически различные области, каждая из которых состоит из по меньшей мере одной мономерной единицы, то есть нуклеотида, в случае олигонуклеотидного соединения. Эти олигонуклеотиды обычно содержат по меньшей мере одну область, модифицированную для придания повышенной устойчивости к расщеплению нуклеазами, усиленного захвата клетками, повышенной аффинности связывания с нуклеиновой кислотой-мишенью и/или повышенной ингибирующей активности. Нет необходимости в том, чтобы все положения данного соединения были модифицированы одинаково, и, действительно, более одной из указанных выше модификаций может присутствовать в одном соединении или даже в одном нуклеозиде олигонуклеотида.
Дополнительная область олигонуклеотида может служить субстратом для ферментов, способных расщеплять гибриды РНК:ДНК или РНК:РНК. В качестве примера, РНКаза Н представляет собой клеточную эндонукеазу, которая расщепляет РНК-цепь дуплекса РНК:ДНК. Активация РНКазы Н, таким образом, приводит к расщеплению РНК-мишени, значительно повышая посредством этого эффективность ингибирования экспрессии гена олигонуклеотидом. В результате, при использовании химерных олигонуклеотидов сопоставимые результаты могут часто быть получены с использованием более коротких олигонуклеотидов, по сравнению с фосфоротиоатными дезоксиолигонуклеотидами, гибридизующимися с той же областью-мишенью. Расщепление РНК-мишени может быть определено обычным способом электрофореза в геле, и, при необходимости, связанными с ним методиками гибридизации нуклеиновых кислот, известными в данной области техники.
Химерные антисмысловые соединения по изобретению могут быть получены в форме сложных структур двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или миметиков олигонуклеотидов, как описано выше. Такие соединения также называют в данной области техники гибридами или гэпмерами. Репрезентативные патенты США, в которых описано получение таких гибридных структур, включают, без ограничения, патенты США №№5013830; 5149797; 5220007; 5256775; 5366878; 5403711; 5491133; 5565350; 5623065; 5652355; 5652356; и 5700922; некоторые из которых принадлежат авторам данной заявки, и каждый из которых полностью включен сюда посредством ссылки.
В случае антисмыслового олигонуклеотида, имеющего гэпмер-мотив, промежуточный сегмент обычно служит субстратом для расщепления эндонуклеазой, в то время как концевые сегменты содержат модифицированные нуклеозиды. В предпочтительном воплощении области гэпмера отличаются типами сахарных группировок, составляющих каждую отдельную область. Типы сахарных группировок, используемые для различения областей гэпмера, могут включать β-D-рибонуклеозиды, β-D-дезоксирибонуклеозиды, 2’-модифицированные нуклеозиды (такие 2’-модифицированные нуклеозиды могут содержать 2’-МОЕ) и модифицированные нуклеозиды с бициклическими сахарами.
Другая модификация олигонуклеотидов по изобретению включает химическое связывание с олигонуклеотидом одной/одного или более группировок или конъюгатов, усиливающих активность олигонуклеотида, его распределение в клетках или захват клетками. Соединения по изобретению могут содержать группы-конъюгаты, ковалентно связанные с такими функциональными группами, как первичные или вторичные гидроксильные группы. Группы-конъюгаты по изобретению включают интеркаляторы, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, полиэфиры, группы, улучшающие фармакодинамические свойства олигомеров, и группы, улучшающие фармакокинетические свойства олигомеров. Типичные группы-конъюгаты включают холестерины, липиды, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители. В контексте данного изобретения группы, улучшающие фармакодинамические свойства, включают группы, улучшающие захват олигомера, повышающие устойчивость олигомера к расщеплению и/или усиливающие последовательность-специфичную гибридизацию с РНК. В контексте данного изобретения группы, улучшающие фармакокинетические свойства, включают группы, улучшающие захват, распределение, метаболизм или выведение олигомера. Типичные группы-конъюгаты раскрыты в международной заявке на патент PCT/US 92/09196, поданной 23 октября 1992 г., содержание которой полностью включено сюда посредством ссылки. Группы-конъюгаты включают, без ограничения, липидные группировки, такие как холестериновая группировка (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холевую кислоту (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическую цепь, например, остатки додекандиола или ундецила (Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), фосфолипид, например, рацемический дигексадецилглицерин или рацемический 1,2-ди-О-гексадецилглицеро-3-Н-фосфонат триметиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), полиаминную или полиэтиленгликолевую цепь (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973) или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), пальмитиловую группировку (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237) или октадециламинную или гексиламинокарбонилоксихолестериновую группировку (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277, 923-937). Олигонуклеотиды по изобретению могут также быть конъюгированы с активными лекарственными веществами, например, аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)-пранопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трийодбензойной кислотой, флуфенамовой кислотой, фолиновой кислотой, бензотиадиазидом (benzothiadiazide), хлортиазидом, диазепином, индометацином, барбитуратом, цефалоспорином, сульфаниламидным лекарственным средством, противодиабетическим лекарственным средством, антибактериальным лекарственным средством или антибиотиком. Конъюгаты олигонуклеотид-лекарственное средство и их приготовление описаны в заявке на патент США №09/334130 (поданной 15 июня 1999 г.), полностью включенной сюда посредством ссылки.
Репрезентативные патенты США, в которых описано получение таких конъюгатов олигонуклеотидов включают, без ограничения, патенты США №№4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717; 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241; 5391723; 5416203; 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928; и 5688941; некоторые из которых принадлежат авторам данной заявки, и каждый из которых полностью включен сюда посредством ссылки.
В другом воплощении изобретения соединение содержит модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов.
В предпочтительном воплощении изобретения соединение содержит последовательность нуклеотидных оснований, изложенную в SEQ ID NO: 39, 40, 45, 52 и 166.
В одном воплощении изобретения композиция содержит модифицированный олигонуклеотид, содержащий связанные нуклеозиды, последовательность нуклеотидных оснований которого представляет собой последовательность, изложенную в одной из SEQ ID NO: 28, 30, 39, 40, 43, 44, 45, 50, 51, 52, 56, 78, 125 и 166, или его соль и фармацевтически приемлемый носитель или разбавитель. Примеры фармацевтически приемлемых солей хорошо известны специалистам в данной области техники.
В одном воплощении изобретения антисмысловое соединение комплементарно в некотором диапазоне нуклеотидов последовательности CTGF. В определенных воплощениях антисмысловое соединение комплементарно в диапазоне нуклеотидов 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147 или 2267-2301 SEQ ID NO: 9. В определенном воплощении антисмысловое соединение комплементарно в диапазоне нуклеотидов 2728-2797 SEQ ID NO: 10. Соединения, направленно действующие на эти диапазоны, демонстрируют по меньшей мере 50%-ное ингибирование (то есть SEQ ID NO: 15, 29, 31, 42, 46-49, 53, 72, 81, 82, 152-154, 164 и 165). Определенные сайты-мишени, перечисленные в Таблице 1, также демонстрируют по меньшей мере 50%-ное ингибирование (то есть SEQ ID NO: 12, 20, 33, 34, 76, 107, 129, 132, 134, 136 и 146). В определенных воплощениях антисмысловое соединение комплементарно в диапазоне нуклеотидов 553-611, 1394-1423, 1469-1508, 1559-1605, 1659-1689 или 2100-2129 SEQ ID NO: 9 и 2623-2647 SEQ ID NO: 10. Соединения, направленно действующие на эти диапазоны, демонстрируют по меньшей мере 60%-ное ингибирование (то есть SEQ ID NO: 27, 28, 38, 39, 40, 43, 44, 45, 50, 51, 52, 54, 55, 56, 77, 78, 79, 138 и 139). Определенные дополнительные сайты-мишени, перечисленные в Таблице 1, также демонстрируют по меньшей мере 60%-ное ингибирование (то есть SEQ ID NO: 24, 30, 61, 63, 67, 69, 73, 86, 125, 128 и 161). В определенных воплощениях антисмысловое соединение комплементарно в диапазоне нуклеотидов 1399-1423. Соединения, направленно действующие на эти диапазоны, демонстрируют по меньшей мере 70%-ное ингибирование (то есть SEQ ID NO: 39 и 40). Определенные сайты-мишени, перечисленные в Таблице 1, также демонстрируют по меньшей мере 70%-ное ингибирование (то есть SEQ ID NO: 28, 30, 44, 45, 51, 56, 78, 128 и 138). Один сайт-мишень, приведенный в Таблице 1, также демонстрирует по меньшей мере 80%-ное ингибирование (то есть SEQ ID NO: 44). В определенных воплощениях указанного процента ингибирования удается достичь при введении антисмыслового соединения в клетки HuVec в концентрации 50 нМ. Более подробно см. Пример 8, приведенный ниже.
В одном воплощении композиции модифицированный олигонуклеотид представляет собой одноцепочечный или двухцепочечный олигонуклеотид. Другое воплощение изобретения включает модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов.
В другом воплощении изобретения предложен способ ингибирования экспрессии фактора роста соединительной ткани в клетке или ткани, включающий приведение клетки или ткани в контакт с соединением, представляющим интерес, в условиях, приводящих к ингибированию экспрессии фактора роста соединительной ткани.
Антисмысловые олигонуклеотиды можно сочетать с фармацевтически приемлемыми активными и/или инертными веществами для изготовления фармацевтических композиций. Композиции и способы изготовления фармацевтических композиций зависят от ряда критериев, включая, без ограничения, путь введения, степень выраженности заболевания и вводимую дозу.
Антисмысловое соединение, действующее на нуклеиновую кислоту, может быть использовано в фармацевтических композициях сочетанием антисмыслового соединения с подходящим фармацевтически приемлемым разбавителем или носителем. Фармацевтически приемлемый разбавитель включает фосфатно-солевой буферный раствор (PBS). PBS является разбавителем, подходящим для применения в композициях для парентеральной доставки. Соответственно, в одном воплощении в способах, описанных здесь, используют фармацевтическую композицию, содержащую антисмысловое соединение, направленно действующее на нуклеиновую кислоту, и фармацевтически приемлемый разбавитель. В одном воплощении фармацевтически приемлемый разбавитель представляет собой PBS. В другом воплощении фармацевтически приемлемый разбавитель представляет собой физиологический раствор фармацевтической степени чистоты или PBS фармацевтической степени чистоты. В других воплощениях антисмысловое соединение представляет собой антисмысловой олигонуклеотид.
Фармацевтические композиции, содержащие антисмысловые соединения, включают любые фармацевтически приемлемые соли, эфиры, или соли таких эфиров, или любой другой олигонуклеотид, который при введении животному, включая человека, способен обеспечивать (непосредственно или косвенно) его биологически активный метаболит или остаток. Соответственно, например, данное описание также включает фармацевтически приемлемые соли антисмысловых соединений, пролекарства, фармацевтически приемлемые соли таких пролекарств и другие биоэквиваленты. Подходящие фармацевтически приемлемые соли включают, без ограничения, соли натрия и калия.
Пролекарство может включать введение дополнительных нуклеозидов в один или оба конца антисмыслового соединения, расщепляемые в организме эндогенными нуклеазами с образованием активного антисмыслового соединения. В частности, варианты-пролекарства олигонуклеотидов по изобретению получают в форме SATE [(8-ацетил-2-тиоэтил)фосфат]-производных способами, раскрытыми в WO 93/24510, Gosselin et al., опубликованной 9 декабря 1993 г., или в WO 94/26764 и патенте США №5770713, Imbach et al.
Термин «фармацевтически приемлемые соли» относится к физиологически и фармацевтически приемлемым солям соединений по изобретению, то есть солям, сохраняющим желаемую биологическую активность исходного соединения без нежелательных токсикологических эффектов.
Фармацевтически приемлемые соли присоединения оснований образованы металлами или аминами, такими как щелочные или щелочноземельные металлы или органические амины. Примерами металлов, используемых в качестве катионов, являются натрий, калий, магний, кальций и тому подобное. Примерами подходящих аминов являются N,N’-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин и прокаин (см., например, Berge et al., "Pharmaceutical Salts," J. of Pharma Sci., 1977, 66, 1-19). Соли присоединения оснований указанных кислотных соединений получают приведением формы свободной кислоты в контакт с достаточным количеством желаемого основания с получением соли обычным способом. Форма свободной кислоты может быть восстановлена приведением солевой формы в контакт с кислотой и выделением свободной кислоты обычным способом. Формы свободных кислот несколько отличаются от их соответствующих солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях, но в остальном в целях настоящего изобретения соли эквивалентны их соответствующим свободным кислотам. При использовании здесь «фармацевтическая соль присоединения» включает фармацевтически приемлемую соль кислотной формы одного из компонентов композиций по изобретению. Они включают органические или неорганические кислые соли аминов. Предпочтительными кислыми солями являются гидрохлориды, ацетаты, салицилаты, нитраты и фосфаты. Другие подходящие фармацевтически приемлемые соли хорошо известны специалистам в данной области техники и включают основные соли множества неорганических и органических кислот, такие как, например, соли неорганических кислот, таких как, например, соляная кислота, бромоводородная кислота, серная кислота или фосфорная кислота; соли органических карбоновых, сульфоновых, сульфо- или фосфокислот или N-замещенных сульфаминовых кислот, например, уксусной кислоты, пропионовой кислоты, гликолевой кислоты, янтарной кислоты, малеиновой кислоты, гидроксималеиновой кислоты, метилмалеиновой кислоты, фумаровой кислоты, яблочной кислоты, винной кислоты, молочной кислоты, щавелевой кислоты, глюконовой кислоты, глюкаровой кислоты, глюкуроновой кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, салициловой кислоты, 4-аминосалициловой кислоты, 2-феноксибензойной кислоты, 2-ацетоксибензойной кислоты, эмбоновой кислоты, никотиновой кислоты или изоникотиновой кислоты; и соли аминокислот, таких как 20 альфа-аминокислот, вовлеченные в синтез белков в природе, например, глутаминовой кислоты или аспарагиновой кислоты; и также соли фенилуксусной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, 2-гидроксиэтансульфоновой кислоты, этан-1,2-дисульфоновой кислоты, бензолсульфоновой кислоты, 4-метилбензолсульфоновой кислоты, нафталин-2-сульфоновой кислоты, нафталин-1,5-дисульфоновой кислоты, 2- или 3-фосфоглицерата, глюкозо-6-фосфата, N-циклогексилсульфаминовой кислоты (с образованием цикламатов); или соли других кислотных органических соединений, таких как аскорбиновая кислота. Фармацевтически приемлемые соли соединений могут также быть получены с использованием фармацевтически приемлемого катиона. Подходящие фармацевтически приемлемые катионы хорошо известны специалистам в данной области техники и включают щелочные, щелочно-земельные, аммониевые и четвертичные аммониевые катионы. Также возможны карбонаты или гидрокарбонаты.
Для олигонуклеотидов предпочтительные примеры фармацевтически приемлемых солей включают, без ограничения: (а) соли, образованные катионами, такими как натрий, калий, аммоний, магний, кальций, и полиаминами, такими как спермин и спермидин, и так далее; (б) соли присоединения кислот, образованные неорганическими кислотами, например, соляной кислотой, бромоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и тому подобными; (в) соли, образованные органическими кислотами, такими как, например, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, глюконовая кислота, лимонная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, пальмитиновая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, нафталиндисульфоновая кислота, полигалактуроновая кислота и тому подобными; (г) соли, образованные элементарными анионами, такими как хлор, бром и йод.
В определенном воплощении изобретения фармацевтически приемлемый носитель или разбавитель является ингредиентом композиции, не обладающим фармакологической активностью, но фармацевтически необходимым или желательным в качестве растворителя, суспендирующего агента или любого другого фармацевтически инертного наполнителя для доставки одной или более нуклеиновых кислот человеку или животному, не являющемуся человеком. Фармацевтические носители хорошо известны специалистам в данной области техники.
Носители
В состав определенных композиций по настоящему изобретению также входят соединения-носители. При использовании здесь «соединение-носитель» или «носитель» может относиться к нуклеиновой кислоте или ее аналогу, являющимся инертными (то есть, они не обладают биологической активностью сами по себе), но распознаваемым как нуклеиновые кислоты при in vivo-процессах, снижающих биодоступность нуклеиновой кислоты, обладающей биологической активностью, например, разрушением биологически активной нуклеиновой кислоты или стимуляцией ее удаления из циркуляции. Одновременное введение нуклеиновой кислоты и соединения-носителя, обычно при избытке соединения-носителя, может приводить к существенному уменьшению количества нуклеиновой кислоты, задерживаемого в печени, почках или других внециркуляторных резервуарах, предположительно, вследствие конкуренции между соединением-носителем и нуклеиновой кислотой за общий рецептор. Например, задержку частично фосфоротиоатного олигонуклеотида в ткани печени можно уменьшить его совместным введением с полиинозиновой кислотой, сульфатом декстрана, полицитидиновой кислотой или 4-ацетамидо-4’-изотиоцианостильбен-2,2’-дисульфоновой кислотой (Miyao et al., Antisense Res. Dev., 1995, 5, 115-121; Takakura et al., Antisense & Nucl. Acid Drug Dev., 1996, 6, 177-183).
Эксципиенты
В отличие от соединения-носителя «фармацевтический носитель» или «эксципиент» представляет собой фармацевтически приемлемый растворитель, суспендирующий агент или любой другой фармакологически инертный наполнитель для доставки одной или более нуклеиновых кислот животному. Эксципиент может быть жидким или твердым, и его выбирают с учетом планируемого способа введения, для обеспечения желаемого объема, консистенции и так далее при сочетании с нуклеиновой кислотой и другими компонентами заданной фармацевтической композиции. Типичные фармацевтические носители включают, без ограничения, связывающие агенты (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон, гидроксипропилметилцеллюлозу и так далее); наполнители (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты или гидрофосфат кальция); смазывающие агенты (например, стеарат магния, тальк, диоксид кремния, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрогенизированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и так далее); разрыхлители (например, крахмал, крахмалгликолят натрия и так далее); и смачивающие агенты (например, лаурилсульфат натрия и так далее).
Фармацевтически приемлемый органический или неорганический эксципиент, подходящий для непарентерального введения, не взаимодействующий нежелательным образом с нуклеиновыми кислотами, также может быть использован для изготовления композиций по настоящему изобретению. Подходящие фармацевтически приемлемые носители включают, без ограничения, воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Композиции для местного введения нуклеиновых кислот могут содержать стерильные и нестерильные водные растворы, неводные растворы в обычных растворителях, таких как спирты, или растворы нуклеиновых кислот в жидких или твердых масляных основаниях. Растворы могут также содержать буферы, разбавители и другие подходящие добавки. Могут быть использованы фармацевтически приемлемые органические или неорганические эксципиенты, подходящие для непарентерального введения, не взаимодействующие нежелательным образом с нуклеиновыми кислотами.
В одном воплощении изобретения композиция содержит модифицированный олигонуклеотид, содержит одноцепочечный или двухцепочечный олигонуклеотид, и где модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
Другое воплощение изобретения включает способ ингибирования экспрессии фактора роста соединительной ткани в клетке или ткани, включающий приведение клетки или ткани в контакт с любым из указанных выше соединений в условиях, приводящих к ингибированию экспрессии фактора роста соединительной ткани.
Определенное воплощение изобретения включает способ лечения животного, имеющего заболевание или состояние, связанное с экспрессией фактора роста соединительной ткани, включающий введение животному количества описанного выше соединения, эффективного для ингибирования экспрессии фактора роста соединительной ткани и, посредством этого, лечения животного.
При практическом применении способа по данному изобретению животное включает человека, а также животного, не являющегося человеком, предпочтительно, человека.
Настоящее изобретение также включает фармацевтические композиции, содержащие антисмысловые соединения по изобретению. Фармацевтические композиции по настоящему изобретению можно вводить несколькими способами, в зависимости от желаемого лечения, местного или системного, и в зависимости от области, подлежащей лечению. Введение может представлять собой внутрикожное введение, включая введение продольной внутрикожной инъекцией с использованием иглы для инъекций, подкожное, местное (включая глазное введение, введение на слизистые оболочки, включая вагинальную и ректальную доставку), легочное, например, ингаляцией или инсуффляцией порошков или аэрозолей, включая введение небулайзером; интратрахеальное, интраназальное, эпидермальное и чрескожное, пероральное или парентеральное. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию; или интракраниальное, например, интратекальное или интравентрикулярное введение.
Фармацевтические композиции для местного введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Обычные фармацевтические носители, водные, порошковые или масляные основания, загустители и тому подобное могут быть необходимы или желательны. Презервативы, перчатки с покрытием и тому подобное могут также быть полезны. Предпочтительные композиции для внутрикожной и местной доставки включают композиции, в которых олигонуклеотиды по изобретению смешаны с агентом для местной доставки, таким как липиды, липосомы, жирные кислоты, эфиры жирных кислот, стероиды, хелатирующие агенты и поверхностно-активные вещества. Предпочтительные липиды и липосомы включают нейтральные (например, диолеоилфосфатидилэтаноламин (DOPE), димиристоилфосфатидилхолин (DMPC), дистеароилфосфатидилхолин), отрицательные (например, димиристоилфосфатидилглицерин (DMPG)) и катионные (например, диолеоилтетраметиламинопропил (DOTAP) и диолеоилфосфатидилэтаноламин (DOTMA)). Олигонуклеотиды по изобретению могут быть инкапсулированы в липосомы или могут образовывать комплексы с ними, в частности с катионными липосомами. Альтернативно, олигонуклеотиды могут быть представлены в комплексе с липидами, в частности с катионными липидами. Предпочтительные жирные кислоты и эфиры включают, без ограничения, арахидоновую кислоту, олеиновую кислоту, эйкозановую кислоту, лауриновую кислоту, каприловую кислоту, каприновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин, глицерил-1-монокапрат, 1-додецилазациклопентан-2-он, ацилкарнитин, ацилхолин или C1-10 алкиловый эфир (например, изопропилмиристат (IPM)), моноглицерид, диглицерид или их фармацевтически приемлемые соли. Композиции для местного введения подробно описаны в заявке на патент США №09/315298, поданной 20 мая 1999 г., полностью включенной сюда посредством ссылки.
Фармацевтические композиции по настоящему изобретению включают, без ограничения, растворы, эмульсии и композиции, содержащие липосомы. Эти композиции могут быть изготовлены из множества компонентов, включая, без ограничения, предварительно полученные жидкости, самоэмульгирующиеся твердые вещества и самоэмульгирующиеся полутвердые вещества.
Фармацевтические композиции по настоящему изобретению, которые могут подходящим образом быть представлены в стандартной лекарственной форме, могут быть изготовлены по обычным методикам, хорошо известным в фармацевтической промышленности. Такие методики включают стадию смешивания активных ингредиентов с фармацевтическим(и) носителем(ями) или эксципиентом(ами). Обычно композиции изготавливают единообразно, тщательно смешивая активные ингредиенты с жидкими носителями или мелкоизмельченными твердыми носителями или и с тем, и с другим, и затем, по необходимости, придавая форму продукту.
Композиции по настоящему изобретению могут быть включены в любую из многих возможных лекарственных форм, таких как, без ограничения, шприцы, предварительно заполненные шприцы, таблетки, капсулы, желатиновые капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции по настоящему изобретению могут также быть изготовлены в форме суспензий в водных, неводных или смешанных средах. Водные суспензии могут дополнительно содержать вещества, повышающие вязкость суспензии, включая, например, карбоксиметилцеллюлозу натрия, сорбит и/или декстран. Суспензия может также содержать стабилизаторы.
В одном воплощении настоящего изобретения фармацевтические композиции могут быть изготовлены и применены в форме пен. Фармацевтические пены включают такие композиции, как, без ограничения, эмульсии, микроэмульсии, кремы, желе и липосомы. Будучи в целом близкими по своим свойствам, эти композиции отличаются друг от друга компонентами и консистенцией конечного продукта. Изготовление таких композиций в целом известно специалисту в области фармацевтики и изготовления композиций и может быть применено для изготовления композиций по настоящему изобретению.
Липосомы
Помимо микроэмульсий существует множество организованных структур из поверхностно-активных веществ, которые были изучены и применены для изготовления композиций лекарственных средств. Эти структуры включают монослои, мицеллы, бислои и везикулы. Везикулы, такие как липосомы, привлекли большой интерес, благодаря их специфичности и продолжительности действия, которую они обеспечивают с точки зрения доставки лекарственных средств. При использовании в настоящем изобретении термин «липосома» обозначает везикулу, состоящую из амфифильных липидов, расположенных сферическим бислоем или бислоями.
Липосомы представляют собой однослойные или многослойные везикулы, имеющие мембрану, образованную липофильным веществом, и водное внутреннее пространство. Водная часть содержит композицию для доставки. Преимущество катионных липосом состоит в их способности к слиянию с оболочкой клетки. Некатионные липосомы, хотя и не способны к эффективному слиянию с оболочкой клетки, подвержены захвату макрофагами in vivo.
Для прохождения через интактную кожу млекопитающего липидные везикулы должны пройти через ряд мелких пор, диаметр каждой из которых составляет менее 50 нм, под влиянием подходящего чрескожного градиента. Поэтому желательно использовать липосому, способную к сильной деформации и прохождению через такие мелкие поры.
Другие преимущества липосом включают следующее: липосомы, полученные из нейтральных фосфолипидов являются биосовместимыми и биодеградируемыми; липосомы могут содержать широкий спектр лекарственных средств, растворимых в воде и липидах; липосомы могут защищать инкапсулированные в их внутренних компартментах лекарственные средства от метаболизма и деградации (Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p.245). Важными факторами при изготовлении липосомных композиций являются поверхностный заряд липидов, размер везикул и водный объем липосом.
Липосомы полезны для переноса и доставки активных ингредиентов к месту действия. Ввиду того, что мембрана липосом структурно сходна с биологическими мембранами, при контакте липосом с тканями происходит слияние липосом с клеточными мембранами. При слиянии липосомы с клеткой содержимое липосомы высвобождается в клетку, где может действовать активный агент.
Липосомные композиции являются предметом всесторонних исследований в качестве способа доставки многих лекарственных средств. Все больше данных о том, что для внутрикожного и местного введения липосомы обладают рядом преимуществ по сравнению с другими композициями. Такие преимущества включают ослабление побочных эффектов, связанных с сильным системным всасыванием вводимого лекарственного средства, усилением накопления вводимого лекарственного средства в желаемом месте и возможность введения широкого спектра лекарственных средств, как гидрофильных, так и гидрофобных, в кожу.
В нескольких сообщениях подробно описана возможность использования липосом для доставки агентов, включая ДНК большой молекулярной массы, в кожу. Соединения, включая анальгетики, антитела, гормоны и ДНК большой молекулярной массы, вводили в кожу. Большинство введений привели к накоплению соединений в верхних слоях эпидермиса.
Выделяют два больших класса липосом. Катионные липосомы представляют собой положительно заряженные липосомы, взаимодействующие с отрицательно заряженными молекулами ДНК с образованием стабильного комплекса. Положительно заряженный комплекс ДНК/липосома связывается с отрицательно заряженной клеточной поверхностью с его последующим поглощением эндосомой. Ввиду кислого рН внутри эндосомы, происходит разрыв липосом с высвобождением их содержимого в цитоплазму клетки (Wang et al., Biochem. Biophys. Res. Commun., 1987, 147, 980-985).
рН-чувствительные или отрицательно заряженные липосомы захватывают ДНК вместо образования комплекса с ней. Поскольку ДНК и липид заряжены одинаково, происходит отталкивание, а не образование комплекса. Тем не менее, происходит захват части ДНК в водном внутреннем пространстве этих липосом. рН-чувствительные липосомы были использованы для доставки ДНК, кодирующей ген тимидинкиназы, в монослои клеток в культуре. В клетках-мишенях была определена экспрессия экзогенного гена (Zhou et al., Journal of Controlled Release, 1992, 19, 269-274).
Липосомные композиции одного важного типа содержат фосфолипиды, отличные от фосфатидилхолина природного происхождения. Нейтральные липосомные композиции, например, могут быть образованы димиристоилфосфатидилхолином (DMPC) или дипальмитоилфосфатидилхолином (DPPC). Анионные липосомные композиции обычно образованы димиристоилфосфатидилглицерином, в то время как анионные фузогенные липосомы образованы главным образом диолеоилфосфатидилэтаноламином (DOPE). Другой тип липосомной композиции образован фосфатидилхолином (PC), таким как, например, PC сои и PC яйца. Другой тип образован смесями фосфолипида, и/или фосфатидилхолина, и/или холестерина.
В нескольких исследованиях была проведена оценка местной доставки липосомных композиций лекарственных средств в кожу. Нанесение липосом, содержащих интерферон, на кожу морских свинок приводило к снижению кожных герпетических язв, в то время как введение интерферона другими способами (например, в форме раствора или в форме эмульсии) было неэффективным (Weiner et al., Journal of Drug Targeting, 1992, 2, 405-410). Кроме того, в дополнительном исследовании была проведена оценка эффективности интерферона, вводимого как часть липосомной композиции, в сравнении с введением интерферона с использованием водной системы, и был сделан вывод о превосходстве липосомной композиции над введением с использованием водной системы (du Plessis et al., Antiviral Research, 1992, 18, 259-265).
Также были проведены исследования неионных липосомных систем для определения их применимости в доставке лекарственных средств в кожу, в частности систем, содержащих неионное поверхностно-активное вещество и холестерин. Неионные липосомные композиции, содержащие Novasome™ I (глицерилдилаурат/холестерин/полиоксиэтилен-10-стеариловый эфир) и Novasome™ II (глицерилдистеарат/холестерин/полиоксиэтилен-10-стеариловый эфир), использовали для доставки циклоспорина-А в дерму мышиной кожи. Результаты показали, что такие неионные липосомные системы были эффективны в усилении отложения циклоспорина-А в различных слоях кожи (Hu et al. S.T.P.Pharma. Sci., 1994, 4, 6, 466).
Липосомы также включают «стерически стабилизированные» липосомы; при использовании здесь данный термин относится к липосомам, содержащим один или более специальных липидов, которые, при включении в липосомы, приводят к увеличению времени жизни в кровотоке, по сравнению с липосомами без таких специальных липидов. Примерами стерически стабилизированных липосом являются липосомы, в которых часть везикулообразующей липидной фракции липосомы (а) содержит один или более гликолипидов, таких как моносиалоганглиозид GM1 или (б) дериватизирована одним или более гидрофильными полимерами, такими как полиэтиленгликолевая (PEG) группировка. Не желая быть связанными какой-либо конкретной теорией, в данной области техники полагают, что, по меньшей мере для стерически стабилизированных липосом, содержащих ганглиозиды, сфингомиелин или PEG-дериватизированные липиды, повышенное время полужизни в кровотоке этих стерически стабилизированных липосом из циркуляции обусловлено ослаблением их захвата клетками ретикулоэндотелиальной системы (RES) (Allen et al., FEBS Letters, 1987, 223, 42; Wu et al., Cancer Research, 1993, 53, 3765).
Различные липосомы, содержащие один или более гликолипидов, известны в данной области техники. Papahadjopoulos et al. (Ann. N.Y. Acad. Sci., 1987, 507, 64) сообщили о способности моносиалоганглиозида GM1, сульфата галактоцереброзида и фосфатидилинозитола увеличивать время полужизни липосом в крови. Эти данные были интерпретированы Gabizon et al. (Proc. Natl. Acad. Sci. U.S.A., 1988, 85, 6949). В патенте США №4837028 и WO 88/04924, автором которых являются Allen et al., раскрыты липосомы, содержащие (1) сфингомиелин и (2) ганглиозид GM1 или сульфатный эфир галактоцереброзида. В патенте США №5543152 (Webb et al.) раскрыты липосомы, содержащие сфингомиелин. Липосомы, содержащие 1,2-sn-димиристоилфосфатидилхолин раскрыты в WO 97/13499 (Lim et al.).
В данной области техники известно много липосом, содержащих липиды, дериватизированные одним или более гидрофильными полимерами, и способы их получения. Sunamoto et al. (Bull. Chem. Soc. Jpn., 1980, 53, 2778) описали липосомы, содержащие неионный детергент, 2C12 15G, содержащий PEG-группировку. Ilium et al. (FEBS Lett., 1984, 167, 79) отметили, что гидрофильное покрытие частиц полистирола полимерными гликолями приводит к существенному увеличению периода полужизни в крови. Синтетические фосфолипиды, модифицированные присоединением карбоксильных групп полиалкиленгликолей (например, PEG), описаны Sears (патенты США №№4426330 и 4534899). Klibanov et al. (FEBS Lett., 1990, 268, 235) описали эксперименты, демонстрирующие, что липосомы, содержащие фосфатидилэтаноламин (РЕ), дериватизированный PEG или стеаратом PEG, имеют более длительное время полужизни в кровотоке. Blume et al. (Biochimica et Biophysica Acta, 1990, 1029, 91) распространили такие наблюдения на другие PEG-дериватизированные фосфолипиды, например, DSPE-PEG, образованный комбинацией дистеароилфосфатидилэтаноламина (DSPE) и PEG. Липосомы, имеющие ковалентно связанные PEG-группировки на их наружной поверхности, описаны в европейском патенте № ЕР 0445131 В1 и WO 90/04384, Fisher. Липосомные композиции, содержащие 1-20 моль-процентов PEG-дериватизированного РЕ, и способы их применения описаны Woodle et al. (патенты США №№5013556 и 5356633) и Martin et al. (патент США №5213804 и европейском патенте № ЕР 0496813 В1). Липосомы, содержащие ряд других липидно-полимерных конъюгатов, раскрыты в WO 91/05545 и патенте США №5225212 (авторами которых являются Martin et al.) и в WO 94/20073 (Zalipsky et al.). Липосомы, содержащие PEG-модифицированные церамидные липиды, описаны в WO 96/10391 (Choi et al.). В патентах США №№5540935 (Miyazaki et al.) и 5556948 (Tagawa et al.) описаны PEG-содержащие липосомы, которые могут быть дополнительно дериватизированы функциональными группировками на их поверхностях.
В данной области техники известно ограниченное число липосом, содержащих нуклеиновые кислоты. В WO 96/40062, Thierry et al., раскрыты способы инкапсуляции нуклеиновых кислот большой молекулярной массы в липосомы. В патенте США №5264221, Tagawa et al., раскрыты липосомы, связанные с белками, и заявлено, что содержимое таких липосом может содержать антисмысловую РНК. В патенте США №5665710, Rahman et al., описаны определенные способы инкапсуляции олигодезоксинуклеотидов в липосомы. В WO 97/04787, Love et al., раскрыты липосомы, содержащие антисмысловые олигонуклеотиды, направленно действующие на ген raf.
Трансферсомы являются еще одним типом липосом и представляют собой липидные агрегаты, которые могут быть привлекательными кандидатами на их использование в качестве везикул для доставки лекарственных средств. Трансферсомы можно описать как липидные капли, способные к настолько сильной деформации, что они легко проникают через поры, размеры которых меньше капли. Трансферсомы адаптируются к среде, в которой их используют, например, они самооптимизируемы (адаптируются к форме пор в коже), самовосстанавливаемы, часто достигают своих мишеней без фрагментации и часто являются самозахватывающими. Для получения трансферсом можно добавлять поверхностно-активные агенты, обычно поверхностно-активные вещества, в стандартную липосомную композицию. Трансферсомы использовали для доставки сывороточного альбумина в кожу. Было показано, что эффективность опосредованной трансферсомами доставки сывороточного альбумина эффективна так же, как подкожная инъекция раствора, содержащего сывороточный альбумин.
Поверхностно-активные вещества широко применяют в таких композициях, как эмульсии (включая микроэмульсии) и липосомы. Наиболее распространенным способом классификации и ранжирования свойств многих различных типов поверхностно-активных веществ, как природных, так и синтетических, является применение гидрофильно-липофильного баланса (HLB). Наиболее применимый способ классификации различных поверхностно-активных веществ, используемых в композициях, основан на свойствах гидрофильной группы (также известной как «головка») (Rieger, in Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p.285).
Если молекула поверхностно-активного вещества не ионизирована, его классифицируют как неионное поверхностно-активное вещество. Неионные поверхностно-активные вещества широко применяют в фармацевтических и косметических продуктах, и их можно использовать в широком диапазоне значений рН. Обычно их HLB-значения варьируют от 2 до приблизительно 18 в зависимости от их структуры. Неионные поверхностно-активные вещества включают неионные эфиры, такие как эфиры этиленгликоля, эфиры пропиленгликоля, эфиры глицерина, эфиры полиглицерина, эфиры сорбита, эфиры сахарозы и этоксилированные эфиры. В данный класс также включены неионные алканоламиды и эфиры, такие как этоксилаты жирных кислот, пропоксилированные спирты и этоксилированные/пропоксилированные блоксополимеры. Полиоксиэтиленовые поверхностно-активные вещества являются наиболее распространенными представителями класса неионных поверхностно-активных веществ.
Если молекула поверхностно-активного вещества несет отрицательный заряд при ее растворении или диспергировании в воде, поверхностно-активное вещество классифицируют как анионное. Анионные поверхностно-активные вещества включают карбоксилаты, такие как мыла, ациллактилаты, ациламиды аминокислот, эфиры серной кислоты, такие как алкилсульфаты и этоксилированные алкилсульфаты, сульфонаты, такие как алкилбензолсульфонаты, ацилизотионаты, ацилтаураты, сульфосукцинаты и фосфаты. Наиболее значимыми представителями класса анионных поверхностно-активных веществ являются алкилсульфаты и мыла.
Если молекула поверхностно-активного вещества несет положительный заряд при ее растворении или диспергировании в воде, поверхностно-активное вещество классифицируют как катионное. Катионные поверхностно-активные вещества включают четвертичные аммониевые соли и этоксилированные амины. Четвертичные аммониевые соли являются наиболее применимыми представителями данного класса.
Если молекула поверхностно-активного вещества может нести либо положительный, либо отрицательный заряд, поверхностно-активное вещество классифицируют как амфотерное. Амфотерные поверхностно-активные вещества включают производные акриловой кислоты, замещенные алкиламиды, N-алкилбетаины и фосфатиды.
Опубликован обзор применения поверхностно-активных веществ в готовых лекарственных формах, композициях и в эмульсиях (Rieger, in Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p.285).
Усилители проникновения
В одном воплощении в настоящем изобретении использованы различные усилители проникновения для обеспечения эффективной доставки нуклеиновых кислот, в частности олигонуклеотидов, в кожу животных. Большинство лекарственных средств присутствуют в растворе как в ионизированной, так и в неионизированной формах. Тем не менее, обычно только растворимые в липидах или липофильные лекарственные средства легко проникают через клеточные мембраны. Было обнаружено, что даже нелипофильные лекарственные средства могут проникать через клеточные мембраны, если мембрана, через которую проникают лекарственные средства, обработана усилителем проникновения. В дополнение к усилению диффузии нелипофильных лекарственных средств через клеточные мембраны, усилители проникновения могут также повышать проникающую способность липофильных лекарственных средств.
Усилители проникновения можно классифицировать как принадлежащие одной из пяти обширных групп, то есть поверхностно-активным веществам, жирным кислотам, солям желчных кислот, хелатирующим агентам и нехелатирующим поверхностно-неактивным веществам (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92). Каждый из указанных выше классов усилителей проникновения описан ниже более подробно.
Поверхностно-активные вещества. В связи с настоящим изобретением поверхностно-активные вещества (или «поверхностно-активные агенты») представляют собой химические вещества, которые, при растворении в водном растворе, уменьшают поверхностное натяжение раствора или межфазное натяжение между водным раствором и другой жидкостью, приводя к усилению всасывания олигонуклеотидов через слизистую оболочку. В дополнение к солям желчных кислот и жирным кислотам, эти усилители проникновения включают, например, лаурилсульфат натрия, полиоксиэтилен-9-лауриловый эфир и полиоксиэтилен-20-цетиловый эфир (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92); и эмульсии перфторсоединений, такие как FC-43 (Takahashi et al., J. Pharm. Pharmacol., 1988, 40, 252).
Жирные кислоты. Различные жирные кислоты и их производные, действующие как усилители проникновения, включают, например, олеиновую кислоту, лауриловую кислоту, каприновую кислоту (н-декановую кислоту), миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин (рацемический 1-моноолеилглицерин), дилаурин, каприловую кислоту, арахидоновую кислоту, глицерин-1-монокапрат, 1-додецилазациклопентан-2-он, ацилкарнитины, ацилхолины, их C1-10алкиловые эфиры (например, метил, изопропил и трет-бутил) и их моно- и диглицериды (например, олеат, лаурат, капрат, миристат, пальмитат, стеарат, линолеат и так далее) (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; EI Hariri et al., J. Pharm. Pharmacol., 1992, 44, 651-654).
Соли желчных кислот. Физиологическая функция желчи состоит в усилении диспергирования и всасывания липидов и жирорастворимых витаминов (Brunton, Chapter 38 in: Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 9th Ed., Hardman et al. Eds., McGraw-Hill, New York, 1996, pp.934-935). Различные природные соли желчных кислот и их синтетические производные действуют как усилители проникновения. Таким образом, термин «соли желчных кислот» включает любой из природных компонентов желчных кислот, а также любое из их синтетических производных. Соли желчных кислот по изобретению включают, например, холевую кислоту (или ее фармацевтически приемлемую натриевую соль, холат натрия), дегидрохолевую кислоту (дегидрохолат натрия), дезоксихолевую кислоту (дезоксихолат натрия), глюкохолевую кислоту (глюкохолат натрия), гликохолевую кислоту (гликохолат натрия), гликодезоксихолевую кислоту (гликодезоксихолат натрия), таурохолевую кислоту (таурохолат натрия), тауродезоксихолевую кислоту (тауродезоксихолат натрия), хенодезоксихолевую кислоту (хенодезоксихолат натрия), урсодезоксихолевую кислоту (UDCA), тауро-24,25-дигидрофузидат натрия (STDHF), гликодигидрофузидат натрия и полиоксиэтилен-9-лауриловый эфир (РОЕ) (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Swinyard, Chapter 39 In: Remington’s Pharmaceutical Sciences, 18th Ed., Gennaro, ed., Mack Publishing Co., Easton, Pa., 1990, pages 782-783; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Yamamoto et al., J. Pharm. Exp. Ther., 1992, 263, 25; Yamashita et al., J. Pharm. Sci., 1990, 79, 579-583).
Хелатирующие агенты. При использовании в связи с настоящим изобретением хелатирующие агенты могут быть определены как соединения, удаляющие ионы металлов из раствора, образуя с ними комплексы, приводя к усилению всасывания олигонуклеотидов через слизистую оболочку. Относительно их применения в качестве усилителей проникновения в настоящем изобретении хелатирующие агенты имеют дополнительное преимущество ингибирования ДНКаз, поскольку для каталитической активности большинства описанных ДНК-нуклеаз необходим ион двухвалентного металла, и поэтому хелатирующие агенты ингибируют ее (Jarrett, J. Chromatogr., 1993, 618, 315-339). Хелатирующие агенты по изобретению включают, без ограничения, двунатриевую соль этилендиаминтетрауксусной кислоты (EDTA), лимонную кислоту, салицилаты (например, салицилат, 5-метоксисалицилат и гомованилат натрия), N-ацилпроизводные коллагена, лаурет-9 и N-аминоацилпроизводные бета-дикетонов (енамины) (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Buur et al., J. Control Rel., 1990, 14, 43-51).
Нехелатирующие поверхностно-неактивные вещества. При использовании здесь нехелатирующие поверхностно-неактивные соединения-усилители проникновения могут быть определены как соединения, демонстрирующие незначительную активность как хелатирующие агенты или как поверхностно-активные вещества, но, несмотря на это, усиливающие всасывание олигонуклеотидов через слизистую оболочку пищеварительного тракта (Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33). Этот класс усилителей проникновения включает, например, ненасыщенные циклические карбамиды, производные 1-алкил- и 1-алкенилазациклоалканонов (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92); и нестероидные противовоспалительные средства, такие как диклофенак натрия, индометацин и фенилбутазон (Yamashita et al., J. Pharm. Pharmacol., 1987, 39, 621-626).
В фармацевтические и другие композиции по настоящему изобретению могут также быть добавлены агенты, усиливающие захват олигонуклеотидов на клеточном уровне. Например, известно, что катионные липиды, такие как липофектин (Junichi et al, патент США №5705188), катионные производные глицерина и поликатионные молекулы, такие как полилизин (Lollo et al., РСТ-заявка WO 97/30731), также усиливают проникновение олигонуклеотидов в клетки.
Для усиления проникновения вводимых нуклеиновых кислот в кожу и через кожу могут быть использованы другие агенты, включая гликоли, такие как этиленгликоль и пропиленгликоль, пирролы, такие как 2-пиррол, азоны и терпены, такие как лимонен и ментон.
Другие компоненты
Композиции по настоящему изобретению могут дополнительно содержать другие вспомогательные компоненты, обычно обнаруживаемые в фармацевтических композициях, при их принятых для применения в данной области техники уровнях. Таким образом, например, композиции могут содержать дополнительные совместимые фармацевтически активные вещества, такие как, например, противозудные агенты, вяжущие агенты, местные анестетики или противовоспалительные агенты, или могут содержать дополнительные вещества, полезные при физическом изготовлении различных лекарственных форм композиций по настоящему изобретению, такие как красители, корригенты, консерванты, антиоксиданты, замутнители, загустители и стабилизаторы. Тем не менее, при их добавлении такие вещества не должны чрезмерно препятствовать биологической активности компонентов композиций по настоящему изобретению. Композиции могут быть стерилизованы и, если желательно, смешаны со вспомогательными агентами, например, смазывающими агентами, консервантами, стабилизаторами, смачивающими агентами, эмульгаторами, солями для влияния на осмотическое давление, буферами, красителями, корригентами и/или ароматизаторами и тому подобным, не взаимодействующими нежелательным образом с нуклеиновой(ыми) кислотой(ами) композиции.
Водные суспензии могут содержать вещества, повышающие вязкость суспензии, включая, например, карбоксиметилцеллюлозу натрия, сорбит и/или декстран. Суспензия может также содержать стабилизаторы.
В другом родственном воплощении композиции по изобретению могут содержать одно или более антисмысловых соединений, в частности олигонуклеотидов, направленно действующих на первую нуклеиновую кислоту, и одно или более дополнительных антисмысловых соединений, направленно действующих на вторую нуклеиновую кислоту-мишень. В данной области техники известно множество примеров антисмысловых соединений. Два или более комбинируемых соединений могут быть использованы совместно или последовательно.
Антисмысловые соединения, используемые в соответствии с данным изобретением, могут быть подходящим и обычным образом получены хорошо известной методикой твердофазного синтеза. Соединения по изобретению могут также быть смешаны, инкапсулированы, конъюгированы или иным образом связаны с другими молекулами, молекулярными структурами или смесями соединений, такими как, например, липосомы, молекулы, направленно действующие на рецепторы, композиции для перорального, ректального, местного или другого введения, способствующие захвату, распределению и/или всасыванию. Репрезентативные патенты США, в которых описано изготовление таких композиций, способствующих захвату, распределению и/или всасыванию, включают, без ограничения, патенты США №№5108921; 5354844; 5416016; 5459127; 5521291; 5543158; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575; и 5595756; каждый из которых включен сюда посредством ссылки.
Определенные указания
Специалисты в данной области техники также используют специфичность и чувствительность антисмысловых соединений для терапевтического применения. Антисмысловые олигонуклеотиды используют в качестве терапевтических группировок в лечении болезненных состояний у животных и человека. Лекарственные средства с антисмысловыми олигонуклеотидами, включая рибозимы, безопасно и эффективно вводят людям, и в настоящее время проходит множество клинических исследований. Таким образом, установлено, что олигонуклеотиды могут быть полезным терапевтическим средством, которое может быть полезным образом применено в терапевтических схемах для лечения клеток, тканей и животных, особенно людей.
В одном воплощении изобретения способ включает лечение заболевания или состояния, где заболевание или расстройство представляет собой фиброзное заболевание. В одном воплощении способа по изобретению фиброзное заболевание представляет собой образование гипертрофических рубцов, келоиды, рубцевание кожи, фиброз печени, фиброз легких, фиброз почек, фиброз сердца или рестеноз.
В другом воплощении изобретения способ дополнительно включает лечение указанного выше заболевания или состояния, где заболевание или расстройство представляет собой фиброз суставов (включая синдром «замороженного плеча», повреждение сухожилий и периферических нервов), послеоперационные спайки, повреждение спинного мозга, коронарное шунтирование, абдоминальные и перитонеальные спайки (включая эндометриоз, лейомиому и фиброиды матки), радиальную кератотомию и фоторефракционную кератэктомию, хирургическую реплантацию сетчатки, фиброз, опосредованный устройством (device mediated fibrosis) (например, при диабете), сухожильные спайки, контрактуру Дюпюитрена или склеродермию.
В другом воплощении изобретения также предложен способ уменьшения образования гипертрофических рубцов или келоидов в результате заживления кожных ран у субъекта, нуждающегося в этом, включающий введение субъекту количества соединения антисмыслового олигонуклеотида, эффективного для ингибирования экспрессии фактора роста соединительной ткани (CTGF) у субъекта и, посредством этого, уменьшения образования рубцов.
Полагают, что изготовление фармацевтических композиций и их последующее введение входят в компетенцию специалистов в данной области техники. Доза зависит от тяжести болезненного состояния, подлежащего лечению, и его ответа на лечение, при этом курс лечения продолжают от нескольких суток до нескольких месяцев или до излечения или достижения ослабления болезненного состояния. Обычно используют дозу от 0,1 до 25 мг на инъекцию на линейный сантиметр рубца, и ее можно вводить один раз в сутки, один раз в неделю, один раз каждые 3 недели, один раз в месяц или два раза в месяц (bi-monthly).
В другом воплощении данного изобретения способ дополнительно включает уменьшение образования гипертрофических рубцов или келоидов в результате заживления кожных ран, где заживление ран представляет собой заживление раны, выбранной из группы, состоящей из повреждения кожи, хирургических разрезов и ожогов.
В определенных воплощениях согласно изобретению предложены способы лечения индивида, включающие введение одной или более фармацевтических композиций по настоящему изобретению. В определенных воплощениях индивид имеет одно из указанных выше расстройств. В определенных воплощениях у индивида есть риск развития одного из указанных выше расстройств. В определенных воплощениях установлено, что индивид нуждается в терапии. В определенных воплощениях согласно изобретению предложены способы профилактического снижения экспрессии CTGF у индивида.
Определенные воплощения включают лечение индивида, нуждающегося в этом, введением индивиду терапевтически эффективного количества антисмыслового соединения, направленно действующего на нуклеиновую кислоту CTGF.
В одном воплощении введение терапевтически эффективного количества антисмыслового соединения, направленно действующего на нуклеиновую кислоту CTGF, сочетают с мониторингом уровней CTGF в коже и/или сыворотке индивида для определения ответа индивида на введение антисмыслового соединения. Врач использует ответ индивида на введение антисмыслового соединения для определения степени и продолжительности терапевтического вмешательства.
В одном воплощении введение антисмыслового соединения, направленно действующего на нуклеиновую кислоту CTGF, приводит к снижению экспрессии CTGF по меньшей мере на 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99% или в диапазоне, определенном любыми двумя из этих значений. В одном воплощении введение антисмыслового соединения, направленно действующего на нуклеиновую кислоту CTGF, приводит к изменению показателя CTGF, как измерено в стандартном анализе, например, без ограничения, CTGF. В некоторых воплощениях введение антисмыслового соединения CTGF снижает показатель по меньшей мере на 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или в диапазоне, определенном любыми двумя из этих значений.
В определенных воплощениях фармацевтическую композицию, содержащую антисмысловое соединение, направленно действующее на CTGF, используют для изготовления лекарственного средства для лечения пациента, страдающего или восприимчивого к любому из указанных выше расстройств.
Определенные варианты комбинированной терапии
В определенных воплощениях одну или более чем одну фармацевтическую композицию по настоящему изобретению вводят совместно с одним или более чем одним другим фармацевтическим агентом. В определенных воплощениях такой один или более чем один другой фармацевтический агент предназначен для лечения того же заболевания или состояния, что и одна или более чем одна фармацевтическая композиция по настоящему изобретению. В определенных воплощениях такой один или более чем один другой фармацевтический агент предназначен для лечения заболевания или состояния, отличного от заболевания или состояния, для лечения которого предназначены одна или более чем одна фармацевтическая композиция по настоящему изобретению. В определенных воплощениях такой один или более чем один другой фармацевтический агент предназначен для лечения нежелательного эффекта одной или более чем одной фармацевтической композиции по настоящему изобретению. В определенных воплощениях одну или более чем одну фармацевтическую композицию по настоящему изобретению вводят совместно с другим фармацевтическим агентом для лечения нежелательного эффекта этого другого фармацевтического агента. В определенных воплощениях одну или более чем одну фармацевтическую композицию по настоящему изобретению и один или более чем один другой фармацевтический агент вводят одновременно. В определенных воплощениях одну или более чем одну фармацевтическую композицию по настоящему изобретению и один или более чем один другой фармацевтический агент вводят в разное время. В определенных воплощениях одна или более чем одна фармацевтическая композиция по настоящему изобретению и один или более чем один другой фармацевтический агент совместно включены в одну композицию. В определенных воплощениях одну или более чем одну фармацевтическую композицию по настоящему изобретению и один или более чем один другой фармацевтический агент вводят раздельно.
В определенных воплощениях фармацевтические агенты, которые могут быть введены совместно с фармацевтической композицией по настоящему изобретению, включают второй терапевтический агент. В таких определенных воплощениях фармацевтические агенты, которые могут быть введены совместно с фармацевтической композицией по настоящему изобретению, включают, без ограничения, второй терапевтический агент. В таких определенных воплощениях второй терапевтический агент вводят перед введением фармацевтической композиции по настоящему изобретению. В таких определенных воплощениях второй терапевтический агент вводят после введения фармацевтической композиции по настоящему изобретению. В таких определенных воплощениях второй терапевтический агент вводят одновременно с фармацевтической композицией по настоящему изобретению. В таких определенных воплощениях доза совместно вводимого второго терапевтического агента равна дозе, которая была бы введена при введении второго терапевтического агента самого по себе. В таких определенных воплощениях доза совместно вводимого второго терапевтического агента меньше дозы, которая была бы введена при введении второго терапевтического агента самого по себе. В таких определенных воплощениях доза совместно вводимого второго терапевтического агента превышает дозу, которая была бы введена при введении второго терапевтического агента самого по себе.
В определенных воплощениях совместное введение второго соединения усиливает терапевтический эффект первого соединения, таким образом, что совместное введение соединений приводит к терапевтическому эффекту, превышающему эффект введения первого соединения самого по себе, синергетическому эффекту. В других воплощениях совместное введение приводит к дополнительным терапевтическим эффектам, по сравнению с эффектами соединений при их введении самих по себе. В других воплощениях совместное введение приводит к супераддитивным терапевтическим эффектам, по сравнению с эффектами соединений при их введении самих по себе. В некоторых воплощениях первое соединение представляет собой антисмысловое соединение. В некоторых воплощениях второе соединение представляет собой антисмысловое соединение.
Данное изобретение проиллюстрировано в последующем разделе «Примеры». Данный раздел приведен для облегчения понимания изобретения, однако подразумевают, что его не следует толковать как какое-либо ограничение изобретения, изложенного в последующей формуле изобретения.
ПРИМЕРЫ
Пример 1: Селекция наиболее удачных кандидатов антисмысловых олигонуклеотидов человеческого фактора роста соединительной ткани (CTGF)
Введение
Разрабатывали серию олигонуклеотидов, направленно действующих на различные области РНК человеческого фактора роста соединительной ткани, с использованием опубликованных последовательностей (регистрационный номер в GenBank NM_001901.2, включена сюда как SEQ ID NO: 9; и регистрационный номер в GenBank NT_025741.14, включена сюда как SEQ ID NO: 10).
В данном исследовании проведен анализ доступных областей последовательностей и модифицированных антисмысловых олигонуклеотидов, направленно действующих как на области экзонов, так и на области интронов CTGF. Было синтезировано приблизительно 150 новых последовательностей для каждой мишени, и был проведен анализ их активности против CTGF в клеточной культуре. Олигонуклеотиды показаны в Таблице 1. Все соединения в Таблице 1 представляют собой химерные олигонуклеотиды («гэпмеры») длиной 20 нуклеотидов, состоящие из центральной «промежуточной» области, состоящей из десяти 2’-дезоксинуклеотидов, по обеим сторонам от которых (в 5’- и 3’-направлении) расположены «концевые» области из пяти нуклеотидов, или из 13 2’-дезоксинуклеотидов, по обеим сторонам от которых (в 5’- и 3’-направлении) расположены «концевые» области из двух и пяти нуклеотидов, соответственно. Концевые области состоят из 2’-метоксиэтиловых (2’-МОЕ) нуклеотидов. Межнуклеозидные (каркасные) связи олигонуклеотида являются фосфоротиоатными (P=S). Все цитидиновые остатки представляют собой 5-метилцитидины. Эффект соединений на уровни мРНК человеческого фактора роста соединительной ткани анализировали количественной полимеразной цепной реакцией (PCR) в реальном времени, как описано далее. Данные представляют собой средние значения, полученные в двух экспериментах. Сокращение «N.D.», если оно присутствует, означает «отсутствие данных».


Как показано в Таблице 1, SEQ ID NO: 11-15, 17-20, 24, 26-34, 36-57, 59, 61, 63-82, 84-86, 88, 95, 97, 99, 102, 103, 105, 107, 108, 122, 125, 127-140, 145, 146, 149, 151-154, 156, 159, 161-165 продемонстрировали в данном анализе ингибирование экспрессии человеческого фактора роста соединительной ткани по меньшей мере на 24% и поэтому являются предпочтительными. Сайты-мишени, которым комплементарны эти предпочтительные последовательности, названы здесь «активными сайтами» и, таким образом, являются предпочтительными сайтами для направленного действия соединениями по настоящему изобретению.
Антисмысловое соединение комплементарно в диапазоне нуклеотидов последовательности CTGF, то есть в диапазоне нуклеотидов 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147 или 2267-2301 SEQ ID NO: 9. В определенном воплощении антисмысловое соединение комплементарно в диапазоне нуклеотидов 2728-2797 SEQ ID NO: 10. Соединения, направленно действующие на эти диапазоны, демонстрируют по меньшей мере 50%-ное ингибирование (то есть SEQ ID NO: 15, 29, 31, 42, 46-49, 53, 72, 81, 82, 152-154, 164 и 165). Определенные сайты-мишени, перечисленные в Таблице 1, также демонстрируют по меньшей мере 50%-ное ингибирование (то есть SEQ ID NO: 12, 20, 33, 34, 76, 107, 129, 132, 134, 136 и 146).
В определенных воплощениях антисмысловое соединение комплементарно в диапазоне нуклеотидов 553-611, 1394-1423, 1469-1508, 1559-1605, 1659-1689 или 2100-2129. Соединения, направленно действующие на эти диапазоны, демонстрируют по меньшей мере 60%-ное ингибирование (то есть SEQ ID NO: 27, 38, 43, 50, 52, 54, 55, 77, 79 и 86). Определенные сайты-мишени, перечисленные в Таблице 1, также демонстрируют по меньшей мере 60%-ное ингибирование (то есть SEQ ID NO: 24, 61, 63, 67, 69, 73, 125, 139 и 161).
Антисмысловое соединение также комплементарно в диапазоне нуклеотидов 1399-1423. Соединения, направленно действующие на эти диапазоны, демонстрируют по меньшей мере 70%-ное ингибирование (то есть SEQ ID NO: 39 и 40). Определенные сайты-мишени, перечисленные в Таблице 1, также демонстрируют по меньшей мере 70%-ное ингибирование (то есть SEQ ID NO: 28, 30, 45, 51, 56, 78, 128 и 138). Один сайт-мишень, приведенный в Таблице 1, также демонстрирует по меньшей мере 80%-ное ингибирование (то есть SEQ ID NO: 44). В определенных воплощениях указанного процента ингибирования удается достичь при введении антисмыслового соединения в клетки HuVec в концентрации 50 нМ.
Как в экзонных, так и в интронных последовательностях было идентифицировано множество удачных кандидатов, активность которых превышала активность последовательности наиболее активного ранее известного ASO (антисмысловой олигонуклеотид) SEQ ID NO: 15 (ISIS 124238).
Материалы и методы
Проводили оценку олигонуклеотидов и подтверждение их активности в концентрации 50 нМ в клетках эндотелия пупочной вены человека (HuVEC) с применением липофектин-опосредованной трансфекции. Клетки HuVEC от Cascade Biologics (Portland, OR), поддерживаемые в среде Medium 200, дополненной добавкой Low Serum Growth Supplement (от Cascade Biologics), высевали на 96-луночные планшеты в количестве 5000 клеток на лунку и инкубировали в течение ночи при 37°С в присутствии 5% CO2. На следующие сутки среду аспирировали и заменяли предварительно нагретой средой Opti-МЕМ I (Invitrogen), содержащей смесь Oligo-Lipofectamine 2000 (Invitrogen) (3 мг Lipofectamine 2000 на 1 мл среды Opti-MEM I). Через 4 часа трансфекционную смесь заменяли свежей средой Medium 200, дополненной добавкой Low Serum Growth Supplement, и инкубировали при 37°С в присутствии 5% CO2. После 16-24 часов, при конфлюентности приблизительно 80%, клетки отмывали фосфатно-солевым буферным раствором (PBS) и лизировали для очистки РНК с использованием набора Qiagen RNeasy Kit. мРНК CTGF измеряли количественной полимеразной цепной реакцией в реальном времени (RT-PCR) (наборы праймеров/зондов показаны ниже) и результаты нормализовали по общей РНК.
Статистический анализ
Каждый образец анализировали дважды, и вертикальными отрезками показан разброс двух измерений.
Результаты и обсуждение
Из приблизительно 150 новых последовательностей на мишень, синтезированных и оцененных на предмет активности против CTGF в клеточной культуре, определенные олигонуклеотиды CTGF (SEQ ID NO: 28, 30, 39, 40, 45, 52, 56, 78, 125 и 166) демонстрируют отличное ингибирование экспрессии мРНК CTGF.
Пример 2: Фармакокинетическое исследование антисмысловых олигонуклеотидов CTGF при однократном внутрикожном введении кроликам
Задача исследования
Задачей данного фармакокинетического исследования на кроликах является оценка диффузии и концентрации антисмыслового олигонуклеотида CTGF (SEQ ID NO: 39, ISIS 412294) в коже кроликов в разные моменты времени после однократной внутрикожной инъекции.
План исследования
На 0 сутки исследования всем животным проводили одну внутрикожную (ID) инъекцию 100 мкл антисмыслового олигонуклеотида CTGF SEQ ID NO: 39 в концентрации 50 мг/мл (общая доза 5 мг). Животным вводили антисмысловой олигонуклеотид в месте, расположенном слева от срединной линии спины, приблизительно параллельно плечам кроликов и рядом с зашитой резаной раной длиной 3 см (Фиг.1А). Иглу вводили таким образом, что исследуемое вещество вводили по направлению к основанию тела животного. На 1, 3, 7 или 14 сутки кроликов умерщвляли и получали два пункционных биопсийных образца полной толщины 1,0 см, один по центру места исходной инъекции и другой вертикально ниже на 0,5 см. Образцы быстро замораживали и хранили при -80°С перед анализом уровней антисмысловых олигонуклеотидных лекарственных средств с применением способа гибридизационного захвата. Результаты представляют собой средние уровни антисмысловых олигонуклеотидов обоих биопсийных образцов в указанные моменты времени.
Результаты и выводы
Существенные уровни антисмыслового олигонуклеотида присутствуют до 14 суток после внутрикожного введения (см. Фиг.1Б). Антисмысловой олигонуклеотид также остается рядом с местом исходного введения (<1 см) при весьма ограниченной боковой диффузии дистально от места введения (Фиг.1Б). Например, уровни антисмысловых олигонуклеотидов (ASO) очень низки на расстоянии 1,5 см дистальнее места инъекции во все моменты времени после инъекции. Таким образом, фармакологические эффекты молекул данного класса будут ограничены областями кожи, непосредственно прилегающими к месту инъекции. Для преодоления этого ограничения была разработана (и применена в клинических исследованиях) методика продольной внутрикожной инъекции, обеспечивающая доставку одинакового количества антисмыслового соединения по всей длине развивающегося рубца. Эти результаты демонстрируют два новых открытия. Во-первых, антисмысловой 2’МОЕ-олигонуклеотид данной химической конфигурации имеет большее время удержания в коже; и, во-вторых, антисмысловые олигонуклеотиды подвержены очень ограниченной боковой диффузии в коже. Последнее ограничение молекул данного класса может быть преодолено введением антисмыслового олигонуклеотида методикой продольной инъекции, как описано ранее.
Пример 3: Исследование антисмыслового олигонуклеотида CTGF, направленно действующего на человеческие келоиды, в in vivo-модельной системе на животных
Задача исследования
Задачей данного исследования являлась оценка эффективности антисмысловых олигонуклеотидов, направленно действующих на человеческий CTGF, в in vivo-модельной системе с применением ксенотрансплантационной модели «человеческий келоид/мышь». Исследованный олигонуклеотид представлял собой антисмысловой олигонуклеотид №412300 (SEQ ID NO: 45).
Методы
Ксенотрансплантационная модель «человеческий келоид/мышь»
Применяли ксенотрансплантационную модель «человеческий келоид/мышь» с использованием человеческой келоидной ткани, трансплантированной бестимусным мышам.
Свежие образцы келоидной ткани получали анонимно из удаленной ткани пациентов, прошедших избирательное иссечение келоидов по косметическим соображениям. Образцы келоидов обрабатывали с получением образцов размерами 10×5×5 мм и взвешивали их на аналитических весах. Затем образцы келоидов имплантировали мышам, как описано ниже.
Мышам проводили анестезию 3%-ным изофлураном. По необходимости, перед оперативным вмешательством и после него вводили бупренорфин (бупренорфин в концентрации 0,3 мг/мл; 2 мг/кг; подкожно).
По достижении общей анестезии и по завершении подготовки животного проводили два разреза кожи длиной 10 мм над левой и правой лопатками и формировали карман с использованием остроконечных ножниц между подкожной жировой клетчаткой и фасцией. В каждый карман вводили один образец келоида. Разрезы закрывали с использованием цианоакрилатного клея для ветеринарного применения (VetBond или Nexaband) и область обрабатывали тампоном с 70%-ным этанолом. Затем на область накладывали стерильные полупроницаемые мембраны (Op-Site™, Smith and Nephew).
Оценка эффектов ASO на келоиды in vivo
Использовали ASO, направленно действующий на человеческий (а не на мышиный) CTGF (антисмысловой олигонуклеотид №412300; SEQ ID NO: 45). Для исследования эффективности ASO в in vivo-модельной системе, описанной выше, в имплантированные келоиды вводили ASO (растворенный в PBS) или контрольный PBS. Было две группы животных, по 8 животных на группу (с двумя келоидами на животное). Животным давали привыкнуть в течение приблизительно 2 недель после имплантации келоидов перед введением ASO.
Общая доза олигонуклеотида составляла 500 мкг на образец келоида, и ее вводили в общем объеме 100 мкл (из исходного раствора в концентрации 5,0 мг/мл). ASO или контрольный PBS вводили в непосредственной близости к каждому имплантату на протяжении в общей сложности 4 недель, два раза в неделю. Через неделю после последней инъекции один имплантат удаляли и подвергали количественной RT-PCR (qRT-PCR) для анализа экспрессии генов, контралатеральный келоид удаляли и проводили его гистологический анализ на предмет содержания коллагена с применением интегральной плотности флуоресценции (IDF).
Выделяли общую РНК и мРНК CTGF или альфа-1-коллагена III типа (Col3A1) определяли количественной PCR в реальном времени с использованием пар праймеров с подтвержденной специфичностью в отношении последовательностей человеческой мРНК. Уровни мРНК сопоставляли с уровнями GAPDH (глицеральдегид-3-фосфатдегидрогеназа) в тех же образцах и вычисляли любые изменения в образцах с введением ASO, по сравнению с контролем с введением PBS самим по себе.
Результаты
Результаты через 4 недели введения 500 мкг антисмыслового олигонуклеотида №412300 (SEQ ID NO: 45) в общем объеме 100 мкл на образец келоида показали снижение экспрессии мРНК CTGF и Col3A1 в отдельных образцах келоидов. Введение ASO CTGF снижало экспрессию мРНК CTGF в келоидной ткани до 67% контроля (р=0,082) (Фиг.2А). Введение ASO CTGF снижало экспрессию мРНК Col3A1 в келоидной ткани до 45% контроля (р=0,153) (Фиг.2Б).
Заключение
Для келоидов характерны аномальная пролиферация фибробластов и чрезмерное образование различных форм коллагена. Гистопатологически для них характерно наличие завитков и узелков толстых гиалинизированных коллагеновых пучков или келоидного коллагена с муцинозным основным веществом и относительно небольшим количеством фибробластов в дерме келоидных рубцов. Большие, толстые коллагеновые пучки и многочисленные тонкие фибриллы расположены близко друг к другу. Коллаген III типа является вторым по распространенности коллагеном кожи и очень распространен в келоидах. Col3A1 значительно повышен в келоидах, по сравнению с нормальной кожей.
В данном изобретении впервые была продемонстрирована способность химически модифицированных 2’MOE-ASO снижать CTGF в интактной человеческой келоидной ткани. Введение ASO CTGF в человеческие келоидные ткани снижало экспрессию мРНК CTGF-мишени на 33%. Это также приводило к снижению экспрессии Col3A1 на 55%. Это снижение экспрессии Col3A1 будет приводить к значительному терапевтическому полезному эффекту у пациентов, страдающих от роста келоидов, и демонстрировать полезность 2’MOE-ASO в качестве нового лекарственного средства для лечения келоидов.
Пример 4: Исследование с коррекцией рубцов молочной железы у людей
Задача исследования
Данное исследование представляет собой рандомизированное, двойное слепое, внутрисубъектное контролируемое клиническое исследование по оценке эффективности и безопасности антисмысловых олигонуклеотидов CTGF (ЕХС 001) у субъектов, прошедших избирательную коррекцию рубцов, являющихся результатом предшествующего оперативного вмешательства на молочной железе. Для данного исследования необходимо, чтобы субъекты имели уже имеющиеся рубцы, выраженность которых является показанием для хирургической коррекции рубцов. Таким образом, в данном исследовании проводят предварительный скрининг с отбором субъектов, у которых можно ожидать высокую частоту образования гипертрофических рубцов или келоидов на месте коррекции рубцов при введении плацебо.
У пациентов с предшествующим оперативным вмешательством на молочной железе и двусторонними сопоставимыми рубцами в одинаковых анатомических областях вводили ЕХС 001 (SEQ ID NO: 39) или плацебо продольными внутрикожными инъекциями в часть рубцов после коррекции. Первичной задачей исследования была оценка эффективности ЕХС 001 в уменьшении последующего рубцевания кожи. Вторичной задачей исследования была оценка безопасности ЕХС 001.
Методы
В отрезок длиной 6 см с любой стороны раны/рубца молочной железы после коррекции вводили 4 дозы ЕХС 001 или плацебо на 2, 5, 8 и 11 неделях после закрытия хирургического разреза. Сторону, на которой вводили ЕХС 001 или плацебо, у каждого субъекта определяли случайным образом.
Использованная доза ЕХС 001 составляла 5 мг на линейный сантиметр. Используемая концентрация ЕХС 001 составляла 25 мг/мл, и на линейный сантиметр раны/рубца молочной железы после коррекции вводили 100 мкл ЕХС 001. Инъекции проводили по обеим сторонам каждого разреза, при этом с каждой стороны на линейный сантиметр вводили половинное количество. Расстояние между инъекциями на одной стороне составляло 3 см. Для доставки плацебо или ЕХС 001 рядом и по всей длине разреза для инъекций использовали иглы для внутрикожных инъекций (длиной 3 см). Иглу вводят непосредственно рядом с хирургическим разрезом на каждой стороне методикой продольной инъекции и ЕХС 001 или плацебо вводят во время извлечения иглы, таким образом, что происходит введение равных количеств антисмыслового лекарственного средства по всей длине рубца.
Продолжительность исследования составляла приблизительно 31 неделю. Субъектам проводили коррекцию рубцов на 1 сутки с последующими 4 введениями ЕХС 001 и плацебо на 2, 5, 8 и 11 неделях после закрытия хирургических разрезов. Наблюдение и оценку рубцов проводили на 24 неделе.
Эффективность определяли оценкой каждой пары сопоставимых разрезов у отдельных пациентов (внутрисубъектный анализ). Эффективность оценивали на 24 неделе после хирургической коррекции рубцов с применением трех способов оценки выраженности рубцов на месте разрезов.
- Оценка своих рубцов субъектом. По шкале от 1 до 10 пациент отмечал свое «общее» мнение о внешнем виде рубца.
- Оценка рубцов врачом (исследователем). По шкале от 1 до 10 врач отмечал свое общее мнение о внешнем виде рубца.
- Оценка пар неподписанных фотографий рубцов группой экспертов с использованием 100 мм визуальной аналоговой шкалы (100 mm Visual Analog Scale (VAS)), где 0 = наилучший возможный рубец и 100 = наихудший возможный рубец. Данный способ дает информацию об абсолютной выраженности рубцов, а также об отличиях двух рубцов в паре.
Результаты
Данное исследование завершил 21 субъект. Анализ фотографий на 24 неделе после хирургического вмешательства показывает, что почти все пациенты демонстрируют рецидивы гипертрофических рубцов по меньшей мере на одной стороне после хирургической коррекции рубцов. В некоторых случаях рубцы распространяются за пределы исходных разрезов и, таким образом, представляют собой келоидные рубцы.
В данном исследовании были получены статистически значимые результаты в пользу ЕХС 001 по всем трем конечным точкам (отрицательный показатель отражает различие между введением плацебо и ЕХС 001 в пользу ЕХС 001 - см. Таблицу 2 ниже).
- Оценка своих рубцов субъектом.
- «Общая» оценка была статистически значима в пользу ЕХС 001 (р=0,033).
- Оценка рубцов врачом.
- «Общая» оценка была статистически высокозначима в пользу ЕХС 001 (p<0,001).
- VAS-оценка фотографий группой экспертов была также статистически высокозначима в пользу ЕХС 001 (p<0,001).
На Фиг.3А показано, что введение антисмыслового олигонуклеотида CTGF (ЕХС 001 или SEQ ID NO: 39) ингибирует образование и рост гипертрофического рубца на 24 неделе после хирургического вмешательства. На Фиг.3Б показаны результаты другого субъекта, также на 24 неделе. В данном втором примере у пациента развился келоид на 24 неделе после хирургической коррекции в рубце, в который вводили плацебо. В отличие от этого, введение ЕХС 001 почти полностью предотвратило образование и рост келоидного рубца в месте коррекции расположенного рядом рубца.
Таким образом, в этих двух примерах введение ЕХС 001 ингибировало рост как гипертрофических рубцов, так и келоидных рубцов. Показатели под каждой группой изображений отражают степень улучшения при сравнении рубцов при введении плацебо и ЕХС 001. Например, экспертная VAS-оценка -19,3 показывает, что рубец при введении плацебо хуже соответствующего рубца при введении ЕХС 001 на 19,3 по 100-балльной шкале. Оценка врачом и субъектом -1 означает, что рубец при введении плацебо хуже соответствующего рубца при введении ЕХС 001 на 1 балл по 10-балльной шкале. Результат демонстрирует, что ЕХС 001 уменьшает выраженность как гипертрофических рубцов, так и келоидных рубцов.
Пример 5: Исследование первичной профилактики при абдоминопластике у людей
Задача исследования
Данное исследование представляет собой рандомизированное, двойное слепое, внутрисубъектное контролируемое клиническое исследование по оценке эффективности и безопасности антисмысловых олигонуклеотидов CTGF (ЕХС 001) у субъектов, прошедших избирательную хирургическую абдоминопластику.
Метод
Продолжительность исследования составляла приблизительно 24 недели. Субъектам проводили абдоминопластику на 1 сутки с последующим введением ЕХС 001 или плацебо на протяжении периода продолжительностью 9 недель.
Использованная доза ЕХС 001 составляла 5 мг на линейный сантиметр. Используемая концентрация ЕХС 001 составляла 25 мг/мл, и на линейный сантиметр раны/рубца после абдоминопластики вводили 100 мкл ЕХС 001. Инъекции проводили по обеим сторонам каждого разреза, при этом с каждой стороны на линейный сантиметр вводили половинное количество. Лекарственное средство или плацебо вводили вдоль двух частей рубца длиной 6 см с каждого латерального конца рубца, и, таким образом, части, где проводили введение, были разделены рубцом длиной по меньшей мере 10 см, где не проводили введений. Расстояние между инъекциями на одной стороне составляло 3 см. Для доставки плацебо или ЕХС 001 рядом или по всей длине разреза для инъекций использовали иглы для внутрикожных инъекций (длиной 3 см). Иглу вводят непосредственно рядом с хирургическим разрезом на каждой стороне методикой продольной инъекции и ЕХС 001 или плацебо вводят во время извлечения иглы.
Субъектам проводили коррекцию рубца на 1 сутки с последующими 4 введениями ЕХС 001 и плацебо на 2, 5, 8 и 11 неделях после закрытия хирургических разрезов. Наблюдение и оценку рубцов проводили на 12 неделе.
Эффективность определяли оценкой каждой сопоставляемой части разреза после введения (введение плацебо в сравнении с введением ЕХС 001) с применением трех способов оценки выраженности рубцов на месте разрезов, как описано в предыдущем примере.
Результаты
ЕХС 001 эффективен по этим критериям на 12 неделе. Пример его эффективности показан на Фиг.4. В данном примере уменьшение выраженности рубца в результате введения ЕХС 001, по сравнению с введением плацебо, очевидна. В части разреза, где вводили плацебо, развился гипертрофический рубец, в то время как часть рубца, где вводили ЕХС 001, была тоньше.
Другой пример способности ЕХС 001 уменьшать образование гипертрофических рубцов показан на Фиг.5. В данном примере в правую часть рубца после абдоминопластики (справа от вертикальной линии) вводили ЕХС 001, в то время как в рубец слева от вертикальной линии введений не проводили. Очевидно, выраженность рубца справа меньше, чем слева.
Данный пример также демонстрирует, что полезный терапевтический эффект ЕХС 001 ограничен областью рубца, расположенной в непосредственной близости к месту введения лекарственного средства продольной внутрикожной инъекцией. Таким образом, лекарственное средство, по-видимому, подвержено ограниченной диффузии от места введения, и необходимо введение непосредственно рядом с рубцом, например, продольной внутрикожной инъекцией.
Пример 6: Исследование биомаркеров, демонстрирующее эффект ЕХС 001 на экспрессию мРНК различных генов у людей
Метод
За 13 недель до абдоминопластики область между пупком и надлобковой линией роста волос использовали в качестве места проведения в общей сложности двадцати разрезов длиной 2 см. Разрезы длиной 2 см были расположены четырьмя столбцами по четыре разреза в каждом (А, В, С, D), и их использовали для анализа РНК на 13 неделе после проведения разрезов. Два дополнительных разреза латерально от этих столбцов на каждой стороне живота (а, b и с, d) использовали для анализа мРНК через 4 или 8 недель после проведения разрезов. Расстояние между столбцами составляло по меньшей мере 4 см, и расстояние между разрезами составляло по меньшей мере 3 см.
Введение ЕХС 001 или плацебо в резаные раны назначали случайным образом двум группам введения. Во все четыре резаные раны в каждом из столбцов А, В, С и D вводили одинаковую дозу ЕХС 001 или плацебо. Во все резаные раны/рубцы на одной стороне живота проводили инъекции ЕХС 001 и на другой стороне проводили инъекции плацебо. Индивид, которому проводили инъекции исследуемых агентов, не знал, какой именно исследуемый агент ему вводят. Все введения в разрезы/рубцы у одного субъекта проводили по одной схеме введения.
Тридцать субъектов случайным образом распределяли в одну из трех групп по 10 субъектов в каждой; каждой группе проводили инъекции по разным схемам введения (но высокая и низкая дозы были одинаковыми для всех групп).
Группа №1: внутрикожные инъекции на 2, 4, 6, 8 и 10 неделях.
Группа №2: внутрикожные инъекции на 2, 5, 8 и 11 неделях.
Группа №3: внутрикожные инъекции на 2, 6 и 10 неделях.
Иглу 27 размера длиной приблизительно 38 мм в длину вводили внутрикожно на 2 см (по всей длине каждого разреза), параллельно и на расстоянии приблизительно 3 мм от резаной раны/рубца (методика продольной внутрикожной инъекции). ЕХС 001 или плацебо затем вводили по мере постепенного извлечения иглы, таким образом, что нужное количество на линейный сантиметр было равномерно распределено в дерме вдоль линии разреза.
Биопсия разрезов
Один пункционный биопсийный образец размером 6 мм на каждой стороне рядом с латеральными разрезами получали на 1 сутки для анализа мРНК, и использовали его в качестве контроля как образцы неповрежденной кожи. На 4 неделе у 9 пациентов в группе 1 и на 8 неделе у 20 пациентов в группах 2 и 3 проводили биопсию их латеральных разрезов (а, b, с, d). В два из этих разрезов вводили ЕХС 001 и в два из этих разрезов вводили плацебо, что было распределено случайным образом. Непосредственно перед хирургической абдоминопластикой (на 13 неделе) оценивали выраженность каждого из рубцов в столбцах А, В, С и D (по оценке врача и группы экспертов, см. Пример 5 выше) и также получали образцы для гистологического анализа и анализа РНК.
Результаты
Наблюдали статистически значимое улучшение рубцов при введении ЕХС 001, по сравнению с введением плацебо, по общей врачебной оценке, когда все группы были объединены при высоком уровне дозы (8,7%, р-значение = 0,018). Также наблюдали статистически значимые различия средних значений по общей оценке при объединении всех групп и при объединении всех доз (5,9%, р-значение = 0,016). Эти результаты вновь демонстрируют способность ЕХС 001 уменьшать выраженность рубцов.
Пример способности ЕХС 001 уменьшать рост и образование гипертрофических рубцов показан на Фиг.6. В данном примере показаны два сопоставимых рубца, один при введении 5 мг/см ЕХС 001 и один при введении плацебо. Выраженность рубца при введении ЕХС 001 меньше, чем рубца при введении плацебо. Гистологический анализ этих двух рубцов также выявил опосредованное ЕХС 001 снижение экспрессии белка CTGF (при иммуногистохимическом исследовании), ясно демонстрируя, что ЕХС 001 действует, снижая экспрессию его предполагаемой мишени (CTGF). Также проводили анализ экспрессии 9 различных мРНК-транскриптов на 4, 8 и 13 неделях после проведения разрезов (Таблица 3).
При послеоперационном раневом процессе ожидали повышения экспрессии мРНК CTGF и коллагена. Экспрессия мРНК CTGF в рубцах была выше, чем в исходной неповрежденной коже во всех трех временных точках и во всех трех группах (приблизительно в 2-5 раз). Также наблюдали повышенную экспрессию ряда генов, связанных с рубцеванием, включая гены коллагена, такие как Col1A2 (в 5-8 раз) и Col3A1 (в 3-7 раз), как и следовало ожидать при развитии рубцовых тканей.
По сравнению с соответствующим рубцом при введении плацебо, во всех трех измеренных временных точках наблюдали подавление индукции мРНК CTGF после инъекций ЕХС 001. Как показано на Фиг.7А, на 13 неделе общее (по всем 3 группам) опосредованное ЕХС 001 снижение индукции мРНК CTGF составило 53%. Степень снижения мРНК CTGF также варьировала в зависимости от времени и группы введения. Например, в одной группе одна доза 5 мг/см снижала индукцию экспрессии CTGF на 74% (р=0,011) до индукции лишь 140% экспрессии, по сравнению с неповрежденной кожей (измерение проведено через две недели после последнего введения ЕХС 001) (Фиг.7Г). Кроме того, введение ЕХС 001 также значимо снижало общие индуцированные уровни экспрессии мРНК Col1A2, Col3A1 (Фиг.7Б) и волокон эластина (ELASF) (Фиг.7В) (на 40% (р=0,0013), 69% (p<0,0001) и 63% (р=0,0004), соответственно) при измерении на 13 неделе (во всех трех группах).
Полное ингибирование экспрессии генов коллагена вероятно не является желательным результатом введения лекарственного средства, поскольку экспрессия некоторых генов коллагена необходима для содействия процессам нормального заживления ран и восстановления. Как показано на Фиг.7Г и Д, введение ЕХС 001 не приводило к значимому ингибированию экспрессии мРНК SMAD3 или TGF-β1, по сравнению с плацебо на 4 или 13 неделе.
Эти данные демонстрируют механизм действия ЕХС 001 у человека. Эти данные также демонстрируют механизм, позволяющий ЕХС 001 уменьшать выраженность кожных рубцов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Модулирование экспрессии рецептора андрогенов | 2013 |
|
RU2670486C9 |
| СОЕДИНЕНИЯ И СПОСОБЫ МОДУЛЯЦИИ ЭКСПРЕССИИ ДИСТРОФИЧЕСКОЙ МИОТОНИН-ПРОТЕИНКИНАЗЫ (DMPK) | 2014 |
|
RU2690333C2 |
| АНТИСМЫСЛОВАЯ РЕГУЛЯЦИЯ ЭКСПРЕССИИ GCGR | 2012 |
|
RU2598709C2 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ АНГИОПОЭТИН-ПОДОБНОГО БЕЛКА 3 | 2014 |
|
RU2706964C2 |
| КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ ЭКСПРЕССИИ АТАКСИНА 2 | 2015 |
|
RU2702838C2 |
| Лечение рака | 2013 |
|
RU2689548C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛЯЦИИ SMN2 СПЛАЙСИНГА У СУБЪЕКТА | 2010 |
|
RU2683772C2 |
| МОДУЛИРОВАНИЕ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА С-III (АРОСIII) У ПАЦИЕНТОВ С ЛИПОДИСТРОФИЕЙ | 2016 |
|
RU2737719C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛЯЦИИ SMN2 СПЛАЙСИНГА У СУБЪЕКТА | 2010 |
|
RU2566724C9 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛЯЦИИ SMN2 СПЛАЙСИНГА У СУБЪЕКТА | 2019 |
|
RU2793459C2 |







































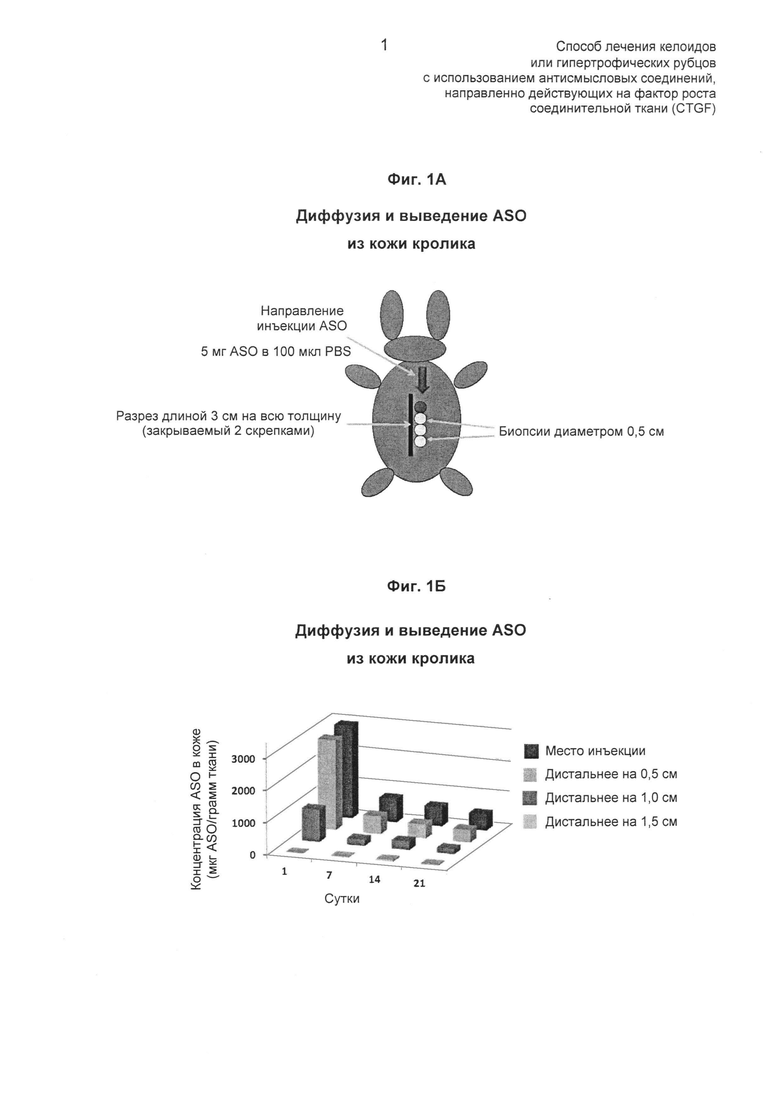
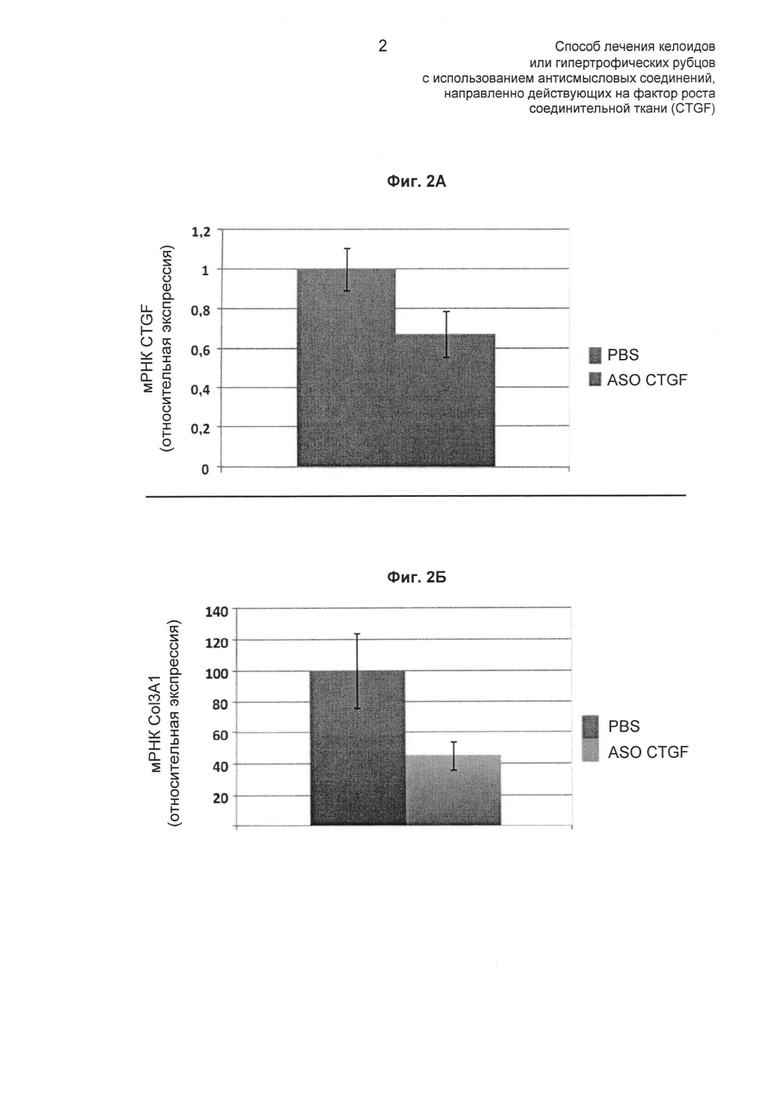
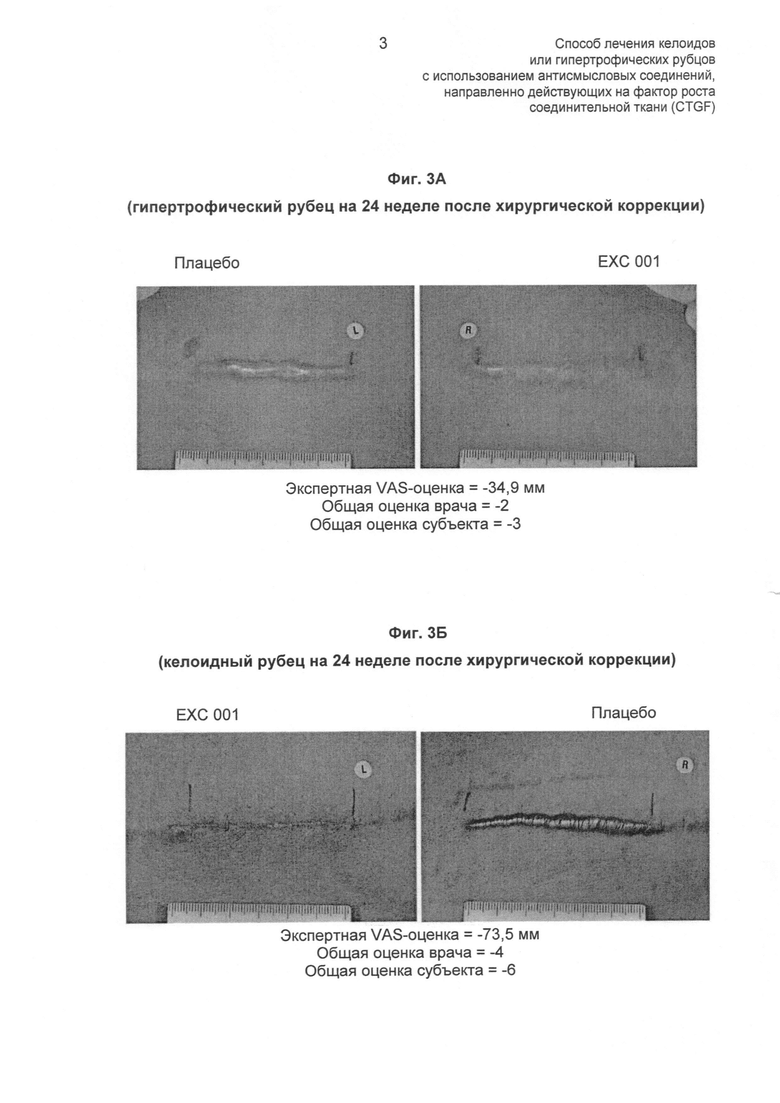


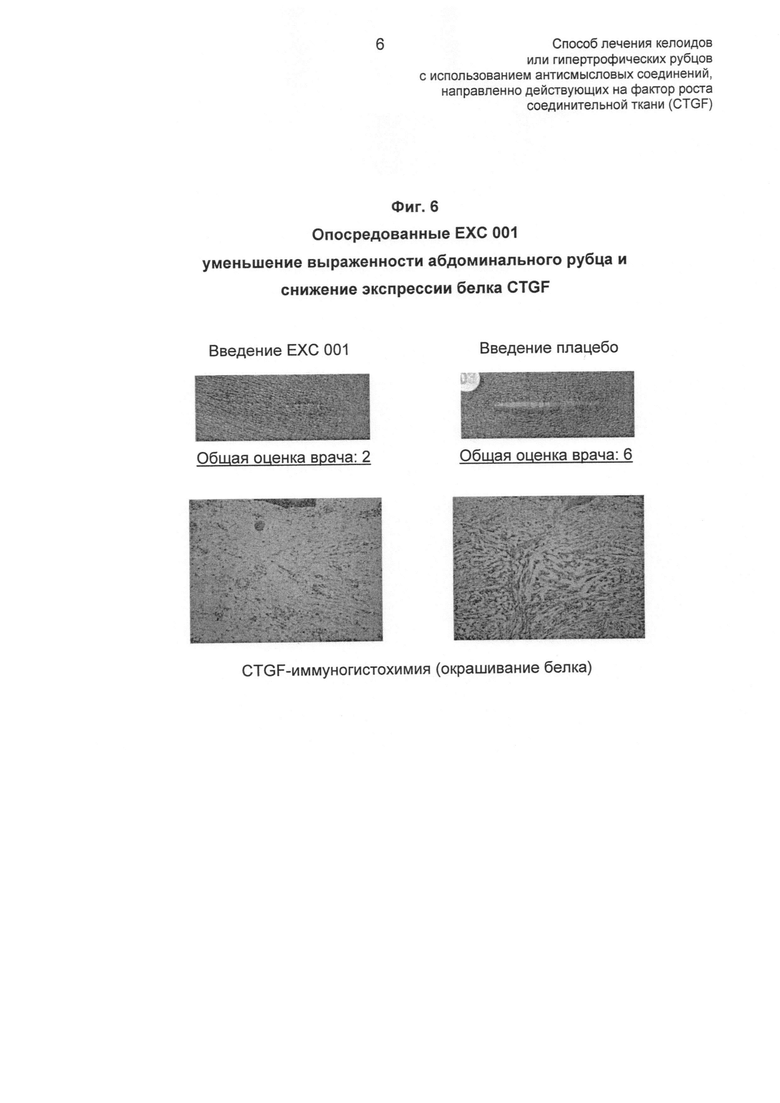
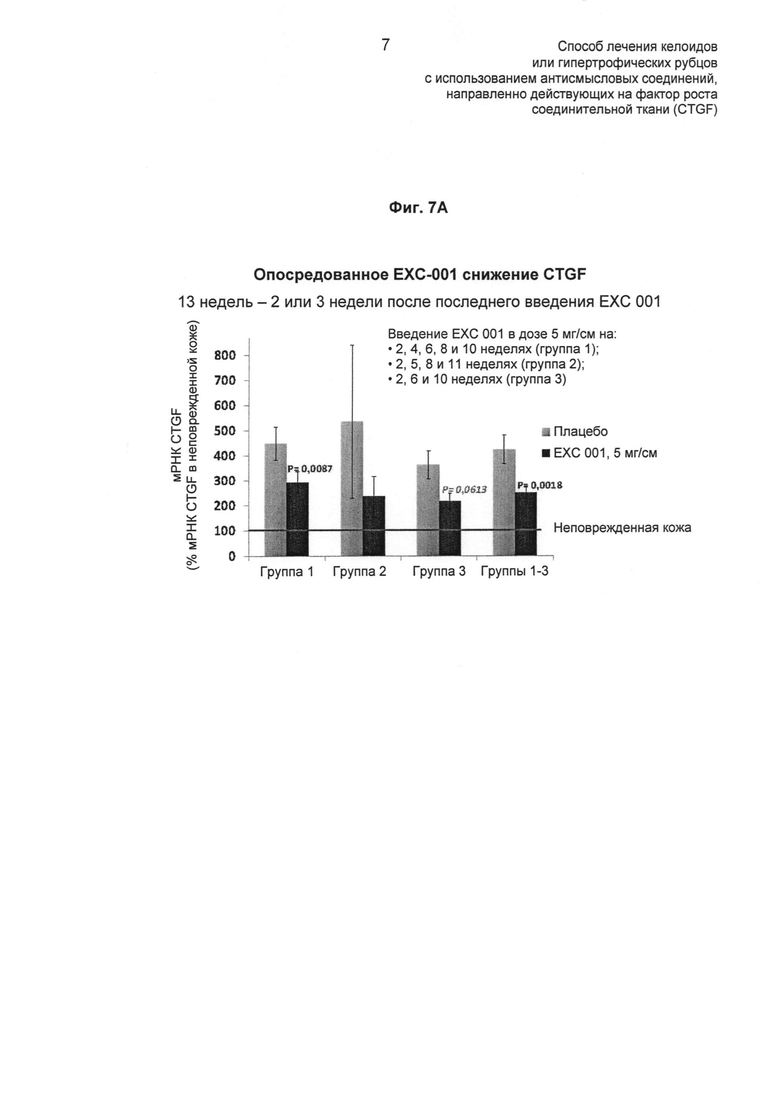
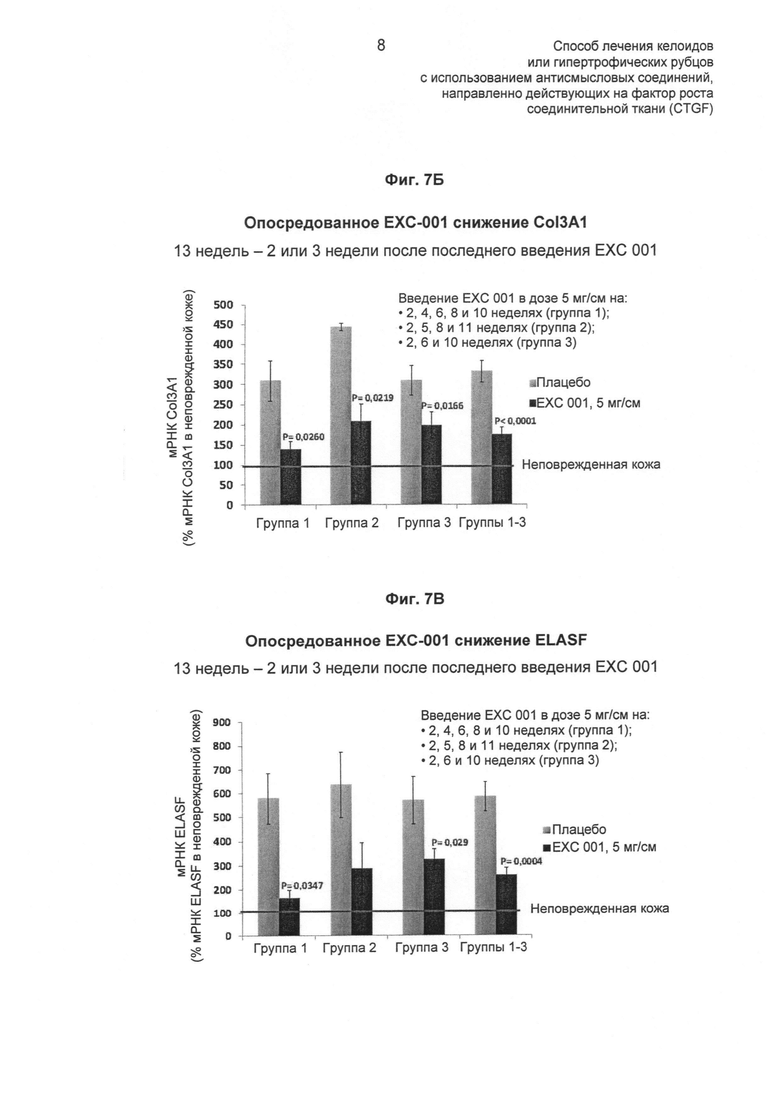
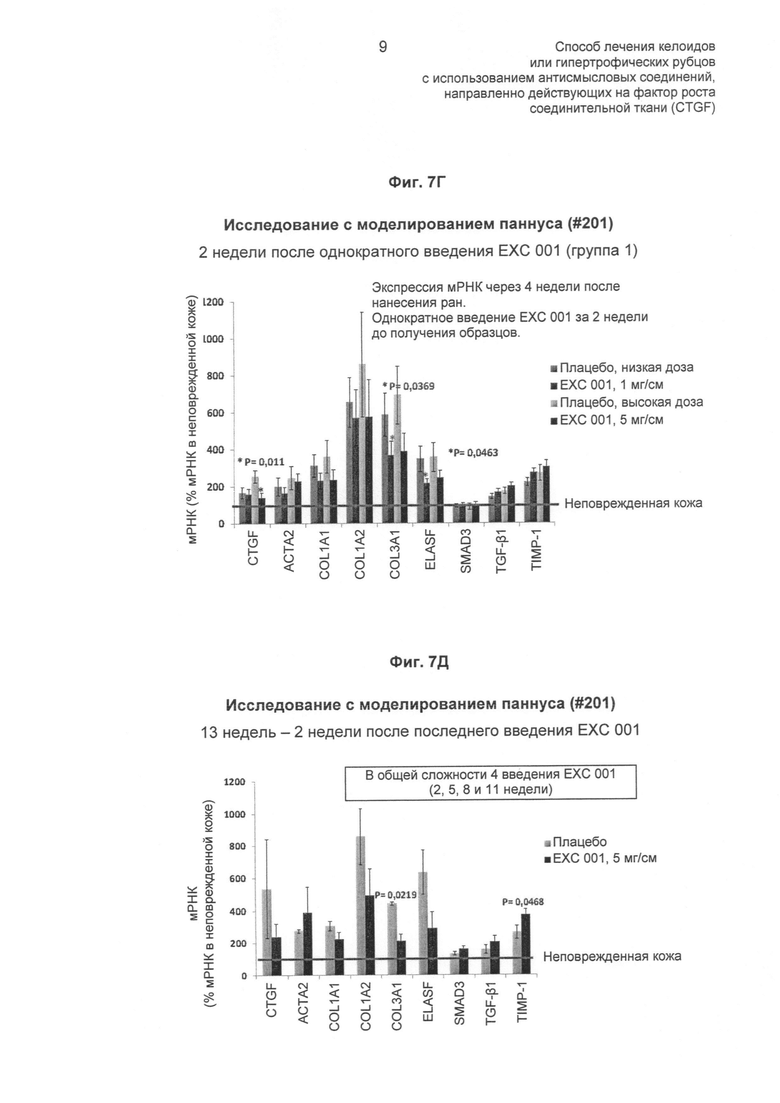
Группа изобретений относится к медицине, а именно к дерматологии, и может быть использована для лечения келоидов или гипертрофических рубцов. Способ по изобретению включают введение композиции, содержащей модифицированный олигонуклеотид. Набор по изобретению включает устройство, заполненное композицией, и инструкцию по его применению. Использование изобретений позволяет уменьшить выраженность и образование келоидов и гипертрофических рубцов за счет доставки антисмыслового нуклеотида в место повреждения путем продольной инъекции. 5 н. и 71 з.п. ф-лы, 3 таб., 7 ил., 5 пр.
1. Способ лечения келоида или предотвращения образования, повторного образования или роста келоида после повреждения кожи у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте келоида или повреждения кожи, одной или более инъекций композиции, содержащей модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований комплементарна нуклеотидам, присутствующим в области, выбранной из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9 и нуклеотидов 2728-2797 SEQ ID NO: 10, или его соль или эфир в количестве, эффективном для лечения или для предотвращения образования, повторного образования или роста келоида, где эффективное количество составляет от 0,1 до 50 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр келоида или повреждения кожи.
2. Способ лечения гипертрофического рубца или предотвращения образования, повторного образования или роста гипертрофического рубца после повреждения кожи у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте гипертрофического рубца или повреждения кожи, одной или более инъекций композиции, содержащей модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований комплементарна нуклеотидам, присутствующим в области, выбранной из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9 и нуклеотидов 2728-2797 SEQ ID NO: 10, или его соль или эфир в количестве, эффективном для лечения или для предотвращения образования, повторного образования или роста гипертрофического рубца, где эффективное количество составляет от 0,1 до 25 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр гипертрофического рубца или повреждения кожи.
3. Способ уменьшения образования, повторного образования или роста рубца или келоида в месте повреждения кожи или лечения уже имеющегося рубца или келоида у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте повреждения или уже имеющегося рубца или келоида, одной или более продольных инъекций композиции, содержащей модифицированный олигонуклеотид или его соль или эфир, направленно действующие на нуклеиновую кислоту, кодирующую белок, вовлеченный в фиброз, в количестве, эффективном для ингибирования экспрессии белка и, посредством этого, уменьшения образования, повторного образования или роста рубца или келоида в месте повреждения или лечения уже имеющегося рубца или келоида.
4. Способ по любому из пп. 1-3, где одна или более продольных инъекций включают многократные продольные внутрикожные инъекции на рубец.
5. Способ уменьшения образования, повторного образования или роста фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения у субъекта, нуждающегося в этом, включающий проведение субъекту, в месте повреждения или уже имеющегося фиброзного поражения, одной или более продольных инъекций композиции, содержащей модифицированный олигонуклеотид или его соль или эфир, направленно действующие на нуклеиновую кислоту, кодирующую белок, вовлеченный в фиброз, в количестве, эффективном для ингибирования экспрессии белка и, посредством этого, уменьшения образования, повторного образования или роста фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения.
6. Способ по любому из пп. 3 или 5, где белок, вовлеченный в фиброз, представляет собой фактор роста соединительной ткани.
7. Способ по любому из пп. 3 или 5, где белок, вовлеченный в фиброз, представляет собой трансформирующий фактор роста бета-1.
8. Способ по любому из пп. 3 или 5, где белок, вовлеченный в фиброз, представляет собой гомолог-3 белка MAD (mothers against decapentaplegic).
9. Способ по любому из пп. 3 или 5, где белок, вовлеченный в фиброз, представляет собой белок раннего ответа (early growth response-1).
10. Способ по любому из пп. 3 или 5, где белок, вовлеченный в фиброз, представляет собой моноцитарный хемотаксический белок-1.
11. Способ по любому из пп. 3 или 5, где белок, вовлеченный в фиброз, представляет собой коллаген.
12. Способ по п. 11, где коллаген представляет собой коллаген 3А1, коллаген 1А2 или коллаген 1А1.
13. Способ по любому из пп. 3 или 5, где белок, вовлеченный в фиброз, представляет собой эластин.
14. Способ по любому из пп. 3 или 5, где эффективное количество составляет от 0,1 до 25 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр места повреждения кожи или уже имеющегося рубца.
15. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят по меньшей мере один раз каждые две недели на протяжении по меньшей мере четырех недель.
16. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят по меньшей мере один раз каждые три недели на протяжении по меньшей мере шести недель.
17. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят по меньшей мере один раз каждые четыре недели на протяжении по меньшей мере восьми недель.
18. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят по меньшей мере один раз каждые восемь недель на протяжении по меньшей мере шестнадцати недель.
19. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят на протяжении периода продолжительностью по меньшей мере девять недель.
20. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят на протяжении периода продолжительностью 26 недель.
21. Способ по п. 6, где модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов, по меньшей мере часть последовательности которого из 12 нуклеотидных оснований комплементарна нуклеотидам, присутствующим в области, выбранной из группы, состоящей из нуклеотидов 553-611, 718-751, 1388-1423, 1457-1689, 2040-2069, 2120-2147, 2267-2301, 1394-1423, 1469-1508, 1559-1605, 1659-1689, 2100-2129 и 1399-1423 SEQ ID NO: 9 и нуклеотидов 2728-2797 SEQ ID NO: 10.
22. Способ по любому из пп. 1, 2 или 5, где по меньшей мере часть последовательности из 12 нуклеотидных оснований модифицированного олигонуклеотида присутствует в последовательности нуклеотидных оснований, изложенной в любой из последовательностей SEQ ID NO: 28, 30, 39, 40, 43, 44, 45, 50, 51, 52, 56, 78, 125 или 166.
23. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
24. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид содержит по меньшей мере 14 связанных нуклеозидов.
25. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид представляет собой одноцепочечный олигонуклеотид.
26. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид представляет собой двухцепочечный олигонуклеотид.
27. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид содержит по меньшей мере один олигодезоксирибонуклеотид.
28. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид содержит по меньшей мере один олигорибонуклеотид.
29. Способ по п. 22, где модифицированный олигонуклеотид имеет последовательность, на 100% идентичную по всей ее длине части любой из последовательностей, изложенных в SEQ ID NO: 28, 30, 39, 40, 43, 44, 45, 50, 51, 52, 56, 78, 125 или 166.
30. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид содержит по меньшей мере одну модифицированную межнуклеозидную связь.
31. Способ по п. 30, где по меньшей мере одна модифицированная межнуклеозидная связь представляет собой фосфотиоатную межнуклеозидную связь.
32. Способ по п. 31, где все межнуклеозидные связи представляют собой фосфотиоатные межнуклеозидные связи.
33. Способ по любому из пп. 1-3 или 5, где по меньшей мере один нуклеозид содержит модифицированный сахар.
34. Способ по п. 33, где модифицированный сахар представляет собой бициклический сахар.
35. Способ по п. 34, где по меньшей мере один модифицированный сахар содержит 2'-О-метоксиэтил.
36. Способ по любому из пп. 1-3 или 5, включающий по меньшей мере один тетрагидропиран-модифицированный нуклеозид, где фуранозное кольцо замещено тетрагидропирановым кольцом.
37. Способ по п. 36, где каждый из по меньшей мере одного тетрагидропиран-модифицированного нуклеозида имеет структуру:
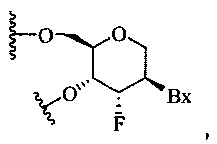
где Вх представляет собой возможно защищенную гетероциклическую основную группировку.
38. Способ по любому из пп. 1-3 или 5, где по меньшей мере один нуклеозид содержит модифицированное нуклеотидное основание.
39. Способ по п. 38, где модифицированное нуклеотидное основание представляет собой дезоксинуклеозид.
40. Способ по п. 38, где модифицированное нуклеотидное основание представляет собой рибонуклеозид.
41. Способ по п. 38, где модифицированное нуклеотидное основание представляет собой 5'-метилцитозин.
42. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид содержит:
а) промежуточный сегмент, состоящий из связанных дезоксинуклеозидов;
б) 5'-концевой сегмент, состоящий из связанных модифицированных нуклеозидов; и
в) 3'-концевой сегмент, состоящий из связанных модифицированных нуклеозидов;
где промежуточный сегмент расположен между 5'-концевым сегментом и 3'-концевым сегментом, и где каждый модифицированный нуклеозид в каждом концевом сегменте содержит модифицированный сахар.
43. Способ по п. 42, где модифицированный олигонуклеотид содержит:
а) промежуточный сегмент, состоящий из тринадцати связанных дезоксинуклеозидов;
б) 5'-концевой сегмент, состоящий из двух связанных модифицированных нуклеозидов; и
в) 3'-концевой сегмент, состоящий из пяти связанных модифицированных нуклеозидов;
где промежуточный сегмент расположен между 5'-концевым сегментом и 3'-концевым сегментом, где каждый модифицированный нуклеозид в каждом концевом сегменте содержит 2'-О-метоксиэтиловый сахар, и где каждая межнуклеозидная связь представляет собой фосфотиоатную связь.
44. Способ по п. 22, где последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 39.
45. Способ по п. 22, где последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 40.
46. Способ по п. 22, где последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 45.
47. Способ по п. 22, где последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 52.
48. Способ по п. 22, где последовательность нуклеотидных оснований представляет собой последовательность, изложенную в SEQ ID NO: 166.
49. Способ по любому из пп. 1-3 или 5, где композиция содержит модифицированный олигонуклеотид или его соль и фармацевтически приемлемый носитель или разбавитель.
50. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид непосредственно или косвенно ингибирует экспрессию коллагена, или эластина, или и того, и другого для лечения келоида, предотвращения образования, повторного образования или роста келоида, лечения гипертрофического рубца, предотвращения образования, повторного образования или роста гипертрофического рубца, уменьшения образования рубца в месте повреждения, лечения уже имеющегося рубца, уменьшения образования фиброзного поражения в месте повреждения или лечения уже имеющегося фиброзного поражения.
51. Способ по любому из пп. 1-3 или 5, дополнительно включающий введение субъекту второго соединения.
52. Способ по п. 51, где второе соединение представляет собой антисмысловое соединение, направленно действующее на ту же или другую последовательность.
53. Способ по п. 52, где модифицированный олигонуклеотид и второе соединение вводят одновременно.
54. Способ по п. 52, где модифицированный олигонуклеотид и второе соединение вводят последовательно.
55. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид представлен в конъюгате с группировкой, усиливающей проникновение соединения в субъект и/или увеличивающей время удержания соединения в субъекте, где время удержания составляет предпочтительно от 7 до 60 суток.
56. Способ по п. 55, где группировка представляет собой полиэтиленгликоль, гиалуроновую кислоту, холестерин, адамантануксусную кислоту, 1-пиренмасляную кислоту, дигидротестостерон, 1,3-бис-О-(гексадецил)глицерин, гексадецилглицерин, гексадециламин, геранилоксигексил, пальмитиновую кислоту, миристиновую кислоту, спермин, спермидин, фолиевую кислоту, витамин Е, углеводную группировку, пептид (включая спираль Antennapedia, фрагменты Tat вируса иммунодефицита человека (ВИЧ), интегринсвязывающий пептид, транспортин или порфирин.
57. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят в системе доставки, усиливающей проникновение соединения в субъект и/или увеличивающей время удержания соединения в субъекте, где время удержания составляет предпочтительно от 7 до 60 суток.
58. Способ по п. 57, где система доставки содержит катионный липид, липосому, микрочастицу, наночастицу, жидкую композицию со взвешенными частицами с лекарственным средством или без него в растворе для немедленного высвобождения или с депо лекарственного средства в частицах (в частности, частицах PLGA (сополимер молочной и гликолевой кислот) и поли-Arg), жидкую композицию, образующую гель после инъекций, такую как термореактивные/чувствительные жидкости (например, плюрониковые гели), жидкости, содержащие полимер и лекарственное средство в биологически совместимом растворителе, выпадающие в осадок при разведении растворителя биологическими жидкостями (например, атригель), гель, полутвердую композицию, такую как гидрогель (с матричным каркасом или в форме распыляемого раствора), порошок для нанесения во время хирургического вмешательства, рассасывающийся шовный материал, быстрорастворимый гель или полимерную полоску.
59. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят субъекту после хирургического удаления келоида, рубца или фиброзного поражения.
60. Способ по любому из пп. 1-3 или 5, где повреждение кожи является результатом хирургического разреза, биопсии, прокола кожи, удаления кожи, ожога или раны.
61. Способ по любому из пп. 1-3 или 5, где эффективное количество составляет приблизительно 5 мг модифицированного олигонуклеотида на инъекцию на линейный сантиметр келоида, гипертрофического рубца, повреждения кожи, места повреждения, уже имеющегося рубца или уже имеющегося фиброзного поражения.
62. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят на протяжении до 6 месяцев.
63. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят на протяжении до 1 года.
64. Способ по любому из пп. 1-3 или 5, дополнительно включающий введение субъекту другого терапевтического агента.
65. Способ по п. 64, где такой другой терапевтический агент представляет собой стероид, силиконовую повязку, трансформирующий фактор роста-β3 (TGF-β3) (то есть ювисту (Juvista)), коллагеназу (то есть ксифлекс (Xyflex)), 17β-эстрадиол (то есть зестим (Zesteem)), интерлейкин-10 (IL-10) (то есть преваскар (Prevascar)), манноза-6-фосфат (то есть ювидекс (Juvidex)), агент, расслабляющий гладкие мышцы (то есть AZX100, синтетический пептид из 24 аминокислот), терапию стволовыми клетками (то есть GBT009), сывороточный амилоидный белок, антитела против интегрина αvβ6, фактора роста соединительной ткани (CTGF), TGF-β или молекулы, ингибирующие активность ALK-4 и/или ALK-5 (рецепторов TGF-бета), любой ингибитор, разработанный для блокады активности TNF (фактор некроза опухоли) (например, этанерцепт), окклюзионный перевязочный материал, компрессионную терапию, криохирургическое вмешательство, хирургическое удаление, лечение лазером, лучевую терапию, терапию интерфероном, блеомицин, 5-фторурацил, верапамил, крем с имиквимодом, способный стимулировать заживление ран, такой как дермаграфт (Dermagraft), аплиграф (Apligraf), тромбоцитарный фактор роста (PDGF) (регранекс (Regranex)), электрическую стимуляцию, «факторы роста» как группу, перевязочный материал как группу, подслизистую основу тонкой кишки (SIS), промогран (Promogran), гипербарический кислород или их комбинации.
66. Способ по п. 23, где модифицированный олигонуклеотид вводят посредством композиции, ультразвука, электропорации, ионофореза или микроиглы.
67. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят рядом с келоидом, гипертрофическим рубцом, повреждением кожи, местом повреждения, уже имеющимся рубцом или уже имеющимся фиброзным поражением.
68. Способ по п. 67, где модифицированный олигонуклеотид вводят по всей длине келоида, гипертрофического рубца, повреждения кожи, места повреждения, уже имеющегося рубца или уже имеющегося фиброзного поражения.
69. Способ по п. 67, где модифицированный олигонуклеотид вводят вдоль каждой стороны келоида, гипертрофического рубца, повреждения кожи, места повреждения, уже имеющегося рубца или уже имеющегося фиброзного поражения.
70. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят непосредственно в келоид, гипертрофический рубец, повреждение кожи, место повреждения, уже имеющийся рубец или уже имеющееся фиброзное поражение.
71. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят внутрикожно.
72. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят внутрикожно методикой продольной инъекции.
73. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят подкожно.
74. Способ по любому из пп. 1-3 или 5, где модифицированный олигонуклеотид вводят местно.
75. Способ по любому из пп. 1-3 или 5, где субъект генетически предрасположен к образованию келоидов или гипертрофических рубцов, или и того, и другого.
76. Набор для осуществления способа по любому из пп. 1-75, содержащий:
а) устройство, предварительно заполненное композицией, содержащей указанный модифицированный олигонуклеотид; и
б) инструкцию по применению указанной композиции в способе по любому из пп. 1-75.
| US 20100130595 A1, 27.05.2010 | |||
| US 20090137475 А1, 28.05.2009 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| WO 2010027830 A2, 11.03.2010 | |||
| Коррекция рубцов | |||
| Под редакцией КЕННЕТА A | |||
| АРНДТА, М.: Рид Элсивер, 2009 | |||
| - С | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
Авторы
Даты
2017-01-23—Публикация
2012-02-02—Подача