Настоящая заявка испрашивает приоритет предварительной заявки США № 61/383668, поданной 16 сентября 2010 г., и заявки на патент Великобритании № 1101665.6, поданной 31 января 2011 г., при этом полное содержание обоих документов включено сюда ссылкой.
ОБЛАСТЬ ТЕХНИКИ
Это изобретение относится к области иммуногенных композиций, включающих конъюгаты капсулярных сахаридов Streptococcus agalactiae с белками-носителями. Композиции являются полезными для иммунизации.
УРОВЕНЬ ТЕХНИКИ
Капсулярные сахариды бактерий использовались много лет в вакцинах против капсулированных бактерий. Поскольку сахариды представляют собой Т-независимые антигены, то они являются слабоиммуногенными. Конъюгирование с носителем может преобразовать Т-независимые антигены в Т-зависимые антигены, увеличивая таким образом ответы памяти, и обеспечивая развитие защитного иммунитета. Поэтому самые эффективные сахаридные вакцины основаны на гликоконъюгатах, и был создан прототип конъюгатной вакцины против Haemophilus influenzae типа b ("Hib") [например, см. главу 14 ссылки 84].
Другая бактерия, для которой были описаны конъюгатные вакцины, является Streptococcus agalactiae, также известная как "стрептококк группы B" или обозначаемая как "GBS". Большая часть этой работы была выполнена Dennis Kasper с коллегами, и описана в документах, таких как ссылки 1-9. Как было показано, конъюгатные вакцины для каждого из GBS серотипов Ia, Ib, II, III и V были безопасны и иммуногенны для людей [10]. Однако все еще остается потребность в улучшенных конъюгатных вакцинах следующего поколения против GBS.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В первом варианте выполнения изобретения используется один или несколько конъюгатов, которые представляют собой капсулярные сахариды GBS серотипов Ia, Ib, III или V, конъюгированные с белком-носителем. В частности, изобретение предоставляет иммуногенные композиции, включающие один или несколько таких конъюгатов. Композиции могут использоваться в качестве вакцин для предотвращения инфекции этим(и) серотипом(ами) GBS.
Во втором варианте выполнения изобретения предоставляется способ иммунизирования пациента против инфекции GBS, включающий стадию введения пациенту конъюгата, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом дифтерии или его производным, где пациент был предварительно иммунизирован токсоидом дифтерии или его производным. Как правило, конъюгат является одним из конъюгатов GBS иммуногенной композиции по первому варианту выполнения изобретения.
Иммуногенные композиции
В одном варианте выполнения изобретения предоставляется иммуногенная композиция, включающая конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем. Во втором варианте выполнения изобретения предоставляется иммуногенная композиция, включающая конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем. В третьем варианте выполнения изобретения предоставляется иммуногенная композиция, включающая конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. В четвертом варианте выполнения изобретения предоставляется иммуногенная композиция, включающая конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем.
Иммуногенные композиции могут включать более одного конъюгата. Варианты выполнения изобретения, включающие два, три или четыре конъюгата, описаны ниже. Авторы изобретения нашли, что среди этих композиций композиции, включающие конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, могут предоставить защиту против GBS серотипа Ia, в дополнение к GBS серотипа Ib. Это наблюдение отличается от раскрытия ссылки 11, где предполагается, что конъюгаты типа Ib не способны к стимулированию антител, которые могут уничтожить бактерии типа Ia. Соответственно, варианты выполнения изобретения, описанные ниже, включающие конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, могут быть полезны тем, что они обеспечивают увеличенную защиту против серотипа Ia (когда композиция также включает конъюгат, который представляет собой капсулярный сахарид GBS серотипа, конъюгированный с белком-носителем), и даже могут обеспечить защиту, когда композиция не содержит конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем.
Как указано выше, иммуногенные композиции могут включать два конъюгата. В одном варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем. Во втором варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид от GBS серотипа Ia, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. В третьем варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем. В четвертом варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. В пятом варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем. В шестом варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем.
Таким же образом, иммуногенные композиции могут включать три конъюгата. В одном варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, и третий конъюгат представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. Авторы изобретения нашли, что такие композиции (например, такие, как показанные ниже) являются, в частности, подходящими для использования в качестве вакцины для предотвращения инфекции GBS. В этой связи этот вариант представляет собой предпочтительный вариант выполнения изобретения. Во втором варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, и третий конъюгат представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем. В третьем варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем, и третий конъюгат представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем. В четвертом варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем, и третий конъюгат представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем.
Аналогично, иммуногенные композиции могут включать четыре конъюгата. В одном варианте выполнения изобретения первый конъюгат представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем, в то время как второй конъюгат представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, третий конъюгат представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем, и четвертый конъюгат представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем.
Как правило, иммуногенные композиции, описанные выше, не будут включать иных конъюгатов, кроме точно указанных, в частности, не будут включать конъюгатов, включающих капсулярные сахариды иных серотипов GBS, кроме точно указанных. Однако, в некоторых в вариантах выполнения изобретения композиции могут включать и другие конъюгаты, включая конъюгаты, включающие капсулярные сахариды других серотипов GBS. Например, композиции могут включать конъюгат, который представляет собой капсулярный сахарид GBS серотипа II, конъюгированный с белком-носителем. Также композиции могут включать конъюгат, который представляет собой капсулярный сахарид GBS серотипа VI, конъюгированный с белком-носителем. В другом варианте выполнения изобретения, композиции могут включить конъюгат, который представляет собой капсулярный сахарид GBS серотипа VIII, конъюгированный с белком-носителем.
Иммуногенные композиции, описанные выше, могут включать любое подходящее количество капсулярного сахарида(ов) на единицу дозы. Подходящее количество капсулярного сахарида(ов) может составлять от 0,1 до 50 мкг на единицу дозы. Как правило, каждый капсулярный сахарид GBS присутствует в количестве от 1 до 30 мкг, например от 2 до 25 мкг, и в частности - от 5 до 20 мкг. Подходящее количество капсулярного сахарида(ов) может включать 5, 10 и 20 мкг на единицу дозы. Авторы изобретения нашли, что это количество является приемлемым, в частности, когда иммуногенная композиция включает капсулярные сахариды GBS серотипов Ia, Ib и/или III. Поэтому приемлемое количество на единицу дозы каждого капсулярного сахарида в вариантах выполнения изобретения, описанных выше, может быть выбрано из различных вариантов в последующих далее таблицах, где соответствующие варианты выполнения композиций по изобретению обозначены ссылкой на серотип(ы), из которого(ых) получен(ы) капсулярный(ые) сахарид(ы).
Иммуногенные композиции, включающие один конъюгат
Иммуногенные композиции, включающие два конъюгата
Ib: 5 мкг
III: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
V: 20 мкг
Ib: 5 мкг
III: 5 мкг
Ib: 5 мкг
III: 5 мкг
V: 5 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
V: 20 мкг
Ib: 5 мкг
III: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
V: 20 мкг
Иммуногенные композиции, включающие три конъюгата
Ib: 5 мкг
III: 5 мкг
Ib: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
Ib: 5 мкг
III: 10 мкг
Ib: 5 мкг
V: 10 мкг
III: 5 мкг
V: 10 мкг
III: 5 мкг
V: 10 мкг
Ib: 5 мкг
III: 20 мкг
Ib: 5 мкг
V: 20 мкг
III: 5 мкг
V: 20 мкг
III: 5 мкг
V: 20 мкг
Ib: 10 мкг
III: 5 мкг
Ib: 10 мкг
V: 5мкг
III: 10 мкг
V: 5мкг
III: 10 мкг
V: 5мкг
Ib: 10 мкг
III: 10 мкг
Ib: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
Ib: 10 мкг
III: 20 мкг
Ib: 10 мкг
V: 20 мкг
III: 10 мкг
V: 20 мкг
III: 10 мкг
V: 20 мкг
Ib: 20 мкг
III: 5 мкг
Ib: 20 мкг
V: 5 мкг
III: 20 мкг
V: 5 мкг
III: 20 мкг
V: 5 мкг
Ib: 20 мкг
III: 10 мкг
Ib: 20 мкг
V: 10 мкг
III: 20 мкг
V: 10 мкг
III: 20 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
Ib: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
Ib: 5 мкг
III: 5 мкг
Ib: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
Ib: 5 мкг
III: 10 мкг
Ib: 5 мкг
V: 10 мкг
III: 5 мкг
V: 10 мкг
III: 5 мкг
V: 10 мкг
Ib: 5 мкг
III: 20 мкг
Ib: 5 мкг
V: 20 мкг
III: 5 мкг
V: 20 мкг
III: 5 мкг
V: 20 мкг
Ib: 10 мкг
III: 5 мкг
Ib: 10 мкг
V: 5 мкг
III: 10 мкг
V: 5 мкг
III: 10 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
Ib: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
Ib: 10 мкг
III: 20 мкг
Ib: 10 мкг
V: 20 мкг
III: 10 мкг
V: 20 мкг
III: 10 мкг
V: 20 мкг
Ib: 20 мкг
III: 5 мкг
Ib: 20 мкг
V: 5 мкг
III: 20 мкг
V: 5 мкг
III: 20 мкг
V: 5 мкг
Ib: 20 мкг
III: 10 мкг
Ib: 20 мкг
V: 10 мкг
III: 20 мкг
V: 10 мкг
III: 20 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
Ib: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
Ib: 5 мкг
III: 5 мкг
Ib: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
III: 5 мкг
V: 5 мкг
Ib: 5 мкг
III: 10 мкг
Ib: 5 мкг
V: 10 мкг
III: 5 мкг
V: 10 мкг
III: 5 мкг
V: 10 мкг
Ib: 5 мкг
III: 20 мкг
Ib: 5 мкг
V: 20 мкг
III: 5 мкг
V: 20 мкг
III: 5 мкг
V: 20 мкг
Ib: 10 мкг
III: 5 мкг
Ib: 10 мкг
V: 5 мкг
III: 10 мкг
V: 5 мкг
III: 10 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
Ib: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
III: 10 мкг
V: 10 мкг
Ib: 10 мкг
III: 20 мкг
Ib: 10 мкг
V: 20 мкг
III: 10 мкг
V: 20 мкг
III: 10 мкг
V: 20 мкг
Ib: 20 мкг
III: 5 мкг
Ib: 20 мкг
V: 5 мкг
III: 20 мкг
V: 5 мкг
III: 20 мкг
V: 5 мкг
Ib: 20 мкг
III: 10 мкг
Ib: 20 мкг
V: 10 мкг
III: 20 мкг
V: 10 мкг
III: 20 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
Ib: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
III: 20 мкг
V: 20 мкг
Из всех вариантов дозирования, описанных в таблице C, авторы изобретения нашли, что эффективными являются варианты 1, 14 и 27, в частности, когда иммуногенная композиция включает: a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и c) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. В этой связи эти варианты дозирования предпочтительны для использования в изобретении, в частности, для такого варианта выполнения изобретения. Может быть выгодным минимизировать общее количество капсулярного сахарида(ов) на единицу дозы для того, чтобы уменьшить потенциальную токсичность. Соответственно, вариант дозирования 1 является, в частности, предпочтительным.
Вполне возможно дополнительно минимизировать количество капсулярного сахарида(ов) на единицу дозы. В частности подходящее количество капсулярного сахарида(ов) может составлять от 0,1 до 5 мкг на единицу дозы. Как правило, каждый капсулярный сахарид GBS может присутствовать в количестве от 0,1 до 5 мкг, например, в количестве 0,5, 2,5 или 5 мкг на единицу дозы. Например, каждый капсулярный сахарид GBS может присутствовать в количестве от 0,5 до 5 мкг, от 1 до 4 мкг, от 2 до 3 мкг, или присутствовать в количестве приблизительно 2,5 мкг на единицу дозы. Авторы изобретения считают, что это количество будет подходящим, когда иммуногенная композиция, в частности, включает a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и c) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. В этой связи, в таком варианте выполнения изобретения подходящее количество каждого капсулярного сахарида на единицу дозы может быть выбрано из перечисленных вариантов в нижеследующей таблице.
Иммуногенные композиции, включающие капсулярные сахариды серотипов GBS Ia, Ib и III
Из вариантов дозирования, описанных в таблице C', авторы изобретения выделяют, в частности, варианты 1, 14 и 27. В этих вариантах капсулярные сахариды GBS представлены в равных долях (например, как в композициях с более высокими дозами, показанных ниже).
Иммуногенные композиции, включающие четыре конъюгата
Ib: 5 мкг
III: 5 мкг
V: 5 мкг
Ib: 5 мкг
III: 5 мкг
V: 5 мкг
Ib: 5 мкг
III: 5 мкг
V: 5 мкг
Ib: 5 мкг
III: 5 мкг
V: 10 мкг
Ib: 5 мкг
III: 5 мкг
V: 10 мкг
Ib: 5 мкг
III: 5 мкг
V: 10 мкг
Ib: 5 мкг
III: 5 мкг
V: 20 мкг
Ib: 5 мкг
III: 5 мкг
V: 20 мкг
Ib: 5 мкг
III: 5 мкг
V: 20 мкг
Ib: 5 мкг
III: 10 мкг
V: 5 мкг
Ib: 5 мкг
III: 10 мкг
V: 5 мкг
Ib: 5 мкг
III: 10 мкг
V: 5 мкг
Ib: 5 мкг
III: 10 мкг
V: 10 мкг
Ib: 5 мкг
III: 10 мкг
V: 10 мкг
Ib: 5 мкг
III: 10 мкг
V: 10 мкг
Ib: 5 мкг
III: 10 мкг
V: 20 мкг
Ib: 5 мкг
III: 10 мкг
V: 20 мкг
Ib: 5 мкг
III: 10 мкг
V: 20 мкг
Ib: 5 мкг
III: 20 мкг
V: 5 мкг
Ib: 5 мкг
III: 20 мкг
V: 5 мкг
Ib: 5 мкг
III: 20 мкг
V: 5 мкг
Ib: 5 мкг
III: 20 мкг
V: 10 мкг
Ib: 5 мкг
III: 20 мкг
V: 10 мкг
Ib: 5 мкг
III: 20 мкг
V: 10 мкг
Ib: 5 мкг
III: 20 мкг
V: 20 мкг
Ib: 5 мкг
III: 20 мкг
V: 20 мкг
Ib: 5 мкг
III: 20 мкг
V: 20 мкг
Ib: 10 мкг
III: 5 мкг
V: 5 мкг
Ib: 10 мкг
III: 5 мкг
V: 5 мкг
Ib: 10 мкг
III: 5 мкг
V: 5 мкг
Ib: 10 мкг
III: 5 мкг
V: 10 мкг
Ib: 10 мкг
III: 5 мкг
V: 10 мкг
Ib: 10 мкг
III: 5 мкг
V: 10 мкг
Ib: 10 мкг
III: 5 мкг
V: 20 мкг
Ib: 10 мкг
III: 5 мкг
V: 20 мкг
Ib: 10 мкг
III: 5 мкг
V: 20 мкг
Ib: 10 мкг
III: 10 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
V: 5 мкг
Ib: 10 мкг
III: 10 мкг
V: 10 мкг
Ib: 10 мкг
III: 10 мкг
V: 10 мкг
Ib: 10 мкг
III: 10 мкг
V: 10 мкг
Ib: 10 мкг
III: 10 мкг
V: 20 мкг
Ib: 10 мкг
III: 10 мкг
V: 20 мкг
Ib: 10 мкг
III: 10 мкг
V: 20 мкг
Ib: 10 мкг
III: 20 мкг
V: 5 мкг
Ib: 10 мкг
III: 20 мкг
V: 5 мкг
Ib: 10 мкг
III: 20 мкг
V: 5 мкг
Ib: 10 мкг
III: 20 мкг
V: 10 мкг
Ib: 10 мкг
III: 20 мкг
V: 10 мкг
Ib: 10 мкг
III: 20 мкг
V: 10 мкг
Ib: 10 мкг
III: 20 мкг
V: 20 мкг
Ib: 10 мкг
III: 20 мкг
V: 20 мкг
Ib: 10 мкг
III: 20 мкг
V: 20 мкг
Ib: 20 мкг
III: 5 мкг
V: 5 мкг
Ib: 20 мкг
III: 5 мкг
V: 5 мкг
Ib: 20 мкг
III: 5 мкг
V: 5 мкг
Ib: 20 мкг
III: 5 мкг
V: 10 мкг
Ib: 20 мкг
III: 5 мкг
V: 10 мкг
Ib: 20 мкг
III: 5 мкг
V: 10 мкг
Ib: 20 мкг
III: 5 мкг
V: 20 мкг
Ib: 20 мкг
III: 5 мкг
V: 20 мкг
Ib: 20 мкг
III: 5 мкг
V: 20 мкг
Ib: 20 мкг
III: 10 мкг
V: 5 мкг
Ib: 20 мкг
III: 10 мкг
V: 5 мкг
Ib: 20 мкг
III: 10 мкг
V: 5 мкг
Ib: 20 мкг
III: 10 мкг
V: 10 мкг
Ib: 20 мкг
III: 10 мкг
V: 10 мкг
Ib: 20 мкг
III: 10 мкг
V: 10 мкг
Ib: 20 мкг
III: 10 мкг
V: 20 мкг
Ib: 20 мкг
III: 10 мкг
V: 20 мкг
Ib: 20 мкг
III: 10 мкг
V: 20 мкг
Ib: 20 мкг
III: 20 мкг
V: 5 мкг
Ib: 20 мкг
III: 20 мкг
V: 5 мкг
Ib: 20 мкг
III: 20 мкг
V: 5 мкг
Ib: 20 мкг
III: 20 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
V: 10 мкг
Ib: 20 мкг
III: 20 мкг
V: 20 мкг
Ib: 20 мкг
III: 20 мкг
V: 20 мкг
Ib: 20 мкг
III: 20 мкг
V: 20 мкг
В вариантах выполнения изобретения, описанных выше, когда иммуногенная композиция включает более одного конъюгата, отношение массы одного капсулярного сахарида к массе другого капсулярного сахарида(ов) может варьироваться. Подходящие соотношения (мас./мас.) для каждого из капсулярных сахаридов в вариантах выполнения изобретения, описанных выше, могут быть выбраны из вариантов, перечисленных в следующих таблицах, где соответствующие варианты выполнения композиций по изобретению обозначены ссылкой на серотип(ы), из которого(ых) получен(ы) капсулярный(е) сахарид(ы).
Иммуногенные композиции, включающие два конъюгата
Иммуногенные композиции, включающие три конъюгата
Из вариантов соотношений, представленных в таблице F, авторы изобретения выделяют, как эффективный, вариант 1, где иммуногенная композиция включает: a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и c) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. Этот выбор соотношения предпочтителен для использования в изобретении, в частности, для этого варианта выполнения изобретения.
Иммуногенные композиции, включающие четыре конъюгата
Ia, Ib, III и V
Как обсуждалось выше, изобретение частично касается иммуногенных композиций, включающих конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем. Авторы изобретения обнаружили, что иммунный ответ на капсулярный сахарид GBS серотипа V в этих композициях может быть сниженным, если иммуногенная композиция включает один или более дополнительных антигенов. Не желая быть связанными какой-либо теорией, считается, что присутствие дополнительного антигена(ов) приводит к "иммунному вмешательству", приводящему к снижению ответа на капсулярный сахарид GBS серотипа V.
Авторы изобретения обнаружили, что ответ на капсулярный сахарид GBS серотипа V в таких иммуногенных композициях может быть увеличен, если композиция будет включать адъювант. Это наблюдение, в отличие от раскрытия ссылки 12, где предполагается, что адъюванты, возможно, не увеличивают иммунный ответ на конъюгаты GBS. Соответственно, в другом варианте выполнения изобретения настоящее изобретение предлагает иммуногенную композицию, включающую: a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем; b) один или несколько антигенов, которые не включают капсулярный сахарид GBS серотипа V; и c) адъювант. Антиген(ы) компонента b) могут быть конъюгатом(ами), включающим капсулярный сахарид(ы) другого серотипа(ов) GBS. Например, такой конъюгат(ы) может быть капсулярным сахаридом(ами) GBS серотипов Ia, Ib и/или III, конъюгированным(и) с белком-носителем (белками-носителями). Соответственно, такой вариант выполнения изобретения охватывает любую из описанных здесь иммуногенных композиций, которые включают конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем, и которые дополнительно включают один или несколько конъюгатов, которые являются капсулярными сахаридами GBS серотипов Ia, Ib и/или III, конъюгированными с белками-носителями, где композиция дополнительно включает адъювант. Альтернативно, антиген(ы) компонента b) может быть другим видом(ами) антигена, например антигеном(ами), описанным ниже в подразделах "Комбинации конъюгатов и других антигенов" и "Белковые антигены GBS". Соответственно, такой вариант выполнения изобретения также охватывает любую иммуногенную композицию, описанную здесь, которая включают конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем, и один или несколько антигенов, которые не включают конъюгаты капсулярного сахарида(ов) другого(их) серотипа(ов) GBS, и при этом композиция дополнительно включает адъювант. Авторы изобретения обнаружили, что адъювант в таком варианте выполнения изобретения может, например, быть солью алюминия, как описано ниже. Квалифицированный специалист способен идентифицировать и другие адъюванты, которые могут использоваться в таких композициях.
Авторы изобретения обнаружили, что ответ на капсулярный сахарид GBS серотипа V может быть увеличен, если доза этого капсулярного сахарида будет повышена. В частности, если иммуногенная композиция включает конъюгат, который представляет собой капсулярный сахарид GBS иного серотипа, чем серотип V, конъюгированный с белком-носителем, то ответ на капсулярный сахарид типа V может быть увеличен, если доза капсулярного сахарида типа V будет больше, чем доза капсулярного сахарида GBS другого серотипа. Соответственно, в другом варианте выполнения настоящее изобретение предоставляет иммуногенную композицию, включающую: a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем; b) один или несколько конъюгатов, каждый из которых представляет собой капсулярный сахарид GBS иного серотипа, чем серотип V, конъюгированный с белком-носителем; где доза капсулярного сахарида типа V больше, чем общая доза(ы) капсулярного сахарида(ов) GBS другого(их) серотипа(ов), или больше по меньшей мере одной из доз или средней дозы капсулярных сахаридов GBS других серотипов. Доза капсулярного сахарида типа V может быть в 1,1, 2, 3, 4, 5, 6, 7, 8, 9 или в 10 раз больше. Когда компонент b) включает более одного конъюгата, то, как правило, доза капсулярного сахарида типа V будет больше, чем средняя доза капсулярных сахаридов GBS других серотипов. Конъюгат(ы) компонента b) может представлять собой конъюгат, включающий капсулярные сахариды GBS любого серотипа, кроме серотипа V. Например, такой конъюгат(ы) может быть капсулярным сахаридом(ами) GBS серотипа(ов) Ia, Ib и/или III, конъюгированным(ми) с белком-носителем (белками-носителями). Соответственно, этот вариант выполнения изобретения охватывает любую из описанных здесь иммуногенных композиций, которые включают конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем, и которые дополнительно включают один или несколько конъюгатов, которые представляют собой капсулярный(е) сахарид(ы) GBS серотипов Ia, Ib и/или III, конъюгированный(ые) с белком-носителем (белками-носителями); где доза капсулярного сахарида типа V больше, чем общая доза(ы) капсулярного(ых) сахарида(ов) GBS другого(их) серотипа(ов), или по меньшей мере больше, чем одна из доз, или больше средней дозы капсулярных сахаридов GBS других серотипов. Авторы изобретения также нашли, что иммунный ответ на капсулярные сахариды GBS другого серотипа(ов) в таких композициях может быть уменьшен за счет большей дозы капсулярного сахарида типа V. Это последствие может быть снижено, если композиция будет включать адъювант, как описано выше. Это наблюдение снова отличается от раскрытия ссылки 12, где предполагается, что адъюванты, вероятно, не усиливают иммунный ответ на конъюгаты GBS.
Способы введения иммуногенных композиций изобретения обсуждены ниже. Кратко, иммуногенные композиции по изобретению можно вводить однократно или в виде нескольких доз. Авторы изобретения обнаружили, что однократное введение дозы иммуногенных композиций изобретения является эффективным, в частности, когда иммуногенная композиция включает капсулярные сахариды GBS серотипов Ia, Ib и/или III; и более конкретно, когда иммуногенная композиция включает: a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и c) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. В этой связи в изобретении предпочтительно однократное введение дозы, в частности, для таких вариантов выполнения изобретения.
Альтернативно, может быть эффективно введение одной дозы, с последующим введением второй дозы. Как правило, вторая (или третья, четвертая, пятая и т.д.) доза является идентичной первой дозе. Вторую дозу можно вводить в любое подходящее время после введения первой дозы, в частности, через 1, 2 или 3 месяца. Например, если иммуногенная композиция включает капсулярные сахариды GBS серотипов Ia, Ib и/или III, то вторую дозу можно вводить через 3 месяца после первой дозы. В другом примере, если иммуногенная композиция включает капсулярные сахариды GBS серотипов V, то вторую дозу можно вводить через 1 месяц после введения первой дозы. Как правило, иммуногенные композиции по изобретению вводят внутримышечно, например, внутримышечно в бедро или в верхнюю часть руки, как описано ниже.
Как описано ниже, иммуногенные композиции по изобретению могут включать один или несколько адъювантов. Однако авторы изобретения нашли, что использование безадъювантных композиций также эффективно, в частности, когда иммуногенная композиция включает капсулярные сахариды GBS серотипов Ia, Ib и/или III; и более конкретно, когда иммуногенная композиция включает: a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и c) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. С целью уменьшения потенциальной токсичности может быть выгодно исключение адъювантов. Соответственно, иммуногенные композиции, которые не содержат адъюванта (в частности, которые не содержат адъюванта на основе солей алюминия), являются предпочтительными для использования в изобретении, в частности, для таких вариантов выполнения изобретения.
Капсулярный сахарид
Настоящее изобретение основано на капсулярном сахариде Streptococcus agalactiae. Капсулярный сахарид ковалентно связан с основной цепью пептидогликана GBS и является отличным от антигена группы B, который является другим сахаридом, присоединенным к основной цепи пептидогликана.
Капсулярные сахариды GBS химически схожи, но в части антигенности существенно различаются. Все капсулярные сахариды GBS имеют следующий коровый трисахарид:
β-D-GlcpNAc(l→3)β-D-Galp(l→4)β-D-Glcp
Различные серотипы GBS отличаются между собой тем, что коровый сахарид является модифицированным. Различие между серотипами Ia и III, например, является результатом использования в этом коре либо GlcNAc (Ia), либо Gal (III), для связи последовательных коровых трисахаридов (фиг. 1). Оба серотипа Ia и Ib имеют дисахарид [α-D-NeupNAc(2→3)β-D-Galp(1→], связанный с GlcNAc кора, но связь представляет собой либо 1→4 (Ia), либо 1→3 (Ib).
Заболевание, связанное с GBS, возникает, прежде всего, от серотипов Ia, Ib, II, III, IV, V, VI, VII и VIII, и более чем 85% из них вызываются пятью серотипами: Ia, Ib, III и V. Изобретение предпочтительно использует сахарид одного или нескольких этих четырех серотипов, в частности, одного или нескольких серотипов: Ia, Ib и III. Как показано на фиг. 2, капсулярные сахариды каждого из этих четырех серотипов включают: (a) терминальный остаток N-ацетил-нейраминовой (NeuNAc) кислоты (обычно называемой сиаловой кислотой), который во всех случаях связан с остатком галактозы связью 2→3; и (b) остаток N-ацетилглюкозамина (GlcNAc) в пределах трисахаридного кора.
Все четыре сахарида включают остатки галактозы в пределах трисахаридного кора, но серотипы Ia, Ib, II и III также содержат дополнительные остатки галактозы в каждом повторяющемся звене.
Сахариды, используемые согласно изобретению, могут быть представлены в их природной форме или могут быть модифицированными. Например, сахарид может быть короче, чем природный капсулярный сахарид, или может быть химически модифицированным. В частности, капсулярный сахарид серотипа V, используемый в изобретении, может быть изменен, как описано в ссылочных документах 13 и 14. Например, капсулярный сахарид серотипа V, который был существенно десиалирован (фиг. 3), как описано в ссылочных документах 13 и 14, в явном виде предусматривается для использования в настоящем изобретении. Десиалированный капсулярный сахарид GBS серотипа V может быть получен путем обработки очищенного капсулярного сахарида GBS серотипа V в слабокислых условиях (например, 0,1M серной кислотой при 80°C в течение 60 минут) или обработкой нейраминидазой, как описано в ссылке 13. Предпочтительный способ получения десиалированного капсулярного сахарида GBS серотипа V состоит в обработке очищенного сахарида 1M уксусной кислотой при 81±3°C в течение двух часов. Таким образом, сахарид, используемый согласно изобретению, может быть по существу полноразмерным капсулярным полисахаридом, как он присутствует в природной форме, или он может быть короче, чем природный полисахарид. Полноразмерные полисахариды могут быть деполимеризованы с получением более коротких фрагментов для использования в изобретении, например, за счет гидролиза в слабой кислоте, нагревания, разделения хроматографией и т.п. Как сообщалось, длина цепи влияет на иммуногенность сахаридов GBS у кроликов [ссылка 4]. В частности, капсулярные сахариды серотипов II и/или III, используемые в изобретении, могут быть деполимеризированы, как описано в ссылках 15 и 16. Эти документы описывают частичную деполимеризацию капсулярных сахаридов типа II и типа III слабым дезаминирующим расщеплением до антигенных фрагментов, с восстановлением терминальных остатков 2,5-ангидро-D-маннозы. Кратко, капсулярный сахарид растворяли в 0,5 н. NaOH и нагревали при 70°C в течение приблизительно от 1 до 4 часов. Продолжительность этой инкубации контролирует уровень деполимеризации, который может быть определен стандартными способами (например, при помощи ВЭЖХ, как описано в ссылке 15). Проба охлаждалась в ванне воды со льдом перед добавлением ледяной уксусной кислоты для доведения величины pH до 4. Затем частично N-деацилированный продукт дезаминировали путем добавления 5% (мас./объем) NaNO2 с перемешиванием при 4°C в течение двух часов. Свободные альдегиды вновь образованных остатков 2,5-ангидро-D-маннозы могут быть использованы для конъюгирования с белком-носителем, как описано ниже.
О деполимеризации капсулярного сахарида серотипа III при помощи эндо-β-галактозидазы сообщалось в ссылках 1 и 4-6, при этом деполимеризованный материал использовался для формирования конъюгатов с носителем, который представлял собой токсоид столбняка. Для деполимеризации капсулярных полисахаридов GBS серотипов III и VIII также использовался озонолиз [ссылка 17]. Предпочтительно использовать сахариды с молекулярной массой более 30 кДа, и могут использоваться по существу полноразмерные капсулярные полисахариды. Для серотипа Ia, предпочтительно использовать полисахариды с молекулярной массой в диапазоне 150-300 кДа, в частности - 175-275 кДа. Как правило, используется сахарид серотипа Ia с молекулярной массой, приблизительно равной 200 кДа или приблизительно равной 260 кДа. Для серотипа Ib предпочтительно использовать полисахариды с молекулярной массой в диапазоне 150-300 кДа, в частности - 175-250 кДа. Как правило, используется сахарид серотипа Ib с молекулярной массой, приблизительно равной 200 кДа или приблизительно равной 230 кДа. Для серотипа III предпочтительно использовать полисахариды с молекулярной массой в диапазоне 50-200 кДа, в частности - 80-150 кДа. Как правило, используется сахарид серотипа III с молекулярной массой, приблизительно равной 100 кДа или приблизительно равной 140 кДа. Для серотипа V предпочтительно использовать полисахариды с молекулярной массой приблизительно до 50 кДа. Как правило, используется сахарид серотипа V с молекулярной массой, приблизительно равной 100 кДа. Эти молекулярные массы могут быть измерены гель-фильтрацией относительно декстрановых стандартов, таких как доступные от Polymer Standard Service [ссылка 18].
Сахарид может быть химически модифицирован по отношению к природному капсулярному сахариду. Например, сахарид может быть O-дезацетилирован (частично или полностью), N-дезацетилирован (частично или полностью), N-пропионирован (частично или полностью) и т.д. Дезацетилирование может быть выполнено до, во время или после конъюгирования, но предпочтительно его проводят перед конъюгированием. В зависимости от конкретного сахарида, дезацетилирование может влиять или не влиять на иммуногенность. Уместность О-ацетилирования сахаридов GBS различных серотипов обсуждена в ссылке 19, и в некоторых вариантах выполнения изобретения О-ацетилирование остатков сиаловых кислот в положениях 7, 8 и/или 9 выполняют до, в течение и после конъюгирования, например, с защитой/снятием защиты, повторным ацетилированием и т.д. Однако, как правило, для сахарида GBS, используемого в настоящем изобретении, по существу не проводят никакого О-ацетилирования остатков сиаловых кислот в положениях 7, 8 и/или 9. В частности, когда сахарид GBS очищен щелочной экстракцией, как описано ниже, то О-ацетилирование, как правило, не выполняется (ссылка 19). Эффект дезацетилирования и т.п. может быть оценен обычным испытанием.
Капсулярные сахариды могут быть очищены известными способами, такими как описано в цитируемых здесь ссылках, например, в ссылках 2 и 20. Типичный способ включает щелочную экстракцию, центрифугирование, фильтрацию, обработку РНКазой/ДНКазой, обработку протеазой, концентрирование, эксклюзионную хроматографию, ультрафильтрацию, ионообменную хроматографию и, дополнительно, ультрафильтрацию. Обработка клеток GBS ферментом мутанолизином, который расщепляет бактериальную стенку клетки для высвобождения компонентов стенки клетки, также полезна.
В качестве альтернативы может использоваться способ очистки, описанный в ссылке 21. Он включает щелочную экстракцию, обработку смесью этанол/CaCl2, осаждение с помощью CTAB и ресолюбилизацию. Дополнительный альтернативный способ описан в ссылке 22.
Изобретение не ограничено сахаридами, выделенными очисткой из природных источников, и сахариды могут быть получены другими способами, такими как полный или частичный синтез.
Конъюгирование
Изобретение включает конъюгаты, которые представляют собой капсулярные сахариды GBS серотипов Ia, Ib, III или V, конъюгированные с белком-носителем. В целом, ковалентное конъюгирование сахаридов и носителей увеличивает иммуногенность сахаридов, поскольку это преобразовывает их из Т-независимых антигенов в Т-зависимые антигены, обеспечивая тем самым примирование иммунологической памяти. В частности, конъюгирование полезно для педиатрических вакцин [см., например, ссылку 23] и является известной техникой [см. обзор в ссылках 24 и 32]. Таким образом, способы изобретения могут включать дополнительную стадию конъюгирования очищенного сахарида и молекулы носителя.
Конъюгирование сахаридов GBS широко известно, см., например, ссылки 1-9. Типичный способ уровня техники для конъюгирования сахарида GBS, как правило, включает восстанавливающее аминирование очищенного сахарида белком-носителем, такого как токсоид столбняка (TT) или CRM197 [ссылка 2]. Восстанавливающее аминирование охватывает аминогруппу боковой цепи аминокислоты носителя и альдегидную группу сахарида. Поскольку капсулярные сахариды GBS в их природной форме не включают альдегидных групп, то, как правило, их формируют путем окисления перед конъюгированием (например, периодатным окислением) части остатков сиаловых кислот (например, от 5 до 40%, в частности, от 10 до 30%, и, предпочтительно - приблизительно 20%) сахарида [см. ссылки 2, 33]. Было показано, что конъюгатные вакцины, полученные таким способом, были безопасны и иммуногенны для людей в отношении GBS каждого из серотипов Ia, Ib, II, III и V [см. ссылку 10]. Как правило, все конъюгаты иммуногенных композиций настоящего изобретения были получены таким способом. Однако, когда в изобретении используется капсулярный сахарид серотипа V, который являются десиалированным, альдегидная группа в этом сахариде может быть образована окислением (например, периодатным окислением) перед конъюгированием части остатков галактозы в сахариде (например, от 5 до 40%, в частности, от 10 до 30%, предпочтительно - приблизительно 20% остатков) [см. ссылку 14]. Альтернативный способ конъюгирования включает использование -NH2-групп в сахариде (или при N-дезацетилировании, или после введения аминов) совместно с бифункциональными линкерами, как описано в ссылке 34. В некоторых вариантах выполнения изобретения один или несколько конъюгатов иммуногенных композиций настоящего изобретения были получены этим способом. Дополнительный альтернативный способ описан в ссылках 15 и 16. В этом способе используются свободные альдегидные группы терминальных остатков 2,5-ангидро-D-маннозы, полученные при деполимеризации капсулярных сахаридов серотипа II или типа III слабым дезаминирующим расщеплением, для конъюгирования с помощью восстанавливающего аминирования. В некоторых вариантах выполнения изобретения один или несколько конъюгатов в иммуногенных композициях настоящего изобретения были получены этим способом.
Изобретение включает использование молекул носителя, которые, как правило, представляют собой белки. Полезные белки-носители включают бактериальные токсины или токсоиды, такие как токсоид дифтерии или токсоид столбняка. Могут также использоваться фрагменты токсинов или токсоидов, например, фрагмент C токсоида столбняка [см. ссылку 35]. Мутант CRM197 токсина дифтерии [см. ссылки 36-38], в частности, является полезным для настоящего изобретения. Другие подходящие белки носителя включают внешний мембранный белок N. meningitidis [см. ссылку 39], синтетические пептиды [см. ссылки 40, 41], белки теплового шока [см. ссылки 42, 43], белки коклюша [см. ссылки 44, 45], цитокины [см. ссылку 46], лимфокины [см. ссылку 46], гормоны [см. ссылку 46], факторы роста [см. ссылку 46], сывороточный альбумин человека (предпочтительно рекомбинантный), искусственные белки, включающие множество эпитопов для CD4+ Т-клеток человека из различных антигенов, полученных из патогенов [см. ссылку 47], таких как N19 [см. ссылку 48], белок D из H. influenzae [см. ссылки 49, 50], пневмококковый поверхностный белок PspA [см. ссылку 51], пневмолизин [см. ссылку 52], белки поглощения железа [см. ссылку 53], токсин A или токсин B из C. difficile [см. ссылку 54], рекомбинантный экзопротеин Pseudomonas aeruginosa (rEPA) [см. ссылку 55], белок GBS (см. ниже; в частности GBS67) [см. ссылку 206], и т.п.
Присоединение к носителю предпочтительно осуществляется через -NH2-группу, например, боковой цепи остатка лизина в белке-носителе, или через остаток аргинина, или по N-концу. Присоединение может также осуществляться через -SH-группу, например, боковой цепи остатка цистеина.
Возможно использование более одного белка-носителя, например, для того, чтобы уменьшить риск супрессии носителя. Таким образом, могут использоваться различные белки-носители для различных серотипов GBS, например, сахариды серотипа Ia могут быть конъюгированы с CRM197, в то время как сахариды серотипа Ib могут быть конъюгированы с токсоидом столбняка. Также можно использовать более одного белка-носителя для конкретного сахаридного антигена; например, сахариды серотипа III могут быть представлены в двух группах, где некоторые из них конъюгированы с CRM197, а другие конъюгированы с токсоидом столбняка. Однако в целом предпочтительно, чтобы для всех сахаридов использовался один и тот же белок-носитель.
Один белок-носитель может нести более одного сахаридного антигена [см. ссылки 56 и 57]. Например, один белок-носитель может быть конъюгирован с сахаридами серотипов Ia и Ib. Для достижения этой цели различные сахариды могут быть смешаны до реакции конъюгирования. Однако в целом предпочтительно иметь отдельные конъюгаты для различных сахаридов каждой серогруппы, которые смешивают после конъюгирования. Отдельные конъюгаты могут иметь одинаковые носители.
Как правило, используются конъюгаты с соотношением сахарид:белок, составляющим от 1:5 (т.е. избыток белка) до 5:1 (т.е. избыток сахарида), при конкретных соотношениях от 1:5 до 2:1 (мас./мас.). Когда в изобретении используется конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем, то соотношение сахарид:белок составляет, как правило, приблизительно от 1:1 до 1:2, в частности, приблизительно 1:1,3 (мас./мас.). Аналогично, когда в изобретении используется конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем, то соотношение сахарид:белок составляет, как правило, приблизительно от 1:1 до 1:2, в частности, приблизительно 1:1,3 (мас./мас.). Когда в изобретении используется конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем, то соотношение сахарид:белок составляет, как правило, приблизительно от 3:1 до 1:1, в частности, приблизительно 2:1 (мас./мас.). Однако также может использоваться GBS серотипа III, конъюгированный с белком-носителем, при соотношении сахарид:белок, составляющим приблизительно от 1:1 до 1:5, в частности, приблизительно 1:3,3 (мас./мас.). Наконец, когда в изобретении используется конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем, то соотношение сахарид:белок, как правило, составляет приблизительно от 2:1 до 1:1, в частности, приблизительно 1,1:1. Таким образом, избыток массы сахарида является типичным, в частности, в случае сахарида с более длинными цепями.
Композиции могут включать небольшое количество свободного носителя [см. ссылку 58]. Когда такой белок-носитель присутствует в композиции по изобретению как в свободной, так и в конъюгированной форме, то неконъюгированная форма составляет предпочтительно не более 5% общей массы белка-носителя в композиции в целом, и более предпочтительно, когда свободный белок-носитель присутствует в количестве менее 2% по массе.
После конъюгирования свободные и конъюгированные сахариды могут быть разделены. Известно много подходящих способов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.п. [см. ссылки 59, 60 и т.п.]. Предпочтительный способ описан в ссылке 61.
Когда композиция по изобретению включает деполимеризованный олигосахарид, то предпочтительно, что деполимеризация выполняется до конъюгирования.
Комбинации конъюгатов и других антигенов
Иммуногенные композиции по изобретению могут включать один или более дополнительных антигенов.
Дополнительный антиген(ы) может включать дополнительные конъюгаты GBS. Различные конъюгаты GBS могут включать различные типы конъюгатов GBS того же самого серотипа и/или конъюгаты GBS различных серотипов. Композицию, как правило, получают путем приготовления отдельных конъюгатов (например, различных конъюгатов для каждого серотипа) и последующего объединения конъюгатов.
Дополнительный антиген(ы) может включать аминокислотные последовательности GBS, как изложено ниже.
Дополнительный антиген(ы) может включать антигены патогенов, не относящихся к GBS. Таким образом, композиции по изобретению могут дополнительно включать один или несколько антигенов, не происходящих из GBS, включая дополнительные антигены бактерий, вирусов или паразитов. Они могут быть выбраны из:
- белкового антигена N. meningitidis серогруппы B, такого как описано в ссылках 62-68, с белком "287" (см. ниже), и его производных (например "AG287"), которые являются предпочтительными;
- препарата везикулы внешней мембраны (OMV) N. meningitidis серогруппы B, такого как раскрыто в ссылках 69, 70, 71, 72 и т.п.;
- сахаридного антигена N. meningitidis серогрупп A, C, W135 и/или Y, такого как олигосахарид, раскрытый в ссылке 73, олигосахарида серогруппы C или олигосахарида, описанного в ссылке 74;
- сахаридного антигена Streptococcus pneumoniae [см., например, ссылки 75-77; главы 22 и 23 из ссылки 84];
- антигена вируса гепатита, такого как инактивированный вирус [см., например, ссылки 78 и 79; главу 15 из ссылки 84];
- антигена вируса гепатита B, такого как поверхностный и/или коровый антиген [см., например, ссылки 79 и 80; главу 16 из ссылки 84];
- антигена вируса гепатита C [см., например, ссылку 81];
- антигена Bordetella pertussis, такого как голотоксин коклюша (PT) и филаментный гемагглютинин (FHA) B. pertussis, необязательно в комбинации с пертактином и/или агглютиногенами 2 и 3 [см., например, ссылки 82 и 83; главу 21 из ссылки 84];
- антигена дифтерии, такого как токсоид дифтерии [см., например, главу 13 из ссылки 84];
- антигена столбняка, такого как токсоид столбняка [см., например, главу 27 из ссылки 84];
- сахаридного антигена Haemophilus influenzae серогруппы B [см., например, главу 14 из ссылки 84];
- антигена N. gonorrhoeae [см., например, ссылки 62, 63 и 64];
- антигена Chlamydia pneumoniae [см., например, ссылки 85, 86, 87, 88, 89, 90 и 91];
- антигена Chlamydia trachomatis [см., например, ссылку 92];
- антигена Porphyromonas gingivalis [см., например, ссылку 93];
- антигена(ов) полиомиелита [см., например, ссылки 94 и 95; главу 24 из ссылки 84], такого как IPV;
- антигена(ов) вируса бешенства [см., например, ссылку 96], такого как лиофилизированный инактивированный вирус [например, см. ссылку 97, RabAvertTM];
- антигенов кори, свинки и/или краснухи [см., например, главы 19, 20 и 26 из ссылки 84];
- антигена(ов) гриппа [см., например, главы 17 и 18 из ссылки 84], такого как гемагглютинин и/или белок поверхностной нейраминидазы;
- антигена Moraxella catarrhalis [см., например, ссылку 98];
- антигена Streptococcus pyogenes (стрептококк группы А) [см., например, ссылки 99, 100 и 101];
- антигена Staphylococcus aureus [см., например, ссылку 102].
Когда используется сахаридный или углеводный антиген, то их предпочтительно конъюгировать с носителем для того, чтобы увеличить иммуногенность. Конъюгирование сахаридных антигенов H. influenzae серогруппы B, менингококков и пневмококков является известным.
Токсичные белковые антигены могут быть при необходимости детоксифицированы (например, см. ссылку 83 в части детоксификации токсина коклюша химическими и/или генетическими средствами).
Когда антиген дифтерии включен в композицию, то предпочтительно также включать антиген столбняка и антигены коклюша. Аналогично, когда включен антиген столбняка, то предпочтительно также включать антигены коклюша и дифтерии. Также, когда включен антиген коклюша, то предпочтительно также включать антигены столбняка и дифтерия.
Антигены могут быть адсорбированы на соли алюминия. Когда в композиции присутствует более чем один конъюгат, то нет необходимости адсорбции всех конъюгатов.
Один предпочтительный тип композиции включает дополнительные антигены из патогенов, передающихся половым путем, таких как: герпесвирус; N. gonorrhoeae; C. trachomatis; и т.п. Другой предпочтительный тип композиции включает дополнительные антигены, которые затрагивают пожилых субъектов и/или субъектов с ослабленным иммунитетом, и, таким образом, антигены GBS изобретения могут быть объединены с одним или несколькими антигенами из следующих, не относящихся к GBS, патогенов: вируса гриппа, Enterococcus faecalis, Staphylococcus epidermis, Pseudomonas aeruginosa, Legionella pneumophila, Listeria monocytogenes, Neisseria meningitidis и вируса парагриппа.
Антигены в композиции будут, как правило, присутствовать в концентрации, по меньшей мере равной 1 мкг/мл, для каждого. В целом, концентрация любого антигена должна быть достаточной, чтобы вызвать иммунный ответ против этого антигена.
Как альтернатива использованию белковых антигенов, в композиции по изобретению может использоваться нуклеиновая кислота, кодирующая антиген [см., например, ссылки 103-111]. Таким образом, белковые компоненты композиций изобретения могут быть заменены нуклеиновой кислотой, которая кодирует белок (предпочтительно ДНК, например, в форме плазмиды).
На практике может существовать верхний предел для числа антигенов, включенных в композиции по изобретению. Число антигенов (включая антигены GBS) в композиции по изобретению может быть менее 20, менее 19, менее 18, менее 17, менее 16, менее 15, менее 14, менее 13, менее 12, менее 11, менее 10, менее 9, менее 8, менее 7, менее 6, менее 5, менее 4, менее 3 или менее 2. Число антигенов GBS в композиции по изобретению может быть менее 6, менее 5, менее 4, менее 3 или менее 2.
Фармацевтические способы и применения
Иммуногенные композиции по изобретению могут дополнительно включать фармацевтически приемлемый носитель. Типичные фармацевтически приемлемые носители включают любой носитель, который сам по себе не индуцирует продукцию антител, вредных для человека, которому вводят композицию. Подходящие носители являются, как правило, большими, медленно метаболизируемыми макромолекулами, такими как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, аминокислотные полимеры, аминокислотные сополимеры, сахароза [см. ссылку 112], трегалоза [см. ссылку 113], лактоза и липидные агрегаты (такие как капли масла или липосомы). Такие носители известны специалистам в данной области. Вакцины могут также содержать разбавители, такие как вода, солевой физиологический раствор, глицерин и т.п. Дополнительно могут присутствовать вспомогательные вещества, такие как солюбилизатор или эмульгатор, буферы pH и т.п. Стерильный, апирогенный, забуференный фосфатом физиологический солевой раствор представляет собой типичный носитель. Полный обзор фармацевтически приемлемых эксципиентов представлен в ссылке 114.
Композиции по изобретению могут быть в водной форме (то есть в виде раствора или суспензии) или в высушенной форме (например, в лиофилизированной форме). Если будет использоваться вакцина в сухой форме, то она должна быть восстановлена в жидкую форму до инъецирования. Лиофилизирование конъюгатных вакцин известно в уровне техники; например, продукт MenjugateTM представлен в лиофилизированной форме. Когда иммуногенные композиции по изобретению включают конъюгаты, включающие капсулярные сахариды более чем одного серотипа GBS, то, как правило, конъюгаты получают по отдельности, смешивают и затем лиофилизируют. Таким образом, как описано здесь, могут быть получены лиофилизированные композиции, включающие два, три или четыре и т.д. конъюгата. Чтобы стабилизировать конъюгаты во время лиофилизирования, может быть предпочтительным включение в композиции сахарного спирта (например, маннита) и/или дисахарида (например, сахарозы или трегалозы) в количестве, например, от 1 до 30 мг/мл, например, приблизительно 25 мг/мл. Использование сахарозы было рекомендовано в качестве стабилизатора для конъюгированных вакцин GBS (см. ссылку 115). При этом типичным стабилизатором вакцин настоящего изобретения является маннит. Когда высушенная вакцина будет восстанавливаться в жидкую форму перед инъецированием, остаточная концентрация маннита будет, как правило, составлять приблизительно 2-20 мг/мл, например 3,75 мг/мл, 7,5 мг/мл или 15 мг/мл. Использование маннита выгодно, поскольку маннит химически отличается от моносахаридных субъединиц капсулярных сахаридов GBS. Это означает, что обнаружение капсулярных сахаридов, например, при анализе контроля качества, может быть основано на выявлении сахаридных субъединиц без мешающего влияния маннита. В противоположность этому, стабилизатор, такой как сахароза, содержит глюкозу, которая может отрицательно влиять на выявление субъединиц глюкозы в сахаридах.
Композиции могут быть представлены в укупорках (флаконах), или они могут быть включены в шприцы, готовые для применения. Шприцы могут поставляться с иглами или без них. Шприц будет включать единичную дозу композиции, тогда как укупорка в виде флакона может включать единичную дозу или несколько доз.
Водные композиции по изобретению являются также подходящими для восстановления других вакцин из их лиофилизированной формы. Когда композиция по изобретению будет использоваться для такого эктемпорального восстановления, изобретение обеспечивает набор, который может включать два флакона, или может включать один шприц, готовый для применения, и один флакон, где содержимое шприца или флакона с раствором используется для восстановления флакона с сухим содержимым перед инъецированием.
Композиции по изобретению могут быть упакованы в форме единичной дозы или в мультидозовой форме. Для мультидозовых форм флаконы являются более предпочтительными чем шприцы, готовые для применения. Эффективные объемы доз могут быть определены обычным путем, но типичная доза композиции для введения человеку, например, для внутримышечной инъекции, имеет объем 0,5 мл.
Значение pH композиции предпочтительно составляет от 6 до 8, и предпочтительно имеет значение, равное приблизительно 7. Стабильное значение pH может быть поддержано при помощи буфера. Иммуногенные композиции по изобретению, как правило, включают буфер на основе дигидрофосфата калия. Буфер на основе дигидрофосфата калия включает приблизительно 1-10 мМ дигидрофосфата калия, например, 1,25 мМ, 2,5 мМ или 5,0 мМ. Если композиция включает соль гидроокиси алюминия, то предпочтительно использовать гистидиновый буфер [см., ссылку 116]. Композиция может быть стерильной и/или апирогенной. Композиции по изобретению могут быть изотоническими в отношении людей.
Композиции по изобретению являются иммуногенными, и более предпочтительно, являются вакцинными композициями. Вакцины по изобретению могут быть профилактическими (то есть предотвращать инфекцию) или терапевтическими (то есть лечить инфекцию), но, как правило, они являются профилактическими. Иммуногенные композиции, используемые в качестве вакцины, включают иммунологически эффективное количество антигена(ов), так же как и любые другие компоненты, если это необходимо. Термин "иммунологически эффективное количество" означает, что введение этого количества индивидууму в виде однократной дозы или как части ряда дозировок, эффективно для лечения или предотвращения заболевания. Это количество варьирует в зависимости от состояния здоровья и физического состояния индивидуума, которому будет вводиться композиция, от его возраста, таксономической группы индивидуума, которому будет вводиться композиция, (например, не человекообразный примат, примат, и т.п.), от способности иммунной системы индивидуума синтезировать антитела, от уровня желаемой защиты, вида формы вакцины, от медицинской ситуации, оцениваемой врачом, и от других релевантных факторов. Ожидается, что количество будет находиться в относительно широком диапазоне, который может быть определен путем обычных испытаний.
В пределах каждой дозы, количество индивидуального сахаридного антигена в целом будет находиться в пределах между 0,1 и 50 мкг (по массе сахарида), в частности, между 1 и 50 мкг или 0,5 и 25 мкг, более конкретно, между 2,5 и 7 мкг, например, составлять приблизительно 1 мкг, приблизительно 2 мкг, приблизительно 5 мкг, приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг или приблизительно 25 мкг. В пределах каждой дозы, общее количество капсулярных сахаридов GBS будет в целом составлять менее или ровно 70 мкг (по массе сахарида), например, менее или ровно 60 мкг. В частности, общее количество может быть менее или ровно 40 мкг (например, менее или ровно 30 мкг) или менее или ровно 20 мкг (например, менее или ровно 15 мкг). Авторы изобретения нашли, что эти общие количества эффективны, когда иммуногенная композиция в частности включает: a) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и c) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем. Поэтому эти общие количества предпочтительны для использования в изобретении, в частности, для этого воплощения. Может быть выгодным минимизировать общее количество капсулярного сахарида(ов) на единицу дозы, для того, чтобы уменьшить потенциальную токсичность. Соответственно, предпочтительно общее количество, которое составляет менее или ровно 20 мкг, например, менее или ровно 15 мкг, менее или ровно 7,5 мкг или менее или ровно 1,5 мкг.
GBS воздействует на различные области организма, и поэтому композиции по изобретению могут быть приготовлены в различных формах. Например, композиции могут быть приготовлены как инъецируемые, т.е. как жидкие растворы или как суспензии. Композиция может быть представлена в форме для легочного введения, например в виде ингалятора, где используется тонкодисперсный порошок, или спрея. Композиция может быть приготовлена в виде суппозитория или пессария. Композиция может быть представлена в форме для назального, ушного или для глазного введения, например в виде спрея, капель, геля или порошка [см., например ссылки 117 и 118]. Сообщалось об успешном назальном введении пневмококковых сахаридов [см. ссылки 119 и 120], сахаридов Hib [см. сылку 121], сахаридов MenC [см. ссылку 122], и конъюгатов смеси сахаридов Hib и MenC [см. ссылку 123].
Композиции по изобретению могут включать антибактериальный препарат, в частности, для случая укупорки для множества доз.
Композиции по изобретению могут включать детергент, например, Tween (полисорбат), такой как Tween 80. Детергенты в целом присутствуют на низких уровнях, например, в количестве менее 0,01%.
Композиции по изобретению могут включать соли натрия (например, хлористый натрий), для обеспечения тоничности. Типичной концентрацией NaCl является значение 10±2 мг/мл. В некоторых вариантах выполнения изобретения может использоваться концентрация NaCl, равная 4-10 мг/мл, например, 9,0, 7,0, 6,75 или 4,5 мг/мл.
Как правило, композиции по изобретению будут включать буфер. В качестве буфера типичным является фосфатный буфер.
Композиции по изобретению можно вводить в комбинации с другим иммунорегуляторам. В частности, композиции могут включать один или несколько адъювантов. Такие адъюванты включают, но без ограничения, следующее.
A. Минералсодержащие композиции
Минералсодержащие композиции, подходящие для использования в настоящем изобретении в качестве адъювантов, включают минеральные соли, такие как соли алюминия и соли кальция (или их смеси). Соли кальция включают фосфат кальция (например, частицы "CAP", раскрытые в ссылке 124). Соли алюминия включают гидроокиси, фосфаты, сульфаты, и т.д., в любой подходящей для соли форме (например, в виде геля, кристаллической форме, аморфной форме и т.п.). Адсорбция на этих солях является предпочтительной. Минералсодержащие композиции могут также быть представлены в виде частиц соли металла [см. ссылку 125].
Могут использоваться адъюванты, известные как гидроокись алюминия и фосфат алюминия. Эти названия являются общепринятыми, и они используются только для удобства, поскольку ни одно из них не отражает точного фактического состава химического соединения, которое представлено в адъюванте (см., например, главу 9 ссылки 126). В изобретение может использоваться любой из "гидроокисных" или "фосфатных" адъювантов, которые традиционно используются как адъюванты. Адъюванты, известные как "гидроокись алюминия", являются, как правило, солями гидроокиси алюминия, которые обычно, по меньшей мере, частично кристаллизованы. Адъюванты, известные как "фосфат алюминия", являются, как правило, гидроксифосфатами алюминия, часто также содержащими небольшое количество сульфата (то есть сульфата гидроксифосфата алюминия). Они могут быть получены осаждением, и условия реакции и концентрации во время осаждения соли влияют на уровень замещения фосфата на гидроксил.
Волокнистая морфология (например, определенная с помощью электронной трансмиссионной микроскопии) является типичной для адъювантов на основе гидроокиси алюминия. Значение pI для адъювантов на основе гидроокиси алюминия, как правило, составляет приблизительно 11, то есть адъювант как таковой имеет положительный поверхностный заряд при физиологическом значении pH. Сообщалось, что адъюванты на основе гидроокиси алюминия обладают адсорбционной емкостью по белку на уровне 1,8-2,6 мг на мг Al+++ при значении pH, равном 7,4.
Адъюванты на основе фосфата алюминия в целом имеют молярное отношение PO4/Al между 0,3 и 1,2, предпочтительно между 0,8 и 1,2, и более предпочтительно - 0,95±0,1. Фосфат алюминия в целом является аморфным, в частности, это касается солей гидроксифосфата. Типичный адъювант представляет собой аморфный гидроксифосфат алюминия с молярным отношением PO4/Al между 0,84 и 0,92, при содержании 0,6 мг Al3+ на миллилитр. Фосфат алюминия в целом является макрочастицей (например, с пластинчатой морфологией, как определяется с помощью электронной трансмиссионной микроскопии). Типичные диаметры частиц, после адсорбции любого антигена, находятся в диапазоне 0,5-20 мкм (например, приблизительно 5-10 мкм). Сообщалось, что адъюванты на основе фосфата алюминия обладают адсорбционной емкостью по белку на уровне 0,7-1,5 мг на мг Al+++ при значении pH, равном 7,4.
Точка нулевого заряда (PZC) фосфата алюминия связана обратной пропорцией с уровнем замены фосфата на гидроксил, и этот уровень замены может изменяться в зависимости от условий реакции и концентрации реагентов, используемых для того, чтобы получить соль путем осаждения. PZC также изменяется при изменении концентрации свободных ионов фосфата в растворе (больше фосфата = более кислотная PZC) или при добавлении буфера, такого как гистидиновый буфер (PZC становится более щелочной). У фосфатов алюминия, используемых согласно изобретению, в целом значение PZC будет находиться между 4,0 и 7,0, более предпочтительно между 5,0 и 6,5, и, например, будет составлять приблизительно, 5,7.
Суспензии солей алюминия, используемые для получения композиций изобретения, могут содержать буфер (например, фосфатный, гистидиновый или Tris буфер), но это не всегда является необходимым. Предпочтительно, суспензии являются стерильными и апирогенными. Суспензия может включать свободные водные ионы фосфата, которые, например, присутствуют в концентрации между 1,0 и 20 мМ, предпочтительно между 5 и 15 мМ, и более предпочтительно - в концентрации приблизительно 10 мМ. Суспензии могут также включать хлорид натрия.
В изобретение может использоваться смесь гидроокиси и фосфата алюминия. В этом случае количество фосфата алюминия может быть больше, чем количество гидроокиси алюминия, и отношение масс может составлять, например, по меньшей мере 2:1, например, более или ровно 5:1, более или ровно 6:1, более или ровно 7:1, более или ровно 8:1, более или ровно 9:1 по массе, и т.п.
Концентрация Al+++ в композиции, предназначенной для введения пациенту, предпочтительно составляет менее 10 мг/мл, например, менее или ровно 5 мг/мл, менее или ровно 4 мг/мл, менее или ровно 3 мг/мл, менее или ровно 2 мг/мл, менее или ровно 1 мг/мл и т.п. Предпочтительный диапазон составляет между 0,3 и 1 мг/мл. Максимум концентрации, составляющий 0,85 мг на дозу, является предпочтительным.
Типичный вспомогательный адъювант на основе фосфата алюминия представляет собой аморфный гидроксифосфат алюминия с молярным соотношением PO4/Al между 0,84 и 0,92, при содержании 0,6 мг Al3+ на миллилитр. Для адсорбции может использоваться низкая доза фосфата алюминия, например, между 50 и 100 мкг Al3+ на дозу конъюгата.
B. Эмульсии масла
Композиции эмульсии масла, подходящие для использования в качестве адъювантов в изобретении, включают водные эмульсии скваленов, такого как MF59 (5%-ый сквален, 0,5% Tween 80 и 0,5% Span 85, в виде эмульсии субмикронных частиц, приготовленной с использованием микрофлюидизатора) [см., главу 10 ссылки 126; а также ссылки 127-129]. MF59 используется в качестве адъюванта в трехвалентной субъединичной вакцине против вируса гриппа FLUADTM.
В частности, предпочтительные адъюванты для использования в композициях представляют собой субмикронные эмульсии типа масла в воде. Предпочтительные субмикронные эмульсии типа масла в воде, для использования в настоящем изобретении, представляют собой эмульсии сквален/вода, необязательно содержащие варьирующее количество MTP-PE, такие как субмикронная эмульсия масла в воде, содержащая 4-5% (мас./объем) сквалена, 0,25-1,0% (масс./объем) Tween 80 (моноолеат полиоксиэтиленсорбитана) и/или 0,25-1,0% Span 85 (триолеат сорбитана) и, необязательно, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE). Субмикронные эмульсии масло-в-воде, способы их получения и иммуностимуляторы, такие как мурамилпептиды, для использования в композициях, подробно описаны в ссылках 127 и 130-131.
В качестве адъювантов в изобретении могут также использоваться полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA).
C. Препараты сапонина [см. главу 22 ссылки 126]
В качестве адъювантов в изобретении также могут использоваться препараты сапонина. Сапонины представляет собой гетерологичную группу стерольных гликозидов и тритерпиноидных гликозидов, которые были найдены в коре, листьях, стеблях, корнях и даже в цветках множества видов растения. Сапонины, выделенные из коры дерева Quillaia saponaria Molina, были широко изучены как адъюванты. Сапонин может быть также получен в коммерческих масштабах из Smilax ornata (сарсапарель), Gypsophilla paniculata (гипсофила метельчатая) и Saponaria officinalis (мыльный корень). Препараты адъюванта на основе сапонина включают очищенные препараты, такие как QS21, так же как и липидные препараты, такие как ISCOM.
Композиции сапонина были очищены с использованием ВЭЖХ и RP-ВЭЖХ. Используя эти методы, были идентифицированы конкретные очищенные фракции, включающие QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно, сапонин представляет собой QS21. Способ получения QS21 раскрыт в ссылке 132. Препараты сапонина могут также включить стерол, такой как холестерин [см. ссылку 133].
Комбинации сапонинов и холестеринов могут использоваться, чтобы получить уникальные частицы, называемые иммуностимулирующими комплексами (ISCOM) [см. главу 23 ссылки 126]. ISCOM, как правило, также включают фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Любой известный сапонин может использоваться в составе ISCOM. Предпочтительно, ISCOM включает один или несколько Quila, QHA и QHC. ISCOM дополнительно описаны в ссылках 133-135. Кроме того, ISCOM, необязательно, могут не иметь никакого дополнительного детергента [см. ссылку 136].
Обзор адъювантов на основе сапонинов может быть найден в ссылках 137 и 138.
D. Виросомы и вирусоподобные частицы
В качестве адъювантов в изобретении могут также использоваться виросомы и вирусоподобные частицы (VLP). В целом, эти структуры включают один или несколько вирусных белков, необязательно объединенных или соединенных с фосфолипидом. Они, в целом, являются непатогенными, нереплицирующимися и, в целом, они не содержат никакого природного вирусного генома. Вирусные белки могут быть получены рекомбинантно или могут быть выделены из целых вирусов. Эти вирусные белки, подходящие для использования в виросомах или VLP, включают белки, полученные из вируса гриппа (такие как HA или NA), вируса гепатита B (такие как коровые белки или белки капсулы вируса), вируса гепатит E, вируса кори, вируса синдбис, ротавируса, вируса ящура, ретровируса, норовируса, вируса папилломы человека, ВИЧ, РНК фага, Qβ фага (такие как белки оболочки), GA фага, fr фага, фага AP205, и Ty (такие как белок p1 ретротранспозона Ty). VLP дополнительно рассмотрены в ссылках 139-144. Виросомы дополнительно рассмотрены, например, в ссылке 145.
E. Бактериальные или микробные производные
Адъюванты, подходящие для использования в изобретении, включают бактериальные или микробные производные, такие как нетоксичные производные энтеробактериального липополисахарида (LPS), производные липида А, иммуностимулирующие олигонуклеотиды, ADP-рибозилированные токсины и их детоксифицированные производные.
Нетоксичные производные LPS включают монофосфориллипид (MPL) и 3-О-дезацилированные MPL (3dMPL). 3dMPL представляет собой смесь 3-О-дезацилированных монофосфориллипидов А с 4, 5 или 6 ацилированными цепями. Предпочтительная "малая частица" из 3-О-дезацилированных монофосфориллипидов А описана в ссылке 146. Такие "малые частицы" из 3dMPL являются достаточно небольшими, чтобы быть стерильными после пропускания через мембраны с порами 0,22 мкм [см. ссылку 146]. Другие нетоксичные производные LPS включают миметики монофосфориллипида A, такие как производные аминоалкилглюкозаминидфосфата, например RC-529 [см. ссылки 147 и 148].
Производные липида А включает производные липида А из Escherichia coli, такой как OM-174. OM-174 описан, например, в ссылках 149 и 150.
Иммуностимулирующие олигонуклеотиды, подходящие для использования в качестве адъювантов в настоящем изобретении, включают последовательности нуклеотида, содержащие мотив CpG (динуклеотидная последовательность, содержащая неметилированный цитозин, связанный фосфатной связью с гуанозином). Двухцепочечные РНК и олигонуклеотиды, содержащие палиндромные или поли(dG) последовательности, как было показано, также являются иммуностимуляторами.
Последовательности с мотивом CpG могут включать нуклеотидные модификации/аналоги, такие как фосфоротиоатные модификации, и могут быть двух- или одноцепочечными. Ссылки 151, 152 и 153 раскрывают возможные аналоговые замены, например, замену гуанозина на 2'-дезокси-7-деазагуанозин. Адъювантный эффект олигонуклеотидов CpG дополнительно рассмотрен в ссылках 154-159.
Последовательность CpG может быть нацелена на TLR9 (Toll-подобный рецептор 9), на мотив, такой как GTCGTT или TTCGTT [см. ссылку 160]. Последовательность CpG, такая как CpG-A ODN, может быть определенна как последовательность для индукции иммунного ответа Thl-типа, или, такая как CpG-B ODN, где она может быть более точно определена как последовательность для индукции ответа В-клеток. CpG-A и CpG-B ODN рассмотрены в ссылках 161-163. Предпочтительно, когда CpG представляет собой CpG-A ODN.
Предпочтительно, олигонуклеотид CpG построен так, что 5'-конец является доступным для рецепторного распознавания. Необязательно, две олигонуклеотидные последовательности CpG могут быть соединены по их 3'-концам, с образованием "иммуномеров". См., например, ссылки 160 и 164-166.
В изобретении могут использоваться в качестве адъювантов бактериальные ADP-рибозилированные токсины и их детоксифицированные производные. Белок предпочтительно получен из E.coli (термолабильный энтеротоксин E.coli "LT"), холеры ("СТ") или коклюша ("PT"). Использование детоксифицированных ADP-рибозилированных токсинов в качестве мукозальных адъювантов описано в ссылке 167, и в качестве парентеральных адъювантов - в ссылке 168. Токсин или токсоид находятся, предпочтительно, в форме голотоксина, включающего субъединицы A и B. Предпочтительно, когда субъединица А содержит детоксифицирующую мутацию; предпочтительно, когда субъединица B не мутирована. Адъювант предпочтительно представляет собой детоксифицированный мутант LT, такой как LT-K63, LT-R72 и LT-G192. Использование ADP-рибозилированных токсинов и их детоксифицированных производных, в частности LT-K63 и LT-R72, в качестве адъювантов, описано ссылках 169-176. Множество ссылок в отношении аминокислотных замен, основанных на выравниваниях субъединиц A и B ADP-рибозилированных токсинов, представлено в ссылке 177, которая включена здесь во всей своей полноте посредством отсылки на этот документ.
F. Иммуномодуляторы человека
Иммуномодуляторы человека, подходящие для использования в качестве адъювантов в настоящем изобретении, включают цитокины, такие как интерлейкины {например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 [см. ссылку 178], и т.д.) [см. ссылку 179], интерфероны (например итерферон-γ), макрофагальный колониестимулирующий фактор и фактор некроза опухоли.
G. Биоадгезивы и мукоадгезивы
Биоадгезивы и мукоадгезивы также могут использоваться в качестве адъювантов в настоящем изобретении. Подходящие биоадгезивы включают микросферы этерифицированных гиалуроновых кислот [см. ссылку 180] или мукоадгезивы, такие как поперечносшитые производные полиакриловой кислоты, поливиниловый спирт, поливинилпирролидон, полисахариды и карбоксиметилцеллюлоза. Хитозан и его производные могут также использоваться в качестве адъювантов в настоящем изобретении [см. ссылку 181].
H. Микрочастицы
Микрочастицы также могут использоваться в качестве адъювантов в настоящем изобретении. Микрочастицы (т.е. частицы размером от приблизительно 100 нм до приблизительно 150 мкм в диаметре, более предпочтительно от приблизительно 200 нм до приблизительно 30 мкм в диаметре, и наиболее предпочтительно размером от приблизительно 500 нм до приблизительно 10 мкм в диаметре), образованные из материалов, которые являются биодеградируемыми и нетоксичными {например поли(α-гидроксикислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т.п.), с поли(лактид-гликолевым сополимером), являются предпочтительными, причем они необязательно могут быть обработаны (например, SDS), для того, чтобы иметь отрицательно заряженную поверхность, или иметь положительно заряженную поверхность (например, при обработке катионоактивным детергентом, таким как CTAB).
I. Липосомы (см. главы 13 и 14 из ссылки 126)
Примеры препаратов липосом, подходящих для использования в качестве адъювантов, описаны в ссылках 182-184.
J. Препараты простых и сложных эфиров полиоксиэтилена
Адъюванты, подходящие для использования в изобретении, включают простые и сложные эфиры полиоксиэтилена [см. ссылку 185]. Такие препараты дополнительно включают сложный эфир полиоксиэтиленсорбитана с поверхностно-активными веществами в комбинации с октоксинолом [см. ссылку 186], так же как и полиоксиэтиленалкильные простые и сложные эфиры с поверхностно-активными веществами, в комбинации с по меньшей мере одним дополнительным неионогенным поверхностно-активным веществом, таким как октоксинол [см. ссылку 187]. Предпочтительные простые эфиры полиоксиэтилена выбраны из следующей группы: простой полиоксиэтилен-9-лауриловый эфир (laureth 9), простой полиоксиэтилен-9-стероиловый эфир, простой полиоксиэтилен-4-лауриловый эфир, простой полиоксиэтилен-35-лауриловый эфир и простой полиоксиэтилен-23-лауриловый эфир.
K. Полифосфазен (PCPP)
Препараты PCPP описаны, например, в ссылках 188 и 189.
L. Мурамилпептиды
Примеры мурамилпептидов, подходящих для использования в изобретении в качестве адъювантов, включают N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP) и N-ацетил-мурамил-L-аланил-D-изоглутаминил-L-аланин-2-(-2'-дипольмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE).
M. Имидазохинолоновые соединения
Примеры имидазохинолоновых соединений, подходящих для использования в изобретении в качестве адъювантов, включают Imiquamod и его гомологи (например, "Resiquimod 3M"), дополнительно описанные в ссылках 190 и 191.
N. Тиосемикарбазоновые соединения
Примеры тиосемикарбазоновых соединений, так же как способы приготовления препаратов из них, получения и скринирования соединений, подходящих для использования в качестве адъювантов в настоящем изобретении, включают описанные в ссылке 192. В частности, тиосемикарбазоны эффективны при стимуляции мононуклеарных клеток периферической крови человека для продуцирования цитокинов, в частности, TNF-α.
O. Триптантриновые соединения
Примеры триптантриновых соединений, так же как способы приготовления препаратов из них, получения и скринирования соединений, подходящих для использования в качестве адъювантов в настоящем изобретении, включают описанные в ссылке 193. В частности, триптантриновые соединения эффективны при стимуляции мононуклеарных клеток периферической крови человека для продуцирования цитокинов, в частности, TNF-α.
Изобретение также может включать комбинации вариантов одного или нескольких адъювантов, описанных выше. Например, в настоящем изобретении могут использоваться в качестве адъювантов следующие комбинации: (1) сапонин и эмульсия масла в воде [см. ссылку 194]; (2) сапонин (например, QS21) и нетоксичное производное LPS (например, 3dMPL) [см. ссылку 195]; (3) сапонин (например, QS21), нетоксичное производное LPS (например, 3dMPL) и холестерин; (4) сапонин (например, QS21), 3dMPL и IL-12 (и необязательно стерол) [см. ссылку 196]; (5) комбинации 3dMPL, например, с QS21 и/или с эмульсией масла в воде [см. ссылку 197]; (6) SAF, содержащий 10% сквалана, 0,4% Tween 80ТМ, 5% блокполимера плюроника и L121, и thr-MDP, где SAF получен микрофлюидизацией в субмикронную эмульсию или получен путем вихревого перемешивания с образованием эмульсии частиц большего размера; (7) адъювантная система RibiTM (RAS) (Ribi Immunochem), содержащая 2% сквалена, 0,2% Tween 80 и один или несколько компонентов клеточной стенки бактерий, из группы, состоящей из монофосфориллипида (MPL), димиколята трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно из MPL и CWS (DetoxTM) и; (8) одна или более минеральных солей (например, соль алюминия) и нетоксичного производного LPS (например, 3dMPL).
Другие вещества, которые действуют как иммуностимуляторы, раскрыты в главе 7 ссылки 126.
В частности, использование адъювантов на основе солей алюминия является предпочтительным, поскольку антигены в целом адсорбированы на таких солях. В композициях настоящего изобретения некоторые антигены можно адсорбировать на гидроокиси алюминия, но композиция должна содержать другие антигены в ассоциации с фосфатом алюминия. Однако в целом является предпочтительным использование только одной соли, например гидроокиси или фосфата, но не две соли. Не все конъюгаты должны быть адсорбированы, т.е. некоторые конъюгаты, или даже все, могут быть в растворе в свободном состоянии.
Способы лечения
Изобретение также предоставляет способ создания иммунного ответа у млекопитающего, включающий введение фармацевтической композиции по изобретению млекопитающему. Иммунный ответ является предпочтительно защитным, и предпочтительно включает антительный ответ. Способ может создавать бустерный ответ.
Млекопитающее предпочтительно представляет собой человека. Когда вакцина используется для профилактики, человек предпочтительно представляет собой ребенка (например, ребенок, начинающий ходить, или несовершеннолетний ребенок) или подростка; когда используется для терапевтических целей, человек предпочтительно представляет собой взрослого человека. Вакцину, предназначенную для детей, можно также вводить взрослым, например, для оценки безопасности, дозировки, иммуногенности и т.п. Предпочтительный контингент людей для лечения представляет собой женщин в детородном возрасте (например, подростки и старше). Другой предпочтительный контингент представляет собой беременных женщин. Пожилые пациенты (например, в возрасте свыше 50, 60, 70, 80 или 90 и т.д. лет, в частности, в возрасте свыше 65 лет), в частности те, которые живут в домах для престарелых, где риск инфекции GBS может быть повышенным [см. ссылку 198], являются другим предпочтительным контингентом людей для лечения. В некоторых вариантах выполнения изобретения у человека, до введения фармацевтической композиции, имеется неиндицируемый уровень антител против капсулярного сахарида GBS серотипа Ia. В других вариантах выполнения изобретения у человека, до введения фармацевтической композиции, имеется неиндицируемый уровень антител против капсулярного сахарида GBS серотипа Ib. В других в вариантах выполнения изобретения у человека, до введения фармацевтической композиции, имеется неиндицируемый уровень антител против капсулярного сахарида GBS серотипа III. В частности, у человека, до введения фармацевтической композиции, может быть неиндицируемый уровень антител против капсулярного сахарида GBS серотипа Ia и неиндицируемый уровень антител против капсулярного сахарида GBS серотипа Ib до введения фармацевтической композиции. Альтернативно или дополнительно, у человека, до введения фармацевтической композиции, может быть неиндицируемый уровень антител против капсулярного сахарида GBS серотипа III. Уровень(ни) антител против капсулярного сахарида(ов) может быть определен с использованием способа ELISA, описанного в разделе "Исследования на людях, (1)", ниже. Уровень(ни) антител может быть проконтролирован за один месяц до введения, в частности, в пределах одного месяца до введения (например, в пределах двух недель, в пределах одной недели до введения или в день введения). У новорожденных детей женщин с таким неиндицирумым уровнем(ями) антител против капсулярного сахарида(ов) могут быть более высокие уровни вероятности инфицирования GBS. Это имеет место из-за того, что более высокие уровни материнских антител против капсулярные сахаридов GBS коррелируют с уменьшением риска заболевания у новорожденных [см. ссылки 199 и 200]. Соответственно, настоящим изобретением предусматривается введение этим женщинам композиций по изобретению.
В некоторых вариантах выполнения изобретения пациент был предварительно иммунизирован токсоидом дифтерии или его производным, например как описано ниже относительно второго варианта выполнения изобретения в разделе "Предварительно иммунизированный пациент". В этих вариантах выполнения изобретения является предпочтительным, чтобы в иммуногенной композиции по меньшей мере один конъюгат был капсулярным сахаридом GBS, конъюгированным с токсоидом дифтерии или его производным. Авторы изобретения обнаружили, что иммунный ответ на капсулярный сахарид может быть улучшен за чет ассоциации сахарида с токсоидом дифтерии или с его производным, когда пациент был предварительно иммунизирован токсоидом дифтерии или его производным. Капсулярный сахарид в композиции, где капсулярный сахарид конъюгирован с токсоидом дифтерии или его производным, может быть, например, капсулярным сахаридом GBS серотипа Ia, Ib или III. В частности, капсулярный сахарид может быть капсулярным сахаридом GBS серотипа III (как показано ниже). В таких вариантах выполнения изобретения это является типичным, когда в композиции все капсулярные сахариды GBS конъюгированы с токсоидом дифтерии или его производным. Когда носитель или антиген в предварительной иммунизации представляет собой производное токсоида дифтерии, то производное предпочтительно остается иммунологически кроссреактивным в отношении Dt, и предпочтительно представляет собой CRM197.
В других вариантах выполнения изобретения пациент был предварительно иммунизирован токсоидом столбняка или его производным, например, как описано ниже относительно второго варианта выполнения изобретения в разделах "Предварительно иммунизированный пациент" и "Носители на основе токсоида столбняка". В этих вариантах выполнения изобретения предпочтительно, когда в иммуногенной композиции по меньшей мере один конъюгат представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом столбняка или его производным. Иммунный ответ на капсулярный сахарид может быть улучшен, за счет ассоциации сахарида с токсоидом столбняка или его производным, когда пациент был предварительно иммунизирован токсоидом столбняка или его производным.
Капсулярный сахарид в композиции, где капсулярный сахарид конъюгирован с токсоидом столбняка или его производным, может быть, например, капсулярным сахаридом GBS серотипа Ia, Ib или III. В частности, капсулярный сахарид может быть капсулярным сахаридом GBS серотипа III. В таких вариантах выполнения изобретения это является типичным, когда в композиции все капсулярные сахариды GBS конъюгированы с токсоидом столбняка или его производным.
Изобретение также предоставляет композицию по изобретению для применения в качестве лекарственного средства. Лекарственное средство предпочтительно способно создавать иммунный ответ у млекопитающего (т.е. оно представляет собой иммуногенную композиция), и более предпочтительно представляет собой вакцину.
Изобретение также обеспечивает применение композиции по изобретению для изготовления лекарственного средства для создания иммунного ответа у млекопитающего.
Эти применения и способы предпочтительно предназначены для предотвращения и/или лечения вызванных S.agalactiae заболеваний, например, сепсиса или бактериемии новорожденных, пневмонии новорожденных, менингита новорожденных, эндометриоза, остеомиелита, септического артрита и т.п.
Субъект, у которого предотвращают заболевание, может быть не тем же самым субъектом, которому вводят конъюгат по изобретению. Например, конъюгат можно ввести женщине (до или во время беременности) для того, чтобы защитить ее потомство (так называемая "материнская иммунизация" [см. ссылки 201-203]).
Один из способов проверки эффективности терапевтического лечения включает контроль инфекции GBS после введения композиции по изобретению. Один из способов проверки эффективности профилактического лечения включает контроль иммунных ответов против антигенов GBS после введения композиции.
Предпочтительные композиции по изобретению могут создавать титр антител у пациента, который превосходит критериальное значение для серопротекции в отношении каждого антигенного компонента, в соответствующих долях, у субъекта-человека. Антигены, указанные выше, и ассоциированные с ними титры антител хозяина, которые рассматриваются как сероконвертированными против антигена, известны, и такие титры опубликованы такими организациями, как ВОЗ. Предпочтительно более 80% статистически значимых проб от субъектов являются сероконвертированными, более предпочтительно более 90%, еще более предпочтительно более 93%, и наиболее предпочтительно - 96-100%.
Как правило, композиции по изобретению вводятся непосредственно пациенту. Прямая доставка может быть достигнута парентеральной инъекцией (например, подкожной, интраперитонеальной, внутривенной, внутримышечной или в интерстициальный участок ткани), или ректальным, оральным, вагинальным, местным, трансдермальным, интраназальным, глазным, слуховым, легочным, мукозальным или другим путем введения. Внутримышечное введение в бедро или в верхнюю часть руки является предпочтительным. Инъекция может быть выполнена через иглу (например, при помощи шприца для подкожных инъекций), но альтернативно может использоваться безыгольная инъекция. Типичная внутримышечная доза составляет 0,5 мл.
Изобретение может использоваться для того, чтобы вызвать системный и/или мукозальный иммунитет.
Дозировки при лечении могут быть реализованы по схеме однократной дозы или по схеме множественного дозирования. Множественное дозирование может использоваться по схеме первичной иммунизации и/или по схеме с бустерной иммунизацией. Схема с однократной первичной дозой может быть дополнена схемой с бустерным дозированием. Подходящий интервал времени между однократными дозами (например, 4-16 недель), и между первичными и бустерными дозами, может определяться обычными способами.
Белковые антигены GBS
Как упомянуто выше, белки GBS могут быть включены в композиции по изобретению. Они могут использоваться как белки-носители для конъюгатов изобретения, как белки-носители для других конъюгатов или как неконъюгированные белковые антигены.
Белковые антигены GBS для использования в изобретении включают белковые антигены, раскрытые в ссылках 99 и 204-206. Два предпочтительных белковых антигена GBS для использования в изобретении известны как GBS67 и GBS80 [см. ссылку 99]. Дополнительно, предпочтительный белковый антиген GBS для использования в изобретении известен как Spb1 [см. ссылку 207]. Дальнейшая детализация этих трех антигенов приведена ниже.
Полноразмерные последовательности этих трех белков GBS представляют собой последовательности SEQ ID NO: 1 - SEQ ID NO: 3, приведенные здесь. Таким образом, композиции по изобретению могут включать (a) полипептид, включающий аминокислотную последовательность, выбранную из SEQ ID NO: 1 - SEQ ID NO: 3, и/или (b) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с одной или нескольким последовательностям SEQ ID NO: 1 - SEQ ID NO: 3, и/или (ii) фрагмент последовательности SEQ ID NO: 1 - SEQ ID NO: 3. Композиции по изобретению могут также включить смеси этих белковых антигенов GBS.
В частности, композиции по изобретению могут включать:
(а1) полипептид, включающий аминокислотную последовательность SEQ ID NO: 1, и/или (b1) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 1 и/или (ii) фрагмент последовательности SEQ ID NO: 1; и
(a2) полипептид, включающий аминокислотную последовательность SEQ ID NO: 2, и/или (b2) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 2 и/или (ii) фрагмент последовательности SEQ ID NO: 2.
Аналогично, композиции по изобретению могут включать:
(а1) полипептид, включающий аминокислотную последовательность SEQ ID NO: 1, и/или (b1) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 1 и/или (ii) фрагмент последовательности SEQ ID NO: 1; и
(a2) полипептид, включающий аминокислотную последовательность SEQ ID NO: 3, и/или (b2) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 3 и/или (ii) фрагмент последовательности SEQ ID NO: 3.
Также, композиции по изобретению могут включать:
(а1) полипептид, включающий аминокислотную последовательность SEQ ID NO: 2, и/или (b1) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 2 и/или (ii) фрагмент последовательности SEQ ID NO: 2; и
(a2) полипептид, включающий аминокислотную последовательность SEQ ID NO: 3, и/или (b2) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 3 и/или (ii) фрагмент последовательности SEQ ID NO: 3.
Композиции по изобретению могут включать:
(а1) полипептид, включающий аминокислотную последовательность SEQ ID NO: 1, и/или (b1) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 1 и/или (ii) фрагмент последовательности SEQ ID NO: 1;
(a2) полипептид, включающий аминокислотную последовательность SEQ ID NO: 2, и/или (b2) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 2 и/или (ii) фрагмент последовательности SEQ ID NO: 2, и
(a3) полипептид, включающий аминокислотную последовательность SEQ ID NO: 3, и/или (b2) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 3 и/или (ii) фрагмент последовательности SEQ ID NO: 3.
Три других предпочтительных белковых антигена GBS для использования в изобретении известны как GBS104, GBS276 и GBS322 [см. ссылку 99]. Аминокислотная последовательность GBS104 серотипа V дикого типа, выделенная из штамма 2603 V/R, приведена в ссылке 21 как SEQ ID NO: 3. Когда варианты выполнения настоящего изобретения определены здесь в отношении последовательности SEQ ID NO: 1, ссылки на последовательность SEQ ID NO: 1 могут быть заменены ссылками на последовательность SEQ ID NO: 3 из ссылки 21. Аминокислотная последовательность GBS276 серотипа V дикого типа, выделенная из штамма 2603 V/R, приведена в ссылке 21 как SEQ ID NO: 4. Когда варианты выполнения настоящего изобретения определены здесь в отношении последовательности SEQ ID NO: 2, ссылки на последовательность SEQ ID NO: 2 могут быть заменены ссылками на последовательность SEQ ID NO: 4 из ссылки 21. Аминокислотная последовательность GBS322 серотипа V дикого типа, выделенная из штамма 2603 V/R, приведена в ссылке 21 как SEQ ID NO: 5. Когда варианты выполнения настоящего изобретения определены здесь в отношении последовательности SEQ ID NO: 3, ссылки на последовательность SEQ ID NO: 3 могут быть заменены ссылками на последовательность SEQ ID NO: 5 из ссылки 21.
В зависимости от конкретной последовательности, уровень идентичности последовательности, указанный в (i), составляет предпочтительно более 50% (например, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более). Такие полипептиды включают гомологи, ортологи, аллельные варианты и функциональные мутанты. Как правило, считается, что идентичность, равная 50% или более, между двумя полипептидными последовательностями является признаком функциональной эквивалентности. Идентичность между полипептидами определяется предпочтительно алгоритмом поиска соответствия Smith-Waterman, как осуществлено в программе MPSRCH (Oxford Molecular), используя анализ поиска аффинных брешей с параметрами: "штраф за брешь-пропуск"=12 и "штраф за брешь-удлинение"=1.
В зависимости от конкретной последовательности, фрагменты (ii) должны включать по меньшей мере "n" последовательных аминокислот из последовательностей и, в зависимости от конкретной последовательности, "n" равно 7 или более (например 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100 или более). Фрагмент может включать последовательность по меньшей мере одного эпитопа для T-клетки или, предпочтительно, для B-клетки. Эпитопы для T-клетки или для B-клетки могут быть идентифицированы опытным путем (например, с использованием PEPSCAN [см. ссылки 208 и 209] или подобных способов), или они могут быть предсказаны (например, с использованием: антигенного индекса Jameson-Wolf [см. ссылку 210], подхода, основанного на матрице [см. ссылку 211], TEPITOPE [см. ссылку 212], нейронных сетей [см. ссылку 213], OptiMer и EpiMer [см. ссылки 214 и 215], ADEPT [см. ссылку 216], Tsites [см. ссылку 217], гидрофильности [см. ссылку 218], индекса антигенности [см. ссылку 219] или способов, раскрытых в ссылке 220, и т.п.). Другие предпочтительные фрагменты представляет собой последовательности SEQ ID NO: 1 - SEQ ID NO: 3 без их N-терминального аминокислотного остатка, или без их N-терминального сигнального пептида. Может использоваться удаление одного или нескольких доменов, таких как область лидерной или сигнальной последовательности, якорного мотива трансмембранной области, цитоплазматической области или области клеточной стенки. Предпочтительные фрагменты конкретного белка могут быть такими фрагментами, которые связываются с антителом, которое может связываться с полноразмерным конкретным белком, например фрагменты могут связываться антителом, которое связывается с последовательностью SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 3. Некоторые полезные фрагменты описаны ниже (SEQ ID NO: 4 - SEQ ID NO: 13).
Эти полипептиды, по сравнению с SEQ ID NO: 1 - SEQ ID NO: 3, могут включать одну или более (например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.) консервативных аминокислотных замен, т.е. замены одной аминокислоты другой, у которого есть аналогичная боковая цепь. Генетически кодируемые аминокислоты в целом делятся на четыре семейства: (1) кислые аминокислоты, т.е. аспартат, глутамат; (2) основные аминокислоты, т.е. лизин, аргинин, гистидин; (3) неполярные аминокислоты, т.е. аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) неполярные аминокислоты, т.е. глицин, аспарагин, глутамин, цистин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда вместе классифицируются как ароматические аминокислоты. В целом, замена единичных аминокислот в пределах этих семейств не имеет существенного влияния на биологическую активность. Полипептиды могут также включать одну или несколько (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.) делеций одной аминокислоты относительно последовательностей SEQ ID NO: 1 - SEQ ID NO: 3. Полипептиды могут также включать одну или несколько (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.) инсерций (при этом, например, каждая инсерция состоит из 1, 2, 3, 4 или 5 аминокислот) относительно последовательностей SEQ ID NO: 1 - SEQ ID NO: 3.
Полипептиды по изобретению могут быть получены различными способами, например, химическим синтезом (полностью или частично), расщеплением более длинных полипептидов с использованием протеаз, трансляцией РНК, очисткой из культуры клеток (например, из системы рекомбинантной экспрессии), непосредственно из организма (например, после культивирования бактерий, или непосредственно из пациентов) и т.п. Предпочтительный способ получения пептидов длиной менее 40 аминокислот включает химический синтез in vitro [см. ссылки 221 и 222]. В частности, предпочтителен твердофазный пептидный синтез, например, способы, основанные на химии tBoc или Fmoc [см. ссылку 223]. Ферментативный синтез [см. ссылку 224] может также использоваться частично или полностью. Как альтернатива химическому синтезу, может использоваться биологический синтез, например полипептиды могут быть получены трансляцией нуклеиновых кислот. Это может быть выполнено в условиях in vitro или in vivo. Биологические способы в целом ограничены производством полипептидов, основанных на L-аминокислотах, но манипуляции с методами трансляции (например, с использованием аминоацилированных молекул тРНК), могут использоваться для того, чтобы обеспечить введение D-аминокислот (или других, не встречающихся в природе аминокислот, таких как иодтирозин, метилфенилаланин, азидогомоаланин и т.п.) [см. ссылку 225]. Когда включены D-аминокислоты, то предпочтительно использовать химический синтез. У полипептидов по изобретению могут быть ковалентные модификации на С- и/или N-конце.
Если эти белки GBS включены в композиции по изобретению, то они могут принимать различные формы (например, природную, слитую, гликозилированную, не гликозилированную, липидированную, не липидированную, фосфорилированную, не фосфорилированную, миристоилированную, не миристоилированную, мономерную, мультимерную, форму в виде макрочастицы, денатурированную и т.п. формы). Они предпочтительно используются в очищенной или по существу очищенной форме, то есть по существу они свободны от других полипептидов (например, они свободны от полипептидов естественного происхождения), в частности - от другого GBS или от других полипептидов клетки-хозяина.
GBS67
Нуклеотидная и аминокислотная последовательности GBS67 из штамма 2603 V/R серотипа V, представлены в ссылке 99 как SEQ ID NO: 3745 и SEQ ID NO: 3746. Аминокислотная последовательность SEQ ID NO: 1 представлена ниже:
MRKYQKFSKILTLSLFCLSQIPLNTNVLGESTVPENGAKGKLVVKKTDDQNKPLSKATFVLKTTAHPESKIEKVTAELTGEATFDNLIPGDYTLSEETAPEGYKKTNQTWQVKVESNGKTTIQNSGDKNSTIGQNQEELDKQYPPTGIYEDTKESYKLEHVKGSVPNGKSEAKAVNPYSSEGEHIREIPEGTLSKRISEVGDLAHNKYKIELTVSGKTIVKPVDKQKPLDVVFVLDNSNSMNNDGPNFQRHNKAKKAAEALGTAVKDILGANSDNRVALVTYGSDIFDGRSVDVVKGFKEDDKYYGLQTKFTIQTENYSHKQLTNNAEEIIKRIPTEAPKAKWGSTTNGLTPEQQKEYYLSKVGETFTMKAFMEADDILSQVNRNSQKIIVHVTDGVPTRSYAINNFKLGASYESQFEQMKKNGYLNKSNFLLTDKPEDIKGNGESYFLFPLDSYQTQIISGNLQKLHYLDLNLNYPKGTIYRNGPVKEHGTPTKLYINSLKQKNYDIFNFGIDISGFRQVYNEEYKKNQDGTFQKLKEEAFKLSDGEITELMRSFSSKPEYYTPIVTSADTSNNEILSKIQQQFETILTKENSIVNGTIEDPMGDKINLQLGNGQTLQPSDYTLQGNDGSVMKDGIATGGPNNDGGILKGVKLEYIGNKLYVRGLNLGEGQKVTLTYDVKLDDSFISNKFYDTNGRTTLNPKSEDPNTLRDFPIPKIRDVREYPTITIKNEKKLGEIEFIKVDKDNNKLLLKGATFELQEFNEDYKLYLPIKNNNSKVVTGENGKISYKDLKDGKYQLIEAVSPEDYQKITNKPILTFEVVKGSIKNIIAVNKQISEYHEEGDKHLITNTHIPPKGIIPMTGGKGILSFILIGGAMMSIAGGIYIWKRYKKSSDMSIKKD
GBS67 содержит трансмембранную область на С-конце, которая выделена подчеркнутой областью вблизи С-конца последовательности SEQ ID NO: 1 (см. выше). Одна или несколько аминокислот из трансмембранной области могут быть удалены, или аминокислота(ы) может быть усечена перед трансмембранной областью. Пример такого фрагмента GBS67 представлен ниже как последовательность SEQ ID NO: 4.
MRKYQKFSKILTLSLFCLSQIPLNTNVLGESTVPENGAKGKLVVKKTDDQNKPLSKATFVLKTTAHPESKIEKVTAELTGEATFDNLIPGDYTLSEETAPEGYKKTNQTWQVKVESNGKTTIQNSGDKNSTIGQNQEELDKQYPPTGIYEDTKESYKLEHVKGSVPNGKSEAKAVNPYSSEGEHIREIPEGTLSKRISEVGDLAHNKYKIELTVSGKTIVKPVDKQKPLDVVFVLDNSNSMNNDGPNFQRHNKAKKAAEALGTAVKDILGANSDNRVALVTYGSDIFDGRSVDVVKGFKEDDKYYGLQTKFTIQTENYSHKQLTNNAEEIIKRIPTEAPKAKWGSTTNGLTPEQQKEYYLSKVGETFTMKAFMEADDILSQVNRNSQKIIVHVTDGVPTRSYAINNFKLGASYESQFEQMKKNGYLNKSNFLLTDKPEDIKGNGESYFLFPLDSYQTQIISGNLQKLHYLDLNLNYPKGTIYRNGPVKEHGTPTKLYINSLKQKNYDIFNFGIDISGFRQVYNEEYKKNQDGTFQKLKEEAFKLSDGEITELMRSFSSKPEYYTPIVTSADTSNNEILSKIQQQFETILTKENSIVNGTIEDPMGDKINLQLGNGQTLQPSDYTLQGNDGSVMKDGIATGGPNNDGGILKGVKLEYIGNKLYVRGLNLGEGQKVTLTYDVKLDDSFISNKFYDTNGRTTLNPKSEDPNTLRDFPIPKIRDVREYPTITIKNEKKLGEIEFIKVDKDNNKLLLKGATFELQEFNEDYKLYLPIKNNNSKVVTGENGKISYKDLKDGKYQLIEAVSPEDYQKITNKPILTFEVVKGSIKNIIAVNKQISEYHEEGDKHLITNTHIPPKGIIPMTGGKGILS
GBS67 содержит аминокислотный мотив, характерный для якоря клеточной стенки, показанный курсивом в последовательности SEQ ID NO: 1, выше. В некоторых рекомбинантных системах клетки-хозяина удаление этого мотива может быть предпочтительно для того, чтобы облегчить секрецию рекомбинантного белка GBS67 из клетки-хозяина. Соответственно, для использования в настоящем изобретении, в одном предпочтительном фрагменте GBS67 мотив трансмембранного якоря и мотив якоря клеточной стенки удалены из GBS67. Пример такого фрагмента GBS67 представлен ниже как последовательность SEQ ID NO: 5.
MRKYQKFSKILTLSLFCLSQIPLNTNVLGESTVPENGAKGKLVVKKTDDQNKPLSKATFVLKTTAHPESKIEKVTAELTGEATFDNLIPGDYTLSEETAPEGYKKTNQTWQVKVESNGKTTIQNSGDKNSTIGQNQEELDKQYPPTGIYEDTKESYKLEHVKGSVPNGKSEAKAVNPYSSEGEHIREIPEGTLSKRISEVGDLAHNKYKIELTVSGKTIVKPVDKQKPLDVVFVLDNSNSMNNDGPNFQRHNKAKKAAEALGTAVKDILGANSDNRVALVTYGSDIFDGRSVDVVKGFKEDDKYYGLQTKFTIQTENYSHKQLTNNAEEIIKRIPTEAPKAKWGSTTNGLTPEQQKEYYLSKVGETFTMKAFMEADDILSQVNRNSQKIIVHVTDGVPTRSYAINNFKLGASYESQFEQMKKNGYLNKSNFLLTDKPEDIKGNGESYFLFPLDSYQTQIISGNLQKLHYLDLNLNYPKGTIYRNGPVKEHGTPTKLYINSLKQKNYDIFNFGIDISGFRQVYNEEYKKNQDGTFQKLKEEAFKLSDGEITELMRSFSSKPEYYTPIVTSADTSNNEILSKIQQQFETILTKENSIVNGTIEDPMGDKINLQLGNGQTLQPSDYTLQGNDGSVMKDGIATGGPNNDGGILKGVKLEYIGNKLYVRGLNLGEGQKVTLTYDVKLDDSFISNKFYDTNGRTTLNPKSEDPNTLRDFPIPKIRDVREYPTITIKNEKKLGEIEFIKVDKDNNKLLLKGATFELQEFNEDYKLYLPIKNNNSKVVTGENGKISYKDLKDGKYQLIEAVSPEDYQKITNKPILTFEVVKGSIKNIIAVNKQISEYHEEGDKHLITNTHIPPKGI
Альтернативно, в некоторых рекомбинантных системах клетки-хозяина может быть предпочтительно использован мотив якоря клеточной стенки для прикрепления экспрессируемого рекомбинантного белка к клеточной стенке. Внеклеточный домен экспрессируемого белка может быть отщеплен во время очистки, или рекомбинантный белок в итоговой композиции можно сохранить прикрепленным к инактивированным клеткам-хозяевам или прикрепленным к мембранам клетки.
В GBS67 были идентифицированы три мотива пилина, содержащих консервативные остатки лизина. Консервативными остатками лизина являются аминокислотные остатки в положениях 478 и 488, аминокислотные остатки в положениях 340 и 342, и аминокислотные остатки в положениях 703 и 717. Последовательности пилина, в частности консервативные остатки лизина, как полагают, важны для формирования олигомерных, пилус-подобных структур GBS67. Предпочтительные фрагменты GBS67 включают по меньшей мере один консервативный остаток лизина. В GBS67 также были идентифицированы два бокса E, содержащие консервативные остатки глутамина. Предпочтительные фрагменты GBS67 включают по меньшей мере один консервативный остаток глутамина. GBS67 содержит несколько предсказанных областей для формирования альфа-спиральной структуры. Такие альфа-спиральные области, вероятно, формируют структуры двойной спирали, и могут быть вовлечены в олигомеризацию GBS67. GBS67 также содержит область, которая является гомологичной домену Cna_B коллагенсвязывающего поверхностного белка S.aureus (pfam05738). Она может формировать слоистую бета-структуру. GBS67 содержит область, которая является гомологичной домену фактора фон Виллебранда (vWF) типа А.
Аминокислотная последовательность GBS67 из штамма H36B серотипа Ib представлена в ссылке 226 как последовательность SEQ ID NO: 20906. Аминокислотная последовательность SEQ ID NO: 24 представлена ниже:
MRKYQKFSKILTLSLFCLSQIPLNTNVLGESTVPENGAKGKLVVKKTDDQNKPLSKATFVLKPTSHSESKVEKVTTEVTGEATFDNLTPGDYTLSEETAPEGYKKTTQTWQVKVESNGKTTIQNSDDKKSIIEQRQEELDKQYPLTGAYEDTKESYNLEHVKNSIPNGKLEAKAVNPYSSEGEHIREIQEGTLSKRISEVNDLDHNKYKIELTVSGKSIIKTINKDEPLDVVFVLDNSNSMKNNGKNNKAKKAGEAVETIIKDVLGANVENRAALVTYGSDIFDGRTVKVIKGFKEDPYYGLETSFTVQTNDYSYKKFTNIAADIIKKIPKEAPEAKWGGTSLGLTPEKKREYDLSKVGETFTMKAFMEADTLLSSIQRKSRKIIVHLTDGVPTRSYAINSFVKGSTYANQFERIKEKGYLDKNNYFITDDPEKIKGNGESYFLFPLDSYQTQIISGNLQKLHYLDLNLNYPKGTIYRNGPVREHGTPTKLYINSLKQKNYDIFNFGIDISGFRQVYNEDYKKNQDGTFQKLKEEAFELSDGEITELMNSFSSKPEYYTPIVTSADVSNNEILSKIQQQFEKILTKENSIVNGTIEDPMGDKINLHLGNGQTLQPSDYTLQGNDGSIMKDSIATGGPNNDGGILKGVKLEYIKNKLYVRGLNLGEGQKVTLTYDVKLDDSFISNKFYDTNGRTTLNPKSEEPDTLRDFPIPKIRDVREYPTITIKNEKKLGEIEFTKVDKDNNKLLLKGATFELQEFNEDYKLYLPIKNNNSKVVTGENGKISYKDLKDGKYQLIEAVSPKDYQKITNKPILTFEVVKGSIQNIIAVNKQISEYHEEGDKHLITNTHIPPKGIIPMTGGKGILSFILIGGAMMSIAGGIYIWKRHKKSSDASIEKD
Этот вариант GBS67 может использоваться в некоторых вариантах выполнения изобретения. Соответственно, когда варианты выполнения настоящего изобретения охватывают последовательность SEQ ID NO: 1, ссылки на последовательность SEQ ID NO: 1 могут быть заменены ссылками на SEQ ID NO: 24.
Также как и последовательность GBS67 из штамма 2603 V/R серотипа V, последовательность GBS67 из штамма H36B серотипа Ib содержит на С-конце трансмембранную область, которая выделена подчеркнутой областью вблизи С-конца последовательности SEQ ID NO: 24, выше. Одна или несколько аминокислот из трансмембранной области могут быть удалены, или аминокислота(ы) может быть усечена перед трансмембранной областью. Пример такого фрагмента GBS67 представлен ниже как последовательность SEQ ID NO: 25.
MRKYQKFSKILTLSLFCLSQIPLNTNVLGESTVPENGAKGKLVVKKTDDQNKPLSKATFVLKPTSHSESKVEKVTTEVTGEATFDNLTPGDYTLSEETAPEGYKKTTQTWQVKVESNGKTTIQNSDDKKSIIEQRQEELDKQYPLTGAYEDTKESYNLEHVKNSIPNGKLEAKAVNPYSSEGEHIREIQEGTLSKRISEVNDLDHNKYKIELTVSGKSIIKTINKDEPLDVVFVLDNSNSMKNNGKNNKAKKAGEAVETIIKDVLGANVENRAALVTYGSDIFDGRTVKVIKGFKEDPYYGLETSFTVQTNDYSYKKFTNIAADIIKKIPKEAPEAKWGGTSLGLTPEKKREYDLSKVGETFTMKAFMEADTLLSSIQRKSRKIIVHLTDGVPTRSYAINSFVKGSTYANQFERIKEKGYLDKNNYFITDDPEKIKGNGESYFLFPLDSYQTQIISGNLQKLHYLDLNLNYPKGTIYRNGPVREHGTPTKLYINSLKQKNYDIFNFGIDISGFRQVYNEDYKKNQDGTFQKLKEEAFELSDGEITELMNSFSSKPEYYTPIVTSADVSNNEILSKIQQQFEKILTKENSIVNGTIEDPMGDKINLHLGNGQTLQPSDYTLQGNDGSIMKDSIATGGPNNDGGILKGVKLEYIKNKLYVRGLNLGEGQKVTLTYDVKLDDSFISNKFYDTNGRTTLNPKSEEPDTLRDFPIPKIRDVREYPTITIKNEKKLGEIEFTKVDKDNNKLLLKGATFELQEFNEDYKLYLPIKNNNSKVVTGENGKISYKDLKDGKYQLIEAVSPKDYQKITNKPILTFEVVKGSIQNIIAVNKQISEYHEEGDKHLITNTHIPPKGIIPMTGGKGILS
Также как и последовательность GBS67 из штамма 2603 V/R серотипа V, последовательность GBS67 из штамма H36B серотипа Ib содержит аминокислотный мотив, характерный для якоря клеточной стенки, показанный курсивом в последовательности SEQ ID NO: 24, выше. Соответственно, в одном предпочтительном фрагменте GBS67, для использования в настоящем изобретении, мотив трансмембранного якоря и мотив якоря клеточной стенки удалены из GBS67. Пример такого фрагмента GBS67 представлен ниже как последовательность SEQ ID NO: 26.
MRKYQKFSKILTLSLFCLSQIPLNTNVLGESTVPENGAKGKLVVKKTDDQNKPLSKATFVLKPTSHSESKVEKVTTEVTGEATFDNLTPGDYTLSEETAPEGYKKTTQTWQVKVESNGKTTIQNSDDKKSIIEQRQEELDKQYPLTGAYEDTKESYNLEHVKNSIPNGKLEAKAVNPYSSEGEHIREIQEGTLSKRISEVNDLDHNKYKIELTVSGKSIIKTINKDEPLDVVFVLDNSNSMKNNGKNNKAKKAGEAVETIIKDVLGANVENRAALVTYGSDIFDGRTVKVIKGFKEDPYYGLETSFTVQTNDYSYKKFTNIAADIIKKIPKEAPEAKWGGTSLGLTPEKKREYDLSKVGETFTMKAFMEADTLLSSIQRKSRKIIVHLTDGVPTRSYAINSFVKGSTYANQFERIKEKGYLDKNNYFITDDPEKIKGNGESYFLFPLDSYQTQIISGNLQKLHYLDLNLNYPKGTIYRNGPVREHGTPTKLYINSLKQKNYDIFNFGIDISGFRQVYNEDYKKNQDGTFQKLKEEAFELSDGEITELMNSFSSKPEYYTPIVTSADVSNNEILSKIQQQFEKILTKENSIVNGTIEDPMGDKINLHLGNGQTLQPSDYTLQGNDGSIMKDSIATGGPNNDGGILKGVKLEYIKNKLYVRGLNLGEGQKVTLTYDVKLDDSFISNKFYDTNGRTTLNPKSEEPDTLRDFPIPKIRDVREYPTITIKNEKKLGEIEFTKVDKDNNKLLLKGATFELQEFNEDYKLYLPIKNNNSKVVTGENGKISYKDLKDGKYQLIEAVSPKDYQKITNKPILTFEVVKGSIQNIIAVNKQISEYHEEGDKHLITNTHIPPKGI
GBS80
GBS80 представляет собой предполагаемый поверхностный белок семейства якоря клеточной стенки. Нуклеотидная и аминокислотная последовательности GBS80 серотипа V, полученные из штамма 2603 V/R, представлены в ссылке 99 как SEQ ID NO: 8779 и SEQ ID NO: 8780. Аминокислотная последовательность GBS80 представлена ниже как последовательность SEQ ID NO: 2.
MKLSKKLLFSAAVLTMVAGSTVEPVAQFATGMSIVRAAEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPSIPNTGGIGTAIFVAIGAAVMAFAVKGMKRRTKDN
GBS80 содержит на N-конце область лидерной последовательности или область сигнальной последовательности, которая выделена подчеркнутой областью, см. выше. Одна или несколько аминокислот из области лидерной или сигнальной последовательности GBS80 могут быть удалены. Пример такого фрагмента GBS80 представлен ниже как последовательность SEQ ID NO: 6.
AEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPSIPNTGGIGTAIFVAIGAAVMAFAVKGMKRRTKDN
GBS80 содержит трансмембранную область на С-конце, которая выделена подчеркнутой областью около конца последовательности SEQ ID NO: 2, см. выше. Одна или несколько аминокислот из трансмембранной области и/или цитоплазматической области могут быть удалены. Пример такого фрагмента представлен ниже как последовательность SEQ ID NO:7.
MKLSKKLLFSAAVLTMVAGSTVEPVAQFATGMSIVRAAEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPSIPNTG
GBS80 содержит аминокислотный мотив, характерный для якоря клеточной стенки, показанный курсивом в последовательности SEQ ID NO: 2, выше. В некоторых рекомбинантных системах клетки-хозяина может быть предпочтительно удаление этого мотива для того, чтобы облегчить секрецию рекомбинантного белка GBS80 из клетки-хозяина. Соответственно, трансмембранная область и/или цитоплазматическая область, и мотив якоря клеточной стенки могут быть удалены из GBS80. Пример такого фрагмента GBS67 представлен ниже как последовательность SEQ ID NO: 8.
MKLSKKLLFSAAVLTMVAGSTVEPVAQFATGMSIVRAAEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPS
Альтернативно, в некоторых рекомбинантных системах клетки-хозяина может быть предпочтительно использован мотив якоря клеточной стенки для прикрепления экспрессируемого рекомбинантного белка к клеточной стенке. Внеклеточный домен экспрессируемого белка может быть отщеплен во время очистки, или рекомбинантный белок в итоговой композиции можно сохранить прикрепленным к инактивированным клеткам-хозяевам или прикрепленным к мембранам клетки.
В одном варианте выполнения изобретения область лидерной или сигнальной последовательности, последовательность трансмембранной области и цитоплазматической области, а также мотив якоря клеточной стенки удалены из последовательности GBS80. Пример такого фрагмента GBS80 представлен ниже как последовательность SEQ ID NO: 9.
AEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPS
В частности, иммуногенный фрагмент GBS80 расположен у N-конца белка, и он представлен здесь как последовательность SEQ ID NO: 10.
AEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKG
Spb1
Последовательность Spb1 серотипа III дикого типа, выделенная из штамма COH1, представляет собой последовательность SEQ ID NO: 3, представленную ниже.
MKKKMIQSLLVASLAFGMAVSPVTPIAFAAETGTITVQDTQKGATYKAYKVFDAEIDNANVSDSNKDGASYLIPQGKEAEYKASTDFNSLFTTTTNGGRTYVTKKDTASANEIATWAKSISANTTPVSTVTESNNDGTEVINVSQYGYYYVSSTVNNGAVIMVTSVTPNATIHEKNTDATWGDGGGKTVDQKTYSVGDTVKYTITYKNAVNYHGTEKVYQYVIKDTMPSASVVDLNEGSYEVTITDGSGNITTLTQGSEKATGKYNLLEENNNFTITIPWAATNTPTGNTQNGANDDFFYKGINTITVTYTGVLKSGAKPGSADLPENTNIATINPNTSNDDPGQKVTVRDGQITIKKIDGSTKASLQGAIFVLKNATGQFLNFNDTNNVEWGTEANATEYTTGADGIITITGLKEGTYYLVEKKAPLGYNLLDNSQKVILGDGATDTTNSDNLLVNPTVENNKGTELPSTGGIGTTIFYIIGAILVIGAGIVLVARRRLRS
Последовательность Spb1 дикого типа содержит область лидерной или сигнальной последовательности на N-конце, которая выделена подчеркнутой областью (аминокислоты 1-29, см. выше). Одна или несколько аминокислот из области лидерной или сигнальной последовательности Spb1 могут быть удалены. Пример такого фрагмента Spb1 представлен ниже как последовательность SEQ ID NO: 11:
AETGTITVQDTQKGATYKAYKVFDAEIDNANVSDSNKDGASYLIPQGKEAEYKASTDFNSLFTTTTNGGRTYVTKKDTASANEIATWAKSISANTTPVSTVTESNNDGTEVINVSQYGYYYVSSTVNNGAVIMVTSVTPNATIHEKNTDATWGDGGGKTVDQKTYSVGDTVKYTITYKNAVNYHGTEKVYQYVIKDTMPSASVVDLNEGSYEVTITDGSGNITTLTQGSEKATGKYNLLEENNNFTITIPWAATNTPTGNTQNGANDDFFYKGINTITVTYTGVLKSGAKPGSADLPENTNIATINPNTSNDDPGQKVTVRDGQITIKKIDGSTKASLQGAIFVLKNATGQFLNFNDTNNVEWGTEANATEYTTGADGIITITGLKEGTYYLVEKKAPLGYNLLDNSQKVILGDGATDTTNSDNLLVNPTVENNKGTELPSTGGIGTTIFYIIGAILVIGAGIVLVARRRLRS
Последовательность Spb1 дикого типа содержит аминокислотный мотив, характерный для якоря клеточной стенки (LPSTG). В некоторых рекомбинантных системах клетки-хозяина может быть предпочтительно удаление этого мотива для того, чтобы облегчить секрецию рекомбинантного белка Spb1 из клетки-хозяина. Соответственно, мотив якоря клеточной стенки и последовательность С-конца у этого мотива могут быть удалены из Spb1. Пример такого фрагмента представлен ниже как последовательность SEQ ID NO: 12.
MKKKMIQSLLVASLAFGMAVSPVTPIAFAAETGTITVQDTQKGATYKAYKVFDAEIDNANVSDSNKDGASYLIPQGKEAEYKASTDFNSLFTTTTNGGRTYVTKKDTASANEIATWAKSISANTTPVSTVTESNNDGTEVINVSQYGYYYVSSTVNNGAVIMVTSVTPNATIHEKNTDATWGDGGGKTVDQKTYSVGDTVKYTITYKNAVNYHGTEKVYQYVIKDTMPSASVVDLNEGSYEVTITDGSGNITTLTQGSEKATGKYNLLEENNNFTITIPWAATNTPTGNTQNGANDDFFYKGINTITVTYTGVLKSGAKPGSADLPENTNIATINPNTSNDDPGQKVTVRDGQITIKKIDGSTKASLQGAIFVLKNATGQFLNFNDTNNVEWGTEANATEYTTGADGIITITGLKEGTYYLVEKKAPLGYNLLDNSQKVILGDGATDTTNSDNLLVNPTVENNKGTE
Альтернативно, в некоторых рекомбинантных системах клетки-хозяина может быть предпочтительно использован мотив якоря клеточной стенки для прикрепления экспрессируемого рекомбинантного белка к клеточной стенке. Внеклеточный домен экспрессируемого белка может быть отщеплен во время очистки, или рекомбинантный белок в итоговой композиции можно сохранить прикрепленным к инактивированным клеткам-хозяевам или прикрепленным к мембранам клетки.
В одном варианте выполнения изобретения область лидерной или сигнальной последовательности, а также мотив якоря клеточной стенки и последовательность С-конца удалены из последовательности Spb1. Пример такого фрагмента Spb1 представлен ниже как последовательность SEQ ID NO: 13.
AETGTITVQDTQKGATYKAYKVFDAEIDNANVSDSNKDGASYLIPQGKEAEYKASTDFNSLFTTTTNGGRTYVTKKDTASANEIATWAKSISANTTPVSTVTESNNDGTEVINVSQYGYYYVSSTVNNGAVIMVTSVTPNATIHEKNTDATWGDGGGKTVDQKTYSVGDTVKYTITYKNAVNYHGTEKVYQYVIKDTMPSASVVDLNEGSYEVTITDGSGNITTLTQGSEKATGKYNLLEENNNFTITIPWAATNTPTGNTQNGANDDFFYKGINTITVTYTGVLKSGAKPGSADLPENTNIATINPNTSNDDPGQKVTVRDGQITIKKIDGSTKASLQGAIFVLKNATGQFLNFNDTNNVEWGTEANATEYTTGADGIITITGLKEGTYYLVEKKAPLGYNLLDNSQKVILGDGATDTTNSDNLLVNPTVENNKGTE
В Spb1 также был идентифицирован бокс E, содержащий консервативные остатки глутамина (подчеркнуто), при этом консервативный остаток глутамина представлен в положении 423 (выделено жирным шрифтом). Мотив бокса E может быть важным для формирования олигомерных, пилус-подобных структур, и таким образом полезные фрагменты Spb1 могут включать консервативный остаток глутамина.
Последовательность Spb1 дикого типа содержит кодон внутреннего метионина (Met-162), у которого в положении апстрим имеется 12-мерная последовательность TAATGGAGCTGT (SEQ ID NO: 14), которая включает коровую последовательность (подчеркнуто) последовательности Шайно-Дальгарно. Эта последовательность Шайно-Дальгарно, как было определено, инициирует трансляцию усеченной последовательности Spbl. Для предотвращения инициирования трансляции на этом сайте, последовательность Шайно-Дальгарно может быть разрушена в области, кодирующей Spb1, используемой для экспрессии. Хотя любой подходящий нуклеотид может быть мутирован для предотвращения рибосомного связывания, последовательность включает кодон глицина GGA, который является частью кора Шайно-Дальгарно и одновременно находится внутри рамки с внутренним кодоном метионина. Третье основание в этом кодоне может быть мутировано на C, G или T, не изменяя кодируемый глицин, избегая, тем самым любого изменения последовательности Spb1.
Композиции по изобретению могут также включать полипептид, определенный в ссылке [227] как аминокислотная последовательность NH2-W-X-L-Y-Z-CO2H, где: X представляет собой последовательность Spb1; L представляет собой необязательный линкер; Y представляет собой последовательность GBS80; W представляет собой дополнительную N-концевую последовательность; и Z представляет собой необязательную С-концевую последовательность. Дальнейшая детализация этого полипептида приведена ниже.
Такие композиции могут также включить один или несколько белковых антигенов GBS, описанных выше. В частности композиции по изобретению могут включать (a) полипептид с аминокислотной последовательностью NH2-W-X-L-Y-Z-CO2H; и (b1) полипептид, включающий аминокислотную последовательность SEQ ID NO: 1, как описано выше, и/или (b2) полипептид, включающий (i) аминокислотную последовательность, которая обладает определенной идентичностью с последовательностью SEQ ID NO: 1, как описано выше, и/или (ii) фрагмент SEQ ID NO: 1, как описано выше.
Полипептид NH2-W-X-L-Y-Z-CO2H
Как правило, полипептид включает аминокислотную последовательность X-L-Y, где: X представляет собой последовательность Spbl; L представляет собой необязательный линкер; и Y представляет собой последовательность GBS80.
X: Последовательность Spb1
Компонент X представляет собой последовательность Spb1. Эта последовательность Spb1, будучи введенной субъекту, вызывает антительный ответ, который включает антитела, связывающиеся с белком Spb1 дикого типа, например с белком S.agalactiae, имеющим аминокислотную последовательность SEQ ID NO: 3 (полноразмерная последовательность белка дикого типа из штамма COH1).
Последовательность Spb1 может включать аминокислотную последовательность, обладающую по меньшей мере определенным процентом идентичности ("а" %) с последовательностью SEQ ID NO: 13. Значение "а" может быть выбрано из величин 50, 60, 70, 80, 85, 90, 95, 96, 97, 98, 99 или более. Последовательность Spb1 может включать последовательность SEQ ID NO: 13.
Последовательность Spb1 может включать фрагмент последовательности SEQ ID NO: 3 и/или SEQ ID NO: 13. Фрагмент будет, как правило, включать по меньшей мере "b" аминокислот из последовательности SEQ ID NO: 3/SEQ ID NO: 13, где значение "b" выбрано из величин 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 175, 200 или более. Фрагмент будет, как правило, включать по меньшей мере один эпитоп для T-клетки или, предпочтительно, эпитоп для B-клетки из последовательности SEQ ID NO: 3/SEQ ID NO: 13. Эпитопы для T- и B-клеток могут быть идентифицированы способами, описанными выше. Последовательность SEQ ID NO: 13 является самостоятельным фрагментом последовательности SEQ ID NO: 3, как объяснено выше.
Последовательность Spb1 может включать аминокислотную последовательность, которая имеет "а" % идентичности с последовательностью SEQ ID NO: 13, и одновременно включает фрагмент последовательности SEQ ID NO: 13, как определено выше.
Компонент X будет, как правило, иметь длину по меньшей мере из "c" аминокислот, где значение "c" выбрано из величин 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320, 340, 360, 380, 400 или более.
Компонент X будет, как правило, иметь длину не более чем из "d" аминокислот, где значение "d" выбрано из величин 500, 480, 460, 440, 420, 400, 380, 360, 340, 320, 300, 280, 260, 240, 220, 200 или менее.
Компонент X будет, как правило, иметь длину в пределах 300-500 аминокислот, например, 350-480, 400-460, 430-450 аминокислот.
Последовательностью Spb1 дикого типа из штамма COH1 серотипа III является последовательностью SEQ ID NO: 3, как указано выше. Конкретные производные ее, описанные в разделе "Spb1" выше, применимы к последовательности Spb1 этого варианта выполнения изобретения.
Y: Последовательность GBS80
Компонент Y представляет собой последовательность GBS80. Эта последовательность GBS80, будучи введенной субъекту, вызывает антительный ответ, который включает антитела, связывающиеся с белком GBS80 дикого типа, например с белком S.agalactiae, имеющим аминокислотную последовательность SEQ ID NO: 2 (полноразмерная последовательность белка дикого типа из штамма 2603V/R).
Последовательность GBS80 может включать аминокислотную последовательность, обладающую по меньшей мере определенным процентом идентичности ("е" %) с последовательностью SEQ ID NO: 9. Значение "е" может быть выбрано из величин 50, 60, 70, 80, 85, 90, 95, 96, 97, 98, 99 или более. Последовательность GBS80 может включать последовательность SEQ ID NO: 9.
Последовательность GBS80 может включать фрагмент последовательности SEQ ID NO: 2 или последовательности SEQ ID NO: 9. Фрагмент будет, как правило, включать по меньшей мере "f" аминокислот из последовательности SEQ ID NO: 2/SEQ ID NO: 9, где значение "f" выбрано из величин 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 175, 200 или более. Фрагмент будет, как правило, включать по меньшей мере один эпитоп для T-клетки или, предпочтительно, эпитоп для B-клетки из последовательности SEQ ID NO: 2/SEQ ID NO:9. Последовательность SEQ ID NO: 9 является самостоятельным фрагментом последовательности SEQ ID NO: 2, как объяснено выше.
Последовательность GBS80 может включать аминокислотную последовательность, которая имеет "е" % идентичности с последовательностью SEQ ID NO: 9, и одновременно включает фрагмент последовательности SEQ ID NO: 9, как определено выше.
Компонент Y будет, как правило, иметь длину по меньшей мере из "g" аминокислот, где значение "g" выбрано из величин 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320, 340, 360, 380, 400, 420, 440, 460, 480, 500, 520, 540, 560, 580, 600 или более.
Компонент Y будет, как правило, иметь длину не более чем из "h" аминокислот, где значение "h" выбрано из величин 600, 580, 560, 540, 520, 500, 480, 460, 440, 420, 400, 380, 360, 340, 320, 300, 280, 260, 240, 220, 200 или менее.
Компонент Y будет, как правило, иметь длину в пределах 350-500 аминокислот, например, 400-520, 450-500, 470-490 аминокислот.
Последовательностью GBS80 дикого типа из штамма 2603 V/R серотипа V является последовательностью SEQ ID NO: 2, как указано выше. Конкретные производные ее, описанные в разделе "GBS80" выше, применимы к последовательности GBS80 этого варианта выполнения изобретения.
L: линкер
Полипептид необязательно включает компонент L для того, чтобы связать компонент X и компонент Y. Компонент L представляет собой, как правило, короткую аминокислотную последовательность, размером, например, в 2-40 аминокислот, состоящую, например, из 2, 3, 4, 5, 6, 7, 8, 9, 10, 1 1, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот.
Линкеры будут, как правило, содержать по меньшей мере один остаток глицина, облегчая, таким образом, структурную гибкость. Линкер может содержать, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более остатков глицина. Глицины могут быть расположены так, чтобы включать по меньшей мере два последовательных глицина, как в последовательности дипептида Gly-Gly, или включать более длинную олиго-Gly последовательность, т.е. Glyn, где n равно 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, например, как в последовательности SEQ ID NO: 15:
GGGG
Линкеры могут быть закодированы кодонами, находящимися в последовательностях распознавания ферментов рестрикции. Например, 6-мерная последовательность, которая является целью конкретного фермента рестрикции, может кодировать дипептид. Таким образом, последовательность распознавания для BamHI (GGATCC) кодирует Gly-Ser, и таким образом, линкер может включать последовательность дипептида Gly-Ser. Такие последовательности облегчают клонирование и операции с последовательностями.
Полезные последовательности линкера включают SEQ ID NO: 15, см. выше, и нижеследующие последовательности SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18.
GGGGSGGGGSGGGG (SEQ ID NO: 16)
GGGGSGGGGSGGGGSEL (SEQ ID NO: 17)
GSGGGG (SEQ ID NO: 18)
Однако, предпочтительные линкеры не включают последовательность, которая разделяет 10 или более смежных аминокислот последовательности полипептида человека. Например, одна богатая глицином последовательность линкера, которая может использоваться в изобретении, представляет собой 14-мер последовательности SEQ ID NO: 16. Однако этот 14-мер также найден в белке связывания РНК человека (gi:8051631), и таким образом, предпочтительно избегать его в составе компонента L.
W: N-концевая последовательность
Компонент X может находиться на N-конце полипептида, но также возможно, что он имеет аминокислоты в положении апстрим по отношению к X. Эти дополнительные аминокислоты формируют компонент W.
Компонент W представляет собой, как правило, короткую аминокислотную последовательность, размером, например, в 2-40 аминокислот, состоящую, например из 2, 3, 4, 5, 6, 7, 8, 9, 10, 1 1, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот.
Примеры компонента W представляют собой лидерные последовательности для управления транскрипции белков, или включают короткие пептидные последовательности, которые облегчают клонирование или очистку белка (например гистидиновые тэги, т.е. Hisn, где n равно 3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие аминокислотные последовательности для N-конца являются очевидными для квалифицированных в данной области специалистов.
Компонент W может обеспечить в образующимся полипептиде метионин на N-конце полипептида (в бактериях - формил-метионин, fMet). Одна или несколько аминокислот могут быть отщеплены от N-конца образующегося компонента W, однако компонент W в полипептиде по изобретению не обязательно включает метионин на N-конце.
Полезные компоненты W включают SEQ ID NO: 19:
MAS
Z: С-концевая последовательность
Компонент Y может находиться на С-конце полипептида, но также он может иметь аминокислоты в положении даунстрим по отношению к Y. Эти дополнительные аминокислоты формируют компонент Z.
Компонент Z представляет собой, как правило, короткую аминокислотную последовательность, размером, например, в 2-40 аминокислот, например состоящую из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот.
Примеры компонента Z включают последовательности для управления транскрипции белков, короткие пептидные последовательности, которые облегчают клонирование или очистку белка (например гистидиновые тэги, т.е. Hisn, где n равно 3, 4, 5, 6, 7, 8, 9, 10 или более), или последовательности, которые усиливают стабильность белка. Другие подходящие аминокислотные последовательности для С-конца являются очевидными для квалифицированных в данной области специалистов, и представляют собой глутатион-S-трансферазу, тиоредоксин, фрагмент белка A размером 14 кДа из S. aureus, биотинилированный пептид, белок, связывающийся с мальтозой, энтерокиназный сигнал и т.п. Один полезный компонент Z включает SEQ ID NO: 20:
HHHHHH
Полезные комбинации
Полезные различные комбинации компонентов X, Y и L включают, но без ограничений, следующие.
MASAETGTITVQDTQKGATYKAYKVFDAEIDNANVSDSNKDGASYLIPQGKEAEYKASTDFNSLFTTTTNGGRTYVTKKDTASANEIATWAKSISANTTPVSTVTESNNDGTEVINVSQYGYYYVSSTVNNGAVIMVTSVTPNATIHEKNTDATWGDGGGKTVDQKTYSVGDTVKYTITYKNAVNYHGTEKVYQYVIKDTMPSASVVDLNEGSYEVTITDGSGNITTLTQGSEKATGKYNLLEENNNFTITIPWAATNTPTGNTQNGANDDFFYKGINTITVTYTGVLKSGAKPGSADLPENTNIATINPNTSNDDPGQKVTVRDGQITIKKIDGSTKASLQGAIFVLKNATGQFLNFNDTNNVEWGTEANATEYTTGADGIITITGLKEGTYYLVEKKAPLGYNLLDNSQKVILGDGATDTTNSDNLLVNPTVENNKGTEGGGGSGGGGSGGGGSELAEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPS (SEQ ID NO:21)
MASAETGTITVQDTQKGATYKAYKVFDAEIDNANVSDSNKDGASYLIPQGKEAEYKASTDFNSLFTTTTNGGRTYVTKKDTASANEIATWAKSISANTTPVSTVTESNNDGTEVINVSQYGYYYVSSTVNNGAVIMVTSVTPNATIHEKNTDATWGDGGGKTVDQKTYSVGDTVKYTITYKNAVNYHGTEKVYQYVIKDTMPSASVVDLNEGSYEVTITDGSGNITTLTQGSEKATGKYNLLEENNNFTITIPWAATNTPTGNTQNGANDDFFYKGINTITVTYTGVLKSGAKPGSADLPENTNIATINPNTSNDDPGQKVTVRDGQITIKKIDGSTKASLQGAIFVLKNATGQFLNFNDTNNVEWGTEANATEYTTGADGIITITGLKEGTYYLVEKKAPLGYNLLDNSQKVILGDGATDTTNSDNLLVNPTVENNKGTEGGGGSGGGGSGGGGSELAEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPSHHHHHH (SEQ ID NO:22)
MASAETGTITVQDTQKGATYKAYKVFDAEIDNANVSDSNKDGASYLIPQGKEAEYKASTDFNSLFTTTTNGGRTYVTKKDTASANEIATWAKSISANTTPVSTVTESNNDGTEVINVSQYGYYYVSSTVNNGAVIMVTSVTPNATIHEKNTDATWGDGGGKTVDQKTYSVGDTVKYTITYKNAVNYHGTEKVYQYVIKDTMPSASVVDLNEGSYEVTITDGSGNITTLTQGSEKATGKYNLLEENNNFTITIPWAATNTPTGNTQNGANDDFFYKGINTITVTYTGVLKSGAKPGSADLPENTNIATINPNTSNDDPGQKVTVRDGQITIKKIDGSTKASLQGAIFVLKNATGQFLNFNDTNNVEWGTEANATEYTTGADGIITITGLKEGTYYLVEKKAPLGYNLLDNSQKVILGDGATDTTNSDNLLVNPTVENNKGTEGSGGGGELAEVSQERPAKTTVNIYKLQADSYKSEITSNGGIENKDGEVISNYAKLGDNVKGLQGVQFKRYKVKTDISVDELKKLTTVEAADAKVGTILEEGVSLPQKTNAQGLVVDALDSKSNVRYLYVEDLKNSPSNITKAYAVPFVLELPVANSTGTGFLSEINIYPKNVVTDEPKTDKDVKKLGQDDAGYTIGEEFKWFLKSTIPANLGDYEKFEITDKFADGLTYKSVGKIKIGSKTLNRDEHYTIDEPTVDNQNTLKITFKPEKFKEIAELLKGMTLVKNQDALDKATANTDDAAFLEIPVASTINEKAVLGKAIENTFELQYDHTPDKADNPKPSNPPRKPEVHTGGKRFVKKDSTETQTLGGAEFDLLASDGTAVKWTDALIKANTNKNYIAGEAVTGQPIKLKSHTDGTFEIKGLAYAVDANAEGTAVTYKLKETKAPEGYVIPDKEIEFTVSQTSYNTKPTDITVDSADATPDTIKNNKRPS (SEQ ID NO:23)
Полипептид может включать аминокислотную последовательность, которая имеет "i" % идентичности с последовательностью SEQ ID NO: 21. Значение "i" может быть выбрано из величин 50, 60, 70, 80, 85, 90, 95, 96, 97, 98, 99 и более. Полипептид может включать последовательность SEQ ID NO: 21.
Полипептид может включать аминокислотную последовательность, которая имеет "i" % идентичности с последовательностью SEQ ID NO: 23. Значение может быть выбрано из величин 50, 60, 70, 80, 85, 90, 95, 96, 97, 98, 99 и более. Полипептид может включать последовательность SEQ ID NO: 23.
Полипептид, используемый в изобретении, может включать аминокислотную последовательность, которая:
(a) является идентичной (т.е. имеет 100% идентичности) последовательности SEQ ID NO: 21 или SEQ ID NO: 23;
(b) обладает определенной идентичностью с последовательностью SEQ ID NO: 21 или SEQ ID NO: 23;
(c) имеет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 (или более) единичных аминокислотных изменений (делеции, инсерции, замещения), которые могут быть расположены в раздельных местах, или могут быть смежным, по сравнению с последовательностями (a) или (b); и
(d) при выравнивании последовательностей SEQ ID NO: 21 или SEQ ID NO: 23 с использованием алгоритма парного выравнивания, каждое движущееся от N-конца к С-концу окно из "x" аминокислот (при условии, что при выравнивании, охватывающем "p" аминокислот, где p>x, количество окон составляет "p-x+1") имеет по меньшей мере "x·y" идентичность по выровненным аминокислотам, где: "x" выбрано из значений 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 150 и 200; "y" выбрано из значений 0,50, 0,60, 0,70, 0,75, 0,80, 0,85, 0,90, 0,91, 0,92, 0,93, 0,94, 0,95, 0,96, 0,97, 0,98 и 0,99; и если значение величины "x·y" не является целым числом, то это значение округляется до самого близкого целого числа. Предпочтительный парный алгоритм выравнивания представляет собой алгоритм выравнивания глобальный Needleman-Wunsch [см. ссылку 228], с использованием параметров по умолчанию (например: штраф за открытие пропуска = 10,0, штраф за продление пропуска = 0,5; результирующая матрица - EBLOSUM62). Этот алгоритм обычно применяется в пакете программ EMBOSS в рамках вкладки "needle" [см. ссылку 229].
Делеции или инсерции в группе (c) могут находиться на N-конце и/или С-конце, или могут находиться между этими двумя концами. Таким образом, трункация (укорачивание) представляет собой пример делеции. Трункации могут включать делецию до 40 (или более) аминокислот на N-конце и/или С-конце.
Последовательности Spb1 и GBS80 в полипептидах могут быть получены из одного или нескольких штаммов GBS. Например, SEQ ID NO: 21 и SEQ ID NO: 23 включают последовательность Spbl из штамма COH1 и последовательность GBS80 из штамма 2603V/R.
Полипептиды
Полипептиды, или индивидуальные компоненты, могут, по сравнению с последовательностями SEQ ID NO: 2, 3, 9, 10, 13, 21 или 23, включать одну или несколько (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.) консервативных аминокислотных замен, то есть замены одной аминокислоты на другую, у которой имеется схожая боковая цепь. Генетически кодируемые аминокислоты в целом делятся на четыре семейства: (1) кислые аминокислоты, т.е. есть аспартат, глутамат; (2) основные аминокислоты, т.е. лизин, аргинин, гистидин; (3) неполярные аминокислоты, т.е. аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) неполярные аминокислоты, т.е. глицин, аспарагин, глутамин, цистин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда вместе классифицируются как ароматические аминокислоты. В целом, замена единичных аминокислот в пределах этих семейств не имеет существенного влияния на биологическую активность. Полипептиды могут также включать одну или несколько (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.) делеций одной аминокислоты относительно референсных последовательностей. Полипептиды могут также включать одну или несколько (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.) инсерций (при этом, например, каждая инсерция состоит из 1, 2, 3, 4 или 5 аминокислот) относительно референсных последовательностей.
Полипептиды могут быть получены различными способами, как описано выше. Полипептиды также могут принимать различные формы (например природную, слитую, гликозилированную, не гликозилированную, липидированную, не липидированную, фосфорилированную, не фосфорилированную, миристоилированную, не миристоилированную, мономерную, мультимерную форму, форму в виде макрочастицы, денатурированную и т.п. формы). Они предпочтительно используются в очищенной или по существу очищенной форме, как описано выше.
Термин "полипептид" относится к аминокислотным полимерам любой длины. Полимер может быть линейным или разветвленным, он может включать измененные аминокислоты, и он может быть содержать разрывы из соединений, не относящихся к аминокислотам. Этот термин также охватывает аминокислотный полимер, который является природноизмененным, или был искусственно модифицирован; например, за счет образования дисульфидных связей, гликозилирования, липидирования, ацетилирования, фосфорилирования, или он подвергся любому другому воздействию или любой другой модификации, такой как конъюгирование с компонентом метки. В рамках этого определения также включены, например, полипептиды, которые содержат один или несколько аналогов аминокислот (включая, например, неприродные аминокислоты и т.п.), так же как и другие модификации, известные в уровне техники. Полипептиды могут быть представлены в форме единичной цепи или связанной цепи. Полипептиды могут быть природно или искусственно гликозилированы (т.е. полипептид имеет профиль гликозилирования, который отличается от профиля гликозилирования, который присутствует в природном полипептиде).
Полипептиды могут содержать, по меньшей мере, 40 аминокислот (например, по меньшей мере 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 350, 400, 450, 500 или более аминокислот). Полипептиды могут содержать меньше, чем 1100 аминокислот.
Предварительное иммунизирование
Во втором варианте выполнения изобретения изобретение предоставляет способ иммунизирования пациента против инфекции GBS, включающий стадию введения пациенту конъюгата, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом дифтерии (Dt) или его производным, где пациент был предварительно иммунизирован токсоидом дифтерии или его производным. Как правило, конъюгат представляет собой один из конъюгатов GBS в иммуногенной композиции по первому варианту выполнения изобретения, как описано выше. Другими словами, иммуногенные композиции по первому варианту выполнения изобретения, где по меньшей мере один конъюгат является капсулярным сахаридом GBS, конъюгированным с токсоидом дифтерии или его производным, могут использоваться во втором варианте выполнения изобретения. Капсулярный сахарид, конъюгированный с токсоидом дифтерии или его производным в композиции, может, например, представлять собой GBS серотипа Ia, Ib или III. В частности, капсулярный сахарид может быть GBS серотипа III (как будет показано ниже). В этом варианте выполнения изобретения является типичным, когда в композиции все капсулярные сахариды GBS конъюгированы с токсоидом дифтерии или его производным. Когда антиген носителя представляет собой производное токсоида дифтерии или предварительная иммунизации выполняется с использованием производного токсоида дифтерии, то производное токсоида дифтерии предпочтительно является иммунологически перекрестнореактивным с Dt, и предпочтительно представляет собой CRM197.
Авторы настоящего изобретения обнаружили, что конъюгаты, которые представляют собой капсулярные сахариды GBS, конъюгированные с токсоидом дифтерии или его производными, скорее всего не имеют негативных проблем, связанных с супрессией от эпитопов носителя (или "супрессия носителем", что является общеизвестным), в частности, с супрессией, которая является результатом примирования носителем. Как будет показано ниже, "супрессия носителем" является феноменом, при котором предварительное иммунизирование животного белком-носителем исключает более позднее формирование иммунного ответа против нового антигенного эпитопа, который присутствует на этом носителе [см. ссылку 230]. В отличие от этого известного явления, авторы настоящего изобретения обнаружили, что иммунный ответ на конъюгаты капсулярного сахарида GBS и токсоида дифтерии или его производного, может быть в действительности улучшен за счет предварительного иммунизирования токсоидом дифтерии или его производным.
Как сообщается в ссылке 231, когда несколько антигенов вакцины содержат один и тот же белковый компонент (используемый в качестве иммуногена и/или в качестве белка носителя в конъюгате), то существует возможность взаимного влияния между этими антигенами. В ссылке 231 описано, что иммунный ответ против антигена, который был конъюгирован с токсоидом столбняка (Tt) в качестве носителя, был подавлен за счет существующего ранее иммунитета против Tt.
В ссылке 232 сообщается, что комбинация вакцины D-T-P с конъюгатной вакциной Hib имела неблагоприятный результат, поскольку носитель для конъюгата Hib был тем же самым, что и антиген столбняка в вакцине D-T-P. Авторы в этой ссылке пришли к заключению, что этот феномен "супрессии носителем", возникающий как результат взаимного влияния общего белка антигена и носителя, должен быть принят во внимание при введении вакцин, которые включают несколько конъюгатов.
В отличие от ссылок 231 и 232, в ссылке 233 сообщается, что при примировании токсоидом столбняка не имелось никаких негативных воздействий на иммунный ответ, возникающий при последующем введении конъюгата Hib-Tt, но у пациентов с антителами против Tt, имеющимися с рождения, был отмечен феномен супрессии. В ссылке 234 сообщается об эффекте "эпитопной супрессии" для конъюгата пептида, основанного на Tt, у пациентов, имеющих антитела против Tt, которые были образованы за счет прививки от столбняка.
В ссылке 235 предполагается, что конъюгат, включающий CRM197 (детоксифицированный мутант токсина дифтерии) в качестве носителя, может быть неэффективным для детей, которым ранее не вводили токсин дифтерии в виде составной части вакцины (например, как части вакцины D-T-P или D-T). Эта работа была далее развита в ссылке 236, где отмечено, что за счет иммунизации вакциной D-T эффект примирования носителем сохранился для последующего иммунизирования конъюгатами Hib.
В ссылке 237 авторы нашли, что предварительное иммунизирование токсоидом дифтерии или токсоидом столбняка в качестве белка-носителя, уменьшало рост уровней антител против Hib, в равной степени для IgG1 и IgG2, от последующего иммунизирования капсулярным сахаридом Hib, конъюгированным с тем же носителям. Ответы на части носителей конъюгатов были также подавлены. Кроме того, была отмечена общая неспецифическая неэпитопная супрессия, поскольку было выявлено, что предварительное иммунизирование первым конъюгатом влияло на иммунные ответы как против носителя, так и против сахаридных частей второго конъюгата, который вводили через четыре недели.
В ссылке 238 сообщается об использовании в единой поливалентной пневмококковой конъюгатной вакцине различных белков носителя, где несколько носителей используются для того, чтобы избежать супрессии носителем. В этой ссылке авторы предполагают, что существует максимальная нагрузка белка-носителя, который может быть использован в поливалентной конъюгатной вакцине, без возникновения негативных взаимных влияний. В ссылке 239 сообщается, что пневмококковые конъюгатные вакцины, включающие смешанные белки-носители вызывали, одновременно с ответом против пневмококков, увеличенные непредвиденные ответы на носители.
В ссылке 240, описывающей исследование о возможности бустерного введения моновалентных конъюгатов менингококков серогруппы C с токсоидами дифтерии и столбняка, было установлено, что титры против менингококкового конъюгата были снижены, когда носитель представлял собой токсоид столбняка, а пациент получал предшествующую иммунизацию вакциной, содержащей токсоид столбняка.
В дополнение к проблеме примирования носителем, имеющим негативное воздействие на иммунные ответы против конъюгатов сахаридов, следует отметить, что может иметь место и обратное влияние, т.е. иммунизирование конъюгатом может иметь негативное воздействие на иммунные ответы против носителя [см. ссылку 241].
Поэтому второй вариант выполнения изобретения предоставляет способ иммунизирования пациента против инфекции GBS, включающий стадию введения пациенту конъюгата, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом дифтерии или его производным, где пациент был предварительно иммунизирован токсоидом дифтерии или его производным. Этот вариант выполнения изобретения также предоставляет конъюгат, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом дифтерии или его производным, для применения при иммунизировании пациента против инфекции GBS, где пациент был предварительно иммунизирован токсоидом дифтерии или его производным. Этот вариант выполнения изобретения дополнительно обеспечивает применение конъюгата, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом дифтерии или его производным, для изготовления лекарственного средства для иммунизирования пациента против инфекции GBS, где пациент был предварительно иммунизирован токсоидом дифтерии или его производным.
Предварительно иммунизированный пациент
Предварительно иммунизированный пациент - это пациент, который будет иммунизирован, но который был предварительно иммунизирован токсоидом дифтерии или его производным. Токсоид дифтерии или его производное может быть введен как носитель в конъюгате капсулярного сахарида, иного, чем сахарид из GBS, и токсоида дифтерии или его производного. Типичный состав для предварительного иммунизирования будет включать: антиген токсоида дифтерии; конъюгат капсулярного сахарида Hib, в котором используется токсоид дифтерии или носитель CRM197; и/или конъюгат пневмококкового капсулярного сахарида, в котором используется токсоид дифтерии или носитель CRM197.
Пациент будет получать по меньшей мере одну (например, 1, 2, 3 или более) дозу антигена(ов) предварительного иммунизирования, и эту дозу (или самые ранние дозы в случае множественного дозирования) вводят пациенту по меньшей мере за шесть месяцев (например 6, 9, 12, 15, 18, 21, 24, 36, 48, 60, 120, 180, 240, 300 или более месяцев) до иммунизации конъюгатами GBS согласно этому варианту выполнения изобретения. В предпочтительной группе пациентов предварительное иммунизирование имеет место в течение 3 лет после рождения, например в течение 2 лет после рождения, в течение 1 года после рождения, в течение 6 месяцев после рождения, или даже в течение 3 месяцев, 2 месяцев или 1 месяца после рождения. Подходящие пациенты, которые будут иммунизированы согласно этому варианту выполнения изобретения, описаны выше в разделе "Способы лечения".
Когда антиген для предварительного иммунизирования представляет собой токсоид дифтерии, то пациент будет, как правило, получать токсоид в качестве антигена "D" в препаратах D-T-P или D-T при предварительном иммунизировании. Такое иммунизирование, как правило, проводится в отношении детей в возрасте 2, 3 и 4 месяца. Когда иммунизирование включает вакцину против коклюша, то вакцина может быть целой клеткой или клеточной вакциной против коклюша ("Pw"), но предпочтительно она является бесклеточной вакциной против коклюша ("Pa"). Вакцины "Pa" для предварительного иммунизирования будут в целом включать один, два или три антигена из следующих известных и хорошо охарактеризованных антигенов B. pertussis: (1) токсоид коклюша ("ΡΤ"), детоксифицированный либо химическими средствами, либо сайт-направленным мутагенезом, например мутант 9K/129G [см. ссылку 242]; (2) филаментный гемагглютинин ("FHA"); (3) пертактин (также известный как "белок внешней мембраны массой 69 кДа"). Бесклеточные вакцины коклюша могут также включать агглютиноген 2 и/или агглютиноген 3. Антиген "Т" в препарате D-T-P для предварительного иммунизирования представляет собой, как правило, токсоид столбняка.
Когда антиген для предварительного иммунизирования представляет собой токсоид дифтерии, то пациент, возможно, также или альтернативно, получает токсоид в качестве белка-носителя конъюгата сахарид-белок. Такие конъюгаты включают конъюгат Hib "PRP-D" [см. таблицу 14-7 в ссылке 243], например, продукт ProHIBITTM.
Когда антиген для предварительного иммунизирования представляет собой CRM197, то пациент будет, как правило, подвергаться предварительному иммунизированию конъюгатом Hib и/или поливалентным пневмококковым конъюгатом. Такое иммунизирование, как правило, проводится в отношении детей в возрасте 2, 3 и 4 месяца. Конъюгаты Hib, в которых используют носитель CRM197, включают "конъюгаты HbOC" [см. таблицу 14-7 в ссылке 243], например, продукт HibTITERTM. Пневмококковые конъюгаты, в которых используется CRM197 в качестве носителя, включают 7-валентные смеси PCV7, например, вакцина PrevNarTM [см. ссылку 244]. Пациента, возможно, также предварительно иммунизируют конъюгатом менингококка серогруппы C ("MenC"). Конъюгаты MenC, в которых используют CRM197 в качестве носителя, включают MeninvactTM/MenjugateTM [см. ссылку 245] и MeningitecTM.
Когда предварительное иммунизирование выполняют конъюгированным антигеном, то пациент практически неизбежно получает также небольшое количество свободного токсоида дифтерии (или его производного) в результате небольшого загрязнения конъюгата (например, за счет гидролиза конъюгата во время хранения), но это небольшое количество, как правило, не будет адекватно обеспечивать формирование существенного иммунного ответа.
Токсоид дифтерии представляет собой известный и хорошо охарактеризованный белок [например, см. главу 13 в ссылке 243], который может быть получен путем химического инактивирования ADP-рибозилированного экзотоксина Corynebacterium diphtheriae такими реагентами, как формалин или формальдегид. CRM197 также известен и хорошо охарактеризован [см. ссылки 246-249], и он широко используется в качестве носителя в конъюгированных сахаридных вакцинах. CRM197 и Dt имеют много общих антигенных эпитопов носителя.
Результат предварительного иммунизирования состоит в том, что иммунная система пациента была подвергнута воздействию антигенами предварительного иммунизирования. Для предварительного иммунизирования токсоидом дифтерии (Dt), в целом подразумевается, что у пациента создается антительный ответ против Dt (как правило, с титром против Dt более 0,01 МЕ/мл), и будут обладать специфической памятью в отношении Dt, т.е. предварительное иммунизирование Dt, как правило, Dt у пациента. В случае предварительного иммунизирования, когда Dt (или его производное) является носителем для сахарида в конъюгате, то предварительное иммунизирование создает ответ против сахарида, и B и/или T лимфоциты пациента будет обладать специфичной памятью в отношении сахарида, т.е. предварительное иммунизирование, как правило, будет вызывать анамнестический иммунный ответ против сахарида. Предварительное иммунизирование будет предпочтительно вызывать защитный иммунитет у пациента, например, против болезни дифтерии.
Таким образом, пациенты, которые будут иммунизированы согласно этому варианту выполнения изобретения, в целом отличаются от пациентов подгруппы населения, у которых иммунная система уже имеет иммунный ответ на антигены предварительного иммунизирования, так что согласно этому варианту выполнения изобретения, иммунизирование конъюгатом GBS, который включает токсоид дифтерии (или его производное) в качестве носителя, вызывает различный иммунный ответ в указанной подгруппе и у пациентов, у которых ранее отсутствовал иммунный ответ на антигены предварительного иммунизирования. Предпочтительными являются пациенты, которые были предварительно иммунизированы Dt (или его производным) в качестве носителя конъюгата (в частности, конъюгатом Hib). В частности, предпочтительно, когда пациентов предварительно иммунизируют Dt (или его производным), в виде носителя конъюгата, и также иммунизируют Dt, в виде неконъюгированного иммуногена.
Пациент, которого предварительно иммунизируют токсоидом дифтерии (или его производным), в конъюгированной или в неконъюгированной форме, может быть предварительно иммунизирован и другими антигенами.
Такие антигены включают, но без ограничения: антиген(ы) коклюша, см. выше; токсоид столбняка, см. выше; Haemophilus influenzae типа B, см. выше; поверхностный антиген гепатита B (HBsAg); полиовирус, такой как инактивированная полиовирусная вакцина (IPV); Streptococcus pneumoniae, см. выше; вирус гриппа; BCG; антигены вируса гепатита А; вирус кори; вирус свинки; вирус краснухи; вирус ветряной оспы; и т.п.
Пациент необязательно может быть предварительно иммунизирован одним или несколькими конъюгатами GBS. В некоторых предпочтительных вариантах выполнения изобретения, во время, когда пациенту сначала вводят конъюгат GBS, он уже был предварительно иммунизирован Dt (или его производным). В других в вариантах выполнения изобретения, конъюгат GBS вводят пациенту, который уже был предварительно иммунизирован (i) Dt или его производным и (ii) конъюгатом GBS.
Носители на основе токсоида столбняка
Хотя этот второй вариант выполнения изобретения был описан выше относительно носителей на основе токсоида дифтерии (и его производного), где токсоид столбняка в предпочтительном варианте не был использован, альтернативные варианты выполнения изобретения используют токсоид столбняка (или его производное) в качестве носителя, где в предпочтительном варианте выполнения изобретения токсоид дифтерии не используется. В этих альтернативных в вариантах выполнения изобретения вышеуказанные определения могут быть соответственно изменены.
Например, второй вариант выполнения изобретения предоставляет способ иммунизирования пациента против инфекции GBS, включающий стадию введения пациенту конъюгата, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом столбняка или его производным, где пациент был предварительно иммунизирован токсоидом столбняка или его производным. Этот вариант выполнения изобретения также предоставляет конъюгат, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом столбняка или его производным, для применения для иммунизирования пациента против инфекции GBS, где пациент был предварительно иммунизирован токсоидом столбняка или его производным. Этот вариант выполнения изобретения дополнительно обеспечивает применение конъюгата, который представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом столбняка или его производным, для изготовления лекарственного средства для иммунизирования пациента против инфекции GBS, где пациент был предварительно иммунизирован токсоидом столбняка или его производным. Конъюгаты, которые представляют собой капсулярные сахариды GBS, конъюгированные с токсоидом столбняка или его производным, возможно, не подвержены эффекту супрессии носителем, в частности супрессии, которая является результатом примирования носителем. Иммунный ответ на конъюгаты капсулярного сахарида GBS и токсоида столбняка или его производного может быть действительно улучшен предварительным иммунизированием токсоидом столбняка или его производным.
Как правило, конъюгат представляет собой одни из конъюгатов GBS в иммуногенной композиции по первому варианту выполнения изобретения, как описано выше. Другими словами, иммуногенные композиции по первому варианту выполнения изобретения, где по меньшей мере один конъюгат представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом столбняка или его производным, могут использоваться во втором варианте выполнения изобретения. Капсулярный сахарид, конъюгированный с токсоидом столбняка или его производным, может быть в композиции капсулярным сахаридом GBS серотипа Ia, Ib или III. В частности, капсулярный сахарид может быть капсулярным сахаридом GBS серотипа III. В этом варианте выполнения изобретения для всех капсулярных сахаридов GBS является типичным, что они конъюгированы с токсоидом столбняка или его производным.
Токсоид столбняка представляет собой известный белок [например, см. главу 27 ссылки 243], и он может быть получен путем инактивирования ADP-рибозилированного экзотоксина Clostridium tetani. Пациенты будут, как правило, получать токсоид столбняка в виде антигена "T" в составе препарата D-T-P или D-T при предварительном иммунизировании, или как белок носителя в конъюгате. Такие конъюгаты включают "PRP-T" конъюгата Hib [см. таблицу 14-7 ссылки 243], например продукты ActHIBTM, OmniHIBTM и HIBEPJXTM.
Общие определения
Термин "включающий", охватывает понятия "включая", так же как и "состоящий"; например, композиция, "включающая" X, может состоять исключительно из X или может дополнительно включать что-то еще, например, X+Y.
Термин "приблизительно" в отношении численного значения x подразумевает, например, x±10%.
Слово "существенно" не исключает "полностью"; например, композиция, которая "по существу свободна" от Y, может быть полностью свободна от Y. Где необходимо, слова "существенно", "по существу" могут быть исключены из определения.
Следует иметь в виду, что сахарные кольца могут находиться в открытой и закрытой форме, и если закрытые формы показаны здесь в структурных формулах, открытые формы также охватываются настоящим изобретением.
Точно также следует иметь в виду, что сахар может существовать в пиранозной и фуранозной формах, и если в структурных формулах, приведенных в описании, показаны пиранозные формы, фуранозные формы также охватываются изобретением. Изобретение также охватывает различные аномерные формы сахаров.
Если не указано конкретно, процесс, включающий стадию смешивания двух или нескольких компонентов, не требует никакого конкретного порядка смешивания. Таким образом, компоненты могут быть смешаны в любом порядке. Когда имеется три компонента, то тогда два компонента могут быть объединены друг с другом, а затем их комбинация может быть объединена с третьим компонентом, и т.д.
Антитела в целом являются специфическими для своей мишени. Таким образом, они будет более высокую аффинность к мишени, чем для нерелевантного белка контроля, такого как бычий сывороточный альбумин.
Если иначе не указано, идентичность между полипептидными последовательностями предпочтительно определена с помощью алгоритма поиска гомологии Smith-Waterman, который применен в программе MPSRCH (Oxford Molecular), используя анализ поиска аффинных брешей с параметрами: "штраф за брешь-пропуск" = 12 и "штраф за брешь-удлинение" = 1.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1 показывает различие между повторяющимися структурами в серотипах GBS Ia и III.
Фигура 2 показывает повторяющиеся структуры капсулярных сахаридов GBS серотипов Ia, Ib, II, III и V.
Фигура 3 показывает повторяющуюся структуру десиалированной формы капсулярного сахарида GBS серотипа V.
Фигура 4 показывает эффект примирования CRM197 до введения конъюгата капсулярных сахаридов GBS серотипа III с CRM197, с адъювантом и без адъюванта.
ВАРИАНТЫ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
Получение конъюгатов
Очищенные капсулярные сахариды Streptococcus agalactiae серотипов Ia, Ib и III были конъюгированы с белком-носителем периодатным окислением, сопровождаемым восстанавливающим аминированием [см. ссылку 2]. Очищенный, десиалированный капсулярный сахарид Streptococcus agalactiae серотипа V был конъюгирован с белком-носителем периодатным окислением, сопровождаемым восстанавливающим аминированием [см. ссылку 14]. Белок-носитель, в большинстве случаев, представлял собой CRM197. Токсоид столбняка использовался в качестве белка-носителя, в случаях, где это специально указано.
Исследование на мышах (1)
В этом исследовании влияние адъюванта на эффективность и иммуногенность конъюгатов GBS серотипа Ia, Ib и III, также как моновалентной или комбинированной вакцины, был оценен в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение.
Мышиная модель "мать-новорожденный", с проверкой ответа на заражение, адаптированная из ссылки 250, использовалась для оценки эффективности специфических антител, приобретенных трансплацентарно от активно вакцинированной матери. В частности, самки мышей линии CD-1 в возрасте 5-6 недель, полученные из Charles River Laboratories (Calco, Италия), были вакцинированы интраперитонеальной инъекцией с двумя или тремя иммунизациями на дни 1, 21 и, в некоторых случаях, на 35 день, с адъювантом или без него. После последней иммунизации мыши спаривались и оставлялись в покое до появления выводка. Прививочный материал штамма GBS (0,05 мл бульона Todd-Hewitt), смертельный для 90% неиммунизированных новорожденных (100-1000 доз LD50), использовался для заражения новорожденных мышей. Заражение выполняли интраперитонеально в течение 48 часов после рождения. На 72 часе было зарегистрировано число выживших новорожденных мышей, и уровни выживания сравнивались во всех исследуемых группах, используя точный критерий Фишера. Самки в контрольной группе получали PBS тем же самым путем введения и с использованием такой же схемы дозирования. Через две недели после последней иммунизации, были собраны образцы крови для оценки иммуногенности, используя два анализа in vitro (ELISA и тест опсонофагоцитоза, описанного ниже).
Анализ ELISA выполнялся для того, чтобы определить титр GBS-специфических антител, продуцируемых после вакцинирования. Анализ ELISA также использовался для того, чтобы определить общее количество IgG против каждого капсулярного сахаридного антигена. Была проанализирована сыворотка от каждой индивидуальной мыши и для каждой группы был вычислен средний геометрический титр (GMT). Титры антител для капсулярных сахаридов типов Ia, Ib и III выражены в единицах ELISA для мышей (MEU), и вычислены на основе способа оценки от базовой линии.
Тест опсонофагоцитоза (OPA) выполнен для того, чтобы оценить титр антител, индуцированных вакцинацией, способных к комплемент-опосредованному GBS киллингу (используя подход, раскрытый в ссылке 251). Испытание выполнено, комбинируя следующие компоненты: бактерии, фагоцитарные клетки (PMN, извлеченные из крови человека или дифференцированной линии клеток HL-60), комплемент и иммунные сыворотки.
Аликвоты реакционной смеси, до и после инкубации в течение 1 часа при температуре 37°C, были помещены в чашки для того, чтобы определить остающиеся колонии (CFU, колониеобразующие единицы). Уровень опсонофагоцитарного киллинга (логарифм киллинга) был вычислен вычитанием логарифма количества выживших колоний из логарифма значения CFU, соответствующего начальному моменту времени. Сыворотка, полученная до иммунизации, и комплемент без PMN, инактивированный высокой температурой, использовались в качестве отрицательного контроля. Бактерицидный титр представлял собой величину, обратную к значению разведения, которое приводило к снижению уровня бактерий на 50%.
В этом исследовании самки мышей CD1 были иммунизированы двумя дозами (1 мкг каждая) трех различных конъюгатов в присутствии адъюванта (гидроокись алюминия или MF59) в дни 0 и 21. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 1.
Определение уровня защиты и титров антител, обеспечиваемого
конъюгатами GBS серотипов Ia, Ib и III, с CRM197, в
присутствии гидроокиси алюминия или MF59, в активной мышиной
модели "мать-новорожденный", с проверкой ответа на заражение
Высокие уровни защиты были достигнуты с одновалентными вакцинами всех трех серотипов с гидроокисью алюминия и с MF59. Однако с адъювантом MF59 были получены более низкие уровни выживаемости, даже в случае более высоких титров антител.
В дополнительном эксперименте мыши были иммунизированы тремя дозами комбинаций, содержащих 1 мкг каждого конъюгата в присутствии адъюванта в дни 0, 21 и 35. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 2.
Определение уровня защиты и титров антитела, обеспечиваемого комбинациями конъюгатов GBS серотипов Ia, Ib и III, с CRM197, в присутствии или отсутствии адъюванта, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
" - ": не применимо
Высокие уровни защиты были достигнуты с комбинациями вакцин для всех трех препаратов в присутствии или отсутствии адъюванта, хотя более низкие титры антитела были достигнуты в отсутствии адъюванта.
Исследование на мышах (2)
В этом исследовании было оценено влияние лиофилизирования на эффективность и иммуногенность конъюгатов GBS серотипа Ia, Ib и III, с CRM197, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы двумя дозами (1 мкг каждая) трех различных конъюгатов, в присутствии или отсутствии адъюванта в дни 0 и 21. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 3.
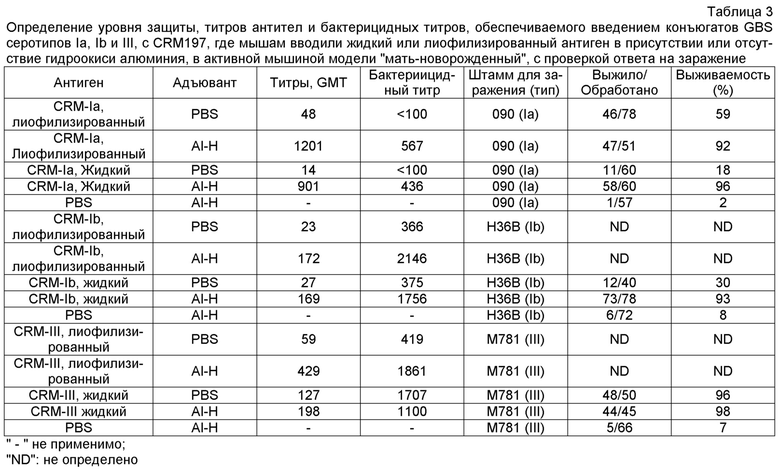
Процесс лиофилизирования не влиял на иммуногенность конъюгатов GBS. Титры антител и бактерицидные титры сопоставимы для мышей, которым вводили жидкие и лиофилизированные препараты.
Исследование на мышах (3)
В этом исследовании было оценено влияние лиофилизирования на эффективность конъюгата GBS серотипа V с CRM197 в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы двумя дозами (1, 5 или 10 мкг каждая) конъюгатов, в присутствии или отсутствии адъюванта в дни 0 и 21. Новорожденных мышей заражали штаммом серотипа V. Результаты показаны ниже в таблице 4.
Определение уровня защиты, обеспечиваемого конъюгатом GBS серотипа V с CRM197, где мышам вводили жидкий или лиофилизированный антиген в присутствии или отсутствии гидроокиси алюминия, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
(% выживаемости)
Процесс лиофилизирования не влиял на иммуногенность конъюгата GBS. Уровни выживаемости сопоставимы для мышей, которые получили жидкие и лиофилизированные препараты.
Исследование на мышах (4)
В этом исследовании было оценено влияние различных доз на эффективность смеси конъюгатов GBS серотипа Ia, Ib, III и V в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы двумя дозами комбинации, равными 0,2, 1 или 5 мкг, для каждого конъюгата GBS серотипа Ia, Ib, III и V без адъюванта в дни 0 и 21. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 5.
Определение уровня защиты, обеспечиваемого комбинациями конъюгатов GBS серотипов Ia, Ib, III и V, с CRM197, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
Более высокая дозировка конъюгата GBS серотипа V увеличила уровень защиты.
Исследование на мышах (5)
В этом исследовании было оценено влияние различного количества доз на эффективность смеси конъюгатов GBS серотипов Ia, Ib, III и V в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы одной, двумя или тремя дозами (1 мкг для каждого конъюгата) комбинации в присутствии адъюванта на основе алюминия (alum) в дни 0, 21 и 35, соответственно. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 6.
Определение уровня защиты, обеспечиваемого комбинациями конъюгатов GBS серотипов Ia, Ib, III и V, с CRM197, в присутствии адъюванта, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
В этом исследовании были измерены бактерицидные титры после введения смеси конъюгатов серотипов Ia, Ib, III и V. Титры OPA показаны ниже:
Число иммунизаций существенно влияет на иммунный ответ на конъюгат GBS V.
Исследование на мышах (6)
В этом исследовании было оценено влияние смеси конъюгатов GBS серотипов Ia, Ib, III и V по сравнению с одним конъюгатом GBS серотипа V, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы комбинации по 1 мкг каждого конъюгата, или конъюгатом GBS серотипа V в дозе 1 мкг, в присутствии адъюванта на основе алюминия (alum) в дни 0, 21 и 35. Новорожденных мышей заражали штаммами CJB111 и 2603 V/R типа V. Результаты показаны в таблице 7 ниже.
Определение уровня защиты, обеспечиваемого комбинациями конъюгатов GBS серотипов Ia, Ib, III и V, с CRM197, или одним конъюгатом GBS серотипа V, в присутствии адъюванта, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
Иммунный ответ на капсулярный сахарид GBS серотипа V уменьшается, когда конъюгаты сахарида GBS серотипов Ia, Ib и III также присутствуют в композиции.
Исследование на мышах (7)
В этом исследовании было оценено влияние адъюванта иммуногенность и эффективность смеси конъюгатов GBS серотипов Ia, Ib, III и V по сравнению с одним конъюгатом GBS серотипа V, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы тремя дозами комбинаций по 1 мкг каждого конъюгата или конъюгатом GBS серотипа V в дозе 1 мкг в присутствии или отсутствии адъюванта в дни 0, 21 и 35. Новорожденных мышей заражали штаммом CJB111 типа V. Результаты показаны в таблице 8 ниже.
Определение уровня защиты, титров антител и бактерицидных титров, обеспечиваемых комбинациями конъюгатов GBS серотипов Ia, Ib, III и V, с CRM197, или одним конъюгатом GBS серотипа V, в присутствии или отсутствии адъюванта, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
" - " не применимо
Еще раз следует отметить, что, иммунный ответ на капсулярный сахарид GBS серотипа V уменьшается, когда конъюгаты GBS серотипов Ia, Ib и III также присутствуют в композиции. Выживание улучшается за счет добавления адъюванта, даже когда в данном эксперименте добавление адъюванта только к одному конъюгату GBS серотипа V не имело этого эффекта.
Исследование на мышах (8)
В этом исследовании было оценено влияние увеличения дозы конъюгата GBS серотипа V на эффективность смеси конъюгатов GBS серотипов Ia, Ib, III и V в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение.
Мыши были иммунизированы двумя дозами комбинаций по 1 мкг каждого конъюгата или двумя дозами комбинаций конъюгатов GBS серотипов Ia, Ib, III по 1 мкг и 5 мкг конъюгата GBS серотипа V в присутствии или отсутствии адъюванта в дни 0, 21 и 35. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 9.
Определение уровня защиты, обеспечиваемого комбинациями конъюгатов GBS серотипов Ia, Ib, III и V с CRM197, в присутствии адъюванта, при различных дозах конъюгата GBS серотипа V в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
"Combo plus" = CRM197-Ia + CRM197-Ib + CRM197-III + CRM197-V (все по 1 мкг, кроме CRM197-V, вводимого в дозе 5 мкг)
Еще раз следует отметить, что в этом эксперименте иммунный ответ на капсулярный сахарид GBS серотипа V в смеси был улучшен за счет дополнения адъювантом. Ответ был также улучшен за счет увеличения дозы этого капсулярного сахарида в композиции. Однако, наличие высокой дозы капсулярного сахарида GBS серотипа V вероятно уменьшает ответ на капсулярные сахариды GBS серотипов Ia, Ib и III. Это следствие было уменьшено за счет дополнения адъювантом.
Исследование на мышах (9)
В этом исследовании было оценено влияние смеси конъюгатов GBS серотипов Ia, Ib и III с белками GBS67 и GBS80, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы комбинациями в присутствии или отсутствии различных адъювантов. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 10.
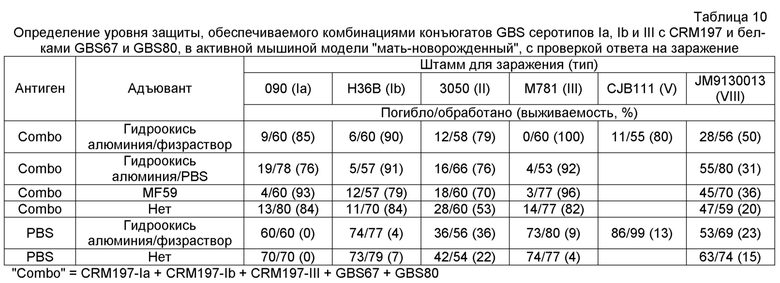
В этом исследовании титры антител были измерены после введения смеси конъюгатов серотипов Ia, Ib, III и V с белками GBS67 и GBS80.
Результаты пяти отдельных экспериментов показаны ниже.
Исследование на мышах (10)
В этом исследовании было оценено влияние смеси конъюгатов GBS серотипов Ia, Ib и III с белками GBS67 и GBS80, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы тремя дозами комбинаций в присутствии или отсутствии различных адъювантов. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 11.
Определение уровня защиты, обеспечиваемого комбинациями конъюгатов GBS серотипов Ia, Ib и III с CRM197 и белками GBS67 и GBS80, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
Исследование на мышах (11)
В этом исследовании было оценено влияние смеси конъюгатов GBS серотипов Ia, Ib, III и V с белком GBS67 и со слитым белком SpbI-GBS80, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы комбинацией в присутствии адъюванта. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 12.
Определение уровня защиты, обеспечиваемого комбинациями конъюгатов GBS серотипов Ia, Ib, III V c CRM197, белком GBS67 и со слитым белком SpbI-GBS80, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
Исследование на мышах (12)
В этом исследовании было оценена эффективность конъюгатов GBS серотипов Ia, Ib, III и V в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение. Мыши были иммунизированы каждым конъюгатом в дозе 1 мкг. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 13. Эксперимент был выполнен дважды.
Определение уровня защиты, обеспечиваемого конъюгатами GBS серотипов Ia, Ib, III и V с CRM197, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
Конъюгат, включающий капсулярный сахарид CBS серотипа Ib обеспечил защиту против GBS серотипа Ia, а также к CBS серотипа Ib.
Исследование на мышах (13)
В этом исследовании была протестирована и сравнена иммуногенность капсулярного сахарида, конъюгированного с токсоидом столбняка (TT), в качестве белка-носителя, или с CRM197, в качестве белка-носителя. Самки мышей CD1 были иммунизированы двумя дозами конъюгатов GBS серотипов Ia, Ib и III по 1 мкг каждая, с адъювантом гидроокиси алюминия в 0 и 21 день. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 14.
Определение уровня защиты, обеспечиваемого капсулярными сахаридами GBS серотипов Ia, Ib и III, и V, конъюгированными с TT или CRM, в активной мышиной модели "мать-новорожденный", с проверкой ответа на заражение
Уровни выживаемости в группах, иммунизированных конъюгатами с CRM197 для всех трех серотипов, были сопоставимы с уровням выживаемости, наблюдаемыми в иммунизированной группе с конъюгатами TT. Основываясь на этих результатах, CRM197 был выбран как белок-носитель для дополнительных исследований.
Исследование на мышах (14)
В этом исследовании было оценено влияние на иммуногенность уровня окисления капсулярного сахарида во время процесса ковалентного конъюгирования. Несколько партий конъюгатов сахаридамов GBS серотипов Ia, Ib и III с различными уровнями окисления были получены при конъюгировании с TT и/или с CRM197, и они были проверены на иммуногенность на самках мышей CD1. Мыши были иммунизированы двумя дозами (по 1 мкг каждая) тремя различными конъюгатами в присутствии адъюванта гидроокиси алюминия в дни 0 и 21. Новорожденных мышей заражали штаммами определенных типов, как показано ниже в таблице 15.
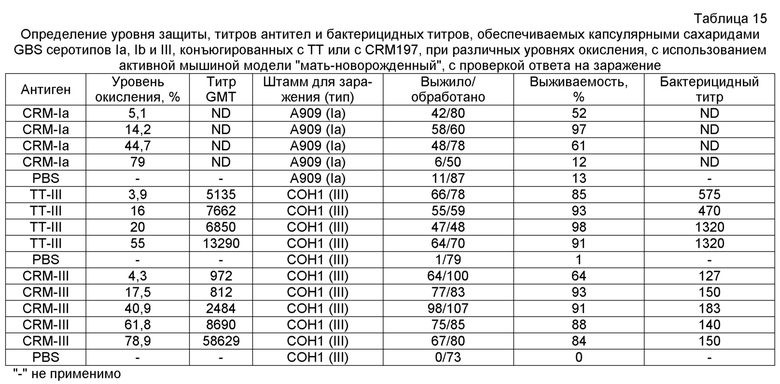
Уровни выживания достигли пика, когда самки были иммунизированы конъюгатами, полученными из сахаридов, окисленных на 15-20%. Титры антител увеличились с увеличением уровнями окисления без какого-либо воздействия на функцию. Бактерицидные титры не увеличивались вместе с ростом титров антител. Основываясь на этих результатах и на дополнительных экспериментах (данные не показаны), оптимальный уровень окисления CPS для всех трех серотипов был определен как от 10 до 30%.
Исследования токсикологии репродукции и развития на кроликах и крысах
Результаты, полученные для двух видов, не показали никакого влияния конъюгатов серотипов Ia, Ib и III с CRM197 на эмбриональное или фетальное развитие.
Кроликам, путем внутримышечной инъекции, вводили комбинацию трех конъюгатов с адъювантом гидроокиси алюминия в клинической дозе, равной 20/20/20 мкг (основанный на массе каждого сахарида), в дни -35, -21 и -7, относительно спаривания в день 0 (в период пред спариванием), и в дни 7 и 20 во время беременности или только в дни 7 или 20 во время беременности. Обработка не привела ни к токсичности в отношении матери, не эффектам на спаривание, ни к заметной смертности эмбрионов, фетотоксичности или тератогенности при любых уровнях доз.
У крыс, при введении комбинации, так же не было отмечено никакой токсичности в отношении матери или заметного влияния на репродуктивную функцию и эмбрионально-фетальное развитие, и не было отмечено никакого различия между группами, которым вводили комбинацию в физиологическом растворе и комбинацию в адъюванте из гидроокиси алюминия путем трех инъекций (только во время беременности) или шести инъекций (до беременности и во время беременности). Инъекции вводились в дни -35, -21 и -7 относительно спаривания в день 0, так же как в дни 6, 12 и 17 во время беременности, или только в дни 6, 12 и 17 во время беременности. Не было выявлено никакого влияния на выживаемость потомства Fl, на его клиническое состояние или массу тела потомства в сосунковом возрасте.
Исследование на людях (1)
Это исследование касалось моновалентных конъюгатных вакцин капсулярного сахарида GBS серотипа Ia с CRM197. Испытуемым группам из 10 субъектов вводили 1 или 2 инъекции дозой 5, 10 или 20 мкг (по масса сахарида). Группы плацебо, из 3 и 2 субъектов, получали соответственно по 1 или 2 инъекции физиологического раствора. Для анализа при помощи ELISA, у каждого субъекта отбирали пробы крови при скринировании и через месяц после первой инъекции. Дополнительно, на третьем месяце исследования, у групп с 2 инъекциями отбирали пробы крови в то время, когда они получили вторую инъекцию, и затем, через месяц, у них еще раз отбирали пробы крови. Дополнительный отбор проб крови был выполнен через 6, 12 и 24 месяца после последней инъекции, которую получали субъекты.
Концентрацию специфических антител против капсулярных сахаридов GBS серотипов Ia, Ib и III (в исследованиях, описанных ниже) измеряли при помощи ELISA. Микротитровальные планшеты были покрыты 1 мкг/мл соответствующего сахарида GBS (конъюгированного с HSA), и их инкубировали с сыворотками от исследуемых субъектов в течение 1 часа при 37°C. Планшеты, после трехкратной промывки, инкубировали с вторичным антителом против IgG человека, меченным щелочной фосфатазой (AP) в течение 90 минут при 37°C, с последующей трехкратной промывкой. К планшетам добавляли субстрат (pNPP), и их инкубировали в течение 30 минут при комнатной температуре. AP катализирует гидролиз субстрата с протеканием колориметрической реакции, которая может быть определена количественно, путем считыванием результатов ELISA при 405 нм (фильтр контроля при 650 нм). Оценку концентраций антител выполняли с использованием калибровочной кривой. Обобщенные значения средней геометрической концентрации (мкг/мл) антител против Ia для каждой группы приведены ниже в таблице 16.
Средние геометрические концентрации (и отношения средних геометрических значений), полученные при исследовании моновалентных конъюгатных вакцин капсулярного сахарида GBS серотипа Ia с CRM197
(0,12-5,86)
(0,015-1,77)
(0,36-3,05)
(0,14-1,29)
N=9
(0,38-4,1)
N=8
(0,1-1,32)
N=7
(0,19-1,57)
(0,034-19)
(0,0007-38)
N=1
(7,6-240)
(1,06-33)
(1,41-45)
(2,52-79)
(4,45-140)
(0,093-9,92)
(0,018-57)
N=1
(11-146)
(4,05-60)
N=9
(2,4-42)
N=8
(12-246)
N=7
(13-166)
(0,05-11)
(0,0016-17)
N=1
(4,43-83)
(0,71-13)
(2,66-50)
(1,63-30)
(3,22-60)
(0,12-6,39)
(0,032-31)
N=1
(6,14-54)
(2,5-25)
N=9
(3,71-43)
N=8
(7,2-98)
N=7
(8,67-77)
(0,054-12)
(0,0016-17)
N=1
(3,3-62)
(0,51-9,68)
(1,68-32)
(1,53-34)
N=9
(2,29-43)
(0,14-6,46)
(0,036-28)
N=1
(4,76-39)
(1,84-17)
N=9
(2,46-26)
N=8
(5,49-68)
N=7
(6,43-53)
(0,043-10)
(0,59-21)
N=7
(0,56-13)
N=9
(1,74-63)
N=7
(0,84-30)
N=7
(1,78-42)
N=9
(0,11-5,95)
(2-28)
N=7
(1,9-22)
N=8
(1,9-33)
N=6
(3,26-56)
N=6
(4,38-45)
N=9
Все данные, выраженные как GMC, показывают значимое увеличение по отношению к исходному уровню и к предыдущим временным точкам (т.е. GMC варьируют от 6 до 43 мкг/мл через один месяц после последнего вакцинирования), и хотя в исследовании было отмечено снижение для 24 месяцев, тем не менее, группа значений GMC оставалась в несколько раз выше, чем значения исходного уровня (GMR варьирует от 7 до 14 мкг/мл, для 24 месяцев). На основании оценке значений GMC, группа, получившая дозу 5 мкг в виде однократной вакцинации, имела самый высокий ответ через месяц после последнего вакцинирования.
Через месяц после последнего вакцинирования, количество субъектов с уровнями антител ≥3 мкг/мл оказалось аналогичным числу "респондентов" при различных дозах (11, 13 и 12 из 20, соответственно для доз 5, 10 и 20 мкг) и при различных схемах вакцинирования (18 из 20 для обоих случаев; данные не показаны). Процентная доля субъектов с уровнями антител ≥5 мкг/мл, подтвердила те же самые наблюдения (данные не показаны). Эти граничные показатели предназначены для корреляционной оценки в контексте потенциальной серологической защиты [основано на ссылке 252]. Эти данные предполагают, что нет никакого заметного вклада от второго вакцинирования или от более высокой дозы вакцины. Поскольку не наблюдали никаких зависимостей ответа от величины дозы, то возможно, что доза 5 мкг, или ниже, может быть оптимальной дозой для группы взрослых людей. Не наблюдалось никаких устойчивых преимуществ от введения двух инъекций по сравнению с одной инъекцией для групп, получающих дозы 5 и 20 мкг. Группа, получающая дозу 10 мкг, показала более высокие пиковые ответы (через 1 месяц после вакцинирования) после двух введений по сравнению с одной инъекцией, но эта тенденция изменилась на противоположную в последующих (фиксированных) временных точках.
Анализ безопасности был выполнен на основе ряда различных критериев. Проблем с безопасностью не было выявлено, и не было отмечено каких-либо отрицательных зависимостей ответа от величины дозы.
Исследование на людях (2)
Это исследование касалось моновалентных конъюгатных вакцин капсулярного сахарида GBS серотипов Ib и III с CRM197. Испытуемым группам из 10 субъектов вводили 1 или 2 инъекции дозой 5, 10 или 20 мкг (по масса сахарида). Группы плацебо, из 3 и 2 субъектов, получали соответственно по 1 или 2 инъекции физиологического раствора. Для анализа при помощи ELISA, у каждого субъекта отбирали пробы крови при скринировании и через месяц после первой инъекции. Дополнительно, на третьем месяце исследования, у групп с 2 инъекциями отбирали пробы крови в то время, когда они получили вторую инъекцию, и затем, через месяц, у них еще раз отбирали пробы крови. Дополнительный отбор проб крови был выполнен через 6, 12 и 24 месяца после последней инъекции, которую получали субъекты. Обобщенные значения средней геометрической концентрации (мкг/мл) антител против Ib и III для каждой группы приведены ниже в таблице 17.
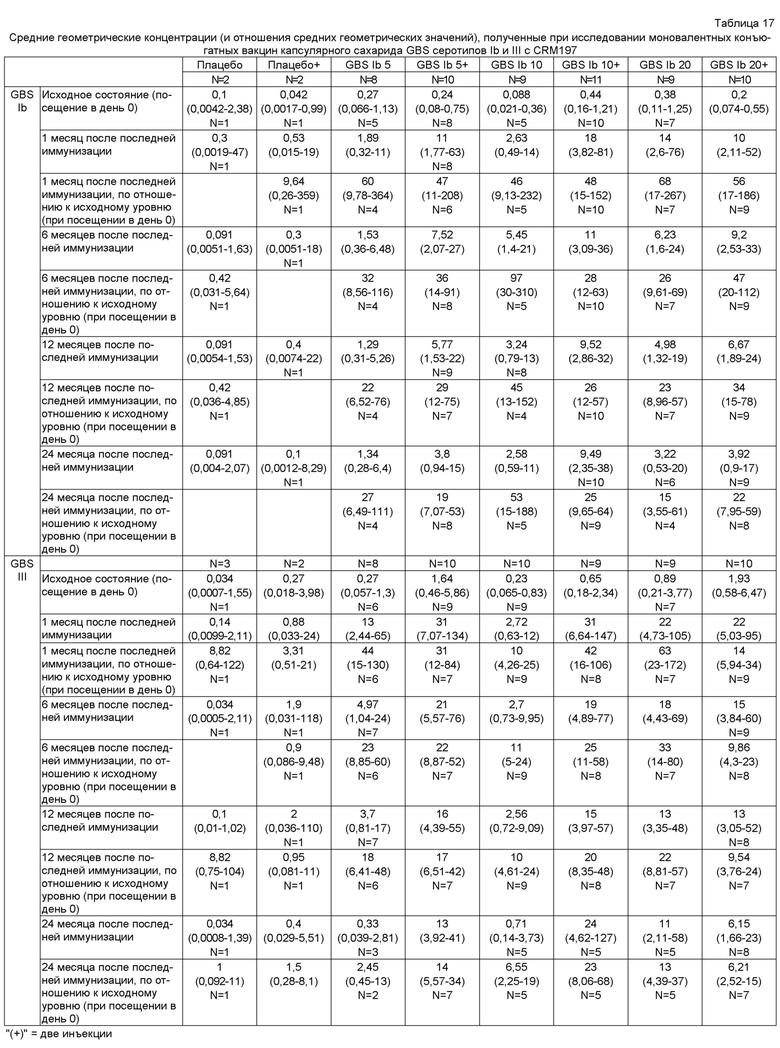
Следует отметить еще раз, что в этом небольшом исследовании не выявлено никаких значимых зависимостей ответа от величины дозы или каких-либо устойчивых преимуществ от введения двух инъекций по сравнению с одной инъекцией.
Анализ безопасности был выполнен на основе ряда различных критериев. Проблем с безопасностью не было выявлено, и не было отмечено каких-либо отрицательных зависимостей ответа от величины дозы. Среди показателей реактогенности в большинстве своем имели место жалобы на местные реакции для обоих серотипов, а именно, боль в месте инъецирования (15 случаев из 98 инъекций для серотипа Ib, и 14 случаев из 96 инъекций для серотипа III), и одной из системной реакций была головная боль, но не наблюдалось никаких явных различия между группами плацебо и группами вакцинируемых людей.
Исследование на людях (3)
Это исследование касалось тривалентной конъюгатной вакцины капсулярного сахарида GBS серотипов Ia, Ib и III с CRM197, вводимой здоровым, небеременным женщинам. Исследовались два различных препарата вакцины, каждый из которых включал комбинацию трех сахаридов в равных пропорциях. Тестировали две различные дозы (5 и 20 мкг, по масса сахарида) в присутствии или отсутствии адъюванта на основе гидроокиси алюминия (alum). Исследование включало оценку внутримышечной инъекции, по схеме одно- или двукратного (с интервалом 30 дней) введения, для каждого препарата. Вакцина также включала 4,5 мг хлорида натрия, 0,34 мг дигидрофосфата калия и 7,5 мг маннита. Результаты для исследуемых групп представлены ниже в таблице 18. Также тестировалась группа плацебо (две инъекции 0,9%-ого физиологического раствора с интервалом 30 дней), состоящая из 20 субъектов.
Групповое исследование тривалентной конъюгатной вакцины капсулярного сахарида GBS серотипов Ia, Ib и III с CRM197
Для анализа при помощи ELISA, у каждого субъекта отбирали пробы крови при скринировании и через месяц после первой инъекции. В группах, получавших две инъекции, отбирали пробы крови через месяц после второй инъекции. Через три месяца был выполнен отбор проб крови для всех групп, принимавших участие в исследовании. Обобщенные значения средней геометрической концентрации (мкг/мл) антител против Ib, Ib и III для каждой группы приведены ниже в таблице 19.
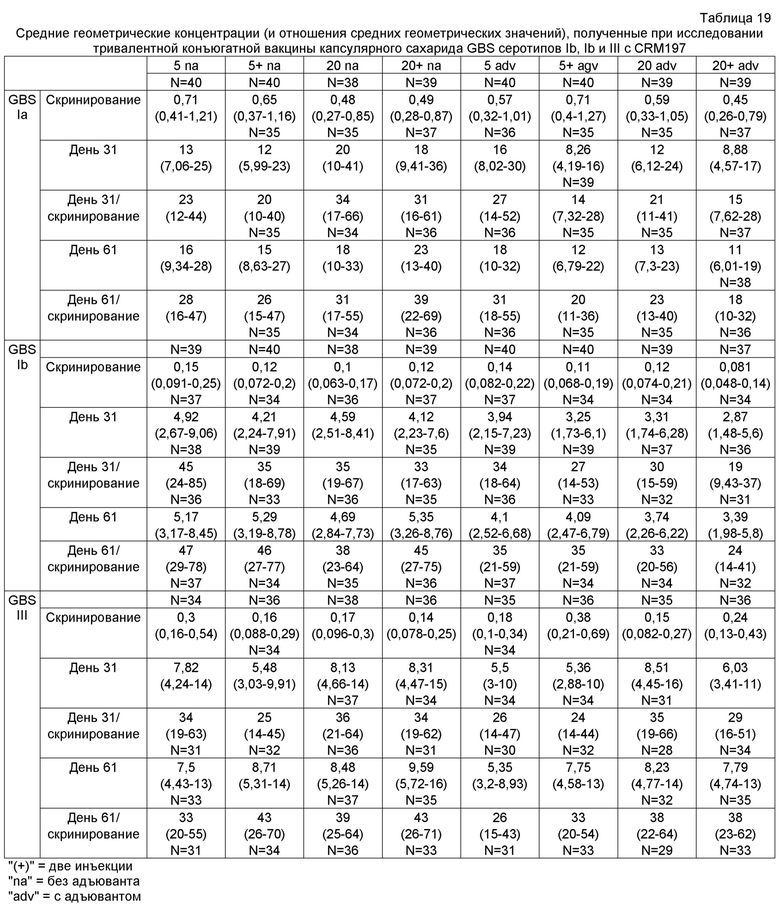
Вакцина была иммуногена, индуцировала у от 80 до 100% субъектов по меньшей мере 2-кратное увеличение антител, специфических к GBS различных серотипов. Сравнение значений GMC в этих восьми группах показало: a) нет никакого эффекта от второй инъекции, по сравнению с однократной инъекцией; b) нет никакого эффекта от включения адъюванта на основе алюминия, по сравнению со случаем, когда адъювант отсутствует; и c) нет никакого эффекта от более высокой дозы 20/20/20 мкг по сравнению с дозой 5/5/5 мкг.
Более конкретно, не было никакого существенного увеличения ответа антител у субъектов, которые получили две инъекции вакцины по сравнению с теми, которые получили только одну инъекцию вакцины против GBS любого из серотипов (Ia, Ib или III). Это отсутствие эффекта от второй инъекции вакцины наблюдалась независимо от дозы (5/5/5 или 20/20/20 мкг) или препарата (отсутствие адъюванта или с адъювантом на основе алюминия). Значения GMC для GBS серотипа Ia, измеренные для каждой из этих восьми групп на 61 день исследования, варьировались от 7 до 20 мкг/мл. Исходя из этих результатов, не выявлено никакого эффекта от двух инъекций (диапазон GMC - от 7 до 16 мкг/мл) по сравнению с одной инъекцией (диапазон GMC - от 9 до 20 мкг/мл, при полном перекрытии 95%-ого доверительного интервала (CI)). Кроме того, отношение значения GMC, полученное для случая одной инъекции, к значению GMC для двух инъекций, составило 1,2 (95% CI: 0,7-2,0). Этот результат показывает практическую эквивалентность одной инъекции по сравнению с двумя (значение p=0,5). Значения GMC для GBS серотипа Ib, измеренные для каждой из этих восьми групп на 61 день исследования, варьировались от 2 до 7 мкг/мл. Не установлено никакого эффекта от второй инъекции (диапазон GMC составил 2-5 мкг/мл), по сравнению с однократной инъекцией (диапазон GMC составил 4-7 мкг/мл, при полном перекрытии 95%-ого доверительного интервала). В этом случае соотношение значений GMC для одной и двух инъекций составило 1,2 (95% CI: 0,7-2,0). Этот результат еще раз показывает практическую эквивалентность этого случая (значение p=0,5). Значения GMC для GBS серотипа III, измеренные для каждой из этих восьми групп на 61 день исследования, варьировались от 5 до 13 мкг/мл. Не установлено никакого эффекта от второй инъекции (диапазон GMC составил 5-11 мкг/мл), по сравнению с однократной инъекцией (диапазон GMC составил GMC 5-13 мкг/мл, при полном перекрытии 95%-ого доверительного интервала). Соотношение значений GMC для одной и двух инъекций составило 0,94 (95%-ый CI: 0,55-1,66), показывает их практическую эквивалентность (значение p=0,8).
Точно так же не было никакого дополнительного эффекта в отношение GMC от включения адъюванта на основе алюминия (alum), по сравнению со случаем, когда адъювант отсутствовал. Отсутствие эффекта от добавки адъюванта на основе алюминия наблюдалось независимо от дозы (5/5/5 или 20/20/20 мкг) или независимо от числа инъекций, и было отмечено для всех трех серотипов (Ia, Ib и III). Значения GMC для GBS серотипа Ia, измеренные для каждой из этих восьми групп на 61 день исследования, варьировались от 7 до 20 мкг/мл, и не показали эффекта от присутствия адъюванта на основе алюминия (диапазон значений GMC составил от 7 до 15 мкг/мл), по сравнению со случаями, когда адъювант отсутствовал (диапазон GMC составил 3-16 мкг/мл, при полном перекрытии 95%-ого CI). Соотношение значений GMC для группы, где не было никакого адъюванта, и для группы, где присутствовал адъювант на основе алюминия, составило 1,6 (95% CI: 0,9-2,6)], и это предполагает, что ответ на препарат без адъюванта потенциально выше, по сравнению с препаратом вакцины, содержащим адъювант на основе алюминия (значение p=0,11). Значения GMC для GBS серотипа Ib, измеренные для каждой из этих восьми групп на 61 день исследования, варьировались от 2 до 7 мкг/мл, и не показали никакого эффекта от присутствия адъюванта на основе алюминия (диапазон значений GMC составил от 2 до 4 мкг/мл), по сравнению со случаями, когда адъювант отсутствовал (диапазон GMC составил 4-7 мкг/мл, при полном перекрытии 95%-ого CI). Соотношение значений GMC для группы, где не было никакого адъюванта, и для группы, где присутствовал адъювант на основе алюминия, составило 1,4 (95% CI: 0,8,-2,4), и это предполагает достаточно близкую эквивалентность значений GMC (значение p=0,2). Значения GMC для GBS серотипа III, измеренные для каждой из этих восьми групп на 61 день исследования, варьировались от 5 до 13 мкг/мл, и не показали никакого эффекта от присутствия адъюванта на основе алюминия (диапазон значений GMC составил от 5 до 11 мкг/мл), по сравнению со случаями, когда адъювант отсутствовал (диапазон GMC составил 5-13 мкг/мл, при полном перекрытии 95%-ого CI).
Соотношение значений GMC для группы, где не было никакого адъюванта, и для группы, где присутствовал адъювант на основе алюминия, составило 1,09 (95% CI: 0,6-1,9), и это предполагает, достаточно близкую эквивалентность значений GMC (значение p=0,7).
Наконец, полученные данные позволяют провести оценку двух доз (5 и 20 мкг, для каждого из трех сахаридов в конъюгатах). Результаты показывают, что более высокая доза (20 мкг) не вызывает более высокого антительного ответа. В частности, соотношения GMC у субъектов, получивших 5 мкг (для всех групп) и у субъектов, получивших 20 мкг (для всех группы), составили: 1,2 (95% CI: 0,7-2,1) для GBS серогруппы Ia, 0,7 (95% CI: 0,4-1,2) для GBS серогруппы Ib и 1,4 (95% CI: 0,9-2,5) для GBS серогруппы III. Эти отношения близки к 1 и значения p для статистического теста на равенство этой величины 1, составляет более 0,15 для всех трех серотипов, не предлагая значимых различий в уровне индуцированных антител между двумя режимами дозирования.
Безопасность была оценена по уровням местной и системной реактогенности, неблагоприятных событий и тяжести неблагоприятных событий, так же как и на основании клинических лабораторных результатов. Трехвалентная вакцина GBS была найдена безопасной и толерантной во всех восьми группах исследования вакцины, по сравнению с группой плацебо. Безопасность была оценена по следующим показателям: доля субъектов с жалобами на местные реакции (т.е. боль на участка инъекции, наличие кровоподтека, эритемы, уплотнения и припухлости) и с жалобами на системные реакции (т.е. озноб, тошнота, недомогание, миалгия, головная боль, усталость, артралгия, сыпь, лихорадка [определяемая по подмышечной температуре более 38°C], и т.п.), которые имеют место в течение 7 дней после каждой вакцинации, вместе с уровнем их тяжести; доля субъектов с другими неблагоприятными состояниями/событиями, о которых они сообщили с 1 по 23 день после каждой прививки; доля субъектов с серьезными неблагоприятными событиями/состояниями, о которых они сообщили; и/или доля субъектов с неблагоприятными событиями/состояниями, которые приводили к исключению их из группы вакцинирования до дня 61 исследования.
Исследование на людях (4)
Ответы субъектов с уровнями антител (Ab) ниже порога обнаружения в начале исследования (0,4, 0,084 и 0,068 мкг/мл, соответственно для серотипов Ia, Ib и III) представляли определенный интерес. Анализ этой подгруппы был выполнен на основе данных, полученных в рамках "Исследования на людях (3)", см. выше. Для каждого серотипа данные оценивались по следующим показателям:
(a) Значения GMC для каждой группы инъекции/препарата/дозы, и соответствующий 95%-ый CI.
(b) Значения GMC для всех субъектов, получившим одну инъекцию, независимо от назначения группы, по сравнению с GMC для всех субъектов, получивших две инъекции. Аналогично, рассматривались значения GMC субъектов, не получивших препарата с адъювантом, по сравнению с GMC у субъектов, получивших препарат с адъювантом, так же как значения GMC, у субъектов, получивших дозы 5/5/5 мкг, по сравнению со значением GMC у всех субъектов, получивших дозу 20/20/20 мкг. Оценка была основана на отношении GMC, вместе с двухсторонними значениями 95% CI относительно расчетного соотношения.
(c) Доля субъектов, имеющих по меньшей мере 4-кратное изменение уровня GMC от уровня при посещении в день 0, который был принято как половина нижнего предела обнаружения (lld).
В целом, приблизительно 25 и 50% женщин имели уровни Ab ниже предела обнаружения для серотипов III и Ia/Ib, соответственно. Доля субъектов в этой подгруппе, у которых было достигнуто более чем 4-кратное увеличение уровня Ab в день 61, по сравнению с исходным уровнем (где величина исходного уровня была принята как половина lld), составила от 64 до 95% (для серотипа Ia), от 80 до 100% (для серотипа III) и от 81 до 100% (для серотипа Ib).
Аналогично, как для результатов, полученных для всех групп, занятых в эксперименте, субъекты с необнаруживаемыми уровнями Ab в начале исследования, также не смогли показать дополнительные положительные эффекты от двух инъекций (против одной инъекции), от более высокой дозировки (против более низкой дозировки) или от включения адъюванта на основе алюминия (alum) (против отсутствия адъюванта). Отношение GMC (в день 61) для всех субъектов, получивших одну инъекцию, к значениям GMC у всех субъектов, получивших две инъекции, составило 1,1 (0,6-1,8 для серотипа Ia), 0,7 (0,3-1,5; для серотипа III) и 0,9 (0,5-1,4 для серотипа Ib); отношение значений GMC для всех субъектов, получивших дозу 5 мкг, к значениям GMC у всех субъектов, получивших дозу 20 мкг, составило 1,3 (0,8-2,1 для серотипа Ia), 1,4 (0,7-2,8 для серотипа III) и 1,4 (0,9-2,3 для серотипа Ib); отношение значений GMC для всех субъектов, получивших препарат без адъюванта, к значениям GMC у всех субъектов, получивших препарат с адъювантом на основе алюминия (alum), составило 1,4 (0,8-2,4 для серотипа Ia), 1,0 (0,5-2,0 для серотипа III) и 1,7 (1,1-2,7 для серотипа Ib).
Исследование на мышах (15)
Мыши были примированы CRM197 и адъювантом гидроокиси алюминия, или только одним адъювантом на основе гидроокиси алюминия в день 0 и затем иммунизированы конъюгатом GBS серотипа III с CRM197, с адъювантом гидроокиси алюминия или без него в дни 21 и 35. Были отобраны пробы крови в день 0 и перед вакцинированием в дни 21 и 35. В пробах сыворотки крови были определены титры IgG/IgM к полисахариду GBS серотипа III и белку-носителю CRM197.
Как показано на фигуре 4, примирование носителем CRM197 привело к значительно более высокому антительному ответу антитела IgG на носитель после одной и двух доз вакцины (с адъювантом или без него), по сравнению с непримированными мышами (р<0,0002). Примирование также привело к хорошему антительному ответу против полисахарида GBS серотипа III после введения двух доз вакцины (с адъювантом или без него). Для непримированных мышей потребовалось введение адъюванта для того, чтобы достичь титра антител против полисахарида, сопоставимого с титром, наблюдаемым у примированных мышей. У непримированных мышей, когда гликоконъюгатная вакцина вводилась без адъюванта, титр антитела был значительно ниже, чем в других группах (р<0,03).
Поэтому, примирование CRM197, вероятно, имеет положительное влияние на последующий антительный ответ на капсулярный сахарид GBS в виде компонента конъюгата, даже когда введение осуществляется без адъюванта.
Исследования на крысах и кроликах
Для оценки потенциальной токсичности трехвалентной вакцины конъюгатов капсулярных сахаридов GBS серотипов Ia, Ib и III с CRM197 в отношении репродуктивности и развития, были выполнены исследования на крысах и кроликах.
Исследование на крысах было выполнено согласно таблице 20, ниже.
Исследование на крысах
"*" гидроокись алюминия, 2 мг/мл
Подкожное введение (SC) трехвалентной вакцины самкам крыс в дни исследования 1, 15, 29 (период до спаривания) и/или в дни 6, 12 и 17 в ходе беременности, в дозе 20 мкг, с адъювантом гидроокиси алюминия или без него, не привело ни к какой токсичности в отношении родителя, или к воздействию на репродуктивную функцию или эмбриофетальное развитие. Не было выявлено никаких различий между группами, обработанными тремя или шестью инъекциями трехвалентной вакцины с адъювантом гидроокиси алюминия или без него. Кроме того, не было выявлено никакого влияния на выживаемость потомства F1, на его клиническое состояние или массу тела потомства в сосунковом возрасте.
Исследование на кроликах было выполнено согласно таблице 21, ниже.
Исследование на кроликах
"*" гидроокись алюминия, 2 мг/мл
Внутримышечное (IM) введение трехвалентной вакцины самкам кроликов в дни исследования 1, 15, 29 (период до спаривания) и/или в дни 7 и 20 в ходе беременности, в дозе 20 мкг, не привело ни к какой токсичности в отношении родителя, к воздействию на спаривание или на эмбриофетальное развитие, не выявлена фетотоксичность или тератогенность. Не было выявлено никаких различий между взрослыми животными потомства Fl контроля и животными, получившими вакцину.
Эти исследования показали, что трехвалентная вакцина иммуногена и не имеет никаких негативных пренатальных или постнатальных эффектов в отношении беременных крыс или кроликов, или в отношении их потомства.
Исследование стабильности
Стабильность трехвалентной вакцины конъюгата капсулярных сахаридов GBS серотипов Ia, Ib и III с CRM197 была оценена в течение 1 месяца хранения при двух различных температурах. Вакцина была приготовлена путем объединения трех гликоконъюгатов, каждый из которых представлял собой раствор 80 мкг сахарида в 1 мл 10мМ KH2PO4 с 3% маннита. Флаконы для единичной дозы емкостью 3 мл были заполнены 0,3 мл раствора, неплотно закрыты пробкой из силиконизированного бромбутилового кацчука, и переданы на стадию цикла замораживания/сушки. По завершении процесса лиофилизирования, флаконы хранились при 2-8°C или при 36-38°C. После хранения при 36-38°C было обнаружено небольшое увеличение содержания свободного сахарида (с использованием высокоэффективной анионообменной хроматографии с импульсной амперометрической детекцией (HPAEC-PAD)). Однако во всех случаях трехвалентная вакцина была устойчива при хранении в течение до одного месяца как при 2-8°C, так и при 36-38°C.
Настоящее изобретение было описано посредством примеров только в иллюстративных целях, поэтому понятно, что в пределах объема притязаний и сущности изобретения могут быть сделаны определенные модификации.
ССЫЛКИ
[1] Paoletti et al. (1990) J Biol Chem 265:18278-83.
[2] Wessels et al. (1990) J Clin Invest 86:1428-33.
[3] Paoletti et al. (1992) Infect Immun 60:4009-14.
[4] Paoletti et al. (1992) J Clin Invest 89:203-9.
[5] Wessels et al. (1987) Proc Natl Acad Sci USA 84:9170-4.
[6] Wang et al. (2003) Vaccine 21:1112-7.
[7] Wessels et al. (1993) Infect Immun 61:4760-6
[8] Wessels et al. (1995) J Infect Dis 171:879-84.
[9] Baker et al. (2004) J Infect Dis 189:1103-12.
[10] Paoletti & Kasper (2003) Expert Opin Biol Ther 3:975-84.
[11] Brigtsen et al. (2002) JID, 185:1277-84.
[12] Paoletti et al. (2001) Infection and Immunity, 69:6696-6701
[13] WO2006/050341
[14] Guttormsen et al. (2008) Proc Natl Acad Sci U S A. 105(15):5903-8. Epub 2008 Mar 31.
[15] WO96/40795
[16] Michon et al. (2006) Clin Vaccine Immunol. 2006 Aug;13(8):936-43.
[17] US patents 6027733 & 6274144.
[18] www.polymer.de
[19] Lewis et al. (2004) PNAS USA 101:11123-8.
[20] Wessels et al. (1989) Infect Immun 57:1089-94.
[21] WO2006/082527.
[22] US patent application US 61/008,941, entitled “FERMENTATION PROCESSES FOR CULTIVATING STREPTOCOCCI AND PURIFICATION PROCESSES FOR OBTAINING CPS THEREFROM” filed on 20th December 2007 and international patent application WO 2009/081276.
[23] Ramsay et al. (2001) Lancet 357(9251):195-196.
[24] Lindberg (1999) Vaccine 17 Suppl 2:S28-36.
[25] Buttery & Moxon (2000) J R Coll Physicians Lond 34:163-68.
[26] Ahmad & Chapnick (1999) Infect Dis Clin North Am 13:113-33, vii.
[27] Goldblatt (1998) J. Med. Microbiol. 47:563-7.
[28] European patent 0477508.
[29] US patent 5,306,492.
[30] WO98/42721.
[31] Dick et al. in Conjugate Vaccines (eds. Cruse et al.) Karger, Basel, 1989, 10:48-114.
[32] Hermanson Bioconjugae Techniques, Academic Press, San Diego (1996) ISBN: 0123423368.
[33] US patent 4356170.
[34] WO2006/082530.
[35] WO2005/000346.
[36] Anonymous (Jan 2002) Research Disclosure, 453077.
[37] Anderson (1983) Infect Immun 39(1):233-238.
[38] Anderson et al. (1985) J Clin Invest 76(1):52-59.
[39] EP-A-0372501.
[40] EP-A-0378881.
[41] EP-A-0427347.
[42] WO93/17712.
[43] WO94/03208.
[44] WO98/58668.
[45] EP-A-0471177.
[46] WO91/01146.
[47] Falugi et al. (2001) Eur J Immunol 31:3816-24.
[48] Baraldo et al. (2004) Infect Immun 72:4884-87.
[49] EP-A-0594610.
[50] WO00/56360.
[51] WO02/091998.
[52] Kuo et al. (1995) Infect Immun 63:2706-13.
[53] WO01/72337
[54] WO00/61761.
[55] WO00/33882
[56] WO99/42130.
[57] WO2004/011027.
[58] WO96/40242.
[59] Lei et al. (2000) Dev Biol (Basel) 103:259-264.
[60] WO00/38711; US patent 6,146,902.
[61] International patent application PCT/IB2008/02690, ‘CONJUGATE PURIFICATION’, claiming priority from GB-0713880.3 (NOVARTIS AG), published as WO 2009/010877.
[62] WO99/24578.
[63] WO99/36544.
[64] WO99/57280.
[65] WO00/22430.
[66] Tettelin et al. (2000) Science 287:1809-1815.
[67] WO96/29412.
[68] Pizza et al. (2000) Science 287:1816-1820.
[69] WO01/52885.
[70] Bjune et al. (1991) Lancet 338(8775):1093-1096.
[71] Fukasawa et al. (1999) Vaccine 17:2951-2958.
[72] Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333.
[73] Costantino et al. (1992) Vaccine 10:691-698.
[74] WO03/007985.
[75] Watson (2000) Pediatr Infect Dis J 19:331-332.
[76] Rubin (2000) Pediatr Clin North Am 47:269-285, v.
[77] Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207.
[78] Bell (2000) Pediatr Infect Dis J 19:1187-1188.
[79] Iwarson (1995) APMIS 103:321-326.
[80] Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
[81] Hsu et al. (1999) Clin Liver Dis 3:901-915.
[82] Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355.
[83] Rappuoli et al. (1991) TIBTECH 9:232-238.
[84] Vaccines (2004) eds. Plotkin & Orenstein. ISBN 0-7216-9688-0.
[85] WO02/02606.
[86] Kalman et al. (1999) Nature Genetics 21:385-389.
[87] Read et al. (2000) Nucleic Acids Res 28:1397-406.
[88] Shirai et al. (2000) J. Infect. Dis. 181(Suppl 3):S524-S527.
[89] WO99/27105.
[90] WO00/27994.
[91] WO00/37494.
[92] WO99/28475.
[93] Ross et al. (2001) Vaccine 19:4135-4142.
[94] Sutter et al. (2000) Pediatr Clin North Am 47:287-308.
[95] Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126.
[96] Dreesen (1997) Vaccine 15 Suppl:S2-6.
[97] MMWR Morb Mortal Wkly Rep 1998 Jan 16;47(1):12, 19.
[98] McMichael (2000) Vaccine 19 Suppl 1:S101-107.
[99] WO02/34771.
[100] Dale (1999) Infect Dis Clin North Am 13:227-43, viii.
[101] Ferretti et al. (2001) PNAS USA 98: 4658-4663.
[102] Kuroda et al. (2001) Lancet 357(9264):1225-1240; see also pages 1218-1219.
[103] Robinson & Torres (1997) Seminars in Immunology 9:271-283.
[104] Donnelly et al. (1997) Annu Rev Immunol 15:617-648.
[105] Scott-Taylor & Dalgleish (2000) Expert Opin Investig Drugs 9:471-480.
[106] Apostolopoulos & Plebanski (2000) Curr Opin Mol Ther 2:441-447.
[107] Ilan (1999) Curr Opin Mol Ther 1:116-120.
[108] Dubensky et al. (2000) Mol Med 6:723-732.
[109] Robinson & Pertmer (2000) Adv Virus Res 55:1-74.
[110] Donnelly et al. (2000) Am J Respir Crit Care Med 162(4 Pt 2):S190-193.
[111] Davis (1999) Mt. Sinai J. Med. 66:84-90.
[112] Paoletti et al. (2001) Vaccine 19:2118-2126.
[113] WO00/56365.
[114] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition, ISBN: 0683306472.
[115] Paoletti (2001) Vaccine 19(15-16):2118-26.
[116] WO03/009869.
[117] Almeida & Alpar (1996) J. Drug Targeting 3:455-467.
[118] Agarwal & Mishra (1999) Indian J Exp Biol 37:6-16.
[119] WO00/53221.
[120] Jakobsen et al. (2002) Infect Immun 70:1443-1452.
[121] Bergquist et al. (1998) APMIS 106:800-806.
[122] Baudner et al. (2002) Infect Immun 70:4785-4790.
[123] Ugozzoli et al. (2002) J Infect Dis 186:1358-1361.
[124]US patent 6355271.
[125] WO00/23105.
[126] Vaccine Design… (1995) eds. Powell & Newman. ISBN: 030644867X. Plenum.
[127] WO90/14837.
[128] Podda (2001) Vaccine 19:2673-80.
[129] Frey et al. (2003) Vaccine 21:4234-7.
[130] US Patent 6,299,884.
[131] US Patent 6,451,325.
[132] US patent 5,057,540.
[133] WO96/33739.
[134] EP-A-0109942.
[135] WO96/11711.
[136] WO00/07621.
[137] Barr et al. (1998) Advanced Drug Delivery Reviews 32:247-271.
[138] Sjolanderet et al. (1998) Advanced Drug Delivery Reviews 32:321-338.
[139] Niikura et al. (2002) Virology 293:273-280.
[140] Lenz et al. (2001) J Immunol 166:5346-5355.
[141] Pinto et al. (2003) J Infect Dis 188:327-338.
[142] Gerber et al. (2001) Virol 75:4752-4760.
[143] WO03/024480.
[144] WO03/024481.
[145] Gluck et al. (2002) Vaccine 20:B10-B16.
[146] EP-A-0689454.
[147] Johnson et al. (1999) Bioorg Med Chem Lett 9:2273-2278.
[148] Evans et al. (2003) Expert Rev Vaccines 2:219-229.
[149] Meraldi et al. (2003) Vaccine 21:2485-2491.
[150] Pajak et al. (2003) Vaccine 21:836-842.
[151] Kandimalla et al. (2003) Nucleic Acids Research 31:2393-2400.
[152] WO02/26757.
[153] WO99/62923.
[154] Krieg (2003) Nature Medicine 9:831-835.
[155] McCluskie et al. (2002) FEMS Immunology and Medical Microbiology 32:179-185.
[156] WO98/40100.
[157] US patent 6,207,646.
[158] US patent 6,239,116.
[159] US patent 6,429,199.
[160] Kandimalla et al. (2003) Biochemical Society Transactions 31 (part 3):654-658.
[161] Blackwell et al. (2003) J Immunol 170:4061-4068.
[162] Krieg (2002) Trends Immunol 23:64-65.
[163] WO01/95935.
[164] Kandimalla et al. (2003) BBRC 306:948-953.
[165] Bhagat et al. (2003) BBRC 300:853-861.
[166] WO03/035836.
[167] WO95/17211.
[168] WO98/42375.
[169] Beignon et al. (2002) Infect Immun 70:3012-3019.
[170] Pizza et al. (2001) Vaccine 19:2534-2541.
[171] Pizza et al. (2000) Int J Med Microbiol 290:455-461.
[172] Scharton-Kersten et al. (2000) Infect Immun 68:5306-5313.
[173] Ryan et al. (1999) Infect Immun 67:6270-6280.
[174] Partidos et al. (1999) Immunol Lett 67:209-216.
[175] Peppoloni et al. (2003) Expert Rev Vaccines 2:285-293.
[176] Pine et al. (2002) J Control Release 85:263-270.
[177] Domenighini et al. (1995) Mol Microbiol 15:1165-1167.
[178] WO99/40936.
[179] WO99/44636.
[180] Singh et al] (2001) J Cont Release 70:267-276.
[181] WO99/27960.
[182] US patent 6,090,406.
[183] US patent 5,916,588.
[184] EP-A-0626169.
[185] WO99/52549.
[186] WO01/21207.
[187] WO01/21152.
[188] Andrianov et al. (1998) Biomaterials 19:109-115.
[189] Payne et al. (1998) Adv Drug Delivery Review 31:185-196.
[190] Stanley (2002) Clin Exp Dermatol 27:571-577.
[191] Jones (2003) Curr Opin Investig Drugs 4:214-218.
[192] WO04/60308.
[193] WO04/64759.
[194] WO99/11241.
[195] WO94/00153.
[196] WO98/57659.
[197] European patent applications 0835318, 0735898 and 0761231.
[198] Hennings et al. (2001) J Infect Dis. 183(7):1138-42. Epub 2001 Mar 1.
[199] Lin et al. (2001) J Infect Dis. 184(8):1022-8.
[200] Lin et al. (2004) J Infect Dis. 190(5):928-34
[201] Glezen & Alpers (1999) Clin. Infect. Dis. 28:219-224.
[202] Madoff et al. (1994) J Clin Invest 94:286-92.
[203] Paoletti et al. (1994) Infect Immun 62:3236-43.
[204] WO03/093306.
[205] WO2004/018646.
[206] WO2004/041157.
[207] Adderson et al. (2003) Infection and Immunity 71(12):6857-6863.
[208] Geysen et al. (1984) PNAS USA 81:3998-4002.
[209] Carter (1994) Methods Mol Biol 36:207-23.
[210] Jameson, BA et al. 1988, CABIOS 4(1):181-186.
[211] Raddrizzani & Hammer (2000) Brief Bioinform 1(2):179-89.
[212] De Lalla et al. (1999) J. Immunol. 163:1725-29.
[213] Brusic et al. (1998) Bioinformatics 14(2):121-30.
[214] Meister et al. (1995) Vaccine 13(6):581-91.
[215] Roberts et al. (1996) AIDS Res Hum Retroviruses 12(7):593-610.
[216] Maksyutov & Zagrebelnaya (1993) Comput Appl Biosci 9(3):291-7.
[217] Feller & de la Cruz (1991) Nature 349(6311):720-1.
[218] Hopp (1993) Peptide Research 6:183-190.
[219] Welling et al. (1985) FEBS Lett. 188:215-218.
[220] Davenport et al. (1995) Immunogenetics 42:392-297.
[221] Bodanszky (1993) Principles of Peptide Synthesis (ISBN: 0387564314).
[222] Fields et al. (1997) Meth Enzymol 289: Solid-Phase Peptide Synthesis. ISBN: 0121821900.
[223] Chan & White (2000) Fmoc Solid Phase Peptide Synthesis. ISBN: 0199637245.
[224] Kullmann (1987) Enzymatic Peptide Synthesis. ISBN: 0849368413.
[225] Ibba (1996) Biotechnol Genet Eng Rev 13:197-216.
[226] WO2006/069200.
[227] UK patent application 0802503.3, entitled “HYBRID POLYPEPTIDE” filed on 11th February 2008, and international patent application WO2009/101403.
[228] Needleman & Wunsch (1970) J. Mol. Biol. 48, 443-453.
[229] Rice et al. (2000) Trends Genet 16:276-277.
[230] Herzenberg et al. (1980) Nature 285: 664-667.
[231] Schutze et al. (1985) J Immunol 135:2319-2322.
[232] Dagan et al. (1998) Infect Immun 66:2093-2098.
[233] Barington et al. (1994) Infect Immun 62:9-14.
[234] Di John et al. (1989) Lancet 2(8677):1415-8.
[235] Granoff et al. (1993) Vaccine Suppl1: S46-51.
[236] Granoff et al. (1994) JAMA 272:1116-1121.
[237] Barington et al. (1993) Infect Immun 61:432-438.
[238] Australian patent 748716 (granted from WO98/51339).
[239] Olander et al. (2001) Vaccine 20:336-341.
[240] Burrage et al. (2002) Infect Immun 70:4946-4954.
[241] Hoppenbrouwers et al. (1999) Vaccine 17:2588-98.
[242] Podda et al. (1991) Vaccine 9:741-745.
[243] Vaccines. (eds. Plotkin & Orenstein). 4th edition, 2004, ISBN: 0-7216-9688-0.
[244] Darkes & Plosker (2002) Paediatr Drugs 4:609-630.
[245] Jones (2001) Curr Opin Investig Drugs 2:47-49.
[246] Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70.
[247] Anonymous (Jan 2002) Research Disclosure, 453077.
[248] Anderson (1983) Infect Immun 39(1):233-238.
[249] Anderson et al. (1985) J Clin Invest 76(1):52-59.
[250] Rodewald et al. (1992) J Infect Dis. 166(3):635-9.
[251] Baltimore et al. (1977) J Immunol.118(2):673-8.
[252] Lin et al. (2001) J Infect Dis. 184(8):1022-8.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛА, СОДЕРЖАЩАЯ SPR0096 и SPR2021 | 2012 |
|
RU2636350C2 |
| ИММУНОГЕННЫЕ ПОЛИСАХАРИД-БЕЛКОВЫЕ КОНЬЮГАТЫ, СОДЕРЖАЩИЕ ПОЛИСАХАРИД, ПОЛУЧЕННЫЙ ИЗ СТРЕПТОКОККА ГРУППЫ B (GBS) | 2017 |
|
RU2791468C2 |
| ПОЛИПЕПТИДНЫЕ ВАКЦИНЫ ДЛЯ ШИРОКОЙ ЗАЩИТЫ ПРОТИВ РЯДОВ ПОКОЛЕНИЙ МЕНИНГОКОККОВ С ПОВЫШЕННОЙ ВИРУЛЕНТНОСТЬЮ | 2003 |
|
RU2333007C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ САХАРИД ПНЕВМОКОККА СЕРОТИПА 14 | 2010 |
|
RU2549438C2 |
| Конъюгаты полисахарида стрептококка группы В и белка, способы получения конъюгатов, иммуногенные композиции, содержащие конъюгаты, и их применения | 2016 |
|
RU2692923C2 |
| АДЪЮВАНТНЫЙ МЕНИНГОКОККОВЫЙ БЕЛОК, СВЯЗЫВАЮЩИЙ ФАКТОР Н | 2010 |
|
RU2557315C2 |
| ЖИДКИЕ ВАКЦИНЫ ДЛЯ МНОЖЕСТВЕННЫХ СЕРОГРУПП МЕНИНГОКОККОВ | 2004 |
|
RU2378010C2 |
| ЖИДКИЕ ВАКЦИНЫ ДЛЯ МНОЖЕСТВЕННЫХ СЕРОГРУПП МЕНИНГОКОККОВ | 2009 |
|
RU2595845C2 |
| КОМПОЗИЦИИ ESCHERICHIA COLI И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2788526C2 |
| ГИПО- И ГИПЕРАЦЕТИЛИРОВАННЫЕ МЕНИНГОКОККОВЫЕ КАПСУЛЬНЫЕ САХАРИДЫ | 2004 |
|
RU2362784C2 |











































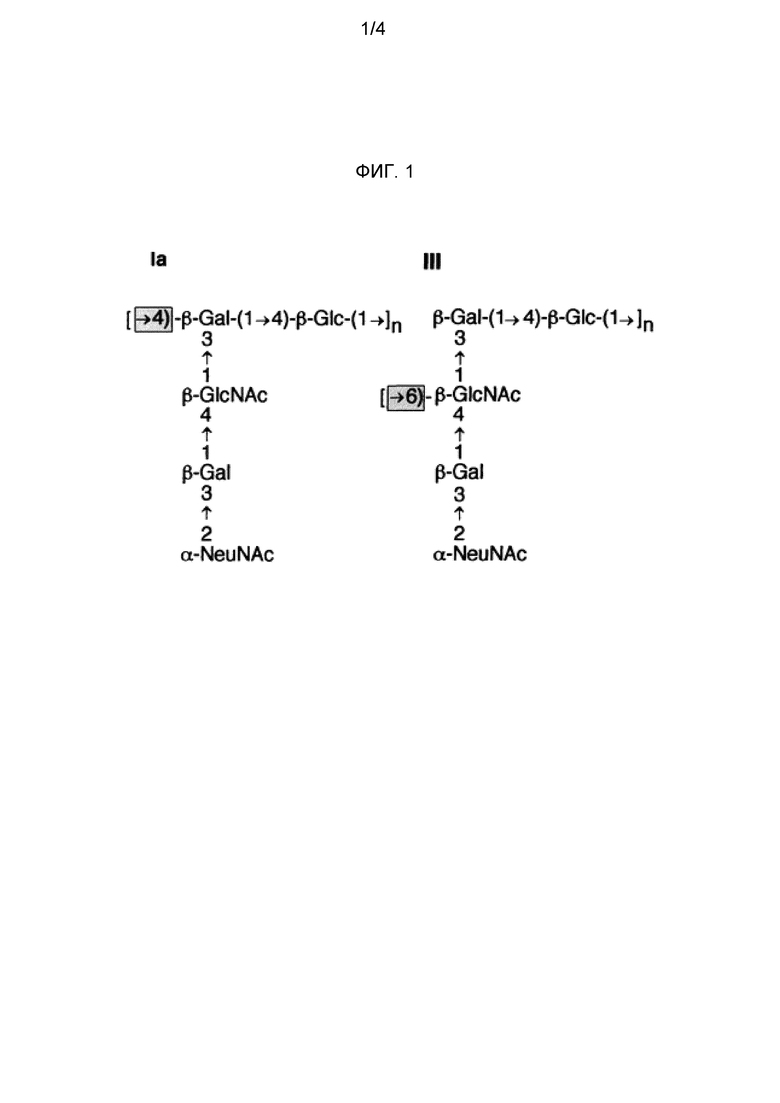
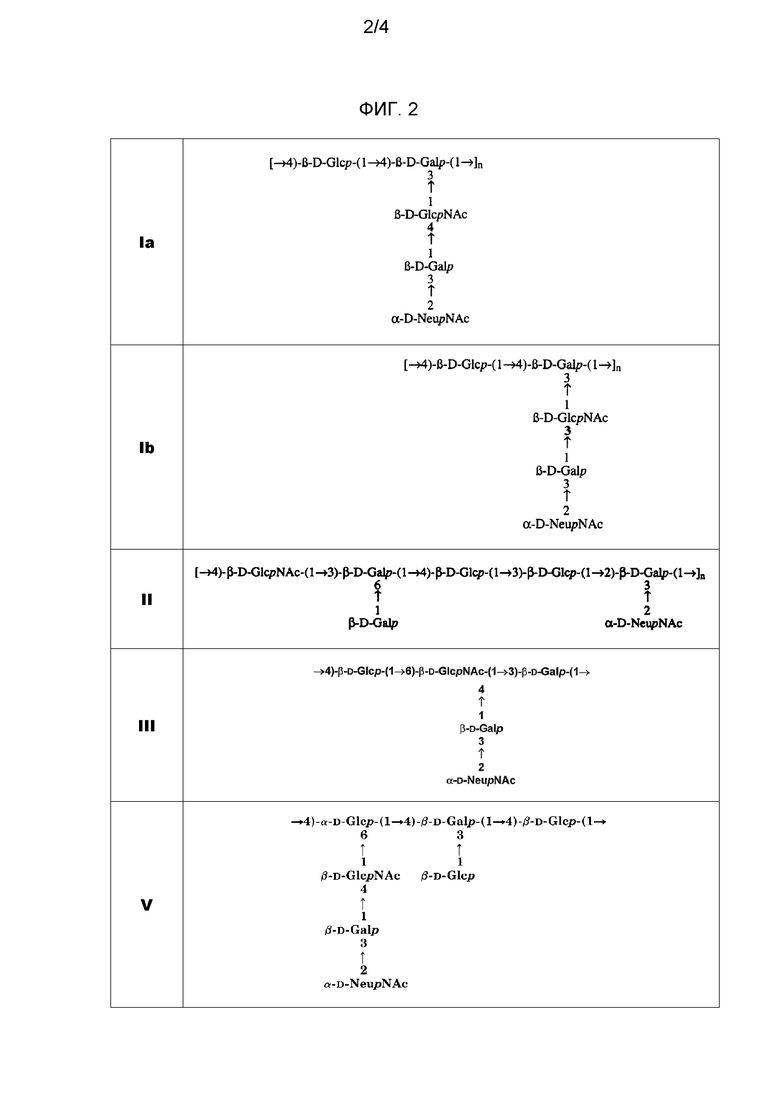

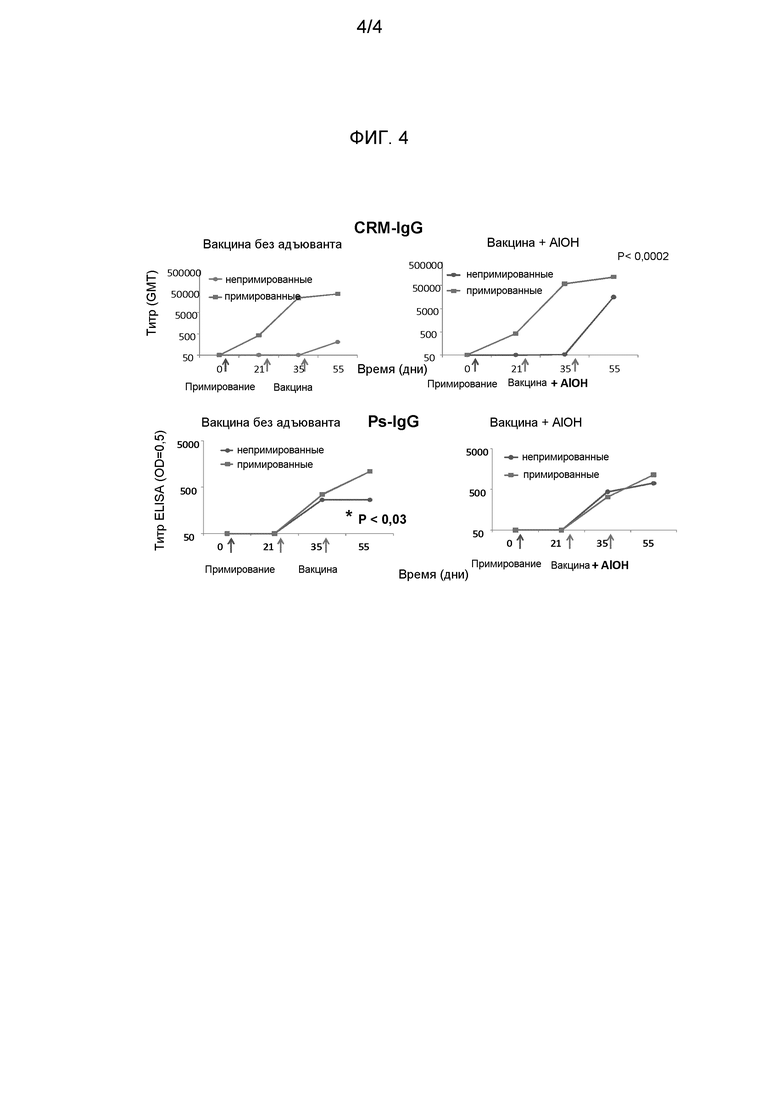
Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для получения иммуногенной композиции. Иммуногенная композиция содержит а) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и с) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем, где (i) где каждый капсулярный сахарид GBS присутствует в количестве 5 мкг, 10 мкг или 20 мкг на единицу дозы, (ii) белок-носитель в а), b) и с) представляет собой токсоид дифтерии или CRM197, и iii) иммуногенная композиция не содержит адъювант на основе соли алюминия. Использование данного состава иммуногенной композиции, имеющей эффективные количества полисахаридов GBS типа Ia, Ib и III, конъюгированных с CRM197, позволяет использовать ее в качестве вакцины для профилактики инфекции GBS в организме человека. 13 з.п. ф-лы, 4 ил., 21 табл.
1. Иммуногенная композиция, содержащая: а) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ia, конъюгированный с белком-носителем; b) конъюгат, который представляет собой капсулярный сахарид GBS серотипа Ib, конъюгированный с белком-носителем; и с) конъюгат, который представляет собой капсулярный сахарид GBS серотипа III, конъюгированный с белком-носителем, где (i) где каждый капсулярный сахарид GBS присутствует в количестве 5 мкг, 10 мкг или 20 мкг на единицу дозы, (ii) белок-носитель в а), b) и с) представляет собой токсоид дифтерии или CRM197, и iii) иммуногенная композиция не содержит адъювант на основе соли алюминия.
2. Иммуногенная композиция по п. 1, где количества капсулярных сахаридов GBS серотипов Ia, Ib и III на единицу дозы составляют 5 мкг, 5 мкг и 5 мкг.
3. Иммуногенная композиция по п. 1, где отношение масс капсулярных сахаридов GBS серотипов Ia, Ib и III составляет 1:1:1.
4. Иммуногенная композиция по п. 1, дополнительно содержащая: d) конъюгат, который представляет собой капсулярный сахарид GBS серотипа V, конъюгированный с белком-носителем.
5. Иммуногенная композиция по п. 1, где композиция предназначена для введения в единичной дозе.
6. Иммуногенная композиция по п. 1, где конъюгат(ы) получали путем восстанавливающего аминирования альдегидных групп, полученных перед конъюгированием путем окисления от 10 до 30% остатков сиаловых кислот сахарида(ов).
7. Иммуногенная композиция по п. 1, где капсулярный сахарид(ы) GBS по существу не имеет O-ацетилированных остатков сиаловых кислот в положениях 7, 8 и/или 9.
8. Иммуногенная композиция по п. 1, где композиция предназначена для внутримышечного введения.
9. Иммуногенная композиция по п. 1, где композиция дополнительно содержит: (а) полипептид, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 1-3, и/или (b) полипептид, содержащий (i) аминокислотную последовательность, которая обладает идентичностью последовательности с одной или несколькими из SEQ ID NO: 1-3, и/или (ii) фрагмент SEQ ID NO: 1-3.
10. Иммуногенная композиция по п. 1, где композиция содержит маннит для стабилизации конъюгата(ов).
11. Иммуногенная композиция по п. 1, где композиция предназначена для применения в качестве лекарственного средства.
12. Иммуногенная композиция по п. 1, где композиция представляет собой вакцину для предотвращения и/или лечения заболевания, вызванного S. agalactiae.
13. Иммуногенная композиция по п. 1, где композиция предназначена для введения людям, выбранным из женщин детородного возраста, беременных женщин и пожилых пациентов.
14. Иммуногенная композиция по любому из предшествующих пунктов, где композиция предназначена для введения пациенту, который был предварительно иммунизирован токсоидом дифтерии или его производным, и по меньшей мере один конъюгат в иммуногенной композиции представляет собой капсулярный сахарид GBS, конъюгированный с токсоидом дифтерии или его производным.
| WO 2006082530 А2, 10.08.2006 | |||
| US 2010150943 A1, 17.06.2010 | |||
| PAOLETTI L.C | |||
| et al | |||
| Neonatal mouse protection against infection with multiple group B streptococcal (GBS) serotypes by maternal immunization with a tetravalent GBS polysaccharide-tetanus toxoid conjugate vaccine // Infect Immun., 1994, Aug; 62(8): 3236-;3243.. |
Авторы
Даты
2017-01-26—Публикация
2011-09-16—Подача