ОБЛАСТЬ ТЕХНИКИ
[0001] Данная заявка испрашивает приоритет на основании предварительной заявки на патент США №61/364211, поданной 14 июля 2010 года, полное содержание которой включено в настоящее описание посредством ссылки.
[0002] Варианты реализации настоящего изобретения включают олигонуклеотиды, модулирующие экспрессию и/или функцию гомолога 1 гена Discs large (DLG1) и связанных с ним молекул.
УРОВЕНЬ ТЕХНИКИ
[0003] Гибридизация ДНК-РНК и РНК-РНК важна для многих аспектов функционирования нуклеиновых кислот, включая репликацию ДНК, транскрипцию и трансляцию. Процесс гибридизации также является основным во множестве технологий, которые позволяют либо обнаруживать конкретную нуклеиновую кислоту, либо изменять ее экспрессию. Антисмысловые нуклеотиды, например, нарушают экспрессию генов за счет гибридизации с РНК-мишенью, таким образом препятствуя сплайсингу РНК, транскрипции, трансляции и репликации. Антисмысловая ДНК обладает дополнительной особенностью, заключающейся в том, что гибриды ДНК-РНК выступают в качестве субстрата для ферментативного расщепления рибонуклеазой Н, активность которой присутствует в большинстве типов клеток. Антисмысловые молекулы могут быть доставлены в клетки, как в случае для олигодезоксинуклеотидов (ОДН), или они могут представлять собой продукты экспрессии эндогенных генов в виде молекул РНК. Недавно Федеральное агентство по контролю за лекарственными средствами США (FDA) одобрило антисмысловое лекарственное средство Витравен (VITRAVENE™) (для лечения цитомегаловирусного ретинита), что отражает полезность этого антисмыслового препарата для терапевтических целей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Настоящее краткое описание предлагает краткое описание настоящего изобретения с той целью, чтобы вкратце обозначить предмет и сущность настоящего изобретения. Краткое описание представляют с пониманием того, что его не следует применять для толкования или ограничения объема или смыслового содержания формулы изобретения.
[0005] В одном варианте реализации согласно изобретению предложены способы для ингибирования действия природного антисмыслового транскрипта путем применения антисмыслового олигонуклеотида (олигонуклеотидов), нацеленного на любую область природного антисмыслового транскрипта, приводящего к увеличению экспрессии соответствующего смыслового гена. Авторы настоящей заявки также предполагают, что ингибирование природного антисмыслового транскрипта может быть достигнуто с помощью малых интерферирующих РНК (ммРНК), рибозимов и малых молекул, рассматриваемых в рамках настоящего изобретения.
[0006] Согласно одному варианту реализации предложен способ модулирования функции и/или экспрессии полинуклеотида DLG1 в клетках или тканях пациента in vivo или in vitro, включающий осуществление контакта указанных клеток или тканей с антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, при этом указанный олигонуклеотид имеет по меньшей мере 50% идентичность последовательности с последовательностью, которая представляет собой обратный комплемент полинуклеотида, содержащего от 5 до 30 последовательных нуклеотидов в пределах нуклеотидов 1-1706, соответствующих SEQ ID NO: 2, что приводит к модулированию функции и/или экспрессии полинуклеотида DLG1 в клетках или тканях пациента in vivo или in vitro.
[0007] В одном варианте реализации олигонуклеотид нацелен на природную аптисмысловую последовательность для полинуклеотидов DLG1, например на нуклеотиды, указанные в последовательности, соответствующей SEQ ID NOS: 2, и любые их варианты, аллели, гомологи, мутанты, производные, фрагменты и последовательности, которые представляют собой их комплемент. Примеры антисмысловых олигонуклеотидов указаны в виде последовательностей, соответствующих SEQ ID NOS: 3-12.
[0008] Согласно другому варианту реализации предложен способ модулирования функции и/или экспрессии полинуклеотида DLG1 в клетках или тканях пациента in vivo или in vitro, включающий осуществление контакта указанных клеток или тканей с антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, при этом указанный олигонуклеотид имеет по меньшей мере 50% идентичность последовательности с последовательностью, которая представляет собой обратный комплемент антисмысловой последовательности для полинуклеотида DLG1, что приводит к модулированию функции и/или экспрессии полинуклеотида DLG1 в клетках или тканях пациента in vivo или in vitro.
[0009] Согласно другому варианту реализации предложен способ модулирования функции и/или экспрессии полинуклеотида DLG1 в клетках или тканях пациента in vivo или in vitro, включающий осуществление контакта указанных клеток или тканей с антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, при этом указанный олигонуклеотид имеет по меньшей мере 50% идентичность последовательности с антисмысловым олигонуклеотидом для антисмыслового полинуклеотида гена DLG1, что приводит к модулированию функции и/или экспрессии полинуклеотида DLG1 в клетках или тканях пациента in vivo или in vitro.
[0010] В одном варианте реализации изобретение включает способ модулирования функции и/или экспрессии полинуклеотида DLG1 в биологической системе, включающий: осуществление контакта указанной системы с по меньшей мере одним антисмысловым олигонуклеотидом, который нацелен на область природного антисмыслового олигонуклеотида для полинуклеотида DLG1 и его изоформ; что приводит к модулированию функции и/или экспрессии полинуклеотида DLG1.
[0011] В одном варианте реализации композиция содержит один или более антисмысловых олигонуклеотидов, которые связываются со смысловыми и/или антисмысловыми полинуклеотидами гена DLG1.
[0012] В одном варианте реализации олигонуклеотиды содержат один или более модифицированных или замещенных нуклеотидов.
[0013] В одном варианте реализации олигонуклеотиды содержат одну или более модифицированных связей.
[0014] В еще одном варианте реализации модифицированные нуклеотиды содержат модифицированные основания, включая молекулы фосфотиоатных, метилфосфтиоатных производных нуклеиновых кислот, пептидо-нуклеиновых кислот, 2’-O-метил-, фтор- или углерод-, метилен- или других закрытых нуклеиновых кислот (ЗНК; locked nucleic acids, LNA). Предпочтительно, модифицированные нуклеотиды представляют собой молекулы закрытых нуклеиновых кислот, включая ЗНК с α-L-рибо-конфигурацией (α-L-ЗНК).
[0015] В одном варианте реализации олигонуклеотиды вводят пациенту подкожно, внутримышечно, внутривенно или интраперитонеально.
[0016] В одном варианте реализации олигонуклеотиды вводят в составе фармацевтической композиции. Схема лечения включает по меньшей мере однократное введение антисмысловых соединений пациенту; однако это лечение может быть модифицировано до введения многократных доз в течение некоторого периода времени. Лечение может быть объединено с одним или более другими типами терапии.
[0017] В одном варианте реализации олигонуклеотиды инкапсулированы в липосому или присоединены к молекуле-носителю (например, холестерину, ТАТ-пептиду).
[0018] Другие аспекты описаны ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0019] Фигура 1 иллюстрирует увеличение уровней мРНК гена DLG1 в клетках HEK293T после обработки антисмысловыми олигонуклеотидами, нацеленными на DLG1-специфичный природный антисмысловой транскрипт (определенное посредством полимеразной цепной реакции (ПЦР) в режиме реального времени). Олигонуклеотиды CUR-1695-CUR-1704 представляют собой антисмысловые олигонуклеотиды, нацеленные на природную антисмысловую последовательность для гена DLG1. * - P<0,05; ** - P<0,01; *** - P<0,001. Столбцы диаграммы, обозначенные как CUR-1695-CUR-1704, соответствуют образцам, обработанным олигонуклеотидами, соответствующими SEQ ID NOS: 3-12 соответственно.
[0020] Фигура 2 иллюстрирует ускоренное восстановление целостности монослоя в клетках HEK293T, обработанных антисмысловыми олигонуклеотидами, нацеленными на DLG1-специфичный природный антисмысловой транскрипт, определенное посредством анализа закрытия дефектов монослоя. Олигонуклеотиды CUR-1696-CUR-1704 представляют собой антисмысловые олигонуклеотиды, нацеленные на природную антисмысловую последовательность для гена DLG1. * - P<0,05; ** - P<0,01; *** - P<0,001. Столбцы диаграммы, обозначенные как CUR-1696, CUR-1699, CUR-1700, CUR-1703 и CUR-1704, соответствуют образцам, обработанным олигонуклеотидами, соответствующими SEQ ID NOS: 4, 7, 8,11 и 12 соответственно.
[0021] Описание Перечня последовательностей - SEQ ID NO: 1: гомолог 1 гена Discs large (Drosophild) человека (DLG1), транскриптный вариант 2, мРНК (номер последовательности в базе данных NCBI (Национального центра биотехнологической информации США): NM_004087); SEQ ID NO: 2: Природная антисмысловая последовательность (Hs.636103) для гена DLG1; SEQ ID NOs: 3-12: Антисмысловые олигонуклеотиды. Символ "*" обозначает фосфотиоатную связь.
ПОДРОБНОЕ ОПИСАНИЕ
[0022] Некоторые аспекты изобретения описаны ниже со ссылкой на примеры применения для иллюстрации. Следует понимать, что многочисленные конкретные детали, связи и способы приведены с целью обеспечения полного понимания изобретения. Однако специалист в данной области техники без труда обнаружит, что изобретение может быть применено на практике без одной или более конкретных деталей или с другими способами. Настоящее изобретение не ограничивается упорядочиванием действий или событий, так как некоторые действия могут быть осуществлены в разном порядке и/или одновременно с другими действиями или событиями. Кроме того, не все проиллюстрированные действия или события требуются для реализации методологии в соответствии с настоящим изобретением.
[0023] Все гены, названия генов и продукты генов, описанные в настоящей заявке, соответствуют гомологам из организмов любых видов, для которых применимы композиции и способы, предложенные в настоящей заявке. Таким образом, данные термины включают, но без ограничения, гены и генные продукты из организмов людей и мышей. Понимают, что, когда предложен ген или продукт гена из организма конкретного вида, этот элемент изобретения представлен исключительно в качестве примера и его не следует истолковывать как ограничение, если контекст, в котором он появляется, ясно не указывает на обратное. Соответственно, например, гены, описанные в настоящей заявке, которые в некоторых вариантах реализации относятся к нуклеотидным и аминокислотным последовательностям млекопитающих, охватывают гомологичные и/или ортологичные гены и продукты генов из организмов других животных, включая, но без ограничения, других млекопитающих, рыб, земноводных, пресмыкающихся и птиц. В одном варианте реализации гены или нуклеотидные последовательности представляют собой гены или последовательности человека.
Определения
[0024] Терминология, применяемая в настоящей заявке, служит исключительно для описания конкретных вариантов реализации и не ограничивает изобретение. В настоящей заявке неопределенная и определенная формы единственного числа также включают множественные формы, если контекст ясно не предписывает иное. Кроме того, в той мере, в какой термины "включающий", "включает", "имеющий", "имеет", "с" или их варианты применяют в подробном описании и/или формуле изобретения, такие термины подразумевают включение в себя подобно термину "содержащий".
[0025] Термин "примерно" или "приблизительно" обозначает нахождение внутри диапазона приемлемой погрешности для конкретной величины, определенного специалистом в данной области техники, который будет зависеть отчасти от того, каким образом величину измеряют или определяют, т.е. от ограничений измерительной системы. Например, термин "примерно" может означать, что величина находится в пределах 1 или более чем 1 стандартного отклонения, как показывает практика в данной области техники. Альтернативно, термин "примерно" может означать диапазон погрешности, составляющий вплоть до 20%, предпочтительно вплоть до 10%, более предпочтительно вплоть до 5% и еще более предпочтительно вплоть до 1% от заданной величины. Альтернативно, применительно к биологическим системам или процессам, термин может означать нахождение в пределах порядка величины, предпочтительно в пределах пятикратного значения и более предпочтительно двукратного значения величины. В тех случаях, когда в заявке и формуле изобретения приведены конкретные значения, то, если не указано иное, следует предполагать термин "примерно", обозначающий нахождение внутри диапазона приемлемой погрешности для конкретной величины.
[0026] В настоящей заявке термин "мРНК" обозначает известный на настоящий момент мРНК-транскрипт(ы) гена-мишени и любые дополнительные транскрипты, происхождение которых может быть объяснено.
[0027] С помощью терминов "антисмысловые олигонуклеотиды" или "антисмысловое соединение" обозначают молекулу РНК или ДНК, которая связывается с другой РНК или ДНК (РНК-, ДНК-мишенью). Например, если антисмысловое соединение представляет собой олигорибонуклеотид, оно связывается с другой РНК-мишенью за счет РНК-РНК-взаимодействий и изменяет активность РНК-мишени. Антисмысловой олигонуклеотид может увеличивать или подавлять экспрессию и/или функцию конкретного полинуклеотида. Определение включает любую чужеродную молекулу ДНК или РНК, подходящую с терапевтической, диагностической или другой точки зрения. Такие молекулы включают, например, молекулы антисмысловых ДНК или РНК, молекулы интерферирующих РНК (РНКи), микроРНК, ложных РНК, ммРНК, ферментативные РНК, РНК, применяемые в исправляющей терапии, и РНК, имеющие свойства агонистов и антагонистов, антисмысловые олигомерные соединения, антисмысловые олигонуклеотиды, олигонуклеотиды внешней направляющей последовательности (external guide sequence, EGS), сплайс-варианты, праймеры, зонды и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени. В связи с этим данные соединения могут быть введены в форме одноцепочечных, двухцепочечных, частично одноцепочечных или кольцевых олигомерных соединений.
[0028] В контексте настоящего изобретения термин "олигонуклеотид" относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или их миметикам. Термин "олигонуклеотид" также включает линейные или кольцевые олигомеры природных и/или модифицированных мономеров или связей, включая дезоксирибонуклеозиды, рибонуклеозиды, их замещенные и альфа-аномерные формы, пептидо-нуклеиновые кислоты (ПНК), закрытые нуклеиновые кислоты (ЗНК; locked nucleic acids, LNA), фосфотиоатные, метилфосфонатные производные и т.п. Олигонуклеотиды способны к специфичному связыванию с полинуклеотидом-мишенью за счет регулярных взаимодействий между мономерными звеньями, такими как Уотсон-Криковский тип спаривания оснований, Хугстиновский или обратный Хугстиновский типы спаривания оснований и т.п.
[0029] Олигонуклеотид может быть "химерным", то есть составленным из разных областей. В контексте настоящего изобретения "химерные" соединения представляют собой олигонуклеотиды, которые содержат две или более химически отличные области, например область (области) ДНК, область (области) РНК, область (области) ПНК и т.д. Каждая химически отличная область состоит из по меньшей мере одной мономерной единицы, т.е. нуклеотида в случае олигонуклеотидного соединения. Эти олигонуклеотиды, как правило, содержат по меньшей мере одну область, в которой олигонуклеотид модифицирован с целью проявления одного или более желаемых свойств. Желаемые свойства олигонуклеотида включают, но без ограничения, например, повышенную устойчивость к деградации нуклеазами, повышенное клеточное поглощение и/или повышенную способность к связыванию с нуклеиновой кислотой-мишенью. Разные области олигонуклеотида могут таким образом обладать разными свойствами. Химерные олигонуклеотиды согласно настоящему изобретению могут быть получены в виде смешанных структур из двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или аналогов олигонуклеотидов, описанных выше.
[0030] Олигонуклеотид может быть составлен из областей, которые могут быть соединены в "ряд", то есть когда мономеры соединены последовательно, как в нативной ДНК, или соединены посредством спейсеров. Спейсеры формируют ковалентный "мостик" между областями и имеют в предпочтительных случаях длину, не превышающую примерно 100 углеродных атомов. Спейсеры могут иметь разные функциональные характеристики, например, могут нести положительный или отрицательный заряд, обладать свойствами специфичного связывания нуклеиновых кислот (интеркаляторы, вещества, связывающиеся с бороздками, токсины, флуорофоры и т.д.), могут быть липофильными, индуцировать образование специфических вторичных структур, как, например, аланинсодержащие пептиды, которые индуцируют образование альфа-спиралей.
[0031] В настоящей заявке термины "ген DLG" и "гомолог гена Discs large" и "полинуклеотид DLG" включают все члены семейства, изоформы, гомологи, мутанты, аллели, фрагменты, виды, кодирующие и некодирующие последовательности, смысловые и антисмысловые полинуклеотидные цепи и т.д.
[0032] В настоящем описании слова "гомолог 1 гена Discs large", dJ1061C18.1.1, DKFZp761P0818, DKFZp781B0426, DLGH1, hdig, hDIg, SAP97, SAP-97, синапс-ассоциированный белок 97 рассматривают как имеющие одно и то же значение в литературе и применяют взаимозаменяемо в настоящей заявке.
[0033] В настоящей заявке термин "олигонуклеотид, специфичный к" или "олигонуклеотид, нацеленный на" относится к олигонуклеотиду, содержащему последовательность, (i) способную образовывать стабильный комплекс с частью гена-мишени или (И) способную образовывать стабильный дуплекс с частью мРНК-транскрипта гена-мишени. Стабильность комплексов и дуплексов может быть определена посредством теоретических расчетов и/или анализов in vitro. Типовые анализы для определения стабильности гибридизационных комплексов и дуплексов описаны в Примерах ниже.
[0034] В настоящей заявке термин "нуклеиновая кислота-мишень" охватывает ДНК, РНК (содержащую пре-мРНК и мРНК), транскрибируемую с такой ДНК, и также кДНК, получаемую на матрице такой РНК, кодирующие, некодирующие последовательности, смысловые или антисмысловые полинуклеотиды. Специфичная гибридизация олигомерного соединения с его нуклеиновой кислотой-мишенью препятствует нормальной функции нуклеиновой кислоты. Это модулирование функции нуклеиновой кислоты-мишени с помощью соединений, которые специфично гибридизуются с последней, в общем случае называют "антисенс-технологией". Затрагиваемые функции ДНК включают, например, репликацию и транскрипцию. Затрагиваемые функции РНК включают все жизненно важные функции, такие как, например, транслокация РНК к месту трансляции белков, трансляция белков на матрице РНК, сплайсинг РНК с образованием одного или более видов мРНК и каталитическая активность, которая может присутствовать у РНК или которой РНК может способствовать. Суммарный эффект такого препятствия функции нуклеиновой кислоты-мишени заключается в модулировании экспрессии кодируемого продукта или олигонуклеотидов.
[0035] РНК-интерференция "РНКи" опосредована молекулами двухцепочечной РНК (дцРНК), которые имеют последовательности, гомологичные их нуклеотидным последовательностям-"мишеням". В некоторых вариантах реализации настоящего изобретения посредники представляют собой дуплексы "малых интерферирующих" РНК (ммРНК) длиной 5-25 нуклеотидов. ммРНК образуются в результате разрезания дцРНК ферментом-РНКазой, известным как Дайсер (Dicer). Дуплексные продукты ммРНК включаются в состав мультибелкового комплекса, называемого MSC (индуцируемый РНК комплекс сайленсинга). Без привязки к какой-либо конкретной теории, комплекс RISC, как полагают, нацелен на нуклеиновую кислоту-мишень (на роль которой подходит мРНК), при этом дуплекс ммРНК взаимодействует с мРНК за счет комплементарности их последовательностей, вызывая расщепление мРНК каталитическим путем. Малые интерферирующие РНК, которые могут быть применены согласно настоящему изобретению, могут быть синтезированы и применены в соответствии со способами, которые хорошо известны в данной области техники и которые будут хорошо знакомы специалисту в данной области техники. Малые интерферирующие РНК для применения в соответствии со способами согласно настоящему изобретению подходящим образом содержат от примерно 1 до примерно 50 нуклеотидов (нт). В примерах неограничивающих вариантов реализации ммРНК могут содержать от примерно 5 до примерно 40 нт, от примерно 5 до примерно 30 нт, от примерно 10 до примерно 30 нт, от примерно 15 до примерно 25 нт или примерно 20-25 нуклеотидов.
[0036] Отбор подходящих олигонуклеотидов упрощается при применении компьютерных программ, которые автоматически выравнивают нуклеотидные последовательности и отмечают идентичные или гомологичные области. Такие программы применяют для сравнения нуклеотидных последовательностей, полученных, например, в результате поиска в базах данных, таких как GenBank, или посредством секвенирования ПЦР-продуктов. Сравнение нуклеотидных последовательностей из организмов ряда видов позволяет отобрать нуклеотидные последовательности, которые обнаруживают подходящую степень идентичности между видами. В случае генов, которые не были просеквенированы, проводят блоттинги по Саузерну с целью определения степени идентичности между генами вида-мишени и других видов. Путем проведения блоттингов по Саузерну при различных степенях строгости условий гибридизации, как хорошо известно в данной области техники, можно получить приблизительную меру идентичности. Эти процедуры позволяют осуществить отбор олигонуклеотидов, которые показывают высокую степень комплементарности нуклеотидным последовательностям-мишеням субъекта, подлежащего контролю, и меньшую степень комплементарности соответствующим нуклеотидным последовательностям других видов. Специалист в данной области техники обнаружит, что существует значительная свобода выбора подходящих областей генов для применения согласно настоящему изобретению.
[0037] С помощью термина "ферментативная РНК" обозначают молекулу РНК, обладающую ферментативной активностью (Cech, (1988) J. American. Med. Assoc. 260, 3030-3035). Ферментативные нуклеиновые кислоты (рибозимы) действуют за счет, во-первых, связывания с РНК-мишенью. Такое связывание происходит через участок ферментативной нуклеиновой кислоты, связывающий РНК-мишень, который находится в непосредственной близости к ферментативному участку молекулы, катализирующему расщепление РНК-мишени. Таким образом, ферментативная нуклеиновая кислота сперва распознает и далее связывает РНК-мишень за счет спаривания оснований и, как только происходит связывание с нужным сайтом, проявляет ферментативную активность, разрезая РНК-мишень.
[0038] С помощью термина "ложная РНК" обозначают молекулу РНК, которая имитирует природный связывающий домен для лиганда. Ложная РНК, таким образом, конкурирует с природной связывающей мишенью за связывание конкретного лиганда. Например, было показано, что сверхэкспрессия РНК-элемента трансактивационного ответа (TAR) ВИЧ может действовать как "ложная" и эффективно связывает белок tat (транскрипционный трансактиватор) ВИЧ, таким образом препятствуя связыванию этого белка с последовательностями TAR, кодируемыми РНК ВИЧ. Подразумевают, что приведенная информация представляет собой конкретный пример. Специалисты в данной области техники обнаружат, что это всего лишь один пример, и другие варианты реализации могут быть легко разработаны с применением методик, общеизвестных в данной области техники.
[0039] В настоящей заявке термин "мономеры", как правило, обозначает мономеры, соединенные посредством фосфодиэфирных связей или их аналогов с образованием олигонуклеотидов, размеры которых изменяются в пределах от нескольких мономерных единиц, например от примерно 3-4, до примерно нескольких сотен мономерных единиц. Аналоги фосфодиэфирных связей включают: фосфотиоатные, фосфодитиоатные, метилфосфонатные, фосфоселеноатные, фосфорамидатные связи и т.п., как более подробно описано ниже.
[0040] Термин "нуклеотид" распространяется на встречающиеся в природе нуклеотиды, а также не встречающиеся в природе нуклеотиды. Специалисту в данной области техники должно быть ясно, что различные нуклеотиды, которые ранее считали "не встречающимися в природе", были впоследствии найдены в природе. Таким образом, термин "нуклеотиды" включает не только известные молекулы, содержащие пуриновые и пиримидиновые гетероциклы, но также и их гетероциклические аналоги и таутомеры. Иллюстративные примеры других типов нуклеотидов представляют собой молекулы, содержащие аденин, гуанин, тимин, цитозин, урацил, пурин, ксантин, диаминопурин, 8-оксо-N6-метиладенин, 7-деазаксантин, 7-деазагуанин, N4,N4-этаноцитозин, N6,N6-этано-2,6-диаминопурин, 5-метилцитозин, 5-(C3-C6)-алкинилцитозин, 5-фторурацил, 5-бромурацил, псевдоизоцитозин, 2-гидрокси-5-метил-4-триазолпиридин, изоцитозин, изогуанин, инозин и "не встречающиеся в природе" нуклеотиды, описанные в публикации Benner et al., Патент США №5432272. Термин "нуклеотид" распространяется на каждый и все из этих примеров, а также их аналоги и таутомеры. Особенно интересными нуклеотидами являются те из них, которые содержат аденин, гуанин, тимин, цитозин и урацил, которые рассматривают как встречающиеся в природе нуклеотиды, относительно терапевтического и диагностического применения у людей. Нуклеотиды содержат природные 2’-дезокси- и 2’-гидроксисахара, например, описанные в Kornberg and Baker, DNA Replication, 2nd Ed. (Freeman, San Francisco, 1992), a также их аналоги.
[0041] Термин "аналоги" в применении к нуклеотидам включает синтетические нуклеотиды, содержащие модифицированные основания и/или модифицированные сахара (см., например, аналоги, описанные, в основном, в Scheit, Nucleotide Analogs, John Wiley, New York, 1980; Freier & Altmann, (1997) Nucl. Acid. Res., 25(22), 4429-4443, Toulmé, J.J, (2001) Nature Biotechnology 19: 17-18; Manoharan M., (1999) Biochemica et Biophysica Acta 1489: 117-139; Freier S.M., (1997) Nucleic Acid Research, 25: 4429-4443, Uhlman, E., (2000) Drug Discovery & Development, 3: 203-213, Herdewin P., (2000) Antisense & Nucleic Acid Drug Dev., 10: 297-310); 2’-O, 3’-C-соединенные [3.2.0]бициклоарабинонуклеозиды. Такие аналоги включают синтетические нуклеотиды, направленные на усиление связывающих свойств, например, стабильности дуплексов или триплексов, специфичности и т.п.
[0042] В настоящей заявке термин "гибридизация" обозначает спаривание практически комплементарных цепей олигомерных соединений. Один механизм спаривания задействует образование водородных связей, которые могут представлять собой Уотсон-Криковские, Хугстиновские или обратные Хугстиновские водородные связи между комплементарными основаниями нуклеозидов или нуклеотидов (нуклеотидами) цепей олигомерных соединений. Например, аденин и тимин являются комплементарными нуклеотидами, которые спариваются за счет образования водородных связей. Гибридизация может происходить при различных условиях.
[0043] Антисмысловое соединение является "способным к специфичной гибридизации", если связывание указанного соединения с нуклеиновой кислотой-мишенью нарушает нормальное функционирование нуклеиновой кислоты-мишени, приводя к модулированию функции и/или активности, и степень комплементарности достаточна, чтобы избежать неспецифичного связывания указанного антисмыслового соединения с нуклеотидными последовательностями, не являющимися мишенями, в условиях, при которых необходимо специфичное связывание, т.е. в физиологических условиях в случае in vivo методик анализа или терапевтического воздействия и в условиях, при которых проводится анализ, в случае исследований in vitro.
[0044] В настоящей заявке фраза "строгие условия гибридизации" или "строгие условия" относится к условиям, при которых соединение согласно изобретению будет гибридизоваться со своей последовательностью-мишенью, но с минимальным количеством других последовательностей. Строгие условия зависят от последовательности и будут различаться в разных обстоятельствах и в контексте настоящего изобретения "строгие условия", при которых олигомерные соединения гибридизуются с последовательностью-мишенью, определяются природой и составом олигомерных соединений и видами анализов, посредством которых их исследуют. В общем случае, строгие условия гибридизации включают низкие концентрации (<0,15 M) солей, содержащих неорганические катионы, такие как Na++ или K++ (т.е. низкую ионную силу), температуру выше точки, расположенной на 20°C-25°C ниже Tпл комплекса, олигомерное соединение: последовательность-мишень и присутствие денатурантов, таких как формамид, диметилформамид, диметилсульфоксид или детергент додецилсульфат натрия (ДСН). Например, скорость гибридизации снижается на 1,1% на каждый добавленный 1% формамида. Примером условий гибридизации с высокой степенью строгости является гибридизация с применением 0,1X буфера хлорид натрия-цитрат натрия (SSC, стандартный цитратно-солевой)/0,1% (масс./об.) ДСН при 60°C в течение 30 минут.
[0045] В настоящей заявке термин "комплементарный" относится к способности точного спаривания между двумя нуклеотидами или одной или двумя олигомерными цепями. Например, если нуклеиновое основание в определенном положении цепи антисмыслового соединения способно к образованию водородных связей с нуклеиновым основанием в определенном положении цепи нуклеиновой кислоты-мишени, причем указанная нуклеиновая кислота-мишень представляет собой молекулу ДНК, РНК или олигонуклеотида, то положение, в котором происходит образование водородных связей между олигонуклеотидом и нуклеиновой кислотой-мишенью, считают комплементарным положением. Олигомерное соединение и дополнительная молекула ДНК, РНК или олигонуклеотида комплементарны друг другу, когда достаточное число комплементарных положений в каждой молекуле занято нуклеотидами, способными образовывать водородные связи друг с другом. Таким образом, термины "специфично гибридизующийся" и "комплементарный" применяют для обозначения достаточной степени точного спаривания, или комплементарности, в пределах достаточного числа нуклеотидов, так что между олигомерным соединением и нуклеиновой кислотой-мишенью происходит стабильное и специфичное связывание.
[0046] Как понимают специалисты в данной области техники, последовательность олигомерного соединения необязательно должна быть на 100% комплементарна последовательности его нуклеиновой кислоты-мишени для того, чтобы соединение было способно к специфичной гибридизации. Кроме того, олигонуклеотид может гибридизоваться поверх одного или более сегментов, так что промежуточные или соседние сегменты оказываются не вовлеченными в процесс гибридизации (например, петлевая структура, отсутствие комплементарности или шпилечная структура). Олигомерные соединения согласно настоящему изобретению содержат последовательность, комплементарную на по меньшей мере примерно 70%, или по меньшей мере примерно 75%, или по меньшей мере примерно 80%, или по меньшей мере примерно 85%, или по меньшей мере примерно 90%, или по меньшей мере примерно 95%, или по меньшей мере примерно 99% области-мишени в пределах нуклеотидной последовательности-мишени, на которую эти соединения нацелены. Например, антисмысловое соединение, в котором 18 из 20 нуклеотидов антисмыслового соединения комплементарны области-мишени и, следовательно, специфично гибридизовались бы с ним, характеризовалось бы 90% комплементарностью. В данном примере остальные некомплементарные нуклеотиды могут располагаться в кластерах комплементарных нуклеотидов или чередоваться с комплементарными нуклеотидами и необязательно должны примыкать друг к другу или к комплементарным нуклеотидам. По этой причине антисмысловое соединение длиной 18 нуклеотидов, содержащее 4 (четыре) некомплементарных нуклеотида, которые фланкированы двумя областями, полностью комплементарными нуклеиновой кислоте-мишени, в целом характеризовалось бы 77,8% комплементарностью с нуклеиновой кислотой-мишенью и попадало бы таким образом в рамки настоящего изобретения. Процент комплементарности антисмыслового соединения с областью нуклеиновой кислоты-мишени может быть определен обычным способом с применением программ BLAST (средства поиска основного локального выравнивания) и программ PowerBLAST, известных в данной области техники. Процент гомологии, идентичности последовательностей или комплементарности может быть определен с помощью, например, программы Gap (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, Madison Wis.) с применением параметров, установленных по умолчанию, которая использует алгоритм Смита-Ватермана (Adv. Appl. Math., (1981) 2, 482-489).
[0047] В настоящей заявке термин "температура плавления (Tпл)" относится к температуре, в условиях определенной ионной силы, рН и концентрации нуклеиновой кислоты, при которой 50% олигонуклеотидов, комплементарных последовательности-мишени, гибридизуются с последовательностью-мишенью в состоянии равновесия. Как правило, строгие условия гибридизации будут отличаться тем, что концентрация соли составляет по меньшей мере примерно от 0,01 до 1,0 М концентрации ионов Na (или других солей) при рН, равном 7,0-8,3, и температура равна по меньшей мере примерно 30°C для коротких олигонуклеотидов (например, длиной от 10 до 50 нуклеотидов). Строгие условия могут также быть достигнуты путем добавления дестабилизирующих агентов, таких как формамид.
[0048] В настоящей заявке термин "модулирование" обозначает либо увеличение (стимулирование), либо ослабление (ингибирование) экспрессии гена.
[0049] Термин "вариант", применительно к последовательности полинуклеотида, может охватывать последовательность полинуклеотида, относящегося к гену дикого типа. Это определение может также включать, например, "аллельные", "сплайс-", "видовые" или "полиморфные" варианты. Сплайс-вариант может быть в значительной степени идентичным исходной молекуле, но будет в общем случае содержать большее или меньшее число полинуклеотидов вследствие альтернативного сплайсинга экзонов во время процессинга мРНК. Соответствующий полипептид может обладать дополнительными функциональными доменами или отличаться отсутствием доменов. Видовые варианты представляют собой последовательности полинуклеотидов, которые варьируют от одного вида к другому. Особенно полезными согласно настоящему изобретению являются варианты продуктов генов дикого типа. Варианты могут возникнуть в результате по меньшей мере одной мутации в нуклеотидной последовательности и могут приводить к появлению измененных мРНК или полипептидов, структура или функция которых могут быть или могут не быть изменены. Любой отдельно взятый природный или рекомбинантный ген может не иметь или иметь одну или много аллельных форм. Обычные мутационные изменения, вызывающие возникновение вариантов, в общем случае приписывают природным делениям, вставкам или заменам нуклеотидов. Каждый из этих типов изменений может произойти отдельно или в комбинации с остальными типами один или более раз в данной последовательности.
[0050] Итоговые полипептиды в общем случае будут характеризоваться значительной идентичностью аминокислотных последовательностей относительно друг друга. Полиморфный вариант представляет собой вариацию в полинуклеотидной последовательности конкретного гена между отдельными особями данного вида. Полиморфные варианты также могут охватывать "одиночные нуклеотидные полиморфизмы" (ОНП), или мутации, затрагивающие одно основание, при которых полинуклеотидная последовательность изменяется на одно основание. Наличие ОНП может указывать на, например, некоторую популяцию со склонностью к болезненному состоянию, что отражает восприимчивость против устойчивости.
[0051] Производные полинуклеотиды включают нуклеиновые кислоты, подвергнутые химической модификации, например замещению водорода на алкил, ацил или аминогруппу. Производные, например производные олигонуклеотиды, могут содержать не встречающиеся в природе фрагменты, такие как измененные остатки сахаров или связи между остатками сахаров. Типовыми среди них являются фосфотиоатные и другие содержащие серу виды связей, которые известны в данной области техники. Производные нуклеиновые кислоты могут также содержать метки, включая радионуклеотиды, ферменты, флуоресцентные агенты, хемилюминесцентные агенты, хромогенные агенты, субстраты, кофакторы, ингибиторы, магнитные частицы и т.п.
[0052] "Производным" полипептидом или пептидом является тот, который модифицирован, например, посредством гликозилирования, пегилирования, фосфорилирования, сульфатирования, восстановления/алкилирования, ацилирования, химического сочетания или мягкой обработки формалином. Производное может также быть модифицировано добавлением детектируемой метки либо напрямую, либо косвенно, включая, но без ограничения, радиоизотопную, флуоресцентную и ферментативную метку.
[0053] В настоящей заявке термин "животное" или "пациент" включает, например, людей, овцу, лосей, оленя, чернохвостого оленя, норок, млекопитающих, обезьян, лошадей, крупный рогатый скот, свиней, коз, собак, кошек, крыс, мышей, птиц, курицу, пресмыкающихся, рыбу, насекомых и паукообразных.
[0054] Термин "млекопитающее" распространяется на теплокровных млекопитающих, которым, как правило, оказывают медицинскую помощь (например, люди и одомашненные животные). Примеры включают кошачьих, псовых, лошадиных, бычьих, и человека, а также только человека.
[0055] Термин "лечение" распространяется на лечение болезненного состояния у млекопитающего и включает: (а) предотвращение возникновения болезненного состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к болезненному состоянию, но оно еще не было диагностировано у субъекта; (b) ингибирование болезненного состояния, например остановку его развития; и/или (с) облегчение болезненного состояния, например индукцию ремиссии болезненного состояния, до тех пор, пока не будет достигнут желаемый результат. Лечение также включает уменьшение интенсивности симптома заболевания (например, уменьшение боли или дискомфорта), при этом такое уменьшение интенсивности симптомов может напрямую влиять или не влиять на заболевание (например, причину, передачу, проявление и т.д.).
[0056] В настоящей заявке термин "рак" относится ко всем типам рака, или новообразований, или злокачественных опухолей, обнаруженных у млекопитающих, включая, но без ограничения: лейкемии, лимфомы, меланомы, карциномы и саркомы. Рак проявляется в виде "опухоли" или ткани, содержащей злокачественные раковые клетки. Примеры опухолей включают саркомы и карциномы, такие как, но без ограничения: фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома, хондрома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэцдотелиосаркома, синовиома, мезотелиома, саркома Юинга, лейомиосаркома, рабдомиосаркома, карцинома толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточная карцинома, базальноклеточная карцинома, аденокарцинома, карцинома потовых желез, карцинома сальной железы, папиллярная карцинома, папиллярные аденокарциномы, цистадепокарцинома, медуллярная карцинома, бронхогенная карцинома, почечно-клеточная карцинома, гепатома, карцинома желчного протока, хориокарцинома, семинома, эмбриональная карцинома, опухоль Вильмса, рак шейки матки, опухоль яичка, карцинома легкого, мелкоклеточная карцинома легкого, карцинома мочевого пузыря, эпителиальная карцинома, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, неврома слухового нерва, олигодендроглиома, менингиома, меланома, нейробластома и ретинобластома. Дополнительные виды рака, которые можно лечить с применением предложенной композиции согласно изобретению, включают, но без ограничения, например, болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, нейробластому, рак молочной железы, рак яичника, рак легкого, рабдомиосаркому, первичный тромбоцитоз, первичную макроглобулинемию, мелкоклеточные опухоли легкого, первичные опухоли мозга, рак желудка, рак толстой кишки, злокачественную инсулиному поджелудочной железы, злокачественный карциноид, рак мочевого пузыря, рак желудочно-кишечного тракта, предраковые заболевания кожи, рак яичка, лимфомы, рак щитовидной железы, нейробластому, рак пищевода, рак мочеполового тракта, злокачественную гиперкальциемию, рак шейки матки, рак эндометрия, рак коры надпочечников и рак предстательной железы.
[0057] В настоящей заявке термин "неврологическое заболевание или расстройство" относится к любому заболеванию или расстройству нервной системы и/или зрительной системы. "Неврологическое заболевание или расстройство" включает заболевание или расстройства, которые затрагивают центральную нервную систему (мозг, ствол мозга и мозжечок), периферическую нервную систему (включая черепные нервы) и вегетативную нервную систему (части которой находятся и в центральной, и в периферической нервной системе). Неврологическое заболевание или расстройство включает, но без ограничения, приобретенную эпилептиформную афазию; острый диссеминированный энцефаломиелит; адренолейкодистрофию; возрастную макулярную дегенерацию; агенезию мозолистого тела; агнозию; синдром Айкарди; болезнь Александера; болезнь Альпера; альтернирующую гемиплегию; болезнь Альцгеймера; сосудистую деменцию; боковой амиотрофический склероз; анэнцефалию; синдром Ангельмана; ангиоматоз; аноксию; афазию; апраксию; арахпоидальные кисты; арахноидит; мальформацию Арнольда-Киари; артериовенозную мальформацию; синдром Аспергера; атаксию-телеангиэктазию; синдром дефицита внимания и гиперактивности; аутизм; вегетативную дисфункцию; боль в спине; болезнь Баттена; болезнь Бехчета; паралич Белла; доброкачественный эссенциальный блефароспазм; доброкачественную фокальную эпилепсию; амиотрофию; доброкачественную внутричерепную гипертензию; болезнь Бинсвангера; блефароспазм; синдром Блоха-Сульцбергера; повреждение плечевого сплетения; абсцесс мозга; травму головного мозга; опухоли мозга (включая мультиформную глиобластому); опухоль спинного мозга; синдром Броун-Секара; болезнь Канавана; синдром запястного канала; каузалгию; центральный болевой синдром; центральный понтинный миелинолиз; цефалический синдром; аневризму сосудов головного мозга; церебральный артериосклероз; церебральную атрофию; церебральный гигантизм; церебральный паралич; болезнь Шарко-Мари-Тута; невропатию и невропатическую боль, вызванные химиотерапией; мальформацию Киари; хорею; хроническую воспалительную демиелинизирующую полинейропатию; хроническую боль; хронический региональный болевой синдром; синдром Коффина-Лоури; кому, включающую устойчивое вегетативное состояние; врожденную лицевую диплегию; кортикобазальную дегенерацию; височный артериит; краниосиностоз; болезнь Крейтцфельдта-Якоба; кумулятивные травматические расстройства; синдром Кушинга; инклюзионную цитомегалию; цитомегаловирусную инфекцию; синдром танцующих глаз-танцующих ног; синдром Денди-Уокера; болезнь Доусона; синдром Де Морсье; паралич Дежерин-Клюмпке; демепцию; дерматомиозит; диабетическую нейропатию; диффузный склероз; вегетативную дистонию; дисграфию; дислексию; дистонию; раннюю инфантильную эпилептическую энцефалопатию; синдром пустого турецкого седла; энцефалит; энцефалоцеле; энцефалотригеминальный ангиоматоз; эпилепсию; паралич Эрба; эссенциальный тремор; болезнь Фабри; синдром Фара; потерю сознания; семейный спастический паралич; фебрильные судороги; синдром Фишера; атаксию Фридрейха; лобно-височную деменцию и другие "таупатии"; болезнь Гоше; синдром Герстманна; гигантоклеточный артериит; гигантоклеточную инклюзионную болезнь; глобоидно-клеточную лейкодистрофию; синдром Гийена-Барре; HTLV-1-ассоциированную миелопатию (миелопатию, ассоциированную с вирусом T-клеточного лейкоза человека); болезнь Галлервордена-Шпатца; травму головы; головную боль; гемифациальный спазм; наследственную спастическую параплегию; наследственную полипевропатическую атаксию; синдром коленчатого узла; опоясывающий лишай; синдром Хираямы; ВИЧ-ассоциированные деменцию и нейропатию (также неврологические проявления СПИДа); голопрозэнцефалию; болезнь Хантингтона и другие заболевания, обусловленные наличием полиглутаминовых повторов; гидроанэнцефалию; гидроцефалию; гиперкортицизм; гипоксию; иммуноопосредованный энцефаломиелит; миозит с включениями телец; недержание пигмента; инфантильную форму болезни накопления фитановой кислоты; инфантильную болезнь Рефсума; инфантильные спазмы; воспалительную миопатию; внутричерепную кисту; внутричерепную гипертензию; синдром Жубера; синдром Кернса-Сейра; болезнь Кеннеди; синдром Kinsboume; синдром Клиппеля-Фейля; болезнь Краббе; болезнь Кугельберга-Веландер; куру; болезнь Лафора; миастенический синдром Ламберта-Итона; синдром Ландау-Клеффнера; боковой медуллярный синдром (синдром Валленберга); необучаемость; болезнь Лея; синдром Леннокса-Гасто; синдром Леша-Нихена; лейкодистрофию; деменцию с тельцами Леви; лиссэнцефалию; синдром окружения; болезнь Лу Герига (например, болезнь двигательных нейронов, или боковой амиотрофический склероз); заболевание поясничных дисков; болезнь Лайма - неврологические осложнения; болезнь Мачадо-Джозефа; макроэнцефалию; мегацефалию; синдром Мелькерссона-Розенталя; болезнь Меньера; менингит; болезнь Менкеса; метахроматическую лейкодистрофию; микроцефалию; мигрень; синдром Миллера-Фишера; мини-инсульты; митохондриальные миопатии; синдром Мебиуса; мономелическую амиотрофию; болезнь двигательных нейронов; болезнь мойя-мойя; мукополисахаридозы; мультиинфарктную деменцию; моторную мультифокальную невропатию; рассеянный склероз и другие демиелинизирующие расстройства; множественную системную атрофию с ортостатической гипотензией; мышечную дистрофию; тяжелую псевдопаралитическую миастению; диффузный миелинокластический склероз; раннюю миоклоническую энцефалопатию; миоклонус; миопатию; врожденную миотонию; нарколепсию; нейрофиброматоз; злокачественный нейролептический синдром; неврологические проявления СПИДа; неврологические осложнения после волчанки; нейромиотонию; нейрональный цероидный липофусциноз; нарушения миграции нейронов; болезнь Ниманна-Пика; синдром O’Салливана-МакЛауда; затылочную невралгию; скрытую дизрафию спинного мозга; синдром Охтахара; оливопонтоцеребеллярную атрофию; опсоклонус-миоклонус синдром; неврит зрительного нерва; ортостатическую гипотензию; синдром перегрузки; парестезию; нейродегенеративное заболевание или расстройство (болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера, боковой амиотрофический склероз (БАС), деменцию, рассеянный склероз и другие заболевания и расстройства, связанные с гибелью нейронов); врожденную парамиотонию; паранеопластические заболевания; пароксизмальные приступы; синдром Парри-Ромберга; болезнь Пелицеуса-Мерцбахера; периодические параличи; периферическую нейропатию; болезненную нейропатию и нейропатическую боль; устойчивое вегетативное состояние; первазивные расстройства развития; световой рефлекс чихания; болезнь накопления фитановой кислоты; болезнь Пика; защемление нерва; опухоли гипофиза; полимиозит; порэнцефалию; постполиомиелитный синдром; постгерпетическую невралгию; постинфекционный энцефаломиелит; ортостатическую гипотензию; синдром Прадера-Вилли; первичный боковой склероз; прионные заболевания; прогрессирующую гемифациальную атрофию; прогрессирующую многоочаговую лейкоэнцефалопатию; прогрессирующую склерозирующую полиодистрофию; прогрессирующий надъядерный паралич; доброкачественную внутричерепную гипертензию; синдром Рамсея-Ханта (типы I и II); энцефалит Расмуссена; синдром рефлекторной симпатической дистрофии; болезнь Рефсума; повторяющиеся расстройства движения; туннельный синдром; синдром беспокойных ног; миелопатию, ассоциированную с ретровирусной инфекцией; синдром Ретта; синдром Рейе; пляску Святого Витта; болезнь Сандхоффа; болезнь Шильдера; шизэнцефалию; септо-оптическую дисплазию; синдром детского сотрясения; опоясывающий лишай; синдром Шая-Дрейджера; синдром Шегрена; апноэ во сне; синдром Сотоса; спастичность; расщепленный позвоночник; повреждение спинного мозга; опухоли спинного мозга; спинальную мышечную атрофию; синдром мышечной скованности; инсульт; синдром Стерджа-Вебера; подострый склерозирующий панэнцефалит; подкорковую атеросклеротическую энцефалопатию; хорею Сиденгама; обмороки; сирингомиелию; позднюю дискинезию; болезнь Тея-Сакса; височный артериит; синдром фиксированного спинного мозга; болезнь Томсена; синдром верхней апертуры грудной клетки; невралгию тройничного нерва; паралич Тодда; синдром Туретта; транзиторную ишемическую атаку; трансмиссивные спонгиоформные энцефалопатии; поперечный миелит; черепно-мозговую травму; тремор; тригеминальную невралгию; тропический спастический парапарез; туберозный склероз; сосудистую деменцию (мультиинфарктную деменцию); васкулит, в том числе височный артериит; болезнь Гиппеля-Линдау; синдром Валленберга; болезнь Верднига-Гоффмана; синдром Веста; хлыстовую травму; синдром Вильямса; болезнь Вильсона и синдром Цельвегера.
[0058] "Сердечно-сосудистое заболевание или расстройство" включает, но без ограничения, заболевания и состояния, ассоциированные с нарушенным кровотоком и/или нарушенной функцией сердца. Такие заболевания или состояния включают хроническую сердечную недостаточность, инфаркт миокарда и любую другую болезнь, связанную с нарушениями работы сердца.
[0059] "Воспалительное заболевание или состояние" включает, но без ограничения, заболевания или состояния, которые приводят к воспалению в качестве симптома такого заболевания или состояния.
[0060] "Легочное заболевание или расстройство" включает, но без ограничения, заболевания и состояния, ассоциированные с нарушенной функцией легких.
[0061] "Пролиферативное заболевание или расстройство" включает, но без ограничения, гемопоэтические неопластические расстройства с участием гиперпластических/неопластических клеток гемопоэтического происхождения, возникающих из миелоидных, лимфоидных или эритроидных ростков или их клеток-предшественников. Эти заболевания включают, но без ограничения, эритробластный лейкоз, острый промиелоцитарный лейкоз (ОПЛ), хронический миелоидный лейкоз (ХМЛ), злокачественные лимфомы, включая, но без ограничения, острый лимфобластный лейкоз (ОЛЛ), который включает B-клеточный ОЛЛ и T-клеточный ОЛЛ, хронический лимфоцитарный лейкоз (ХЛЛ), пролимфоцитарный лейкоз (ПЛЛ), волосатоклеточный лейкоз (ВКЛ) и макроглобулинемию Вальденстрема (MB). Дополнительные формы злокачественных лимфом включают, но без ограничения, неходжкинскую лимфому и ее варианты, периферические T-клеточные лимфомы, T-клеточный лейкоз-лимфому взрослых (ATL), кожную T-клеточную лимфому (КТКЛ), крупногранулярный лимфоцитарный лейкоз (LGF), болезнь Ходжкина и болезнь Рид-Штернберга.
[0062] Настоящее изобретение включает способ лечения любого из заболеваний или состояний, указанных выше, с применением олигонуклеотида согласно изобретению. Настоящее изобретение относится к применению олигонуклеотида, который нацелен на природный антисмысловой транскрипт изоформы мРНК гена DLG, для получения лекарственного препарата для лечения заболевания или состояния, ассоциированного с аномальной экспрессией гена DLG.
Полинуклеотидные и олигонуклеотидные композиции и молекулы
[0063] Мишени: В одном варианте реализации мишени включают нуклеотидные последовательности гена DLG и его изоформ, включая, без ограничения, смысловые и/или антисмысловые некодирующие и/или кодирующие последовательности, связанные с геном DLG. Предпочтительной экспрессионной мишенью является ген DLG1. В предпочтительном варианте реализации настоящее изобретение относится к природным антисмысловым транскриптам для мРНК семейства генов DLG и олигонуклеотидам длиной от примерно 5 до примерно 30 нуклеотидов, которые нацелены на указанные природные антисмысловые транскрипты и по меньшей мере частично комплементарны им.
[0064] Человеческий гомолог гена Drosophila Discs large (Dig1) представляет собой ассоциированную с мембраной гуанилаткиназу (membrane-associated guanylate kinase, MAGUK), обнаруженную в постсинаптических уплотнениях в центральной нервной системе. Киназа Dig1 была вовлечена в формирование плотных контактов, в полярность эпителиальных клеток и в контроль пролиферации имагинальных дисков Drosophila. Белок состоит из N-концевого богатого пролином домена, нескольких PDZ-доменов, SH3-домена, HOOK-домена, i3-домена и подобного гуапилаткиназе (GK) домена.
[0065] Ассоциированные с мембраной гуанилаткиназы (MAGUK) имеют важное значение для организации ионных каналов и рецепторов в нейронных синапсах и плотных контактах. Киназы MAGUK экспрессируются в кардиомиоцитах и, в частности, синапс-ассоциированный белок 97 (SAP97) обнаружен на уровне интеркалированных дисков в предсердном и желудочковом миокарде, где он солокализуется с каналами Kv1.5. Кроме того, субъединицы сердечных белков SAP97 и Kv1.5 были копреципитированы, что позволяет предположить прямое взаимодействие между двумя указанными белками. Сильное взаимодействие между белками SAP97 и Kv1.5 было продемонстрировано с применением белковых микроанализов и количественного измерения поляризации флуоресценции для характеристики селективности связывания PDZ-доменов. Однако непрямые взаимодействия посредством N-концевой части канала или с участием вторичных мессенджеров также возможны. Независимо от характера взаимодействия между двумя белками все исследования сходятся на том, что коэкспрессия субъединиц белков SAP97 и Kv1.5 приводит к увеличенному направленному наружу калиевому току в гетерологичных системах. Ассоциированные с мембраной гуанилаткиназы (MAGUK) являются важными партнерами для организации нескольких ионных каналов. Белок SAP97, относящийся к киназам MAGUK, обильно экспрессируется в миокарде и взаимодействует с потенциалзависимыми каналами типа Shaker Kv1.5 и Кir. Как и в других тканях, белок SAP97 может регулировать направление сердечных ионных каналов в сарколемму. Действительно, в неонатальных миоцитах крысы сверхэкспрессия белка SAP97 вызывает кластеризацию и иммобилизацию каналов Kv1.5 в плазматической мембране и увеличивает соответствующий ток.
В одном варианте реализации антисмысловые олигонуклеотиды применяют для предотвращения или лечения заболеваний или расстройств, ассоциированных с членами семейства генов DLG1. Типовые заболевания и расстройства, опосредованные геном DLG1, которые можно лечить с помощью олигонуклеотидов согласно изобретению и/или с помощью клеток/тканей, регенерированных из стволовых клеток, полученных с применением антисмысловых соединений, включают: заболевание или расстройство, ассоциированное с аномальными функцией и/или экспрессией гена DLG1, рак, заболевание или состояние, ассоциированное с или характеризуемое пролиферацией клеток, заболевание или расстройство, вызываемое онкогенным вирусом человека, заболевание или расстройство, ассоциированное со спецификацией судьбы клеток, заболевание или расстройство, ассоциированное с нарушенной клеточной супрессией, развитие опухолевых заболеваний глаз, карциному протоков, неоплазию шейки матки, злокачественную фиброзную гистиоцитому, заболевание или расстройство, ассоциированное с мутантным вариантом или аберраптной экспрессией или функцией гена DLG1, заболевание или расстройство, ассоциированное с дефектом клеточного цикла, заболевание или расстройство, ассоциированное с дисфункциональным соединением PDZ-доменов, заболевание или расстройство, ассоциированное с нарушенной активацией Т-клеток, заболевание или расстройство иммунной системы, инфицирование вирусом иммунодефицита человека-1, нарушенную аксональную стимуляцию миелинизации нервов, нарушенную миелинизацию нервов, нарушенный гомеостаз мембран в миелинизации шванновских клеток, неврологическое заболевание или расстройство, шизофрению, болезнь Паркинсона, умственную отсталость, аутизм, болезнь Шарко-Мари-Тута, заболевание, или расстройство, или состояние, ассоциированное с нарушенной регуляцией сердечных каналов Kv4 и Kv1.5, заболевание, или расстройство, или состояние, ассоциированное с нарушенными транспортом и внедрением глутаматного рецептора 1 (GluR1) в синапсы клеток CF/Пуркинье, заболевание, или расстройство, или состояние, ассоциированное с нарушенным синаптогенезом, заболевание, или расстройство, или состояние, ассоциированное с нарушенной функцией синапсов, заболевание, или расстройство, или состояние, ассоциированное с пониженной синаптической силой, повреждение сетчатки, заболевание или расстройство, ассоциированное с дифференцировкой кератиноцитов и/или заживлением ран, заболевание, или расстройство, или состояние, ассоциированное с нарушенным графиком трансмембранных рецепторов из ЭР в плазматическую мембрану, нарушенное развитие урогецитального тракта, гидронефроз, аномалию мочевыводящих путей, заболевание, или расстройство, или состояние, ассоциированное с нарушенной ориентацией гладких мышц, заболевание, или расстройство, или состояние, ассоциированное с поврежденными компонентами нервно-мышечного соединения, включающими скелетные мышцы и двигательные нейроны, заболевание или расстройство почек и волчью пасть. Как указано в процитированном источнике ниже, развитие гамет требует координированного взаимодействия сома-зародышевая линия, которое обеспечивает обновление и дифференцировку клеток зародышевой линии и соматических стволовых клеток. Авторы этой публикации утверждают, что физический контакт между популяциями клеток зародышевой линии и соматических клеток является ключевым, поскольку он допускает обмен способными к распространению сигналами между ними. Авторы также утверждают, что ген-супрессор опухолевого роста DLG кодирует септировапный соединительный белок с функциями, относящимися к полярности эпителиальных клеток, асимметричному делению нейробластов и формированию нервно-мышечных соединений. Последние публикации предлагают новую роль белка DLG в семенниках Drosophila, так как мутации в гене DLG приводят к дефектам семенников и гибели клеток. Белок DLG необходим на протяжении всего сперматогенеза в соматической линии, и его локализация изменяется от равномерного распределения вдоль плазматической мембраны соматических клеток в верхнем отделе семенников до ограниченной локализации на дистально расположенных соматических клетках в растущих цистах. Крупные дефекты в семенниках при мутациях в гене DLG подчеркивают важность соматических клеток для установления и сохранения ниши стволовых клеток самцов и дифференцировки соматических клеток. Это несомненно может также относиться к клеткам млекопитающих, и, таким образом, увеличение экспрессии гена DLG благоприятно при заболеваниях или состояниях, ассоциированных с нарушенными функцией ниши стволовых клеток самцов и дифференцировкой соматических клеток. См. http://www.ncbl.nlm.nlh.gov/pubmed/20798604.
[0066] В вариантах реализации настоящего изобретения терапевтические и/или косметические режимы и связанные с ними индивидуальные способы лечения предложены субъектам, нуждающимся в лечении (лечениях) тканей, например лечениях кожи и т.п., или находящимся в группе риска развития состояний, при которых они бы нуждались в восстановлении тканей или омолаживании, например лечениях кожи. Диагноз может быть поставлен, например, на основе статуса субъекта по гену DLG1. Уровни экспрессии гена DLG1 у пациента в данных ткани/органе, таких как кожа, мышцы, мозг, спинной мозг, щитовидная железа, поджелудочная железа, легкие, сердце или нервно-мышечные соединения, могут быть определены посредством методов, известных специалистам в данной области техники и описанных в тексте настоящей заявки, например, путем анализа тканей с применением ПЦР или посредством методов, основанных на детекции антителами.
[0067] В одном варианте реализации модулирование гена DLG с помощью одного или более антисмысловых олигонуклеотидов представляет собой введение последних пациенту, нуждающемуся в этом, для предотвращения или лечения любого заболевания или расстройства, связанного с аномальными экспрессией, функцией, активностью белка DLG по сравнению с нормальным контролем.
[0068] В одном варианте реализации олигонуклеотиды специфичны для полинуклеотидов гена DLG1, которые содержат, без ограничения, некодирующие области. Мишени гена DLG1 включают варианты гена DLG1; мутанты гена DLG1, в том числе ОНП; некодирующие последовательности гена DLG1; аллели, фрагменты и т.п. Предпочтительно, олигонуклеотид представляет собой молекулу антисмысловой РНК.
[0069] В соответствии с вариантами реализации изобретения молекула нуклеиновой кислоты-мишени не ограничивается исключительно полинуклеотидами DLG1, но распространяется на любые из изоформ, рецепторов, гомологов, некодирующих областей гена DLG1 и т.п.
[0070] В одном варианте реализации олигонуклеотид нацелен на природную антисмысловую последовательность (природную антисмысловую последовательность для кодирующих и некодирующих областей) для мишеней DLG1, включая, без ограничения, варианты, аллели, гомологи, мутанты, производные, фрагменты и последовательности, которые представляют собой их комплемент. Предпочтительно, олигонуклеотид представляет собой молекулу антисмысловой РНК или ДНК.
[0071] В одном варианте реализации олигомерные соединения согласно настоящему изобретению также включают варианты, в которых разные основания находятся в одном или более нуклеотидных положениях в соединении. Например, если первый нуклеотид представляет собой аденин, то могут быть получены варианты, содержащие тимидин, гуанозин, цитидин или другие природные или неприродные нуклеотиды в этом положении. Это может быть выполнено в любой из позиций антисмыслового соединения. Эти соединения далее исследуют, применяя способы, описанные в настоящей заявке, с целью определения их способности ингибировать экспрессию нуклеиновой кислоты-мишени.
[0072] В некоторых вариантах реализации гомология, идентичность последовательностей или комплементарность между антисмысловым соединением и мишенью составляет от примерно 50% до примерно 60%. В некоторых вариантах реализации гомология, идентичность последовательностей или комплементарность составляет от примерно 60% до примерно 70%. В некоторых вариантах реализации гомология, идентичность последовательностей или комплементарность составляет от примерно 70% до примерно 80%. В некоторых вариантах реализации гомология, идентичность последовательностей или комплементарность составляет от примерно 80% до примерно 90%. В некоторых вариантах реализации гомология, идентичность последовательностей или комплементарность составляет примерно 90%, примерно 92%, примерно 94%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99% или примерно 100%.
[0073] Антисмысловое соединение является способным к специфичной гибридизации, если связывание указанного соединения с нуклеиновой кислотой-мишенью нарушает нормальное функционирование нуклеиновой кислоты-мишени, приводя к потере активности, и степень комплементарности достаточна, чтобы избежать неспецифичного связывания указанного антисмыслового соединения с нуклеотидными последовательностями, не являющимися мишенями, в условиях, при которых необходимо специфичное связывание. Такие условия включают, например, физиологические условия в случае in vivo методик анализа или терапевтического воздействия и условия, при которых проводится анализ, в случае исследований in vitro.
[0074] Антисмысловое соединение, будь то ДНК, РНК, химерное соединение, замещенное соединение и т.д., способно к специфичной гибридизации, когда связывание соединения с молекулой ДНК- или РНК-мишени нарушает нормальное функционирование ДНК- или РНК-мишени, приводя к потере функции, и степень комплементарности достаточна, чтобы избежать неспецифичного связывания указанного антисмыслового соединения с последовательностями, не являющимися мишенями, в условиях, при которых необходимо специфичное связывание, т.е. при физиологических условиях в случае in vivo методик анализа или терапевтического воздействия и условиях, при которых проводится анализ, в случае исследований in vitro.
[0075] В одном варианте реализации нацеленное воздействие на ген DLG1, включающее, без ограничения, антисмысловые последовательности, идентифицируемые и раскрываемые с применением, например, ПЦР, гибридизации и т.д., одну или несколько последовательностей, соответствующих SEQ ID NOS: 2, и т.п., модулирует экспрессию или функцию гена DLG1. В одном варианте реализации экспрессия или функция увеличиваются по сравнению с контролем. В одном варианте реализации экспрессия или функция подавляются по сравнению с контролем.
[0076] В одном варианте реализации олигонуклеотиды содержат нуклеотидные последовательности, соответствующие SEQ ID NOS: 3-12, включая антисмысловые последовательности, идентифицируемые и раскрываемые с применением, например, ПЦР, гибридизации и т.д. Эти олигонуклеотиды могут содержать один или более модифицированных нуклеотидов, более короткие или более длинные фрагменты, модифицированные связи и т.п.. Примеры модифицированных связей или межнуклеотидных связей включают фосфотиоатные, фосфодитиоатные связи и т.п. В одном варианте реализации нуклеотиды содержат фосфатное производное. Фосфатное производное (или модифицированная фосфатная группа), которое может быть присоединено к остатку сахара или аналогу остатка сахара в модифицированных олигонуклеотидах согласно настоящему изобретению, может представлять собой монофосфат, дифосфат, трифосфат, алкилфосфат, алканфосфат, фосфотиоат и т.п. Получение указанных выше аналогов фосфата и их включение в состав нуклеотидов, модифицированных нуклеотидов и олигонуклеотидов, по сути, также известно и необязательно должно быть описано в настоящей заявке.
[0077] Специфичность и чувствительность антисмысловой последовательности также используются специалистами в данной области техники для терапевтического применения. Антисмысловые олигонуклеотиды были применены в качестве терапевтических агентов для лечения болезненных состояний у животных и человека. Антисмысловые олигонуклеотиды были безопасно и эффективно введены людям, и многочисленные клинические испытания в настоящее время находятся в стадии реализации. Таким образом установлено, что олигонуклеотиды могут представлять собой подходящие терапевтические средства, которые могут быть сконфигурированы так, чтобы подходить к режимам лечения для обработки клеток, тканей и животных, особенно людей.
[0078] В вариантах реализации настоящего изобретения олигомерные антисмысловые соединения, в частности олигонуклеотиды, связываются с молекулами нуклеиновых кислот-мишеней и модулируют экспрессию и/или функцию молекул, кодируемых геном-мишенью. Затрагиваемые функции ДНК включают, например, репликацию и транскрипцию. Затрагиваемые функции РНК включают все жизненно важные функции, такие как, например, транслокация РНК к месту трансляции белков, трансляция белков на матрице РНК, сплайсинг РНК с образованием одного или более видов мРНК и каталитическая активность, которая может присутствовать у РНК или которой РНК может способствовать. Функции могут быть усилены или ингибированы в зависимости от желаемых функций.
[0079] Антисмысловые соединения включают антисмысловые олигомерные соединения, антисмысловые олигонуклеотиды, олигонуклеотиды внешней направляющей последовательности (EGS), сплайс-варианты, праймеры, зонды и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени. Сами по себе эти соединения могут быть введены в форме одноцепочечных, двухцепочечных, частично одноцепочечных или кольцевых олигомерных соединений.
[0080] Нацеливание антисмыслового соединения на молекулу конкретной нуклеиновой кислоты, в контексте настоящего изобретения, может представлять собой многоступенчатый процесс. Процесс обычно начинается с идентификации нуклеиновой кислоты-мишени, функция которой подлежит модулированию. Эта нуклеиновая кислота-мишень может являться, например, клеточным геном (или мРНК, транскрибируемой на матрице гена), экспрессия которого связана с конкретным расстройством или болезненным состоянием, или молекулой нуклеиновой кислоты из инфекционного агента. Согласно настоящему изобретению нуклеиновая кислота-мишень кодирует ген DLG1.
[0081] Процесс нацеливания обычно также включает определение по меньшей мере одной области-мишени, сегмента или сайта в пределах нуклеиновой кислоты-мишени для того, чтобы антисмысловое взаимодействие могло произойти, так что желаемый эффект, например модулирование экспрессии, будет достигнут. В контексте настоящего изобретения термин "область" определяют как часть нуклеиновой кислоты-мишени, имеющую по меньшей мере одну поддающуюся идентификации структуру, функцию или характеристику. Внутри областей нуклеиновых кислот-мишеней находятся сегменты. "Сегменты" определяют как меньшие области или части областей в пределах нуклеиновой кислоты-мишени. "Сайты" в настоящем изобретении определяют как позиции в пределах нуклеиновой кислоты-мишени.
[0082] В одном варианте реализации антисмысловые олигонуклеотиды связываются с природными антисмысловыми последовательностями гена DLG1 и модулируют экспрессию и/или функцию гена DLG1 (соответствующего SEQ ID NO: 1). Примеры антисмысловых последовательностей включают последовательности, соответствующие SEQ ID NOS: 2.
[0083] В одном варианте реализации антисмысловые олигонуклеотиды связываются с одним или более сегментами полинуклеотидов DLG1 и модулируют экспрессию и/или функцию гена DLG1. Сегменты содержат по меньшей мере пять последовательных нуклеотидов смысловых или антисмысловых полинуклеотидов DLG1.
[0084] В одном варианте реализации антисмысловые олигонуклеотиды специфичны к природным антисмысловым последовательностям для гена DLG1, при этом связывание олигонуклеотидов с природными антисмысловыми последовательностями для гена DLG1 модулирует экспрессию и/или функцию гена DLG1.
[0085] В одном варианте реализации олигонуклеотидные соединения содержат последовательности, соответствующие SEQ ID NOS: 3-12, антисмысловые последовательности, идентифицируемые и раскрываемые с применением, например, ПЦР, гибридизации и т.д. Эти олигонуклеотиды могут содержать один или более модифицированных нуклеотидов, более короткие или более длинные фрагменты, модифицированные связи и т.п. Примеры модифицированных связей или межнуклеотидных связей включают фосфотиоатные, фосфодитиоатные связи и т.п. В одном варианте реализации нуклеотиды содержат фосфатное производное. Фосфатное производное (или модифицированная фосфатная группа), которое может быть присоединено к остатку сахара или аналогу остатка сахара в модифицированных олигонуклеотидах согласно настоящему изобретению, может представлять собой монофосфат, дифосфат, трифосфат, алкилфосфат, алканфосфат, фосфотиоат и т.п. Получение указанных выше аналогов фосфата и их включение в состав нуклеотидов, модифицированных нуклеотидов и олигонуклеотидов, по сути, также известно и необязательно должно быть описано в настоящей заявке.
[0086] Поскольку, как известно в данной области техники, инициаторный кодон представляет собой, как правило, 5’-AUG (в транскрибируемых молекулах мРНК; 5’-ATG в соответствующей молекуле ДНК), инициаторный кодон также часто называют "AUG кодон", "старт-кодон" или "AUG старт-кодон". Меньшая часть генов имеет инициаторный кодон, содержащий последовательность РНК 5’-GUG, 5’-UUG или 5’-CUG; и 5’-AUA, 5’-ACG и 5’-CUG, как было показано, функционируют in vivo. Таким образом, термин "инициаторный кодон" и "старт-кодон" может охватывать множество последовательностей кодонов, хотя инициаторная аминокислота в каждом случае представляет собой, как правило, метионин (у эукариот) или формилметионин (у прокариот). Эукариотические и прокариотические гены могут содержать два или более альтернативных старт-кодона, любой из которых может быть предпочтительно использован для инициации трансляции в конкретном типе клеток или ткани, или при конкретном наборе условий. В контексте настоящего изобретения, "старт-кодор" и "инициаторный кодон" относятся к кодону или кодонам, которые используются in vivo для инициации трансляции мРНК, транскрибируемой на матрице гена, кодирующего белок DLG1, независимо от последовательности (последовательностей) таких кодонов. Кодон терминации трансляции (или "стоп-кодон") гена может иметь одну из трех последовательностей, т.е. 5’-UAA, 5’-UAG и 5’-UGA (соответствующими последовательностями ДНК являются 5’-TAA, 5’-TAG и 5’-TGA соответственно).
[0087] Термины "область старт-кодона" и "область инициаторного кодона" относятся к части такой мРНК или гена, которая охватывает от примерно 25 до примерно 50 последовательных нуклеотидов в любом направлении (т.е. 5’ или 3’) от инициаторного кодона. Аналогично, термины "область стоп-кодона" и "область кодона терминации трансляции" относятся к части такой мРНК или гена, которая охватывает от примерно 25 до примерно 50 последовательных нуклеотидов в любом направлении (т.е. 5’ или 3’) от кодона терминации трансляции. Следовательно, "область старт-кодона" (или "область инициаторного кодона") и "область стоп-кодона" (или "область кодона терминации трансляции") обе являются областями, на которые могут быть эффективно нацелены антисмысловые соединения согласно настоящему изобретению.
[0088] Открытая рамка считывания (ОРС) или "кодирующая область", которая, как известно в данной области техники, относится к области между инициаторным кодоном и кодоном терминации трансляции, также представляет собой область, на которую может быть эффективно направлено воздействие. В контексте настоящего изобретения область-мишень является внутригенной областью, включающей инициаторный кодон или кодон терминации трансляции открытой рамки считывания (ОРС) гена.
[0089] Другая область-мишень включает 5’-нетранслируемую область (5’-НТО), обозначающую в данной области техники часть мРНК в 5’-направлении от инициаторного кодона и, таким образом, содержащую нуклеотиды между 5’-сайтом кэпирования и инициаторпым кодоном мРНК (или соответствующие нуклеотиды гена). Еще одна область-мишень включает 3’-нетранслируемую область (3’-НТО), обозначающую в данной области техники часть мРНК в 3’-направлении от кодона терминации трансляции и, таким образом, содержащую нуклеотиды между кодоном термипации трансляции и 3’-концом мРНК (или соответствующие нуклеотиды гена). 5’-сайт кэпирования мРНК содержит N7-метилированный остаток гуанозина, присоединенный к самому крайнему 5’-остатку мРНК посредством 5’-5’-трифосфатной связи. Область 5’-кэпа мРНК, как считают, включает собственно структуру 5’-кэпа, а также первых 50 нуклеотидов, прилегающих к сайту кэпирования. Другая область-мишень согласно настоящему изобретению представляет собой область 5’-кэпа.
[0090] Несмотря на то что некоторые эукариотические мРНК-трапскрипты прямо транслируются, многие из них содержат одну или более областей, известных как "нитроны", которые вырезаются из транскрипта, прежде чем он подвергается трансляции. Остальные (и, таким образом, транслируемые) области известны как "экзоны" и они соединяются друг с другом с образованием непрерывной последовательности мРНК. В одном варианте реализации нацеливание на сайты сплайсинга, т.е. на места соединения интрон-экзон или места соединения экзон-интрон, особенно подходит в случаях, в которых аберрантный сплайсинг вовлечен в развитие заболевания или в которых сверхсинтез конкретного продукта сплайсинга вовлечен в развитие заболевания. Соединение в результате аберрантного слияния вследствие перестройки или делеции представляет собой другой вариант реализации сайта-мишени. мРНК-транскрипты, полученные в результате процесса сплайсинга двух (или более) мРНК из различных источников гена известны как "транскрипты слияния". Интроны могут быть эффективно задействованы в качестве мишени с применением антисмысловых соединений, нацеленных на, например, ДНК или пре-мРНК.
[0091] В одном варианте реализации антисмысловые олигонуклеотиды связываются с кодирующими и/или некодирующими областями полинуклеотида-мишени и модулируют экспрессию и/или функцию молекулы-мишени.
[0092] В одном варианте реализации антисмысловые олигонуклеотиды связываются с природными антисмысловыми полинуклеотидами и модулируют экспрессию и/или функцию молекулы-мишени.
[0093] В одном варианте реализации антисмысловые олигонуклеотиды связываются со смысловыми полинуклеотидами и модулируют экспрессию и/или функцию молекулы-мишени.
[0094] Альтернативные РНК-транскрипты могут быть получены из одной и той же геномной области ДНК. Эти альтернативные транскрипты в общем случае известны как "варианты". Конкретнее, "варианты пре-мРНК" представляют собой транскрипты, получаемые из одной и той же геномной ДНК, которые отличаются от других транскриптов, получаемых из этой же геномной ДНК, положением их либо старт-, либо стоп-кодона и содержат как интронные, так и экзонные последовательности.
[0095] После удаления одной или более экзонной или интроной областей или их частей в процессе сплайсипга варианты пре-мРНК становятся источниками меньших "вариантов мРНК". Следовательно, варианты мРНК являются процессированными вариантами пре-мРНК, и каждый уникальный вариант пре-мРНК должен всегда давать уникальный вариант мРНК в результате сплайсинга. Эти варианты мРНК также известны как "альтернативные сплайс-варианты". Если сплайсинга варианта пре-мРНК не происходит, то вариант пре-мРНК идентичен варианту мРНК.
[0096] Варианты могут быть получены путем применения альтернативных сигналов для запуска или остановки транскрипции. Пре-мРНК и мРНК могут иметь более одного старт-кодона или стоп-кодона. Варианты, которые происходят из пре-мРНК или мРНК, использующих альтернативные старт-кодоны, известны как "альтернативные старт-варианты" этих пре-мРНК или мРНК. Те транскрипты, которые используют альтернативный стоп-кодон, известны как "альтернативные стоп-варианты" этих пре-мРНК или мРНК. Один конкретный тип альтернативного стоп-варианта представляет собой "полиА-вариант", в котором множественные получаемые транскрипты являются результатом альтернативного выбора одного из "полиА-стоп-сигналов" транскрипционным аппаратом, что приводит к получению транскриптов, которые заканчиваются на уникальных полиА-сайтах. В контексте настоящего изобретения типы вариантов, описанные в настоящей заявке, также представляют собой варианты реализации нуклеиновых кислот-мишеней.
[0097] Области в целевой нуклеиновой кислоте, с которыми гибридизуются антисмысловые соединения, определяют как часть области-мишени длиной по меньшей мере 5 нуклеотидов, на которую нацелено активное антисмысловое соединение.
[0098] В то время как специфические последовательности некоторых типовых сегментов-мишеней приведены в настоящей заявке, как будет обнаружено специалистом в данной области техники, эти последовательности служат для иллюстрации и описания конкретных вариантов реализации в рамках настоящего изобретения. Дополнительные сегменты-мишени легко поддаются идентификации специалистом в данной области техники в свете настоящего описания.
[0099] Сегменты-мишени длиной 5-100 нуклеотидов, содержащие цепь из по меньшей мере пяти (5) последовательных нуклеотидов, выбранных из нуклеотидов в пределах иллюстративных предпочтительных сегментов-мишеней, как полагают, также являются подходящими для нацеливания.
[00100] Сегменты-мишени могут включать последовательности ДНК или РНК, которые содержат по меньшей мере 5 последовательных нуклеотидов с 5’-конца одного из иллюстративных предпочтительных сегментов-мишеней (остальные нуклеотиды представляют собой последовательную цепь той же самой ДНК или РНК, начинающуюся непосредственно выше от 5’-конца сегмента-мишени и продолжающуюся в пределах от примерно 5 до примерно 100 нуклеотидов). Аналогично предпочтительные сегменты-мишени представлены последовательностями ДНК или РНК, которые содержат по меньшей мере 5 последовательных нуклеотидов с 3’-конца одного из иллюстративных предпочтительных сегментов-мишеней (остальные нуклеотиды представляют собой последовательную цепь той же самой ДНК или РНК, начинающуюся непосредственно ниже 3’-конца сегмента-мишени и продолжающуюся в пределах от примерно 5 до примерно 100 нуклеотидов). Специалист в данной области техники, имеющий в наличии сегменты-мишени, проиллюстрированные в настоящей заявке, будет способен без проведения лишних экспериментов идентифицировать далее предпочтительные сегменты-мишени.
[00101] Как только одну или более областей-мишеней, сегментов-мишеней или сайтов-мишеней идентифицируют, отбирают антисмысловые соединения, которые в достаточной степени комплементарны мишени, т.е. гибридизуются достаточно хорошо и с достаточной специфичностью с получением желаемого эффекта.
[00102] В вариантах реализации настоящего изобретения олигонуклеотиды связываются с антисмысловой цепью конкретной мишени. Олигонуклеотиды имеют длину по меньшей мере 5 нуклеотидов и могут быть синтезированы таким образом, что каждый олигонуклеотид нацелен на перекрывающиеся последовательности, так что олигонуклеотиды синтезируют для покрытия всей длины полинуклеотида-мишени. Указанные мишени также включают и кодирующие, и некодирующие области.
[00103] В одном варианте реализации предпочитают воздействовать на конкретные нуклеиновые кислоты антисмысловыми олигонуклеотидами. Нацеливание антисмыслового соединения на конкретную нуклеиновую кислоту представляет собой многоступенчатый процесс. Процесс обычно начинается с идентификации последовательности нуклеиновой кислоты, функция которой подлежит модулированию. Эта последовательность может представлять собой, например, клеточный ген (или мРНК, транскрибируемую на матрице этого гена), экспрессия которого связана с конкретным расстройством или болезненным состоянием, или некодирующий полинуклеотид, такой как, например, некодирующая РНК (нкРНК).
[00104] Молекулы РНК могут быть классифицированы на (1) матричные РНК (мРНК), которые транслируются в белки, и (2) РНК, не кодирующие белки (нкРНК). нкРНК включают микроРНК, антисмысловые транскрипты и другие единицы транскрипции (ЕТ), содержащие высокую плотность стоп-кодонов и не имеющие каких-либо протяженных "открытых рамок считывания". Многие нкРНК, по-видимому, начинаются с сайтов инициации в 3’-нетранслируемых областях (3’-НТО) кодирующих белок локусов. нкРНК, как правило, редки и по меньшей мере половина из нкРНК, которые были просеквенированы Международным консорциумом по анализу РНК (FANTOM), по-видимому, не являются полиаденилированными. Большинство исследователей по очевидным причинам сфокусировали внимание на полиаденилированных мРНК, которые подвергаются процессингу и экспорту в цитоплазму. Недавно было показано, что набор пеполиаденилированных ядерных РНК может быть очень большим и что многие такие транскрипты появляются из так называемых межгенных областей. Механизм, посредством которого нкРНК могут регулировать экспрессию генов, заключается в спаривании оснований с транскриптами-мишенями. РНК, которые функционируют за счет спаривания оснований, могут быть сгруппированы в (1) цис-кодируемые РНК, которые кодируются в одном и том же участке гена, но на противоположной цепи по отношению к РНК, на которые они воздействуют, показывая таким образом совершенную комплементарность их мишени, и (2) транс-кодируемые РНК, которые кодируются в участках хромосом, отличных от участков для РНК, на которые они воздействуют, и не показывают в совершенной степени потенциального спаривания оснований с их мишенями.
[00105] Без привязки к какой-либо конкретной теории, модификация антисмыслового полинуклеотида антисмысловыми олигонуклеотидами, описанными в настоящей заявке, может изменять экспрессию соответствующих смысловых информационных РНК. Однако такая регуляция может быть либо несогласованной (антисмысловой "нокдаун" приводит к повышению уровня информационной РНК), либо согласованной (антисмысловой "нокдаун" приводит к сопутствующему понижению уровня информационной РНК). В этих случаях антисмысловые олигонуклеотиды могут быть нацелены на перекрывающиеся или неперекрывающиеся части антисмыслового транскрипта, в результате чего происходит его "нокдаун" или секвестрирование. Кодирующие, а также некодирующие антисмысловые молекулы можно нацеливать одинаковым образом, и обе категории способны регулировать соответствующие смысловые транскрипты либо согласованным, либо несогласованным образом. Стратегии, которые применяют для выявления новых олигонуклеотидов для взаимодействия с мишенями, могут быть основаны на "нокдауне" антисмысловых РНК-транскриптов антисмысловыми олигонуклеотидами или на любых других способах модулирования желаемой мишени.
[00106] Стратегия 1: В случае несогласованной регуляции "нокдаун" антисмыслового транскрипта повышает экспрессию обычного (смыслового) гена. В случае если этот ген кодирует известную или предполагаемую мишень для лекарственного средства, то "нокдаун" его антисмыслового эквивалента может предположительно имитировать действие агониста рецептора или стимулятора фермента.
[00107] Стратегия 2: В случае согласованной регуляции можно одновременно осуществить "нокдаун" как антисмыслового, так и смыслового транскриптов и тем самым добиться синергетического уменьшения экспрессии обычного (смыслового) гена. Если, например, антисмысловой олигонуклеотид применяют для достижения "нокдауна", тогда эта стратегия может быть применена для нацеленного воздействия одним антисмысловым олигонуклеотидом на смысловой транскрипт и другим антисмысловым олигонуклеотидом на соответствующий антисмысловой транскрипт или единственным энергетически симметричным антисмысловым олигонуклеотидом, одновременно нацеленным на перекрывающиеся смысловые и антисмысловые транскрипты.
[00108] Согласно настоящему изобретению антисмысловые соединения включают антисмысловые олигонуклеотиды, рибозимы, олигонуклеотиды внешней направляющей последовательности (EGS), ммРНК соединения, одно- или двухцепочечные РНК-интерферирующие (РНКи) соединения, такие как ммРНК соединения, и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени и модулируют ее функцию. Соответственно, они могут представлять собой ДНК, РНК, ДНК-подобные соединения, РНК-подобные соединения или их смеси или могут представлять собой миметики одного или более из указанных соединений. Такие соединения могут представлять собой одноцепочечные, двухцепочечные, кольцевые или шпилькообразные олигомерные соединения и могут содержать структурные элементы, такие как внутренние или концевые выпетливания, некомплементарные положения или петли. Антисмысловые соединения обычно получают в виде линейных соединений, но они могут быть соединены или получены иным способом для получения кольцевых и/или разветвленных соединений. Антисмысловые соединения могут включать такие конструкты, как, например, две гибридизованные цепи, образующие полностью или частично двухцепочечное соединение или одиночную цепь с самокомплементарностью, достаточной для гибридизации и образования полностью или частично двухцепочечного соединения. Указанные две цепи могут быть связаны внутренними связями, имея свободные 3’- или 5’-концы, или могут быть связаны с образованием непрерывной шпилькообразной структуры или петли. Указанная шпилькообразная структура может содержать липкий конец либо на 5’-, либо на 3’-конце, образующий удлинение одноцепочечного характера. Указанные двухцепочечные соединения необязательно могут содержать липкие концы. Другие модификации могут включать конъюгированные группы, присоединенные к одному из концов, нуклеотидам в определенных положениях, сахарам в определенных положениях или к одной из межнуклеозидных связей. Альтернативно, указанные две цепи могут быть связаны посредством ненуклеинового фрагмента или линкерной группы. Образованная только одиночной цепью дцРНК может принимать форму самокомплементарной шпилькообразной молекулы, складывающейся с самой собой с образованием дуплекса. Таким образом, указанные дцРНК могут быть полностью или частично двухцепочечными. Специфическое модулирование экспрессии генов может быть достигнуто за счет стабильной экспрессии шпилек дцРНК в трансгенных клеточных линиях, однако в некоторых вариантах реализации указанные экспрессия или функция генов увеличиваются. При образовании из двух цепей или одиночной цепи, принимающей форму самокомплементарной шпилькообразной молекулы, складывающейся с самой собой с образованием дуплекса, указанные две цепи (или образующие дуплекс области одиночной цепи) представляют собой комплементарные цепи РНК, которые спариваются основаниями по Уотсону-Крику.
[00109] При попадании в систему соединения согласно настоящему изобретению могут вызывать действие одного или нескольких ферментов или структурных белков по расщеплению или другим модификациям нуклеиновой кислоты-мишени или могут работать по механизму "занятия положения" (occupancy-based mechanism). В общем случае, нуклеиновые кислоты (в том числе олигонуклеотиды) могут быть описаны как "ДНК-подобные" (т.е. содержащие, как правило, один или более 2’-дезоксисахаров и, как правило, преимущественно Т, а не U основания) или "РНК-подобные" (т.е. содержащие, как правило, один или более 2’-гидрокси- или 2’-модифицированных сахаров и, как правило, преимущественно U, а не Т основания). Спирали нуклеиновых кислот могут быть представлены структурами более чем одного типа, чаще всего А- и В-формами. Считают, что, в общем случае, олигонуклеотиды, которые имеют структуру, подобную В-форме, являются "ДНК-подобными", а олигонуклеотиды, которые имеют структуру, подобную А-форме, являются "РНК-подобными". В некоторых (химерных) вариантах реализации антисмысловое соединение может содержать области как А-, так и В-формы.
[00110] В одном варианте реализации желаемые олигонуклеотиды или антисмысловые соединения содержат по меньшей мере одно из следующего: антисмысловую РНК, антисмысловую ДНК, химерные антисмысловые олигонуклеотиды, антисмысловые олигонуклеотиды, содержащие модифицированные связи, интерферирующие РНК (РНКи), малые интерферирующие РНК (ммРНК); микроинтерферирующие РНК (микроРНК); малые временные РНК (мвРНК); или короткие шпилечные РНК (кшРНК); малые РНК индуцированной активации гена (РНКа); малые активирующие РНК (маРНК) или их комбинации.
[00111] дцРНК может также активировать экспрессию генов, механизм, который получил название "малые РНК индуцированной активации генов" или РНКа. дцРНК, нацеленные на промоторы генов, вызывают мощную транскрипционную активацию ассоциированных генов. РНКа была продемонстрирована в клетках человека с помощью синтетических дцРНК, называемых "малые активирующие РНК" (маРНК). В настоящее время неизвестно, консервативна ли РНКа в других организмах.
[00112] Было обнаружено, что малые двухцепочечные РНК (дцРНК), такие как малые интерферирующие РНК (ммРНК) и микроРНК (микроРНК), запускают эволюционно-консервативный механизм, известный как РНК-интерференция (РНКи). РНКи неизбежно ведет к выключению (сайленсингу) генов за счет ремоделирования хроматина, что приводит к подавлению транскрипции, деградации комплементарной мРНК или блокированию трансляции белка. Тем не менее, в примерах, подробно описанных в последующей экспериментальной части, показано, что олигонуклеотиды вызывают увеличение экспрессии и/или функции полинуклеотидов DLG1 и кодируемых ими продуктов. дцРНК может также выступать в качестве малых активирующих РНК (маРНК). Без привязки к какой-либо конкретной теории, посредством нацеленного действия на последовательности в промоторах генов-мишеней маРНК индуцируют экспрессию гена-мишени в результате явления, называемого дцРНК индуцированной транскрипционной активацией (РНКа).
[00113] В другом варианте реализации "предпочтительные сегменты-мишени", определенные в настоящей заявке, можно применять для отбора дополнительных соединений, которые модулируют экспрессию полинуклеотидов DLG1. "Модуляторы" представляют собой соединения, понижающие или повышающие экспрессию молекулы нуклеиновой кислоты, кодирующей ген DLG1, и содержащие по меньшей мере 5-нуклеотидный участок, комплементарный предпочтительному сегменту-мишени. Способ отбора включает этапы осуществления контакта предпочтительного сегмента-мишепи молекулы нуклеиновой кислоты, кодирующей смысловые или природные антисмысловые полинуклеотиды DLG1 с одним или несколькими потенциальными модуляторами, и отбор одного или более потенциального модулятора, понижающего или повышающего экспрессию молекулы нуклеиновой кислоты, кодирующей полинуклеотиды DLG1, например SEQ IDNO: 3-12. После того как подтверждена способность потенциального(ых) модулятора(ов) к модулированию (например, понижению или повышению) экспрессии молекулы нуклеиновой кислоты, кодирующей полинуклеотиды DLG1, указанный модулятор можно применять для дальнейших исследований функций полинуклеотидов DLG1 или для применения в качестве агента для исследований, диагностики или лечения согласно настоящему изобретению.
[00114] Нацеленное воздействие при помощи природной антисмысловой последовательности предпочтительно модулирует функцию гена-мишени, например, гена DLG1 (в частности, под номером последовательности в базе данных NCBI NM_004087). В одном варианте реализации мишень представляет собой антисмысловой полинуклеотид гена DLG1. В одном варианте реализации антисмысловой олигонуклеотид нацелен на смысловые и/или природные антисмысловые последовательности полинуклеотидов DLG1 (в частности, под номером последовательности в базе данных NCBI NM_004087), их варианты, аллели, изоформы, гомологи, мутанты, производные, фрагменты и комплементарные последовательности. Предпочтительно, указанный олигонуклеотид представляет собой антисмысловую молекулу, и указанные мишени включают кодирующие и некодирующие участки антисмысловых и/или смысловых полинуклеотидов DLG1.
[00115] Предпочтительные целевые сегменты согласно настоящему изобретению могут также быть скомбинированы с соответствующими комплементарными антисмысловыми соединениями, предложенными в настоящем изобретении, с формированием стабилизированных двухцепочечных (дуплексных) олигонуклеотидов.
[00116] В данной области техники показано, что такие двухцепочечные олигонуклеотидные фрагменты модулируют экспрессию мишеней и регулируют трансляцию, а также процессинг РНК посредством антисмыслового механизма. Кроме того, указанные двухцепочечные фрагменты могут подвергаться химическим модификациям. Например, показано, что такие двухцепочечные фрагменты ингибируют мишень посредством классической гибридизации антисмысловой цепи указанного дуплекса с мишенью, запуская тем самым ферментное расщепление мишени.
[00117] В одном варианте реализации антисмысловой олигонуклеотид нацелен на полинуклеотиды DLG1 (в частности, под номером последовательности в базе данных NCBI NM_004087), их варианты, аллели, изоформы, гомологи, мутанты, производные, фрагменты и комплементарные последовательности. Предпочтительно, указанный олигонуклеотид представляет собой антисмысловую молекулу.
[00118] Согласно вариантам реализации настоящего изобретения целевая молекула нуклеиновой кислоты не ограничивается собственно DLG1 и может быть представлена любыми изоформами, рецепторами, гомологами и т.п. молекулами DLG1.
[00119] В одном варианте реализации олигонуклеотид нацелен на природную антисмысловую последовательность полинуклеотидов DLG1, например полинуклеотидов, представленных в последовательностях SEQ ID NOS: 2, и любых их вариантов, аллелей, гомологов, мутантов, производных, фрагментов и комплементарных последовательностей. Примеры антисмысловых олигонуклеотидов представлены последовательностями SEQ ID NOS: 3-12.
[00120] В одном варианте реализации указанные олигонуклеотиды комплементарны или связываются с нуклеотидными последовательностями антисмысловых последовательностей для гена DLG1, включающими, не ограничиваясь перечисленными, некодирующие смысловые и/или антисмысловые последовательности, связанные с полипуклеотидами DLG1, и модулируют экспрессию и/или функцию молекул DLG1.
[00121] В одном варианте реализации указанные олигонуклеотиды комплементарны нуклеотидным последовательностям природных антисмысловых последовательностей для гена DLG1, соответствующим SEQ ID NOS:2, или связываются с ними и модулируют экспрессию и/или функцию молекул DLG1.
[00122] В одном варианте реализации олигонуклеотиды содержат последовательности, состоящие по меньшей мере из 5 последовательных нуклеотидов последовательностей SEQ ID NOS: 3-12, и модулируют экспрессию и/или функцию молекул DLG1.
[00123] Указанные полинуклеотидные мишени включают DLG1, в том числе представителей этого семейства, варианты DLG1; мутанты DLG1, в том числе SNP; некодирующие последовательности DLG1; аллели DLG1; видовые варианты, фрагменты и т.п. Предпочтительно, указанный олигонуклеотид представляет собой антисмысловую молекулу.
[00124] В одном варианте реализации олигонуклеотид, который нацелен на полинуклеотиды DLG1, включает: антисмысловую РНК, интерферирующую РНК (мРНК), малую интерферирующую РНК (ммРНК); микроинтерферирующую РНК (микроРНК), малую, временную РНК (мвРНК) или короткую шпилечную РНК (кшРНК); малую РНК-индуцированной активации гена (РНКа) или малую активирующую РНК (маРНК).
[00125] В одном варианте реализации направленное воздействие с помощью олигонуклеотидов на полинуклеотиды DLG1, например, соответствующие SEQ ID NOS: 1, и природные антисмысловые последовательности таких изоформ гена DLG, например, соответствующие SEQ ID NO: 2, модулирует экспрессию или функцию этих мишеней. В одном варианте реализации экспрессия или функция увеличивается по сравнению с контролем. В одном варианте реализации экспрессия или функция подавляется по сравнению с контролем.
[00126] В одном варианте реализации антисмысловые соединения включают последовательности, соответствующие SEQ ID NOS: 3-12. Такие олигонуклеотиды могут содержать один или более модифицированных нуклеотидов, более короткие или более длинные фрагменты, модифицированные связи и т.п.
[00127] В одном варианте реализации последовательности SEQ ID NOS: 3-12 содержат один или более ЗНК-нуклеотидов. В Таблице 1 приведены типовые антисмысловые олигонуклеотиды, подходящие для применения в способах согласно настоящему изобретению.
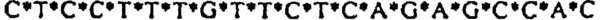
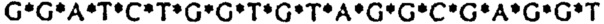


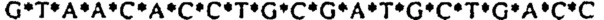
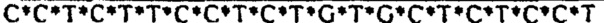
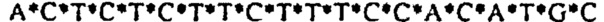
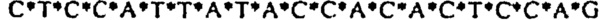

[00128] Модулирование нужной целевой нуклеиновой кислоты может быть осуществлена несколькими известными в данной области техники способами. Например, антисмысловые олигонуклеотиды, ммРНК и т.д. Молекулы ферментативной нуклеиновой кислоты (например, рибозимы) представляют собой молекулы нуклеиновой кислоты, способные катализировать одну или несколько разнообразных реакций, включая способность многократно расщеплять другие отдельные молекулы нуклеиновой кислоты чувствительным к последовательности нуклеиновых оснований сиквенс-специфичным образом. Такие молекулы ферментативной нуклеиновой кислоты могут применяться, например, для нацеленного действия на практически любой РНК-транскрипт.
[00129] Из-за сиквенс-специфичности транс-расщепляющие молекулы ферментативной нуклеиновой кислоты являются многообещающими потенциальными терапевтическими агентами для лечения заболеваний человека. Ферментативные молекулы нуклеиновых кислот могут быть сконструированы для расщепления конкретных РНК мишеней в общем пуле клеточной РНК. Такое расщепление делает указанные мРНК нефункциональными и отменяет экспрессию белка с этой РНК. Таким образом, синтез белка, связанного с болезненным состоянием, может быть избирательно заблокирован.
[00130] В общем случае, ферментативные нуклеиновые кислоты с активностью по расщеплению РНК действуют, во-первых, за счет связывания с РНК-мишенью. Такое связывание происходит посредством мишень-связывающего фрагмента ферментативной нуклеиновой кислоты, который располагается в непосредственной близости к ферментативному фрагменту указанной молекулы, расщепляющему целевую РНК. Таким образом, указанная ферментативная нуклеиновая кислота сначала распознает целевую РНК, а потом связывается с ней посредством комплементарного спаривания оснований и после связывания с соответствующим участком ферментативно расщепляет целевую РНК. Стратегическое расщепление такой целевой РНК уничтожит ее способность к прямому синтезу кодируемого белка. После того как ферментативная нуклеиновая кислота связала и расщепила целевую РНК, она отсоединяется от этой РНК, освобождается для другой мишени и может повторно связывать и расщеплять новые мишени.
[00131] Ряд подходов, таких как in vitro стратегии отбора (извлечения) (Orgel, (1979) Proc. R. Soc. London, В 205, 435), были использованы для получения новых нуклеиновых катализаторов, способных катализировать различные реакции, такие как расщепление и лигирование фосфодиэфирных связей и амидных связей.
[00132] Получение рибозимов, обладающих оптимальной каталитической активностью, внесет существенный вклад в любую стратегию, включающую применение РНК-расщепляющих рибозимов для регулирования генной экспрессии. Рибозим типа «головка молотка», например, функционирует со скоростью каталитической реакции (kcat) приблизительно 1 мин-1 в присутствии насыщающих (10 мМ) концентраций кофактора Mg2+. Показано, что синтетический «РНК-лигазный» рибозим катализирует соответствующую реакцию самоизменения со скоростью приблизительно 100 мин-1. Кроме того, известно, что определенные модифицированные рибозимы типа «головка молота», имеющие связывающие субстрат, состоящие из ДНК «ручки», катализируют расщепление РНК со скоростями оборотов, достигающими 100 мин-1. Наконец, замещение специфического остатка каталитического ядра «головки молота» определенными нуклеотидными аналогами дает модифицированные рибозимы, демонстрирующие повышение скорости каталитической реакции вплоть до 10-кратного. Эти результаты показывают, что рибозимы могут обеспечивать химические преобразования с каталитическими скоростями, значительно превышающими таковые, демонстрируемые in vitro большинством природных саморасщепляющих рибозимов. В этом случае возможно, что структуры некоторых саморасщепляющих рибозимов можно оптимизировать, чтобы получить максимальную каталитическую активность, или что могут быть получены совершенно новые РНК мотивы, демонстрирующие значительно увеличенные скорости фосфодиэфирного расщепления РНК.
[00133] Внутримолекулярное расщепление РНК-субстрата РНК катализатором, соответствующим модели «головка молота», впервые было показано в 1987 (Uhlenbeck, О.С. (1987) Nature, 328: 596-600). Указанный РНК катализатор был выделен и вступал в реакцию с различными РНК-молекулами, подтверждая, что он действительно является катализатором.
[00134] Каталитические РНК, сконструированные на основе мотива «головка молота», применялись для расщепления специфических целевых последовательностей осуществлением подходящего спаривания оснований в каталитической РНК для обеспечения необходимого спаривания оснований с целевыми последовательностями. Это позволило применить указанную каталитическую РНК для расщепления специфических целевых последовательностей и показать, что каталитические РНК, сконструированные согласно модели «головка молота», предположительно способны расщеплять специфические субстратные РНК in vivo.
[00135] РНК-интерференция (РНКи) стала мощным инструментом модулирования генной экспрессии у млекопитающих и в клетках млекопитающих. Этот подход предполагает получение малых интерферирующих РНК (ммРНК) в виде самой РНК или в виде ДНК с применением экспрессионной плазмиды или вируса и кодирующей последовательности для малых шпилечных РНК, которые процессируются в ммРНК. Эта система обеспечивает эффективный транспорт пре-ммРНК в цитоплазму, где они проявляют активность, и позволяет применение регулируемых и тканеспецифичных промоторов генной экспрессии.
[00136] В одном варианте реализации олигонуклеотид или антисмысловое соединение содержит олигомер или полимер рибонуклеиновой кислоты (РНК) и/или дезоксирибонуклеиновой кислоты (ДНК) или их миметик, химеру, аналог или гомолог. Этот термин включает олигонуклеотиды, состоящие из встречающихся в природе нуклеотидов, сахаров и ковалентных межнуклеозидных (скелетных) связей, а также олигонуклеотиды, содержащие не встречающиеся в природе фрагменты, функционирующие сходным образом. Такие модифицированные или замещенные олигонуклеотиды часто предпочтительнее нативных форм, так как они обладают необходимыми свойствами, такими как, например, увеличенное поглощение клетками, увеличенная связывающая способность в отношении целевой нуклеиновой кислоты и повышенная стабильность в присутствии нуклеаз.
[00137] Согласно настоящему изобретению указанные олигонуклеотиды или «антисмысловые соединения» включают антисмысловые олигонуклеотиды (например, РНК, ДНК, их миметики, химеры, аналоги или гомологи), рибозимы, олигонуклеотиды внешних вспомогательных последовательностей (EGS), ммРНК соединения, одно- или двухцепочечные РНК-интерферирующие (РНКи) соединения, такие как ммРНК соединения, каРНК, аРНК, и другие олигомерные соединения, которые гибридизуются по меньшей мере с частью целевой нуклеиновой кислоты и модулируют ее функцию. Соответственно, они могут представлять собой ДНК, РНК, ДНК-подобные соединения, РНК-подобные соединения или их смеси или могут представлять собой миметики одного или более из указанных соединений. Такие соединения могут представлять собой одноцепочечные, двухцепочечные, кольцевые или шпилькообразные олигомерные соединения и могут содержать структурные элементы, такие как внутренние или концевые выпетливания, некомплементарные положения или петли. Аптисмысловые соединения обычно получают в виде линейных соединений, но они могут быть объединены или получены иным способом для получения кольцевых или и/или разветвленных соединений. Антисмысловые соединения могут включать такие конструкты, как, например, две гибридизованные цепи, формирующие полностью или частично двухцепочечное соединение, или одиночную цепь с достаточной самокомплементарностью для гибридизации и формирования полностью или частично двухцепочечного соединения. Указанные две цепи могут быть связаны внутренними связями, имея свободные 3’ или 5’ концы, или могут связываться с образованием непрерывной шпилькообразной структуры или петли. Указанная шпилькообразная структура может содержать липкий конец на 5’ или на 3’ конце, образующий удлинение одноцепочечного характера. Указанные двухцепочечные соединения в некоторых случаях могут содержать липкие концы. Другие модификации могут включать конъюгированные группы, присоединенные к одному из концов, нуклеотидам в определенных положениях, сахарам в определенных положениях или к одной из межнуклеозидных связей. Как вариант, указанные две цепи могут быть связаны посредством ненуклеинового фрагмента или линкерной группы. Сформированная одиночной цепью дцРНК может принимать форму самокомплементарной шпилькообразной молекулы, складывающейся с самой собой с образованием дуплекса. Таким образом, указанные дцРНК могут быть полностью или частично двухцепочечными. Специфическое модулирование генной экспрессии может быть достигнуто стабильной экспрессией дцРНК-шпилек в трансгенных клеточных линиях. При формировании из двух цепей или одиночной цепи, принимающей форму самокомплементарной шпилькообразной молекулы, складывающейся с самой собой с формированием дуплекса, указанные две цепи (или формирующие дуплекс участки одиночной цепи) представляют собой комплементарные цепи РНК, которые спариваются по Уотсону-Крику.
[00138] При введении в систему соединения, предложенные в настоящем изобретении, могут приводить к активации одного или более ферментов или структурных белков, влияя па расщепление или иные модификации целевой нуклеиновой кислоты, либо могут действовать через механизмы «заполнения». Как правило, нуклеиновые кислоты (включая олигонуклеотиды) могут быть названы «ДНК-подобными» (т.е., как правило, содержащими один или более 2’-дезоксисахар и, как правило, преимущественно Т, а не U основания) или «РНК-подобными» (т.е., как правило, содержащими один или более 2’-гидроксил- или 2’-модифицированные сахара и, как правило, преимущественно Т, а не U, основания). Спирали нуклеиновых кислот могут быть представлены структурами более чем одного типа, чаще всего А- и В-формами. Предполагают, что, как правило, олигонуклеотиды, имеющие структуру типа В-формы, «ДНКподобны», а имеющие структуру типа А-формы - «РНКподобны». Согласно некоторым вариантам реализации (с химерами) антисмысловое соединение может содержать участки как А-, так и В-формы.
[00139] Антисмысловые соединения согласно настоящему изобретению могут содержать антисмысловой фрагмент приблизительно от 5 до приблизительно 80 нуклеотидов (т.е. приблизительно от 5 до приблизительно 80 связанных нуклеозидов) длиной. Это относится к длине указанной антисмысловой цепи или части указанного антисмыслового соединения. Иными словами, одноцепочечпое антисмысловое соединение, предложенное в настоящем изобретении, содержит от 5 до приблизительно 80 нуклеотидов, а двухцепочечпое антисмысловое соединение, предложенное в настоящем изобретении (такое как, например, дцРНК) содержит смысловую и антисмысловую цепь или фрагменты от 5 до приблизительно 80 нуклеотидов длиной. Специалисту в данной области техники будет ясно, что под этим понимаются антисмысловые фрагменты, составляющие в длину 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34,35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 нуклеотидов или принадлежащие любому диапазону в пределах указанного.
[00140] В одном варианте реализации антисмысловые соединения, предложенные в настоящем изобретении, содержат антисмысловые фрагменты 10-50 нуклеотидов длиной. Специалисту в данной области техники будет ясно, что сюда включены олигонуклеотиды, содержащие антисмысловые фрагменты, составляющие в длину 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 нуклеотидов или принадлежащие любому диапазону в пределах указанного. Согласно некоторым вариантам реализации длина указанных олигонуклеотидов составляет 15 нуклеотидов.
[00141] В одном варианте реализации антисмысловые или олигонуклеотидные соединения, предложенные в настоящем изобретении, содержат антисмысловые фрагменты, составляющие от 12 или 13 до 30 нуклеотидов в длину. Специалисту в данной области техники будет ясно, что сюда включены антисмысловые соединения, содержащие антисмысловые фрагменты, составляющие в длину 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов или принадлежащие любому диапазону в пределах указанного.
[00142] В одном варианте реализации олигомерные соединения, предложенные в настоящем изобретении, также включают варианты, в которых в одном или нескольких положениях нуклеотидов указанного соединения присутствуют различающиеся основания. Например, если первый нуклеотид представляет собой аденозин, могут быть получены варианты, которые содержат тимидин, гуанозин или цитидин в этом положении. Это может быть осуществлено в любом положении указанного антисмыслового или дцРНК-соедипения. Такие соединения затем тестируют с применением способов, описанных в настоящей заявке, для определения их способности ингибировать экспрессию целевой нуклеиновой кислоты.
[00143] Согласно некоторым вариантам реализации степень гомологии, идентичности последовательностей или комплементарности между указанным антисмысловым соединением и мишенью составляет от приблизительно 40% до приблизительно 60%. Согласно некоторым вариантам реализации степень гомологии, идентичности последовательностей или комплементарности составляют приблизительно от 60% до приблизительно 70%. Согласно некоторым вариантам реализации степень гомологии, идентичности последовательностей или комплементарности составляют приблизительно от 70% до приблизительно 80%. Согласно некоторым вариантам реализации степень гомологии, идентичности последовательностей или комплементарности составляют приблизительно от 80% до приблизительно 90%. Согласно некоторым вариантам реализации гомология, идентичность последовательностей или комплементарность составляют приблизительно 90%, приблизительно 92%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 100%.
[00144] В одном варианте реализации антисмысловые олигонуклеотиды, такие как, например, молекулы нуклеиновой кислоты, представленные в последовательностях SEQ ID NOS: 3-12, включают одну или более чем одну замену или модификацию. Согласно одному из вариантов реализации указанные нуклеотиды заменены закрытыми нуклеиновыми кислотами (ЗНК).
[00145] В одном варианте реализации указанные олигонуклеотиды нацеленно взаимодействуют с одним или более участком молекул нуклеиновой кислоты смысловых и/или антисмысловых кодирующих и/или некодирующих последовательностей, связанных с геном DLG1, и последовательностей, соответствующих SEQ ID NOS: 1 и 2. Олигонуклеотиды также нацелены на перекрывающиеся участки, соответствующие SEQ ID NOS: 1 и 2.
[00146] Некоторые предпочтительные олигонуклеотиды, предложенные в настоящем изобретении, представляют собой химерные олигонуклеотиды. «Химерные олигонуклеотиды» или «химеры» в контексте настоящего изобретения представляют собой олигонуклеотиды, которые содержат два или более химически отличных участка, каждый из которых состоит по меньшей мере из одного нуклеотида. Такие олигонуклеотиды, как правило, содержат по меньшей мере один участок модифицированных нуклеотидов, обеспечивающий одно или более полезное свойство (такое как, например, увеличенная устойчивость к нуклеазам, увеличенное поглощение клетками, повышенная связывающая способность по отношению к мишени) и участок, который представляет собой субстрат для ферментов, способных к расщеплению РНК:ДНК или РНК:РНК гибридов. Как пример, РНКаза Н представляет собой клеточную эпдонуклеазу, которая расщепляет РНК-цепь РНК:ДНК дуплекса. Активация РНКазы Н, таким образом, приводит к расщеплению целевой РНК, тем самым значительно повышая эффективность антисмыслового модулирования генной экспрессии. Соответственно, при использовании химерных олигонуклеотидов сопоставимые результаты часто могут быть получены с более короткими олигонуклеотидами, по сравнению с использованием фосфоротиоатных дезоксиолигонуклеотидов, гибридизующихся с тем же целевым участком. Расщепление целевой РНК можно определять стандартным способом посредством гель-электрофореза и, при необходимости, сопутствующих методик гибридизации нуклеиновых кислот, известных в данной области техники. В одном варианте реализации химерный олигонуклеотид содержит по меньшей мере один участок, модифицированный для увеличения способности связываться с мишенью, и, как правило, участок, функционирующий как субстрат РНКазы Н. Связывающая способность олигонуклеотида по отношению к мишени (в данном случае нуклеиновой кислоте, кодирующей газ) определяется стандартным способом измерением температуры плавления пары олигонуклеотид/мишень, представляющим собой температуру, при которой олигонуклеотид и мишень диссоциируют; диссоциацию определяют спектрофотометрически. Чем выше температура плавления, тем больше связывающая способность указанного олигонуклеотида по отношению к мишени.
[00147] Химерные антисмысловые соединения, предложенные в настоящем изобретении, могут быть получены в виде составных структур из двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или миметиков олигонуклеотидов согласно приведенным выше описаниям. Такие соединения также известны в данной области техники как гибриды или гапмеры. Примеры патентов США, в которых описано получение таких гибридных структур, включают, не ограничиваясь перечисленными, патенты США 5013830; 5149797; 5220007; 5256775; 5366878; 5403711; 5491133; 5565350; 5623065; 5652355; 5652356; и 5700922, каждый из которых включен в настоящую заявку посредством ссылки.
[00148] В одном варианте реализации модифицируемый участок указанного олигонуклеотида содержит по меньшей мере один нуклеотид, модифицированный по 2’ положению сахара, наиболее предпочтительно 2’-O-алкил, 2’-O-алкил-O-алкил или 2’-фтор-модифицированный нуклеотид. В другом варианте реализации РНК модификации включают 2’-фтор, 2’-амино и 2’-O-метильные модификации рибозы пиримидинов, лишенные азотистого основания остатки или обратное основание на 3’-конце указанной РНК. Такие модификации олигонуклеотидов осуществляют стандартными способами; показано, что такие олигонуклеотиды имеют более высокую температуру плавления (т.е. большую способность связываться с мишенью), чем 2’-дезоксиолигонуклеотиды, относительно определенной мишени. В результате такой повышенной связывающей способности значительно усиливается ингибирование генной экспрессии РНКи-олигонуклеотидом. РНКаза Н представляет собой клеточную эндонуклеазу, расщепляющую РНК цепь РНК:ДНК дуплексов; активация этого фермента, таким образом, приводит к расщеплению целевой РНК, и, следовательно, может значительно увеличивать эффективность РНКи ингибирования. Расщепление целевой РНК может быть подтверждено обычным способом посредством гель-электрофореза. В одном варианте реализации указанный химерный олигонуклеотид также модифицирован для увеличения устойчивости к нуклеазе. Клетки содержат множество экзо- и эндонуклеаз, способных разлагать нуклеиновые кислоты. Показано, что некоторые нуклеотидные и нуклеозидные модификации придают олигонуклеотиду, в состав которого они входят, большую устойчивость к нуклеазному расщеплению по сравнению с нативным олигодезоксинуклеотидом. Устойчивость к нуклеазам измеряют обычным способом, инкубируя олигонуклеотиды с клеточными экстрактами или растворами с выделенными нуклеазами и измеряя содержание интактных олигонуклеотидов спустя определенное время, как правило, посредством гель-электрофореза. Олигонуклеотиды, модифицированные для увеличения устойчивости к нуклеазам, остаются интактными на протяжении более длительного времени по сравнению с немодифицированными олигонуклеотидами. Показано, что ряд модификаций олигонуклеотидов усиливают или придают им устойчивость к нуклеазам. Олигонуклеотиды, которые содержат по меньшей мере одну фосфоротиоатную модификацию, на настоящий момент более предпочтительны. В некоторых случаях модификации олигонуклеотидов, усиливающие способность связываться с мишенью также, независимым образом, способны повышать устойчивость к нуклеазам.
[00149] Специфические примеры некоторых предпочтительных олигонуклеотидов, предусмотренных настоящим изобретением, включают содержащие модифицированные остовы, например, фосфоротиоаты, фосфотриэфиры, метилфосфонаты, алкильные с короткой цепью или циклоалкильные связи между сахарами или гетероатомпые с короткой цепью или гетероциклические связи между сахарами. Наиболее предпочтительными являются олигонуклеотиды с фосфоротиоатными остовами и с гетероатомными остовами, в частности, CH2-NH-O-CH2, CH, -N(CH3)-O-CH2 [известный как метилен(метилимино) или ММ1 остов], CH2-O-N(CH3)-CH2, CH2-N(CH3)-N(CH3)-CH2 и O-N (CH3)-CH2-CH2 остовы, где нативный фосфодиэфирный остов представлен в виде O-P-O-CH,). Амидные остовы, описанные в De Mesmaeker et al. (1995) Асе. Chem. Res. 28: 366-374, также являются предпочтительными. Также предпочтительными являются олигонуклеотиды, содержащие морфолиновые остовы (Summer-ton and Weller, патент США 5034506). В другом варианте реализации, таком как остов на основе пептидной нуклеиновой кислоты (ПНК), фосфодиэфирный остов олигонуклеотида заменен полиамидным остовом, нуклеотиды связаны прямо или непрямо с азотными атомами азагрупп полиамидного остова. Олигонуклеотиды могут также содержать один или более фрагмент замещенного сахара. Предпочтительные олигонуклеотиды содержат один из следующих заместителей в положении 2’: OH, SH, SCH3, F, OCN, OCH3OCH3, OCH3O(CH2)nCH3, O(CH2)nNH2 или O(CH2)n CH3, где n принимает значения от 1 до приблизительно 10; C1-C10 низшие алкилы, алкоксиалкокси, замещенные низшие алкилы, алкарил или аралкил; Cl; Br; CN; CF3; OCF3; O-, S-, или N-алкил; O-, S-, или N-алкенил; SOCH3; SO2 CH3; ONO2; NO2; N3; NH2; гетероциклоалкил; гетероциклоалкарил; аминоалкиламино; полиалкиламино; замещенные силилы; РНК расщепляющую группу; репортерную группу; интеркалятор; группу, улучшающую фармакокинетические свойства олигонуклеотида; или группу, улучшающую фармакодинамические свойства олигонуклеотида, и другие заместители, обладающие сходными свойствами. Предпочтительная модификация включает 2’-метоксиэтокси[2’-O-CH2CH2OCH3, также известный как 2’-O-(2-метоксиэтил)]. Другие предпочтительные модификации включают 2’-метокси(2’-O-CH3), 2’-пропокси(2’-OCH2CH2CH3) и 2’-фтор (2’-F). Сходные модификации могут быть также осуществлены в других положениях олигонуклеотида, в частности по 3’ положению сахара 3’ концевого нуклеотида и 5’ положению 5’ концевого нуклеотида. Олигонуклеотиды могут также содержать миметики сахаров, такие как циклобутилы, вместо пентофуранозильной группы.
[00150] Олигонуклеотиды могут также содержать, дополнительно или альтернативно, модификации или замены нуклеинового основания (часто называемого в данной области техники просто «основанием»). Используемые в настоящей заявке термины «немодифицированные» или «природные» нуклеотиды включают аденин (А), гуанин (G), тимин (Т), цитозин (С) и урацил (U). Модифицированные нуклеотиды включают нуклеотиды, обнаруживаемые в природных нуклеиновых кислотах редко или временно, например гипоксантин, 6-метиладенин, 5-Ме пиримидины, в частности 5-метилцитозин (также называемый 5-метил-2’ дезоксицитозин и часто упоминаемый в данной области техники как 5-Me-C), 5-гидроксиметилцитозин (ГМЦ), шикозил ГМЦ и гентобиозил ГМЦ, а также синтетические нуклеотиды, например 2-аминоаденин, 2-(метиламино)аденин, 2-(имидазолилалкил)аденин, 2-(аминоалкиламино)аденин или другие гетерозамещенные алкиладенины, 2-тиоурацил, 2-тиотимин, 5-бромурацил, 5-гидроксиметилурацил, 8-азагуанин, 7-деазагуанин, N6 (6-аминогексил)аденин и 2,6-диаминопурин. «Универсальное» основание из известных в данной области техники, например инозин, может также быть включено. Показано, что 5-Me-C замещения увеличивают стабильность дуплексов нуклеиновых кислот на 0,6-1,2°C и на настоящий момент являются предпочтительными замещениями оснований.
[00151] Другая модификация олигонуклеотидов, предложенных в настоящем изобретении, включает химическое связывание с указанным олигонуклеотидом одного или нескольких фрагментов или конъюгатов, увеличивающих активность или поглощение клетками указанного олигонуклеотида. Такие фрагменты включают, не ограничиваясь перечисленными, липидные фрагменты, такие как фрагменты холестерина, фрагмент холестерила, алифатические цепи, например додекандиольные или ундецильные остатки, цепь полиамина, или полиэтиленгликоля, или адамантан-уксусную кислоту. Олигонуклеотиды, содержащие липофильные фрагменты, и способы получения таких олигонуклеотидов известны в данной области техники, см., например, патенты США 5138045, 5218105 и 5459255.
[00152] Необязательно, чтобы все положения конкретного нуклеотида были модифицированы единообразно, и на самом деле в одном олигонуклеотиде, или даже в одном нуклеозиде в составе олигонуклеотида может содержаться более одной из упомянутых выше модификаций. Настоящее изобретение также включает олигонуклеотиды, которые представляют собой химерные олигонуклеотиды согласно данному выше определению.
[00153] В другом варианте реализации молекула нуклеиновой кислоты, предложенная в настоящем изобретении, конъюгирована с другим фрагментом, включая, но не ограничиваясь перечисленными, лишенные оснований нуклеотиды, полиэфиры, полиамины, полиамиды, пептиды, углеводороды, липиды или полиуглеводородные соединения. Специалистам в данной области техники будет ясно, что такие молекулы могут быть связаны с любым одним или более чем одним нуклеотидом, содержащим молекулу нуклеиновой кислоты, в нескольких положениях на сахаре, основании или фосфатной группе.
[00154] Олигонуклеотиды, применяемые согласно настоящему изобретению, могут быть удобно и просто получены с применением общеизвестной техники твердофазного синтеза. Оборудование для такого синтеза коммерчески доступно от ряда поставщиков, включая Applied Biosystems. Можно также применять любые другие способы такого синтеза;
фактический синтез указанного олигонуклеотида не представляет трудностей для среднего специалиста в данной области техники. Также общеизвестна возможность применения сходных методик для получения других олигонуклеотидов, таких как фосфоротиоатные и алкилатные производные. Также общеизвестна возможность применения сходных техник и коммерчески доступных модифицированных амидитов и продуктов на основе стекла с контролируемым размером пор (CPG), таких как биотин-, флуоресцеин-, акридин- или псорален-модифицированные амидиты и/или CPG (доступные от Glen Research, Sterling VA) для синтеза флуоресцентно меченых, биотинилированных или других модифицированных олигонуклеотидов, таких как холестерин-модифицированные олигонуклеотиды.
[00155] В соответствии с настоящим изобретением подразумевается применение модификаций, например применение мономеров ЗНК для усиления силы, специфичности и продолжительности действия и расширение диапазона путей введения олигонуклеотидов, состоящих из конкретных компонентов, таких как МОЭ, АНК, ФАНК, ФТ и т.д. Это может быть достигнуто замещением некоторых мономеров в конкретных олигонуклеотидах ЗНК-мономерами. ЗНК-модифицированный олигонуклеотид может иметь размер, соответствующий исходному соединению, или может быть больше либо, предпочтительно, меньше. Предпочтительно, чтобы такие ЗНК-модифицированные олигонуклеотиды содержали менее чем приблизительно 70%, более предпочтительно менее чем приблизительно 60%, наиболее предпочтительно менее чем приблизительно 50% мономеров ЗНК и чтобы их размеры составляли приблизительно от 5 до 25 нуклеотидов, более предпочтительно приблизительно от 12 до 20 нуклеотидов.
[00156] Предпочтительные модифицированные олигонуклеотидные остовы включают, не ограничиваясь перечисленными: фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, включая 3’алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3’-амино фосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры, и боранофосфаты, включающие нормальные 3’-5’ связи, 2’-5’ связанные аналоги, и имеющие обращенную полярность, где соседние пары нуклеозидных единиц связаны 3’-5’ к 5’-3’ или 2’-5’ к 5’-2’. Различные соли, смешанные соли и свободные кислоты также включены.
[00157] Примеры патентов США, раскрывающих получение вышеприведенных фосфорсодержащих связей, включают, не ограничиваясь перечисленными, патенты США 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361; и 5625050, каждый из которых включен в настоящую заявку посредством ссылки.
[00158] Предпочтительные модифицированные олигонуклеотидные остовы, не включающие атомы фосфора, образованы алкильными с короткой цепью или циклоалкильными межнуклеозидными связями, смешанными гетероатомными и алкильными или циклоалкильными межнуклеозидными связями, или одной или более гетероатомными с короткой цепью или гетероциклическими межнуклеозидиыми связями. Они включают остовы с морфолиновыми связями (образованными частично сахаром нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; алкенсодержащие остовы; сульфаматные остовы; метилениминовые и метиленгидразиновые остовы; сульфопатпые и сульфонамидные остовы; амидные остовы; и другие, содержащие смешанные N, О, S и CH2-компопепты.
[00159] Примеры патентов США, содержащие указание по получению описанных выше олигонуклеотидов, включают, не ограничиваясь перечисленными, патенты США 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; и 5677439, каждый из которых включен в настоящую заявку посредством ссылки.
[00160] В других предпочтительных миметиках олигонуклеотидов и сахара, и межнуклеозидная связь, т.е. остов, нуклеотидных единиц, заменены новыми группами. Основания сохраняют для гибридизации с подходящим целевым соединением нуклеиновой кислоты. Одно из таких олигомерных соединений, олигонуклеотидный миметик, продемонстрировавший прекрасную способность к гибридизации, называют пептидной нуклеиновой кислотой (ПНК). В ПНК-соединениях сахарный остов олигонуклеотида заменен амидсодержащим остовом, например, аминоэтилглициновым остовом. Основания нуклеиновых кислот сохранены и связаны прямо или непрямо с азотными атомами азагрупп амидной части остова. Примеры патентов США, в которых описано получение ПНК-соединений, включают, не ограничиваясь перечисленными, патенты США 5539082; 5714331; и 5719262, каждый из которых включен в настоящую заявку посредством ссылки. Дальнейшее описание ПНК-соединений можно найти у Nielsen, et al. (1991) Science 254, 1497-1500.
[00161] В одном варианте реализации изобретения олигонуклеотиды с фосфоротиоатными остовами и олигонуклеозиды с гетероатомными остовами, и в частности- CH2-NH-O-CH2-, -CH2-N (CH3)-O-CH2-, известным как метилен (метилимино) или ММ1 остов, - CH2-O-N(CH3)-CH2-, -CH2N(CH3)-N(CH3)CH2- и -O-N(CH3)-CH2-CH2-, где нативный фосфодиэфирный остов представлен как -O-P-O-CH2- согласно упомянутому выше патенту США 5489677, и амидные остовы согласно упомянутому выше патенту США 5602240. Также предпочтительными являются олигонуклеотиды, содержащие морфолиновые остовы согласно вышеупомянутому патенту США 5034506.
[00162] Модифицированные олигонуклеотиды могут также содержать один или более фрагмент замещенного сахара. Предпочтительные олигонуклеотиды содержат один из следующих заместителей по положению 2’: ОН; F; o-, S-, или N-алкил; o-, S-, или N-алкеиил; o-, S- или N-алкииил; или О алкил-O-алкил, где указанные алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C→CO алкил или C2→CO алкенил и алкинил. В частности, предпочтительными являются O(CH2)n OmCH3, O(CH2)n, OCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2nON(CH2)nCH3)2, где n и m могут принимать значения от 1 до приблизительно 10. Другие предпочтительные олигонуклеотиды содержат один из следующих заместителей по положению 2’: C→CO, (низшие алкилы, замещенные низшие алкилы, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенные силилы, РНК расщепляющую группу, репортерную группу, интеркалятор, группу, улучшающую фармакокинетические свойства олигопуклеотида, или группу, улучшающую фармакодинамические свойства олигонуклеотида, и другие заместители, обладающие сходными свойствами. Предпочтительная модификация включает 2’-метоксиэтокси(2’-O-CH2CH2OCH3, также известную как 2’-O-(2-метоксиэтил) или 2’-МОЭ), т.е. алкоксиалкокси группу. Еще одна предпочтительная модификация включает 2’-диметиламинооксиэтокси, т.е., O(CH2)2ON(CH3)2 группу, также известную как 2’-ДМАОЭ, согласно описанию в приведенных ниже в настоящей заявке примерах, и 2’-диметиламиноэтоксиэтокси (также известной в данной области техники как 2’-O-диметиламипоэтоксиэтил или 2’-ДМАЭОЭ), т.е., 2’-O-CH2-O-CH2-N(CH2)2.
[00163] Другие предпочтительные модификации включают 2’-метокси (2’-О CH3), 2’-аминопропокси (2’-O CH2CH2CH2NH2) и 2’-фтор (2’-F). Сходные модификации могут быть также осуществлены в других положениях олигонуклеотида, в частности по 3’ положению сахара 3’ концевого нуклеотида или в 2’-5’связанных олигонуклеотидах и 5’ положению 5’ концевого нуклеотида. Олигонуклеотиды могут также содержать миметики сахаров, например циклобутильные фрагменты вместо пентофуранозильного сахара. Примеры патентов США, в которых описано получение таких модифицированных сахарных структур, включают, не ограничиваясь перечисленными, патенты США 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; и 5700920, каждый из которых включен в настоящую заявку посредством ссылки.
[00164] Олигонуклеотиды могут также содержать модифицированные или замещенные нуклеиновые основания (часто называемое в данной области техники просто «основания»). В контексте настоящей заявки «немодифицированные» или «природные» нуклеотиды включают пуриновые основания аденин (А) и гуанин (G), и пиримидиновые основания тимин (Т), цитозин (С) и урацил (U). Модифицированные иуклеотиды включают другие синтетические и природные нуклеотиды, такие как 5-метилцитозин (5-me-C), 5-гидроксимегил цитозин, ксантин, гипоксантин, 2- аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил урацил и цитозип, 6-азо урацил, цитозин и тимин, 5-урацил (псевдо-урацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазаадепип и 3-деазагуанин и 3-деазааденин.
[00165] Далее, нуклеотиды включают описанные в патенте США 3687808, описанные в ‘The Concise Encyclopedia of Polymer Science And Engineering’, стр.858-859, Kroschwitz, J.I., ed. John Wiley & Sons, 1990, описанные у Engllsch et al., ‘Angewandle Chemie, international Edition’, 1991, 30, стр.613, и описанные у Sanghvl, Y.S., Chapter 15, ‘Ant 1 sense Research and Applications’, стр.289-302, Crooke, S.T. и Lebleu, B. ea., CRC Press, 1993. Некоторые из этих нуклеотидов подходят, в частности для увеличения связывающей способности олигомерных соединений, предложенных в настоящем изобретении. Такие включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и 0-6 замещенные пурины, в том числе 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. 5-метилцитозиновые замещения, как было показано, повышают стабильность дуплексов нуклеиновых кислот на 0,6-1,2°C (Sanghvl, Y.S., Crooke, S.T., Lebleu, В., eds, ‘Ant 1 sense Research and Applications’, CRC Press, Boca Raton, 1993, pp.276-278) и на настоящий момент являются предпочтительными замещениями оснований, в частности в комбинации с 2’-O-метоксиэтиловыми модификациями сахаров.
[00166] Примеры патентов США, в которых описано получение вышеупомянутых модифицированных нуклеотидов, а также других модифицированных нуклеотидов, включают, не ограничиваясь перечисленными, патенты США 3687808, а также 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5596091; 5614617; 5750692 и 5681941, каждый из которых включен в настоящую заявку посредством ссылки.
[00167] Другая модификация олиго нуклеотидов, предложенных в настоящем изобретении, подразумевает химическое связывание с олигонуклеотидом одного или более фрагмента или конъюгата, стимулирующего активность, распределение в клетках или поглощение клетками указанного олигонуклеотида.
[00168] Такие фрагменты содержат, не ограничиваясь перечисленными, липидные фрагменты, такие как фрагменты холестерина, холевая кислота, тиоэфир, например, гексил-S-тритилтиол, тиохолестерин, алифатические цепи, например, додекандиольные или ундецильные остатки, фосфолипид, например, ди-гексадецил-rac-глицерин или триэтиламмоний 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат, цепь полиамипа или полиэтиленгликоля, или адамантан-уксусную кислоту, пальмитиловый (фрагмент, или октадециламииовый или гексиламино-карбонил-t оксихолестериновый фрагмент.
[00169] Примеры патентов США, в которых описано получение таких олигонуклеотидных конъюгатов, включают, не ограничиваясь перечисленными, патенты США 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717, 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941, каждый из которых включен в настоящую заявку посредством ссылки.
[00170] Поиск новых лекарственных средств: соединения, предложенные в настоящем изобретении, могут также применяться для поиска новых лекарств и валидации мишеней. Настоящее изобретение включает применение описанных в настоящей заявке соединений и предпочтительных целевых сегментов при поиске новых лекарственных средств для выяснения взаимосвязей, существующих между полинуклеотидами DLG1 и болезнью, фенотипом или состоянием. Такие способы включают обнаружение или модулирование полинуклеотидов DLG1, включая осуществление контакта образца, ткани, клетки или организма с соединениями, предложенными в настоящем изобретении, измерение уровня нуклеиновой кислоты или белка полинуклеотидов DLG1 и/или оценка соответствующего фенотипического или химического конечного состояния через некоторое время после лечения и, в некоторых случаях, сравнение измеряемой величины с необработанными образцами или образцами, обработанными другими предложенными в настоящем изобретении соединениями. Эти способы могут применяться параллельно или в комбинации с другими экспериментами по определению функций неизвестных генов в процессе валидации мишеней или для определения обоснованности применения конкретного генного продукта в качестве мишени для лечения или предотвращения конкретного заболевания, состояния или фенотипа.
Оценка/увеличения или ингибировання экспрессии генов:
[00171] Перенос экзогенной нуклеиновой кислоты в клетку-хозяина или в организм-хозяина может быть оценен прямым определением присутствия указанной нуклеиновой кислоты в указанных клетке или организме. Такое определение может быть проведено несколькими известными специалистам в данной области техники способами. Например, присутствие экзогенной нуклеиновой кислоты может быть определено посредством саузерн-блоттинга или полимеразной цепной реакции (ПЦР) с применением праймеров, специфически амплифицирующих нуклеотидные последовательности, связанные с указанной нуклеиновой кислотой. Экспрессия указанных экзогенных нуклеиновых кислот также может быть измерена с применением общепринятых способов, в том числе анализа генной экспрессии. Например, мРНК, полученная из экзогенной нуклеиновой кислоты, может быть обнаружена и количественно определена с применением нозерн-блоттинга и ПЦР с обратной транскрипцией (ОТ-ПЦР).
[00172] Экспрессия РНК с указанной экзогенной нуклеиновой кислоты может также быть определена измерением ферментативной активности или активности репортерного белка. Например, антисмысловая модулирующая активность может быть непрямо измерена через понижение или повышение экспрессии целевой нуклеиновой кислоты в качестве показателя того, что экзогенная нуклеиновая кислота производит эффекторную РНК. Используя консервативность последовательностей, можно сконструировать праймеры и использовать для амплификации кодирующих участков указанных генов-мишеней. Сначала можно использовать наиболее активно экспрессируемую кодирующая область каждого гена для построения модели контрольного гена, хотя может быть использована любая кодирующая или некодирующая область. Каждый контрольный ген получен встраиванием каждой кодирующей области между кодирующей репортер областью и ее поли(А)-сигналом. Эти плазмиды производят мРНК с репортерным геном в вышележащей части гена и потенциальной мишенью РНКи в 3’ некодирующей области. Эффективность индивидуальных антисмысловых олигонуклеотидов может быть проанализирована по модулированию репортерного гена. Репортерные гены, подходящие для применения в способах, предложенных в настоящем изобретении, включают гены синтазы ацетогидроксикислот (АГКС), щелочной фосфатазы (ЩФ), бетагалактозидазы (LacZ), бета глюкоронидазы (GUS), хлорамфеникол ацетилтрансферазы (ХАТ), зеленого флуоресцентного белка (GFP), красного флуоресцентного белка (RFP), желтого флуоресцентного белка (YFP), голубого флуоресцентного белка (CFP), пероксидазы хрена (ПОХ), люциферазы (Luc), нопалин синтазы (NOS), октопин синтазы (OCS) и их производных. Доступны различные селективные маркеры, придающие устойчивость к ампициллину, блеомицину, хлорамфениколу, гентамиципу, гигромицину, канамицину, линкомицину, метотрексату, фосфинотрицину, пуромицину и тетрациклину. Способы определения модулирования репортерного гена хорошо известны в данной области техники, и включают, не ограничиваясь перечисленными: флуорометрические способы (например, флуоресцентная спектроскопия, сортировка флуоресцентно-активированных клеток (FACS), флуоресцентная микроскопия), определение устойчивости к антибиотику.
[00173] Экспрессия белка и мРНК DLG1 может быть проанализирована с применением известных специалистам в данной области техники способов, описанных в любом из разделов настоящей заявки. Например, для измерения уровней белка могут применяться методы иммуноанализа, такие как ELISA. Наборы ELISA для анализа DLG1 коммерчески доступны, например, от R&D Systems (Minneapolis, MN).
[00174] В вариантах реализации экспрессия DLG1 (например, мРНК или белка) в образце (например, в клетках или тканях in vivo или in vitro), обработанном с применением антисмыслового олигонуклеотида, предложенного в настоящем изобретении, оценивается посредством сравнения с экспрессией DLG1 в контрольном образце. Например, экспрессия белка или нуклеиновой кислоты может сравниваться с применением известных специалистам в данной области техники способов с таковой в плацебо-образце или в необработанном образце. Как вариант, может быть проведено сравнение с образцом, обработанным контрольным антисмысловым олигонуклеотидом (например, имеющим измененную или иную последовательность), в зависимости от того, какую информацию необходимо получить. Согласно другому варианту реализации различие в экспрессии белка или нуклеиновой кислоты DLG1 между необработанным и обработанным образцами может сравниваться с различием в экспрессии различных нуклеиновых кислот (включая любые стандартные, признанные исследователем подходящими, например, конститутивный ген) в обработанном и необработанном образцах.
[00175] Наблюдаемые различия могут быть выражены в удобной форме, например, в виде пропорции или доли, для сравнения с контролем. В вариантах реализации уровень мРНК или белка DLG1 в образце, обработанном антисмысловым олигонуклеотидом, предложенным в настоящем изобретении, повышается или снижается приблизительно 1,25-кратно-10-кратно или более относительно необработанного образца или образца, обработанного контрольной нуклеиновой кислотой. В вариантах реализации уровень мРНК или белка DLG1 повышается или снижается по меньшей мере приблизительно 1,25-кратно, по меньшей мере приблизительно 1,3-кратно, по меньшей мере приблизительно 1,4-кратно, по меньшей мере приблизительно 1,5-кратно, по меньшей мере приблизительно 1,6-кратно, по меньшей мере приблизительно 1,7-кратно, по меньшей мере приблизительно 1,8-кратно, по меньшей мере приблизительно 2-кратно, по меньшей мере приблизительно 2,5-кратно, по меньшей мере приблизительно 3-кратно, по меньшей мере приблизительно 3,5-кратно, по меньшей мере приблизительно 4-кратно, по меньшей мере приблизительно 4,5-кратно, по меньшей мере приблизительно 5-кратно, по меньшей мере приблизительно 5,5-кратно, по меньшей мере приблизительно 6-кратно, по меньшей мере приблизительно 6,5-кратно, по меньшей мере приблизительно 7-кратно, по меньшей мере приблизительно 7,5-кратно, по меньшей мере приблизительно 8-кратно, по меньшей мере приблизительно 8,5-кратно, по меньшей мере приблизительно 9-кратно, по меньшей мере приблизительно 9,5-кратно, или по меньшей мере приблизительно 10-кратно или более.
Наборы, реагенты для исследования, диагностика и терапия
[00176] Соединения, предложенные в настоящем изобретении, можно применять для диагностики, лечения и профилактики, а также в качестве реагентов для исследований и компонентов наборов. Кроме того, антисмысловые олигонуклеотиды, способные ингибировать генную экспрессию с высокой специфичностью, часто используются специалистами в данной области техники для выяснения функций отдельных генов или распознавания функций различных компонентов биологического пути.
[00177] Для применения в наборах и для диагностики, и в различных биологических системах, соединения, предложенные в настоящем изобретении, по отдельности или в комбинации с другими соединениями или терапевтическими средствами подходят в качестве инструмента дифференциального и/или комбинаторного анализа для определения паттернов экспрессии части или всего набора генов, экспрессируемых в клетках и тканях.
[00178] Используемый в настоящей заявке термин «биологическая система» или «система» определен как любой организм, клетка, клеточная культура или ткань, экспрессирующая, или с приобретенной способностью экспрессировать, продукты генов DLG1. Они включают, не ограничиваясь перечисленными: человека, трансгенных животных, клетки, культуры клеток, ткани, ксенотрансплантаты, трансплантаты и их комбинации.
[00179] Согласно одному из неограничивающих примеров паттерны экспрессии в клетках или тканях, обработанных одним или несколькими антисмысловыми соединениями, сравнивают с контрольными клетками или тканями, не обработанными антисмысловыми соединениями, и исходя из полученных паттернов анализируют дифференциальные уровни генной экспрессии, так как они связаны, например, с болезнью, сигнальными путями, локализацией в клетках, уровнями экспрессии, размером, структурой или функцией изучаемых генов. Эти исследования могут быть выполнены на стимулированных или не стимулированных клетках в присутствии или в отсутствие других соединений, которые влияют на паттерны экспрессии.
[00180] Примеры способов анализа генной экспрессии, известных в данной области техники, включают анализ на ДНК-чипах или на микрочипах, SAGE (серийный анализ экспрессии генов), READS (рестриктазная амплификация расщепляемых кДНК), TOGA (полный анализ генной экспрессии), белковые чипы и протеомику, секвенирование меток экспрессируемой последовательности (EST), вычитающий РНК фингерпринтинг (SuRF), вычитающее клонирование, дифференциальный дисплей (DD), сравнительная геномная гибридизация, FISH (флуоресцентная гибридизация in situ) и масс-спектрометрические методы.
[00181] Соединения, предложенные в настоящем изобретении, подходят для исследований и диагностики, поскольку такие соединения гибридизуются с нуклеиновыми кислотами, кодирующими DLG1. Например, олигонуклеотиды, гибридизующиеся с эффективностью и в условиях, описанных в настоящей заявке, являясь эффективными модуляторами гена DLG1, представляют собой эффективные праймеры или зонды в условиях, благоприятных для амплификации или определения гена, соответственно. Такие праймеры и зонды подходят для способов, требующих специфического определения молекул нуклеиновой кислоты, кодирующих DLG1, и для амплификации указанных молекул нуклеиновой кислоты для определения или для применения в дальнейших исслеованиях гена DLG1. Гибридизация указанных антисмысловых олигонуклеотидов, в частности праймеров и зондов, предложенных в настоящем изобретении, с нуклеиновой кислотой, кодирующей DLG1, может быть определена при помощи известных в данной области техники способов. Такие способы могут включать конъюгирование фермента с указанным олигонуклеотидом, радиоактивное мечение указанного олигонуклеотида и любые другие подходящие способы детекции. Могут также быть подготовлены наборы для определения уровней DLG1 в образце при помощи таких способов определения.
[00182] Специфичность и чувствительность антисмысловых соединений также используются специалистами в данной области техники для терапевтических целей. Антисмысловые соединения применялись в качестве терапевтических компонентов при лечении болезненных состояний у животных, в том числе человека. Лекарственные средства на основе антисмысловых олигонуклеотидов безопасно и эффективно вводили людям, и в настоящее время проводятся многочисленные клинические испытания. Таким образом, установлено, что антисмысловые соединения могут применяться в качестве терапевтических средств, которые могут быть модифицированы под терапевтические схемы для лечения клеток, тканей и животных, в особенности человека.
[00183] В случае терапевтических средств животное, предпочтительно человек, у которого, предположительно, имеется заболевание или расстройство, лечение которого может проводиться модулированием экспрессии полинуклеотидов DLG1, получает лечение в виде введения антисмысловых соединений в соответствии с настоящим изобретением. Например, согласно одному из неограничивающих вариантов реализации указанные способы включают этап введения животному, нуждающемуся в лечении, терапевтически эффективного количества модулятора гена DLG1. Модуляторы гена DLG1, предложенные в настоящем изобретении, эффективно модулируют активность гена DLG1 или модулируют экспрессию белка DLG1, Согласно одному из вариантов реализации указанные активность или экспрессия гена DLG1 у животного подавлены приблизительно на 10% по сравнению с контролем. Предпочтительно, указанные активность или экспрессия гена DLG1 у животного подавлены приблизительно на 30%. Более предпочтительно, указанные активность или экспрессия гена DLG1 у животного подавлены приблизительно на 50% или более. Таким образом, указанные олигомерные соединения модулируют экспрессию мРНК гена DLG1 по меньшей мере на 10%, по меньшей мере на 50%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98%, по меньшей мере на 99%, или на 100% относительно контроля.
[00184] В одном варианте реализации указанные активность и/или экспрессия гена DLG1 у животного повышены приблизительно на 10% по сравнению с контролем. Предпочтительно, указанные активность или экспрессия гена DLG1 у животного повышены приблизительно на 30%. Более предпочтительно, указанные активность или экспрессия гена DLG1 у животного повышены на 50% или более. Таким образом, указанные олигомерные соединения изменяют экспрессию мРНК гена DLG1 по меньшей мере на 10%, по меньшей мере на 50%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98%, по меньшей мере на 99%, или на 100% относительно контроля.
[00185] Например, снижение экспрессии гена DLG1 может быть определено в сыворотке, крови, жировой ткани, печени или любой другой жидкости организма, ткани или органе указанного животного. Предпочтительно, клетки, содержащиеся в указанных анализируемых жидкостях, тканях или органах, содержат молекулу нуклеиновой кислоты, кодирующую пептиды DLG1 и/или собственно белок DLG1.
[00186] Соединения, предложенные в настоящем изобретении, применять в фармацевтических композициях посредством добавления эффективного количества соединения к подходящему фармацевтически приемлемому разбавителю или носителю. Применение соединений и способов, предложенных в настоящем изобретении, может также подходить для профилактики.
Коньюгаты
[00187] Другая модификация олигонуклеотидов, предложенных в настоящем изобретении, включает химическое связывание с указанным олигонуклеотидом одного или нескольких фрагментов или конъюгатов, которые повышают активность, усиливают клеточное распределение или поглощение клетками указанного олигонуклеотида. Такие фрагменты или конъюгаты могут включать конъюгированные группы, ковалентно связанные с функциональными группами, такими как первичные или вторичные гидроксильные группы. Конъюгированные группы, предложенные в настоящем изобретении, включают интеркаляторы, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, простые полиэфиры, группы, улучшающие фармакодинамические свойства олигомеров, и группы, улучшающие фармакокинетические свойства олигомеров. Типовые конъюгированные группы включают холестерины, липиды, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители. Группы, усиливающие фармакодинамические свойства, в контексте настоящего изобретения включают группы, улучшающие поглощение, повышающие сопротивление разрушению и/или усиливающие сиквенс-специфичную гибридизацию с целевой нуклеиновой кислотой. Группы, улучшающие фармакокинетические свойства, в контексте настоящего изобретения включают группы, улучшающие поглощение, распределение, метаболизм или выведение соединений, предложенных в настоящем изобретении. Типовые конъюгированные группы описаны в международной заявке на патент PCT/US 92/09196, поданной 23 октября 1992, и патенте США 6287860, включенных в настоящую заявку посредством ссылки. Конъюгированные фрагменты включают, не ограничиваясь перечисленными: липидные фрагменты, такие как фрагменты холестерина, холевую кислоту, тиоэфир, например, гексил-5-тритилтиол, тиохолестерин, алифатические цепи, например, додекандиольные или ундецильные остатки, фосфолипид, например, ди-гексадецил-гас-глицерин или триэтиламмоний 1,2-ди-О-гексадецил-гас-глицеро-3-Нфосфонат, цепь полиамина или полиэтиленгликоля, или адамантан-уксусную кислоту, пальмитиловый фрагмент, октадециламин или фрагмент гексиламино-карбонил-оксихолестерина. Олигонуклеотиды, предложенные в настоящем изобретении, могут быть также конъюгированы с активными лекарственными веществами, например, аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)-пранопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трийодбензойпой кислотой, флуфенамовой кислотой, фолиновой кислотой, бензотиадиазидом, хлортиазидом, диазепином, индометицином, барбитуратом, цефалоспорином, сульфамидным препаратом, антидиабетическим средством, антибактериальным веществом или антибиотиком.
[00188] Примеры патентов США, в которых описано получение таких олигонуклеотидных конъюгатов, включают, не ограничиваясь перечисленными: патенты США 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717, 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941.
Составы
[00189] Соединения, предложенные в настоящем изобретении, также могут быть смешаны, инкапсулированы, конъюгированы или иным образом связаны с другими молекулами, молекулярными структурами или смесями соединений, например, липосомами, молекулами-мишенями рецепторов, составами для перорального, ректального, местного или иного пути введения, для способствования поглощению, распределению и/или абсорбции. Примеры патентов США, в которых описано получение таких способствующих поглощению, распределению и/или абсорбции составов, включают, не ограничиваясь перечисленными: патенты США 5108921; 5354844; 5416016; 5459127; 5521291; 5543165; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575; и 5595756, каждый из которых включен в настоящую заявку посредством ссылки. [00190] Хотя указанные антисмысловые олигонуклеотиды не обязательно должны вводиться при помощи вектора, чтобы модулировать экспрессию и/или функцию мишени, варианты реализации настоящего изобретения включают векторные конструкции для экспрессии антисмысловых олигонуклеотидов, включая промоторы, последовательности генов составных промоторов и обладающие выраженной конститутивной промоторной активностью или промоторной активностью, которая может быть индуцирована при необходимости.
[00191] В одном варианте реализации осуществление изобретения включает введение по меньшей мере одного из вышеуказанных антисмысловых олигонуклеотидов при помощи подходящей системы доставки на основе нуклеиновой кислоты. Согласно одному из вариантов реализации такая система включает невирусный вектор, функционально связанный с указанным полинуклеотидом. Примеры таких невирусных векторов включают собственно олигонуклеотид (например, любая(ые) из последовательностей SEQ IDNOS: 3-12) или его комбинацию с подходящим белковым, полисахаридным или липидным составом.
[00192] Дополнительно, подходящие системы доставки нуклеиновой кислоты включают вирусные векторы, как правило, на основе последовательности одного или нескольких аденовирусов, аденоассоциированного вируса (ААВ), хелперзависимого аденовируса, ретровируса, или липосомального комплекса с японским гемагглютинирующим вирусом (HVJ). Предпочтительно, указанный вирусный вектор содержит сильный эукариотический промотор, функционально связанный с указанным полинуклеотидом, например, промотор цитомегаловируса (ЦМВ).
[00193] Дополнительные предпочтительные векторы включают вирусные векторы, белки слияния и химические конъюгаты. Ретровирусные векторы включают вирусы мышиного лейкоза Молони и ВИЧ-вирусы. Один из предпочтительных ВИЧ-вирусных векторов содержит по меньшей мере два вектора, где гены gag и pol происходят из генома ВИЧ, а ген env - из другого вируса. Предпочтительными являются ДНК-вирусные векторы. Такие векторы включают pox-векторы, такие как ортопокс- или авипокс-векторы, герпесвирусные векторы, такие как векторы на основе вируса простого герпеса (HSV) 1, адеповирусные векторы и векторы на основе аденоассоциированного вируса.
[00194] Антисмысловые соединения, предложенные в настоящем изобретении, включают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров, или любое другое соединение, которое при введении животному, включая человека, способно обеспечить получение (прямо или непрямо) биологически активного метаболита или его компонента.
[00195] Термин «фармацевтически приемлемые соли» относится к физиологически и фармацевтически приемлемым солям соединений, предложенных в настоящем изобретении: т.е. солям, сохраняющим необходимую биологическую активность исходного соединения и, кроме того, не дающих нежелательных токсических эффектов. Предпочтительные примеры фармацевтически приемлемых солей олигонуклеотидов и их применение подробнее описаны в патенте США 6287860, включенном в настоящую заявку посредством ссылки.
[00196] Настоящее изобретение также включает фармацевтические композиции и составы, содержащие антисмысловые соединения, предложенные в настоящем изобретении. Фармацевтические композиции, предложенные в настоящем изобретении, могут вводиться различными способами в зависимости от того, требуется ли местное или системное лечение, и от того, на какую область необходимо воздействовать. Введение может быть местным (в том числе через глаза и через слизистые оболочки, включая вагинальное и ректальное введение), через легкие, например, посредством вдыхания или вдувания порошков или аэрозолей, в том числе при помощи небулайзера; интратрахеально, интраназально, эпидермально и трансдермально), пероральным или парентеральным. Парентеральное введение включает внутривенные, внутриартериальные, подкожные, внутрибрюшинные или внутримышечные инъекцию или инфузию; или внутричерепное, например, интратекальное или интравентрикулярное, введение.
[00197] При лечении тканей центральной нервной системы введение может осуществляться, например, инъекцией или инфузией в спинномозговую жидкость. Введение антисмысловой РНК в спинномозговую жидкость описано, например, в заявке на патент США, опубликованной под номером 2007/0117772, "Methods for slowing familial ALS disease progression» («Способы замедления развития наследственного заболевания БАС»), включенной в настоящую заявку посредством ссылки во всей полноте.
[00198] Если предполагается введение антисмыслового олигонуклеотида, предложенного в настоящем изобретении, в клетки центральной нервной системы, введение может осуществляться совместно с одним или несколькими агентами, способными обеспечить проникновение указанного антисмыслового олигонуклеотида через гематоэнцефалический барьер. Инъекция может быть сделана, например, в энторинальную область коры или гиппокамп. Доставка нейротрофических факторов введением аденовирусного вектора в двигательные нейроны мышечной ткани описана, например, в патенте США 6632427, "Adenoviral-vector-mediated gene transfer into medullary motor neurons» («Перенос генов в двигательные нейроны мозга, опосредованный аденовирусным вектором»), включенном в настоящую заявку посредством ссылки. Доставка векторов непосредственно в мозг, например в стриатум, таламус, гиппокамп или черную субстанцию известна в данной области техники и описана, например, в патенте США 6756523, «Adenovirus vectors for the transfer of foreign genes into cells of the central nervous system particularly in brain» («Аденовирусные векторы для переноса чужеродных генов в клетки центральной нервной системы, в частности, клетки мозга»), включенном в настоящую заявку посредством ссылки. Введение может быть быстрым в случае инъекции или осуществляться в течение некоторого промежутка времени в случае медленной инфузии или введения составов с замедленным высвобождением.
[00199] Рассматриваемые антисмысловые олигонуклеотиды могут быть связаны или конъюгированы с агентами, обеспечивающими необходимые фармацевтические или фармакокинетические свойства. Например, указанный антисмысловой олигонуклеотид может сочетаться с любым веществом, которое, как известно в данной области техники, способствует проникновению или транспорту через гематоэнцефалический барьер, таким как антитело к рецептору трансферрина, и вводимому путем внутривенной инъекции. Указанное антисмысловое соединение может быть связано с вирусным вектором, например, придающим указанному антисмысловому соединению большую эффективность и/или усиливающим транспорт указанного антисмыслового соединения через гематоэнцефалический барьер. Осмотическое преодоление гематоэицефалического барьера может также быть достигнуто, например, инфузией сахаров, включая, но не ограничиваясь перечисленными, мезоэритрит, ксилит, D(+) галактозу, D(+) лактозу, D(+) ксилозу, дульцит, миоинозитол, L(-) фруктозу, D(-) маннит, D(+) глюкозу, D(+) арабинозу, D(-) арабинозу, целлобиозу, D(+) мальтозу, D(+) раффинозу, L(+) рамнозу, D(+) мелибиозу, D(-) рибозу, адонит, D(+) арабит, L(-) арабит, D(+) фукозу, L(-) фукозу, D(-) ликсозу, L(+) ликсозу и L(-) ликсозу, или аминокислот, включая, но не ограничиваясь перечисленными, глутамин, лизин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глицин, гистидин, лейцин, метионин, фенилаланин, пролин, серии, треонин, тирозин, валин и таурин. Способы и материалы для повышения проникновения через гематоэнцефалический барьер описаны, например, в патенте США 4866042, «Method for the delivery of genetic material across the blood brain barrier» («Способы доставки генетического материала через гематоэнцефалический барьер»), патенте США 6294520, «Material for passage through the blood-brain barrier» («Материал для прохождения через гематоэнцефалический барьер») и патенте США 6936589, «Parenteral delivery systems» («Парентеральные системы доставки»), включенных в настоящую заявку посредством ссылки во всей полноте.
[00200] Рассматриваемые антисмысловые соединения могут быть смешаны, инкапсулированы, конъюгированы или иным образом связаны с другими молекулами, молекулярными структурами или смесями соединений, например, липосомами, молекулами-мишенями рецепторов, составами для перорального, ректального, местного или иного пути введения, для способствования поглощению, распределению и/или абсорбции. Например, катионные липиды могут также быть включены в указанный состав для облегчения поглощения олигонуклеотидов. Одной из таких композиций, как показано, способствующей поглощению, является LIPOFECTin (доступный у GIBCO-BRL, Bethesda, MD).
[00201] Олигонуклеотиды, содержащие по меньшей мере одну 2’-O-метоксиэтильную модификацию, предположительно подходят, в частности, для перорального введения. Фармацевтические композиции и составы для местного применения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Обычные фармакологические носители, водные, порошковые или масляные основы, загустители и т.п.могут быть необходимы или желательны. Подходящие применения включают также покрытия для презервативов, перчаток и т.п.
[00202] Фармацевтические составы, предложенные в настоящем изобретении, которые могут быть представлены в виде удобной единичной дозированной формы, могут быть получены согласно общепринятым методикам, хорошо известным в области фармацевтической индустрии. Такие техники включают этап соединения активных ингредиентов с фармацевтическими носителями и вспомогательными веществами. Как правило, указанные составы получают равномерным глубоким соединением активных ингредиентов с жидкими носителями или тонкомолотыми твердыми носителями, или с ними обоими, и затем, при необходимости, придают продукту форму.
[00203] Композиции, предложенные в настоящем изобретении, могут быть получены в виде любой из многих возможных лекарственных форм, включая, но не ограничиваясь перечисленными, таблетки, капсулы, гелевые капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции, предложенные в настоящем изобретении, могут также быть получены в виде суспензий на основе водных, неводных или смешанных сред. Водные суспензии могут дополнительно содержать вещества, увеличивающие вязкость суспензии, включая, например, натрия карбоксиметилцеллюлозу, сорбит и/или декстран. Указанная суспензия может также содержать стабилизаторы.
[00204] Фармацевтические композиции, предложенные в настоящем изобретении, включают, не ограничиваясь перечисленными: растворы, эмульсии, пены и содержащие липосомы составы. Фармацевтические композиции и составы, предложенные в настоящем изобретении, могут содержать один или более усилители проникновения, носители, вспомогательные вещества или другие активные или неактивные ингредиенты.
[00205] Эмульсии представляют собой, как правило, гетерогенные системы, где одна жидкость распределена в другой в виде капель, как правило, более 0,1 мкм в диаметре. Эмульсии могут содержать дополнительные компоненты помимо дисперсных фаз, и активное лекарственное вещество может присутствовать в растворе в водной фазе, масляной фазе или быть представлено отдельной фазой. Микроэмульсии также относятся к вариантам реализации настоящего изобретения. Эмульсии и их применение хорошо известны в данной области техники и подробнее описаны в патенте США 6287860.
[00206] Составы, предложенные в настоящем изобретении, включают липосомальные составы. В контексте настоящего изобретения термин «липосома» означает пузырьки, состоящие из амфифильных липидов, образующих один или более чем один сферический бислой. Липосомы представляют собой однослойные или многослойные пузырьки с мембраной, образованной липофильными веществами и водной внутренней фазой, где содержится композиция, которую необходимо доставить. Катионные липосомы представляют собой положительно заряженные липосомы, которые предположительно взаимодействуют с отрицательно заряженными молекулами ДНК с образованием стабильного комплекса. рН-чувствительные или отрицательно заряженные липосомы, предположительно, скорее захватывают ДНК, чем образуют с ней комплексы. Как катионные, так и некатионные липосомы применялись для доставки ДНК в клетки.
[00207] Липосомы также включают «стерически стабилизированные» липосомы, что при использовании в настоящей заявке относится к липосомам, содержащим один или более специализированный липид. После включения в липосомы эти специализированные липиды образуют липосомы с увеличенной продолжительностью существования по сравнению с липосомами, не содержащими таких специализированных липидов. Примерами стерически стабилизированных липосом являются такие, в которых часть образующего пузырек липидного компонента липосомы содержит один или более гликолипид или дериватизирован одним или несколькими гидрофильными полимерами, таких как фрагмент полиэтиленгликоля (ПЭГ). Липосомы и их применение подробнее описаны в патенте США 6287860.
[00208] Фармацевтические составы и композиции, предложенные в настоящем изобретении, могут также включать поверхностно-активные вещества. Применение поверхностно-активных веществ в лекарственных продуктах, составах и эмульсиях хорошо известно в данной области техники. Поверхностно-активные вещества и их применение подробнее описаны в патенте США 6287860, включенном в настоящую заявку посредством ссылки.
[00209] Согласно одному из вариантов реализации настоящее изобретение включает различные усилители проникновения, способствующие эффективной доставке нуклеиновых кислот, в частности олигонуклеотидов. Кроме способствования диффузии нелипофильных препаратов через клеточные мембраны, усилители проникновения повышают проникающую способность липофильных препаратов. Усилители проникновения могут быть разделены на пять больших категорий, а именно: поверхностно-активные вещества, жирные кислоты, соли желчных кислот, хелатирующие агенты и нехелатирующие не-ПАВ-вещества. Усилители проникновения и их применение подробнее описаны в патенте США 6287860, включенном в настоящую заявку посредством ссылки.
[00210] Специалисту в данной области техники будет понятно, что составы получают согласно стандартным методикам в соответствии с их назначением, т.е. способом введения.
[00211] Предпочтительные составы для местного применения включают такие, в которых олигонуклеотиды, предложенные в настоящем изобретении, смешаны с агентами для местного введения, такими как липиды, липосомы, жирные кислоты, сложные эфиры жирных кислот, стероиды, хелатирующие агенты и поверхностно-активные вещества, Предпочтительные липиды и липосомы включают нейтральные (например, диолеилфосфатидил DOPE этаноламин, димиристоилфосфатидил холин DMPC, дистеаролфосфатидилхолип) отрицательно заряженные (например, димиристоилфосфатидил глицерина DMPG) и катионные (например, диолеилтетраметиламинопропил DOTAP и диолеилфосфатидил этаноламин DOTMA).
[00212] Для местного или другого применения олигонуклеотиды, предложенные в настоящем изобретении, могут быть инкапсулированы в липосомы или входить в состав липосомальных комплексов, в частности с катионными липосомами. Как вариант, олигонуклеотиды могут входить в состав липидных комплексов, в частности с катионными липидами. Предпочтительные жирные кислоты и сложные эфиры, их фармацевтически приемлемые соли и их применение подробнее описаны в патенте США 6287860.
[00213] Композиции и составы для перорального введения включают порошки или гранулы, содержащие микрочастицы, наночастицы, суспензии или растворы в воде или неводных средах, капсулы, гелевые капсулы, порционные упаковки, таблетки или минитаблетки. Присутствие загустителей, вкусоароматических агентов, разбавителей, эмульгаторов, диспергирующих агентов или связующих веществ может быть желательным. Предпочтительными составами для перорального приема являются такие, в которых олигонуклеотиды, предложенные в настоящем изобретении, вводятся совместно с одним или несколькими усилителями проникновения, поверхностно-активными веществами и хелатирующими веществами. Предпочтительные поверхностно-активные вещества включают жирные кислоты и/или сложные эфиры или их соли, желчные кислоты и/или их соли. Предпочтительные желчные кислоты/соли и жирные кислоты и их применение подробнее описаны в патенте США 6287860, включенном в настоящую заявку посредством ссылки. Также предпочтительными являются комбинации усилителей проникновения, например, жирные кислоты/соли в комбинации с желчными кислотами/солями. В частности, предпочтительной является комбинация натриевой соли лауриновой кислоты, каприновой кислоты и УДХК. Другие усилители проникновения включают полиоксиэтилен-9-лауриловый эфир, полиоксиэтилен-20-цетиловый эфир. Олигонуклеотиды, предложенные в настоящем изобретении, могут быть введены перорально, в гранулированной форме, включая высушенные распылением частицы, или в составе комплексов микро- или наночастиц. Комплексообразующие агенты для олигонуклеотидов и их применение подробнее описаны в патенте США 6287860, включенном в настоящую заявку посредством ссылки.
[00214] Композиции и составы для парентерального, интратекального или интравентрикулярного введения могут включать стерильные водные растворы, которые могут также содержать буферы, разбавители и другие подходящие добавки, включая, но не ограничиваясь перечисленными, усилители проникновения, переносчики и другие фармацевтически приемлемые носители или вспомогательные вещества.
[00215] Определенные варианты реализации настоящего изобретения включают фармацевтические композиции, содержащие одно или более олигомерное соединение и один или более другой химиотерапевтический агент, действующий с помощью не-антисмыслового механизма. Примеры таких химиотерапевтических агентов включают, не ограничиваясь перечисленными, химиотерапевтические лекарственные средства для лечения рака, такие как даунорубицин, дауномицин, дактиномицин, доксорубицин, эпирубицин, идарубиции, эзорубицин, блеомицин, мафосфамид, ифосфамид, цитозина арабинозид, бис-хлорэтил-нитрозомочевина, бусульфан, митомицин С, актиномицин D, митрамицин, преднизон, гидроксипрогестерон, тестостерон, тамоксифен, дакарбазин, прокарбазин, гексаметилмеламин, пентаметилмеламин, митоксантрон, амсакрин, хлорамбуцил, метилциклогексилнитрозомочевина, мустарген, мелфалан, циклофосфамид, 6-меркаптопурип, 6-тиогуанин, цитарабип, 5-азацитидин, гидроксимочевина, дезоксикоформицин, 4-гидроксипероксицикло-фосфорамид, 5-фторурацил (5-FU), 5-фтордезоксиуридин (5-FUdR), метотрексат (МТХ), колхицин, таксол, винкристин, винбластин, этопозид (VP-16), триметрексат, иринотекан, топотекан, гемцитабин, тенипозид, цисплатин и диэтилстильбэстрол(DES). При применении с соединениями, предложенными в настоящем изобретении, такие химиотерапевтические агенты могут применяться индивидуально (например, 5-FU и олигонуклеотид), последовательно (например, 5-FU и олигонуклеотид в течение некоторого времени, затем МТХ и олигонуклеотид) или в комбинации с одним или несколькими другими такими химиотерапевтическими агентами (например, 5-FU, МТХ и олигонуклеотид, или 5-FU, лучевая терапия и олигонуклеотид). Противовоспалительные лекарственные средства, включая, но не ограничиваясь перечисленными, нестероидные противовоспалительные лекарственные средства и кортикостероиды, и противовирусные лекарственные средства, включая, но не ограничиваясь перечисленными, рибавирин, видарабин, ацикловир и ганцикловир, могут также быть скомбинированы в композициях, предложенных в настоящем изобретении. Комбинации антисмысловых соединений и других неантисмысловых лекарственных средств также входят в объем настоящего изобретения. Два или более скомбинированных соединения могут применяться совместно или последовательно. Комбинации антисмысловых соединений с одним или более клеточными лекарственными средствами также входят в объем изобретения. Например, настоящее изобретение включает комбинацию из олигонуклеотида согласно изобретению и стволовой клетки - например, мезенхималыюй стволовой клетки для лечения заболевания или состояния, ассоциированного с экспрессией DLK, и заболевания или состояния, ассоциированного с или требующего репарации клеток, омоложения, восстановления или замены - например, хронической сердечной недостаточности или другого заболевания или состояния, при котором стволовые клетки могут активировать рост новых клеток для восстановления больных или поврежденных тканей. Настоящее изобретение включает способ восстановления целостности монослоя, включающий введение олигонуклеотида, заявленного или упомянутого в настоящем описании, пациенту, нуждающемуся в таком лечении, и при этом пациента возможно лечат с применением дополнительных соединений или клеток.
[00216] В другом сходном варианте реализации композиции, предложенные в настоящем изобретении, могут содержать одно или несколько антисмысловых соединений, в частности олигонуклеотидов, нацеленных на первую нуклеиновую кислоту, и одно или несколько дополнительных антисмысловых соединений, нацеленных на вторую нуклеиновую кислоту. Например, первой мишенью может быть конкретная антисмысловая последовательность для гена DLG1, а второй мишенью может быть участок другой нуклеотидной последовательности. Как вариант, композиции, предложенные в настоящем изобретении, могут содержать два антисмысловых соединения или более, нацеленных на разные участки одной и той же целевой нуклеиновой кислоты DLG1. Многочисленные примеры антисмысловых соединений приведены в настоящей заявке, другие могут быть выбраны из подходящих соединений, известных в данной области техники. Два или более скомбинированных соединения могут применяться совместно или последовательно.
Дозирование:
[00217] Получение фармацевтических композиций и их последующее введение (дозирование) должны быть знакомы специалистам в данной области техники. Дозы зависят от тяжести и чувствительности к лечению болезненного состояния-мишени терапии, курс лечения может длиться от нескольких дней до нескольких месяцев, или до излечения, или до облегчения болезненного состояния. Оптимальный режим дозирования может быть рассчитан на основании измерений накопления препарата в организме пациента. Специалист без труда определит оптимальные дозировки, методологию дозировок и частоту повторения. Оптимальные дозы могут варьировать в зависимости от относительной эффективности конкретных олигонуклеотидов, и, как правило, могут быть рассчитаны исходя из EC50, эффективных для животных моделей in vitro и in vivo. Как правило, доза составляет от 0,01 мкг до 100 г на кг массы тела, и может вводиться однократно или чаще ежедневно, еженедельно, ежемесячно, или ежегодно, или даже каждые 2-20 лет. Специалист без труда может рассчитать частоту введения доз, основанную на времени удержания и концентрациях лекарства в жидкостях или тканях организма. После проведения эффективного лечения может быть желательно применение поддерживающей терапии у пациента для предотвращения рецидива заболевания, при этом указанный олигонуклеотид вводится в поддерживающих дозах, варьирующих от 0,01 мкг до 100 г на кг массы тела, от однократного или более частого ежедневного приема до однократного приема один раз в 20 лет.
[00218] Согласно вариантам реализации пациент получает дозу лекарственного средства, составляющую по меньшей мере приблизительно 1, по меньшей мере приблизительно 2, по меньшей мере приблизительно 3, по меньшей мере приблизительно 4, по меньшей мере приблизительно 5, по меньшей мере приблизительно 6, по меньшей мере приблизительно 7, по меньшей мере приблизительно 8, по меньшей мере приблизительно 9, по меньшей мере приблизительно 10, по меньшей мере приблизительно 15, по меньшей мере приблизительно 20, по меньшей мере приблизительно 25, по меньшей мере приблизительно 30, по меньшей мере приблизительно 35, по меньшей мере приблизительно 40, по меньшей мере приблизительно 45, по меньшей мере приблизительно 50, по меньшей мере приблизительно 60, по меньшей мере приблизительно 70, по меньшей мере приблизительно 80, по меньшей мере приблизительно 90, или по меньшей мере приблизительно 100 мг/кг массы тела. Некоторые вводимые дозировки антисмысловых олигонуклеотидов описаны, например, в патенте США 7563884, «Ant 1 sense modulation of PTP1B expression» («Антисмысловое модулирование экспрессии PTP1B»), включенном в настоящую заявку посредством ссылки во всей полноте.
[00219] Хотя выше и были описаны различные варианты реализации настоящего изобретения, следует понимать, что они представлены только в качестве примеров, а не для ограничения. Многочисленные модификации раскрытых вариантов реализации могут быть осуществлены согласно описаниям в настоящей заявке, не выходя за рамки сущности и объема настоящего изобретения. Таким образом, объем и сущность настоящего изобретения не ограничены какими-либо из приведенных выше вариантов реализации.
[00220] Все упоминаемые здесь документы включены в настоящую заявку посредством ссылок. Все публикации и патентные документы, упомянутые в настоящей заявке, включены посредством ссылок в том же объеме, как если бы каждая публикация или каждый патентный документ были упомянуты в индивидуальном порядке. Цитируя различные источники в данном документе, заявители не признают, что какой-либо из источников представляет «предшествующий уровень техники» относительно настоящего изобретения. Варианты реализации предложенных в изобретении композиций и способов проиллюстрированы приведенными ниже примерами.
ПРИМЕРЫ
[00221] Следующие неограничивающие примеры предназначены для иллюстрации некоторых вариантов реализации настоящего изобретения. Следует иметь в виду, что вариации содержания и вариантов элементов описанных компонентов очевидны специалистам в данной области техники и входят в объем вариантов реализации настоящего изобретения.
Пример 1: Конструирование антисмысловых олигонуклеотидов, специфичных к молекуле нуклеиновой кислоты, антисмысловой к DLG1, и/или смысловой цепи полинуклеотида DLG1
[00222] Как указано выше, термин "олигонуклеотид, специфичный для" или "олигонуклеотид с нацеленным действием" относится к олигонуклеотиду, содержащему последовательность, (i) способную формировать стабильный комплекс с фрагментом гена-мишени или (ii) способную формировать стабильный дуплекс с фрагментом мРНК-транскрипта гена-мишени.
[00223] Отбор подходящих олигонуклеотидов упрощается при применении компьютерных программ (например, IDT AntiSense Design, IDT OligoAnalyzer), автоматически идентифицирующих в каждой конкретной последовательности субпоследовательности из 19-25 нуклеотидов, способные образовывать гибриды с целевой полинуклеотидной последовательностью, имеющие требуемую температуру плавления (как правило, 50-60°C) и не образующие гомодимеров или других комплексных вторичных структур.
[00224] Отбор подходящих олигонуклеотидов также упрощается при применении компьютерных программ, которые автоматически выравнивают нуклеотидные последовательности и определяют участки идентичности или гомологии. Такие программы применяют для сравнения нуклеотидных последовательностей, полученных, например, в результате поиска в базах данных, таких как GenBank, или посредством секвенирования ПЦР-продуктов. Сравнение нуклеотидных последовательностей различных генов и межгенных областей конкретного генома позволяет отобрать нуклеотидные последовательности, которым свойственна необходимая степень специфичности к нужному гену. Такие процедуры позволяют провести отбор олигонуклеотидов, проявляющих значительную степень комплементарности целевым нуклеотидным последовательностям и более низкую степень комплементарности другим нуклеотидным последовательностям из конкретного генома. Специалисту в данной области техники будет ясно, что существует значительная свобода выбора подходящих участков генов для применения согласно настоящему изобретению.
[00225] Антисмысловое соединение является "способным к специфичной гибридизации", если связывание указанного соединения с целевой нуклеиновой кислотой нарушает нормальное функционирование целевой нуклеиновой кислоты, приводя к модулированию функции и/или активности, и степень комплементарности достаточна, чтобы избежать неспецифичного связывания указанного антисмыслового соединения с нецелевыми нуклеотидными последовательностями в условиях, при которых необходимо специфичное связывание, т.е. в физиологических условиях в случае in vivo методик анализа или терапевтического воздействия и в условиях, при которых проводится анализ, в случае исследований in vitro.
[00226] Характеристики гибридизации олигонуклеотидов, описанных в настоящей заявке, могут быть определены с применением одного или более in vitro способов анализа из известных специалистам в данной области техники. Например, указанные характеристики олигонуклеотидов, описанных в настоящей заявке, могут быть получены путем определения силы связывания целевых природных антисмысловых последовательностей и молекул потенциального лекарственного средства с применением анализа кривых плавления.
[00227] Сила связывания целевых природных антисмысловых последовательностей и молекулы потенциального лекарственного средства (далее - Молекулы) может быть оценена с применением любых стандартных способов измерения силы межмолекулярных взаимодействий, например, анализа кривых плавления.
[00228] Анализ кривых плавления определяет температуру, при которой происходит быстрый переход от двухцепочечной к одноцепочечной конформации комплекса природной антисмысловой последовательности/Молекулы. Эта температура широко используется как надежная мера силы взаимодействия между двумя молекулами.
[00229] Анализ кривых плавления может быть выполнен с применением кДНК-копии актуальной природной антисмысловой молекулы РНК или синтетического нуклеотида ДНК или РНК, соответствующего связывающему сайту Молекулы. Доступны многочисленные наборы, содержащие все необходимые реагенты для проведения анализа (например, набор MeltDoctor от Applied Biosystems Inc.). Такие наборы содержат подходящий буферный раствор, содержащий один из связывающих двухцепочечную ДНК (дцДНК) красителей (таких как красители HRM от ABI, SYBR Green, SYTO и т.д.). Свойства дцДНК-красителей таковы, что они практически не флуоресцируют в свободной форме, но очень выраженно флуоресцируют при связывании с дцДНК.
[00230] Для проведения анализа указанную кДНК или соответствующий олигонуклеотид смешивают с Молекулой в концентрациях, определенных согласно протоколам конкретных производителей. Смесь подогревают до 95°C для диссоциации преформированных комплексов дцДНК, затем медленно охлаждают до комнатной температуры или другой более низкой температуры, указанной производителем набора, для ренатурации молекул ДНК. Вновь сформировавшиеся комплексы затем медленно нагревают до 95°C, одновременно непрерывно измеряя интенсивность флуоресценции в результате реакции. Интенсивность флуоресценции обратно пропорциональна количеству присутствующих в реакции дцДНК. Информация может быть получена с применением инструмента на основе ПЦР в режиме реального времени, совместимого с набором (например, StepOne Plus Real Time PCR System от ABI или инструмент lightTyper от Roche Diagnostics, Lewes, UK).
[00231] Пики плавления получают построением графика зависимости отрицательной производной флуоресценции по температуре (-d(Флуоресценция)/dT) по оси y) от температуры (ось x) с применением подходящего программного обеспечения (например, lightTyper (Roche) или SDS Dissociation Curve, ABI). Информацию анализируют с целью определить температуру быстрого перехода комплекса дцЦНК в одноцепочечные молекулы. Эту температуру называют температурой плавления, и она прямо пропорциональна силе взаимодействия между двумя молекулами. Как правило, температура плавления превышает 40°C.
Пример 2: Модулирование полинуклеотидов DLG1
Обработка клеток Hek293T антисмысловыми олигонуклеотидами
[00232] Клетки Hek293T от ATCC (cat# CRL-1573) выращивали на ростовой среде (MEM/EBSS (Hyclone cat# SH30024, либо Mediatech cat# MT-10-010-CV)+10% ЭБС (Mediatech cat# MT35-011-CV) + пенициллин/стрептомицин (Mediatech cat# MT30-002-CI)) при 37°C и 5% CO2. За день до эксперимента клетки пересевали с плотностью 1,5×105/мл в 6-луночные планшеты и инкубировали при 37°C и 5% CO2. В день эксперимента среду в 6-луночных планшетах заменяли на свежую ростовую среду. Все антисмысловые олигонуклеотиды разводили до концентрации 20 мкМ. Два мкл этого раствора инкубировали с 400 мкл среды Opti-MEM (Gibco cat# 31985-070) и 4 мкл Липофектамина 2000 (Lipofectamine 2000) (Invitrogen cat# 11668019) при комнатной температуре в течение 20 мин и вносили в каждую лунку 6-луночных планшетов с клетками Hek293T. Аналогичную смесь, содержащую 2 мкл воды вместо раствора олигонуклеотида, применяли для контрольной "пустой" трансфекции. После 3-18 ч инкубации при 37°C и 5% CO2 среду заменяли на свежую ростовую среду. Через 48 ч после добавления антисмысловых олигонуклеотидов среду удаляли и выделяли РНК из клеток с применением SV Total RNA Isolation System от Promega (cat# Z3105) или набора RNeasy Total RNA Isolation kit от Qiagen (cat# 74181), следуя инструкциям производителя. 600 нг выделенной РНК вводили в реакцию обратной транскрипции, проводимую с применением кДНК-набора Verso cDNA kit от Thermo Scientific (cat# AB1453B) или набора High Capacity cDNA Reverse Transcription Kit (cat# 4368813) согласно описанию в протоколе производителя. кДНК, полученные в результате реакции обратной транскрипции, применяли для мониторинга генной экспрессии при помощи ПЦР в режиме реального времени с применением ABI Taqman Gene Expression Mix (cat# 4369510) и праймеров/зондов, сконструированных ABI (Applied Biosystems Taqman Gene Expression Assay: Hs00938294_ml от Applied Biosystems Inc., Foster City CA). Использовали следующий цикл ПЦР: 50°C в течение 2 мин, 95°C в течение 10 мин, 40 циклов при (95°C в течение 15 секунд, 60°C в течение 1 мин) с применением термоциклера Mx4000 (Stratagene) или аппарата для ПЦР в режиме реального времени StepOne Plus Real Time PCR Machine (Applied Biosystems). Кратность изменения экспрессии гена после обработки антисмысловыми олигонуклеотидами вычисляли на основании разности значений dCt, нормализованных по 18S, между обработанными и ложнотрансфицированными образцами.
[00233] Результаты: Результаты ПЦР в режиме реального времени показывают, что уровни мРНК гена DLG1 в клетках Hek293T значимо повышаются в течение 48 ч после обработки олигонуклеотидами, сконструированными для аптисмысловой мРНК Hs.636103 гена DLG1 (Фиг.1).
Пример 3: Ускоренное восстановление целостности монослоя в клетках HEK293T после обработки антисмысловыми олигонуклеотидами, нацеленными на DLG1-специфичный природный антисмысловой транскрипт
[00234] В Примере 3 почечные эпителиальные клетки линии HEK293T обрабатывали антисмысловыми олигонуклеотидами, нацеленными на DLG1-специфичный природный антисмысловой транскрипт, которые, как было показано в Примере 2, увеличивают экспрессию мРНК гена DLG1 в конечной концентрации, составляющей 20 нМ. Приведенные ниже данные показывают, что увеличение экспрессии мРНК гена DLG1 посредством модулирования функции DLG1-специфичного природного антисмыслового транскрипта ассоциировано с ускоренным восстановлением целостности монослоя, определенным посредством анализа закрытия дефектов монослоя.
Материалы и методы
[00235] Анализ закрытия дефектов монослоя в клетках HEK293T, обработанных антисмысловыми олигонуклеотидами, нацеленными на DLG1-специфичный природный антисмысловой транскрипт. Клетки HEK293T от АТСС (cat# CRL-1573) выращивали па ростовой среде (MEM/EBSS (Hyclone cat# SH30024)+10% ЭБС (Mediatech cat# MT35-011-CV) + пенициллин/стрептомицин (Mediatech cat# MT30-002-CI)) при 37°С и 5% СО2. За день до эксперимента клетки пересевали с плотностью 5×105/лунка в 6-луночные планшеты и инкубировали при 37°C и 5% CO2 в течение ночи. В день эксперимента среду в 6-луночных планшетах заменяли на свежую ростовую среду (1,5 мл/лунка). Все антисмысловые олигонуклеотиды были получены в IDT Inc. (Coralville, IA). Последовательности для всех олигонуклеотидов приведены в Таблице 1. Олигонуклеотиды разводили до концентрации 20 мкМ в стерильной воде, не содержащей ДНКаз/РНКаз. Для внесения в одну лунку 2 мкл этого раствора инкубировали с 400 мкл среды Opti-MEM (Gibco cat# 31985-070) и 4 мкл Липофектамина 2000 (Invitrogen cat# 11668019) при комнатной температуре в течение 20 мин и вносили по каплям в одну лунку 6-луночного планшета с клетками НЕК293Т. Аналогичную смесь, содержащую 2 мкл воды вместо раствора олигонуклеотида, применяли для контрольной "пустой" трансфекции. После 18 ч инкубации при 37°C и 5% CO2 среду заменяли на свежую ростовую среду. Через сорок восемь часов после добавления антисмысловых олигонуклеотидов монослой клеток оцарапывали с помощью стерильного наконечника объемом 200 мкл или хлопкового тампона. Закрытие царапины, продолжавшееся в течение последующих 3-5 дней, было оценено с применением слепого метода тремя независимыми наблюдателями на по меньшей мере 3 разных образцах. Оценки каждого наблюдателя были выражены в % от необработанных контролей, далее результаты для повторностей, соответствующих обработке каждым олигонуклеотидом, были усреднены и сопоставлены с контрольными лунками с применением программы ANOVA и ретроспективных анализов.
[00236] Результаты: Результаты анализа закрытия дефектов монослоя показывают, что обработка антисмысловыми олигонуклеотидами, нацеленными на DLG1-специфичный природный антисмысловой транскрипт, которые, как было показано в Примере 2, увеличивают экспрессию мРНК гена DLG1, ускоряет восстановление целостности монослоя, которое может быть полезным при лечении ран эпителия и связанных с ними состояний.
[00237] Данные из опубликованной научной литературы позволяют предположить, что белок DLG1 представляет собой белковый компонент эпителиальных клеткок, важный для полярности клеток и образования контактов. Соединительная функция выполняет важную роль в сохранении клеток вместе в виде ткани. В основном белок DLG1 обеспечивает целостность эпителия. Структурная целостность эпителия - т.е. группа эпителиальных клеток, которые коллективно образуют ткань - является главным свойством эпителия; разрушение или прерывание целостности поставило бы под угрозу многие другие функции эпителия. Можно считать, что нарушение любой функции вследствие разрушения плотного эпителия причиняет вред (потеря воды или других компонентов из одного биологического компартмента, поступление/перемещение компонентов из одного компартмента в другой…). Плотные эпителиальные клетки образуют очень связный эпителий, который обеспечивает наличие важного барьера между двумя разными средами. Например, целостность эпителия в коже защищает пациента или организм от попадания грязи и возможных вирусных или бактериальных инфекций.
[00238] Следующие ссылки относятся к эпителию, и любое рассматриваемое в приведенных ссылках состояние может подлежать лечению с применением олигонуклеотидов согласно настоящему изобретению:
http://www.ncbi.nlm.nih.gov/pubmed/21576947
http://www.ncbi.nlm.nih.gov/pubmed/20720487
http://www.ncbi.nlm.nih.gov/pubmed/19022769
http://www.ncbi.nlm.nih.gov/pubmed/20078790
http://www.ncbi.nlm.nih.gov/pubmed/19560577
http://www.ncbi.nlm.nih.gov/pubmed/21565554
http://www.ncbi.nlm.nih.gov/pubmed/21143118
http://www.ncbi.nlm.nih.gov/pubmed/21233513
http://www.ncbi.nlm.nih.gov/pubmed/21154999
http://www.ncbi.nlm.nih.gov/pubmed/21143689
http://www.ncbi.nlm.nih.gov/pubmed/21082369
http://www.ncbi.nlm.nih.gov/pubmed/19779720
http://www.ncbi.nlm.nih.gov/pubmed/19061857
[00239] Любые ткань или орган, экспрессирующие изоформы гена DLG, представляют собой мишень для заявляемых в настоящем описании олигопуклеотидов.
[00240] Таким образом, настоящее изобретение включает способ лечения множества заболеваний и/или состояний, связанных с целостностью и надлежащим функционированием ткани, включая, но не ограничиваясь, распределение эпителиальных клеток (и/или эпителиальной ткани), полярность и функционирование. Указанное состояние включает состояния кожи, слизистой оболочки, кишечника, эпителия дыхательных путей и/или состояния, ассоциированные с миграцией раковых клеток, проникновением вирусной или бактериальной инфекции через кожу или любой вид эпителия, состояния, ассоциированные с целостностью гематоретинального барьера, гематоэнцефалического барьера, целостностью монослоя и гематоликворного барьера.
Увеличение экспрессии гена DLG1 также относится к надлежащей поляризации клеток, входящих в состав ткани, например, эпителия и/или эпителиальных клеток. Несмотря на то, что настоящее изобретение проиллюстрировано и описано посредством ссылок на один или несколько вариантов реализации, эквивалентные изменения и модификации будут очевидны для специалистов в данной области техники после прочтения и понимания настоящего описания и прилагаемых чертежей. Кроме того, хотя конкретные свойства согласно настоящему изобретению могут раскрываться только в одном из нескольких вариантов реализации, такие свойства могут быть скомбинированы с одним или несколькими другими свойствами других вариантов реализации, что может быть необходимо и полезно для любого или частного случая применения.
[00241] Реферат настоящего изобретения позволит читателю быстро понять техническую суть изобретения. Подразумевается, что он не будет использован для целей толкования или ограничения сути и объема приведенной ниже формулы изобретения.






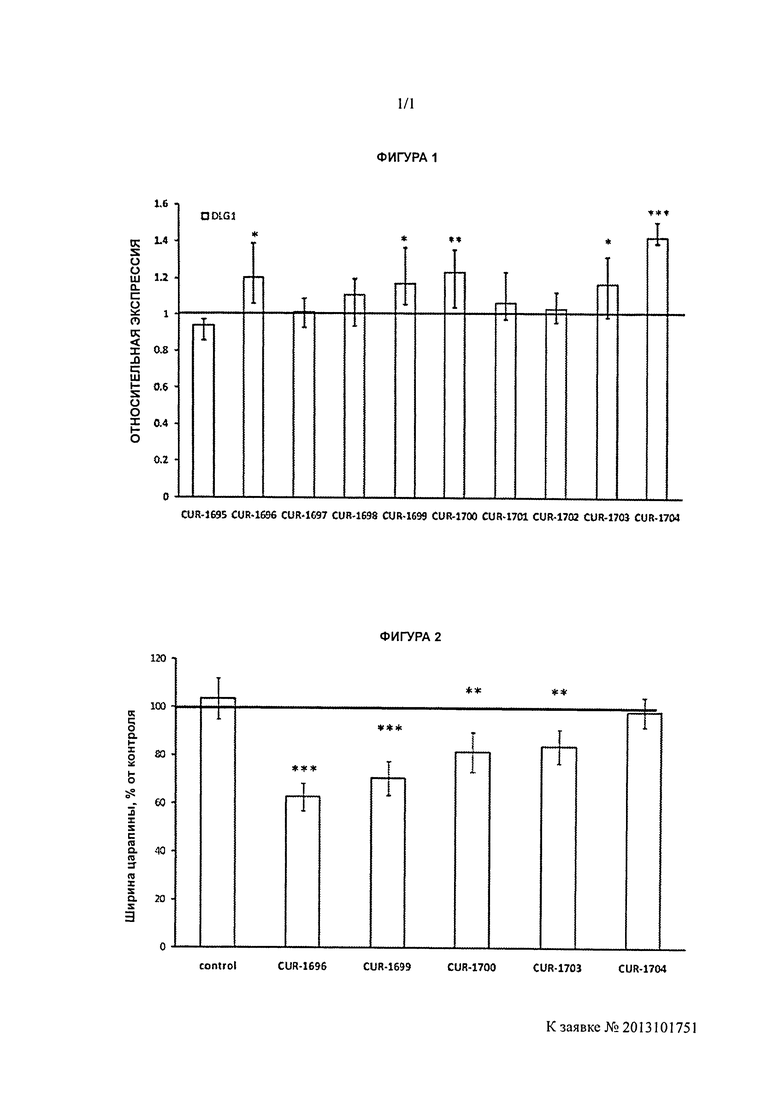
Изобретение относится к биохимии. Описан олигонуклеотид длиной приблизительно от 15 до 30 нуклеотидов, содержащий по меньшей мере одну модификацию, при этом указанная по меньшей мере одна модификация выбрана из: по меньшей мере одного модифицированного остатка сахара; по меньшей мере одной модифицированной межнуклеотидной связи; по меньшей мере одного модифицированного нуклеотида; и их комбинаций. При этом указанный олигонуклеотид гибридизуется с природным антисмысловым транскриптом гена Discs large homolog 1 (DLG1) и имеет последовательность, по меньшей мере на 80% идентичную обратному комплементу участка последовательности SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1. Изобретение также относится к применению указанного антисмыслового олигонуклеотида для лечения заболеваний и расстройств, ассоциированных с экспрессией гена DLG1. Изобретение расширяет арсенал средств для лечения заболеваний и расстройств, ассоциированных с экспрессией гена DLG1. 7 н. и 26 з.п. ф-лы, 2 ил., 1 табл., 3 пр.
1. Способ повышения экспрессии гена Discs large homolog 1 (DLG1) в биологической системе, включающий: осуществление контакта указанной системы с по меньшей мере одним олигонуклеотидом длиной от 15 до 30 нуклеотидов, при этом указанный олигонуклеотид гибридизуется с природным антисмысловым транскриптом гена Discs large homolog (DLG1) и имеет последовательность, по меньшей мере на 80% идентичную обратному комплементу участка последовательности SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1, причем указанный олигонуклеотид необязательно содержит одну или более модификаций, выбранных из следующих: по меньшей мере один модифицированный остаток сахара, по меньшей мере одна модифицированная межнуклеозидная связь, по меньшей мере один модифицированный нуклеотид и их комбинации.
2. Способ повышения экспрессии полинуклеотида гена Discs large homolog 1 (DLG1) в биологической системе по п. 1 тем, что последовательность указанного олигонуклеотида на 100% идентична обратному комплементу участка последовательности SEQ ID NO: 2.
3. Способ повышения экспрессии гена DLG1 в клетках или тканях пациента in vivo или in vitro, включающий: осуществление контакта указанных клеток или тканей с по меньшей мере одним олигонуклеотидом длиной от 15 до 30 нуклеотидов, при этом указанный олигонуклеотид гибридизуется с природным антисмысловым транскриптом гена Discs large homolog 1 (DLG1) и имеет последовательность, по меньшей мере на 80% идентичную обратному комплементу участка последовательности SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1, причем указанный олигонуклеотид необязательно содержит одну или более модификаций, выбранных из следующих: по меньшей мере один модифицированный остаток сахара, по меньшей мере одна модифицированная межнуклеозидная связь, по меньшей мере один модифицированный нуклеотид и их комбинации.
4. Способ по п. 3, отличающийся тем, что последовательность указанного олигонуклеотида на 100% идентична обратному комплементу участка последовательности SEQ ID NO: 2.
5. Способ по п. 3, отличающийся тем, что экспрессия гена DLG1 увеличивается in vivo или in vitro по сравнению с контролем.
6. Способ по п. 3, отличающийся тем, что указанный олигонуклеотид содержит одну или более модификаций, выбранных из: по меньшей мере одного модифицированного остатка сахара, по меньшей мере одной модифицированной межнуклеозидной связи, по меньшей мере одного модифицированного нуклеотида и их комбинаций.
7. Способ по п. 6, отличающийся тем, что указанные одна или более модификаций включают по меньшей мере один модифицированный остаток сахара, выбранный из: 2'-O-метоксиэтил-модифицированного остатка сахара, 2'-метокси-модифицированного остатка сахара, 2'-O-алкил-модифицированного остатка сахара, бициклического остатка сахара и их комбинаций.
8. Способ по п. 6, отличающийся тем, что указанные одна или более модификаций включают по меньшей мере одну модифицированную межнуклеозидную связь, выбранную из: фосфотиоата, 2'-O-метоксиэтила (МОЭ), 2'-фтор, алкилфосфоната, фосфодитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфирфосфата, ацетамидата, карбоксиметилового эфира и их комбинаций.
9. Способ по п. 6, отличающийся тем, что указанные одна или более модификаций включают по меньшей мере один модифицированный нуклеотид, выбранный из: пептидо-нуклеиновой кислоты, закрытой нуклеиновой кислоты, арабинонуклеиновой кислоты (FANA), их аналога, производного и комбинаций.
10. Способ по п. 3, отличающийся тем, что указанный олигонуклеотид содержит по меньшей мере одну из олигонуклеотидных последовательностей, соответствующих SEQ ID NOS: 3-12.
11. Способ повышения экспрессии гена Discs large homolog 1 (DLG1) в клетках или тканях млекопитающих in vivo или in vitro, включающий: осуществление контакта указанных клеток или тканей с по меньшей мере одним олигонуклеотидом малой интерферирующей РНК (миРНК) длиной от 15 до 30 нуклеотидов, причем указанный олигонуклеотид миРНК гибридизуется с природным антисмысловым транскриптом полинуклеотида гена Discs large homolog 1 (DLG1) и имеет последовательность, по меньшей мере на 80% идентичную обратному комплементу участка последовательности SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1.
12. Способ по п. 11, отличающийся тем, что последовательность указанного олигонуклеотида на 100% идентична обратному комплементу участка последовательности SEQ ID NO: 2.
13. Олигонуклеотид длиной приблизительно от 15 до 30 нуклеотидов, содержащий по меньшей мере одну модификацию, при этом указанная по меньшей мере одна модификация выбрана из: по меньшей мере одного модифицированного остатка сахара; по меньшей мере одной модифицированной межнуклеотидной связи; по меньшей мере одного модифицированного нуклеотида; и их комбинаций; при этом указанный олигонуклеотид гибридизуется с природным антисмысловым транскриптом гена Discs large homolog 1 (DLG1) и имеет последовательность, по меньшей мере на 80% идентичную обратному комплементу участка последовательности SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1.
14. Олигонуклеотид по п. 13, отличающийся тем, что последовательность указанного олигонуклеотида на 100% идентична обратному комплементу участка последовательности SEQ ID NO: 2.
15. Олигонуклеотид по п. 13, отличающийся тем, что указанная по меньшей мере одна модификация включает межнуклеотидную связь, выбранную из группы, состоящей из: фосфотиоата, алкилфосфоната, фосфодитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфирфосфата, ацетамидата, карбоксиметилового эфира и их комбинаций.
16. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит по меньшей мере одну фосфотиоатную межнуклеотидную связь.
17. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит остов из фосфотиоатных межнуклеотидных связей.
18. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит по меньшей мере один модифицированный нуклеотид, при этом указанный модифицированный нуклеотид выбран из: пептидо-нуклеиновой кислоты, закрытой нуклеиновой кислоты, их аналога, производного и комбинации.
19. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит множество модификаций, при этом указанные модификации включают модифицированные нуклеотиды, выбранные из: фосфотиоата, алкилфосфоната, фосфодитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфирфосфата, ацетамидата, карбоксиметилового эфира и их комбинаций.
20. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит множество модификаций, при этом указанные модификации включают модифицированные нуклеотиды, выбранные из: пептидо-нуклеиновых кислот, закрытых нуклеиновых кислот, их аналогов, производных и комбинации.
21. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит по меньшей мере один модифицированный остаток сахара, выбранный из: 2'-O-метоксиэтил-модифицированного остатка сахара, 2'-метокси-модифицированного остатка сахара, 2'-O-алкил-модифицированного остатка сахара, бициклического остатка сахара и их комбинации.
22. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит множество модификаций, при этом указанные модификации включают модифицированные остатки сахаров, выбранные из: 2'-O-метоксиэтил-модифицированного остатка сахара, 2'-метокси-модифицированного остатка сахара, 2'-O-алкил-модифицированного остатка сахара, бициклического остатка сахара и их комбинации.
23. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид повышает экспрессию гена DLG1 in vivo или in vitro по сравнению с нормальным контролем.
24. Олигонуклеотид по п. 13, отличающийся тем, что указанный олигонуклеотид содержит последовательности, соответствующие SEQ ID NOS: 3-12.
25. Фармацевтическая композиция для предотвращения или лечения заболевания, ассоциированного с геном DLG1 и/или по меньшей мере одним продуктом, который он кодирует, содержащая эффективное количество по меньшей мере одного олигонуклеотида согласно любому из пп. 13-24; или по меньшей мере одного олигонуклеотида длиной от 15 до 30 нуклеотидов, который гибридизуется с природным антисмысловым транскриптом гена DLG1 и имеет последовательность, по меньшей мере на 80% идентичную последовательности, обратно комплементарной участку SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1, и фармацевтически приемлемое вспомогательное вещество.
26. Композиция по п. 25, отличающаяся тем, что указанный олигонуклеотид имеет по меньшей мере примерно 80% идентичность последовательности по сравнению с любой из нуклеотидных последовательностей, соответствующих SEQ ID NOS: 3-12.
27. Композиция по п. 25, отличающаяся тем, что указанные олигонуклеотиды содержат нуклеотидные последовательности, соответствующие SEQ ID NOS: 3-12.
28. Композиция по п. 27, отличающаяся тем, что олигонуклеотиды, соответствующие SEQ ID NOS: 3-12, содержат одну или более модификаций или замен.
29. Композиция по п. 28, отличающаяся тем, что указанные одна или более модификаций выбраны из: фосфотиоата, метилфосфоната, пептидо-нуклеиновой кислоты, закрытой нуклеиновой кислоты и их комбинаций.
30. Способ предотвращения или лечения заболевания, ассоциированного с геном DLG1 и/или по меньшей мере одним продуктом, который он кодирует, включающий: ведение пациенту терапевтически эффективной дозы по меньшей мере одного олигонуклеотида по любому из пп. 13-24, или по меньшей мере одного олигонуклеотида длиной от 15 до 30 нуклеотидов, который гибридизуется с природным антисмысловым транскриптом гена DLG1 и имеет последовательность, по меньшей мере на 80% идентичную последовательности, обратно комплементарной участку SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1.
31. Способ по п. 30, отличающийся тем, что заболевание, ассоциированное с указанным геном DLG1, выбрано из: заболевания или расстройства, связанного с аномальной функцией и/или экспрессией гена DLG1, рака, заболевания или состояния, ассоциированного с или характеризуемого пролиферацией клеток, заболевания или расстройства, вызываемого онкогенным вирусом человека, заболевания или расстройства, ассоциированного со спецификацией судьбы клеток, заболевания или расстройства, ассоциированного с нарушенной клеточной супрессией, развития опухолевых заболеваний глаз, карциномы протоков, неоплазии шейки матки, злокачественной фиброзной гистиоцитомы, заболевания или расстройства, ассоциированного с мутантным вариантом, или аберрантной экспрессией, или функцией гена DLG1, заболевания или расстройства, ассоциированного с дефектом клеточного цикла, заболевания или расстройства, ассоциированного с дисфункциональным соединением PDZ-доменов, заболевания или расстройства, ассоциированного с нарушенной активацией Т-клеток, заболевания или расстройства иммунной системы, заражения вирусом иммунодефицита человека-1, нарушенной аксональной стимуляции миелинизации нервов, нарушенной миелинизации нервов, нарушенного гомеостаза мембран в миелинизации шванновских клеток, неврологического заболевания или расстройства, шизофрении, болезни Паркинсона, умственной отсталости, аутизма, болезни Шарко-Мари-Тута, заболевания, или расстройства, или состояния, ассоциированного с нарушенной регуляцией сердечных каналов Kv4 и Kv1.5, заболевания, или расстройства, или состояния, ассоциированного с нарушенными транспортом и внедрением глутаматного рецептора 1 (GluR1) в синапсы клеток CF/Пуркинье, заболевания, или расстройства, или состояния, ассоциированного с нарушенным синаптогенезом, заболевания, или расстройства, или состояния, ассоциированного с нарушенной функцией синапсов, заболевания, или расстройства, или состояния, ассоциированного с пониженной синаптической силой, повреждения сетчатки, заболевания или расстройства, ассоциированного с дифференцировкой кератиноцитов и/или заживлением ран, заболевания, или расстройства, или состояния, ассоциированного с нарушенным графиком трансмембранных рецепторов из ЭР в плазматическую мембрану, нарушенного развития урогенитального тракта, гидронефроза, аномалии мочевыводящих путей, заболевания, или расстройства, или состояния, ассоциированного с нарушенной ориентацией гладких мышц, заболевания, или расстройства, или состояния, ассоциированного с поврежденными компонентами нервно-мышечного соединения, включающими скелетные мышцы и двигательные нейроны, заболевания или расстройства почек и волчьей пасти.
32. Способ лечения заболевания или состояния, ассоциированного с распространением, целостностью или полярностью клеток, включающий введение олигонуклеотида по любому из пп. 13-24, или по меньшей мере одного олигонуклеотида длиной от 15 до 30 нуклеотидов, который гибридизуется с природным антисмысловым транскриптом гена DLG1 и имеет последовательность, по меньшей мере на 80% идентичную последовательности, обратно комплементарной участку SEQ ID NO: 2, или имеет последовательность, по меньшей мере на 80% идентичную участку последовательности SEQ ID NO: 1.
33. Способ по п. 32, отличающийся тем, что указанное заболевание или состояние выбрано из заболевания, состояния или повреждения, ассоциированного с тканью.
| US 20090258925 A1, 15.10.2009 | |||
| WO 2008091703 A3, 31.07.2008 | |||
| Центробежный насос | 1925 |
|
SU3319A1 |
Авторы
Даты
2017-02-21—Публикация
2011-07-13—Подача