ПРИОРИТЕТ
Настоящая заявка испрашивает приоритет относительно предварительной заявки на патент США №61/566,948, поданной 5 декабря 2011 г., предварительной заявки на патент США №61/569,595, поданной 12 декабря 2011 г., предварительной заявки на патент США №61/637,570, поданной 24 апреля 2012 г., заявки на патент США №13/465,490, поданной 7 мая 2012 г., и предварительной заявки на патент США №61/664,494, поданной 26 июня 2012 г., которые в полном объеме включены в данный текст посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение частично относится к нуклеиновым кислотам, кодирующим белки, нуклеиновым кислотам, содержащим неканонические нуклеотиды, терапевтическим препаратам, содержащим нуклеиновые кислоты, способам, наборам инструментов и устройствам для индукции экспрессии белков клетками, способам, наборам инструментов и устройствам для трансфекции, редактирования генов и перепрограммирования клеток, и клеткам, организмам и терапевтическим препаратам, полученным при помощи этих способов, наборов инструментов и устройств.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ
Содержание текстового файла, поданного в электронном виде вместе с заявкой, в полном объеме включено в данный текст посредством ссылки: копия перечня последовательностей в читаемом компьютером формате (название файла: FABI_001_01WO_SeqList_ST25.txt; дата записи: 4 декабря 2012 г.; размер файла: 18 КБ).
УРОВЕНЬ ТЕХНИКИ
Трансфекция нуклеиновыми кислотами
Нуклеиновые кислоты можно in vitro и in vivo доставлять в клетки путем предварительного комплексирования нуклеиновых кислот с заряженными липидами, липидоидами, протеинами, полимерами или их смесями. Подобные трансфекционные реагенты являются коммерчески доступными и широко применяются для доставки нуклеиновых кислот в клетки при культивировании. Клетки, обрабатываемые комплексами из трансфекционного реагента и нуклеиновой кислоты, могут поглощать эти комплексы путем эндоцитоза либо другими способами. Оказавшись внутри клетки, нуклеиновая кислота может осуществлять предназначенную ей биологическую функцию. В случае кодирующей белок РНК, к примеру, РНК может быть транслирована в белок рибосомами клетки.
Бессывороточная клеточная культура
Животные сыворотки, такие как фетальная бычья сыворотка (ФБС), обычно используют в качестве добавок в клеточных культуральных средах для стимуляции роста многих типов клеток. При этом неопределенная природа сыворотки делает клетки, контактирующие с этим компонентом, непригодными как для исследований, так и для терапевтических применений. Как следствие, были разработаны бессывороточные клеточные культуральные среды для того, чтобы исключить постоянную изменчивость и риск загрязнения токсичными и/или патогенными веществами, которые присущи сыворотке.
Наиболее распространенным белком в сыворотке является сывороточный альбумин. Сывороточный альбумин связывается с большим количеством молекул как in vitro, так и in vivo, включая гормоны, жирные кислоты, ионы кальция и металлов, а также низкомолекулярные лекарственные препараты, и может транспортировать эти молекулы в клетки как in vitro, так и in vivo. Сывороточный альбумин (наиболее часто это бычий сывороточный альбумин (БСА) или человеческий сывороточный альбумин (ЧСА)) является обычным ингредиентом в бессывороточной клеточной культуральной среде, в которой его обычно используют в концентрации 1-10 г/Л. Как правило, сывороточный альбумин готовят из плазмы крови путем фракционирования этанолом (по методу Кона). Фракцию, содержащую сывороточный альбумин (ʺфракция Кона Vʺ или просто "фракция Vʺ), выделяют и обычно используют без дальнейшей обработки. Таким образом, стандартное приготовление сывороточного альбумина включает белковую часть (полипептид сывороточного альбумина) и часть с участием ассоциированных молекул (включая соли, жирные кислоты и т.д., которые связаны с полипептидом сывороточного альбумина). Состав компонента сывороточного альбумина, содержащего ассоциированные молекулы, в общем случае является сложным и неизвестным.
Сывороточный альбумин можно обрабатывать для использования в определенных специализированных применениях (см. Barker A method for the deionization of bovine serum albumin. Tissue Culture Association. 1975; Droge et al. Biochem Pharmacol. 1982; 31:3775-9; Ng et al. Nat Protoc. 2008; 3:768-76; Публикация заявки на патент США №2010/0168000, содержание которых включено в данный текст посредством ссылки). Обычно процессы обработки применяются для удаления из растворов сывороточного альбумина глобулинов и контаминантных вирусов и они часто включают стабилизацию полипептида сывороточного альбумина путем добавления короткоцепочечной жирной кислоты, октановой кислоты с последующей термоинактивацией/преципитацией загрязняющих веществ. Для высокоспециализированных применений в культивировании стволовых клеток было показано, что использование ионообменной смолы для удаления излишка соли из растворов БСА повышает жизнеспособность клеток (см. Ng et al. Nat Protoc. 2008; 3:768-76; Публикация заявки на патент США №2010/0168000, содержание которых включено в данный текст посредством ссылки). При этом такая обработка не приносит пользы в случае рекомбинантного сывороточного альбумина даже при аналогичных чувствительных способах применения в культивировании стволовых клеток (см. Ng et al. Nat Protoc. 2008; 3:768-76; Публикация заявки на патент США №2010/0168000, содержание которых включено в данный текст посредством ссылки), демонстрируя, что эффект деионизации в этих применениях направлен на удаления излишка соли в растворе альбумина, но не на изменение компонента альбумина, содержащего ассоциированные молекулы. Вдобавок, до настоящего времени не исследовали воздействие такой обработки на другие типы клеток, такие как человеческие фибробласты, а также воздействие такой обработки на эффективность трансфекции и на связанную с трансфекцией токсичность. Более того, было показано, что связанные с альбумином липиды являются критическими для культуры человеческих полипотентных стволовых клеток, а удаление таких клеток из альбумина приводит к спонтанной дифференциации человеческих полипотентных стволовых клеток даже в том случае, когда липиды отдельно добавляют в клеточную культуральную среду (см. Garcia-Gonzalo et al. PLoS One. 2008; 3:e1384, содержание которой включено в данный текст посредством ссылки). Таким образом, считается, что клеточная культуральная среда, содержащая альбумин с немодифицированным компонентом, содержащим ассоциированные молекулы, является критической для культуры человеческих полипотентных стволовых клеток. Важным является и то, что взаимосвязь между содержащим ассоциированные молекулы компонентом липидного носителя, такого как альбумин, и эффективностью трансфекции и связанной с трансфекцией токсичности, до настоящего времени не была исследована.
Перепрограммирование клеток
Клетки можно перепрограммировать путем воздействия на них специфических внеклеточных сигналов и/или путем эктопической экспрессии специфических белков, микроРНК и т.д. Хотя ранее было описано несколько способов перепрограммирования, большинство способов, основанных на эктопической экспрессии, требует внесения экзогенной ДНК, что может привести к риску появления мутаций. Сообщалось о способах перепрограммирования без участия ДНК, основанных на прямой доставке перепрограммирующих белков, но при этом данные способы являются слишком неэффективными и ненадежными для коммерческого использования. Вдобавок были описаны основанные на РНК способы перепрограммирования, но при этом существующие основанные на РНК способы перепрограммирования являются медленными, ненадежными и неэффективными при применении их к зрелым клеткам, требуют большого количества трансфекций (что приводит к высокой стоимости и возможности ошибки), могут перепрограммировать лишь ограниченное количество типов клеток, могут перепрограммировать клетки лишь в ограниченное количество типов клеток, требуют использования иммунодепрессантов, а также требуют использования большого количества компонентов человеческого происхождения, включая полученный из крови ЧСА и человеческие фибробластные фидеры. Большое количество недостатков описанных ранее способов перепрограммирования клеток делают их непригодными как для применения в исследованиях, так и для терапевтического применения.
Генное редактирование
Некоторые белки природного происхождения содержат ДНК-связывающие домены, которые могут распознавать специфические последовательности ДНК, например, цинковые пальцы (ЦП) и транскрипционные эффекторы активаторного типа (TALEs - от англ. ʺtranscription activator-like effectorsʺ). Белки слияния, содержащие один или более ДНК-связывающих доменов и каталитический домен нуклеазы, можно использовать для создания двухцепочечного разрыва в нужном участке ДНК в клетке. При соединении с ДНК-матрицей, содержащей один или более участков, гомологичных к ДНК клетки, генно-редактирующие белки можно использовать для вставки последовательности ДНК или изменения последовательности ДНК клетки другим контролируемым способом. При этом большинство существующих на данный момент способов генного редактирования в клетках используют векторы на основе ДНК для экспрессии генно-редактирующих белков. Как следствие, эти способы генного редактирования являются неэффективными и несут риск возникновения неконтролируемого мутагенеза, что делает их непригодными как для применения в исследованиях, так и для терапевтического применения. Способы генного редактирования соматических клеток без участия ДНК ранее не исследовали, как и способы одновременного или последовательного генного редактирования и перепрограммирования соматических клеток. И наконец, применение генного редактирования в антибактериальном, противовирусном или противораковом лечении ранее не исследовали.
Модельные организмы
Крыс с выключенными генами получали путем эмбриональной микроинъекции нуклеиновых кислот, кодирующих цинк-пальцевые нуклеазы и TALE-нуклеазы (TALENs). Также сообщалось о генном редактировании с целью внесения специфичных к последовательности мутаций (также называемых ʺвыключениямиʺ), проводимом на мышах и крысах путем инъекции нуклеиновых кислот, кодирующих цинк-пальцевые нуклеазы, в эмбрионы. Генетически модифицированных крыс получали, используя эмбриональные стволовые клетки, а компетентные крысиные полипотентные стволовые клетки зародышевой линии получали при помощи перепрограммирования соматических клеток. При этом ранее не исследовали использование клеток, прошедших перепрограммирование и генное редактирование, для получения генетически модифицированных организмов.
В данной области техники существует потребность в усовершенствованных способах и препаратах для трансфекции клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, в настоящем изобретении предложены реагенты, протоколы, наборы инструментов и устройства для индукции экспрессии белков клетками и для трансфекции, перепрограммирования и генного редактирования клеток. В отличие от способов, о которых сообщалось ранее, отдельные варианты реализации настоящего изобретения не включают обработку клеток экзогенной ДНК или аллогенными материалами либо материалами животного происхождения.
В одном аспекте данного изобретения предложена синтетическая молекула РНК, содержащая три или более неканонических нуклеотидов, каждый их которых содержит одну или более из следующих замен: пиримидина в позиции 2С, пиримидина в позиции 4С, пиримидина в позиции 5С, пурина в позиции 6С, пурина в позиции 7N и пурина в позиции 8С. В некоторых вариантах реализации изобретения синтетическую молекулу РНК получают путем in vitro транскрипции. В других вариантах реализации изобретения синтетическая молекула РНК дополнительно содержит по меньшей мере один следующий элемент: 5ʹ-кэп, 5ʹ-кэп 1 структуру и 3ʹ-поли(А) хвост. В других вариантах реализации изобретения по меньшей мере два неканонических нуклеотида являются пиримидинами. В других вариантах реализации изобретения неканонические нуклеотиды содержат по меньшей мере одно из следующих соединений: псевдоуридин, 2-тиоуридин, 4-тиоуридин, 5-азауридин, 5-гидроксиуридин, 5-аминоуридин, 5-метилуридин, 2-тиопсевдоуридин, 4-тиопсевдоуридин, 5-гидроксипсевдоуридин, 5-метилпсевдоуридин, 5-аминопсевдоуридин, псевдоизоцитидин, 5-метилцитидин, N4-метилцитидин, 2-тиоцитидин, 5-азацитидин, 5-гидроксицитидин, 5-аминоцитидин, N4-метилпсевдоизоцитидин, 2-тиопсевдоизоцитидин, 5-гидроксипсевдоизоцитидин, 5-аминопсевдоизоцитидин, 5-метилпсевдоизоцитидин, N6-метиладенозин, 7-деазааденозин, 6-тиогуанозин, 7-деазагуанозин, 8-азагуанозин, 6-тио-7-деазагуанозин, 6-тио-8-азагуанозин, 7-деаза-8-азагуанозин и 6-тио-7-деаза-8-азагуанозин. В других вариантах реализации изобретения по меньшей мере два неканонических нуклеотида содержат менее чем 20% молекулы синтетической РНК каждый. В других вариантах реализации изобретения неканонические нуклеотиды содержат по меньшей мере одно из следующих соединений: псевдоуридин, 2-тиоуридин, 4-тиоуридин, 5-азауридин, 5-гидроксиуридин, 5-аминоуридин, 5-метилуридин, 2-тиопсевдоуридин, 4-тиопсевдоуридин, 5-гидроксипсевдоуридин, 5-метилпсевдоуридин и 5-аминопсевдоуридин, и по меньшей мере из следующих соединений: псевдоизоцитидин, 5-метилцитидин, N4-метилцитидин, 2-тиоцитидин, 5-азацитидин, 5-гидроксицитидин, 5-аминоцитидин, N4-метилпсевдоизоцитидин, 2-тиопсевдоизоцитидин, 5-гидроксипсевдоизоцитидин, 5-аминопсевдоизоцитидин и 5-метилпсевдоизоцитидин. В дополнительном варианте реализации изобретения неканонические нуклеотиды дополнительно содержат по меньшей мере одно из следующих соединений: N6-метиладенозин, 7-деазааденозин, 6-тиогуанозин, 7-деазагуанозин, 8-азагуанозин, 6-тио-7-деазагуанозин, 6-тио-8-азагуанозин, 7-деаза-8-азагуанозин и 6-тио-7-деаза-8-азагуанозин.
В другом аспекте данного изобретения предложена синтетическая молекула РНК, которая содержит неканонический нуклеотид и кодирует генно-редактирующий белок.
В другом варианте реализации изобретения предложен терапевтический состав, содержащий описанную в данном тексте синтетическую молекулу РНК.
В другом аспекте данного изобретения предложен терапевтический состав, содержащий синтетическую молекулу РНК, которая кодирует генно-редактирующий белок, и трансфекционный реагент.
В другом варианте реализации изобретения предложен способ трансфекции клетки нуклеиновой кислотой, включающий приведение клетки в контакт с описанной в данном тексте синтетической молекулой РНК.
В другом варианте реализации изобретения предложен способ индукции экспрессии клеткой млекопитающего представляющего интерес белка, включающий приведение клетки в контакт с описанными в данном тексте синтетическими молекулами РНК. В другом варианте реализации изобретения предложен способ перепрограммирования клетки, включающий приведение клетки в контакт с описанными в данном тексте синтетическими молекулами РНК. В другом варианте реализации изобретения предложен способ генного редактирования клетки, включающий приведение клетки в контакт с описанными в данном тексте синтетическими молекулами РНК.
В другом аспекте данного изобретения предложен способ трансфекции клетки нуклеиновой кислотой, включающий: приведение клетки в контакт со средой, содержащей гидрокортизон и/или альбумин, причем альбумин обработан ионообменной смолой или древесным углем, и приведение клетки в контакт с нуклеиновой кислотой. В одном варианте реализации изобретения альбумин обработан короткоцепочечной жирной кислотой и/или нагрет до температуры, составляющей по меньшей мере 40°С. В других вариантах реализации изобретения данный способ дополнительно включает приведение клетки в контакт с трансфекционным реагентом. В других вариантах реализации изобретения клетка является клеткой млекопитающего, а в клетке млекопитающего индуцируют экспрессию представляющего интерес белка. В других вариантах реализации изобретения данный способ дополнительно включает приведение клетки в контакт с нуклеиновой кислотой по меньшей мере дважды в продолжение 5 последовательных дней. В некоторых вариантах реализации изобретения нуклеиновая кислота кодирует перепрограммирующий белок. В других вариантах реализации изобретения клетку перепрограммируют. В другом варианте реализации изобретения клетка является клеткой кожи, а способ дополнительно включает культивирование клетки кожи в условиях, которые способствуют росту по меньшей мере одного из следующих видов клеток: клеток кожи, полипотентных стволовых клеток, глюкозозависимых инсулин-продуцирующих клеток, гемопоэтических клеток, сердечных клеток и ретинальных клеток, при этом клетку кожи перепрограммируют в клетку, выбранную из: клетки кожи, полипотентной стволовой клетки, глюкозозависимой инсулин-продуцирующей клетки, гемопоэтической клетки, сердечной клетки и ретинальной клетки. В другом варианте реализации изобретения нуклеиновая кислота кодирует белок Oct4. В другом варианте реализации изобретения данный способ дополнительно включает приведение клетки в контакт с нуклеиновой кислотой, которая кодирует по меньшей мере один из белков: белок Sox2, белок Klf4 и белок c-Myc. В другом варианте реализации изобретения данный способ дополнительно включает приведение клетки в контакт с одной или более нуклеиновыми кислотами, которые кодируют белок Sox2, белок Klf4 и белок c-Myc. В других вариантах реализации изобретения нуклеиновая кислота кодирует генно-редактирующий белок. В других вариантах реализации изобретения нуклеиновая кислота кодирует белок, который действуя отдельно или в комбинации с одной или более другими молекулами, создает одноцепочечный или двухцепочечный разрыв в молекуле ДНК. В разных вариантах реализации изобретения клетка является генетически отредактированной. В некоторых вариантах реализации изобретения одноцепочечный или двухцепочечный разрыв составляет около 5,000,000 оснований сайта инициации транскрипции гена, выбранного из: CCR5, CXCR4, GAD1, GAD2, CFTR, НВА1, НВА2, НВВ, HBD, FANCA, ХРА, ХРВ, ХРС, ERCC2, POLH, НТТ, DMD, SOD1, АРОЕ, АРР, LRRK2, PRNP, BRCA1 и BRCA2, или его аналога, варианта и представителя семейства. В некоторых вариантах реализации изобретения данный способ дополнительно включает приведение клетки в контакт с по меньшей мере одним соединением из: поли-L-лизина, поли-L-орнитина, RGD-пептида, фибронектина, витронектина, коллагена и ламинина, или его биологически активным фрагментом, функциональным вариантом или представителем семейства. В других вариантах реализации изобретения нуклеиновая кислота является синтетической молекулой РНК, которая может содержать по меньшей мере одно соединение из: псевдоуридина, 5-метилпсевдоуридина и 5-метилцитидина. В некоторых вариантах реализации изобретения данный способ предусматривает приведение клетки в контакт с фактором дифференцировки или получение клетки от пациента и/или доставку клетки пациенту.
В другом аспекте данного изобретения предложена среда, содержащая альбумин, причем альбумин является рекомбинантным и обработанным ионообменной смолой или древесным углем. В другом варианте реализации изобретения среда дополнительно содержит буферный солевой раствор и аминокислоты, а также один или более компонентов из инсулина, трансферрина и селена, и/или холестерин, и/или стероид (такой как, например, гидрокортизон), и/или иммунодепрессант (такой как, например, B18R).
В другом аспекте данного изобретения предложен набор инструментов, содержащий гидрокортизон и/или альбумин, причем альбумин обработан ионообменной смолой или древесным углем, и синтетическую молекулу РНК. В одном варианте реализации изобретения синтетическая молекула РНК кодирует по меньшей мере один из белков: белок Oct4, белок Sox2, белок Klf4, белок c-Myc, белок Nanog, белок Lin28 и белок Utfl. В другом варианте реализации изобретения набор инструментов дополнительно содержит трансфекционный реагент и/или описанные в данном тексте синтетические молекулы РНК. В другом варианте реализации изобретения набор инструментов является набором инструментов для перепрограммирования и/или набором инструментов для генного редактирования.
В другом аспекте данного изобретения предложен комплекс из нуклеиновой кислоты и трансфекционного реагента, содержащий нуклеиновую кислоту и трансфекционный реагент, при этом комплекс из нуклеиновой кислоты и трансфекционного реагента отвержден путем охлаждения. В некоторых вариантах реализации изобретения комплекс из нуклеиновой кислоты и трансфекционного реагента отвержден путем приведения в контакт комплекса из нуклеиновой кислоты и трансфекционного реагента с жидким азотом в жидком и/или парообразном состоянии.
В другом аспекте данного изобретения предложен способ трансфекции клетки, включающий приведение клетки в контакт с описанным в данном тексте комплексом из нуклеиновой кислоты и трансфекционного реагента.
В другом аспекте данного изобретения предложено устройство для трансфекции клеток, содержащее приспособления для приведения клеток в контакт с трансфекционной средой и приспособления для приведения клеток в контакт с комплексами из нуклеиновой кислоты и трансфекционного реагента. В некоторых вариантах реализации изобретения атмосфера, окружающая клетки, содержит около 5% углекислого газа и/или около 5% кислорода.
В некоторых вариантах реализации изобретения предложены клетка, и/или организм, и/или терапевтический состав, и/или терапевтический состав, содержащие клетку, полученную при помощи описанных в данном тексте способов.
В некоторых аспектах предложены синтетические молекулы РНК с низкой токсичностью и высокой трансляционной эффективностью. В других аспектах предложены способы, наборы инструментов и устройства для получения и доставки синтетических молекул РНК в клетки. В других аспектах предложена клеточная культуральная среда для высокоэффективной трансфекции, перепрограммирования и генного редактирования клеток. Другие аспекты относятся к содержащим синтетические молекулы РНК терапевтическим препаратам для лечения заболеваний, включая диабет 1 типа, сердечную недостаточность, включая ишемическую и дилатационную кардиомиопатию, макулярную дегенерацию, болезнь Паркинсона, кистозный фиброз, серповидноклеточную анемию, талассемию, анемию Фанкони, тяжёлый комбинированный иммунодефицит, радикулярную сенсорную наследственную невропатию, пигментную ксеродерму, болезнь Хантингтона, мышечную дистрофию, амиотрофический боковой склероз, болезнь Альцгеймера, рак и инфекционные заболевания, включая гепатиты и ВИЧ/СПИД. Дополнительные аспекты относятся к содержащим клетки терапевтическим препаратам для лечения заболеваний, включая диабет 1 типа, сердечную недостаточность, включая ишемическую и дилатационную кардиомиопатию, макулярную дегенерацию, болезнь Паркинсона, кистозный фиброз, серповидноклеточную анемию, талассемию, анемию Фанкони, тяжёлый комбинированный иммунодефицит, радикулярную сенсорную наследственную невропатию, пигментную ксеродерму, болезнь Хантингтона, мышечную дистрофию, амиотрофический боковой склероз, болезнь Альцгеймера, рак и инфекционные заболевания, включая гепатиты и ВИЧ/СПИД.
ДЕТАЛЬНОЕ ОПИСАНИЕ ФИГУР
Данное изобретение в качестве примера, но не в качестве ограничения, проиллюстрировано фигурами из прилагаемых чертежей.
На ФИГ. 1 показана РНК, кодирующая указанные белки, разделенные в денатурирующем формальдегидном арагозном геле.
На ФИГ. 2А показаны первичные человеческие фибробласты, трансфицированные синтетической РНК, кодирующей Oct4 и содержащей указанные нуклеотиды. ʺАʺ обозначает аденозин, ʺГʺ обозначает гуанозин, ʺУʺ обозначает уридин, ʺЦʺ обозначает цитидин, ʺпсУʺ обозначает псевдоуридин, ʺ5мЦʺ обозначает 5 метилцитидин, ʺN4мЦʺ обозначает N4-метилцитидин, ʺ7дГʺ обозначает 7-деазагуанозин и ʺпсизоЦʺ обозначает псевдоизоцитидин. Числа перед нуклеотидами указывают на долю соответствующего нуклеотид-5ʹ-трифосфата в реакции in vitro транскрипции. Например, 0,5 N4мЦ обозначает РНК, синтезированную при помощи реакции in vitro транскрипции с участием равных количеств N4-метилцитидин-5ʹ-трифосфата и цитидин-5ʹ-трифосфата. Через 20 ч после трансфекции клетки фиксировали и окрашивали на наличие белка Oct4.
На ФИГ. 2Б показана экспрессия Oct4 и клеточная плотность культур первичных человеческих фибробластов, трансфицированных синтетической РНК, кодирующей Oct4 и содержащей указанные нуклеотиды. Нуклеотиды обозначаются так же, как и на ФИГ. 2А, за исключением того, что ʺ7дАʺ обозначает 7-деазааденозин и ʺпиЦʺ обозначает псевдоизоцитидин. Приведенная клеточная плотность нормирована относительно нетрансфицированных клеток. Приведенная экспрессия Oct4 нормирована относительно синтетической РНК, содержащей только канонические нуклеотиды. Планки погрешностей показывают среднеквадратическую погрешность (n=3).
На ФИГ. 3А показана перепрограммированная клеточная линия, полученная путем трансфекции первичных человеческих фибробластов РНК, кодирующей белки Oct4, Sox2, Klf4, с-Мус-2 (Т58А) и Lin28, через день после того, как колонии были собраны и высеяны на покрытый экстрагированной базальной мембраной планшет.
На ФИГ. 3Б показана перепрограммированная клеточная линия, полученная таким же способом, как и на ФИГ. 3А, окрашенная на наличие полипотентных маркеров стволовых клеток Oct4 и SSEA4. На сегменте, обозначенном как ʺХехстʺ, показаны ядра, а на сегменте, обозначенном как ʺСовмещениеʺ показаны совмещенные сигналы от трех каналов.
На ФИГ. 3В показаны первичные человеческие фибробласты, трансфицированные и культивированные как на ФИГ. 3А. Всего было проведено 5 трансфекций. Снимки делали на 7 день. Видно несколько колоний клеток с перепрограммированной морфологией.
На ФИГ. 4А показан образец ткани диаметром 1,5 мм, полученный путем проведения биопсии при помощи дерматома.
На ФИГ. 4Б показан образец ткани, полученный как на ФИГ. 4А и находящийся во взвешенном состоянии на границе раздела воздух-жидкость раствора, содержащего фермент.
На ФИГ. 4В показаны первичные человеческие фибробласты, полученные как на ФИГ. 4А, диссоциированные как на ФИГ. 4Б и высеянные в лунки 96-луночного планшета.
На ФИГ. 5А показаны первичные человеческие фибробласты, перепрограммированные в инсулин-продуцирующие клетки. Клетки фиксировали и окрашивали на наличие инсулина.
На ФИГ. 5Б показаны первичные человеческие фибробласты, перепрограммированные в гемопоэтические клетки. Клетки фиксировали и окрашивали на наличие CD34.
На ФИГ. 5В показаны первичные человеческие фибробласты, перепрограммированные в сократительные сердечные клетки.
На ФИГ. 6А показана передняя цепь матрицы для in vitro транскрипции для получения остова РНК TALEN™.
На ФИГ. 6Б показана матрица с ФИГ. 6А после проведения реакции клонирования Золотые ворота для включения серии повторяющихся мономеров, образующих полную матрицу РНК TALEN™.
На ФИГ. 6В показана 5ʹ-кэпированная, 3ʹ-поли(А)-хвостовая РНК TALEN™, полученная с матрицы с ФИГ. 6Б.
На ФИГ. 7 показана последовательность матрицы с ФИГ. 6Б, где РНК TALEN™ предназначена для связывания с участком ДНК в 20 п.о. и где участки, обозначенные как ʺХ(02)Хʺ, ʺХ(03)Хʺ и так далее, представляют собой повторяющиеся вариабельные домены (ПВД), которые можно выбрать таким образом, чтобы они были нацелены на специфическую последовательность ДНК. Данная матрица кодирует РНК TALEN™, причем первый остаток, который связывает РНК TALEN™, является остатком тимидина независимым от ПВД, и, таким образом, первый ПВД обозначен как ʺХ(02)Хʺ вместо ʺХ(01)Хʺ.
На ФИГ. 8 показаны первичные человеческие фибробласты, генетически отредактированные и перепрограммированные. Стрелки указывают на колонии клеток с перепрограммированной морфологией.
На ФИГ. 9А показан вид спереди на устройство, которое может трансфицировать и/или перепрограммировать клетки в автоматическом или полуавтоматическом режиме.
На ФИГ. 9Б показана задняя панель устройства с ФИГ. 9А.
На ФИГ. 9В показаны основные компоненты устройства с ФИГ. 9А.
На ФИГ. 10А показано комплексирование РНК и трансфекционного реагента в комплексообразующей среде.
На ФИГ. 10Б показаны два способа распределения пре-комплексационных таблеток, содержащих нуклеиновые кислоты.
На ФИГ. 10В показан способ снятия крышки с луночного планшета путем присасывания.
На ФИГ. 10Г показан способ снятия крышки с луночного планшета при помощи зажима.
На ФИГ. 11 показано устройство, которое может трансфицировать и/или перепрограммировать клетки в автоматическом или полуавтоматическом режиме в функциональной комбинации с оборудованием для визуализации, инкубации и других манипуляций с клетками.
Определения
Под ʺмолекулойʺ подразумевается молекулярная частица (молекула, ион, комплекс и т.д.).
Под ʺбелкомʺ подразумевается полипептид.
Под ʺмолекулой РНКʺ подразумевается молекула, которая содержит РНК.
Под ʺсинтетической молекулой РНКʺ подразумевается молекула РНК, которая синтезирована вне клетки или которая синтезирована в клетке при помощи биоинженерии, например, синтезированная путем реакции in vitro транскрипции молекула РНК, синтезированная путем прямого химического синтеза молекула РНК или синтезированная в созданной методами генетической инженерии клетке E. coli молекула РНК.
Под ʺнуклеотидомʺ подразумевается нуклеотид либо его фрагмент или производное, например, нуклеиновое основание, нуклеозид, нуклеотид-трифосфат и т.д.
Под ʺнуклеозидомʺ подразумевается нуклеотид.
Под ʺтрансфекциейʺ подразумевается приведение клетки в контакт с молекулой, при котором молекула поглощается клеткой.
Выражение ʺпри трансфекцииʺ подразумевает во время или после трансфекции.
Под ʺтрансфекционный реагентомʺ подразумевается вещество или смесь веществ, которое связывается с молекулой и способствует доставке молекулы в клетку и/или поглощению молекулы клеткой, например, катионный липид, заряженный полимер или проникающий в клетку пептид.
Под ʺтрансфекцией на основе реагентаʺ подразумевается трансфекция, осуществленная при помощи трансфекционного реагента.
Под ʺклеточной культуральной средойʺ подразумевается среда, которая может быть использована для культивирования клеток, например, среда Игла, модифицированная по способу Дульбекко (DMEM - от англ. ʺDulbeccoʹs Modified Eagleʹs Mediumʺ) или DMEM + 10% фетальной бычьей сыворотки (ФБС).
Под ʺсредой для комплексированияʺ подразумевается среда, в которую добавляют трансфекционный реагент и трансфектируемую молекулу, и в которой трансфекционный реагент связывается с трансфектируемой молекулой.
Под ʺтрансфекционной средойʺ подразумевается среда, которую можно использовать для трансфекции, например, среда Игла, модифицированная по способу Дульбекко (DMEM) или DMEM/F12.
Под ʺрекомбинантным белкомʺ подразумевается белок или пептид который не синтезируется в организме животных или людей. Неограничивающие примеры включают человеческий трансферрин, который синтезируется в бактериях, человеческий фибронектин, который синтезируется в in vitro культуре мышиных клеток, и человеческий сывороточный альбумин, который синтезируется в рисовой культуре.
Под ʺлипидным носителемʺ подразумевается вещество, которое может повысить растворимость липида или липидорастворимой молекулы в водном растворе, например, человеческий сывороточный альбумин или метил-бета-циклодекстрин.
Под ʺбелком Oct4ʺ подразумевается белок, который кодируется геном POU5F1, либо его природный или полученный методами генетической инженерии вариант, представитель семейства, ортолог, фрагмент или конструкция слияния, например, человеческий белок Oct4 (SEQ ID NO: 1), мышиный белок Oct4, белок Oct1, белок, кодируемый псевдогеном 2 POU5F1, ДНК-связывающий домен белка Oct4 или белок слияния Oct4-ЗФБ. В некоторых вариантах реализации изобретения белок Oct4 содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID NO: 1, или, в других вариантах реализации изобретения - по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID NO: 1. В некоторых вариантах реализации изобретения белок Oct4 содержит аминокислотную последовательность, содержащую от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 1. В других вариантах реализации изобретения белок Oct4 содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 1.
Под ʺбелком Sox2ʺ подразумевается белок, который кодируется геном SoX2, либо его природный или полученный методами генетической инженерии вариант, представитель семейства, ортолог, фрагмент или конструкция слияния, например, человеческий белок Sox2 (SEQ ID NO: 2), мышиный белок Sox2, ДНК-связывающий домен белка Sox2 или белок слияния Sox2-ЗФБ. В некоторых вариантах реализации изобретения белок Sox2 содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID NO: 2, или, в других вариантах реализации изобретения - по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID NO: 2. В некоторых вариантах реализации изобретения белок Sox2 содержит аминокислотную последовательность, содержащую от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 2. В других вариантах реализации изобретения белок Sox2 содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 2.
Под ʺбелком Klf4ʺ подразумевается белок, который кодируется геном KLF4, либо его природный или полученный методами генетической инженерии вариант, представитель семейства, ортолог, фрагмент или конструкция слияния, например, человеческий белок Klf4 (SEQ ID NO: 3), мышиный белок Klf4, ДНК-связывающий домен белка Klf4 или белок слияния Klf4-ЗФБ. В некоторых вариантах реализации изобретения белок Klf4 содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID NO: 3, или, в других вариантах реализации изобретения - по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID NO: 3. В некоторых вариантах реализации изобретения белок Klf4 содержит аминокислотную последовательность, содержащую от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 3. В других вариантах реализации изобретения белок Klf4 содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 3.
Под ʺбелком с-Мусʺ подразумевается белок, который кодируется геном MYC, либо его природный или полученный методами генетической инженерии вариант, представитель семейства, ортолог, фрагмент или конструкция слияния, например, человеческий белок с-Мус (SEQ ID NO: 4), мышиный белок с-Мус, белок 1-Мус, белок с-Мус (Т58А), ДНК-связывающий домен белка с-Мус или белок слияния с-Мус-ЗФБ. В некоторых вариантах реализации изобретения белок с-Мус содержит аминокислотную последовательность, которая обладает по меньшей мере 70% идентичности с SEQ ID NO: 4, или, в других вариантах реализации изобретения - по меньшей мере 75%, 80%, 85%, 90% или 95% идентичности с SEQ ID NO: 4. В некоторых вариантах реализации изобретения белок с-Мус содержит аминокислотную последовательность, содержащую от 1 до 20 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 4. В других вариантах реализации изобретения белок с-Мус содержит аминокислотную последовательность, содержащую от 1 до 15 или от 1 до 10 аминокислотных инсерций, делеций или замен (в совокупности) по отношению к SEQ ID NO: 4.
Под ʺперепрограммированиемʺ подразумевается инициация изменения в фенотипе клетки, например, инициация дифференцирования β-клетки-предшественницы в зрелую β-клетку, инициация дедифференцирования фибробласта в полипотентную стволовую клетку, инициация трансдифференцирования кератиноцита в сердечную стволовую клетку или инициация роста аксона нейрона.
Под ʺфактором перепрограммированияʺ подразумевается молекула, которая в случае контакта клетки с этой молекулой и/или экспрессии этой молекулы клеткой, может как отдельно, так и в комбинации с другими молекулами, инициировать перепрограммирование, например, это белок Oct4.
Под ʺфидеромʺ подразумевается клетка, которую можно использовать для улучшения среды или другого способа стимуляции роста других клеток в культуре.
Под ʺкондиционированиемʺ подразумевается приведение одного или более фидеров в контакт со средой.
Под ʺжирной кислотойʺ подразумевается молекула, которая содержит алифатическую цепь, содержащую по меньшей мере два атома углерода, например, линолевая кислота, α-линолевая кислота, октановая кислота, лейкотриен, простагландин, холестерин, глюкокортикоид, резолвин, протектин, тромбоксан, липоксин, марезин, сфинголипид, триптофан, N-ацетил триптофан или их соли, метиловые эфиры или производные.
Под ʺкороткоцепочечной жирной кислотойʺ подразумевается жирная кислота, которая содержит алифатическую цепь, содержащую от двух до 30 атомов углерода.
Под ʺальбуминомʺ подразумевается белок, который является хорошо растворимым в воде, например, человеческий сывороточный альбумин.
Под ʺассоциированной молекулойʺ подразумевается молекула, которая нековалентно связана с другой молекулой.
Под ʺкомпонентом альбумина, содержащим ассоциированные молекулыʺ подразумеваются одна или более молекул, которые связаны с полипептидом альбумина, например, это липиды, гормоны, холестерин, ионы кальция и т.д., которые связаны с полипептидом альбумина.
Под ʺобработанным альбуминомʺ подразумевается альбумин, который обработан для того, чтобы уменьшить, удалить, заменить или каким-либо другим способом инактивировать компонент альбумина, содержащий ассоциированные молекулы, например, это человеческий сывороточный альбумин, который инкубирован при повышенной температуре, человеческий сывороточный альбумин, который приведен в контакт с октаноатом натрия, или человеческий сывороточный альбумин, который приведен в контакт с пористым материалом.
Под ʺионообменной смолойʺ подразумевается вещество, которое при контакте с содержащим ионы раствором может заменить один или более ионов одним или более отличными ионами, например, вещество, которое может заменить один или более ионов кальция одним или более ионами натрия.
Под ʺзародышевой клеткойʺ подразумевается сперматозоид или яйцеклетка.
Под ʺполипотентной стволовой клеткойʺ подразумевается клетка, которая может дифференцироваться в клетки всех трех зародышевых слоев (эндодерма, мезодерма и эктодерма) in vivo.
Под ʺсоматической клеткойʺ подразумевается клетка, которая не является полипотентной стволовой клеткой или зародышевой клеткой, например, клетка кожи.
Под ʺглюкозозависимой инсулин-продуцирующей клеткойʺ подразумевается клетка, которая при воздействии определенной концентрации глюкозы может синтезировать и/или секретировать такое количество инсулина, которое отличается (как в меньшую, так и в большую сторону) от количества инсулина, которое клетка синтезирует и/или секретирует при воздействии другой концентрации глюкозы, например, это β-клетка.
Под ʺгемопоэтической клеткойʺ подразумевается клетка крови или клетка, которая может дифференцироваться в клетку крови, например, гемопоэтическая стволовая клетка или белые кровяные тельца.
Под ʺсердечной клеткойʺ подразумевается клетка сердца или клетка, которая может дифференцироваться в клетку сердца, например, сердечная стволовая клетка или кардиомиоцит.
Под ʺретинальной клеткойʺ подразумевается клетка сетчатки или клетка, которая может дифференцироваться в клетку сетчатки, например, ретинальная пигментная эпителиальная клетка.
Под ʺклеткой кожиʺ подразумевается клетка, которую обычно можно обнаружить в коже, например, фибробласт, кератиноцит, меланоцит, адипоцит, мезенхимная стволовая клетка, жировая стволовая клетка или клетка крови.
Под ʺагонистом Wnt-сигнального путиʺ подразумевается молекула, которая может выполнять одну или более биологических функций одного или более представителей семейства белков Wnt, например, Wnt1, Wnt2, Wnt3, Wnt3a или 2-амино-4-[3,4-(метилендиокси)бензиламино]-6-(3-метоксифенил)пиримидин.
Под ʺагонистом IL-6-сигнального путиʺ подразумевается молекула, которая может выполнять одну или более биологических функций белка IL-6, например, белок IL-6 или рецептор IL-6 (также известный как растворимый рецептор IL-6, IL-6R, IL-6R альфа и т.д.).
Под ʺагонистом TGF-β-сигнального путиʺ подразумевается молекула, которая может выполнять одну или более биологических функций одного или более представителей надсемейства белков TGF-β, например, TGF-β1, TGF-β3, активин А, КМБ-4 или Nodal.
Под ʺиммунодепрессантомʺ подразумевается вещество, которое может подавлять один или более аспектов иммунной системы и которое обычно не присутствует в организме млекопитающего, например, B18R или дексаметазон.
Под ʺгенным редактированиемʺ подразумевается изменение последовательности ДНК клетки.
Под ʺгенно-редактирующим белкомʺ подразумевается белок, который может как отдельно, так и в комбинации с другой молекулой, изменять последовательность ДНК клетки, например, это нуклеаза, транскрипционная активаторо-подобная эффекторная нуклеаза (TALEN - от англ. ʺtranscription activator-like effector nucleaseʺ), цинк-пальцевая нуклеаза, мегануклеаза, никаза, либо его природный или полученный методами генетической инженерии вариант, представитель семейства, ортолог, фрагмент или конструкция слияния.
Под ʺодноцепочечным разрывомʺ подразумевается участок одноцепочечной или двухцепочечной ДНК, на котором в одной из одной или двух цепей были разорваны одна или более ковалентных связей между нуклеотидами.
Под ʺдвухцепочечным разрывомʺ подразумевается участок двухцепочечной ДНК, на котором в каждой из двух цепей были разорваны одна или более ковалентных связей между нуклеотидами.
Сывороточный альбумин является обычным компонентом в бессывороточной клеточной культуральной среде. Недавно было обнаружено, что сывороточный альбумин может подавлять трансфекцию и что добавление необработанного сывороточного альбумина в трансфекционную среду в концентрации, которая обычно используется в бессывороточной клеточной культуральной среде, может привести к низкой эффективности трансфекции и/или низкой жизнеспособности клеток после трансфекции. Полипептид сывороточного альбумина может связываться с большим количеством молекул, включая липиды, ионы, холестерин и т.д., как in vitro, так и in vivo, и в результате как выделенный из крови сывороточный альбумин, так и рекомбинантный сывороточный альбумин содержат полипептидный компонент и компонент, содержащий ассоциированные молекулы. Недавно было обнаружено, что низкая эффективность трансфекции и низкая жизнеспособность клеток после трансфекции, причиной которых является сывороточный альбумин, могут быть частично вызваны компонентом сывороточного альбумина, содержащим ассоциированные молекулы. Также было обнаружено, что эффективность трансфекции можно повысить, а связанную с трансфекцией токсичность снизить путем частичного или полного уменьшения, удаления, замены или инактивации каким-либо другим способом компонента сывороточного альбумина, содержащего ассоциированные молекулы. Определенные варианты реализации изобретения, следовательно, относятся к белку, который обработан таким образом, чтобы уменьшить, удалить, заменить или инактивировать каким-либо другим способом компонент белка, содержащий ассоциированные молекулы.
Определенные варианты реализации изобретения относятся к способу обработки белка путем приведения белка в контакт с одной или более молекулами, которые уменьшают низкую эффективность трансфекции и/или низкую жизнеспособность клеток после трансфекции, причиной которых является белок. Было обнаружено, что приведение сывороточного альбумина в контакт с короткоцепочечной жирной кислотой, октаноатом натрия (также известным как ʺоктановая кислотаʺ, ʺоктаноатʺ, ʺкаприлатʺ или ʺкаприловая кислотаʺ) в некоторых ситуациях уменьшает низкую эффективность трансфекции и низкую жизнеспособность клеток после трансфекции, причиной которых является сывороточный альбумин. Другие вещества, которые можно применять для обработки белка, включают: каприновую кислоту, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, арахидиновую кислоту, бегеновую кислоту, лигноцериновую кислоту, церотиновую кислоту, миристолеиновую кислоту, пальмитолеиновую кислоту, сапиеновую кислоту, олеиновую кислоту, элаидиновую кислоту, вакценовую кислоту, линолевую кислоту, линоэлаидиновую кислоту, альфа-линолевую кислоту, арахидоновую кислоту, эйкозапентаеновую кислоту, эруковую кислоту, докозагексаеновую кислоту, триптофан, N-ацетил триптофан, холестерин, другие жирные кислоты и их соли, смеси, фрагменты и производные. Вещества для обработки белка могут являться чистыми веществами, смесями с точно определенными компонентами либо комплексными смесями или смесями с неопределенными компонентами, такими как масла животного или растительного происхождения, например, рыбий жир. В определенных вариантах реализации изобретения белок обрабатывают после того, как белок очищают. В других вариантах реализации изобретения белок обрабатывают перед тем, как белок очищают. В других вариантах реализации изобретения белок обрабатывают и очищают одновременно. В других вариантах реализации изобретения белок обрабатывают, но не очищают.
Инкубация белка при повышенной температуре может привести к частичной или полной денатурации полипептидного компонента белка, что может уменьшить количество или ликвидировать связывающие участки, которые могут являться критическими для поддержания компонента белка, содержащего ассоциированные молекулы. Определенные варианты реализации изобретения, следовательно, относятся к способу обработки белка путем инкубации белка при повышенной температуре. В одном варианте реализации изобретения белок инкубируют при температуре, составляющей по меньшей мере 40°С, на протяжении по меньшей мере около 10 мин. В другом варианте реализации изобретения белок инкубируют при температуре, составляющей по меньшей мере 50°С, на протяжении по меньшей мере около 10 минут. В другом варианте реализации изобретения белок инкубируют при температуре, составляющей по меньшей мере 55°С, на протяжении по меньшей мере около 30 мин. В одном варианте реализации изобретения белок приводят в контакт с октаноатом натрия, а потом инкубируют при около 60°С на протяжении нескольких часов, например между около 1 ч и около 24 ч, или между около 2 ч и около 6 ч. В другом варианте реализации изобретения концентрация октаноата натрия составляет между около 5 мМ и около 50 мМ, или между около 10 мМ и около 40 мМ. В определенных вариантах реализации изобретения октаноат натрия заменяют или применяют в комбинации с по меньшей мере одним элементом из каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты, арахидиновой кислоты, бегеновой кислоты, лигноцериновой кислоты, церотиновой кислоты, миристолеиновой кислоты, пальмитолеиновой кислоты, сапиеновой кислоты, олеиновой кислоты, элаидиновой кислоты, вакценовой кислоты, линолевой кислоты, линоэлаидиновой кислоты, альфа-линолевой кислоты, арахидоновой кислоты, эйкозапентаеновой кислоты, эруковой кислоты, докозагексаеновой кислоты, триптофана, N-ацетил триптофана и холестерина или их солей, смесей, фрагментов и производных.
Гликирование и гликозилирование являются процессами, при помощи которых одна или более молекул Сахаров связываются с белком. Гликирование и гликозилирование могут влиять на связывающие свойства белка, а сывороточный альбумин содержит несколько потенциальных участков гликирования. Определенные варианты реализации изобретения, следовательно, относятся к способу обработки белка путем гликирования или гликозилирования белка.
Ионообменные смолы, включая анионообменные, катионообменные и смешанные смолы, обычно применяют для деионизации растворов. Содержащий ассоциированные молекулы компонент белков, таких как сывороточный альбумин, может содержать ионы. Определенные варианты реализации изобретения, следовательно, относятся к способу обработки белка путем приведения белка в контакт с одной или более ионообменными смолами. В одном варианте реализации изобретения одна или более из ионообменных смол содержит смешанную смолу, содержащую функциональные группы с протонными (Н+) и гидроксильными (ОН-) формами. В другом варианте реализации изобретения одна или более из ионообменных смол содержит индикатор, который изменяет цвет, когда смола насыщается ионами. Дополнительно к приведению в контакт с одной или более ионообменными смолами можно использовать другие способы для того, чтобы уменьшить, удалить, заменить или инактивировать каким-либо другим способом компонент белка, содержащий ассоциированные молекулы, включая приведение белка в контакт с древесным углем, который может быть активирован и/или обработан химическим веществом, таким как сульфат декстрана, диализ (включая разбавление, приводящее к деассоциации компонента белка, содержащего ассоциированные молекулы, с или без последующего удаления деассоциированных молекул из раствора), кристаллизацию, хроматографию, электрофорез, тепловую обработку, низкотемпературную обработку, обработку растворами с высоким уровнем pH, обработку растворами с низким уровнем pH, преципитацию органическими растворителями и афинную очистку.
Определенные способы обработки белка могут предпочтительно уменьшить, удалить, заменить или инактивировать каким-либо другим способом специфические типы молекул. Следовательно, в определенных ситуациях может быть выгодным комбинировать два или более способов обработки белка для того, чтобы уменьшить низкую эффективность трансфекции и/или низкую жизнеспособность клеток после трансфекции, причиной которых является белок. Определенные варианты реализации изобретения, следовательно, относятся к способу обработки белка, в котором применяются два или более способов для того, чтобы уменьшить, удалить, заменить или инактивировать каким-либо другим способом компонент белка, содержащий ассоциированные молекулы. В одном варианте реализации изобретения белок приводят в контакт с одной или более ионообменными смолами и активированным древесным углем. В другом варианте реализации изобретения белок приводят в контакт с октаноатом натрия, инкубируют при повышенной температуре, приводят в контакт с одной или более ионообменными смолами и приводят в контакт с активированным древесным углем. В другом варианте реализации изобретения белок является сывороточным альбумином, а повышенная температура составляет по меньшей мере около 50°С.
Определенные элементы компонента белка, содержащего ассоциированные молекулы, могут оказаться полезными для клеток в культуре и/или для трансфекции, например, это некоторые резолвины, протектины, липоксины, марезины, эйкозаноиды, простациклины, тромбоксаны, лейкотриены, циклопентенон простагландины и глюкокортикоиды. Определенные варианты реализации изобретения, следовательно, относятся к способу обработки белка для того, чтобы уменьшить, удалить, заменить или инактивировать каким-либо другим способом компонент белка, содержащий ассоциированные молекулы, без уменьшения, удаления, замены или инактивации каким-либо другим способом одного или более из полезных элементов компонента белка, содержащего ассоциированные молекулы. Другие варианты реализации изобретения относятся к способу обработки белка для того, чтобы уменьшить, удалить, заменить или инактивировать каким-либо другим способом компонент белка, содержащий ассоциированные молекулы, и дополнительного приведения белка в контакт с одной или более молекулами, содержащими один или более полезных элементов компонента белка, содержащего ассоциированные молекулы.
Другие варианты реализации изобретения относятся к способу обработки белка для того, чтобы уменьшить низкую эффективность трансфекции и/или низкую жизнеспособность клеток после трансфекции, причиной которых является белок, путем приведения белка в контакт с одной или более молекулами, содержащими один или более полезных элементов компонента белка, содержащего ассоциированные молекулы. Другие варианты реализации изобретения относятся к способу повышения эффективности трансфекции и/или повышения жизнеспособности клеток после трансфекции путем приведения клетки в контакт с одной или более молекулами, содержащими один или более полезных элементов компонента белка, содержащего ассоциированные молекулы. В одном варианте реализации изобретения белок приводят в контакт с одной или более ионообменными смолами или древесным углем и дополнительно приводят в контакт с глюкокортикоидом, таким как гидрокортизон, преднизон, преднизолон, метилпреднизолон, дексаметазон или бетаметазон. В другом варианте реализации изобретения клетку приводят в контакт с глюкокортикоидом, таким как гидрокортизон, преднизон, преднизолон, метилпреднизолон, дексаметазон или бетаметазон. Дополнительно было обнаружено, что в определенных ситуациях добавление в трансфекционную среду одного или более стероидов и/или одного или более антиоксидантов может повысить эффективность трансфекции, эффективность перепрограммирования и эффективность генного редактирования. Определенные варианты реализации изобретения, следовательно, относятся к способу индукции экспрессии клеткой представляющего интерес белка путем культивирования клетки в среде, содержащей стероид и приведения клетки в контакт с одной или более синтетическими молекулами РНК. В одном варианте реализации изобретения стероид является гидрокортизоном. В другом варианте реализации изобретения гидрокортизон присутствует в среде в концентрации между около 0,1 мкМ и около 10 мкМ или около 1 мкМ. Другие варианты реализации изобретения относятся к способу индукции экспрессии клеткой представляющего интерес белка путем культивирования клетки в среде, содержащей антиоксидант и приведения клетки в контакт с одной или более синтетическими молекулами РНК. В одном варианте реализации изобретения антиоксидант является аскорбиновой кислотой или аскорбиновой кислотой-2-фосфатом. В другом варианте реализации изобретения аскорбиновая кислота или аскорбиновая кислота-2-фосфат присутствует в среде в концентрации между около 0,5 мг/Л и около 500 мг/Л, включая около 50 мг/Л. Другие варианты реализации изобретения относятся к способу перепрограммирования и/или генного редактирования клетки путем культивирования клетки в среде, содержащей стероид и/или антиоксидант и приведения клетки в контакт с одной или более синтетическими молекулами РНК, при этом одна или более из синтетических молекул РНК кодирует один или более перепрограммирующих и/или генно-редактирующих белков. В определенных вариантах реализации изобретения клетка изначально присутствует в организме, а стероид и/или антиоксидант доставляют в организм.
Сообщалось, что добавление в среду для комплексирования трансферрина в определенных ситуациях повышает эффективность плазмидной трансфекции. Недавно было обнаружено, что добавление трансферрина в среду для комплексирования также может повысить эффективность трансфекции синтетическими молекулами РНК. Определенные варианты реализации изобретения, следовательно, относятся к способу индукции экспрессии клеткой представляющего интерес белка путем добавления одной или более синтетических молекул РНК и трансфекционного реагента в раствор, содержащий трансферрин. В одном варианте реализации изобретения трансферрин присутствует в растворе в концентрации между около 1 мг/Л и около 100 мг/Л, например, около 5 мг/Л. В другом варианте реализации изобретения трансферрин является рекомбинантным.
Другие варианты реализации изобретения относятся к среде, содержащей белок, который обработан согласно одному или более способам настоящего изобретения. В определенных вариантах реализации изобретения белок обрабатывают до того, как его смешивают с одним или более другими ингредиентами среды. В одном варианте реализации изобретения среда является трансфекционной средой. В другом варианте реализации изобретения данная среда также способствует эффективной трансфекции и высокой жизнеспособности клеток. В определенных вариантах реализации изобретения белок и одну или более молекул, которые уменьшают низкую эффективность трансфекции и/или низкую жизнеспособность клеток после трансфекции, причиной которых является белок, добавляют в среду независимо друг от друга. В одном варианте реализации изобретения белок обрабатывают до того, как его смешивают с одним или более других ингредиентов среды. В другом варианте реализации изобретения среду готовят, обрабатывая сначала концентрированный раствор сывороточного альбумина путем приведения концентрированного раствора сывороточного альбумина в контакт с одной или более ионообменными смолами, затем удаляя одну или более ионообменных смол из концентрированного раствора сывороточного альбумина, и затем добавляя обработанный концентрированный раствор сывороточного альбумина к другим компонентам среды. В другом варианте реализации изобретения концентрированный раствор сывороточного альбумина дополнительно приводят в контакт с древесным углем перед тем, как добавить обработанный концентрированный раствор сывороточного альбумина к другим компонентам среды. В другом варианте реализации изобретения концентрированный раствор сывороточного альбумина сначала приводят в контакт с октаноатом натрия, затем нагревают до температуры по меньшей мере около 50°С на протяжении по меньшей мере 10 минут, затем приводят в контакт с одной или более ионообменными смолами, затем приводят в контакт с активированным древесным углем, а затем добавляют к другим компонентам среды.
Недавно было обнаружено, что трансфекция клеток с применением среды, содержащей буферный солевой раствор, аминокислоты, холестерин, гидрокортизон и сывороточный альбумин, может привести к эффективной трансфекции, и что трансфекция клеток с применением среды, в значительной степени, состоящей из буферного солевого раствора, аминокислот, инсулина, трансферрина, холестерина, гидрокортизона, сывороточного альбумина и фактора роста фибробластов, может привести к эффективной трансфекции и эффективному перепрограммированию. Определенные варианты реализации изобретения, следовательно, относятся к трансфекционной среде, содержащей: буферный солевой раствор, аминокислоты, холестерин, гидрокортизон и сывороточный альбумин. Другие варианты реализации изобретения относятся к трансфекционной среде, в значительной степени состоящей из и/или содержащей: буферный солевой раствор, аминокислоты, инсулин, трансферрин, холестерин, гидрокортизон, сывороточный альбумин и фактор роста фибробластов. Другие варианты реализации изобретения относятся к перепрограммирующей среде, в значительной степени состоящей из и/или содержащей: буферный солевой раствор, аминокислоты, инсулин, трансферрин, холестерин, гидрокортизон, сывороточный альбумин и фактор роста фибробластов. В одном варианте реализации изобретения среда также содержит полиоксиэтиленсорбитан моноолеат и/или D-альфа-токоферола ацетат. В другом варианте реализации изобретения среда также содержит аскорбиновую кислоту или аскорбиновую кислоту-2-фосфат, например, в концентрации между около 1 мг/Л и около 100 мг/Л. В одном варианте реализации изобретения гидрокортизон присутствует в концентрации около 1 мкМ. В другом варианте реализации изобретения фактор роста фибробластов является основным фактором роста фибробластов, и основной фактор роста фибробластов присутствует в концентрации между около 1 нг/мЛ и около 200 нг/мЛ, например, между около 4 нг/мЛ и около 100 нг/мЛ, или между около 10 нг/мЛ и около 50 нг/мЛ, или около 20 нг/мЛ. В одном варианте реализации изобретения сывороточный альбумин является человеческим сывороточным альбумином, и человеческий сывороточный альбумин присутствует в концентрации между около 0,05% и около 2%, включая между около 0,1% и около 1%, например, около 0,5%. В другом варианте реализации изобретения человеческий сывороточный альбумин является рекомбинантным. В другом варианте реализации изобретения холестерин присутствует в концентрации около 4,5 мг/Л. В одном варианте реализации изобретения среда не содержит компонентов животного происхождения. В другом варианте реализации изобретения среда не содержит компонентов с неопределенным составом, например, жирных кислот рыбьего жира или сыворотки. В одном варианте реализации изобретения среда содержит ингибитор TGF-β, например, А83-01 или SB431542. В одном варианте реализации изобретения ингибитор TGF-β присутствует в концентрации между около 0,1 мкМ и около 10 мкМ. В одном варианте реализации изобретения среда содержит агонист Wnt-сигнального пути, такой как Wnt3a. В другом варианте реализации изобретения агонист Wnt-сигнального пути присутствует в концентрации между около 10 нг/мЛ и около 500 нг/мЛ, включая между около 50 нг/мЛ и около 200 нг/мЛ. В одном варианте реализации изобретения среда содержит источник селена, такой как селенит натрия.
В определенных ситуациях может возникать необходимость замены компонентов животного происхождения на компоненты неживотного происхождения и/или рекомбинантные компоненты, частично по причине того, что компоненты неживотного происхождения и/или рекомбинантные компоненты можно получать с более высокой степенью выдержанности, чем компоненты животного происхождения, и частично по причине того, что риск загрязнения компонентов неживотного происхождения и/или рекомбинантных компонентов токсичными и/или патогенными веществами меньше, чем для компонентов животного происхождения. Определенные варианты реализации изобретения, следовательно, относятся к белку, который имеет неживотное происхождение и/или является рекомбинантным. Другие варианты реализации изобретения относятся к среде, отличающейся тем, что некоторые или все компоненты данной среды имеют неживотное происхождение и/или являются рекомбинантными. В одном варианте реализации изобретения белок является рекомбинантным сывороточным альбумином. В другом варианте реализации изобретения белок является рекомбинантным человеческим сывороточным альбумином. В другом варианте реализации изобретения белок является рекомбинантным сывороточным альбумином, а все компоненты среды имеют неживотное происхождение и/или являются рекомбинантными.
N-конец сывороточного альбумина может содержать никель- и медь-связывающий домен, который может являться важной антигенной детерминантой. Удаление остатка аспарагиновой кислоты с N-конца сывороточного альбумина может исключить никель- и медь-связывающую активность сывороточного альбумина и привести к образованию гипоаллергенного варианта белка. Определенные варианты реализации изобретения, следовательно, относятся к белку с модифицированными связывающими характеристиками и/или другими необходимыми характеристиками, таким как гипоаллергенность. В одном варианте реализации изобретения белок является сывороточным альбумином, а в сывороточном альбумине отсутствует N-концевая аспарагиновая кислота.
Другие варианты реализации изобретения относятся к способу трансфекции клетки. В одном варианте реализации изобретения клетку трансфицируют одной или более нуклеиновыми кислотами, а трансфекцию проводят при помощи трансфекционного реагента, такого как трансфекционный реагент на липидной основе. В одном варианте реализации изобретения одна или более нуклеиновых кислот включает по меньшей мере одну молекулу РНК. В другом варианте реализации изобретения клетку трансфицируют одной или более нуклеиновыми кислотами, а одна или более нуклеиновых кислот кодирует по меньшей мере один элемент из: р53, TERT, цитокина, секретируемого белка, мембраносвязанного белка, фермента, генно-редактирующего белка, хроматин-модифицирующего белка, ДНК-связывающего белка, транскрипционного фактора, гистондеацетилазы, патоген-ассоциированного молекулярного паттерна и опухолеассоциированного антигена, либо его биологически активный фрагмент, аналог, вариант или представителя семейства. В другом варианте реализации изобретения клетку трансфицируют многократно, например, по меньшей мере 2 раза на протяжении около 10 последовательных дней, или по меньшей мере 3 раза на протяжении около 7 последовательных дней, или по меньшей мере 4 раза на протяжении около 6 последовательных дней.
Перепрограммирование можно проводить при помощи трансфекции клеток одной или более нуклеиновыми кислотами, кодирующими один или более перепрограммирующих факторов, и культивирования клеток в среде, которая поддерживает жизнедеятельность перепрограммированных клеток. Примеры перепрограммирующих факторов включают, но не ограничиваются этим: белок Oct4, белок Sox2, белок Klf4, белок с-Мус, белок 1-Мус, белок TERT, белок Nanog, белок Lin28, белок Utf1, белок Aicda, микро-РНК miR200, микро-РНК miR302, микро-РНК miR367, микро-РНК miR369 и их биологически активные фрагменты, аналоги, варианты или представителей семейств. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клетки. В одном варианте реализации изобретения клетку перепрограммируют путем трансфекции клетки одной или более нуклеиновыми кислотами, кодирующими один или более перепрограммирующих факторов. В одном варианте реализации изобретения одна или более нуклеиновых кислот включает молекулу РНК, которая кодирует белок Oct4. В другом варианте реализации изобретения одна или более нуклеиновых кислот также включает одну или более молекул РНК, которая кодирует белок Sox2, белок Klf4 и белок с-Мус. В другом варианте реализации изобретения одна или более нуклеиновых кислот также включает молекулу РНК, которая кодирует белок Lin28. В одном варианте реализации изобретения клетка является человеческой клеткой кожи, а человеческую клетку кожи перепрограммируют в полипотентную стволовую клетку. В другом варианте реализации изобретения клетка является человеческой клеткой кожи, а человеческую клетку кожи перепрограммируют в глюкозозависимую инсулин-продуцирующую клетку. Примеры других клеток, которые можно перепрограммировать, и других клеток, в которые клетку можно перепрограммировать, включают, но не ограничиваются этим: клетки кожи, полипотентные стволовые клетки, мезенхимные стволовые клетки, β-клетки, ретинальные пигментные эпителиальные клетки, гемопоэтические клетки, сердечные клетки, эпителиальные клетки верхних дыхательных путей, нейральные стволовые клетки, нейроны, глиальные клетки, костные клетки, клетки крови и стволовые клетки зубной пульпы. В других вариантах реализации изобретения клетку культивируют в среде, которая поддерживает жизнедеятельность перепрограммированной клетки. В одном варианте реализации изобретения среда также поддерживает жизнедеятельность клетки.
Сообщалось о важном факте, который состоит в том, что инфицирование клеток вирусами, кодирующими Oct4, Sox2, Klf4 и с-Мус в комбинации с культивированием клеток в среде, которая способствует росту кардиомиоцитов, приводит к перепрограммированию клеток кожи в кардиомиоциты без предварительного перепрограммирования клеток кожи в полипотентные стволовые клетки (Смотрите Efs et al Nat Cell Biol. 2011; 13:215-22, содержание которой включено в данный текст посредством ссылки). В определенных ситуациях, например, при разработке индивидуального терапевтического препарата, может быть необходимым прямое перепрограммирование (перепрограммирование одной соматической клетки в другую соматическую клетку без предварительного перепрограммирования соматической клетки в полипотентную стволовую клетку, также известное как ʺтрансдифференцировкаʺ), частично из-за того, что культивирование полипотентных стволовых клеток может требовать продолжительного времени и высоких затрат, дополнительная обработка, требуемая для создания и оценки стабильной линии полипотентных стволовых клеток, может нести повышенный риск загрязнения, а дополнительное время в процессе культивирования, связанное с изначальным получением полипотентных стволовых клеток, может нести повышенный риск геномной нестабильности и появления мутаций, включая точечные мутации, вариации числа копий и кариотипические нарушения. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования соматической клетки, в котором клетку перепрограммируют в соматическую клетку, и в котором не формируется характерная линия полипотентных стволовых клеток.
Известные ранее способы перепрограммирования клеток путем их трансфекции РНК, кодирующей перепрограммирующие факторы, требуют применения фидеров. Во многих ситуациях применение фидеров может быть нежелательным, частично потому, что фидеры могут быть получены из животных иди алогенных ресурсов и, таким образом, могут нести риск иммуногенности и загрязнения патогенами. Недавно было обнаружено, что с помощью среды, являющейся объектом настоящего изобретения, можно осуществить перепрограммирование РНК в отсутствие фидеров. Дополнительно было обнаружено, что перепрограммирование клеток согласно способам настоящего изобретения, в котором клетки не приводят в контакт с фидерами, может быть быстрым, эффективным и надежным. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клетки, в котором клетку не приводят в контакт с фидерами.
Недавно было обнаружено, что эффективность перепрограммирования может коррелировать с начальной плотностью клеток, в случае, когда клетки перепрограммируют согласно способам настоящего изобретения. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клеток, в котором клетки высевают с плотностью между около 100 клеток/см2 и около 100,000 клеток/см2. В одном варианте реализации изобретения клетки высевают с плотностью между около 100 клеток/см2 и около 10,000 клеток/см2, или между около 2000 клеток/см2 и около 20,000 клеток/см2, или между около 1000 клеток/см2 и около 2000 клеток/см2.
Дополнительно было обнаружено, что в некоторых ситуациях для перепрограммирования клетки согласно способам настоящего изобретения может требоваться меньшее общее количество трансфекций, чем при других способах. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клетки, в котором на протяжении около 20 последовательных дней проводят от около 2 до около 12 трансфекций, или на протяжении около 15 последовательных дней проводят от около 4 до около 10 трансфекций, или на протяжении около 10 последовательных дней проводят от около 4 до около 8 трансфекций. Известно, что когда в среду, в которой культивируют клетку, добавляют нуклеиновые кислоты, с большей вероятностью может произойти контакт и/или поглощение клеткой более чем одной молекулы нуклеиновой кислоты как одновременно, так и в разное время. Соответственно, клетка может контактировать с нуклеиновой кислотой более одного раза, т.е., неоднократно, даже в случае, когда нуклеиновые кислоты только один раз добавляют в среду, в которой культивируют клетку.
Фидеры могут способствовать адгезии клеток к поверхности, секретируя молекулы, такие как коллаген, которые связываются с поверхностью (ʺмолекулы клеточной адгезииʺ). Белки, включая интегрины, находясь на поверхности клеток, могут связываться с этими молекулами клеточной адгезии, что может привести к прикреплению клеток к поверхности. Недавно было обнаружено, что клетки можно перепрограммировать, в том числе в отсутствие фидеров, при помощи покрытия поверхности одной или более молекулами клеточной адгезии. Дополнительно было обнаружено, что такие молекулы клеточной адгезии как фибронектин и витронектин особенно хорошо подходят для этой цели. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции, перепрограммирования и/или генного редактирования клетки, в котором клетку приводят в контакт с поверхностью, которую приводят в контакт с одной или более молекулами клеточной адгезии. В одном варианте реализации изобретения одна или более из молекул клеточной адгезии включает по меньшей мере одно соединение из: поли-L-лизина, поли-L-орнитина, RGD-пептида, фибронектина, витронектина, коллагена и ламинина, либо его биологически активный фрагмент, аналог, вариант или представителя семейства. В другом варианте реализации изобретения одна или более из молекул клеточной адгезии является фибронектином или его биологически активным фрагментом. В другом варианте реализации изобретения фибронектин является рекомбинантным. В другом варианте реализации изобретения одна или более из молекул клеточной адгезии представляют собой смесь фибронектина и витронектина или их биологически активных фрагментов. В другом варианте реализации изобретения фибронектин и витронектин каждый присутствуют на поверхности в концентрации около 100 нг/см2 или в растворе, который применяют для покрытия поверхности, в концентрации около 1 мкг/мЛ. В другом варианте реализации изобретения фибронектин и витронектин являются рекомбинантными. Приведение поверхности в контакт с одной или более молекулами клеточной адгезии можно проводить как независимый этап и/или путем добавления одной или более молекул клеточной адгезии в среду.
Следует отметить, что нуклеиновые кислоты могут содержать один или более неканонических или ʺмодифицированныхʺ остатков (например, остатков, которые не являются аденином, гуанином, тимином, урацилом и цитозином или их стандартными нуклеозидными, нуклеотидными, дезоксинуклеозидными или дезоксинуклеотидными производными). В особенности следует отметить, что уридин-5ʹ-трифосфат можно заменить на псевдоуридин-5ʹ-трифосфат в реакции in vitro транскрипции, чтобы получить синтетическую РНК, отличающуюся тем, что до 100% остатков уридина синтетической РНК можно заменить остатками псевдоуридина. При помощи in vitro транскрипции можно получить РНК с иммуногенностью остатков, даже когда уридин и цитидин полностью заменены псевдоуридином и 5-метилцитидином соответственно (Смотрите Angel Reprogramming Human Somatic Cells to Pluripotency Using RNA [Doctoral Thesis]. Cambridge, MA: MIT; 2011, содержание которой включено в данный текст посредством ссылки). По этой причине при трансфекции клеток РНК обычно применяют добавление в трансфекционную среду иммунодепрессанта. В некоторых ситуациях добавление в трансфекционную среду иммунодепрессанта может быть нежелательным, частично из-за того, что наиболее часто применяемый для этой цели рекомбинантный иммунодепрессант B18R может быть дорогостоящим и труднопроизводимым. Недавно было обнаружено, что клетки можно трансфицировать и/или перепрограммировать согласно способам настоящего изобретения без применения B18R или любого другого иммунодепрессанта. Дополнительно было обнаружено, что перепрограммирование клеток согласно способам настоящего изобретения без применения иммунодепрессантов может быть быстрым, эффективным и надежным. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции клетки, в котором трансфекционная среда не содержит иммунодепрессант. Другие варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клетки, в котором трансфекционная среда не содержит иммунодепрессант. В определенных ситуациях, например, при применении высокой клеточной плотности, добавление иммунодепрессанта в трансфекционную среду может быть полезным. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции клетки, в котором трансфекционная среда содержит иммунодепрессант. Другие варианты реализации изобретения относятся к способу перепрограммирования клетки, в котором трансфекционная среда содержит иммунодепрессант. В одном варианте реализации изобретения иммунодепрессант является B18R либо его биологически активным фрагментом, аналогом, вариантом или представителем семейства или дексаметазоном либо его производным. В одном варианте реализации изобретения клетки высевают с плотностью, составляющей менее чем около 20,000 клеток/см2, а трансфекционная среда не содержит иммунодепрессант. В другом варианте реализации изобретения трансфекционная среда не содержит иммунодепрессант, а дозировку нуклеиновой кислоты подбирают так, чтобы избежать излишней токсичности. В другом варианте реализации изобретения дозировка нуклеиновой кислоты составляет менее чем 2 мкг/лунку 6-луночного планшета, например, около 0,25 мкг/лунку 6-луночного планшета или около 1 мкг/лунку 6-луночного планшета.
Перепрограммированные клетки, полученные согласно определенным способам настоящего изобретения, подходят для терапевтических применений, включая трансплантацию пациентам, так как они не содержат экзогенных последовательностей ДНК и не подвержены действию продуктов животного или человеческого происхождения, состав которых может быть неопределенным, и которые могут содержать токсичные и/или патогенные примеси. Более того, высокая скорость, эффективность и надежность определенных способов настоящего изобретения может снизить риск появления и накопления мутаций и других хромосомных аномалий. Определенные варианты реализации настоящего изобретения можно, таким образом, применять для получения клеток с приемлемым профилем безопасности для применения в терапевтических целях. Например, путем перепрограммирования клеток при помощи РНК и среды согласно настоящему изобретению, отличающейся тем, что среда не содержит компонентов животного или человеческого происхождения, можно получить клетки, которые не подвергались действию аллогенных веществ. Определенные варианты реализации изобретения, следовательно, относятся к перепрограммированным клеткам, которые имеют необходимый профиль безопасности. В одном варианте реализации изобретения перепрограммированная клетка обладает нормальным кариотипом. В другом варианте реализации изобретения перепрограммированная клетка содержит менее чем около 5 вариаций числа копий (ВЧК) по сравнению с геномом пациента, например, менее чем около 3 вариаций числа копий по сравнению с геномом пациента, или не содержит вариаций числа копий по сравнению с геномом пациента. В другом варианте реализации изобретения перепрограммированная клетка обладает нормальным кариотипом и содержит менее чем около 100 одиночных нуклеотидных вариантов на кодирующих участках по сравнению с геномом пациента, или менее чем около 50 одиночных нуклеотидных вариантов на кодирующих участках по сравнению с геномом пациента, или менее чем около 10 одиночных нуклеотидных вариантов на кодирующих участках по сравнению с геномом пациента.
Эндотоксины и нуклеазы могут проходить совместную очистку и/или связываться с другими белками, такими как сывороточный альбумин. В частности, рекомбинантные белки могут содержать высокие уровни ассоциированных эндотоксинов и нуклеаз, частично из-за лизиса клеток, который может происходить во время их получения. Эндотоксины и нуклеазы можно уменьшить в количестве, удалить, заменить или каким-либо другим способом инактивировать при помощи многих способов настоящего изобретения, включая, например, ацетилирование, добавление стабилизатора, такого как октаноат натрия с последующей тепловой обработкой, добавление ингибиторов нуклеазы в раствор альбумина и/или среду, кристаллизацию, приведение в контакт с одной или более ионообменными смолами, приведение в контакт с древесным углем, препаративный электрофорез или аффинную хроматографию. Недавно было обнаружено, что частичное или полное уменьшение количества, удаление, замена или инактивация каким-либо другим способом эндотоксинов и/или нуклеаз в среде и/или в одном или более компонентах среды может повысить эффективность, с которой клетки могут быть трансфицированы и перепрограммированы. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции клетки одной или более нуклеиновыми кислотами, в котором трансфекционную среду обрабатывают для того, чтобы частично либо полностью уменьшить в количестве, удалить, заменить или каким-либо другим способом инактивировать один или более эндотоксинов и/или нуклеаз. Другие варианты реализации изобретения относятся к среде, в которой происходит минимальная деградация нуклеиновых кислот. В одном варианте реализации изобретения данная среда содержит менее чем около 1 единицы эндотоксина на мЛ, или менее чем около 0,1 единицы эндотоксина на мЛ, или менее чем около 0,01 единицы эндотоксина на мЛ.
В определенных ситуациях липидные носители на белковой основе, такие как сывороточный альбумин, можно заменить липидными носителями на небелковой основе, такими как метил-бета-циклодекстрин. Среду, являющуюся объектом настоящего изобретения, также можно применять без липидного носителя, например, когда трансфекцию проводят способом, который может не требовать или для которого может не быть выгодным присутствие липидного носителя, например, при использовании одного или более трансфекционных реагентов на полимерной основе или трансфекционных реагентов на белковой основе.
Многие ассоциированные с белком молекулы, такие как металлы, могут быть высокотоксичными для клеток. Эта токсичность может являться причиной сниженной жизнеспособности в культуре, а также появления мутаций. Определенные варианты реализации изобретения, следовательно, имеют дополнительное преимущество, состоящее в получении клеток, в которых отсутствуют токсичные молекулы.
Компонент белка, содержащий ассоциированные молекулы можно оценить путем растворения белка в растворе и измерения проводимости раствора. Определенные варианты реализации изобретения, следовательно, относятся к среде, содержащей белок, в которой приблизительно 10% раствор белка в воде имеет проводимость менее чем около 500 мкСм/см. В одном варианте реализации изобретения раствор имеет проводимость менее чем около 50 мкСм/см.
Окружающая среда с низким содержанием кислорода может быть благоприятной для культивирования многих типов клеток. Определенные варианты реализации изобретения, следовательно, относятся к способу культивирования, трансфекции, перепрограммирования и/или генного редактирования клеток, в котором клетки культивируют, трансфицируют, перепрограммируют и/или генетически редактируют в среде с низким содержанием кислорода. В одном варианте реализации изобретения среда с низким содержанием кислорода содержит между около 2% и около 10% кислорода или между около 4% и около 6% кислорода.
Количество доставленной в клетки нуклеиновой кислоты можно увеличить для того, чтобы увеличить необходимый эффект от нуклеиновой кислоты. При этом увеличение количества доставленной в клетки нуклеиновой кислоты выше определенной величины может привести к снижению жизнеспособности клеток, частично по причине токсичности трансфекционного реагента. Недавно было обнаружено, что когда нуклеиновую кислоту доставляют в клеточную популяцию в фиксированном объеме (например, клетки на участке ткани или клетки, выращенные в емкости для культивирования клеток), количество доставляемой в каждую клетку нуклеиновой кислоты может зависеть от общего количества нуклеиновой кислоты, доставляемой в клеточную популяцию, и от плотности клеток, когда более высокая плотность клеток приводит к меньшему количеству доставляемой в каждую клетку нуклеиновой кислоты. В определенных вариантах реализации изобретения клетку трансфицируют одной или более нуклеиновыми кислотами более одного раза. В определенных условиях, например, в случае пролиферации клеток, плотность клеток может изменяться от одной трансфекции к следующей. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции клетки нуклеиновой кислотой, в котором клетку трансфицируют более одного раза и в котором количество доставляемой в клетку нуклеиновой кислоты отличается для двух трансфекций. В одном варианте реализации изобретения клетка пролиферирует между двумя трансфекциями, а количество доставляемой в клетку нуклеиновой кислоты является большим для второй из двух трансфекций, чем для первой из двух трансфекций. В другом варианте реализации изобретения клетку трансфицируют более двух раз, а количество доставляемой в клетку нуклеиновой кислоты является большим для второй из трех трансфекций, чем для первой из тех же трех трансфекций, и количество доставляемой в клетку нуклеиновой кислоты является большим для третьей из тех же трех трансфекций, чем для второй из тех же трех трансфекций. В другом варианте реализации изобретения клетку трансфицируют более одного раза, а максимальное количество доставляемой в клетку во время каждой трансфекции нуклеиновой кислоты является в достаточной мере низким для того, чтобы достичь приблизительно 80% жизнеспособности для по меньшей мере двух последовательных трансфекций.
Недавно было обнаружено, что изменение количества нуклеиновой кислоты, доставляемой в популяцию пролиферирующих клеток на протяжении ряда трансфекций, может привести как к повышенной эффективности нуклеиновой кислоты, так и повышенной жизнеспособности клеток. Дополнительно было обнаружено, что в некоторых ситуациях, когда клетки приводят в контакт с одной или более нуклеиновыми кислотами, кодирующими один или более перепрограммирующих факторов на протяжении ряда трансфекций, эффективность перепрограммирования можно повысить, если количество нуклеиновой кислоты, доставляемой во время более поздних трансфекций, является большим, чем количество нуклеиновой кислоты, доставляемой во время более ранних трансфекций, по меньшей мере для части трансфекций. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клеток, в котором одну или более нуклеиновых кислот неоднократно доставляют в клетку на протяжении ряда трансфекций, а количество доставляемой в клетку нуклеиновой кислоты является большим для по меньшей мере одной из более поздних трансфекций, чем для по меньшей мере одной из более ранних трансфекций. В одном варианте реализации изобретения клетку трансфицируют от около 2 до около 10 раз, или от около 3 до около 8 раз, или от около 4 до около 6 раз. В другом варианте реализации изобретения одна или более нуклеиновых кислот включают по меньшей мере одну молекулу РНК, клетку трансфицируют от около 2 до около 10 раз, а количество нуклеиновой кислоты, доставляемой в клетку во время каждой трансфекции, является одинаковым или большим, чем количество нуклеиновой кислоты, доставляемой в клетку во время наиболее поздней из предыдущих трансфекций. В другом варианте реализации изобретения количество нуклеиновой кислоты, доставляемой в клетку во время первой трансфекции, составляет между около 20 нг/см2 и около 250 нг/см2 или между около 100 нг/см2 и около 600 нг/см2. В другом варианте реализации изобретения клетку трансфицируют около 5 раз с интервалами, составляющими от около 12 до около 48 ч, а количество нуклеиновой кислоты, доставляемой в клетку, составляет около 25 нг/см2 для первой трансфекции, около 50 нг/см2 для второй трансфекции, около 100 нг/см2 для третьей трансфекции, около 200 нг/см2 для четвертой трансфекции и около 400 нг/см2 для пятой трансфекции. В другом варианте реализации изобретения клетку дополнительно трансфицируют по меньшей мере один раз после пятой трансфекции, а количество нуклеиновой кислоты, доставляемой в клетку, составляет около 400 нг/см2.
Определенные варианты реализации изобретения относятся к способу трансфекции клетки нуклеиновой кислотой, в котором количество нуклеиновой кислоты определяют, измеряя плотность клеток и выбирая количество нуклеиновой кислоты для трансфекции на основе измеренной плотности клеток. В одном варианте реализации изобретения клетка находится в in vitro культуре, а плотность клеток измеряют оптическими методами. В другом варианте реализации изобретения клетку трансфицируют неоднократно, плотность клеток увеличивается в промежутке между двумя трансфекциями, а количество трансфицируемой нуклеиновой кислоты является большим для второй из двух трансфекций, чем для первой из двух трансфекций.
Недавно было обнаружено, что в некоторых ситуациях эффективность трансфекции и жизнеспособность клеток, культивируемых в среде согласно настоящему изобретению, можно повысить путем кондиционирования среды. Определенные варианты реализации изобретения, следовательно, относятся к способу кондиционирования среды. Другие варианты реализации изобретения относятся к среде, которую кондиционируют. В одном варианте реализации изобретения фидеры являются фибробластами, а среду кондиционируют приблизительно на протяжении 24 ч. Другие варианты реализации изобретения относятся к способу трансфекции клетки, в котором трансфекционную среду кондиционируют. Другие варианты реализации изобретения относятся к способу перепрограммирования и/или генного редактирования клетки, в котором среду кондиционируют. В одном варианте реализации изобретения фидеры являются митотически инактивированными, например, при помощи обработки химическим веществом, таким как митомицин-С, или при помощи радиоактивного облучения. В определенных вариантах реализации изобретения может быть более выгодным использование только аутологических материалов, частично для того, как можно привести в качестве примера, и не ограничивая себя теорией, чтобы избежать риска передачи заболевания от фидеров к клетке. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции клетки, в котором трансфекционную среду кондиционируют, и в котором фидеры получены из того же организма, что и трансфицируемая клетка. Другие варианты реализации изобретения относятся к способу перепрограммирования и/или генного редактирования клетки, в котором среду кондиционируют, и в котором фидеры получены из того же организма, что и перепрограммируемая и/или генетически редактируемая клетка.
Путем кондиционирования в среду можно добавить несколько молекул. Определенные варианты реализации изобретения, следовательно, относятся к среде, в которую добавлены одна или более молекул, которые присутствуют в кондиционированной среде. В одном варианте реализации изобретения в среду добавляют Wnt1, Wnt2, Wnt3, Wnt3a либо их биологически активный фрагмент, аналог, вариант, агонист или представителя семейства. В другом варианте реализации изобретения в среду добавляют TGF-β либо его биологически активный фрагмент, аналог, вариант, агонист или представителя семейства. В другом варианте реализации изобретения клетку перепрограммируют согласно способу настоящего изобретения, при этом в среду не добавляют TGF-β на протяжении от около 1 и до около 5 дней, а затем добавляют TGF-β на протяжении по меньшей мере около 2 дней. В другом варианте реализации изобретения в среду добавляют IL-6, IL-6R либо их биологически активный фрагмент, аналог, вариант, агонист или представителя семейства. В другом варианте реализации изобретения в среду добавляют сфинголипид или жирную кислоту. В другом варианте реализации изобретения сфинголипид является лизофосфатидной кислотой, лизосфингомиелином, сфингозин-1-фосфатом либо их биологически активным аналогом, вариантом или производным.
Дополнительно к митотической инактивации клеток в определенных условиях генную экспрессию клеток может изменить облучение, приводя к тому, что клетки вырабатывают меньшее количество определенных белков и большее количество других определенных белков, чем необлученные клетки, например, представителей семейства белков Wnt. Вдобавок, определенные представители семейства белков Wnt могут стимулировать рост и трансформацию клеток. Недавно было обнаружено, что в некоторых ситуациях эффективность перепрограммирования РНК можно значительно повысить путем приведения клетки в контакт со средой, которая является кондиционированной при помощи облученных фидеров вместо фидеров, обработанных митомицином-с. Дополнительно было обнаружено, что повышение эффективности перепрограммирования, наблюдаемой при применении облученных фидеров, происходит частично по причине секретируемых фидерами белков Wnt. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клетки, в котором клетку приводят в контакт с Wnt1, Wnt2, Wnt3, Wnt3a либо их биологически активным фрагментом, аналогом, вариантом, представителем семейства или агонистом, включая агонистов низлежащих мишеней белков Wnt, и/или веществами, которые имитируют один или более биологических эффектов белков Wnt, например, 2-амино-4-[3,4-(метилэтилендиокси)бензиламино]-6-(3-метоксифенил)пиримидином.
Недавно было обнаружено, что среду, являющуюся объектом настоящего изобретения, можно использовать для поддержания жизнедеятельности клеток, включая фибробласты и человеческие полипотентные стволовые клетки, в культуре (т.е., в качестве ʺподдерживающей средыʺ). Определенные варианты реализации изобретения, следовательно, относятся к среде, которую используют качестве поддерживающей среды. В одном варианте реализации изобретения данная среда не содержит каких-либо компонентов человеческого происхождения. В другом варианте реализации изобретения состав среды химически определен.
Из-за низкой эффективности многих способов перепрограммирования на основе ДНК эти способы может быть трудно или невозможно применять к клеткам, полученным из образцов пациентов, в которых может содержаться лишь небольшое количество клеток. И наоборот, высокая эффективность определенных вариантов реализации настоящего изобретения может дать возможность надежного перепрограммирования небольшого количества клеток, начиная с одиночных клеток. Определенные варианты реализации изобретения, следовательно, можно применять для того, чтобы перепрограммировать клетки из биопсийного образца, в том числе без предварительного создания большой культуры. Перепрограммирование клеток прямо из биопсийного образца может быть необходимым в определенных ситуациях, например, при разработке индивидуального терапевтического препарата, частично из-за того, что создание большой культуры первичных клеток может требовать продолжительного времени, дополнительная обработка, требуемая для создания большой культуры, может нести повышенный риск загрязнения, а дополнительное время в процессе культивирования может нести повышенный риск геномной нестабильности и появления мутаций, включая точечные мутации, вариации числа копий и кариотипические нарушения. Определенные варианты реализации изобретения, следовательно, относятся к способу перепрограммирования клетки, включающему получение клетки от пациента или из биопсийного образца и последующее перепрограммирование клетки. В одном варианте реализации изобретения клетку перепрограммируют без предварительного создания большой культуры, а первую трансфекцию проводят предпочтительно до того, как культуру перевивают более двух раз. В другом варианте реализации изобретения клетку получают от пациента, а первую трансфекцию проводят не позднее, чем приблизительно через 14 дней после того, как клетка была высеяна в первый раз. В другом варианте реализации изобретения клетку получают из биопсийного образца, а первую трансфекцию проводят не позднее, чем приблизительно через 7 дней после того, как клетка была высеяна в первый раз. В другом варианте реализации изобретения биопсийный образец является полнослойным биопсийным образцом, полученным при помощи дерматома, клетку получают из биопсийного образца путем обработки одним или более ферментами, клетку высеивают на поверхность, которая покрыта одной или более молекулами клеточной адгезии, и/или клетку высеивают в среду, которая содержит молекулу клеточной адгезии, клетку трансфицируют одной или более нуклеиновыми кислотами, содержащими по меньшей мере одну молекулу РНК, а первую трансфекцию проводят не позднее, чем приблизительно через 14 дней после того, как клетка была высеяна в первый раз. В другом варианте реализации изобретения фермент является коллагеназой. В другом варианте реализации изобретения коллагеназа не содержит компонентов животного происхождения. В другом варианте реализации изобретения коллагеназа присутствует в концентрации, составляющей между около 0,1 мг/мЛ и около 10 мг/мЛ или между около 0,5 мг/мЛ и около 5 мг/мЛ. В другом варианте реализации изобретения клетку получают из крови. В другом варианте реализации изобретения клетку высеивают в среду, содержащую один или более белков, которые получены из крови пациента. В другом варианте реализации изобретения клетку высеивают в среду, содержащую DMEM/F12 + 2 мМ L-аланил-L-глутамина + от около 5% до около 25% полученной от пациента сыворотки, или от около 10% до около 20% полученной от пациента сыворотки, или около 20% полученной от пациента сыворотки.
Недавно было обнаружено, что в некоторых ситуациях трансфекция клеток, содержащих смесь РНК, кодирующей Oct4, Sox2, Klf4 и с-Мус, с применением среды, являющейся объектом настоящего изобретения, может привести к возрастанию скорости пролиферации клеток. Когда количество доставляемой в клетки РНК является слишком низким для гарантии того, что все клетки трансфицированы, повышенную скорость пролиферации может демонстрировать только часть клеток. В определенных ситуациях, например, при разработке индивидуального терапевтического препарата, повышение скорости пролиферации клеток может быть желательным, частично потому, что таким образом можно уменьшить время, необходимое для создания терапевтического препарата, и, следовательно, можно уменьшить стоимость терапевтического препарата. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции клетки смесью РНК, кодирующей Oct4, Sox2, Klf4 и с-Мус, в котором клетка демонстрирует повышенную скорость пролиферации. В одном варианте реализации изобретения клетки, демонстрирующие повышенную скорость пролиферации, выделяют из культуры. В другом варианте реализации изобретения клетки, демонстрирующие повышенную скорость пролиферации, увеличивают в количестве и культивируют в среде, которая способствует росту одного или более типов клеток, и перепрограммируют в клетку, принадлежащую одному или более типам клеток.
Многие заболевания связаны с наличием одной или более мутаций. Мутации можно исправить путем приведения клетки в контакт с нуклеиновой кислотой, которая кодирует белок, который либо отдельно, либо в комбинации с другими молекулами исправляет мутацию (пример генного редактирования). Примеры таких белков включают: цинк-пальцевые нуклеазы и TALENs. Определенные варианты реализации изобретения, следовательно, относятся к способу трансфекции клетки нуклеиновой кислотой, в котором нуклеиновая кислота кодирует белок, который либо отдельно, либо в комбинации с другими молекулами, создает одноцепочечный или двухцепочечный разрыв в молекуле ДНК. В одном варианте реализации изобретения белок является цинк-пальцевой нуклеазой или TALEN. В другом варианте реализации изобретения нуклеиновая кислота является молекулой РНК. В другом варианте реализации изобретения одноцепочечный или двухцепочечный разрыв составляет около 5,000,000 оснований сайта инициации транскрипции гена, выбранного из группы: CCR5, CXCR4, GAD1, GAD2, CFTR, НВА1, НВА2, НВВ, HBD, FANCA, ХРА, ХРВ, ХРС, ERCC2, POLH, НТТ, DMD, SOD1, АРОЕ, PRNP, BRCA1 и BRCA2, его их аналога, варианта и представителя семейства. В другом варианте реализации изобретения клетку трансфицируют нуклеиновой кислотой, которая действует как репарационная матрица, обеспечивая инсерцию последовательности ДНК на участке одноцепочечного или двухцепочечного разрыва либо обеспечивая какое-либо другое изменение последовательности ДНК на участке одноцепочечного или двухцепочечного разрыва. В другом варианте реализации изобретения проводят перепрограммирование клетки и последовательное генное редактирование. В другом варианте реализации изобретения проводят генное редактирование клетки и последовательное перепрограммирование. В другом варианте реализации изобретения генное редактирование и перепрограммирование проводят с интервалом между ними, составляющим около 7 дней. В другом варианте реализации изобретения генное редактирование и перепрограммирование происходит одновременно или в один день. В другом варианте реализации изобретения клетка является клеткой кожи, клетку кожи генетически редактируют для того, чтобы разрушить ген CCR5, клетку кожи перепрограммируют в гемопоэтическую стволовую клетку, создавая, таким образом, терапевтический препарат против ВИЧ/СПИД, а терапевтический препарат вводят пациенту вместе с ВИЧ/СПИД. В другом варианте реализации изобретения клетка кожи получена от того же пациента, которому вводят терапевтический препарат.
Гены, которые можно редактировать согласно способам настоящего изобретения для того, чтобы создавать терапевтические препараты согласно настоящему изобретению, включают гены, которые можно редактировать так, чтобы сохранить их нормальную функцию, а также гены, которые можно редактировать так, чтобы снизить или элиминировать их функцию. Такие гены включают, но не ограничиваются этим, бета глобин (НВВ), мутации в котором могут привести к серповидноклеточной анемии (СКА) и β-талассемии, ген рака груди 1 с ранним началом (BRCA1) и рака груди 2 с ранним началом (BRCA2), мутации в которых могут усилить подверженность раку груди, С-С хемокиновый рецептор типа 5 (CCR5) и С-Х-С хемокиновый рецептор типа 4 (CXCR4), мутации в которых могут подавлять устойчивость к ВИЧ инфекции, муковисцидозный трансмембранный регулятор (CFTR), мутации в котором могут привести к кистозному фиброзу, дистрофии (DMD), мутации в котором могут привести к мышечной дистрофии, включая мышечную дистрофию Дюшенна и мышечную дистрофию Беккера, глутамат декарбоксилазу 1 и глутамат декарбоксилазу 2 (GAD1, GAD2), мутации в которых могут препятствовать аутоиммунному разрушению β-клеток, гемоглобин альфа 1, гемоглобин альфа 2 и гемоглобин дельта (НВА1, НВА2 и HBD), мутации в которых могут привести к талассемии, Хантингтон (НТТ), мутации в котором могут привести к хорее Хантингтона, супероксиддисмутазу 1 (SOD1), мутации в котором могут привести к амиотрофическому боковому склерозу (ALS), ХРА, ХРВ, ХРС, XPD (ERCC6) и полимеразу (ДНК-направленную), эта (POLH), мутации в котором могут привести к пигментной ксеродерме, богатую лейцином повторную киназу 2 (LRRK2), мутации в котором могут привести к болезни Паркинсона и анемии Фанкони, комплементационные группы А, В, С, D1, D2, Е, F, G, I, J, L, М, N, Р (FANCA, FANCB, FANCC, FANCD1, FANCD2, FANCE, FANCF, FANCG, FANCI, FANCJ, FANCL, FANCM, FANCN, FANCP), и гомолог RAD51 С (S. cerevisiae) (RAD51C), мутации в котором могут привести к анемии Фанкони.
Определенные варианты реализации изобретения относятся к терапевтическому препарату, содержащему нуклеиновую кислоту, которая кодирует один или более редактирующих гены белков. Другие варианты реализации изобретения относятся к терапевтическому препарату, содержащему одну или более клеток, которые являются трансфицированными, перепрограммированными и/или генетически отредактированными согласно способам настоящего изобретения. В одном варианте реализации изобретения клетка является трансфицированной, перепрограммированной и/или генетически отредактированной, и трансфицированную, перепрограммированную и/или генетически отредактированную клетку вводят пациенту. В другом варианте реализации изобретения клетку получают от того же пациента, которому вводят трансфицированную, перепрограммированную и/или генетически отредактированную клетку. Примеры заболеваний, которые можно лечить при помощи терапевтических препаратов, являющихся объектами настоящего изобретения, включают, но не ограничиваются этим болезнь Альцгеймера, повреждение спинного мозга, амиотрофический боковой склероз, кистозный фиброз, сердечную недостаточность, включая ишемическую и дилатационную кардиомиопатию, макулярную дегенерацию, болезнь Паркинсона, болезнь Хантингтона, диабет, серповидноклеточную анемию, талассемию, анемию Фанкони, пигментную ксеродерму, мышечную дистрофию, тяжёлый комбинированный иммунодефицит, радикулярную сенсорную наследственную невропатию, рак и ВИЧ/СПИД. В определенных вариантах реализации изобретения клетку получают от пациента, клетку перепрограммируют и смешивают с большим количеством жировых клеток, создавая, таким образом, косметическое средство, а косметическое средство вводят пациенту. В других вариантах реализации изобретения косметическое средство применяют для восстановления ткани.
Хотя приведенные в данном тексте детальные примеры описывают создание специфических типов клеток и создание терапевтических препаратов, содержащих специфические типы клеток, понятно, что способы согласно данному изобретению можно применять для того, чтобы создавать множество других типов клеток и терапевтических препаратов, содержащих одну или более из множества других типов клеток, например, путем перепрограммирования клеток согласно способам настоящего изобретения и культивирования клеток в условиях, которые повторяют один или более из аспектов получения, путем создания условий, которые схожи с условиями клеточной микросреды во время получения.
Определенные варианты реализации изобретения относятся к библиотеке клеток, содержащей множество типов антигенов лейкоцитов человека (HLA - от англ. ʺhuman leukocyte antigenʺ) (ʺHLA-библиотекиʺ). HLA-библиотека может быть полезной, частично потому, что она может обеспечить быстрое создание и/или распространение терапевтических препаратов без ожидания пациентом создания терапевтического препарата из клетки пациента. Такая библиотека может быть частично полезной в лечении сердечной недостаточности и заболеваний крови и/или иммунной системы, так как возможность немедленного приобретения терапевтического препарата удобна для пациентов.
Определенные варианты реализации изобретения относятся к клетке, которая используется для моделирования ткани/органа или для моделирования заболевания. В одном варианте реализации изобретения клетку кожи перепрограммируют и смешивают с большим количеством сердечных клеток, а сердечные клетки используют для скрининга биоактивных молекул на предмет кардиотоксичности (пример испытания на безвредность). В другом варианте реализации изобретения клетку кожи от пациента с болезнью Альцгеймера перепрограммируют и смешивают с большим количеством кортикальных нейронов, а кортикальные нейроны используют для скрининга биоактивных молекул на предмет снижения накопления нерастворимых бляшек (пример испытание на эффективность). Определенные варианты реализации изобретения, следовательно, полезны для испытаний на безвредность и/или испытаний на эффективность.
Определенные варианты реализации изобретения относятся к способу инкапсуляции клеток и/или высевания клеток на матрицу и к клеткам, которые инкапсулированы и/или высеяны на матрицу. В определенных ситуациях инкапсуляция клеток может быть выгодной, частично потому что инкапсулированные клетки могут оказаться менее иммуногенными, чем неинкапсулированные клетки. В одном варианте реализации изобретения клетку перепрограммируют в глюкозозависимую инсулин-продуцирующую клетку, глюкозозависимую инсулин-продуцирующую клетку инкапсулируют в веществе, таком как альгинат, а инкапсулированную глюкозозависимую инсулин-продуцирующую клетку вводят пациенту с диабетом 1 типа. В другом варианте реализации изобретения введение осуществляется путем внутрибрюшинной инъекции или интрапортальной инъекции. В определенных ситуациях высевание клеток на матрицу может быть выгодным, частично потому что матрица может обеспечить механическую устойчивость. В одном варианте реализации изобретения клетку перепрограммируют и смешивают с большим количеством фибробластов и кератиноцитов, фибробласты и кератиноциты высевают на матрицу, содержащую коллаген, а засеянную матрицу прикладывают к ране, формируя искусственный кожный трансплантат. В другом варианте реализации изобретения клетку перепрограммируют, перепрограммированную клетку смешивают с матрицей в жидкой форме или форме суспензии, смесь вводят пациенту, а плотность матрицы увеличивается во время или после введения.
Определенные варианты реализации изобретения относятся к способу очищения клеток. Трансфекция, перепрограммирование и генное редактирование часто приводят к созданию клеточных популяций, которые содержат клетки с желательным фенотипом и клетки с одним или более нежелательными фенотипами. Определенные варианты реализации изобретения, следовательно, относятся к способу очищения трансфицированных, перепрограммированных и/или генетически отредактированных клеток. В одном варианте реализации изобретения клетки очищают, используя градиент плотности. В другом варианте реализации изобретения клетки очищают путем приведения клеток в контакт с одним или более антителами, которые делают возможным отделение клеток, имеющих один или более из желательных фенотипов, от клеток, имеющих один или более из нежелательных фенотипов. В другом варианте реализации изобретения антитело связано с субстратом, предпочтительно, с магнитным микроносителем. В другом варианте реализации изобретения антитело связано с флуоресцентной молекулой, а разделение проводят при помощи сортировки флуоресцентно-активированных клеток (СФАК) или подобных способов. В другом варианте реализации изобретения предупреждают пролиферацию клеток с нежелательным фенотипом путем приведения клеток в контакт с одной или более молекулами, которые препятствуют делению клеток, предпочтительно, с митомицином-с, 5-аза-деоксицитидином, фторурацилом либо их биологически активным аналогом или производным. Другие варианты реализации изобретения относятся к терапевтическому препарату, содержащему клетки, которые были очищены для того, чтобы увеличить долю клеток, имеющих один или более из желательных фенотипов.
Определенные варианты реализации изобретения относятся к способу создания животных моделей, включая модели мутаций и заболеваний. В одном варианте реализации изобретения животную клетку кожи генетически редактируют и перепрограммируют в полипотентную стволовую клетку. В другом варианте реализации изобретения около 1-100 перепрограммированных и генетически отредактированных клеток вносят в бластоцисту, а бластоцисту имплантируют в рог матки животного. В одном варианте реализации изобретения животное выбрано из группы, включающей: кота, собаку, мышь, свинью, лошадь, корову, цыпленка, овцу, козу, рыбу, примата и крысу. В другом варианте реализации изобретения животное является крысой.
Определенные неканонические нуклеотиды при инкорпорации в синтетическую молекулу РНК могут снизить токсичность синтетических молекул РНК, частично путем препятствования связыванию белков, которые распознают экзогенные нуклеиновые кислоты, например, протеинкиназ R, Rig-1 и семейства белков олигоаденилат синтетазы. Неканонические нуклеотиды, о которых сообщалось, что они снижают токсичность синтетических молекул РНК при инкорпорации их в молекулы, включают: псевдоуридин, 5-метилуридин, 2-тиоуридин, 5-метилцитидин, N6-метиладенозин и их некоторые комбинации. При этом химические характеристики неканонических нуклеотидов, которые дают им возможность снижения токсичности синтетических молекул РНК, до сих пор остаются неизвестными. Более того, инкорпорация в больших количествах большинства неканонических нуклеотидов, например, 5-метилуридина, 2-тиоуридина, 5-метилцитидина и N6-метиладенозина, может снизить эффективность, с которой молекулы синтетической РНК могут быть транслированы в белок, что ограничивает полезность синтетических молекул РНК, содержащих эти нуклеотиды, в применениях, которые требуют экспрессии белка. Вдобавок, хотя в синтетических молекулах РНК уридин можно полностью заменить псевдоуридином без снижения эффективности, с которой молекулы синтетической РНК могут быть транслированы в белок, в определенных ситуациях, например, при проведении частых неоднократных трансфекций избыточную токсичность могут демонстрировать синтетические молекулы РНК, содержащие только аденозин, гуанозин, цитидин и псевдоуридин.
Недавно было обнаружено, что синтетические молекулы РНК, содержащие один или более неканонических нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина, могут быть менее токсичными, чем синтетические молекулы РНК, содержащие только канонические нуклеотиды, частично благодаря способности замен в этих позициях препятствовать распознаванию синтетических молекул РНК белками, которые распознают экзогенные нуклеиновые кислоты, и, более того, замены в этих позициях могут оказывать минимальное влияние на эффективность, с которой молекулы синтетической РНК могут быть транслированы в белок, частично благодаря небольшому влиянию замен в этих позициях на спаривание оснований и межплоскостное взаимодействие оснований.
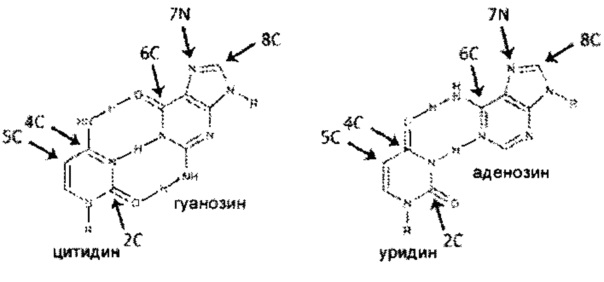
Примеры неканонических нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина, включают, но не ограничиваются этим: 2-тиоуридин, 5-азауридин, псевдоуридин, 4-тиоуридин, 5-метилуридин, 5-аминоуридин, 5-гидроксиуридин, 5-метил- 5-азауридин, 5-амино-5-азауридин, 5-гидрокси-5-азауридин, 5-метилпсевдоуридин, 5- аминопсевдоуридин, 5-гидроксипсевдоуридин, 4-тио-5-азауридин, 4-тиопсевдоуридин, 4-тио-5-метилуридин, 4-тио-5-аминоуридин, 4-тио-5-гидроксиуридин, 4-тио-5-метил-5-азауридин, 4-тио-5-амино-5-азауридин, 4-тио-5-гидрокси-5-азауридин, 4-тио-5-метилпсевдоуридин, 4-тио-5-гидроксипсевдоуридин, 2-тиоцитидин, 5-азацитидин, псевдоизоцитидин, N4-метилцитидин, N4-аминоцитидин, N4-гидроксицитидин, 5-метилцитидин, 5-аминоцитидин, 5-гидроксицитидин, 5-метил-5-азацитидин, 5-амино-5-азацитидин, 5-гидрокси-5-азацитидин, 5-метилпсевдоизоцитидин, 5-гидроксипсевдоизоцитидин, N4-метил-5-азацитидин, N4-метилпсевдоизоцитидин, 2-тио-5-азацитидин, 2-тиопсевдоизоцитидин, 2-тио-N4-метилцитидин, 2-тио-N4-аминоцитидин, 2-тио-N4-гидроксицитидин, 2-тио-5-метилцитидин, 2-тио-5-аминоцитидин, 2-тио-5-гидроксицитидин, 2-тио-5-метил-5-азацитидин, 2-тио-5-амино-5-азацитидин, 2-тио-5-гидрокси-5-азацитидин, 2-тио-5-метилпсевдоизоцитидин, 2-тио-5-аминопсевдоизоцитидин, 2-тио-5-гидроксипсевдоизоцитидин, 2-тио-N-метил-5-азацитидин, 2-тио-N4-метилпсевдоизоцитидин, N4-метил-5-метилцитидин, N4-метил-5-аминоцитидин, N4-метил-5-гидроксицитидин, N4-метил-5-метил-5-азацитидин, N4-метил-5-амино-5-азацитидин, N4-метил-5-гидрокси-5-азацитидин, N4-метил-5-метилпсевдоизоцитидин, N4-метил-5-аминопсевдоизоцитидин, N4-метил-5-гидроксипсевдоизоцитидин, N4-амино-5-азацитидин, N4-аминопсевдоизоцитидин, N4-амино-5-метилцитидин, N4-амино-5-аминоцитидин, N4-амино-5-гидроксицитидин, N4-амино-5-метил-5-азацитидин, N4-амино-5-амино-5-азацитидин, N4-амино-5-гидрокси-5-азацитидин, N4-амино-5-метилпсевдоизоцитидин, N4-амино-5-аминопсевдоизоцитидин, N4-амино-5-гидроксипсевдоизоцитидин, N4-гидрокси-5-азацитидин, N4-гидроксипсевдоизоцитидин, N4-гидрокси-5-метилцитидин, N4-гидрокси-5-аминоцитидин, N4-гидрокси-5-гидроксицитидин, N4-гидрокси-5-метил-5-азацитидин, N4-гидрокси-5-амино-5-азацитидин, N4-гидрокси-5-гидрокси-5-азацитидин, N4-гидрокси-5-метилпсевдоизоцитидин, N4-гидрокси-5-аминопсевдоизоцитидин, N4-гидрокси-5-гидроксипсевдоизоцитидин, 2-тио-N4-метил-5-метилцитидин, 2-тио-N4-метил-5-аминоцитидин, 2-тио-N4-метил-5-гидроксицитидин, 2-тио-N4-метил-5-метил-5-азацитидин, 2-тио-N4-метил-5-амино-5-азацитидин, 2-тио-N4-метил-5-гидрокси-5-азацитидин, 2-тио-N4-метил-5-метилпсевдоизоцитидин, 2-тио-N4-метил-5-аминопсевдоизоцитидин, 2-тио-N4-метил-5-гидроксипсевдоизоцитидин, 2-тио-N4-амино-5-азацитидин, 2-тио-N4-аминопсевдоизоцитидин, 2-тио-N4-амино-5-метилцитидин, 2-тио-N4-амино-5-аминоцитидин, 2-тио-N4-амино-5-гидроксицитидин, 2-тио-N4-амино-5-метил-5-азацитидин, 2-тио-N4-амино-5-амино-5-азацитидин, 2-тио-N4-амино-5-гидрокси-5-азацитидин, 2-тио-N4-амино-5-метилпсевдоизоцитидин, 2-тио-N4-амино-5-аминопсевдоизоцитидин, 2-тио-N4-амино-5-гидроксипсевдоизоцитидин, 2-тио-N4-гидрокси-5-азацитидин, 2-тио-N4-гидроксипсевдоизоцитидин, 2-тио-N4-гидрокси-5-метилцитидин, 2-тио-N4-гидрокси-5-аминоцитидин, 2-тио-N4-гидрокси-5-гидроксицитидин, 2-тио-N4-гидрокси-5-метил-5-азацитидин, 2-тио-N-гидрокси-5-амино-5-азацитидин, 2-тио-N-гидрокси-5-гидрокси-5-азацитидин, 2-тио-N4-гидрокси-5-метилпсевдоизоцитидин, 2-тио-N4-гидрокси-5-аминопсевдоизоцитидин, 2-тио-N4-гидрокси-5-гидроксипсевдоизоцитидин, N6-метиладенозин, N6-аминоаденозин, N6-гидроксиаденозин, 7-деазааденозин, 8-азааденозин, N6-метил-7-деазааденозин, N6-метил-8-азааденозин, 7-деаза-8-азааденозин, N6-метил-7-деаза-8-азааденозин, N6-амино-7-деазааденозин, N6-амино-8-азааденозин, N6-амино-7-деаза-8-азааденозин, N6-гидроксиаденозин, N6-гидрокси-7-деазааденозин, N6-гидрокси-8-азааденозин, N6-гидрокси-7-деаза-8-азааденозин, 6-тиогуанозин, 7-деазагуанозин, 8-азагуанозин, 6-тио-7-деазагуанозин, 6-тио-8-азагуанозин, 7-деаза-8-азагуанозин и 6-тио-7-деаза-8-азагуанозин. Стоит отметить, что для некоторых неканонических нуклеотидов существуют альтернативные схемы наименований. Например, в некоторых ситуациях 5-метилпсевдоуридин может обозначаться как ʺ3-метилпсевдоуридинʺ или ʺN3-метилпсевдоуридинʺ.
Нуклеотиды, которые содержат приставку ʺаминоʺ могут обозначать любой нуклеотид, который содержит атом азота, связанный с атомом в указанной позиции нуклеотида, например, 5-аминоцитидин может обозначаться как 5-аминоцитидин, 5-метиламиноцитидин и 5-нитроцитидин. Аналогично, нуклеотиды, которые содержат приставку ʺметилʺ могут обозначать любой нуклеотид, который содержит атом углерода, связанный с атомом в указанной позиции нуклеотида, например, 5-метилцитидин может обозначаться как 5-метилцитидин, 5-этилцитидин и 5-гидроксиметилцитидин, нуклеотиды, которые содержат приставку ʺтиоʺ могут обозначать любой нуклеотид, который содержит атом серы, связанный с атомом в данной позиции нуклеотида, а нуклеотиды, которые содержат приставку ʺгидроксиʺ могут обозначать любой нуклеотид, который содержит атом кислорода, связанный с атомом в данной позиции нуклеотида.
Определенные варианты реализации изобретения, следовательно, относятся к молекуле синтетической РНК, содержащей один или более нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина. Другие варианты реализации изобретения относятся к терапевтическому препарату, при этом терапевтический препарат содержит одну или более синтетических молекул РНК, а одна или более из синтетических молекул РНК содержит один или более нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина. В одном варианте реализации изобретения терапевтический препарат содержит трансфекционный реагент. В другом варианте реализации изобретения трансфекционный реагент содержит катионный липид, липосому или мицеллу. В другом варианте реализации изобретения липосома или мицелла содержит фолат, а терапевтический состав обладает противораковой активностью. В другом варианте реализации изобретения один или более нуклеотидов содержат по меньшей мере одно из следующих соединений: псевдоуридин, 2-тиоуридин, 4-тиоуридин, 5-азауридин, 5-гидроксиуридин, 5-метилуридин, 5-аминоуридин, 2-тиопсевдоуридин, 4-тиопсевдоуридин, 5-гидроксипсевдоуридин, 5-метилпсевдоуридин, 5-аминопсевдоуридин, псевдоизоцитидин, N4-метилцитидин, 2-тиоцитидин, 5-азацитидин, 5-гидроксицитидин, 5-аминоцитидин, 5-метилцитидин, N4-метилпсевдоизоцитидин, 2-тиопсевдоизоцитидин, 5-гидроксипсевдоизоцитидин, 5-аминопсевдоизоцитидин, 5-метилпсевдоизоцитидин, 7-деазааденозин, 7-деазагуанозин, 6-тиогуанозин и 6-тио-7-деазагуанозин. В другом варианте реализации изобретения один или более нуклеотидов содержат по меньшей мере одно из следующих соединений: псевдоуридин, 2-тиоуридин, 4-тиоуридин, 5-азауридин, 5-гидроксиуридин, 5-метилуридин, 5-аминоуридин, 2-тиопсевдоуридин, 4-тиопсевдоуридин, 5-гидроксипсевдоуридин, 5-метилпсевдоуридин и 5-аминопсевдоуридин, и по меньшей мере одно из следующих соединений: псевдоизоцитидин, N4-метилцитидин, 2-тиоцитидин, 5-азацитидин, 5-гидроксицитидин, 5-аминоцитидин, 5-метилцитидин, N4-метилпсевдоизоцитидин, 2-тиопсевдоизоцитидин, 5-гйдроксипсевдоизоцитидин, 5-аминопсевдоизоцитидин и 5-метилпсевдоизоцитидин. В другом варианте реализации изобретения один или более нуклеотидов содержат по меньшей мере одно из следующих соединений: псевдоуридин, 2-тиоуридин, 4-тиоуридин, 5-азауридин, 5-гидроксиуридин, 5-метилуридин, 5-аминоуридин, 2-тиопсевдоуридин, 4-тиопсевдоуридин, 5-гидроксипеевдоуридин и 5-метилпсевдоуридин, 5-аминопсевдоуридин, и по меньшей мере одно из следующих соединений: псевдоизоцитидин, N4-метилцитидин, 2-тиоцитидин, 5-азацитидин, 5-гидроксицитидин, 5-аминоцитидин, 5-метилцитидин, N4-метилпсевдоизоцитидин, 2-тиопсевдоизоцитидин, 5-гидроксипсевдоизоцитидин, 5-аминопсевдоизоцитидин и 5-метилпсевдоизоцитидин, и по меньшей мере одно из следующих соединений: 7-деазагуанозин, 6-тиогуанозин и 6-тио-7-деазагуанозин. В другом варианте реализации изобретения один или более нуклеотидов включают: 5-метилцитидин и 7-деазагуанозин. В другом варианте реализации изобретения один или более нуклеотидов также содержат псевдоуридин или 4-тиоуридин, или 5-метилуридин, или 5-аминоуридин, или 4-тиопсевдоуридин, или 5-метилпсевдоуридин, или 5-аминопсевдоуридин. В другом варианте реализации изобретения один или более нуклеотидов также содержит 7-деазагуанозин. В другом варианте реализации изобретения один или более нуклеотидов содержат: псевдоизоцитидин и 7-деазагуанозин, и 4-тиоуридин. В другом варианте реализации изобретения один или более нуклеотидов содержат: псевдоизоцитидин или 7-деазагуанозин и псевдоуридин. В другом варианте реализации изобретения один или более нуклеотидов содержат: 5-метилуридин и 5-метилцитидин, и 7-деазагуанозин. В дополнительном варианте реализации изобретения один или более нуклеотидов содержат: псевдоуридин или 5-метилпсевдоуридин и 5-метилцитидин, и 7-деазагуанозин. В другом варианте реализации изобретения один или более нуклеотидов содержат: псевдоизоцитидин и 7-деазагуанозин, и псевдоуридин.
Определенные неканонические нуклеотиды могут быть включены в состав синтетических молекул РНК более эффективно, чем другие неканонические нуклеотиды, при помощи РНК полимераз, которые обычно применяют для in vitro транскрипции, частично благодаря свойству этих определенных неканонических нуклеотидов принимать участие в стандартных взаимодействиях спаривания оснований и межплоскостных взаимодействиях оснований, и взаимодействовать с РНК полимеразой способом, аналогичным тому, которым соответствующие канонические нуклеотиды взаимодействуют с РНК полимеразой. Следовательно, определенные смеси нуклеотидов, содержащие один или более неканонических нуклеотидов, могут являться целесообразными, частично потому, что при помощи реакций in vitro транскрипции с участием данных смесей нуклеотидов можно получить большое количество синтетической РНК. Определенные варианты реализации изобретения, следовательно, относятся к смеси нуклеотидов, содержащей один или более нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5 С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина. Смеси нуклеотидов включают, но не ограничиваются этим (цифры перед каждым нуклеотидом указывают на приведенную в качестве примера долю трифосфата неканонического нуклеотида в реакции in vitro транскрипции, например, 0,2 псевдоизоцитидина относится к реакции с участием аденозин-5ʹ-трифосфата, гуанозин-5ʹ-трифосфата, уридин-5ʹ-трифосфата, цитидин-5ʹ-трифосфата и псевдоизоцитидин-5ʹ-трифосфата, в которой псевдоизоцитидин-5ʹ-трифосфат присутствует в реакции в количестве, приблизительно равном 0,2 части от общего количества, в котором в реакции присутствуют псевдоизоцитидин-5ʹ-трифосфат + цитидин-5ʹ-трифосфат, при этом количества рассчитаны на основе молярной массы или массы, а наличие более чем одной цифры перед нуклеозидом указывает на диапазон приведенных в качестве примера долей): 1,0 псевдоуридина, 0,1-0,8 2-тиоуридина, 0,1 0,8 5-метилуридина, 0,2-1,0 5-гидроксиуридина, 0,1-1,0 5-аминоуридина, 0,1-1,0 4-тиоуридина, 0,1-1,0 2-тиопсевдоуридина, 0,1-1,0 4-тиопсевдоуридИна, 0,1-1,0 5-гидроксипсевдоуридина, 0,2-1,5-метилпсевдоуридина, 0,1-1,0 5-аминопсевдоуридина, 0,2-1,0 2-тиоцитидина, 0,1-0,8 псевдоизоцитидина, 0,2-1,0 5-метилцитидина, 0,2-1,0 5-гидроксицитидина, 0,1-1,0 5-аминоцитидина, 0,2-1,0 N4-метилцитидина, 0,2-1,0 5-метилпсевдоизоцитидина, 0,2-1,0 5-гидроксипсевдоизоцитидина, 0,2-1,0 5-аминопсевдоизоцитидина, 0,2-1,0 N4-метилпсевдоизоцитидина, 0,2-1,0 2-тиопсевдоизоцитидина, 0,2-1,0 7-деазагуанозина, 0,2-1,0 6-тиогуанозина, 0,2-1,0 6-тио-7-деазагуанозина, 0,2-1,0 8-азагуанозина, 0,2-1,0 7-деаза-8-азагуанозина, 0,2-1,0 6-тио-8-азагуанозина, 0,1-0,5 7-деазааденозина и 0,1-0,5 N6-метиладенозина.
Недавно было обнаружено, что комбинирование определенных неканонических нуклеотидов может являться целесообразным, частично потому, что вклад неканонических нуклеотидов в снижение токсичности синтетических молекул РНК может быть кумулятивным. Определенные варианты реализации изобретения, следовательно, относятся к нуклеотидной смеси, при этом нуклеотидная смесь содержит более одного неканонического нуклеотида из вышеперечисленных, например, нуклеотидная смесь содержит как псевдоизоцитидин, так и 7-деазагуанозин, или нуклеотидная смесь содержит как N4- метилцитидин, так и 7-деазагуанозин, и т.д. В одном варианте реализации изобретения нуклеотидная смесь содержит более одного неканонического нуклеотида из вышеперечисленных, а доля каждого из неканонических нуклеотидов, присутствующих в смеси, составляет одно из вышеперечисленных значений, например, нуклеотидная смесь содержит 0,1-0,8 псевдоизоцитидина и 0,2-1,0 7-деазагуанозина или нуклеотидная смесь содержит 0,2-1,0 N4-метилпсевдоизоцитидина и 0,2-1,0 7-деазагуанозина и т.д.
В определенных ситуациях, например, когда может быть необязательным или нежелательным максимизировать выход реакции in vitro транскрипции, можно использовать доли нуклеотидов, отличные от вышеперечисленных. Приведенные в качестве примеров вышеперечисленные доли и диапазоны долей относятся к растворам нуклеотид-трифосфатов стандартной степени чистоты (более чем 90% чистоты). Большие доли этих и других нуклеотидов можно применять путем применения растворов нуклеотид-трифосфатов большей степени чистоты, например, более чем около 95% чистоты, или более чем около 98% чистоты, или более чем около 99% чистоты, более чем около 99,5% чистоты, которой можно достичь, например, путем очищения раствора нуклеотид-трифосфатов при помощи существующих методов химической очистки, таких как жидкостная хроматография при высоких давлениях (ЖХВД) или других способов. В одном варианте реализации изобретения нуклеотиды с множественными изомерами очищают для того, чтобы увеличить долю необходимого изомера.
Другие варианты реализации изобретения относятся к способу индукции экспрессии клеткой представляющего интерес белка путем приведения клетки в контакт с синтетической молекулой РНК, которая содержит один или более неканонических нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина. Другие варианты реализации изобретения относятся к способу трансфекции, перепрограммирования и генного редактирования клетки путем приведения клетки в контакт с синтетической молекулой РНК, которая содержит один или более неканонических нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина. В одном варианте реализации изобретения синтетическую молекулу РНК получают путем in vitro транскрипции. В другом варианте реализации изобретения один или более из перепрограммирующих факторов содержит белок Oct4. В другом варианте реализации изобретения клетку также приводят в контакт с синтетической молекулой РНК, которая кодирует белок Sox2. В другом варианте реализации изобретения клетку также приводят в контакт с синтетической молекулой РНК, которая кодирует белок Klf4. В другом варианте реализации изобретения клетку также приводят в контакт с синтетической молекулой РНК, которая кодирует белок с-Мус. В другом варианте реализации изобретения клетку также приводят в контакт с синтетической молекулой РНК, которая кодирует белок Lin28.
Ферменты, такие как Т7 РНК полимераза могут преимущественно инкорпорировать канонические нуклеотиды в реакции in vitro транскрипции с участием как канонических, так и неканонических нуклеотидов. Следовательно, реакция in vitro транскрипции с участием определенной доли неканонического нуклеотида может давать на выходе РНК, содержащую отличную, часто более низкую, долю неканонического нуклеотида, чем та доля, в которой неканонический нуклеотид присутствовал в реакции. В определенных вариантах реализации изобретения ссылки на доли инкорпорации нуклеотида (например, ʺсинтетическая молекула РНК, содержащая 50% псевдоизицитидинаʺ или ʺ0,1-0,8 псевдоизоцитидинаʺ), таким образом, могут относится как к молекулам РНК, содержащим указанную долю нуклеотида, и к молекулам РНК, синтезированным в реакции, содержащей указанную долю нуклеотида (или производного нуклеотида, например, нуклеотид-трифосфата), не смотря даже на то, что такая реакция может дать на выходе РНК, содержащую долю нуклеотида, отличную от доли, в которой неканонический нуклеотид присутствовал в реакции.
Разные нуклеотидные последовательности могут кодировать один и тот же белок, путем использования альтернативных кодонов. В определенных вариантах реализации изобретения ссылки на доли инкорпорации нуклеотида, таким образом, могут относится как к молекулам РНК, содержащим указанную долю нуклеотида, и к молекулам РНК, кодирующим тот же самый белок в качестве отличной молекулы РНК, при этом отличная молекула РНК содержит указанную долю нуклеотида.
Определенные варианты реализации изобретения относятся к набору инструментов, содержащему один или более материалов, необходимых для осуществления настоящего изобретения на практике. В одном варианте реализации изобретения набор инструментов содержит синтетические молекулы РНК. В одном варианте реализации изобретения набор инструментов содержит синтетические молекулы РНК, которые кодируют один или более перепрограммирующих факторов и/или редактирующих гены белков. В другом варианте реализации изобретения синтетические молекулы РНК содержат один или более неканонических нуклеотидов, которые содержат одну или более замен в 2С, и/или 4С, и/или 5С позициях в случае пиримидина или 6С, и/или 7N, и/или 8С позициях в случае пурина. В другом варианте реализации изобретения набор инструментов содержит один или более следующих элементов: трансфекционную среду, трансфекционный реагент, среду для комплексирования и раствор для покрытия. В одном варианте реализации изобретения раствор для покрытия содержит фибронектин и/или витронектин, предпочтительно, рекомбинантный фибронектин и/или рекомбинантный витронектин. В одном варианте реализации изобретения один или более из компонентов набора инструментов присутствуют в виде множества аликвот. В одном варианте реализации изобретения набор инструментов содержит аликвоты комплексов трансфекционного реагента и нуклеиновой кислоты. В другом варианте реализации изобретения набор инструментов содержит аликвоты комплексов трансфекционного реагента и нуклеиновой кислоты, которые находятся в твердой форме, например, в виде замороженных или высушенных заморозкой таблеток. В другом варианте реализации изобретения набор инструментов содержит аликвоты среды, при этом каждая аликвота содержит комплексы трансфекционного реагента и нуклеиновой кислоты, которые стабилизированы либо путем химической обработки, либо путем заморозки.
Трансфекция в общем случае и перепрограммирование в частности могут представлять собой трудоемкие и требующие больших затрат времени методы, которые могут быть повторяемыми и предрасположенными к ошибке. При этом эти методы часто осуществляются вручную из-за недостатка автоматического оборудования для трансфекции. Определенные варианты реализации изобретения, следовательно, относятся к устройству, которое может трансфицировать, перепрограммировать и/или генетически редактировать клетки в автоматическом или полуавтоматическом режиме.
С учетом фигур от ФИГ. 9А до ФИГ. 11, определенные варианты реализации изобретения относятся к устройству (1), при помощи которого можно проводить трансфекцию клеток в многолуночных планшетах (2). В одном варианте реализации изобретения планшет помещают в лоток (3), который выдвигается из устройства. В другом варианте реализации изобретения в устройстве рассчитано на размещение нескольких планшетов (12). В другом варианте реализации изобретения устройство содержит приспособления (4) для хранения среды при определенной температуре, предпочтительно, между 2°С и 6°С. В одном варианте реализации изобретения устройство содержит приспособления (5) для хранения жидкости, отходов и/или клеток, удаленных их лунок. В другом варианте реализации изобретения устройство содержит соединение для подачи питания (6). В другом варианте реализации изобретения устройство содержит порт (33) для подключения к компьютеру (34). В одном варианте реализации изобретения порт является USB портом. В одном варианте реализации изобретения устройство содержит вентилятор (7). В другом варианте реализации изобретения устройство содержит соединение для создания вакуума (8).
На жизнеспособность клеток может благоприятно влиять регулирование окружающих условий, в которых находятся клетки. Определенные варианты реализации изобретения, следовательно, относятся к устройству, содержащему приспособления для инкубации клеток при установленной или необходимой температуре. В одном варианте реализации изобретения клетки инкубируют при одной или более температурах, составляющих между 35С и 39С. В одном варианте реализации изобретения клетки инкубируют при температуре, составляющей около 37С. Другие варианты реализации изобретения относятся к устройству, содержащему приспособления для регулирования атмосферы, в которой инкубируют клетки. В одном варианте реализации изобретения устройство содержит приспособления для регулирования концентрации углекислого газа в атмосфере. В одном варианте реализации изобретения концентрация углекислого газа составляет между 3% и 7%, предпочтительно, около 5%. В другом варианте реализации изобретения устройство содержит приспособления для регулирования концентрации кислорода в атмосфере. В одном варианте реализации изобретения устройство регулирует концентрацию кислорода при помощи подачи азота. В другом варианте реализации изобретения концентрация кислорода составляет от около 3% до около 7%, например, около 5%. В одном варианте реализации изобретения устройство содержит приспособления для регулирования концентраций как кислорода, так и углекислого газа в атмосфере, в которой инкубируют клетки. В другом варианте реализации изобретения устройство содержит соединение для подачи углекислого газа (9). В другом варианте реализации изобретения устройство содержит соединение для подачи азота (10). В другом варианте реализации изобретения устройство содержит соединение для подачи кислорода (11).
Определенные варианты реализации изобретения относятся к устройству, содержащему приспособления для подачи комплексов из нуклеиновой кислоты и трансфекционного реагента и/или среды (24). В одном варианте реализации изобретения устройство содержит одну или более пипеток с фронтальной загрузкой, которые могут подавать комплексы и/или среду. Примеры других приспособлений для подачи комплексов включают, но не ограничиваются этим: пипетку с задней загрузкой, перистальтический насос, микроструйное устройство, электрораспылительную форсунку, пьезоэлектрический эжектор и акустический капельный эжектор. Определенные варианты реализации изобретения относятся к устройству, содержащему приспособления для создания комплексов из нуклеиновой кислоты и трансфекционного реагента (13). В одном варианте реализации изобретения устройство содержит приспособления для комбинирования одного или более трансфекционных реагентов (14) и одной или более нуклеиновых кислот (15). В одном варианте реализации изобретения приспособления для комбинирования содержит одну или более пипеток с фронтальной загрузкой. Примеры других приспособлений, которые можно использовать для комбинирования включают, но не ограничиваются этим: пипетку с задней загрузкой, перистальтический насос, микроструйное устройство, электрораспылительную форсунку, пьезоэлектрический эжектор и акустический капельный эжектор. В одном варианте реализации изобретения устройство содержит один или более съемных наконечников. В другом варианте реализации изобретения один или более съемных наконечников можно стерилизовать. В другом варианте реализации изобретения один или более съемных наконечников являются одноразовыми. В другом варианте реализации изобретения один или более съемных наконечников выполнены из пластика или стекла. В другом варианте реализации изобретения пластик является полипропиленом. В одном варианте реализации изобретения устройство содержит приспособления для инкубации одной или более нуклеиновых кислот с одним или более трансфекционными реагентами в одной или более средах для комплексирования (16). В одном варианте реализации изобретения устройство содержит приспособления для хранения одной или более нуклеиновых кислот, одного или более трансфекционных реагентов и одной или более сред для комплексирования. В одном варианте реализации изобретения комплексирование происходит при комнатной температуре. В одном варианте реализации изобретения устройство содержит приспособления для нагревания среды перед приведением клетки в контакт со средой, например, до между около 20°С и около 39°С или до между около 30°С и около 39°С. В одном варианте реализации изобретения среду нагревают при помощи нагревательного элемента (25). В одном варианте реализации изобретения устройство содержит приспособления для хранения и/или подачи нескольких культуральных сред.
Определенные варианты реализации изобретения относятся к способу хранения комплексов из нуклеиновой кислоты и трансфекционного реагента. В одном варианте реализации изобретения одну или более нуклеиновых кислот и один или более трансфекционных реагентов соединяют с одной или более средами для комплексирования и охлаждают для получения таблетки из нуклеиновой кислоты и трансфекционного реагента. В одном варианте реализации изобретения охлаждение проводят путем приведения в контакт с жидким азотом. Другие способы охлаждения включают, но не ограничиваются этим, приведение в контакт с: охлаждающим элементом Пельтье, охлажденным жидким пропаном, охлажденным жидким этаном и охлажденной полированной металлической поверхностью. В одном варианте реализации изобретения данный способ является в значительной степени свободным от РНКазы. Определенные варианты реализации изобретения относятся к способу трансфицирования клеток с применением таблетки из нуклеиновой кислоты и трансфекционного реагента. В одном варианте реализации изобретения таблетку нагревают перед тем, как добавить в трансфекционную среду. В одном варианте реализации изобретения таблетку нагревают путем помещения таблетки в небольшой объем теплой трансфекционной среды, которую затем приводят в контакт с клетками, предназначенными для трансфекции. В другом варианте реализации изобретения таблетку добавляют прямо в трансфекционную среду. Определенные варианты реализации изобретения относятся к устройству, при помощи которого можно осуществить трансфекцию с применением таблеток из нуклеиновой кислоты и трансфекционного реагента. В одном варианте реализации изобретения устройство содержит приспособления для хранения таблеток (17) в определенном диапазоне температур. В одном варианте реализации изобретения диапазон температур составляет между около -90°С и около 0°С, предпочтительно, между около -30°С и около -4°С. В одном варианте реализации изобретения устройство содержит приспособления для распределения таблеток. В одном варианте реализации изобретения таблетки распределяют при помощи плунжера (19). В другом варианте реализации изобретения таблетки распределяют при помощи вращающегося диска (20), в котором находится отверстие (21), через которое подаются таблетки. В одном варианте реализации изобретения устройство содержит приспособления для разогревания таблетки перед добавлением таблетки в трансфекционную среду. В одном варианте реализации изобретения таблетку разогревают, помещая таблетку в небольшой контейнер (22), содержащий теплую трансфекционную среду, которую затем приводят в контакт с трансфицируемыми клетками. В другом варианте реализации изобретения устройство содержит приспособления для подачи таблеток прямо в трансфекционную среду. В другом варианте реализации изобретения таблетки хранят в картридже (16). В одном варианте реализации изобретения устройство содержит приспособления для смены картриджей (36).
Во время культивирования клеток может быль целесообразной замена, либо полная либо частичная, культуральной среды или дополнение культуральной среды добавочным количеством среды или другой добавки с целью добавить питательные вещества и/или уменьшить, удалить или инактивировать другим способом клеточные отходы или другие нежелательные компоненты, которые могут присутствовать в среде, включая остаточные комплексы. Определенные варианты реализации изобретения, следовательно, относятся к устройству, содержащему приспособления (23) для удаления, полного либо частичного, культуральной среды от клеток. В одном варианте реализации изобретения устройство содержит аспиратор.
Определенные варианты реализации изобретения относятся к устройству, содержащему приспособления для удаления крышки с луночного планшета. В одном варианте реализации изобретения устройство содержит приспособления для удаления крышки с луночного планшета (26) путем присасывания (27). Другие приспособления для удаления крышки с луночного планшета включают, но не ограничиваются этим: клейкий материал, шарнирный элемент (28), зажим, магнит и электромагнит. В определенных вариантах реализации изобретения устройство содержит приспособления для визуализации клеток (29). В одном варианте реализации изобретения плотность клеток определяют путем измерения оптической плотности емкости, в которой содержатся клетки. В другом варианте реализации изобретения плотность клеток определяют при помощи визуализации клеток.
Определенные варианты реализации изобретения относятся к устройству, которое применяют в рабочей комбинации с другим оборудованием, например, оборудованием для культивирования, визуализации или каких-либо других манипуляций с клетками. В одном варианте реализации изобретения устройство (1) загружают при помощи роботизированной руки (30). В другом варианте реализации изобретения роботизированную руку используют для помещения планшетов в и/или извлечения планшетов из инкубатора (31). В другом варианте реализации изобретения для визуализации клеток используют плоское устройство для визуализации (32). В другом варианте реализации изобретения устройством управляют через компьютер (34). В одном варианте реализации изобретения устройство используют для трансфекции, перепрограммирования и/или генного редактирования клеток.
Цель настоящего изобретения, следовательно, состоит в обеспечении продуктов для применения как в исследованиях, так и для терапевтического применения.
Детали данного изобретения изложены в прилагающемся ниже описании. Хотя способы и материалы, схожие либо одинаковые с теми, которые описаны в данном тексте, можно применять при практическом осуществлении или тестировании настоящего изобретения, ниже будут описаны иллюстративные способы и материалы. Другие отличительные признаки, объекты и преимущества данного изобретения станут понятны из описания и формулы изобретения. В описании изобретения и прилагающейся формуле изобретения формы единственного числа часто включают в себя множественное число, если другое четко не предусмотрено контекстом. Если не указано иное, все употребляемые в данном тексте технические и научные термины имеют те же значения, которые обычно подразумеваются специалистами в данной области техники, которым принадлежит данное изобретение.
ПРИМЕРЫ
Пример 1 Синтез РНК
РНК, кодирующие человеческие белки Oct4, Sox2, Klf4, с-Мус-2 (Т58А) и Lin28 и содержащие различные комбинации канонических и неканонических нуклеотидов, синтезировали с ДНК матриц (Таблица 1). Образцы РНК анализировали при помощи электрофореза в арагозном геле для того, чтобы оценить качество РНК (ФИГ. 1). Затем РНК разводили до концентрации между 100 нг/мкЛ и 500 нг/мкЛ. Для определенных экспериментов добавляли ингибитор РНКазы (Superase-In™, Life Technologies Corporation) в концентрации 1 мкЛ/100 мкг РНК. Растворы РНК хранили при 4С. Для определенных экспериментов со смесями РНК, РНК, кодирующие Oct4, Sox2, Klf4, с-Мус-2 (Т58А) и Lin28 смешивали в мольном отношении 3:1:1:1:1.
ʺАʺ обозначает аденозин-5ʹ-трифосфат, ʺГʺ обозначает гуанозин-5ʹ-трифосфат, ʺУʺ обозначает уридин-5ʹ-трифосфат, ʺЦʺ обозначает цитидин-5'-трифосфат, ʺпсУʺ обозначает псевдоуридин-5ʹ-трифосфат, ʺ5мЦʺ обозначает 5-метилцитидин-5ʹ-трифосфат, ʺ2сУʺ обозначает 2-тиоуридин-5ʹ-трифосфат, ʺпсизоЦʺ обозначает псевдоизоцитидин-5ʹ-трифосфат, ʺ5мУʺ обозначает 5-метилуридин-5ʹ-трифосфат, ʺ7дАʺ обозначает 7-деазааденозин-5ʹ-трифосфат, ʺ7дГʺ обозначает 7-деазагуанозин-5ʹ-трифосфат и ʺN4mЦʺ обозначает N4-метилцитидин-5ʹ-трифосфат.
Пример 2 Приготовление трансфекционной среды
Состав среды разрабатывали таким образом, чтобы она способствовала эффективной трансфекции, перепрограммированию и генному редактированию клеток: DMEM/F12 + 10 мкг/мЛ инсулина + 5,5 мкг/мЛ трансферрина + 6,7 нг/мЛ селенита натрия + 20 нг/мЛ bFGF + 5 мг/мЛ обработанного человеческого сывороточного альбумина.
Также были разработаны варианты этой среды для того, чтобы обеспечить улучшенные показатели при применении определенных трансфекционных реагентов, определенных нуклеиновых кислот и определенных типов клеток: DMEM/F12 + 10 мкг/мЛ инсулина + 5,5 мкг/мЛ трансферрина + 6,7 нг/мЛ селенита натрия + 4,5 мкг/мЛ холестерина + 20 нг/мЛ bFGF + 5 мг/мЛ обработанного человеческого сывороточного альбумина, DMEM/F12 + 10 мкг/мЛ инсулина + 5,5 мкг/мЛ трансферрина + 6,7 нг/мЛ селенита натрия + 1 мкМ гидрокортизона + 20 нг/мЛ bFGF + 5 мг/мЛ обработанного человеческого сывороточного альбумина и DMEM/F12 + 10 мкг/мЛ инсулина + 5,5 мкг/мЛ трансферрина + 6,7 нг/мЛ селенита натрия + 4,5 мкг/мЛ холестерина +1 мкМ гидрокортизона + 20 нг/мЛ bFGF + 5 мг/мЛ обработанного человеческого сывороточного альбумина.
Примеры дополнительных компонентов, которые добавляли в клеточную культуральную среду в определенных экспериментах (перечисленные с приведенными в качеств примера концентрациями), включают: 15 мМ ГЭПЭС, 2 мМ L-аланил-L-глутамина, 2 мкг/мЛ этаноламина, 10 мкг/мЛ жирных кислот, 10 мкг/мЛ жирных кислот из рыбьего жира (метил эфиров), 25 мкг/мЛ полиоксиэтиленсорбитан моноолеата, 2 мкг/мЛ D-альфа-токоферол ацетата, 1-50 мкг/мЛ L-аскорбиновой кислоты 2-фосфат сесквимагний соль гидрата, 200 нг/мЛ B18R и 0,1% плюроника F-68.
Для определенных экспериментов, в которых среду кондиционировали, применяли следующий вариант:
DMEM/F12 + 15 мМ ГЭПЭС + 2 мМ L-аланил-L-глутамина + 10 мкг/мЛ инсулина + 5,5 мкг/мЛ трансферрина + 6,7 нг/мЛ селенита натрия + 2 мкг/мЛ этаноламина + 4,5 мкг/мЛ холестерина + 10 мкг/мЛ жирных кислот из рыбьего жира (метил эфиров) + 25 мкг/мЛ полиоксиэтиленсорбитан моноолеата + 2 мкг/мЛ D-альфа-токоферол ацетата + 1 мкг/мЛ L-аскорбиновой кислоты 2-фосфат сесквимагний соль гидрата + 0,1% плюроника F-68 + 20 нг/мЛ bFGF + 5 мг/мЛ обработанного человеческого сывороточного альбумина.
Для определенных экспериментов, в которых среду не кондиционировали, применяли следующий вариант:
DMEM/F12 + 15 мМ ГЭПЭС + 2 мМ L-аланил-L-глутамина + 10 мкг/мЛ инсулина + 5,5 мкг/мЛ трансферрина + 6,7 нг/мЛ селенита натрия + 2 мкг/мЛ этаноламина + 4,5 мкг/мЛ холестерина + 1 мкМ гидрокортизона + 0-25 мкг/мЛ полиоксиэтиленсорбитан моноолеата + 2 мкг/мЛ D-альфа-токоферол ацетата + 50 мкг/мЛ L-аскорбиновой кислоты 2-фосфат сесквимагний соль гидрата + 20 нг/мЛ bFGF + 5 мг/мЛ обработанного человеческого сывороточного альбумина.
Для приготовления этих вариантов обработанный человеческий сывороточный альбумин обрабатывали путем добавления 32 мМ октаноата натрия с последующим нагреванием при 60С на протяжении 4 ч, с последующей обработкой ионообменной смолой (AG501-X8(D)) на протяжении 6 ч при комнатной температуре, с последующей обработкой покрытым декстраном активированным древесным углем (С6241, Sigma-Aldrich Co. LLC.) на протяжении ночи при комнатной температуре, с последующими центрифугированием, фильтрацией, доведением до 10% раствора не содержащей нуклеазы водой, с последующим добавлением к другим компонентам среды. Для определенных экспериментов, в которых среду кондиционировали, среду кондиционировали на протяжении 24 ч на облученных фидерах их человеческих неонатальных фибробластов. Клетки высевали на покрытые фибронектином планшеты или покрытые фибронектином и витронектином планшеты, если не указано иное.
Состав среды может быть адаптирован к требованиям определенных типов культивируемых клеток. Более того, в определенных ситуациях, обработанный человеческий сывороточный альбумин можно заменить другим обработанным альбумином, например, обработанным бычьим сывороточным альбумином, вместо или дополнительно к L-аланил-L-глутамину можно использовать другие источники глутамина, например, L-глутамин, вместо или дополнительно к ГЭПЕС можно использовать другие буферные системы, например, фосфатные, бикарбонатные и т.д., вместо или дополнительно к селениту натрия селен может присутствовать в других формах, например, селенистой кислоты, вместо или дополнительно к L-аскорбиновой кислоте 2-фосфат сесквимагний соль гидрату и/или D-альфа-токоферол ацетату можно использовать другие антиоксиданты, например L-аскорбиновую кислоту, вместо или дополнительно к полиоксиэтиленсорбитан моноолеату и/или плюронику F-68 можно использовать другие поверхностно активные вещества, например, плюроник F-127, вместо или дополнительно к DMEM/F12 можно использовать другие базальные среды, например, MEM, DMEM и т.д., а компоненты культуральной среды можно менять со временем, например, путем применения среды TGF-β, начиная с 0-го дня до 5-го дня, затем применяя среду, содержащую 2 нг/мЛ TGF-β после 5-го дня. В некоторых ситуациях можно добавлять другие ингредиенты, например, жирные кислоты, лизофосфатидную кислоту, лизосфингомиелин, сфингозин-1-фосфат, другие сфинголипиды, представителей семейства белков TGF-β/NODAL, IL-6, представителей семейства белков Wnt и т.д. в подходящих концентрациях, а ингредиенты, для которых известно, что они стимулируют или подавляют рост определенных типов клеток, и/или агонисты, и/или антагонисты белков либо другие молекулы, для которых известно, что они стимулируют или подавляют рост определенных типов клеток, можно добавлять в среду в подходящих концентрациях при применении с этими типами клеток, например, сфингозин-1-фосфат и полипотентные стволовые клетки. Ингредиенты могут находиться в форме очищенных соединений, частей смесей с точно определенным составом, частей сложных смесей или смесей с неопределенным составом, например, животных и растительных масел, и могут быть добавлены при помощи биологических процессов, например, кондиционирования. Концентрации компонентов могут отличаться от перечисленных значений в границах диапазонов, которые очевидны для специалистов в данной области техники.
Пример 3 Трансфекция клеток синтетической РНК
Для трансфекции в 6-луночных планшетах 2 мкг РНК и 6 мкЛ трансфекционного реагента (Липофектамин™ RNAiMAX, Life Technologies Corporation) разводили сначала раздельно в среде для комплексирования (Опти-МЕМ®, Life Technologies Corporation) до общего объема, составляющего 60 мкЛ для каждого компонента. Затем разведенные РНК и трансфекционный реагент смешивали и инкубировали на протяжении 15 мин при комнатной температуре согласно инструкциям производителя трансфекционного реагента. Затем комплексы добавляли к клеткам в культуре. От 30 мкЛ до 240 мкЛ комплексов добавляли в каждую лунку 6-луночного планшета, в которых уже находилось по 2 мЛ трансфекционной среды. Затем планшеты аккуратно встряхивали для того, чтобы распределить комплексы по объему лунки. Клетки инкубировали вместе с комплексами от 2 ч до ночи перед тем, как сменить среду свежей трансфекционной средой (2 мЛ/лунку). Объемы устанавливали для трансфекции в 24-луночных и 96-луночных планшетах. Клетки фиксировали и окрашивали через 20-24 ч после трансфекции с использованием антитела к Oct4 (ФИГ. 2А). Ядра окрашивали и пересчитывали, чтобы определить относительную токсичность РНК (ФИГ. 2Б).
Пример 4 Анализ способности препаратов необработанного человеческого сывороточного альбумина способствовать трансфекции нуклеиновой кислоты и перепрограммированию РНК
Первичные человеческие неонатальные фибробласты культивировали в среде с или без 5 мг/мЛ ЧСА. Исследовали фракцию Кона V (А6784, Sigma-Aldrich Co. LLC.) и четыре различных препарата рекомбинантного ЧСА (А6608, А7736, А9731 и А9986, все от Sigma-Aldrich Co. LLC). Клетки трансфицировали согласно Примеру 3 РНК, синтезированной согласно Примеру 1. В то время как нетрансфицированные клетки хорошо росли в средах, содержащих любой из препаратов ЧСА, в трансфицированных лунках для каждого из препаратов ЧСА наблюдали существенные различия в морфологии клеток и плотности клеток, и ни один из препаратов не привел к морфологическим изменениям, которые указывали бы на перепрограммирование.
Пример 5 Получение человеческого сывороточного альбумина, обработанного октаноатом
10% раствор ЧСА предварительно инкубировали с 22 мМ хлорида натрия и 16 мМ октаноата натрия (Sigma-Aldrich Co. LLC), а затем инкубировали при 37С на протяжении 3 ч до образования конечной среды.
Пример 6 Обработка человеческого сывороточного альбумина при помощи ионообменной хроматографии
20% раствор рекомбинантного ЧСА, синтезированного в Pichia pastoris (А7736, Sigma-Aldrich Co. LLC), готовили путем растворения 2 г ЧСА в 10 мЛ не содержащей нуклеаз воды и аккуратного перемешивания при комнатной температуре. Затем раствор ЧСА деионизировали, добавляя сначала 1 г смешанной деионизирующей смолы (AG 501-X8(D), Bio-Rad Laboratories, Inc.), и встряхивая на протяжении 1 ч при комнатной температуре. Затем раствор ЧСА переливали в пробирку, содержащую 5 г свежей смолы, и встряхивали на протяжении 4 ч при комнатной температуре. В конце деионизированный раствор ЧСА переливали, доводили не содержащей нуклеаз водой до общего содержания белка в 10%, стерилизовали посредством фильтрации, используя 0,2 мкм мембранный фильтр из полиэфирсульфона, и хранили при 4С.
Пример 7 Анализ эффективности трансфекции и жизнеспособности клеток, культивированных в среде, содержащей обработанный октаноатом человеческий сывороточный альбумин
Первичные человеческие неонатальные фибробласты культивировали в среде, содержащей рекомбинантный ЧСА, обработанный согласно Примеру 4, или обработанный ЧСА, полученный из крови (Bio-Pure HSA, Biological Industries). Клетки трансфицировали ежедневно согласно Примеру 3 РНК, синтезированной согласно Примеру 1, начиная с 0-го дня. Снимки делали на 3-й день. В лунках, содержащих октаноат, наблюдали несколько небольших участков, на которых клетки претерпевали морфологические изменения, схожие с мезенхимально-эпителиальным переходом, что указывает на повышенную эффективность трансфекции. Для образцов, содержащих обработанный ЧСА, полученный из крови, наблюдали много крупных участков морфологических изменений, схожих с мезенхимально-эпителиальным переходом. В обоих случаях морфологические изменения были характерны для перепрограммирования.
Пример 8 Перепрограммирование человеческих фибробластов с использованием среды, содержащей обработанный октаноатом человеческий сывороточный альбумин
Первичные человеческие неонатальные фибробласты высевали на 6-луночные планшеты при плотности в 5000 клеток/лунку в среду для фибробластов (DMEM + 10% фетальная бычья сыворотка). Через 6 ч среду меняли на трансфекционную среду, содержащую обработанный октаноатом ЧСА. Клетки трансфицировали ежедневно согласно Примеру 3 РНК, синтезированной согласно Примеру 1, начиная с 0-го дня. К 5-му дню лунка содержала несколько участков клеток, демонстрирующих морфологию, которая соответствует перепрограммированию. В этом эксперименте не использовали фидеры или иммунодепрессанты.
Пример 9 Анализ эффективности трансфекции и жизнеспособности клеток, культивированных в среде, содержащей обработанный ионообменной смолой человеческий сывороточный альбумин
Первичные человеческие неонатальные фибробласты трансфицировали согласно Примеру 3 РНК, синтезированной согласно Примеру 1, начиная с 0-го дня. Снимки делали на 2-й день. Клетки в лунке, содержащей необработанный ЧСА демонстрировали низкую жизнеспособность по сравнению с лункой, содержащей обработанный ЧСА, полученный из крови, или обработанный ионообменной смолой ЧСА.
Пример 10 Перепрограммирование человеческих фибробластов с использованием обработанного ионообменной смолой человеческого сывороточного альбумина
Первичные человеческие неонатальные фибробласты высевали на 6-луночные планшеты при плотности в 10,000 клеток/лунку в среду для фибробластов (DMEM + 10% фетальная бычья сыворотка). Клетки трансфицировали ежедневно согласно Примеру 3 РНК, синтезированной согласно Примеру 1, начиная с 0-го дня. На 4-й день проводили пересев клеток с индексом разведения 1:20. Снимки делали на 10-й день. Лунка содержала много крупных колоний клеток, демонстрирующих морфологию, которая соответствует перепрограммированию. В лунках, в которых находилась клеточная культуральная среда, содержащая необработанный ЧСА, колоний не наблюдали.
Пример 11 Перепрограммирование человеческих фибробластов без использования фидеров или иммунодепрессантов
Первичные человеческие фибробласты высевали на 6-луночные планшеты при плотности в 20,000 клеток/лунку в среду для фибробластов (DMEM + 10% фетальная бычья сыворотка). Через 6 ч среду меняли на трансфекционную среду, содержащую обработанный ЧСА и не содержащую иммунодепрессантов, а клетки трансфицировали ежедневно согласно Примеру 3 РНК, синтезированной согласно Примеру 1, за исключением того, что дозу РНК уменьшили до 1 мкг/лунку, при этом было проведено всего 5 трансфекций. Снимки делали на 7-й день. К 5-му дню можно было видеть небольшие колонии клеток, демонстрирующих морфологию, которая соответствует перепрограммированию. На 7-й день среду меняли на DMEM/F12 + 20% Knockout™ Serum Replacement (Life Technologies Corporation) + 1X заменимых аминокислот + 2 мМ L-глутамина, кондиционировали на облученных мышиных эмбриональных фибробластах на протяжении 24 ч, а затем добавляли 20 нг/мЛ bFGF и 10 мкМ Y-27632. К 8-му дню можно было видеть крупные колонии с перепрограммированной морфологией. Колонии собирали на 10-й день и высевали в лунки, покрытые экстрактом базальной мембраны (Cultrex® Human ВМЕ Pathclear®, Trevigen Inc.) (ФИГ. 3А). Клетки быстро росли, их пересевали для того, чтобы получить стабильные линии. Стабильные линии демонстрировали положительное окрашивание в отношении маркеров полипотентных стволовых клеток Oct4 и SSEA4 (ФИГ. 3Б). После повторного проведения полного протокола действий наблюдали аналогичные результаты (ФИГ. 3В).
Пример 12 Эффективное быстрое получение и перепрограммирование клеток из биопсийного образца человеческой кожи
Полнослойным биопсийный образец брали при помощи дерматома у здорового 31 -летнего добровольца согласно утвержденному протоколу. Вкратце, участок кожи на левом плече обезболивали при помощи местного применения 2,5% лидокаина. Участок дезинфицировали 70% изопропанолом и проводили взятие полнослойного биопсийного образца кожи при помощи дерматома диаметром 1,5 мм (ФИГ. 4А). Ткань промывали в фосфатно-солевом буферном растворе (ФСР) и помещали в 1,5 мЛ пробирку, содержащую 250 мкЛ TrypLE™ Select CTS™ (Life Technologies Corporation), и инкубировали при 37C на протяжении 30 мин. Затем ткань перемещали в 1,5 мЛ пробирку, содержащую 250 мкЛ DMEM/F12-CTS™ (Life Technologies Corporation) + 5 мг/мЛ коллагеназы, и инкубировали при 37С на протяжении 2 ч (ФИГ. 4Б). Эпидермис удаляли при помощи щипцов, а ткань механически разделяли. Клетки дважды промывали в DMEM/F12-CTS™ и высевали в покрытые фибронектином лунки 24-луночных и 96-луночных планшетов. Тому же добровольцу проводили флеботомию и собирали венозную кровь в пробирки Vacutainer® SST™ (Becton, Dickinson and Company). Сыворотку выделяли согласно протоколу производителя. Изогенную среду для высевания готовили путем смешивания DMEM/F12-CTS™ + 2 мМ L-аланил-L-глутамина (Sigma-Aldrich Co. LLC.) + 20% человеческой сыворотки. Клетки из образца кожной ткани высевали как в трансфекционную среду, так и в изогенную среду для высевания. Через 2 дня лунки промывали, а среду меняли на трансфекционную среду. Много клеток с морфологией фибробластов прикрепились и начали делиться на 2-й день (ФИГ. 4В). Клетки трансфицировали согласно Примеру 3 РНК, синтезированной согласно Примеру 1, начиная со 2-го дня, при этом все объемы были установлены так, чтобы соответствовать более маленьким лункам. К 5-му дню наблюдали участки клеток с морфологией, которая соответствует перепрограммированию.
Пример 13 Перепрограммирование человеческих фибробластов с использованием синтетической РНК, содержащей неканонические нуклеотиды
Первичные человеческие фибробласты высевали на 6-луночные планшеты, покрытые рекомбинантным человеческим фибронектином и рекомбинантным человеческим витронектином (каждый разводили в DMEM/F12 до концентрации 1 мкг/мЛ, 1 мЛ/лунку, и инкубировали при комнатной температуре на протяжении 1 ч) при плотности в 20,000 клеток/лунку в трансфекционную среду. На следующий день клетки трансфицировали как в Примере 3 РНК, синтезированной согласно Примеру 1, за исключением того, что доза РНК составляла 0,5 мкг/лунку в 1-й день, 0,5 мкг/лунку во 2-й день и 2 мкг/лунку на 3-й день. Снимки делали на 4-й день. На 4-й день можно было видеть небольшие колонии клеток, демонстрирующих морфологию, которая соответствует перепрограммированию.
Пример 14 Перепрограммирование человеческих фибробластов при помощи некондиционированной трансфекционной среды
Первичные человеческие фибробласты высевали на 6-луночные планшеты, покрытые рекомбинантным человеческим фибронектином и рекомбинантным человеческим витронектином (каждый разводили в DMEM/F12 до концентрации 1 мкг/мЛ, 1 мЛ/лунку, и инкубировали при комнатной температуре на протяжении 1 ч) при плотности в 20,000 клеток/лунку в трансфекционную среду. На следующий день клетки трансфицировали как в Примере 3 РНК, синтезированной согласно Примеру 1, за исключением того, что доза РНК составляла 0,5 мкг/лунку в 1-й день, 0,5 мкг/лунку во 2-й день и 2 мкг/лунку на 3-й день, 2 мкг/лунку на 4-й день и 4 мкг/лунку на 5-й день. К 5-му дню можно было видеть небольшие колонии клеток, демонстрирующих морфологию, которая соответствует перепрограммированию. На 7-й день среду меняли на DMEM/F12 + 20% Knockout™ Serum Replacement (Life Technologies Corporation) + 1X заменимых аминокислот + 2 мМ L-глутамина, кондиционировали на облученных мышиных эмбриональных фибробластах на протяжении 24 ч, а затем добавляли 20 нг/мЛ bFGF и 10 мкМ Y-27632. К 8-му дню можно было видеть крупные колонии с перепрограммированной морфологией. Колонии собирали на 10-й день и высевали в лунки, покрытые экстрактом базальной мембраны (Cultrex® Human ВМЕ Pathclear®, Trevigen Inc.). Клетки быстро росли, их пересевали для того, чтобы получить стабильные линии.
Пример 15 Получение глюкозозависимых инсулин-продуцирующих клеток
Клетки перепрограммировали согласно Примеру 11 или Примеру 12, а затем культивировали в DMEM/F12 + 0,2% ЧСА + 0,5Х N2 добавки + 0,5Х В27 добавки + 100 нг/мЛ активина А + 1 мкМ вортманнина на протяжении 4 дней, затем в 1:1 F12/IMDM + 0,5% ЧСА + 0,5% ITS добавки + 0,5Х В27 добавки + 2 мкМ ретиноевой кислоты + 20 нг/мЛ FGF7 + 50 нг/мЛ NOGGIN на протяжении 4 дней, затем в DMEM + 0,5% ЧСА + 1% ITS добавки + 1X N2 добавки + 50 нг/мЛ EGF на протяжении 5 дней, затем в DMEM/F12 + 1% ITS добавки + 10 нг/мЛ bFGF + 10 мМ никотинамида + 50 нг/мЛ эксендина-4 + 10 нг/мЛ ВМР4 на протяжении 7-9 дней для того, чтобы получить глюкозозависимые инсулин-продуцирующие клетки. В альтернативном варианте клетки перепрограммировали согласно Примеру 11 или Примеру 12, а затем культивировали в 1:1 F12/IMDM + 0,5% ЧСА + 0,5% ITS добавки + 0,5Х В27 добавки + 2 мкМ ретиноевой кислоты + 20 нг/мЛ FGF7 + 50 нг/мЛ NOGGIN на протяжении 4 дней, затем в DMEM + 0,5% ЧСА + 1% ITS добавки + 1X N2 добавки + 50 нг/мЛ EGF на протяжении 5 дней, затем в DMEM/F12 + 1% ITS добавки + 10 нг/мЛ bFGF + 10 мМ никотинамида + 50 нг/мЛ эксендина-4 + 10 нг/мЛ ВМР4 на протяжении 7-9 дней для того, чтобы получить глюкозозависимые инсулин-продуцирующие клетки без получения зрелых эндодермальных клеток. В альтернативном варианте клетки перепрограммировали согласно Примеру 11 или Примеру 12, а затем культивировали в 1:1 F12/IMDM + 0,5% ЧСА + 0,5% ITS добавки + 0,5Х В27 добавки + 2 мкМ ретиноевой кислоты + 20 нг/мЛ FGF7 + 50 нг/мЛ NOGGIN на протяжении 4 дней, затем в DMEM/F12 + 1% ITS добавки + 10 нг/мЛ bFGF + 10 мМ никотинамида + 50 нг/мЛ эксендина-4 + 10 нг/мЛ ВМР4 на протяжении 7-9 дней для того, чтобы получить глюкозозависимые инсулин-продуцирующие клетки без получения зрелых эндодермальных клеток и без роста клеток-предшественниц. Хотя эндодермальные клетки или инсулин-продуцирующие клетки можно отделить от других присутствующих в культуре клеток, при помощи данного способа получают достаточно высокое процентное содержание глюкозозависимых инсулин-продуцирующих клеток, поэтому в общем случае такое отделение не является необходимым. Полученные клетки затем можно использовать in vitro или in vivo для скрининга биоактивных молекул для исследования диабета или для разработки терапевтических препаратов от диабета.
Пример 16 Получение глюкозозависимых инсулин-продуцирующих клеток с использованием рекомбинантных белков
Клетки перепрограммировали согласно Примеру 11, а затем культивировали в DMEM/F12, 100 нг/мл активина А, 25 нг/мл Wnt3a, 0,01% рекомбинантном ЧСА, 1X ITSE на протяжении 1 дня, затем в DMEM/F12, 100 нг/мл активина А, 0,01% рекомбинантном ЧСА, 1X ITSE на протяжении 2 дней, затем в DMEM/F12, 50 нг/мл FGF10, 0,25 мкМ KAAD-циклопамина, 0,01% рекомбинантном ЧСА, 1X ITSE на протяжении 3 дней, затем в DMEM/F12, 1% В27, 2 мкМ полностью транс-ретиноевой кислоты, 50 нг/мл FGF10, 0,25 мкМ KAAD-циклопамина на протяжении 4 дней, затем в DMEM/F12, 1% В27, 1 мкМ ингибитора γ-секретазы DAPT, 50 нг/мл эксендина-4, 10 нМ бетацеллюлина, 10 мМ никотинамида на протяжении 2 дней, затем в DMEM/F12, 50 мг/Л аскорбиновой кислоты-2-фосфата, 1% В27, 1 мкМ ингибитора γ-секретазы DAPT, 50 нг/мл эксендина-4, 50 нг/мл IGF-1, 50 нг/мл HGF, 10 нМ бетацеллюлина, 10 мМ никотинамида на протяжении 6 дней для того, чтобы получить глюкозозависимые инсулин-продуцирующие клетки (ФИГ. 5А). Полученные клетки затем можно использовать in vitro или in vivo для скрининга биоактивных молекул для исследования диабета или для разработки терапевтических препаратов от диабета.
Пример 17 Индивидуальная заместительная клеточная терапия диабета I типа, включающая применение перепрограммированных клеток
Клетки кожи пациента перепрограммировали в глюкозозависимые инсулин-продуцирующие клетки согласно Примеру 12 и Примеру 14. Затем клетки ферментативным способом извлекали из емкости для культивирования и во внутрибрюшинное пространство или в воротную вену вводили от около 1×106 до около 1×107 клеток. В случае внутрибрюшинной инъекции клетки предварительно смешивали с белками внеклеточного матрикса, чтобы предотвратить избыточную миграцию. Клетки приживались и начинали вырабатывать инсулин. Отслеживали уровни инсулина/С-пептида и в случае необходимости проводили дополнительные инъекции.
Пример 18 Синтез РНК TALEN
РНК, кодирующую совпадающие по 20 п.о. TALEN, синтезировали с ДНК матрицы как в Примере 1 (ФИГ. 6А-В и ФИГ. 7) (Таблица 2). Полученные РНК анализировали при помощи электрофореза в арагозном геле для того, чтобы оценить качество РНК. Затем РНК разводили до 200 нг/мкЛ и добавляли ингибитор РНКазы (Superase-In™, Life Technologies Corporation) в концентрации 1 мкЛ/100 мкг РНК. Растворы РНК хранили при 4С. РНК, кодирующие каждую половину из пары TALEN смешивали в мольном отношении 1:1.
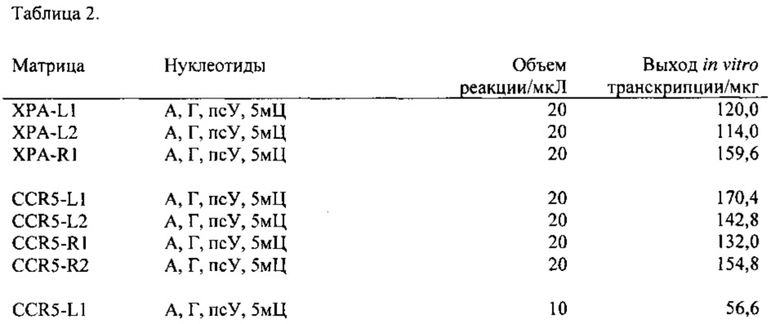

Пример 19 Синтез РНК TALEN, нацеленных на ген CCR5
РНК, кодирующую TALEN L1: TCATTTTCCATACAGTCAGT, L2: TTTTCCATACAGTCAGTATC, R1: TGACTATCTTTAATGTCTGG, и R2: TATCTTTAATGTCTGGAAAT синтезировали согласно Примеру 18. Эти TALEN нацелены на участки в 20 п.о. гена CCR5, находящиеся на смысловой (L1 и L2) или антисмысловой (R1 и R2) цепи. Готовили следующие пары TALEN: L1 и R1, L1 и R2, L2 и R1 и L2 и R2.
Пример 20 Генное редактирование гена CCR5 с использованием РНК TALEN и перепрограммирование человеческих фибробластов без ДНК, фидеров, иммунодепрессантов и кондиционирования
Первичные человеческие фибробласты высевали на 6-луночные планшеты, покрытые рекомбинантным человеческим фибронектином и рекомбинантным человеческим витронектином (каждый разводили в DMEM/F12 до концентрации 1 мкг/мЛ, 1 мЛ/лунку, и инкубировали при комнатной температуре на протяжении 1 ч) при плотности в 10,000 клеток/лунку в трансфекционную среду. На следующий день клетки трансфицировали как в Примере 3 РНК, за исключением того, что доза РНК составляла 0,5 мкг/лунку, а РНК синтезировали согласно Примеру 19. Начиная со следующего дня клетки перепрограммировали согласно Примеру 11. Как и в Примере 11 было видно крупные колонии клеток, демонстрирующих морфологию, которая соответствует перепрограммированию. Снимки делали на 9-й день (ФИГ. 8).
Пример 21 Трансфекция клеток РНК TALEN и матрицей для репарации ДНК
0,5 мкг РНК + 0,5 мкг ДНК, содержащей участок в 1001 п.о., простирающийся от 500 п.о. выше целевого месторасположения двухцепочечного разрыва до 500 п.о. ниже целевого месторасположения двухцепочечного разрыва, и 6 мкЛ трансфекционного реагента (Липофектамин™ 2000, Life Technologies Corporation) сначала разводили отдельно в среде для комплексирования (Опти-МЕМ®) до общего объема, составляющего около 60 мкЛ для каждого компонента. Затем разведенные РНК+ДНК и трансфекционный реагент смешивали и инкубировали на протяжении 15 мин при комнатной температуре согласно инструкциям производителя трансфекционного реагента. Затем комплексы добавляли к клеткам в культуре. От 60 мкЛ до 120 мкЛ комплексов добавляли в каждую лунку 6-луночного планшета, в которых уже находилось по 2 мЛ трансфекционной среды. Затем планшеты аккуратно встряхивали для того, чтобы распределить комплексы по объему лунки. Клетки инкубировали вместе с комплексами от 2 ч до ночи перед тем, как сменить среду свежей трансфекционной средой (2 мЛ/лунку).
Пример 22 Генное редактирование с использованием РНК TALEN и матрицы для репарации ДНК и перепрограммирование человеческих фибробластов без ДНК, фидеров, иммунодепрессантов и кондиционирования
Первичные человеческие фибробласты высевали на 6-луночные планшеты при плотности в 10,000 клеток/лунку в среду для фибробластов (DMEM + 10% фетальная бычья сыворотка). Через 6 ч среду меняли на трансфекционную среду, содержащую обработанный ЧСА и не содержащую иммунодепрессантов, а клетки трансфицировали согласно Примеру 21. Начиная со следующего дня клетки перепрограммировали согласно Примеру 11 или Примеру 12, за исключением того, что этапы первичного высевания и замены среды были опущены.
Пример 23 Получение гемопоэтических клеток
Клетки перепрограммировали согласно Примеру 11, а затем культивировали в IMDM + 0,5% ЧСА + 1x ITS добавки + 450 мкМ монотиоглицерола + 2 мМ L-глутамина + 1X заменимых аминокислот + 50 нг/мЛ ВМР4 + 50 нг/мЛ VEGF + 50 нг/мЛ bFGF на протяжении 6 дней для того, чтобы получить гемопоэтические клетки (ФИГ. 5Б). В альтернативном варианте клетки перепрограммировали согласно Примеру 11, или Примеру 12, или Примеру 20, или Примеру 22, а затем культивировали в IMDM + 0,5% ЧСА + 1x ITS добавки + 450 мкМ монотиоглицерола + 2 мМ L-глутамина + 1X заменимых аминокислот + 50 нг/мЛ ВМР4 + 50 нг/мЛ VEGF + 50 нг/мЛ bFGF на протяжении 6 дней, затем в IMDM + 0,5% ЧСА + 1x ITS добавки + 0,1 мМ 2-меркаптоэтанола + 5 ед./мЛ гепарина + 10 нг/мЛ ТПО + 25 нг/мЛ ФСК + 25 нг/мЛ FLT3L + 10 нг/мЛ IL-3 + 10 нг/мЛ IL-6 на протяжении 8 дней для того, чтобы получить гемопоэтические клетки. В альтернативном варианте клетки перепрограммировали согласно Примеру 11, или Примеру 12, или Примеру 20, или Примеру 22, а затем повторно высевали в коллаген IV и культивировали в IMDM + 0,5% ЧСА + 1x ITS добавки + 450 мкМ монотиоглицерола + 2 мМ L-глутамина + 1X заменимых аминокислот + 50 нг/мЛ ВМР4 + 50 нг/мЛ VEGF + 50 нг/мЛ bFGF на протяжении 6 дней, затем в IMDM + 0,5% ЧСА + 1x ITS добавки + 0,1 мМ 2-меркаптоэтанола + 5 ед./мЛ гепарина + 10 нг/мЛ ТПО + 25 нг/мЛ ФСК + 25 нг/мЛ FLT3L + 10 нг/мЛ IL-3 + 10 нг/мЛ IL-6 на протяжении 8 дней для того, чтобы получить гемопоэтические клетки. В альтернативном варианте клетки перепрограммировали согласно Примеру 11, или Примеру 12, или Примеру 20, или Примеру 22, а затем культивировали в 1:1 F12/IMDM + 0,5% ЧСА + 1x ITS добавки + 4,5 мкг/мЛ холестерина + 10 мкг/мЛ жирных кислот из рыбьего жира (метил эфиров) + 25 мкг/мЛ полиоксиэтиленсорбитан моноолеата + 2 мкг/мЛ D-α-токоферол ацетата + 450 мкМ монотиоглицерола + 2 мМ L-глутамина + 25 нг/мЛ ВМР4 + 25 нг/мЛ VEGF + 25 нг/мЛ bFGF + 20 нг/мЛ ФСК на протяжении 10 дней для того, чтобы получить гемопоэтические клетки.
Пример 24 Индивидуальная заместительная клеточная терапия заболевания крови, включающая применение перепрограммированных клеток
Клетки кожи пациента перепрограммировали в гемопоэтические клетки согласно Примеру 23. Затем клетки извлекали из емкости для культивирования, и за период времени, составляющий несколько часов, в главную вену вводили от около 1×106 до около 1×107 клеток/кг массы тела пациента.
Пример 25 Индивидуальная заместительная клеточная терапия ВИЧ/СПИД, включающая применение генетически отредактированных и перепрограммированных клеток
Клетки кожи пациента генетически редактировали и перепрограммировали в гемопоэтические клетки согласно Примеру 23. Затем клетки ферментативным способом извлекали из емкости для культивирования, и за период времени, составляющий несколько часов, в главную вену вводили от около 1×106 до около 1×107 клеток/кг массы тела пациента. Гемопоэтические клетки оседали в костномозговой полости и приживались. В альтернативном варианте клетки кожи пациента генетически редактировали и перепрограммировали в гемопоэтические клетки согласно Примеру 23, затем клетки ферментативным способом извлекали из емкости для культивирования, и выделяли клетки CD34+/CD90+/Lin- или CD34+/CD49f+/Lin-. Пациенту в главную вену вводили от около 1×103 до около 1×105 клеток. Гемопоэтические клетки оседали в костномозговой полости и приживались.
Пример 26 Модели сердечных заболеваний для скрининга биоактивных молекул
Клетки перепрограммировали согласно Примеру 11, а затем культивировали в DMEM/F12 + 0,2% ЧСА + 0,5Х N2 добавки + 0,5Х В27 добавки + 100 нг/мЛ активина А + 1 мкМ вортманнина на протяжении 4 дней, затем в 1:1 F12/IMDM + 0,5% ЧСА + 0,5% ITS добавки + 0,5Х В27 добавки + 2 мкМ ретиноевой кислоты + 20 нг/мЛ FGF7 + 50 нг/мЛ NOGGIN на протяжении 4 дней, затем в DMEM/F12 + 1% ITS добавки + 10 нг/мЛ bFGF + 10 мМ никотинамида + 50 нг/мЛ эксендина-4 + 10 нг/мЛ ВМР4 на протяжении 7-9 дней для того, чтобы получить сердечные клетки (ФИГ. 5В). В альтернативном варианте клетки перепрограммировали согласно Примеру 12. Хотя сердечные клетки можно отделить от других присутствующих в культуре клеток, при помощи данного способа получают достаточно высокое процентное содержание сердечных клеток, поэтому в общем случае такое отделение не является необходимым. Полученные клетки затем можно использовать in vitro или in vivo для скрининга биоактивных молекул для исследования сердечной недостаточности или для разработки терапевтических препаратов от сердечной недостаточности. Полученные клетки также можно использовать для исследования кардиотоксичности.
Пример 27 Индивидуальная заместительная клеточная терапия ишемической кардиомиопатии, включающая применение перепрограммированных клеток
Клетки кожи пациента перепрограммировали в сердечные клетки согласно Примеру 26. Затем клетки ферментативным способом извлекали из емкости для культивирования, и вводили от около 1×103 до около 1×107 клеток в перикард или от около 1×107 до около 1×105 клеток в одну или более коронарных артерий. Клетки приживались, а дополнительные инъекции проводили в случае необходимости.
Пример 28 Модели заболеваний сетчатки для скрининга биоактивных молекул
Клетки перепрограммировали согласно Примеру 11 или Примеру 12, а затем культивировали в DMEM/F12 + 0,2% ЧСА + 0,5Х N2 добавки + 0,5Х В27 добавки на протяжении 7 дней для того, чтобы получить ретинальные клетки. Полученные клетки затем можно использовать in vitro или in vivo для скрининга биоактивных молекул для исследования заболеваний сетчатки или для разработки терапевтических препаратов от заболеваний сетчатки.
Пример 29 Индивидуальная заместительная клеточная терапия макулярной дегенерации, включающая применение перепрограммированных клеток
Клетки кожи пациента перепрограммировали в ретинальные клетки согласно Примеру 28. Затем клетки ферментативным способом извлекали из емкости для культивирования, и вводили от около 1×104 до около 1×105 клеток в сетчатку или чуть ниже. Клетки приживались, а дополнительные инъекции проводили в случае необходимости.
ЭКВИВАЛЕНТЫ
Специалисты в данной области техники признают или смогут установить при помощи стандартных экспериментов существование многочисленных эквивалентных вариантов описанных в данном тексте отдельных вариантов реализации изобретения. Такие эквивалентные варианты включены в объем приведенной ниже формулы изобретения.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛОК
Все патентные заявки и публикации, перечисленные в тексте, в полном объеме включены в данный текст посредством ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ ТРАНСФЕКЦИИ КЛЕТОК | 2012 |
|
RU2691027C2 |
| СПОСОБЫ И ПРОДУКТЫ ДЛЯ ЭКСПРЕССИИ БЕЛКОВ В КЛЕТКАХ | 2013 |
|
RU2711249C2 |
| СПОСОБ ПОВЫШЕНИЯ ЭКСПРЕССИИ РНК В КЛЕТКЕ | 2018 |
|
RU2784654C2 |
| Способ синтеза трансфецирующего наноагента для генотерапевтических применений (варианты) | 2021 |
|
RU2838201C1 |
| СТИМУЛЯЦИЯ ПУТИ Wnt ПРИ ПЕРЕПРОГРАММИРОВАНИИ СОМАТИЧЕСКИХ КЛЕТОК | 2008 |
|
RU2492232C2 |
| ПОСЛЕДОВАТЕЛЬНОСТИ 3'-UTR ДЛЯ СТАБИЛИЗАЦИИ РНК | 2016 |
|
RU2783165C1 |
| ПОСЛЕДОВАТЕЛЬНОСТИ 3'-UTR ДЛЯ СТАБИЛИЗАЦИИ РНК | 2016 |
|
RU2720934C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ НЕРВНЫХ СТВОЛОВЫХ КЛЕТОК, ПЕРЕПРОГРАММИРОВАННЫХ ИЗ КЛЕТОК, НЕ ЯВЛЯЮЩИХСЯ НЕРВНЫМИ, С ИСПОЛЬЗОВАНИЕМ HMGA2 | 2014 |
|
RU2646099C2 |
| СОСТАВЫ НА ОСНОВЕ МОДИФИЦИРОВАННОГО НУКЛЕОЗИДА, НУКЛЕОТИДА И НУКЛЕИНОВОЙ КИСЛОТЫ | 2012 |
|
RU2649364C2 |
| Комбинированное лекарственное средство, обладающее противовирусным эффектом в отношении нового коронавируса SARS-CoV-2 | 2021 |
|
RU2746362C1 |









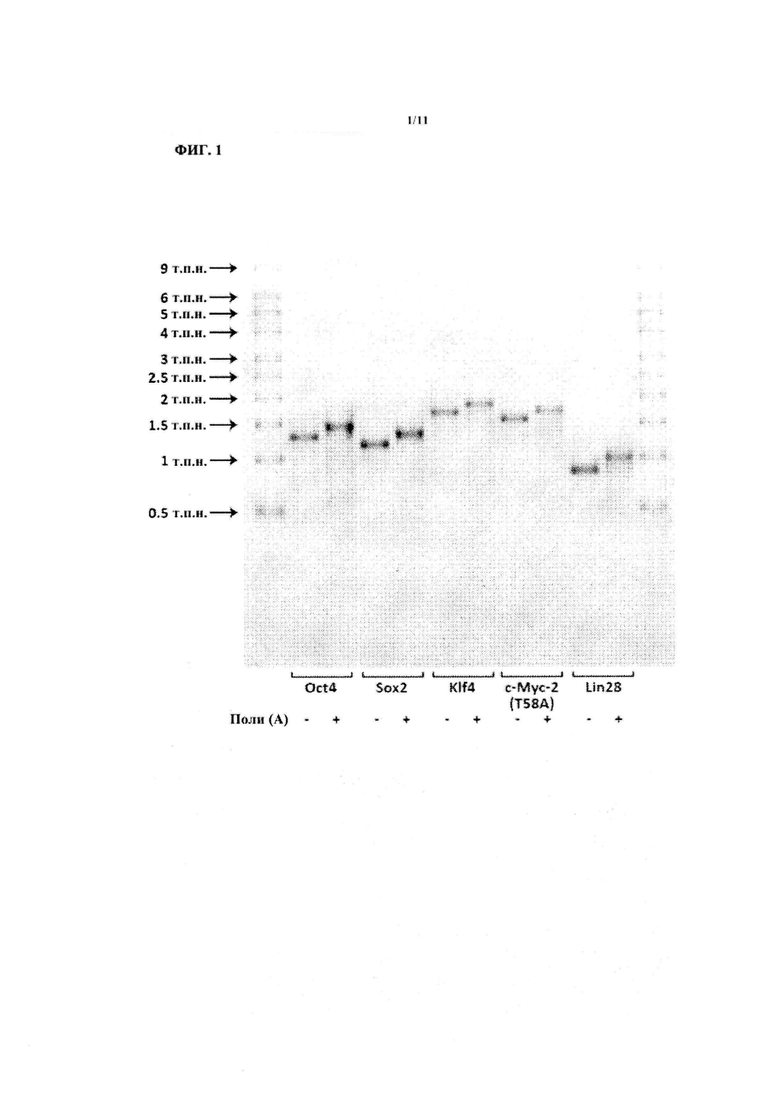
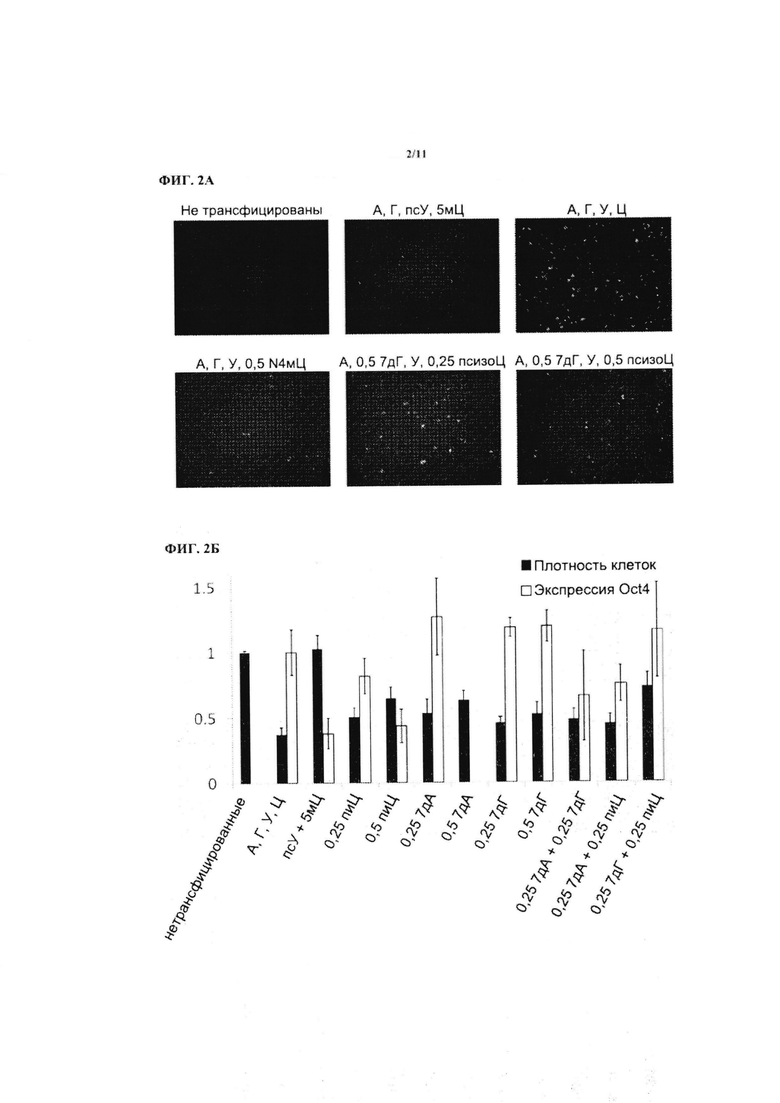
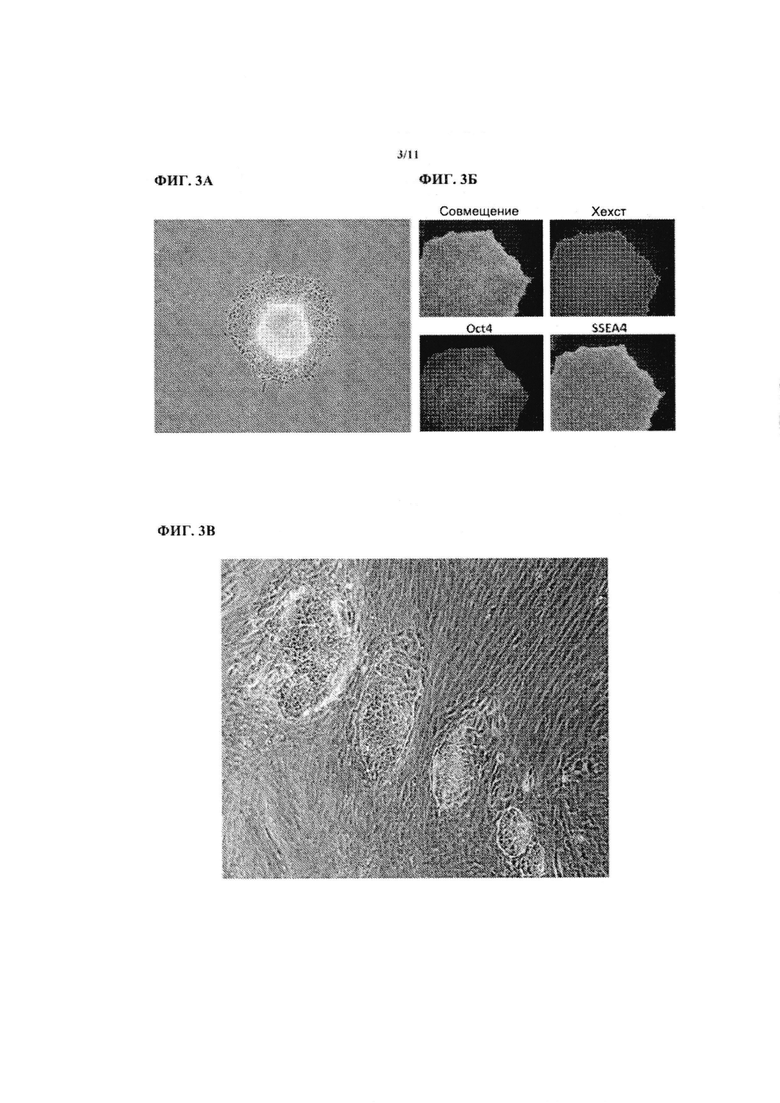

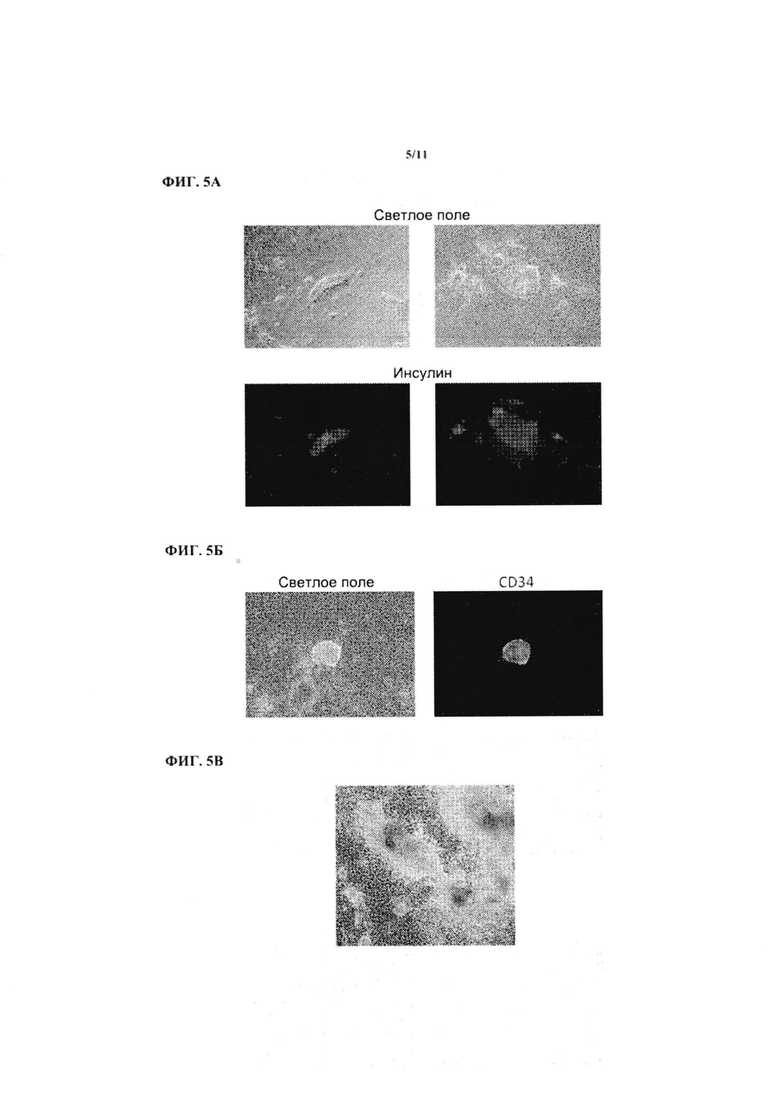
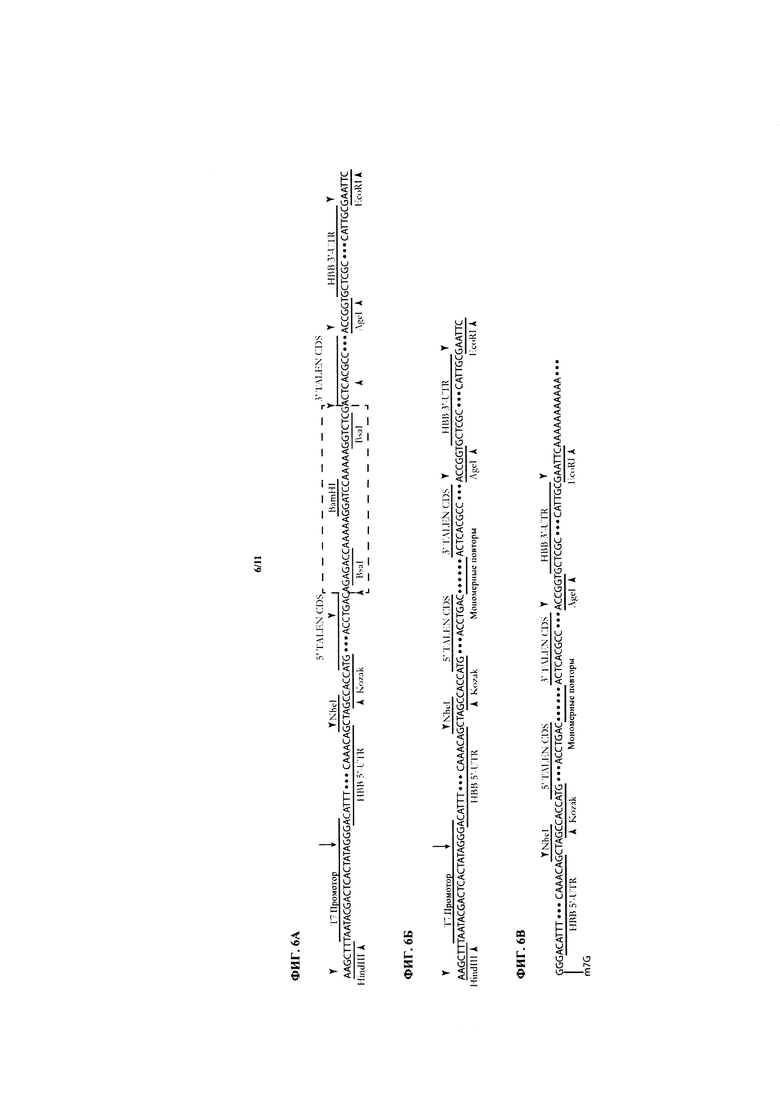


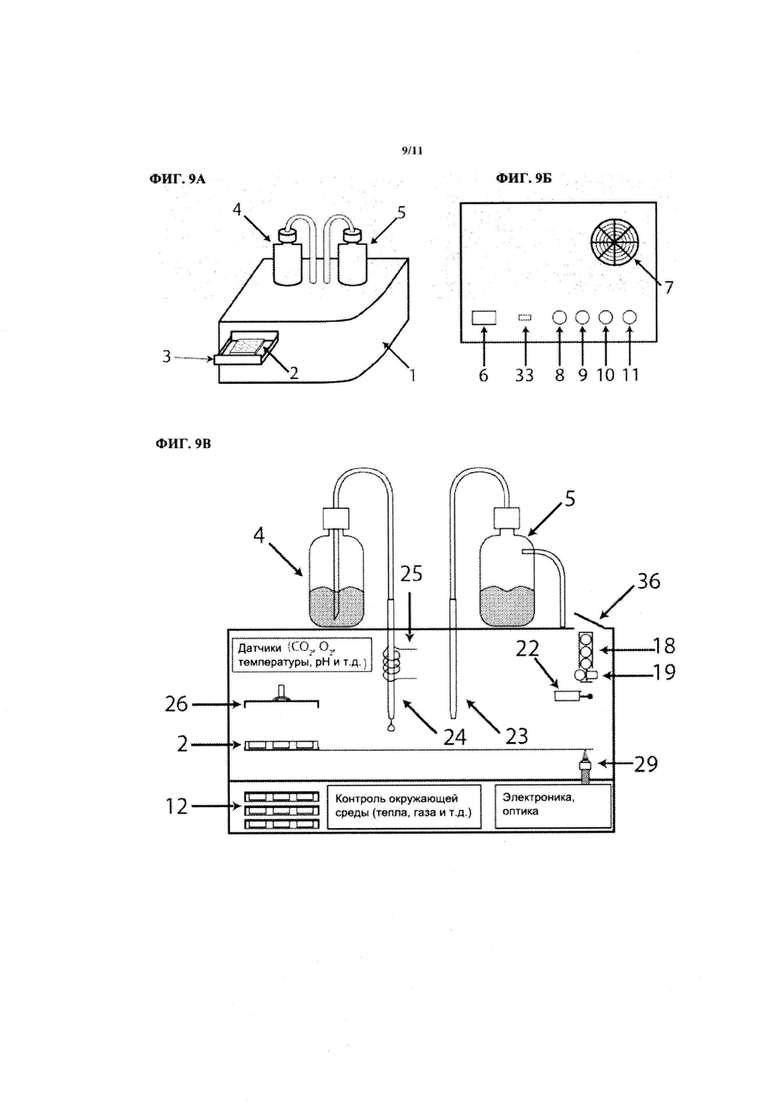
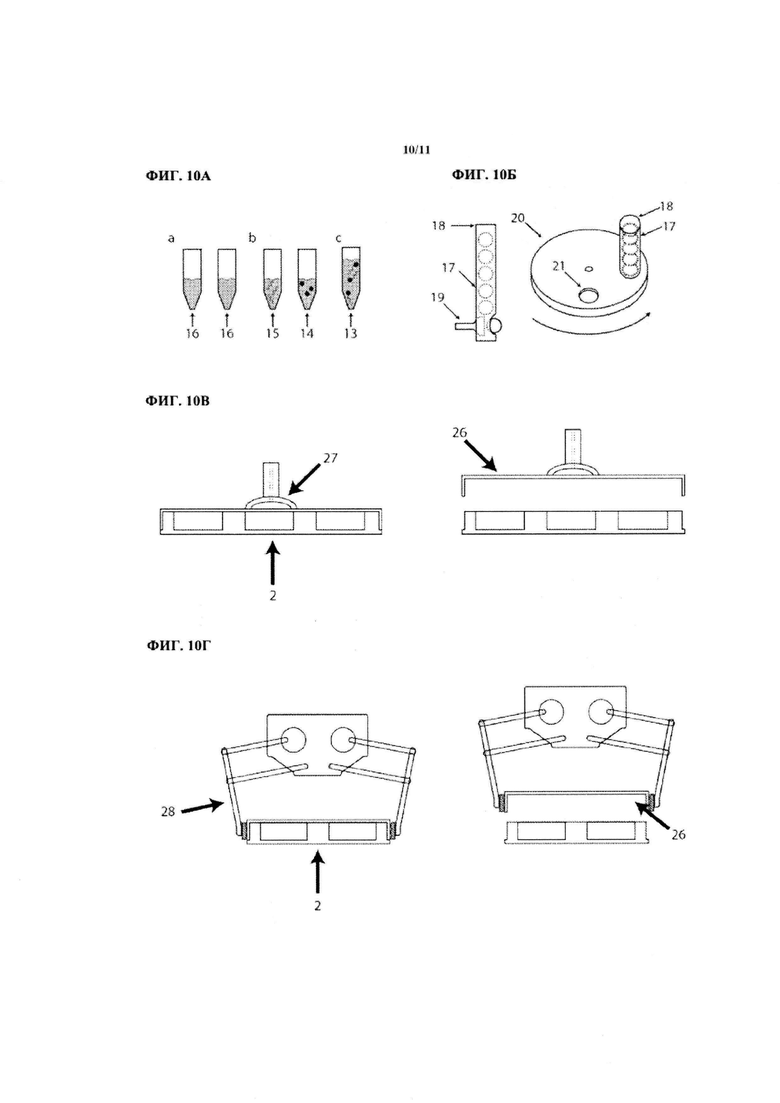
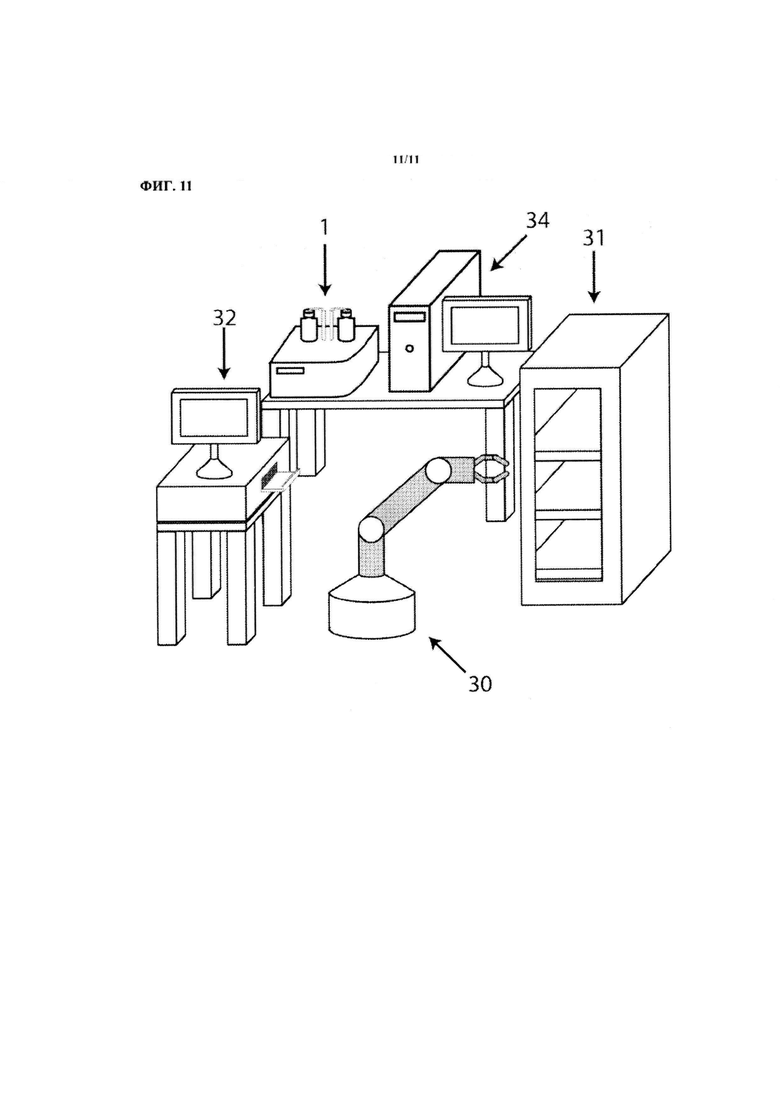
Изобретение относится к биохимии. Описан способ перепрограммирования клетки в менее дифференцированное состояние, включающий культивирование дифференцированной клетки в среде для перепрограммирования, содержащей альбумин, где альбумин обработан ионообменной смолой или древесным углем, трансфицирование клетки одной или более синтетических молекул РНК, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую один или более факторов перепрограммирования, и где указанное трансфицирование приводит к получению клетки, экспрессирующей один или более факторов перепрограммирования; и повторение стадии (b) по меньшей мере дважды в течение 5 последовательных дней с получением клетки, перепрограммированной в менее дифференцированное состояние. Описана среда для культивирования клеток для перепрограммирования клетки в менее дифференцированное состояние, содержащая: среду Игла, модифицированную по способу Дульбекко: питательную среду F-12 (DMEM/F12), 10 мкг/мЛ инсулина, 5,5 мкг/мЛ трансферрина, 6,7 нг/мЛ селенита натрия, 20 нг/мЛ основного фактора роста фибробластов (bFGF) и 5 мг/мЛ альбумина, где альбумин обработан ионообменной смолой и/или древесным углем. Также представлена среда для культивирования клеток для перепрограммирования клетки в менее дифференцированное состояние, содержащая среду Игла, модифицированную по способу Дульбекко: питательную среду F-12 (DMEM/F12), 10 мкг/мЛ инсулина, 5,5 мкг/мЛ трансферрина, 6,7 нг/мЛ селенита натрия, 20 нг/мЛ основного фактора роста фибробластов (bFGF) и 5 мг/мЛ альбумина, где менее чем 0,65% сухого веса альбумина включает липиды и/или менее чем 0,35% сухого веса альбумина включает свободные жирные кислоты. Изобретение расширяет арсенал способов перевода клетки в менее дифференцированное состояние. 4 н. и 24 з.п. ф-лы, 11 ил., 2 табл., 29 пр.
1. Способ перепрограммирования клетки в менее дифференцированное состояние, включающий:
(a) культивирование дифференцированной клетки в среде для перепрограммирования, содержащей альбумин, где альбумин обработан ионообменной смолой или древесным углем,
(b) трансфицирование клетки одной или более синтетических молекул РНК, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую один или более факторов перепрограммирования, и где указанное трансфицирование приводит к получению клетки, экспрессирующей один или более факторов перепрограммирования; и
(c) повторение стадии (b) по меньшей мере дважды в течение 5 последовательных дней с получением клетки, перепрограммированной в менее дифференцированное состояние.
2. Способ по п. 1, где альбумин был обработан октаноатом натрия.
3. Способ по п. 2, где альбумин нагрет до температуры, составляющей по меньшей мере 40°C.
4. Способ по п. 1, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую по меньшей мере один член группы: белок Oct4, белок Sox2, белок Klf4 и белок c-Myc.
5. Способ по п. 1, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую белок Oct4, по меньшей мере одну молекулу РНК, кодирующую белок Sox2, по меньшей мере одну молекулу РНК, кодирующую белок Klf4, и по меньшей мере одну молекулу РНК, кодирующую белок c-Myc.
6. Способ по п. 1, дополнительно включающий приведение указанной клетки в контакт с по меньшей мере с одним членом группы: поли-L-лизин, поли-L-орнитин, RGD-пептид, фибронектин, витронектин, коллаген и ламинин.
7. Способ по п. 1, где указанные одна или более синтетических молекул РНК включают по меньшей мере один член группы: остаток псевдоуридина и остаток 5-метилцитидина.
8. Способ по п. 1, где клетка представляет собой клетку кожи.
9. Способ по п. 1, где альбумин дополнительно обрабатывают октаноатом натрия и нагревают до температуры, составляющей по меньшей мере 40°C.
10. Способ по п. 9, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую по меньшей мере один член группы: белок Oct4, белок Sox2, белок Klf4 и белок c-Myc.
11. Способ по п. 9, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую белок Oct4, по меньшей мере одну молекулу РНК, кодирующую белок Sox2, по меньшей мере одну молекулу РНК, кодирующую белок Klf4, и по меньшей мере одну молекулу РНК, кодирующую белок c-Myc.
12. Способ по п. 9, дополнительно включающий приведение указанной клетки в контакт по меньшей мере с одним членом группы: поли-L-лизин, поли-L-орнитин, RGD-пептид, фибронектин, витронектин, коллаген и ламинин.
13. Способ по п. 9, где указанные одна или более синтетических молекул РНК включают по меньшей мере один член группы: остаток псевдоуридина и остаток 5-метилцитидина.
14. Способ по п. 9, где клетка представляет собой клетку кожи.
15. Среда для культивирования клеток для перепрограммирования клетки в менее дифференцированное состояние, содержащая: среду Игла, модифицированную по способу Дульбекко: питательную среду F-12 (DMEM/F12), 10 мкг/мЛ инсулина, 5,5 мкг/мЛ трансферрина, 6,7 нг/мЛ селенита натрия, 20 нг/мЛ основного фактора роста фибробластов (bFGF) и 5 мг/мЛ альбумина, где альбумин обработан ионообменной смолой и/или древесным углем.
16. Среда для культивирования клеток по п. 15, дополнительно включающая по меньшей мере одно из следующих: 15 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (ГЭПЭС), 2 мМ L-аланил-L-глутамин, 2 мкг/мЛ этаноламин, 4,5 мкг/мЛ холестерин, 25 мкг/мЛ полиоксиэтиленсорбитан моноолеат, 2 мкг/мЛ D-альфа-токоферол ацетат и 1 мкг/мЛ L-аскорбиновой кислоты 2-фосфат сесквимагний соль гидрата.
17. Среда для культивирования клеток по п. 15, где альбумин обработан октаноатом натрия.
18. Среда для культивирования клеток по п. 15, где альбумин нагрет до температуры, составляющей по меньшей мере 40°C.
19. Среда для культивирования клеток по п. 15, где альбумин является рекомбинантным.
20. Среда для культивирования клеток для перепрограммирования клетки в менее дифференцированное состояние, содержащая среду Игла, модифицированную по способу Дульбекко: питательную среду F-12 (DMEM/F12), 10 мкг/мЛ инсулина, 5,5 мкг/мЛ трансферрина, 6,7 нг/мЛ селенита натрия, 20 нг/мЛ основного фактора роста фибробластов (bFGF) и 5 мг/мЛ альбумина, где менее чем 0,65% сухого веса альбумина включает липиды и/или менее чем 0,35% сухого веса альбумина включает свободные жирные кислоты.
21. Среда для культивирования клеток по п. 20, дополнительно включающая по меньшей мере одно из следующих: 15 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (ГЭПЭС), 2 мМ L-аланил-L-глутамин, 2 мкг/мЛ этаноламин, 4,5 мкг/мЛ холестерин, 25 мкг/мЛ полиоксиэтиленсорбитан моноолеат, 2 мкг/мЛ D-альфа-токоферол ацетат и 1 мкг/мЛ L-аскорбиновой кислоты 2-фосфат сесквимагний соль гидрата.
22. Среда для культивирования клеток по п. 20, где альбумин является рекомбинантным.
23. Набор, включающий среду для культивирования клеток по п. 15 и одну или более синтетических молекул РНК.
24. Набор по п. 23, где альбумин является рекомбинантным.
25. Набор по п. 23, где указанные одна или более синтетических молекул РНК содержат по меньшей мере одну молекулу РНК, кодирующую один или более факторов перепрограммирования.
26. Набор по п. 25, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую по меньшей мере один из: белка Oct4, белка Sox2, белка Klf4 и белка c-Myc.
27. Набор по п. 25, где указанные одна или более синтетических молекул РНК включают по меньшей мере одну молекулу РНК, кодирующую белок Oct4, по меньшей мере одну молекулу РНК, кодирующую белок Sox2, по меньшей мере одну молекулу РНК, кодирующую белок Klf4, и по меньшей мере одну молекулу РНК, кодирующую белок c-Myc.
28. Набор по п. 25, где указанные одна или более синтетических молекул РНК включают по меньшей мере один из остатка псевдоуридина и остатка 5-метилцитидина.
| US 20110143397 A1, 16.06.2011 | |||
| Механическая форсунка | 1928 |
|
SU14166A1 |
| RU 2009148666 A, 10.07.2011. | |||
Авторы
Даты
2017-06-30—Публикация
2012-12-05—Подача