Изобретение относится к области медицины, в частности к области стоматологии, и может быть использовано в хирургической и ортопедической стоматологии для реабилитации больных с частичной или полной потерей зубов.
Из предшествующего уровня техники известен способ изготовления стоматологического имплантата, включающего внекостную и внутрикостную часть, заключающийся в нанесении на имплантат пористого слоя физиологически адаптированного пластика с катализатором, стимулирующим остеогенез. В качестве катализаторов используются различные материалы (карбонат кальция, силикат магния или алюминия и т.д.). Наряду с другими компонентами используется костная ткань. Толщина слоя 200-400 нм, открытые поры и сообщающиеся каналы имеют диаметр 50-200 нм [1].
Способ обладает следующими недостатками:
- связь пористого слоя из различных материалов с материалом, из которого выполнена основа имплантата, недостаточно прочная;
- катализаторы не могут в полной мере стимулировать остеогенез, потому что данный процесс обеспечивают только остеогенные детерминированные продромальные клетки или, в некоторых случаях, костный морфологический белок.
Известен способ изготовления остеоинтегрируемого стоматологического имплантата, который выполняют из металла, на наружную поверхность внутрикостной части которого наносят глухие углубления, являющиеся элементами макроретенции, и создают шероховатости, являющиеся элементами микроретенции. Наружная поверхность опорной внутрикостной части за счет элементов макроретенции и микроретенции увеличивает площадь контакта с костью на 50% [2].
Известный способ имеет следующие недостатки:
- шероховатости на внутрикостной поверхности имплантата могут включать элементы частиц рабочего агента (окись алюминия, кремний и др.), посредством которого была обработана поверхность и получены элементы микроретенции, указанные включения способны негативно влиять на процесс остеоинтеграции;
- микрорельеф поверхности не позволяет добиваться первичной стабильности в неплотной кости (тип III-IV).
Наиболее близким к заявляемому является способ, описанный в патенте [3].
Способ-прототип заключается в том, что на стоматологический имплантат, изготовленный из упрочненного сплава титана ВТ 1-0, относящегося к разряду GRADE 4 (ASTM F67), имеющий внекостную часть и внутрикостную часть, на наружной поверхности которой выполняют элементы макроретенции и микроретенции, при этом элементы макроретенции выполняют в виде упорной резьбы с постоянным профилем по всей длине внутрикостной части, а элементы микроретенции выполняют в виде поверхностного слоя толщиной от 10 до 200 мкм с развитым микрорельефом, приближенным к микроархитектонике кости. При этом микрорельеф наружной поверхности, приближенный к микроархитектонике кости, получают обработкой поверхности имплантата мощным ионным (электронным) пучком - МИП наносекундной или микросекундной длительности с плотностью энергии в пучке 1-40 Дж/см2 и числом импульсов от 10 до 100 в атмосфере аргона или при остаточном давлении 0,1-1 Па без последующего отжига.
Недостатком способа-прототипа является то, что имплантат выполняют из упрочненного сплава титана ВТ1-0, относящегося к разряду GRADE 4 (ASTM F67), который имеет относительно низкую остеоинтеграцию с альвеолярной костью, что обусловлено двумя причинами: низкой биосовместимостью сплава титана ВТ 1-0 с костью пациента, а также тем, что твердость поверхности внутрикостной части имплантата после обработки ее электронным или ионным пучком имеет твердость, превышающую твердость альвеолярной кости пациента.
Задачей изобретения является создание имплантата из более биосовместимого материала, чем сплав ВТ1-0, с созданием поверхностного слоя на внутрикостной части имплантата, твердость которого не превышала бы твердость альвеолярной кости пациента, с микроархитектоникой указанной поверхности, близкой к микроархитектонике кости.
Технический результат изобретения достигается за счет того, что в способе изготовления стоматологического остеоинтегрируемого имплантата, содержащего внекостную и внутрикостную части, на наружной поверхности которой выполняют элементы макроретенции в виде упорной резьбы с постоянным профилем по всей длине внутрикостной части, а элементы микроретенции выполняют в виде поверхностного слоя толщиной 10-200 мкм с развитым микрорельефом, приближенным к микроархитектонике кости, который получают облучением поверхности имплантата при разрежении (0,1÷1) Па мощным электронным пучком микросекундной длительности, основу имплантата выполняют из циркония, помещают имплантат в камеру ускорителя, создают в камере разрежение порядка 10-2 Па, после чего заполняют камеру водяным паром и при достижении в ней давления водяных паров (0,1÷1) Па облучают имплантат электронным пучком, плотность энергии которого лежит в диапазоне 60÷100 Дж/см2, частота импульсов которого лежит в диапазоне 8÷10 импульсов в секунду, а диаметр пучка электронов в области облучения имплантата лежит в диапазоне L≤D≤1,2L, где L - продольный размер внутрикостной части имплантата, при этом в процессе облучения поверхность имплантата обрабатывают водяным паром и вращают под электронным пучком со скоростью 0,8-1 об/с, процесс облучения заканчивают, после того как имплантат совершит 5-10 полных оборотов.
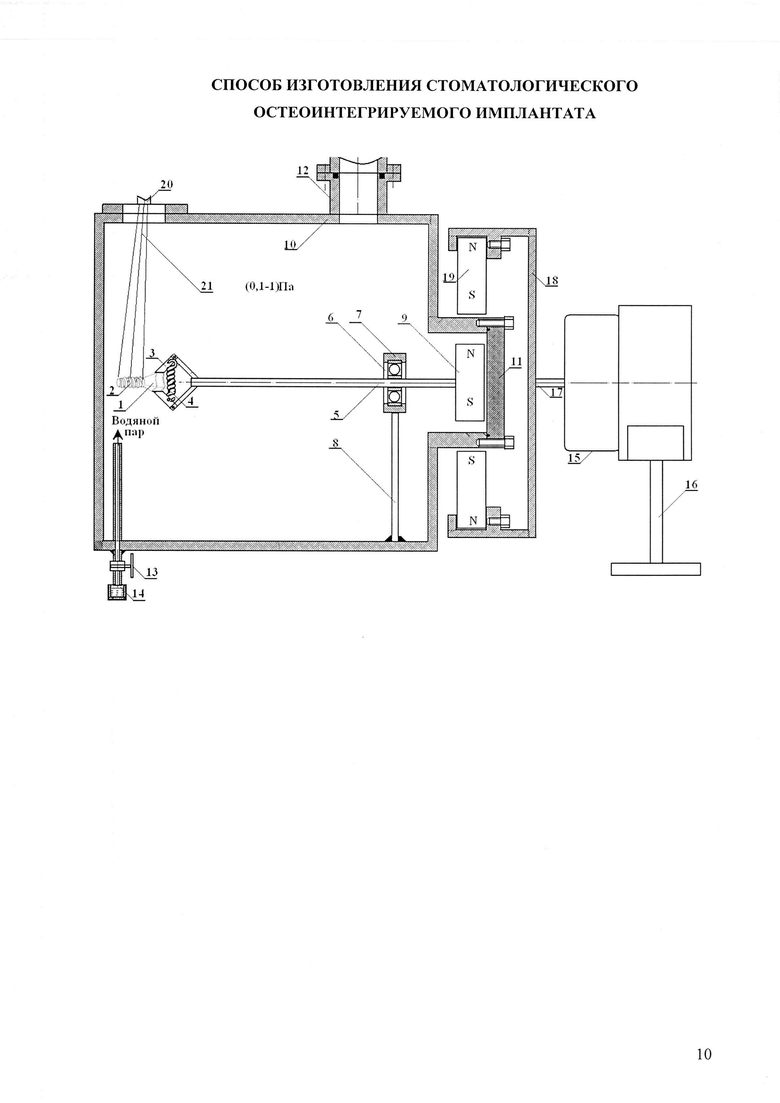
Сущность изобретения поясняется графическим материалом, приведенным на фиг. 1. На фиг. 1 введены следующие обозначения: 1 - наружная поверхность внутрикостной части имплантата; 2 - наружная поверхность внекостной части имплантата; 3 - зажим имплантата; 4 -пружина зажима; 5 - ось; 6 - подшипник; 7 держатель подшипника; 8 - стойка; 9 - магнит; 10 - камера; 11 - заглушка; 12 - патрубок вакуумного насоса; 13 - натекатель; 14 - сосуд с водой; 15 - электродвигатель; 16 - подставка; 17 - вал; 18 - узел крепления магнитов; 19 - магниты; 20 - пушка ускорителя; 21 - электронный пучок.
Сущность изобретения заключается в следующем. Известно, что до недавнего времени наиболее распространенными были зубные имплантаты, выполненные из титановых сплавов, что, в частности, и описывается в способе-прототипе. Однако титан обладает относительно низкой биосовместимостью, и у некоторых пациентов наблюдается аллергия на титан. Под действием электрогальванизма отделившиеся частицы титана соединяются с белками и воспринимаются иммунной системой как чужеродный белок.
Имплантаты из диоксида циркония лишены подобных недостатков. Из свойств циркония наибольший интерес представляют такие, как биологическая инертность, значительная стойкость к различным химическим воздействиям, высокие характеристики усталостной выносливости, склонность к «самозалечиванию» поверхностных дефектов, технологичность, прочность. Поэтому изделия из сплава циркония нашли широкое применение в стоматологической практике. Сплавы циркония используются в основном для производства дентальных имплантатов. Этим и обусловлен выбор диоксида циркония в заявляемом способе. Однако часть поверхности имплантатов, которую вставляют в альвеолярную кость, выполненная из циркония или его оксидов, обычно имеет твердость, значительно превышающую твердость альвеолярной кости. Это приводит к значительному ухудшению сцепления имплантата с альвеолярной костью. Поэтому для улучшения процессов соединения имплантата с альвеолярной костью на поверхности имплантатов создают шероховатость поверхности с помощью ее механической обработки, лазерной обработки и т.п. Однако для улучшения биологического сродства и достижения высоких показателей соединения с костью простого придания шероховатости на поверхности имплантата недостаточно, так как при этом биологическое сродство и высокие показатели соединения с костью являются труднодостижимыми.
В заявляемом способе значительного улучшения биологической совместимости имплантата, изготовленного из циркония, добиваются путем облучения его внутрикостной части 2 (фиг. 1) импульсным пучком электронов в парах воды. При прохождении пучка электронов через водяной пар под действием высокой энергии пучка происходит интенсивное разложение воды на ионы кислорода, ионы гидроксильной группы и ионы водорода. Цирконий начинает взаимодействовать с ионами образованной в парах воды плазмы. Высокие градиенты температуры, возникающие на облучаемой внутрикостной поверхности имплантата, проникновение в имплантат ионов гидроксильной группы, кислорода и разогретых молекул воды приводят к образованию на облучаемой поверхности гидроксидного слоя, с многочисленными порами и мелкими трещинами, обладающего значительно меньшей твердостью, чем циркониевая основа имплантата. При установке указанного имплантата в альвеолярную кость поверхностный слой внутрикостной части имплантата действует в качестве буферного слоя, обеспечивающего сокращение разницы в степени твердости между костью и основой, вследствие чего указанная мягкая поверхность дополнительно улучшает характеристики и процесс срастания с костью. При этом, поскольку на поверхностном слое имплантата создаются многочисленные микроретенции, после установки имплантата в альвеолярную кость костные клетки начинают входить в указанные поры и микротрещины в поверхностном слое. Вхождение костных клеток в микротрещины приводит к значительному увеличению площади поверхности контакта межу имплантатом и костью, что обеспечивает эффект межмолекулярного соединения и возможность получения улучшенных характеристик адгезии и соединения с костью.
Пример конкретного выполнения. Каркас зубного имплантата (фиг. 1) был выполнен из циркония. Внутрикостная часть 2 (дистальный конец) зубного имплантата была выполнена в виде сужающегося книзу усеченного конуса. На указанном конусе была выполнена самонарезающая резьба, что обеспечивало возможность непосредственного ввинчивания имплантата в высверленное отверстие в альвеолярной кости. В предложенном имплантате упорная резьба по всей длине внутрикостной части выполняла функцию элементов макроретенции. Каркас зубного имплантата закрепляли зажимом 3, шарнирное соединение которого сжималось пружиной 4. Зажим 3 был расположен на торце оси 5 вращающего узла. Ось 5 вращающего узла была впрессована во внутреннюю часть шарикоподшипника 6, внешняя часть которого была жестко закреплена в держателе подшипника 7. Держатель подшипника 7 через стойку 8 был механически закреплен к корпусу камеры 10. На другом торце оси 5 вращающего узла, размещенного в камере 10, были закреплены 6 постоянных магнитов (на фиг. 1 показан один магнит 9), равномерно распределенных по окружности в виде шестиконечной звезды. Камера 10 была герметично закрыта заглушкой 11. Камера 10 и заглушка 11 были выполнены из нержавеющей немагнитной стали Х18Н10Т.
Обработку внутрикостной (дентальной) части 2 осуществляли следующим образом. В камере 10 создавали разрежение порядка 10-2 Па при помощи вакуумного насоса, закрепленного к патрубку 12 камеры 10. После создания разрежения 10-2 Па, вакуумный насос отключали и перекрывали его сообщение с камерой 10 специальным вентилем, имеющимся в вакуумном насосе. После этого открывали вентиль 13 натекателя и вода, находящаяся в сосуде 14, начинала закипать. Закипание воды в сосуде 14 при открытии натекателя 13 объясняется тем, что внутри камеры 10 был создан вакуум. Известно, что чем ниже величина разрежения, тем меньше температура вскипания воды. Например, при разрежении 10 Торр вода закипает при 18°C. Поэтому если вода в сосуде 14 находится при комнатной температуре, то она начинает кипеть. Для повышения интенсивности кипения воду в сосуде 14 можно подогреть до 40°C, 50°C и боле высоких температур.
Водяной пар заполняет камеру 10, и в ней повышается давление. При достижении давления в камере (0,1-1) Па концентрация водяного пара в камере становится достаточной для того, чтобы под действием пучка электронов получить необходимое количество плазмы для создания слоя на внутрикостной поверхности 2 имплантата. Опыты показали, что толщина образуемого на внутрикостной части 2 поверхности имплантата слоя гидроксида циркония, помимо прочих факторов, зависит от концентрации водяных паров практически прямо пропорционально.
В рассматриваемом примере облучение внекостной части имплантата осуществляли при давлении 0,5 Па.
Обработка внутрикостной части 2 имплантата осуществлялась следующим образом. После повышения давления водяного пара в камере 10 порядка 0,5 Па включали электродвигатель 15, установленный вне вакуумной камеры на подставке 16. Вращение имплантата было необходимо осуществлять для того, чтобы на всей поверхности внутрикостной части 2 имплантата создать однородный по толщине и свойствам слой гидроксида циркония. Вращение имплантата происходило следующим образом. Вал 17 электродвигателя 15 начинал вращаться и вращать закрепленный на нем держатель магнитов 18. Постоянные магниты 19, в количестве 6, были радиально распределены на внутренней поверхности держателя 18 в виде симметричной шестиконечной звезды и охватывали выступающую цилиндрическую часть камеры 10 с заглушкой 11. Количество магнитов 9 как внутри камеры, так и вне камеры 19 может быть любым, но в нашем случае оно равнялось 6. Магниты 9 и магниты 19 были выполнены из сплава NdFeB. Марка магнитов №42. Габариты магнитов 40×40×20 мм. Магниты имели следующие характеристики: остаточная индукция 1,28-1,30 Тл; коэрцитивная сила ≥923 кА/м; магнитная энергия 318-342 кДж/м. Для вращения имплантата был использован реверсивный двигатель РД-09 с редуктором. Так как камера 10 и заглушка 11 были выполнены из немагнитной нержавеющей стали, то вращение магнитов 19 создавало вращающееся магнитное поле, которое проникало внутрь камеры 10. Образованное вращающееся магнитное поле, за счет магнитного взаимодействия с магнитами 9, приводило к их вращению. Передача вращения из внешней среды в вакуум с помощью магнитной связи постоянных магнитов 9 и 19 гарантировала сохранение герметичности в камере 10. После того как имплантат начинал равномерно вращаться, включали импульсный электронный ускоритель. Пушка ускорителя 20 начинала излучать пучки электронов 21.
Предварительно диаметр пучка был экспериментально отъюстирован таким образом, чтобы его диаметр D в области облучения имплантата лежал в диапазоне L≤D≤1,2L, где L - длина внутрикостной части 2 имплантата. В рассматриваемом примере диаметр D пучка электронов в области облучения составлял D=10 мм. Выбранный диаметр пучка электронов обеспечивал равномерное облучение любых имплантатов, внутрикостная часть которых L могла изменяться от 0,5 и до 10 мм. Выбор размеров диаметра пучка в диапазоне L≤D≤1,2L обусловлен следующими соображениями. При значениях диаметра D пучка меньше величины L пучок не способен равномерно облучить всю поверхность внекостной части 2 имплантата, что не дает возможности создания равномерного поверхностного слоя из гидроксида циркония на упомянутой поверхности.
Плотность энергии пучка зависит от его диаметра. При одних и тех же параметрах пучка плотность энергии в месте его облучающего действия падает обратно пропорционально квадрату диаметра пучка. Поэтому при значениях диаметра D пучка больше величины L коэффициент полезного действия пучка снижается, так как часть его будет падать не на облучаемую внекостную часть 2. Выбор максимального диаметра пучка D=1,2L обусловлен тем, что при таких значениях диаметра КПД пучка падает незначительно, но внутрикостная часть 2 имплантата гарантированно будет облучена равномерно. Глубина проникновения электронного пучка обуславливает толщину создаваемого слоя из гидроксида циркония и его архитектонику и зависит от энергии пучка. Экспериментально было получено, что толщину слоя из гидроксида циркония от 10 до 200 мкм с развитым микрорельефом можно гарантированно получать при плотности энергии пучка, лежащей в диапазоне (60÷100) Дж/см2. В рассматриваемом примере плотность энергии пучка была равна 80 Дж/см2. Длительность одного импульса электронного пучка лежала в микросекундной области и была равна 50 мкс. Выбор частоты электронных импульсов в диапазоне (8÷10) импульсов в секунду был обусловлен следующими соображениями. Обеспечение частоты следования импульсов более 10 импульсов в секунду при указанной длительности и мощности вызывает определенные технические сложности. При частоте менее 8 импульсов в секунду снижается производительность процесса. В рассматриваемом примере частота следования импульсов была равна 9 с-1.
Выбор скорости вращения имплантата в процессе облучения в диапазоне (0,8-1) об/с обусловлен следующими причинами. Для того чтобы обеспечить равномерное облучение пучком электронов всей внутрикостной части 2 имплантата, нужно, чтобы за период между двумя импульсами электронов имплантат повернулся на угол, не превышающий (30÷40) градусов. Чем выше скорость вращения имплантата, тем на больший угол он повернется за время между двумя импульсами пучков электронов. При скорости вращения имплантата 1 об/с за один его оборот, при частоте следования импульсов, равной 10 с-1, за время между двумя импульсами электронного пучка имплантат повернется на угол 36°. При большей скорости вращения угол поворота будет возрастать и выйдет из оптимальных значений. При скорости вращения менее 8 об/с за период между двумя импульсами пучков электронов угол поворота за время облучения составит 28,8 градуса, и по мере снижения скорости он также будет снижаться. Однако при этом будет уменьшаться производительность процесса. При частоте следования импульсов, равной 9 с-1, выбранной нами, угол поворота имплантата составит порядка 32,7 градуса, что лежит в оптимальной области значений. Для того чтобы обеспечить оптимальную толщину слоя из гидроксида циркония и оптимальную архитектонику его поверхности, необходимо, чтобы поверхность была облучена количеством импульсов, лежащих в диапазоне от 40 до 100. При выбранной скорости вращения и частоте следования импульсов за 1 оборот на внутрикостную часть имплантата воздействует от 8 до 10 импульсов электронных пучков. За (5-10) полных оборотов внутрикостная часть 2 имплантата будет облучена оптимальным количеством импульсов электронных пучков, лежащих в диапазоне от 40 до 100 импульсов. В приведенном примере имплантат совершил 8 полных оборотов и был облучен 72 импульсами пучков электронов.
Исследования с помощью электронной микроскопии внутрикостной части 2 поверхности имплантата, обработанной электронными пучками, показали, что она, по сравнению с необработанной поверхностью имеет, многочисленные микротрещины и поры диаметром 1,5-4 мкм, равномерно распределенные по поверхности имплантата. Рентгеноструктурный анализ показал, что поверхностный слой состоит, в основном, из гидроксида циркония и толщина его достигает порядка 100 мкм. Поверхности необработанных и обработанных электронными пучками образцов имплантатов исследовали на твердость по методу Виккерса. Количественным показателем твердости по Виккерсу является число твердости (HV). В результате измерений твердости по Виккерсу обработанного электронными импульсными пучками внутрикостной части образца имплантата, выполненного только из циркониевой основы без воздействия на нее паров воды, и внекостной части 1 образца имплантата были получены значения 1129 (HV) и 998 (HV) соответственно. В отличие от этого, твердость по Виккерсу облученной в парах воды пучками электронов внутрикостной части 2 поверхности образцов имплантата, в котором поверхностный слой состоял из гидроксида циркония, составила в среднем 328 (HV). Таким образом, обработанная пучками электронов внутрикостная часть поверхности зубного имплантата примерно в 1,5 менее твердая, чем альвеолярная кость, твердость которой по Виккерсу обычно составляет 500 (HV). В предложенном имплантате упорная резьба по всей длине внутрикостной части выполняет функцию элементов макроретенции, а микрорельеф, полученный при обработке внутрикостной поверхности имплантата электронными пучками в парах воды, выполняет функцию элементов микроретенции, что обеспечивает необходимую первичную стабильность и надежную фиксацию имплантата в челюстных костях, а в итоге - его долговременное функционирование.
Имплантат устанавливают следующим образом. После выполнения местной анестезии проводят разрез, обнажают альвеолярный отросток и последовательно, двумя или тремя сверлами (развертками), формируют костное имплантационное ложе. Далее метчиком, профиль которого конгруэнтен геометрии резьбовой поверхности имплантата, нарезают резьбу - в зависимости от плотности кости до половины или на всю длину сформированного костного ложа. Затем с помощью ключа-имплантатовода устанавливают имплантат до уровня кортикального слоя кости и ушивают операционную рану.
Эффективность остеоинтеграции в костную ткань имплантатов, не облученных и облученных пучками электронов, исследовалась на подопытных животных (крысах). Исследования показали, что коэффициент срастания поверхности корпуса имплантата с костной тканью для сравнительного (не облученного пучками электронов) образца составил порядка 28%, а для опытного (облученного пучками электронов) образца - 65%, что говорит о значительном повышении эффективности врастания имплантата, облученного электронным пучком, в костную ткань. Более высокая эффективность остеоинтеграции облученного пучками электронов в атмосфере водяного пара имплантата обусловлена двумя факторами: высокой пористостью и многочисленными микротрещинами, заполняемыми костной тканью в процессе вживления имплантата в кость, и буферными свойствами умягченного слоя имплантата.
Имплантат апробирован в клинике. Проведено лечение 10 пациентов обоего пола в возрасте от 20 до 65 лет без выраженной сопутствующей патологии с использованием 75 имплантатов. В ближайшем и отдаленном послеоперационном периоде осложнений не наблюдали. При отсутствии воспаления репарация костной ткани проходит по пути контактного остеогенеза, о чем свидетельствуют результаты многочисленных экспериментальных работ, и в данном случае это показал рентгенологический мониторинг. Такой тип заживления кости является морфологическим эквивалентом остеоинтеграции, когда в пограничном имплантату пространстве стадийно формируются зрелые костные структуры. Кость постепенно интегрируется с развитым по схожести с ее микроархитектоникой рельефом имплантата, что приводит к образованию прочного соединения «костная ткань - имплантат».
Таким образом, по сравнению с прототипом имплантат имеет возможность при облучении его импульсными электронными пучками равномерно вращаться, что дает возможность, в совокупности с обработкой его поверхности водяным паром, получать однородный слой из гидроксида циркония с многочисленными порами и микротрещинами, причем твердость полученного слоя ниже твердости альвеолярной кости. Полученные при помощи заявляемого способа имплантаты из циркония имеют более высокую эффективность соединения с костной тканью, чем имплантаты, полученные по способу-прототипу. Заявляемый способ может быть использован не только для зубных имплантатов, но и любых других имплантатов, изготавливаемых из циркония.
Источники информации
1. Патент США №4051598, кл. А61С 13/00, 1977 г.
2. Патент России №2146113, кл. А61С 8/00, опубликовано: 10.03.2000 в БИ №7.
3. Патент России №2179001, кл. А61С 13/00, опубликовано: 10.02.2002.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ СТОМАТОЛОГИЧЕСКОГО ОСТЕОИНТЕГРИРУЕМОГО ИМПЛАНТАТА | 2019 |
|
RU2712578C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ СТОМАТОЛОГИЧЕСКОГО ОСТЕОИНТЕГРИРУЕМОГО ИМПЛАНТАТА | 2019 |
|
RU2712642C1 |
| СТОМАТОЛОГИЧЕСКИЙ ОСТЕОИНТЕГРИРУЕМЫЙ ИМПЛАНТАТ С РЕГЛАМЕНТИРОВАННЫМ МИКРОРЕЛЬЕФОМ ПОВЕРХНОСТИ | 2001 |
|
RU2179001C1 |
| УСТРОЙСТВО ДЛЯ ОБРАБОТКИ ПОВЕРХНОСТИ ИМПЛАНТАТОВ | 2016 |
|
RU2624369C1 |
| ВНУТРИКОСТНЫЙ ДЕНТАЛЬНЫЙ ИМПЛАНТАТ | 2006 |
|
RU2325133C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ДЕТАЛЕЙ ЗУБНЫХ МОСТОВ | 2016 |
|
RU2624379C1 |
| УСТРОЙСТВО ДЛЯ ОБРАБОТКИ ПОВЕРХНОСТИ ИМПЛАНТАТОВ | 2016 |
|
RU2624368C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ДЕТАЛЕЙ ЗУБНОГО ИМПЛАНТАТА ИЗ ЦИРКОНИЯ | 2016 |
|
RU2630883C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ДЕТАЛЕЙ ЗУБНОГО ИМПЛАНТАТА | 2016 |
|
RU2624364C1 |
| КОРПУС ИМПЛАНТАТА, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И ЗУБНОЙ ИМПЛАНТАТ | 2009 |
|
RU2471451C2 |
Изобретение относится к области медицины, в частности к области стоматологии, и может быть использовано в хирургической и ортопедической стоматологии для реабилитации больных с частичной или полной потерей зубов. Способ изготовления стоматологического остеоинтегрируемого имплантата, содержащего внекостную и внутрикостную части, заключающийся в том, что на наружной поверхности выполняют элементы макроретенции в виде упорной резьбы с постоянным профилем по всей длине внутрикостной части, а элементы микроретенции выполняют в виде поверхностного слоя толщиной 10-200 мкм с развитым микрорельефом, приближенным к микроархитектонике кости, который получают облучением поверхности имплантата при разрежении (0,1÷1) Па мощным электронным пучком микросекундной длительности. Основу имплантата выполняют из циркония, помещают имплантат в камеру ускорителя, создают в камере разрежение порядка 10-2 Па, после чего заполняют камеру водяным паром и при достижении в ней давления водяных паров (0,1÷1) Па облучают имплантат электронным пучком, плотность энергии которого лежит в диапазоне (60÷100) Дж/см2, частота импульсов которого лежит в диапазоне 8÷10 импульсов в секунду, а диаметр пучка электронов в области облучения имплантата лежит в диапазоне L≤D≤1,2L, где L - продольный размер внутрикостной части имплантата. В процессе облучения поверхность имплантата обрабатывают водяным паром и вращают под электронным пучком со скоростью (0,8-1) об/с, процесс облучения заканчивают, после того как имплантат совершит 5-10 полных оборотов. Изобретение позволяет получать однородный слой из гидроксида циркония, с многочисленными порами и микротрещинами, причем твердость полученного слоя ниже твердости альвеолярной кости. Полученные при помощи заявляемого способа имплантаты из циркония имеют более высокую эффективность соединения с костной тканью, чем имплантаты, полученные по способу-прототипу. Заявляемый способ может быть использован не только для зубных имплантатов, но и любых других имплантатов, изготавливаемых из циркония. 1 ил.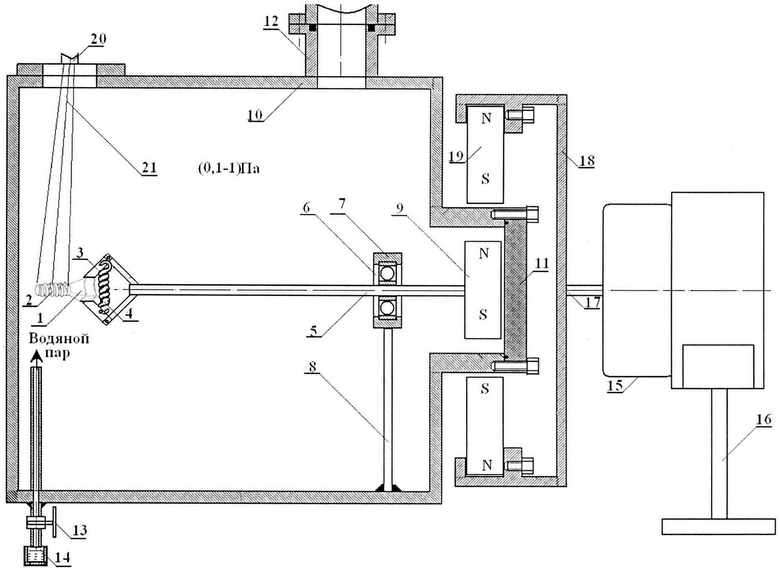
Способ изготовления стоматологического остеоинтегрируемого имплантата, содержащего внекостную и внутрикостную части, на наружной поверхности которой выполняют элементы макроретенции в виде упорной резьбы с постоянным профилем по всей длине внутрикостной части, а элементы микроретенции выполняют в виде поверхностного слоя толщиной 10-200 мкм с развитым микрорельефом, приближенным к микроархитектонике кости, который получают облучением поверхности имплантата при разрежении (0,1÷1) Па мощным электронным пучком микросекундной длительности, отличающийся тем, что основу имплантата выполняют из циркония, помещают имплантат в камеру ускорителя, создают в камере разрежение порядка 10-2 Па, после чего заполняют камеру водяным паром и при достижении в ней давления водяных паров (0,1÷1) Па облучают имплантат электронным пучком, плотность энергии которого лежит в диапазоне (60÷100) Дж/см2, частота импульсов которого лежит в диапазоне 8÷10 импульсов в секунду, а диаметр пучка электронов в области облучения имплантата лежит в диапазоне L≤D≤1,2L, где L - продольный размер внутрикостной части имплантата, при этом в процессе облучения поверхность имплантата обрабатывают водяным паром и вращают под электронным пучком со скоростью (0,8-1) об/с, процесс облучения заканчивают, после того как имплантат совершит 5-10 полных оборотов.
| ИМПЛАНТАТ И СПОСОБ ОБРАБОТКИ ПОВЕРХНОСТИ ИМПЛАНТАТА | 2003 |
|
RU2314772C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО ИМПЛАНТАТА С ИОННО-ЛУЧЕВОЙ МОДИФИКАЦИЕЙ | 2013 |
|
RU2530568C1 |
| US 6863531 B2, 08.03.2005 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОВЕРХНОСТИ МЕТАЛЛИЧЕСКОГО ИМПЛАНТАТА НА ОСНОВЕ ТИТАНА ДЛЯ ВСТАВЛЕНИЯ В КОСТНУЮ ТКАНЬ | 2007 |
|
RU2448739C2 |
| US 20100136506 A1, 03.06.2010. | |||
Авторы
Даты
2017-07-03—Публикация
2016-03-17—Подача