Область техники, к которой относится изобретение
Изобретение относится к области металлических имплантатов для вставления в костную ткань. А именно, изобретение относится к способу получения поверхности металлического имплантата, проявляющей хорошую шероховатость и имеющей оптимизированный химический состав и толщину, приводящие к улучшенному клеточному ответу и, таким образом, улучшенному связыванию имплантата с костью. Изобретение также относится к металлическому имплантату, проявляющему эти свойства.
Предшествующий уровень техники
Как хорошо известно в данной области техники, некоторые металлы или сплавы металлов, такие как титан, цирконий, гафний, тантал, ниобий или их сплавы, применяются для образования относительно прочных связей с костной тканью. В частности, металлические имплантаты из титана и его сплавов известны примерно с 1950, благодаря их способности прочно связываться с костной тканью. Это связывание было названо Branemark et al. как остеоинтеграция (Branemark et al., "Osseointegrated implants in the treatment of the edentulous jaw. Experience from a 10-year period", Scand. J. Plast. Reconstr. Surg., II, suppl 16 (1977)).
Хотя связывание между данным металлом и костной тканью является относительно прочным, необходимо усилить это связывание. В данной области техники разработано много способов обработки таких металлических имплантатов для получения поверхности, подходящей для усовершенствования их остеоинтеграции. Подразумевается, что термин «поверхность» относится к поверхностному слою или самой наружной области имплантата, состоящей главным образом из оксида соответствующего металла, чьи физические свойства явно отличаются от цельного материала, из которого изготовлен имплантат.
Некоторые из этих способов направлены на изменение морфологии этого поверхностного слоя, повышение его шероховатости, чтобы обеспечить увеличенную область контакта и, таким образом, связывание между имплантатом и костной тканью, приводящее к увеличенной механической способности к удерживанию и прочности, т.е. к улучшенной остеоинтеграции имплантата.
Основы этих процедур для увеличения шероховатости поверхности изучались в исследованиях, выполненных в течение последних нескольких лет (Buser et al., "Influence of surface characteristics on bone integration of titanium implants. A histomorphometric study in miniature pigs", J Biom Mater Res, (1991), 25:889-902; Wennerberg et al., "Torque and histomorphometric evaluation of c.p. titanium screws blasted with 25- and 75-um-sized particles of Al2O3", J Biom Mater Res, (1996); 30:251-260; Buser et al., "Removal torque value of titanium implants in the maxilla of miniature pigs", J Oral Maxillofac Implants (1998) 13:611-619; and Lazzara et al., "Bone response to dual acid-etched and machined titanium implant surfaces", Bone Engineering, chap. 34 (2000) J.E.Davies eds.), при этом было продемонстрировано, что остеоинтеграция имплантата в короткие и средние сроки улучшается благодаря микрометрической поверхностной шероховатости.
Кроме того, в других исследованиях (Buser et al. 1991, supra; Cochran et al., "Attachment and growth of periodontal cells on smooth and rough titanium", Int. J Oral Maxillofac Implants (1994) 9:289-297; Martin et al., "Effect of titanium surface roughness on proliferation, differentiation, and protein synthesis of human osteoblast-like cells (MG63)", J Biom Mat Res (1995) 29:389-401; Lazzara et al. 2000, supra; and Orsini et al., "Surface analysis of machined vs sandblasted and acid-etched titanium implants", J. Oral Maxillofac Implants (2000) 15:779-784) было продемонстрировано, что наличие микрометрической шероховатости в поверхностном слое имплантата улучшает клеточную экспрессию остеобластов, способствуя повышению клеточной дифференцировки и улучшению экспрессии остеобластов. Следствием данного эффекта является усовершенствованная остеоинтеграция и улучшенное образование кости.
Кроме того, некоторые другие производители, занимающиеся научными исследованиями, такие как Nobel Biocare, разработали такие способы обработки поверхности, чтобы повысить толщину и кристалличность слоя оксида титана, поскольку некоторые исследования позволили сделать предположение о взаимосвязи между степенью кристалличности и улучшенной остеоинтеграцией имплантата (Sul et al., "Oxidized implants and their influence on the bone response", J Mater Sci: Mater in Medicine (2002); 12:1025-1031).
Способы, применяемые в данной области техники для увеличения поверхностной шероховатости имплантата, являются крайне разнообразными. Среди прочего можно выделить покрытие поверхности оболочкой, струйную обработку поверхности частицами и химическую обработку поверхности.
Общие способы покрытия оболочкой поверхности металлического имплантата состоят в нанесении на металл, обычно титан, оболочки или керамического слоя, обычно гидроксиапатита, посредством различных методик, таких как плазменная пульверизация или плазменное распыление (Palka, V. et al., "The effect of biological environment on the surface of titanium and plasma-sprayed layer of hydroxylapatite". Journal of Materials Science: Materials in Medicine (1998) 9, 369-373).
В случае струйной обработки поверхности применяют частицы различных материалов и размеров, которые наносят на поверхность имплантата таким образом, чтобы изменить ее морфологию. Обычно применяют частицы корунда (оксида алюминия) (Buser et al. 1991, supra; Wennerberg et al. 1996; supra), или частицы оксида титана (Gotfredsen, К. et al., "Anchorage of TiO2-blasted, HA-coated, and machined implants: an experimental study with rabbits"., J Biomed Mater Res (1995) 29, 1223-1231).
С другой стороны, химическую обработку поверхности проводят с применением различных минеральных кислот, таких как соляная кислота, серная кислота и т.д. Так, например, в ряде патентов США от Implant Innovations Inc. (US 5,603,338; US 5,876,453; US 5,863,201 и US 6,652,765) описана двухэтапная кислотная обработка, применяющаяся для получения поверхности коммерческого Osseotite®. На первом этапе применяют соляную кислоту для удаления слоя природного оксида на поверхности металла; на втором этапе применяют смесь соляной кислоты и серной кислоты для получения поверхности с микрометрической шероховатостью. В Европейской заявке на патент ЕР 1477 141, также от Implant Innovations Inc., описан вариант данного способа, в котором применяют смесь фтористоводородной кислоты и соляной кислоты на втором этапе обработки поверхностей имплантатов на основе титана и сплавов Ti6A14V.
Также описано комбинированное применение обеих методик, то есть струйная обработка поверхности имплантата с последующей химической обработкой. Так, Buser (Buser et al. 1991, Buser at al. 1998, supra) описывает, среди прочих способов, струйную обработку частицами оксида алюминия среднего размера с последующим травлением смесью фтористоводородной и азотной кислот; а также струйную обработку крупными частицами оксида алюминия с последующим химическим травлением смесью фтористоводородной и серной кислот. Подобным образом Cochran (Cochran et al. 1994, supra) применяет струйную обработку мелкими или крупными частицами корунда с последующей химической обработкой соляной и серной кислотой для обработки поверхности титана. Подобным образом Choi Seok et al. (KR 2003007840) описывает струйную обработку частицами фосфата кальция с последующей обработкой смесью соляной и серной кислот. Аналогичным образом в документе WO 2004/008983 от Astra Tech описан способ обработки поверхностей имплантатов, объединяющий струйную обработку мелкими и крупными частицами оксида титана с последующей обработкой фтористоводородной кислотой. Кроме того, Franchi (Franchi et al., (2004) "Early detachment of titanium particles from various different surfaces of endosseous dental implants", Biomaterials 25, 2239-2246) и Guizzardi (Guizzardi et al., (2004) "Different titanium surface treatment influences human mandibular osteoblast response", J Periodontol 75, 273-282) описывают струйную обработку мелкими и крупными частицами оксида циркония с последующей обработкой неустановленной кислотой.
Что касается термической обработки, Browne (Browne et al. (1996), "Characterization of titanium alloy implant surfaces with improved dissolution resistance", Journal of Materials Science: Materials in Medicine 7, 323-329) и Lee (Lee et al. (1998), "Surface characteristics of Ti6A14V alloy: effect of materials, passivation and autoclaving", Journal of Materials Science: Materials in Medicine 9, 439-448) описывают обработку предварительно не обработанного титанового сплава горячим воздухом при температуре 400°С в течение 45 минут для достижения повышенной устойчивости к растворению и увеличенной толщины оксидного слоя; хотя достигается толщина только 4 нм.
Таким образом, с помощью этих способов получают поверхности с микрометрической шероховатостью, но со значительно сниженной толщиной поверхности оксида титана, что влечет за собой недостаток, заключающийся в отсутствии высоко стабильного слоя оксида титана и отсутствии снижения высвобождения ионов металла во внешнюю среду.
Таким образом, для предшествующего уровня техники по-прежнему требуются альтернативные способы обработки поверхностного слоя металлических имплантатов, обеспечивающие микрометрическую шероховатость поверхности и усовершенствованный химический состав и толщину, чтобы оптимизировать процесс их остеоинтеграции.
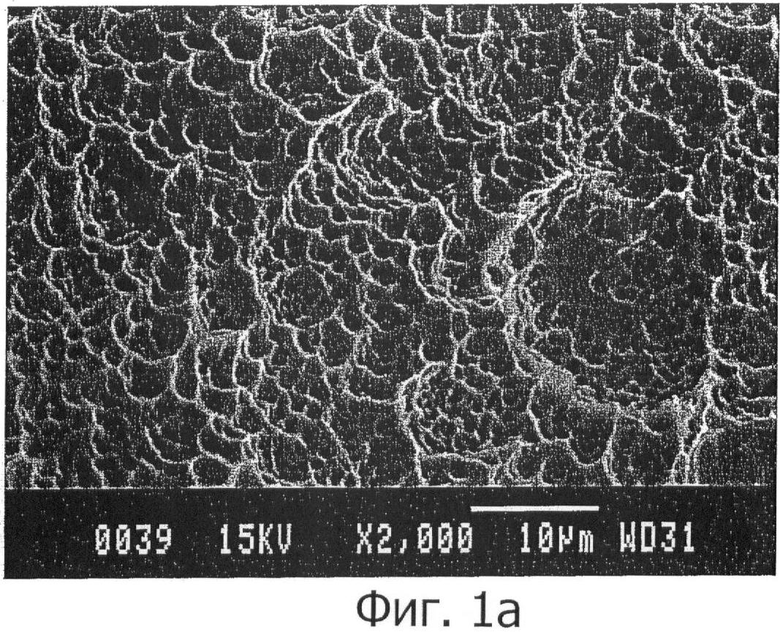
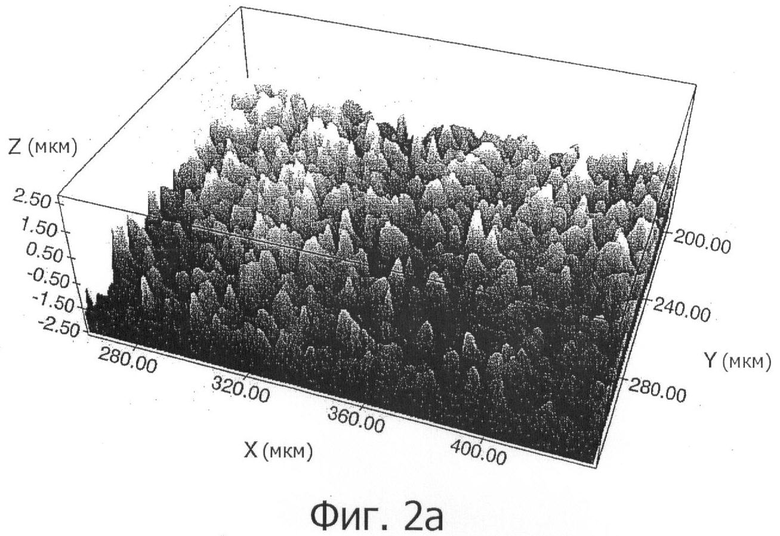
В испанской заявке на патент 200701518 авторов настоящего изобретения описан способ получения поверхности металлических имплантатов на основе титана, практически свободной от примесей, с толщиной, превышающей примерно в три раза толщину обычных поверхностей, и с шероховатостью и морфологией микрометрического диапазона (фигуры 1а и 2а), оптимизирующей остеоинтеграцию и процессы закрепления в кости.
Указанный способ состоит в обработке внешней области имплантатов частицами оксида циркония струей под давлением с последующей химической обработкой определенной комбинацией кислот и окончательной термической обработкой. Применение смеси серной кислоты и фтористоводородной кислоты, а также комбинация этих трех обработок и условий окончательной термической обработки не были описаны ранее.
Авторы настоящего изобретения установили, что в процессе струйной обработки предшествующего способа замена типа частиц вместе с модификацией их размера и давления, под которым они подаются, позволяет получить альтернативную поверхность металлического имплантата с морфологией микрометрического диапазона, отличающейся, но также пригодной для оптимизации остеоинтеграции и процессов закрепления в кости.
Таким образом, способ настоящего изобретения позволяет получить альтернативные поверхности металлических имплантатов на основе титана с оптимизированными свойствами в отношении химического состава, толщины и шероховатости и морфологии микрометрического масштаба, обеспечивающих хорошие свойства для остеоинтеграции и клеточного ответа.
Задача изобретения
Задачей настоящего изобретения, таким образом, является обеспечение способа получения поверхности металлического имплантата на основе титана, предназначенного для вставления в костную ткань.
Другой задачей изобретения является обеспечение поверхности, достигаемой указанным способом.
И, наконец, другой задачей изобретения является обеспечение металлического имплантата, обладающего указанной поверхностью.
Описание чертежей
На фигуре 1а показана микрофотография (150х) поверхности, полученной предшествующим способом авторов настоящего изобретения.
На фигуре 1b показана микрофотография (150х) поверхности, полученной способом изобретения.
На фигуре 2а показана шероховатость в трехмерном виде, полученная конфокальной микроскопией поверхности, полученной предшествующим способом авторов настоящего изобретения.
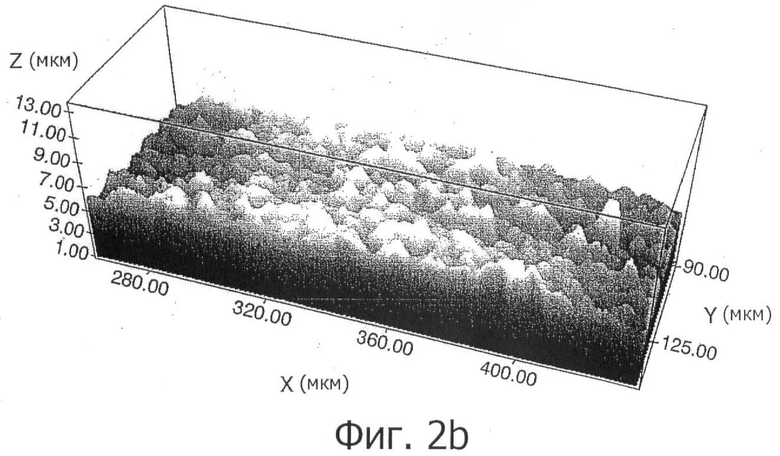
На фигуре 2b показана шероховатость в трехмерном виде, полученная конфокальной микроскопией поверхности, полученной способом изобретения.
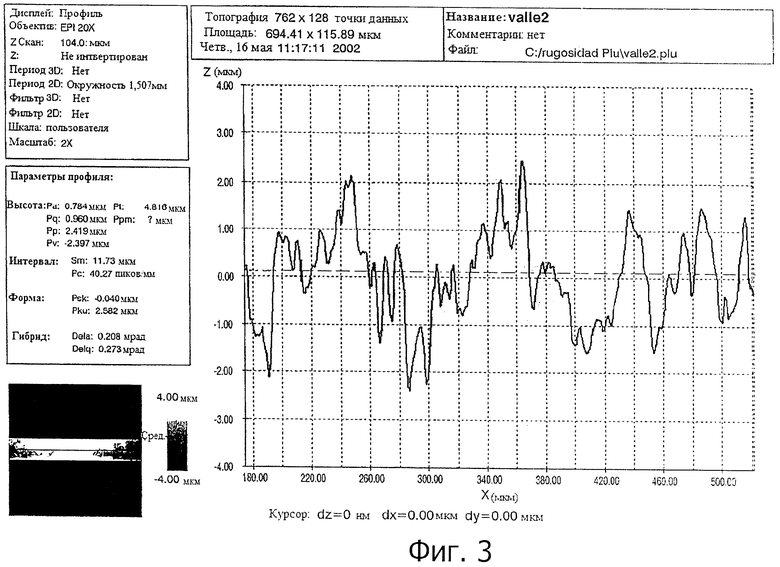
На фигуре 3 показана реконструкция сектора внешней неровной области имплантата и измерение соответствующей шероховатости поверхности, полученной способом настоящего изобретения.
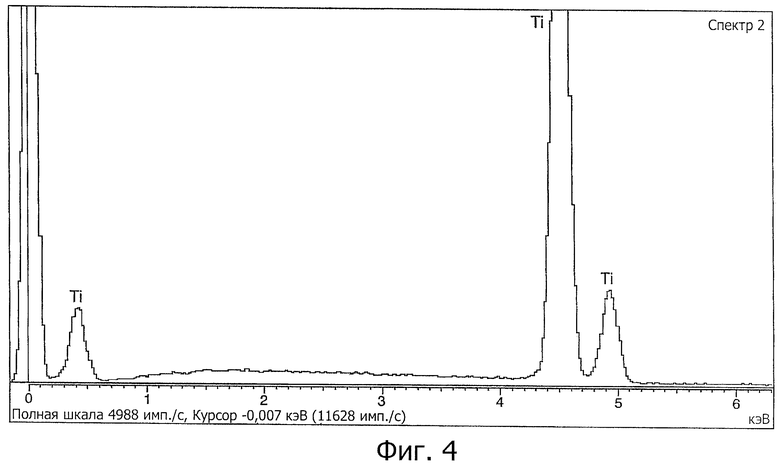
На фигуре 4 показан энергодисперсионный рентгеновский спектр (ЭДС) поверхности, полученной способом настоящего изобретения.
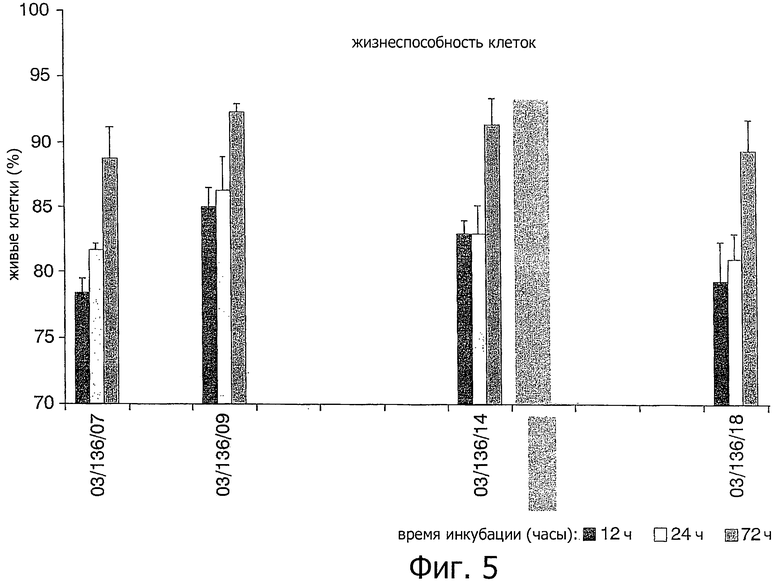
На фигуре 5 показана жизнеспособность клеток спустя 12, 24 и 72 часа в качестве показателя цитотоксичности поверхности, полученной способом изобретения (03/136/14) по сравнению с другими обычными поверхностями.
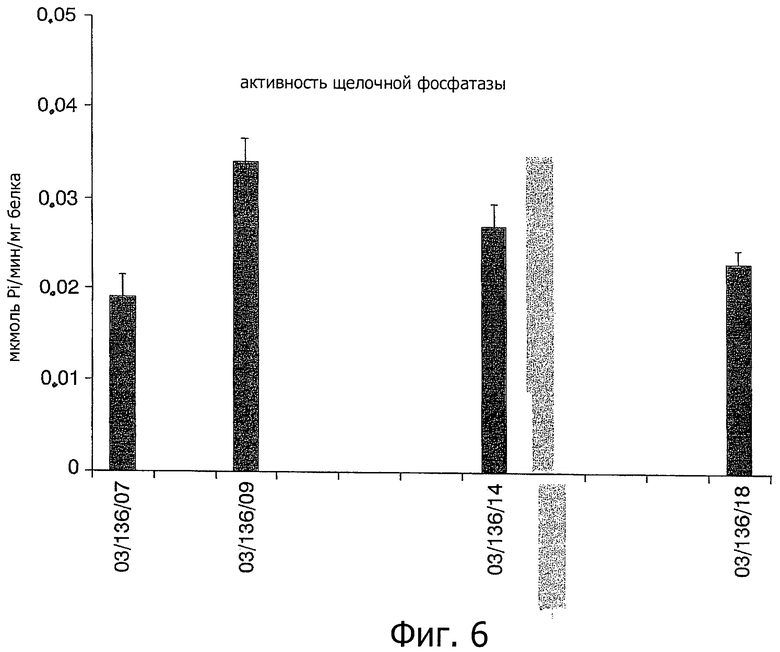
На фигуре 6 показана активность щелочной фосфатазы спустя 6 суток культивирования в качестве показателя продукции костного матрикса остеобластами, высеянными на поверхность, полученную способом изобретения (03/136/14), по сравнению с другими обычными поверхностями.
Подробное раскрытие сущности изобретения
Настоящее изобретение обеспечивает способ получения поверхности металлического имплантата на основе титана, предназначенного для вставления в костную ткань, далее «способ изобретения», включающий этапы:
(a) струйной обработки внешней области имплантата частицами оксида алюминия под давлением;
(b) химической обработки внешней области имплантата, подвергнутой струйной обработке, кислотной композицией, включающей серную кислоту и фтористоводородную кислоту; и
(c) термической обработки внешней области имплантата, подвергнутой струйной обработке и химической обработке, путем нагревания до температуры 200-450°C в течение 15-120 мин.
Как указано выше, поверхность имплантата на основе титана является поверхностным слоем или его самой ближней внешней областью, состоящей главным образом из оксида титана.
Поверхность, полученная способом изобретения, имеет толщину 8-50 нм, конкретно 10-30 нм и более конкретно 15 нм. Указанная толщина, почти в три раза превышающая толщину обычных поверхностей, влечет за собой повышенную остеоинтеграцию имплантата, в дополнение к значительному уменьшению примесей, как указано выше.
Более того, поверхность, полученная способом изобретения, включает почти стехиометрическую композицию оксида титана, приблизительно 98% по массе (проценты измеряли посредством РФЭ, или фотоэмиссионной спектроскопии, после 1 минуты напыления, или облучения ускоренными ионами для удаления загрязнения, присутствующего во внешней области полученной поверхности, что присуще способу анализа, и получали его действительный состав).
Поверхность, полученная способом изобретения, дополнительно обладает шероховатостью микрометрического диапазона и, таким образом, очень хорошими свойствами остеоинтеграции и клеточного ответа. Фактически, морфология обработанной поверхности подобна трабекулярной кости, оптимизированной для начала восстановления кости. Более того, ее характеристики пористости и шероховатости обеспечивают гомогенизацию остаточных нагрузок, адгезию и фиксацию исходных протеинов, а также клеточную адгезию, пролиферацию и созревание и стабильность экстрацеллюлярного матрикса.
Металлический имплантат, подлежащий обработке, является имплантатом из титана или титанового сплава. Титан может быть коммерчески чистым титаном, например. Более того, титановый сплав может быть любым подходящим титановым сплавом, например, таким, как сплав титана, алюминия и ванадия Ti6A14V. Указанный металлический имплантат на основе титана пригоден для вставления в костную ткань, таким образом, он может быть зубным имплантатом, ортопедическим имплантатом и т.д., в зависимости от костной ткани, в которую предполагается вставлять имплантат.
В частном воплощении указанного способа струйную обработку внешней области имплантата частицами оксида алюминия на этапе (а) выполняют под давлением 1-6 атм. В предпочтительном воплощении струйную обработку частицами оксида алюминия выполняют под давлением 3 атм.
В другом частном воплощении способа изобретения частицы оксида алюминия, применяемые на этапе (а), имеют размер частиц 10-100 мкм. В предпочтительном воплощении указанные частицы оксида алюминия имеют размер частиц 25 мкм.
При струйной обработке частицами оксида алюминия предотвращаются проблемы биосовместимости, возникающие в случае, когда такие частицы остаются в конце процесса, поскольку он является материалом с хорошей биосовместимостью. Более того, частицы этого материала и размера имеют многочисленные острые края и углы, которые при комбинации с давлением и химической обработкой создают точку воздействия с выраженной вогнутой формой, подходящей для хорошего клеточного ответа.
Любое подходящее устройство, такое как оборудование для струйной очистки торговой марки Renfert модели Basic Quattro, может применяться для выполнения струйной обработки, или гомогенизации механического воздействия. Указанное оборудование подсоединяют к линии сжатого воздуха, подающей частицы оксида алюминия, которыми загружают машину. По окончании струйной обработки поверхность очищают любым подходящим способом в данной области техники, таким как подача сжатого воздуха и последующая ультразвуковая очистка.
В частном воплощении способа изобретения кислотная композиция, применяемая на этапе (b), включает 15-50% (о/о) серной кислоты и 0,01-1% (о/о) фтористоводородной кислоты. В предпочтительном воплощении указанная кислотная композиция включает 28,8% (о/о) серной кислоты и 0,024% (о/о) фтористоводородной кислоты.
Эта частная комбинация кислот обеспечивает частную шероховатость и морфологию, которые, при комбинации с химическим составом поверхности, полученной с минимальным содержанием каких-либо примесей, обеспечивают оптимальный клеточный ответ.
В другом частном воплощении способа изобретения химическую обработку на этапе (b) проводят при температуре 50-110°C в течение 4-60 минут. В предпочтительном воплощении указанную химическую обработку проводят при температуре 75°C в течение 12 минут.
Для протравливания применяют стандартное лабораторное оборудование внутри вытяжного шкафа (например, вытяжного шкафа торговой марки Cruma модели 9001-GH) для предотвращения испарения кислот. После химической обработки имплантат извлекают из емкости с кислотой, а затем обрабатывают посредством ультразвука и высушивают. Для высушивания можно применять обычное подходящее сушильное оборудование, такое как печь для высушивания торговой марки Renfert.
В другом частном воплощении способа изобретения термическую обработку на этапе (с) проводят при температуре 285°C в течение 60 минут.
Эта термическая обработка при указанной температуре и в течение предусмотренного времени вызывает реструктуризацию поверхностного слоя оксида титана, с увеличением кристалличности и уменьшением примесей, что влечет за собой улучшение клеточного ответа. Более того, указанная термическая обработка повышает толщину поверхностного слоя оксида титана. При нормальных условиях титан под воздействием атмосферы окисляется и образует слой оксида титана толщиной примерно 5 нанометров. Этот оксидный слой защищает остальной титан от окисления. Таким образом, выгодно получить слой оксида титана с повышенной толщиной, но не настолько, чтобы хрупкость указанного слоя могла вызвать образование микрочастиц при трении о кость во время вставления имплантата. В этом отношении приемлемый диапазон толщины, достигаемой способом изобретения, составляет от 8 до 50 нм.
Таким образом, для получения упомянутой толщины термическую обработку нужно проводить при температуре, достаточной для ускорения диффузии атмосферного кислорода в материал, но не достаточно высокой для окисления титана до видимого изменения цвета. Таким образом, выбранная рабочая температура составляет от 200°C до 450°C.
Наконец, время обработки является вторым параметром, который необходимо контролировать. Сильно сокращенное время не позволяет осуществить эффективную диффузию кислорода. Слишком долгое время вызывает избыточное увеличение толщины слоя и не может быть внедрено в производство. Обоснованный диапазон между этими двумя крайними вариантами расположен между 15 минутами и 24 часами, в зависимости от температуры обработки. Таким образом, выбранное рабочее время варьирует между 15 и 120 минутами.
Эту термическую обработку проводят обычными средствами, например, с применением низкотемпературной печи модели Memmert UM-100.
В другом аспекте изобретения обеспечивается поверхность, получаемая предварительно описанным способом. Как было указано, данная поверхность включает по существу чистый оксид титана и обладает толщиной 8-50 нм, в частности 10-30 нм и более конкретно 15 нм.
В другом аспекте изобретения обеспечивается металлический имплантат на основе титана, предназначенный для вставления в костную ткань, имеющий поверхность, достигаемую предварительно описанным способом. В частном воплощении указанный металлический имплантат является имплантатом из титана или титанового сплава. В другом частном воплощении указанный металлический имплантат является зубным имплантатом.
Следующие примеры иллюстрируют изобретение и не должны рассматриваться как ограничивающие его объем.
Пример 1
Получение титанового зубного имплантата с поверхностью, получаемой способом изобретения
Резной внутрикостный цилиндрическо-конический имплантат Defcon TSA, изготовленный из коммерчески чистого титана, подвергали струйной обработке частицами оксида алюминия 25 мкм под давлением 3 атм, помещая выходное сопло перпендикулярно обрабатываемой поверхности, на расстоянии от 2 до 3 см. После струйной обработки его очищали сжатым воздухом, а затем погружали в чистую воду и обрабатывали ультразвуком в течение 10 минут. После этого высушивали посредством сжатого воздуха.
Затем готовили водный раствор следующего состава: 28,8% по объему серной кислоты и 0,024% по объему фтористоводородной кислоты. Стакан с реагентом помещали в термальную баню, устанавливая температуру для нагревания реагента до 75°±2°C. При достижении необходимой температуры реагента проводили химическую обработку посредством погружения предварительно обработанного частицами имплантата в раствор реагента на 12 минут (±15 секунд). По окончании указанной обработки имплантат извлекали из кислотной бани и промывали путем встряхивания в течение примерно 15 секунд два раза в водяной бане с чистой водой. Затем погружали в чистую воду и обрабатывали ультразвуком в течение примерно 10 минут, а затем высушивали в печи.
Наконец, обработанный таким образом имплантат подвергали окончательной термической обработке при температуре 285°C (±20°C) в течение 60 минут в низкотемпературной печи модели Memmert UM-100.
Пример 2
Характеристика поверхности, полученной в Примере 1
Морфология
Морфологию поверхности, полученной в Примере 1, изучали посредством микрофотографии поверхности и измерения шероховатости с помощью конфокальной микроскопии.
Микрофотографии поверхности
Микрофотографии поверхности получали на сканирующем электронном микроскопе JEOL JSM 840 с потенциалом сканирующего пучка 15 кВ.
На фигуре 1b показана микрофотография (150х) указанной поверхности, на которой видно, что поверхность обладает очень характерной поверхностной шероховатостью со значением шероховатости Ra (средней шероховатости) примерно 1 мкм, характеризующейся округлой морфологией с острыми внешними краями и наличием однородно распределенной глубокой пористости, благодаря действию кислотного травления поверхности.
Данный уровень шероховатости позволяет выполнять требования, указанные в различных научных статьях (Buser et al. 1991, Cochran et al. 1994, Martin et al. 1995, Wennerberg et al. 1996, Wennerberg et al. 1997, Buser et al. 1998, Lazzara et al. 2000, Orsini et al. 2000, supra) в отношении необходимости наличия на поверхности имплантата шероховатости, обеспечивающей хорошее закрепление клеток.
Измерение шероховатости конфокальной микроскопией
Трехмерное измерение шероховатости проводили конфокальным микроскопом, оснащенным программным обеспечением PLµ, разработанным Отделением Оптики Escuela Técnica Universitaria de Terrassa (Политехнический Университет Каталонии). Измерения проводили в соответствии со стандартом DIN 4768, с 800 мкм отсекающим фильтром Гаусса.
На фигуре 2b показана шероховатость в трех измерениях поверхности, полученной посредством данной методики. Кроме того, на фигуре 3 показана реконструкция сектора внешней резной области имплантата и измерение шероховатости в соответствии с поперечным профилем поверхности.
Значения полученной шероховатости составили средние величины Ra (средней шероховатости) 1,0 мкм, с промежутком между пиками Sm 12 мкм. Эти величины близки к значениям, упомянутым как необходимые в литературе, приведенной в предыдущем разделе.
Химический состав поверхности
Анализ химического состава поверхности проводили посредством двух различных методик: анализа с помощью энергодисперсионной рентгенометрии (ЭДР) и анализа с помощью фотоэлектронной спектрометрии (РФЭС).
Анализ посредством энергодисперсионной рентгенометрии (ЭДР)
Эта методика позволяет определить количественный состав поверхности толщиной примерно 1 мкм с высоким пространственным разрешением. ЭДР позволяет выявить наличие атомов с атомной массой, включенной между бором и ураном, и подсчитать их наличие на исследуемой поверхности.
ЭДР измерения были выполнены на базе Научно-технической службы Университета Барселоны. Использовали Leica Electroscan 360 SEM, с оборудованием ЭДР Link-Inca, способным выявлять атомы с атомной массой, большей или равной массе атома бора. На фигуре 4 показан полученный энергодисперсионный рентгеновский спектр (ЭДР).
Анализ, выполненный посредством ЭДР, показал наличие только титана и кислорода на поверхности обработанного образца титана, со случайными следами алюминия. Наличие алюминия обусловлено эффектами предыдущей стрессовой гомогенизационной обработки, при которой некоторые частицы алюминия остаются прилипшими к поверхности. Различные анализы показали, что это характерно для всей поверхности обработанного имплантата.
Анализ посредством фотоэмиссионной спектрометрии (РФЭС)
РФЭС анализы проводили с помощью блоков ESCA и ТЕМ анализа на базе Научно-технической службы Университета Барселоны. Результаты (в процентах атомов) показаны в Таблице 1, вместе со сравнением с данными РФЭС анализа, упомянутыми в литературе по нескольким зубным имплантатам (Wieland et al., "Measurement and evaluation of the chemical composition and topography of titanium implant surfaces", Bone Engineering, chap.14 (2000) J.E. Davies eds; Massaro et al., "Comparative investigation of the surface properties of commercial titanium dental implants. Part I: chemical composition". J Mat Sci: Mat in Medicine (2002) 13: 536-548).
Сравнение результатов показало, что химический состав поверхности анализируемых образцов практически эквивалентен составу других имплантатов, имеющихся в продаже, даже с меньшим наличием примесей углерода и кремния (Wennerberg et al. 1996, supra; Wieland et al. 2000, supra; и Sittig et al., "Surface characterization of implant materials c.p. Ti, Ti6A17Nb and Ti6A14V with different pretreatments", J Mater Sci: Mater in Medicine (1999), 10:35-46).
Наличие некоторых элементов на поверхности, таких как азот, обусловлено процессом термической обработки. Наличие других загрязнителей, обычных для других процессов, таких как кремний или натрий, не было выявлено. Остаточный процент до 100%, связанный с выявленным аргоном (не показан), является результатом измерительного процесса РФЭС.
Пример 3
Клеточный ответ на поверхности титанового образца, полученной способом, подобным описанному в Примере 1
Анализ проведен исследовательской группой 063-13 (Фармакологическое отделение, Школа медицины и одонтологии, Университет Сантьяго де Компостелла, Испания) для биологической оценки титановых образцов (коммерческие диски из чистого титана диаметром 5 мм), обработанных с помощью способа, подобного описанному в Примере 1.
Человеческие остеобласты высевали на рабочие образцы (8×103 клеток/диск трехкратно) в модифицированной культуральной среде Дульбекко, с 10% эмбриональной телячьей сывороткой и 1% раствором антибиотика. Биологическую активность клеток (показатель цитотоксичности поверхности) и продукцию щелочной фосфатазы (показатель продукции остеобластами костного матрикса) на поверхности, полученной с помощью способа изобретения (код 03/136-14), измеряли при сравнении с контрольной поверхностью титановых образцов, подвергавшихся механической обработке (код 03/136-07), другой контрольной поверхностью такого же титана, подвергавшегося струйной обработке (очищенных шлифовальной бумагой с карбидом кремния примерно 5 мкм) (код 03/136-18) и контрольной поверхностью, подвергавшейся струйной очистке и кислотной обработке, подобной ITI SLA поверхности (код 03/136-09).
На фигуре 5 показаны результаты измерения жизнеспособности клеток спустя 12, 24 и 72 часа в указанных образцах. На фигуре 6, соответственно, показаны результаты измерения активности щелочной фосфатазы спустя 6 суток культивирования указанных образцов.
Активность щелочной фосфатазы давно ассоциируется с биологической кальцификацией. Таким образом, улучшение экспрессии данного фермента кажется необходимым перед минерализацией костного матрикса, обеспечивая локализованное обогащение неорганическим фосфатом для нуклеации и разрастания кристаллов гидроксиапатита, главного компонента костной ткани.
Как видно на указанных фигурах 5 и 6, полученные результаты показали улучшенный клеточный ответ на поверхности, полученной способом изобретения (код 03/136/14) по сравнению с контрольными образцами после механической (код 03/136/07) и струйной обработки (код 03/136/18). С другой стороны, результаты клеточного ответа на поверхности в соответствии с изобретением эквивалентны тем, что получены для контрольных образцов после струйной и кислотной обработки (код 03/136/09).
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВАЯ ПОВЕРХНОСТЬ МЕТАЛЛИЧЕСКИХ ИМПЛАНТАТОВ НА ОСНОВЕ ТИТАНА, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ВВЕДЕНИЯ В КОСТНУЮ ТКАНЬ | 2007 |
|
RU2435613C2 |
| ОПОРА ДЛЯ ВРЕМЕННОЙ ЗУБНОЙ КОРОНКИ | 2007 |
|
RU2446770C2 |
| ПОСТЭКСТРАКЦИОННЫЙ ДЕНТАЛЬНЫЙ ИМПЛАНТАТ | 2008 |
|
RU2459594C2 |
| ИМПЛАНТАТ ВНУТРИЧЕЛЮСТНОЙ ЗУБНОЙ УСОВЕРШЕНСТВОВАННЫЙ | 2006 |
|
RU2400176C2 |
| УЗЕЛ ЗУБНОГО ИМПЛАНТАТА И УСТРОЙСТВА ВЗЯТИЯ ЗУБНОГО СЛЕПКА | 2006 |
|
RU2408323C2 |
| Способ подготовки поверхности металлических фитингов к склеиванию с профилем из композиционного материала | 2021 |
|
RU2775768C1 |
| ИМПЛАНТАТ И СПОСОБ ОБРАБОТКИ ПОВЕРХНОСТИ ИМПЛАНТАТА | 2003 |
|
RU2313307C2 |
| ИМПЛАНТАТ И СПОСОБ ОБРАБОТКИ ПОВЕРХНОСТИ ИМПЛАНТАТА | 2003 |
|
RU2314772C2 |
| Дробеструйная обработка металлических имплантатов оксида титана | 2012 |
|
RU2615418C2 |
| СПОСОБ ДИСПЕРГИРОВАНИЯ НАНОЧАСТИЦ | 2009 |
|
RU2520477C2 |

Изобретение относится к области изготовления металлических имплантатов на основе титана, предназначенных для вставления в костную ткань. Предложен способ получения поверхности металлического имплантата на основе титана, предназначенного для вставления в костную ткань, включащий: (а) струйную обработку внешней области имплантата частицами оксида алюминия под давлением; (b) химическую обработку внешней области имплантата, подвергнутой струйной обработке, кислотной композицией, содержащей серную кислоту и фтористоводородную кислоту; и (с) термическую обработку внешней области имплантата, подвергнутой струйной обработке и химической обработке, путем нагревания до температуры 200-450°С в течение 15-120 мин. Кроме того, предлагается металлический имплантат, имеющий поверхность, полученную вышеуказанным способом. Полученная таким образом поверхность обладает хорошей шероховатостью микрометрического масштаба с подходящей морфологией, а также составом, практически свободным от примесей, и толщиной, превосходящей примерно в три раза толщину обычных поверхностей, что обеспечивает очень хорошие свойства остеоинтеграции. 2 н. и 9 з.п. ф-лы, 1 табл., 3 пр., 8 ил.
1. Способ получения поверхности металлического имплантата на основе титана, предназначенного для вставления в костную ткань, включающий этапы:
(a) струйной обработки внешней области имплантата частицами оксида алюминия под давлением;
(b) химической обработки внешней области имплантата, подвергнутой струйной обработке, кислотной композицией, включающей серную кислоту и фтористоводородную кислоту; и
(c) термической обработки внешней области имплантата, подвергнутой струйной обработке и химической обработке, путем нагревания до температуры 200-450°С в течение 15-120 мин.
2. Способ по п.1, характеризующийся тем, что струйную обработку поверхности частицами оксида алюминия на этапе (а) выполняют под давлением 1-6 атм.
3. Способ по п.2, характеризующийся тем, что струйную обработку поверхности частицами оксида алюминия на этапе (а) выполняют под давлением 3 атм.
4. Способ по п.1, характеризующийся тем, что частицы оксида алюминия, используемые на этапе (а), имеют размер 10-100 мкм.
5. Способ по п.4, характеризующийся тем, что частицы оксида алюминия, используемые на этапе (а), имеют размер 25 мкм.
6. Способ по п.1, характеризующийся тем, что кислотная композиция, используемая на этапе (b), содержит 15-50 об.% серной кислоты и 0,01-1 об.% фтористоводородной кислоты.
7. Способ по п.6, характеризующийся тем, что кислотная композиция, используемая на этапе (b), включает 28,8 об.% серной кислоты и 0,024 об.% фтористоводородной кислоты.
8. Способ по п.1, характеризующийся тем, что химическую обработку на этапе (b) проводят при температуре 50-110°С в течение 4-60 мин.
9. Способ по п.8, характеризующийся тем, что химическую обработку на этапе (b) проводят при температуре 75°С в течение 12 мин.
10. Способ по п.1, характеризующийся тем, что термическую обработку на этапе (с) проводят при температуре 285°С в течение 60 мин.
11. Металлический имплантат на основе титана, имеющий поверхность, полученную по способу по одному из пп.1-10.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Аналого-цифровой преобразователь изображений | 1989 |
|
SU1674051A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| RU 2005104560 А, 27.08.2005 | |||
| US 6689170 В1, 10.02.2004 | |||
| US 5603338 А, 18.02.1997 | |||
| US 4818559 А, 04.04.1989 | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ЗАЩИТЫ ОТ РАЗРУШЕНИЯ ОБМУРОВКИ ЗАГРУЗОЧНЫХ ОТВЕРСТИЙ ШАХТНЫХ ИЛИ КАМЕРНЫХ ТОПОК | 1925 |
|
SU3728A1 |
| KR 20040066699 А, 27.07.2004. | |||
Авторы
Даты
2012-04-27—Публикация
2007-10-03—Подача