Перекрестная ссылка на родственную заявку(и)
По настоящей заявке испрашивается приоритет патентной заявки США 61/471036, поданной 01 апреля 2011 года, которая включена в настоящую описание посредством ссылки.
Уровень техники
Рак может возникать, если у клеток есть мутации, которые, в конечном счете, придают таким клеткам преимущество в росте. Соматические мутации включают, например, замены, делеции, вставки, амплификации и перестановки нуклеотидных оснований. Идентификация соматических мутаций, которые присутствуют при раке, предоставляет ценную информацию относительно развития рака. Такая информация также полезна для идентификации диагностических маркеров и терапевтических мишеней при раке (см., например, Bamford et al. (2004) British Journal of Cancer 91:355-358). Идентификация соматических мутаций, связанных с раком, оказалась ценной в клинических условиях, например, при выявлении отличий популяций пациентов, которые чувствительны к специфической терапии (см., например, Lynch et al. (2004) N. Engl. J. Med. 350:2129-2139; O'Hare (2004) Blood 104:2532-2539). Таким образом, сохраняется потребность в идентификации соматических мутаций, которые присутствуют при раке.
Эмбриональные вариации, или полиморфизм, являются наследственными вариациями, которые присутствуют в геноме организма. Полиморфизмы включают полиморфизм длины рестрикционных фрагментов (RFLP), короткие тандемные повторы (STR) и однонуклеотидный полиморфизм (SNP). Эмбриональные вариации также могут быть связаны с восприимчивостью к некоторым заболеваниям, включая рак (см., например, Vierimaa et al. (2006) Science 312:1228-1230; Landi et al. (2006) Science 313:521-522; Zhu et al. (2004) Cancer Research 64:2251-2257). Таким образом, сохраняется потребность в идентификации полиморфизмов, связанных с раком.
Сущность некоторых вариантов осуществления изобретения
Изобретения, описанные в настоящей описании, удовлетворяют описанным выше потребностям и обеспечивают другие преимущества.
Авторы обнаружили, что биомаркеры могут прогнозировать эффективность ингибиторов AKT при лечении гиперпролиферативных нарушений, таких как рак.
Авторы обнаружили, что некоторые мутации в AKT могут привести к нарушению взаимодействий между PH-доменом AKT и киназным доменом. Нарушение между указанными доменами, вызванное мутацией(ями), по-видимому, приводит к конститутивному фосфорилированию AKT и к конститутивной сигнализации AKT. Такие эффекты также допускают перерождение клеток. Данные мутации придают устойчивость к PI3K и аллостерическим ингибиторам Akt. Соответственно, присутствие таких мутаций указывает на то, что эффективная дозировка PI3K и аллостерических ингибиторов Akt будет выше, а также указывает, что необходимо использовать другие ингибиторы помимо PI3K и/или аллостерических ингибиторов Akt, такие как АТФ-конкурентные ингибиторы Akt. Применение указанного биомаркера, одного или в комбинации с другими биомаркерами, описанными в настоящем описании, может быть предназначено для прогнозирования чувствительности роста опухолевых клеток к ингибитору AKT, который вводят отдельно или в комбинации с другим терапевтическим соединением, таким как 5-FU, платиносодержащее средство (карбоплатин, цисплатин, оксалиплатин и т.д.) иринотекан, доцетаксел, доксорубицин, гемцитабин, SN-38, капецитабин, темозоломид, эрлотиниб, PD-0325901, паклитаксел, бевацизумаб, пертузумаб, тамоксифен, рапамицин, лапатиниб, PLX-4032, MDV3100, абиратерон и GDC-0973, и другие ингибиторы MEK.
Краткое описание фигур
На фиг.1 показаны AKT и взаимодействия PH и киназного домена (1A и 1B), а также показаны положения взаимодействий между указанными доменами (1C).
На фиг.2 представлены результаты, показывающие, что синтетические мутации по сайтам, вероятно, нарушают взаимодействия PH домена с киназным доменом и приводят к конститутивному фосфорилированию Akt.
На фиг.3 показаны соматические мутации.
На фиг.4 представлены результаты, показывающие, что соматические мутации, которые приводят к конститутивному фосфорилированию Akt, приводят к конститутивной сигнализации Akt.
На фиг.5 представлены результаты, показывающие, что мутанты Akt1 могут вызывать перерождение клеток.
На фиг.6 представлены результаты, показывающие, что мутанты Akt1 придают устойчивость к ингибиторам PI3K и аллостерическим ингибиторам AKT.
На фиг.7 показаны изменения в pPRAS40 T246 в опухолях пациентов, получавших GDC-0068.
На фиг.8 показаны опухоли с активированным путем PI3K/AKT.
На фиг.9 представлены результаты, показывающие, что профиль высокой активности AKT предсказывает чувствительность к GDC-0068.
На фиг.10 представлены результаты, демонстрирующие сильную корреляцию с потерей PTEN и чувствительностью к GDC-0068 в линиях клеток предстательной железы и яичников. Результаты соответствуют нормализованному дозозависимому эффекту одного соединения в GDC-0068.
На фиг.11 представлены результаты, демонстрирующие, что потеря PTEN и мутации PIK3CA сильно коррелируют с чувствительностью к монотерапии GDC-0068 in vitro.
На фиг.12A и 12B представлены результаты активности одного GDC-0068 на ксенотрансплантатных моделях (12A) и данные in vitro скрининга клеточных линий (12B), показывающие, что наиболее высокий процент ингибирования роста опухоли также доказывает активацию пути либо через потерю PTEN, либо в результате мутации PI3K. На моделях с активацией пути AKT (и без активации пути MEK) наблюдается высокая эффективность.
На фиг.13 представлены результаты, показывающие негативную корреляцию между чувствительностью к GDC-0068 и ингибитором MEK по отдельности в различных клеточных линиях.
На фиг.14 представлены результаты, демонстрирующие сильную синергию в клеточных линиях с активацией пути AKT (потеря PTEN, мутации PI3K). Анализ BLISS указывает на широкую синергию для GDC-0068 в комбинации с ингибитором MEK (GDC-0973).
На фиг.15 представлены результаты, согласно которым комбинированные эффекты GDC-0068 с цисплатином+5FU связаны с активацией пути AKT. Комбинированный скрининг с 5FU/цисплатином (FOLFOX) демонстрирует доказательство аддитивных эффектов. Аддитивные эффекты связаны с активацией путей: PTEN, pAKT, мутация PI3K.
На фиг.16 показаны мутации участка контакта PH-киназного домена, приводящие к активации AKT. (A) IL-3-независимая пролиферация клеток BaF3, стабильно экспрессирующих пустой вектор (EV), дикий тип (WT), миристоилированный (Myr) или E17K AKT1, один или в комбинации с MEK1 N3. (B) Представление в форме "открытая книга" PH и KD AKT1 в комплексе с аллостерическим ингибитором (код доступа в PDB 3O96). (C) Схематическое изображение скрининга, использованного для оценки эффекта мутаций в интерфейсе PH-KD AKT1. (D) Мутации в интерфейсе PH-KD способствуют пролиферации IL-3-независимых клеток BaF3. (E) Иммуноблот-анализ клеток NIH3T3, стабильно экспрессирующих пустой вектор и указанные конструкции AKT1.
На фиг.17 показаны соматические мутации AKT при раке у человека. Соматические мутации представителей семейства AKT. Горизонтальные черные полосы указывают остатки, консервативные в AKT 1, 2 и 3.
Подробное описание
Недавние структурные исследования указывают, что ингибирующие междоменные взаимодействия играют важную роль в регуляции активации AKT. При использовании мутационного скрининга показано, что активация AKT может являться результатом мутаций по остаткам, вовлеченным в контакты PH-киназного домена. Кроме того, сообщается об идентификации новых мутаций в раковых образованиях человека, из которых некоторые включают остатки в PH-KD интерфейсе.
В дополнение к ранее идентифицированной мутации E17K, мутант L52R PH-домена AKT1 и мутант D323H киназного домена, идентифицированные в клинических образцах, опосредуют клеточное перерождение и являются онкогенными in vivo. Исследование структуры полноразмерной AKT1 показывает, что E17, L52 и D323 расположены в интерфейсе PH-KD, и замены в указанных положениях теоретически могут нарушить связывание PH-KD. В соответствии с этим, L52R и D323H ослабляют связывание PH-KD в 2-гибридных анализах. Ранее механизм активации E17K связывали с измененной липид-связывающей специфичностью. Эти результаты указывают, что нарушение междоменных взаимодействий представляет собой дополнительный механизм, лежащий в основе активации E17K. В совокупности указанные наблюдения дают возможность предположить, что онкогенность мутаций в интерфейсе PH-KD AKT1, идентифицированных в настоящем изобретении, обусловлена дестабилизацией междоменных контактов.
Ингибиторы, направленные против участников пути PI3K-AKT, включая AKT, в настоящее время находятся на различных этапах разработки. Предыдущие исследования показали, что аллостерические ингибиторы AKT требуют наличия интактного PH-KD интерфейса, поскольку такие ингибиторы предпочтительно связывают закрытую конформацию "PH-in". В соответствии с этим, мутации в AKT, которые способствуют появлению открытой конформации ("PH-out"), демонстрируют пониженную чувствительность к аллостерическим ингибиторам AKT, хотя они сохраняют чувствительность к АТФ-конкурентным ингибиторам. Это указывает на то, что мутационный статус AKT имеет важное значение при выборе ингибитора в клинике. Мутации AKT, которые хотя и могут послужить причиной возникновения первичных опухолей, также могут возникать в опухолях в ответ на агенты, которые взаимодействуют с вышестоящими элементами пути AKT.
В некоторых вариантах осуществления присутствие мутации B-Raf или K-Ras является негативным предиктором (то есть, служит противопоказанием), и такие пациенты должны быть исключены из группы терапии, получающей такие ингибиторы AKT, как GDC-0068.
GDC-0068 и подобные АТФ-конкурентные ингибиторы предпочтительно воздействуют на активную Akt и запертую Akt в гиперфосфорилированном, но неактивном состоянии, блокируя дефосфорилирование. Увеличение pAkt может использоваться в качестве фармакодинамического биомаркера ("PD-биомаркера") действия GDC-0068 и подобных АТФ-конкурентных ингибиторов.
В некоторых вариантах осуществления изобретения pGSK-3β или PRAS40 могут применяться в качестве фармакодинамических биомаркеров для таких ингибиторов AKT, как GDC-0068. Кроме того, в некоторых вариантах осуществления нужная дозировка такого соединения, как GDC-0068, может быть определена и скорректирована с учетом ингибирования пути AKT с применением PD биомаркеров, например, pGSK-3β или PRAS40 (см. фиг.7).
Также полагают, что GDC-0068 и подобные АТФ-конкурентные ингибиторы более активны против гиперактивированной Akt.
Селективный таргетинг активной Akt может действовать в сочетании с добавлением онкогена, увеличивая терапевтический индекс GDC-0068 и подобных АТФ-конкурентных ингибиторов в отношении опухолей с высокими стационарными уровнями активной Akt, включая опухоли, вызванные мутациями Akt, потерей PTEN (гемизиготной или гомозиготной), потерей функции INPP4B, потерей функции PHLPP, потерей функции PP2A, мутацией PI3K и Her2 и/или амплификацией Her3.
Эффективность GDC-0068 прогнозируется в опухолях, которые являются PTEN нулевыми или имеют мутации PI3k, например, при раке предстательной железы, молочной железы и яичников.
Потеря PTEN является биомаркером, который предсказывает синергию с ингибиторами MEK, например, при раке поджелудочной железы.
Таким образом, активность GDC-0068 связана, например, выборочно связана, с активацией пути AKT. Доказательство подобной зависимости было продемонстрировано в клеточных линиях и ксенотрансплантатных исследованиях.
Потеря PTEN, мутации киназного домена PI3K и высокие уровни pAKT являются важными маркерами, которые прогнозируют активность соединения, например, в виде отдельно применяемого средства; с аддитивными эффектами с комбинациями химиотерапевтических соединений и с синергическими эффектами, например, с ингибиторами MEK. Примечательно, что синергия с ингибитором MEK наблюдается с активацией пути MEK. Напротив, активация пути MEK (например, KRAS/BRAF) является маркером устойчивости к воздействию отдельного средства (например, GDC-0068). Другие потенциальные прогностические факторы активности соединения, например, активности GDC-0068, включают РТК-регулируемую активацию пути (HER2 при раке молочной железы, HER2 и Met при раке желудка), мутации E17K AKT1, амплификации AKT2, овер-экспрессию AKT3 и амплификации PI3K.
Текущие оценки распространенности биомаркеров рака желудка, предстательной железы и поджелудочной железы, основанные на литературных данных
В целях понимания настоящего описания использованы следующие определения, и каждый раз, в соответствующих случаях, термины, используемые в единственном числе, будут также включать множественное число, и наоборот. В случае если какое-либо определение, представленное ниже, противоречит какому-либо документу, включенному в настоящее описание посредством ссылки, определение, представленное ниже, должно иметь преимущественную силу.
Термины "полинуклеотид" или "нуклеиновая кислота", используемые в настоящем описании попеременно, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами, или любым субстратом, который может быть включен в полимер ДНК- или РНК-полимеразой. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае присутствия, модификация структуры нуклеотида может быть введена до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, посредством конъюгирования с меткой. Другие типы модификаций включают, например, "кэпы", замену одного или более природных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые группы, например, такие как белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации интеркаляторами (например, акридином, псораленом и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкилирующие соединения, модификации модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих на сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевой ОН может быть фосфорилирован или замещен аминами или молекулами органических кэппирующих групп длиной от 1 до 20 атомов углерода. Другие гидроксилы также можно дериватизировать стандартными защитными группами. Полинуклеотиды также могут содержать формы аналогов сахаров, рибозы или дезоксирибозы, которые широко известны в данной области, включая, например, 2'-О-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пираноза, фураноза, седогептулоза, ациклические аналоги и абазические аналоги нуклеозидов, такие как метилрибозид. Одна или более фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Такие альтернативные связывающие группы включают, но без ограничения, варианты осуществления, где фосфат заменен Р(О)S ("тиоатом"), P(S)S ("дитиоатом"), (O)NR 2 ("амидатом"), P(O)R, P(O)OR', СО или СН 2 ("формацеталем"), где каждый из R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С); необязательно, содержащий простую эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Нет необходимости, чтобы все связи в полинуклеотиде были идентичными. Приведенное выше описание относится ко всем полинуклеотидам, перечисленным в настоящем описании, включая РНК и ДНК.
"Олигонуклеотид", как используется в настоящем описании, относится к коротким, одноцепочечным полинуклеотидам, которые имеют длину по меньшей мере приблизительно семь нуклеотидов и менее чем приблизительно 250 нуклеотидов. Олигонуклеотиды могут быть синтетическими. Термины "олигонуклеотид" и "полинуклеотид" не являются взаимоисключающими. Описание, представленное выше для полинуклеотидов, в равной мере и полностью применимо к олигонуклеотидам.
Термин "праймер" относится к одноцепочечному полинуклеотиду, который способен к гибридизации с нуклеиновой кислотой и обеспечивает полимеризацию комплементарной нуклеиновой кислоты, обычно предоставляя свободную группу 3'-OH.
Термин "нуклеотидная вариация" относится к изменению в нуклеотидной последовательности (например, вставке, делеции, инверсии или замене одного или более нуклеотидов, такой как однонуклеотидный полиморфизм (SNP)) по сравнению с референсной последовательностью (например, последовательностью дикого типа). Термин также охватывает соответствующее изменение в комплементарной нуклеотидной последовательности, если не указано иное. Нуклеотидная вариация может быть соматической мутацией или эмбриональным полиморфизмом.
Термин "аминокислотная вариация" относится к изменению в аминокислотной последовательности (например, вставке, замене или делеции одной или более аминокислот, такой как внутренняя делеция или N- или C-концевое усечение) по сравнению с референсной (например, последовательностью дикого типа).
Термин "детектирование" включает любые способы детектирования, включая прямое и опосредованное детектирование.
Термин "диагностика" используется в настоящем описании для обозначения идентификации или классификации молекулярного или патологического состояния, заболевания или состояния. Например, "диагностика" может относиться к идентификации конкретного типа рака, например, рака легкого. "Диагностика" также может относиться к классификации конкретного типа рака, например, по гистологии (например, немелкоклеточной карциномы легкого), по молекулярным особенностям (например, рак легкого, характеризуемый нуклеотидной и/или аминокислотной вариацией(ями) в конкретном гене или белке) или по тому и другому.
Термин "прогноз" используется в настоящем описании для обозначения прогнозирования вероятности смерти, связанной с раком, или прогрессии рака, включая, например, рецидив, распространение метастазов и устойчивость к лекарственному средству неопластического заболевания, такого как рак.
Термин "прогнозирование" (а такие вариации, как предсказание), используется в настоящем описании для обозначения вероятности, с которой пациент будет иметь благоприятную или неблагоприятную реакцию на воздействие лекарственного средства или набора лекарственных средств. В одном варианте осуществления прогнозирование относится к степени таких реакций. В другом варианте осуществления прогнозирование относится к тому, переживет ли и/или к вероятности того, что пациент переживет последующую терапию, например, лечение конкретным терапевтическим средством и/или хирургическое удаление первичной опухоли, и/или химиотерапию в течение некоторого периода времени, без рецидива рака. Способы прогнозирования по изобретению могут применяться клинически, для принятия решений о лечении при выборе наиболее подходящих методов лечения любого конкретного пациента. Способы прогнозирования настоящего изобретения являются ценным инструментом в прогнозировании, будет ли пациент благоприятно отвечать на схему лечения, такую как данная терапевтическая схема, включающая, например, введение данного терапевтического средства или комбинации, хирургического вмешательства, химиотерапии и т.д., или будет ли вероятным продолжительное выживание пациента после применения терапевтической схемы.
Термины "клеточное пролиферативное нарушение" и "пролиферативное нарушение" относятся к нарушениям, которые связаны с измеряемой степенью патологической пролиферации клеток. В одном варианте осуществления клеточным пролиферативным нарушением является рак.
"Опухоль", как используется в настоящем описании, относится ко всем типам роста и пролиферации неопластических клеток, злокачественных или доброкачественных, а также ко всем предраковым и раковым клеткам и тканям. Термин "рак", "раковый", "клеточное пролиферативное нарушение," "пролиферативное нарушение" и "опухоль" не являются взаимоисключающими, как указано в настоящем описании.
Термины "рак" и "раковый" относятся к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом и пролиферацией клеток. Примеры рака включают, но, не ограничиваясь ими, карциному, лимфому (например, ходжкинскую и неходжкинскую лимфому), бластому, саркому и лейкоз. Более конкретные примеры раковых опухолей включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, перитонеальный рак, гепатоцеллюлярный рак, почечно-клеточная карцинома, желудочно-кишечный рак, рак желудка, рак пищевода, рак поджелудочной железы, глиому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы (например, гормонорезистентный рак молочной железы), рак толстой кишки, рак прямой кишки, рак легкого, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, меланому, лейкоз и другие лимфопролиферативные нарушения, а также различные типы злокачественных образований головы и шеи.
Термин "опухоль легкого" относится к любой опухоли легкого, включая, но без ограничений, мелкоклеточную карциному легкого и немелкоклеточную карциному легкого, при этом последняя включает, но без ограничений, аденокарциному, плоскоклеточную карциному и крупноклеточную карциному.
Термины "неоплазия" или "неопластическая клетка" относятся к патологической ткани или клетке, которые пролифирируют быстрее, чем соответствующие нормальные ткани или клетки, и продолжают расти после удаления стимула, который инициировал рост.
"Клетка опухоли легкого" относится к клетке опухоли легкого, in vivo или in vitro, и охватывает клетки, полученные из первичных опухолей легкого или метастатических опухолей легкого, а также клеточные линии, полученные из таких клеток.
Как используется в настоящем описании, "лечение" (и такие вариации, как "лечить") относится к клиническому вмешательству в попытке изменить естественное состояние индивидуума или клетки, подвергаемые лечению, и может быть выполнено для профилактики или во время клинической патологии. Требуемые эффекты лечения включают предотвращение появления или рецидива заболевания, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение метастазирования, уменьшение скорости прогрессирования заболевания, уменьшение тяжести или облегчение состояния болезни и ремиссию или улучшенный прогноз.
"Индивидуум", "субъект" или "пациент" представляет собой позвоночное животное. В некоторых вариантах осуществления позвоночным животным является млекопитающее. Млекопитающие включают, но, не ограничиваясь ими, сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как кошки, собаки и лошади), приматов (включая человека и не относящихся к человеку приматов) и грызунов (например, мышей и крыс). В некоторых вариантах осуществления млекопитающим является человек и может быть мужского или женского пола.
"Эффективное количество" относится к эффективному количеству, в дозировках и в течение периодов времени, необходимого для достижения требуемого терапевтического или профилактического результата.
"Терапевтически эффективное количество" вещества/молекулы по изобретению может изменяться в зависимости от таких факторов, как состояние болезни, возраст, пол и масса индивидуума, и от способности вещества/молекулы вызывать требуемый ответ у индивидуума. Терапевтически эффективное количество охватывает количество, при котором любые токсические или нежелательные эффекты вещества/молекулы перевешиваются благоприятными терапевтически эффектами. "Профилактически эффективное количество" относится к эффективному количеству, в дозировках и в течение периодов времени, необходимому для достижения требуемого профилактического результата. Как правило, но необязательно, поскольку профилактическая доза используется у субъектов до болезни или на ее более ранней стадии, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
Термин "длительная" выживаемость используется в настоящем описании для обозначения выживаемости в течение по меньшей мере 1 года, 5 лет, 8 лет или 10 лет после терапевтического воздействия.
Термин "повышенная устойчивость" к конкретному терапевтическому средству или методу лечения, при использовании согласно изобретению, означает уменьшенный ответ на стандартную дозу лекарственного средства или на стандартную схему лечения.
Термин "пониженная чувствительность" к конкретному терапевтическому средству или методу лечения, при использовании согласно изобретению, означает уменьшенный ответ на стандартную дозу средства или на стандартную схему лечения, где уменьшенный ответ можно компенсировать (по меньшей мере частично) увеличением дозы средства или интенсивности лечения.
"Ответ пациента" может быть оценен с использованием любого конечного критерия, показывающего благоприятное воздействие на пациента, включая, но без ограничения, (1) ингибирование до некоторой степени роста опухоли, включая замедление или полное прекращение роста; (2) уменьшение количества опухолевых клеток; (3) уменьшение размера опухоли; (4) ингибирование (например, уменьшение, замедление или полную остановку) инфильтрации опухолевых клеток в смежные периферические органы и/или ткани; (5) ингибирование (например, уменьшение, замедление или полную остановку) метастазирования; (6) усиление противоопухолевого иммунного ответа, который может, но необязательно, приводить к регрессии или отторжению опухоли; (7) облегчение до некоторой степени одного или более симптомов, связанных с опухолью; (8) увеличение продолжительности выживания после лечения; и/или (9) уменьшение смертности в данный момент времени после лечения.
"Антитела" (Ab) и "иммуноглобулины" (Ig) относятся к гликопротеинам, обладающим сходными структурными особенностями. Хотя антитела демонстрируют специфичность связывания в отношении определенного антигена, иммуноглобулины включают как антитела, так и другие подобные антителам молекулы, которые обычно не имеют антигенной специфичности. Полипептиды последнего типа, например, вырабатываются в низких уровнях лимфатической системой и в повышенных уровнях миеломами.
Термины "антитело" и "иммуноглобулин" используются попеременно в самом широком смысле и включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, одновалентные антитела, поливалентные антитела, мультиспецифические антитела (например, биспецифические антитела, при условии, что они проявляют требуемую биологическую активность), и могут также включать некоторые фрагменты антител (как более подробно описано в настоящем описании). Антитело может быть химерным, человеческим, гуманизированным и/или с созревшей афинностью.
"FOXO3a" относится к белку с боксом forkhead/winged helix класса O, который представляет собой нижестоящую мишень PI3K/AKT киназного сигнального пути. Активированная AKT киназа непосредственно регулирует активность FOXO3a посредством фосфорилирования, вызывая ее транслокацию в цитоплазму, где она подвергается секвестрации под действием шаперона 14-3-3. Ингибирование киназ PI3K/AKT приводит к дефосфорилированию и ядерной локализации FOXO3a, вызывая его активацию. Ядерная локализация FOXO3a дает возможность ему действовать в качестве фактора транскрипции, вызывая остановку клеточного цикла и/или апоптоз через апрегуляцию его ключевых генов-мишеней, таких как p27Kip1 и Bim.
"Профиль локализации" относится к количеству данной молекулы в одном местоположении по сравнению с ее количеством во втором местоположении. В одном примере профиль локализации FOXO3a относится к количеству FOXO3a в клеточном ядре по сравнению с его количеством в цитоплазме клетки. Профиль локализации может быть выражен через отношение (например, количество FOXO3a в ядре, деленное на количество FOXO3a в цитоплазме) или разность (например, количество FOXO3a в ядре минус количество FOXO3a в цитоплазме). "Ядерный профиль локализации" относится к профилю локализации, при котором уровни FOXO3a существенно выше в ядре, чем в цитоплазме. В одном примере ядерный профиль локализации включает более чем приблизительно 50% FOXO3a в ядре по сравнению с цитоплазмой. В других примерах ядерный профиль локализации включает более чем приблизительно 70%, альтернативно, более чем приблизительно 80%, альтернативно, более чем приблизительно 90% FOXO3a в ядре, чем в цитоплазме. "Цитоплазматический профиль локализации" относится к профилю локализации, при котором уровни FOXO3a существенно выше в цитоплазме, чем в ядре. В одном примере цитоплазматический профиль локализации включает более чем приблизительно 50% FOXO3a в цитоплазме, чем в ядре. В других примерах цитоплазматический профиль локализации включает более чем приблизительно 70%, альтернативно, более чем приблизительно 80%, альтернативно, более чем приблизительно 90% FOXO3a в цитоплазме, чем в ядре.
Один аспект, таким образом, включает способ прогнозирования чувствительности роста опухолевых клеток к ингибированию под действием ингибитора AKT-киназного пути, включающий: определение профиля локализации FOXO3a в клетке опухоли, где цитоплазматический профиль локализации FOXO3a коррелирует с чувствительностью к ингибированию под действием ингибитора AKT-киназы, и ядерный профиль локализации FOXO3a коррелирует с устойчивостью к ингибированию под действием ингибитора AKT-киназы.
"Профиль pAKT" относится к уровню активации или фосфорилирования AKT ("pAKT") по сравнению с уровнем неактивированной или нефосфорилированной AKT в данном образце. В одном примере образцом является опухолевая клетка. Профиль pAKT может быть выражен через отношение (например, количества pAKT в клетке опухоли, деленное на количество нефосфорилированной AKT в клетке или в неопухолевой клетке того же типа) или разность (например, количество pAKT в клетке опухоли минус количество нефосфорилированной AKT в клетке или в неопухолевой клетке того же типа). Профиль pAKT может также быть выражен через уровень активации пути при измерении количества фосфорилированных нижестоящих мишеней AKT (например, pGSK или PRAS40). "Высокий профиль pAKT" относится к уровням активации или фосфорилирования суммарной AKT в образце, которые превышают базовое значение. В одном примере базовое значение представляет собой базальные уровни pAKT для клетки данного типа. В другом примере базовое значение представляет собой средний уровень pAKT в данной популяции исследуемых клеток. В другом примере "высокий профиль pAKT" относится к опухолевой клетке, в которой повышена экспрессия или амплифицирована фосфорилированная или активированная AKT по сравнению со средним значением в нормальных, здоровых (например, неопухолевых) клетках того же типа или из той же популяции млекопитающих или пациентов. На фиг.9 показан пример, который демонстрирует, что высокий профиль pAKT предсказывает чувствительность к ингибиторам AKT, например, GDC-0068. Профиль pAKT также может применяться в сочетании с другими маркерами (например, потерей PTEN, мутациями PI3K, Kras или Braf киназ, или профилями локализации FOXO3) для прогнозирования эффективности некоторых ингибиторов AKT.
Способы измерения уровней активации AKT и количеств pAKT в образце известны в данной области техники. Например, могут использоваться иммунопреципитационные анализы, такие как набор AKT Activity Assay (производства Abcam®, San Francisco, CA). В другом примере могут использоваться Вестерн-блот анализы, такие как набор AKT Western Blot Assay (производства Cell Signaling Technology, Danvers, MA). Другие известные форматы анализов, используемые для измерения уровней pAKT, включают хемилюминесцентный иммуносорбентный анализ, см. Cicenas, J, et. al., "Increased level of phosphorylated akt measured by chemiluminescence-linked immunosorbent assay is a predictor of poor prognosis in primary breast cancer overexpressing ErbB-2," Breast Can. Res., 7(4), R394, 2005. Доступны другие анализы, которые могут использоваться, например, набор AlphaScreen SureFire Akt 1 (p-Thr308) (производства Perkin Elmer, Waltham, MA).
Методы определения присутствия мутаций PI3K известны в данной области техники. Например, известны анализы для обнаружения определенных мутаций в гене PIK3CA (в экзонах 9 и 20, а также мутации H1047R или H1047L) при использовании ПЦР в реальном времени (Qiagen, Valencia, CA).
Нуклеиновой кислотой, может являться, например, геномная ДНК, РНК, транскрибированная с геномной ДНК или кДНК, полученной с РНК. Нуклеиновая кислота может быть получена из позвоночного животного, например, млекопитающего. Нуклеиновая кислота, как говорят, "происходит из" конкретного источника, если она получена непосредственно из того источника, или если она является копией нуклеиновой кислоты, обнаруженной в данном источнике.
Вариации в нуклеиновых кислотах и аминокислотных последовательностях могут быть обнаружены с помощью определенных методов, известных специалистам в данной области техники. Такие методы включают, но без ограничения, секвенирование ДНК; анализы с удлинением праймеров, включая анализы включения аллель-специфичных нуклеотидов и анализы с удлинением аллель-специфичных праймеров (например, аллель-специфичную ПЦР, аллель-специфичную лигазную цепную реакцию (ЛЦР) и ЛЦР с пропусками); анализы гибридизации аллель-специфичных олигонуклеотидов (например, анализы лигирования олигонуклеотидов); анализы с защитой от расщепления, где защита от расщепляющих агентов используется для обнаружения ошибочно спаренных оснований в дуплексах нуклеиновых кислот; анализ связывания белка MutS; электрофоретический анализ, в котором сравнивают подвижность измененных молекул нуклеиновых кислот и молекул дикого типа; денатурирующий градиентный гель-электрофорез (DGGE, как описано, например, Myers et al. (1985) в Nature 313:495); анализ расщепления РНКазой по ошибочно спаренным парам оснований; анализ химического или ферментативного расщепления гетеродуплекса ДНК; масс-спектрометрию (например, MALDI-TOF); анализ генетической информации (GBA); 5'-нуклеказный анализ (например, TaqMan®); и анализы с использованием молекулярных маяков. Некоторые из указанных методов обсуждаются ниже более подробно.
Обнаружение вариаций в целевых нуклеиновых кислотах может быть выполнено с помощью молекулярного клонирования и секвенирования целевых нуклеиновых кислот при использовании методик, известных в данной области техники. Альтернативно, методики амплификации, такие как полимеразная цепная реакция (ПЦР), могут использоваться для амплификации целевых последовательностей нуклеиновых кислот непосредственно из препарата геномной ДНК, выделенной из опухолевой ткани. Нуклеотидная последовательность амплифицированных последовательностей может быть затем определена, и вариации, присутствующие в них, идентифицированы. Методики амплификации известны в данной области техники, например, полимеразная цепная реакция описана Saiki et al., в Science 239:487, 1988; и патентах США 4683203 и 4683195.
Лигазная цепная реакция, которая известна в данной области техники, также может использоваться для амплификации целевых последовательностей нуклеиновых кислот. См., например, Wu et al., Genomics 4:560-569 (1989). Кроме того, методика, известная как аллель-специфичная ПЦР, также может использоваться для обнаружения вариаций (например, замен). См., например, Ruano and Kidd (1989) Nucleic Acids Research 17:8392; McClay et al. (2002) Analytical Biochem. 301:200-206. В некоторых вариантах осуществления данной методики используется аллель-специфичный праймер, при этом 3'-концевой нуклеотид праймера комплементарен (то есть, способен к специфичному спариванию оснований) определенной вариации в целевой нуклеиновой кислоте. Если определенная вариация не присутствует, продукт амплификации не наблюдается. Система обнаружения мутаций ARMS (от англ. Amplification Refractory Mutation System) также может использоваться для обнаружения вариаций (например, замен). Система ARMS описана, например, в европейской патентной заявке 0332435 и Newton et al., в Nucleic Acids Research, 17:7, 1989.
Другие методы, которые могут применяться для обнаружения вариаций (например, замен), включают, но, не ограничиваясь ими: (1) анализы включения аллель-специфичных нуклеотидов, такие как анализы с удлинением на одно основание (см., например, Chen et al. (2000) Genome Res. 10:549-557; Fan et al. (2000) Genome Res. 10:853-860; Pastinen et al. (1997) Genome Res. 7:606-614; и Ye et al. (2001) Hum. Mut. 17:305-316); (2) анализы с удлинением аллель-специфичных праймеров (см., например, Ye et al. (2001) Hum. Mut. 17:305-316; и Shen et al. Genetic Engineering News, vol. 23, Mar. 15, 2003), включая аллель-специфичную ПЦР; (3) 5'-нуклеазные анализы (см., например, De La Vega et al. (2002) BioTechniques 32:S48-S54 (с описанием анализа TaqMan®); Ranade et al. (2001) Genome Res. 11:1262-1268; и Shi (2001) Clin. Chem. 47:164-172); (4) анализы с использованием молекулярных маяков (см., например, Tyagi et al. (1998) Nature Biotech. 16:49-53; и Mhlanga et al. (2001) Methods 25:463-71); и (5) анализы лигирования олигонуклеотидов (см., например, Grossman et al. (1994) Nuc. Acids Res. 22:4527-4534; опубликованная патентная заявка США 2003/0119004 A1; международная публикация PCT WO 01/92579 A2; и патент США 6027889).
Вариации также могут быть обнаружены с помощью методов обнаружения ошибочного спаривания. Ошибочное спаривание наблюдается в гибридизованных дуплексах нуклеиновых кислот, которые не обладают 100% комплементарностью. Отсутствие полной комплементарности может быть обусловлено присутствием делеций, вставок, инверсий или замен. Одним из примеров метода обнаружения ошибочного спаривания является анализ обнаружения репарации ошибочного спаривания (MRD), описанный, например, Faham et al., в Proc. Natl Acad. Sci. USA 102:14717-14722 (2005) и Faham et al., в Hum. Mol. Genet. 10:1657-1664 (2001). Другим примером методики расщепления ошибочного спаривания является метод защиты от РНКазы, который подробно описан Winter et al., в Proc. Natl. Acad. Sci. USA, 82:7575, 1985, и Myers et al., в Science 230:1242, 1985. Например, способ изобретения может включать применение меченого рибозонда, который комплементарен человеческой целевой нуклеиновой кислоте дикого типа. Рибозонд и целевая нуклеиновая кислота, полученная из образца ткани, отжигаются (гибридизуются) вместе и затем подвергаются расщеплению ферментом РНКазой, которая способна обнаруживать некоторые ошибочно спаренные основания в структуре РНК дуплекса. Если ошибочное спаривание обнаружено РНКазой A, она расщепляет РНК на участке ошибочного спаривания. Таким образом, когда препарат отожженной РНК разделяют в матрице электрофорезного геля, если ошибочное спаривание было обнаружено и расщеплено РНКазой A, будет наблюдаться РНК продукт, меньший, чем полноразмерный РНК дуплекс для рибозонда и мРНК или ДНК. Нет необходимости, чтобы рибозонд имел полную длину целевой нуклеиновой кислоты, и он может быть частью целевой нуклеиновой кислоты, если он охватывает положение, подозреваемое на присутствие вариации.
Подобным способом ДНК зонды могут использоваться для обнаружения ошибок спаривания, например, путем ферментативного или химического расщепления. См., например, Cotton et al., Proc. Natl. Acad. Sci. USA, 85:4397, 1988; и Shenk et al., Proc. Natl. Acad. Sci. USA, 72:989, 1975. Альтернативно, ошибочное спаривание может быть обнаружено по изменениям электрофоретической подвижности дуплексов, содержащих ошибочно спаренные основания, в сравнении с полностью комплементарными дуплексами. См., например, Cariello, Human Genetics, 42:726, 1988. Целевая нуклеиновая кислота, подозреваемая на наличие вариации, может быть амплифицирована перед гибридизацией с использованием рибозондов или ДНК-зондов. Вариации в целевой нуклеиновой кислоте также могут быть обнаружены при использовании Саузерн-гибридизации, в особенности, если вариации представляют собой существенные перестройки, такие как делеции и вставки.
Зонды полиморфизма длин рестрикционных фрагментов (RFLP) для целевой нуклеиновой кислоты или окружающих маркерных генов могут использоваться для обнаружения вариаций, например, вставок или делеций. Вставки и делеции также могут быть обнаружены с помощью клонирования, секвенирования и амплификации целевой нуклеиновой кислоты. Анализ методом одноцепочечного конформационного полиморфизма (SSCP) также может использоваться для обнаружения вариантов аллелей с измененными основаниями. См., например, Orita et al., Proc. Natl. Acad. Sci. USA 86:2766-2770, 1989, и Genomics, 5:874-879, 1989.
Изобретение также предоставляет ряд композиций, подходящих для применения при осуществлении способов по изобретению. Например, в изобретении предоставлены чипы, которые могут применяться в таких способах. В одном варианте осуществления чип по изобретению включает отдельные молекулы нуклеиновой кислоты или их коллекции, используемые для обнаружения вариаций. Например, чип по изобретению может включать ряд дискретно расположенных индивидуальных аллель-специфичных олигонуклеотидов или наборы аллель-специфичных олигонуклеотидов. Известно несколько методик закрепления нуклеиновых кислот на твердой подложке, такой как предметное стекло. Один из способов состоит во включении в синтезируемые молекулы нуклеиновой кислоты модифицированных оснований или аналогов, которые содержат реакционноспособную группу, которая способна прикрепляться к твердой подложке, такую как аминогруппа, производная аминогруппы или другая группа с положительным зарядом. Затем синтезированный продукт наносят на твердую подложку, такую как предметное стекло, покрытое альдегидом или другой реакционноспособной группой. Альдегид или другая реакционноспособная группа образуют ковалентную связь с реакционноспособной группой на амплифицированном продукте, который ковалентно присоединен к предметному стеклу. Другие методы, такие как с использованием химии присоединения аминопропилсилана, также известны в данной области техники.
Биологический образец, согласно любому из вышеуказанных способов, может быть получен при использовании некоторых способов, известных специалистам в данной области техники. Биологические образцы могут быть получены из позвоночных животных и, в частности, млекопитающих. Биопсию ткани часто используют для получения репрезентативной части опухолевой ткани. Альтернативно, клетки опухоли могут быть получены косвенно, в форме тканей или жидкостей, в которых, как известно или предполагается, содержатся целевые клетки опухоли. Например, образцы раковых образований легкого могут быть получены с помощью резекции, бронхоскопии, тонкоигольной аспирационной биопсии, бронхиальной щеточной биопсии или из слюны, плевральной жидкости или крови. Вариации в целевых нуклеиновых кислотах (или кодируемых полипептидах) могут быть обнаружены из образца опухоли или из других образцов организма, таких как моча, слюна или сыворотка. Раковые клетки отделяют от опухолей и проявляют в таких образцах организма. Путем скрининга таких образцов организма простой ранний диагноз может быть установлен для таких заболеваний, как рак. Кроме того, прогресс терапии можно отслеживать еще более простым путем, анализируя такие образцы организма на наличие вариаций в целевых нуклеиновых кислотах (или кодируемых полипептидах). Кроме того, способы обогащения препарата ткани клетками опухоли известны в данной области. Например, ткань может быть выделена из криостатных или парафиновых срезов. Раковые клетки могут быть также отделены из нормальных элементов с помощью проточной цитометрии или лазерной захватывающей микродиссекции.
Ингибиторы AKT киназы
Некоторые ингибиторы AKT киназы известны как АТФ-конкурентные ингибиторы благодаря своей способности конкурировать с АТФ за связывание с активным центром AKT. Некоторые ингибиторы AKT киназы, известные как аллостерические ингибиторы, не связываются с активным центром AKT. Кроме того, ингибиторы AKT киназы могут быть пан-ингибиторами AKT, где ингибитор может ингибировать активность двух или более из AKT-1, AKT-2 и AKT-3. Ингибиторы AKT киназы могут быть селективными ингибиторами AKT, где ингибитор может ингибировать активность одной из AKT-1, AKT-2 и AKT-3, не ингибируя при этом активность двух других.
В одном варианте осуществления ингибитор AKT киназы представляет собой АТФ-конкурентный ингибитор. В другом варианте осуществления АТФ-конкурентный ингибитор представляет собой пан-ингибитор AKT. Например, в некоторых вариантах осуществления ингибитор AKT представляет собой АТФ-конкурентный пан-ингибитор AKT формулы I:
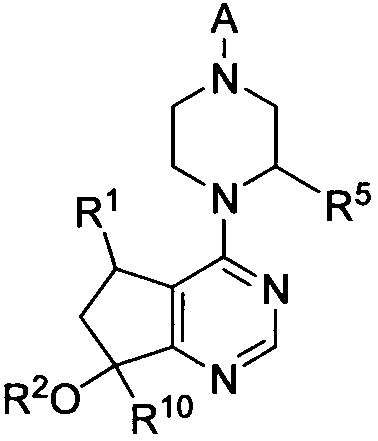 I
I
и его таутомеры, разделенные энантиомеры, разделенные диастереомеры, сольваты и соли, где
R1 представляет собой H, Me, Et и CF3;
R2 представляет собой H или Me;
R5 представляет собой H или Me;
A представляет собой:
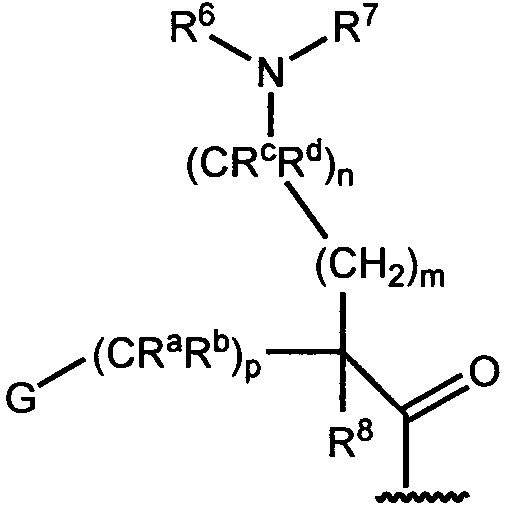 ,
,
где G представляет собой фенил, необязательно замещенный одной-четырьмя группами R9, или 5-6-членный гетероарил, необязательно замещенный галогеном;
R6 и R7 независимо представляют собой H, OCH3, (C3-C6циклоалкил)-(CH2), (C3-C6циклоалкил)-(CH2CH2), V-(CH2)0-1, где V представляет собой 5-6-членный гетероарил, W-(CH2)1-2, где W представляет собой фенил, необязательно замещенный F, Cl, Br, I, OMe, CF3 или Me, C3-C6циклоалкил, необязательно замещенный C1-C3алкилом или O(C1-C3алкилом), гидрокси(C3-C6циклоалкил), фтор(C3-C6циклоалкил), CH(CH3)CH(О)фенил, 4-6-членный гетероцикл, необязательно замещенный F, OH, C1-C3алкилом, циклопропилметилом или C(=O)(C1-C3алкилом), или C1-C6алкил, необязательно замещенный одной или более группами, независимо выбранными из OH, оксо, O(C1-C6алкила), CN, F, NH2, NH(C1-C6алкила), N(C1-C6алкил)2, циклопропила, фенила, имидазолила, пиперидинила, пирролидинила, морфолинила, тетрагидрофуранила, оксетанила или тетрагидропиранила, или R6 и R7, вместе с атомом азота, к которому они присоединены, образуют 4-7-членное гетероциклическое кольцо, необязательно замещенное одной или более группами, независимо выбранными из OH, галогена, оксо, CF3, CH2CF3, CH2CH2OH, O(C1-C3алкила), C(=O)CH3, NH2, NHMe, N(Me)2, С(O)2CH3, циклопропилметила и C1-C3алкила;
Ra и Rb представляют собой H, или Ra представляет собой H, а Rb и R6, вместе с атомами, к которым они присоединены, образуют 5-6-членное гетероциклическое кольцо, содержащее один или два атома азота в кольце;
Rc и Rd представляют собой H или Me, или Rc и Rd, вместе с атомом, к которому они присоединены, образуют циклопропильное кольцо;
R8 представляет собой H, Me, F или OH, или R8 и R6, вместе с атомами, к которым они присоединены, образуют 5-6-членное гетероциклическое кольцо, содержащее один или два атома азота в кольце;
каждый R9 независимо представляет собой галоген, C1-C6алкил, C3-C6циклоалкил, O-(C1-C6алкил), CF3, OCF3, С(C1-C6алкил), CN, OCH2-фенил, CH2O-фенил, NH2, NH-(C1-C6алкил), N-(C1-C6алкил)2, пиперидин, пирролидин, CH2F, CHF2, OCH2F, OCHF2, OH, SO2(C1-C6алкил), C(O)NH2, C(O)NH(C1-C6алкил) и C(O)N(C1-C6алкил)2;
R10 представляет собой H или Me; и
m, n и p независимо равны 0 или 1.
Другой вариант осуществления включает ингибиторы AKT формулы I, где R1 представляет собой метил; R2, R5 и R10 представляют собой H; G представляет собой фенил, необязательно замещенный 1-3 R9; R9 представляет собой галоген, C1-C3алкил, CN, CF3, OCF3, OCH3 или OCH2фенил; Rc и Rd представляют собой H или метил; m, n и p равны 0 или 1; и R8 представляет собой H или метил.
Другой вариант осуществления включает ингибиторы AKT формулы I, выбранные из:
дигидрохлорида 2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
дигидрохлорида (R)-2-амино-3-(4-хлорфенил)-1-((S)-4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
дигидрохлорида (R)-2-амино-3-(4-хлор-3-фторфенил)-1-((S)-4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
дигидрохлорида (R)-2-амино-3-(4-хлор-3-фторфенил)-1-((S)-4-((5R,7R)-7-метокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
дигидрохлорида (S)-3-амино-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-амино-3-(4-хлорфенил)-1-((S)-4-((S)-7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
(R)-2-амино-3-(4-хлор-3-фторфенил)-1-((S)-4-((S)-7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
(2R)-2-амино-3-(4-хлор-3-фторфенил)-1-((3S)-4-((5R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
(2R)-2-амино-3-(4-хлорфенил)-1-(4-(7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-амино-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метоксифенил)пропан-1-она;
2-(4-хлорфенил)-1-((S)-4-((R)-7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
дигидрохлорида 2-(4-хлорфенил)-1-(4-(7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
2-(4-хлорфенил)-3-(изопропиламино)-1-(4-(7-метокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
2-(4-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
2-(3,4-дифторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(пиридин-3-илметиламино)пропан-1-она;
2-(2,4-дихлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(пентан-3-иламино)пропан-1-она;
2-(4-хлорфенил)-3-((1S,2R)-1-гидрокси-1-фенилпропан-2-иламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((1R,4R)-4-гидроксициклогексиламино)пропан-1-она;
((3S,4R)-4-(3,4-дихлорфенил)пирролидин-3-ил)(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)метанона;
((3R,4S)-4-(3,4-дихлорфенил)пирролидин-3-ил)(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)метанона;
2-(4-хлорфенил)-2-гидрокси-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
4-амино-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-метилпентан-1-она;
4-амино-2-(3,4-дифторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-метилпентан-1-она;
(4-(4-хлор-3-фторфенил)пиперидин-4-ил)(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)метанона;
(3-(4-хлорфенил)пирролидин-3-ил)(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)метанона;
1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-2-п-толилпропан-1-она;
1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-2-(4-метоксифенил)пропан-1-она;
3-(этиламино)-2-(4-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(метиламино)пропан-1-она;
(S)-3-амино-2-(3,4-дихлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(пирролидин-1-ил)пропан-1-она;
(R)-2-амино-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-((S)-4-((S)-7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(R)-2-амино-3-(4-хлорфенил)-1-((S)-4-((R)-7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
(R)-2-амино-3-(4-хлор-3-фторфенил)-1-((S)-4-((R)-7-гидрокси-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R)-7-гидрокси-5,7-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
дигидрохлорида (4-(3,4-дихлорфенил)пиперидин-4-ил)(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)метанона;
дигидрохлорида 4-(3,4-дихлорфенил)пирролидин-3-ил)(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)метанона;
1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(4-метоксифенил)-3-(пирролидин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(2,2,2-трифторэтиламино)пропан-1-она;
3-(трет-бутиламино)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(метил(тетрагидро-2H-пиран-4-ил)амино)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(циклопропилметиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(5-хлортиофен-2-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(R)-2-амино-3-(4-хлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-2-(4-(трифторметил)фенил)пропан-1-она;
4-(1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-1-оксопропан-2-ил)бензонитрила;
(S)-2-(4-хлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
3-(азетидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(3-гидроксиазетидин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(неопентиламино)пропан-1-она;
2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
2-(4-хлорфенил)-3-(4-фторпиперидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-3-((S)-3-фторпирролидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-3-(этиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропил(метил)амино)пропан-1-она;
2-(4-хлорфенил)-3-(4,4-дифторпиперидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-3-(3,3-дифторпирролидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-бром-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(R)-2-амино-3-(4-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-амино-3-(3,4-дихлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-амино-3-(3,4-дифторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-3-((R)-3-фторпирролидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-2-(4-(трифторметокси)фенил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(циклопропиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(3-гидроксиазетидин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(3-гидроксиазетидин-1-ил)пропан-1-она;
(R)-4-амино-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-метилпентан-1-она;
(S)-4-амино-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-метилпентан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((R)-пирролидин-3-иламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((S)-пирролидин-3-иламино)пропан-1-она;
(S)-3-((R)-1-ацетилпирролидин-3-иламино)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-((S)-1-ацетилпирролидин-3-иламино)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(пиперидин-4-иламино)пропан-1-она;
(S)-3-(1-ацетилпиперидин-4-иламино)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(2-метоксиэтиламино)пропан-1-она;
(R)-2-(4-хлорфенил)-4-(диметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)бутан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((1R,4S)-4-гидроксициклогексиламино)пропан-1-она;
(S)-3-(азетидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(азетидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-((S)-2-(4-хлорфенил)-3-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-оксопропиламино)ацетамида;
2-((S)-2-(4-хлорфенил)-3-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-оксопропиламино)-N,N-диметилацетамида;
2-((S)-2-(4-хлорфенил)-3-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-оксопропиламино)-N-метилацетамида;
(R)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(изопропиламино)бутан-1-она;
(R)-2-(4-бромфенил)-4-(диметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)бутан-1-она;
(R)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(изобутиламино)бутан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-((2-метоксиэтил)(метил)амино)бутан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(изопропиламино)бутан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(3-гидроксиазетидин-1-ил)бутан-1-она;
2-((R)-3-(4-бромфенил)-4-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-оксобутиламино)-N,N-диметилацетамида;
(R)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(2-гидроксиэтиламино)бутан-1-она;
(2R)-2-(4-бромфенил)-4-(2-гидрокси-1-(тетрагидро-2H-пиран-4-ил)этиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)бутан-1-она;
(R)-2-амино-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-иодфенил)пропан-1-она;
4-((R)-2-амино-3-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-оксопропил)бензонитрила;
(R)-2-амино-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-(трифторметил)фенил)пропан-1-она;
(S)-3-(4-ацетилпиперазин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(4-ацетилпиперазин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(метиламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-(2-гидроксиэтил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-(2-гидроксиэтил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(3-метоксиазетидин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-4-(циклогексиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)бутан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(тетрагидро-2H-пиран-4-иламино)бутан-1-она;
(2R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(2-гидроксипропиламино)бутан-1-она;
(2R)-2-(4-хлорфенил)-4-(2-гидрокси-1-(тетрагидро-2H-пиран-4-ил)этиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)бутан-1-она;
(2R)-2-(4-хлорфенил)-4-(2-гидрокси-1-фенилэтиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)бутан-1-она;
(S)-2-(4-хлорфенил)-3-(этил(тетрагидро-2H-пиран-4-ил)амино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(2-метоксиэтиламино)бутан-1-она;
(2R)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(3,3,3-трифтор-2-гидроксипропиламино)бутан-1-она;
(R)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-((1-гидроксициклопропил)метиламино)бутан-1-она;
2-((R)-3-(4-бромфенил)-4-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-оксобутиламино)ацетамида;
(R)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-4-(тетрагидро-2H-пиран-4-иламино)бутан-1-она;
(R)-4-(3-(1H-имидазол-1-ил)пропиламино)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)бутан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-морфолинопропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-морфолинопропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(S)-3-(3-аминоазетидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(3-аминоазетидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-тиоморфолинопропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-тиоморфолинопропан-1-она;
(R)-2-(4-хлорфенил)-3-(4-фторпиперидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(4-фторпиперидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(3-метоксиазетидин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(3-метоксиазетидин-1-ил)пропан-1-она;
(S)-2-(3,4-дихлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(диметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-фтор-3-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(метоксиамино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метоксипиперидин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метоксипиперидин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(S)-3-(4-аминопиперидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(4-аминопиперидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(метил(тетрагидро-2H-пиран-4-ил)амино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропил(метил)амино)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-(метилсульфонил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-(метиламино)пиперидин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-(метиламино)пиперидин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-хлор-3-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(R)-2-(4-хлорфенил)-3-(4-этилпиперазин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(4-этилпиперазин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-3-((S)-3-(диметиламино)пирролидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-((S)-3-(диметиламино)пирролидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((R)-тетрагидрофуран-3-иламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((R)-тетрагидрофуран-3-иламино)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(2-фторэтиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-фтор-3-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(3,5-бис(трифторметил)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(3-фтор-4-метоксифенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
4-((R)-2-(4-хлорфенил)-3-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-оксопропил)пиперазин-2-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((R)-3-гидроксипирролидин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(4-(диметиламино)пиперидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-3-(4-(диметиламино)пиперидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(3-хлор-5-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(3-бром-4-метоксифенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(пиперидин-4-иламино)пропан-1-она;
(R)-2-(1-ацетилпиперидин-4-иламино)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-((R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-1-оксопропан-2-иламино)-N-изопропилацетамида;
(R)-3-(4-хлорфенил)-2-(диметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(2-морфолиноэтиламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(изопропиламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-((S)-4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилпиперазин-1-ил)-2-(изопропиламино)пропан-1-она;
2-((R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-1-оксопропан-2-иламино)-N,N-диметилацетамида;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(1,4-оксазепан-4-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(1,4-оксазепан-4-ил)пропан-1-она;
(R)-2-(4-хлор-2-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-хлор-2-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(2-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(циклогексиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(циклогексиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метоксициклогексиламино)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((S)-тетрагидрофуран-3-иламино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилтетрагидро-2H-пиран-4-иламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(2-(тетрагидро-2H-пиран-4-ил)этиламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(3,3,3-трифторпропиламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-((тетрагидро-2H-пиран-4-ил)метиламино)пропан-1-она;
(R)-3-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(изопропил(метил)амино)пропан-1-она;
(S)-3-(трет-бутиламино)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(трет-бутиламино)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(R)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-морфолинопропан-1-она;
(R)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(R)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(S)-3-(циклопропилметиламино)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-(циклопропилметиламино)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-2-(4-(трифторметил)фенил)пропан-1-она;
(S)-3-амино-2-(4-бромфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-амино-2-(4-хлор-3-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
3-((S)-2-(4-хлорфенил)-3-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-оксопропиламино)пропанамида;
3-((S)-2-(4-хлорфенил)-3-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-оксопропиламино)пропанамида;
(4-(4-хлорфенил)пиперидин-4-ил)(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)метанона;
(S)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-3-амино-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-амино-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(3,4-дихлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-3-амино-2-(3,4-дихлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(3,4-дихлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(S)-2-(3,4-дихлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(R)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(S)-2-(3,5-дифторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-3-((R)-3-аминопирролидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-((R)-3-аминопирролидин-1-ил)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-морфолинопропан-1-она;
(R)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-морфолинопропан-1-она;
(S)-3-(4-этилпиперазин-1-ил)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(4-этилпиперазин-1-ил)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-(4-ацетилпиперазин-1-ил)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-3-(4-ацетилпиперазин-1-ил)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(3,4-дихлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-бромфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-3-(циклопропилметиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-(бис(циклопропилметил)амино)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-3-(циклопропилметиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-бромфенил)-3-((циклопропилметил)(метил)амино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-(циклопропилметиламино)-2-(3,4-дихлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)-2-(4-(трифторметокси)фенил)пропан-1-она;
(R)-2-(4-хлорфенил)-3-((3S,5R)-3,5-диметилпиперазин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-хлорфенил)-3-((2S,6R)-2,6-диметилморфолино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-((2S,6R)-2,6-диметилморфолино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-((3S,5R)-3,5-диметилпиперазин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(R)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(R)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-метилпиперазин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(R)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(S)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(4-(трифторметокси)фенил)пропан-1-она;
(S)-3-амино-2-(4-бром-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-амино-2-(4-бром-3-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(3,4-дихлорфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-бром-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-бром-3-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-бром-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-бром-3-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-бром-3-фторфенил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бром-3-фторфенил)-3-(циклопропилметиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-изопропилпиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(S)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(4-(трифторметил)фенил)пропан-1-она;
(S)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)-2-(4-(трифторметил)фенил)пропан-1-она;
(S)-3-(циклопропилметиламино)-2-(2-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(R)-2-(4-бром-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(4-гидроксипиперидин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропил(метил)амино)пропан-1-она;
(S)-3-амино-2-(4-бром-2-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-амино-2-(4-бром-2-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропил(метил)амино)пропан-1-она;
(S)-2-(4-бром-2-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(4-бром-2-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-3-амино-2-(4-хлор-2-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
2-(4-хлорфенил)-3-((3S,4R)-4-(диметиламино)-3-фторпиперидин-1-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бром-2-фторфенил)-3-(циклопропилметиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-(трет-бутиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(4-(трифторметил)фенил)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлор-2-фторфенил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бром-2-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлор-2-фторфенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(4-хлор-2-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)-2-(4-(трифторметил)фенил)пропан-1-она;
(S)-3-(циклопропилметиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-2-(4-(трифторметил)фенил)пропан-1-она;
(S)-2-(4-бромфенил)-3-(трет-бутиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изобутиламино)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-3-(циклопентилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлор-3-фторфенил)-3-(циклопентиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(2-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропил(метил)амино)пропан-1-она;
(S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-((2-гидроксиэтил)(изопропил)амино)пропан-1-она;
(S)-2-(2-фтор-4-(трифторметил)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(2-фтор-4-(трифторметил)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-3-амино-2-(2-фтор-4-(трифторметил)фенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-(циклопропилметиламино)-2-(3-фтор-4-(трифторметил)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-3-(циклопропилметиламино)-2-(3-фтор-4-(трифторметокси)фенил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-3-(4,4-диметилциклогексиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-бромфенил)-3-(3,3-диметилциклогексиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(4,4-диметилциклогексиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(4-хлорфенил)-3-(3,3-диметилциклогексиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)-2-(тиофен-2-ил)пропан-1-она;
(S)-2-(5-бромтиофен-2-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(5-бромтиофен-2-ил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(5-бромтиофен-2-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(R)-2-(5-бромпиридин-2-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(5-бромпиридин-2-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(5-бромтиофен-2-ил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(5-бромтиофен-2-ил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(5-хлортиофен-2-ил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(5-хлортиофен-2-ил)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она;
(S)-2-(5-хлортиофен-2-ил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пропан-1-она;
(S)-2-(5-хлортиофен-2-ил)-3-(циклопропилметиламино)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она;
(S)-2-(5-хлортиофен-2-ил)-3-(циклопропилметиламино)-1-(4-((5R,7S)-7-гидрокси-5-метил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)пропан-1-она и
их солей.
Другой вариант осуществления включает ингибиторы AKT формулы I, включающие соединения:
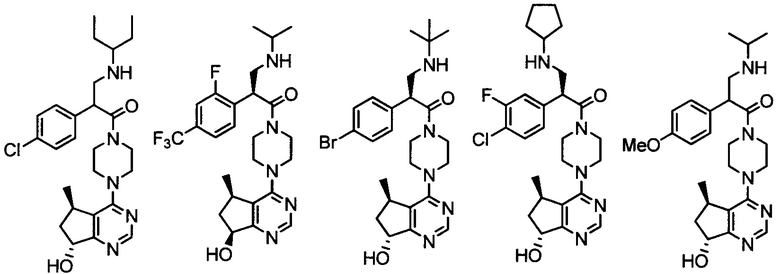
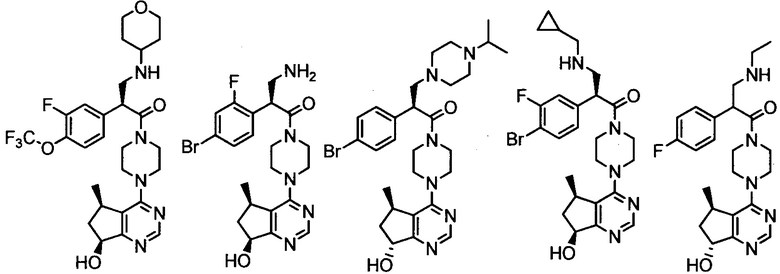
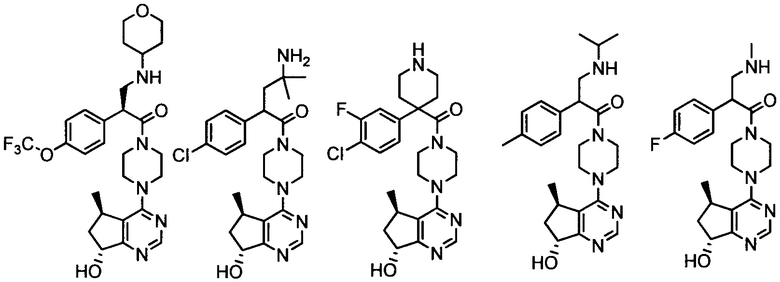
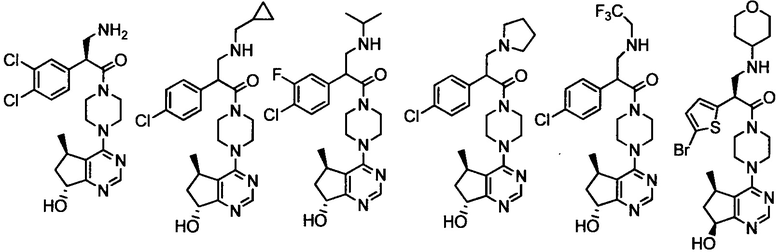
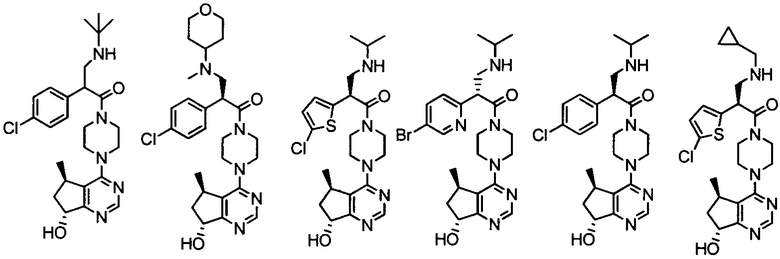
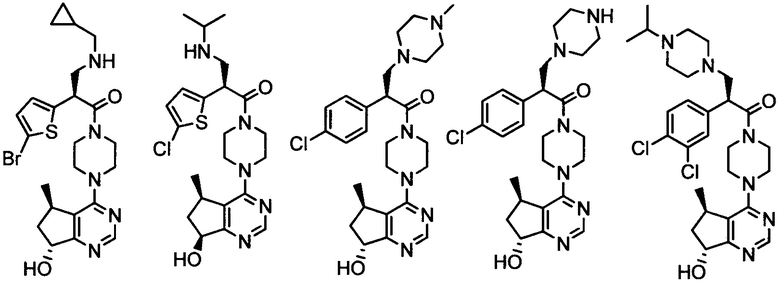
и их соли.
Получение соединений формулы I
Соединения формулы I могут быть получены согласно способам, описанным в опубликованной патентной заявке США 2008/0051399 (патентная заявка США 11/773949, поданная 5 июля 2007 года, озаглавленная "Hydroxylated and Methoxylated Pyrimidyl Cyclopentanes as AKT Protein Kinase Inhibitors"), которая включена в настоящее описание посредством ссылки во всех отношениях.
Соединения формулы I могут быть получены по отдельности или в виде библиотек соединений, включающих по меньшей мере 2, например, 5-1000 соединений или 10-100 соединений. Библиотеки соединений формулы I могут быть получены способом комбинаторного "расщепления и смешивания" или с помощью множественных параллельных синтезов при использовании жидкофазной или твердофазной химии.
В иллюстративных целях на схемах 1-4 показан общий способ получения соединений формулы I, а также ключевых промежуточных соединений. Специалисты в данной области смогут оценить, что могут быть использованы другие пути синтеза. Хотя определенные исходные соединения и реагенты изображены на схемах и обсуждаются ниже, другие исходные вещества и реагенты могут с легкостью использоваться вместо них, обеспечивая получение различных производных и/или условия реакции. Кроме того, многие из соединений, полученных описанными ниже способами, могут быть дополнительно изменены согласно настоящему описанию, с использованием стандартной химии, известной специалистам в данной области техники.
Схема 1
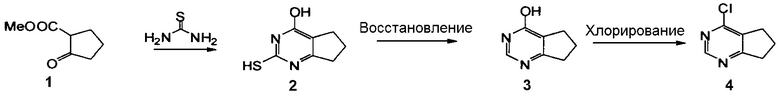
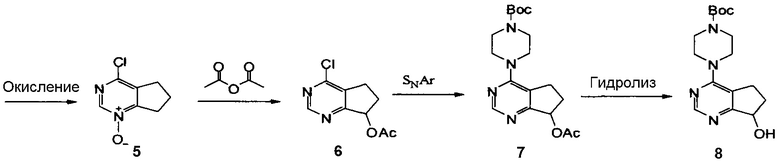
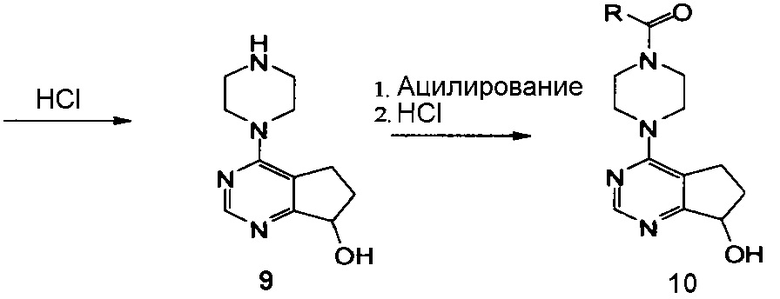
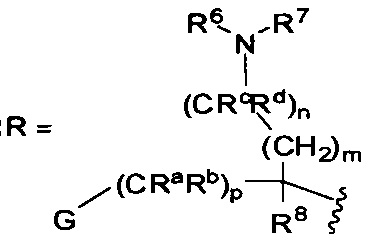
На схеме 1 показан способ получения соединения 10 формулы I, где R1 представляет собой H, R2 представляет собой OH, и R5 представляет собой H. Образование пиримидина 2 может быть осуществлено взаимодействием кетоэфира 1 с тиомочевиной в присутствии основания, такого как KOH, в соответствующем растворителе, таком как этанол. После восстановления меркаптогруппы соединения 2 в стандартных восстанавливающих условиях (например, Ni Ренея и NH4OH) с получением соединения 3, гидроксипиримидин 3 может быть подвергнут хлорированию в стандартных условиях (например, POCl3 в DIEA/DCE), с получением соединения 4. Затем соединение 4 окисляют в стандартных условиях (например, MCPBA в соответствующем растворителе, таком как CHCl3), с получением пиримидиноксида 5. Обработка пиримидиноксида уксусным ангидридом дает продукт перегруппировки 6. Соединение 7 получают взаимодействием соединения 6 с подходящим образом замещенным пиперидином в стандартных условиях реакции SNAr, с получением соединения 7. Соединение 7 подвергают гидролизу с получением соединения 8, с которого затем снимают защиту, с получением промежуточного соединения 9. Ацилирование пиперазинилциклопента[d]пиримидина 9 соответствующей аминокислотой в присутствии сшивающего реагента, такого как HBTU, с последующим снятием защиты в случае необходимости, приводит к соединению 10 формулы I.
Схема 2
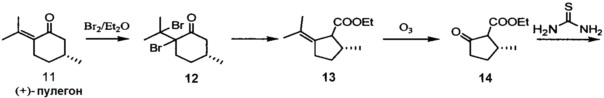
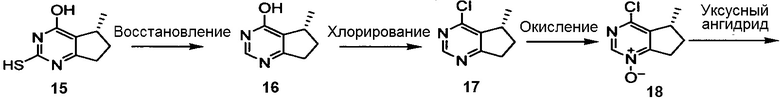
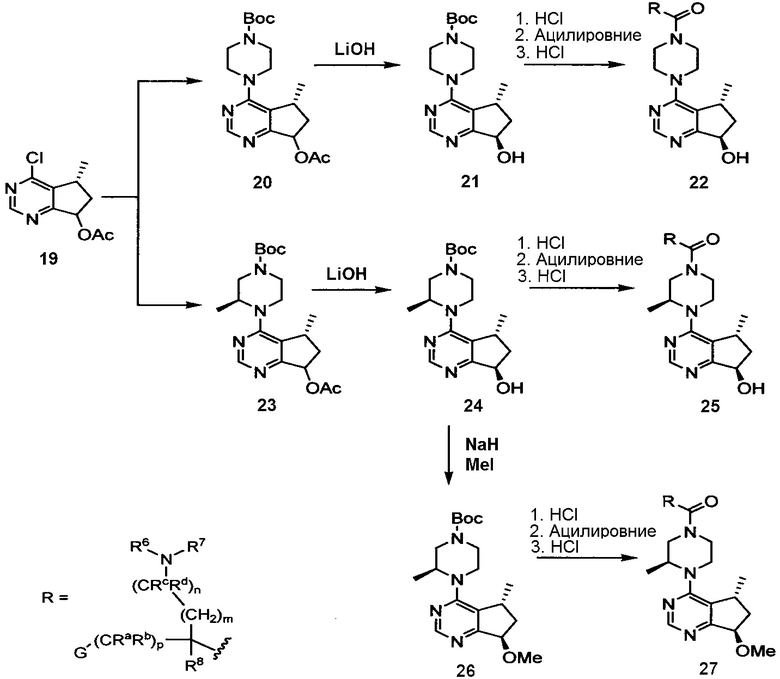
На схеме 2 показан способ получения соединений 22, 25 и 27 формулы I, где R1, R2 и R5 представляют собой метил. Согласно схеме 2, бромирование (+)-пулегона 11 бромом дает дибромид 12. Обработка дибромида 12 основанием, таким как этилат натрия, приводит к пулегенату 13. Озонолиз пулегената 13 дает кетоэфир 14. Обработка кетоэфира 14 тиомочевиной в присутствии основания, такого как KOH в этаноле, с последующим восстановлением меркаптогруппы в нормальных условиях (например, катализатор Ni Ренея в аммиаке), приводит к гидроксипиримидину 16. Хлорирование гидроксипиримидина 16 при нормальных условиях (например, POCl3) дает 4-хлорпиримидин 17. Окисление 4-хлорпиримидина 17 окислителем, таким как MCPBA или пероксид водорода, дает N-оксид 18. Перегруппировка N-оксида 18 в присутствии уксусного ангидрида приводит к получению промежуточного соединения 19. Соединение 19 подвергают взаимодействию с требуемым пиперазином согласно методике, описанной на схеме 1, с получением соединения 20, где R5 представляет собой H, и 23, где R5 представляет собой Me. Соединения 20 и 23 подвергают хиральному разделению, используя ВЭЖХ с хиральной неподвижной фазой, и последующему гидролизу при обработке основанием, таким как гидроксид лития, с получением соединений 21 и 24, соответственно. После снятия защиты, соединения 21 и 24 подвергают взаимодействию с соответствующей аминокислотой, с получением соединений 22 и 25, соответственно.
Альтернативно, 7-гидроксигруппа соединения 24 может быть алкилирована алкилирующим реагентом, таким как алкилгалогенид, в присутствии основания, такого как NaH или KOH, с получением соединения 26, в котором R2 представляет собой Me. После снятия защиты, соединение 26 подвергают взаимодействию с соответствующей аминокислотой, с получением соединения 27.
Схема 3
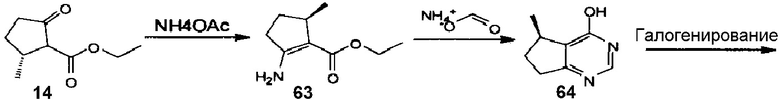
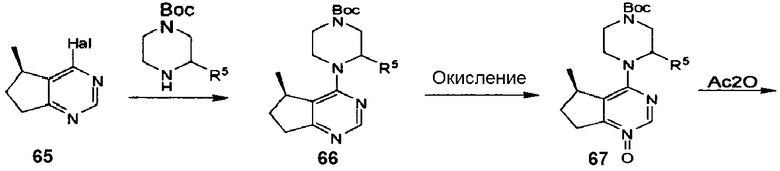
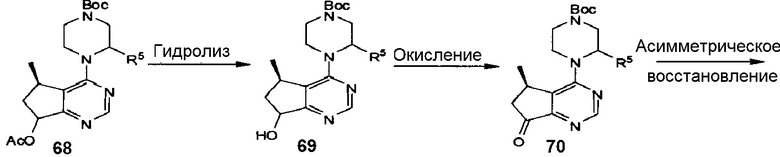
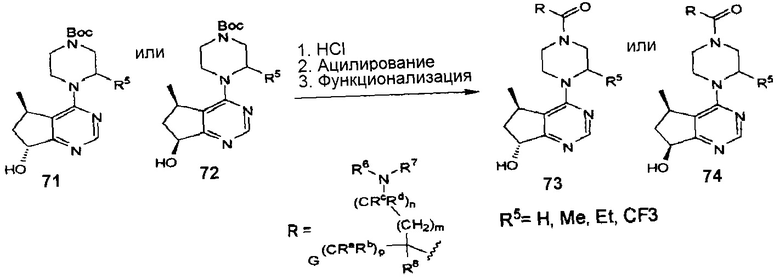
На схеме 3 показан альтернативный способ получения соединений 73 и 74. Согласно схеме 3, аминирование соединения 14 с использованием синтона аммиака дает соединение 63. Образование пиримидина при использовании, например, формиата аммония в присутствии формамида при 50°C-250°C и/или при высоком давлении дают бициклическую единицу соединения 64. Активация соединения 64 при использовании, например, POCl3 или SOCl2, дает активированный пиримидин 65. Вытеснение данной уходящей группы при использовании подходящего защищенного/замещенного пиперидина при температуре от 0°C до 150°C дает пиперидин 66. Окисление с использованием, например, м-хлорпероксибензойной кислоты ("MCPBA" или "mCPBA") или Oxone® при температуре от -20°C до 50°C дает N-оксид 67. Обработка ацилирующим агентом (например, уксусным ангидридом), с последующим нагреванием (40°C-200°C), вызывает перегруппировку с образованием соединения 68. Гидролиз с использованием, например, LiOH или NaOH при температуре 0°C-50°C, дает спирт 69. Окисление с использованием, например, условий Сверна, MnO4 или комплекса пиридин-SO3 при соответствующих температурах, дают кетон 70. Асимметричное восстановление с использованием, например, каталитического количества хирального катализатора в присутствии водорода, катализатора CBS или борогидридного восстановителя в присутствии хирального лиганда, приводит к (R) или (S) стереохимии в спирте 71 или 72. Альтернативно, можно использовать нехиральный восстановитель (например, H2, Pd/C), что дает возможность метильной группе на циклопентановой группе обеспечить фациальную селективность и, в конечном счете, диастереоселективность. Если восстановление дает более низкую диастереоселективность, диастереомеры могут быть разделены (например) хроматографией, кристаллизацией или получением производных. Наконец, снятие защитной Boc-группы с использованием, например, кислоты при 0°C-50°C, ацилирование с использованием требуемого производного аминокислоты и конечная функционализация амина данной аминокислоты (например, удаление любой блокирующей группы, алкилирование, восстановительное аминирование или ацилирование, с введением новых заместителей), приводит к получению конечных соединений 73 и 74.
Схема 4
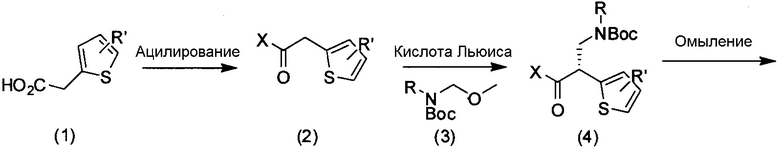
Введение хирального вспомогательного агента (например, оксазолидинона Эванса и т.д.) в соединение (1) может быть достигнуто с помощью стандартных методик ацилирования, с получением конъюгата (2). Например, обработка кислоты активирующим агентом (например, COCl2) или образование смешанного ангидрида (например, 2,2-диметилпропаноилхлорида) в присутствии амина в качестве основания при температуре от -20°C до 100°C, с последующей обработкой подходящим хиральным вспомогательным агентом (X) дает соединение (2). Стереохимия и выбор хирального вспомогательного агента могут определять стереохимию заново создаваемого хирального центра и диастереоселективность. Обработка соединения (2) кислотой Льюиса (например, TiCl4) при низкой температуре (например, от -20°C до -100°C) и аминным основанием (например, основанием Хунига), с последующим использованием подходящим образом замещенного предшественника иона иминия (3) при низкой температуре, приводит затем к получению соединения (4). Температура, кислота Льюиса и хиральный вспомогательный агент, как можно ожидать, будут влиять на диастереоселективность аддукта. Наконец, омыление в мягких условиях (например, LiOH/H2O при температуре от -10°C до 30°C) приводит к образованию требуемой кислоты (5).
В другом варианте осуществления ингибитор AKT киназы представляет собой АТФ-конкурентный пан-AKT ингибитор формулы II:
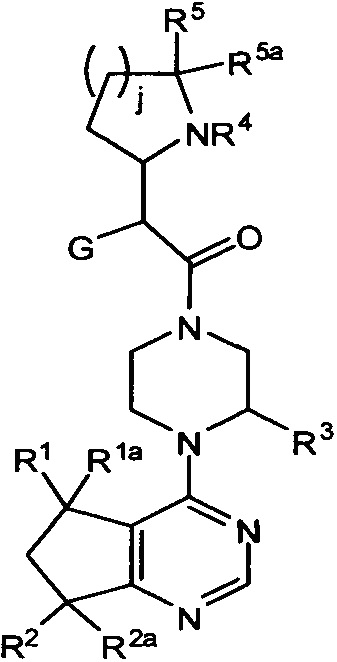 II
II
и его стереоизомеры, таутомеры или фармацевтически приемлемые соли, где:
G представляет собой фенил, необязательно замещенный одной-тремя группами Ra, или 5-6-членный гетероарил, необязательно замещенный галогеном;
R1 и R1a независимо выбраны из H, Me, CF3, CHF2 или CH2F;
R2 представляет собой H, F или -OH;
R2a представляет собой H;
R3 представляет собой H;
R4 представляет собой H или C1-C4алкил, необязательно замещенный F, -OH или -O(C1-C3алкилом);
R5 и R5a независимо выбраны из H и C1-C4алкила, или R5 и R5a, вместе с атомом, к которому они присоединены, образуют 5-6-членный циклоалкил или 5-6-членный гетероцикл, где гетероцикл содержит гетероатом кислорода;
каждый Ra независимо представляет собой галоген, C1-C6алкил, C3-C6циклоалкил, -O-(C1-C6алкил), CF3, -OCF3, С(C1-C6алкил), CN, -OCH-фенил, NH2, -NO2, -NH-(C1-C6алкил), -N-(C1-C6алкил)2, пиперидин, пирролидин, CH2F, CHF2, -OCH2F, -OCHF2, -OH, -SO2(C1-C6алкил), C(O)NH2, C(O)NH(C1-C6алкил) и C(O)N(C1-C6алкил)2; и
j равен 1 или 2.
Другой вариант осуществления включает соединения ингибиторы AKT, включающие:
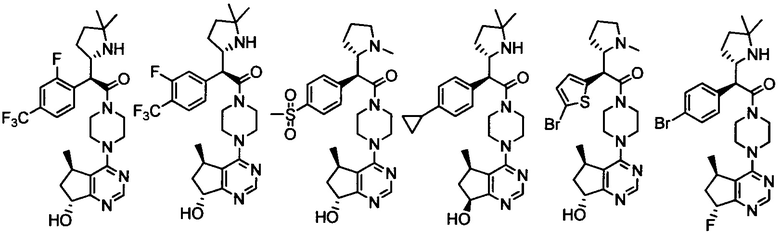

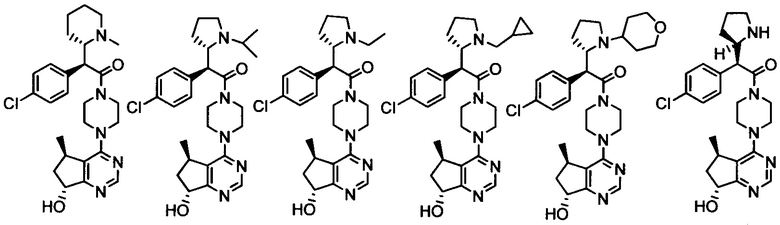
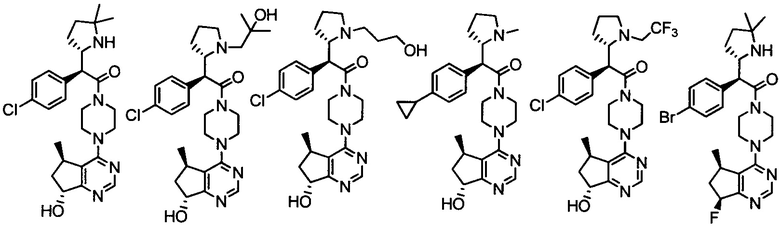 .
.
В одном варианте осуществления ингибитором AKT является соединение указанных выше формул, выбранных из GDC-0068.
Соединения формулы II могут быть получены согласно способам, описанным в WO 2009006567, которая включена в настоящее описание посредством ссылки во всех отношениях.
В одном варианте осуществления ингибитор AKT представляет собой аллостерический ингибитор AKT формулы III:
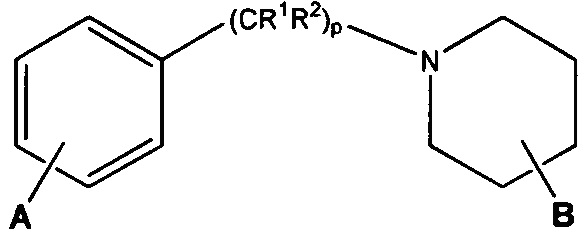 III
III
где R1 и R2 независимо являются водородом, C1-C5алкилом, гидроксилом, C1-5алкокси или амином; p равен целому числу от 1 до 6; A представляет собой карбоцикл, содержащий 5-14 атомов углерода, бициклическое или трициклическое, ароматическое или гетероароматическое кольцо, которое необязательно может быть замещено галогеном, OH, амино, диалкиламино, моноалкиламино, C1-C6алкилом или фенилом, необязательно замещенным галогеном, OH, C1-C3алкилом или циклопропилметилом; и в одном варианте осуществления A имеет одну из следующих структур:
 и
и  ,
,
где D и E независимо представляют собой -CH или N;
где каждый из R3 и R4 независимо представляет собой водород, галоген, OH, амино, диалкиламино, моноалкиламино или C1-C6алкил, необязательно замещенный галогеном, OH, C1-C3алкилом или циклопропилметилом;
R5 представляет собой 5- или 6-членное ароматическое или гетероароматическое кольцо, необязательно замещенное галогеном, OH, амино, диалкиламино, моноалкиламино или C1-C6алкилом, который необязательно замещен галогеном, OH, C1-C3алкилом или циклопропилметилом; в одном варианте осуществления R5 является фенилом;
B представляет собой ароматическое, гетероароматическое, циклическое или гетероциклическое кольцо, имеющее формулу:
 ,
,
где каждый Q, T, X и Y независимо выбран из группы, состоящей из -CH, -CH2, C=O, N или O;
Z представляет собой -CH, -CH2, C=O, N, O или -C=C-;
R6 и R7 независимо выбраны из группы, состоящей из водорода, галогена, карбонила и 5- или 6-членного ароматического или гетероароматического кольца, которое необязательно замещено галогеном, OH, амино, диалкиламино, моноалкиламино или C1-C6алкилом, необязательно замещенным галогеном, OH, C1-C3алкилом или циклопропилметилом; в одном варианте осуществления R6 или R7 представляет собой пиридинил, или R6 и R7, взятые вместе, образуют 5-6-членное ароматическое, гетероароматическое, циклическое или гетероциклическое кольцо, которое необязательно может быть замещено галогеном, OH, амино, диалкиламино, моноалкиламино или C1-C6алкилом, необязательно замещенным галогеном, OH, C1-C3алкилом или циклопропилметилом; в одном варианте осуществления B имеет одну из следующих структур:
 и
и  ,
,
где X, Y, Q, R6 и R7 являются такими, как описано выше, а X', Q' и T' представляют собой -CH или N.
Другой вариант осуществления включает аллостерический ингибитор AKT, имеющий формулу:
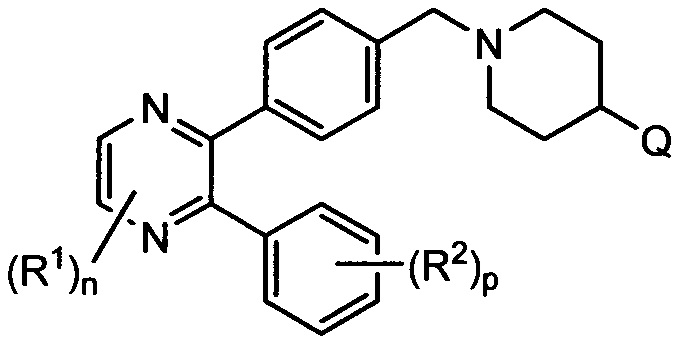 ,
,
где a равен 0 или 1; b равен 0 или 1; m равен 0, 1 или 2; n равен 0, 1 или 2; p равен 0, 1 или 2; r равен 0 или 1; s равен 0 или 1;
Q выбран из -NR7R8,
 и
и  ;
;
R1 независимо выбран из (C=O)aObC1-C6алкила, (C=O)aObарила, C2-C6алкенила, C2-C6алкинила, (C=O)aObгетероциклила, (C=O)aObC3-C6циклоалкила, CO2H, галогена, CN, OH, ObC1-C6перфторалкила, Oa(C=O)bNR7R8, NRc(C=O)NR7R8, S(O)mRa, S(O)2NR7R8, NRcS(O)mRa, оксо, CHO, NO2, NRc(C=O)ObRa, O(C=O)ObC1-C6алкила, O(C=O)ObC3-C6циклоалкила, O(C=O)Obарила и O(C=O)Ob-гетероцикла, где указанные алкил, арил, алкенил, алкинил, гетероциклил и циклоалкил необязательно замещены одним или более заместителями, выбранными из Rz;
R2 независимо выбран из C1-C6алкила, арила, гетероциклила, CO2H, галогена, CN, OH и С(O)2NR7R8, где указанные алкил, арил и гетероциклил необязательно замещены одним, двумя или тремя заместителями, выбранными из Rz;
R7 и R8 независимо выбраны из H, (C=O)ObC1-C10алкила, (C=O)ObC3-C8циклоалкила, (C=O)Obарила, (C=O)Obгетероциклила, C1-C10алкила, арила, C2-C10алкенила, C2-C10алкинила, гетероциклила, C3-C8циклоалкила, SO2Ra и (C=O)NRb2, где указанные алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил необязательно замещены одним или более заместителями, выбранными из Rz, или
R7 и R8, взятые вместе азотом, к которому они присоединены, могут образовывать моноциклический или бициклический гетероцикл с 5-7 членами в каждом кольце, необязательно содержащий, в дополнение к азоту, один или два дополнительных гетероатома, выбранных из N, O и S, где указанный моноциклический или бициклический гетероцикл необязательно замещен одним или более заместителями, выбранными из Rz;
Rz выбран из: (C=O)rOs(C1-C10)алкила, Or(C1-C3)перфторалкила, (C0-C6)алкилен-S(O)mRa, оксо, OH, галогена, CN, (C=O)rOs(C2-C10)алкенила, (C=O)rOs(C2-C10)алкинила, (C=O)rOs(C3-C6)циклоалкила, (C=O)rOs(C0-C6)алкиленарила, (C=O)rOs(C0-C6)алкиленгетероциклила, (C=O)rOs(C0-C6)алкилен-N(Rb)2, C(O)Ra, (C0-C6)алкилен-CO2Ra, C(O)H, (C0-C6)алкилен-CO2H, C(O)N(Rb)2, S(O)mRa и S(O)2N(Rb)2NRc(C=O)ObRa, O(C=O)ObC1-C10алкила, O(C=O)ObC3-C8циклоалкила, O(C=O)Obарила и O(C=O)Obгетероцикла, где указанные алкил, алкенил, алкинил, циклоалкил, арил и гетероциклил необязательно замещены тремя заместителями, выбранными из Rb, OH, (C1-C6)алкокси, галогена, CO2H, CN, O(C=O)C1-C6алкила, оксо и N(Rb)2;
Ra представляет собой (C1-C6)алкил, (C3-C6)циклоалкил, арил или гетероциклил; и
Rb представляет собой H, (C1-C6)алкил, арил, гетероциклил, (C3-C6)циклоалкил, (C=O)OC1-C6алкил, (C=O)C1-C6алкил или S(O)2Ra;
Rc выбран из H, C1-C6алкила, арила, C2-C6алкенила, C2-C6алкинила, гетероциклила, C3-C8циклоалкила и C1-C6перфторалкила, где указанные алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил необязательно замещены одним или более заместителями, выбранными из Rz;
или его фармацевтически приемлемую соль или стереоизомер.
Другой вариант осуществления включает аллостерический ингибитор AKT, имеющий формулу:
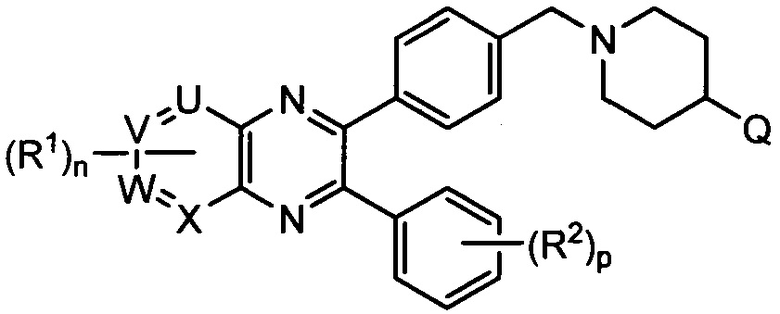 ,
,
где a равен 0 или 1; b равен 0 или 1; m равен 0, 1 или 2; n равен 0, 1, 2 или 3; p равен 0, 1 или 2; r равен 0 или 1; s равен 0 или 1; u, v, w и x независимо выбраны из CH и N, при условии, что только один из u, v, w и x может быть N;
Q выбран из -NR5R6,
 и
и  ;
;
R1 независимо выбран из (C=O)aObC1-C6алкила, (C=O)aObарила, C2-C6алкенила, C2-C6алкинила, (C=O)aObгетероциклила, (C=O)aObC3-C6циклоалкила, CO2H, галогена, CN, OH, ObC1-C6перфторалкила, Oa(C=O)bNR7R8, NRc(C=O)NR7R8, S(O)mRa, S(O)2NR7R8, NRcS(O)mRa, оксо, CHO, NO2, NRc(C=O)ObRa, O(C=O)ObC1-C6алкила, O(C=O)ObC3-C6циклоалкила, O(C=O)Obарила и O(C=O)Obгетероцикла, где указанные алкил, арил, алкенил, алкинил, гетероциклил и циклоалкил необязательно замещены одним или более заместителями, выбранными из Rz;
R2 независимо выбран из C1-C6алкила, арила, гетероциклила, CO2H, галогена, CN, OH и S(O)2NR7R8, где указанные алкил, арил и гетероциклил необязательно замещены одним, двумя или тремя заместителями, выбранными из Rz;
R7 и R8 независимо выбраны из H, (C=O)ObC1-C10алкила, (C=O)ObC3-C8циклоалкила, (C=O)Obарила, (C=O)Obгетероциклила, C1-C10алкила, арила, C2-C10алкенила, C2-C10алкинила, гетероциклила, C3-C8циклоалкила, SO2Ra и (C=O)NRb2, где указанные алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил необязательно замещены одним или более заместителями, выбранными из Rz, или
R7 и R8, взятые вместе с атомом азота, к которому они присоединены, могут образовывать моноциклический или бициклический гетероцикл с 5-7 членами в каждом кольце, необязательно содержащий, в дополнение к азоту, один или два дополнительных гетероатома, выбранных из N, O и S, где указанный моноциклический или бициклический гетероцикл необязательно замещен одним или более заместителями, выбранными из Rz;
Rz выбран из (C=O)rOs(C1-C10)алкила, Or(C1-C3)перфторалкила, (C0-C6)алкилен-S(O)mRa, оксо, OH, галогена, CN, (C=O)rOs(C2-C10)алкенила, (C=O)rOs(C2-C10)алкинила, (C=O)rOs(C3-C6)циклоалкила, (C=O)rOs(C0-C6)алкиленарила, (C=O)rOs(C0-C6)алкиленгетероциклила, (C=O)rOs(C0-C6)алкилен-N(Rb)2, C(O)Ra, (C0-C6)алкилен-CO2Ra, C(O)H, (C0-C6)алкилен-CO2H, C(O)N(Rb)2, S(O)mRa и S(O)2N(Rb)2NRc(C=O)ObRa, O(C=O)ObC1-C10алкила, O(C=O)ObC3-C8циклоалкила, O(C=O)Obарила и O(C=O)Obгетероцикла, где указанные алкил, алкенил, алкинил, циклоалкил, арил и гетероциклил необязательно замещены тремя заместителями, выбранными из Rb, OH, (C1-C6)алкокси, галогена, CO2H, CN, O(C=O)C1-C6алкила, оксо и N(Rb)2;
Ra представляет собой (C1-C6)алкил, (C3-C6)циклоалкил, арил или гетероциклил; и
Rb представляет собой H, (C1-C6)алкил, арил, гетероциклил, (C3-C6)циклоалкил, (C=O)OC1-C6алкил, (C=O)C1-C6алкил или S(O)2Ra;
Rc выбран из H, C1-C6алкила, арила, C2-C6алкенила, C2-C6алкинила, гетероциклила, C3-C8циклоалкила и C1-C6перфторалкила, где указанные алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил необязательно замещены одним или более заместителями, выбранными из Rz;
или его фармацевтически приемлемую соль или стереоизомер.
Другой вариант осуществления включает аллостерический ингибитор AKT, имеющий формулу:
 ,
,
где a равен 0 или 1; b равен 0 или 1; m равен 0, 1 или 2; n равен 0, 1, 2 или 3; p равен 0, 1 или 2; r равен 0 или 1; s равен 0 или 1; u, v, и x независимо выбраны из CH и N; W является связью, CH или N;
Q выбран из -NR5R6,
 и
и  ;
;
R1 независимо выбран из (C=O)aObC1-C6алкила, (C=O)aObарила, C2-C6алкенила, C2-C6алкинила, (C=O)aObгетероциклила, (C=O)aObC3-C6циклоалкила, CO2H, галогена, CN, OH, ObC1-C6перфторалкила, Oa(C=O)bNR7R8, NRc(C=O)NR7R8, S(O)mRa, S(O)2NR7R8, NRcS(O)mRa, оксо, CHO, NO2, NRc(C=O)ObRa, O(C=O)ObC1-C6алкила, O(C=O)ObC3-C6циклоалкила, O(C=O)Obарила и O(C=O)Obгетероцикла, где указанные алкил, арил, алкенил, алкинил, гетероциклил и циклоалкил необязательно замещены одним или более заместителями, выбранными из Rz;
R2 независимо выбран из C1-C6алкила, арила, гетероциклила, CO2H, галогена, CN, OH и S(O)2NR7R8, где указанные алкил, арил и гетероциклил необязательно замещены одним, двумя или тремя заместителями, выбранными из Rz;
R7 и R8 независимо выбраны из H, (C=O)ObC1-C10алкила, (C=O)ObC3-C8циклоалкила, (C=O)Obарила, (C=O)Obгетероциклила, C1-C10алкила, арила, C2-C10алкенила, C2-C10алкинила, гетероциклила, C3-C8циклоалкила, SO2Ra и (C=O)NRb2, где указанные алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил необязательно замещены одним или более заместителями, выбранными из Rz, или
R7 и R8, взятые вместе с атомом азота, к которому они присоединены, могут образовывать моноциклический или бициклический гетероцикл с 5-7 членами в каждом кольце, необязательно содержащий, в дополнение к азоту, один или два дополнительных гетероатома, выбранных из N, O и S, где указанный моноциклический или бициклический гетероцикл необязательно замещен одним или более заместителями, выбранными из Rz;
Rz выбран из (C=O)rOs(C1-C10)алкила, Or(C1-C3)перфторалкила, (C0-C6)алкилен-S(O)mRa, оксо, OH, галогена, CN, (C=O)rOs(C2-C10)алкенила, (C=O)rOs(C2-C10)алкинила, (C=O)rOs(C3-C6)циклоалкила, (C=O)rOs(C0-C6)алкиленарила, (C=O)rOs(C0-C6)алкиленгетероциклила, (C=O)rOs(C0-C6)алкилен-N(Rb)2, C(O)Ra, (C0-C6)алкилен-CO2Ra, C(O)H, (C0-C6)алкилен-CO2H, C(O)N(Rb)2, S(O)mRa и S(O)2N(Rb)2NRc(C=O)ObRa, O(C=O)ObC1-C10алкила, O(C=O)ObC3-C8циклоалкила, O(C=O)Obарила и O(C=O)Obгетероцикла, где указанные алкил, алкенил, алкинил, циклоалкил, арил и гетероциклил необязательно замещены тремя заместителями, выбранными из Rb, OH, (C1-C6)алкокси, галогена, CO2H, CN, O(C=O)C1-C6алкила, оксо и N(Rb)2;
Ra представляет собой (C1-C6)алкил, (C3-C6)циклоалкил, арил или гетероциклил; и
Rb представляет собой H, (C1-C6)алкил, арил, гетероциклил, (C3-C6)циклоалкил, (C=O)OC1-C6алкил, (C=O)C1-C6алкил или S(O)2Ra;
Rc выбран из H, C1-C6алкила, арила, C2-C6алкенила, C2-C6алкинила, гетероциклила, C3-C8циклоалкила и C1-C6перфторалкила, где указанные алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил необязательно замещены одним или более заместителями, выбранными из Rz;
или его фармацевтически приемлемую соль или стереоизомер.
Другой вариант осуществления включает аллостерический ингибитор AKT, выбранный из:
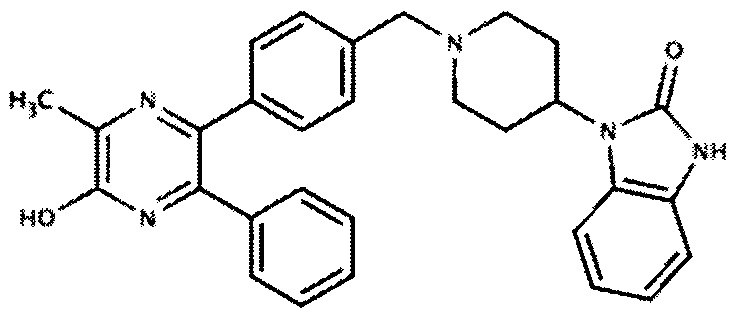
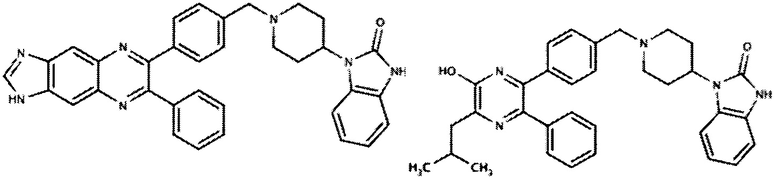
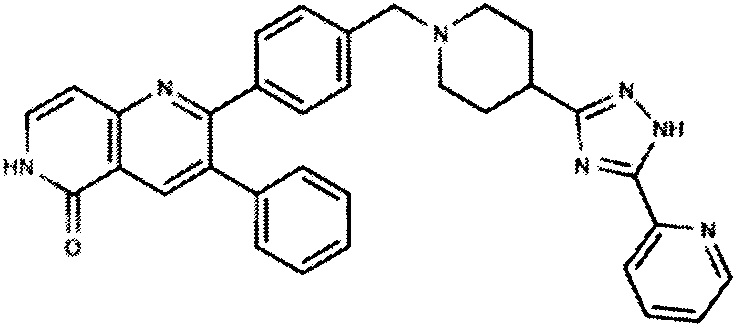
и их солей.
В одном варианте осуществления ингибитор киназы является селективным АТФ-конкурентным ингибитором AKT-1 и представляет собой соединение формулы IV:
 IV
IV
и его фармацевтически приемлемые соли, где
Ar выбран из арила, замещенного арила, гетероарила и замещенного гетероарила;
Q выбран из циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, арила, замещенного арила, гетероарила и замещенного гетероарила;
R1 и R2 независимо выбраны из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, гетероциклоалкила, замещенного гетероциклоалкила, арила, замещенного арила, гетероарила и замещенного гетероарила; или R1 и R2, вместе с атомом азота, к которому присоединены R1 и R2, образуют кольцо, выбранное из циклогетероалкила, замещенного циклогетероалкила, гетероарила и замещенного гетероарила;
p выбран из 2, 3, 4 и 5; и
q равен 0 или 1.
Соединения формулы IV включают:
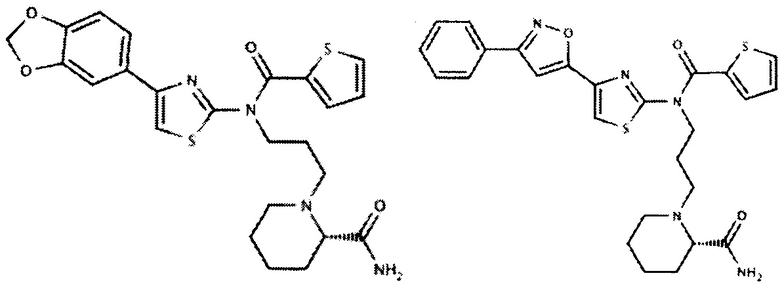 и их соли.
и их соли.
Другой вариант осуществления включает ингибиторы AKT, такие как перифосин, имеющий формулу:
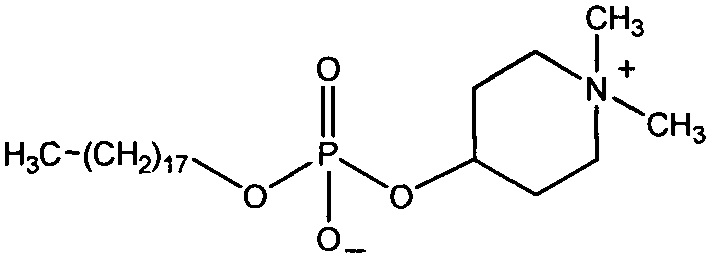 .
.
Другой вариант осуществления включает ингибиторы AKT, такие как антитела против AKT и против ДНК или РНК AKT.
Другой вариант осуществления включает ингибиторы AKT, имеющие формулу:
 ,
,
и их фармацевтически приемлемые соли.
Другой вариант осуществления включает ингибиторы AKT, такие как олигонуклеотиды, включающие антисмысловые олигонуклеотиды, имеющие последовательности: 5' ccagcccccaccagtccact 3' (SEQ ID NO:1), 5' cgccaaggagatcatgcagc 3' (SEQ ID NO:2), 5' gctgcatgatctccttggcg 3' (SEQ ID NO:3), 5' agatagctggtgacagacag 3' (SEQ ID NO:4), 5' cgtggagagatcatctgagg 3' (SEQ ID NO:5), 5' tcgaaaaggtcaagtgctac 3' (SEQ ID NO:6), 5' tggtgcagcggcagcggcag 3' (SEQ ID NO:7) и 5' ggcgcgagcgcgggcctagc 3' (SEQ ID NO:8).
Далее некоторые варианты осуществления изобретения будут проиллюстрированы следующими неограничивающими примерами.
Активирующие мутации в AKT1
Авторы обнаружили, что некоторые мутации в AKT1 могут приводить к нарушению взаимодействий между PH-доменом и киназным доменом AKT1. Разрыв между указанными доменами, вызываемый мутацией(ями), по-видимому, приводит к конститутивному фосфорилированию AKT1 и к конститутивной сигнализации AKT1. Указанные эффекты также допускают перерождение клеток. Эти мутации придают устойчивость к PI3K и аллостерическим ингибиторам Akt. Таким образом, присутствие подобных мутаций указывает, что эффективная дозировка PI3K и аллостерических ингибиторов Akt будет более высокой, а также указывает, что потребуется использовать другие ингибиторы помимо PI3K и/или аллостерических ингибиторов Akt, такие как конкурентные ингибиторы Akt.
AKT и взаимодействия PH и киназного домена изображены на фиг.1A и 1B. Авторами также представлены положения взаимодействий между PH и киназным доменом на фиг.1C.
Результаты, показывающие, что синтетические мутации на сайтах, которые, как полагают, прерывают взаимодействия PH домена с киназным доменом, приводят к конститутивному фосфорилированию Akt, показаны на фиг.2.
Соматические мутации, обнаруженные у больных раком, показаны на фиг.3.
Авторы обнаружили, что соматические мутации приводят к конститутивному фосфорилированию Akt, а также приводят к конститутивной сигнализации Akt (см. фиг.4).
Авторы также продемонстрировали, что мутанты Akt1 могут вызывать перерождение клеток (см. фиг.5).
Примечательно, что мутанты Akt1 придают устойчивость к PI3K ингибиторам и аллостерическим ингибиторам AKT. Данное открытие биомаркера, который показывает, какие схемы лечения были бы наиболее благоприятными для пациента, который имеет такой биомаркер, будет выгодным. Таким образом, такие мутации важны для диагностики рака и для определения требуемого терапевтического воздействия.
Дополнительно, мутации Akt также влияют на мембранную локализацию Akt с минимальной транслокацией в плазматическую мембрану.
В некоторых вариантах осуществления изобретения предложены молекулы нуклеиновой кислоты (например, молекулы ДНК или РНК), которые могут быть выделены или очищены, которые кодируют мутанты AKT, и аминокислотные последовательности мутантов AKT. В некоторых вариантах осуществления изобретения предложены способы применения таких мутантов для скрининга соединений, являющихся потенциальными ингибиторами AKT.
Мутации, приводящие к конститутивной активации AKT
Протеинкиназа AKT, ключевой регулятор выживания и пролиферации клеток, часто гиперактивирована в раковых опухолях человека. Внутримолекулярные взаимодействия плекстрин-гомологичного (PH) домена и киназного домена (KD) важны для поддержания AKT в неактивном состоянии. Активация AKT происходит после конформационного изменения, которое вызывает отделение PH от киназного домена. С целью изучения таких аутоингибирующих взаимодействий, в интерфейс PH-KD были введены мутации, и было обнаружено, что большинство подобных мутаций вызывает конститутивную активацию AKT. Такие мутации, вероятно, являются другим механизмом, по которому активация может происходить в раковых опухолях и при других заболеваниях у человека. В поддержку данного предположения, в интерфейсе PH-KD AKT1 были обнаружены соматические мутации, которые не были описаны ранее в раковых опухолях человека. Более того, соматические мутанты AKT1 являются конститутивно активными, что приводит к онкогенной сигнализации. Дополнительно, мутанты AKT1 не ингибируются эффективно аллостерическими ингибиторами AKT, что согласуется с потребностью в интактном интерфейсе PH-KD для аллостерического ингибирования. Представленные результаты имеют важное значение для терапевтического вмешательства у пациентов с мутациями AKT в интерфейсе PH-KD.
В данном исследовании был проведен систематический анализ для изучения эффектов от нарушения взаимодействия PH-KD на активацию AKT. Разрыв междоменных контактов при мутации остатков в интерфейсе PH-KD приводит к активации AKT. С учетом этого, большое количество человеческих опухолей было секвенировано с целью определения, встречаются ли в раковых опухолях мутации в участках контакта PH-KD. Что примечательно, было обнаружено, что человеческие опухоли, которые несут мутации в AKT в данных участках, указывающие на нарушение взаимодействий PH-KD, являются важным механизмом активации AKT в раковых образованиях. Указанные опухолеспецифические соматические мутации исследовали на активность, при этом было показано, что они являются онкогенными. Кроме того, ингибиторы AKT протестировали против данных мутантов, и АТФ-конкурентные ингибиторы оказались более эффективными по сравнению с аллостерическими ингибиторами AKT.
Нарушение контактов PH-киназного домена приводят к активации AKT
Для оценки статуса активации AKT был разработан анализ, позволяющий измерять способность AKT стимулировать независимое от фактора роста выживание IL-3-зависимых клеток BaF3. Про-B-клетки BaF3 можно сделать независимыми от фактора роста в результате принудительной экспрессии онкогенов. Были созданы клетки BaF3, экспрессирующие AKT1 дикого типа (WT AKT1), миристоилированный (Myr) или E17K мутант AKT1, и было обнаружено, что активированная AKT сама по себе не может поддерживать независимость от фактора. Впрочем, совместная экспрессия Myr AKT1 или онкогенной E17K AKT1 и активированной формы MAP2 киназы MEK1 (Mek1 ΔN3, S218E, S222D) способствовала фактор-независимому росту и выживанию клеток BaF3. Хотя WT AKT1 в комбинации с активной MEK1 (MEK1 N3) показала некоторую активность в данном анализе, она была менее эффективной по сравнению с мутантной AKT1.
Анализ BaF3 использовали для исследования последствий нарушения взаимодействий PH-KD. Используя недавно опубликованную структуру полноразмерной AKT1 (Wu et al., (2010). PLoS One 5, e12913), идентифицировали остатки в интерфейсе PH-KD. Мутации на данных участках подбирали так, чтобы нарушалось взаимодействие PH-KD при удалении благоприятных взаимодействий, увеличивая стерический объем или изменяя заряд боковых цепей, участвующих в междоменных полярных контактах. Создали библиотеку из 35 таких мутантов AKT1 (фиг.16; таблица 1). Также в пул включили E17K мутантную конструкцию AKT1, которая служила в качестве положительного контроля, и клон WT AKT1 с молчащей мутацией, который служил в качестве отрицательного контроля активности. Использовали три библиотеки мутантных AKT, чтобы получить пул клеток BaF3, которые стабильно ко-экспрессировали мутанты вместе с MEK1 N3. После роста при отсутствии IL-3, из пула клеток отбирали образцы через 3 дня и 4 дня после удаления IL-3, и определяли относительную долю различных мутантов в пуле относительно начала на момент 0 часов, используя секвенирование следующего поколения (фиг.16C). Каждую мутацию оценивали на основе нормализованного отношения наблюдаемой частоты в данный момент времени, по сравнению с начальной частотой, и полученные отношения затем нормализовали к отношениям для WT AKT1. Как ожидалось, E17K AKT1 встречалась более чем в 50 раз чаще по сравнению с диким типом. Аналогичным образом, такие мутанты, как T81Y и D323A были также сильно распространены (>15 чаще, чем WT), что указывало на то, что такие мутации приводят к активации AKT. Другие мутанты, Р23а, N53A, F55Y, L78T, Q79E, W80A, E191A, T195I, V270A, V271A, L321A, D325A и R328A, показали умеренное распространение (в 2-6 раз чаще, чем WT на 3 дня или на 4 дня) в анализе, и также могут вызывать активацию (фиг.16D, таблица 1).
Сводка по мутациям PH-KD AKT1 и их эффектам
nd = не определяли
Для большего понимания эффекта мутантов по интерфейсу PH-KD, создавали клеточные линии NIH3T3, стабильно экспрессирующие каждый из мутантов AKT1, и оценивали статус фосфорилирования T308 и S473 (pT308 и pS473). Согласно скринингу в анализе выживания, мутанты N53A, F55Y, L78T, Q79E, W80A, T81Y, E191A, T195I, L321A, D323A, D325A и R328A показали повышенное фосфорилирование по T308 и S473 (фиг.16E). Кроме того, хотя мутанты Н54а AKT1, V83D, E114A, L202F, V320A, N324K и Y326A показали только умеренное распространение (в ~1,5-2 раза больше по сравнению с WT) в скрининге выживания, они показали повышенные уровни pT308 и pS473. Приведенные результаты указывают, что нарушение контактов PH-KD приводит к конститутивному фосфорилированию AKT.
Идентификация соматических мутаций AKT при раке
Учитывая, что нарушения в интерфейсе PH-KD приводят к активации AKT, производили оценку, присутствуют ли такие мутации в первичных опухолях человека. Для идентификации потенциальных мутаций AKT, все кодирующие экзоны AKT1, 2 и 3 секвенировали в общей сложности в 394 образцах первичных опухолей человека, состоящих из 65 образцов рака толстой и прямой кишки, 51 образца рака молочной железы, 48 образцов немелкоклеточной аденокарциномы легкого (NSCLC) (adeno), 43 образцов NSCLC (плоскоклеточной), 43 образцов карциномы почки, 37 образцов меланомы, 33 образцов рака желудка, 32 образцов рака яичников, 15 образцов рака пищевода, 11 образцов гепатоцеллюлярной карциномы (HCC), 10 образцов мелкоклеточного рака легкого (SCLC) и 6 других образцов (5 образцов крупноклеточного рака легкого и 1 образца рака легкого другого типа). Изменяющие белок, соматические мутации AKT1 были обнаружены в 4% рака молочной железы (2/51) и 1,5% рака толстой кишки (1/65). Соматические мутации AKT2 были обнаружены в ~5% NSCLC (adeno; 2/43) (фиг.17).
Помимо мутации E17K, существует также мутация AKT1 в кодоне 52, L52R. L52 находится в интерфейсе PH-KD и осуществляет гидрофобные контакты с V270, V271, Y326 и метиленовой группой R328 в киназном домене. Хотя мутация L52A увеличивала уровень фосфорилирования AKT1 по сравнению с WT, она не приводила к повышению выживания в анализе BaF3. Впрочем, мутация L52R, вероятно, будет отрицательно влиять на взаимодействия PH-KD (и, следовательно, усиливать активность AKT1), так как благоприятные гидрофобные взаимодействия будут утеряны, а неблагоприятное взаимодействие с R328 будет введено. Аналогичным образом, мутация D323H, идентифицированная в опухоли молочной железы, расположена в киназном домене AKT1, вблизи от трех основных остаткам в PH домене (K14, R23 и R25) (фиг.1B, 2B). Синтетический мутант D323А был конститутивно активен, позволив предположить, что D323H также будет конститутивно активным, поскольку гистидин в еще большей степени препятствует междоменным контактам, нежели аланин (увеличенный стерический объем; вероятность изменения заряда на противоположный). Остаток R96 расположен в главной спирали PH домена и сильно удален от интерфейса киназного домена и, следовательно, с малой вероятностью будет вызывать активацию посредством прерывания взаимодействий PH-KD. Электронная плотность не наблюдается для остатков K189-E198 в кристаллической структуре полноразмерной AKT1. Хотя данная петля киназного домена вероятно расположена вблизи от C-конца спирали PH домена, основанная на структуре оценка изменений активности AKT1, связанных с мутацией K189N, не возможна.
Семейные мутации изменения белка AKT в человеческих раковых образованиях
(аминокислотное изменение)
Соматические мутанты AKT1 вызывают конститутивную сигнализацию и приводят к перерождению
Для оценки функциональной значимости соматических мутаций исследовали мутантов AKT1, L52R и D323H, которые согласно прогнозу влияют на взаимодействия PH-KD. Кроме того, исследовали мутацию K189N, которая присутствует в киназном домене. Указанных мутантов исследовали относительно их влияния на передачу сигнала, используя клетки NIH3T3, стабильно экспрессирующие WT AKT1, меченную N-концевой меткой FLAG, миристоилированную AKT1 (Myr AKT1) или мутанты E17K, L52R, K189N и D323H. Иммуноблот-анализ показал, что в отличие от трансдуцированных вектором или WT AKT1 клеток, все мутанты, за исключением K189N, показали повышение pT308 и pS473, аналогично Myr AKT1. Согласно этому, наблюдали сопутствующее повышение фосфорилирования AKT субстратов FOXO и S6 рибосомного белка в клетках, экспрессирующих Myr или мутантную AKT1, по сравнению с клетками, экспрессирующими пустой вектор, WT AKT1 или K189N мутант AKT1. Что примечательно, в отличие от Myr AKT или L52R мутанта, экспрессия E17K или D323H не приводила к повышению фосфорилирования субстрата AKT PRAS40, позволяя предположить, что эти мутанты могут затрагивать различные нижестоящие эффекторные пути.
Мутанты PH-киназного домена AKT1 ослабляют междоменные взаимодействия и демонстрируют нарушение транслокации в плазматическую мембрану
Хотя онкоспецифические мутации AKT1, L52R и D323H присутствуют в положениях, которые согласно прогнозу нарушают взаимодействия PH-KD, наблюдаемые аминокислотные замены отличались от синтетических мутантов, полученных и проанализированных ранее. С целью непосредственной проверки, вызывают ли такие соматические мутации ослабление междоменных взаимодействий, 2-гибридный анализ млекопитающих проводили с использованием AKT PH и KD конструкций, слитых с активационным доменом VP16 (VP16 AD) и ДНК-связывающим доменом Gal4 (Gal4 DBD), соответственно. Силу взаимодействия измеряли с использованием люциферазы в качестве репортера, где активность люциферазы пропорциональна силе взаимодействия. Комбинация L52R PH домен/WT-KD и WT-PH/D323H KD показала 50% снижение сигнала взаимодействия по сравнению с WT-PH/WT-KD или E17K-PH/WT-KD, подтверждая, что у мутантов L52R и D323H нарушено PH-KD взаимодействие.
Для дополнительного изучения механизма активации мутантов AKT, определяли их клеточную локализацию. В покоящихся клетках AKT1 дикого типа диффузно локализована в цитоплазме и ядре, и, в ответ на митогенетическую стимуляцию, быстро перемещается в плазматическую мембрану, что приводит к ее активации.
Мутант L52R PH домена исследовали на субклеточную локализацию и перемещение в мембрану, используя слитую конструкцию GFP-AKT1 PH домена. Слитые конструкции WT и E17K PH домена AKT1 с GFP служили в качестве контроля. В отсутствие стимуляции фактором роста, не смотря на то, что PH домен WT AKT1 был распределен в цитоплазме и ядре, PH домен E17K AKT1 был конститутивно локализован в плазматической мембране. В отличие от PH домена E17K AKT1, PH домен L52R AKT1 был распределен в цитоплазме и ядре, проявляя аналогичные PH домену WT AKT1 свойства. Однако при стимуляции фактором роста, в отличие от PH домена WT AKT1, мутантный L52R PH домен не перемещался в плазматическую мембрану. Это указывает на то, что в отличие от мутанта E17K, который активируется в ответ на изменение липидной аффинности и локализации, мутант L52R наиболее вероятно активируется в цитоплазме из-за отсутствия аутоингибирующих взаимодействий.
Нарушение PH-KD взаимодействий в AKT2 и AKT3 приводит к их
активации
Принимая во внимание общую доменную архитектуру представителей семейства AKT, исследовали возможность активации AKT2 и AKT3 при нарушении PH-KD взаимодействий. Для проверки этого, были созданы мутанты L52R и D324H AKT2 и мутанты L51R и D320H AKT3 (эквивалентные L52R и D323H AKT1), которые согласно прогнозу должны иметь нарушенное PH-KD взаимодействие. Поскольку мутации E17K AKT3 можно обнаружить в меланоме, а о мутации E17K AKT2 сообщали при гипогликемии у человека, мутанты E17K AKT2 и AKT3 были созданы, наряду с дополнительными соматическими мутациями AKT2 и AKT3, которые были идентифицированы в раковых образованиях человека. Кроме того, Myr AKT2 и Myr AKT3 были созданы в качестве положительного контроля. Мутанты AKT2 и AKT3 стабильно экспрессировались в клетках NIH3T3, при этом оценивали статус фосфорилирования T308 и S473. AKT2 E17K, L52R и D324H, и AKT3 E17K, L51R и D320H показали повышение pT308 и pS473 по сравнению с клетками, экспресирующими WT AKT2 или AKT3. Согласно статусу активации, указанные мутанты AKT2 и AKT3 были способны поддерживать независимое от фактора роста выживание клеток BaF3 в комбинации с активированной MEK1. Что примечательно, мутант R371H AKT2, идентифицированный в человеческой раковой опухоли, также показал повышение pT308 и pS473, но не был способен поддерживать независимое от фактора роста выживание BaF3. Остальные мутанты (V90L и R101L AKT2 и Q124L и G171R AKT3) не показывали повышения pT308 и pS473 и не были способны поддерживать независимое от фактора роста выживание клеток BaF3. Изучение моделей гомологии, созданных для полноразмерных AKT2 и AKT3, показывает, что все эти мутации присутствуют в поверхностных петлях и не располагаются вблизи от интерфейса PH-KD. Следует отметить, что даже, несмотря на то, что V90L AKT2 и Q124L AKT3 находятся в петлях, не определенных в электронной плотности AKT1, концы указанных петель не расположены вблизи от PH-KD интерфейса. Таким образом, структурный анализ не позволяет понять, каким образом R371H AKT2 способна повышать фосфорилирование или каким образом любой из указанных мутантов мог бы являться причиной возникновения раковых образований, в которых они были идентифицированы.
Соматические мутанты AKT1 способствуют онкогенезу in vivo
Предыдущие исследования показали, что клетки BaF3, стабильно экспрессирующие онкогены, при имплантации мышам вызывают лейкозо-подобное заболевание, приводя к уменьшению общей выживаемости. Поскольку мутанты AKT1 взаимодействуют с активной MEK1, способствуя фактор-независимому росту клеток BaF3, данную модельную систему использовали для исследования их туморогенного потенциала in vivo. Мыши, которым имплантировали клетки BaF3, совместно экспрессирующие MEK1 N3 и Myr AKT1 или мутантную E17K, L52R или D323H AKT1, показали срединную выживаемость 19-20,5 дней. Напротив, мыши, которые получали клетки BaF3, совместно экспрессирующие MEK1 N3 и WT AKT1, показали значительно более продолжительную срединную выживаемость 29 дней. Это согласуется с тем фактом, что WT AKT1 в присутствии активной MEK1 была способна поддерживать фактор-независимое выживание клеток BaF3, хотя эффект был более скромным по сравнению с мутантами AKT. Как ожидалось, мыши, получавшие контрольные клетки BaF3, которые экспрессировали только MEK1 N3, были живы в конце 55-дневного периода исследования. Некропсию проводили через 19 дней после трансплантации, в когорте из 3 мышей в каждой группе терапии, для отслеживания прогрессии заболевания. Согласно сниженной общей выживаемости, значительная часть меченых GFP клеток BaF3 была обнаружена в костном мозге и селезенке мышей, которые получали мутантную AKT1, по сравнению с мышами, которые получали WT AKT1 или контрольные клетки с пустым вектором. У мышей, экспрессирующих мутантную AKT1, обнаружили значительное увеличение печени и селезенки. Гистологическое исследование окрашенных гематоксилином и эозином (Г/Э) срезов печени, селезенки и костного мозга выявило доказательство инфильтрации лейкобластных клеток у мышей, которые получали клетки, трансдуцированные мутантной AKT1, по сравнению с мышами, которые получали контрольные клетки с вектором или WT AKT1. Эти результаты подтверждают трансформирующий потенциал мутантов AKT1 in vivo.
Мутанты AKT1 с дефицитным взаимодействием PH-KD менее чувствительны к аллостерическим ингибиторам
Несколько АТФ-конкурентных и аллостерических низкомолекулярных ингибиторов AKT находятся в процессе разработки и/или клинических испытаний (Mattmann et al., (2011). Expert Opin Ther Pat.; Pal et al., (2010). Expert Opin Investig Drugs 19, 1355-1366). Предыдущие исследования показали, что аллостерические ингибиторы AKT требуют присутствия интактного интерфейса PH-KD для проявления своей активности. Учитывая, что у некоторых соматических мутантов AKT1 были нарушены контакты PH-KD, было сделан прогноз, что аллостерические ингибиторы, вероятно, будут менее эффективными при ингибировании активности таких мутантов. Активность двух АТФ-конкурентных ингибиторов, GNE-692 (Bencsik et al. (2010). Bioorg Med Chem Lett 20, 7037-7041) и GSK690693 (Rhodes et al. (2008). Cancer Res 68, 2366-2374), а также двух аллостерических ингибиторов, ингибитора VIII (Lindsley et al., (2005). Bioorg Med Chem Lett 15, 761-764) и GNE-929, тестировали на полноразмерном рекомбинантном WT и мутантном ферменте AKT1. Действие ингибиторов на пролиферацию клеток NIH3T3, экспрессирующих WT или мутантную AKT1, также исследовали.
В биохимических анализах активности, АТФ-конкурентные ингибиторы GNE-692 и GSK690693 были эффективны при блокировании активности фермента WT AKT1 (GNE-692 IC50 24,3 нМ), как и мутантных ферментов (E17K, L52R и D323H; GNE-692 IC50 3,7-15,8 нМ). Аналогично, АТФ-конкурентные ингибиторы были одинаково эффективны как против WT, так и против мутантной AKT1 в клеточном анализе пролиферации. Напротив, аллостерические ингибиторы, ингибитор VIII и GNE-929, были менее эффективными против полноразмерных рекомбинантных мутантных ферментов (ингибитор VIII: IC50 268,4 нМ в отношении L52R; IC50>1 мкМ в отношении D323H) по сравнению с WT AKT1 (ингибитор VIII: IC50 119,3 нм; фиг.6C). В соответствии с этим, в клеточном анализе аллостерический ингибитор, ингибитор VIII, как было обнаружено, был по меньшей мере на 50% менее эффективным при блокировании пролиферации клеток, экспрессирующих мутантную AKT1, по сравнению с WT AKT.
Для подтверждения того, что пониженная чувствительность мутантов к аллостерическим ингибиторам была обусловлена нарушенными PH-KD взаимодействиями, проводили биохимический анализ сборки in vitro, используя очищенные рекомбинантные PH и киназные домены. В этой системе аллостерический ингибитор VIII при тестировании против только одного киназного домена AKT1 был неспособен блокировать его активность. Однако при добавлении очищенного WT PH домена к киназному домену и сборке фермента, ингибитор VIII мог блокировать активность фермента, хотя наблюдалось трехкратное увеличение IC50 в отношении повторно собранного фермента (IC50 238,8 нМ) по сравнению с полноразмерным ферментом WT (IC50 80,8 нМ). Напротив, сборка с мутантным доменом PH (L52R или E17K) еще более ослабляла способность ингибитора VIII блокировать AKT1 (L52R IC50 713,5 нМ и E17K IC50>1 мкМ). Аналогичным образом, ингибитор VIII не показал активности при повторной сборке WT PH домена с мутантным D323H киназным доменом. Отсутствие ингибирования E17K аллостерическими ингибиторами указывает на то, что в дополнение к увеличенной аффинности в отношении PIP2 данная мутация также может влиять на PH-KD взаимодействие, что приводит к его активации. В клеточном 2-гибридном анализе мутант E17K не показал нарушений во взаимодействии PH-KD, что говорит о том, что точный механизм активации E17K требует дополнительного исследования. Представленные данные подтверждают важность интактного интерфейса PH-KD для аллостерических ингибиторов AKT1.
Суррогатный PD биомаркер пробирные анализы
Фосфо-GSK-3b в обогащенной тромбоцитами плазме (PRP) использовали в качестве суррогатного PD биомаркера для измерения ингибирования пути Akt у пациентов после терапии GDC-0068 в различные моменты времени в течение 22 дней. Периферическую кровь собирали в пробирки Vacutainer, содержащие 0,38% цитрата в качестве антикоагулянта. Кровь центрифугировали при 200 g в течение 15 минут при комнатной температуре. Слой PRP осторожно отбирали из пробирки и затем растворяли в буфере, содержащем детергенты, ингибиторы протеаз и фосфатаз. Уровни фосфорилированной и общей GSK-3β в лизатах PRP измеряли при использовании мультиплексного анализа MSD (Meso Scale Discovery) фосфо-GSK3β/общая GSK3β. Уровни pGSk-3β нормализовали по уровням общей GSk-3β, и ингибирование pGSk-3β после введения дозы выражали как отношение уровней перед введением дозы для каждого пациента. Был продемонстрирован дозо- и время-зависимый фармакологический ответ, с уменьшением уровня pGSK3β≥75% при дозах ≥200 мг.
Обращенно-фазовые белковые чипы
Биоптаты опухолей, полученные при трепанобиопсии у пациентов, получавших GDCC0068, мгновенно замораживали в OCT и приготавливали срезы толщиной 8 мкм. Ткань лизировали в RPPA лизисном буфере, содержащем TPER, 300 мМ NaCl и ингибиторы фосфатаз. Фосфопротеиновые сигнатуры лизатов анализировали при использовании обращенно-фазовых белковых чипов: образцы отпечатывали на нитроцеллюлозных пластинках и окрашивали Sypro для определения концентраций суммарного белка. Каждую пластинку обрабатывали разным антителом при 4°C в течение ночи. Затем данные нормализовали по уровням суммарного белка и удалили пространственные эффекты, используя квадратичную медианную нормализацию. Уменьшение на 60%-70% pPRAS40 и уменьшение на ~50% циклина D1 (по сравнению с базовым) произошло у всех 3 пациентов, получавших по 400 мг ежедневно. По поводу методов и обзора RPPA см.: Reverse phase protein microarrays advance to use in clinical trials, Molecular Oncology. 2010 Dec; 4(6):461-81, Mueller C et al. В некоторых вариантах осуществления рак, подвергаемый лечению по настоящему изобретению, включает одну или более мутаций AKT, PI3k, PTEN и HER2 или нарушенную сигнализацию AKT, PI3k, PTEN или HER2. В одном примере рак представляет собой раком желудка, включающим высокую активность pAKT и низкий или нулевой статус PTEN.
В одном определенном аспекте изобретения предложен способ лечения пациента, имеющего рак, который ассоциирован с мутацией или потерей экспрессии PTEN, мутацией или амплификацией AKT, мутацией или амплификацией PI3K, или амплификацией Her2/ErbB2, включающий введение комбинации по изобретению пациенту. В другом аспекте изобретения предложен способ идентификации пациента с раком, который можно лечить комбинацией по изобретению, включающий определение, ассоциирован ли рак у пациента с мутацией или потерей экспрессии PTEN, мутацией или амплификацией AKT, мутацией или амплификацией PI3K, или амплификацией Her2/ErbB2, где ассоциация рака у пациента с мутацией или потерей экспрессии PTEN, мутацией или амплификацией AKT, мутацией или амплификацией PI3K, или амплификацией Her2/ErbB2, является показателем присутствия рака, который можно лечить комбинацией по изобретению. В другом аспекте изобретения предложен способ, дополнительно включающий лечение пациента, идентифицированного с применением комбинации по изобретению.
В другом примере рак, подвергаемый лечению, связан с PTEN положительным, низким или нулевым статусом в комбинации с положительным или отрицательным статусом HER2. Примеры включают рак желудка, который является (i) PTEN отрицательным (HScore меньше, чем приблизительно 10, или 0) и Her2 отрицательным, (ii) PTEN низким (HScore меньше, чем приблизительно 200) и Her2 отрицательным, (iii) PTEN отрицательным и Her2 положительным, или (iv) PTEN положительным и Her2 отрицательным. В данном примере рак можно лечить с применением комбинации соединения формулы I, например, GDC-0068, или его соли, и FOLFOX.
Все документы, цитируемые в настоящем описании, включены посредством ссылки. Хотя некоторые варианты осуществления изобретения описаны, и множество деталей представлено в целях иллюстрации, некоторые из деталей могут различаться, без отступления от основных принципов изобретения.
Использование единственного числа в оригинальном тексте описания в рамках описания вариантов осуществления изобретения следует считать охватывающим как единственное, так и множественное число, если не указано иное или прямо не противоречит контексту. Термины "включающий", "имеющий" и "содержащий" следует рассматривать как открытые термины (то есть, означающие "включающий, но не ограниченный"), если не указано иное. Перечисление диапазонов значений в настоящем описании просто предназначено, чтобы служить упрощенным методом индивидуального обращения к каждому отдельному значению, попадающему в указанный диапазон, если не указано иное, при этом каждое отдельное значение включено в описание, как если бы оно было индивидуально указано в настоящем описании. В дополнение к порядку, представленному в настоящем описании, описанные способы могут быть осуществлены в любом подходящем порядке, если не указано иное или иное прямо не противоречит контексту. Использование любого и всех примеров или примерного выражения (например, "такой как"), представленных в настоящем описании, предназначено для лучшего пояснения вариантов осуществления изобретения и не должно налагать ограничений на объем изобретения, если иное прямо не указано в формуле изобретения. Ни одно выражение в описании не следует считать указанием того, что любой незаявленный элемент является существенным для осуществления изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛИРОВАННЫХ ЦИКЛОПЕНТАПИРИМИДИНОВЫХ СОЕДИНЕНИЙ И ИХ СОЛЕЙ | 2013 |
|
RU2642311C2 |
| ГИДРОКСИЛИРОВАННЫЕ И МЕТОКСИЛИРОВАННЫЕ ЦИКЛОПЕНТА[D]ПИРИМИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ АКТ ПРОТЕИНКИНАЗ | 2007 |
|
RU2478632C2 |
| ФОРМЫ И СОСТАВЫ ПИРИМИДИНИЛЦИКЛОПЕНТАНОВОГО СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2013 |
|
RU2650511C2 |
| КОМБИНАЦИИ СОЕДИНЕНИЙ-ИНГИБИТОРОВ АКТ И АБИРАТЕРОНА, И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2631240C2 |
| ГИДРОКСИЛИРОВАННЫЕ ПИРИМИДИЛЦИКЛОПЕНТАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ (АКТ) | 2009 |
|
RU2504542C2 |
| ГИДРОКСИЛИРОВАННЫЙ ПИРИМИДИЛ ЦИКЛОПЕНТАН В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ (АКТ) | 2009 |
|
RU2520735C2 |
| ЦИКЛОПЕНТА(D)ПИРИМИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ АКТ | 2007 |
|
RU2481336C2 |
| ПИРИМИДИЛЦИКЛОПЕНТАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ AKT-ПРОТЕИНКИНАЗЫ | 2008 |
|
RU2486178C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИМИДИНИЛЦИКЛОПЕНТАНОВЫХ СОЕДИНЕНИЙ | 2014 |
|
RU2702355C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИМИДИНИЛЦИКЛОПЕНТАНОВЫХ СОЕДИНЕНИЙ | 2014 |
|
RU2826179C2 |
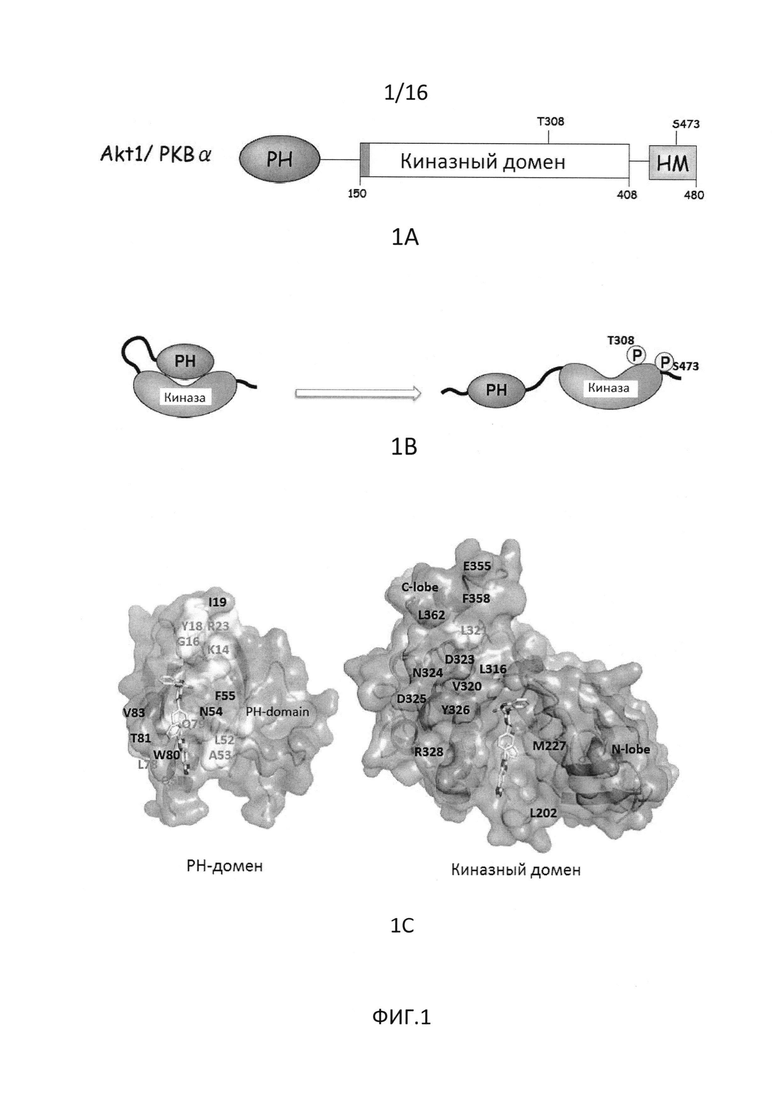
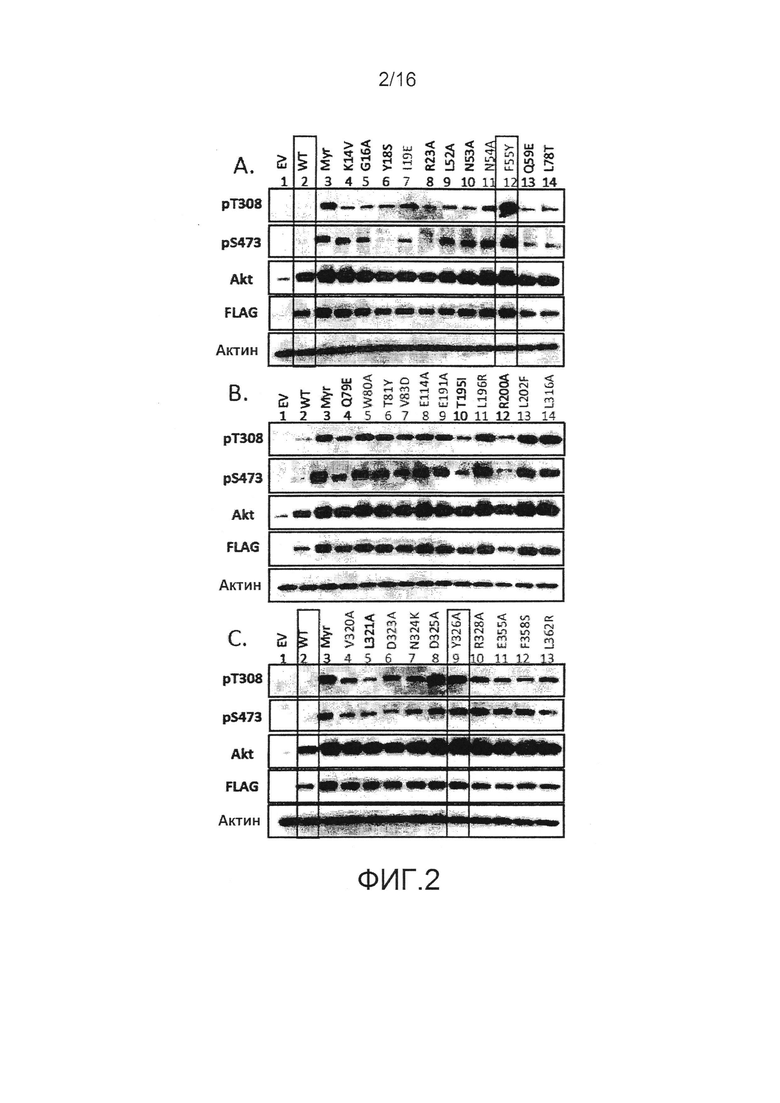
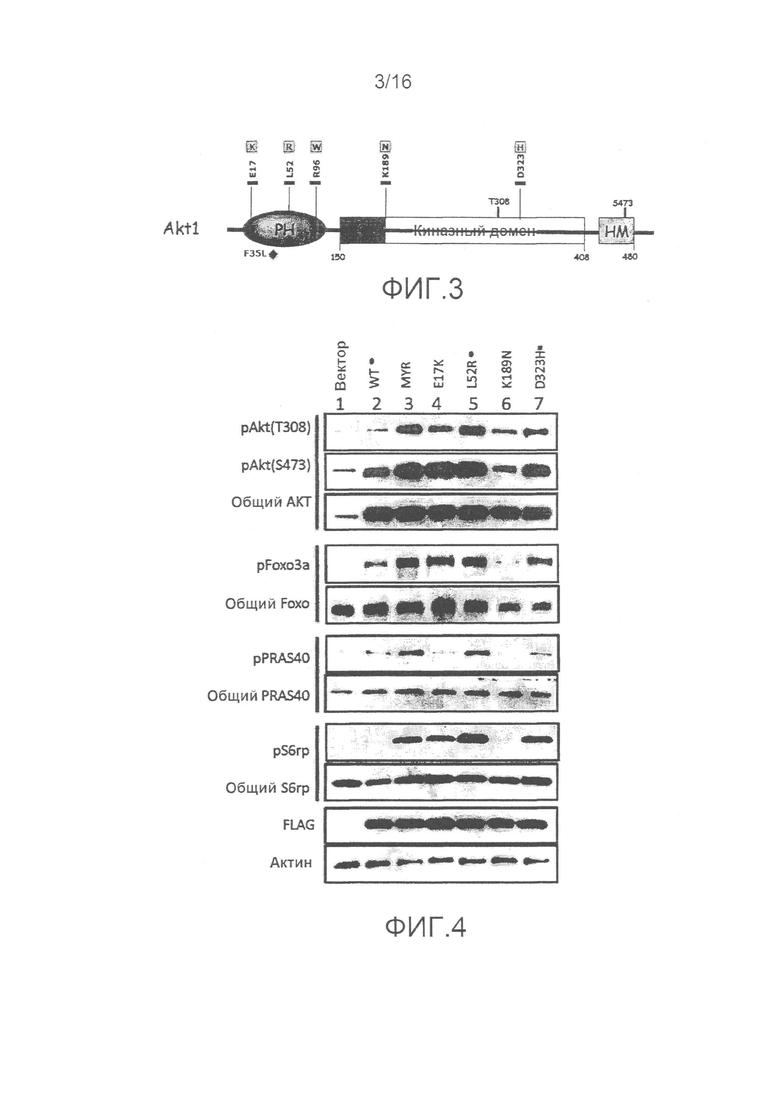
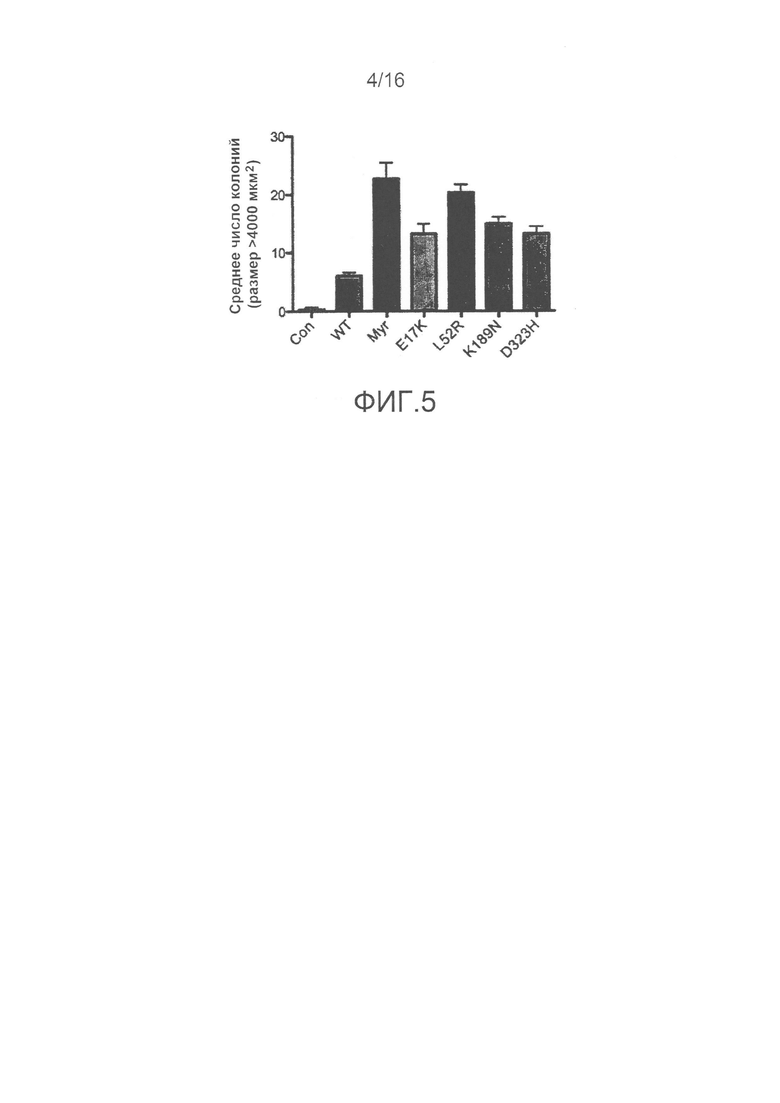
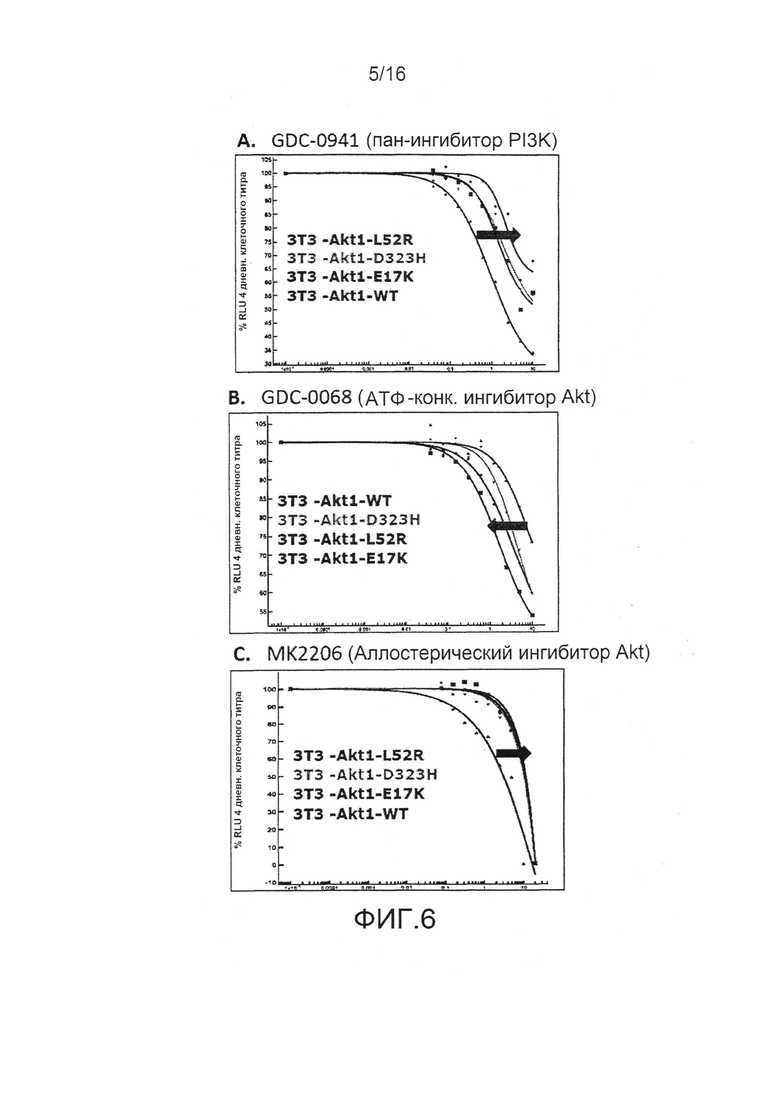
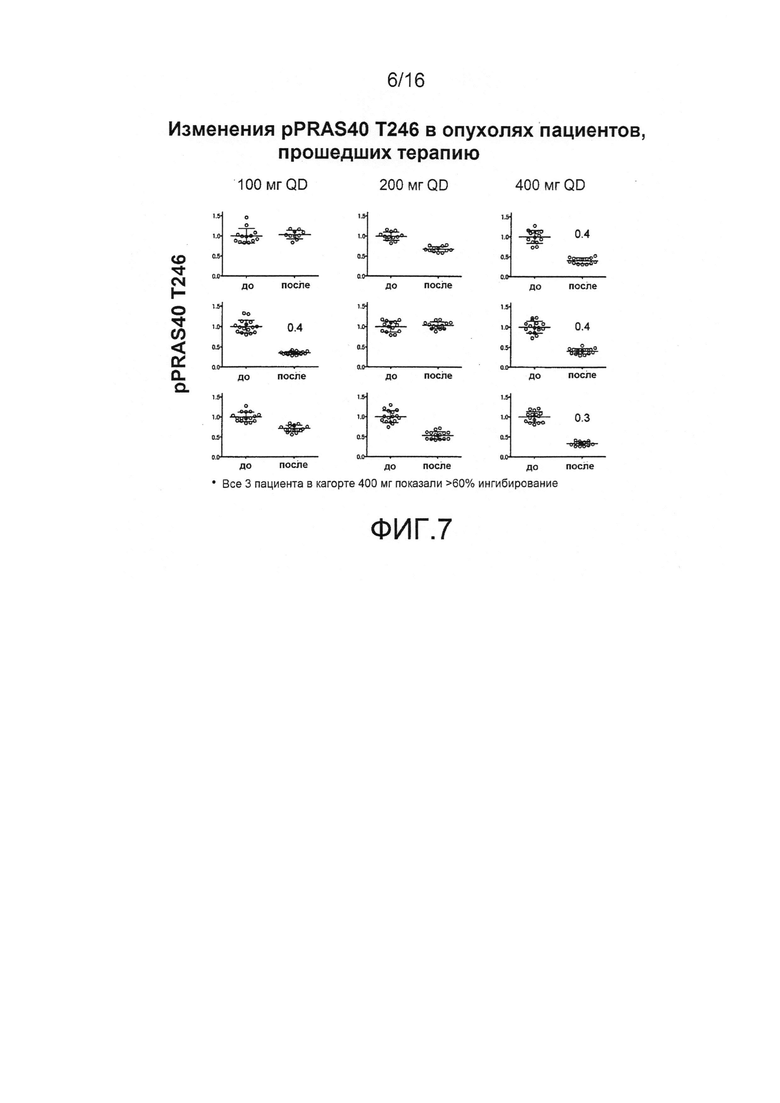
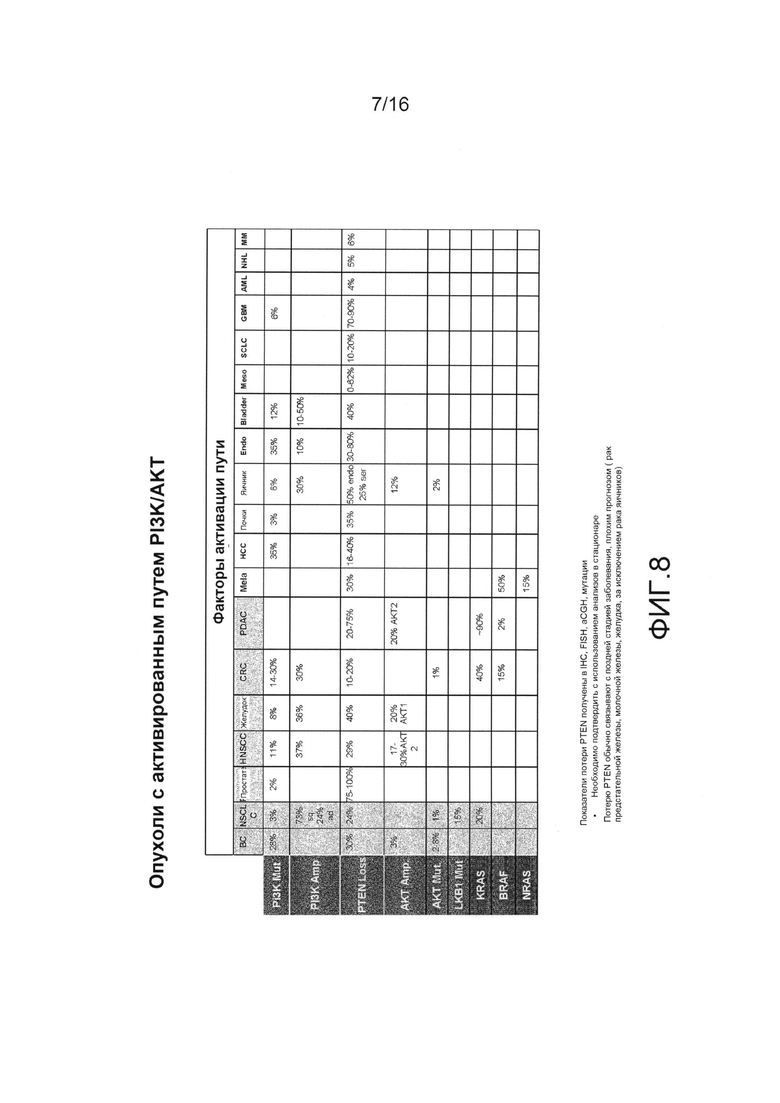
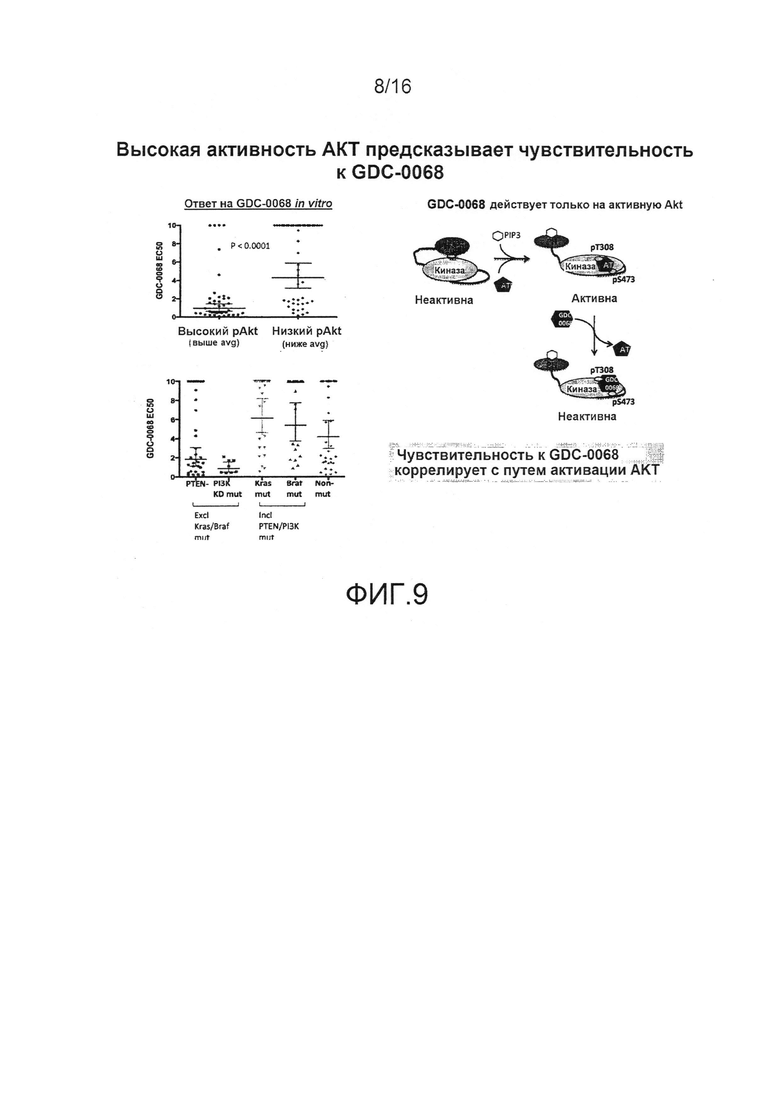
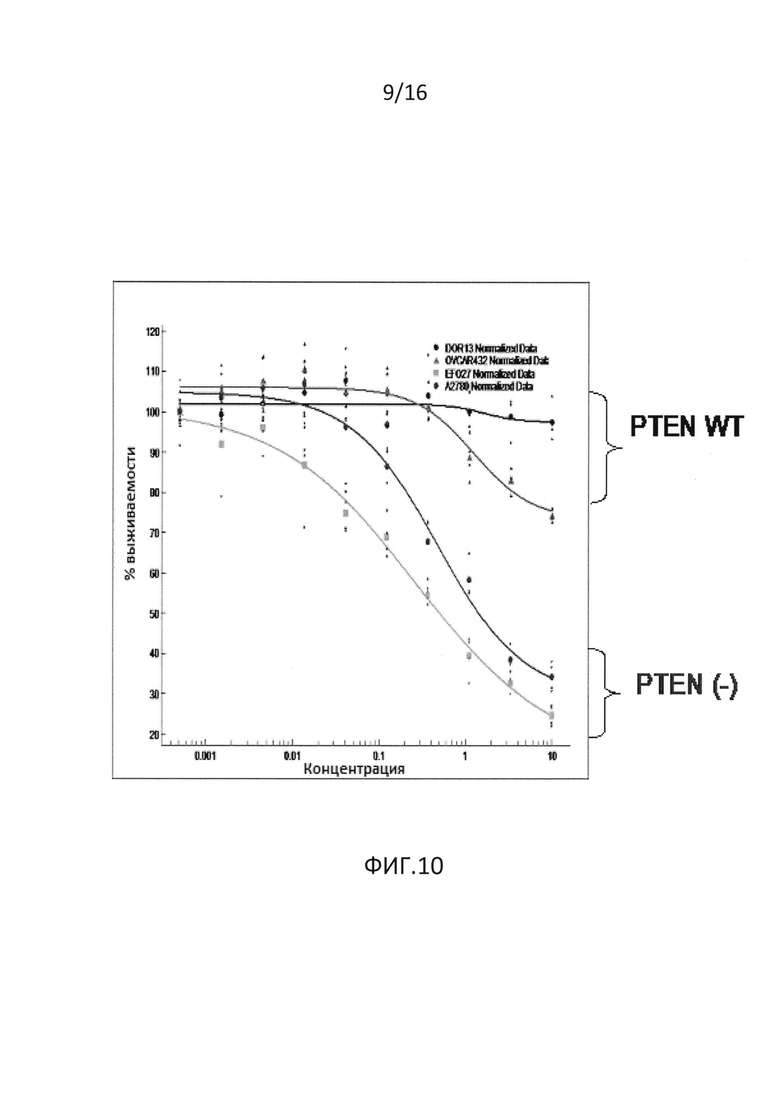

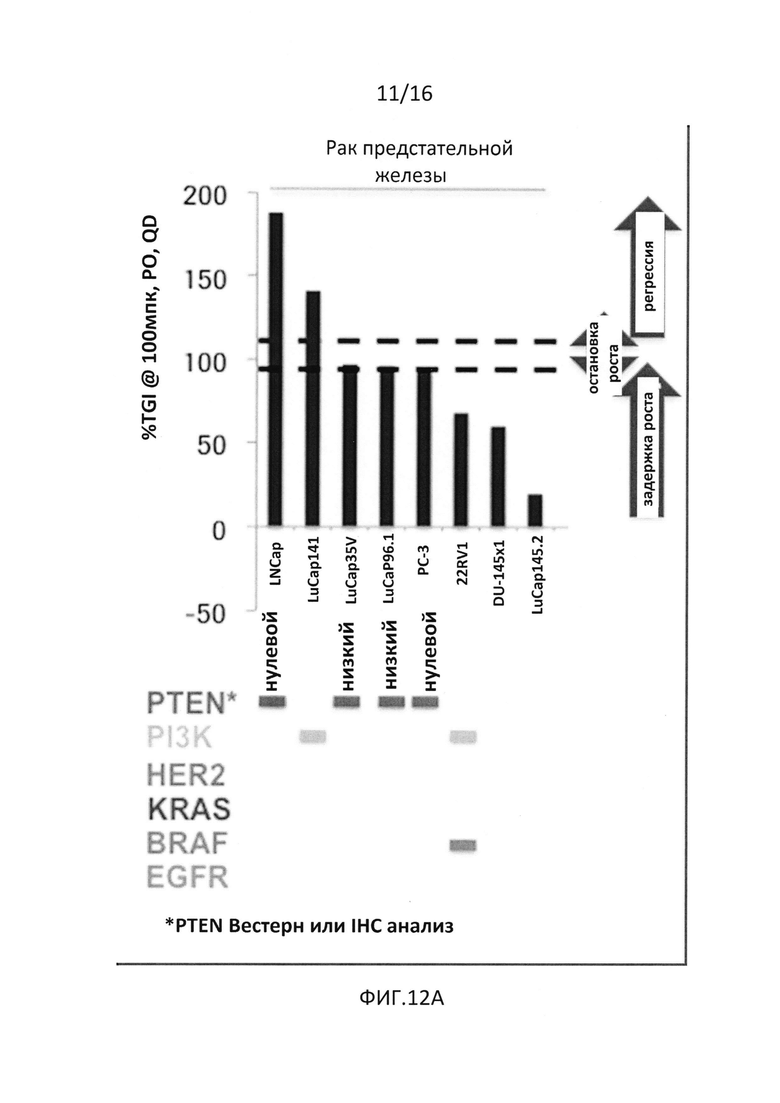

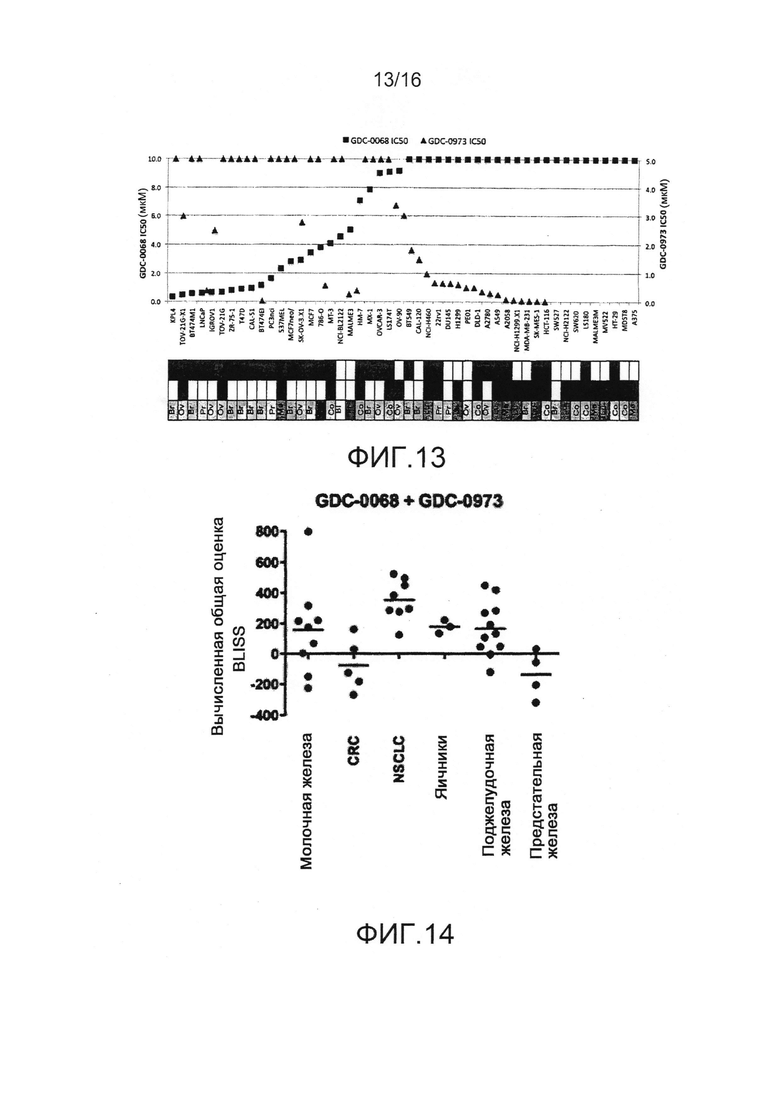

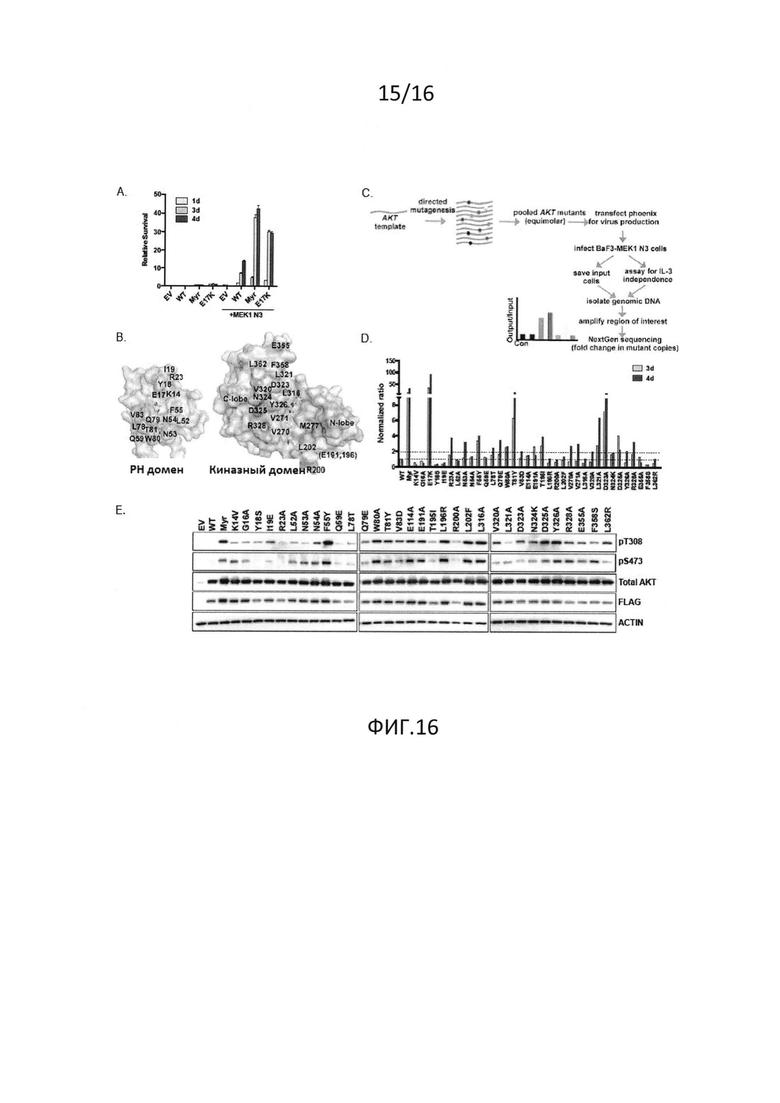
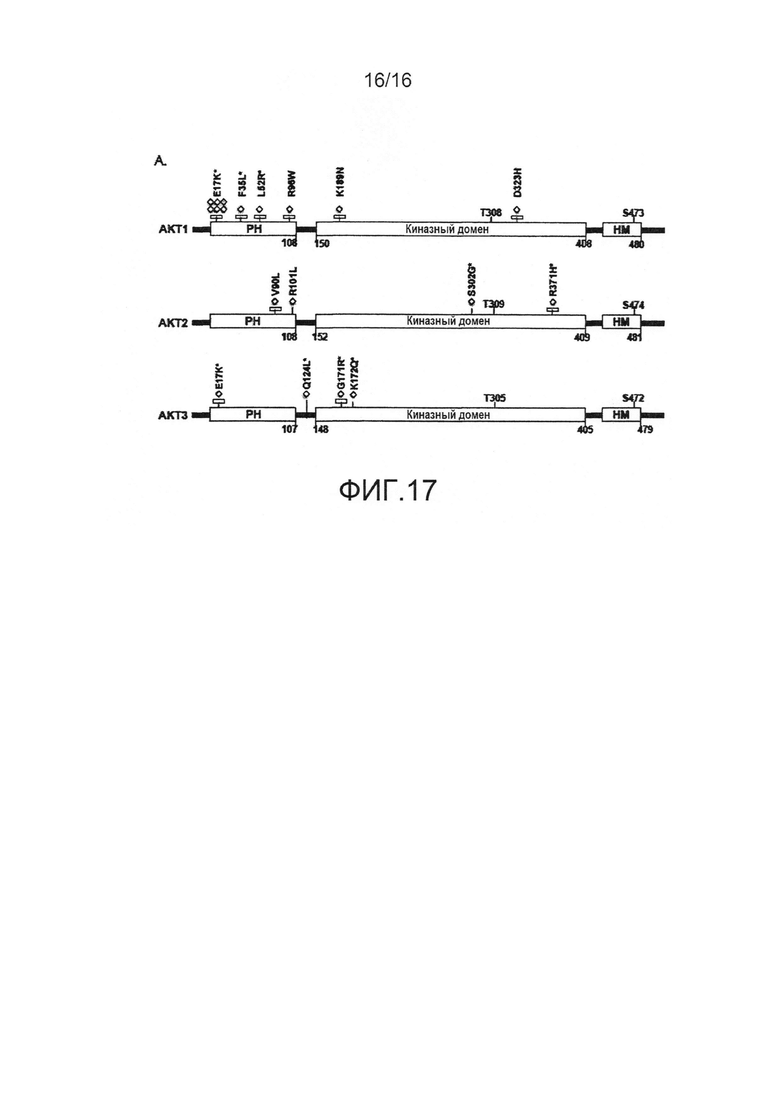
Изобретение относится к области медицины, в частности к онкологии, и предназначено для лечения рака у пациента, обладающего мутацией AKT1 в положении L52 или D323. Определяют присутствие мутации L52 или D323 в гене AKT1 у пациента. Пациенту с такой мутацией вводят (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она или его фармацевтически приемлемую соль. Изобретение обеспечивает эффективное лечение рака у пациента. 16 з.п. ф-лы, 18 ил., 3 табл., 4 пр.
1. Способ лечения рака у пациента, обладающего мутацией AKT1 в положении L52 или D323, включающий
(a) определение присутствия мутации в AKT1 в клетке в физиологическом образце пациента, где мутация соответствует или совпадает с L52 или D323, и
(b) введение пациенту (S)-2-(4-хлорфенил)-1-(4-((5R,7R)-7-гидрокси-5-метил-6,7-дигидро-5Н-циклопента[d]пиримидин-4-ил)пиперазин-1-ил)-3-(изопропиламино)пропан-1-она или его фармацевтически приемлемой соли.
2. Способ по п. 1, где мутация в AKT1 нарушает взаимодействие между РН-доменом и киназным доменом AKT.
3. Способ по п. 1, где мутация в AKT1 увеличивает фосфорилирование AKT.
4. Способ по п. 3, где увеличение фосфорилирования происходит вследствие конститутивного фосфорилирования.
5. Способ по п. 1, где способ дополнительно включает определение статуса PTEN клетки, где потеря PTEN коррелирует с увеличенной чувствительностью к ингибитору.
6. Способ по п. 5, где клетка представляет собой клетку раковой опухоли яичников или предстательной железы.
7. Способ по п. 1, где способ дополнительно включает определение присутствия мутации PI3K клетки, где присутствие мутации PI3K коррелирует с увеличенной чувствительностью к ингибированию ингибитором.
8. Способ по п. 7, где указанные мутации PI3K представляют собой одну или обе из H1047R и H1047L.
9. Способ по п. 1, где способ дополнительно включает определение профиля pAKT клетки, где высокий профиль активности pAKT коррелирует с увеличенной чувствительностью к ингибированию ингибитором.
10. Способ по п. 1, где способ дополнительно включает определение профиля pAKT клетки, где низкий профиль активности pAKT коррелирует с уменьшенной чувствительностью к ингибированию ингибитором.
11. Способ по п. 1, где способ дополнительно включает определение Her2 и/или Her3 статуса клетки, где Her2+ и/или Her3+ статус клетки коррелирует с увеличенной чувствительностью к ингибированию ингибитором.
12. Способ по п. 1, где способ дополнительно включает определение присутствия мутации Met киназы клетки, где присутствие мутации Met киназы коррелирует с чувствительностью клетки к ингибитору AKT.
13. Способ по п. 1, где способ дополнительно включает определение присутствия B-Raf или K-Ras мутации клетки, где присутствие B-Raf или K-Ras мутации коррелирует с уменьшением чувствительности клетки к ингибитору AKT.
14. Способ по п. 1, где способ дополнительно включает определение профиля локализации FOXO3a в клетке, где цитоплазматический профиль локализации FOXO3a коррелирует с чувствительностью клетки к ингибированию ингибитором Akt.
15. Способ по п. 1, где клетка представляет собой клетку рака предстательной железы, яичников, молочной железы, желудка или поджелудочной железы.
16. Способ по п. 15, где клетка представляет собой клетку гормонорезистентного рака молочной железы.
17. Способ по п. 1, где способ дополнительно включает определение INPP4B, PHLPP и/или РР2А статуса клетки, где потеря INPP4B, PHLPP и/или РР2А коррелирует с увеличенной чувствительностью к ингибитору.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| HIROMURA M | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J | |||
| Biol | |||
| Chem | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Краткий курс молекулярной фармакологии | |||
| Под общей редакцией профессора П.В | |||
| Сергеева | |||
| М.: II Московский медицинский институт им | |||
| Н.И | |||
| Пирогова, 1975, стр.10 | |||
| ХОЛОДОВ Л.Е | |||
| и др | |||
| Клиническая фармакокинетика | |||
| М.: Медицина, 1985, стр.83-98, 134-138, 160, 378-380. | |||
Авторы
Даты
2017-11-09—Публикация
2012-03-30—Подача