Изобретение относится к медицине, в частности к гинекологии, и может использоваться для лечения атрофического вагинита у женщин в постменопаузе. Постменопауза характеризуется эстрогендефицитным состоянием у женщин, обусловленным возрастным снижением, а затем и прекращением функции яичников. Как известно, любые эпителиальные ткани реагируют на изменение окружающей их гормональной среды сходным образом, но ни одна из них не может сравниться с эпителием свода влагалища и шейки матки по скорости и отчетливости реакции на гормоны, в первую очередь на половые стероиды. Снижение концентрации женских половых гормонов приводит не только к появлению атрофии слизистой влагалища и связанным с этим неприятным симптомам в вульве и влагалище, но и к изменениям в структуре ее микрофлоры.
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения. Гормональная терапия достаточно быстро улучшает индекс созревания эпителия влагалища и толщину слизистой оболочки.
Однако подобная тактика ведения женщин акцентируется исключительно на состояние слизистой влагалища, не принимая во внимания изменения, происходящие в микрофлоре влагалища. Последние исследования демонстрируют тесную связь между последствиями гипоэстрогенного состояния у женщин в постменопаузе, особенностями биоценоза влагалища и симптомами BA. Согласно результатам последних исследований [Hummelen R, Macklaim JM, Bisanz JE, et al. Vaginal microbiome and epithelial gene array in post-menopausal women with moderate to severe dryness. PLoS One 2011; 6: e26602] сухость влагалища у женщин в постменопаузе имеет обратную корреляционную связь с численностью лактобактерий в вагинальном биотопе (p=0,00141). Отсутствие сухости влагалища либо незначительный дискомфорт во влагалище наблюдали у женщин с высоким содержанием лактобктерий в биоценозе, в то время как наиболее выраженные симптомы сопровождались трансформацией микроэкологии влагалища в сторону увеличения численности Prevotella timonensis, Porphyromonas, Peptoniphilus и Bacillus на фоне снижения лактобактериальной обсемененности. Таким образом, современные подходы лечения ВА не принимают во внимание изменения микрофлоры влагалища и тем самым упускают из виду одну из возможных патогенетический причин возникновения жалоб у женщин постменопаузе вследствие эстрогенной недостаточности.
К аналогам предлагаемого в качестве изобретения способа можно отнести: «применение эстриола в низкой дозе» (RU 2483734), «Способ лечения климактерических расстройств у женщин во время или после менопаузы» (RU 2268035), «Способ лечения атрофического кольпита» (RU 2300370). К недостаткам аналогов относятся отсутствие дифференцированного подхода к терапии в зависимости от состояния биоценоза влагалища. Эффект лечения в данных работах оценивали по виду ороговевших клеток, определением индекса созревания влагалищного эпителия, кольпоскопии, оценке общей трофики и жалоб пациентов.
Исторически сложилось, что первые исследования, посвященные изучению компонентов экосистемы влагалища у женщин, проводились с помощью микроскопического и/или микробиологического (культурального) методов диагностики. Однако эти методы диагностики не лишены недостатков.
Микроскопический метод исследования позволяет идентифицировать ассоциированный с исследуемым материалом микроорганизм в фиксированном препарате, т.е. метод предоставляет лишь качественную оценку состава биоценоза. К тому же, что «эффективность обнаружения микроорганизма в препарате однозначно определяется степенью обсемененности им исследуемого материала: если при обсемененности, превышающей 106 клеток/мл, обнаружение микроорганизмов не встречает затруднений, то при обсемененности 105 клеток/мл оно становится весьма трудно разрешимой задачей, а при обсемененности, не превышающей 104 клеток/мл - фактически неразрешимой». Также известно, что многие виды и роды условно патогенных микроорганизмов имеют похожие морфотипы, что затрудняет оценить видовую характеристику бактерий в препарате, окрашенном по Граму.
Кроме того, данный метод диагностики не позволяет идентифицировать ряд этиологически значимых условно патогенных бактерий, как например, Atopobium vaginae, Megasphaera spp., Mobiluncus spp. и тд.
Вторым методом идентификации микробиома влагалища является культуральный метод, который, который позволяет установить видовой состав аэробных, факультативно анаэробных и некоторых облигатно анаэробных бактерий. К недостаткам данной методики можно отнести длительные сроки культивирования микроорганизмов (в среднем 5 дней) и необходимость сохранения их жизнеспособности до момента поступления биоматериала в лабораторию, а также отсутствие условий для культивирования таких микроорганизмов во многих лечебных учреждений практического здравоохранения. Кроме того, имеющиеся микробиологические критерии базируются лишь на оценке процентного соотношения тех или иных микроорганизмов без учета референсных значений каждого микроорганизма. Данные методы исследования были применены в нескольких работах.
В 2002 году проведена работа по анализу микробного пейзажа у женщин в постменопаузе. Описанные результаты были получены в рамках диссертации на соискание степени кандидата медицинских наук по теме: «Клинико-патогенетические особенности вагинальной атрофии в постменопаузе» (Есефидзе Ж.Т.). Автор определил микроценоз слизистой оболочки влагалища у пациенток в постменопаузе на основании культуральной диагностики и микроскопии вагинальных мазков, окрашенных по Граму. По результатам интегральной оценки состава микрофлоры, характера вагинального эпителия и лейкоцитарной реакции у женщин выявлены различные состояния микроэкологии влагалища. «Согласно поученным данным у женщин в постменопаузе наиболее часто встречается условно нормоценоз и вагинальная атрофия (43% и 41% соответственно). Под условно нормоценозом понимали незначительное снижение титра лактобацилл на 1-2 порядка в ассоциации с умеренным или низким титром УПМ, как факультативного, так и облигатоно-анаэробного происхождения. Микробиологической особенностью вагинальной атрофии являлось элиминация или резкое снижение лактобацилл при отсутствии массивной колонизации вагинального биотопа УПМ. У 15% пациенток был выявлен бактериальный вагиноз и у 1% неспецифический вагинит» [Есефидзе Жанна Тамазовна. Клинико-патогенетические особенности вагинальной атрофии в постменопаузе. Диссертация на соискание ученой степени кандидата медицинских наук. Москва, 2002].
Известен способ, описанный как «одновременный забор отделяемого и соскобного материала из влагалища, с последующим смывом из влагалища 5,0 мл 6,0% раствора полиглюкина, цитологическим исследованием окрашенного по Граму мазка соскобного материала с определением бактериальной обсемененности эпителиоцитов, количества лейкоцитов и ключевых клеток, посева отделяемого влагалища и соскобного материала из серийных разведений на питательные среды с определением количества лактобацилл, условно-патогенной факультативно-анаэробной и облигатно-анаэробной микрофлоры, определяют в смыве из влагалища концентрации IgA, sIgA, IgM и свободного секреторного компонента» (RU 2249821). В данной работе сравнивали данные, полученные в результате исследования, с критериями, установленными для нормоценоза влагалища, и делали вывод о состоянии микробиоценоза влагалища. Также известен способ комплексного микробиологического исследования пациенток с наличием жидкости в полости матки.
В рамках данного исследования проводилось комплексное микробиологическое исследование, которое включало оценку микробиоценоза влагалища по данным микроскопии мазка, окрашенного по Грамму, и культурального исследования вагинального отделяемого, изучение микрофлоры аспирата из полости матки. По данным интегральной оценки состава микрофлоры, характера вагинального эпителия и лейкоцитарной реакции у обследуемых женщин в постменопаузе выявлены различные состояния микроэкологии влагалища. Согласно результатам исследования основную группу женщин на 52,8% составили пациентки с атрофическим кольпитом, в 38,6% случаев выявлен бактериальный вагиноз, и только у 8,6% женщин отмечен условно нормоценоз. Контрольную группу - 66%, составили пациентки с условно нормоценозом и 34% с атрофическим кольпитом. Микробиологический анализ аспирата из полости матки показал массивное микробное обсеменение эндометрия у большинства женщин с наличием жидкости в полости матки. Общее количество микроорганизмов достигало 5-8 ∧ КОЕ/мл. Выявлен полимикробный характер микрофлоры. Характер микрофлоры напоминает вагинальный спектр.
У пациенток контрольной группы аспираты из полости матки при бактериологическом исследовании были стерильными. На основе полученных результатов УЗИ с ЦДК и доплерометрии, микроскопических, бактериологических и цитологических исследований вагинального отделяемого и аспирата из полости матки определяли тактику врача в терапии указанных расстройств [Гасанова Мехрибан Кязим кызы. Современные подходы к диагностике и лечению серозометры в постменопаузе. Диссертация на соискание ученой степени кандидата медицинских наук. Москва, 2008].
Известен способ интегральной оценки состояния микробиоты влагалища и диагностика оппортунистических вагинитов позволяет установить видовой состав аэробных, факультативно- и облигатно-анаэробных бактерий, микроаэрофилов, в том числе лактобацилл, а также дрожжевых грибов рода Candida. Данная работа выполнялась с у четом комплексного исследования вагинального отделяемого с помощью микроскопии мазка, окрашенного по Граму, и культурального исследования. При микроскопии оценивают состояние вагинального эпителия, лейкоцитарную реакцию, количественный и качественный состав микрофлоры по бактериальным морфотипам. Разработаны критерии нормы вагинальной микробиоты у женщин репродуктивного возраста: общая микробная обсемененность не превышает 106-108 КОЕ/мл; абсолютное преобладание лактобацилл; условно-патогенные микроорганизмы определяются в низком титре (менее 104 КОЕ/мл) или отсутствуют. Также приведены характеристики различных нарушений вагинальной микрофлоры (бактериальный вагиноз (БВ), кандидозный вагинит (KB), сочетание БВ и KB, бессимптомное носительство грибов, неспецифический (аэробный) вагинит, мезоценоз, цитолитический вагиноз, вагинальная эпителиальная атрофия). [Анкирская А.С., Муравьева В.В. «Интегральная оценка состояния микробиоты влагалища. Диагностика оппортунистических вагинитов» (медицинская технология). – Москва, 2011. - 19 с.].
Для более детальной характеристики микрофлоры влагалища требуются молекулярные методы исследования, такие как полимеразная цепная реакция с детекцией результатов в режиме реального времени и секвенирование гена 16S рРНК, обладающая высокой чувствительностью и специфичностью. Суть метода ПЦР в режиме «реального времени» заключается в том, что с помощью метода ПЦР в «реальном времени» в исследуемой биопробе определяют общее число геномов микроорганизмов, характерных для конкретного биотопа, число геномов нормобиоты и условно-патогенной биоты.
Одним из ближайших аналогов для оценки микробного спектра слизистой влагалища у женщин в постменопаузе является способ оценки состояния микробиоты влагалища среди женщин репродуктивного возраста [Л.Д. Андросова, Медицинский Альманах №4 (13), ноябрь 2010, с. 177-179]. Суть данного способа диагностики дисбаланса микробиоты различных биотопов человека и степени его выраженности (RU 2362808), заключающийся в том, что с помощью метода полимеразной цепной реакции в «реальном времени» в исследуемой биопробе определяют общее число геномов бактерий, характерных для конкретного биотопа, число геномов нормобиоты и условно-патогенной биоты. Полученные величины сравнивают между собой, определяют соотношение между числом геномов нормобиоты и условно-патогенной биоты и при превышении числа геномов нормобиоты относительно числа геномов условно-патогенной биоты в 1000 раз констатируют отсутствие дисбаланса, оценивая данный показатель как вариант нормы. При значении данного показателя менее чем 1000 раз диагностируют дисбаланс и устанавливают степень его выраженности путем определения соотношения между числом геномов нормобиоты и общим числом геномов бактерий, присутствующих в исследуемой пробе, а также между числом геномов условно-патогенной биоты и нормобиоты. При снижении числа геномов нормобиоты относительно общего числа геномов бактерий в 10-100 раз и снижении числа геномов условно-патогенной биоты относительно числа геномов нормобиоты в 100-1000 раз устанавливают легкую степень дисбаланса, а при превышении числа геномов нормобиоты относительно общего числа геномов микроорганизмов более чем в 100 раз и превышении числа геномов условно-патогенной биоты относительно числа геномов нормобиоты в 10 раз и более раз или менее этой величины устанавливают выраженную степень дисбаланса.
Также известен другой способ диагностики инфекционно-воспалительных урогенитальных заболеваний у женщин, основанный на ПЦР в «реальном времени» [Болдырева М.Н., Липова Е.В., Витвицкая Ю.Г. Урогенитальные инфекции у женщин, обусловленные условно-патогенной биотой: способы выявления и коррекция // Научные исследования. - 2010. №2. - С. 26-31]. С помощью вышеописанной методики авторы определяют общую бактериальную массу, количественное и качественное содержание содержание Lactobacillus spp., Enterobacteriaceae, Streptococcus spp., Mobiluncus spp. / Corynebacterium spp., Lachnobacterium spp. / Clostridium spp., Peptostococcus spp., Eubacterium spp., Prevotella bivia / Porphyromonas spp., Megasphera spp. / Veilonella spp. / Dialister spp., Sneathia spp. / Leptotrihia spp. / Fusobacterium spp., Atopobium vaginae, Gardnerella vaginalis, Candida albicans. В зависимости от качественного и количественного состава микрофлоры авторы проводят микробиологическую диагностику (анаэробный вагиноз, аэробный вагинит, смешанный аэробно-анаэробный вагинит), а также оценивают степень выраженности нарушений: 1 степень (слабовыраженная) или 2 степень (выраженная).
В рамках диссертации на соискание степени кандидата медицинских наук по теме: «Патогенетическое обоснование дифференцированного лечения рецидивирующих сращений малых половых губ в периоде раннего детства» проведена работа по анализу микробного пейзажа у девочек от 0 до 3 лет (№2545897). С помощью ПЦР-исследования в режиме реального времени оценивали состояние микроценоза слизистой оболочки влагалища для здоровых девочек в возрасте от 0 до 3 лет, по результатам которого авторы установили такие параметры как общую бактериальную обсемененность в центильном интервале от 105,1 до 106,2 ГЭ/образец с представительством микроорганизмов: Prevotella bivia/Porphiromonas ГЭ/обр от 103,0 до 106,0, Enterobacterium spp. ГЭ/обр от 102,0 до 105,0, Eubacterium spp. ГЭ/обр от 103,0 до 106,0, Megasphaera spp/Velionella spp/Dialister ГЭ/обр от 103,0 до 105,0, Peptostreptococcus spp. ГЭ/обр от 103,0 до 105,0, Streptococcus spp. ГЭ/обр от 103,0 до 105,0, Mobiluncus spp. / Corynebacterium spp. ГЭ/обр от 103,0 до 105,0, Snethia spp / Fusobacterium spp / Leptotrihia ГЭ/обр от 102,0 до 105,0, Lachnobacterium spp / Clostridium spp. ГЭ/обр от 103,0 до 104,0, Staphylococcus spp. ГЭ/обр от 103,0 до 104,0, Gardnerella vaginalis ГЭ/обр от 0 до 103,0, Lactobacillus spp.ГЭ/обр от 0 до 102,0, Bifidobacterium ГЭ/обр от 0 до 103,0, Enterococcus spp. ГЭ/обр от 0 до 104,0, Atopobium vaginae ГЭ/обр от 0 до 103,0 при отсутствии ДНК патогенных микроорганизмов.
Данный способ, как и описанный выше, ориентированы на изучение микробиоты влагалища у женщин репродуктивного возраста и девочек в возрасте от 0 до 3 лет и не учитывают возможные особенности микробного пейзажа слизистой оболочки влагалища у женщин постменопаузального периода.
Задачей изобретения является разработка индивидуальных подходов лечения вагинальной атрофии у женщин в постменопаузе с учетом состояния биоценоза влагалища при использовании ПЦР-РВ.
Методика исследования
При выполнении данного исследования нами было обследовано 136 женщин в постменопаузе. Критериями отбора в группу обследуемых явились: отсутствие менструаций в течение последнего года, длительность менопаузы от 1 года до 20 лет. Критерии исключения были: гормонозависимые опухоли; влагалищное кровотечение неясной этиологии; тромбозы (венозные и артериальные), в т.ч. в анамнезе; прием ЗГТ в течение 6 месяцев до начала проведения исследования; системная и местная антибактериальная терапия в течение 1 месяца до начала проведения исследования; сахарный диабет; склероатрофический лихен; ИППП; дисплазия шейки матки средней и тяжелой степени, отказ пациентки от участия в исследовании на любом этапе.
Всем пациенткам проводили диагностику ВА с помощью цитологического метода исследования. Цитологический соскоб стенки влагалища производили из верхней трети с помощью урогенитального зонда. В дальнейшем вагинальный мазок подвергали окрашиванию согласно технике по Папаниколау и подсчету индекса созревания эпителия влагалища (ИСЭВ). ИСЭВ рассчитывали на основе процентного соотношения эпителиальных клеток: поверхностных; промежуточных; базальных и парабазальных: ИСЗВ = 0,5 × кол-во промежуточных клеток (%) + 1 × кол-во поверхностных клеток (%); (Норма - ≥65%; <65 - вагинальная атрофия).
Симптомы ВА оценивали с помощью валидизированной анкеты «Vulvovaginal Symptoms Questionnaire (VSQ)».
Для оценки интенсивности симптомов BA использовали 5-ти бальную систему D. Barlow.
1 балл - незначительная проблема, не оказывающая влияния на повседневную жизнь;
2 балла - дискомфорт, периодически влияющий на повседневную жизнь;
3 балла - выраженная рецидивирующая проблема, влияющая на повседневную жизнь;
4 балла - выраженные проблема, постоянно влияющая на повседневную жизнь;
5 баллов - крайне выраженная проблема, мешающая жить.
Для оценки состояния микробиоценоза влагалища проводилась ПЦР-диагностика мазка-соскоба. Забор биологического материала стенки влагалища осуществлялся при помощи стерильного уро-гинекологического зонда. Перед началом анализа количественного и качественного состава биоты исследуемого региона подтверждалось соблюдение техники получения соскоба эпителиоцитов. Показателем адекватности процедуры получения биоматериала являлось достаточное количество геномной ДНК человека (контроль взятия материала - КВМ), попадающей в пробу из эпителиальных клеток, при правильной технике взятия биоматериала. Показатель КВМ оценивался в абсолютных значениях (геном-эквивалент на образец, ГЭ/обр.), за минимально достаточный уровень принимался показатель, равный 104 ГЭ. При снижении данного показателя результат ПЦР в режиме реального времени считался недостоверным. Уровень КВМ, был валиден во всех случаях, что подтверждает объективность последующего анализа полученных результатов.
При исследовании микробиоценоза влагалища также учитывалась оценка состояния нормофлоры. Для оценки нормоценоза в зависимости от процентного соотношения доли лактобактерий в составе ОБМ были сформировано три группы: 1 - Lactobacillus spp.больше 80%, 2 - содержание Lactobacillus spp. от 20% до 80%, 3 - Lactobacillus spp. меньше 20%. В качестве нормоценоза был принят вариант биоценоза с высоким содержанием лактобактерий, т.е. 1 группа. 2 группа расценивалась как умеренный дисбиоз влагалища и 3 - как выраженный дисбиоз влагалища [«Применение метода полимеразной цепной реакции в реальном времени для оценки микробиоценоза урогенитального тракта у женщин (тест Фемофлор®)». Москва 2011]. Для удобства интерпретации данных из-за малочисленности 2 группы, 2 и 3 группы были объединены.
На последнем этапе проводили статистический анализ полученных клинико-лабораторных данных.
Полученные результаты
В исследовании приняли участие 136 женщин в возрасте от 40 до 75 лет (средний возраст - 55,3±5,8 года) в постменопаузе с длительностью постменопаузы от 1 года до 19 лет (средняя длительность постменопаузы - 6,4±5,2 года).
1 этап. Всем пациенткам провели цитологическое исследование стенки влагалища (вагинальная атрофия подтвердилась у 84 пациенток), анкетирование для уточнения наличия жалоб и их интенсивности, а также количественно определяли общую бактериальную массу, Lactobacillus spp., Enterobacteriaceae spp., Streptococcus spp., Staphylococcus spp., Gardnerella vaginalis/Prevotella bivia/ Porhyromonas spp., Eubacterium spp., Sneathia spp. / Leptotrihia spp. / Fusobacterium spp., Megasphaera spp. / Veillonella spp. / Dialister spp., Lachnobacterium spp. / Clostridium spp., Mobiluncus spp. / Corynebacterium spp., Peptostreptococcus spp., Atopobium vaginae, Mycoplasma (hominis/genitalium), Ureaplasma (urealyticum + parvum), Candida spp (ФЕМОФЛОР 16, («ДНК-Технология», Россия).
ДНК Mycoplasma hominis/genitalium и Candida spp. не были обнаружена ни в одном из образцов.
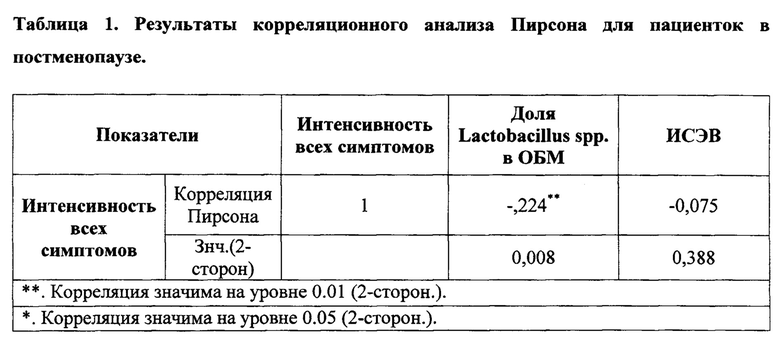
В дальнейшем результаты исследований подвергли корреляционному анализу, в котором учитывались следующие показатели: интенсивность всех симптомов, доля лактобактерий от ОБМ, индекс созревания. При проведении корреляционного анализа Пирсона нами было установлено, что наибольшая зависимость прослеживалась между интенсивностью симптомов и долей лактобактерий в ОБМ (таб. 1). Таким образом, нами отмечено, что жалобы пациенток в большей степени зависят от состояния биоценоза влагалища, чем от индекса созревания эпителия.
2 этап. Из 84 человек, у которых подтвердился диагноз вагинальная атрофия, были отобраны 44 пациентки, которые вошли в группы лечения. Длительность наблюдения составила 3 месяца. С помощью блочной рандомизации участницы исследования были разделены на 2 группы по 22 человека в каждой. В первой группе применяли препарат, в состав которого входил эстриол в дозе 0,5 мг (Овипол Клио), во второй группе использовали препарат, содержащий лиофилизированную культуру лактобактерий L. casei rhamnosus Doderleini - 341 мг.; эстриол - 0,2 мг.; прогестерон - 2,0 мг. (Триожиналь). Для пациенток обеих групп были разработаны схемы лечения с одинаковой курсовой дозой эстриола, составившая 9,8 мг (Группа 1: 0,5 мг эстриола через день - 3 недели, после по 0,5 мг × 1 раз в неделю - 9 недель; Группа 2: лиофилизированная культура лактобактерий L. casei rhamnosus Doderleini - 341 мг; эстриол - 0,2 мг; прогестерон - 2,0 мг ежедневно - 2 недели, далее через день - 10 недель). Из 44 пациенток трехмесячный курс лечения закончили 41 (93%). Две пациентки (9%) из первой группы и одна пациентка из второй группы (9%) прекратили прием препаратов в связи с побочными явлениями. Причиной отказа от приема терапии в первой группе послужили жалобы на зуд о влагалище (4,5%) и обострение цистита (4,5%). Во 2 группе пациентка также прекратила прием препарата в связи с появлением зуда во влагалище (4,5%). Исходно и в конце лечения всем пациенткам проводили цитологическое исследование стенки влагалища, анкетирование для уточнения наличия жалоб и их интенсивности, а также ПЦР-диагностику микрофлоры влагалища.
После 3 месяцев лечения в группах наблюдения отмечена высокая эффективность препаратов по параметру ИСЭВ. В 1 группе ИСЭВ среднем составил 76,8±12,9 (p<0,0001), во второй группе - 79,4±19,6 (p<0,0001).
Важно отметить, что после лечебного курса пациентки обеих групп отметили значимое улучшение своего состояния, облегчение или исчезновение жалоб. Как видно из представленных данных в таблице 2, в группах лечения пациентки были сопоставимы по частоте встречаемости жалоб как до, так и после лечения. В обеих группах по истечении срока лечения были пациентки, у которых сохранились жалобы. Однако интенсивность жалоб у пациенток 2 группы статистически значимо снизилась по сравнению с участницами из 2 группы. В первой группе исходно интенсивность симптомов составила 2,05±1,3, после лечения 1,57±1,3 (p=0,135). Во второй группе исходно интенсивность симптомов составила 2,04±1,43, после лечения - 0,95±1,32(p=0,013).
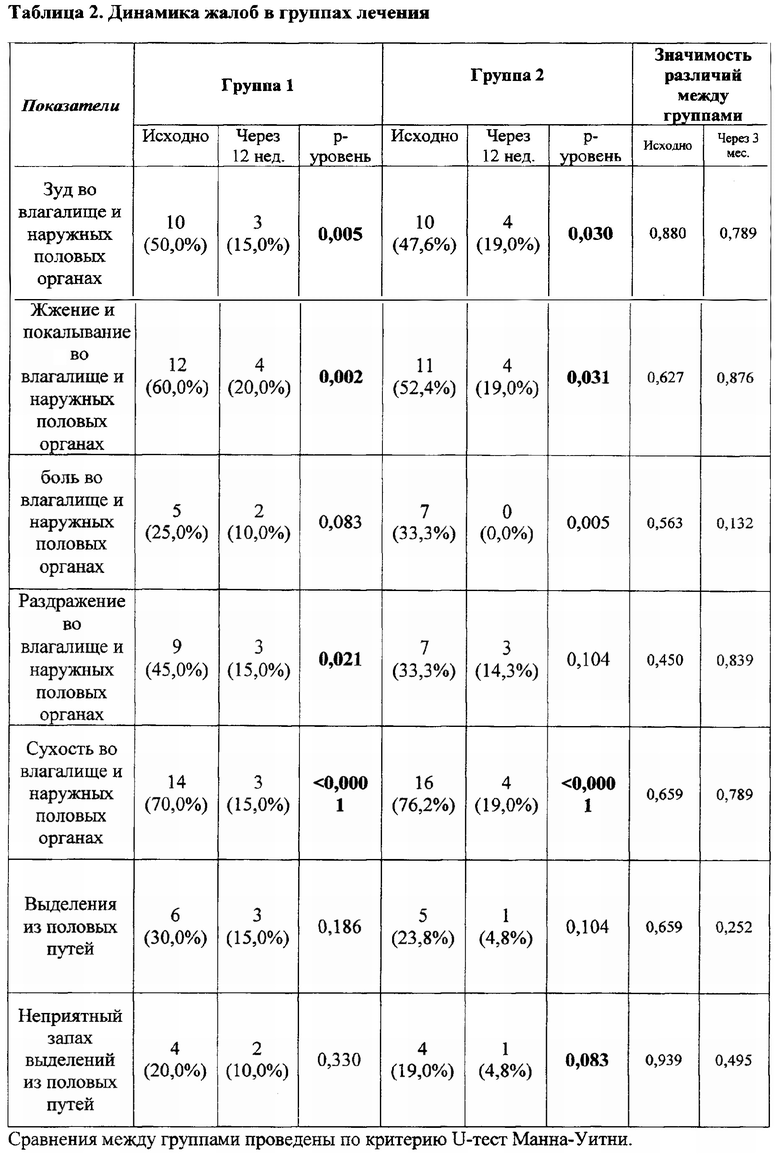
По данным ПЦР диагностики микробиоценоз слизистой оболочки влагалища исходно у женщин в группах лечения характеризовался резким снижением количества лактобактерий (1 группа - 0,0% (0,0 - 89,9); 2 группа - 0,0% (0,0 - 2,8)). После проведенного курса лечения отмечено повышение количества лактобактерий (1 группа - 17,9% (0,0 - 99,9) (p=0,178); 2 группа - 86% (8,0 - 99,2)) (p=0,014) табл. 3 и 4.
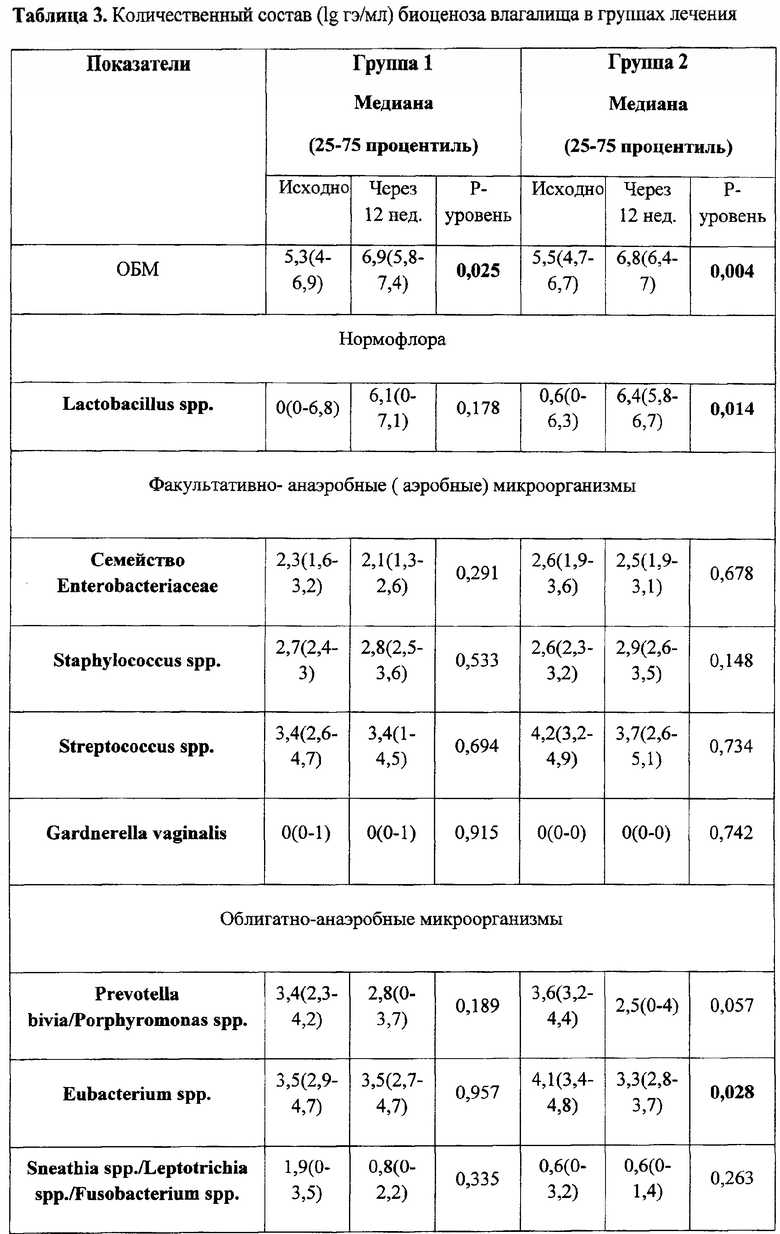
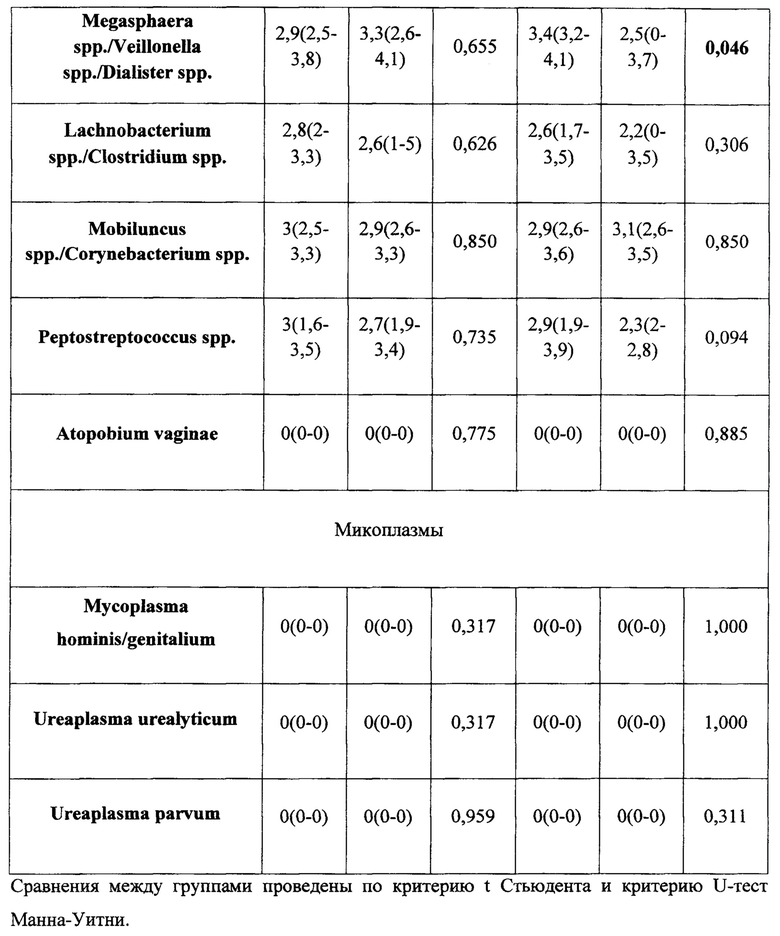
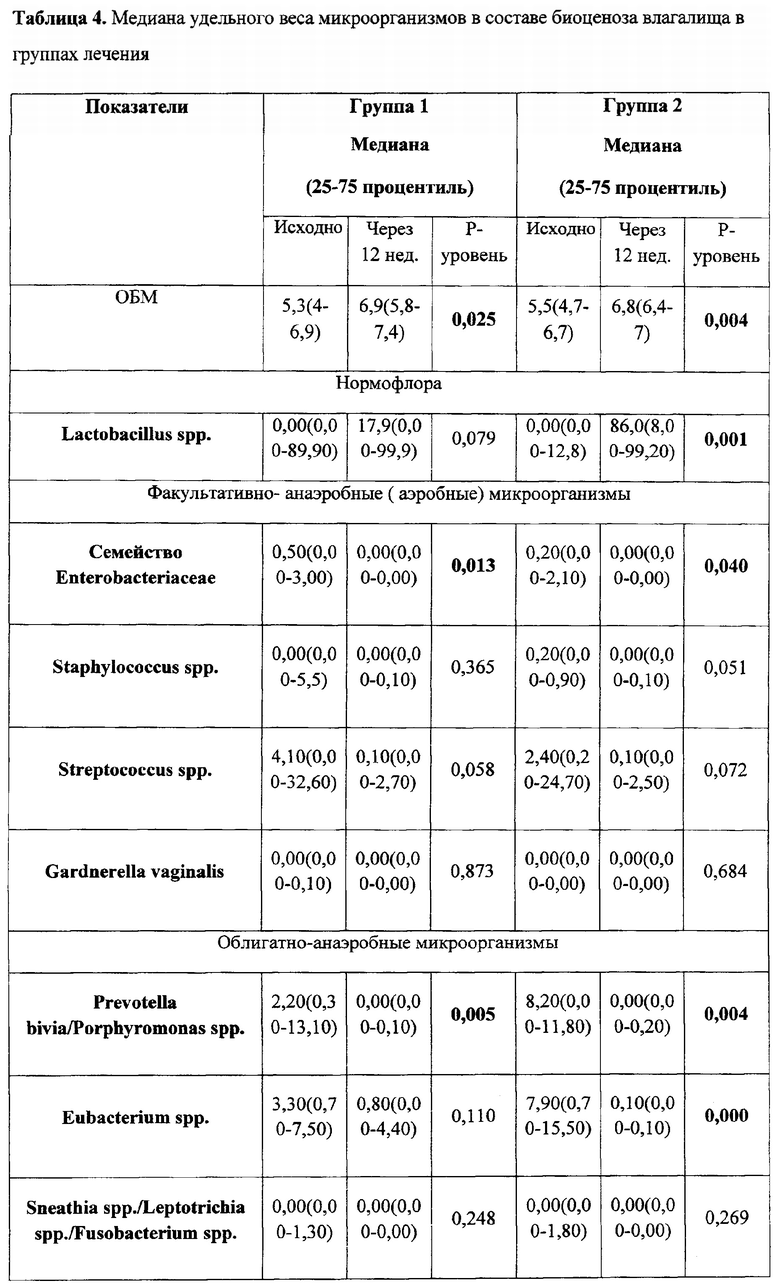
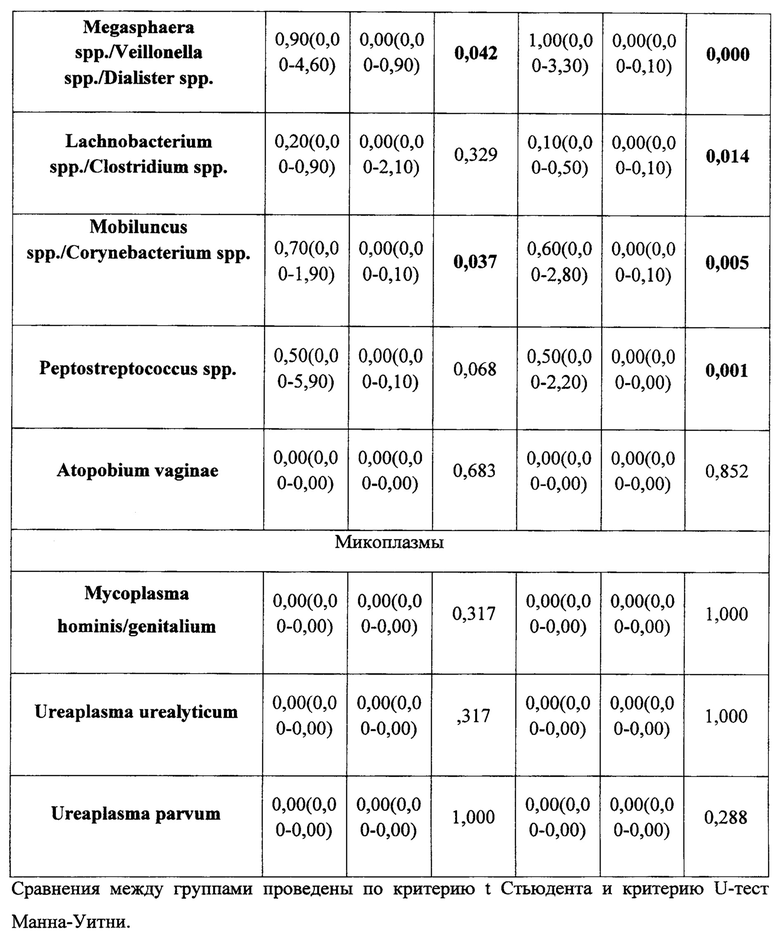
Важно отметить, что к концу терапии эстриолсодержащими препаратами увеличилась доля лактобактерий в ОБМ, что привело к повышению частоты выявления нормоценоза в исследуемых группах (табл. 5). Однако в первой группе частота встречаемости нормоценоза увеличилась лишь на 10%, в то время как во 2 группе лечения почти на 40%.

Суммируя вышепредставленные данные, мы видим, что на фоне применения комбинированного препарата во 2 группе у пациенток после проведенного курса лечения чаще наблюдали нормализацию биоценоза влагалища и, несмотря на сохранение жалоб, интенсивность жалоб была ниже, чем в 1 группе.
Способ осуществляется следующим образом.
Биоматериал со слизистой с заднего или боковых сводов влагалища, взятого с помощью вагинального или уретрального зонда путем соскоба с поверхности эпителия, помещают в отдельные одноразовые пластиковые пробирки типа Эппендорф с транспортной средой (1,5 мл с 300 мкл стерильного физиологического раствора или в пробирки с реагентом ПРОБА-РАПИД (ООО «НПО ДНК-Технология»).
С помощью ПЦР в режиме реального времени исследуют микрофлору влагалища и определяют количество геном-эквивалентов микроорганизмов, применяя следующую диагностическую панель: Lactobacillus spp., Enterobacteriaceae spp., Streptococcus spp., Staphylococcus spp., Gardnerella vaginalis / Prevotella bivia / Porhyromonas spp., Eubacterium spp., Sneathia spp. / Leptotrihia spp. / Fusobacterium spp., Megasphaera spp. / Veillonella spp. / Dialister spp., Lachnobacterium spp. / Clostridium spp., Mobiluncus spp. / Corynebacterium spp., Peptostreptococcus spp., Atopobium vaginae, Mycoplasma (hominis/genitalium), Ureaplasma (urealyticum + parvum), Candida spp., при этом осуществляют контроль взятия материала (КВМ) и оценивают общую бактериальную массу (ОБМ) (ФЕМОФЛОР 16, («ДНК-Технология», Россия). Интерпретация результатов с анализа показателя КВМ. Этот показатель отражает количество ДНК клеток человека, попавших в пробирку с биологическим материалом. Для получения адекватных результатов исследования величина КВМ должна быть больше 104 ГЭ/образец, в этом случае можно переходить к дальнейшему анализу. Если КВМ меньше 104 ГЭ/образец, то забор материала необходимо повторить. Следующим этапом заключается в оценке ОБМ. Величина ОБМ должна находиться в пределах от 105 до 107 ГЭ/образец. Если ОБМ меньше 105 ГЭ/образец, то соотношения различных микроорганизмов могут определяться с большой погрешностью. Далее проводится оценка состояния нормофлоры: количества Lactobacillus spp. относительно ОБМ. В зависимости от этого показателя различают: 1. Lactobacillus spp.больше 80% - состояние нормоценоза (физиологического микробиоценоза влагалища) характеризующегося доминированием нормофлоры. И Lactobacillus spp. менее 80% - дисбиоз влагалища.
Клинические примеры
Пример 1. Пациентка A, 51 года, обратилась с жалобами на сухость во влагалище. При анализе интенсивности жалоб, пациентка оценила ощущаемый дискомфорт как крайне выраженную проблему, мешающую жить. На основании цитологического исследования, был выставлен диагноз «Вагинальная атрофия», ИСЭВ составил 51,5. Произведено взятие биоматериала для исследования с помощью ПЦР в «реальном времени». При этом выявлено: КВМ - 4,65 ГЭ/образец, ОБМ - 7,53 ГЭ/образец Lactobacillus spp. - 7,38 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 2,53 ГЭ/образец, Streptococcus spp. - 2,97 ГЭ/образец, Staphylococcus spp. - 3,62 ГЭ/образец, Eubacterium spp. - 3,03 ГЭ/образец, Gardnerella vaginalis - 0,00 ГЭ/образец, Prevotella bivia/Porphyromonas spp. - 2,65 ГЭ/образец, Mycoplasma hominis - 0,00 ГЭ/образец, Ureaplasma urealyticum - 0,00 ГЭ/образец; Candida spp. - 0,00 ГЭ/образец. Состояние биоценоза влагалища было расценено, как норомценоз. В дальнейшем пациентке была назначена локальная гормональная терапия (препарат Овипол клио). После проведенного курса лечение, длительность которого составила 3 месяца, пациентку не беспокоила сухость во влагалище. Согласно данным повторного цитологического исследования стенки влагалища ИСЭВ составил 94. При повторной ПЦР-диагностике соскоба влагалища выявлено: КВМ - 4,65 ГЭ/образец, ОБМ - 7,44 ГЭ/образец Lactobacillus spp. - 7,26 ГЭ/образец. УПМ были представлены: Enterobacteriaceae -1,26 ГЭ/образец, Streptococcus spp. - 0,00 ГЭ/образец, Staphylococcus spp. - 2,09 ГЭ/образец, Eubacterium spp. - 1,94 ГЭ/образец, Gardnerella vaginalis - 0,00 ГЭ/образец, Prevotella bivia/Porphyromonas spp. - 2,47 ГЭ/образец, Mycoplasma hominis - 0,00 ГЭ/образец, Ureaplasma urealyticum - 0,00 ГЭ/образец; 0,00 ГЭ/образец. Состояние биоценоза влагалища было расценено как нормоценоз.
Пример 2. Пациентка Б, 47 лет, обратилась с жалобами на зуд, жжение, боль, раздражение, сухость во влагалище, наличие выделений из половых путей с неприятным запахом и диспареунию. При анализе интенсивности жалоб пациентка оценила ощущаемый дискомфорт как крайне выраженную проблему, мешающую жить. На основании цитологического исследования был выставлен диагноз «Вагинальная атрофия», ИСЭВ составил 60. Произведено взятие биоматериала для исследования с помощью ПЦР в «реальном времени». При этом выявлено: КВМ - 4,88 ГЭ/образец, ОБМ - 6,06ГЭ/образец Lactobacillus spp .- 0,62 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 3,06ГЭ/образец, Streptococcus spp. - 6,24 ГЭ/образец, Staphylococcus spp. - 2,65 ГЭ/образец, Eubacterium spp. - 3,76 ГЭ/образец, Gardnerella vaginalis - 0,00 ГЭ/образец, Prevotella bivia/Porphyromonas spp. - 3,65 ГЭ/образец, Mycoplasma hominis - 0,00 ГЭ/образец, Ureaplasma urealyticum - 0,00 ГЭ/образец; 0,00 ГЭ/образец. Состояние биоценоза влагалища было расценено как дисбиоз. В дальнейшем пациентке была назначена локальная гормональная терапия (препарат Триожиналь), содержащая лактокультуру. После проведенного лечения пациентка отметила улучшение состояния. После проведенного курса лечение, длительность которого составила 3 месяца, из вышеперечисленных жалоб сохранилась сухость во влагалище, однако интенсивность данной жалобы пациентка расценила как незначительную проблему, не оказывающую влияния на повседневную жизнь. Согласно данным повторного цитологического исследования стенки влагалища ИСЭВ составил 85. При повторной ПЦР-диагностике соскоба влагалища выявлено: КВМ - 4,65 ГЭ/образец, ОБМ - 7,24 ГЭ/образец Lactobacillus spp. - 4,94 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 0,00ГЭ/образец, Streptococcus spp. - 7,35 ГЭ/образец, Staphylococcus spp. - 1,50 ГЭ/образец, Eubacterium spp. - 2,47 ГЭ/образец, Gardnerella vaginalis - 0,00 ГЭ/образец, Prevotella bivia/Porphyromonas spp. - 0,00 ГЭ/образец, Mycoplasma hominis - 0,00 ГЭ/образец, Ureaplasma urealyticum - 0,00 ГЭ/образец; Candida spp. - 0,00 ГЭ/образец. Состояние биоценоза влагалища было расценено как нормоценоз.
Пример 3. Пациентка В, 54 лет, обратилась с жалобами на зуд, жжение, сухость во влагалище, наличие выделений из половых путей. При анализе интенсивности жалоб пациентка оценила ощущаемый дискомфорт как крайне выраженную проблему, мешающую жить. На основании цитологического исследования был выставлен диагноз «Вагинальная атрофия», ИСЭВ составил 51,5. Произведено взятие биоматериала для исследования с помощью ПЦР в «реальном времени». При этом выявлено: КВМ - 5,53 ГЭ/образец, ОБМ - 3,85 ГЭ/образец Lactobacillus spp. - 0,00 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 1,88 ГЭ/образец, Streptococcus spp. - 2,24 ГЭ/образец, Staphylococcus spp. - 2,85 ГЭ/образец, Eubacterium spp. - 3,21 ГЭ/образец, Gardnerella vaginalis - 0,00 ГЭ/образец, Prevotella bivia/Porphyromonas spp. - 3,65 ГЭ/образец, Mycoplasma hominis - 0,00 ГЭ/образец, Ureaplasma urealyticum - 0,00 ГЭ/образец; Candida spp. - 0,00 ГЭ/образец. Состояние биоценоза влагалища было расценено как дисбиоз. В дальнейшем пациентке была назначена локальная гормональная терапия (препарат Овипол клио). После проведенного курса лечение, длительность которого составила 3 месяца, из вышеперечисленных жалоб сохранились сухость во влагалище и зуд. Интенсивность данных жалоб пациентка расценила как выраженную рецидивирующую проблему, влияющую на повседневную жизнь. Согласно данным повторного цитологического исследования стенки влагалища ИСЭВ составил 71. При повторной ПЦР-диагностике соскоба влагалища выявлено: КВМ - 5,21 ГЭ/образец, ОБМ - 4,56 ГЭ/образец Lactobacillus spp. - 0,00 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 2,24 ГЭ/образец, Streptococcus spp. - 3,44 ГЭ/образец, Staphylococcus spp. - 2,50 ГЭ/образец, Eubacterium spp. - 4,24 ГЭ/образец, Gardnerella vaginalis - 2,09 ГЭ/образец, Prevotella bivia/Porphyromonas spp. - 3,97 ГЭ/образец, Mycoplasma hominis - 0,00 ГЭ/образец, Ureaplasma urealyticum - 0,00 ГЭ/образец; Candida spp. - 0,00 ГЭ/образец. Состояние биоценоза влагалища было расценено, как дисбиоз.
Литература
1. Андросова Л.Д., Медицинский Альманах №4 (13), ноябрь 2010, с.1 77-179.
2. Анкирская А.С., Муравьева В.В. Опыт микробиологической диагностики оппортунистических инфекций влагалища // Клиническая микробиология и антимикробная химиотерпия. - 2001. - том 3. - №2. - С. 190-194.
3. Анкирская А.С., Муравьева В.В. «Интегральная оценка состояния микробиоты влагалища. Диагностика оппортунистических вагинитов» (медицинская технология). – М.: 2011. - 19 с.
4. Болдырева М.Н., Липова Е.В., Витвицкая Ю.Г. Урогенитальные инфекции у женщин, обусловленные условно-патогенной биотой: способы выявления и коррекция // Научные исследования. - 2010. №2 - с. 26-31.
5. Воропаева Е.А., Караулов А.В., Афанасьев С.С. и др. Оценка микробиоценоза влагалища при акушерской и гинекологической патологии (новая медицинская технология). – М.-Астрахань: АГМА. - 2012. - 50 с.
6. Ворошилина Е.С., Тумбинская Л.В., Донников А.Е., Плотко Е.Э., Хаютин Л.В. Биоценоз влагалища с точки зрении количественной полимеразно-цепной реакции: что есть норма? // Акушерство и гинекология. - 2011. - №1. - с. 57-65
7. Шипицына Е.В., Мартикайнен З.М., Воробьева Н.Е., Ерошкина М.С., Степанова О.С., Донников А.Е., и др. Применение теста Фемофлор для оценки микробиоценоза влагалища // Журнал акушерства и женских болезней. - 2009. - том LVIII. - выпуск 3. - с. 44-50.
8. Есефидзе Жанна Тамазовна. Клинико-патогенетические особенности вагинальной атрофии в постменопаузе. Диссертация на соискание ученой степени кандидата медицинских наук. – М.: 2002.
9. Гасанова Мехрибан Кязим кызы. Современные подходы к диагностике и лечению серозометры в постменопаузе. Диссертация на соискание ученой степени кандидата медицинских наук. – М.: 2008.
10. Батырова Залина Кимовна. Патогенетическое обоснование дифференцированного лечения рецидивирующих сращений малых половых губ в периоде раннего детства. – М.: 2014.
11. «Применение метода полимеразной цепной реакции в реальном времени для оценки микробиоценоза урогенитального тракта у женщин (тест Фемофлор®)». – М.: 2011
12. Урогенитальные расстройства в климактерии (клиника, диагностика, заместительная гормонотерапия). Дис. д-ра мед. наук. - М.: 1998.
13. The North American Menopause Society. Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society. 2013; 20(9): 888-902.
14. Rebecca M. Brotman, PhD, MPH,1,2 Michelle D. Shardell, PhD,2 Pawel Gajer, PhD,1 Doug Fadrosh, MS,1 Kathryn Chang, RN,3 Michelle I. Silver, ScM,3 Raphael P. Viscidi, MD,4 Anne E. Burke, MD, MPH,5 Jacques Ravel, PhD,1,6 and Patti E. Gravitt, PhD, MS3. Association between the vaginal microbiota, menopause status, and signs of vulvovaginal atrophy. Menopause, Vol. 21, No. 5, 2014.
15. Bomar L, Maltz M, Colston S, Graf J. Directed culturing of microorganisms using metatranscriptomics. mBio 2011; 2: e00012-e00011.e37818.
16. Brotman R, Gajer P, Sakamoto J, et al. Temporal dynamics of vaginal bacterial communities. International Society for Sexually Transmitted Disease Research, July 10 to 13, 2011, Quebec City, Canada.
17. Elisabeth A. Erekson et al. The Vulvovaginal Symptoms Questionnaire: a questionnaire for measuring vulvovaginal symptoms in postmenopausal women. Menopause: The Journal of The North American Menopause Society Vol. 20, No. 9, pp. 973/979.
18. Hummelen R, Macklaim JM, Bisanz JE, et al. Vaginal microbiome and epithelial gene array in post-menopausal women with moderate to severe dryness. PLoS One 2011; 6: e26602.
19. Sturdee DW, Panay N. Recommendations for the management of postmenopausal vaginal atrophy. Climacteric 2010; 13: 509-522.
20. Santiago Palacios. Managing urogenital atrophy.// Maturitas. - 2009; 63: 315-318
21. James H. Pickar. Emerging therapies for postmenopausal vaginal atrophy. // Maturitas. - 2013; 75: 3-6.
22. Camil Castelo-Branco, Maria Jes'us Cancelo, Jose Villero, Francisco Nohales, Maria Dolores Juli'a. Management of post-menopausal vaginal atrophy and atrophic vaginitis. // Maturitas. - 2005; 52: 46-52.
23. Kingsberg SA, Krychman ML. Resistance and barriers to local estrogen therapy in women with atrophic vaginitis. // J Sex Med. - 2013; 1567-74.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЦЕНТИЛЬНОЙ ОЦЕНКИ МИКРОЦЕНОЗА СЛИЗИСТОЙ ВЛАГАЛИЩА У ДЕВОЧЕК В ВОЗРАСТЕ ОТ 0 ДО 3 ЛЕТ | 2014 |
|
RU2545897C1 |
| СПОСОБ ОЦЕНКИ МИКРОБНОГО СПЕКТРА ЭНДОМЕТРИЯ ДЛЯ ЭТИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ХРОНИЧЕСКОГО ЭНДОМЕТРИТА | 2015 |
|
RU2599479C1 |
| Способ центильной оценки микроценоза слизистой влагалища у девочек в зависимости от стадии полового созревания с учетом шкалы Таннера | 2016 |
|
RU2671561C2 |
| СПОСОБ КОМПЛЕКСНОЙ ДИАГНОСТИКИ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА ВУЛЬВЫ И ВЛАГАЛИЩА БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ У ДЕВОЧЕК В ВОЗРАСТЕ ОТ 0 ДО 8 ЛЕТ | 2014 |
|
RU2563182C1 |
| Способ лабораторной верификации вагинита у девочек с вульвитом в возрасте до 8 лет | 2016 |
|
RU2622028C1 |
| Способ прогнозирования преждевременных родов | 2022 |
|
RU2783672C1 |
| Способ диагностики состояния микрофлоры влагалища и кишечника у женщин с осложненной беременностью | 2020 |
|
RU2742110C1 |
| Способ прогноза риска дородового излития околоплодных вод при доношенной беременности | 2020 |
|
RU2739123C1 |
| Способ выявления и оценки уровня патогенности возбудителей оппортунистических инфекций у женщин репродуктивного возраста и новорожденных детей для прогнозирования течения и развития осложнений инфекционных заболеваний | 2016 |
|
RU2638453C1 |
| СПОСОБ КРИОКОНСЕРВАЦИИ ВАГИНАЛЬНОЙ МИКРОБИОТЫ | 2022 |
|
RU2800686C1 |
Изобретение относится к области медицины, в частности к гинекологии, и предназначено для лечения вагинальной атрофии у женщин в постменопаузе с учетом состояние биоценоза влагалища. Биоматериал берут с помощью вагинального или уретрального зонда путем соскоба влагалища. Методом ПЦР в режиме реального времени с помощью комплекта реагентов «Фемофлор-16» определяют количество геном-эквивалентов микроорганизмом и их долю в общей бактериальной массе. Если доля Lactobacillus spp. больше 80%, диагностируют нормоценоз, характеризующийся доминированием нормофлоры. Если доля Lactobacillus spp. менее 80%, диагностируют дисбиоз. При вагинальной атрофии на фоне нормоценоза назначают гормональную терапию. При вагинальной атрофии на фоне дисбиоза назначают гормональную терапию и препараты, содержащие лактокультуру. Изобретение обеспечивает разработку индивидуальных подходов лечения вагинальной атрофии у женщин в постменопаузе с учетом состояния биоценоза влагалища. 5 табл., 3 пр.
Способ лечения вагинальной атрофии у женщин в постменопаузе, отличающийся тем, что терапию подбирают с учетом состояние биоценоза влагалища, биоматериал со слизистой с заднего или боковых сводов влагалища, взятый с помощью вагинального или уретрального зонда путем соскоба с поверхности эпителия, исследуют методом ПЦР в режиме реального времени с помощью комплекта реагентов «Фемофлор-16» и определяют количество геном-эквивалентов и долю в общей бактериальной массе Lactobacillus spp., Enterobacteriaceae spp., Streptococcus spp., Staphylococcus spp., Gardnerella vaginalis/Prevotella bivia/ Porhyromonas spp., Eubacterium spp., Sneathia spp./Leptotrihia spp./ Fusobacterium spp., Megasphaera spp./Veillonella spp./Dialister spp., Lachnobacterium spp./Clostridium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp., Atopobium vaginae, Mycoplasma (hominis/genitalium), Ureaplasma (urealyticum + parvum), Candida spp., полученные результаты оценивают следующим образом: доля Lactobacillus spp. больше 80% - нормоценоз, характеризующийся доминированием нормофлоры; доля Lactobacillus spp. менее 80% - дисбиоз влагалища, и при вагинальной атрофии на фоне нормоценоза влагалища назначают гормональную терапию, а при вагинальной атрофии на фоне дисбиоза назначают гормональную терапию и препараты, содержащие лактокультуру.
| ПРИСПОСОБЛЕНИЕ ДЛЯ УБИВАНИЯ КРЫС И МЫШЕЙ ЭЛЕКТРИЧЕСКИМ ТОКОМ | 1926 |
|
SU14878A1 |
| СПОСОБ ЛЕЧЕНИЯ КЛИМАКТЕРИЧЕСКИХ РАССТРОЙСТВ У ЖЕНЩИН ВО ВРЕМЯ ИЛИ ПОСЛЕ МЕНОПАУЗЫ | 2001 |
|
RU2268035C2 |
| АНДОСОВА Л.Д | |||
| и др | |||
| Характеристика биоценозов урогенитального тракта у женщин репродуктивного возраста с применением теста "Фемофлор" | |||
| Медицинский альманах | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ШЕВЧЕНКО Е.П | |||
| и др | |||
| Диагностика урогенитальных нарушений у женщин, обусловленных условно-патогенными микроорганизмами, с применением метода полимеразной цепной реакции в режиме реального времени | |||
| Украiнський журнал дерматологіi, венерологіi, косметологіi | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2017-11-24—Публикация
2017-02-20—Подача