Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям на основе гликозаминогликана для местного применения, которые способствуют проникновению гликозаминогликанов, модифицированных посредством ковалентного связывания липидных фрагментов с 1-10% дисахаридных мономерных звеньев, через кожный барьер в эпидермальный и дермальный слои кожи, за счет чего обеспечивается кожное применение гликозаминогликана без необходимости инъекции. В частности, предложенные в изобретении композиции способны доставлять гиалуронан до эпидермального и дермального слоев кожи, в которых он задерживается на более длительное время, чем при местном применении гиалуронана, и могут применяться для омолаживания, улучшения состояния кожи, восполнения содержания гиалуронана и защитной терапии. Композиции также могут применяться в качестве средств доставки лечебных соединений, включая полипептиды, белки и другие биомакромолекулы аналогичного размера, для облегчения их прохождения через кожный барьер. Также предложен способ изготовления композиции, к которой степень ковалентного связывания липидного фрагмента с гликозаминогликаном регулируется за счет использования активирующего средства в качестве ограничивающего реагента.
Предпосылки создания изобретения
Процесс старения кожи лица происходит в виде ряда предсказуемых событий, проявляющихся в уменьшении объема и потере упругости кожи. Уменьшение объема кожи, причиной которого является множество факторов, включая разложение коллагена, приводит к атрофии подкожной жировой клетчатки, нижележащих мышечных и фасциальных слоев кожи, развитию носогубных складок, утрате очерченности контура челюсти и огрублению кожи. Потеря упругости кожи приводит к дряблости и обвисанию лицевой ткани. Для борьбы с этими явлениями используются омолаживающие процедуры в попытке скорректировать как тканевый объем, так и тонус и добиться естественного внешнего вида подвергнутой лечению кожи. Эти процедуры могут предусматривать использование наполнителей ткани, например инъекций коллагена или хирургическое подтягивание наряду с другими средствами, используемыми по отдельности или в сочетании.
В настоящее время доступен ряд временных наполнителей ткани, таких как коллаген, гиалуронан и гидроксиапатит, однако эти наполнители вводятся посредством ряда инъекций и обеспечивают лишь временный эффект, часто длящийся не более 12 месяцев в случае коллагена и гиалуронана. Применение имеющих более длительный эффект средств, таких как гидроксиапатиты (которые способны действовать в течение 2-5 лет), также предусматривает аутотрансплантацию жировой ткани (действующую в течение 1-3 лет) с использованием подкожных жировых клеток с целью коррекции потери объема и обвисания и придания помолодевшего внешнего вида кожи лица.1,2,3 Последействия инъекций, которые могут длиться до одной недели, могут включать припухлость, покраснение, боль, кровоподтеки и болезненность. Кроме того, лечение требует умелого введения множества инъекций и сопряжено с риском инфекции в местах инъекций.
Возможно, наиболее важным типом клеток для обеспечения помолодевшего внешнего вида кожи являются кератиноциты. Соответственно, они необходимы для поддержания увлажнения кожи и в особенности предрасположены к старению под воздействием факторов окружающей среды, таких как ультрафиолетовое излучение, поскольку они подвержены воздействию этих факторов более постоянно, чем клетки кожи других типов. Кроме того, согласно недавним данным процессу старения, вызванного внутренним состоянием организма, предположительно также могут способствовать наследственные кератиноцитные факторы. Поскольку кератиноциты вырабатывают паракринные факторы, которые влияют на состояние/функционирование фибробластов и других кожных клеток, факторы, пагубные для функций кератиноцитов также пагубны для функций кожных клеток.6 Гиалуронан (также известный как гиалуронат и гиалуроновая кислота) представляет собой крупный отрицательно заряженный гликозаминогликановый полисахарид, повсеместно распространенный в организме и в особо больших количествах содержащийся в коже.4 Как дермальный, так эпидермальный слои кожи имеют высокое содержание гиалуронана, который присутствует в составе заключенной в оболочку внеклеточной матрицы (которая также содержит коллаген и другие белки), в которой он окружает клетки (например, эпидермальные кератиноциты и дермальные фибробласты).5 Хотя молодая кожа имеет высокое содержание перицеллюлярного гиалуронана как в кератиноцитном, так и дермальном слоях, в стареющей коже его количество в обоих слоях снижается, при этом потеря гиалуронана в кератиноцитном слое является значительно более выраженной, чем в дермальном слое.6
В молодо выглядящей коже гиалуронан служит для кератиноцитов в эпидермисе и фибробластов в дерме эффективной оболочкой в виде желеобразной капсулы (оболочки клетки), которая обеспечивает клетки соответствующими факторами роста и питательными веществами, способствующими выработке коллагена и эластина, характерных для молодо выглядящей кожи. Помимо гиалуронана основным компонентом клеточных капсул или оболочек также считаются внеклеточные белки и другие вещества, такие как коллагены, протеогликаны (PG), такие как TSG-6, и другие гликозаминогликаны. Трехмерная структура гиалуронана имеет форму плавной спирали (в которой высокомолекулярные элементы различимы как длинные линейные цепочки), которая может переплетаться, обеспечивая тем самым идеальный шаблон для формирования матриц вокруг клеток. Эти капсулы или оболочки обычно сохраняются вокруг клеток за счет связывания гиалуронана с клеточными рецепторами, например CD44, RHAMM, LYVE 1 и другими. По мере старения кожи способность дермальных фибробластов и кератиноцитов сохранять свои гиалуронановые капсулы снижается, что приводит к обезвоженному и обвисшему внешнему виду стареющей кожи.5,7 Кроме того, при травмировании кожи, например, в результате воздействия чрезмерного ультрафиолетового излучения (солнечных ожогов) выработка гиалуронана клетками дермы снижается, что приводит к усилению распада гиалуронана и увеличению содержания продуктов распада гиалуронана в коже.
Капсулы гиалуронана содержат белки структурной матрицы, которые гидратируют и защищают клетки, а также питательные вещества, цитокины, гормоны, и факторы роста, необходимые для поддержания оптимального состояния обмена веществ и дифференцировки клеток. Способность обеспечивать строительные матрицы является ведущим фактором, лежащим в основе применения гиалуронана для сохранения молодой кожи. Вторым фактором являются вязкоупругие свойства гиалуронана, которые влияют на диффузию питательных веществ из системы кровоснабжения и упругость кожи; в совокупности эти факторы обеспечивают текстуру и гладкость, характерные для молодой кожи. Третьим фактором является способность перицеллюлярного гиалуронана служить мишенью для активных форм кислорода (ROS), которые могут вырабатываться после воздействия ультрафиолетового излучения спектра А/В, способного агрессивно воздействовать на гиалуронан и разбивать его на фрагменты, которые в свою очередь защищают другие клеточные факторы от вызываемого ROS повреждения. Последний фактор связан с непосредственным биологическим воздействием гиалуронана на кератиноцит и фибробласты. Гиалуронан способствует как пролиферации, так и дифференцировке кератиноцитов. Например, такие факторы, как ретиноевая кислота, которая усиливает дифференцировку кератиноцитов, также укрепляет перицеллюлярную гиалуронановую оболочку. Кроме того, добавление in vitro или in vivo гиалуронана к кератиноцитам способствует увеличению толщины кератиноцитного слоя и дифференцировке кератиноцитов, о чем свидетельствует экспрессия CD44 и кератина. Гиалуронан также влияет на дифференцировку фибробластов путем блокирования их трансдифференцировки в миофибробласты, которые являются кожными клетками, вырабатывающими большие количества коллагена I и обладающими присущими им сократительными свойствами, что в обоих случаях способствует образованию морщин.
Со временем гиалуронановые оболочки клеток распадаются (разбиваются на фрагменты) и все в большей степени поглощаются клетками в процессе их старения. Причиной этого распада частично является происходящее со временем накопление бескислородных радикалов и изменение генетически управляемой программы развития (например, старения), что способствует высвобождению гиалуронидазы, которая разрушает или разбивает на фрагменты гиалуронановую оболочку. Образующиеся фрагменты активизируют механизм поглощения клетками, что приводит к демонтажу и разрушению гиалуронановой оболочки клеточными лизоцимами. Помимо того, что гиалуронан все в большей степени истощается в стареющей коже, в частности, вокруг кератиноцитов, было также обнаружено, что гиалуронан истощается в морщинистых областях молодой кожи в результате воздействия ультрафиолетового излучения спектра А/В, применения стероидов или воспаления.5,6,8,9
Гиалуронановый рецептор CD44 конститутивно экспрессирует в кератиноцитах и других клетках кожи, и считается существенно важным для задержания гиалуронана вокруг клеток в слоях, известных как "оболочки клеток", и для соответствующего метаболизма гиалуронана в коже.5,10,11,12 В процессе старения и после воздействия факторов старения, таких как ультрафиолетовое излучение или заболевания/факторы, вызывающие атрофию кожи, кожа теряет рецептор CD44.5,9 В отличие от этого, экспрессия RHAMM, являющегося одним из дополнительных гиалуронановых рецепторов, который при нормальных условиях в значительной степени не экспрессирует в нормальной коже, усиливается в результате воздействия ультрафиолетового излучения спектра А/В и других травмирующих факторов. Считается, что RHAMM благоприятствует способности CD44 усваивать/метаболизировать гиалуронан. Для выработки и задержания гиалуронановой оболочки, окружающей кожные клетки, также важны связывающие нецелый внеклеточный гиалуронан белки, такие как TSG-6.13
Хотя известно, что гиалуронан обладает идеальными свойствами для применения в качестве наполнителя тканей для восстановления свойств молодой кожи, единственными доступными в настоящее время продуктами, которые оказывают воздействие ниже кожного барьера, а не на поверхность кожи, являются сшитые формы гиалуронана, которые инъецируют с целью разглаживания морщин на лице и увеличения объема лицевых областей, таких как губы. Хотя сшитый гиалуронан действительно лучше задерживается в месте инъекции, эти инъекции не действуют постоянно и должны периодически (раз в 6-12 месяцев) повторяться для сохранения их омолаживающего эффекта. Тем не менее считается, что в результате самосшивания гиалуронана снижается его способность связывать рецепторные белки на поверхности клеток, что является ключевым свойством, необходимым для заключения клеток в оболочку из гиалуронана. Одним из дополнительных затруднений является сложность в равномерном распределении или "разглаживании" инъецированного гиалуронана под кожей. Таким образом, хотя применяемый в виде инъекций гиалуронан может действовать как эффективный временный наполнитель, он не способен действовать таким же образом, как естественный гиалуронан и обеспечивать защищающую клетки оболочку. Хотя распад наполнителей на основе сшитого гиалуронана для инъекций предположительно может служить источником гиалуронана, маловероятно, что гиалуронан задерживается с учетом известного истощения рецепторов гиалуронана на поверхностях клеток кожи и высокой скорости распада гиалуронана в коже.
Поскольку содержащие сшитый гиалуронан наполнители для инъекций вводятся только в месте морщины или носогубной складки, эти процедуры обеспечивают не "омолаживание" кожи путем восполнения содержания истощенного гиалуронана в соседних областях, а видимость омоложения за счет заполнения потерявшей тонус области. В результате, введение наполнителей кожи для инъекций не помогает предотвращать или замедлять появление новых морщин в соседних необработанных областях и не устраняет первопричину, которой является дефицит гиалуронана и как следствие снижение увлажнения кожи.
С учетом естественного присутствия гиалуронана в коже и его истощения в процессе старения под действием ультрафиолетового излучения (солнечных ожогов и фотостарения) и других повреждений кожи помимо применения гиалуронана в качестве наполнителя для инъекций его также включают во многие средства по уходу за кожей. Гиалуронан для местного применения должен проникать через гидрофобный слой церамида/кератина, покрывающий наружные слои кератиноцитов. Тем не менее, поскольку гиалуронан является полианионом, маловероятно, что он способен эффективно проникать через кератиноцитный слой кожи. Соответственно, гиалуронан для местного применения оказывает поверхностное воздействие (например, традиционные содержащие гиалуронан кремы для кожи) или должен вводиться путем инъекций, если желательно значительное проникновение в кожу (например, при борьбе с морщинами, когда вводятся инъекции сшитого гиалуронана).
По имеющимся данным гиалуронан с определенной молекулярной массой способен до некоторой степени проникать через кожный барьер. В статье Brown и др.14 указано, что гиалуронан с молекулярной массой 250 и 400 килодальтон в сочетании с полиэтиленгликолем и бензиловым спиртом, которые являются известными способствующими проникновению веществами, способен проникать через кожный барьер. Хотя в некоторых других источниках сообщалось, что неопределенные фракции, содержащие гиалуронан с молекулярной массой 40-400 килодальтон, способны проникать через рот и кожу человека 15, также известно, что нативный гиалуронан с молекулярной массой >400 килодальтон не проникает через кожу в случае местного применения. Кроме того, хотя в статье Brown и др. продемонстрировано, что гиалуронан способен проникать через кожный барьер, очевидно, что доля гиалуронана, проникающая через кожу, является небольшой, и гиалуронан быстро попадает в кровоток и распадается. В статье Кауа и др.5 также продемонстрировано, что гиалуронан для местного применения плохо задерживается в эпидермальном слое, на короткое время задерживается в дермальном слое, и поглощается кожными клетками и кератиноцитами. Соответственно, только обеспечение проникновения гиалуронана через кожный барьер необязательно приносит полезный эффект, и во многих случаях для наблюдения эффекта также может быть необходимо, чтобы гиалуронан имел большую продолжительность задержания. Это достигается за счет применения чрескожных переносчиков для доставки гиалуронан путем местного применения, как описано в патенте на имя Schultz и др. (US 4808576). Хотя при этом эффективно обеспечивается проникновение гиалуронана через кожный барьер, гиалуронан не задерживается внутри кожи, и продолжает проникать в нижележащие суставы и сухожилия. Кроме того, потребность в чрескожном переносчике, наиболее эффективным из которых является DMSO, обычно несовместима с длительным применением.
В заявке на имя Schwach-Abdellaoui и Malle (WO 2008/000260) описана композиция с увлажняющими и предохраняющими от морщин свойствами, содержащая гиалуронан в виде фракций, имеющих две молекулярные массы.
Указано, что фракция с первой, меньшей молекулярной массой (50 килодальтон) способна проникать через кожный барьер, а фракция со второй, большей молекулярной массой (300 килодальтон) имеет наиболее выраженный эффект, который проявляется в снижении шероховатости кожи, за счет ее накопления преимущественно на поверхности кожи. В основе этого применения гиалуронана, типичного для косметических препаратов, лежит его использование в качестве недолговечного внешнего наполнителя, который в силу природной растворимости гиалуронана в воде выводится при мытье лица. Как отмечалось со ссылкой на статью Brown и др., доля гиалуронана, способная проникать через кожный барьер, является небольшой, а та доля гиалуронана, которая способна проникать через кожный барьер, имеет малую продолжительность задержания в самой коже. В результате, вместо гиалуронана для местного применения в современных процедурах биоомоложения, таких как мезотерапия,16 применяется несшитый гиалуронан для инъекций по отдельности или в сочетании с другими действующими ингредиентами.
Таким образом, в технике сохраняется потребность в создании способов доставки высокомолекулярных фракций гиалуронана через кожный барьер без необходимости инъекций. Предполагается, что высокомолекулярные фракции гиалуронана (например, >100 килодальтон) являются более биологически упругими и способны лучше имитировать естественный высокомолекулярный гиалуронан, содержащийся в коже.
Как было недавно доказано, гиалуронановые фрагменты обладают терапевтическим действием на заживление ран и физиологию нормальной кожи. Хотя эти фрагменты проникают через кожу лучше, чем высокомолекулярный гиалуронан, они не задерживаются во внеклеточных пространствах кожи.5
В настоящее время известно несколько примеров гиалуронана и других гликозаминогликанов, которые модифицируют посредством связывания липидов в разнообразных целях. В патенте на имя Sakurai и др. (US 5464942) описаны липидированные гликозаминогликаны (включая гиалуронан) с одной боковой липидной цепью, присоединенной в конечном положении или одном случайном внутреннем положении гликозаминогликана. Указывается, что эти композиции способны ингибировать сцепление раковых клеток с эндотелиальными клетками кровеносных сосудов и их внеклеточными матрицами.
В заявке на имя Yerushalmi и др. (WO 2006/050246) описаны носители липидированного гликозаминогликана (включая гиалуронан) для целенаправленной доставки слаборастворимых в воде лекарств. После липидации происходит самоорганизация модифицированных гликозаминогликанов с образованием сфер, при этом гидрофильная часть гликозаминогликана находится на наружной поверхности, а гидрофобная липидная часть находится в пределах защищенной внутренней поверхности. Аналогичные самоорганизующиеся наносферы и микросферы также описаны в заявке на имя Margarlit и Peer (WO 03/015755), в которой указано, что в зависимости от количества фосфолипида, связанного с гиалуроновой кислотой, могут формироваться наночастицы (при ~20% занятых мест связывания) или микрочастицы (при ~33% занятых мест связывания).
В патенте на имя Scott (ЕР 0295 092 В1), в котором отмечены сложности проникновения гиалуронана через кожу, описаны предназначенные для местного применения композиции на основе фрагментов гиалуроновой кислоты, содержащие 7-50 звеньев моносахаридов. Проникновение через кожный барьер облегчается за счет добавляемых в композицию усилителей активности, применения липосом, образующихся из фосфатидилхолина, в качестве средства доставки или применения с пластыря для ионотерапии с батарейным питанием. Тем не менее, как следует из предпочтительного выбранного интервала гиалуронана, составляющего 7-25 звеньев моносахаридов (приблизительно 1300-4700 дальтон) с учетом сложности доставки гиалуронана через кожный барьер, эти композиции неприменимы для облегчения проникновения высокомолекулярного гиалуронана через кожный барьер.
В патенте на имя Delia Valle и Romeo (US 4851521) описаны сложные эфиры гиалуроновой кислоты для разнообразных применений, включая косметические средства и в качестве наполнителей ткани, а также для получения пленок и нитей. Несмотря на упоминание разнообразных применений, не указано, что композиции на основе модифицированного гиалуронана способны переносить гиалуронан через кожный барьер, и описано подкожное и внутрикожное применение.
Обычно диффузия веществ через эпителиальный барьер резко уменьшается, когда молекулярная масса превышает 700 дальтон. Хотя в заявке на имя Pinsky (WO 2009/086504) описаны композиции для ухода за кожей с использованием липосом для доставки низкомолекулярных фрагментов коллагена (массой 8,5 килодальтон) и необязательно гиалуронана в кожу, сохраняется потребность в способах, обеспечивающих дермальную доставку высокомолекулярных коллагенов и эластинов, а также терапевтически полезных пептидов и белков, в особенности, если для этого не требуется применение и получение липосом. Методы эпителиальной доставки, включая чрескожную доставку пептидов и белков, были недавно рассмотрены в работе Antosova и др.,17 в которой отмечается, что, несмотря на привлекательность чрескожной доставки с учетом ее высокой биологической доступности, большой длительности действия и безболезненности, препятствием для нее является кожный барьер, предотвращающий проникновение и местное раздражение, что исключает длительное применение.
Несмотря на описанное в источниках применение липосом на основе фосфолипидов для переноса гиалуронана через кожный барьер, их применение связано с рядом сложностей, наиболее ощутимой из которых является нестабильность при хранении. Кроме того, для получения и очистки липосом на основе фосфолипидов в масштабе, необходимом для их применения в косметических препаратах, требуются высокие расходы.
Несмотря на множество упоминаний в патентной литературе о содержащих гиалуронан косметических композициях для местного применения, способствующих проникновению гиалуронана через кожный барьер в эпидермальный и дермальный слои, по-прежнему не существует доступных косметических средств, выполняющих это назначение. В частности, в настоящее время отсутствуют приемлемые способы эффективной доставки достаточных количеств высокомолекулярного гиалуронана (например, с молекулярной массой >250000 дальтон) в эпидермальный и дермальный слои кожи с использованием косметических составов для местного применения, которые обеспечивают задержание гиалуронана в коже. Вместо этого сохраняется потребность в наполнителях на основе гиалуронана, таких Hyal-System™ для инъекций в косметических целях или в применении гиалуронана в качестве поверхностного наполнителя, который временно задерживается на поверхности кожи.
Соответственно одной из задач настоящего изобретения является создание композиций, которые обеспечивают проникновение модифицированного гиалуронана через кожный барьер в эпидермальный и дермальный слои кожи без необходимости применения инъекций, липосом или других способствующих проникновению веществ.
Одной из дополнительных задач настоящего изобретения является создание композиций на основе модифицированного гиалуронана, применимых для оздоровления кожи, восполнения содержания гиалуронана и/или защитной терапии для борьбы с признаками старения кожи и различными формами атрофии кожи.
Одной из дополнительных задач изобретения является создание композиций на основе модифицированного гиалуронана, применимых для уменьшения рубцевания.
Одной из дополнительных задач изобретения является создание композиций на основе модифицированного гиалуронана, которые способны повышать степень задержания гиалуронана во внеклеточных покрытиях кожных клеток, несмотря на истощение или отсутствие рецепторов гиалуронана, таких как CD44 и RHAMM, которые, как предполагается, имеют важное значение для задержания гиалуронана и, как известно, истощаются в стареющей и поврежденной коже.
Одной из дополнительных задач изобретения является создание композиций на основе модифицированного гиалуронана, которые могут использоваться в качестве носителя для местного применения с целью доставки косметических и фармацевтических действующих лекарственных веществ через кожный барьер.
Одной из дополнительных задач изобретения является создание композиций на основе модифицированного гиалуронана, которые могут использоваться для местной доставки белков, полипептидов и других крупных биомакромолекул (с молекулярной массой от 700 дальтон до около 400-500 килодальтон) через кожный барьер.
Одной из дополнительных задач изобретения является создание композиций на основе модифицированного гликозаминогликана, которые способны проникать через кожный барьер, для применения в целях восполнения содержания гликозаминогликанов в коже, имитации гиалуронана, доставки косметических и фармацевтических действующих веществ и доставки полипептидов, белков и других крупных биомолекул.
Одной из дополнительных задач изобретения является создание способов изготовления описанных композиций на основе модифицированного гликозаминогликана, в которых используется активирующее средство в качестве ограничивающего реагента для регулирования количества липида, ковалентно связанного с гликозаминогликаном.
Дополнительные и прочие задачи изобретения станут ясны из следующего далее краткого изложения сущности изобретения, рассмотрения изобретения и его вариантов осуществления и примеров.
Краткое изложение сущности изобретения
В настоящем изобретении предложены композиции, облегчающие местную доставку модифицированного гиалуронана через кожный барьер и тем самым обеспечивающие альтернативный путь доставки наполнителей на основе гиалуронанов для инъекций. За счет облегчения доставки в кожную ткань композиции согласно настоящему изобретению обеспечивают восполнение содержания гиалуронана в истощенных областях кожи, в которых применяют композиции, и тем самым обеспечивают омолаживающий кожу эффект, одним из результатов которого является уменьшение проявлений морщин без необходимости инъекций.
Кроме того, в настоящем изобретении предложен способ формирования, восстановления или восполнения микросреды вокруг клеток (оболочек клеток), характерных для клеток молодой кожи, и тем самым придания помолодевшего внешнего вида старой коже или устранения повреждений травмированной кожи.
В настоящем изобретении также предложены композиции, которые содержат гиалуронан и другие гликозаминогликаны, модифицированные путем ковалентного связывания фрагментов амфипатических липидов, включая фосфолипиды, глицерофосфолипиды, гликолипиды, стероиды, сфинголипиды, гликосфинголипиды и жирные кислоты с от около 1 до около 15% дисахаридных мономерных звеньев, в результате чего образуются композиции, облегчающие проникновение модифицированного гликозаминогликана в кожную ткань, а также способы такой модификации.
В настоящем изобретении также предложена доставка модифицированного гиалуронана через кожный барьер посредством композиций, содержащих фосфолипиды, ковалентно связанные с гиалуронаном.
В настоящем изобретении также предложены нетоксичный модифицированный гиалуронан, способный проникать через кожный барьер и применимый для оздоровления кожи, восполнения содержания гиалуронана и/или защитной терапии (например, в качестве увлажняющего слоя для стареющей или атрофической кожи).
В настоящем изобретении также предложены композиции на основе модифицированного гиалуронана, применимые для доставки в кожную ткань и чрескожной доставки лекарственных веществ, например, простагландинов, которые подавляют воспаление, делают кожу более гладкой и мягкой, и ускоряют заживление ран; пепдуцинов (лекарственных веществ, содержащих аминокислоты с липидными хвостами), которые помимо других своих функций способны регулировать рост клеток; ингибиторов гиалуронидазы, которые способствуют уменьшению распада гиалуронана в коже; ингибиторов RHAMM, которые, как доказано, обладают предохраняющим от морщин действием; и других пептидов, имитаторов пептидов и белков, таких как ботулотоксин, например, типа А (ВОТОХ™), коллагены, эластин или гиалуронан-синтазы.
В настоящем изобретении также предложен способ увеличения содержания гиалуронана в коже и тем самым создания более "молодо выглядящей" микросреды вокруг эпидермальных и кожных клеток, результатом чего является регулирование клеточных функций (например, выработки коллагена и эластина кожными клетками; блокирования трансдифференцировки дермальных фибробластов в миофибробласты, которые вырабатывают коллаген I рубцового типа, стягивают дерму и, как считается, способствуют образованию морщин; и активации кератиноцитов с целью выработки цитокинов и факторов роста, которые способствуют функции клеток кожи), образование множества слоев/распространению кератиноцитов, защита от бескислородных радикалов и задержание воды, что в целом придает коже помолодевший внешний вид.
В настоящем изобретении также предложены нетоксичные композиции, содержащие модифицированный гиалуронан для местного применения на коже с целью уменьшения проявлений рубцевания, растяжек, ожоговых контрактур, фиброзных повреждений, розовых угрей, дерматита и атрофии кожи вследствие воздействия ультрафиолетового излучения спектра А/В, старения, химиотерапии, лучевой терапии или применения стероидов.
В настоящем изобретении также предложены нетоксичные композиции, содержащие фрагменты модифицированного гиалуронана для местного применения на коже, которые усиливают деятельность врожденной иммунной системы, направленную на защиту кожи от бактериальных и вирусных инфекций и быстрое заживление обширных ран (например, ожогов) кератиноцитами.
В настоящем изобретении также предложены нетоксичные композиции на основе модифицированного гиалуронана, способные проникать через эпидермальный барьер и применимые для ускорения регенеративного заживления ран и для улучшения внешнего вида не поврежденной, но нарушенной кожи (например, кожи курильщиков) путем способствования ангиогенезу.
В настоящем изобретении также предложены композиции, облегчающие проникновение других модифицированных гликозаминогликанов, таких как дерматансульфат, кератинсульфат и хондроитинсульфат в их полисахаридной или протеогликановой форме, как описано выше применительно к гиалуронану. Подразумевается, что выбор гликозаминогликан для использования зависит от воздействия, которое должно осуществляться.
В настоящем изобретении также предложены содержащие модифицированный гиалуронан или другие гликозаминогликаны композиции, облегчающие проникновение в кожную ткань полипептидов, таких как коллаген и эластин, для косметического применения с целью уменьшения проявлений морщин.
Согласно первой особенности настоящего изобретения предложена композиция на основе гликозаминогликана, содержащая гликозаминогликан, модифицированный посредством ковалентного связывания липидного фрагмента с около 1-15% повторяющихся дисахаридных мономерных звеньев гликозаминогликана, в которой:
модифицируемый гликозаминогликан представляет собой гиалуронан, производное гиалуронана, полисахарид, состоящий из повторяющихся дисахаридных звеньев уроновой кислоты или гексозы, связанной с гексозамином, или их производные,
модифицируемый гликозаминогликан имеет молекулярную массу от около 2 килодальтон до около 2500 килодальтон,
липидный фрагмент содержит одну или несколько природных или синтезированных жирных кислот, глицеролипидов, фосфолипидов, сфинголипидов, стероллипидов, преноллипидов или их производных при условии, что полярная головная группа липидного фрагмента содержит функциональную группу, обеспечивающую ковалентное связывание липида с гликозаминогликаном, а модифицированный гликозаминогликан способен проникать через кожный барьер или мембрану слизистой оболочки при нанесении на нее,
при этом в результате реакции гликозаминогликана с липидным фрагментом образуется модифицированный гликозаминогликан.
Согласно этой особенности гликозаминогликан предпочтительно модифицирован посредством ковалентного связывания липидного фрагмента с около 1-12% повторяющихся дисахаридных мономерных звеньев гликозаминогликана; более предпочтительно около 1-10% повторяющихся дисахаридных мономерных звеньев; еще более предпочтительно около 1-7,5% повторяющихся дисахаридных мономерных звеньев; наиболее предпочтительно 2-6% повторяющихся дисахаридных мономерных звеньев. Примеры композиций согласно настоящему изобретению включают композиции, в которых модифицировано около 5,5% или около 6% повторяющихся дисахаридных мономерных звеньев. Модифицируемый гликозаминогликан предпочтительно имеет молекулярную массу от около 50 килодальтон до около 2500 килодальтон; более предпочтительно от около 100 килодальтон до около 2000 килодальтон; еще более предпочтительно от около 350 килодальтон до около 1500 килодальтон; наиболее предпочтительно от около 500 килодальтон до около 1500 килодальтон. Модифицируемый гликозаминогликан предпочтительно представляет собой гиалуронан или производное гиалуронана; более предпочтительно гликозаминогликан представляет собой гиалуронан. Полярная головная группа липидного фрагмента предпочтительно содержит аминогруппу, ковалентно связывающую гликозаминогликан посредством амидной связи с группой карбоновых кислот гликозаминогликана; более предпочтительно липидный фрагмент содержит один или несколько фосфатидилэтаноламинов или фосфатидилсеринов; наиболее предпочтительно липидный фрагмент содержит один или несколько фосфатидилэтаноламинов. Модифицированный гликозаминогликан предпочтительно способен проникать через кожный барьер. Более предпочтительно модифицированный гликозаминогликан имеет большую продолжительность задержания в коже, чем немодифицированный гликозаминогликан после доставки в кожную ткань; наиболее предпочтительно этим гликозаминогликаном является гиалуронан.
Согласно второй особенности настоящего изобретения предложен препарат для применения на коже или мембране слизистой оболочки, содержащий композицию на основе гликозаминогликана в сочетании с одним или несколькими косметически или фармацевтически приемлемыми наполнителями или носителями, при этом композиция на основе гликозаминогликана содержит:
гликозаминогликан, модифицированный посредством ковалентного связывания липидных фрагментов с 1-15% повторяющихся дисахаридных мономерных звеньев гликозаминогликана,
гликозаминогликан представляет собой гиалуронан, производное гиалуронана, полисахарид, состоящий из повторяющихся дисахаридных звеньев уроновой кислоты или гексозы, связанной с гексозамином, или их производные,
модифицируемый гликозаминогликан имеет молекулярную массу от около 2 килодальтон до около 2500 килодальтон,
липидный фрагмент содержит одну или несколько природных или синтезированных жирных кислот, глицеролипидов, фосфолипидов, сфинголипидов, стероллипидов, преноллипидов или их производных при условии, что полярная головная группа липидного фрагмента содержит функциональную группу, обеспечивающую ковалентное связывание липида с гликозаминогликаном, а модифицированный гликозаминогликан способен проникать через кожный барьер или мембрану слизистой оболочки при нанесении на нее,
при этом в результате реакции гликозаминогликана с липидным фрагментом образуется модифицированный гликозаминогликан.
Согласно этой особенности гликозаминогликан предпочтительно модифицирован посредством ковалентного связывания липидного фрагмента с около 1-12% повторяющихся дисахаридных мономерных звеньев гликозаминогликана; более предпочтительно около 1-10% повторяющихся дисахаридных мономерных звеньев; еще более предпочтительно около 1-7,5% повторяющихся дисахаридных мономерных звеньев; наиболее предпочтительно около 2-6% повторяющихся дисахаридных мономерных звеньев. Примеры композиций согласно настоящему изобретению включают композиции, в которых модифицировано около 5,5% или около 6% повторяющихся дисахаридных мономерных звеньев гликозаминогликана. Модифицируемый гликозаминогликан предпочтительно имеет молекулярную массу от около 50 килодальтон до около 2500 килодальтон; более предпочтительно от около 100 килодальтон до около 2000 килодальтон; еще более предпочтительно от около 350 килодальтон до около 1500 килодальтон; наиболее предпочтительно от около 500 килодальтон до около 1500 килодальтон. Модифицируемый гликозаминогликан предпочтительно представляет собой гиалуронан или производное гиалуронана; более предпочтительно, гликозаминогликан представляет собой гиалуронан. Полярная головная группа липидного фрагмента предпочтительно содержит аминогруппу, ковалентно связывающую гликозаминогликан посредством амидной связи с карбоксильной группой гликозаминогликана; более предпочтительно липидный фрагмент содержит один или несколько фосфатидилэтаноламинов или фосфатидилсеринов; наиболее предпочтительно липидный фрагмент содержит один или несколько фосфатидилэтаноламинов. Модифицированный гликозаминогликан предпочтительно способен проникать через кожный барьер. Более предпочтительно модифицированный гликозаминогликан имеет большую продолжительность задержания в коже, чем немодифицированный гликозаминогликан после доставки в кожную ткань.
Препараты согласно этой особенности изобретения могут дополнительно содержать один или несколько ингредиентов, которые переносятся через кожный барьер или мембрану слизистой оболочки композицией на основе гликозаминогликана; предпочтительно через кожный барьер. В число дополнительного одного или нескольких ингредиентов, которые могут считаться относящимися к этой особенности изобретения, входят антиоксиданты, витамины, эфирные масла, средства, защищающие от ультрафиолетового излучения, или другие питательные вещества, применение которых обеспечивает положительное воздействие на состояние или внешний вид кожи.
В число дополнительного одного или нескольких ингредиентов, которые могут считаться относящимися к этой особенности изобретения, входят лекарственные препараты; предпочтительно терапевтические средства для лечения воспаления, такие как простагландин, рака кожи или состояний кожи, доставляемые через кожный барьер.
В число дополнительного одного или нескольких ингредиентов, которые могут считаться относящимися к этой особенности изобретения, входят белки, пептиды, имитаторы пептидов, пепдуцины, полинуклеотиды или другие биомолекулы; предпочтительно этот один или несколько ингредиентов имеют молекулярную массу от 700 дальтон до 500 килодальтон. Дополнительные ингредиенты, доставляемые через кожный барьер, могут включать коллаген или эластин. Кроме того, одни или несколькими дополнительными ингредиентами может являться белок; предпочтительно ботулотоксин, который доставляется через кожный барьер; более предпочтительно ботулотоксин типа А. Особо предпочтительным белком для доставки через кожный барьер является гиалуронан-синтаза. Дополнительные один или несколько ингредиентов также могут включать пепдуцин.
В число дополнительного одного или нескольких ингредиентов, которые могут считаться относящимися к этой особенности изобретения, входят ингибиторы гиалуронидазы, доставляемые через кожный барьер, или ингибиторы RHAMM, доставляемые через кожный барьер.
Согласно третьей особенности настоящего изобретения предложено применение композиции на основе гликозаминогликана согласно первой особенности в целях восполнения содержания гликозаминогликана, от природы присутствующего в коже; при этом гликозаминогликан предпочтительно представляет собой гиалуронан. Композицию согласно этой особенности применяют для уменьшения проявлений для уменьшения проявлений морщин, повышения степени увлажнения кожи, уменьшения признаков старения кожи, уменьшения проявлений или предотвращения атрофии кожи, уменьшения проявлений или предотвращения рубцевания кожи, ослабления воспаления, сопутствующего старческому кератозу, усиления ангиогенеза (например, с целью регенеративного заживления ран или улучшения внешнего вида не поврежденной, но нарушенной кожи) и для ослабления последствий повреждений кожи. Ослабление последствий повреждений кожи, которые могут рассматриваться, включает уменьшения проявлений рубцевания, растяжек, ожеговых контрактур, фиброзных повреждений, розовых угрей, дерматита или атрофии кожи. В число причин этих повреждений входят ультрафиолетовое излучение, ожоги, местное применение лекарственных препаратов и применение стероидов.
Согласно четвертой особенности настоящего изобретения предложено применение композиции на основе гликозаминогликана согласно первой особенности в качестве средства доставки в кожную ткань или чрескожной доставки косметических или терапевтических действующих ингредиентов. В число косметических или терапевтических действующих ингредиентов, которые могут доставляться согласно этой особенности изобретения, входят ингибиторы гиалуронидазы, ингибиторы RHAMM, коллаген или эластин. В число косметических или терапевтических действующих ингредиентов, которые могут доставляться согласно этой особенности изобретения, также входят белки, пептиды, имитаторы пептидов, пепдуцины, полинуклеотиды или другие биомолекулы; при этом предпочтительно доставляются белки. Предпочтительными типами белков, которые могут доставляться, являются ботулотоксин (предпочтительно ботулотоксин типа А) и гиалуронан-синтаза. В число косметических или терапевтических действующих ингредиентов, которые могут доставляться согласно этой особенности изобретения также входят лекарственные препараты, такие как противовоспалительные средства (например, простагландин). Предпочтительной является чрескожная доставка лекарственных препаратов. Применение для чрескожной доставки предпочтительно включает доставку лекарственных препаратов для лечения кожных воспалений, рака кожи, кожной аллергии или других состояний кожи; наиболее предпочтительно для лечения рака кожи.
Согласно пятой особенности настоящего изобретения предложен способ получения композиций на основе гликозаминогликана согласно первой особенности изобретения, включающий стадии:
обработки модифицируемого гликозаминогликана активирующим средством, чтобы способствовать ковалентному связыванию гликозаминогликана с липидным фрагментом,
смешивания активированного гликозаминогликана и липидного фрагмента, и
введения липидного фрагмента в реакцию с активированным гликозаминогликаном с целью ковалентного связывания липидного фрагмента с гликозаминогликаном,
при этом активирующим средством является ограничивающий реакцию реагент, который добавляют в количестве, достаточном, чтобы способствовать ковалентному связыванию липидного фрагмента с от около 1 до около 15% дисахаридных мономерных звеньев гликозаминогликана.
Согласно этой особенности активирующее средство предпочтительно добавляют в количестве, достаточном, чтобы способствовать ковалентному связыванию липидного фрагмента с около 1-12% дисахаридных мономерных звеньев гликозаминогликана; более предпочтительно с около 1-10% дисахаридных мономерных звеньев; еще более предпочтительно с около 1-7,5% дисахаридных мономерных звеньев; наиболее предпочтительно с 2-6% дисахаридных мономерных звеньев. Примеры способов согласно настоящему изобретению включают способы, в которых модифицируют около 5,5% или около 6% повторяющихся дисахаридных мономерных звеньев.
Согласно этой особенности изобретения предпочтительно, чтобы формируемой ковалентной связью являлась амидная связь между карбоксильной группой гликозаминогликана и липидным фрагментом, полярная головная группа которого содержит функциональную аминогруппу. Связывающим агентом предпочтительно является карбодиимид; более предпочтительно, карбодиимид представляет собой 1-этил-3-(3-диметиламинопропил) карбодиимид.
Согласно этой особенности изобретения предпочтительный модифицируемый гликозаминогликан представляет собой гиалуронан.
Согласно этой особенности изобретения предпочтительно, чтобы липидный фрагмент содержал один или несколько фосфатидилэтаноламинов и фосфатидилсеринов; более предпочтительно, чтобы липидный фрагмент содержал один или несколько фосфатидилэтаноламинов.
Таким образом, изобретение согласно одной из особенностей облегчает проникновение в кожу крупных молекул гиалуронана вместе с крупными (с молекулярной массой >10 килодальтон) молекулами белков.
Не будучи связанными какой-либо теорией действия, автор изобретения полагает, что описанная в изобретении гиалуронан-фосфолипидная композиция способствует образованию гиалуронановых оболочек вокруг кожи вне зависимости от рецепторов и предотвращает образование липосом/наночастиц. За счет прямого внедрения композиции в клеточную оболочку и ее недисперсной природы (например, не в виде липосом или наночастиц) предотвращается ее эндоцитоз или пиноцитоз и тем самым быстрое разрушение. За счет этого увеличивается ее продолжительность задержания в коже в виде интактного гиалуронан-фосфолипида.
Краткое описание чертежей
Различные особенности и предпочтительные и альтернативные варианты осуществления изобретения проиллюстрированы на описанных далее чертежах, на которых:
на фиг.1 показаны микрофотографии фибробластов кожи человека, иллюстрирующие увеличение гиалуронановой оболочки клеток после применения конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) согласно настоящему изобретению по сравнению с немодифицированным гиалуронаном и PBS в качестве контроля, при этом характерные гиалуронановые оболочки клеток обозначены стрелкой на каждом изображении,
на фиг.2 показана диаграмма, иллюстрирующая воздействие композиции на основе модифицированного гиалуронана (НА-РЕ-1) на процентное содержание фибробластов, имеющих оболочки, по сравнению с фибробластами, обработанными гиалуронаном в чистом виде,
на фиг.3 показана диаграмма, иллюстрирующая воздействие композиции на основе модифицированного гиалуронана (НА-РЕ-1) на размер гиалуронановой оболочки клеток по сравнению с клетками, обработанными немодифицированным гиалуронаном,
на фиг.4 показана диаграмма, иллюстрирующая различие в числе эмбриональных фибробластов с гиалуронановыми оболочками у мышей, выведенных методами генной инженерии без гиалуронановых рецепторов (RHAMM-/-, CD44-/- или RHAMM-/-:CD44-/-), после обработки конъюгатом гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) согласно настоящему изобретению, немодифицированным гиалуронаном и физиологическим раствором (в качестве контроля), при этом характерные микрофотографии обработанных фибробластов показаны на фиг.5,
на фиг.5 показаны микрофотографии эмбриональных фибробластов с гиалуронановыми оболочками у мышей, выведенных методами генной инженерии без гиалуронановых рецепторов (RHAMM-/-, CD44-/- или RHAMM-/-:CD44-/-), после обработки конъюгатом гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) согласно настоящему изобретению, немодифицированным гиалуронаном и физиологическим раствором (в качестве контроля),
на фиг.6 показаны микрофотографии человеческих фибробластов, обработанных SKL-каталазой, конъюгатом гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) и сочетанием SKL-каталазы и НА-РЕ-1, демонстрирующие, что композиции на основе модифицированного гиалуронана усиливают воздействие SKL-каталазы при ее применении в сочетании,
на фиг.7 показаны микрофотографии кожи мышей, которую в течение четырех дней обрабатывали конъюгатом гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) согласно настоящему изобретению, иллюстрирующие способность композиций согласно настоящему изобретению проникать через кожный барьер после местного применения; при этом изображения 71 (НА-РЕ-1) и 73 (контроль) иллюстрируют слои кожи с 20-кратным увеличением, на которых кератиноцитный слой обозначен как "[", а изображения 72 (после обработки) и 74 (контроль) иллюстрируют слои кожи с 40-кратным увеличением, на которых характерные кератиноциты обозначены стрелкой,
на фиг.8 показана диаграмма, на которой в количественной форме представлена способность крема, содержащего конъюгат гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) согласно настоящему изобретению, проникать через кожный барьер мышей и задерживаться в кератиноцитном слое после 4-дневной обработки, и микрофотографии, показанные на фиг.7,
на фиг.9 показаны микрофотографии, сравнивающие кожу мышей после 4-дневной обработки конъюгатом гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) согласно настоящему изобретению, гиалуронаном, смешанным с лецитином (НА+РЕ), или гиалуронаном в чистом виде, при этом кератиноцитный слой на каждом изображении обозначен стрелкой, а также показаны микрофотографии образцов кожи через 7 дней после прекращения 4-дневной обработки,
на фиг.10 показана диаграмма, на которой представлено количество конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-1) согласно настоящему изобретению, которое было способно проникать через кожу мышей, по сравнению с мышами, обработанными смесью гиалуронана с лецитином (НА+РЕ) и гиалуронаном в чистом виде, а также микрофотографии, показанные на фиг.9,
на фиг.11 показаны микрофотографии, демонстрирующие, что распространение композиций на основе модифицированного гиалуронана согласно настоящему изобретению ограничено местом их применения в эпидермисе, а применение гиалуронана не приводит к накоплению гиалуронана в эпидермисе, при этом граница распространения обозначена стрелкой, а область применения обозначена стрелкой в виде ломаной линии,
на фиг.12 показана диаграмма, на которой в количественной форме представлены уровни содержания гиалуронана в обработанных и необработанных областях кожи мышей на фиг.11,
на фиг.13 показаны микрофотографии и количественная диаграмма, показывающая, что композиции на основе гиалуронана (НА-РЕ-2) способны проникать через кожный барьер и накапливаться в эпидермисе мышей, выведенных без гиалуронановых рецепторов RHAMM (RHAMM-/- мышей), при этом кератиноцитный слой на каждом изображении обозначен стрелкой,
на фиг.14 показаны микрофотографии и количественная диаграмма, показывающая, что композиции на основе гиалуронана (НА-РЕ-2) способны проникать через кожный барьер и накапливаться в эпидермисе мышей, выведенных без гиалуронановых рецепторов RHAMM или CD44 (RHAMM-/-:CD44-/- мышей), при этом кератиноцитный слой на каждом изображении обозначен стрелкой,
на фиг.15 показаны микрофотографии конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ- 2) согласно настоящему изобретению и липидированные гликозаминогликаны в виде частиц, полученные известными из уровня техники способами,
на фиг.16 показаны микрофотографии, демонстрирующие способность конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-2) согласно настоящему изобретению доставлять белок (RHAMM, меченный GST) массой 84 килодальтон и белок (GST) массой 26 килодальтон через кожный барьер после местного применения на мышах, при этом кератиноцитный слой обозначен как "^", а нижележащий мышечный слой обозначен стрелкой,
на фиг.17 показана диаграмма, на которой в количественной форме представлены показанные на фиг.16 микрофотографии, иллюстрирующие доставку белка GST-RHAMM массой 84 килодальтон через кожный барьер после местного применения на мышах конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-2) согласно настоящему изобретению.
Описание изобретения
В настоящем изобретении предложены композиции, облегчающие проникновение модифицированных гликозаминогликанов через кожный барьер после местного применения, что делает их применимыми для использования в косметических препаратах и в качестве носителей для доставки в кожную ткань и чрескожной доставки косметических или фармацевтических действующих терапевтических средств. Эти композиции на основе гликозаминогликана получают посредством ковалентного связывания липидного фрагмента с гликозаминогликаном путем ограничения степени связывания до от около 1 до около 15% дисахаридных мономерных звеньев с целью придания достаточной липофильности гликозаминогликану для облегчения его проникновения через кожный барьер и в то же время сохранения природы гликозаминогликана, в частности взаимодействия его клеток. Степень связывания дисахаридных мономерных звеньев предпочтительно составляет около 1-12%, более предпочтительно около 1-10%, еще более предпочтительно около 1-7,5%, наиболее более предпочтительно около 2-6%, например, около 5,5% и около 6%. Одним из эффективных способов введения липидного фрагмента является его присоединение к группам карбоновых кислот в сахаридных остатках гликозаминогликана. При связывании липидного фрагмента с гликозаминогликаном при получении композиции согласно настоящему изобретению важно учитывать процентную долю используемых доступных мест связывания. Как указано в заявке на имя Margarlit и Peer (WO 03/015755), при ковалентном связывании фосфатидилэтаноламина с использованием 20-33% доступных мест связывания с карбоновой кислотой получают композицию, которая самоорганизуется с образованием наносфер или микросфер в виде частиц, которые способны действовать как носители нерастворимых или слаборастворимых соединений. Соответственно, было обнаружено, что во избежание образования этих нежелательных структур в виде частиц необходима меньшая степень связывания при получении композиций согласно настоящему изобретению.
При получении композиций на основе модифицированного гликозаминогликана согласно настоящему изобретению ковалентное связывание липидного фрагмента с гликозаминогликаном может осуществляться любым известным способом и может, например, включать связывание с существующими функциональным группами (например, карбоксильными и гидроксильными) или с немаскированными функциональными группами (например, посредством частичного гидролиза N-ацетильных групп с получением первичных аминов). Хотя может использоваться любая форма ковалентной связи между гликозаминогликаном и липидным фрагментом, обычно предпочтительна связь, гидролизуемая в организме, например амидные и сложные эфирные связи, чтобы модифицированному гликозаминогликану можно было вернуть природную форму и тем самым облегчить его окончательное биопоглощение и снизить вероятность токсических и/или аллергических реакций при использовании гликозаминогликанов и липидов, которые от природы присутствуют в коже.
Композиции на основе гликозаминогликана согласно настоящему изобретению предпочтительно получают с использованием гиалуронана, хотя также могут использоваться другие гликозаминогликаны, в частности производные гиалуронана, включая частично N-деацетилированный гиалуронан. Хотя природные гликозаминогликаны за исключением гиалуронана присоединяются к белкам, используемый в контексте настоящего изобретения термин гликозаминогликан относится только к полисахаридной части гликозаминогликанов. Гликозаминогликаны, применимые для использования в композициях согласно настоящему изобретению, включают любые длинноцепочечные неразветвленные полисахариды, образованные в основном повторяющимся дисахаридным звеном, состоящим из уроновой кислоты или гексозы, связанной с гексозамином, при условии соблюдения описанных далее требований к размеру.
Гиалуронан в больших количествах содержится в коже и, когда композиции согласно настоящему изобретению используются в качестве средств доставки косметических и фармацевтических терапевтических средств, включая белки и биомакромолекулы аналогичных размеров, может достигаться двойной эффект, выражающийся в доставке терапевтического средства и в усилении гиалуронановых оболочек клеток в обработанной области. Этот двойной эффект может быть особо выгоден по сравнению с местной доставкой терапевтического средства, которая ранее сопровождалась повреждением кожи в месте применения, как, например, при местной доставке глюкокортикоидов, в результате чего, как известно, снижается содержание гиалуронана в коже.18 Одной из дополнительных причин предпочтительного применения на коже гиалуронана, а не других природных гликозаминогликанов (например, гепаринсульфата, дерматинсульфата, кератинсульфата или хондроитинсульфата), является его доступность в форме высокомолекулярных (массой >100 килодальтон) соединений, получаемых путем биосинтеза с использованием бактерий, что позволяет получать его независимо от животных источников и тем самым снижать вероятность аллергических реакций, сопутствующих применению веществ животного происхождения.
Гликозаминогликан, используемый в настоящем изобретении, обычно имеет молекулярную массу от около 50 килодальтон до около 2500 килодальтон, предпочтительно от около 100 килодальтон до около 2000 килодальтон. Более предпочтительно, гликозаминогликан имеет молекулярную массу около 350-1500 килодальтон, наиболее предпочтительно около 500-1500 килодальтон. Тем не менее в особых случаях медицинского применения для лечения ран, таких как активация наследственного иммунитета, ангиогенез и затягивание ран, оптимальным является гиалуронан с меньшей молекулярной массой, которая может составлять от около 2 до около 100 килодальтон, поскольку фрагментированный гиалуронан более активно вступает в биологические реакции, чем нативный гиалуронан.
Липидный фрагмент композиций согласно изобретению может состоять из одного или нескольких липидов, предпочтительно выбранных из жирных кислот, глицеролипидов, фосфолипидов, сфинголипидов, стероллипидов и преноллипидов. Хотя согласно настоящему изобретению требуется, чтобы липидный фрагмент был ковалентно связан с гликозаминогликаном, композиции согласно настоящему изобретению могут содержать липидированный гликозаминогликан, а также дополнительные липиды, которые не связаны ковалентными связями.
Единственным условием использования заданного липида для модификации гликозаминогликана является наличие у него способности ковалентно связывать гликозаминогликан посредством своей полярной головной группы. Хотя предпочтительным является использование липидов, которые от природы присутствуют в организме человека или животного, также могут использоваться производные формы природных липидов при условии сохранения их липидной природы. Получение таких производных может требоваться, когда доступные функциональные группы в полярной головной группе липида не обеспечивают связывание липида с гликозаминогликаном. Примеры производных липидов включают липиды, модифицированные с целью обеспечения связывания липида с гликозаминогликаном, например, за счет введения первичного амина в полярную головную группу липида. Дополнительные примеры включают липиды с модифицированным гидрофобным хвостом при условии сохранения липофильной природы этой области. Кроме того, также могут использоваться стереоизомеры природных липидов с получением дополнительных производных при необходимости обеспечения связывания липида с гликозаминогликаном. Специалистам в данной области техники хорошо известны способы осуществления любых необходимых модификаций липидов.
В целом, в композициях согласно настоящему изобретению может использоваться любая жирная кислота по отдельности или в составе группы жирных кислот или других липидов, предпочтительно содержащая более 12 атомов углерода, включая насыщенные, мононенасыщенные и полиненасыщенные жирные кислоты. Хотя предпочтительно использовать жирные кислоты, которые от природы присутствуют в организме человека, это объясняется лучшим биопоглощением композиций и сниженной вероятностью токсических и/или аллергических побочных эффектов, а не их способностью проникать через кожный барьер. Жирная кислота, используемая по отдельности или в виде компонента более крупного липида, предпочтительно содержит 12-24 атомов углерода. Далее приведены не ограничивающие примеры жирных кислот, которые по отдельности или в составе более крупного липида могут использоваться в композициях согласно настоящему изобретению: миристиновая (12:0, тетрадекановая), пальмитиновая (16:0, гексадекановая), стеариновая (18:0, октадекановая), арахиновая (20:0, эйкозановая) и бегеновая (22:0, докозановая), насыщенные жирные кислоты; пальмитолеиновая (16:1(n-7), цис-9-гексадеценовая), петроселиновая (18:1(n-12), цис-6-октадекановая), олеиновая (18:1(n-9), цис-октадекановая, цис-вакценовая (18:1(n-7), цис-11-октадекановая), эруковая (22:1(n-9), цис-13-докозеновая мононенасыщенные жирные кислоты; и линолевая (18:2(n-6),9,12-октадекадиеновая), γ-линоленовая (18:3(n-6),6,9,12-октадекатриеновая), α-линоленовая (18:3(n-3),9,12,15-октатриеновая), арахидоновая (20:4(n-6),5,8,11,14,17-эйкозатетраеновая), ЕРА (20:5(n-3),5,8,11,14,17-эйкозапентаеновая) и DHA (22:6(n-3),4,7,10,13,16,19-доказагексаеновая) полиненасыщенные кислоты. Помимо применения в природной форме упомянутые жирные кислоты могут быть модифицированы с целью лучшего обеспечения ковалентного или нековалентного связывания с гликозаминогликаном путем, например, преобразования головной кислотной группы в амин или спирт, из которого дополнительно получают производное в виде уходящей группы, или в уходящую группу. Из жирной кислоты также может быть получено производное путем введения короткого спейсера, например, с образованием сложных эфиров, таких как 2-аминоэтанол, этиленгликоль или другие производные этанола, содержащие желаемую функциональную группу. Все химические реакции, необходимые для получения таких модифицированных жирных кислот, считаются стандартными и известными специалистам в области органического синтеза. Очевидно, что применение помимо всего прочего незаменимых жирных кислот, т.е. тех жирных кислот, которые не вырабатываются в тканях организма человека и должны поступать в организм с пищей, таких как арахидоновая, линолевая и линоленовая кислоты и их метаболитов, таких как ЕРА и DHA, может помимо их действия согласно настоящему изобретению обеспечивать дополнительный источник этих питательных веществ, отдельный от пищевого рациона, после их применения для доставки гиалуронана через кожный барьер по мере биологического распада композиций согласно настоящему изобретению. Незаменимые жирные кислоты могут применяться сами по себе, в составе более крупного липида или в виде вспомогательного липида, который ковалентно не связан с липидированным гликозаминогликаном, а доставляется липидированным гликозаминогликаном в кожную ткань или чрескожно. В настоящем изобретении также могут использоваться производные жирных кислот с заместителями или разветвлениями на протяжении углеродной цепи при условии сохранения липидной природы жирной кислоты, из которой получают производные.
Дополнительные жирные кислоты, применимые в композициях согласно настоящему изобретению, включают жирные кислоты с разветвленной цепью, содержащие от 10 до 30 атомов углерода. Разветвления могут содержать одну или несколько метиловых групп, замещенных в любом положении на протяжении цепи насыщенной или ненасыщенной жирной кислоты, или более крупные алкильные группы. Другие применимые жирные кислоты включают кислоты, имеющие одно или несколько алициклических колец на протяжении основной цепи жирной кислоты или в конечном положении. Дополнительные применимые жирные кислоты также включают жирные оксикислоты, в которых гидроксильная группа содержится в двух атомах углерода карбоновой кислоты (жирные α- и β-оксикислоты). Из α- или β-гидроксильной группы жирных оксикислот также могут быть получены дополнительные производные с образованием простых или сложных эфиров для введения второй цепи жирной кислоты в липид и тем самым усиления его липофильной природы.
Сказанное выше в отношении жирных кислот также относится к их использованию в липидах следующих типов, которые содержат компоненты жирных кислот.
Помимо жирных кислот применимые липиды для использования в настоящем изобретении также включают амиды жирного ряда, которые представляют собой амидные аналоги жирных кислот. Предпочтительными амидами жирного ряда являются амиды, в которых жирная кислота преобразована в амид, путем, например, обработки 2-аминоэтанолом, в результате чего образуется спирт, который при желании может быть дополнительно модифицирован. Амиды жирного ряда также могут быть получены с использованием диаминов, таких как 1,2-диаминоэтан, в результате чего образуется первичный амин, облегчающий связывание с гликозаминогликаном. Применимые амиды жирного ряда также могут быть получены с использованием жирных кислот и аминокислот, из которых при желании затем могут быть получены дополнительные производные.
Предпочтительные амиды жирного ряда включают анандамид, который, как известно, обладает противовоспалительными и противораковыми свойствами, N-арахидоноилглицин и N-пальмитоилэтаноламид, которые также могут применяться для лечения воспаления. За счет использования таких амидов жирного ряда, в том числе обладающих терапевтическим действием, обеспечивает получение двойного эффекта, например перенос гликозаминогликана через кожный барьер и оказание собственного известного терапевтического действия после гидролиза в организме из липидированного гликозаминогликана.
Глицеролипиды, которые могут использоваться в настоящем изобретении, включают моно- и диацилглицеролипиды. Предпочтительными глицеролипидами являются моно- и диацилглицерины и гликозилглицерины. Более предпочтительными являются глицеролипиды, содержащие жирные кислоты, выбранные из упомянутых выше групп. Также предпочтительными являются глицеролипиды, которые могут действовать как посредники биосинтеза триацилглицеринов и других липидов; тем не менее это предпочтение объясняется их способностью обеспечивать дополнительный эффект после гидролиз из липидированных гликозаминогликанов согласно настоящему изобретению, а не их способностью способствовать проникновение через кожный барьер. В зависимости от желаемого типа формируемой связи с гликозаминогликаном из глицеролипида также могут быть получены дополнительные производные, например, за счет использования спейсера или прямым путем с образованием первичной аминогруппы и амидов с группами карбоновых кислот гликозаминогликана.
Фосфолипиды, применимые для использования в композициях согласно настоящему изобретению, включают фосфатидилэтаноламины (кефалины), фосфатидилсерины, фосфатидил-L-треонины, фосфатидилглицерины, фосфатидилинозиты, фосфатидные кислоты, бимфосфатидилглицерины (кардиолипины) и фосфогликолипиды. Фосфолипидами предпочтительных типов являются фосфатидилэтаноламины, фосфатидилинозиты и фосфатидилсерины. Более предпочтительными являются фосфатидилэтаноламины и фосфатидилсерины. Наиболее предпочтительными являются фосфатидилэтаноламины. Хотя по соображениям биопоглощения, а не проникновения через кожу предпочтительны от природы присутствующие в организме фосфолипиды, также могут использоваться от природы не присутствующие в организме фосфолипиды. От природы не присутствующие в организме фосфолипиды включают фосфолипиды, представляющие собой разновидности производных фосфолипидов, неприменимых для связывания с гликозаминогликаном, такие как фосфатидилхолины, при этом в результате получения производных обеспечивается функциональная группа для ковалентного связывания липида с гликозаминогликаном. Помимо своих традиционных диацильных форм, применимые фосфолипиды также могут включать эфирные фосфолипиды, например, алкилацильные фосфолипиды и акленилацильные. В настоящем изобретении также могут применяться лизофосфолипиды любых из перечисленных фосфолипидов, в которых одна их цепей жирной кислоты должна быть гидролизирована с получением моноацильного, моноалкильного или моноалкенильного фосфолипида. У применимых фосфолипидов также может быть модифицирована их головная группа при условии, что это способствует или не препятствует ковалентному связыванию фосфолипида с гликозаминогликаном.
Сфинголипиды, применимые для использования в композициях согласно настоящему изобретению, включают сфингозин и другие сфингооснования, церамиды, церамидфосфолипиды и гликосфинголипиды. В контексте настоящего изобретения церамидфосфолипиды означают отличающиеся от сфингомиелина Сфинголипиды, в которых церамид связывает фосфатную группу, и включают такие Сфинголипиды, как церамидфосфорилэтаноламины, церамидфосфорилглицерины, церамидинозиты и соединения аналогичных классов. Применимые сфингооснования для использования по отдельности в качестве сфинголипида или в качестве одного из компонентов церамида, церамидфосфолипида, сфингомиелина, гликосфинголипида или другого сфинголипида, также могут включать аналоги сфингооснований с отличающимися углеродными цепями (по длине, ненасыщенности, гидроксилированию), но предпочтительно содержащие 14-24 атома углерода. Предпочтительные сфингооснования для использования по отдельности в качестве сфинголипида или в качестве одного из компонентов церамида, церамидфосфолипида, гликосфинголипида или другого сфинголипида, включают сфингозин (d18:1, d18:1Δt, 4E-d18:1 или его цис-изомер: d18:1Δ4c, 4Z-d18:1), дигидросфингозин (d18:0, сфинганин), фитосфингозин (t18:0) и дигидрофитосфингозин (t18:1, t18:1Δ8t, 8Z-t18:1 или цис-изомер: t18:1Δ8c, 8Z-t18:1) и эйкозасфингозин (d20:1, 4E-d20:1, d20:1Δ4t). Что касается описанных выше классов липидов, предпочтительными являются сфинголипиды, которые от природы присутствуют в организме. Сфинголипиды предпочтительных типов включают церамидфосфорилэтаноламины, церамидфосфорилинозиты и моногликосфинголипиды. Применимые сфинголипиды также могут включать сфинголипиды, у которых этаноламин, серин или другая соответствующая группа непосредственно связана с церамидом. Другие предпочтительные сфинголипиды включают гликозосфинголипиды с модифицированной сахаридной группой и также включают фосфорилэтаноламин, фосфорилсерин, фосфороэтаноламин, серин или этаноламин. Поскольку известно, что по сравнению с липидами на основе глицерина в сфинголипидах по природе содержатся другие жирные кислоты, такие как описаны выше, предпочтительные в сфинголипидах жирные кислоты могут отличаться от описанных выше жирных кислот. Так, предпочтительные в сфинголипидах жирные кислоты могут содержать до 28 атомов углерода и иметь четное или нечетное число атомов углерода. Из этих жирных кислот, которые могут являться насыщенными, мононенасыщенными или полиненасыщенными, предпочтительными являются насыщенные или мононенасыщенные жирные кислоты с 16-24 атомами углерода.
Помимо описанных фосфолипидов и сфинголипидов на основе фосфатидной кислоты, в композициях согласно настоящему изобретению также могут использоваться аналогичные фосфополипиды, такие как фосфонилэтаноламины и фосфонил-1-гидрокси-2-аминоэтаны; предпочтительными фосфополипидами являются фосфонилэтаноламины.
Поскольку церамиды являются природными компонентами кожи, и их истощение из-за возраста или заболевания приводит к обезвоживанию кожи, морщинам/обвисанию и восприимчивости к заболеваниям, применение церамидов и липидов на основе церамидов, которые путем гидролиза могут быть преобразованы в церамиды, обеспечивает двойную пользу для кожи. Кожное применение липидов на основе церамидов, которые путем гидролиза могут быть преобразованы в церамиды, в композициях согласно изобретению способствует доставке гиалуронана через кожный барьер, а также обеспечивает источник, помогающий восполнять содержание церамида после распада композиций.
Стероллипиды, применимые для использования в композициях, согласно изобретению включают стерины и оксистерины с окисленным холестериновым кольцом А или В, а не алкильной цепью, такие как 7β-гидроксихолестерин или 4β-гидроксихолестерин. Также применимы оксистерины с гидроксилированной боковой алкильной цепью, необязательно преобразованные в амин, при условии, что холестериновые кольца А и В каркаса находятся в приведенной форме, т.е. дигидроксилированы. Также могут использоваться оксистерины с основной гидроксильной группой, окисленной до карбоновой кислоты, в особенности, при эстерификации 2-аминоэтанолом с образованием конечной аминогруппы, обеспечивающей связывание с гликозаминогликаном. Помимо стеринов, которые обычно содержатся в организме млекопитающих, в композициях согласно настоящему изобретению также могут использоваться стерины другого происхождения, такие как стерины на растительной основе (фитостерины). Применимые фитостерины включают без ограничения кампестерин, ситостерин, брассикастерин, стигмастерин, авенастерин. Производные стеринов также могут быть получены путем введения, например, 2-аминоэтанола, инозита, серина, гликозида, фосфорилэтаноламина, фосфонилэтаноламина, фосфорилсерина, фосфорилинозита, фосфорилгликозидов или гликозидов, полученных с использованием 2-аминоэтанола, серина, фосфорилэтаноламина или фосфонилэтаноламина, в находящийся в положении 3 гидроксизаместитель кольца А или гидроксизаместитель боковой алкильной цепи любого из перечисленных стеринов или оксистеринов. Кроме того, из аминокислот могут быть получены сложные эфиры с образованием аминогруппы для обеспечения связывания с гликозаминогликаном.
Дополнительной выгодой применения 7-дигидрохолестерина может являться его преобразование в витамин D3 (холекальциферол) под действием ультрафиолетового облучения после его проникновения в эпидермальный слой кожи. В качестве альтернативы, холекальциферол или его предшественник провитамин D3 может использоваться непосредственно в качестве липида. Аналогичные выгоды также достижимы при использовании эргостерина или эргокальциферола (витамина D2) или ситокальциферола (витамина D5), который под действием ультрафиолетового облучения образуется из 7-дигидроситостерина. В результате, липидные фрагменты, используемые в настоящем изобретении для модификации гликозаминогликанов, также могу служить средствами доставки биологически важных липидов по мере распада модифицированных гликозаминогликанов в организме (при условии использования гидролизуемых связей, обеспечивающих высвобождение липида в физиологических условиях). При использовании любых из перечисленных соединений в качестве липидов в композициях согласно настоящему изобретению их количества относительно других липидов могут регулироваться в зависимости от количеств витамина D, добавление которого желательно после его гидролиза из гликозаминогликана.
Помимо выделяемого из стеринов витамина D, в композициях согласно настоящему изобретению также могут использоваться другие жирорастворимые витамины, такие как витамины А и Е и другие преноллипиды, включая другие токоферолы, токотриенолы, ретиноевую кислоту, долихолы и полипренолы с функциональными группами для обеспечения связывания с гликозаминогликаном. Дополнительные производные таких липидов также могут быть получены, например, путем введения в доступный гидроксизаместитель 2-аминоэтанола, инозита, серина, гликозид, фосфорилэтаноламина, фосфонилэтаноламина, фосфорилсерина, фосфорилинозита, фосфорилгликозидов или гликозидов, полученных с использованием 2-аминоэтанола, серина, фосфорилэтаноламина или фосфонилэтаноламина. Кроме того, из аминокислот могут быть получены сложные эфиры с образованием аминогруппы для обеспечения связывания с гликозаминогликаном. Как и в случае с применения любого липида, способного проявлять биологическую реакцию после разрыва связи с гликозаминогликаном, количество, используемое в любом препарате, определяется количеством липида, который желательно использовать. Также могут применяться дифосфатные производные пренолов, такие как фарнезилпирофосфат и пресквалендифосфат, которые используются в биосинтезе стеринов. Предпочтительные преноллипиды включают токоферолы (включая витамин Е) и токотриеналы, которые дополнительно способны действовать как антиоксиданты после проникновения через кожный барьер, витамин А или более предпочтительно ретиноевую кислоту в качестве его окисленной формы, которая, как известно, стимулирует выработку коллагена в коже, а также фарнезольные липиды, которые, как известно, благоприятствуют наружному липидному слою эпидермиса. Присутствие антиоксидантов в коже может дополнительно способствовать предотвращению распада гиалуронана, как от природы присутствующего в организме, так и содержащегося в композициях согласно настоящему изобретению.
Как упомянуто выше, наиболее предпочтительными липидами являются те из них, которые от природы присутствуют в организме человека, однако это предпочтение объясняется легкостью их биопоглощения и сниженной вероятностью токсических и/или аллергических побочных эффектов, а не их способностью обеспечивать проникновение гликозаминогликана через кожный барьер. Поскольку композиции согласно настоящему изобретению предназначены для косметического и терапевтического применения, нежелательно, чтобы композиции обладали значительной токсичностью с учетом постепенного гидролиза липидов в организме. В результате, до применения конкретного липид может проводиться испытание с целью определить, оказывает ли конкретный липид токсическое действие, вызывает ли он реакции аллергического типа или раздражение при высвобождении в коже. Поскольку известно, что многие липиды, применимые в композициях согласно настоящему изобретению, оказывают биологическое воздействие на людей, количество любого используемого липида может быть изменено в целях использования или предотвращения такого воздействия в зависимости от поставленных исходных задач применения композиций.
Более предпочтительными из класса липидов являются фосфолипиды или финголипиды, выбранные из группы, включающей фосфатидилэтаноламины, фосфатидилсерины, фосфатидилинозиты, сфингозины, церамиды и липиды на основе церамидов. Наиболее предпочтительным является использование фосфатидилэтаноламинов.
Помимо гликозаминогликанов, модифицированных путем добавления липида одного типа, в композиции на основе гликозаминогликана согласно настоящему изобретению также добавляют липиды двух или более различных типов. В них могут добавляться, например, фосфатидилэтаноламины, в липофильной хвостой части которых содержатся различные жирные кислоты, или фосфатидилэтаноламины и липиды на основе церамидом, т.е. липиды различных классов, связанные с одним и тем же гликозаминогликаном.
Липид, ковалентно связываемый с гликозаминогликаном, предпочтительно содержит основную аминогруппу, способствующую образованию амида с участием групп карбоновых кислот, присутствующих в моносахаридных звеньях гликозаминогликана. В качестве альтернативы, липиды других предпочтительных классов могут содержать гидроксильную группу, способную образовывать сложную эфирную связь с карбоксильной группой гликозаминогликана, или группу карбоновых кислот, способную образовывать сложную эфирную связь с гидроксильными группами гликозаминогликана или амидную связь с аминогруппой гликозаминогликана (в составе частично деацетилированного или неацетилированного гликозаминогликана). Помимо рассмотренных выше предпочтительных форм связывания липида с гликозаминогликаном, связывание также может осуществляться другими способами, известными специалистам в данной области техники; тем не менее эти формы являются менее предпочтительными.
Между группой карбоновых кислот гликозаминогликана и аминогруппой липида предпочтительно образуется амидная связь. Такие связи могут легко формироваться с использованием карбодиимида согласно известному из уровня техники подходу к аналогичным ковалентно связанным системам на основе липида и гликозаминогликана (например, как в патенте US 5464942 на имя Sakurai и др., заявке WO 2006/050246 на имя Yerushalmi и др. или заявке WO 03/015755 на имя Margarlit и Peer). Основное отличие этого подхода с использованием карбодиимида для получения композиции согласно изобретению от ранее использовавшихся подходов состоит в его упрощении, использовании меньшего количества связывающего агента и отсутствии необходимости использовать органические растворители, хотя при желании они могут использоваться. Предполагается, что осуществление реакций связывания в водных растворах в отсутствии органических растворителей или с использованием их небольших количеств и использованием меньших количеств связывающего агента ограничивает степень связывания липидной части с гликозаминогликаном, предотвращая тем самым образование нежелательных нано- и микросфер в виде частиц при более высоких (>20%) степенях замещения, а также снижает количество потенциально аллергенных компонентов (например, распавшегося связывающего агента и побочных продуктов реакции связывания), которые могут оставаться в конечном продукте.
Упрощенная общая процедура получение липидированных гликозаминогликанов посредством формирования амидных связей, которая дополнительно проиллюстрирована в Примере 2 и Примере 3, включает:
(i) смешивание водного раствора, содержащего гликозаминогликан, с липидом или содержащей липид смесью (растворенной в воде или в растворимом/полурастворимом в воде растворителе) с необязательным нагревом,
(ii) добавление связывающего агента, например карбодиимида, в таком количестве, чтобы он являлся ограничивающим реагентом, регулирующим степень связывания липида, и
(iii) осуществление связывания с перемешиванием в течение от 30 минут до 3 часов.
В способе, который используется в следующих далее примерах, связывающий агент, то есть карбодиимид, способствующий образованию амида, представляет собой ограничивающий реагент, добавляемый в количестве, зависящем от желаемого процентного содержания молекул липида, присоединяемых к каждой цепи. Липид обычно добавляют в избыточной, предпочтительно сильно избыточной молярной концентрации относительно количества используемого связывающего агента, в результате чего степень присоединения липида регулируется количеством используемого связывающего агента. Таким образом, количество используемого связывающего агента отображает теоретический максимум количества липида, который будет ковалентно связан с гликозаминогликаном. Соответственно, при получении композиций согласно настоящему изобретению желательно использовать недавно приобретенные, только что очищенные и/или недавно исследованные связывающие агенты, чтобы с более высокой точностью регулировать максимальное количество липида, который может быть связан с гликозаминогликаном в заданном препарате.
Кроме того, применение связывающего агента, например карбодиимида, используемого при образовании амида, в качестве ограничивающего реагента в ходе реакции, а также сведение к минимуму или исключение применения органических растворителей может являться полезным для снижения вероятности аллергических реакций на применение композиции на коже. После связывания липидного фрагмента с гликозаминогликаном полученная композиция может быть необязательно очищена при желании с любым традиционным способом, чтобы удалить остающийся связывающий агент, продукты распада и/или побочные продукты реакции связывания. Предполагается, что очистка связанных композиций дополнительно снижает ожидаемую низкую вероятность аллергических реакций на местное применение композиций согласно настоящему изобретению. При желании очищенные композиции могут быть дополнительно введены в реакцию с одним или несколькими липидами на дополнительных стадиях связывания липидов, с целью получения модифицированных гликозаминогликанов, содержащих множество липидов и/или липиды, связывающие гликозаминогликан различными способами. Также может быть желательным получение композиций, дополнительно содержащих не связанные ковалентно липиды для облегчения переноса композиций через кожный барьер.
Один из альтернативных способов связывания с липидом групп карбоновых кислот, присутствующих в сахаридных звеньях гликозаминогликана, может предусматривать формирование сложных эфирных связей любым традиционным способом получения сложных эфиров, включая подход, аналогичный описанному в патенте US 4851521 на имя della Valle. Этот подход применим при использовании производных липидов, с уходящей группой в гидрофильной части, например йодом, который может быть замещен кислородом карбоксилатной группы гликозаминогликана, в результате чего образуется сложный эфир. Что касается ранее описанного использования карбодиимидамидных связей, основное отличие от патента della Valle состоит в используемых соотношениях гликозаминогликана и липида.
Помимо описанных способов может использоваться любой другой применимый способ ковалентного связывания липидных фрагментов с гликозаминогликаном. Применимые способы определяют, исходя из доступных функциональных групп гликозаминогликана, доступных функциональных групп липида и типа ковалентной связи, которую желательно сформировать.
Композиции согласно настоящему изобретению могут быть получены с использованием (1) липида одного типа, ковалентно связывающего гликозаминогликан; (2) липидов множеств типов, связывающих гликозаминогликан, т.е. композиции получают с использованием множества липидов в ходе одной или нескольких реакций, в результате чего к гликозаминогликану присоединены липиды множества типов; (3) смеси липидированных гликозаминогликанов, т.е. смеси, содержащей гликозаминогликан, связанный с липид А, гликозаминогликан, связанный с липидом В, и т.д.; или (4) гликозаминогликана нескольких типов.
Хотя предпочтительная особенность настоящего изобретения относится к применению гиалуронана согласно приведенным далее примерам, аналогичные композиции также могут быть получены с использованием других гликозаминогликанов аналогичным способом.
Композиции согласно настоящему изобретению могут иметь ряд различных применений, в том числе, когда в качестве гликозаминогликана используется гиалуронан.
(а) Как косметическое средство для омоложения клеток эпидермиса и кожи за счет использования гиалуронана с целью восполнения гиалуронановой оболочки клеток. Следствием повышенного содержания гиалуронана в этих слоях является восстановление водного баланса в слоях кожи на клеточном уровне и эффект "обращения вспять старения" клеток, в результате чего кожа приобретает помолодевший внешний вид. За счет этого восстановления водного баланса композиции могут применяться в качестве средства, уменьшающего проявления морщин, а также придающего характеристики блеска и свежести молодой кожи.
(б) Как проникающая через кожу/задерживающаяся в коже система, позволяющая модифицированному гиалуронану проникать через кожный барьер при местном применении, и имеющая более длительное время полужизни в коже, чем у постоянно присутствующего в ней гиалуронана, т.е. композиции согласно изобретению распадаются в коже медленнее, чем от природы присутствующий в ней гиалуронан.
(в) Для уменьшения рубцевания за счет способствования возобновлению роста кожи у пациентов с атрофией кожи, например атрофией вследствие иммунных проблем или применения стероидов, как в случае пациентов, страдающих раком, для уменьшения рубцевания после хирургического вмешательства, а также устранения рубцевания в целом, например общего рубцевание, связанного с целлюлитом рубцевания, растяжек и т.д.
(г) Для лечения старческого кератоза с целью уменьшения сопутствующего ему воспаления и защиты поврежденной кожи от дальнейшего повреждения ультрафиолетовым излучением спектра А/В. Также могут быть разработаны композиции на основе модифицированного гиалуронана для доставки биологически активных компонентов, снижающих распространение ороговевшего слоя, пораженного старческим кератозом.
(д) Как система доставки, обеспечивающая местную доставку белка, полипептида или биомакромолекул аналогичного размера через кожный барьер.
(е) Как система доставки лекарств, в которой в композиции на основе липидированного гиалуронана согласно настоящему изобретению добавляют действующий фармацевтический ингредиент для облегчения его чрескожной доставки. Такие системы обеспечивают двойной эффект, доставляя в кожную ткань как фармацевтический ингредиент, так и гиалуронан, при этом после чрескожной доставки лекарства содержащийся в системе гиалуронан действует как омолаживающее средство на клетки дермы и эпидермиса, как описано выше.
Конкретные терапевтические применения в качестве систем доставки лекарства согласно настоящему изобретению включают:
1. борьбу с дефицитом стромальных клеток для применения при лечении воспалительных заболеваний, рака, регенерации кожи/заживлении ран, химических и термических ожогах;
2. лечение рака кожи;
3. лечение различных состояний кожи, таких как угревая сыпь, контактный дерматит, псориаз и экзема;
4. лечение обезображивающих заболеваний кожи за счет уменьшения рубцевания и способствования регенерации тканей; и
5. лечение артрита суставов, в частности пальцев, когда затруднена инъекция.
Таким образом, композиции согласно изобретению могут применяться в косметике, медицине (например, при лечении ожогов и других состояний, на которые известно благоприятное воздействие гиалуронана), для смазки мембраны слизистых оболочек и в качестве систем доставки лекарственных препаратов в местную микросреду. Косметические применения включают уменьшение проявлений морщин, придание кожи помолодевшего внешнего вида, увеличение выработки коллагена в коже, восстановление водного стареющей или сухой кожи, усиление питания кожи и борьба с пятнистостью, сопутствующей старческому кератозу. Применения для доставки лекарств включают местное применение лекарств, таких как нестероидные противовоспалительные средства для системного или локализованного лечения артрита, химиотерапевтических веществ для системного или локализованного лечения раков кожи и применения в качестве заменителя пластырей или в составе пластырей (например, композицию согласно настоящему изобретению внедряют в пластырь и наносят его на кожу, обеспечивая тем самым постепенное поглощение с течением времени) для введения эстрогена, никотина или других веществ. Предпочтительно некосметические применения имеют целью локализованное, а не системное воздействие и тем самым сводят к минимуму воздействие лекарств и, следовательно, снижают интенсивность побочных эффектов, присущих системному воздействию.
Композиции согласно настоящему изобретению могут также иметь применения, связанные с тканевой инженерии, способствуя восстановлению тканей путем привлечения стволовых клеток (известно, что гиалуронан привлекает стволовые клетки), защиты резидентных стволовых клеток от апоптоза (известно, что гиалуронан защищает стволовые клетки) и уменьшения рубцевания (при высоком содержании гиалуронана в коже уменьшается фиброзная репарация). Предполагается, что применение композиции согласно изобретению для уменьшения рубцевания также способствует восстановлению после паралича, поскольку нервные клетки не способны повторно расти, используя первоначальные пути после, например, инсульта или травмы головы из-за фиброза, который преимущественно создает преграду на нейронных проводящих путях. Соответственно, уменьшение фиброзного рубцевания приводит к уменьшению количества нервных клеток, которые вынуждены блуждать вокруг фиброзной ткани и не способны вернуться на первоначальный путь, в результате чего эти формы паралича облегчаются или становятся временными.
Композиции, в которых используются отличающиеся от гиалуронана гликозаминогликаны, в особенности хондроитинсульфат, который является близкородственным гиалуронану, также могут иметь ряд различных применений, включающих:
(а) в качестве косметического средства для омоложения клеток эпидермиса и дермы за счет гликозаминогликана, способного усиливать способность кожи задерживать воду и/или связывать поверхности клеток вместо гиалуронана,
(б) в качестве проникающей через кожу/задерживающейся в коже системы, в которой гликозаминогликан способен проникать через кожный барьер при местном применении,
(в) в качестве системы доставки, в которой белок, полипептид или другие крупные биомакромолекулы аналогичного размера могут местно доставляться через кожный барьер,
(г) в качестве системы доставки лекарств, в которой действующий фармацевтический ингредиент смешан с липидированными композициями на основе гликозаминогликана согласно настоящему изобретению для обеспечения чрескожной доставки.
Конкретные терапевтические применения в качестве систем доставки лекарств согласно настоящему изобретению включают:
1. борьбу с дефицитом стромальных клеток для применения при лечении воспалительных заболеваний, рака, регенерации кожи/заживлении ран, химических и термических ожогах;
2. лечение рака кожи;
3. лечение различных состояний кожи, таких как контактный дерматит, псориаз и экзема;
4. лечение обезображивающих заболеваний кожи за счет уменьшения рубцевания и способствования регенерации тканей; и
5. лечение артрита суставов, в частности пальцев, когда затруднена инъекция.
Применения композиций на основе гликозаминогликана, предусматривающие доставку необязательно добавляемых действующих лекарственных веществ, направлены в основном на лечение связанных с кожей состояний. Тем не менее, когда необязательно добавляемое действующее лекарственное вещество после его доставки через кожный барьер способно проникать через эпидермальный и дермальный слои и поступать в большой круг кровообращения, композиции могут иметь более общее применение в качестве системы чрескожной доставки.
Хотя композиции согласно настоящему изобретению в основном используются в составах для местного применения, их применения согласно настоящему изобретению также включают обеспечение перорального потребления гликозаминогликанов и лекарств (при этом модифицированный гиалуронан действует как система доставки лекарств), а также обеспечение накопления гиалуронана и систем доставки лекарств на основе гиалуронана после подкожной, внутрикожной или других форм инъекции. Помимо использования способности описанных в изобретении композиций проникать через кожный барьер, они также могут применяться для облегчения проникновения через мембрану слизистых оболочек и, соответственно, для обеспечения доставки композиций на основе гликозаминогликана, а также любых необязательно добавляемых лекарственных веществ с использованием этих дополнительных путей. Так, композиции согласно настоящему изобретению также могут использоваться в составах для применения на слизистой оболочке щеки, пищевода, кишечника, носа, органов обоняния, рта, бронхов, матки или пениса. Кроме того, композиции согласно настоящему изобретению могут быть предназначены для доставки липидированного гликозаминогликана и/или дополнительных терапевтических средств внутрь глаза без необходимости инъекции путем местного применения мази, капель или другого применимого состава.
Композиции согласно настоящему изобретению могут использоваться для получения составов согласно желаемому способу применения любым способом, известным специалистам в области изготовления косметических и/или фармацевтических изделий. Такие способы описаны, например, в книге Remington под названием "The Science and Practice of Pharmacy or Cosmetic and Toiletry Formulations" помимо множества других источников. Предпочтительные составы включают составы для местного применения на коже, такие как кремы, мази, гели, лосьоны или пасты. Кроме того, композиции согласно настоящему изобретению также могут применяться в пластырях, которые обычно используются для чрескожной доставки лекарств, сами по себе или в качестве средства доставки терапевтического вещества, такого как лекарство или белок.
Помимо получения препаратов с использованием стандартных способов и наполнителей, композиции согласно настоящему изобретению также могу смешиваться со стандартным предлагаемым на рынке косметическим кремом, при этом не требуется использовать какие-либо дополнительные или специализированные способствующие проникновению вещества. Способность композиции согласно изобретению проникать через кожу при применении с кремами стандартных типов также позволяет не использовать дополнительные влагонепроницаемые барьеры, такие как обертки, непроницаемые пластмассовые пленки или барьеры других типов для облегчения проникновения через кожный барьер путем предотвращения и уменьшения способности кожи терять поверхностную воду.
В составы, содержащие композиции на основе гликозаминогликана согласно настоящему изобретению, также входят дополнительные компоненты, такие как антиоксиданты, помогающие предотвращать распад гиалуронана и других гликозаминогликанов, от природы присутствующих в организме или доставляемых в составе композиций согласно настоящему изобретению. В составы также могут входить витамины, эфирные масла и другие питательные вещества, применение которых, как известно, обеспечивает положительное воздействие на здоровье и/или внешний вид кожи. Кроме того, в составы также могут быть включены ингредиенты, ослабляющие или предотвращающие вредное воздействие ультрафиолетового излучения на кожу, такие как ингредиенты, обычно содержащиеся в лосьонах для загара и солнцезащитных средствах.
Для лучшего понимания изобретения далее приведены наглядные неограничивающие примеры. В описанных далее примерах использовались мыши линии CD44-/-, предоставленные Jackson Laboratories (Бар Харбор, штат Мэн, США), мыши линии RHAMM-/-, выведенные собственными силами описанным у Tolg и др.19 способом с использованием мышей C57-BL6 немутатного типа, предоставленных Charles River Laboratories, и мыши линии CD44-/-:RHAMM-/-, выведенные собственными силами описанным у Tolg и др.20 способом. Также были получены клетки описанными у Tolg и др. способами.
Пример 1
Получение нековалентно связанного конъюгата гиалуронана и фосфатидилэтаноламина (НА+РЕ)
Путем смешивания водного раствора гиалуронана (78,5 мл, 12 мг/мл; Baxyl®, производства компании Cogent Solutions Group, Лексингтон, штат Кентукки, США) с соевым лецитином (78,5 мл; Soya Lecithin GT Non-GM IP, содержащим 13% фосфатидилэтаноламина производства компании Imperial-Oel-Import) в изопропаноле (10 мл) (для способствования смешиванию) при комнатной температуре в течение 30 минут в смесителе получили ассоциированный (нековалентно связанный) комплекс гиалуронана и фосфатидилэтаноламина (НА+РЕ). Затем смесь выдерживали в течение 48 часов при температуре 4°С, после чего использовали при изготовлении крема для местного применения, как описано в Примере 4 применительно к связанным композициям согласно изобретению.
Лецитин, использованный в этом и других описанных в изобретении примерах, содержал 15% фосфатидилхолина, 13% фосфатидилэтаноламина, 10% фосфатидилинозита, 19% других липидов, 5% углеводов и 38% соевого масла. Эти фосфолипиды в основном содержали С14-С22 жирные кислоты в качестве гидрофобного компонента, преимущественно стеариновую кислоту и пальмитиновую кислоту, а также небольшие количества олеиновой кислоты, пальмитолеиновой кислоты и миристиновой кислоты.
Это нековалентно связанное вещество, не входящее в объем настоящего изобретения, было использовано в некоторых из следующих примеров в целях сравнения, чтобы продемонстрировать влияние ковалентного связывания на способность композиций согласно изобретению проникать через кожный барьер.
Были также проведены эксперименты с использованием аналогичного нековалентно связанного конъюгата, полученного с использованием гиалуронана массой ~350 килодальтон, однако при сравнении результатов не было обнаружено отличий от описанного выше конъюгата с использованием гиалуронана массой ~500 килодальтон.
Пример 2
Получение связанных конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-1)
Путем предварительного смешивания раствора гиалуронана (5 мл, 10 мг/мл деионизированной воды, 50 мг; ~350 килодальтон (производства компании Life Core, штат Миннесота, США), ~1,3×10-4 моль групп -СО2Н) с фосфатидилэтаноламином (РЕ) (250 мг, Sigma-Aldrich®, номер по каталогу 60648; 500 мг с содержанием ~50% по данным анализа) с быстрым перемешиванием в ручном смесителе получили ковалентно связанный конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-1). До добавления фосфатидилэтаноламина в гиалуронан его сначала растворили в хлороформе (0,5 мл), который затем испарили, заменили изопропанолом (0,5 мл) и суспендировали с помощью ручного виброзонда. Добавили 1-этил-3-(3-диметиламинопропил) карбодиимида (EDC) (1,2 мг, 7,7×10-6 моль; 10 мкл свежеприготовленного исходного раствора, содержащего 120 мг EDC, растворенного в деионизированной воде (1 мл)) и тщательно перемешивали в течение 30 минут, а затем в течение 2 часов выдерживали при комнатной температуре.
Для клеточных исследований использовали НА-РЕ-1 (Пример 5, Пример 6, Пример 7 и Пример 8).
Исходя из количества EDC, использованного в качестве связывающего агента, и предположительно почти поддающегося количественной оценке связывания с поправкой на свежеприготовленный раствор EDC (использованного выше), предполагаемая степень связывания в Примере 2 составит ~6% (верхний предел) дисахаридных звеньев гиалуронана, которые будут модифицированы ковалентно связанными фосфатидилэтаноламиновыми группами. Предполагается, что эффективность связывания снижается, если EDC ранее подвергается воздействию воды.
Пример 3
Получение связанного конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-2)
Помимо чистого фосфатидилэтаноламин, такого как в Примере 2, также могут использоваться липиды, содержащие фосфатидилэтаноламин. Например, жидкий соевый лецитин (Soya Lecithin GT Non-GM IP производства компании Imperial-Oel-lmport) содержит приблизительно 15% фосфатидилхолинов, 13% фосфатидилэтаноламинов, 10% фосфатидилинозитов, 19% других фосфолипидов и липидов, 5% углеводов и 38% соевого масла. Это составляет приблизительно 330 мг фосфатидилэтаноламинов (единственного липида, предположительно в больших количествах участвующего в реакции с использованием EDC в качестве связывающего агента) на чайную ложку (14,79 мл).
Смешали нерафинированный жидкий соевый лецитин (78,5 мл; Soya Lecithin GT Non-GM IP производства компании Imperial-Oel-lmport) с гиалуронаном (78,5 мл, 12 мг/мл, 942 мг, ~2.5×10-3 моль групп -СО2Н; 500-2500 килодальтон, полидисперсным Baxyl НА производства компании Cogent Solutions Group, Лексингтон, штат Кентукки, США) и изопропанолом (10 мл) путем быстрого перемешивания в ручном смесителе в течение 10-15 минут при комнатной температуре. Добавили 1-этил-3-(3-диметиламинопропил) карбодиимида (EDC) (22 мг, 1,4×10-4 моль; 100 мкл свежеприготовленного исходного раствора из 220 мг EDC в 1 мл охлажденной до температуры замерзания деионизированной воды), дополнительно смешивали в течение 10-15 минут, а затем в течение 2 часов выдерживали при комнатной температуре. В качестве альтернативы, когда масштаб реакций позволяет точно взвешивать EDC, композиции также могут быть получены путем прямого добавления EDC, т.е. без получения исходного раствора. Полученный НА-РЕ-2 хранили при температуре 4°C и использовали без дополнительной очистки при получении косметических препаратов (смотри Пример 4) для применения при исследованиях на мышах (смотри Пример 9, Пример 10, Пример 11, и Пример 13) и людях (смотри Пример 14, Пример 15, Пример 16, Пример 17, Пример 18 и Пример 19).
Исходя из количества EDC, использованного в качестве связывающего агента, и предположительно почти поддающегося количественной оценке связывания с поправкой на свежеприготовленный раствор EDC (использованного выше), предполагаемая степень связывания в Примере 3 составит ~5,5% (верхний предел) дисахаридных звеньев гиалуронана, которые будут модифицированы ковалентно связанными фосфатидилэтаноламиновыми группами. Предполагается, что эффективность связывания снижается, если EDC ранее подвергается воздействию воды.
Пример 4
Получение кремов для местного применения
Кремы для местного применения на основе модифицированного гиалуронана, полученного в Примере 2 или Примере 3, могут быть получены соответствующими способами, обычно применяемыми в технике для получения косметических и медицинских кремов для местного применения. Описанное далее получение следует рассматривать как неограничивающий пример.
Гель НА-РЕ-2, полученный в Примере 3, смешали в соотношении 1:1 (по объему) с предлагаемым на рынке базовым кремом (NIVEA Creme; ингредиенты: вода, минеральное масло, микрокристаллический воск, глицерин, ланолиновый спирт, парафин, пантенол, децилолеат, октилдодеканол, стеарат алюминия, лимонная кислота, сульфат магния, стеарат магния, метилхлоризотиазолинон, отдушка) в смесителе и хранили при температуре 4°C до использования. Эта температура хранения служила мерой предосторожности из-за отсутствия в креме дополнительных ингредиентов, например противомикробные веществ для предотвращения потенциального распада гиалуронана, и не должна рассматриваться как ограничение составов как таковых.
При использовании модифицированного гиалуронана в альтернативных базовых кремах, например OIL OF OLAY® (увлажняющий крем OLAY® Classic; ингредиенты: вода, глицерин, цетиловый спирт, вазелин, циклопентасилоксан, стеариловый спирт, изопропилпальмитат, диметикон, карбомер, стеарат ПЭГ-100, стеариновая кислота, гидроксид натрия, гидантоин DMDM, йодопропинилбутилкарбамат, этилендиаминотетрауксусная кислота, отдушка, диоксид титана, краситель Red 4) или L'OREAL® (антивозрастной крем от морщин; ингредиенты: вода, циклопентасилоксан, гидрогенизированный полиизобутен, цетиловый спирт, глицерин, глицерилстеарат, стеарат ПЭГ-40, миристилмиристат, этилгексилпальмитат, масло ши, сорбитантристеарат, глициновый соевый белок, метилпарабен, диазолидинилмочевина, токоферилацетат, сополимер акрилатов, пропилпарабен, лимонен, динатрийэтилендиаминотетрауксусная кислота, гидроксицитронеллаль, линалоол, бензиловый спирт, бензилбензоат, бутилфенилметилпропиональ, гуанозин, альфа-изометилионон, цитраль, эвгенол, хлорфенезин, дегидроацетат натрия, отдушка, FIL K29371/2) не были обнаружены какие-либо отличия в его биологической активности или действии.
Помимо перечисленных выше или других предлагаемых на рынке кремов соответствующие составы для местного применения также могут быть получены с использованием хорошо известных способов. Помимо модифицированного гликозаминогликана также могут добавляться другие компоненты, обладающие свойствами отдушки или любым другим косметическим, дерматологическим или медицинским свойством.
Пример 5
Модифицированный гиалуронан (НА-РЕ-1) увеличивает оболочки фибробластов кожи человека
Применимость композиций согласно изобретению оценили путем определения их способности заключать в оболочку/окружать культуры фибробластов кожи, выращенных из образцов пункционной биопсии кожи человека. Образцы пункционной биопсии поместили на стерильную чашку Петри (35×10 мм) и с помощью небольших (например, 19G) стерильных игл разделили на небольшие фрагменты. Фрагментам дали просохнуть в течение короткого времени (например, не более 10 минут) до дна чашки Петри, чтобы способствовать слипанию фрагментов ткани. Затем осторожно добавили модифицированную по способу Дульбекко среду Игла (DMEM), дополненную 10% фетальной телячьей сыворотки (FCS), и приблизительно на одну неделю поместили культуру в увлажненный инкубатор при температуре 37°C, в который добавили 5% СО2. Затем извлекли выращенные из эксплантатов фибробласты, поместили в стерильную смесь 0,025% трипсина и этилендиаминотетрауксусной кислоты и осторожно центрифугировали с ускорением 1,1×g в течение 3 минут, после чего удалили трипсин, и высеяли клетки при разведении 1:5 в свежие стерильные культуральные планшеты с плотностью ~50000 на лунку (24-луночные планшеты) на стерилизованные стеклянные покровные стекла в 1 мл DMEM, дополненной 10% фетальной телячьей сыворотки в увлажненной среде 5% СО2. Через 18 часов в течение 1 часа воздействовали на клетки раствором гиалуронана (500 мкг/мл, 350 килодальтон) или модифицированным гиалуронаном (НА-РЕ-1) (25 мкг/мл). В лунки добавили флуоресцентные желтые наносферы полистирола размером 30-40 нм (производства компании Corpuscular Inc., Колд Спринг, штат Нью-Йорк, США) и в течение 30 минут позволили им осесть на прилипающие клетки при температуре 37°C. Затем культуры зафиксировали в свежеприготовленом параформальдегиде и поместили на предметное стекло с полостью. Клетки сфотографировали (смотри фиг.1) с помощью инвертированного микроскопа Nikon Eclipse ТЕ300, оснащенного оптикой компании Hoffman и эпифлуоресцентной микроскопией. Согласно другому способу обнаружения гиалуронановых оболочек, который использовался в следующем далее Примере 7, в лунки добавили зафиксированные в параформальдегиде зрелые эритроциты овец, которым позволили осесть, как описано выше. Оболочки клеток, обнаруженные этими способами, сфотографировали с помощью упомянутого инвертированного микроскопа Nikon с использованием оптики компании Hoffman (смотри фиг.5).
На изображениях, представленных на фиг.1, гиалуронановые оболочки клеток выглядят как темное пространство, поскольку из оболочки исключены небольшие флуоресцентные гранулы, как указано стрелкой на изображении. Клетки без оболочки невозможно обнаружить этим способом, поскольку они целиком покрыты флуоресцентными гранулами. Как показано на фиг.1, при добавлении в культуральную среду гиалуронана в чистом виде (изображение 12) наблюдалось незначительное дополнительное воздействие на размер гиалуронановых оболочек по сравнению с PBS в качестве контроля (изображение 11). В результате добавления в культуральную среду НА-РЕ-1 (изображение 13) наблюдалось заметное увеличение гиалуронановой оболочки, на что указывало исчезновение вокруг клеток флуоресцентных гранул, создающих эффект ореола.
Пример 6
Влияние модифицированного гиалуронана (НА-РЕ-1) на процентное содержание клеток с гиалуронановой оболочкой и на размер гиалуронановой оболочки
В стареющие фибробласты человека в возрастающих концентрациях (0-100 мкг/мл) добавили модифицированный гиалуронан (НА-РЕ-1), полученный по Примеру 2, или гиалуронан в чистом виде (350 килодальтон; 10 мг/мл исходный раствор в физиологическом растворе). Процентное содержание клеток с гиалуронановой оболочкой (смотри фиг.2) увеличивалось по мере увеличения концентрации НА-РЕ-1 в отличие от добавления гиалуронана в чистом виде. В результате применения только немодифицированного гиалуронана у меньшего числа клеток имелась гиалуронановая оболочка, а процентное содержание клеток с оболочкой стабилизировалось при концентрации гиалуронана 10 мкг/мл. В отличие от этого, в результате добавления модифицированного гиалуронана (НА-РЕ-1) наблюдался зависимый от дозы рост процентного содержания клеток с гиалуронановой оболочкой, при этом процентное содержание клеток с оболочкой было значительно большим в присутствии 100 мкг/мл НА-РЕ-1 чем 50 мкг/мл НА-РЕ-1 (проверка по критерию Стьюдента, р<0,01). В результате добавления НА-РЕ-1 во всех концентрациях наблюдалось значительно больше клеток с гиалуронановой оболочкой, чем при добавлении только немодифицированного гиалуронана (проверка по критерию Стьюдента, р<0,0001).
Влияние добавления модифицированного гиалуронана (НА-РЕ-1; 50 мкг/мл) по сравнению с добавлением гиалуронана в чистом виде (50 мкг/мл) на размер оболочки клеток было представлено в количественной форме с использованием визуального анализа (Elements 3.1, Nikon). Применение модифицированного гиалуронана (НА-РЕ-1) в этой концентрации значительно увеличивало средний размер гиалуронановой оболочки/клетки по сравнению с применением только НА (проверка по критерию Стьюдента, р<0,05) (смотри фиг.3). Полученные данные являются средними значениями РЭМ для 10 образцов.
Пример 7
Способность модифицированного гиалуронана (НА-РЕ-1) заключать в оболочку эмбриональные фибробласты мышей без гиалуронановых рецепторов
Гиалуронан нормально связывает клетки посредством взаимодействий с гиалуронановыми рецепторами, такими как CD44, RHAMM, LYVE-1 и толл-подобные рецепторы 2,4. Эмбриональные фибробласты мышей избирательно экспрессируют CD44 и RHAMM, которые являются двумя рецепторами, отвечающими за способность этих клеток связывать гиалуронан и формировать гиалуронановую оболочку.
Из (14-дневных) эмбрионов мышей линий CD44-/-, RHAMM-/- и CD44-/-:RHAMM-/-, т.е. эмбрионов без гиалуронановых рецепторов CD44-/-, RHAMM-/-и CD44-/-:RHAMM-/-, соответственно, выделили эмбриональные фибробласты, и получили иммортализованные клоны путем ограничения разбавления. В культуральную среду добавили модифицированный гиалуронан, полученный по Примеру 2 (НА-РЕ-1), или гиалуронан в чистом виде, как описано в Примере 5. В отличие от Примера 5, в котором для визуализации оболочек клеток использовали флуоресцентные наносферы, гиалуронановые оболочки клеток визуализировали с использованием зафиксированных эритроцитов овец, которые действовали как частицы и удалялись со дна чашки Петри, как только у клеток формировалась гиалуронановая оболочка, которую наблюдали с использованием оптики компании Hoffman, а не эпифлуоресцентной микроскопии. Клетки, у которых не формировалась оболочка, скрыты под эритроцитами и неразличимы в условиях обнаружения. Области, не содержащие эритроцитов, отображают эмбриональные фибробласты мышей, имеющие гиалуронановую оболочку. Данные, полученные для диаграммы на фиг.4, являются средними значениями РЭМ для 10 образцов каждой процедуры и генотипа.
Как показано на фиг.5, в результате добавления модифицированного гиалуронана (НА-РЕ-1) (изображения 51 (клетки RHAMM-/-), 52 (клетки CD44-/-), 53 (клетки RHAMM-/-: CD44-/-)) увеличивался как размер гиалуронановых оболочек, так и количество клеток, имеющих гиалуронановую оболочку, по сравнению с клетками, обработанными гиалуронаном в чистом виде (изображения 54 (клетки RHAMM-/-), 55 (клетки CD44-/-), 56 (клетки RHAMM-/-:CD44-/-)). По-видимому, действие модифицированного гиалуронана (НА-РЕ-1) согласно настоящему изобретению не зависит от экспрессии гиалуронановых рецепторов, характерных для фибробластов, поскольку потеря любого одного или обоих рецепторов CD44 и RHAMM, являющихся двумя наиболее широко распространенными гиалуронановыми рецепторами, значительно не влияет на количество клеток, которые имеют гиалуронановую оболочку (смотри изображения 51 (клетки RHAMM-/-), 52 (клетки CD44-/-), 53 (клетки RHAMM-/-:CD44-/-) и фиг.4). Кроме того, в результате применения модифицированного гиалуронана (НА-РЕ-1) процентное содержание клеток с гиалуронановой оболочкой значительно увеличилось (проверка по критерию Стьюдента, р<0,001) во всех генотипах по сравнению с добавлением физиологического раствора (изображения не показаны, результаты представлены на фиг.4) или гиалуронана (500 мкг/мл; 350 килодальтон).
Описанные испытания in vitro (Пример 5, Пример 6 и Пример 7) показывают, что ковалентно связанные производные гиалуронан-фосфолипидов (например, НА-РЕ-1) обладают лучшей способностью формировать оболочки клеток, чем немодифицированный гиалуронан. Способность НА-РЕ-1 связывать эмбриональные фибробласты мышей, которые не экспрессируют гиалуронановые рецепторы, показывает, что модифицированному гиалуронану согласно настоящему изобретению не требуется взаимодействовать с гиалуронановым рецептором для связывания с клеточной мембраной, и, вероятно, его липидный хвост непосредственно внедряется в фосфолипидные слои клеточной мембраны. Это не исключает взаимодействия модифицированного гиалуронана с гиалуронановыми рецепторами, если их экспрессируют клетки. Крупные оболочки, наблюдаемые у клеток, не экспрессирующих CD44 и RHAMM, дополнительно говорят о том, что взаимодействие модифицированного гиалуронана с клетками является стабильным.
Пример 8
Усиление функции SKL-каталазы композициями на основе модифицированного гиалуронана
SKL-каталаза является генетически модифицированным ферментом, который более эффективно ослабляют активные формы кислорода (ROS) внутри клеток, чем немодифицированная эндогенная каталаза. Каталазы необходимы для снижения вызываемой ROS токсичности, которая способствует старению. Одной из функций SKL-каталазы является уменьшение фрагментации гиалуронана под действием ROS. Было обнаружено, что за счет применения композиций согласно настоящему изобретению описанные конъюгаты фосфатидилэтаноламина и гиалуронана способны усиливать функцию SKL-каталазы.
С помощью SKL получили производное рекомбинантного белка каталазы (человеческий эритроцит, 10 мкг/мл, Sigma) для проникновения в клетки.21 Полученную SKL-каталазу смешали с НА-РЕ-1 и добавили в культуру стареющих человеческих фибробластов. Полученные изображения (смотри фиг.6) показывают, что клетки, обработанные конъюгатом гиалуронана и фосфатидилэтаноламина по Примеру 2 (НА-РЕ-1) и SKL-каталазой (изображение 63), имели более крупные оболочки, чем оболочки, сформировавшиеся в случае применения только SKL-каталазы (изображение 61) или только НА-РЕ-1 (изображение 62). Судя по наблюдавшему увеличению размера оболочек клеток, эти результаты показывают, что композиции на основе гиалуронана согласно настоящему изобретению усиливают воздействие SKL-каталаза на выработку ROS. Эти результаты говорят о том, что производные гиалуронана согласно настоящему изобретению способны связывать разнообразные белки и задерживать их на поверхности клеток, что согласуется с механизмом действия композиций согласно настоящему изобретению посредством молекулярной сети.
В следующих примерах (Пример 9, Пример 10, Пример 11 и Пример 12) продемонстрировано, что композиции согласно настоящему изобретению способны проникать через кожный барьер мышей после местного применения. Предполагается, что этого достаточно, чтобы обоснованно прогнозировать способность композиций согласно изобретению аналогичным образом проникать через кожный барьер людей.
Пример 9
Местное применение НА-РЕ-2 на мышах
В состав базового крема NIVEA Creme ввели (в соотношении 1:1 по объему) НА-РЕ-2 (полученный, как описано в Примере 3), как описано в Примере 4. Затем крем (0,18 г НА-РЕ-2 на одно применение) один раз в день в течение 4 дней наносили на выбритые области спины 9-месячных самок мышей (линии BL6, размер выбритой области 40×30 мм). В качестве контроля наносили базовый крем, смешанный с соевым лецитином (1:1). На пятый день мышей умертвили, и с помощью 8-мм дерматома взяли образец обработанной кожи, который зафиксировали в свежеприготовленном 4% параформальдегиде/забуференном фосфатом физиологическом растворе. Зафиксированные ткани обработали парафином, рассекли и окрасили на гиалуронан с использованием комплекта Echelon® (тест-набор ELISA для определения гиалуронана производства компании Echelon). Кератиноциты, содержащиеся в коже, на которую был нанесен НА-РЕ-2, окрасились темнее, чем в результате нанесения только крема (р<0,00001, проверка по критерию Стьюдента), и имели более толстый эпидермальный слое, чем у контрольных мышей. Плотность окрашивания на гиалуронан была представлена в количественной форме с использованием визуального анализа (Elements 3.1, Nikon). На фиг.7 показаны изображения сечений обработанной кожи (изображения 71 и 72) и контрольной кожи (изображения 73 и 74). Увеличение содержания гиалуронана кератиноцитах демонстрируется расчетами плотности элементов изображений, как показано на диаграмме на фиг.8. Нижележащий дермальный слой имел высокое содержание гиалуронана как у обработанных НА-РЕ, так и контрольных животных (смотри фиг.8). Эти результаты говорят о том, что модифицированный гиалуронан согласно настоящему изобретению проникает через кожный барьер и связывает по меньшей мере кератиноцитный слой. Полученные данные являются средними значениями РЭМ для каждой процедуры с использованием четырех мышей 10.
Пример 10
Сравнение способности НА-РЕ-2 и гиалуронана проникать через кожный барьер мышей
В состав базового косметического крема NIVEA ввели (в соотношении 1:1 по объему) НА-РЕ-2, полученный, как описано в Примере 3, гиалуронан, смешанный, но нековалентно связанный с липидами, присутствующими в лецитинах по Примеру 3 (смотри Пример 1), и гиалуронан в чистом виде (без добавления фосфолипида), как описано в Примере 4. Затем крем один раз в день в течение 4 дней наносили на выбритые области спины (0,18 г НА-РЕ-2 на одно применение, размер выбритой области 40×30 мм) 9-месячных самок мышей линии BL6 дикого типа. После этого умертвили одну группу животных, и подвергли анализу, описанному в Примере 9. Вторую группу животных не подвергали дальнейшей обработке в течение еще 2 дней, а на 7-й день затем умертвили/подвергли анализу, как описано Примере 9. Изображения на фиг.9 и сопровождающая их диаграмма (на фиг.10), на которой в количественной форме представлен гиалуронан, который смог проникнуть через кожный барьер, указывают на значительно более сильное окрашивание на гиалуронан у мышей, обработанных НА-РЕ-2 (изображение 91), чем смесью гиалуронана и фосфатидилэтаноламина (изображение 92) или гиалуронаном в чистом виде (изображение 93), при этом в обоих этих случаях через кожный барьер проникали ничтожные количества гиалуронана (проверка по критерию Стьюдента, р<0,000001) по сравнению с НА-РЕ-2. После прекращения обработки количество гиалуронана, содержащееся в кератиноцитах, постепенно снижалось, что отображено уменьшением степени окрашивания на гиалуронан у мышей, получавших НА-РЕ-2 (смотри изображение 94 и фиг.10). Как и ожидалось, степень окрашивания на гиалуронан у остальных мышей (смотри изображения 95 и 96 и на фиг.10) оставалось пренебрежимо малым.
Эти результаты демонстрируют усиленную способность композиций на основе модифицированного гиалуронана согласно настоящему изобретению в составе базового косметического крема проникать через кожный барьер по сравнению со смесью гиалуронана и липидов, присутствующих в соевом лецитине (включая фосфатидилэтаноламин) или по сравнению с гиалуронаном в чистом виде. Что важнее, модифицированный гиалуронан, способный проникать через кожный барьер, задерживается в кератиноцитном слое за счет усиленной способности композиций на основе модифицированного гиалуронана согласно изобретению связывать клетки, как продемонстрировано в Примере 5. Как упоминалось выше, в статье Brown и др. 14 сообщалось о проникновении фрагментов гиалуронана аналогичного размера через кожный барьер, однако этот гиалуронан легко попадает в большой круг кровообращения и выводится из организма. Аналогичные факты приведены в статье Кауа и др.,5 в которой также указано, что гиалуронан массой 50-400 килодальтон способен проникать в эпидермис и также увеличивать толщину кератиноцитного слоя, но вводимый гиалуронан (с использованием меченого гиалуронана) не задерживается в эпидермисе, быстро выводится из дермы, а для достижения эффектов функционального характера требуется экспрессия CD44 в клетках. Полученные результаты дополнительно подтверждают, что даже в случае проникновения немодифицированного гиалуронана через кожу он не задерживается в коже в какой-либо ощутимой степени и, соответственно, не способен действовать таким образом, чтобы восполнять содержание гиалуронана в коже.
Поскольку количество эндогенного гиалуронана в коже может изменяться в зависимости от местонахождения, были разработаны средства внутреннего контроля для оценки окрашивания на гиалуронан, обработанной и контрольной кожи, и подтверждения различия между областью обработанной и необработанной кожи. На выбритые области спины мышей нанесли НА-РЕ-2 и контрольный крем (гиалуронан в чистом виде), как описано ранее. Обработанные области промаркировали (шерсть на соседних необработанных границах была удалена с помощью Nair™ и проштамповали с захватом обработанной и необработанной областей; проштампованные ткани поместили в небольшие контейнеры с сохранением правильной ориентации на протяжении анализа и промаркировали разметочным пером с указанием гистологии), и собрали/проанализировали ткани, как описано ранее (Пример 9). Полученные образцы показывают (смотри фиг.11, на которой граница распространения обозначена стрелкой, а область применения пунктирной линией), что при применении гиалуронан в чистом виде не наблюдалась четкая граница окрашивания (изображение 111), и это говорило о том, что в области применения проникло/задержалось очень мало, если это вообще имело место, введенного гиалуронана. В отличие от этого, на границе распространения НА-РЕ-2 (изображение 112) наблюдалась четкая граница раздела окрашивания, которое было значительно интенсивнее в обработанной, чем необработанной области кожи (проверка по критерию Стьюдента, р<0,000001). Эти результаты, представленные в количественной форме на сопровождающей диаграмме на фиг.12, подтверждают, что композиции на основе модифицированного гиалуронана согласно настоящему изобретению проникают в эпидермис и накапливаются в нем в месте применения, и остаются в пределах первоначальной области применения.
Пример 11
Замещение гиалуронановых оболочек клеток с использованием НА-РЕ-2 у мышей без гиалуронановых рецепторов
На выбритые области спин (размером 40×30 мм) 9-месячных самок мышей RHAMM-/- (организм которых экспрессирует гиалуронановый рецептор CD44, но не гиалуронановый рецептор RHAMM) в течение 4 дней ежедневно наносили крем, содержащий НА-РЕ-2 (0,18 г НА-РЕ-2, полученного, как описано выше). На 5-й день после начала обработки животных умертвили, и взяли образцы обработанной кожи, как описано в Примере 9. В качестве контроля использовали кожу мышей, на которую наносили базовый крем в чистом виде. Как показано на изображениях 131 и 132 на фиг.13 и сопровождающей их диаграмме, гиалуронан задерживался в обработанном НА-РЕ-2 эпидермисе (изображение 131) в значительно большей степени, чем коже контрольных животных (изображение 132), в которой его содержание было ничтожно малым (проверка по критерию Стьюдента, р<0,000001). Полученные данные являются средними значениями РЭМ для 4 мышей.
На выбритые области спин 9-месячных самок мышей CD44-/-.-RHAMM-/-(организм которых не экспрессирует ни гиалуронановый рецептор CD44, ни RHAMM, выведенных, как описано в статье Tolg и др. 22) также наносили НА-РЕ-2, как описано выше, и с использованием аналогичного контроля. Как показано на изображениях 141 и 142 на фиг.14 и сопровождающих их диаграмме, в эпидермальном слое обработанной кожи (изображение 141) накаливалось значительно больше гиалуронана, чем в коже контрольных животных (изображение 142). Полученные данные являются средними значениями РЭМ для 4 мышей. Это говорит о том, что для взаимодействия композиций на основе модифицированного гиалуронана согласно настоящему изобретению с кератиноцитами не требуются гиалуронановые рецепторы (CD44 и RHAMM, которые являются основными рецепторами в коже). Эти результаты в сочетании с известной способностью фосфатидилэтаноламина внедряться в клеточные мембраны говорят о том, что модифицированный гиалуронан непосредственно внедряется в клеточные мембраны без помощи гиалуронановых рецепторов. Сравнение окрашивания на эндогенный гиалуронан и НА-РЕ-2 в эпидермальном слое мышей RHAMM-/- (CD44+) (фиг.13) с окрашиванием у мышей с отрицательной экспрессией гиалуронановых рецепторов (CD44-/-:RHAMM-/-) (фиг.14) показывает, что окрашивание на эндогенный гиалуронан (изображения 132 и 142) и после обработки эпидермиса с использованием НА-РЕ-2 (изображения 131 и 141) является более сильным в случае экспрессии CD44, чем в случае отсутствия обоих гиалуронановых рецепторов. Эти результаты говорят о том, что как эндогенная оболочка, так и оболочка из конъюгата гиалуронана и фосфатидилэтаноламина (НА-РЕ-2) стабилизируется за счет присутствия рецепторов CD44, что согласуется с известным участием рецепторов CD44 в формировании эндогенных гиалуронановых оболочек культивируемых клеток.
Пример 12
Сравнение композиций согласно изобретению с веществами в виде частиц на основе фосфатидилэтаноламина и гиалуронана, описанными в WO 2003/015755
Способом, описанным в заявке WO 2003/015755 на имя Margalit, получили конъюгаты фосфатидилэтаноламина и гиалуронана в виде частиц (нано- и микросфер).
В лабораторный стакан поместили 2 мл соевого лецитина. Гиалуронан (2 мл, 12 мг/мл, 6,3×10-5 моль групп -СО2Н; полидисперсный Baxyl™ массой 500-2500 килодальтон производства компании Cogent Solutions Group) активировали путем снижения pH до 4,5, а затем добавления EDC (2,5 мг, 1,6×10-5 моль; из свежеприготовленного исходного раствора), после чего добавили активированный гиалуронан в лабораторный стакан с лецитином, а затем добавили деионизированную воду (1 мл) и с помощью NaOH довели pH до 8,6. Полученную смесь в течение ночи инкубировали в вертикальном шейкере при температуре 37°C, после чего довели pH до 7,2, в течение 10 минут разрушали смесь ультразвуком, и в течение 40 минут дважды центрифугировали с перегрузкой 1,2×105 при температуре 40°C, чтобы получить вещество в виде частиц в качестве изолята. Исходя из количества использованного свежеприготовленного исходного раствора EDC, расчетная теоретическая максимальная степень связывания фосфатидилэтаноламина и гиалуронана составляла -25%. Полученное вещество поместили непосредственно на предметные стекла и смешали с базовым кремом таким же образом, как описано в настоящем изобретении, после чего нанесли на предметное стекло.
Образцы в виде частиц, полученные согласно методике, ранее описанной в заявке Margalit, сравнили с композициями согласно настоящему изобретению. Нанесли конъюгаты гиалуронана и фосфатидилэтаноламина, описанные в Примере 3 (НА-РЕ-2), на предметное стекло непосредственно после получения и в виде смеси в соотношении 1:1 с базовым кремом, описанным в Примере 4 (базовым кремом NIVEA Creme), который также нанесли на предметное стекло.
Все образцы покрыли покровным стеклом и исследовали с помощью инвертированного микроскопа Nikon ТЕ300 с оптикой компании Hoffman с 40-кратным увеличением, и получили изображения, представленные на фиг.15. На изображениях 153 (прямое применение) и 154 (препарат на основе крема) ясно видна пузырчатая структура или корпускулярная природа композиций в виде частиц, полученных согласно методике, описанной в заявке WO 2003/015755 на имя Margalit. Тем не менее, как видно на изображениях 151 и 152, у композиций согласно настоящему изобретению отсутствуют признаки веществ с аналогичной самоорганизацией.
Основным применением согласно настоящему изобретению является применение в качестве носителя для доставки гиалуронана в эпидермальный и дермальный слои кожи, где он может служить для восполнения количества гиалуронана на участках кожи, на которых имеется его дефицит.
После получения модифицированного гиалуронана согласно настоящему изобретению, например, как описано в Примере 2 или Пример 3, могут быть получены составы с использованием известных из техники технологий и методов или предлагаемых на рынке или других исходных косметических кремов, как описано в Примере 4. Помимо композиций на основе модифицированного гиалуронана согласно настоящему изобретению в эти составы также могут быть включены другие косметические действующие ингредиенты, такие как обычно входят в предлагаемые на рынке кремы для кожи, включая те из них, которые, как известно, помогают придавать коже помолодевший внешний вид, например, витамины, аминокислоты, соферменты, β-глюканы, полинуклеотиды, акцепторы радикалов, факторы роста, эстрогены и адипогенные факторы помимо всего прочего. В составы также могут добавляться ингибиторы гиалуронидазы с целью снижения скорости распада гиалуронана в коже или ингибиторы RHAMM, которые, как доказано, вызывают образование клеток подкожной жировой клетчатки, потерянные в процессе старения. 22 Кроме того, в составы могут входить фармацевтические действующие ингредиенты, в частности, действующие ингредиенты для лечения состояний кожи, таких как рак кожи, контактный дерматит, псориаз и экзема. Таким образом, в настоящем изобретении предложен способ доставки лекарственных препаратов путем локализованного, местного применения, а не системного перорального введения или с использованием внутривенных лекарственных форм или инъекций для подкожного или внутрикожного введения.
Согласно одной из дополнительных особенностей изобретения производные гликозаминогликана также могут использоваться для переноса белка через кожный барьер. Эта способность переноса является неожиданной и предположительно достаточной для обеспечения нацеленной доставки от низкомолекулярных (массой 700 дальтон) до высокомолекулярных (массой 400-500 килодальтон) белков по меньшей мере в дермальный и эпидермальный слои кожи, а также нижележащие мышечные ткани. Таким образом, композиции согласно настоящему изобретению могут дополнительно применяться для введения косметически важных высокомолекулярных белков, таких как Botox™ путем местного применения, и тем самым устранять необходимость во множестве инъекций. Способность доставки белков в кожу также позволяет осуществлять местное применение терапевтических белков, таких как гиалуронидаза и ингибиторы RHAMM; интерфероны или противовоспалительные белки/цитокины; средства против рака кожи, такие как антитела, рекомбинантные белки, белковые фрагменты и пептиды; и вакцинацию с использованием пептидов/белков, и тем самым обеспечивает воздействие на локализованную область, а не посредством системного введения или инъекций, что предположительно снижает частоту или исключает возникновение побочных эффектов, обычно сопутствующих системному воздействию. Кроме того, композиции согласно изобретению могут применяться для доставки ферментов, таких как гиалуронан-синтаза, способствующих выработке гиалуронана в коже. Помимо этого, этим способом могут вводиться другие высокомолекулярные соединения, такие как ДНК, РНК или кДНК.
Хотя из уровня техники известно применение липидированных гликозаминогликанов в качестве средства доставки белков (например, из заявки WO 03/015755 на имя Margarlit и Peer), в этих примерах предусмотрено захватывание белка самоорганизующейся структурой в виде частиц. Исходя из действия композиций согласно настоящему изобретению и результатов проведенных до сих пор экспериментов, которые описаны в предыдущих примерах, предполагается, что в отличие от описанной ранее известной из уровня техники доставки белка, механизм действия композиций согласно изобретению не основан на заключение в оболочку, поскольку описанные в изобретении композиции не демонстрируют самоорганизацию в упорядоченную структуру. Предполагается, что вместо этого композиции согласно настоящему изобретению способны обеспечивать доставку белков через кожный барьер посредством механизма неорганизованного спутывания липидированного гликозаминогликан вокруг белка и внутри него. Способность обеспечивать доставку белка в кожу описана в следующем примере.
Пример 13
Перенос белков RHAMM через кожный барьер с использованием модифицированных гликозаминогликанов (НА-РЕ-2)
Смешали мышиный GST-RHAMM (35 мкг исходного раствора 1 мг/мл), меченый белок массой 84 килодальтон или мышиный GST (массой 26 килодальтон) в чистом виде (35 мкг исходного раствора 3 мг/мл) с НА-РЕ-2 (0,18 г) и ввели в базовый крем NIVEA Creme, как описано в Примере 4. В качестве контроля использовали препарат гиалуронана и базового крема NIVEA Creme, содержащего белки. 0,18 г лечебного состава (содержащего 35 мкг белка) и контрольный крем ежедневно в течение 5 дней наносили на выбритые области спины размером 40×30 мм 9-месячных самок мышей линии BL6 дикого типа, которых умертвили на шестой день. С помощью 8-мм дерматома были взяты образцы кожи, которые зафиксировали в свежеприготовленном 4%-ном параформальдегиде, а затем обработали парафином. Из ткани перпендикулярно образцу вырезали 8-мкм сечения, которые окрасили на GST с использованием антител против GST, взятых у коз. Связанное антитело визуализировали с использованием взятого у коз биотинилированного антитела к IgG кролика, конъюгата стрептавидина и пероксидазы хрена и Dab, и получили коричневое пятно при помещении антитела против GST на предметное стекло. Для обнаружения GST-RHAMM также использовали антитела против GST, а не RHAMM, поскольку кожа нормально не экспрессирует GST. Визуализация образцов (смотри фиг.16) показала, что GST-RHAMM был перенесен через кожный барьер мышей в нижележащий мышечный слой при доставке с композицией согласно настоящему изобретению (изображение 161), тогда как GST-RHAMM почти не был обнаружен в кератиноцитном слое контрольного образца, содержащего немодифицированный гиалуронан (изображение 163). Относительные количества GST-RHAMM, достигшего как кератиноцитный слой, так и нижележащий мышечный слой, показаны на диаграмме на фиг.17, на которой представлены средние значения для 5 мышей. Аналогичные результаты были получены в случае белка GST с меньшей молекулярной массой (26 килодальтон) (смотри фиг.16, изображение 162, доставлен с НА-РЕ-2, и изображение 164, доставлен с немодифицированным гиалуронаном).
Ранее считалось, что чрескожная доставка белков с использованием способствующих проникновению веществ ограничена белками массой менее 10000 дальтон. Обширный список способов, разработанных в попытке способствовать местной и чрескожной доставке белков и пептидов, таких как липосомы, способствующих проникновению веществ, таких как спирты, DMSO, монотерпены и сложные эфиры жирных кислот, физической модификации пролекарств и применению физических методов усиления проникновения через кожу (например, путем гидратирования смесью этанола и воды, обнажения наружного кератиноцитного слоя) и созданию химических средств доставки (например, путем электрического и теплового воздействия на кожу) говорит как о сложностях чрескожной доставки, так и о необходимости эффективного способа доставки. Такие способы описаны, например, в том числе в работах Sugino и др.,24 Skountzou и Kang 25 и Antosova, и др. 17 Соответственно способ доставки белков с использованием композиций согласно настоящему изобретению представляет собой значительное усовершенствование способности доставки белков через кожный барьер. Хотя согласно настоящему изобретению в целях использования в качестве носителя белков и/или других фармацевтических или косметических веществ, которые желательно доставлять через кожный барьер, может быть модифицирован любой гликозаминогликан, в качестве гликозаминогликана обычно предпочтительно используют гиалуронан с учетом его врожденного присутствия в коже и общедоступности его высокомолекулярных форм.
Помимо доставки белков через кожный барьер композиции на основе гликозаминогликана согласно настоящему изобретению также могут использоваться для доставки других биомакромолекул через кожный барьер. Другие биомакромолекулы включают, например полипептиды (в том числе ферменты), протеогликаны, углеводы/полисахариды, цепи нуклеиновых кислот, белковые и пептидные лечебные средства, антисмысловые лечебные средства, биоактивные искусственные полимеры и биоактивные липидные полимеры.
Хотя белок, переносимый через кожный барьер в Примере 13, имел массу 84 килодальтона, предполагается, что она не является ограничением (известно, что RHAMM образует димеры и тримеры, a GST, которая также самоассоциациируется, способствует накоплению в ней RHAMM; соответственно, фактическая масса переносимого белка может достигать 255 килодальтон (гримерный GST-RHAMM)), и была выбрана с учетом доступности и сходства с Botox™ (150 килодальтон), который является одним из представляющих интерес белков для косметического применения согласно настоящему изобретению. Предполагается, что основным ограничивающим фактором при выборе применимых биомакромолекул является не масса, а их способность внедряться в молекулярные сети, которые предположительно формируются композициями на основе гликозаминогликана согласно изобретению. Таким образом, предполагается, что с увеличением массы способность к переносу преимущественно линейных биомакромолекул, например фрагментов коллагена, снижается в большей степени, чем у нелинейных биомакромолекул такого же размера, например белков.
В следующих примерах, которые не имеют целью ограничить объем изобретения, продемонстрирована эффективность описанного выше модифицированного гиалуронана (НА-РЕ-2) при использовании для местного воздействия на пациентов с разнообразными связанными с кожей состояниями.
Пример 14
Борьба с морщинами
Обычно кожа рук стареет быстрее, чем где-либо еще, частично из-за скудности слоя подкожной жировой клетчатки, важного для снабжения фибробластов кожи цитокинами и факторами роста. Кроме того, кожа рук является более тонкой, чем, например, кожа лица.
Руки 59-летней женщины 2-3 раза в день в течение 10 дней обрабатывали смесью 2,5 мл НА-РЕ-2 и базового крема NIVEA Creme, полученной по Примеру 4. До начала процедур на коже на руках имелись небольшие фиброзные рубцы или морщины, и она выглядела сухой/чешуйчатой; после процедур кожа на руках стала более блестящей, потеряла сухой, чешуйчатый внешний вид, а фиброзные рубцы заметно уменьшились. Через 2 недели после прекращения процедур кожа на обработанных участках опять приобрела более сухой внешний вид, но небольшие рубцы снова не появились.
Пример 15
Борьба с воспалением, сопутствующим старческому кератозу
Пациенту с вызванными старческим кератозом поражениями кожи, которые ранее лечили жидким азотом, наносили смесь НА-РЕ-2 и базового крема NIVEA Creme, полученную по Примеру 4. Процедура состояла в нанесении один раз в день в течение 7-10 дней ~2,5 мл средства на одну сторону черепа с последующей обработкой азотом с целью удаления поражений. В течение курса процедур воспаление значительно уменьшилось, а скорость заживления на обработанном участке увеличилась по сравнению с применением крема для кожи, который дерматолог использовал для удаления повреждений. Этот результат согласуется с данными о том, что нативный или высокомолекулярный гиалуронан обладает противовоспалительными свойствами, которые являются одной из функций от природы присутствующего в коже гиалуронана.6
Пример 16
Борьба с сухостью кожи лица
25-летней женщине с предрасположенностью к угревой сыпи системно вводили третиноин А. Лечение в сочетании с ежедневным плаванием в бассейне с хлорированной водой стало причиной чрезвычайной сухости и болезненности кожи лица, в частности трещины и шершавость кожи вокруг рта. Пациент в течение одной недели получал смесь НА-РЕ-2 и базового крема Oil of Olay™, полученную по Примеру 4. По окончании процедур сухой внешний вид и болезненные ощущения на коже лица исчезли. Процедуры не повлияли положительным или отрицательным образом на исходную угревую сыпь.
Пример 17
Борьба с рубцеванием кожи
Профессиональному музыканту с фиброзным рубцеванием в области плеча, образовавшимся вследствие многих лет игры на альте, один раз в день в течение 30 дней втирали в зарубцевавшуюся кожу ~2,5 мл содержащего НА-РЕ-2 крема, полученного по Примеру 4. По завершении процедур рубцевание, которое существовало в течение многих лет, исчезло.
Пример 18
Борьба с трещинами на коже пальцев
Пораженную трещинами кожу пальцев нескольких музыкантов (виолончелистов, скрипачей, альтистов и пианистов) обрабатывали содержащей НА-РЕ-2 композицией, полученной по Примеру 4. У исполнителей, играющих на смычковых инструментах, кожа большого пальца руки трескается, в частности, в зимнее время из-за давления на колодку смычка во время игры в условиях сухой холодной погоды. У пианистов, в особенности, более возрастных, часто появляются трещины на кончиках пальцев, вероятно, частично из-за давления, оказываемого на кончики пальцев в процессе игры.
Трем исполнителям, играющим на смычковых инструментах, и двум пианистам наносили на потрескавшиеся кончики пальцев крем (~1 мл), состоящий из смеси НА-РЕ-2 и базового крема NIVEA Creme (полученной по Примеру 4), в результате чего трещины на коже исчезли в течение 3-4 дней.
Применение в прошлом других кремом, включая базовый крем NIVEA Creme, использовавшийся в Примере 4, не оказывало эффекта на лечение трещин на коже.
Пример 19
Борьба с трещинами на коже пяток
С возрастом кожа пяток обычно становится толще и имеет тенденцию трескаться, в особенности, в периоды холодной, сухой погоды зимой. Трем пациентам в возрасте 55-65 лет с сильными трещинами на коже пяток, вызывавшими боль при ходьбе, каждый вечер в течение 5-7 дней наносили на пятки ~2,5 мл смеси НА-РЕ-2 и базового крема NIVEA Creme, полученной по Примеру 4. Каждый пациент в течение 2-3 дней заметил улучшение состояния, включая способность ходить без болевых ощущений. После прекращения процедур благоприятный эффект исчез в течение 5-7 дней. При повторном применении течение 2-3 дней трещины и боль снова уменьшались у каждого пациента. Применение крема в чистом виде не принесло облегчения ни одному из пациентов.
Пример 20
Воздействие на кожу лица
Трем пациентам 1-2 раза в день наносили смесь НА-РЕ-2 и базового крема NIVEA Creme, полученную по Примеру 4. В течение 1 недели после начала процедур кожа стала более блестящей и гладкой. На протяжении этого времени кожа выглядела хорошо увлажненной (процедуры проводились в зимнее время, когда пониженные температуры вызывают сухость кожи), и исчезли небольшие морщины вокруг глаз. Через 1 месяц проведения процедур первоначально наблюдавшийся эффект усилился, и кожа выглядела более толстой, в особенности, вокруг глаз, и уменьшились проявления морщин вокруг губ. После прекращения процедур кожа на обработанных участках опять стала сухой, а вокруг глаз и губ постепенно снова появились морщины.
Поскольку в описанные варианты осуществления может быть внесено множество изменений, не выходящих за пределы объема изобретения, предполагается, что все должны рассматриваться в качестве иллюстрации, а не ограничения изобретения.
В приведенном выше описании содержатся ссылки на следующие документы:
1 Fisher, G. J.; Varani, J.; Voorhees, J.J. Archives of Dermatology. 2008, 14495, 666-6672.
2 Verdier-Servrain, S.; Bonte, F. Journal of Cosmetic Dermatology 2007, 6(2), 75-82.
3 Baumann, L. Journal of Pathology 2007, 211(2), 241-251.
4 Tammi, M.I.; Day, A.J.; Turley, E.A. The Journal of Biological Chemistry 2002, 277(7),4581-4584.
5 Kaya, G.; Tran, C; Sorg, O.; Hotz, R.; Grand, D.; Carraux, P.; Didierjean, L.; Stamenkovic, I.; Saurat, J.-H. PLoS Medicine 2006, 3, e493 (2291-2303).
6 Stem, R.; Maibach, H.I. Clinics in Dermatology 2008, 26, 106-122.
7 Wiest, L.; Kerscher, M. Journal der Deutschen nepManbHbinologischen Gesellschaft (JDDG) 2008, 6(3), 176-180.
8 Masferrer, J.P.; Mejia, M.M.; Femandez, M.V.; Astudillo, A.A.; Armenteros; A.L.H.; Hemandez, V.M.; Perez, R.S.; Ferre, A.M. Clinical & Translational Oncology. 2010, 12, 43-48.
9 Tzellos, Т.G.; Klagas, I.; Vahtsevanos, K.; Triaridis, S.; Printza, A.; Kyrgidis, A.; Karakiulakis, G.; Zouboulis, C.C.; Papakonstantinou, E. Experimental Dermatology 2009, 18, 1028-1035.
10 Yu, Q.; Banerjee, S.D.; Toole, B.P. Developmental. Dynamics. 1992, 193(2), 145-151.
11 Rilla, K.; Tolhonen, R.; Kultti, A.; Tammi, M.; Tammi, R. Journal of Histochemistry and Cytochemistry 2008, 56(10), 901-910.
12 Buchanan, E.P.; Longaker, M.Т.; Lorenz, H.P. Advances in Clinical Chemistry 2009, 48, 137-161.
13 Webber, J.; Meran, S.; Steadman, R.; Phillips, A. The Journal of Biological Chemistry 2009, 284(14), 9083-9092.
14 Brown, T.J.; Alcom, D.; Fraser, J.R.E. The Journal of Investigative Dermatology 1999, 3, 740-76.
15 Zhang, L.-S.; Greyner, H.J.; Mummert, M.E. Journal of Dermato logical Science 2009, 55, 56-59.
16 lorizzo, M.; De Padova, M.P.; Tosti, A. Clinics in Dermatology 2008, 26, 177-181.
17 Antosova, A.; Mackova, M.; Krai, V.; Macek, T. Trends in Biotechnology 2009, 27, 628-635.
18 Gebhardt, C.; Averbeck, M.; Diedenhofen, N.; Willenberg, A.; Anderegg, U.; Sleeman, J.P.; Simon, J.C. Journal of Investigative Dermatology 2010, 130, 141-149.
19 Tolg, С; Poon, R.; Foode. E.; Turley, E.A.; Alman, B.A. Oncogene 2003, 22, 6873-6882.
20 Tolg, С.; Hamilton, S.R.; Nakrieko, K.-A.; Kooshesh, F.; Walton, P.; McCarthy, J.В.; Bissell, M.J.; Turley, E.A. Journal of Cell Biology 2006, 175(6), 1017-1028.
21 Koepke, J.I.; Nakrieko, K.-A.; Wood, C.S.; Boucher, K.K.; Terlecky, L.J.; Walton, P.A.; Terlecky, S.R. Traffic 2007, 8, 1590-1600.
22 Tolg, C.; Hamilton, S.R.; Nakrieko, K.-A.; Kooshesh, F.; Wlaton, P.; McCarthy, J.В.; Bissell, M.J.; Turley, E.A. Journal of Cell Biology 2006, 175(6), 1017-1028.
23 Girish, K.S.; Kemparaju, K.; Nagaraju, S.; Vishwanath, B.S. Current Medicinal Chemistry 2009, 16, 2261-2288.
24 Sugino, M.; Todo, H.; Sugibayashi, K. Yakugaku Zasshi im, 129(12), 1453-1458 (abstract).
25 Skountzou, I.; Kang, S.-M. Current Topics in Microbiology and Immunology 2009, 333, 347-368.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ КОЖНОГО НАПОЛНИТЕЛЯ ДЛЯ ЛЕЧЕНИЯ МЕЛКИХ МОРЩИН | 2012 |
|
RU2626513C2 |
| УГЛЕВОДНЫЙ СШИВАЮЩИЙ АГЕНТ | 2016 |
|
RU2733145C2 |
| КОМПОЗИЦИЯ КОЖНОГО НАПОЛНИТЕЛЯ И СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2679317C1 |
| КОМПОЗИЦИИ КОЖНЫХ НАПОЛНИТЕЛЕЙ | 2012 |
|
RU2638713C2 |
| ИНЪЕКЦИОННЫЙ ГЕЛЕВЫЙ ПРОДУКТ | 2018 |
|
RU2783125C2 |
| КОМПОЗИЦИИ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ ПЕРЕКРЕСТНО-СШИТЫЕ ГЛИКОЗАМИНОГЛИКАНЫ | 2017 |
|
RU2748750C2 |
| СТАБИЛИЗИРОВАННАЯ ГИАЛУРОНОВАЯ КИСЛОТА | 2019 |
|
RU2805502C2 |
| ОФТАЛЬМОЛОГИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2734344C2 |
| СПОСОБ ТРАНСПЛАНТАЦИИ КЛЕТОК ИЗ ПЛОТНЫХ ТКАНЕЙ | 2011 |
|
RU2574364C2 |
| СПОСОБ ПРИВИВКИ КЛЕТОК ПЕЧЕНИ СУБЪЕКТУ С ЗАБОЛЕВАНИЕМ ИЛИ ДИСФУНКЦИЕЙ ПЕЧЕНИ | 2011 |
|
RU2736955C2 |
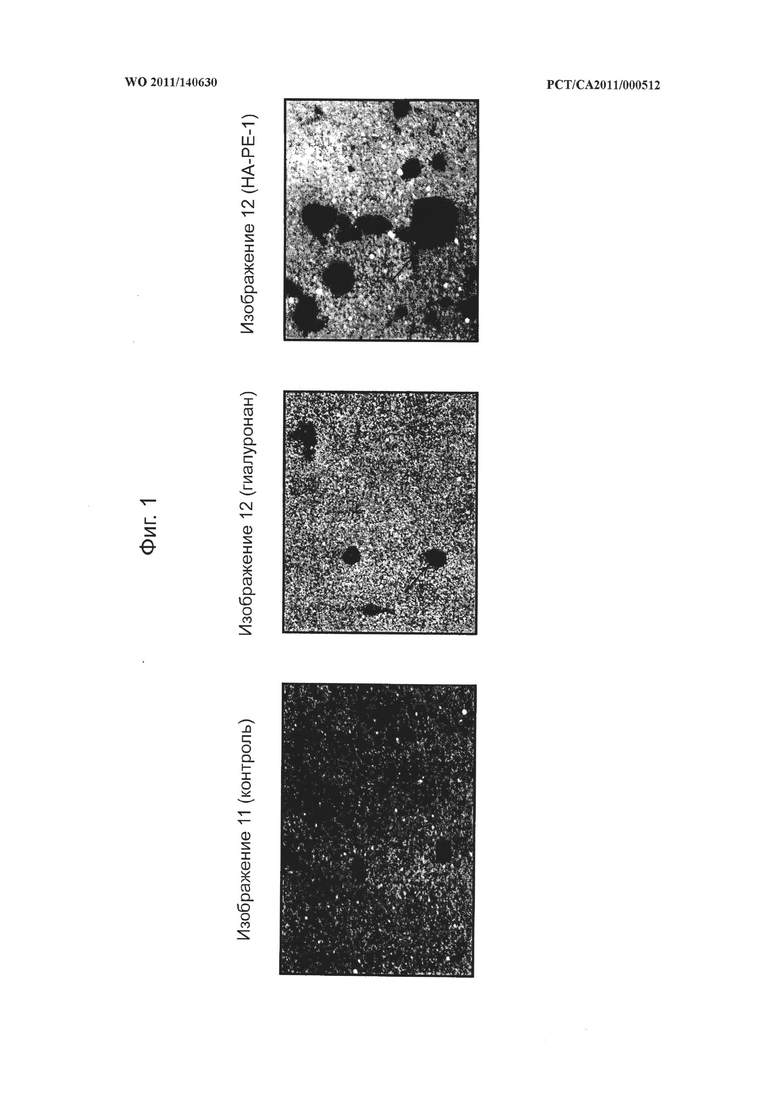
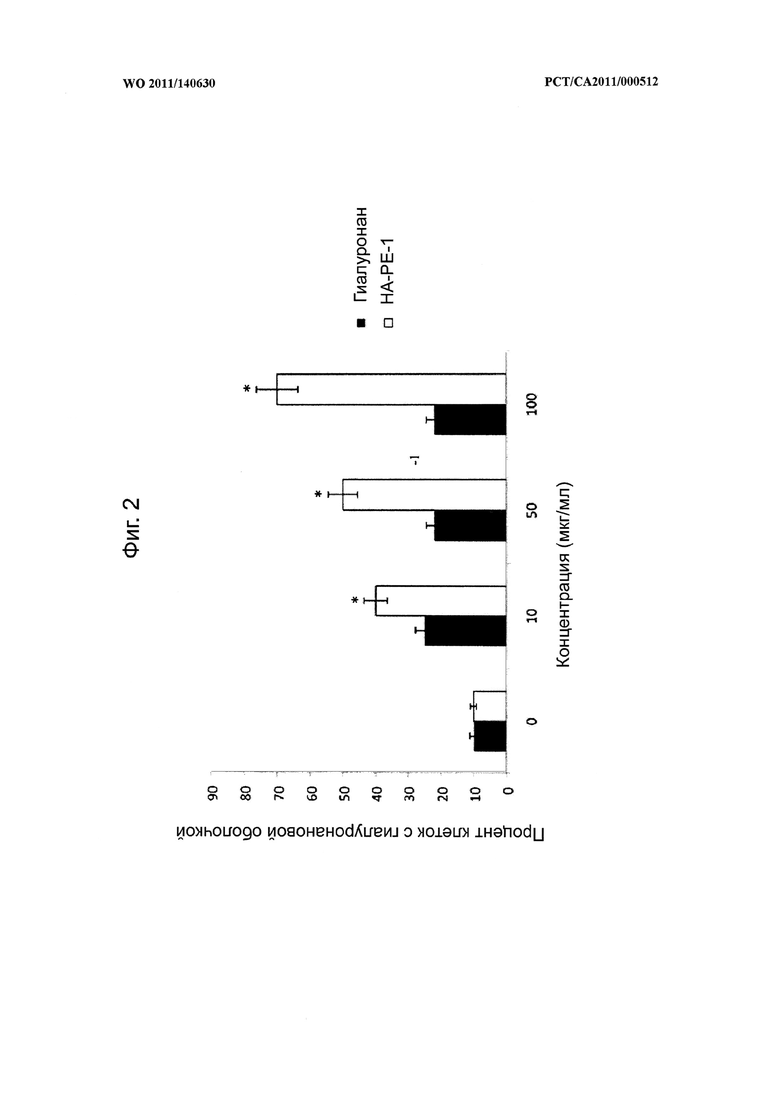
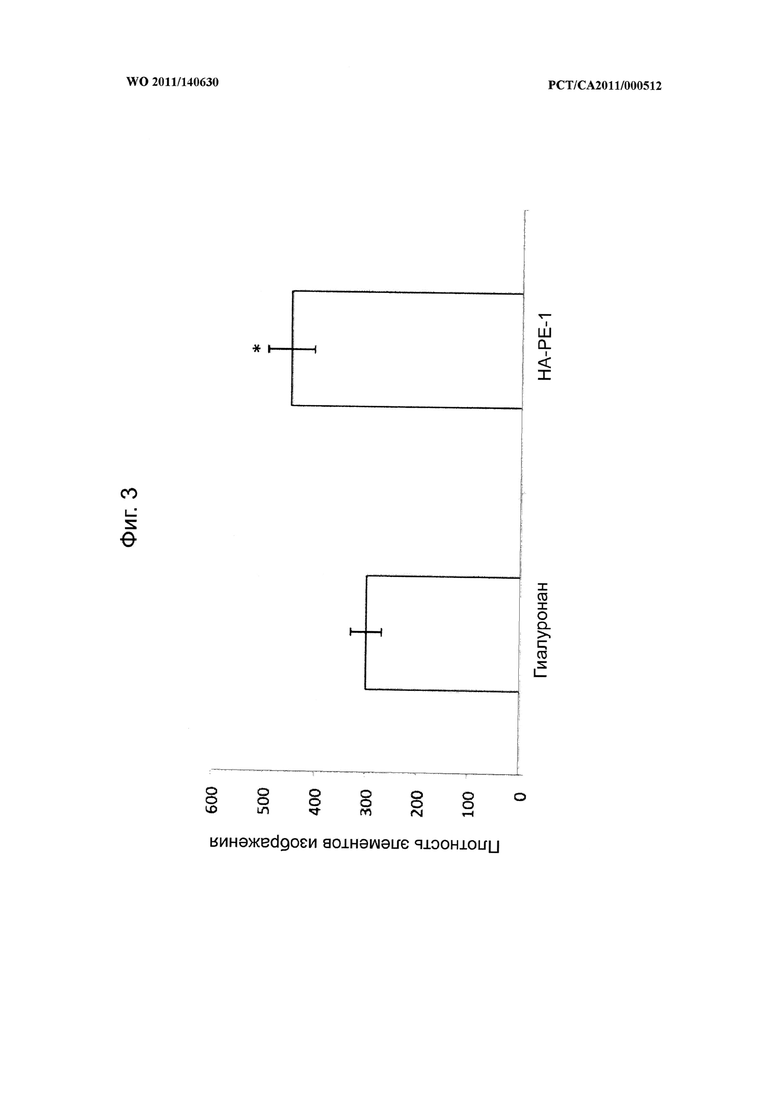
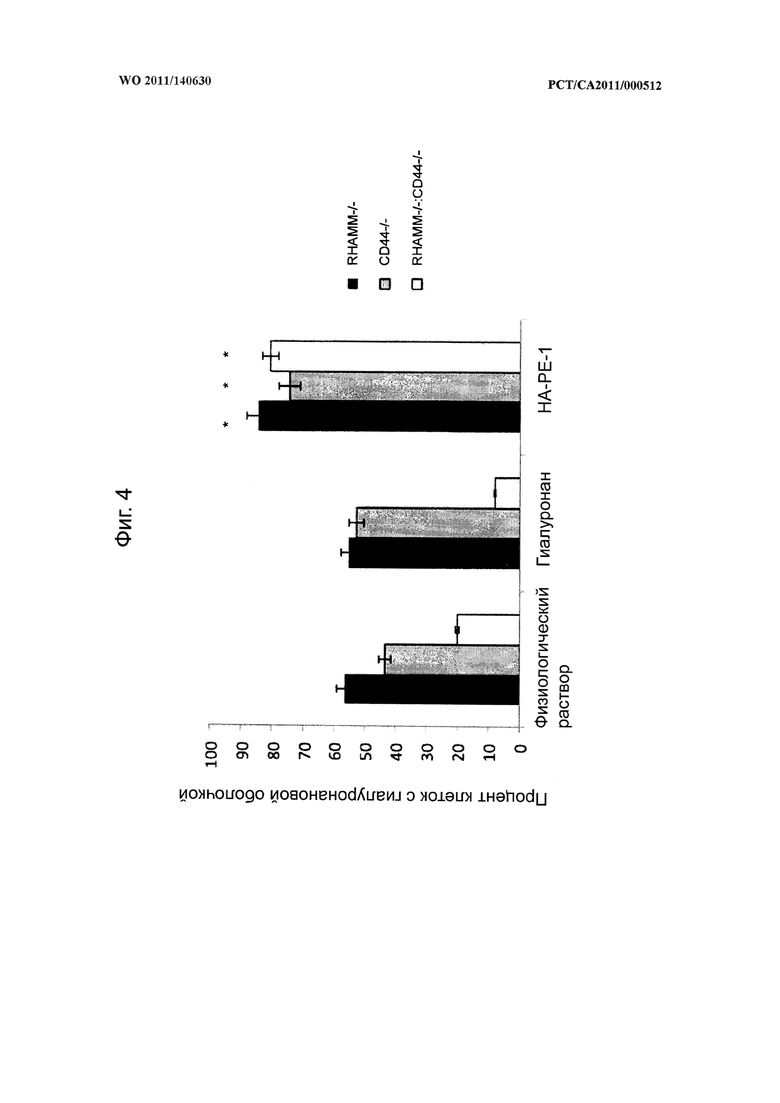

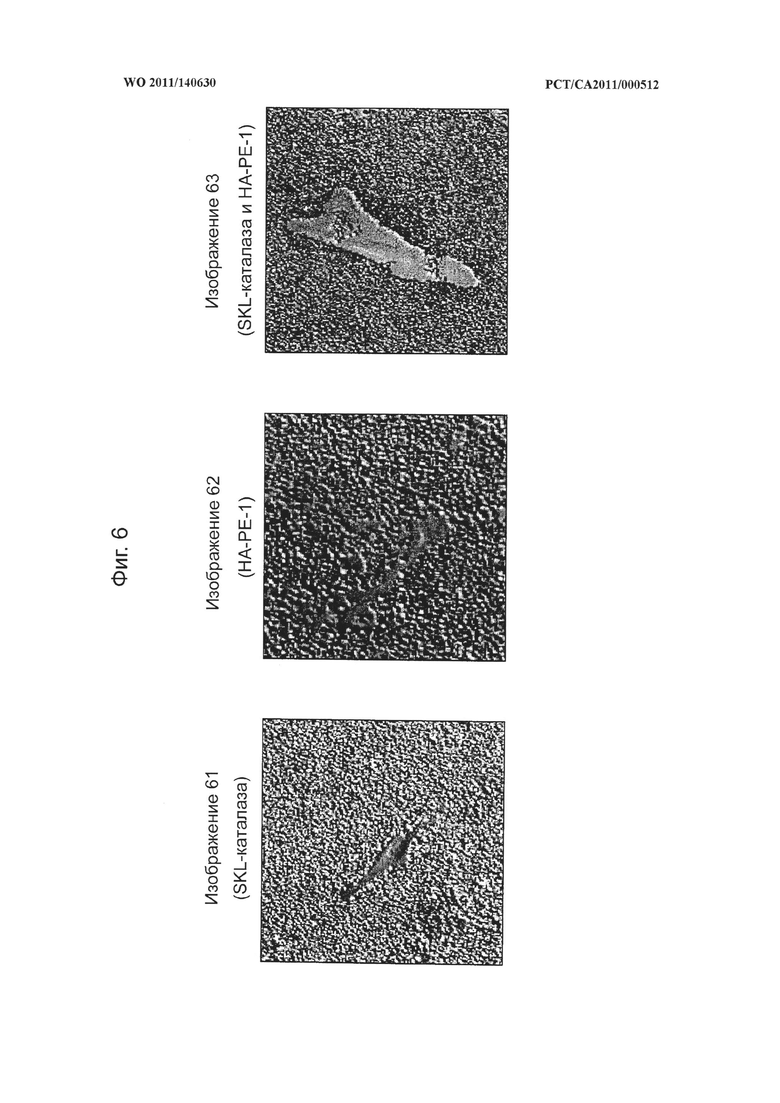
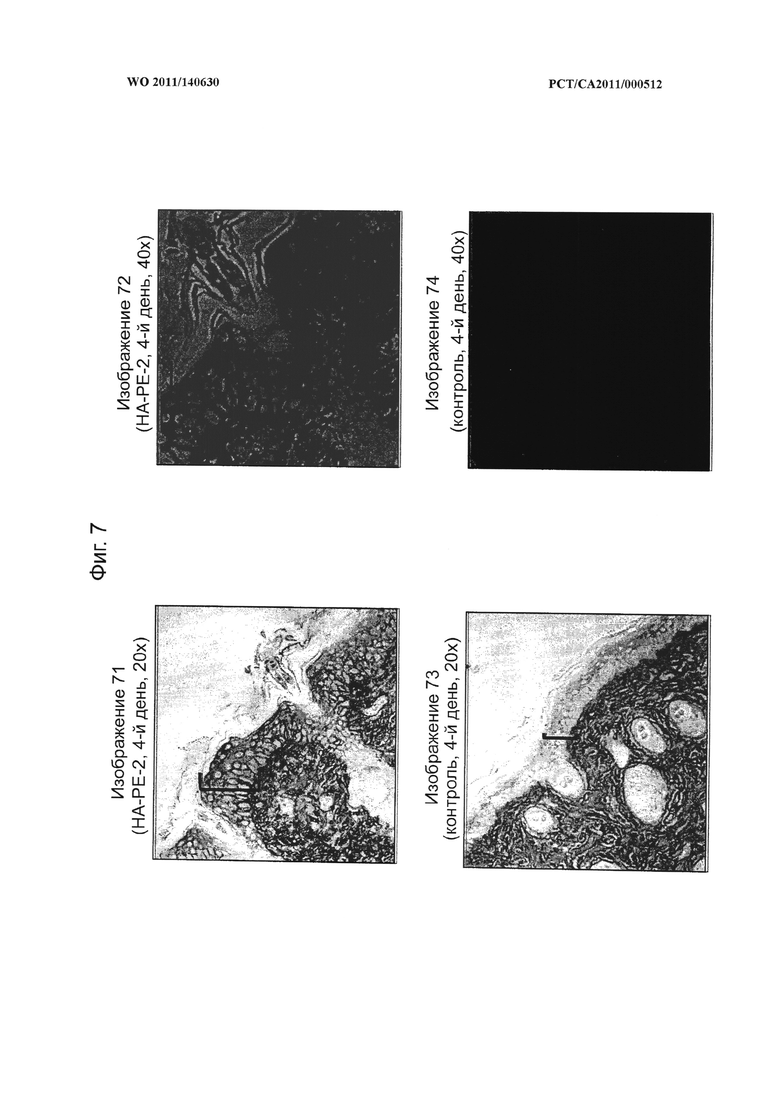
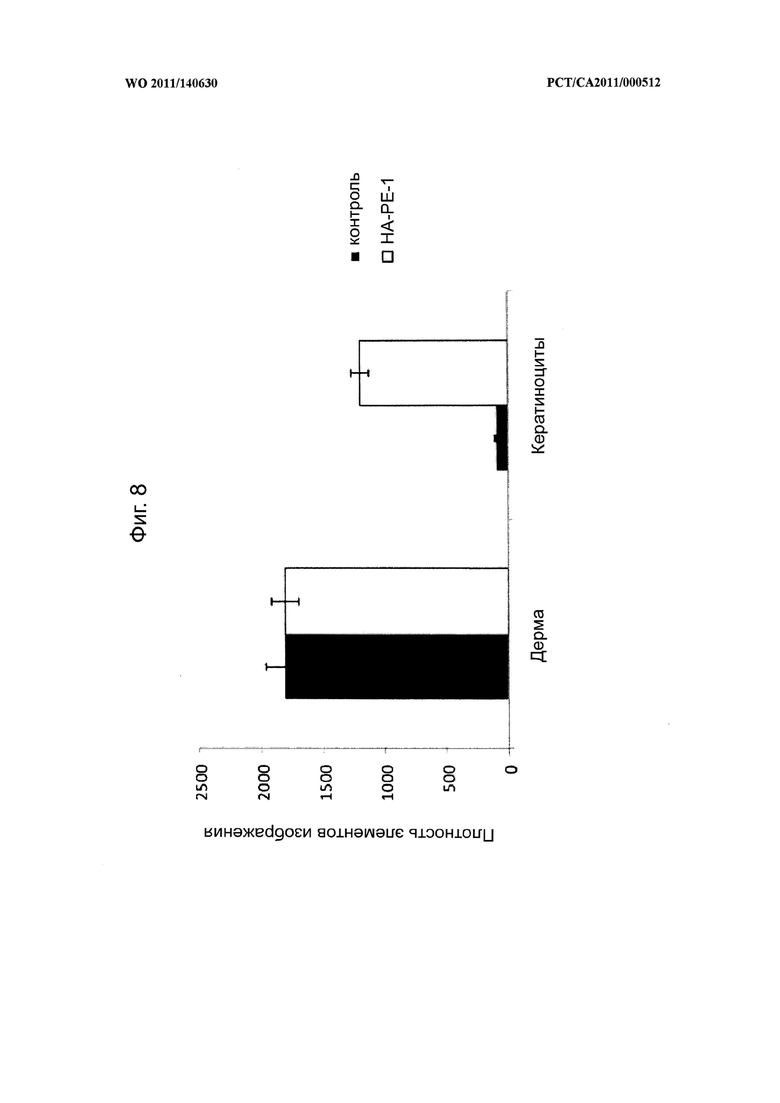
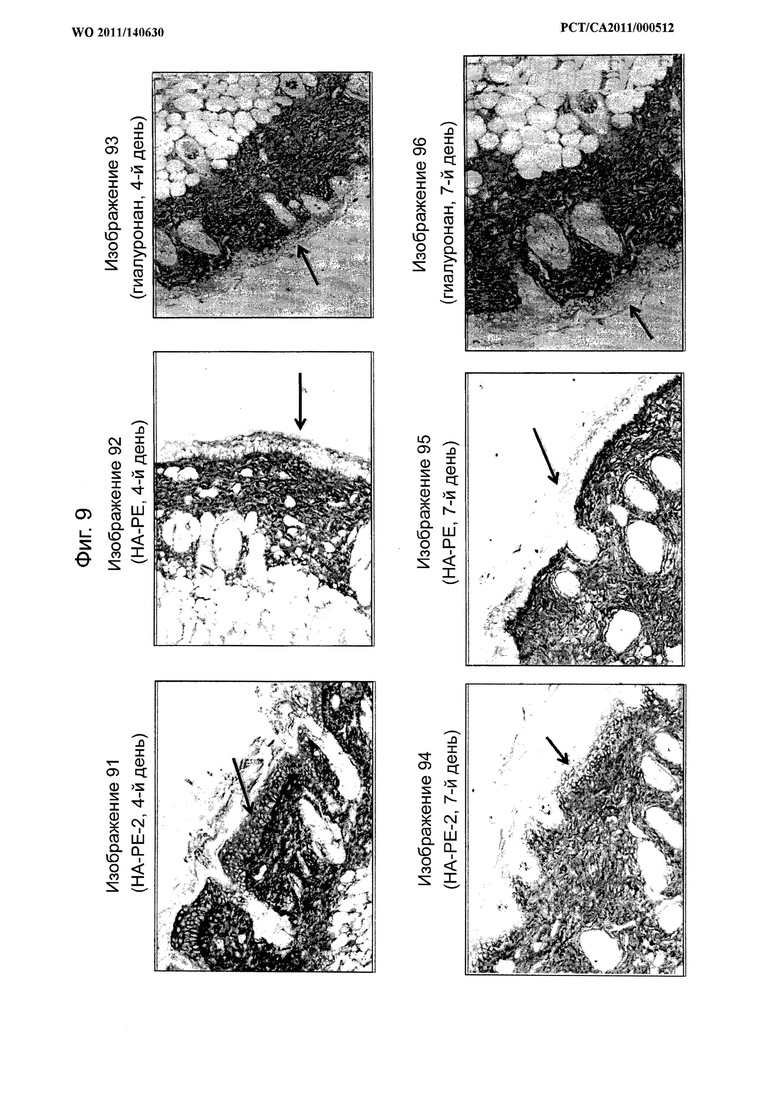
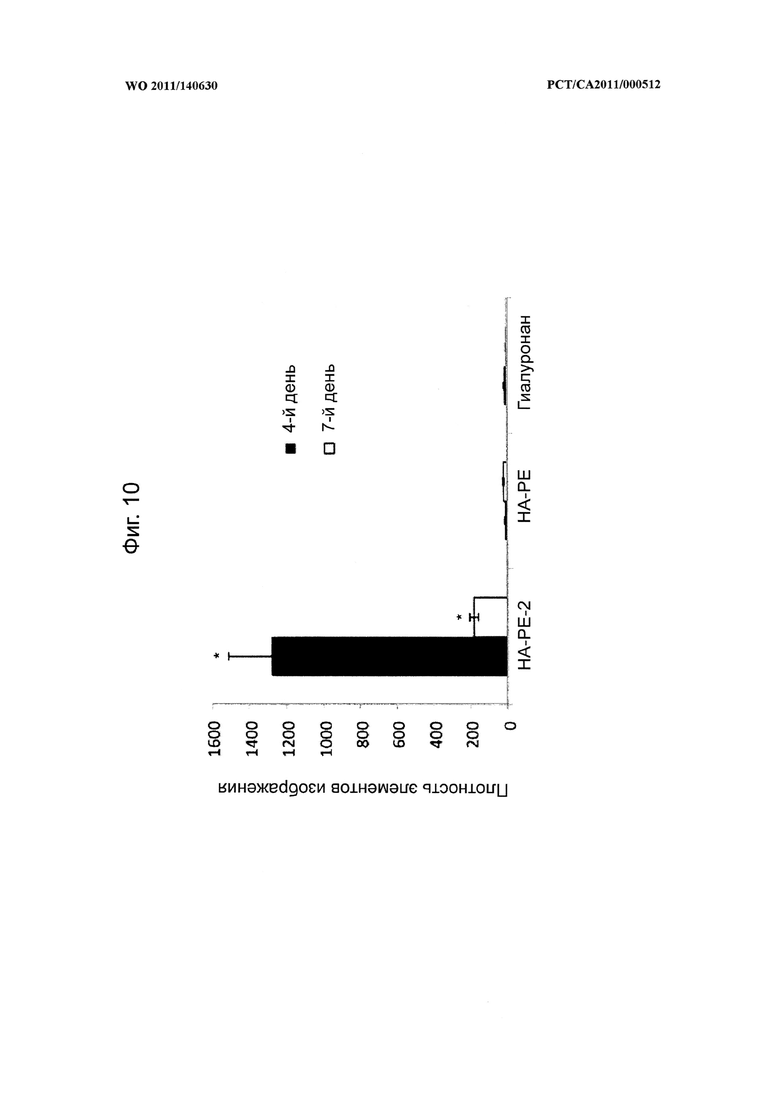
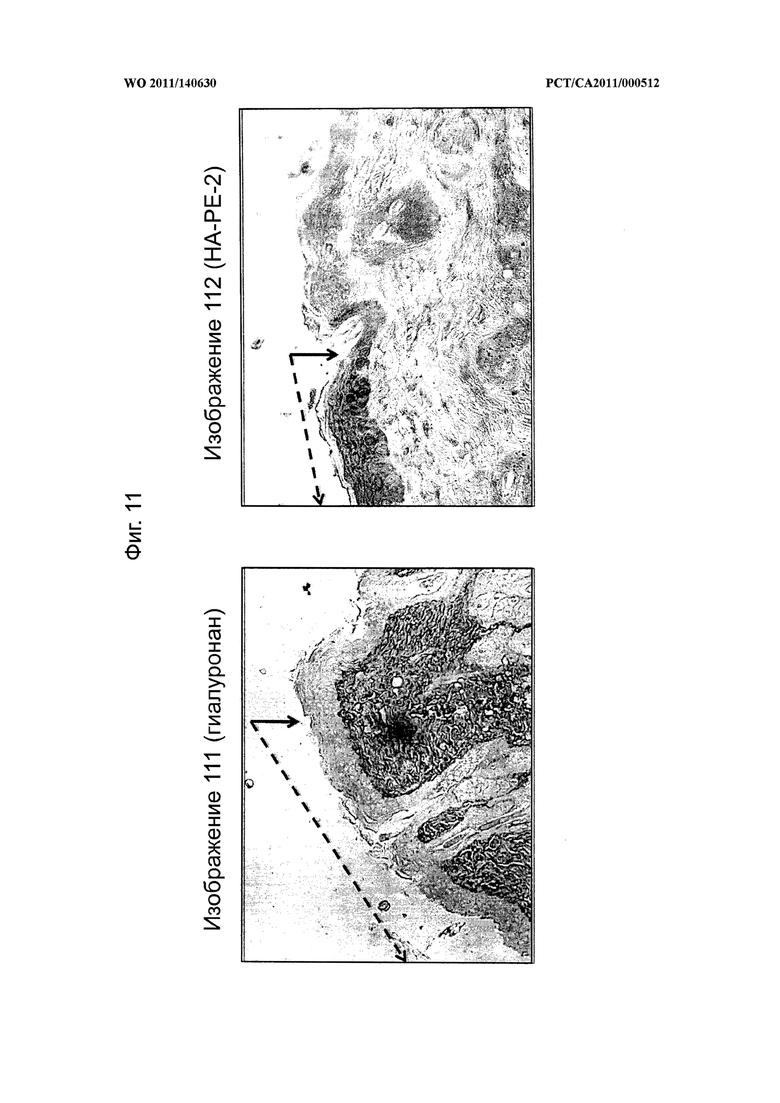
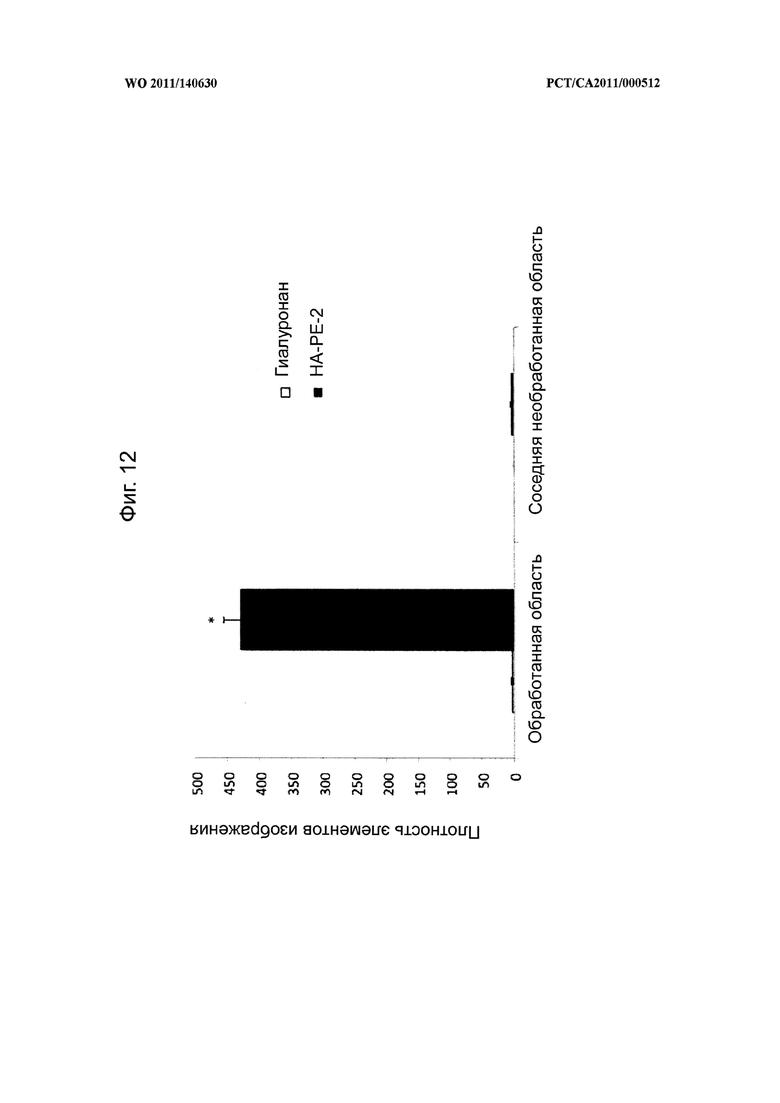
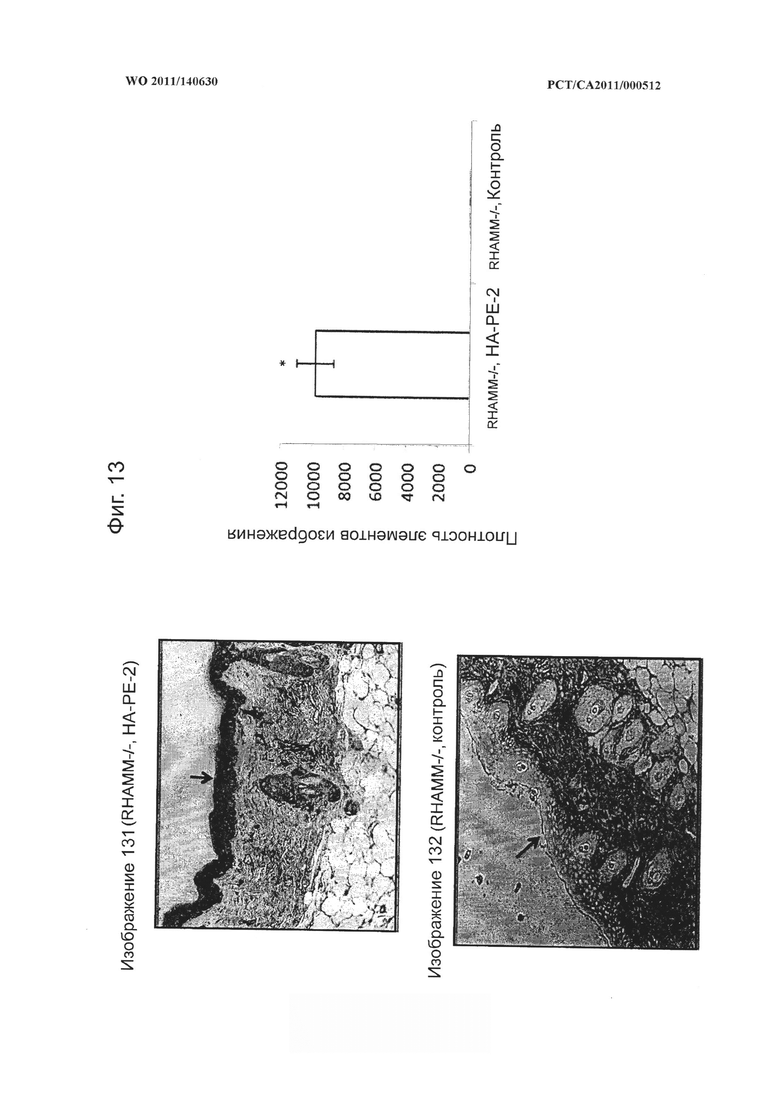
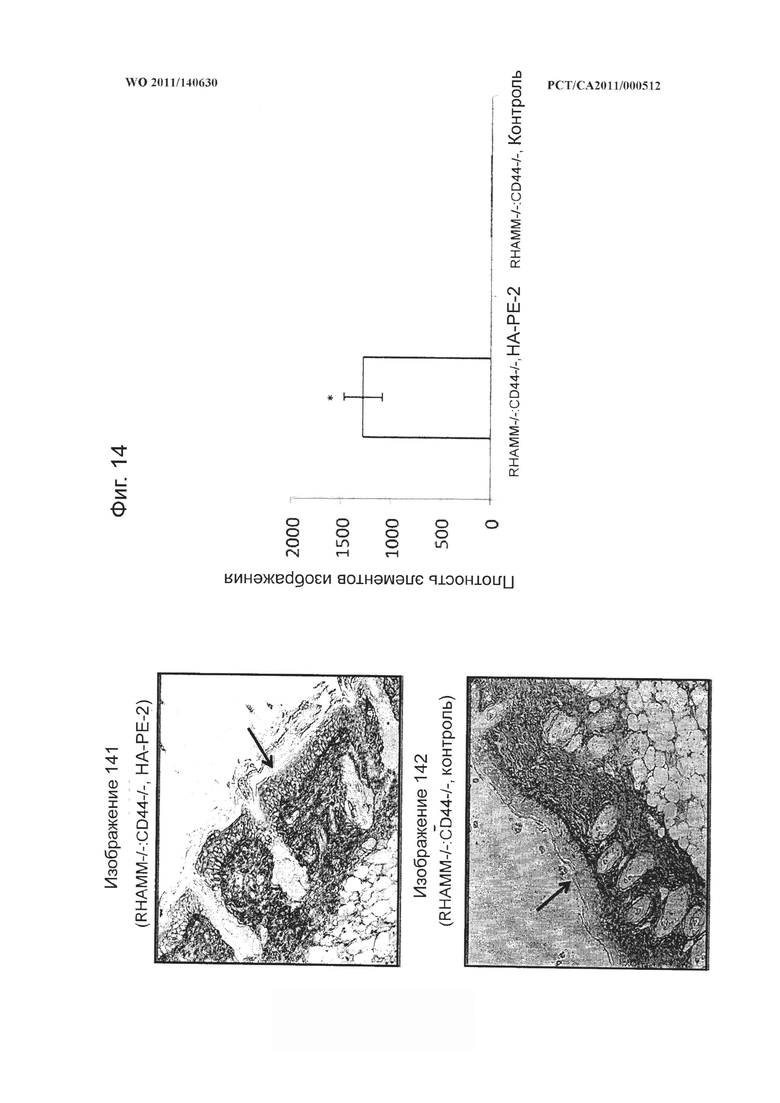
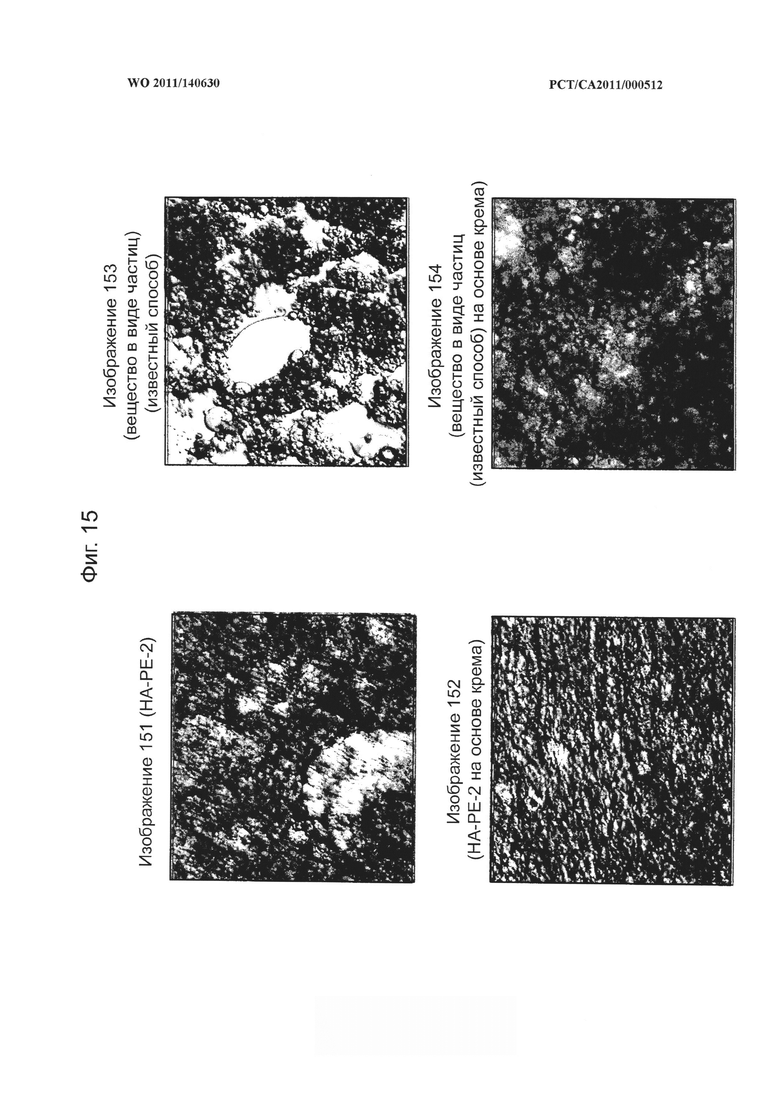
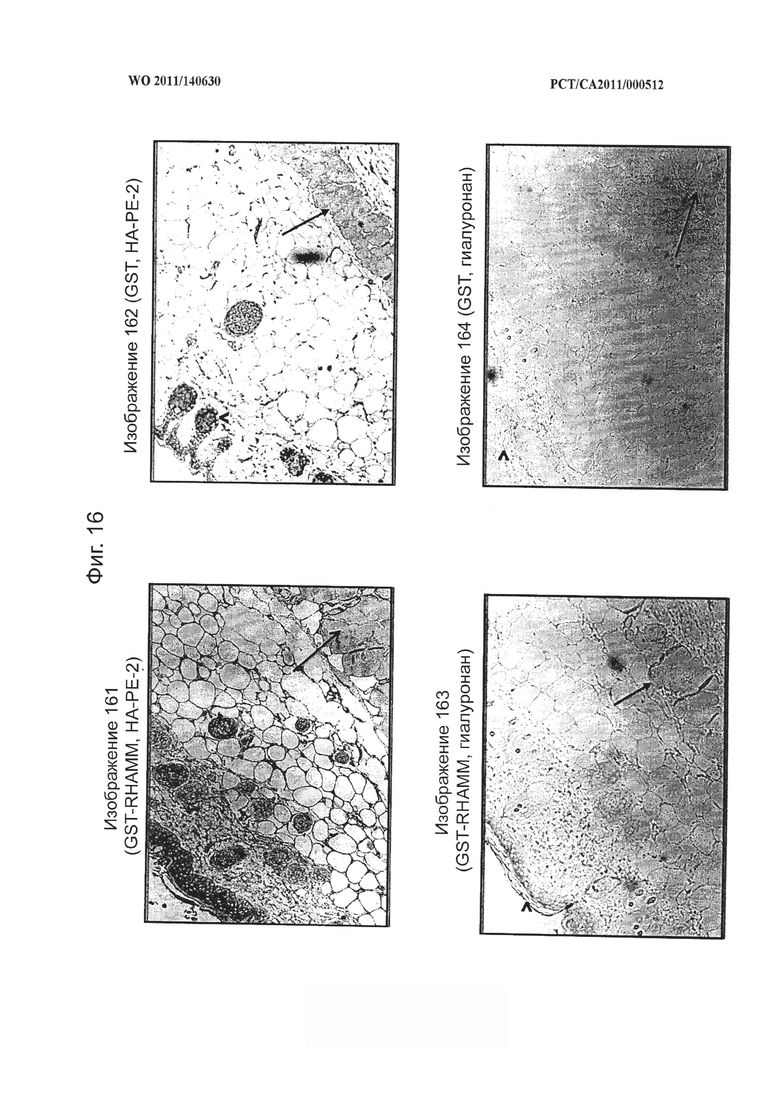
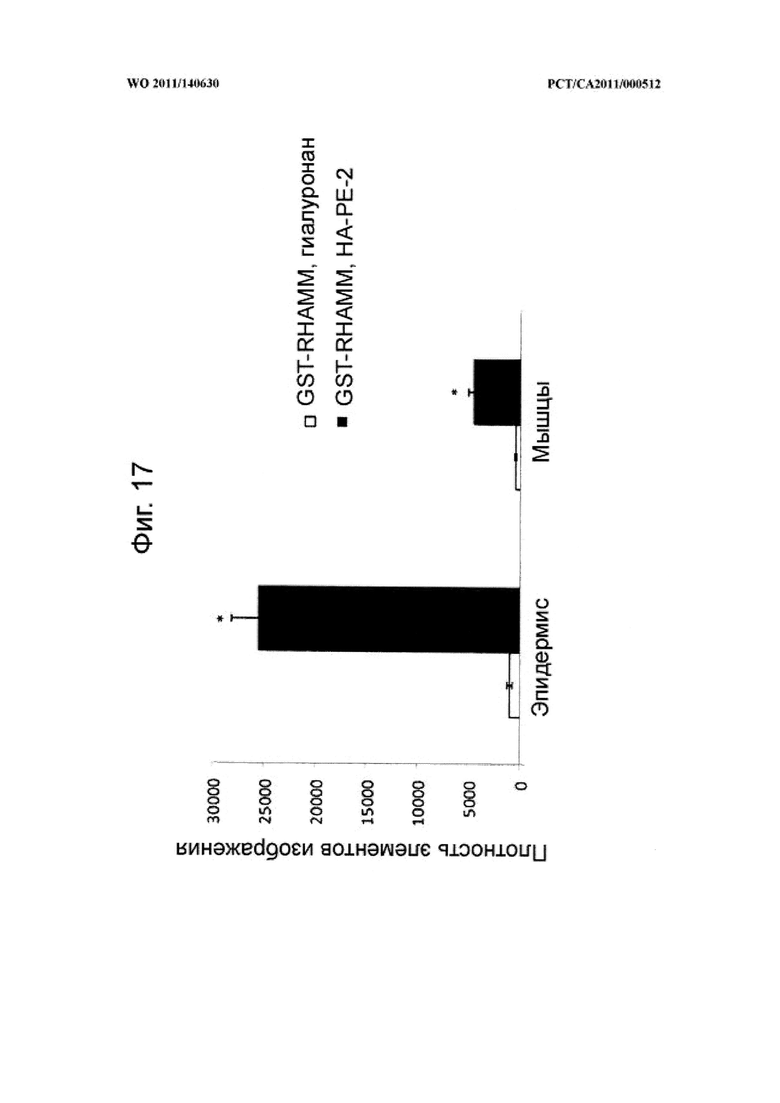
Группа изобретений относится к фармацевтической и косметической промышленности, а именно к способу получения модифицированного гликозаминогликана, согласно которому гликозаминогликан, который представляет собой гиалуронан или его производное и имеет молекулярную массу 50-2500 кДа, обрабатывают активирующим средством, которое является ограничивающим реакцию реагентом, далее вводят липидный фрагмент, который содержит аминогруппу, в реакцию, время которой составляет от 30 минут до 3 часов, с активированным гликозаминогликаном с целью их ковалентного связывания, при этом молярное количество липидного фрагмента в реакции превышает количество используемого активирующего средства, которое, в свою очередь, добавляют в таком количестве, чтобы способствовать ковалентному связыванию липидного фрагмента с 1-7,5% дисахаридных мономерных звеньев гликозаминогликана; а также к модифицированному гликозаминогликану, полученному указанным способом, к препарату на его основе и к его применениям. Группа изобретений обеспечивает улучшенную местную доставку модифицированного гиалуронана через кожный барьер. 5 н. и 22 з.п. ф-лы, 20 пр., 17 ил.
1. Способ получения модифицированного гликозаминогликана, включающий стадии:
обработки модифицируемого гликозаминогликана активирующим средством, чтобы способствовать ковалентному связыванию гликозаминогликана с липидным фрагментом,
введения в реакцию активированного гликозаминогликана и липидного фрагмента в течение реакции, время которой составляет от около 30 минут до около 3 часов, и
введения липидного фрагмента в реакцию с активированным гликозаминогликаном с целью ковалентного связывания липидного фрагмента с гликозаминогликаном,
при этом активирующим средством является ограничивающий реакцию реагент, модифицируемый гликозаминогликан представляет собой гиалуронан или производное гиалуронана и имеет молекулярную массу от 50 кДа до 2500 кДа, липидный фрагмент содержит одну или несколько природных или синтезированных жирных кислот, глицеролипидов, фосфолипидов, сфинголипидов, стероллипидов, преноллипидов или их производных при условии, что полярная головная группа липидного фрагмента содержит функциональную аминогруппу, обеспечивающую ковалентное связывание липида с гликозаминогликаном, а молярное количество липидного фрагмента в реакции превышает количество используемого активирующего средства, и активирующее средство добавляют в количестве, достаточном, чтобы способствовать ковалентному связыванию липидного фрагмента с от около 1 до около 7,5% дисахаридных мономерных звеньев гликозаминогликана.
2. Способ по п. 1, характеризующийся тем, что активирующее средство добавляют в количестве, достаточном, чтобы способствовать ковалентному связыванию липидного фрагмента с около 2-6% или 5,5-6% повторяющихся дисахаридных мономерных звеньев гликозаминогликана.
3. Способ по п. 1, характеризующийся тем, что активирующее средство представляет собой карбодиимид.
4. Способ по п. 1, характеризующийся тем, что смешивание активированного гликозаминогликана и липидного фрагмента происходит при отсутствии органического растворителя.
5. Модифицированный гликозаминогликан, полученный способом по пп. 1-4, характеризующийся тем, что способен проникать через кожный барьер или мембрану слизистой оболочки при нанесении на нее.
6. Модифицированный гликозаминогликан по п. 5, характеризующийся тем, что модифицированный гликозаминогликан модифицирован посредством ковалентного связывания липидного фрагмента с 2-6% или 5,5-6% повторяющихся дисахаридных мономерных звеньев гликозаминогликана.
7. Модифицированный гликозаминогликан по п. 5 или 6, характеризующийся тем, что имеет молекулярную массу от 350 кДа до 2500 кДа, от 350 кДа до 1500 кДа, от 350 кДа до 500 кДа, от 500 кДа до 1500 кДа или от 100 кДа до 2000 кДа.
8. Модифицированный гликозаминогликан по п. 5 или 6, характеризующийся тем, что полярная головная группа липидного фрагмента содержит аминогруппу, ковалентно связывающую гликозаминогликан посредством амидной связи с группой карбоновых кислот гликозаминогликана.
9. Модифицированный гликозаминогликан по п. 5 или 6, характеризующийся тем, что липидный фрагмент содержит один или несколько фосфатидилэтаноламинов или фосфатидилсеринов.
10. Модифицированный гликозаминогликан по п. 5 или 6, характеризующийся тем, что имеет большую продолжительность задержания в коже, чем немодифицированный гликозаминогликан после доставки в кожную ткань.
11. Модифицированный гликозаминогликан по п. 5 или 6, характеризующийся тем, что гликозаминогликаном является гиалуронан для формирования оболочки клеток с гиалуронановыми рецепторами или без гиалуронановых рецепторов.
12. Препарат для применения на коже или мембране слизистой оболочки, содержащий модифицированный гликозаминогликан по п. 5 в сочетании с одним или несколькими косметически или фармацевтически приемлемыми наполнителями или носителями.
13. Препарат по п. 12, характеризующийся тем, что модифицированный гликозаминогликан модифицирован посредством ковалентного связывания липидного фрагмента с 2-6% или 5,5-6% повторяющихся дисахаридных мономерных звеньев гликозаминогликана.
14. Препарат по п. 12 или 13, характеризующийся тем, что модифицированный гликозаминогликан имеет молекулярную массу от 350 кДа до 2500 кДа, от 350 кДа до 1500 кДа, от 350 кДа до 500 кДа, от 500 кДа до 1500 кДа или от 100 кДа до 2000 кДа.
15. Препарат по п. 12 или 13, характеризующийся тем, что полярная головная группа липидного фрагмента содержит аминогруппу, ковалентно связывающую гликозаминогликан посредством амидной связи с группой карбоновых кислот гликозаминогликана.
16. Препарат по п. 12 или 13, характеризующийся тем, что модифицированный гликозаминогликан имеет большую продолжительность задержания в коже, чем немодифицированный гликозаминогликан после доставки в кожную ткань.
17. Препарат по п. 12 или 13, характеризующийся тем, что дополнительно содержит один или несколько ингредиентов, которые переносятся через кожный барьер или мембрану слизистой указанным препаратом на основе модифицированного гликозаминогликана.
18. Препарат по п. 17, характеризующийся тем, что дополнительный один или несколько ингредиентов являются фармацевтическими.
19. Препарат по п. 18, характеризующийся тем, что дополнительный один или несколько ингредиентов содержат терапевтические средства для лечения воспаления, рака кожи или состояний кожи, которые доставляются через кожный барьер.
20. Препарат по п. 17, характеризующийся тем, что дополнительный один или несколько ингредиентов содержат ингибитор RHAMM, который доставляется через кожный барьер.
21. Применение модифицированного гликозаминогликана по п. 5 или 6 для пополнения содержания гликозаминогликана, от природы присутствующего в коже.
22. Применение по п. 21, характеризующееся тем, что гликозаминогликаном является гиалуронан.
23. Применение по п. 22 для уменьшения признаков старения кожи.
24. Применение по п. 22 для ослабления последствий повреждения кожи.
25. Применение по п. 23 или 24 для уменьшения проявлений рубцевания, растяжек, ожоговых контрактур, фиброзных повреждений, розовых угрей, дерматита или атрофии кожи.
26. Применение модифицированного гликозаминогликана по п. 5 или 6 в качестве средства доставки в кожную ткань или чрескожной доставки косметических или терапевтических действующих ингредиентов.
27. Применение по п. 26 для чрескожной доставки ингибитора RHAMM.
| US 20080193538 A1, 14.08.2008 | |||
| US 20090088396 A1, 02.04.2009 | |||
| WO 2006050246 A2, 11.05.2006 | |||
| Устройство для измерения давления воздуха в пневматических шинах автомобилей | 1972 |
|
SU493622A1 |
Авторы
Даты
2017-12-04—Публикация
2011-05-04—Подача