Настоящее изобретение относится к фтор-9-метил-β-карболинам, к их получению, к их применению в медицине, а также к фармацевтическим композициям, содержащим фтор-9-метил-β-карболины.
Соединения согласно изобретению могут быть использованы для лечения острых и хронических заболеваний уха и нарушений слуха, головокружения и нарушения равновесия, а в частности, потери слуха, травм при взрыве, контузии, шума в ушах, лабиринтной глухоты, вызываемой постоянными шумовыми воздействиями, возрастной потери слуха, травмы во время имплантации протеза внутреннего уха (травмы при введении протеза), головокружения, вызываемого заболеваниями в области внутреннего уха, головокружения, ассоциированного с болезнью Меньера и/или являющегося симптомом болезни Меньера, нарушения равновесия, ассоциированного с болезнью Меньера и/или являющегося симптомом болезни Меньера, и нарушений слуха, вызываемых антибиотиками и цитостатическими агентами.
По оценке специалистов Всемирной Организации Здравоохранения (ВОЗ), приблизительно 250 миллионов человек страдают слабыми и тяжелыми нарушениями слуха. В США, нарушениями слуха и потерей слуха страдают 30-40 миллионов человек. Стоимость одного лишь лечения составляет приблизительно 50 миллиардов долларов США каждый год. По данным Немецкой Ассоциации специалистов по лечению нарушения слуха (Deutscher Schwerhörigenbund), в 2007 году, нарушениями слуха страдает приблизительно 19% всего населения Германии в возрасте от 14 лет.
С возрастом, процент нарушения слуха возрастает. Даже в настоящее время, расстройства слуха наблюдаются, в основном, у людей старше 65 лет и, среди хронических физических расстройств, занимают четвертое место после заболеваний костей и суставов, высокого кровяного давления и болезней сердца. 37% людей в возрасте от 60 до 69 лет, и 54% людей в возрасте от 70 лет страдают нарушениями слуха. В Федеративной Республике Германии, приблизительно 12-15 миллионов пациентов страдают лабиринтной глухотой и приблизительно у 2,9 миллиона пациентов страдают шумом в ушах.
Термин «шум в ушах» или просто «шум» означает симптом или также синдром, при котором человек, страдающий данным расстройством, ощущает непрерывные или периодические шумы, которые могут быть подразделены на два типа. В случае относительно редкого шума, а именно «объективного шума в ушах», шумы, ощущаемые пациентом, могут быть также слышны посторонними или по меньшей мере могут быть зарегистрированы. Они обычно воспринимаются как источник звука в собственном организме, например, в кровеносных сосудах, находящихся поблизости от внутреннего уха. Значительно более часто встречается акустический феномен, называемый «субъективным шумом в ушах», который не воспринимается другими людьми как внешний источник шума. Таким образом, «субъективный шум в ушах» означает звук, который воспринимается пациентом независимо от внешнего звука. Причины такого восприятия могут быть различными и ассоциируются, среди прочих, с нарушением слуховых функций внутреннего уха. Типы различимых шумов, которые воспринимаются пациентом как шум в ушах, значительно отличаются друг от друга. Термин «шум в ушах» объединяет в себе следующие акустические восприятия:
- жужжащий или свистящий шум,
- шипящий шум,
- отрывистый шум,
- шум, напоминающий щелчки или удары.
Шум может быть постоянным по своей интенсивности и может также иметь ритмический-пульсирующий характер.
Анатомия уха такова: От долек ушной раковины отходит слуховой проход, который простирается вовнутрь уха. Слуховой проход заканчивается барабанной перепонкой. Эта часть уха называется наружным ухом. За наружным ухом находится пространство, а именно, среднее ухо, также называемое барабанной полостью, которая соединена с евстахиевой трубой, а также с носоглоткой. Среднее ухо закрыто барабанной перепонкой с одной стороны и овальным окном и окном улитки с противоположной стороны. За этими окнами находится пространство, называемое внутренним ухом. Внутреннее ухо имеет несколько органов, таких как система равновесия (вестибулярный аппарат) и так называемая улитка (cochlea) для акустического восприятия. Это внутреннее ухо также включает кортиев орган, который служит в качестве носителя сенсорных клеток (волосковых клеток) во внутреннем ухе.
Мембрана окна улитки образует биологический барьер для пространства внутреннего уха, что является огромным препятствием для проведения местной терапии поражений и заболеваний внутреннего уха. Вводимый активный агент должен преодолеть эту мембрану и войти в пространство внутреннего уха. Активный агент не может быть введен через эту мембрану механически или с помощью инструмента, поскольку, в результате такой манипуляции, мембрана может быть повреждена. Активный агент может быть введен хирургически (то есть, путем местной инъекции через барабанную перепонку) в мембрану канала улитки, после чего он может проникать через мембрану окна улитки. Затем активный агент достигает пространства внутреннего уха, заполненного перилимфой, где указанное пространство образовано взаимосвязанными отделами улитки, а именно, барабанной лестницей и лестницей преддверия. Отдел, разделенный мембранами, расположенными между барабанной лестницей и лестницей преддверия, называется средней лестницей и содержит сенсорные клетки слухового органа (волосковые клетки внутреннего и наружного уха), окруженные эндолимфой. Эти органы, вместе с окружающими их поддерживающими клетками, называются коритевым органом. Волосковые клетки ответственны за развитие лабиринтной глухоты любой этиологии (возрастной или медикаментозной, вызываемой приемом некоторых антибиотиков или цитостатических агентов), а также за восприятие, главным образом, шума в ушах. Активные агенты могут проходить через мембраны, которые отделяют среднюю лестницу от перилимфатического пространства, и достигать волосковых клеток либо непосредственно, либо через эндолимфу. Поскольку перилимфатические, а также эндолимфатические отделы улитки связаны с вестибулярной системой, то активные агенты могут также поступать из улитки в сенсорные клетки вестибулярного аппарата.
В заявке на патент Германии (DE 10 2007 009264 A1) описаны 9-алкил-β-карболины, которые, благодаря своим нейропротективным свойствам, могут быть использованы для лечения и/или профилактики расстройств двигательной системы и/или нервных болезней, таких как, например, болезнь Альцгеймера или болезнь Паркинсона.
Von Hamann и сотрудниками (J. Hamann et al.; Neurochem Internat. 2008, 52, 688-700) было обнаружено нейропротективное свойство β-карболина, а именно, 9-метил-β-карболина в первичных клеточных культурах нейронов среднего мозга. Однако, увеличение продолжительности жизни нейронов под действием описанного здесь 9-метил-β-карболина, не вызывалось увеличением уровня их пролиферации. В противоположность этому, введение 9-метил-β-карболина приводило к ингибированию пролиферации и к повышению степени дифференцировки нейронов. Такой эффект 9-метил-β-карболина был подтвержден на клетках человеческой нейробластомы (SH-SY5Y). Было подтверждено, что наряду со стимуляцией дифференцировки наблюдается повышение уровня экспрессии нейтротропных факторов, таких как фактор «звуковой еж», фактор Wnt1 и Wnt5a. Кроме того, 9-метил-β-карболин индуцирует увеличение числа допаминергических нейронов, присутствующих в первичной клеточной культуре нейронов среднего мозга. Таким образом, в перспективе, терапевтический эффект 9-метил-β-карболина будет иметь большое значение для лечения болезни Паркинсона.
В заявке на патент США (US 2004/038970 A1) описано использование β-карболинов в качестве активных агентов для лечения различных клинических патологий, включая шум в ушах, где указанные β-карболины принадлежат к группе соединений со значительно отличающейся структурой, таких как 9-алкил-β-карболины и 6- и/или 7-фтор-9-метил-карболины.
В Международной патентной заявке (WO 2011/079841) описаны β-карболины, а в частности, 9-алкил-β-карболины и способы их применения для лечения заболеваний или поражений внутреннего уха. Было также обнаружено, что 9-алкил-β-карболины стимулируют дифференцировку нервных клеток человеческой нейробластомы (SH-SY5Y), а также экспрессию нейротропных факторов с нейропротективными свойствами. Это свойство было подтверждено в препаратах клеточных культур улитки у крыс. Кроме того, было обнаружено, что 9-метил-β-карболин, после его местного введения в окно улитки внутреннего уха морских свинок, может диффундировать в перилимфатическое пространство внутреннего уха, что будет приводить к повышению электрофизиологической активности волосковых сенсорных клеток кортиева органа.
Главной целью настоящего изобретения является получение активного агента, а также фармацевтических композиций, которые могут быть использованы для профилактики и лечения нарушений слуха, возрастной потери слуха (старческой тугоухости), головокружения и нарушений равновесия, а также для повышения способности к обучению и улучшения памяти, и которые имеют значительные преимущества по сравнению с уже известными агентами и композициями.
Цели настоящего изобретения подробно изложены в независимых пунктах формулы изобретения. Другие предпочтительные признаки, аспекты и детали настоящего изобретения представлены в зависимых пунктах, в описании, на чертежах и в примерах настоящего изобретения.
Фтор-9-метил-β-карболины
Неожиданно было обнаружено, что в соответствии с настоящим изобретением, фтор-9-метил-β-карболины общей формулы (I) обладают более высокой эффективностью при лечении заболеваний внутреннего уха по сравнению с известными соединениями (например, 9-метил-β-карболином). Такие соединения согласно изобретению могут быть введены в более низких дозах и имеют пониженную токсичность, а поэтому они обладают более высокой терапевтической эффективностью по сравнению с известными соединениями.
Кроме того, было неожиданно обнаружено, что 6- и/или 7-фтор-9-метил-β-карболины согласно изобретению, благодаря своим особым свойствам, выгодно отличаются от известных соединений, применяемых в терапии. Таким образом, было подтверждено, что 6- и/или 7-фтор-9-метил-β-карболины, по сравнению с 9-метил-β-карболином, обладают более высокой эффективностью в отношении стимуляции дифференцировки нейронов в клетках человеческой нейробластомы. Кроме того, 6- и/или 7-фтор-9-метил-β-карболины, по сравнению с 9-метил-β-карболином, обладают значительно более высокой липофильностью, которая ассоциируется с повышенной проницаемостью мембраны. Это открывает широкие перспективы использования соединения согласно изобретению для лечения заболеваний или поражений внутреннего уха или улучшения памяти и повышения способности к обучению. Как уже упоминалось выше, биологические мембраны, такие как барабанная перепонка, мембрана окна улитки и мембраны средней лестницы (покровная перепонка и перепонка Рейсснера) создают природное препятствие для проникновения активного агента в волосковые клетки внутреннего уха. Это в частности, относится к местному нанесению активного агента на барабанную перепонку или на мембрану окна улитки. Благодаря повышенной проницаемости мембраны также повышается доступность активного агента. Помимо проницаемости мембраны, важную роль в эффективности этих соединений играет разложение активного агента в организме, в частности, при системном введении, а также вероятность возникновения побочных эффектов. 9-метил-β-карболин разлагается посредством гидроксилирования в положении 6 после проведения реакции конъюгирования, а в случае 6-фтор-9-метил-β-карболина, такой метаболический путь блокируется фторидной(ыми) группой(ами). Таким образом, повышается не только время полужизни 6-фтор-9-метил-β-карболина в кровотоке, но также и снижается риск образования потенциально токсичных продуктов разложения. Благодаря повышенной эффективности 6- и/или 7-фтор-9-метил-β-карболина, это соединение может быть введено в более низких дозах по сравнению с другими 9-алкил-β-карболинами. Это особенно важно при проведении длительной терапии хронических заболеваний, поскольку, в данном случае, может уменьшаться нагрузка на организм, и может наблюдаться снижение нежелательных побочных эффектов. Следовательно, настоящая заявка представляет собой на изобретение отбора.
Термин «6- и/или 7-фтор-9-метил-β-карболин» означает соединение 6-фтор-9-метил-β-карболина или соединение 7-фтор-9-метил-β-карболина, если между ними стоит союз «или», и соединения 6-фтор-9-метил-β-карболина и 7-фтор-9-метил-β-карболина, если между ними стоит союз «и».
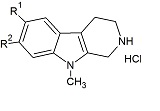
Настоящее изобретение относится к соединениям общей формулы (I) или к фтор-9-метил-β-карболинам общей формулы (I):
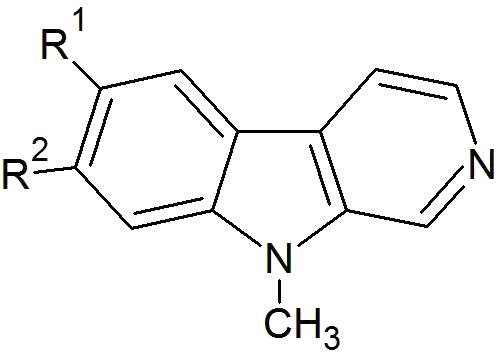 (I)
(I)
где R1 представляет собой -F, а R2 представляет собой -H или -F, или
где R1 представляет собой -H, а R2 представляет собой -F;
а также к фармакологически приемлемым солям, сольватам, гидратам, пролекарствам и комплексам вышеупомянутых соединений.
Настоящее изобретение также относится к соединениям общей формулы (I) или к фтор-9-метил-β-карболинам общей формулы (I):
где каждый из R1 и R2 независимо представляет собой -F или -H, и
где по меньшей мере один из остатков R1 или R2 представляет собой -F;
а также к фармакологически приемлемым солям, сольватам, гидратам, пролекарствам и комплексам вышеупомянутых соединений.
Настоящее изобретение также относится к соединениям общей формулы (I) или к фтор-9-метил-β-карболинам общей формулы (I):
 (I)
(I)
где каждый из R1 и R2 независимо представляет собой -F или -H, и
где по меньшей мере один из остатков R1 или R2 представляет собой -H;
а также к фармакологически приемлемым солям, сольватам, гидратам, пролекарствам и комплексам вышеупомянутых соединений.
При этом, предпочтительно, если R1 представляет собой -F, то R2 представляет собой -H, или если R1 представляет собой -H, то R2 представляет собой -F.
Используемый здесь термин «пролекарство» определен как фармакологическое вещество, вводимое в неактивной или менее эффективной форме. После введения в организм пациента, это вещество превращается в активную и эффективную форму, то есть, фтор-9-метил-β-карболин общей формулы (I).
Кислотами, которые могут образовывать кислотно-аддитивную соль с соединением согласно изобретению, могут быть следующие кислоты: серная кислота, сульфоновая кислота, фосфорная кислота, азотная кислота, азотистая кислота, перхлорная кислота, бромистоводородная кислота, хлористоводородная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, щавелевая кислота, глюконовая кислота (гликоновая кислота, декстроновая кислота), молочная кислота, яблочная кислота, винная кислота, тартроновая кислота (гидроксималоновая кислота, гидроксипропандионовая кислота), фумаровая кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, малоновая кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, (o-, м-, п-) толуоиловая кислота, бензойная кислота, п-аминобензойная кислота, п-гидроксибензойная кислота, салициловая кислота, п-аминосалициловая кислота, метансульфоновая кислота, этансульфоновая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, п-толуолсульфоновая кислота, нафталинсульфоновая кислота, нафтиламиносульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, Хина (хинная кислота), o-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота (2,4,6-тринитрофенол), адипиновая кислота, d-o-толилвинная кислота, аминокислоты, такие как метионин, триптофан, аргнинин, а в частности, кислотные аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота. Кроме того, могут быть также использованы соединения типа бетаинов.
В другом своем аспекте, настоящее изобретение относится к способу получения соединений согласно изобретению общей формулы (I) (и фтор-9-метил-β-карболинов общей формулы (I), соответственно), где указанный способ включает следующие стадии:
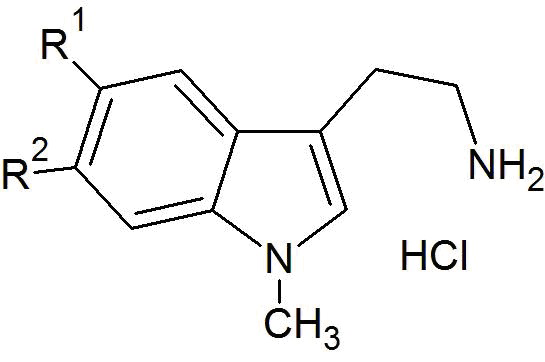
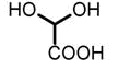
a) реакцию взаимодействия исходного соединения общей формулы (II) (и гидрохлорида фтор-1-метилтриптамина общей формулы (II), соответственно) в присутствии гидрата глиоксиловой кислоты формулы (III) и основания с получением соединения общей формулы (IV)
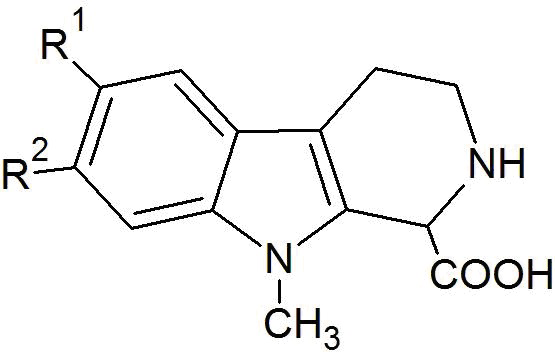
b) декарбоксилирование соединения общей формулы (IV) в присутствии кислоты и при нагревании с получением соединения общей формулы (V) (и фтор-9-метил-2,3,4,9-тетрагидро-β-карболина общей формулы (V), соответственно)
 (V)
(V)
c) ароматизацию соединения общей формулы (V) (и фтор-9-метил-2,3,4,9-тетрагидро-β-карболина общей формулы (V), соответственно) с получением соединения общей формулы (I) (и фтор-9-метил-β-карболина общей формулы (I), соответственно) в присутствии катализатора;
где:
R1 представляет собой -F, а R2 представляет собой -H или -F, или
R1 представляет собой -H, а R2 представляет собой -F.
При этом, само собой разумеется, что определение остатков R1 и R2, представленное выше для некоторых способов получения соединения согласно изобретению, относится не только к исходному соединению, используемому в соответствующей реакции синтеза, но также и к полученным промежуточным продуктам и к конечному продукту такого синтеза.
Следовательно, в другом своем аспекте, настоящее изобретение относится к способу получения соединения согласно изобретению общей формулы (I) (и фтор-9-метил-β-карболина общей формулы (I), соответственно), где указанный способ включает следующие стадии:
a) реакцию взаимодействия исходного соединения общей формулы (II) (и гидрохлорида фтор-1-метилтриптамина общей формулы (II), соответственно) в присутствии гидрата глиоксиловой кислоты формулы (III) и основания с получением соединения общей формулы (IV)



b) декарбоксилирование соединения общей формулы (IV) в присутствии кислоты и при нагревании с получением соединения общей формулы (V) (и фтор-9-метил-2,3,4,9-тетрагидро-β-карболина общей формулы (V), соответственно)
 (V)
(V)
c) ароматизацию соединения общей формулы (V) (и фтор-9-метил-2,3,4,9-тетрагидро-β-карболина общей формулы (V), соответственно) с получением соединения общей формулы (I) (и фтор-9-метил-β-карболина общей формулы (I), соответственно) в присутствии катализатора;
где:
R1 представляет собой -F, а R2 представляет собой -H или -F, и это в равной степени относится к соединениям общей формулы (I), (II), (IV) и (V),
или где R1 представляет собой -H, а R2 представляет собой -F, и это в равной степени относится к соединениям общей формулы (I), (II), (IV) и (V).
Гидрохлориды фтор-1-метилтриптамина, используемые в качестве исходных соединений, являются коммерчески доступными (также см. ниже). В предпочтительном варианте осуществления изобретения, в стадии (a), величина pH составляет от 2 до 6, предпочтительно, от 3 до 5, а особенно предпочтительно, рН составляет 4, что достигается при добавлении основания. В другом предпочтительном варианте осуществления изобретения, в стадии (a’), кристаллизацию соединения IV инициируют путем инкубирования в воде со льдом.
В другом предпочтительном варианте осуществления изобретения, реакцию в стадии (b) осуществляют в атмосфере инертного газа, а особенно предпочтительно, N2. Кроме того, кристаллизацию продукта реакции стадии (b) в стадии (b)’ предпочтительно, инициировать путем инкубирования на холоде, а особенно предпочтительно, при температуре от 0°C до 5°C в течение нескольких часов. В другом предпочтительном варианте очистки продукта реакции стадии b), перекристаллизацию из метанола осуществляют после кристаллизации. Кроме того, предпочтительно, чтобы фтор-9-метил-2,3,4,9-тетрагидро-β-карболины (и соединения общей формулы (V), соответственно) в стадии (c) были сначала растворены в воде с последующим добавлением основания, например, гидроксида натрия или карбоната натрия, для доведения рН до щелочного значения, особенно предпочтительно, до рН 11-14, а наиболее предпочтительно, до pH 13.
В предпочтительном варианте осуществления изобретения, катализаторами для реакции окислительной ароматизации в стадии (c) могут быть, среди прочих, Pd/C, Pt/C, PdCl2, Pd/сепиолит, Pd/SiO2 и Pd/AlO4. Специалистам также известны и другие добавки, стимулирующие окислительную ароматизацию. Однако предпочтительным катализатором является Pd/C (палладий на угле, палладий на активированном угле).
Основаниями, добавляемыми в стадиях (a) и (c), могут быть, независимо друг от друга, другие неорганические или органические основания, например, NaOH, KOH, NH4OH, гидроксид тетраалкиламмония, лизин или аргинин. Специалисту в данной области известно, какие основания являются подходящими для проведения реакции. Однако предпочтительными являются KOH и NaOH, соответственно.
Кислотами, добавляемыми в стадии (b), могут быть неорганические или органические кислоты, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, яблочная кислота, салициловая кислота, п-аминосалициловая кислота, малоновая кислота, фумаровая кислота, янтарная кислота, аскорбиновая кислота, малеиновая кислота, сульфоновая кислота, фосфоновая кислота, перхлорная кислота, азотная кислота, муравьиная кислота, пропионовая кислота, глюконовая кислота, молочная кислота, винная кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, бензойная кислота, п-аминобензойная кислота, п-гидроксибензойная кислота, метансульфоновая кислота, этансульфоновая кислота, азотистая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, п-толуолсульфоновая кислота, нафтилсульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, хинная кислота, миндальная кислота, o-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота, адипиновая кислота, d-o-толилвинная кислота, тартроновая кислота, α-толуиловая кислота, (o-, м-, п-) толуиловая кислота или нафтиламиносульфоновая кислота. Специалисту в данной области известно, какие кислоты являются подходящими для проведения реакции. Однако предпочтительной является хлористоводородная кислота.
В других своих вариантах, настоящее изобретение относится к фтор-9-метил-β-карболину общей формулы (I)
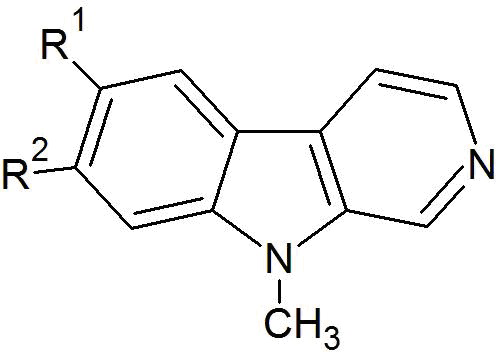 (I)
(I)
где R1 представляет собой -F, а R2 представляет собой -F, еще более предпочтительно, R1 представляет собой -H, а R2 представляет собой -F, а наиболее предпочтительно, R1 представляет собой -F, а R2 представляет собой -H.
6-Фтор-9-метил-β-карболин (6F9MβC)
В соответствии со своим особенно предпочтительным вариантом, настоящее изобретение относится к препаратам β-карболина, 6-фтор-9-метил-β-карболина, которые могут быть использованы в медицине, а также к фармацевтическим композициям, содержащим 6-фтор-9-метил-β-карболин. Соединение 6-фтор-9-метил-β-карболина может иногда обозначаться здесь «6F9MβC» или «AC102». С другой стороны, 9-метил-β-карболин, известный специалистам, иногда обозначается «9MβC» или «AC002».
Соединение согласно изобретению, а именно, 6-фтор-9-метил-β-карболин, не было подробно, то есть, конкретно, описано ранее. Кроме того, было неожиданно обнаружено, что 6-фтор-9-метил-β-карболин согласно изобретению значительно отличается от известного соединения по своим конкретным свойствам, которые позволяют использовать это соединение в терапевтических целях. Таким образом, было подтверждено, что 6-фтор-9-метил-β-карболин, по сравнению с 9-метил-β-карболином, обладает более высокой эффективностью в отношении стимуляции дифференцировки нейронов в клетках человеческой нейробластомы (см. пример 2). Кроме того, 6-фтор-9-метил-β-карболин, по сравнению с 9-метил-β-карболином, обладает значительно более высокой липофильностью, которая ассоциируется с повышенной проницаемостью мембраны. Это открывает широкие перспективы использования этого соединения согласно изобретению для лечения заболеваний и поражений внутреннего уха, соответственно. Как уже упоминалось выше, биологические мембраны, такие как барабанная перепонка, мембрана окна улитки и мембраны средней лестницы (покровная перепонка и перепонка Рейсснера) создают природное препятствие для проникновения активного агента в волосковые клетки внутреннего уха. Это в частности, относится к местному нанесению активного агента на барабанную перепонку или на окно улитки. Благодаря повышенной проницаемости мембраны также повышается доступность активного агента. Помимо проницаемости мембраны, важную роль в эффективности этих соединений играет разложение активного агента в организме, в частности, при системном введении, а также вероятность возникновения побочных эффектов. 9-метил-β-карболин разлагается посредством гидроксилирования в положении 6 после проведения реакции конъюгирования, а в случае 6-фтор-9-метил-β-карболина, такой метаболический путь блокируется фторидной группой. Таким образом, повышается не только время полужизни 6-фтор-9-метил-β-карболина в кровотоке, но также и снижается риск образования потенциально токсичных продуктов разложения. Благодаря повышенной эффективности 6- и/или 7-фтор-9-метил-β-карболина, это соединение может быть введено в более низких дозах по сравнению с другими 9-алкил-β-карболинами. Это особенно важно при проведении длительной терапии хронических заболеваний, поскольку, в данном случае, может уменьшаться нагрузка на организм и может наблюдаться снижение нежелательных побочных эффектов.
Настоящее изобретение относится к соединению 6-фтор-9-метил-β-карболина формулы (Ia)
 (Ia)
(Ia)
а также к фармакологически приемлемым солям, сольватам, гидратам, пролекарствам и комплексам вышеупомянутых соединений.
Используемый здесь термин «пролекарство» определен как фармакологическое вещество, вводимое в неактивной или в менее эффективной форме. После введения, это вещество превращается в активную и эффективную форму, то есть, в вышеуказанное соединение 6-фтор-9-метил-β-карболина.
Кислотами, которые могут образовывать кислотно-аддитивную соль с соединением 6-фтор-9-метил-β-карболина согласно изобретению, могут быть следующие кислоты: серная кислота, сульфоновая кислота, фосфорная кислота, азотная кислота, азотистая кислота, перхлорная кислота, бромистоводородная кислота, хлористоводородная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, щавелевая кислота, глюконовая кислота (гликоновая кислота, декстроновая кислота), молочная кислота, яблочная кислота, винная кислота, тартроновая кислота (гидроксималоновая кислота, гидроксипропандионовая кислота), фумаровая кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, малоновая кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, (o-, м-, п-) толуоиловая кислота, бензойная кислота, п-аминобензойная кислота, п-гидроксибензойная кислота, салициловая кислота, п-аминосалициловая кислота, метансульфоновая кислота, этансульфоновая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, п-толуолсульфоновая кислота, нафталинсульфоновая кислота, нафтиламиносульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, Хина (хинная кислота), o-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота (2,4,6-тринитрофенол), адипиновая кислота, d-o-толилвинная кислота, аминокислоты, такие как метионин, триптофан, аргнинин, а в частности, кислотные аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота. Кроме того, могут быть также использованы соединения типа бетаинов.
В другом своем аспекте, настоящее изобретение относится к способу получения соединения 6-фтор-9-метил-β-карболина согласно изобретению, где указанный способ включает следующие стадии:
a) реакцию взаимодействия исходного соединения гидрохлорида 5-фтор-1-метилтриптамина формулы (IIа) в присутствии гидрата глиоксиловой кислоты формулы (III) и основания с получением соединения формулы (IVа)
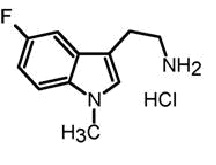

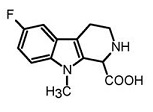
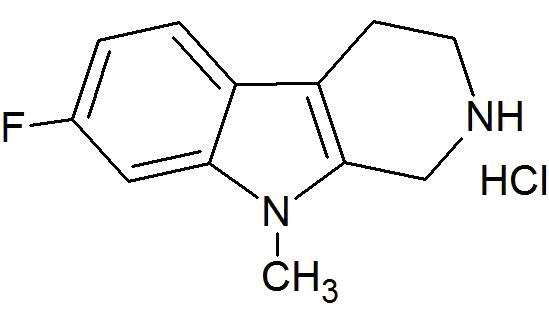
b) декарбоксилирование соединения формулы (IVа) в присутствии кислоты и при нагревании с получением 6-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина формулы (Vа).
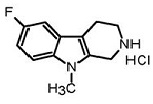 (Va)
(Va)
c) ароматизацию 6-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Vа) с получением 6-фтор-9-метил-β-карболина (Iа) в присутствии катализатора.
Исходное соединение гидрохлорида 5-фтор-1-метилтриптамина, является коммерчески доступным, например, оно поставляется компанией AKos GmbH (Steinen). В предпочтительном варианте осуществления изобретения, в стадии (a), величина pH составляет от 2 до 6, предпочтительно, от 3 до 5, а особенно предпочтительно, рН составляет 4, что достигается при добавлении основания. В другом варианте осуществления изобретения, в стадии (a’), кристаллизацию соединения IVа инициируют путем инкубирования в воде со льдом.
В другом предпочтительном варианте осуществления изобретения, реакцию в стадии (b) осуществляют в атмосфере инертного газа, а особенно предпочтительно, N2. Кроме того, кристаллизацию продукта реакции стадии (b) в стадии (b)’ предпочтительно, инициировать путем инкубирования на холоде, а особенно предпочтительно, при температуре от 0°C до 5°C в течение нескольких часов. В другом предпочтительном варианте очистки продукта реакции стадии (b), перекристаллизацию из метанола осуществляют после кристаллизации. Кроме того, предпочтительно, чтобы 6-фтор-9-метил-2,3,4,9-тетрагидро-β-карболин в стадии (c) был сначала растворен в воде с последующим добавлением основания, например, гидроксида натрия или карбоната натрия, для доведения рН до щелочного значения, особенно предпочтительно, до рН 11-14, а наиболее предпочтительно, до pH 13.
В предпочтительном варианте осуществления изобретения, катализаторами для реакции окислительной ароматизации в стадии (c) могут быть, среди прочих, Pd/C, Pt/C, PdCl2, Pd/сепиолит, Pd/SiO2 и Pd/AlO4. Специалистам также известны и другие добавки, стимулирующие окислительную ароматизацию. Однако предпочтительным катализатором является Pd/C (палладий на угле, палладий на активированном угле).
Основаниями, добавляемыми в стадиях (a) и (c), могут быть, независимо друг от друга, другие неорганические или органические основания, например, NaOH, KOH, NH4OH, гидроксид тетраалкиламмония, лизин или аргинин. Специалисту в данной области известно, какие основания являются подходящими для проведения реакции. Однако предпочтительными являются KOH и NaOH, соответственно.
Кислотами, добавляемыми в стадии b), могут быть неорганические или органические кислоты, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, яблочная кислота, салициловая кислота, п-аминосалициловая кислота, малоновая кислота, фумаровая кислота, янтарная кислота, аскорбиновая кислота, малеиновая кислота, сульфоновая кислота, фосфоновая кислота, перхлорная кислота, азотная кислота, муравьиная кислота, пропионовая кислота, глюконовая кислота, молочная кислота, винная кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, бензойная кислота, п-аминобензойная кислота, п-гидроксибензойная кислота, метансульфоновая кислота, этансульфоновая кислота, азотистая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, п-толуолсульфоновая кислота, нафтилсульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, хинная кислота, миндальная кислота, o-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота, адипиновая кислота, d-o-толилвинная кислота, тартроновая кислота, α-толуиловая кислота, (o-, м-, п-) толуиловая кислота или нафтиламиносульфоновая кислота. Специалисту в данной области известно, какие кислоты являются подходящими для проведения реакции. Однако предпочтительной является хлористоводородная кислота.
Было неожиданно обнаружено, что соединение 6-фтор-9-метил-β-карболина согласно изобретению (Ia), по сравнению с уже известными и протестированными β-карболинами, такими как 9-метил-β-карболин, обладает повышенной эффективностью при лечении заболеваний внутреннего уха. На это указывают оценка индуцированной активным агентом экспрессии генов ключевых клеточных факторов (см. пример 4), которые имеют важное значение для регенерации клеток (в частности, во внутреннем ухе) после травм, и гистологический анализ (см. пример 6), а также физиологические оценки (см. пример 7) регенерации слуховой системы после акустической травмы. Кроме того, несколько экспериментов указывали на значительно более высокую липофильность (см. пример 3) соединения 6-фтор-9-метил-β-карболина согласно изобретению (Ia). Это соединение, по сравнению с известным соединением 9-метил-β-карболина, имеет, среди прочих, следующие преимущества:
1. Повышенную способность прохождения через мембрану.
2. Медленную элиминацию (время полужизни 6F9MβC приблизительно в 1,75 раза выше, чем время полужизни 9MβC).
3. Блокирование этого метаболического пути фторидной группой в положении 6, в отличие от известных β-карболинов, которые разлагаются путем гидроксилирования в положении 6 и последующей реакции конъюгирования, где указанное приводит:
- к повышению биологической доступности после перорального введения;
- к минимизации риска образования токсических метаболитов или потенциально аллергенных метаболитов.
4. Существует еще один известный метаболический путь β-карболинов, приводящий к образованию токсических диметилированных продуктов разложения, которое происходит в результате дальнейшего N-метилирования in vivo, где сначала метилируется азот в положении 2, а затем азот в положении 9. В недавно проведенных экспериментах было показано, что 6F9MβC, к счастью, не приводит к образованию токсических диметилированных продуктов (см. пример 8), что дополнительно минимизирует риск продуцирования токсических метаболитов.
5. Повышенную эффективность индуцированной активным агентом экспрессии генов ключевых клеточных факторов (см. пример 4), которые имеют важное значение для регенерации клеток (в частности, во внутреннем ухе) после травм и для проведения гистологического анализа (см. пример 6), а также для физиологических оценок (см. пример 7) регенерации слуховой системы после акустической травмы.
7-Фтор-9-метил-β-карболин (7F9MβC)
В другом своем варианте, настоящее изобретение относится к препаратам β-карболина, а именно, 7-фтор-9-метил-β-карболина, которые могут быть использованы в медицине, а также к фармацевтическим композициям, содержащим 7-фтор-9-метил-β-карболин.
Соединение 7-фтор-9-метил-β-карболина может также иногда обозначаться здесь «7F9MβC».
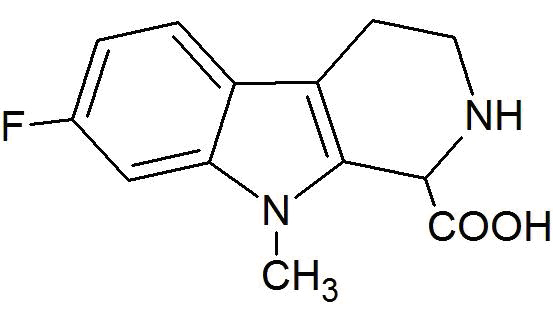
Настоящее изобретение относится к соединению 7-фтор-9-метил-β-карболина формулы (Ib)
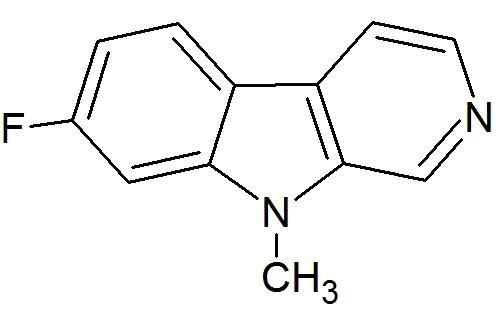 (Ib)
(Ib)
а также к фармакологически приемлемым солям, сольватам, гидратам, пролекарствам и комплексам вышеупомянутых соединений.
Как указывалось выше, используемый здесь термин «пролекарство» определен как фармакологическое вещество, вводимое в неактивной или в менее эффективной форме. После введения, это вещество превращается в активную и эффективную форму, то есть, в вышеуказанное соединение 7-фтор-9-метил-β-карболина.
Кислотами, которые могут образовывать кислотно-аддитивную соль с соединением 7-фтор-9-метил-β-карболина согласно изобретению, могут быть следующие кислоты: серная кислота, сульфоновая кислота, фосфорная кислота, азотная кислота, азотистая кислота, перхлорная кислота, бромистоводородная кислота, хлористоводородная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, щавелевая кислота, глюконовая кислота (гликоновая кислота, декстроновая кислота), молочная кислота, яблочная кислота, винная кислота, тартроновая кислота (гидроксималоновая кислота, гидроксипропандионовая кислота), фумаровая кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, малоновая кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, (o-, м-, п-) толуоиловая кислота, бензойная кислота, п-аминобензойная кислота, п-гидроксибензойная кислота, салициловая кислота, п-аминосалициловая кислота, метансульфоновая кислота, этансульфоновая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, п-толуолсульфоновая кислота, нафталинсульфоновая кислота, нафтиламиносульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, Хина (хинная кислота), o-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота (2,4,6-тринитрофенол), адипиновая кислота, d-o-толилвинная кислота, аминокислоты, такие как метионин, триптофан, аргнинин, а в частности, кислотные аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота. Кроме того, могут быть также использованы соединения типа бетаинов.
В другом своем аспекте, настоящее изобретение относится к способу получения соединения 7-фтор-9-метил-β-карболина согласно изобретению, где указанный способ включает следующие стадии:
a) реакцию взаимодействия исходного соединения гидрохлорида 6-фтор-1-метилтриптамина формулы (IIb) в присутствии гидрата глиоксиловой кислоты формулы (III) и основания с получением соединения формулы (IVb)
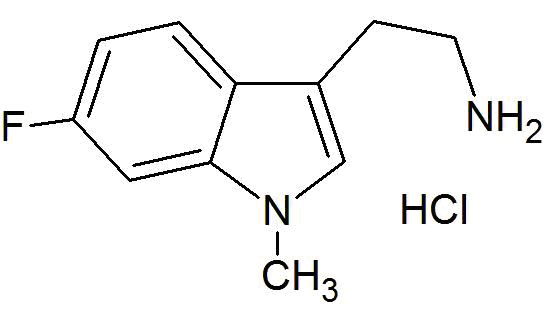

b) декарбоксилирование соединения формулы (IVb) в присутствии кислоты и при нагревании с получением 7-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина формулы (Vb)
 (Vb)
(Vb)
c) ароматизацию 7-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Vb) с получением 7-фтор-9-метил-β-карболина (Ib) в присутствии катализатора.
Исходное соединение гидрохлорида 6-фтор-1-метилтриптамина, является коммерчески доступным, например, оно поставляется компанией Otavachemicals Ltd. (Vaughan, Kanada). В предпочтительном варианте осуществления изобретения, в стадии (a), величина pH составляет от 2 до 6, предпочтительно, от 3 до 5, а особенно предпочтительно, рН составляет 4, что достигается при добавлении основания. В другом варианте осуществления изобретения, в стадии (a’), кристаллизацию соединения IVb инициируют путем инкубирования в воде со льдом.
В другом предпочтительном варианте осуществления изобретения, реакцию в стадии (b) осуществляют в атмосфере инертного газа, а особенно предпочтительно, N2. Кроме того, кристаллизацию продукта реакции стадии (b) в стадии (b)’ предпочтительно, инициировать путем инкубирования на холоде, а особенно предпочтительно, при температуре от 0°C до 5°C в течение нескольких часов. В другом предпочтительном варианте очистки продукта реакции стадии (b), перекристаллизацию из метанола осуществляют после кристаллизации. Кроме того, предпочтительно, чтобы 7-фтор-9-метил-2,3,4,9-тетрагидро-β-карболин в стадии (c) был сначала растворен в воде с последующим добавлением основания, например, гидроксида натрия или карбоната натрия, для доведения рН до щелочного значения, особенно предпочтительно, до рН 11-14, а наиболее предпочтительно, до pH 13.
В предпочтительном варианте осуществления изобретения, катализаторами для реакции окислительной ароматизации в стадии (c) могут быть, среди прочих, Pd/C, Pt/C, PdCl2, Pd/сепиолит, Pd/SiO2 и Pd/AlO4. Специалистам также известны и другие добавки, стимулирующие окислительную ароматизацию. Однако предпочтительным катализатором является Pd/C (палладий на угле, палладий на активированном угле).
Основаниями, добавляемыми в стадиях (a) и (c), могут быть, независимо друг от друга, другие неорганические или органические основания, например, NaOH, KOH, NH4OH, гидроксид тетраалкиламмония, лизин или аргинин. Специалисту в данной области известно, какие основания являются подходящими для проведения реакции. Однако предпочтительными являются KOH и NaOH, соответственно.
Кислотами, добавляемыми в стадии (b), могут быть неорганические или органические кислоты, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, яблочная кислота, салициловая кислота, п-аминосалициловая кислота, малоновая кислота, фумаровая кислота, янтарная кислота, аскорбиновая кислота, малеиновая кислота, сульфоновая кислота, фосфоновая кислота, перхлорная кислота, азотная кислота, муравьиная кислота, пропионовая кислота, глюконовая кислота, молочная кислота, винная кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, бензойная кислота, п-аминобензойная кислота, п-гидроксибензойная кислота, метансульфоновая кислота, этансульфоновая кислота, азотистая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, п-толуолсульфоновая кислота, нафтилсульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, хинная кислота, миндальная кислота, o-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота, адипиновая кислота, d-o-толилвинная кислота, тартроновая кислота, α-толуиловая кислота, (o-, м-, п-) толуиловая кислота или нафтиламиносульфоновая кислота. Специалисту в данной области известно, какие кислоты являются подходящими для проведения реакции. Однако предпочтительной является хлористоводородная кислота.
Было неожиданно обнаружено, что соединение 7-фтор-9-метил-β-карболина согласно изобретению (Ib), по сравнению с уже известными и протестированными β-карболинами, такими как 9-метил-β-карболин, обладает повышенной эффективностью при лечении заболеваний внутреннего уха. На это указывает недавно проведенная оценка эффективности 7-фтор-9-метил-β-карболина по сравнению с известным соединением 9-метил-β-карболина, где указанный 7-фтор-9-метил-β-карболин имеет, среди прочих, следующие преимущества:
1. Повышенную способность прохождения через мембрану.
2. Медленную элиминацию (время полужизни 7F9MβC приблизительно в 1,5 раза выше, чем время полужизни 9MβC).
3. Повышенную эффективность индуцированной активным агентом экспрессии генов ключевых клеточных факторов (см. примеры 4 и 5), которые имеют важное значение для регенерации клеток (в частности, во внутреннем ухе) после травм.
Фармацевтические композиции и их применение
Соединения согласно изобретению являются особенно подходящими для лечения заболеваний или поражений внутреннего уха, а в частности нейронных и сенсорных структур внутреннего уха. Такими описанным здесь заболеваниями или поражениями являются, предпочтительно, потеря слуха и/или нарушение вестибулярной функции. Сопутствующими симптомами являются, среди прочих, нарушение слуха, потеря слуха, головокружение, нарушение равновесия, шум в ушах, дезориентация, тошнота и рвота.
Таким образом, в одном из своих аспектов, настоящее изобретение относится к соединениям общей формулы (I) (или к фтор-9-метил-β-карболинам общей формулы (I)), используемым в качестве лекарственного препарата. Настоящее изобретение также относится к соединению 6-фтор-9-метил-β-карболина, используемому в качестве лекарственного препарата. Настоящее изобретение также относится к соединению 7-фтор-9-метил-β-карболина, используемому в качестве лекарственного препарата. Соединения согласно изобретению, в частности, 7-фтор-9-метил-β-карболин, а особенно предпочтительно, 6-фтор-9-метил-β-карболин, являются наиболее подходящими для лечения заболеваний и/или поражений внутреннего уха, а в частности, лабиринтной глухоты. Заболеваниями и/или поражениями внутреннего уха могут быть, предпочтительно, острые и хронические заболевания внутреннего уха. Акустическая травма, контузия уха, глухота и травмы, возникающие во время имплантации протеза внутреннего уха (травмы при введении протеза), считаются острыми заболеваниями внутреннего уха. Хроническими заболеваниями внутреннего уха являются, среди прочих, хроническая акустическая травма (лабиринтная глухота, вызванная длительным шумовым воздействием), старческая тугоухость (возрастная потеря слуха), отосклероз и болезнь Меньера. Термин «лабиринтная глухота» (также определяемый здесь улитковая или сенсорная глухота) включает глухоту, вызываемую длительным шумовым воздействием (также определяемую как хроническая лабиринтная глухота или хроническая шумовая травма), а также старческую тугоухость (возрастную потерю слуха).
Таким образом, в другом своем аспекте, настоящее изобретение относится к соединению общей формулы (I), в частности, к 7-фтор-9-метил-β-карболину, а наиболее предпочтительно, к 6-фтор-9-метил-β-карболину, используемым для лечения заболеваний и/или поражений внутреннего уха, где заболеваниями и/или поражениями внутреннего уха являются острые заболевания внутреннего уха, выбранные из группы, включающей акустическую травму, контузию уха, потерю слуха и травму при введении протеза.
Таким образом, в другом своем аспекте, настоящее изобретение относится к соединению общей формулы (I), в частности, к 7-фтор-9-метил-β-карболину, а наиболее предпочтительно, к 6-фтор-9-метил-β-карболину, используемым для лечения заболеваний и/или поражений внутреннего уха, где заболеваниями и/или поражениями внутреннего уха являются острые заболевания внутреннего уха, выбранные из группы, включающей хроническую акустическую травму, шум в ушах и старческую тугоухость.
Кроме того, соединения согласно изобретению являются подходящими для лечения головокружения и нарушения равновесия, вызываемых нарушениями слуха или заболеваниями уха, а в частности, нарушениями ощущения равновесия в ушах, и эти соединения являются подходящими для улучшения памяти, способности к обучению и сохранения памяти, а в частности, кратковременной памяти или долговременной памяти.
Заболевания и поражения внутреннего уха могут быть также вызваны действием ототоксических веществ, таких как антибиотики и/или цитостатические агенты. Соединения согласно изобретению, частности, 7-фтор-9-метил-β-карболин, а наиболее предпочтительно, 6-фтор-9-метил-β-карболин являются подходящими для лечения заболеваний и/или поражений внутреннего уха, где указанные поражения внутреннего уха вызываются ототоксическими веществами. Ототоксическими веществами, предпочтительно, являются, антибиотики и/или цитостатические агенты, предпочтительно, выбранные из группы, включающей, или состоящей из них, ампициллин, бакампициллин, карбенициллин, инданил, мезлоциллин, пиперациллин, тикарциллин, амоксициллин-клавулановую кислоту, ампициллин-сулбактам, бензилпенициллин, клоксациллин, диклоксациллин, метициллин, оксациллин, пенициллин G, пенициллин V, пиперациллин, тазобактам, тикарциллин, клавулановую кислоту, нафциллин, цефалоспорин, цефадроксил, цефазолин, цефалексин, цефалотин, цефапирин, цефрадин, цефаклор, цефамандол, цефоницид, цефотетан, цефокситин, цефпрозил, цефметазол, цефуроксим, лоракарбеф, цефдинир, цефтибутен, цефоперазон, цефиксим, цефотаксим, цефподоксим проксетил, цефтазидим, цефтизоксим, цефтриаксон, цефепим, азитромицин, кларитромицин, клиндамицин, диритромицин, эритромицин, рокситромицин, телитромицин, цетромицин, спирамицин, анзимацин, оландомицин, линкомицин, тролеандомицин, циноксацин, ципрофлоксацин, эноксацин, гатифлоксацин, грепафлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, налидиксовую кислоту, норфлоксацин, офлоксацин, спарфлоксацин, тровафлоксацин, оксолиновую кислоту, гемифлоксацин, пефлоксацин, имипенем-циластатин, меропенем, азтреонамом, амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин, паромомицин, тейкопланин, ванкомицин, демеклоциклин, доксициклин, метациклин, миноциклин, окситетрациклин, тетрациклин, хлортетрациклин, тигециклин, мафенид, сульфадиазид серебра, сульфацетамид, сульфадиазин, сульфаметоксазол, сульфасалазин, сульфисоксазол, триметоприм-сульфаметоксазол, сульфаметизол, рифабутин, рифампицин, рифапентин, линезолид, стрептограмины, хинопристин, дальфопристин, бацитрацин, хлорамфеникол, фосфомицин, изониазид, метенамин, метронидазол, мупироцин, нитрофурантоин, нитрофуразон, новобиоцин, полимиксин, спектиномицин, триметоприм, колистин, циклосерин, капреомицин, этионамид, пиразинамид, пара-аминосалициловую кислоту, эритромицин-2’-ацетат, эритромицин-2’-стеарат, эстолат эритромицина, этилсукцинат эритромицина, глутамат эритромицина, рифампицин, миконазол, кетоконазол, клотримазол, эконазол, бифоназол, бутоконазол, фентиконазол, изоконазол, оксиконазол, сертаконазол, сульконазол, тиоканазол, флуконазол, итроконазол, изавуконазол, равуконазол, позаконазол, вориконазол, тераконазол, абфунгин, тербинафин, аморолфин, нафтифин, бутенафин, анидулафунгин, каспофунгин, микафунгин, бензойную кислоту, циклопироксоламин, толнафтат, 5-фтороцитозин, гризеофульвин, галопрогин, фузидиновую кислоту, грамицидин, пристинамицин, рамопланин, тиротрицин, натамицин, римоцидин, филипин, нистатин, амфотерицин В, кандицин и гамицин.
Кроме того, в другом своем аспекте, настоящее изобретение относится к соединению общей формулы (I), в частности, к 7-фтор-9-метил-β-карболину, а особенно предпочтительно, к 6-фтор-9-метил-β-карболину, используемым для лечения заболеваний и/или поражений внутреннего уха, где указанное поражение внутреннего уха вызывается ототоксическими веществами.
В другом своем аспекте, настоящее изобретение относится к применению соединений согласно изобретению, в частности, 7-фтор-9-метил-β-карболина, а наиболее предпочтительно, 6-фтор-9-метил-β-карболина, в целях приготовления лекарственного препарата для лечения заболеваний и/или поражений внутреннего уха. В одном из своих вариантов, настоящее изобретение относится к способу лечения заболеваний и/или поражений внутреннего уха путем введения соединения общей формулы (I), предпочтительно, 7-фтор-9-метил-β-карболина (Ib), а особенно предпочтительно, 6-фтор-9-метил-β-карболина (Ia).
Кроме того, другой представляющий интерес аспект настоящего изобретения заключается в том, что в экспериментах, проводимых авторами на клеточном уровне, было обнаружено, что 6-фтор-9-метил-β-карболин (6F9MβC) способствует повышению концентрации CREB в 8 раз и повышению концентрации BDNF (нейротропного фактора головного мозга) в 3 раза. Полученные данные дают основание предположить, что 6-фтор-9-метил-β-карболин (6F9MβC) согласно изобретению может быть использован не только для лечения заболеваний и/или поражений внутреннего уха, но также и для улучшения когнитивной функции и памяти.
Механизмы, лежащие в основе когнитивной функции и формирования памяти, являются очень сложными. Они могут рассматриваться на молекулярном и на клеточном уровне, на уровне биологической системы и с точки зрения психологии. Одним из ключевых процессов формирования памяти на молекулярном уровне является активация белков, связывающихся с cAMP-отвечающим элементом (CREB). Это приводит к образованию новых синапсов, то есть, к процессу, ассоциированному с формированием памяти. Такое процесс регулируется многими факторами. Позитивная амплификация индуцируется BDNF головного мозга и его рецептором TRKB. Эксперименты на биологическое поведение (см. пример 9), проводимые на крысиных моделях, по сравнению с контрольными необработанными животными, показали, что внутрибрюшинное введение 6-фтор-9-метил-β-карболина (6F9MβC) согласно изобретению приводило к ускорению процессов обучения и к улучшению памяти.
Таким образом, в другом своем аспекте, настоящее изобретение относится к соединению общей формулы (I), в частности, к 7-фтор-9-метил-β-карболину, а особенно предпочтительно, к 6-фтор-9-метил-β-карболину, используемым для улучшения когнитивной функции и памяти или для улучшения памяти, повышения способности к обучению и сохранения памяти.
В своем дополнительном аспекте, настоящее изобретение относится к применению соединений согласно изобретению, в частности, 7-фтор-9-метил-β-карболина, а особенно предпочтительно, 6-фтор-9-метил-β-карболина, в целях приготовления фармацевтического препарата для улучшения когнитивной функции и памяти. В одном из своих вариантов, настоящее изобретение относится к способу улучшения когнитивной функции и памяти путем введения соединения общей формулы (I), предпочтительно, 7-фтор-9-метил-β-карболина (Ib), а особенно предпочтительно, 6-фтор-9-метил-β-карболина (Ia).
Таким образом, в другом своем аспекте, настоящее изобретение относится к соединению общей формулы (I), в частности, к 7-фтор-9-метил-β-карболину, а особенно предпочтительно, к 6-фтор-9-метил-β-карболину, используемым для ускорения процессов обучения и/или улучшения памяти.
В другом своем аспекте, настоящее изобретение относится к применению соединений согласно изобретению, в частности, 7-фтор-9-метил-β-карболина, а особенно предпочтительно, 6-фтор-9-метил-β-карболина, в целях приготовления фармацевтического препарата для ускорения процессов обучения и/или улучшения памяти. В одном из своих вариантов, настоящее изобретение относится к способу ускорения процессов обучения и/или улучшения памяти путем введения соединения общей формулы (I), предпочтительно, 7-фтор-9-метил-β-карболина (Ib), а особенно предпочтительно, 6-фтор-9-метил-β-карболина (Ia).
В другом своем аспекте, настоящее изобретение относится к фармацевтическим композициям, приготовленным в форме капель, мазей, спреев, липосом, гелей, эмульсий или растворов для инъекций, содержащих по меньшей мере одно из соединений согласно изобретению (или по меньшей мере одно соединение общей формулы (I)).
В другом своем аспекте, настоящее изобретение относится к фармацевтическим композициям, приготовленным в форме капель, мазей, спреев, липосом, гелей, эмульсий или растворов для инъекций, содержащих одно или более соединений согласно изобретению (или одно или более соединений общей формулы (I)).
В другом своем аспекте, настоящее изобретение относится к фармацевтическим композициям, приготовленным в форме капель, мазей, спреев, липосом, гелей, эмульсий или растворов для инъекций, содержащих 6-фтор-9-метил-β-карболин.
В другом своем аспекте, настоящее изобретение относится к фармацевтическим композициям, приготовленным в форме капель, мазей, спреев, липосом, гелей, эмульсий или растворов для инъекций, содержащих 7-фтор-9-метил-β-карболин.
В другом своем аспекте, настоящее изобретение относится к фармацевтическим композициям, приготовленным в форме капель, мазей, спреев, липосом, гелей, эмульсий или растворов для инъекций, содержащих 6-фтор-9-метил-β-карболин и 7-фтор-9-метил-β-карболин.
Настоящее изобретение также относится к фармацевтическим композициям, приготовленным в форме капель, мазей, спреев, липосом, гелей, эмульсий или растворов для инъекций, содержащих 6-фтор-9-метил-β-карболин и/или 7-фтор-9-метил-β-карболин.
Кроме того, настоящее изобретение также относится к фармацевтическим композициям, приготовленным с использованием по меньшей мере одного из соединений согласно изобретению (или по меньшей мере одного соединения общей формулы (I)) или их соли.
Кроме того, настоящее изобретение также относится к фармацевтическим композициям, приготовленным с использованием одного или более соединений согласно изобретению (или одного или более соединений общей формулы (I)) или их солей.
Кроме того, настоящее изобретение также относится к фармацевтическим композициям, приготовленным с использованием соединения 7-фтор-9-метил-β-карболина согласно изобретению или его соли.
Кроме того, настоящее изобретение также относится к фармацевтическим композициям, приготовленным с использованием соединения 6-фтор-9-метил-β-карболина согласно изобретению или его соли.
Кроме того, настоящее изобретение также относится к фармацевтическим композициям, приготовленным с использованием соединения 6-фтор-9-метил-β-карболина согласно изобретению или его соли и соединения 7-фтор-9-метил-β-карболина согласно изобретению или его соли.
Аналогичным образом, настоящее изобретение относится к фармацевтическим композициям, приготовленным с использованием соединения(й) 6-фтор-9-метил-β-карболина и/или 7-фтор-9-метил-β-карболина согласно изобретению или их солей.
Фармацевтические композиции предпочтительно содержат, помимо по меньшей мере одного из соединений согласно изобретению (или одного соединения общей формулы (I)), а в частности, помимо 7-фтор-9-метил-β-карболина, а особенно предпочтительно, 6-фтор-9-метил-β-карболина, фармакологически приемлемый носитель, адъювант и/или растворитель.
Фармацевтические композиции предпочтительно содержат, помимо 6-фтор-9-метил-β-карболина согласно изобретению, фармакологически приемлемый носитель, адъювант и/или растворитель.
Фармацевтические композиции, содержащие соединение согласно изобретению, могут быть приготовлены и введены в форме систем для трансдермального применения (пластырей, пленок), капель, пилюль, таблеток, таблеток с пленочным покрытием, таблеток с многослойным покрытием, драже, гелей, гидрогелей, мазей, сиропов, гранул, суппозиториев (овулей), эмульсий, дисперсий, микрокапсул, капсул, микропрепаратов, нанопрепаратов, липосом, порошков, спреев, аэрозолей, растворов, соков, суспензий, растворов для вливания или растворов для инъекций. Предпочтительными являются фармацевтические композиции в форме липосом, гелей и эмульсий. Особенно предпочтительными являются препараты в форме гидрогеля.
Такими композициями являются, среди прочих, композиции, подходящие для ингаляции или для внутривенного, внутрибрюшинного, внутримышечного, подкожного, слизисто-кожного, перорорального, ректального, трансдермального, местного, подщечного, интрадермального, интрагастрального, внутрикожного, интраназального, интрабуккального, чрезкожного, интратимпанального или подъязычного введения. Особенно предпочтительными являются введение или инъекция в среднее ухо, а также местное введение в барабанную перепонку.
В качестве фармацевтически приемлемого носителя могут быть использованы, например, лактоза, крахмал, сорбит, сахароза, целлюлоза, стеарат магния, дифосфат кальция, сульфат кальция, тальк, маннит, этиловый спирт и т.п. Порошки, а также таблетки могут на 5-95 масс.% состоять из такого носителя.
Кроме того, в фармацевтические композиции могут быть добавлены разрыхлители, красители, ароматизаторы и/или связывающие вещества.
Жидкие композиции содержат растворы, суспензии, спреи и эмульсии. Так, например, растворы для инъекций могут быть водными, а растворы для парентеральных инъекций могут быть приготовлены на основе смеси воды и пропиленгликоля. Для приготовления суппозиториев предпочтительно использовать воски с низкой температурой плавления, сложные эфиры жирной кислоты и глицериды.
Капсулы, например, приготавливают с использованием метилцеллюлозы, поливиниловых спиртов или денатурированного желатина или крахмала. В качестве разрыхлителей могут быть использованы крахмал, карбоксиметилированный натрий-содержащий крахмал, натуральные и синтетические камеди, такие как, например, камедь рожкового дерева, камедь карайи, гуаровая камедь, трагакантовая камедь и агар, а также производные целлюлозы, такие как метилцеллюлоза, натрий-содержащая карбоксиметилцеллюлоза, микрокристаллическая целлюлоза, и кроме того, альгинаты, глины и бентониты. Эти компоненты могут быть использованы в количестве 2-30 масс.%.
В качестве связующих агентов могут быть использованы сахар, кукурузный, рисовый или картофельный крахмал, натуральные и синтетически камеди, такие как аравийская камедь или гуаровая камедь, желатин, трагакантовая камедь, альгиновая кислота, альгинат натрия, альгинат аммония-кальция, метилцеллюлоза, натрий-содержащая карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, полиэтиленгликоль, воски, а также неорганические соединения, такие как силикаты магния-алюминия. Эти связующие агенты могут быть добавлены в количестве 1-30 масс.%.
В качестве замасливателей могут быть использованы стеараты, такие как стеарат магния, стеарат кальция, стеарат калия, стеариновая кислота, воски с высокой температурой плавления, а также водорастворимые замасливатели, такие как хлорид натрия, бензоат натрия, ацетат натрия, олеат натрия, полиэтиленгликоль, борная кислота и аминокислоты, такие как лейцин. Указанные замасливатели могут быть использованы в количестве 0,05-15 масс.%.
Таким образом, предпочтительными являются все фармацевтические композиции, подходящие для местного введения активного агента в мембрану окна улитки. Кроме того, если фармацевтические препараты содержат проникающий в мембрану промотор, то предпочтительно, чтобы соединение согласно изобретению общей формулы (I), в частности, 7-фтор-9-метил-β-карболин, а особенно предпочтительно, 6-фтор-9-метил-β-карболин, проходило через мембрану окна улитки. В соответствии с этим, особенно предпочтительными являются жидкие или гелевые препараты. Очевидно, что активный агент может быть также введен перорально.
Фармацевтические композиции для введения соединений любого типа общей формулы (I) содержат терапевтически эффективное количество соединения(й) общей формулы (I) и, если это необходимо, неорганические или органические, твердые или жидкие фармацевтически приемлемые носители. Фармацевтические композиции, подходящие для местного введения в среднее ухо, содержат водные растворы или суспензии, которые могут быть приготовлены до их введения в среднее ухо, например, в виде лиофилизованных препаратов, содержащих соединение(я) общей формулы (I), которые могут быть введены отдельно или вместе с носителем.
Фармацевтические композиции для введения 7-фтор-9-метил-β-карболина любого типа содержат терапевтически эффективное количество 7-фтор-9-метил-β-карболина и, если это необходимо, неорганические или органические, твердые или жидкие фармацевтически приемлемые носители. Фармацевтические композиции, подходящие для местного введения в среднее ухо, содержат водные растворы или суспензии, которые могут быть приготовлены до их введения в среднее ухо, например, в виде лиофилизованных препаратов, содержащих 7-фтор-9-метил-β-карболин, который может быть введен отдельно или вместе с носителем.
Фармацевтические композиции для введения 6-фтор-9-метил-β-карболина любого типа содержат терапевтически эффективное количество 6-фтор-9-метил-β-карболина и, если это необходимо, неорганические или органические, твердые или жидкие фармацевтически приемлемые носители. Фармацевтические композиции, подходящие для местного введения в среднее ухо, содержат водные растворы или суспензии, которые могут быть приготовлены до их введения в среднее ухо, например, в виде лиофилизованных препаратов, содержащих 6-фтор-9-метил-β-карболин, который может быть введен отдельно или вместе с носителем.
Кроме того, фармацевтические композиции содержат гели, которые являются биологически разлагаемыми или биологически неразлагаемыми, а также водными или безводными, или гели, приготовленные на основе микросфер. Примерами таких гелей являются полиоксамеры, гиалуронаты, ксилоглюканы, хитозаны, полиэфиры, полилактиды, полигликолиды или их сополимеры PLGA, изобутират ацетата сахарозы и моноолеат глицерина. Фармацевтические композиции, подходящие для внутрикишечного или парентерального введения, представляют собой таблетки или желатиновые капсулы, или водные растворы или суспензии, описанные выше.
Фармацевтические композиции могут быть стерилизованы и/или могут содержать адъювант, например, консерванты, стабилизаторы, увлажнители и/или эмульгаторы, соли для регуляции осмотического давления и/или буфер. Фармацевтические композиции согласно изобретению могут содержать, если это необходимо, дополнительные активные агенты. Эти фармацевтические композиции могут быть приготовлены любым методом, известным специалистам, например, стандартными методами, такими как смешивание, грануляция, осахаривание, растворение и лиофилизация, и могут содержать приблизительно 0,01-100 масс.%, предпочтительно, 0,1-50 масс.% 6-фтор-9-метил-β-карболина, а для лиофилизатов, до 100 масс.% 6-фтор-9-метил-β-карболина. Эти фармацевтические композиции могут также содержать приблизительно 0,01-100 масс.%, предпочтительно, 0,1-50 масс.% 7-фтор-9-метил-β-карболина, а для лиофилизатов, до 100 масс.% 7-фтор-9-метил-β-карболина. Такие фармацевтические композиции могут также содержать приблизительно 0,01-100 масс.%), а предпочтительно, 0,1-50 масс.% соединений общей формулы (I), а для лиофилизатов, до 100 масс.% соединений общей формулы (I).
В предпочтительном варианте осуществления изобретения, фармацевтическую композицию согласно изобретению приготавливают для местного введения. Подходящими носителями для отогенного введения могут служить органические и неорганические вещества, которые являются фармацевтически приемлемыми и не реагируют с соединением согласно изобретению и/или с дополнительными активными агентами, и такими носителями являются, например, поваренная соль, спирты, растительные масла, бензиловые спирты, алкилгликоли, полиэтиленгликоли, триацетат глицерина, желатин, углеводы, такие как лактоза или крахмал, карбонат магния (магнезия, мел), стеарат (воски), тальк и петролатум (вазелин). Описанные композиции могут быть стерилизованы и/или могут содержать адъюванты, например, замасливатели, консерванты, такие как тиомерсал (то есть, 50 масс.%), стабилизаторы и/или увлажнители, эмульгаторы, соли для регуляции осмотического давления, буферы, красители и/или ароматизаторы. Эти композиции могут также содержать, если это необходимо, один или множество дополнительных активных агентов. Отогенные композиции согласно изобретению могут содержать и другие соединения и/или вещества, например, другие биологически активные добавки, например, антибиотики, противовоспалительные активные агенты, такие как стероиды, кортизоны, аналгетики, антипирины, бензокаины, прокаины.
Композиции согласно изобретению для местного введения могут содержать другие фармацевтически приемлемые соединения и/или вещества. В предпочтительном варианте осуществления изобретения, выбранными наполнителями для местного введения являются наполнители, которые не стимулируют высвобождение соединений общей формулы (I), в частности, 7-фтор-9-метил-β-карболина, а наиболее предпочтительно, 6-фтор-9-метил-β-карболина, и, возможно, дополнительного активного агента или активных агентов в кровоток или в центральную нервную систему при введении такого наполителя в ухо, в среднее ухо или в слуховой проход. Вещества-носители могут содержать соли угольной кислоты, безводные абсорбенты, такие как гидрофильный петролатум (вазелин) и безводный ланолин (то есть, Aquaphor®), и вещества, полученные на основе эмульсии типа «вода в масле», такие как ланолин и холодный крем. Более предпочтительными являются носители, которые включают, но не ограничиваются ими, водорастворимые носители, а также вещества, полученные на основе эмульсии типа «масло в воде» (кремы или гидрофильные мази), и вещества с водорастворимой основой, такие как носители, полученные на основе полиэтиленгликоля и водных растворов, которые представляют собой гели, содержащие несколько веществ, таких как метилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилметилцеллюлоза.
Соединение для перорального введения согласно изобретению, приготовленное в форме таблеток или капсул, может быть смешано с нетоксичными фармацевтически приемлемыми адъювантами, выбранными из списка адъювантов, включающего связующие вещества, такие как кукурузный крахмал, набухающий в холодной воде, поливинилпирролидон или гидроксипропилметилцеллюлоза; наполнители, такие как лактоза, сахароза, глюкоза, маннит, сорбит и другие восстанавливающие и невосстанавливающие сахара, микрокристаллическая целлюлоза, сульфат кальция, гидрофосфат кальция; замасливатели, такие как стеарат магния, такль или двуокись кремния, стериновая кислота, стеарилфумарат натрия, глицерилбегенат, стеарат кальция и т.п.; дезинтеграторы, такие как картофельный крахмал или крахмал на основе гликолята натрия; увлажнители, такие как долецилсульфат натрия; красители; ароматизаторы; желатин; подсластители; натуральные и синтетические камеди, такие как аравийская камедь, трагакантовая камедь или альгинаты; буферные соли; карбоксиметилцеллюлоза; полиэтиленгликоль; воски и т.п.
Таблетки могут быть покрыты концентрированным сахарным раствором, который может содержать, например, аравийскую камедь, желатин, тальк, оксид титана и т.п. В другом варианте осуществления изобретения, таблетки могут быть покрыты полимером, который растворяется в летучем органическом растворителе или в смеси органических растворителей. В предпочтительном варианте осуществления изобретения, соединения согласно изобретению общей формулы (I), в частности, 7-фтор-9-метил-β-карболин, а особенно предпочтительно, 6-фтор-9-метил-β-карболин, приготавливают в виде таблетки для быстрого высвобождения или в виде таблетки для пролонгированного высвобождения. Лекарственные формы для быстрого высвобождения обеспечивают высвобождение значительного количества или всего количества соединения общей формулы (I) в течение непродолжительного периода времени, составляющего 60 минут или менее, и быструю абсорбцию соединения согласно изобретению. Лекарственные формы для пролонгированного высвобождения обеспечивают замедленное высвобождение в течение длительного периода времени, достаточного для достижения соответствующего уровня терапевтически активного соединения общей формулы (I) в плазме и/или для сохранения этого уровня терапевтически активного соединения в плазме в течение более длительного периода времени и/или для модификации других фармакокинетических свойств соединений общей формулы (I), в частности, 7-фтор-9-метил-β-карболина, а особенно предпочтительно, 6-фтор-9-метил-β-карболина.
Соединение согласно изобретению может быть смешано, например, с растительным маслом или полиэтиленгликолем с получением мягких желатиновых капсул. Твердые желатиновые капсулы могут содержать соединение согласно изобретению в гранулированной форме, приготовленной с использованием любых вышеупомянутых и применяемых для таблеток адъювантов, таких как лактоза, сахароза, маннит, крахмалы, такие как картофельный крахмал, кукурузный крахмал или амилопектин, производные целлюлозы или желатин. Твердые желатиновые капсулы могут быть также заполнены жидкими или полужидкими формами соединения согласно изобретению.
Соединения согласно изобретению общей формулы (I), в частности, 7-фтор-9-метил-β-карболин, а особенно предпочтительно, 6-фтор-9-метил-β-карболин, могут быть также включены в микросферы или микрокапсулы, приготовленные, например, на основе полигликолевой кислоты/молочной кислоты (PGLA). Биосовместимые полимеры, выбранные из списка, включающего полимолочную кислоту, полигликолевую кислоту, сополимеры полимолочной кислоты и полигликолевой кислоты, поли-ε-капролактон, полигидроксимасляную кислоту, полиортоэфир, полиацетали, полигидропураны, полицианоакрилаты и перекрестно связанные или амфипатические блоксополимеры гидрогелей, могут быть использованы для достижения регулируемого высвобождения соединения согласно изобретению из фармацевтических композиций согласно изобретению.
В другом варианте осуществления изобретения, соединения согласно изобретению общей формулы (I), в частности, 7-фтор-9-метил-β-карболин, а особенно предпочтительно, 6-фтор-9-метил-β-карболин, могут быть использованы в качестве жидкого препарата для перорального введения. Жидкие препараты для перорального введения могут быть приготовлены в форме растворов, сиропов, эмульсий или суспензий. Альтернативно, жидкие пероральные препараты, перед их введением, могут быть приготовлены путем разведения сухого препарата для перорального введения водой или другим подходящим носителем. Препараты для перорального введения могут быть приготовлены так, чтобы достигалось регулируемое и замедленное высвобождение соединения согласно изобретению и, возможно, дополнительных активных агентов.
Соединение согласно изобретению для перорального введения в жидкой форме могут быть приготовлено в комбинации с нетоксическими фармацевтически приемлемыми инертными носителями, такими как этанол, глицерин, вода; суспендирующими агентами, такими как сорбитный сироп, производные целлюлозы или отвержденные пищевые жиры; эмульгаторами, такими как лецитин или аравийская камедь; безводными носителями, такими как миндальное масло, сложные эфиры масел, этанол или фракционированные растительные масла; консервантами, такими как метил- или пропил-п-гидроксибензоаты или сорбиновая кислота; и т.п. Для стабилизации лекарственной формы могут быть также использованы стабилизаторы, например, антиоксиданты, такие как бутилгидроксианизол, бутилгидрокситолуол, пропилгаллат, аскорбат натрия и лимонная кислота. Так, например, растворы соединения согласно изобретению могут содержать приблизительно от 0,2 масс.% до 20 масс.% уравновешивающего агента, где таким агентом может быть сахар и смесь этанола, воды, глицерина и пропиленгликоля. Эти жидкие препараты могут содержать, но необязательно, красители, ароматизаторы, сахарин, карбоксицеллюлозу, используемую в качестве загустителя, и/или другие адъюванты.
В другом варианте осуществления изобретения, терапевтически активную дозу соединения согласно изобретению вводят перорально в виде раствора, где указанный раствор может содержать консервант, подсластитель, солюбилизатор и растворитель. Раствор для перорального введения может содержать один или более буферов, ароматизаторов или других наполнителей. В другом варианте осуществления изобретения, в раствор соединения согласно изобретению для перорального введения добавляют отдушку, такую как перечная мята, или другую отдушку.
Соединение согласно изобретению, предназначенное для ингаляции, может быть введено подходящим способом, например, в виде унифицированной дозы аэрозольного спрея, впрыскиваемой из контейнера под давлением или из ингалятора с использованием подходящего пропеллента, такого как дихлорфторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. При использовании аэрозоля под давлением, доза может быть определена путем установки клапана для введения отмеренного количества спрея. Капсулы и кассеты, содержащие, например, желатин, используемый в ингаляторах или инсуффляторах, могут быть сконструированы так, чтобы они содержали порошкообразную смесь соединения согласно изобретению и, возможно, один или более дополнительных активных агентов, а также подходящее вещество в виде порошка, такое как лактоза или крахмал.
Растворы для парентерального введения путем инъекции могут быть приготовлены из водного раствора водорастворимой фармацевтически приемлемой соли соединения согласно изобретению, в частности, 7-фтор-9-метил-β-карболина, а особенно предпочтительно, 6-фтор-9-метил-β-карболина, в концентрации приблизительно от 0,5 масс.% до 10 масс.%. Эти растворы могут также содержать стабилизаторы и/или буферы, и этими растворами могут быть соответствующим образом заполнены ампулы с различными унифицированными дозами.
Таким образом, представленные здесь соединения согласно изобретению в частности, 7-фтор-9-метил-β-карболин, а особенно предпочтительно, 6-фтор-9-метил-β-карболин, могут быть использованы в целях приготовления фармацевтических композиций для лечения заболеваний и/или поражения внутреннего уха. Описанными здесь заболеваниями и/или поражениями внутреннего уха, предпочтительно, являются острые и/или хронические заболевания внутреннего уха. К острым заболеваниям внутреннего уха принадлежат, среди прочих, акустическая травма, контузия уха, потеря слуха и травма при трансплантации. К хроническим заболеваниям внутреннего уха принадлежат хроническая акустическая травма, шум в ушах и старческая тугоухость. Эти заболевания и/или поражения могут также отличаться тем, что они могут быть вызваны действием ототоксических веществ.
Описание чертежей
Фиг. 1: Схема трехстадийной реакции фтор-1-метилтриптамина (в виде гидрохлорида) общей формулы (II) и гидрата глиоксиловой кислоты (III) с получением промежуточного продукта общей формулы (IV) и реакции фтор-9-метил-2,3,4,9-тетрагидро-β-карболина общей формулы (V) с получением фтор-9-метил-β-карболина общей формулы (I). В данной реакционной схеме, R1 представляет собой -F, а R2 представляет собой -H или -F, и это в равной степени относится к соединениям общей формулы (I), (II), (IV) и (V), или R1 представляет собой -H, а R2 представляет собой -F, и это в равной степени относится к соединениям общей формулы (I), (II), (IV) и (V).
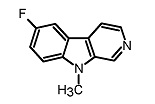
Фиг. 1a: Схема трехстадийной реакции гидрохлорида 5-фтор-1-метилтриптамина (IIа) и гидрата глиоксиловой кислоты (III) с получением промежуточного продукта (IVа) и реакции 6-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Vа) с получением 6-фтор-9-метил-β-карболина (Iа).
Фиг. 1b: Схема трехстадийной реакции гидрохлорида 6-фтор-1-метилтриптамина (IIb) и гидрата глиоксиловой кислоты (III) с получением промежуточного продукта (IVb) и реакции 7-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Vb) с получением 7-фтор-9-метил-β-карболина (Ib).
Фиг. 2: Инкубирование клеточной линии SH-SY5Y с AC102 (6-фтор-9-метил-β-карболином) в течение 15 дней.
Фиг. 3: Инкубирование клеточной линии SH-SY5Y с AC002 (9-метил-β-карболином) в течение 15 дней.
Фиг. 2 и 3: Показана культура клеток человеческой нейробластомы (SH-SY5Y), которую обрабатывали возрастающими концентрациями 6-фтор-9-метил-β-карболина (AC102) в течение 15 дней (Фиг. 2). Для сравнения проиллюстрировано действие 9-метил-β-карболина (AC102) в условиях, описанных на Фиг. 3. В верхнем ряду представлены данные эксперимента с использованием концентрации 70 мкмоль/л, а в нижнем ряду представлен график зависимости от концентрации, полученной в ранее проведенном эксперименте. Соединение согласно изобретению (AC102) ингибирует пролиферацию клеток и индуцирует разрастание небольших отростков, а также изменение размера и формы клеток. Это можно объяснить индуцированием дифференцировки. Такое действие соединения является более выраженным при концентрациях 0 мкМ (исходная) и 30 мкМ, которые сравнивали в указанные периоды времени.
Фиг. 4: ВЭЖХ-хроматограмма 9-метил-β-карболина (9MβC, AC002) и 6-фтор-9-метил-β-карболина (6F9MβC, AC102). Время удерживания составляет 5,3 и 7,3 минуты, соответственно. Колонка: Phenomenex Luna 3uC18 (2) 100A; элюент: ACN90%/NH4Ac 40 мМ [45/55].
Фиг. 5. Показана относительная экспрессия гена BDNF (нейротропного фактора головного мозга, Фиг. 5A), Lif (фактора ингибирования лейкоза, Фиг. 5B), NT3 (нейротропина 3, Фиг. 5C), Id2 (ингибитора дифференцировки 2, Фиг. 5D), BTG2 (гена транслокации В-клеток 2, Фиг. 5E), Cbln (белка-предшественника церебеллина 1, Фиг. 5F), DRD2S (короткоцепочечного варианта рецептора допамина подтипа 2, Фиг. 5H), DKK1 (белка 1, родственного белку Диккопфа 1, Фиг. 5I), а также фактора отношения генов Bax/Bcl2 (Фиг. 5G), через 2 дня (светло-серые столбцы), 7 дней (темно-серые столбцы) и 14 дней (черные столбцы) после обработки клеток SH-SY5Y соединениями 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). Термин «относительная экспрессия гена» означает экспрессию гена соответствующего фактора по сравнению с экспрессией гена этого фактора в стандартных условиях.
Фиг. 6. Показана относительная экспрессия гена BDNF (нейротропного фактора головного мозга, Фиг. 6A), Lif (фактора ингибирования лейкоза, Фиг. 6B), DRD2S (короткоцепочечного варианта рецептора допамина подтипа 2, Фиг. 6С) и DKK1 (белка 1, родственного белку Диккопфа 1, Фиг. 6D) через 2 дня (светло-серые столбцы), 7 дней (темно-серые столбцы) и 14 дней (черные столбцы) после обработки клеток SH-SY5Y соединением 7F9MβC. Термин «относительная экспрессия гена» означает экспрессию гена соответствующего фактора по сравнению с экспрессией гена этого фактора в стандартных условиях.
Фиг. 7: Изображение срезов улитки уха морских свинок после акустической травмы, полученное на флуоресцентном микроскопе после иммуногистохимического окрашивания фаллоидином (который был помечен реагентом Alexa Fluor® 488), где одно ухо было обработано 6-фтор-9-метил-β-карболином (6F9MβC, всего 0,105 мг на ухо) (Фиг. 7B), а другое необработанное ухо служило в качестве внутригруппового контроля (также обозначаемое «contr», Фиг. 7A). Могут быть детектированы внутренние волосковые клетки (IHC) и три ряда (I, II, III) наружных волосковых клеток (OHC). Погибшие клетки были отмечены белыми стрелками и был продемонстрирован поражающий эффект акустической травмы. Масштаб = 25 мкм.
Фиг. 8: Изображение срезов улитки уха морских свинок после акустической травмы, полученное на флуоресцентном микроскопе после иммуногистохимического окрашивания фаллоидином (который был помечен реагентом Alexa Fluor® 488), где одно ухо было обработано 9-метил-β-карболином (9MβC, всего 0,2 мг на ухо) (Фиг. 8B), а другое необработанное ухо служило в качестве внутригруппового контроля (также обозначаемое «contr», Фиг. 8A). Могут быть детектированы внутренние волосковые клетки (IHC) и наружные волосковые клетки (OHC). Погибшие клетки были отмечены белыми стрелками и был продемонстрирован поражающий эффект акустической травмы. Масштаб = 100 мкм.
Фиг. 9. Показан перманентный сдвиг слухового порога морских свинок после травмы, индуцированной шумовым воздействием, где одно ухо после шумовой травмы было обработано 6-фтор-9-метил-β-карболином (6F9MβC, всего 0,18 мг на ухо), а другое необработанное ухо служило в качестве внутригруппового контроля («contr»). Слуховой порог был определен путем измерения потенциалов ствола головного мозга, вызываемых шумовым воздействием, где указанный слуховой порог был измерен за 3 дня до акустической травмы (D-3), через 30 минут после акустической травмы (D0) и через 14 дней после акустической травмы (D14). Перманентный сдвиг слухового порога вычисляли исходя из измеренных величин на дни D14-D3. Эти величины представлены как средние величины для четырех независимых экспериментов (n=4).
Фиг. 10: Аналогична Фиг. 9, за исключением того, что на этой фигуре показано восстановление слухового порога у морских свинок после травмы, индуцированной шумовым воздействием. Пороговые значения вычисляли исходя из измеренных величин на дни D0-D14. Эти величины представлены как средние величины для четырех независимых экспериментов (n=4).
Фиг. 11. Показано восстановление слухового порога у морских свинок после травмы, индуцированной шумовым воздействием, где одно ухо после шумовой травмы было обработано 9-метил-β-карболином (9MβC, всего 0,2 мг на ухо), а другое необработанное ухо служило в качестве внутригруппового контроля («contr»). Слуховой порог был определен путем измерения потенциалов ствола головного мозга, вызываемых шумовым воздействием, где указанный слуховой порог был измерен за 3 дня до акустической травмы (D3), после акустической травмы (D1) и через 14 дней после акустической травмы (D14). Восстановление слухового порога вычисляли исходя из измеренных величин на дни D1-D14.
Фиг. 12: Аналогична Фиг. 11, за исключением того, что было введено 0,35 мг 9-метил-β-карболина на ухо.
Фиг. 13: ВЭЖХ-хроматограммы для необработанного 6-фтор-9-метил-β-карболина (6F9MβC, Фиг. 13A), для 6-фтор-9-метил-β-карболина, инкубированого с гомогенатом печени в течение 1 часа (Фиг. 13B), для иона 6-фтор-2,9-диметил-β-карболиния (6F29DMβC, Фиг. 13C) и иона 2,9-диметил-β-карболиния (29DMβC, Фиг. 13D). Время удерживания составляло 19,0 минуты (6F9MβC и печень + 6F9MβC), 10,1 минуты (6F29DMβC) и 9,1 минуты (29DMβC). Колонка: Phenomenex Luna 3uC18 (2) 100A; элюент: ACN90%/NH4Ac 40 мМ [45/55].
Примеры
Пример 1a: Синтез 6-фтор-9-метил-β-карболина
По аналогии с процедурой, описанной Ho и Walker (Beng T. Ho и K. E. Walker; Org. Synth. 1971, 51, 136 или Org. Synth. 1988, Coll. Vol. 6, 965), в 10 мл воды растворяли 3,5 ммоль (800 мг) гидрохлорида 5-фтор-1-метилтриптамина (Фигура 1a, Формула IIa, AKos GmbH, Steinen), и этот раствор объединяли с раствором 3,9 ммоль (356,4 мг) гидрата глиоксиловой кислоты (Фигура 1a, Формула III) в 810 мкл воды. Затем пипеткой добавляли, перемешивая, раствор 3,4 ммоль (190,4 мг) гидроксида калия, и pH доводили приблизительно до 4. Реакционную смесь перемешивали в течение 3 часов при комнатной температуре и помещали на ледяную баню еще на несколько часов для кристаллизации. Оранжево-бежевый осадок бетаина (Фигура 1a, Формула IVa) отфильтровывали и промывали небольшим количеством воды со льдом. Для проведения реакции декарбоксилирования, еще влажный осадок бетаина на фильтре (Фигура 1a, Формула IVa) переносили в колбу и растворяли в разбавленной соляной кислоте (6,48 мл воды и 918 мкл концентрированной соляной кислоты). Реакционную смесь кипятили с обратным холодильником в течение 10 минут в атмосфере азота, а затем через перегородку снова добавляли 945 мкл концентрированной соляной кислоты, и эту смесь снова пипятили с обратным холодильником в течение 15 минут. Затем, раствор доводили до комнатной температуры и хранили в течение 2 часов при 0-5°C. Образовавшиеся кристаллы 6-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Фигура 1a, Формула Va) отфильтровывали и перекристаллизовывали из метанола. Выхлд: 230 мг (52%).
Для проведения реакции ароматизации, в 15 мл воды растворяли 230 мг 6-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Фигура 1a, Формула Va), pH доводили до 13 путем добавления гидроксида натрия, и этот раствор три раза экстрагировали смесью этилацетата и толуола (1:1). Объединенные органические фазы сушили над сульфатом магния (MgSO4) и выпаривали при пониженном давлении. Маслянистый остаток растворяли в 50 мл толуола, объединяли со 100 мг Pd/C (10%) и пипятили с обратным холодильником в течение 24 ч. Pd/C отфильтровывали из еще теплого раствора, и осадок на фильтре промывали 20 мл теплого толуола. Органическую фазу выпаривали в вакууме. Маслянистый остаток 6-фтор-9-метил-β-карболина (Фигура 1a, Формула Ia) кристаллизовался при отстаивании с образованием 183 мг (96%) кристаллов горчично-желтого цвета.
Температура плавления: 117-118°C; ЖХ/МС свободного основания: m/z=201 (10%), 200 (100%), 199 (71%), 185 (13%), 145 (6%), 131 (6%), 1H-ЯМР: δ (м.д.) метанол d4, 400 Мгц: 3,80, с, 3H, N-CH3; 7,34, м, 1H; 7,43, м, 1H; 7,73, м, 1H; 7,91, м, 1H; 8,24, м, 1H; 8,73, м, 1H, 13C-ЯМР: δ (м.д.) метанол d4, 100 Мгц: 28,23; 106,38; 106,64; 110,20 и 110,29, д; 114,67; 116,25; 116,52; 120,59 и 120,66, д; 127,91; 131,30; 136,95; 137,51; 138,35; 156,20 и 158,55, д.
Элементный анализ для C12H9FN2×0,1 H2O×0,1 толуола: C, H, N, вычислено: C: 72,21; H: 4,77; N: 13,26, найдено: C: 72,01; H: 4,55; N: 13,45.
Пример 1b: Синтез 7-фтор-9-метил-β-карболина
Аналогично синтезу 6-фтор-9-метил-β-карболина, в 10 мл воды растворяли 3,5 ммоль (800 мг) гидрохлорида 6-фтор-1-метилтриптамина (Фигура 1b, Формула IIb, Otavachemicals Ltd., Vaughan, Canada), и этот раствор объединяли с раствором 3,9 ммоль (356,4 мг) гидрата глиоксиловой кислоты (Фигура 1b, Формула III) в 810 мкл воды. Затем пипеткой добавляли, перемешивая, раствор 3,4 ммоль (190,4 мг) гидроксида калия, и pH доводили приблизительно до 4. Реакционную смесь перемешивали в течение 3 часов при комнатной температуре и помещали на ледяную баню еще на несколько часов для кристаллизации. Оранжево-бежевый осадок бетаина (Фигура 1b, Формула IVb) отфильтровывали и промывали небольшим количеством воды со льдом. Для проведения реакции декарбоксилирования, еще влажный осадок бетаина на фильтре (Фигура 1b, Формула IVb) переносили в колбу и растворяли в разбавленной соляной кислоте (6,48 мл воды и 918 мкл концентрированной соляной кислоты). Реакционную смесь кипятили с обратным холодильником в течение 10 минут в атмосфере азота, а затем через перегородку снова добавляли 945 мкл концентрированной соляной кислоты, и эту смесь снова кипятили с обратным холодильником в течение 15 минут. Затем, раствор доводили до комнатной температуры и хранили в течение 12 часов при 0-5°C, в результате чего получали осадок 7-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Фигура 1b, Формула Vb) в виде HCl-соли. Образовавшиеся кристаллы отфильтровывали и перекристаллизовывали из метанола. Выход: 1 ммоль и 250 мг (28%), соответственно.
Для проведения реакции ароматизации, в 15 мл воды растворяли 250 мг 7-фтор-9-метил-2,3,4,9-тетрагидро-β-карболина (Фигура 1b, Формула Vb), pH доводили до 13 путем добавления разбавленного раствора гидроксида калия, и этот раствор хранили в холодильнике в течение ночи. Свободное основание кристаллизовалось в виде бежевого кристаллического твердого вещества, которое отфильтровывали, промывали водой и сушили в вакууме. Твердое вещество суспендировали в 50 мл толуола, объединяли со 100 мг Pd/C (10%) и кипятили с обратным холодильником в течение 8 часов (ТСХ для подтверждения превращения). Pd/C отфильтровывали из еще теплого раствора, и осадок на фильтре промывали 20 мл теплого толуола. Органическую фазу выпаривали в вакууме. Маслянистый остаток 7-фтор-9-метил-β-карболина (Фигура 1b, Формула Ib) кристаллизовался при отстаивании с образованием кристаллов горчично-желтого цвета, которые очищали колоночной хроматографией (CHCl3/метанол, 9:1). В результате было получено 160 мг (80%) продукта.
Пример 2: Дифференцировка клеток человеческой нейробластомы (SH-SY5Y)
Клеточная линия SH-SY5Y была получена из Немецкой коллекции микроорганизмов и клеточных культур - DSMZ, Braunschweig. Эти клетки культивировали в MEM (в минимальной поддерживающей среде, Life Technologies) с 10% FCS (фетальной телячьей сывороткой, Biochrom AG) и с пенициллином/стрептомицином (Biochrom AG). Для морфологической оценки, клетки высевали с плотностью 1,5×104 клеток/см2 в 24-луночные планшеты (Falcon, обработанная клеточная культура), содержащие 1 мл среды. Маточный раствор 10 ммоль/л соединения согласно изобретению, а именно, 6-фтор-9-метил-β-карболина, приготавливали в 50% этанола и стерилизовали на фильтре. Через пять часов после посева клеток, соединение согласно изобретению, а именно, 6-фтор-9-метил-β-карболин, добавляли в соответствующем количестве в эту среду до получения нужной конечной концентрации. Среду заменяли один раз в неделю. Клетки регулярно оценивали под микроскопом. Изображения получали под микроскопом BZ Keyence 10 с линзой с увеличением 10× и с цифровым зуммом 4×. Автоматическое увеличение контрастности изображения осуществляли с помощью программы BZ Analyzer.
Полученные данные указывали на преимущество соединения 6-фтор-9-метил-β-карболина согласно изобретению по сравнению с 9-метил-β-карболином, во-первых, потому, что при концентрации приблизительно 70 мкМ 9-метил-β-карболина и при 30 мкМ 6-фтор-9-метил-β-карболина наблюдалась сравнимая дифференцировка тестируемых клеток. 9-метил-β-карболин при концентрации 50 мкМ давал очень низкий рост нейритов, в отличие от соединения 6-фтор-9-метил-β-карболина согласно изобретению, концентрация которого составляла 30 мкМ, на что указывала дифференцировка клеток человеческой нейробластомы.
Пример 3: Липофильность 6-фтор-9-метил-β-карболина по сравнению с липофильностью 9-метил-β-карболина
Описанные ниже эксперименты проводили для того, чтобы определить, насколько липофильность 6-фтор-9-метил-β-карболина превышает липофильность 9-метил-β-карболина. Липофильность экспериментально определяли путем оценки фактического распределения между октанолом и водой, или более простым методом, описанным Valkó, в ВЭЖХ-экспериментах, осуществляемых на обращенно-фазовых колонках (RP18) (K. Valkó; Journal of Chromatography A 2004, 1037 (1-2), 299-310). В данном случае, компоненты исследуемого вещества достаточно сильно взаимодействуют со стационарной фазой. Если взаимодействие компонента со стационарной фазой было слабее, то его вводили в колонку раньше. В зависимости от силы этих взаимодействий, компоненты вещества появлялись в разное время (время удерживания) на конце делительной колонки. Такие эксперименты проводили для обоих веществ. Было показано, что соединение 6-фтор-9-метил-β-карболина согласно изобретению имеет более длительное время удерживания, чем 9-метил-β-карболин (Фигура 4), что явно указывает на более высокую липофильность 6-фтор-9-метил-β-карболина на выбранной колонке со стационарной фазой.
Кроме того, растворимость обоих соединений в воде определяли путем получения серий концентраций этих соединений в воде при комнатной температуре. Концентрацию, при которой соединение почти не растворяется в воде, определяли путем внешней калибровки. Соответствующую концентрацию количественно оценивали с помощью ВЭЖХ. Было обнаружено, что 6-фтор-9-метил-β-карболин (основание) имел максимальную растворимость при концентрации 29,7 мг/л, а 9-метил-β-карболин (основание) имел максимальную растворимость при концентрации 168,3 мг/л. И наоборот, более низкая растворимость 6-фтор-9-метил-β-карболина в воде указывала на его повышенную липофильность по сравнению с 9-метил-β-карболином.
Липофильность соединения оказывает большое влияние на параметры ADME («абсорбцию», «распределение», «метаболизм» и экскрецию»). Благодаря повышенной липофильности, соединения особенно богаты липофильными группами. Для прохождения через мембраны, химические вещества должны проникать через гидрофобную часть двойной биологической мембраны, а поэтому, они должны быть липофильными. При этом часто наблюдается хорошая корреляция между растворимостью в липидах и способностью проходить через мембрану. Следовательно, липофильность оказывает значительное влияние на фармакокинетику соединения. В целом, многие эксперименты указывали на достаточно высокую липофильность 6-фтор-9-метил-β-карболина по сравнению с липофильностью 9-метил-β-карболина.
В своем более важном аспекте, настоящее изобретение относится к соединению согласно изобретению, которое имеет длительное время полужизни. 9-метил-β-карболин разлагается посредством гидроксилирования в положении 6 после проведения реакции конъюгирования, а в случае 6-фтор-9-метил-β-карболина, такой метаболический путь блокируется фторидной группой. Это, вероятно, обусловлено увеличением времени полужизни 6-фтор-9-метил-β-карболина по сравнению с временем полужизни 9-метил-β-карболина. По Харману, время полужизни структурного аналога 9-метил-β-карболина в плазме крови человека составляет приблизительно 68 минут (Rommelspacher et al.; Eu J Pharmacol 2002, 441 (1-2), 115-125), и повышение этой величины дает соединению согласно изобретению важное преимущество, в частности, при лечении хронических заболеваний.
Для более точной оценки времени полужизни 9-метил-β-карболина (9MβC), 6-фтор-9-метил-β-карболина (6F9MβC) и 7-фтор-9-метил-β-карболин (7F9MβC) в организме животного, а более конкретно, в перилимфе (в указанном участке действия), были проведены эксперименты на морских свинках. Для этого, соответствующий активный агент (всего 1,4 мг активного агента на ухо), упакованный в 40 мкл гидрогеля (18% полоксамера 407 и 0,6% альгината), вводили сразу в переднюю часть мембраны окна улитки уха анетезированных морских свинок. Эти мембраны отделяли заполненное воздухом среднее ухо от заполненного перилимфой внутреннего уха. По истечении нужного периода времени (20 минут, 2 часов, 8 часов или 24 часов), у животных под анестезией каждый раз удаляли 5 мкл перилимфы из верхушки улитки (апекса). Затем животных умерщвляли. Через каждый определенный период времени (через 20 минут, 2 часа, 8 часов или 24 часа) брали значения по меньшей мере для ушей, и эти значения усредняли.
Концентрацию соответствующего активного агента в образцах перилимфы определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ, иногда также называемой жидкостной хроматографией высокого давления) и автоматизированных измерений флуоресценции соответствующего активного агента. Для ВЭЖХ, элюент представлял собой 45%-90% ацетонитрил и 55% ацетат аммония (40 мМ, pH<5). Скорость потока составляла 0,4 мл/мин, а объем впрыска составлял 10 мкл. Если сигнал был слишком сильным, то каждый образец разбавляли 60% метанолом. После каждой реакции, иглу для инъекций промывали 100% изопропанолом. Предел детектирования составлял 20 фмоль/л.
Затем, исходя из определенных концентраций активного агента вычисляли время полужизни до элиминации. Было обнаружено, что время полужизни 9-метил-β-карболина до элиминации составляло приблизительно 3,4 часа, время полужизни 6-фтор-9-метил-β-карболина до элиминации составляло приблизительно 6,0 часа, а время полужизни 7-фтор-9-метил-β-карболина до элиминации составляло приблизительно 5,0 часа. При увеличении времени полужизни соединений согласно изобретению в 1,5 раза (7F9MβC) или 1,75 раза (6F9MβC) по сравнению с временем полужизни 9-метил-β-карболина, значительно увеличивалась биологическая доступность этих соединений по сравнению с биологической доступностью известного соединения. Интересно отметить, что в целом, время полужизни, определенное в перилимфе, превышает время полужизни, определенное в крови (например, это относится к 9MβC).
Пример 4: Эксперименты I, проводимые с помощью количественной ОТ-ПЦР
Был проведен анализ клеток нейробластомы для того, чтобы определить степень влияния соединений согласно изобретению, таких как 6-фтор-9-метил-β-карболин и 7-фтор-9-метил-β-карболин, а также известного соединения 9-метил-β-карболина, на экспрессию важных нейропротективных и нейротропных факторов, которые, как известно, оказывают регенерирующее действие на пораженные сенсорные волосковые клетки. Кроме того, эти соединения повышают жизнеспособность нервных клеток спирального ганглия, которые передают информацию от внутреннего уха через ствол головного мозга в слуховой центр головного мозга. В случае травмы, нервные отростки сенсорных волосковых клеток уменьшаются, в результате чего соответствующий звуковой сигнал больше не передается. Благодаря нейротропным факторам снова возникает взаимосвязь между нервными отростками и соответствующими сенсорными волосковыми клетками, в результате чего соответствующий звуковой сигнал будет слышен снова.
Клеточные линии SH-SY5Y, которые были получены из Института генетики человека при Университетской клинике Эппендорфа, и которые были, в свою очередь, получены из Научно-исследовательского института в Брауншвейге, были снова использовали в экспериментах, проводимых с помощью ОТ-ПЦР (полимеразной цепной реакции с обратной транскриптазой) и осуществленных в вышеуказанных целях.
Эти клетки инкубировали в MEM (в минимальной поддерживающей среде, Life Technologies) с 10% FCS (фетальной телячьей сывороткой, Biochrom AG) и с пенициллином/стрептомицином (Biochrom AG). Затем клетки высевали с плотностью 1×105 клеток/см2 в бутыли для культивирования клеток размером 25 см2 (Falcon, обработанная клеточная культура), содержащие 5 мл среды. Маточные растворы 10 ммоль/л соединений 9-метил-β-карболина (AC-002 или 9MβC) и 6-фтор-9-метил-β-карболина (AC-102 или 6F9MβC), соответственно, приготавливали в дистиллированной воде и стерилизовали на фильтре. Через один день после посева клеток, соединения добавляли в соответствующем количестве (5-55 мкл) до достижения конечной концентрации в среде, составляющей 10 мкМ, 20 мкМ и 30 мкМ для 6F9MβC и 30 мкМ, 50 мкМ и 70 мкМ для 9MβC. Контроль получали только с использованием соответствующего количества растворителя (дистиллированной воды). Среду заменяли один раз в неделю.
Клетки регулярно оценивали под микроскопом и через 2, 7 и 14 дней после инкубирования собирали, а затем промывали PBS и сразу замораживали при -80°C.
Выделение РНК осуществляли с использованием набора для выделения РНК HighPure, поставляемого компанией Roche. Такое выделение включает гидролиз ДНКазой I. Концентрацию РНК измеряли на спектрометре nanoDrop, а целостность РНК определяли на биоанализаторе Bioanalyzer 2100 (Agilent). 300 нг PHK каждого образца транскрибировали в кДНК с использованием рандомизированных гексамерных праймеров, ингибитора защиты от РНКазы (Roche) и обратной транскриптазы (фермента).
После прохождения реакции, эту партию разводили 1:4 и использовали 2 мкл для каждой количественной ОТ-ПЦР. Эту реакцию осуществляли в термоячейке LightCycler 480 в стандартных условиях в формате SybrGreen при температурах гибридизации, определенных для каждого конкретного праймера. При этом, могут быть использованы, если это возможно, праймеры, охватывающие экзон.
Список используемых праймеров приводится в таблице 1.
Последовательности праймеров для проведения экспериментов с помощью количественной ОТ-ПЦР. В скобках приводятся соответствующие идентификационные номера последовательностей (SEQ-ID). Последовательности всех праймеров представлены в 5’-3’-направлении.
(SEQ-ID 01)
(SEQ-ID 02)
(SEQ-ID 03)
(SEQ-ID 04)
(SEQ-ID 05)
(SEQ-ID 06)
(SEQ-ID 07)
(SEQ-ID 08)
(SEQ-ID 09)
(SEQ-ID 10)
(SEQ-ID 11)
(SEQ-ID 12)
(SEQ-ID 13)
(SEQ-ID 14)
(SEQ-ID 15)
(SEQ-ID 16)
(SEQ-ID 17)
(SEQ-ID 18)
(SEQ-ID 19)
(SEQ-ID 20)
(SEQ-ID 21)
(SEQ-ID 22)
Специфичность подтверждали с помощью анализа кривой плавления и последующего гель-электрофореза. Для каждой ПЦР определяли эффективность ПЦР и величину Cq с помощью программы LinRegPCR, и эти данные использовали для последующих вычислений. B2M (β2-микроглобулин) идентифицировали из множества известных генов, подходящих для оценки эффективности в различных условиях. Все полученные данные представляют собой результаты по отношению к соответствующим результатам, полученным в стандартных условиях, при которых был введен только растворитель в определенные периоды времени (то есть, через 2 дня, 7 дней или 14 дней). На фигурах 5A-5I также проиллюстрирована относительная экспрессия генов (по отношению к экспрессии в стандартных условиях). На этих фигурах, 2-дневная обработка показана светло-серым, 7-дневная обработка показана темно-серым, а 14-дневная обработка показана черным. Каждая измеряемая величина, представленная на фигурах 5A-5I, означает среднюю величину для 3 независимых биологических образцов.
На фигуре 5A показана относительная экспрессия гена нейротропина BDNF (нейротропного фактора головного мозга) после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии BDNF после обработки 30 мкМ 6F9MβC или 9MβC было обнаружено, что уже в этой концентрации, экспрессия, индуцированная соединением 6F9MβC, приблизительно в два раза превышала экспрессию, индуцированную соединением 9MβC.
На фигуре 5В показана относительная экспрессия гена Lif (фактора ингибирования лейкоза), который стимулирует дифференцировку клеток и ингибирует их пролиферацию через 2 дня, 7 дней и 14 дней после обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии Lif после обработки 30 мкМ 6F9MβC или 9MβC было обнаружено, что уже в этой концентрации, экспрессия Lif, индуцированная соединением 6F9MβC, после 2-дневной обработки, приблизительно в три раза превышала экспрессию, индуцированную соединением 9MβC. Кроме того, после 14-дневной обработки соединением 6F9MβC, экспрессия Lif приблизительно в два раза превышала экспрессию, индуцированную соединением 9MβC. И лишь после 7-дневной обработки соединением 6F9MβC, экспрессия Lif была несколько ниже, чем экспрессия Lif, индуцированная соединением 9MβC. Также наблюдалась высокая экспрессия при низких концентрациях 6F9MβC.
На фигуре 5С показана относительная экспрессия гена нейротропина NT3 (нейротропина 3) после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии NT3 после обработки 30 мкМ 6F9MβC или 9MβC было обнаружено, что уже в этой концентрации, экспрессия NT3, индуцированная соединением 6F9MβC, после 14-дневной обработки, приблизительно в 3,5 раза превышала экспрессию, индуцированную соединением 9MβC. Также наблюдалась высокая экспрессия при низких концентрациях 6F9MβC, а особенно после 7-дневной обработки только 10 мкМ соединения 6F9MβC.
На фигуре 5D показана относительная экспрессия гена Id2 (ингибитора дифференцировки 2), который ингибирует дифференцировку клеток и стимулирует их пролиферацию. Было также описано, что у мышей, у которых этот ген был дезактивирован, наблюдался феномен нейродегенерации. Была также показана относительная экспрессия гена Id2 после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии Id3 после обработки 30 мкМ 6F9MβC или 9MβC было обнаружено, что уже в этой концентрации, экспрессия Id2, индуцированная соединением 6F9MβC, приблизительно в 2-3,5 раза превышала экспрессию, индуцированную соединением 9MβC. Также наблюдалась высокая экспрессия Id2 при низких концентрациях 6F9MβC.
На фигуре 5Е показана относительная экспрессия гена нейропротектора BTG2 (гена транслокации В-клеток 2) после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии BTG2 после обработки 30 мкМ 6F9MβC или 9MβC было обнаружено, что уже в этой концентрации, экспрессия BTG2, индуцированная соединением 6F9MβC, приблизительно в 1,25-2,7 раза превышала экспрессию, индуцированную соединением 9MβC. Также примечательно, что уже при концентрации 10 мкМ 6F9MβC наблюдалась экспрессия BTG2, сравнимая с экспрессией при самой высокой концентрации 9MβC (за исключением экспрессии, наблюдаемой после 2-дневной обработки).
На фигуре 5F показана относительная экспрессия гена нейропротектора Cbln (белка-предшественника церебеллина 1) после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии Cbln после обработки 30 мкМ 6F9MβC или 9MβC было обнаружено, что уже в этой концентрации, экспрессия Cbln, индуцированная соединением 6F9MβC, приблизительно в 1,5 раза превышала экспрессию, индуцированную соединением 9MβC (за исключением экспрессии, наблюдаемой после 2-дневной обработки). И уже даже при концентрации 20 мкм 6F9MβC наблюдался более высокий уровень экспрессии Cbln.
На фигуре 5G показана относительная экспрессия генов Bac и Bcl2, которые являются маркерами апопотоза, после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). Чем меньше отношение Bax/Bcl2, тем ниже уровень апоптоза. При сравнении отношений Bax/Bcl2 после обработки 30 мкМ 6F9MβC или 9MβC, уровень экспрессии после обработки соединением 6F9MβC был значительно ниже, чем после обработки соединением 9MβC (за исключением экспрессии, наблюдаемой после 2-дневной обработки). Также примечательно, что низкое отношение Bax/Bcl2 наблюдалось при низких концентрациях 6F9MβC.
На фигуре 5H показана относительная экспрессия гена DRD2S (короткоцепочечного варианта рецептора допамина подтипа 2) после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии DRD2S после обработки 30 мкМ 6F9MβC или 9MβC было обнаружено, что в этой концентрации, экспрессия DRD2S, индуцированная соединением 6F9MβC после 2-дневной и 14-дневной обработки, превышала экспрессию, а после 7-дневной обработки, была ниже, чем экспрессия, индуцированная соединением 9MβC. Очевидно, что при низких концентрациях 6F9MβC, экспрессия DRD2S после 7-дневной обработки была сравнима с экспрессией, индуцированной соединением 9MβC.
На фигуре 5I показана относительная экспрессия гена фактора DKK1 (белка 1, родственного белку Диккопфа 1), который имеет важное значение для дифференцировки нервных клеток и, в соответствии с современными представлениями, играет определенную роль в поражении сенсорных клеток, после 2-дневной, 7-дневной и 14-дневной обработки соединением 6F9MβC (10 мкМ, 20 мкМ и 30 мкМ) или 9MβC (30 мкМ, 50 мкМ и 70 мкМ). При сравнении экспрессии DKK1 после обработки 30 мкМ 6F9MβC или 9MβC, в частности, при более кратковременной обработке (2-дневной и 7-дневной), было обнаружено, что экспрессия DKK1, индуцированная соединением 6F9MβC, в 1,4-2,7 раза превышала экспрессию, индуцированную соединением 9MβC. После 14-дневной обработки, эти величины были сравнимыми, а после 7-дневной обработки, уровень экспрессии был ниже, чем уровень экспрессии, индуцированный соединением 9MβC. Также примечательно, что уже при концентрации 10 мкМ 6F9MβC, уровень экспрессии DKK1 был сравним с уровнем экспрессии, наблюдаемым при самой высокой концентрации 9MβC, или даже превышал этот уровень.
В целом было показано, что 6-фтор-9-метил-β-карболин согласно изобретению, в отличие от известного 9-метил-β-карболина, оказывает благоприятное действие почти на все оцениваемые клеточные факторы, которые прямо или опосредованно влияют на дифференцировку и пролиферацию клеток и, тем самым, на регенерацию сенсорных тканей после травм. Стоит особенно подчеркнуть, что факторы BDNF и Lif принадлежат к числу наиболее важных факторов, участвующих в процессах репарации клеток после травм внутреннего уха. Следовательно, 6-фтор-9-метил-β-карболин согласно изобретению, в отличие от известных метил-β-карболинов, могут быть успешно применены для лечения заболеваний и/или поражений внутреннего уха, и при этом, могут быть введены в более низких концентрациях.
Пример 5: Эксперименты II, проводимые с помощью количественной ОТ-ПЦР
По аналогии с экспериментами, описанными в примере 4, эксперименты с помощью ОТ-ПЦР также проводили с использованием активного агента согласно изобретению, а именно, 7-фтор-9-метил-β-карболина (7F9MβC), и с использованием некоторых важных клеточных факторов. Процедура проведения эксперимента была идентична процедуре проведения экспериментов с использованием 6-фтор-9-метил-β-карболина и 9-метил-β-карболина. В этом эксперименте, в среду для культивирования добавляли те же самые конечные концентрации (как и для 6F9MβC), составляющие 30 мкМ, 50 мкМ и 70 мкМ 7F9MβC. Были протестированы следующие факторы: BDNF (нейротропный фактор головного мозга), Lif (фактор ингибирования лейкоза), DRD2S (короткоцепочечный вариант рецептора допамина подтипа 2) и DKK1 (белок 1, родственный белку Диккопфа 1). В этом эксперименте были использованы те же самые праймеры, которые были уже перечислены для соответствующих генов-мишеней в примере 4 (таблица 1). Как уже указывалось выше, факторы BDNF и Lif принадлежат к числу наиболее важных факторов, участвующих в процессах репарации клеток после травм внутреннего уха.
На фигуре 6A показана относительная экспрессия гена нейротропина BDNF (нейротропного фактора головного мозга) после 2-дневной, 7-дневной и 14-дневной обработки соединением 7F9MβC (10 мкМ, 20 мкМ и 30 мкМ). При сравнении экспрессии BDNF после обработки 30 мкМ 7F9MβC или 9MβC (фиг. 5А), было обнаружено, что после 2-дневной обработки, экспрессия BDNF, индуцированная соединением 7F9MβC, приблизительно в три раза превышала экспрессию, индуцированную соединением 9MβC. При более длительной обработке, эти величины были сравнимыми.
На фигуре 6В показана относительная экспрессия гена Lif (фактора ингибирования лейкоза), который стимулирует дифференцировку клеток и ингибирует их пролиферацию, после 2-дневной, 7-дневной и 14-дневной обработки соединением 7F9MβC (10 мкМ, 20 мкМ и 30 мкМ). При сравнении экспрессии Lif после обработки 30 мкМ 7F9MβC и 30 мкМ 9MβC (фиг.5В) было обнаружено, что после 2-дневной обработки, экспрессия Lif, индуцированная соединением 7F9MβC, приблизительно в три раза превышала экспрессию, индуцированную соединением 9MβC. После 7-дневной обработки, экспрессия Lif, индуцированная соединением 7F9MβC, была более низкой, а после 14-дневной обработки, эти величины были сравнимыми. Также примечательно, что высокая экспрессия Lif наблюдалась после 2-дневной обработки 20 мкМ 7F9MβC.
На фигуре 6С показана относительная экспрессия гена DRD2S (короткоцепочечного варианта рецептора допамина подтипа 2) после 2-дневной, 7-дневной и 14-дневной обработки соединением 7F9MβC (10 мкМ, 20 мкМ и 30 мкМ). При сравнении экспрессии DRD2S после обработки 30 мкМ 7F9MβC и 30 мкМ 9MβC (фиг.5Н) было обнаружено, что после 2-дневной обработки, экспрессия DRD2S, индуцированная соединением 7F9MβC, почти в два раза превышала экспрессию, индуцированную соединением 9MβC. После 7-дневной обработки, эти величины были сравнимыми, а после 14-дневной обработки, экспрессия DRD2S, индуцированная соединением 7F9MβC, была немного ниже, чем экспрессия, индуцированная соединением 9MβC.
На фигуре 6D показана относительная экспрессия гена фактора DKK1 (белка 1, родственного белку Диккопфа 1), который имеет важное значение для дифференцировки нервных клеток и, в соответствии с современными представлениями, играет определенную роль в поражении сенсорных клеток, после 2-дневной, 7-дневной и 14-дневной обработки соединением 7F9MβC (10 мкМ, 20 мкМ и 30 мкМ). При сравнении экспрессии DKK1 после обработки 30 мкМ 7F9MβC и 30 мкМ 9MβC (фиг.5I) было обнаружено, что после 2-дневной обработки, экспрессия DKK1, индуцированная соединением 7F9MβC, в 1,4 раза превышала экспрессию, индуцированную соединением 9MβC. После 7-дневной обработки, эти величины были сравнимыми, а после 14-дневной обработки, экспрессия DKK1, индуцированная соединением 7F9MβC, в 2,2 раза превышала экспрессию, индуцированную соединением 9MβC.
В целом было показано, что 7-фтор-9-метил-β-карболин, в отличие от известного 9-метил-β-карболина, дает, в частности, больший эффект за короткое время обработки. Одним из возможных объяснений этого феномена является то, что 7-фтор-9-метил-β-карболин является более липофильным, чем 9-метил-β-карболин, и то, что он быстрее проникает в клетки, а поэтому быстрее достигает более высоких концентраций в клетке. С терапевтической точки зрения, такое соединение имеет явные преимущества, поскольку оно дает благоприятный эффект при лечении пациента за более короткий промежуток времени. Поэтому, 7-фтор-9-метил-β-карболин, по сравнению с известным 9-метил-β-карболином, является более эффективным для лечения острых заболеваний внутреннего уха, таких как, например, акустическая травма и потеря слуха.
Пример 6: Иммуногистохимические эксперименты
В данном примере описан гистологический анализ, который был проведен для того, чтобы определить, может ли введение 9-метил-β-карболина (9MβC) или 6-фтор-9-метил-β-карболина (6F9MβC) морским свинкам предотвращать индуцированную акустической травмой гибель наружных волосковых клеток (OHC) во внутреннем ухе. В связи с этим, следует отметить, что внутренние волосковые клетки (IHC) являются менее восприимчивыми к любой травме.
Для индуцирования акустической травмы, морских свинок анестезировали 60 мг/кг кетамина и 8 мг/кг ксиламина. Затем, в уши вводили мазь Бепатен (Bayer), и животных помещали в звуконепроницаемую камеру. Непосредственно над головой животного устанавливали градуированный микрофон, который издавал звуки на полуоктавной полосе, центрированной по частоте приблизительно 8 кГц, с громкостью в 110 дБ и продолжительностью в 30 минут.
6-фтор-9-метил-β-карболин и 9-метил-β-карболин, соответственно, упакованные в гидрогеле (18% полоксамера 407 и 0,6% альгината), приготавливали в свежем виде для каждого эксперимента, и перед введением, хранили в холодильнике при +4°C.
Термочувствительную жидкую смесь вводили в таком виде шприцем Гамильтона непосредственно в переднюю часть мембраны окна улитки среднего уха (10 мкл). Первую дозу 6-фтор-9-метил-β-карболина (например, 0,07 мг) вводили через один час после акустической травмы в концентрации 0,007 мг/мкл, а вторую дозу 6-фтор-9-метил-β-карболин (0,035 мг в объеме 5 мкл) вводили на день 3. При этом, обрабатывали только одно ухо животного, а другое ухо служило в качестве внутригруппового контроля. Используемый здесь контроль обозначен «contr». В сравнительных экспериментах было обнаружено, что результаты введения только активного агента-носителя (гидрогеля) не отличаются от результатов, полученных для абсолютно необработанного уха. Каждый активный агент (включая контроль) вводили четырем морским свинкам, а затем проводили исследования.
На 14-й день после акустической травмы, область уха разрезали так, чтобы в него входила улитка. Препарат помещали в охлажденный льдом 4% параформальдегид (PFA) на 24 часа и хранили при +4°C. После PFA-фиксации, препарат два раза промывали забуференным фосфатом раствором хлорида натрия (PBS), а затем этот препарат помещали в 10% этилендиаминтетрауксусную кислоту (EDTA) для декальцификации. По меньшей мере через 48 часов, препарат два раза промывали PBS и извлекали улитку. Затем, из улитки извлекали целый кортиев орган, содержащий сенсорные клетки, и этот орган разрезали на четыре сегмента одинаковой длины. Каждый сегмент соответствовал кортиеву органу, составляющему ¾ от завитка улитки. Таким образом, поражение, индуцированное звуком, может быть локализовано и количественно оценено. Срезы помещали на 10 минут в PBS, содержащий 2% альбумин бычьей сыворотки (BSA) и Alexa Fluor® 488-меченный фаллоидин (Invitrogen, catalogue #A12379) в разведении 1:40. После этого, срезы три раза промывали PBS в течение 10 минут и помещали плашмя на предметное стекло. На срезы добавляли каплю Pro Long DAPI, содержащую фиксирующую среду (Invitrogen, cat #P36935), а затем эти срезы покрывали покровным стеклом. После этого, препарат фиксировали лаком для ногтей. Изображения срезов получали под флуоресцентным микроскопом с 40-кратным увеличением (Keyence). На фигурах 7 и 8 представлены репрезентативные результаты оценок для каждой из четырех морских свинок.
В экспериментах с необработанным контролем (см. фиг. 7a и фиг. 8A) было обнаружено, что акустическая травма вызывала интенсивную гибель наружных волосковых клеток. Такая гибель может быть предотвращена путем одного интратимпанального введения лишь 0,105 мг 6-фтор-9-метил-β-карболина (см. фиг. 7B). После введения 9-метил-β-карболина может быть предотвращена гибель наружных волосковых клеток (см. фиг. 8B), но в этом случае, в отличие от введения 6-фтор-9-метил-β-карболина, может потребоваться введение значительно более высокой дозы (0,2 мг 9-метил-β-карболина). Следовательно, 6-фтор-9-метил-β-карболин согласно изобретению является не только подходящим для лечения потери слуха, но также и более эффективным, чем уже известный 9-метил-β-карболин.
Пример 7: Вызванные акустические потенциалы
Описанное ниже влияние 6-фтор-9-метил-β-карболина (6F9MβC), а также 9-метил-β-карболина (9MβC) на изменение слухового порога, индуцированного акустической травмой, исследовали на морских свинках, используемых в качестве модели.
Для индуцирования акустической травмы, морских свинок анестезировали 60 мг/кг кетамина и 8 мг/кг ксиламина. Затем, в уши вводили мазь Бепантен (Bayer), и животных помещали в звуконепроницаемую камеру. Непосредственно над головой животного устанавливали градуированный микрофон, который издавал звуки на полуоктавной полосе, центрированной по частоте приблизительно 8 кГц, с громкостью в 110 дБ и продолжительностью в 30 минут.
В качестве параметра для оценки слухового порога у морских свинок измеряли вызванные акустические потенциалы. Следовательно, электрофизиологическая активность нервных клеток в стволе головного мозга, которые передают импульсы от внутреннего уха, была индуцирована после звукового воздействия на ухо с частотой 8, 11,3, 16, 22,6 и 32 кГц. Громкость звука повышали от 0 дБ до 90 дБ с шагом в 5 дБ.
Измерение проводили за 3 дня до индуцирования акустической травмы (D-3) и через 30 минут после акустической травмы (D0), а также через 14 дней после акустической травмы (D14).
При этом, одно ухо животного не обрабатывали и использовали в качестве внутригруппового контроля (используемый здесь контроль обозначен «contr»), а другое ухо обрабатывали 6-фтор-9-метил-β-карболином. Затем, через один час после акустической травмы интратимпанально вводили дозу 0,12 мг 6-фтор-9-метил-β-карболина (в гидрогеле, используемом в качестве носителя). Через 3 дня после акустической травмы осуществляли дополнительное интратимпанальное введение 0,06 мг 6-фтор-9-метил-β-карболина. Измерение проводили на четырех морских свинках (n=4).
В сравнительных экспериментах было обнаружено, что результаты введения только активного агента-носителя (гидрогеля) не отличаются от результатов, полученных для абсолютно необработанного уха.
Затем, остаточный сдвиг слухового порога (также называемого перманентным сдвигом слухового порога) определяли исходя из полученных величин, измеренных до акустической травмы (D-3) и через 14 дней после акустической травмы (D14). Исходя из величин, измеренных сразу после акустической травмы (D0) и через 14 дней после акустической травмы (D14), также определяли степень восстановления после травмы (D0-D14).
Если принять во внимание то, что через 14 дней все еще наблюдалось нарушение слуха (см. фиг. 9), то можно сказать, что введение 6-фтор-9-метил-β-карболина (всего 0,18 мг) приводит к значительному снижению слухового порога по сравнению с необработанным контролем. В частности, в случае звукового воздействия на частоте 11,3 и 16 кГц, соответственно, обработка 6-фтор-9-метил-β-карболином согласно изобретению приводила к снижению слухового порога приблизительно на 20 дБ или 30 дБ.
Что касается восстановления слуха после акустической травмы (см. фиг. 10), то такое восстановление, по сравнению с необработанным контролем, может быть значительно более эффективным после введения 6-фтор-9-метил-β-карболина (всего 0,18 мг). Таким образом, в случае звукового воздействия на частоте 8, 11,3 и 16 кГц, соответственно, с громкостью 5 дБ, 25 дБ или 20 дБ, обработка соединением 6-фтор-9-метил-β-карболина согласно изобретению приводила к более эффективному восстановлению слуха, чем это наблюдалось в случае необработанного контроля.
Аналогично вышеописанным экспериментам, проводимым с использованием 6-фтор-9-метил-β-карболина, также проводили соответствующие эксперименты с использованием 9-метил-β-карболина. Процедуры этих экспериментов были почти идентичны, за исключением того, что в последнем случае, вместо 6-фтор-9-метил-β-карболина использовали 9-метил-β-карболин. Используемая здесь общая доза 9-метил-β-карболина составляла 0,2 мг и 0,35 мг на ухо, соответственно.
Уже известный специалистам 9-метил-β-карболин также стимулировал заметное восстановление слуха, в отличие от необработанного контроля (см. фиг. 11 и 12). Было показано, что, по сравнению с 6-фтор-9-метил-β-карболином, уровень восстановления повышался приблизительно с 5 дБ и до максимум 10 дБ в случае небольшого повышения дозы на 0,2 мг (см. фиг. 11). Кроме того, последующее повышение дозы 9-метил-β-карболина на 0,35 мг (в два раза превышающей дозу 6-фтор-9-метил-β-карболина) давало улучшение приблизительно лишь на 10 дБ (см. Фиг. 12).
Пример 8: Разложение соединений в печени с образованием токсических продуктов разложения
Ниже описаны эксперименты, проводимые для того, чтобы определить, может ли 6-фтор-9-метил-β-карболин (6F9MβC) согласно изобретению подвергаться метаболизму в печени с образованием известных токсических продуктов разложения.
Что касается β-карболинов, то давно известно, что они превращаются в метилированные катионы β-карболиния посредством реакции, катализируемой N-метилтрансферазой. Эти соединения, наряду с 1-метил-4-фенилпиридинием (MPP+, также известным как нейротоксин Паркинсона), обладают некоторыми общими токсикологическими свойствами, поскольку они могут, среди прочих свойств, ингибировать митохондриальное дыхание и обладают нейротоксическим действием. Особенно токсичными являются диметилированные катионы β-карболиния, то есть, катионы 2,9-диметил-β-карболиния. Эти катионы образуются в результате последовательного метилирования в положениях 2 и 9. Таким образом, были проведены эксперименты для того, чтобы определить, может ли 6-фтор-9-метил-β-карболин (6F9MβC) согласно изобретению подвергаться метаболизму в печени с образовавнием соответствующих токсинов, таких как катион 6-фтор-2,9-диметил-β-карболиния (образующийся непосредственно из 6F9MβC) и катион 2,9-диметил-β-карболиния (образующийся из 9MβC), соответственно.
Для идентификации этих веществ с помощью ВЭЖХ, катион 6-фтор-2,9-диметил-β-карболиния (6F29DMβC), а также катион 2,9-диметил-β-карболиния (29DMβC) синтезировали in situ, и их соответствующее время удерживания определяли путем стандартных измерений с помощью ВЭЖХ. Кроме того, осуществляли стандартные измерения для чистого 6-фтор-9-метил-β-карболина (6F9MβC).
Для имитации процесса разложения соединений в печени, 6-фтор-9-метил-β-карболин (6F9MβC) в различных концентрациях (1 мкМ, 10 мкМ и 100 мкМ) инкубировали с гомогенизованной крысиной печенью в течение одного часа в физиологических условиях (при 37°C в физиологическом забуференном фосфатом растворе хлорида натрия, PBS). Затем, отфильтрованный экстракт оценивали с помощью ВЭЖХ.
Характеризацию каждого вещества осуществляли с помощью выкокоэффективной жидкостной хроматографией (ВЭЖХ, иногда также называемой жидкостной хроматографии высокого давления). Для ВЭЖХ, элюент представлял собой 45%-90% ацетонитрил и 55% ацетат аммония (40 мМ, pH<5). Скорость потока составляла 0,4 мл/мин, а объем впрыска составлял 10 мкл. Если сигнал был слишком сильным, то каждый образец разбавляли 60% метанолом. Так, например, образец гомогената печени разводили 1:40, а затем проводили измерения в динамическом диапазоне аналитического метода.
Стандартные измерения показали, что для неочищенного 6-фтор-9-метил-β-карболина (6F9MβC), время удерживания составляло 19,0 минуты (см. фиг. 13A), тогда как время удерживания для катиона 6-фтор-2,9-диметил-β-карболиния (6F29DMβC) составляло 10,1 минуты (см. фиг. 13C), а для катиона 2,9-диметил-β-карболиния (29DMβC), время удерживания составляло 9,1 минуты (см. фиг. 13D). Все три контрольных образца имели разное время удерживания. 6-фтор-9-метил-β-карболин (также обозначаемый 6F9MβC) (100 мкМ), инкубированный с гомогенатами крысиной печени, давал пик через 19,0 минуты, а катион 6-фтор-2,9-диметил-β-карболиния (6F29DMβC) и катион 2,9-диметил-β-карболиния (29DMβC) не давали пиков. Кроме того, протестированный 6-фтор-9-метил-β-карболин (1 мкМ и 10 мкМ) в более низких концентрациях давал идентичные результаты.
Отсюда можно сделать вывод, что 6-фтор-9-метил-β-карболин согласно изобретению, в данных условиях не подвергался метаболизму с образованием известных токсических продуктов разложения.
Ниже описан синтез известных катионов 6-фтор-2,9-диметил-β-карболиния (6F29DMβC) и 2,9-диметил-β-карболиния (29DMβC).
Для синтеза 6F29DMβC, к раствору 50 мг (то есть, 0,25 ммоль) 6-фтор-9-метил-β-карболина (свободного основания) в 3 мл ацетонитрила добавляли 200 мг (то есть, 1,4 ммоль) метилиодида. Реакционную смесь перемешивали в атмосфере азота в течение 24 часов при комнатной температуре. Затем растворители удаляли в потоке азота. Желтый флуоресцентный остаток перекристаллизовывали из небольшого количества ацетонитрила. Выход: 53 мг (то есть, 15 ммоль) 60% продукта.
Для синтеза 29DMβC, к раствору 50 мг (то есть, 0,27 ммоль) 9-метил-β-карболина (свободного основания) в 3 мл ацетонитрила добавляли 200 мг (то есть, 1,4 ммоль) метилиодида. Реакционную смесь перемешивали в атмосфере азота в течение 24 часов при комнатной температуре. Затем растворители удаляли в потоке азота. Желтый флуоресцентный остаток перекристаллизовывали из небольшого количества ацетонитрила, отфильтровывали и сушили в вакууме. Выход: 43 мг (то есть, 13 ммоль) 48% продукта.
Пример 9: 6-фтор-9-метил-β-карболин повышает способность к обучению и улучшает память
Механизмы, лежащие в основе способности к обучению и улучшения памяти, являются очень сложными. Они могут рассматриваться на молекулярном и на клеточном уровне, на уровне биологической системы и с точки зрения психологии. Одним из ключевых процессов формирования памяти на молекулярном уровне является активация белков, связывающихся с cAMP-отвечающим элементом (CREB). Это приводит к образованию новых синапсов, то есть, к процессу, ассоциированному с формированием памяти. Такой процесс регулируется многими факторами. Позитивная амплификация индуцируется BDNF головного мозга и его рецептором TRKB. Поэтому, эксперименты с использованием 6-фтор-9-метил-β-карболина (6F9MβC) согласно изобретению должны быть проведены на клеточном уровне.
Проведенные авторами настоящего изобретения эксперименты на клеточном уровне показали, что 6-фтор-9-метил-β-карболин (6F9MβC) согласно изобретению способствует увеличению концентрации CREB в 8 раз и увеличению концентрации BDNF почти в три раза. Полученные данные позволяют предположить, что 6F9MβC повышает способность к обучению и улучшает память. Эта гипотеза была подтверждена в следующем эксперименте.
Влияние 6F9MβC на способность к обучению оценивали по поведению животных в лабиринте с восьмью коридорами. В эксперименте в ежедневных сеансах, проводимых в течение 10 дней, были использованы 5-месячные самцы крыс. Затем, этих крыс выпускали в лабиринт во время множества сеансов, проводимых в течение 2 дней, и обучали так, что в случае успешного выполнения задания, они получали корм в качестве вознаграждения. Затем, количество корма уменьшали до тех пор, пока масса тела не снижалась на 10% от первоначальной массы. После этого, на выходе каждого из 8 коридоров лабиринта лежал корм и была установлена камера, которая фиксировала каждое перемещение животного. В первый день проведения эксперимента, крыс помещали на платформу, находящуюся в центре лабиринта, без предварительной инъекции. На следующий день, экспериментатор внутрибрюшинно вводил крысам 6-фтор-9-метил-β-карболина (6F9MβC) (свободного основания), растворенного в физиологическом растворе хлорида натрия, в количестве 2 мг/кг массы тела. Через 2 часа животных помещали на платформу в центре лабиринта, откуда они имели доступ ко всем коридорам. Эту процедуру повторяли ежедневно до тех пор, пока животное не сделает хотя бы одну ошибку, то есть, пока оно не выйдет в коридор, в который оно уже попадало ранее в соответствующем сеансе. По окончании сеансов, крысы должны пройти все 8 коридоров.
Было проведено исследование 12 крыс, которым вводили 6F9MβC, и 12 крыс контрольной группы, которым вводили только физиологический раствор хлорида натрия. Животные экспериментальной группы (получавшие 6F9MβC) достигали нужных показателей через 6 дней, а животные контрольной группы через 14 дней. Это различие было подтверждено с помощью анализа ANOVA для повторных измерений и было значимым (p<0,01). Полученные результаты со всей очевидностью показали, что 6F9MβC ускоряет процессы обучения и улучшает память. Авторы также подтвердили свои гипотезы.
Было продемонстрировано, что активный агент 6F9MβC является не только эффективным для лечения заболеваний внутреннего уха, но также оказывает благоприятный эффект на такие сложные процессы, как способность к обучению и память.
Библиография:
1) Application of high-performance liquid chromatography based measurements of lipophilicity to model biological distribution. Valkó K Journal of Chromatography A 2004; 1037 (1-2): 299-310.
2) The levels of norharman are high enough after smoking to affect monoamineoxidase B in platelets. Rommelspacher et al., Eu J Pharmacol 2002; 441 (1-2): 115-125.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛЬНАЯ ПОЛИМОРФНАЯ ФОРМА 6-ФТОР-9-МЕТИЛ-9H-БЕТА-КАРБОЛИНА И ЕЕ ПРИМЕНЕНИЯ | 2020 |
|
RU2806322C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ШУМА В УШАХ, ИНДУЦИРОВАННОГО УЛИТКОВОЙ ЭКСИТОТОКСИЧНОСТЬЮ | 2005 |
|
RU2380094C2 |
| БЕТА-КАРБОЛИНОВЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБЫ СВЯЗЫВАНИЯ, ДОСТИЖЕНИЯ АГОНИСТИЧЕСКОГО/АНТАГОНИСТИЧЕСКОГО ЭФФЕКТА | 1999 |
|
RU2233841C2 |
| ПРОИЗВОДНЫЕ БЕТА-КАРБОЛИНА, ОБЛАДАЮЩИЕ ДЕЙСТВИЕМ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), СПОСОБ ЕЕ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ ДЕЙСТВИЯ ФОСФОДИЭСТЕРАЗЫ (ВАРИАНТЫ) И СПОСОБ УВЕЛИЧЕНИЯ КОНЦЕНТРАЦИИ ЦГМФ | 2001 |
|
RU2271358C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОПИРИДО[3,4-b]ИНДОЛА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ РАКА | 2014 |
|
RU2664109C2 |
| Способы лечения кохлеарной синаптопатии | 2017 |
|
RU2757276C2 |
| НОВЫЕ СОЕДИНЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ОТКРЫВАТЕЛЕЙ КАЛИЕВЫХ КАНАЛОВ | 2018 |
|
RU2779131C2 |
| НОВЫЕ СОЕДИНЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ОТКРЫВАТЕЛЕЙ КАЛИЕВЫХ КАНАЛОВ | 2018 |
|
RU2779111C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО ФЕНОТИАЗИНА ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ПОТЕРИ СЛУХА | 2005 |
|
RU2377992C2 |
| МОДУЛИРУЮЩИЕ АПОПТОЗ КОМПОЗИЦИИ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ УХА | 2009 |
|
RU2493828C2 |





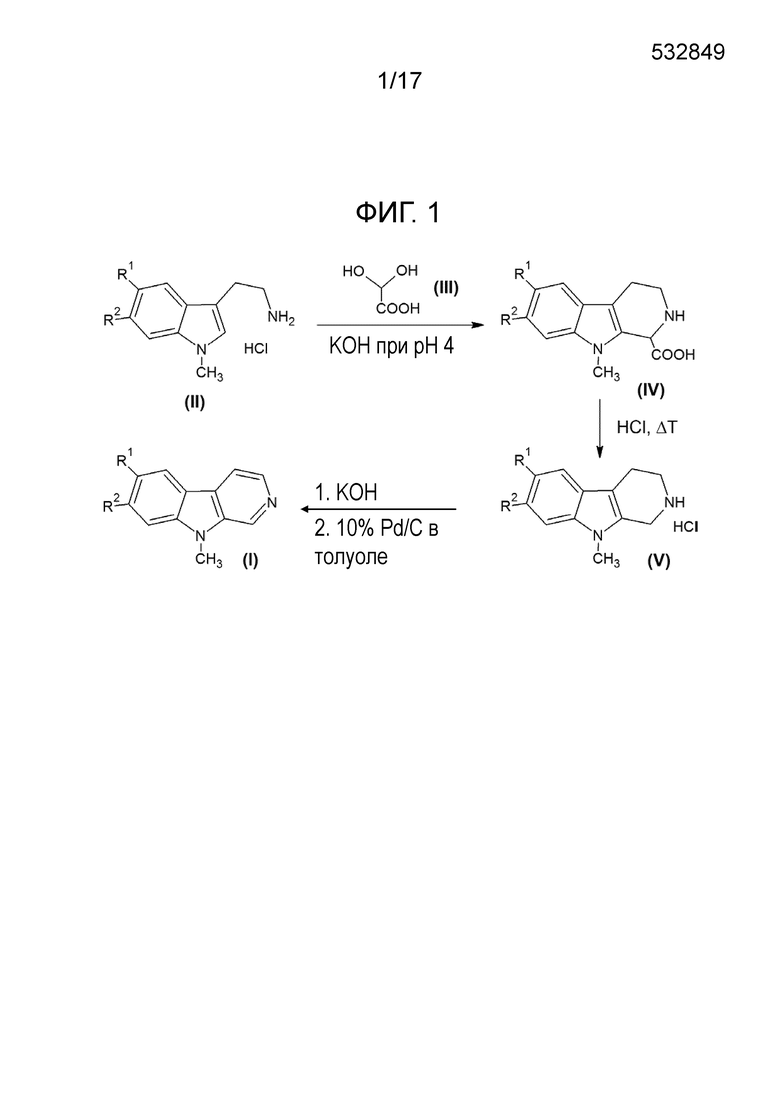
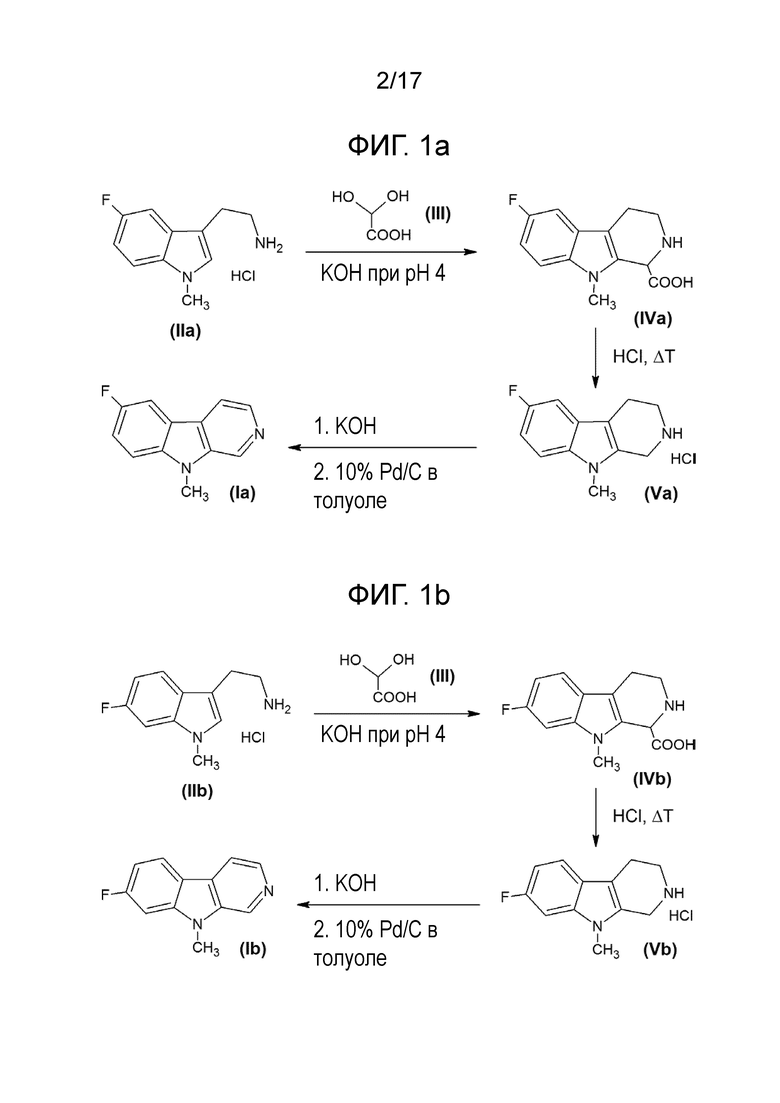


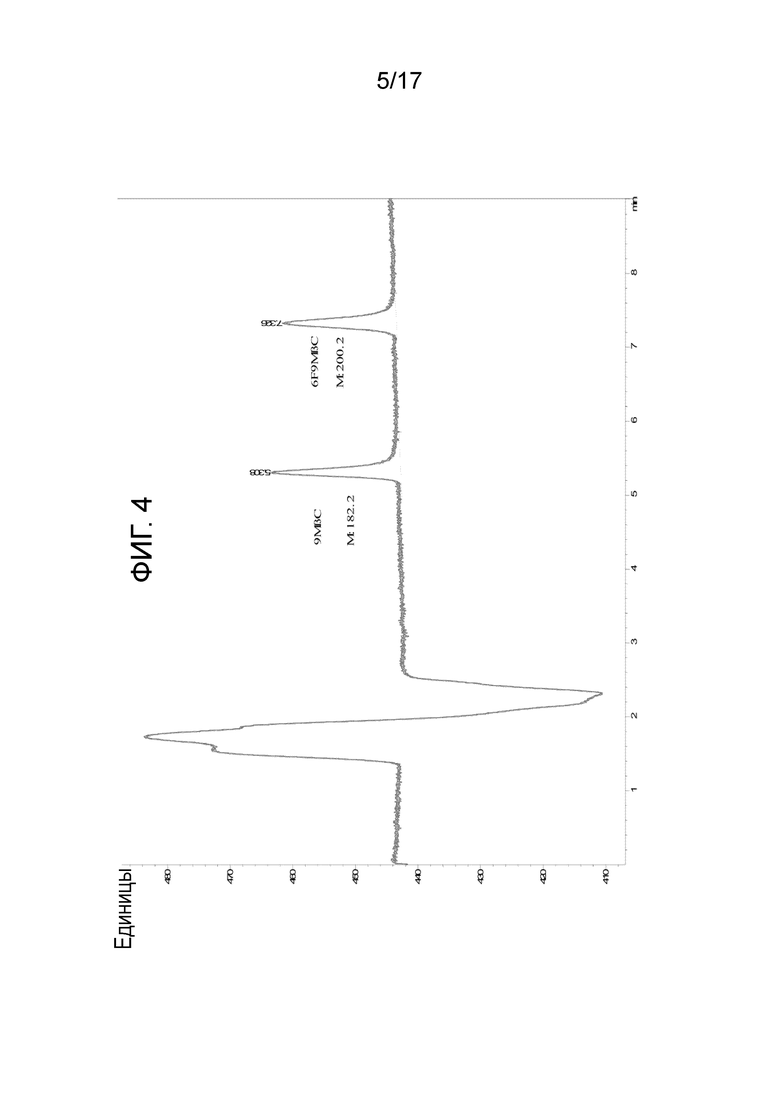
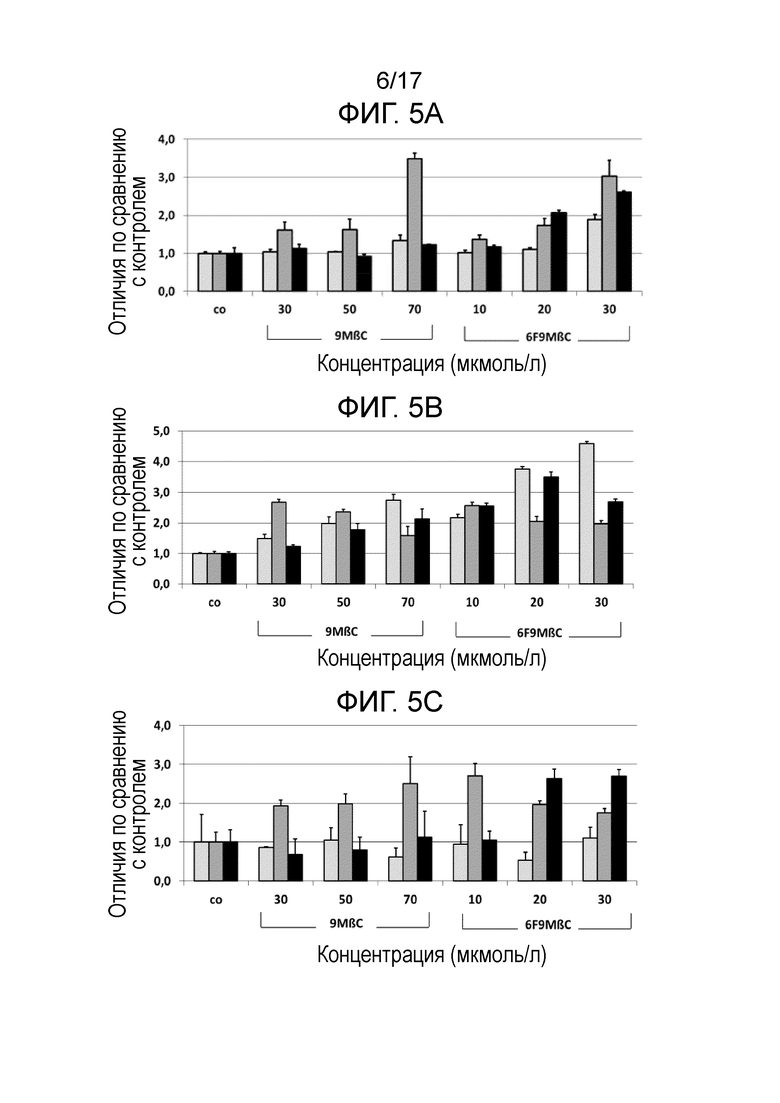
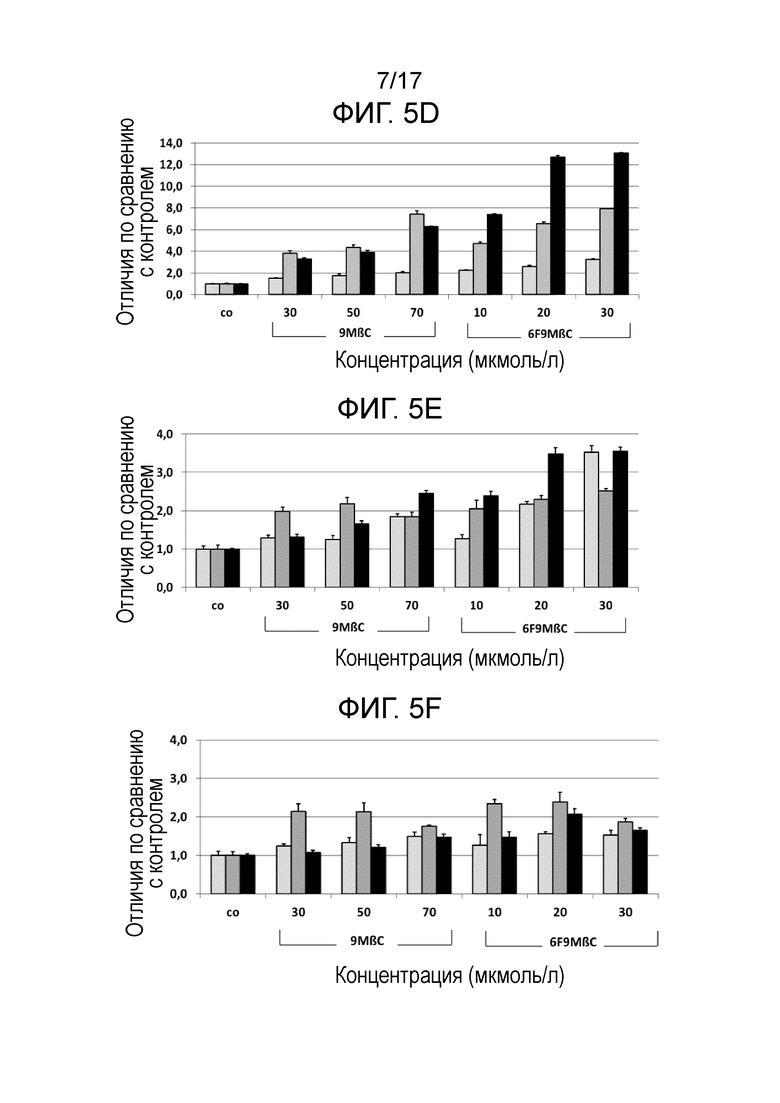
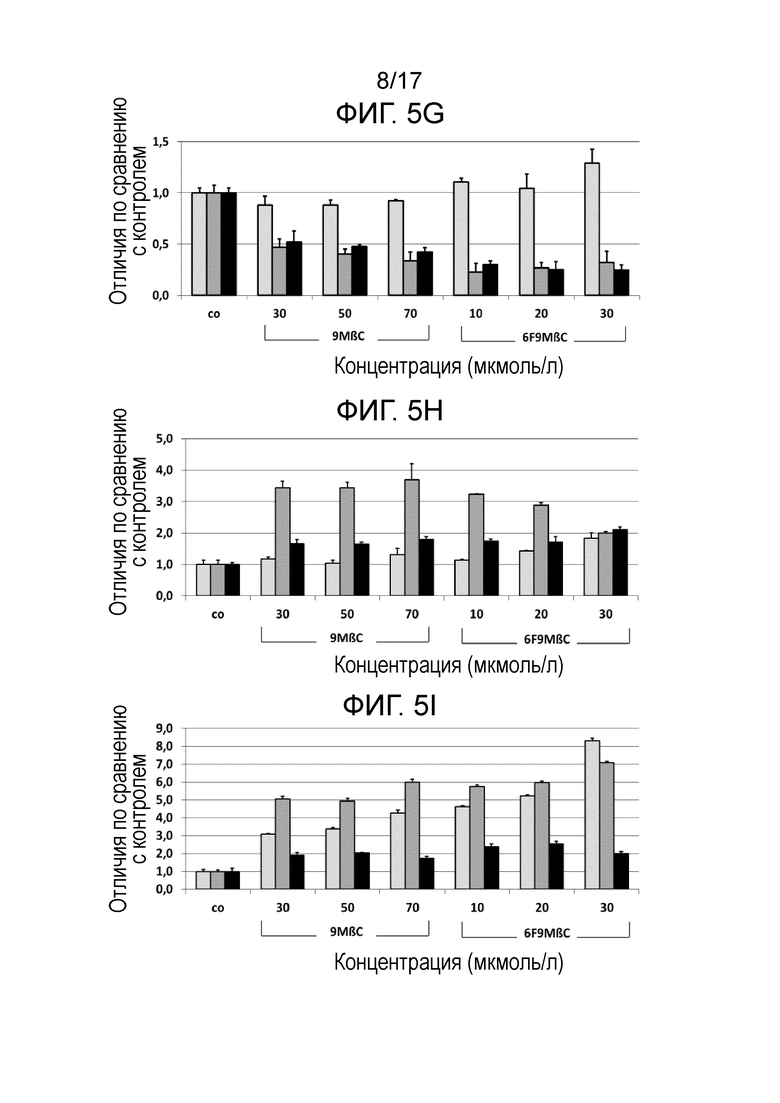
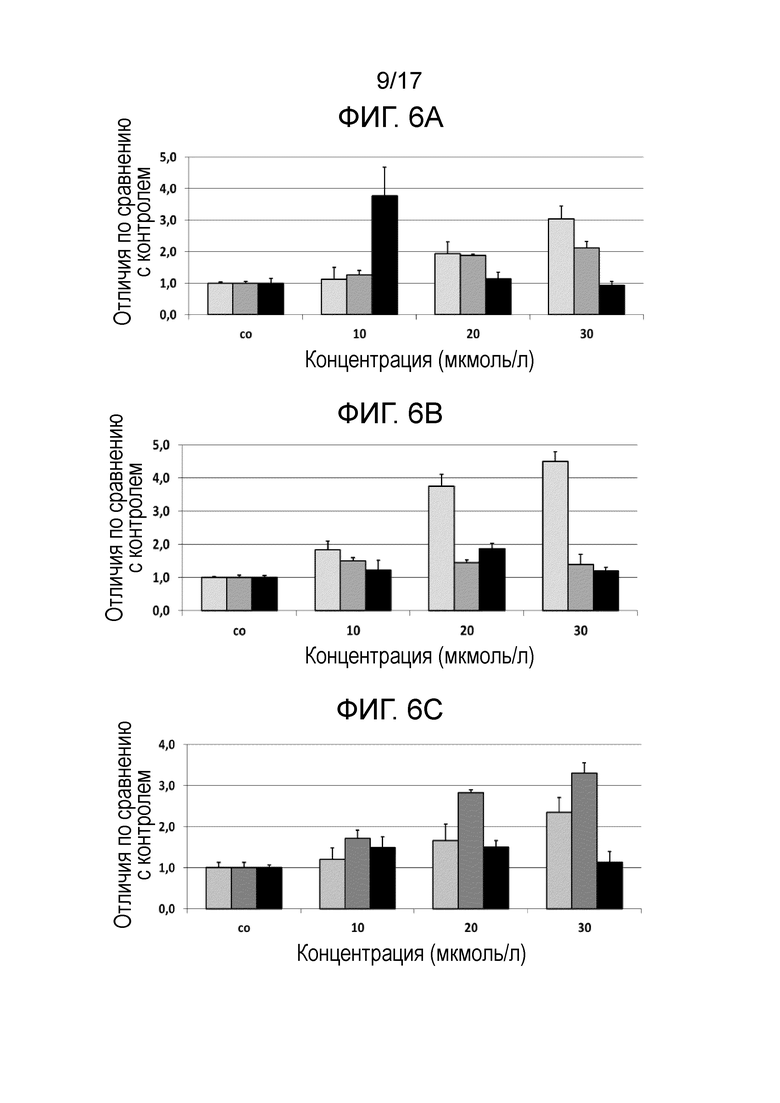
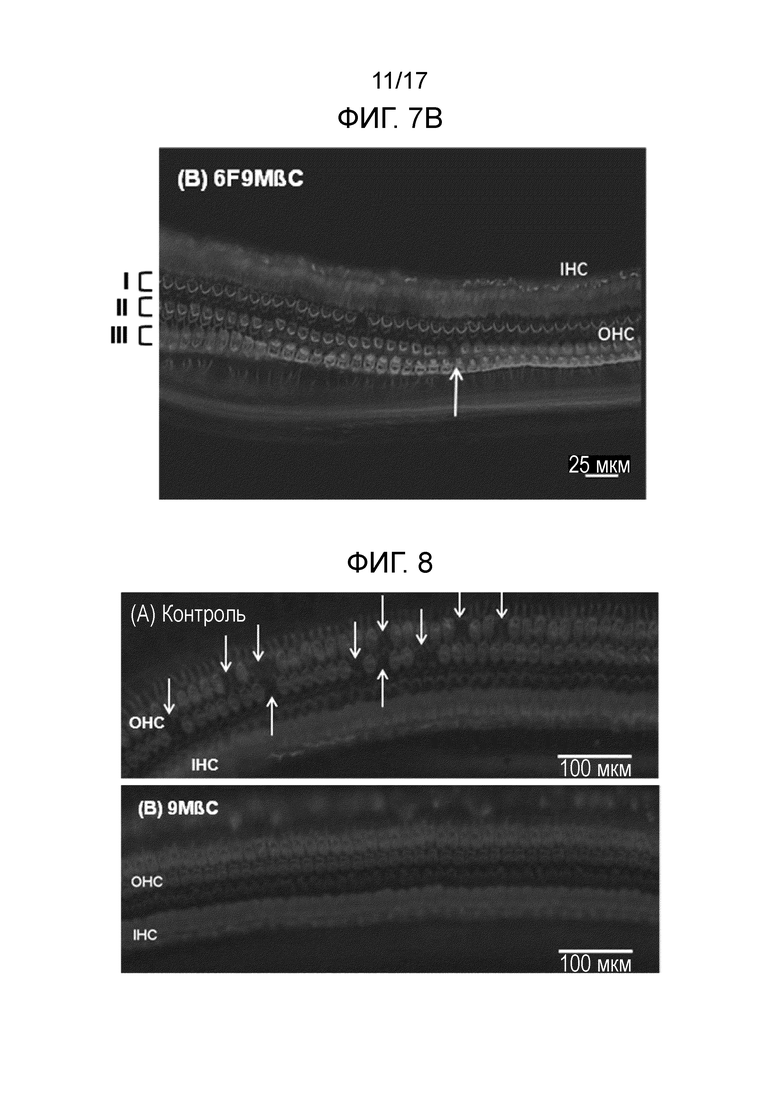
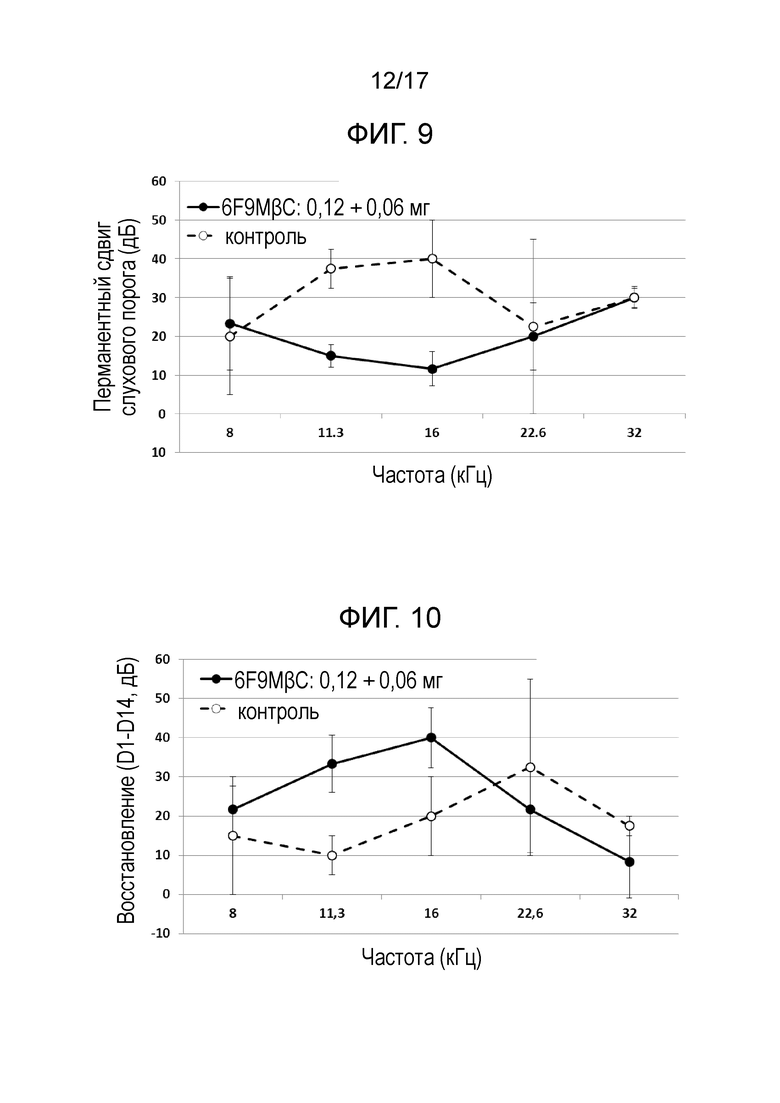
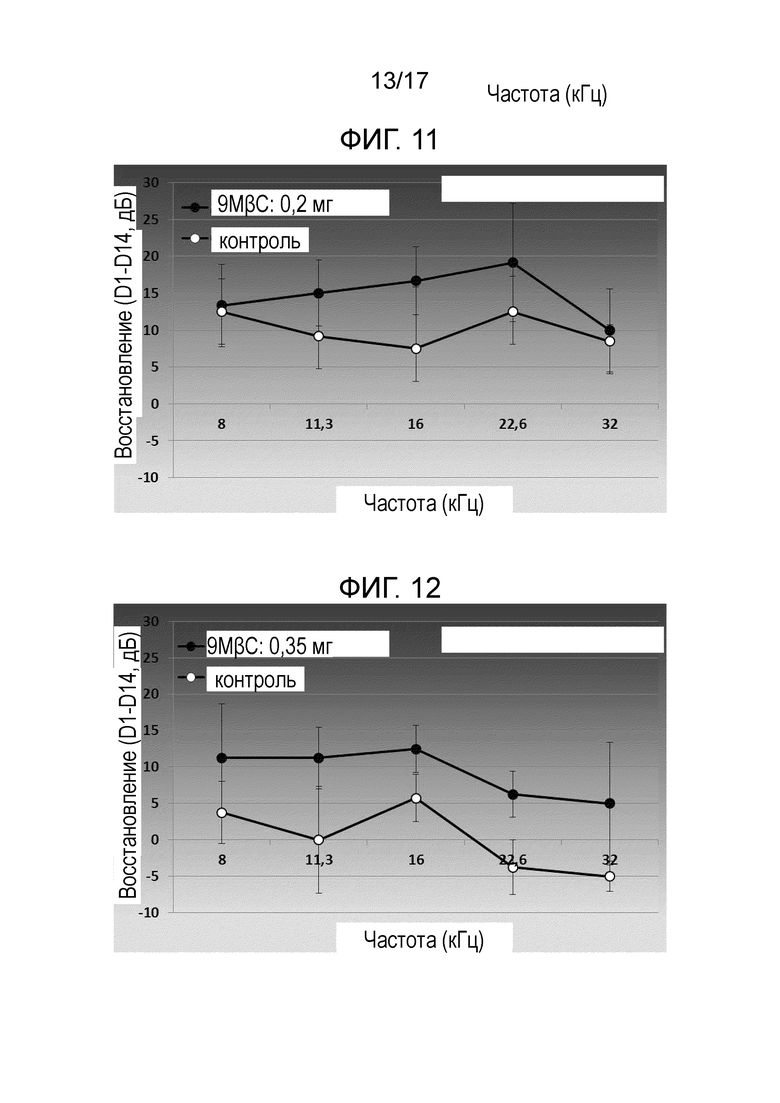
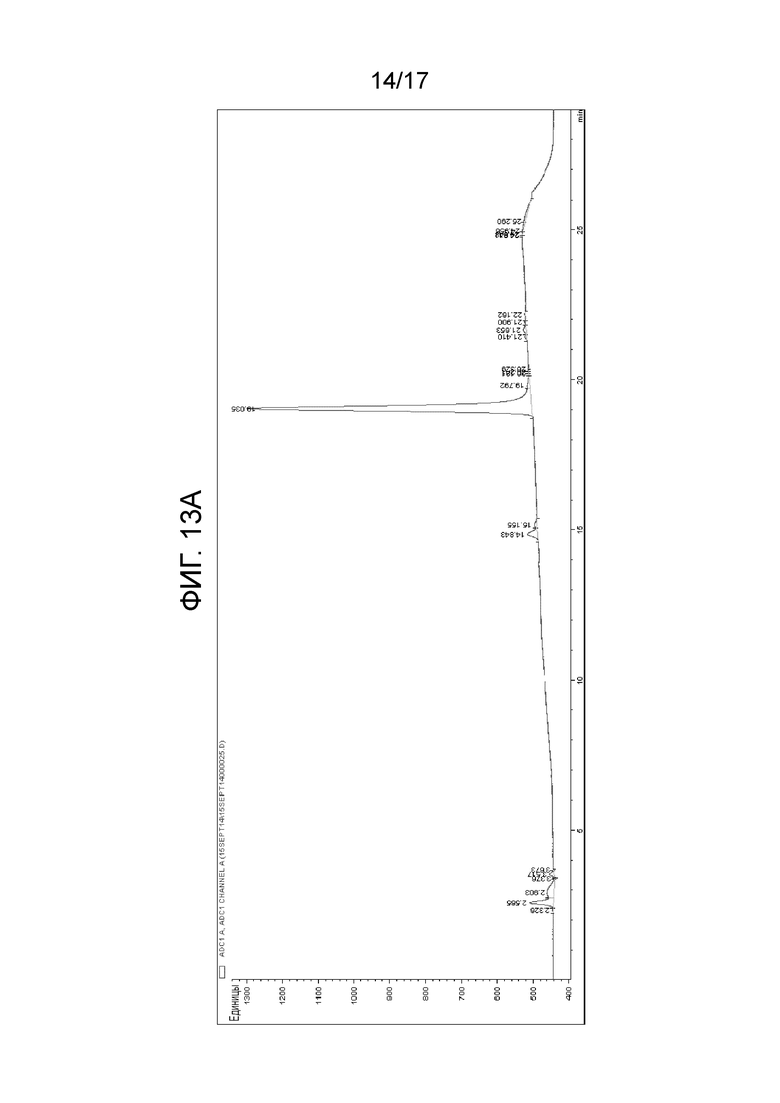
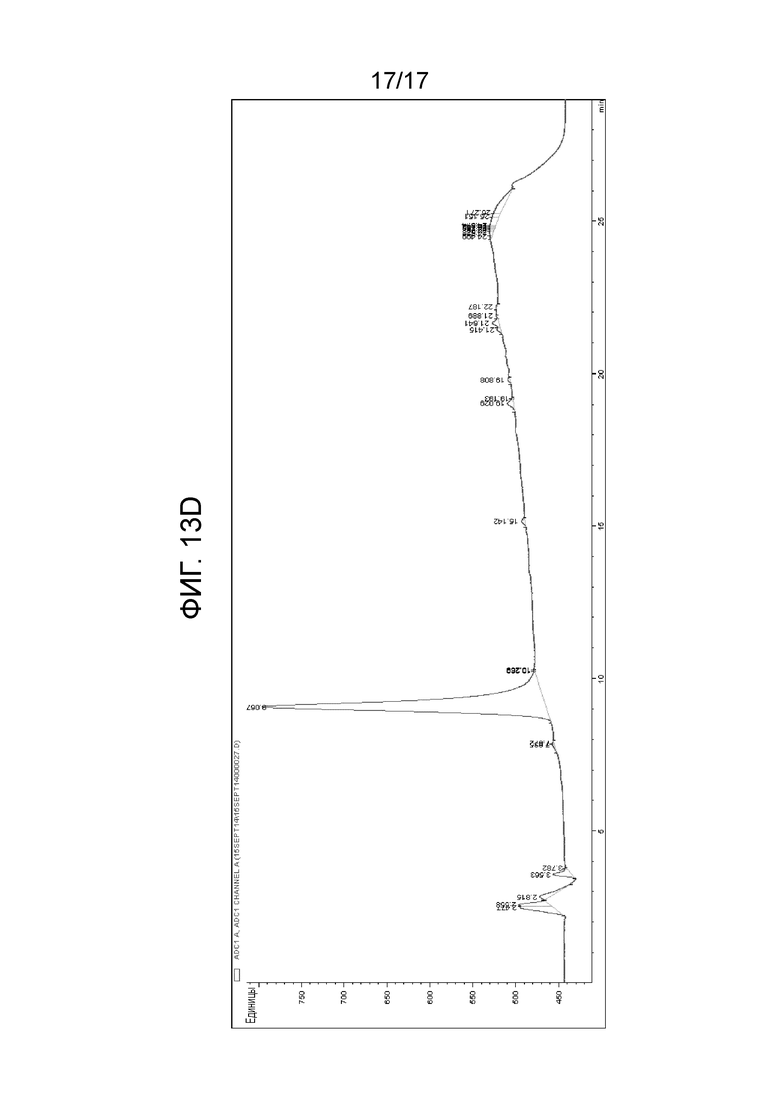
Изобретение относится к соединению общей формулы (I)
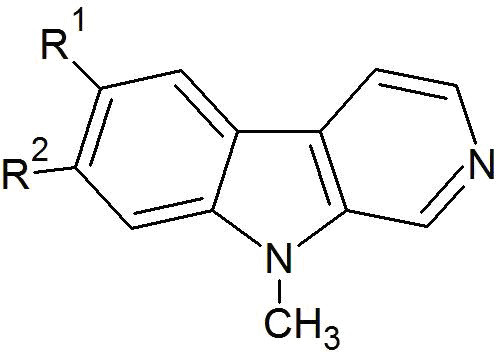 (I)
(I)
где R1 представляет собой -F, а R2 представляет собой -H или -F, или R1 представляет собой -H, а R2 представляет собой -F; которые могут быть использованы в качестве лекарственного препарата для лечения заболеваний и/или поражений внутреннего уха. 3 н. и 7 з.п. ф-лы, 30 ил., 1 табл., 9 пр.
1. Соединения общей формулы (I)
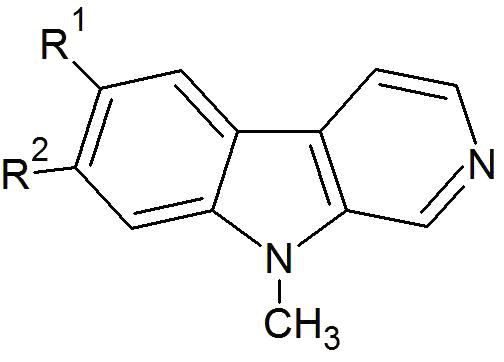 (I)
(I)
где R1 представляет собой -F, а R2 представляет собой -H или -F, или
R1 представляет собой -H, а R2 представляет собой -F;
а также фармакологически приемлемые соли, сольваты, гидраты вышеупомянутых соединений.
2. Соединение по п.1, где R1 представляет собой -F, а R2 представляет собой -H.
3. Способ получения соединения по п.1, включающий следующие стадии:
a) реакцию взаимодействия исходного соединения общей формулы (II) в присутствии гидрата глиоксиловой кислоты формулы (III) и основания с получением соединения общей формулы (IV)
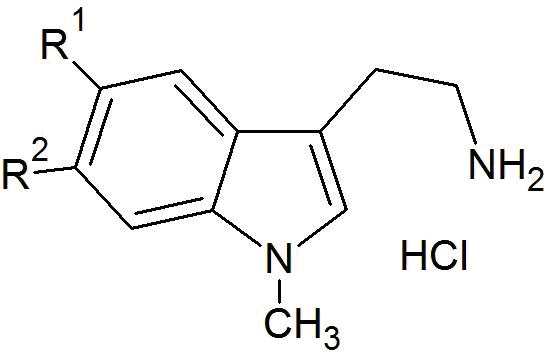
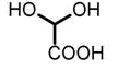
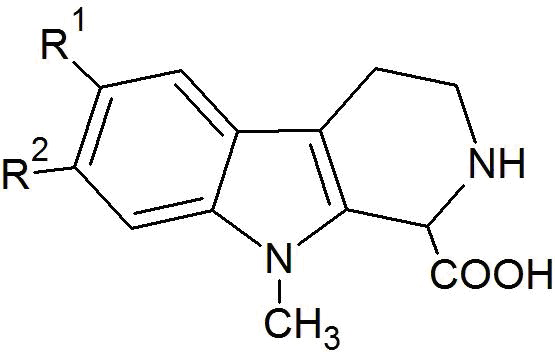
b) декарбоксилирование соединения общей формулы (IV) в присутствии кислоты и при нагревании с получением соединения общей формулы (V)
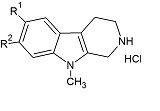 (V)
(V)
c) ароматизацию соединения общей формулы (V) с получением соединения общей формулы (I) в присутствии катализатора;
где:
R1 представляет собой -F, а R2 представляет собой -H или -F, или
R1 представляет собой -H, а R2 представляет собой -F.
4. Способ по п.3, отличающийся тем, что в стадии c) использовали катализатор Pd/C.
5. Соединение по п. 1 или 2, используемое в качестве лекарственного препарата для лечения заболеваний и/или поражений внутреннего уха.
6. Соединение по п. 1, используемое для лечения заболеваний и/или поражений внутреннего уха.
7. Соединение по п.6, отличающееся тем, что заболевания и/или поражения внутреннего уха представляют собой острые заболевание внутреннего уха, выбранные из группы, включающей контузию, поражение уха при взрыве, потерю слуха и травму при трансплантации.
8. Соединение по п.6, отличающееся тем, что заболевания и/или поражения внутреннего уха представляют собой хронические заболевание внутреннего уха, выбранные из группы, включающей хроническую акустическую травму, шум в ушах и старческую тугоухость.
9. Соединение по любому из пп. 6-8, отличающееся тем, что поражение внутреннего уха вызывается ототоксическими веществами.
10. Фармацевтическая композиция в форме капель, мазей, спреев, липосом, гелей, эмульсий или растворов для инъекций, содержащих по меньшей мере одно соединение по п.1 для лечения заболеваний и/или поражений внутреннего уха.
| WO 2011079841 A1 07.07.2011 | |||
| RU 2010147298 A 27.05.2012. |
Авторы
Даты
2018-01-26—Публикация
2014-09-29—Подача