ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка заявляет приоритет по предварительной заявке США №61/618404, поданной 30 марта 2012 г., которая включена посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
Настоящее раскрытие относится к области биосинтеза пероксикарбоновых кислот и ферментативному катализу. В частности, предлагаются многокомпонентные системы для образования перкислот, содержащие ферментативный катализатор, обладающий пергидролитической активностью. Также предлагаются способы применения ферментативного катализатора по настоящему изобретению для получения пероксикарбоновых кислот.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Композиции пероксикарбоновых кислот могут быть эффективными противомикробными средствами. Были описаны способы применения пероксикарбоновых кислот для очистки, дезинфекции и/или санитарной обработки твердых поверхностей, текстильных изделий, мясных продуктов, живых растительных тканей и медицинских изделий с противодействием нежелательному росту микроорганизмов (патент США 6545047; патент США 6183807; патент США 6518307; публикация заявки на патент США №2003-0026846 и патент США 5683724). Также пероксикарбоновые кислоты применяли в различных путях применения в отбеливании, включая, но без ограничения, пути применения в отбеливании/делигнификации древесной массы и уходе за бельем (Европейский патент 1040222 В1; патент США 5552018; патент США 3974082; патент США 5296161; и патент США 5364554). Желаемая эффективная концентрация пероксикарбоновой кислоты может варьировать в зависимости от пути применения продукта (например, от приблизительно 500 ч./млн до 1000 ч./млн для путей применения в дезинфекции медицинских инструментов, от приблизительно 30 ч./млн до 80 ч./млн для путей применения в отбеливании или дезинфекции при уходе за бельем) при времени реакции от 1 мин до 5 мин в условиях нейтрального pH.
Ферменты, классифицируемые по структуре как представители семейства 7 эстераз углеводов (СЕ-7), применяли в качестве пергидролаз для катализа реакции пероксида водорода (или альтернативного пероксидного реагента) с алкиловыми сложными эфирами карбоновых кислот в воде в диапазоне pH от основного до щелочного (от pH, составляющего приблизительно 10, до pH, составляющего приблизительно 5) с получением пероксикарбоновой кислоты в эффективной концентрации для таких путей применения, как дезинфекция (как, например, дезинфекция медицинских инструментов, твердых поверхностей, текстильных изделий), отбеливание (как, например, пути применения в обработке/делигнификации древесной массы или бумажной массы, отбеливании текстильных изделий и уходе за бельем), а также другие пути применения в уходе за бельем, такие как обесцвечивание, дезодорация и санитарная обработка, а также пути применения в личной гигиене (патенты США 7964378; 7951566; и 7723083; опубликованная заявка на патент США №2008-0176299 DiCosimo et al.; и опубликованные заявки на патенты США №2012-0317733 и 2012-0328534 Chisholm et al.). Было обнаружено, что ферменты СЕ-7 имеют высокую специфическую активность в отношении пергидролиза сложных эфиров, в частности, ацетиловых сложных эфиров спиртов, диолов и глицеринов. Варианты пергидролаз СЕ-7, полученных от ряда видов, имеющие улучшенные функциональные характеристики, описаны DiCosimo et al. (патенты США 7927854; 7923233; 7932072; 7910347; 7960528; 8062875; 8206964; 8389254 и 8389255 и опубликованные заявки на патенты США №2011-0236336 и 2011-0236338).
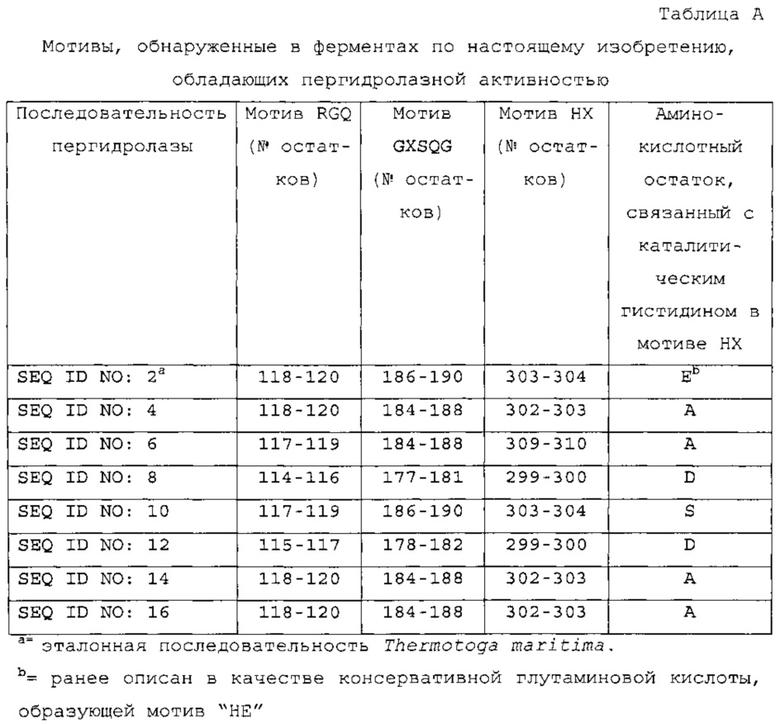
Описанные ранее эстеразы углеводов СЕ-7, обладающие пергидролитической активностью (как дикого типа, так и их варианты), содержали консервативный структурный "сигнатурный" мотив, определенный Vincent et al. (J. Mol. Biol., 330: 593-606 (2003)). В частности, сигнатурный мотив СЕ-7, применяемый для структурной идентификации и определения представителей семейства эстераз углеводов СЕ-7, содержит три консервативных субмотива: 1) субмотив "RGQ" из Arg118-Gly119-Gln120, 2) субмотив "GXSQG" из Gly186-Xaa187-Ser188-Gln189-Gly190 и 3) субмотив "НЕ" из His303-Glu304 (нумерация и ориентация остатков по отношению к эталонной последовательности Thermotoga maritima предложены в виде SEQ ID NO: 2).
В то время как подавляющее большинство ферментов, классифицируемых как эстеразы углеводов СЕ-7, содержат сигнатурный мотив, определенный Vincent et al., к семейству 7 эстераз углеводов было добавлено несколько последовательностей полипептидов, которые не содержат субмотива "НЕ" (Cantarel et al., "The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics", WAR, 37: D233-D238 (2009)). Для этой подгруппы не отмечали наличие пергидролитической активности.
Для включения технологии с применением пергидролитических ферментов в некоторые пути применения может потребоваться идентификация новых пергидролитических ферментов. В связи с этим сохраняется потребность идентификации дополнительных ферментативных катализаторов, включающих в себя полипептиды, имеющие значительную пергидролитическую активность.
КРАТКОЕ ОПИСАНИЕ
Было идентифицировано несколько ферментов, имеющих пергидролитическую активность, подходящих для получения перкислот в эффективных концентрациях.
В одном варианте осуществления предложена ферментативная система для образования перкислот, содержащая набор компонентов реакции, включающий:
(1) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X = сложноэфирная группа формулы R6-C(O)O;
R6 = линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6=C2-C7;
R5 = линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m = целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
(ii) одного или нескольких глицеридов, имеющих структуру
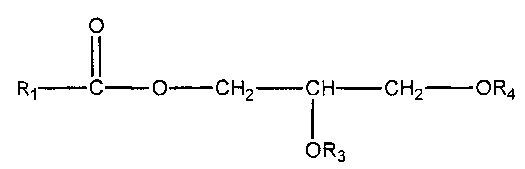 ,
,
где R1 = неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R3 и R4 в отдельности представляют собой H или R1C(O);
(iii) одного или нескольких сложных эфиров формулы:
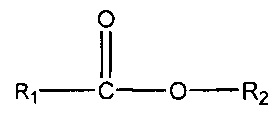 ,
,
где R1 = неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R2 = неразветвленный или разветвленный C1-C10-алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)n или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацетилированных моносахаридов, ацетилированных дисахаридов или ацетилированных полисахаридов и
(v) любой комбинации из (i)-(iv);
(2) источник пероксида и
(3) ферментативный катализатор, содержащий полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевым участком каталитического гистидина, не является глутаминовой кислотой;
при этом перкислоту получают ферментативным путем в результате объединения компонентов реакции при соответствующих условиях реакции.
В другом варианте осуществления также предлагается способ получения пероксикарбоновой кислоты, включающий:
(а) обеспечение набора компонентов реакции, содержащего:
(1) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X = сложноэфирная группа формулы R6-C(O)O;
R6 = линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6=C2-C7;
R5 = линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m = целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
(ii) одного или нескольких глицеридов, имеющих структуру
 ,
,
где R1 = неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R3 и R4 в отдельности представляют собой H или R1C(O);
(iii) одного или нескольких сложных эфиров формулы:
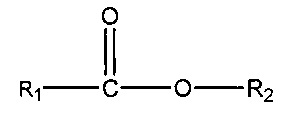 ,
,
где R1 = неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R2 = неразветвленный или разветвленный C1-C10-алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)n или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацилированных моносахаридов, ацилированных дисахаридов или ацилированных полисахаридов и
(v) любой комбинации из (i)-(iv);
(2) источник пероксида и
(3) ферментативный катализатор, содержащий полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевым участком каталитического гистидина, не является глутаминовой кислотой;
(b) объединение набора компонентов реакции при соответствующих условиях реакции, в результате чего получают пероксикарбоновую кислоту; и
(c) необязательно разбавление пероксикарбоновой кислоты, полученной на этапе (b).
В другом варианте осуществления предлагается способ, включающий этап (d), на котором пероксикарбоновая кислота, полученная на этапе (b) или этапе (c), контактирует с твердой поверхностью, поверхностью тела или по меньшей мере с одним предметом одежды.
Способ по настоящему изобретению приводит к получению желаемой пероксикарбоновой кислоты при объединении компонентов реакции. Компоненты реакции до применения могут оставаться разделенными.
В дополнительном аспекте предлагается система для образования и доставки пероксикарбоновой кислоты, включающая: (a) первый отдел, содержащий
(1) ферментативный катализатор, содержащий полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевым участком каталитического гистидина, не является глутаминовой кислотой;
(2) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X = сложноэфирная группа формулы R6-C(O)O;
R6 = линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6=C2-C7;
R5 = линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m = целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
(ii) одного или нескольких глицеридов, имеющих структуру
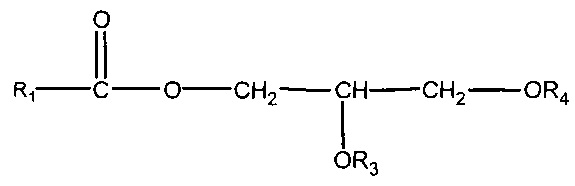 ,
,
где R1 = неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R3 и R4 в отдельности представляют собой H или R1C(O);
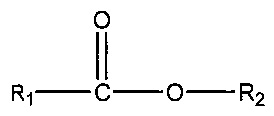
(iii) одного или нескольких сложных эфиров формулы:
 ,
,
где R1 = неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R2 = неразветвленный или разветвленный C1-C10-алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)n или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацилированных моносахаридов, ацилированных дисахаридов или ацилированных полисахаридов и
(v) любой комбинации из (i)-(iv); и
(3) необязательный буфер; и
(b) второй отдел, содержащий
(1) источник пероксида;
(2) стабилизатор пероксида и
(3) необязательный буфер.
В дополнительном варианте осуществления предлагается композиция для ухода за бельем, содержащая:
a) полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевым участком каталитического гистидина, не является глутаминовой кислотой;
b) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X = сложноэфирная группа формулы R6-C(O)O;
R6 = линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6=C2-C7;
R5 = линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m = целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
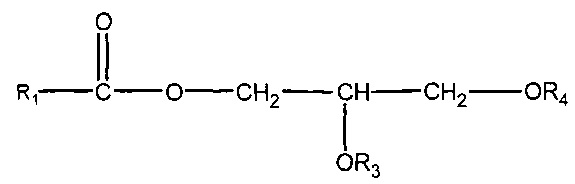
(ii) одного или нескольких глицеридов, имеющих структуру
 ,
,
где R1 = неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R3 и R4 в отдельности представляют собой H или R1C(O);
(iii) одного или нескольких сложных эфиров формулы:
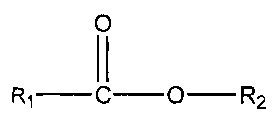 ,
,
где R1 = неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R2 = неразветвленный или разветвленный C1-C10-алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)n или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацилированных моносахаридов, ацилированных дисахаридов или ацилированных полисахаридов и
(v) любой комбинации из (i)-(iv); и
c) источник пероксида; и
d) по меньшей мере одно поверхностно-активное вещество.
В дополнительном варианте осуществления предлагается средство личной гигиены, содержащее полипептид, обладающий пергидролитической активностью, при этом указанный полипептид имеет аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевым участком каталитического гистидина, не является глутаминовой кислотой.
В дополнительном варианте осуществления средством личной гигиены являются шампунь, лосьон для тела, гель для душа, увлажняющее средство для местного применения, зубная паста, гель для чистки зубов, ополаскиватель для рта, средство для полоскания рта, ополаскиватель против зубного налета или очищающее средство для местного применения.
В дополнительном варианте осуществления предложена выделенная молекула нуклеиновой кислоты, которая выбрана из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, обладающего пергидролитической активностью, причем указанный полипептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 14 или в SEQ ID NO: 16;
(b) полинуклеотида, содержащего последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 13 или в SEQ ID NO: 15; и
(c) полинуклеотида, полностью комплементарного нуклеотиду из (a) или (b).
В дополнительном варианте осуществления предложен выделенный полипептид, обладающий пергидролитической активностью, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 14 или в SEQ ID NO: 16.
КРАТКОЕ ОПИСАНИЕ ФИГУРЫ
Фигура 1А и Фигура 1В представляют собой выравнивание в CLUSTALW SEQ ID NO: 2, 4, 6, 8, 10 и 12.
КРАТКОЕ ОПИСАНИЕ БИОЛОГИЧЕСКИХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Следующие последовательности соответствуют §§ 1.821-1.825 раздела 37 C.F.R. ("Требования, предъявляемые к патентным заявкам, содержащим раскрытия нуклеотидных последовательностей и/или аминокислотных последовательностей - правила для последовательностей") и согласуются со стандартом ST.25 (2009) Всемирной организации интеллектуальной собственности (WIP0) и требованиями к перечню последовательностей Европейской патентной конвенции (ЕРС) и правилами 5.2 и 49.5(a-bis) Договора о патентной кооперации (РСТ), а также разделом 208 и Дополнением С Административных инструкций. Символы и формат, применяемые для данных по нуклеотидным и аминокислотным последовательностям, соответствуют правилам, изложенным в § 1.822 раздела 37 C.F.R.
SEQ ID NO: 1 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему ацетилксиланэстеразу Thermotoga maritima, обладающую пергидролитической активностью.
SEQ ID NO: 2 является аминокислотной последовательностью ацетилксиланэстеразы Thermotoga maritima, обладающей пергидролитической активностью.
SEQ ID NO: 3 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему ацетилксиланэстеразу Actinosynnema mirum, обладающую пергидролитической активностью.
SEQ ID NO: 4 является аминокислотной последовательностью ацетилксиланэстеразы Actinosynnema mirum, обладающей пергидролитической активностью.
SEQ ID NO: 5 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему ацетилксиланэстеразу Propionibacterium acnes, обладающую пергидролитической активностью.
SEQ ID NO: 6 является аминокислотной последовательностью ацетилксиланэстеразы Propionibacterium acnes, обладающей пергидролитической активностью.
SEQ ID NO: 7 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему ацетилксиланэстеразу Streptococcus equi, обладающую пергидролитической активностью.
SEQ ID NO: 8 является аминокислотной последовательностью ацетилксиланэстеразы Streptococcus equi, обладающей пергидролитической активностью.
SEQ ID NO: 9 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему ацетилксиланэстеразу Stackebrandtia nassauensis, обладающую пергидролитической активностью.
SEQ ID NO: 10 является аминокислотной последовательностью ацетилксиланэстеразы Stackebrandtia nassauensis, обладающей пергидролитической активностью.
SEQ ID NO: 11 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему ацетилксиланэстеразу Streptococcus agalactiae, обладающую пергидролитической активностью.
SEQ ID NO: 12 является аминокислотной последовательностью ацетилксиланэстеразы Streptococcus agalactiae, обладающей пергидролитической активностью.
SEQ ID NO: 13 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему вариант C277S ацетилксиланэстеразы Actinosynnema mirum, обладающий пергидролитической активностью.
SEQ ID NO: 14 является аминокислотной последовательностью варианта C277S ацетилксиланэстеразы Actinosynnema mirum, обладающего пергидролитической активностью.
SEQ ID NO: 15 является последовательностью нуклеиновой кислоты, соответствующей кодирующему участку с оптимизированными кодонами, кодирующему вариант С277Т ацетилксиланэстеразы Actinosynnema mirum, обладающий пергидролитической активностью.
SEQ ID NO: 16 является аминокислотной последовательностью варианта С277Т ацетилксиланэстеразы Actinosynnema mirum, обладающего пергидролитической активностью.
SEQ ID NO: 17 является аминокислотной последовательностью варианта C277S Thermotoga maritima (патент США 8062875).
SEQ ID NO: 18 является аминокислотной последовательностью варианта С277Т Thermotoga maritima (патент США 8062875).
ПОДРОБНОЕ ОПИСАНИЕ
Предлагаются композиции и способы, включающие полипептид, обладающий пергидролитической активностью, при этом полипептид имеет аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевой частью каталитического гистидина, не является глутаминовой кислотой. Композиции и способы подходят для получения ферментативным путем по меньшей мере одной перкислоты, подходящей для применения в качестве средства для ухода за бельем, средства дезинфекции, косметического средства или средства личной гигиены.
В настоящем раскрытии применяется ряд терминов и сокращений. Применяются следующие определения, если конкретно не указано иное.
Применяемые в данном документе формы единственного числа элемента и компонента по настоящему изобретению подразумеваются как неограничивающие в отношении числа примеров (т.е. случаев) элемента или компонента. Таким образом, формы единственного числа следует читать как включающие одно или по меньшей мере одно, и форма единственного числа элемента или компонента также включает множественное число, если только число очевидно не должно быть единственным.
Термин "содержащий" указывает на присутствие указанных признаков, целых чисел, этапов или компонентов, указанных в формуле изобретения, но не исключает присутствия или добавления одного или нескольких других признаков, целых чисел, этапов, компонентов или их групп. Термин "содержащий" подразумевает включение вариантов осуществления, охватываемых терминами "по сути состоящий из" и "состоящий из". Подобным образом, термин "по сути состоящий из" подразумевает включение вариантов осуществления, охватываемых термином "состоящий из".
Применяемый в данном документе термин "приблизительно", изменяющий количество используемых ингредиента или реагента, относится к изменению численной величины, которое может иметь место, например, в ходе процедур обычного измерения и работы с жидкостями, применяемых для получения концентратов, или применения растворов на практике; в результате неизбежной ошибки в этих процедурах; из-за различий в производстве, источнике или чистоте ингредиентов, используемых для получения композиций или выполнения способов; и т.п. Термин "приблизительно" также охватывает количества, которые различаются вследствие различных состояний равновесия для композиции, полученной из конкретной начальной смеси. Вне зависимости от изменения термином "приблизительно" формула изобретения включает эквиваленты количеств.
При наличии этого термина включают и комбинируют все диапазоны. Например, при упоминании диапазона "от 1 до 5" упоминаемый диапазон следует рассматривать как включающий диапазоны "от 1 до 4", "от 1 до 3", "1-2", "1-2 и 4-5", "1-3 и 5 " и т.п.
Применяемый в данном документе термин "многокомпонентная система" будет обозначать систему для образования пероксикарбоновой кислоты ферментативным путем, в которой компоненты до применения остаются разделенными. В связи с этим многокомпонентная система будет включать по меньшей мере один первый компонент, который остается отделенным по меньшей мере от одного второго компонента. Первый и второй компоненты до применения разделены по разным отделам (т.е. с применением первого и второго отделов). Схема многокомпонентных систем часто будет зависеть от физической формы компонентов, которые необходимо объединять, и подробно описана далее.
Применяемый в данном документе термин "пероксикарбоновая кислота" является синонимом перкислоты, пероксикислоты, надкислоты, перкарбоновой кислоты и пероксокислоты.
Применяемый в данном документе термин "перуксусная кислота" сокращен до "РАА" и является синонимом пероксиуксусной кислоты, этанпероксокислоты и всех других синонимов с регистрационным номером CAS 79-21-0.
Применяемый в данном документе термин "моноацетин" является синонимом моноацетата глицерола, моноацетата глицерина и глицерилмоноацетата.
Применяемый в данном документе термин "диацетин" является синонимом диацетата глицерола; диацетата глицерина, глицерилдиацетата и всех других синонимов с регистрационным номером CAS 25395-31-7.
Применяемый в данном документе термин "триацетин" является синонимом триацетата глицерина; триацетата глицерола, глицерилтриацетата; 1,2,3-триацетоксипропана; 1,2,3-пропантриолтриацетата и всех других синонимов с регистрационным номером CAS 102-76-1.
Применяемый в данном документе термин "монобутирин" является синонимом монобутирата глицерола, монобутирата глицерина и глицерилмонобутирата.
Применяемый в данном документе термин "дибутирин" является синонимом дибутирата глицерола и глицерилдибутирата.
Применяемый в данном документе термин "трибутирин" является синонимом трибутирата глицерола; 1,2,3-трибутирилглицерола и всех других синонимов с регистрационным номером CAS 60-01-5.
Применяемый в данном документе термин "монопропионин" является синонимом монопропионата глицерола, монопропионата глицерина и глицерилмонопропионата.
Применяемый в данном документе термин "дипропионин" является синонимом дипропионата глицерола и глицерилдипропионата.
Применяемый в данном документе термин "трипропионин" является синонимом глицерилтрипропионата; трипропионата глицерола; 1,2,3-трипропионилглицерола и всех других синонимов с регистрационным номером CAS 139-45-7.
Применяемые в данном документе термины "ацилированный сахар" и "ацилированный сахарид" означают моно-, ди- и полисахариды, содержащие по меньшей мере одну ацильную группу, где ацильная группа выбрана из группы, состоящей из алифатических неразветвленных карбоксилатов, имеющих длину цепи от C2 до C8. Примеры включают, но без ограничения, пентаацетат глюкозы, тетраацетат ксилозы, ацетилированный ксилан, фрагменты ацетилированного ксилана, 1,2,3,5-тетраацетат β-D-рибофуранозы, три-O-ацетил-D-галакталь и три-O-ацетилглюкаль.
Применяемые в данном документе термины "гидрокарбил", "гидрокарбильная группа" и "гидрокарбильный фрагмент" означают группировку атомов углерода, соединенных одинарными, двойными или тройными углерод-углеродными связями и/или эфирными связями и замещенных, соответственно, атомами водорода, в форме прямой цепи, разветвленной цепи или цикла. Такие гидрокарбильные группы могут быть алифатическими и/или ароматическими. Примеры гидрокарбильных групп включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, циклопропильную, циклобутильную, пентильную, циклопентильную, метилциклопентильную, гексильную, циклогексильную, бензильную и фенильную группы. В одном варианте осуществления гидрокарбильный фрагмент является группировкой атомов углерода, соединенных одинарными углерод-углеродными связями и/или эфирными связями и замещенных, соответственно, атомами водорода, в форме прямой цепи, разветвленной цепи или цикла.
Применяемый в данном документе термин "ароматический" означает органическое соединение или фрагмент, характеризующиеся повышенной химической стабильностью в связи с делокализацией электронов в кольцевой системе, содержащие, как правило, несколько сопряженных двойных связей. Плоские моноциклические сопряженные кольца, имеющие делокализованные электроны, должны быть ароматическими, если они имеют (4n+2) π-электронов. Примеры ароматических соединений могут включать производные бензола (такие как 2-, 3- или 4-ацетоксибензойная кислота). В одном варианте осуществления сложноэфирным субстратом может быть 4-ацетоксибензойная кислота.
Применяемый в данном документе термин "гетероциклический" означает органическое соединение или фрагмент с кольцевой структурой, имеющие один или несколько атомов, отличных от углерода, по меньшей мере в одном из своих колец.
Применяемый в данном документе термин "гетероароматический" означает органическое соединение или фрагмент с кольцевой структурой, которые являются как гетероциклическими, так и ароматическими, где ядро содержит по меньшей мере один из гетероатомов кислорода, азота или серы. Примеры гетероароматических фрагментов могут включать пиридиновые, пиррольные, фурановые или тиофеновые фрагменты.
Применяемые в данном документе термины "сложные моноэфиры" и "сложные диэфиры" 1,2-этандиола, 1,2-пропандиола, 1,3-пропандиола, 1,2-бутандиола, 1,3-бутандиола, 2,3-бутандиола, 1,4-бутандиола, 1,2-пентандиола, 2, 5-пентандиола, 1,6-пентандиола, 1,2-гександиола, 2,5-гександиола, 1,6-гександиола означают указанные соединения, содержащие по меньшей мере одну сложноэфирную группу формулы RC(O)O, где R представляет собой линейный гидрокарбильный C1-C7-фрагмент.
Применяемые в данном документе термины "подходящий состав для ферментативной реакции", "компоненты, подходящие для образования пероксикарбоновой кислоты", "подходящие компоненты реакции", "компоненты реакции", "реакционный состав" и "подходящий водный реакционный состав" означают вещества и воду, в которой реагенты и ферментативный катализатор, содержащий вариант полипептида по настоящему изобретению, обладающий пергидролитической активностью, вступают в контакт с образованием желаемой пероксикарбоновой кислоты. В настоящем документе предложены компоненты реакционного состава, и специалисты в данной области определят диапазон изменений компонентов, подходящий для этого способа. В одном варианте осуществления состав для ферментативной реакции приводит к получению пероксикарбоновой кислоты in situ при объединении компонентов реакции. В связи с этим компоненты реакции можно предложить в качестве многокомпонентной системы, где один или несколько компонентов реакции до применения остаются разделенными. Схема систем и способов для разделения и объединения нескольких активных компонентов известна в данной области и будет зависеть главным образом от физической формы отдельных компонентов реакции. Например, в системах с несколькими активными жидкостями (жидкостных) обычно применяются многокамерные баллоны с дозаторами или двухфазные системы (публикация заявки на патент США №2005-0139608; патент США 5398846; патент США 5624634; патент США 6391840; Европейский патент 0807156 В1; публикация заявки на патент США 2005-0008526 и публикация согласно РСТ № WO 00/61713), такие как обнаруживаемые в некоторых путях применения в отбеливании, в которых желаемое отбеливающее средство получают при смешивании реакционноспособных жидкостей. Многокомпонентные составы и многокомпонентные системы для образования, применяемые для получения пероксикарбоновых кислот ферментативным путем из сложных эфиров карбоновых кислот, описаны DiCosimo et al. в опубликованных заявках на патенты США №№2010-0086510 и 2010-0086621 соответственно. Другие формы многокомпонентных систем, применяемых для образования пероксикарбоновой кислоты, могут включать, но без ограничения, таковые, разработанные для одного или нескольких твердых компонентов или комбинаций твердых и жидких компонентов, такие как порошки, применяемые во многих коммерчески доступных отбеливающих композициях (например, патент США 5116575), многослойные таблетки (например, патент США 6210639), водорастворимые пакетики, имеющие многочисленные отделы (например, патент США 6995125), и твердые агломераты, которые вступают в реакцию при добавлении воды (например, патент США 6319888).
Применяемый в данном документе термин "субстрат" или "субстрат на основе сложного эфира карбоновой кислоты" будет обозначать компоненты реакции, пергидролизованные ферментативным путем с помощью ферментативного катализатора по настоящему изобретению в присутствии подходящего источника пероксида, такого как пероксид водорода. В одном варианте осуществления субстрат содержит по меньшей мере одну сложноэфирную группу, способную к пергидролизу ферментативным путем с помощью ферментативного катализатора, в результате чего образуется пероксикарбоновая кислота.
Применяемый в данном документе термин "пергидролиз" определяют как реакцию выбранного субстрата с источником пероксида водорода с образованием пероксикарбоновой кислоты. Как правило, неорганический пероксид реагирует с выбранным субстратом в присутствии катализатора с получением пероксикарбоновой кислоты. Применяемый в данном документе термин "химический пергидролиз" включает реакции пергидролиза, в которых субстрат (такой как предшественник пероксикарбоновой кислоты) объединяют с источником пероксида водорода, где пероксикарбоновая кислота образуется в отсутствие ферментативного катализатора. Применяемый в данном документе термин "ферментативный пергидролиз" означает реакцию выбранного субстрата с источником пероксида водорода с образованием пероксикарбоновой кислоты, где реакция катализируется ферментативным катализатором, обладающим пергидролитической активностью.
Применяемый в данном документе термин "пергидролазная активность" означает активность ферментативного катализатора на единицу массы (например, миллиграмм) белка, сухой массы клеток или массы иммобилизованного катализатора.
Применяемый в данном документе термин "одна единица активности фермента", или "одна единица активности", или "ЕД." определяют как величину пергидролазной активности, необходимую для получения 1 мкмоль продукта в виде пероксикарбоновой кислоты (такого как перуксусная кислота) в минуту при определенной температуре. "Одну единицу активности фермента" также можно применять в данном документе для обозначения величины гидролитической активности в отношении пероксикарбоновой кислоты, необходимой для гидролиза 1 мкмоль пероксикарбоновой кислоты (например, перуксусной кислоты) в минуту при определенной температуре.
Применяемые в данном документе термины "ферментативный катализатор" и "пергидролазный катализатор" означают катализатор, содержащий фермент (т.е. полипептид), обладающий пергидролазной активностью, и который может быть в виде целой микробной клетки, микробной (микробных) клетки (клеток) с нарушенной проницаемостью мембраны, одного или нескольких клеточных компонентов экстракта микробных клеток, частично очищенного фермента или очищенного фермента. Ферментативный катализатор также может быть модифицированным химическим путем (например, посредством пегилирования или посредством реакции со сшивающими реагентами). Пергидролазный катализатор также может быть иммобилизован на растворимой или нерастворимой подложке посредством способов, хорошо известных специалистам в данной области; см., например, Immobilization of Enzymes and Cells (2nd Edition); Jose M. Guisan, Editor; Humana Press, Totowa, NJ, USA; 2006.
Применяемые в данном документе термины "классифицируемый по структуре как фермент СЕ-7", "классифицируемый по структуре как фермент из семейства 7 эстераз углеводов", "классифицируемый по структуре как эстераза углеводов СЕ-7" и "пергидролаза СЕ-7" будут применяться в данном документе для обозначения ферментов, обладающих пергидролазной активностью, классифицируемых по структуре как эстеразы углеводов СЕ-7 (см. Cantarel et al., "The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics", NAR, 37: D233-D238 (2009)).
Применяемые в данном документе термины "цефалоспорин-C-деацетилаза" и "цефалоспорин-C-ацетилгидролаза" означают фермент (Е.С. 3.1.1.41), который катализирует деацетилирование цефалоспоринов, таких как цефалоспорин С и 7-аминоцефалоспориновая кислота (Mitsushima et al., Appl. Environ. Microbiol., 61 (6): 2224-2229 (1995); патент США 5528152 и патент США 5338676).
Применяемый в данном документе термин "ацетилксиланэстераза" означает фермент (Е.С. 3.1.1.72; АХЕ), который катализирует деацетилирование ацетилированных ксиланов и других ацетилированных сахаридов.
Применяемый в данном документе термин "Thermotoga maritima" означает бактериальную клетку, о которой сообщалось, что она обладает ацетилксиланэстеразной активностью (GENBANK® NP_227893.1). В одном аспекте штаммом Thermotoga maritima является Thermotoga maritima MSB8. Аминокислотная последовательность фермента дикого типа, обладающего пергидролазной активностью, Thermotoga maritima предложена в виде SEQ ID NO: 2.
Термин "аминокислота" означает основную химическую структурную единицу белка или полипептида. Для определения конкретных аминокислот в данном документе применяют следующие сокращения.
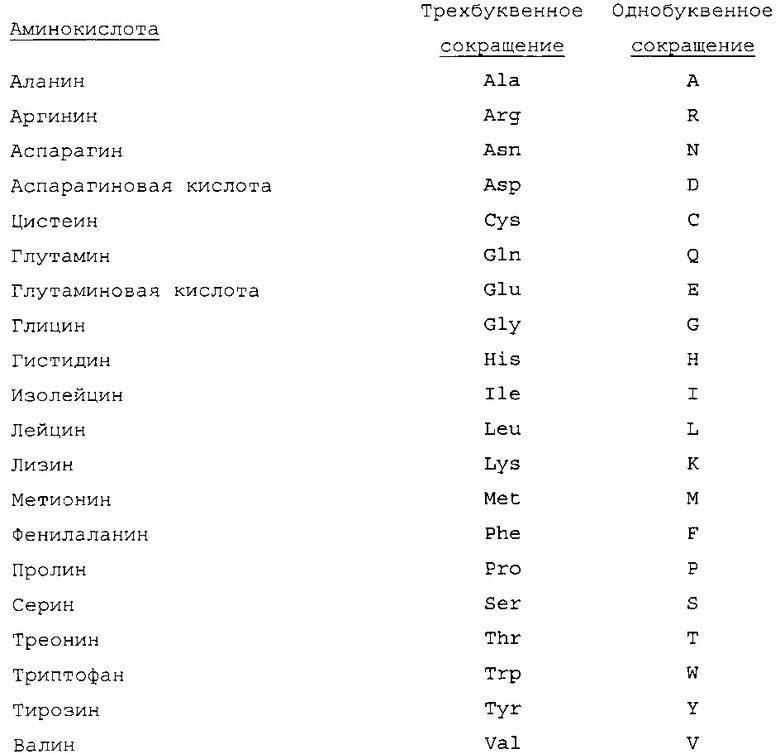

Применяемый в данном документе термин "биологические загрязнители" означает один или несколько нежелательных и/или патогенных биологических объектов, в том числе, но без ограничения, микроорганизмы, споры, вирусы, прионы и их комбинации. Фермент по настоящему изобретению можно применять для получения эффективной концентрации по меньшей мере одной пероксикарбоновой кислоты, пригодной для уменьшения и/или устранения присутствия жизнеспособных биологических загрязнителей. В предпочтительном варианте осуществления биологическим загрязнителем является жизнеспособный патогенный организм.
Применяемый в данном документе термин "дезинфицировать" означает процесс уничтожения или предотвращения роста биологических загрязнителей. Применяемый в данном документе термин "дезинфицирующее средство" означает средство, обеспечивающее дезинфекцию посредством нарушения, нейтрализации или ингибирования роста биологических загрязнителей. Обычно дезинфицирующие средства применяют для обработки неживых объектов или поверхностей. Применяемый в данном документе термин "антисептик" означает химическое средство, которое ингибирует рост болезнетворных микроорганизмов. В одном аспекте варианта осуществления биологическими загрязнителями являются патогенные микроорганизмы.
Применяемый в данном документе термин "санитария" означает восстановление или сохранение здоровья, обычно путем удаления, ограничения распространения или контроля агента, который может наносить вред здоровью, или имеет отношение к этому. Применяемый в данном документе термин "подвергать санитарной обработке" означает проведение санитарии. Применяемый в данном документе термин "санитайзер" означает средство для санитарной обработки. Применяемый в данном документе термин "санитарная обработка" означает акт или способ санитарной обработки.
Применяемый в данном документе термин "вирулицид" означает средство, которое ингибирует активность вирусов или разрушает их, и является синонимом термина "вирицид". Средство, которое проявляет способность к ингибированию активности вирусов или их разрушению, описывается как обладающее "вирулицидной" активностью. Пероксикарбоновые кислоты могут обладать вирулицидной активностью. Типичные альтернативные вирулициды, известные в данной области, которые могут подходить для применения в настоящем изобретении, включают, например, спирты, эфиры, хлороформ, формальдегид, фенолы, бета-пропиолактон, йод, хлор, соли ртути, гидроксиламин, этиленоксид, этиленгликоль, соединения четвертичного аммония, ферменты и моющие средства.
Применяемый в данном документе термин "биоцид" означает химическое средство, как правило, широкого спектра действия, которое инактивирует или разрушает микроорганизмы. Химическое средство, которое проявляет способность к инактивации или разрушению микроорганизмов, описывается как обладающее "биоцидной" активностью. Пероксикарбоновые кислоты могут обладать биоцидной активностью. Типичные альтернативные биоциды, известные в данной области, которые могут подходить для применения в настоящем изобретении, включают, например, хлор, диоксид хлора, хлоризоцианураты, гипохлориты, озон, акролеин, амины, хлорированные фенольные соединения, соли меди, сероорганические соединения и соли четвертичного аммония.
Применяемая в данном документе фраза "минимальная биоцидная концентрация" означает минимальную концентрацию биоцидного средства, которая в течение конкретного времени контакта будет приводить к желаемому необратимому сокращению жизнеспособной популяции целевых микроорганизмов со смертельным эффектом. Эффективность можно измерять по снижению log10 количества жизнеспособных организмов после обработки. В одном аспекте целевое снижение количества жизнеспособных организмов после обработки составляет по меньшей мере 3-кратное снижение loq10, более предпочтительно по меньшей мере 4-кратное снижение log10 и наиболее предпочтительно по меньшей мере 5-кратное снижение log10. В другом аспекте минимальной биоцидной концентрацией является концентрация, вызывающая по меньшей мере 6-кратное снижение log10 количества жизнеспособных микробных клеток.
Применяемые в данном документе термины "пероксидный источник" и "источник пероксида" означают соединения, способные обеспечивать пероксид водорода в концентрации приблизительно 1 мМ или более, находясь в водном растворе, в том числе, но без ограничения, пероксид водорода, аддукты пероксида водорода (например, аддукт мочевины с пероксидом водорода (пероксид кармабида)), пербораты и перкарбонаты, такие как перкарбонат натрия. Описанная в данном документе концентрация пероксида водорода, обеспечиваемая пероксидным соединением в водном реакционном составе, изначально составляет по меньшей мере 1 мМ или более при объединении компонентов реакции. В одном варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 0,5 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 10 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 100 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 200 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет 500 мМ или более. В еще одном варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет 1000 мМ или более. Молярное отношение пероксида водорода к субстрату фермента, такому как триглицерид (H2O2:субстрат), в водном реакционном составе может составлять от приблизительно 0,002 до 20, предпочтительно от приблизительно 0,1 до 10 и наиболее предпочтительно от приблизительно 0,5 до 5.
Применяемый в данном документе термин "средство, оказывающее положительное воздействие" означает вещество, которое способствует полезному преимуществу, благоприятному/желаемому эффекту или положительному воздействию или усиливает таковые. В одном варианте осуществления предлагается способ, в котором средство, оказывающее положительное воздействие, такое как композиция, содержащая пероксикарбоновую кислоту, наносят на текстильное изделие или предмет одежды для осуществления желаемого положительного воздействия, такого как дезинфекция, отбеливание, обесцвечивание, дезодорация и любая их комбинация. В другом варианте осуществления вариант полипептида по настоящему изобретению, обладающий пергидролитической активностью, можно применять для получения средства, оказывающего положительное воздействие, на основе перкислоты для применения в средствах личной гигиены (таких как средства для ухода за волосами, средства для ухода за кожей, средства для ухода за ногтями или средства для ухода за полостью рта). В одном варианте осуществления предлагается средство личной гигиены, содержащее полипептид, обладающий пергидролитической активностью, при этом указанный полипептид имеет аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, 14 или 16, при условии, что аминокислотный остаток, связанный с С-концевой частью каталитического гистидина, не является глутаминовой кислотой. Средства личной гигиены составлены так, чтобы обеспечивать безопасную и эффективную концентрацию желаемого перкислотного средства, оказывающего положительное воздействие.
Применяемый в данном документе термин "средства личной гигиены" означает средства, применяемые для очистки, отбеливания и/или дезинфекции волос, кожи, кожи головы и зубов, в том числе, но без ограничения, шампуни, лосьоны для тела, гели для душа, увлажняющие средства для местного применения, зубную пасту, гели для чистки зубов, ополаскиватели для рта, средства для полоскания рта, ополаскиватели против зубного налета и/или другие очищающие средства для местного применения. В некоторых особенно предпочтительных вариантах осуществления эти средства применяют в отношении людей, в то время как в других вариантах осуществления эти средства находят применение в отношении животных, отличных от человека (например, в путях применения в ветеринарии).
Применяемые в данном документе термины "осветление зубов" и "отбеливание зубов" применяют взаимозаменяемо для обозначения улучшения яркости (например, осветления) зуба или зубов. Подразумевается, что этот термин охватывает любой способ, подходящий для осветления зубов, включая способ по настоящему изобретению, а также химическую обработку, обработку слабыми кислотами, абразивное осветление зубов и лазерное осветление зубов. В особо предпочтительных вариантах осуществления настоящее изобретение обеспечивает пергидролазу и композиции, содержащие пергидролазу, для осветления зубов.
Полипептиды, обладающие пергидролитической активностью "Сигнатурный мотив" эстераз СЕ-7, о которых ранее сообщалось, что они обладают пергидролитической активностью, содержит три консервативных субмотива (нумерация положения остатков по отношению к эталонной последовательности SEQ ID NO: 2; ацетилксиланэстеразы Thermotoga maritima дикого типа):
a) Argll8-Glyll9-Glnl20 ("мотив RGQ");
b) Glyl86-Xaal87-Serl88-Glnl89-Glyl90 ("мотив GXSQG") и
c) His303-Glu304 ("мотив НЕ").
Как правило, Хаа в положении 187 аминокислотного остатка является глицином, аланином, пролином, триптофаном или треонином. Два из трех аминокислотных остатков, принадлежащих к каталитической триаде, обозначены жирным шрифтом.
Несмотря на то что пергидролитические ферменты по настоящему изобретению содержат мотив RGQ и мотив GXSQG, ни один из пергидролитических ферментов по настоящему изобретению не содержит глутаминовую кислоту в "мотиве НЕ", ранее описанном в качестве консервативного структурного мотива, показанного в таблице А и на фигуре 1А.
По-видимому, полипептиды по настоящему изобретению, обладающие пергидролитической активностью, могут представлять новую подгруппу в более крупном родовом классе эстераз углеводов СЕ-7, указанных в качестве объектов базы данных CAZy (Cantarel et al., "The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics", NAR, 37: D233-D238 (2009)). В связи с этим полипептиды, обладающие пергидролитической активностью, применяемые в данной заявке, будут обозначаться в данном документе как "эстеразы углеводов СЕ-7" или "пергидролазы СЕ-7" даже несмотря на то, что у них может отсутствовать часть определенного ранее "сигнатурного мотива".
В другом варианте осуществления полипептиды по настоящему изобретению, обладающие пергидролитической активностью, дополнительно определяют как имеющие следующую комбинацию мотивов при выравнивании с эталонной последовательностью SEQ ID NO: 2 (нумерация положения остатков по отношению к эталонной последовательности SEQ ID NO: 2; ацетилксиланэстеразы Thermotoga maritima дикого типа):
a) Arg118-Gly119-Gln120 ("мотив RGQ");
b) Gly186-Xaa187-Ser188-Gln189-Gly190 ("мотив GXSQG") и
c) His303-Xaa304 ("мотив НХ"); где "Хаа" не является глутаминовой кислотой.
В предпочтительном аспекте аминокислотным остатком "X" в "мотиве НХ" является аланин, аспарагиновая кислота или серин.
В другом аспекте полипептид по настоящему изобретению, обладающий пергидролитической активностью, содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 12, 14 и 16, при условии, что аминокислотный остаток, связанный с С-концевой частью каталитического гистидина, не является глутаминовой кислотой.
В одном варианте осуществления полипептиды по настоящему изобретению, обладающие пергидролитической активностью, обладают по меньшей мере 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 84, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичностью по отношению к последовательностям, предложенным в данном документе, при условии, что аминокислотный остаток, связанный с С-концевой частью каталитического гистидина, не является глутаминовой кислотой.
В другом аспекте полипептид по настоящему изобретению, обладающий пергидролитической активностью, содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с С-концевой частью каталитического гистидина, не является глутаминовой кислотой. В другом аспекте полипептид по настоящему изобретению, обладающий пергидролитической активностью, содержит аминокислотную последовательность SEQ ID NO: 4.
Применяемый в данном документе термин "вариант пергидролазы" или "вариант" будут обозначать пергидролитические ферменты, имеющие модификацию, которая приводит по меньшей мере к одному случаю добавления, удаления и/или замены аминокислоты по сравнению с соответствующим ферментом (как правило, ферментом дикого типа), из которого этот вариант был получен, при условии, что сохраняются необходимые мотивы, описанные в данном документе, и связанная с ними пергидролитическая активность. Варианты пергидролаз СЕ-7 также можно применять в композициях и способах по настоящему изобретению. Примеры вариантов предложены в виде SEQ ID NO: 14 и 16.
Специалист в данной области понимает, что в композициях и способах по настоящему изобретению также можно применять по существу аналогичные последовательности пергидролаз. В одном варианте осуществления по существу аналогичные последовательности определяют по их способности к гибридизации в условиях высокой жесткости с молекулами нуклеиновых кислот, связанных с последовательностями, приведенными в качестве примера в данном документе. В другом варианте осуществления для определения по существу аналогичных ферментов на основе выявления процентной идентичности по отношению к последовательностям ДНК или аминокислотным таковым, предложенным в данном документе, можно применять алгоритмы выравнивания последовательностей.
Как применяется в данном документе, молекула нуклеиновой кислоты "поддается гибридизации" с другой молекулой нуклеиновой кислоты, такой как кДНК, геномная ДНК или РНК, если одна цепь первой молекулы может подвергаться отжигу с другой молекулой при подходящих условиях температуры и ионной силе раствора. Условия гибридизации и отмывки хорошо известны и проиллюстрированы на примере в Sambrook, J. and Russell, D., Т. Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor (2001). Условия температуры и ионной силы определяют "жесткость" гибридизации. Условия жесткости можно корректировать для скрининга в отношении от молекул, обладающих незначительных сходством, таких как гомологичные последовательности организмов с отдаленным родством, до весьма сходных молекул, таких как гены, посредством которых дублируются функциональные ферменты близкородственных организмов. Условия жесткости обычно определяют отмывки после гибридизации. При одном наборе предпочтительных условий применяются серии отмывок, причем начинают с 6Х SSC, 0,5% SDS при комнатной температуре в течение 15 мин, затем повторяют с 2Х SSC, 0,5% SDS при 45°C в течение 30 мин, а затем дважды повторяют с 0,2Х SSC, 0,5% SDS при 50°C в течение 30 мин. При более предпочтительном наборе условий применяются более высокие температуры, при которых отмывки идентичны отмывкам, указанным выше, за исключением того, что температуру двух заключительных отмывок в течение 30 мин с помощью 0,2Х SSC, 0,5% SDS повышают до 60°C. Другим предпочтительным набором условий гибридизации высокой жесткости является 0,1X SSC, 0,1% SDS при 65°C и отмывка с помощью 2Х SSC, 0,1% SDS с последующей заключительной отмывкой с помощью 0,1Х SSC, 0,1% SDS при 65°C.
Для гибридизации требуется, чтобы две нуклеиновые кислоты содержали комплементарные последовательности, хотя в зависимости от жесткости гибридизации возможны несовпадения между основаниями. Подходящая жесткость гибридизации нуклеиновых кислот зависит от длины нуклеиновых кислот и степени комплементарности, переменных, хорошо известных в данной области техники. Чем больше степень сходства или гомологии между двумя нуклеотидными последовательностями, тем больше значение Tm для гибридов нуклеиновых кислот, имеющих эти последовательности. Относительная стабильность (соответствующая более высокому значению Tm) гибридизации нуклеиновых кислот снижается в следующем порядке: РНК:РНК, ДНК:РНК, ДНК:ДНК. Для гибридов длиной более чем 100 нуклеотидов были получены уравнения для расчета Tm (Sambrook and Russell, выше). Для гибридизации с более короткими нуклеиновыми кислотами, т.е. олигонуклеотидами, положение несовпадений становится более важным, а длина олигонуклеотида определяет его специфичность (Sambrook and Russell, выше). В одном аспекте длина нуклеиновой кислоты, поддающейся гибридизации, составляет по меньшей мере приблизительно 10 нуклеотидов. Предпочтительно, минимальная длина нуклеиновой кислоты, поддающейся гибридизации, составляет по меньшей мере 15 нуклеотидов в длину, более предпочтительно по меньшей мере приблизительно 20 нуклеотидов в длину, еще более предпочтительно по меньшей мере 30 нуклеотидов в длину, еще более предпочтительно по меньшей мере 300 нуклеотидов в длину и наиболее предпочтительно по меньшей мере 800 нуклеотидов в длину. Также специалисту в данной области будет понятно, что температуру и концентрацию солей в отмывающем растворе можно при необходимости корректировать в зависимости от факторов, таких как длина зонда.
Применяемый в данном документе термин "процентная идентичность" представляет собой взаимосвязь между двумя или более последовательностями полипептидов или двумя или более последовательностями полинуклеотидов, определяемую посредством сравнения последовательностей. В данной области техники "идентичность" также в определенных случаях означает степень родства последовательностей между последовательностями полипептидов и полинуклеотидов, определяемую совпадением между нитями таких последовательностей. "Идентичность" и "сходство" можно легко рассчитать с помощью известных способов, включая, но без ограничения, таковые, описанные в: Computational Molecular Biology (Lesk, A.M., ed.) Oxford University Press, NY (1988); Biocomputing: Informatics and Genome Projects (Smith, D.W., ed.) Academic Press, NY (1993); Computer Analysis of Sequence Data, Part I (Griffin, A.M., and Griffin, H.G., eds.) Humana Press, NJ (1994); Sequence Analysis in Molecular Biology (von Heinje, G., ed.) Academic Press (1987); и Sequence Analysis Primer (Gribskov, M. and Devereux, J., eds.) Stockton Press, NY (1991). Способы определения идентичности и сходства закреплены в общедоступных компьютерных программах. Выравнивания последовательностей и расчеты процентной идентичности можно выполнять с помощью программы Megalign из пакета программ для биоинформационных вычислений LASERGENE (DNASTAR Inc., Мэдисон, Висконсин), программы AlignX из Vector NTI v. 7.0 (Informax, Inc., Бетесда, Мэриленд) или пакета открытого программного обеспечения EMBOSS (EMBL-EBI; Rice et al., Trends in Genetics 16, (6): 216-211 (2000)). Множественное выравнивание последовательностей можно выполнить с помощью способа выравнивания CLUSTAL (такого как CLUSTALW; например, версии 1.83) (Higgins and Sharp, CABIOS, 5: 151-153 (1989); Higgins et al., Nucleic Acids Res. 22: 4673-4680 (1994); и Chenna et al., Nucleic Acids Res 31 (13): 3497-500 (2003)), доступного от Европейской молекулярно-биологической лаборатории через Европейский институт биоинформатики) с параметрами по умолчанию. Подходящие параметры для выравнивания белковых последовательностей в CLUSTALW включают: штраф за открытие гэпа = 15, штраф за продолжение гэпа = 0,2, матрица = Gonnet (например, Gonnet250), штраф за концевой гэп в белковой последовательности = -1, расстояние между гэпами в белковой последовательности = 4 и KTUPLE = 1. В одном варианте осуществления применяется быстрое или медленное выравнивание с установками по умолчанию, причем предпочтительным является медленное выравнивание. Альтернативно, параметры, применяемые в способе CLUSTALW (например, версии 1.83), можно модифицировать с применением также следующих: KTUPLE = 1, штраф за открытие гэпа = 10, штраф за продолжение гэпа = 1, матрица = BLOSUM (например, BLOSUM64), размер окна=5 и сохраненные лучшие диагонали = 5.
Под "каталитическим гистидином" подразумевается гистидиновый остаток в раскрытых в настоящем изобретении пергидролазах, который образует каталитическую триаду с серином и аспарагиновой кислотой. Например, в SEQ ID NO: 4 каталитическим гистидином является аминокислотный остаток с номером 302. Вариант SEQ ID NO: 4, обладающий пергидролазной активностью, будет иметь его каталитический гистидин, выравненный с каталитическим гистидином SEQ ID NO: 4, где последовательности сравнивают с помощью CLUSTALW, что означает, что каталитический гистидин варианта может, но не должен, находиться в положении аминокислоты 302 в варианте.
В одном аспекте подходящие выделенные молекулы нуклеиновых кислот кодируют полипептид, имеющий аминокислотную последовательность, являющуюся по меньшей мере на 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 84, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичной по отношению к аминокислотным последовательностям, описанным в данном документе. Подходящие молекулы нуклеиновых кислот не только обладают вышеуказанной гомологией, но также, как правило, кодируют полипептид, имеющий длину от приблизительно 210 до 340 аминокислот, от приблизительно 300 до приблизительно 340 аминокислот, предпочтительно от приблизительно 310 до приблизительно 330 аминокислот и наиболее предпочтительно от приблизительно 318 до приблизительно 325 аминокислот, где каждый полипептид характеризуется как обладающий пергидролитической активностью.
Подходящие условия реакции для катализируемого ферментами получения пероксикарбоновых кислот из сложных эфиров карбоновых кислот и пероксида водорода
Предлагается способ получения водного состава, содержащего по меньшей мере одну пероксикарбоновую кислоту, путем введения в реакцию сложных эфиров карбоновых кислот и неорганического пероксида (такого как пероксид водорода, перборат натрия или перкарбонат натрия) в присутствии ферментативного катализатора, обладающего пергидролитической активностью, где ферментативный катализатор в одном варианте осуществления содержит полипептид, обладающий по меньшей мере 80% идентичностью по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 4, 6, 8, 10, 12, 14 и 16, при условии, что аминокислотный остаток, связанный с С-концевой частью каталитического гистидина, не является глутаминовой кислотой. В дополнительном варианте осуществления полипептид, обладающий пергидролитической активностью, содержит аминокислотную последовательность, выбранную из SEQ ID NO: 4, 6, 8, 10, 12, 14 и 16. В дополнительном варианте осуществления полипептид имеет аминокислотную последовательность SEQ ID NO: 4.
В одном варианте осуществления подходящие субстраты включают один или несколько сложных эфиров, представленных следующей формулой:
[X]mR5,
где
X = сложноэфирная группа формулы R6-C(O)O;
R6 = линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6=C2-C7;
R5 = линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m = целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C.
В другом варианте осуществления R6 = линейный гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, необязательно содержащий одну или несколько эфирных связей. В дополнительном предпочтительном варианте осуществления R6 = линейный гидрокарбильный C2-C7-фрагмент, необязательно замещенный гидроксильными группами и/или необязательно содержащий одну или несколько эфирных связей.
В одном варианте осуществления подходящий субстрат может включать 2-ацетоксибензойную кислоту, 3-ацетоксибензойную кислоту, 4-ацетоксибензойную кислоту или их смеси.
В другом варианте осуществления подходящие субстраты также включают один или несколько глицеридов формулы:
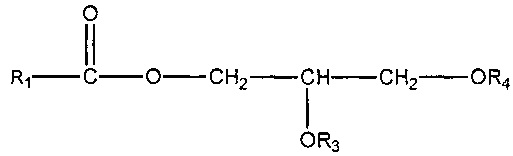 ,
,
где R1 = неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R3 и R4 в отдельности представляют собой H или R1C(O). В одном варианте осуществления подходящим субстратом является глицерид приведенной выше формулы, где R1 = неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R3 и R4 в отдельности представляют собой H или R1C(O).
В другом аспекте подходящие субстраты также могут включать один или несколько сложных эфиров формулы:
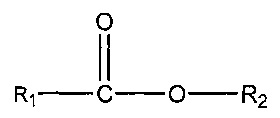 ,
,
где R1 = неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, a R2 = неразветвленный или разветвленный C1-C10-алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)n или (CH2CH(CH3)-O)nH и n равно от 1 до 10.
Пригодные субстраты также могут включать один или несколько ацилированных сахаридов, выбранных из группы, состоящей из ацилированных моно-, ди- и полисахаридов. В другом варианте осуществления ацилированные сахариды выбраны из группы, состоящей из ацетилированного ксилана, фрагментов ацетилированного ксилана, ацетилированной ксилозы (как, например, тетраацетат ксилозы), ацетилированной глюкозы (как, например, пентаацетат α-D-глюкозы; пентаацетат β-D-глюкозы); пентаацетата β-D-галактозы, гексаацетата сорбита, октаацетата сахарозы, 1,2,3,5-тетраацетата β-D-рибофуранозы, три-O-ацетил-D-галакталя, три-O-ацетил-D-глюкаля, тетраацетилксилофуранозы, пентаацетата α-D-глюкопиранозы, пентаацетата α-D-маннопиранозы и ацетилированной целлюлозы. В предпочтительном варианте осуществления ацетилированный сахарид выбран из группы, состоящей из 1,2,3,5-тетраацетата β-D-рибофуранозы, три-O-ацетил-D-галакталя, три-O-ацетил-D-глюкаля, октаацетата сахарозы и ацетилированной целлюлозы.
В другом варианте осуществления подходящие субстраты выбраны из группы, состоящей из моноацетина; диацетина; триацетина; монопропионина; дипропионина; трипропионина; монобутирина; дибутирина; трибутирина; пентаацетата глюкозы; тетраацетата ксилозы; ацетилированного ксилана; фрагментов ацетилированного ксилана; 1,2,3,5-тетраацетата β-D-рибофуранозы; три-O-ацетил-D-галакталя; три-O-ацетил-D-глюкаля; сложных моноэфиров или сложных диэфиров 1,2-этандиола, 1,2-пропандиола, 1,3-пропандиола, 1,2-бутандиола, 1,3-бутандиола, 2,3-бутандиола, 1,4-бутандиола, 1,2-пентандиола, 2,5-пентандиола, 1,6-пентандиола, 1,2-гександиола, 2,5-гександиола, 1,6-гександиола и их смесей.
В другом варианте осуществления сложный эфир карбоновой кислоты выбран из группы, состоящей из моноацетина, диацетина, триацетина и их комбинаций. В другом варианте осуществления субстратом является полиол C1-C6, содержащий одну или несколько сложноэфирных групп. В предпочтительном варианте осуществления одна или несколько гидроксильных групп полиола C1-C6 замещены одной или несколькими ацетоксигруппами (как, например, в случае диацетата 1,3-пропандиола, диацетата 1,4-бутандиола и др.). В дополнительном варианте осуществления субстратом является диацетат пропиленгликоля (PGDA), диацетат этиленгликоля (EGDA) или их смесь.
В другом варианте осуществления подходящие субстраты выбраны из группы, состоящей из этилацетата; метиллактата; этиллактата; метилгликолята; этилгликолята; метилметоксиацетата; этилметоксиацетата; метил-3-гидроксибутирата; этил-3-гидроксибутирата; триэтил-2-ацетилцитрата; пентаацетата глюкозы; глюконолактона; глицеридов (моно-, ди и триглицеридов), таких как моноацетин, диацетин, триацетин, монопропионин, дипропионин (глицерилдипропионат), трипропионин (1,2,3-трипропионилглицерол), монобутирин, дибутирин (глицерилдибутират), трибутирин (1,2,3-трибутирилглицерол); ацетилированных сахаридов и их смесей.
В дополнительном варианте осуществления подходящие субстраты выбраны из группы, состоящей из моноацетина, диацетина, триацетина, монопропионина, дипропионина, трипропионина, монобутирина, дибутирина, трибутирина, этилацетата и этиллактата. В еще одном аспекте субстрат выбран из группы, состоящей из диацетина, триацетина, этилацетата и этиллактата. В наиболее предпочтительном варианте осуществления подходящий субстрат включает в себя триацетин.
Сложный эфир карбоновой кислоты находится в водном реакционном составе в концентрации, достаточной для получения желаемой концентрации пероксикарбоновой кислоты в результате катализируемого ферментами пергидролиза. Сложный эфир карбоновый кислоты не должен быть полностью растворимым в водном реакционном составе, но имеет достаточную растворимость для того, чтобы способствовать превращению сложного эфира с помощью пергидролазного катализатора в соответствующую пероксикарбоновую кислоту. Сложный эфир карбоновой кислоты находится в водном реакционном составе в концентрации от 0,0005 вес. % до 40 вес. % водного реакционного состава, предпочтительно в концентрации от 0,01 вес. % до 20 вес. % водного реакционного состава и более предпочтительно в концентрации от 0,05 вес. % до 10 вес. % водного реакционного состава. Вес.% сложного эфира карбоновой кислоты может необязательно превышать предел растворимости сложного эфира карбоновой кислоты, так, чтобы концентрация сложного эфира карбоновой кислоты составляла по меньшей мере 0,0005 вес. % в водном реакционном составе, который состоит из воды, ферментативного катализатора и источника пероксида, где остаток сложного эфира карбоновой кислоты сохраняется в качестве второй отдельной фазы двухфазного водного/органического реакционного состава. Не весь добавленный сложный эфир карбоновой кислоты должен незамедлительно растворяться в водном реакционном составе, и после начального смешивания всех компонентов реакции дополнительное непрерывное или периодическое смешивание является необязательным.
Пероксикарбоновые кислоты, получаемые с помощью компонентов реакции согласно настоящему изобретению, могут отличаться в зависимости от выбранных субстратов при условии применения ферментативного катализатора по настоящему изобретению. В одном варианте осуществления получаемой пероксикарбоновой кислотой является перуксусная кислота, перпропионовая кислота, пермасляная кислота, пероктановая кислота, пермолочная кислота, пергликолевая кислота, перметоксиуксусная кислота, пер-β-гидроксимасляная кислота или их смеси.
Пероксидный источник может включать, но без ограничения, пероксид водорода, аддукты пероксида водорода (например, аддукт мочевины с пероксидом водорода (пероксид карбамида)), перборатные соли и перкарбонатные соли. Альтернативно, пероксид водорода может образовываться in situ посредством реакции субстрата и кислорода, катализируемой ферментом, обладающим оксидазной активностью (включая, но без ограничения, глюкозооксидазу, галактозооксидазу, сорбитоксидазу, гексозооксидазу, алкогольоксидазу, глицеролоксидазу, моноаминоксидазу, гликолятоксидазу, лактатоксидазу, пируватоксидазу, оксалатоксидазу, холиноксидазу, холестериноксидазу, пиранозооксидазу, карбоксиалкогольоксидазу, оксидазу L-аминокислот, глициноксидазу, глутаматоксидазу, лизиноксидазу и уриказу). Концентрация пероксидного соединения в водном реакционном составе может варьировать в диапазоне от 0,0033 вес. % до приблизительно 50 вес. %, предпочтительно от 0, 033 вес. % до приблизительного вес. %, более предпочтительно от 0,33 вес. % до приблизительно 30 вес. %.
Сообщалось, что многие пергидролазные катализаторы (такие как целые клетки, клетки с нарушенной проницаемостью мембраны и частично очищенные экстракты целых клеток) обладают каталазной активностью (ЕС 1.11.1.6). Каталазы катализируют превращение пероксида водорода в кислород и воду. В одном аспекте у ферментативного катализатора, обладающего пергидролазной активностью, отсутствует каталазная активность. В другом аспекте ферментативный катализатор, обладающий пергидролазной активностью, обладает достаточно низкой каталазной активностью, поэтому наличие указанной каталазной активности в значительной степени не препятствует катализируемому пергидролазами получению пероксикарбоновой кислоты. В другом аспекте к водному реакционному составу добавляют ингибитор каталазы. Примеры ингибиторов каталазы включают, но без ограничения, азид натрия и гидроксиламинсульфат. Специалист в данной области при необходимости может скорректировать концентрацию ингибитора каталазы. Концентрация ингибитора каталазы, как правило, варьирует в диапазоне от 0,1 мМ до приблизительно 1 М; предпочтительно от приблизительно 1 мМ до приблизительно 50 мМ; более предпочтительно от приблизительно 1 мМ до приблизительно 20 мМ. В одном аспекте концентрация азида натрия, как правило, варьирует в диапазоне от приблизительно 20 мМ до приблизительно 60 мМ, в то время как концентрация гидроксиламинсульфата, как правило, составляет от приблизительно 0,5 мМ до приблизительно 30 мМ, предпочтительно приблизительно 10 мМ.
Каталазную активность в клетке-хозяине можно снизить или подавить путем нарушения экспрессии гена (генов), отвечающего (отвечающих) за каталазную активность, с помощью хорошо известных способов, включая, но без ограничения, транспозонный мутагенез, экспрессию антисмысловых РНК, направленный мутагенез и случайный мутагенез. В предпочтительном варианте осуществления ген(ы), отвечающий(отвечающие) за активность эндогенной каталазы, характеризуются пониженной или нарушенной экспрессией (т.е. "подвергнут(ы) нокауту"). Как применяется в данном документе, ген с "нарушенной экспрессией" является геном, больше не обеспечивающим активность и/или функцию белка, кодируемого модифицированным геном. Средства нарушения экспрессии гена хорошо известны в данной области техники и могут включать, но без ограничения, вставки, делеции и мутации гена, при условии, что активность и/или функция соответствующего белка больше не обеспечивается. В дополнительном предпочтительном варианте осуществления организмом-источником является организм-источник Е. coli, содержащий ген каталазы с нарушенной экспрессией, выбранный из группы, состоящей из katG и katE (см. патент США 7951566 DiCosimo et al.). В другом варианте осуществления организмом-источником является штамм Е. coli, характеризующийся пониженной и/или нарушенной экспрессией как гена каталазы katG, так и гена каталазы katE. Штамм Е. coli, характеризующийся двойным нокаутом katG и icatE, был получен и описан как штамм KLP18 Е. coli (патент США 7951566 DiCosimo et al.).
Концентрация катализатора в водном реакционном составе зависит от конкретной каталитической активности катализатора и выбирается для получения желаемой скорости реакции. Масса катализатора в реакциях пергидролиза, как правило, варьирует в диапазоне от 0,0001 мг до 50 мг на мл общего объема реакционной смеси, предпочтительно от 0,0005 мг до 10 мг на мл, более предпочтительно от 0,0010 мг до 2,0 мг на мл. Катализатор также может быть иммобилизован на растворимой или нерастворимой подложке с помощью способов, хорошо известных специалистам в данной области; см., например, Immobilization of Enzymes and Cells (2nd Edition); Jose M. Guisan, Editor; Humana Press, Totowa, NJ, USA; 2006. Применение иммобилизованных катализаторов позволяет производить извлечение и повторное применение катализаторов в последующих реакциях. Ферментативный катализатор может быть в виде целых микробных клеток, микробных клеток с нарушенной проницаемостью мембраны, экстрактов микробных клеток, частично очищенных или очищенных ферментов и их смесей.
В одном аспекте концентрация пероксикарбоновой кислоты, образованной с помощью комбинации химического пергидролиза и ферментативного пергидролиза сложного эфира карбоновых кислот, достаточна для получения эффективной концентрации пероксикарбоновой кислоты для дезинфекции, отбеливания, санитарной обработки, дезодорации или обесцвечивания при желаемом уровне pH. В другом аспекте пероксикарбоновая кислота образуется в безопасной и эффективной концентрации, подходящей для применения в средстве личной гигиены для нанесения на волосы, кожу, ногти или ткани полости рта, такие как зубная эмаль, зубной налет или десны. В другом аспекте способы по настоящему изобретению обеспечивают комбинации ферментов и субстратов ферментов для получения желаемой эффективной концентрации пероксикарбоновой кислоты, в которых в отсутствие добавляемого фермента получают пероксикарбоновую кислоту в значительно более низкой концентрации. Несмотря на то, что посредством прямой химической реакции неорганического пероксида с субстратом фермента может в некоторой степени происходить химический пергидролиз субстрата фермента, концентрация образованной пероксикарбоновой кислоты может быть недостаточной для обеспечения эффективной концентрации пероксикарбоновой кислоты в желаемых путях применения, и значительного повышения общей концентрации пероксикарбоновой кислоты достигают путем добавления соответствующего пергидролазного катализатора к водному реакционному составу.
В одном аспекте настоящего изобретения концентрация пероксикарбоновой кислоты (например, перуксусной кислоты), образованной с помощью ферментативного пергидролиза в течение 5 минут, более предпочтительно в течение 1 минуты после начала реакции ферментативного пергидролиза, составляет по меньшей мере приблизительно 2 ч./млн, предпочтительно по меньшей мере 20 ч./млн, предпочтительно по меньшей мере 100 ч./млн, более предпочтительно по меньшей мере приблизительно 200 ч./млн пероксикарбоновой кислоты, более предпочтительно по меньшей мере 300 ч./млн, более предпочтительно по меньшей мере 500 ч./млн, более предпочтительно по меньшей мере 700 ч./млн, более предпочтительно по меньшей мере приблизительно 1000 ч./млн пероксикарбоновой кислоты, более предпочтительно по меньшей мере приблизительно 2000 ч./млн пероксикарбоновой кислоты, наиболее предпочтительно по меньшей мере 10000 ч./млн пероксикарбоновой кислоты. Во втором аспекте настоящего изобретения концентрация пероксикарбоновой кислоты (например, перуксусной кислоты), образованной с помощью ферментативного пергидролиза в течение 5 минут, более предпочтительно в течение 1 минуты после начала реакции ферментативного пергидролиза (т.е. времени, измеренного с момента объединения компонентов реакции до образования состава), составляет по меньшей мере приблизительно 2 ч./млн, предпочтительно по меньшей мере 20 ч./млн, предпочтительно по меньшей мере 30 ч./млн, более предпочтительно по меньшей мере приблизительно 40 ч./млн пероксикарбоновой кислоты, более предпочтительно по меньшей мере 50 ч./млн, более предпочтительно по меньшей мере 60 ч./млн, более предпочтительно по меньшей мере 70 ч./млн, более предпочтительно по меньшей мере приблизительно 80 ч./млн пероксикарбоновой кислоты, наиболее предпочтительно по меньшей мере 100 ч./млн пероксикарбоновой кислоты.
Водный состав, содержащий пероксикарбоновую кислоту, можно необязательно разбавить разбавителем, содержащим воду, или раствором, преимущественно состоящим из воды, с получением состава с желаемой более низкой целевой концентрацией пероксикарбоновой кислоты. В одном аспекте время реакции, необходимое для получения желаемой концентрации (или диапазона концентраций) пероксикарбоновой кислоты, составляет приблизительно 20 минут или менее, предпочтительно приблизительно 5 минут или менее, наиболее предпочтительно приблизительно 1 минуту или менее.
В других аспектах поверхность или неживой объект, загрязненные скоплением биологического(биологических) загрязнителя(загрязнителей), приводят в контакт с пероксикарбоновой кислотой, образованной в соответствии со способами, описанными в данном документе, в течение от приблизительно 1 минуты до приблизительно 168 часов после объединения указанных компонентов реакции, или в течение от приблизительно 1 минуты до приблизительно 48 часов, или в течение от приблизительно 1 минуты до 2 часов после объединения указанных компонентов реакции, или в течение любого такого промежутка времени в пределах указанных в данном документе значений.
В другом аспекте пероксикарбоновую кислоту, образованную в соответствии со способами, описанными в данном документе, применяют в пути применения в уходе за бельем, где пероксикарбоновую кислоту приводят в контакт с бельем или текстильным изделием для обеспечения положительного воздействия, такого так дезинфекция, отбеливание, обесцвечивание, дезодорация и/или их комбинация. Пероксикарбоновую кислоту можно применять в ряде средств для ухода за бельем, включая, но без ограничения, замачиватели белья и текстильных изделий, стиральные порошки или моющие добавки, пятновыводители, отбеливающие композиции, дезодорирующие композиции и ополаскиватели для одежды. В одном варианте осуществления способ по настоящему изобретению для получения пероксикарбоновой кислоты для целевой поверхности выполняют in situ.
В контексте путей применения в уходе за одеждой термин "приведение в контакт предмета одежды или текстильного изделия" означает, что предмет одежды или текстильное изделие подвергаются воздействию состава, раскрытого в данном документе. В связи с этим существует ряд форматов, в которых можно применять состав для обработки предметов одежды или текстильных изделий, включая, но без ограничения, жидкость, твердые вещества, гель, пасту, пластинки, таблетки, спрей, пену, порошок или гранулы, и можно доставлять посредством ручного дозирования, порционного дозирования, дозирования из субстрата, распыления или автоматического дозирования из стиральной машины или сушильной машины. Гранулированные композиции также могут быть в компактной форме; жидкие композиции также могут быть в концентрированной форме.
Если составы, раскрытые в данном документе, применяют в стиральной машине, то состав может дополнительно содержать компоненты, типичные для стиральных порошков. Например, типичные компоненты включают, но без ограничения, поверхностно-активные вещества, отбеливающие средства, активаторы отбеливания, дополнительные ферменты, пеногасители, диспергаторы, диспергаторы кальциевых мыл, средства для суспендирования и против повторного осаждения загрязнений, размягчители, ингибиторы коррозии, ингибиторы потускнения, гермициды, средства для регулирования уровня pH, источники щелочности, не являющиеся моющими компонентами, хелатообразователи, органические и/или неорганические заполнители, растворители, гидротропные вещества, оптические отбеливатели, красители и отдушки. Составы, раскрытые в данном документе, также можно применять в твердой или жидкой форме в качестве моющих добавок. Подразумевается, что такие добавки дополнят или повысят функциональные характеристики стандартных моющих композиций и могут добавляться на любой стадии процесса очистки.
Применительно к системам и способам для ухода за бельем по настоящему изобретению, в которых перкислота образуется для одного или нескольких из отбеливания, выведения пятен и уменьшения запаха, концентрация перкислоты (например, перуксусной кислоты), образованной посредством пергидролиза по меньшей мере одного сложного эфира карбоновой кислоты, может составлять по меньшей мере приблизительно 2 ч./млн, предпочтительно по меньшей мере 20 ч./млн, предпочтительно по меньшей мере 100 ч./млн и более предпочтительно по меньшей мере приблизительно 200 ч./млн перкислоты. Применительно к системам и способам для ухода за бельем по настоящему изобретению, в которых перкислота образуется для дезинфекции или санитарной обработки, концентрация перкислоты (например, перуксусной кислоты), образованной посредством пергидролиза по меньшей мере одного сложного эфира карбоновой кислоты в течение 10 минут, предпочтительно в течение 5 минут и наиболее предпочтительно в течение 1 минуты после начала реакции пергидролиза, может составлять по меньшей мере приблизительно 2 ч./млн, более предпочтительно по меньшей мере 20 ч./млн, более предпочтительно по меньшей мере 200 ч./млн, более предпочтительно по меньшей мере 500 ч./млн, более предпочтительно по меньшей мере 700 ч./млн, более предпочтительно по меньшей мере приблизительно 1000 ч./млн перкислоты, наиболее предпочтительно по меньшей мере 2000 ч./млн перкислоты. Полученный состав, содержащий перкислоту, можно необязательно разбавить водой или раствором, преимущественно состоящим из воды, с получением состава с желаемой более низкой целевой концентрацией перкислоты. В одном аспекте способов и систем по настоящему изобретению время реакции, необходимое для получения желаемой концентрации перкислоты, составляет не более чем приблизительно два часа, предпочтительно не более чем приблизительно 30 минут, более предпочтительно не более чем приблизительно 10 минут, еще более предпочтительно не более чем приблизительно 5 минут и наиболее предпочтительно приблизительно 1 минуту или менее.
Для контроля как скорости реакции, так и стабильности активности ферментативного катализатора выбирают температуру реакции. Температура реакции может варьировать в диапазоне от немного превышающей температуру замерзания водного реакционного состава (приблизительно 0°C) до приблизительно 85°C, при этом предпочтительный диапазон температуры реакции составляет от приблизительно 5°C до приблизительно 75°C.
pH водного реакционного состава при получении пероксикарбоновой кислоты ферментативным путем поддерживается при pH, варьирующем в диапазоне от приблизительно 5,0 до приблизительно 10,0, предпочтительно от приблизительно 6,5 до приблизительно 8,5 и даже еще более предпочтительно от приблизительно 6,5 до приблизительно 7,5. В одном варианте осуществления pH водного реакционного состава варьирует в диапазоне от приблизительно 6,5 до приблизительно 8,5 в течение по меньшей мере 30 минут после объединения компонентов реакции. pH водного реакционного состава можно корректировать или контролировать с помощью добавления или включения подходящего буфера, включая, но без ограничения, фосфатный, пирофосфатный, бикарбонатный, ацетатный или цитратный буфер. В одном варианте осуществления буфер выбран из фосфатного буфера, бикарбонатного буфера или буфера, образованного путем объединения жесткой воды (водопроводной воды для моделирования путей применения в уходе за бельем) и перкарбоната (из перкарбоната натрия, применяемого для образования пероксида водорода). При применении концентрация буфера, как правило, составляет от 0,1 мМ до 1,0 М; предпочтительно от 1 мМ до 300 мМ; наиболее предпочтительно от 10 мМ до 100 мМ. В другом аспекте настоящего изобретения при получении пероксикарбоновой кислоты ферментативным путем к реакционной смеси не добавляют буфер.
В еще одном аспекте водный реакционный состав для ферментативного пергидролиза может содержать органический растворитель, который действует в качестве диспергатора для повышения скорости растворения сложного эфира карбоновой кислоты в водном реакционном составе. Такие растворители включают, но без ограничения, метиловый эфир пропиленгликоля, ацетон, циклогексанон, бутиловый эфир диэтиленгликоля, метиловый эфир трипропиленгликоля, метиловый эфир диэтиленгликоля, бутиловый эфир пропиленгликоля, метиловый эфир дипропиленгликоля, циклогексанол, бензиловый спирт, изопропанол, этанол, пропиленгликоль и их смеси.
В другом аспекте продукт ферментативного пергидролиза может содержать дополнительные компоненты, которые обеспечивают желаемые функциональные характеристики. Эти дополнительные компоненты включают, но без ограничения, буферы, моющие компоненты моющих средств, загустители, эмульгаторы, поверхностно-активные вещества, смачивающие средства, ингибиторы коррозии (например, бензотриазол), стабилизаторы ферментов и стабилизаторы пероксида (например, хелатообразователи для ионов металлов). Многие из дополнительных компонентов хорошо известны в производстве моющих средств (см., например, патент США 5932532, включенный в данный документ посредством ссылки). Примеры эмульгаторов включают, но без ограничения, поливиниловый спирт или поливинилпирролидон. Примеры загустителей включают, но без ограничения, LAPONITE® RD (синтетический слоистый силикат), кукурузный крахмал, PVP, CARBOWAX® (полиэтиленгликоль и/или метоксипропиленгликоль), CARBOPOL® (сшитый полимер на основе акрилатов), CABOSIL® (синтетический аморфный высокодисперсный диоксид кремния), полисорбат 20, PVA и лецитин. Примеры буферных систем включают, но без ограничения, одноосновный фосфат натрия/двухосновный фосфат натрия; сульфаминовую кислоту/триэтаноламин; лимонную кислоту/триэтаноламин; винную кислоту/триэтаноламин; янтарную кислоту/триэтаноламин и уксусную кислоту/триэтаноламин. Примеры поверхностно-активных веществ включают, но без ограничения, a) неионогенные поверхностно-активные вещества, такие как блок-сополимеры этиленоксида или пропиленоксида, этоксилированные и пропоксилированные линейные и разветвленные первичные и вторичные спирты и алифатические фосфиноксиды; b) катионные поверхностно-активные вещества, такие как соединения четвертичного аммония, в частности соединения четвертичного аммония, имеющие алкильную группу C8-C20, связанную с атомом азота, дополнительно связанным с тремя алкильными группами C1-C2; с) анионные поверхностно-активные вещества, такие как алкановые карбоновые кислоты (например, жирные кислоты C8-C20), алкилфосфонаты, алкансульфонаты (например, додецилсульфат натрия "SDS") или линейные или разветвленные алкилбензолсульфонаты, алкенсульфонаты; и d) амфотерные и цвиттер-ионные поверхностно-активные вещества, такие как аминокарбоновые кислоты, аминодикарбоновые кислоты, алкилбетаины и их смеси. Дополнительные компоненты могут включать ароматизаторы, красители, стабилизаторы пероксида водорода (например, металлохелаты, такие как 1-гидроксиэтилиден-1,1-дифосфоновая кислота (DEQUEST® 2010, Solutia Inc., Сент-Луис, Миссури) и этилендиаминтетрауксусная кислота (EDTA)), TURPINAL® SL (этидроновая кислота), DEQUEST® 0520 (фосфонат), DEQUEST® 0531 (фосфонат), стабилизаторы активности ферментов (например, полиэтиленгликоль (PEG)) и моющие компоненты моющих средств.
В другом аспекте продукт ферментативного пергидролиза можно предварительно перемешать с образованием желаемой концентрации пероксикарбоновой кислоты перед контактом с поверхностью или неживым объектом, которые необходимо дезинфицировать.
В другом аспекте продукт ферментативного гидролиза не подвергают предварительному перемешиванию с образованием желаемой концентрации пероксикарбоновой кислоты перед контактом с поверхностью или неживым объектом, которые необходимо дезинфицировать, однако вместо этого компоненты водного реакционного состава, которые обеспечивают образование желаемой концентрации пероксикарбоновой кислоты, приводят в контакт с поверхностью или неживым объектом, которые необходимо дезинфицировать, и/или отбелить, или обесцветить, с образованием желаемой концентрации пероксикарбоновой кислоты. В некоторых вариантах осуществления компоненты водного реакционного состава объединяют или смешивают в месте воздействия. В некоторых вариантах осуществления компоненты реакции доставляют в место воздействия или наносят на него и впоследствии смешивают или объединяют с образованием желаемой концентрации пероксикарбоновой кислоты.
Получение пероксикарбоновых кислот с помощью пергидролазного катализатора
Сразу после образования пероксикарбоновые кислоты являются достаточно реактивными, и их концентрация может снижаться в течение продолжительных периодов времени в зависимости от переменных, которые включают, но без ограничения, температуру и pH. В связи с этим может быть желательным поддержание различных компонентов реакции разделенными, в особенности для жидких составов. В одном аспекте источник пероксида водорода отделен от субстрата или пергидролазного катализатора, предпочтительно от обоих. Этого можно достичь с помощью ряда методик, включая, но без ограничения, многоотдельные камерные распределители (патент США 4585150), а также во время применения физического объединения пергидролазного катализатора с источником пероксида (таким как пероксид водорода) и субстратами по настоящему изобретению для инициирования реакции ферментативного пергидролиза в воде. Пергидролазный катализатор перед контактом с поверхностью и/или объектом, предназначенным для обработки, может необязательно быть иммобилизованным в емкости реакционной камеры или отделенным (например, отфильтрованным и т.д.) от продукта реакции, содержащего пероксикарбоновую кислоту. Пергидролазный катализатор может быть в жидкой матрице или в твердой форме (например, в форме порошка или таблетки) или включенным в твердую матрицу, которую впоследствии смешивают с субстратами для инициирования реакции ферментативного пергидролиза. В дополнительном аспекте пергидролазный катализатор может содержаться в растворимом или пористом пакете, который можно добавлять к водной матрице субстрата для инициирования ферментативного пергидролиза. В еще одном дополнительном аспекте пергидролазный катализатор может содержать компоненты, содержащиеся в особом отделе растворимого или пористого пакета, который имеет по меньшей мере один дополнительный отдел для содержания компонентов, содержащих сложноэфирный субстрат и/или источник пероксида. В еще одном дополнительном аспекте порошок, содержащий ферментативный катализатор, распределен в субстрате (например, триацетине) и во время применения смешивается в воде с источником пероксида.
Способ определения концентрации пероксикарбоновой кислоты и пероксида водорода
Для анализа реагентов и продуктов реакции в способе по настоящему изобретению можно применять ряд аналитических методов, включая, но без ограничения, титрование, высокоэффективную жидкостную хроматографию (ВЭЖХ), газовую хроматографию (ГФ), масс-спектроскопию (МС), капиллярный электрофорез (СЕ), аналитическую методику ВЭЖХ, описанную U. Karst et al. (Anal. Chem., 69 (17): 3623-3627 (1997)), и анализ 2,2'-азино-бис(3-этилбензотиазолин)-6-сульфоната (ABTS) (см. U. Pinkernell et al., The Analyst 122: 567-571 (1997); S. Minning, et al., Analytica Chimica Acta 378: 293-298 (1999) и WO 2004/058961 A1), описанный в патенте США 7951566.
Определение минимальной биоцидной концентрации пероксикарбоновых кислот
Способ, описанный J. Gabrielson et al. (J. Microbiol. Methods 50: 63-73 (2002)), можно применять для определения минимальной биоцидной концентрации (МВС) пероксикарбоновых кислот или пероксида водорода и субстратов фермента. Способ анализа основан на ингибировании восстановления ХТТ, где ХТТ (2,3-бис[2-метокси-4-нитро-5-сульфофенил]-5-[(фениламино)карбонил]-2Н-тетразолий, внутренняя соль, мононатриевая соль) является окислительно-восстановительным красителем, который указывает на дыхательную активность микроорганизма путем изменения оптической плотности (OD), измеренной при 490 нм или 450 нм. Однако существует ряд других способов, доступных для изучения активности дезинфицирующих средств и антисептиков, включая, но без ограничения, определение количества жизнеспособных микроорганизмов, определение количества микроорганизмов прямым подсчетом под микроскопом, определение сухой массы, измерение мутности, определение абсорбции и биолюминесценции (см., например, Brock, Semour S., Disinfection, Sterilization, and Preservation, 5th edition, Lippincott Williams & Wilkins, Philadelphia, PA, USA; 2001).
Области применения полученных ферментативным путем композиций пероксикарбоновых кислот
Образованную с помощью ферментативного катализатора пероксикарбоновую кислоту в соответствии со способом по настоящему изобретению можно применять для уменьшения скопления биологических загрязнителей на множестве твердых поверхностей/неживых объектов, такого как деконтаминация медицинских инструментов (например, эндоскопов), текстильных изделий (таких как швейные изделия и ковровые покрытия), поверхностей для приготовления пищи, инвентаря для хранения продуктов и упаковки продуктов, материалов, применяемых для упаковки продуктов, инкубаторов и оборудования для выращивания кур, ограждений для содержания животных и сточных вод, которые обладают микробной и/или вирулицидной активностью. Образованные ферментативным путем пероксикарбоновые кислоты можно применять в составах, предназначенных для инактивации прионов (например, с помощью определенных протеаз) для дополнительного обеспечения биоцидной активности (см. патент США 7550420 DiCosimo et al.).
В одном аспекте композицию пероксикарбоновых кислот применяют в качестве дезинфицирующего средства для медицинских инструментов, не обрабатываемых в автоклаве, и оборудования для упаковки продуктов. Поскольку состав, содержащий пероксикарбоновые кислоты, можно получить с помощью GRAS (общепризнанных безопасными) или пищевых компонентов (фермент, субстрат фермента, пероксид водорода и буфер), образованную ферментативным путем пероксикарбоновую кислоту также можно применять для деконтаминации туш животных, мяса, фруктов и овощей или для деконтаминации приготовленной пищи. Образованную ферментативным путем пероксикарбоновую кислоту можно включить в продукт, конечной формой которого является порошок, жидкость, гель, пленка, твердое вещество или аэрозоль. Образованную ферментативным путем пероксикарбоновую кислоту можно разбавить до концентрации, которая по-прежнему обеспечивает эффективную деконтаминацию.
Композиции, содержащие эффективную концентрацию пероксикарбоновой кислоты, можно применять для дезинфекции поверхностей и/или объектов, загрязненных (или предположительно загрязненных) биологическими загрязнителями, такими как патогенные микробы-загрязнители, путем контактирования поверхности или объекта с продуктами, полученными с помощью способов по настоящему изобретению. Применяемый в данном документе термин "контактирование" относится к приведению композиции дезинфицирующего средства, содержащего эффективную концентрацию пероксикарбоновой кислоты, в контакт с поверхностью или неживым объектом, предположительно загрязненных биологическим загрязнителем, в течение периода времени, достаточного для очистки и дезинфекции. Контактирование включает распыление, обработку, погружение, промывку, вливание или наливание, смешивание, объединение, смазывание, покрытие, нанесение, фиксацию на поверхности и другого рода взаимодействие раствора пероксикарбоновой кислоты или композиции, содержащей эффективную концентрацию пероксикарбоновой кислоты, или раствора или композиции, которая образует эффективную концентрацию пероксикарбоновой кислоты, с поверхностью или неживым объектом, предположительно загрязненных скоплением биологического загрязнителя. Композиции дезинфицирующего средства могут объединяться с чистящими композициями для обеспечения как очистки, так и дезинфекции. Альтернативно, чистящее средство (например, поверхностно-активное вещество или моющее средство) можно включать в состав для обеспечения очистки и дезинфекции в одной композиции.
Композиции, содержащие эффективную концентрацию пероксикарбоновой кислоты, также могут содержать по меньшей мере одно дополнительное противомикробное средство, комбинации протеаз, разрушающих прионы, вирулицид, спорицид или биоцид. Комбинации этих средств с пероксикарбоновой кислотой, полученной с помощью заявленных способов, могут привести к повышенным и/или синергическим эффектам при применении для очистки и дезинфекции поверхностей и/или объектов, загрязненных биологическими загрязнителями (или предположительно загрязненных). Пригодные противомикробные средства включают карбоновые эфиры (например, пара-гидроксиалкилбензоаты и алкилциннаматы); сульфоновые кислоты (например, додецилбензолсульфоновую кислоту); соединения йода или соединения активных галогенов (например, элементарные галогены, оксиды галогенов (например, NaOCl, HOCl, HOBr, ClO2), йод, межгалогенные соединения (например, монохлорид йода, дихлорид йода, трихлорид йода, тетрахлорид йода, хлорид брома, монобромид йода или дибромид йода), полигалогенные соединения, соли-гипохлориты, гипохлористую кислоту, соли-гипобромиты, гипобромистую кислоту, хлор- и бромгидантоины, диоксид хлора и хлорит натрия); органические пероксиды, в том числе бензоилпероксид, алкилбензоилпероксиды, озон, источники синглетного кислорода и их смеси; фенольные производные (например, орто-фенилфенол, орто-бензил-пара-хлорфенол, трет-амилфенол и алкилгидроксибензоаты C1-C6); соединения четвертичного аммония (например, хлорид алкилдиметилбензиламмония, хлорид диалкилдиметиламмония и их смеси); а также смеси таких противомикробных средств в количестве, достаточном для обеспечения желаемой степени защиты от микроорганизмов. Эффективные количества противомикробных средств включают от приблизительно 0,001 вес. % до приблизительно 60 вес. % противомикробного средства, от приблизительно 0,01 вес. % до приблизительно 15 вес. % противомикробного средства или от приблизительно 0,08 вес. % до приблизительно 2,5 вес. % противомикробного средства.
В одном аспекте пероксикарбоновые кислоты, образованные с помощью способа, можно применять для снижения концентрации жизнеспособных биологических загрязнителей (таких как популяция микроорганизмов) при внесении в и/или нанесении на место воздействия. Применяемый в данном документе термин "место воздействия" включает часть целевой поверхности для дезинфекции или отбеливания или всю таковую. Целевые поверхности включают все поверхности, которые потенциально могут быть загрязненными биологическими загрязнителями. Неограничивающие примеры включают поверхности оборудования, имеющегося в пищевой промышленности или промышленности безалкогольных напитков (такого как котлы, конвейеры, полы, отводы, кулеры, холодильники, поверхности оборудования, стены, клапаны, ремни, трубы, отводы, соединения, расщелины и их комбинации и т.п.); поверхности помещений (такие как стены, полы и окна); не связанные с пищевой промышленностью трубы и отводы, включая оборудование для обработки воды, бассейнов и спа, а также ферментационных емкостей; поверхности в больницах и ветеринарных учреждениях (такие как стены, полы, кровати, оборудование (такое как эндоскопы), одежда, одеваемая в больницах/ветеринарных учреждениях или других медицинских учреждениях, включая одежду, хирургические костюмы, обувь и другие поверхности в больницах и ветеринарных учреждениях); поверхности в ресторанах; поверхности в ваннах; туалеты; одежду и обувь; поверхности амбаров и хлевов для скота, такого как птица, крупный рогатый скот, молочные коровы, козы, лошади и свиньи; инкубаторы для птицы или для креветок; а также поверхности объектов фармацевтической или биофармацевтической промышленности (например, фармацевтического или биофармацевтического производственного оборудования, фармацевтических или биофармацевтических ингредиентов, фармацевтических или биофармацевтических наполнителей). Дополнительные твердые поверхности включают продукты питания, такие как говядина, мясо птицы, свинина, овощи, фрукты, морепродукты, их комбинации и т.п. Место воздействия также может включать водопоглощающие материалы, такие как инфицированное белье или другие текстильные изделия. Место воздействия также включает собранные растения или растительные продукты, включая семена, луковицы, клубни, фрукты и овощи, растущие растения и, особенно, полевые растения, включая злаковые, лиственные овощи и салатные культуры, корнеплоды, бобовые, ягоды, цитрусовые и затвердевшие плоды.
Неограничивающими примерами материалов твердых поверхностей являются металлы (например, сталь, нержавеющая сталь, хром, титан, железо, медь, латунь, алюминий и их сплавы), минералы (например, бетон), полимеры и пластмассы (например, полиолефины, такие как полиэтилен, полипропилен, полистирол, поли(мет)акрилат, полиакрилонитрил, полибутадиен, сополимер акрилонитрила, бутадиена и "стирола, сополимер акрилонитрила и бутадиена, бутадиенакрилонитрильный каучук; сложные полиэфиры, такие как полиэтилентерефталат; и полиамиды, такие как нейлон). Дополнительные поверхности включают кирпич, черепицу, керамику, фарфор, древесину, древесную массу, бумагу, винил, линолеум и ковровые покрытия.
Пероксикарбоновые кислоты, образованные с помощью способа по настоящему изобретению, могут оказывать положительное воздействие на предмет одежды или текстильное изделие, включая, но без ограничения, дезинфекцию, санитарную обработку, отбеливание, обесцвечивание и дезодорацию. Пероксикарбоновые кислоты, образованные с помощью способа по настоящему изобретению, можно применять во многих средствах для ухода за бельем, включая, но без ограничения, например, замачиватели текстильных изделий, стиральные порошки, стиральные порошки или моющие добавки, пятновыводители, отбеливающие композиции, дезодорирующие композиции и ополаскиватели для белья, и это только некоторые из них.
Пероксикарбоновые кислоты, образованные с помощью способа по настоящему изобретению, можно применять на одном или нескольких этапах способа отбеливания/делигнификации древесной массы или бумажной массы, в частности, при применении перуксусной кислоты (например, см. ЕР 1040222 В1 и патент США 5552018 Devenyns, J.).
Пути применения в личной гигиене
Пергидролитические ферменты, описанные в данном документе, можно применять для получения перкислотного средства, оказывающего положительное воздействие, для путей применения в личной гигиене, таких как, например, пути применения в уходе за волосами (средства для отбеливания, депиляции), уходе за кожей (средства для отбеливания кожи, противомикробные средства) и уходе за полостью рта (средства для осветления/отбеливания зубов или антисептики), и это только некоторые из них. Композиции и способы, описанные в данном документе, могут дополнительно содержать один или несколько допустимых в дерматологическом или косметологическом плане компонентов, известных или другим образом эффективных для применения в средствах для ухода за волосами, ухода за кожей, ухода за ногтями или других средствах личной гигиены, при условии, что необязательные компоненты физически и химически совместимы с обязательными компонентами, описанными в данном документе, или другим образом чрезмерно не ухудшают стабильность, органолептические свойства и функциональные характеристики продукта. Неограничивающие примеры таких необязательных компонентов раскрыты в International Cosmetic Ingredient Dictionary, Ninth Edition, 2002, и CTFA Cosmetic Ingredient Handbook, Tenth Edition, 2004.
В одном варианте осуществления допустимый в дерматологическом/косметологическом плане носитель может содержать от приблизительно 10 вес. % до приблизительно 99,9 вес. %, альтернативно от приблизительно 50 вес. % до приблизительно 95 вес. % и альтернативно от приблизительно 75 вес. % до приблизительно 95 вес. % допустимого в дерматологическом плане носителя. Носители, подходящие для применения с композицией (композициями), могут включать, например, носители, применяемые в составе спреев для волос, муссов, тоников, гелей, увлажнителей кожи, лосьонов и несмываемых кондиционеров. Носитель может включать воду; органические масла; кремнийсодержащие соединения, такие как летучие кремнийсодержащие соединения, аминокислотные и неаминокислотные силиконовые каучуки или масла и их смеси; минеральные масла; растительные масла, такие как оливковое масло, касторовое масло, рапсовое масло, кокосовое масло, масло из зародышей пшеницы, масло сладкого миндаля, масло авокадо, масло австралийского ореха, абрикосовое масло, сафлоровое масло, масло плодов свечного дерева, рыжиковое масло, масло таману, лимонное масло и их смеси; воски и органические соединения, такие как алканы C2-C10, ацетон, метилэтилкетон, летучие органические спирты C1-C12, сложные эфиры (с пониманием, что выбор сложного (сложных) эфира (эфиров) может зависеть от того, могут ли они выступать в качестве субстрата (субстратов) на основе сложных эфиров карбоновых кислот для пергидролаз) кислот C1-C20 и спиртов C1-C8, такие как метилацетат, бутилацетат, этилацетат и изопропилмиристат, диметоксиэтан, диэтоксиэтан, жирные спирты C1-C30, такие как лауриловый спирт, цетиловый спирт, стеариловый спирт и бегениловый спирт; жирные кислоты C10-C30, такие как лауриновая кислота и стеариновая кислота; амиды жирных кислот C10-C30, такие как диэтаноламид лауриновой кислоты; алкиловые сложные эфиры жирных кислот C10-C30, такие как алкилбензоаты жирных кислот C10-C30; гидроксипропилцеллюлозу и их смеси. В одном варианте осуществления носитель включает воду, жирные спирты, летучие органические спирты и их смеси. Композиция(композиции) по настоящему изобретению также могут содержать от приблизительно 0,1% до приблизительно 10%, и, альтернативно, от приблизительно 0,2% до приблизительно 5,0% гелеобразующего средства для обеспечения желаемой вязкости композиции (композиций). Неограничивающие примеры пригодных необязательных гелеобразующих средств включают сшитые полимеры на основе карбоновых кислот; ненейтрализованные сшитые полимеры на основе карбоновых кислот; ненейтрализованные модифицированные сшитые полимеры на основе карбоновых кислот; сшитые сополимеры этилена и малеинового ангидрида; ненейтрализованные сшитые сополимеры этилена и малеинового ангидрида (например, коммерчески доступный ЕМА 81 от Monsanto); ненейтрализованные сшитые сополимеры алкилового эфира и акрилата (например, коммерчески доступный Salcare™ SC90 от Allied Colloids); ненейтрализованные сшитые сополимеры полиакрилата натрия, минерального масла и PEG-1-тридецета-6 (например, коммерчески доступный Salcare™ SC91 от Allied Colloids); ненейтрализованные сшитые сополимеры метилвинилового эфира и малеинового ангидрида (например, коммерчески доступный сополимер Stabileze™ QM-PVM/MA от International Specialty Products); гидрофобно модифицированные не содержащие ионогенных групп полимеры на основе целлюлозы; гидрофобно модифицированные полимеры на основе этоксилатуретана (например, серии коммерчески доступных полимеров Ucare™ Polyphobe, набухающих в щелочных условиях, от Union Carbide); и их комбинации. В этом контексте термин "ненейтрализованный" обозначает, что необязательные полимерные и сополимерные вещества гелеобразующих средств содержат ненейтрализованные кислотные мономеры. Предпочтительные гелеобразующие средства включают водорастворимые ненейтрализованные сшитые сополимеры этилена и малеинового ангидрида, водорастворимые ненейтрализованные сшитые полимеры на основе карбоновых кислот, водорастворимые гидрофобно модифицированные полимеры на основе целлюлозы, не содержащие ионогенных групп, и гелевые сетки на основе поверхностно-активного вещества/жирного спирта, как, например, таковые, пригодные для средств для укладки волос.
Экспрессия рекомбинантных микроорганизмов
Гены и продукты генов рассматриваемых последовательностей можно получать в гетерологичных клетках-хозяевах, в частности, в клетках микроорганизмов-хозяев. Предпочтительными гетерологичными клетками-хозяевами для экспрессии рассматриваемых генов и молекул нуклеиновых кислот являются клетки микроорганизмов-хозяев, которые можно встретить в семействах грибов и бактерий и которые растут в широком диапазоне температур, значений pH и устойчивости к растворителям. Например, предполагается, что любой организм среди бактерий, дрожжей и нитчатых грибов может быть пригодным для экспрессии молекул нуклеиновой кислоты по настоящему изобретению. Пергидролаза может экспрессироваться внутриклеточно, внеклеточно или сочетанно - как внутриклеточно, так и внеклеточно, при этом внеклеточная экспрессия способствует более легкому извлечению желаемого белка из продукта ферментации, чем в способах извлечения белка, полученного путем внутриклеточной экспрессии. Аппарат транскрипции, трансляции и биосинтеза белка сохраняется неизменным по сравнению с клеточным твердым субстратом, применяемым для создания клеточной биомассы; функциональные гены будут экспрессироваться в любом случае. Примеры штаммов-хозяев включают, но без ограничения, виды бактерий, грибов и дрожжей, такие как Aspergillus, Trichoderma, Saccharomyces, Pichia, Phaffia, Kluyveromyces, Candida, Hansenula, Yarrowia, Salmonella, Bacillus, Acinetobacter, Zymomonas, Agrobacterium, Erythrobacter, Chlorobium, Chromatium, Flavobacterium, Cytophaga, Rhodobacter, Rhodococcus, Streptomyces, Brevibacterium, Corynebacteria, Mycobacterium, Deinococcus, Escherichia, Erwinia, Pantoea, Pseudomonas, Sphingomonas, Methylomonas, Methylobaсter, Methylococcus, Methylosinus, Methylomicrobium, Methylocystis, Alcaligenes, Synechocystis, Synechococcus, Anabaena, Thiobacillus, Methanobacterium, Klebsiella и Myxococcus. В одном варианте осуществления бактериальные штаммы-хозяева включают Escherichia, Bacillus и Pseudomonas. В предпочтительном варианте осуществления бактериальной клеткой-хозяином является клетка Bacillus subtilis или Escherichia coli.
Промышленное получение
Для получения пергидролазного катализатора можно применять ряд методик культивирования. Крупномасштабное получение конкретного продукта гена, сверхэкспрессирующегося в рекомбинантном микроорганизме-хозяине, может осуществляться посредством методик периодического культивирования, культивирования с подпиткой и непрерывного культивирования. Способы периодического культивирования и культивирования с подпиткой распространены и хорошо известны в данной области, и примеры можно найти в Thomas D. Brock в Biotechnology: А Textbook of Industrial Microbiology, Second Edition, Sinauer Associates, Inc., Sunderland, MA (1989) и Deshpande, Mukund V., Appl. Biochem. Biotechnol., 36: 227 (1992).
В одном варианте осуществления коммерческое получение желаемого пергидролазного катализатора выполняют с применением непрерывного культивирования. Непрерывные культуры являются открытыми системами, в которых определенную среду для культивирования непрерывно добавляют в биореактор, а такое же количество кондиционированной среды одновременно удаляют в процессе получения. Непрерывные культуры, как правило, содержат клетки при постоянной высокой плотности жидкой фазы, где клетки находятся преимущественно в фазе логарифмического роста. Альтернативно, непрерывное культивирование можно применять в отношении иммобилизованных клеток, к которым непрерывно добавляют углерод и питательные вещества, а из клеточной массы непрерывно удаляют ценные продукты, побочные продукты и продукты жизнедеятельности. Иммобилизацию клеток можно выполнять с помощью множества твердых подложек, состоящих из природных и/или синтетических материалов.
Извлечение желаемых пергидролазных катализаторов из среды периодической ферментации или ферментации с подпиткой или из непрерывной культуры может осуществляться с помощью любых способов, которые известны специалистам в данной области. Например, при внутриклеточном получении ферментативного катализатора клеточную массу отделяют от среды для культивирования с помощью центрифугирования или мембранной фильтрации, необязательно промывая водой или водным буфером при желаемом pH, затем суспензию клеточной массы при желаемом pH гомогенизируют с получением клеточного экстракта, содержащего желаемый ферментативный катализатор. Клеточный экстракт можно необязательно отфильтровывать через пригодный вспомогательный фильтрующий материал, такой как целит или двуокись кремния, для удаления клеточного дебриса перед этапом тепловой обработки, необходимой для осаждения нежелательного белка из раствора ферментативного катализатора. Раствор, содержащий желаемый ферментативный катализатор, можно затем отделять от осажденного клеточного дебриса и белка, полученного во время этапа тепловой обработки, с помощью мембранной фильтрации или центрифугирования, а полученный частично очищенный раствор ферментативного катализатора, концентрированный посредством дополнительной мембранной фильтрации, затем необязательно смешивать с соответствующим наполнителем (например, мальтодекстрином, трегалозой, сахарозой, лактозой, сорбитом, маннитом, фосфатным буфером, цитратным буфером или их смесями) и высушивать распылением с получением твердого порошка, содержащего желаемый ферментативный катализатор. Альтернативно, образующийся в результате частично очищенный раствор ферментативного катализатора, полученный, как описано ранее, можно необязательно концентрировать посредством дополнительной мембранной фильтрации, и частично очищенный раствор ферментативного катализатора или полученный концентрат фермента затем необязательно смешивают с одним или несколькими стабилизирующими средствами (например, глицеролом, сорбитом, пропиленгликолем, 1,3-пропандиолом, полиолами, полимерамиполиолами, поливиниловым спиртом или их смесями), одной или несколькими солями (например, хлоридом натрия, сульфатом натрия, хлоридом калия, сульфатом калия или их смесями) и одним или несколькими биоцидами и до применения сохраняют в виде водного раствора.
Если количество, концентрация или другое значение или параметр приводятся в виде диапазона, предпочтительного диапазона или перечня верхних предпочтительных значений и нижних предпочтительных значений, эти значения необходимо понимать как определенно представляющие все диапазоны, образованные из любой пары любого верхнего предела диапазона или предпочтительного значения и любого нижнего предела диапазона или предпочтительного значения, независимо от того, представлены или не представлены диапазоны по отдельности. Когда в данном документе упоминается диапазон числовых значений, то, если не указано иное, подразумевается, что диапазон включает его предельные значения, а также все целые числа и дробные числа в пределах диапазона. Не подразумевается, что объем ограничен конкретными значениями, упоминаемыми при определении диапазона.
ОБЩИЕ СПОСОБЫ
Для демонстрации различных вариантов осуществления предлагаются следующие примеры. Специалистам в данной области будет понятно, что методики, раскрытые в следующих примерах, представляют методики, описанные изобретателем для эффективного практического применения способов, раскрытых в данном документе, и таким образом, могут рассматриваться для формирования предпочтительных режимов практического применения. В то же время специалистам в данной области необходимо понимать, что в свете настоящего раскрытия можно выполнять многие изменения в конкретных раскрытых вариантах и получать подобный или близкий результат без отступления от сущности или объема раскрытых в настоящем изобретении способов.
Все реагенты и материалы получены из DIFCO Laboratories (Детройт, Мичиган), GIBCO/BRL (Гейтерсберг, Мэриленд), TCI America (Портленд, Орегон), Roche Diagnostics Corporation (Индианаполис, Индиана) или Sigma-Aldrich Chemical Company (Сент-Луис, Миссури), если не указано иное.
Следующие сокращения в описании соответствуют указанным далее единицам измерения, методикам, свойствам или соединениям: "сек" или "с" обозначает секунду (секунды), "мин" обозначает минуту (минуты), "ч" обозначает час (часы), "мкл" обозначает микролитр (микролитры), "мл" обозначает миллилитр (миллилитры), "л" обозначает литр (литры), "мМ" обозначает миллимолярный, "М" обозначает молярный, "ммоль" обозначает миллимоль (миллимоли), "ppm" обозначает часть (частей) на миллион, "вес." обозначает вес, "вес. %" обозначает весовой процент, "г" обозначает грамм (граммы), "мкг" обозначает микрограмм (микрограммы), "нг" обозначает нанограмм (нанограммы), "д" обозначает ускорение, "ВЭЖХ" обозначает высокоэффективную жидкостную хроматографию, "dd H2O" обозначает дистиллированную и деионизированную воду, "dcw" обозначает сухую массу клеток, "АТСС" или "АТСС®" обозначает Американскую коллекцию типовых культур (Манассас, Виргиния), "U" обозначает единицу (единицы) пергидролазной активности, "об/мин" обозначает оборот (обороты) в минуту, "EDTA" обозначает этилендиаминтетрауксусную кислоту, "IPTG" обозначает изопропил-β-D-тиогалактозид, "ВСА" обозначает бицинхониновую кислоту и "ABTS" обозначает 2,2'-азино-бис(3-этилбензотиазолин-6-сульфонат).
ПРИМЕР 1
Клонирование и получение ацетилксиланэстеразы СЕ-7 Actinosynnema mirum в Е. coli
Ген, кодирующий фермент ацетилксиланэстеразу Actinosynnema mirum, зарегистрированную в GENBANK® (№ доступа ACU35776.1; GI:255920265), синтезировали с помощью кодонов, оптимизированных для экспрессии в Е. coli (DNA 2.0, Менло-Парк, Калифорния). Продукт нуклеиновой кислоты (SEQ ID NO: 3) субклонировали в PJEXPRESS404® (DNA 2.0, Менло-Парк, Калифорния) для создания плазмиды, определяемой как рМР91. Для создания штамма, определяемого как KLP18/pMP91, применяли плазмиду рМР91 для трансформации KLP18 Е. coli (описанной в патенте США 7723083). KLP18/pMP91 выращивали в среде LB при 37°C при встряхивании до OD600нм=0,4-0,5, при этом добавляли IPTG до получения конечной концентрации 1 мМ и инкубацию продолжали в течение 2-3 ч. Клетки отбирали для анализа с помощью центрифугирования при 5000×g в течение 15 минут, затем ресуспендировали (20% вес/объем) в 50 мМ калий-фосфатном буфере, pH 7,0, с добавлением 1,0 мМ дитиотреитола. Ресуспендированные клетки дважды пропускали через пресс Френча. Клетки, подвергшиеся лизису, центрифугировали в течение 30 минут при 12000×g, и концентрацию белка в надосадочной жидкости экстракта определяли с помощью набора для ВСА-анализа (Sigma-Aldrich, Сент-Луис, Миссури). Для подтверждения экспрессии фермента СЕ-7 (SEQ ID NO: 4) применяли SDS-PAGE, и анализ гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, показал, что пергидролаза составляла 11% от общего растворимого белка.
ПРИМЕР 2
Клонирование и получение ацетилксиланэстеразы СЕ-7
Propionibacterium acnes в Е. coli
Ген, кодирующий фермент ацетилксиланэстеразу
Propionibacterium acnes, зарегистрированную в GENBANK® (№ доступа АЕЕ71478.1; GI:332674662), синтезировали с помощью кодонов, оптимизированных для экспрессии в Е. coli (DNA 2.0, Менло-Парк, Калифорния). Продукт нуклеиновой кислоты (SEQ ID NO: 5) субклонировали в PJEXPRESS404® (DNA 2.0, Менло-Парк, Калифорния) для создания плазмиды, определяемой как рМР92. Для создания штамма, определяемого как KLP18/pMP92, применяли плазмиду рМР92 для трансформации KLP18 Е. coli (описанной в патенте США 7723083). KLP18/pMP92 выращивали в среде LB при 37°C при встряхивании до OD600нм=0,4-0,5, при этом добавляли IPTG до получения конечной концентрации 1 мМ и инкубацию продолжали в течение 2-3 ч. Клетки отбирали для анализа с помощью центрифугирования при 5000×g в течение 15 минут, затем ресуспендировали (20% вес/объем) в 50 мМ калий-фосфатном буфере, pH 7,0, с добавлением 1,0 мМ дитиотреитола. Ресуспендированные клетки дважды пропускали через пресс Френча. Клетки, подвергшиеся лизису, центрифугировали в течение 30 минут при 12000×g и концентрацию общего растворимого белка в надосадочной жидкости экстракта определяли с помощью набора для ВСА-анализа (Sigma-Aldrich, Сент-Луис, Миссури). Для подтверждения экспрессии фермента СЕ-7 (SEQ ID NO: 6) применяли SDS-PAGE, и анализ гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, показал, что пергидролаза составляла 13% от общего растворимого белка.
ПРИМЕР 3
Клонирование и получение ацетилксиланэстеразы СЕ-7
Streptococcus equi в Е. coli
Ген, кодирующий фермент ацетилксиланэстеразу Streptococcus equi, зарегистрированную в GENBANK® (№ доступа САХ00506.1; GI:225702544), синтезировали с помощью кодонов, оптимизированных для экспрессии в Е. coli (DNA 2.0, Менло-Парк, Калифорния). Продукт нуклеиновой кислоты (SEQ ID NO: 7) субклонировали в РJEXPRESS404® (DNA 2.0, Менло-Парк, Калифорния) для создания плазмиды, определяемой как рМР93. Для создания штамма, определяемого как KLP18/pMP93, применяли плазмиду рМР93 для трансформации KLP18 Е. coli (описанной в патенте США 7723083). KLP18/pMP93 выращивали в среде LB при 37°C при встряхивании до OD600нм=0,4-0,5, при этом добавляли IPTG до получения конечной концентрации 1 мМ и инкубацию продолжали в течение 2-3 ч. Клетки отбирали для анализа с помощью центрифугирования при 5000×g в течение 15 минут, затем ресуспендировали (20% вес/объем) в 50 мМ калий-фосфатном буфере, pH 7,0, с добавлением 1,0 мМ дитиотреитола. Ресуспендированные клетки дважды пропускали через пресс Френча. Клетки, подвергшиеся лизису, центрифугировали в течение 30 минут при 12000×g и концентрацию общего растворимого белка в надосадочной жидкости экстракта определяли с помощью набора для ВСА-анализа (Sigma-Aldrich, Сент-Луис, Миссури). Для подтверждения экспрессии фермента СЕ-7 (SEQ ID NO: 8) применяли SDS-PAGE, и анализ гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, показал, что пергидролаза составляла 26% от общего растворимого белка.
ПРИМЕР 4
Клонирование и получение ацетилксиланэстеразы СЕ-7
Stackebrandtia nassauensis в Е. coli
Ген, кодирующий фермент ацетилксиланэстеразу Stackebrandtia nassauensis, зарегистрированную в GENBANK® (№ доступа ADD42786.1; GI:290569821), синтезировали с помощью кодонов, оптимизированных для экспрессии в Е. coli (DNA 2.0, Менло-Парк, Калифорния). Продукт нуклеиновой кислоты (SEQ ID NO: 9) субклонировали в РJEXPRESS404® (DNA 2.0, Менло-Парк, Калифорния) для создания плазмиды, определяемой как рМР94. Для создания штамма, определяемого как KLP18/pMP94, применяли плазмиду рМР94 для трансформации KLP18 Е. coli (описанной в патенте США 7723083). KLP18/pMP94 выращивали в среде LB при 37°C при встряхивании до OD600нм=0,4-0,5, при этом добавляли IPTG до получения конечной концентрации 1 мМ и инкубацию продолжали в течение 2-3 ч. Клетки отбирали для анализа с помощью центрифугирования при 5000×g в течение 15 минут, затем ресуспендировали (20% вес/объем) в 50 мМ калий-фосфатном буфере, рН 7,0, с добавлением 1,0 мМ дитиотреитола. Ресуспендированные клетки дважды пропускали через пресс Френча. Клетки, подвергшиеся лизису, центрифугировали в течение 30 минут при 12000×g и концентрацию общего растворимого белка в надосадочной жидкости экстракта определяли с помощью набора для ВСА-анализа (Sigma-Aldrich, Сент-Луис, Миссури). Для подтверждения экспрессии фермента СЕ-7 (SEQ ID NO: 10) применяли SDS-PAGE, и анализ гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, показал, что пергидролаза составляла 33% от общего растворимого белка.
ПРИМЕР 5
Клонирование и получение ацетилксиланэстеразы СЕ-7
Streptococcus agalactiae в Е. coli
Ген, кодирующий фермент ацетилксиланэстеразу Streptococcus agalactiae, зарегистрированную в GENBANK® (№ доступа ААМ98949.1; GI:22533045), синтезировали с помощью кодонов, оптимизированных для экспрессии в Е. coli (DNA 2.0, Менло-Парк, Калифорния). Продукт нуклеиновой кислоты (SEQ ID NO: 11) субклонировали в PJEXPRESS404® (DNA 2.0, Менло-Парк, Калифорния) для создания плазмиды, определяемой как рМР95. Для создания штамма, определяемого как KLP18/pMP95, применяли плазмиду рМР95 для трансформации KLP18 Е. coli (описанной в патенте США 7723083). KLP18/pMP95 выращивали в среде LB при 37°C при встряхивании до OD600нм=0,4-0,5, при этом добавляли IPTG до получения конечной концентрации 1 мМ и инкубацию продолжали в течение 2-3 ч. Клетки отбирали для анализа с помощью центрифугирования при 5000×g в течение 15 минут, затем ресуспендировали (20% вес/объем) в 50 мМ калий-фосфатном буфере, pH 7,0, с добавлением 1,0 мМ дитиотреитола. Ресуспендированные клетки дважды пропускали через пресс Френча. Клетки, подвергшиеся лизису, центрифугировали в течение 30 минут при 12000×g и концентрацию общего растворимого белка в надосадочной жидкости экстракта определяли с помощью набора для ВСА-анализа (Sigma-Aldrich, Сент-Луис, Миссури). Для подтверждения экспрессии фермента СЕ-7 (SEQ ID NO: 12) применяли SDS-PAGE, и анализ гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, показал, что пергидролаза составляла 7,3% от общего растворимого белка.
ПРИМЕР 6
Анализ пергидролазной активности
Пергидролазную активность в надосадочной жидкости экстракта определяли с помощью реакционных смесей, содержащих 22,5 мМ триацетина, 22,5 мМ пероксида водорода и 6,25 мкг общего растворимого белка надосадочной жидкости экстракта/мл. Инкубацию проводили в течение 10 минут при температуре окружающей среды (22-24°C). Реакции останавливали путем добавления равного объема 1,25 М фосфорной кислоты, содержащей 100 мМ ортофенилендиамина. Через 30 минут измеряли абсорбцию при 458 нм (таблица 1). Дополнительные измерения пергидролазной активности проводили в реакционных смесях, содержащих 10 мМ триацетина и 10 мМ пероксида водорода или 50 мМ триацетина и 50 мМ пероксида водорода (таблица 1). Ацетилксиланэстеразу СЕ-7 Т. maritima также получали в KLP18 Е. coli (что описано в публикации патентной заявки США 2008-0176299) и применялась в качестве положительного контроля для анализа пергидролазной активности. В качестве отрицательного контроля применяли экстракт KLP18 Е. coli, не содержащий фермент СЕ-7.
ПРИМЕР 7
Получение перуксусной кислоты из триацетина и пероксида водорода с помощью эстераз СЕ-7
Реакции (в общем объеме 10 мл) проводили при 25°C в калий-фосфатном буфере (50 мМ, pH 7,0), содержащем триацетин (10 мМ), пероксид водорода (20 мМ) и 5,0 мкг/мл общего растворимого белка надосадочной жидкости экстракта, содержащего эстеразу СЕ-7 Actinosynnema mirum (SEQ ID NO: 4), Propionibacterium acnes (SEQ ID NO: 6), Streptococcus equi (SEQ ID NO: 8), Stackebrandtia nassauensis (SEQ ID NO: 10) или Streptococcus agalactiae (SEQ ID NO: 12), полученную, как описано в примерах 1-5. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, применяя 5,0 мкг/мл общего растворимого белка экстракта, выделенного из KLP18 Е. coli (применяемого для экспрессии эстераз СЕ-7), где надосадочную жидкость экстракта получали в соответствии с процедурой из примера 1. Вторую сравнительную контрольную реакцию также проводили при условиях, идентичных описанным непосредственно выше, не добавляя общий растворимый белок надосадочной жидкости экстракта, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза триацетина с помощью пероксида водорода при определенных условиях реакции. Ацетилксиланэстеразу СЕ-7 Т. maritima (SEQ ID NO: 2) также получали в KLP18 Е. coli (что описано в публикации заявки на патент США 2008-0176299) и применяли в качестве положительного контроля в сравнительной реакции (11% от общего растворимого белка в надосадочной жидкости клеточного экстракта).
Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в Pinkernell et. al. (Analyst, 122:567 (1997)), с помощью колориметрической детекции окисления ABTS перуксусной кислотой. 50 мкл образца реакционной смеси добавляли к 950 мкл 5 мМ H3PO4 для остановки ферментативной реакции (конечное значение pH между pH 2-3) и 50 мкл полученного раствора добавляли в 96-луночный микропланшет, содержащий 200 мкл водного раствора, содержащего 0,25 М уксусной кислоты, 0,125 г/л ABTS и 5,0 мг/л KI. Раствору позволяли проявиться в течение 5 мин, затем с помощью считывающего устройства для микропланшета измеряли абсорбцию раствора при 405 нм. Концентрацию перуксусной кислоты в каждом образце рассчитывали, исходя из градуировочной кривой, построенной в то же самое время с применением раствора реагентов для образования перуксусной кислоты (таблица 2).
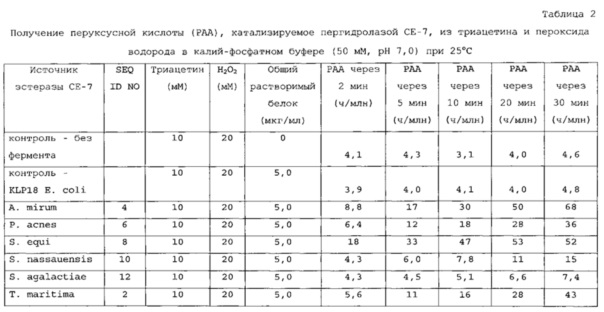
ПРИМЕР 8
Получение перуксусной кислоты из диацетата пропиленгликоля и пероксида водорода с помощью эстераз СЕ-7
Реакции (в общем объеме 10 мл) проводили при 25°C в калий-фосфатном буфере (50 мМ, pH 7,0), содержащем диацетат пропиленгликоля (10 мМ), пероксид водорода (20 мМ) и 5,0 мкг/мл общего растворимого белка надосадочной жидкости экстракта, содержащего эстеразу СЕ-7 Actinosynnema mirum (SEQ ID NO: 4), Propionibacterium acnes (SEQ ID NO: 6), Streptococcus equi (SEQ ID NO: 8) или Stackebrandtia nassauensis (SEQ ID NO: 10), полученную, как описано в примерах 1-4. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, применяя 5,0 мкг/мл общего растворимого белка экстракта, выделенного из KLP18 Е. coli (применяемого для экспрессии эстераз СЕ-7), где надосадочную жидкость экстракта получали в соответствии с процедурой из примера 1. Вторую сравнительную контрольную реакцию также проводили при условиях, идентичных описанным непосредственно выше, не добавляя общий растворимый белок надосадочной жидкости экстракта, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза диацетата пропиленгликоля с помощью пероксида водорода при определенных условиях реакции. Ацетилксиланэстеразу СЕ-7 Г. maritima (SEQ ID NO: 2) также получали в KLP18 Е. coli (что описано в публикации заявки на патент США 2008-0176299) и применяли в качестве положительного контроля в сравнительной реакции (11% от общего растворимого белка в надосадочной жидкости клеточного экстракта). Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 3).
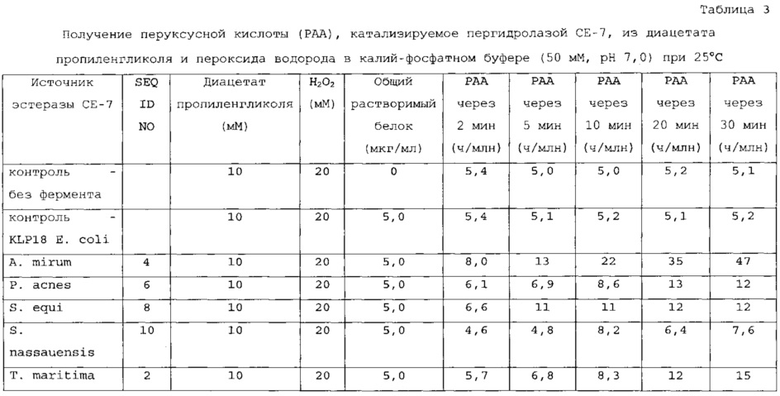
ПРИМЕР 9
Получение перуксусной кислоты из пентаацетата α-D-глюкозы и пероксида водорода с помощью эстераз СЕ-7
Реакции (в общем объеме 10 мл) проводили при 25°C в калий-фосфатном буфере (50 мМ, pH 7,0), содержащем пентаацетат α-D-глюкозы (10 мМ), пероксид водорода (20 мМ) и 5,0 мкг/мл общего растворимого белка надосадочной жидкости экстракта, содержащего эстеразу СЕ-7 Actinosynnema mirum (SEQ ID NO: 4), Streptococcus equi (SEQ ID NO: 8) или Streptococcus agalactiae (SEQ ID NO: 12), полученную, как описано в примерах 1, 3 и 5. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, применяя 5,0 мкг/мл общего растворимого белка экстракта, выделенного из KLP18 Е. coli (применяемого для экспрессии эстераз СЕ-7), где надосадочную жидкость экстракта получали в соответствии с процедурой из примера 1. Вторую сравнительную контрольную реакцию также проводили при условиях, идентичных описанным непосредственно выше, не добавляя общий растворимый белок надосадочной жидкости экстракта, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза пентаацетата α-D-глюкозы с помощью пероксида водорода при определенных условиях реакции. Ацетилксиланэстеразу СЕ-7 T. maritima (SEQ ID NO: 2) также получали в KLP18 Е. coli (что описано в публикации заявки на патент США 2008-0176299) и применяли в качестве положительного контроля в сравнительной реакции (11% от общего растворимого белка в надосадочной жидкости клеточного экстракта). Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 4).
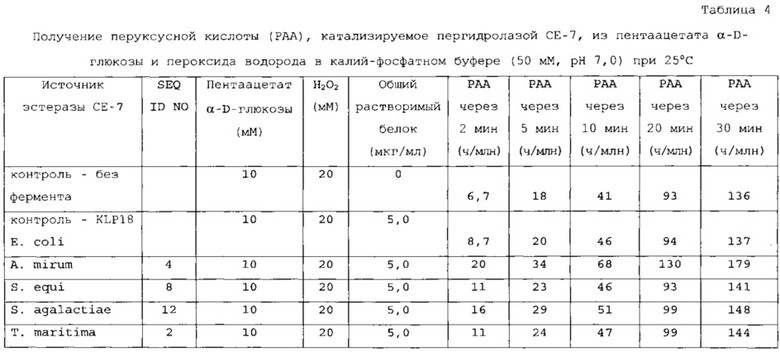
ПРИМЕР 10
Получение перуксусной кислоты из гексаацетата D-сорбита и пероксида водорода с помощью эстераз СЕ-7
Реакции (в общем объеме 10 мл) проводили при 25°C в калий-фосфатном буфере (50 мМ, pH 7,0), содержащем гексаацетат D-сорбита (10 мМ), пероксид водорода (20 мМ) и 5,0 мкг/мл общего растворимого белка надосадочной жидкости экстракта, содержащего эстеразу СЕ-7 Actinosynnema mirum (SEQ ID NO: 4) или Streptococcus equi (SEQ ID NO: 8), полученную, как описано в примерах 1 и 3. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, применяя 5,0 мкг/мл общего растворимого белка экстракта, выделенного из KLP18 Е. coli (применяемого для экспрессии эстераз СЕ-7), где надосадочную жидкость экстракта получали в соответствии с процедурой из примера 1. Вторую сравнительную контрольную реакцию также проводили при условиях, идентичных описанным непосредственно выше, не добавляя общий растворимый белок надосадочной жидкости экстракта, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза гексаацетата D-сорбита с помощью пероксида водорода при определенных условиях реакции. Ацетилксиланэстеразу СЕ-7 Т. maritima (SEQ ID NO: 2) также получали в KLP18 Е. coli (что описано в публикации заявки на патент США 2008-0176299) и применяли в качестве положительного контроля в сравнительной реакции (11% от общего растворимого белка в надосадочной жидкости клеточного экстракта). Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 5).
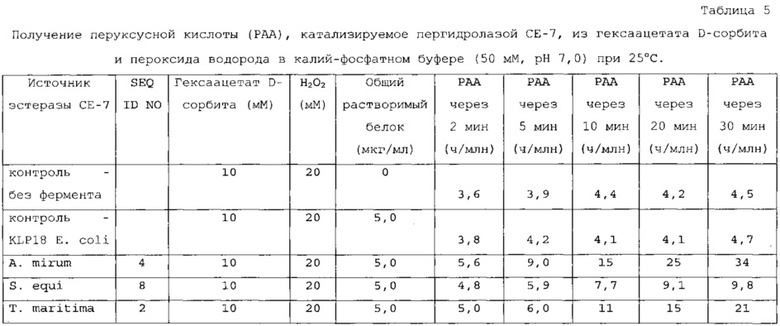
ПРИМЕР 11
Получение перуксусной кислоты из три-O-ацетил-D-глюкаля и пероксида водорода с помощью эстераз СЕ-7
Реакции (в общем объеме 50 мл) проводили при 25°C в калий-фосфатном буфере (10 мМ, pH 7,0), содержащем три-О-ацетил-D-глюкаль (2 мМ), пероксид водорода (10 мМ) и 5,0 мкг/мл общего растворимого белка надосадочной жидкости экстракта, содержащего эстеразу СЕ-7 Actinosynnema mirum (SEQ IP NO: 4) или Streptococcus equi (SEQ ID NO: 8), полученную, как описано в примерах 1 и 3. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, применяя 5,0 мкг/мл общего растворимого белка экстракта, выделенного из KLP18 Е. coli (применяемого для экспрессии эстераз СЕ-7), где надосадочную жидкость экстракта получали в соответствии с процедурой из примера 1. Вторую сравнительную контрольную реакцию также проводили при условиях, идентичных описанным непосредственно выше, не добавляя общий растворимый белок надосадочной жидкости экстракта, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза три-O-ацетил-D-глюкаля с помощью пероксида водорода при определенных условиях реакции. Ацетилксиланэстеразу СЕ-7 T. maritima (SEQ IP NO: 2) также получали в KLP18 Е. coli (что описано в публикации заявки на патент США 2008-0176299) и применяли в качестве положительного контроля в сравнительной реакции (11% от общего растворимого белка в надосадочной жидкости клеточного экстракта). Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 6).
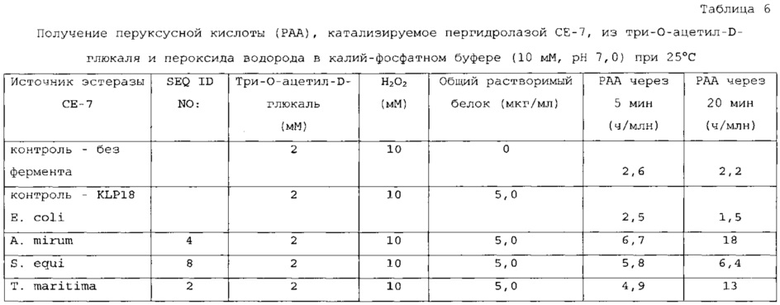
ПРИМЕР 12
Получение перуксусной кислоты из 4-(ацетилокси)-бензойной кислоты и пероксида водорода с помощью эстераз СЕ-7
Реакции (в общем объеме 10 мл) проводили при 20°C в калий-фосфатном буфере (50 мМ, pH 7,0), содержащем 4-(ацетилокси)-бензойную кислоту (CAS 2345-34-8; 25 мМ), пероксид водорода (20 мМ) и 5,0 мкг/мл общего растворимого белка надосадочной жидкости экстракта, содержащего эстеразу СЕ-7 Actinosynnema mirum (SEQ ID NO: 4), Propionibacterium acnes (SEQ ID NO: 6), Streptococcus equi (SEQ ID NO: 8) или Stackebrandtia nassauensis (SEQ ID NO: 10), полученную, как описано в примерах 1-4. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, применяя 5,0 мкг/мл общего растворимого белка экстракта, подвергнутого тепловой обработке, выделенного из KLP18 Е. coli (применяемого для экспрессии эстераз СЕ-7), где надосадочную жидкость экстракта получали в соответствии с процедурой из примера 1. Вторую сравнительную контрольную реакцию также проводили при условиях, идентичных описанным непосредственно выше, не добавляя общий растворимый белок надосадочной жидкости экстракта, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза 4-(ацетилокси)-бензойной кислоты с помощью пероксида водорода при определенных условиях реакции. Ацетилксиланэстеразу СЕ-7 T. maritima (SEQ ID NO: 2) также получали в KLP18 Е. coli (что описано в публикации заявки на патент США 2008-0176299) и применяли в качестве положительного контроля в сравнительной реакции (11% от общего растворимого белка в надосадочной жидкости клеточного экстракта). Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 7).
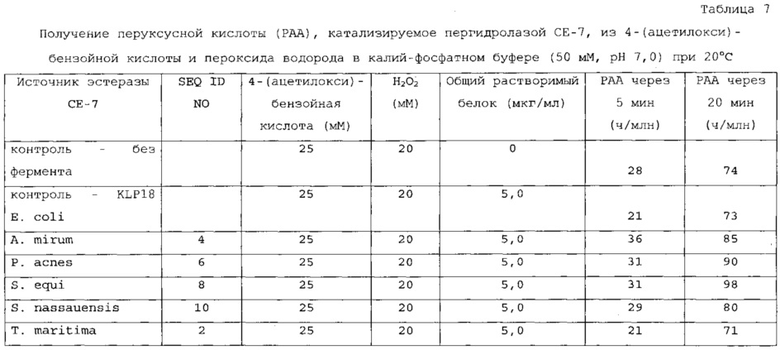
ПРИМЕР 13
Клонирование и получение варианта ацетилксиланэстеразы Actinosynnema mirum
Ген, кодирующий вариант фермента ацетилксиланэстеразы А. mirum, зарегистрированной в GENBANK® (№ доступа ACU35776.1; GI:255920265), синтезировали с помощью кодонов, оптимизированных для экспрессии в Е. coli (DNA 2.0, Менло-Парк, Калифорния). Продукт нуклеиновой кислоты (SEQ ID NO: 13) субклонировали в PJEXPRESS404® (DNA 2.0, Менло-Парк, Калифорния) для создания плазмиды, определяемой как рМР91а. Кодируемый вариант белка называется Ami_C276S (SEQ ID NO: 14). Для создания штамма, определяемого как KLP18/рМР91а, применяли плазмиду рМР91а для трансформации KLP18 Е. coli (описанной в патенте США 7723083). KLP18/pMP91a выращивали в среде LB при 37°C при встряхивании до OD600нм=0,4-0,5, при этом добавляли IPTG до получения конечной концентрации 1 мМ и инкубацию продолжали в течение 2-3 ч. Клетки отбирали для анализа с помощью центрифугирования при 5000×g в течение 15 минут, затем ресуспендировали (20% вес/объем) в 50 мМ калий-фосфатном буфере, pH 7,0, с добавлением 1,0 мМ дитиотреитола. Ресуспендированные клетки дважды пропускали через пресс Френча. Клетки, подвергшиеся лизису, центрифугировали в течение 30 минут при 12000×g и концентрацию белка в надосадочной жидкости определяли с помощью набора для ВСА-анализа (Sigma-Aldrich, Сент-Луис, Миссури). Для подтверждения экспрессии фермента применяли SDS-PAGE и для расчета количества белкового фермента, составившего приблизительно 16-18% от количества общего белка, применяли денситометрию (программное обеспечение ImageJ, Национальный институт здравоохранения, Бетесда, Мэриленд).
ПРИМЕР 14
Клонирование и получение варианта ацетилксиланэстеразы Actinosynnema mirum
Ген, кодирующий вариант фермента ацетилксиланэстеразы А. mirum, зарегистрированной в GENBANK® (№ доступа ACU35776.1; GI:255920265), синтезировали с помощью кодонов, оптимизированных для экспрессии в Е. coli (DNA 2.0, Менло-Парк, Калифорния). Продукт нуклеиновой кислоты (SEQ ID NO: 15) субклонировали в PJEXPRESS404® (DNA 2.0, Менло-Парк, Калифорния) для создания плазмиды, определяемой как рМР91b. Кодируемый вариант белка называется Ami_C276T (SEQ ID NO: 16). Для создания штамма, определяемого как KLP18/pMP91b, применяли плазмиду рМР91b для трансформации KLP18 Е. coli (описанной в патенте США 7723083). KLP18/pMP91b выращивали в среде LB при 37°C при встряхивании до OD600нм=0,4-0,5, при этом добавляли IPTG до получения конечной концентрации 1 мМ и инкубацию продолжали в течение 2-3 ч. Клетки отбирали для анализа с помощью центрифугирования при 5000×g в течение 15 минут, затем ресуспендировали (20% вес/объем) в 50 мМ калий-фосфатном буфере, pH 7,0, с добавлением 1,0 мМ дитиотреитола. Ресуспендированные клетки дважды пропускали через пресс Френча. Клетки, подвергшиеся лизису, центрифугировали в течение 30 минут при 12000×g и концентрацию белка в надосадочной жидкости определяли с помощью набора для ВСА-анализа (Sigma-Aldrich, Сент-Луис, Миссури). Для подтверждения экспрессии фермента применяли SDS-PAGE и для расчета количества белкового фермента, составившего приблизительно 16-18% от количества общего белка, применяли денситометрию (программное обеспечение ImageJ, Национальный институт здравоохранения, Бетесда, Мэриленд).
ПРИМЕР 15
Анализы пергидролазной активности
Пергидролазную активность в экстрактах определяли с помощью реакционных смесей, содержащих 22,5 мМ триацетина, 22,5 мМ пероксида водорода и 1,5 мкг общего белка/мл. Инкубацию проводили в течение 10 минут при температуре окружающей среды (22-24°C). Реакции останавливали путем добавления равного объема 1,25 М фосфорной кислоты, содержащей 100 мМ ортофенилендиамина. Через 30 минут измеряли абсорбцию при 458 нм (таблица 8). В качестве отрицательного контроля применяли экстракт KLP18 Е. coli, не содержащий фермента ацетилксиланэстеразы.

ПРИМЕР 16
Получение перуксусной кислоты из триацетина и пероксида водорода с помощью вариантов эстеразы СЕ-7
Реакции (в общем объеме 10 мл) проводили при 25°C в калий-фосфатном буфере (20 мМ, pH 7,0), содержащем триацетин (0,75 мМ), пероксид водорода (1,4 мМ) и 1,0 мкг/мл или 2,0 мкг/мл эстеразы СЕ-7 Actinosynnema mirum дикого типа (SEQ ID NO: 4, полученной, как описано в примере 1), варианта C276S Actinosynnema mirum (SEQ ID NO: 14, полученной, как описано в примере 13), варианта С276Т Actinosynnema mirum (SEQ ID NO: 16, полученной, как описано в примере 14), C277S Т. maritima (SEQ ID NO: 17, получаемой в KLP18 Е. coli, как описано в патенте США 8062875) и С277Т T. maritima (SEQ ID NO: 18, получаемой в KLP18 Е. coli, как описано в патенте США 8062875). Анализ клеточных экстрактов, содержащих эстеразу СЕ-7, с помощью гелей для SDS-PAGE в сочетании с анализом гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, применяли для расчета концентрации эстеразы СЕ-7 в клеточных экстрактах в виде процентной доли от общего растворимого белка. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, не добавляя эстеразу СЕ-7, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза триацетина с помощью пероксида водорода при определенных условиях реакции. Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 9).
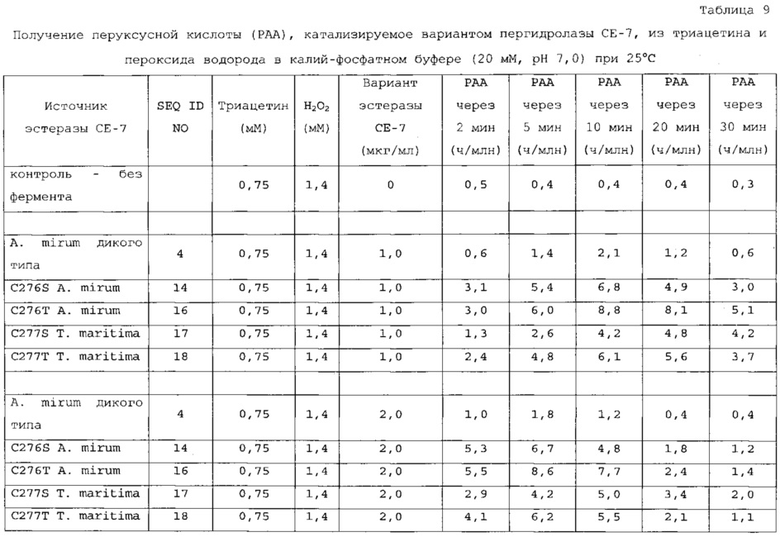
ПРИМЕР 17
Получение перуксусной кислоты из триацетина и пероксида водорода с помощью вариантов эстеразы СЕ-7
Реакции (в общем объеме 10 мл) проводили при 25°C в калий-фосфатном буфере (50 мМ, pH 7,0), содержащем триацетин (10 мМ), пероксид водорода (20 мМ) и 0,5 мкг/мл эстеразы СЕ-7 Actinosynnema mirum дикого типа (SEQ ID NO: 4, полученной, как описано в примере 1), варианта C276S Actinosynnema mirum (SEQ ID NO: 14, полученной, как описано в примере 13), варианта С276Т Actinosynnema mirum (SEQ ID NO: 16, полученной, как описано в примере 14), C277S Т. maritima (SEQ ID NO: 17) и C277T Т. maritima (SEQ ID NO: 18). Анализ клеточных экстрактов, содержащих эстеразу СЕ-7, с помощью гелей для SDS-PAGE в сочетании с анализом гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, применяли для расчета концентрации эстеразы СЕ-7 в клеточных экстрактах в виде процентной доли от общего растворимого белка. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, не добавляя эстеразу СЕ-7, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза триацетина с помощью пероксида водорода при определенных условиях реакции. Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 10).
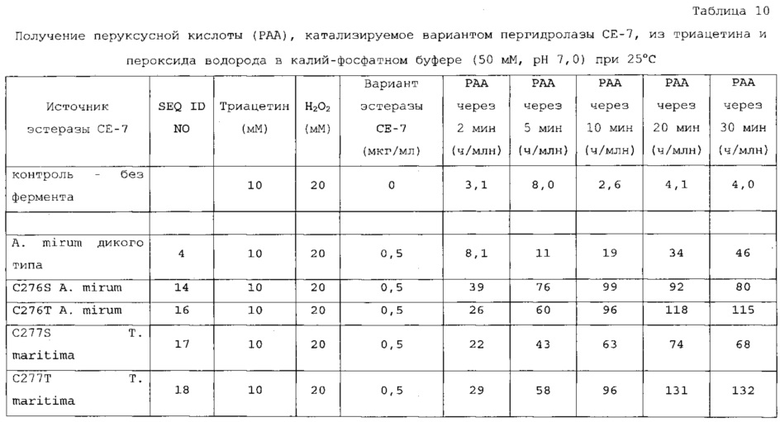
ПРИМЕР 18
Получение перуксусной кислоты из триацетина и пероксида водорода с помощью вариантов эстеразы СЕ-7
Реакции (в общем объеме 10 мл) проводили при 25°C в натрий-карбонатном буфере (20 мМ, рН 10,5), содержащем триацетин (0,75 мМ), пероксид водорода (1,4 мМ, из перкарбоната натрия) и 1,0 мкг/мл или 2,0 мкг/мл эстеразы СЕ-7 Actinosynnema mirum дикого типа (SEQ ID NO: 4, полученной, как описано в примере 1), варианта C276S Actinosynnema mirum (SEQ ID NO: 14, полученной, как описано в примере 13), варианта С276Т Actinosynnema mirum (SEQ ID NO: 16, полученной, как описано в примере 14), Т. maritima C277S (SEQ ID NO: 17) и C277T T. maritima (SEQ ID NO: 18). Анализ клеточных экстрактов, содержащих эстеразу СЕ-7, с помощью гелей для SDS-PAGE в сочетании с анализом гелей с помощью ImageJ, общедоступной Java-программы обработки изображений, применяли для расчета концентрации эстеразы СЕ-7 в клеточных экстрактах в виде процентной доли от общего растворимого белка. Реакционные смеси перемешивали только в течение первых 45 секунд реакции для начального смешивания реагентов и фермента. Сравнительную контрольную реакцию проводили при условиях, идентичных описанным непосредственно выше, не добавляя эстеразу СЕ-7, где перуксусная кислота, получаемая в отсутствие добавленной эстеразы, была результатом химического пергидролиза триацетина с помощью пероксида водорода при определенных условиях реакции. Анализ образцов реакционной смеси для получения перуксусной кислоты проводили согласно способу, описанному в примере 7 (таблица 11).
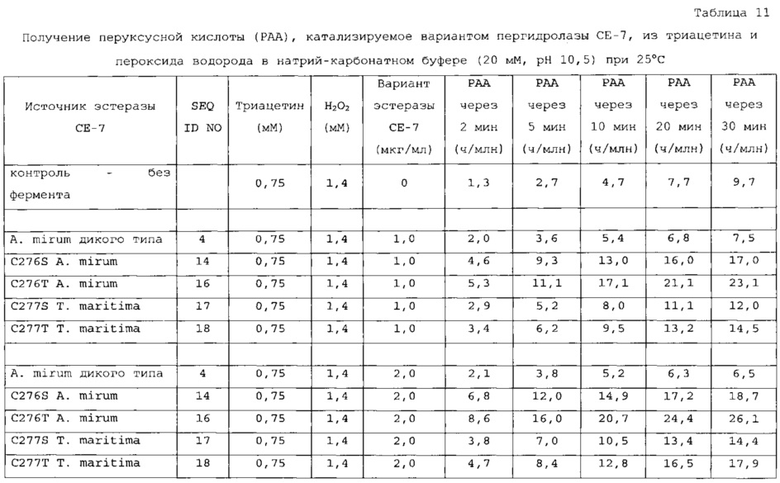
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ ПЕРКИСЛОТ И КОМПОЗИЦИИ С ИСПОЛЬЗОВАНИЕМ ФЕРМЕНТА, ОБЛАДАЮЩЕГО ПЕРГИДРОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2636466C2 |
| ФЕРМЕНТЫ, ПРИГОДНЫЕ ДЛЯ ПОЛУЧЕНИЯ ПЕРКИСЛОТ | 2013 |
|
RU2644330C2 |
| ФЕРМЕНТЫ, ПРИГОДНЫЕ ДЛЯ ПОЛУЧЕНИЯ ПЕРКИСЛОТ | 2013 |
|
RU2644333C2 |
| ФЕРМЕНТЫ, ПРИГОДНЫЕ ДЛЯ ПОЛУЧЕНИЯ ПЕРКИСЛОТ | 2013 |
|
RU2644336C2 |
| ФЕРМЕНТАТИВНОЕ ОБРАЗОВАНИЕ ПЕРКИСЛОТЫ ДЛЯ ПРИМЕНЕНИЯ В ПРОДУКТАХ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА | 2011 |
|
RU2793140C2 |
| ФЕРМЕНТАТИВНОЕ ОБРАЗОВАНИЕ ПЕРКИСЛОТЫ ДЛЯ ПРИМЕНЕНИЯ В ПРОДУКТАХ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА | 2011 |
|
RU2660373C2 |
| СИСТЕМА, ОБЕСПЕЧИВАЮЩАЯ КАТАЛИЗИРУЕМУЮ ПЕРГИДРОЛАЗОЙ РЕАКЦИЮ | 2012 |
|
RU2607481C2 |
| КОМПОЗИЦИИ, ОБРАЗУЮЩИЕ ПЕРКИСЛОТУ | 2012 |
|
RU2581906C2 |
| СИСТЕМЫ, ОБЕСПЕЧИВАЮЩИЕ КАТАЛИЗИРУЕМЫЕ ФЕРМЕНТАМИ РЕАКЦИИ | 2011 |
|
RU2599892C2 |
| КОМПОЗИЦИИ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА И СПОСОБЫ ОТБЕЛИВАНИЯ ЗУБОВ | 2017 |
|
RU2743118C2 |























Группа изобретений относится к биотехнологии, а именно к многокомпонентным системам для образования перкислот, содержащим ацетилксиланэстеразы и их варианты, обладающие пергидролитической активностью, и способу получения пероксикарбоновых кислот. Способ получения пероксикарбоновой кислоты включает введение в реакцию сложных эфиров карбоновых кислот и неорганического пероксида в присутствии полипептида, обладающего пергидролитической активностью и имеющего аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью по отношению к аминокислотной последовательности SEQ ID NO:4, при условии, что аминокислотный остаток, связанный с C-концевой частью каталитического гистидина, не является глутаминовой кислотой. Указанный полипептид применяют для создания системы для образования и доставки пероксикарбоновой кислоты, композиции для личной гигиены, композиции для ухода за бельем и в средстве личной гигиены. Также предложены выделенный полипептид, обладающий пергидролитической активностью, содержащий аминокислотную последовательность SEQ ID NO: 14 или в SEQ ID NO: 16, и кодирующая его нуклеиновая кислота. 7 н. и 12 з.п. ф-лы, 1 ил., 12 табл., 18 пр.
1. Способ получения пероксикарбоновой кислоты, включающий:
(a) обеспечение набора компонентов реакции, содержащего:
(1) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X - сложноэфирная группа формулы R6-C(O)O;
R6 - линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6 - C2-C7;
R5 - линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m - целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
(ii) одного или нескольких глицеридов, имеющих структуру
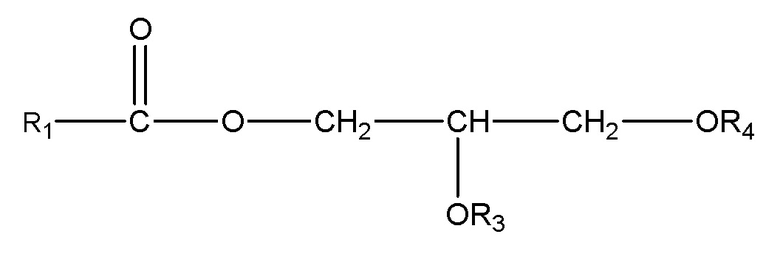 ,
,
где R1 - неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R3 и R4 в отдельности представляют собой H или R1C(O);
(iii) одного или нескольких сложных эфиров формулы:
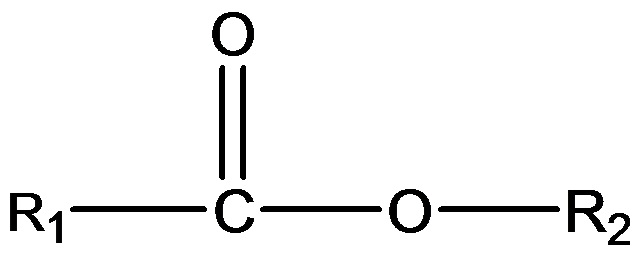 ,
,
где R1 - неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R2 - C1-C10 неразветвленный или разветвленный алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)nH или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацилированных моносахаридов, ацилированных дисахаридов или ацилированных полисахаридов и
(v) любой комбинации из (i)-(iv);
(2) источник пероксида и
(3) ферментативный катализатор, содержащий полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевой частью каталитического гистидина, не является глутаминовой кислотой;
(b) объединение набора компонентов реакции при соответствующих условиях реакции, в результате чего получают пероксикарбоновую кислоту; и
(c) необязательно разбавление пероксикарбоновой кислоты, полученной на этапе (b).
2. Способ по п.1, дополнительно включающий этап d) приведения твердой поверхности или неживого объекта в контакт с пероксикарбоновой кислотой, полученной на этапе (b) или на этапе (c), посредством чего указанную твердую поверхность или неживой объект дезинфицируют, отбеливают, обесцвечивают или подвергают комбинации данных типов воздействия.
3. Способ по п.1, отличающийся тем, что неживым объектом является медицинский инструмент.
4. Способ по п.1, дополнительно включающий этап d) приведения предмета одежды или текстильного изделия в контакт с пероксикарбоновой кислотой, полученной на этапе (b) или на этапе (c), посредством чего на предмет одежды или текстильное изделие оказывают положительное воздействие.
5. Способ по п.4, отличающийся тем, что положительное воздействие выбирают из группы, состоящей из дезинфекции, санитарной обработки, отбеливания, обесцвечивания, дезодорации и их комбинаций.
6. Способ по п.1, дополнительно включающий этап d) приведения древесной массы или бумажной массы в контакт с пероксикарбоновой кислотой, полученной на этапе (b) или на этапе (c), посредством чего древесную массу или бумажную массу отбеливают.
7. Способ по п.1, отличающийся тем, что субстрат выбирают из группы, состоящей из моноацетина; диацетина; триацетина; монопропионина; дипропионина; трипропионина; монобутирина; дибутирина; трибутирина; пентаацетата глюкозы; пентаацетата β-D-галактозы; гексаацетата сорбита; октаацетата сахарозы; тетраацетата ксилозы; ацетилированного ксилана; фрагментов ацетилированного ксилана; 1,2,3,5-тетраацетата β-D-рибофуранозы; три-O-ацетил-D-галакталя; три-O-ацетил-D-глюкаля; сложных моноэфиров или сложных диэфиров 1,2-этандиола, 1,2-пропандиола, 1,3-пропандиола, 1,2-бутандиола, 1,3-бутандиола, 2,3-бутандиола, 1,4-бутандиола, 1,2-пентандиола, 2,5-пентандиола, 1,5-пентандиола, 1,2-гександиола, 2,5-гександиола, 1,6-гександиола, 4-ацетоксибензойной кислоты и их смесей.
8. Способ по п.7, отличающийся тем, что субстратом является триацетин.
9. Способ по п.1, отличающийся тем, что получаемая пероксикарбоновая кислота представляет собой перуксусную кислоту, перпропионовую кислоту, пермасляную кислоту, пермолочную кислоту, пергликолевую кислоту, перметоксиуксусную кислоту, пер-β-гидроксимасляную кислоту или их смеси.
10. Способ по п.1, отличающийся тем, что ферментативный катализатор находится в виде микробной клетки, микробной клетки с нарушенной проницаемостью мембраны, экстракта микробных клеток, частично очищенного фермента или очищенного фермента.
11. Способ по п.1, где аминокислотная последовательность представляет собой последовательность, приведенную в SEQ ID NO: 14 или 16.
12. Композиция для личной гигиены, содержащая:
(a) набор компонентов реакции, содержащий:
(1) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X - сложноэфирная группа формулы R6-C(O)O;
R6 - линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6 - C2-C7;
R5 - линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m - целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
(ii) одного или нескольких глицеридов, имеющих структуру
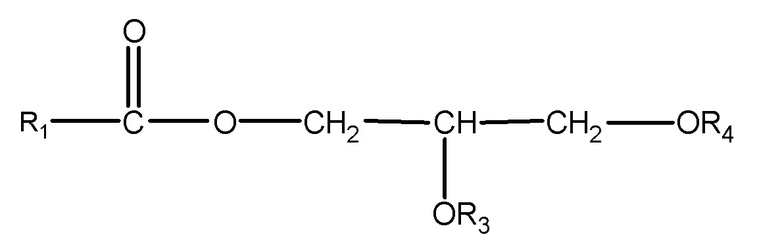 ,
,
где R1 - неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R3 и R4 в отдельности представляют собой H или R1C(O);
(iii) одного или нескольких сложных эфиров формулы:
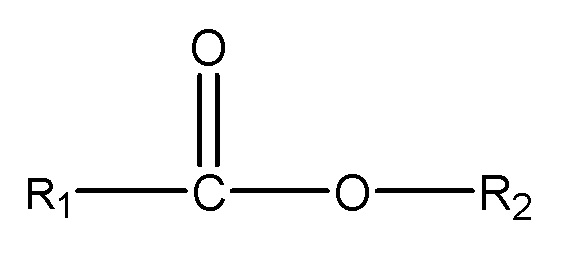 ,
,
где R1 - неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R2 - C1-C10 неразветвленный или разветвленный алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)nH или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацилированных моносахаридов, ацилированных дисахаридов или ацилированных полисахаридов и
(v) любой комбинации из (i)-(iv);
(2) источник пероксида и
(3) ферментативный катализатор, содержащий полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевой частью каталитического гистидина, не является глутаминовой кислотой; и
(b) по меньшей мере одну пероксикарбоновую кислоту, образованную при объединении набора компонентов реакции (a).
13. Система для образования и доставки перкислот, содержащая:
(a) первый отдел, содержащий
(1) ферментативный катализатор, содержащий полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевой частью каталитического гистидина, не является глутаминовой кислотой;
(2) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X - сложноэфирная группа формулы R6-C(O)O;
R6 - линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6 - C2-C7;
R5 - линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m - целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
(ii) одного или нескольких глицеридов, имеющих структуру
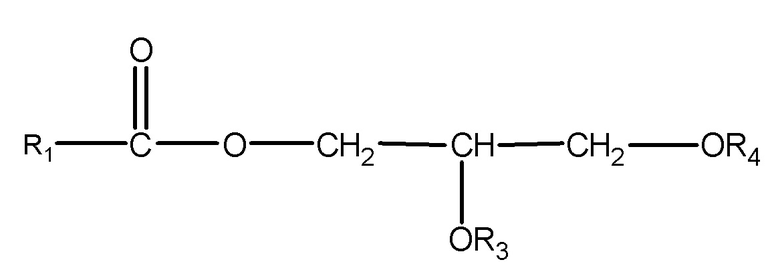 ,
,
где R1 - неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R3 и R4 в отдельности представляют собой H или R1C(O);
(iii) одного или нескольких сложных эфиров формулы:
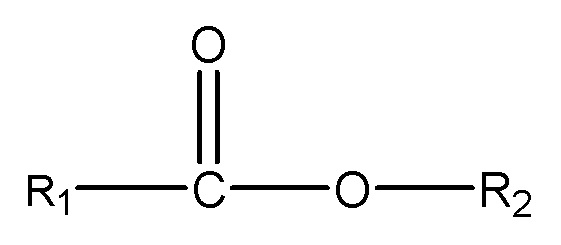 ,
,
где R1 - неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R2 - C1-C10 неразветвленный или разветвленный алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)nH или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацилированных моносахаридов, ацилированных дисахаридов или ацилированных полисахаридов и
(v) любой комбинации из (i)-(iv); и
(3) необязательный буфер; и
(b) второй отдел, содержащий
(1) источник пероксида;
(2) стабилизатор пероксида и
(3) необязательный буфер.
14. Система для образования и доставки перкислот по п.13, отличающаяся тем, что субстрат включает в себя триацетин.
15. Выделенная молекула нуклеиновой кислоты, кодирующая полипептид, обладающий пергидролитической активностью, причем указанный полипептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 14 или в SEQ ID NO: 16.
16. Выделенный полипептид, обладающий пергидролитической активностью, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 14 или в SEQ ID NO: 16.
17. Композиция для ухода за бельем, содержащая
а) полипептид, обладающий пергидролитической активностью и имеющий аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевой частью каталитического гистидина, не является глутаминовой кислотой;
b) по меньшей мере один субстрат, выбранный из группы, состоящей из:
(i) одного или нескольких сложных эфиров, имеющих структуру
[X]mR5,
где
X - сложноэфирная группа формулы R6-C(O)O;
R6 - линейный, разветвленный или циклический гидрокарбильный C1-C7-фрагмент, необязательно замещенный гидроксильными группами или C1-C4-алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей в случае R6 - C2-C7;
R5 - линейный, разветвленный или циклический гидрокарбильный C1-C6-фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 в отдельности соединен не более чем с одной гидроксильной группой или не более чем с одной сложноэфирной группой или группой карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m - целое число, варьирующее в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде, составляющую по меньшей мере 5 ч./млн при 25°C;
(ii) одного или нескольких глицеридов, имеющих структуру
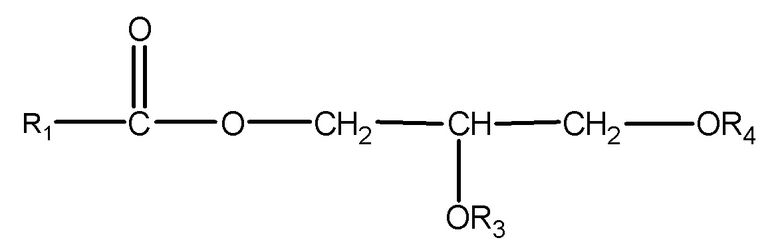 ,
,
где R1 - неразветвленный или разветвленный C1-C21-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R3 и R4 в отдельности представляют собой H или R1C(O);
(iii) одного или нескольких сложных эфиров формулы:
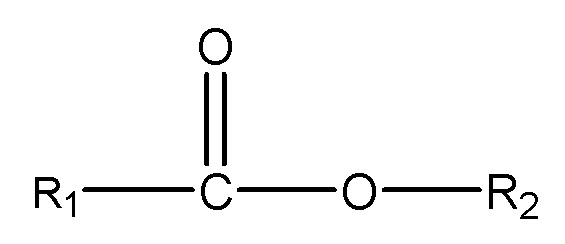 ,
,
где R1 - неразветвленный или разветвленный C1-C7-алкил, необязательно замещенный гидроксильной или C1-C4-алкоксигруппой, а R2 - C1-C10 неразветвленный или разветвленный алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)nH или (CH2CH(CH3)-O)nH и n равно от 1 до 10;
(iv) одного или нескольких ацилированных моносахаридов, ацилированных дисахаридов или ацилированных полисахаридов и
(v) любой комбинации из (i)-(iv); и
с) источник пероксида; и
d) по меньшей мере одно поверхностно-активное вещество.
18. Средство личной гигиены, содержащее полипептид, обладающий пергидролитической активностью, при этом указанный полипептид имеет аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью по отношению к аминокислотной последовательности, приведенной под SEQ ID NO: 4, при условии, что аминокислотный остаток, связанный с C-концевой частью каталитического гистидина, не является глутаминовой кислотой.
19. Средство личной гигиены по п.18, отличающееся тем, что средство представляет собой шампунь, лосьон для тела, гель для душа, увлажняющее средство для местного применения, зубную пасту, гель для чистки зубов, ополаскиватель для рта, средство для полоскания рта, ополаскиватель против зубного налета или очищающее средство для местного применения.
| WO 2011119706 A1, 29.09.2011 | |||
| DATABASE UniProt [Online] | |||
| Accession no | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 2010039958 A1, 08.04.2010 | |||
| RU 2009121821 A, 20.12.2010 | |||
| RU 2010130255 A, 27.01.2012. | |||
Авторы
Даты
2018-02-19—Публикация
2013-03-13—Подача