ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет преимущество предварительной заявки на патент США № 61/424903, поданной 20 декабря 2010 года, которая включена в данный документ с помощью ссылки в полном ее объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области продуктов личной гигиены, содержащих по меньшей мере одну перкислоту в качестве полезного средства для ухода за полостью рта. Перкислоту ферментативно получают в присутствии по меньшей мере одного подходящего субстрата на основе сложного эфира карбоновой кислоты и источника кислорода пероксигруппы. В частности, ферментный катализатор, обладающий пергидролитической активностью, применяют для получения перкислотного полезного средства для применения в продукте для ухода за полостью рта. Пергидролитический фермент может находиться в форме гибридного белка ("нацеленная пергидролаза"), сконструированного содержащим по меньшей мере один пептидный компонент со сродством к поверхности полости рта так, чтобы ферментативно получаемая перкислота продуцировалась на требуемой поверхности или рядом с требуемой поверхностью.
УРОВЕНЬ ТЕХНИКИ
Пероксикарбоновые кислоты ("перкислоты") являются эффективными противомикробными средствами. Были описаны способы очистки, обеззараживания и/или санитарной обработки твердых поверхностей, продуктов питания, живых растительных тканей и медицинских устройств против роста нежелательных микроорганизмов (например, патент США 6545047; патент США 6183807; патент США 6518307; патент США 5683724 и патент США 6635286). Также сообщалось, что перкислоты пригодны в получении осветляющих композиций для применений, связанных со стиральным порошком (например, патент США 3974082; патент США 5296161; и патент США № 5364554).
Также были раскрыты композиции для ухода за полостью рта, содержащие перкислоту. В патенте США 5302375, Viscio, D., раскрыты пероральные композиции для отбеливания зубов, содержащие перуксусную кислоту, растворенную в среде, где перуксусную кислоту получают в среде in situ путем объединения воды, ацетилсалициловой кислоты и водорастворимого перкарбоната щелочного металла. В патенте США 5279816, Church et al., раскрыто применение композиции, содержащей перуксусную кислоту для отбеливания потемневших или пожелтевших зубов. В патентах США 6221341 и 7189385, Montgomery, R., раскрыты композиции для беления зубов на основе пероксидной кислоты, подходящие для применения в способе отбеливания зубов. Более конкретно, композицию на основе перуксусной кислоты получают путем объединения предшественника пероксида водорода, сложного эфира уксусной кислоты и глицерина и воды с образованием, в результате химического пергидролиза, перуксусной кислоты. Ферментативный пергидролиз не описан.
В публикации заявки на патент США № 2009-0311198, Concar et al., раскрыта пероральная композиция, содержащая фермент M. smegmatis, обладающий пергидролитической активностью для осветления зубов. Применение пергидролазы СЕ-7 для получения перкислотного полезного средства не раскрыто. Concar et al. также умалчивают о применении нацеленного пергидролитического фермента в композиции для ухода за полостью рта.
Включение специфических вариантных субтилизиновых протеаз Карлсберга, обладающих пергидролитической активностью, в средство для ухода за телом раскрыто в патенте США 7510859, Wieland et al. Пергидролитические ферменты, помимо специфических вариантных протеаз, не описаны, как и не существует каких-либо рабочих примеров, демонстрирующих ферментативное получение перкислоты в качестве полезного средства для личной гигиены.
В публикациях заявок на патент США №№ 2008-0176783 A1; 2008-0176299 A1; 2009-0005590 A1 и 2010-0041752 A1, DiCosimo et al. раскрыты ферменты, структурно классифицированные как представители семейства СЕ-7 эстераз углеводов (т.е. деацетилазы цефалоспорин С [CAH] и ацетилксиланэстеразы [AXE]), которые характеризуются значительной пергидролитической активностью в отношении превращения субстратов на основе сложного эфира карбоновой кислоты (в присутствии подходящего источника кислорода пероксигруппы, такого как пероксид водорода) в пероксикарбоновую кислоту в концентрациях, подходящих для применения в качестве обеззараживающего средства и/или осветляющего средства. Было продемонстрировано, что некоторые члены семейства СЕ-7 эстераз углеводов обладают пергидролитической активностью, достаточной для получения 4000-5000 ч./млн перуксусной кислоты из сложных ацетилэфиров спиртов, диолов и глицеринов за 1 минуту и до 9000 ч./млн за период от 5 до 30 минут после смешивания реакционных компонентов (DiCosimo et al., U.S. 2009-0005590 A1). В публикации заявки на патент США № 2010-0087529 А1 описаны вариантные ферменты СЕ-7, обладающие повышенной пергидролитической активностью. Несмотря на то, что пергидролазы СЕ-7 обладают избыточной пергидролитической активностью, их применение в продуктах личной гигиены все еще не было раскрыто. В связи с этим, проблема, которую необходимо решить, заключается в получении композиций личной гигиены и способов, включающих применение по меньшей мере одной пергидролазы СЕ-7 для получения перкислотного полезного средства.
Перкислоты являются сильными окислительным средствами, которые могут вступать в реакцию с рядом материалов, включая материалы, не являющиеся целью для желаемого полезного эффекта. В связи с этим, определенные применения, связанные с личной гигиеной, могут давать полезный эффект за счет возможности ориентировать/фокусировать перкислотное полезное средство на желаемую поверхность тела путем локализации образования перкислоты на или возле желаемой целевой поверхности тела. Ферментативное получение перкислоты может давать полезный эффект за счет ориентирования пергидролазы на поверхности тела. Дополнительного полезного эффекта можно достичь путем ориентирования пергидролазы на материал для доставки с тем, чтобы ограничить концентрацию фермента и воздействие на потребителя.
Сообщалось о композициях для ухода за полостью рта и/или способах обработки нуждающейся в уходе поверхности полости рта при помощи фермента, связанного с материалом полости рта. В патенте США № 4138476, Simonson et al., раскрыт способ обработки зубного налета, включающий применение глюкан-разрушающего фермента, ковалентно связанного через комплексообразователь с группой фосфатного носителя, обладающей сродством к поверхности зуба. Полагают, что ферментное разрушение отложений глюкана способствует растворению и диспергированию материала зубного налета.
В публикации заявки на патент США № 2005-0158253, патенте США 6830745, Budny et al., раскрыта двухкомпонентная композиция, содержащая фиксирующийся ферментный комплекс для ферментативного разрушения биопленочных структур и второй фиксирующийся ферментный компонент, способный действовать непосредственно на бактерии. Разрушающими биопленку ферментами являются ферменты, которые непосредственно разрушают структуры экзополисахаридного скелета.
В патенте США 5871714, Budny, J., раскрыта композиция для контроля бактериального роста/колониеобразования (например, уменьшения зубного налета), содержащая фермент, который разрушает матрикс зубного налета, связанный с фиксирующейся молекулой. Применение нацеленной пергидролазы не раскрыто.
В патенте Соединенных Штатов 5490988 и европейском патенте ЕР 0479600, Beggs et al., раскрыто применение фрагментов антител в качестве средств для связывания с целевым участком, при этом терапевтическое средство соединено через дополнительный пептид, присоединенный к фрагменту антитела для прикрепления терапевтического средства к целевому участку. Раскрыт продукт для ухода за полостью рта, содержащий модифицированный фрагмент антитела, обладающий сродством к антигенному компоненту бактерий в зубном налете для доставки терапевтического средства. Терапевтическим средством может быть цитотоксическое средство, производимое ферментом или комбинацией ферментов, как, например, оксидаза в сочетании с пероксидазой с образованием галидов. Применение нацеленной пергидролазы для получения перкислотного полезного средства, не описано.
В европейском патенте ЕР 0450800 В1, Beggs et al., раскрыто использование двух различных ферментов, работающих вместе, воздействуя на вещества, встречающиеся в микрофлоре рта. Первый фермент образует промежуточный продукт, который используется в качестве субстрата для второго фермента для получения средства, активного в отношении цели во рту. Каждый фермент присоединен к антителу или фрагменту антитела, обладающему сродством к целевой поверхности во рту, причем при применении ферменты связываются с целевым участком поблизости друг с другом. Проиллюстрирована комбинация с глюкозооксидазой для получения пероксида водорода, которая затем может преобразоваться при помощи пероксидазы, в присутствии галида или тиоцианата, с получением гипогалогенита или гипотиоцианата, соответственно. Применение нацеленной пергидролазы для получения перкислотного полезного средства, не описано.
В европейском патенте EP 0451972 B1, Beggs et al., описан продукт, содержащий два фермента, при этом продукт содержит первый фермент для образования активного средства против мишени и второй фермент для образования промежуточного продукта, который является субстратом для первого фермента; причем указанный продукт дополнительно содержит средства для связывания (т.е. антитело или фрагмент антитела), присоединенные или присоединяемые к обоим ферментам для связывания ферментов друг с другом, в результате чего образуется комплекс, который связывается с целевой клеткой. Проиллюстрирована оксидаза (способная создавать пероксид водорода), связанная с пероксидазой, которая катализирует образование гипогалогенитного или гипотиоцианатного активного средства.
В европейском патенте EP 0453097 B1, Beggs et al., описана доставка активного средства к целевому участку с помощью множества антител или фрагментов антител, которые могут самостоятельно собираться с образованием мостика между средством и целевым участком. Активным средством является глюкозооксидаза или сочетание глюкозооксидазы и пероксидазы. Применение нацеленной пергидролазы для получения перкислотного полезного средства не описано.
Применение антител, фрагментов антител (Fab), отдельной цепи, слитой с антителом, содержащим вариабельный участок, (scFc), антител Camelidae и скелетных белков-дисплеев в качестве пептидных материалов, обладающих сродством, может не подходить для некоторых применений, связанных с личной гигиеной, вследствие их размера и стоимости. В связи с этим, остается необходимость в определенных дешевых косметических применениях для использования более коротких, менее дорогостоящих пептидных материалов, обладающих сродством, для нацеленной доставки полезного средства.
Было описано применение более коротких пептидов, обладающих сильным сродством, для ориентирования косметического полезного средства на поверхность тела (патенты США №№ 7220405; 7309482; 7285264 и 7807141; публикации заявок на патенты США №№ 2005-0226839 A1; 2007-0196305 A1; 2006-0199206 A1; 2007-0065387 A1; 2008-0107614 A1; 2007-0110686 A1; 2006-0073111 A1; 2010-0158846; 2010-0158847 и 2010-0247589; и опубликованные PCT заявки WO2008/054746; WO2004/048399 и WO2008/073368). В патенте США 7807141, Huang et al., раскрыты пептидные реагенты для ухода за поверхностью полости рта, подходящие для связывания полезного средства на полость рта с поверхностью зуба. Не было описано применение пептидного материала, обладающего сродством к поверхности полости рта, для связывания активной пергидролазы СЕ-7 (т.е. "нацеленных пергидролаз"), производящей перкислотное полезное средство.
В связи с этим, дополнительная проблема, которую необходимо решить, заключается в обеспечении композиций и способов, подходящих для того, чтобы ориентировать ферментативное получение перкислоты на поверхность полости рта.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Предложены способы и композиции, содержащие компоненты для ферментативного получения и доставки перкислотного полезного средства к поверхности полости рта.
В одном варианте осуществления приведены композиции и способы для ухода за полостью рта, в которых применяют пергидролазу СЕ-7 для ферментативного получения перкислотного полезного средства, для использования в применениях, связанных с гигиеной полости рта, таких как очистка поверхности полости рта, отбеливание зубов, обеззараживание, обесцвечивание, дезодорирование, лечение зубного кариеса, предупреждение зубного кариеса, уменьшение количества ротовых бактерий, связанных с зубным кариесом, и лечение или удаление биопленок во рту (например, зубного налета).
В одном варианте осуществления приведен способ, включающий:
1) обеспечение набора реакционных компонентов, который содержит:
а) по меньшей мере один субстрат, выбранный из группы, состоящей из:
i) сложных эфиров со структурой
[X]mR5,
где Х = сложноэфирная группа с формулой R6C(O)O;
R6=C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6=C2-C7;
R5=C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
ii) глицеридов со структурой
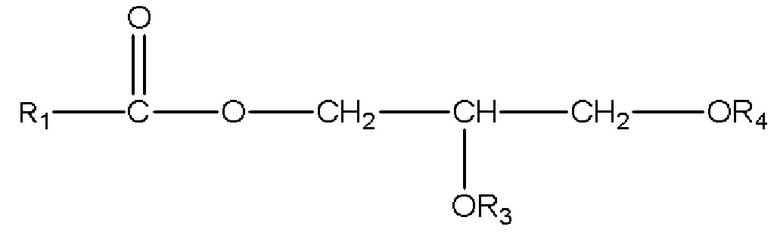 ,
,
где R1=C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
iii) одного или нескольких сложных эфиров с формулой
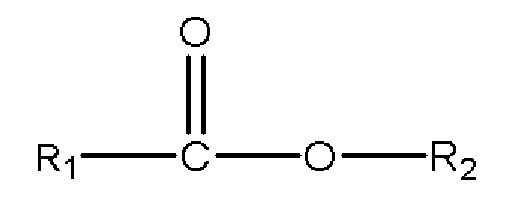 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или разветвленной цепью, (CH2CH2O)n или (CH2CH(CH3)O)nH, и n равен 1-10; и
iv) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов;
b) источник кислорода пероксигруппы; и
с) ферментный катализатор, обладающий пергидролитической активностью, при этом указанный катализатор включает фермент, обладающий сигнатурным мотивом СЕ-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2 с помощью CLUSTALW, причем указанный сигнатурный мотив содержит:
i) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
ii) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2; и
iii) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2; и
2) объединение реакционных компонентов (1) при подходящих реакционных условиях, посредством чего ферментативно получают по меньшей мере одну перкислоту;
3) приведение в контакт поверхности полости рта по меньшей мере с одной перкислотой, посредством чего поверхность полости рта получает основанный на перкислоте полезный эффект, выбранный из группы, состоящей из осветления, отбеливания зубов, обеззараживания, обесцвечивания, дезодорирования, уменьшения или устранения биопленки или их комбинаций.
В одном варианте осуществления поверхность полости рта представляет собой зубную эмаль, налет на зубах, мягкую ткань в полости рта (например, десна, язык) или биопленку в полости рта (например, налет во рту).
В другом варианте осуществления предлагаются композиции и способы, включающие применение гибридного белка (т.е. "нацеленной пергидролазы"), содержащего пергидролитический фермент и пептидный компонент, обладающий сродством к поверхности полости рта, при этом два компонента необязательно могут быть разделены пептидным спейсером.
В одном варианте осуществления приведен способ, включающий:
1) обеспечение набора реакционных компонентов, который содержит:
а) по меньшей мере один субстрат, выбранный из группы, состоящей из:
i) сложных эфиров со структурой
[X]mR5,
где Х = сложноэфирная группа с формулой R6C(O)O;
R6=C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6=C2-C7;
R5=C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
ii) глицеридов со структурой
 ,
,
где R1=C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
iii) одного или нескольких сложных эфиров с формулой
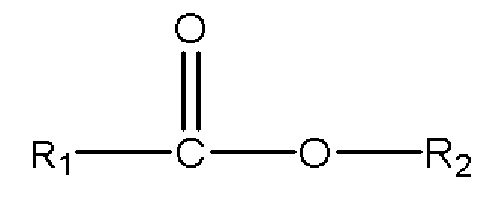 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или разветвленной цепью, (CH2CH2O)n или (CH2CH(CH3)O)nH, и n равен 1-10; и
iv) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов;
b) источник кислорода пероксигруппы; и
с) ферментный катализатор, обладающий пергидролитической активностью, при этом указанный ферментный катализатор включает гибридный белок со следующей общей структурой:
PAH-[L]y-OCBD
или
OCBD-[L]y-PAH,
где
PAH является ферментом, обладающим пергидролитической активностью;
OCBD является пептидным компонентом, обладающим сродством к поверхности полости рта; и
L является необязательным пептидным линкером, варьирующим в длину от 1 до 100 аминокислот; и
y равен 0 или 1;
2) объединение реакционных компонентов (1) при подходящих реакционных условиях, посредством чего ферментативно получают по меньшей мере одну перкислоту;
3) приведение в контакт поверхности полости рта по меньшей мере с одной перкислотой, посредством чего поверхность полости рта получает основанный на перкислоте полезный эффект, выбранный из группы, состоящей из осветления, отбеливания зубов, обеззараживания, обесцвечивания, дезодорирования, уменьшения или устранения биопленки или их комбинаций.
Гибридный белок может содержать пергидролитический фермент, выбранный из группы, состоящей из липаз, протеаз, эстераз, ацилтрансфераз, арилэстераз, эстераз углеводов и их комбинаций.
В одном варианте осуществления гибридный белок содержит пергидролитическую арилэстеразу (ArE) из Mycobacterium smegmatis. В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, которая по меньшей мере на 95% идентична арилэстеразе S54V Mycobacterium smegmatis, приведенной в SEQ ID NO: 460.
В одном варианте осуществления гибридный белок содержит пергидролитическую эстеразу из Pseudomonas fluorescens. В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, которая по меньшей мере на 95% идентична эстеразе Pseudomonas fluorescens, приведенной в SEQ ID NO: 477.
В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 424, 425, 426, 427, 428, 429, 430, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 476, 477, 478 и 479.
В другом варианте осуществления гибридный белок содержит пергидролазу СЕ-7 с сигнатурным мотивом СЕ-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2 с помощью CLUSTALW, причем указанный сигнатурный мотив содержит:
i) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
ii) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2; и
iii) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2.
В другом варианте осуществления пептидный компонент, обладающий сродством к поверхности полости рта, предпочтительно представляет собой одноцепочечный пептид, содержащий по меньшей мере один пептид, связывающийся с поверхностью полости рта. В следующем варианте осуществления пептид, связывающийся с поверхностью полости рта, представляет собой пептид, обладающий сродством к зубной эмали, налету на зубах и как к зубной эмали, так и к налету на зубах.
В другом варианте осуществления предлагается гибридный белок, имеющий следующую общую структуру:
PAH-[L]y-OCBD
или
OCBD-[L]y-PAH,
где
1) PAH является ферментом, обладающим пергидролитической активностью;
2) OCBD является пептидным компонентом, обладающим сродством к поверхности полости рта;
3) L является необязательным пептидным линкером, варьирующим в длину от 1 до 100 аминокислот; и
4) y равен 0 или 1.
В другом варианте осуществления предлагается гибридный белок, имеющий общую структуру:
PAH-[L]y-OCBD
или
OCBD-[L]y-PAH,
где
а) РАН представляет собой эстеразу углеводов СЕ-7, обладающую пергидролитической активностью; при этом РАН имеет сигнатурный мотив СЕ-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2 с помощью CLUSTALW, причем указанный сигнатурный мотив содержит:
i) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
ii) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2; и
iii) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2; и
b) OCBD является пептидным компонентом, обладающим сродством к поверхности полости рта;
c) L является необязательным пептидным линкером, варьирующим в длину от 1 до 100 аминокислот; и
d) y равен 0 или 1.
В другом варианте осуществления приведен продукт для ухода за полостью рта, содержащий:
1) ферментный катализатор, содержащий любой из вышеприведенных пергидролитических гибридных белков;
2) по меньшей мере один субстрат, выбранный из группы, состоящей из:
а) сложных эфиров со структурой
[X]mR5,
где Х = сложноэфирная группа с формулой R6C(O)O;
R6=C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6=C2-C7;
R5=C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
b) глицеридов со структурой
 ,
,
где R1=C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
с) одного или нескольких сложных эфиров с формулой
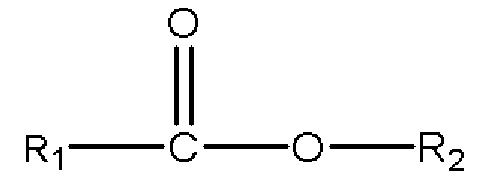 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или разветвленной цепью, (CH2CH2O)n или (CH2CH(CH3)O)nH, и n равен 1-10; и
d) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов;
3) источник кислорода пероксигруппы; и
4) приемлемую для рта несущую среду.
В другом варианте осуществления приведен продукт для ухода за полостью рта, содержащий:
1) ферментный катализатор, обладающий пергидролитической активностью, при этом указанный катализатор включает фермент, обладающий сигнатурным мотивом СЕ-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2 с помощью CLUSTALW, причем указанный сигнатурный мотив содержит:
а) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
b) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2; и
с) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2; и
2) по меньшей мере один субстрат, выбранный из группы, состоящей из:
а) сложных эфиров со структурой
[X]mR5,
где Х = сложноэфирная группа с формулой R6C(O)O;
R6=C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6=C2-C7;
R5=C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
b) глицеридов со структурой
 ,
,
где R1=C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
с) одного или нескольких сложных эфиров с формулой
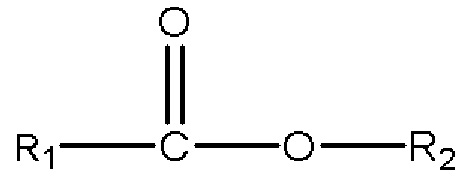 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или разветвленной цепью, (CH2CH2O)n или (CH2CH(CH3)O)nH, и n равен 1-10; и
d) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов;
3) источник кислорода пероксигруппы; и
4) приемлемую для рта несущую среду.
В другом варианте осуществления предлагается выделенный полипептид, обладающий сродством к поверхности полости рта, причем указанный полипептид имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421 и 422.
В другом варианте осуществления также предлагается применение эстеразы углеводов СЕ-7, обладающей пергидролитической активностью, в продукте для ухода за полостью рта для получения эффективной концентрации по меньшей мере одной перкислоты для осветления, отбеливания, обеззараживания, обесцвечивания, дезодорирования или удаления биопленки с материала полости рта/поверхности полости рта.
В другом варианте осуществления предлагается применение композиции для образования перкислоты, содержащей:
а) ферментный катализатор, обладающий пергидролитической активностью, при этом указанный катализатор включает фермент, обладающий сигнатурным мотивом СЕ-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2 с помощью CLUSTALW, причем указанный сигнатурный мотив содержит:
i) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
ii) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2; и
iii) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2; и
b) по меньшей мере один субстрат, выбранный из группы, состоящей из:
1) сложных эфиров со структурой
[X]mR5,
где Х = сложноэфирная группа с формулой R6C(O)O;
R6=C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6=C2-C7;
R5=C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический, или шестичленный циклический ароматический, или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
2) глицеридов со структурой
 ,
,
где R1=C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
3) одного или нескольких сложных эфиров с формулой
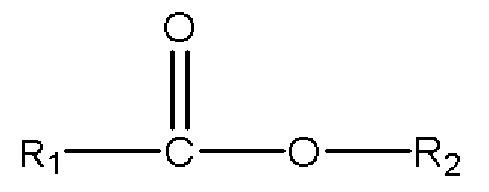 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или разветвленной цепью, (CH2CH2O)n или (CH2CH(CH3)O)nH и n равно 1-10; и
d) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов; и
с) источник кислорода пероксигруппы;
в результате чего образуется перкислота при одновременном или поэтапном (но не в конкретном порядке) смешивании (а), (b) и (с); для лечения, предупреждения зубного кариеса, гингивита, орального кандидоза или периодонтита.
В другом варианте осуществления предлагается применение в продукте для полости рта гибридного белка, содержащего следующую общую структуру, которая включает:
PAH-[L]y-OCBD
или
OCBD-[L]y-PAH,
где
1) РАН является ферментом, обладающим пергидролитической активностью, с аминокислотной последовательностью, которая имеет по меньшей мере 95% аминокислотную идентичность с SEQ ID NO: 460;
2) OCBD является пептидным компонентом, обладающим сродством к поверхности полости рта;
3) L является пептидным линкером, варьирующим в длину от 1 до 100 аминокислот; и
4) y равен 0 или 1.
Некоторые из описанных в данном документе субстратов на основе сложных эфиров (Таблица 20) были особенно восприимчивы к химическому пергидролизу при вступлении в реакцию с пероксидом водорода с образованием перуксусной кислоты. В другом варианте осуществления предлагается продукт личной гигиены, содержащий предшественник перкислоты, выбранный из группы, состоящей из 1,2,3,5-тетра-O-ацетилрибофуранозы; 1,2,3,4-тетра-O-ацетилрибофуранозы; 2-ацетамидо-2-дезокси-1,3,4,6-тетраацетил-β-D-глюкопиранозы; β-D-глюкопиранозы 1,2,3,4-тетраацетата; 2,3,4,6-тетраацетил-β-D-глюкопиранозы; 1,3,4,6-тетра-O-ацетилманнопиранозы и α-D-маннопиранозы пентаацетата. В предпочтительном варианте осуществления продукт личной гигиены является продуктом для ухода за полостью рта.
В другом варианте осуществления также обеспечивается способ, включающий:
a) обеспечение набора реакционных компонентов, который содержит
i) предшественник перкислоты, выбранный из группы, состоящей из 1,2,3,5-тетра-O-ацетилрибофуранозы; 1,2,3,4-тетра-O-ацетилрибофуранозы; 2-ацетамидо-2-дезокси-1,3,4,6-тетраацетил-β-D-глюкопиранозы; β-D-глюкопиранозы 1,2,3,4-тетраацетата; 2,3,4,6-тетраацетил-β-D-глюкопиранозы; 1,3,4,6-тетра-O-ацетилманнопиранозы и α-D-маннопиранозы пентаацетата; и
ii) источник кислорода пероксигруппы;
b) приведение в контакт поверхности организма с эффективным количеством перуксусной кислоты, образованной в результате объединения набора реакционных компонентов в присутствии воды; в результате чего перуксусная кислота обеспечивает благоприятное воздействие на поверхность организма.
В предпочтительном аспекте поверхность организма в вышеуказанном способе представляет собой ткань в полости рта, такую как зубы и/или десна.
КРАТКОЕ ОПИСАНИЕ БИОЛОГИЧЕСКИХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Следующие последовательности соответствуют §§ 1.821-1.825 37 C.F.R. ("Требования для патентных заявок, содержащих раскрытия нуклеотидных последовательностей и/или аминокислотных последовательностей - Правила для последовательностей") и согласуются со Стандартом ST.25 (2009) Всемирной организации интеллектуальной собственности (ВОИС) и требованиями для перечня последовательностей Европейской патентной конвенции (ЕПК) и Правилами 5.2 и 49.5 (a-bis) Договора о патентной кооперации (РСТ) и разделом 208 и приложение С Административной инструкции. Символы и формат, применяемые для данных по нуклеотидным и аминокислотным последовательностям, соответствуют правилам, изложенным в § 1.822 37 C.F.R.
SEQ ID NO: 1 представляет собой последовательность нуклеиновой кислоты, кодирующую деацетилазу цефалоспорина С из Bacillus subtilis ATCC® 31954™.
SEQ ID NO: 2 представляет собой аминокислотную последовательность деацетилазы цефалоспорина С из Bacillus subtilis ATCC® 31954™.
SEQ ID NO: 3 представляет собой последовательность нуклеиновой кислоты, кодирующую деацетилазу цефалоспорина С из Bacillus subtilis subsp. subtilis, штамм 168.
SEQ ID NO: 4 представляет собой аминокислотную последовательность деацетилазы цефалоспорина С из Bacillus subtilis subsp. subtilis, штамм 168.
SEQ ID NO: 5 представляет собой последовательность нуклеиновой кислоты, кодирующую деацетилазу цефалоспорина С из B. subtilis ATCC® 6633™.
SEQ ID NO: 6 представляет собой аминокислотную последовательность деацетилазы цефалоспорина С из B. subtilis ATCC® 6633™.
SEQ ID NO: 7 представляет собой последовательность нуклеиновой кислоты, кодирующую деацетилазу цефалоспорина С из B. licheniformis ATCC® 14580™.
SEQ ID NO: 8 представляет собой производную аминокислотную последовательность деацетилазы цефалоспорина С из B. licheniformis ATCC® 14580™.
SEQ ID NO: 9 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу B. pumilus PS213.
SEQ ID NO: 10 представляет собой производную аминокислотную последовательность ацетилксиланэстеразы B. pumilus PS213.
SEQ ID NO: 11 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу из Clostridium thermocellum ATCC®27405™.
SEQ ID NO: 12 представляет собой производную аминокислотную последовательность ацетилксиланэстеразы из Clostridium thermocellum ATCC®27405™.
SEQ ID NO: 13 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу из Thermotoga neapolitana.
SEQ ID NO: 14 представляет собой аминокислотную последовательность ацетилксиланэстеразы из Thermotoga neapolitana.
SEQ ID NO: 15 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу из Thermotoga maritima MSB8.
SEQ ID NO: 16 представляет собой аминокислотную последовательность ацетилксиланэстеразы из Thermotoga maritima MSB8.
SEQ ID NO: 17 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу из Thermoanaerobacterium sp. JW/SL YS485.
SEQ ID NO: 18 представляет собой производную аминокислотную последовательность ацетилксиланэстеразы из Thermoanaerobacterium sp. JW/SL YS485.
SEQ ID NO: 19 представляет собой последовательность нуклеиновой кислоты деацетилазы цефалоспорина С из Bacillus sp. NRRL B-14911. Следует отметить, что последовательность нуклеиновой кислоты, кодирующая деацетилазу цефалоспорина С из Bacillus sp. NRRL B-14911 по данным GENBANK® с инвентарным номером ZP_01168674, оказывается кодирует N-концевое дополнение длиной 15 аминокислот, которое, вероятно, является неверным, исходя из выравниваний последовательностей с другими деацетилазами цефалоспорина С и сравнения приведенной длины (340 аминокислот) по сравнению с наблюдаемой длиной других ферментов САН (обычно 318-325 аминокислот длиной; см. публикацию заявки на патент США US-2010-0087528-A1; включенной в данный документ в качестве ссылки). В связи с этим, последовательность нуклеиновой кислоты, приведенная в данном документе, кодирует последовательность деацетилазы цефалоспорина С из Bacillus sp. NRRL B-14911 без N-концевых 15 аминокислот, приведенных под инвентарным номером GENBANK® ZP_01168674.
SEQ ID NO: 20 представляет собой производную аминокислотную последовательность деацетилазы цефалоспорина С из Bacillus sp. NRRL B-14911, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 19.
SEQ ID NO: 21 представляет собой последовательность нуклеиновой кислоты, кодирующую деацетилазу цефалоспорина С из Bacillus halodurans C-125.
SEQ ID NO: 22 представляет собой производную аминокислотную последовательность деацетилазы цефалоспорина С из Bacillus halodurans C-125.
SEQ ID NO: 23 представляет собой последовательность нуклеиновой кислоты, кодирующую деацетилазу цефалоспорина С из Bacillus clausii KSM-K16.
SEQ ID NO: 24 представляет собой производную аминокислотную последовательность деацетилазы цефалоспорина С из Bacillus clausii KSM-K16.
SEQ ID NO: 25 представляет собой последовательность нуклеиновой кислоты, кодирующую деацетилазу цефалоспорина С (САН) из Bacillus subtilis ATCC® 29233™.
SEQ ID NO: 26 представляет собой производную аминокислотную последовательность деацетилазы цефалоспорина С (САН) из Bacillus subtilis ATCC® 29233™.
SEQ ID NO: 27 представляет собой производную аминокислотную последовательность варианта ацетилксиланэстеразы Thermotoga neapolitana из публикации заявки на патент США № 2010-0087529 (включенной в данный документ в качестве ссылки), где остатком Xaa в положении 277 является Ala, Val, Ser или Thr.
SEQ ID NO: 28 представляет собой производную аминокислотную последовательность варианта ацетилксиланэстеразы Thermotoga maritima MSB8 из публикации заявки на патент США № 2010-0087529, где остатком Xaa в положении 277 является Ala, Val, Ser или Thr.
SEQ ID NO: 29 представляет собой производную аминокислотную последовательность варианта ацетилксиланэстеразы Thermotoga lettingae из публикации заявки на патент США № 2010-0087529, где остатком Xaa в положении 277 является Ala, Val, Ser или Thr.
SEQ ID NO: 30 представляет собой производную аминокислотную последовательность варианта ацетилксиланэстеразы Thermotoga petrophila из публикации заявки на патент США № 2010-0087529, где остатком Xaa в положении 277 является Ala, Val, Ser или Thr.
SEQ ID NO: 31 представляет собой производную аминокислотную последовательность варианта ацетилксиланэстеразы Thermotoga sp. RQ2, происходящий от "RQ2(a)" из публикации заявки на патент США № 2010-0087529, где остатком Xaa в положении 277 является Ala, Val, Ser или Thr.
SEQ ID NO: 32 представляет собой производную аминокислотную последовательность варианта ацетилксиланэстеразы Thermotoga sp. RQ2, происходящий от "RQ2(b)" из публикации заявки на патент США № 2010-0087529, где остатком Xaa в положении 278 является Ala, Val, Ser или Thr.
SEQ ID NO: 33 представляет собой производную аминокислотную последовательность ацетилксиланэстеразы Thermotoga lettingae.
SEQ ID NO: 34 представляет собой производную аминокислотную последовательность ацетилксиланэстеразы Thermotoga petrophila.
SEQ ID NO: 35 представляет собой производную аминокислотную последовательность первой ацетилксиланэстеразы из Thermotoga sp. RQ2, описываемой в данном документе как “RQ2(a)”.
SEQ ID NO: 36 представляет собой производную аминокислотную последовательность второй ацетилксиланэстеразы из Thermotoga sp. RQ2, описываемой в данном документе как “RQ2(b)”.
SEQ ID NO: 37 представляет собой последовательность нуклеиновой кислоты с оптимизированным кодоном, которая кодирует деацетилазу цефалоспорина С Thermoanearobacterium saccharolyticum.
SEQ ID NO: 38 представляет собой производную аминокислотную последовательность деацетилазы цефалоспорина С Thermoanearobacterium saccharolyticum.
SEQ ID NO: 39 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу из Lactococcus lactis (инвентарный номер GENBANK® EU255910).
SEQ ID NO: 40 представляет собой аминокислотную последовательность ацетилксиланэстеразы из Lactococcus lactis (инвентарный номер GENBANK® ABX75634.1).
SEQ ID NO: 41 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу из Mesorhizobium loti (инвентарный номер GENBANK® NC_002678.2).
SEQ ID NO: 42 представляет собой аминокислотную последовательность ацетилксиланэстеразы из Mesorhizobium loti (инвентарный номер GENBANK® BAB53179.1).
SEQ ID NO: 43 представляет собой последовательность нуклеиновой кислоты, кодирующую ацетилксиланэстеразу из Geobacillus stearothermophilus (инвентарный номер GENBANK® AF038547.2).
SEQ ID NO: 44 представляет собой аминокислотную последовательность ацетилксиланэстеразы из Geobacillus stearothermophilus (инвентарный номер GENBANK® AAF70202.1).
SEQ ID NO: 45 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу (вариантная “A3”) со следующими заменами аминокислотной последовательности относительно ацетилксиланэстеразы дикого типа Thermotoga maritima: (F24I/S35T/Q179L/N275D/C277S/S308G/F317S).
SEQ ID NO: 46 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы "А3".
SEQ ID NO: 47 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу N275D/C277S.
SEQ ID NO: 48 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы N275D/C277S.
SEQ ID NO: 49 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу C277S/F317S.
SEQ ID NO: 50 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы C277S/F317S.
SEQ ID NO: 51 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу S35T/C277S.
SEQ ID NO: 52 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы S35T/C277S.
SEQ ID NO: 53 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу Q179L/C277S.
SEQ ID NO: 54 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы Q179L/C277S.
SEQ ID NO: 55 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу 843H9 со следующими заменами аминокислотной последовательности относительно ацетилксиланэстеразы дикого типа Thermotoga maritima: (L8R/L125Q/Q176L/V183D/F247I/C277S/P292L).
SEQ ID NO: 56 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы 843H9.
SEQ ID NO: 57 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу 843F12 со следующими заменами аминокислотной последовательности относительно ацетилксиланэстеразы дикого типа Thermotoga maritima: K77E/A266E/C277S.
SEQ ID NO: 58 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы 843F12.
SEQ ID NO: 59 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу 843C12 со следующими заменами аминокислотной последовательности относительно ацетилксиланэстеразы дикого типа Thermotoga maritima: F27Y/I149V/A266V/C277S/I295T/N302S.
SEQ ID NO: 60 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы 843C12.
SEQ ID NO: 61 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу 842H3 со следующими заменами аминокислотной последовательности относительно ацетилксиланэстеразы дикого типа Thermotoga maritima: L195Q/C277S.
SEQ ID NO: 62 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы 842H3.
SEQ ID NO: 63 представляет собой последовательность нуклеиновой кислоты, кодирующую вариантную ацетилксиланэстеразу 841A7 со следующими заменами аминокислотной последовательности относительно ацетилксиланэстеразы дикого типа Thermotoga maritima: Y110F/C277S.
SEQ ID NO: 64 представляет собой аминокислотную последовательность вариантной ацетилксиланэстеразы 841A7.
SEQ ID NO: 65-221, 271 и 368 являются неограничивающим перечнем аминокислотных последовательностей пептидов, обладающих сродством к волосу.
SEQ ID NO: 217-269 являются аминокислотными последовательностями пептидов, обладающих сродством к коже.
SEQ ID NO: 270-271 являются аминокислотными последовательностями пептидов, обладающих сродством к ногтю.
SEQ ID NO: 272-382 являются аминокислотными последовательностями пептидов, обладающих сродством к поверхности полости рта. SEQ ID NO: 272-291 и 312-382 обладают сродством к налету на зубах. SEQ ID NO: 272-291 и 292-311 обладают сродством к зубной эмали.
SEQ ID NO: 383-396 являются аминокислотными последовательностями пептидных линкеров/спейсеров.
SEQ ID NO: 397 является последовательностью нуклеиновой кислоты экспрессирующей плазмиды pLD001.
SEQ ID NO: 398 является последовательностью нуклеиновой кислоты праймера для секвенирования.
SEQ ID NO: 399-410 являются аминокислотными последовательностями пептидов, связывающихся с зубной эмалью и связывающихся с налетом на зубах, из Примера 2.
SEQ ID NO: 411 является аминокислотной последовательностью пептидов, связывающихся с зубом, DenP03 с C-концевым лизином, как показано в Таблице 4.
SEQ ID NO: 412-422 являются аминокислотной последовательностью пептидов, связывающихся с зубной эмалью, и пептидов, связывающихся с налетом на зубах, с C-концевым лизином, как показано в Таблице 4.
SEQ ID NO: 423 является аминокислотной последовательностью пептида НС263.
SEQ ID NO: 424 является аминокислотной последовательностью вариантной Thermotoga maritima C277S, также называемой в настоящей заявке ферментом “EZ-1”.
SEQ ID NO: 425-430, и 437-467, и 479 являются аминокислотными последовательностями различных конструктов пергидролаз, которые раскрыты в Таблице 5 и/или Таблице 6.
SEQ ID NO: 431-436 и 468-475 являются аминокислотными последовательностями различных нацеливающих последовательностей, раскрытых в Примере 4.
SEQ ID NO: 476 представляет собой аминокислотную последовательность вариантной HTS-007-D5 Thermotoga maritima со следующими заменами: C277T/R296P.
SEQ ID NO: 477 является аминокислотной последовательностью эстеразы Pseudomonas fluorescens, обладающей пергидролитической активностью (патент США 7384787; вариант “L29P”. Следует отметить, что нумерация замен взята из упомянутого патента, который не включает изначальный остаток метионина. SEQ ID NO: 477 содержит замену L29P в номере положения остатка 30, поскольку в настоящей последовательности включен изначальный метионин).
SEQ ID NO: 478 является аминокислотной последовательностью арилэстеразы дикого типа Mycobacterium smegmatis (патент США 7754460).
ДЕТАЛЬНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В данном раскрытии используют ряд терминов и аббревиатур. Если четко не указано иного, то применяют следующие определения.
Применяемые в данном документе формы единственного числа элемента и компонента по настоящему изобретению подразумеваются как неограничивающие в отношении числа примеров (т.е. случаев) элемента и компонента. Таким образом, формы единственного числа следует читать как включающие по меньшей мере одно, и форма единственного числа элемента или компонента также включает множественное число, если только числа очевидно не должно означать единственное.
Применяемый в данном документе термин "включающий" означает наличие установленных признаков, целых чисел, этапов или компонентов, которые изложены в формуле изобретения, но так, чтобы он не исключал наличие дополнительных одного или нескольких признаков, целых чисел, этапов, компонентов или групп из них. Термин "включающий" подразумевают как включающий варианты осуществления, охватываемые терминами "по сути состоящий из" и "состоящий из". Подобным образом, термин "по сути состоящий из" подразумевают, как включающий варианты осуществления, охватываемые термином "состоящий из".
Применяемый в данном документе термин "приблизительно", модифицирующий количество используемого ингредиента или реактива, относится к вариации в числовом количестве, которое может произойти, например, в результате стандартных процедур измерения и процедур с манипуляцией жидкостями, применяемых для получения концентратов или готовых к использованию растворов на практике; в результате неизбежной ошибки в этих процедурах; в результате различий в производстве, источнике и чистоте ингредиентов, используемых для получения композиций или для осуществления способов; и тому подобное. Термин "приблизительно" также охватывает количества, которые различаются вследствие различных состояний равновесия для композиции, полученной из конкретной начальной смеси. Независимо от того, модифицированы или нет термином "приблизительно", пункты формулы изобретения включают эквиваленты этих количеств.
При наличии, все диапазоны являются включающими и комбинируемыми. Например, при упоминании диапазона "от 1 до 5" упомянутый диапазон следует рассматривать как включающий диапазоны "от 1 до 4", "от 1 до 3", "1-2", "1-2 и 4-5", "1-3 и 5" и т.п.
Применяемый в данном документе термин "приведение в контакт" относится к помещению композиции в контакт с целевой поверхностью организма на период времени, достаточный для достижения необходимого результата (связывание с целевой поверхностью, основанные на перкислоте эффекты и т.д.). В одном варианте осуществления "приведение в контакт" может относится к помещению в контакт композиции, содержащей (или способной производить) эффективную концентрацию перкислоты при контакте с целевой поверхностью организма в течение периода времени, достаточного для достижения необходимого результата. В другом варианте осуществления "приведение в контакт" может также относится к помещению по меньшей мере одного компонента композиции личной гигиены, такого как один или несколько реакционных компонентов, применяемых для ферментативного пергидролиза, в контакт с целевой поверхностью организма. Приведение в контакт включает распыление, обработку, погружение, промывку, заливание или вливание, смешивание, объединение, нанесение кистью, нанесение покрытия, нанесение, присоединение и другие способы взаимодействия раствора перкислоты или композиции, содержащей эффективную концентрацию перкислоты, раствора или композиции, которая образует эффективную концентрацию перкислоты или компонента композиции, который образует эффективную концентрацию перкислоты, с поверхностью организма.
Применяемые в данном документе термины "субстрат", "подходящий субстрат" и "субстрат на основе сложного эфира карбоновой кислоты" взаимозаменяемо относятся в частности к:
(а) одному или нескольким сложным эфирам со структурой
[X]mR5,
где
Х является сложноэфирной группой с формулой R6C(O)O;
R6 представляет собой C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильной группой или C1-C4 алкоксигруппой, при этом R6 необязательно содержит одну или несколько эфирных связей, где R6 является C2-C7;
R5 представляет собой C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или циклический пятичленный гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильной группой; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы, и где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5,
при этом указанные один или несколько сложных эфиров имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C; или
(b) одному или нескольким глицеридам со структурой
 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O); или
(с) одному или нескольким сложным эфирам с формулой
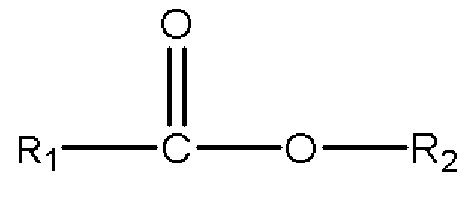 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или разветвленной цепью, (CH2CH2O)n или (CH2CH(CH3)O)nH, и n равен 1-10; или
(d) одному или нескольким ацетилированным моносахаридам, ацетилированным дисахаридам или ацетилированным полисахаридам; или
(е) любой комбинации из (а)-(d).
Применяемый в данном документе термин "перкислота" синонимичен пероксикислоте, пероксикарбоновой кислоте, пероксикислоте, перкарбоновой кислоте и пероксовой кислоте.
Применяемый в данном документе термин "перуксусная кислота" имеет аббревиатуру "РАА" и синонимичен пероксиуксусной кислоте, этанпероксовой кислоте и всем другим синонимам регистрационного номера CAS 79-21-0.
Применяемый в данном документе термин "моноацетин" синонимичен глицеролмоноацетату, моноацетату глицерина и глицерилмоноацетату.
Применяемый в данном документе термин "диацетин" синонимичен глицеролдиацетату, диацетату глицерина, глицерилдиацетату и всем другим синонимам регистрационного номера CAS 25395-31-7.
Применяемый в данном документе термин "триацетин" синонимичен триацетату глицерина, глицеролтриацетату, глицерилтриацетату, 1,2,3-триацетоксипропану, 1,2,3-пропантриолу и всем другим синонимам регистрационного номера CAS 102-76-1.
Применяемый в данном документе термин "монобутирин" синонимичен глицеролмонобутирату, монобутирату глицерина и глицерилмонобутирату.
Применяемый в данном документе термин "дибутирин" синонимичен глицеролдибутирату и глицерилдибутирату.
Применяемый в данном документе термин "трибутирин" синонимичен глицеролтрибутирату, 1,2,3-трибутирилглицеролу и всем другим синонимам регистрационного номера CAS 60-01-5.
Применяемый в данном документе термин "монопропионин" синонимичен глицеролмонопропионату, монопропионату глицерина и глицерилмонопропионату.
Применяемый в данном документе термин "дипропионин" синонимичен глицеролдипропионату и глицерилдипропионату.
Применяемый в данном документе термин "трипропионин" синонимичен глицерилтрипропионату, глицеролтрипропионату, 1,2,3-трипропионглицеролу и всем другим синонимам регистрационного номера CAS 139-45-7.
Применяемые в данном документе термины "ацетилированный сахар" и "ацетилированный сахарид" относятся к моно-, ди- и полисахаридам, содержащим по меньшей мере одну ацетильную группу. Примеры включают, но без ограничений, пентаацетат глюкозы, тетраацетат ксилозы, ацетилированный ксилан, фрагменты ацетилированного ксилана, β-D-рибофураноза-1,2,3,5-тетраацетат; три-O-ацетил-D-галактат и три-O-ацетилглюкал.
Применяемые в данном документе термины "гидрокарбил", "гидрокарбильная группа" и "гидрокарбильный фрагмент" означают прямую цепь, разветвленную или циклическую группировку атомов углерода, соединенных одинарной, двойной или тройной углерод-углеродными связями и/или эфирными мостиками и соответственно замещенных атомами водорода. Такие гидрокарбильные группы могут быть алифатическими и/или ароматическими. Примеры гидрокарбильных групп включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, циклопропил, циклобутил, пентил, циклопентил, метилциклопентил, гексил, циклогексил, бензил и фенил. В предпочтительном варианте осуществления гидрокарбильный фрагмент представляет собой прямую цепь, разветвленную или циклическую группировку атомов углерода, соединенных одинарными углерод-углеродными связями и/или эфирными мостиками и соответственно замещенных атомами водорода.
Применяемые в данном документе термины "сложные моноэфиры" и "сложные диэфиры" 1,2-этандиола, 1,2-пропандиола, 1,3-пропандиола, 1,2-бутандиола, 1,3-бутандиола, 2,3-бутандиола, 1,4-бутандиола, 1,2-пентандиола, 2,5-пентандиола, 1,5-пентандиола, 1,6-пентандиола; 1,2-гександиола, 2,5-гександиола, 1,6-гександиола и их смеси относятся к указанным соединениям, содержащим по меньшей мере одну сложноэфирную группу, с формулой RC(O)O, где R представляет собой C1-C7 линейный гидрокарбильный фрагмент. В одном варианте осуществления субстрат на основе сложного эфира карбоновой кислоты выбран из группы, состоящей из диацетата пропиленгликоля (PGDA), диацетата этиленгликоля (EDGA) и их смесей.
Применяемый в данном документе термин "диацетат пропиленгликоля" синонимичен 1,2-диацетоксипропану, пропилендиацетату, 1,2-пропандиолдиацетату и всем другим синонимам регистрационного номера CAS 623-84-7.
Применяемый в данном документе термин "диацетат этиленгликоля" синонимичен 1,2-диацетоксиэтану, этилендиацетату, гликоль диацетату и всем другим синонимам регистрационного номера CAS 111-55-7.
Применяемые в данном документе термины "подходящая смесь для ферментативной реакции", "компоненты, подходящие для in situ получения перкислоты", "подходящие реакционные компоненты", "подходящая водная реакционная смесь", "реакционная смесь" и "компоненты, создающие перкислоту" относятся к материалам и воде, в которых приводят в контакт реактивы и пергидролитический ферментный катализатор. Компоненты, создающие перкислоту, будут включать по меньшей мере фермент, обладающий пергидролитической активностью, где предпочтительно пергидролитический фермент представляет собой по меньшей мере одну пергидролазу СЕ-7 (необязательно в форме гибридного белка, нацеленного на поверхность организма), по меньшей мере один субстрат на основе сложного эфира карбоновой кислоты, источник кислорода пероксигруппы и воду (водный раствор, содержащий источник кислорода пероксигруппы, например пероксид водорода). В одном варианте осуществления какой-либо пергидролитический фермент, не принадлежащий к классу СЕ-7 эстераз углеводов, будет, с оговоркой, применяться в форме гибридного белка по меньшей мере с одним пептидным компонентом, обладающим сродством к целевой поверхности, предпочтительно поверхности полости рта.
Применяемый в данном документе термин "пергидролиз" определяют как реакцию выбранного субстрата с пероксидом с образованием перкислоты. Как правило, неорганический пероксид вводят в реакцию с выбранным субстратом в присутствии катализатора с получением пероксикарбоновой кислоты. Применяемый в данном документе термин "химический пергидролиз" включает реакции пергидролиза, в которых субстрат (предшественник пероксикарбоновой кислоты) объединяют с источником пероксида водорода, при этом пероксикарбоновая кислота образуется в отсутствие ферментного катализатора. Применяемый в данном документе термин "ферментный пергидролиз" включает реакции пергидролиза, в которых субстрат на основе сложного эфира карбоновой кислоты (предшественник перкислоты) объединяют с источником пероксида водорода и водой, в результате чего ферментный катализатор катализирует образование перкислоты.
Применяемый в данном документе термин "пергидролазная активность" относится к каталитической активности на единицу массы (например, миллиграмм) белка, сухого клеточного веса или веса иммобилизированного катализатора.
Применяемое в данном документе выражение "одна единица ферментативной активности" или "одна единица активности" или "Ед." определяют как величину пергидролазной активности, необходимую для производства 1 мкмоля продукта пероксикарбоновой кислоты за минуту при заданной температуре.
Применяемые в данном документе термины "ферментный катализатор" и "пергидролазный катализатор" относятся к катализатору, включающему фермент, обладающий пергидролитической активностью, и который может быть представлен в форме цельной клетки микроорганизма, пермеабилизированной клетки(ок) микроорганизма(ов), одного или нескольких клеточных компонентов экстракта клеток микроорганизмов, частично очищенного фермента или очищенного фермента. Ферментный катализатор также может быть химически модифицированным (как, например, посредством пегилирования или при помощи реакции с перекрестносвязывающими реагентами). Пергидролазный катализатор также может быть иммобилизирован на растворимой или нерастворимой подложке при помощи способов, хорошо известных, см., например, Immobilization of Enzymes and Cells; Gordon F. Bickerstaff, Editor; Humana Press, Totowa, NJ, USA; 1997. В одном варианте осуществления пергидролазный катализатор может быть нековалентно или ковалентно иммобилизирован в или на полоске для гигиены полости рта (например, полоска для отбеливания зубов) или капе. Иммобилизированный фермент может быть непосредственно связан с полимерной подложкой и/или компонентом в полоске для гигиены полости рта или капе (например, диоксидом титана, гидроксиапатитом, приемлемым для рта адгезивом, полиэтиленом, полипропиленом и т.д.) В следующем варианте осуществления нековалентную иммобилизацию с полосках или капой можно осуществить посредством применения пептидного связывающего домена, обладающего сильным сродством к материалу в или на полоске или капе (например, гибридный белок, содержащий пергидролитический фермент, соединенный посредством необязательного пептидного спейсера с пептидным связывающим доменом). В другом варианте осуществления капа представляет собой деформируемую капу. В другом дополнительном варианте осуществления пергидролазный катализатор иммобилизирован в или на деформируемой капе после формирования зубного слепка.
Применяемое в данном документе выражение "ацетилксиланэстеразы" относится к ферменту (Е.С. 3.1.1.72; AXE), который катализирует деацетилирование ацетилированных ксиланов и других ацетилированных сахаридов. Некоторые проиллюстрированные в данном документе ферменты, классифицированные как ацетилксиланэстеразы, приведены как обладающие значительной пергидролитической активностью.
Применяемые в данном документе термины "деацетилаза цефалоспорина С" и "ацетилгидролаза цефалоспорина С" относятся к ферменту (Е.С. 3.1.1.41), который катализирует деацетилирование цефалоспоринов, таких как цефалоспорин С и 7-аминоцефалоспорановая кислота (Mitsushima et al., (1995) Appl. Env. Microbiol. 61(6):2224-2229). В данном документе приведены аминокислотные последовательности некоторых деацетилаз цефалоспорина С, обладающих значительной пергидролитической активностью.
Применяемый в данном документе термин “Bacillus subtilis ATCC® 31954™” относится к бактериальной клетке, депонированной в Американскую коллекцию типовых культур (АТСС) с международным инвентарным номером в депозитарии ATCC® 31954™. Описываемый в данном документе фермент, обладающий значительной пергидролазной активностью из B. subtilis ATCC® 31954™ приведен как SEQ ID NO: 2 (см. публикацию заявки на патент США № 2010-0041752).
Применяемый в данном документе термин “Thermotoga maritima MSB8” относится к бактериальной клетке которая, по сообщениям, обладает ацетилксиланэстеразной активностью (GENBANK® NP_227893.1; см. публикацию заявки на патент США № 2008-0176299). Аминокислотная последовательность фермента, обладающего пергидролазной активностью из Thermotoga maritima MSB8, приведена как SEQ ID NO: 16.
Применяемые в данном документе выражения "выделенная молекула нуклеиновой кислоты", "выделенный полинуклеотид", "выделенный фрагмент нуклеиновой кислоты" будут использоваться взаимозаменяемо и относятся к полимеру РНК или ДНК, которые являются одно- или двухцепочечными, необязательно содержащими синтетические, неприродные или измененные нуклеотидные основания. Выделенная молекула нуклеиновой кислоты в форме полимера ДНК может состоять из одного или нескольких сегментов кДНК, геномной ДНК или синтетической ДНК.
Термин "аминокислота" относится к основной химической структурной единице белка или полипептида. Следующие аббревиатуры в данном документе применяют для выявления специфических аминокислот:
Аббревиатура
Аббревиатура
Например, из уровня техники хорошо известно, что изменения в гене, которые приводят к получению химически эквивалентной аминокислоты в данном сайте, но не затрагивают функциональные свойства кодируемого белка, являются общими. В контексте настоящего изобретения замены определяют как изменения в пределах одной из следующих пяти групп:
1. Небольшие алифатические, неполярные или слегка полярные остатки: Ala, Ser, Thr (Pro, Gly);
2. Полярные, отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, Gln;
3. Полярные, положительно заряженные остатки: His, Arg, Lys;
4. Большие алифатические неполярные остатки: Met, Leu, Ile, Val (Cys); и
5. Большие ароматические остатки: Phe, Tyr и Trp.
Таким образом, кодон для аминокислоты аланин, гидрофобной аминокислоты, можно заменить кодоном, который кодирует другой, менее гидрофобный остаток (как, например, глицин) или более гидрофобный остаток (как, например, валин, лейцин или изолейцин). Аналогично, также можно ожидать, что изменения, которые приводят к замене одного отрицательно заряженного остатка на другой (как, например, аспарагиновая кислота на глутаминовую кислоту) или одного положительно заряженного остатка на другой (как, например, лизин на аргинин), дадут функционально эквивалентный продукт. Во многих случаях ожидается, что изменения нуклеотидов, которые приводят к изменениям N-концевой и C-концевой частей белковой молекулы, не приведут к изменениям активности белка. Каждая из предложенных модификаций находится в пределах квалификации рядового специалиста в данной области, равно как и определение сохранения биологической активности кодируемых продуктов.
Применяемые в данном документе термины "сигнатурный мотив" и "диагностический мотив" относятся к консервативным структурам, которые являются общими для представителей семейства ферментов, обладающих определенной активностью. Сигнатурный мотив можно использовать для определения и/или идентификации семейства структурно-родственных ферментов, обладающих подобной ферментативной активностью в отношении определенного семейства субстратов. Сигнатурный мотив можно быть отдельной последовательностью смежных аминокислот или собранием несмежных консервативных мотивов, которые вместе образуют сигнатурный мотив. Как правило, консервативный(е) мотив(ы) представлен(ы) аминокислотной последовательностью. В одном варианте осуществления пергидролитический фермент содержит сигнатурный мотив эстеразы углеводов СЕ-7.
Применяемый в данном документе термин "оптимизированный кодон", поскольку он относится к генам или кодирующим участкам молекул нуклеиновой кислоты для трансформации различных хозяев, относится к изменению кодонов в гене или кодирующих участках молекул нуклеиновой кислоты с тем, чтобы отражать типичное использование кодонов у организма-хозяина без изменения полипептида, который кодируется ДНК.
Применяемые в данном документе "синтетические гены" можно собрать из олигонуклеотидных строительных блоков, которые синтезированы химическим путем с помощью процедур, известных специалистам в данной области. Эти строительные блоки сшивают или отжигают с образованием генных сегментов, которые затем ферментативно собирают для построения целого гена. "Химически синтезированный", в отношении последовательности ДНК, означает, что компоненты-нуклеотиды были собраны in vitro. Химический синтез вручную ДНК можно осуществить с помощью хорошо отлаженных процедур, или автоматизированный химический синтез можно осуществить с помощью одного из ряда коммерчески доступных устройств. Соответственно, гены можно адаптировать для оптимальной генной экспрессии, исходя из оптимизации нуклеотидных последовательностей с тем, чтобы отражать смещение кодона у клетки-хозяина. Специалист в данной области оценит вероятность успешной экспрессии гена в случае, если частота использования кодона смещена в сторону кодонов, предпочитаемых хозяином. Определение предпочтительных кодонов может быть основано на просмотре генов, происходящих от клетки-хозяина, где доступна информация о последовательностях.
Применяемый в данном документе "ген" относится к молекуле нуклеиновой кислоты, которая экспрессирует специфический белок, включающей регуляторные последовательности до (5'-некодирующие последовательности) и после (3'-некодирующие последовательности) кодирующей последовательности. "Нативный ген" относится к гену, который встречается в природе со своими собственными регуляторными последовательностями. "Гибридный ген" относится к любому гену, который не является нативным геном, включающему регуляторные и кодирующие последовательности, которые вместе не встречаются в природе. Соответственно, гибридный ген может содержать регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного источника, но расположены в порядке, отличающемся от встречающегося в природе. "Эндогенный ген" относится к нативному гену в его природной локализации в геноме организма. "Чужеродный" ген относится к гену, который в норме не встречается у организма-хозяина, но который введен в организм-хозяин при помощи генного переноса. Чужеродные гены могут содержать нативные гены, вставленные в ненативный организм, или гибридные гены. "Трансген" представляет собой ген, который был введен в геном при помощи процедуры трансформации.
Применяемая в данном документе "кодирующая последовательность" относится к последовательности ДНК, которая кодирует специфическую аминокислотную последовательность. "Подходящие регуляторные последовательности" относятся к нуклеотидным последовательностям, расположенным выше (5'-некодирующие последовательности), в пределах или ниже (3'-некодирующие последовательности) кодирующей последовательности и которая влияет на транскрипцию, процессинг или стабильность РНК или трансляцию ассоциированной кодирующей последовательности. Регуляторные последовательности могут включать промоторы, трансляционные лидерные последовательности, сайты процессинга РНА, эффектор-связывающий сайт и структуру "ствол-петля".
Применяемый в данном документе термин "функционально связанный" относится к ассоциации последовательностей нуклеиновой кислоты на отдельной молекуле нуклеиновой кислоты так, чтобы функция одной затрагивала другую. Например, промотор функционально связан с кодирующей последовательностью, если он способен затрагивать экспрессию такой кодирующей последовательности, т.е. кодирующая последовательность находится под транскрипционный контролем промотора. Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
Применяемый в данном документе термин "экспрессия" относится к транскрипции и устойчивому накоплению смысловой (мРНК) или антисмысловой РНК, происходящей от молекулы нуклеиновой кислоты по настоящему изобретению. Экспрессия также может относиться к трансляции мРНК в полипептид.
Применяемая в данном документе "трансформация" относится к переносу молекулы нуклеиновой кислоты в геном организм-хозяина, приводя к генетически устойчивому наследованию. В настоящем изобретении геном клетки-хозяина включает хромосомные и внехромосомные (например, плазмидные) гены. Организмы-хозяева, содержащие трансформированные молекулы нуклеиновой кислоты, называют "трансгенными", "рекомбинантными" или "трансформированными" организмами.
Применяемый в данном документе термин "программное обеспечение для анализа последовательностей" относится к любому компьютерному алгоритму или программному обеспечению, которое подходит для анализа нуклеотидных или аминокислотных последовательностей. "Программное обеспечение для анализа последовательностей" может быть коммерчески доступным или независимо разработанным. Типичное программное обеспечение для анализа последовательностей будет включать, но без ограничений, пакет программ GCG (Wisconsin Package, версии 9.0, Accelrys Software Corp., Сан-Диего, Калифорния), BLASTP, BLASTN, BLASTX (Altschul et al., J. Mol. Biol. 215:403-410 (1990)), и DNASTAR (DNASTAR, Inc. 1228 S. Park St. Madison, WI 53715 USA), CLUSTALW (например, версии 1.83; Thompson et al., Nucleic Acids Research, 22(22):4673-4680 (1994)), и программу FASTA, включающую алгоритм Смита-Уотермана (W. R. Pearson, Comput. Methods Genome Res., [Proc. Int. Symp.] (1994), Meeting Date 1992, 111-20. Editor(s): Suhai, Sandor. Publisher: Plenum, New York, NY), Vector NTI (Informax, Бетезда, Мэриленд) и Sequencher v. 4.05. В контексте данной заявки следует понимать, что если для анализа применяют программное обеспечение для анализа последовательностей, то результаты анализа будут основаны на "значениях по умолчанию" указываемой программы, если не уточняется иное. Применяемые в данном документе "значения по умолчанию" будут обозначать любой набор значений или параметров, установленных производителем программного обеспечения, который изначально загружается программным обеспечением при первом запуске.
Термин "поверхность организма" относится к любой поверхности организма человека, которая может служить целью для полезного средства, такого как перкислотное полезное средство. Настоящие способы и композиции направлены на применения и продукты, связанные с гигиеной полости рта. В связи с этим, поверхность организма включает материал/поверхность полости рта. В одном варианте осуществления материал полости рта представляет собой зубную эмаль, налет на зубах, мягкие ткани, такие как щеки, язык и десна, и биопленки в полости рта (например, налет во рту).
Применяемый в данном документе термин "биологические загрязнения" относится к одному или нескольким нежелательным и/или патогенным биологическим объектам, включая, но без ограничений, микроорганизмы, споры, вирусы, прионы и их смеси. В одном варианте осуществления предлагается способ ферментативного получения эффективной концентрации по меньшей мере одной перкислоты, пригодной для уменьшения и/или устранения присутствия биологических загрязнений.
Применяемый в данном документе термин "обеззараживать" относится к способу разрушения или предупреждения роста биологических загрязнений. Применяемый в данном документе термин "обеззараживающее средство" относится к средству, которое обеззараживает путем уничтожения, нейтрализации или ингибирования роста биологических загрязнений, которые могут включать биологические загрязнения в полости рта человека, такие как микроорганизмы, ассоциированные с зубным кариесом, гингивитом, оральным кандидозом или периодонтитом. Применяемый в данном документе термин "обеззараживание" относится к действию или способу обеззараживания. Применяемый в данном документе термин "антисептическое средство" относится к химическому средству, которое ингибирует рост микроорганизмов-переносчиков заболевания. В одном аспекте биологические загрязнения являются патогенными микроорганизмами.
Применяемый в данном документе термин "дезинфицирование" означает или относится к восстановлению или сохранению здоровья, как правило, путем удаления, предупреждения или контроля агента, который может быть вредным для здоровья. Применяемый в данном документе термин "дезинфицировать" означает осуществление дезинфицирования. Применяемый в данном документе термин "санитайзер" означает дезинфицирующее средство. Применяемый в данном документе термин "дезинфекция" относится к действию или способу дезинфицирования.
Применяемый в данном документе термин "биоцид" относится к химическому средству, как правило, широкого спектра, которое инактивирует или уничтожает микроорганизмы. Химическое средство, которое проявляет способность к инактивации или уничтожению микроорганизмов, описывается как обладающее "биоцидной" активностью. Перкислоты могут обладать биоцидной активностью. Типичные альтернативные биоциды могут включать, например, хлор, диоксид хлора, хлоризоцианураты, гипохлориты, озон, акролеин, амины, хлорсодержащие фенольные смолы, соли меди, сероорганические соединения и соли четвертичного аммония.
Применяемая в данном документе фраза "минимальная биоцидная концентрация" относится к минимальной концентрации биоцидного средства, которое за определенное время контакта будет производить требуемое летальное, необратимое уменьшение жизнеспособной популяции целевых микроорганизмов. Эффективность можно измерить по log10 уменьшению жизнеспособных микроорганизмов после обработки. В одном аспекте целенаправленное уменьшение жизнеспособных микроорганизмов после обработки составляет по меньшей мере 3-log10 уменьшение, более предпочтительно по меньшей мере 4-log10 уменьшение и наиболее предпочтительно по меньшей мере 5-log10 уменьшение. В другом аспекте минимальная биоцидная концентрация составляет по меньшей мере 6-log10 уменьшение жизнеспособных клеток микроорганизмов.
Применяемые в данном документе "чистящие композиции" и "чистящие составы" относятся к композициям, которые находят применение в удалении нежелательных соединений с зубов (ополаскиватели для рта, зубные пасты и т.д.). Термин охватывает любые материалы/соединения, выбранные для конкретного типа необходимой чистящей композиции и формы продукта (например, композиция в виде жидкости, пасты, геля, эмульсии, гранул или спрея), при условии, что композиция совместима с пергидролазным и другим ферментом(ами), применяемым(и) в композиции.
Применяемые в данном документе "пероральные чистящие композиции" относятся к средствам для ухода за зубами, зубным пастам, зубным гелям, зубным порошкам, ополаскивателям для рта, спреям для рта, гелям для рта, жевательным резинкам, пастилкам для рассасывания, саше, таблеткам, биогелям, профилактическим пастам, растворам для лечебно-профилактического ухода за зубами и т.п. Композиции для ухода за полостью рта, которые находят применение в сочетании с пергидролазами по настоящему изобретению, хорошо известны в данной области техники (см., например, патенты США №№ 5601750, 6379653 и 5989526, все из которых включены в данный документ в качестве ссылки в полном объеме).
Применяемый в данном документе "фармацевтически приемлемый" означает, что лекарственные средства, лекарственные препараты и/или инертные ингредиенты, которые описывает термин, подходят для применении в соприкосновении с тканями людей и других животных без излишней токсичности, несовместимости, нестабильности, раздражения, аллергической реакции и т.п. в соответствии с приемлемым соотношением благоприятное воздействие/риск.
Применяемые в данном документе продукты личной гигиены означают продукты, применяемые в чистке, осветлении и/или обеззараживании волос, кожи, кожи волосяной части головы и зубов, включая, но без ограничений, шампуни, лосьоны для тела, гели для душа, местные увлажняющее средства, зубную пасту, ополаскиватели для рта, средства для полоскания рта, ополаскиватели против кариеса и/или другие местные очищающие средства. В некоторых особенно предпочтительных вариантах осуществления эти продукты используют на людях, в то время как в других вариантах осуществления эти продукты находят применения на остальных животных (например, в ветеринарных областях применения).
Применяемые в данном документе термины "отбеливание зубов" и "осветление зубов" применяют взаимозаменяемо для обозначения улучшения яркости (например, отбеливание) зуба или зубов. Подразумевается, что данный термин охватывает любой способ, подходящий для отбеливания зубов, включая настоящее изобретение, а также химическую обработку, мягкую обработку кислотой, абразивное отбеливание зубов и лазерное отбеливание зубов. В особенно предпочтительных вариантах осуществления настоящее изобретение предлагает пергидролазу и содержащие пергидролазу композиции, подходящие для отбеливания зубов.
Применяемые в данном документе "внутренние пятна" у зубов относятся к получению цвета от хромогенов в эмали и нижележащем дентине. Внутренний цвет зубов человека имеет склонность становиться боле желтым с возрастом вследствие истончения эмали и потемнения нижележащего желтого дентина. Удаление характерного пятна обычно нуждается в применении пероксидов или других окислительных средств, которые проникают в эмаль и обесцвечивают внутренние хромогены.
В отличие от внутренних пятен "внешние пятна" образуются на поверхности зубов при связывании внешних хромогенных материалов с эмалью, обычно в налете, который природно покрывает зубы. Большинство людей накапливают некоторый уровень неприглядных внешних пятен на своих зубах с течением времени. Этот процесс появления пятен стимулируется такими факторами как: (1) поглощение таннин-содержащих пищевых продуктов и напитков, таких как кофе, чай или красное вино; (2) употребление табачных изделий; и/или (3) воздействие определенных катионных веществ (например, олова, железа и хлоргексидина). Эти вещества имеют склонность адгезироваться в гидроксиапатитную структуру эмали, что приводит к потере цвета и сопутствующей уменьшении белизны зуба. Через несколько лет внешние пятна могут проникнуть внутрь слоя эмали и привести к образованию внутренних пятен.
Применяемый в данном документе термин "дезодорирование" означает устранение или предупреждение неприятного запаха.
Применяемый в данном документе термин "обесцвечивать" или "обесцвечивание" относится к процессу удаления пятна с поверхности полости рта. Пятно (пятна) могут быть внутренними пятнами, внешними пятнами или их комбинацией.
Применяемый в данном документе термин "повышенная эффективность" содержащей пергидролазу композиции определяют как повышение очистки чувствительных к выбеливанию пятен по сравнению с другими композициями при определении с помощью стандартных способов в области стоматологии. В конкретных вариантах осуществления пергидролаза по настоящему изобретению обеспечивает повышенную эффективность окисления и удаления цветных пятен. В следующих вариантах осуществления пергидролаза по настоящему изобретению обеспечивает повышенную эффективность удаления и/или обесцвечивание пятен.
Применяемое в данном документе "эффективное количество пергидролазного фермента" относится к количеству пергидролазного фермента, необходимому для достижения ферментативной активности, необходимой в конкретном применении. Такие эффективные количества легко установит рядовой специалист в данной области, исходя из многих факторов, таких как конкретный используемый вариант фермента, чистящее применение, конкретная композиция чистящей композиции и того, нужна ли жидкая или не жидкая (например, эмульсионная) композиция, и т.д.
Применяемые в данном документе термины "источник кислорода пероксигруппы" относятся к соединениям, способным обеспечивать пероксид водорода в концентрации приблизительно 1 мМ или более при нахождении в водном растворе, включая, но без ограничений, пероксид водорода, аддукты пероксида водорода (например, аддукты пероксида водорода и мочевины (пероксид карбамида)), пербораты и перкарбонаты. Описываемая в данном документе концентрация пероксида водорода, обеспечиваемая соединением с кислородом пероксигруппы в водном реакционном составе, изначально составляет по меньшей мере 0,1 мМ или более при объединении реакционных компонентов. В одном варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 0,5 мМ. В одном варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 1 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 10 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 100 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 200 мМ. В другом варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 500 мМ или более. В еще одном варианте осуществления концентрация пероксида водорода в водном реакционном составе составляет по меньшей мере 1000 мМ или более. Молярное соотношение пероксида водорода к субстрату фермента, например, триглицериду, (H2O2:субстрат) в водном реакционном составе может составлять от приблизительно 0,002 до 20, предпочтительно от приблизительно 0,1 до 10 и наиболее предпочтительно от приблизительно 0,5 до 5.
Применяемый в данном документе термин "олигосахарид" относится к соединениям, содержащим от 2 до по меньшей мере 24 моносахаридных звеньев, соединенных гликозидными связями. Термин "моносахарид" относится к соединению с эмпирической формулой (CH2O)n, где n≥3, углеродный скелет не разветвлен, каждый атом углерода за исключением одного содержит гидроксильную группу, а оставшийся атом углерода является альдегидным или кетонным в положении атома углерода 1. Термин "моносахарид" также относится к внутриклеточным циклическим полуацетальным или полукетальным формам.
Применяемый в данном документе термин "наполнитель" относится к неактивному веществу, применяемому в качестве носителя для активных ингредиентов в составе. Наполнитель можно применять для стабилизации активного ингредиента в составе, как, например, стабильности активного ингредиента при хранении. Наполнители также иногда применяют для увеличения объема составов, которые содержат активные ингредиенты. Описываемый в настоящем документе "активный ингредиент" может быть ферментом, обладающим пергидролитической активностью, перкислотой, производимой пергидролитическим ферментом при подходящих реакционных условиях, или их комбинацией.
Термин "по сути не содержит воду" будет относиться к концентрации воды в составе, которая не оказывает отрицательного влияния на стабильность фермента или ферментного порошка при хранении при наличии в сложном эфире карбоновой кислоты. Сложный эфир карбоновой кислоты может содержать очень низкую концентрацию воды, например, триацетин обычно содержит от 180 ч./млн до 300 ч./млн воды. В одном варианте осуществления пергидролитический фермент хранят в субстрате на основе сложного эфира карбоновой кислоты, который по сути не содержит воду. В следующем варианте осуществления "по сути не содержит воду" может обозначать менее 2000 ч./млн, предпочтительно менее 1000 ч./млн, более предпочтительно менее 500 ч./млн и еще более предпочтительно менее 250 ч./млн воды в составе, содержащем фермент (или ферментный порошок) и сложный эфир карбоновой кислоты. В одном варианте осуществления пергидролитический фермент можно хранить в водном растворе, если генерирующая система разработана так, чтобы фермент был стабилен в водном растворе (например, раствор не содержит значительной концентрации субстрата на основе сложного эфира карбоновой кислоты, способного гидролизироваться ферментом при хранении). В одном варианте осуществления пергидролитический фермент можно хранить в смеси, содержащей субстрат на основе сложного эфира карбоновой кислоты, который по сути не содержит воды, и один или несколько буферов (например, натриевая и/или калиевая соль бикарбоната, цитрата, ацетата, фосфата, пирофосфата, метилфосфоната, сукцината, малата, фумарата, тартрата и малеата).
Ферменты, обладающие пергидролитической активностью
Ферменты, обладающие пергидролитической активностью, могут включать некоторые ферменты, классифицируемые как липазы, протеазы, эстеразы, ацилтрансферазы, арилтрансферазы, эстеразы углеводов и комбинации, при условии, что фермент обладает пергидролитической активностью в отношении одного или нескольких присутствующих субстратов. Примеры могут включать, но без ограничений, пергидролитические протеазы (вариант субтилизина Карлсберга; патент США 7510859), пергидролитические арилэстеразы (Pseudomonas fluorescens; SEQ ID NO: 477; патент США 7384787), пергидролитическую арилэстеразу/ацилтрансферазу из Mycobacterium smegmatis (SEQ ID NO: 460 и 478; патент США 7754460; WO2005/056782; и EP1689859 B1) и пергидролазные эстеразы углеводов. В предпочтительном аспекте пергидролитическая эстераза углеводов представляет собой эстеразу углеводов СЕ-7.
В одном варианте осуществления подходящие пергидролазы могут включать ферменты, содержащие аминокислотную последовательность с по меньшей мере 30%, 33%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью аминокислотной последовательности к любой из аминокислотных последовательностей, приведенных в данном документе, при условии, что пергидролазы, отличные от СЕ-7, ограничены целевыми пергидролазными применениями (т.е. пергидролитические ферменты, не принадлежащие к семейству эстераз углеводов СЕ-7, применяют в форме гибридного белка, содержащего по меньшей мере один пептидный нацеливающий домен).
В другом варианте осуществления подходящие пергидролазы могут включать ферменты, содержащие аминокислотную последовательность по меньшей мере с 30%, 33%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% аминокислотной идентичностью с SEQ ID NO: 460, 477 и 478, при условии, что пергидролазы, отличные от СЕ-7, ограничены целевыми пергидролазными применениями (т.е. пергидролитические ферменты, не принадлежащие к семейству эстераз углеводов СЕ-7, применяют в форме гибридного белка, содержащего по меньшей мере один пептидный нацеливающий домен). Понятно, что сравнения по процентной идентичности и выравнивания последовательностей, применяемые для выявления по сути похожих пергидролитических ферментов, проводят против части гибридного белка, содержащей пергидролитический фермент (т.е. нацеливающие домены и линкеры не включены).
В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, которая по меньшей мере на 95% идентична арилэстеразе S54V Mycobacterium smegmatis, приведенной в SEQ ID NO: 460.
В одном варианте осуществления гибридный белок содержит пергидролитическую эстеразу из Pseudomonas fluorescens. В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, которая по меньшей мере на 95% идентична эстеразе Pseudomonas fluorescens, приведенной в SEQ ID NO: 477.
В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 424, 425, 426, 427, 428, 429, 430, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 476, 477, 478 и 479.
В другом варианте осуществления по сути похожие пергидролитические ферменты могут включать ферменты, кодируемые полинуклеотидными последовательностями, которые гибридизируются в очень жестких условиях гибридизации (0,1X SSC, 0,1% SDS, 65°C и промывают 2X SSC, 0,1% SDS с последующей конечной промывкой 0,1X SSC, 0,1% SDS, 65°C) с полинуклеотидными последовательностями, кодирующими настоящие пергидролитические ферменты, при условии, что пергидролазы, отличные от СЕ-7, ограничены целевыми пергидролазными применениями (т.е. пергидролитические ферменты, не принадлежащие к семейству эстераз углеводов СЕ-7, применяют в форме гибридного белка, содержащего по меньшей мере один пептидный нацеливающий домен).
Пергидролазы СЕ-7
В предпочтительном варианте осуществления композиции и способ для ухода за полостью рта включают ферменты, обладающие пергидролитической активностью, которые структурно классифицируют в качестве представителей эстераз углеводного семейства, семейства 7 (семейства СЕ-7) ферментов (см., Coutinho, P.M., Henrissat, B. “Carbohydrate-active enzymes: an integrated database approach” в Recent Advances in Carbohydrate Bioengineering, H.J. Gilbert, G. Davies, B. Henrissat and B. Svensson eds., (1999) The Royal Society of Chemistry, Cambridge, pp. 3-12.). Было продемонстрировано, что семейство ферментов СЕ-7 особенно эффективно для получения пероксикарбоновых кислот из ряда субстратов на основе сложных эфиров карбоновой кислоты при объединении с источником кислорода пероксигруппы (патенты США 7794378, 7951566, 7723083 и 7964378 и публикации заявок на патенты США №№ 2008-0176299, 2010-0087529, 2011-0081693 и 2011-0236335, DiCosimo et al.; каждая из которых включена в данный документ посредством ссылки).
Представители семейства СЕ-7 включают деацетилазы цефалоспорина С (САН, Е.С. 3.1.1.41) и ацетилксиланэстеразы (AXE; E.C. 3.1.1.72). Представители семейства эстераз СЕ-7 имеют общий консервативный сигнатурный мотив (Vincent et al., J. Mol. Biol., 330:593-606 (2003)). Пергидролазы, содержащие сигнатурный мотив СЕ-7 ("пергидролазы СЕ-7") и/или по сути сходную структуру, пригодны для применения в описываемых в данном документе композициях и способах. Средства для определения по сути сходных биологических молекул хорошо известны в данной области техники (например, протоколы выравнивания последовательностей, гибридизации нуклеиновых кислот и/или присутствие консервативного сигнатурного мотива). В одном аспекте пергидролаза включает фермент, характеризующийся сигнатурным мотивом СЕ-7 и по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 33%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 42%, более предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% аминокислотной идентичностью с одной из приведенных в данном документе последовательностей.
Применяемую в данном документе фразу "фермент структурно классифицируют как фермент СЕ-7", "пергидролаза СЕ-7" и "структурно классифицируемый как фермент семейства эстераз углеводов 7" будут использовать в отношении ферментов, обладающих пергидролизной активностью, которые структурно классифицируют как эстераза углеводов СЕ-7. Семейство ферментов можно определить по присутствию сигнатурного мотива (Vincent и соавт., выше). Сигнатурный мотив для эстераз СЕ-7 включает три консервативных мотива (нумерация положений остатков относительно эталонной последовательности SEQ ID NO: 2; пергидролаза CE-7 из B. subtilis ATCC® 31954™):
a) Arg118-Gly119-Gln120;
b) Gly179-Xaa180-Ser181-Gln182-Gly183; и
c) His298-Glu299.
Как правило, Хаа в положении аминокислотного остатка 180 является глицином, аланином, пролином, триптофаном или треонином. Два из трех аминокислотных остатков, принадлежащих к каталитической триаде, обозначены жирным шрифтом. В одном варианте осуществления Хаа в положении аминокислотного остатка 180 выбран из группы, состоящей из глицина, аланина, пролина, триптофана и треонина.
Дальнейший анализ консервативных мотивов в семействе эстераз углеводов СЕ-7 показывает присутствие дополнительного консервативного мотива (LXD в аминокислотных положениях 267-269 в SEQ ID NO: 2), который можно использовать для дополнительного определения пергидролазы, принадлежащей к семейству эстераз углеводов СЕ-7. В следующем варианте осуществления определенный выше сигнатурный мотив может включать дополнительный (четвертый) консервативный мотив, определяемый следующим:
Leu267-Xaa268-Asp269.
Хаа в положении аминокислотного остатка 268, как правило, является изолейцином, валином или метионином. Четвертый мотив включает остаток аспарагиновой кислоты (жирным шрифтом), принадлежащий к каталитической триаде (Ser181-Asp269-His298).
Пергидролазы СЕ-7 могут быть в форме гибридных белков по меньшей мере с одним пептидным компонентом, обладающим сродством по меньшей мере к одной поверхности организма. В одном варианте осуществления все выравнивания, используемые для определения того, содержит ли нацеленная пергидролаза (гибридный белок) сигнатурный мотив СЕ-7, будут основываться на аминокислотной последовательности пергидролитического фермента без пептидного компонента, обладающего сродством к поверхности организма.
Ряд хорошо известных алгоритмов глобального выравнивания (т.е. программное обеспечение для анализа последовательностей) можно применять для выравнивания двух или более аминокислотных последовательностей, представляющих ферменты, обладающие пергидролазной активностью, для определения того, содержит ли фермент настоящий сигнатурный мотив. Выровненную(ые) последовательность(и) сравнивают с эталонной последовательностью (SEQ ID NO: 2) для определения существования сигнатурного мотива. В одном варианте осуществления выравнивание CLUSTAL (такое как CLUSTALW) с помощью эталонной аминокислотной последовательности (применяемой в данном документе последовательностью пергидролазы (SEQ ID NO: 2) из Bacillus subtilis ATCC® 31954™) применяют для выявления пергидролаз, принадлежащих к семейству эстераз СЕ-7. Относительная нумерация консервативных аминокислотных остатков основана на нумерации остатков эталонной аминокислотной последовательности для того, чтобы принять в внимание небольшие вставки или делеции (например, как правило, пять аминокислот или менее) в пределах выравниваемой последовательности.
Примеры других подходящих алгоритмов, которые можно применять для выявления последовательностей, содержащих настоящий сигнатурный мотив (при сравнении с эталонной последовательностью), включают, но без ограничений, Needleman и Wunsch (J. Mol. Biol. 48, 443-453 (1970); инструмент глобального выравнивания) и Smith-Waterman (J. Mol. Biol. 147, 195-197 (1981); инструмент локального выравнивания). В одном варианте осуществления выравнивание по Smith-Waterman осуществляют с применением параметров по умолчанию. Пример подходящих параметров по умолчанию включает применение матрицы замен BLOSUM62 с GAP open penalty = 10 и GAP extension penalty = 0,5.
Сравнение общей процентной идентичности среди пергидролаз показывает, что ферменты, которые характеризуются до 33% аминокислотной идентичностью с SEQ ID NO: 2 (при сохранении сигнатурного мотива), проявляют значительную пергидролазную активность и структурно классифицируются как эстеразы углеводов СЕ-7. В одном варианте осуществления подходящие пергидролазы включают ферменты, содержащие сигнатурный мотив СЕ-7 и характеризующиеся по меньшей мере 20%, предпочтительно по меньшей мере 30%, 33%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% аминокислотной идентичностью с SEQ ID NO: 2.
Примеры подходящих эстераз углеводов СЕ-7, обладающих пергидролитической активностью, включают, но без ограничений, ферменты с такой аминокислотной последовательностью, как SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476. В одном варианте осуществления фермент содержит аминокислотную последовательность, выбранную из группы, состоящей из 14, 16, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476.
Применяемый в данном документе термин "вариант СЕ-7", "вариантная пергидролаза" или "вариант" будет относиться к пергидролазам СЕ-7 с генетической модификацией, которая в результате приводит по меньшей мере к одному аминокислотному присоединению, делеции и/или замене по сравнению с соответствующим ферментом (как правило, ферментом дикого типа), от которого был получен вариант; при условии сохранения сигнатурного мотива СЕ-7 и связанной пергидролитической активности. Вариантные пергидролазы СЕ-7 также можно применять в настоящих композициях и способах. Примеры вариантов СЕ-7 приведены в виде SEQ ID NO: 27, 28, 29, 30, 31, 32, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476. В одном варианте осуществления варианты могут включать SEQ ID NO: 27, 28, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476.
Специалист в данной области поймет, что по сути сходные последовательности пергидролаз СЕ-7 (сохраняющие сигнатурные мотивы) также можно применять в настоящих композициях и способах. В одном варианте осуществления по сути сходные последовательности определяют по их способности гибридизироваться в условиях высокой жесткости с молекулами нуклеиновой кислоты, связанными с иллюстрируемыми в данном документе последовательностями. В другом варианте осуществления алгоритмы выравнивания последовательностей можно применять для определения по сути сходных ферментов на основе процентной идентичности с приведенными в данном документе последовательностями ДНК или аминокислотными последовательностями.
В контексте данного документа, молекула нуклеиновой кислоты "может гибридизироваться" с другой молекулой нуклеиновой кислоты, такой как кДНК, геномная ДНК или РНК, если одна цепь первой молекулы может комплементарно соединяться с другой молекулой при соответствующих условиях температуры и ионной силы раствора. Условия гибридизации и отмывки хорошо известны и проиллюстрированы в Sambrook, J. and Russell, D., T. Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor (2001). Условия температуры и ионной силы определяют "жесткость" гибридизации. Жесткие условия можно скорректировать для отбора от умеренно сходных молекул, таких как гомологичные последовательности от удаленно родственных организмов, до сильно сходных молекул, таких как гены, которые копируют функциональные ферменты от близко родственных организмов. Условия жесткости обычно определяются пост-гибридизационными отмывками. В одном наборе предпочтительных условий задействуют серию промывок, начиная с 6X SSC, 0,5% SDS при комнатной температуре в течение 15 мин, затем повторяют с 2X SSC, 0,5% SDS при 45°C в течение 30 мин и затем повторяют два раза с 0,2X SSC, 0,5% SDS при 50°C в течение 30 мин. В более предпочтительном наборе условий задействуют более высокие температуры, при которых отмывки идентичны тем, которые описаны выше, за исключением того, что температуру конечных двух 30-минутных отмывок в 0,2X SSC, 0,5% SDS повысили до 60°C. Другой предпочтительный набор чрезвычайно жестких условий гибридизации представляет собой 0,1X SSC, 0,1% SDS, 65°C и осуществляют отмывку с 2X SSC, 0,1% SDS с последующей конечной промывкой 0,1X SSC, 0,1% SDS, 65°C.
Для гибридизации необходимо, чтобы две нуклеиновые кислоты содержали комплементарные последовательности, хотя в зависимости от жесткости гибридизации возможны несовпадения между основаниями. Соответствующая жесткость гибридизирующихся нуклеиновых кислот зависит от длины нуклеиновых кислот и степени комплементарности, переменных факторов, хорошо известных в данной области. Чем больше степень сходства или гомологии между двумя нуклеотидными последовательностями, тем большее значение Tm для гибридов нуклеиновых кислот с такими последовательностями. Относительная стабильность (соответствующая большей Tm) гибридизаций нуклеиновых кислот понижается в следующем порядке: РНК:РНК, ДНК:РНК, ДНК:ДНК. Для гибридов больше 100 нуклеотидов в длину были выведены уравнения для расчета Tm (Sambrook и Russell, ранее). Для гибридизаций с более короткими нуклеиновыми кислотами, т.е. олигонуклеотидов, положение несовпадений становится более важным, и длина олигонуклеотида определяет его специфичность (Sambrook и Russell, ранее). В одном аспекте длина поддающейся гибридизации нуклеиновой кислоты составляет по меньшей мере 10 нуклеотидов. Предпочтительно, минимальная длина для поддающейся гибридизации нуклеиновой кислоты составляет по меньшей мере 15 нуклеотидов в длину, более предпочтительно по меньшей мере приблизительно 20 нуклеотидов в длину, еще более предпочтительно по меньшей мере 30 нуклеотидов в длину, еще более предпочтительно по меньшей мере 300 нуклеотидов в длину и наиболее предпочтительно по меньшей мере 800 нуклеотидов в длину. Кроме того, специалист в данной области поймет, что температуру и концентрацию солей раствора для отмывки можно корректировать при необходимости в соответствии с такими факторами, как, например, длина зонда.
Применяемый в данном документе термин "процент идентичности" представляет собой взаимозависимость между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями при определении при помощи сравнения последовательностей. В данной области техники "идентичность" также означает степень родства последовательностей между полипептидными или полинуклеотидными последовательностями, в зависимости от обстоятельств, при определении по совпадению между нитями таких последовательностей. "Идентичность" и "сходство" могут быть легко рассчитаны известными способами, включая, но без ограничений, те, которые описаны в: Computational Molecular Biology (Lesk, A. M., ed.) Oxford University Press, NY (1988); Biocomputing: Informatics and Genome Projects (Smith, D. W., ed.) Academic Press, NY (1993); Computer Analysis of Sequence Data, Part I (Griffin, A. M., and Griffin, H. G., eds.) Humana Press, NJ (1994); Sequence Analysis in Molecular Biology (von Heinje, G., ed.) Academic Press (1987); и Sequence Analysis Primer (Gribskov, M. and Devereux, J., eds.) Stockton Press, NY (1991). Способы определения идентичности и сходства систематизированы в общедоступных компьютерных программах. Выравнивания последовательностей и расчеты процента идентичности можно произвести с помощью программы Megalign из программного пакета для расчета данных по биоинформатике LASERGENE (DNASTAR Inc., Мэдисон, Висконсин), программы AlignX из Vector NTI, версия 7.0 (Informax, Inc., Бетезда, Мериленд) или пакета открытого программного обеспечения EMBOSS (EMBL-EBI; Rice et al., Trends in Genetics 16, (6):276-277 (2000)). Множественное выравнивание последовательностей можно произвести с помощью способа выравнивания Clustal (такого как CLUSTALW; например версии 1.83) (Higgins and Sharp, CABIOS, 5:151-153 (1989); Higgins et al., Nucleic Acids Res. 22:4673-4680 (1994); и Chenna et al., Nucleic Acids Res 31 (13):3497-500 (2003)), доступный от Европейской лаборатории молекулярной биологии через Европейский институт биоинформатики) с параметрами по умолчанию. Подходящие параметры для выравниваний белка CLUSTALW включают GAP Existence penalty = 15, GAP extension = 0,2, матрица = Gonnet (например, Gonnet250), ENDGAP белка = -1, GAPDIST белка = 4 и KTUPLE = 1. В одном варианте осуществления быстрое или медленное выравнивание применяют с настройками по умолчанию, где медленное выравнивание является предпочтительным. В качестве альтернативы, параметры, применяемые в способе CLUSTALW (например, версии 1.83), можно модифицировать, чтобы также использовать KTUPLE = 1, GAP PENALTY = 10, GAP extension = 1, матрицы = BLOSUM (например, BLOSUM64), WINDOW = 5 и TOP DIAGONALS SAVED = 5.
В одном аспекте подходящие выделенные молекулы нуклеиновых кислот кодируют полипептид с аминокислотной последовательностью, которая по меньшей мере на приблизительно 20%, предпочтительно по меньшей мере на 30%, 33%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотным последовательностям, описанным в данном документе. В другом аспекте подходящие выделенные молекулы нуклеиновых кислот кодируют полипептид с аминокислотной последовательностью, которая по меньшей мере на приблизительно 20%, предпочтительно по меньшей мере на 30%, 33%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотным последовательностям, описанным в данном документе, с оговоркой, что полипептид сохраняет сигнатурный мотив CE-7. Подходящие молекулы нуклеиновых кислот не только имеют описанные выше гомологии, но также обычно кодируют полипептид, имеющий приблизительно 210-340 аминокислот в длину, от приблизительно 300 до приблизительно 340 аминокислот, предпочтительно от приблизительно 310 до приблизительно 330 аминокислот, и наиболее предпочтительно от приблизительно 318 до приблизительно 325 аминокислот в длину, где каждый полипептид характеризуется как обладающий пергидролитической активностью.
Нацеленные пергидролазы
Применяемый в данном документе термин "нацеленная пергидролаза" и "нацеленный фермент, обладающий пергидролитической активностью" будет относиться к гибридным белкам, содержащим по меньшей мере один пергидролитический фермент (дикого типа или его вариант), слитый/соединенный по меньшей мере с одним пептидным компонентом, обладающим сродством к целевой поверхности, предпочтительно целевой поверхности организма. Пергидролитический фермент в нацеленной пергидролазе может быть любым пергидролитическим ферментом и может включать липазы, протеазы, эстеразы, ацилтрансферазы, арилэстеразы, эстеразы углеводов и комбинации, при условии, что фермент обладает пергидролитической активностью в отношении одного или нескольких присутствующих субстратов. Примеры могут включать, но без ограничений, пергидролитические протеазы (например, вариант субтилизина, патент США 7510859), пергидролитические эстеразы (например, Pseudomonas fluorescens; патент США 7384787; SEQ ID NO: 477) и пергидролитические арилэстеразы (например, Mycobacterium smegmatis; патент США 7754460; WO2005/056782; и EP1689859 B1; SEQ ID NO: 460 [вариант S54V] и 478 [дикий тип]).
В одном варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, которая по меньшей мере на 95% идентична арилэстеразе S54V Mycobacterium smegmatis, приведенной в SEQ ID NO: 460.
В одном варианте осуществления гибридный белок содержит пергидролитическую эстеразу из Pseudomonas fluorescens. В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, которая по меньшей мере на 95% идентична эстеразе Pseudomonas fluorescens, приведенной в SEQ ID NO: 477.
В другом варианте осуществления гибридный белок содержит пергидролитический фермент с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 424, 425, 426, 427, 428, 429, 430, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 476, 477, 478 и 479.
Применяемые в данном документе термины "пептидный компонент", "пептидный компонент, обладающий сродством к поверхности полости рта" и “OCBD” будут относиться к компоненту гибридного белка, который не является частью пергидролитического фермента, содержащего по меньшей мере один полимер из двух или более аминокислот, соединенных пептидной связью; где компонент обладает сродством к целевой поверхности полости рта.
В одном варианте осуществления пептидный компонент, обладающий сродством к поверхности организма, может являться антителом, Fab фрагментом антитела, антителом из одноцепочечного вариабельного фрагмента (scFv), антителом Camelidae (Muyldermans, S., Rev. Mol. Biotechnol. 2001) 74:277-302), каркасным дисплейным белком, не имеющим природу антитела (Hosse et al., Prot. Sci. (2006) 15(1): 14-27 и Binz, H. et al. (2005) Nature Biotechnology 23, 1257-1268 для обзора различных подходов, связанных с каркасом), или одноцепочечным полипептидом без иммуноглобулиновой укладки. В другом аспекте пептидный компонент, обладающий сродством к поверхности организма, является одноцепочечным пептидом без иммуноглобулиновой укладки (т.е. пептидом, связывающимся с поверхностью организма, или доменом, связывающимся с поверхностью организма, содержащим по меньшей мере один связывающийся с поверхностью организма пептид, обладающий сродством к поверхности полости рта). В предпочтительном варианте осуществления пептидный компонент является одноцепочечным пептидом, содержащим один или несколько связывающихся с поверхностью организма пептидов, обладающих сродством к поверхности полости рта.
Пептидный компонент, обладающий сродством к поверхности полости рта, можно отделить от пергидролитического фермента при помощи необязательного пептидного линкера. Определенные пептидные линкеры/спейсеры в длину составляют от 1 до 100 или от 1 до 50 аминокислот. В некоторых вариантах осуществления пептидные спейсеры в длину составляют от приблизительно 1 до приблизительно 25, от 3 до приблизительно 40 аминокислот или от 3 до приблизительно 30 аминокислот. В других вариантах осуществления имеют место спейсеры, которые в длину составляют от приблизительно 5 до приблизительно 20 аминокислот. Можно применять множественные пептидные линкеры. В одном варианте осуществления присутствует по меньшей мере один пептидный линкер, и он может повторяться до 10 раз.
Пептиды, ранее определенные как обладающие сродством к одной поверхности организма, могут обладать в равной степени сродством к поверхности полости рта. В связи с этим, гибридный белок может содержать по меньшей мере одно, ранее описанное как обладающее сродством к другой поверхности организма, как, например, волосу (SEQ ID NO 65-221, 271 и 368); коже (SEQ ID NO: 217-269) или ногтю (SEQ ID NO: 270-271). В одном варианте осуществления гибридный белок содержит по меньшей мере один пептид, связывающийся с поверхностью полости рта, из группы, включающей SEQ ID NO: 272-382 и 399-422. В одном варианте осуществления гибридный пептид содержит по меньшей мере один пептид, связывающийся с поверхностью полости рта, выбранный из группы, состоящей из SEQ ID NO: 272-382, 399-410 и 412-422; где SEQ ID NO 272-291 и 312-382 обладают сродством к налету на зубах; SEQ ID NO: 292-311 обладают сродством к зубной эмали, и SEQ ID NO 399-410 и 412-422 обладают сродством к зубной эмали или налету на зубах. Некоторые из пептидов, связывающихся с поверхностью организма, могут обладать сильным сродством к нескольким поверхностям организма и, в связи с этим, могут быть применены для нацеливания пергидролитических ферментов на различные поверхности организма. В другом варианте осуществления гибридный пептид может включать любой пептид, связывающийся с поверхностью организма, сконструированный как обладающий электростатическим притяжением к целевой поверхности организма (например, пептид, связывающийся с поверхностью организма, сконструированный для электростатического связывания с целевой поверхностью организма).
В другом варианте осуществления целевая поверхность представляет собой материал, который является частью процесса упаковки и/или способа доставки в полость рта. Пептидный компонент выбирают по его сродству к используемому материалу или материалам, как, например, полимеры, пластики и пленки. Конструкция гибридного белка нацеленной пергидролазы предусматривает контролируемую доставку и удаление пергидролазы из пользователя путем ее удержания на удаляемом устройстве, как, например, но без ограничений, капе или полоске для рта.
Нацеленные пергидролазы CE-7
В предпочтительном варианте осуществления "нацеленная пергидролаза" представляет собой нацеленную эстеразу углеводов CE-7, обладающую пергидролитической активностью. Применяемые в данном документе термины "нацеленная пергидролаза CE-7" и "нацеленная эстераза углеводов CE-7" будут относиться к гибридным белкам, содержащим по меньшей мере одну пергидролазу CE-7 (дикого типа или вариантную пергидролазу), слитую/соединенную по меньшей мере с одним пептидным компонентом, обладающим сродством к целевой поверхности, предпочтительно целевой поверхности организма. Пептидный компонент, обладающий сродством к поверхности организма, может быть любым из описанных выше. В предпочтительном аспекте пептидный компонент у нацеленной пергидролазы CE-7 является одноцепочечным пептидом без иммуноглобулиновой укладки (т.е. пептидом, связывающимся с поверхностью организма, или доменом, связывающимся с поверхностью организма, содержащим по меньшей мере один пептид, связывающийся с поверхностью организма, обладающий сродством к поверхности полости рта). В предпочтительном варианте осуществления пептидный компонент является одноцепочечным пептидом, содержащим один или несколько связывающихся с поверхностью организма пептидов, обладающих сродством к поверхности полости рта.
Пептидный компонент, обладающий сродством к поверхности полости рта, можно отделить от пергидролазы CE-7 при помощи необязательного пептидного линкера. Определенные пептидные линкеры/спейсеры в длину составляют от 1 до 100 или от 1 до 50 аминокислот. В некоторых вариантах осуществления пептидные спейсеры в длину составляют от приблизительно 1 до приблизительно 25, от 3 до приблизительно 40 аминокислот или от 3 до приблизительно 30 аминокислот. В других вариантах осуществления имеют место спейсеры, которые в длину составляют от приблизительно 5 до приблизительно 20 аминокислот. Можно применять множественные пептидные линкеры.
В связи с этим, примеры нацеленных пергидролаз CE-7 могут включать, но без ограничений, любую из пергидролаз CE-7 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476, соединенную с пептидным компонентом, обладающим сродством к поверхности полости рта. В предпочтительном варианте осуществления примеры нацеленных пергидролаз могут включать, но без ограничений, любую из пергидролаз CE-7 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476, соединенную с одним или несколькими связывающимися с поверхностью организма пептидами, обладающими сродством к поверхности полости рта (необязательно, посредством пептидного спейсера).
В другом варианте осуществления нацеленные пергидролазы CE-7 могут содержать пептиды, ранее определенные как обладающие сродством к одной поверхности организма, и могут обладать в равной степени сродством к поверхности полости рта. В связи с этим, гибридный белок может содержать по меньшей мере одно, ранее описанное как обладающее сродством к другой поверхности организма, как, например, волосу (SEQ ID NO: 65-221, 271 и 368); коже (SEQ ID NO: 217-269) или ногтю (SEQ ID NO: 270-271). В одном варианте осуществления гибридный белок содержит по меньшей мере один связывающийся с поверхностью полости рта пептид из группы, включающей SEQ ID NO: 272-382 и 399-422. В одном варианте осуществления гибридный пептид пергидролазы CE-7 содержит по меньшей мере один пептид, связывающийся с поверхностью полости рта, выбранный из группы, состоящей из SEQ ID NO: 272-382, 399-410 и 412-422; где SEQ ID NO 272-291 и 312-382 обладают сродством к налету на зубах, SEQ ID NO: 292-311 обладают сродством к зубной эмали, и SEQ ID NO 399-410 и 412-422 обладают сродством к зубной эмали или налету на зубах. Некоторые из пептидов, связывающихся с поверхностью организма, могут обладать сильным сродством к нескольким поверхностям организма и, в связи с этим, их можно применять для нацеливания пергидролитических ферментов на различные поверхности организма. В другом варианте осуществления гибридный пептид пергидролазы CE-7 может включать любой пептид, связывающийся с поверхностью организма, сконструированный как обладающий электростатическим притяжением к целевой поверхности организма (например, пептид, связывающийся с поверхностью организма, сконструированный для электростатического связывания с целевой поверхностью организма).
В другом варианте осуществления целевая поверхность представляет собой материал, который является частью процесса упаковки и или доставки к полости рта. Пептидный компонент выбирают по его сродству к используемому материалу или материалам, как, например, полимеры, пластики и пленки. Конструкция гибридного белка нацеленной пергидролазы CE-7 предусматривает контролируемую доставку и удаление пергидролазы из пользователя путем ее удержания на удаляемом устройстве, как, например, капе или полоске для рта.
Пептиды, обладающие сродством к поверхности организма
Одноцепочечные пептиды без иммуноглобулиновой укладки, которые способны связываться с поверхностью полости рта, называют "пептидами, связывающимися с поверхностью полости рта", (OCBP) и они могут включать, например, пептиды, которые связываются с поверхностью зуба (связывающиеся с зубом пептиды), пептиды, обладающие сродством к мягкой ткани, как, например, десна, или пептиды, обладающие сродством к приемлемому для рта материалу, который безопасен для применения в полости рта. Связывающиеся с зубом пептиды могут включать пептиды, обладающие сродством к зубной эмали ("пептиды, связывающиеся с зубной эмалью"), и пептиды, обладающие сродством к налету на зубах ("пептиды, связывающиеся с налетом на зубах").
В данном документе приведен неограничивающий перечень пептидов, обладающих сродством по меньшей мере к одной поверхности организма, включая те, которые обладают сродством к волосу (связывающиеся с волосами пептиды с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 65-221, 271 и 368), коже (пептиды, связывающиеся с кожей, содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 217-269) и ногтю (пептиды, связывающиеся с ногтем, содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 270-271). Примеры пептидов, обладающих сродством к поверхности полости рта (пептиды, связывающиеся с полостью рта), содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 272-382 и 399-422. В предпочтительном аспекте пептиды, обладающие сродством к поверхности полости рта, выбраны из группы, состоящей из SEQ ID NO: 272-382, 399-410 и 412-422; где SEQ ID NO 272-291 и 312-382 обладают сродством к налету на зубах; SEQ ID NO: 292-311 обладают сродством к зубной эмали, и при этом SEQ ID NO: 399-410 и 412-422 обладают сродством к зубной эмали или налету на зубах.
В одном варианте осуществления пептид, который также может обладать сродством к поверхности полости рта, может включать одну или несколько из SEQ ID NO: 65-382, 399-410 и 412-422. Предпочтительно, пептиды, применяемые в настоящих композициях и способах, выбраны из группы, состоящей из SEQ ID NO: 272-382, 399-410 и 412-422. В другом варианте осуществления пептиды, связывающиеся с поверхностью полости рта, могут включать пептиды, связывающиеся с кожей, для некоторых поверхностей полости рта (например, десна). В другом варианте осуществления гибридный пептид может включать любой пептид, связывающийся с поверхностью организма, сконструированный как обладающий электростатическим притяжением к целевой поверхности организма (например, пептид, связывающийся с поверхностью организма, сконструированный для электростатического связывания с целевой поверхностью организма).
В другом варианте осуществления настоящие композиции и способы включают по меньшей мере один связывающийся с поверхностью полости рта пептид с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 399-410 и 412-422.
В некоторых вариантах осуществления домены, связывающиеся с поверхностью полости рта, состоят из пептидов, связывающихся с поверхностью полости рта, которые составляют в длину до приблизительно 60 аминокислот. В одном варианте пептиды, связывающийся с поверхностью полости рта, составляют в длину от 5 до 60 аминокислот. В других вариантах осуществления пептиды, связывающиеся с поверхностью, составляют в длину от 7 до 50 аминокислот или от 7 до 30 аминокислот. В еще одних вариантах осуществления представлены такие пептиды, связывающиеся с поверхностью полости рта, которые составляют в длину от 7 до 27 аминокислот.
В то время как гибридные пептиды, содержащие пептиды, связывающиеся с поверхностью полости рта, представляют собой определенные варианты осуществления настоящего изобретения, в других вариантах осуществления настоящего изобретения можно преимущественно применять множественные пептиды, связывающиеся с поверхностью полости рта. Включение множества, т.е. двух или более, пептидов, связывающихся с поверхностью полости рта, может дать пептидный компонент, который является, например, даже более надежным, чем такие связывающие элементы, которые включают отдельный пептид, связывающийся с поверхностью полости рта. В некоторых вариантах осуществления домены, связывающиеся с поверхностью полости рта (то есть множественные, т.е. два или более пептидов, связывающихся с поверхностью полости рта), включают от 2 до приблизительно 50 или от 2 до приблизительно 25 пептидов, связывающихся с поверхностью полости рта. Другие варианты осуществления включают такие домены, связывающиеся с поверхностью полости рта, которые включают от 2 до приблизительно 10 или от 2 до 5 пептидов, связывающихся с поверхностью полости рта.
Множественные связывающиеся элементы (т.е. пептиды, связывающиеся с поверхностью полости рта, или домены, связывающиеся с поверхностью полости рта) могут быть соединены вместе напрямую, или они могут быть соединены вместе с помощью пептидных спейсеров. Определенные пептидные спейсеры/линкеры составляют в длину от 1 до 100 или от 1 до 50 аминокислот. В некоторых вариантах осуществления пептидные спейсеры составляют в длину от приблизительно 1 до приблизительно 25, от 3 до приблизительно 40 или от 3 до приблизительно 30 аминокислот. В других вариантах осуществления приведены спейсеры, которые составляют в длину от 1 до приблизительно 20 или от приблизительно 5 до приблизительно 20 аминокислот.
Домены, связывающиеся с поверхностью полости рта, и более короткие пептиды, связывающиеся с поверхностью полости рта, из которых они состоят, можно идентифицировать с помощью любого ряда способов, известных специалистам в данной области, включая, например, любые известные методики биопэннинга, как, например, фаговый дисплей, бактериальный дисплей, дрожжевой дисплей, рибосомный дисплей, мРНК-дисплей и их комбинации. Как правило, случайную или практически случайную (в случае, если существует стандартная ошибка) библиотеку полипептидов подвергают биопэннингу по отношению к целевой поверхности организма для определения пептидов в рамках библиотеки, обладающих сродством к целевой поверхности организма.
Создание случайных библиотек пептидов хорошо известно и может быть осуществлено с помощью разнообразных методик, включая бактериальный дисплей (Kemp, D.J.; Proc. Natl. Acad. Sci. USA 78(7):4520-4524 (1981) и Helfman et al., Proc. Natl. Acad. Sci. USA 80(1):31-35, (1983)), дрожжевой дисплей (Chien et al., Proc Natl Acad Sci USA 88(21):9578-82 (1991)), комбинаторный твердофазный пептидный синтез (патент США № 5449754, патент США № 5480971, патент США № 5585275, патент США № 5639603) и технологию фагового дисплея (патент США № 5223409, патент США № 5403484, патент США № 5571698, патент США № 5837500); рибосомный дисплей (патент США № 5643768; патент США № 5658754 и патент США № 7074557) и технологию мРНК-дисплея (PROFUSION™; см. патенты США №№ 6258558; 6518018; 6281344; 6214553; 6261804; 6207446; 6846655; 6312927; 6602685; 6416950; 6429300; 7078197 и 6436665).
Сродство связывания
Пептидный компонент, обладающий сродством к поверхности полости рта, характеризуется сродством связывания к поверхности полости рта 10-5 молярным (M) или меньше. В определенных вариантах осуществления пептидный компонент представляет собой один или несколько пептидов и/или домен(ов), связывающихся с поверхностью полости рта, обладающих сродством связывания к человеческому волосу, коже, ногтю или полости рта с 10-5 молярностью (M) или меньше. В некоторых вариантах осуществления связывающиеся пептиды или домены будут иметь значение сродства связывания 10-5 молярное (M) или меньше в присутствии по меньшей мере приблизительно 50-500 мМ соли. Термин "сродство связывания" относится к силе взаимодействия связывающегося пептида с его соответствующим субстратом в случае поверхности полости рта человека (десен, зубов и т.д.). Сродство связывания можно определить или измерить, исходя из константы диссоциации (“KD”) связывающегося пептида или “MB50”.
“KD” соответствует концентрации пептида, при которой участок связывания на цели наполовину занят, т.е. когда концентрация цели со связавшимся пептидом (связанный целевой материал) равна концентрации цели при отсутствии связавшегося пептида. Чем меньше константа диссоциации, тем сильнее связывается пептид. Например, пептид с наномолярной (нМ) константой диссоциации связывается сильнее, чем пептид с микромолярной (мкМ) константой диссоциации. Определенные варианты осуществления настоящего изобретения будут иметь значение KD 10-5 или меньше.
“MB50” относится к концентрации связывающегося пептида, которая дает сигнал, который составляет 50% от максимального сигнала, полученного в ИФА анализе связывания. См. например, Пример 3 публикации заявки на патент США №2005/022683; которая включена в данный документ в качестве ссылки. MB50 приводит показатель силы связывающего взаимодействия или сродства связывания компонентов комплекса. Чем ниже значение MB50, тем сильнее, т.е. "лучше", взаимодействие пептида с его соответствующим субстратом. Например, пептид с наномолярной (нМ) MB50 связывает прочнее, чем пептид с микромолярной (мкМ) MB50. Определенные варианты осуществления настоящего изобретения будут иметь значение MB50 10-5 М или меньше.
В некоторых вариантах осуществления пептидный компонент, обладающий сродством к поверхности полости рта, может обладать сродством связывания, которое измеряют при помощи значений KD или MB50, меньшим или равным приблизительно 10-5 M, меньшим или равным приблизительно 10-6 M, меньшим или равным приблизительно 10-7 M, меньшим или равным приблизительно 10-8 M, меньшим или равным приблизительно 10-9 M или меньшим или равным приблизительно 10-10 M.
В некоторых вариантах осуществления пептиды, связывающиеся с поверхностью полости рта, и/или домены, связывающиеся с поверхностью полости рта, могут обладать сродством связывания, которое измеряют при помощи значений KD или MB50, меньшим или равным приблизительно 10-5 M, меньшим или равным приблизительно 10-6 M, меньшим или равным приблизительно 10-7 M, меньшим или равным приблизительно 10-8 M, меньшим или равным приблизительно 10-9 M или меньшим или равным приблизительно 10-10 M.
Применяемый в данном документе термин "сильное сродство" будет относиться к сродству связывания, обладающему значением KD или MB50, меньшим или равным приблизительно 10-5 M, предпочтительно меньшим или равным приблизительно 10-6 M, более предпочтительно меньшим или равным приблизительно 10-7 M, более предпочтительно меньшим или равным приблизительно 10-8 M, меньшим или равным приблизительно 10-9 M или наиболее предпочтительно меньшим или равным приблизительно 10-10 M.
Многокомпонентные системы получения пероксикарбоновой кислоты
Схема систем и способов для разделения и объединения множественных активных компонентов известна в данной области и, главным образом, будет зависеть от физической формы отдельных реакционных компонентов. Например, в системах с множеством активных жидких сред (жидкость-жидкость) обычно применяют многокамерные емкости с дозатором или двухфазные системы (например, публикация заявки на патент США № 2005/0139608; патент США № 5398846; патент США № 5624634; патент США 6391840; Европейский патент 0807156B1; публикация заявки на патент США № 2005/0008526 и РСТ публикация № WO 00/61713), как, например, такие, которые встречаются в некоторых применениях, связанных с отбеливанием, где необходимое отбеливающее средство получают в результате смешивания реакционно-способных жидких сред. Другие формы многокомпонентных систем, применяемые для получения пероксикарбоновой кислоты, могут включать, но без ограничений, такие, которые разработаны для одного или нескольких твердых компонентов или комбинаций твердо-жидкостных компонентов, как, например, порошки (например, патент США № 5116575), многослойные таблетки (например, патент США № 6210639), растворяемые в воде пакеты с множеством компонентов (например, патент США № 6995125) и твердые агломераты, которые реагируют в результате добавления воды (например, патент США № 6319888).
В другом варианте осуществления сложный эфир карбоновой кислоты в первом компоненте выбирают из группы, состоящей из моноацетина, диацетина, триацетина и их комбинаций. В другом варианте осуществления сложный эфир карбоновой кислоты в первом компоненте представляет собой ацетилированный сахарид. В другом варианте осуществления ферментный катализатор в первом компоненте может быть твердым веществом в форме частиц, жидкостью или гелем. В другом варианте осуществления первый реакционный компонент может быть твердой таблеткой или порошком.
Пероксикарбоновые кислоты являются вполне реакционно-способными и обычно уменьшаются в концентрации с течением времени. Это особенно справедливо в отношении коммерческих предварительно сформированных композиций пероксикарбоновых кислот, которым часто недостает долгосрочной стабильности. Водные растворы предварительно сформированных пероксикарбоновых кислот могут также представлять некоторые трудности для упаковки и/или транспортировки, особенно при транспортировке большими контейнерами и/или высококонцентрированными растворами пероксикарбоновых кислот на длинные расстояния. В дополнение, растворы предварительно сформированных пероксикарбоновых кислот могут быть не способны дать желаемую концентрацию пероксикарбоновой кислоты для конкретного целевого применения. В связи с этим, очень желательно хранить различные реакционные компоненты раздельно, в особенности в том, что касается жидких составов.
Сообщалось о применении многокомпонентных систем для образования пероксикарбоновых кислот, содержащих два или более компонентов, которые объединяют для получения требуемой пероксикарбоновой кислоты. Отдельные компоненты должны быть безопасны для обращения и стабильны в течение продолжительных периодов времени (т.е. при измерении по концентрации пероксикарбоновой кислоты, полученной при смешивании). В одном варианте осуществления стабильность при хранении многокомпонентной системы для ферментативного образования пероксикарбоновой кислоты можно измерить на основе стабильности ферментативного катализатора.
В данном документе приведены продукты личной гигиены, содержащие многокомпонентный состав для образования пероксикарбоновых кислот, в которых применяют ферментный катализатор для быстрого получения водного раствора перкислоты с необходимой концентрацией пероксикарбоновой кислоты. Смешивание можно осуществить непосредственно перед применением и/или на месте применения (in situ). В одном варианте осуществления состав продукта личной гигиены будет состоять по меньшей мере из двух компонентов, которые остаются разделенными до применения. Смешивание компонентов быстро формирует водный раствор перкислоты. Каждый компонент разработан так, чтобы полученный в результате водный раствор перкислоты содержал эффективную концентрацию перкислоты, подходящую для предполагаемого конечного применения. Композиция из отдельных компонентов должна быть разработана с (1) обеспечением стабильности при продолжительном хранении и/или (2) обеспечением способности к усилению формирования подходящего водного реакционного состава, имеющего в составе пероксикарбоновую кислоту.
Многокомпонентный состав может иметь в составе по меньшей мере два по сути жидких компонента. В одном варианте осуществления многокомпонентный состав может представлять собой двухкомпонентный состав, который содержит первый жидкий компонент и второй жидкий компонент. Применение терминов "первый" или "второй" жидкий компонент относительно, при условии что два различных жидких компонента, содержащих указанные ингредиенты, остаются разделенными до применения. Как минимум, многокомпонентный состав пероксикарбоновой кислоты содержит (1) по меньшей мере один ферментный катализатор, обладающий пергидролизной активностью, где указанный по меньшей мере один фермент предпочтительно классифицируют как эстераза CE-7, (2) субстрат на основе сложного эфира карбоновой кислоты и (3) источник кислорода пероксигруппы и воды, где состав ферментативно производит необходимую перкислоту в результате объединения компонентов.
Тип и количество различных ингредиентов, применяемых в рамках двухкомпонентных составов, должны быть тщательно отобраны и сбалансированы для обеспечения (1) стабильности при хранении каждого компонента, особенно пергидролизной активности ферментного катализатора, и (2) физических характеристик, которые повышают растворимость и/или способность эффективно формировать необходимый водный раствор пероксикарбоновой кислоты (например, ингредиенты, которые увеличивают растворимость основанного на сложном эфире субстрата в водной реакционной смеси, и/или ингредиенты, которые модифицируют вязкость и концентрацию по меньшей мере одного из жидких компонентов [т.е. по меньшей мере один совместный растворитель, который не оказывает значительный, неблагоприятный эффект на ферментативную пергидролизную активность]).
Были раскрыты различные способы улучшения эксплуатационных характеристик и/или каталитической стабильности систем для ферментативного образования перкислоты. В публикации заявки на патент США № 2010-0048448 A1 описано применение по меньшей мере одного совместного растворителя для повышения растворимости и/или характеристик смешивания у определенных субстратов на основе сложного эфира. В настоящих композициях и способах личной гигиены также можно применять совместный растворитель. В одном варианте осуществления компонент, содержащий субстрат на основе сложного эфира карбоновой кислоты и пергидролазный катализатор, содержит органический растворитель со значением log P меньше приблизительно 2, где log P определяют как логарифм коэффициента распределения вещества между октанолом и водой, выраженный в виде P = [растворенное вещество]октанол/[растворенное вещество]вода. Описаны несколько совместных растворителей со значением log P 2 или меньше, которые не оказывают явное неблагоприятное воздействие на ферментативную активность. В другом варианте осуществления совместный растворитель составляет от приблизительно 20 вес.% до приблизительно 70 вес.% в реакционном компоненте, содержащем субстрат на основе сложного эфира карбоновой кислоты и фермент. Реакционный компонент, содержащий субстрат на основе сложного эфира карбоновой кислоты и фермент, может необязательно содержать один или несколько буферов (например, натриевая и/или калиевая соль бикарбоната, цитрата, ацетата, фосфата, пирофосфата, метилфосфоната, сукцината, малата, фумарата, тартрата и малеата).
В публикации заявки на патент США № 2010-0086534 A1 описано применение двухкомпонентной системы, где первый компонент содержит состав жидкого сложного эфира карбоновой кислоты и твердый порошок фермента; где указанный порошок фермента содержит состав из (a) по меньшей мере одной эстеразы CE-7, обладающей пергидролизной активностью, и (b) по меньшей мере одного олигосахаридного наполнителя; и второй компонент содержит воду с источником кислорода пероксигруппы и стабилизатором пероксида водорода. В настоящих композициях и способах личной гигиены можно применять двухкомпонентный состав, сходный с системой, описанной в документе US 2010-0086534 A1. В связи с этим, олигосахаридный наполнитель можно применять для того, чтобы способствовать стабилизации ферментативной активности. В одном варианте осуществления олигосахаридный наполнитель может иметь среднечисловой молекулярный вес по меньшей мере приблизительно 1250 и средневесовой молекулярный вес по меньшей мере приблизительно 9000. В другом варианте осуществления олигосахаридный наполнитель может иметь среднечисловой молекулярный вес по меньшей мере приблизительно 1700 и средневесовой молекулярный вес по меньшей мере приблизительно 15000. В другом варианте осуществления олигосахарид представляет собой мальтодекстрин.
В публикации заявки на патент США № 2010-0086535-A1 также описана двухкомпонентная система, где первый компонент содержит состав жидкого сложного эфира карбоновой кислоты и твердого порошка фермента, причем указанный состав содержит (a) порошок фермента, содержащий по меньшей мере одну эстеразу CE-7, обладающую пергидролизной активностью, и по меньшей мере один олигосахаридный наполнитель, и по меньшей мере одно поверхностно-активное вещество; и (b) по меньшей мере один буфер, где в предпочтительном варианте осуществления буфер добавляют как отделенный (т.е. отдельно от порошка фермента) нерастворимый компонент к субстрату на основе сложного эфира карбоновой кислоты; и второй компонент содержит воду с источником кислорода пероксигруппы и стабилизатором пероксида водорода. В настоящих композициях и способах личной гигиены можно применять двухкомпонентный состав, сходный с системой, описанной в документе US 2010-0086535 A1. В одном варианте осуществления наполнитель может быть олигосахаридным наполнителем, который имеет среднечисловой молекулярный вес по меньшей мере приблизительно 1250 и средневесовой молекулярный вес по меньшей мере приблизительно 9000. В другом варианте осуществления олигосахаридный наполнитель может иметь среднечисловой молекулярный вес по меньшей мере приблизительно 1700 и средневесовой молекулярный вес по меньшей мере приблизительно 15000. В другом варианте осуществления олигосахарид представляет собой мальтодекстрин. В следующем варианте осуществления необязательный pH-буфер представляет собой бикарбонатный буфер. В еще одном следующем варианте осуществления стабилизатором пероксида водорода является TURPINAL® SL.
Порошки ферментов
В некоторых вариантах осуществления в композициях личной гигиены можно применять ферментный катализатор в форме стабилизированного порошка фермента. Способы получения и стабилизации составов, содержащих порошок фермента, описаны в публикациях заявок на патенты США № 2010-0086534 и № 2010-0086535.
В одном варианте осуществления фермент может находиться в порошке фермента в количестве в диапазоне от приблизительно 5 весовых процентов (вес.%) до приблизительно 75 вес.% от сухого веса порошка фермента. Предпочтительный диапазон весовых процентов фермента в порошке фермента/смеси, подвергнутой распылительной сушке, представляет собой от приблизительно 10 вес.% до 50 вес.%, и более предпочтительный диапазон весовых процентов фермента в порошке фермента/смеси, подвергнутой распылительной сушке, представляет собой от приблизительно 20 вес.% до 33 вес.%.
В одном варианте осуществления порошок фермента может дополнительно включать наполнитель. В одном аспекте наполнитель обеспечивают в количестве в диапазоне от приблизительно 95 вес.% до приблизительно 25 вес.% от сухого веса порошка фермента. Предпочтительный диапазон вес.% наполнителя в порошке фермента представляет собой от приблизительно 90 вес.% до 50 вес.%, и более предпочтительный диапазон вес.% наполнителя в порошке фермента представляет собой от приблизительно 80 вес.% до 67 вес.%.
В одном варианте осуществления наполнитель, применяемый для приготовления порошка фермента, может представлять собой олигосахаридный наполнитель. В одном варианте осуществления олигосахаридный наполнитель имеет среднечисловой молекулярный вес по меньшей мере приблизительно 1250 и средневесовой молекулярный вес по меньшей мере приблизительно 9000. В некоторых вариантах осуществления олигосахаридный наполнитель имеет среднечисловой молекулярный вес по меньшей мере приблизительно 1700 и средневесовой молекулярный вес по меньшей мере приблизительно 15000. Конкретные олигосахариды могут включать, но без ограничений, мальтодекстрин, ксилан, маннан, фукоидан, галактоманнан, хитозан, раффинозу, стахиозу, пектин, инсулин, леван, граминан, амилопектин, сахарозу, лактулозу, лактозу, мальтозу, трегалозу, целлобиозу, нигеротриозу, мальтотриозу, мелецитозу, мальтотриулозу, раффинозу, кестозу и их смеси. В предпочтительном варианте осуществления олигосахаридный наполнитель представляет собой мальтодекстрин. Наполнители на основе олигосахаридов могут также включать, но без ограничений, растворимые в воде неионные простые целлюлозные эфиры, как, например, гидроксиметилцеллюлоза и гидроксипропилметилцеллюлоза и их смеси. В еще одном дополнительном варианте осуществления наполнитель можно выбрать, но без ограничений, из одного или нескольких следующих соединений: трегалоза, лактоза, сахароза, маннит, сорбит, глюкоза, целлобиоза, α-циклодекстрин и карбоксиметилцеллюлоза.
Составы могут содержать по меньшей мере одно необязательное поверхностно-активное вещество, где предпочтительно присутствие по меньшей мере одного поверхностно-активного вещества. Поверхностно-активные вещества могут включать, но без ограничений, ионные или неионные поверхностно-активные вещества или увлажняющие средства, как, например, этоксилированное касторовое масло, полигликолизированные глицериды, ацетилированные моноглицериды, сложные эфиры сорбита и жирной кислоты, полоксамеры, сложные полиоксиэтиленовые эфиры сорбита и жирной кислоты, полиоксиэтиленовые производные, моноглицериды или их этоксилированные производные, диглицериды или их полиоксиэтиленовые производные, натрия докузат, натрийлаурилсульфат, холевая кислота или и ее производные, лецитины, фосфолипиды, блок-сополимеры этиленгликоля и пропиленгликоля и неионные органосиликоны. Предпочтительно, поверхностно-активное вещество представляет собой сложный полиоксиэтиленовый эфир сорбита и жирной кислоты, при этом более предпочтительным является полисорбат 80.
В случае, когда состав содержит порошок фермента, поверхностно-активное вещество, применяемое для приготовления порошка, может присутствовать в количестве, варьирующем в диапазоне от приблизительно 5 вес.% до 0,1 вес.% по весу белка, присутствующего в порошке фермента, предпочтительно от приблизительно 2 вес.% до 0,5 вес.% по весу белка, присутствующего в порошке фермента.
Порошок фермента может дополнительно содержать один или несколько буферов (например, натриевые и/или калиевые соли бикарбоната, цитрата, ацетата, фосфата, пирофосфата, метилфосфоната, сукцината, малата, фумарата, тартрата и малеата) и ферментный стабилизатор (например, этилендиаминтетрауксусная кислота, (1-гидроксиэтилиден)бисфосфоновая кислота)).
Сушку распылением состава для образования порошка фермента осуществляют, например, как описано в целом в Spray Drying Handbook, 5th ed., K. Masters, John Wiley & Sons, Inc., NY, N.Y. 1991) и в патентных публикациях PCT № WO 97/41833 и WO 96/32149, Platz, R. et al.
В целом, сушка распылением состоит из объединения высокодисперсной жидкости и достаточного объема горячего воздуха с получением испарения и высушивания жидких капель. Как правило, исходную реакционную смесь распыляют в поток теплого фильтрованного воздуха, который испаряет растворитель и переносит высушенный продукт в приемник. Отработанный воздух затем удаляют с растворителем. Специалисты в данной области поймут, что можно применять несколько различных типов устройств для получения необходимого продукта. Например, промышленные распылительные сушки, произведенные Buchi Ltd. (Постфах, Швейцария) или GEA Niro Corp. (Копенгаген, Дания), будут эффективно производить частицы необходимого размера. Дополнительно, будет понятно, что такие распылительные сушки и, в особенности, их распылители, можно модифицировать или приспособить для специфических применений, как, например, одновременное распыление двух растворов с применением технологии с двумя соплами. Более конкретно, эмульсию по типу "вода в масле" можно распылять из одного сопла, а раствор, содержащий антиадгезив, как, например, маннит, можно одновременно распылять из второго сопла. В других случаях это может быть целесообразно для продвижения раствора исходной реакционной смеси через сконструированное по заказу сопло с помощью насоса для жидкостной хроматографии высокого давления (HPLC). При условии, что получаются микроструктуры, имеющие правильную морфологию и/или композицию, выбор устройства не является критичным и может быть очевидным для специалиста в данной области с учетом идей данного документа.
Температура как на входе, так и на выходе газа, применяемого для сушки распыленного материала, является такой, чтобы она не приводила к разложению фермента в распыляемом материале. Такие температуры обычно определяют экспериментальным путем, хотя, в целом, температура на входе будет находиться в диапазоне от приблизительно 50°C до приблизительно 225°C, в то время как температура на выходе будет находиться в диапазоне от приблизительно 30°C до приблизительно 150°C. Предпочтительные параметры включают давления распыления, варьирующие от приблизительно 20 до 150 psi (0,14 МПа-1,03 МПа) и предпочтительно от приблизительно 30-40 до 100 psi (от 0,21-0,28 МПа до 0,69 МПа). Как правило, используемое давление распыления будет одним из следующих (МПа): 0,14, 0,21, 0,28, 0,34, 0,41, 0,48, 0,55, 0,62, 0,69, 0,76, 0,83 или выше.
В одном варианте осуществления выражение "по сути сохраняет свою ферментативную активность" подразумевает, что порошок фермента или состав порошка фермента в сложном эфире карбоновой кислоты сохраняет по меньшей мере приблизительно 75 процентов ферментативной активности фермента в порошке фермента или составе порошка фермента после длительного срока хранения при температуре окружающей среды и/или после короткого периода хранения при повышенной температуре (выше температуры окружающей среды) в составе, состоящем из сложного эфира карбоновой кислоты и порошка фермента, по сравнению с начальной ферментативной активностью порошка фермента перед приготовлением состава, состоящего из сложного эфира карбоновой кислоты и порошка фермента. Длительный период хранения представляет собой период времени от приблизительно одного года до приблизительно двух лет при температуре окружающей среды. В одном варианте осуществления короткий период хранения при повышенной температуре представляет собой период времени от того момента, как состав, состоящий из сложного эфира карбоновой кислоты и порошка фермента, получают при 40°C до приблизительно восьми недель при 40°C. В другом варианте осуществления повышенная температура находится в диапазоне от приблизительно 30°C до приблизительно 52°C. В предпочтительном варианте осуществления повышенная температура находится в диапазоне от приблизительно 30°C до приблизительно 40°C.
В некоторых вариантах осуществления порошок фермента сохраняет по меньшей мере 75 процентов ферментативной активности через восемь недель хранения при 40°C в составе, состоящем из сложного эфира карбоновой кислоты и порошка фермента, по сравнению с изначальной ферментативной активностью порошка фермента до приготовления состава, состоящего из сложного эфира карбоновой кислоты и порошка фермента, при 40°C. В других вариантах осуществления порошок фермента сохраняет по меньшей мере 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 процентов ферментативной активности по меньшей мере одного фермента через восемь недель хранения при 40°C в составе, состоящем из сложного эфира карбоновой кислоты и порошка фермента, по сравнению с изначальной ферментативной активностью порошка фермента до приготовления состава, состоящего из сложного эфира карбоновой кислоты и порошка фермента, при 40°C. Предпочтительно, пергидролизную активность измеряют, как описано в Примерах 8-13 публикации заявки на патент США № 2010-0086510; но можно применять любой способ измерения пергидролизной активности.
Дополнительное улучшение ферментативной активности в пределах указанных периодов времени можно достичь добавлением буфера, обладающего буферной емкостью в диапазоне pH от приблизительно 5,5 до приблизительно 9,5, к составу, состоящему из сложного эфира карбоновой кислоты и высушенного распылением порошка фермента, как описано в публикации заявки на патент США № 2010-0086534. Подходящий буфер может включать, но без ограничений, натриевую соль, калиевую соль или смеси натриевых или калиевых солей бикарбоната, пирофосфата, фосфата, метилфосфоната, цитрата, ацетата, малата, фумарата, тартрата, малеата или сукцината. Предпочтительные буферы для применения в составе, состоящем из сложного эфира карбоновой кислоты и высушенного распылением порошка фермента, включают натриевую соль, калиевую соль или смеси натриевых или калиевых солей бикарбоната, пирофосфата, фосфата, метилфосфоната, цитрата, ацетата, малата, фумарата, тартрата, малеата или сукцината.
В вариантах осуществления, где в составе из сложного эфира карбоновой кислоты и порошка фермента может присутствовать буфер, буфер может присутствовать в количестве в диапазоне от приблизительно 0,01 вес.% до приблизительно 50 вес.% по весу сложного эфира карбоновой кислоты в составе, состоящем из сложного эфира карбоновой кислоты и порошка фермента. Буфер может присутствовать в более предпочтительном диапазоне от приблизительно 0,10% до приблизительно 10% по весу сложного эфира карбоновой кислоты в составе, состоящем из сложного эфира карбоновой кислоты и порошка фермента. Дополнительно, в этих вариантах осуществления сравнение между пергидролизной активностью фермента определяют в отношении порошка фермента, который сохраняет по меньшей мере 75 процентов пергидролизной активности по меньшей мере одного фермента через восемь недель хранения при 40°C в составе, состоящем из сложного эфира карбоновой кислоты, буфера, обладающего буферной емкостью в диапазоне pH от приблизительно 5,5 до приблизительно 9,5, и порошка фермента по сравнению с изначальной пергидролизной активностью порошка фермента до приготовления состава, состоящего из сложного эфира карбоновой кислоты, буфера, обладающего буферной емкостью в диапазоне pH от приблизительно 5,5 до приблизительно 9,5, и порошка фермента.
Предполагается, что высушенный порошок фермента хранят в виде состава с органическим соединением, которое представляет собой субстрат для по меньшей мере одного фермента, таким как триацетин. При отсутствии добавленного пероксида водорода триацетин в норме гидролизируется в водном растворе эстеразой углеводов CE-7 с образованием диацетина и уксусной кислоты, и образование уксусной кислоты приводит в результате к понижению pH реакционной смеси. Одним условием стабильности при длительном хранении фермента в триацетине является то, что отсутствует значительная реакция триацетина с какой-либо водой, которая могла бы присутствовать в триацетине; техническим требованием для содержания воды в одном коммерческом триацетине (поставляемом Tessenderlo Group, Брюссель, Бельгия) является 0,03 вес.% воды (300 ч./млн). Любой гидролиз триацетина, который происходит во время хранения фермента в триацетине, будет давать уксусную кислоту, что может привести к понижению активности или дезактивации пергидролаз CE-7; пергидролазы обычно неактивны при pH 5,0 или ниже (см. публикацию заявки на патент США № 2009-0005590, DiCosimo, R. и соавт.). Наполнитель, выбранный для применения согласно настоящей заявке, должен обеспечивать стабильность фермента в органическом субстрате для фермента при условиях, где уксусная кислота может образовываться в связи с наличием низких концентраций воды в составе. Высушенный порошок фермента можно хранить в виде состава в органическом соединении, которое является субстратом по меньшей мере для одного фермента, где состав дополнительно содержит наполнитель и один или несколько буферов (например, натриевая и/или калиевая соли бикарбоната, цитрата, ацетата, фосфата, пирофосфата, метилфосфоната, сукцината, малата, фумарата, тартрата и малеата).
Подходящие реакционные условия для ферментативно катализируемого получения перкислоты из сложных эфиров карбоновой кислоты и пероксида водорода
Для получения эффективной концентрации необходимой перкислоты (перкислот) в настоящих композициях и способах личной гигиены можно применять один или несколько ферментов, обладающих пергидролитической активностью. Необходимую пероксикарбоновую кислоту можно получить реакцией сложных эфиров карбоновых кислот с источником кислорода пероксигруппы, включая, но без ограничений, пероксид водорода, пероксид цинка, пероксид натрия, пероксид мочевины, пероксид кальция, перборат натрия, перкарбонат натрия или комплексы пероксида водорода, в присутствии ферментного катализатора, обладающего пергидролизной активностью.
Пергидролитический фермент в нацеленной пергидролазе может быть любым пергидролитическим ферментом и может включать липазы, протеазы, эстеразы, ацилтрансферазы, арилэстеразы, эстеразы углеводов и комбинации, при условии, что фермент обладает пергидролитической активностью в отношении одного или нескольких присутствующих субстратов. Примеры могут включать, но без ограничений, пергидролитические протеазы (вариант субтилизина, патент США 7510859), пергидролитические эстеразы (Pseudomonas fluorescens; патент США № 7384787; “L29P” вариант SEQ ID NO: 477) и пергидролитические арилэстеразы (Mycobacterium smegmatis; патент США № 7754460; WO2005/056782; и EP1689859 B1; SEQ ID NO: 460 [вариант S54V] и 478 [дикий тип]).
В одном варианте осуществления ферментный катализатор содержит по меньшей мере один фермент, обладающий пергидролазной активностью, где указанный фермент структурно классифицирован как представитель семейства эстераз углеводов СЕ-7 (СЕ-7; см. Coutinho, P.M., и Henrissat, B., ранее). В другом варианте осуществления пергидролазный катализатор структурно классифицирован как деацетилаза цефалоспорина С. В другом варианте осуществления пергидролазный катализатор структурно классифицирован как ацетилксиланэстераза.
В одном варианте осуществления пергидролазный катализатор содержит фермент, обладающий пергидролизной активностью и имеющий сигнатурный мотив, содержащий:
a) RGQ мотив, который выравнивается с аминокислотными остатками 118-120 из SEQ ID NO: 2;
b) GXSQG мотив, который выравнивается с аминокислотными остатками 179-183 из SEQ ID NO: 2; и
c) HE мотив, который выравнивается с аминокислотными остатками 298-299 из SEQ ID NO: 2.
В предпочтительном варианте осуществления выравнивание с эталонной SEQ ID NO: 2 осуществляют с помощью CLUSTALW.
В дополнительном варианте осуществления сигнатурный мотив CE-7 дополнительно может содержать и дополнительный (т.е. четвертый) мотив, обозначенный как LXD мотив, в аминокислотных остатках 267-269 при выравнивании с эталонной последовательностью SEQ ID NO: 2 при помощи CLUSTALW.
В другом варианте осуществления пергидролазный катализатор содержит фермент, обладающий пергидролазной активностью, причем указанный фермент имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476.
В другом варианте осуществления пергидролазный катализатор содержит фермент, обладающий пергидролазной активностью, причем указанный фермент имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 424, 437 и 476, где указанный фермент может иметь одно или несколько дополнений, делеций или замен, при условии, что сигнатурный мотив является консервативным и сохранена пергидролазная активность.
Как описано выше, пергидролаза CE-7 может быть гибридным белком, имеющим первую часть, которая содержит пергидролазу CE-7, и вторую часть, которая содержит пептидный компонент, обладающий сродством к целевой поверхности организма таким образом, чтобы пергидролаза была "нацеленной" на необходимую поверхность организма. В одном варианте осуществления пергидролаза CE-7 (как определено по наличию сигнатурного мотива CE-7) может быть слита с любым пептидным компонентом/связующим элементом, способным нацеливать фермент на поверхность организма. В одном аспекте пептидный компонент, обладающий сродством к поверхности полости рта, может включать антитела, фрагменты антител (Fab), а также одноцепочечные вариабельные фрагменты (scFv; гибрид вариабельных участков тяжелой (VH) и легкой цепей (VL) иммуноглобулинов), однодоменных антител верблюда, каркасных дисплейных белков и одноцепочечных аффинных пептидов без иммуноглобулиновой укладки. Композиции, содержащие антитела, фрагменты антител и другие происходящие от иммуноглобулинов связывающие элементы, а также большие каркасные дисплейные белки, часто являются экономически нерентабельными. В связи с этим, и в предпочтительном аспекте, пептидный компонент/связывающий элемент является одноцепочечным аффинным пептидом без иммуноглобулиновой укладки и/или иммуноглобулинового домена. Короткие одноцепочечные пептиды, связывающие с поверхностью организма, можно создать эмпирически (например, положительно заряженные полипептиды, нацеленные на отрицательно заряженные поверхности), или создать с применением биопэннинга по отношению к целевой поверхности организма. Способы определения/получения аффинных пептидов с помощью ряда технологий дисплея (например, фаговый дисплей, дрожжевой дисплей, бактериальный дисплей, рибосомный дисплей и мРНК дисплей) хорошо известны в данной области. Отдельные пептиды, связывающиеся с поверхностью полости рта, можно соединить друг с другом посредством необязательных спейсеров/линкеров с образованием более крупных связывающихся "доменов" (также называемых в данном документе как связывающиеся "руки") для улучшения присоединения/локализации пергидролитического фермента с целевой поверхности полости рта.
Гибридные белки могут также включать один или несколько пептидных линкеров/спейсеров, разделяющих пергидролазный фермент CE-7, домен, связывающийся поверхность полости рта, и/или различные пептиды, связывающиеся с поверхностью полости рта (например, если множество пептидов, связывающихся с поверхностью полости рта, соединены с образованием большего домена, связывающегося с целевой поверхностью полости рта). Могут присутствовать множественные пептидные линкеры/спейсеры, и ряд линкеров могут повторяться до 10 раз. Неограничивающий перечень иллюстративных пептидных спейсеров приведен в виде аминокислотных последовательностей SEQ ID NO: 383-396 и тех, которые отображены в Таблице 5.
Подходящие пептиды, обладающие сродством к поверхности полости рта, описаны в данном документе ранее. Способы определения дополнительных пептидов, связывающихся с поверхностью полости рта, с помощью любых из описанных выше технологий "дисплея", хорошо известны, и их можно применять для определения дополнительных пептидов, связывающихся с поверхностью полости рта.
Подходящие субстраты на основе сложного эфира карбоновой кислоты могут включать сложные эфиры со следующими формулами:
(а) один или несколько сложных эфиров со структурой
[X]mR5,
где
Х является сложноэфирной группой с формулой R6C(O)O;
R6 представляет собой C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильной группой или C1-C4 алкоксигруппой, где R6 необязательно содержит одну или несколько эфирных связей, где R6 является C2-C7;
R5 представляет собой C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильной группой; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты, и где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5,
при этом указанные один или несколько сложных эфиров имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C; или
(b) один или несколько глицеридов со структурой
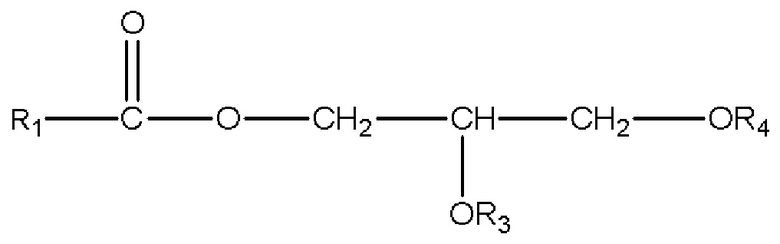 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O); или
(с) один или несколько сложных эфиров с формулой
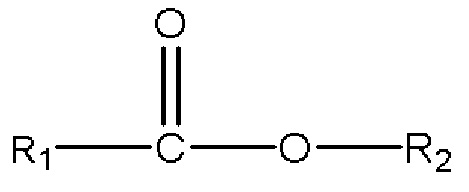 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 прямой или разветвленный алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)n или (CH2CH(CH3)O)nH, и n равен 1-10; или
(d) один или несколько ацетилированных моносахаридов, ацетилированных дисахаридов или ацетилированных полисахаридов; или
(е) любая комбинация из (а)-(d).
Подходящие субстраты также могут включать один или несколько ацилированных сахаридов, выбранных из группы, состоящей из ацилированных моно-, ди- и полисахаридов. В другом варианте осуществления ацилированные сахариды выбраны из группы, состоящей из ацетилированного ксилана; фрагментов ацетилированного ксилана; ацетилированной ксилозы (как, например, ксилозатетраацетат); ацетилированной глюкозы (как, например, α-D-глюкозы пентаацетат; β-D-глюкозы пентаацетат; 1-тио-β-D-глюкоза-2,3,4,6-тетраацетат); β-D-глюкозы пентаацетата; сорбита гексаацетата; сахарозы октаацетата; β-D-рибофураноза-1,2,3,5-тетраацетата; β-D-рибофураноза-1,2,3,4-тетраацетата; три-O-ацетил-D-галакталя; три-O-ацетил-D-глюкаля; β-D-ксилофуранозы тетраацетата; α-D-глюкопиранозы пентаацетата; β-D-глюкопираноза-1,2,3,4-тетраацетата; β-D-глюкопираноза-2,3,4,6-тетраацетата; 2-ацетамидо-2-дезокси-1,3,4,6-тетрацетил-β-D-глюкопиранозы; 2-ацетамидо-2-дезокси-3,4,6-триацетил-1-хлорид-α-D-глюкопиранозы; α-D-маннопиранозапентаацетата и ацетилированной целлюлозы. В предпочтительном варианте осуществления ацетилированный сахарид выбран из группы, состоящей из β-D-рибофураноза-1,2,3,5-тетраацетата; три-O-ацетил-D-галакталя; три-O-ацетил-D-глюкаля; сахарозы октаацетата и ацетилированной целлюлозы.
В другом варианте осуществления дополнительные подходящие субстраты могут также включать 5-ацетоксиметил-2-фуральдегид; 3,4-диацетокси-1-бутен; 4-ацетоксибензойную кислоту; ванилинацетат; ацетат метилового эфира пропиленгликоля; метиллактат; этиллактат; метилгликолят; этилгликолят; метилметоксиацетат; этилметоксиацетат; метил-3-гидроксибутират; этил-3-гидроксибутират и триэтил-2-ацетилцитрат.
В другом варианте осуществления подходящие субстраты выбраны из группы, состоящей из моноацетина; диацетина; триацетина; монопропионина, дипропионина, трипропионина, монобутирина; дибутирина; трибутирина; глюкозы пентаацетата; ксилозы татраацетата; ацетилированного ксилана; фрагментов ацетилированного ксилана; β-D-рибофураноза-1,2,3,5-тетраацетата; три-O-ацетил-D-галакталя; три-O-ацетил-D-глюкаля; сложных моноэфиров или диэфиров 1,2-этандиола; 1,2-пропандиола; 1,3-пропандиола; 1,2-бутандиола; 1,3-бутандиола; 2,3-бутандиола; 1,4-бутандиола; 1,2-пентандиола; 2,5-пентандиола; 1,5-пентандиола; 1,6-пентандиола; 1,2-гександиола; 2,5-гександиола; 1,6-гександиола и их смесей. В другом варианте осуществления субстрат представляет собой C1-C6 полиол, содержащий одну или несколько сложноэфирных групп. В предпочтительном варианте осуществления одна или несколько гидроксильных групп на C1-C6 полиоле замещены одной или несколькими ацетоксигруппами (как, например, 1,3-пропандиолдиацетат; 1,2-пропандиолдиацетат; 1,4-бутандиолдиацетат; 1,5-пентандиолдиацетат и т.д.). В дополнительном варианте осуществления субстрат представляет собой пропиленгликольдиацетат (PGDA), этиленгликольдиацетат (EGDA) или их смеси.
В дополнительном варианте осуществления подходящие субстраты выбраны из группы, состоящей из моноацетина, диацетина, триацетина, монопропионина, дипропионина, трипропионина, монобутирина, дибутирина и трибутирина. В другом аспекте субстрат выбран из группы, состоящей из диацетина и триацетина. В наиболее предпочтительном варианте осуществления подходящий субстрат содержит триацетин.
В предпочтительном варианте осуществления сложный эфир карбоновой кислоты представляет собой жидкий субстрат, выбранный из группы, состоящей из моноацетина, диацетина, триацетина и их комбинаций (т.е. смесей). Сложный эфир карбоновой кислоты присутствует в реакционном составе в концентрации, достаточной для получения необходимой концентрации пероксикарбоновой кислоты в результате ферментно катализируемого пергидролиза. Сложный эфир карбоновой кислоты не должен быть полностью растворимым в реакционном составе, но имеет достаточную растворимость для возможности превращения сложного эфира пергидролазным катализатором до соответствующей пероксикарбоновой кислоты. Сложный эфир карбоновой кислоты присутствует в реакционном составе в концентрации от 0,05 вес.% до 40 вес.% реакционного состава, предпочтительно в концентрации от 0,1 вес.% до 20 вес.% реакционного состава и более предпочтительно в концентрации от 0,5 вес.% до 10 вес.% реакционного состава.
Источник кислорода пероксигруппы может включать, но без ограничений, пероксид водорода, аддукты пероксида водорода (например, аддукт гидроперита (пероксид карбамида)), перборатные соли, перкарбонатные соли и пероксидные соли. Концентрация соединения с кислородом пероксигруппы в реакционном составе может варьировать от 0,0033 вес.% до приблизительно 50 вес.%, предпочтительно от 0,033 вес.% до приблизительно 40 вес.%, более предпочтительно от 0,1 вес.% до приблизительно 30 вес.%.
Источник кислорода пероксигруппы (т.е. пероксид водорода) можно также образовывать ферментативно с помощью фермента, способного производить эффективное количество пероксида водорода. Например, различные оксидазы можно применять в настоящих композициях и способах для получения эффективного количества пероксида водорода, включая, но без ограничений, оксидазу глюкозы, оксидазу лактозы, оксидазу углеводов, алкогольоксидазу, этиленгликольоксидазу, глицеролоксидазу и оксидазу аминокислот.
Сообщалось, что многие пергидролазные катализаторы (целые клетки, пермеабилизированные целые клетки и частично очищенные экстракты целых клеток) обладают каталазной активностью. Каталазы катализируют превращение пероксида водорода в кислород и воду. В одном аспекте пергидролизный катализатор не обладает каталазной активностью. В другом аспекте каталазный ингибитор можно добавить к реакционному составу. Специалист в данной области может скорректировать концентрацию каталазного ингибитора по необходимости. Концентрация каталазного ингибитора обычно варьирует от 0,1 мМ до приблизительно 1 М, предпочтительно от приблизительно 1 мМ до приблизительно 50 мМ, более предпочтительно от приблизительно 1 мМ до приблизительно 20 мМ.
В другом варианте осуществления ферментный катализатор не обладает значительной каталазной активностью или может быть сконструирован с уменьшением или устранением каталазной активности. Каталазную активность в клетке-хозяине можно подавить или устранить путем нарушения экспрессии гена(ов), отвечающего за каталазную активность, с помощью хорошо известных технологий, включая, но без ограничений, транспозонный мутагенез, экспрессию антисмысловой РНК, направленный мутагенез и случайный мутагенез. В предпочтительном варианте осуществления ген(ы), кодирующий(е) эндогенную каталазную активность, подавляют или нарушают (т.е. нокаутируют). Применяемый в данном документе "нарушенный" ген является геном, в котором более не присутствует активность и/или функция белка, кодируемого модифицированным геном. Средства нарушения гена хорошо известны в данной области и могут включать, но без ограничений, вставки, делеции или мутации гена при условии, что больше не присутствует активность и/или функция соответствующего белка. В следующем предпочтительном варианте осуществления организмом-источником является организм-источник E. coli, содержащий нарушенный ген каталазы, выбранный из группы, состоящей из katG и katE (см. публикацию заявки на патент США № 2008-0176299). В другом варианте осуществления организм-источник представляет собой штамм E. coli, у которого присутствует подавление и/или нарушение в как katG, так и katE генах каталазы.
Концентрация катализатора в водном реакционном составе зависит от специфической каталитической активности катализатора, и ее выбирают для получения необходимой скорости реакции. Вес катализатора в пергидролизных реакциях обычно варьирует от 0,0001 мг до 10 мг на мл общего реакционного объема, предпочтительно от 0,001 мг до 2,0 мг на мл. Катализатор также может быть иммобилизирован на растворимой или нерастворимой подложке при помощи способов, хорошо известных специалистам в данной области, см., например, Immobilization of Enzymes and Cells; Gordon F. Bickerstaff, Editor; Humana Press, Totowa, NJ, USA; 1997. Применение иммобилизированных катализаторов позволяет восстановление и повторное применение катализатора в последующих реакциях. Ферментный катализатор может быть в форме целых микробных клеток, пермеабилизированных микробных клеток, экстрактов микробных клеток, частично очищенных или очищенных ферментов и их смесей.
В одном аспекте концентрация пероксикарбоновой кислоты, образованной при сочетании химического пергидролиза и ферментативного пергидролиза сложного эфира карбоновой кислоты, достаточна для получения эффективной концентрации пероксикарбоновой кислоты для выбранного применения, связанного с личной гигиеной. В другом аспекте настоящие способы обеспечивают комбинации ферментов и ферментных субстратов для получения необходимой эффективной концентрации пероксикарбоновой кислоты, где при отсутствии добавленного фермента имеет место значительно более низкая концентрация получаемой пероксикарбоновой кислоты. Несмотря на то, что в некоторых случаях может протекать значительный химический пергидролиз ферментного субстрата в результате прямой химической реакции неорганической перкислоты с ферментным субстратом, концентрация образуемой пероксикарбоновой кислоты для получения эффективной концентрации пероксикарбоновой кислоты при необходимых применениях может быть недостаточной, и значительное повышение общей концентрации пероксикарбоновой кислоты достигают путем добавления соответствующего пергидролазного катализатора к реакционному составу.
Концентрация образуемой пероксикарбоновой кислоты (например, перуксусной кислоты) в результате пергидролиза по меньшей мере одного сложного эфира карбоновой кислоты составляет по меньшей мере приблизительно 0,1 ч./млн, предпочтительно по меньшей мере 0,5 ч./млн, 1 ч./млн, 5 ч./млн, 10 ч./млн, 20 ч./млн, 100 ч./млн, 200 ч./млн, 300 ч./млн, 500 ч./млн, 700 ч./млн, 1000 ч./млн, 2000 ч./млн, 5000 ч./млн или 10000 ч./млн перкислоты в течение 10 минут, предпочтительно в течение 5 минут, после начала реакции пергидролиза. Состав продукта, содержащий пероксикарбоновую кислоту, можно необязательно разбавить водой или раствором, преимущественно состоящим из воды, с получением состава с необходимой более низкой концентрацией пероксикарбоновой кислоты, исходя из целевого применения. Понятно, что специалист в данной области техники может скорректировать реакционные компоненты и/или количества разбавителя для получения необходимой концентрации перкислоты для выбранного продукта личной гигиены.
В одном аспекте время реакции, необходимое для образования требуемой концентрации перкислоты, составляет не более чем приблизительно два часа, предпочтительно не более чем приблизительно 30 минут, более предпочтительно не более чем приблизительно 10 минут и наиболее предпочтительно приблизительно 5 минут или меньше. В других аспектах поверхность полости рта приводят в контакт с пероксикарбоновой кислотой, образованной в соответствии с описанными в данном документе способами, в течение 5 минут после объединения реакционных компонентов. В одном варианте осуществления целевую поверхность полости рта приводят в контакт с пероксикарбоновой кислотой, полученной при помощи способа, описанного в данном документе, в течение от приблизительно 5 минут до приблизительно 168 часов после объединения указанных реакционных компонентов, или в течение от приблизительно 5 минут до приблизительно 48 часов, или в течение от приблизительно 5 минут до 2 часов после объединения указанных реакционных компонентов, или любого такого временного интервала в пределах указанных в данном документе значений.
Перкислоту, образуемую в соответствии со способами, описанными в данном документе, применяют в продуктах личной гигиены/применениях, связанных с личной гигиеной, где перкислоту приводят в контакт с целевой поверхностью полости рта для получения основанного на перкислоте полезного эффекта по отношению к полости рта. В одном варианте осуществления способ получения перкислоты для целевой поверхности организма осуществляют in situ.
Можно выбрать температуру реакции для контроля как скорости реакции, так и стабильности активности ферментного катализатора. Понятно, что для определенных применений, связанных с личной гигиеной, температура целевой поверхности организма (например, 37°C внутри полости рта) может быть температурой реакции. Температура реакции может варьировать от немного выше точки замерзания реакционного состава (приблизительно 0°C) до приблизительно 95°C, с предпочтительным диапазоном от 5°C до приблизительно 75°C и более предпочтительным диапазоном температуры реакции от приблизительно 5°C до приблизительно 55°C.
pH конечного состава реакции, содержащего пероксикарбоновую кислоту, составляет от приблизительно 2 до приблизительно 9, предпочтительно от приблизительно 3 до приблизительно 8, более предпочтительно от приблизительно 5 до приблизительно 8, еще более предпочтительно от приблизительно 5,5 до приблизительно 8 и даже еще более предпочтительно от приблизительно 6,0 до приблизительно 7,5. pH реакции и конечного реакционного состава можно необязательно контролировать добавлением подходящего буфера, включая, но без ограничений, фосфат, пирофосфат, бикарбонат, ацетат или цитрат. Концентрация буфера, в случае использования, обычно составляет от 0,1 мМ до 1,0 М, предпочтительно от 1 мМ до 300 мМ, наиболее предпочтительно от 10 мМ до 100 мМ.
В другом аспекте реакционный состав для ферментативного пергидролиза может содержать органический растворитель, который действует как диспергирующее средство для увеличения степени растворения сложного эфира карбоновой кислоты в реакционном составе. Такие растворители включают, но без ограничений, простой метиловый эфир пропиленгликоля, ацетон, циклогексанон, простой бутиловый эфир диэтиленгликоля, простой метиловый эфир трипропиленгликоля, простой метиловый эфир диэтиленгликоля, простой бутиловый эфир пропиленгликоля, простой метиловый эфир дипропиленгликоля, циклогексанол, бензиловый спирт, изопропанол, этанол, пропиленгликоль и их смеси.
Одноэтапный способ применения по сравнению с многоэтапным способом применения
Обычно минимальный набор реакционных компонентов для ферментативного получения перкислотного полезного средства будет включать (1) по меньшей мере один фермент, обладающий пергидролитической активностью, как описано в данном документе, такой как пергидролаза CE-7 (необязательно в форме нацеленного гибридного белка), (2) по меньшей мере один подходящий субстрат на основе сложного эфира карбоновой кислоты и (3) источник кислорода пероксигруппы.
Образующие перкислоту реакционные компоненты композиции личной гигиены можно хранить раздельно до применения. В одном варианте осуществления образующие перкислоту компоненты объединяют и затем приводят в контакт с целевой поверхностью организма, в результате чего полезное средство на основе перкислоты оказывает полезный эффект на поверхность организма. Компоненты можно объединять и затем приводить в контакт с целевой поверхностью организма или можно объединять на целевой поверхности организма. В одном варианте осуществления образующие перкислоту компоненты объединяют так, чтобы получить перкислоту in situ.
Также можно использовать многоэтапное применение. Один или два отдельных компонента композиции образующей перкислоту системы (т.е. последовательного применения на поверхности организма по меньшей мере одного из трех основных реакционных компонентов) можно привести в контакт с поверхностью полости рта до применения оставшихся компонентов, необходимых для ферментативного получения перкислоты. В одном варианте осуществления пергидролитический фермент приводят в контакт с поверхностью полости рта до приведения в контакт поверхности полости рта с субстратом на основе сложного эфира карбоновой кислоты и/или источником кислорода пероксигруппы (т.е. "двухэтапное применение"). В одном варианте осуществления фермент, обладающий пергидролитической активностью, представляет собой нацеленную пергидролазу, которую применяют по отношению к поверхности полости рта до объединения оставшихся компонентов, необходимых для ферментативного получения перкислоты.
В предпочтительном варианте осуществления фермент, обладающий пергидролитической активностью, представляет собой "нацеленную пергидролазу CE-7" (т.е. гибридный белок CE-7), которую применяют по отношению к поверхности полости рта до объединения с оставшимися компонентами, необходимыми для ферментативного получения перкислоты (т.е. двухэтапный способ применения). Нацеленную пергидролазу приводят в контакт с поверхностью полости рта при подходящих условиях, способствующих нековалентному связыванию гибридного белка с поверхностью полости рта. Для удаления избытка и/или несвязавшегося гибридного белка можно задействовать необязательный этап ополаскивания перед объединением оставшихся реакционных компонентов.
В дополнительном варианте осуществления пергидролитический фермент (необязательно в форме гибридного белка, нацеленного на поверхность полости рта) и сложный эфир карбоновой кислоты применяют по отношению к целевой поверхности полости рта перед добавлением источника кислорода пероксигруппы.
В дополнительном варианте осуществления пергидролитический фермент (необязательно в форме гибридного белка, нацеленного на поверхность полости рта) и источник кислорода пероксигруппы (например, водный раствор, содержащий пероксид водорода) применяют по отношению к поверхности полости рта перед добавлением субстрата на основе сложного эфира карбоновой кислоты.
В дополнительном варианте осуществления субстрат на основе сложного эфира карбоновой кислоты и источник кислорода пероксигруппы (например, водный раствор, содержащий пероксид водорода) применяют по отношению к поверхности полости рта перед добавлением пергидролитического фермента (необязательно в форме гибридного белка, нацеленного на поверхность полости рта).
В еще другом варианте осуществления любые композиции или способы, описанные в данном документе, могут быть включены в набор для осуществления настоящего изобретения. Наборы могут содержать материалы и реагенты для обеспечения ферментативного получения перкислоты. Типичный набор содержит субстрат, источник кислорода пероксигруппы и ферментный катализатор, обладающий пергидролитической активностью, где ферментный катализатор необязательно может быть нацеленным на поверхность полости рта. Другие компоненты набора могут включать, без ограничения, один или несколько из следующих компонентов: пробирки для образцов, твердые подложки, инструктивный материал и другие растворы или другие химические реагенты, пригодные для ферментативного получения перкислот, как, например, приемлемые компоненты или носители.
Композиции для ухода за полостью рта
Приемлемые для рта компоненты/носители
Настоящие композиции и способы также могут включать приемлемые для рта носители, а также дополнительные (т.е. в дополнение к полезному средству на основе перкислоты) полезные средства для полости рта. Применяемый в данном документе термин "полезное средство для полости рта" является общим термином, применяемым по отношению к соединению или веществу, которое обеспечивает необходимый/полезный эффект или свойство по отношению к поверхности рта. В одном варианте осуществления полезные средства для поверхностей полости рта могут включать (в дополнение к полезному средству на основе перкислоты) красящие вещества, включая, но без ограничений, белые пигменты, как, например, диоксид титана и белые минералы, такие как гидроксиапатит или циркон. В другом варианте осуществления полезные средства для полости рта могут также включать отбеливающие средства и дополнительные ферменты, такие как, например, оксидазы, пероксидазы, протеазы, липазы, гликозидазы, эстеразы и полисахаридные гидролазы. В другом аспекте полезные средства могут включать средства против образования зубного налета, средства для выведения пятен с зубов и противомикробные средства. Противомикробные средства могут включать, но без ограничений, противомикробные пептиды, магаинины, цекропины, микробиоциды, триклозан, хлоргексидин, цетилпиридиния хлорид, соединения четвертичного аммония, хлорксиленол, хлороксиэтанол, фталиевая кислота и ее соли, тимол и их комбинации. Полезные средства для полости рта могут также включать противокариозные средства, как, например, фтористый натрий или монофторфосфат натрия, и ароматизирующие вещества, как, например, масло грушанки, мяты перечной или мяты курчавой, или метилсалицилат, эвкалиптол или ванилин. Полезные средства для полости рта могут также включать хладогены, как, например, сукцинатные хладогенные соединения и средства, вызывающие слюноотделение, помимо прочего. Применяемый в данном документе термин "средства, вызывающие слюноотделение" относится к материалу, который способствует более сильному слюноотделению у потребителя, при наличии в композиции для ухода за полостью рта. В одном варианте осуществления полезное средство является приемлемым для полости рта материалом, пригодным для применения в продуктах для ухода за полостью рта. В другом варианте осуществления приемлемое для полости рта полезное средство применяют для косметического улучшения внешнего вида зубов.
Неограничивающим перечнем соединений, часто применяемых в приемлемой для рта среде-носителе, описаны White et al., в патенте США № 6740311; Lawler et al., в патенте США № 6706256; Fuglsang et al., в патенте США № 6264925; и Ibrahim et al. в публикации заявки на патент США № 2005-0069501, каждая из которых включена в данный документ в качестве ссылки в полном их объеме. Например, композиция для ухода за полостью рта может содержать один или несколько из следующего: абразивные вещества, поверхностно-активные вещества, антиоксиданты, хелатообразующие средства, источники фторидов, загустители, буферизирующие средства, растворители, смачивающие средства, носители, объемообразующие средства, противоналетные средства, противоокрашивающие средства, противомикробные средства, противокариозные средства, противовоспалительные средства, десенсибилизаторы, подсластители, ароматизирующие вещества, освежающие дыхание средства, хладогены, питательные вещества и средства, вызывающие слюноотделение.
Понятно, что компоненты в смеси выбирают таким образом, чтобы композиция для ухода за полостью рта сохраняла способность ферментативного образования необходимого перкислотного полезного средства. Подходящие смеси систем для гигиены полости рта, раскрытые в данном документе, может определить любой специалист в данной области с помощью проведения простого эксперимента. Общая концентрация полезных средств для полости рта с составом для ухода за полостью рта может составлять от приблизительно 0,001% до приблизительно 90% по весу по отношению к общему весу композиции для ухода за полостью рта.
Композиции для ухода за полостью рта могут включать, но без ограничений, зубную пасту, зубной крем, зубной гель или зубной порошок, жидкость для полоскания рта, освежитель дыхания и зубную нить. Дополнительные варианты осуществления включают применение реакционных компонентов в пасте или геле, которые применяют в среде полости при помощи ротовой капы. Один или несколько реакционных компонентов также могут быть изначально нанесены на пластиковую полоску, которую приклеивают к эмали для доставки одного или нескольких реакционных компонентов, образующих перкислотное полезное средство. В случае нанесения пергидролазного гибридного соединения на устройство доставки, такое как полоска, пергидролазное гибридное соединение может быть сконструировано как включающее связывающие элементы со сродством к материалу полоски для того, чтобы способствовать нанесению и удержанию пергидролазы на полоске в ходе применения и удаления устройства после применения.
Перкислотные продукты для ухода за полостью рта для уменьшения количества микробов, связанных с заболеваниями полости рта, или удаления нежелательной биопленки
Перкислотные продукты для ухода за полостью рта можно применять для уменьшения количества бактерий полости рта, связанных с зубным кариесом (как, например, Streptococcus mutans), гингивитом, оральным кандидозом или периодонтитом. Перкислотные продукты для ухода за полостью рта можно применять для уменьшения или удаления биопленки(ок) во рту.
В одном варианте осуществления предложено применение фермента, обладающего пергидролитической активностью, в продукте для ухода за полостью рта для получения эффективной концентрации по меньшей мере одной перкислоты для осветления, отбеливания, обеззараживания, обесцвечивания, дезодорирования или удаления биопленки с поверхности полости рта.
В одном варианте осуществления фермент, обладающий пергидролитической активностью, является нацеленной пергидролазой и может включать липазы, протеазы, эстеразы, ацилтрансферазы, арилэстеразы, эстеразы углеводов и комбинации, при условии, что фермент обладает пергидролитической активностью в отношении одного или нескольких присутствующих субстратов. Примеры могут включать, но без ограничений, пергидролитические протеазы (например, вариант субтилизина, патент США 7510859), пергидролитические эстеразы (например, Pseudomonas fluorescens; патент США № 7384787; SEQ ID NO: 477), пергидролитические арилэстеразы (например, Mycobacterium smegmatis; патент США № 7754460; WO2005/056782; и EP1689859 B1; SEQ ID NO: 460 [вариант S54V] и 478 [дикий тип]).
В другом варианте осуществления предлагается применение эстеразы углеводов СЕ-7, обладающей пергидролитической активностью, в продукте для ухода за полостью рта для получения эффективной концентрации по меньшей мере одной перкислоты, предоставляемой для осветления, отбеливания, обеззараживания, обесцвечивания, дезодорирования или удаления биопленки с поверхности полости рта.
В другом варианте осуществления предлагается применение следующей композиции для образования перкислоты, содержащей:
а) ферментный катализатор, обладающий пергидролитической активностью, при этом указанный ферментный катализатор включает фермент, обладающий сигнатурным мотивом СЕ-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2 с помощью CLUSTALW, причем указанный сигнатурный мотив содержит:
i) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
ii) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2; и
iii) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2; и
b) по меньшей мере один субстрат, выбранный из группы, состоящей из:
1) сложных эфиров со структурой
[X]mR5,
где Х = сложноэфирная группа с формулой R6C(O)O;
R6=C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6=C2-C7;
R5=C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
М является целым числом в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
2) глицеридов со структурой
 ,
,
где R1=C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
3) одного или нескольких сложных эфиров с формулой
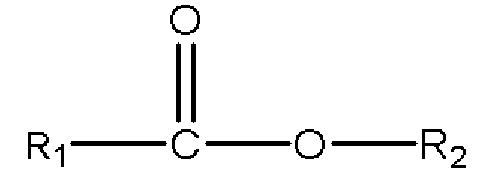 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или разветвленной цепью, (CH2CH2O)n или (CH2CH(CH3)O)nH, и n равен 1-10; и
4) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов; и
с) источник кислорода пероксигруппы;
в результате чего образовывалась перкислота при смешивании (а), (b) и (с); где состав для получения перкислоты применяют для лечения или предупреждения зубного кариеса, гингивита, орального кандидоза или периодонтита.
Способ HPLC-анализа для определения концентрации пероксикарбоновой кислоты и пероксида водорода
Можно применять ряд аналитических способов в настоящих способах для анализа реактивов и продуктов, включая, но без ограничений, титрование, высокоэффективную жидкостную хроматографию (HPLC), газовую хроматографию (GC), масс-спектроскопию (MS), капиллярный электрофорез (CE), аналитический способ, описанный U. Pinkernell et al., (Anal. Chem., 69(17): 3623-3627 (1997)), и анализ с применением 2,2’-азино-бис-(3-этилбензотазолин)-6-сульфоната (ABTS) (U. Pinkernell et. al. Analyst, 122: 567-571 (1997) и Dinu et. al. Adv. Funct. Mater., 20: 392-398 (2010)), которые описаны в настоящих примерах.
Определение минимальной биоцидной концентрации пероксикарбоновых кислот
Определенные применения, связанные с личной гигиеной, могут быть связаны с удалением нежелательных микробов, как, например, тех, которые ассоциированы, помимо прочих, с состоянием организма, микозами и развитием зубного кариеса. В связи с этим может быть необходимо измерить минимальную биоцидную концентрацию для целевого применения, связанного с личной гигиеной. Способ, описанный J. Gabrielson, et al. (J. Microbiol. Methods 50: 63-73 (2002)), можно использовать для определения минимальной биоцидной концентрации (MBC) пероксикарбоновых кислот или пероксида водорода и ферментных субстратов. Способ анализа основан на ингибировании уменьшения XTT, где XTT ((2,3-бис[2-метокси-4-нитро-5-сульфофенил]-5-[(фениламино)карбонил]-2H-тетразолиум, внутренняя соль, однонатриевая соль) является редокс-красителем, который показывает микробную дыхательную активность по изменению оптической плотности (OD), измеренной при 490 нм или 450 нм. Тем не менее, существует ряд других доступных способов для тестирования активности обеззараживающих средств и антисептических средств, включая, но без ограничений, определение количества жизнеспособных бактерий посевом, определение количества микроорганизмов прямым подсчетом под микроскопом, сухой вес, измерения плотности, логарифм коэффициента поглощения и биолюминесценцию (см., например, Brock, Semour S., Disinfection, Sterilization, and Preservation, 5th edition, Lippincott Williams & Wilkins, Philadelphia, PA, USA; 2001).
Рекомбинантная микробная экспрессия
Гены и генные продукты обсуждаемых последовательностей можно получить в гетерологичных клетках-хозяевах, в частности, в клетках микробных хозяев. Предпочтительными гетерологичными клетками-хозяевами для экспрессии обсуждаемых генов и молекул нуклеиновых кислот являются микробные хозяева, которые можно обнаружить среди семейств грибов или бактерий, и которые растут в широком диапазоне температур, значений pH и устойчивости к растворителям. Например, предполагается, что любые бактерии, дрожжи и мицелиальные грибы могут соответственно выступать хозяином для экспрессии настоящих молекул нуклеиновых кислот. Пергидролазу можно экспрессировать внутриклеточно, внеклеточно или одновременно как внутриклеточно, так и внеклеточно, где внеклеточная экспрессия представляет собой более легкое выделение необходимого белка из продукта ферментирования, чем способы выделения белка, продуцируемого в результате внутриклеточной экспрессии. Аппараты транскрипции, трансляции и белкового биосинтеза остаются неизменными в том, что касается клеточного сырья, применяемого для образования клеточной биомассы; функциональные гены будут экспрессироваться независимо. Примеры штаммов-хозяев включают, но без ограничений, такие виды бактерий, грибов и дрожжей, как Aspergillus, Trichoderma, Saccharomyces, Pichia, Phaffia, Kluyveromyces, Candida, Hansenula, Yarrowia, Salmonella, Bacillus, Acinetobacter, Zymomonas, Agrobacterium, Erythrobacter, Chlorobium, Chromatium, Flavobacterium, Cytophaga, Rhodobacter, Rhodococcus, Streptomyces, Brevibacterium, Corynebacteria, Mycobacterium, Deinococcus, Escherichia, Erwinia, Pantoea, Pseudomonas, Sphingomonas, Methylomonas, Methylobacter, Methylococcus, Methylosinus, Methylomicrobium, Methylocystis, Alcaligenes, Synechocystis, Synechococcus, Anabaena, Thiobacillus, Methanobacterium, Klebsiella и Myxococcus. В одном варианте осуществления бактериальные штаммы-хозяева включают Escherichia, Bacillus, Kluyveromyces и Pseudomonas. В предпочтительном варианте осуществления бактериальная клетка-хозяин представляет собой Bacillus subtilis или Escherichia coli.
В массовом росте микробов и экспрессии функциональных генов может быть задействован широкий диапазон простых или сложных углеводов, органических кислот и спиртов или насыщенных углеводородов, как, например, метан или диоксид углерода в случае фотосинтезирующих или хемоавтотрофных хозяев, форма и количество азота, фосфора, серы, кислорода, углерода или любого следового микроэлемента, включая любой неорганический ион. На регуляцию скорости роста можно воздействовать путем добавления, или не добавления, специфических регуляторных молекул в культуру, и их обычно не рассматривают как источники питательных веществ или энергии.
Векторы или кассеты, пригодные для трансформации подходящих клеток-хозяев, хорошо известны в данной области. Обычно вектор или кассета содержит последовательности, управляющие транскрипцией и трансляцией соответствующего гена, селектируемый маркер и последовательности, обеспечивающие автономную репликацию или интеграцию в хромосому. Подходящие векторы содержат участок 5' гена, который несет элементы, управляющие инициацией транскрипции, и участок 3' фрагмента ДНК, который управляет окончанием транскрипции. Наиболее предпочтительно, когда оба управляющих участка получены из генов, гомологичных по отношению к трансформированной клетке-хозяину, и/или нативных по отношению к организму-источнику, хотя такие управляющие участки не обязательно должны быть получены таким образом.
Управляющие инициацией участки или промоторы, которые подходят для управления экспрессией кодирующего участка настоящей деацетилазы цефалоспорина C в необходимой клетке-хозяине, разнообразны и хорошо знакомы специалистам в данной области. Фактически, любой промотор, способный управлять данными генами, является подходящим для настоящего изобретения, включая, но без ограничений, промоторы CYC1, HIS3, GAL1, GAL10, ADH1, PGK, PHO5, GAPDH, ADC1, TRP1, URA3, LEU2, ENO, TPI (пригодные для экспрессии в Saccharomyces); AOX1 (подходящий для экспрессии в Pichia); и lac, araB, tet, trp, lPL, lPR, T7, tac и trc (пригодные для экспрессии в Escherichia coli), а также amy, apr, npr и различные фаговые промоторы, подходящие для экспрессии в Bacillus.
Терминирующие управляющие участки также можно получить из различных генов, нативных в отношении предпочтительной клетки-хозяина. В одном варианте осуществления включение терминирующего управляющего участка является необязательным. В другом варианте осуществления гибридный ген включает терминирующий управляющий участок, полученный из предпочтительной клетки-хозяина.
Промышленное получение
Для получения пергидролазного катализатора можно применять ряд методик культивирования. Например, крупномасштабное получение конкретного генного продукта, сверхэкспрессируемого у рекомбинантного микробного хозяина, можно производить периодическими, полупериодическими и непрерывными методиками культивирования. Периодические и полупериодические способы культивирования являются традиционными и хорошо известными в данной области, и примеры можно найти в Thomas D. Brock в Biotechnology: A Textbook of Industrial Microbiology, Second Edition, Sinauer Associates, Inc., Sunderland, MA (1989) и Deshpande, Mukund V., Appl. Biochem. Biotechnol., 36: 227-234 (1992).
Промышленное получение необходимого пергидролазного катализатора можно также выполнить при помощи непрерывной культуры. Непрерывные культуры представляют собой открытую систему, в которой определенную культуральную среду непрерывно добавляют в биореактор и равное количество кондиционированной среды одновременно удаляют на переработку. Непрерывные культуры обычно поддерживают клетки при постоянной высокой плотности в жидкой фазе, при которой клетки преимущественно находятся в экспоненциальной фазе роста. В качестве альтернативы, непрерывную культуру на практике можно получить при помощи иммобилизированных клеток, где непрерывно добавляют углерод и питательные вещества, а ценные продукты, побочные продукты или продукты жизнедеятельности непрерывно удаляют из клеточной массы. Иммобилизацию клеток можно выполнить с помощью широкого диапазона твердых подложек, состоящих из натуральных или синтетических материалов.
Выделение необходимых пергидролазных катализаторов из периодической ферментационной, полупериодической ферментационной или непрерывной культуры можно выполнить при помощи любого из известных специалистам в данной области способов. Например, при внутриклеточном получении ферментного катализатора, клеточную массу отделяют от культуральной среды центрифугированием или мембранной фильтрацией, необязательно промывают водой или водным буфером с необходимым pH, затем суспензию клеточной массы в водном буфере с необходимым pH гомогенизируют с получением клеточного экстракта, содержащего необходимый ферментный катализатор. Клеточный экстракт можно необязательно профильтровать через подходящий вспомогательный фильтрующий материал, как, например, целит или диоксид кремния, для удаления клеточного дебриса до этапа тепловой обработки для осаждения нежелательного белка из раствора ферментного катализатора. Раствор, содержащий необходимый ферментный катализатор, можно затем отделить от осажденного клеточного дебриса и белка путем мембранной фильтрации или центрифугирования, и полученный в результате частично очищенный раствор ферментного катализатора сконцентрировать при помощи дополнительной мембранной фильтрации, затем, необязательно, смешать с соответствующим носителем (например, мальтодекстрином, фосфатным буфером, цитратным буфером или их смесями) и высушить распылением с получением твердого порошка, содержащего необходимый ферментный катализатор.
Если количество, концентрация или другое значение или параметр задан в виде либо диапазона, либо предпочтительного диапазона, либо перечня наиболее предпочтительных значений и менее предпочтительных значений, это следует понимать, в частности, как раскрытие всех диапазонов, образуемых из любой пары любого верхнего предела диапазона или предпочтительного значения и любого нижнего предела диапазона или предпочтительного значения, независимо от того, раскрыты ли диапазоны отдельно. Там, где изложен диапазон числовых значений в данном документе, если не указано иное, диапазон подразумевают с включением его крайних точек и всех целых чисел и дробных значений в рамках диапазона. Не подразумевается, что объем будет ограничен до конкретных значений, упомянутых при определении диапазона.
ОБЩИЕ СПОСОБЫ
Следующие примеры приведены для демонстрации предпочтительных аспектов настоящего изобретения. Специалисты в данной области должны понимать, что методики, раскрытые в примерах, происходят от методик, хорошо работающих при практическом осуществлении настоящего изобретения, и, следовательно, их можно рассматривать как устанавливающие предпочтительные способы его практической реализации. Тем не менее, специалисты в данной области должны, в свете настоящего раскрытия, понимать, что можно внести множество изменений в конкретные варианты осуществления, которые раскрыты, и все еще получить подобный или сходный результат, не отклоняясь от замысла и объема, раскрываемых в данный момент способов и примеров.
Все реагенты и материалы были получены от DIFCO Laboratories (Детройт, Мичиган), GIBCO/BRL (Гейтерсберг, Мэриленд), TCI America (Портленд, Орегон), Roche Diagnostics Corporation (Индианаполис, Индиана), Thermo Scientific (Pierce Protein Research Products) (Рокфорд, Иллинойс) или Sigma/Aldrich Chemical Company (Сент-Луис, Миссури), если не указано иное.
Следующие аббревиатуры в описании соответствуют единицам измерения, методикам, свойствам или соединениям, как указано далее: “сек” или “с” означает секунда(ы), “мин” означает минута(ы), “ч.” или “час” означает час(ы), “мкл” означает микролитр(ы), “мл” означает миллилитр(ы), “л” означает литр(ы), “мМ” означает миллимоль, “M” означает моль, “ммоль” означает миллимоль, “ч./млн” означает частей на миллион, “вес” означает вес, “вес.%” означает весовой процент, “г” означает грамм, “мг” означает миллиграмм, “мкг” означает микрограмм, “нг” означает нанограмм, “g” означает силу притяжения, “HPLC” означает высокоэффективную жидкостную хроматографию, “dd H2O” означает дистиллированную или деионизированную воду, “dcw” означает сухой вес клеток, “ATCC” или “ATCC®" означает Американскую коллекцию типовых культур (Манассас, Ванкувер), “ед.” означает единицу(ы) пергидролазной активности, “rpm” означает оборотов в минуту, “Tg” означает температуру стеклования, и “EDTA” означает этилендиаминтетрауксусную кислоту.
Вектор экспрессии pLD001
Плазмида pLD001 (SEQ ID NO: 397) ранее упоминалась как подходящий вектор экспрессии для E. coli (см. публикацию заявки на патент США №2010-0158823 A1 Wang et al.; включенную в данный документ в качестве ссылки).
Вектор pLD001 был получен из коммерчески доступного вектора pDEST17 (Invitrogen, Карлсбад, Калифорния). Он включает последовательности, полученные из коммерчески доступного вектора pET31b (Novagen, Мэдисон, Висконсин), который кодирует фрагмент ферментативной кетостероидной изомеразы (KSI). Фрагмент KSI был включен как гибридный компонент для того, чтобы способствовать разделению пептидов на нерастворимые тельца включения в E. coli. Последовательность, кодирующую KSI, из pET31b модифицировали с помощью стандартных методик мутагенеза (QuickChange II, Stratagene, Ла-Хойя, Калифорния) со встраиванием трех дополнительных кодонов Cys, в дополнение к одному кодону Cys, который встречается в последовательности KSI дикого типа. Кроме того, все кодоны Asp в кодирующей последовательности были заменены на кодоны Glu. Плазмиду pLD001, приведенную в SEQ ID NO: 397, построили с помощью стандартных способов с применением рекомбинантной ДНК, которые хорошо известны специалистам в данной области.
ПРИМЕР 1
ЭФФЕКТИВНОСТЬ ПЕРУКСУСНОЙ КИСЛОТЫ В КАЧЕСТВЕ ОТБЕЛИВАЮЩЕГО СРЕДСТВА ДЛЯ ЗУБОВ
В этом примере описано применение перуксусной кислоты для достижения отбеливающего эффекта на модели с окрашенными поверхностями эмали. Покрытые эмалью резцы крупного рогатого скота получили от SE Dental (Батон-Руж, Луизиана). Зубы разделяли на части и разрезали на бруски эмали приблизительно 7 мм на каждой стороне с помощью дисковой пилы DREMEL® (Robert Bosch Power Tool Corporation; Чикаго, Иллинойс) с диском с алмазной режущей кромкой. Бруски эмали очищали и слегка покрывали лаком для удаления стружки с поверхности. Эмаль предварительно обрабатывали смесью кофе и чая в течение 1-5 дней для того, чтобы окрасить до цвета, сходного с окрашенными зубами человека.
Каждый блок эмали перед использованием гидратировали в воде в течение по меньшей мере 1 часа. Замеры цвета для субстрата получали до погружения в тестовые растворы. Растворы перуксусной кислоты готовили из 32% исходного раствора в 500 мМ натрий-фосфатном буфере, pH 7,2. Раствор 2,5% H2O2 также готовили в таком же буфере. Множество блоков эмали подвергали воздействию каждого раствора в течение 1 мин, с последующими дополнительными погружениями на 5 мин, 10 мин, 15 мин и 30 мин. Для каждой обработки готовили свежий раствор перуксусной кислоты и пероксида водорода из исходных растворов. После каждой обработки блоки эмали прополаскивали водой и измеряли при помощи спектрофотометра Konica-Minolta 2600d. Показатель белизны определяли для каждого образца, перечисленного в Таблицах 1 и 2.
Показатель белизны (WI) определен Международной светотехнической комиссией (CIE) и описан в ASTM способе E313-05, и его рассчитывают для падающего луча D65/10, как:
WI=Y+800*(0,3138-x)+1700*(0,3310-y),
где Y, x и y, соответственно, являются коэффициентом яркости и координатами цветности для субстрата из эмали.
Сравнение отбеливания перуксусной кислотой с пероксидом водорода на окрашенной эмали крупного рогатого скота
Сравнение отбеливания перуксусной кислотой с пероксидом водорода на окрашенной эмали крупного рогатого скота при различных концентрациях
Изменение показателя отбеливания на более положительное значение указывало на отбеливающий эффект. Визуальная проверка образцов также показала заметный отбеливающий эффект для образцов, обработанных перуксусной кислотой, по сравнению с контролями с буфером и пероксидом водорода. Эти данные демонстрируют, что перуксусная кислота является эффективным отбеливающим средством и обеспечивает превосходные характеристики по сравнению с пероксидом водорода при более низких концентрациях.
ПРИМЕР 2
ВЫБОР ПЕПТИДОВ, СВЯЗЫВАЮЩИХСЯ С ЗУБНОЙ ЭМАЛЬЮ И НАЛЕТОМ, С ПРИМЕНЕНИЕМ СТАНДАРТНОГО БИОПЭННИНГА
Целю этого примера было определение фаговых пептидов, которые связываются с зубной эмалью и пленкой, с применением стандартного биопэннинга на основе фагового дисплея.
Покрытые эмалью резцы крупного рогатого скота получили от SE Dental (Батон-Руж, Луизиана). Зубы разрезали на приблизительно 5-мм квадраты и покрывали лаком для удаления стружки с поверхности. Блоки эмали стерилизовали перед использованием. Блоки эмали погружали в луночный планшет, содержавший формовочный материал, так, чтобы воздействию подвергалась только поверхность эмали в ячейке. Налет формировали на дополнительных блоках эмали путем закрепления блоков на восковом закреплении для инкубирования во рту в течение 30 мин с получением поверхности, покрытой налетом. Субстраты из эмали, покрытые налетом, чистили щеткой с 1:2 суспензией зубной пасты COLGATE® MAXFRESH® (Colgate-Palmolive, Нью-Йорк, Нью-Йорк) и повторно инкубировали в течение дополнительных 30 мин. Часть блоков удаляли из воска и погружали в луночный планшет, в то время как другие повторно чистили щеткой перед погружением в луночный планшет. Способ погружения предусматривал контакт раствора только с эмальной и покрытой налетом эмальной поверхностью.
Субстраты затем инкубировали в блокирующем буфере в течение 1 часа при комнатной температуре (~22°C; 1 мг/мл альбумина бычьей сыворотки в фосфатно-солевом буферном растворе с pH 7,2 (Pierce BUPH™ № 28372) с 0,1% TWEEN®20 (PBST), за которым последовали 2 промывки посредством PBST. В каждую лунку добавляли библиотеки фагов, содержащие случайные пептидные вставки (1011 КОЕ) в длину от 15 до 20 аминокислот. Конечный связывающий раствор содержал 1011 КОЕ фагов, 10% обработанной УФ цельной слюны и 1 мг/мл BSA в 0,1% TWEEN®20 (PBST). Через 30 минут инкубирования при 37°C при встряхивании при 50 rpm несвязавшиеся фаги удаляли аспирацией жидкости из каждой лунки, за которой последовало 6 промываний посредством 1,0 мл PBST.
Блоки эмали затем переносили в чистую пробирку и 1 мл элюирующего буфера, состоящего из 1 мг/мл BSA в 0,2 M глицин-HCl, pH 2,2, добавляли в каждую лунку и инкубировали в течение 10 мин для элюирования связавшихся фагов. Затем в каждую лунку добавляли 167 мкл нейтрализующего буфера, состоящего из 1М Tris-HCl, pH 9,1. Фаговые частицы, которые были в элюирующем буфере, а также на блоках эмали, амплифицировали инкубированием с 20 мл разведенных клеток E. coli ER2738, из полученной в течение ночи культуры, разбавленной 1:100 в среде LB, при 37°C в течение 4,5 ч. По прошествии этого времени, клеточную культуру центрифугировали в течение 2 мин, и верхние 15 мл надосадочной жидкости переносили в неиспользованную пробирку, добавляли 2,5 мл PEG/NaCl (20% полиэтиленгликоль-800, 2,5 M хлорида натрия), и фагам позволяли осесть в течение ночи при 4°C. Осадок собирали при помощи центрифугирования при 10000g при 4°C и полученный в результате осадок ресуспендировали в 1 мл PBS. Это был первый цикл у амплифицированного исходного раствора. Амплифицированный исходный раствор фагов первого цикла затем титровали в соответствии со стандартным протоколом. Для последующих циклов биопэннинга применяли более 2×1011 КОЕ исходного раствора фагов из предыдущего цикла. Каждый дополнительный цикл после первого также включал дополнительное промывание цельной слюной человека (обработанной УФ в течение 2 часов при комнатной температуре), два промывания углеродным буфером pH 9,4 (Pierce BUPH™ карбонатно-бикарбонатный буфер № 28382), 2 промывания 50 мМ фосфатного буфера pH 2,5 и с последующими 2 промываниями при помощи нормального PBST.
После 3-го цикла биопэннинга и каждый последующий цикл выделяли 95 взятых случайным образом отдельных фаговых бляшек и получали одноцепочечную фаговую геномную ДНК с помощью набора для амплификации Illustra Templiphi 500 Amplification Kit (GE Healthcare, Пискатавэй, Нью-Джерси) и секвенировали на оборудовании для секвенирования DuPont Sequencing Facility, применяя -96 gIII праймер для секвенирования (5’-CCCTCATAGTTAGCGTAACG-3’; SEQ ID NO: 398). Обнаруженный пептид локализировали сразу после сигнального пептида гена III. Исходя из пептидных последовательностей определяли 12 фагов-кандидатов для последующего анализа связывания, которые показаны в Таблице 3.
Последовательности пептидов, связывающихся с зубной эмалью и связывающихся с налетом
ПРИМЕР 3
ХАРАКТЕРИСТИКА СВЯЗЫВАЮЩИХСЯ С ЗУБОМ КАНДИДАТОВ НА ЭМАЛИ
Цель этого примера заключается в подтверждении связывания композиций пептидов на поверхности эмали с помощью синтетически полученных пептидов.
Изготовили всего 11 синтетических пептидов с помощью последовательностей, взятых из Таблицы 3. Пептиды получили от SynBioSci Corp. (Ливермор, Калифорния) с помеченным биотином лизином на С-конце.
Субстраты из эмали готовили так, как описывалось в Примере 2. Каждый субстрат инкубировали в течение 1 ч при комнатной температуре (~22°C) с 1 мл блокирующего буфера, состоящего из 1 мг/мл BSA в PBST (Pierce BUPH™ № 28372 с 0,1% TWEEN® 20). Блокирующий буфер удаляли аспирацией жидкости из каждой лунки. Пробирку 2 раза ополаскивали промывочным буфером, состоящим из PBST. Лунки заполняли 500 мкл 20 мкМ раствора пептида, который получили путем разбавления в блокирующем буфере. Образцы инкубировали в течение 30 мин с медленным покачиванием при 37°C. Несвязывающиеся пептиды удаляли 6-кратным промыванием PBST. Затем добавляли 500 мкл конъюгата пероксидаза хрена/стрептавидин (Pierce №22127), разбавленного 1:1000 в PBST, и инкубировали в течение 1 ч при комнатной температуре (~22°C). Удаляли раствор конъюгата и блоки эмали 4 раза промывали посредством PBST.
Каждый субстрат из эмали удаляли из лунки и снова промывали в 15 мл тестовой пробирке посредством 10 мл PBST. Каждый субстрат из эмали затем погружали в чистый луночный планшет, при этом открытой осталась только поверхность эмали. 200 мкл раствора для субстрата QUANTABLU™ (Thermo-Fisher, Рокфорд, Иллинойс; № 1856187) добавляли непосредственно в каждый блок эмали. Раствор инкубировали в течение 20 мин при комнатной температуре. Добавляли 200 мкл стоп-раствора QUANTABLU™ (Thermo Fisher). После смешивания 200 мкл раствора переносили в чистый темный 96-луночный микропланшет для центрифугирования. Флуоресценцию планшета измеряли при 325 нм возбуждении и 420 нм излучении без пороговой длины волны с помощью микропланшетного спектрофотометра (Molecular Devices, Саннивэйл, Калифорния). Полученные в результате показатели флуоресценции приведены в Таблице 4. Анализ 11 кандидатов, связывающихся с налетом/эмалью, сравнивали с известным связывающимся пептидом DenP03. Каждую последовательность тестировали с субстратами из эмали в трех повторностях.
Результаты ИФА синтетического пептида на эмали крупного рогатого скота для связывающихся кандидатов, полученных в результате биопэннинга
ПРИМЕР 4
КОНСТРУКЦИЯ ПЕРГИДРОЛАЗЫ И ПЕРГИДРОЛАЗНЫХ ГИБРИДОВ
Этот пример описывает конструирование системы экспрессии для получения пергидролаз, нацеленных на эмаль с помощью последовательностей, связывающихся с эмалью.
Гены, кодирующие гибриды фермента, обладающего пергидролитической активностью ("пергидролаза"), с доменами, связывающимися с эмалью, конструировали с полинуклеотидной последовательностью различных ферментов, перечисленных в Таблице 5, слитых на 3'-конце с нуклеотидной последовательностью, кодирующей различные аминокислотные гибкие линкеры; каждый линкер дополнительно слит с доменом, связывающимся с эмалью, или несвязывающимися последовательностями-контролями, которые описаны в Таблице 6. Гены подвергали кодон-оптимизации для экспрессии в E. coli и синтезировали при помощи DNA2.0 (Менло Парк, Калифорния). Кодирующие последовательности клонировали в плазмидах после промотора T7 (вектор экспрессии pLD001 (SEQ ID NO: 397)) или промотора pBAD, между участками рестрикции NdeI и AscI, с получением плазмид. Для экспрессии гибридного белка плазмиды переносили в соответствующего хозяина экспрессии: штамм BL21AI E. coli (Invitrogen, Карлсбад, Калифорния) для конструктов под управлением промотора T7 или в AraBAD производном MG1655 E. coli для конструктов под управлением промотора pBAD.
Ненацеленные варианты пергидролазы, перечисленные в Таблице 5, клонировали аналогичным способом. Получение и рекомбинантная экспрессия вариантов Thermotoga maritima была ранее описана DiCosimo et al. в публикации заявки на патент США № 2010-0087529; включенной в данный документ в качестве ссылки.
Дополнительные гидролазы CE-7 из Lactococcus lactis (ацетилксиланэстераза; SEQ ID NO: 40), Mesorhizobium loti (ацетилксиланэстераза; SEQ ID NO: 42) и Bacillus pumilus (ацетилксиланэстераза; SEQ ID NO: 10) клонировали аналогичным образом. Клонирование и экспрессия пергидролаз CE-7 из Lactococcus lactis, Mesorhizobium loti и Bacillus pumilus ранее были описаны DiCosimo et al. в публикации заявки на патент США № 2011-0081693 и патенте США № 7951566; каждый из которых включен в данный документ в качестве ссылки.
Пергидролитические ферменты, не принадлежащие к семейству пергидролаз CE-7, также клонировали аналогичным образом. Арилэстераза Mycobacterium smegmatis (“ArE”; последовательность дикого типа представляет собой SEQ ID NO: 478; вариант S54V приведен как SEQ ID NO: 460), обладающая пергидролитической активностью, описана в патенте США № 7754460. Вариант L29P эстеразы Pseudomonas fluorescens (“Pfl”; SEQ ID NO: 477), обладающий пергидролитической активностью, описан в патенте США № 7384787.
Описание и последовательности для пергидролазных конструктов
(SEQ ID NO:)
(SEQ ID NO: 10)
(SEQ ID NO: 40)
Пергидролазные конструкты с нацеливающими последовательностями, полученными для применения в гигиене полости рта
(SEQ ID NO:)
гибридного белка
(SEQ ID NO:)
(SEQ ID NO: 424)
(SEQ ID NO: 425)
(SEQ ID NO:431)
(SEQ ID NO: 426)
(SEQ ID NO:432)
(SEQ ID NO: 427)
(SEQ ID NO:433)
(SEQ ID NO: 428)
(SEQ ID NO:434)
(SEQ ID NO: 429)
(SEQ ID NO:435)
(SEQ ID NO: 430)
(SEQ ID NO:436)
(SEQ ID NO: 437)
(SEQ ID NO: 438)
(SEQ ID NO:435)
(SEQ ID NO: 439)
(SEQ ID NO:436)
(SEQ ID NO: 440)
(SEQ ID NO:431)
(SEQ ID NO:441)
(SEQ ID NO:432)
(SEQ ID NO:442)
(SEQ ID NO:434)
(SEQ ID NO: 443)
(SEQ ID NO: 468)
(SEQ ID NO: 444)
(SEQ ID NO: 469)
(SEQ ID NO:445)
(SEQ ID NO: 470)
(SEQ ID NO: 446)
(SEQ ID NO: 471)
(SEQ ID NO: 447)
(SEQ ID NO: 472)
(SEQ ID NO: 448)
(SEQ ID NO: 473)
(SEQ ID NO: 449)
(SEQ ID NO: 474)
(SEQ ID NO: 450)
(SEQ ID NO: 475)
(SEQ ID NO: 451)
(SEQ ID NO:436)
(SEQ ID NO: 452)
(SEQ ID NO:431)
(SEQ ID NO: 453)
(SEQ ID NO:435)
(SEQ ID NO: 454)
(SEQ ID NO:436)
(SEQ ID NO: 455)
(SEQ ID NO:431)
(SEQ ID NO: 456)
(SEQ ID NO:435)
(SEQ ID NO: 457)
(SEQ ID NO:436)
(SEQ ID NO: 458)
(SEQ ID NO:431)
(SEQ ID NO: 459)
(SEQ ID NO:435)
(SEQ ID NO: 460)
(SEQ ID NO: 461)
(SEQ ID NO:436)
(SEQ ID NO: 462)
(SEQ ID NO:431)
(SEQ ID NO: 463)
(SEQ ID NO:434)
(SEQ ID NO: 464)
(SEQ ID NO:435)
(SEQ ID NO: 465)
(SEQ ID NO:431)
(SEQ ID NO: 466)
(SEQ ID NO:434)
(SEQ ID NO: 467)
(SEQ ID NO:435)
(SEQ ID NO: 479)
(SEQ ID NO:431)
ПРИМЕР 5
ПОЛУЧЕНИЕ ГИБРИДНЫХ БЕЛКОВ
Этот пример описывает экспрессию и очистку пергидролаз при наличии и отсутствии нацеливающих последовательностей для связывания с поверхностью полости рта.
Штаммы выращивали в 1 л самоиндуцирующей среды (10 г/л триптона, 5 г/л дрожжевого экстракта, 5 г/л NaCl, 50 мМ Na2HPO4, 50 мМ KH2PO4, 25 мМ (NH4)2SO4, 3 мМ MgSO4, 0,75% глицерина, 0,075% глюкозы и 0,05% арабинозы), содержащей 50 мг/л спектиномицина при 37°C в течение 20 часов при покачивании 200 rpm. Получение ненацеленной пергидролазы ранее было описано в публикации заявки на патент США № 2010-0087529 DiCosimo et al. Получение нацеленных пергидролаз проводили в соответствии с аналогичным протоколом. Клетки собирали центрифугированием при 8000 rpm и промывали ресуспендированием клеточного осадка в 20 мл 50 мМ калий-фосфатного буфера, pH 7,1, содержащего 1 мМ DTT. Раствор снова центрифугировали при 8000 rpm, удаляли надосадочную жидкость, и осадок повторно диспергировали в фосфатном буфере, содержащем DTT. Раствор затем гомогенизировали в течение 30 секунд для диспергирования осадка (гомогенизатор Brinkman модели PCU11). Клетки затем лизировали путем пропускания раствора через French Press (SLM Instruments) с давлением 13000 psi (~89,6 МПа). Раствор пропускали через пресс дополнительно два раза для достижения полного лизиса. Клеточный раствор затем переносили в коническую пробирку и центрифугировали при 8500 rpm в течение 5 мин. Для конструктов T. maritima удаляли надосадочную жидкость и нагревали при 80°C в течение 30 мин. Раствор снова центрифугировали и надосадочную жидкость переносили в чистый сосуд.
Для нетермофильных ферментов не применяли тепловую обработку для очистки ферментов от засоряющих клеточных компонентов. Вместо этого образцы очищали с применением His6-метки, слитой с C-концом ферментов, с помощью металло-комплесообразовательной хроматографии с применением агарозы Co-NTA (HisPur Cobalt Resin, Thermo Scientific, номер продукта: 89965). Как правило, клеточные экстракты загружали на 5-10-мл колонку агарозы Co-NTA, уравновешенную 4 объемами равновесного буфера (10 мМ Tris HCl, pH 7,5, 10% глицерин, 1 мМ имидазол и 150 мМ NaCl). Количество каждого экстракта, закруженного на колонку, корректировали до содержания от 5 до 10 мг пергидролазного гибрида на мл гранул из Co-NTA агарозы. Смолу промывали двумя объемами слоя равновесного буфера и элюировали двумя объемами элюирующего буфера (10 мМ Tris HCl, pH 7,5, 10% глицерин, 150 мМ имидазол, 500 мМ NaCl). Собирали фракции, и наличие очищенных белков полной длины подтверждали при помощи PAGE.
Для получения конструктов EZ-19-EZ-26 после получения клеток, клетки собрали центрифугированием при 8000 rpm и промывали ресуспендированием клеточного осадка в 20 мл 50 мМ калий-фосфатного буфера, pH 7,2. Раствор снова центрифугировали при 8000 rpm, удаляли надосадочную жидкость, и осадок повторно диспергировали в фосфатном буфере. Раствор затем гомогенизировали в течение 30 секунд для диспергирования осадка (гомогенизатор Brinkman модели PCU11). Клетки затем лизировали путем пропускания раствора через French Press (SLM Instruments) с давлением 13000 psi (~89,6 МПа). Раствор пропускали через пресс дополнительно два раза для достижения полного лизиса. Клеточный раствор затем переносили в коническую пробирку и центрифугировали при 8500 rpm в течение 5 мин. Нерастворимые осадки лизата растворяли в саркозильном буфере (50 мМ фосфатного буфера при pH 7,2, 2% TRITON®-X100 и 1,5% саркозил) с 3 мл буфера на 50 мл осадка клеточного лизата. Раствор центрифугировали, и надосадочную жидкость переносили в новую пробирку. Гибридные белки очищали с помощью набора HisPurTM Cobalt Resin от Thermo Scientific (Рокфорд, Иллинойс).
Выход в соответствии с такими инструкциями получения и очистки обычно составляет 2-10 мг белка на мл с чистотой гибридной пергидролазы от 90% до 75% белка по оценке с помощью электрофоретического анализа в полиакриламидном геле (PAGE). Общий белок количественно оценивали с помощью анализа с применением бицинхониновой кислоты (BCA) (Thermo Scientific), применяя раствор альбумина сыворотки крупного рогатого скота в качестве стандарта.
ПРИМЕР 6
СВЯЗЫВАНИЕ НАЦЕЛЕННОГО НА ЭМАЛЬ ПЕРГИДРОЛАЗНОГО ГИБРИДА С ГИДРОКСИАПАТИТОМ
Этот пример описывает связывание пергидролазы с частицами гидроксиапатита. Гидроксиапатит является эффективным имитатором эмали.
Пергидролазные ферменты, перечисленные в Таблице 6, оценивали на связывание с гидроксиапатитом. Дисперсию наночастиц гидроксиапатита (Aldrich 677418) получали на уровне 0,5% твердых частиц в 10 мМ фосфатном буфере при pH 7,2. Исходный раствор фермента добавляли к дисперсии гидроксиапатита до конечной концентрации 10 мкм и инкубировали в течение 30 мин в микропробирке для центрифугирования с легким покачиванием. Каждый образец центрифугировали в течение 5 мин при 10000 rpm. Надосадочную жидкость удаляли и добавляли дополнительный буфер. Частицы ресуспендировали и переносили в новую пробирку. Способ повторяли еще два раза. Образцы первичного ввода фермента, надосадочную жидкость, удаленную с частиц на каждом этапе промывания, и конечные частицы готовили для анализа SDS-PAGE путем объединения 60 мкл образца, 20 мкл буфера LDS и 8 мкл восстанавливающего средства (Nu-PAGE). Образцы нагревали при 85°C в течение 10 мин. 25 мкм каждого образца загружали на 4-12% гель BisTris (Invitrogen) и прогоняли при 115 вольт в течение 1,5 ч. Вынимали гель и красили при помощи разбавленного 1:1 раствора красителя Simply Blue (Invitrogen) в течение ночи и смывали краску в течение 4 ч в деионизированной воде. Гель анализировали, и определение фермента в каждой фракции оценивали по наличию бэнда. Результаты анализа представлены в Таблице 7 с указанием относительной интенсивности каждого бэнда в геле по сравнению с вводом фермента (ввод = 1) для определения прочности связывания между поверхностью гидроксиапатита и каждым ферментом.
Удерживание пергидролазы на гидроксиапатите
Данные в таблице 7 демонстрируют, что пергидролазные гибриды с нацеливающими последовательностями сохранялись на гидроксиапатите после промывок, в то время как ненацеленная пергидролаза не сохранялась.
ПРИМЕР 7
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ ПЕРГИДРОЛАЗНОЙ АКТИВНОСТИ В РАСТВОРЕ И В СВЯЗАННОМ С ГИДРОКСИАПАТИТОМ СОСТОЯНИИ
Этот пример описывает способ определения и количественного определения пергидролазы по ее пергидролазной активности с применением триацетина и пероксида водорода для образования перуксусной кислоты.
Определение перуксусной кислоты проводили в соответствии со способом, описанным у Pinkernell et. al. (Analyst, 1997, 122, 567), с применением колориметрического определения окисления 2,2’-азино-бис(3-этилбензотиазолин)-6-сульфоната (ABTS) перуксусной кислотой. После образования перуксусной кислоты в результате добавления триацетина и пероксида водорода добавляли 90 мкл раствора к 10 мкл 0,1 M H3PO4 в луночном планшете. Добавляли 50 мкл 1 M уксусной кислоты, 50 мкл 0,5 г/л ABTS и 50 мкл 0,002 г/л KI. Раствору позволили развиваться в течение 5 мин. Измеряли абсорбцию раствора при 405 нм с помощью микропланшетного ридера. Концентрацию перуксусной кислоты рассчитывали на основании калибровочной кривой, построенной одновременно с применением раствора реагента перуксусной кислоты.
Ферментативную активность в растворе измеряли путем получения раствора 0,625 мкг/мл каждого фермента в 50 мМ фосфатном буфере, рН 7,2. 10 мкл раствора фермента смешивали с 90 мкл буфера, 30 мкл 3% триацетина в воде, 30 мкл 30 мМ H2O2. Раствор инкубировали в течение 5 мин. Забирали 90-мкл аликвоту для определения по окислению ABTS, как описано выше. Результаты приведены в Таблице 8.
Определение перуксусной кислоты с помощью окисления ABTS для фермента с триацетином и пероксидом водорода в растворе
сопутствующий субстрат
Пергидролазную активность гибридов после связывания с поверхностями дисков HAP определяли при помощи аналогичного способа ABTS. Гидроксиапатитные диски (HiMed Inc, Олд Бетпейдж, Нью Йорк; 5 мм в диаметре × 1,8 мм толщиной) инкубировали в 20 мкМ растворе фермента (50 мМ калий-фосфатный буфер, pH 7,2) в течение 60 мин с последующим 6-кратным промыванием (50 мМ калий-фосфатный буфер, pH 7,2). Диски с абсорбированным ферментом переносили в новые лунки и добавляли 200 мкл фосфатного буфера (10 мМ, pH 7,2), 30 мкл 3% триацетина (конечная концентрация 0,346%) и 30 мкл 30 мМ H2O2 (конечная концентрация 3,46 мМ). Раствору позволяли инкубироваться при комнатной температуре в течение 5 мин. 90 мкл раствора отмеряли пипеткой в новую лунку, содержащую 10 мкл 100 мМ H3PO4. Добавляли 50 мкл уксусной кислоты, 50 мкл KI, 50 мкл ABTS, как описано выше. Раствор развивали в течение 5 мин при комнатной температуре и считывали при А405 нм. Результаты приведены в Таблице 9.
Определение перуксусной кислоты при помощи ABTS с ферментом, связанным с гидроксиапатитом
минус фон
мкм на диск
Этот эксперимент демонстрирует, что EZ-5 и EZ-7 являются активными ферментами при связывании с гидроксиапатитом и производят перуксусную кислоту при добавлении триацетина и пероксида водорода. Низкое значение перуксусной кислоты, определенное при помощи EZ-1, совпадало с другими результатами наблюдения, что EZ-1 не связывается с гидроксиапатитом (Пример 6) и не присутствует на поверхности, образуя перуксусную кислоту.
ПРИМЕР 8
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ ПЕРГИДРОЛАЗНОЙ АКТИВНОСТИ В РАСТВОРЕ И В СВЯЗАННОМ С ГИДРОКСИАПАТИТОМ СОСТОЯНИИ ДЛЯ ДОПОЛНИТЕЛЬНЫХ ПЕРГИДРОЛАЗНЫХ КОНСТРУКТОВ СЕ-7
Этот пример описывает пергидролитические активности пергидролазы CE-7 и соответствующих гибридных белков в растворе и при связывании с гидроксиапатитом из Thermotoga maritima, Bacillus pumilus (Bpu), Mesorhizobium loti (Mlo) и Lactobacillus lactis (Lla) при применении триацетина и пероксида водорода для получения перуксусной кислоты.
Пергидролазные ферменты, перечисленные в Таблице 6, оценивали на связывание по активностям в растворах. Способ измерения активности пергидролазы в растворе был описан в Примере 7 путем получения 500 мкл раствора, содержащего 0,5 мкМ каждого фермента, 100 мМ триацетина и 100 мМ Н2О2 в 100 мМ фосфатного буфера, рН 7,2. Раствор перемешивали и инкубировали в течение 10 мин при 37°C. Забирали 10 мкл аликвоту и разводили для определения, как описано в Примере 7. Концентрацию перуксусной кислоты определяли с помощью калибровочной кривой, построенной при помощи исходного раствора перуксусной кислоты (Aldrich). Эксперимент также осуществляли при отсутствии фермента в качестве контроля.
Перуксусная кислота, полученная в растворе в течение 10 минут реакции с различными CE-7 пергидролазными гибридами
Для оценки связывания этих конструктов с гидроксиапатитом 33 мг частиц гидроксиапатита (керамический гидроксиапатит Macro-prep I ТИПА, размером 80 мкм, BioRad, Геркулес, Калифорния) промывали 10 мМ фосфатным буфером с рН 7,2. После удаления надосадочной жидкости исходный раствор фермента добавляли к дисперсии гидроксиапатита до конечной концентрации 10 мкм и инкубировали в течение 30 мин в микропробирке для центрифугирования с легким покачиванием. Каждый образец центрифугировали в течение 1 мин при 10000 rpm. Надосадочную жидкость удаляли и добавляли дополнительный буфер. Частицы ресуспендировали и переносили в новую пробирку. Способ повторяли еще два раза. Активность связавшегося с гидроксиапатитом фермента измеряли путем добавления 500 мкл раствора, содержащего 100 мМ триацетина и 100 мМ Н2О2 в 100 мМ фосфатном буфере, рН 7,2. Раствор инкубировали в течение 30 мин при 37ºC. Забирали аликвоту, и смешивали с H3PO4, и соответствующим образом разбавляли для определения по окислению ABTS, как описано в Примере 7. Эксперименты проводили в другой день при отсутствии фермента в качестве контроля для каждого эксперимента. Результаты приведены в Таблице 11.
Образование перуксусной кислоты у СЕ-7 пергидролазных гибридов, связанных с гидроксиапатитом
Эксперименты продемонстрировали, что все CE-7 пергидролазные гибриды из Bpu, Mlo и Llo фермента проявляли значительную пергидролазную активность в растворе, а также после связывания с поверхностями гидроксиапатита по сравнению с контролем без фермента. Все три CE-7 пергидролазные гибриды из B. pumilus обладают более высокой ферментативной активностью по сравнению с гибридными ферментами из M. loti или L. lactis. Нацеленная EZ-29 из B. pumilus проявляла более высокую активность связывания по сравнению с ненацеленной EZ-27.
ПРИМЕР 9
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ В РАСТВОРЕ И В СВЯЗАННОМ С ГИДРОКСИАПАТИТОМ ДЛЯ НАЦЕЛЕННЫХ C277S ПЕРГИДРОЛАЗНЫХ ГИБРИД С ПЕПТИДАМИ CXH
Этот пример описывает CE-7 C277S и гибриды с пептидами CXH и их пергидролазные активности с применением триацетина и пероксида водорода для получения перуксусной кислоты в растворе и при связывании с гидроксиапатитом. Гидроксиапатит является эффективным имитатором эмали.
Пергидролазные ферменты EZ-19-EZ-26, перечисленные в Таблице 6, оценивали на ферментативную активность в растворе. Способ измерения активности пергидролазы в растворе был описан в Примере 7. Ферментативную активность в растворе измеряли путем получения 500 мкл раствора в саркозильном буфере 0,5 мкМ каждого фермента в 100 мМ триацетина и 100 мМ Н2О2 и 10 мМ фосфатного буфера, рН 7,2. Раствор инкубировали в течение 10 мин при 37°C. После остановки реакции путем смешивания с Н3РО4 10-мкл аликвоту забирали для соответствующего разведения и затем определяли по окислению ABTS, как описано в Примере 7. Результаты приведены в Таблице 12.
Такие же пергидролазные гибридные ферменты также оценивали на связывание с гидроксиапатитом. Применяли гидратированные в воде гидроксиапатитные диски (5 мм в диаметре × 1,8 мм толщиной, от HiMed Inc). Диски уравновешивали в 10 мМ фосфатном буфере при pH 7,2 в течение 10 мин. 200 мкл раствора фермента добавляли к гидроксиапатитным дискам до конечной концентрации 10 мкМ в 10 мМ фосфатном буфере и инкубировали в течение 30 мин в микропробирке для центрифугирования при легком покачивании. Удаляли надосадочную жидкость и применяли ее для анализов активности несвязавшихся ферментов. Диски переносили в новую пробирку и ополаскивали фосфатным буфером. Способ повторяли еще два раза. Ферментативную активность гидроксиапатитных дисков со связавшимися ферментами измеряли путем добавления 500 мкл раствора, содержащего 100 мМ триацетина, 100 мМ H2O2 и 100 мМ фосфатного буфера, pH 7,2, к диску и инкубирования в течение 30 мин при 37°C. После остановки реакции путем смешивания с Н3РО4 10-мкл аликвоту забирали для соответствующего разведения и затем определяли по окислению ABTS, как описано в Примере 7. Эксперименты проводили в течение нескольких дней при отсутствии раствора фермента, применяемого в качестве контроля каждый день. Результаты после вычитания контроля без фермента приведены в Таблице 12.
Перуксусная кислота, полученная от C277s и пергидролазных гибридных белков CXH в растворе и при связывании с гидроксиапатитными дисками
Эксперименты демонстрировали, что все варианты C277S с CXH нацеливающими последовательностями являются активными и образуют значительные количества перуксусной кислоты в растворе и при связывании с гидроксиапатитом.
ПРИМЕР 10
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ ПЕРГИДРОЛАЗНОЙ АКТИВНОСТИ В РАСТВОРЕ И В СВЯЗАННОМ С ГИДРОКСИАПАТИТОМ СОСТОЯНИИ ДЛЯ КОНСТРУКТОВ, НЕ КОДИРУЮЩИХ ПЕРГИДРОЛАЗУ СЕ-7
Цель данного примера заключается в демонстрации применения нацеленных или ненацеленных вариантов арилэстеразных ферментов из M. smegmatis и вариантов пергидролазы из P. fluorescens, приведенных в Таблице 6, для получения перуксусной кислоты в растворе и при связывании с гидроксиапатитом.
Для арилэстеразных конструктов ферментативную активность в растворе измеряли путем получения 1 мл раствора 0,5 мкМ каждого фермента, 100 мМ триацетина и 100 мМ Н2О2 в 100 мМ фосфатном буфере, рН 7,2. Раствор перемешивали и инкубировали в течение 30 мин при 37°C. Как описано в Примере 7, реакцию останавливали путем удаления части Н3РО4, и забирали 10-мкл аликвоту и разводили для определения по окислению ABTS.
Для оценки связывания и активности на гидроксиапатите арилэстеразные ферменты подвергали воздействию гидроксиапатитных частиц. как описано в Примере 8, с помощью 33 мг промытых в буфере НАР-частиц (Macro-prep керамические гидроксиапатит I типа, 80 мкм размер, BioRad, Геркулес, Калифорния) с применением 10 мкМ раствора в 10 мМ фосфатном буфере. После центрифугирования и удаления раствора фермента частицы промывали фосфатным буфером путем центрифугирования и удаления надосадочной жидкости. 200 мкл раствора, содержащего 100 мМ триацетина, 100 мМ Н2О2 и 100 мМ фосфатного буфера, рН 7,2, добавляли к частицам и инкубировали при 37°C в течение 30 мин. Как описано в Примере 7, реакцию останавливали путем удаления части Н3РО4 и забирали 10-мкл аликвоту, разводили для определения по окислению ABTS. Результаты анализов, как для раствора, так и для связанного с поверхностью состояния, приведены в Таблице 13.
Образование перкислоты в растворе и в связанном с поверхностью состоянии для образцов арилэстеразы M. smegmatis
(SEQ ID NO.)
(SEQ ID NO: 460)
(SEQ ID NO: 461)
(SEQ ID NO: 463)
(SEQ ID NO: 464)
Для конструктов P. fluorescens активность раствора измеряли путем перемешивания 1 мл раствора, содержащего 2 мкМ фермента, 100 мМ Н2О2 в 1 М натрий-ацетатном буфере, рН 5,5. Раствор инкубировали при 37°C в течение 30 мин. Как описано в Примере 7, реакцию останавливали путем удаления части Н3РО4, и забирали 10-мкл аликвоту и разводили для определения по окислению ABTS. Для оценки связывания и активности на гидроксиапатите ферменты P. fluorescens подвергали воздействию гидроксиапатитных частиц в количестве 20 мкМ в 10 мМ фосфатном буфере, как описано в Примере 8, с помощью 100 мг промытых в буфере НАР-частиц (Macro-prep керамический гидроксиапатит I типа, 80 мкм размер, BioRad, Геркулес, Калифорния). После центрифугирования и удаления раствора фермента частицы промывали фосфатным буфером путем центрифугирования и удаления надосадочной жидкости. 200 мкл раствора, содержащего 300 мМ Н2О2 в 1 М натрий-ацетатном буфере, рН 5,5, добавляли к частицам и инкубировали при 37°C в течение 10 мин. Как описано в Примере 7, реакцию останавливали путем удаления части Н3РО4, и забирали 10-мкл аликвоту и разводили для определения по окислению ABTS. Результаты анализов, как для раствора, так и для связанного с поверхностью состояния, приведены в Таблице 14.
Образование перкислоты в растворе и в связанном с поверхностью состоянии для образцов пергидролазы P. fluorescens
(SEQ ID NO.)
(SEQ ID NO: 465)
(SEQ ID NO: 466)
(SEQ ID NO: 467)
(SEQ ID NO: 479)
Данные эксперименты демонстрируют, что пергидролазы из семейств, отличных от семейства СЕ-7, активны в растворе и при связывании с гидроксиапатитом у конструктов, включающих нацеливающую последовательность.
ПРИМЕР 11
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПЕРГИДРОЛИТИЧЕСКОЙ АКТИВНОСТИ НАЦЕЛЕННЫХ НА ЭМАЛЬ ВАРИАНТНЫХ ПЕРГИДРОЛАЗНЫХ ГИБРИДОВ C277S И C277T В РАСТВОРЕ И В СВЯЗАННОМ С ЭМАЛЬЮ КРУПНОГО РОГАТОГО СКОТА СОСТОЯНИИ
Данный пример описывает связывание пергидролазных гибридных белков с эмалью крупного рогатого скота и измерение ферментативной активности в растворе и при связывании с эмалью крупного рогатого скота.
Пергидролазные ферменты, перечисленные в Таблице 5, оценивали на ферментативную активность в растворе, как описано в Примере 7. Ферментативную активность в растворе измеряли путем получения 500 мкл раствора 0,5 мкМ каждого фермента в 100 мМ триацетина и 100 мМ Н2О2 и 10 мМ фосфатном буфере, рН 7,2. Раствор инкубировали в течение 10 мин при 37°C. После остановки реакции путем смешивания аликвоты с Н3РО4 забирали 10-мкл аликвоту для соответствующего разведения и затем определяли по окислению ABTS, как описано в Примере 7. Результаты приведены в Таблице 15.
Пергидролазные ферменты также оценивали на связывание с субстратами из эмали крупного рогатого скота. Субстраты из эмали готовили так, как описывалось в Примере 2 и 3. Каждый блок эмали перед использованием гидратировали в воде в течение ночи при комнатной температуре (~22°C). Блоки эмали затем уравновешивали при помощи 10 мМ калий-фосфатного буфера, рН 7,2, в течение 10 мин. Субстраты из эмали 3 раза промыли буфером. Лунки с эмалью заполнили 500 мкл 10 мкМ растворов фермента, которые получили разбавлением в 10 мМ фосфатном буфере. Образцы инкубировали в течение 30 мин с медленным встряхиванием при 37°C. Несвязывающиеся ферменты удаляли при помощи 4-кратного промывания фосфатным буфером. Затем каждый блок эмали погружали в заполненный гелем 24-луночный планшет, при этом открытой осталась только верхняя поверхность эмали. Пергидролазную активность связанного с эмалью фермента измеряли, как описано в Примере 8. 100 мкл реакционных смесей (100 мМ фосфатного буфера, рН 7,2, и 100 мМ Н2О2 и 100 мМ триацетина) добавляли на верхнюю часть эмали и инкубировали в течение 30 мин при 37°C. Забирали 90-мкл аликвоту для определения по окислению ABTS, как описано в Примере 8. Результаты приведены в Таблице 15. Каждая точка данных образца представляет среднее от 3 независимых блоков эмали.
Перуксусная кислота, образовавшаяся в растворе и при связывании с поверхностью эмали крупного рогатого скота, для конструктов T. maritima
(SEQ ID NO:)
(SEQ ID NO: 424)
(SEQ ID NO: 425)
(SEQ ID NO: 426)
(SED ID NO: 428)
(SEQ ID NO: 429)
(SEQ ID NO: 430)
(SEQ ID NO: 437)
(SEQ ID NO: 440)
(SEQ ID NO: 441)
(SEQ ID NO: 438)
(SEQ ID NO: 442)
(SEQ ID NO: 439)
Данный эксперимент демонстрирует, что гибриды, полученные с помощью вариантов последовательностей C227S и C277T из T. Maritima, активны в растворе и при связывании с эмалью крупного рогатого скота у конструктов, включающих нацеливающую последовательность, и образуют достаточные уровни перуксусной кислоты для отбеливания зубов.
ПРИМЕР 12
ЭФФЕКТИВНОСТЬ ОСВЕТЛЕНИЯ ЗУБОВ ПРИ ПОМОЩИ ПЕРГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ ПРИ ОДНОЭТАПНОМ ПРИМЕНЕНИИ
Цель этого примера заключается в демонстрации осветляющего зубы эффекта у образованной ферментативным способом перуксусной кислоты при одноэтапном применении и в сравнении с результативностью, достигаемой с помощью химически полученной перуксусной кислоты. Были разработаны два способа применения системы пергидролитического фермента (пергидролазы СЕ-7) для достижения целевого уровня осветления зубов. Первый способ (называемый в данном документе как "одноэтапный подход") включает объединение различных количеств по меньшей мере одной пергидролазы СЕ-7 с триацетином (пример подходящего субстрата на основе сложного эфира) и пероксидом водорода с образованием перуксусной кислоты с помощью модельных субстратов из окрашенной эмали. Резцы с эмалью крупного рогатого скота готовили так, как описывалось в Примере 1. Блоки окрашенной эмали крупного рогатого скота гидратировали в воде по меньшей мере за 1 час перед использованием для стабилизации цвета подложки. Цвет каждого блока эмали измеряли после гидратации перед началом эксперимента. Для каждого типа раствора обрабатывали три образца эмали. Применяемыми растворами были контроль, содержащий только буфер, 2,5% Н2О2, 1% перуксусная кислота, композиция с пергидролазой, включавшая 10 мкМ EZ-1 (C277S; SEQ ID NO: 424), 100 мМ триацетин и 250 мМ H2O2 и контроль без фермента из 100 мМ триацетина и 250 мМ H2O2. Все растворы готовили в 500 мМ натрий-фосфатном буфере, pH 7,2. Высокая сила буфера нужна была для поддержания нейтрального рН у 1% раствора перуксусной кислоты. Все растворы были свежеприготовленными для каждой точки обработки. Комбинацию фермент-триацетин-Н2О2 и комбинацию триацетин-Н2О2 смешивали непосредственно перед воздействием на эмаль. После каждого этапа обработки каждый блок эмали прополаскивали водой и проводили замер. Использовали общее время обработки 61 мин с продолжительностями воздействия 1 мин, 5 мин, 10 мин, 15 мин и 30 мин. Концентрацию перуксусной кислоты в растворе через 1 мин, 10 мин и 30 мин после обработок оценивали с помощью колорометрического определения окисления ABTS. Результаты приведены в Таблицах 16 и 17.
Эффективность осветления системы пергидролазы при 1-этапном применении на окрашенной эмали крупного рогатого скота
Триацетин/H2O2
Определение концентрации перуксусной кислоты (РАА) в реакционных смесях с помощью колориметрического способа проводили в соответствии со способом, описанным Dinu et. al. (ранее). Готовили раствор реагентов из 1 мМ 2,2’-азино-бис(3-этилбензотиазолин)-6-сульфоната (ABTS), 50 мкМ йодида калия в 125 мМ калий-цитратном буфере с рН 5,0. 25 мкл образца смешивали с 975 мкл этого реагента для определения и оставили инкубироваться на 5 мин. Раствор анализировали на поглощение при 405 нм с помощью микропланшетного ридера. Сравнение относительных количеств перуксусной кислоты в растворе определяли непосредственным сравнением значений поглощения.
Оценка концентрации перуксусной кислоты в растворе в конце указанного времени обработки. Каждый образец представлял собой разведение 1:100 в реагенте для определения ABTS, измеряемом при 405 нм
Данные в Таблице 16 подтверждают, что композиция фермент-сложный эфир-пероксид является эффективной при отбеливании зубов. Данные в Таблице 17 демонстрируют, что перуксусная кислота образуется в результате действия комбинации фермента EZ-1 (C277S; SEQ ID NO: 424), триацетина и H2O2. Сравнение данных по поглощению для химической перуксусной кислоты также показывает, что, к удивлению, система ферментативного осветления демонстрирует более хорошую результативность с более низкой выявляемой перуксусной кислотой. Низкий уровень перуксусной кислоты также через время производится для не содержащего фермент триацетина и Н2О2, который выявляли при разведении 1:10 в реагенте ABTS (не включено в Таблицу). Это приводит к выявляемой результативности осветления, но с более низкой скоростью по сравнению с ферментно катализируемым получением высокого уровня перуксусной кислоты.
ПРИМЕР 13
ЭФФЕКТИВНОСТЬ ОСВЕТЛЕНИЯ ЗУБОВ ПРИ ПОМОЩИ НАЦЕЛЕННОГО НА ЭМАЛЬ ПЕРГИДРОЛИТИЧЕСКОГО ФЕРМЕНТА ПРИ ОДНОЭТАПНОМ ПРИМЕНЕНИИ
Цель этого примера заключается в демонстрации осветляющего зубы эффекта у полученной ферментативным способом перуксусной кислоты при одноэтапном применении с помощью нацеленной пергидролазы СЕ-7 и в сравнении с результативностью, достигаемой с помощью химически полученной перуксусной кислоты.
Резцы с эмалью крупного рогатого скота готовили так, как описывалось в Примере 1. Блоки окрашенной эмали крупного рогатого скота гидратировали в воде по меньшей мере за 1 час перед использованием для стабилизации цвета подложки. Цвет каждого блока эмали измеряли после гидратации перед началом эксперимента. Для каждого типа раствора обрабатывали два образца эмали. Применяемыми растворами были контроль, содержащий только буфер, 0,1% перуксусная кислота, композиция с пергидролазой, включавшая 0,52 мкМ EZ-7 (C277S с доменом, связывающимся с эмалью; SEQ ID NO: 429), 100 мМ триацетина и 32,6 мМ H2O2. Все растворы готовили в 100 мМ натрий-фосфатном буфере, pH 7,2. Все растворы были свежеприготовленными для каждой точки обработки. Комбинацию фермент-триацетин-Н2О2 смешивали непосредственно перед воздействием на эмаль. После каждого этапа обработки каждый блок эмали прополаскивали водой и производили замер. 30-мин периоды обработки повторили 4 раза для каждого набора подложек из эмали. Концентрация перуксусной кислоты в растворе после 30-минутной обработки оценивали колорометрическим определением окисления ABTS. Результаты приведены в Таблицах 18 и 19.
Эффективность осветления у нацеленной пергидролазы при 1-этапном применении на окрашенной эмали крупного рогатого скота. Данные усреднены от двух подложек
Оценка концентрации перуксусной кислоты в растворе в конце указанного времени обработки. Каждый образец представлял собой разведение 1:10 в реагенте для определения ABTS,
измеряемом при 405 нм
Данные в Таблице 18 подтверждают, что композиция нацеленный фермент-сложный эфир-пероксид является эффективной при отбеливании зубов в 1-этапном способе. Данные в Таблице 19 демонстрируют, что перуксусная кислота образуется в результате действия комбинации фермента EZ-7, триацетина и Н2О2.
ПРИМЕР 14
ПОЛУЧЕНИЕ ПЕРУКСУСНОЙ КИСЛОТЫ С ПОМОЩЬЮ ПЕРГИДРОЛАЗ СЕ-7 В ОТНОШЕНИИ РЯДА СУБСТРАТОВ НА ОСНОВЕ СЛОЖНОГО ЭФИРА
Цель данного примера заключалась в демонстрации того, что широкий спектр пергидролаз СЕ-7, включая нацеливающуюся на эмаль пергидролазу, катализируют образование перуксусной кислоты из широкого спектра сложных эфиров в специфических условиях полости рта.
Варианты пергидролазы Thermotoga maritima клонировали, рекомбинантно экспрессировали и очищали способом, по типу описанного в Примере 4. Изменения последовательностей у этих вариантов пергидролаз приведены в Таблице 5.
Тестировали различные субстраты на основе сложных эфиров по отношению по меньшей мере к двум или более вариантам пергидролазы, приведенным в Таблице 5. За исключением трех сложных эфиров, которые были специально синтезированы, все другие сложные эфиры были прибретены у Sigma-Aldrich (Сент-Луис, Миссури), TCI America (Портленд, Орегон), Alpha Aesar (Уорд-Хилл, Массачусетс) или Tessendlo Company (Феникс, Аризона).
Для тестирования различных ферментов по отношению к субстрату на основе сложного эфира удобно было проводить до 4 реакций одновременно, располагая ступенями начало каждой реакции с интервалом 0,5-1 мин. Каждую отдельную реакцию проводили в стеклянном сосуде (высота: 76 мм; внешний диаметр: 33 мм; внутренний диаметр: 24 мм), оснащенном магнитной мешалкой. Четыре реакционных сосуда скрепляли вместе и хранили при постоянной температуре в однолитровом химическом стакане из нержавеющей стали с рубашкой (KGW IsoTherm, № TSS-G 1000W) с циркулирующей водой, контролируемой при помощи рециркуляционного термостата Thermo NesLab (модель № RTE-7 Digital One). В каждый реакционный сосуд добавляли буфер (6 мл, 100 мМ натрий-фосфатный буфер, рН 7,2) и оставляли уравновешиваться до 37°C. Представляющий интерес субстрат на основе сложного эфира добавляли до достижения концентрации 100 мМ. Реакцию инициировали одновременным добавлением 40 ч./млн фермента и 60 мМ H2O2 (37 мкл, 30% раствор пероксида водорода). Для отслеживания получения перуксусной кислоты забирали 80-мкл образцы из каждой реакции через определенные интервалы от 1 до 15 минут. Образец сразу гасили в микроцентрифужной пробирке с фильтром (NanoSep 30K VWR кат. № 82031-354), содержащей некоторый объем и концентрацию раствора фосфорной кислоты, которого было достаточно для остановки ферментативной реакции (путем понижения рН на 2-3) и для разведения образца для подходящих ВЭЖХ анализов. Погашенные кислотой образцы центрифугировали в течение 5 минут для удаления каких-либо частиц. После фильтрования сразу ставили реакцию Карста и анализы ВЭЖХ на перуксусную кислоту на каждом наборе образцов с применением способа, описанного ранее в патенте США № 7829315, DiCosimo et al. Максимальная перуксусная кислота, полученная при помощи каждого субстрата на основе сложного эфира, приведена в Таблице 20.
Максимальная перуксусная кислота, полученная при нейтральных условиях.1
(CAS №)
фермента
(SEQ ID NO: 424)
(SEQ ID NO: 437)
(SEQ ID NO: 476)
(SEQ ID NO: 16)
(19879-84-6)
(542-59-6)
(628-68-2)
(7208-47-1)
(126-14-7)
(2345-34-8)
(881-68-5)
(108-65-5)
(3068-34-6)
(10551-58-3)
(111-55-7)
(623-84-7)
(25395-31-7)
(604-68-2)
(604-69-3)
(13035-61-5)
(4049-34-7)
(2873-29-2)
(4163-60-4)
(7772-79-4)
(CV Chem)a
(18085-02-4)
(13100-46-4)
(10343-06-3)b
(18531-01-6)b
(18968-05-3)
(4163-65-9)
Эти субстраты на основе сложных эфиров тестировали в отношении получения перуксусной кислоты с помощью нацеленного варианта пергидролазы C277S, EZ-7, в тех же реакционных условиях, которые использовали для получения данных для Таблицы 20. Получение перуксусной кислоты с помощью диацетата пропиленгликоля или октаацетата сахарозы с пергидролазной системой EZ-7 показано в Таблице 21. Показанные данные демонстрируют, что альтернативные сложные эфиры являются эффективными субстратами для нацеленных вариантов пергидролазы, которые описаны в Примере 5.
Максимальная перуксусная кислота, полученная с помощью альтернативных субстратов с применением нацеленной или ненацеленной пергидролазы СЕ-7
ПРИМЕР 15
ОСВЕТЛЕНИЕ ЗУБОВ С ПОМОЩЬЮ ПЕРГИДРОЛАЗ СЕ-7 В ОТНОШЕНИИ РЯДА СУБСТРАТОВ НА ОСНОВЕ СЛОЖНОГО ЭФИРА
Цель данного примера заключалась в демонстрации эффективности осветления зубов с помощью пергидролазы СЕ-7, которая катализирует образование перуксусной кислоты из четырех сложных эфиров в соответствующих условиях полости рта.
Для данного примера вариант C277S (EZ-1) пергидролазы Thermotoga maritima клонировали, рекомбинантно экспрессировали и очищали, как в Примере 4. Все субстраты были приобретены у Sigma-Aldrich (Сент-Луис, Миссури) за исключением триацетина (Tessendlo Company (Феникс, Аризона)).
Субстраты триацетин (ТА), пентаацетат α-D-глюкозы (GPA), октаацетат сахарозы (SOC) и диацетат пропиленгликоля (PGDA) использовали для демонстрации опосредованного ферментами отбеливания зубов с помощью EZ-1 (C277S; SEQ ID NO: 424). Оптимальные условия, применяемые для получения перуксусной кислоты с каждым субстратом, были выведены из исследований в Примере 14 и перечислены ниже в следующем виде:
40 ч./млн EZ-1, 100 мМ субстрат, X мМ H2O2, 95 мМ фосфат, pH 7,2, где X варьирует в зависимости от идентичности субстрата; 100 мМ H2O2 (TA), 360 мМ H2O2 (PGDA и SOC), 60 мМ H2O2 (GPA).
Резцы с эмалью крупного рогатого скота готовили так, как описывалось в Примере 1. Окрашенные блоки эмали помещали в 24-луночный планшет, при этом сторона дентина смотрела вниз, и гидратировали в течение ночи в фосфатном буфере, рН 7,2. Перед обработкой выполняли измерение цвета для каждого зуба с помощью спектрофотометра Konica-Minolta 2600d и рассчитывали показатель белизны, как описано в Примере 1.
Каждый раствор фермента готовили в 1,5-мл микроцентрифужной пробирке (Eppendorf, № 2243102-1), и 1 мл раствора сразу переносили в 24-луночный планшет, содержащий предварительно гидратированные зубы. Контрольные образцы состояли из 100 мМ фосфатного буфера, рН 7,2, и 9% Н2О2 в 100 мМ цитратном/фосфатном буфере, рН 5,3. Зубы инкубировали при комнатной температуре в течение 30 минут, вынимали, промывали 100 мМ фосфатом, рН 7,2, и проводили измерение цвета. Зубы помещали назад в 24-луночный планшет, при этом готовили свежие растворы ферментов и добавляли в каждую лунку. Этот способ повторяли, в общей сумме, для 3 отбеливающих обработок; 30 минут на обработку (Таблица 22).
Измерения цвета окрашенной кофе-чаем эмали крупного рогатого скота, подвергнутой воздействию 40 ч./млн EZ-1, 100 мМ субстрата, различного количества H2O21, 95 мМ фосфата, рН 7,2
Как видно из Таблицы 22, все образцы перуксусной кислоты, ферментативно полученной с помощью TA, PGDA, SOC и GPA, демонстрируют значительное изменение в показателе белизны, на что указывает смещение в сторону более положительных значений при каждой последующей обработке. Изменение показателя белизны для контроля-буфера находится в пределах ΔWI, составляющем 11,4. Эти обработки также совпадают с визуальным осмотром зубов после каждой 30-минутной обработки. Эти данные демонстрируют, что перуксусная кислота, ферментативно полученная с применением ряда различных субстратов с EZ-1, эффективна при отбеливании окрашенных кофе-чаем зубов крупного рогатого скота.
ПРИМЕР 16
ЭФФЕКТИВНОСТЬ ОСВЕТЛЕНИЯ ЗУБОВ ПРИ ПОМОЩИ ПЕРГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ ПРИ ДВУХЭТАПНОМ ПРИМЕНЕНИИ
Целью этого примера была демонстрация эффективности отбеливания зуба пергидролазными системами при двухэтапном применении.
Резцы с эмалью крупного рогатого скота готовили так, как описывалось в Примере 1. Окрашенные блоки эмали погружали в 48-луночный планшет для защиты дентиновой задней стороны от воздействия раствором. Готовили раствор 10 мкм каждого фермента в 10 мМ фосфатном буфере, pH 7,2, и 500 мкл раствора инкубировали с каждой подложкой из эмали в течение 60 мин. Раствор фермента удаляли и три раза промывали каждую лунку дополнительными 500 мкл буфера. Блоки эмали располагали в неиспользованной лунке для процедуры отбеливания. Раствор с конечной концентрацией 40 мМ триацетина, 100 мМ H2O2 в 50 мМ фосфатном буфере с pH 7,2 заново готовили и добавляли 500 мкл раствора к каждому блоку эмали. Через 1 ч блоки эмали забирали и проводили измерение цвета, а затем каждый возвращали в раствор в луночный планшет. Отслеживали показатель белизны для каждого образца. Результаты перечислены в Таблице 23.
Измерения цвета окрашенной чаем-кофе эмали крупного рогатого скота, подверженной воздействию различных пергидролаз и триацетина/H2O2 в 2 этапа
Этот пример демонстрирует, что связанную с поверхностью пергидролазу можно применять для отбеливания зубов, катализируя образование перуксусной кислоты на поверхности эмали. Результативность осветления в этом примере коррелирует с наблюдаемым удерживанием каждого фермента на гидроксиапатите. Ненацеленная EZ-1 (C277S; SEQ ID NO: 424) демонстрирует слабое удерживание на гидроксиапатите и эмали, и, следовательно, низкий потенциал к осуществлению подходящего отбеливания в 2-этапном способе. Добавление эффективной нацеливающей последовательности для удерживания фермента на эмали делает возможным получение перуксусной кислоты в 2-этапном способе применения.
ПРИМЕР 17
ЭФФЕКТИВНОСТЬ ОСВЕТЛЕНИЯ ЗУБОВ ПРИ ПОМОЩИ ПЕРГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ ПРИ ДВУХЭТАПНОМ ПРИМЕНЕНИИ
Цель этого примера заключалась в демонстрации эффективности осветления зубов у систем нацеленных и ненацеленных пергидролаз при двухэтапном применении.
Резцы с эмалью крупного рогатого скота готовили так, как описывалось в Примере 1. Окрашенные блоки эмали погружали в лунку, заполненную Silly Putty® (Crayola LLC, Истон, Пенсильвания), 24-луночного планшета для защиты дентиновой задней стороны от воздействия раствора. Готовили раствор с 20 мкМ каждого фермента в 10 мМ фосфатном буфере, рН 7,2, и 500 мкл раствора фермента добавляли к каждому блоку эмали и инкубировали в течение 10 мин при 37°C. Блок эмали затем три раза ополаскивали каждый раз посредством дополнительных 500 мкл буфера. Блоки эмали переносили и погружали в неиспользованной лунке с силиконовым полимером для процедуры отбеливания. Раствор (200 мкл), содержащий 100 мМ фосфатный буфер, 100 мМ триацетин, 100 мМ Н2О2, рН 7,2, добавляли к эмали и инкубировали в течение 10 мин при 37°C. Забирали блок эмали из лунки с помощью пинцета, затем ополаскивали и хранили в лунке, заполненной 1,5 мл воды, для измерений цвета. 2-этапный способ повторяли 5 раз (в целом 50 мин). Результаты измерений цвета окрашенной кофе-чаем эмали крупного рогатого скота после 2-этапного способа были показаны в Таблице 24. Каждая точка данных образца представляет 2 повтора независимых блоков эмали.
Для измерения уровня образованной в системе перуксусной кислоты применяли способ с ABTS, забирали 90 мкл реакционных смесей в новую лунку, содержащую 10 мкл стоп-буфера (1,33 М H3PO4). Образцы разводили 1:100 посредством 100 мМ фосфатного буфера и добавляли к проявляющему реагенту ABTS, который упомянут в Примере 8. Результаты приведены в Таблице 25. Каждая точка данных образца представляет 2 повтора независимых блоков эмали.
Измерения цвета окрашенной чаем-кофе эмали крупного рогатого скота, подверженной воздействию различных пергидролаз и триацетина/H2O2 в 2 этапа
Уровень образования перуксусной кислоты после каждого цикла способа отбеливания
Этот пример демонстрирует, что связанную с поверхностью пергидролазу можно применять для отбеливания зубов, катализируя образование перуксусной кислоты на поверхности эмали. Результативность осветления в этом примере с применением эмали крупного рогатого скота коррелирует с наблюдаемым удерживанием каждого фермента на гидроксиапатите. Ненацеленная EZ-1 (C277S) демонстрирует слабое удерживание на гидроксиапатите и эмали и, следовательно, низкий потенциал к осуществлению подходящего отбеливания в 2-этапном способе. Добавление эффективной нацеливающей последовательности для удерживания фермента на эмали делает возможным получение перуксусной кислоты в 2-этапном способе применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕРМЕНТАТИВНОЕ ОБРАЗОВАНИЕ ПЕРКИСЛОТЫ ДЛЯ ПРИМЕНЕНИЯ В ПРОДУКТАХ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА | 2011 |
|
RU2793140C2 |
| СИСТЕМА, ОБЕСПЕЧИВАЮЩАЯ КАТАЛИЗИРУЕМУЮ ПЕРГИДРОЛАЗОЙ РЕАКЦИЮ | 2012 |
|
RU2607481C2 |
| КОМПОЗИЦИИ, ОБРАЗУЮЩИЕ ПЕРКИСЛОТУ | 2012 |
|
RU2581906C2 |
| ФЕРМЕНТЫ, ПРИГОДНЫЕ ДЛЯ ПОЛУЧЕНИЯ ПЕРКИСЛОТ | 2013 |
|
RU2644333C2 |
| ФЕРМЕНТЫ, ПРИГОДНЫЕ ДЛЯ ПОЛУЧЕНИЯ ПЕРКИСЛОТ | 2013 |
|
RU2644336C2 |
| ФЕРМЕНТЫ, ПРИГОДНЫЕ ДЛЯ ПОЛУЧЕНИЯ ПЕРКИСЛОТ | 2013 |
|
RU2644330C2 |
| ФЕРМЕНТЫ, ПРИГОДНЫЕ ДЛЯ ПОЛУЧЕНИЯ ПЕРКИСЛОТ | 2013 |
|
RU2645257C2 |
| ПОЛУЧЕНИЕ ПЕРКИСЛОТ И КОМПОЗИЦИИ С ИСПОЛЬЗОВАНИЕМ ФЕРМЕНТА, ОБЛАДАЮЩЕГО ПЕРГИДРОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2636466C2 |
| ФЕРМЕНТ ДЛЯ ПРОДУКЦИИ ДЛИННОЦЕПОЧЕЧНОЙ ПЕРКИСЛОТЫ | 2007 |
|
RU2487939C2 |
| СИСТЕМЫ, ОБЕСПЕЧИВАЮЩИЕ КАТАЛИЗИРУЕМЫЕ ФЕРМЕНТАМИ РЕАКЦИИ | 2011 |
|
RU2599892C2 |
















































































































































































































































Группа изобретений относится к области продуктов для личной гигиены, предназначенных для обработки полости рта перкислотным средством, способу получения такого средства и пергидролитическому ферменту в форме гибридного белка для его получения. Перкислоту получают из субстрата с применением ферментного катализатора в форме гибридного белка, обладающего пергидролитической активностью, в присутствии источника кислорода пероксигруппы. Указанный гибридный белок содержит следующую общую структуру: PAH-[L]y-OCBD или OCBD-[L]y-PAH, где PAH является ферментом, обладающим пергидролитической активностью, и представляет собой эстеразу углеводов, имеющую сигнатурный мотив CE-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2 и содержит: 1) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2; 2) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2, и 3) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2; OCBD является пептидным компонентом, обладающим сродством к поверхности полости рта, и представляет собой антитело из одноцепочечного вариабельного фрагмента (scFv) или одноцепочечный полипептид без иммуноглобулиновой укладки; L является необязательным пептидным линкером длиной в диапазоне от 1 до 100 аминокислот; и y равен 0 или 1. Продукт для ухода за полостью рта содержит вышеуказанный гибридный белок, по меньшей мере один субстрат на основе сложного эфира карбоновой кислоты, источник кислорода пероксигруппы и приемлемую для рта среду-носитель. Перкислотное полезное средство можно применять для осветления, отбеливания, обеззараживания, обесцвечивания, дезодорирования, уменьшения и/или устранения биопленки с поверхности полости рта. При этом использование вышеуказанного гибридного белка обеспечивает «нацеливание» пергидролитической активности на поверхность полости рта. 3 н. и 10 з.п. ф-лы, 25 табл., 17 пр.
1. Способ получения перкислотного средства, включающий:
1) обеспечение набора реакционных компонентов, который содержит:
а) по меньшей мере один субстрат, выбранный из группы, состоящей из:
i) сложных эфиров со структурой
[X]mR5,
где Х - сложноэфирная группа с формулой R6C(O)O;
R6 - C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6 - C2-C7;
R5 - C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами; где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты; где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5; и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
ii) глицеридов со структурой
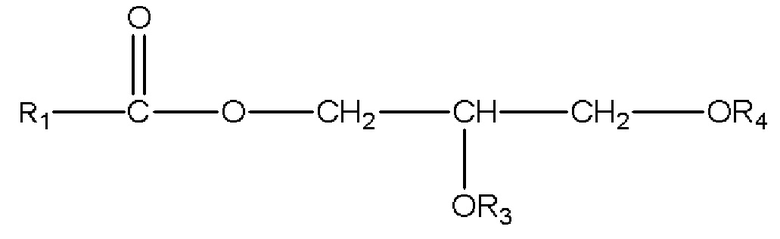 ,
,
где R1 - C1-C7 алкил с прямой цепью или с разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
iii) одного или нескольких сложных эфиров с формулой
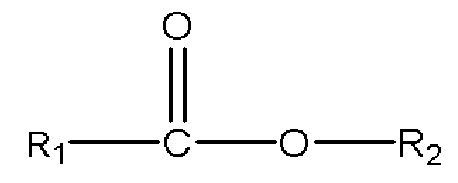 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или с разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 с прямой цепью или с разветвленной цепью алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил, (CH2CH2O)n или (CH2CH(CH3)O)nH и n равен 1-10, и
iv) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов;
b) источник кислорода пероксигруппы и
с) ферментный катализатор, обладающий пергидролитической активностью, при этом указанный ферментный катализатор включает гибридный белок со следующей общей структурой:
PAH-[L]y-OCBD
или
OCBD-[L]y-PAH,
где PAH является ферментом, обладающим пергидролитической активностью, где указанный фермент представляет собой эстеразу углеводов, имеющую сигнатурный мотив CE-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2, причем указанный сигнатурный мотив содержит:
1) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
2) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2, и
3) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2;
OCBD является пептидным компонентом, обладающим сродством к поверхности полости рта, где пептидный компонент представляет собой антитело из одноцепочечного вариабельного фрагмента (scFv) или одноцепочечный полипептид без иммуноглобулиновой укладки;
L является необязательным пептидным линкером длиной в диапазоне от 1 до 100 аминокислот и
y равен 0 или 1;
2) объединение реакционных компонентов из (1) при подходящих реакционных условиях, посредством чего ферментативно получают по меньшей мере одну перкислоту,
где поверхность полости рта, приведенная в контакт по меньшей мере с одним полученным перкислотным средством, получает основанный на перкислоте полезный эффект, выбранный из группы, состоящей из осветления, отбеливания зубов, обеззараживания, обесцвечивания, дезодорирования, уменьшения или устранения биопленки или их комбинаций.
2. Гибридный белок, содержащий следующую общую структуру:
PAH-[L]y-OCBD
или
OCBD-[L]y-PAH,
где PAH является ферментом, обладающим пергидролитической активностью, где указанный фермент представляет собой эстеразу углеводов, имеющую сигнатурный мотив CE-7, который выравнивается с эталонной последовательностью SEQ ID NO: 2, причем указанный сигнатурный мотив содержит:
1) мотив RGQ в положениях, соответствующих положениям 118-120 у SEQ ID NO: 2;
2) мотив GXSQG в положениях, соответствующих положениям 179-183 у SEQ ID NO: 2, и
3) мотив HE в положениях, соответствующих положениям 298-299 у SEQ ID NO: 2;
OCBD является пептидным компонентом, обладающим сродством к поверхности полости рта, где пептидный компонент представляет собой антитело из одноцепочечного вариабельного фрагмента (scFv) или одноцепочечный полипептид без иммуноглобулиновой укладки;
L является пептидным линкером длиной в диапазоне от 1 до 100 аминокислот и
y равен 0 или 1.
3. Гибридный белок по п. 2, где одноцепочечный полипептид включает по меньшей мере один связывающийся с поверхностью полости рта пептид длиной в диапазоне от 5 до 60 аминокислот.
4. Гибридный белок по п. 3, где указанный по меньшей мере один пептид, связывающийся с поверхностью полости рта, характеризуется значением константы диссоциации (KD) или значением концентрации связывающегося пептида (MB50) 10-5 M или менее.
5. Гибридный белок по п. 3, где одноцепочечный полипептид включает 2-50 пептидов, связывающихся с поверхностью полости рта, где пептиды, связывающиеся с поверхностью полости рта, независимо и необязательно отделены полипептидным спейсером длиной в диапазоне от 1 до 100 аминокислот.
6. Гибридный белок по п. 2, где пептидный компонент, обладающий сродством к поверхности полости рта, характеризуется длиной не более 200 аминокислот.
7. Продукт для ухода за полостью рта, содержащий:
1) ферментный катализатор, включающий гибридный белок по п. 2;
2) по меньшей мере один субстрат, выбранный из группы, состоящей из:
а) сложных эфиров со структурой
[X]mR5,
где Х - сложноэфирная группа с формулой R6C(O)O;
R6 - C1-C7 линейный, разветвленный или циклический гидрокарбильный фрагмент, необязательно замещенный гидроксильными группами или C1-C4 алкоксигруппами, где R6 необязательно содержит одну или несколько эфирных связей для R6 - C2-C7;
R5 - C1-C6 линейный, разветвленный или циклический гидрокарбильный фрагмент, или пятичленный циклический гетероароматический фрагмент, или шестичленный циклический ароматический или гетероароматический фрагмент, необязательно замещенный гидроксильными группами, где каждый атом углерода в R5 отдельно содержит не более одной гидроксильной группы или не более одной сложноэфирной группы или группы карбоновой кислоты, где R5 необязательно содержит одну или несколько эфирных связей;
m является целым числом в диапазоне от 1 до числа атомов углерода в R5 и
где указанные сложные эфиры имеют растворимость в воде по меньшей мере 5 ч./млн при 25°C;
b) глицеридов со структурой
 ,
,
где R1 - C1-C7 алкил с прямой цепью или с разветвленной цепью, необязательно замещенный гидроксильной или C1-C4 алкоксигруппой, и R3 и R4 по отдельности являются H или R1C(O);
с) одного или нескольких сложных эфиров с формулой
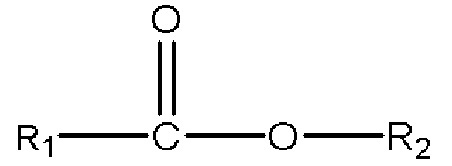 ,
,
где R1 представляет собой C1-C7 алкил с прямой цепью или с разветвленной цепью, необязательно замещенный гидроксильной или С1-С4 алкоксигруппой, и R2 представляет собой C1-C10 алкил, алкенил, алкинил, арил, алкиларил, алкилгетероарил, гетероарил с прямой цепью или с разветвленной, (CH2CH2O)n или (CH2CH(CH3)O)nH цепью и n равен 1-10, и
d) ацетилированных сахаридов, выбранных из группы, состоящей из ацетилированных моносахаридов, ацетилированных дисахаридов и ацетилированных полисахаридов;
3) источник кислорода пероксигруппы и
4) приемлемую для рта среду-носитель.
8. Продукт для ухода за полостью рта по п. 7, где одноцепочечный полипептид без иммуноглобулиновой укладки содержит по крайней мере один пептид, связывающийся с зубной эмалью, или пептид, связывающийся с налетом на зубах.
9. Продукт для ухода за полостью рта по п. 8, где по крайней мере один пептид, связывающийся с зубной эмалью, или пептид, связывающийся с налетом на зубах, имеет длину в диапазоне от 5 до 60 аминокислот.
10. Продукт для ухода за полостью рта по пп. 7-9, где продукт для ухода за полостью рта представлен в форме порошка, пасты, геля, жидкости, мази, таблетки, ополаскивающей жидкости или любой их комбинации.
11. Продукт для ухода за полостью рта по п. 7, где продукт для ухода за полостью рта представляет собой зубную пасту, зубной крем, зубной гель, зубной порошок, жидкость для полоскания рта, освежитель дыхания и зубную нить.
12. Продукт для ухода за полостью рта по п. 7, где продукт для ухода за полостью рта представлен в форме полоски для отбеливания зубов или капы.
13. Продукт для ухода за полостью рта по пп. 7-9, где ферментный катализатор остается отделенным от субстрата, источника кислорода пероксигруппы или как от субстрата, так и источника кислорода пероксигруппы до применения продукта для ухода за полостью рта.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| RU 2008139090 A, 10.04.2010. | |||
Авторы
Даты
2018-07-05—Публикация
2011-12-19—Подача