Область техники, к которой относится изобретение
Изобретение относится к способу синтеза 2,2'-бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислоты) и 4,7-дихлор-1,10-фенантролин-2,9-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислоты) в качестве органических водорастворимых лигандов для комплексообразования с ионами f-элементов (в первую очередь с ионами европия), что может быть использовано во времяразрешенном иммунофлуоресцентном и других видах флуоресцентного анализа.
Предпосылки создания изобретения
Иммунохимический анализ на сегодняшний день признан одним из самых точных и результативных методов лабораторной диагностики различных опухолевых заболеваний, поскольку он обладает высокой точностью и воспроизводимостью результатов. Его относят к методам связывания - группе родственных методов, отличительной особенностью которых является возможность определять количество анализируемого вещества не по биологической (функциональной) активности, а по количеству комплекса-метки, образовавшегося при взаимодействии этого вещества со связывающим агентом и последующим измерении его распределения между «свободной» и «связанной» фазами. Иммунофлуоресцентный анализ не уступает в чувствительности и специфичности широко распространенным методам иммуноанализа с применением радиоактивной и ферментной метки. При этом нужно отметить, что флуоресцентные метки значительно дешевле изотопных, срок годности наборов для иммунофлуоресцентного анализа намного больше, чем наборов радиоиммунного анализа, а флуоресценцию можно измерять на простых флуориметрах. Хотя многие достоинства иммунофлуоресцентного анализа свойственны и методам иммуноферментного анализа (доступность методик ковалентного связывания ферментов с антигенами или антителами, стабильность меченых продуктов, безопасность и др.), но главный недостаток иммуноферментного анализа связан со способом измерения результата анализа, а именно с необходимостью дополнительной операции определения активности фермента с помощью соответствующего субстрата. Эта операция усложняет и замедляет анализ и в принципе может снижать точность результата. Кроме того, биологические образцы часто содержат ферменты, активность которых близка к активности ферментной метки. На результат анализа могут влиять и другие факторы, например присутствие в пробах ингибиторов фермента. Тот же недостаток (высокий уровень фона), а также неспецифическое окрашивание тканей некоторых типов, в частности почечных, имеет биотин-авидиновый комплекс. Исходя из вышесказанного, эффективным, недорогим и безопасным является использование флуоресцентных меток в иммуногистохимическом анализе.
Развитие флуоресцентного анализа в настоящее время происходит в следующих направлениях: поиск новых способов (технологий) проведения иммунохимических реакций и разделения их компонентов, разработка новых методов детекции и обработки флуоресцентного сигнала, увеличение чувствительности методов и поиск новых высокочувствительных маркеров, в первую очередь на основе хелатов ионов лантаноидов с гетероциклическими ароматическими соединениями (Hanaoka K.; Kikuchi K.; Kobayashi S.; Nagano Т.: Time-Resolved Long-Lived Luminescence Imaging Method Employing Luminescent Lanthanide Probes with a New Microscopy System. J. Am. Chem. Soc. 2007, 129, 13502-13509. Mizukami S.; Yamamoto Т.; Yoshimura A.; Watanabe S.; Kikuchi K.: Covalent Protein Labeling with a Lanthanide Complex and Its Application to Photoluminescence Lifetime-Based Multicolor Bioimaging. Angew. Chem. Int. Ed. 2011, 50, 8750-8752. Mizukami S.; Tonai K.; Kaneko M.; Kikuchi K.: Lanthanide-Based Protease Activity Sensors for Time-Resolved Fluorescence Measurements. J. Am. Chem. Soc. 2008, 130, 14376-14377. Liu X.; Ye Z.; Wei W.; Du Y.; Yuan J.; Ma D.: Artificial luminescent protein as abioprobe for time-gated luminescence bioimaging. Chem. Commun. 2011, 47, 8139-8141).
В ряде работ описано получение фосфонатных хелатирующих агентов на основе замещенного пиридина (L. Charbonniere, С. Christine, A. Lecointre, K. Nchmimi Nono "Bifunctional phosphonate chelating agents" US 0199243 18 june 2012; P.J. Cywinski, K. Nchimi Nono, L. Charbonniere, T Hammanna, H.-G. Lohmannsroben "Photophysical evaluation of a new functional terbium complex in FRET-based time-resolved homogenous fluoroassays", Phys. Chem. Chem. Phys., 2014, 16, 6060; Song X.-P., Bouillon C., Lescrinier E., Herdewijn P. Iminodipropionic Acid as the Leaving Group for DNA Polymerization by HIV-1 Reverse Transcriptase//ChemBioChem., 2011, 12 (12), 1868). Но в указанных работах фосфонатная функция входит в состав аминогруппы, а не карбоксамидной.
Наиболее близким к изобретению является синтез диамидов 2,2'-бипиридил-6,6'-дикарбоновых кислот, описанный в патенте RU 2530025, Н.Е. Борисова, М.Д. Решетова, Ю.А. Устынюк, А.В. Иванов, Л.А. Коротков, М.Ю. Аляпышев, В.А. Бабаин "Диамиды 2,2'-бипиридил-6,6'-дикарбоновых кислот и способ их получения". Описанный в патенте способ получения диамидов 2,2'-бипиридил-6,6'-дикарбоновых кислот заключается в обработке хлорангидридов 2,2'-бипиридил-6,6'-дикарбоновых кислот различными этиларил замещенными вторичными аминами. Однако в данном методе не описано получение диамидов с функционально замещенными аминами.
Раскрытие изобретения
Задачей изобретения является синтез производных полигетероарил-бис[карбонилнитрилоди(метилен)]тетракис(фосфоновых кислот) и разработка способа их получения с целью образования люминесцирующих комплексов редкоземельных элементов.
Поставленная задача решается синтезом производных полигетероарил-бис[карбонилнитрилоди(метилен)]тетракис(фосфоновых кислот) общей формулы

где при X и Z, представляющих собой CH2 группы, соединенные между собой двойной связью (-СН2=СН2-), R представляет собой Cl; в случае, когда X и Z представляют собой Н, R представляет собой Н.
В случае при X=Z=H и R=H соединение представляет собой 2,2'-Бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен) тетракис(фосфоновую кислоту) формулы
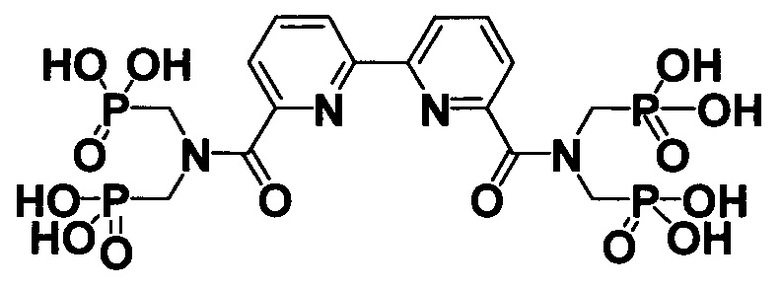
При X и Z, представляющих собой CH2 группы, соединенные между собой двойной связью (-CH2=CH2-) и R=Cl соединение представляет собой 4,7-дихлор-1,10-фенантролин-2,9-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновую кислоту) формулы
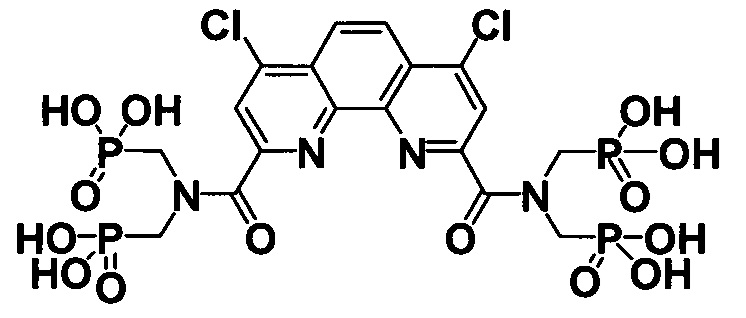
Поставленная задача также решается способом получения заявляемых соединений, заключающемся в том, что полигетероарилдикарбоновые кислоты кипятят с хлористым тионилом, взятым в по меньшей в 10-кратном мольном избытке по отношению к кислоте, а затем полученные хлорангидриды обрабатывают вторичным амином тетраэтил[иминоди(метилен)]бис(фосфонатом), взятом в мольном соотношении не менее чем 2:1 по отношению к полигетероарилдикарбоновой кислоте с получением диамидов. Гидролиз последних в системе Me3SiCl/KI, взятом по меньшей мере в 10-кратном мольном избытке по отношению к эфиру приводит к получению заявляемых соединений.
Техническим результатом группы изобретений является синтез новых соединений, обладающих способностью образования люминесцирующих комплексов с редкоземельными элементами, а также в качестве лигандов для разделения редкоземельных элементов.
Краткое описание чертежей
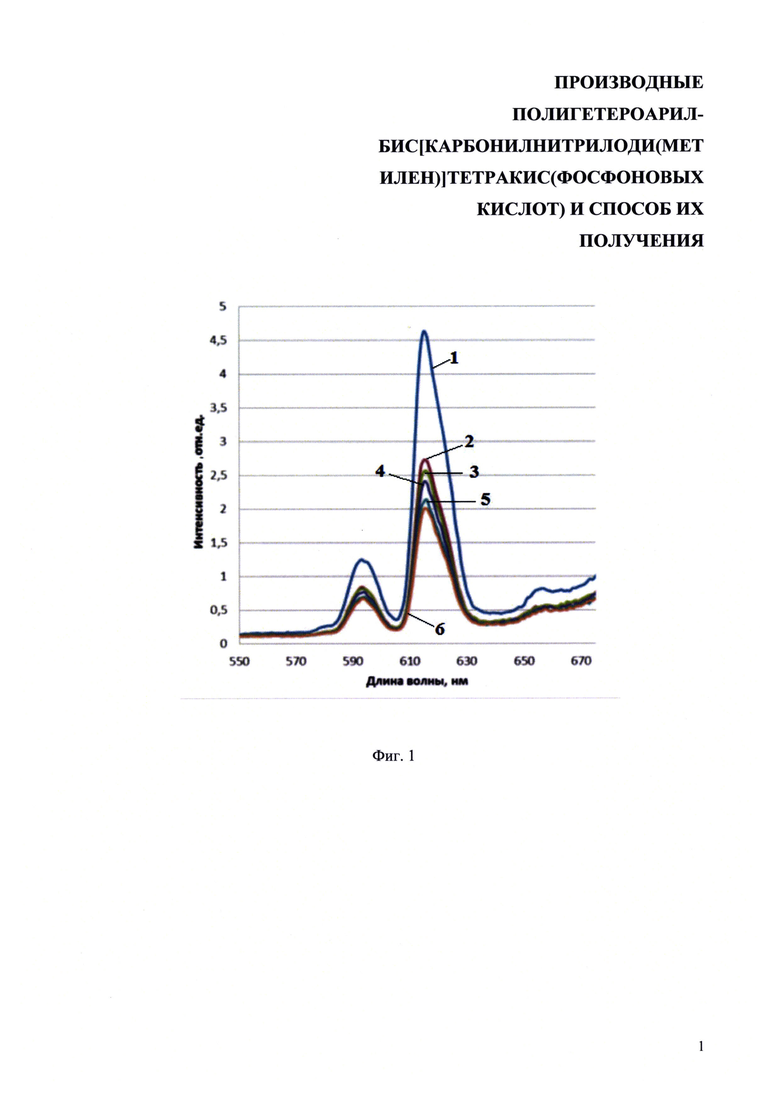
На фиг. 1 представлены спектры испускания люминесценции растворов комплекса европия с 2,2'-бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислотой) в водном метаноле (λех=270 нм), где под цифрой 1 обозначен спектр раствора соединения в метаноле, 2 - раствор с добавлением 100 мкл воды, 3 - с добавлением 200 мкл воды, 4 - с добавлением 300 мкл воды, 5 - с добавлением 400 мкл воды, 6 - с добавлением 500 мкл воды.
Осуществление изобретения
Для синтеза диамидов 2,2'-бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислоты) и 1,10-фенантролин-2,9-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислоты) предложена следующая схема:
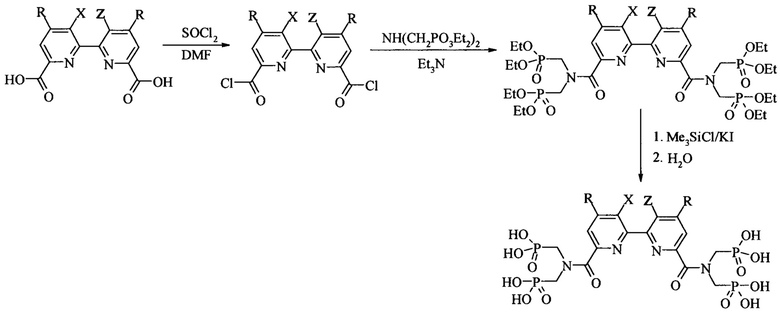
В качестве исходных соединений для синтеза заявляемых соединений используют полигетероарилдикарбоновые кислоты, выбранные из группы 2,2-бипиридил-6,6-дикарбоновую кислоту и 4,7-дихлор-1,10-фенантролин-2,9-дикарбоновую кислоту, а также любые арилдикарбоновые кислоты.
Постадийный метод синтеза диамидов представлен ниже.

Исходную 2,2'-бипиридил-6,6'-дикарбоновую кислоту (0.37 г, 0.0015 моль) кипятили в 10 мл хлористого тионила с добавлением 0.3 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 1 г (0.00315 моль) тетраэтил[иминоди(метилен)]бис(фосфоната) и 1 мл триэтиламина в 10 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 16 ч при комнатной температуре. К реакционной массе добавляли 5 мл воды и отделяли органический слой. Органическую фазу промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителя к полученному темному маслу добавляли 5 мл диэтилового эфира и затирали до образования осадка. Выпавший осадок отфильтровывали, промывали холодным эфиром и высушивали на воздухе. Получали 1 г (0.0012 моль, 79%) белого вещества. Тпл=116-118°С. Спектр ЯМР 1Н (CDCl3, J Нz, 400 MHz) δ, м. д.: 1.19 (12Н, т., 3J=7.0, СН2СН3), 1.36 (12Н, т., 3J=7.0, СН2СН3), 3.94-4.01 (8Н, м., СН2СН3), 4.20-4.27 (8Н, м., СН2СН3), 4.39 (4Н, д., 2J=11.1, 2СН2Р), 4.76 (4Н, д., 2J=11.2, 2СН2Р), 7.85 (2Н, д, 3J=7.5, 3,3'-СН), 7.97 (2Н, т, 3J=7.7, 4,4'-СН), 8.50 (2Н, д, 3J=7.2, 5,5'-СН). Спектр ЯМР 13С (CDCl3, 100 MHz) м. д.: 16.2 (д, J=5.1), 16.3 (д, J=5.0), 41.3 (д, J=155.9), 44.5 (д, J=154.7), 62.2 (д, J=6.0), 62.6 (д, J=5.7), 122.1, 125.4, 138.2, 152.5, 153.1, 167.5. Спектр ЯМР 31Р (CDCl3, 162.1 MHz) м. д.: 21.64, 21.65. Масс-спектр (MALDI-TOF), m/z: 881 [M+K]+. Найдено, %: С 45.72; Н 6.51; N 14.78. C32H54N4O14P4. Вычислено, %: С 45.61; Н 6.46; N 14.70.

Октаэтил{2,2'-бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен)]}тетракис-(фосфрнат) (1) (0.1 г, 0.0001 моль) растворили в 3 мл сухого ацетонитрила, добавили сухой KI (0.15 г, 0.001 моль) и перемешивали до растворения. Затем медленно по каплям добавили триметилхлорсилан (0.11 г, 0.001 моль) и перемешивали при комнатной температуре 4 ч. По истечении этого времени реакционную массу фильтровали от хлористого калия, а ацетонитрил испаряли под вакуумом без нагрева. К сухому остатку добавили немного воды и упарили все досуха под вакуумом. К остатку добавили немного изопропилового спирта и затирали до кристаллизации. Выход: 0.040 г (65%), Тпл>250°С. Спектр ЯМР 1Н (D2O, J Hz, 400 MHz) δ, м. д.: 3.88 (4Н, д., 2J=10.7, 2СН2Р), 4.04 (4Н, д., 2J=11.8, 2СН2Р), 7.81 (2Н, д, 3J=7.7, 3,3'-СН), 8.20 (2Н, т, 3J=7.9, 4,4'-СН), 8.29 (2Н, д, 3J=8.1, 5,5'-СН). Спектр ЯМР 13С (D2O, 100 MHz) м. д.: 43.9 (д, J=146.7), 46.8 (д, J=145.4), 124.5, 125.2, 141.6, 150.7, 150.7, 167.7. Спектр ЯМР 31Р (D2O, 162.1 MHz) м. д.: 15.49, 16.97. Найдено, %: С 31.19; Н 3.65; N 9.14. C16H22N4O14P4. Вычислено, %: С 31.08; Н 3.59; N 9.06.

Исходную 4,7-дихлор-1,10-фенантролин-2,9-дикарбоновую кислоту (0.25 г, 0.00075 моль) грели при 60°С в 10 мл хлористого тионила с добавлением 0.3 мл диметилформамида в течение 4 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 10 мл хлористого метилена. Полученный раствор при перемешивании порциями добавляли к смеси 0.57 г (0.0018 моль) тетраэтил[иминоди(метилен)]бис(фосфоната) и 0.5 мл триэтиламина в 5 мл хлористого метилена. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 16 ч при комнатной температуре. К реакционной массе добавляли 5 мл воды и отделяли органический слой. Органическую фазу промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителя к полученному темному маслу добавляли 5 мл диэтилового эфира и затирали до образования осадка. Выпавший осадок отфильтровывали, промывали холодным эфиром и высушивали на воздухе. Получали 0.5 г (0.00053 моль, 71%) белого вещества. Тпл=120-123°С. Спектр ЯМР 1Н (CDCl3, J Hz, 400 MHz) δ, м. д.: 1.03 (12Н, т., 3J=6.6, СН2СН3), 1.35 (12Н, т., 3J=6.8, СН2СН3), 3.78-3.93 (8Н, м., СН2СН3), 4.20-4.38 (8Н, м., СН2СН3), 4.38 (4Н, д., 2J=11.4, СН2Р), 4.56 (4Н, д., 2J=11.6, СН2Р), 8.47 (2Н, с, 1,10-СН), 8.52 (2Н, с, 3,8-СН). Спектр ЯМР 13С (CDCl3, 100 MHz) м. д.: 16.2, 19.2, 19.4, 65.1, 65.5, 65.8, 127.2, 127.3, 128.1, 128.4, 147.5, 151.2, 167.1. Найдено, %: С 43.80; Н 5.66; N 7.08. C34H52Cl2N4O14P4. Вычислено, %: С 43.65; Н 5.60; N 5.99.

Октаэтил {4,7-дихлор-1,10-фенантролин-2,9-диилбис[карбонилнитрилоди-(метилен)]}тетракис(фосфонат) (3) (0.2 г, 0.00021 моль) растворили в 3 мл сухого ацетонитрила, добавили сухой KI (0.315 г, 0.0021 моль) и перемешивали до растворения. Затем медленно по каплям добавили триметилхлорсилан (0.23 г, 0.0021 моль) и перемешивали при комнатной температуре 4 ч. По истечениии этого времени реакционную массу фильтровали от хлористого калия, а ацетонитрил испаряли под вакуумом без нагрева. К сухому остатку добавили немного воды и упарили все досуха под вакуумом. К остатку добавили немного изопропилового спирта и затирали до кристаллизации. Выход: 0.095 г (64%), Тпл>250°С. Спектр ЯМР 1H (D2O, 400 MHz) δ, м. д.: 4.46-4.51 (4Н, м, 2СН2), 4.49-4.54 (4Н, м, 2СН2), 8.47 (2Н, с, 1,10-СН), 8.52 (2Н, с, 3,8-СН). Найдено, %: С 30.58; Н 2.89; N 7.95. C18H20Cl2N4O14P4. Вычислено, %: С 30.40; Н 2.83; N 7.88.
Комплекс европия с 2,2'-бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислотой).
При перемешивании к раствору 2,2'-бипиридин-6,6-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислотой) (2) (0.02 г, 0.00003 моль) в 2 мл дистиллированной воды добавили раствор 0.013 г гексагидрата нитрата европия (III) в 0.5 мл дистиллированной воды, перемешивали 5 мин и отфильтровали белый осадок. Выход 85%. Спектр ЯМР 1Н (D2O, J Hz, 400 MHz): 3.55-3.60 (4Н, м., 2СН2), 3.74-3.80 (4Н, м., 2СН2), 7.51-7.60 (2Н, м., 2Н Аr), 8.03-8.17 (2Н, м., 2Н Ar), 8.46-8.55 (2Н, м., 2Н Ar). Найдено, %: С 20.17; Н 2.40; N 10.32. C16H22EuN7O23P4. Вычислено, %: С 20.10; Н 2.32; N 10.25.
Комплекс европия с 4,7-дихлор-1,10-фенантролин-2,9-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислотой).
При перемешивании к раствору 4,7-дихлор-1,10-фенантролин-2,9-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислотой) (4) (0.02 г, 0.000028 моль) в 2 мл дистиллированной воды добавили раствор 0.013 г гексагидрата нитрата европия (III) в 0.5 мл дистиллированной воды, перемешивали 5 мин и отфильтровали белый осадок. Выход 73%. Спектр ЯМР 1Н (D2O, 400 MHz) δ, м. д.: 4.46-4.51 (4Н, м, 2СН2), 4.49-4.54 (4Н, м, 2СН2), 7.86 (2Н, с, 1,10-СН), 7.95 (2Н, с, 3,8-СН). Найдено, %: С 20.80; Н 2.01; N 9.39. C18H20Cl2EuN7O23P4. Вычислено, %: С 20.61; Н 1.92; N9.35.
Комплекс нитрата европия с {[2,2'-бипиридин]-6,6-диилбис[карбонилнитрилобис(метилен)]}тетракис(фосфоновой кислотой) в метанольном растворе имеет квантовый выход люминесценции 36%, а при добавлении небольшого количества воды резко падает до 15% (фиг. 1). Дальнейшее разбавление метанола водой не изменяет квантовый выход люминесценции 2,2'-бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислоты) данного комплекса.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИАМИДЫ 2,2'-БИПИРИДИЛ-6,6'-ДИКАРБОНОВЫХ КИСЛОТ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2530025C2 |
| ДИАМИДЫ 4,7-ДИЗАМЕЩЕННЫХ 1,10-ФЕНАНТРОЛИН-2,9-ДИКАРБОНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЭКСТРАКЦИОННАЯ СМЕСЬ НА ИХ ОСНОВЕ | 2014 |
|
RU2601554C2 |
| N,N’-ДИЭТИЛ- N,N’-ДИ(2-БРОМ-4-R-ФЕНИЛ)ДИАМИДЫ 2,2’-БИПИРИДИЛ-6,6’-ДИКАРБОНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ, ЦИКЛИЗАЦИЯ ПОЛУЧЕННЫХ АМИДОВ С ОБРАЗОВАНИЕМ 6,6’-ДИЭТИЛ-9,9’-ДИR-ДИБЕНЗО[F]-1,7-НАФТИРИДИН-5,5’(6Н,6’H)-ДИОНОВ | 2016 |
|
RU2647578C1 |
| ДИ(3-СУЛЬФОФЕНИЛФОСФИНИЛ)ПРОИЗВОДНЫЕ 2,2'-БИПИРИДИЛА, 1,10-ФЕНАНТРОЛИНА И ПИРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2620265C1 |
| Способ получения производного неокупроина | 2022 |
|
RU2799334C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИОКСИДАНТНОЙ ЕМКОСТИ ОПТИЧЕСКИМ МЕТОДОМ С ИСПОЛЬЗОВАНИЕМ КОМПЛЕКСОВ ЖЕЛЕЗА С ПРОИЗВОДНЫМИ БИПИРИДИНА | 2024 |
|
RU2835107C1 |
| СПИРО[2.3]ГЕКСАНОВЫЕ АМИНОКИСЛОТЫ - КОНФОРМАЦИОННО-ЖЕСТКИЕ АНАЛОГИ γ-АМИНОМАСЛЯНОЙ КИСЛОТЫ - И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2629357C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ АРИЛ-ТИОГИДАНТОИНА, ИНГИБИТОРЫ АНДРОГЕНОВОГО РЕЦЕПТОРА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2017 |
|
RU2708253C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНОСПИРО[2.3]ГЕКСАН-1-КАРБОНОВОЙ КИСЛОТЫ | 2017 |
|
RU2659404C1 |
| ЦИНКОВЫЕ ДИМЕРНЫЕ КОМПЛЕКСЫ КРАУНСОДЕРЖАЩИХ СТИРИЛФЕНАНТРОЛИНОВ В КАЧЕСТВЕ ОПТИЧЕСКИХ СЕНСОРОВ НА КАТИОНЫ ЩЕЛОЧНОЗЕМЕЛЬНЫХ И ТЯЖЕЛЫХ МЕТАЛЛОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2516656C1 |
Изобретение относится к производному полигетероарил-бис[карбонилнитрилоди(метилен)]тетракис(фосфоновой кислоты), которое может применяться для флуоресцентного анализа, формулы
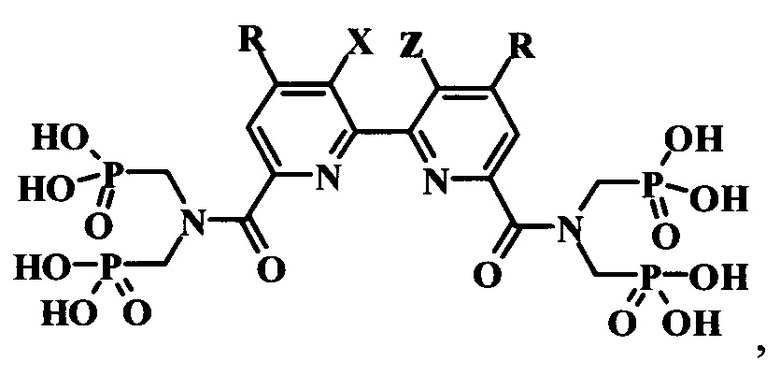
где, когда X и Z образуют фрагмент -СН2=СН2-, R представляет собой Cl; когда X и Z представляют собой Н, R представляет собой Н. Это производное получают путем обработки полигетероарилдикарбоновой кислоты 10-кратным мольным избытком хлористого тионила с последующим взаимодействием полученного хлорангидрида с тетраэтил[иминоди(метилен)]бис(фосфонатом), взятым в мольном соотношении 2:1 по отношению к дикарбоновой кислоте, после чего полученный этиловый эфир гидролизуют 10-кратным мольным избытком триметилхлорсилана. Предложены новые соединения, эффективные в качестве органических водорастворимых лигандов для комплексообразования с ионами f-элементов, а также новый эффективный способ их получения. 2 н. и 2 з.п. ф-лы, 1 ил., 6 пр.
1. Производные полигетероарил-бис[карбонилнитрилоди(метилен)]тетракис(фосфоновых кислот) общей формулы
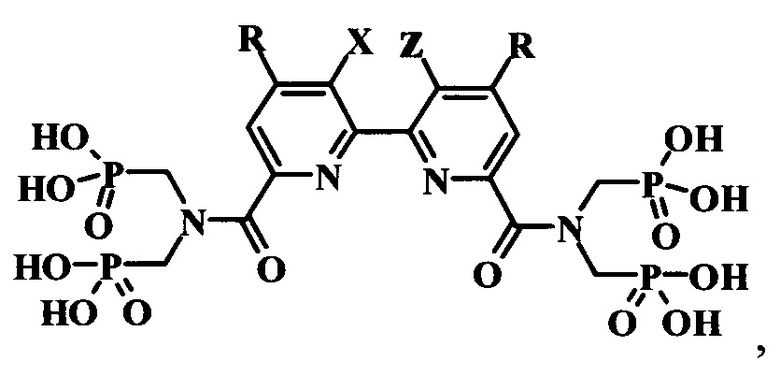
где при X и Z, представляющих собой CH2 группы, соединенные между собой двойной связью (-СН2=СН2-), R представляет собой Cl; в случае, когда X и Z представляет собой Н, R представляет собой Н.
2. Соединение по п. 1, характеризующееся тем, что представляет собой 2,2'-бипиридин-6,6'-диилбис[карбонилнитрилоди(метилен)тетракис(фосфоновую кислоту) формулы

3. Соединение по п. 1, характеризующееся тем, что представляет собой 4,7-дихлор-1,10-фенантролин-2,9-диилбис[карбонилнитрилоди(метилен)]тетракис(фосфоновую кислоту) формулы

4. Способ получения производных полигетероарил-бис[карбонилнитрилоди(метилен)]тетракис(фосфоновых кислот) по п. 1, включающий обработку полигетероарилдикарбоновой кислоты хлористым тионилом, взятым по меньшей мере в 10-кратном мольном избытке по отношению к дикарбоновой кислоте, а затем по реакции полученных хлорангидридов с тетраэтил[иминоди(метилен)]бис(фосфонатом), взятым в мольном соотношении не менее чем 2:1 по отношению к дикарбоновой кислоте, полученные этиловые эфиры гидролизуют триметилхлорсиланом, взятым по меньшей мере в 10-кратном мольном избытке по отношению к эфиру, с получением производных полигетероарил-бис[карбонилнитрилоди(метилен)]тетракис(фосфоновых кислот).
| ДИАМИДЫ 2,2'-БИПИРИДИЛ-6,6'-ДИКАРБОНОВЫХ КИСЛОТ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2530025C2 |
| Xiao-Ping Song et al | |||
| ChemBioChem, 2011, 12, 12, 1868-1880 | |||
| Xiangyou Liu et al | |||
| Chemical Communications, 2011, 28, 47, 8139-8141. | |||
Авторы
Даты
2018-02-27—Публикация
2016-12-20—Подача