Область техники, к которой относится изобретение
Настоящее изобретение относится к способу десорбции хлороводорода из водных растворов соляной кислоты и/или ее гидролизующихся солей и может использоваться, в частности, в процессах дистилляции, ректификации, регенерации и концентрирования соляной кислоты, в том числе в процессах переработки водных растворов гидролизующихся хлоридов.
Уровень техники
Известен промышленно применяемый способ алкилирования углеводородов в присутствии хлорида алюминия в качестве катализатора (Липович В.Г., Полубенцева М.Ф. Алкилирование ароматических углеводородов. - М.: Химия, 1985, с. 248). По завершении процесса очистка реакционной массы от хлорида алюминия проводится путем перевода его в алюминиевые мыла с помощью высших карбоновых кислот. Метод заключается в следующем: в реакционную массу алкилирования при 50-60°C добавляется бензольный раствор карбоновой кислоты с одновременной продувкой инертным сухим газом до прекращения выделения хлорида водорода. Затем реактор продувается влажным инертным газом. После такой обработки реакционная масса освобождается от AlCl3 и отделяется от образовавшегося мыла. Этот способ весьма интересен применением инертного газа для повышения скорости процесса десорбции хлороводорода, но не пригоден для водных растворов и не предусматривает разложение хлорида алюминия (или иного металла).
Известен способ извлечения соляной кислоты и кислородных соединений металлов из хлоридных растворов (СА 2788965 A1, Priority date 2010-02-18, Filing date 2011-02-04, Publication date 2011-08-25), по которому растворы хлоридов Fe, Cu, Co, Ni, Pb, Al, Mg и др. подвергаются гидролизу в концентрированном растворе хлорида цинка, нагретом вплоть до 225°C, с получением раствора соляной кислоты и оксидов или гидроксидов соответствующих металлов за исключением цинка. Высокая температура кипения раствора позволяет проводить процесс при атмосферном давлении. Однако по этому способу возникают проблемы с регенерацией матричного раствора хлорида цинка, так как кислородсодержащие продукты гидролиза выделяются в виде коллоидной гелеобразной фазы (что экспериментально установлено авторами заявляемого изобретения), отделить которую от матричного раствора чрезвычайно сложно.
Известен способ регенерации оксида железа и хлористоводородной кислоты (RU 2495827, Конвенционный приоритет: 19.06.2008 JP 2008-160890), по которому жидкость, содержащую хлорид железа (III), и необязательно свободную хлористоводородную кислоту, гидролизуют при температуре 155-350°C, при поддержании концентрации хлорида железа (III) на уровне не менее 65 мас. % для получения потока, содержащего хлористый водород, и жидкость, содержащую оксид железа (III). Процесс осуществляется при давлении, близком к атмосферному, поскольку поток, содержащий хлористый водород и пары воды, направляется на конденсацию при пониженной температуре. Недостатком этого способа является уже упомянутое выделение кислородсодержащих продуктов гидролиза, например гидроксида алюминия, в виде гелеобразной, не фильтруемой фазы, что также экспериментально установлено авторами заявляемого изобретения.
Известен способ (US 3394056 C1, Priority date 1965-08-31 Filing date: 1965-08-31 Publication date: 1968-07-23 Grant date: 1968-07-23), по которому предложено выделять практически сухой хлороводород из соляной кислоты ее азеотропной ректификацией под избыточным давлением 59-127 бар и соответственно при температуре 279-329°C. Положительный эффект в способе достигается тем, что содержание HCl в азеоторопной смеси при данных условиях составляет 2,8-0,1%. Однако использование столь высоких температур и давлений ограничено коррозионной стойкостью оборудования в солянокислотных средах. Поэтому данный способ не нашел промышленного применения.
Раскрытие изобретения
Задача настоящего изобретения заключается в разработке способа десорбции хлороводорода из водных растворов соляной кислоты и/или ее гидролизующихся солей, позволяющего выделять газообразный хлороводород с содержанием влаги не более 25 мас. % при температурах и давлениях, позволяющих использовать соответствующее оборудование из доступных коррозионностойких материалов, а также сократить затраты тепловой энергии по сравнению с существующей промышленной практикой.
Техническим результатом является создание промышленно реализуемого энергоэффективного способа десорбции хлороводорода из водных растворов с использованием стандартного коррозионностойкого оборудования.
В соответствии с одним аспектом изобретения достижение указанного технического результата обеспечивается тем, что способ десорбции хлороводорода из водного раствора соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли осуществляют следующим образом: а) нагревают указанный водный раствор соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли в герметичном сосуде до температуры от 120 до 240°C и до достижения давления, равного значению равновесного давления водяного пара при данной температуре для данного раствора; б) нагнетают в указанный сосуд по меньшей мере один неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ, до достижения давления, превышающего значение равновесного давления водяного пара при данной температуре; г) выделяют из сосуда смесь газов, включающую хлористый водород и указанный неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ.
В соответствии со вторым аспектом изобретения достижение указанного технического результата обеспечивается тем, что способ десорбции хлороводорода из водного раствора соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли осуществляют следующим образом: а) нагревают указанный водный раствор соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли в герметичном сосуде до температуры от 120 до 240°C и до достижения давления, равного значению равновесного давления паров над жидкой фазой при данной температуре; б) нагнетают в указанный сосуд по меньшей мере один неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ, до достижения давления, превышающего значение равновесного давления паров над жидкой фазой при данной температуре; г) выделяют из сосуда смесь газов, включающую хлористый водород и указанный неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ.
В одном варианте осуществления изобретения полученную в ходе осуществления способа смесь газов подвергают дополнительной обработке для очистки и выделения хлористого водорода.
В одном предпочтительном варианте осуществления изобретения в качестве гидролизующейся соли соляной кислоты может быть использован хлорид алюминия и хлорид железа (III), либо их смесь.
В наиболее предпочтительном варианте осуществления изобретения в качестве гидролизующейся соли соляной кислоты может быть использован хлори алюминия или хлорид железа (III).
В другом предпочтительном варианте осуществления изобретения нагревание указанного водного раствора осуществляют до температуры от 150 до 200°C.
В наиболее предпочтительно варианте нагревание указанного водного раствора осуществляют до температуры 180°C.
В другом предпочтительном варианте осуществления изобретения в качестве неконденсирующегося и инертного по отношению к компонентам жидкой фазы газа могут использовать азот, аргон или гелий. В наиболее предпочтительном варианте осуществления в качестве неконденсирующегося и инертного по отношению к компонентам жидкой фазы газа используют азот.
В другом предпочтительном варианте осуществления изобретения неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ могу нагнетать в указанный сосуд до достижения в нем давления более 30 бар.
В наиболее предпочтительном варианте осуществления неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления не более 35 бар.
В другом наиболее предпочтительном варианте осуществления неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления в интервале от 3 до 35 бар.
В другом варианте осуществления нагнетание в сосуд газа осуществляют до достижения давления, превышающего значение равновесного давления паров над жидкой фазой на 0,2-2 бара. В другом предпочтительном варианте осуществления давление, достигаемое за счет нагнетания в сосуд газа корректируют в ходе процесса десорбции с учетом изменения равновесного давления паров над жидкой фазой.
В соответствии с третьим аспектом изобретения достижение указанного технического результата обеспечивается тем, что предлагаемый способ получения хлороводорода включает дополнительную обработку смеси газов, полученной в способе десорбции хлороводорода из водных растворов в соответствии с первым аспектом иобретения, с последующей очисткой и выделением хлористого водорода.
В соответствии с четвертым аспектом изобретения, достижение указанного технического результата обеспечивается тем, что предлагаемый способ концентрирования соляной кислоты включает абсорбцию водой или раствором соляной кислоты смеси газов, полученной в способе десорбции хлороводорода в соответствии с первым аспектом изобретения, или абсорбцию водой или раствором соляной кислоты хлороводорода, полученного в соответствии со вторым аспектом изобретения.
Там, где это используется в настоящем описании, выражение «инертный газ» в конктексте заявленного изобретения подразумевает неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ, например такой, как аргон, гелий, азот и др.
Десорбция хлороводорода из соляной кислоты или водных растворов ее гидролизующихся солей (хлоридов) используется в промышленности, но инертный газ для этих целей нигде не применялся и не применяется. В отсутствие инертного газа температура и давление в сосуде (автоклаве, реакторе) тесно связаны между собой термодинамическими законами для данной химической системы. Растворы соляной кислоты относятся к системам с так называемым отрицательным азеотропизмом (Коган В.Б. Азеотропная и экстрактивная ректификация. Л.: Госхимиздат, 1951, с. 77). Это означает, что хлороводород и вода нераздельно кипят при более высокой температуре (при нормальном атмосферном давлении 108,5°C), чем оба компонента этой смеси, взятые в чистом виде (Левинский М.И., Мазанко А.Ф., Новиков И.Н. Хлористый водород и соляная кислота. – М.: Химия, 1985, с. 8-24). Так, вода в этих условиях кипит при 100°C, а хлороводород при -85°C. Это создает технологические трудности при дистилляции и ректификации соляной кислоты, и повлекло за собой использование в промышленности таких сложных, многостадийных и энергозатратных процессов, как дистилляция при разных давлениях, солевая ректификация, стриппинг-процесс и т.п. (Якименко Л.М. Производство хлора и каустической соды и неорганических хлорпродуктов. М.: Химия, 1974, с. 492-510).
Авторами настоящего изобретения предлагается управлять процессом десорбции хлороводорода путем изменения давления в системе. Избыточное давление в системе создается нагнетанием в реактор (сосуд) неконденсирующегося и инертного по отношению к компонентам жидкой фазы газа. Предлагаемый прием направлен на подавление скорости испарения воды, как более высококипящего компонента указанной азеотропной смеси. Система H2O-HCl при повышенном внешнем давлении не изучена, но можно предположить, что это повышение приводит к смещению состава азеотропной смеси в сторону увеличения содержания в ней воды.
В случае десорбции хлороводорода из водных растворов гидролизующихся солей соляной кислоты, например, хлоридов Fe, Cu, Co, Ni, Pb, Al, Mg и др., достаточно высокая заявленная температура процесса (120-240°C) обеспечивает ускорение гидролиза указанных солей. Высвобождающийся хлороводород десорбируется из растворов по механизму, описанному выше.
Хлороводород, отведенный из сосуда через редукционный клапан, может быть абсорбирован водой или разбавленным раствором соляной кислоты известными способами, с получением соляной кислоты с концентрацией вплоть до 35%.
Инертный газ, отделенный от хлороводорода, может быть сжат компрессором и вновь введен в сосуд под требуемым давлением.
В процессе десорбции хлороводорода из водного раствора соляной кислоты и/или ее гидролизующихся солей состав жидкой фазы постепенно меняется и приближается к чистой воде. Поэтому в отсутствие оперативных данных о текущем составе жидкой фазы в конкретный момент времени целесообразно поддерживать давление в сосуде постоянно выше равновесного давления паров чистой воды.
Если состав жидкой фазы (и, следовательно, равновесное давление пара над поверхностью жидкой фазы при данной температуре) может быть инструментально определен в ходе процесса десорбции хлороводорода, целесообразно поддерживать давление инертного газа, нагнетаемого в сосуд, на 0,2-2 бара выше равновесного давления пара над поверхностью жидкой фазы. Такой прием позволит дополнительно экономить электроэнергию, расходуемую на сжатие инертного газа.
Краткое описание чертежей
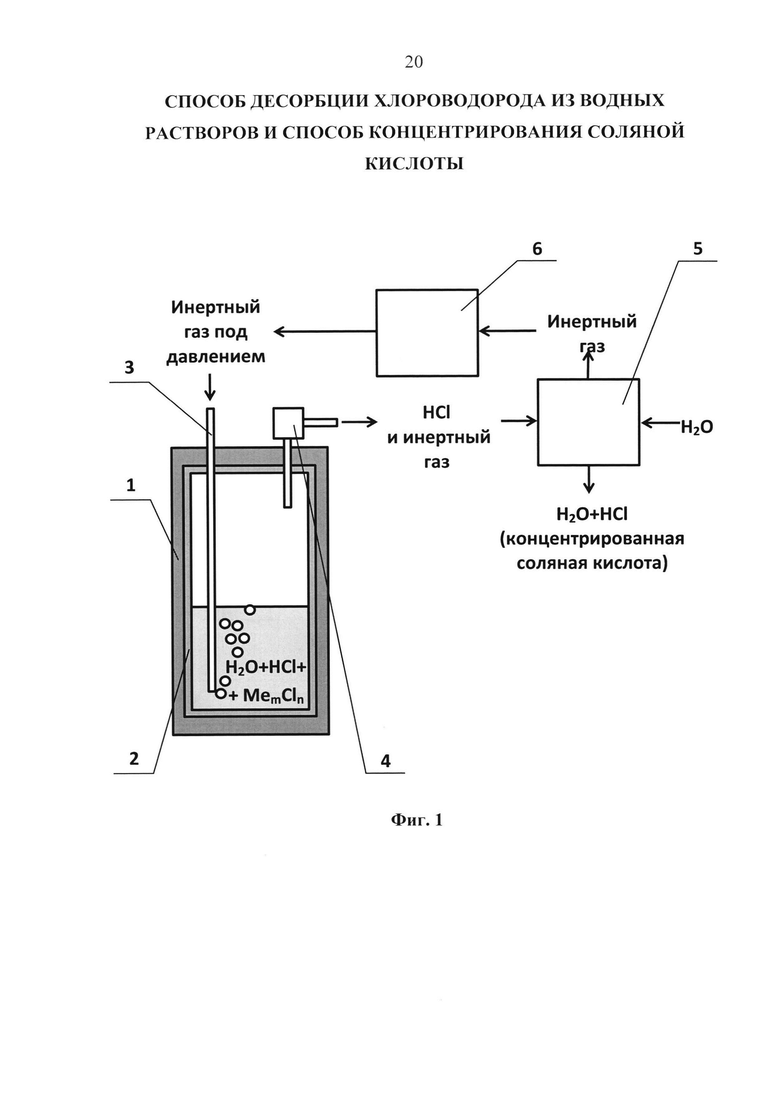
На Фиг. 1 схематически показана лабораторная установка для осуществления способа десорбции хлороводорода из водных растворов соляной кислоты или ее гидролизующийся солей.
1 - корпус установки (сосуда) для осуществления десорбции хлороводорода, изготовленный из нержавеющей стали,
2 - внутренняя футеровка корпуса 1, изготовленная из политетрафторэтилена (ПТФЭ),
3 - трубка для барботирования водного раствора соляной кислоты и/или ее гидролизующихся солей неконденсирующимся и инертным по отношению к компонентам жидкой фазы газом,
4 - редукционный клапан для стравливания избыточного газа, изготовленный из нержавеющей стали,
5 - абсорбер для абсорбции хлороводорода и получения концентрированной соляной кислоты,
6 - компрессор для сжатия инертного газа с целью его повторной подачи в сосуд.
Осуществление изобретения
Экспериментальную реализацию предлагаемого способа осуществляли на лабораторной установке, схематически представленной на Фиг 1. Лабораторная установка представляла собой сосуд (автоклав, реактор), предназначенный для работы под давлением до 50 бар, корпус 1 сосуда был изготовлен из нержавеющей стали с внутренней футеровкой 2 из политетрафторэтилена (ПТФЭ). Из ПТФЭ была изготовлена также трубка 3 для барботирования раствора инертным газом. Остальные детали: внешние трубопроводы и редукционный клапан 4 были выполнены из нержавеющей стали марки 12Х18Н9Т (американский аналог - сталь 321).
В соответствии с дополнительным аспектом изобретения десорбированный хлороводород совместно с неконденсирующимся и инертным по отношению к компонентам жидкой фазы (инертным) газом отводили из сосуда через редукционный клапан 4 в абсорбер 5. В абсорбере 5 хлороводород абсорбировался водой или разбавленным раствором соляной кислоты с получением концентрированной соляной кислоты, а неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ отводился в атмосферу. При промышленной реализации возможно дополнение аппаратурной схемы компрессором 6 для сжатия инертного газа с целью его повторной подачи в сосуд.
Предлагаемый способ иллюстрируется следующими примерами.
Пример 1
50 мл 10-процентной соляной кислоты поместили в сосуд (автоклав), нагрели до 200°C. Равновесное давление в автоклаве составило 9 бар. Равновесное давление паров чистой воды при этих условиях составляет 15,4 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 16 бар. Избыток газов удаляли из автоклава через редукционный клапан, отрегулированный на 16 бар. Через 10 часов процесс прекратили, автоклав охладили. Из автоклава извлекли 44 мл жидкости с pH=6,5, то есть практически чистой воды. Таким образом, несмотря на достаточно высокую температуру и продолжительность процесса испарение воды было крайне мало.
Пример 2
Эксперимент осуществляли аналогично примеру 1, используя в качестве инертного газа азот. Полученные результаты полностью совпадают с примером 1.
Пример 3
5 г хлорида алюминия растворили в 50 мл воды, поместили в сосуд (автоклав), нагрели до 200°C. Равновесное давление в автоклаве составило 8,2 бар. Равновесное давление паров чистой воды при этих условиях составляет 15,4 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 16 бар. Избыток газов удаляли из автоклава через редукционный клапан, отрегулированный на 16 бар. Через 10 часов процесс прекратили, автоклав охладили, открыли, извлекли и разделили твердую и жидкую фазы. Твердый, крупнокристаллический осадок представлял собой смесь различных модификаций оксида алюминия, соответствующих полиморфным модификациям гамма, каппа и, в незначительном количестве, альфа. Примесей хлоридов или оксихлоридов алюминия не обнаружено. Жидкая фаза представляла собой воду.
Пример 4
Эксперимент осуществляли аналогично примеру 3, используя в качестве инертного газа азот. Полученные результаты полностью отвечают примеру 3.
Пример 5
10,0 г хлорида алюминия и 5,0 г хлорида железа растворили в 50 мл воды, поместили в сосуд (автоклав) с фторопластовой футеровкой, нагрели до 200°C. Равновесное давление в автоклаве составило 8,0 бар. Равновесное давление паров чистой воды при этих условиях составляет 15,4 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 16 бар. Избыток газов удаляли из автоклава через редукционный клапан, отрегулированный на 16 бар. Через 10 часов процесс прекратили, автоклав охладили, открыли, извлекли и разделили твердую и жидкую фазы.
Твердый крупнокристаллический осадок представлял собой смесь оксида железа, соответствующего структуре гематита и оксида алюминия, соответствующего структуре корунда с увеличенными параметрами решетки. Примесей хлоридов или оксихлоридов алюминия не обнаружено. Жидкая фаза представляла собой воду.
Пример 6
50 мл 10-процентной соляной кислоты поместили в сосуд (автоклав) и нагрели до 120°C. Равновесное давление в автоклаве составило 1,9 бар. Равновесное давление паров чистой воды при этих условиях составляет 2,0 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 3,0 бар. Через 10 часов процесс прекратили, автоклав охладили. Из автоклава извлекли 43 мл жидкости с pH=4,6, то есть слабокислой воды.
Пример 7
Эксперимент осуществляли аналогично примеру 6 с тем отличием, что инертный газ (аргон) нагнетали со ступенчатым повышением давления от 2,0 бар до 3,0 бар с шагом 0,2 бар через каждый час. Спустя 10 часов от начала эксперимента процесс прекратили, автоклав охладили. Из автоклава извлекли 42,5 мл жидкости с pH=4,5, то есть слабокислой воды.
Пример 8
50 мл 10-процентной соляной кислоты поместили в сосуд (автоклав) и нагрели до 240°C. Равновесное давление в автоклаве составило 27,0 бар. Равновесное давление паров чистой воды при этих условиях составляет 32,5 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 34 бар. Через 10 часов процесс прекратили, автоклав охладили. Из автоклава извлекли 40 мл жидкости с pH=5,1, то есть слабокислой воды.
Пример 9
10,0 г хлорида алюминия и 5,0 г хлорида железа растворили в 50 мл 10-процентной соляной кислоты, поместили в сосуд (автоклав) и нагрели до 200°C. Равновесное давление в автоклаве составило 8,0 бар. Равновесное давление паров чистой воды при этих условиях составляет 15,4 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 16 бар. Через 10 часов процесс прекратили, автоклав охладили. Из автоклава извлекли 42 мл жидкости с pH=6,7, то есть практически чистой воды.
Пример 10
10,0 г хлорида алюминия и 10,0 г хлорида железа растворили в 50 мл 10-процентной соляной кислоты, поместили в сосуд (автоклав) и нагрели до 200°C. Равновесное давление в автоклаве составило 7,8 бар. Равновесное давление паров чистой воды при этих условиях составляет 15,4 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 16 бар. Через 6 часов процесс прекратили, автоклав охладили. Из автоклава извлекли 43 мл жидкости с pH=6,7, то есть практически чистой воды.
Пример 11
10,0 г хлорида алюминия растворили в 50 мл 10-процентной соляной кислоты, поместили в сосуд (автоклав) и нагрели до 200°C. Равновесное давление в автоклаве составило 8,1 бар. Равновесное давление паров чистой воды при этих условиях составляет 15,4 бар. Затем в автоклав стали нагнетать инертный газ (аргон) до 16 бар. Через 10 часов процесс прекратили, автоклав охладили. Из автоклава извлекли 42 мл жидкости с pH=6,7, то есть практически чистой воды.
Таким образом, во всех случаях хлороводород из водного раствора десорбировался практически полностью.
Следует отметить, что детали выпускного тракта сосуда (автоклава), выполненные из нержавеющей стали марки 12Х18Н9Т, которые контактировали с отходящей газовой фазой, содержащей хлороводород за все время проведения экспериментов не подверглись коррозии, что свидетельствует о исключительно малом содержании в этой газовой фазе водяного пара, поскольку влажный хлороводород обладает очень высокой коррозионной способностью по отношению к данной марке стали.
Заявляемый верхний предел температуры в сосуде (автоклаве) (240°C) позволяет использовать при создании промышленного оборудования в качестве коррозионностойкого материала доступный политетрафторэтилен. Нижний предел температуры (120°C) обеспечивает минимальную приемлемую скорость гидролиза хлоридов, позволяющую говорить о возможности ее промышленного применения.
Отсутствие необходимости испарения воды в предлагаемом изобретении позволяет экономить тепловую энергию по сравнению с промышленно применяемыми в рассматриваемой области технологиями, например, широко известным стриппинг процессом в количестве не менее 200 Мкал на каждую тонну выпаренной воды.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛУРГИЧЕСКОГО ГЛИНОЗЕМА (ВАРИАНТЫ) | 2016 |
|
RU2647041C1 |
| СПОСОБ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ И КАТАЛИТИЧЕСКАЯ СИСТЕМА ДЛЯ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ | 1994 |
|
RU2132840C1 |
| СПОСОБ ПЕРЕРАБОТКИ ОТХОДОВ РАСТВОРОВ ХЛОРИДОВ ЖЕЛЕЗА | 2020 |
|
RU2752352C1 |
| ПРИМЕНЕНИЕ ИНДИЯ В КАЧЕСТВЕ СТАБИЛИЗАТОРА КАТАЛИТИЧЕСКОЙ СИСТЕМЫ В СПОСОБЕ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ | 2003 |
|
RU2413714C2 |
| СПОСОБ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ КАРБОНИЛИРОВАНИЕМ ДИМЕТИЛОВОГО ЭФИРА | 1996 |
|
RU2183619C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-АМИНОКАПРОНОВОЙ КИСЛОТЫ | 2021 |
|
RU2786162C2 |
| Способ получения металлургического глинозема кислотно-щелочным способом | 2018 |
|
RU2705071C1 |
| Способ удаления хлорорганических соединений из нефти | 2019 |
|
RU2735843C1 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ СПИРТА | 1996 |
|
RU2173313C2 |
| СПОСОБ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ | 2007 |
|
RU2458908C2 |
Изобретение относится к способу десорбции хлороводорода из водных растворов соляной кислоты и/или ее гидролизующихся солей и может использоваться, в частности, в процессах дистилляции, ректификации и концентрирования соляной кислоты, в том числе в процессах переработки водных растворов гидролизующихся хлоридов. Способ включает а) нагревание водного раствора соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли в герметичном сосуде до заданной температуры и до достижения давления, равного значению равновесного давления паров над жидкой фазой при данной температуре. Затем б) нагнетают в указанный сосуд по меньшей мере один неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ, до достижения давления, превышающего значение равновесного давления водяного пара при данной температуре для чистой воды. Далее г) выделяют из сосуда смесь газов, включающую хлористый водород и указанный неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ. Технический результат заключается в создании промышленно реализуемого энергоэффективного способа десорбции хлороводорода из водных растворов с использованием стандартного коррозионностойкого оборудования. 4 н. и 23 з.п. ф-лы, 1 ил., 11 пр.
1. Способ десорбции хлороводорода из водного раствора соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли, в котором:
а) нагревают указанный водный раствор соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли в герметичном сосуде до температуры от 120 до 240°C и до достижения давления, равного значению равновесного давления паров над жидкой фазой при данной температуре;
б) нагнетают в указанный сосуд по меньшей мере один неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ, до достижения давления, превышающего значение равновесного давления водяного пара при данной температуре для чистой воды;
г) выделяют из сосуда смесь газов, включающую хлористый водород и указанный неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ.
2. Способ по п.1, в котором дополнительно осуществляют выделение хлористого водорода из полученной смеси газов.
3. Способ по п.1, в котором в качестве гидролизующейся соли соляной кислоты используют по меньшей мере одну соль, выбранную из группы, включающей хлорид алюминия и хлорид железа.
4. Способ по п.3, в котором в качестве гидролизующейся соли соляной кислоты используют хлорид алюминия.
5. Способ по п.3, в котором в качестве гидролизующейся соли соляной кислоты используют хлорид железа.
6. Способ по п.1, в котором нагревание указанного водного раствора осуществляют до температуры от 150 до 200°C.
7. Способ по п.6, в котором нагревание указанного водного раствора осуществляют до температуры 180°C.
8. Способ по п.1, в котором в качестве неконденсирующегося и инертного по отношению к компонентам жидкой фазы газа используют газ, выбранный из группы, включающей азот, аргон и гелий.
9. Способ по п.8, в котором в качестве неконденсирующегося и инертного по отношению к компонентам жидкой фазы газа используют азот.
10. Способ по п.1, в котором неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления более 30 бар.
11. Способ по п.10, в котором неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления не более 35 бар.
12. Способ по п.1, в котором неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления в интервале от 3 до 35 бар.
13. Способ десорбции хлороводорода из водного раствора соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли, в котором:
а) нагревают указанный водный раствор соляной кислоты и/или по меньшей мере одной ее гидролизующейся соли в герметичном сосуде до температуры от 120 до 240°C и до достижения давления, равного значению равновесного давления паров над жидкой фазой при данной температуре;
б) нагнетают в указанный сосуд по меньшей мере один неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ, до достижения давления, превышающего значение равновесного давления паров над жидкой фазой при данной температуре;
г) выделяют из сосуда смесь газов, включающую хлористый водород и указанный неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ.
14. Способ по п.13, в котором нагнетание в сосуд газа осуществляют до достижения давления, превышающего значение равновесного давления паров над жидкой фазой на 0,2-2 бара.
15. Способ по п.13, в котором давление, достигаемое за счет нагнетания в сосуд газа, корректируют в ходе процесса десорбции с учетом изменения равновесного давления паров над жидкой фазой.
16. Способ по п.13, в котором в качестве гидролизующейся соли соляной кислоты используют по меньшей мере одну соль, выбранную из группы, включающей хлорид алюминия и хлорид железа.
17. Способ по п.16, в котором в качестве гидролизующейся соли соляной кислоты используют хлорид алюминия.
18. Способ по п.16, в котором в качестве гидролизующейся соли соляной кислоты используют хлорид железа.
19. Способ по п.13, в котором нагревание указанного водного раствора осуществляют до температуры от 150 до 200°C.
20. Способ по п.19, в котором нагревание указанного водного раствора осуществляют до температуры 180°C.
21. Способ по п.13, в котором в качестве неконденсирующегося и инертного по отношению к компонентам жидкой фазы газа используют газ, выбранный из группы, включающей азот, аргон и гелий.
22. Способ по п.21, в котором в качестве неконденсирующегося и инертного по отношению к компонентам жидкой фазы газа используют азот.
23. Способ по п.13, в котором неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления более 30 бар.
24. Способ по п.23, в котором неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления не более 35 бар.
25. Способ по п.13, в котором неконденсирующийся и инертный по отношению к компонентам жидкой фазы газ нагнетают в указанный сосуд до достижения в нем давления в интервале от 3 до 35 бар.
26. Способ получения хлороводорода, в котором смесь газов, полученную в способе по любому из пп.1-12 или пп.13-25, подвергают очистке с выделением хлороводорода.
27. Способ концентрирования соляной кислоты, в котором смесь газов, полученную в способе по любому из пп.1-12 или пп. 13-25 или хлороводород, полученный в способе по п.26, подвергают процессу абсорбции водой или раствором соляной кислоты.
| US 2012134912 A1, 31.05.2012 | |||
| US 2012134912 A1, 31.05.2012 | |||
| А.М.СУХОТИН и др., "Коррозия и защита химической аппаратуры | |||
| Справочное отделение | |||
| Производство хлора и его неорганических соединений", "Химия", Ленинградское отделение, т | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| CN 101792125 A1, 04.08.2010, см | |||
| Насос | 1917 |
|
SU13A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИСТОГО ВОДОРОДА | 0 |
|
SU196733A1 |
Авторы
Даты
2018-03-23—Публикация
2016-07-07—Подача