ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Для настоящей заявки испрашивается приоритет согласно § 119(е) раздела 35 свода законов США по предварительной заявке на патент США с №61/706164, поданной 27 сентября 2012, полное содержание и описание которой включены сюда посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к соединению для борьбы с отсутствием аппетита и способам его применения для борьбы с отсутствием аппетита у животных. В частности, настоящее изобретение относится к новому применению соединения для борьбы с отсутствием аппетита, чтобы потенциально вызвать повышенное потребление пищи и рост сухой мышечной массы у животных, страдающих отсутствием аппетита или другими болезнями или нарушениями, которые вызывают потерю веса, слабость и/или кахексию.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Как и люди, животные-компаньоны и скот могут страдать отсутствием аппетита и другими нарушениями, которые могут приводить к потере сухой мышечной массы, неспособности стать вовлеченными в физическую активность, а также другим нежелательным последствиям для животного-компаньона и хозяина. Например, животные-компаньоны, подвергающиеся химиотерапии или пораженные раком, болезнью сердца или хроническим заболеванием почек, могут страдать отсутствием аппетита, потерей веса, общей слабостью и/или кахексией. Кроме того, состояния или болезни, вызывающие отсутствие аппетита, потерю веса, общую слабость и/или кахексию, могут по меньшей мере частично обостряться в результате того, что рационы этих животных состоят из меньшего количества калорий, витаминов, минералов, белков и других необходимых питательных компонентов вследствие уменьшения потребления пищи. В результате, эти животные могут демонстрировать уменьшение сухой мышечной массы, общую слабость, в том числе ослабление иммунной системы, что, возможно, делает животных чувствительными к инфекциям.
Кроме того, хотя общее увеличение потребления пищи могло бы быть полезным для животных, важно, чтобы у этих животных не наблюдалось значительное увеличение отложения жировой ткани. Соответственно, было бы желательно иметь композицию и способ применения композиции для борьбы с отсутствием аппетита без вызова значительного увеличения жировой ткани. На сегодняшний день нет разрешенных к применению ветеринарных активных фармацевтических ингредиентов для лечения отсутствия аппетита, нежелательной потери веса, общей слабости, кахексии и других связанных недугов, осложнений и болезней. В связи с этим желательно иметь соединение или терапию для применения при лечении отсутствия аппетита у животных, в том числе животных-компаньонов.
Также желательно иметь соединение, которое увеличивает сухую мышечную массу у животных-компаньонов, но это особенно желательно у скота. Увеличение сухой мышечной массы имеет важное значение для общего состояния здоровья животных-компаньонов и скота. Соединение для борьбы с отсутствием аппетита при увеличении сухой мышечной массы не было представлено ранее в данной области техники. Таким образом, существует потребность в соединении, способном к уменьшению отсутствия аппетита при увеличении сухой мышечной массы.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам применения соединения для борьбы с отсутствием аппетита, которое может также увеличить сухую мышечную массу. Например, соединение для борьбы с отсутствием аппетита предпочтительно включает агонист грелина, такой как капроморелин, и назначается одному или более животным-компаньонам (например, собакам или кошкам) или скоту (например, животным, используемым в качестве источника пищи). Композиция, содержащая агонист грелина, предпочтительно предоставляется в терапевтически эффективном количестве для лечения вызванной отсутствием аппетита потери веса или стимулирования увеличения сухой мышечной массы. В некоторых вариантах осуществления содержащую капроморелин композицию вводят животным-компаньонам или скоту множеством различных путей, в том числе в полость рта или внутривенно, и ее можно вводить по меньшей мере один или два раза в день на протяжении схемы лечения. Лишь в качестве примера, в одном варианте осуществления, содержащая капроморелин композиция предпочтительно включает капроморелин в концентрации от приблизительно 0,2 до 6 мг на килограмм веса тела животного. Соединение может представлять собой таблетку или жидкость и может быть подвергнуто корригированию, чтобы спрятать любой неприятный или горький вкус. Кроме того, в некоторых вариантах осуществления содержащую капроморелин композицию назначают животному-компаньону в сочетании с химиотерапевтической схемой для по меньшей мере частичного предотвращения, ингибирования, ослабления отсутствия аппетита, связанного с химиотерапией, и/или борьбы с ним. В другом варианте осуществления содержащую капроморелин композицию вводят в виде части пищевого продукта, лакомства и/или леденца. Например, в предпочтительном варианте осуществления пищевой продукт, лакомство или леденец изготовлен из условия, чтобы содержащая капроморелин композиция была включена в продукт до достижения потребителя. Альтернативно содержащая капроморелин композиция может быть приготовлена в виде жидкости и распылена на пищевой продукт для животных, такой как корм для скота. В альтернативном варианте осуществления содержащую капроморелин композицию добавляют к готовому пищевому продукту, лакомству или леденцу перед кормлением животных-компаньонов.
В частности, обеспечивается способ увеличения сухой мышечной массы у животного, не являющегося человеком. Предпочтительно этот способ включает стадию введения содержащей капроморелин композиции животному, не являющемуся человеком. Предпочтительно способ также частично снимает потерю веса. Содержащую капроморелин композицию предпочтительно вводят перорально. Доза содержащей капроморелин композиции предпочтительно представляет собой терапевтически эффективную дозу содержащей капроморелин композиции. Содержащая капроморелин композиция может необязательно включать один или более корригентов или маскирующих вкус средств, однако это не является обязательным. В предпочтительном варианте осуществления терапевтически эффективная доза содержащей капроморелин композиции побуждает животного, не являющегося человеком, или скот к потреблению больших количеств пищи по сравнению с теми животными, у которых наблюдается отсутствие аппетита, но которые не получают содержащую капроморелин композицию, или по сравнению с не потреблением пищи животным. Кроме того, терапевтически эффективная доза содержащей капроморелин композиции предпочтительно увеличивает сухую мышечную массу по сравнению с теми животными, которые не получают содержащую капроморелин композицию. Предпочтительно, когда сухая мышечная масса увеличивается на 1%-100%, причем предусматриваются такие увеличения, как увеличение сухой мышечной массы на 2%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% и 95%. В дальнейшем варианте осуществления содержащая капроморелин композиция включает капроморелин в концентрации от приблизительно 0,2 до 6 мг на килограмм веса тела животного, не являющегося человеком. Кроме того, может предусматриваться концентрация капроморелина в композиции, как например, 0,5 мг, 0,8 мг, 1,0 мг, 2,0 мг, 3,0 мг, 4,0 мг, 5,0 мг, 6,0 мг или значения в промежутке между ними, где количество капроморелина является таковым на килограмм веса тела животного. В предпочтительном варианте осуществления обеспечивается содержащая капроморелин композиция настоящего изобретения, причем содержащая капроморелин композиция включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам. Кроме того, в некоторых вариантах осуществления, содержащую капроморелин композицию назначают животному, не являющемуся человеком, в сочетании с химиотерапевтической схемой для по меньшей мере частичного предотвращения, ингибирования, ослабления отсутствия аппетита, связанного с химиотерапией, и/или борьбы с ним. Предпочтительно, когда также увеличивается сухая мышечная масса.
В настоящем изобретении предусматривается способ лечения животного, не являющегося человеком, у которого наблюдается вызванная отсутствием аппетита потеря веса. Предпочтительно способ включает стадии определения того, что у животного, не являющегося человеком, наблюдается вызванная отсутствием аппетита потеря веса, и введения по меньшей мере одной дозы содержащей капроморелин композиции животному, не являющемуся человеком. В другом варианте осуществления способ, кроме того, включает стадию слежения за показателем (например, потреблением пищи, весом тела, сухой мышечной массой, уровнями инсулиноподобного фактора роста, гормона роста и т.д.) или получения образца от животного, не являющегося человеком, и измерения количества маркера в плазме (например, уровней инсулиноподобного фактора роста, гормона роста и т.д.) в образце. В некоторых вариантах осуществления доза содержащей капроморелин композиции может регулироваться с учетом количества маркера в плазме в образце. В других вариантах осуществления композиция может вводиться животному, не являющемуся человеком, пока животное не наберет достаточный вес. В некоторых вариантах осуществления маркером в плазме может быть по меньшей мере один из инсулиноподобного фактора-1 роста, кортизола, капроморелина и их комбинации. Например, в некоторых вариантах осуществления дозу содержащей капроморелин композиции увеличивают до уровня, который вызывает увеличение количества инсулиноподобного фактора-1 роста в образце. В некоторых вариантах осуществления дозу содержащей капроморелин композиции можно уменьшить для соответствующего уменьшения количества кортизола в образце. В другом варианте осуществления способ, кроме того, включает стадию получения образца сыворотки от животного, не являющегося человеком, причем образец сыворотки необязательно может быть проанализирован в отношении уровня определенных маркеров в плазме или изменений уровня определенных маркеров в плазме в течение времени.
В настоящем изобретении, кроме того, предусматривается фармацевтическая композиция для лечения отсутствия аппетита у животных, не являющихся людьми. Предпочтительно фармацевтическая композиция включает терапевтически эффективное количество капроморелина и по меньшей мере один носитель. Необязательно, фармацевтическая композиция также включает по меньшей мере одно из следующего: корригент или маскирующее вкус средство (например, подсластитель, соленое вещество, горькое вещество, подкисливающее средство и т.д.). Кроме того, в некоторых вариантах осуществления фармацевтическая композиция включает или эмульгатор, или загуститель, или их комбинации. Например, фармацевтическая композиция предпочтительно включает от приблизительно 0,01% до приблизительно 10% в отношении веса к объему эмульгатора и/или загустителя, причем предусматриваются такие значения, как 0,03%, 0,2%, 0,4%, 0,6%, 0,8%, 1,0%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% и 10% в отношении веса к объему эмульгатора и/или загустителя. Терапевтически эффективное количество капроморелина предпочтительно включает концентрацию, составляющую от приблизительно 0,2 до 6 мг капроморелина на килограмм веса тела животного, не являющегося человеком. Кроме того, может предусматриваться концентрация капроморелина в композиции, как например, 0,5 мг, 0,8 мг, 1,0 мг, 2,0 мг, 3,0 мг, 4,0 мг, 5,0 мг, 6,0 мг или значения в промежутке между ними, где количество капроморелина является таковым на килограмм веса тела животного. В дополнительном варианте осуществления настоящего изобретения фармацевтическая композиция включает носитель, и объем дозы может содержаться в шприце для перорального введения. В предпочтительном варианте осуществления обеспечивается содержащая капроморелин композиция, причем содержащая капроморелин композиция содержит количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам. Фармацевтическая композиция настоящего изобретения может быть приготовлена для перорального, внутривенного, внутримышечного и/или подкожного введения. В вариантах осуществления, включающих носитель, носитель может включать солевой или буферный раствор, который может быть смешан с капроморелином. Предпочтительно, вариант осуществления, содержащий солевой или буферный раствор, может вводиться с помощью внутривенного или подкожного введения. Фармацевтическая композиция настоящего изобретения предоставляется в предпочтительной дозе, составляющей приблизительно 1, приблизительно 3, приблизительно 4,5 и/или приблизительно 6 мг капроморелина на килограмм веса тела. Дозу фармацевтической композиции настоящего изобретения предпочтительно вводят животному, не являющемуся человеком, по меньшей мере один раз в день или по меньшей мере два раза в день в течение заданного периода времени, но и предусматриваются дополнительные последующие дозы. В одном варианте осуществления заданный период времени для введения составляет приблизительно семь дней.
Настоящим изобретением обеспечивается еще один способ лечения потери веса у животного-компаньона. Предпочтительно, также обеспечивается способ увеличения сухой мышечной массы у животного или скота. Предпочтительно способ включает стадии определения того, что у животного-компаньона наблюдается потеря веса, и введения по меньшей мере одной дозы содержащей капроморелин композиции животному. В дальнейшем варианте осуществления способ включает стадию введения композиции в организм животного с помощью шприца. Способ необязательно включает дополнительную стадию оценки одного или более маркеров в плазме у животного, которые связаны с потерей веса. Предпочтительно, дозу содержащей капроморелин композиции регулируют с учетом оценки одного или более маркеров в плазме. Маркеры в плазме предпочтительно включают, но без ограничения, инсулиноподобный фактор-1 роста, кортизол, капроморелин и их комбинации. Например, доза содержащей капроморелин композиции может быть увеличена или уменьшена в зависимости от уровня маркера в плазме, присутствующего у животного. Предпочтительно фармацевтическую композицию настоящего изобретения вводят животному-компаньону по меньшей мере один или два раза в день. Предпочтительная доза композиции включает концентрацию от приблизительно 0,2 до приблизительно 6 мг капроморелина на килограмм веса тела животного-компаньона или скота. Кроме того, может предусматриваться концентрация капроморелина в композиции, как например, 0,5 мг, 0,8 мг, 1,0 мг, 2,0 мг, 3,0 мг, 4,0 мг, 5,0 мг, 6,0 мг или значения в промежутке между ними, где количество капроморелина является таковым на килограмм веса тела животного. В одном варианте осуществления содержащая капроморелин композиция содержит количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам. Предпочтительно, когда композицию вводят животному-компаньону путем перорального, внутривенного, внутримышечного, подкожного или внутрибрюшинного введения. В дополнительном варианте осуществления оценивается показатель для определения того, нужны ли животному последующие дозы или увеличенное количество содержащей капроморелин композиции. Показатели включают, но без ограничения, изменение веса, увеличение веса, потерю веса, изменение потребления пищи и увеличение или уменьшение сухой мышечной массы.
Настоящим изобретением также обеспечивается набор для лечения вызванной отсутствием аппетита потери веса у животного, не являющегося человеком. Предпочтительно набор включает шприц и сосуд, содержащий фармацевтическую композицию, которая включает капроморелин. Набор также предпочтительно включает инструкции для информирования пользователя о заборе дозы композиции из сосуда и введении дозы животному, не являющемуся человеком. Инструкции предпочтительно информируют пользователя о заборе приблизительно одной дозы фармацевтической композиции из сосуда с помощью шприца и введении приблизительно одной дозы фармацевтической композиции животному, не являющемуся человеком, с помощью шприца. Фармацевтическая композиция, включенная в набор, предпочтительно приготовлена для перорального, внутривенного, внутримышечного и/или подкожного введения.
Дальнейший способ настоящего изобретения обеспечивает лечение животных, не являющихся людьми, (например, скота) с помощью фармацевтической композиции, которая может вызывать полезное повышение веса у животных, не являющихся людьми, причем животные, не являющиеся людьми, включают, но без ограничения, животных-компаньонов и скот. Например, эффективное и/или увеличенное повышение веса предпочтительно вызывается после введения фармацевтической композиции настоящего изобретения животному, не являющемуся человеком. В варианте осуществления, в котором фармацевтическую композицию вводят скоту, у скота предпочтительно увеличивается сухая мышечная масса. Фармацевтическая композиция настоящего изобретения может быть введена животным, не являющимся людьми, с помощью одного или более путей введения. Путь введения предпочтительно выбирают из группы, состоящей, но без ограничения, из перорального, внутривенного введения или в виде имплантата, размещенного в кожной или мышечной ткани скота. Альтернативно, фармацевтическая композиция настоящего изобретения может быть смешана с кормом, предоставляемым животным, не являющимся людьми, для питания. В дальнейшем альтернативном варианте осуществления композиция может быть введена в виде пилюли, таблетки, имплантата, пластыря, пленки, инъекции, суппозитория, чрескожно, спрея для пищевых продуктов, заполненного жидкостью шприца и т.д., или их комбинации. В некоторых вариантах осуществления композиция может назначаться скоту в виде части пищевого продукта (например, корма для скота), так что обычный процесс кормления приводит к введению композиции скоту. Кроме того, композиция может быть введена скоту в дозе, составляющей от 0,2 мг до 6,0 мг капроморелина на килограмм веса тела скота. Кроме того, может предусматриваться концентрация капроморелина в композиции, как например, 0,5 мг, 0,8 мг, 1,0 мг, 2,0 мг, 3,0 мг, 4,0 мг, 5,0 мг, 6,0 мг или значения в промежутке между ними, где количество капроморелина является таковым на килограмм веса тела животного. Предпочтительно, когда у животных, не являющихся людьми, (например, скота) наблюдается повышение сухой мышечной массы после введения фармацевтической композиции настоящего изобретения. Предпочтительно, когда увеличение сухой мышечной массы приводит к улучшению производства мяса для продажи последующим потребителям.
В дальнейшем варианте осуществления фармацевтическая композиция настоящего изобретения обеспечивается в виде фармацевтической композиции для перорального введения, подходящей для лечения отсутствия аппетита у собак или кошек. Предпочтительно, фармацевтическая композиция для перорального введения включает терапевтически эффективное количество капроморелина. Терапевтически эффективное количество капроморелина предпочтительно включает концентрацию, составляющую от приблизительно 0,2 мг до примерно 4 мг капроморелина на килограмм веса тела собак или кошек. Однако концентрация капроморелина может также включать количества, составляющие приблизительно 0,5 мг, 0,8 мг, 1,0 мг, 1,5 мг, 2,0 мг, 2,5 мг, 3,0 мг и приблизительно 4,0 мг капроморелина на килограмм веса тела собак или кошек.
Настоящим изобретением также обеспечивается способ лечения или профилактики липидоза печени у животных-компаньонов. Предпочтительно животным-компаньоном является кошка, однако изобретение не ограничивается этим и может включать другого животного-компаньона, такого как, но без ограничения, собаки. Способ предпочтительно включает стадии введения терапевтически эффективного количества содержащей капроморелин композиции животному-компаньону. Композиция может вводиться перорально, используя способ введения, выбираемый, но без ограничения, из шприца, аэрозоля, пилюли или таблетки, или композиция может быть введена парентерально. Предпочтительная доза композиции включает концентрацию, составляющую от приблизительно 2 мг до приблизительно 4 мг капроморелина на килограмм веса тела животных-компаньонов. Однако концентрация капроморелина может также включать количества, составляющие приблизительно 0,5 мг, 0,8 мг, 1,0 мг, 1,5 мг, 2,0 мг, 2,5 мг, 3,0 мг и приблизительно 4,0 мг капроморелина на килограмм веса тела собак или кошек. В предпочтительном варианте осуществления содержащая капроморелин композиция включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам.
Настоящим изобретением также обеспечивается способ лечения отсутствия аппетита у животного, не являющегося человеком. Предпочтительно способ включает стадии введения фармацевтической композиции животному, не являющемуся человеком, по меньшей мере один раз в день до тех пор, пока не произойдет достаточное увеличение веса. В некоторых аспектах достаточное увеличение веса включает увеличение веса тела на 5%, 10% или 20% относительно веса тела животного, не являющегося человеком, до получения фармацевтической композиции. Предпочтительно, когда фармацевтическая композиция включает приблизительно 3 мг капроморелина на килограмм веса тела животного, не являющегося человеком.
Кроме того, настоящим изобретением также обеспечивается способ сохранения веса тела у животного-компаньона. Предпочтительно способ включает стадии введения некоторого количества содержащей капроморелин композиции животному-компаньону и слежение за весом животного-компаньона для определения того, что вес тела животного сохраняется. В одном варианте осуществления композиция вводится животному-компаньону по меньшей мере один раз в два дня в течение приблизительно одного месяца. Предпочтительная доза фармацевтической композиции включает концентрацию, составляющую 0,2 мг капроморелина на килограмм веса тела животного-компаньона. В дальнейшем варианте осуществления композиция может вводиться перорально или вводиться в виде части леденца, лакомства или пищевого продукта.
Также обеспечивается способ достижения желаемых фармакокинетических значений путем введения фармацевтической композиции и носителя. Композиция, вводимая в качестве части способа, предпочтительно включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно 2 часам. Альтернативно, композиция включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 905 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно 25 минутам. Предпочтительно, Tmax составляет от приблизительно двадцати пяти минут до 2 часов, причем Tmax может составлять 25 минут, 30 минут, 1 час или 2 часа. Cmax предпочтительно находится в диапазоне от приблизительно 100 нг/мл до приблизительно 1000 нг/мл.
Кроме особо оговоренных случаев, все технические и научные термины, используемые здесь, имеют значение, одинаковое со значением, в котором они обычно понимаются специалистом в области техники, к которой относится это изобретение на момент подачи заявки. В случае специального определения термина определение, представленное здесь, превалирует над любым приведенным в словаре или вне этого документа определением. Кроме того, если иное не предусмотрено по контексту, термины в единственном числе должны включать термины во множественном числе, а термины во множественном числе должны включать термины в единственном числе. Здесь использование «или» означает «и/или», если не указано иное. Все патенты и публикации, на которые здесь ссылаются, включены посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой график в виде ломаной линии, на котором представлено сравнение между первой схемой лечения капроморелином (3 мг капроморелина на килограмм веса тела, которые вводят дважды в день), второй схемой лечения капроморелином (6 мг капроморелина на килограмм веса тела, которые вводят один раз в день) и отрицательным контролем.
Фиг. 2 представляет собой график в виде ломаной линии, на котором представлены касающиеся потребления пищи данные Фиг. 1 лишь для кобелей гончих.
Фиг. 3 представляет собой график в виде ломаной линии, на котором представлены касающиеся потребления пищи данные Фиг. 1 лишь для сук гончих.
Фиг. 4 представляет собой график в виде ломаной линии, на котором представлено сравнение между первой схемой лечения капроморелином, второй схемой лечения капроморелином и отрицательным контролем.
Фиг. 5 представляет собой график в виде ломаной линии, на котором представлено сравнение между первой схемой лечения капроморелином, второй схемой лечения капроморелином и отрицательным контролем.
Фиг. 6 представляет собой график в виде ломаной линии, на котором представлено увеличение веса по сравнению с исходными данными, представленное на Фиг. 5, лишь для кобелей гончих.
Фиг. 7 представляет собой график в виде ломаной линии, на котором представлено увеличение веса по сравнению с исходными данными, представленное на Фиг. 5, лишь для сук гончих.
Фиг. 8 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля.
Фиг. 9 представляет собой график в виде ломаной линии, на котором представлена концентрация капроморелина в сыворотке, представленная на Фиг. 8, лишь для кобелей гончих.
Фиг. 10 представляет собой график в виде ломаной линии, на котором представлена концентрация капроморелина в сыворотке, представленная на Фиг. 8, лишь для сук гончих.
Фиг. 11 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора 1 роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, в первый день лечения.
Фиг. 12 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора 1 роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на второй день лечения.
Фиг. 13 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора 1 роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на четвертый день лечения.
Фиг. 14 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора 1 роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на седьмой день лечения.
Фиг. 15 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации инсулиноподобного фактора 1 роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, через три дня после завершения схем лечения.
Фиг. 16 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации гормона роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, в первый день лечения.
Фиг. 17 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации гормона роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на второй день лечения.
Фиг. 18 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации гормона роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на четвертый день лечения.
Фиг. 19 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации гормона роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на седьмой день лечения.
Фиг. 20 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации гормона роста в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, через три дня после завершения схем лечения.
Фиг. 21 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, в первый день лечения.
Фиг. 22 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на второй день лечения.
Фиг. 23 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, на седьмой день лечения.
Фиг. 24 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации кортизола в сыворотке кобелей и сук, подвергнутых лечению с использованием первой схемы лечения, второй схемы лечения и отрицательного контроля, через три дня после завершения схем лечения.
Фиг. 25 представляет собой график в виде ломаной линии, на котором представлены результаты экспериментов по проверке первой схемы лечения капроморелином в сочетании с положительным контролем (т.е. внутривенным введением) и двумя корригирующими составами, определяемые по концентрации капроморелина в сыворотке кобелей и сук гончих в течение восьми часов.
Фиг. 26 представляет собой график в виде ломаной линии, на котором представлены результаты экспериментов по проверке первой схемы лечения капроморелином в сочетании с дополнительными тремя корригирующими составами, определяемые по концентрации капроморелина в сыворотке кобелей и сук гончих в течение восьми часов.
Фиг. 27 представляет собой диаграмму в виде столбцов, на которой представлены концентрации инсулиноподобного фактора-1 роста в сыворотке кобелей и сук гончих из экспериментов с результатами, представленными на Фиг. 25 и 26.
Фиг. 28 представляет собой график в виде ломаной линии, на котором представлены результаты экспериментов по проверке первый схемы лечения капроморелином в сочетании с четырьмя корригирующими составами, определяемые по концентрации капроморелина в сыворотке кобелей и сук гончих в течение восьми часов.
Фиг. 29 представляет собой диаграмму в виде столбцов, на которой представлены концентрации инсулиноподобного фактора-1 роста 1 в сыворотке кобелей и сук гончих из экспериментов с результатами, представленными на Фиг. 28.
Фиг. 30 представляет собой диаграмму в виде столбцов, на которой представлено общее количество пищи, потребленной гончими в ответ на получение различных концентраций содержащей капроморелин композиции и схем лечения ею.
Фиг. 31 представляет собой график в виде ломаной линии, на котором представлено среднесуточное потребление пищи гончими в ответ на получение различных концентраций содержащей капроморелин композиции и схем лечения ею.
Фиг. 32 представляет собой график в виде ломаной линии, на котором представлен средний вес тела гончих, которые получили различные концентрации содержащей капроморелин композиции и схемы лечения ею.
Фиг. 33 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке гончих в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 34 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке гончих на 7-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 35 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора-1 роста в сыворотке гончих в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 36 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора-1 роста в сыворотке гончих на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 37 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора-1 роста в сыворотке гончих на 7-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 38 представляет собой диаграмму в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора-1 роста в сыворотке гончих после семи дней лечения различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею и трех дней без лечения (т.е. в 10 день).
Фиг. 39 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации гормона роста в сыворотке гончих в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 40 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации гормона роста в сыворотке гончих на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 41 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации гормона роста в сыворотке гончих на 7-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 42 представляет собой диаграмму в виде ломаной линии, на которой представлены измерения концентрации гормона роста в сыворотке гончих после семи дней лечения различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею и трех дней без лечения (т.е. в день 10).
Фиг. 43 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке гончих в 1-й день после подвергания лечению различными
концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 44 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке гончих на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 45 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке гончих на 7-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 46 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации кортизола в сыворотке гончих после семи дней лечения различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею и трех дней без лечения (т.е. в день 10).
Фиг. 47 представляет собой график в виде ломаной линии, на котором представлены концентрации капроморелина в сыворотке на протяжении двенадцати часов у кошек, получивших внутривенную инъекцию 0,75 мг капроморелина на килограмм веса тела.
Фиг. 48 представляет собой график в виде ломаной линии, на котором представлены концентрации капроморелина в сыворотке на протяжении двенадцати часов у кошек, которым перорально введены 3 мг капроморелина на килограмм теса тела.
Фиг. 49 представляет собой диаграмму в виде столбцов, на которой представлены концентрации инсулиноподобного фактора-1 роста в сыворотке у кошек, которым внутривенно и перорально введен капроморелин.
Фиг. 50 представляет собой график в виде ломаной линии, на котором представлено среднесуточное потребление пищи кошками в ответ на получение различных концентраций содержащей капроморелин композиции и схем лечения ею.
Фиг. 51 представляет собой диаграмму в виде столбцов, на которой представлен средний вес кошек, которые получили различные концентрации содержащей капроморелин композиции и схемы лечения ею.
Фиг. 52 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 53 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 54 представляет собой диаграмму в виде столбцов, на которой представлены концентрации капроморелина в сыворотке кошек через три дня после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 55 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора-1 роста в сыворотке кошек в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 56 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации инсулиноподобного фактора-1 роста в сыворотке кошек на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 57 представляет собой диаграмму в виде столбцов, на которой представлены концентрации инсулиноподобного фактора-1 роста в сыворотке кошек через семь дней лечения различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею и три дня без лечения (т.е. в день 10).
Фиг. 58 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке кошек в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 59 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке кошек на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 60 представляет собой диаграмму в виде столбцов, на которой представлены концентрации кортизола в сыворотке кошек через семь дней лечения различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею и три дня без лечения (т.е. в день 10).
Фиг. 61 представляет собой график в виде ломаной линии, на котором представлены измерения потребленной животными пищи на протяжении эксперимента, в котором животные были подвергнуты лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 62 представляет собой график в виде ломаной линии, на котором представлены концентрации капроморелина в сыворотке животных в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 63 представляет собой график в виде ломаной линии, на котором представлены концентрации капроморелина в сыворотке животных на 7-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 64A представляет собой график в виде ломаной линии, на котором представлены концентрации IGF-1 в сыворотке животных в 1-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 64B представляет собой график в виде ломаной линии, на котором представлены концентрации IGF-1 в сыворотке животных на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 65 представляет собой график в виде ломаной линии, на котором представлены концентрации IGF-1 в сыворотке животных на 7-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 66 представляет собой график в виде ломаной линии, на котором представлены концентрации IGF-1 в сыворотке животных после семи дней лечения содержащей капроморелин композицией и двух дней без лечения (т.е. в день 9).
Фиг. 67 представляет собой график в виде ломаной линии, на котором представлены концентрации гормона роста в сыворотке животных в 1-ый день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 68 представляет собой график в виде ломаной линии, на котором представлены концентрации гормона роста в сыворотке животных на 4-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 69 представляет собой график в виде ломаной линии, на котором представлены концентрации гормона роста в сыворотке животных на 7-й день после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 70 представляет собой диаграмму в виде столбцов, на которой представлены концентрации гормона роста в сыворотке животных после семи дней лечения с использованием схем лечения содержащей капроморелин композицией и двух дней без лечения (т.е. в день 9).
Фиг. 71 представляет собой график в виде ломаной линии, на котором представлены концентрации кортизола в сыворотке животных в день 1 после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 72 представляет собой график в виде ломаной линии, на котором представлены концентрации кортизола в сыворотке животных в день 4 после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 73 представляет собой график в виде ломаной линии, на котором представлены концентрации кортизола в сыворотке животных в день 7 после подвергания лечению различными концентрациями содержащей капроморелин композиции и с использованием различных схем лечения ею.
Фиг. 74 представляет собой диаграмму в виде столбцов, на которой представлены концентрации кортизола в сыворотке животных после семи дней лечения с использованием схем лечения содержащей капроморелин композицией и двух дней без лечения (т.е. в день 9).
Фиг. 75 представляет собой диаграмму в виде столбцов, на которой представлено среднее увеличение веса у животных в течение пятидневного исследования, в котором сравниваются два состава содержащей капроморелин композиции.
Фиг. 76 представляет собой график в виде ломаной линии, на котором представлено потребление пищи животными в течение пятидневного исследования, в котором сравниваются два состава содержащей капроморелин композиции.
Фиг. 77 представляет собой график в виде ломаной линии, на котором представлены средние концентрации капроморелина в сыворотке животных на 5 день после подвергания лечению двумя составами содержащей капроморелин композиции.
Фиг. 78 представляет собой диаграмму в виде столбцов, на которой представлены средние концентрации IGF-1 в сыворотке животных на 5 день после подвергания лечению двумя составами содержащей капроморелин композиции.
Фиг. 79 представляет собой таблицу, в которой представлены наблюдения приемлемости в течение шести дней у кошек, которым перорально вводили содержащую капроморелин композицию.
Фиг. 80 представляет собой таблицу, в которой представлены наблюдения приемлемости в течение шести дней у кошек, которым перорально вводили содержащую капроморелин композицию.
Фиг. 81 представляет собой таблицу, в которой представлены наблюдения приемлемости в течение шести дней у кошек, которым перорально вводили содержащую капроморелин композицию.
Фиг. 82 представляет собой таблицу, в которой представлены наблюдения приемлемости в течение шести дней у кошек, которым перорально вводили содержащую капроморелин композицию.
Фиг. 83 представляет собой диаграмму в виде столбцов, на которой представлено измерение веса тела животных на протяжении эксперимента, в котором животных подвергали лечению различными составами содержащей капроморелин композиции.
Фиг. 84 представляет собой таблицу, в которой представлены измерения потребления пищи до и во время шестидневного периода у кошек, которым перорально вводили содержащую капроморелин композицию.
Фиг. 85 представляет собой таблицу, в которой представлены измерения потребления пищи (в граммах) до и во время шестидневного периода у кошек, которым перорально вводили содержащую капроморелин композицию.
Фиг. 86 представляет собой график в виде ломаной линии, на котором представлены измерения потребленной животными пищи на протяжении эксперимента, в котором животные были подвергнуты лечению различными составами содержащей капроморелин композиции.
Фиг. 87 представляет собой график в виде ломаной линии, на котором представлены концентрации капроморелина в сыворотке животных на 6-й день после подвергания лечению различными составами содержащей капроморелин композиции.
Фиг. 88 представляет собой диаграмму в виде столбцов, на которой представлены концентрации IGF-1 в сыворотке животных на 6-й день после подвергания лечению различными составами содержащей капроморелин композиции.
Фиг. 89 представляет собой график в виде ломаной линии, на котором представлено измерение веса тела животных в дни 1 и 8 эксперимента, в котором животных подвергали лечению различными дозами состава содержащей капроморелин композиции.
Фиг. 90 представляет собой диаграмму в виде столбцов, на которой представлено измерение веса тела животных в дни 1 и 8 эксперимента, в котором животных подвергали лечению различными дозами состава содержащей капроморелин композиции.
Фиг. 91 представляет собой график в виде ломаной линии, на котором представлены измерения количества потребленной животными пищи на протяжении эксперимента, в котором животных подвергали лечению различными дозами состава содержащей капроморелин композиции.
Фиг. 92 представляет собой график в виде ломаной линии, демонстрирующий корреляцию между изменениями потребления пищи с изменениями веса тела для экспериментов, представленных на Фиг. 89-91.
Фиг. 93 представляет собой график в виде ломаной линии, на котором представлено среднесуточное потребление пищи кошками в ответ на получение различных концентраций содержащей капроморелин композиции.
Фиг. 94 представляет собой диаграмму в виде столбцов, на которой представлен средний вес кошек, которые получили различные концентрации содержащей капроморелин композиции.
Фиг. 95 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек в 1-ый день после подвергания лечению различными концентрациями содержащей капроморелин композиции.
Фиг. 96 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек на 10 день после подвергания лечению различными концентрациями содержащей капроморелин композиции.
Фиг. 97 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации IGF-1 в сыворотке кошек в 1-ый день после подвергания лечению различными концентрациями содержащей капроморелин композиции.
Фиг. 98 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации IGF-1 в сыворотке кошек на 10 день после подвергания лечению различными концентрациями содержащей капроморелин композиции.
Фиг. 99 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации IGF-1 в сыворотке кошек после десяти дней лечения различными концентрациями содержащей капроморелин композиции и двух дней без лечения (т.е. в день 12).
Фиг. 100 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации IGF-1 в сыворотке кошек после десяти дней лечения различными концентрациями содержащей капроморелин композиции и пяти дней без лечения (т.е. в день 15).
Фиг. 101 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке кошек в 1-ый день после подвергания лечению различными концентрациями содержащей капроморелин композиции.
Фиг. 102 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации кортизола в сыворотке кошек на 10 день после подвергания лечению различными концентрациями содержащей капроморелин композиции.
Фиг. 103 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации кортизола в сыворотке кошек после десяти дней лечения различными концентрациями содержащей капроморелин композиции и двух дней без лечения (т.е. в день 12).
Фиг. 104 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации кортизола в сыворотке кошек после десяти дней лечения различными концентрациями содержащей капроморелин композиции и пяти дней без лечения (т.е. в день 15).
Фиг. 105 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек в день 0 (т.е. в первый день эксперимента), после внутривенного введения капроморелина в концентрации, составляющей 0,75 мг/кг.
Фиг. 106 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек в день 0 (т.е. в первый день эксперимента), после перорального введения капроморелина в концентрации, составляющей 3,0 мг/кг.
Фиг. 107 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации IGF-1 в сыворотке кошек в день 0 (т.е. в первый день эксперимента) после получения различных лечений содержащей капроморелин композицией.
Фиг. 108 представляет собой таблицу, в которой представлены данные фармакокинетических исследований кошек, которым внутривенно вводили содержащую капроморелин композицию.
Фиг. 109 представляет собой таблицу, в которой представлены данные фармакокинетических исследований кошек, которым перорально вводили содержащую капроморелин композицию.
Фиг. 110 представляет собой диаграмму в виде столбцов, на которой представлены измерения веса тела кошек, которые были подвергнуты различным лечениям с использованием содержащей капроморелин композиции на протяжении четырнадцатидневного эксперимента.
Фиг. 111 представляет собой график в виде ломаной линии, на котором представлены измерения потребления пищи на протяжении четырнадцатидневного эксперимента.
Фиг. 112 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек в день 0 (т.е. в первый день эксперимента) после или внутривенного введения капроморелина в дозе, составляющей 0,75 мг/кг, или подкожного введения капроморелина в дозе, составляющей 2 мг/кг.
Фиг. 113 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек в день 13 (т.е. на четырнадцатый день эксперимента) после подкожных введений капроморелина в дозе, составляющей 2 мг/кг, в течение 14 дней.
Фиг. 114 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации IGF-1 в сыворотке кошек в день 0 (т.е. в первый день эксперимента) после внутривенного введения содержащей капроморелин композиции.
Фиг. 115 представляет собой диаграмму в виде столбцов, на которой представлены измерения концентрации IGF-1 в сыворотке кошек в день 0 (т.е. в первый день эксперимента) и день 13 (т.е. на четырнадцатый день эксперимента) после схемы лечения с использованием подкожно вводимого капроморелина.
Фиг. 116 представляет собой график в виде ломаной линии, на котором представлены измерения концентрации капроморелина в сыворотке кошек в день 0 (т.е. в первый день эксперимента) после или внутривенного введения капроморелина в дозе, составляющей 0,75 мг/кг, или подкожного введения капроморелина в дозе, составляющей 2 мг/кг.
Фиг. 117 представляет собой таблицу, в которой представлены данные фармакокинетических исследований кошек, которым внутривенно вводили содержащую капроморелин композицию.
Фиг. 118 представляет собой таблицу, в которой представлены данные фармакокинетических исследований кошек, которым подкожно вводили содержащую капроморелин композицию.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Представленные здесь композиции могут использоваться для лечения, профилактики, частичного снятия вызванной отсутствием аппетита потери веса и/или борьбы с ней у животных, в том числе животных-компаньонов, а также применения для лошадей, скота, ряда млекопитающих и видов птиц. Например, скот включает любых животных, не являющихся людьми, которые могут быть использованы в производстве пищевых продуктов, которое включает, но без ограничения, коров различных видов, овец различных видов, свиней различных видов и других животных, продукты (например, мясо, полученное из мышц) на основе которых могут потребляться людьми. Предпочтительно, когда после введения фармацевтической композиции настоящего изобретения животному, не являющемуся человеком, композиция вызывает продукцию одной или более молекул, которые могут привести к испытанию животным, не являющимся человеком, чувства голода. В одном варианте осуществления обеспечивается способ увеличения продукции одной или более молекул, которые приводят к испытанию животным чувства голода. Предпочтительно способ включает стадию введения композиции, содержащей капроморелин, животному, у которого наблюдается отсутствие аппетита.
Также обеспечивается способ увеличения сухой мышечной массы. Предпочтительно способ включает стадию введения композиции, содержащей капроморелин. Предпочтительно, когда введение содержащей капроморелин композиции животному, не являющемуся человеком, индуцирует одну или более молекул, которые увеличивают сухую мышечную массу. В одном варианте осуществления корм, потребленный в результате увеличения чувства голода, являющегося следствием введения содержащей капроморелин композиции, используется для увеличения сухой мышечной массы вместо значительного количества отложения жира. Композиция настоящего изобретения предпочтительно увеличивает сухую мышечную массу на по меньшей мере 5%, по меньшей мере 10% или по меньшей мере 15%. В варианте осуществления, в котором животным является скот, предпочтительно, чтобы содержащая капроморелин композиция была распылена на корм для скота или включена в него. Фармацевтическая композиция настоящего изобретения предпочтительно включает агонист грелина, такой как, но без ограничения, капроморелин. Предпочтительно, когда фармацевтическая композиция настоящего изобретения включает по меньшей мере один корригент или маскирующее вкус средство. Как описано подробнее ниже, один вариант осуществления настоящего изобретения обеспечивает фармацевтические композиции, предназначенные для не перорального введения, и в качестве таковых эти фармацевтические композиции не включают корригент или маскирующее вкус средство. Настоящее изобретение основано, по меньшей мере частично, на обнаружение того, что у животных-компаньонов и скота, страдающих вызванной отсутствием аппетита потерей веса, которые получают одну или несколько доз фармацевтической композиции настоящего изобретению, отмечаются увеличение веса тела, увеличение потребления пищи и повышенные уровни в сыворотке одного или более соответствующих белков и/или других молекул, таких как, но без ограничения, инсулиноподобный фактор-1 роста (в дальнейшем «IGF-1»), гормон роста (в дальнейшем «GH») и/или кортизол. Соответственно, настоящим изобретением обеспечивается способ увеличения веса тела у животного, включающий стадии введения композиции, содержащей капроморелин, нуждающемуся в этом животному. Также обеспечивается способ увеличения потребления пищи у животного, включающий стадии введения композиции, содержащей капроморелин, животному, нуждающемуся в этом.
Кроме того, обеспечивается способ увеличения уровней в сыворотке одного или более соответствующих белков и/или других молекул, используемых в качестве маркеров в плазме, таких как, но без ограничения, инсулиноподобный фактор-1 роста (в дальнейшем «IGF-1»), гормон роста (в дальнейшем «GH») и/или кортизол, включающий стадию введения композиции, содержащей капроморелин, нуждающемуся в этом животному. В одном варианте осуществления способ, кроме того, включает стадию определения концентрации маркера в плазме в кровотоке животного и слежения за концентрацией маркера в плазме в крови животного в течение долгого времени. Предпочтительно, когда способ, кроме того, включает стадию введения содержащей капроморелин композиции животному до момента времени, когда концентрация маркеров в плазме в крови увеличивается по сравнению с исходной концентрацией маркера в плазме у животного.
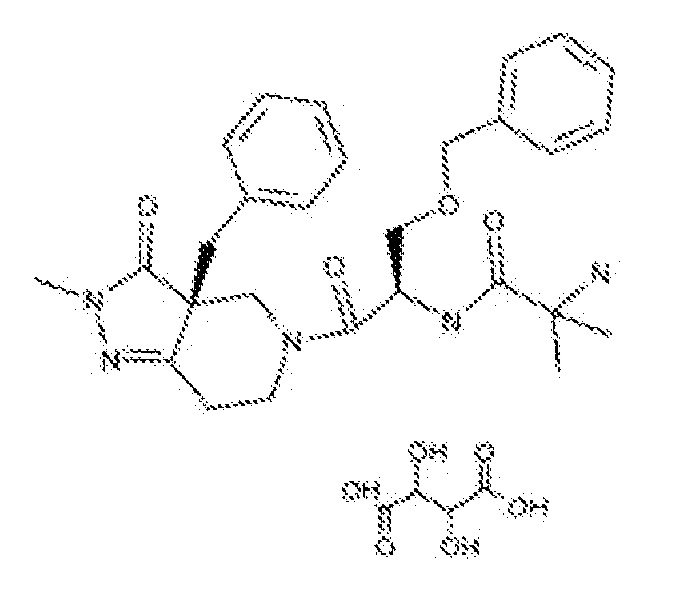
Композиции настоящего изобретения, предназначенные для борьбы с вызванной отсутствием аппетита потерей веса, предпочтительно включают капроморелин, который включает любые рацематы, полиморфы, энантиомеры, соли и любое другое подходящее фармацевтически приемлемое производное капроморелина. Например, в некоторых аспектах, композиция может включать любой активный ингредиент, описанный в патентах США № 6482825, 6852722 или 6306875, все из которых включены сюда посредством ссылки в их полном объеме. В частности, капроморелин также известен как 2-амино-N-[2-(3aR-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидро-пиразоло[4,3-с]пиридин-5-ил-1R-бензилоксиметил-2-оксо-этил]-изобутирамид-L-тартрат. Кроме того, капроморелин имеет следующую химическую структуру.
http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000025_0001.png
У некоторых животных-компаньонов и скота грелин является гормоном, который продуцируется в основном в желудке и других частях пищеварительного тракта и является эндогенным лигандом рецептора грелина, который также известен как рецептор стимулятора секреции гормона роста (GHS-R). GHS-R может быть представлен в различных тканях, включая относящиеся к нервной системе ткани, такие как, но без ограничения, гипофиз и гипоталамус. Грелин имеет относительно короткий полупериод существования (например, приблизительно десять минут) в крови животных, в том числе животных-компаньонов и скота, и начинает накапливаться в крови вскоре после завершения приема пищи. Соответственно, чем дольше период времени с момента последнего приема пищи животным, тем больше концентрация грелина будет в крови животного. Кроме того, как только достаточное количество грелина связывается с GHS-R в гипоталамусе, животные начинают чувствовать голод, который стимулирует потребление пищи.
В дополнение к связыванию с GHS-R в гипоталамусе, циркулирующий грелин может также связываться с GHS-R в гипофизе со стимуляцией выброса гормона роста (GH). Кроме того, в дополнение к выбросу GH в результате связывания грелина с GHS-R в гипофизе, у животных естественно секретируется GH в процессе всего цикла - циркадного ритма. Хотя этот естественный выброс остается постоянным на протяжении всей жизни животного, величина выбросов GH уменьшается в течение жизни животного. Выброшенный GH может циркулировать в крови животного-компаньона, что может индуцировать продукцию и секрецию IGF-1 в кровотоке. Увеличение уровней в циркулирующих IGF-1 может вызвать рост сухой мышечной массы, который может корррелировать с увеличением силы, выносливости и благополучия. Кроме того, в дополнение к индукции продукции GH, грелин может также индуцировать продукцию кортизола, который, как было установлено, увеличивает вероятность отложения жировой ткани.
При введении в организм животного, такого как животное-компаньон или скот, капроморелин может функционировать в качестве агониста GHS-R для борьбы с отсутствием аппетита, потерей веса, анорексией и/или кахексией. В частности, введение капроморелина может привести к стимуляции аппетита и секреции GH. В отличие от эндогенного грелина, капроморелин обычно демонстрирует больший полупериод существования в кровотоке, и в отличие от экзогенного грелина капроморелин может вводиться перорально. В некоторых вариантах осуществления настоящего изобретения содержащую капроморелин композицию предпочтительно вводят животным перорально. Однако, как обсуждается подробнее ниже, содержащие капроморелин композиции могут быть также введены другими путями, в том числе, но без ограничения, например, внутривенным, внутрибрюшинным, внутримышечным, интратекальным, подкожным и любым другим подходящим путем введения.
Кроме того, в некоторых вариантах осуществления, фармацевтические композиции настоящего изобретения содержат подобные грелину соединения (например, агонисты GHS-R), отличные от капроморелина. Эти композиции эффективны для лечения и/или по меньшей мере частичного снятия вызванной отсутствием аппетита потери веса. Например, по меньшей мере некоторые из не являющихся капроморелином, подобных грелину соединений могут также связываться с GHS-R с вызовом чувства голода и стимуляцией потребления пищи у животных, получающих эти соединения. Для целей настоящего изобретения любой подходящий агонист GHS-R может использоваться в фармацевтической композиции настоящего изобретения.
Фармакологический механизм действия капроморелина функционирует аналогично механизму действия грелина. Например, после введения капроморелин связывается с GHS-R, сопряженным с G-белком рецептором, который может активировать протеинкиназу С и стимулировать выброс GH из гипофиза, что может привести к увеличению циркулирующего GH. GH может затем вызвать выброс IGF-1, который может индуцировать отрицательную обратную связь с гипофизом, таким образом, снижая или ингибируя выброс GH. Как упоминалось ранее, IGF-1 также действует с увеличением сухой мышечной массы. Кроме того, введение капроморелина может дополнить снижающийся в течение жизни животного естественный выброс GH. Кроме того, отрицательная обратная связь, являющаяся результатом циркулирующего IGF-1, также может снизить уровни циркулирующего кортизола, таким образом, по меньшей мере частично уменьшая вероятность увеличения отложения жира.
Так же, тот же самый фармакологический механизм действия капроморелина распространяется на применение композиции для лечений не на основе отсутствия аппетита. Например, тот же самый процесс может происходить у здорового или относительно здорового скота, которому вводят композицию. В частности, может быть желательным вызов полезного, эффективного и увеличенного роста мышечной массы у здорового скота, что может привести к повышению розничной стоимости животноводческих продуктов (например, мяса). В частности, люди, продающие животноводческие продукты, могут ввести одну или более доз композиции, чтобы вызвать увеличение мышечной массы, что соответствует большему количеству животноводческих продуктов, имеющихся для перепродажи. Кроме того, как подробнее описано ниже, композиция может вводиться скоту в виде части ежедневного приема пищи ими, что не требует особых усилий, для обеспечения скота композицией.
В некоторых вариантах осуществления капроморелин включен в композицию для борьбы с отсутствием аппетита в одной или более концентраций. В некоторых из следующих вариантов осуществления капроморелин по меньшей мере частично растворяется в растворителе на водной основе (например, деионизированной и/или очищенной воде). Например, в некоторых вариантах осуществления концентрация капроморелина в композиции для борьбы с отсутствием аппетита находится предпочтительно в диапазоне от приблизительно 0,01 мг капроморелина на килограмм веса тела животного (в дальнейшем «мг/кг») до приблизительно 75 мг/кг. Например, в некоторых вариантах осуществления концентрация капроморелина предпочтительно находится в диапазоне от приблизительно 0,1 мг/кг до приблизительно 7,5 мг/кг. В одном варианте осуществления диапазоном концентрации капроморелина является предпочтительно диапазон от приблизительно 0,75 мг/кг до приблизительно 6 мг/кг. В качестве дополнительного примера, в некоторых вариантах осуществления концентрацией капроморелина предпочтительно является по меньшей мере одна из 0,75 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 3,0 мг/кг, 4,0 мг/кг, 5,0 мг/кг, 6,0 мг/кг и любые концентрации между ними. Кроме того, в некоторых вариантах осуществления, как описано подробнее ниже, капроморелин может по меньшей мере частично растворяться в растворителе на водной основе, и фармацевтическая композиция может содержать другие неактивные ингредиенты, такие как консерванты, эмульгаторы и/или загустители, подсластители, корригенты, маскирующие вкус средства и/или другие материалы-носители.
Кроме того, в некоторых вариантах осуществления концентрация капроморелина в композиции для борьбы с отсутствием аппетита по меньшей мере частично зависит от пути введения и/или количества раз в заданном периоде времени введения композиции животным-компаньонам или скоту. Например, один или более составов композиции разрабатывают для введения с помощью инъекции. В результате, капроморелин в композиции может доставляться непосредственно в кровеносную систему (например, с помощью внутривенного введения), таким образом, обходя необходимость абсорбции в желудочно-кишечном тракте. Соответственно, большие количества капроморелина могут достигать желаемых мишеней (например, GHS-R) по сравнению с пероральными составами, что приводит к более низкой, необходимой концентрации капроморелина в стерильной инъекционной форме. В других вариантах осуществления композиция для борьбы с отсутствием аппетита вводится перорально один или более раз в день. Например, композицию можно вводить в виде раствора, твердого вещества или предпочтительного состава в виде вязкой жидкости. Соответственно, чем большее число раз в день вводят композицию животным-компаньонам, тем меньшее количество капроморелина необходимо для получения желаемых результатов.
Лишь в качестве примера, в некоторых вариантах осуществления, дозирование животных можно разделить на несколько схем лечения, в зависимости от тяжести признаков у животного. В некоторых вариантах осуществления животное может получать 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,33 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 3,5 мг/кг, в дозе 4 мг/кг, 4,5 мг/кг, 5 мг/кг, 5,5 мг/кг или 6 мг/кг схемы дозирования. Кроме того, некоторые из этих схем дозирования могут быть в форме твердых или жидких составов. Например, некоторые животные (например, собаки) могут получать один или более твердых составов для перорального введения, таких как композиция для борьбы с отсутствием аппетита, приготовленная для введения через капсулы, желатиновые капсулы, подобные гелям жидкости (т.е. вязкие жидкости), пилюли, каплеты, таблетки или другие твердые, жидкие или распыляемые формы. Например, капсулы или другие формы могут включать различные концентрации капроморелина для того, чтобы сделать возможным обеспечение дозировки для животных с множеством весов (т.е. поскольку дозировка капроморелина по меньшей мере частично зависит от веса животного). Лишь в качестве примера, в некоторых вариантах осуществления капсулы могут быть изготовлены с концентрацией капроморелина, составляющей 20 мг на капсулу, 35 мг на капсулу и 75 мг на капсулу. В результате, различные комбинации капсул можно вводить животным, нуждающимся в лечении, для обеспечения необходимой дозы капроморелина животному. Лишь в качестве примера, для животных весом приблизительно 15 кг и с нахождением на схеме лечения с использованием 3 мг/кг потребуется приблизительно 45 мг капроморелина на дозу. Соответственно, животное может получить две 20-мг капсулы для обеспечения дозы капроморелина, которая близка к 45 мг (т.е. с использованием 5-10 мг желаемой дозы на основе веса животного или в пределах диапазона дозировки). Другие животные других размеров и с нахождением на других схемах лечения могут быть подвергнуты аналогичному лечению для обеспечения эффективного количество капроморелина.
В предпочтительном варианте осуществления доза капроморелина включает количество, достаточное для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно 2 часам. В альтернативном варианте осуществления доза капроморелина включает количество, достаточное для достижения Cmax, составляющей приблизительно 905 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двадцати пяти минутам. Tmax может иметь место у отдельных животных предпочтительно через 30-минутный, 1-часовой или 2-часовой интервал времени, при этом диапазоном является диапазон от приблизительно 30 минут до 2 часов до достижения Tmax. Предпочтительно, когда Cmax составляет от 100 нг/мл до 1000 нг/мл, однако она варьирует у различных животных, поэтому Cmax может быть даже выше. Предпочтительно, Cmax составляет приблизительно 100 нг/мл, приблизительно 200 нг/мл, приблизительно 300 нг/мл, приблизительно 400 нг/мл, приблизительно 500 нг/мл, приблизительно 600 нг/мл, приблизительно 700 нг/мл, приблизительно 800 нг/мл, приблизительно 900 нг/мл и приблизительно 100 нг/мл.
В некоторых вариантах осуществления выбранная схема дозирования может по меньшей мере частично коррелировать с целями лечения. Например, в некоторых обстоятельствах может быть желательным предоставление доз животным, у которых или наблюдаются значительные побочные эффекты от отсутствия аппетита, или которые подвергаются лечению для более эффективного и результативного роста сухой мышечной массы. Кроме того, в некоторых обстоятельствах может быть желательным предоставление доз животным, которые функционируют для подержания текущего веса и мышечной массы. Как таковые, эти поддерживающие дозы могут предоставляться на регулярной основе (например, раз в неделю, в месяц, дважды в месяц, через день в течение месяца и т.д.) и могут включать меньшую дозу капроморелина (например, 0,2 мг/кг), так что введение приносит пользу, заключающуюся в уменьшении отсутствия аппетита и/или увеличении сухой мышечной массы, но не в такой же степени, как в случае более высоких доз.
Кроме того, некоторые варианты осуществления композиции для борьбы с отсутствием аппетита включают жидкие составы для перорального введения, которые могут использовать аналогично приведенному выше твердому составу для перорального введения. Кроме того, жидкие составы могут быть введены в шприц или распылены на корм для животных, лакомства или леденцы. В варианте осуществления, в котором животным является скот, композиция для борьбы с отсутствием аппетита предпочтительно распылена на корм или включена в него. Например, могут быть приготовлены жидкие составы, которые включают капроморелин в следующих концентрациях в жидком составе: 20 мг/мл, 30 мг/мл, 40 мг/мл или 60 мг/мл. Как и в случае твердых составов, которые обсуждались выше, различные концентрации жидкого состава могут использоваться, чтобы сделать возможным обеспечение дозировки для животных с множеством весов (т.е. поскольку дозировка капроморелина по меньшей мере частично зависит от веса животного). В результате, различные объемы различных растворов могут вводиться животным для обеспечения требуемой дозы капроморелина. Лишь в качестве примера, для животных весом приблизительно 15 кг и с нахождением на схеме лечения с использованием 3 мг/кг, потребуется приблизительно 45 мг капроморелина на дозу. Соответственно, животное может получить приблизительно 2,3 мл раствора с концентрацией 20 мг/мл или 1,1 мл раствора с концентрацией 40 мг/мл для обеспечения дозы капроморелина, которая близка к 45 мг. Аналогично, в случае того же самого животного с нахождением на схеме лечения с использованием 4,5 мг/кг, оно могло бы получить 2,3 мл раствора с концентрацией 30 мг/мл или 1,1 мл раствора с концентрацией 60 мг/мл для обеспечения дозы капроморелина, которая близка к 67,5 мг (т.е. дозе, которую должно получить животное весом 15 кг в этой схеме лечения). Другие животные других размеров и с нахождением на других схемах лечения могут быть подвергнуты аналогичному лечению для обеспечения эффективного количество капроморелина.
В некоторых вариантах осуществления композиция для борьбы с отсутствием аппетита может вводиться с использованием любого из множества путей введения. Композиция для борьбы с отсутствием аппетита может вводиться перорально, парентерально и/или местно. Например, в некоторых вариантах осуществления, композиция для борьбы с отсутствием аппетита может вводиться перорально в виде жидкости и/или твердого состава, так что композицию можно вводить, используя по меньшей мере одно из следующего: аэрозоль, шприц, пилюлю, таблетку, каплету, желатиновую капсулу или иную схему введения на основе жидкости. В других вариантах осуществления композиция может быть приготовлена для введения с помощью подкожного, внутрикожного, внутривенного, внутримышечного, внутричерепного, внутрибрюшинного или интратекального введения (например, с помощью инъекции или насоса-дозатора композиции). Например, в некоторых вариантах осуществления композиция может быть приготовлена в виде вводимого парентерально состава замедленного всасывания, который может быть скомпонован для длительного высвобождения капроморелина (например, высвобождения в течение периода от нескольких дней до нескольких месяцев). Кроме того, композиция может быть введена в виде геля, который контактирует с кожей или другой тканью животных и, соответственно, абсорбируется через нее. Альтернативно, композиция может быть введена с использованием системы электрофореза для нагнетания композиции в кровоток животного.
Тем не менее, в других вариантах осуществления может быть приготовлена композиция для чрескожного введения и/или введения через слизистую оболочку (например, с использованием пленки или пластыря для трансбуккального введения, которая(ый) прикладывается к эпидермису животного). Кроме того, в некоторых вариантах осуществления композиция для борьбы с отсутствием аппетита может вводиться интраназально или в виде одного или более суппозиториев. В некоторых вариантах осуществления композиция может быть приготовлена в виде имплантата, который можно разместить внутри мягкой ткани животных. Например, содержащий композицию имплантат можно имплантировать в кожную, подкожную и/или мышечную ткань животных для пролонгированного высвобождения. Кроме того, может быть также приготовлена композиция для введения в кожу животного «точечным» образом. Тем не менее, в других вариантах осуществления композиция для борьбы с отсутствием аппетита может быть приготовлена для любого другого подходящего пути введения, известного в данной области техники.
В некоторых вариантах осуществления композиция может вводиться животному в виде части ежедневного режима кормления. Например, может быть приготовлена композиция для смешивания с кормом или другим пищевым продуктом, предназначенным для потребления животным, так что по мере ежедневного приема пищи животным (например, гранул или мягкой пищи) оно также потребляет композицию. В частности, композиция может быть приготовлена в виде жидкости или порошка, так что перед кормлением животного состав может быть внесен (например, распылен) в пищу для потребления животным. Кроме того, в некоторых вариантах осуществления пища, даваемая животным (например, животным-компаньонам или скоту), может подаваться вместе с фармацевтической композицией, уже смешанной с пищевым продуктом, так что скотнику необходимо лишь дать пищу с лекарственным средством животному.
В некоторых вариантах другие пищевые продукты, даваемые животному (например, животным-компаньонам или скоту), могут быть дополнены содержащей капроморелин композицией. Например, мягкие или твердые лакомства или леденцы (например, сыромятная кожа или другие продукты животного происхождения, даваемые животным для удовольствия и/или повышения питательности), могут быть дополнены содержащей капроморелин композицией, причем содержащую капроморелин композицию либо включают в лакомство или леденец, либо распыляют на лакомство или леденец. В некоторых аспектах лакомства или леденцы можно приобрести в форме, которая уже включает содержащую капроморелин композицию. В других аспектах содержащая капроморелин композиция может быть позже добавлена к лакомствам или леденцам согласно индивидуальному кормлению животного.
Кроме того, в некоторых вариантах осуществления гранулы, лакомства и/или леденцы смешивают с поддерживающей дозой содержащей капроморелин композиции. Предпочтительно, когда животное, получающее поддерживающую дозу, способно к сохранению определенного уровня потребления пищи. Например, как обсуждалось выше, поддерживающая доза (например, 0,2 мг/кг) может предоставляться животным на регулярной или нерегулярной основе для обеспечения более низкие дозы активного ингредиента для продолжения предотвращения отсутствия аппетита, для лечения незначительных случаев отсутствия аппетита или для предоставления низких доз для постоянного стимулирования роста сухой мышечной массы. Предоставляя эти поддерживающие дозы вместе с пищевыми продуктами (например, гранулами), лакомствами и/или леденцами, животные могут в общем и целом наслаждаться ощущением от получения поддерживающих доз, так что незначительное количество активного ингредиента теряется в процессе введения.
В некоторых вариантах осуществления композиция изготавливается и поставляется в виде набора. Набор предпочтительно включает шприц, один или более сосудов, а также инструкции, которые информируют пользователя о заборе приблизительно одной дозы из сосуда и введении дозы животным. В качестве лишь примера, в некоторых вариантах осуществления композиция может храниться в одном или более сосудах (например, стерильном флаконе), из которого лицо (например, ветеринар и/или скотник/владелец животного) может иметь доступ к композиции для борьбы с отсутствием аппетита. Например, используя шприц, человек может забрать приблизительно одну дозу композиции (например, приблизительно пять миллилитров) из сосуда для введения животному. В некоторых вариантах осуществления человек может зафиксировать животное, и поместите шприц в рот животного (например, задний угол рта вблизи задней части языка). После приготовления человек может нажать на поршень шприца, чтобы выпустить композицию в рот/ротовую полость животного, так что животное проглатывает композицию. В результате размещения шприца вблизи задней части рта, животное будет почти непроизвольно проглатывать композицию, так что некоторое количество или вся композиция поступит в желудочно-кишечный тракт животного. В других вариантах осуществления, до и/или после забора дозы композиции для борьбы с отсутствием аппетита из сосуда, игла может быть прикреплена к шприцу, и доза может быть введена в организм животного любым из упомянутых ранее путей введения. Тем не менее, в других вариантах осуществления композиция для контроля аппетита может включать твердый лекарственный состав, так что композиция может быть предоставлена в других формах (например, пилюль, каплет, таблеток и т.д.) с пищей или без нее.
В некоторых вариантах осуществления человек снабжается композицией для борьбы с отсутствием аппетита в виде «готовой к употреблению» композиции. Например, композиция может быть предоставлена в сосуде, так что человеку не требуется осуществлять какие-либо дополнительные добавки в сосуд или обрабатывать композицию каким-либо образом для приготовления композиции для введения животному. В других вариантах осуществления композиция для борьбы с отсутствием аппетита может быть предоставлена в виде эмульгированного жидкого состава или суспензии, так что может потребоваться добавление или осуществление одного или более дополнительных соединений, наполнителей, других материалов или подготовительных стадий для приготовления композиции для введения животному.
В некоторых вариантах осуществления композиция включает один или более фармацевтически приемлемых наполнителей или носителей. Например, некоторые примеры возможных наполнителей или носителей включают, но без ограничения, разбавители, связующие вещества, наполнители, буферные агенты, агенты, модифицирующие рН, разрыхлители, диспергирующие агенты, стабилизаторы, консерванты, растворы солей и/или красители. Количество и типы наполнителей могут быть выбраны в соответствии с известными принципами фармацевтики.
В некоторых вариантах осуществления композиция, которая может быть приготовлена для перорального введения, может включать один или более из следующих корригентов и/или маскирующих вкус средств (например, подсластителей): сукралозу, дисперсию соединений из корня солодки, производный из корня солодки продукт и экстракт из корня солодки (глицирризиновую кислоту/глицирризинат аммония однозамещенный), MagnaSweet®, смесь сахарина натрия и неогесперидина дигидрохалкона (Optisweet™ SD), 97:3 (в весовом отношении) смесь сахарозы и мальтодекстрина (Di-Pac®), тауматин 7% (подсластитель), смешанный с неактивным мальтодекстрином (Тауматин T200X), чистый тауматин (Talin-Pure), экстракт стевии ребаудиозид А (стевиоловые гликозиды), неотам и/или полиолы (сахароспирты), такие как сорбит, мальтит, изомальт, ксилит и глицерин.
Как здесь используется, «MagnaSweet®» относится к композиции, по существу состоящей из одного или более подсластителей, выбираемых из группы, состоящей из глицирризиновой кислоты (GA), глицирризината аммония однозамещенного (MAG), ребаудиозида А и глицерина. В некоторых вариантах осуществления MagnaSweet® по существу состоит из глицирризиновой кислоты (GA), глицирризината аммония однозамещенного (MAG), ребаудиозида А и глицерина. В других вариантах осуществления MagnaSweet® по существу состоит из глицирризиновой кислоты (GA), глицирризината аммония однозамещенного (MAG) и глицерина. В некоторых вариантах осуществления MagnaSweet® включает от приблизительно 0,5% до приблизительно 25% GA/MAG, от приблизительно 0% до приблизительно 15% ребаудиозида А и от приблизительно 75% до приблизительно 99,5% глицерина. В других вариантах осуществления MagnaSweet® включает от приблизительно 1,5% до приблизительно 17% GA/MAG, от приблизительно 0% до приблизительно 7,5% ребаудиозида А и от приблизительно 83% до приблизительно 91% глицерина. В приводимых в качестве примера вариантах осуществления MagnaSweet® включает приблизительно 1,5% GA/MAG, приблизительно 7,5% ребаудиозида А и приблизительно 91% глицерина. В других приводимых в качестве примера вариантах осуществления MagnaSweet® включает приблизительно 9% GA/MAG и приблизительно 91% глицерина. В другом приводимом в качестве примера варианте осуществления MagnaSweet® включает приблизительно 17% GA/MAG и приблизительно 83% глицерина.
В частности, некоторые сахаросодержащие подсластители, например, содержащие сахарозу материалы, сахароза, глюкоза, фруктоза и мальтодекстрин, могут по меньшей мере частично разрушать капроморелин в композиции. Соответственно, следует избегать высоких концентраций некоторых сахаросодержащих подсластителей.
Кроме того, в некоторых вариантах осуществления корригенты и/или маскирующие вкус средства могут включать ваниль-содержащую композицию, такую как, но без ограничения, этилванилин, ванилин (vanillin-RHD), натуральная ванильная эссенция (vanillin-Merck), идентичная натуральной ванильная эссенция (vanilla-TG-old) и подходящие растворители (например, этанол и/или воду).
В других вариантах осуществления корригенты и/или маскирующие вкус средства могут включать один или более выбираемых из тех, которые придают вкус куриного мяса, бекона, говядины, свинины, печени, рыбы, меда, жженого сахара и банана.
В некоторых вариантах осуществления корригенты и/или маскирующие вкус средства предпочтительно составляют в процентах в отношении веса к конечному объему композиции для борьбы с отсутствием аппетита от приблизительно 50% до приблизительно 0,001%, в зависимости от выбранного вещества. Предпочтительно, корригенты и/или маскирующие вкус средства могут составлять в процентах в отношении веса к конечному объему композиции для борьбы с отсутствием аппетита от приблизительно 40% до приблизительно 0,01%, в зависимости от выбранного вещества. Более предпочтительно, корригенты и/или маскирующие вкус средства могут составлять в процентах в отношении веса к конечному объему композиции для борьбы с отсутствием аппетита от приблизительно 30% до приблизительно 0,01%, в зависимости от выбранного вещества. Как упоминалось ранее, в некоторых вариантах осуществления композиция для борьбы с отсутствием аппетита может включать более чем один корригент и/или маскирующее вкус средство.
В некоторых вариантах осуществления композиция для борьбы с отсутствием аппетита включает один или более неактивных ингредиентов (например, носителей), которые могут функционировать для стабилизации композиции или создания рН в ней, функционировать в качестве эмульгатора или загустителя для по меньшей мере одного или более компонентов композиции, функционировать в качестве носителя, функционировать в качестве замещающего сахарозу материала, функционировать в качестве растворителя и могут функционировать с выполнением любой другой желательной роли. Например, композиция для борьбы с отсутствием аппетита может включать одно или более из следующих веществ: лимонную кислоту, цитрат натрия, хлорид натрия, соль метил-4-гидроксибензоат, соль пропил-4-гидроксибензоат, сорбит Neosorb, мальтит, пропиленгликоль, растительный глицерин, Коллидон (Kollidon) 90F, ксантановую камедь, Pluriol-E3350®, поливинилпирролидон, полиэтиленгликоль и/или очищенную/деионизированную воду. В некоторых вариантах осуществления неактивные ингредиенты могут составлять в процентах в отношении веса к конечному объему композиции для борьбы с отсутствием аппетита от приблизительно 80% до приблизительно 0,001%, в зависимости от выбранного агента. Предпочтительно, неактивные ингредиенты могут составлять в процентах в отношении веса к конечному объему или весу композиции для борьбы с отсутствием аппетита от приблизительно 40% до приблизительно 0,01%, в зависимости от выбранного агента. Более предпочтительно, неактивные ингредиенты могут составлять в процентах в отношении веса к конечному объему композиции для борьбы с отсутствием аппетита от приблизительно 25% до приблизительно 0,01%, в зависимости от выбранного агента. Как упоминалось ранее, в некоторых вариантах осуществления композиция для борьбы с отсутствием аппетита может включать более чем один неактивный ингредиент.
В некоторых вариантах осуществления композиция может быть приготовлена альтернативно. Например, как упоминалось ранее, композиция может быть приготовлена для внутривенного введения, в случае которой она может включать капроморелин, растворенный в физиологически приемлемом стерильном растворе (т.е. носителе), таком как вода или солевой раствор (например, забуференный фосфатом солевой раствор). В других вариантах осуществления композиция может быть приготовлена для подкожного введения. Как таковая, композиция может включать физиологически приемлемые носители, такие как бензиловый спирт и буфер (например, цитратный буфер).
В некоторых вариантах осуществления композиция для борьбы с отсутствием аппетита может включать следующий базовый состав в растворе: http//patentimages.storage.googleapis.com/WO2014052780A2/imgf000035_0001.png
Тем не менее, эта композиция является примером, ибо количества каждого компонента и сочетание ингредиентов подлежат изменению.
Кроме того, следующие комбинации материалов, растворов, композиций и/или соединений могут быть добавлены к базовому составу, раскрытому выше, для образования одной или более композиций для борьбы с отсутствием аппетита для введения с целью лечения вызванной отсутствием аппетита потери веса. В предпочтительном варианте осуществления композиция настоящего изобретения включает капроморелин, загуститель и корригент и/или маскирующее вкус средство. Корригент и/или маскирующее вкус средство предпочтительно представляет собой подсластитель. Кроме того, один или более из компонентов может быть исключен из базового состава при приготовлении композиций для борьбы с отсутствием аппетита. Составы, приведенные ниже, являются иллюстративными и не предназначены для ограничения.
(1,4%-1,5%)
MagnaSweet® (0,3%)
В некоторых вариантах осуществления композиции могут использоваться в сочетании с другой схемой лечения, которая может вызвать отсутствие аппетита. Например, в некоторых вариантах осуществления композиции могут быть вводиться животным (например, животным-компаньонам и/или скоту) в виде части схемы химиотерапии или лучевой терапии. Квалифицированным в данной области техники специалистам будет понятно, что схемы химиотерапии или лучевой терапии могут привести к значительной потере веса, истощению, потере мышечной массы, кахексии или другим негативным побочным эффектам, которые можно по меньшей мере частично уменьшить или аннулировать путем дополнительного потребления пищи и/или увеличений сухой мышечной массы. Соответственно, введение терапевтически эффективных количеств композиций, содержащих капроморелин, может стимулировать потребление пищи, приводя таким образом к увеличению веса и увеличению сухой мышечной массы. В результате, животные могут иметь больше энергии для активностей и выдерживания схем лечения.
Кроме того, в некоторых вариантах осуществления композиции вводят животным, страдающим другими состояниями, в случае которых требуется невкусная пища. Например, некоторые животные, у которых диагностировано хроническое заболевание почек, сажают на специализированную диету для улучшения этого состояния. Однако некоторые животные не находят специализированную диетическую пищу вкусной, и, как следствие, не потребляют достаточное количество специализированной диетической пищи для лечения хронического заболевания почек или для поддержания. Соответственно, некоторые животные могут получать терапевтически эффективные количества композиции для борьбы с отсутствием аппетита, содержащей капроморелин, для вызова голода и стимуляции потребления специализированной диетической пищи. В результате хроническое заболевание почек можно лучше контролировать с помощью специализированного диетического питания, и животное может потреблять достаточное количество калорий для радостного существования.
В некоторых вариантах осуществления композиции могут использоваться для лечения общего состояния вызванной отсутствием аппетита потери веса. Например, у некоторых животных, по неизвестным причинам, наблюдается отсутствие аппетита, которое, как уже упоминалось ранее, может привести к потере веса, истощению, кахексии, вялости и другим неприятным результатам. После диагностирования вызванной отсутствием аппетита потери веса квалифицированным в данной области техники специалистом, таким как ветеринар, животные могут получать одну или более терапевтически эффективных доз композиции, содержащей капроморелин, для увеличения потребления пищи и сухой мышечной массы. Как следствие, у животных-компаньонов может наблюдаться полезное увеличение веса, ведущее к улучшению качества жизни.
В некоторых вариантах осуществления композиция может использоваться для увеличения сухой мышечной массы. Например, может быть желательным увеличение сухой мышечной массы у некоторых животных (например, скота, такого как коровы или свиньи), как уже упоминалось ранее. Соответственно, композицию можно вводить в терапевтически эффективном количестве в одной или более доз для увеличения сухой мышечной массы без необходимости в лечении вызванной отсутствием аппетита потери веса. В предпочтительном варианте осуществления содержащая капроморелин композиция включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно 2 часам. Однако предпочтительно Tmax составляет от приблизительно двадцати пяти минут до 2 часов, причем предусматриваются интервалы в приблизительно 30 минут, приблизительно 1 час и приблизительно 2 часа. Кроме того, Cmax составляет предпочтительно от приблизительно 100 нг/мл до приблизительно 1000 нг/мл.
В некоторых вариантах осуществления композиция может вводиться животным-компаньонам для лечения или профилактики других заболеваний, болезней, страданий и других признаков. Например, в некоторых вариантах осуществления содержащую капроморелин композицию можно вводить кошкам для лечения и/или предотвращения липидоза печени у кошек (т.е. жировой болезни печени у кошек). При некоторых условиях липидоз печени у кошек может возникнуть в результате избыточных жировых отложений в печени, что приводит к нарушению нормального функционирования гепатоцитов. Хотя механизм, приводящий к возникновению липидоза печени у кошек, не полностью понят, полагают, что отсутствие аппетита у кошек является пусковым сигналом для развития этого состояния. В частности, после того как кошка перестала есть или значительно снизила свое суточное потребление пищи (например, из-за стресса), печень кошки начинает пытаться расщепить избыточное количество жира организма для подержания метаболизма. Перенос жира организма в печень приводит к избыточному количеству жира, хранящемуся в печени, что приводит к возникновению липидоза печени.
В некоторых вариантах осуществления в настоящем изобретении предусматривается способ лечения липидоза печени у кошек или собак. Способ предпочтительно включает стадию введения содержащей капроморелин композиции животному, нуждающемуся в этом. Например, кошке, которая страдает отсутствием аппетита или которой уже поставлен диагноз липидоз печени у кошек, можно вводить от приблизительно 2 мг/кг до приблизительно 4 мг/кг капроморелина или в пероральном составе в виде раствора, или в инъецируемом составе один или более раз в день в течение от приблизительно 4 дней до приблизительно недели. В некоторых аспектах содержащую капроморелин композицию можно вводить в качестве превентивной меры, когда кошка, как ожидается, будет иметь сниженный аппетит (например, в случае химиотерапии, госпитализации, погрузки на борт и т.д.). Кроме того, содержащую капроморелин композицию можно вводить, когда у кошки уже начал развиваться липидоз печени у кошек или, как можно было бы обоснованно ожидать, будет развиваться (например, после длительного периода отсутствие аппетита). В результате введения содержащей капроморелин композиции у кошки может отмечаться повышение аппетита, что, вероятно, приведет к увеличению потребления пищи после первой дозы в течение периода лечения. Например, владелец кошки может, как правило, следить за количеством потребляемой кошкой пищи, чтобы быть уверенным, что лечение является эффективным. Поскольку кошка потребляет большее количество пищи из-за лечения композицией, липидоз печени будет подвергаться лечению или будет предотвращаться его возникновение. В некоторых вариантах осуществления лечение липидоза печени может быть повторено столько раз, сколько это необходимо.
Схему лечения композицией для борьбы с отсутствием аппетита настоящего изобретения можно по меньшей мере частично регулировать в ходе лечения. Например, после выявления того, что у животного наблюдается вызванная отсутствием аппетита потеря веса (например, независимо от причины), количество композиции, которое, как полагают, является терапевтически эффективным, можно вводить животному (например, перорально, внутривенно и т.д.). После заданного периода времени (например, приблизительно восьми часов после первого введения композиции и спустя приблизительно семь дней), лаборант, ветеринар или любой другой подходящий человек может взять образец (например, образец сыворотки) у животного для измерения количеств одного или более маркеров в плазме в образце. В других вариантах осуществления образцы могут быть взяты в любые другие подходящие моменты времени, известных квалифицированным в данной области техники специалистам, которые были бы соответствующими для измерения одного или нескольких маркеров в плазме. Например, маркеры в плазме предпочтительно выбирают из группы, состоящей, но без ограничения, из IGF-1, кортизола, капроморелина и их комбинаций. В альтернативном варианте осуществления используется показатель. Показатель предпочтительно выбирают, но без ограничения, из увеличения веса, потери веса, увеличения потребления пищи, уменьшения потребления пищи, увеличения мышечной массы, уменьшения мышечной массы, а также их комбинаций. В результате, зная количества одного или более из этих маркеров в плазме и/или показателей, доза композиции может быть отрегулирована с учетом количеств маркеров в плазме или показателей в образце. В одном варианте осуществления минимальная концентрация одного или более маркеров в плазме определяется в первый момент времени, минимальная концентрация одного или более маркеров в плазме определяется во второй момент времени, и так далее. Предпочтительно, минимальная концентрация одного или более маркеров в плазме определяется в первый момент времени, первый и второй момент времени, или первый, второй и третий момент времени. Предпочтительно, концентрацию маркеров в плазме можно сравнить, чтобы определить, увеличивается или уменьшается маркер в плазме со временем. Кроме того, в одном варианте осуществления концентрацию маркеров в плазме можно сравнить с заданной величиной, так что дозу фармацевтической композиции можно увеличить или уменьшить в зависимости от концентрации маркера в плазме. Эффективность композиции может быть определена, используя указанные выше стадии, и предпочтительно подвергнута регулированию в ходе лечения. Например, если количество или концентрация IGF-1 в образце являются небольшими, дозу композиции увеличивают путем увеличения или концентрации капроморелин, или количества капроморелина, вводимого животному-компаньону. Наоборот, если количество кортизола в образце является слишком большим, что может привести к увеличению отложения жира, дозу композиции можно уменьшить путем уменьшения или концентрации капроморелина, или количества капроморелина, вводимого животному-компаньону.
В дальнейшем варианте осуществления обеспечивается способ определения эффективности фармацевтической композиции. Способ предпочтительно включает стадии определения того, что у животного наблюдается отсутствие аппетита, измерения одного или более маркеров в плазме, введения композиции, содержащей капроморелин, животному, проведения дополнительного измерения одного или более маркеров в плазме и определения, является ли доза соответствующей, и ее необходимо скорректировать. Маркеры в плазме предпочтительно выбирают из группы, состоящей из, но без ограничения, IGF-1, кортизола, капроморелина и их комбинаций.
В некоторых вариантах осуществления описанная выше схема лечения может выполняться без отбора образца. Например, после введения одной или более терапевтически эффективных доз животному, другие показатели потери веса могут быть определены для оценки эффективности схемы лечения. Эти показатели могут включать изменение веса (например, продолжение потери веса, увеличение веса, стабилизацию потери веса), изменение потребления пищи (например, увеличение потребления пищи по сравнению с периодом времени до начала лечения) и/или определение изменения сухой мышечной массы (например, оценку значения индекса сухой мышечной массы у животного, чтобы оценить рост мышечной массы). В результате, животное не подвергается инвазивному отбору образца сыворотки, и лица, контролирующие схему лечения, могут соответствующим образом скорректировать дозу схемы лечения.
В некоторых вариантах осуществления одна или более из описанных выше схем лечения может выполняться до достижения удовлетворительного результата. В частности, содержащую капроморелин композицию можно вводить животному, нуждающемуся в этом, до тех пор, пока животное больше не будет нуждаться в этом. Например, содержащую капроморелин композицию можно вводить животному, страдающему от вызванной отсутствием аппетита потери веса, до тех пор, пока животное не восстановит достаточную величину веса. В частности, ветеринар или скотник может продолжать введение композиции (например, ежедневно, через день и т.д.) до тех пор, пока вес животного не увеличится в достаточной степени. Например, достаточная степень увеличения веса может быть увеличением на 5% веса тела по сравнению с весом тела животного до получения первоначальной дозы композиции. В других вариантах осуществления достаточная степень увеличения веса может составлять более чем 5% (например, 10%, 20%, 25% и т.д.), как определено по нехваткам у животного.
В настоящем изобретении предусматривается способ лечения отсутствия аппетита, включающий стадии определения того, что у животного отсутствует аппетит, введения по меньшей мере одной дозы содержащей капроморелин композиции, оценки маркера в плазме или значения показателя у животного и продолжения введения содержащей капроморелин композиции до тех пор, пока значение для маркера в плазме или показателя не будет соответствующим для животного.
Хотя описанное здесь изобретение допускает различные модификации и альтернативные итерации, его конкретные варианты осуществления были описаны более подробно выше. Однако следует понимать, что подробное описание композиции не предназначено для ограничения изобретения раскрытыми конкретными вариантами осуществления. Вернее, следует понимать, что изобретение, как предполагается, охватывает все модификации, эквиваленты и альтернативы, попадающие в рамки сущности и объема изобретения, определяемого формулой изобретения.
ОПРЕДЕЛЕНИЯ
Используемые здесь термины «около» и «приблизительно» обозначают, что значение находится в пределах статистически значимого диапазона. Такой диапазон может типично быть в пределах 20%, типичнее в пределах 10% и еще типичнее в пределах 5% от заданного значения или диапазона. Допустимая вариация, охватываемая терминами «около» и «приблизительно», зависит от конкретной рассматриваемой системы и может быть легко оценена специалистом со средним уровнем компетентности в данной области техники.
Используемый здесь термин «животное» означает животных, не являющихся людьми, таких как «скот» и «животные-компаньоны».
Используемый здесь термин «скот» включает крупный рогатый скот, овец, свиней, птицу (например, кур, индюков, перепелов и т.д.), коз, лам и других подобных животных.
Используемый здесь термин «ч» обозначает часы.
Используемый здесь термин «композиция» относится к любому твердому предмету, полутвердой или жидкой композиции, которая в соответствии с разработкой содержит конкретное заданное количество (дозу) определенного ингредиента, например, активного фармацевтического ингредиента, ранее упоминаемого и обсуждаемого ниже. Подходящими композициями могут быть фармацевтические системы доставки лекарственных средств, в том числе таковые для перорального введения, буккального введения, ректального введения, местного введения или введения через слизистую оболочку, или подкожные имплантаты или другие имплантируемые системы доставки лекарственных средств; или композиции для доставки минералов, витаминов и других биологически активных добавок, средства по уходу за полостью рта, корригенты, маскирующие вкус средства и т.п. В одном варианте осуществления настоящего изобретения композиции, как правило, являются жидкостью, однако они могут содержать твердые или полутвердые компоненты. Как правило, лекарственная форма представляет собой перорально вводимую систему для доставки фармацевтического активного ингредиента в желудочно-кишечный тракт животного-компаньона.
Используемый здесь термин «мг/кг» означает миллиграммы композиции на килограмм веса тела.
Используемый здесь термин «лечение» состояния, такого как отсутствие аппетита, включает ингибирование существующего состояния или прекращение его развития; или облегчение или вызов регрессии состояния. Термин «предотвращение» или «профилактика» состояния, такого как отсутствие аппетита, потеря веса или кахексии, включает по существу блокирование или ингибирование развития состоянии до его начала.
Используемый здесь термин «животное» относится к млекопитающему, в частности, животному-компаньону, в том числе, но без ограничения, собакам, кошкам, кроликам, хорькам, лошадям и хомячкам.
Используемое здесь выражение «терапевтически эффективное количество» относится к количеству, эффективному, в необходимых дозах и в течение необходимых периодов времени, для достижения желаемого терапевтического результата. Терапевтически эффективное количество капроморелина может быть определено квалифицированным в данной области техники специалистом (например, ветеринаром) и может варьировать в зависимости от таких факторов, как клиническое состояние, возраст, пол и вес животного-компаньона, биодоступность капроморелина и способность активного агента(ов) к вызову желаемой ответной реакцию у животного-компаньона. Терапевтически эффективное количество также является количеством, в котором терапевтически благоприятные эффекты перевешивают любые токсические или вредные эффекты активного агента(ов). Терапевтически эффективное количество также включает количество, которое является эффективным, в необходимых дозах и в течение необходимых периодов времени, для достижения желаемого результата (например, увеличения веса за счет добавления сухой мышечной массы).
Используемый здесь термин «q.s.» («сколько потребуется») означает добавить количество (например, объем или массу) какого-либо ингредиента до достижения конечного количества (например, объема или массы).
Используемый здесь термин «в отношении веса к объему» означает концентрацию вещества, определяемую в виде веса вещества на единицу объема раствора или композиции.
Следующие примеры предназначены для дополнительной иллюстрации и объяснения настоящего изобретения. Изобретение, таким образом, не должно ограничиваться какими-либо деталями в этих примерах.
Пример 1 - Определение схемы дозирования соединения для борьбы с отсутствием аппетита, содержащего капроморелин, для стимулирования потребления пищи и увеличений сухой мышечной массы у животных-компаньонов
Было проведено контролируемое исследование в течение семи дней для оценки влияния различных схем дозирования капроморелина на продукцию инсулиноподобного фактора 1 роста (в дальнейшем «IGF-1»), гормона роста (в дальнейшем «GH») и кортизола. Различные схемы дозирования капроморелина также оценивали в отношении влияния на потребление пищи и изменения веса тела.
Восемнадцать взрослых, используемых ранее в опытах собак породы бигль (гончих) (девять кобелей и девять сук) были разделены на три группы лечения. Каждая из трех групп лечения включала три кобеля и три суки. Группе А, которая была контрольной группой, вводили два раза в день, через желудочный зонд, носитель (лишь деионизированную воду), и ее использовали в качестве точки исходных данных для сравнения со схемами активного лечения. Группа B включала группу активного лечения, которая получала два лечения в день, с помощью желудочного зонда, содержащей капроморелин композицией с концентрацией, составляющей 3 мг/кг капроморелина на каждое лечение. Наконец, группа C включала группу активного лечения, которая получала одно лечение в день, с помощью желудочного зонда, содержащей капроморелин композицией с концентрацией, составляющей 6 мг/кг капроморелина на каждое лечении.
Во время десятидневного периода исследования за каждой из собак следили, по меньшей мере один раз в день, для клинических наблюдений, в отношении смертности, заболеваемости, веса тела и потребления пищи. Отбирали образцы сыворотки для измерения концентрации капроморелина, концентрации GH, концентрации IGF-1 и концентрации кортизола. Образцы сывороток отбирали в дни 1, 2, 4 и 7 в моменты времени -15 мин (перед введением дозы), непосредственно перед введением дозы (0 минут) и через 30, 45, 60, 90, 120, 240, 360 и/или 480 минут после введения дозы. Дополнительные образцы крови отбирали в 8 утра на 10-й день исследования, чтобы оценить долгосрочное воздействие активных методов лечения.
Как показано на Фиг. 1-7, собаки в группах активного лечения (т.е. группах В и С) потребляли большие количества пищи и набирали больший вес по сравнению с собаками в контрольной группе (т.е. группе А). Как показано на Фиг. 1-3, в целом, собаки, подвергнутые лечению один раз в день 6 мг/кг дозой или дважды в день 3 мг/кг дозой капроморелина, потребляли больше пищи, чем собаки, получающие лишь деионизированную воду. Кроме того, со ссылкой на Фиг. 2 и 3, хотя кобели, подвергнутые лечению один раз в день 6 мг/кг дозой или дважды в день 3 мг/кг дозой капроморелина, как правило, потребляли больше пищи, суки, подвергнутые лечению один раз в день 6 мг/кг, как правило, потребляли больше пищи, чем суки в других группах.
Так же, как показано на Фиг. 4-7, собаки, подвергнутые лечению один раз в день 6 мг/кг дозой или дважды в день 3 мг/кг дозой капроморелина, набирали больший вес, чем собаки, получающие лишь деионизированную воду. У кобелей в этих группах лечения наблюдалось увеличение веса на 4-5% на протяжении семидневного периода лечения (Фиг. 6); однако изменения веса тела у сук (Фиг. 7) не были так четко выражены. Увеличение веса тела, по-видимому, коррелировало с увеличением потребления пищи. Конкретнее, как обсуждалось выше, кобели, как правило, потребляли больше пищи (Фиг. 2), и, соответственно, кобели также набирали больший вес тела (Фиг. 6).
Теперь со ссылкой на Фиг. 8-10, у собак в обеих группах B и C наблюдались повышенные концентрации капроморелина в их сыворотке. Используя данных, полученные исходя из образцов сыворотки, взятых в дни 1 и 7 исследования, концентрации капроморелина, как правило, резко возрастали через приблизительно 0,5 часа после введения дозы и, как правило, уменьшались до почти неопределяемых уровней к восьми часам после введения дозы (т.е. 480 минут). Количество капроморелина, выявляемого в сыворотке собак, коррелирует со схемой дозирования. В частности, у собак, получающих 6 мг/кг дозу, отмечались более высокие концентрации капроморелина в их сыворотке (в приблизительно 2,3 раза выше), чем у собак, получающих два раз в день 3 мг/кг дозу, как показано на Фиг. 8-10. Кроме того, как показано на Фиг. 9 и 10, у сук, получающих 3 мг/кг дозу, отмечалась несколько более высокая концентрация капроморелина в сыворотке, чем у кобелей, получающих такую же дозу.
Как показано на Фиг. 11-24, у собак в обеих группах В и С наблюдались изменения концентраций в сыворотке IGF-1, GH и кортизола, которые, скорее всего, связаны с введением капроморелина.
Во-первых, как показано на Фиг. 11-15, лечение капроморелином стимулировало уровни IGF-1 в сыворотке собак. А именно, как показано на Фиг. 11, через приблизительно один-четыре часа после введения собакам первоначальной дозы капроморелина, уровни IGF-1 продемонстрировали увеличение в сыворотке, по сравнению с собаками, получающими лишь деионизированную воду. Кроме того, как показано на Фиг. 12-14, в дни 2, 4 и 7 курса лечения, уровни IGF-1 в сыворотке оставались постоянно выше у собак, получающих обе дозы капроморелина. Как показано на Фиг. 15, через три дня после прекращения лечения (в день 10), уровни IGF-1 в сыворотке собак, получающих лечение капроморелином, не существенно отличались от уровней IGF-1 в сыворотке собак, получающих лишь деионизированную воду. Кроме того, схожее общее повышение IGF-1 на протяжении схемы лечения было отмечено у собак, подвергнутых лечению один раз в день 6 мг/кг дозой или дважды в день 3 мг/кг дозой капроморелина.
Как и уровни IGF-1 в сыворотке, в ходе исследования, уровни GH в сыворотке, по-видимому, зависели от введения капроморелина, как показано на Фиг. 16-20. А именно, в дни 1, 2, 4 и 7, уровни GH увеличивались через приблизительно 0,5 ч после получения собаками дозы капроморелина для них. До начала лечения, у всех собак отмечался почти неопределяемый уровень GH в сыворотке; однако после получения или один раз в день 6 мг/кг дозы, или дважды в день 3 мг/кг дозы капроморелина у собак в группах В и С наблюдалось заметное увеличение уровней GH в сыворотке, которые продолжали быть повышенными по сравнению с собаками в группе А, которые получали лишь деионизированную воду. Как показано на Фиг. 20, через три дня после прекращения лечения (в день 10), уровни GH в сыворотке у собак, получающих лечение капроморелином, не отличались значительно от уровней GH в сыворотке собак, получающих лишь деионизированную воду. Кроме того, за исключением дня 1 (Фиг. 11), уровни GH в сыворотке, по-видимому, коррелировали с дозой, полученной собаками. А именно, как показано на Фиг. 12-14, в дни 2, 4 и 7, собаки, получающие один раз в день 6 мг/кг дозу, демонстрируют более высокие концентрации GH в сыворотке, чем собаки, получающие два раза в день 3 мг/кг дозу.
Теперь со ссылкой на Фиг. 21-24, подобно GH, концентрации кортизола в сыворотке, по-видимому, коррелируют с введением капроморелина. А именно, в дни 1, 2 и 7 (Фиг. 21-23, соответственно), через приблизительно 0,5 часа после лечения, концентрации кортизола в сыворотке собак, повергнутых лечению капроморелином, увеличивались по сравнению с собаками, получающими лишь деионизированную воду. Кроме того, величина увеличения концентрации кортизола в сыворотке коррелирует с используемой схемой дозирования. В частности, у собак, получавших один раз в день 6 мг/кг дозу, наблюдались более высокие концентрации кортизола в сыворотке, чем у собак, которые получали два раза в день 3 мг/кг дозу капроморелина. Кроме того, как показано на Фиг. 24, через три дня после прекращения лечения (в день 10), уровни кортизола в сыворотке собак, получающих лечение капроморелином, не отличались значительно от уровней кортизола в сыворотке собак, получающих лишь деионизированную воду.
В целом, обе схемы дозирования оказывали заметные влияния на собак групп B и C, по сравнению с собаками группы А в качестве отрицательного контроля. Кроме того, не отмечались токсикологические реакции. Отмечались фармакологические эффекты, в том числе увеличение веса тела и потребления пищи, а также повышение уровней GH, IGF-1, кортизола и капроморелина в сыворотке. В общем, увеличения концентраций GH, IGF-1 и кортизола в сыворотке были более выраженными у животных, которым была назначена схема введения один раз в день 6 мг/кг дозы. Кроме того, хотя обе схемы дозирования стимулировали GH, IGF-1 и кортизол, схема введения два раза в день 3 мг/кг дозы приводила к достаточным количествам IGF-1 для стимулирования роста сухой мышечной массы у собак, но не вызывала увеличений концентраций GH и кортизола в той же степени, как схема введения один раз в день 6 мг/кг дозы. В результате более низких концентраций GH и кортизола, у собак с меньшей вероятностью будет наблюдаться увеличение отложения жира, что означает, что увеличение веса тела скорее всего будет за счет сухой мышечной массы.
Пример 2 - Оценка фармакокинетического профиля капроморелина и приемлемости собаками/вкусовых качеств
После выбора схемы введения 3 мг/кг дозы было проведено контролируемое, восьмичасовое исследование для оценки фармакокинетического профиля и приемлемости/вкусовых качеств различных составов капроморелина. Вкратце, двенадцать собак породы бигль (шесть кобелей и шесть сук) были рандомизированы на три группы, причем четыре собаки были в каждой группе (два кобеля и две суки). Каждая собака получала исследуемый состав капроморелина путем одного введения с использованием желудочного зонд или внутривенно ("IV"). Это исследование включало две итерации с теми же тремя группами собак с использованием семидневного периода вымывания между итерациями. Сыворотку получали перед введением (в момент время 0) и через 0,5 ч и 1, 2, 4 и 8 часов после введения капроморелина. Сыворотку проверяли на концентрацию капроморелина и IGF-1, и за собаками наблюдали в отношении клинических изменений.
Кроме того, тех же собак использовали для оценки приемлемости/вкусовых качеств. Проверку приемлемости/вкусовых качеств проводили в первые два дня после фармакокинетического анализа. Вкратце, в то же время в дни 1 и 2 после фармакокинетического анализа собакам перорально вводили в угол рта составы капроморелина, используемые в фармакокинетическом анализе. Регистрировали ответные реакции собак на разные составы.
Как показано на Фиг. 25-27, все составы, исследуемые в фармакокинетическом анализе, приводили к определяемым уровням капроморелина и повышенным уровням IGF-1 в сыворотке собак в течение восьми часов. А именно, в первой итерации (Фиг. 25), которая включает состав для IV и исследуемые составы 2 и 3, все три состава вызывали увеличение концентрации капроморелина в сыворотке в пределах 0,5 ч от введения, которая снижалась на протяжении восьмичасового исследования. Аналогично, во второй итерации, которая включает составы 4, 5 и 6, все три состава вызывали увеличение концентрации капроморелина в сыворотке, при этом максимальные концентрации имели место между 0,5 ч и 2 ч после введения. Как показано на Фиг. 27, уровни IGF-1 через восемь часов после введения также увеличивались в результате введения всех составов собакам. В общем, неблагоприятные клинические побочные эффекты не отмечались ни у одной из собак в ходе испытания, за исключением чрезмерного слюноотделения у собак, получающих состав для IV.
Хотя никакие данные анализа приемлемости/вкусовых качеств не представлены, собаки соглашались на введение состава в угол рта с помощью шприца, но не очень легко соглашались. По-видимому, собакам не нравился вкус составов, при этом состав 5 был наиболее принимаемым, а состав 1 был наименее принимаемым.
В целом, каждый из исследуемых составов приводил к соответствующим концентрациям капроморелина в сыворотке. Кроме того, введение всех составов вызывало увеличение уровней IGF-1 в сыворотке. Однако состав 4 будет использоваться в будущих экспериментах, поскольку он приводил к наиболее последовательному профилю капроморелина в сыворотке. Как обсуждается подробнее ниже, дальнейшее улучшение состава четыре будет необходимо для улучшения вкусовых качеств, что может увеличить легкость, с которой владельцы животных-компаньонов могут ввести композицию.
В частности, состав 4 включает следующие компоненты в следующих концентрациях, определяемых в виде веса компонента в общем объеме раствора: http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000050_0001.png
Пример 3 - Улучшение приемлемости собаками/вкусовых качеств содержащей капроморелин композиции
После выбора композиции 4 было проведено контролируемое, восьмичасовое исследование для улучшения состава 4, чтобы улучшить приемлемость/вкусовые качества этого состава капроморелина. В частности, состав 4 (как показано выше) смешивали с множеством различных подсластителей, корригентов и/или маскирующих вкус средств для улучшения приемлемости собаками/вкусовых качеств этого состава. Вкратце, двадцать собак породы бигль (десять кобелей и десять сук) были рандомизированы в пять групп, при этом четыре собаки были в каждой группе (два кобеля и две суки). Каждая собака получала исследуемый состав капроморелина с использованием одной пероральной дозы в угол рта. Эта проверка включала две итерации с теми же группами собак в последовательные дни. Однако на второй день потребовалось всего четыре группы, поскольку в общей сложности девять составов были проверены (т.е. пять составов были проверены в первый день, и четыре состава были проверены на второй день).
В ходе проверки девять новых составов состава 4 были проверены в дозе, составляющей 3 мг/кг. Кроме того, во время введения исследуемых составов за собаками следили, чтобы определить, являются ли исследуемые составы «хорошо принимаемыми» по оценке отсутствия клинических наблюдений и по явной приемлемости или готовности получать составы перорально. Кроме того, в ходе проверки в случае, если по меньшей мере три из четырех собак в исследуемой группе демонстрировали ответ с «хорошей приемлемостью» исследуемого состава (как определено проводящим проверку сотрудником), образцы сыворотки получали в момент времени 0, через 0,5 ч, 1 ч, 2 ч, 4 ч и 8 ч после введения. Образцы сыворотки проверяли в отношении концентрации капроморелина и IGF-1.
Данные, отражающие «хорошо принимаемые» составы, представлены на Фиг. 28 и 29. В частности, было определено, что из девяти исследованных составов составы 1, 3, 7 и 8 являются «хорошо принимаемые» собаками. В дополнение к тому, что каждый из этих составов был «хорошо принимаемым», он приводил к определяемым уровням капроморелина в сыворотке и увеличениям IGF-1 через восемь часов после введения. Было установлено, что состав 8 вызывал наиболее последовательный профиль капроморелина в сыворотке, однако настоящее изобретение не ограничивается вариантом состава 8.
В частности, «хорошо принимаемые» составы включают следующие компоненты в следующих концентрациях, определяемых в виде веса компонента в общем объеме раствора: http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000050_0001.png
Пример 4 - Усовершенствование схемы дозирования соединения для борьбы с отсутствием аппетита, содержащего капроморелин.
Хотя для дальнейшего анализа состава ранее была выбрана схема введения два раза в день 3 мг/кг дозы, был проведен дополнительный анализ схемы дозирования с целью уточнения концентраций и количества ежедневных введений содержащей капроморелин композиции. В частности, был проведен анализ для определения, является ли схема менее частого введения дозы содержащей капроморелин композиции жизнеспособной альтернативой схеме введения два раза в день 3 мг/кг дозы.
Было проведено контролируемое исследование в течение семи дней для оценки влияния различных схем дозирования капроморелина на продукцию IGF-1, GH и кортизола. Различные схемы дозирования капроморелина также оценивали в отношении влияния на потребление пищи и изменения веса тела.
Двадцать четыре взрослых, используемых ранее в опытах собак породы бигль (двенадцать кобелей и двенадцать сук) были отнесены к одной из трех групп лечения, с использованием одной группы в качестве отрицательного контроля и двух групп активного лечения. Каждая из трех групп лечения включала три кобеля и три суки. Первая группа получала состав-плацебо (т.е. деионизированную воду) дважды в день, с помощью желудочного зонда. Вторая группа получала один раз в день дозу содержащей капроморелин композиции в концентрации, составляющей 3 мг/кг, через желудочный зонд. Третья группа получала два раза в день дозу содержащей капроморелин композиции в концентрации, составляющей 3 мг/кг, через желудочный зонд.
Во время десятидневного периода исследования за каждой из собак следили, по меньшей мере один раз в день, для клинических наблюдений, в отношении смертности, заболеваемости, веса тела, приемлемости/вкусовых качеств и потребления пищи. Отбирали образцы сыворотки для измерения концентрации капроморелина, концентрации GH, концентрации IGF-1 и концентрации кортизола. Образцы сыворотки отбирали в дни 1, 2, 4 и 7 в момент времени -15 мин (перед введением дозы), непосредственно перед введением дозы (0 минут) и через 30, 45, 60, 90, 120, 240, 360 и/или 480 минут после введения дозы. Дополнительные образцы сыворотки крови отбирали в 8 утра на 10-й день исследования, чтобы оценить долгосрочное воздействие активных методов лечения.
Как показано на Фиг. 30-32, собаки в группах активного лечения (т.е. во второй и третьей группах лечения) потребляли большие количества пищи и не теряли вес во время эксперимента, по сравнению с собаками в контрольной группе (т.е. первой группе). А именно, как показано на Фиг. 30 и 31, собаки, получающие активное лечение, независимо от дозы, потребляли больше пищи, чем собаки в группе отрицательного контроля. Например, собаки, получающие один раз в день и два раза в день 3 мг/кг дозу капроморелина, потребляли в среднем на приблизительно 34% больше потребляемой ежедневно пищи, по сравнению с отрицательным контролем. Соответственно, как показано на Фиг. 32, у собак, получающих активные лечения, не наблюдалась та же потеря веса, которая наблюдалась у собак в группе отрицательного лечения. Хотя у собак в группах активного лечения не наблюдалось значительное увеличение веса в ходе эксперимента, собаки, получающие лишь деионизированную воду, имели среднюю потерю веса на 3,73%. И, наоборот, у собак, которым вводят раз в день капроморелин, не отмечалась потеря веса или не отмечалась потеря веса, равная таковой в группе отрицательного контроля.
Теперь со ссылкой на Фиг. 33 и 34, у собак в группах активного лечения наблюдались повышенные концентрации капроморелина в их сыворотках. Используя данные, полученные исходя из образцов сыворотки, взятых в дни 1 и 7 исследования, концентрации капроморелин, как правило, начинали возрастать через приблизительно 0,5 часа после введения дозы и, как правило, уменьшались до почти неопределяемых уровней к восьми часам после введения дозы. Результаты подтверждали, что содержащая капроморелин композиция вводилась правильно.
Как показано на Фиг. 35-46, у собак в группах активного лечения наблюдались изменения концентраций в сыворотке IGF-1, GH и кортизола, которые, скорее всего, связаны с введением капроморелина.
Во-первых, как показано на Фиг. 35-38, лечение капроморелином стимулировало уровни IGF-1 в сыворотке собак. А именно, как показано на Фиг. 35, через приблизительно один-четыре часа после введения собакам первоначальной дозы капроморелина, уровни IGF-1 продемонстрировали увеличение в сыворотке, по сравнению с собаками, получающими лишь деионизированную воду. Кроме того, как показано на Фиг. 36 и 37, в дни 4 и 7 эксперимента по лечению, уровни IGF-1 в сыворотке оставались постоянно выше у собак, получающих капроморелин. Как показано на Фиг. 38, через три дня после прекращения лечения (в день 10), уровни IGF-1 в сыворотке собак, получающих лечение капроморелином, не отличались значительно от уровней IGF-1 в сыворотке собак, получающих лишь деионизированную воду.
В дополнительном анализе тех же данных, и что данные, которые обсуждались выше, относительно момента времени 0 (т.е. до введения содержащей капроморелин композиции), у собак в группе активного лечения наблюдаются повышенные уровни IGF-1 в сыворотке. Например, в день 1, через восемь часов после введения, у собак, получающих лечение один раз в день, наблюдается увеличение на приблизительно 83,9% концентрации IGF-1 в сыворотке, по сравнению с моментом времени 0 в день 1. У собак, получающих лечение два раза в день, наблюдается увеличение на приблизительно 50,6% концентрации IGF-1 в сыворотке, по сравнению с моментом времени 0 в день 1. В дни 4 и 7, через восемь часов после введения, осуществляемое один раз в день лечение приводит к увеличению на приблизительно 39,5% и 36,8% концентрации IGF-1 в сыворотке, по сравнению с моментом времени 0 в дни 4 и 7, соответственно. Аналогично, в дни 4 и 7, через восемь часов после введения, осуществляемое два раза в день лечение приводит к увеличению на приблизительно 15,4% и 13,3% концентрации IGF-1 в сыворотке, по сравнению с моментом времени 0 в дни 4 и 7, соответственно. Вполне возможно, что у собак, которым осуществляют введение два раза в день содержащей капроморелин композиции, наблюдаются увеличения меньшей величины, поскольку IGF-1 в сыворотке уже присутствует в более высоких концентрациях, чем уровни IGF-1 у собак, которым осуществляют введение капроморелина один раз в день.
Как и уровни IGF-1 в сыворотке, в ходе исследования, уровни GH в сыворотке, по-видимому, зависели от введения капроморелина, как показано на Фиг. 39-20. А именно, в дни 1, 4 и 7, уровни GH увеличивались через приблизительно 0,5 ч после получения собаками содержащей капроморелин композиции. До начала лечения, у всех собак отмечались почти неопределяемые уровни GH в сыворотке; однако после получения или один раз в день 3 мг/кг дозы, или дважды в день 3 мг/кг дозы капроморелина у собак в группах активного лечения наблюдалось заметное увеличение уровней GH в сыворотке, которые продолжали быть повышенные по сравнению с собаками в группе отрицательного контроля, которые получали лишь деионизированную воду. Как показано на Фиг. 42, через три дня после прекращения лечения (в день 10), уровни GH в сыворотке собак, получающих лечение капроморелином, не отличались значительно от уровней GH в сыворотке собак, получающих лишь деионизированную воду.
Теперь со ссылкой на Фиг. 43-46, подобно GH, концентрации кортизола в сыворотке, по-видимому, коррелируют с введением капроморелина. А именно, в дни 1, 4 и 7 (Фиг. 43-45, соответственно), через приблизительно через 0,5 часа после лечения, концентрации кортизола в сыворотке собак, повергнутых лечению капроморелином, увеличивались по сравнению с собаками, получающими лишь деионизированную воду. Кроме того, увеличения уровней кортизола в сыворотке были уменьшенными в дни 4 и 7, и даже в большей степени в случае лечения капроморелином два раза в день. Кроме того, как показано на Фиг. 46, через три дня после прекращения лечения (в день 10), уровни кортизола в сыворотке собак, получающих лечение капроморелином, не отличались значительно от уровней кортизола в сыворотке собак, получающих лишь деионизированную воду.
В целом, обе схемы дозирования оказывали заметные влияния на собак групп активного лечения, по сравнению с собаками группы отрицательного контроля. Кроме того, не отмечались токсикологические реакции. Отмечались фармакологические эффекты, в том числе отсутствие значительных уменьшений веса тела и увеличение потребления пищи, а также повышение уровней GH, IGF-1, кортизола и капроморелина в сыворотке. В общем, более выраженные увеличения концентраций в сыворотке IGF-1 и уменьшение экспрессии кортизола отмечались у собак, которым осуществляли введения два раза в день. Из-за этого отмеченного преимущества, введение два раза в день содержащей капроморелин композиции (в концентрации, составляющей 3 мг/кг) будет в дальнейшем исследоваться, наряду с другими схемами дозирования, для определения самой эффективной дозы в оптимальном объеме.
Пример 5 - Дальнейшие усовершенствования схемы дозирования соединения для борьбы с отсутствием аппетита, содержащего капроморелин.
В целях дальнейшего усовершенствования схемы дозирования, которая обеспечила бы соответствующий профиль капроморелина в крови и желаемые результаты с точки зрения увеличения потребления пищи и увеличения веса, был проведен дополнительный ряд экспериментов. В этих экспериментах, двадцать четыре взрослых (кобелей и сук) собаки породы бигль весом приблизительно 9-13 кг были случайным образом разделены на четыре группы. Группа 1 получала состав-плацебо, без какого-либо активного соединения, два раза в день; группа 2 получала композицию, содержащую 3 мг/кг веса тела капроморелина, один раз в день; группа 3 получала композицию, содержащую 4,5 мг/кг веса тела капроморелина, один раз в день; и группа 4 получала композицию, содержащую 3 мг/кг веса тела капроморелина, два раза в день.
В частности, с первого дня введения дозы, дня 1, до последнего дня дозирования, дня 7, включительно композиции вводили животным перорально (например, используя шприц) в корригированном составе следующего состава: http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000057_0001.png
В этих экспериментах животным перорально вводили корригированный состав примерно в 8:00 утра и, только группе 4, снова в 6:00 вечера. Животных кормили в 10:00 утра, начиная за семь дней до дня 1 и продолжая в течение всего исследования. Животным предлагали дважды нормальное количество пищи. Приблизительно через два часа после предложения пищи остаток удаляли и взвешивали для определения потребления пищи. Этот режим ограниченного кормления начинали в день -7, чтобы сделать возможным переход животных к нормальному потреблению корма до начала исследования. Потребление пищи рассчитывали и регистрировали с дня -7 до дня 7 включительно. Исходное потребление пищи рассчитывали для каждой отдельной собаки как среднее число граммов пищи, потребленных в дни -3, -2 и -1. Потребление пищи в период исследования рассчитывали для каждой отдельной собаки как среднее значение с дня 1 до дня 7 включительно. Вес тела измеряли в дни -1, 3 и 7. Кровь получали для измерений концентраций капроморелина, гормона роста, кортизола и IGF-1 в дни 1, 4 и 7 за приблизительно 15 минут до введения, непосредственно перед введением дозы (0 мин), через 30, 45, 60, 90, 120, 240, 360 и/или 480 минут после введения дозы в яремную вену или другой удобный сосуд. Как явствует из данных Фиг. 61-74, ответная реакция животных на содержащую капроморелин композицию находится в основном в соответствии с результатами, обсуждавшимися выше.
Во-первых, как показано на Фиг. 61 и в таблице 1 ниже, животные, которые получали экспериментальные композиции, потребляли большее количество пищи и набирали больший вес, чем животные в группе 1 (т.е. в группе плацебо). В частности, как показано на Фиг. 61, животные групп 2-4, (т.е. те, которые получали содержащую капроморелин композицию) потребляли большее количество пищи по сравнению с животными контрольной группы. В частности, при сравнении пищи, потребленной в дни -1 и 7, контрольные животные потребили почти на 16% меньше пищи, при этом животные группы 2 потребили на 42,7% больше пищи, животные группы 3 потребили на 34,5% больше пищи, и животные группы 4 потребили на 31,5% больше пищи. Кроме того, как показано в таблице 1 ниже, увеличенное потребление пищи соответствовало увеличению веса тела. http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000059_0001.png
Изменение веса
Соответственно, как показано на Фиг. 62 и 63, концентрации капроморелина в сыворотке были в соответствии с ожиданиями. А именно, концентрация в сыворотке капроморелина сначала резко возрастала через 30 минут после введения и к 8 часам возвращалась к исходным уровням. Кроме того, как и ожидалось, у животных в группе 3, которые получали самую высокую дозу капроморелина, наблюдались более высокие концентрации в сыворотке капроморелина. Кроме того, эти данные также показывают, что не было никаких доказательств накопления капроморелина у этих животных, поскольку концентрация упала ниже детектируемых уровней к 8 часам после введения.
Так же, как показано на Фиг. 64A-74, уровни IGF-1, гормона роста и кортизола увеличивались в результате введения капроморелина. А именно, как показано на Фиг. 64A-66, уровни IGF-1 у контрольных животных оставались вблизи исходного уровня на протяжении всего исследования. Однако у животных в группах 2-4 наблюдались увеличения количеств IGF-1, присутствующего в сыворотке, в дни 1, 4 и 7. Кроме того, уровни IGF-1 продемонстрировали устойчивый рост на протяжении двадцати четырех часового периода у подвергнутых лечению животных ко дню 4 (Фиг. 64В) и оставались повышенными в день 7. Кроме того, у животных, которым осуществляли введения дважды в день (группа 4), наблюдался наибольший устойчивый рост, но, как представлялось, было небольшое различие в устойчивых уровнях IGF-1 между группами 2 и 3. Наконец, данные, представленные на Фиг. 66, показывают, что уровни IGF-1 оставалась слегка повышенными после прекращения лечения на 2 дня (т.е. в день 9).
Как показано на Фиг. 67-70, у групп 2-4 наблюдались первоначальные увеличения концентрации в сыворотке гормона роста. А именно, уровень гормона роста у животных группы 1 оставался вблизи исходного уровня на протяжении эксперимента. Однако у животных, получивших капроморелин, наблюдалось увеличение уровня гормона роста в сыворотке в день 1 (Фиг. 67), который уменьшался к дню 4 (Фиг. 68), еще более уменьшался к дню 7 (Фиг. 69) и не выявлялся после завершения эксперимента (день 9; Фиг. 70).
Наконец, как показано на Фиг. 71-74, лечение капроморелином также приводило к исходно повышенным уровнем кортизола. А именно, уровень кортизола у животных группы 1 оставался вблизи исходного уровня на протяжении эксперимента. Однако у животных, получивших капроморелин, наблюдалось первоначальное увеличение уровня кортизола в сыворотке в день 1 (Фиг. 71), который уменьшался к дню 4 (Фиг. 72), еще более уменьшался к дню 7 (Фиг. 73) и не выявлялся после завершения эксперимента (день 9; Фиг. 74). Интересно, что, как представлялось, профиль кортизола был больше всего подавлен у животных группы 4, но не было значимого различия между животными групп 2 и 3.
В целом, на основании результатов, обсуждавшихся выше, экспериментальные составы были хорошо принимаемыми животными. Эти результаты показывают, что введение собакам содержащей капроморелин композиций приводило к измеряемому профилю в сыворотке капроморелина во всех исследованных дозах. Кроме того, хотя количество животных было небольшим, и продолжительность была короткой, в группах 2-4 наблюдалась тенденция к повышению веса тела и потреблению пищи. Кроме того, по-видимому, не было различий в группах, которым вводили дозы один или два раза в день, в группах 2-4. Соответственно, на основе этих экспериментов и данных, представленных в предыдущих примерах, очевидно, что одна доза капроморелина между приблизительно 3 и приблизительно 4 мг на кг веса тела может быть эффективной дозой.
Пример 6 - Улучшение приемлемости собаками/вкусовых качеств содержащей капроморелин композиции
После некоторых из вышеупомянутых экспериментов и полученных, не представленных данных проводились дополнительные эксперименты с целью дальнейшего улучшения состава на основе приемлемости животными/вкусовых качеств. В частности, были проведены эксперименты, используя следующие составы: http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000061_0001.png
В этих экспериментах проверку проводили для оценки состава 2 по сравнению с составом 9 в дозе 4 мг/кг веса тела в схеме лечения один раз в день. В частности, это исследование проводилось для измерения концентраций капроморелина в сыворотке, а также измерений потребления пищи и изменения веса. В этих экспериментах шестнадцать взрослых (кобелей и сук) собак породы бигль с весом тела приблизительно от 9 до 13 кг были случайным образом разделены на две группы лечения, группа 1 получала состав 9 один раз в день, а группа 2 получала состав 2 один раз в день.
В этих экспериментах животным перорально вводили различные составы примерно в 8:00 утра. Животных кормили в 10:00 утра, начиная за семь дней до дня 1 и продолжая в течение всего исследования (5 дней). Животным предлагали дважды нормальное количество пищи. Приблизительно через два часа после предложения пищи остаток удаляли и взвешивали для определения потребления пищи. Этот режим ограниченного кормления начинали в день -7, чтобы сделать возможным переход животных к нормальному потреблению корма до начала исследования. Потребление пищи рассчитывали и регистрировали с дня -7 до дня 5 включительно. Исходное потребления пищи рассчитывали для каждой отдельной собаки как среднее число граммов пищи, потребленных в дни -3, -2 и -1. Потребление пищи в период исследования рассчитывали для каждой отдельной собаки как среднее значение с дня 1 до дня 5 включительно. Вес тела измеряли в дни -1 и 5. Кровь получали для измерений концентраций капроморелина и IGF-1 в день 5 за приблизительно 15 минут до введения, непосредственно перед введением дозы (0 мин), через 30, 60, 120, 240 и/или 480 минут после введения дозы. Как явствует из данных Фиг. 75-78, ответная реакция животных продемонстрировала позитивные признаки после введения обоих композиций.
В частности, как показано на Фиг. 75 и 76, оба состава вызывали увеличение веса и увеличение потребления пищи в течение всего исследования. Во-первых, как показано на Фиг. 75, хотя на протяжении всего эксперимента вес тела животных был выше в группе, получающей состав 9, большее увеличение веса тела отмечалось у животных, получающих состав 2. В частности, у животных, получающие состав 2, наблюдалось увеличение веса тела приблизительно на 7,84% в день 5, по сравнению с днем -1, в то время как у животных, получающих состав 9, наблюдалось увеличение веса тела приблизительно на 6,5% в течение того же периода времени. Аналогично, как показано на Фиг. 76, обе группы животных также потребляли повышенные количества пищи в течение пяти дней эксперимента. В частности, относительно дней с -3 до -1, в течение пяти дней эксперимента собаки, получившие состав 9, потребили на 73,5% больше пищи, а собаки, получившие состав 2, потребили на 56,9% больше пищи. Кроме того, как показано на Фиг. 77 и 78, капроморелин и увеличенные концентрации IGF-1 были обнаружены в сыворотках животных. В целом, на основании данных, описанных выше, очевидно, что или состав 2, или 9 может функционировать в качестве носителя для доставки содержащей капроморелин композиции.
Пример 7 - Исследование титрования дозы для собак
Дополнительные эксперименты проводились с целью дальнейшего уточнения вводимой собакам дозы для обеспечения желаемой ответной реакцию (т.е. увеличения веса тела и увеличения потребления пищи). В частности, собаки получали или состав 2 из примера 6, приведенного выше, или форму плацебо того же состава. В этих экспериментах собаки были разделены на пять групп, причем каждая группа содержала три кобеля и три суки. Группы были разделены согласно концентрации дозы. А именно, первая группа получала состав плацебо один раз в день, вторая группа получала состав 2, который вводили в дозе, составляющей 0,33 мг/кг, один раз в день, третья группа получала состав 2, который вводили в дозе, составляющей 2,0 мг/кг, один раз в день, четвертая группа получала состав 2, который вводили в дозе, составляющей 3,0 мг/кг, один раз в день, и пятая группа получала состав 2, который вводили в дозе, составляющей 4,0 мг/кг, один раз в день.
В этих экспериментах животным перорально вводили состав примерно в 8:00 утра. Животных кормили в 10:00 утра, начиная за 10 дней до дня 1 и продолжая в течение всего исследования (7 дней). Приблизительно через два часа после предложения пищи остаток удаляли и взвешивали для определения потребления пищи. Этот режим кормления начинали в день -10, чтобы сделать возможным переход животных к нормальному потреблению корма до начала исследования. Потребление пищи рассчитывали и регистрировали с дня -3 до дня 7 включительно. Исходное потребления пищи рассчитывали для каждой группы собак как среднее число граммов пищи, потребленных в дни -3, -2 и -1. Потребление пищи в период исследования рассчитывали для каждой группы собак как среднее значение с дня 1 до дня 7 включительно. Вес тела измеряли в день 1 (непосредственно перед введением дозы) и 8 (после ночного голодания). Кровь не получали во время этого эксперимента.
Как явствует из данных, представленных на Фиг. 89 и 90, ответная реакция животных продемонстрировала позитивные признаки после введения почти всех доз. В частности, как лучше всего видно на Фиг. 89, вес тела увеличивался во всех группах собак, которые получали состав 2. Интересно, что вес тела животных в группе плацебо незначительно снизился. Если смотреть по-другому, процент изменения веса тела увеличился у всех животных, получавших состав 2, как показано в таблице 2. Кроме того, с помощью статистического анализа было установлено, что по сравнению с плацебо все лечения, за исключением лечения 0,33 мг/кг, приводили к статистически значимым увеличениям значений веса тела. http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000064_0001.png
Изменение веса
Кроме того, как показано на Фиг. 91 и в таблице 3 ниже, по сравнению с исходным уровнем среднее потребление пищи увеличивалось в группах, получавших не являющийся плацебо состав. В частности, среднее значение на исходном уровне рассчитывали посредством усреднения пищи, потребленной собаками в каждый из дней с -3 до -1. Затем, среднее потребление пищи рассчитывали по ежедневному потреблению пищи в период исследования в дни с 1 до 7. В частности, на Фиг. 91 в целом показано увеличение количества пищи, потребляемой животными, получающими не являющийся плацебо состав. Кроме того, с помощью статистического анализа было установлено, что по сравнению с плацебо группа, подвергнутая лечению 4 мг/кг, потребляла значительно больше пищи. Кроме того, как показано на Фиг. 92, коэффициент корреляции Пирсона для процента изменения потребления пищи к проценту изменения веса тела составлял 0,585, что соответствует наклону 5,9%. Соответственно, увеличение веса тела было прямо пропорционально увеличению потребления пищи. http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000065_0001.png
Изменение потребления пищи
Пример 8 - Исследование пробного состава для кошек
Схожее с упомянутым ранее фармакокинетическим анализом, проведенным на собаках, фармакокинетическое исследование было проведено на кошках для оценки концентраций капроморелина и IGF-1 в сыворотке после введения различных составов. Вкратце, двенадцать кошек были отнесены случайным порядком к группе А (шесть кошек) и группе В (шесть кошек). Группа А получала внутривенно состав, который включал 0,75 мг/кг капроморелина, а группа B получала ранее исследованный состав 4 с помощью желудочного зонда. Состав 4 включает капроморелин в концентрации, составляющей 3 мг/кг. Образцы сыворотки крови отбирали после введения двух исследуемых составов для оценки концентраций капроморелина и IGF-1. Образцы отбирали в момент времени 0 (перед введением) и через 5 минут, 10 минут, 30 минут, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч и 12 ч после введения.
Как показано на Фиг. 47 и 48, содержащие капроморелин композиции не демонстрируют у кошек тот же фармакокинетический профиль, который демонстрируют эти композиции у собак. В частности, как показано на Фиг. 48, состав 4, который вводили с помощью желудочного зонда, приводил к относительно низкой концентрации в сыворотке капроморелина, при этом максимальная концентрация имела место через два часа после введения. Однако состав, вводимый IV, приводил к концентрации в сыворотке капроморелина, схожей с таковой, отмечаемой у собак. В частности, концентрация в сыворотке капроморелина возрастала относительно рано после введения (т.е. 5 минут) и переходила к снижению вплоть до тех пор, пока последние образцы не были взяты через двенадцать часов после введения. Несмотря на относительно низкие уровни биодоступности при пероральном введении (состав 4), IGF-1 все еще индуцируется через восемь часов после введения, как показано на Фиг. 49. Это несоответствие биодоступности и экспрессии IGF-1 могло указывать на относительно широкое окно эффективности вызова капроморелином ответной реакции - IGF-1-индуцируемого увеличения сухой мышечной массы.
Пример 9 - Усовершенствование схемы дозирования соединения для борьбы с отсутствием аппетита, содержащего капроморелин, для кошек.
Четырехдневное исследование было проведено с целью дальнейшей оценки фармакокинетики состава 8 из примера 3 (т.е. наиболее «хорошо принимаемого» состава) у кошек. Кроме того, введение состава 8 было также проанализировано для определения, может ли введение этого состава вызвать устойчивую продукцию IGF-1 и относительно пониженные, уменьшенные или более низкие уровни кортизола. Различные схемы дозирования капроморелина были также оценены в отношении влияния на потребление пищи и изменения веса тела.
Двадцать четыре взрослых кошек были отнесены к одной из четырех групп лечения, с использованием всех четырех групп в качестве групп активного лечения. Каждая из групп лечения включала 6 кошек. Первая группа получала стерильную инъекцию содержащей капроморелин композиции с концентрацией капроморелина, составляющей 0,75 мг/кг, один раз в день во время четырехдневного эксперимента. Вторая группа получала один раз в день стерильную инъекцию содержащей капроморелин композиции с концентрацией капроморелина, составляющей 2 мг/кг. Третья группа получала один раз в день дозу содержащей капроморелин композиции с концентрацией, составляющей 2 мг/кг, через желудочный зонд. Четвертая группа получала один раз в день дозу содержащей капроморелин композиции с концентрацией, составляющей 4 мг/кг, через желудочный зонд.
Во время семидневного периода исследования за каждой из кошек следили, по меньшей мере один раз в день, для клинических наблюдений, в отношении смертности, заболеваемости, веса тела, приемлемости/вкусовых качеств и потребления пищи. Отбирали образцы сыворотки для измерения концентрации капроморелина, концентрации IGF-1 и концентрации кортизола. Образцы сыворотки отбирали в дни 1 и 4 непосредственно перед введением дозы (0 минут) и через 30, 60, 90, 120, 240, 360 и/или 480 минут после введения дозы. Дополнительные образцы сыворотки отбирали в 8 утра в день 7 исследования, чтобы оценить долгосрочное воздействие активных методов лечения.
Как показано на Фиг. 50 и 51, в ходе эксперимента большинство кошек потребляло большее количество пищи и не теряло вес во время эксперимента. А именно, как показано на Фиг. 50, кошки, получающие стерильные инъецируемые составы или 4 мг/кг капроморелина через желудочный зонд, потребляли больше пищи в день 4 эксперимента по сравнению с предшествующими днями эксперимента. Так же, как показано на Фиг. 51, в общем кошки набирали вес в ходе эксперимента. Например, у кошек, получающих стерильные инъекции 0,75 мг/кг и 2 мг/кг капроморелина, наблюдалось увеличение на 1,33% и 2,37% веса тела, соответственно, по сравнению с измерениями на исходном уровне. Так же у кошек, которым вводили перорально 2 мг/кг и 4 мг/кг капроморелина, наблюдалось увеличение на 0,70% и 1,47% веса тела, по сравнению с измерениями на исходном уровне.
Теперь со ссылкой на Фиг. 52-54, у кошек, получающих стерильные инъецируемые составы, отмечался фармакокинетический профиль, отличный от такового для кошек, получающих состав перорально. У кошек, получающих стерильный инъецируемый состав, отмечался фармакокинетический профиль, подобный таковому предыдущих примеров с собаками. В частности, концентрация капроморелина в сыворотке достигала максимума через приблизительно 0,5 ч после введения и уменьшилась до достижения почти неопределяемых уровней к приблизительно восьми часам после введения. Кроме того, концентрации капроморелина в сыворотке в группах, получающих стерильный инъецируемый состав, по-видимому, соответствовали вводимой концентрации капроморелина, как показано на Фиг. 51-53. Конкретнее, максимальные концентрации капроморелина в сыворотке приблизительно в 2,5-3 раза выше в группе кошек, получающих стерильную инъекцию 2 мг/кг, по сравнению с кошками, получающими 0,75 мг/кг дозу.
Наоборот, у кошек, получающих пероральные составы, наблюдались относительно низкие уровни капроморелина в сыворотке. В частности, в случае вводимого в дозе 2 мг/кг перорального состава в группах активного лечения были обнаружены повышенные концентрации капроморелина в их сыворотке, но ниже, чем у кошек, получающих стерильные инъекцируемые составы. Используя данные, полученные исходя из образцов сыворотки, взятых в дни 1 и 4 исследования, концентрации капроморелина, как правило, начинали возрастать через приблизительно 0,5 часа после введения дозы и, как правило, уменьшались до почти неопределяемых уровней к восьми часам после введения дозы. Эти результаты подтверждают, что содержащая капроморелин композиция вводилась правильно.
Как показано на Фиг. 55-60, у кошек, получающих и стерильные инъецируемые составы, и пероральные составы, наблюдались изменения концентраций в сыворотке IGF-1 и кортизола, которые, скорее всего, связаны с введением капроморелина.
Во-первых, как показано на Фиг. 55-57, лечение капроморелином стимулировало уровни IGF-1 в сыворотке кошек. А именно, как показано на Фиг. 55, через примерно два-четыре часа после введения кошкам первоначальной дозы большинства составов капроморелина, уровни IGF-1 продемонстрировали увеличение в сыворотке. Однако, в одной группе лечения, у кошек, получающих пероральный состав в дозе 2 мг/кг, отмечались только умеренно повышенные концентрации IGF-1 через восемь часов после введения по сравнению с уровнями до лечения. Так же, в день 4, у кошек, получающих стерильные инъецируемые составы и пероральный состав в дозе 4 мг/кг, отмечалось устойчивое увеличение уровней IGF-1, подобно профилю IGF-1, наблюдаемому у собак. На 4-й день, у кошек, которым вводили пероральный состав в дозе 2 мг/кг, не были обнаружены дальнейшие увеличения IGF-1, как показано на Фиг. 56. Как показано на Фиг. 57, через три дня после прекращения лечения (день 7), уровни IGF-1 в сыворотке кошек, получающих лечение капроморелином, были сходными во всех группах лечения.
Конкретнее, в не представленных данных, по сравнению с моментом времени 0 (т.е. до введения содержащей капроморелин композиции), у кошек в по меньшей мере некоторых из групп лечения наблюдаются повышенные уровни IGF-1 в сыворотке. Например, в день 1, через восемь часов после введения, у кошек, получающих стерильные инъецируемые составы в дозах 0,75 мг/кг и 2 мг/кг, наблюдаются увеличения на приблизительно 39,8% и 43,1% концентрации IGF-1 в сыворотке, соответственно, по сравнению с моментом времени 0 в день 1. У кошек, получающих пероральные составы в дозах 2 мг/кг и 4 мг/кг, наблюдаются увеличения на приблизительно 26,6% и 30,8% концентрации IGF-1 в сыворотке, соответственно, по сравнению с моментом времени 0 в день 1. В день 4, через восемь часов после введения, вводимые в дозе 0,75 мг/кг и 2 мг/кг стерильные инъецируемые составы индуцируют увеличения на приблизительно 12,2% и 10,8% концентрации IGF-1 в сыворотке по сравнению с моментом времени 0 в день 4, соответственно. Так же, в день 4, через восемь часов после введения вводимые в дозе 2 мг/кг и 4 мг/кг пероральные составы индуцируют увеличения на приблизительно 7,6% и 0,7% концентрации IGF-1 в сыворотке по сравнению с моментом времени 0 в день 4, соответственно. Вполне возможно, что у кошек, получающих стерильный инъецируемый состав и пероральные составы в дозе 4 мг/кг, наблюдаются увеличения меньшей величины, поскольку IGF-1 в сыворотке уже присутствует на более высоком уровне, чем уровни IGF-1 у кошек, которым назначены эти схемы дозирования капроморелина.
Теперь со ссылкой на Фиг. 58-60, концентрации кортизола в сыворотке, по-видимому, коррелируют с введением капроморелина. А именно, в дни 1 и 4 (Фиг. 58 и 59, соответственно), через приблизительно 0,5 часа после лечения, концентрации кортизола в сыворотке кошек, повергнутых лечению капроморелином, начинают увеличиваться. Кроме того, во всех группах лечения, отличных от группы лечения пероральным составом в дозе 2 мг/кг, концентрации кортизола продолжали увеличиваться до периода времени между 90 и 120 минутами, когда концентрация стали уменьшаться до достижения почти неопределяемых уровней через 480 минут. Кроме того, увеличения уровней кортизола в сыворотке были уменьшенными в день 4, по сравнению с уровнями, обнаруженными в день 1. Кроме того, как показано на Фиг. 60, через три дня после прекращения лечения (в день 7), уровни кортизола в сыворотке кошек, получающих лечение капроморелином, были схожими во всех группах лечения.
В целом, большинство схем дозирования оказывали заметные влияния на кошек. Кроме того, не отмечались токсикологические реакции. Отмечались фармакологические эффекты, в том числе увеличения веса тела и потребления пищи, а также повышение уровней IGF-1, кортизола и капроморелина в сыворотке. В общем, казалось, будто бы стерильный инъецируемый состав индуцирует более желательные профили IGF-1, кортизола и капроморелина в сыворотке.
Пример 10 - Дальнейшие усовершенствования схемы дозирования соединения для борьбы с отсутствием аппетита, содержащего капроморелин, для кошек.
Затем в целях дальнейшего улучшения состава, предназначенного для использования с соединением для борьбы с отсутствием аппетита, содержащим капроморелин, для подтверждения профиля капроморелина в сыворотке и ответной реакции IGF-1, и подтверждения того, что лечение содержащей капроморелин композицией приводит к увеличению веса и увеличению потребления пищи, были проведены дополнительные эксперименты. А именно, после периода адаптации в течение семи дней, в общей сложности 20 кошек (10 кастрированных котов и 10 интактных кошек) были случайным образом разделены между четырьмя группами лечения, с отнесением пяти животных к каждой группе. В частности, группа 1 получала состав 1 (называемый PRT2-81 на соответствующих фигурах; описанный ниже) один раз в день в дозе, составляющей 4 мг/кг веса тела капроморелина; группа 2 получала состав 2 (называемый также новой формой на соответствующих фигурах; описанный ниже) один раз в день в дозе, составляющей 4 мг/кг веса тела капроморелина; группа 3 получила состав 3 (называемый PERT2-86 на соответствующих фигурах; описанный ниже) один раз в день в дозе, составляющей 4 мг/кг веса тела капроморелина; и группа 4 получила состав 4 (называемый PRT3-99I на соответствующих фигурах; описанный ниже) один раз в день в дозе, составляющей 4 мг/кг веса тела капроморелина. http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000070_0001.png
В этих экспериментах, с дня 1 по день 6 включительно, всем животным перорально вводили соответствующий состав капроморелина с помощью шприца в угол с правой стороны рта. На 6-й день образцы крови брали у каждой кошки в различные моменты времени для измерений капроморелина и IGF-1 в сыворотке. В частности, образцы крови брали до введения дозы (0 минут), через 30, 60, 90, 120, 240, и 480 минут после введения дозы. Кроме того, IGF-1 измеряли в моменты времени 0 минут и 480 минут, а капроморелин измеряли в каждый период времени. Кроме того, в дни 1, 2, 3, 4 и 5 были проведены наблюдения, касающиеся приемлемости дозы и ее вкусовых качеств.
Как суммировано на Фиг. 79-82, не представлялось, что кошкам не нравится какой-либо из составов, хотя кошкам, по-видимому, не нравилась в общем процедура введения дозы. В общем, ни один из составов не был «хорошо принимаемым» кошками; однако большинство составов были, тем не менее, принимаемыми с некоторыми неблагоприятными клиническими наблюдениями, которые отмечаются у некоторых из кошек (т.е. облизыванием, причмокиванием ртом/губами и слюнотечением). В целом, составы являются, как правило, принимаемыми в сходной степени кошками.
Далее, как показано на Фиг. 83 и в таблице 4 ниже, все кошки набирали вес в результате получения исследуемых составов. В среднем, во всех группах наблюдалось увеличение веса на 2%-4%.
http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000073_0001.png
Изменение веса
Как показано на Фиг. 84-86 и в таблице 5 ниже, отмечаемое увеличение веса кошек было обусловлено по меньшей мере частично увеличением потребления пищи. В частности, в ходе эксперимента, потребление пищи рассчитывали для всех животных, в том числе во время периода адаптации в течение дней от -3 до -1. В частности, в период адаптации, среднее индивидуальное потребление пищи находилось в диапазоне от 19 до 60 граммов в день для всех котов исследования и от 23 до 50 граммов в день для всех кошек исследования. Среднее в период адаптации индивидуальное количество ежедневно потребляемой пищи, на основе веса тела в день -1, в соответствии с расчетами составляло от 3,6 до 8,8 г/кг для всех котов исследования и от 6,1 до 14,0 г/кг для всех кошек исследования. Как показано на Фиг. 84-86, у всех животных исследования отмечалось повышение аппетита, что приводило к увеличению среднего потребления пищи, при сравнении периода адаптации с периодом после введения дозы. Примечательно, что потребление пищи, вероятно, уменьшалось на 6-й день из-за многочисленных образцов крови, получаемых в этот день. Как было отмечено в таблице 3, каждый из различных составов вызывал значительные увеличения потребления пищи. http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000074_0001.png
Увеличение потребления пищи
Далее, как показано на Фиг. 87, подобно предварительным результатам и в случае кошек, и в случае собак, каждый из исследуемых составов вызывал первоначальный всплеск концентрации капроморелина у исследуемых животных в пределах 30 минут от введения. После первоначального всплеска и в течение следующих восьми часов концентрации в сыворотке капроморелина снижались до уровней ниже пределов обнаружения анализа. Интересно, что животные в группе 1, в среднем, продемонстрировали больший первоначальный всплеск концентрации капроморелина в сыворотке, но в конечном итоге выводили композицию к восьми часам после введения дозы. Кроме того, как показано на Фиг. 88 и в таблице 6 ниже, все четыре исследованных состава индуцировали некоторый уровень увеличения концентрации IGF-1 в сыворотке. Как обсуждалось в предыдущих экспериментах, эти ежедневные увеличения могут не быть столь значительными, как ожидалось, в связи с тем, что к дню 6 можно было бы ожидать наличие постоянных количеств IGF-1, циркулирующего по всему организму животных, в результате лечения содержащей капроморелин композицией.
Процент увеличения уровней IGF-1 в сыворотке в день 6
Пример 11 - Дополнительное улучшение схемы дозирования соединения для борьбы с отсутствием аппетита, содержащего капроморелин, для кошек.
Для определения схемы дозирования для кошек, которая обеспечивает требуемый профиль уровней IGF-1 и кортизола для поддержания положительных эффектов, связанных с композицией для борьбы с отсутствием аппетита (т.е. увеличением аппетита и мышечной массы), были проведены дополнительные эксперименты. А именно, все кошки в этом эксперименте получили различные дозы состава 4 из примера 10, обсуждавшегося выше. В частности, в общей сложности 30 кошек делили на пять групп, при этом в каждую группу включали три кота и три кошки: группа 1 получала состав плацебо один раз в день; группа 2 получала состав 4 в дозе, составляющей 1 мг/кг, один раз в день; группа 3 получала состав 4 в дозе, составляющей 2 мг/кг, один раз в день; группа 4 получила состав 4 в дозе, составляющей 3 мг/кг, один раз в день; и группа 5 получала состав 4 в дозе 4, составляющей мг/кг, один раз в день. В случае всех животных осуществляли пероральные введения.
Эксперимент продолжался после периода адаптации в течение семи дней, при этом этот период предназначался для того, чтобы позволить кошкам адаптироваться к режиму кормления, связанному с экспериментами. Начиная с дня -7, 300 г пищи предлагали каждому из животных в течение приблизительно 4 часов, начиная с 11:00 и заканчивая в 15:00. После удаления корм взвешивали каждый день для оценки потребления. В этих экспериментах в дни с 1 по 10 включительно всем животным перорально вводили в угол рта соответствующую дозу состава 4. В дни 1 и 10 брали образцы крови у каждой кошки в различные моменты времени для измерения капроморелина, IGF-1 и/или кортизола в сыворотке. В частности, образцы крови брали до введения дозы (0 минут), через 30, 60, 90, 120, 240 и 480 минут после введения дозы. Образцы крови также брали в дни 12 и 15 для оценки «вымывания» композиции, содержащей капроморелин. Кроме того, вес тела отдельных животных измеряли в дни -7, -1, 5 и 10. Кроме того, соответствующее дозирование состава 4 основывалось на относящихся к весу данных, собранных в день -1.
Как показано на Фиг. 93 и в таблице 7, введение композиции для борьбы с отсутствием аппетита приводило к общему ежедневному увеличению потребления пищи, по сравнению с количествами на исходном уровне. В частности, исходные значения рассчитывали путем усреднения потребленной пищи для каждой группы в дни с -3 по -1, а среднее значение в период исследования рассчитывали, исходя из дней с 1 до 10 включительно. Хотя потребление пищи, как правило, увеличивалось во время исследования, в день 10, один из двух дней, когда осуществлялся большой забор крови, количество потребленной пищи было немного уменьшенным, что, вероятно, связано со стрессом, вызванным забором крови. Как показано в таблице 7 и в общем проиллюстрировано на Фиг. 93, лечение всеми различными дозами состава 4 приводило к увеличению потребления пищи.
http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000076_0001.png
Увеличение потребления пищи
Далее, как показано на Фиг. 94 и в таблице 8 ниже, лечение различными дозами состава 4 композиции для борьбы с отсутствием аппетита также приводило обычно к увеличению веса тела кошек. Кроме того, у животных, которые получали состав плацебо, не было какого-либо изменения веса тела между днями -1 и 10. В целом, кошки во всех экспериментальных группах набирали вес в результате лечения, при этом у животных, которые получали 3 мг/кг и 4 мг/кг дозы, отмечались значительные увеличения веса тела, по сравнению с контролем животными, которые получали плацебо.
Изменение веса тела
Теперь со ссылкой на Фиг. 95 и 96, лечение различными дозами состава 4 композиции для борьбы с отсутствием приводило к соответствующим увеличениям концентрации капроморелина в сыворотке. В частности, более высокие дозы капроморелина, вводимого кошкам, коррелировали с большими концентрациями капроморелина, обнаруживаемого в сыворотке в течение восьми часов после введения и в день 1, и в день 10. Кроме того, не было фактов накопления капроморелина у животных, поскольку концентрация капроморелина возвращалась к неопределяемым уровням к восьми часам после введения в оба дня 1 и 10.
Как показано на Фиг. 97-100 и таблицах 9 и 10 ниже, лечение различными дозами состава 4 композиции для борьбы с отсутствием аппетита приводило к первоначальным увеличениям уровней IGF-1 в сыворотке кошек. Сначала, как показано на Фиг. 97 и в таблице 9, после введения в день 1, уровни IGF-1 в сыворотке начинали увеличиваться в экспериментальных группах через приблизительно 120 минут после введения и были все выше через 480 мин после введения, по сравнению с моментом времени до введения дозы. Кроме того, как показано на Фиг. 98 и в таблице 10, в день 10, у всех животных, получающих состав, не являющийся плацебо, наблюдались устойчивые увеличения концентрации IGF-1 в сыворотке в течение всего периода времени отбора образцов. Это устойчивое увеличение IGF-1 после получения множества последовательных вводимых один раз или два раза в день доз композиции, содержащей капроморелин, согласуется с ранее рассмотренными примерами. В целом, на основе анализа данных, по-видимому, у животных в группе 4 (3 мг/кг) наблюдалось наибольшее устойчивое увеличение IGF-1 в течение периода исследования. В частности, как показано в таблице 10, процент увеличения IGF-1 для группы 4 в момент времени = 480 минутам по сравнению с моментом времени до введения дозы является на самом деле отрицательным из-за очень устойчивых уровней IGF-1 на протяжении предыдущих 24 часов. Кроме того, как показано на Фиг. 99 и 100, через два дня после прекращения лечения (в день 12 - Фиг. 99), уровни IGF-1 в сыворотке начинали снижаться, и через пять дней после лечения (день 15 - Фиг. 100), уровни IGF-1 в сыворотке возвращались к исходному уровню. http://patentimages.storage.googleapis.com/WO2014052780A2/imgf000078_0001.png
Концентрация IGF-1 в сыворотке: день 1
Концентрация IGF-1 в сыворотке: день 10
Как показано на Фиг. 101 и 102, лечение различными дозами состава 4 композиции для борьбы с отсутствием аппетита приводило к первоначальным увеличениям уровней кортизола в сыворотке кошек. В частности, как показано на Фиг. 101, в день 1, у каждого из животных в экспериментальных группах наблюдалось первоначальное увеличение концентрации кортизола в сыворотке, которая в конце концов возвращалась к исходным уровням через 480 мин после введения. Кроме того, это увеличение, отмечаемое в день 1, в экспериментальных группах было уменьшенным к дню 10. В частности, как показано на Фиг. 102, увеличение концентрации кортизола в сыворотке было аннулировано, по сравнению с резкими повышениями концентраций в сыворотке, обнаруженными в день 1, что согласуется с другими примерами, обсуждавшимися выше. Кроме того, как показано на Фиг. 103 и 104, после экспериментального периода, в дни 12 и 15, не было устойчивого увеличения концентраций кортизола в сыворотке, выявляемых у экспериментальных или контрольных животных.
Пример 12 - Исследование пробного состава для кошек и фармакокинетический анализ
Схожее с некоторыми из других фармакокинетических анализов, проведенных на собаках и кошках, дополнительное фармакокинетическое исследование было проведено на кошках для оценки содержащих капроморелин составов, которые делают возможной циркуляцию достаточного количества лекарственного средства с вызовом стимуляции аппетита, и для определения фармакокинетического профиля капроморелина у кошек. Вкратце, двенадцать кошек были отнесены случайным порядком к группе 1 (шесть кошек) и группе 2 (шесть кошек). Группа А получала внутривенно состав, который включал 0,75 мг/кг капроморелина, растворенного в стерильной воде, а группа 2 получала ранее исследованный состав с помощью желудочного зонда. Потребление пищи определяли ежедневно для всех кошек. А именно, животным предлагали корм в приблизительно 11:00 утра, с удалением корма в приблизительно 15:00. После удаления корма рассчитывали потребленное количество. В качестве исходного вопроса, в наблюдаемом потреблении пищи не выявлены какие-либо значительные увеличения (данные не представлены), но продолжительность схемы лечения была короче традиционных схем лечения.
Вначале, кошкам предоставляли семидневный период адаптации, чтобы приспособиться к экспериментальным условиям и предоставляемому корму. После периода адаптации, в день 0, все животные в группе 1 получали внутривенную инъекцию композиции, содержащей дозу, составляющую 0,75 мг/кг капроморелина. В день 0, животным в группе 2 вводили перорально состав через желудочный зонд в дозе, составляющей 3 мг/кг капроморелина. В день 0, образцы сыворотки брали у животных группы 1 в момент времени время 0 (перед введением) и через 5 минут, 10 минут, 30 минут, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч и 12 ч после введения, и образцы сыворотки крови также брали у животных группы 2 в момент времени время 0 (перед введением) и через 15 минут, 30 минут, 45 минут, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч и 12 ч после введения. После этого, в день 1, животные в группе 2 получали вторую дозу исследуемого состава в дозе, составляющей 1 мг/кг, для оценки вкусовых качеств и приемлемости, в результате были обнаружены общая приемлемость и вкусовые качества состава (данные не представлены).
Как показано на Фиг. 105 и 106, профили концентрации капроморелина в сыворотке отличались между группами 1 и 2. А именно, как и можно было бы ожидать, концентрация в сыворотке животных группы 1 увеличивалась гораздо более быстрыми темпами, и в итоге достигала намного более высокого уровня, по сравнению с группой 2. В частности, у животных группы 2, которым вводили перорально содержащую капроморелин композицию, наблюдался небольшой пик концентрации в сыворотке через приблизительно 2 часа после введения приблизительно, составляющий 150 нг/мл. С другой стороны, у животных группы 1, которые получали внутривенную инъекцию композиции, наблюдался больший пик (приблизительно 625 нг/мл) через приблизительно 5 минут после введения. Обратимся теперь к Фиг. 107, у животных группы 1 также отмечались увеличенные в большей степени уровни IGF-1 в сыворотке, чем у животных группы 2.
В дополнение к проверке вышеуказанных уровней капроморелина и IGF-1 в плазме также выполняли дополнительный фармакокинетический анализ. В частности, было установлено, что профиль капроморелина в плазме животных группы 1 был двухфазным, включая как распределение, так и компонент выведения. Кроме того, этот анализ также показал, что клиренс капроморелина у животных группы был быстрым (приблизительно 30 мл/мин/кг), что по существу соответствует печеночному кровотоку у кошек. В результате этой относительно высокой скорости клиренса, можно предположить, что биодоступность при пероральном ведении будет, как правило, низкой и переменной у кошек. Кроме того, фармакокинетические данные также показывают, что полупериод существования на конечной фазе капроморелина у кошек составляет приблизительно 0,9 ч. Общие данные фармакокинетического исследования животных группы 1 проиллюстрированы на Фиг. 108.
Профиль в плазме животных группы 2 состоял из фазы абсорбции, плато или двойного пика в Тmax и быстрой конечной фазы. В частности, данные фармакокинетического исследования животных группы 2 проиллюстрированы на Фиг. 109. Например, средняя Сmax составляла 148,9 нг/мл и возникала через 2 часа. Плато или двойной пик профиля могли быть обусловлены энтерогепатической рециркуляцией, которая происходит, когда лекарственное средство выводится в виде комплекса лекарственное средство-конъюгат в желчь, так что комплекс разрушается в дистальном отделе желудочно-кишечного тракта, так что лекарственное средство вновь поглощается. Плато или двойной пик могли быть также обусловлены абсорбцией в различных местах желудочно-кишечного тракта. Кроме того, средний полупериод существования на конечной фазе составлял 1,04 часа.
Пример 13 - Исследование нарушенной функции почек у кошек
Следующее исследование было предпринято, чтобы оценить несколько моментов. Во-первых, следующие эксперименты проводились с целью определения, может ли состав капроморелина, при введении или внутривенно, или подкожно, стимулировать аппетит у кошек с нарушенной функцией почек. Во-вторых, следующие эксперименты проводились с целью оценки фармакокинетического профиля капроморелина в сыворотке кошек с нарушенной функцией почек. Наконец, следующие эксперименты проводились с целью определения, накапливается ли капроморелин, который вводят подкожно, в сыворотке после 14 дней лечения.
Шестнадцать кошек с нарушенной функцией почек были подвергнуты адаптации для следующего исследования. Животным, отнесенным к группе 1 (N=6), вводили внутривенно состав капроморелина (т.е. капроморелин в стерильной воде) в дозе, составляющей 0,75 мг/кг, в день 0 эксперимента. Животным, отнесенным к группе 2 (N=6), вводили подкожно состав капроморелина (2,1% в отношении веса к объему капроморелина, 1% в отношении веса к объему бензилового спирта и цитратный буфер) ежедневно в течение 14 дней в дозе, составляющей 2 мг/кг. Животные, отнесенные к группе 3 (N=4), служили в качестве не подвергнутых лечению контролей. В ходе исследования отбирали образцы крови у животных группы 1 в момент времени 0 (перед введением), через 5 минут, 10 минут, 30 минут, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч и 12 ч после введения в день 0. Образцы крови брали у животных группы 2 в момент времени 0 (перед введением), через 15 минут, 30 минут, 45 минут, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч и 12 ч после введения в день 0 и в момент времени 0, через 30 минут, 1 ч, 2 ч, 4 ч и 8 ч после введения в день 13. Кроме того, вес тела измеряли в дни исследования -7, -1 и 13 (только для групп 2 и 3). Также следили за потреблением пищи в дни исследования -7 до 13 только для животных в группах 2 и 3.
Как показано на Фиг. 110, не было найдено существенных различий в весе тела животных в группах 2 и 3 на протяжении всего исследования. В частности, во время исследования, животные в обеих группах 2 и 3 потеряли вес, что свидетельствует о том, что потеря веса у животных группы 2, скорее всего, не из-за лечения. Аналогично, как показано на Фиг. 111, нет существенного различия в количестве потребляемой пищи между животными в группах 2 и 3, хотя, как представляется, средние для группы значения для пищи, потребленной животными группы 2, больше средних значений для количества пищи, потребленной животными группы 3.
Как показано на Фиг. 112, после введения содержащих капроморелин композиций животным в группах 1 и 2 сразу же отмечалось первоначальное увеличение концентрации капроморелина в сыворотке. В частности, у животных группы 1, которым внутривенно вводили композицию, концентрация капроморелина в сыворотке сначала резко возрастала через приблизительно 5 минут после введения (приблизительно 397 нг/мл), а затем постепенно возвращалась к исходному уровню к приблизительно 8 часам после введения. Аналогично, в день 0 у животных группы 2, которые получали подкожную инъекцию композиции, концентрация капроморелина в сыворотке также сначала резко возрастала через приблизительно 15 минут после введения (приблизительно 833 нг/мл), а затем возвращалась к исходным уровням к приблизительно 8 часам после введения. Кроме того, как показано на Фиг. 113, в день 13 исследования (т.е. после получения 13 предшествующих введений), у животных в группе 2 отмечался всплеск концентрации капроморелина в сыворотке через 30 мин после введения (приблизительно 950 нг/мл), и затем концентрация возвращалась к исходным уровням к приблизительно 8 часам после введения. Таким образом, по-видимому, капроморелин не накапливается в сыворотке животных после 14 дней лечения, поскольку уровни капроморелина у животных группы 2 находились на исходном уровне и в момент времени 0, и через 8 часов после введения в день 13.
Теперь со ссылкой на Фиг. 114 и 115, у животных в обеих группах 1 и 2 наблюдалась увеличенная в сыворотке концентрация IGF-1 в результате лечения капроморелином. В частности, через 8 часов после введения в день 0, у животных в группе 1 наблюдалось увеличение IGF-1 (Фиг. 114), которое также отмечалось в дни 0 и 13 у животных группы 2 (Фиг. 115).
Кроме того, дополнительные фармакокинетические анализы были также проведены на образцах сыворотки животных групп 1 и 2. Как показано на Фиг. 116 и 117, фармакокинетика капроморелина у животных группы 1 была схожей с тем, что наблюдалось ранее, что касается быстрого клиренса (20 мл/мин/кг) у нескольких из исследуемых животных. Кроме того, полупериод существования на конечной фазе капроморелина по оценкам составлял от 0,67 до 0,9 часов. Все вместе, фармакокинетика является по существу такой же, как у кошек без нарушения функции почек, что касается введения с помощью внутривенной инъекции.
Как показано на Фиг. 116 и 118, фармакокинетики вводимого подкожно капроморелина также определяли. В частности, средняя геометрическая Cmax составляла 893 нг/мл и отмечалась через 0,42 часа. Кроме того, определяли среднюю абсорбированную часть дозы путем деления средней площади под кривой (AUC)/дозу для животных в группе 2, с последующим делением на отношение AUC/доза для животных в группе 1. В этом случае, средняя абсорбированная доля дозы (F) равна 1,37. Среднее время абсорбции было коротким (0,4 ч), что свидетельствует о быстрой абсорбции капроморелина при подкожном введении, которое короче времени абсорбции при пероральном введении. Взятые вместе, эти данные фармакокинетических исследований свидетельствуют о том, что капроморелин, вводимый подкожно кошкам, хорошо абсорбируется.
Все композиции и способы, раскрытые и заявленные здесь, могут быть приготовлены и выполнены без излишних экспериментов в свете настоящего описания. Хотя композиции и способы этого изобретения были описаны с учетом предпочтительных вариантов осуществления, квалифицированным в данной области техники специалистам будет очевидно, что изменения могут быть внесены в композиции и способы, и в стадии или в последовательность стадий описанного здесь способа, не отступая от концепции, сущности и объема изобретения. Конкретнее, будет очевидно, что определенные агенты, которые являются родственными как химически, так и физиологически, могут использоваться вместо агентов, описанных здесь, при достижении тех же или схожих результатов. Все такие аналогичные замены и модификации, очевидные квалифицированным в данной области техники специалистам, считаются находящимися в пределах сущности, объема и концепции настоящего изобретения, определяемых следующей формулой изобретения.
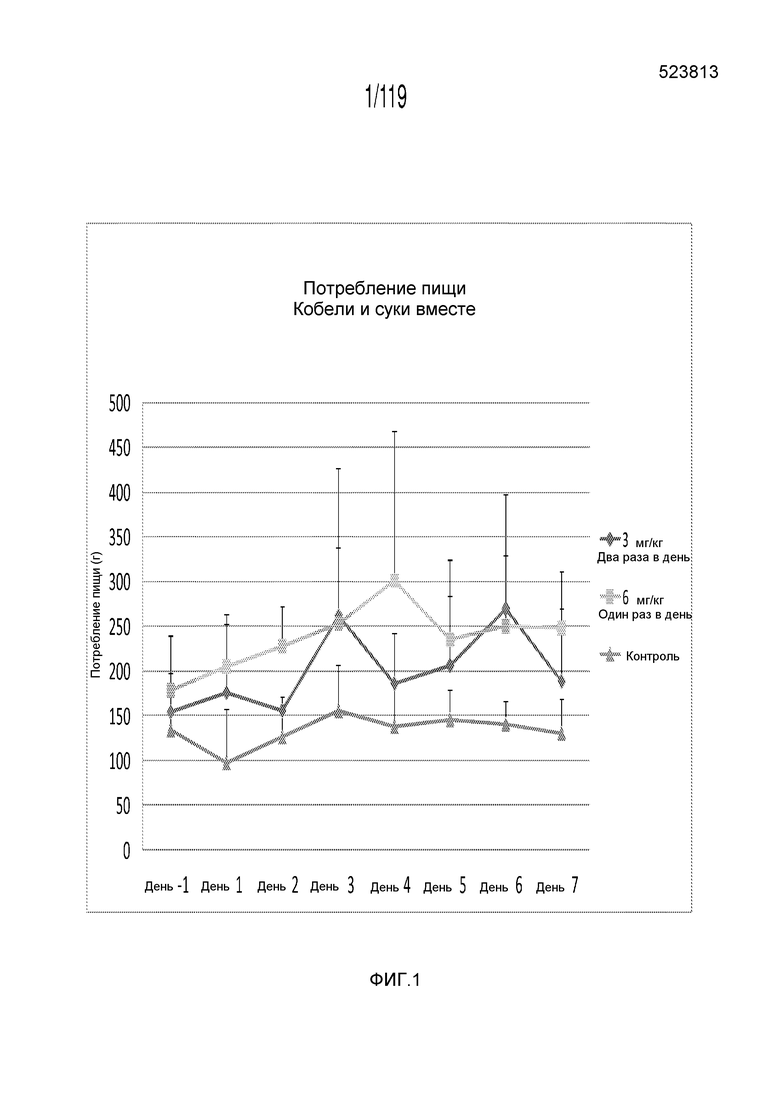
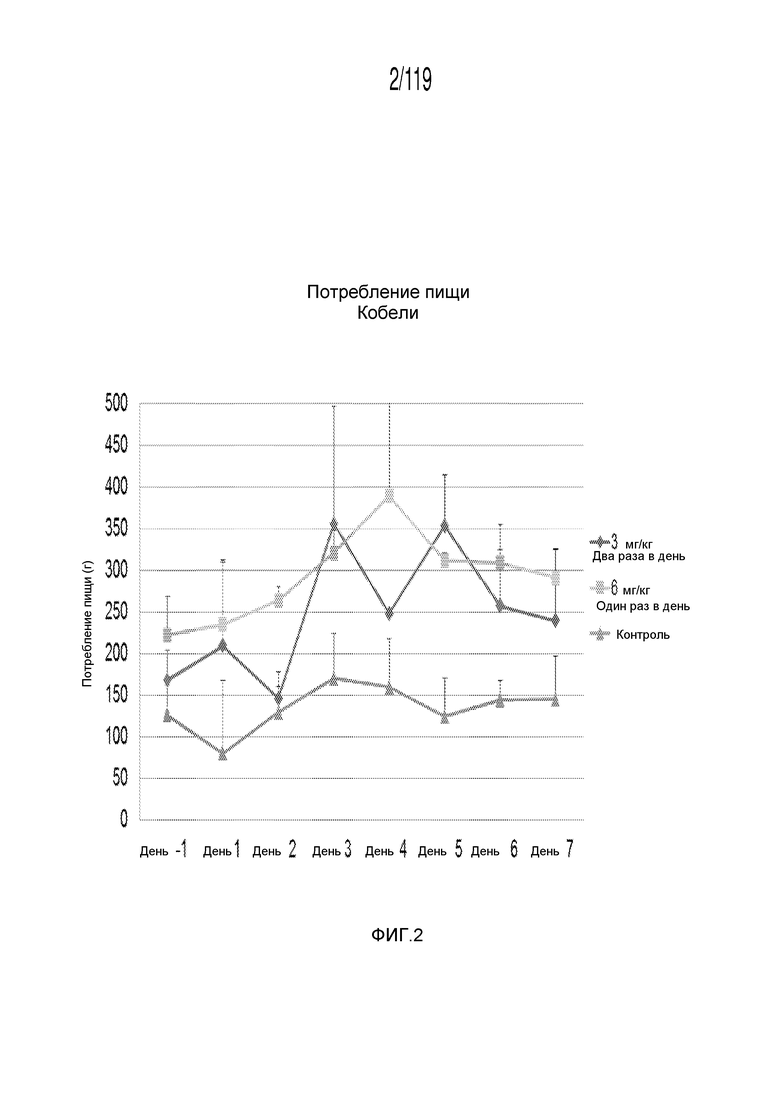
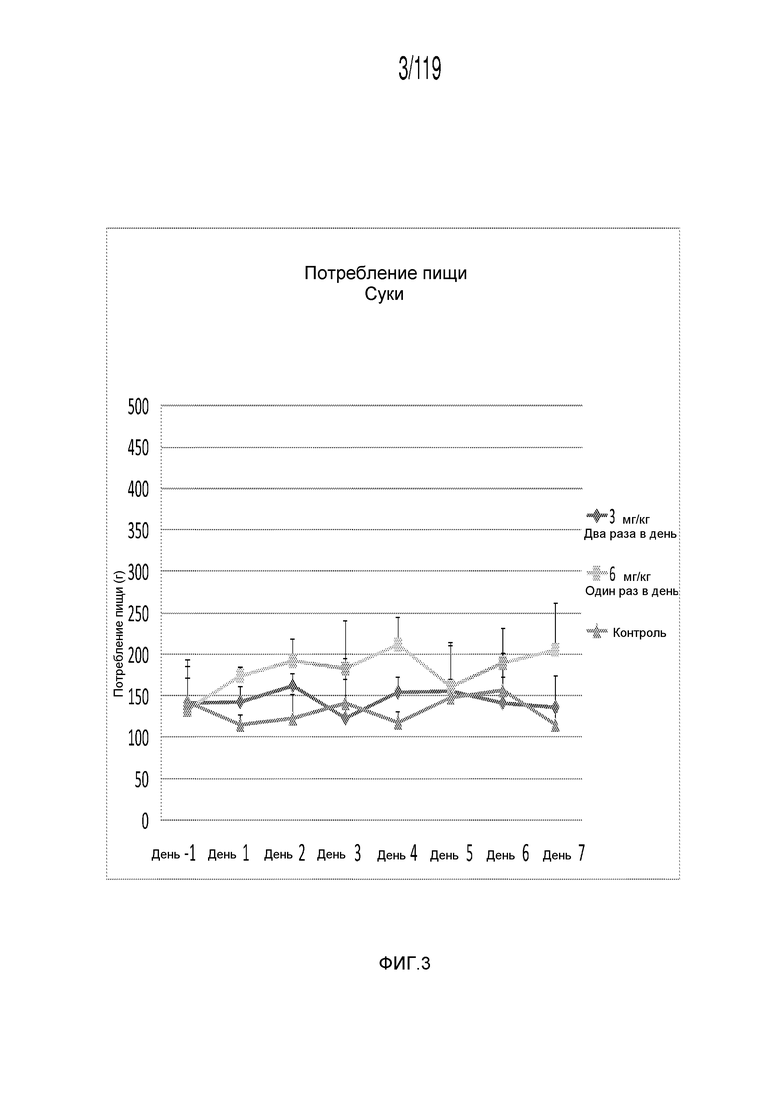
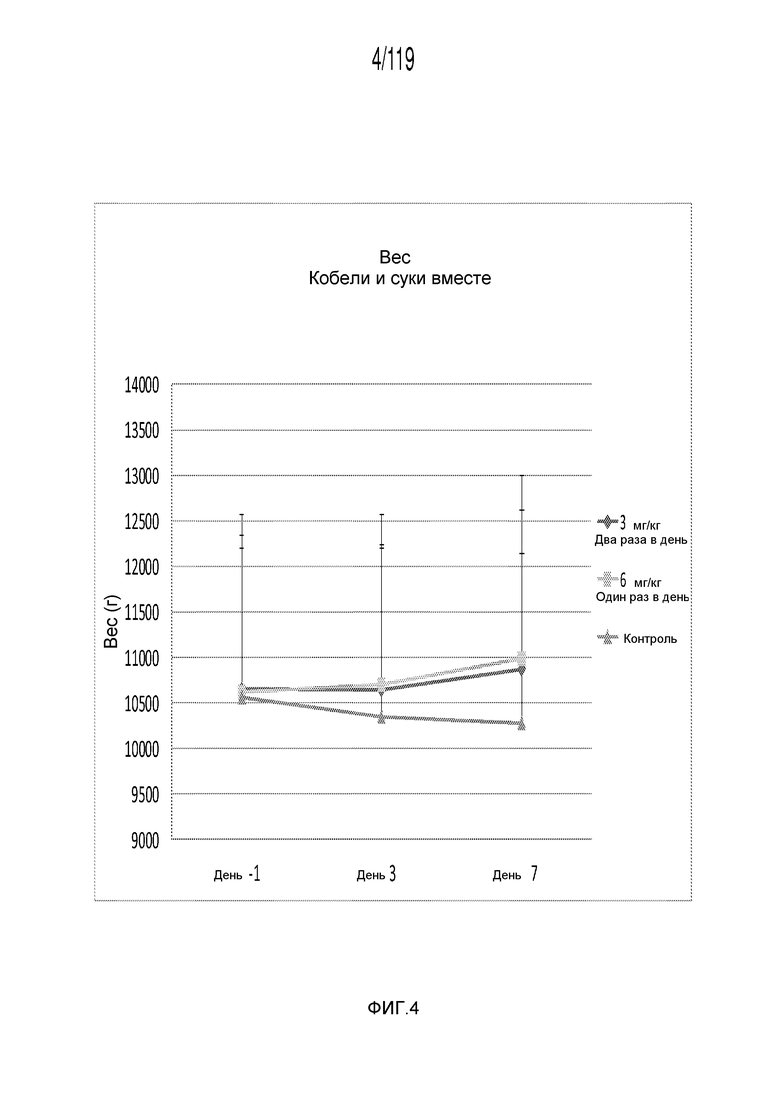
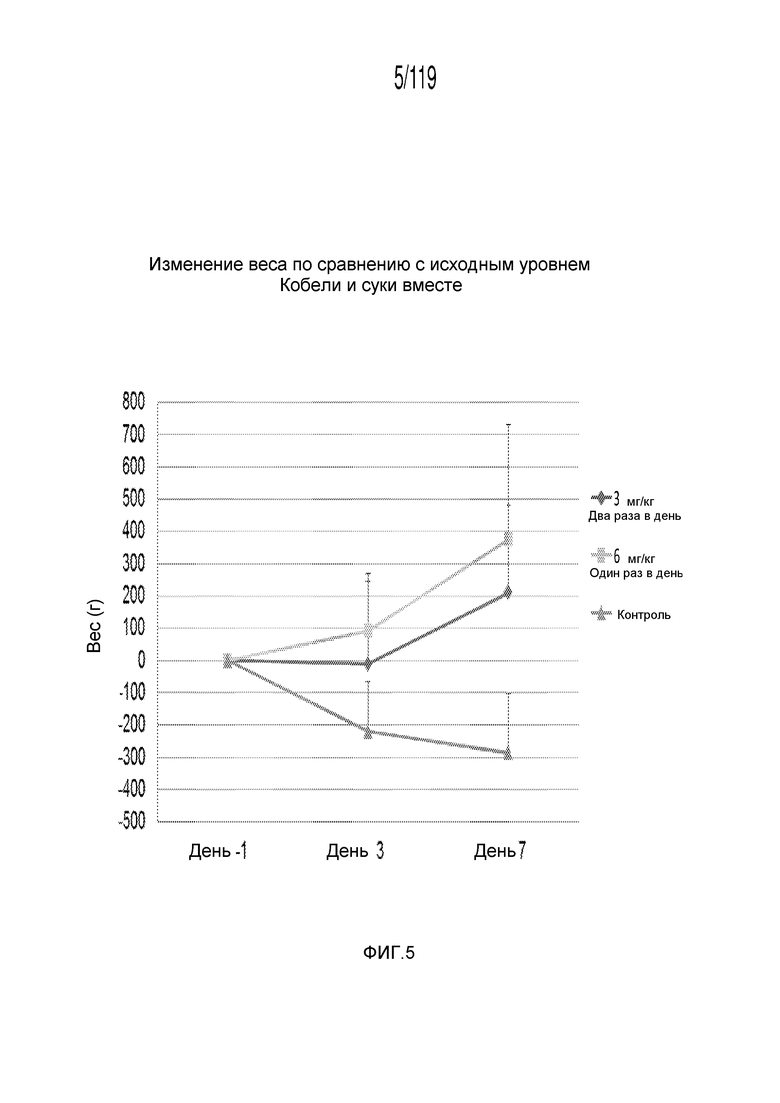
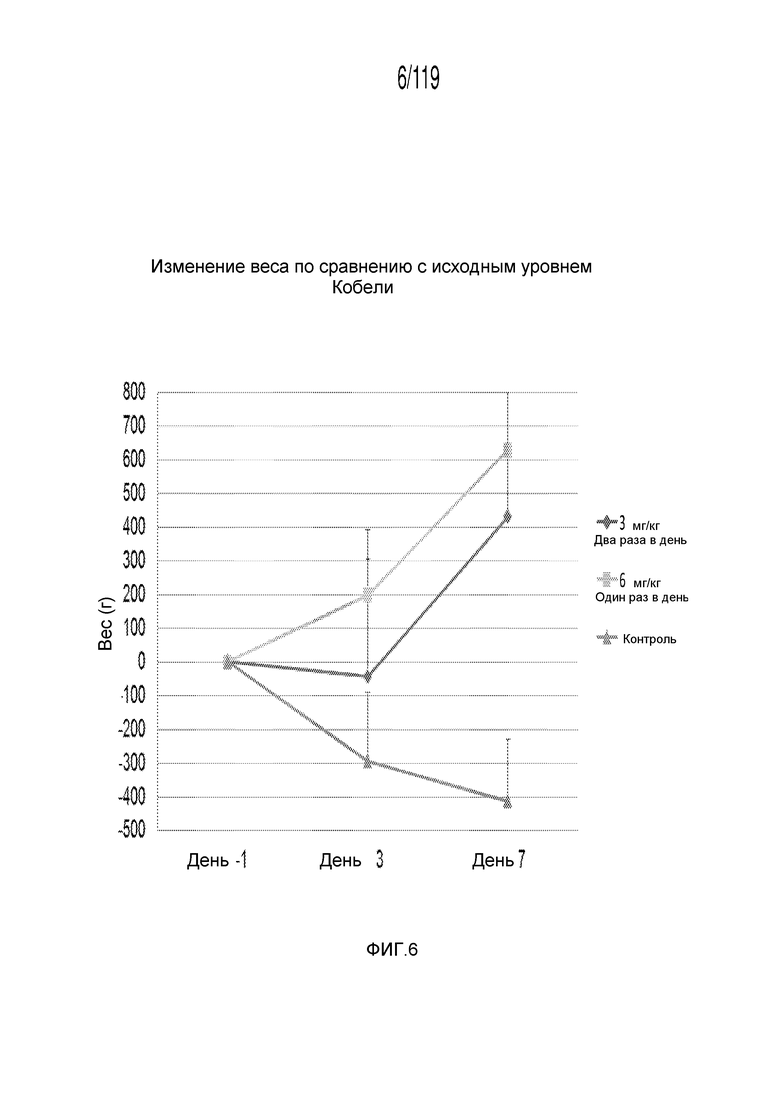
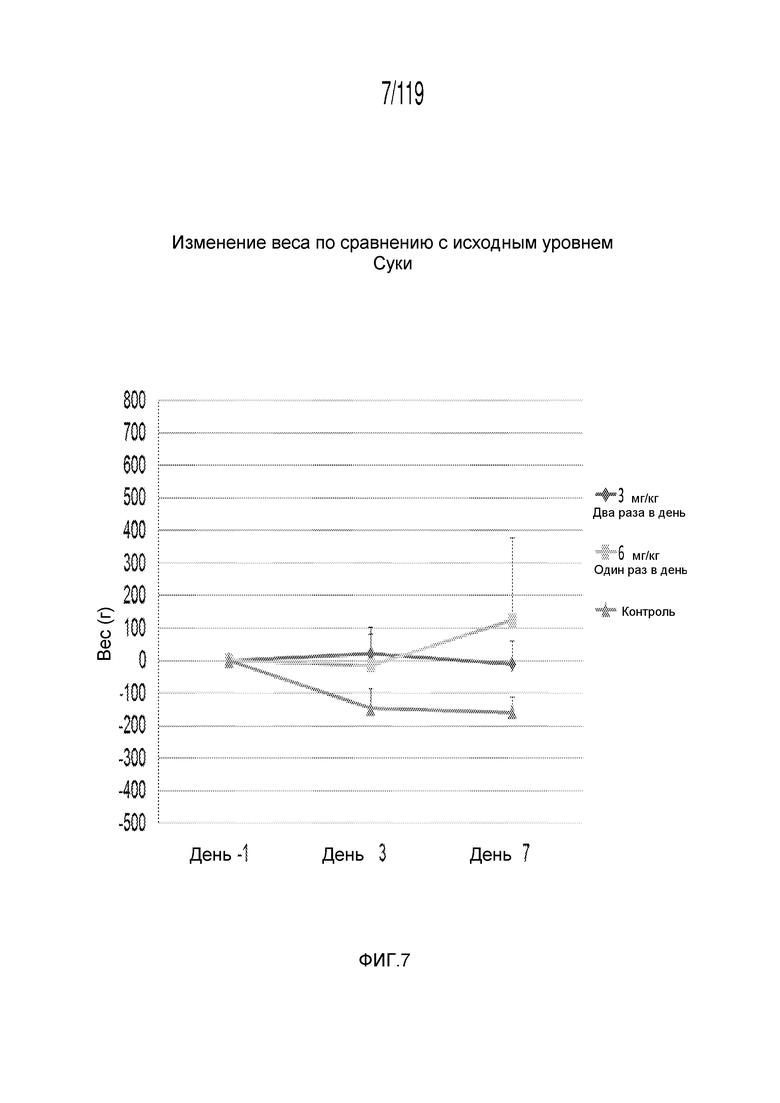
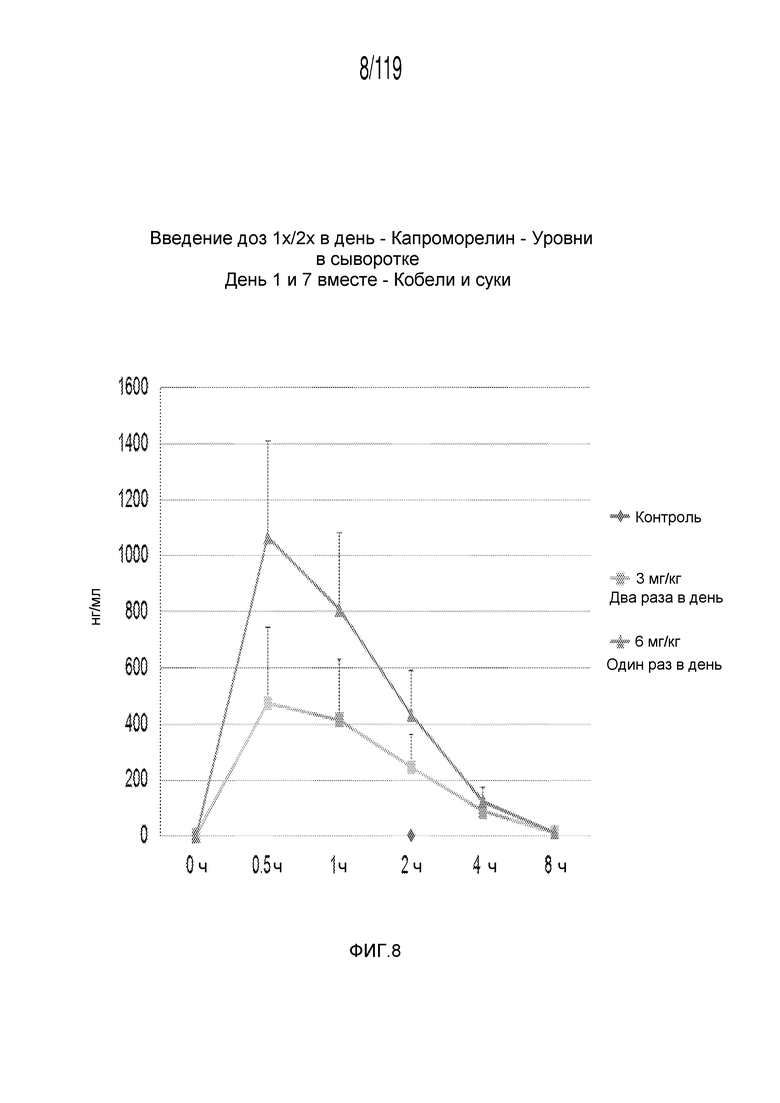
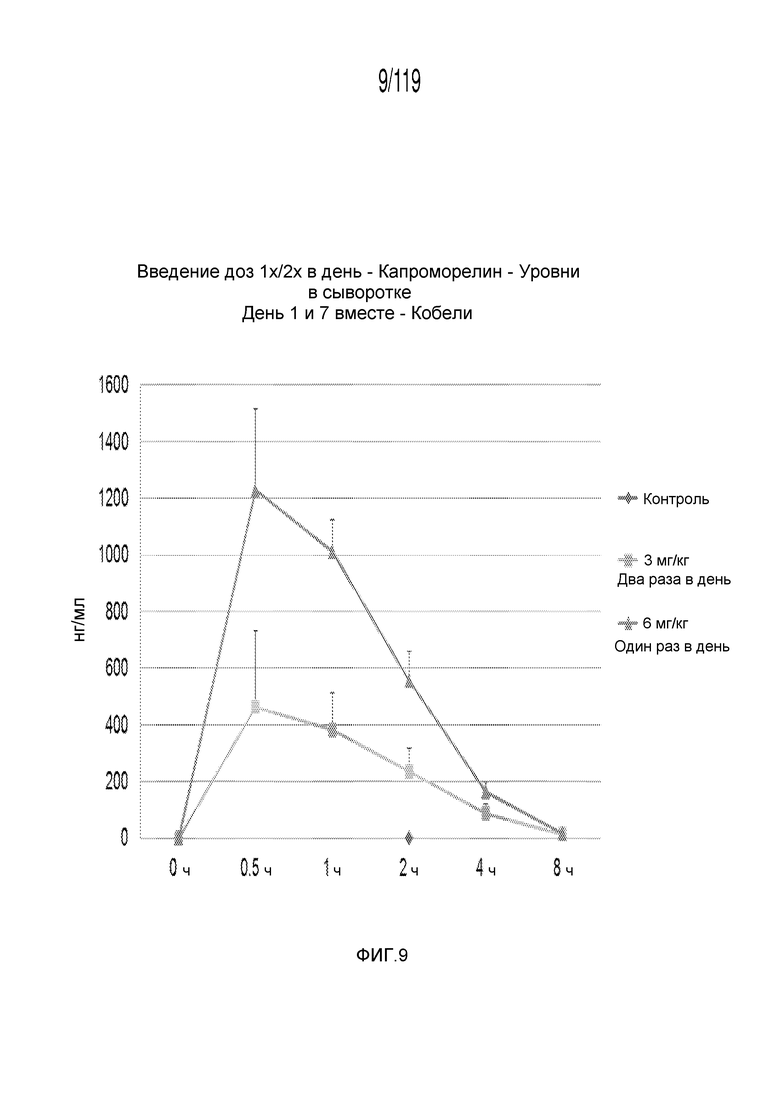
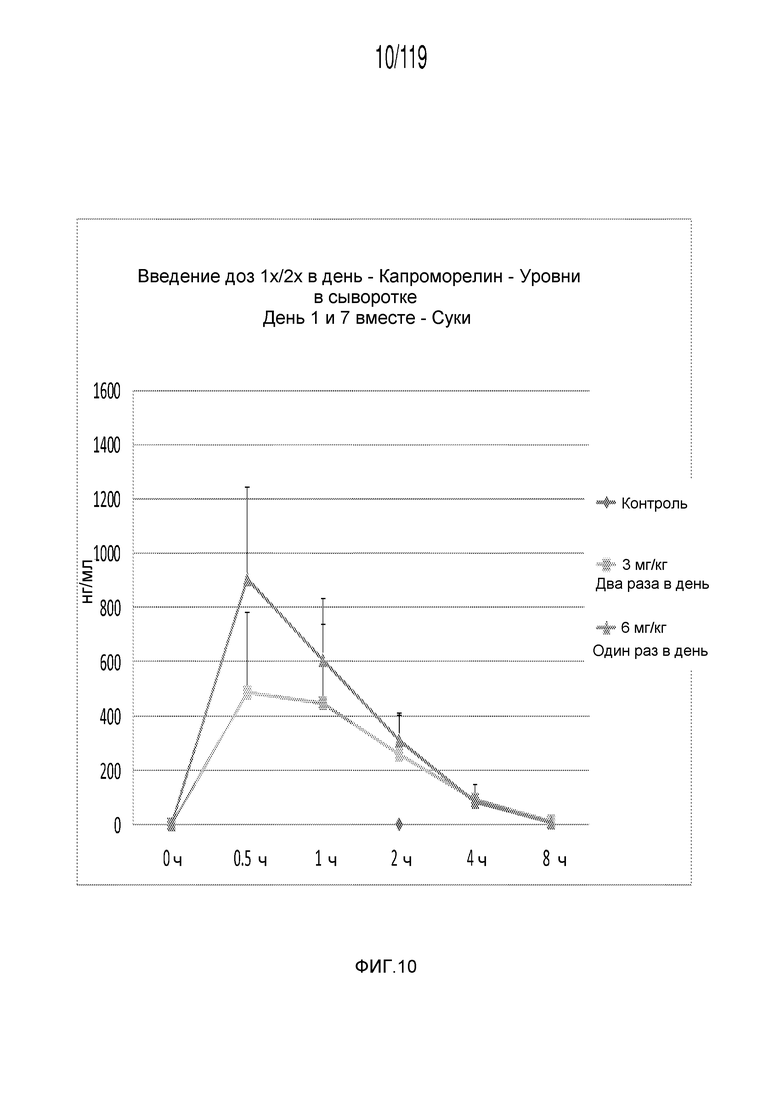
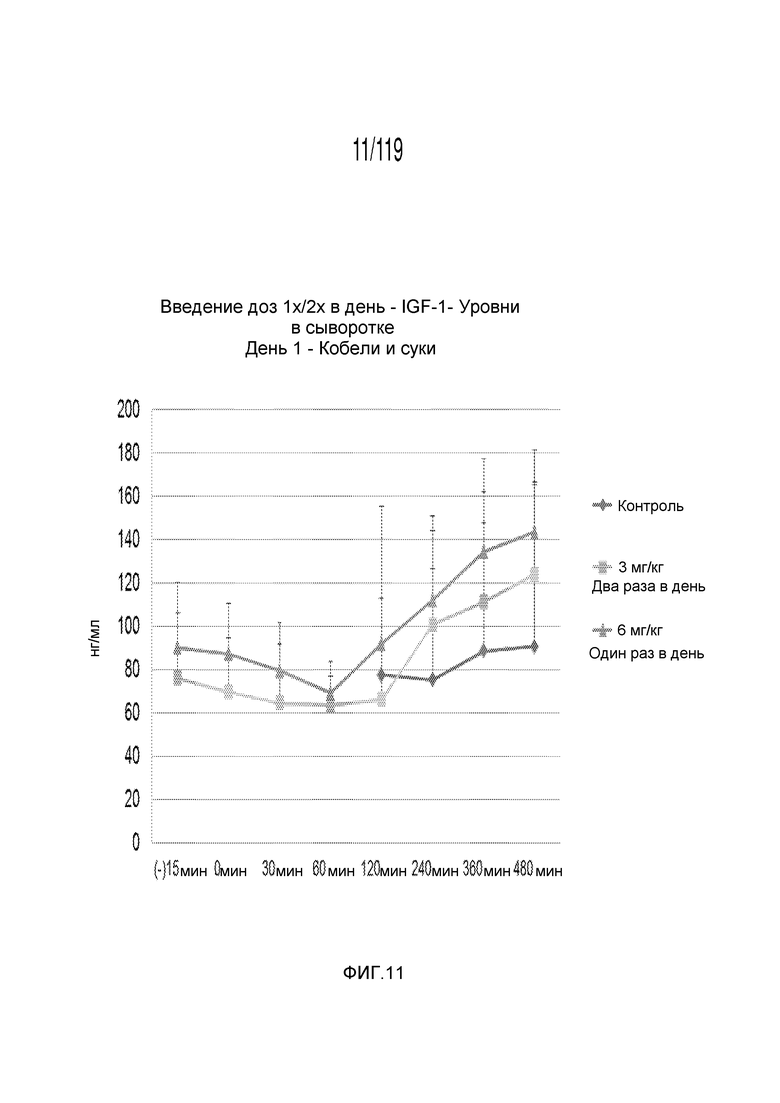
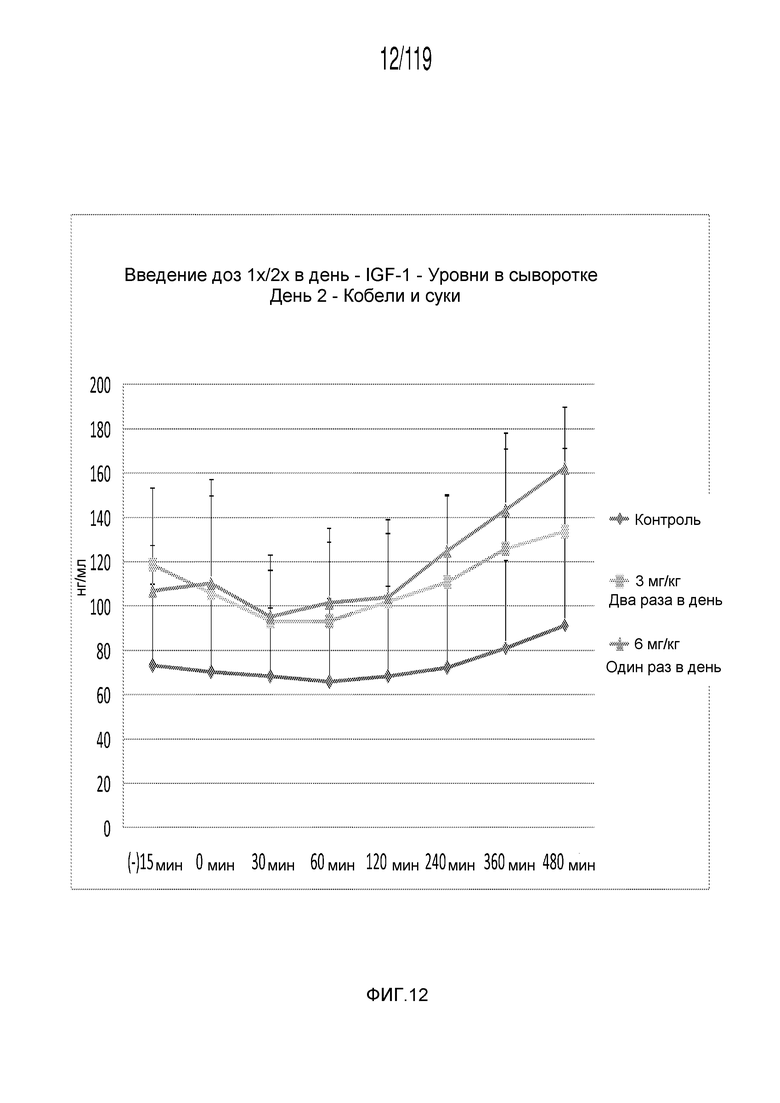
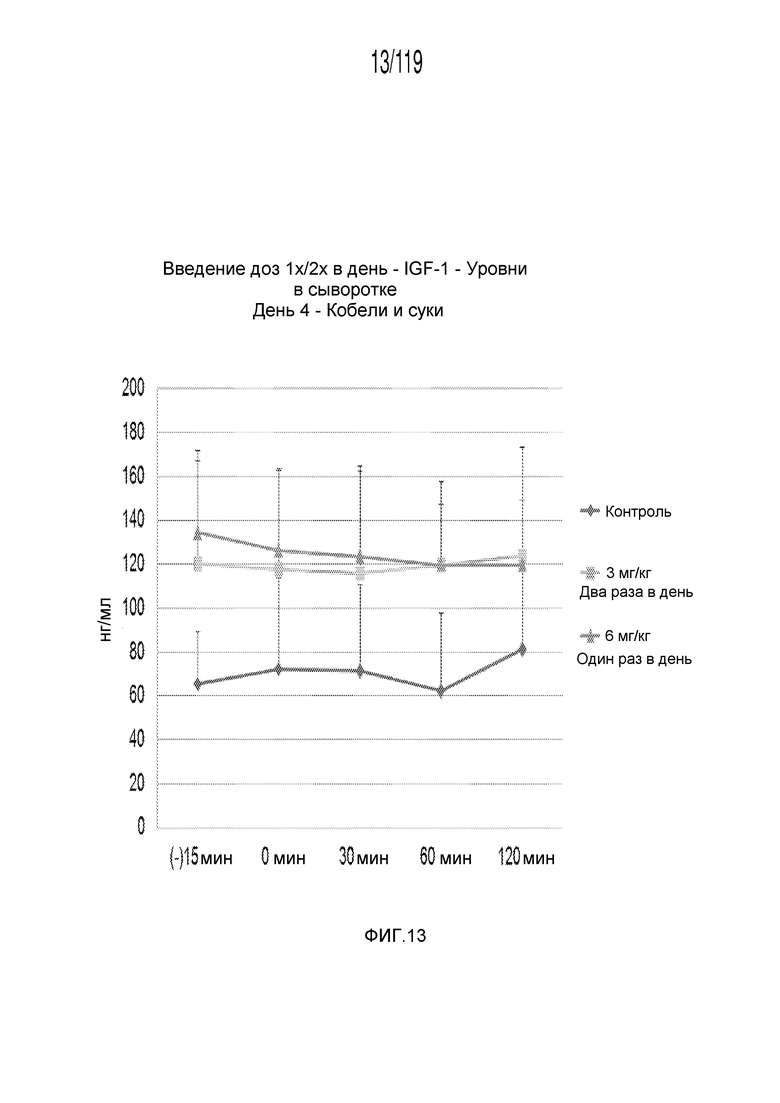
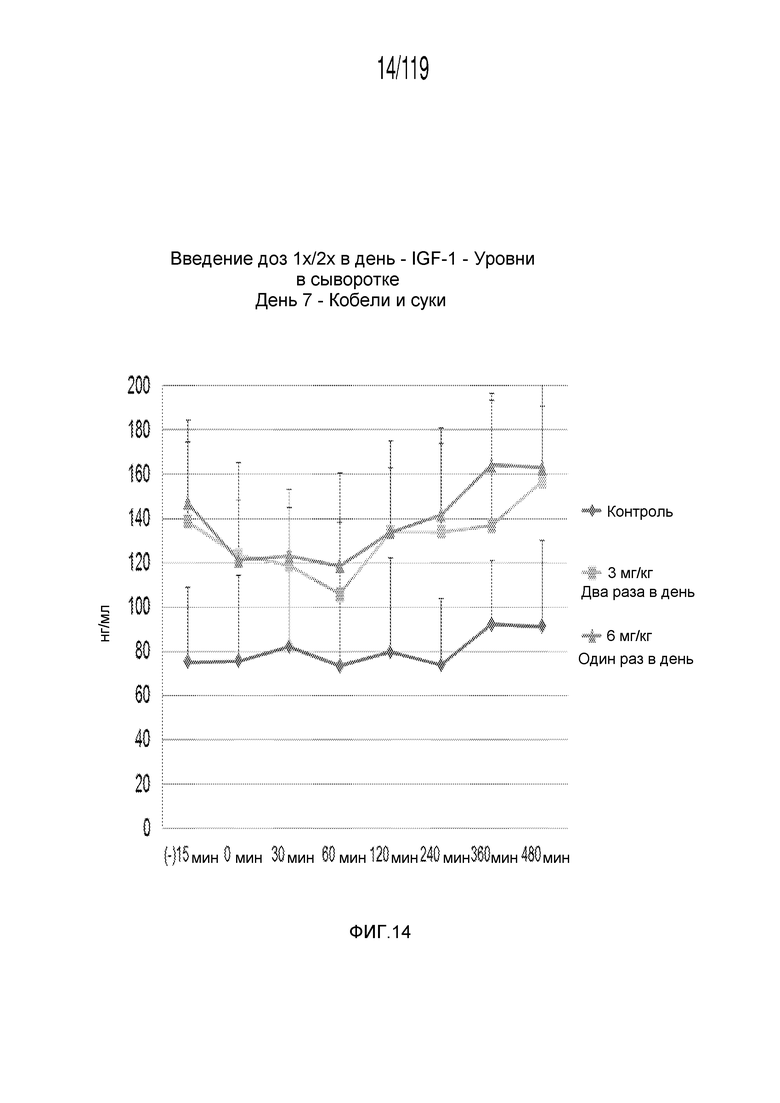
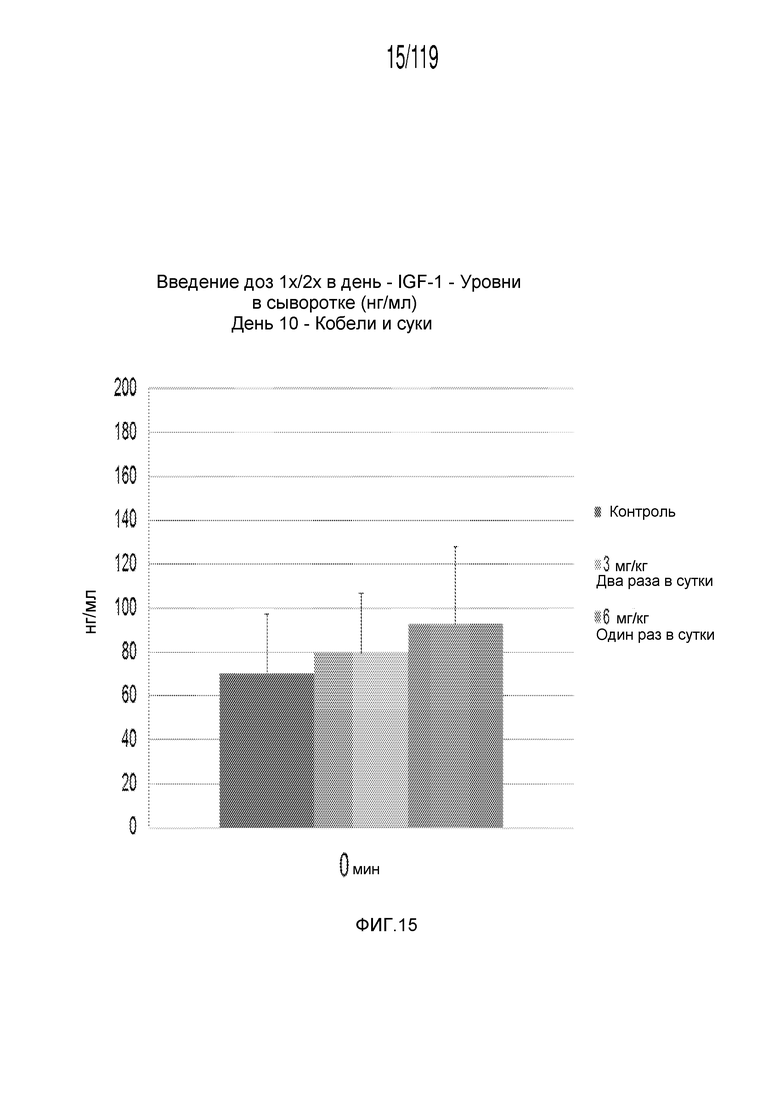
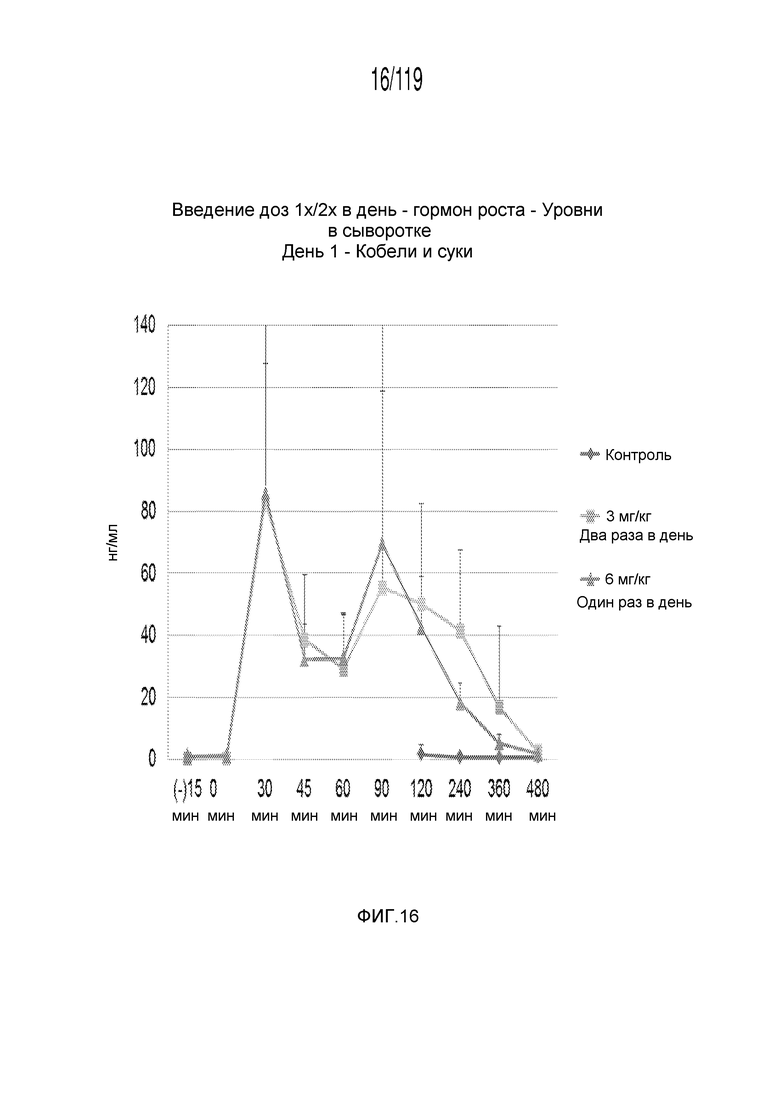
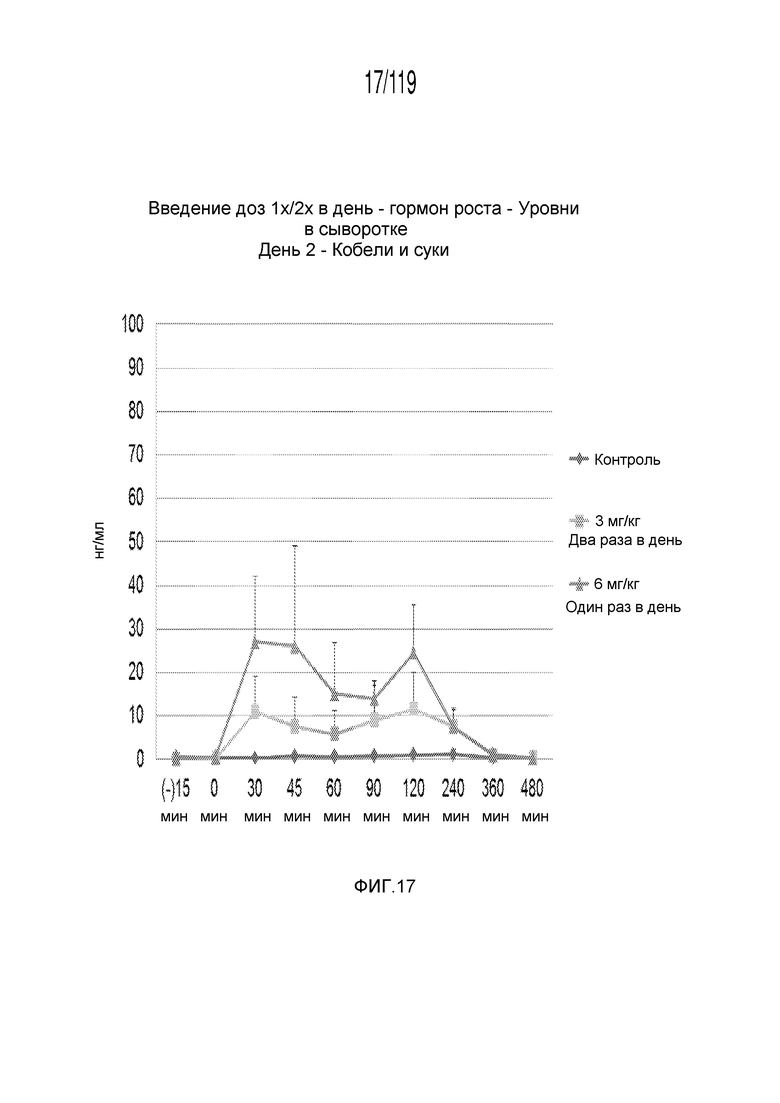
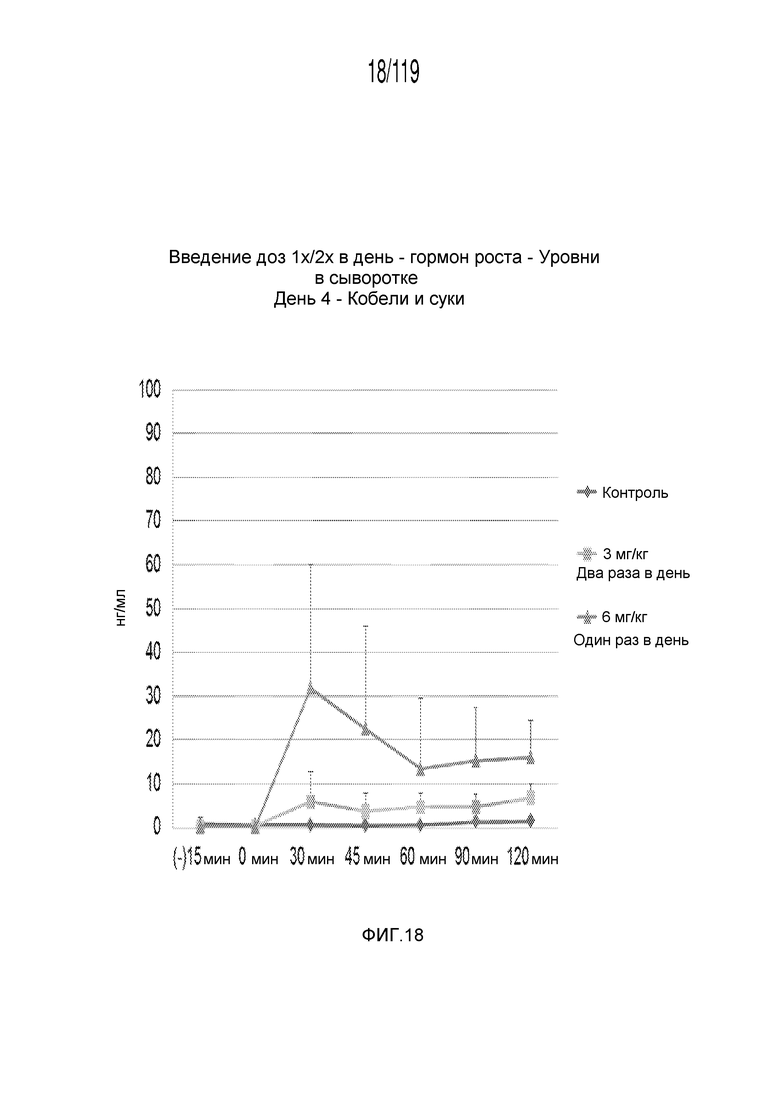
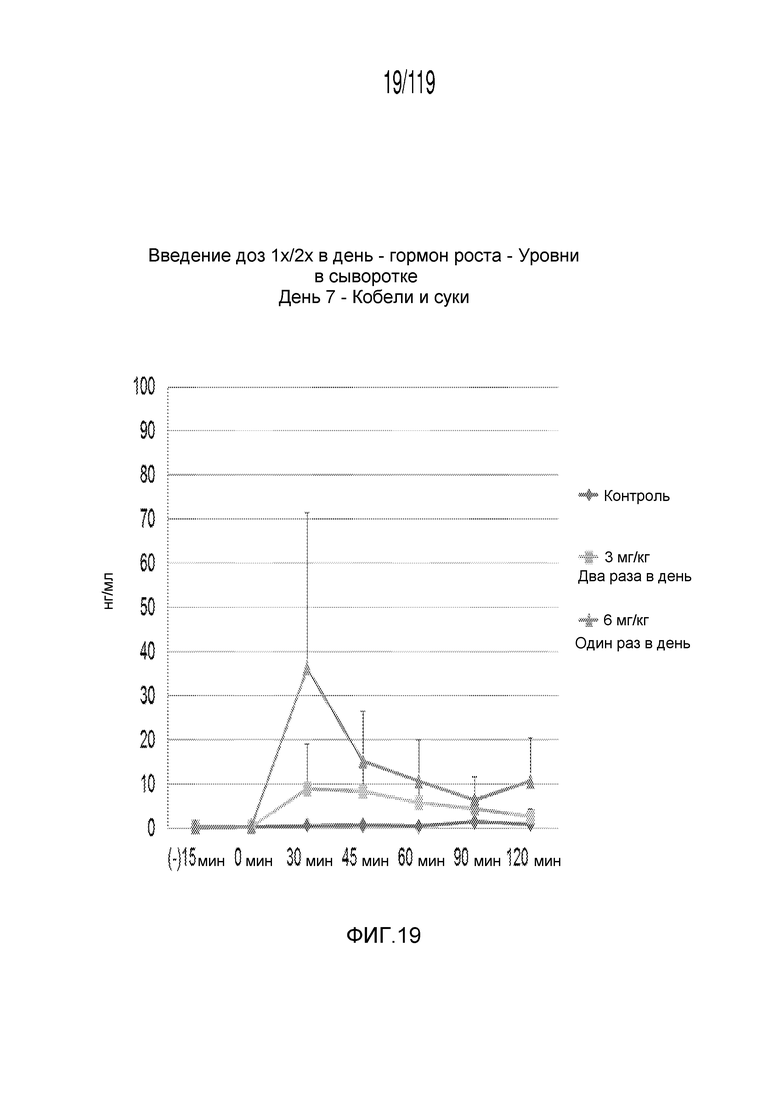
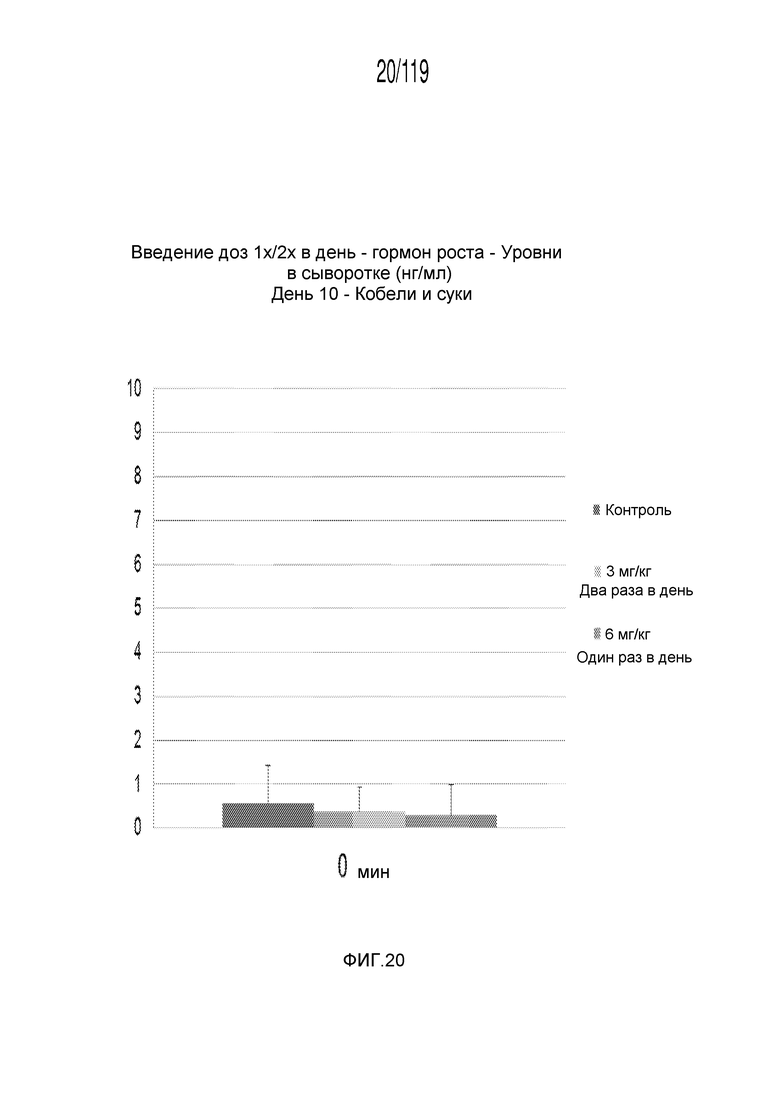
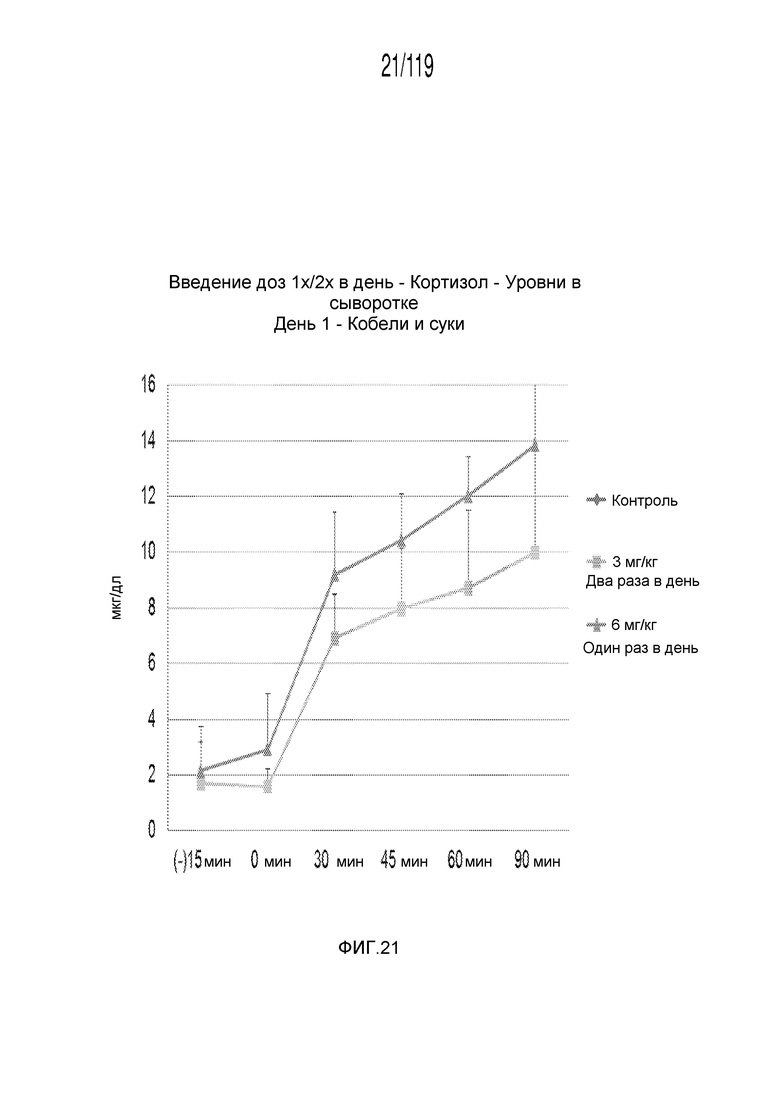
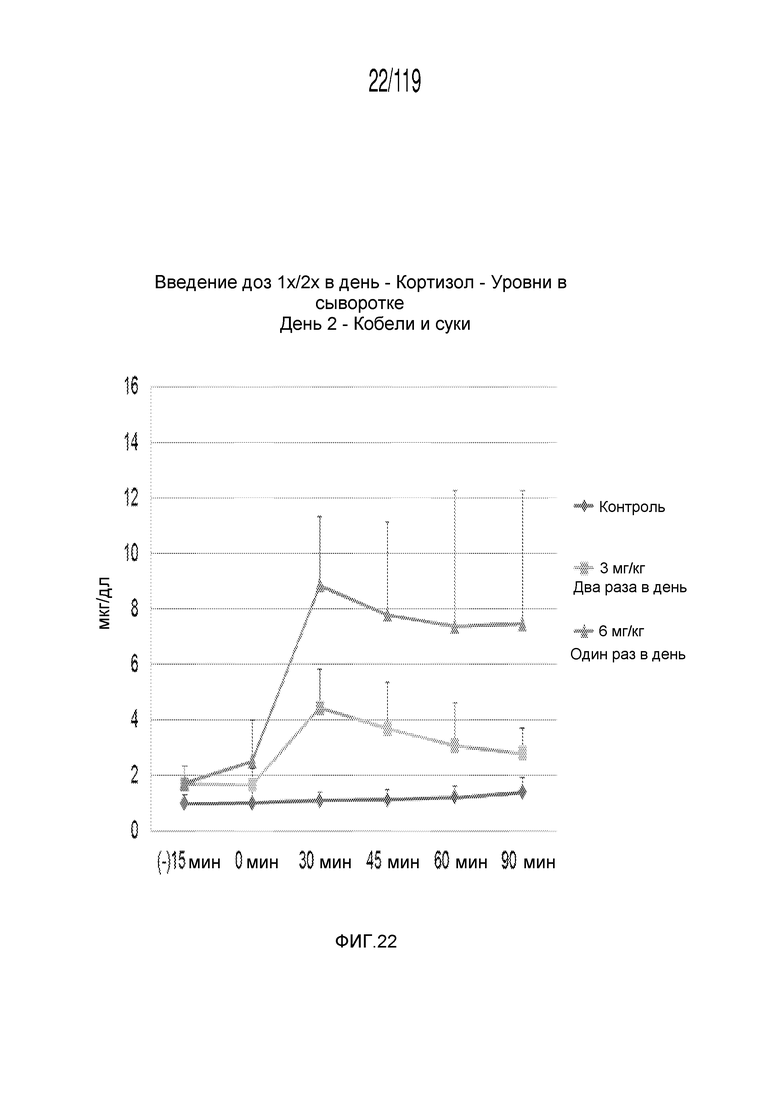
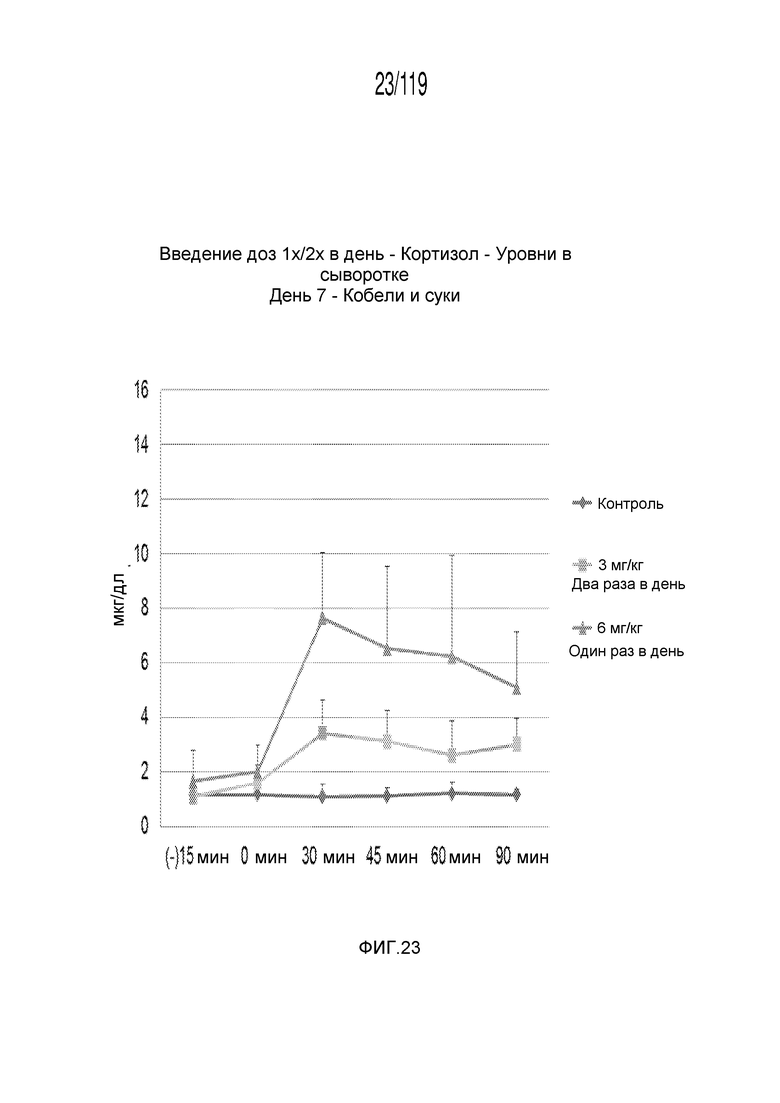
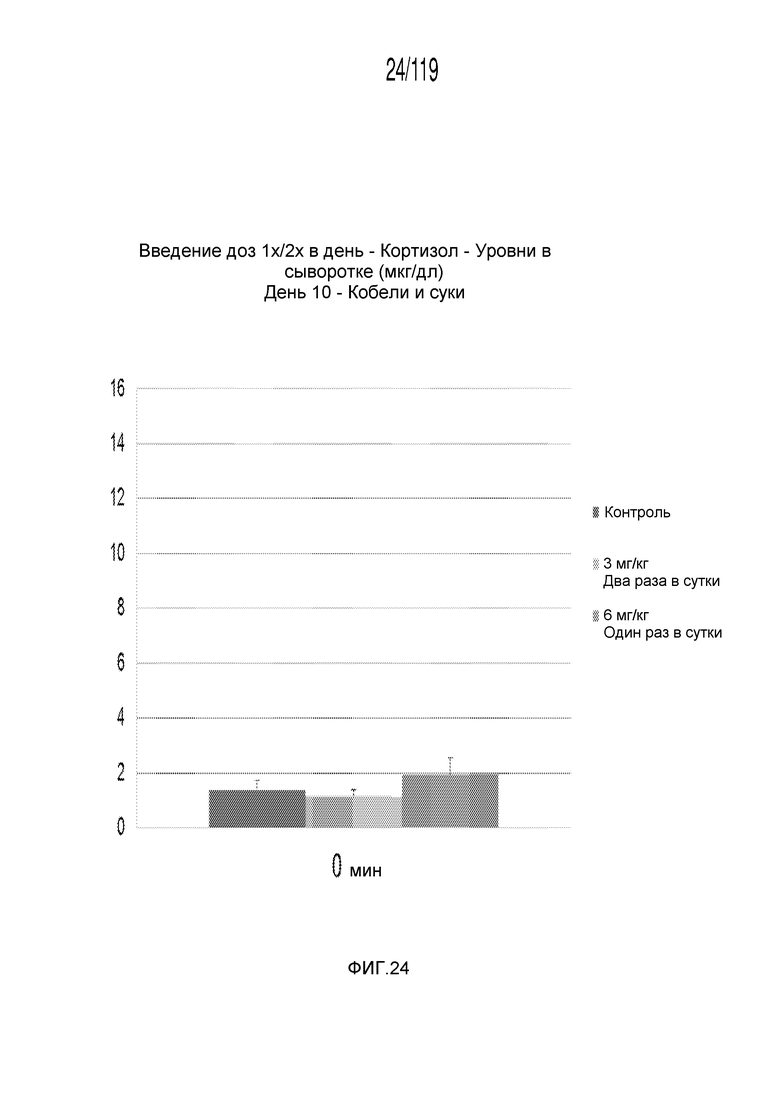

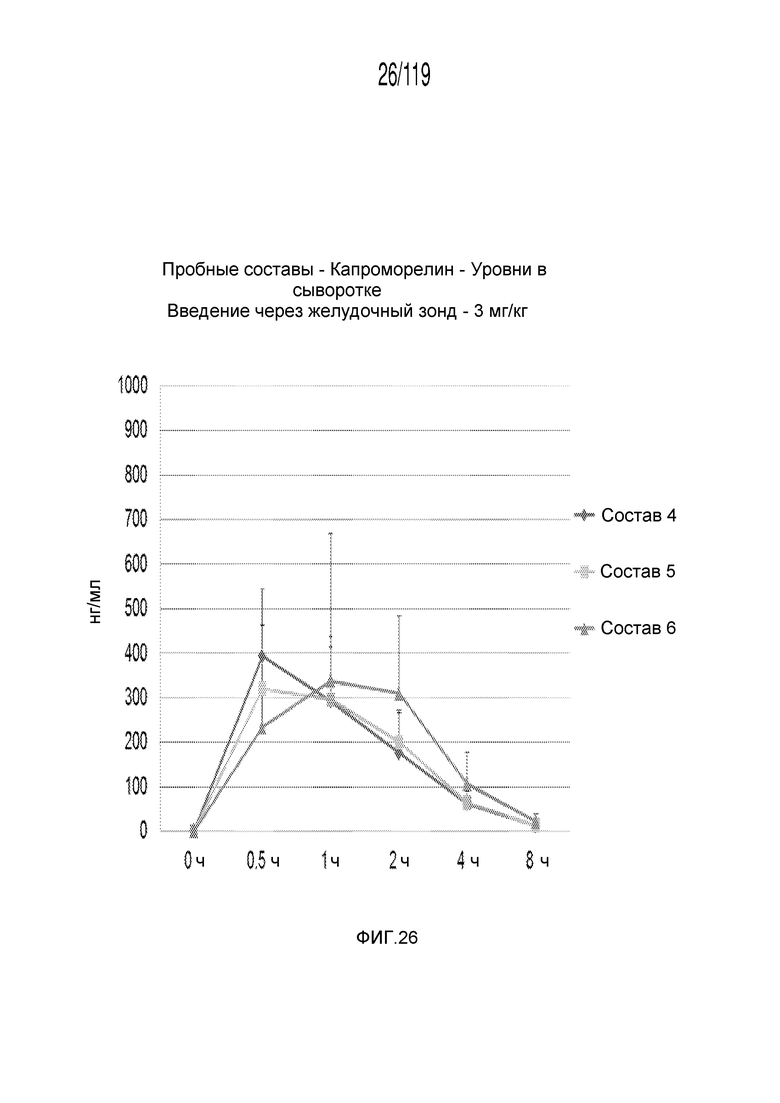
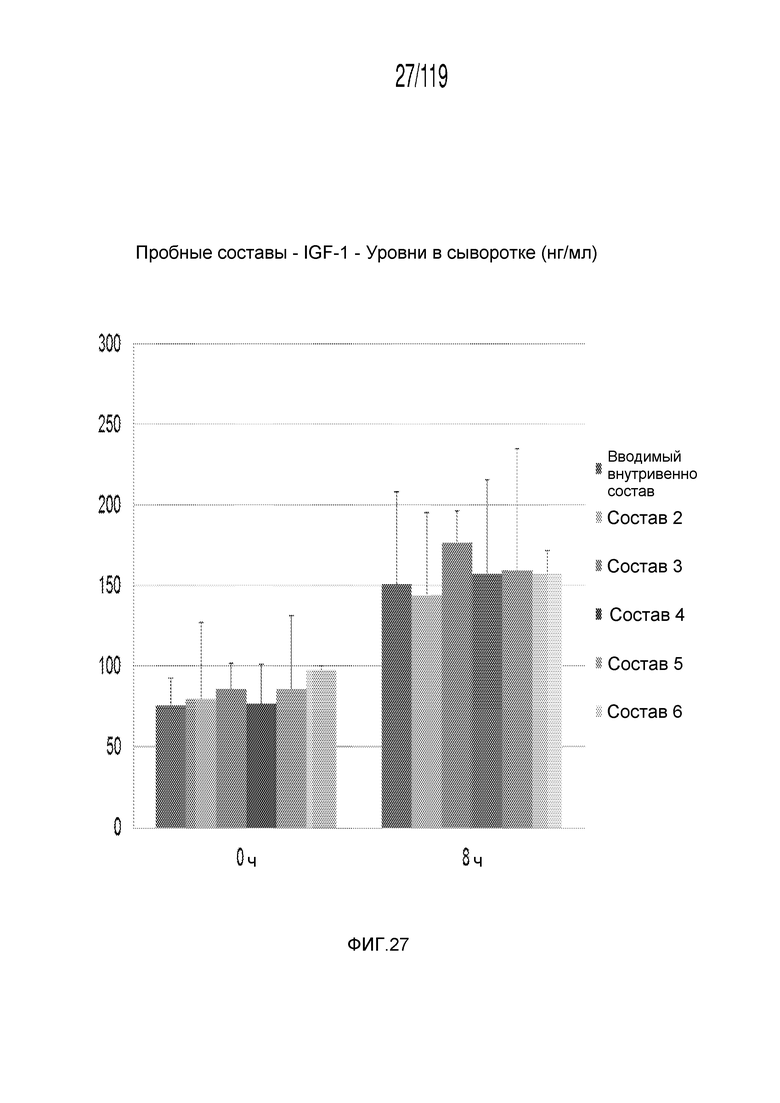
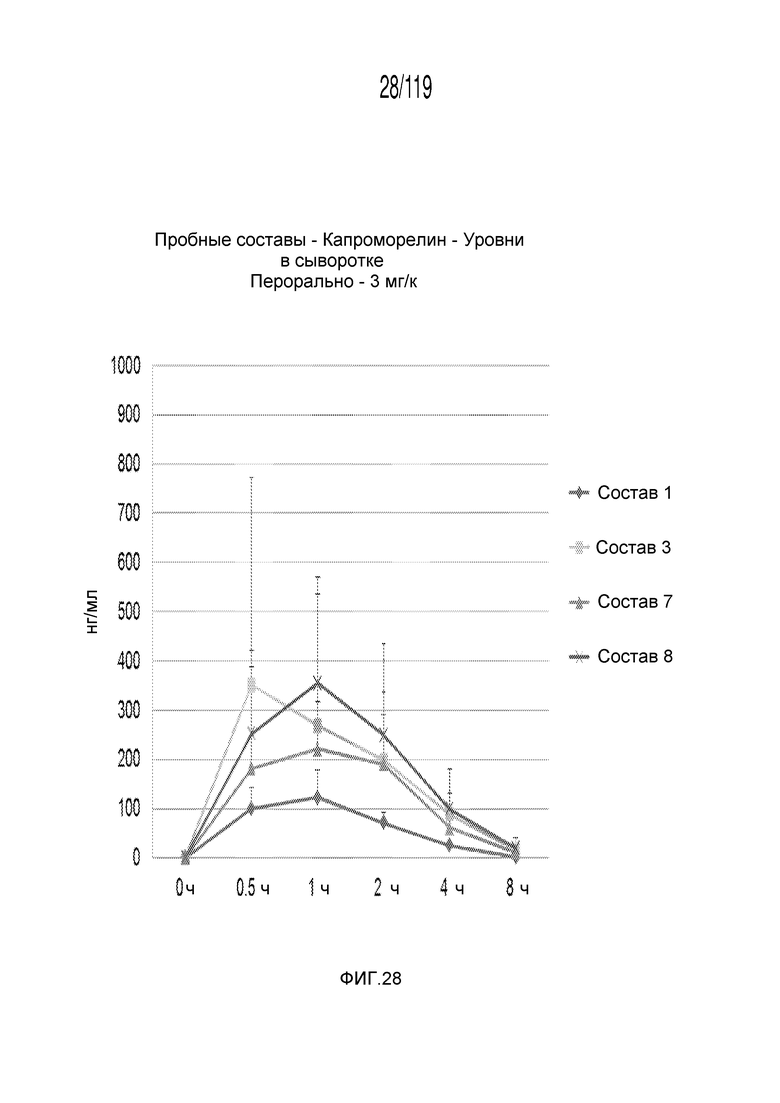
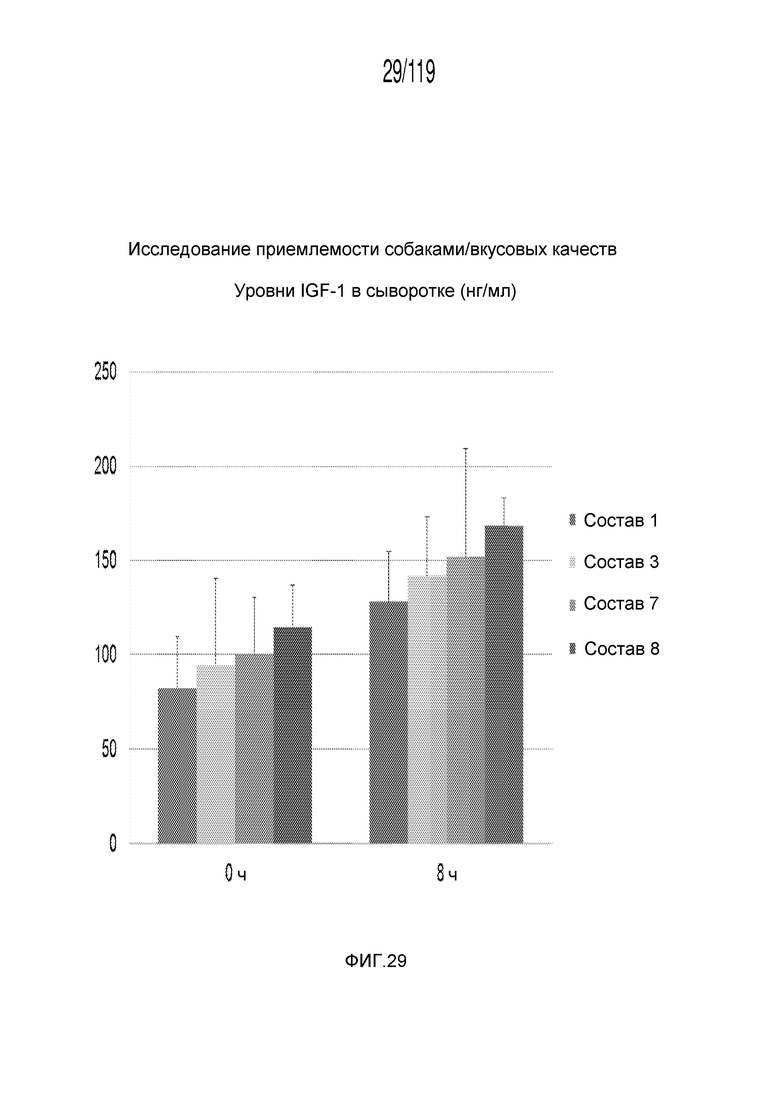
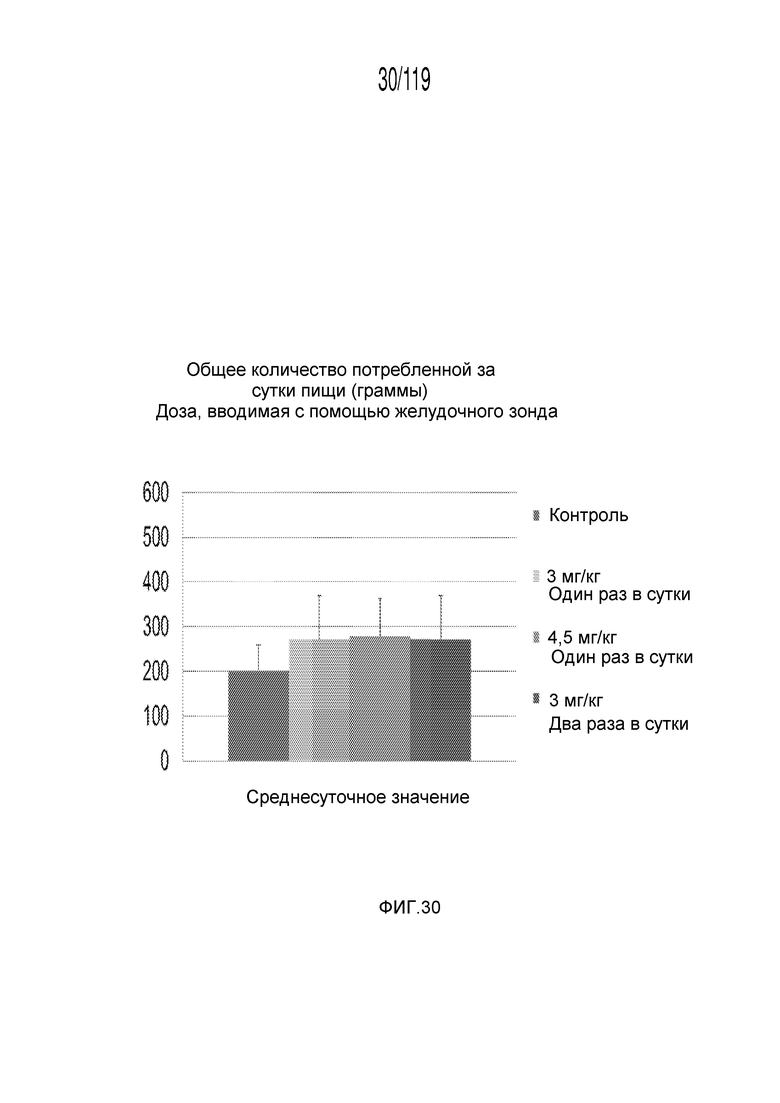
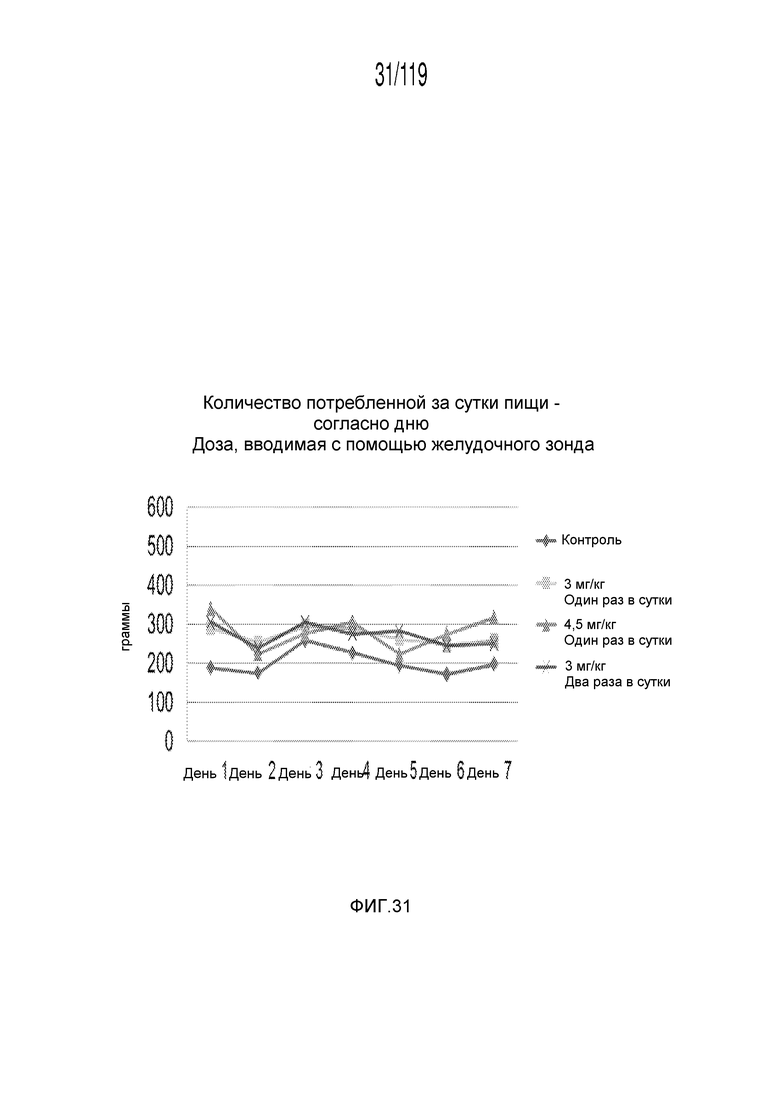
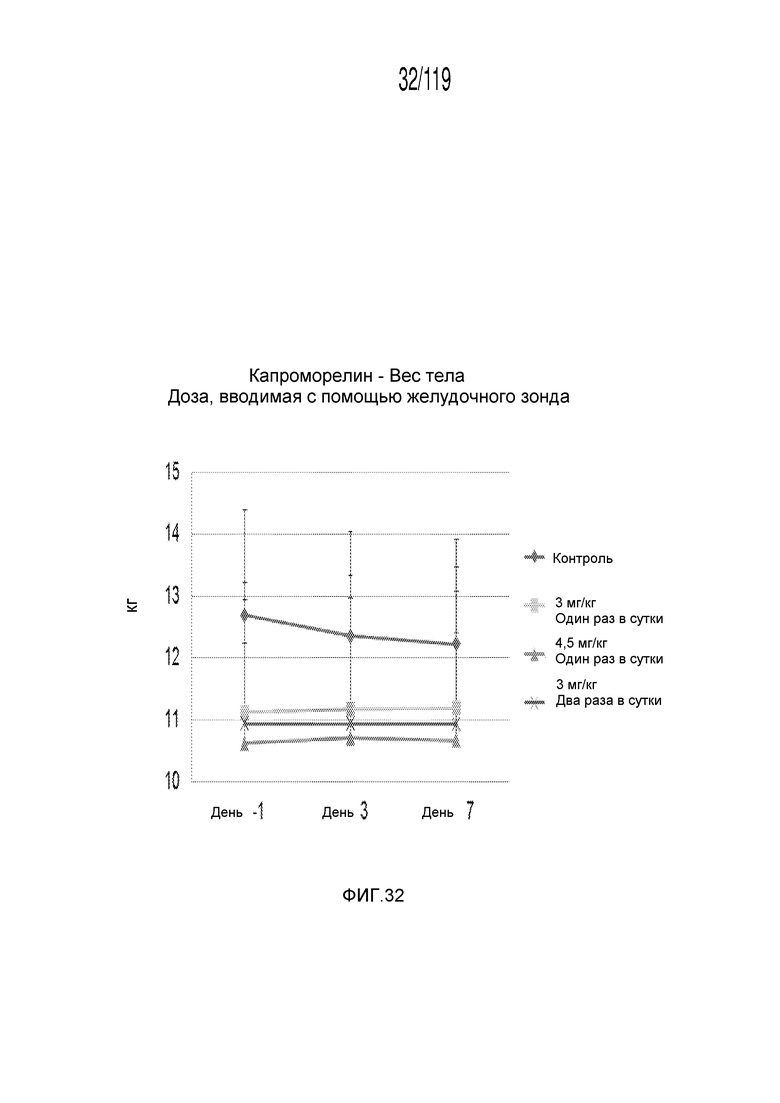
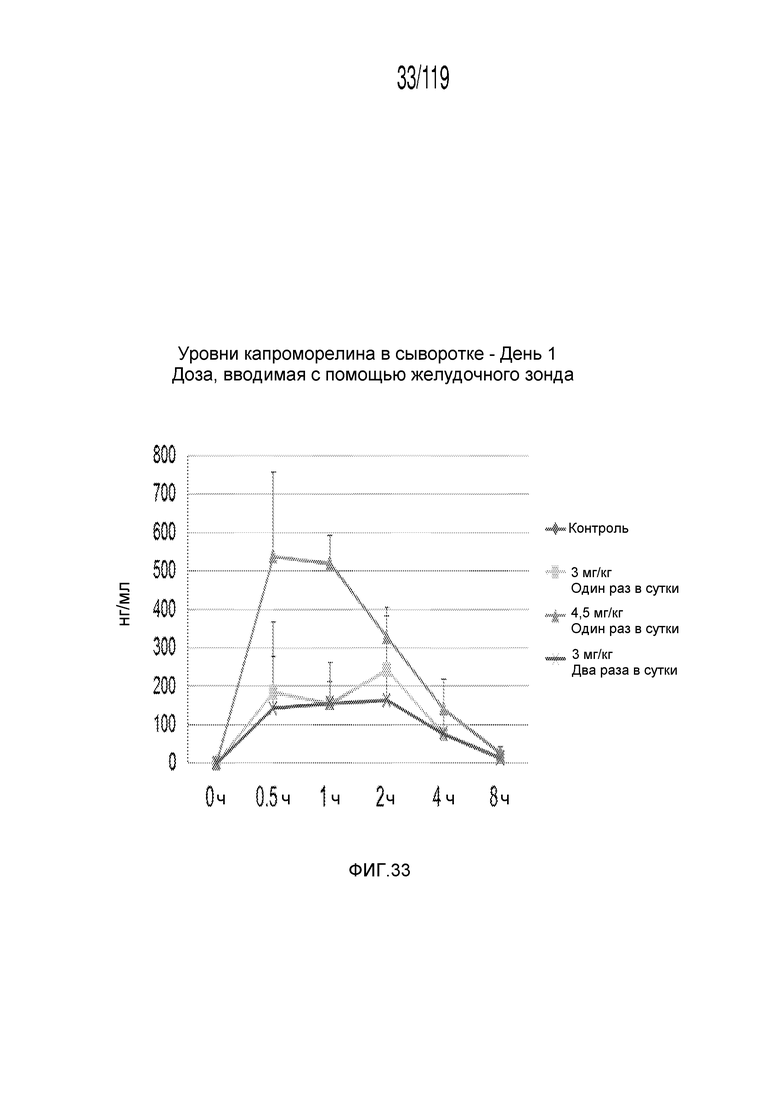
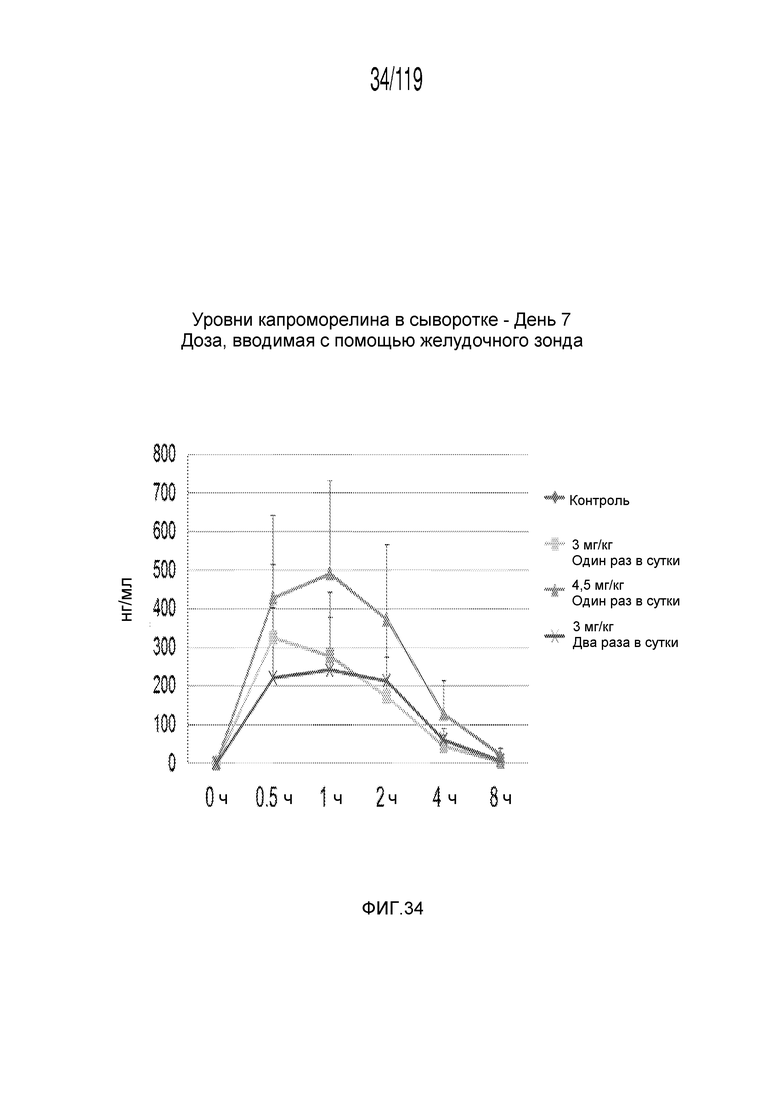
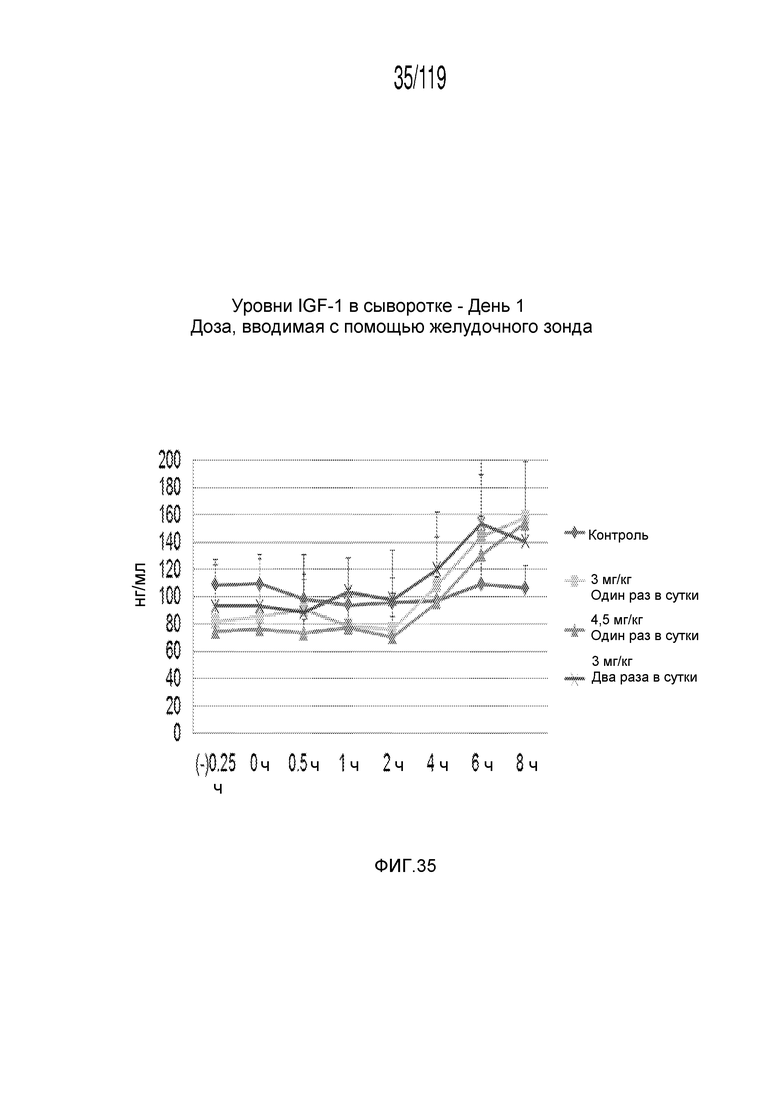

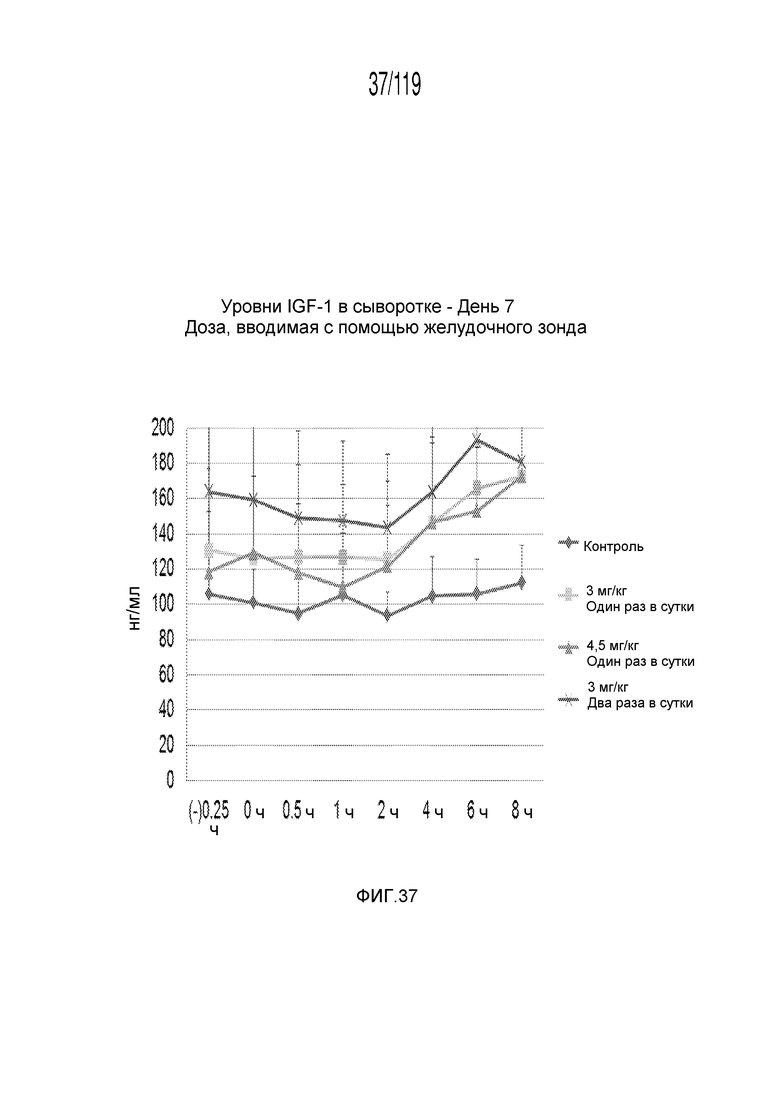
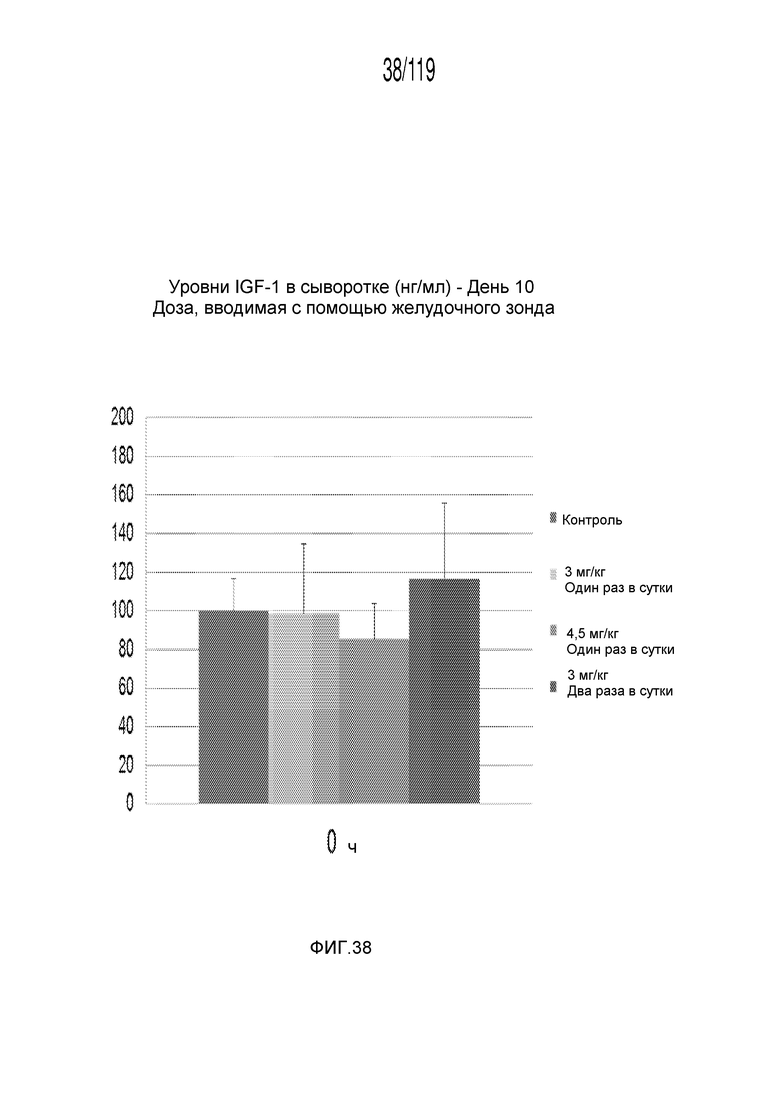
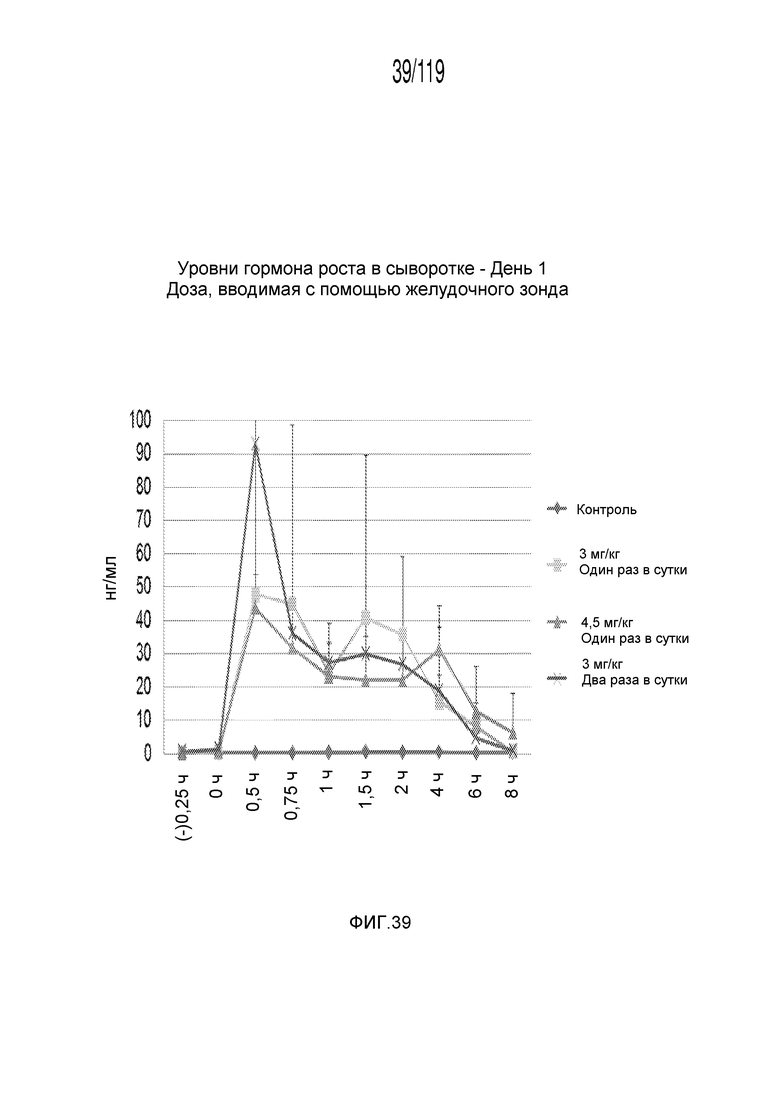
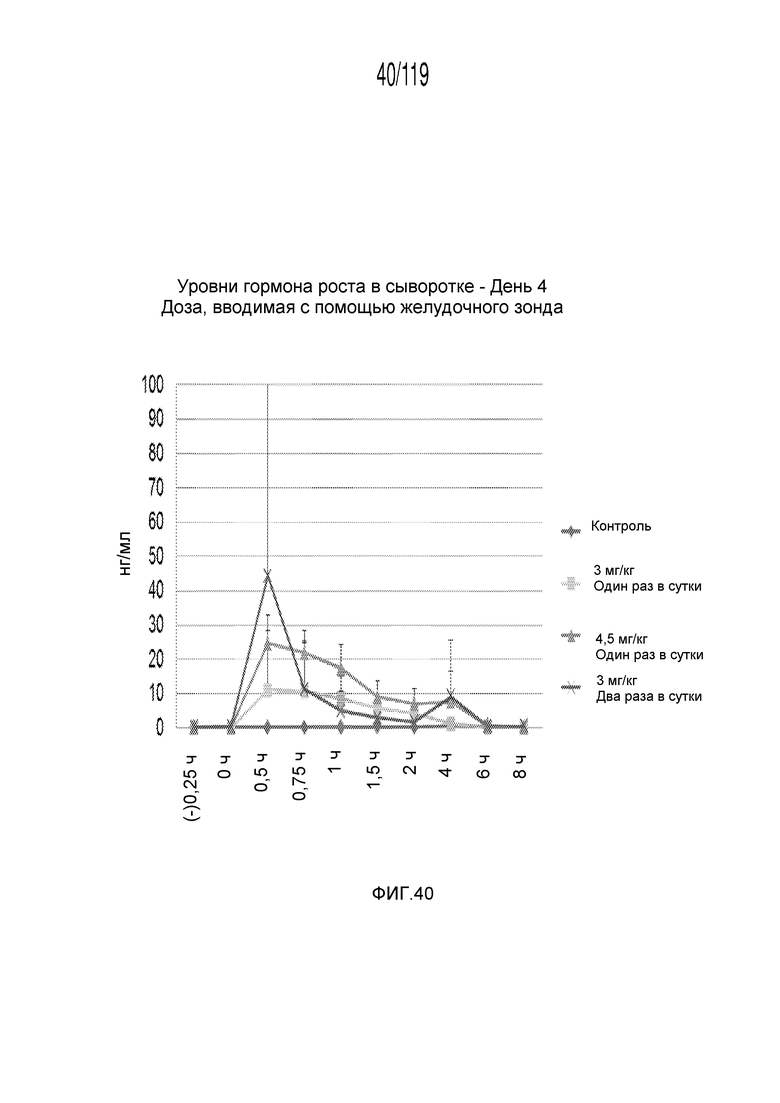
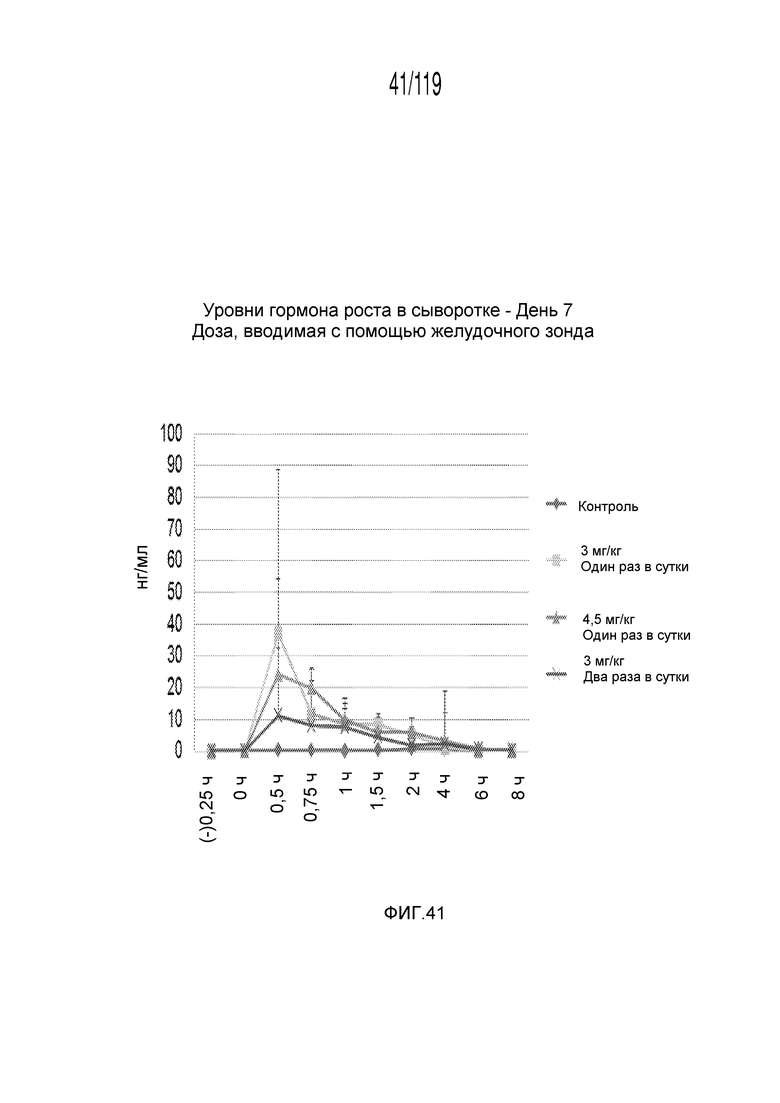

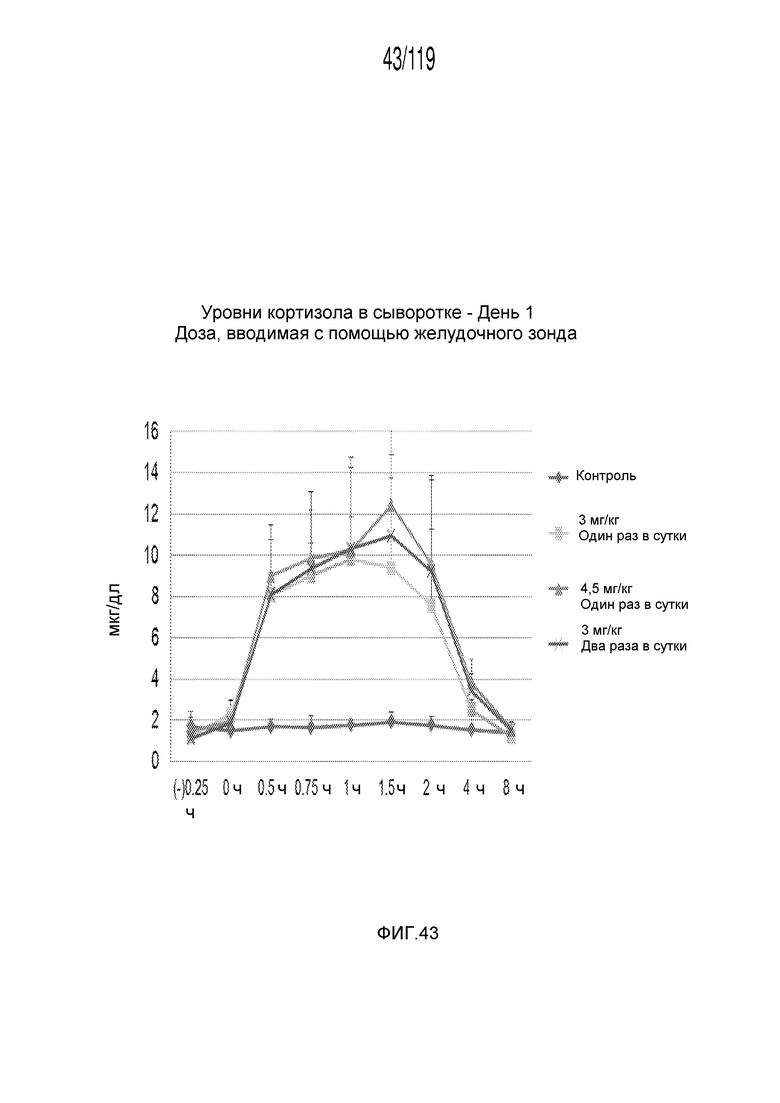
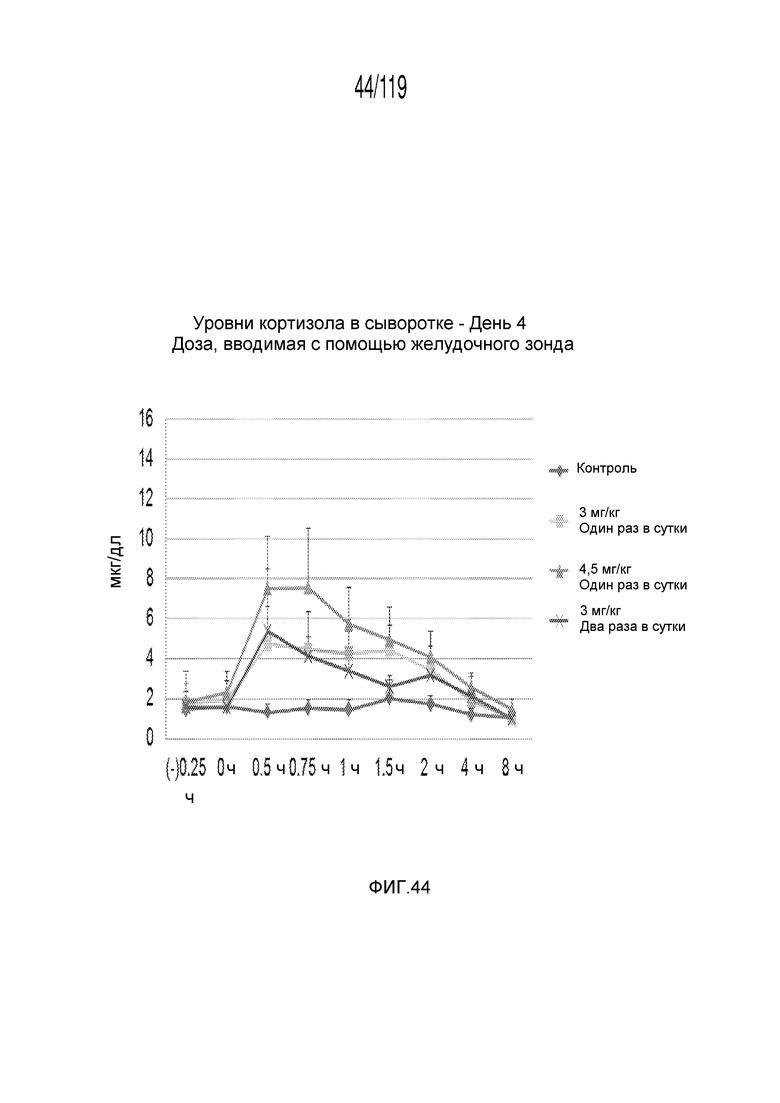
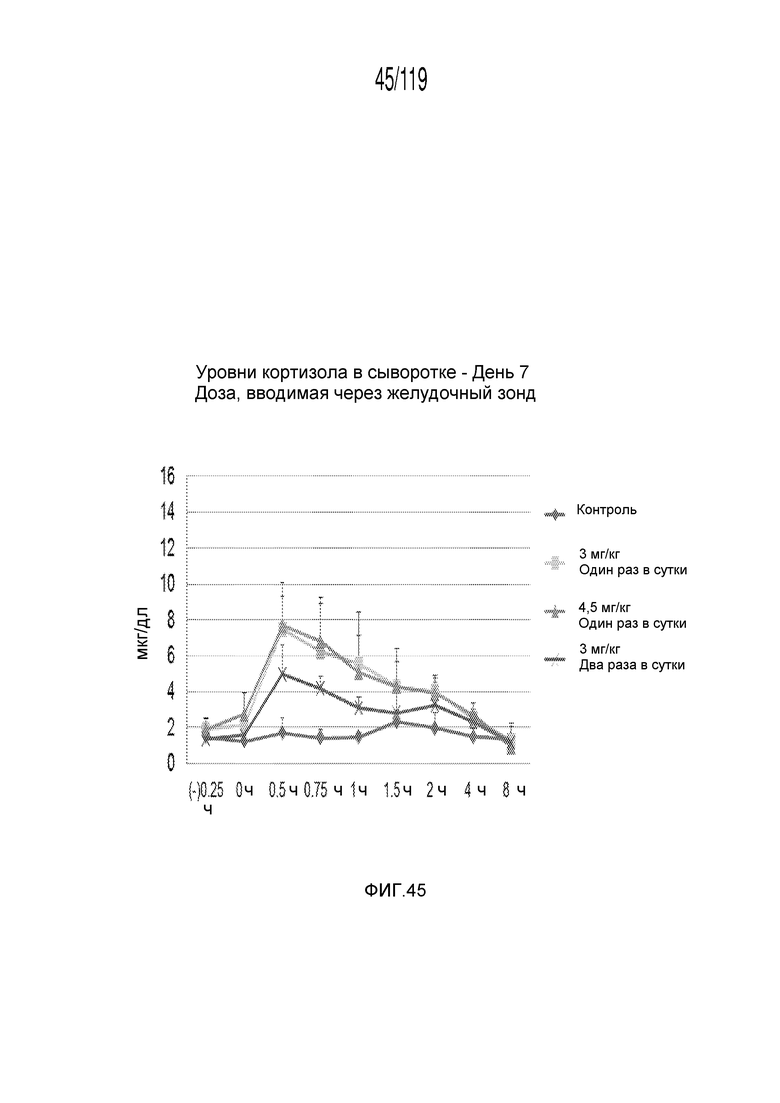
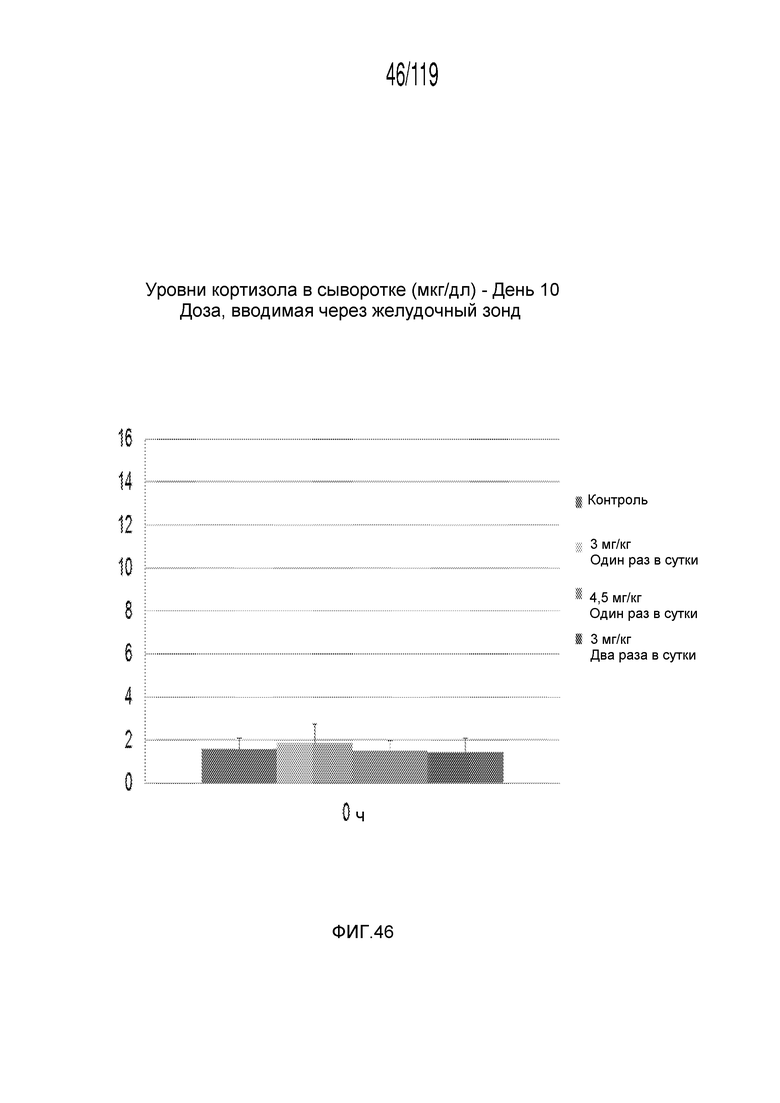
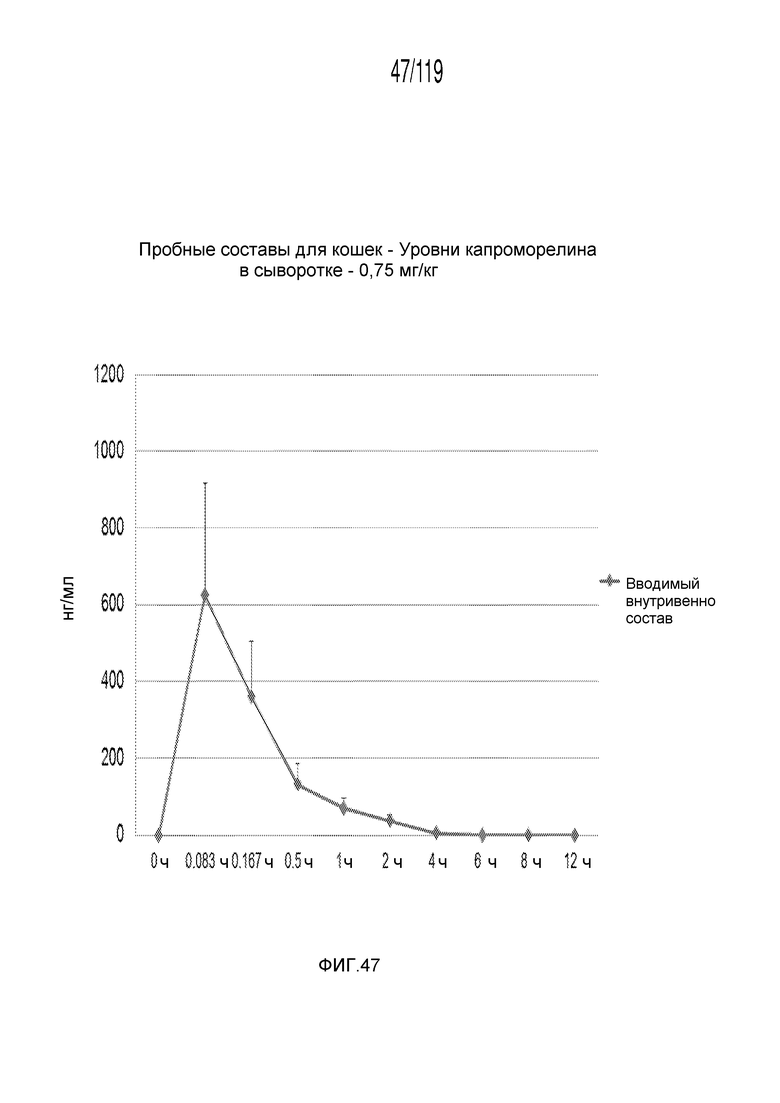
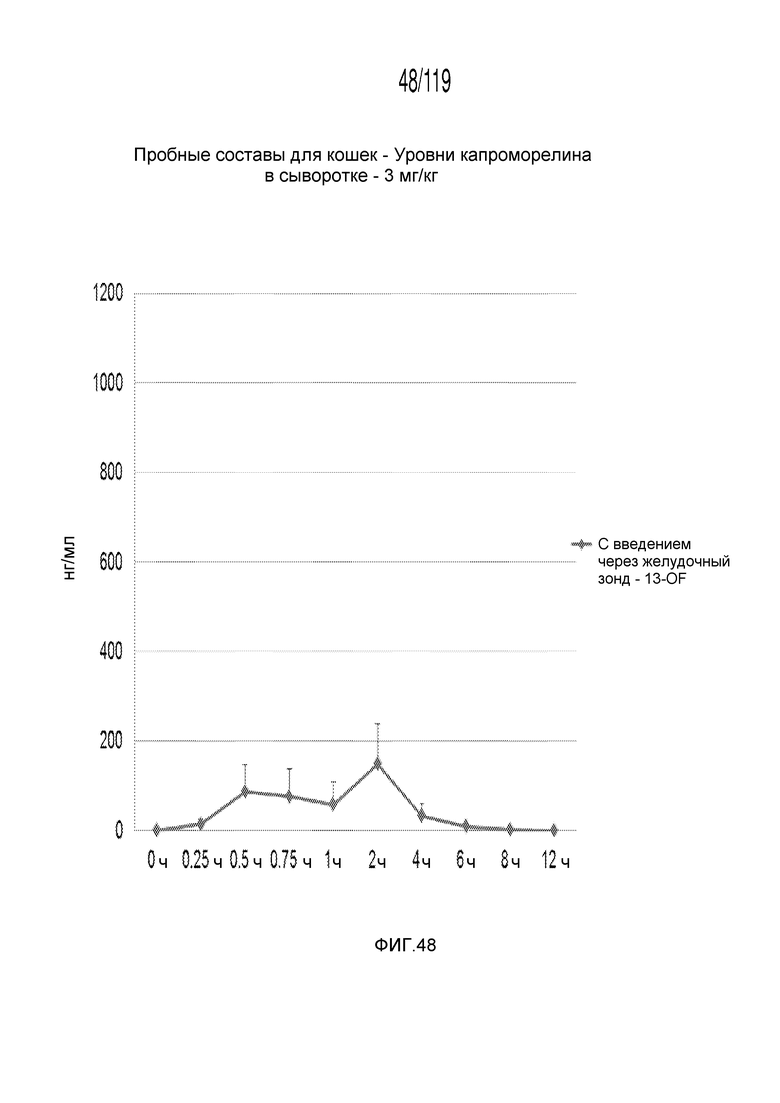
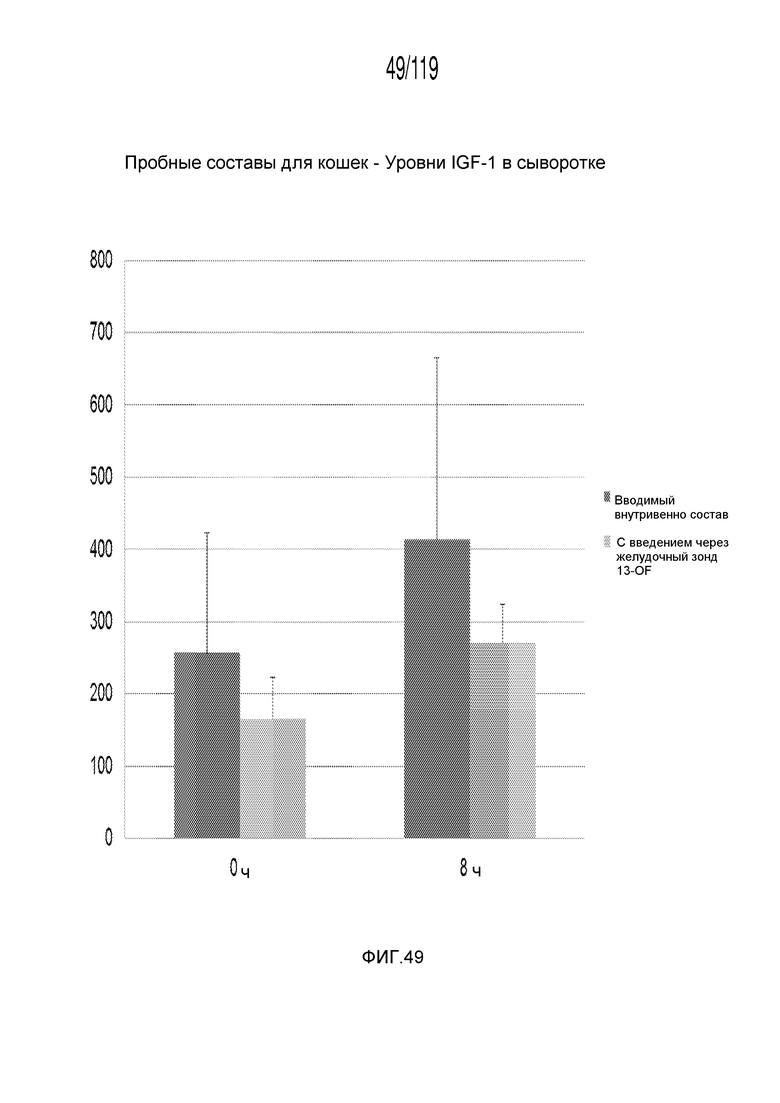
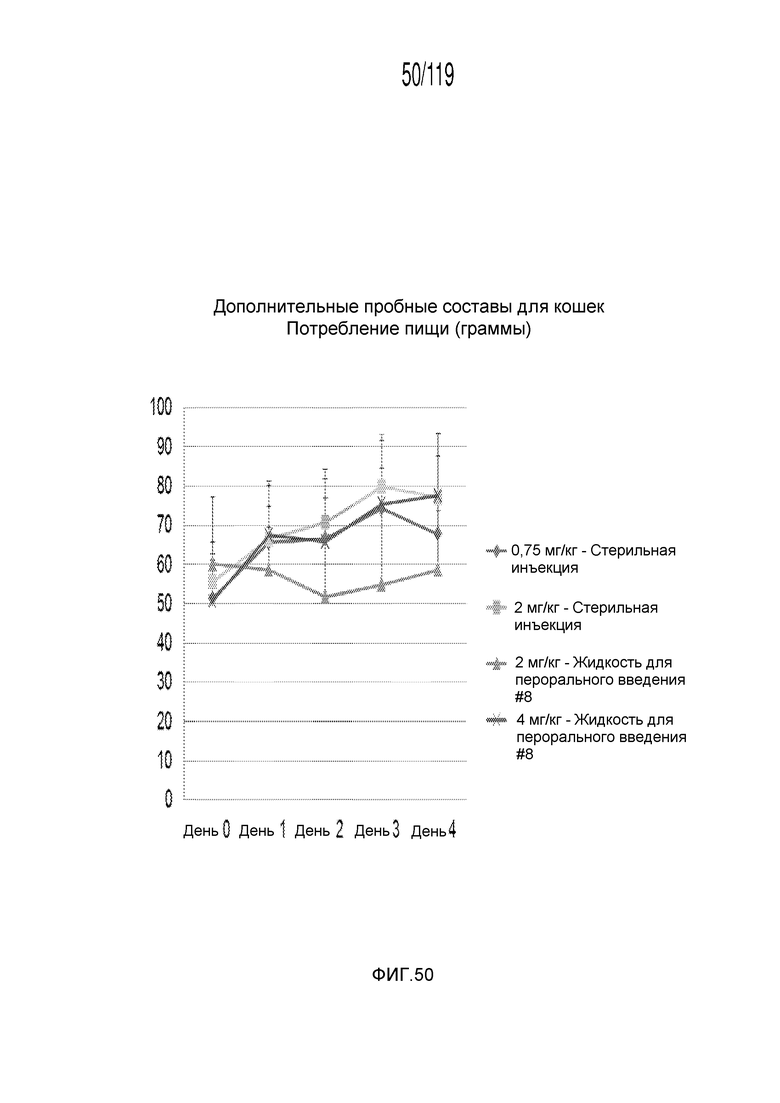


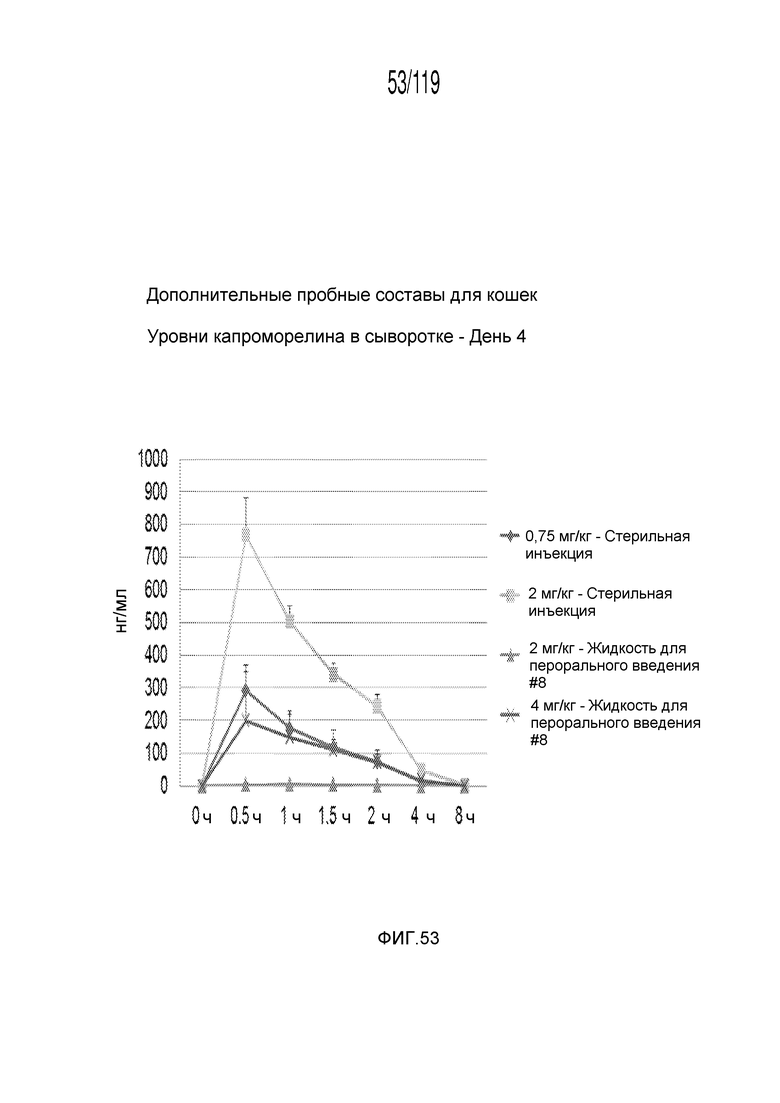

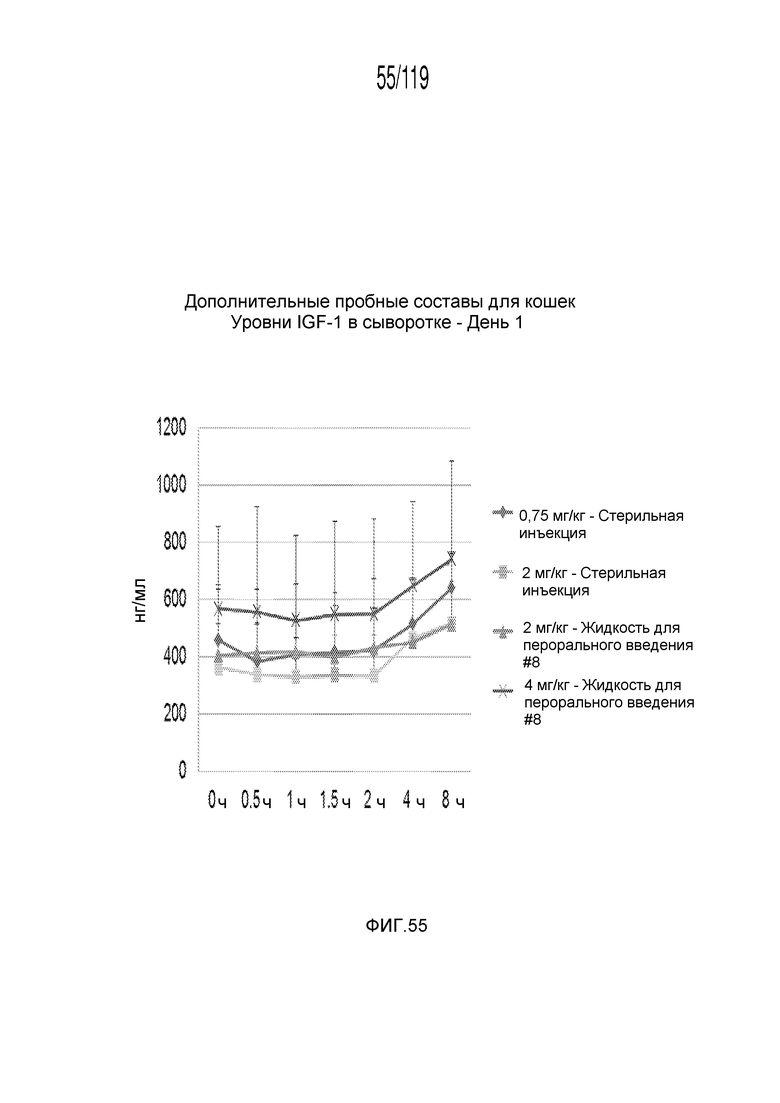
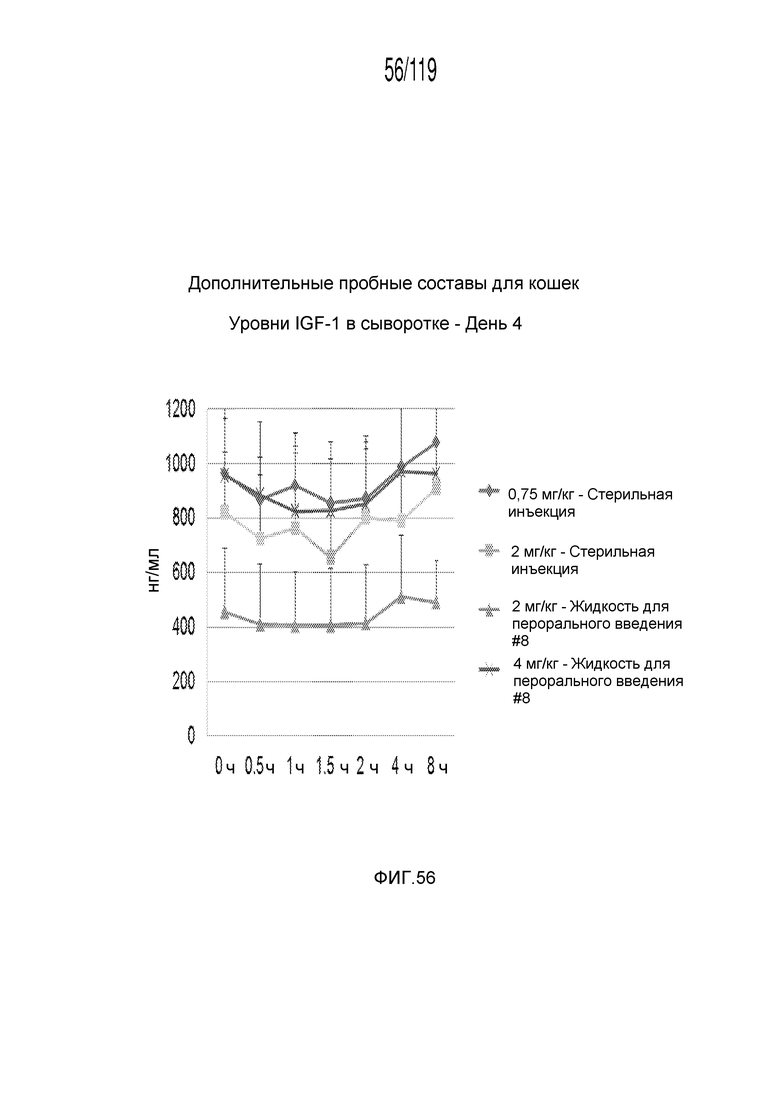
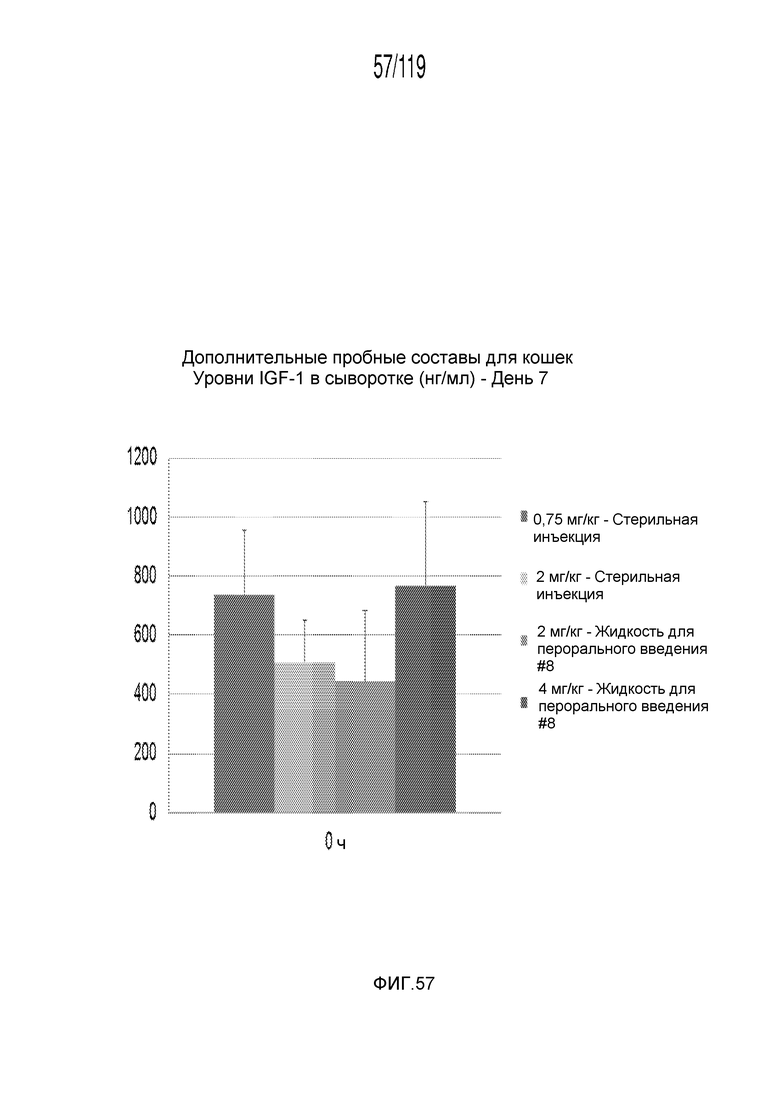
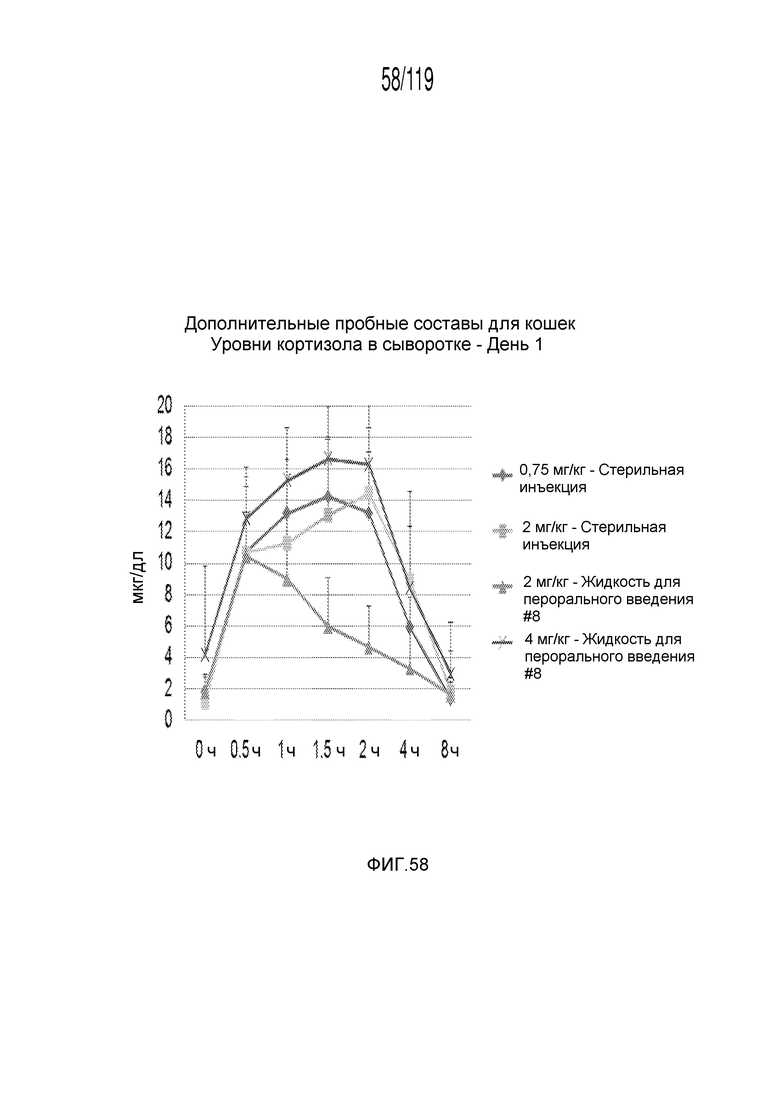
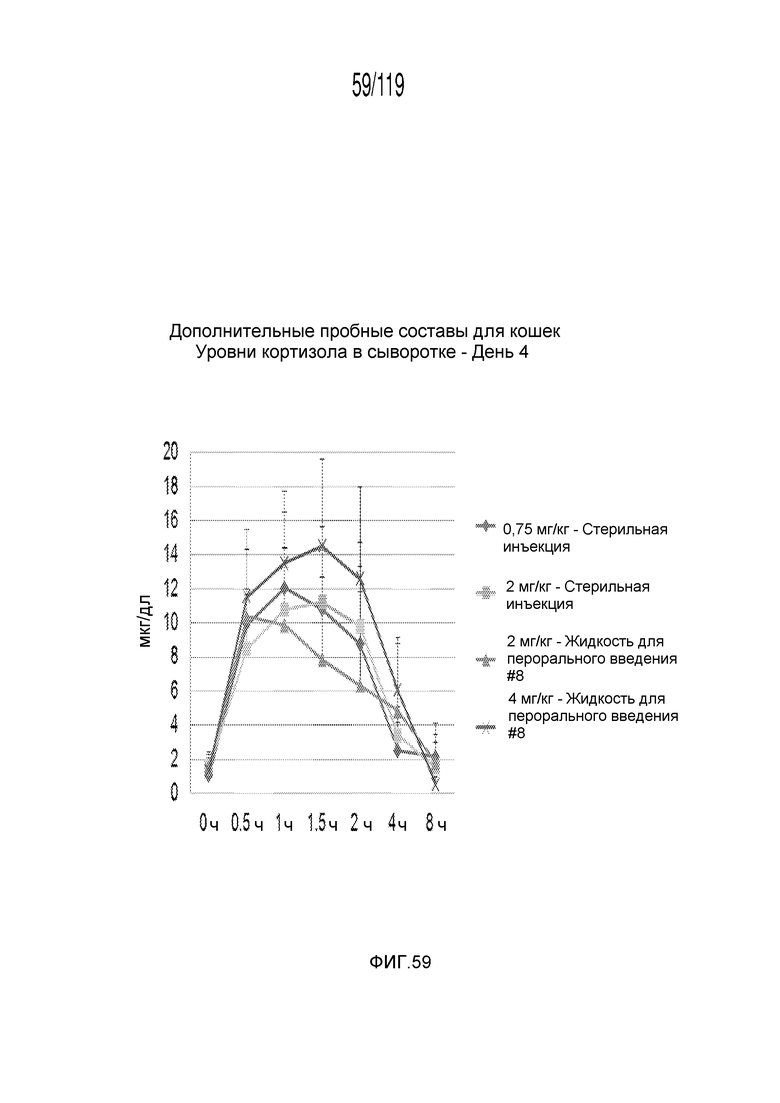

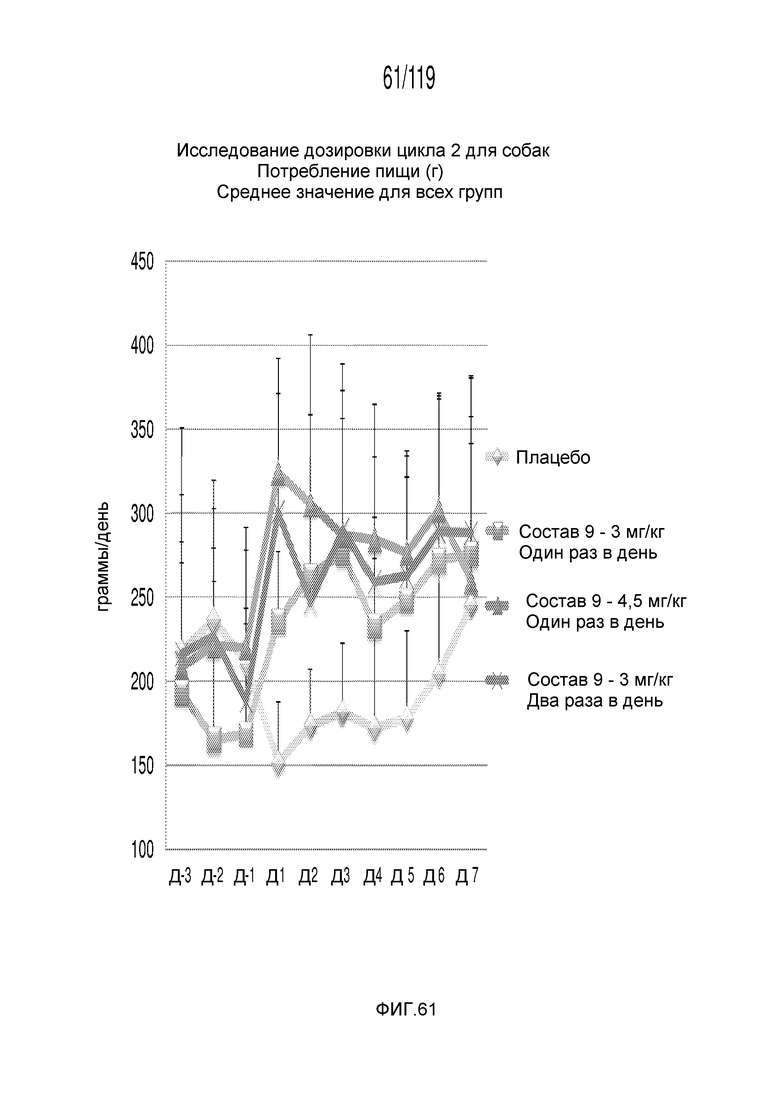
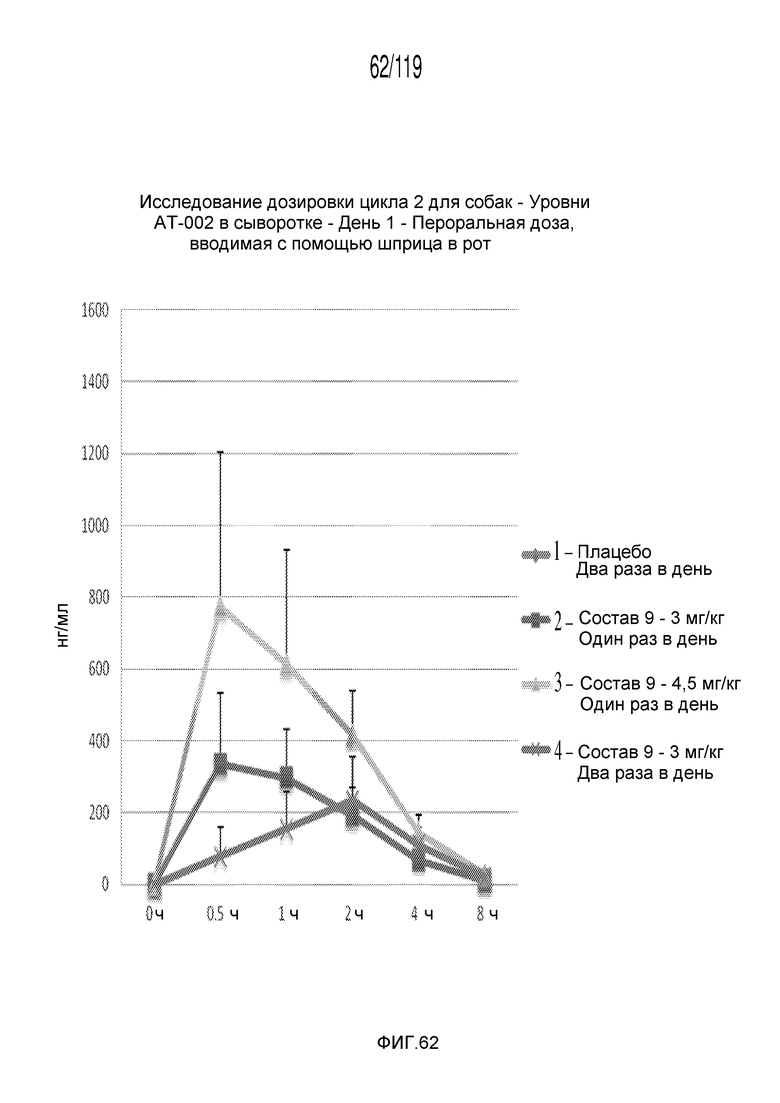
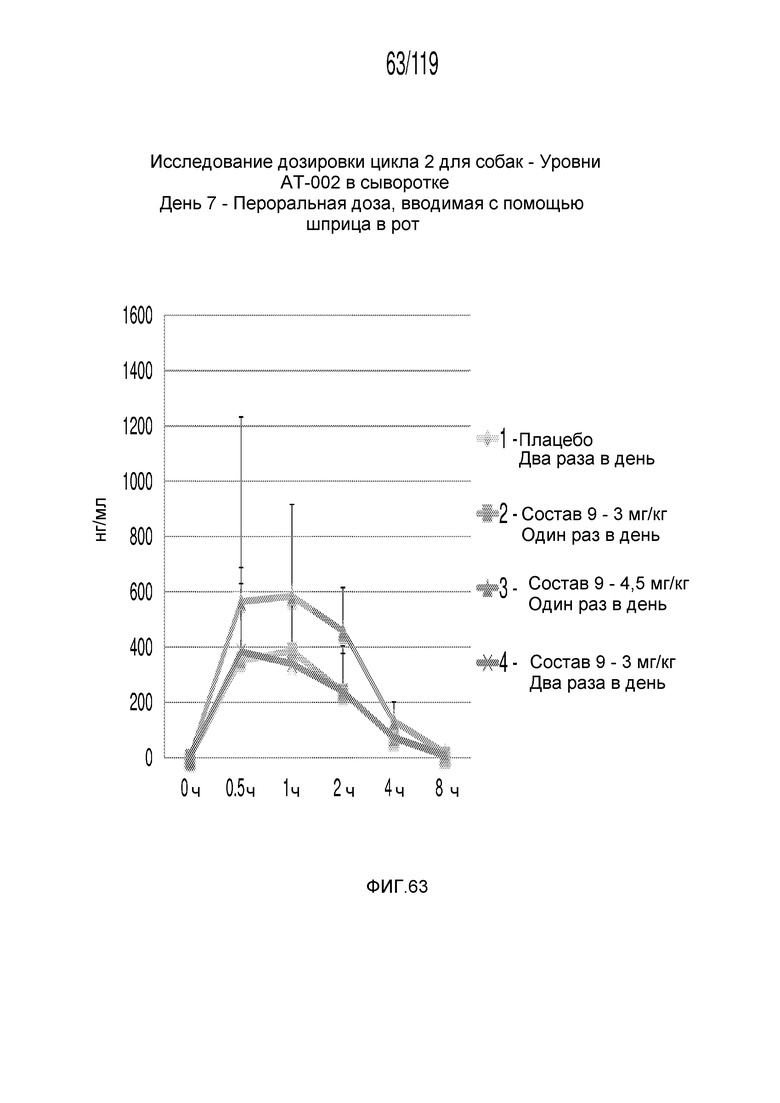
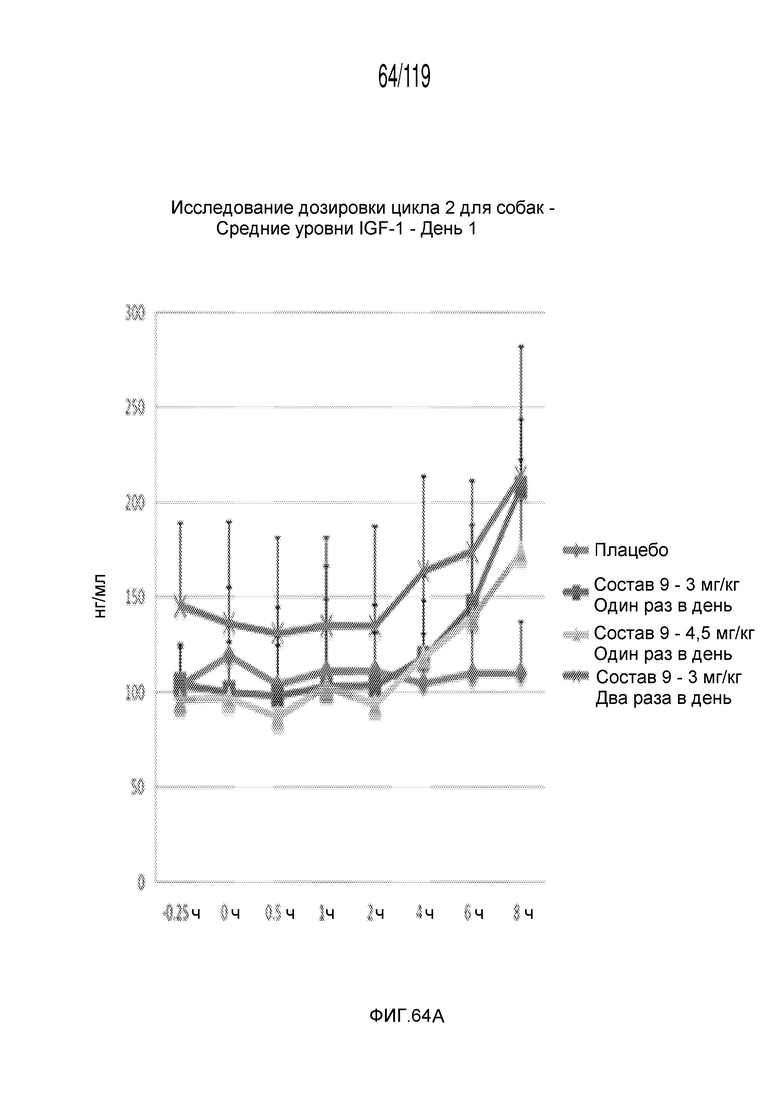
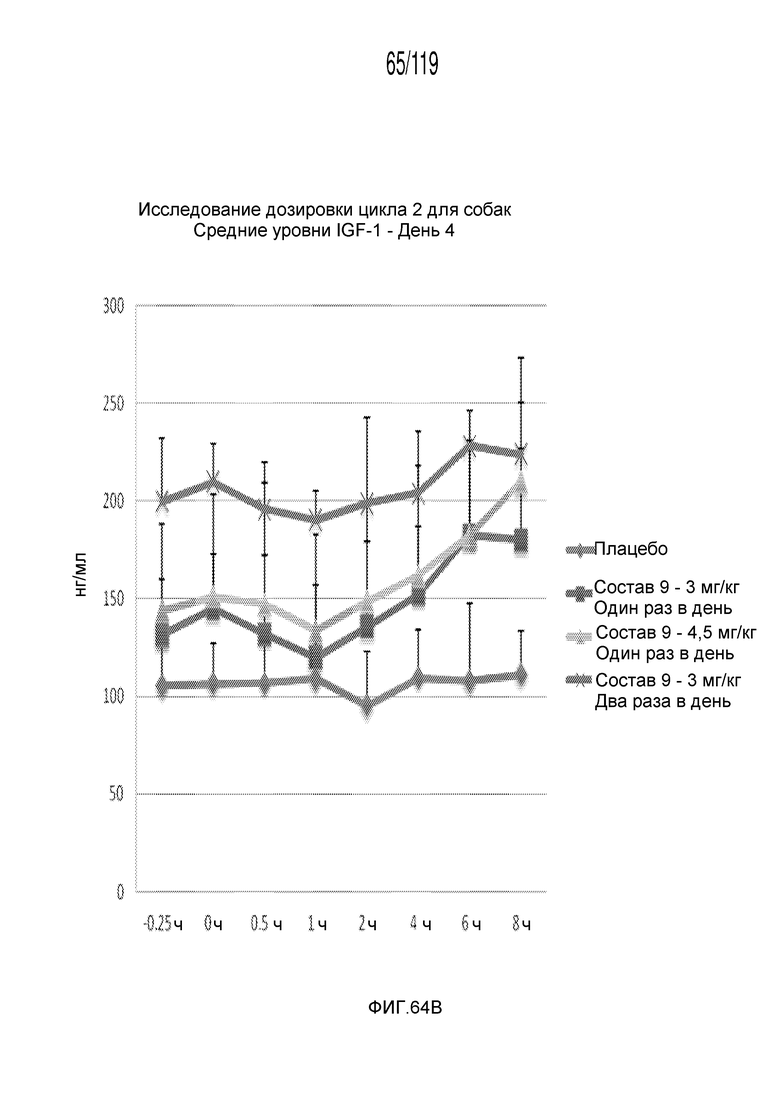
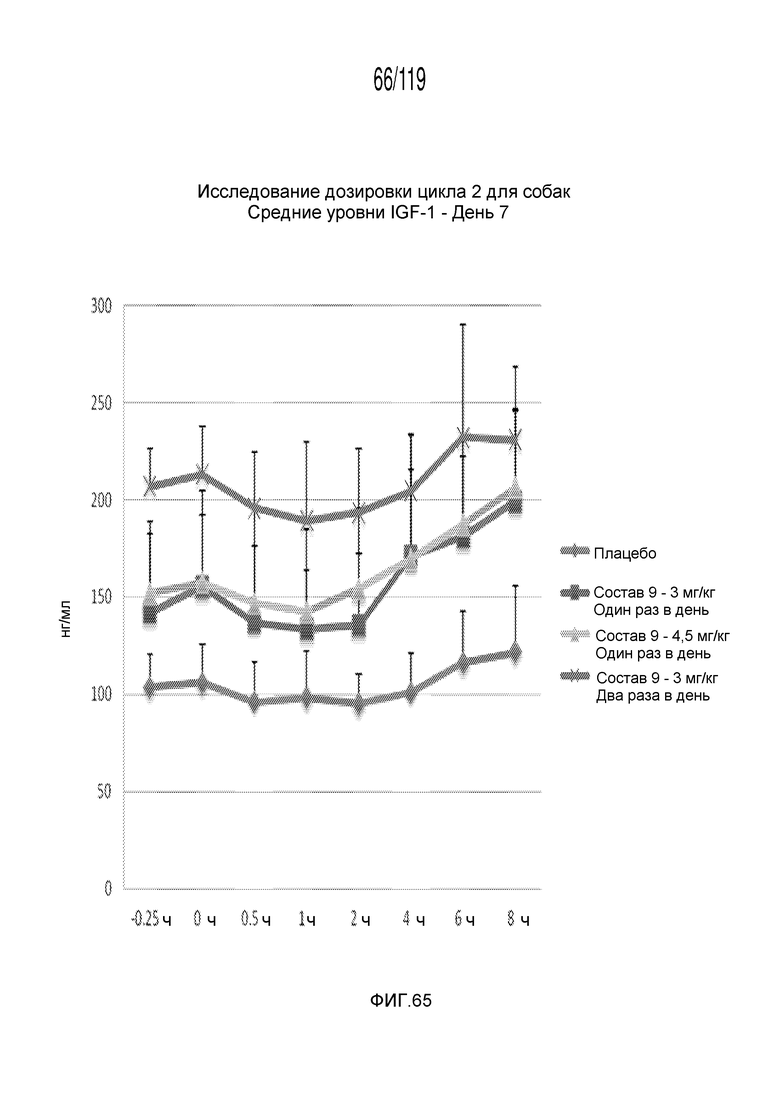
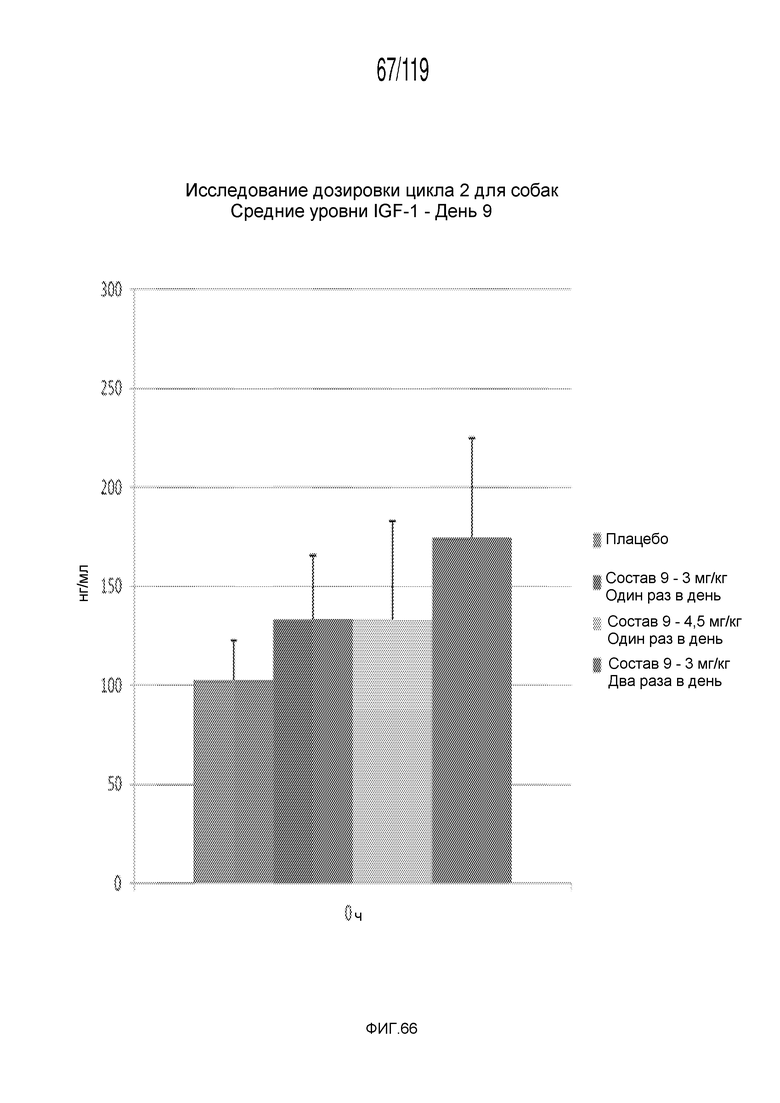

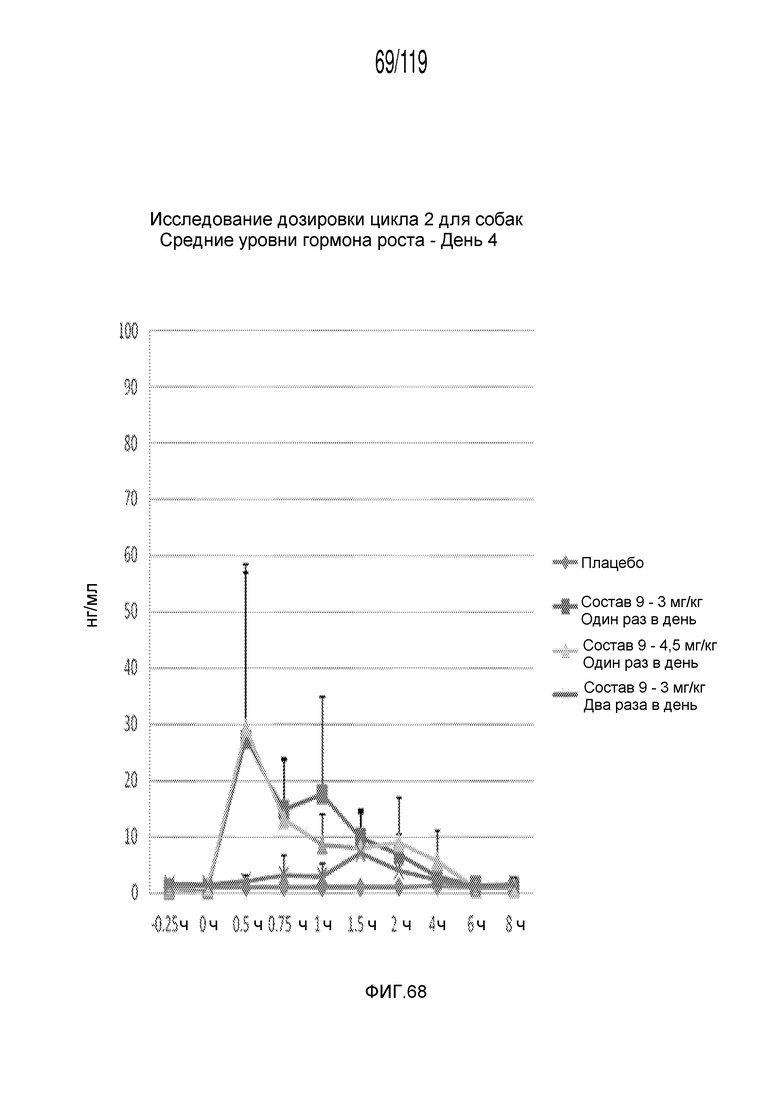
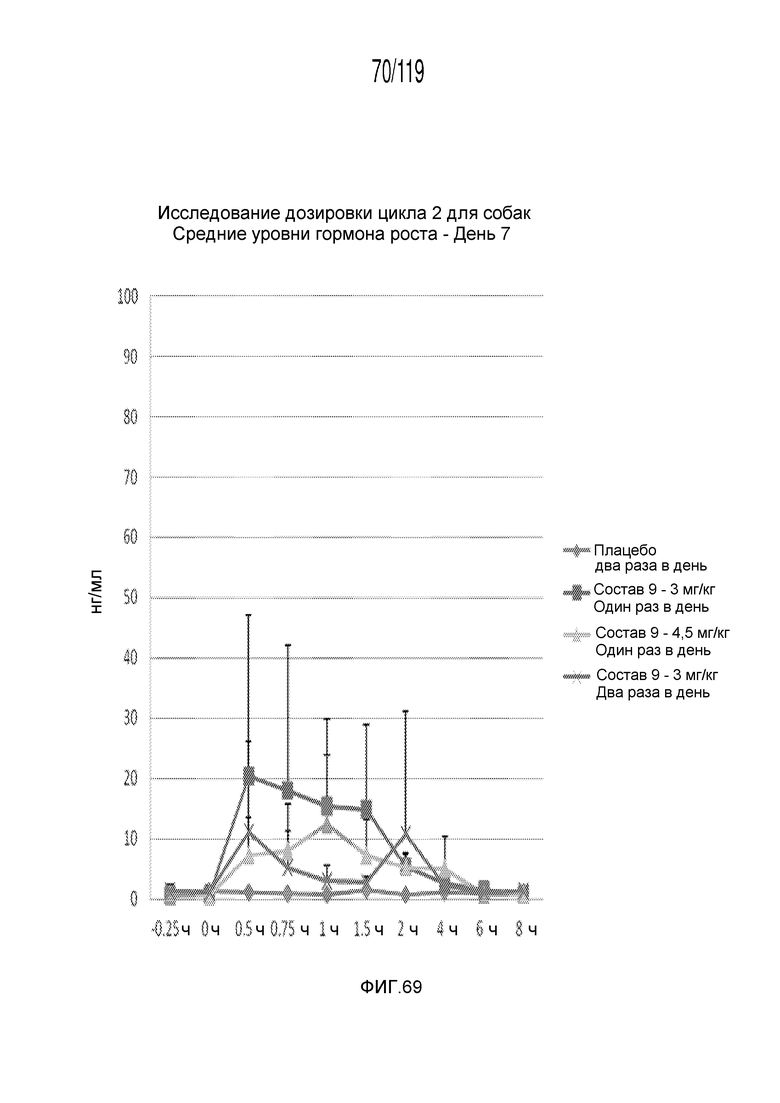
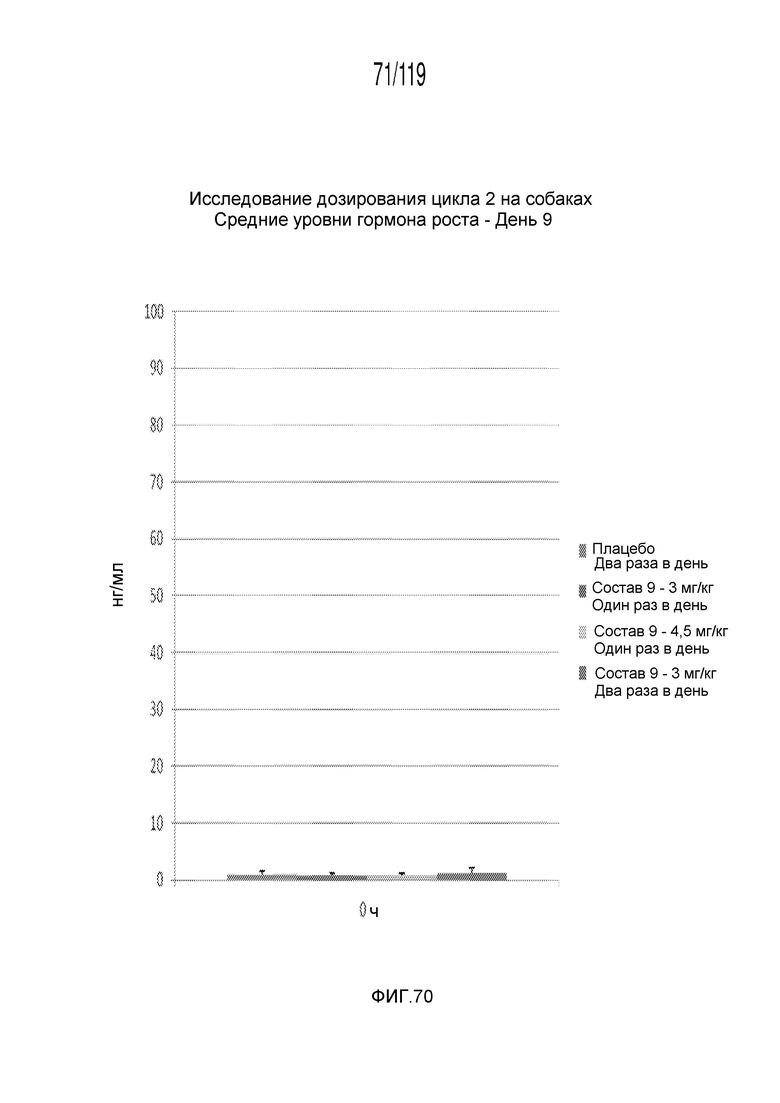
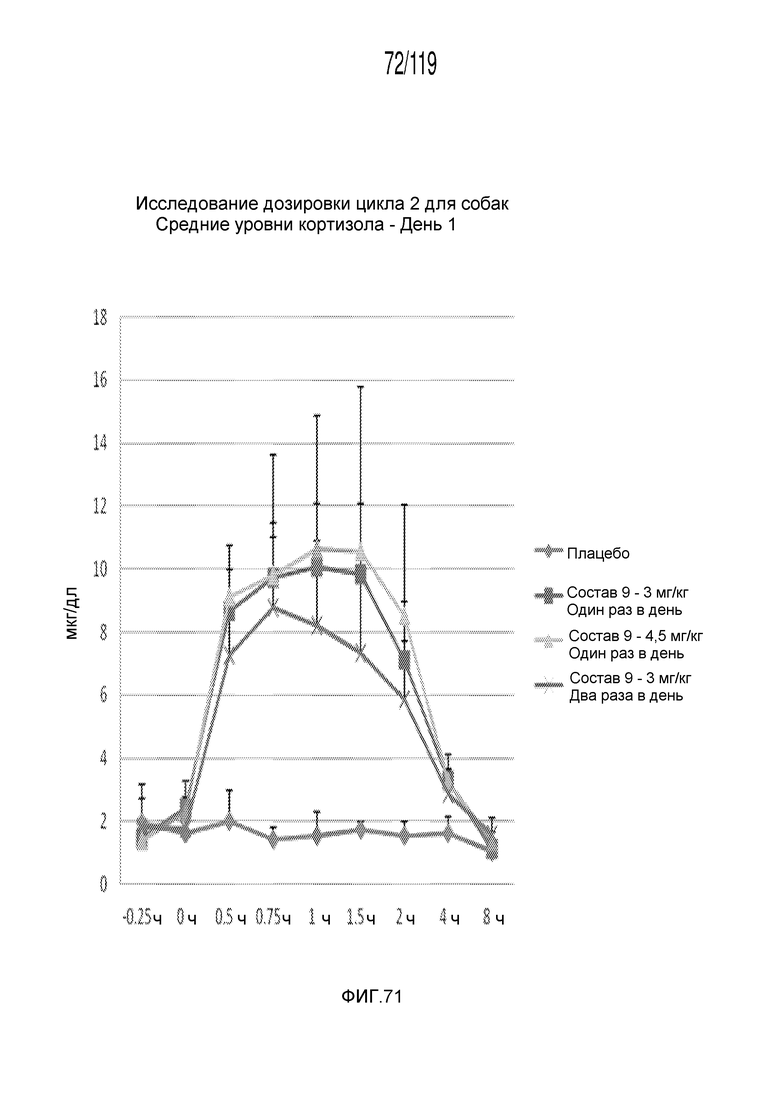
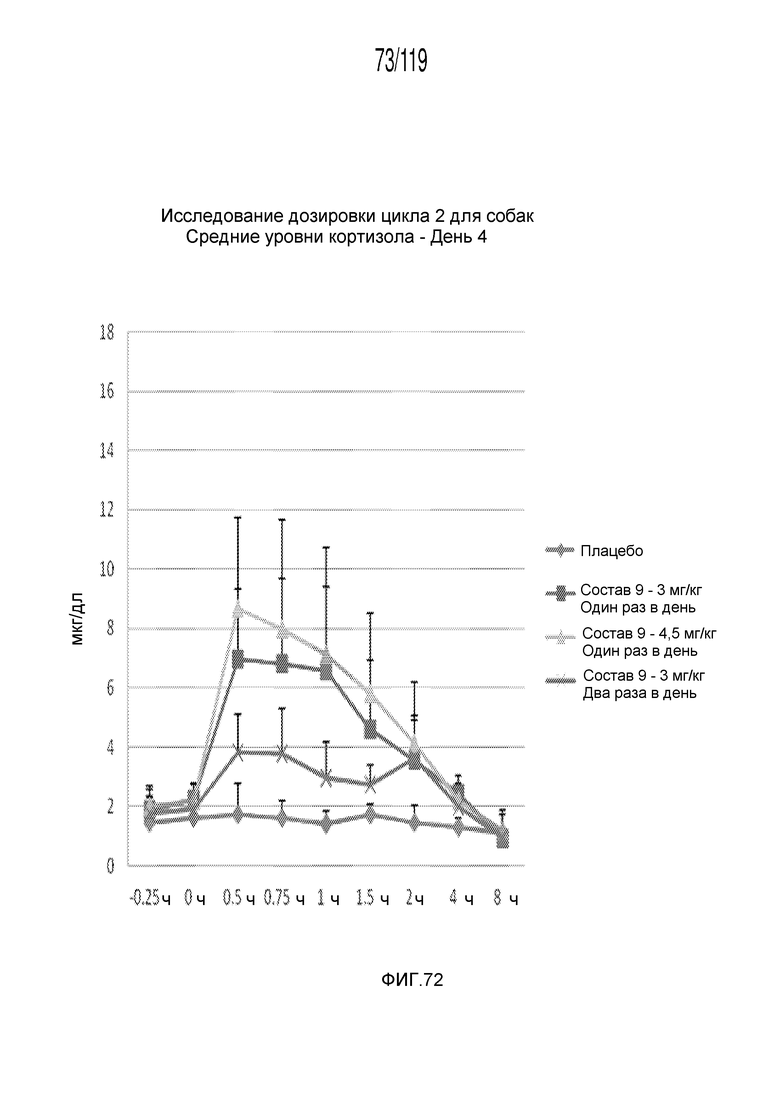
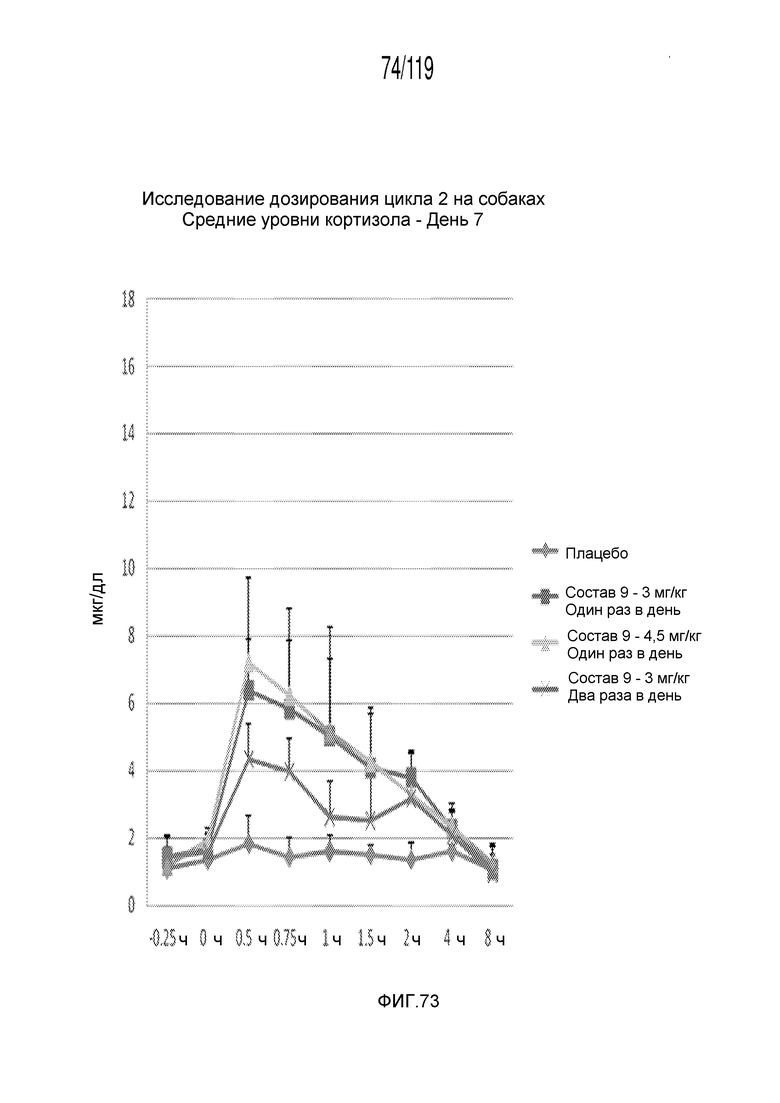
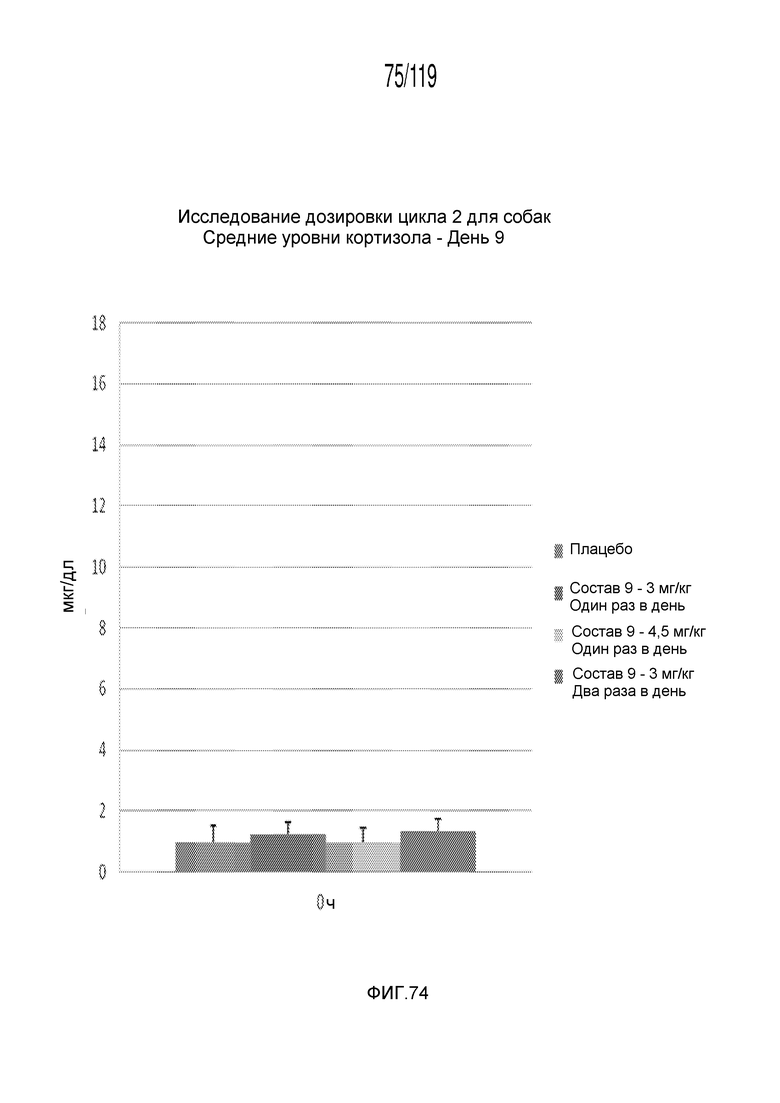
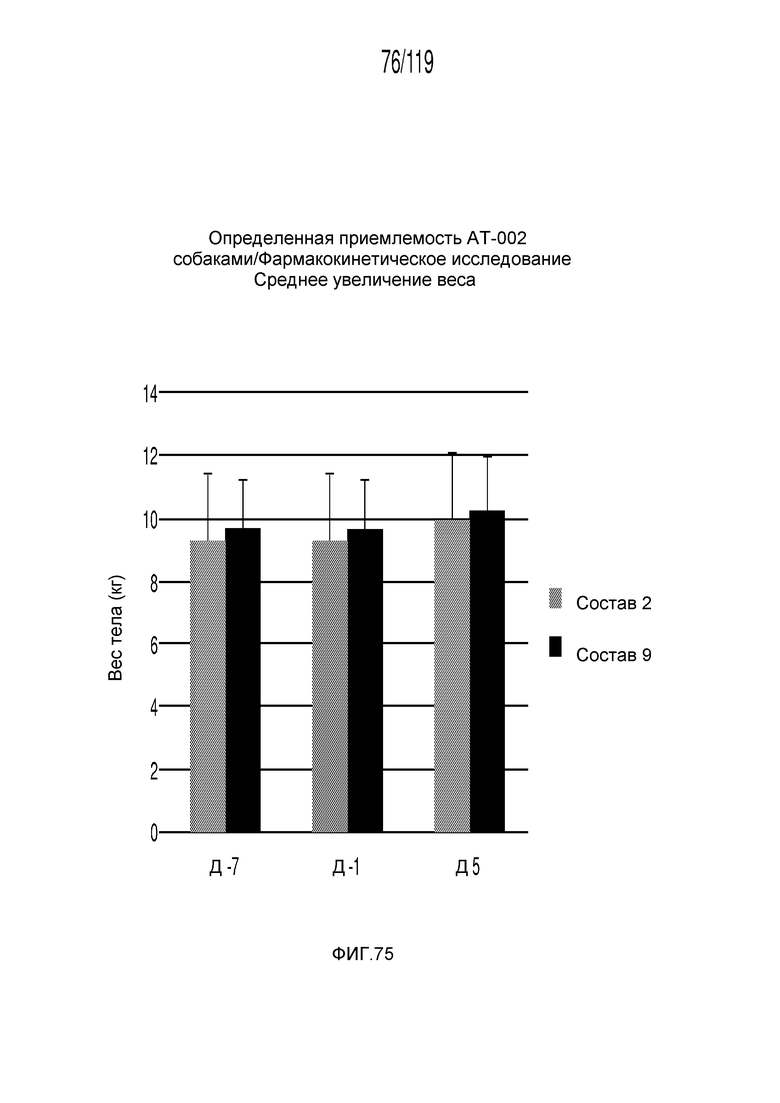
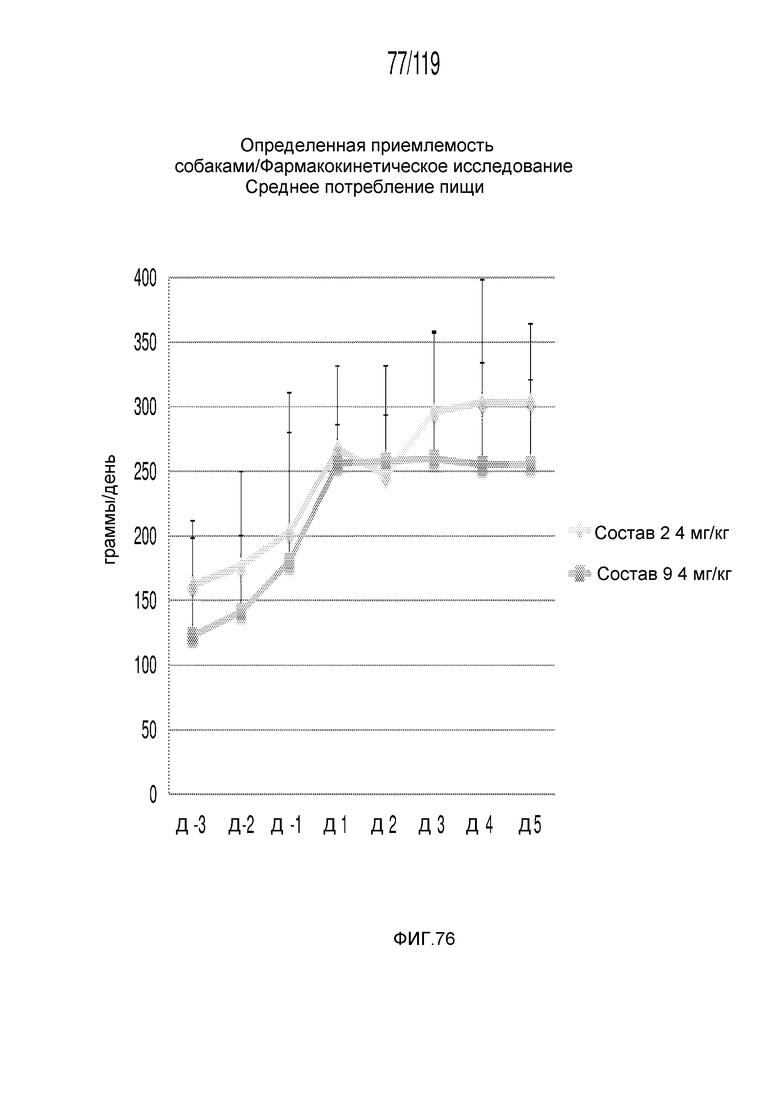
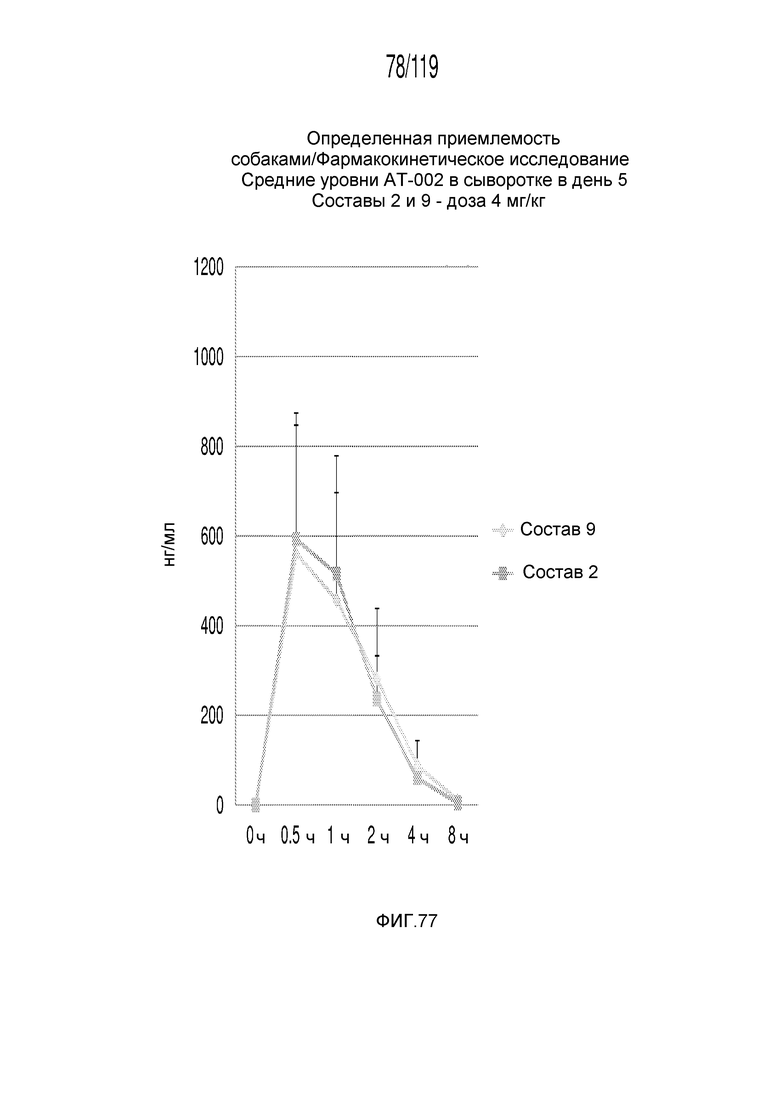
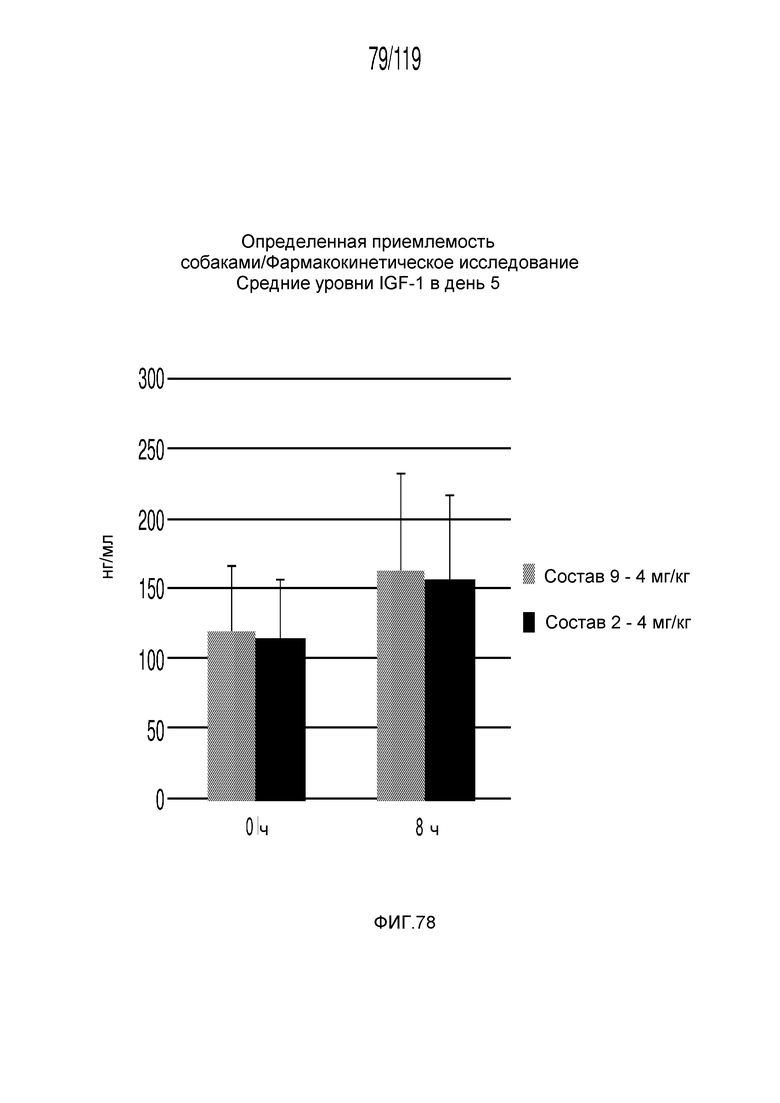
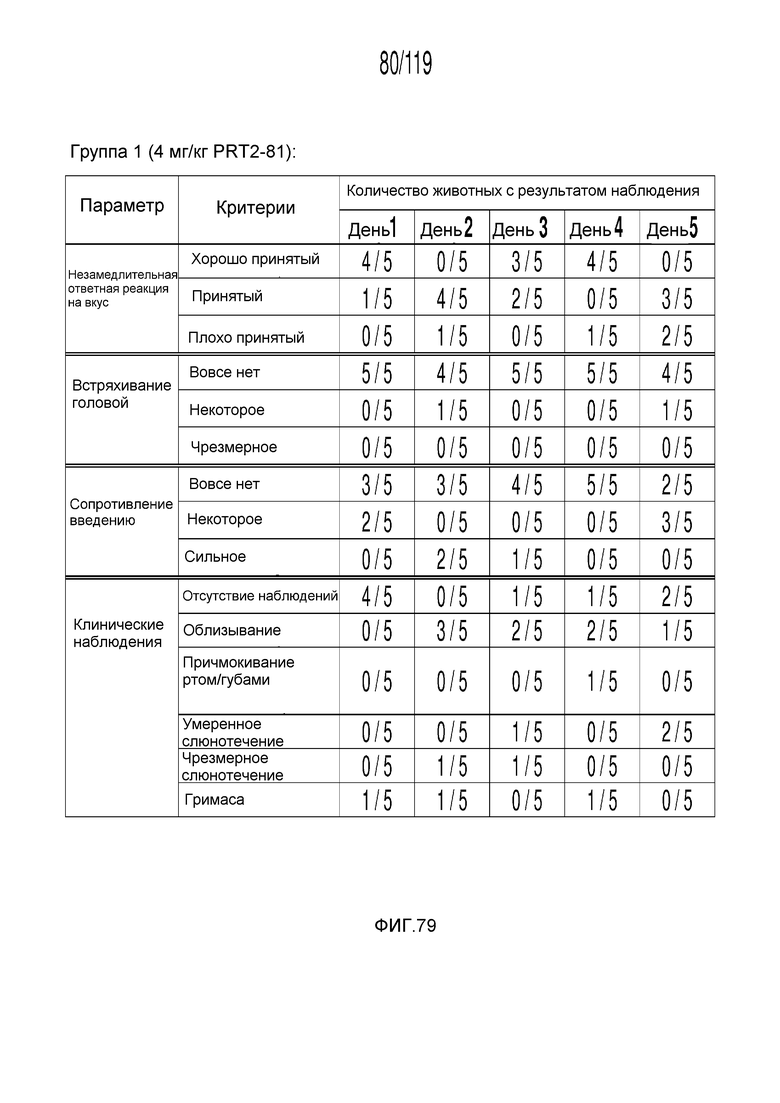
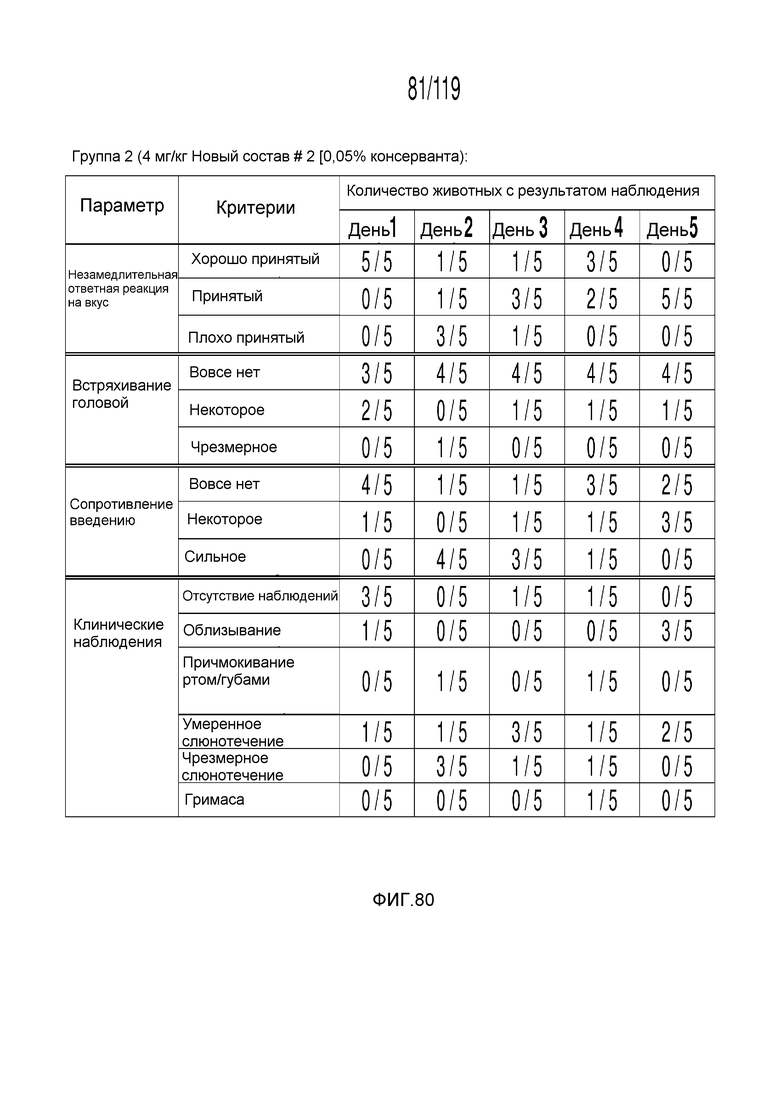
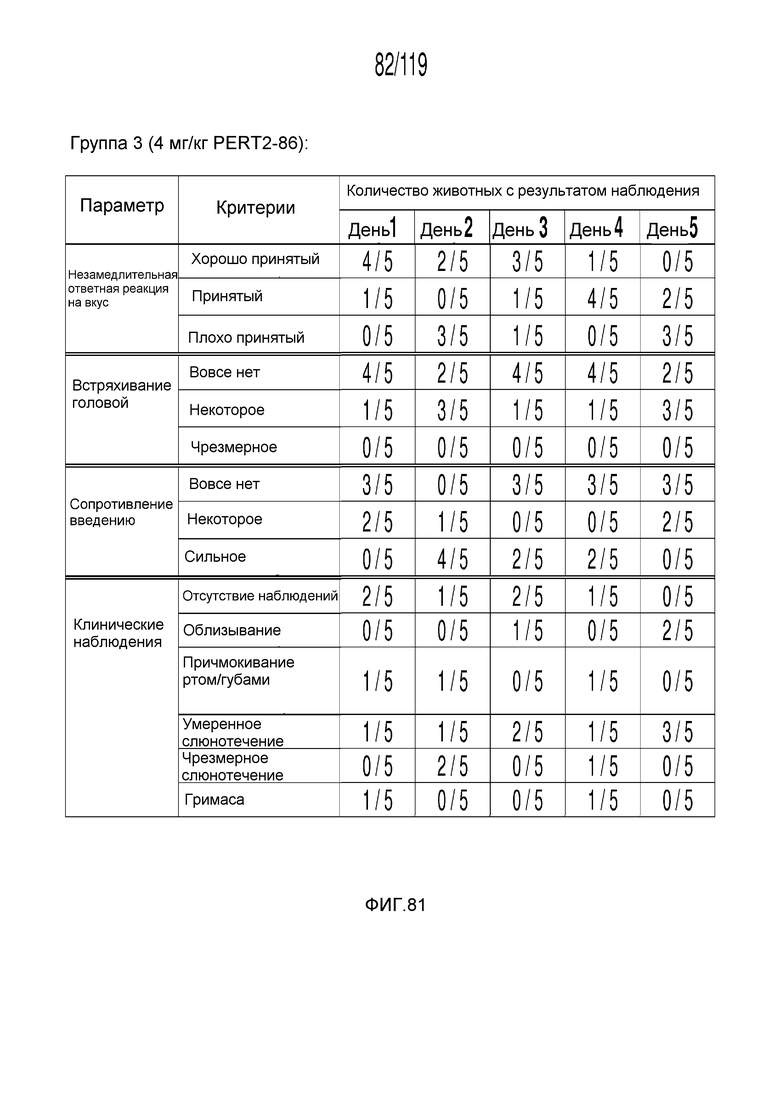
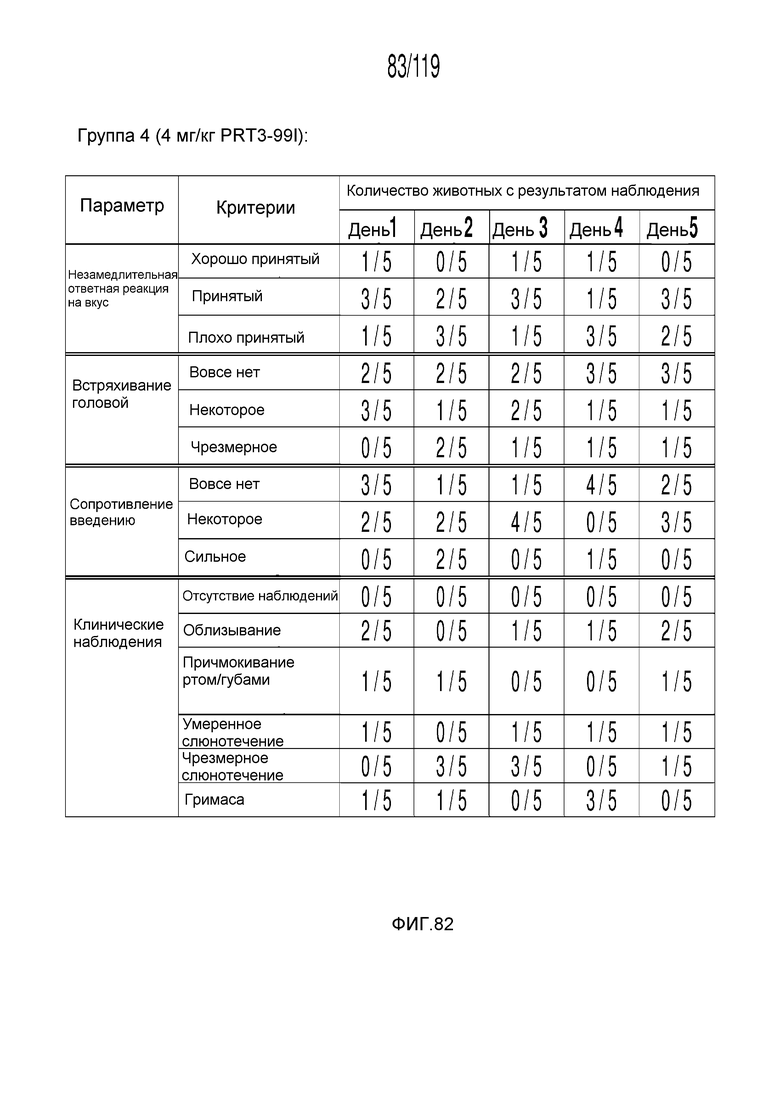
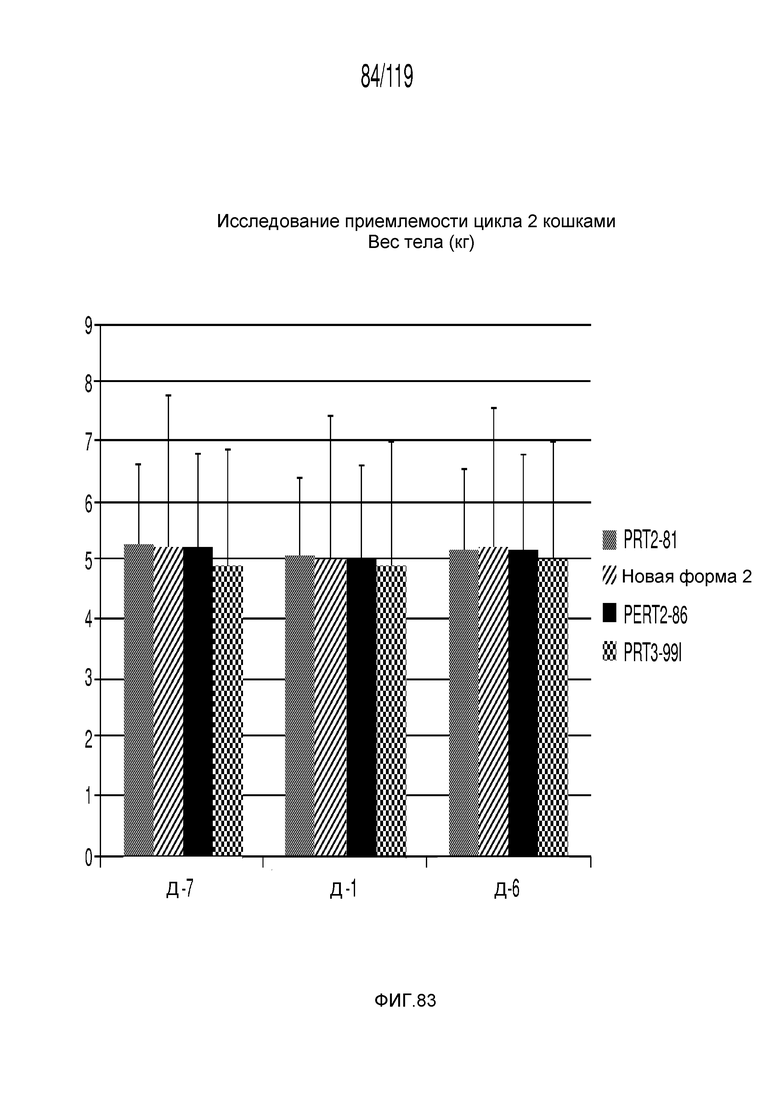
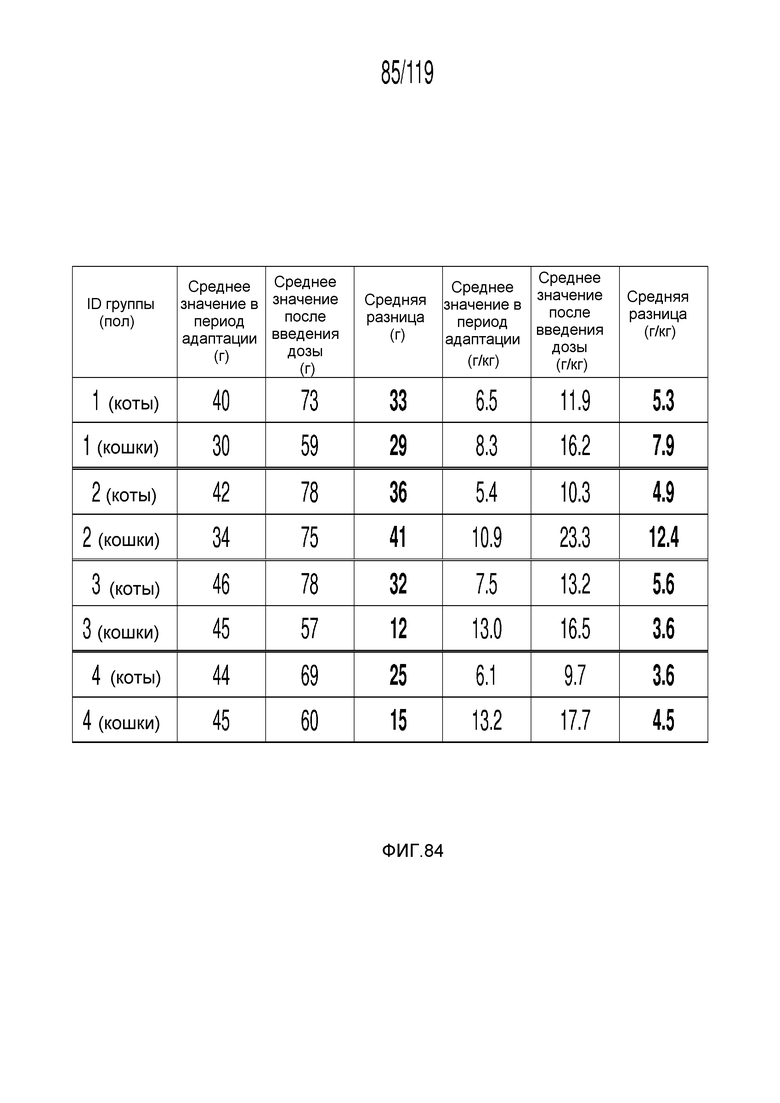
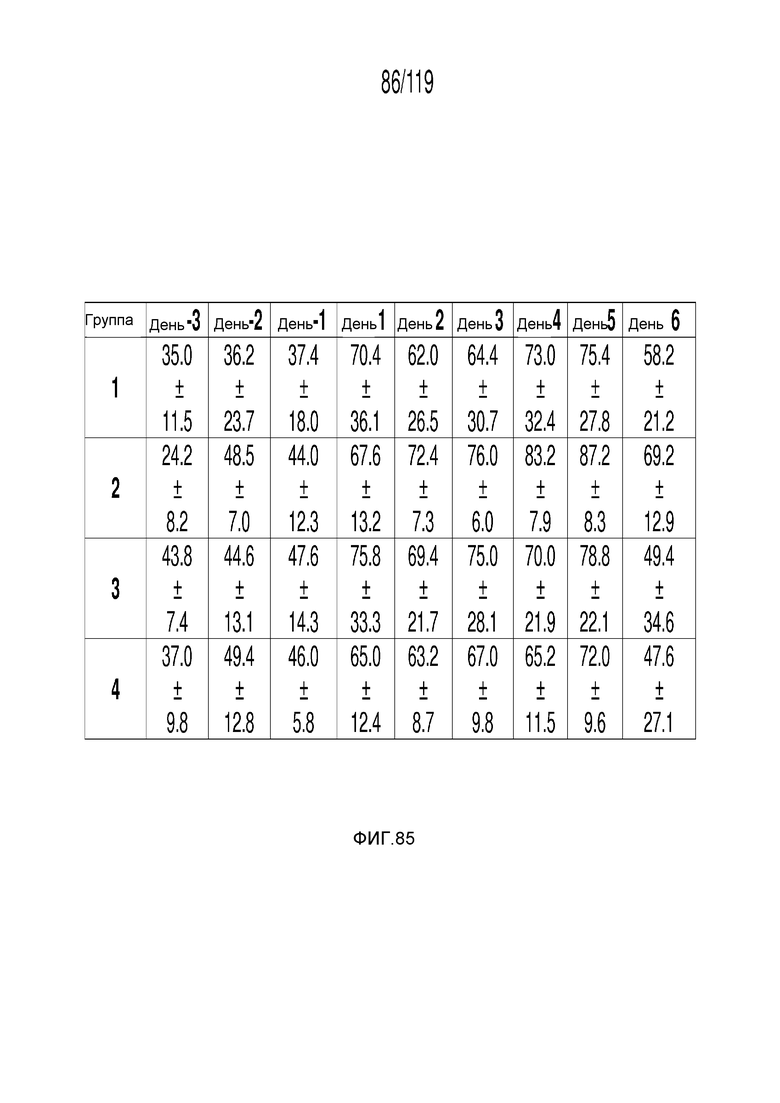
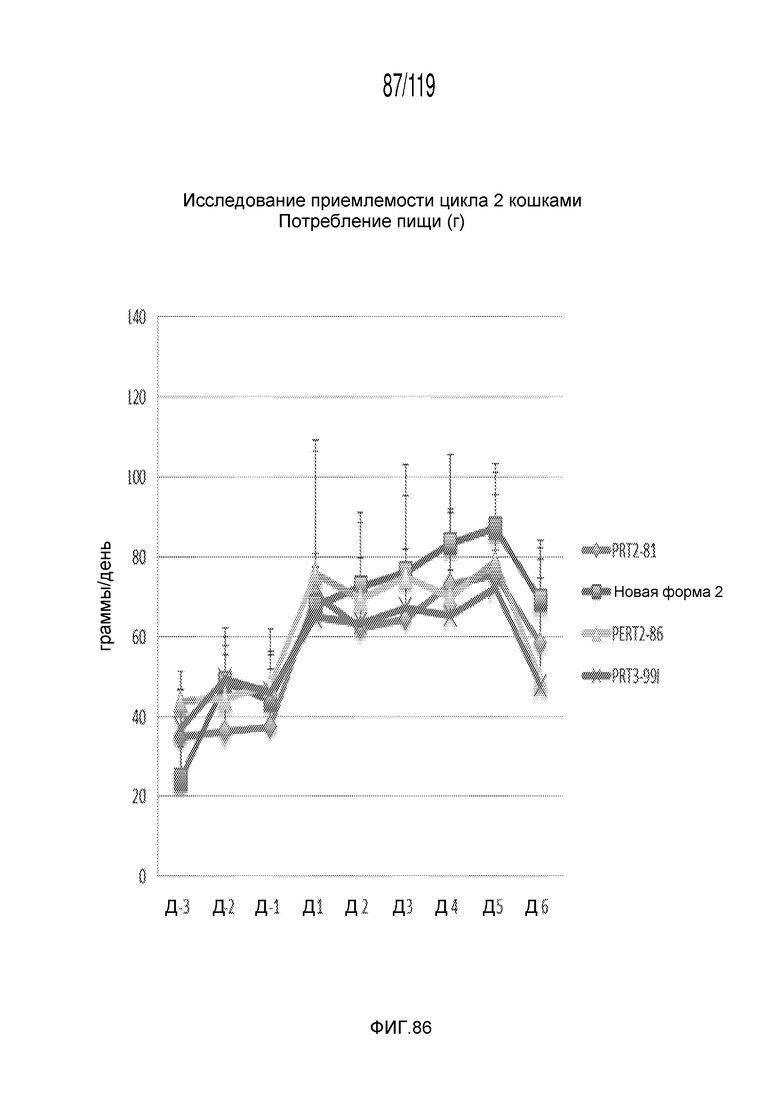
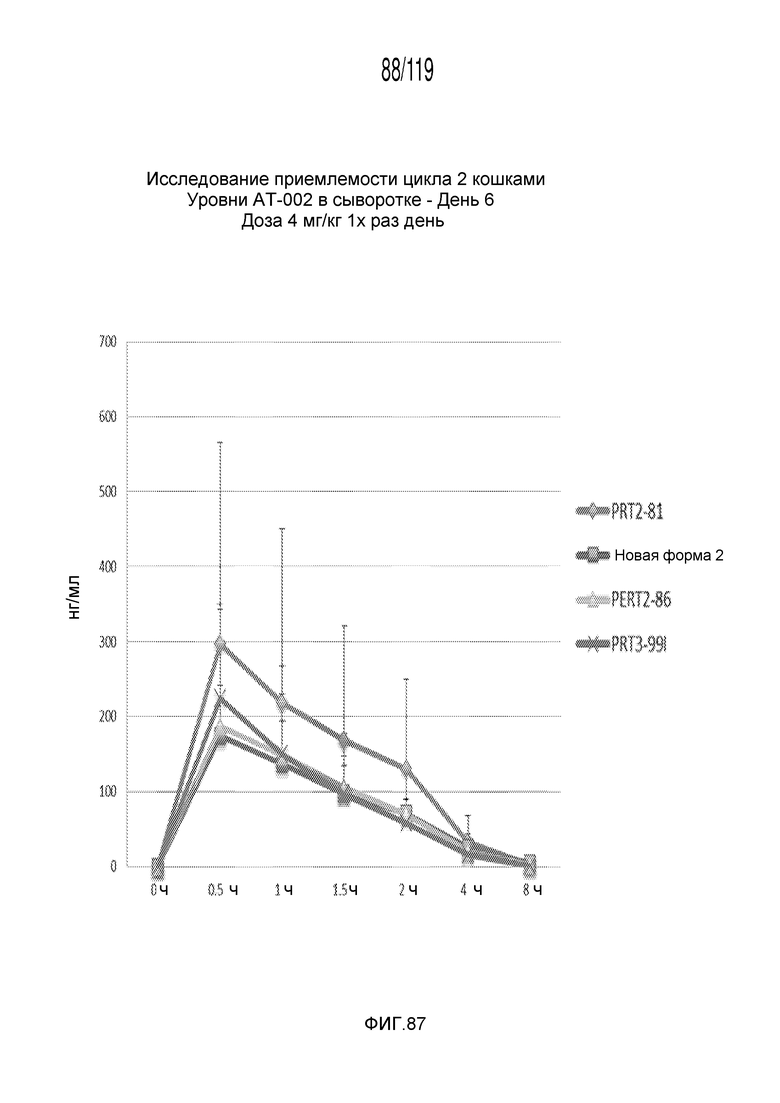
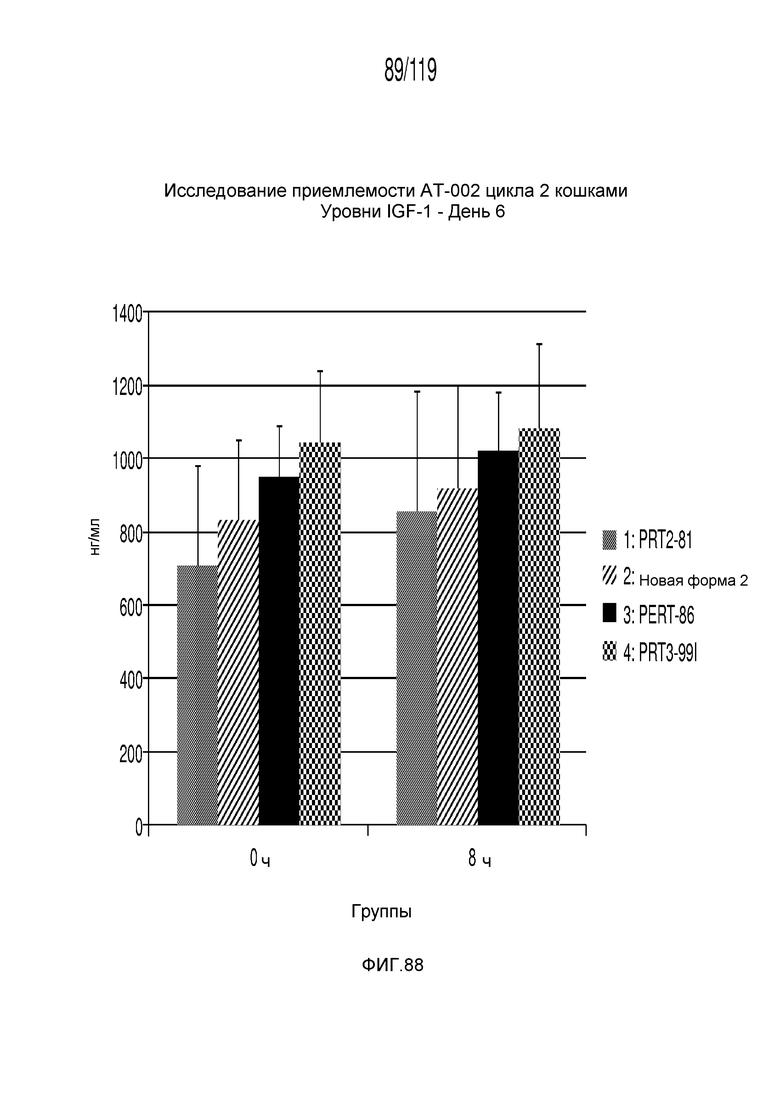
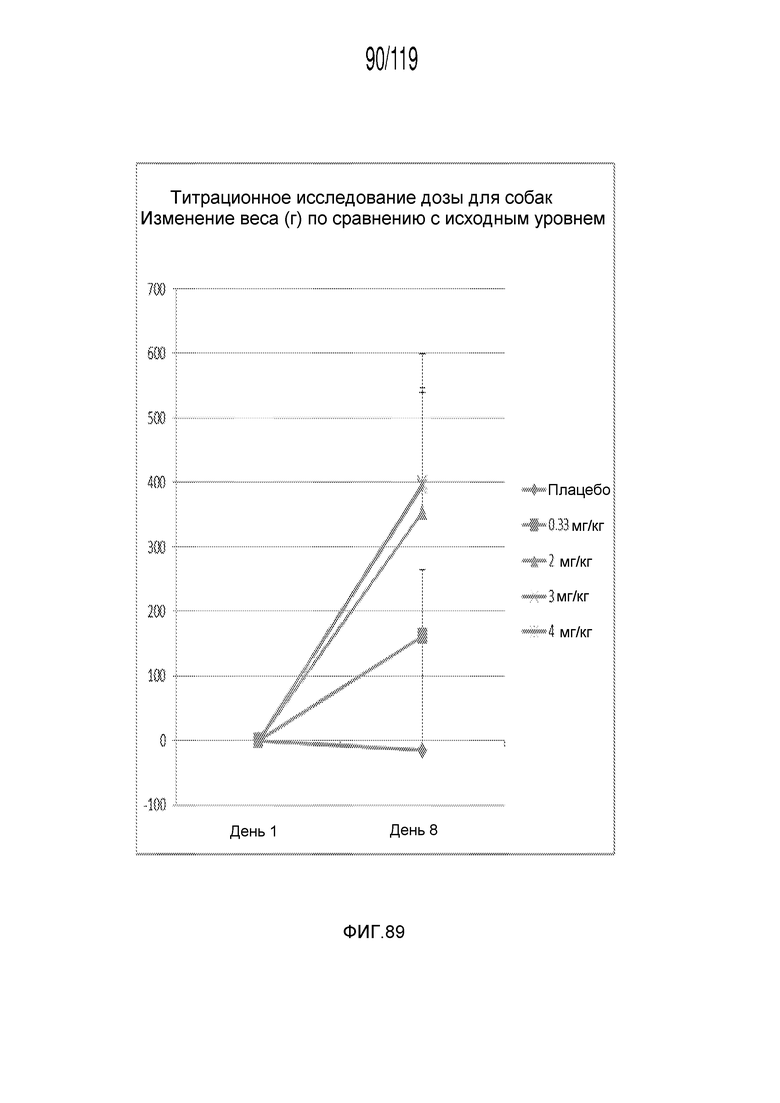
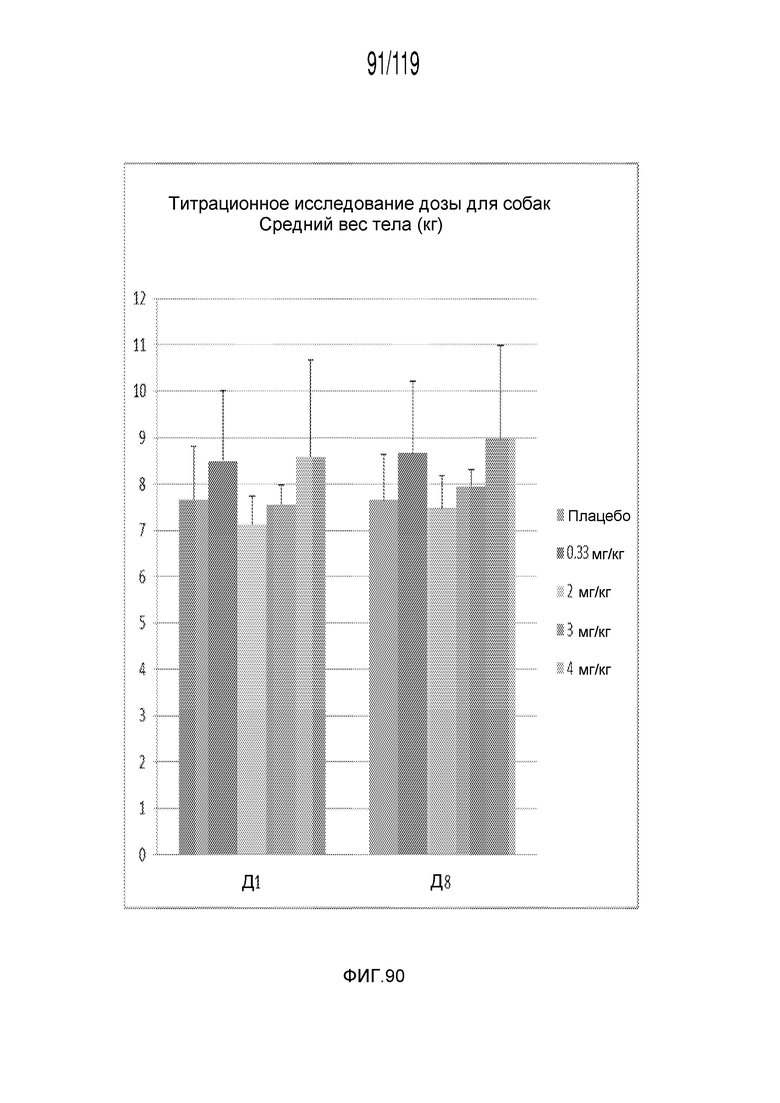
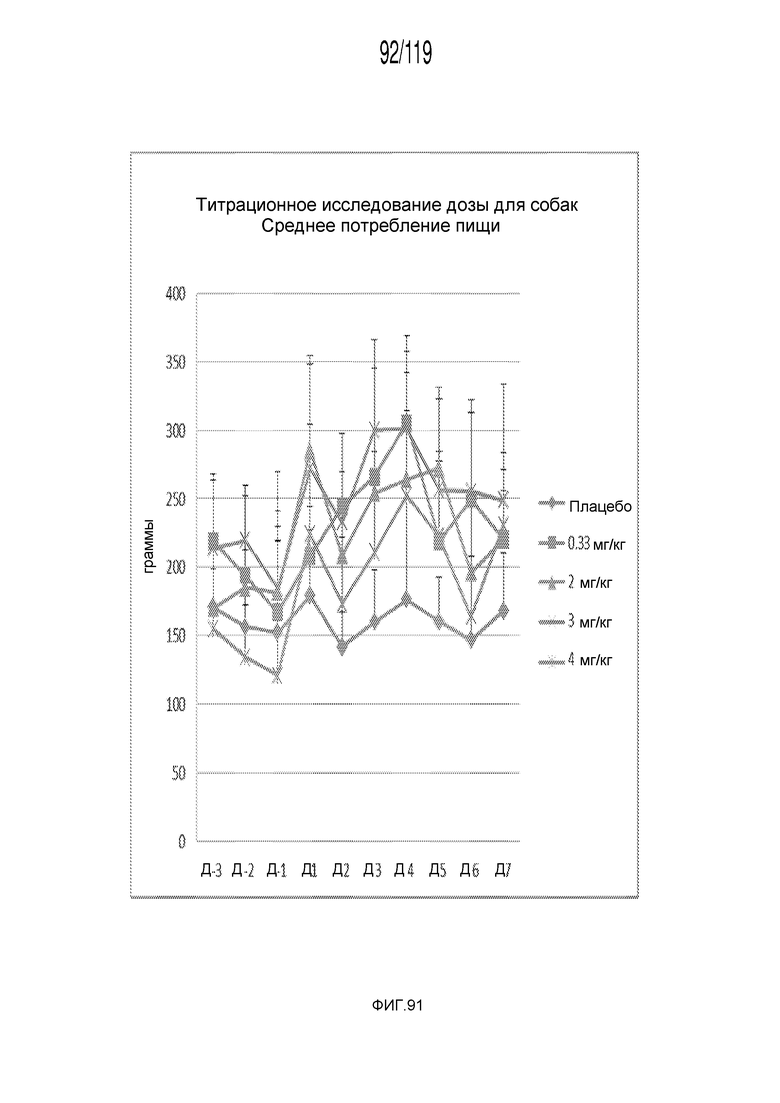
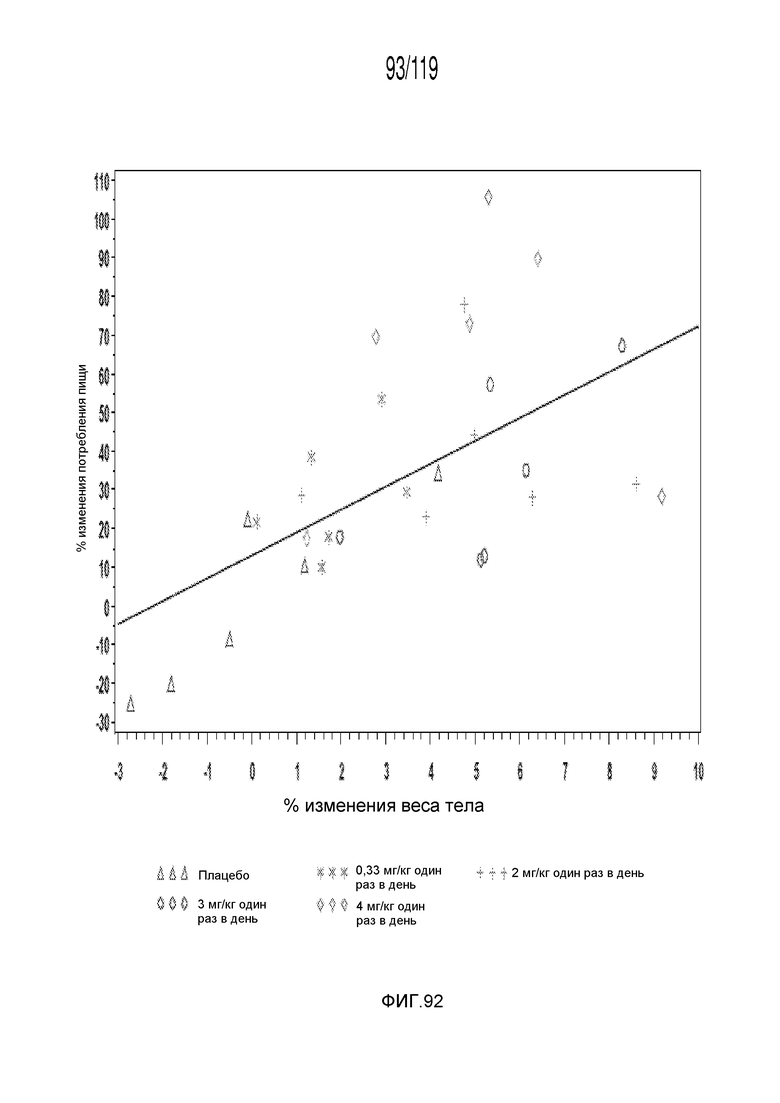
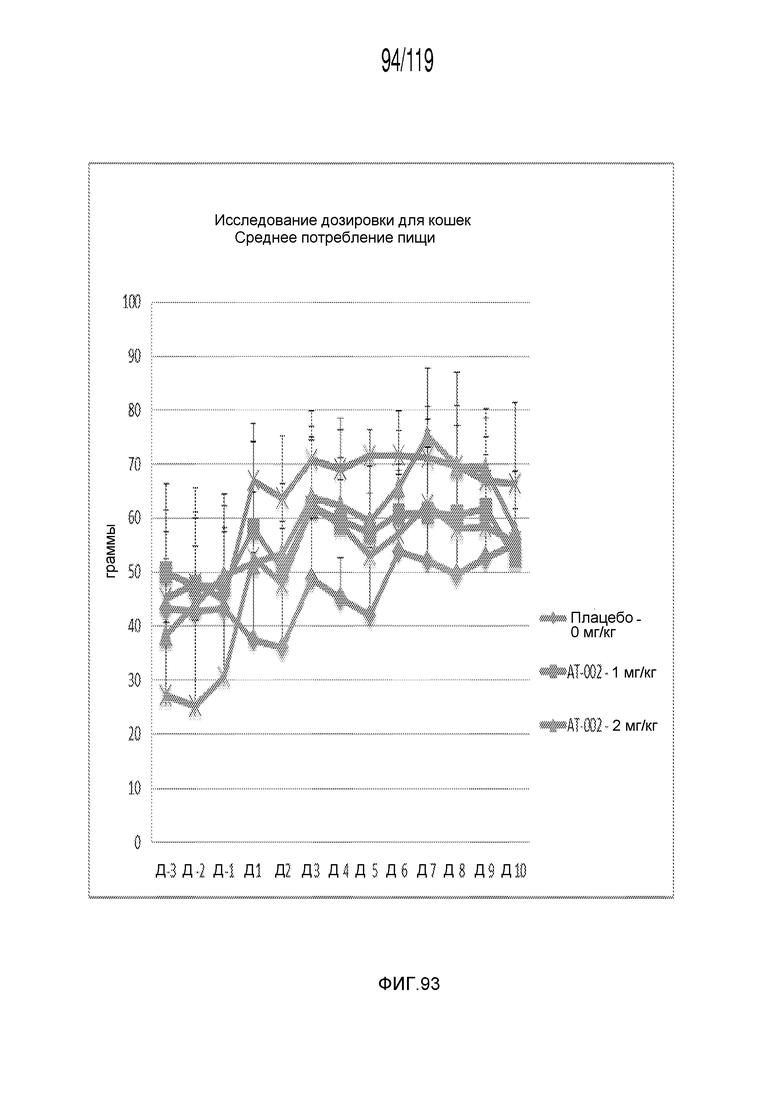
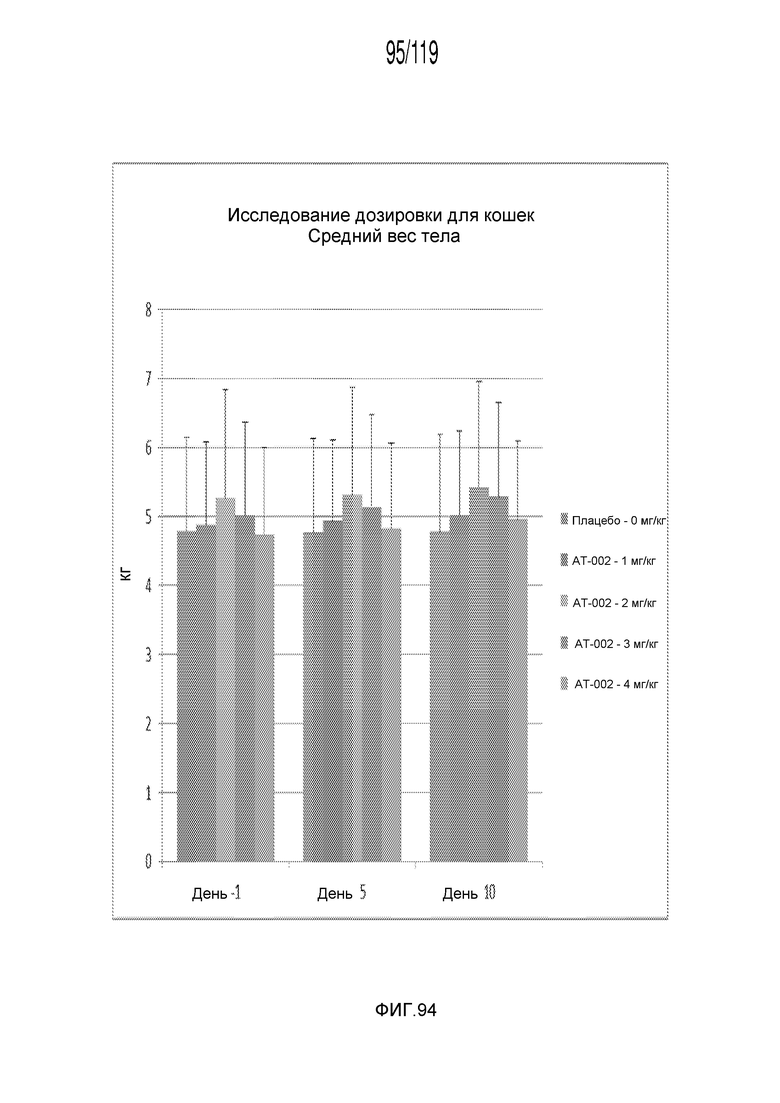
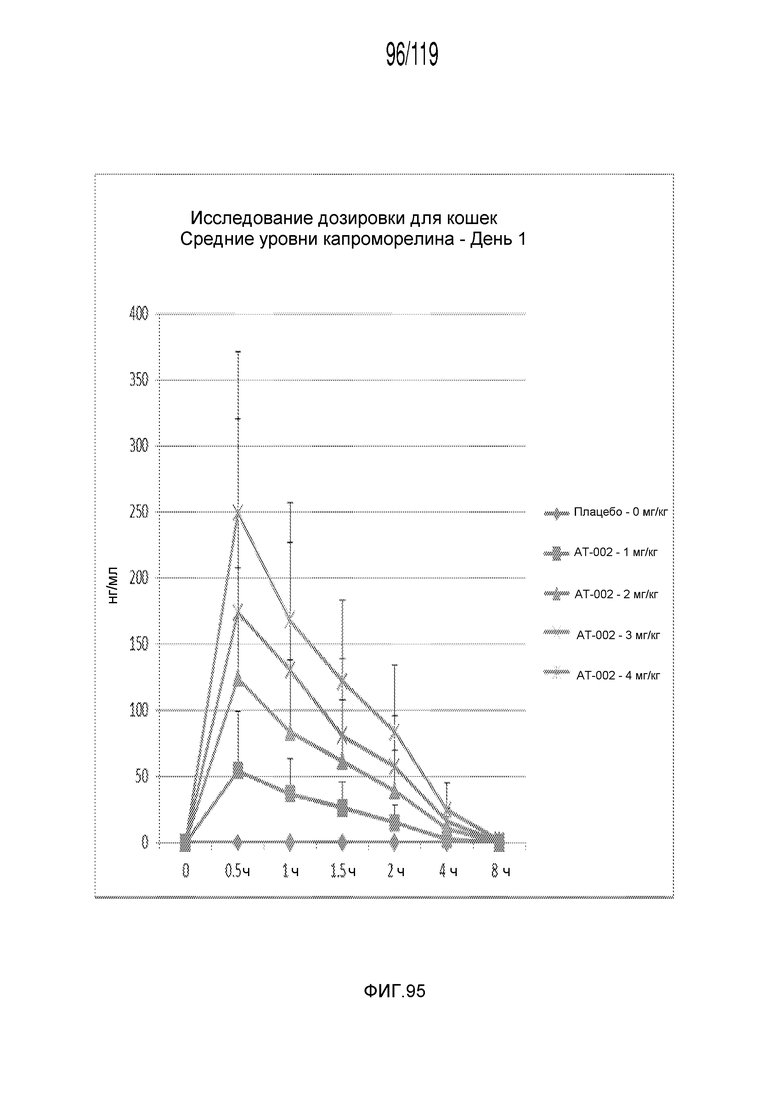
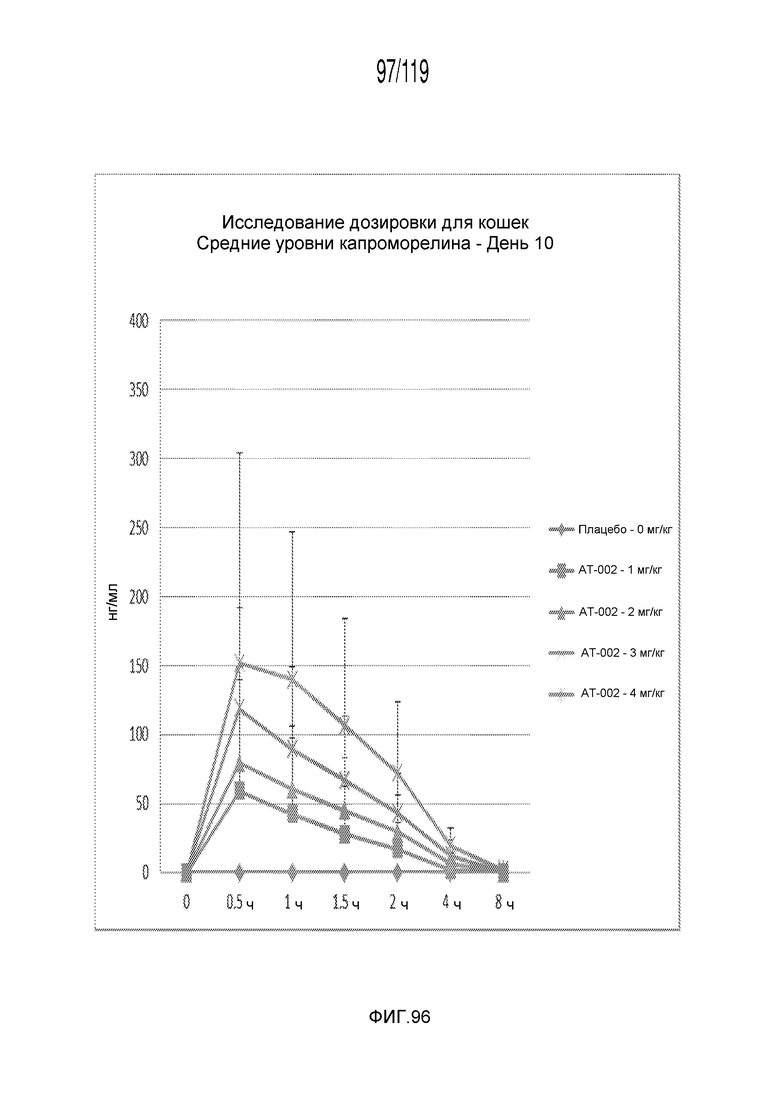
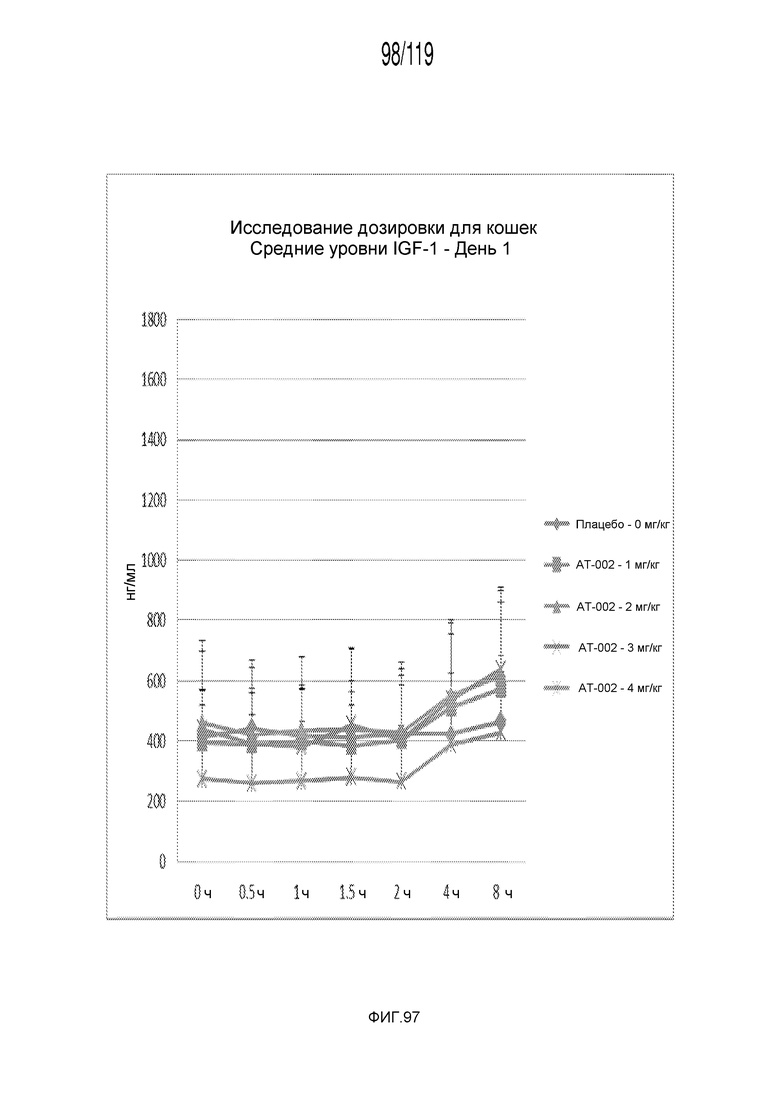
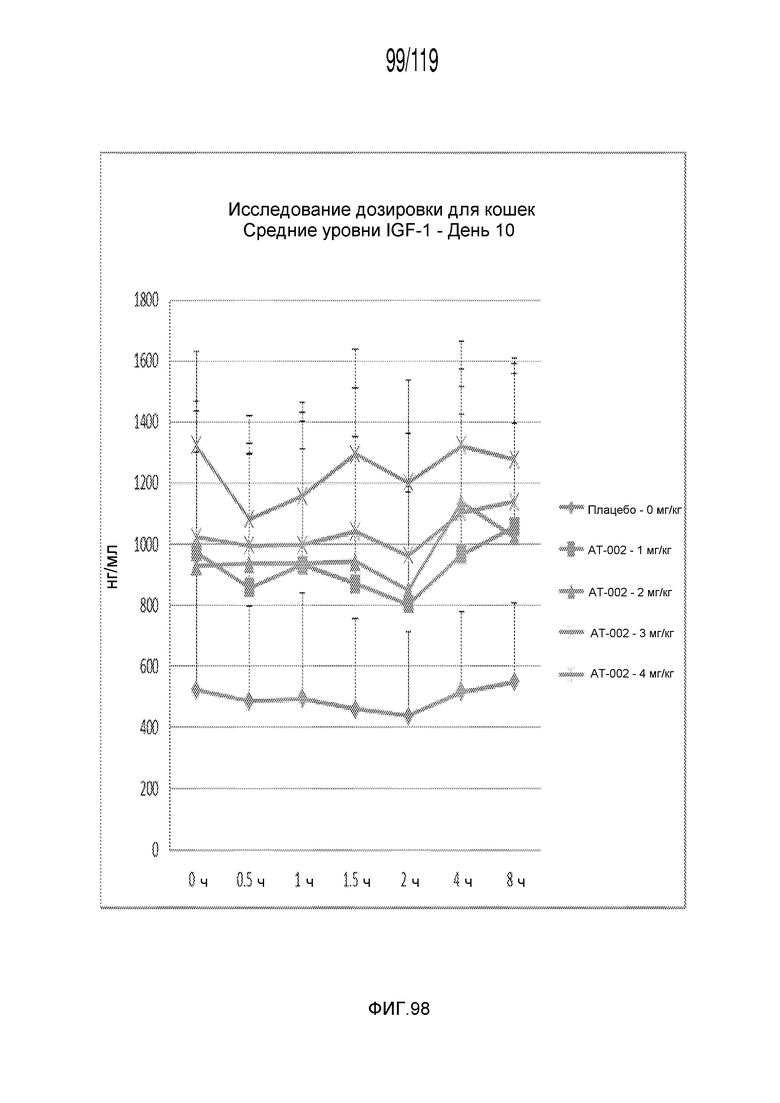
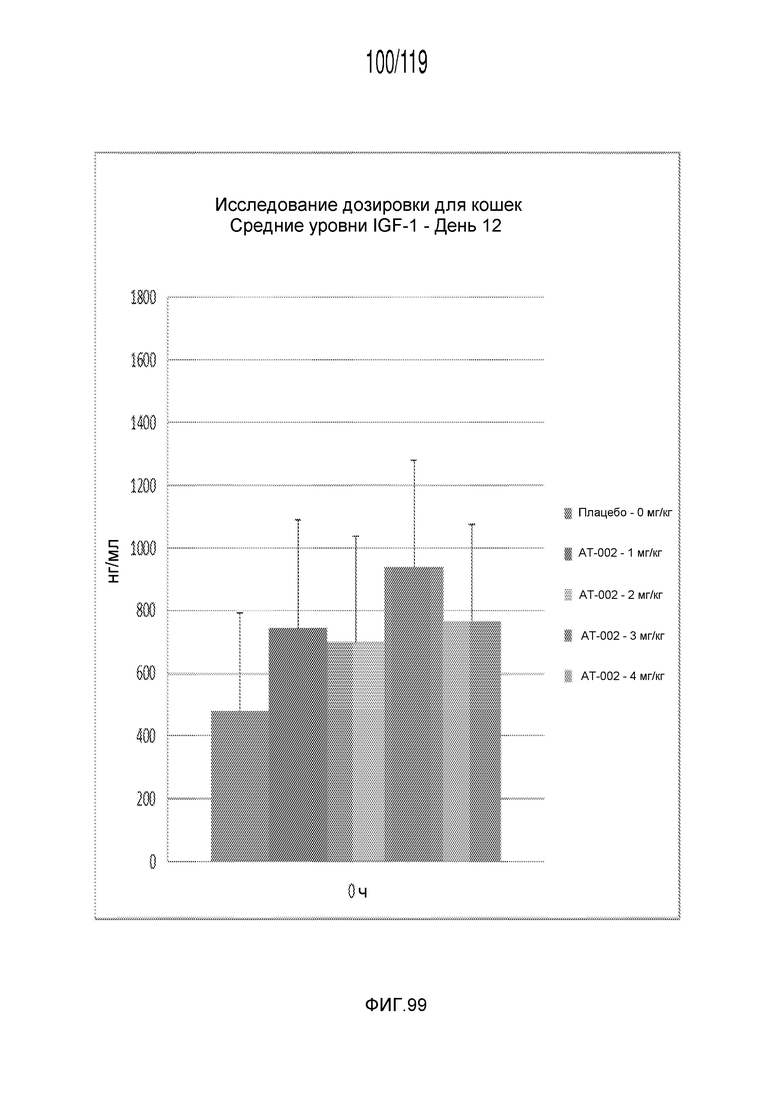
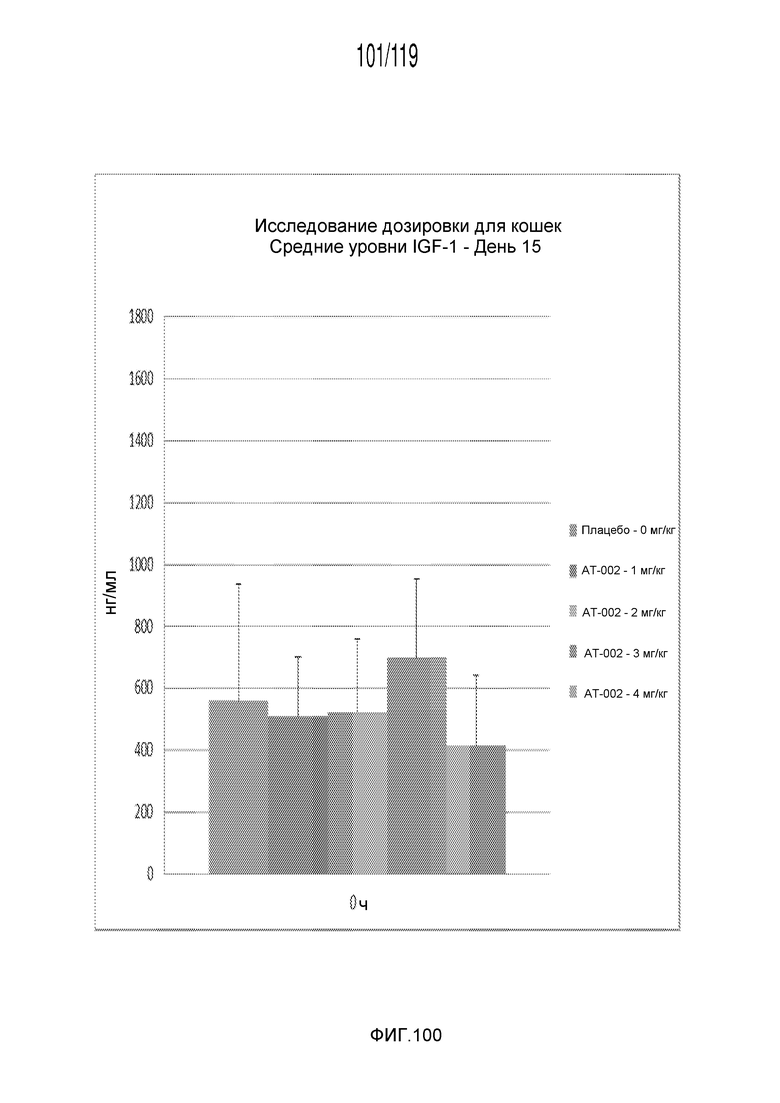
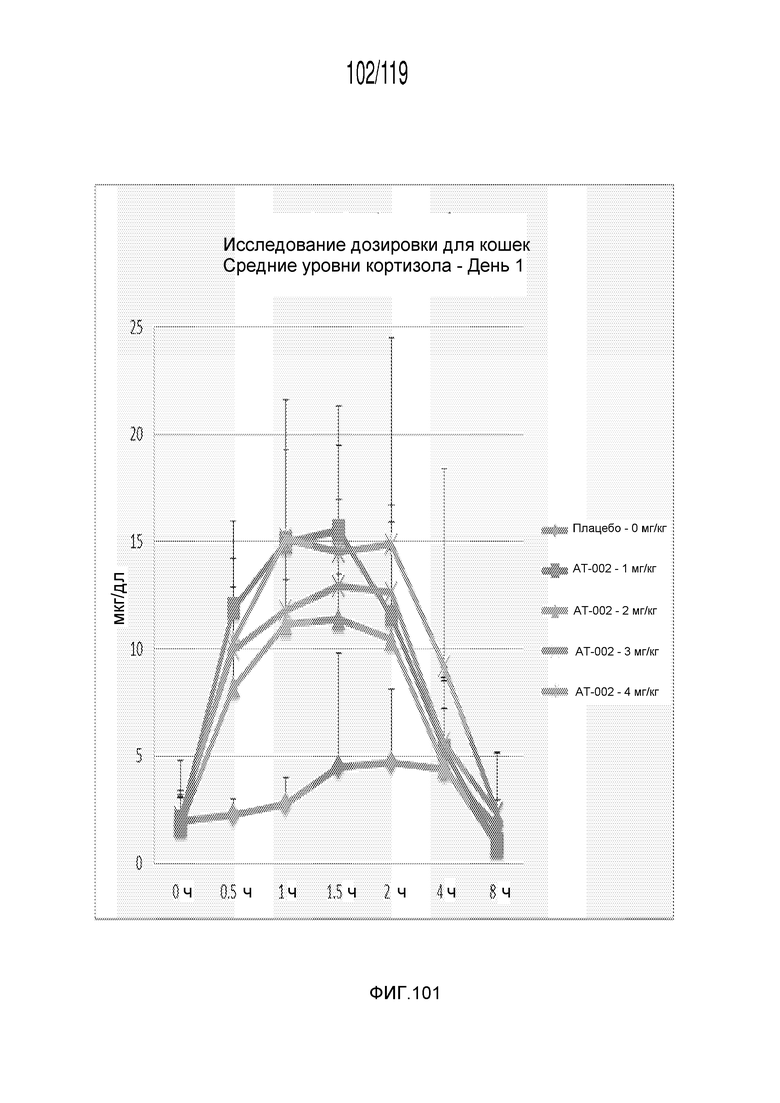
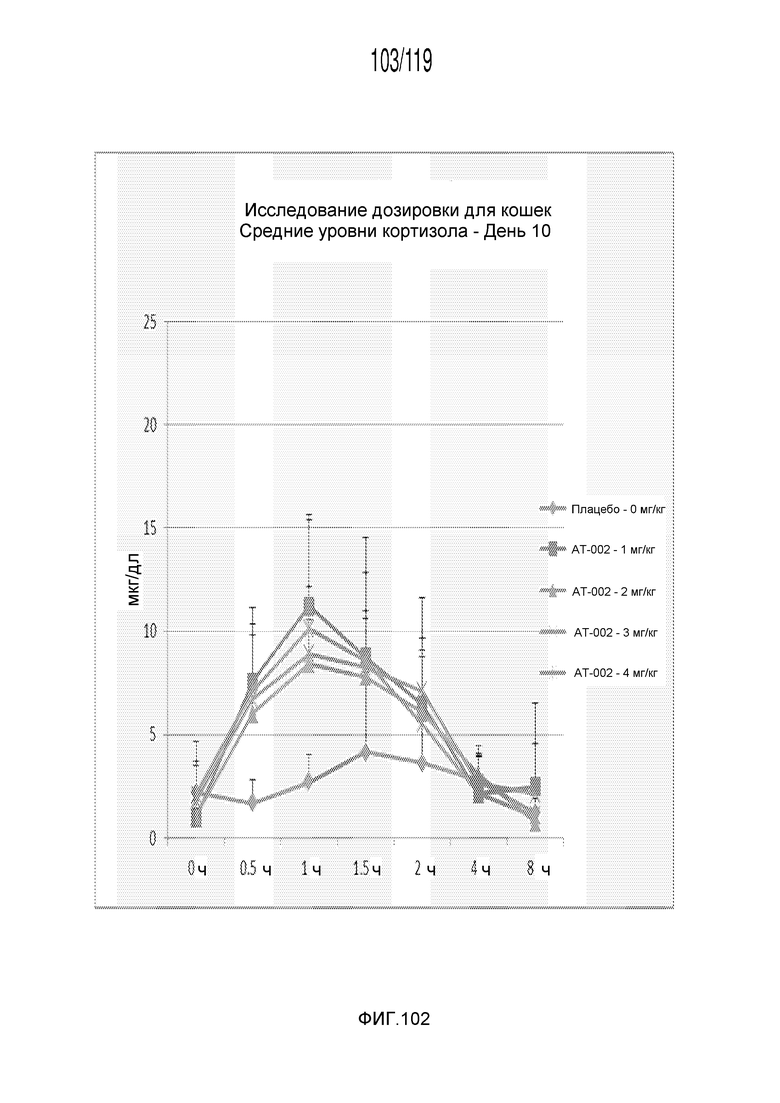
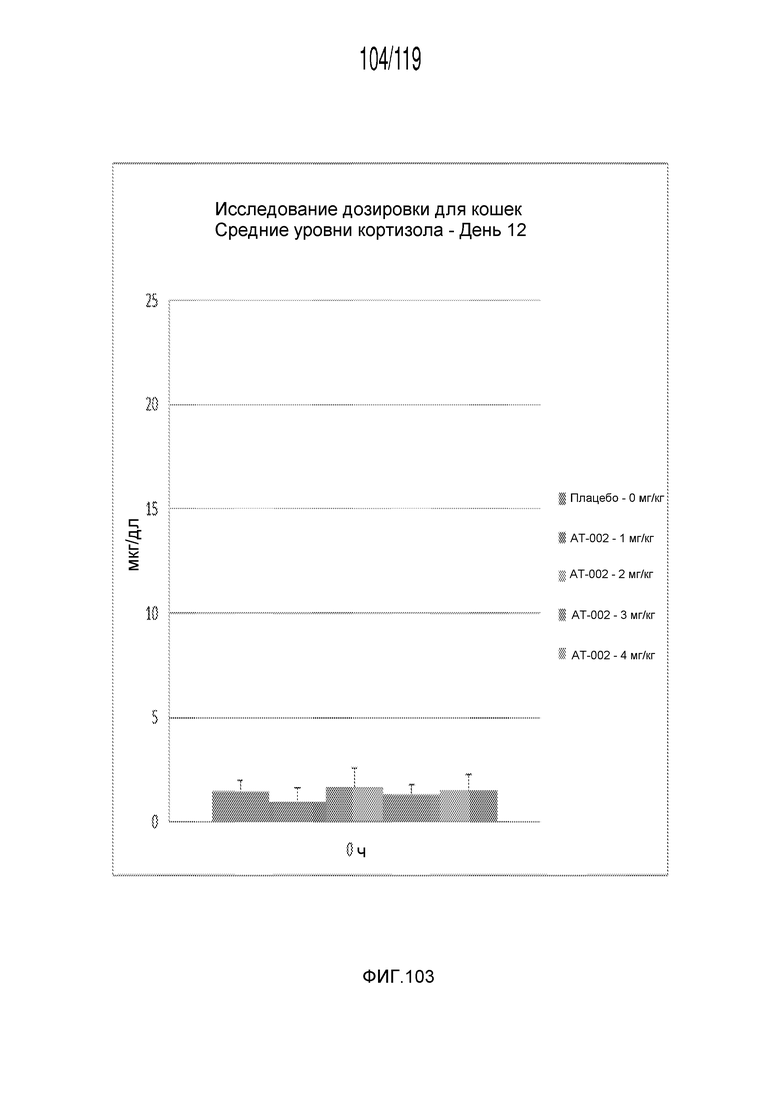
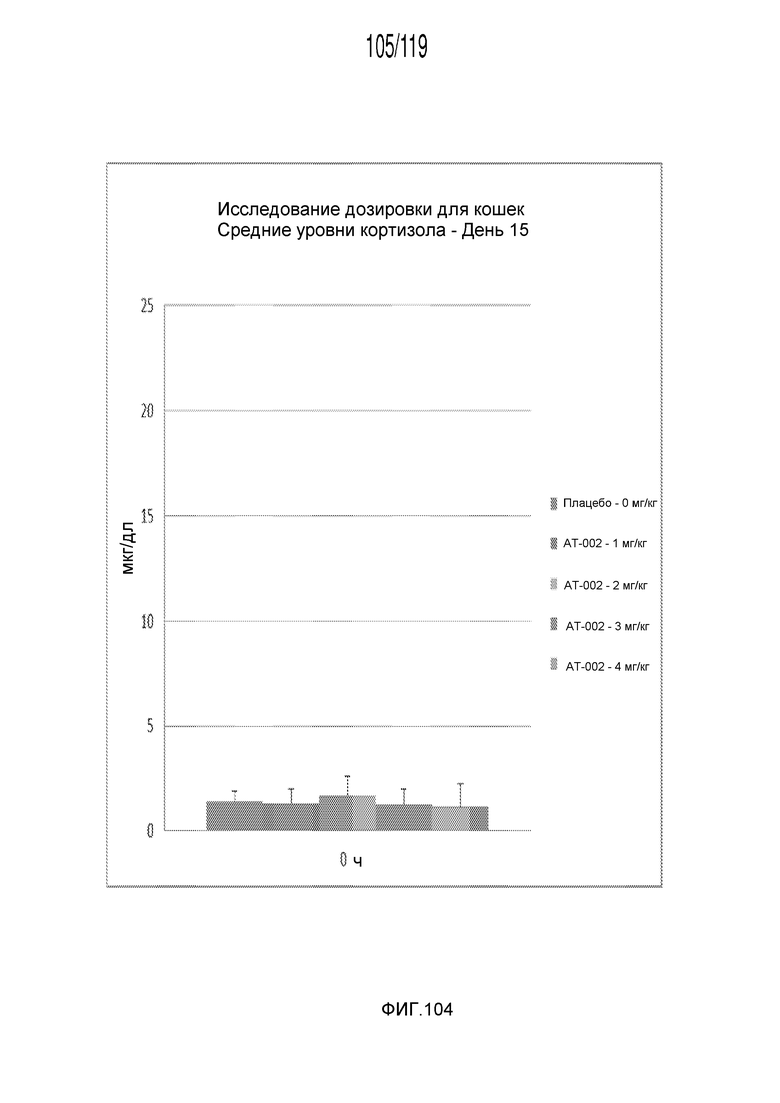
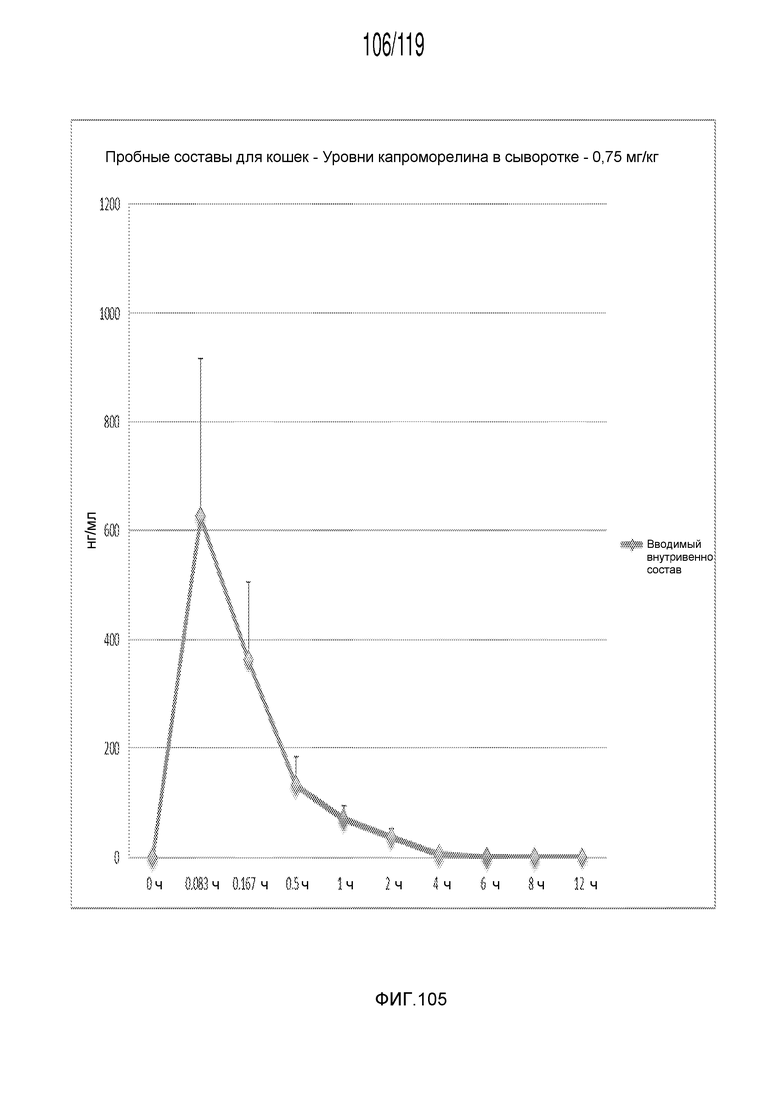
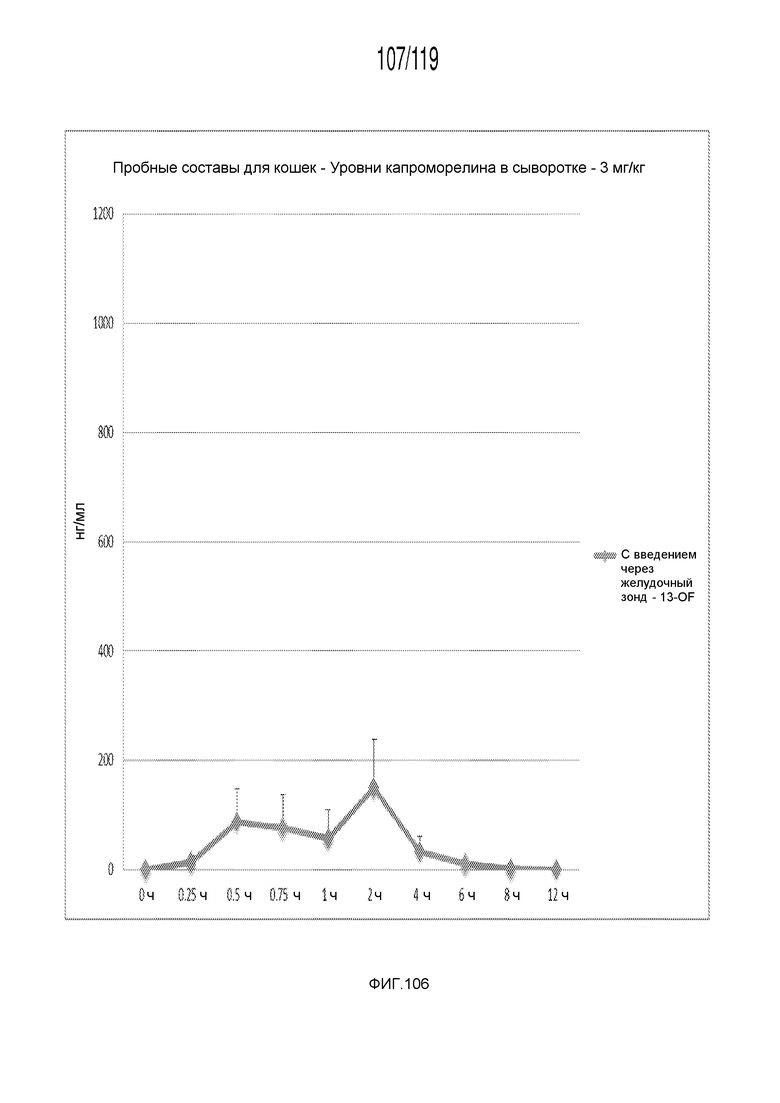
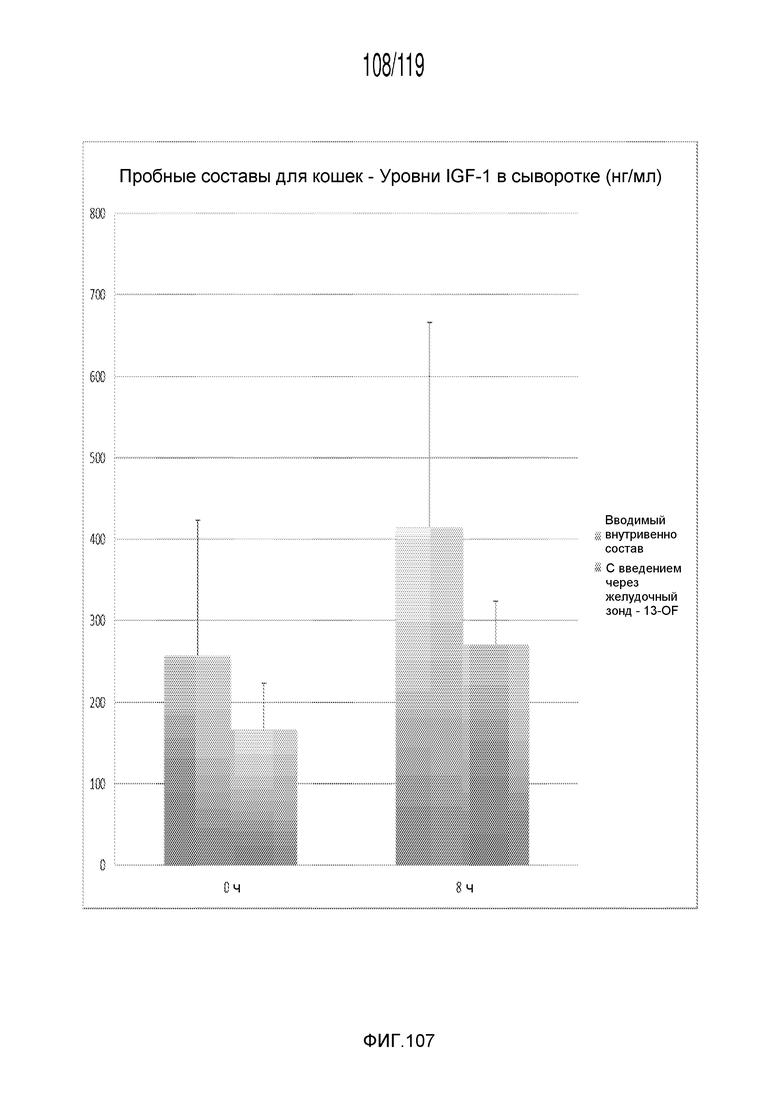
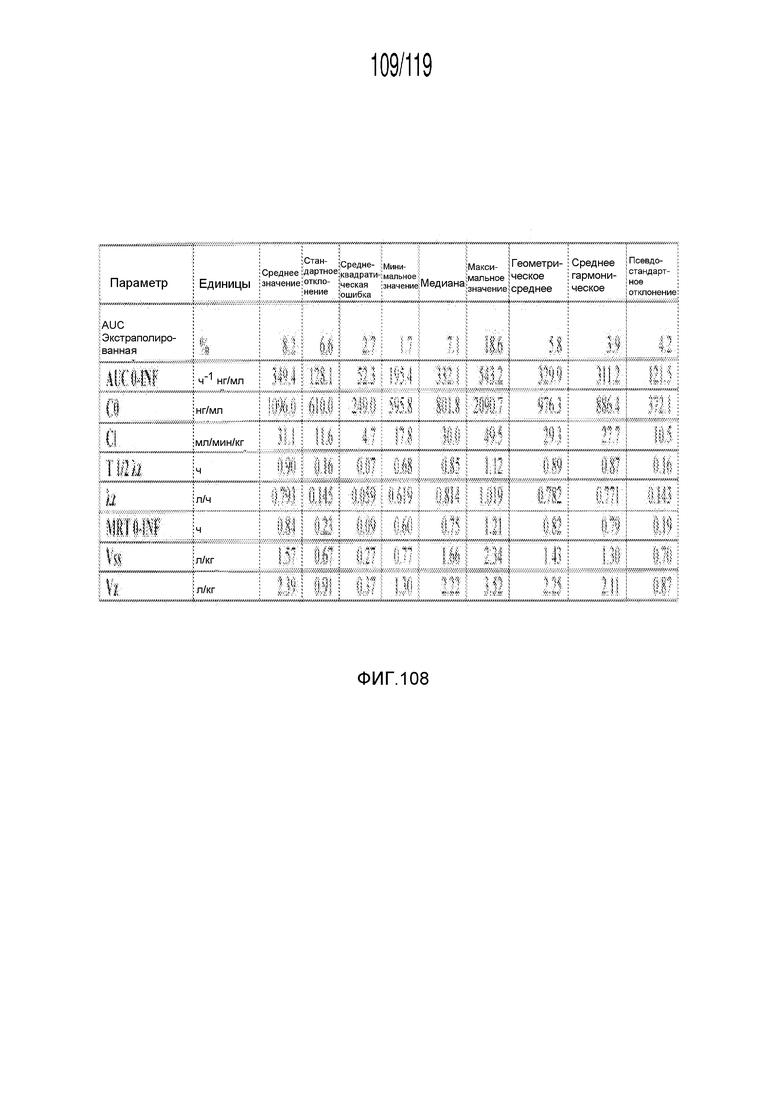
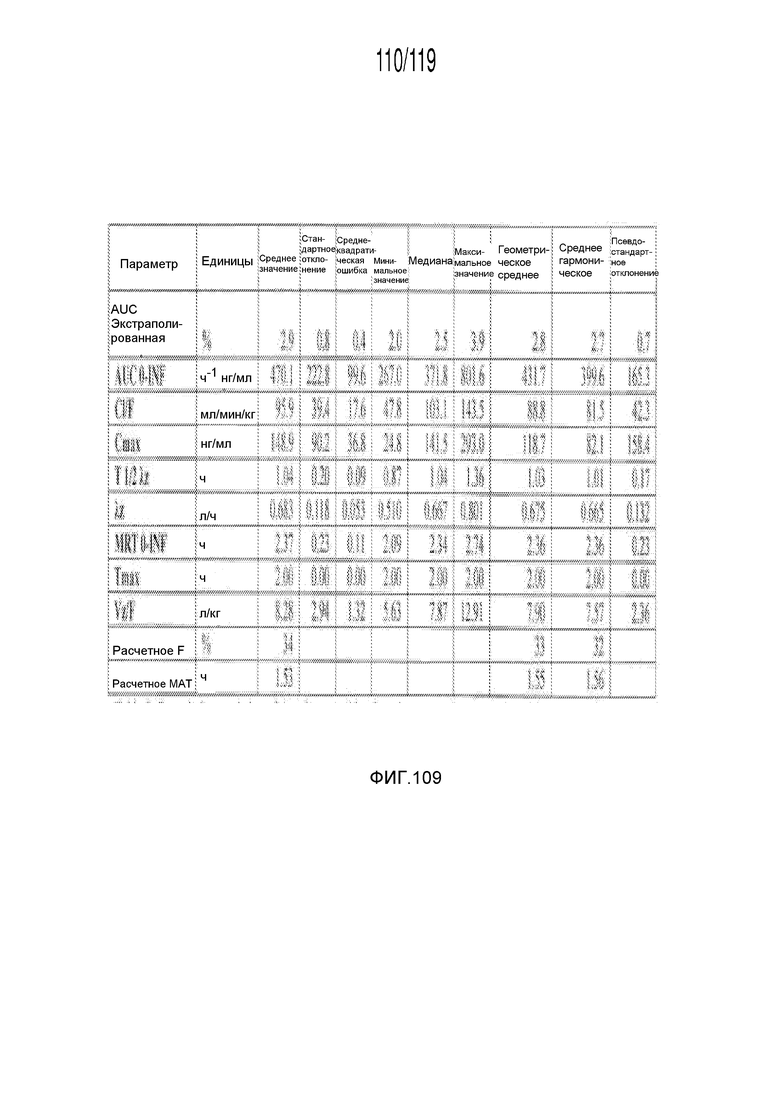
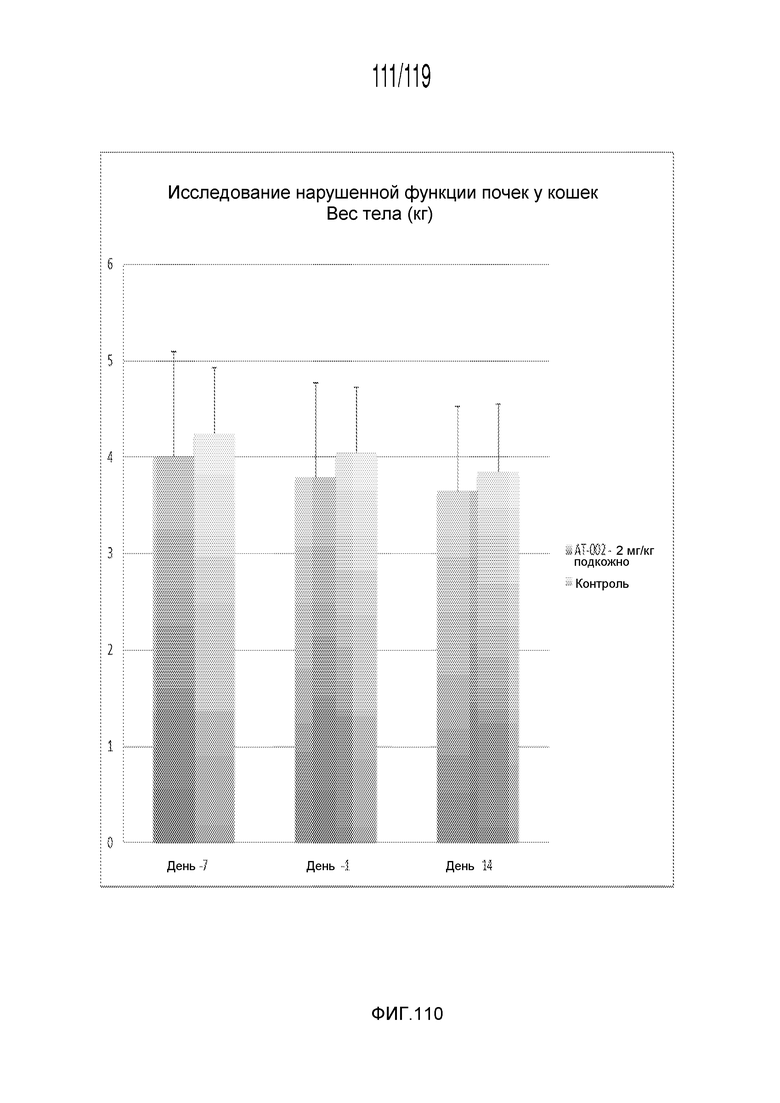
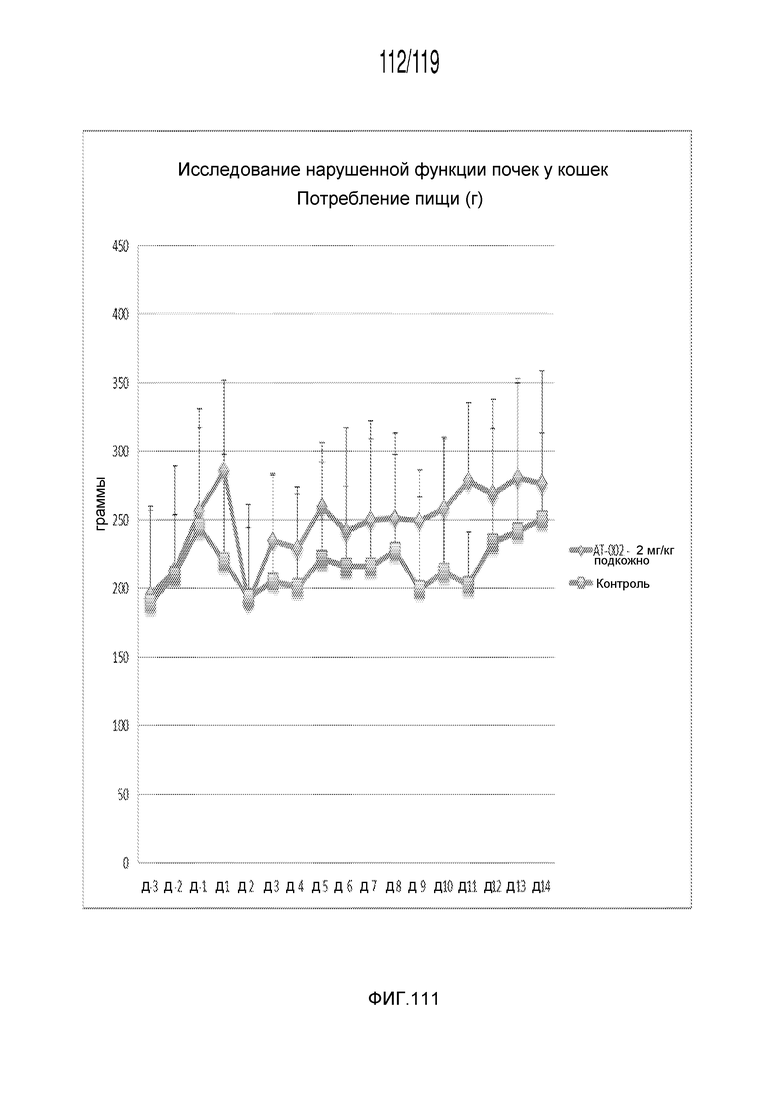
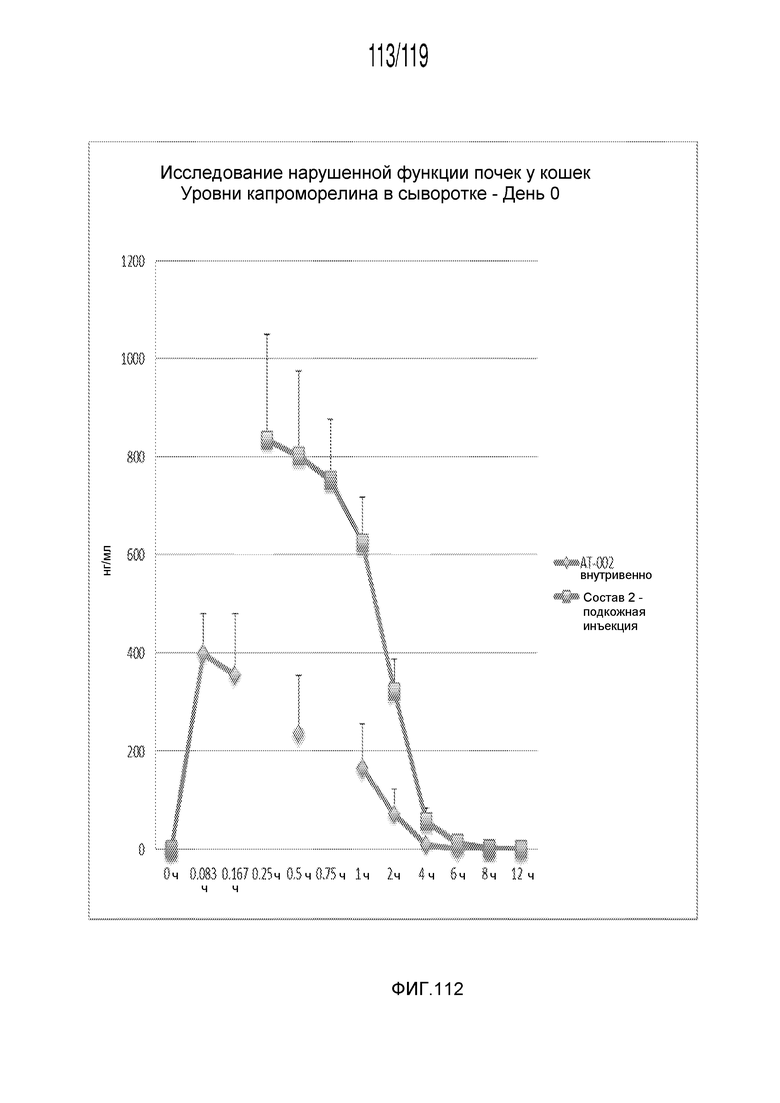
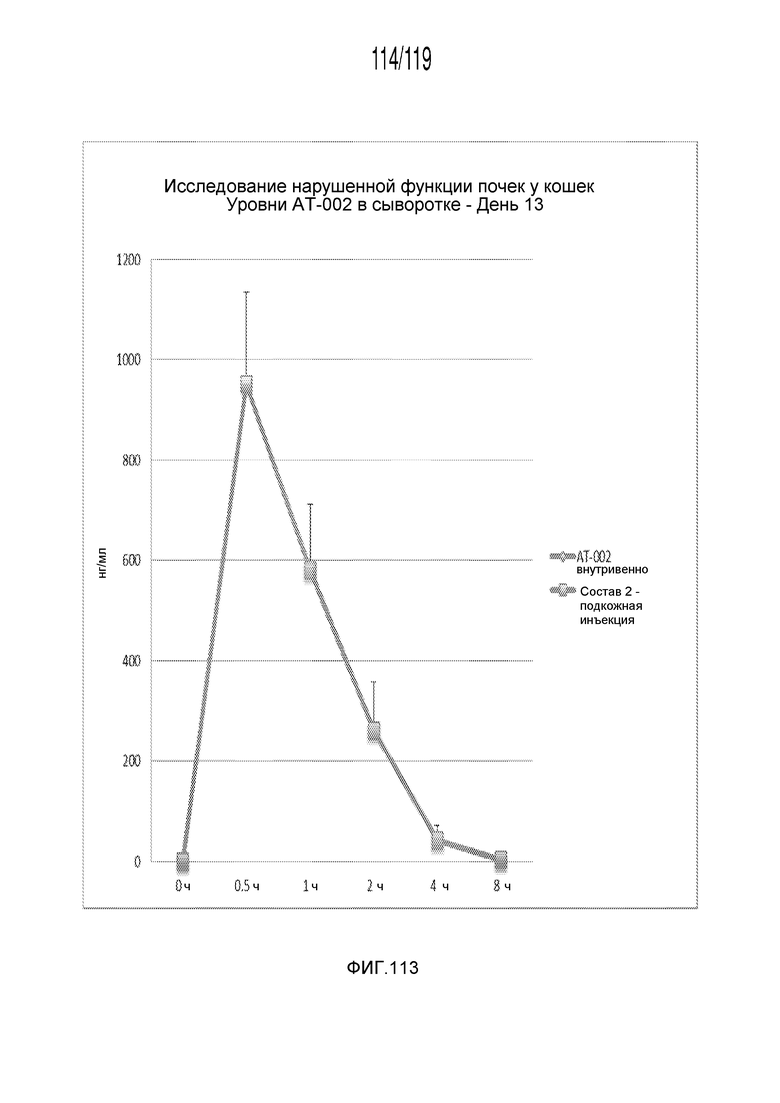
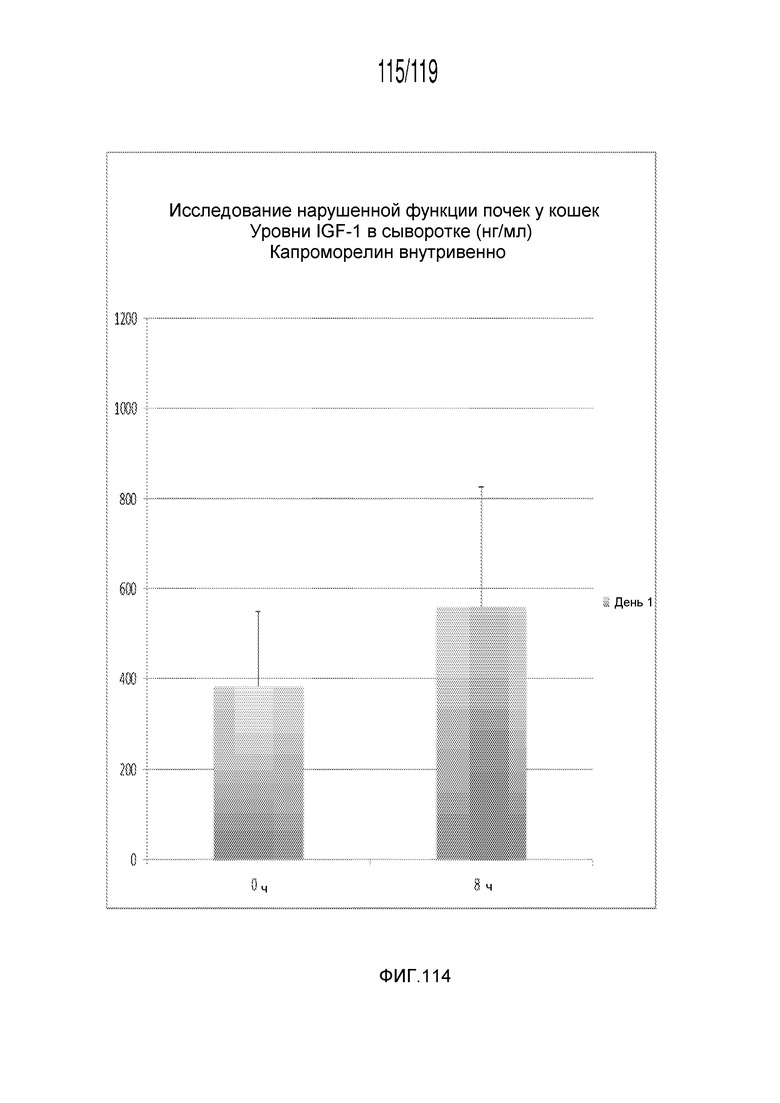
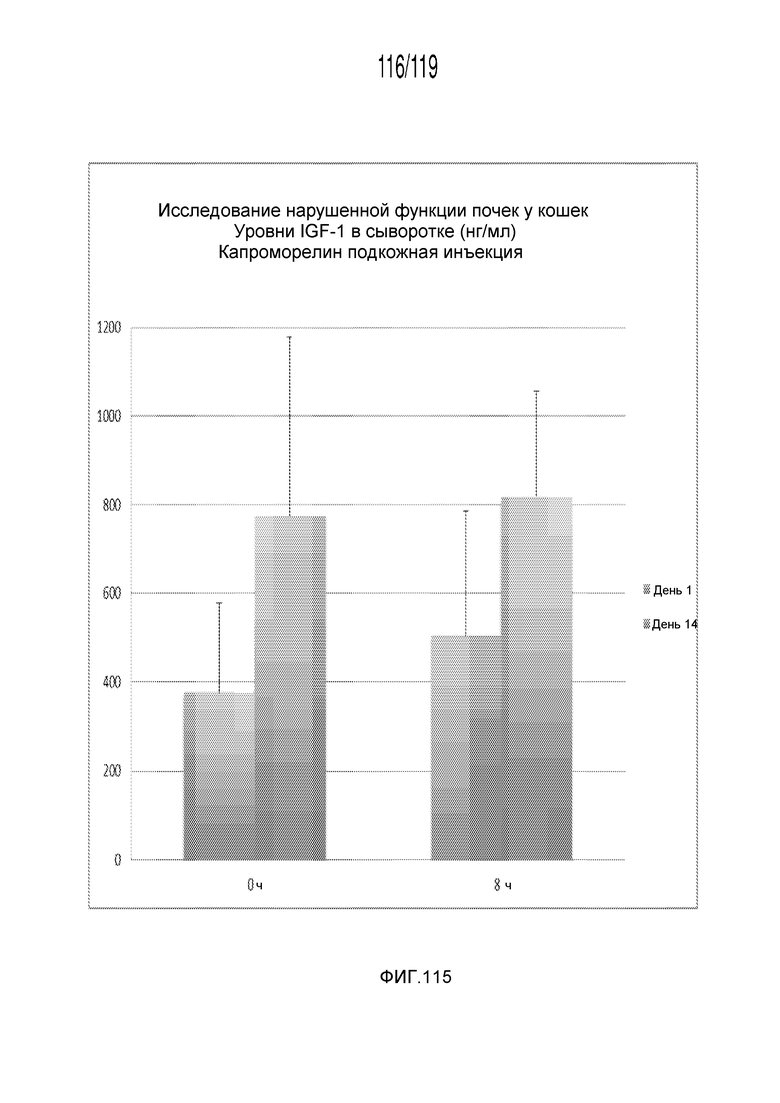
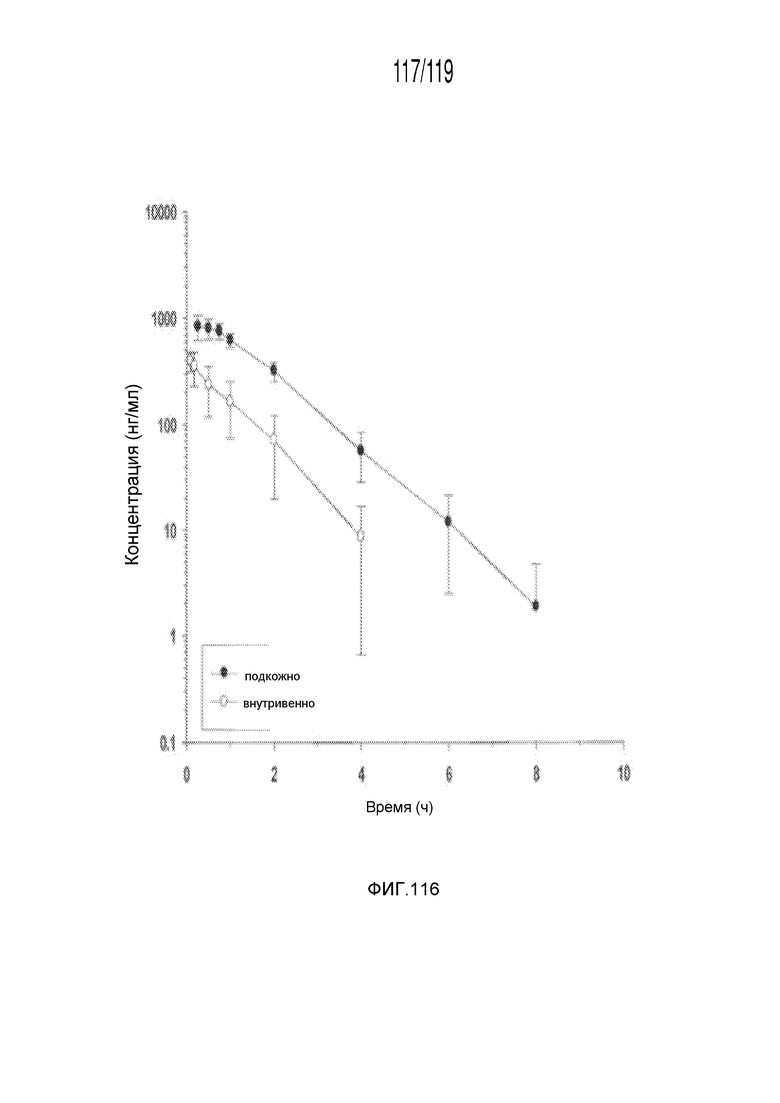
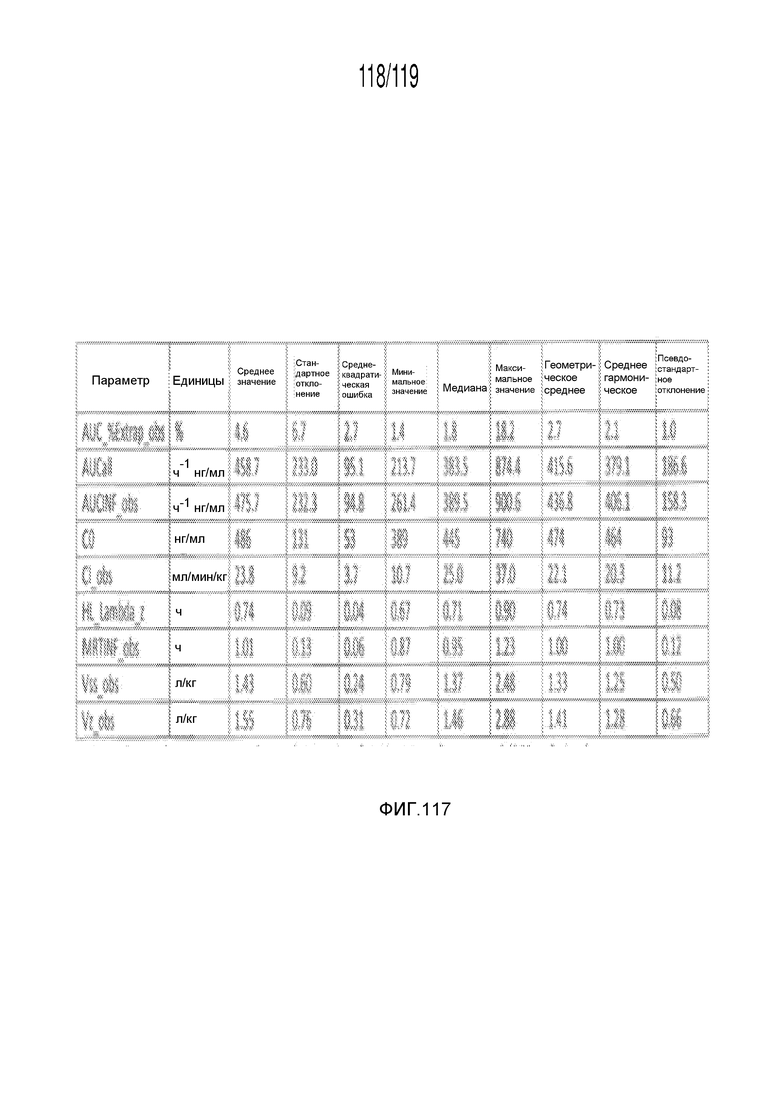
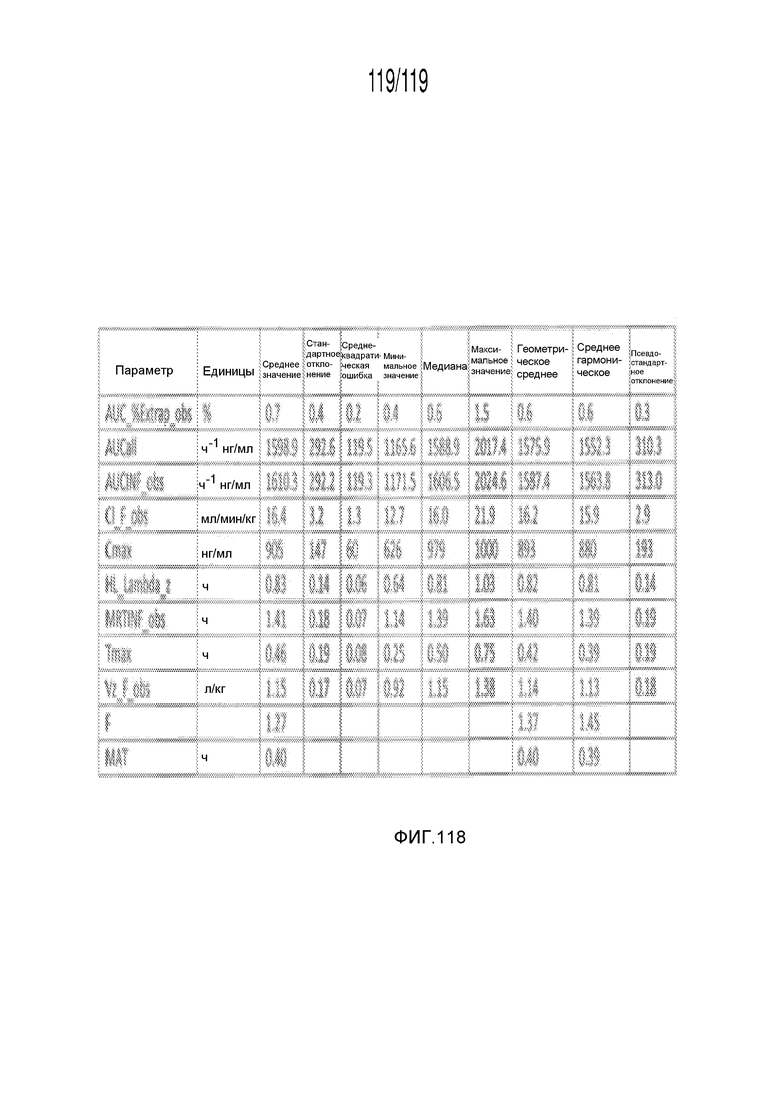
Группа изобретений относится к фармацевтической композиции и способам ее применения для борьбы с отсутствием аппетита у животных, страдающих отсутствием аппетита или другими болезнями или нарушениями, которые вызывают потерю веса. Способ лечения отсутствия аппетита у животного включает введение композиции, содержащей капроморелин в количестве приблизительно от 1 мг до 5 мг на килограмм веса тела животного, по меньшей мере, один раз в день. Также раскрыты пероральная композиция и набор для лечения отсутствия аппетита, способы увеличения сухой мышечной массы у животного или скота, способы связывания рецепторов стимулятора секреции гормона роста с капроморелином в гипоталамусе животного, способ лечения и профилактики липидоза печени и способ сохранения потребления пищи животным. Группа изобретений позволяет увеличить потребление пищи животным по меньшей мере на 50% по сравнению с потреблением пищи до введения, а также увеличить вес тела животного за счет сухой мышечной массы по меньшей мере на 5% по сравнению с весом тела животного до введения. 11 н. и 67 з.п. ф-лы, 119 ил., 13 пр., 10 табл.
1. Способ лечения отсутствия аппетита у животного-компаньона, где способ включает введение терапевтически эффективного количества содержащей капроморелин композиции, которая содержит приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного-компаньона, по меньшей мере один раз в день;
где капроморелин связывается с рецепторами стимулятора секреции гормона роста (GHS-R) в гипоталамусе животного-компаньона и это связывание стимулирует голод у животного-компаньона независимо от высвобождения гормона роста;
где потребление пищи животным-компаньоном увеличивается по меньшей мере на 50% по сравнению с потреблением пищи до введения и
где вес тела животного-компаньона увеличивается по меньшей мере на 5% за счет сухой мышечной массы по сравнению с весом тела животного-компаньона до введения.
2. Способ по п.1, где терапевтически эффективное количество содержащей капроморелин композиции вводят перорально животному-компаньону.
3. Способ по п.1, где терапевтически эффективное количество содержащей капроморелин композиции включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нг капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам.
4. Способ по п.2, где содержащая капроморелин композиция дополнительно содержит подсластитель, который выбирают из группы, состоящей из Тауматина T200X, ребаудиозида А стевии, MagnaSweet®, сукралозы, Talin-Pure, OptisweetSD, содержащей ваниль композиции и их комбинаций.
5. Способ по п.1, где терапевтически эффективное количество содержащей капроморелин композиции вводят, используя лекарственную форму, выбираемую из группы, состоящей из аэрозоля, перорального раствора, пилюли, таблетки, имплантата, пластыря, внутривенного раствора, внутримышечного раствора, подкожного раствора, внутрибрюшинного раствора и пленки.
6. Способ по п.1, где терапевтически эффективное количество содержащей капроморелин композиции вводят внутривенно животному-компаньону по меньшей мере дважды в день.
7. Способ по п.1, где терапевтически эффективное количество вводят на протяжении периода лечения, составляющего по меньшей мере одну неделю.
8. Способ по п.7, где терапевтически эффективное количество вводят на протяжении периода лечения, составляющего по меньшей мере две недели.
9. Способ по п.8, где терапевтически эффективное количество содержащей капроморелин композиции вводят на протяжении периода лечения, составляющего по меньшей мере один месяц.
10. Способ по п.1, где концентрация капроморелина в содержащей капроморелин композиции составляет от приблизительно 3 мг до приблизительно 4,5 мг капроморелина на килограмм веса тела животного-компаньона.
11. Способ по п.1, где животным-компаньоном является кошка.
12. Способ по п.1, где животным-компаньоном является собака.
13. Способ по п.1, где животным-компаньоном является лошадь.
14. Способ по п.1, где терапевтически эффективную дозу содержащей капроморелин композиции вводят с химиотерапевтической схемой.
15. Способ по п.1, где содержащая капроморелин композиция находится в пероральной жидкой лекарственной форме.
16. Способ по п.15, где пероральную жидкую лекарственную форму или распыляют на пищевой продукт, или вводят с использованием шприца.
17. Способ по п.1, где содержащую капроморелин композицию включают в пищевой продукт, лакомство или леденец.
18. Способ по п.1, где сухая мышечная масса у животного-компаньона увеличивается на по меньшей мере 10%.
19. Способ по п.1, где животное-компаньон увеличивает потребление пищи на по меньшей мере 85% по сравнению с потреблением пищи до введения.
20. Способ увеличения сухой мышечной массы и лечения отсутствия аппетита у животного, не являющегося человеком, где способ включает пероральное введение терапевтически эффективной дозы пероральной содержащей капроморелин композиции животному, не являющемуся человеком, которая включает приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного, не являющегося человеком, по меньшей мере один раз в день;
где капроморелин связывается с рецепторами стимулятора секреции гормона роста (GHS-R) в гипоталамусе животного, не являющегося человеком, и это связывание стимулирует голод у животного, не являющегося человеком, независимо от высвобождения гормона роста;
где потребление пищи животным, не являющимся человеком, увеличивается по меньшей мере на 50% по сравнению с потреблением пищи до введения и
где вес тела животного, не являющегося человеком, увеличивается по меньшей мере на 5% за счет сухой мышечной массы по сравнению с весом тела животного, не являющегося человеком, до введения.
21. Способ по п.20, где терапевтически эффективная доза содержащей капроморелин композиции состоит из количества капроморелина, достаточного для достижения Cmax, составляющей приблизительно 150 нанограмм капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам.
22. Способ по п.20, где сухая мышечная масса увеличивается на по меньшей мере 10% после введения содержащей капроморелин пероральной композиции животному, не являющемуся человеком.
23. Способ по п.20, где терапевтически эффективную дозу содержащей капроморелин пероральной композиции вводят с химиотерапевтической схемой.
24. Способ по п.20, где животное, не являющееся человеком, выбирают из группы, состоящей из собаки, кошки и лошади.
25. Способ по п.20, где потребление пищи животным, не являющимся человеком, увеличивается на по меньшей мере 85% по сравнению с потреблением пищи до введения.
26. Способ по п.20, где содержащая капроморелин пероральная композиция дополнительно содержит подсластитель, выбранный из группы, состоящей из Тауматина T200X, ребаудиозида А стевии, MagnaSweet®, сукралозы, Talin-Pure, OptisweetSD и содержащей ваниль композиции.
27. Способ по п.20, где содержащая капроморелин пероральная композиция, кроме того, включает по меньшей мере один эмульгатор.
28. Способ по п.20, где лекарственную форму для перорального введения содержащей капроморелин композиции выбирают из группы, состоящей из пилюли, имплантата, аэрозоля, раствора для перорального введения, таблетки и пленки.
29. Способ по п.20, где содержащую капроморелин композицию вводят по меньшей мере дважды в день.
30. Способ по п.20, где содержащую капроморелин композицию вводят в течение по меньшей мере одной недели.
31. Способ по п.30, где содержащую капроморелин композицию вводят в течение по меньшей мере двух недель.
32. Способ связывания рецепторов стимулятора секреции гормона роста (GHS-R) с капроморелином в гипоталамусе животного, не являющегося человеком, для лечения вызванной отсутствием аппетита потери веса у животного, не являющегося человеком, где способ включает:
диагностирование у животного, не являющегося человеком, наличия вызванной отсутствием аппетита потери веса,
пероральное введение по меньшей мере одной дозы содержащей капроморелин пероральной композиции животному, не являющемуся человеком, при этом доза включает приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного, не являющегося человеком, по меньшей мере один раз в день, таким образом, что связывание стимулирует голод у животного-компаньона независимо от высвобождения гормона роста; и
слежение за по меньшей мере одним показателем или маркером в плазме у животного, не являющегося человеком.
33. Способ по п.32, дополнительно включающий стадию введения дополнительных доз содержащей капроморелин композиции животному, не являющемуся человеком, до момента времени, когда показатель или маркер в плазме или увеличится, или уменьшится в ответ на дозу капроморелина.
34. Способ по п.32, где по меньшей мере один маркер в плазме выбирают из группы, состоящей из инсулиноподобного фактора-1 роста, кортизола, веса тела животного, не являющегося человеком, и капроморелина.
35. Способ по п.34, где инсулиноподобный фактор-1 роста, кортизол и капроморелин увеличиваются у животного, получающего содержащую капроморелин пероральную композицию.
36. Способ по п.32, где показатель выбирают из группы, состоящей из величины потребления пищи, увеличения веса, потери веса и увеличения сухой мышечной массы.
37. Способ по п.36, в котором показателем является потеря веса и содержащую капроморелин композицию вводят до прибавления у животного достаточной величины веса.
38. Способ по п.32, где по меньшей мере одна доза содержащей капроморелин пероральной композиции включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нг капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам.
39. Способ по п.32, где по меньшей мере две дозы в день содержащей капроморелин пероральной композиции вводят перорально животному, не являющемуся человеком.
40. Способ по п.32, где содержащую капроморелин пероральную композицию вводят в течение по меньшей мере одной недели.
41. Способ по п.40, где содержащую капроморелин пероральную композицию вводят в течение по меньшей мере двух недель.
42. Способ по п.32, где содержащая капроморелин пероральная композиция дополнительно содержит подсластитель, который выбирают из группы, состоящей из Тауматина T200X, ребаудиозида А стевии, MagnaSweet®, сукралозы, Talin-Pure, OptisweetSD, содержащей ваниль композиции и их комбинаций.
43. Способ связывания рецепторов стимулятора секреции гормона роста (GHS-R) с капроморелином в гипоталамусе животного-компаньона для лечения потери веса, где способ включает:
определение того, что у животного-компаньона наблюдается потеря веса,
пероральное введение по меньшей мере одной дозы содержащей капроморелин пероральной композиции животному-компаньону, используя шприц, при этом доза включает приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного-компаньона, по меньшей мере один раз в день, таким образом, что связывание стимулирует голод у животного-компаньона независимо от высвобождения гормона роста; и
оценку одного или более маркеров в плазме или показателей у животного-компаньона.
44. Способ по п.43, где один или более маркеров у животного-компаньона выбирают из группы, состоящей из изменения веса животного-компаньона, изменения потребления пищи животным-компаньоном и изменения сухой мышечной массы.
45. Способ по п.43, дополнительно включающий стадию введения дополнительных доз содержащей капроморелин композиции животному-компаньону до момента времени, когда показатель или маркер в плазме не будет находиться на соответствующем уровне.
46. Способ по п.43, в котором показателем является потеря веса и содержащую капроморелин пероральную композицию вводят до прибавления у животного-компаньона достаточной величины веса.
47. Способ по п.43, где по меньшей мере две дозы в день содержащей капроморелин пероральной композиции вводят животному-компаньону.
48. Способ по п.43, где один или более маркеров в плазме выбирают из группы, состоящей из инсулиноподобного фактора-1 роста, кортизола и капроморелина.
49. Способ по п.43, где оценка одного или более маркеров в плазме включает определение минимального количества маркера в кровотоке животного.
50. Способ по п.43, дополнительно включающий стадию увеличения или уменьшения дозы капроморелина с учетом минимального количества маркера в плазме в кровотоке животного-компаньона.
51. Способ по п.43, где оценка одного или более маркеров в плазме или показателей происходит по меньшей мере один раз в первую неделю после перорального введения содержащей капроморелин пероральной композиции.
52. Способ по п.43, где содержащая капроморелин пероральная композиция дополнительно содержит подсластитель, который выбирают из группы, состоящей из Тауматина T200X, ребаудиозида А стевии, MagnaSweet®, сукралозы, Talin-Pure, OptisweetSD, содержащей ваниль композиции и их комбинаций.
53. Пероральная фармацевтическая композиция для лечения отсутствия аппетита у животного, не являющегося человеком, где композиция включает:
терапевтически эффективное количество капроморелина, которое включает приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного-компаньона по меньшей мере один раз в день; и
по меньшей мере один носитель;
где после введения композиции капроморелин связывается с рецепторами стимулятора секреции гормона роста (GHS-R) в гипоталамусе и стимулирует голод у животного, не являющегося человеком, независимо от высвобождения гормона роста;
где потребление пищи животным, не являющимся человеком, увеличивается по меньшей мере на 50% по сравнению с потреблением пищи до введения,
где вес тела животного-компаньона увеличивается по меньшей мере на 5% за счет сухой мышечной массы по сравнению с весом тела животного-компаньона до введения композиции, и
где композиция включает количество капроморелина, достаточное для достижения Cmax, составляющей приблизительно 150 нг капроморелина или его метаболита на миллилитр плазмы, в Tmax, равный приблизительно двум часам.
54. Пероральная фармацевтическая композиция по п.53, дополнительно включающая компонент, выбранный из группы, состоящей из эмульгатора или загустителя.
55. Пероральная фармацевтическая композиция по п.53, дополнительно содержащая подсластитель, выбранный из группы, состоящей из Тауматина T200X, ребаудиозида А стевии, MagnaSweet®, сукралозы, Talin-Pure, OptisweetSD, содержащей ваниль композиции и их комбинаций.
56. Пероральная фармацевтическая композиция по п.53, где фармацевтическая композиция содержится в шприце.
57. Пероральная фармацевтическая композиция по п.53, в растворе или суспензии.
58. Пероральная фармацевтическая композиция по п.53, где носитель включает физиологический раствор.
59. Пероральная фармацевтическая композиция по п.53, приготовленная в виде по меньшей мере одного из следующего: пленка, пластырь, аэрозоль, имплантат и суппозиторий.
60. Способ связывания рецепторов стимулятора секреции гормона роста (GHS-R) с капроморелином в гипоталамусе животного-компаньона для лечения отсутствия аппетита, где связывание стимулирует голод у животного-компаньона независимо от высвобождения гормона роста, где способ включает:
пероральное введение пероральной фармацевтической композиции, содержащей капроморелин, животному-компаньону, используя шприц, при этом фармацевтическая композиция включает приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного-компаньона, по меньшей мере один раз в день, и
определение эффективности фармацевтической композиции посредством слежения за одним или более маркерами в плазме или показателями у животного-компаньона.
61. Способ по п.60, где один или более показателей выбирают из группы, состоящей из изменения веса тела животного-компаньона и изменения потребления пищи животным-компаньоном.
62. Способ лечения или профилактики липидоза печени у животного-компаньона, включающий стадии перорального введения терапевтически эффективного количества содержащей капроморелин композиции животному-компаньону, при этом терапевтически эффективное количество капроморелина включает концентрацию приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного-компаньона.
63. Способ по п.62, где животным-компаньоном является кошка.
64. Способ по п.62, где содержащую капроморелин пероральную композицию вводят животному-компаньону по меньшей мере два раза в день.
65. Способ по п.62, где содержащая капроморелин пероральная композиция включает капроморелин в концентрации от приблизительно 2 мг до приблизительно 4 мг на килограмм веса тела животного-компаньона.
66. Набор, используемый для связывания рецепторов стимулятора секреции гормона роста (GHS-R) с капроморелином в гипоталамусе животного, не являющегося человеком, для лечения отсутствия аппетита, где связывание стимулирует голод у животного, не являющегося человеком, независимо от высвобождения гормона роста, при этом набор включает:
шприц,
сосуд, содержащий фармацевтический состав, включающий содержащую капроморелин композицию, и
инструкции, которые информируют пользователя о заборе приблизительно одной дозы фармацевтического состава из сосуда с помощью шприца и введении фармацевтической композиции животному, не являющемуся человеком, с помощью шприца.
67. Набор по п.66, где фармацевтический состав приготовлен для перорального введения.
68. Способ связывания рецепторов стимулятора секреции гормона роста (GHS-R) с капроморелином в гипоталамусе животного-компаньона для сохранения веса, где способ включает пероральное введение некоторого количества содержащей капроморелин пероральной композиции и подсластителя животному-компаньону, которое сохраняет вес тела животного-компаньона,
при этом эффективное количество капроморелина включает концентрацию приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного-компаньона по меньшей мере один раз в день; и
при этом подсластитель выбирают из группы, состоящей из тауматина, мальтодекстрина, ребаудиозида А стевии, глицирризиновой кислоты, моноаммония глицирризината, сукралозы, сахарина натрия, неогесперидина дигидрохалкона, содержащей ваниль композиции и их комбинаций.
69. Способ увеличения сухой мышечной массы у скота, где способ включает пероральное введение содержащей капроморелин композиции нуждающемуся в этом скоту,
при этом количество капроморелина в содержащей капроморелин пероральной композиции включает концентрацию приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела скота по меньшей мере один раз в день,
где капроморелин связывается с рецепторами стимулятора секреции гормона роста (GHS-R) в гипоталамусе и стимулирует голод у скота независимо от высвобождения гормона роста;
где потребление пищи скотом увеличивается по меньшей мере на 50% по сравнению с потреблением пищи до введения, и
где вес тела скота увеличивается по меньшей мере на 5% за счет сухой мышечной массы по сравнению с весом тела скота до введения композиции.
70. Способ по п.69, где содержащая капроморелин пероральная композиция, кроме того, включает подсластитель, выбранный из группы, состоящей из Тауматина T200X, ребаудиозида А стевии, MagnaSweet®, сукралозы, Talin-Pure, OptisweetSD, содержащей ваниль композиции и их комбинаций.
71. Способ по п.70, где содержащую капроморелин композицию смешивают с кормом.
72. Способ по п.71, где содержащую капроморелин композицию вводят по меньшей мере дважды в день.
73. Способ по п.71, где сухая мышечная масса у скота увеличивается на по меньшей мере 10%.
74. Способ по п.71, где содержащую капроморелин композицию вводят в течение по меньшей мере одной недели.
75. Способ по п.74, где содержащую капроморелин композицию вводят в течение по меньшей мере двух недель.
76. Способ по п.71, где скот выбирают из группы, состоящей из коров различных видов, овец различных видов, свиней различных видов, птиц различных видов и животных, используемых в качестве источника пищи.
77. Способ сохранения потребления пищи животным, не являющимся человеком, при этом способ включает:
получение жидкого состава содержащей капроморелин композиции, включающей капроморелин и подсластитель;
распыление жидкого состава на пищевой продукт и
кормление пищевым продуктом животного, не являющегося человеком,
при этом капроморелин в содержащей капроморелин пероральной композиции содержится в концентрации приблизительно от 1 мг до 5 мг капроморелина на килограмм веса тела животного, не являющегося человеком, по меньшей мере один раз в день; и
где подсластитель выбран из группы, состоящей из Тауматина T200X, ребаудиозида А стевии, MagnaSweet®, сукралозы, Talin-Pure, OptisweetSD, содержащей ваниль композиции и их комбинаций;
где капроморелин связывается с рецепторами стимулятора секреции гормона роста (GHS-R) в гипоталамусе и стимулирует голод у животного, не являющегося человеком, независимо от высвобождения гормона роста;
где потребление пищи животным, не являющимся человеком, увеличивается по меньшей мере на 50% по сравнению с потреблением пищи до введения, и
где вес тела животного, не являющегося человеком, увеличивается по меньшей мере на 5% за счет сухой мышечной массы по сравнению с весом тела животного, не являющегося человеком, до введения композиции.
78. Способ по п.77, где способ позволяет животному, не являющемуся человеком, потреблять такое количество пищи, которое поддерживает вес животного.
| US 20090170757 A1, 02.07.2009 | |||
| US 20120095057 A1, 19.04.2012 | |||
| CARPINO A.P | |||
| et al | |||
| Pyrazolinone-piperidine Dipeptide Growth Hormone Secretagogues (GHSs): Discovery of Capromoreline / Bioorganic & Medicainal Chemistry, 2003, V.11, pp.581-590 | |||
| HERSH C.E | |||
| et al | |||
| Growth hormone (GH)-releasing hormone and GH secretagogues in normal aging: Fountain of Youth or Pool of Tantalus? / Clinical Interventions in Aging, 2008, V.3, pp.121-129 | |||
| US 20120202759 A1, 09.08.2012 | |||
| US 20080300194 А1, 04.12.2008 | |||
| US 20020086865 A1, 04.07.2002 | |||
| АНАЛОГИ ГРЕЛИНА С ЗАМЕЩЕНИЕМ НА N-КОНЦЕ | 2007 |
|
RU2459831C2 |
| RU 2009115711 A, 10.11.2010 | |||
| RU 2007129408 A, 10.02.2009 | |||
| RU 2010111849 А, 10.10.2011. | |||
Авторы
Даты
2018-03-28—Публикация
2013-09-27—Подача