ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Цитомегаловирус человека (HCMV), β-герпесвирус, представляет собой повсеместно встречающийся патоген. У иммунокомпетентного субъекта инфекция HCMV как правило протекает незаметно, проявляясь наиболее мягкими и неспецифическими симптомами. Напротив, у групп риска, например, у пациентов с подавленным иммунитетом, таких как пациентов с ВИЧ или пациентов после трансплантаций, а также после пренатального инфицирования, HCMV имеет серьезные проявления (Staras S.A. et al., 2006 Clin Infect Dis 43(9): 1143-51; Hebart H. et al, 2004 Hum Immunol 65(5):432-6; Rowshani AT. et al, 2005 Transplantation 79(4) :381-6). Существующие способы лечения включают применение иммуноглобулинов и противовирусных средств, таких как ганцикловир и его производные, которые наиболее эффективны при профилактическом применении или на самых ранних стадиях инфекционного процесса в популяциях риска. Тем не менее, существующие способы лечения отличаются значительной токсичностью и ограниченной эффективностью, особенно в случае заболевания с поздним началом (Boeckh М., 2004 Pediatr Transplant 8 (Suppl. 5): 19-27; Limaye A.P., 2004 Transplantation 78(9): 1390-6), а также они не обладают действием в отношении врожденного заболевания HCMV. Разработка эффективной вакцины для защиты от заболевания HCMV признано важным приоритетным направлением общественного здравоохранения (Arvin A.M. et al, 2004 Clin Infect Dis 39(2):233-9).
[0003] Тесты in vitro представляют собой важный инструмент для оценки вакцин-кандидатов в отношении их способности противодействовать инфицированию HCMV. Например, разработаны тесты нейтрализации, чтобы изучить иммунный ответ у инфицированных субъектов, а также оценить иммуногены-кандидаты для вакцин, как в клинических, так и доклинических испытаниях. В случае HCMV, применение антиген-связывающих систем ИФА (иммуноферментный анализ) позволяет измерять антитела специфичные для антигенов HCMV; тем не менее, только тест, в котором измеряют нейтрализацию вирусного проникновения в клетки, дает возможность установить и оценить количественно биологическую активность HCMV антиген-специфичных антител (Abai et al., 2007 J Immunol Methods 332(1-2):82-93). Обычно в таких тестах нейтрализации, применяемых для HCMV, степень, до которой нейтрализующие антитела уменьшают HCMV инфицирование клеток в тесте, определяют подсчетом ядер инфицированных клеток, основываясь на экспрессии одного или большего количества вирусных белков в клетке. Такие анализы могут требовать много времени и представлять сложности в плане применения высокопроизводительных методик. В данной области остается необходимость в улучшенных методах скрининга потенциальных вакцин-кандидатов HCMV для индукции нейтрализующих антител.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Согласно настоящему изобретению, помимо прочего, предложены способы пригодные для определения уровней HCMV инфекции в клетках-хозяевах, и как следствие, определение нейтрализующих антител, присутствующих в образце. Настоящее изобретение касается распознавания вирусов HCMV, которые имеют флуоресцентную метку, позволяющую выявить вирусную инфекцию (например, с помощью оценки флуоресценции в клетках после контакта клетки-хозяина с вирусом). Согласно некоторым вариантам реализации уровень HCMV инфекции определяют детекцией флуоресценции, при этом вирус уже преинкубирован с тестируемым образцом (например, образцом сыворотки), полученным от субъекта. Согласно некоторым вариантам реализации субъекту вводили вакцину-кандидат HCMV.
[0005] Другие особенности, цели или преимущества настоящего изобретения очевидны из его последующего подробного описания. Очевидно, тем не менее, что указанное подробное описание, хотя и указывает варианты реализации настоящего изобретения, приведено лишь в качестве иллюстрации, не имеющей ограничительного характера. Из подробного описания разнообразные изменения и модификации в рамках объема изобретения станут очевидны специалистам в данной области техники.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0006] Рисунки приведены только в иллюстративных целях, не имеющих ограничительного характера.
[0007] На Фиг. 1 представлены приведенные в качестве примера титры антител к g (гликопротеин) В по данным ИФА после иммунизации бивалентными gB вирусоподобными частицами (ВПЧ) (gB/рр65 и gB/рр65 + gH-G/pp65). Бивалентные gB ВПЧ индуцировали у кроликов мощный и длительный иммунитет после однократной иммунизации.
[0008] На Фиг. 2 представлены результаты проведенного в качестве примера анализа с помощью флуорсцентно-активированной клеточной сортировки (FACS) экспрессии GFP в фибробластах показательные в отношении ответа нейтрализующих антител у кроликов, индуцированного gB/pp65 CMV ВПЧ. Кроликов (n = 6/группа) иммунизировали (IM) дважды на 0 и 8 неделе, а через 2 недели производили забор крови. Сыворотки объединяли и тестировали в указанных разведениях в сравнении с Cytogam™ в сходных разведениях в отношении GFP-экспрессирующего CMV вируса (ТВ40) в фибробластах крайней плоти человека (HFF). 100000 клеток собирали в ходе проточного цитометрического анализа инфицированных (GFP+) клеток.
[0009] На Фиг. 3 представлены результаты проведенного в качестве примера FACS анализа экспрессии GFP в фибробластах показательные в отношении ответа нейтрализующих антител у кроликов, индуцированного gB + gH CMV ВПЧ. Кроликов (n=6/группа) иммунизировали (IM) дважды на 0 и 8 неделе, а через 2 недели производили забор крови. Сыворотки объединяли и тестировали в указанных разведениях в сравнении с Cytogam™ в сходных разведениях в отношении GFP-экспрессирующего CMV вируса (ТВ40) в фибробластах HFF. 100000 клеток собирали в ходе проточного цитометрического анализа инфицированных (GFP+) клеток.
[00010] На Фиг. 4 представлено приведенное в качестве примера процентное количество нейтрализаций в фибробластах крайней плоти человека (HFF-1). Представлены нейтрализации для 15RA09 группы 7 (моновалентный gB-G/моновалентный gH-G с алюминиевым адъювантом) объединенные образцы P1Vd14, P1Vd28, P1Vd42, P1Vd55 и P2Vd14; и 15RA05 группы 8 (пустой MLV Gag) (MLV - вирус лейкемии мышей) P2Vd14, в присутствии 10% комплемента морской свинки, в отношении 1:6 CMV-GFP-ТВ40-010512 в клетках HFF-1.
[00011] На Фиг. 5 представлено приведенное в качестве примера процентное количество нейтрализаций в пигментированных эпителиальных клетках сетчатки ARPE-19. Представлены нейтрализации для 15RA09 группы 7 (моновалентный gB-G/моновалентный gH-G с алюминиевым адъювантом) объединенные образцы P1Vd14, P1Vd28, P1Vd42, P1Vd55 и P2Vd14; и 15RA05 группы 8 ("пустой" MLV Gag) P2Vd14, в присутствии 2,5% комплемента кролика, в отношении 1:3 CMV-GFP-Towne-150612 в клетках ARPE-19.
ОПРЕДЕЛЕНИЯ
[00012] Для более четкого понимания настоящего изобретения ниже будет дано определение некоторых терминов. Дополнительные определения для следующих терминов и других терминов изложены в ходе данного описания.
[00013] Аминокислота: как использовано в тексте данного документа, термин "аминокислота" в его самом широком смысле обозначает соединение и/или вещество, которое может быть встроено в полипептидную цепь. Согласно некоторым вариантам реализации аминокислота имеет общую структуру H2N-C(H)(R)-COOH. Согласно некоторым вариантам реализации аминокислота представляет собой аминокислоту природного происхождения. Согласно некоторым вариантам реализации аминокислота представляет собой синтетическую аминокислоту; согласно некоторым вариантам реализации аминокислота представляет собой d-аминокислоту; согласно некоторым вариантам реализации аминокислота представляет собой 1-аминокислоту. "Стандартная аминокислота" обозначает любую из двадцати стандартных 1-аминокислот, обычно обнаруживаемых в пептидах природного происхождения. "Нестандартная аминокислота" обозначает любую аминокислоту отличную от стандартной аминокислоты, в независимости от того получена ли она синтетически, или из натурального источника. Как использовано в тексте данного документа термин "синтетическая аминокислота" охватывает химически модифицированные аминокислоты, включая, но не ограничиваясь перечисленным, соли, производные аминокислот (такие как амиды) и/или замещенные аминокислоты. Аминокислоты, включая карбокси- и/или амино-терминальные аминокислоты в пептидах, могут быть модифицированы метилированием, амидированием, ацетилированием, введением защитных групп и/или замещением другими химическими группами, что может изменять время полужизни пептида в циркуляции без негативного влияния на его активность. Аминокислоты могут принимать участие в образовании дисульфидной связи. Аминокислоты могут включать одну или несколько посттрансляционных модификаций, таких как связывание с одним или большим количеством химических фрагментов (групп) (например, метильными группами, ацетатными группами, ацетильными группами, фосфатными группами, формильными фрагментами, изопреноидными группами, сульфатными группами, фрагментами полиэтиленгиколя, липидными фрагментами, углеводными фрагментами, биотиновыми фрагментами и т.д.). Указанный термин "аминокислота" применяют взаимозаменяемо с термином "аминокислотный остаток", и он может обозначать свободную аминокислоту и/или аминокислотный остаток пептида. Из контекста, в котором использован термин, будет понятно, обозначает ли он свободную аминокислоту, или остаток пептида.
[00014] Антиген: как использовано в тексте данного документа термин "антиген" обозначает субстанцию, содержащую один или большее количество эпитопов (линейных, конформационных или обоих типов), которые распознаются антителами. Согласно определенным вариантам реализации антиген представляет собой или включает вирус или вирусный полипептид. Согласно определенным вариантам реализации термин "антиген" обозначает субъединицу антигена (например, антиген отдельный и дискретный по отношению к целому вирусу, с которым антиген связан в природе; например, антиген, который связан с вирусоподобной частицей). В качестве варианта или дополнения согласно некоторым вариантам реализации термин "антиген" обозначает убитые, ослабленные или инактивированные вирусы. Согласно определенным вариантам реализации антиген представляет собой "иммуноген".
[00015] Приблизительно: как использовано в тексте данного документа термин "приблизительно", примененный к одному или большему количеству значений, обозначает значение, которое сходно с установленным контрольным значением. Согласно определенным вариантам реализации термин "приблизительно" обозначает диапазон значений, которые укладываются в рамки 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или меньшего количества процентов в любом направлении (в сторону увеличения или уменьшения) указанного установленного контрольного значения, если не указано другое или другое неочевидно из контекста (за исключением случаев, где такое число должно превосходить 100% от возможного значения).
[00016] Смягчение: как использовано в тексте данного документа термин "смягчение" означает предотвращение, уменьшение или временное облегчение состояния или улучшение состояния субъекта. Смягчение включает, но не требует полного восстановления или полного предотвращения заболевания, расстройства или патологического состояния (например, HCMV инфекции). Термин "предотвращение" обозначает задержку начала заболевания, расстройства или патологического состояния. Предотвращение можно считать полным, когда начало заболевания, расстройства или патологического состояния было задержано на заранее определенный период времени.
[00017] Лекарственная форма: как использовано в тексте данного документа термины "лекарственная форма" и "лекарственная форма с однократной дозировкой" обозначают физически дискретную единицу дозирования лекарственного средства, предназначенную для пациента подлежащего лечению. Каждая единица дозирования содержит заранее определенное количество активного материала, вычисленное так, чтобы вызвать желаемый лечебный эффект. Тем не менее, очевидно, что общая доза указанной композиции будет определяться лечащим врачом с медицинской точки зрения.
[00018] Режим дозирования: "режим дозирования" (или "режим лечения"), как использовано в тексте данного документа, представляет собой набор однократных доз (обычно более одной), которые индивидуально вводят субъекту, указанные дозы обычно разделены периодами времени. Согласно некоторым вариантам реализации данное лекарственное средство имеет рекомендованный режим дозирования, который может включать одну или большее количество доз. Согласно некоторым вариантам реализации режим дозирования включает множество доз, каждая из которых отделена от другой периодом времени равной длины; согласно некоторым вариантам реализации режим дозирования включает множество доз и, по меньшей мере, два разных периода времени, разделяющих индивидуальные дозы.
[00019] Экспрессия: как использовано в тексте данного документа "экспрессия" последовательности нуклеиновой кислоты обозначает одно или большее количество следующих событий: (1) получение матрицы РНК с последовательности ДНК (например, путем транскрипции); (2) процессинг транскрипта РНК (например, путем сплайсинга, редактирования, 5' кэпирования и/или 3' кэпирования); (3) трансляции РНК в полипептид или белок; и/или (4) посттрансляционная модификация полипептида или белка.
[00020] Флуоресценция: как использовано в тексте данного документа термин флуоресценция обозначает молеулярную метку, которая люминесцирует. Обычно, флуоресцентные молекулярные метки содержат электроны, которые могут поглощать электромагнитную энергию на одной длине волны и испускать электромагнитную энергию на второй длине волны. Некоторые белки или низкомолекулярные соединения в клетках обладают природной флуоресценцией (например, НАДН, триптофан, эндогенный хлорофилл, фикоэритрин или зеленый флуоресцентный белок (GFP)). Очевидно, что уже сконструированы разнообразные мутантные формы флуоресцентных белков, которые могут быть использованы согласно настоящему изобретению, такие как, EGFP, синий флуоресцентный белок (EBFP, EBFP2, Azurite, mKalamal), голубой флуоресцентный белок (ECFP, Cerulean, CyPet), желтый флуоресцентный белок (YFP, Citrine, Venus, YPet), потенциал-чувствительный GFP (roGFP) и мономерный GFP. GFP и другие флуоресцентные белки могут быть экспрессированны экзогенно в клетках как таковые или в виде белка слияния. Указанный подход позволяет использовать флуоресцентные белки в качестве репортеров для любого количества биологических событий, таких как субклеточная локализация и паттерны экспрессии.
[00021] В качестве варианта или дополнения специфические или неспецифические белки, нуклеиновые кислоты, липиды или низкомолекулярные соединения могут быть помечены внешним флуорофором, флуоресцентным красителем, который может быть низкомолекулярным соединением, белком или квантовой точкой. Приведенные в качестве примера флуорофоры включают, но не ограничены только перечисленным, 1,5 IAEDANS; 1,8-ANS; 4-метилумбеллиферон; 5-карбокси-2,7-дихлорфлуоресцеин; 5-карбоксифлуоресцеин (5-FAM); 5-карбоксинафтофлуоресцеин; 5-карбокситетраметилродамин (5-TAMRA); 5-гидрокситриптамин (5-НАТ); 5-ROX (карбокси-Х-родамин); 6-карбоксиродамин 6G; 6-CR 6G; 6-JOE; 7-амино-4-метилкумарин; 7-аминоактиномицин D (7-AAD); 7-гидрокси-4-1 метилкумарин; 9-амино-6-хлор-2-метоксиакридин (АСМА); ABQ; кислый фуксин; акридиновый оранжевый; акридиновый красный; акридиновый желтый; акрифлавин; акрифлафин Фельген SITSA; экворин (фотопротеин); AFPs - AutoFluorescent Protein (Quantum Biotechnologies) см. sgGFP, sgBFP; Alexa Fluor 350.TM.; Alexa Fluor 430.TM.; Alexa Fluor 488.TM.; Alexa Fluor 532.TM.; Alexa Fluor 546.TM.; Alexa Fluor 568.TM.; Alexa Fluor 594.TM.; Alexa Fluor 633.TM.; Alexa Fluor 647.TM.; Alexa Fluor 660.TM.; Alexa Fluor 680.TM.; ализарин complexon; ализарин красный; аллофикоцианин (АРС); АМС, AMCA-S; аминометилкумарин (АМС А); АМСА-Х; аминоактиномицин D; аминокумарин; анилиновый синий; антроцил стеарат; АРС-Су7; APTRA-BTC; APTS; астразон бриллиантовый красный 4G; астразон оранжевый R; астразон красный 6В; астразон желтый 7 GLL; атабрин; ATTO-TAG.TM. CBQCA; ATTO-TAG.TM. FQ; аурамин; аурофосфин G; аурофосфин; ВАО 9 (бис-аминофенилоксадиазол); BCECF (высокий рН); BCECF (низкий рН); берберин сульфат; бета-лактамаза; BFP blue shifted GFP (Y66H); синий флуоресцентный белок; BFP/GFP FRET; Bimane; Bisbenzemide; Bisbenzimide (Hoechst); bis-BTC; бланкофор FFG; бланкофор SV; BOBO.TM.-l; BOBO.TM.-3; Bodipy492/515; Bodipy493/503; Bodipy500/510; Bodipy; 505/515; Bodipy 530/550; Bodipy 542/563; Bodipy 558/568; Bodipy 564/570; Bodipy 576/589; Bodipy 581/591; Bodipy 630/650-X; Bodipy 650/665-X; Bodipy 665/676; Bodipy Fl; Bodipy FL ATP; Bodipy Fl-Ceramide; Bodipy R6G SE; Bodipy TMR; Bodipy TMR-X conjugate; Bodipy TMR-X, SE; Bodipy TR; Bodipy TR ATP; Bodipy TR-X SE; BO-PRO.TM.-l; BO-PRO.TM.-3; бриллиантовый сульфофлавин FF; BTC; BTC-5N; кальцеин; кальцеин синий; Calcium Crimson-; Calcium Green; Calcium Green-1 Ca.sup.2+ Dye; Calcium Green-2 Ca.sup.2+; Calcium Green-5N Ca.sup.2+; Calcium Green-C18 Ca.sup.2+; Calcium Orange; калькофлюор белый; карбокси-Х-родамин (5-ROX); Cascade Blue.TM.; Cascade Yellow; катехоламин; CCF2 (GeneBlazer); CFDA; CFP (голубой флуоресцентный белок); CFP/YFP FRET; хлорофилл; хромомицин А; хромомицин A; CL-NERF; CMFDA; целентеразин; целентеразин cp; целентеразин f; целентеразин fcp; целентеразин h; целентеразин hep; целентеразин ip; целентеразин n; целентеразин О; кумарин фаллоидин; С-фикоцианин; СРМ I метилкумарин; СТС; СТС Formazan; Су2.ТМ.; Су3.1 8; Су3.5.ТМ.; Су3.ТМ.; Су5.1 8; Су5.5.ТМ.; Су5.ТМ.; Су7.ТМ.; Cyan GFP; цАМФ флуоросенсор (FiCRhR); дабцил; дансил; дансил амин; дансил кадаверин; дансил хлорил; дансил DHPE; дансил фторид; DAPI; дапоксил; дапоксил 2; дапоксил 3'DCFDA; DCFH (Dichlorodihydrofluorescem Diacetate); DDAO; DHR (дигидрородамин 123); Di-4-ANEPPS; Di-8-ANEPPS (non-ratio); DiA (4-Di 16-ASP); Dichlorodihydrofluorescem Diacetate (DCFH); DiD-липофильный трейсер; DiD (DilC18(5)); DIDS; дигидрородамин 123 (DHR); Dil (DilC18(3)); I динитрофенол; DiO (DiOC18(3)); DiR; DiR (Dil CI 8(7)); DM-NERF (высокий рН); DNP; дофамин; DsRed; DTAF; DY-630-NHS; DY-635-NHS; EBFP; ECFP; EGFP; ELF 97; эозин; эритрозин; эритрозин ITC; этидия бромид; этидия гомодимер-1 (EthD-1); эукризин; EukoLight; хлорид европия (111); EYFP; быстрый синий; FDA; Фельген (парарозанилин); FIF (формальдегид-индуцированная флуоресценция); FITC; Flazo Orange; флуо-3; флуо-4; флуоресцеин (FITC); флуоресцеина диацетат; Fluoro-Emerald; Fluoro-Gold (гидроксистилбамидин); Fluor-Ruby; FluorX; FM 1-43.TM.; FM 4-46; Fura Red.TM. (высокий рН); Fura Red.TM./Fluo-3; Fura-2; Fura-2/BCECF; генакриловый бриллиантовый красный В; генакриловый бриллиантовый желтый 10GF; генакриловый розовый 3G; генакриловый желтый 5GF; GeneBlazer; (CCF2); GFP (S65T); GFP красный сдвиг (rsGFP); GFP дикого типа* УФ-возбуждение отсутствует (wtGFP); GFP дикий тип, УФ-возбуждение отсутствует (wtGFP); GFPuv; глоксаловая кислота; гранулярный синий; гематопорфирин; Hoechst 33258; Hoechst 33342; Hoechst 34580; HPTS; гидроксикумарин; гидроксистилбамидин (FluoroGold); гидрокситриптамин; индо-1, высокий кальций; индо-1 низкий кальций; индодикарбоцианин (DiD); индотрикарбоцианин (DiR); Intrawhite Cf; JC-1; JO JO-1; JO-PRO- 1; LaserPro; Laurodan; LDS 751 (DNA); LDS 751 (RNA); лейкофор PAF; лейкофор SF; лейкофор WS; лиссамин-родамин; лиссамин-родамин В; кальцеин/этидий гомодимер; LOLO-1; LO-PRO-1; Lucifer Yellow; Lyso Tracker Blue; Lyso Tracker Blue-White; Lyso Tracker Green; Lyso Tracker Red; Lyso Tracker Yellow; LysoSensor Blue; LysoSensor Green; LysoSensor Yellow/Blue; Mag Green; Magdala Red (Phloxin B); Mag-Fura Red; Mag-Fura-2; Mag-Fura-5; Mag-lndo-1; магний зеленый; магний оранжевый; малахитовый зеленый; Marina Blue; I Maxilon Brilliant Flavin 10 GFF; Maxilon Brilliant Flavin 8 GFF; мероцианин; метоксикумарин; Mitotracker Green FM; Mitotracker Orange; Mitotracker Red; митрамицин; Monobromobimane; Monobromobimane (mBBr-GSH); Monochlorobimane; MPS (Methyl Green Pyronine Stilbene); NBD; NBD Amine; Nile Red; Nitrobenzoxedidole; норадреналин; ядерный быстрый красный; i ядерный желтый; Nylosan Brilliant lavin E8G; Oregon Green.TM.; Oregon Green.TM. 488; Oregon Green.TM. 500; Oregon Green.TM. 514; Pacific Blue; парарозанилин (Фельген); PBFI; PE-Cy5; PE-Cy7; PerCP; PerCP-Cy5.5; PE-TexasRed (Red 613); Phloxin В (Magdala Red); Phorwite AR; Phorwite BKL; Phorwite Rev; Phorwite RPA; фосфин 3R; PhotoResist; фикоэритрин В [РЕ]; фикоэритрин R [РЕ]; PKH26 (Sigma); PKH67; PMIA; Pontochrome Blue Black; POPO-1; POPO-3; PO-PRO-1; PO-1 PRO-3; примулин; Procion Yellow; пропидия иодид (PI); PyMPO; пирен; пиронин; пиронин В; Pyrozal Brilliant Flavin 7GF; QSY 7; Quinacrine Mustard; Resorufin; RH 414; Rhod-2; родамин; родамин 110; родамин 123; родамин 5 GLD; родамин 6G; родамин В; родамин В 200; родамин В extra; родамин ВВ; родамин BG; родамин Green; родамин фаллицидин; родамин: фаллоидин; родамин Red; родамин WT; бенгальский розовый; R-фикоцианин; R-фикоэритрин (РЕ); rsGFP; S65A; S65C; S65L; S65T; Sapphire GFP; SBFI; серотонин; Sevron Brilliant Red 2B; Sevron Brilliant Red 4G; Sevron I Brilliant Red B; Sevron Orange; Sevron Yellow L; sgBFP.TM. (super glow BFP); sgGFP.TM. (super glow GFP); SITS (примулин; стильбен изотиосулфоновая кислота); SNAFL кальцеин; SNAFL-1; SNAFL-2; SNARF кальцеин; SNARF1; Sodium Green; SpectrumAqua; SpectrumGreen; SpectrumOrange; Spectrum Red; SPQ (6-метокси-N-(3-сульфопропил) хинолиний; стильбен; сульфородамин В и С; сульфородамин Extra; SYTO 11; SYTO 12; SYTO 13; SYTO 14; SYTO 15; SYTO 16; SYTO 17; SYTO 18; SYTO 20; SYTO 21; SYTO 22; SYTO 23; SYTO 24; SYTO 25; SYTO 40; SYTO 41; SYTO 42; SYTO 43; SYTO 44; SYTO 45; SYTO 59; SYTO 60; SYTO 61; SYTO 62; SYTO 63; SYTO 64; SYTO 80; SYTO 81; SYTO 82; SYTO 83; SYTO 84; SYTO 85; SYTOX синий; SYTOX зеленый; SYTOX оранжевый; тетрациклин; тетраметилродамин (TRITC); Texas Red.TM.; Texas Red-X.TM. конъюгат; тиадикарбоцианин (DiSC3); тазиновый красный R; тиазоловый оранжевый; тиофлавин 5; тиофлавин S; тиофлавин TON; Thiolyte; тиозоловый оранжевый; Tinopol CBS (калькофлюор белый); TIER; TO-PRO-1; TO-PRO-3; ТО-PRO-5; ТОТО-1; ТОТО-3; Tricolor (РЕ-Су5); TRITC тетраметилродаминизоцианат; True Blue; Tru Red; Ultralite; уранин В; Uvitex SFC; дикий тип GFP; WW 781; Х-родамин; XRITC; ксиленовый оранжевый; Y66F; Y66H; Y66W; Yellow GFP; YFP; YO-PRO-1; YO- PRO 3; YOYO-l;YOYO-3; Sybr Green; тиазоловый оранжевый (взаимохелатирующие красители); полупроводниковые наночастицы, такие как квантовые точки; или "запертый" флуорофор (который может быть активирован светом или другим источником электромагнитного излучения), или их комбинация.
[00022] Белок слияния: как использовано в тексте данного документа термин "белок слияния" в основном обозначает полипептид, включающий, по меньшей мере, два сегмента, каждый из которых демонстрирует высокую степень аминокислотной идентичности по отношению пептидному соединению, которое (1) встречается в природе, и/или (2) представляет функциональный домен полипептида. Как правило предполагают, что полипептид, содержащий, по меньшей мере, два таких сегмента является белком слияния, если указанные два сегмента представляют собой фрагменты, которые (1) не включены в природе в один и тот же пептид, и/или (2) прежде не были соединены в один полипептид, и/или (3) соединены искусственно.
[00023] Ген: как использовано в тексте данного документа термин "ген" имеет значение, принятое в данной области техники. Для специалиста в данной области, очевидно, что термин "ген" может включать регуляторные последовательности гена (например, промоторы, энхансеры и т.д.) и/или последовательности интрона. Кроме того, очевидно, что определения гена включают ссылки на нуклеиновые кислоты, которые не кодируют белки, а скорее кодируют функциональные молекулы РНК, такие как тРНК, РНК-индуцирующие агенты и т.д. Для ясности следует заметить, что термин "ген" в основном обозначает часть нуклеиновой кислоты, которая кодирует белок; указанный термин, возможно, включает регуляторные последовательности, что будет очевидно из контекста для специалистов в данной области. Указанное определение не имеет целью исключить применимость термина "ген" к единицам экспрессии, некодирующим белок, но скорее пояснить, что в большинстве случаев, указанный термин в данном документе обозначает нуклеиновую кислоту, кодирующую белок.
[00024] Продукт гена или продукт экспрессии: как использовано в тексте данного документа, термин "продукт гена" или "продукт экспрессии" в основном обозначает РНК, транскрибированную с гена (пре- и/или постпроцессинговую), или полипептид (до и/или после модификации), кодируемый РНК, транскрибированной с гена.
[00025] Высокопроизводительный: как использовано в тексте данного документа, термин "высокопроизводительный" обозначает в широком смысле исследования с большим количеством тестов, такие в которых проводят формирование каждого индивидуального образца, сводящее к минимуму стадии и затруднения подготовки, и измерение результатов теста или одновременно, или по типу быстрой последовательности. Высокопроизводительные тесты, как правило, не включают проводимые вручную по одному тесты, такие как тесты, проводимые одним человеком, в которых подготовку, выполнение, измерение и сбор данных для одного теста полностью завершают перед тестированием следующего образца. Высокопроизводительные тесты обычно включают, например, любые тесты, в которых подготавливают и измеряют серию образцов (например, 24, 96, 384 или большее количество тестируемых образцов). Формирование тестируемых образцов в указанных тестах означает ускорение процесса тестирования путем измерения результатов теста или одновременно, или по типу быстрой последовательности, такого, которого достигают при помощи автоматизации.
[00026] Иммуногенный: как использовано в тексте данного документа, термин "иммуногенный" означает способность продуцировать иммунный ответ у животного-хозяина против внешнего агента (например, антигена HCMV). Согласно определенным вариантам реализации указанный иммунный ответ формирует основу защитного иммунитета, вызванного вакциной против специфического инфекционного организма (например, HCMV).
[00027] Иммунный ответ: как использовано в тексте данного документа, термин "иммунный ответ" обозначает ответ, вызванный у животного. Иммунный ответ может относиться к клеточному иммунитету, гуморальному иммунитету, или может задействовать оба звена. Иммунный ответ может также быть ограничен частью иммунной системы. Например, согласно определенным вариантам реализации иммуногенная композиция может индуцировать усиленный ответ IFNγ (гамма-интерферон). Согласно определенным вариантам реализации иммуногенная композиция может индуцировать ответ секреторного IgA (например, измеренный в назальных или ректальных смывах). Согласно определенным вариантам реализации иммуногенная композиция может индуцировать системный ответ IgG (например, измеренный в сыворотке). Согласно определенным вариантам реализации иммуногенная композиция может индуцировать вирус-нейтрализующие антитела или ответ нейтрализующих антител.
[00028] Улучшить, увеличить или уменьшить: как использовано в тексте данного документа, термины "улучшить", "увеличить" или "уменьшить", или их грамматические эквиваленты обозначают значения относительные к измерению на уровне "базовой линии", такому как измерение у того же субъекта до начала лечения, описание которого приведено в тексте данного документа, или измерения у контрольного субъекта (или нескольких контрольных субъектов) в отсутствии лечения, описание которого приведено в тексте данного документа.
[00029] Субъект, пациент: как использовано в тексте данного документа, термины "субъект" или "пациент" обозначают человека или млекопитающее отличное от человека. Субъект (также именуемый "пациент") подлежащий лечению является субъектом (плод, новорожденный, ребенок, подросток или взрослый), страдающим от заболевания, например, инфекции HCMV. Согласно некоторым вариантам реализации субъект подвержен риску в отношении инфекции HCMV. Согласно некоторым вариантам реализации субъект является субъектом в состоянии подавленного иммунитета. Например, согласно некоторым вариантам реализации субъект в состоянии подавленного иммунитета, выбран из группы ВИЧ-инфицированных, пациентов больных СПИДом, реципиентов после трансплантации, детей и беременных. Согласно некоторым вариантам реализации субъект был подвержен контакту с источником HCMV. Согласно некоторым вариантам реализации субъект является человеком.
[00030] Выделенный: как использовано в тексте данного документа, термин "выделенный" обозначает субстанцию и/или агент, который (1) отделили, по меньшей мере, от некоторых компонентов, с которыми он был изначально связан, при своем появлении (или в природе и/или в экспериментальных условиях), и/или (2) получен, приготовлен и/или произведен искусственно. Выделенные субстанции и/или агенты могут быть отделены приблизительно от 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 91%, 92%, 93%, 94% 95%, 96%, 97%, 98%, 99% или более чем 99% других компонентов с которыми они были изначально связаны. Согласно некоторым вариантам реализации выделенные агенты обладают степенью чистоты приблизительно 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более чем 99%. Как использовано в тексте данного документа, субстанция является "чистой", если она в значительной степени свободна от других компонентов. Как использовано в тексте данного документа, вычисление чистоты выделенных субстанций и/или агентов в процентном выражении не должно включать эксципиенты (например, буфер, растворитель, воду и т.д.).
[00031] Линкер: как использовано в тексте данного документа, термин "линкер" обозначает, например, белок слияния, последовательность аминокислот соответствующей длины, отличающуюся от таковой, наблюдаемой в определенной позиции в природном белке, и в основном предназначенный для использования в качестве гибкой и/или промежуточной структуры, такой как альфа-спираль, между двумя фрагментами белка. Линкер, в основном, позволяет сохранить у двух или более доменов белка слияния 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более от биологической активности каждого домена. Линкер может также именоваться спейсером.
[00032] Нуклеиновая кислота: как использовано в тексте данного документа, термин "нуклеиновая кислота" в самом широком смысле обозначает любое соединение или субстанцию, которое представляет собой или может быть встроено в олигонуклеотидную цепь. Согласно некоторым вариантам реализации нуклеиновая кислота представляет собой соединение или субстанцию, которое представляет собой или может быть встроено в олигонуклеотидную цепь с помощью фосфодиэфирной связи. Согласно некоторым вариантам реализации "нуклеиновая кислота" обозначает отдельные компоненты нуклеиновой кислоты (например, нуклеотиды и/или нуклеозиды). Согласно некоторым вариантам реализации "нуклеиновая кислота" обозначает олигонуклеотидную цепь, включающую отдельные компоненты нуклеиновой кислоты. Как использовано в тексте данного документа, термины "олигонуклеотид" и "полинуклеотид" могут быть использованы взаимозаменяемо. Согласно некоторым вариантам реализации "нуклеиновая кислота" включает РНК, а также одно- и/или двухцепочечную ДНК и/или кДНК. Кроме того, термины "нуклеиновая кислота", "ДНК", "РНК" и/или похожие термины включают аналоги нуклеиновой кислоты, т.е. аналоги, имеющие основную цепь отличную фосфодиэфирной. Например, так называемые "пептидные нуклеиновые кислоты" известные в данной области техники и имеющие пептидные связи вместо фосфодиэфирной, входят в объем настоящего изобретения. Термин "последовательность нуклеотидов, кодирующая последовательность аминокислот" включает все последовательности нуклеотидов, которые являются вырожденными версиями и/или кодируют одну и ту же последовательность аминокислот. Последовательности нуклеотидов, которые белки и/или РНК могут включать интроны. Нуклеиновые кислоты могут быть выделены из природных источников, получены, используя рекомбинантные системы экспрессии и, возможно, очищены, синтезированы химически и т.д. Если необходимо, например, в случае химически синтезированных молекул, нуклеиновые кислоты могут включать аналоги нуклеозидов, такие как аналоги, имеющие химически модифицированные основания или сахара, модификации основной цепи и т.д. Последовательность нуклеиновой кислоты представлена в направлении 5'-3', если не указано другое. Термин "сегмент нуклеиновой кислоты" использован в тексте данного документа для обозначения последовательности нуклеиновой кислоты, которая является составляющей более длинной последовательности нуклеиновой кислоты. Согласно многим вариантам реализации сегмент нуклеиновой кислоты включает, по меньшей мере, 3, 4, 5, 6, 7, 8, 9, 10 компонентов. Согласно некоторым вариантам реализации нуклеиновая кислота представляет собой или включает природные нуклеозиды (например, аденозин, тимидин, гуанозин, цитидин, уридин, дезоксиаденозин, дезокситимидин, дезоксигуанозин и дезоксицитидин); аналоги нуклеозидов (например, 2-аминоаденозин, 2-тиотимидин, инозин, пирроло-пиримидин, 3-метиладенозин, 5-мети л цитидин, C-5-пропинил-цитидин, C-5-пропинил-уридин, 2-аминоаденозин, С5-бромуридин, С5-фторуридин, С5-иодуридин, С5-пропинил-уридин, С5-пропинил-цитидин, С5-метилцитидин, 2-аминоаденозин, 7-деазоаденозин, 7-деазогуанозин, 8-оксоаденозин, 8-оксогуанозин, 0(6)-метилгуанин и 2-тиоцитидин); химически модифицированные основания; биологически модифицированные основания (например, метилированные основания); интеркалированные основания; модифицированные сахара (например, 2'-фторрибоза, рибоза, 2'-дезоксирибоза, арабиноза и гексоза); и/или модифицированные фосфатные группы (например, фосфоротиоаты и 5'-N-фосфорамидатные связи). Согласно некоторым вариантам реализации настоящее изобретения в основном касается "немодифицированных нуклеиновых кислот", обозначающих нуклеиновые кислоты (например, полинуклеотиды и компоненты, включая нуклеотиды и/или нуклеозиды), которые не были химически модифицированы, в целях осуществить или облегчить их доставку.
[00033] Фармацевтически приемлемый: Термин "фармацевтически приемлемый", как использовано в тексте данного документа, обозначает субстанции, которые с медицинской точки зрения подходят для применения, предполагающего контакт с тканями человека и животных без превышения токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримые с разумным соотношением польза/возможный вред.
[00034] Полипептид: как использовано в тексте данного документа, "полипептид" в основном обозначает цепь, состоящую, по меньшей мере, из двух аминокислот, соединенных одна с другой пептидной связью. Согласно некоторым вариантам реализации полипептид может включать, по меньшей мере, 3-5 аминокислот, каждая из которых присоединена к другим с помощью, по меньшей мере, одной пептидной связи. Для специалистов в данной области техники очевидно, что полипептиды иногда включают "неприродные" аминокислоты или другие экзогенные фрагменты, которые, тем не менее, возможно, способны интегрировать в полипептидную цепь.
[00035] Существенная гомология: Фраза "существенная гомология" использована в тексте данного документа, чтобы обозначить сравнение последовательности аминокислот или последовательности нуклеиновых кислот. Для специалистов в данной области очевидно, что последовательности считают "существенно гомологичными", если они содержат гомологичные компоненты в соответствующих позициях. Гомологичные компоненты могут быть идентичны. В качестве варианта, гомологичные компоненты могут быть не идентичны, но будут обладать соответствующими сходными структурными и/или функциональными свойствами. Например, как хорошо известно специалистам в данной области техники, определенные аминокислоты обычно классифицируют как "гидрофобные" или "гидрофильные" аминокислоты, и/или как имеющие "полярные" или "неполярные" боковые цепи. Замещение одной аминокислоты на другую того же типа часто может считаться "гомологичным" замещением.
[00036] Как хорошо известно в данной области техники, последовательности аминокислот или последовательности нуклеиновых кислот можно сравнить, применяя любой из множества алгоритмов, включая доступные в коммерческих компьютерных программах, таких как BLASTN для последовательностей нуклеотидов и BLASTP, gapped BLAST и PSI-BLAST последовательностей аминокислот. В качестве примера описание таких программ приведено в Altschul, et al, Basic local alignment search tool, J. Mol. Biol, 215(3): 403-410, 1990; Altschul, et al, Methods in Enzymology; Altschul, et al, "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25:3389-3402, 1997; Baxevanis, et al, Bioinformatics : A Practical Guide to the Analysis of Genes and Proteins, Wiley, 1998; and Misener, et al, (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. Кроме выявления гомологичных последовательностей вышеуказанные программы обычно предоставляют указание степени гомологии. Согласно некоторым вариантам реализации две последовательности считают существенно гомологичными, если по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большее количество их соответствующих остатков гомологичны в подходящем диапазоне остатков. Согласно некоторым вариантам реализации подходящий диапазон представляет собой полностью всю последовательность. Согласно некоторым вариантам реализации подходящий диапазон составляет, по меньшей мере, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 или большее количество остатков.
[00037] Существенная идентичность: Фраза "существенная идентичность" использована в тексте данного документа, чтобы обозначить сравнение между последовательностью аминокислот или последовательностью нуклеиновых кислот. Для специалистов в данной области очевидно, две последовательности считают в основном "существенно идентичными", если они содержат идентичные компоненты в соответствующих позициях. Как хорошо известно в данной области техники, последовательности аминокислот или последовательности нуклеиновых кислот можно сравнивать, применяя любые из множества алгоритмов, включая доступные коммерческие программы для компьютера, такие как BLASTN для последовательностей нуклеотидов и BLASTP, gapped BLAST, и PSI-BLAST для последовательностей аминокислот. В качестве примера описание таких программ приведено в Altschul, et al., Basic local alignment search tool, J. Mol. Biol., 215(3): 403-410, 1990; Altschul, et al., Methods in Enzymology; Altschul et al., Nucleic Acids Res. 25:3389-3402, 1997; Baxevanis et al., Bioinformatics : A Practical Guide to the Analysis of Genes and Proteins, Wiley, 1998; and Misener, et al., (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. Кроме выявления идентичных последовательностей вышеуказанные программы обычно предоставляют указание степени идентичности. Согласно некоторым вариантам реализации две последовательности считают существенно идентичными, если, по меньшей мере, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большее количество соответствующих остатков идентичны в подходящем диапазоне остатков. Согласно некоторым вариантам реализации подходящий диапазон представляет собой полностью всю последовательность. Согласно некоторым вариантам реализации подходящий диапазон состоит, по меньшей мере, из 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 или большего количества остатков.
[00038] Страдающий от: Субъект, который является "страдающим от" заболевания, расстройства или патологического состояния (например, инфекции HCMV) диагностирован на предмет наличия и/или проявляет один или большее количество симптомов заболевания, расстройства или патологического состояния.
[00039] Восприимчивый: Субъект, который является "восприимчивым" к заболеванию, расстройству или патологическому состоянию (например, инфицированию HCMV) подвержен риску развития заболевания, расстройства или патологического состояния. Согласно некоторым вариантам реализации субъект восприимчивый к заболеванию, расстройству или патологическому состоянию еще не был диагностирован на предмет заболевания, расстройства и/или патологического состояния. Согласно некоторым вариантам реализации субъект восприимчивый к заболеванию, расстройству или патологическому состоянию является субъектом, который подвергался условиям, связанным с развитием заболевания, расстройства или патологического состояния (например, указанный субъект подвергался контакту с HCMV).
[00040] Симптомы уменьшаются: Согласно настоящему изобретению "симптомы уменьшаются", если один или большее количество симптомов определенного заболевания, расстройства или патологического состояния уменьшены по величине (например, интенсивность, тяжесть и т.д.) или частоте. Для ясности, задержку начала проявления определенного симпома считают одной из форм уменьшения частоты данного симптома. Не предполагается, что применимость настоящего изобретения ограничена только случаями, когда симптомы исчезают. Согласно настоящему изобретению, в частности, предполагается такое лечение, что один или большее количество симптомов уменьшаются (и состояние субъекта поэтому "улучшается"), хотя симптомы и не исчезают полностью.
[00041] Терапевтически эффективное количество: как использовано в тексте данного документа, термин "терапевтически эффективное количество" обозначает количество достаточное, чтобы обеспечить лечебный эффект у леченного субъекта при разумном соотношении польза/возможный вред применимого к любому медицинскому лечению. Указанный лечебный эффект может быть объективным (т.е. измеримый каким-либо тестом или маркером) или субъективным (т.е. субъект указывает на эффект или чувствует его). В частности, указанное "терапевтически эффективное количество" обозначает количество лечебного белка или композиции достаточно эффективное, чтобы лечить, смягчить или предотвратить требуемое заболевание или патологическое состояние, или чтобы проявился определимый лечебный или профилактический эффект, такой как смягчение симптомов, связанных с заболеванием, предотвращение или задержку начала заболевания и/или уменьшение тяжести или частоты симптомов заболевания. Терапевтически эффективное количество обычно вводят согласно режиму дозирования, который может включать несколько однократных доз. Для любой определенной иммуногенной композиции терапевтически эффективное количество (и/или подходящая однократная доза в рамках эффективного режима дозирования) может варьировать, например, в зависимости от способа введения, комбинации с другими фармацевтическими средствами. Также, конкретное терапевтически эффективное количество (и/или однократная доза) для каждого конкретного пациента может зависеть от множества факторов, включая расстройство подлежащее лечению и тяжесть указанного расстройства; активности конкретного применяемого фармацевтического средства; конкретной применяемой композиции; возраста, массы тела, общего состояния здоровья, пола и рациона пациента; времени введения, способа введения и/или скорости экскреции или метаболизма конкретной применяемой иммуногенной композиции; длительности лечения; и других подобных факторов, которые хорошо известны в медицине.
[00042] Лечение: как использовано в тексте данного документа, термин "лечение" (также "лечить") обозначает любое введение иммуногенной композиции, которая частично или полностью облегчает, смягчает, ингибирует, залерживает начало, уменьшает тяжесть и/или уменьшает встречаемость одного или большего количества симптомов или проявлений определенного заболевания, расстройства и/или патологического состояния (например, инфекции HCMV) или предрасположенности к заболеванию. Такое лечение может быть применено к субъекту, который не проявляет признаков соответствующего заболевания, расстройства и/или патологического состояния, и/или к субъекту, который проявляет лишь ранние признаки заболевания, расстройства и/или патологического состояния. В качестве варианта или дополнения, такое лечение может быть применено к субъекту, который проявляет один или большее количество установленных признаков соответствующего заболевания, расстройства и/или патологического состояния. Согласно определенны вариантам реализации термин "лечение" обозначает вакцинацию пациента.
[00043] Тропизм: как использовано в тексте данного документа, термин "тропизм" или "тропизм к хозяину" или "клеточный тропизм" в контексте вирусов и других патогенов в основном обозначает способность вируса или патогена инфицировать определенный тип клеток. Тропизм может обозначать способ, которым вирус или патоген развился в предпочтительной для него мишени определенных видов хозяев или в определенных типах клеток указанных видов. Например, HCMV обычно может инфицировать довольно широкий клеточный спектр организма-хозяина, включая клетки паренхимы, клетки соединительной ткани практически любого органа и разнообразные типы гематопоэтических клеток. Эпителиальные клетки, эндотелиальные клетки, фибробласты, гладкомышечные клетки являются преобладающими мишенями для репликации вируса. Тем не менее, тропизм к разным клеткам сильно варьирует у различных штаммов HCMV, например, из-за изменений в локусе гена UL128-131. Согласно некоторым вариантам реализации штамм HCMV способен инфицировать фибробласты, но не эпителиальные и/или эндотелиальные клетки. Согласно некоторым вариантам реализации штамм HCMV способен инфицировать фибробласты, эпителиальные и эндотелиальные клетки.
[00044] Вакцинация: как использовано в тексте данного документа, термин "вакцинация" обозначает введение композиции, предназначенной для генерации иммунного ответа, например, против агента, вызывающего заболевание (например, HCMV). В целях реализации настоящего изобретения вакцинация может быть проведена перед, в течение и/или после контакта с агентом, вызывающим заболевание, и согласно некоторым вариантам реализации перед, в течение и/или в короткое время после контакта с указанным агентом. Согласно некоторым вариантам реализации вакцинация включает множественные введения композиции для вакцинации, подходящим образом распределенные по времени.
[00045] Вектор: как использовано в тексте данного документа "вектор" обозначет молекулу нуклеиновой кислоты способную транспортировать другую нуклеиновую кислоту, с которой она связана. Согласно некоторым вариантам реализации векторы способны к внехромосомной репликации и/или экспрессии нуклеиновых кислот, с которыми они связаны в клетке-хозяине, такой как эукариотическая и/или прокариотическая клетка. Векторы способные управлять экспрессией функционально связанных генов в тексте данного документа именуются "векторы экспрессии".
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00046] Согласно настоящему изобретению, помимо прочего, предложены способы пригодные для определения уровня инфекции HCMV в клетках-хозяевах, и как следствие, определение уровня нейтрализующих антител, присутствующих в образце. Настоящее изобретение касается распознавания вирусов HCMV, которые имеют флуоресцентную метку, что позволяет выявить вирусную инфекцию (например, с помощью оценки флуоресценции в клетках после контакта клетки-хозяина с вирусом). Согласно некоторым вариантам реализации уровень HCMV инфекции определяют детекцией флуоресценции, при этом вирус уже преинкубирован с тестируемым образцом (например, образцом сыворотки), полученным от субъекта. Согласно некоторым вариантам реализации субъекту вводили вакцину-кандидат HCMV.
I. Инфекция HCMV и вакцины
[00047] Цитомегаловирус человека (HCMV), β-герпесвирус, представляет собой повсеместно встречающийся патоген. В основном, проникновение герпесвирусов в клетки представляет собой сложный процесс, запускаемый адсорбцией и рецепторным связыванием, за которыми следует слияние внешней вирусной оболочки с клеточной мембраной. Слияние в основном происходит или с плазматической мембраной, или с мембраной эндосом. HCMV инфицирует многие типы клеток in vivo, включая эпителиальные клетки, эндотелиальные клетки и фибробласты (Plachter В et al., 1996 Adv Virus Res 46: 195-261). Он сливается с плазматическими мембранами фибробластов (Compton Т et al., 1992 Virology 191 :387-395), но проникает в пигментированные эпителиальные клетки сетчатки и эпителиальные клетки пупочной вены с помощью эндоцитоза (Bodaghi В et al., 1999 J Immunol 162:957-964; Ryckman BJ et al, 2006 J Virol 80:710-722). Механизм, которым герпесвирусы выбирают способ проникновения, невыяснен. В основном предполагается, что пути проникновения определяются, главным образом, клеткой-хозяином, но существует свидетельство тропной роли гликопротеинов вириона (Wang X et al, 1998 J Virol 72:5552-5558). HCMV кодирует два gH/gL комплекса: gH/gL/gO и gH/gL/UL128/UL130/UL131. gO-содержащий комплекс достаточен для инфицирования фибробластов, при этом pUL128/UL130/UL131-содержащий комплекс важен для HCMV инфицирования эндотелиальных и эпителиальных клеток. Как использовано в тексте данного документа, термины "тропизм", " тропизм к хозяину" или "клеточная тропизм" в контексте вирусов и других патогенов в основном обозначает способность вируса или патогена инфицировать определенный тип клеток. Тропизм может обозначать способ, которым вирус или патоген развился в предпочтительной для него мишени определенных видов хозяев или определенных типах клеток указанных видов. Согласно некоторым вариантам реализации штамм HCMV способен инфицировать фибробласты, но не эпителиальные и/или эндотелиальные клетки. Согласно некоторым вариантам реализации штамм HCMV способен инфицировать фибробласты, эпителиальные и эндотелиальные клетки.
[00048] HCMV поражает к 40 годам 50-85% взрослых (Gershon АА et al, 1997 in Viral Infections of Humans, 4th edition, New York; Plenum Press: 229-251). Наиболее здоровые субъекты, которые заразились HCMV после рождения, проявляют мало симптомов или не проявляют их вовсе. Тем не менее, заболевание HCMV является причиной значительной заболеваемости и смертности у субъектов с ослабленным имунитетом, таких как реципиентов пересаженных гематопоэтических клеток (НСТ) и пересаженных органов (SOT) (Pass R.F. 2001 Cytomegalovirus. In Fields Virology. 4th edition, Philadelphia; Lippincott Williams & Wilkens:2675-2705). В SOT или НСТ популяциях заболевание HCMV может возникать или по типу первичной инфекции, переданной через донорский орган или пересаженные гематопоэтические клетки, или может быть результатом реактивации у реципиента латентного вируса. У ВИЧ-инфицированных инфекция HCMV ускоряет прогрессирование СПИДа и наступление смерти, несмотря на доступность антиретровирусной терапии (Deayton J.R. et al, 2004 Lancet 363:2116-2121). Кроме того, в США HCMV представляет собой наиболее распространенную пренатальную инфекцию и вызывает врожденные аномалии, которые приводят в результате к смерти или тяжелым врожденным дефектам, включая глухоту и задержку умственного развития приблизительно у 8000 новорожденных ежегодно (Stagon S et al, 1986 JAMA 256:1904-1908).
[00049] Иммунные ответы, которые контролируют HCMV, не вполне понятны. По аналогии с другими герпесвирусами человека можно предположить, что как клеточный, так и гуморальный иммунный ответ играет важную роль (Kohl S. 1992 Current topics in Microbiology and Immunology 179:75-88). В отношении HCMV мышей показано, что достаточным для защиты от летального инфицирования является или ответ Т-киллеров, или пассивный перенос нейтрализующих антител (Rapp М. et al, 1993 Multidisciplinary Approach to Understanding Cytomegalovirus Disease 327-332; Reddehase M.J. et al, 198 J Virology 61 :3102-3108).
[00050] Контроль HCMV у лиц с ослабленным иммунитетом первично связан с клеточными иммунными ответами; как CD8+, так и CD4+ Т-лимфоциты представляются важными для защиты от заболевания CMV (Gamadia L.E. et al, 2003 Blood 101 : 2686-2692; Cobbold M. et al, 2005 J Exp Med 202:379-386). Клеточный иммунный ответ на CMV включает ответы CD4+ Т-хелперов и CD8+ цитотоксических Т-лимфоцитов на ряд антигенов, обнаруженных в вирусном тегументе, области вирусной частицы между внешней оболочкой и капсидом. В недавнем исследовании CMV-специфичных CD4+ и CD8+ Т-лимфоцитов, полученных от здоровых доноров, использовали перекрывающиеся пептиды из серий открытых рамок считывания CMV, чтобы идентифицировать антигены, распознанные после инфекции CMV (Sylwester A.W. et al, 2005 J Exp Med 202:673-685). Фосфопротеин 65 тегумента CMV (pp65) и поверхностный гликопротеин gB оказались антигенами, наиболее часто распознаваемыми CD4+ Т-лимфоцитами, а белок рр65 оказался также одним из антигенов, наиболее часто распознаваемыми CD8+ Т-лимфоцитами.
[00051] В противоположность трансплантации, представляется, что материнский гуморальный иммунный ответ против вируса важен в плане предотвращения заболевания HCMV у новорожденного. Представляется, что антитела к поверхностным гликопротеинам, особенно gB, критичны для защиты против переноса HCMV от матери к плоду (Fowler K.В. et al, 2003 JAMA 289: 1008-1011). Более того, в исследовании ранней вакцинации показано, что защита от повторного инфицирования коррелирует с нейтрализующими антителами (Adler S.P. et al., 1995 J Infectious Diseases 171 :26-32). Гуморальный иммунный ответ к HCMV доминирует за счет гликопротеинов внешней вирусной оболочки, присутствующих снаружи внешней оболочки вирусной частицы (например, gB и gH).
[00052] В случае HCMV прямая оценка функций иммуннологического эффектора затруднена, поскольку вирус является строго видоспецифичным и отсутствует доступная модель на животных. Тем не менее, CMV мышей и CMV морских свинок использовали для оценки методологии разработки вакцин у хозяев данных видов.
[00053] CMV вакцина, которая индуцирует защитные ответы как Т-лимфоцитов, так и нейтрализующих антител обладает потенциалом для предотвращения инфекции или смягчения заболевания CMV вследствие врожденной инфекции или трансплантации.
[00054] Первая живая ослабленная вакцина-кандидат HCMV, протестированная на человеке, была основана на лабораторно-адаптированном штамме AD169. Последующие испытания другого лабораторно-адаптированного, клинического штамма Towne, подтвердили, что живые ослабленные вакцины могут индуцировать нейтрализующие антитела, а также ответы CD4+ и CD8+ Т-лимфоцитов. Эффективность вакцины Towne оценивали в серии исследований у реципиентов с пересаженной почкой. Хотя вакцина Towne обладала защитным воздействием в отношении заболевания HCMV (инфекции), она была не в состоянии предотвратить инфицирование HCMV после трансплантации (Plotkin S.A. et al., 1984 Lancet 1 :528-530). Вакцину Towne также оценивали в плацебо-контролируемом исследовании матерей с серонегативным статусом, у которых были дни детских посещений, где указанная вакцина была не в состоянии защитить этих женщин от заражения инфекцией от их HCMV-инфицированных детей (Adler S.P. et al, 1995 J Infectious Diseases 171: 26-32). На основании результатов указанных исследований был сделан вывод, что вакцина Towne слишком ослаблена. Чтобы изучить указанную возможную причину были получены серии генетических рекомбинантов, у которых области неослабленного штамма CMV "Toledo" замещали соответствующе области генома Towne, что в результате привело к конструированию "химер" Towne/Toledo, которые содержали некоторые, но не все мутации, участвующие в ослаблении вакцины Towne (Heineman ТС et al. 2006 J Infect Disease193: 1350-1360). Безопасность и переносимость четырех "химер" Towne/Toledo тестировали в фазе I клинических испытаний. Беспокойство относительно потенциального риска возникновения в перспективе латентной инфекции HCMV воспрепятствовали дальнейшей разработке живых ослабленных вакцин.
[00055] Лидирующая субъединичная вакцина-кандидат CMV основана на гликопротеине оболочки, gB, (очищенная рекомбинантная gB вакцина производится Sanofi-Pasteur Vaccines) по причине способности указанного белка вызывать ответ вирус-нейтрализующих антител с высоким титром при реальном инфицировании. Рекомбинантная вакцина gB вызывает ответ нейтрализующих антител и обладает превосходным профилем безопасности, тем не менее, она не затрагивает другие гликопротеиновые мишени ответа нейтрализующих антител и, что более важно, мишени Т-лимфоцитов. Для оптимизации имунногенности указанной вакцины требуется адъювант MF59. В самом недавнем испытании вакцина продемонстрировала суммарную эффективность 50% в отношении предотвращения CMV инфекции в фазе II клинических испытаний у молодых женщин (Pass R.F. et al, 2009 N Engl J Med 360: 1191-1199). Другие вирусные белки, оцениваемые в качестве субъединичных вакцин-кандидатов, включают рр65 и IE1, оба вызывают ответы Т-лимфоцитов.
[00056] ДНК вакцины вызывают мощный клеточный и гуморальный иммунный ответ у животных и в плане специфичности и точности хорошо подходят для создания вакцин. Уже разработаны ДНК вакцины для CMV, в плане целевых иммуногенов-кандидатов они сосредоточены на белках gB, IE1 и рр65. Бивалентная вакцина-кандидат CMV ДНК (Wloch М.K., 2008 J Infectious Diseases 297: 1634-1642), использующая плазмидную ДНК, кодирующую рр65 и gB, и тривалентная вакцина-кандидат (Jacobson М.А., 2009 Vaccine 27: 1540-1548), которая включает, также, третью плазмиду, кодирующую продукт гена IE1 разработаны Vical Vaccines (Патент США №7410795). Указаннная тривалентная вакцина сама по себе обладала минимальной иммунногенностью в независимости от способа введения. Тем не менее, CMV ДНК вакцина все же обладала четким прайминг-эффектом в отношении мнемонического ответа на антигены CMV, наблюдаемым после введения живого ослабленного CMV (Towne).
[00057] При использовании подхода к созданию вакцин на основе векторов, целевой продукт гена экспрессируется в окружении нереплицирующегося (обычно вирусного) носителя. Одним из примеров является вектор на основе вируса канарипокс, называемый ALVAC, разработанный Virogenetics и Sanofi-Pasteur Vaccines, который представляет собой ослабленный поксвирус, который абортивно реплицируется в клетках млекопитающих. ALVAC, экспрессирующий CMV gB, и ALVAC, экспрессирующий рр65 (Патент США №6267965) уже протестированы в клинических испытаниях. ALVAC-CMV(gB) не индуцировал нейтрализующих антител, но обладал прайминг-эффектом, проявившимся более высоким титром нейтрализующих антител после последующей инфекции штаммом CMV Towne (Adler S.P. et al., 1999 J Infectious Diseases 180:843-846), хотя указанный вектор не проявил бустерного действия в отношении титров нейтрализующих антител после последующей иммунизации субъединичной gB/MF59 вакциной (Bernstein D.I. et al., 2002 J Infectious Diseases 185:686-690). Вектор на основе вируса канарипрокс, экспрессирующий рр65, ALVAC-CMV(pp64), индуцировал продолжительные ответы цитотоксических Т-лимфоцитов у всех волонтеров с изначально серонегативным статусом, по частоте сравнимые с субъектами с реальным серопозитивным статусом (Berencsi К. et al, 2001 J Infectious Diseases 183: 1 Hil I 79). Еще одним подходом, используемым для экспрессии gB в качестве векторной вакцины, является использование системы репликона альфавируса AlphaVax Inc (патент США №7419674). Указанный подход использует дефективную в плане распространения систему вектора репликона одноцикловой РНК, происходящей от ослабленного штамма альфавируса, вируса Венецианского энцефалита лошадей (VEE), чтобы получать вирусоподобные частицы репликона (VRP), экспрессирующие белки рр65, IE1 или gB (Berstein et al, 2010 Vaccine 28:484-493). Двухкомпонентную вакцину репликона альфавируса использовали, чтобы экспрессировать указанные три белка CMV в виде растворимой формы CMV gB (штамм Towne) и белок слияния pp65/IE1 (Reap Е.А. et al., 2007 Vaccine 25:7441-7449), обнаружено, что вакцина безопасна и индуцировала высокий уровень нейтрализующих антител и полифункциональные ответы CD4+ и CD8+ антигенспецифичных Т-лимфоцитов. Среднее геометрическое титра (GMT) в группе, получавшей высокую дозу, составляло приблизительно половину от GMT у 12 реально инфицированных CMV субъектов с серопозитивным статусом, прошедших указанный тест.
[00058] Кандидатом для вакцинации против HCMV, находящимся в настоящее время на доклинической стадии разработки, является вакцина "плотных телец". Плотные тельца (DB) представляют собой заключенные во внешнюю оболочку, дефектные в отношении репликации частицы, образуемые в ходе репликации CMV в клеточной культуре. Они содержат как гликопротеины оболочки, так и большие количества белка рр65. DB неинфекционногенны и иммунногенны, не способны к развитию латентной инфекции HCMV у реципиента вакцины. Показано, что DB способны индуцировать вирус-нейтрализующие антитела и ответы Т-лимфоцитов у мышей при отсутствии экспрессии вирусного гена (Pepperl S. et al, 2000 J Virol 74:6132-6146, PCT Publication No. WO 00/53729 и патент США №6713070).
[00059] Дополнительными кандидатами, рассматриваемыми в плане вакцинации против HCMV, являются вирусоподобные частицы (ВПЧ). Ретровирусы представляют собой покрытые оболочкой РНК вирусы, которые относятся к семейству Retroviridae. После инфицирования клетки-хозяина ретровирусом РНК транскрибируется в ДНК с помощью фермента обратной транскриптазы. Затем ДНК встраивается в геном клетки-хозяина с помощью фермента интегразы и, после этого, реплицируется как часть ДНК клетки-хозяина. Семейство Retroviridae включает следующие роды альфаретровирус, беттаретровирус, гаммаретровирус, дельтаретровирус, эпсилонретровирус, лентивирус, спумавирус. Хозяевами для указанного семейства ретровирусов в основном являются позвоночные. Ретровирусы продуцируют инфекционногенный вирион, содержащий сферический нуклеокапсид (вирусный геном в комплексе с вирусными структурными белками), окруженный двойным липидным слоем, происходящим из мембраны клетки-хозяина.
[00060] Ретровирусные векторы могут быть использованы для генерации покрытых оболочкой вирионов, которые инфектогенны и либо репликативно-компетентны, или репликативно-дефектны. Репликативно-компетентные инфектогеные ретровирусные векторы содержат все необходимые гены для синтеза вириона и продолжения своего распространения, как только произошло инфицирование клетки-хозяина. Репликативно-дефектные инфектогеные ретровирусные векторы не распространяются после первичного инфицирования. Это достигается заменой большинства кодирующих областей ретровируса генами или последовательностями нуклеотидов, предназначенными для передачи; так что указанный вектор неспособен продуцировать белки необходимые для дополнительных раундов репликации.
[00061] В качестве варианта или дополнения ретровирусные векторы могут быть использованы, чтобы генерировать вирусоподобные частицы (ВПЧ), которые лишены генома ретровирусного происхождения и не являются ни инфектогенными, ни реплицирующимися. В виду преимуществ ВПЧ, ВПЧ могут быть использованы в качестве системы доставки антигена. Более того, поскольку ВПЧ неинфектогенны, они могут безопасно вводиться в качестве иммуногенной композиции (например, вакцины). ВПЧ структурно в основном похожи на покрытые внешней оболочкой вирусы, описание которых приведено выше, но лишены генома вирусного происхождения, что делает маловероятным возможность вирусной репликации. Экспрессия белков капсида (например, Gag) некоторых вирусов (например, вирусов лейкемии мышей, таких как вирус лейкемии мышей Молони (MMLV) приводит к самосборке в частицы похожие на соответствующий нативный вирус, частицы которого свободны от вирусного генетического материала.
[00062] Получено много разнообразных ВПЧ. Например, получены ВПЧ, включающие один или несколько белков капсида, как содержащие, так и не содержащие белки внешней оболочки и/или поверхностные гликопротеины. В ряде случаев ВПЧ не покрыты внешней оболочкой и собираются при экспрессии лишь одного главного белка капсида, как показано для ВПЧ, полученных из гепаднавирусов (например, Engerix™, GSK и Recombivax НВ™, Merck), папилломавирусов (например, Cervarix™, GSK и Gardasil™, Merck), паровирусов или полиомавирусов. Согласно некоторым вариантам реализации ВПЧ покрыты оболочкой и могут включать ряд антигенных белков, обнаруженных в соответствующем нативном вирусе. ВПЧ, как правило, похожи на соответствующий нативный вирус и могут быть поливалентными дисперсными структурами. Согласно некоторым вариантам реализации антигенные белки могут быть представлены внутри ВПЧ в качестве компонента структуры ВПЧ и/или на поверхности ВПЧ. Согласно некоторым вариантам реализации представление антигена в контексте ВПЧ обладает преимуществом для индукции нейтрализующих антител против антигена по сравнению с другими формами представления антигена, например, растворимыми антигенами несвязанными с ВПЧ. Нейтрализующие антитела наиболее часто распознают третичные или четвертичные структуры, что часто требует представления антигенных белков подобных гликопротеинам оболочки в их нативной вирусной конформации. В качестве варианта или дополнения ВПЧ могут быть пригодны для представления антигенов в контексте, который индуцирует клеточный иммунитет (например, ответ Т-лимфоцитов). Согласно некоторым вариантам реализации применение комбинации антигенов в системе ВПЧ может генерировать улучшенный иммунный ответ.
II. Определяемый HCMV
[00063] Как приведено в описании выше, согласно настоящему изобретению, помимо прочего, предложены способы для определения уровней HCMV инфекции в клетках-хозяевах, и как следствие, определения уровней нейтрализующих антител, присутствующих в образце. Настоящее изобретение касается распознавания вирусов HCMV, которые имеют флуоресцентную метку, что позволяет выявить вирусную инфекцию (например, с помощью детекции флуоресценции в клетках после контакта клетки-хозяина с вирусом). Согласно некоторым вариантам реализации уровень HCMV инфекции определяют детекцией флуоресценции, при этом вирус уже преинкубирован с тестируемым образцом (например, образцом сыворотки), полученным от субъекта. Согласно некоторым вариантам реализации субъекту вводили вакцину-кандидата HCMV.
[00064] Предложенные способы используют вирус HCMV, который включает флуоресцентную метку. Любой вирус HCMV, описание которого приведено в тексте данного документа, способный инфицировать клетку-хозяина может быть сконструирован таким образом, чтобы включать флуоресцентную метку. Согласно некоторым вариантам реализации, чтобы инфицировать фибробласты, вирус HCMV, который включает полностью или частично комплекс гликопротеинов gH/gL/gO, может быть сконструирован таким образом, чтобы включать флуоресцентную метку. Согласно некоторым вариантам реализации, чтобы инфицировать эндотелиальные и/или эпителиальные клетки, вирус HCMV, который включает полностью или частично комплекс gH/gL/UL128/UL130/UL131, может быть сконструирован таким образом, чтобы включать флуоресцентную метку. Модифицированные штаммы HCMV, которые доступны для флуоресцентной детекции, известны в данной области техники и могут быть использованы согласно настоящему изобретению. Например, UL32-EGFP-HCMV-TB40 представляет собой продукт in vitro рекомбинации штамма HCMV ТВ40 с плазмидой, несущей ген ТВ40 UL32 слитый с GFP (АТСС; VR-1578). Указанный рекомбинантный штамм UL32-EGFP-HCMV-TB40 дает начало рекомбинантному вирусу HCMV, включающему GFP слитый с С-концевым остатком фосфопротеина ppl50 тегумента, продукта гена UL32 (Sampaio et al, 2005 Journal of Virology 79(5):2754). Поскольку GFP связан с вирусным структурным белком, вирусные частицы проявляют зеленую флуоресценцию при подходящем освещении. Показано, что штамм UL32-EGFP-HCMV-TB40 обладает тропизмом к фибробластам (Sampaio et al., 2005 Journal of Virology 79(5):2754). Еще одним штаммом HCMV, который доступен для флуоресцентной детекции является HB15-tl78b, который содержит геном штамма CMV AD 169 и кассету репортера GFP (Saccoccio et al, 2011 Vaccine 29(15):2705).
[00065] Следует учесть, что термин флуоресценция, как он использован в тексте данного документа, обозначает метку, которая люминисцирует. Обычно, флуоресцентные молекулярные метки содержат электроны, которые могут поглощать электромагнитную энергию на одной длине волны и испускать электромагнитную энергию на второй длине волны. Некоторые белки или низкомолекулярные соединения в клетках обладают природной флуоресценцией (например, НАДН, триптофан, эндогенный хлорофилл, фикоэритрин или зеленый флуоресцентный белок (GFP)). Очевидно, что уже сконструированы разнообразные мутантные формы флуоресцентных белков, которые могут быть использованы согласно настоящему изобретению, такие как, EGFP, синий флуоресцентный белок (например, EBFP, EBFP2, Azurite, mKalamal), голубой флуоресцентный белок (например, ECFP, Cerulean, CyPet), желтый флуоресцентный белок (например, YFP, Citrine, Venus, YPet), потенциал-чувствительный GFP (например, roGFP) и мономерный GFP. GFP и другие флуоресцентные белки могут быть экспрессированы экзогенно в клетках как таковые или в виде белка слияния. Указанный подход позволяет использовать флуоресцентные белки в качестве репортеров для любого количества биологических событий, таких как субклеточная локализация и паттерны экспрессии.
[00066] В качестве варианта или дополнения специфические или неспецифические белки, нуклеиновые кислоты, липиды или низкомолекулярные соединения могут быть помечены внешним флуорофором, флуоресцентным красителем, который может быть низкомолекулярным соединением, белком или квантовой точкой. Приведенные в качестве примера флуорофоры включают, но не ограничены только перечисленными, 1,5 IAEDANS; 1,8-ANS; 4-метилумбеллиферон; 5-карбокси-2,7-дихлорфлуоресцеин; 5-карбоксифлуоресцеин (5-FAM); 5-карбоксинафтофлуоресцеин; 5-карбокситетраметилродамин (5-TAMRA); 5-гидрокситриптамин (5-НАТ); 5-ROX (карбокси-Х-родамин); 6-карбоксиродамин 6G; 6-CR 6G; 6-JOE; 7-амино-4-метилкумарин; 7-аминоактиномицин D (7-AAD); 7-гидрокси-4-1 метилкумарин; 9-амино-6-хлор-2-метоксиакридин (АСМА); ABQ; кислый фуксин; акридиновый оранжевый; акридиновый красный; акридиновый желтый; акрифлавин; акрифлафин Фельген SITSA; экворин (фотопротеин); AFPs - AutoFluorescent Protein~(Quantum Biotechnologies) см. sgGFP, sgBFP; Alexa Fluor® 350; Alexa Fluor® 430; Alexa Fluor® 488; Alexa Fluor® 532; Alexa Fluor® 546; Alexa Fluor® 568; Alexa Fluor® 594; Alexa Fluor® 633; Alexa Fluor® 647; Alexa Fluor® 660; Alexa Fluor® 680; ализарин complexon; ализарин красный; аллофикоцианин (АРС); АМС, AMCA-S; аминометилкумарин (АМС А); АМСА-Х; аминоактиномицин D; аминокумарин; анилиновый синий; антроцил стеарат; АРС-Су7; APTRA-BTC; APTS; астразон бриллиантовый красный 4G; астразон оранжевый R; астразон красный 6В; астразон желтый 7 GLL; атабрин; АТТО-TAG™ CBQCA; ATTO-TAG™ FQ; аурамин; аурофосфин G; аурофосфин; ВАО 9 (бис-аминофенилоксадиазол); BCECF (высокий рН); BCECF (низкий рН); берберин сульфат; бета-лактамаза; BFP blue shifted GFP (Y66H); синий флуоресцентный белок; BFP/GFP FRET; Bimane; Bisbenzemide; Bisbenzimide (Hoechst); bis-BTC; бланкофор FFG; бланкофор SV; BOBO™-l; BOBO™-3; Bodipy492/515; Bodipy493/503; Bodipy500/510; Bodipy; 505/515; Bodipy 530/550; Bodipy 542/563; Bodipy 558/568; Bodipy 564/570; Bodipy 576/589; Bodipy 581/591; Bodipy 630/650-X; Bodipy 650/665-X; Bodipy 665/676; Bodipy Fl; Bodipy FL ATP; Bodipy Fl-Ceramide; Bodipy R6G SE; Bodipy TMR; Bodipy TMR-X conjugate; Bodipy TMR-X, SE; Bodipy TR; Bodipy TR ATP; Bodipy TR-X SE; BO-PRO.TM.-l; BO-PRO.TM.-3; бриллиантовый сульфофлавин FF; BTC; BTC-5N; кальцеин; кальцеин синий; Calcium Crimson™; Calcium Green™; Calcium Green™-1 Ca2+ Dye; Calcium Green®-2 Ca2+; Calcium Green™-5N Ca2+; Calcium Green™-C18 Ca2+; Calcium Orange; калькофлюор белый; карбокси-Х-родамин (5-ROX); Cascade Blue®; Cascade Yellow™; катехоламин; CCF2 (GeneBlazer); С FDA; CFP (голубой флуоресцентный белок); CFP/YFP FRET; хлорофилл; хромомицин A; хромомицин A; CL-NERF; CMFDA; целентеразин; целентеразин cp; целентеразин f; целентеразин fcp; целентеразин h; целентеразин hep; целентеразин ip; целентеразин n; целентеразин О; кумарин фаллоидин; С-фикоцианин; СРМ I метилкумарин; СТС; СТС Formazan; Су2™; Су3.1 8; Су3.5™; Су3™; Су5.1 8; Су5.5™; Су5™; Су7™; Cyan GFP; цАМФ флуоросенсор (FiCRhR); дабцил; дансил; дансил амин; дансил кадаверин; дансил хлорил; дансил DHPE; дансил фторид; DAPI; дапоксил; дапоксил 2; дапоксил 3'DCFDA; DCFH (Dichlorodihydrofluorescem Diacetate); DDAO; DHR (дигидрородамин 123); Di-4-ANEPPS; Di-8-ANEPPS (непропорциональный); DiA (4-Di 16-ASP); Dichlorodihydrofluorescem Diacetate (DCFH); DiD-липофильный трейсер; DiD (DilC18(5)); DIDS; дигидрородамин 123 (DHR); Dil (DilC18(3)); I динитрофенол; DiO (DiOC18(3)); DiR; DiR (Dil CI 8(7)); DM-NERF (высокий рН); DNP; дофамин; DsRed; DTAF; DY-630-NHS; DY-635-NHS; EBFP; ECFP; EGFP; ELF 97; эозин; эритрозин; эритрозин ITC; этидия бромид; этидия гомодимер-1 (EthD-1); эукризин; EukoLight; хлорид европия (111); EYFP; быстрый синий; FDA; Фельген (парарозанилин); FIF (формальдегид-индуцированная флуоресценция); FITC; Flazo Orange; флуо-3; флуо-4; флуоресцеин (FITC); флуоресцеина диацетат; Fluoro-Emerald; Fluoro-Gold (гидроксистилбамидин); Fluor-Ruby; FluorX; FM 1-43®; FM® 4-46; Fura Red™ (высокий рН); Fura Red™/Fluo-3; Fura-2; Fura-2/BCECF; генакриловый бриллиантовый красный В; генакриловый бриллиантовый желтый 10GF; генакриловый розовый 3G; генакриловый желтый 5GF; GeneBlazer; (CCF2); GFP (S65T); GFP красный сдвиг (rsGFP); GFP дикого типа* УФ-возбуждение отсутствует (wtGFP); GFP дикого типа, УФ-возбуждение (wtGFP); GFPuv; глоксаловая кислота; гранулярный синий; гематопорфирин; Hoechst 33258; Hoechst 33342; Hoechst 34580; HPTS; гидроксикумарин; гидроксистилбамидин (FluoroGold); гидрокситриптамин; индо-1, высокий кальций; индо-1 низкий кальций; индодикарбоцианин (DiD); индотрикарбоцианин (DiR); Intrawhite Cf; JC-1; JO JO-1; JO-PRO- 1; LaserPro; лауродан; LDS 751 (DNA); LDS 751 (RNA); лейкофор PAF; лейкофор SF; лейкофор WS; лиссамин-родамин; лиссамин-родамин В; кальцеин/этидий гомодимер; LOLO-1; LO-PRO-1; Lucifer Yellow; Lyso Tracker Blue; Lyso Tracker Blue-White; Lyso Tracker Green; Lyso Tracker Red; Lyso Tracker Yellow; LysoSensor Blue; LysoSensor Green; LysoSensor Yellow/Blue; Mag Green; Magdala Red (флоксин В); Mag-Fura Red; Mag-Fura-2; Mag-Fura-5; Mag-Indo-1; магний зеленый; магний оранжевый; малахитовый зеленый; Marina Blue; I Maxilon Brilliant Flavin 10 GFF; Maxilon Brilliant Flavin 8 GFF; мероцианин; метоксикумарин; Mitotracker Green FM; Mitotracker Orange; Mitotracker Red; митрамицин; Monobromobimane; Monobromobimane (mBBr-GSH); Monochlorobimane; MPS (Methyl Green Pyronine Stilbene); NBD; NBD Amine; Nile Red; Nitrobenzoxedidole; норадреналин; ядерный быстрый красный; i ядерный желтый; Nylosan Brilliant lavin E8G; Oregon Green®; Oregon Green® 488; Oregon Green® 500; Oregon Green® 514; Pacific Blue; парарозанилин (Фельген); PBFI; РЕ-Су5; РЕ-Су7; PerCP; PerCP-Cy5.5; PE-TexasRed (Red 613); Phloxin В (Magdala Red); Phorwite AR; Phorwite BKL; Phorwite Rev; Phorwite RPA; фосфин 3R; PhotoResist; фикоэритрин В [РЕ]; фикоэритрин R [РЕ]; PKH26 (Sigma); PKH67; PMIA; Pontochrome Blue Black; POPO-1; POPO-3; PO-PRO-1; PO-1 PRO-3; примулин; Procion Yellow; пропидия иодид (PI); PyMPO; пирен; пиронин; пиронин В; Pyrozal Brilliant Flavin 7GF; QSY 7; Quinacrine Mustard; Resorufin; RH 414; Rhod-2; родамин; родамин 110; родамин 123; родамин 5 GLD; родамин 6G; родамин В; родамин В 200; родамин В extra; родамин ВВ; родамин BG; родамин Green; родамин фаллицидин; родамин: фаллоидин; родамин Red; родамин WT; бенгальский розовый; R-фикоцианин; R-фикоэритрин (РЕ); rsGFP; S65A; S65C; S65L; S65T; Sapphire GFP; SBFI; серотонин; Sevron Brilliant Red 2B; Sevron Brilliant Red 4G; Sevron I Brilliant Red B; Sevron Orange; Sevron Yellow L; sgBFP.TM. (super glow BFP); sgGFP.TM. (super glow GFP); SITS (примулин; стильбен изотиосулфоновая кислота); SNAFL кальцеин; SNAFL-1; SNAFL-2; SNARF кальцеин; SNARF1; Sodium Green; SpectrumAqua; SpectrumGreen; SpectrumOrange; Spectrum Red; SPQ (6-метокси-N-(3-сульфопропил) хинолиний; стильбен; сульфородамин В и С; сульфородамин Extra; SYTO 11; SYTO 12; SYTO 13; SYTO 14; SYTO 15; SYTO 16; SYTO 17; SYTO 18; SYTO 20; SYTO 21; SYTO 22; SYTO 23; SYTO 24; SYTO 25; SYTO 40; SYTO 41; SYTO 42; SYTO 43; SYTO 44; SYTO 45; SYTO 59; SYTO 60; SYTO 61; SYTO 62; SYTO 63; SYTO 64; SYTO 80; SYTO 81; SYTO 82; SYTO 83; SYTO 84; SYTO 85; SYTOX Blue; SYTOX Green; SYTOX Orange; тетрациклин; тетраметилродамин (TRITC); Texas Red.TM.; Texas Red-X.TM. конъюгат; тиадикарбоцианин (DiSC3); тазиновый красный R; тиазоловый оранжевый; тиофлавин 5; тиофлавин S; тиофлавин TON; Thiolyte; тиозоловый оранжевый; Tinopol CBS (калькофлюор белый); TIER; TO-PRO-1; TO-PRO-3; TO-PRO-5; ТОТО-1; ТОТО-3; Tricolor (РЕ-Су5); TRITC тетраметилродаминизоцианат; True Blue; Tru Red; Ultralite; уранин В; увитекс SFC; wt GFP; WW 781; Х-родамин; XRITC; ксиленовый оранжевый; Y66F; Y66H; Y66W; Yellow GFP; YFP; YO-PRO-1; YO- PRO 3; YOYO-l;YOYO-3; Sybr Green; тиазоловый оранжевый (хелатирующие красители); полупроводниковые наночастицы, такие как квантовые точки; или "запертый" флуорофор (который может быть активирован светом или другим источником электромагнитного излучения), или их комбинация.
III. Инфекционные тесты
[00067] Определение вирусного титра HCMV как правило включает контакт клетки-хозяина восприимчивой к инфицированию HCMV с последовательными разведениями указанного вируса (например, HCMV, который включает флуоресцентную метку) в условиях подходящих для инфицирования клетки при отстутствии какой-либо тестируемой субстанции. Число целевых клеток, экспрессирующих конструкцию репортерного гена (например, флуоресцентную метку, например, GFP) может быть определено (например, методом проточной цитометрии), чтобы вычислить вирусный титр вирусного препарата.
[00068] Чтобы оценить присутствие и/или активность нейтрализующих антител в сыворотке субъекта, которому ввели вакцину-кандидата, указанная сыворотка может быть преинкубирована с HCMV (например, HCMV, который включает флуоресцентную метку, например, GFP) в течение времени достаточного для того, чтобы нейтрализующие антитела уменьшили инфекционность HCMV (например, по меньшей мере 15 минут, по меньшей мере 30 минут, по меньшей мере 1 час, по меньшей мере 2 часа или больше). Последовательные разведения преинкубированной смеси сыворотки и HCMV (например, HCMV, который включает флуоресцентную метку) могут в последствии быть использованы для контакта с клеткой-хозяином восприимчивой к инфицированию HCMV при условиях подходящих для инфицирования. Специалисты в данной области техники смогут определить подходящие разведения сыворотки для тестов инфицирования. Например, согласно некоторым вариантам реализации тестируемые разведения 1:6, 1:12, 1:24, 1:48, 1:96, 1:192 или их комбинации.
[00069] Очевидно, что условия подходящие для инфицирования могут варьировать в зависимости от разнообразных факторов, включая, помимо прочего, вирусный штамм, тип клетки-хозяина, температуры, клеточной конфлюэнтности, вирусной концентрации. Специалисты в данной области техники смогут модифицировать условия инфицирования подходящим образом. Согласно некоторым вариантам реализации условия инфицирования включают инкубацию клетки-хозяина с вирусом в течение, по меньшей мере 1 часа, по меньшей мере 2 часов, по меньшей мере 3 часов, по меньшей мере 4 часов, по меньшей мере 5 часов, по меньшей мере 6 часов, по меньшей мере 7 часов или по меньшей мере 8 часов или больше. Очевидно, также, что наблюдение в течение инфицирования клеток может включать визуальную оценку клеточной морфологии (например, клеточного набухания и округления) и/или визуальную оценку флуоресценции (например, детектируя флуоресценцию при помощи устройства, такого как флуоресцентный микроскоп). После инфицирования клетки-хозяева могут быть собраны (например, промывкой и трипсинизацией и/или соскабливанием) и проанализированы методами флуоресцентной детекции доступными в данной области техники и описание, которых приведено в данном тексте.
[00070] Любая клетка-хозяин подверженная инфицированию HCMV может быть использована в способах, описание которых приведено в данном тексте. Приведенные в качестве примера клетки-хозяева включают, но неограничены ими, фибробласты человека, такие как фибробласты крайней плоти человека (HFF), и эпителиальные клетки человека, такие как пигментированные эпителиальные клетки сетчатки (ARPE-19). Среда, в которой выращиваются клетки-хозяева в течение теста инфицирования, может варьировать в зависимости от типа клеток. Например, согласно некоторым вариантам реализации среда инфицирования для HFF включает MEM + 5% FBS + 1% PenStrep. Согласно некоторым вариантам реализации среда инфицирования для APRE включает DMEM.F-12 + 1% FBS (DMEM -модифицированная по Dulbecco среда Eagle; MEM - минимальная среда Eagle; FBS - фетальная бычья сыворотка; Pen/Strep - раствор пенициллина стрептомицина).
IV. Детекция флуоресценции и оценка нейтрализующих антител
[00071] Флуоресценция может быть детектирована использованием подходящего метода, включая, например, проточный цитометрический анализ, флуоресцентно-активированную клеточную сортировку или проточную микрофлуорометрию. Очевидно, что чувствительность детекции флуоресценции в основном зависит от числа копий флуоресцентных объектов в системе детекции, эффективности измерительного прибора и яркости флуоресценции флуоресцентного объекта относительно фоновой флуоресценции, которая возникает от эндогенных биологических флуоресцентных объектов в образце и от неспецифического связывания флуоресцентного объекта с образцом. Яркость флуоресцентного объекта, в свою очередь, зависит от квантовой эффективности флуоресцентного объекта, который продуцирует флуоресцентный сигнал и светопоглощающей способности (количественно выражаемой коэффициентом экстинкции) флуоресцентного объекта.
[00072] Следует учесть, что клетки могут быть идентифицированы и/или собраны на основании уровня поверхностной и/или внутриклеточной флуоресценции, используя репортерные молекулы, такие как зеленый флуоресцентный белок (GFP). В основном будет наблюдаться корреляция между интенсивностью флуоресценции и продуцированием белка (например, вирусным инфицированием и продуцированием белка). Например, согласно некоторым вариантам реализации высокие уровни интенсивности флуоресценции в клетке-хозяине коррелируют с высоким уровнем вирусного инфицирования клетки-хозяина.
[00073] Согласно некоторым вариантам реализации клетки оценивают по общему уровню флуоресценции (например, вне зависимости от субклеточной локализации флуоресценции). Согласно некоторым вариантам реализации клетки оценивают по уровню флуоресценции в определенной субклеточной локализации (например, ядро) клетки. В основном, проточная цитометрия позволяет проводить количественное фенотипирование большого числа клеток, тем не менее, многие приложения проточной цитометрии лишены возможности визуализировать клетки после того, как они подсчитаны. Согласно некоторым вариантам реализации детекция и количественное определение флуоресценции клеток являются достаточными для оценки инфицирования. Очевидно, что в ряде случаев желательно определить локализацию флуоресценции в пределах клетки. Согласно некоторым вариантам реализации проточный цитометрический анализ клеток может быть комбинирован с визуальной оценкой флуоресценции. Совмещенный анализ уровня флуоресценции и локализации может быть выполнен, используя несколько устройств (например, проточную цитометрию и флуоресцентную микроскопию) или одно устройство. Такие устройства, которые позволяют проводить анализ флуоресценции и/или количественное определение совместно с анализом локализации доступны в данной области техники. Например, lmageStreamx (Amnis®) количественно определяет как интенсивность, так и локализацию флуоресценции и позволяет визуализировать более 50000 клеток в минуту.
[00074] Уровни клеточной флуоресценции могут быть количественно определены подходящим методом известным в данной области техники. Уровни клеточной флуоресценции могут сравниваться с контрольным уровнем. Согласно некоторым вариантам реализации указанный контрольный уровень является предварительно определенным или ранее определенным контрольным уровнем. Согласно некоторым вариантам реализации указанный контрольный уровень получают параллельным сравнением с контрольным образцом (например, положительным или отрицательным контролем).
[00075] Появление способов скрининга и селекции, которые используют проточную цитометрию и сортировку клеток значительно увеличило количество клеток, которые могут быть подвергнуты скринингу. Например, несколько миллионов клеток могут быть подвергнуто скринингу за короткое время, и субпопуляции и единичные клетки могут быть выделены из смешанных клеточных популяций, даже если они представлены с низкой частотой, до 10-6 в пределах популяции. Очевидно, что одним из преимуществ предложенных способов является то, что оценка образца может быть выполнена по типу высокопроизводительного анализа. Согласно некоторым вариантам реализации предложенные способы повышают производительность на 10%, 20%, 30%, 40%, 50%, 60%, 70% или больше по сравнению с известными способами детекции инфицирования и/или нейтрализующих антител (например, окрашивание вирусных белков, флуоресцентная микроскопия, ELISPOT и т.д.). Предложенные способы могут быть выполнены в формате многоячеечного планшета и поэтому особенно подходят для применения при скрининге производительностью от средней до высокой. Согласно некоторым вариантам реализации многоячеечные планшеты имеют 96 ячеек. Согласно некоторым вариантам реализации многоячеечные планшеты имеют другое число ячеек, которое включают планшеты, но не ограничено только перечисленными, а именно 6, 12, 24, 384, 864 или 1536 ячеек. Термины "многоячеечный планшет" и "микротитровочный планшет" используются взаимозаменяемо.
[00076] Согласно некоторым вариантам реализации анализируют живые клетки. Согласно некоторым вариантам реализации клетки фиксируют перед анализом.
[00077] Согласно некоторым вариантам реализации настоящего изобретения предложены способы для измерения нейтрализующих антител к HCMV путем корреляции детекции флуоресценции и/или вирусного инфицирования клеток-хозяев. Например, HCMV, содержащий флуоресцентную метку (например, GFP) может быть преинкубирован с сывороткой, полученной от субъекта, иммунизированного вакциной-кандидатом HCMV. Нейтрализующие антитела, присутствующие в сыворотке, уменьшат инфекционность HCMV (например, HCMV, содержащий флуоресцентную метку) в отношении клетки-хозяина, которая обычно подвержена инфицированию HCMV. Преинкубированная смесь, включающая HCMV (например, HCMV, содержащий флуоресцентную метку) и сыворотку может быть далее использована для контакта с такой клеткой-хозяином, и уровни флуоресценции клетки-хозяина могут быть оценены. Основываясь на уровнях флуоресценции в клетке-хозяине, может быть определен уровень инфицирования клетки-хозяина. Уровень инфицирования клетки-хозяина в основном связан обратной зависимостью с присутствием и количеством нейтрализующих антител в сыворотке, которые в свою очередь, коррелируют с эффективностью вакцины-кандидата в отношении способности вызывать терапевтический ответ (например, защитный иммунный ответ). Например, чем эффективнее вакцина-кандидат в отношении индукции нейтрализующих антител у субъекта, тем больше нейтрализующих антител будет присутствовать в сыворотке, в свою очередь, соответствуя уменьшению способности HCMV, который включает флуоресцентную метку, инфицировать клетку-хозяина после преинкубации с сывороткой, далее соответствуя уменьшению детекции флуоресценции в клетке-хозяине после ее контакта с HCMV, который включает флуоресцентную метку. Согласно некоторым вариантам реализации способы, предложенные согласно настоящему изобретению, возможно, включают отбор и/или идентификацию, основанные на корреляции, описание которой приведено в тексте данного документа, вакцины-кандидата (например, вакцины-кандидата HCMV) в качестве вакцины, которая индуцирует нейтрализующие антитела.
ПРИМЕРЫ
[00078] В следующих примерах дано описание некоторых приведенных в качестве примера способов получения и практического применения определенных композиций, описание которых приведено в тексте данного документа. Следует учесть, что указанные примеры даны только в целях иллюстрации и не предполагают ограничения объема композиций и способов, описание которых приведено в тексте данного документа.
Пример 1: Иммунизация кроликов вирусоподобными частицами
[00079] В указанном Примере дано описание приведенной в качестве примера иммунизации кроликов вирусоподобными частицами, содержащими различные рекомбинантные антигены HCMV.
[00080] Клетки HEK 293Т (АТСС, CRL-11268) трансфицировали случайно, используя кальций фосфатные методы, плазмидами экспрессии, кодирующими различные рекомбинантные антигены HCMV. Экспрессию различных антигенов HCMV клетками HEK 293 подтверждали методом проточной цитометрии. Через 48-72 часа после трансфекции супернатанты, содержащие ВПЧ, собирали и фильтровали через мембрану с размером пор 0,45 мкм и, далее, концентрировали и очищали с помощью ультрацентрифугирования через слой 20% сахарозы (ротор SW32 Beckman 25000 об./мин, 2 часа, 4°С). Осадок ресуспендировали в стерильном свободном от эндотоксинов PBS (фосфатно-солевой буфер) (GIBCO), чтобы получить в 500 раз более концентрированные стоковые аликвоты ВПЧ. Общий белок определяли в аликвоте с помощью набора (BioRad) для количественного анализа по Bradford. Очищенные ВПЧ хранили при -80°С до использования.
[00081] Кроликов иммунизировали внутримышечным введением ВПЧ на t=0 и t=8 неделе, как указано ниже в Таблице 1. Сыворотку собирали на t=4, 6, 8, 10, 13 и 16 неделе.
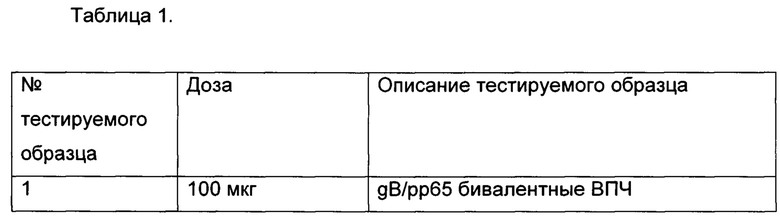
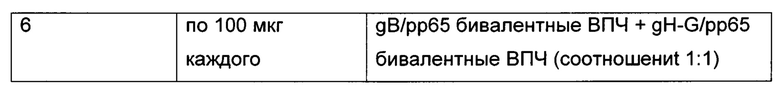
[00082] Чтобы определить содержание IgG к HCMV в сыворотке кроликов, проводили иммуноферментный анализ (ИФА). На Фиг. 1 показаны данные, свидетельствующие о мощном и продолжительном иммунитете у кроликов, иммунизированных gB/рр65 бивалентными ВПЧ (вверху) и gB/рр65 бивалентными ВПЧ + gH-G/pp65 бивалентными ВПЧ (внизу).
Пример 2: Нейтрализующая активность по данным проточной цитометрии
[00083] В данном Примере приведено описание оценки ответов нейтрализующих антител к HCMV в сыворотке иммунизированных животных. Цели данного Примера включают, но не ограничены только перечисленным: 1) подтверждение иммуногенности клинических компонентов-кандидатов CMV, выбранных из других исследований на животных; 2) оценка дозы и потенциального синергизма и/или антагонизма со способами введения (например, внутримышечное в сравнении с внутрибрюшинным введением); и 3) оценка иммунологического усиления и стойкости иммунитета.
[00084] Образцы сыворотки от кроликов, иммунизированых Тестируемым Образцом №6 из Примера 1, собирали в моменты времени t=0 (P0V) и t=2 недели (P2Vd14). Объединенные, инактивированные нагреванием (HI) образцы от указанной группы далее тестировали на активность нейтрализующих антител, описание чего приведено ниже.
[00085] Образцы сыворотки разводили от 1/6 до 1/96. Использовали клетки HFF (Р=9, использованы через 24 часа после высевания) и свежесобранный вирус ТВ40-230212. Вирус ТВ40-230212 является потомком ТВ40-010212. ТВ40-010212 получали из (АТСС VR-1578; герпесвирус человека 5; UL32-EGFP-HCMV-TB40). Длительность вирусного инфицирования составляла 15 дней в колбе Т150 (Таблица 2). Микроскопические наблюдения показали, что вирус был инфектогенным. Среда инфицирования представляла собой среду инфицирования TB40-HFF-1 (MEM+5%FBS+l%Pen/Strep) или среду инфицирования VR1814-APRE-19 (DMEM:F-12+1%FBS).

[00086] HFF, высеянные в колбу Т150, инфицировали CMV ТВ40-010212 (5 флаконов) + 20 мл среды инфицирования (MEM - Минимальная среда Eagle от Sigma Cat.No. М4655+ 5% FBS + 1% P/S). Инфицирование клеток прошло успешно после выдерживания в СО2 инкубаторе при 37°С в течение 15 дней. Вирус собирали удалением почти всего супернатанта из колбы и помещением его в 50 мл пробирку Falcon. Оставшийся супернатант, приблизительно 5-7 мл, служил для облегчения соскабливания клеток при помощи клеточного скребка (NUNC, Cat# 179707). После соскабливания интенсивное пипетирование забор/сброс (до 10 раз) облегчало высвобождение вируса из клеток. Добавляли половину первоначального объема супернатанта из пробирки Falcon (сса. 8 мл), чтобы получить более активный вирус.
[00087] Пять пробирок ТВ40-010212 (вирус-предшественик) доставали из жидкого азота и инфицировали содержимое одной колбы Т150, инкубированной при 37°С, 5% СО2 в течение 1 часа. После инкубации добавляли 12 мл среды инфицирования. Вирус концентрировали в 15 мл супернатанта.
[00088] Cytogam™ (CMV-IGIV - цитомегаловирусный иммуноглобулин для внутривенного введения - человеческий; CSL Behring; коммерчески доступные концентрации 2,5 г/50 мл или 50 мг/мл) использовали в качестве положительного контроля. Приготовили разведение 1/20 в качестве основной концентрации (разведение 1 к 20: 100 Cytogam™ 50 мг/мл + 1900 среды инфицирования) и позднее использовали ее для приготовления разведений, такие же разведения использовали для сывороток кроликов. Cytogam™ инактивировали нагреванием при тех же условиях, что и сыворотки кроликов (описание приведено ниже в Таблицах 3-5).
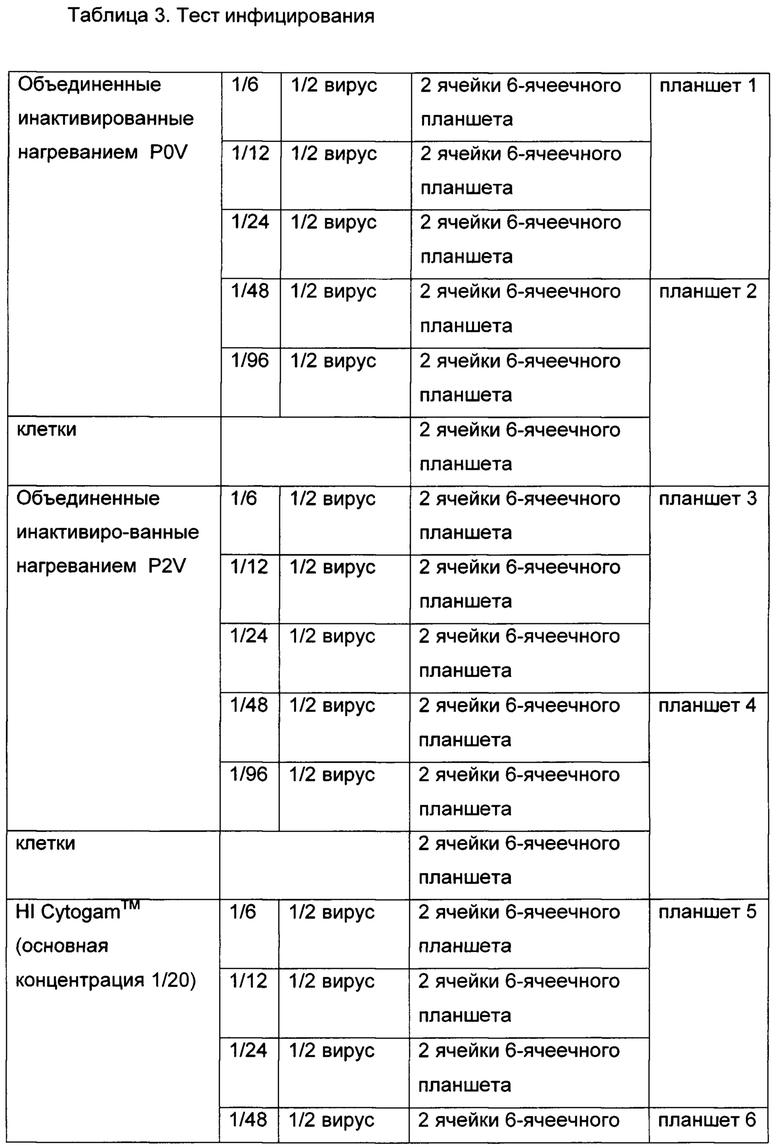
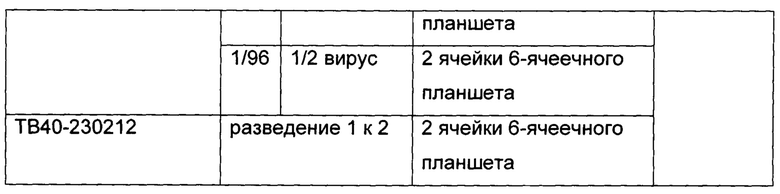
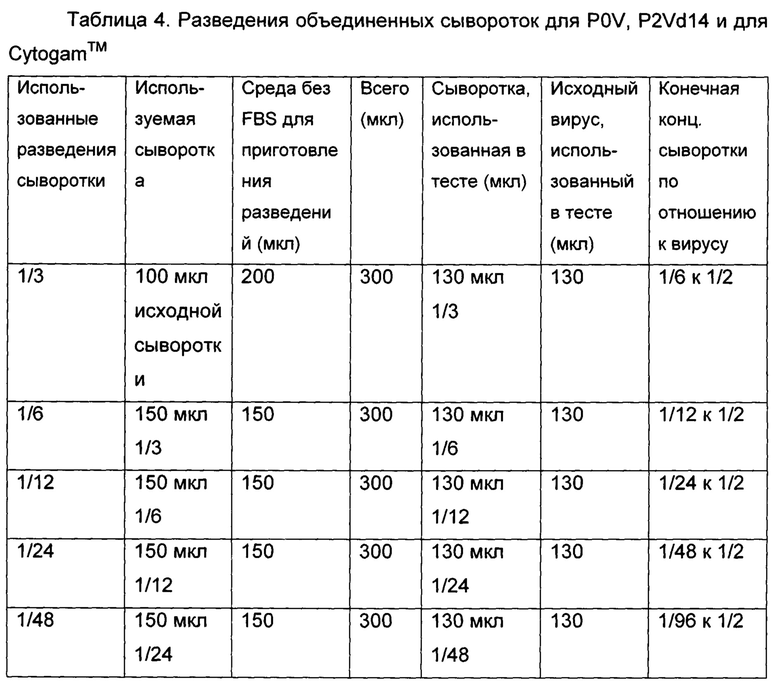
[00089] Каждую отдельную концентрацию сывороток или Cytogam и 1/2 конечного разведения вируса комбинировали и центрифугировали при 37°С в течение 1 часа. Готовые к использованию 6-ячеечные планшеты с клетками HFF 95-100% конфлюэнтности аккуратно промывали дважды теплым PBS, затем наносили смесь вирус-сыворотка в параллелях в виде 100 мкл смеси на ячейку + 200 мкл среды инфицирования, чтобы избежать высыхания в течение свыше 4 часов. Инкубировали при 37°С/5% СО2/4 часа (встряхивали каждые 60 минут). После 4 часа инкубации, содержимое аккуратно аспирировали из каждой ячейки с помощью пипетки и добавляли 3 мл свежей среды инфицирования. Планшеты выдерживали в инкубаторе при 37°С/5% СО2 в течение 10 дней. Ежедневные проверки вирусной инфекции в клетках проводили, как правило, начиная с 5 дня после инфицирования. Набухание и округление клеток визуализировали с помощью светового микроскопа или детекцией зеленой флуоресценции с помощью флуоресцентного микроскопа.
[00090] Для сбора образцов, среду аспирировали из каждой ячейки. Каждую ячейку промывали дважды PBS (HyClone DPBS/модифицированая без кальция и магния; Cat#SH30028.02) и добавляли 100 мкл IX трипсин-ЭДТА (Sigma; Cat#T4174-100 ml) и 100 мкл PBS. Образцы выдерживали в CO2 инкубаторе 2-3 минуты, пока клетки не были трипсинизированы в достаточной степени. Добавляли 1 мл на ячейку PBS+5% FBS, чтобы инактивировать трипсин. Образцы собирали в прозрачные пробирки для предназначенные для проточной цитометрии (две ячейки для одного и того же образца/пробирки) (BD Falcon, 5 мл полистирол круглодонные, REF 352054). Планшеты проверяли под световым микроскопом, чтобы подтвердить, что все клетки собраны (иначе добавляли дополнительно 500 мкл PBS+5% FBS, чтобы собрать остаток). Образцы центрифугировали на 900 об./мин в течение 10 минут). Супернатант отбрасывали, а осадок оставляли. Пробирку перемещивали на вортексе, так, чтобы диспергировать осадок в остатке буфера. Оставшиеся стадии выполняли при минимальной освещенности. 200 мкл фиксатива (BD Biosciences, BD Cytofix, Fixation buffer Cat#554655, 100 ml) добавляли и инкубировали на льду в течение 15 минут. 1 мл на пробирку смеси PBS+5% FBS добавляли, чтобы инактивировать Cytofix. Образцы центрифугировали на 900 об/мин в течение 10 минут. Супернатант отбрасывали, а осадок оставляли. Осадок разводили в 500 мкл PBS+5% FBS и энергично перемешивали на вортексе перед помещением в проточный цитометр.
[00091] Образцы подвергали проточной цитометрии и анализировали, используя компьютерную программу Cellquest. Параметры FSC и SSC были установлены как "linear", тогда как другие параметры были установлены как "log.". В ходе проточно-цитометрического анализа инфицированных клеток было собрано 100000 клеток. Обычные установки потока при использовании HFF клеток и ТВ40 CMV были FSC Е-l и 4,83; SSC 325; FL1 427, хотя параметры могут быть слегка изменены относительно существующих установок, чтобы получить более подходящую точечную диаграмму.
[00092] На Фиг. 2 представлены результаты проведенного в качестве примера FACS анализа экспрессии GFP в фибробластах показательные в отношении ответа нейтрализующих антител у кроликов, индуцированного gB/pp65 CMV ВПЧ. Кроликов (n=6/группа) иммунизировали (IM) дважды на 0 и 8 неделе, а через 2 недели производили забор крови. Сыворотки объединяли и тестировали в указанных разведениях в сравнении с Cytogam™ в сходных разведениях в отношении GFP-экспрессирующего CMV вируса (ТВ40) в фибробластах HFF. 100000 клеток собирали в ходе проточного цитометрического анализа инфицированных (GFP+) клеток.
[00093] На Фиг. 3 представлены результаты проведенного в качестве примера FACS анализа экспрессии GFP в фибробластах показательные в отношении ответа нейтрализующих антител у кроликов, индуцированного gB + gH CMV ВПЧ. Кроликов (n=6/группа) иммунизировали (IM) дважды на 0 и 8 неделе, а через 2 недели производили забор крови. Сыворотки объединяли и тестировали в указанных разведениях в сравнении с Cytogam™ в сходных разведениях в отношении GFP-экспрессирующего CMV вируса (ТВ40) в фибробластах HFF. 100000 клеток собирали в ходе проточного цитометрического анализа инфицированных (GFP+) клеток.
Пример 3: Приведенный в качестве примера тест микронейтрализации для детекции нейтрализующих антител с помощью проточной цитометрии
[00094] В данном Примере приведено описание детекции функциональных нейтрализующих антител к CMV с помощью проточной цитометрии в образцах сыворотки от вакцинированных животных.
Оборудование и материалы
[00095] В данном тесте использованы следующее оборудование и материалы: Фибробласты крайней плоти человека (HFF-1) АТСС# SCRC-1041; Пигментированный эпителий сетчатки человеческого происхождения (ARPE-19) - ATCC#CRL-2302; Герпесвирус человека 5 HCMV (UL32-EGFP-HCMV-TB40) -АТСС# VR-1578; Человеческий CMV-GFP-Towne TS15-rR (получен от Dr. М. McVoy, VCU-Virginia); Антисыворотка коз к IgG кролика (GAR) MP Cappel, Cat#: 55620; Комплемент-содержащая сыворотка кролика Sigma-Aldrich Cat#S7764-5 ml; Стандартный комплемент морской свинки Cedarlane Cat#CL-5000; Стерильная дистиллированная вода Gibco, Cat#15230; Модифицированная по Dulbecco среда Eagle (DMEM) HyClone; Cat# SH30243.01 (ростовая среда); Минимальная среда Eagle (MEM) Sigma; Cat# M4655-500 ml (среда инфицирования); Фетальная бычья сыворотка (FBS) HyClone; Cat# SH30396.03; Раствор пенициллина стрептомицина (Pen/Strep) Sigma; Cat# Р0781-100 ml; IX трипсин-ЭДТА - Sigma; Cat#T4174-100 ml; Модифицированный фосфатно-буферный физраствор (DPBS - без кальция и магния) HyClone; Cat# SH30028.02; Фиксирующий буфер BD Biosciences; BD Cytofix Cat#554655-100 ml; Cytogam (CMV-IGIV - цитомегаловирусный иммуноглобулин для внутривенного введения/человеческий CSL Behring; закупленная в концентрации 2,5 г/50 мл; Диметилсульфоксид (DMSO) Sigma-Aldrich Cat# D1435-500 ml; Бокс биологической безопасности; Инкубатор 5% CO2, 37°С; Центрифуга; Вортекс; Пробирки для образцов для проточного цитометра (BD Falcon, 5 мл полистирол круглодонные, REF 352054); 6-ячеечные планшеты; Емкости для многоканальных механических дозаторов; Градуированные пипетки на 5 и 10 мл; Одноканальные механические дозаторы переменного объема от 10 до 1000 мкл с сменными одноразовыми наконечниками; Клеточный скребок NUNC; Cat# 179707; 50 мл пробирки Falcon BD 358206; Встряхиватель для пробирок эппендорф; Флуоресцентный микроскоп; Устройство F AC SCAN.
Получение и сбор вируса
[00096] Клетки HFF-1 (конфлюэнтность монослоя, высеянного в колбу Т 150 составляла 95%) инфицировали 1,5 мл UL32-EGFP-HCMV-TB40 ("ТВ40"). Клетки ARPE-19 инфицировали HCMV-GFP-Towne-TS15-rR ("Towne") таким же способом. Поскольку данные вирусы являются светочувствительными, клетки инфицировали при выключенном освещении. Колбы инкубировали в СО2 инкубаторе при 37°С в течение 30 минут, чтобы произошло соединение клеток и вируса.
[00097] Затем к клеткам добавляли 25 мл среды инфицирования (см. Таблицу 6 и 7). Колбы выдерживали в СО2 инкубаторе при 37°С, пока клетки не были инфицированы в достаточной степени (в случае ТВ40 набухание и округление клеток наблюдали с помощью светового микроскопа или с помощью зеленой флуоресценции, используя флуоресцентный микроскоп). Время необходимое для нужной степени инфицирования зависит от инфектогенной способности указанного вируса-предшественника.
[00098] Сбор начинали удалением почти всего супернатанта из колбы и помещения его в стерильном виде в 50 мл пробирки Falcon. Оставшийся супернатант, приблизительно 5 мл, облегчал соскабливание клеток клеточным скребком. Тщательное соскабливание и интенсивное пипетирование забор/сброс (до 10 раз) позволяло высвободить вирус из клеток. Добавляли 10 мл от первоначального объема супернатанта из пробирки Falcon и центрифугировали при 900 об./мин в течение 10 минут. Осадок удаляли и получали приблизительно 15 мл концентрированного вируса. Добавляли 5% криопротектора (DMSO) к общему количеству вируса. Приготовляли аликвоты по одному мл, помечали и хранили в течение короткого времени при -80°С или длительно в жидком азоте.
Постановка и способ эксперимента
[00099] Образцы сыворотки, полученные забором крови у иммунизированных животных, перед использованием инактивировали нагреванием при 56°С в течение 30 минут. Производимую промышленно сыворотку Cytogam, которая служила положительным контролем, также инактивировали нагреванием. Разведения сыворотки приготовляли, начиная с 1/6 до необходимых разведений в параллелях. Cytogam тестрировали при сравнимых разведениях, перед разведением стокового реагента 1:20, чтобы установить lg содержания человеческих/крольичих сывороток (см. Таблицу 8).
[000100] Определенные концентрации сыворотки (Cytogam) и вируса комбинировали и перемешивали при 37°С в течение 1 часа. В некоторах тестах включали комплемент. Для тестов, использующих комплемент и клетки HFF, добавляли 10% стандартного комплемента морской свинки к каждой отдельной смеси сыворотка (Cytogam)/вирус. Контроль вируса проводили таким же образом. Для тестов, использующих комплемент и клетки ARPE-19, добавляли 2,5% комплемента морской свинки к каждой смеси, несмотря на то, какой вид использовали (кролик или сыворотка). Указанные сыворотки и вирус перемешивали в ротационном шейкере при 37°С в течение 1 часа.
[000101] Клетки 95% конфлюэнтности (высеянные в 6-ячеечные планшеты) аккуратно промывали дважды теплым PBS перед нанесением смеси вирус-сыворотка. 100 мкл смеси на ячейку + 200 мкл среды инфицирования добавляли, чтобы избежать высыхания в течение свыше 4 часов инкубации. Клетки инкубировали при 37°С/5% СО2/4 часа (встряхивали каждые 60 минут). После 4 часа инкубации, содержимое аккуратно аспирировали из каждой ячейки с помощью пипетки и добавляли 3 мл соответствующей свежей теплой среды инфицирования. Планшеты инкубировали при 37°С/5% СО2, пока не происходило инфицирование в достаточной степени. Через 5 дней после инкубации клетки анализировали на наличие вирусной инфекции. Инфекцию клеток HFF-1 определяли по набуханию и округлению клеток, визуализированным с помощью светового микроскопа или детекцией зеленой флуоресценции с помощью флуоресцентного микроскопа. Инфекцию клеток ARPE-19 детектировали по зеленой флуоресценции с помощью флуоресцентного микроскопа.
Сбор образцов и подготовка к проточной цитометрии
[000102] Перед сбором образцов наличие выраженной в достаточной степени инфекции подтверждали с помощью светового микроскопа и, при возможности, анализом GFP, интегрированного в клетки, используя флуоресцентный микроскоп. Среду аспирировали или сливали из каждой ячейки. Клетки дважды промывали PBS (HyClone DPBS/модифицированая без кальция и магния; Cat#SH30028.02). К клеткам HFF-1 добавляли 100 мкл IX трипсин-ЭДТА (Sigma; Cat#T4174-100 ml) и 200 мкл PBS. К клеткам ARPE-19 добавляли 200 мкл IX трипсин-ЭДТА и 100 мкл PBS. Клетки выдерживали в СО2 инкубаторе 2-3 минуты, пока клетки не были трипсинизированы в достаточной степени. Добавляли 1 мл на ячейку PBS+5% FBS, чтобы инактивировать трипсин. Клетки собирали в прозрачные flow intended пробирки (две ячейки для одного и того же образца/пробирки) (BD Falcon, 5 мл полистирол круглодонные, REF 352054). Ячейки проверяли под световым микроскопом, и если клетки оставались, добавляли дополнительно 500 мкл PBS+5% FBS, чтобы собрать дополнительные клетки.
[000103] Пробирки Falcon центрифугировали на 900 об./мин в течение 10 минут. Супернатант отбрасывали, а осадок оставляли. Пробирку откручивали на вортексе, так, чтобы диспергировать осадок в остаточном буфере. Оставшиеся стадии выполняли в темноте. 200 мкл Cytofix (BD Biosciences, BD Cytofix, Fixation buffer Cat#554655, 100 ml) добавляли в каждую пробирку и образцы инкубировали на льду в течение 15 минут. 1 мл смеси PBS+5% FBS добавляли в каждую пробирку, чтобы инактивировать Cytofix. Пробирки центрифугировали на 900 об./мин в течение 10 минут. Супернатант выливали, а осадок оставляли. Осадок разводили в 500 мкл PBS+5% FBS и энергично перемешивали на вортексе и проводили проточную цитометрию.
Пример 4: Активность нейтрализации приведенных в качестве примера ВПЧ у кроликов
[000104] Клетки СНО трансфицировали при клеточной плотности от 1.5Е06 до 2.0Е06 клеток/мл плазмидами моновалентного gB-G и моновалентного gH-G (полученных согласно описанию, приведенному в PCT/US 2012/64556). Чтобы довести общую концентрацию ДНК до 1 мкг/мл клеточной культуры, добавляли искусственную межгенную последовательность ДНК (спейсер). Плазмиды, использованные для трансфекции вначале очищали с помощью наборов для очистки плазмид MaxiPrep или GigaPrep (Qiagen). PEIMAX, использованный для трансфекции, чтобы доставлять ДНК в клетки, применяли в соотношении 6:1 (PEL DNA масс/масс). Клеточную культуру собирали через 72 часа после трансфекции центрифугированием в 1 литровых бутылях при 4000 об./мин в течение 20 минут, используя ротор JS-4.2A производства Beckman Coulter. Супернатант фильтровали через 0,8/0,45 мкм фильтр (AcroPak 500 Capsule, Pall). Отфильтрованный супернатант затем концентрировали фильтрацией в тангенциальном потоке (TFF для концентрации ВПЧ) и диафильтрацией против гистидин-содержащего буфера. 70 мкл бензоназы (Novogen степень чистоты 99% (D00127703), содержащей 250 Ед/л) диспергировали в 400 мкл PBS с добавкой MgCl2 до конечной концентрации 2 mM. Порции TFF ретентата смешивали с разбавленной бензоназой в растворе PBS и помещали в роторный шейкер (тщательное перемешивание) при комнатной температуре в течение 1 часа, затем указанные пробирки помещали на ночь на 4°С. Потом диафильтрованный, обработанный бензоназой материал, загружали в анионообменную хроматографическую колонку (АЕХ для уменьшения содержания общей ДНК и белков хозяина), собирали элюат. Элюат затем стерилизовали фильтрацией через 0,45 мкм и разделяли на аликвоты разных объемов.
[000105] Композиции моновалентных gB-G и моновалентных gH-G ВПЧ, полученные как указано выше, смешивали, добавляли алюминиевый адъювант и после этого тестировали на самках Новозеландского белого кролика в возрасте 6-8 недель (минимум 5 животных в каждой группе тестирования) в отношении нейтрализующей активности, используя тест микронейтрализации, описание которого приведено в Примере 3. Кроликов иммунизировали внутримышечной инъекцией 0,5 мл (250 мкл в две точки проксимальной каудальной мыщцы бедра композиций ВПЧ, трижды, один раз на день 0 (первичная иммунизация), один раз на 57 день (8 неделя бустерная иммунизация) и один раз на 162 день (24 неделя бустерная иммунизация). Кролики получили по 50 мкг обеих моновалентных gB-G и моновалентных gH-G (смешанных в соотношении 1:1) композиций ВПЧ. Чтобы оценить гуморальные иммунные ответы у кроликов, производили забор крови у всех кроликов, участвующих в исследовании перед первой иммунизацией и после первой иммунизации на 28, 42 и 55 день и после второй иммунизации на 14 день.
[000106] Ответы нейтрализующих антител к HCMV определяли, используя тест микронейтрализации на фибробластах, основанный на GFP-экспрессирующем вирусе CMV (ТВ40) и проточноцитометрическом анализе инфицированных (GFP+) клеток HFF-1, описание которого приведено ранее. Сыворотки кроликов, собранные перед и после иммунизации, как указано выше, объединяли и тестировали на нейтрализующую активность, в присутствии комплемента морской свинки, в отношении HCMV, экспрессирующего GFP в фибробластах HFF, относительно положительного контроля гиперглобулина CMV, Cytogam™ и отрицательного контроля, состоящего из "пустых" Gag ВПЧ (лишенных антигенных белков gB-G и/или gH-G).
[000107] На Фиг. 4 представлено процентное количество нейтрализаций в клетках HFF-1, инкубированных с вирусом CMV-GFP-TB40-010512, в присутствии 10% комплемента морской свинки, и сывороткой кролика (объединенную сыворотку группы 7 из исследования 15RA09 использовали в качестве представления положительного контроля, при этом животные получали моновалентные gB-G и моновалентные gH-G ВПЧ трижды, а также группу 8 из исследования 15RA05 (пустой Gag) использовали в качестве отрицательного контроля). Как показано на Фиг. 4 комбинация моновалентных gB-G и моновалентных gH-G композиций ВПЧ вызывала быстрый, синергичный продолжительный ответ нейтрализующих антител кроликов против инфекции фибробластов, тогда как "пустые" Gag ВПЧ не проявили ответа нейтрализующих антител. ("GFP-TB40-010512" обозначает герпесвирус человека 5 HCMV (UL32-EGFP-HCMV-TB40) - АТСС# VR-1578 (описание приведено в Примере 3) продуцирован 1 мая 2012).
[000108] Объединенные сыворотки кролика также тестировали на ответ нейтрализующих антител в отношении HCMV, используя тест микронейтрализации на эпителиальных клетках, основанный на GFP-экспрессирующем вирусе HCMV (Towne TS15-rR) и проточноцитометрическом анализе инфицированных (GFP+) клеток ARPE-19, описание которого приведено ранее. Сыворотки кроликов, собранные перед и после иммунизации, как указано выше, объединяли и тестировали на нейтрализующую активность, в присутствии 2,5% комплемента кролика, в отношении HCMV, экспрессирующего GFP в эпителиальных клетках ARPE-19, относительно положительного контроля гиперглобулина CMV, Cytogam™ и отрицательного контроля, состоящего из пустых Gag ВПЧ (лишенных антигенных белков gB-G и/или gH-G).
[000109] На Фиг. 5 представлено процентное количество нейтрализаций в клетках ARPE-19, инкубированных с вирусом CMV-GFP-Towne-150612, в присутствии 2,5% комплемента кролика, и сывороткой кролика (объединенную сыворотку группы 7 из исследования 15RA09 использовали в качестве положительного контроля, при этом животные получали моновалентные gB-G и моновалентные gH-G ВПЧ трижды, а также группу 8 из исследования 15RA05 ("пустой" Gag) использовали в качестве отрицательного контроля). Как показано на Фиг. 5 комбинация моновалентных gB-G и моновалентных gH-G композиций ВПЧ вызывала быстрый, синергичный продолжительный ответ нейтрализующих антител кроликов против инфицирования эпителиальных клеток, тогда как "пустые" Gag ВПЧ не проявили ответа нейтрализующих антител. ("GFP-Towne-150612" обозначает Human CMV-GFP-Towne TS15-rR (получен от Dr. М. McVoy, VCU-Virginia, описание приведено в Примере 3) продуцирован 15 июня 2012).
Другие варианты реализации настоящего изобретения
[000110] Другие варианты реализации настоящего изобретения должны быть очевидны специалистам в данной области техники исходя из содержания настоящего описания или практических реализаций изобретения, раскрытых в тексте данного документа. Предполагается, что данное описание и примеры приведены только в иллюстративных целях, при этом действительный объем изобретения определен формулой изобретения. Содержание любого литературного источника, приведенного в тексте данного документа, включено в данный документ во всей полноте посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ЦИТОМЕГАЛОВИРУСА | 2012 |
|
RU2737530C1 |
| УСЛОВНО РЕПЛИЦИРУЮЩИЙСЯ ЦИТОМЕГАЛОВИРУС В КАЧЕСТВЕ ВАКЦИНЫ ПРОТИВ CMV | 2012 |
|
RU2611198C2 |
| УСЛОВНО РЕПЛИЦИРУЮЩИЙСЯ ЦИТОМЕГАЛОВИРУС В КАЧЕСТВЕ ВАКЦИНЫ ПРОТИВ CMV | 2012 |
|
RU2670012C1 |
| ПЛАТФОРМЫ ДОСТАВКИ АНТИГЕНОВ | 2011 |
|
RU2597974C2 |
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ ЦИТОМЕГАЛОВИРУС ЧЕЛОВЕКА, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2469045C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЧАСТИЦЫ HCMV | 2008 |
|
RU2505314C2 |
| МОДИФИКАЦИЯ РЕКОМБИНАНТНОГО АДЕНОВИРУСА ИММУНОГЕННЫМИ ЭПИТОПАМИ БЕЛКА CIRCUMSPOROZOITE ПЛАЗМОДИЯ | 2010 |
|
RU2585228C2 |
| АНТИТЕЛО К ЦИТОМЕГАЛОВИРУСУ ЧЕЛОВЕКА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2817217C1 |
| ПОЛУЧЕНИЕ ВИРУСНОГО ВЕКТОРА | 2014 |
|
RU2658487C2 |
| ГЕНЫ, КОДИРУЮЩИЕ ГЛАВНЫЙ КАПСИДНЫЙ БЕЛОК L1 ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2494106C2 |
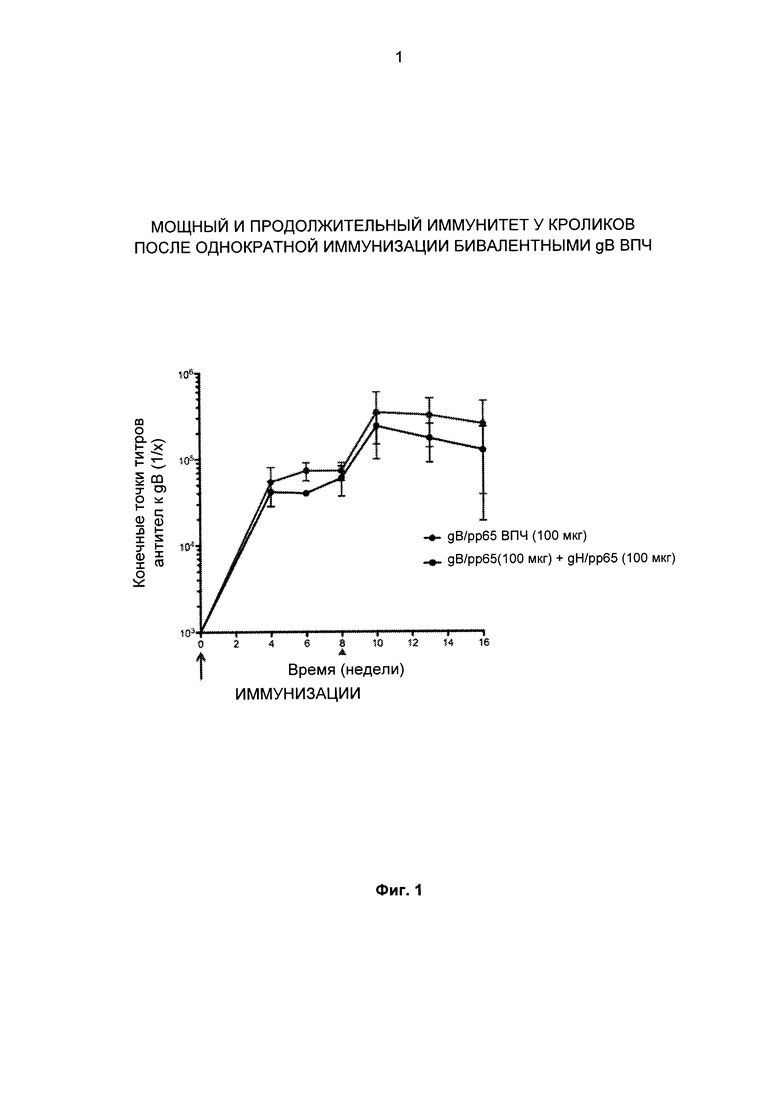

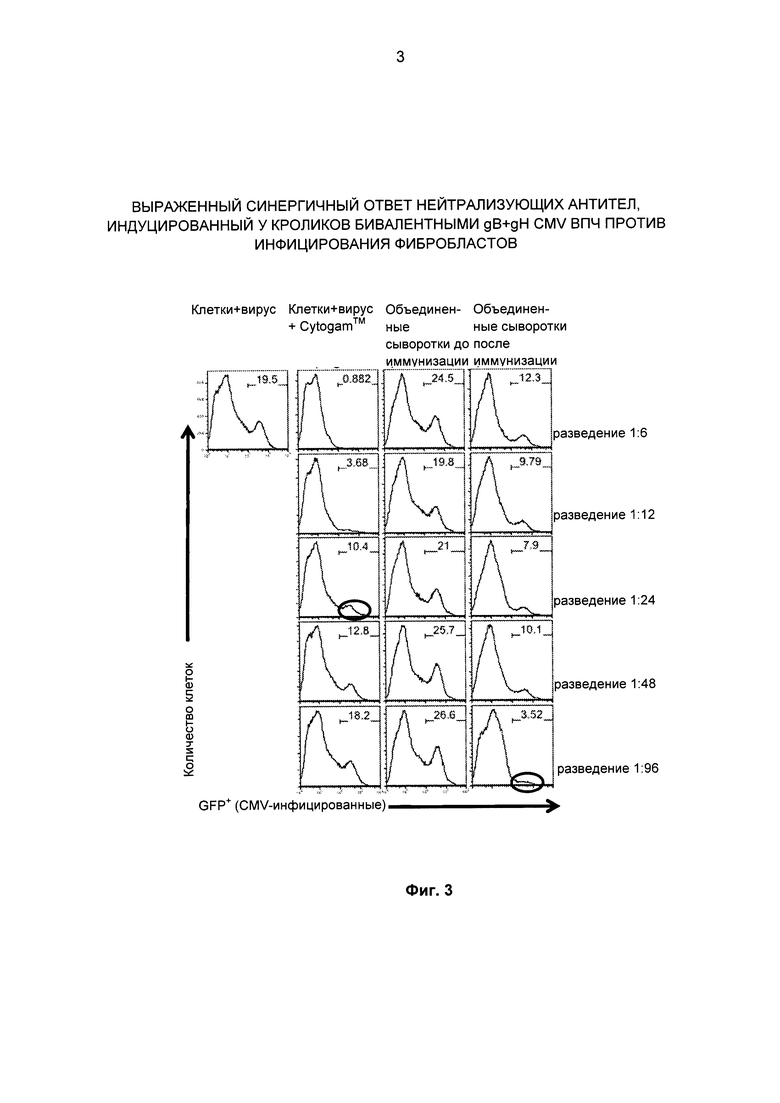
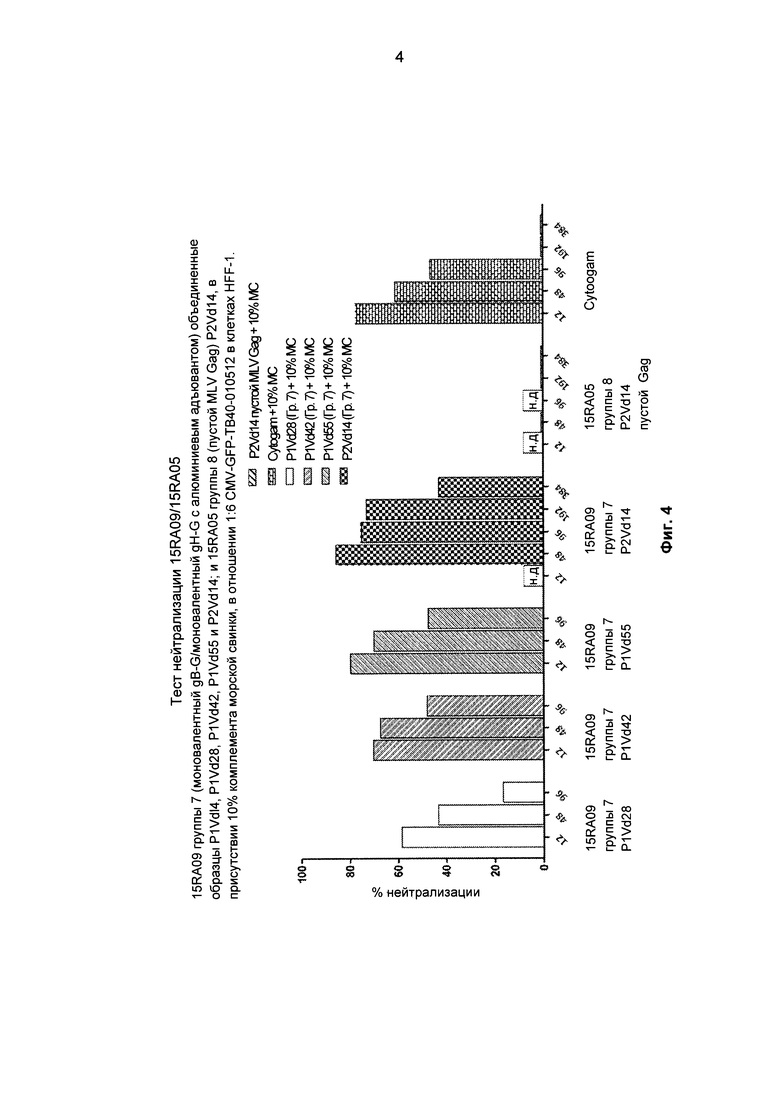
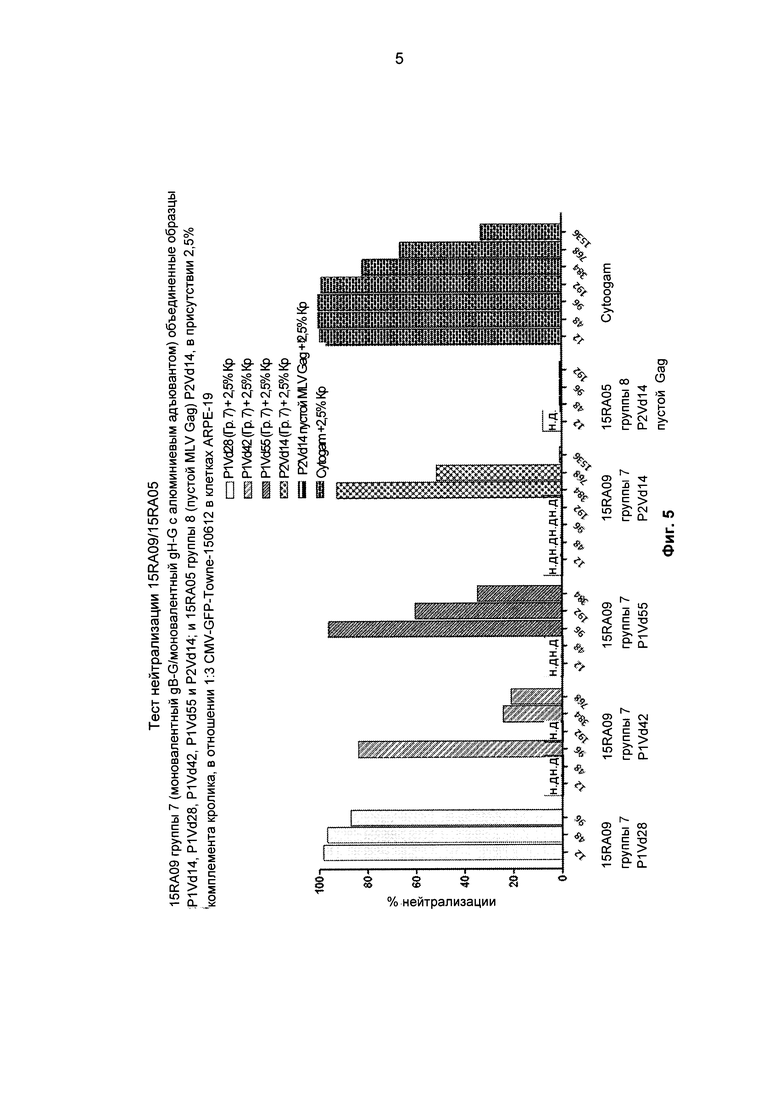
Предложен способ проведения теста нейтрализации для оценки способности вакцины-кандидата противодействовать инфицированию HCMV (цитомегаловирус человека). Способ включает следующие стадии: (i) смешивание инактивированной нагреванием сыворотки от субъекта, иммунизированного вакциной-кандидатом HCMV, с HCMV, содержащим флуоресцентную метку, для получения смеси; (ii) добавление 2,5% комплемента кролика к смеси со стадии (i); (iii) контакт клетки-хозяина, восприимчивой к инфекции HCMV, где указанная клетка-хозяин представляет собой пигментированную эпителиальную клетку сетчатки клеточной линии ARPE-19, при условиях, подходящих для инфицирования смесью инактивированной нагреванием сыворотки в присутствии комплемента кролика со стадии (ii); (iv) оценку уровня флуоресценции клетки-хозяина, находившейся в контакте с указанной смесью, методом проточной цитометрии; и (v) определение уровня инфицирования клетки-хозяина на основе измеренного уровня флуоресценции. Изобретение позволяет проводить оценку потенциальных вакцин-кандидатов для индукции нейтрализующих антител. 19 з.п. ф-лы, 5 ил., 8 табл., 4 пр.
1. Способ проведения теста нейтрализации для оценки способности вакцины-кандидата противодействовать инфицированию HCMV (цитомегаловирус человека), включающий стадии:
(i) смешивания инактивированной нагреванием сыворотки от субъекта, иммунизированного вакциной-кандидатом HCMV, с HCMV, содержащим флуоресцентную метку, для получения смеси;
(ii) добавления 2,5% комплемента кролика к смеси со стадии (i);
(iii) контакта клетки-хозяина, восприимчивой к инфекции HCMV, где указанная клетка-хозяин представляет собой пигментированную эпителиальную клетку сетчатки клеточной линии ARPE-19, при условиях, подходящих для инфицирования смесью инактивированной нагреванием сыворотки в присутствии комплемента кролика со стадии (ii);
(iv) оценки уровня флуоресценции клетки-хозяина, находившейся в контакте с указанной смесью, методом проточной цитометрии и
(v) определения уровня инфицирования клетки-хозяина на основе измеренного уровня флуоресценции.
2. Способ по п. 1, где иммунизированный субъект является человеком.
3. Способ по п. 1, где сыворотка содержит нейтрализующие антитела к HCMV.
4. Способ по п. 1, где вакцина-кандидат HCMV содержит ВПЧ (вирусоподобные частицы).
5. Способ по п. 4, где ВПЧ содержат один или более из gB, gH, и рр65 HCMV.
6. Способ по п. 1, где смесь со стадии (ii) инкубируют по меньшей мере 15 минут, по меньшей мере 30 минут, по меньшей мере 1 час или по меньшей мере 2 часа перед стадией (iii).
7. Способ по п. 1, где стадия оценки (iv) включает сравнение уровня флуоресценции со стандартным уровнем.
8. Способ по п. 7, где стандартный уровень представляет собой ранее определенный уровень.
9. Способ по п. 7, где стандартный уровень представляет собой уровень, полученный параллельным сравнением.
10. Способ по п. 1, дополнительно включающий определение титра нейтрализующих антител к HCMV в сыворотке по результатам стадии определения.
11. Способ по п. 10, дополнительно включающий оценку эффективности вакцины-кандидата HCMV по результатам стадии определения.
12. Способ по п. 11, дополнительно включающий отбор вакцины HCMV в качестве вакцины-кандидата, которая индуцирует нейтрализующие антитела, если уровень флуоресценции клетки-хозяина, находившейся в контакте с указанной смесью, ниже стандартного уровня флуоресценции.
13. Способ по п. 1, где стадия контакта (iii) включает инкубацию в течение по меньшей мере 1 часа, по меньшей мере 2 часов, по меньшей мере 3 часов, по меньшей мере 4 часов, по меньшей мере 5 часов, по меньшей мере 6 часов, по меньшей мере 7 часов или по меньшей мере 8 часов.
14. Способ по п. 1, где клетку-хозина дополнительно наблюдают в течение инфицирования с помощью визуальной оценки клеточной морфологии или с помощью визуальной оценки флуоресценции.
15. Способ по п. 14, где визуальная оценка клеточной морфологии включает наблюдение за клеточным набуханием и округлением.
16. Способ по п. 14, где визуальная оценка флуоресценции включает детекцию флуоресценции.
17. Способ по п. 16, где флуоресценцию детектируют с помощью флуоресцентного микроскопа.
18. Способ по п. 1, где оценивают уровень флуоресценции ядра клетки-хозяина.
19. Способ по п. 1, где оценивают уровень флуоресценции всей клетки-хозяина.
20. Способ по п. 1, дополнительно включающий стадию количественного определения уровня флуоресценции клетки-хозяина.
| WO 2008025095 A1, 06.03.2008 | |||
| SARAH STRASCHEWSKI et al., Human Cytomegaloviruses Expressing Yellow Fluorescent Fusion Proteins - Characterization and Use in Antiviral Screening, PLoS ONE, February 2010, Volume 5, Issue 2, e9174 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ВАКЦИНА ПРОТИВ ЦИТОМЕГАЛОВИРУСА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2491340C2 |
Авторы
Даты
2018-07-09—Публикация
2013-03-27—Подача