Изобретение относится к композиции, содержащей агент, в которой такой агент выбран из группы, включающей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, к применению таких композиций и способу производства такой композиции.
Цитомегаловирус человека (HCMV), β-герпесвирус, представляет собой повсеместно встречающийся патоген. У иммунокомпетентного человека инфекция HCMV обычно незаметна, проявляющаяся слабо выраженными и неспецифическими симптомами. В отличие от этого, в определенных группах риска, например у пациентов с ослабленным иммунитетом, таких как пациенты со СПИДом или получателей пересаженных органов, и после внутриутробной инфекции, инфицирование HCMV обладает серьезными проявлениями.
Для лечения инфекций HCMV доступны химиотерапевтические препараты. Успех противовирусной химиотерапии инфекции HCMV, тем не менее, ограничен, в частности, токсичностью лекарственных средств и развитием устойчивых вариантов вируса, если увеличена продолжительность лечения. Кроме того, профилактическое или терапевтическое применение противовирусной гипериммунной сыворотки, как оказалось, обладает только ограниченной эффективностью.
В течение многих лет проводили работу по разработке вакцины против HCMV. Таким образом, предпринимались попытки вызвать необходимый иммунитет при помощи ослабленных (аттенюированных) живых вакцин. Такие вакцины, тем не менее, обладали только ограниченной эффективностью. Причинами этого могут являться, среди прочего, ограниченная жизнеспособность таких аттенюированных вирусов у людей и специфичные для штаммов изменения антигенных свойств. Помимо непригодности при индукции постоянного иммунитета, использование живой вакцины должно оцениваться критически; отсутствие знания о патогенетических механизмах при инфекции HCMV и риск реактивации штамма вакцины после иммунодепрессии делает использование живой вакцины, по меньшей мере, сомнительным в таких клинических ситуациях.
Во избежание таких рисков в последнее время предпочтительно развивались стратегии для разработки субъединичных вакцин против HCMV, которые содержат белки из вирусной оболочки, синтезированные в различных системах экспрессии. Такие белки оболочки, особенно гликопротеины gB и gH, представляют собой основные антигены-мишени для нейтрализующих антител против HCMV. Нейтрализующие антитела способны предотвратить инфицирование. Индуцировать такие нейтрализующие антитела при помощи субъединичной вакцины с gB возможно как у экспериментальных животных, так и в клинических исследованиях. Тем не менее, у людей гуморальный иммунный ответ, индуцированный таким образом, как оказалось, является непродолжительным и не подходит для профилактики инфекции во всех случаях. Это неблагоприятно в отношении широкого применения субъединичных вакцин, основанных исключительно на gB HCMV. Причинами, которые выдвигаются в качестве предположения относительно ограниченной эффективности таких антигенных препаратов, в свою очередь, являются штаммоспецифическая изменчивость иммунного ответа, недостаток индукции адекватной клеточной иммунной реакции и структурные ограничения используемого антигена, эпитопы которого, как известно в некоторых случаях, являются конформационно-зависимыми.
На основе данного опыта, следовательно, требования, которым должна удовлетворять эффективная и широко применимая вакцина HCMV, указаны ниже: (1) пролонгированная индукция нейтрализующих антител, которые защищают от инфекции HCMV перекрывающим несколько штаммов образом. Для этого необходима эффективная индукция так называемого «ответа хэлперных клеток» (CD4-положительных T-лимфоцитов) против HCMV, чтобы способствовать созреванию секретирующих антитела B-лимфоцитов. (2) Индукция образования цитотоксических T-клеток против HCMV. Лимфоциты данного типа имеют первостепенную важность для пресечения инфекции HCMV, которая имеет место, и для ограничения распространения вируса в организме. (3) Снижение до минимума побочных эффектов при помощи вакцины. Невозможно оценить риск, который мог бы иметь место от жизнеспособного вируса при заражении, который, согласно последним данным, будет обладать способностью переходить в латентное состояние после иммуносуппрессии. Следовательно, цель должна заключаться в том, чтобы получить нежизнеспособный вирусный антиген в качестве вакцины.
Вакцина такого типа описана в международной патентной заявке WO 00/53729.
Хотя такой тип вакцин несомненно целесообразен, необходимо соответствие высоким стандартам с точки зрения уменьшения остаточной инфекционности такого вида вирусных частиц из-за возможного присутствия остаточных инфекционных вирионов HCMV. Следовательно, проблема, лежащая в основе настоящего изобретения заключалась в том, чтобы получить композицию, содержащую частицы HCMV и, более конкретно, вирионы HCMV и/или плотные тельца HCMV, не обладающие остаточной инфекционностью, в частности без остаточной инфекционности при анализе, как описано в настоящем документе.
Дальнейшая проблема, лежащая в основе настоящего изобретения, заключается в том, чтобы получить препараты частиц HCMV, которые не являются инфекционными, но обеспечивают индукцию антигенспецифичного CD8+ цитотоксического T-клеточного ответа. Следующая проблема, лежащая в основе настоящего изобретения, заключается в том, чтобы получить препараты частиц HCMV, которые не являются инфекционными, но обеспечивают индукцию антигенспецифичного иммунного ответа, при этом такой иммунный ответ включает антитела против антигена, предпочтительно, нейтрализующие антитела против антигена.
Данная и другие проблемы решена посредством объектов независимых пунктов формулы изобретения. Предпочтительные варианты осуществления можно заимствовать из зависимых пунктов многозвенной формулы изобретения.
Более конкретно, проблема, лежащая в основе настоящего изобретения, решена в первом аспекте посредством композиции, содержащей агент, выбранный из группы, включающей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, где композиция способна проявлять иммунный ответ, в то время как вирионы, NIEP и/или плотные тельца не способны к слиянию. В варианте осуществления агент не является инфекционным.
Проблема, лежащая в основе настоящего изобретения, решена во втором аспекте посредством композиции, содержащей агент, выбранный из группы, включающей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, где композиция способна проявлять иммунный ответ, в то время как вирионы, NIEP и/или плотные тельца не способны к слиянию, где композицию можно получить способом, включающим стадии:
a) получения одного или нескольких агентов;
b) обработки агента(ов) для того, чтобы лишить их способности к слиянию, в тоже время все еще оставляя их способными индуцировать иммунный ответ.
В варианте осуществления агент не является инфекционным.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный CD8+ ответ.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный цитотоксический T-клеточный ответ.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный CD8+ цитотоксический T-клеточный ответ.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, предпочтительно иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, при котором антитела представляют собой нейтрализующие антитела.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный ответ CD4+ хелперных T-клеток.
В варианте осуществления первого и второго аспектов антиген представляет собой антиген HCMV, где антиген HCMV предпочтительно выбран из группы, включающей антиген pp65, производные антигена pp65, pp28 и производные pp28, pp150 и производные pp150, gB и производные gB, gH и производные gH и предранние антигены и их производные, гликопротеины и производные гликопротеинов, предпочтительно, гликопротеины HCMV и производные гликопротеинов HCMV, при этом гликопротеины предпочтительно представляют собой gM и производные gM или gN и производные gN.
В группе предранних антигенов предранний антиген-1 (IE-1) является особенно предпочтительным.
В варианте осуществления первого и второго аспектов антиген инактивирован.
В варианте осуществления первого и второго аспектов композиция представляет собой фармацевтическую композицию или диагностическую композицию.
Проблема, лежащая в основе настоящего изобретения, решена в третьем аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где агент не способен к слиянию, для производства лекарственного средства, предпочтительно, для проявления иммунного ответа против одного или нескольких антигенов HCMV.
Проблема, лежащая в основе настоящего изобретения, решена в четвертом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, предпочтительно композиции, определенной в третьем аспекте, где композиция и/или агент были подвергнуты инактивации, для производства лекарственного средства для проявления иммунного ответа, предпочтительно, иммунного ответа против одного или нескольких антигенов HCMV.
Проблема, лежащая в основе настоящего изобретения, решена в пятом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где агент не способен к слиянию, для производства вакцины.
Проблема, лежащая в основе настоящего изобретения, решена в шестом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, предпочтительно, композиции, определенной в третьем аспекте, где композиция и/или агент были подвергнуты инактивации, для производства вакцины.
В варианте осуществления третьего и четвертого аспекта иммунный ответ представляет собой антигенспецифичный CD8+ ответ.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный цитотоксический T-клеточный ответ.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный CD8+ цитотоксический T-клеточный ответ.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, предпочтительно, иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, при котором антитела представляют собой нейтрализующие антитела.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный ответ CD4+ хелперных T-клеток.
В варианте осуществления с третьего по шестой аспект антиген представляет собой антиген HCMV, где антиген HCMV предпочтительно выбран из группы, включающей антиген pp65, производные антигена pp65, pp28 и производные pp28, pp150 и производные pp150, gB и производные gB, gH и производные gH и предранние антигены и их производные, гликопротеины и производные гликопротеинов, предпочтительно, гликопротеины HCMV и производные гликопротеинов HCMV, где гликопротеины предпочтительно представляют собой gM и производные gM или gN и производные gN.
В варианте осуществления пятого и шестого аспекта вакцина предназначена для лечения и/или профилактики инфекции HCMV.
В варианте осуществления пятого и шестого аспекта вакцина предназначена для лечения и/или профилактики заболевания, вызванного HCMV у донора трансплантата и/или получателя трансплантата.
Проблема, лежащая в основе настоящего изобретения, решена в седьмом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где агент не способен к слиянию, для производства диагностического средства.
Проблема, лежащая в основе настоящего изобретения, решена в восьмом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где композиция и/или агент были подвергнуты инактивации, для производства диагностического средства.
Проблема, лежащая в основе настоящего изобретения, решена в девятом аспекте посредством способа производства композиции, определенной в первом и во втором аспекте, включающего стадии
a) получения агента, выбранного из группы, включающей вирионы HCMV, NIEP HCMV и плотные тельца HCMV;
b) обработки агента для того, чтобы лишить его способности к слиянию, в то время как указанный агент все еще способен индуцировать иммунный ответ.
В варианте осуществления девятого аспекта обработка на стадии b) представляет собой одну меру или любую комбинацию мер, выбранных из группы, включающей обработку УФ-излучением, облучение с высокой энергией, обработку при низком значении pH, термическую обработку и обработку при помощи сшивающих средств.
В предпочтительном варианте осуществления девятого аспекта обработка УФ-излучением представляет собой обработку УФС-излучением, при этом длина волны составляет приблизительно 100-280 нм, или обработку длинноволновым УФ-излучением.
В рамках настоящего изобретения, помимо использования для инактивации УФС-излучения, также можно использовать длинноволновое УФ-излучение. В таком случае длинноволновое УФ-излучение используется совместно с фотореактивным средством, которое активируется при указанной длине волны УФ-излучения. В варианте осуществления такое фотореактивное средство представляет собой амотосален, который используют совместно с УФА-излучением, 4'-аминометил-4,5',8-триметилпсорален, который используется совместно с УФA-излучением, и диметилметиленовый синий, который используют совместно с УФA- и УФB-излучением, соответственно.
В варианте осуществления девятого аспекта обработка УФ-излучением представляет собой применение диапазона доз приблизительно от 100 до приблизительно 2000 мДж/см2, предпочтительно, приблизительно от 100 до приблизительно 1000 мДж/см2 и, более предпочтительно, приблизительно от 150 до приблизительно 900 мДж/см2.
В варианте осуществления девятого аспекта перед, одновременно или после обработки УФ-излучением агент подергается облучению гамма-лучами.
В предпочтительном варианте осуществления девятого аспекта облучение с высокой энергией представляет собой облучение гамма-лучами.
В дополнительном предпочтительном варианте осуществления девятого аспекта гамма-излучение применительно к облучению гамма-лучами используют в диапазоне доз приблизительно от 15 до приблизительно 70 кгр, более предпочтительно, приблизительно от 20 до приблизительно 65 кгр и, более предпочтительно, приблизительно от 20 до приблизительно 60 кгр.
В варианте осуществления девятого аспекта обработка представляет собой обработку при низком значении pH, и обработка при низком значении pH включает воздействие на агент рН приблизительно от 0 до 5, предпочтительно, от 1 до 4,5 и, более предпочтительно, от 2 до 4,5.
В предпочтительном варианте осуществления девятого аспекта агент подвергают обработке при низком значении pH в течение приблизительно от 0,5 до 24 часов, предпочтительно, приблизительно от 0,5 до 12 часов и, более предпочтительно, приблизительно от 0,5 до 6 часов.
В варианте осуществления девятого аспекта агент подвергают обработке при низком значении pH при температуре приблизительно от 1 до 50°C, предпочтительно, при приблизительно от 1 до приблизительно 45°C и, более предпочтительно, при приблизительно от 1 до приблизительно 40°C.
В варианте осуществления девятого аспекта термическая обработка включает инкубацию агента при температуре в диапазоне приблизительно от 37,5°C до приблизительно 65°C, предпочтительно, при температуре в диапазоне приблизительно от 37,5 до приблизительно 60°C и, более предпочтительно, при температуре в диапазоне приблизительно от 37,5 до приблизительно 56°C.
В предпочтительном варианте осуществления девятого аспекта агент инкубируют в течение периода времени в диапазоне приблизительно от 5 секунд до приблизительно 36 часов, предпочтительно, в диапазоне приблизительно от 5 секунд до приблизительно 30 часов и, более предпочтительно, в диапазоне приблизительно от 5 секунд до приблизительно 24 часов.
В варианте осуществления девятого аспекта обработка представляет собой обработку при помощи одного или нескольких сшивающих средств, при этом сшивающее средство, каждое и независимо друг от друга, выбрано из группы, включающей лактоны, этилаты и альдегиды.
В варианте осуществления девятого аспекта сшивающее средство представляет собой β-пропиолактон.
В варианте осуществления девятого аспекта сшивающее средство представляет собой этиленоксид.
В варианте осуществления девятого аспекта сшивающее средство представляет собой формальдегид.
В варианте осуществления девятого аспекта агент подвергают воздействию сшивающего средства при концентрации сшивающего средства, и более предпочтительно β-пропиолактона, в среде, содержащей агент, находящейся в диапазоне приблизительно от 0,05 до приблизительно 10% (об./об.), предпочтительно, в диапазоне приблизительно от 0,05 до приблизительно 10% (об./об.) и, более предпочтительно, в диапазоне приблизительно от 0,05 до приблизительно 7,5% (об./об.).
В варианте осуществления девятого аспекта агент инкубируют со сшивающим средством, и предпочтительно с β-пропиолактоном, в течение периода времени в диапазоне от приблизительно от 1 минуты до приблизительно 72 часов, предпочтительно, приблизительно от 1 минуты до приблизительно 48 часов и, более предпочтительно, приблизительно от 1 минуты до приблизительно 24 часов.
В варианте осуществления девятого аспекта агент инкубируют при температуре в диапазоне приблизительно от 1°C до приблизительно 60°C, предпочтительно, при температуре в диапазоне приблизительно от 1°C до приблизительно 50°C, более предпочтительно, при температуре в диапазоне приблизительно от 1°C до приблизительно 40°C.
Согласно известному уровню техники считается, что частицы HCMV для того, чтобы вызвать антигенспецифичный CD8+ цитотоксический T-клеточный ответ на вирусные антигены и зараженные вирусом клетки, должны слиться с мембраной клетки-мишени (Pepperl et al. 2000 J Virol 74:6132-6146). Такое слияние считают необходимым предварительным условием для того, чтобы направить вирусные антигены по пути процессинга и презентации антигена молекулами MHC класса I, либо непосредственно после проникновения в клетки, либо после внутриклеточной транскрипции и трансляции вирусных белков (Pepperl et al 2000 J Virol 74:6132-6146). Презентация антигена посредством пути MHC класса I, в свою очередь, является необходимым предварительным условием для иммунной системы, чтобы быть способной осуществить или проявить антигенспецифичный CD8+ цитотоксический T-клеточный ответ на вирусные антигены и зараженные вирусом клетки.
Авторы настоящего изобретения к настоящему времени обнаружили, что частицы HCMV, которые больше не способны к слиянию, все еще способны вызывать такой тип антигенспецифичного CD8+ цитотоксического T-клеточного ответа на вирусные антигены и зараженные вирусом клетки. Это применимо, в частности, к частицам HCMV, которые обработали или обрабатывают или получают, используя одно или несколько средств и способов, соответственно, описанных в настоящем документе для или применительно к какой-либо инактивации и процедуре инактивации, соответственно. Данная первая находка по настоящему изобретению до большой степени неожиданна, поскольку согласно известному уровню техники, такая способность к слиянию частиц HCMV, как думали, является необходимым предварительным условием для данного вида T-клеточного ответа, как уже указано выше.
Такое отсутствие способности к слиянию можно обеспечить, применяя к частицам HCMV средства и способы, по существу, обычно известные в данной области для инактивации HCMV или снижения инфекционности HCMV и частиц HCMV, предпочтительно те средства и способы, описываемые в настоящем документе, которые также обозначают как средства и способы, соответственно, описываемые в настоящем документе, для или применительно к инактивации и процедурам инактивации. Такие инактивирующие средства и способы или средства и способы инактивации, соответственно, применяют и осуществляют до такой степени, что указанное отсутствие способности к слиянию налагается или придается таким частицам HCMV.
Вторая находка, лежащая в основе настоящего изобретения относится к получению частиц HCMV или композиций, включающих такие частицы HCMV, не обладающие инфекционностью, предпочтительно без остаточной инфекционности, при этом указанные частицы HCMV и композиции, включающие их, получают, используя любые средства и способы, соответственно, описываемые в настоящем документе, применительно к первому аспекту по настоящему изобретению, начиная с частиц HCMV или содержащих частицы HCMV композиций, все еще содержащих инфекционные частицы HCMV и, в особенности, вирионы HCMV. Также такой тип частиц HCMV, как было к удивлению обнаружено, подходит для индукции иммунного ответа, как описано в настоящем документе, то есть, в частности, антигенспецифичного CD8+ цитотоксического T-клеточного ответа, антигенспецифичного гуморального иммунного ответа, при этом гуморальный иммунный ответ предпочтительно представляет собой ответ, обусловленный антигенспецифичными нейтрализующими антителами, и антигенспецифичного ответа CD4+ хелперных T-клеток.
Среди специалистов в данной области, общеизвестно, что для индукции антигенспецифичного гуморального иммунного ответа и антигенспецифичного CD8+ цитотоксического T-клеточного ответа, соответственно, необходимо появление антигенспецифичных CD4+ хэлперных T-клеток. Следовательно, в настоящем изобретении появление антигенспецифичных CD4+ хэлперных T-клеток подтверждается проявлением специфических для pp65 цитотоксических CD8+ T-клеточных ответов и появлением антител, в частности, нейтрализующих антител, специфичных для антигенов HCMV. Таким образом, частицы HCMV, которые подвергали обработке для того, чтобы инактивировать остаточную инфекционность HCMV и лишить материал способности к слиянию, все еще способны вызвать образование антигенспецифичных CD4+ хэлперных T-клеток.
Предпочтительно используемый в настоящем документе термин отсутствие остаточной инфекционности обозначает, что никакие инфекционные частицы и, в особенности, никакие инфекционные частицы HCMV, невозможно определить в образце или композиции, содержащей частицы HCMV, используя анализ инфекционности, более предпочтительно, анализ инфекционности, как описано в настоящем документе. Другими словами, композиция или препарат, содержащий одно или несколько плотных телец HCMV, вирионов HCMV и/или NIEP HCMV, представляют собой композицию и препарат, соответственно, в которых невозможно определить никакого инфекционного HCMV или частицы HCMV в том же самом анализе инфекционности. Специалист в данной области признает, будет ли определяться предел чувствительности и если да, то до какой степени, то есть как много таких частиц HCMV, тем не менее, присутствует в соответствующей композиции и препарате, соответственно.
Предпочтительно используемый в настоящем документе термин частицы HCMV включает вирионы HCMV, плотные тельца HCMV и NIEP HCMV.
Предпочтительно используемые в настоящем документе вирионы HCMV представляют собой инфекционные вирусные частицы, которые состоят из мембраны, тегумента (оболочки) и капсида, который содержит вирусную ДНК.
Предпочтительно используемые в настоящем документе плотные тельца (DB) HCMV представляют собой неинфекционные частицы HCMV, которые утратили капсид и ДНК HCMV, но включают мембрану и тегумент.
Предпочтительно используемые в настоящем документе NIEP HCMV представляют собой неинфекционные заключенные в оболочку частицы HCMV, которые утратили ДНК, но содержат мембрану, капсид и тегумент.
Предпочтительно используемый в настоящем документе термин плотные тельца включает как нерекомбинантные, так и рекомбинантные плотные тельца. Рекомбинантные плотные тельца предпочтительно экспрессируют один или несколько гетерологичных антигенов.
Предпочтительно используемый в настоящем документе термин NIEP включает как нерекомбинантные, так и рекомбинантные NIEP. Рекомбинантные NIEP экспрессируют один или несколько гетерологичных антигенов.
Предпочтительно используемый в настоящем документе термин вирионы включает как нерекомбинантные, так и рекомбинантные вирионы. Рекомбинантные вирионы предпочтительно экспрессируют один или несколько гетерологичных антигенов.
Предпочтительно используемый в настоящем документе термин гетерологичный антиген представляет собой антиген, который экспрессируется в различном окружении при экспрессии. В одном из вариантов осуществления такое отличающееся окружение при экспрессии представляет собой окружение, где антиген представляет собой антиген, который не свойственен соответствующим плотным тельцам дикого типа, NIEP дикого типа и вириону дикого типа. Точнее говоря, гетерологичный антиген предпочтительно представляет собой антиген, который представляет собой либо собственный, либо внутренний компонент частицы HCMV, включая в качестве неограничивающих примеров неструктурный антиген HCMV или антиген гетерологичного организма, предпочтительно, гетерологичный патоген. В дополнительном варианте осуществления такое отличающееся окружение при экспрессии представляет собой окружение, которое отличается от окружения дикого типа в том, что промотор, который контролирует экспрессию антигена, отличается от промотора, контролирующего экспрессию антигена плотных телец дикого типа, NIEP дикого типа и вирионов дикого типа. В дополнительном варианте осуществления различное окружение состоит из различных трансляционных систем или трансляционного фона, где экспрессируется антиген, которые, опять же, отличаются от систем дикого типа и фона дикого типа. Более определенно, плотные тельца дикого типа представляют собой плотные тельца HCMV дикого типа, NIEP дикого типа представляют собой NIEP HCMV дикого типа и вирионы дикого типа представляют собой вирионы HCMV дикого типа.
Предпочтительно используемый в настоящем документе термин дикий тип обозначает штамм или происходящий из штамма объект, который способен формировать плотные тельца, предпочтительно в условиях культивирования клеток in vitro. Такой дикий тип или штамм дикого типа предпочтительно представляет собой Ad169 и Towne.
Будет признано, что любое утверждение, вариант осуществления, особенность или преимущество, описываемое в настоящем документе в отношении частиц HCMV, также, и в особенности, применимы к плотным телам HCMV и NIEP HCMV и, более конкретно, применимы к плотным тельцам HCMV.
Предпочтительно используемый в настоящем документе термин способность к слиянию обозначает способность вирусных или субвирусных частиц, таких как HCMV, сливаться с клеткой-мишенью, опосредованную слиянием мембран вирусных и субвирусных частиц, соответственно, с клеточной мембраной клетки-мишени. Такие вирусные и субвирусные частицы, соответственно, обозначают как «способные к слиянию»; при этом такие вирусные и субвирусные частиц, соответственно, которые не способны сливаться с клеткой-мишенью обозначают как неспособные к слиянию.
Основываясь на находке авторов настоящего изобретения, а именно, что такие частицы HCMV, включающие в качестве неограничивающих примеров вирионы HCMV, плотные тельца HCMV и NIEP HCMV, которые обрабатывают или обработали для инактивации их остаточной инфекционности HCMV, все же способны эффективно индуцировать антигенспецифичный CD8+ цитотоксический T-клеточный ответ в отношении вирусных антигенов, несмотря на доказанную потерю способности к слиянию, средства и способы инактивации инфекционности HCMV и, более определенно, инактивации остаточной инфекционности HCMV при помощи средств и в условиях, соответственно, которые сопровождаются потерей способности к слиянию, можно применить к частице HCMV, содержащейся в препаратах и композициях, соответственно, чтобы получить как безопасную вакцину HCMV, так и антигенспецифичный CD8+ цитотоксический T-клеточный ответ.
Частицы HCMV, которые образуют исходный продукт для получения частиц HCMV и их композиций, соответственно, каждые в качестве объекта по настоящему изобретению, предпочтительно представляют собой вирусные частицы, которые высвобождаются после инфицирования клетки млекопитающих HCMV. Такие частицы HCMV, которые используют в качестве исходного продукта, окружены липидной мембраной, которая дает возможность частицам сливаться с определенными клетками млекопитающих таким образом, что их содержимое входит в цитоплазму клетки, хотя, в соответствии с первым аспектом по настоящему изобретению, такие частицы, получаемые при обработке их средствами и способами, соответственно, описываемыми в настоящем документе применительно к инактивации или подходящих для инактивации, не способны к слиянию. Вне зависимости от этого, мембрана частиц HCMV содержит вирусные гликопротеины, которые представляют собой основные антигены для нейтрализующих вирусы антител. Кроме того, они содержат вирусный антиген pp65 (ppUL83), который является весьма иммуногенной мишенью для хелперных T-клеток и представляет собой основной антиген для индукции цитотоксических T-лимфоцитов (CTL) против HCMV.
Тип иммунного ответа, вызываемый частицами HCMV и, в особенности, вирионами HCMV, NIEP HCMV и/или плотными тельцами HCMV и композиции, их содержащие, соответственно, каждые в соответствии с настоящим изобретением, представляют собой, безотносительно к способу введения, ответ хелперных T-клеток типа Th1. Ввиду данной характерной черты частицы HCMV и, в особенности, вирионы HCMV, плотные тельца HCMV и/или NIEP HCMV, и композиции, содержащие, по меньшей мере, одну из них, соответственно, подходят для вакцины против HCMV.
Специалист в данной области признает, что частицы HCMV по настоящему изобретению и любую композицию, их содержащую, можно использовать для получения лекарственного средства, которое применяют для лечения и/или профилактики заболевания, предпочтительно, такое заболевание представляет собой заболевание, которое вызвано HCMV в качестве возбудителя заболевания или условно-патогенного агента.
В предпочтительном варианте осуществления лекарственное средство представляет собой вакцину.
Особая группа субъектов, предпочтительно млекопитающие и, более предпочтительно, люди, для лечения и/или профилактики у которых используют такое лекарственное средство, в соответствии с настоящим изобретением представляют собой людей, страдающих заболеванием или подверженных риску возникновения заболевания, вызванного HCMV, при этом такие субъекты являются донорами трансплантатов и/или реципиентами трансплантатов. Специалисты в данной области также признают, что частицы HCMV по настоящему изобретению и любую композицию, их содержащую, можно использовать для получения диагностического средства. Более предпочтительно, такая диагностика предназначена для выявления заболевания, которое вызвано HCMV в качестве возбудителя заболевания или условно-патогенного агента.
В заключение, частицы HCMV можно использовать для получения или производства лекарственного средства или диагностического средства, при этом лекарственное средство и диагностическое средство являются одним из средств, выбранных из группы, включающей антитела, аптамеры и шпигельмеры, при этом средства направлены, предпочтительно, специфически направлены, против одной или нескольких частиц HCMV по настоящему изобретению. Получение таких антител, аптамеров и шпигельмеров известны специалисту в данной области.
Производство антитела, специфичного для частиц HCMV по настоящему изобретению известно специалисту в данной области и, например, описано у Harlow, E., and Lane, D., "Antibodies: A Laboratory Manual," Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988). Предпочтительно, применительно к настоящему изобретению можно использовать моноклональные антитела, которые можно получить согласно протоколу Cesar и Milstein и дополнительных разработок на его основе. Антитела, как используют в настоящем документе, включают в качестве неограничивающих примеров полные антитела, фрагменты или производные антител такие, как Fab-фрагменты, Fc-фрагменты и одноцепочечные антитела, при условии, что они подходят и способны связывать частицы HCMV по настоящему изобретению. Помимо моноклональных антител также можно использовать и/или получать поликлональные антитела. Получение поликлональных антител также известно специалисту в данной области и, например, описано у Harlow, E., and Lane, D., "Antibodies: A Laboratory Manual," Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988). Предпочтительно, антитела, применяемые для терапевтических целей, представляют собой гуманизированные антитела или антитела человека, как определено выше.
Антитела, которые можно использовать по настоящему изобретению, могут содержать один или несколько маркеров или меток. Такие маркеры или метки можно применять для обнаружения антитела либо при его диагностическом применении, либо его терапевтическом применении. Предпочтительно, маркеры и метки выбраны из группы, включающей авидин, стрептавидин, биотин, золото и флуоресцеин, и используются, например, в способах ELISA. Данные и дополнительные маркеры, а также способы описаны, например, у Harlow, E., and Lane, D., "Antibodies: A Laboratory Manual," Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988).
Также в рамки настоящего изобретения входит тот факт, что метка или маркер проявляет дополнительную функцию помимо детектирования, такую как взаимодействие с другими молекулами. Такое взаимодействие может представлять собой, например, специфическое взаимодействие с другими соединениями. Данные другие соединения могут либо являться соединениями, присущими системе, где используют антитело, такой как организм человека или животного, либо представлять собой образец, который анализируют, используя соответствующее антитело. Подходящие маркеры могут представлять собой, например, биотин или флуоресцеин с их специфически взаимодействующими партнерами, такими как авидин и стрептавидин и тому подобным, присутствующими на соответствующем соединении или структуре для взаимодействия с таким образом маркированным или помеченным антителом.
Аптамеры в качестве объекта по настоящему изобретению представляют собой D-нуклеиновые кислоты, которые являются либо одноцепочечными, либо двухцепочечными и которые специфически взаимодействуют с молекулой-мишенью. Производство или селекция аптамеров описана, например, в европейском патенте EP 0533838. В основном, выполняют следующие ниже стадии. Во-первых, получают смесь нуклеиновых кислот, то есть возможные аптамеры, при этом каждая нуклеиновая кислота, как правило, содержит сегмент из нескольких, предпочтительно, по меньшей мере, восьми следующих друг за другом рандомизированных нуклеотидов. Данная смесь впоследствии связывается с молекулой-мишенью, посредством чего нуклеиновая кислота(ы) связывается с молекулой-мишенью, например, исходя из повышенной аффинности к мишени или с большей силой в отношении нее по сравнению со смесью-кандидатом. Связывающаяся нуклеиновая кислота(ы) впоследствии отделяется/отделяются от остатка смеси. Необязательно, таким образом полученную нуклеиновую кислоту(ы) апмлифицируют, используя, например, полимеразную цепную реакцию. Данные стадии можно повторять несколько раз получая в результате смесь, содержащую повышенное соотношение нуклеиновых кислот, специфически связывающихся с мишенью, из которой затем необязательно отбирают конечную связывающуюся нуклеиновую кислоту. Данную специфически связывающуюся нуклеиновую кислоту(ы) обозначают как аптамеры. Очевидно, что любую стадию способа для получения или идентификации образцов аптамеров в смеси отдельных нуклеиновых кислот можно использовать для того, чтобы определить их последовательность, применяя стандартные методики. В рамках настоящего изобретения, что апатамеры можно стабилизировать, так как, например, при введении определенных химических групп, которые известны специалисту в данной области получения аптамеров. Такую модификацию можно, например, разместить при ведении аминогруппы в 2'-положение сахарной части нуклеотидов. Аптамеры в настоящее время применяют в качестве терапевтических средств. Однако, также в рамках настоящего изобретения, что таким образом выбранные или полученные аптамеры можно использовать для подтверждения наличия мишени и/или в качестве вещества-прототипа для разработки лекарственных средств, предпочтительно, лекарственных средств на основе низкомолекулярных соединений. Это практически выполнено при конкурентном анализе, при этом специфическое взаимодействие между молекулой-мишенью и аптамером ингибируют лекарственным средством-кандидатом, при этом при замене аптамера из комплекса с мишенью на аптамер можно предположить, что соответствующее лекарственное средство-кандидат позволяет осуществлять специфическое ингибирование взаимодействия между мишенью и аптамером, и, если взаимодействие является специфическим, указанное лекарственное средство-кандидат, по меньшей мере, в принципе, подойдет для того, чтобы заблокировать мишень и таким образом снизить ее биологическую доступность или активность в соответствующей системе, содержащую такую мишень. Таким образом полученное низкомолекулярное соединение можно затем подвергнуть дальнейшему получению производных и модификации, чтобы оптимизировать его физические, химические, биологические и/или медицинские характеристики, такие как токсичность, специфичность, биоразлагаемость и биодоступность.
Получение или производство шпигельмеров, которые можно использовать или получить по настоящему изобретению, используя частицы HCMV по настоящему изобретению, основано на схожем принципе. Производство шпигельмеров описано в международной патентной заявке WO 98/08856. Шпигельмеры представляют собой L-нуклеиновые кислоты, что означает, что они состоят из L-нуклеотидов, а не аптамеры, которые состоят из D-нуклеотидов, как есть аптамеры. Шпигельмеры характеризуются тем фактом, что они обладают очень высокой стабильностью в биологической системе и, по сравнению с аптамерами, специфически взаимодействуют с молекулой-мишенью, против которой они направлены. С целью получения шпигельмеров, создают гетерогенную популяцию D-нуклеиновых кислот и данная популяция связывается с оптическим антиподом молекулы-мишени, в данном случае, например, с D-энантиомером встречающегося в природе L-энантиомера частиц HCMV по настоящему изобретению или их части. В дальнейшем, данные D-нуклеиновые кислоты, которые не взаимодействуют с оптическим антиподом молекулы-мишени, отделяют. Тем не менее, данные D-нуклеиновые кислоты, взаимодействующие с оптическим антиподом молекулы-мишени, отделяют, необязательно определяют последовательность и/или секвенируют и в дальнейшем соответствующие L-нуклеиновые кислоты синтезируют на основе информации о последовательности нуклеиновой кислоты, полученной из D-нуклеиновых кислот. Такие L-нуклеиновые кислоты, которые идентичны в контексте последовательности с указанными выше D-нуклеиновыми кислотами, взаимодействующими с оптическим антиподом молекулы-мишени, будут специфически взаимодействовать со встречающейся в природе молекулой-мишенью, а не с ее оптическим антиподом. Схожим образом со способом получения аптамеров, также возможно повторять различные стадии несколько раз и, таким образом, обогатить такие нуклеиновые кислоты, специфически взаимодействующие с оптическим антиподом молекулы-мишени.
В рамках настоящего изобретения, такое лекарственное средство и диагностическое средство можно использовать для лечения, профилактики и диагностики, соответственно, каждого и любого заболевания и состояний, перечисленных в настоящем документе применительно к использованию частиц HCMV по настоящему изобретению. Специалисту в данной области будет понятно, что частицы HCMV по настоящему изобретению также можно использовать в качестве лекарственных средств и вакцин для лечения и/или профилактики таких заболеваний, которые поддаются излечению при индукции иммунного ответа против антигена и, причем указанный антиген экспрессируется частицами HCMV по настоящему изобретению. В рамках настоящего изобретения, что такой антиген является гомологичным или гетерологичным, в особенности, по отношению к указанной частице HCMV.
Способы для определения того, способна ли частица HCMV и, в частности, вирион HCMV и/или плотное тельце HCMV и композиция, содержащая, по меньшей мере, одно из них, соответственно, вызвать иммунный ответ, хотя частицы, вирионы и/или плотные тельца предпочтительно не способны к слиянию, очевидны для специалистов в данной области, по меньшей мере, в свете настоящего изобретения. Некоторые соответствующие тесты описаны в настоящем документе, в частности, в его разделе примеров.
Для того чтобы обеспечить индукцию иммунного ответа, частицы HCMV по настоящему изобретению должны содержать или продуцировать соответствующие антигены для индукции антигенспецифичных антител, предпочтительно, нейтрализующих антител и для стимуляции хелперных клеток (TH-лимфоциты) и цитотоксических T-клеток (CTL).
В принципе, антигены HCMV, которые подходят для индукции иммунного ответа, предпочтительно у человека, представляют собой, в частности, следующие ниже антигены, хотя специалист в данной области признает, что другие антигены HCMV также могут быть активны до такой степени (Sylwester AW, JEM Vol. 202, September 5, 2005, p.673-685).
Антигены HCMV, распознаваемые CD4+ T-клетками, предпочтительно выбраны из группы, включающей UL55 (gB), UL83 (pp65), UL86, UL99 (pp28), UL122 (IE2), UL36, UL48, UL32 (pp150), UL113, IRS-1, UL123 (IE1), UL25, UL141, UL52, UL82 (pp71), US22, UL75 (gH), US23, UL69, US26, UL44 (pp50), UL16, US3, US18, UL78, UL18, UL17, TRL14, UL100, UL45, UL145, UL154, UL43, UL152, UL144, UL24, UL4 (gp48), UL49, UL102 и UL87. Более предпочтительно, антигены, подверженные CD4+ T-клеточным ответам, выбраны из группы, включающей UL55, UL83, UL86, UL99, UL153 и UL32.
Антигены HCMV, распознаваемые CD8+ T-клетками, предпочтительно выбраны из группы, включающей UL48, UL83 (pp65), UL123 (IE1), UL122 (IE2), US32, UL28, US29, US3, UL32 (pp150), UL55 (gB), UL94, UL69, UL105, UL82 (pp71), UL99 (pp28), UL154, UL44 (pp50), UL86, UL33, UL49, US1, UL150, UL34, US30, TRL14, IRS-1, UL36, UL37, UL75 (gH), UL45, UL153, UL116 и UL54. Более предпочтительно, антигены, подверженные CD8+ T-клеточным ответам, выбраны из группы, включающей UL123, UL83, UL122, UL28, UL48, US3, UL151, UL82, UL94, US29, UL99, UL103, US32, US24 и UL36.
Нейтрализующие антитела, согласно изученности в настоящее время, после инфицирования HCMV образуются исключительно против белков вирусной оболочки, и, в особенности, против гликопротеинов gB, gH, gM и gN (Shen et al, Vaccine 20, 2007).
TH-клетки образуются, в основном, против белков тегумента вируса, и, в частности, против так называемого pp65 (ppUL83), gH и gB (Sylwester et al., J. Exp. Medicine Vol. 202, 2005). Более определенно, pp65 представляет собой необходимый антиген для индукции CTL против HCMV. Презентация pp65 имеет место не только, как обычно, после синтеза de novo клетками применительно к молекулам MHC класса I; его также можно ввести в путь презентации молекулами MHC I при помощи так называемого «экзогенного введения».
Указанные антигены представляют собой необходимые элементы частиц HCMV по настоящему изобретению и, более определенно, плотных телец HCMV и NIEP HCMV, каждые по настоящему изобретению. Наиболее определенно, плотные тельца (DB) представляют собой структуры, которые видно под электронным микроскопом. Наиболее представленным белком (в большом количестве) в DB является белок тегумента pp65. DB сопоставимы с вирусными частицами в том, что они имеют клеточную липидную мембрану, которая также возвращается к исходному вирулентному состоянию, как оболочка, модифицированная вирусными гликопротеинами. Вирусные гликопротеины, весьма вероятно, находятся в данном конверте в природной конформации. Поскольку DB не содержат никакой вирусной ДНК и никакого вирусного капсида, они не являются инфекционными. Их можно сконцентрировать в большом количестве в надосадочной жидкости клеточной культуры общепринятыми способами.
Следующие ниже варианты осуществления описаны в отношении pp65. Тем не менее, будет понятно, что, в принципе, такие же принципы применимы для других антигенов, подходящих для практики по настоящему изобретению, и/или антигенов, описываемых в настоящем документе либо непосредственно, либо в качестве ссылки.
В дополнительном варианте осуществления обнаружены и описаны частицы HCMV, которые содержат слитый белок, который включает в одной части один или несколько фрагментов вирусного антигена pp65 (ppUL83) для T-клеток или полный белок и в другой части один или несколько фрагментов из одного или нескольких других белков.
Это позволяет оптимизировать антигенные свойства частиц HCMV, поскольку данный слитый белок присутствует в частицах в большом количестве. Дополнительно известно, что экспрессия антигенов для клеточного и гуморального иммунного ответа в одной молекуле может резко усилить антигенные свойства. Различные фрагменты pp65 и других белков можно напрямую сливать вместе, но также возможно, например, для последовательностей линкеров, которые не являются природным составляющим компонентом одного из соответствующих белков, что они присутствуют между различными фрагментами. Последовательности такого типа могут быть результатом клонирования или их можно специально встраивать для того, чтобы оказывать влияние на свойства антигена. Тем не менее, слитый белок предпочтительно не содержит инородных последовательностей, которые не являются составляющим компонентом одного из участников слияния. В таких вариантах осуществления слитый белок состоит из одной или нескольких частей pp65 и одной или нескольких частей одного или нескольких других белков.
Это применимо ко всем вариантам осуществления, упоминаемым в дальнейшем, где полный pp65 или одна или несколько его частей может присутствовать в слитом белке. Формулировка «слитый белок (состоящий из) pp65» предназначена в данной заявке для целей, которые не нужно понимать как укороченный в отношении полного pp65. «Часть» или «фрагмент», присутствующий в слитом белке, содержит, по меньшей мере, 6, предпочтительно, по меньшей мере, 8, наиболее предпочтительно, по меньшей мере, 9, 15 или 20 последовательных аминокислот белка, из которого они происходят.
Предпочтительный вариант осуществления включает слитый белок pp65 (ppUL83) и один или несколько нейтрализующих эпитопов вирусных гликопротеинов gB или gH. Частицы такого типа можно получить, как изображено на фиг.1. Слитый белок может попадать, посредством антигенспецифичного поглощения, специфичными для гликопротеинов B-клетками, которые, в свою очередь, способны представлять эпитопы как гликопротеинов, так и pp65 в контексте молекул MHC класса II. Кроме того, также для фрагментов слитого белка возможно представление специальными антигенпредставляющими клетками (APC) в контексте молекул MHC класса II. В обоих случаях результатом является эффективная стимуляция TH-ответа как в отношении pp65, так и в отношении вирусных гликопротеинов. Такие CD4-положительные TH-клетки способны стимулировать специфические для гликопротеинов B-клетки, которые представляют пептиды pp65 и вирусных гликопротеинов в контексте молекул MHC класса II, для образования антител, в частности, нейтрализующих антител, при этом антитела направлены в одном из вариантов осуществления на гомологичный антиген и в другом варианте осуществления на гетерологичный антиген. Кроме того, частицы такого типа могут подобно инфекционным вирионам захватываться внутрь клеток, и пептиды pp65 могут встраиваться посредством экзогенного введения в путь MHC класса I. Это обеспечивает, что необычно для инактивированных вакцин, стимуляцию ответа CTL в отношении HCMV.
В дополнительном предпочтительном варианте осуществления частицы HCMV содержат слитый белок, состоящий из pp65 и одной или нескольких частиц другого белка HCMV, белка IE1 (ppUL123). Части белка IE1, которые будут представляться, в частности, представляют собой белки, против которых у людей образуются цитотоксические T-клетки во время естественного инфицирования. Пептиды белка IE1 в некоторых случаях представляются различными молекулами MHC класса I, которые представляют собой пептиды pp65. Добавление таких дополнительных «эпитопов для CTL» из IE1 предназначено для того, чтобы гарантировать, что после иммунизации привитые субъекты, у которых экспрессируются различные молекулы MHC класса I, способны продуцировать CTL против HCMV настолько всеобъемлющим образом, насколько возможно.
В дополнительном предпочтительном варианте осуществления частицы HCMV содержат слитый белок, состоящий из pp65, одного или нескольких нейтрализующих эпитопов гликопротеинов HCMV и одного или нескольких эпитопов CTL IE1. Слияние pp65 с нейтрализующими эпитопами и эпитопами CTL предназначено для того, чтобы гарантировать, что одновременно возможно образование как нейтрализующих антител, так и CTL у привитых субъектов настолько всеобъемлющим образом, насколько возможно, то есть у максимального количества людей, отличающихся паттерном молекул MHC класса I.
В дополнительном предпочтительном варианте осуществления частицы HCMV содержат слитый белок pp65 и один или несколько эпитопов другого патогена человека. Подходящие фрагменты других патогенов человека представляют собой антигены, против которых у людей образуются нейтрализующие антитела. Посредством слияния таких «нейтрализующих антигенов» с T-клеточным антигеном pp65 возможно ожидать заметного усиления иммунного ответа, то есть гуморального иммунного ответа, по сравнению с применением отдельного «нейтрализующего антигена». Примерами таких «нейтрализующих антигенов», которые следует упомянуть, являются поверхностные белки вируса гепатита B (из области HBsAG), вируса гепатита C (например, E2), вирусов иммунодефицита человека (HIV, из области Env), вируса гриппа (гемагглютинин, нейраминидаза, нуклеопротеин) или другие вирусные патогены. Дополнительные подходящие патогены для человека представляют собой бактерии, такие как Haemophilus influenzae, Bordetella pertussis, Mycobacterium tuberculosis, Neisseria meningitidis и другие. В заключение, антигены из эукариотических патогенов, такие как плазмодий (малярия) можно сливать с pp65. Такие антигены или слитые белки также обозначены в настоящем документе как производные антигенов, и слитый белок, взаимодействующий как антиген, содержащий полноразмерный или частичный pp65, также обозначен в настоящем документе как производное антигена.
В дополнительном предпочтительном варианте осуществления частицы HCMV содержат слитый белок, состоящий из pp65 и одного или нескольких частей белков или пептидов, при этом воздействия pp65 могут осуществляться в качестве поддержки указанных белков и пептидов, соответственно, из других патогенов, против которых образуются CTL у людей при естественном инфицировании данными патогенами. Примерами таких эпитопов CTL, которые можно упомянуть, являются части белков HIV-I, HBV, HCV или вируса гриппа. Предназначение такой процедуры состоит в том, чтобы использовать уникальные иммуногенные свойства DB для продукции защитных CTL, то есть цитотоксических T-лимфоцитов, предпочтительно цитотоксических CD8+ T-клеток, против гетерологичных патогенов у людей.
В дополнительном предпочтительном варианте осуществления частицы HCMV содержат слитый белок, состоящий из pp65, одного или нескольких нейтрализующих эпитопов гетерологичного патогена и одного или нескольких эпитопов CTL того же самого патогена. Такое слияние предназначено для того, чтобы гарантировать, что привитые субъекты способны продуцировать как защитные антитела, так и CTL против данного патогена.
Изобретение дополнительно относится к частицам HCMV, содержащим, по меньшей мере, два различных гликопротеина, которые представляют собой варианты одного и того же гликопротеина из разных штаммов HCMV.
Предпочтительный вариант осуществления содержит как раз два варианта, один вариант, соответствующий штамму Towne HCMV, и другой вариант, соответствующий штамму Ad 169 HCMV. Предпочтительный вариант осуществления содержит гликопротеин gB и штамма Towne, и штамма Ad 169.
Данные два белка можно с одинаковой эффективностью встраивать в мембрану рекомбинантных плотных телец в инфицированной клетке. Такие рекомбинантные плотные тельца подходят для индукции не только перекрывающего несколько штаммов, но также специфичного для штамма нейтрализующего иммунного ответа в отношении двух прототипов штаммов HCMV.
В рамках настоящего изобретения помимо антигенов дикого типа, то есть таких, как присутствуют в штаммах HCMV дикого типа, или нерекомбинантных антигенов, их производные можно использовать в практике по настоящему изобретению. Используемый в настоящем документе термин производное применительно к антигену предпочтительно относится к антигену, который представляет собой рекомбинантный антиген. Рекомбинантный антиген представляет собой антиген, в варианте осуществления, который по сравнению с полноразмерным антигеном укорочен, содержит одну или несколько замен аминокислот, когда имеет такую же длину, что и антигены дикого типа, или содержит дополнительные аминокислотные остатки. В рамках настоящего изобретения, что дополнительные аминокислотные остатки можно добавлять к укороченной форме антигена или к форме, которая содержит одну или несколько замен аминокислот. Такое укорочение можно осуществить до такой степени, чтобы характеристики антигена все еще сохранялись. В другом варианте осуществления рекомбинантный антиген содержит помимо полноразмерного антигена или укороченного антигена дополнительный фрагмент. Такой дополнительный фрагмент предпочтительно происходит из антигена вируса, при этом такой вирус отличен от HCMV, антигена микроорганизма, предпочтительно патогенного микроорганизма, или антигена из не принадлежащего к микроорганизмам организма, который представляет собой патоген. Предпочтительно патогенный микроорганизм представляет собой микроорганизм, патогенный для млекопитающих и, более определенно, для людей, и патоген представляет собой патоген, который является патогенным для млекопитающих и, более определенно, для людей. Дополнительный фрагмент может представлять собой полноразмерный антиген или укороченный фрагмент из него. В варианте осуществления дополнительный фрагмент подходит для индукции одного или нескольких иммунных ответов, описываемых в настоящем документе. В дополнительном варианте осуществления производное антигена представляет собой гетерологичный антиген. В еще одном дополнительном варианте осуществления производное антигена представляет собой гетерологичный антиген, как предпочтительно определено в настоящем документе. Предпочтительно, иммунный ответ, который можно вызвать частицами HCMV в их различных формах, представляет собой, по меньшей мере, один из следующих ниже: антигенспецифичный CD8+ T-клеточный ответ, антигенспецифичный цитотоксический T-клеточный ответ, антигенспецифичный CD8+ цитотоксический T-клеточный ответ, антигенспецифичный гуморальный иммунный ответ, при этом, предпочтительно, антитела такого гуморального иммунного ответа представляют собой нейтрализующие антитела, антигенспецифичный ответ CD4+ хелперных T-клеток.
Вирионы и/или плотные тельца HCMV, особенно пригодные в практике по настоящему изобретению, можно получить, как описано в международной патентной заявке WO 00/53729.
Специалист в данной области признает, что различные меры, описываемые в настоящем документе, для инактивации, как таковые, известны в данной области, и их можно применять в настоящем изобретении.
Настоящее изобретение в данном документе дополнительно иллюстрируется фигурами и примерами, их которых можно почерпнуть дополнительные характерные особенности, варианты осуществления и преимущества, при этом
на фиг.1 показана стратегия получения рекомбинантных DB, которые содержат слитый белок с гомологичными или гетерологичными антигенами;
на фиг.2 показан CD8+ цитотоксический T-клеточный ответ в отношении препаратов DB, обработанных при помощи различных процедур инактивации, на повторную стимуляцию пептидной смесью pp65 (фиг.2a) и пептидом, не принадлежащим HCMV (фиг.2b);
на фиг.3 показан ответ IgG против HCMV для препаратов DB, обработанных при помощи различных процедур инактивации;
на фиг.4 показан CD8+ цитотоксический T-клеточный ответ в отношении препаратов DB, обработанных при помощи двух различных процедур инактивации, на повторную стимуляцию пептидной смесью pp65 (фиг.4a) и пептидом, не принадлежащим HCMV (фиг.4b);
на фиг.5 показан ответ IgG против HCMV для препаратов DB, обработанных при помощи двух различных процедур инактивации;
на фиг.6 показан CD8+ цитотоксический T-клеточный ответ в отношении препаратов DB, которые либо обрабатывали для инактивации остаточной инфекционности и лишали их способности к слиянию (полудинамическое УФС-излучение), либо которые не подвергались такой обработке. Повторная стимуляция пептидной смесью pp65 (фиг.6a) и пептидом, не принадлежащим HCMV (фиг.6b);
фиг.7-12 представляют собой микрофотографии, показывающие результат анализа способности к слиянию, при этом частицы HCMV, исследуемые в отношении способности к слиянию, подвергали воздействию различных способов инактивации; и
фиг.13-19 представляют собой микрофотографии, показывающие результат анализа инфекционности, при этом частицы HCMV, исследуемые в отношении способности к слиянию, подвергали воздействию различных способов инактивации.
Пример 1: Материалы и способы
Следующее ниже описание представляет собой краткое изложение различных материалов и способов, которые использовали в практике по настоящему изобретению или которые будут применимы для специалиста в данной области, применяющего настоящее изобретение.
Вкратце, препараты DB HCMV подвергали обработке для инактивации остаточной инфекционности HCMV и для лишения материала способности к слиянию. После этого четыре различных основных типа анализа проводили с использованием инактивированного материала. Анализировали способность индуцировать антигенспецифичный CD8+ цитотоксический T-клеточный ответ у мышей. Анализировали способность индуцировать образование специфических антител против HCMV. Анализировали инфекционность материала DB, обработанного для инактивации остаточной инфекционности. Анализировали способность к слиянию инактивированного материала.
1. Инактивация остаточной инфекционности HCMV
Различные способы использовали применительно к настоящему изобретению для того, чтобы инактивировать остаточную инфекционность HCMV в композициях, содержащих вирионы HCMV и/или плотные тельца HCMV.
1.1 Полудинамическая обработка УФС-излучением
Аликвоты препаратов DB объемом 300 мкл (0,2 мг белка/мл PBS) облучали в течение 5 минут в медленно встряхивающемся 24-луночном планшете для культивирования клеток УФС-светом сверху (254 нм; доза УФС 720 мДж/см2; УФС-свет: Schϋtt Osram HNS 11 Watt).
1.2 Облучение гамма-лучами
Аликвоты препаратов DB объемом 675 мкл (0,2 мг белка/мл) в стеклянных пробирках объемом 2 мл обрабатывали гамма-излучением 52 КГр на сухом льду. После процесса инактивации материал замораживали при -80°C для последующего анализа.
1.3 Низкое значение pH
1,15 мл препаратов DB (0,2 мг белка/мл) смешивали с 100 мМ цитрата натрия при pH 4,5 и инкубировали при 30°C в течение 60 мин. После этого материал осаждали ультрацентрифугированием (45 мин, ротор SW 50.1) и ресуспендировали в 1,1 мл PBS для последующего анализа (хранение при -80°C).
1.4 Термическая обработка
1,15 мл препаратов DB (0,2 мг белка/мл) инкубировали при 56°C в течение 30 мин. После процесса инактивации материал замораживали при - 80°C для последующего анализа.
1.5 β-пропиолактон (BPL)
1,15 мл образца (0,2 мг белка/мл) смешивали с 10 мл 50 мМ Tris/HCl pH 8,0 и 0,24 мл свежеприготовленного 10% раствора BPL в 50 мМ Tris/HCl pH 8,0 (0,21% об./об. конечная концентрация BPL). Образцы инкубировали в течение 60 мин при 30°C. После чего материал осаждали ультрацентрифугированием (45 мин, ротор SW 50.1) и ресуспендировали в 1,1 мл PBS для последующего анализа (хранение при -80°C).
1.6 Динамическая обработка УФС-излучением с последующим облучением гамма-лучами
Частицу HCMV, содержащуюся в надосадочной жидкости культуры клеток (среда без красителя), облучали дозой динамического УФС-излучения 200 мДж/см2 при помощи небольшого блока UVivatec Lab (поставляемого BTS Bayer Technology Services, D-51368 Leverkusen, Germany). Дозу при 254 нм вычисляли согласно расчетному листу, предоставляемому BTS. Затем препараты DB переливали в стеклянные пробирки и обрабатывали гамма-излучением 23,8 KГр на сухом льду. Хранение при -80°C для последующего анализа.
2. Исследование способности вирионов HCMV и плотных телец HCMV индуцировать антигенспецифичный CD8+ цитотоксический T-клеточный ответ у мышей
Общий обзор: мышей будут иммунизировать материалом DB, который обрабатывали для инактивации остаточной инфекционности HCMV. Мышей будут умерщвлять и удалят селезенки. Затем получат отдельные суспензии клеток селезенки и лизируют эритроциты. После чего оставшиеся клетки селезенки перенесут в культуру клеток и будут инкубировать с определенными пептидами. Впоследствии клетки селезенки будут анализировать в отношении количества IFN-гамма-положительных CD8+ T-клеток. Пептидами, специфичными для антигена pp65 HCMV, будут повторно стимулировать клетки селезенки, поскольку они происходят из мышей, иммунизированных при помощи pp65, содержащими в DB. В данном анализе CD8-положительные цитотоксические T-клетки (содержащиеся в суспензии клеток селезенки), которые специфичны в отношении pp65, будут продуцировать IFN-гамма. Обработка клеток селезенки нерелевантным, не принадлежащим HCMV пептидом служит в качестве отрицательного контроля. Нерелевантный, не принадлежащий HCMV пептид не должен приводить к индукции IFN-гаммаположительных CD8+ цитотоксических T-клеток, поскольку мышей не иммунизировали данным антигеном до этого. Анализ продуцирующих IFN-гамма CD8+ цитотоксических T-клеток будут проводить посредством проточной цитометрии (FACS).
2.1 Иммунизация мышей
Самок мышей BALB/c в возрасте 8 недель иммунизировали (п/к) 20 мкг препарата DB. Через 3 недели их стимулировали (п/к) 20 мкг препарата DB. Еще через 2 недели животных умерщвляли для анализа специфичного для pp65 ответа CTL, для анализа антигенспецифичных CD4+ хелперных T-клеток, для анализа специфичного для HCMV гуморального иммунного ответа и для анализа нейтрализующего HCMV гуморального иммунного ответа.
2.2 Повторная стимуляция специфичных для pp65 CTL в селезенке мыши
2.2.1. Получение клеток селезенки
- подогреть все необходимые буферы до 37°C
- получить селезенки
- поместить нейлоновое сито фалькон размером 100 мкм в пробирку фалькон объемом 50 мл, пропустить селезенку через ячейки сита, чтобы получить отдельную клеточную суспензию, прополоскать всего 10 мл PBS/1% FCS
- центрифугировать при 1400 об./мин (250-300 g), 5 мин, 20°C
- удалить надосадочную жидкость, ресуспендировать осадок в в 10 мл буфера для лизиса эритроцитов (37°C)
- инкубировать 3 мин при комнатной температуре (RT)
- центрифугировать при 1400 об./мин (250-300 g), 4 мин, 20°C
- промыть осадок 10 мл PBS/1% FCS; центрифугировать при 1400 об./мин., 4 мин, 20°C; ресуспендировать второй раз с 10 мл PBS/1% FCS и удалить скопление соединительной ткани
- забрать аликвоты, чтобы определить концентрацию клеток (использовать разведение 1:10 для определения)
- центрифугировать при 1400 об./мин. (250-300 g), 4 мин, 20°C
- ресуспендировать осадок в смеси среды Клика RPMI/полной среды, доводя концентрацию до 1,5 × 107 клеток/мл
- необходимо 4 параллельных лунки (100 мкл клеточной суспензии на лунку) на образец для повторной стимуляции (четырехкратные повторы)
2.2.2 Пептиды
2.2.2.1 Для повторной стимуляции специфичными для pp65 HCMV пептидами
Реактивы: pp65 HCMVA PepMix из фирмы JPT Peptide Technologies GmbH, 10115 Berlin; pp65 (HCMVA) № P06725, 1 флакон = 25 мкг на пептид; смесь 138 пептидов (15-меры, перекрывание 11); хранение маточного раствора 400 мкг/мл в химически чистом DMSO (хранить при -20°C); приготовить рабочий маточный раствор 2 мкг/мл.
2.2.2.2 Для повторной стимуляции нерелевантным контрольным пептидом
Реактивы: нерелевантный нонамерный контрольный пептид. Например, для мышей BALB/c Kd-связывающий пептид малярии (SYVPSAEQI); хранение маточного раствора 1 мг/мл в DMSO (хранить при -20°C); приготовить рабочий маточный раствор 2 мкг/мл.
2.2.3 Брефелдин A
Получить маточный раствор брефелдина A (Sigma №B-7651) в концентрации 10 мг/мл в DMSO; получить рабочий раствор в концентрации 20 мкг/мл в смеси среды Клика RPMI/полной среды (конечная концентрация в лунке для повторной стимуляции 5 мкг/мл).
Брефелдин A блокирует транспорт в аппарате Гольджи посредством ингибирования секреции продуцируемых цитокинов, цитокины остаются внутриклеточными при обработке брефелдином A, так что продуцирующие цитокины клетки можно определить, применяя способы внутриклеточного окрашивания.
2.2.4 PMA/иономицин
PMA (форбол-12-миристат-13-ацетат), Sigma №P8139; приготовить маточный раствор в концентрации 1 мг/мл в DMSO; приготовить рабочий раствор в концентрации 0,4 мкг/мл в смеси среды Клика RPMI/полной среды (0,05 мкг PMA/мл в лунке для повторной стимуляции).
Иономицин, Sigma №10634; приготовить маточный раствор в концентрации 1 мг/мл в DMSO; приготовить рабочий раствор в концентрации 4 мкг/мл в смеси среды Клика RPMI/полной среды (0, 5 мкг PMA/мл в лунке для повторной стимуляции).
PMA и иономицин поликлонально стимулируют T-клетки. Они служат в качестве положительного контроля при анализе, чтобы убедиться, что качество клеток и способы внутриклеточного окрашивания были оптимальны.
2.2.5 Смесь среда Клика RPMI/полная среда
10,81 г среды Клика RPMI в виде порошка (+ L-глутамин/- NaHCO3) фирмы AppliChem № A2504.
+ 1,175 г NaHCO3
Добавить 1 л дистиллированной воды → стерильная фильтрация
+ Глутамин 2 мМ
+ PenStrep - 100 ед/мл пенициллина, 100 мкг/мл стрептомицина
+ 5% фетальная телячья сыворотка (FCS), Invitrogen/Gibco № 10106-185,
+ β-меркаптоэтанол 4 × 10-6 M
+ буфер Hepes 10 мМ, Invitrogen/Gibco № 15630-049
2.2.6 Препарат для повторной стимуляции
- На каждую селезенку и используемый для повторной стимуляции пептид раскапать пипеткой по 100 мл суспензии клеток селезенки в каждые 4 лунки 96-луночного круглодонного планшета (конечное количество клеток на лунку 1,5 × 106)
- добавить 50 мкл рабочего раствора пептида или рабочего раствора 25 мкл PMA/25 мкл иономицина
- добавить 50 мкл брефелдина A (при концентрации 20 мкг/мл)
- инкубировать 4 ч при 37°C (5% CO2) перед анализом FACS
2.3 CD8-положительные (CD8+) T-клетки/окрашивание внутриклеточного IFNγ для анализа FACS
День 1:
- довести связывающий буфер до комнатной температуры (RT)
- центрифугировать 96-луночный круглодонный планшет, содержащий препарат для повторной стимуляции (1400 об/мин/4 мин/4°C/с тормозным механизмом; 250-300 г).
- объединить осадки параллельных инкубаций (четырехкратные повторы) с 90 мкл буфера A (PBS + 0,5% (масс./об.) BSA + 0,1% (масс./об.) NaN3) и перенести в новый 96-луночный круглодонный планшет. Повторить промывание 90 мкл объема, чтобы получить все оставшиеся клетки из препарата для повторной стимуляции → 180 мкл общего объема на образец препарата
- центрифугировать новый планшет, добавить 120 мкл надосадочной жидкости от гибридомы (2.4G2) на лунку, смешать и инкубировать 15 мин при 4°C
- центрифугировать планшет + удалить надосадочную жидкость
- добавить 100 мкл CD8.PE против рецептора мыши (разведенный в соотношении 1:200 в буфере A) → ресуспендировать осадок → инкубировать 20 мин, 4°C
- после периода инкубации добавить 100 мкл буфера А
- центрифугировать планшет и два раза промыть 150 мкл буфера А/центрифугировать
- добавить 150 мкл связывающего буфера (1% параформальдегид в PBS) к осадку, ресуспендировать → инкубировать 15 мин при RT (в темноте)
- центрифугировать планшет → ресуспендировать осадок 150 мкл буфера A
- планшет можно хранить при 4°C в таком виде в течение одной или двух ночей до того как приступить к внутриклеточному окрашиванию
День 2:
- центрифугировать планшет → ресуспендировать с 150 мкл буфера B на лунку → инкубировать 15 мин при RT (в темноте)
- центрифугировать → добавить 50 мкл/лунку антиIFNγ.FITC, (разведенные в буфере В в соотношении 1:200) → ресуспендировать и инкубировать 30 мин при RT (в темноте)
- добавить 100 мкл буфера B (PBS + 0,5% (масс./об.) BSA + 0,5% (масс./об.) сапонин + 0,05% (масс./об.)NaN3), вращать.
- промыть три раза 150 мкл буфера B на лунку
- ресуспендировать клетки в 150 мкл буфера A на лунку и перенести в пробирки для FACS
- снова ресуспендировать оставшиеся клетки в 150 мкл буфера A и объединить в ту же самую пробирку для FACS
- проанализировать 60000 CD8+ T-клеток на образец проточной цитометрией
Другие реактивы
Нейлоновое сито фалькон 100 мкм (Falcon каталожный № 352360).
Конъюгат с PE против CD8a мыши, 0,2 мг/мл; каталожный № 553033; BD Biosciences.
Крысиное антитело против IFNy мыши, конъюгированное с FITC, 0,1 мг; IgG1 крысы; клон XMG1.2, каталожный №554411; BD Biosciences.
Параформальдегид степени чистоты EM, каталожный № 00380-250; 250 мг Polysciences Europe.
Сапонин (от Quillaja bark), Sigma № S-2149; 25 г;
Буфер для лизиса эритроцитов
Приготовить маточный раствор NH4Cl 0,16 M. Приготовить маточный раствор Tris 0,17 M. Смешать 4,5 литра маточного раствора NH4Cl и 0,5 литра маточного раствора Tris, перемешивать в течение 1 часа, затем довести pH до значения 7,2. Автоклавировать.
Надосадочная жидкость от гибридомы 2.4G2
Рецептор FcRII против Fcγ; надосадочная жидкость культуры приблизительно от 4-дневной культуры (плотное сито для клеток). Рецептор FcRII против Fcγ предназначен для того, чтобы предотвратить неспецифическое связывание антител, используемых для окрашивания CD8 и IFNγ, с клеточными Fc-рецепторами. Неспецифическое связывания антител, используемых для окрашивания, могло бы привести к ложноположительным сигналам.
Гибридома 2.4G2 доступна в ATCC.
Связывающий буфер
1% параформальдегид в PBS: 1 г параформальдегида в 100 мл PBS [взвешивать в химическом вытяжном шкафу!]; нагревать 1 час при 70°C, чтобы растворить; хранить при 4°C.
3. ELISA для определения ответа IgG против HCMV у мышей
Материал: SERION ELISA classic CMV IgG (Clindia); стрипы, покрытые лизатом HCMV, готовые для использования (ESR 109G)
Образец: сыворотка мыши (смотри 2.1)
Способ:
- Сыворотка: добавить 100 мкл разведенной сыворотки (в PBS/T) в каждую лунку, например, 1:125; 1:250; 1:500; 1:1000; 1:2000; 1:4000 и 1:8000
Инкубировать в течение 1 часа при 37°C без встряхивания
- Отмывка: быстро вытащить раствор антитела в мойку.
Промыть планшет, промывая каждую лунку 5× 200 мкл промывочного буфера.
После стадии третьей отмывки, удалить остаточную жидкость, осторожно встряхивая планшет лицевой стороной вниз, на несколько слоев бумажных полотенец.
- AK/HRP: добавить конъюгат с HRP AK против IgG мыши, разведенный в соотношении 1:1000 в PBS/T в количесвте 100 мкл/лунку, инкубировать в течение 1 часа при 37°C без встряхивания
- Отмывка: Повторить стадию 2
- Окрашивание: Приготовить окрашивающий раствор непосредственно перед использованием:
1 мг OPD/мл субстратного буфера + 1 мкл/мл H2O2 (например, растворить 11 мг OPD/ 11 мл субстратного буфера, добавить 11 мкл H2O2)
Добавить окрашивающий раствор 100 мкл/лунку, инкубировать при RT в темноте в течение от 10 до 15'
- Фиксация: Добавить 50 мкл стоп-реагента и измерить на считывателе ELISA при 492 нм.
Реактивы
H2O2 30%
4. Анализ способности к слиянию частиц HCMV
Цель данного анализа заключается в исследовании, способны ли все еще частицы HCMV к слиянию с определенной мишенью, такой как фибробласты человека MRC5. Анализировали, может ли белок pp65 HCMV проникать в соответствующие клетки-мишени. Такой анализ осуществляли при помощи иммунофлуоресцентной микроскопии (против pp65; зеленое флуоресцентное окрашивание в ядре). При слиянии DB с фибробластом, белок pp65 высвобождается в цитоплазму клетки-мишени. Поскольку pp65 транспортируется в ядро, он обнаруживается там при иммуноокрашивании. В частицах HCMV, которые не сливаются с HCMV-отрицательными клетками-мишенями, белок тегумента pp65 локализован внутри частиц HCMV. Его нет внутри клеток-мишеней. Наоборот, в клетках, которые слились с частицами HCMV, будет иметь место зеленое флуоресцентное окрашивание в клетках, указывающее на присутствие pp65 в ядре клеток.
Протокол анализа способности к слиянию:
- Поместить 100 мкл фибробластов человека MRC5 (ATCC, № ATCC-CCL-171) из ведущейся культуры в свежую культуру (1 × 105 клеток/мл среды для культивирования; 37°C, 5% CO2; четырехкратные повторы; 96-луночные планшеты).
- Инкубировать в течение ночи при 37°C
- Удалить 70 мкл среды из каждой лунки и добавить 5 мкл образца, который необходимо исследовать в отношении способности к слиянию
- Через 1 ч обратно добавить 70 мкл среды и инкубировать в течение 24 ч
- Удалить надосадочную жидкость от клеток (96-луночный планшет)
- Добавить 200 мкл/лунку 96% этанола и инкубировать 20 мин при RT
- Промыть 4 раза 150 мкл PBS/0,1% Triton X100 на лунку
- Блокировать 50 мкл SN2.4G2 на лунку в течение 15 мин при RT
- Удалить надосадочную жидкость от клеток
- Добавить первичное антитело (50 мкл/лунку): против pp65, разведение в PBS 1:100, № C8A023M.
- Инкубировать в течение 1 ч при 37°C
- Промыть 3 раза 150 мкл PBS/0,1% Triton X100 на лунку
- 50 мкл/лунку: добавить вторичное антитело + Эванс голубой (2.Ab 1:50/Эванс голубой 1:25 в PBS), № E0413, и инкубировать в течение 30 мин при 37°C.
- Промыть 4 раза 150 мкл PBS/0,1% Triton X100 на лунку
- Добавить смесь стрептавидин/FITC в количестве 50 мкл/лунку (1:100 в PBS), Beckman Coulter, № PNIM0307.
- Инкубировать в течение 15 мин при 4°C.
- Промыть 3 раза 150 мкл PBS/0,1% Triton X100 на лунку
- Добавить 150 мкл PBS на лунку (без TX100) и хранить при 4°C, обернутым алюминиевой фольгой (защищенным от света) до готовности для анализа при помощи флуоресцентной микроскопии.
- Анализировать посредством флуоресцентной микроскопии.
Первичное антитело:
Для того чтобы увидеть способность к слиянию: против pp65, клон 1-L-11, асциты мыши, Biodesign, каталожный № C8A023M, 1 мг/мл; использовать разведенным 1:100 в PBS.
Вторичное антитело:
Поликональное кроличье против Ig мыши/биотинилированный кроличий F(ab')2 Dako, № E0413, (0,79 г/л); использовать разведенным 1:50 в PBS.
Эванс голубой:
Fluka № 46160 - растворить до 0,5% в PBS и использовать разведенным 1:25 в PBS.
Стрептавидин-DTAF (Strep/FITC)
Beckman Coulter, № PN IM 0307 (1,8 мг/мл); использовать разведенным 1:100 в PBS.
PBS/0,1% Triton X-100 (для промывки).
Надосадочная жидкость от гибридомы SN2.4G2
Рецептор FcRII против Fcγ; надосадочная жидкость культуры приблизительно от 4-дневной культуры (плотное сито для клеток). Рецептор FcRII против Fcγ предназначен для того, чтобы предотвратить неспецифическое связывание антител, используемых для окрашивания CD8 и IFNγ, с клеточными Fc-рецепторами. Неспецифическое связывание антител, используемых для окрашивания, могло бы привести к ложноположительным сигналам.
Гибридома 2.4G2 доступна в ATCC.
Среда:
MEM с 10% FCS
2 мМ глутамина
50 мг/мл гентамицина
1 мМ MEM пирувата натрия
1× NEAA (заменимые аминокислоты)
5. Исследование инфекционности частиц HCMV
Анализ по исследованию инфекционности используют, чтобы установить эффективность инактивации вируса. В данном анализе клетки фибробласты инкубируют вместе с образцами, содержащими либо инфекционный (положительный контроль), либо инактивированный (неинфекционный) вирус. Последующее AEC (= 3-амино-9-этилкарбазол) окрашивание представляет собой иммуногистохимический анализ, визуализирующий целевые белки. В данном случае, моноклональное мышиное антитело направлено против IEA (предраннего антигена) HCMV, вирусного белка, который появляется вскоре после инфицирования клетки IEA, достигает максимума интенсивности через 48 часов и персистирует во время всего цикла инфицирования HCMV. Вторичное антитело представляет собой поликлональное антитело против антитела мыши, конъюгированное с HRP (пероксидазой хрена). Несвязавшийся конъюгат смывают и добавляют хромогенное вещество (AEC). Данный субстрат гидролизуется связывающим конъюгат ферментом и это приводит к получению нерастворимого конечного продукта, который является красным, и его можно визуально наблюдать под микроскопом. Поскольку IEA является ядерным белком, клетки, которые были инфицированы HCMV, можно идентифицировать по их окрашенным ядрам. Образец сравнения служит только в качестве контроля для процедуры окрашивания. Данный образец расценивается как неинфекционный, когда в соответствующих лунках ядра клеток не окрашены.
Протокол для анализа инфекционности
- Поместить 100 мкл фибробластов человека MRC5 (ATCC, № ATCC-CCL-171) из ведущейся культуры в свежую культуру (1 × 105 клеток/мл среды для культивирования; 37°C, 5% CO2; четырехкратные повторы; 96-луночные планшеты).
- Через 24 часа добавить 100 мкл разведения материала, который необходимо проанализировать в отношении инфекционности, к 100 мкл клеток (например, в таблице 1: разведение 1:200 для объекта сравнения или 0,3 мкг белка исследуемых образцов, соответственно)
- Инкубировать в течение 48 ч при 37°C
- Удалить надосадочную жидкость HCMV после 48 ч
- Промыть клетки 150 мкл PBS/каждую лунку
- Фиксировать клетки 96% этанолом (200 мкл/лунку) в течение 20 мин при RT
- Промыть 2 раза PBS (150 мкл/лунку)
- Добавить первичное антитело, предназначенное для антигена IE (αHCMV IEA, Argene; № 11-003), разведенное в соотношении 1:100 в PBS (50 мкл/лунку)
- Инкубировать в течение 60 мин при 37°C; обернутым пищевой пленкой во влажной камере (инкубаторе)
- Промыть 3 раза PBS/0,1% Triton X100 на лунку по 150 мкл/каждую лунку.
- Добавить вторичное антитело: против антитела мыши с пероксидазой (например, Dako P0260), разведенное в соотношении 1:500 в PBS (50 мкл/лунку)
- Инкубировать в течение 60 мин при 37°C; обернутым пищевой пленкой во влажной камере (инкубаторе)
- Промыть 3 раза PBS/0,1% Triton X100 на лунку по 150 мкл/каждую лунку.
- Окрашивание: Маточный раствор AEC, разведенный в соотношении 1:20 в ацетатном буфере, 2× отфильтрованный через бумажный фильтр, который до этого предварительно смачивали ацетатным буфером.
- Непосредственно перед процедурой окрашивания добавить 1:1000 H2O2 (30%)
- Из данного окрашивающего раствора добавить 100 мкл/лунку
- Инкубировать точно в течение 1ч при 37°C в темноте (инкубаторе)
- Промыть 2 × PBS по 150 мкл/каждую лунку.
- Для микроскопии добавить 1 × PBS (150 мкл/лунку); хранить при 4°C. Инфицированные ядра будут ярко-красными.
Маточный раствор AEC:
400 мг AEC (= 3-Амино-9-этилкарбазол; Sigma; № A6926) довести до 100 мл DMF (диметилформамидом; Roth; № 6251.1);приготовить аликвоты по 2 мл и хранить при -20°C.
Ацетатный буфер:
13,6 г ацетата натрия × 3 H2O + 2,88 мл безводной уксусной кислоты + H2O до 1000 мл довести до pH 4,9.
Среда:
MEM с 10% FCS
2 мМ глутамина
50 мг/мл гентамицина
1 мМ MEM пирувата натрия
1× NEAA (заменимые аминокислоты)
Пример 2
Результаты
Результаты по специфичному для pp65 CD8+ CTL ответу
В общих словах, данные показывают, что препараты DB, обработанные для того, чтобы инактивировать остаточную инфекционность HCMV и лишить препараты DB способности к слиянию, остаются способными индуцировать специфичный для pp65 CD8+ цитотоксический T-клеточный ответ у мышей (фиг.2 и 4). Обработанные образцы не способны к слиянию, как показано на фиг.7-12 и, как показано в таблице 1, не являются инфекционными.
Препараты DB, обработанные для того, чтобы инактивировать остаточную инфекционность HCMV и лишить препараты DB способности к слиянию, как было показано, иммуногенны в равной степени, как и необработанные препараты HCMV (фиг.6). Об этом судили по специфичному для pp65 HCMV CD8+ цитотоксическому T-клеточному ответу у мышей.
На фиг 2 показаны результаты для мышей Balb/C, которых иммунизировали материалом DB, который обрабатывали для того, чтобы инактивировать остаточную инфекционность HCMV и лишить их способности к слиянию, как изложено в примере 1: УФС-излучением (720 мДж/см2), низким значением pH, высокой температурой, облучением гамма-лучами (52 кгр) и β-пропиолактоном, соответственно. На оси X указано количество продуцирующих IFN-гамма CD8+ цитотоксических T-клеток на 105 CD8+ T-клеток. В данном анализе CD8-положительные цитотоксические T-клетки (содержащиеся в суспензии клеток селезенки), которые специфично для pp65, продуцируют IFN-гамма (фиг.2a). Обработка клеток селезенки нерелевантным, не принадлежащим HCMV пептидом служила в качестве отрицательного контроля при повторной стимуляции (фиг.2b). Результаты показывают, что даже препараты DB, обработанные для того, чтобы инактивировать остаточную инфекционность, все еще способны индуцировать CD8+ цитотоксический T-клеточный ответ, специфичный в отношении pp65 HCMV. У мышей, иммунизированных PBS, почти не показаны какие-либо продуцирующие IFN-гамма CD8+ T-клетки.
На фиг.4 показаны результаты для мышей Balb/C, которых иммунизировали материалом DB, который обрабатывали для того, чтобы инактивировать остаточную инфекционность HCMV и лишить их способности к слиянию, как изложено в примере 1: либо одним только УФС-облучением, либо динамическим УФС-излучением и последующим облучением гамма-лучами (23,8 кгр). На оси X указано количество продуцирующих IFN-гамма CD8+ цитотоксических T-клеток на 105 CD8+ T-клеток. В данном анализе CD8-положительные цитотоксические T-клетки (содержащиеся в суспензии клеток селезенки), которые специфично для pp65, продуцируют IFN-гамма (фиг.4a). Обработка клеток селезенки нерелевантным, не принадлежащим HCMV пептидом служила в качестве отрицательного контроля при повторной стимуляции (фиг.4b). Результаты показывают, что даже препараты DB, обработанные комбинацией двух процедур облучений, все еще способны индуцировать CD8+ цитотоксический T-клеточный ответ, специфичный в отношении pp65 HCMV. У мышей, иммунизированных PBS, почти не показаны какие-либо продуцирующие IFN-гамма CD8+ T-клетки.
На фиг.6 показаны результаты для мышей Balb/C, которых иммунизировали материалом DB. Материал либо обрабатывали для того, чтобы инактивировать остаточную инфекционность HCMV и лишить его способности к слиянию (полудинамическое УФС-облучение), либо материал не подвергался такой обработке.
На оси X указано количество продуцирующих IFN-гамма цитотоксических CD8+ T-клеток на 105 CD8+ T-клеток. В данном анализе CD8-положительные цитотоксические T-клетки (содержащиеся в суспензии клеток селезенки), которые специфично для pp65, продуцируют IFN-гамма (фиг.6a). Обработка клеток селезенки нерелевантным, не принадлежащим HCMV пептидом служила в качестве отрицательного контроля при повторной стимуляции (фиг.6b). Результаты показывают, что препараты DB, обработанные для того, чтобы инактивировать остаточную инфекционность и лишить препараты DB способности к слиянию, были в равной степени иммуногены как и необработанные препараты. Об этом судили по специфичному для pp65 HCMV CD8+ цитотоксическому T-клеточному ответу у мышей. У мышей, иммунизированных PBS, почти не показаны какие-либо продуцирующие IFN-гамма CD8+ T-клетки.
Результаты по ответу IgG против HCMV
В общих словах, данные показывают, что препараты DB, обработанные для того, чтобы инактивировать остаточную инфекционность HCMV и лишить препараты DB способности к слиянию, остаются способными индуцировать специфический ответ IgG против HCMV (фиг.3 и 5). Образцы неспособны к слиянию, как показано на фиг.7-12, и не являются инфекционными, как показано в таблице 1.
На фиг.3 показаны результаты для мышей Balb/C, которых иммунизировали материалом DB, который обрабатывали для того, чтобы инактивировать остаточную инфекционность HCMV и лишить его способности к слиянию, как изложено в примере 1: УФС-излучением (720 мДж/см2), низким значением pH, высокой температурой, облучением гамма-лучами (52 кгр) и β-пропиолактоном, соответственно. Чем выше максимальное разведение сыворотки, которое все еще способно индуцировать сигнал при анализе, тем сильнее индуцированный ответ против HCMV. Результаты показывают, что даже препараты DB, обработанные комбинацией двух процедур облучения, все еще способны индуцировать специфический ответ IgG против HCMV.
На фиг.5 показаны результаты для мышей Balb/C, которых иммунизировали материалом DB, который обрабатывали для того, чтобы инактивировать остаточную инфекционность HCMV и лишить его способности к слиянию, как изложено в примере 1: либо одним только УФС-облучением, либо динамическим УФС-излучением и последующим облучением гамма-лучами (23,8 KГр). Чем выше максимальное разведение сыворотки, которое все еще способно индуцировать сигнал при анализе, тем сильнее индуцированный ответ против HCMV. Результаты показывают, что даже препараты DB, обработанные комбинацией двух процедур облучения, все еще способны индуцировать специфический ответ IgG против HCMV.
Результаты анализа способности к слиянию:
В общих словах, результаты показывают, что инактивированные препараты DB, используемые для проявления специфичного для pp65 цитотоксического CD8+ T-клеточного ответа (фиг.2 и 4), а также индукции специфических антител против HCMV (фиг.3 и 5), не способны к слиянию; и, как показано в таблице 2, не являются инфекционными. Образцы обрабатывали, как изложено в примере 1. Неспецифическое зеленое окрашивание в образце P4 являлось следствием артефакта.
Результаты типичного анализа инфекционности
В общих словах, результаты показывают, что препараты DB, обработанные для того, чтобы инактивировать остаточную инфекционность HCMV и лишить препараты DB способности к слиянию, не являются инфекционными. Тем не менее, данные образцы остаются иммуногенными, судя по их способности индуцировать CD8-положительный цитотоксический T-клеточный ответ, специфичный для антигена pp65 HCMV (фиг.2 и 4) и судя по их способности индуцировать специфичные IgG против HCMV (фиг.3 и 5). Клетки, инкубированные только в среде, служили в качестве отрицательного контроля. Только неинактивированный образец сравнения был способен вызвать появление окрашенных красным ядер, то есть был инфекционным. Образцы обрабатывали, как изложено в примере 1.
Отличительные признаки по настоящему изобретению, указанные в описании, формуле изобретения и/или чертежах могут как отдельно, так и в любом их сочетании представлять собой материал для реализации изобретения в его различных формах.

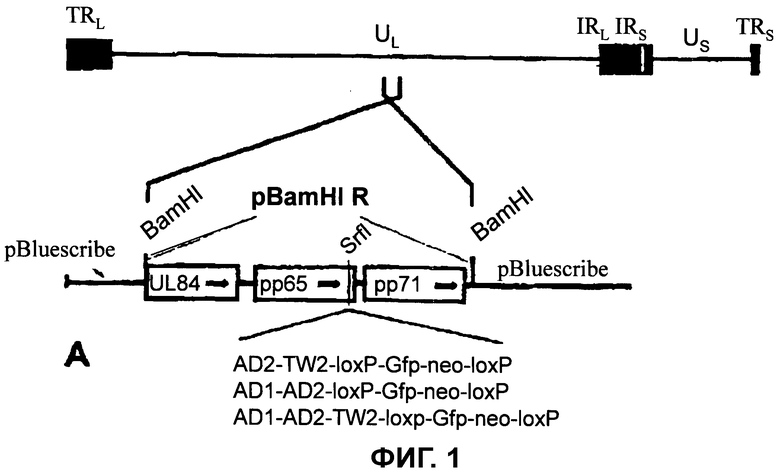
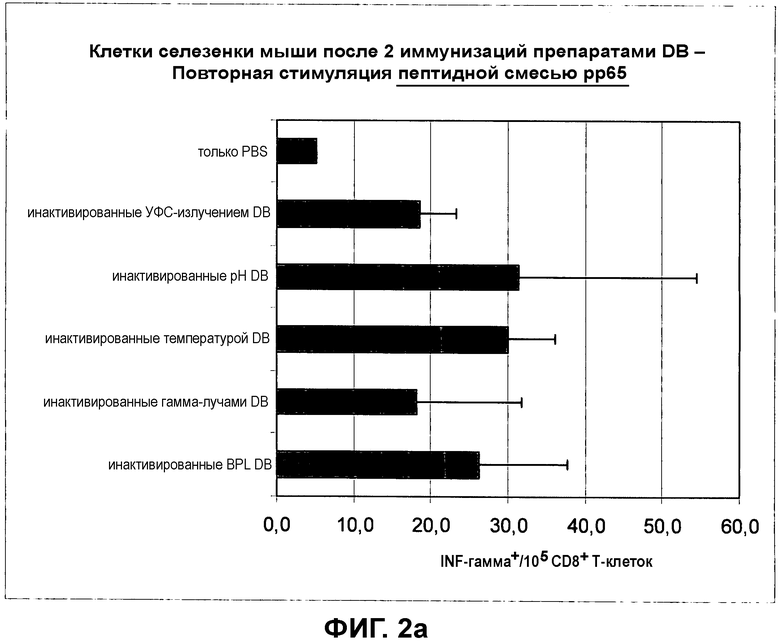
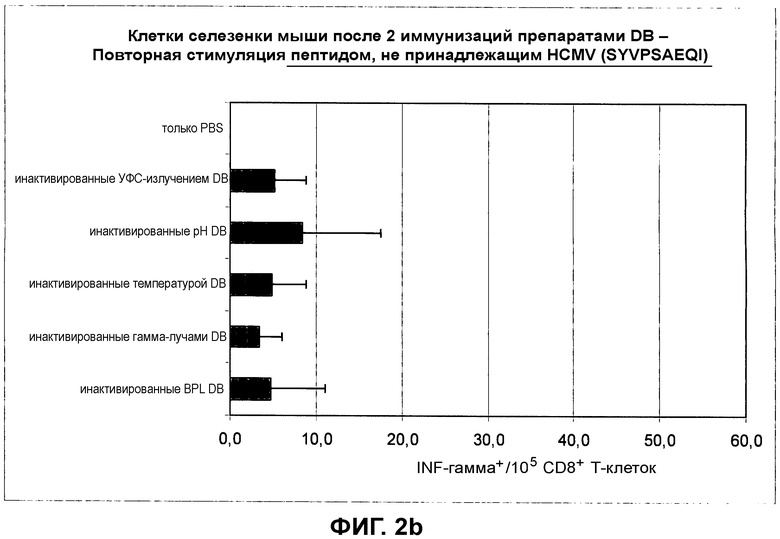
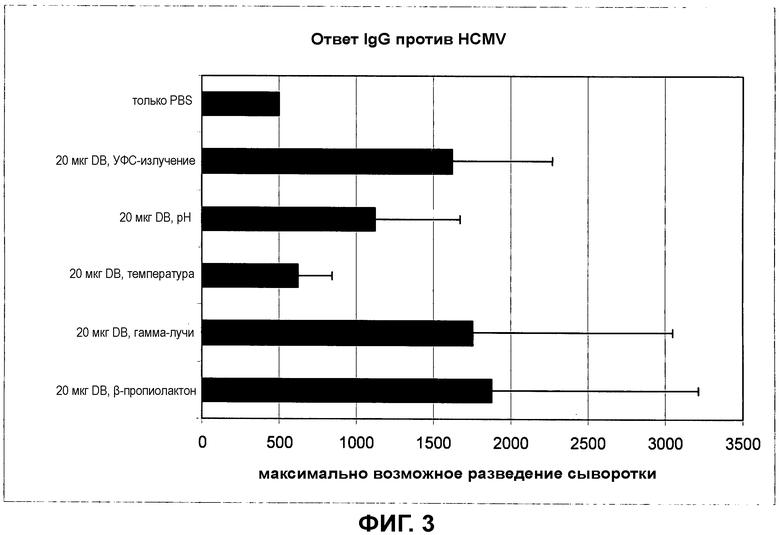
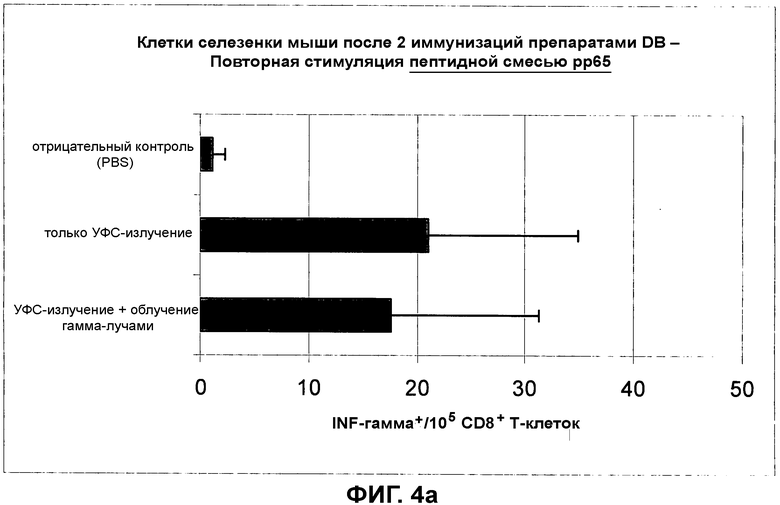


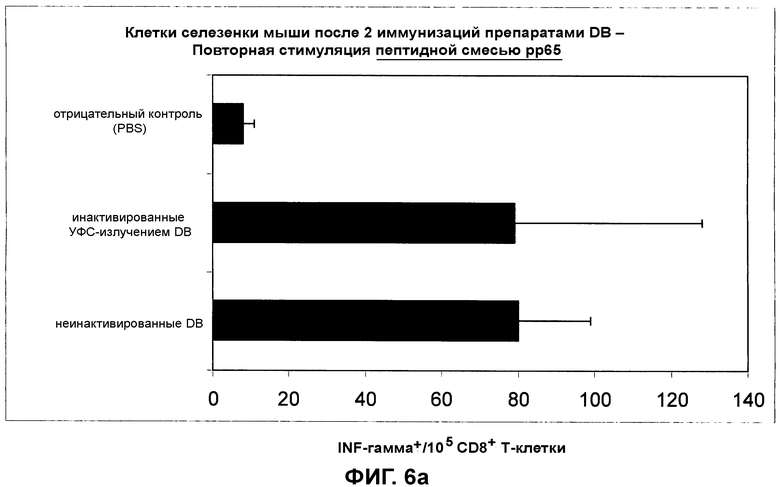
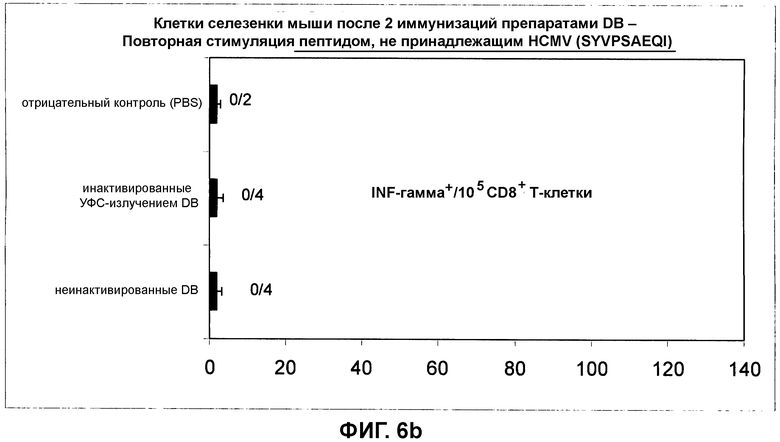













Группа изобретений относится к области медицины, в частности к вирусологии. Композиции содержат агент, выбранный из группы, содержащей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, при этом композиция способна проявлять иммунный ответ, в то время как вирионы, NIEP и/или плотные тельца не способны к слиянию. Заявлен способ производства композиции, а также применения агента, выбранного из группы, состоящей из вириона HCMV, плотного тельца HCMV и NIEP HCMV, при этом агент не способен к слиянию, для получения вакцины. Группа изобретений обеспечивает получение композиции, не обладающей остаточной инфекционностью, но обеспечивающей иммунный ответ, включающий нейтрализующие антитела против антигена. 9 н. и 34 з.п. ф-лы, 1 табл., 2 пр., 19 ил.
1. Композиция, содержащая агент, выбранный из группы, состоящей из вирионов HCMV, плотных телец HCMV и NIEP HCMV, где композиция способна вызывать иммунный ответ, в то время как вирионы, NIEP и плотные тельца не способны к слиянию.
2. Композиция, содержащая агент, выбранный из группы, состоящей из вирионов HCMV, плотных телец HCMV и NIEP HCMV, где композиция способна вызывать иммунный ответ, в то время как вирионы, NIEP и плотные тельца не способны к слиянию, где композицию можно получить способом, включающим стадии:
a) получения одного или нескольких агентов;
b) обработки агентов для того, чтобы лишить их способности к слиянию, в то время как они еще способны индуцировать иммунный ответ.
3. Композиция по любому из пп.1 и 2, где иммунный ответ представляет собой антигенспецифичный CD8+ ответ.
4. Композиция по любому из пп.1 и 2, где иммунный ответ представляет собой антигенспецифичный цитотоксический Т-клеточный ответ.
5. Композиция по любому из пп.1 и 2, где иммунный ответ представляет собой антигенспецифичный CD8+ цитотоксический Т-клеточный ответ.
6. Композиция по любому из пп.1 и 2, где иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, предпочтительно иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, при котором антитела представляют собой нейтрализующие антитела.
7. Композиция по любому из пп.1 и 2, в котором иммунный ответ представляет собой антигенспецифичный ответ CD4+ хелперных Т-клеток.
8. Композиция по любому из пп.1 и 2, где антиген представляет собой антиген HCMV, при этом антиген HCMV предпочтительно выбран из группы, включающей антиген рр65, производные антигена рр65, рр28 и производные рр28, рр150 и производные рр150, gB и производные gB, gH и производные gH и предранние антигены и их производные, гликопротеины и производные гликопротеинов, предпочтительно гликопротеины HCMV и производные гликопротеинов HCMV, при этом гликопротеины предпочтительно представляют собой gM, и производные gM или gN, и производные gN.
9. Композиция по любому из пп.1 и 2, где агент инактивирован.
10. Композиция по любому из пп.1 и 2, которая представляет собой фармацевтическую композицию или диагностическую композицию.
11. Применение агента, где агент выбран из группы, состоящей из вириона HCMV, плотного тельца HMCV и NIEP HCMV, или композиции, определенной в п.1, при этом агент не способен к слиянию, для производства лекарственного средства для вызывания иммунного ответа против антигена HCMV.
12. Применение агента, где агент выбран из группы, состоящей из вириона HCMV, плотного тельца HMCV и NIEP HCMV, при этом агент не способен к слиянию, или композиции, определенной в п.1, где композиция и/или агент были подвергнуты инактивации, для производства лекарственного средства для вызывания иммунного ответа против антигена HCMV.
13. Применение агента, где агент выбран из группы, состоящей из вириона HCMV, плотного тельца HMCV и NIEP HCMV, или композиции, содержащей такой агент, при этом агент не способен к слиянию, для производства вакцины.
14. Применение агента, где агент выбран из группы, состоящей из вириона HCMV, плотного тельца HMCV и NIEP HCMV, при этом агент не способен к слиянию, или композиции, определенной в п.1, где композиция и/или агент были подвергнуты инактивации, для производства вакцины.
15. Применение по любому из пп.11 и 12, в котором иммунный ответ представляет собой антигенспецифичный CD8+ ответ.
16. Применение по любому из пп.11-14, в котором иммунный ответ представляет собой антигенспецифичный цитотоксический Т-клеточный ответ.
17. Применение по любому из пп.11-14, в котором иммунный ответ представляет собой антигенспецифичный CD8+, цитотоксический Т-клеточный ответ.
18. Применение по любому из пп.11-14, в котором иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, предпочтительно иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, при котором антитела представляют собой нейтрализующие антитела.
19. Применение по любому из пп.11-14, в котором иммунный ответ представляет собой антигенспецифичный ответ CD4+ хелперных Т-клеток.
20. Применение по любому из пп.11-14, где антиген представляет собой антиген HCMV, при этом антиген HCMV предпочтительно выбран из группы, включающей антиген рр65, производные антигена рр65, рр28 и производные рр28, рр150 и производные рр150, gB и производные gB, gH и производные gH и предранние антигены и их производные, гликопротеины и производные гликопротеинов, предпочтительно гликопротеины HCMV и производные гликопротеинов HCMV, при этом гликопротеины предпочтительно представляют собой gM и производные gM или gN и производные gN.
21. Применение по любому из пп.11-14, в котором вакцина предназначена для лечения и/или профилактики инфекции HCMV.
22. Применение по любому из пп.11-14, в котором вакцина предназначена для лечения и/или профилактики заболевания, вызванного HCMV у донора трансплантата и/или получателя трансплантата.
23. Применение агента, где агент выбран из группы, состоящей из вириона HCMV, плотного тельца HMCV и NIEP HCMV, или композиции, содержащей такой агент, при этом агент не способен к слиянию, для производства диагностического средства.
24. Применение агента, где агент выбран из группы, состоящей из вириона HCMV, плотного тельца HMCV и NIEP HCMV, при этом агент не способен к слиянию, или композиции, содержащей такой агент, где композиция и/или агент были подвергнуты инактивации, для производства диагностического средства.
25. Способ производства композиции, определенной в любом из пп.1-10, включающий стадии
a) получения агента, выбранного из группы, состоящей из вирионов HCMV, NIEP HCMV и плотных телец HMCV;
b) обработки агента для того, чтобы лишить его способности к слиянию, в то время как указанный агент все еще способен индуцировать иммунный ответ.
26. Способ по п.25, где обработка на стадии b) представляет собой одну или любую комбинацию мер, выбранных из группы, включающей обработку УФ-излучением, облучение с высокой энергией, обработку при низком значении рН, термическую обработку и обработку при помощи сшивающих средств.
27. Способ по п.26, где обработка УФ-излучением представляет собой обработку УФС-излучением, при этом длина волны составляет приблизительно 100-280 нм, или обработку длинноволновым УФ-излучением.
28. Способ по любому из пп.26 и 27, где обработка УФ-излучением представляет собой применение диапазона доз от 100 до 2000 мДж/см2, предпочтительно от 100 до 1000 мДж/см2 и, более предпочтительно от 150 до 900 мДж/см2.
29. Способ по любому из пп.26 и 27, где перед, одновременно или после обработки УФ-излучением агент подергают облучению гамма-лучами.
30. Способ по п.26, где облучение с высокой энергией представляет собой облучение гамма-лучами.
31. Способ по п.30, где гамма-излучение применительно к облучению гамма-лучами применяют в диапазоне доз приблизительно от 15 до 70 КГр, более предпочтительно от 20 до 65 КГр и, более предпочтительно от 20 до 60 КГр.
32. Способ по п.20, где обработка представляет собой обработку при низком значении pH, и обработка при низком значении pH включает воздействие на агент pH приблизительно от 0 до 5, предпочтительно от 1 до 4,5 и, более предпочтительно от 2 до 4,5.
33. Способ по п.32, где агент подвергают обработке при низком значении pH в течение приблизительно от 0,5 до 24 ч, предпочтительно от 0,5 до 12 ч и, более предпочтительно от 0,5 до 6 ч.
34. Способ по любому из пп.32 и 33, где агент подвергают обработке при низком значении рН при температуре приблизительно от 1 до 50°С, предпочтительно от 1 до 45°С и, более предпочтительно от 1 до 40°С.
35. Способ по п.26, где термическая обработка включает инкубацию агента при температуре в диапазоне от 37,5°С до 65°С, предпочтительно при температуре в диапазоне от 37,5 до 60°С и, более предпочтительно при температуре в диапазоне от 37,5 до 56°С.
36. Способ по п.35, где агент инкубируют в течение периода в диапазоне от 5 с до 36 ч, предпочтительно в диапазоне от 5 с до 30 ч и, более предпочтительно в диапазоне от 5 с до 24 ч.
37. Способ по п.26, где обработка представляет собой обработку при помощи одного или нескольких сшивающих средств и при этом сшивающее средство, каждое и независимо друг от друга, выбрано из группы, включающей лактоны, этилаты и альдегиды.
38. Способ по п.37, где сшивающее средство представляет собой β-пропиолактон.
39. Способ по п.37, где сшивающее средство представляет собой этиленоксид.
40 Способ по п.37, где сшивающее средство представляет собой формальдегид.
41. Способ по любому из пп.37-40, где агент подвергают воздействию сшивающего средства при концентрации сшивающего средства, и более предпочтительно β-пропиолактона, в среде, содержащей агент, находящейся в диапазоне от 0,01 до 10% (об./об.), предпочтительно в диапазоне от 0,05 до 10% (об./об.) и, более предпочтительно в диапазоне от 0,05 до 7,5% (об./об.).
42. Способ по любому из пп.37-40, где агент инкубируют со сшивающим средством, и предпочтительно с β-пропиолактоном, в течение периода времени в диапазоне от 1 м до 72 ч, предпочтительно от 1 мин до 48 ч и, более предпочтительно от 1 мин до 24 ч.
43. Способ по любому из пп.37-40, где агент инкубируют при температуре в диапазоне приблизительно от 1°C до приблизительно 60°C, предпочтительно при температуре в диапазоне приблизительно от 1°C до 50°C, более предпочтительно при температуре в диапазоне приблизительно от 1°C до 40°C.
| PEPPERL S | |||
| et al.Dense Bodies of Human Cytomegalovirus Induce both Humoral and Cellular Immune Responses in the Absence of Viral Gene Expression.J | |||
| of Virology, July 2000, v.74, № 13, p.6132-6146 | |||
| DEFILIPPIS V., FRUH K | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| J | |||
| Virol | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Цилиндрический сушильный шкаф с двойными стенками | 0 |
|
SU79A1 |
Авторы
Даты
2014-01-27—Публикация
2008-05-13—Подача