ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В рамках настоящего изобретения испрашивается приоритет заявки с серийным номером 61/224446 от 09 июля 2009 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям для восстановления поврежденного миокарда при помощи человеческих клеток, производных от кардиальной ткани. Более конкретно, настоящее изобретение относится к способам и композициям для восстановления поврежденного миокарда при помощи экспандированных человеческих клеток, производных от кардиальной ткани, которые не экспрессируют теломеразу.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Острый инфаркт миокарда (ОИМ) - основная причина смерти в США. ОИМ возникает в результате внезапной и продолжительной недостаточности притока крови к отдельным участкам сердца, обычно обусловленной сужением коронарной артерии. Без достаточного снабжения кровью начинается ишемия ткани, что приводит к отмиранию миоцитов и васкулярных структур. Участок некротической ткани называется очагом инфаркта и впоследствии замещается рубцовой тканью. Оставшиеся кардиомиоциты неспособны восстановить некротическую ткань, и функция сердца со временем ухудшается. Такое ухудшение может выражаться в потере функциональности сердечной мускулатуры, связанной с ремоделированием поврежденного миокарда.
В основе некоторых видов лечения острого инфаркта миокарда лежит тромболизис или, как вариант, ангиопластика, позволяющая открыть закупоренный сосуд и восстановить приток крови к очагу инфаркта. Такие способы лечения обеспечивают эффективное сокращение размера зоны инфаркта и улучшение систолической функции сердца, но не позволяют обратить потерю функциональности сердечной мышцы, связанную с ремоделированием поврежденного миокарда. Другие способы лечения, например, с использованием ингибиторов ангиотезин-превращающего фермента (иАПФ) и бета-блокаторов, способны улучшить общую функциональность и выживаемость. Однако терапевтический эффект от использования этих препаратов помогает повысить выживаемость у пациентов в состоянии после ОИМ менее чем на 5%.
Другим перспективным способом лечения острого инфаркта миокарда является клеточная трансплантация. Например, Orlic et al. (Nature 410: 701-705 (2001)) сообщает о введении Lin- c-kit+ клеток костного мозга в поврежденный миокард. Orlic et al. сообщают: «Наши исследования показывают, что локально доставляемые клетки костного мозга способны заново образовывать миокард, улучшая исход заболевания коронарных артерий».
В другом примере Nygren et al. (Nature Medicine 10: 494-501 (2004)) сообщают: «Мы показали, что нефракционированные клетки костного мозга и очищенная популяция гемопоэтических стволовых клеток и клеток-предшественников успешно пересаживаются в миокард, пораженный в результате инфаркта. Вживление носит транзиторный, но гемопоэтический характер. В отличие от этого кардиомиоциты, производные от клеток костного мозга, редко встречались за пределами миокарда, пораженного в результате инфаркта, и возникали исключительно путем слияния клеток».
Однако механизм, благодаря которому происходит лечение ОИМ при помощи клеток костного мозга остается неясным. Например, Murry et al. (Nature 428: 664-668 (2004)) сообщает: «Мы использовали репортерные трансгены, экспрессированные как кардиомиоцитом, так и убиквитарно, чтобы проследить поведение гемопоэтических стволовых клеток после 145 трансплантаций в здоровые и пораженные ткани сердца взрослых мышей. Трансдифференцирование в кардиомиоцитах при использовании этих генетических методик, позволяющих проследить дальнейшее развитие клеток и сердец с вживленными стволовыми клетками, не выявлено, а сердца с вживленными стволовыми клетками не показали выраженного увеличения кардиомиоцитов по сравнению с сердцами, в которые вживлялось плацебо. Эти результаты показывают, что гемопоэтические стволовые клетки не способны быстро приобрести кардиальный фенотип, и ставят под вопрос клинические исследования по восстановлению миокарда после инфаркта».
В другом примере Werner et al. (Nature Clinical Practice Cardiovascular Medicine 5: 78-79 (2008)) сообщает: «Все еще существует ряд вопросов, требующих ответов в отношении наиболее эффективной субпопуляции клеток-предшественников, лучшего способа наращивания клеток-предшественников, основополагающих механизмов действия, а также долгосрочной безопасности и эффективности способа. Более того, несколько попыток использования клеток костного мозга для лечения пациентов с ОИМ привели к отрицательным результатам, возможно, вследствие временной вариативности введения клеток костного мозга после ОИМ, различий в применяемых способах получения клеток-предшественников или обоих факторов».
В другом примере Balsam et al. (Nature 428: 668-673 (2004)) сообщают: «Наши данные позволяют предположить, что даже в микросреде пораженного сердца клетки костного мозга, обогащенные c-kit, клетки костного мозга Lin- c-kit+ и гемопоэтические стволовые клетки c-kit+ Thy1.1lo Lin- Sca-1+ долгосрочного восстановления повторяют традиционный для гемопоэтических клеток путь развития».
Другим возможным источником клеток являются эмбриональные стволовые клетки. Например, Gold et al. (WO 2005090558) описывает способы получения клеток, дифференцированных в кардиомиоциты, из эмбриональных стволовых клеток для использования в регенеративной медицине.
В другом примере Gold and Hassanipour (WO 2007002136) описывают способы дифференциации полипотентных стволовых клеток приматов в клетки, способные дифференцировать в кардиомиоциты.
Другим возможным источником клеток являются кардиальные клетки-предшественники. Кардиальные клетки-предшественники были выявлены в сердце человека и крысы. Кардиальные клетки-предшественники имеют самовосстанавливающуюся и мультипотентную природу, обуславливающую возможность дифференцирования по любой линии.
Например, в заявке на патент США № US 20040126879 A1 описано использование кардиальных стволовых клеток CD31+, CD38+ и c-kit- для лечения поврежденного миокарда.
В другом примере Oh et al. (PNAS 100: 12313-12318 (2003)) описывают существование в сердце взрослого человека кардиальных клеток-предшественников, экспрессирующих Sca-1, CD31 и CD38, и не способных экспрессировать CD4, CD8, B220, Gr-1, Mac-1, TER119, c-kit, Flk-1, e-Cadherin, фактор фон Виллебранда, CD45 и CD34.
В другом примере в заявке на патент США № US 20080241111 A1 описан способ выделения клеток, производных от кардиальной ткани млекопитающего. Выделение осуществляется в несколько стадий: (i) ферментная обработка фрагмента кардиальной ткани млекопитающего для приготовления клеточной суспензии, (ii) выделение группы клеток, производных от кардиальной ткани, из указанной клеточной суспензии методом градиента плотности и (iii) суспензионное культивирование полученной группы клеток, производных от кардиальной ткани, в питательной среде, содержащей фактор роста фибробластов и эпидермальный фактор роста, а затем селекция и выделение клеток, образующих рабочую сферу.
В другом примере в заявке на патент США № US 20080213231 A1 описана группа плюрипотентных стволовых клеток, состоящая из плюрипотентных стволовых клеток, производных от ткани скелетной мускулатуры человека или мыши, плюрипотентные стволовые клетки c-met-отриц., Pax-7-отриц., Myf-5-отриц., MyoD-отриц., Myogenin-отриц., M-cadherin-отриц., CD105-полож., CD90-полож., c-kit-отриц., и CD45-отриц., плюрипотентные стволовые клетки CD34-отриц., в случае если они являются производными стволовых клеток человека, CD34-полож., в случае если они являются производными стволовых клеток мыши, и группа плюрипотентных стволовых клеток, полученная путем пролиферации одной клетки.
В другом примере Laugwitz et al. (Nature 433: 647-653 (2005) описывают кардиальные клетки-предшественники isl1-1+ в постнатальном миокарде крысы, мыши и человека.
В другом примере Messina at al (Circulation Research 95: 911-921, (2004)) описывают «изолирование недифференцированных клеток, растущих в виде самосклеивающихся кластеров (которые мы назвали «кардиосферами») из субкультур постнатального атриального или вентрикулярного биоптата человека и мышиных сердец. Эти клетки имеют клональное происхождение, экспрессируют антигены/маркеры стволовых и эндотелиальных клеток-предшественников и очевидно обладают свойствами взрослых кардиальных стволовых клеток». Messina at al сообщают: «Заново развивающиеся человеческие и мышиные кардиосферы обнаруживают экспрессию маркеров эндотелиальных (KDR (человека)/flk-1 [мыши], CD-31) и стволовых клеток (CD-34, c-kit, sca-1)».
В другом примере Smith et al. (Circulation 115(7): 896-908 (2007) сообщают: «Из образцов чрескожной эндомиокардиальной биопсии получена первичная культура в виде многоклеточных кластеров, известных как кардиосферы, которые высеваются для выращивания стволовых клеток, полученных из кардиосферы (CDC)».
В другом примере в заявке на патент США № US 20070020758 описан способ изолирования, экспансирования и сохранения кардиальных стволовых клеток из биоптатов ткани человека или животного для клеточной трансплантации и функционального восстановления миокарда и других органов.
В другом примере Beltrami et al. (Cell 114(6): 763-776 (2003)) описывают «существование клеток Lin− c-kitPOS, обладающих свойствами кардиальных стволовых клеток. Они имеют клональное происхождение, являются самовосстанавливающимися и мультипотентными, и, соответственно, могут дифференцироваться в миоциты, гладкомышечные и эндотелиальные клетки».
В другом примере в международной патентной заявке № WO 2008054819 описаны кардиоваскулярные стволовые клетки, положительные по маркерам isl1+/Nkx 2.5+/flk1+, и кардиоваскулярные стволовые клетки, которые могут дифференцироваться по линии эндотелиальных, кардиальных или гладкомышечных клеток.
В другом примере в международной патентной заявке № WO 2008109839 A1 описывается расширенная популяция стволовых клеток, включающая полипептид CXCR4 и полипептид FIk-I, при этом указанные стволовые клетки способны дифференцировать в клетки, экспрессирующие Mef2C, GATA-4, миокардин и Nkx2.5.
В другом примере в международной патентной заявке № 2008081457A2 описывается способ изолирования кардиальных стволовых клеток. Способ включает обработку ткани, содержащей кардиальные стволовые клетки, составом, содержащим диспазу Il, в условиях, пригодных для индуцирования диссоциации клеток, в результате чего происходит изолирование кардиальных стволовых клеток.
В другом примере в международной патентной заявке № 2008058273 A2 описывается способ получения клеток из миоцитов (MDC), подобных стволовым клеткам млекопитающего, из атриальной или вентрикулярной ткани сердца. Способ включает следующие стадии: изолирование клеток из атриальной или вентрикулярной ткани сердца для получения клеточной суспензии; культивирование клеток в среде, содержащей митоген, с получением композиции, содержащей MDC.
В другом примере в международной патентной заявке № 2008054819 A2 описывается способ изолирования кардиоваскулярных стволовых клеток. Способ включает обработку популяции клеток агентами, реактивными к Islet1, Nkx2.5 и flk1, и отделение реактивно-положительных клеток от реактивно-отрицательных клеток.
В другом примере в заявке на патент США № US 20070212423 A1 описывается способ изолирования c-kit-/c-met- клетки-предшественника кардиомиоцита мышечного происхождения, включающий выделение клеток с диаметром менее 40 мкм из суспензии мышечных клеток, культивирование клеток в тканевой культурной среде на твердом субстрате, изолирование клеток в суспензии в среде, таким образом изолируя c-kit-/c-met- клетки-предшественника кардиомиоцита мышечного происхождения.
В другом примере в заявке на патент США № US 20050058633 описана изолированная c-kit-/c-met-клетка-предшественник кардиомиоцита млекопитающего мышечного происхождения.
В другом примере в международной патентной заявке № WO 2004019767 описана изолированная кардиомиоцитная стволовая клетка млекопитающего, имеющая фенотип c-kitneg/CD31+/CD38+ и экспрессирующая обратную транскриптазу теломеразы.
В другом примере в международной патентной заявке № WO 2008083962 A1 описаны клетки-предшественники кардиомиоцитов (CMPC), характеризующиеся наличием эпитопа, подобного Sca-1 или Sca-1, и CD31 на клеточной поверхности.
В другом примере в заявке на патент США № 20080213230 A1 описан способ подготовки изолированной популяции клеток, обогащенной стволовыми клетками или клетками-предшественниками. Способ включает: (a) культивирование образца ткани, (b) получение клеток, мигрирующих поверх склеенных фибробластов в процессе указанного культивирования, (c) клонирование одной или нескольких клеток, полученных по п.(b) для создания одной или нескольких клоногенных популяций, (d) идентификация одной или нескольких клоногенных популяций, имеющих желаемый фенотип, (e) изолирование стволовых клеток или клеток-предшественников из одной или нескольких клоногенных популяций, идентифицированных по п.(d), путем сортировки клеток с использованием одной или нескольких клеточных поверхностей или внутренних маркеров стволовых клеток или клеток-предшественников и (f) культивирование изолированных стволовых клеток или клеток-предшественников в контролируемой среде, в которой отсутствуют питающие клетки, для получения в результате изолированной популяции клеток, обогащенной стволовыми клетками или клетками-предшественниками.
При этом одним из факторов, препятствующих использованию кардиальных клеток-предшественников, является отсутствие эффективного способа изолирования и экспандирования клеток. Таким образом, по-прежнему существует потребность в эффективном изолировании и экспансии кардиальных клеток-предшественников с целью оценки их эффективности при лечении повреждений миокарда.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам изолирования и экспандирования клеток, производных от кардиальной ткани человека. Клетки, изолированные и экспандированные в соответствии со способами, составляющими предмет настоящего изобретения, не экспрессируют теломеразу и могут использоваться для лечения или восстановления поврежденного миокарда.
Настоящее изобретение относится к очищенной популяции клеток, производных от кардиальной ткани человека, не экспрессирующих теломеразу.
Настоящее изобретение относится к способу получения клеток, производных от кардиальной ткани человека, включающему следующие стадии:
a) получение сердечной ткани;
b) диссоциация сердечной ткани;
c) обработка ферментами сердечной ткани с целью высвобождения клеток;
d) удаление кардиомиоцитов из числа высвободившихся клеток; и
e) культивирование оставшихся клеток.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения или восстановления поврежденного миокарда у пациента. Способ включает следующие стадии:
a) получение популяции клеток, производных от кардиальной ткани человека, не экспрессирующих теломеразу; и
b) введение популяции клеток, производных от кардиальной ткани человека, пациенту в количестве, достаточном для лечения или восстановления поврежденного миокарда.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, используемые для лечения пациента, были заморожены.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 в виде схемы представлена процедура изолирования клеток, составляющих предмет настоящего изобретения. Процесс получения клеточных популяций подробно описан в примере 1.
На фиг.2 в виде схемы представлен процесс изолирования клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения. Процесс получения первичных популяций клеток подробно описан в примере 1.
На фиг.3 в виде схемы представлен альтернативный способ изолирования клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения.
На фиг.4 показана морфология клеток, производных от кардиальной ткани человека (hCTC’s), составляющих предмет настоящего изобретения. Все изображения представлены в 100X увеличении, если не указано иное. Панель a: изображение клеточной суспензии, полученной из предварительного посева клеток, полученных после первоначальной ферментации. Черная стрелка указывает на рефрактильные неприлипающие клетки S. Панель b: черная стрелка указывает на рефрактильные кластеры клеток S. Белая стрелка указывает на прилипающие клетки, полученные из первичного посева (изображения представлены в 200-кратном увеличении). На панели c показаны клетки A2, полученные из повторного посева клеточных культур S. На панели d показаны повторно высеянные рефрактильные клетки S в клеточной культуре A2.
На фиг.5 показано влияние густоты посева на потенциал роста клеток hCTC. Ось x отражает количество дней в культуре после посева клеток hCTC (A1) и hCTC (S) из замороженных пробирок. Ось y отражает аккумулятивную общую дупликацию клеток hCTC (A3).
На фиг.6 показано влияние сниженного уровня кислорода на потенциал роста клеток hCTC (A3).
На фиг.7 показан потенциал роста клеток (rCTC (A2)), производных от кардиальной ткани крысы rCTCA2. Ось x отражает количество дней в культуре после повторного посева клеток rCTC (S) из замороженных пробирок. Ось y отражает аккумулятивную общую дупликацию клеток rCTC (A2).
На фиг.8 показаны восстановление и жизнеспособность клеток hCTC (A3) после замораживания и имитации доставки при помощи потенциального устройства введения (представляющего собой иглу калибра 30). Количество восстановившихся жизнеспособных клеток обозначено слева на оси y. Жизнеспособность клеток указана справа на оси y. Закрашенные ромбы используются для обозначения жизнеспособности клетки. Квадраты без заливки обозначают клеточное восстановление. Подробности описаны в примере 6.
На фиг.9 показаны восстановление и жизнеспособность клеток rCTC (A2) после замораживания и имитации доставки при помощи потенциального устройства введения (представляющего собой иглу калибра 30). Количество восстановившихся жизнеспособных клеток обозначено слева на оси y. Жизнеспособность клеток указана справа на оси y. Закрашенные квадраты используются для обозначения восстановления клеток перед помещением в иглу. Закрашенные треугольники используются для обозначения жизнеспособности клеток перед помещением в иглу. Квадраты без заливки используются для обозначения жизнеспособности клеток после введения при помощи иглы. Треугольники без заливки используются для обозначения восстановления клеток после введения при помощи иглы. Подробности описаны в примере 6.
На фиг.10 на основании данных проточной цитометрии показана экспрессия маркера клеточной поверхности hCTC (A3). На каждой гистограмме пунктирной линией отмечен контроль изотипа антител. Сплошной линией обозначено окрашивание антигена. Антигены показаны на выделенных панелях. Ось x отражает интенсивность свечения фикоэритрина (PE) по логарифмической шкале. Ось y отражает количество клеток.
На фиг.11 приведены результаты сравнения экспрессии маркера клеточной поверхности клеток hCTC (A3) (верхняя панель) и взрослых дермальных фибробластов человека - NHDF (номер по каталогу CC-2511, Lonza, нижние панели). На каждой гистограмме ось x отражает интенсивность свечения фикоэритрина (PE) по логарифмической шкале. Ось y отражает количество клеток. Пунктирной линией показан контроль изотипа антител. Сплошной линией обозначено окрашивание антигена. Позитивная популяция селектирована на основании 1% позитивной популяции по контролю изотипа. Индивидуальные маркеры указаны на каждой гистограмме.
На фиг.12 на основании данных проточной цитометрии показана экспрессия маркера клеточной поверхности rCTC (A2). Пунктирной линией отмечен контроль изотипа. Сплошной линией обозначено окрашивание антигена CD31 (левая панель) и CD90 (правая панель).
На фиг.13 показана экспрессия кардио-специфических генов в клетках hCTC (A3), что установлено путем количественной полимеразной цепной реакции в реальном времени (qRT-PCR). Подробное описание приведено в примере 8. Ось y отражает процентное отношение GAPDH и подразделяется на нижнюю и верхнюю шкалы. Нижняя шкала ранжируется в пределах от 0 до 0,01%, а верхняя шкала ранжируется в пределах от 0,05% до 0,15%. Значения аббревиатур: ТЦМ - тяжелая цепь миозина, кардиальный ФТ - фактор транскрипции, НЧДФ - неонатальный человеческий дермальный фибробласт, ч-сердце - сердце человека. Данные представлены в виде среднего значения ± стандартное отклонение (n=3).
На фиг.14 показана повышенная экспрессия мышиной специфической тяжелой цепи миозина (ТЦМ) в совместной культуре мышиных клеток (mCTC (A2)), производных от кардиальной ткани (А2), с крысиными неонатальными кардиомиоцитами (номер по каталогу R357-6W, Cell Application, Остин, Техас). Уровень экспрессии гена мышиной ТЦМ представлен в виде процентного содержания мышиного GAPDH в каждом образце. Ось y отражает процентное содержание мышиного GAPDH. Значения аббревиатур: mCTC - клетки mCTC (A2), выращенные в дифференцирующей среде, как описано в примере 9, КМ - кардиомиоциты, mCTC+CM-mCTC, культивированные совместно с крысиными кардиомиоцитами КМ в дифференцирующей среде. Данные представлены в виде среднего значения ± стандартное отклонение (n=3).
На фиг.15 показана кривая роста свиных клеток (pCTC (A3)), производных от кардиальной ткани (А3), культивированных по способу, описанному в примере 10. Ось x отражает время культивации после посева. Ось y отражает общее совокупное количество дупликаций в популяции.
На фиг.16 на основании данных проточной цитометрии показана экспрессия маркера клеточной поверхности pCTC (A3). Пунктирной линией показан контроль изотипа антител. Сплошной линией обозначено окрашивание антигена CD90 (верхняя левая панель), CD105 (верхняя правая панель), маркер свиных эндотелиальных клеток (нижняя левая панель), CD16 (нижняя средняя панель), CD45 (нижняя правая панель).
На фиг.17 в динамике показано кардиальное ремоделирование, следующее за острым инфарктом миокарда. Динамическое изображение воспроизведено из исследования Pfeffer M. in Atlas of heart failure (Colucci W, editor, 1999).
На фиг.18 показано влияние введения клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, на фракцию укорочения (ФУ) у животных, у которых имел место острый инфаркт миокарда, что установлено путем эхокардиографии. Фракция укорочения представляет собой процентное изменение (ФУ%) в систолу и диастолу в каждом сердечном цикле и отражает общую функцию сердца. Данные, отражающие фракцию укорочения, записаны индивидуально у каждого животного на 5 (Д5) или 28 день (Д28) после индукции ОИМ. Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.19 показано влияние клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, на оценку регионарного движения стенки (ОРДС) у животных, у которых был вызван острый инфаркт миокарда, что установлено путем эхокардиографии. Каждая панель, отделенная вертикальной сплошной линией, представляет собой экспериментальную ветвь в исследовании. 5Д и 28Д соответствуют периодам 5 дней и 28 дней после возбуждения ОИМ, соответственно. ОРДС выполнялась на 5Д (исходное состояние) и 28Д (контроль при последующем наблюдении). Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.20 показано влияние клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, на конечный диастолический размер левого желудочка (КДРЛЖ) у животных, у которых был вызван острый инфаркт миокарда. КДРЛЖ - измерение размера левого желудочка в конце диастолы. Измерение КДРЛЖ проводилось на 5 (5Д) и 28 день (28Д) после вызывания инфаркта миокарда. Представленные данные отражают относительное изменение [(28Д-5Д)/5Д] каждого отдельного животного. Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.21 представлен статистический анализ на основе сравнения относительного изменения КДРЛЖ в каждой экспериментальной группе. При выполнении однофакторного дисперсионного анализа (ANOVA) данных использовался F-критерий. Группа 1: носитель; группа 2: клетки rCTC (A2) 1×106 клетки (целевая доза); группа 3: клетки hCTC (A3) 1×104 клетки (целевая доза); группа 4: клетки hCTC (A3) 1×105 клетки (целевая доза); группа 5: клетки hCTC (A3) 1×106 клетки (целевая доза).
На фиг.22 показано влияние введения человеческих клеток, производных от кардиальной ткани, на конечный систолический размер левого желудочка (КСРЛЖ). КСРЛЖ - измерение размера желудочка в конце систолы каждого сердечного цикла. Каждая панель, отделенная вертикальной сплошной линией, представляет собой экспериментальную ветвь в исследовании. Измерение КСРЛЖ проводилось на 5 (5Д) и 28 день (28Д) после вызывания инфаркта миокарда. Данные, представленные в записях, относятся к одному животному в каждый момент времени. Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.23 отражена функция сердца на 5 и 28 день после инфаркта и введения человеческих клеток, производных от кардиальной ткани; у каждого отдельного животного измерялись четыре параметра (ФУ, ОРДС, КСРЛЖ, КДРЛЖ). Каждая черная точка отражает сердечную функцию каждого отдельно взятого животного в момент времени, обозначенный на оси X. Черная сплошная линия отражает тренд изменений в период с 5Д по 28Д, отмеченных у каждого отдельно взятого животного. Каждая панель отражает один параметр, измеренный путем эхокардиографии.
На фиг.24 представлена корреляция между фракцией укорочения и дозировкой клеток, производных от кардиальной ткани. Ось Y отражает абсолютное изменение на 28 день, начиная с 5 дня после инфаркта и введения клеток (28Д-5Д). На оси X показана дозировка hCTC (A3) по линейной шкале. Данные представлены в виде среднего значения ± стандартное отклонение (n=35).
На фиг.25 представлена корреляция между КДРЛЖ и дозировкой клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения. Ось Y отражает абсолютное изменение на 28 день, начиная с 5 дня после инфаркта и введения клеток (28Д-5Д). На оси X показана дозировка hCTC (A3) по линейной шкале. Данные представлены в виде среднего значения ± стандартное отклонение (n=35).
На фиг.26 показана ретенция клеток hCTC (A3), введенных в сердце животного, перенесшего инфаркт миокарда. Ретенция оценивалась по уровню экспрессии бета-микроглобулина, отмеченному в крысиных сердцах. На панели a показана ретенция клеток hCTC (A3) в течение 4 недели после введения в дозировке, показанной на оси. На панели b показана динамика ретенции клеток hCTC (A3), где на оси x показано количество дней после введения клеток в пораженные инфарктом миокарда сердца крыс, а на оси y показано процентное отношение целевой дозировки. На панели c показана ретенция клеток hCTC (A3) в динамике по времени на основании зарегистрированного среднего значения процентного содержания клеток, при этом количество человеческих клеток, зарегистрированных непосредственно после введения, принимается за 100%. На оси x показано количество дней после введения клеток в пораженные инфарктом миокарда сердца крыс.
На фиг.27 представлена корреляция между ретенцией hCTC (A3) и профилактикой ремоделирования у крыс с инфарктом миокарда. На левой панели представлен корреляционный график. На оси x показано количество клеток на логарифмической шкале; ось y отражает изменения ремоделирования (дельта КДРЛЖ, 28Д-5Д). Количество клеток у каждого животного через 4 недели после введения и соответствующая дельта-функция КДРЛЖ отражены на графике. На правой панели приведен статистический анализ линейной регрессии.
На фиг.28 показана локализация человеческого антигена ядерного матрикса (NuMA) в миокарде крыс, которые получали лечение клетками hCTC (A3) (целевая доза - 1×106 клеток). На левой панели показано позитивное окрашивание человеческого NuMA, наблюдаемого в миокарде при целевой дозе 1×106 hCTC при 400-кратном увеличении. На правой панели показано окрашивание в среде лекарства у контрольного животного.
На фиг.29 показана локализация человеческого антигена NuMA у другого животного, получавшего целевую дозу 1×106 hCTC (A3) клеток. На верхней левой панели показано увеличенное изображение (100-кратное увеличение), где видны два кластера NuMA-положительных клеток. На верхней правой панели представлено изображение с сильным увеличением (400-кратное увеличение) кластеров NuMA-положительных клеток. На нижней левой панели представлено изображение с сильным увеличением NuMA-положительных клеточных кластеров. На нижней правой панели представлено изображение с сильным увеличением ядер NuMA-положительных клеток с миоцитоподобной морфологией.
На фиг.30 показано окрашивание контрольных антител для NuMA, присутствующих в миокарде человека и крысы. На двух изображениях сверху показано NuMA-позитивное окрашивание (левая панель) с высокой ядерной специфичностью (отсутствие окрашивания в изотипном контроле, правая панель) в сердце человека. На двух изображениях снизу показан контроль крысиных сердец, демонстрирующих специфичность NuMA-антител к человеческим клеткам.
На фиг.31 представлена оценка миокардиальной гипертрофии в группах, получавших hCTC (A3) или носитель. Целевая доза обозначена на оси y. Животные, получавшие клетки hCTC (A3), получали целевую дозу 1×104, 1×105 или 1×106 клетки. Область, закрашенная светло-серым цветом, отражает пропорцию негипертрофированных участков в сердце в целом. Область, закрашенная темно-серым цветом, отражает пропорцию гипертрофированных участков в сердце в целом.
На фиг.32 приводится оценка размера зоны инфаркта. На левой панели показан относительный размер зоны инфаркта (процентное отношение площади зоны инфаркта к общей площади левого желудочка), на правой панели показана абсолютная площадь зоны инфаркта. Каждое животное обозначено черной точкой. Средний размер зоны инфаркта в группе обозначен сплошной черной линией.
На фиг.33 показано окрашивание плотности капилляров в группах, получавших в качестве лечения клетки hCTC (A3) или носитель. Животные, получавшие клетки hCTC (A3), получали целевую дозу 1×104, 1×105 или 1×106 клетки. На панели a показана плотность капилляров в краевой зоне инфаркта миокарда, что установлено при помощи окрашивания изолектином-B4. На панели b показана плотность капилляров в краевой зоне, что установлено при помощи окрашивания CD31.
На фиг.34 показана плотность миоцитов за пределами зоны инфаркта. На панели a показаны типичные примеры H&E окрашивания миокарда животных из группы, получавшей в качестве лечения носитель (левая панель), и животных, получавших 1×105 клетки hCTC (A3) (правая панель). На панели b показана плотность миоцитов, наблюдаемая в областях сердца за пределами зоны инфаркта, выраженная в количестве миоцитов на мм2. Данные представлены в виде среднего значения ± стандартное отклонение (n=6). На панели c показаны пролиферирующие миоциты, наблюдаемые в результате двойного окрашивания Ki-67 и тяжелой цепи миозина. Данные представлены в виде среднего значения ± стандартное отклонение (n=6).
На фиг.35 показаны дифференциально экспрессированные гены в миокарде крыс в ответ на лечение клетками hCTC (A3) во всех целевых дозах.
На фиг.36 в количественном выражении отражено влияние введения клеток hCTC и hMSC на кардиальную ткань у крыс, перенесших острый инфаркт миокарда. На панели a показано отношение площади зоны инфаркта к площади здоровой ткани на свободной стенке левого желудочка. На панели b показано ранжирование дилатации, наблюдаемой в сердцах животных во всех группах. На панели c показан жизнеспособный миокард.
На фиг.37 показано влияние введения клеток hCTC (A3) и человеческих мезенхимальных стволовых клеток (номер по каталогу PT-2501, Lonza, Уолкерсвиль, Мерилэнд) на кардиальную ткань у крыс, перенесших острый инфаркт миокарда. Для каждого животного приводятся два разреза, расположенных рядом друг с другом: один выполнен по средней линии между сосочковой мышцей и предсердиями, а второй выполнен со стороны сосочковой мышцы. Две колонки слева принадлежат испытуемым животным из группы, получавшей в качестве лечения носитель. Две колонки в центре относятся к группе, получавшей hMSC (целевая доза 1×106). Две колонки справа относятся к группе, получавшей клетки hCTC (A3) (целевая доза 1×105).
На фиг.38 показано влияние введения клеток hCTC (A3) на сердечную функцию у крыс, перенесших острый инфаркт миокарда, на 28 день после инфаркта и введения клеток. При помощи эхокардиографии измерены три параметра (ФУ, КСРЛВ, КДРЛЖ). Показано относительное изменение по сравнению с исходным состоянием (7 день после инфаркта и введения клеток) на 28 день после введения клеток и инфаркта. Представлены три партии клеток hCTC (A3) от разных доноров, человеческие фибробласты и клетки pCTC (A3).
На фиг.39 показано влияние введения клеток hCTC (A3) на сердечную функцию у крыс, перенесших острый инфаркт миокарда, на 84 день после инфаркта и введения клеток. При помощи эхокардиографии измерены три параметра (ФУ, КСРЛВ, КДРЛЖ). Показано относительное изменение по сравнению с исходным состоянием (7 день после инфаркта и введения клеток) на 84 день после введения клеток и инфаркта. В исследовании были использованы человеческие дермальные фибробласты и три различных партии клеток hCTC (A3) от разных доноров.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
ОПРЕДЕЛЕНИЯ
В рамках настоящего документа термин «поврежденный миокард» относится к клеткам миокарда, подвергшимся ишемии. Ишемия может быть вызвана инфарктом миокарда или другим сердечнососудистым заболеванием или сопутствующими заболеваниями.
Термин «острый инфаркт миокарда» в рамках настоящего документа относится к патологическому состоянию, более известному как «сердечный приступ», при котором нарушается приток крови к одному из участков сердца, вызывая гибель клеток сердца. Как правило, это является следствием окклюзии (закупорки) коронарной артерии в результате обрыва легко уязвимой атеросклеротической бляшки, которая представляет собой нестойкое скопление жиров (например, холестерола) и белых клеток крови (в особенности макрофагов) на стенке артерии. Возникающие в результате ишемия (ограничение притока крови) и нехватка кислорода без лечения в течение достаточно продолжительного периода могут привести к повреждению и (или) отмиранию мышечной ткани сердца (миокарда).
Термин «популяция hCTC (S)» или «hCTC (S)» в рамках настоящего документа относится к неприлипающей популяции человеческих клеток, производных от кардиальной ткани, полученной из первоначальной культуры клеток после диссоциации человеческой кардиальной ткани, ее ферментной обработки и фильтрации в соответствии со способами, составляющими предмет настоящего изобретения.
Термин «популяция hCTC (A1)» или «клетки hCTC (A1)» в рамках настоящего документа относится к прилипающей популяции человеческих клеток, производных от кардиальной ткани, полученной из первоначальной культуры клеток после диссоциации человеческой кардиальной ткани, ее ферментной обработки и фильтрации в соответствии со способами, составляющими предмет настоящего изобретения.
Термин «популяция hCTC (A2)» или «клетки hCTC (A2)» в рамках настоящего документа относится к популяции прилипающих клеток, полученной in vitro из культуры клеток hCTC (S).
Термин «популяция hCTC (A3)» или «клетки hCTC (A3)» в рамках настоящего документа относится к популяции прилипающих клеток, полученных in vitro из смешанной культуры клеток hCTC (S) и hCTC (A1).
Способы получения клеток, составляющих предмет настоящего изобретения
Настоящее изобретение относится к способу получения клеток, производных от кардиальной ткани человека, которые не экспрессируют теломеразу. Способ включает следующие стадии:
a) получение сердечной ткани;
b) диссоциацию сердечной ткани;
c) обработка ферментами сердечной ткани с целью высвобождения клеток;
d) удаление кардиомиоцитов из числа высвободившихся клеток; и
e) культивирование оставшихся клеток.
Сердечная ткань может быть диссоциирована вручную. В альтернативном варианте осуществления сердечная ткань может быть диссоциирована механически.
Удаление кардиомиоцитов из числа высвободившихся клеток может осуществляться любым подходящим для этих целей способом. Например, кардиомиоциты могут быть удалены путем фильтрации, центрифугирования или при помощи клеточного сортера с возбуждением флюоресценции (FACS).
В одном из вариантов осуществления изобретения клетки, высвобождаемые в результате обработки ферментами сердечной ткани, подвергаются фильтрации для отделения кардиомиоцитов. Целью фильтрации является исключение клеток, размер которых превышает размер клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения. В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, имеют диаметр от приблизительно 5 до приблизительно 50 микрон, а выбранный размер пор фильтра составляет 50 микрон, что позволяет клеткам, производным от кардиальной ткани человека, составляющим предмет настоящего изобретения, беспрепятственно проходить через фильтр.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, проходящие через фильтр, культивируются in vitro. В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, культивируемые после фильтрации in vitro, представляют собой смесь неприлипающих клеток и прилипающих клеток.
Клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, способны прилипать к любому твердому субстрату. В одном из вариантов осуществления изобретения в качестве твердого субстрата используется поликарбонат. В альтернативном варианте осуществления в качестве твердого субстрата может использоваться полистирол. В альтернативном варианте осуществления в качестве твердого субстрата может использоваться стекло. Твердый субстрат может быть покрыт адсорбирующим слоем, состоящим из внеклеточной протеиновой матрицы, например, коллагена или ламинина и т.п.
Прилипающие клетки, составляющие предмет настоящего изобретения, полученные после первоначального культивирования, в рамках настоящего документа называются популяцией клеток, производных от кардиальной ткани человека (A1), или клетками hCTC (A1). Неприлипающие клетки, составляющие предмет настоящего изобретения, полученные после первоначального культивирования, в рамках настоящего документа называются популяцией клеток, производных от кардиальной ткани человека (S), или клетками hCTC (S).
В одном из вариантов осуществления изобретения клетки hCTC (A1) экспандируют в культуре. Клетки hCTC (A1), составляющие предмет настоящего изобретения, могут культивироваться в любой подходящей тканевой питательной среде для культивирования. Например, в одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани, могут культивироваться в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной декстрозой в количестве 1000 г/л, L-глютамином в количестве 584 мг/л, пируватом натрия в количестве 110 мг/л и эмбриональной бычьей сывороткой 10%. В питательную среду могут быть добавлены антибиотики, например, пенициллин 50 ЕД/мл и стрептомицин 50 мкг/мл. В альтернативном варианте осуществления антибиотики могут добавляться в клеточную суспензию, полученную после диссоциации и обработки ферментами сердечной ткани. Клетки hCTC (A1), составляющие предмет настоящего изобретения, могут быть посеяны с плотностью посева от приблизительно 1000 до приблизительно 10000 жизнеспособных клеток/см2 на тканевые культурные субстраты. Клетки hCTC (A1), составляющие предмет настоящего изобретения, могут инкубироваться при 5-20% объем к объему атмосферного кислорода.
В одном из вариантов осуществления изобретения клетки hCTC (A1), составляющие предмет настоящего изобретения, пассируются по достижении приблизительно 80% слияния. В альтернативном варианте осуществления клетки hCTC (A1), составляющие предмет настоящего изобретения, пассируются по достижении приблизительно 90% слияния. В альтернативном варианте осуществления клетки hCTC (A1), составляющие предмет настоящего изобретения, пассируются каждые 1-7 дней.
В одном из вариантов осуществления изобретения клетки hCTC (S) экспандируют в культуре. В одном из вариантов осуществления изобретения клетки hCTC (S), составляющие предмет настоящего изобретения, могут культивироваться в любой подходящей тканевой питательной среде для культивирования. Например, в одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани, могут культивироваться в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной декстрозой в количестве 1000 г/л, L-глютамином в количестве 584 мг/л, пируватом натрия в количестве 110 мг/л и эмбриональной бычьей сывороткой 10%. В питательную среду могут быть добавлены антибиотики, например, пенициллин 50 ЕД/мл и стрептомицин 50 мкг/мл. В альтернативном варианте осуществления антибиотики могут добавляться в клеточную суспензию, полученную после диссоциации и обработки ферментами сердечной ткани. Клетки hCTC (S), составляющие предмет настоящего изобретения, могут инкубироваться при 5-20% объем к объему атмосферного кислорода. В одном из вариантов осуществления изобретения замена тканевой питательной среды для культивирования выполняется каждые три дня.
В одном из вариантов осуществления изобретения клетки hCTC (S) со временем слипаются в культуре. Время в культуре, за которое слипаются клетки hCTC (S), составляет от приблизительно 1 до приблизительно 7 дней. Популяция прилипающих клеток, возникающая в результате слипания клеток hCTC (S), в рамках настоящего документа называется популяцией клеток, производных от кардиальной ткани человека (A2), или клетками hCTC (A2).
В одном из вариантов осуществления изобретения клетки hCTC (A2) экспандируют в культуре. Клетки hCTC (A2), составляющие предмет настоящего изобретения, могут культивироваться в любой подходящей тканевой питательной среде для культивирования. Например, в одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани, могут культивироваться в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной декстрозой в количестве 1000 г/л, L-глютамином в количестве 584 мг/л, пируватом натрия в количестве 110 мг/л и эмбриональной бычьей сывороткой 10%. В питательную среду могут быть добавлены антибиотики, например, пенициллин 50 ЕД/мл и стрептомицин 50 мкг/мл. В альтернативном варианте осуществления антибиотики могут добавляться в клеточную суспензию, полученную после диссоциации и обработки ферментами сердечной ткани. Клетки hCTC (A2), составляющие предмет настоящего изобретения, могут быть посеяны с плотностью посева от приблизительно 1000 до приблизительно 10000 жизнеспособных клеток/см2 на тканевые культурные субстраты. Клетки hCTC (A2), составляющие предмет настоящего изобретения, могут инкубироваться при 5-20% объем к объему атмосферного кислорода.
В одном из вариантов осуществления изобретения клетки hCTC (A2), составляющие предмет настоящего изобретения, пассируются по достижении приблизительно 80% слияния. В альтернативном варианте осуществления клетки hCTC (A2), составляющие предмет настоящего изобретения, пассируются по достижении приблизительно 90% слияния. В альтернативном варианте осуществления клетки hCTC (A2), составляющие предмет настоящего изобретения, пассируются каждые 1-7 дней.
В одном из вариантов осуществления изобретения смесь клеток hCTC (A1) и клеток hCTC (S) экспандирует в культуре. В одном из вариантов осуществления изобретения смесь клеток hCTC (A1) и клеток hCTC (S) со временем образует в культуре популяцию прилипающих клеток. Время в культуре, за которое слипаются клетки hCTC (S), составляет от 2 приблизительно до приблизительно 14 дней. Популяция прилипающих клеток, возникающая в результате слипания клеток hCTC (A1) и клеток hCTC (S), в рамках настоящего документа называется популяцией клеток, производных от кардиальной ткани человека (A3), или клетками hCTC (A32).
В одном из вариантов осуществления изобретения клетки hCTC (A3) экспандируют в культуре. Клетки hCTC (A3), составляющие предмет настоящего изобретения, могут культивироваться в любой подходящей тканевой питательной среде для культивирования. Например, в одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани, могут культивироваться в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной декстрозой в количестве 1000 г/л, L-глютамином в количестве 584 мг/л, пируватом натрия в количестве 110 мг/л и эмбриональной бычьей сывороткой 10%. В питательную среду могут быть добавлены антибиотики, например, пенициллин 50 ЕД/мл и стрептомицин 50 мкг/мл. В альтернативном варианте осуществления антибиотики могут добавляться в клеточную суспензию, полученную после диссоциации и обработки ферментами сердечной ткани. Клетки hCTC (A3), составляющие предмет настоящего изобретения, могут быть посеяны с плотностью посева от приблизительно 1000 до приблизительно 10000 жизнеспособных клеток/см2 на тканевые культурные субстраты. Клетки hCTC (A3), составляющие предмет настоящего изобретения, могут инкубироваться при 5-20% объем к объему атмосферного кислорода.
В одном из вариантов осуществления изобретения клетки hCTC (A3), составляющие предмет настоящего изобретения, пассируются по достижении приблизительно 80% слияния. В альтернативном варианте осуществления клетки hCTC (A3), составляющие предмет настоящего изобретения, пассируются по достижении приблизительно 90% слияния. В альтернативном варианте осуществления клетки hCTC (A3), составляющие предмет настоящего изобретения, пассируются каждые 1-7 дней.
Один из способов получения клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, представлен на фиг.1. Альтернативный способ получения клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, представлен на фиг.2. Альтернативный способ получения клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, представлен на фиг.3.
Клетки, составляющие предмет настоящего изобретения, могут быть выделены путем диссоциации целого сердца с последующей обработкой ферментами диссоциированной ткани. В альтернативном варианте осуществления клетки, составляющие предмет настоящего изобретения, могут быть получены путем диссоциации фрагментов сердечной ткани с последующей обработкой ферментами диссоциированной ткани. Фрагменты могут быть получены из любой части сердца, например, из предсердия или желудочков, верхушки сердца, или могут быть взяты на любой из сторон сердца.
Диссоциированная сердечная ткань может быть обработана ферментами, например, коллагеназой и диспазой. Ферменты могут использоваться отдельно или, в альтернативном варианте, в сочетании друг с другом. В одном из вариантов осуществления изобретения диссоциированная ткань обрабатывается с помощью смеси коллагеназы и диспазы.
Коллагеназа может использоваться в концентрации от приблизительно 0,1 ЕД/мл до приблизительно 10 ЕД/мл. В альтернативном варианте осуществления коллагеназа может использоваться в концентрации от приблизительно 0,1 ЕД/мл до приблизительно 5 ЕД/мл. В альтернативном варианте осуществления коллагеназа может использоваться в концентрации приблизительно 5 ЕД/мл. В альтернативном варианте осуществления коллагеназа может использоваться в концентрации приблизительно 1 ЕД/мл.
Диспаза может использоваться в концентрации от приблизительно 0,5 ЕД/мл до приблизительно 50 ЕД/мл. В альтернативном варианте осуществления коллагеназа может использоваться в концентрации от приблизительно 0,5 ЕД/мл до приблизительно 10 ЕД/мл. В альтернативном варианте осуществления коллагеназа может использоваться в концентрации приблизительно 10 ЕД/мл. В альтернативном варианте осуществления коллагеназа может использоваться в концентрации приблизительно 5 ЕД/мл.
Диссоциированная ткань может подвергаться обработке ферментами в течение периода, равного от приблизительно 5 минут до приблизительно 5 часов. В альтернативном варианте осуществления диссоциированная ткань может подвергаться обработке ферментами в течение периода, равного от приблизительно 30 минут до приблизительно 5 часов. В альтернативном варианте осуществления диссоциированная ткань может подвергаться обработке ферментами в течение периода, равного от приблизительно 30 минут до приблизительно 4 часов. В альтернативном варианте осуществления диссоциированная ткань может подвергаться обработке ферментами в течение периода, равного от приблизительно 30 минут до приблизительно 3 часов. В альтернативном варианте осуществления диссоциированная ткань может подвергаться обработке ферментами в течение периода, равного от приблизительно 30 минут до приблизительно 2 часов. В альтернативном варианте осуществления диссоциированная ткань может подвергаться обработке ферментами в течение периода, равного от приблизительно 30 минут до приблизительно 1 часа. В одном из вариантов осуществления изобретения диссоциированная ткань может подвергаться обработке ферментами в течение приблизительно 2,5 часов.
При необходимости клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, могут, например, подвергаться воздействию агента (например, антитела), который специфично распознает маркер белка, экспрессируемый клетками, производными от кардиальной ткани, с целью идентификации и отбора клеток, производных от кардиальной ткани. Это позволит получить по существу чистую популяцию клеток, производных от кардиальной ткани.
Клетки, составляющие предмет настоящего изобретения
Настоящее изобретение относится к популяции клеток, производных от кардиальной ткани человека, которые не экспрессируют теломеразу, могут сохраняться и экспандироваться в культуре и могут применяться в лечении и восстановлении поврежденного миокарда. Свойства клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, представлены в таблице 1.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, не экспрессирующие теломеразу, составляющие предмет настоящего изобретения, экспрессируют по меньшей мере один из перечисленных маркеров: CD49e, CD105, CD59, CD54, CD90, CD34 и CD117.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, не экспрессирующие теломеразу, составляющие предмет настоящего изобретения, не экспрессируют по меньшей мере один из перечисленных маркеров: MDR, CD19, CD16, CD31, CD45 и Isl-1.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, не экспрессирующие теломеразу, составляющие предмет настоящего изобретения, экспрессируют по меньшей мере один из перечисленных маркеров: CD49e, CD105, CD59, CD54, CD90, CD34 и CD117.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, не экспрессирующие теломеразу, составляющие предмет настоящего изобретения, не экспрессируют по меньшей мере один из перечисленных маркеров: MDR, CD19, CD16, CD31, CD45 и Isl-1.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, впоследствии дифференцируются в кардиомиоциты. Такое дифференцирование осуществляется до введения пациенту или, в альтернативном варианте, после введения. Дифференцирование представляет собой повышение степени приобретения или обладания одной или несколькими характеристиками или функциями, которые отличаются от характеристик и функций оригинальной клетки (так называемая специализация клетки). Определение дифференцирования может осуществляться, например, путем скрининга изменения фенотипа клетки (то есть идентификации морфологических изменений в клетке и (или) маркеров поверхности на клетке). Допускается применение любого способа, допускающего дифференцирование клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, в кардиомиоциты.
Например, клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, могут впоследствии дифференцироваться в кардиомиоциты в соответствии со способами, описанными в заявке на патент США № US 20040126879.
В другом примере клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, могут впоследствии дифференцироваться в кардиомиоциты в соответствии со способами, описанными в международной патентной заявке № WO 2004019767.
Способы лечения или восстановления поврежденного миокарда
Повреждения миокарда возникают вследствие различных сердечных заболеваний, например, острого инфаркта миокарда, острой сердечной недостаточности и т.п. Клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, могут использоваться в лечении поврежденного миокарда. В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, используются в качестве терапии для восстановления миокарда, поврежденного вследствие острого инфаркта миокарда.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения поврежденного миокарда у пациента. Способ включает следующие стадии:
a. получение популяции клеток, производных от кардиальной ткани человека, не экспрессирующих теломеразу; и
b. введение популяции клеток, производных от кардиальной ткани человека, пациенту в количестве, достаточном для лечения поврежденного миокарда.
В одном из вариантов осуществления настоящее изобретение относится к способу восстановления поврежденного миокарда у пациента. Способ включает следующие стадии:
a. получение популяции клеток, производных от кардиальной ткани человека, не экспрессирующих теломеразу; и
b. введение популяции клеток, производных от кардиальной ткани человека, пациенту в количестве, достаточном для лечения поврежденного миокарда.
В одном из вариантов осуществления изобретения популяция клеток, производных от кардиальной ткани человека, очищается и вводится пациенту без культивирования клеток. В альтернативном варианте осуществления изобретения популяция клеток, производных от кардиальной ткани человека, подготавливается и культивируется in vitro перед введением пациенту.
В случае когда популяция клеток, производных от кардиальной ткани человека, культивируется и экспандируется in vitro, популяция культивируемых и растущих клеток может быть популяцией клеток hCTC (A1). В альтернативном варианте популяция культивируемых и экспандируемых клеток может быть популяцией клеток hCTC (A2). В альтернативном варианте популяция культивируемых и экспандируемых клеток может быть популяцией клеток hCTC (A3).
Клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся пациенту, имеющему повреждения миокарда, любым подходящим для этих целей способом, известным в данной области техники. Специалист в данной области техники может выбрать подходящий способ.
Например, введение клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, в поврежденный миокард может осуществляться путем прямой инъекции в поврежденный миокард. В альтернативном варианте осуществления клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся систематически. При систематической доставке клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, эффективность доставки клеток к поврежденному миокарду можно повысить, например, путем проведения дополнительной терапии пациента с использованием по меньшей мере еще одного агента или с помощью другого способа улучшения доставки клеток к поврежденному миокарду.
Например, клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся параллельно с другим агентом, выбранным из группы, состоящей из: фактора стволовых клеток (ФСК), гранулоцитарного колониестимулирующего фактора (Г-КСФ), гранулоцитарно-моноцитарного колониестимулирующего фактора (ГМ-КСФ), фактора стромальных клеток-1, стального фактора, фактора роста эндотелия сосудов, макрофагального колониестимулирующего фактора, гранулоцитарно-макрофагального колониестимулирующего фактора и интерлейкина-3.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся параллельно с другим агентом в соответствии со способами, описанными в заявке на патент США № US 20020061587.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся параллельно с другим агентом в соответствии со способами, описанными в заявке на патент США № US 2002162796.
Например, эффективность доставки клеток к поврежденному миокарду можно повысить путем изолирования сердечного кровообращения от системы кровообращения пациента и перфузии раствором, содержащим клетки, в сердце. Пример этого способа описан в международной патентной заявке № WO 2007067502.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся пациенту в соответствии со способами, описанными Iwasaki, Kawamoto et al. (Circulation 113: 1311-1325; 2006).
В альтернативном варианте осуществления клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся пациенту при помощи катетера, который помещается в коронарную артерию в соответствии со способами, описанными Sherman, Martens et al. (Nature Clinical Practice Cardiovascular Medicine 3, suppl 1: S57-64; 2006).
В альтернативном варианте осуществления клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся пациенту при помощи катетера, позволяющего осуществлять картирование электрической активности миокарда. В одном из вариантов осуществления клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся пациенту при помощи катетера, позволяющего осуществлять картирование электрической активности миокарда в соответствии со способами, описанными Perin, Dohmann et al. (Circulation 107: 2294-2302; 2003); и Perin, Silva et al. (Journal of Molecular and Cellular Cardiology 44: 486-495; 2008). В альтернативном варианте осуществления клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся пациенту в соответствии со способами, описанными Sherman, Martens et al. (Nature Clinical Practice Cardiovascular Medicine 3, suppl 1: S57-64; 2006).
В альтернативном варианте осуществления клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, вводятся пациенту при помощи катетера, позволяющего осуществлять интрамиокардиальную инъекцию в соответствии со способами, описанными Hashemi, Ghods et al. (European Heart Journal 29: 251-259; 2008).
Настоящее изобретение иллюстрируют, но не ограничивают, следующие примеры.
ПРИМЕР 1
Изолирование клеток, производных от кардиальной ткани человека
Материалы и способы. Приготовление коктейля из пищеварительных ферментов: Коктейль из пищеварительных ферментов, используемый в рамках настоящего изобретения для изолирования клеток, производных от кардиальной ткани из сердца человека, приготовлен как 2X основного раствора коктейля в фосфатно-солевом буферном растворе (ФСБР, Gibco, Invitrogen, Карлсбад, Калифорния). Концентрации составили 0,2 ЕД/мл или 2 ЕД/мл коллагеназы (Serva Electrophoresis GmbH, Гейдельберг, Германия) и 10 ЕД/мл диспазы II (Roche Applied Science, Индианаполис, Индиана). Эти основные растворы ферментов хранились при температуре -40°C. Перед обработкой ферментами производилось фильтрование коктейля из ферментов при помощи 0,22 мкм вакуумной системы фильтрования (Corning Incorporated, Актон, Массачусетс). Для обработки ферментами человеческого сердца во время процедуры использовался основной раствор коллагеназы 2 ЕД/мл. Конечные концентрации пищеварительных ферментов составили 1 ЕД/мл коллагеназы и 5 ЕД/мл диспазы. Процесс обработки ферментами человеческого сердца и изолирования клеток, производных от кардиальной ткани человека (hCTC), отражен на фиг.1.
Материалы и способы. Человеческое сердце: отбракованные трансплантаты (целые сердца) получены из Национального исследовательского института (National Development and Research Institutes (NDRI), Нью-Йорк). Период между заявкой и получением сердец-трансплантатов составил от 40 до 98 часов. Целый орган погрузили в питательную среду (модифицированную по способу Дульбекко среду Игла (DMEM)+10% эмбриональной бычьей сыворотки) и хранили при температуре 4°C до начала изолирования клеток.
Материалы и способы. Обработка человеческой сердечной ткани: ткань целого сердца поместили в биологически безопасный бокс и квадратную чашку для биологического анализа (Corning Inc., Актон, Массачусетс). Излишек жировой ткани удалили при помощи стерильного скальпеля (Bard Parker, Becton Dickinson, Хэнкок, Нью-Йорк). Первое целое сердце разрезали на маленькие кусочки (2-3 см3). После этого три четверти маленьких кусочков ткани вручную порубили на мельчайшие фрагменты (размером 1-2 мм3). На выполнение этой процедуры понадобилось два часа. Одну четверть кусочков переместили в камеру гомогенизатора PRO250 (Pro Scientific, Оксфорд, Коннектикут). Камеру закрыли крышкой и подключили генератор PRO250 к генератору, установленному на режим 3. Гомогенизация кусочков ткани выполнялась в течение 10 секунд при комнатной температуре без добавления буфера, после чего выполнялась визуальная проверка ткани. Процесс гомогенизации был завершен, когда ткань удалось измельчить до мельчайших частиц (в итоге размер фрагментов составил менее 1 мм3).
Материалы и способы. Обработка ферментами человеческой ткани: кусочки ткани, измельченные вручную и гомогенизированные, поместили в отдельные конусообразные пробирки емкостью 250 мл (Corning Inc., Корнинг, Нью-Йорк). Ткань в каждой пробирке промывали три раза путем добавления 100 мл ФСБР комнатной температуры и переворачивания пробирки пять раз. После этого пробирку устанавливали вертикально, при этом ткань осаждалась. Аспирация супернатанта выполнялась при помощи пипетки емкостью 2 мл (BD falcon, BD Biosciences, Сан-Хосе, Калифорния). Основной раствор коктейля из пищеварительных ферментов (2X) добавили в пробирку емкостью 250 мл в соотношении ферментов к ткани 1:1. Конечная концентрация ферментов составила 1 ЕД/мл коллагеназы и 5 ЕД/мл диспазы II. Пробирки, содержавшие ткань и ферменты, при температуре 37°C переместили в орбитальный встряхиватель, работавший на скорости 225 оборотов в минуту (Barnstead Lab, Мелроуз Парк, Иллинойс) и инкубировали в течение 2,5 часов. После инкубации пробирку переместили обратно в биологически безопасный бокс. Клеточная суспензия разжижалась путем заполнения пробирок ФСБР комнатной температуры. Для удаления остатков необработанной ферментами ткани клеточная суспензия подвергалась фильтрации, осуществляемой при помощи стандартного лабораторного сита диаметром 20,3 см (8 дюймов), 250 мкм (Sigma-Aldrich, Сент-Луис, Миссури) и аналитического стакана емкостью 500 мл. После этого клеточная суспензия в аналитическом стакане подвергалась дальнейшей фильтрации при помощи сетчатого фильтра 100 мкм (BD Falcon) и нескольких конусообразных пробирок 50 мл (BD Falcon). Клеточную суспензию промывали путем центрифугирования 338×g в течение 5 минут при комнатной температуре при помощи центрифуги Sorvall Legend T (Thermo Fisher Scientific, Inc, Уолтхем, Миннесота) для осаждения клеток. Удаление супернатанта осуществлялось путем аспирации, а дебрис повторно суспендировали в ФСБР и помещали в отдельные пробирки емкостью 50 мл, в одной из пробирок дебрис измельчали вручную, а в другой - гомогенизировали. Клеточная суспензия промывалась еще три раза с помощью 40 мл ФСБР комнатной температуры. После промывания осадок в пробирке повторно суспендировали в 20 мл буфера для лизиса (Lonza, Уолкерсвиль, Мэриленд) и инкубировали в течение 10 минут при комнатной температуре для растворения оставшихся эритроцитов. После инкубации клеточную суспензию промывали два или более раз с помощью 40 мл ФСБР комнатной температуры. После конечного центрифугирования остаток в пробирке ресуспендировали в 20 мл питательной среды для выращивания при комнатной температуре (DMEM, 1000 мг/л декстрозы, L-глютамин, 110 мг/л пирувата натрия и 10% эмбриональной бычьей сыворотки, 50 ЕД/мл пенициллина, 50 мкг/мл стрептомицина) и подсчитывали.
Материалы и способы. Подсчет клеток: общая плотность жизнеспособных клеток и анализ жизнеспособности проводили при помощи Vi-Cell™ XR (Beckman Coulter, Фуллертон, Калифорния). Анализатор жизнеспособности Vi-Cell™ автоматически проводит оценку жизнеспособности клеток способом исключения трипанового синего и анализ изображений на основании 100 изображений клеток в потоке. Система Vi-Cell имеет погрешность подсчета ± 6%. Подготовка и анализ образцов выполнялись в соответствии с рекомендациями производителя (руководство PN 383674 Rev. A). Вкратце, 500 мкл аликвотной пробы клеточной суспензии, полученной после лизиса эритроцитов, поместили в пробирки Vi-Cell™ емкостью 4 мл и выполнили анализ при помощи анализатора жизнеспособности Vi-Cell™ XR. При этом по умолчанию был установлен следующий профиль клеток:











Результаты. Урожай клеток, полученный в результате обработки ферментами целого сердца: из первого целого сердца после обработки ткани, измельченной вручную, получено 43 миллиона жизнеспособных клеток после диссоциации и обработки ферментами. Жизнеспособность составила 65%. В результате механической гомогенизации получено 12 миллионов жизнеспособных клеток, жизнеспособность составила 63%. Ввиду того, что для ручного измельчения было использовано в 3 раза больше ткани, разницы между этими способами в отношении величины урожая и жизнеспособности полученных клеток не отмечено. Исходя из полученных результатов, в дальнейшем человеческие сердца подвергались механической гомогенизации. После обработки ферментами общий урожай клеток, как правило, составлял 34-64 миллионов жизнеспособных клеток на одно сердце. Жизнеспособность составила 55-81%, как показано в таблице 2.
ПРИМЕР 2
Селекция и культивирование in vitro клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения
Клеточная суспензия, полученная путем диссоциации и обработки ферментами человеческого сердца, была экспандирована для последующего экспериментального анализа.
Первичный посев клеток, полученных путем диссоциации и обработки ферментами человеческого сердца: клеточную суспензию, полученную путем диссоциации и обработки ферментами человеческого сердца в соответствии со способами, описанными в примере 1, добавили в колбы с тканевой культурой T225 (Corning Inc., Corning, Нью-Йорк). 10 мл клеточной суспензии добавили в колбу, содержавшую 50 мл питательной среды для роста (DMEM, 1000 мг/л декстрозы, 584 мг/л L-глютамина, 110 мг/л пирувата натрия, 10% эмбриональной бычьей сыворотки, 50 ЕД/мл пенициллина, 50 мкг/мл стрептомицина производства Invitrogen, Карлсбад, Калифорния). Конечный объем первичной культуры составил 60 мл. Клетки инкубировали при температуре 37°C в среде, содержащей 20% O2 и 5% CO2, в течение 2 дней. По истечении этого времени наблюдалась гетерогенная культура клеток. Наблюдались неприлипающие рефрактильные клетки (в настоящем документе называемые клетки hCTC (S)) и прилипающие клетки (в настоящем документе называемые клетки hCTC (A1)). См. фиг.4.
Клетки hCTC (S), полученные после стадии первичного культивирования, имели морфологию, аналогичную морфологии кардиальных стволовых клеток, описанных Anversa (Beltrami, Barlucchi et al. 2003; Cell 114(6): 763-76). См. фиг.4a. Кроме того, наблюдались кластеры клеток, подобные описанные Messina et al. (Messina, De Angelis et al. 2004; Circulation Research 95(9): 911-21), см. фиг.4b.
Рост популяции hCTC (S): в одном исследовании клетки hCTC (S) удалялись из колб с культурой после двух дней периода первичного культивирования. Клетки hCTC (S) перемещали в конусообразные пробирки емкостью 50 мл. Клетки hCTC (S) центрифугировали при 338×g в течение 5 минут при комнатной температуре. Супернатант сливали, а клеточный осадок повторно суспендировали в 20 мл свежей питательной среды для роста. После повторного суспендирования проводили подсчет клеток hCTC (S). Общее количество клеток hCTC (S), полученных после стадии первичного культивирования, составило приблизительно 10-14 миллионов клеток. Фракция клеток hCTC (S) была заморожена в консервационной среде в концентрации 1-1,5 млн/мл и хранилась при температуре -140°C. Оставшиеся клетки экспандировались в культуре. Клетки hCTC (S) были повторно посеяны в колбы, плотность посева составила 5000 клеток/см2. После 2 дней в культуре клетки hCTC (S) приобрели способность к прилипанию и сформировали гомогенную прилипающую клеточную популяцию, в настоящем документе именуемую популяцией hCTC (A2), или клетками hCTC (A2). После того как клетки hCTC (A2), составляющие предмет настоящего изобретения, достигли слияния 80% приблизительно через 10-14 дней после посева hCTC (S), клетки трипсинизировали путем аспирации питательной среды для роста, промывали 60 мл ФСБР комнатной температуры, а затем в каждую колбу добавляли 4 мл трипсин-ЭДТА (Invitrogen, Карлсбад, Калифорния). Клетки hCTC (A2) инкубировали в течение приблизительно 5 минут при комнатной температуре до отсоединения клеток. В каждую колбу добавляли 6 мл питательной среды для роста и перемещали клеточную суспензию в новую конусообразную пробирку емкостью 50 мл (BD Falcon, BD Biosciences, Сан-Хосе, Калифорния). 500 мкл аликвоты извлекли и поместили в чашу для образцов Vi-cell для подсчета при помощи анализатора жизнеспособности клеток Vi-Cell™, описанного в примере 1. Производили повторный посев этих клеток, плотность посева 5000 клеток/см2 или 3000 клеток/см2.
Экспансия клеток hCTC (S) производилась с использованием замороженных клеток. Замороженные жизнеспособные клетки S размораживали при температуре 37°C и промывали один раз ФСБР. После этого производили подсчет и посев клеток, плотность посева 5000 клеток/см2, посев в питательную среду для роста в колбы с культурой. Каждый день отслеживали клеточную экспансию и слияние.
Исходя из визуального наблюдения, количество неприлипающих клеток hCTC (S) в культуре по прошествии 2 дней значительно сократилось и количество неприлипающих клеток hCTC (S) не увеличилось в культуре за период 10-14 дней. Клетки hCTC (S) в культуре начали прикрепляться к поверхности колбы через 2 дня в культуре и продолжили расти как прилипающие клетки. После посева клеток hCTC (S) они достигли слияния 80% через 10-14 дней. Хотя в культуре по-прежнему наблюдались отдельные клетки hCTC (S), количество неприлипающей популяции не увеличивалось в культуре. Возможно, это являлось следствием морфологического превращения неприлипающих клеток hCTC (S) в прилипающие hCTC (A2) в культуре. По истечении 2 дней после прикрепления клеток hCTC (S) к поверхности колбы количество неприлипающих клеток значительно снизилось, и их подсчет не производился.
В отличие от этого прилипающие клетки hCTC (A2), производные от клеток hCTC (S), демонстрировали потенциал роста до 10 дупликаций популяций (PDL), как показано на фиг.5a. Темпы роста этой популяции составляли от 1 до 3 PDL/единицу пассирования до достижения устойчиво высокого положения на уровне 9-10 PDL, когда клетки hCTC (A2) были посеяны с плотностью 5000 клеток/см2 или 3000 клеток/см2. Однако поскольку расчет PDL основан на исходном количестве клеток, посеянных в культуру (то есть количестве клеток hCTC (S)), оценка PDL не может быть абсолютно точной.
Экспансия популяции клеток hCTC (A1): после удаления среды, содержащей клетки hCTC (S), из колб, содержащих клетки с момента исходного посева, к оставшимся прилипающим клеткам в колбы был добавлено 60 мл свежей питательной среды для роста. Клетки hCTC (A1) культивировали до момента достижения 80% слияния. После этого клетки трипсинизировали путем аспирации питательной среды для роста, промывали 60 мл ФСБР комнатной температуры, а затем в каждую колбу добавляли 4 мл трипсин-ЭДТА (Invitrogen, Карлсбад, Калифорния). Клетки инкубировали в течение приблизительно 5 минут при комнатной температуре до отсоединения клеток. В каждую колбу добавляли 6 мл питательной среды для роста и перемещали клеточную суспензию в новую конусообразную пробирку емкостью 50 мл (BD Falcon, BD Biosciences, Сан-Хосе, Калифорния). 500 мкл аликвоты извлекли и поместили в чашу для образцов Vi-cell для подсчета при помощи анализатора жизнеспособности клеток Vi-Cell™. После этого часть клеток повторно суспендировали с криоконсервационной средой (90% ФСБР и 10% ДМСО) и сохраняли при плотности 1-1,5 млн клеток/мл и хранились при температуре -140°C. Оставшиеся клетки экспандировали путем повторного посева жизнеспособных клеток, плотность посева 3000 клеток/см2. Истощенную среду заменили через три дня после повторного посева, пассирование клеток производили на 7 день. Эти клетки пассировали каждые 7 дней. Замена среды производилась на 3 день с использованием трипсинизации.
Экспансия популяции клеток hCTC (A3): клетки hCTC (A1) и клетки hCTC (S) в пробирках промыли, а затем соединили вместе в одной конусообразной пробирке емкостью 50 мл (BD Falcon, BD Biosciences, Сан-Хосе, Калифорния). Смесь плотностью 5000 клеток/см2 или 3000 клеток/см2 объединенной клеточной суспензии добавили в отдельные колбы T225. Каждую колбу заполнили свежей питательной средой для роста, по 60 мл на колбу, и клетки инкубировали при температуре 37°C, 20% атмосферного O2 в течение 2 дней. После этого большая часть клеток образовала популяцию прилипающих клеток, в настоящем документе называемую популяцией клеток hCTC (A3), или клетками hCTC (A3). По достижении слияния 80% клетки пассировали путем трипсинизации и повторного посева плотностью 5000 клеток/см2 или 3000 клеток/см2 для идентификации соответствующей плотности и инкубировали при температуре 37°C, 20% атмосферного O2. Как правило, клетки hCTC (A3) достигали слияния 80% через 7 дней после посева. Визуальное наблюдение неприлипающих клеток hCTC (S) осуществлялось ежедневно. Через 2 дня в культуре количество этих клеток значительно сократилось, таким образом, клетки hCTC (A3) образовали гомогенную популяцию клеток. В среднем этот процесс занимал приблизительно 2 дней. Популяция hCTC (A3) обладала способностью к экспансии со скоростью 1-3 PDL за пассирование. При посеве клеток hCTC (A3) плотностью 5000 клеток/см2 клетки hCTC (A3) обладали способностью к достижению уровня 9-10 PDL до наступления физиологического старения. В отличие от этого, при посеве клеток hCTC (A3) плотностью 3000 клеток/см2, клетки hCTC (A3) обладали способностью к достижению 24 PDL до наступления физиологического старения. См. фиг.5b.
Характеристика клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения: клетки hCTC (A2) и hCTC (A3) демонстрировали одинаковые темпы роста, в пределах 1-3 PDL за единицу пассирования. Клеткам обоих типов потребовалось приблизительно 7 дней для достижения слияния 80-90% для пассирования. Различия в PDL у этих двух популяций клеток могут быть обусловлены неправильной исходной оценкой PDL для клеток hCTC (A2) при их образовании от популяции клеток hCTC (S).
Различий в экспрессии маркеров клеточной поверхности или генов во всех популяциях клеток, производных от кардиальной ткани человека, изолированных способами, составляющими предмет настоящего изобретения, не выявлено. Клетки hCTC (A1), hCTC (S), hCTC (A2) и hCTC (A3) не экспрессировали теломеразу. См. таблицу 1, в которой приведен перечень генов, экспрессированных в клетках, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, и кардиальных клеток-предшественников, известных в данной области техники. Все популяции клеток, изолированных в соответствии со способами, составляющими предмет настоящего изобретения, демонстрировали позитивную экспрессию генов GATA4 и Nkx2.5. Экспрессии генов тяжелой цепи миозина не наблюдалось. Маркер стволовых клеток c-kit обнаружен при экспрессии генов во всех популяциях клеток, составляющих предмет настоящего изобретения. См. таблицу 8. Методом проточной цитометрии установлено, что клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, были положительны в отношении CD105 и CD90. Клетки, составляющие предмет настоящего изобретения, не экспрессировали CD31, CD45 и CD16. См. таблицу 8.
В характеристиках популяций клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, не выявлено значимых различий. Для дальнейших исследований была выбрана популяция клеток hCTC (A3).
ПРИМЕР 3
Культивирование клеток, производных от кардиальной ткани человека in vitro
Непосредственное влияние на рост клеток оказывают плотность клеток и гипоксия (Tavaluc R et al, Cell Cycle 6:20, 2554-2562, 15 October 2007). Тесный контакт клеток между собой снижает потенциал роста клетки, а низкая плотность посева снижает вероятность соприкосновения клеток и повышает потенциал роста. Гипоксия или недостаток O2, как показало исследование, сокращает контактное торможение клеточного роста (Nonomura Y. et al; The Journal of Rheumatology April 1, 2009 vol. 36 no. 4 698-705). В рамках настоящего изобретения при плотности посева 3000 клеток/см2 выявлен больший потенциал роста по сравнению с плотностью посева 5000 клеток/см2.
Для сравнения воздействия уровня O2 на рост клеток, клетки hCTC (A3) высевали с плотностью 3000 клеток/см2 каждый раз после пассирования в колбах T225. Клетки инкубировали в среде с 20% атмосферного O2 или 5% атмосферного O2. На 3 день истощенную среду заменяли 60 мл свежей питательной среды для роста. На 7 день собирали урожай клеток hCTC (A3) в соответствии со способами, описанными в примере 2. Кинетика роста определялась путем исследования аккумулятивного общего PDL до момента появления признаков физиологического старения. Общая продолжительность эксперимента составила более 100 дней, в течение которых клетки пассировали 16-17 раз. Клетки hCTC (A3) культивировали в нормальных кислородных условиях (20% O2), кривая роста достигла стабильного уровня на отметке PDL=24. Хотя при культивировании клеток hCTC (A3) на отметке PDL=12 в условиях низкого содержания кислорода (5% O2), кривая роста достигла стабильного уровня на отметке PDL 28, как показано на фиг.6.
ПРИМЕР 4
Изолирование клеток, производных от кардиальной ткани крысы
Крысы линии Спраг-Доули в возрасте 8-12 недель анестезировали изофлураном, после чего выполнялось открытие брюшной полости. Сместив кишечник, отделяли аорту. Иглу калибра 27 вводили в грудной отдел полой вены и осуществляли перфузию сердца 10 мл ФСБР, содержавшего 5 ЕД/мл гепарина. После чего выполнили ретроградную перфузию сердца путем инъекции 10 мл ФСБР, содержавшего 5 ЕД/мл гепарина, через торакальную аорту. Принимались соответствующие меры, направленные на поддержание сердцебиения во время процедуры. После этого сердце целиком извлекали из грудной полости и помещали в ледяной буферный раствор Хэнка. Пять изолированных крысиных сердец соединили для последующей диссоциации и обработки ферментами.
После этого изолированные крысиные сердца дважды промыли 20 мл ФСБР комнатной температуры, и слили супернатант. Затем сердца измельчили вручную при помощи хирургического скальпеля при комнатной температуре, измельченную ткань поместили в пробирки емкостью 50 мл. После этого измельченную ткань промыли три раза 25 мл ФСБР, переворачивая пробирку пять раз.
Фрагменты ткани поместили в отдельные конусообразные пробирки емкостью 50 мл (Corning Inc., Корнинг, Нью-Йорк). Ткань в каждой пробирке промывали три раза путем добавления 30 мл ФСБР комнатной температуры и переворачивания пробирки пять раз. После этого пробирку поместили вертикально, при этом ткань осаждалась. Аспирацию супернатанта выполняли при помощи пипетки емкостью 2 мл (BD falcon, BD Biosciences, Сан-Хосе, Калифорния). Основной раствор коктейля из пищеварительных ферментов (2X) добавили в пробирку емкостью 50 мл в соотношении ферментов к ткани 1:1. Конечная концентрация ферментов составила 1 ЕД/мл коллагеназы и 5 ЕД/мл диспазы II. Пробирки, содержащие ткань и ферменты, при температуре 37°C переместили в орбитальный встряхиватель, работающий на скорости 225 оборотов в минуту (Barnstead Lab, Мелроуз Парк, Иллинойс) и инкубировали в течение 2,5 часов. После инкубации пробирку переместили обратно в биологически безопасный бокс. Клеточная суспензия разжижалась путем заполнения пробирок ФСБР при комнатной температуре. Для того чтобы удалить остатки необработанной ферментами ткани клеточная суспензия подвергалась фильтрации, осуществляемой при помощи стандартного лабораторного сита диаметром 20,3 см (8 дюймов) и с размером ячейки 100 мкм (BD Falcon), а затем сита с размером ячейки 40 мкм (BD Falcon) и шести конусообразных пробирок емкостью 50 мл (BD Falcon). Размер фильтра, использованного для клеток, производных от кардиальной ткани крысы, был меньше размера сита, использованного для клеток человека, вследствие разных размеров миоцитов у человека и крысы. Клеточную суспензию промыли путем центрифугации 338×г в течение 5 минут при комнатной температуре при помощи центрифуги Sorvall Legend T (Thermo Fisher Scientific, Inc, Уолтхем, Миннесота) для осаждения клеток. Удаление супернатанта осуществлялось путем аспирации, а дебрис повторно суспендировали в ФСБР в питательной среде для роста, поместили в одну пробирку емкостью 50 мл с 20 мл питательной среды для роста и извлекли образец для определения урожая клеток. Как правило, размер полученного урожая составлял 10 миллионов клеток на сердце, жизнеспособность клеток 70%.
При подготовке клеток, производных от кардиальной ткани, для обработки ферментами кардиальной ткани использовали либо 0,1 ЕД/мл, либо 1 ЕД/мл основного раствора коллагеназы. После инкубации в течение 3 часов в каждую пробирку добавили 20 мл питательной среды для роста, как описано в примере 1. Однако кардиальная ткань, обработанная коллагеназой 0,1 ЕД/мл, не дала урожая клеток.
Клеточную суспензию, полученную путем диссоциации и обработки ферментами кардиальной ткани, посеяли в колбы с тканевой культурой T225 (Corning Inc., Corning, Нью-Йорк), по 10 мл в каждую колбу. В каждую колбу добавили 35 мл питательной среды для роста (DMEM, 1000 мг/л декстрозы, 584 мг/л L-глютамина, 110 мг/л пирувата натрия, 10% эмбриональной бычьей сыворотки, 50 ЕД/мл пенициллина, 50 мкг/мл стрептомицина производства Invitrogen, Карлсбад, Калифорния). Таким образом, конечный объем раствора в каждой колбе составил 45 мл. Исходная клеточная культура выдерживалась в течение двух дней при температуре 37°C с атмосферным кислородом 20% O2 и 5% CO2. По прошествии двух дней первичного культивирования неприлипающие клетки rCTC (S) извлекли и переместили в конусообразные пробирки емкостью 50 мл, а затем подвергли центрифугированию 338×g в течение 5 минут при комнатной температуре. Супернатант сливали, а клеточный осадок повторно суспендировали в 20 мл свежей питательной среды для роста. Клетки подсчитывали и повторно высевали в колбы T225, плотность посева составляла 5000 клеток/см2. Клетки rCTC (S) культивировали в питательной среде для роста. После дополнительного культивирования в течение двух дней было отмечено, что клетки rCTC (s) стали прилипающими. Популяция прилипающих клеток, образованная клетками rCTC (S), которые приобрели способность к прилипанию, в настоящем документе называются популяцией клеток rCTC (A2), или клетками rCTC (A2).
Урожай клеток rCTC (A2) собрали и пассировали на седьмой день путем трипсинизации в соответствии со способами, описанными в примере 2. Посев клеток rCTC (A2) выполняли с плотностью 5000 клеток/см2 в колбы T225, каждая из которых содержала 45 мл питательной среды для роста. Пассирование клеток проводили по достижении слияния приблизительно 80%. Исследованная кривая роста клеток rCTC (A2) показана на фиг.7.
ПРИМЕР 5
Изолирование клеток, производных от кардиальной ткани мышей, экспрессирующих зеленый флуоресцентный белок (GFP)
Пять мышей линии FVB.Cg-Tg(ACTB-EGFP)B5Nagy/J (GFP mice, Jackson Lab, Бар Харбор, Мэн) в возрасте 8-12 недель анестезировали изофлураном, после чего выполняли открытие брюшной полости. Сместив кишечник, отделили аорту. Игла калибра 27 ввели в грудной отдел полой вены и осуществили перфузию сердца 10 мл ФСБР, содержащего 5 ЕД/мл гепарина. После чего выполнили ретроградную перфузию сердца путем инъекции 10 мл ФСБР, содержавшего 5 ЕД/мл гепарина, через торакальную аорту. Принимались соответствующие меры, направленные на поддержание сердцебиения во время процедуры. После этого сердце целиком извлекли из грудной полости и поместили в ледяной буферный раствор Хэнка.
Пять изолированных GFP-мышиных сердец соединили для последующей диссоциации и обработки ферментами. После этого изолированные мышиные сердца дважды промыли 20 мл ФСБР комнатной температуры, и слили супернатант. Затем сердца измельчили вручную при помощи хирургического скальпеля при комнатной температуре, измельченную ткань поместили в пробирки емкостью 50 мл. После этого измельченную ткань промыли три раза 25 мл ФСБР, переворачивая пробирку пять раз. Фрагменты ткани поместили в отдельные конусообразные пробирки емкостью 50 мл (Corning Inc., Корнинг, Нью-Йорк). Ткань в каждой пробирке промывали три раза путем добавления 30 мл ФСБР комнатной температуры и переворачивания пробирки пять раз. После этого пробирку поместили вертикально, при этом ткань осаждалась. Аспирация супернатанта выполнялась при помощи пипетки емкостью 2 мл (BD falcon, BD Biosciences, Сан-Хосе, Калифорния). Основной раствор коктейля из пищеварительных ферментов (2X) добавили в пробирку емкостью 50 мл в соотношении ферментов к ткани 1:1. Конечная концентрация ферментов составила 1 ЕД/мл коллагеназы и 5 ЕД/мл диспазы II. Пробирки, содержащие ткань и ферменты, при температуре 37°C переместили в орбитальный встряхиватель, работающий на скорости 225 оборотов в минуту (Barnstead Lab, Мелроуз Парк, Иллинойс) и инкубировали в течение 2,5 часов. После инкубации пробирку переместили обратно в биологически безопасный бокс. Клеточная суспензия разжижалась путем заполнения пробирок ФСБР при комнатной температуре. Для того чтобы удалить остатки необработанной ферментами ткани, клеточная суспензия подвергалась фильтрации, осуществляемой при помощи стандартного лабораторного сита диаметром 20,3 см (8 дюймов) и с размером ячейки 100 мкм (BD Falcon), а затем сита с размером ячейки 40 мкм (BD Falcon) и шести конусообразных пробирок емкостью 50 мл (BD Falcon). Размер фильтра, использованного для клеток, производных от кардиальной ткани крысы, был меньше размера сита, использованного для клеток человека, вследствие разных размеров миоцитов у человека и крысы. Клеточную суспензию промыли путем центрифугирования 338×g в течение 5 минут при комнатной температуре при помощи центрифуги Sorvall Legend T (Thermo Fisher Scientific, Inc., Уолтхем, Миннесота) для осаждения клеток. Удаление супернатанта осуществлялось путем аспирации, а дебрис повторно суспендировали в ФСБР в питательной среде для роста, поместили в одну пробирку емкостью 50 мл с 20 мл питательной среды для роста и извлекли образец для определения урожая клеток. Как правило, размер полученного урожая составлял 10 миллионов клеток на сердце, жизнеспособность клеток 70%.
После инкубации в течение 3 часов в каждую пробирку добавили 20 мл питательной среды для роста, как описано в примере 4. Для того чтобы удалить остатки необработанной ферментами ткани, клеточная суспензия подвергалась фильтрации, осуществляемой при помощи стандартного лабораторного сита диаметром 20,3 см (8 дюймов) и с размером ячейки 100 мкм (BD Falcon), а затем сита с размером ячейки 40 мкм (BD Falcon) и шести конусообразных пробирок емкостью 50 мл (BD Falcon). Клеточную суспензию промыли путем центрифугирования 338×g в течение 5 минут при комнатной температуре при помощи центрифуги Sorvall Legend T (Thermo Fisher Scientific, Inc, Уолтхем, Миннесота) для осаждения клеток. Удаление супернатанта осуществлялось путем аспирации, а дебрис повторно суспендировали в ФСБР в питательной среде для роста, поместили в одну пробирку емкостью 50 мл с 20 мл питательной среды для роста и извлекли образец для определения урожая клеток. Размер полученного урожая составлял 10 миллионов клеток на сердце, жизнеспособность клеток 70%. Результаты получены на основе 2 изолированных сердец. Популяция mCTC (A2) использовалась в последующих исследованиях. Клетки экспандировали и пассировали два раза перед проведением последующих исследований.
ПРИМЕР 6
Криоконсервация, жизнеспособность и восстановление клеток
Клетки, производные от кардиальной ткани человека и крысы, подготовили для криоконсервации. Вкратце, клетки из популяции hCTC (A3) или rCTC (A2) получили путем экспансии криоконсервированных клеток hCTC (A3) и rCTC (A2) на ранних стадиях пассирования. Клетки высевали плотностью 3000 клеток/см2, инкубировали при 37°C, 20% атмосферного O2 и пассировали через 7 дней в культуре с заменой среды на третий день. Клетки собрали, когда они достигли уровня 12-14 PDL.
Клетки трипсинизировали и повторно суспендировали для криоконсервации в СИСТЕМЕ CRYOSTOR D-LITETM (Biolife Solutions, Inc, Ботхелл, Вашингтон), содержавшей 2% ДМСО. Криоконсервация выполнена в криопробирках Nalgene емкостью 2 мл (полипропилен, стерильно, с внутренней резьбой и навинчивающейся крышкой (Nalgne Nunc, Рочестер, Нью-Йорк), при помощи программируемого морозильника Integra 750 Plus (Planer, Мидлсекс, Великобритания.) на базе ПО DeltaT. Клетки и растворы выдерживали при комнатной температуре перед загрузкой в программируемый морозильник, который держали при температуре 15°C. В пробирку с замораживающим буферным раствором поместили температурный датчик. Для криоконсервации использовалась следующая программа:
Когда температура достигла -140°C, образцы переместили в криогенную емкость на хранение.
Жизнеспособность и восстановление клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, после криоконсервации: после хранения в криогенной емкости в течение одного месяца (-140°C) одну пробирку с клетками hCTC (A3), хранившуюся в CRYOSTOR D-LITETM и содержавшую 1 миллион клеток/пробирка, извлекли и разморозили при комнатной температуре. После чего пробирку поместили в биологически безопасный бокс. 50 мкл образца (содержание клеток 0,5 миллиона) поместили в микроцентрифужную пробирку емкостью 1,8 мл, содержавшую 50 мкл раствора трипанового синего. Во время подготовки дважды производился подсчет путем помещения 10 мкл раствора в гемоцитометр. Эти подсчеты применялись для установления t0 восстановления и жизнеспособности перед прокалыванием иглой. Для определения жизнеспособности и восстановления клеток после пассирования иглой без инкубации при комнатной температуре (t0 после прокалывания иглой) произвели забор 100 мкл клеточной суспензии шприцом для инъекций туберкулина (1 мл) (BD, номер по каталогу 309602) через иглу калибра 30 (BD, номер по каталогу 305106). После этого образец еще раз пропустили через иглу и ввели в микроцентрифужную пробирку емкостью 1,8 мл. В эту пробирку добавили 100 мкл трипанового синего и провели подсчет дупликаций, как описано выше. Процедура выполнялась после инкубации продолжительностью 10 мин, 20 мин, 30 мин при комнатной температуре, а также через 30 минут без пассирования пропусканием через иглу.
После хранения в течение одного месяца жизнеспособность клеток hCTC (A3) после размораживания составила 94%. Восстановление клеток составило 0,54 миллиона, что аналогично количеству оригинальных клеток до криоконсервации, как показано в таблице 3 и на фиг.8.
Жизнеспособность клеток, производных от кардиальной ткани человека, тестировали после пропускания через иглу калибра 30, при этом введение в иглу составило более 90% через 30 минут инкубации при комнатной температуре, что соответствует периоду, в течение которого необходимо ввести клетки для лечения инфаркта у крыс. Количество восстановленных клеток соответствовало количеству клеток перед пропусканием через иглу, как показано в таблице 3 и на фиг.8.
Клетки hCTC (A3) экспандировали до уровня 12 PDL, затем объединили для проведения последующих исследований in vivo. Образцы объединенных клеток исследовали на наличие кариотипических отклонений. Результаты приведены в таблице 4.
Биологическая совместимость клеток, производных от кардиальной ткани крысы: одну пробирку с клетками rCTC (A2) в CRYOSTOR D-LITETM, содержавшую 2 миллиона клеток, разморозили, как описано выше. После этого пробирку поместили в биологически безопасный бокс. 50 мкл образца поместили в микроцентрифужную пробирку емкостью 1,8 мл, содержавшую 50 мкл раствора трипанового синего. Во время подготовки трижды производился подсчет путем помещения 10 мкл в гемоцитометр. Для определения исходного урожая клеток и их жизнеспособности после пропускания через иглу подсчет клеток выполняли до пропускания через иглу и после пропускания через иглу с периодом инкубации 0, 10, 20, 30 мин. В каждый заданный момент времени производили забор 100 мкл клеточной суспензии шприцем для инъекций туберкулина (1 мл) (BD, номер по каталогу 309602) через иглу калибра 30 (BD, номер по каталогу 305106). После этого образец еще раз пропустили через иглу и ввели в микроцентрифужную пробирку емкостью 1,8 мл. В эту пробирку добавили 100 мкл трипанового синего и провели подсчет дупликаций, как описано выше. Процедура выполнялась после инкубации продолжительностью 10 мин, 20 мин, 30 мин при комнатной температуре с целью имитации потенциальной процедуры введения клеток модели крысы с острым инфарктом миокарда.
После хранения в течение одного месяца в жидком азоте жизнеспособность клеток rCTC (A2) после размораживания составила 94%. Восстановление клеток составило 1,4 млн/мл, то есть приблизительно 70% от оригинальной концентрации клеток (2 млн/мл). Жизнеспособность клеток rCTC (A2) после пропускания через иглу составила свыше 90% через 30 минут инкубации при комнатной температуре, что соответствует периоду, в течение которого необходимо ввести клетки для лечения инфаркта у крыс. Количество восстановленных клеток соответствовало количеству клеток перед пропусканием через иглу, как показано в таблице 5 и на фиг.9.
ПРИМЕР 7
Характеристика клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения
Экспрессию протеинов клеточной поверхности исследовали на популяциях клеток, производных от кардиальной ткани, полученных способами, составляющими предмет настоящего изобретения, из кардиальной ткани крысы и человека. Исследуемые маркеры клеточной поверхности показаны в таблице 6. В качестве контрольной группы клеток в исследовании использованы популяции человеческих дермальных фибробластов.
Более 90% популяции клеток hCTC (A3) экспрессировали CD59, CD105, CD54 и CD90 (каждую группу клеток анализировали отдельно). Приблизительно 30% популяции клеток hCTC (A3) экспрессировали CD34, маркер стволовых клеток эндотелиальных клеток-предшественников. Таким образом, приблизительно 30% hCTC (A3) оказались положительными по отношению к c-Kit. В отличие от этого менее 5% популяции клеток hCTC (A3) экспрессировали либо CD31, либо CD45, либо CD16. См. фиг.10, 11 и таблицу 7. Популяции клеток hCTC (A1), hCTC (A1) и hCTC (S) также продемонстрировали аналогичную экспрессию маркеров клеточной поверхности. См. таблицу 8. Более того, аналогичные результаты наблюдались при исследовании популяции клеток rCTC (A3). См. фиг.12. CD54 и фактор межклеточной адгезии 1 (ICAM) связываются с интегринами на лейкоцитах и опосредуют трансмиграцию лейкоцитов через сосудистый барьер в ткани (Yang L et al, Blood 106 (2):584-92, July, 2005). Таким образом, при введении в коронарную артерию экспрессия клеточной поверхности этой молекулы может усилить транслокацию hCTC (A3) из сосудистой системы в миокард.
ПРИМЕР 8
Анализ экспрессии генов клеток, производных от кардиальной ткани
Собраны образцы РНК популяций клеток, производных от кардиальной ткани: hCTC (A1), hCTC (A2), hCTC (A3), rCTC (A2) и mCTC (A2) (РНК собрана из одного миллиона клеток каждой популяции клеток).
В собранных образцах исследовали экспрессию панели генов с помощью ПЦР в реальном времени. ПЦР в реальном времени инициирована в соответствии с реакционной смесью, определенной в таблице 9, а праймеры исследованных генов приведены в таблице 10. Были изучены две категории генов: специфические кардиальные гены и гены стволовых клеток. Затем специфические кардиальные гены разделили на дифференцированные маркеры, такие как тяжелая цепь миозина (ТЦМ), и дифференцированные кардиальные маркеры, такие как GATA-4 и Nkx2.5. Затем гены стволовых клеток классифицировали, выделив следующие группы: маркер стволовых клеток c-kit, маркер эмбриональных кардиальных клеток islet-1 и маркер клеточного деления теломераза. Ген «домашнего хозяйства» - глицеральдегид-3-фосфатдегидрогеназа (ГАФД) использовали в качестве эталона для нормализации уровней экспрессии в каждом образце.
Установлено, что исследуемая экспрессия генов аналогична экспрессии в популяциях клеток hCTC (A1), hCTC (A2) и hCTC (A3). См. таблицу 10. Установлена экспрессия маркера стволовых клеток c-kit (Ct: 27-29), тогда как экспрессия теломеразы и islet-1 не зафиксирована в популяциях клеток hCTC (A1), hCTC (A2) и hCTC (A3). Нет данных для генов при значении Ct=40. Экспрессия кардиальных маркеров GATA 4 и Nkx2.5 отмечена при значениях CT=25 и 32-34, соответственно, в популяциях hCTC (A1), hCTC (A2) и hCTC (A3), тогда как ни экспрессия тяжелой цепи миозина, ни экспрессия кардиального актина не наблюдалась одной популяции клеток hCTC (A1), hCTC (A2) и hCTC (A3). См. таблицу 10.
Полученные данные позволяют предположить, что клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, представляют собой подобие клеток-предшественников, а более конкретно конкретнее, что отношение экспрессии маркера клеток-предшественников к экспрессии дифференцированного клеточного маркера составило более 50000 в популяциях hCTC (A1), hCTC (A2) и hCTC (A3) по сравнению с кардиомиоцитами (1%) и человеческими фибробластами (12%). См. таблицы 10, 11 и фиг.13.
Клетки rCTC (A2) также экспрессировали кардиальные линейные гены, такие как GATA-4 (Ct: 28) и Nkx2.5 (Ct: 27). Однако в отличие от клеток, производных от кардиальной ткани человека, клетки, производные от кардиальной ткани крысы, показали более высокий уровень экспрессии Nkx2.5. Маркеры c-kit, Islet-1 и теломераза также экспрессировались в клетках rCTC (A2). См. таблицу 12. Аналогично клеткам, производным от кардиальной ткани, полученным из сердца крысы, клетки, производные от кардиальной ткани мыши, также экспрессировали Nkx2.5, c-kit, Islet-1 и теломеразу. См. таблицу 13.
ПРИМЕР 9
Клетки, производные от кардиальной ткани, могут дифференцироваться в кардиомиоциты
Клетки mCTC (A2) (200K), полученные способами, описанными в примере 5, сначала культивировали в питательной среде в течение 2 дней, а затем их собрали путем трипсинизации и подсчитывали перед смешиванием с кардиальными миоцитами крысы (1 миллион, номер по каталогу R357, Cell Application, Inc., Остин, Техас), в соотношении 1:5. Кардиальные миоциты крысы выдерживали в среде в течение 5 дней перед трипсинизацией и подсчетом, а затем миоциты смешивали с клетками mCTC (A2). Смесь клеток высеяли на 6-луночный планшет, обработанный ламинином (номер по каталогу 354595 BD Biosciences, Нью-Йорк), на 5 дней. Способность клеток mCTC (A2) дифференцироваться исследовали путем инкубирования смеси клеток в тканевой культурной среде, содержащей среду DMEM-F12(1:1)+10% лошадиной сыворотки (Sigma), далее называемой дифференцировочной средой. Клетки инкубировали в дифференцировочной среде в течение 5 дней при 20% O2 в атмосфере и температуре 37°C. По прошествии этого времени собран урожай клеток и экстрагирована РНК. Общее количество РНК, экстрагированное из совместной культуры клеток mCTC (A2) и крысиных кардиомиоцитов, а также из параллельных культур клеток mCTC (A2), исследовали на экспрессию генов мышиной тяжелой цепи миозина. Для этого использовали следующие праймеры мышиной тяжелой цепи миозина:
Совместная культура клеток mCTC (A2) с крысиными кардиомиоцитами в результате продемонстрировала 9-кратное увеличение экспрессии мышиной тяжелой цепи миозина по сравнению с параллельными культурами одних только клеток mCTC (A2). См. фиг.14. Полученные данные позволяют предположить, что клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, обладают способностью к дифференцированию в кардиомиоциты, а совместное культивирование клеток, составляющих предмет настоящего изобретения, с кардиомиоцитами способствует усилению дифференцировки.
ПРИМЕР 10
Изолирование, экспансия и характеристика клеток, производных от кардиальной ткани свиньи
Для каждой процедуры изолирования использовано сердце геттингенской карликовой свиньи в возрасте 8-12 недель. Материал приобретен у компании Marshall Bioresources (Норт-Роуз, Нью-Йорк). Сердце перфузировали, чтобы удалить кровь перед сбором клеток, затем целый орган погрузили в модифицированную по способу Дульбекко среду Игла (DMEM)+10% ФСБР на льду на время транспортировки. Период между заявкой и получением ткани составил от 48 до 96 часов. В общей сложности провели четыре процедуры изолирования в соответствии с процедурами, описанными ниже.
Сердца разрезали на маленькие кусочки (размером приблизительно 2-3 см3). Эти кусочки ткани гомогенизировали путем механической гомогенизации, как описано в примере 1, чтобы получить фрагменты ткани размером менее 1 мм3. Затем материал помещали в одну конусообразную пробирку емкостью 250 мл (Corning Inc., Корнинг, Нью-Йорк) и промывали три раза. В пробирку емкостью 250 мл добавили основной раствор коктейля из пищеварительных ферментов (2X) в соотношении ферментов к ткани 1:1. Конечная концентрация ферментов составила 1 ЕД/мл коллагеназы и 5 ЕД/мл диспазы II. Пробирки, содержащие ткань и ферменты, при температуре 37°C переместили в орбитальный встряхиватель, работавший на скорости 225 оборотов в минуту (Barnstead Lab, Мелроуз Парк, Иллинойс) и инкубировали в течение 2,5 часов. После инкубации, для того чтобы удалить остатки необработанной ферментами ткани, клеточная суспензия подвергалась фильтрации, осуществляемой при помощи стандартного лабораторного сита диаметром 20,3 см (8 дюймов), 250 мкм (Sigma-Aldrich, Сент-Луис, Миссури). Это позволило собрать необработанную ферментами соединительную и жировую ткань. После чего использовали сетчатые фильтры с размером ячейки 100 мкм (BD Falcon) для исключения кардиомиоцитов. Среду, содержащую клетки и пропущенную через фильтр, поместили в несколько конусообразных пробирок емкостью 50 мл (BD Falcon). После этого клеточную суспензию промыли. После промывания осадок в пробирке повторно суспендировали в 20 мл буфера для лизиса (Lonza, Уолкерсвиль, Мэриленд) и инкубировали в течение 10 минут при комнатной температуре с целью растворения оставшихся эритроцитов. После инкубации клеточную суспензию промывали два или более раз с использованием 40 мл ФСБР комнатной температуры. После конечного центрифугирования остаток в пробирке повторно суспендировали в 20 мл питательной среды для выращивания при комнатной температуре и подсчитали. После диссоциации и обработки фрементами урожай клеток, как правило, составлял 27 миллионов клеток в объеме 20 мл. Как правило, жизнеспособность клеток составляла 80%.
Клеточную суспензию, полученную путем диссоциации и обработки фрементами, добавили в колбы с тканевой культурой T225 (Corning Inc., Корнинг, Нью-Йорк). 10 мл клеточной суспензии добавили в колбу, содержащую 50 мл питательной среды для роста (DMEM, 1000 мг/л декстрозы, 584 мг/л L-глютамина, 110 мг/л пирувата натрия, 10% эмбриональной бычьей сыворотки, 50 ЕД/мл пенициллина, 50 мкг/мл стрептомицина производства Invitrogen, Карлсбад, Калифорния). Конечный объем первичной культуры составил 60 мл. Клетки инкубировали при температуре 37°C в среде, содержащей 20% O2 и 5% CO2, в течение 2 дней. По истечении этого времени была получена гетерогенная культура клеток. Наблюдались неприлипающие рефрактильные клетки (в настоящем документе называемые клетки pCTC (S) (S)) и прилипающие клетки (в настоящем документе называемые клетки pCTC(A1)).
Диссоциация и обработка фрементами свиного сердца, выполненные в соответствии со способами, составляющими предмет настоящего изобретения, и последующая экспансия клеток позволили получить следующие популяции клеток: pCTC (S), pCTC (A1), pCTC (A2) и pCTC (A3). Морфология кардиальных клеток свиньи, составляющих предмет настоящего изобретения, аналогична морфологии кардиальных клеток человека, составляющих предмет настоящего изобретения. Для дальнейшей характеристики и последующих исследований in vivo была выбрана популяция клеток pCTC (A3).
Клетки pCTC (S) и клетки pCTC (A1) сначала совместно экспандировались в культуре в колбах T225. Каждую колбу заполнили свежей питательной средой для роста, по 60 мл на колбу, и клетки инкубировали при температуре 37°C, 20% O2 в течение 2 дней. После этого большая часть клеток образовала популяцию прилипающих клеток, в настоящем документе называемую популяцией клеток pCTC (A3), или клетками pCTC (A3). После 2 дней в культурной среде, исходя из визуального наблюдения, количество неприлипающих клеток уменьшилось, и клетки pCTC (A3) образовали гомогенную популяцию клеток. В среднем это заняло 2 дня. Клетки pCTC (A3) пассировали по достижении слияния 90-100% и повторно высевали плотностью 3000 клеток/см2. Экспансия клеток pCTC (A3) в культурной среде превысила рост человеческих клеток, производных от кардиальной ткани. Клетки pCTC (A3) достигли слияния свыше 90% через 3-4 дня. См. фиг.15, где показана кривая роста клеток pCTC (A3), составляющих предмет настоящего изобретения.
Клетки pCTC (A3) не экспрессировали теломеразу или тяжелую цепь миозина, что установлено путем ПЦР в реальном времени. Однако клетки pCTC (A3) экспрессировали GATA-4. Экспрессия Nkx2.5 не исследовалась в клетках, производных от кардиальной ткани свиньи, составляющих предмет настоящего изобретения. Единичное окрашивание маркеров показало, что более 90% популяции клеток pCTC (A3) оказались позитивными к экспрессии CD105 и CD90. Менее 5% клеток pCTC (A3) экспрессировали либо CD45, либо CD16, либо маркер эндотелиальных клеток свиньи (номер по каталогу MCA1752, Serotec). Этот маркер представляет собой молекулу главного комплекса гистосовместимости II класса, идентифицированную на капиллярном эндотелии различных тканей, описанную Wilson et al. (Immunology. 1996 May; 88(1):98-103). См. фиг.16 и таблицу 14. Другие популяции клеток, такие как клетки pCTC (A1) или pCTC (A2), не исследовали.
ПРИМЕР 11
Лечение острого инфаркта миокарда при помощи клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения
Острый инфаркт миокарда на модели крысы: крысиная модель инфаркта миокарда успешно использовалась для тестирования эффективности агентов, таких как иАПФ и бета-блокаторы, применяемых для лечения острого инфаркта миокарда (ОИМ). На всех стадиях эксперимента тестирование животных проводилось в соответствии с местными методическими указаниями.
Крысиная модель инфаркта миокарда хорошо подходит для имитации патофизиологии человека после инфаркта миокарда и последующего ухудшения сердечной функции после инфаркта (Pfeffer M. A. et al, Circ Res 1979; 44: 503-12; Litwin S. E. et al, Circulation 1994; 89: 345-54; Hodsman G. P. et al. Circulation 1988; 78: 376-81).
Женские особи бестимусных крыс (весом 250-300 г, производитель Shizuoka Agricultural Cooperation Association, Сидзуока, Япония) анестезировали кетамином и ксилазином (60 и 10 мг/кг интраперитонеально, соответственно) и обеспечили дыханием под положительным давлением через эндотрахеальную трубку. Грудную клетку открыли в области четвертого межреберного промежутка слева, произвели экстериоризацию сердца и надрез перикарда. После этого сердце удерживали при помощи щипцов, петлю нити Proline 6-0 разместили под левой передней нисходящей коронарной артерией, приблизительно на 2 мм ниже ее начала. ОИМ индуцировали в сердце путем натяжения лигатуры и окклюзии артерии. Визуально отмечено обесцвечивание пораженного инфарктом миокарда. Суспензию клеток, производных от кардиальной ткани, или носитель ввели в краевую зону обесцвеченной области приблизительно через 20 минут после начала инфаркта, как описано ниже в разделе «Введение клеток». После инъекции грудную клетку закрыли и вернули крыс в клетки. В определенные моменты времени после оперативного вмешательства у крыс под действием анестезии вырезали сердце.
Криоконсервированные популяции клеток hCTC (A3) и rCTC (A2), хранившиеся при температуре -80°C, размораживали на льду и определяли их жизнеспособность перед введением подопытным животным. Жизнеспособность клеток, использованных в настоящем исследовании, составляла свыше 95%.
Клетки ввели подопытным животным через 20 минут после лигирования передней нисходящей коронарной артерии. Криоконсервированные популяции клеток hCTC (A3) вводили путем инъекции в краевую зону обесцвеченной области. Подопытные животные получили одну из перечисленных целевых доз в 120 мкл раствора Cryostor D-lite (15 животных на целевую дозу): 1×104 клеток (низкая дозировка), 1×105 клеток (средняя дозировка) или 1×106 клеток (высокая дозировка). Параллельно криоконсервированные популяции клеток rCTC (A2) вводили путем инъекции в краевую зону обесцвеченной области. Подопытные животные получили одну из перечисленных целевых доз в 120 мкл раствора Cryostor D-lite (15 животных на целевую дозу): 1×106 клеток.
Все подопытные животные получили криоконсервированные клетки в общем объеме 120 л криоконсервационной среды. Клетки одной целевой дозы ввели путем инъекции в пять точек вокруг обесцвеченной области сердца. В исследование также была включена контрольная группа, получившая инъекцию криоконсервационной среды (120 мкл).
Для оценки функции левого желудочка (ЛЖ) на 5 и 28 день после начала ОИМ применяли трансторакальную эхокардиографию (SONOS 5500, Philips Medical Systems). На время выполнения эхокардиографии крыс анестезировали кетамином и ксилазином. Конечный диастолический и систолический размер ЛЖ (КДРЛЖ и КСРЛЖ, соответственно) и фракция укорочения (ФУ) измерялись в середине сосочковых мышц. ФУ отражает насосную функцию сердца, измеренную в виде разницы систолического диаметра (конец сокращения) и диастолического диаметра (конец заполнения), выраженной в процентах. Оценка регионарного движения стенки (ОРДС) выполнялась по известным критериям. Оценка 1: нормальное движение и утолщение стенки, оценка 2: редуцированное движение и утолщение стенки, оценка 3: отсутствие движения и утолщения стенки, оценка 4: движение кнаружи или выпячивание (см. примеры Schiller, Shah et al. (Journal of American Society of Echocardiography vol 2: 358-367; 1989)).
При помощи эхокардиограммы были получены семнадцать последовательных томографических снимков. Оценка движения стенки на каждом снимке выполнялась на основе определений, приведенных в таблице 15. Сумма оценок всех 17 снимков была использована для определения сократительной способности стенки. ОРДС представляет собой прямое измерение сократительной способности. Снижение ОРДС указывает на улучшение сократительной способности и отражает улучшение функции сердечной мышцы. В таблице 15 приведены критерии каждой оценки.
Отмеченный процент смертности в рамках исследования составил 16%. Значимых различий уровней смертности между двумя группами, представленными в таблице 16, не выявлено.
Результаты
На фиг.17, взятом из атласа сердечной недостаточности Pffeffer et al. (1999), показаны патологические изменения в сердце после инфаркта. Крысиная модель острого инфаркта миокарда хорошо подходит для имитации ОИМ и хронической сердечной недостаточности у людей. После инфаркта у крысы, как и у человека, желудочек претерпевает ряд патологических изменений, начинающихся с замещения миокарда фиброзной тканью в зоне инфаркта. Сократительная способность и давление в желудочке вызывает расширение зоны инфаркта, постепенное растяжение камеры желудочка и, в итоге, приводит к ремоделированию левого желудочка, выраженному в преобразовании геометрии камеры от эллиптической в шаровидную, а также клеточными изменениями, такими как гипертрофия миоцитов.
Криоконсервированные популяции клеток hCTC (A3) способствовали улучшению общей функции и сократительной способности сердца, что было установлено путем измерения фракции укорочения (ФУ) и оценки регионарного движения стенки (ОРДС), соответственно. Улучшения общей функции сердца и сократительной способности сердца наблюдались при всех целевых дозах клеток hCTC (A3). См. фиг.18 и 19.
Через пять дней после введения животные, получившие дозу клеток rCTC (A2) или целевую дозу 1×106 клеток hCTC (A3), показали ФУ на 3,3% (hCTC (A3)) и 3,8% (rCTC (A2)) меньше, чем у животных, получивших носитель. Через четыре недели после введения клеток абсолютное значение фракции укорочения (вычисленное путем вычитания значения ФУ на пятый день из значения ФУ на 28 день) улучшилось. См. фиг.18, таблицы 17 и 18. Абсолютное значение ФУ у животных, получивших в качестве лечения клетки hCTC (A3) 1×104, составило 9,687±1,329% (n=12, P менее 0,001). Абсолютное значение ФУ у животных, получивших в качестве лечения клетки hCTC (A3) 1×105, составило 10,9±1,6% (n=11, P<0,001). Абсолютное значение ФУ у животных, получивших в качестве лечения клетки hCTC (A3) 1×106, составило 12,9±1,8% (n=10, P менее 0,001). Существует несколько возможных объяснений относительно неэффективности клеток rCTC в экспериментальной модели, использованной в рамках настоящего изобретения. Несмотря на то что бестимусные крысы характеризуются иммунной недостаточностью, не удалось полностью исключить отторжение чужеродных клеток. В рамках настоящего исследования у бестимусных крыс более вероятно иммунное отторжение клеток rCTC, чем человеческих клеток. Их ретенция в миокарде нарушена вследствие иммунного отторжения, таким образом, их влияние на миокард может быть предотвращено.
Снижение ОРДС также наблюдалось у животных, получавших в качестве лечения клетки hCTC (A3), спустя четыре недели после введения клеток. ОРДС у животных, получавших в качестве лечения 1×104 клетки hCTC (A3), составила 24,42±1,4 через 5 дней после инфаркта и введения клеток, но снизилась до 21,08±1,7 (n=12, P менее 0,001) через 4 недели после инфаркта и введения клеток. ОРДС у животных, получавших в качестве лечения 1×105 клетки hCTC (A3), составила 25,58±1,4 через 5 дней после инфаркта и введения клеток, но снизилась до 21,08±1,9 (n=11, P менее 0,001). ОРДС у животных, получавших в качестве лечения 1×106 клеток hCTC (A3), составила 25,91±1,6 через 5 дней после инфаркта и введения клеток, но снизилась до 20±1,7 (n=10, P менее 0,001) через 4 недели после инфаркта и введения клеток. Хотя лечение с использованием клеток rCTC (A2) не повлияло на фракцию укорочения, отмечено незначительное снижение ОРДС. ОРДС у животных, получавших в качестве лечения 1×106 клетки rCTC (A2), составила 25,29±1,9 через 5 дней после инфаркта и введения клеток, и снизилась до 23,86±2,3 (n=12, P=0,09) через четыре недели после введения клеток. См. фиг.19, таблицы 17 и 19. Данные, полученные при наблюдении животных, получавших в качестве лечения клетки rCTC (A2), позволяют предположить, что, несмотря на то, что клетки rCTC (A2) не улучшают общую функцию, они улучшают сократительную способность сердца, о чем свидетельствует ОРДС.
С другой стороны, данные, полученные при наблюдении за животными, получавшими в качестве лечения клетки hCTC (A3), позволяют предположить, что человеческие клетки, производные от кардиальной ткани, улучшают общую функцию сердца и его сократительную способность.
Кардиальное ремоделирование также удалось предотвратить у животных, получавших клетки hCTC (A3). Кардиальное ремоделирование относится к изменениям размера, формы и функции сердца, которые наблюдаются после ишемических поражений, например, инфаркта миокарда. Наблюдаемые изменения включают отмирание клеток миокарда и диспропорциональное утолщение стенки камеры в зоне инфаркта. Тонкая стенка камеры неспособна выдерживать давление и объемную нагрузку на сердце. Результатом этого является дилятация камеры, исходящая из области инфаркта и распространяющаяся на компенсирующую сердечную мышцу, незатронутую инфарктом. Со временем по мере того как сердце подвергается постоянной дилятации, желудочек увеличивается в размере, изменяется его форма (из эллиптической она превращается в шаровидную), о чем свидетельствует увеличение размеров на эхокардиографии. Увеличение массы и объема желудочка в дальнейшем отрицательно сказывается на функции сердца. В итоге увеличенный объем в конце диастолы ослабляет способность сердца к расслаблению между сокращениями, что в дальнейшем ухудшает его функцию. Степень увеличения желудочка определяет прогноз состояния пациентов. Увеличение камеры коррелирует с сокращением ожидаемой продолжительности жизни у пациентов с сердечной недостаточностью.
Степень кардиального ремоделирования в левом желудочке животных после начала острого инфаркта миокарда определили путем измерения размеров левого желудочка в конце диастолы (конечный диастолический размер левого желудочка КДРЛЖ) и систолы (конечный систолический размер левого желудочка, КСРЛЖ) методом эхокардиографии. Увеличение КДРЛЖ и КСРЛЖ указывают на усиление тяжести кардиального ремоделирования. В противоположность этому, снижение наблюдаемых значений КДРЛЖ и КСРЛЖ указывает на реверсию кардиального ремоделирования или на улучшение сердечной функции.
У животных, получавших в качестве лечения носитель, КДРЛЖ увеличился с 0,74±0,020 мм через пять дней после введения клеток до 0,83±0,019 мм через 4 недели после введения клеток. Это соответствует 12% относительного увеличения [100%(Д28-Д5)/Д5] левого желудочка. У животных, получавших в качестве лечения клетки rCTC (A2), КДРЛЖ увеличился с 0,69±0,022 мм через пять дней после введения клеток до 0,80±0,018 мм через 4 недели после введения клеток. У животных, получавших в качестве лечения 1×104 клетки hCTC (A3), КДРЛЖ увеличился с 0,70±0,012 мм через пять после введения клеток до 0,77±0,022 мм через 4 недели после введения клеток.
У животных, получавших в качестве лечения 1×105 клетки hCTC (A3), КДРЛЖ не претерпел значимых изменений. Так, КДРЛЖ составил 0,73±0,012 мм через пять дней после введения клеток и 0,74±0,023 мм после 4 недель после введения клеток. Относительное изменение составило 1,4% (p менее 0,01 по сравнению с группой, получившей носитель). Аналогичным образом, у животных, получавших в качестве лечения 1×106 клетки hCTC (A3), КДРЛЖ также не претерпел значимых изменений. Так, КДРЛЖ составил 0,76±0,011 мм через пять дней после введения клеток и 0,71±0,028 мм через 4 недели после введения клеток. Относительное изменение 6,6% снизилось по сравнению с периодом через пять дней после введения клеток (p менее 0,001 по сравнению с группой, получившей носитель). Эти данные позволяют предположить, что дозы 1×105 hCTC (A3) и 1×106 hCTC (A3) предотвращают кардиальное ремоделирование. См. фиг.23, таблицу 17 и таблицу 20. Относительное изменение КДРЛЖ (100%(28Д-5Д)/5Д) представлено в таблице 21 и на фиг.20-21.
У животных, получавших в качестве лечения 1×104 клетки hCTC (A3), КДРЛЖ составил 0,71±0,045 мм на пятый день и 0,78±0,079 мм на 28 день. У животных, получавших в качестве лечения 1×106 клетки rCTC (A2), КДРЛЖ составил 0,70±0,083 мм на пятый день и 0,80±0,071 мм на 28 день. Существенных различий в КДРЛЖ по сравнению с контрольной группой животных не отмечено, что предполагает отсутствие улучшения в ремоделировании по сравнению с группой, получавшей носитель. См. таблицу 17 и фиг.23.
Животные, получавшие в качестве лечения человеческие клетки, производные от кардиальной ткани, также демонстрировали сокращение конечного систолического размера левого желудочка (КСРЛЖ). КСРЛЖ представляет собой размер желудочка в конце сокращения. Этот параметр не только свидетельствует о ремоделировании, но и отражает сократительную способность сердечной мышцы. Сокращение КСРЛЖ соответствует повышению силы сокращения.
КСРЛЖ уменьшился с 5 до 28 дня в контрольной группе животных, получавших в качестве лечения носитель. КСРЛЖ сохранился на одном уровне у животных, получавших в качестве лечения 1×104 клетки hCTC (A3) (0,56±0,05 см на 5 день и 0,54±0,08 см на 28 день). КСРЛЖ сократился у животных, получавших в качестве лечения 1×105 (0,58±0,04 см на 5 день и 0,51±0,08 см на 28 день) и 1×106 клетки hCTC (A3) 0,62±0,05 см на 5 день и 0,48±0,09 см на 28 день). См. фиг.22 и таблицу 22. Функциональные данные по всем четырем параметрам, измеренным путем эхокардиографии у каждого животного в каждый заданный момент времени, показаны на фиг.23. Трендовые изменения между 5 и 28 днями остаются постоянными в каждой группе.
Анализ целевой дозы введения клеток hCTC (A3) и сердечной функции, установленной путем измерения фракции укорочения (ФУ), определяющей общую функцию, показал корреляцию (p=0,001, n=35) между дозировкой клеток и функциональным улучшением. См. фиг.24.
Аналогичным образом был проведен анализ целевой дозы введения клеток hCTC (A3) и кардиального ремоделирования, определяемого по абсолютному изменению КДРЛЖ с 5 до 28 дня (28Д-5Д), (p=0,0002, n=35). См. фиг.25. Установлена корреляция, которая является экспоненциальной, а не линейной.
ПРИМЕР 12
Ретенция клеток, производных от кардиальной ткани человека, в крысиной модели острого инфаркта миокарда
Для более глубокого понимания механизмов и биологических преимуществ клеток, производных от кардиальной ткани человека, применяемых в терапии поврежденного миокарда, образцы ткани взяты у животных, получавших в предыдущем примере в качестве лечения клетки, производные от кардиальной ткани человека, для определения ретенции клеток, производных от кардиальной ткани человека, у животных спустя четыре недели после введения клеток.
Спустя четыре недели после введения клеток у животных, получавших в предыдущем примере в качестве лечения клетки, производные от кардиальной ткани человека, были удалены сердца. Ретенция клеток определялась гистологией (n=6 на дозу клеток) и количественной ПЦР в реальном времени (n=4 на дозу клеток).
Для определения исходных значений ретенции клетки hCTC (A3) ввели подопытным животным через 20 минут после лигирования левой передней нисходящей коронарной артерии. Криоконсервированные популяции клеток hCTC (A3) ввели каждому животному путем инъекции в краевую зону обесцвеченной области в пяти точках. Животным ввели целевые дозы клеток 1×104, 1×105 или 1×106. Животных умерщвляли в 0, 1, 3 и 7 день, после чего извлекали сердца для анализа ретенции клеток путем количественной ПЦР в реальном времени (n=3 на группу).
В случаях, когда брали образцы для количественной ПЦР в реальном времени, сердечные ткани обрабатывали с целью получения общего количества РНК. Ретенция человеческих клеток оценивалась исходя из количества человеческой РНК, обнаруженной в образцах сердечных тканей.
РНК из клеток, производных от кардиальной ткани человека, выявляли через 4 недели после введения клеток животным, получавшим в качестве лечения клетки hCTC (A3). Как установлено, ретенция клеток зависит от величины дозы, при этом у животных, получавших 1×106 клеток hCTC (A3), выявлена большая ретенция клеток, чем у животных, получавших 1×105 клеток hCTC (A3). У животных, получавших 1×104 клеток hCTC (A3), ретенция клеток принята за фоновый уровень, исходя из количества человеческой РНК, обнаруженного в образцах.
Человеческая РНК обнаружена в сердцах животных, умерщвленных в 0, 1, 3 и 7 дни после введения клеток. Ретенция клеток быстро упала непосредственно после введения клеток и продолжала снижаться в течение 24 часов после введения клеток. Как показано на фиг.26, панели c и d, непосредственно после введения клеток оставалось только приблизительно 8% целевой дозы, что установлено по количеству человеческой РНК, обнаруженной в образцах сердечной ткани. Принимая 0 момент времени за точку отсчета, уровень ретенции клеток продолжал снижаться, и при измерении через 24 часа после введения клеток составил приблизительно 10% от значения в 0 момент времени. Уровень ретенции клеток оставался одинаковым в течение 7 дней после введения клеток.
Отмечена корреляция между ретенцией клеток, производных от кардиальной ткани человека, и предотвращением кардиального ремоделирования. У животных, получавших клетки, производные от кардиальной ткани человека, изменение КДРЛЖ (Д28-Д5) коррелирует с ретенцией клеток, производных от кардиальной ткани человека. Как показано на фиг.27, тренд корреляции наиболее выражен при значении p равном 0,023 и при значении r2 равном 41%. В клиническом фармакологическом исследовании (Lilian Murray et al. in Br J Clin Pharmacol. 1998; 45(6): 559-566) эналаприла, препарата, применяемого при лечении гипертензии, установлена существенная корреляция между эналаприлом и снижением кровяного давления в рамках исследования (p менее 0,01). Однако «прогнозируемый потенциал модели увеличился (r2=23,6%, p менее 0,01), но большая вариабельность ответов остается необъясненной».
В тех случаях, когда образцы брали на иммуногистохимию, сердца помещали в среду OCT и быстро замораживали в жидком азоте (n=6 на группу). Фрагменты вырезали в базальной, средней и верхушечной частях сердца. Залитые замороженные ткани были отправлены в QualTek Technology (Санта-Барбара, Калифорния) для дальнейших гистологических исследований. Ткани разморозили при комнатной температуре, повторно зафиксировали в формалине, залили парафином и разделили на фрагменты 5мкм. Фрагменты окрасили при помощи антител в отношении человеческого антигена ядерного матрикса (hu NuMA) с целью выявления клеток, производных от кардиальной ткани человека, в крысином миокарде.
Результаты иммуногистохимического анализа соответствовали результатам количественной ПЦР (кПЦР). Позитивное окрашивание человеческим NuMA идентифицировали в миокарде животных, получавших целевую дозу 1×106 клеток hCTC (A3). См. фиг.28, панель a, и фиг.29. NuMA-положительные клетки, окрашенные в темно-коричневый цвет, и аналогичные по свойствам окрашивания клеткам в контрольной группе, на фигуре обведены кругом, в котором отсутствует окрашенный фон. Оценочное количество клеток составило приблизительно 100 человеческих клеток/фрагмент. При сильном увеличении удалось идентифицировать миоцитоподобные человеческие клетки, как показано на фиг.29, панель d. В группе животных, получавших носитель, положительного окрашивания человеческим NuMA не выявлено. См. фиг.28, панели a и b, фиг.29 и фиг.30.
ПРИМЕР 13
Клетки, производные от кардиальной ткани человека, способствуют снижению гипертрофии в животных моделях острого инфаркта миокарда
Для более глубокого понимания механизмов и биологических преимуществ клеток, производных от кардиальной ткани человека, применяемых в терапии поврежденного миокарда, образцы ткани взяты у животных, получавших в примере 11 в качестве лечения клетки, производные от кардиальной ткани человека, для определения влияния введения клеток, производных от кардиальной ткани человека на размер зоны инфаркта и общую патологию сердца.
Гистопатология выполнена патологоанатомом компании QualTek (Санта-Барбара, Калифорния). Патологоанатом не был ознакомлен с подробностями исследования. Сердечные ткани были залиты в парафиновые блоки. Фрагменты были выполнены через каждые 5 мкм по всей протяженности органа и оценивались на предмет общей патологии. Оценка гипертрофии выполнена в соответствии с системой балльных оценок. Гипертрофированный миокард (оценка 1), то есть миокардиальные клетки с увеличенной цитоплазмой и непарными ядрами, был обнаружен в большинстве случаев. В других случаях миокард получал оценку 0. Количество фрагментов с гипертрофией и без гипертрофии были подсчитаны и представлены на фиг.31 в виде отношения общего количества фрагментов к количеству фрагментов с гипертрофией.
Миокардиальная гипертрофия наблюдалась в сердцах животных контрольной группы, получавшей носитель, при этом приблизительно 70% миокарда оказалось гипертрофировано (оценка 1). См. фиг.31. Лечение с применением клеток, производных от кардиальной ткани человека, позволило в значительной степени сократить гипертрофию в сердцах по сравнению с контрольной группой животных, получавших носитель. В сердцах животных, получавших клетки hCTC (A3) в целевой дозировке 1×104, 1×105 или 1×106, наблюдалось снижение гипертрофии миокарда до 30-50%. См. фиг.31.
Для определения тяжести инфаркта миокарда произведена окраска трихром по Массону фрагментов на уровне сосочковой мышцы каждого сердца. Размер инфаркта определяли прямым измерением зоны инфаркта и зоны, не пораженной инфарктом. Относительный размер зоны инфаркта приняли за 100% [зона инфаркта/(зона инфаркта + зона, не пораженная инфарктом)]. Все морфометрические исследования выполнялись в соответствии со способами, описанными Iwasaki et al. in Circulation. 2006; 113:1311-1325.
Тенденция к сокращению относительного размера инфаркта наблюдалась у животных, получавших либо 1×105 (16,5±7,3%, p=0,02), либо 1×106 клетки hCTC (A3) (14,8±8,6%, p=0,01), в отличие от контрольной группы, получавшей носитель (24,1±2,9%). См. фиг.32, панель a. Аналогичным образом тенденция к сокращению зоны инфаркта при наличной области инфаркта наблюдалась у животных, получавших либо 1×105 (557±221, p=0,09), либо 1×106 (537±261, p=0,08) клетки hCTC (A3), в отличие от контрольной группы животных, получавших носитель (748±191). См. фиг.32, панель b.
Миокардиальная гипертрофия наблюдалась в сердцах животных, получавших носитель, где приблизительно 70% миокарда было гипертрофировано (оценка 1). См. фиг.31. Лечение с применением клеток, производных от кардиальной ткани человека, позволило существенно сократить гипертрофию в сердцах по сравнению с контрольной группой животных, получавших носитель. В сердцах животных, получавших клетки hCTC (A3) в целевой дозировке 1×104, 1×105 или 1×106, отмечено сокращение гипертрофированного миокарда до 30-50%. См. фиг.31. Сокращение гипертрофии, достигнутое благодаря hCTCs, может объясняться непосредственно трофическим или паракринным эффектом, то есть наличием цитокинов, секретируемых клетками hCTC, как показано в таблице 24, и (или) вторичным влиянием на возросшую de novo генерацию миоцитов, как отмечается ниже в примере 14.
ПРИМЕР 14
Клетки, производные от кардиальной ткани человека, способствуют повышению капиллярной плотности у животных в моделях острого инфаркта миокарда
Для более глубокого понимания механизмов и биологических преимуществ клеток, производных от кардиальной ткани человека, применяемых в терапии поврежденного миокарда, образцы ткани взяты у животных, получавших в примере 11 в качестве лечения клетки, производные от кардиальной ткани человека, для определения влияния введения клеток, производных от кардиальной ткани человека, на капиллярную плотность в краевой зоне области инфаркта.
Пять фрагментов ткани левого желудочка каждого сердца, взятых в краевой зоне области инфаркта, были отобраны случайным образом. Путем гистологического исследования была произведена морфометрическая оценка капиллярной плотности, при этом осуществлялась визуализация капилляров при помощи антител к изолектину B4 (Vector Laboratories, Берлингейм, Калифорния), или CD31. Изолектин B4 обладает специфичностью к остаткам сахаров на поверхности эндотелиальных клеток и, как установлено, способен распознавать эндотелиальные клетки в различных наборах, как описано Vasudevan et al. in Nature Neuroscience 11: 429-439 (2008) и Schmidt et al. in Development 134, 2913-2923 (2007). CD31, также известный как молекула адгезии тромбоцит-эндотелиальных клеток (PECAM), широко использовали для идентификации эндотелиальных клеток и, таким образом, сосудистой сети в различных тканях, включая сердце (Tabibiazar and Rockson Eur Heart J 2001vol 22; 903-918).
Визуализация капилляров либо при помощи изолектина B4, либо при помощи CD31 показала, что введение клеток, производных от кардиальной ткани человека, способствовало повышению капиллярной плотности в краевой зоне области инфаркта. Введение клеток hCTC (A3) в любой дозировке приводило к увеличению капиллярной плотности по сравнению с контрольными группами, получавшими носитель, спустя четыре недели после введения клеток. См. фиг.33, панели a и b (p=0,0068 окрашивание на изолектин-B4 и p=0,0005 окрашивание на CD31).
Увеличение капиллярной плотности отчасти может являться следствием секреции факторов из клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения. Эти трофические факторы могут оказывать, например, паракринное воздействие на клетки сердца. Трофические факторы могут воздействовать напрямую или опосредованно на формацию кровеносных сосудов, функцию кровеносных сосудов и гемодинамику, ремоделирование сердечной мышцы и ее функцию, пролиферацию миоцитов (миогенез), гипертрофию миоцитов, фиброз или повышение выживаемости кардиальных клеток. Трофические факторы также могут участвовать в регулировании иммунного ответа реципиента. Для установления секреции трофических факторов клетками, производными от кардиальной ткани человека, из популяций клеток hCTC (A3) отобрали культуру, которую культивировали in vitro в течение семи дней. Образцы среды хранили при температуре -80°C перед проведением анализа на наличие секретированных цитокинов.
Цитокины, секретированные клетками hCTC (A3), включают эндотелиальный фактор роста сосудов (VEGF) и ангиопоэтин 2 (ANG2). См. таблицу 24. Эти цитокины играют значимую роль в ангиогенезе. Более того, комбинация VEGF и ANG2 синергично инициирует и усиливает процесс прорастания капилляров, как отмечено Maisonpierre et al. in Science 277:55-60 (1997) и проверено Ramsauer et al. in Journal of Clinical Investigation 110: 1615-1617 (2002).
ПРИМЕР 15
Клетки, производные от кардиальной ткани человека, повышают плотность миоцитов в области, не затронутой инфарктом, у животных, получавших клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения
Для более глубокого понимания механизмов и биологических преимуществ клеток, производных от кардиальной ткани человека, применяемых в терапии поврежденного миокарда, образцы ткани взяты у животных, получавших в примере 11 в качестве лечения клетки, производные от кардиальной ткани человека, для определения влияния введения клеток, производных от кардиальной ткани человека, на пролиферацию крысиных миоцитов в краевой зоне инфаркта и плотность миоцитов в областях сердца, не затронутых инфарктом.
Зафиксированные в формалине залитые парафином образцы ткани разрезали на фрагменты толщиной 4 мкм. От каждого животного отобрали один микроскопический препарат приблизительно на 17-м срезе. Срезы инкубировали с добавлением антитела к Ki-67 (MIB-5) в течение 60 минут при комнатной температуре, промыли в ФСБР и инкубировали с аффинным вторичным антителом к мышиному IgG, меченым микрополимером. Микроскопические препараты промыли ФСБР, а затем проявили при помощи субстрата Vector SG, выделяющего продукт реакции темно-синего (серого) цвета. Микроскопические препараты промыли в ФСБР и провели контрастное окрашивание с использованием ДАПИ (KPL, Гейтерсберг, Мэриленд). В каждый протокол окрашивания включены положительный и отрицательный контроль.
Параллельно срезы, зафиксированные в формалине, инкубировали с антителом к кардиальному миозину в течение 45 минут при комнатной температуре, промыли в ФСБР и инкубировали с биотинилированным вторичным антителом к мышиному IgG. После окончания вторичной инкубации ввели реагент Vectastain ABC-AP (Vectastain Universal ABC-AP Kit, Vector Laboratories, Inc., Берлингейм, Калифорния) на 30 минут. Микроскопические препараты промыли в ФСБР, а затем проявили при помощи жидкого субстрата-хромогена (Liquid Permanent Red Chromogen) (Dako, Карпинтерия, Калифорния), выделяющего продукт реакции от темно-красного до красного цвета. Микроскопические препараты промыли в ФСБР и провели контрастное окрашивание с использованием ДАПИ (KPL, Гейтерсберг, Мэриленд). В каждый протокол окрашивания включены положительный и отрицательный контроль.
Измерение пролиферирующих миоцитов провели путем двойного окрашивания Ki-67 и тяжелой цепи миозина (ТЦМ). После чего подсчитали общее количество миоцитов, выявленных путем окрашивания ТЦМ. Общее количество миоцитов в одном поле зрения микроскопа под большим увеличением было одинаковым как в группах, получавших носитель, так и в группах, получавших клетки во всех дозировках. Содержание пролиферирующих миоцитов на фоне общего количества миоцитов было выше у животных, получавших клетки hCTC (A3) в дозировке 1×104 (3,8±0,02%) или 1×105 (3,7±0,02%), по сравнению с группой животных, получавших носитель в дозировке (2,3±0,01%), или группой животных, получавших клетки в дозировке 1×106 (1,2±0,01%). См. таблицу 25 и фиг.34.
Одним из возможных объяснений низкого содержания пролиферирующих миоцитов на фоне общего количества миоцитов у животных, получавших клетки в дозировке 1×106, может быть вхождение миоцитов в фазу G0 в ответ на лечение клетками hCTC (A3). Ki-67 является маркером пролиферации клеток, который присутствует во всех фазах клеточного цикла. Однако когда циклически изменяющиеся клетки входят в фазу G0, Ki-67 исчезает. См., например, (Thomas Scholzen 2000; Journal of Cellular Physiology; 182 (3), 311-322).
Окрашивание Г&Э: микроскопические препараты депарафинизировали ксилолом, 2 цикла по 10 минут на препарат, затем повторно гидратировали абсолютным спиртом 2 цикла по 5 минут на каждый препарат, после этого 95% спиртом в течение 2 минут и 70% спиртом в течение 2 минут. Микроскопические препараты быстро промыли в дистиллированной воде, затем окрасили, поместив в раствор гематоксилина на 8 минут, промыли проточной водой в течение 5 минут, дифференцировали в 1% спиртокислоте в течение 30 секунд, промыли проточной водопроводной водой в течение 1 минуты, окрасили, погрузив в 0,2% водный раствор аммиака на период от 30 секунд до 1 минуты. После этого микроскопические препараты промыли проточной водопроводной водой в течение 5 минут, прополоскали в 95% спирте (10 погружений), затем провели контрастное окрашивание погружением в раствор эозин-флоксина B на период от 30 секунд до 1 минуты, дегидратировали 95% спиртом, 2 цикла абсолютного спирта по 5 минут каждый, промыли ксилолом, 2 цикла по 5 минут каждый, и залили закрепляющей средой на основе ксилола.
Для окрашивания Г&Э от каждого животного отобраны образцы одного уровня. На каждом уровне в стенке левого желудочка на удалении от зоны инфаркта были выбраны пять 400X полей (67500 мкм2 на поле), содержащих поперечно срезанные миофибриллы с преимущественно поперечно срезанными капиллярами. Плотность миоцитов зафиксирована на каждом уровне в виде среднего значения пяти полей и выражена в мм2. Среднее значение, стандартное отклонение и стандартная погрешность среднего значения подсчитаны для каждой экспериментальной группы.
При 400-кратном увеличении в ткани, окрашенной гематоксилином и эозином (Г&Э) наблюдались отдельные миоциты. На фиг.35 представлены типичные изображения, полученные на основе образцов сердец животных, получавших клетки hCTC (A3) в дозировке 1×105, а также на основе образцов, полученных от животных, для лечения которых применяли носитель. В таблице 26 среднее значение группы, получавшей носитель (1813±84/мм2), было ниже среднего значения любой из групп, получавших клетки (1×104 hCTC (A3)): 2210±227, 1×105 клетки hCTC (A3): 2220±186, 1×106 клетки hCTC (A3): 2113±186). Повышенная плотность миоцитов может быть следствием повышения пролиферации миоцитов (миогенез) и (или) сокращение гипертрофии миоцитов, как показано в примере 13.
ПРИМЕР 16
Лечение клетками, производными от кардиальной ткани человека, вызывает дифференциальную экспрессию генов в миокарде крысы
Для понимания молекулярных изменений, вызванных введением клеток, производных от кардиальной ткани человека, был проведен анализ профилей генов, позволивший сравнить уровни экспрессии генов в группах, получавших носитель клетки, производные от кардиальной ткани человека. Сердца крыс взяты у животных, получавших клетки hCTC (A3) 1×104, 1×105, 1×106 или носитель, через четыре недели после введения клеток, у животных, использованных в исследовании, описанном в примере 11. Из образцов собрано общее количество РНК.
Для проведения анализа экспрессии генов в образцах использовали ДНК-чип HG-U133_Plus_2 компании Affymetrix. Используя ПО Spotfire DecisionSite, набор данных нормализовали по всем микрочипам при помощи функции «Нормализовать по среднему значению». Отдельные чипы объединили в группы для сравнения (целевая доза клеток hCTC (A3) 1×104, 1×105, 1×106 и носитель). Используя Spotfire DecisionSite, между группами установили значения вероятности (р-значения) и кратность изменений. Гены отфильтровали, получив, таким образом, следующие группы: гены, не имеющие значения P по меньшей мере в 3 колонках; гены, имеющие полученное на основе сравнения групп значение p меньше или равное 0,05 по меньшей мере в 2 колонках; остальные гены, не имеющие кратных изменений больше или равно 2,0 или меньше или равно 0,5 по меньшей мере в 2 колонках. Фильтруемый набор включал 45 генов, представляющих интерес. 45 генов ввели в программу анализа главных компонентов (PCA) компании Spotfire DecisionSite для визуального отображения разделения групп при помощи этого подмножества генов. См. таблицу 27, где идентифицированы и перечислены дифференциально экспрессируемые гены.
Среди идентифицированных генов рецептор трансформирующего фактора роста бета (TGFβR) был подавлен у животных, получавших клетки hCTC (A3) в любой дозировке. См. фиг.35. Ранее выработку TGFβR связывали с повышенной гипертрофией (см., например, Watkins, Jonker et al. Cardiovasc Res. 2006 Feb 1; 69 (2):432-9) и ремоделированием миокарда после инфаркта (Ellmers, Scott et al. Endocrinology. 2008 Nov; 149(11):5828-34.). Для сокращения ремоделирования и фиброза вследствие гипертрофии предлагалось применить блокаду TGFβ и TGFβR (см., например, Ellmers, Scott et al. Endocrinology. 2008 Nov; 149(11): 5828-34). Помимо этого, по имеющимся данным, активация выработки TGFβ и TGFβR после инфаркта способствует усилению гипертрофии миоцитов и желудочка, а также ремоделирования (см., например, Matsumoto-Ida, Takimoto et al. Am J Physiol Heart Circ Physiol. 2006 Feb; 290(2): H709-15).
Еще одним геном, идентифицированным путем анализа дифференциальной экспрессии генов, была нейрональная синтаза оксида азота (NOS1). После инфаркта экспрессия NOS1 в сердце повысилась. По имеющимся данным, избыточная экспрессия NOS1 снижает сократительную способность миокарда (см., например, (Burkard, Rokita et al. Circ Res. 2007 Feb 16; 100(3): e32-44). При сердечной недостаточности у человека, согласно имеющимся данным, экспрессия NOS1 на уровне мРНК и белков в значительной степени повышается, что свидетельствует о роли NOS1 в патогенезе сердечной дисфункции (см., например, Damy, Ratajczak et al. Lancet. 2004 Apr 24; 363 (9418):1365-7). В миокарде, для восстановления которого применялись клетки hCTC (A3) в любой дозировке, экспрессия NOS1 была ниже по сравнению с миокардом контрольной группы, получавшей носитель, более чем в 10 раз.
ПРИМЕР 17
Лечение клетками, производными от кардиальной ткани человека, способствует уменьшению размера зоны инфаркта и препятствует гипертрофии в крысиной модели острого инфаркта миокарда
Эффективность клеток, производных от кардиальной ткани человека, в лечении поврежденного миокарда сравнивали с мезенхимальными стволовыми клетками костного мозга на примере модели острого инфаркта миокарда у грызунов. В этом исследовании использовали 96 женских особей бестимусных крыс (Charles River Laboratories) в возрасте 8-10 недель. Выполнение хирургических манипуляций описано в примере 11. Клетки hCTC (A3) 1×105 (партия 1) ввели в криопробирку 100 мкл CryoStor D-lite. Параллельно человеческие мезенхимальные стволовые клетки 1×106 (номер по каталогу PT-2501, Lonza) ввели в криопробирку емкостью 100 мкл Cryostor D-lite. Процедура, аналогичная той, что описана в примере 11, несколько изменена исходя из предпочтений хирурга: клеточные инъекции, 50 мкл каждая, произвели в две точки краевой зоны инфаркта при помощи инсулинового шприца емкостью 0,3 мл, снабженного иглой калибра 29, приблизительно через 10 минут после лигирования левой нисходящей артерии, когда обесцвеченная зона инфаркта стала отчетливо различима. Животных умертвили на 28 день после введения клеток, и извлекли сердца для последующего анализа.
Предсердия вырезали, желудочки промыли физиологическим раствором. Сердца поместили в 10% нейтральный буферный формалин (НБФ) на 24 часа перед разделением на четыре среза толщиной 2 мм. Каждый срез подготовили для изучения под микроскопом, залили парафином, выполнили срез толщиной 5 мкм и окрасили гематоксилином и эозином (Г&Э) и (или) способом окраски трихром по Массону. Рядом показаны два среза, взятые у одного животного: один срез взят в области средней линии между сосочковой мышцей и базальным уровнем, а второй срез взят из сосочковой мышцы.
Срезы ткани, взятые во всех группах во все заданные моменты времени, не идентифицировали и разместили в порядки уменьшения степени тяжести заболевания (декомпенсация/дилятация и гипертрофия). Каждому элементу присвоено число, где самое большое число соответствует самой высокой степени тяжести заболевания. После этого образцы идентифицировали и собрали оценочные значения для каждой группы.
Все изображения относятся к разным частям свободной стенки левого желудочка, которая также содержит зону инфаркта. Изображения с небольшим увеличением (2X) относятся к 2 срезам ткани, взятым у каждого животного, и окрашенным трихромом. Произведен анализ этих срезов для определения размера инфаркта. Для проведения автоматического морфометрического анализа размера инфаркта на собранных изображениях использовали ПО Image-Pro Plus v 5.1 (Media Cybernetics, Inc., Бетесда, Мэриленд). Периметр свободной стенки левого желудочка трассировали и обозначили как область, представляющую интерес (ОПИ). На каждом изображении измеряли две величины: процент площади, окрашенной в голубой цвет и представляющий инфаркт, и процент площади, окрашенной в красный цвет и представляющий функционально способный миокард.
Срезы ткани сердца, окрашенные Г&Э и способом трихром по Массону, исследовали спустя 28 дней после инфаркта. У животных, получавших 1×105 клетки hCTC (A3), а также у животных, получавших 1×106 человеческие мезенхимальные стволовые клетки, отмечено сокращение зоны инфаркта по сравнению с группой животных, получавших носитель. Помимо этого, отмечено уменьшение дилятации левого и правого желудочков. См. фиг.36, панели a и b. Кроме того, наблюдалось сохранение функциональной способности миокарда в свободной стенке левого желудочка у животных, получавших 1×105 клетки hCTC (A3), а также у животных, получавших 1×106 человеческие мезенхимальные стволовые клетки. См. фиг.36, панель c.
Интересно, что клетки hCTC (A3) и человеческие мезенхимальные стволовые клетки показали различное влияние на межжелудочковую перегородку (МЖП), так, клетки hMSC показали гипертрофию МЖП, а у животных, получавших клетки hCTC (A3), таких изменений отмечено не было. См. фиг.37. Признаки гипертрофических изменений кардиомиоцитов присутствовали в перегородках обеих групп, однако более выраженными они были у животных, получавших клетки hMSC. Гипертрофированные миоциты и МЖП, в конечном итоге, способствуют ремоделированию в сердце. Таким образом, можно предположить, что клетки, производные от кардиальной ткани человека, составляющие предмет настоящего изобретения, оказывают более благоприятное воздействие на сердечную функцию, чем человеческие мезенхимальные стволовые клетки.
ПРИМЕР 18
Различные партии и долговременная эффективность клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения, в животной модели острого инфаркта миокарда
Несколько партий клеток, производных от кардиальной ткани человека, были получены от трех доноров. Информация о донорах приведена в таблице 28. Партия 1 получена из сердца, пригодного для трансплантации. Партия 2 получена из здорового сердца, однако донор не отвечает возрастному критерию для трансплантации. Партия 3 получена от донора, у которого диагностировали дилатационную кардиомиопатию и сердечную недостаточность.
Женские особи бестимусных крыс (весом 250-300 г) анестезировали кетамином и ксилазином (60 и 10 мг/кг интраперитонеально, соответственно). Грудную клетку открыли в области четвертого межреберного промежутка слева, произвели экстериоризацию сердца и надрез перикарда. После этого сердце удерживали при помощи щипцов, петлю нити Proline 6-0 разместили под левой передней нисходящей коронарной артерией, приблизительно на 2 мм ниже ее начала. ОИМ индуцировали в сердце путем натяжения лигатуры и окклюзии артерии. Визуально отмечено обесцвечивание пораженного инфарктом миокарда.
Через двадцать минут после индуцирования инфаркта миокарда крысам была сделана внутримиокардиальная трансплантация 1×106 клеток hCTC (A3) из партии 1, 2 или 3 hCTC (A3). Параллельно животные получили 1×106 клетки pCTC (A3), человеческие клетки неонатальных дермальных фибробластов (номер по каталогу CC-2509, Lonza) или носитель. Все популяции клеток были подвергнуты криоконсервации перед введением и введены в сердце в конечном объеме 120 мкл (криопробирка CryoStor Dlite). Клетки ввели путем инъекции в двух точках, по 50 мкл клеточной суспензии или одну криопробирку CryoStor Dlite в каждую. После того как инъекции были выполнены, грудную клетку закрыли. Каждая группа состояла из 10 животных. Наблюдаемый в рамках исследования уровень смертности составил 32%. Между группами не выявлено значимых различий по уровню смертности, как показано в таблице 29. Абсолютные значения сердечной функции приведены в таблице 30.
Для оценки функции левого желудочка (ЛЖ) через 1, 4 и 12 недель после введения клеток применяли трансторакальную эхокардиографию (SONOS 5500, Philips Medical Systems). Измеряли следующие параметры: конечный диастолический размер левого желудочка (КДРЛЖ), конечный систолический размер ЛЖ (КСРЛЖ), фракцию укорочения (ФУ), оценку регионарного движения стенки (ОРДС).
Введение клеток hCTC (A3) из партии 1 способствовало улучшению сердечной функции по всем исследуемым параметрам через 28 дней и через 84 дня после введения клеток. См. фиг.38 и 39. Введение клеток hCTC (A3) из партии 2 способствовало улучшению сократительной способности сердца и общей функции сердца через 84 дня после инфаркта, о чем свидетельствует ОРДС и ФУ.
ФУ через 7 дней после введения клеток была одинаковой у группы, получавшей носитель, и групп, получавших клетки. Однако через 84 дня после введения клеток функция сердца на основе измерения ФУ улучшилась и составила 9,5±6,0% (n=8, p<0,01), 8,9±4,1% (n=8, p<0,001) в группах, получавших клетки hCTC (A3) из партии 2, и клетки hCTC (A3) из партии 1, соответственно. См. фиг.39 и таблицу 30. Минимальные изменения ФУ отмечены в группах, получавших носитель, (-1,0±3,3%), клетки hCTC из партии 3 (-0,4±3,0%) и человеческие фибробласты (4,1±2,1%). См. фиг.39 и таблицу 30. Наряду с общей функцией ОРДС также снизилась у животных, получавших клетки hCTC (A3) из партии 1 с 24,83±1,64 на 7 день до 22,13±1,5 (N=8, p менее 0,05), или клетки из партии 2 с 25,44±1,0 до 23,13±2,2 (N=8, p менее 0,05), по сравнению с группой животных, получавших носитель. См. таблицу 30.
В настоящем исследовании клетки hCTC (A3) из партии 1 или 2 препятствовали ремоделированию на 28 и 84 день после инфаркта, о чем свидетельствует КСРЛЖ. Через 28 дней после введения клеток КСРЛЖ уменьшился у животных, получавших клетки hCTC (A3) из партии 1 (-8,9±4,1%). КСРЛЖ у животных, получавших клетки hCTC (A3) из партии 2, сохранился на исходном уровне (-0,5±4,3%). В противоположность этому у животных, получавших носитель, через 28 дней после введения клеток КСРЛЖ увеличился до 16,4±5,2%. У животных, получавших клетки hCTC (A3) из партии 3, или человеческие фибробласты, КСРЛЖ увеличился до 9,1±2,3% и 5,4±3,6%, соответственно. См. фиг.38 и таблицу 30.
Через 84 дня после введения клеток в группе, получавшей носитель КСРЛЖ увеличился до 16,3±2,8%. Аналогичным образом, у животных, получавших клетки hCTC (A3) из партии 3 или человеческие фибробласты, также произошло увеличение левого желудочка через 84 дня. КСРЛЖ увеличился на 12,5±3,7% и 7,6±3,7%, соответственно. В отличие от этого, кардиального ремоделирования не произошло у животных, получавших клетки hCTC (A3) из партии 1 (-3,9±5,2%), а также у животных, получавших клетки hCTC (A3) из партии 2 (-1,8±4,2%). См. фиг.39 и таблицу 30.
Увеличение дилятации левого желудочка, о чем свидетельствует измерение КДРЛЖ, в конце диастолы удалось предотвратить у животных, получавших клетки hCTC (A3) из партии 1 (7 дней: 0,80±0,10 см, 84 дня: 0,84±0,07 см, 5% увеличение) и у животных, получавших клетки hCTC (A3) из партии 2 (7 дней: 0,74±0,07 см, 84 дней: 0,82±0,06 см, 6,7% увеличение). В противоположность этому КДРЛЖ увеличился у животных, получавших носитель (7 дней: 0,75±0,03 см, 84 дня: 0,86±0,06 см, 14,6% увеличение), и у животных, получавших человеческие фибробласты (7 дней: 0,73±0,034 см, 84 дня: 0,83±0,06 см, 13,7% увеличение). Животные, получавшие клетки hCTC (A3) из партии 3, также продемонстрировали увеличение КДРЛЖ (7 дней: 0,73±0,04 см, 84 дня: 0,82±0,06 см, 12,3% увеличение). См. фиг.39 и таблицу 30.
ПРИМЕР 19
Размер клеток, производных от кардиальной ткани
Способы и материалы. Размер клеток, производных от кардиальной ткани, полученных из сердца человека, мыши, свиньи и крысы, в соответствии со способами, составляющими предмет настоящего изобретения, анализировали в процессе подсчета клеток. Подсчет общего количества жизнеспособных клеток проводили после обработки фрементами перед повторным посевом популяции клеток при помощи анализатора Vi-Cell™ XR (Beckman Coulter, Фуллертон, Калифорния). Анализатор жизнеспособности клеток Vi-Cell™ работает автоматически, применяя способ исключения красителя трипанового синего для оценки жизнеспособности клетки с использованием технологий оцифровки изображений и анализа до 100 изображений клеток в потоке.
Образцы подготовили и анализировали в соответствии с инструкциями производителя (справочное руководство PN 383674 Rev.A). 500 мкл аликвотной пробы клеточной суспензии, полученной после лизиса эритроцитов, поместили в пробирки Vi-Cell™ емкостью 4 мл и выполнили анализ при помощи анализатора жизнеспособности Vi-Cell™ XR. Размер клеток определяли по среднему диаметру подсчитанных клеток.
Средний диаметр клеток hCTC (A3) составил 16,7±2,13 мкм. Диаметр клеток rCTC (A2) составил 18,4±1,02 мкм, а диаметр клеток pCTC(A3) составил 17,2±0,42 мкм. На основе этих данных можно предположить, что фильтр размером больше или равный 20 мкм, пропуская клетки, производные от кардиальной ткани, составляющие предмет настоящего изобретения, позволит исключить клетки других типов.
ПРИМЕР 20
Криоконсервация клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения
Предпочтительно создать продукт, который можно было бы незамедлительно вводить пациенту, то есть продукт, не требующий дополнительной обработки в клинике. Для разработки такого продукта исследовали возможность криоконсервации клеток, производных от кардиальной ткани человека, при помощи клинически испытанного криоконсервационного раствора. Помимо этого, также исследовали токсичность криконсервационного раствора в миокарде.
Для криоконсервации клетки hCTC (A3) собрали из колб путем трипсинизации. Банки клеток подвергали криоконсервации в растворе CryoStor DliteTM (BioLife Solutions, Inc., Ботхелл, Вашингтон), содержавшей 2% в объемном отношении ДМСО. CryoStor Dlite - раствор для криоконсервации, не содержит продуктов животного происхождения и предназначен для подготовки и консервации клеток в среде ультранизких температур (от -80 до -196°C) в соответствии с принципами, описанными в издании Advances in Biopreservation edited by J.G. Baust and J.M. Baust. Помимо этого, допускается использование других растворов, обеспечивающих, например, необходимые электролитические, осмотические и буферные условия.
Криоконсервация клеточной суспензии выполнена в криопробирках Nalgene емкостью 2 мл (полипропилен, стерильно, с внутренней резьбой и навинчивающейся крышкой (Nalgne Nunc, Рочестер, Нью-Йорк), при помощи программируемого морозильника Integra 750 Plus (Planer, Мидлсекс, Великобритания.) и ПО DeltaT. Клетки и растворы выдерживали при комнатной температуре перед загрузкой в программируемый морозильник, выдерживаемый при температуре 15°C. В пробирку с замораживающим буферным раствором поместили температурный датчик. Для криоконсервации использовалась следующая программа:
Когда температура достигла -140°C, образцы переместили в криогенную емкость на хранение.
Публикации, цитируемые в данном документе, полностью включаются в настоящий документ в форме ссылок. Хотя различные аспекты изобретения иллюстрируются ссылками на примеры и предпочтительные варианты осуществления, подразумевается, что область изобретения ограничивается не представленным выше описанием, а следующими пунктами формулы изобретения, составленными в соответствии с принципами патентного законодательства.
Сравнение клеток hCTC с другими клетками, производными от кардиальной ткани
(сердце целиком)
Крыса: сердце целиком, возраст 6-12 недель
(1-2 мм3)
Мышь: сердце целиком
(стандарт GMP)
Диспаза (стандарт GMP)
Диспаза (стандарт GMP)
Коллагеназа IV
5 ЕД/мл
5 ЕД/мл
0,1%
(800 ЕД/мл)
-: MyHC;
Islet-1
Islet-1
-: MyHC
Nkx2.5
-: MyHC
-: MyHC
-: MyHC
Islet-1
-: MyHC
-: теломераза, Mdr
-: Mdr
-: CD34
-: CD34
-: c-kit, CD34
-:
CD34, c-kit
-: CD16, CD31, CD45
-: CD31, CD45
-: Cd45, CD34, CD31, CD90
-: CD45, CD31
-: c-kit, CD31
-: c-kit, CD45, CD31
Выход и жизнеспособность клеток после обработки фрементами сердечной ткани
Жизнеспособность клеток после криоконсервации
и пассирования иглой
Кариотип клеток hCTC (A3)
Восстановление и жизнеспособность крысиных клеток, производных от кардиальной ткани (CTC), после криоконсервации
и пассирования иглой
Антитела, нанесенные на 96-луночный планшет при выполнении проточной цитометрии
Средняя интенсивность флуоресценции (СИФ) и дельта СИФ
Маркеры клеточной поверхности в трех популяциях клеток hCTC
Набор праймеров, использованных при количественной ПЦР
Сравнение различных клеток, полученных в результате процедуры
дифференцирование
Экспрессия генов в экспандированных клетках hCTC
дифференцирование
Экспрессия генов в клетках rCTC
Экспрессия генов в мышиных клетках GFP-CTC
Экспрессия генов в клетках pCTC
Определение оценки регионарного движения стенки
Сводные данные относительно наблюдаемого уровня смертности
Сводные данные относительно сердечной функции
Статистический анализ абсолютного изменения фракции укорочения
(A и B)
(Нижний предел
Верхний предел)
Статистический анализ абсолютного изменения оценки регионарного движения стенки
(A и B)
(Нижний предел
Верхний предел)
Статистический анализ абсолютного изменения КДРЛЖ
(A и B)
(Нижний предел
Верхний предел)
Статистический анализ относительного изменения КДРЛЖ
Статистический анализ абсолютного изменения КСРЛЖ
(A в сравнении с B)
Оценка
(Нижний предел
Верхний предел)
Изолирование крысиных клеток, производных от кардиальной ткани, из различных областей сердца
Секреция цитокинов клетками hCTC
Отношение пролиферирующих миоцитов к общему количеству миоцитов в краевой зоне
Плотность миоцитов (мм2)
Дифференциально экспрессируемые гены в исследуемых группах, не обнаруженные в контрольной группе
Информация о донорах клеток hCTC
(партия 1)
(партия 2)
(партия 3)
Болезнь коронарных артерий
Уровень смертности в исследовании долгосрочной эффективности с использованием различных партий клеток
Сердечная функция, измеренная путем эхокардиографии (абсолютное значение)
(FS, %)
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛЕТКИ, ПРОИЗВОДНЫЕ ОТ КАРДИАЛЬНОЙ ТКАНИ | 2010 |
|
RU2642282C1 |
| КЛЕТКИ, ПРОИЗВОДНЫЕ ОТ КАРДИАЛЬНОЙ ТКАНИ | 2010 |
|
RU2583287C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2009 |
|
RU2542512C2 |
| КОМПОЗИЦИИ, УЛУЧШАЮЩИЕ ПЕРФУЗИЮ В ОБЛАСТИ ИНФАРКТА, И СПОСОБЫ ВОССТАНОВЛЕНИЯ СОСУДИСТОГО ПОВРЕЖДЕНИЯ | 2013 |
|
RU2550959C2 |
| СПОСОБ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ ТКАНЕИНЖЕНЕРНЫХ КОНСТРУКЦИЙ НА ОСНОВЕ ПРОГЕНИТОРНЫХ КЛЕТОК ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СЕРДЦА | 2015 |
|
RU2636464C2 |
| БИОТРАНСПЛАНТАТ И СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ (ВАРИАНТЫ) | 2005 |
|
RU2299073C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2004 |
|
RU2268061C1 |
| СПОСОБ ПОЛУЧЕНИЯ И ИНДУКЦИИ НАПРАВЛЕННОЙ ДИФФЕРЕНЦИРОВКИ КУЛЬТУРЫ МУЛЬТИПОТЕНТНЫХ КЛЕТОК СЕРДЦА ДЛЯ КЛЕТОЧНОЙ ТЕРАПИИ И/ИЛИ ТКАНЕВОЙ ИНЖЕНЕРИИ В ЗОНЕ ИШЕМИИ МИОКАРДА | 2008 |
|
RU2366706C1 |
| ПРИМЕНЕНИЕ КОМПОЗИЦИИ, СОСТОЯЩЕЙ ИЗ КОНЦЕНТРИРОВАННОЙ КЛЕТОЧНОЙ ПОПУЛЯЦИИ, ПРЕДСТАВЛЯЮЩЕЙ СОБОЙ СТВОЛОВЫЕ КЛЕТКИ И НЕДИФФЕРЕНЦИРОВАННЫЕ КЛЕТКИ-ПРЕДШЕСТВЕННИКИ | 2004 |
|
RU2372924C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КАРДИО-ГЕНЕРАТИВНОГО ПОТЕНЦИАЛА КЛЕТОК МЛЕКОПИТАЮЩИХ | 2010 |
|
RU2624498C2 |
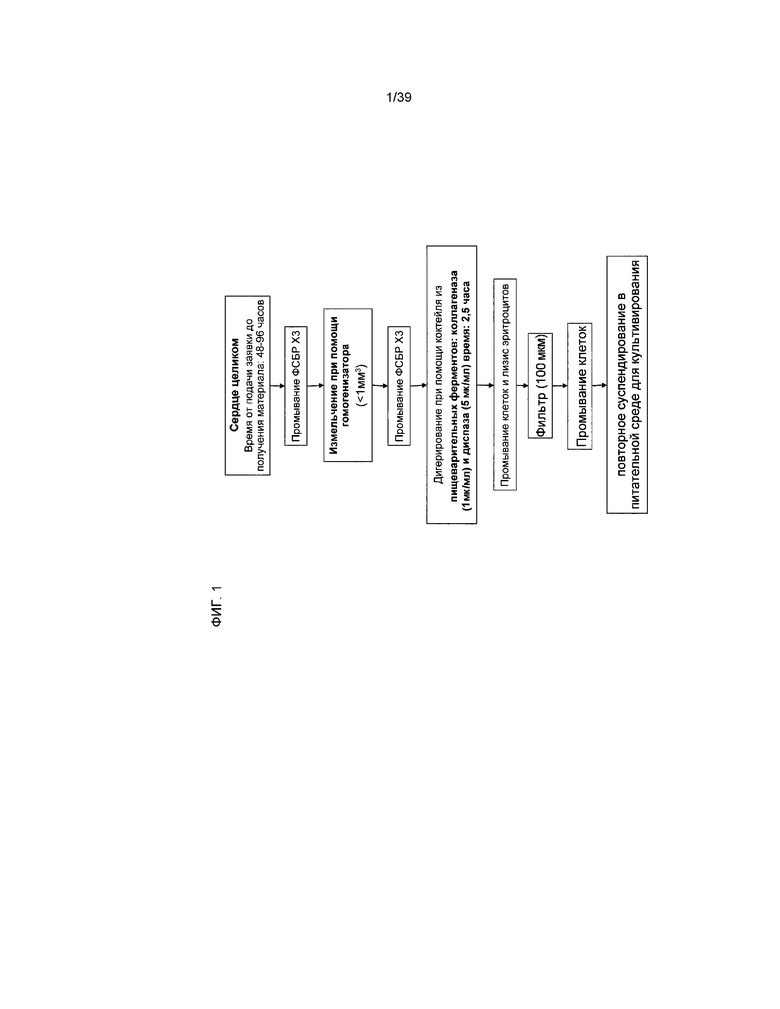
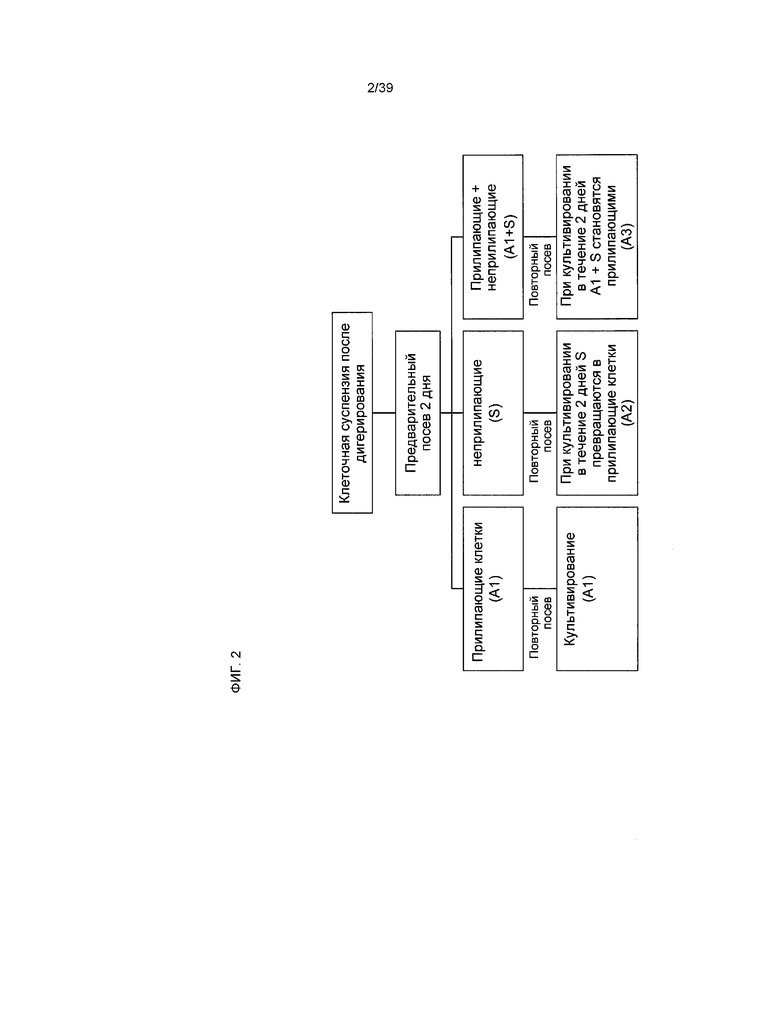
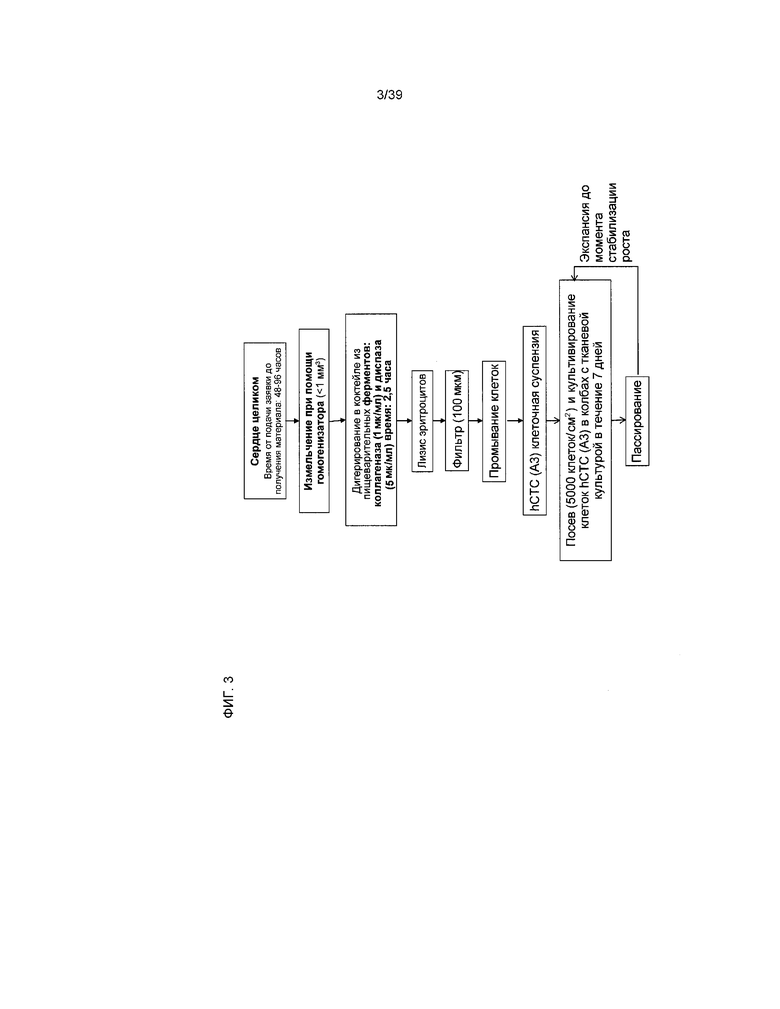
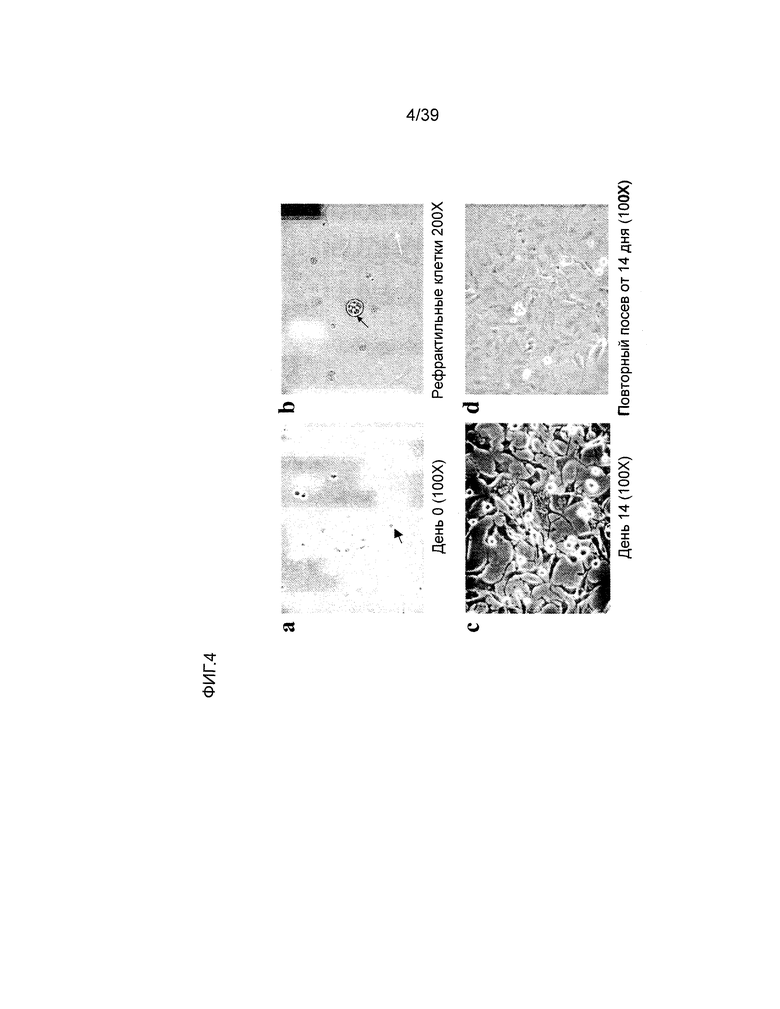
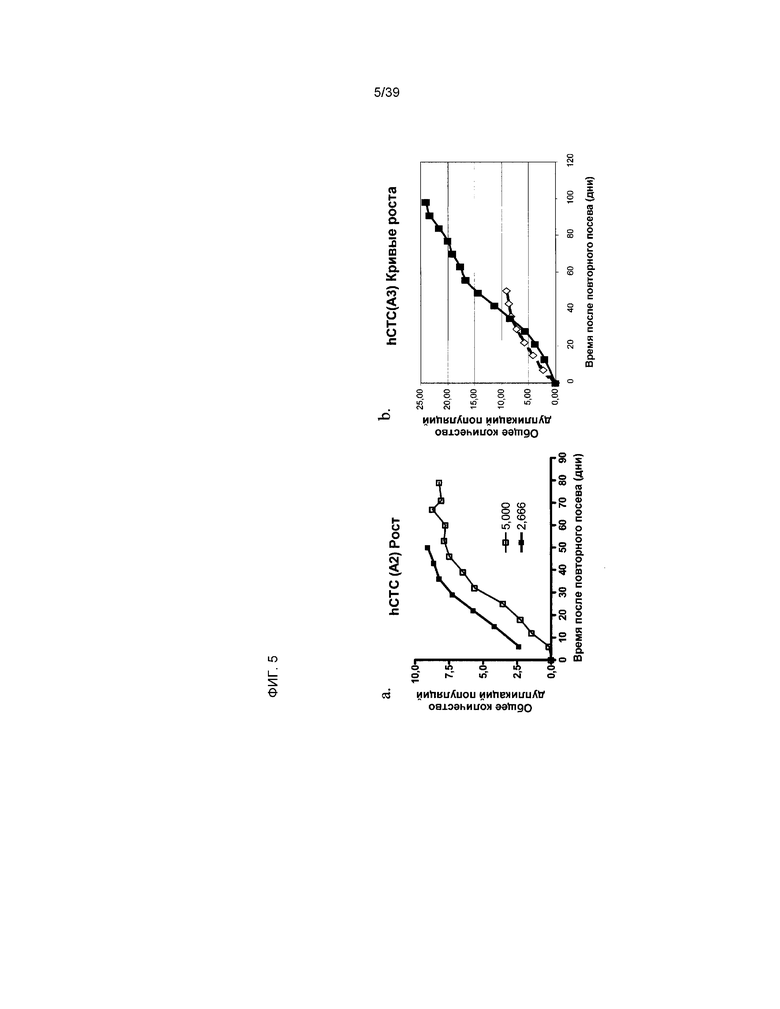
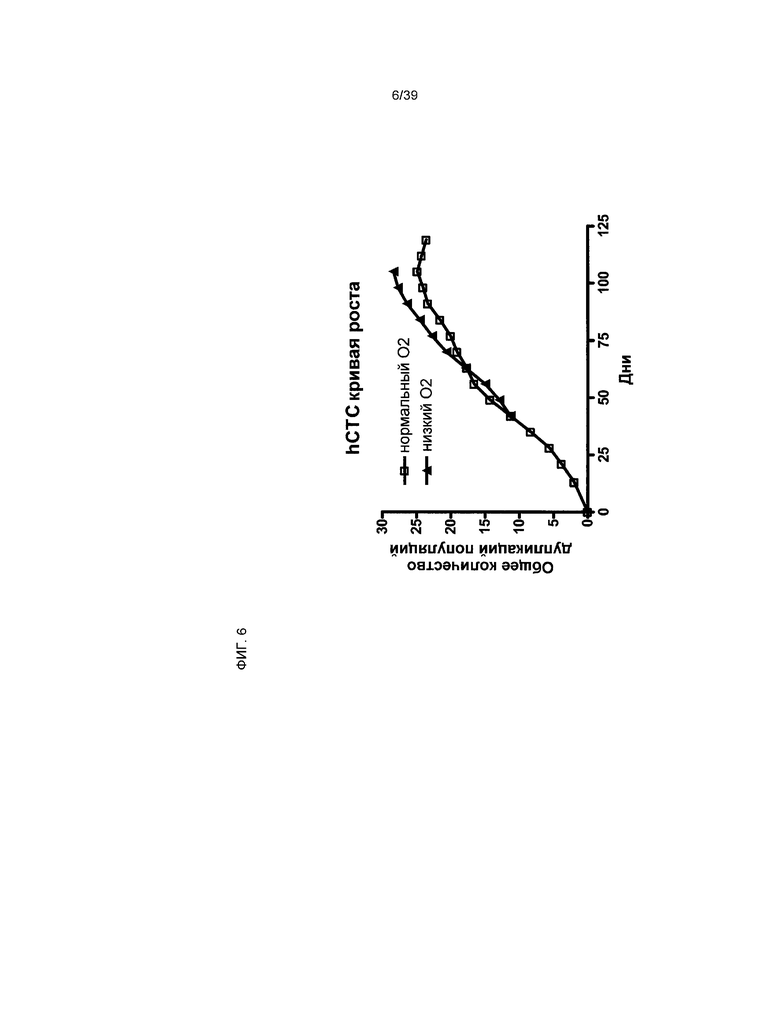
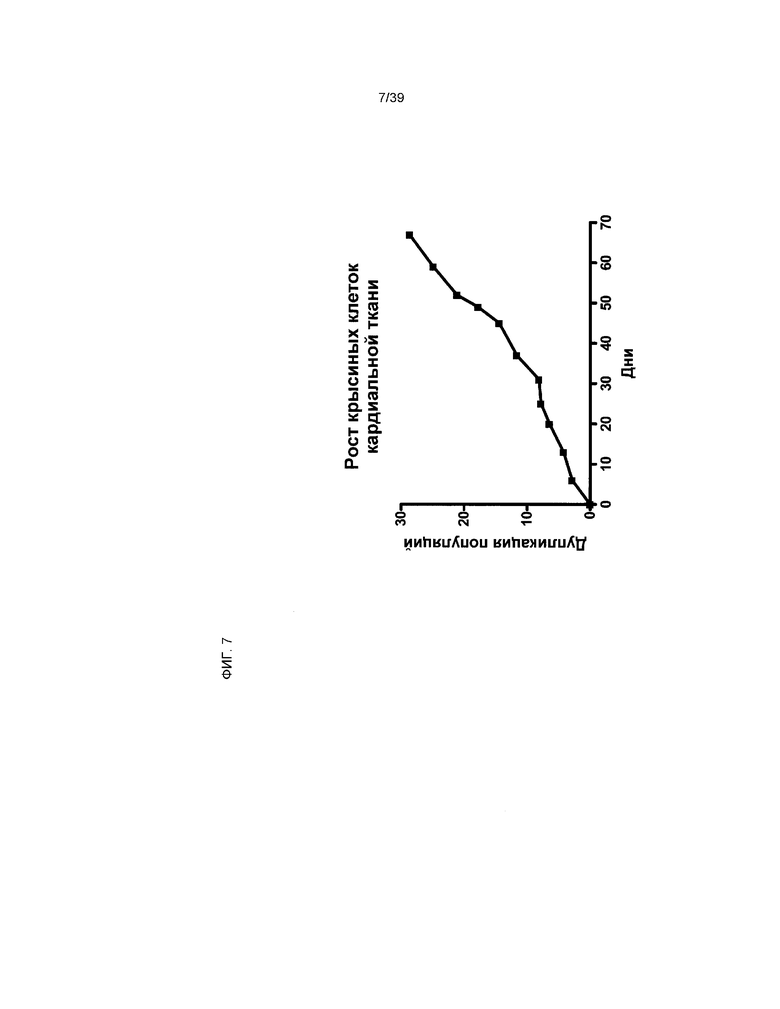
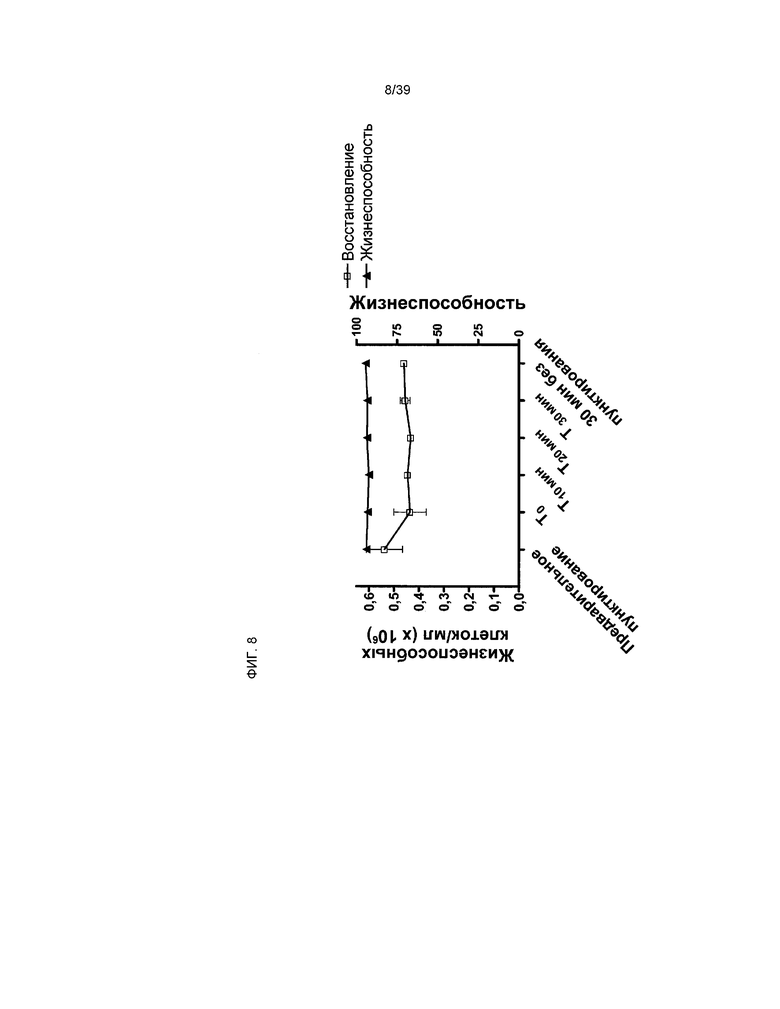
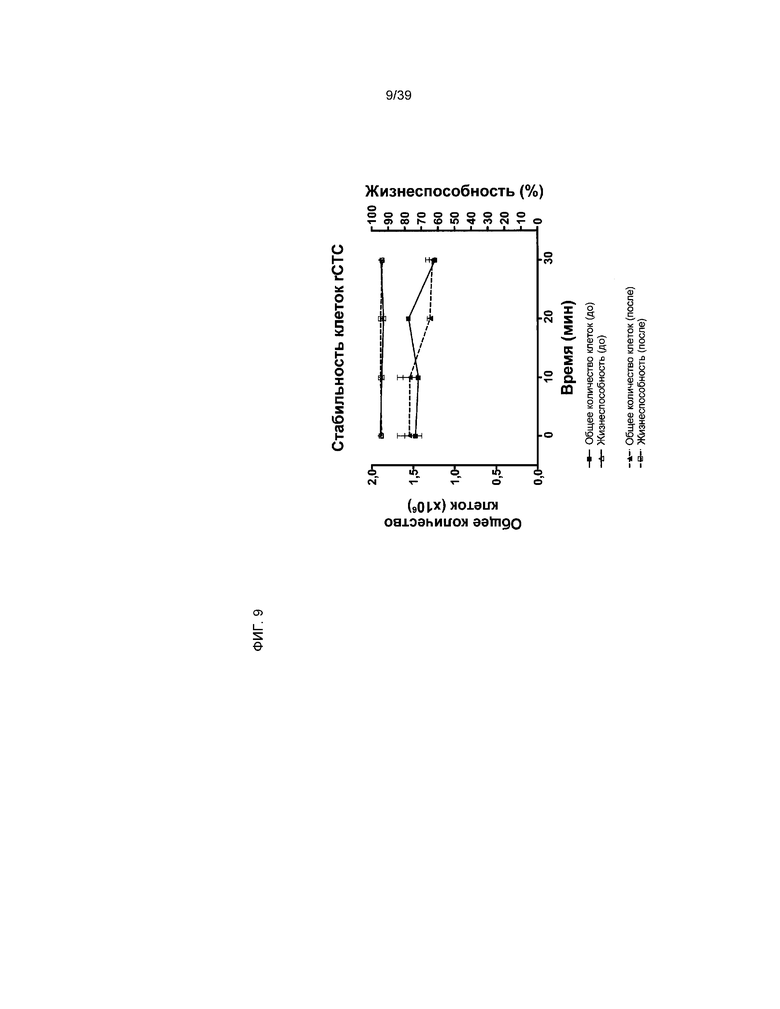
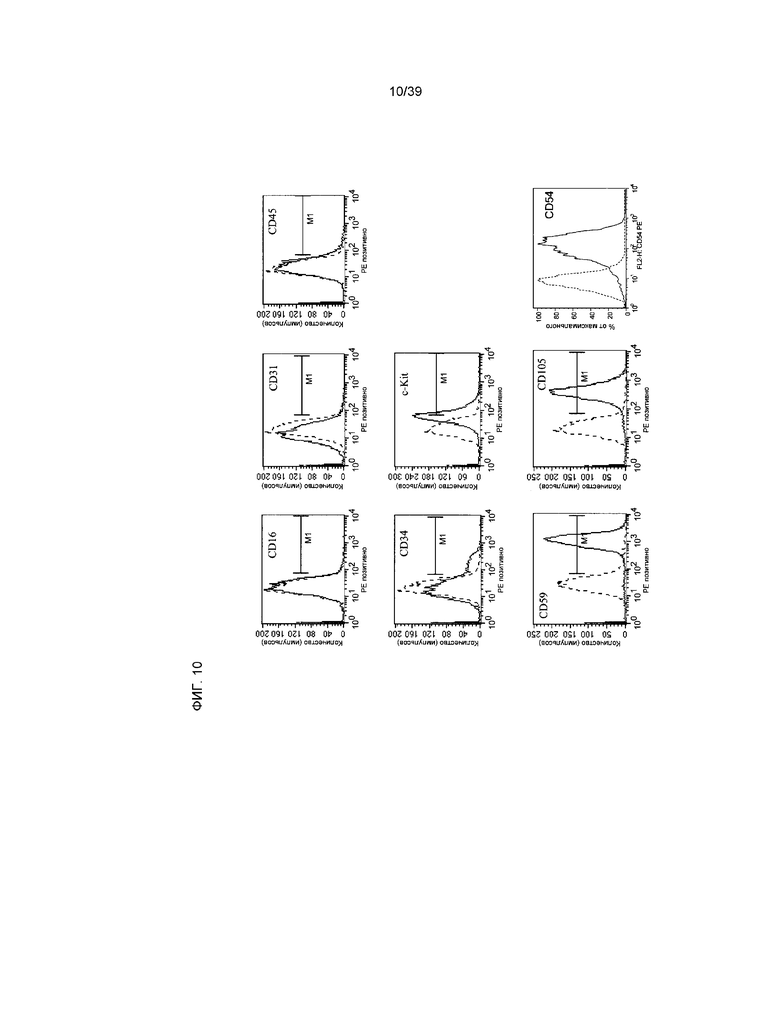
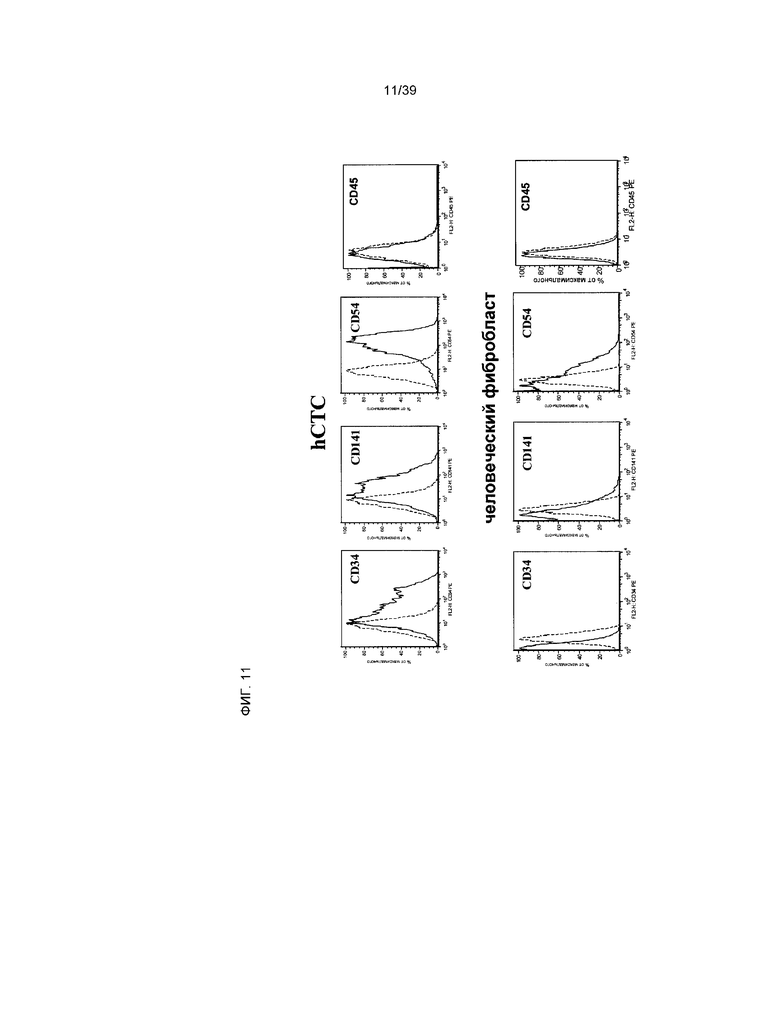
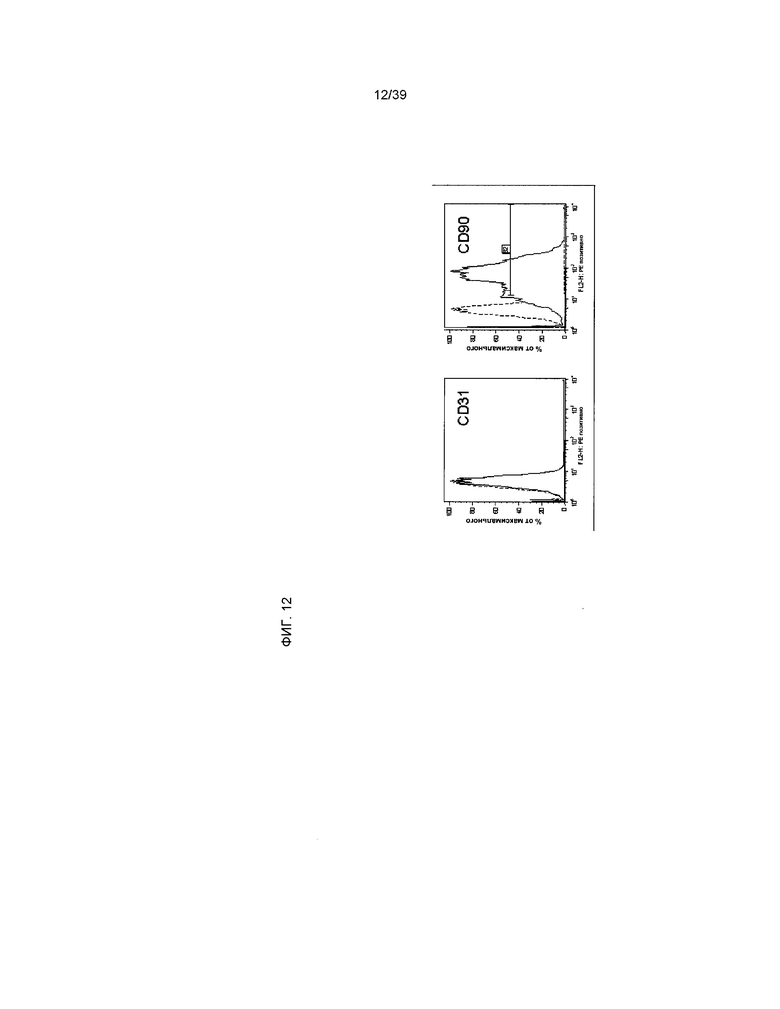

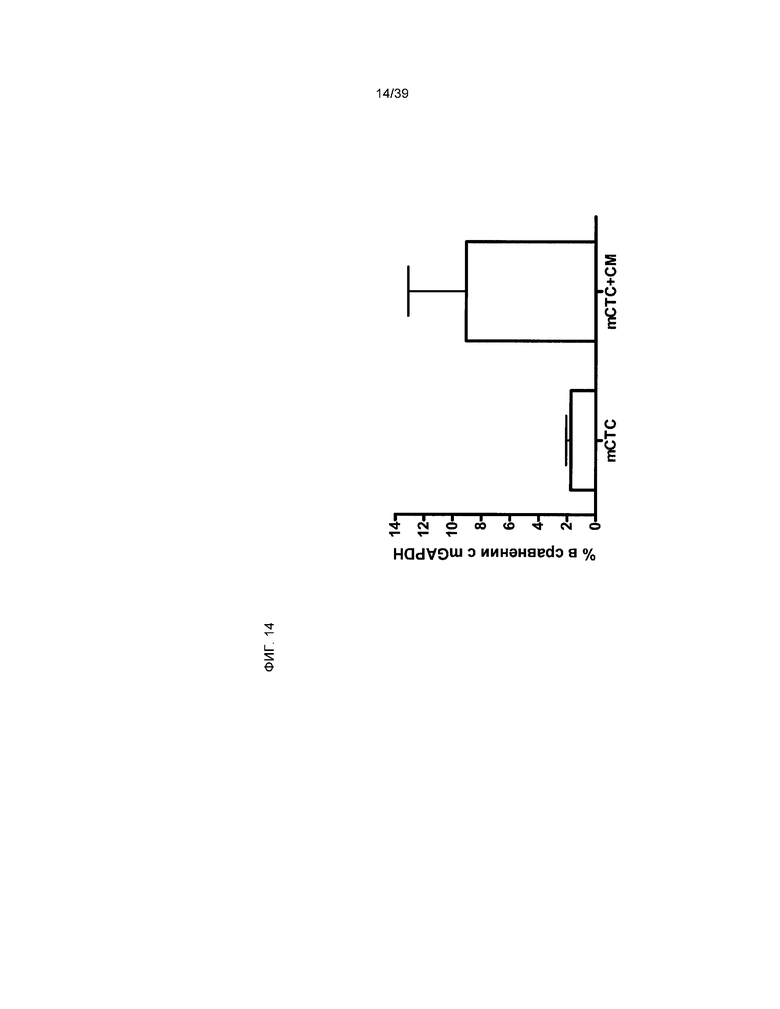

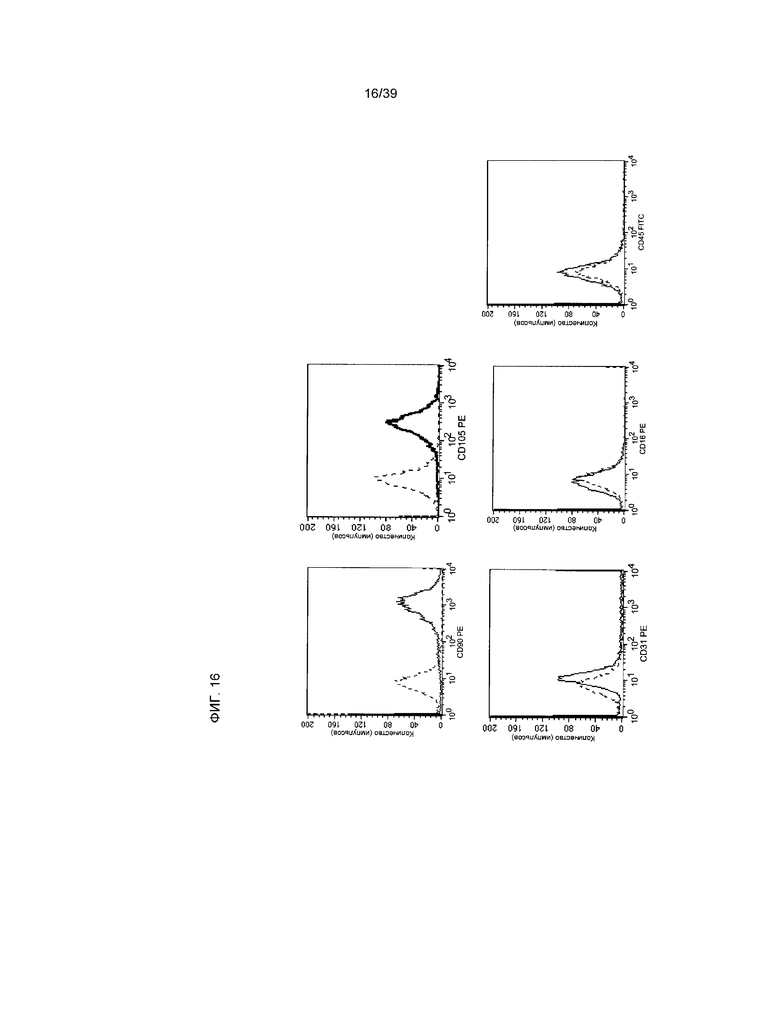


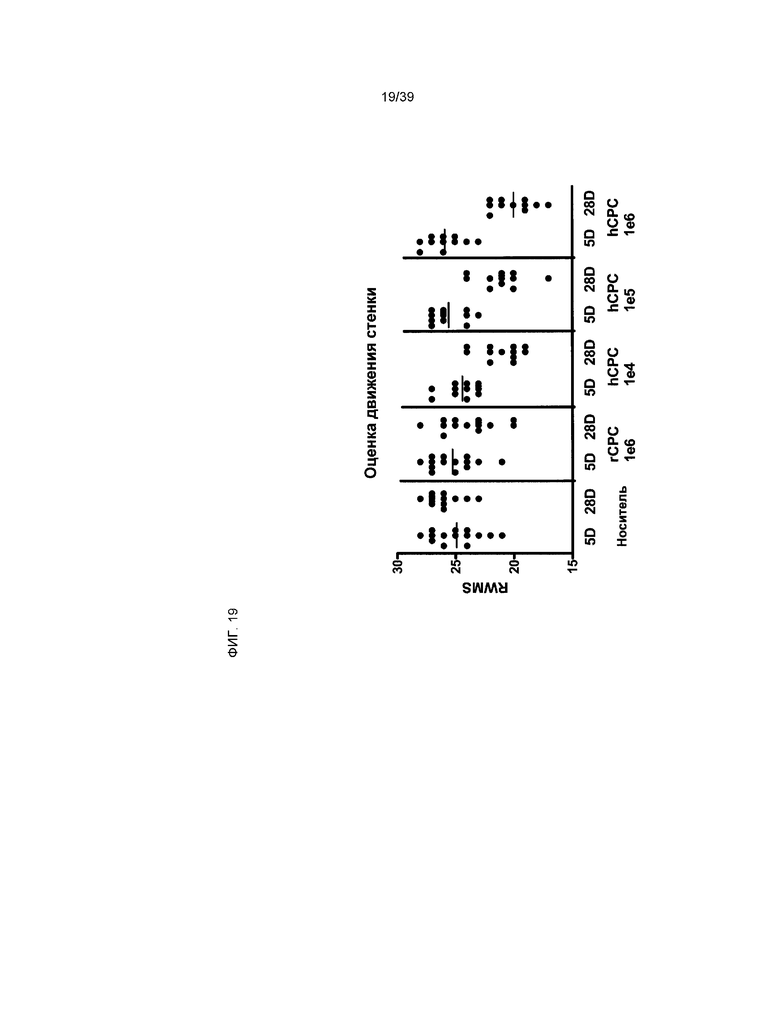
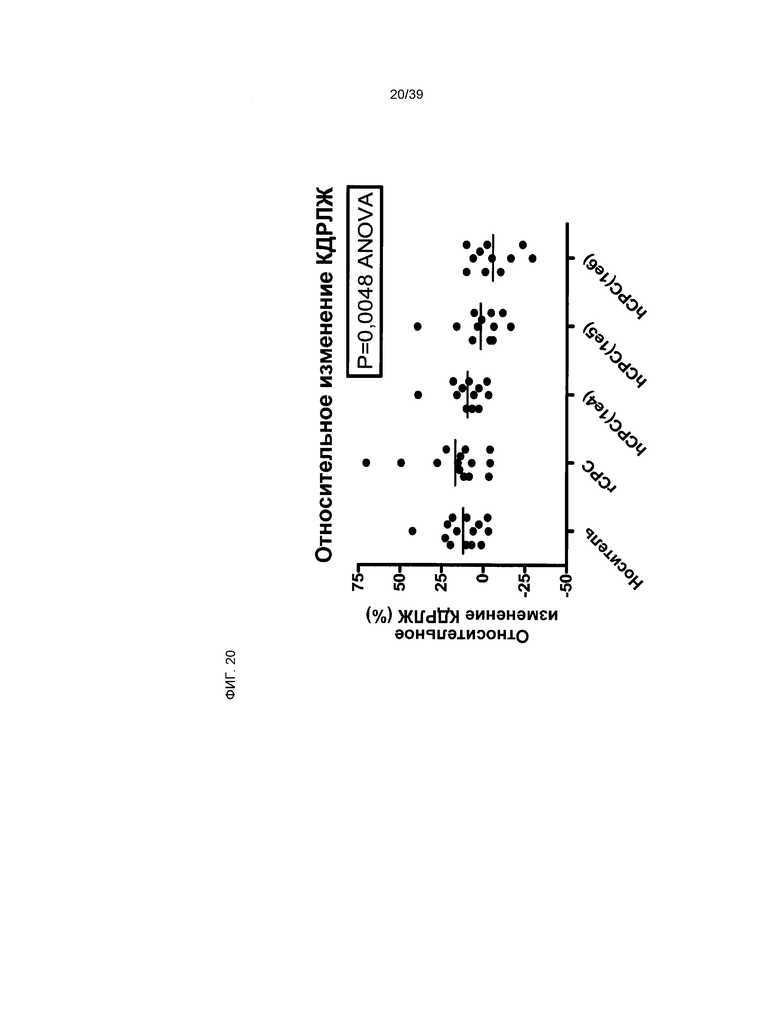


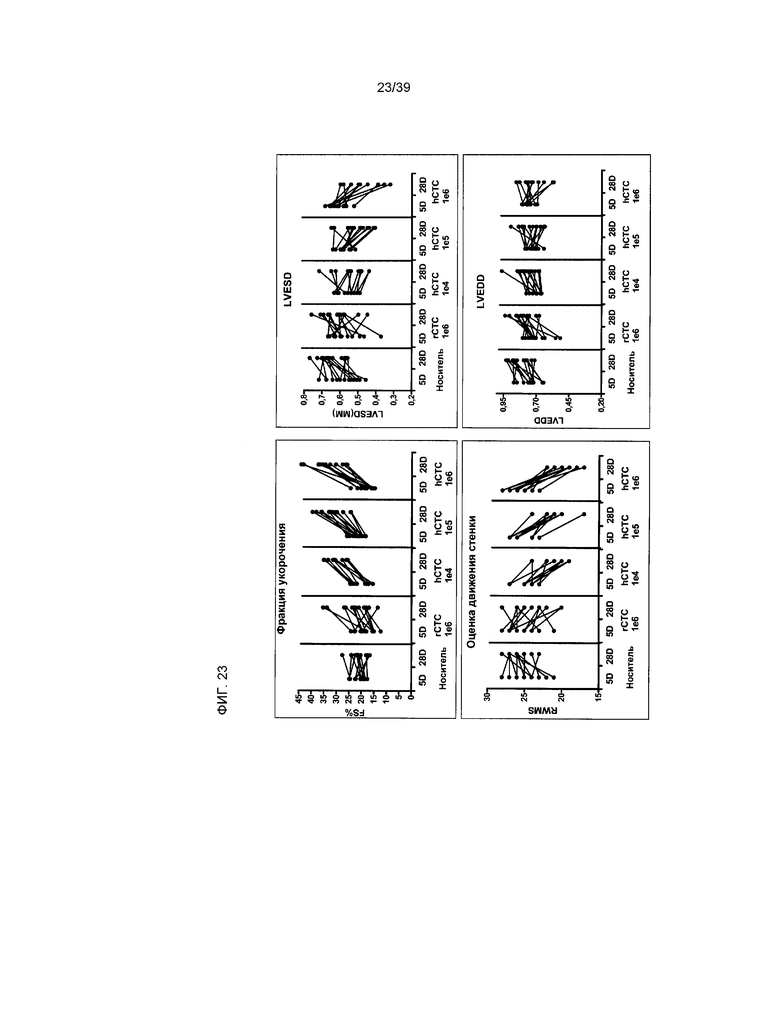
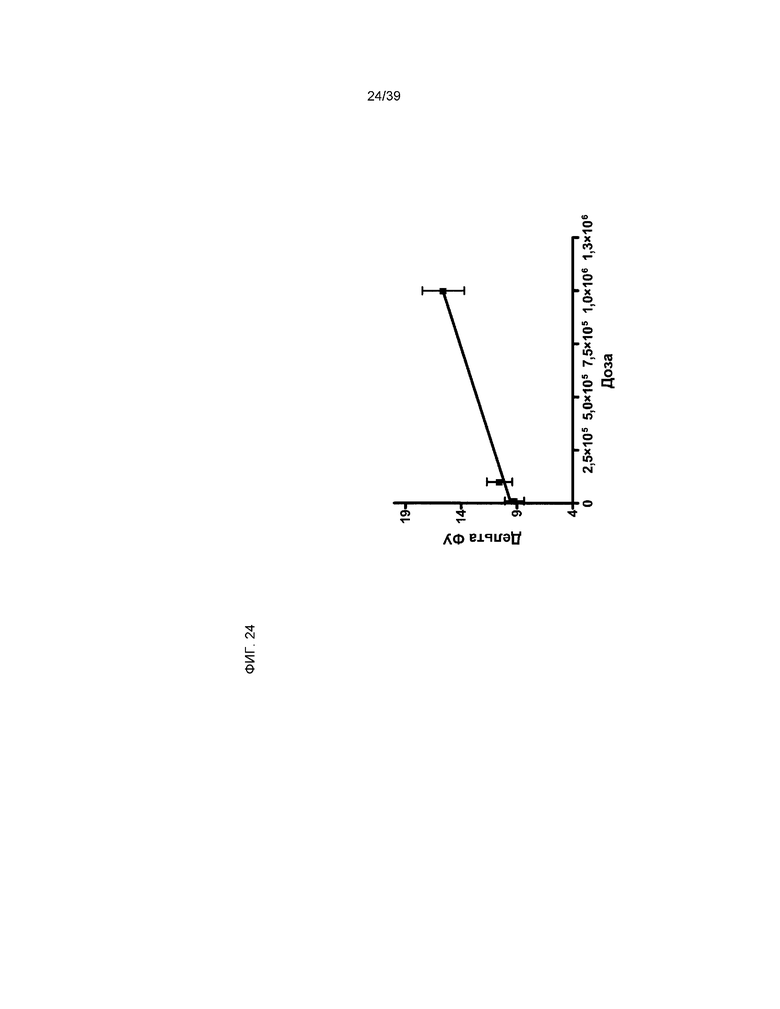
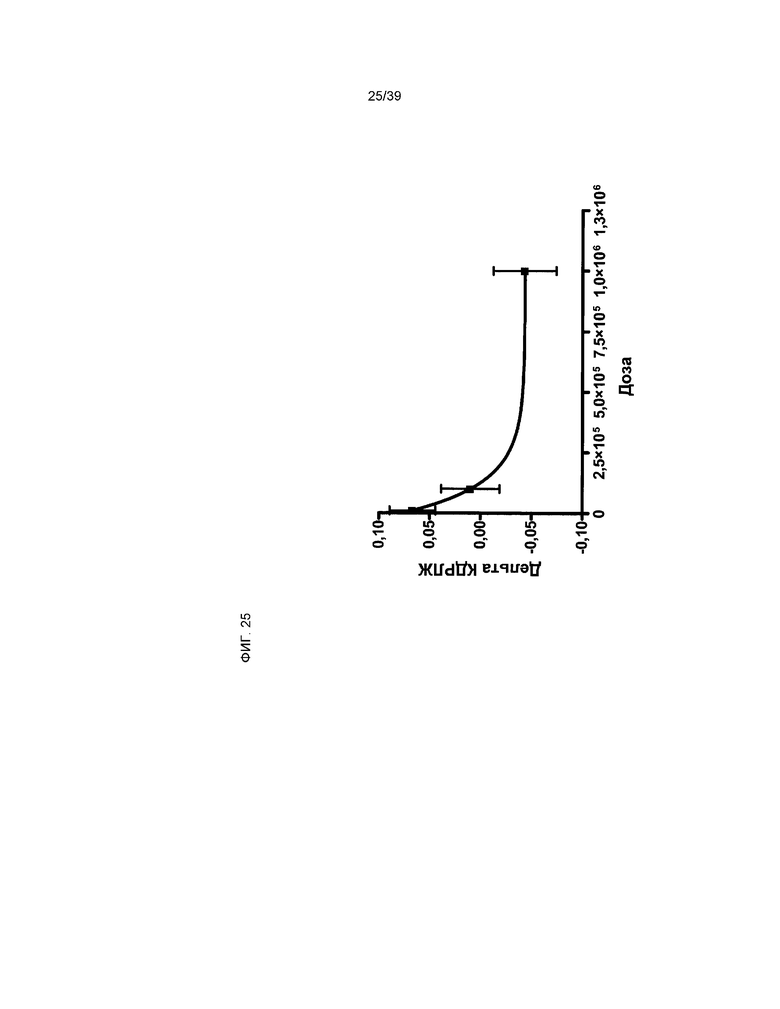
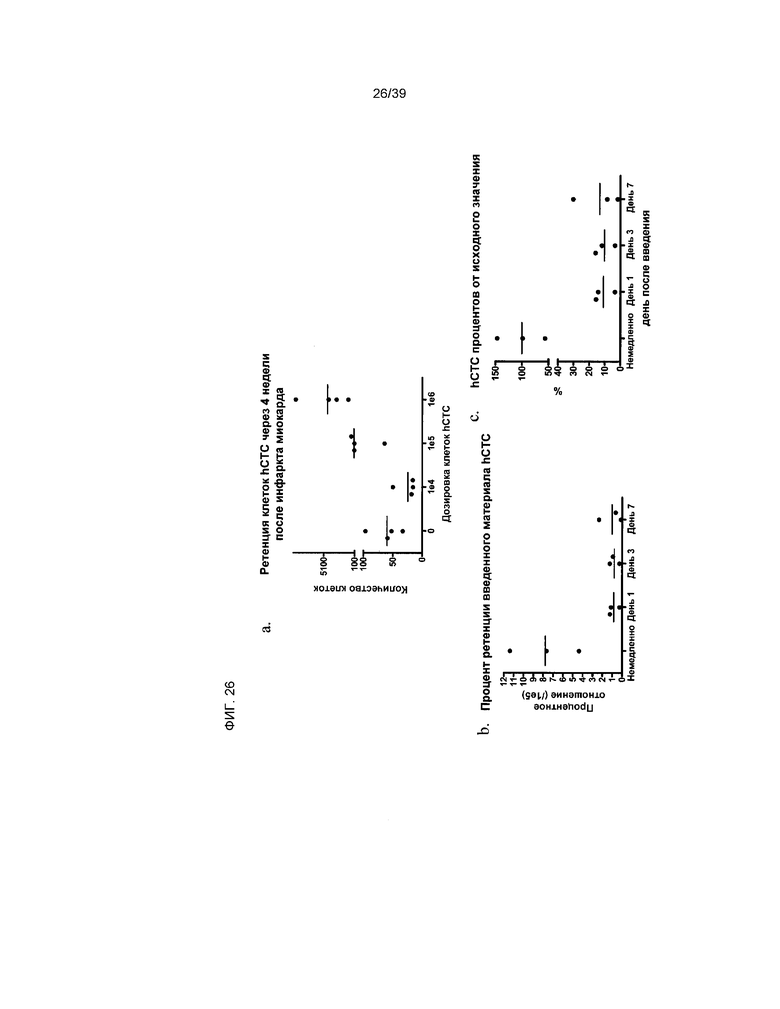

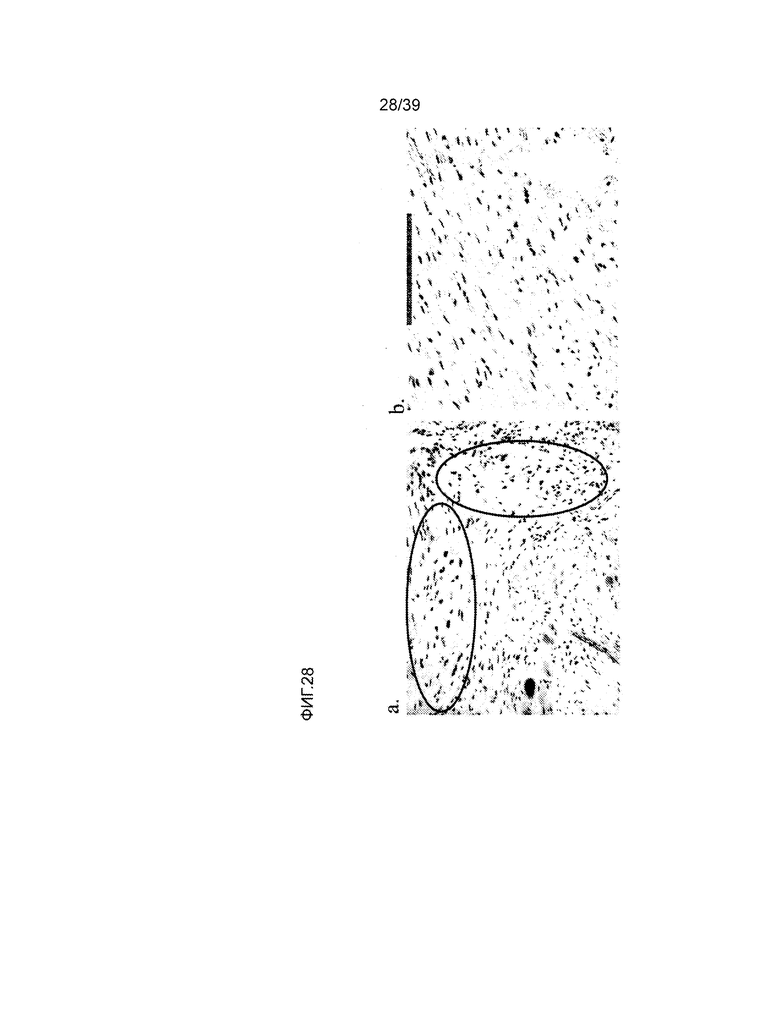

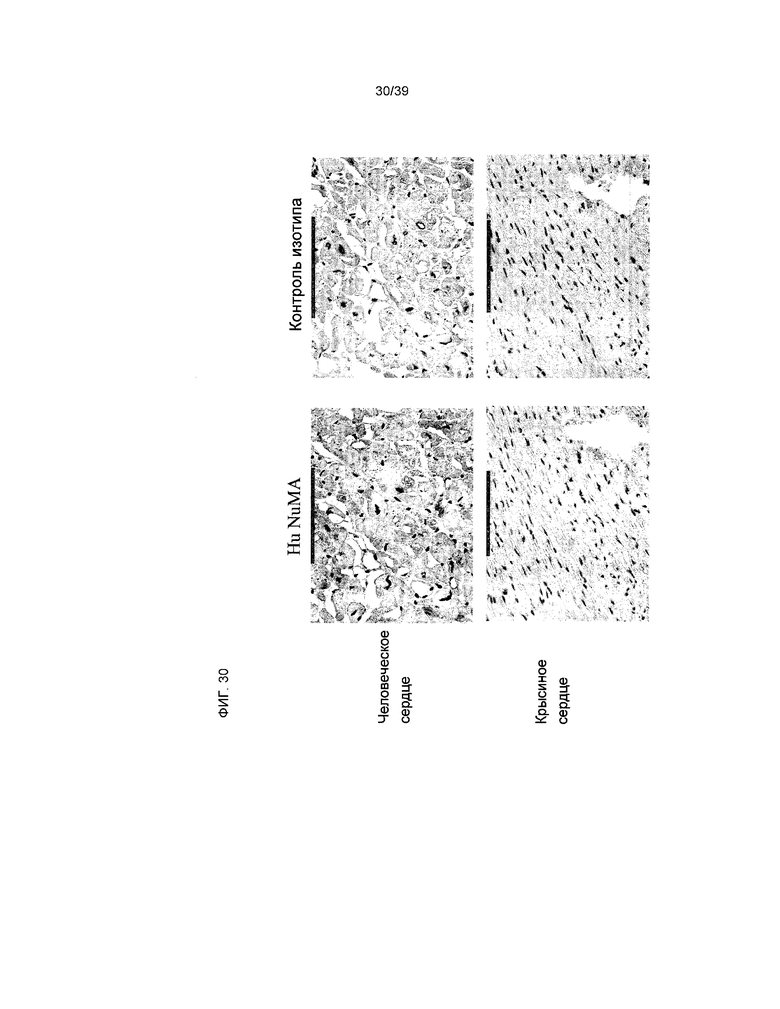


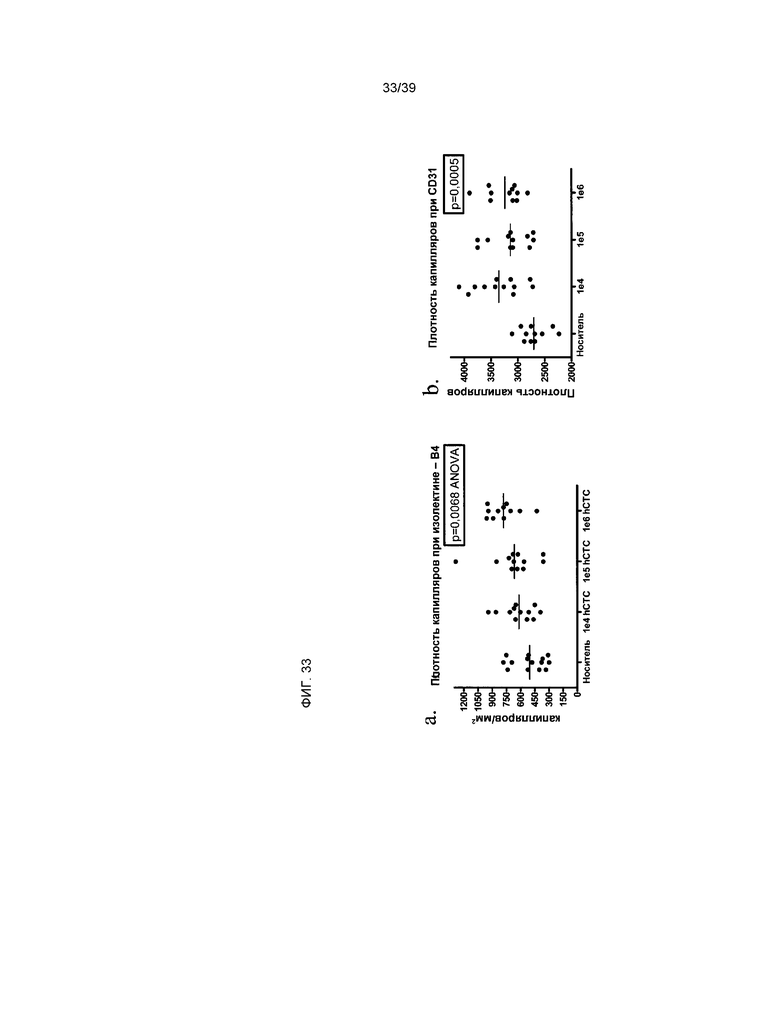
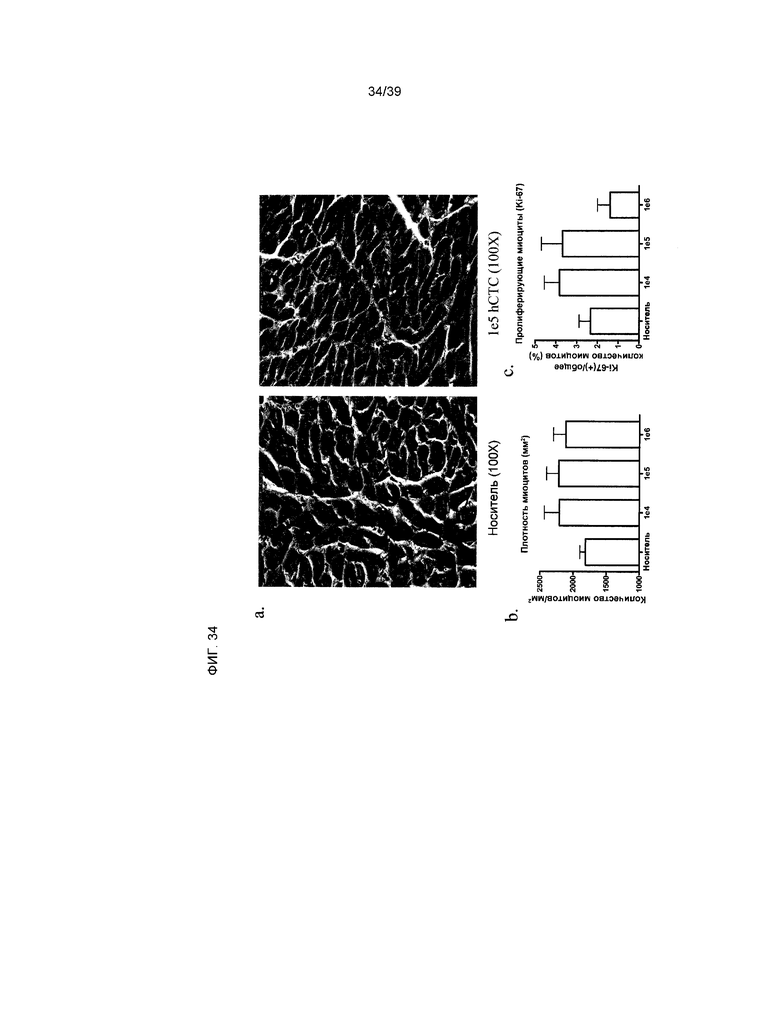

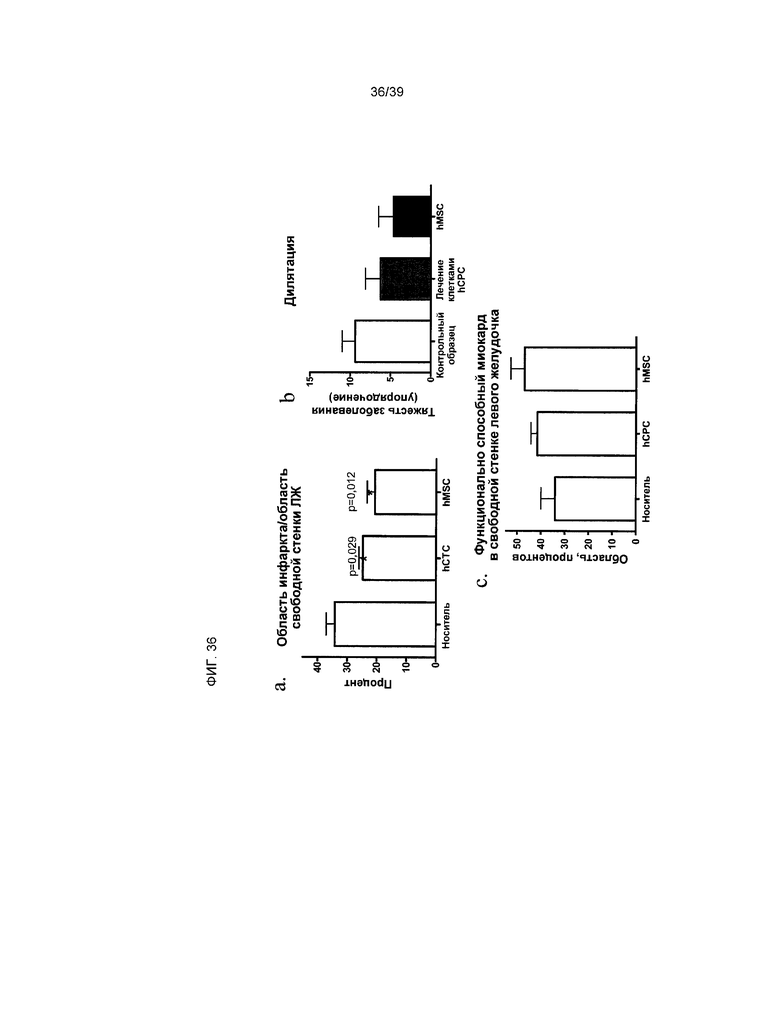

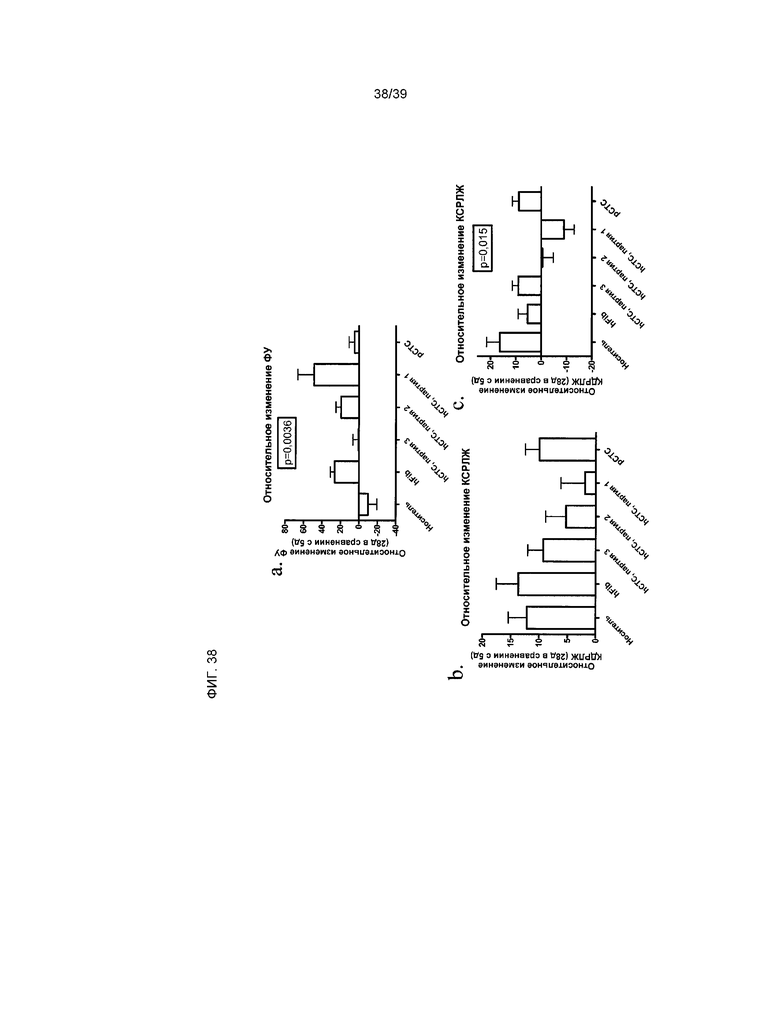
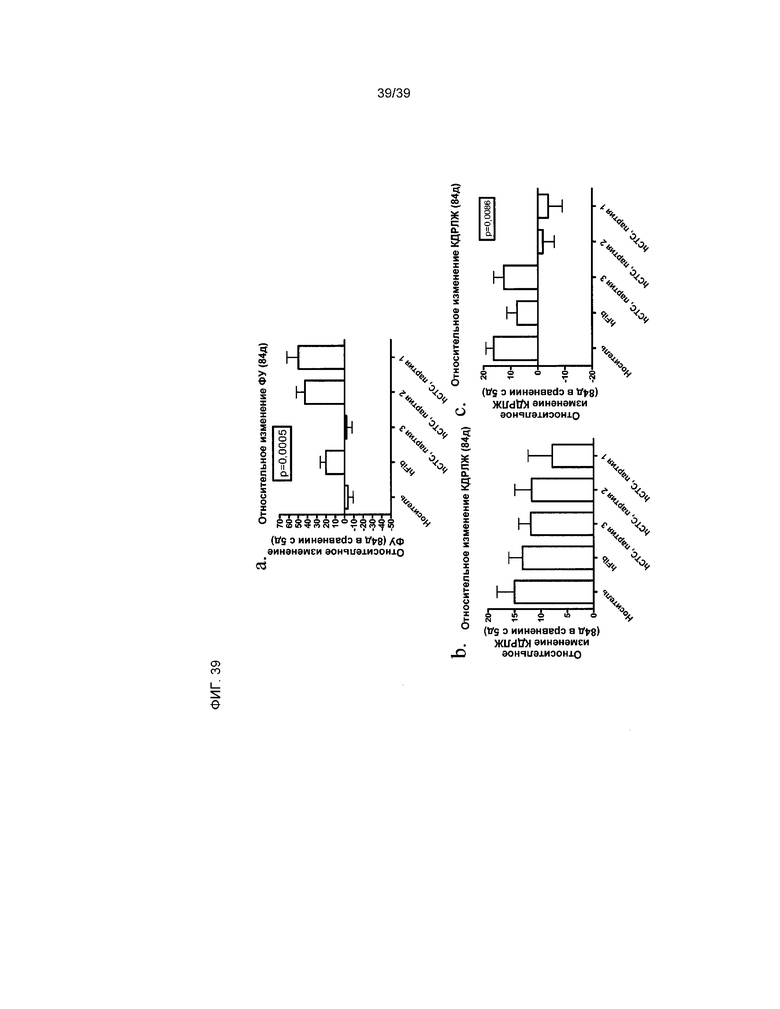
Настоящее изобретение относится к области биотехнологии, конкретно к клеточной терапии, и может быть использовано в медицине для восстановления поврежденного миокарда. Из сердца взрослого человека выделены популяции клеток, производных от кардиальной ткани человека, на основе которых составлены терапевтические композиции. Дополнительно композиции могут включать агент, выбранный из: фактора стволовых клеток (ФСК), гранулоцитарного колониестимулирующего фактора (Г-КСФ), гранулоцитарно-моноцитарного колониестимулирующего фактора (ГМ-КСФ), фактора стромальных клеток-1, стального фактора, фактора роста эндотелия сосудов, макрофагального колониестимулирующего фактора, гранулоцитарно-макрофагального колониестимулирующего фактора и интерлейкина-3. Изобретение позволяет эффективно восстанавливать поврежденный миокард. 4 н. и 3 з.п. ф-лы, 39 ил., 30 табл. и 20 пр.
1. Композиция, содержащая от 1×104 до 1×106 клеток очищенной популяции клеток, производных от кардиальной ткани человека, которая не экспрессирует CD31, теломеразу и ISL-1, которая экспрессирует CD117 и которая также не экспрессирует по меньшей мере один из следующих маркеров: MDR, CD16, CD19, CD45 и CD106, где очищенная популяция клеток, производная от кардиальной ткани человека, способна восстанавливать поврежденный миокард, где очищенная популяция клеток, производная от кардиальной ткани человека, получена из сердца взрослого человека и где композиция составлена для восстановления поврежденного миокарда.
2. Композиция по п.1, отличающаяся тем, что клетки очищенной популяции клеток, производных от кардиальной ткани человека, также экспрессируют по меньшей мере один из следующих маркеров: CD49e, CD105, CD59, CD81, CD90 и CD34.
3. Композиция, содержащая от 1×104 до 1×106 клеток очищенной популяции клеток, производных от кардиальной ткани человека, которая не экспрессирует теломеразу, ISL-1, CD16, CD31 и CD45 и которая экспрессирует CD117, GATA4, Nkx2.5, CD105 и CD90, где очищенная популяция клеток, производная от кардиальной ткани человека, получена из сердца взрослого человека и где композиция составлена для восстановления поврежденного миокарда.
4. Композиция по любому из пп.1-3, где клетки очищенной популяции клеток, производных от кардиальной ткани человека, являются прилипающими.
5. Композиция, включающая от 1×104 до 1×106 клеток очищенной популяции клеток, производных от кардиальной ткани человека, и агент,
где клетки, производные от кардиальной ткани человека, не экспрессируют CD31, теломеразу и ISL-1, экспрессируют CD117 и также не экспрессируют по меньшей мере один из следующих маркеров: MDR, CD16, CD19, CD45 и CD106,
где очищенная популяция клеток, производная от кардиальной ткани человека, способна восстанавливать поврежденный миокард,
где очищенная популяция клеток, производная от кардиальной ткани человека, получена из сердца взрослого человека,
где композиция составлена для восстановления поврежденного миокарда, и
где агент выбран из группы, состоящей из: фактора стволовых клеток (ФСК), гранулоцитарного колониестимулирующего фактора (Г-КСФ), гранулоцитарно-моноцитарного колониестимулирующего фактора (ГМ-КСФ), фактора стромальных клеток-1, стального фактора, фактора роста эндотелия сосудов, макрофагального колониестимулирующего фактора, гранулоцитарно-макрофагального колониестимулирующего фактора и интерлейкина-3.
6. Композиция по п.5, в которой клетки, производные от кардиальной ткани человека, также экспрессируют по меньшей мере один из следующих маркеров: CD49e, CD105, CD59, CD81, CD90 и CD34.
7. Композиция, включающая от 1×104 до 1×106 клеток очищенной популяции клеток, производных от кардиальной ткани человека, и агент,
где очищенная популяция клеток, производная от кардиальной ткани человека, способна восстанавливать поврежденный миокард,
где клетки, производные от кардиальной ткани человека, не экспрессируют теломеразу, ISL-1, CD16, CD31 и CD45 и экспрессируют CD117, GATA4, Nkx2.5, CD105 и CD90,
где композиция составлена для восстановления поврежденного миокарда, и
где агент выбран из группы, состоящей из: фактора стволовых клеток (ФСК), гранулоцитарного колониестимулирующего фактора (Г-КСФ), гранулоцитарно-моноцитарного колониестимулирующего фактора (ГМ-КСФ), фактора стромальных клеток-1, стального фактора, фактора роста эндотелия сосудов, макрофагального колониестимулирующего фактора, гранулоцитарно-макрофагального колониестимулирующего фактора и интерлейкина-3.
| GALVEZ B.G | |||
| et al., Human cardiac mesoangioblasts isolated from hypertrophic cardiomyopathies are greatly reduced in proliferation and differentiation potency, Cardiovasc | |||
| Res., 2009, v.83,n.4,p.707-716 | |||
| US 20080050347 A1, 28.02.2008 | |||
| URBANEK K | |||
| ET AL., Myocardial regeneration by activation of multipotent cardiac stem cells in ischemic heart failure, PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES, 2005, v.102, n.24, p.8692 - 8697 | |||
| RU 2006114832 A, 10.11.2007. |
Авторы
Даты
2018-07-26—Публикация
2010-07-08—Подача