Перекрестная ссылка
Настоящая заявка испрашивает приоритет на основании не являющейся предварительной заявки на патент США №12/411250, поданной 25 марта 2009 года, полное описание которой включено в настоящий документ посредством данной конкретной ссылки.
Уровень техники
Настоящее изобретение относится к внутриглазным системам и способу лечения глазных заболеваний. В частности, настоящее изобретение направлено на местное применение систем доставки лекарственных средств с замедленным высвобождением (имплантатов, содержащих лекарственный препарат) в переднюю камеру глаза (т.е. внутрикамерное введение) для лечения повышенного внутриглазного давления в водной камере глаза (т.е. гипертензивного состояния), которое может быть симптомом глаукомы или риска развития глаукомы.
Система доставки лекарственного средства согласно нашему изобретению может представлять собой имплантат, содержащий лекарственный препарат (т.е. единую монолитную систему доставки лекарственного средства с замедленным высвобождением) или имплантаты. Систему доставки лекарственного средства можно применять терапевтически для лечения глазного заболевания или состояния, такого как повышенное внутриглазное давление и/или глаукома. Глаукома представляет собой заболевание глаза, характеризующееся повышенным внутриглазным давлением (ВГД) в водной камере глаза. При отсутствии лечения глаукома может привести к слепоте. Глаукома может быть первичной или вторичной. Первичная глаукома у взрослых (врожденная глаукома) может быть открытоугольной, или острой, или хронической закрытоугольной. Вторичная глаукома возникает в результате ранее существовавших глазных заболеваний, таких как увеит, внутриглазная опухоль или увеличенная катаракта. Для понижения ВГД и лечения глаукомы применялись различные гипертензивные агенты. Например, для лечения внутриглазной гипертензии и глаукомы применялись некоторый простагландины и их аналоги и производные, такие как производное латанопроста PGF2α (иногда называемое простагландиновым аналогом F2α), продаваемое под торговой маркой Ксалатан®. Внутриглазные имплантаты и микросферы, содержащие простагландин и простамид, описаны, например, в заявках на патент США №11/368845; 11/303462, 10/837260 и 12/259153. Особый интерес представляют примеры 1-5 на стр. 36-47 заявки №12/259153. Также вызывает интерес заявка США №11/952938. Кроме того, также представляют интерес патенты США 5972326 и 5965152.
Общепринятый способ лечения глаукомы заключается в ежедневном применении глазных капель, содержащих антигипертензивный лекарственный препарат для снижения ВГД. Показатель соблюдения пациентами режима и схемы лечения регулярного, ежедневного применения глазных капель часто является низким. См., например, Nordstrom et al. AJO 2005; 140: 598. Кроме того, в результате неправильного применения глазной пипетки может возникнуть глазная инфекция. Поэтому существует потребность в продолжительном (т.е. с замедленным высвобождением) способе лечения внутриглазной гипертензии, который можно легко применять, например, во время посещения кабинета врача. Следовательно, было бы предпочтительно обеспечить внутриглазные системы доставки лекарственного средства с замедленным высвобождением (включающие имплантаты) для внутриглазного терапевтического применения для лечения повышенного ВГД и/или глаукомы.
Краткое описание
Настоящее изобретение удовлетворяет эту потребность и обеспечивает способ лечения глазных заболеваний с применением внутриглазных систем доставки лекарственного средства с замедленным высвобождением. Внутриглазная система доставки лекарственного средства с замедленным высвобождением находится в форме имплантата, который преимущественно обеспечивает длительное высвобождение одного или более терапевтических антигипертензивных препаратов (например, простагландина или простамида, такого как латанопрост).
Определения
В настоящей заявке применяют следующие определения.
"Примерно" означает плюс или минут десять процентов от числа, параметра или характеристики, ограниченной таким образом.
"Имплантат" представляет собой устройство доставки лекарственного средства для лечения глазного заболевания (такого как глаукома). Обычно в переднюю камеру глаза вводят от одного до самое большое шести имплантатов.
"Глазничная область" или "место глазницы" означает любой участок глазного яблока, в том числе передний и задний сегмент глаза, которой в общем случае включает, но не ограничивается ими, любые функциональные (например, для обеспечения зрения) или структурные ткани, имеющиеся в глазном яблоке, или ткани или слои клеток, которые частично или полностью выстилают внутреннюю или внешнюю часть глазного яблока. Конкретные примеры участков глазного яблока в глазничной области включают переднюю (водную) камеру, заднюю камеру, полость стекловидного тела, сосудистую оболочку глаза, супрахориоидальное пространство, конъюнктиву, подконъюктивальное пространство, эписклеральное пространство, внутрироговичное пространство, эпикорнеальное пространство, склеру, плоскую часть ресничного тела, образующиеся после хирургической операции бессосудистые области, пятно и сетчатку.
"Глазное заболевание" означает заболевание, недомогание или состояние, которое поражает глаз или одну из частей или областей глаза или затрагивает их. В общих чертах, глаз включает глазное яблоко и ткани и жидкости, которые составляют глазное яблоко, периокулярные мышцы (такие как косые и прямые мышцы) и участок зрительного нерва, которые проходит внутри глазного яблока или рядом с ним.
Заболевание передней части глаза представляет собой заболевание, недомогание или состояние, которое поражает или затрагивает переднюю (т.е. лицевую) часть глаза, глазничную область или участок, такой как периокулярная мышца, глазное веко или ткань глазного яблока, или жидкость, которая находится между передней и задней стенкой мембраны хрусталика или цилиарных мышц. Таким образом, заболевание передней части глаза главным образом поражает или затрагивает конъюнктиву, роговицу, переднюю камеру, радужную оболочку, заднюю камеру (позади сетчатки, но впереди задней стенки мембраны хрусталика), хрусталик или мембрану хрусталика и кровеносные сосуды и нерв, которые васкуляризируют или возбуждают переднюю глазничную область или участок.
Таким образом, заболевание передней части глаза может включать заболевание, недомогание или состояние, такое как, например, афакия; артифакия; астигматизм; тонический блефароспазм; катаракта; заболевания конъюнктивы; конъюнктивит; заболевания роговицы; язва роговицы; синдромы сухого глаза; заболевания век; заболевания слезных органов; непроходимость слезного канальца; близорукость; старческая дальнозоркость; заболевания зрачка; рефракционные заболевания и косоглазие. Глаукому также можно рассматривать как состояние передней части глаза, поскольку клиническая задача лечения глаукомы может состоять в снижении гипертензии водной жидкости в передней камере глаза (т.е. понижении внутриглазного давления).
Заболевание задней части глаза представляет собой заболевание, недомогание или состояние, которое главным образом поражает или затрагивает заднюю глазничную область или участок, такой как сосудистая оболочка глаза или склера (в положении позади плоскости, проходящей через заднюю стенку мембраны хрусталика), стекловидное тело, стекловидная камера, сетчатка, зрительный нерв (т.е. диск зрительного нерва) и кровеносные сосуды и нервы, которые васкуляризируют или возбуждают заднюю глазничную область или участок.
Таким образом, заболевание задней части глаза может включать заболевание, недомогание или состояние, такое как, например, острая макулярная нейроретинопатия; болезнь Бехчета; хориоидальная неоваскуляризация; диабетический увеит; гистоплазмоз; инфекции, такие как микозы и вирусные инфекции; дегенерация желтого пятна, такая как острая дегенерация желтого пятна, неэкссудативная возрастная дегенерация желтого пятна и экссудативная возрастная дегенерация желтого пятна; отек, такой как макулярный отек, кистозный макулярный отек и диабетический макулярный отек; многоочаговый хориоидит; травма глаза, которая поражает заднюю область или участок глазницы; глазные опухоли; нарушения сетчатки, такие как окклюзия центральной вены сетчатки, диабетическая ретинопатия (в том числе пролиферативная диабетическая ретинопатия), пролиферативная витреоретинопатия (PVR), окклюзионное поражение артерии сетчатки, отслоение сетчатки, увеальное заболевание сетчатки; симпатическая офтальмия; синдром Фогта-Коянаги-Харада (VKH); увеальная диффузия; состояние задней части глаза, вызванное или связанное с лазерным лечением глаза; состояние задней части глаза, вызванное или связанное с фототерапией, фотокоагуляция, радиационная ретинопатия, нарушения эпиретианальной мембраны, окклюзия ветки вены сетчатки, передняя ишемическая оптическая нейропатия, не связанная с ретинопатией диабетическая дисфункция сетчатки, пигментная дистрофия сетчатки и глаукома. Глаукома может рассматриваться как заболевание задней части глаза, поскольку терапевтическая цель состоит в предотвращении потери или снижения частоты потери зрения вследствие повреждения или потери клеток сетчатки или клеток зрительного нерва (т.е. нейрозащите).
"Биоразлагаемый полимер" означает полимер или полимеры, которые разлагаются in vivo, при этом эрозия полимера или полимеров со временем происходит параллельно с высвобождением терапевтического агента или после этого. Термины "биоразлагаемый" и "биоэродируемый" являются равнозначными и применяются в настоящей заявке взаимозаменяемо. Биоразлагаемый полимер может представлять собой гомополимер, сополимер или полимер, содержащий более двух различных полимерных звена. Полимер может представлять собой полимер типа геля или гидрогеля, полимер на основе полимолочной кислоты (ПМК) или на основе сополимеров молочной и гликолевой кислот (ПМГК) или их смеси или производные.
"Терапевтически эффективное количество" означает уровень или количество препарата, необходимое для лечения глазного заболевания или уменьшения или предотвращения повреждения или поражения глаза, не вызывающее существенных негативных или вредных побочных эффектов в глазу или в области глаза. На основе вышеизложенного, терапевтически эффективное количество терапевтического средства, такого как латанопрост, представляет собой количество, эффективное для ослабления по меньшей мере одного симптома глазного заболевания.
Имплантаты в рамках предлагаемого нами изобретения могут высвобождать антигипертензивный препарат на протяжении сравнительно длительного периода времени, например, в течение по меньшей мере примерно 10 дней или, например, в течение примерно от двух до примерно четырех месяцев, после внутриглазного (т.е. внутрикамерного) введения имплантата, содержащего антигипертензивный препарат. Такие длительные периоды высвобождения способствуют достижению успешных результатов лечения. Внутриглазную систему доставки лекарственного средства с замедленным высвобождением предпочтительно вводят внутрикамерно (то есть в водную камеру [также называемую передней камерой] глаза).
Предлагаемое нами изобретение представляет собой способ лечения повышенного внутриглазного давления путем внутрикамерного введения пациенту с повышенным внутриглазным давлением вплотную к трабекулярной сети имплантата замедленного высвобождения выполненного в форме стержня, содержащего латанопрост или биматопрост и биоразлагаемый полимер, при этом имплантат содержит от примерно 10 до примерно 50 масс.% латанопроста или биматопроста и от примерно 50 до примерно 90 масс.% биоразлагаемого полимера, причем имплантат высвобождает терапевтически эффективные количества латанопроста или биматопроста на протяжении периода времени от примерно 10 дней до примерно 120 дней.
Наиболее предпочтительный вариант реализации предлагаемого нами изобретения представляет собой один монолитный (т.е. антигипертензивный лекарственный препарат гомогенно распределен [т.е., имплантаты резервуарного типа исключены из объема наиболее предпочтительного варианта реализации предлагаемого нами изобретения] по всей полимерной матрице имплантата) имплантат (содержащий терапевтическое количество антигипертензивного препарата) замедленного высвобождения выполненный в форме стержня, размещенный внутри камеры, длина которого составляет примерно от 2 мм до примерно 4 мм, а ширина составляет примерно от 0,5 мм до примерно 2 мм, имплантированный в положение, соответствующее 6-ти или 12-ти часам на циферблате, вплотную к трабекулярной сети с применением шприца-аппликатора (инжектора) (т.е., 22 калибра). Имплантат в форме диска не является предпочтительным, поскольку он не будет плотно примыкать и/или не будет оставаться в месте, прилегающем к трабекулярной сети. Размещение маленького имплантата в форме стержня (с приведенными выше размерами) вплотную к трабекулярной сети использует потоки, протекающие через водную камеру глаза и дренирование жидкости в трабекулярную сеть для удержания имплантата в заданном месте вплотную к трабекулярной сети, тем самым, предотвращая смывание имплантата с места его размещения. При таком наиболее предпочтительном варианте реализации изобретения, не происходит ухудшения зрения после устойчивого размещения имплантата и отсутствует раздражение радужной оболочки.
Дополнительные аспекты и преимущества настоящего изобретения изложены в приведенном ниже описании и формуле изобретения, в частности, при рассмотрении в сочетании с прилагаемыми чертежами.
Чертежи
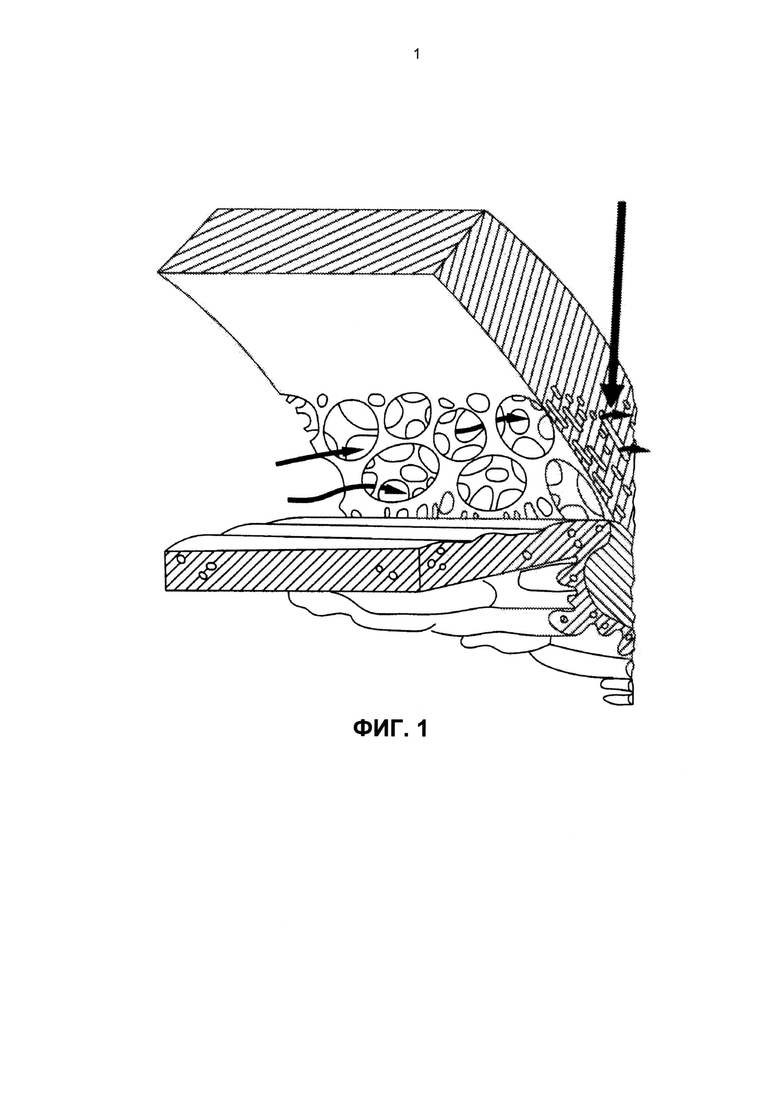
Фиг. 1 представляет собой изображение поперечного сечения области угла, образованного передней камерой нормального человеческого глаза, на котором показано направление потока внутриглазной жидкости (горизонтальные стрелки) через большие поры в трабекуле в юкстаканаликулярную область (показано вертикальной стрелкой).
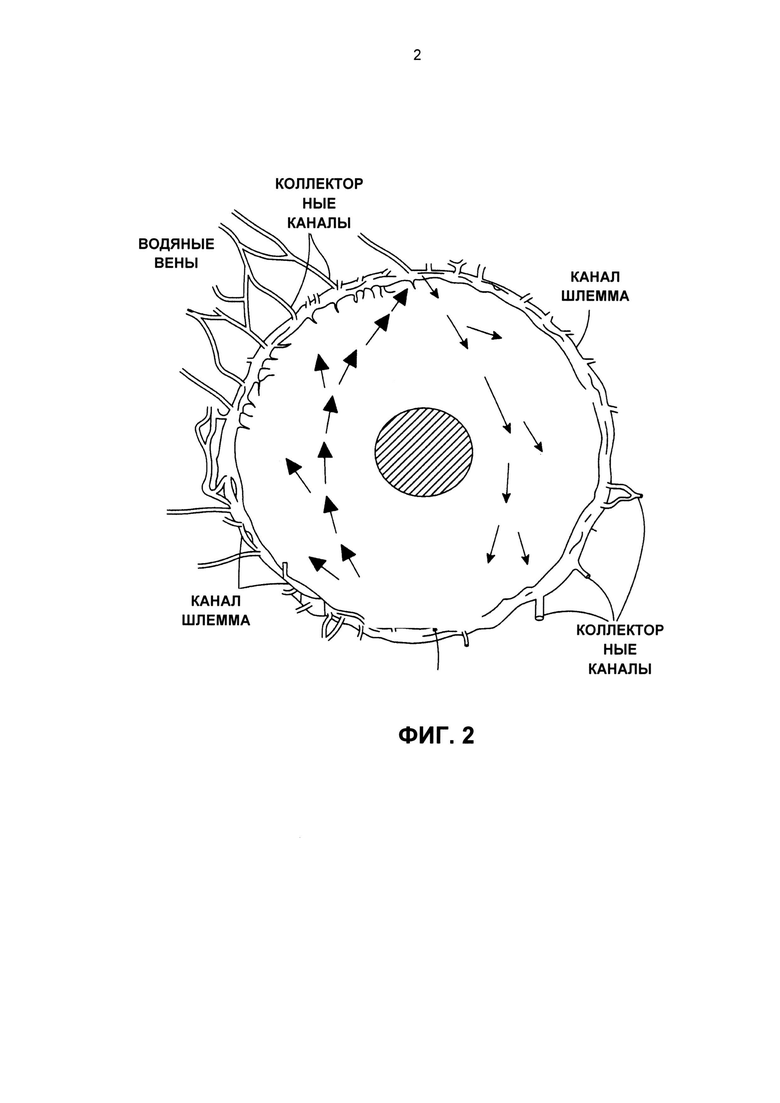
Фиг. 2 представляет собой схематический чертеж, на котором стрелками показаны конвективные потоки внутриглазной жидкости в передней камере глаза.
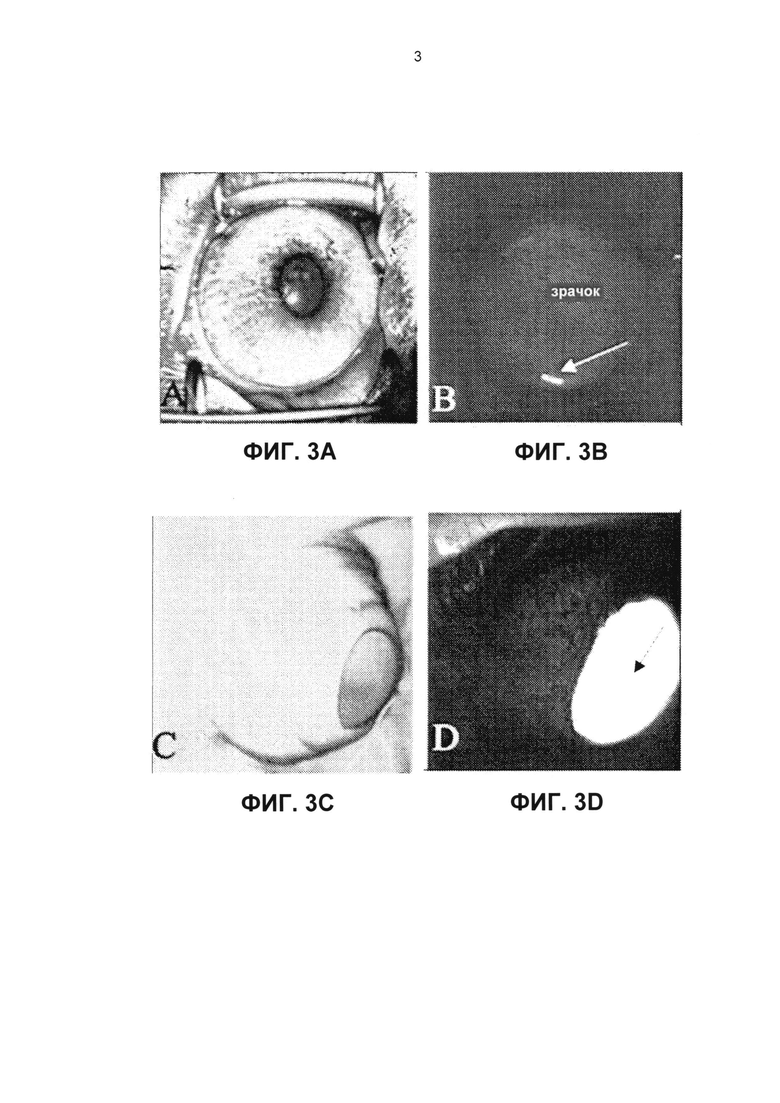
Фиг. 3А представляет собой фотографию наружной стороны глаза кролика, вид спереди.
Фиг. 3В представляет собой изображение глаза кролика, показанного на фиг. 3А, полученное с применением флуоресцеиновых фильтров в заданном месте на формирователе изображения Heidelberg HRA, через два дня после имплантации флуоресцеинового имплантата (стрелка).
Фиг. 3С представляет собой фотографию наружной стороны глаза кролика, повернутого вниз.
Фиг. 3D представляет собой изображение глаза кролика, показанного на фиг. 3С, полученное с помощью HRA через семь дней после имплантации флуоресцеинового имплантата, на котором показано распределение (стрелка) флуоресцеина, высвобождаемого из имплантата.
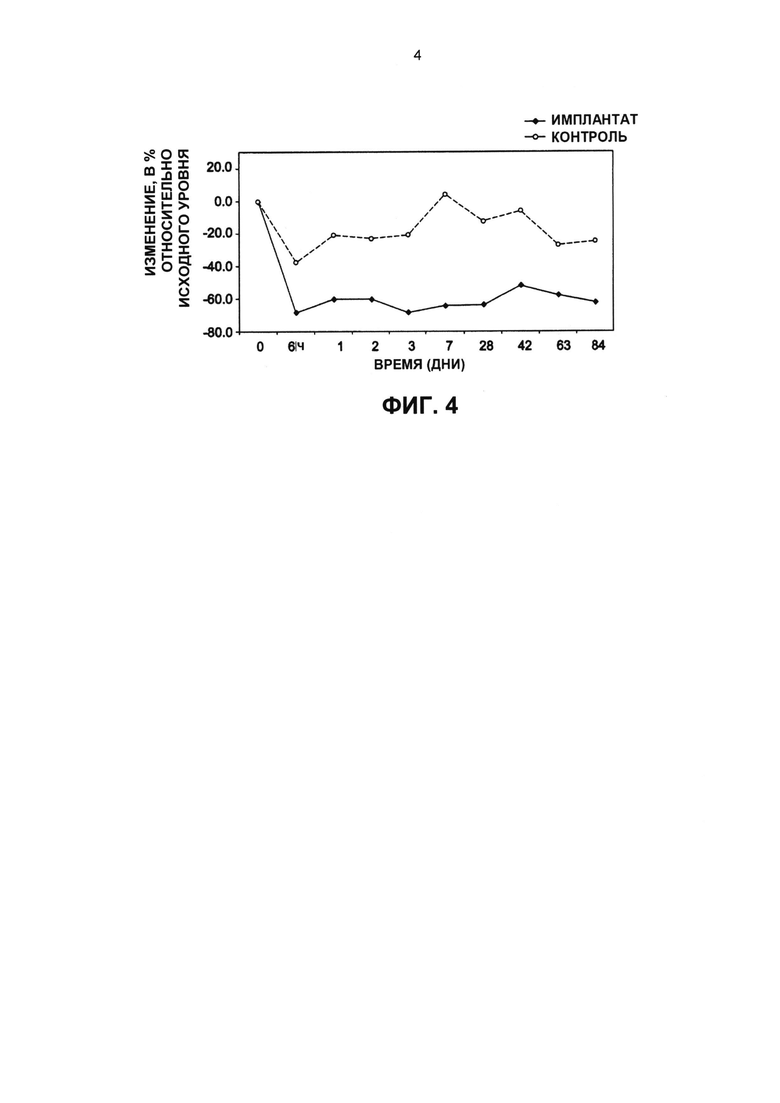
Фиг. 4 представляет собой график изменения в процентах внутриглазного давления от исходного уровня (ось Y) у исследуемой собаки относительно времени в днях (ось X) на протяжении 84-дневного периода после внутрикамерного введения имплантата ("Имплантат") в форме бруска с биматопростом, описанного в примере 5, который показывает, что падение ВГД на примерно 50% - 60% сохранялось в течение 84-дневного периода наблюдения. Во второй (левый или "контрольный") глаз вводили имплантат с плацебо (без биматопроста).
Описание
Транссклеральная доставка включает введение в глаз лекарственного препарата путем его местного (т.е., глазные капли), а также внутрисклерального (т.е., подконъюктивального или субтенонового) размещения (например, путем инъекции, ввода или имплантации). Предлагаемое нами изобретение основано на наблюдении, что транссклеральная доставка является неэффективным способом введения антигипертензивного препарата (лекарственного средства или биопрепарата) в целевую ткань водной камеры или стекловидной камеры глаза для лечения повышенного внутриглазного давления. Мы полагаем, что это действительно так из-за очевидного существования трех типов барьеров, затрудняющих транссклеральную доставку лекарственного препарата - статических, динамических и метаболических барьеров. Ткани глаза, которые обладают физическим барьером в отношении диффузии лекарственного препарата (склера, сосудистая оболочка Бруха, пигментный эпителий сетчатки), представляют собой статические барьеры. Динамические барьеры связаны механизмами выведения лекарственных препаратов через кровеносные и лимфатические сосуды, в основном, расположенные в конъюнктиве, через основной поток жидкости от передней к задней части глаза через сетчатку и выведения через хориокапилляр и склеру, и белки-переносчики пигментного эпителия сетчатки. Метаболические барьеры также существуют в глазу и уменьшают проникновение лекарственного препарата в глаз вследствие быстрого разложения введенных в склеру лекарственных препаратов. По-видимому, динамические барьеры являются наиболее важным барьером с точки зрения транссклеральной (т.е. субтеноновой) доставки терапевтических средств в переднюю часть глаза (переднюю камеру) для лечения внутриглазной гипертензии и глаукомы.
Предлагаемое нами изобретение основано на открытии, что прямое внутрикамерное введение лекарственного средства с замедленным высвобождением, как изложено в настоящей заявке, (включающей имплантаты, содержащие антигипертензивный препарат) можно эффективно применять для лечения глазного заболевания, такого как глаукома, характеризующегося повышенным внутриглазным давлением, минуя труднопреодолимые механизмы выведения лекарственного препарата через склеру.
Мы обнаружили существование подходящих альтернативных участков для доставки лекарственных препаратов в переднюю часть глаза (переднюю камеру) для понижения внутриглазного давления (ВГД) и преодоления активного выведения вызванного транссклеральным барьером. Внутрикамерные инъекции (т.е., прямая инъекция в переднюю камеру глаза) позволяют эффективно преодолеть транссклеральные барьеры и увеличить эффективность глазных антигипертензивных соединений. Важно то что, как было обнаружено нами, системы внутрикамерной доставки лекарственного средства требовали разработки системы доставки лекарственного средства замедленного высвобождения с новыми физическими свойствами, необходимыми для терапевтической эффективности вследствие уникальной анатомии и физиологии передней камеры глаза. Например, в передней камере глаза скорости водного потока являются высокими, и это может фактически элиминировать микросферы замедленного высвобождения, содержащие лекарственные препараты, понижающие ВГД, и ускорить разложение других полимерных систем доставки. Внутриглазная жидкость выделяется в заднюю камеру с помощью цилиарного тела, в частности, с помощью непигментированного эпителия цилиарного тела, за счет процесса, называемого ультрафильтрацией. Жидкость протекает через узкую щель между передней частью хрусталиков и задней частью радужной оболочки и выделяется через зрачок в переднюю камеру глаза. Внутриглазная жидкость дренирует в направлении 360 градусов в трабекулярную сеть, размеры диаметров пор которой на начальной стадии варьируют у людей от 10 до ниже 30 микрон (см. Фиг. 1). Фиг. 1 представляет собой изображение поперечного сечения области угла, образованного передней камерой глаза, на котором показано направление потока внутриглазной жидкости (горизонтальные стрелки) через поры большего размера (примерно от 10 до менее чем 30 микрон) в трабекуле и постепенно вплоть до юкстаканаликулярной области (показано вертикальной стрелкой), где размер пор снижается до примерно 6 микрон перед попаданием в канал Шлемма. Внутриглазная жидкость дренирует через канал Шлемма и выходит из глаза через 25-30 коллекторных каналов в водяные вены и, в конечном счете, в эписклеральную сосудистую сеть и вены глазницы (см. Фиг. 2). Фиг. 2 представляет собой схематический чертеж, на котором стрелки указывают конвективные потоки водной внутриглазной жидкости в передней камере глаза. Свободный лекарственный препарат, элюирующий из имплантата, поступает в конвективные потоки водной внутриглазной жидкости (стрелки). Затем лекарственный препарат успешно диспергируется по всей передней камере глаза и поступает в целевые ткани, такие как трабекулярная сеть и область цилиарного тела, через область корня радужной оболочки.
Другое преимущество внутрикамерной инъекции состоит в том, что передняя камера глаза представляет собой иммунологически привилегированную область тела и с меньшей вероятностью реагирует на инородный материал, такой как полимерные системы доставки лекарственного средства. Не так обстоит дело в случае субтенонового пространства, в котором при внесении инородных материалов часто имеют место воспалительные реакции. Помимо передней камеры глаза, содержащей иммунорегуляторные факторы, которые придают иммунную защиту, частицы с диаметрами больше чем 30 микрон, являются менее иммуногенными и проявляют меньшую склонность вызывать воспаление глаза. Оседлые макрофаги в глазу представляют собой первую линию обороны от инородных тел или возбудителей инфекции; однако, частицы с размером больше чем 30 микрон трудно фагоцитировать. Поэтому, частицы с размером больше чем 30 микрон проявляют меньшую склонность к активированию макрофагов и последующему воспалительному каскаду.
Мы обнаружили, что эффективность доставки лекарственного средства во внутриглазную жидкость с применением полимерной системы высвобождения гораздо выше при внутрикамерном размещении по сравнению с субтеноновым применением. Так, менее чем 1% лекарственного препарата, доставленного в субтеноновое пространство, будет поступать во внутриглазную жидкость, при этом 100% лекарственного препарата, высвобожденного из внутрикамерной системы, будет поступать во внутриглазную жидкость. Следовательно, ожидается, что для эффективных систем внутрикамерной доставки лекарственного средства потребуются меньшие дозы лекарственного препарата по сравнению с субтеноновой доставкой и, в результате, будет происходить меньшее системное воздействие указанного препарата. Кроме того, будет иметь место меньшее воздействие конъюнктивы на активный фармацевтический ингредиент и проявляться меньшая склонность в отношении развития конъюнктивальной гиперемии при доставке лекарственных препаратов, таких как простагландиновые аналоги. В заключении, лекарственный препарат будет поступать в конъюнктивальный/эписклеральный кровеносный сосуд непосредственно после внутрикамерных инъекций через водяные вены. Это может минимизировать конъюнктивальную гиперемию при применении простагландиновых аналогов по сравнению с субтеноновой инъекцией, когда множество сосудов подвергаются риску расширения при высокой концентрации лекарственного препарата, присутствующего диффузно в экстраваскулярном пространстве конъюнктивы. Прямые инъекции в глаз также устраняют необходимость применения консервантов, которые, при применении в местных каплях, могут раздражать поверхность глаза.
Антигипертензивные препараты, подходящие для применения в качестве активного агента в системах внутрикамерной доставки лекарственного средства с замедленным высвобождением, описанные в настоящей заявке, включают:
простагландины, простамиды и гипотензивные липиды (например, биматопрост (лумиган)) {биматопрост увеличивает увеосклеральный отток внутриглазной жидкости, а также увеличивает трабекулярный отток} и соединения, описанные в патенте США №5352708. Простагландины представляют собой класс фармакологически активных гормоноподобных веществ, вырабатываемых в различных тканях млекопитающих, которые образуются из арахидоновой кислоты и опосредуют широкий ряд физиологических функций, в том числе, кровяное давление, сокращение гладких мышц и воспаление. Латанопрост фактически представляет собой пролекарство простагландина (т.е. 1-изопропиловый эфир простагландина) однако, его называют простагландином, поскольку он оказывает действие на рецептор простагландина F после гидролизации до 1-карбоновой кислоты. Простамид (также называемый простагландин-этаноламидом) представляет собой аналог простагландина, который фармакологически отличается от простагландина (т.е., поскольку простамиды оказывают действие на другой клеточный рецептор [рецептор простамида], нежели простагландины) и представляет собой нейтральный липид, образованный как продукт ферментного оксигенирования с помощью циклооксигеназы-2 ("СОХ-2") эндоканнабиноида (такого как анандамид). Кроме того, простамиды не гидролизуются in-situ до 1-карбоновой кислоты. Примерами простамидов являются биматопрост (синтетически полученный этиламид 17-фенилпростагландина F2α) и простамид F2α;
аналоги простагландина (аналоги простагландина увеличивают увеосклеральный отток внутриглазной жидкости) (т.е. латанопрост [ксалатан]);
простамиды, такие как биматопрост.
Мы разработали имплантаты, которые способны высвобождать дозы лекарственного препарата в течение различных периодов времени. Такие имплантаты при внутрикамерном введении обеспечивают терапевтические уровни антигипертензивного препарата в течение длительных периодов времени (например, в течение примерно от 10 дней до примерно 120 дней). Кроме того, мы разработали новые способы изготовления имплантатов.
Подходящие полимерные материалы или композиции для применения в имплантате включают такие материалы, которые являются совместимыми, биосовместимыми с глазом, так что не вызывают значительного нарушения в функционировании или физиологии глаза. Указанные материалы предпочтительно являются по меньшей мере частично и, более предпочтительно, по существу полностью биоразлагаемыми или биоэродируемыми.
Примеры подходящих полимерных материалов включают, без ограничения, материалы, содержащие и/или полученные из органических простых и сложных эфиров, которые, при разложении, образуют физиологически приемлемые продукты разложения, в том числе, мономеры. Кроме того, также могут найти применение полимерные материалы, содержащие и/или полученные из ангидридов, амидов, ортоэфиров и т.п., сами по себе или в комбинации с другими мономерами. Полимерные материалы могут представлять собой полимеры, полученные ступенчатой полимеризацией, или конденсационные полимеры, преимущественно, конденсационные полимеры. Полимерные материалы могут быть сшитыми или несшитыми, например, только слегка сшитыми, например, когда менее чем примерно 5% или менее чем примерно 1% полимерного материала является сшитым. Большей частью, кроме углерода и водорода, полимеры будут включать по меньшей мере один элемент из кислорода и азота, преимущественно, кислород. Кислород может присутствовать в виде окси, например, гидрокси или эфира, карбонила например, карбонила, не относящегося к оксо, такого как эфир карбоновой кислоты и т.п.Азот может присутствовать в виде амида, циано и амино.
Дополнительный интерес представляют полимеры гидроксиалифатических карбоновых кислот, или гомополимеры или сополимеры, и полисахариды. Представляющие интерес простые полиэфиры включают полимеры D-молочной кислоты, L-молочной кислоты, рацемическую молочную кислоту, гликолевую кислоту, поликапролактон и их комбинации. В общем, при применении L-лактата или D-лактата, получают медленно эродирующий полимер или полимерный материал, при этом эрозия по существу усиливается при включении рацемата лактата. Из применимых полисахаридов, без ограничения, альгинат кальция и функционализированная целлюлоза, в частности, эфиры карбоксиметилцеллюлозы, характеризуются водонерастворимостью, молекулярной массой примерно от 5 кД до 500 кД, например.
Другие представляющие интерес полимеры включают, без ограничения, поливиниловый спирт, простые полиэфиры, сложные полиэфиры и их комбинации, которые биосовместимы и могут биодеградировать и/или биоразлагаться. Некоторые предпочтительные характеристики полимеров или полимерных материалов, применяемых в настоящем изобретении, могут включать биосовместимость, совместимость с выбранным терапевтическим средством, легкость применения полимера при изготовлении систем доставки лекарственного средства согласно настоящему изобретению, период полувыведения в физиологической среде, равный по меньшей мере примерно 6 часов, предпочтительно, больше чем примерно один день, и нерастворимость в воде.
Биоразлагаемые полимерные материалы, которые применяют для создания матрицы, являются предпочтительным объектом ферментативной или гидролитической нестабильности. Водорастворимые полимеры можно сшить путем образования гидролитических или биоразлагаемых нестабильных поперечных связей с получением подходящих водонерастворимых полимеров. Степень стабильности может широко варьировать, в зависимости от выбора мономера, применения гомополимера или сополимера, применения смесей полимеров и присутствия в полимере конечных кислотных групп.
В равной степени важным для регулирования биодеградации полимера и, следовательно, профиля длительного высвобождения имплантата является относительная средняя молекулярная масса полимерной композиции, применяемой в имплантатах.. Для латанопростных имплантатов, относительная средняя молекулярная масса полимера будет предпочтительно лежать в диапазоне от примерно 4 до примерно 25 кД, более предпочтительно, от примерно 5 до примерно 20 кД и, наиболее предпочтительно, от примерно 5 до примерно 15 кД.
Имплантаты могут быть монолитными, т.е., содержать активный агент или агенты, гомогенно распределенные по всей полимерной матрице или инкапсулированные, когда резервуар с активным агентом инкапсулирован с полимерной матрицей. Благодаря простоте изготовления, монолитные имплантаты обычно являются предпочтительными по сравнению с инкапсулированными формами. Однако, возможность более эффективного регулирования, предоставляемая инкапсулированными микросферами, может иметь преимущество при определенных обстоятельствах, когда терапевтический уровень лекарственного препарата попадает в узкое окно. Кроме того, терапевтический компонент, в том числе, латанопростный компонент, может быть распределен в матрице негомогенным образом. Суммарная масса имплантата в одной дозе представляет собой оптимальное количество, зависящее от объема передней камеры глаза и активности или растворимости активного агента. Наиболее часто, доза обычно составляет примерно от 0,1 мг до примерно 200 мг имплантата на дозу.
Имплантат может представлять собой частицы с любой геометрией, в том числе, микро- и наносферы, микро- и наночастицы, сферы, порошки, фрагменты и т.п. Верхний предел размера имплантата будет определен с учетом таких факторов, как переносимость, ограничение размеров с точки зрения введения, требуемая скорость высвобождения, удобство в обращении и т.п.
Соотношение антигипертензивного препарата, полимера и любых других модификаторов можно определить эмпирически. Для измерения скорости высвобождения можно применять способ, одобренный фармакопеей США, для испытаний на растворение или высвобождение (USP 23; NF 18 (1995) pp. 1790-1798). В дополнение к терапевтическому компоненту, имплантаты, описанные в настоящей заявке, могут включать композиции или могут быть обеспечены в композициях, которые включают эффективные количества буферных веществ, консервантов и т.п. Подходящие водорастворимые буферные вещества включают, без ограничения, карбонаты, фосфаты, бикарбонаты, цитраты, бораты, ацетаты, сукцинаты щелочных и щелочно-земельных металлов и т.п., такие как фосфат, цитрат, борат, ацетат, бикарбонат, карбонат натрия и т.п. Указанные вещества преимущественно присутствуют в количествах, достаточных для поддержания pH системы в диапазоне от примерно 2 до примерно 9 и, более предпочтительно, от примерно 4 до примерно 8. По существу, буферное вещество может составлять вплоть до примерно 5% по массе всего имплантата. Подходящие водорастворимые консерванты включают бисульфит натрия, бисульфат натрия, тиосульфат натрия, аскорбат, хлорид бензалкония, хлорбутанол, тимерозал, фенилртутьацетат, фенилртутьборат, фенилртутьнитрат, парабены, метилпарабен, поливиниловый спирт, бензиловый спирт, фенилэтанол и т.п. и их смеси.
Указанные вещества могут присутствовать в количествах от примерно 0.001% до примерно 5% по массе и, предпочтительно, от примерно 0.01% до примерно 2% по массе. По меньшей мере в одном из настоящих имплантатов содержится консервант хлорид бензалкония, например, когда латанопрост в основном состоит из биматопроста.
Различные методы можно применять для изготовления имплантатов, описанных в настоящей заявке. Подходящие методы включают, но не обязательно ограничиваются ими, методы самоэмульгирования, метод сверхкритических жидкостей, метод испарения растворителя, метод фазового разделения, метод распылительной сушки, метод измельчения, межфазные методы, методы формования, методы инжекционного формования, их комбинации и т.п.
Как описано в настоящей заявке, полимерный компонент, описанный в настоящем способе, может содержать биоразлагаемый полимер или биоразлагаемый сополимер. Согласно по меньшей мере одному варианту реализации изобретения, полимерный компонент содержит сополимер поли(лактид-со-гликолида) и ПМГК. Согласно дополнительному варианту реализации изобретения, соотношение лактид/гликолид в сополимере ПМГК составляет 75/25. Согласно еще дополнительному варианту реализации изобретения, сополимер ПМГК имеет по меньшей мере одну из молекулярных масс, равную примерно 63 килодальтон, и удельную вязкость примерно 0.6 дл/г.
Кроме того, максимальный диаметр частиц в настоящей совокупности микрочастиц может составлять менее чем примерно 200 мкм. Согласно некоторым вариантам реализации изобретения, средний диаметр частиц в совокупности микрочастиц может составлять менее чем примерно 50 мкм. Согласно дополнительным вариантам реализации изобретения, средний диаметр частиц в совокупности микрочастиц составляет от примерно 30 мкм до примерно 50 мкм.
Имплантаты, содержащие антигипертензивный препарат, описанные в настоящей заявке, можно применять для лечения глазного заболевания, такого как следующие заболевания: макулопатии/дистрофия сетчатки: дегенерация желтого пятна, в том числе, возрастная дегенерация желтого пятна (ARMD), такая как неэкссудативная возрастная дегенерация желтого пятна и экссудативная возрастная дегенерация желтого пятна, хориоидальная неоваскуляризация, ретинопатия, в том числе, диабетическая ретинопатия, острая и хроническая макулярная нейроретинопатия, центральная серозная хориопатия и макулярный отек, в том числе, кистозный макулярный отек и диабетический макулярный отек. Увеит/ретинит/хориоидит: острая многоочаговая плакоидная пигментированная эпителиопатия, болезнь Бехчета, дробьевидная ретинохориоидопатия, инфекционный (сифилис, болезнь Лайма, туберкулез, токсоплазмоз), увеит, в том числе, интермедиарный увеит (плоской части ресничного тела) и передний увеит, многоочаговый хориоидит, синдром множественных «летучих» белых пятен (MEWDS), глазной саркоидоз, задний склерит, серпигинозный хориоидит, субретинальный фиброз, увеит-синдром и синдром Фогта-Коянаги-Харада. Сосудистые заболевания/экссудативные заболевания: окклюзионное поражение артерии сетчатки, окклюзия центральной вены сетчатки, диссеминированная внутрисосудистая коагулопатия, окклюзия ветки вены сетчатки, гипертензивные изменения глазного дна, ишемический синдром глаза, ретинальная артериальная микроаневризма, болезнь Коутса, парафовеальная телеангиэктазия, гемиретинальная окклюзия вены сетчатки, папиллофлебит, окклюзия центральной артерии сетчатки, окклюзия ветки артерии сетчатки, болезнь сонной артерии (CAD), ангиит матовой ветви, серповидно-клеточная ретинопатия и другие гемоглобинопатии, ангиоидные полосы сетчатки, семейная эксудативная форма витреоретинопатии, болезнь Илза. Последствия травм/хирургических операций: симпатическая офтальмия, увеальное заболевание сетчатки, отслоение сетчатки, травма, последствия лечения лазером, фотодинамическим способом лечения, фотокоагуляция, гипоперфузия во время хирургической операции, радиационная ретинопатия, ретинопатия при пересадке костного мозга. Пролиферативные нарушения: пролиферативная витреальная ретинопатия и эпиретианальные мембраны, пролиферативная диабетическая ретинопатия. Инфекционные заболевания: гистоплазмоз глаза, токсокариаз глаза, вероятный синдром глазного гистоплазмоза (POHS), эндофтальмит, токсоплазмоз, заболевания сетчатки, связанные с ВИЧ инфекцией, хориоидальное заболевание, связанное с ВИЧ инфекцией, увеальное заболевание, связанное с ВИЧ инфекцией, вирусный ретинит, острый ретинальный некроз, прогрессивный внешний ретинальный некроз, грибковые заболевания сетчатки, сифилис глаза, туберкулез глаза, диффузионный односторонний подострый нейроретинит и миаз. Генетические заболевания: пигментная дистрофия сетчатки, системные заболевания, связанные с ретинальной дистрофией, врожденная постоянная куриная слепота, дистрофии колбочка сетчатки, дегенерация желтого пятна Штаргардта и желтопятнистая абиотрофия сетчатки, болезнь Беста, узорчатая дистрофия ретинального пигментированного эпителия, сцепленная с Х-хромосомой расщелина сетчатки, дистрофия глазного дна Сорсби, доброкачественная концентрическая макулопатия, дистрофия хрусталика Биетти, эластическая псевдоксантома. Разрыв сетчатки/перфорация сетчатки: отслоение сетчатки, перфорация сетчатки, гигантский разрыв сетчатки. Опухоли: заболевание сетчатки, связанное с опухолями, врожденная гипертония пигментного эпителия сетчатки, задняя увеальная меланома, хориоидальная гемангиома, хориоидальная остеома, хориоидальный метастаз, смешанная гамартома сетчатки и ретинального пигментированного эпителия, ретинобластома, вазопролиферативные опухоли глазного дна, ретинальная астроцитома, внутриглазные лимфоидные опухоли. Другие заболевания: точечная внутренняя эпителиопатия, острая задняя многоочаговая плакоидная пигментированная эпителиопатия, миопическая дистрофия сетчатки, острый ретинальный пигментный эпителиит и т.п.
Имплантат в рамках объема предлагаемого нами изобретения можно приготовить с применением высоковязкого, полимерного геля для снижения дисперсии композиции после внутриглазной инъекции. Предпочтительно, гель имеет высокую характеристику сдвига, что означает, что гель можно инъецировать в участок внутри глаза через иглу калибра 25-30 и, более предпочтительно, через иглу калибра 27-30. Подходящий гель для этой цели может представлять собой гидрогель или коллоидный гель, приготовленный в виде дисперсии в воде или другой водной среде. Примеры подходящих гелей включают синтетические полимеры, такие как полигидроксиэтил метакрилат и сшитый химическим или физическим путем поливиниловый спирт, полиакриламид, поли(N-винилпиролидон), полиэтиленоксид и гидролизованный полиакрилонитрил. Примеры подходящих гидрогелей, которые представляют собой органические полимеры, включают сшитые с помощью ковалентных или ионных связей гидрогели на основе полисахаридов, такие как соли многовалентных металлов альгината, пектин, карбоксиметилцеллюлоза, гепарин, гиалуронат (т.е. полимерная гиалуроновая кислота) и гидрогели из хитина, хитозана, пуллулана, геллана, ксантана и гидроксипропилметилцеллюлозы. В качестве высоковязкого геля согласно некоторым вариантам реализации предложенной нами фармацевтической композиции можно применять коммерчески доступные кожные наполнители (такие как Hylafrom®, Restylane®, Sculptura™ и Radiesse).
Гиалуроновая кислота ("ГК") представляет собой полисахарид, вырабатываемый различными тканями тела. В патенте США 5166331 описана очистка различных фракций гиалуроновой кислоты для применения в качестве заменителя внутриглазных жидкостей и в качестве топического носителя глазного лекарственного препарата. Другие патентные заявки США, в которых описаны применения гиалуроновой кислоты для лечения глаз, включают №11/859627; 11/952927; 10/966764; 11/741366; и 11/039192. Фармацевтические композиции в рамках объема предлагаемого нами изобретения предпочтительно содержат высоковязкую гиалуроновую кислоту, средняя молекулярная масса которой составляет от примерно 1 до 4 миллион Дальтон и, более предпочтительно, средняя молекулярная масса составляет от примерно 2 до 3 миллион Дальтон и, наиболее предпочтительно, средняя молекулярная масса составляет от примерно (±10%) 2 миллиона Дальтон.
Сухой несшитый материал ГК включает волокна или порошок коммерчески доступной ГК, например, волокна или порошок гиалуроната натрия (NaГК). ГК может представлять собой гиалуронат натрия, поставляемый бактериями, гиалуронат натрия, полученный из животных, или их комбинацию. Согласно некоторым вариантам реализации изобретения, сухой материал ГК представляет собой комбинацию исходных материалов, в том числе, ГК и по меньшей мере одного другого полисахарида, например, гликозаминогликан (ГАГ). В нашем изобретении, применяемая ГК содержит или состоит из высокомолекулярной ГК. То есть, почти 100% материала ГК в настоящих композициях представляют собой высокомолекулярную ГК. Высокомолекулярная ГК означает ГК с молекулярной массой по меньшей мере примерно от 1,0 миллиона Дальтон (мол.м. ≥106 Да) до примерно 4.0 миллион Да (мол.м ≤4×106 Да). Например, молекулярная масса высокомолекулярной ГК в настоящих композициях может составлять примерно 2.0 миллион Да (мол.м 2×106 Да). В другом примере, молекулярная масса высокомолекулярной ГК может составлять примерно 2.8 миллион Да (мол.м 2.8×106 Да).
Согласно одному варианту реализации предлагаемого нами изобретения, сухая или необработанная ГК (в этом конкретном примере, NaГК) с требуемым соотношением высоко/низкомолекулярной массы очищают от примесей и рафинируют. Эти стадии в общем случае включали гидратацию сухих волокон или порошка ГК при требуемом соотношении высоко/низкомолекулярной массы, например, путем применения чистой воды, и фильтрования материала для удаления крупных инородных веществ и/или других примесей. Затем отфильтрованный, гидратированный материал высушивают и очищают. Высоко и низкомолекулярную NaГК можно очистить от примесей и рафинировать по отдельности или можно смешать вместе, например, в требуемом соотношении, непосредственно перед поперечным сшиванием. На этой стадии процесса, чистые, высушенные волокна NaГК гидратируют в щелочном растворе с получением щелочного геля несшитой NaГК. На этой стадии для гидротирования ΝaΓΚ можно применять любой подходящий щелочной раствор, например, но не ограничиваясь водным раствором, содержащим NaOH. Образовавшийся щелочной гель будет иметь pH выше 7,5, например, pH выше 8, например, pH выше 9, например, pH выше 10, например, pH выше 12, например, pH выше 13. В этом конкретном примере, следующая стадия производственного процесса включает стадию поперечного сшивания гидратированного, щелочного геля NaГК с помощью подходящего агента для поперечной сшивки, например, бутандиол-диглицидил-эфира (BDDE).
Стадию поперечного сшивания можно выполнить с применением способов, известных специалистам в данной области техники. Такие специалисты в данной области техники понимают, как оптимизировать условия поперечного сшивания в соответствии со свойствами ГК и как осуществить сшивание с достижением оптимизированной степени. Согласно некоторым вариантам реализации настоящего изобретения, степень поперечного сшивания составляет по меньшей мере примерно от 2% до примерно 20%, например, составляет примерно от 4% до примерно 12%, при этом степень поперечного сшивания определяют как процентное соотношение в композиции массы агента для поперечной сшивки к массе ГК-мономерных звеньев. Гидратированный сшитый гель ГК можно нейтрализовать путем добавления водного раствора, содержащего HCl. Затем гель набухает в фосфатно-солевом буферном растворе в течение достаточного времени и при низкой температуре.
Согласно некоторым вариантам реализации изобретения, образовавшийся набухший гель (ГК) представляет собой когезионный гель, содержащий по существу визуально не различимые частицы, например, по существу визуально не различимые частицы при рассмотрении невооруженным глазом. Согласно некоторым вариантам реализации изобретения, гель содержит по существу визуально не различимые частицы при увеличении менее чем в 35 крат. Потом гель (ГК) очищают с применением общепринятых способов, например, диализа или осаждения спиртом, для извлечения сшитого материала, стабилизации pH полученного материала и удалению непрореагировавшего агента для поперечной сшивки. Для доведения концентрации NaГК в композиции до требуемой можно добавить дополнительное количество воды или слегка щелочного водного раствора. Согласно некоторым вариантам реализации изобретения, концентрация NaГК в композиции находится в диапазоне от примерно 10 мг/мл до примерно 30 мг/мл.
Имплантаты в рамках предлагаемого нами изобретения можно ввести с применением любого подходящего устройства для внутриглазной инъекции, в том числе, аппликаторов (инжекторов), показанных в патентных заявках США 11/455392; 11/552835; 11/552630 и 12/355709.
Варианты реализации согласно нашему изобретению могут представлять собой биоразлагаемые имплантаты замедленного высвобождения. Предпочтительный вариант реализации предлагаемого нами изобретения представляет собой имплантат из ПМК и/или ПМГК, содержащий антигипертензивный препарат, поскольку мы установили, что имплантаты из такой композиции вызывают значительно меньшее воспаление (т.е. меньшую корнеальную гиперемию) после внутрикамерного введения или введения в переднюю область стекловидного тела. Вариант реализации предлагаемого нами изобретения может включать систему доставки лекарственного средства с множеством антигипертензивных препаратов, содержащихся в различных сегментах одного и того же имплантата или в различных имплантатах, введенных одновременно. Например, один сегмент (т.е., один имплантат) может содержать мускариновый антигипертензивный препарат, второй сегмент (т.е., второй имплантат) может содержать антигипертензивный простагландин, и третий сегмент (т.е., третий имплантат) может содержать антигипертензивный бета-блокатор. Многочисленные имплантаты ("сегменты") можно инъецировать одновременно, например, один имплантат с антигипертензивным препаратом для усиления оттока воды через трабекулярную сеть (например, мускариновый препарат), второй имплантат можно применять для усиления увеосклерального потока (например, гипотензивный липид) и третий имплантат может понижать выработку внутриглазной жидкости (например, бета-блокатор). Многочисленные антигипертензивные препараты с различными механизмами действия могут быть более эффективными при понижении ВГД, чем монотерапия, то есть, применение одного типа антигипертензивного препарата. Преимущество многочисленных сегментов (имплантатов) состоит в возможности использования более низких доз каждого отдельного применяемого антигипертензивного препарата по сравнению с дозой, необходимой при монотерапии, и, тем самым, уменьшении побочных эффектов каждого применяемого антигипертензивного препарата. Отдельный и дополнительный сегмент, содержащий, например, нейропротективное или нейростимулирующее соединение, можно также доставить вместе с другими сегментами, содержащими антигипертензивные препараты.
В том случае, когда используются множественные сегменты (т.е., множества введенных имплантатов), длина каждого сегмента предпочтительно составляет не больше чем примерно 2 мм. Предпочтительно, общее количество сегментов, введенных в одном и том же канале иглы с диаметром 22-25 калибра, составляет примерно четыре. При применении иглы с диаметром 27 калибра суммарная длина сегментов в канале иглы или просвете может доходить до примерно 12 мм.
Мы установили, что трабекулярная сеть (ТС) проявляет обнаруживаемое поглощение жидкости или эффект всасывания в отношении жидкости водной камеры глаза. Такое поглощение жидкости трабекулярной сетью вызывает дренирование микросфер (МС) с диаметром менее чем 30 микрон в ТС, как было установлено нами путем создания изображений методом гониоскопии.
Мы также установили, что эффект поглощения жидкости трабекулярной сетью можно использовать, чтобы помешать имплантатам, которые имеют подходящие геометрические размеры, блуждать по всей передней камере глаза, вызывая ухудшение зрения. Сила тяжести направляет эти имплантаты вниз в положение, соответствующее 6-ти часам на циферблате, и мы обратили внимание, что имплантаты очень устойчивы (сравнительно неподвижны) в этом положении. Имплантаты, которые можно ввести внутрь глаза с помощью иглы с диаметром 22-30 калибра и длиной, составляющей в сумме не более чем примерно 6-8 мм (при включении всех сегментов), являются наиболее предпочтительными с точки зрения использования преимущества механизма поглощения жидкости трабекулярной сетью и обеспечивают неподвижность внутриглазного имплантата и отсутствие ухудшения зрения. Таким образом, несмотря на устойчивость в положении, соответствующем 6-ти часам на циферблате в передней камере глаза благодаря эффекту поглощения жидкости трабекулярной сетью, имплантаты могут иметь скорость высвобождения, превышающую скорость выведения через ТС, и это позволяет антигипертензивному препарату, высвобождаемому имплантатами, быстро заполнить переднюю камеру глаза и равномерно распределиться в целевых тканях согласно схеме распределения в направлении 360 градусов. Наше исследование имплантатов в углу передней камеры глаза с применением гониоскопии показало отсутствие инкапсуляции воспалительной ткани вблизи имплантатов.
Примеры
В следующих примерах описаны неограничивающие варианты реализации согласно нашему изобретению.
Пример 1
Определение конвективных потоков в передней камере глаза
Мы установили, что в передней камере глаза существуют вертикальные восходящие конвективные потоки, движущиеся от положения, соответствующего 6-ти часам на циферблате, к положению, соответствующему 12-ти часам на циферблате, возникающие за счет более высоких температур внутриглазной жидкости, находящейся в контакте с радужной оболочкой. Мы также установили, что в передней камере глаза существуют нисходящие конвективные водные потоки, проходящие от положения, соответствующего 12-ти часам на циферблате, к положению, соответствующему 6-ти часам на циферблате, возникающие за счет более низких температур внутриглазной жидкости, прилегающей к корнеальному эндотелию. См. Фиг. 2. Мы высказали гипотезу, что указанные потоки внутриглазной жидкости могут эффективно переносить антигипертензивные лекарственные препараты по всей передней камере глаза согласно схеме распределения в направлении 360 градусов, если система доставки высвобождает лекарственный препарат непосредственно во внутриглазную жидкость, и мы продемонстрировали эффективность конвективных потоков в распределении суррогатного лекарственного препарата в передней камере глаза путем визуализирующего исследования высвобождения из имплантата с замедленным высвобождением, помещенного в переднюю камеру глаза. См. Фиг. 3.
Кроме того, мы изготовили микросферы с диаметрами, большими, чем 30 микрон, и с плотностью, достаточной для осаждения в нижнем углу передней камеры глаза после внутрикамерной инъекции микросфер. Важно, что микросферы с диаметром, большим, чем 30 микрон, не выводятся через трабекулярную сеть и не встраиваются в нее, тем самым, гарантируя, свободное высвобождение лекарственного препарата непосредственно в водные потоки, которые эффективное распределяют лекарственный препарат в углу согласно схеме распределения в направлении 360 градусов. Свободный лекарственный препарат может проходить через трабекулярную сеть и корень радужной оболочки в область цилиарного тела. Для ускорения оседания составов микросфер в положение, соответствующее 6-ти часам на циферблате, к микросферам, в качестве носителя, можно добавить несшитый или сшитый гидрогель, такой как гиалуроновая кислота или соединение метил целлюлозы, при концентрации 0.2%-4%. Добавление геля может облегчить прохождение микросфер с диаметрами больше чем 30 микрон через иглы маленького калибра (например, калибра 27-30) и позволяет применять их в предварительно заполненных шприцах. Также можно применять альтернативные системы доставки, такие как твердые имплантаты с биоразлагаемыми полимерами, поскольку они будут оседать в положении, соответствующем 6-ти часам на циферблате, после инъекции в переднюю камеру глаза (см. Фиг. 3В).
Так, на Фиг. 3 представлено доказательство доставки лекарственного средства во внутриглазную жидкость (после внутрикамерного размещения имплантата в положении, соответствующем 6-ти часам на циферблате) с помощью конвективных потоков, которое можно визуально видеть благодаря применению формирователя изображения Heidelberg HRA. Фиг. 3А представляет собой фотографию наружной стороны глаза кролика при взгляде спереди. Фиг. 3В представляет собой изображение глаза кролика, показанного на Фиг. 3А, полученное с применением флуоресцеиновых фильтров в заданном месте на приборе HRA. На Фиг. 3В показан кролик через два дня после имплантации флуоресцеинового имплантата с замедленным высвобождением в переднюю камеру глаза и, как можно видеть, имплантат оседал в положение, соответствующее 6-ти часам на циферблате. Фиг. 3С представляет собой фотографию наружной стороны того же глаза кролика, повернутого вниз.
Фиг. 3D представляет собой изображение глаза кролика, показанного на Фиг. 3С, полученное с помощью прибора HRA. На Фиг. 3D показан кролик через 7 дней после имплантации флуоресцеинового имплантата с замедленным высвобождением в переднюю камеру глаза, который опустился в положение, соответствующее 6-ти часам на циферблате, как показано на Фиг. 3В. Отметим, что с помощью конвективных потоков, свободный флуоресцеин, высвобожденный из имплантата, равномерно распределился по всей передней камере глаза (стрелка) и, тем самым, окажет воздействие в направлении 360 градусов на трабекулярную сеть и цилиарное тело, целевые ткани с целью гипотензивного лечения.
Мы также установили, что микросферы или другие системы доставки замедленного высвобождения, которые имеют более низкую плотность, чем внутриглазная жидкость, могут являться терапевтически применимыми, поскольку они будут всплывать и оседать сверху в положении, соответствующем 12-ти часам на циферблате. В настоящем документе система доставки лекарственного средства может высвобождать лекарственный препарат в конвективные потоки и это является подходящей альтернативой систем доставки, которые размещают в положение, соответствующее 6-ти часам на циферблате с целью распределения свободного лекарственного препарата под углом 360 градусов. Таким образом, мы воспользовались прежними изображениями суррогата лекарственного препарата, инъецированного в положение, соответствующее 6-ти часам на циферблате, и продемонстрировали присутствие конвективных потоков в передней камере глаза, которые распределяли суррогат лекарственного препарата по всей (воздействие гомогенного лекарственного препарата в направлении 360 градусов) передней камере глаза в течение 20 минут.
Как описано ниже, мы разработали метод, в котором ПВА (поливинилацетатный) стабилизатор, применяемый в производственном процессе, промывали водой 5 раз для удаления ПВА компонента с микросфер. Такая химическая модификация позволяла микросферам всплывать в направлении положения, соответствующего 12-ти часам на циферблате, в передней камере глаза, поскольку поверхности микросфер становятся очень гидрофобными после потери гидрофильного ПВА, и вода не может эффективно увлажнять поверхности частиц. Крайне важно, чтобы система доставки лекарственного средства быстро оседала вниз или верх для очищения зрительной оси от какой-либо преграды.
Неожиданно, фармакокинетическое изучение, направленное на исследование уровней лекарственного препарата в тканях цилиарного тела, продемонстрировало высокие концентрации после инъекции имплантатов замедленного высвобождения в переднюю область стекловидного тела. Ранее полагали, что большинство лекарственных препаратов, инъецированных в полость стекловидного тела, будет диффундировать и/или направляться под действием различных механизмов в заднюю часть глаза и элиминировать через сетчатку и сосудистую оболочку глаза. Мы провели визуализирующие и фармакологические исследования и разместили системы доставки в переднее основание стекловидного тела и установили, что, тем самым, можно осуществить доставку антигипертензивных препаратов в цилиарное тело с достижением более низкого ВГД. Указанные визуализирующие исследования продемонстрировали, что лекарственный препарат, помещенный в переднее основание стекловидного тела, может иметь доступ во внутриглазную жидкость в задней камере и быстро диспергировать в направлении 360 градусов, как в глазах животных, так и человека. Системы доставки лекарственного средства, такие как микросферы и имплантаты, можно обычным способом поместить в переднюю область стекловидного тела, применяя стандартные хирургические процедуры. Магнитно-резонансные визуализирующие исследования были проведены с применением свиного глаза после инъекции суррогата лекарственного препараты в переднюю область стекловидного тела. Лекарственный препарат быстро проходил в заднюю камеру и распределялся по всему цилиарному телу в направлении 360 градусов. Кроме того, мы проводили магнитно-резонансные визуализирующие исследования человеческого глаза после инъекции суррогата лекарственного препарата в переднюю область стекловидного тела и, показали, что лекарственный препарат быстро проходил в заднюю и переднюю камеру глаза, что свидетельствует о возможности доставки лекарственных препаратов во внутриглазную жидкость посредством инъекций в стекловидное тело.
Пример 2
Внутрикамерный имплантат с биматопростом
Экструдированные путем нагревания имплантаты замедленного высвобождения, содержащие биматопрост, были изготовлены с применением 45 масс.% резомера R203s (поли-DL-молочная кислота), 20 масс.% R202H (поли(DL-лактид)), 30 масс.% дозы лекарственного препарата и 5 масс.% ПЭГ 3350 в качестве сорастворителя. Суммарная масса изготовленных имплантатов в форме бруска составляла или 1.64 мг (492.4 мкг доза лекарственного препарата) или 800 мкг, при этом последний, имплантат половинного размера в форме бруска, имел ширину 1 мм и длину 2 мм. Показанные имплантаты высвобождали in vitro биматопрост в течение четырех месяцев.
Внутрикамерное введение
Один 800 мкг имплантат с биматопростом вставляли в переднюю камеру глаза через отлогий надрез в прозрачной роговице сверху около лимба правого глаза, левый глаз получал имплантат с плацебо (не содержащий биматопрост). Имплантат был помещен сверху в точку, соответствующую 6-ти часам на циферблате, и оседал вниз в положении, соответствующем 6-ти часам на циферблате, в течение 24 часов после введения. Была отмечена медленная биоэрозия имплантата и отсутствие признаков внутриглазной токсичности. Имело место значительное снижение ВГД на 60-70% относительно показаний исходного уровня, отмеченное в первые 24 часа и сохраняющееся впоследствии. См. Фиг. 7.
Имплантат высвобождал примерно 6 мкг биматопроста каждый день в течение первых 30 дней после введения. Имплантат при введении хорошо соответствовал лунке угла вдоль трабекулярной сети в 6-часовом положении. Угол передней камеры возникает, когда роговица соприкасается с радужной оболочкой. В это месте находится трабекулярная сеть, которая представляет собой участок, на котором (в нормальном глазу) внутриглазная жидкость дренирует из глаза. Если внутриглазная жидкость не может вытекать из глаза надлежащим образом, возникает повышенное внутриглазное давление. Фиг. 7 представляет собой график процентного изменения от исходного уровня внутриглазного давления (ось Y) у исследуемой собаки относительно времени в днях (ось X) на протяжении 84-дневного периода после внутрикамерного введения имплантата в форме бруска ("Импрантат") с биматопростом, который показывает, что падение ВГД на примерно 50% - 60% сохранялось на протяжении 84-дневных периодов наблюдений, что свидетельствует об огромном превосходстве такого одного внутрикамерного имплантата замедленного высвобождения по сравнению с альтернативным ежедневным (по меньшей мере один раз каждый день в течение 84 дней) введением глазных капель с антигипертензивным препаратом для лечения повышенного ВГД.
Пример 3
Внутрикамерные имплантаты с латанопростом
Изготавливали имплантат замедленного высвобождения с латанопростом (тепловая экструзия), содержащий 30% латанопроста, 40% RG752s, 20% RG502s, 5% плаздона и 5% ПЭГ 3350 и внутрикамерно инъецировали в левый глаз собаки. С помощью кератома делали пологий надрез в положении, соответствующем 11-ти часам на циферблате, и вставляли имплантат с латанопростом в переднюю камеру глаза. Надрез закрывали с применением викрилового шва 9-0. Наблюдалось примерно 50% снижение ВГД от исходного уровня, зарегистрированное в этом глазу через 24 часа.
Пример 4
Имплантаты, содержащие антигипертензивный лекарственный препарат
Биоразлагаемые имплантаты замедленного высвобождения, содержащие антигипертензивный лекарственный препарат, можно приготовить для внутрикамерной инъекции для лечения гипертензивного состояния, такого как глаукома. Антигипертензивный лекарственный препарат представляет собой латанопрост или биматопрост. Имплантаты могут быть получены посредством экструзии горячего расплава и содержат примерно 30 масс.% латанопроста или биматопроста, 40-60 масс.% биоразлагаемого поли(DL-лактид-ко-гликолид) полимера (резомер® RG752s)(ПМГК), 0-20% биоразлагаемого поли(DL-лактид) полимера (резомер® R202s)(ПМК) и 10% ПЭГ-3350.
В этом примере биоразлагаемые полимерные имплантаты, содержащие предложенное соединение, можно изготовить с помощью экструзии горячего расплава, применяя поршневой микроэкструдер с механическим приводом, но их также можно получить посредством прямого прессования или формования окунанием в раствор. Имплантаты предпочтительно имеют форму стержня, но их можно выполнить в любой геометрической форме, изменяя экструзионную матрицу или пресс-форму. Полимеры (резомеры) применяют в том виде, в котором они получены из компании Boehringer Ingelheim.
Соединение (латанопрост или биматопрост) и порошок полимера и резомера сначала перемешивают (включая 10 масс.% ПЭГ) с помощью шпателя в блюдце весов в течение 15 минут. Затем смесь переносят в контейнер из нержавеющей стали, содержащий шарик из нержавеющей стали размером 2% дюйма, и продолжают перемешивание, применяя смеситель Turbula, в течение двух отдельных 15-минутных циклов. В промежутке между каждым циклом и после конечного цикла порошковую смесь перемешивают вручную с применением шпателя. Затем смешанный материал уплотняют в цилиндре экструдера и помещают цилиндр экструдера в нагретую камеру (50-55°С) поршневого экструдера и выдавливают, применяя насадку 500 пм и показатель установки скорости 0.0025. Экструдированные имплантаты в виде нити (в форме стержня) разрезают с получением имплантата весом один миллиграмм (приблизительно 3 мм длины). Такие биоразлагаемые имплантаты замедленного высвобождения можно ввести внутрикамерно с обеспечением пониженного ВГД (гипотензивный эффект) в течение от 1 до 6 месяцев (или дольше).
Все ссылки, статьи, публикации, патенты и заявки на патент, упоминаемые в настоящем документе, в полном объеме включены в него посредством ссылки.
Хотя настоящее изобретение было описано в отношении различных конкретных примеров и вариантов реализации изобретения, следует понимать, что это изобретение не ограничено ими и что оно может быть реализовано на практике в рамках объема приведенной ниже формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВНУТРИГЛАЗНЫЕ СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2532333C2 |
| СНИЖЕНИЕ ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ ПРИ ПОМОЩИ ВНУТРИКАМЕРНЫХ ИМПЛАНТАТОВ БИМАТОПРОСТА | 2011 |
|
RU2586298C2 |
| ВНУТРИГЛАЗНЫЕ ИМПЛАНТАТЫ, СОДЕРЖАЩИЕ ПРОСТАМИД, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2650614C2 |
| ВНУТРИКАМЕРНЫЕ ИМПЛАНТАТЫ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ ТЕРАПЕВТИЧЕСКОГО АГЕНТА | 2011 |
|
RU2565445C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА ВНУТРЬ ГЛАЗА | 2007 |
|
RU2440102C2 |
| ВНУТРИГЛАЗНЫЕ ИМПЛАНТАТЫ, СОДЕРЖАЩИЕ ПРОСТАМИДЫ | 2014 |
|
RU2666603C2 |
| УСТРОЙСТВО ДОСТАВКИ ВНУТРИГЛАЗНОГО ИМПЛАНТАТА И СПОСОБЫ ЕГО ИСПОЛЬЗОВАНИЯ | 2015 |
|
RU2728195C2 |
| СПОСОБ ЛЕЧЕНИЯ АТРОФИЧЕСКОЙ ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ | 2009 |
|
RU2521338C9 |
| Способ лечения атрофической возрастной макулярной дегенерации | 2009 |
|
RU2668371C2 |
| ИМПЛАНТАТ ДЛЯ ПРОЛОНГИРОВАННОЙ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2014 |
|
RU2641021C2 |
Изобретение относится к области медицины, а именно к офтальмологии, и предназначено для лечения повышенного внутриглазного давления. Способ лечения повышенного внутриглазного давления включает стадию внутрикамерного введения пациенту вплотную к трабекулярной сети имплантата с замедленным высвобождением. Указанный имплантат выполнен в форме стержня, содержащего биоразлагаемый полимерный матрикс и латанопрост или биматопрост. Имплантат содержит от примерно 10 до примерно 50 мас.% латанопроста или биматопроста и от примерно 50 до примерно 90 мас.% биоразлагаемого полимерного матрикса. Имплантат высвобождает терапевтически эффективные количества латанопроста или биматопроста на протяжении периода времени от примерно 10 дней до примерно 120 дней. Использование изобретения позволяет повысить эффективность лечения повышенного внутриглазного давления за счет прямого внутрикамерного введения лекарственного средства с замедленным высвобождением. 4 ил., 4 пр.
Способ лечения повышенного внутриглазного давления, включающий стадию внутрикамерного введения пациенту с повышенным внутриглазным давлением вплотную к трабекулярной сети имплантата с замедленным высвобождением, выполненного в форме стержня, содержащего биоразлагаемый полимерный матрикс и латанопрост или биматопрост, при этом имплантат содержит от примерно 10 до примерно 50 мас.% латанопроста или биматопроста и от примерно 50 до примерно 90 мас.% биоразлагаемого полимерного матрикса, причем имплантат высвобождает терапевтически эффективные количества латанопроста или биматопроста на протяжении периода времени от примерно 10 дней до примерно 120 дней.
| US 2005244464 A1, 03.11.2005 | |||
| WO 2008070402 A2, 12.06.2008 | |||
| US 2006246145 A1, 02.11.2006 | |||
| US 2006182781 A1, 17.08.2006 | |||
| MARQUIS RE et al | |||
| Management of glaucoma: Focus on pharmacological therapy | |||
| Drugs Aging, 2005, 22 (1), p.1-21. |
Авторы
Даты
2018-08-21—Публикация
2014-08-15—Подача