ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет предварительной заявки на патент США №61/765554, поданной 15 февраля 2013 г., полное содержание которой включено в данное описание посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Область техники
Описание данной заявки в целом относится к имплантатам для доставки лекарственных средств и более конкретно к имплантатам для доставки лекарственных средств, используемых для лечения глазных патологий.
Описание предшествующего уровня техники
Диабетическая ретинопатия является основной причиной слепоты у взрослых в возрасте от 20 до 74 лет. По оценкам, каждый год регистрируется 75000 новых случаев макулярного отека, 65000 случаев пролиферативной ретинопатии и от 12000 до 24000 новых случаев слепоты. Пигментный ретинит (ПР) представляет собой гетерогенную группу наследственных нейродегенеративных заболеваний сетчатки, которые вызывают гибель фоторецепторных клеток (палочек и колбочек), что со временем приводит к слепоте. Глаукома представляет собой многофакторную оптическую невропатию, вызванную потерей клеток ретинальных ганглиев, соответствующей атрофией зрительного нерва и потерей зрительной функции, что проявляется преимущественно в потере поля зрения, а также снижении остроты зрения и цветового зрения. Географическая атрофия (ГА) является одной из 2 форм продвинутой стадии возрастной макулярной дегенерации (ВМД). Продвинутая стадия ВМД относится к стадии, на которой ВМД может привести к потере остроты зрения. Отслоение сетчатки является характерной причиной заболеваемости глаз. Существует 3 типа отслоения сетчатки: регматогенное, тракционное и экссудативное.
Бримонидин (5-бром-6-(2-имидазолидинилиденамино)хиноксалин) представляет собой альфа-2-селективный агонист адренорецептора, эффективный при лечении открытоугольной глаукомы за счет снижения продуцирования внутриглазной жидкости и увеличения увеосклерального оттока. Бримонидина тартрата глазной раствор 0,2% (продается под наименованием АЛЬФАГАН®) получил разрешение Управления по контролю за пищевыми продуктами и медикаментами США (FDA) в сентябре 1996 г. и в Европе в марте 1997 г. (Великобритания). Бримонидина тартрата глазной раствор с пуритом (Purite®) 0,15% и 0,1% (продается под наименованием АЛЬФАГАН® П) получил разрешение FDA в марте 2001 г. и августе 2005 г. соответственно. Эти композиции в настоящее время показаны для снижения ВГД (внутриглазного давления) у пациентов с открытоугольной глаукомой (ОУГ) и гипертензией глаза (ОНТ).
Нейропротекторный эффект бримонидина тартрата был продемонстрирован на животных моделях с раздавливанием зрительного нерва, умеренной гипертензии глаза, ишемии, индуцированной давлением и сосудистой ишемии. Нейропротекторный эффект местного применения бримонидина тартрата также изучался в клинических условиях у пациентов с глаукомой, возрастной макулярной дегенерацией, пигментным ретинитом, диабетической ретинопатией и острой неартериитической передней ишемической невропатией зрительного нерва. Однако при использование бримонидина тартрата во внутриглазных имплантатах существуют определенные ограничения. Например, из-за размера молекулы бримонидина тартрата количество лекарственного средства, которое можно загрузить в имплантат, может быть ограничено. Также гидрофильный характер бримонидина тартрата может ограничивать возможности использования лекарственного средства в композициях с замедленным высвобождением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, вариант реализации изобретения предлагает внутриглазной имплантат для лечения патологии задней части глаза у человека, включающий биоразлагаемую полимерную матрицу, содержащую по меньшей мере один биоразлагаемый полимер и агент свободного основания бримонидина, причем имплантат может быть предназначен для доставки агента свободного основания бримонидина в стекловидное тело глаза пациента, имеющего патологию задней части глаза, для доставки агента свободного основания бримонидина на протяжении периода до шести месяцев, и биоразлагаемая полимерная матрица рассчитана на полное или почти полное разложение после помещения в стекловидное тело глаза, в течение периода времени, составляющего примерно удвоенный период доставки агента свободного основания бримонидина или меньше. В некоторых вариантах реализации изобретения агент свободного основания бримонидина присутствует в имплантате в количестве примерно 50% от веса имплантата с учетом общего веса имплантата. В некоторых вариантах реализации изобретения имплантат может иметь стержнеобразную форму и стержнеобразная форма может иметь диаметр стержня примерно 350 мкм и длину стержня примерно 6 мм. Согласно другим вариантам реализации изобретения агент свободного основания бримонидина диспергирован в биоразлагаемой полимерной матрице. В некоторых вариантах реализации изобретения по меньшей мере один биоразлагаемый полимер включает поли(D,L-лактид-ко-гликолид) и поли(D,L-лактид). В некоторых вариантах реализации изобретения биоразлагаемая полимерная матрица содержит по меньшей мере один полимер, выбранный из группы, состоящей из поли(D,L-лактид-ко-гликолида) с концевыми кислотными группами и поли(D,L-лактида) с концевыми кислотными группами. В некоторых вариантах реализации изобретения продолжительность доставки агента свободного основания бримонидина находится в диапазоне от около 1 месяца до около 6 месяцев.
Эти и другие варианты реализации изобретения более подробно описаны ниже.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Эти и другие признаки будут далее описаны со ссылкой на графические материалы, вкратце описанные ниже. Эти графические материалы и относящиеся к ним описания приведены для иллюстрации одного или нескольких вариантов реализации изобретения и не предназначены для ограничения объема изобретения.
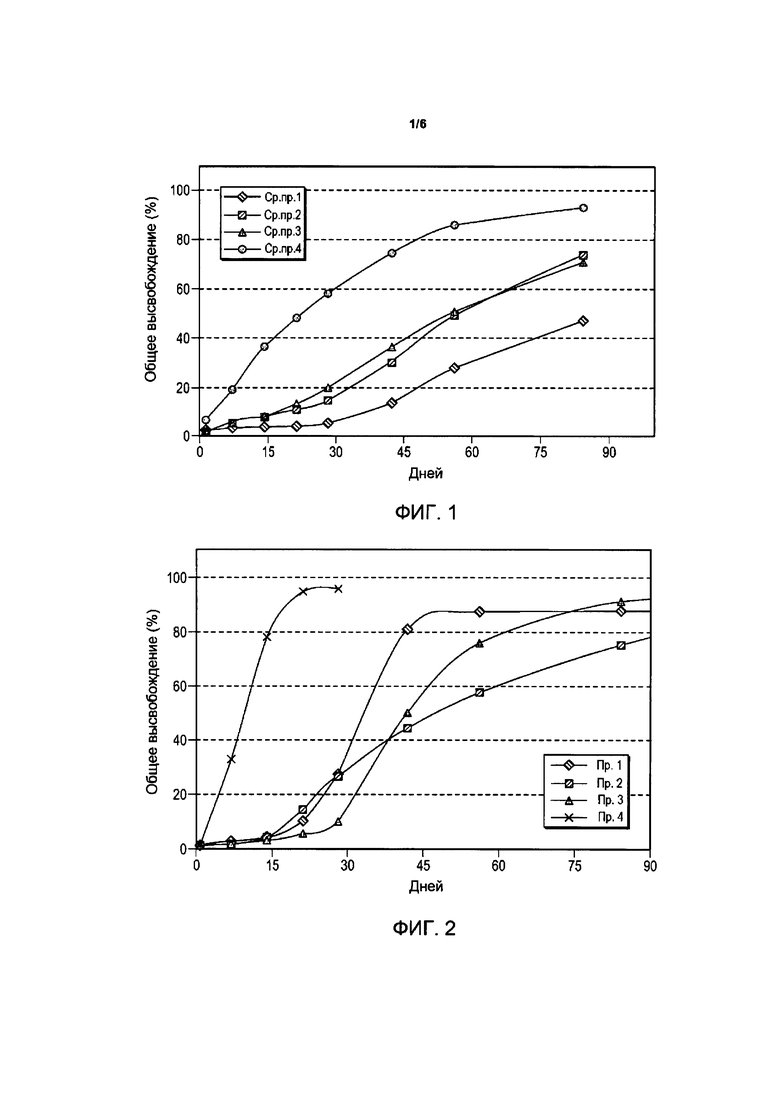
Фигура 1 иллюстрирует профили высвобождения лекарственного средства композиции имплантата бримонидина тартрата в 0,01 М PBS (натрий-фосфатный буфер) с pH 7,4 при 37°C для сравнительных примеров композиций.
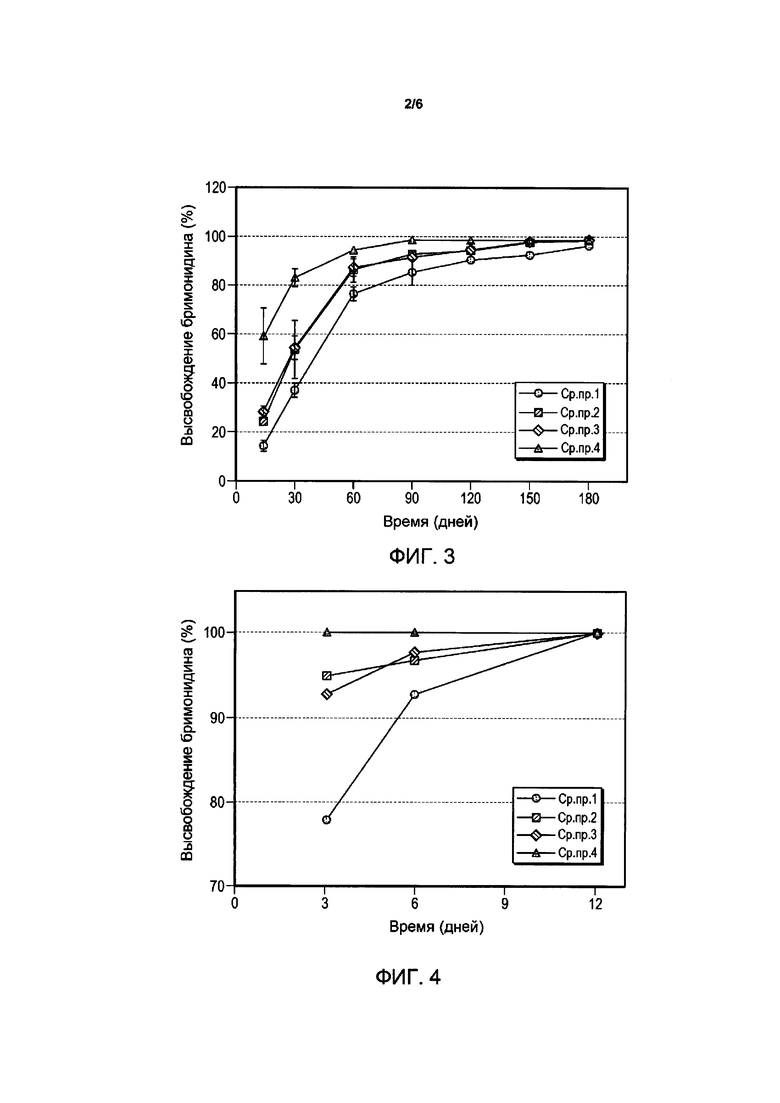
Фигура 2 представляет профили высвобождения лекарственного средства композиции имплантата свободного основания бримонидина в 0,01 М PBS с pH 7,4 при 37°C для примеров композиций.
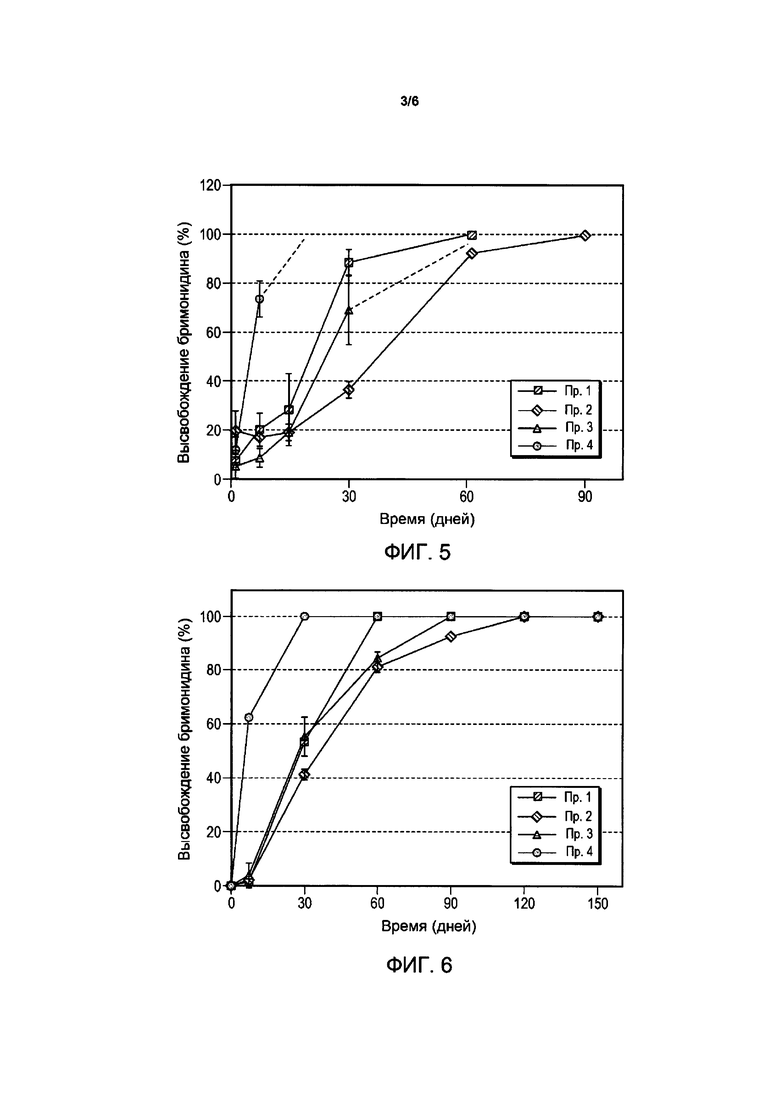
Фигура 3 представляет профили высвобождения лекарственного средства композиции имплантата бримонидина тартрата у кроликов-альбиносов для сравнительных примеров композиций.
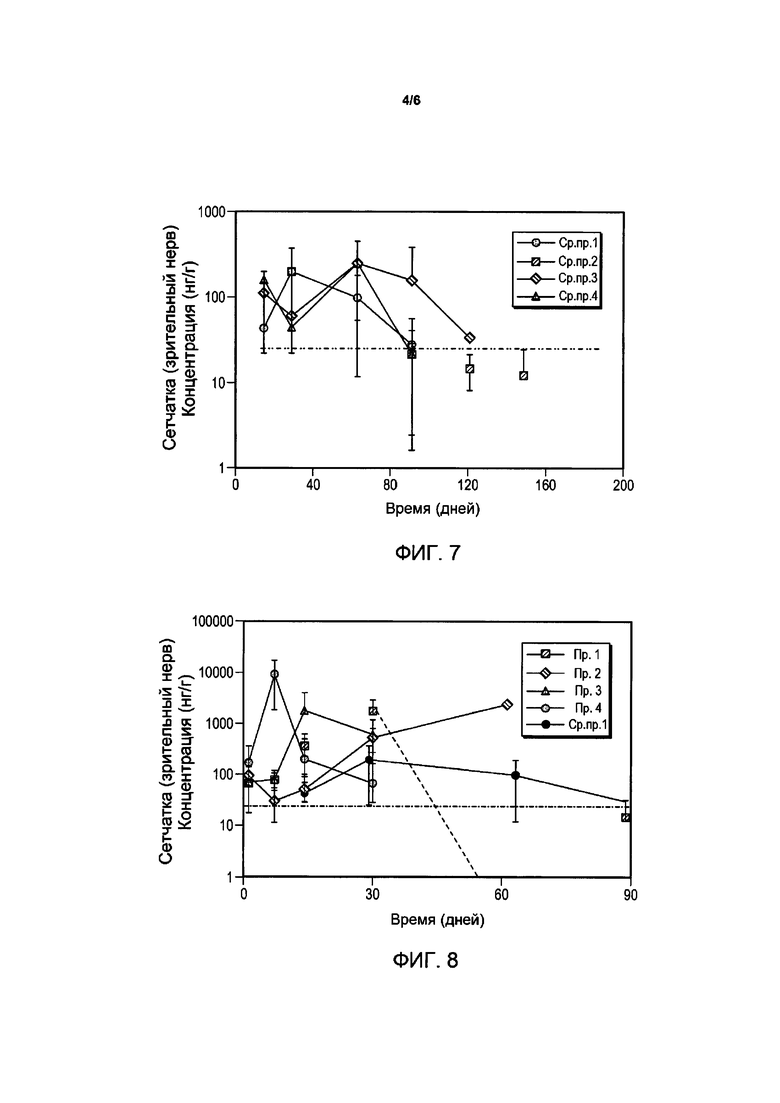
Фигура 4 представляет профили высвобождения лекарственного средства композиции имплантата бримонидина тартрата у яванских макак для сравнительных примеров композиций.
Фигура 5 иллюстрирует профили высвобождения лекарственного средства композиции имплантата свободного основания бримонидина у кроликов-альбиносов для примеров композиций.
Фигура 6 иллюстрирует профили высвобождения лекарственного средства композиции имплантата свободного основания бримонидина у яванских макак для примеров композиций.
Фигура 7 представляет зависимость концентрации лекарственного средства композиций имплантата бримонидина тартрата в сетчатке (зрительный нерв) кроликов-альбиносов от времени для сравнительных примеров композиций. Пунктирная линия показывает концентрацию α2A EC90 у человека.
Фигура 8 представляет зависимость концентрации лекарственного средства композиции имплантата свободного основания бримонидина в сетчатке (зрительном нерве) кроликов-альбиносов от времени для примеров композиций. Пунктирная линия показывает концентрацию α2A EC90 у человека.
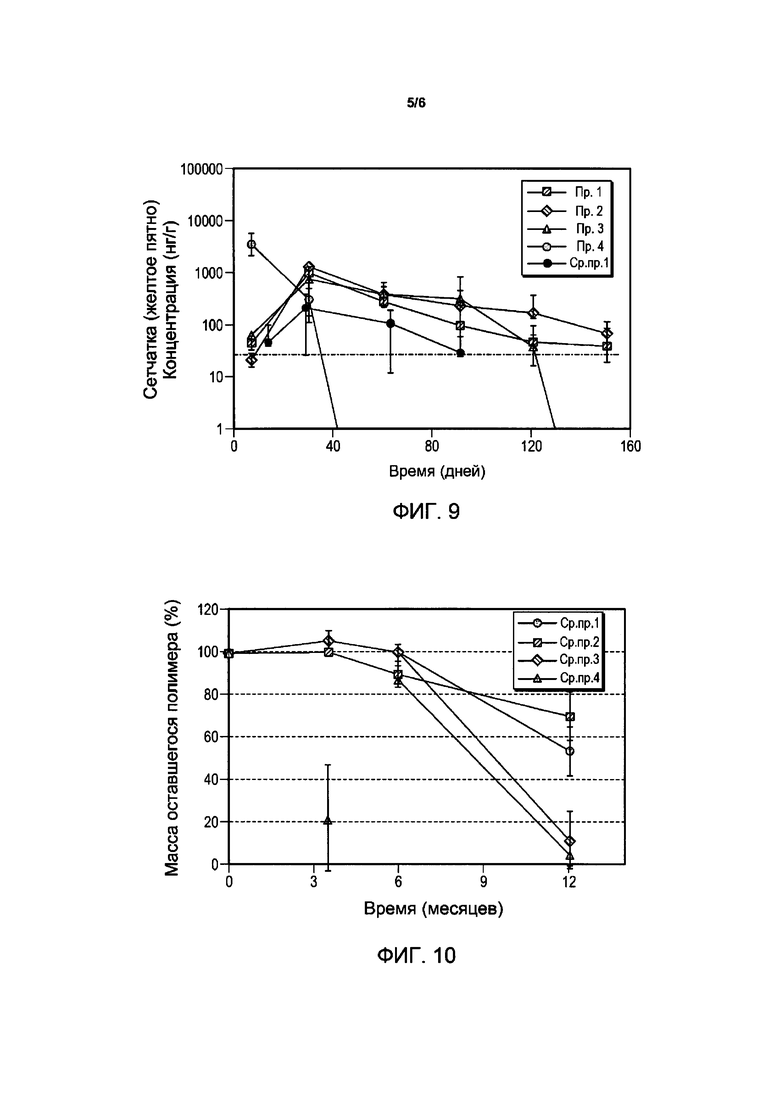
Фигура 9 иллюстрирует зависимость концентрации лекарственного средства композиции имплантата свободного основания бримонидина в сетчатке (желтом пятне) яванских макак от времени для примеров композиций. Пунктирная линия показывает концентрацию α2A EC90 у человека. Для сравнения включена композиция Сравнительного примера 1 (Ср. пр. 1) бримонидина.
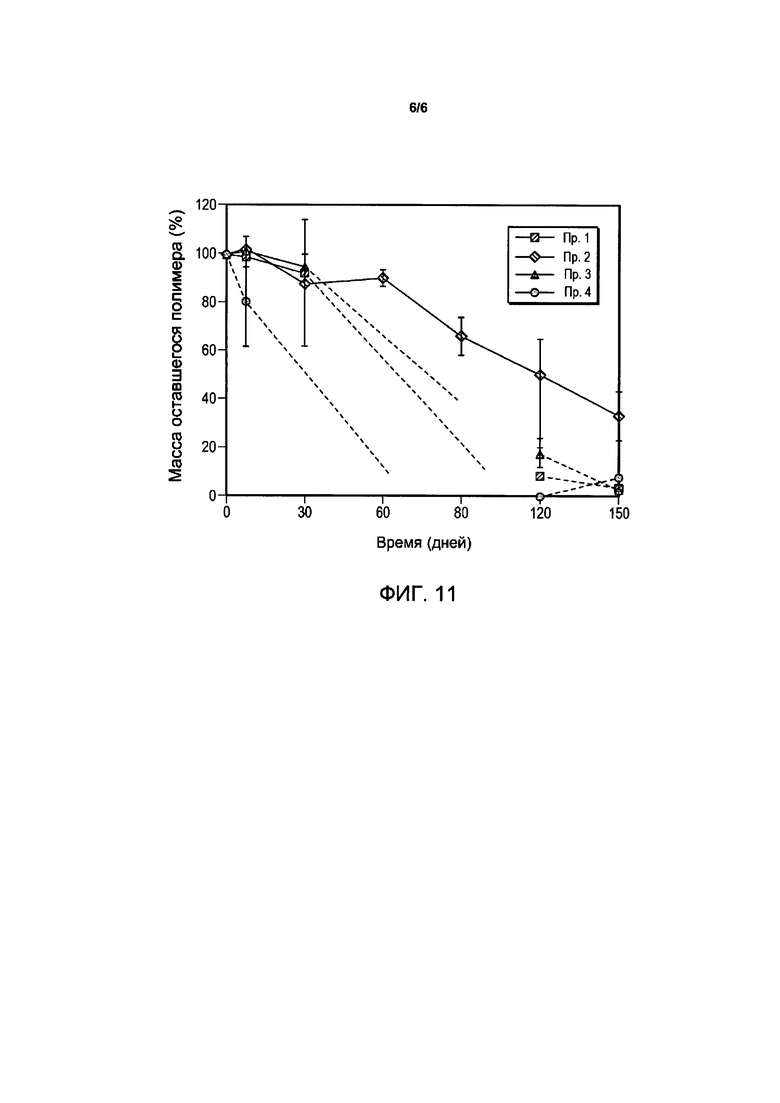
Фигура 10 иллюстрирует разложение полимерной матрицы композиции имплантата бримонидина тартрата у яванских макак со временем для сравнительных примеров композиций.
Фигура 11 представляет разложение полимерной матрицы композиции имплантата свободного основания бримонидина у яванских макак со временем для примеров композиций.
ПОДРОБНОЕ ОПИСАНИЕ
В общих чертах, вариант реализации изобретения относится к пролонгированной доставке свободного основания бримонидина для терапевтического применения в задней части глаза. В некоторых вариантах реализации изобретения композицию для имплантата свободного основания бримонидина изготавливают с одним или несколькими полимерами в полимерной матрице, причем полимеры выбирают таким образом, чтобы они обеспечивали требуемую пролонгированную доставку свободного основания бримонидина и/или требуемое разложение одного или нескольких полимеров. Согласно некоторым вариантам реализации изобретения композиции свободного основания бримонидина и биоразлагаемого полимера или полимеров создают таким образом, чтобы полимерная матрица разлагалась в течение периода времени, не более чем вдвое превышающего продолжительность высвобождения свободного основания бримонидина, но большего, чем продолжительность высвобождения свободного основания бримонидина. Согласно некоторым вариантам реализации изобретения система доставки лекарственного средства свободного основания бримонидина демонстрирует заданную продолжительность доставки лекарственного средства от одного до шести месяцев и заданное время разложения матрицы от двух до двенадцати месяцев.
Варианты реализации изобретения, описанные в данном документе, раскрывают новую систему доставки лекарственных средств и способы изготовления и применения таких систем для замедленного или пролонгированного высвобождение лекарственного средства в глаз, например, для достижения одного или нескольких желательных терапевтических эффектов. Система доставки лекарственных средств может быть в форме имплантатов или элементов имплантатов, которые могут быть помещены в глаз. Системы и способы, описанные в некоторых вариантах реализации изобретения в данном документе, могут обеспечивать увеличенное время высвобождения одного или нескольких терапевтических агентов. Таким образом, например, пациент, которому установили такой имплантат в глаз, может получать терапевтическое количество агента в течение длительного или увеличенного периода времени, не требуя дополнительного введения агента. Согласно некоторым вариантам реализации изобретения имплантат также может оставаться в глазу пациента только в течение заданного или ограниченного периода времени, после чего он полностью или почти полностью разлагается. Благодаря ограничению периода времени, в течение которого чужеродный объект, такой как имплантат, находится у пациента в глазу или стекловидном теле, пациент чувствует себя комфортнее, а риск инфекции или других осложнений минимизируется. Также можно избежать осложнений, которые могут возникнуть в результате столкновения имплантата с роговицей или другой частью глаза в динамическом потоке в стекловидном теле.
В данном контексте "внутриглазной имплантат" относится к устройству или элементам, которые имеют строение, размер или как-либо иначе сконструированы для размещения в глазу. Внутриглазные имплантаты, как правило, биосовместимы с физиологическими условиями глаза. Внутриглазные имплантаты можно вводить в глаз без нарушения зрительной функции глаза.
В данном документе "терапевтический компонент" относится к части внутриглазного имплантата, содержащей один или несколько терапевтических агентов или веществ, используемых для лечения глаз. Терапевтический компонент может представлять собой отдельную часть внутриглазного имплантата или может быть равномерно распределен в объеме имплантата. Терапевтические агенты терапевтического компонента, как правило, являются офтальмологически приемлемыми и находятся в форме, не вызывающей нежелательных реакций при помещении имплантата в глаз.
В данном контексте "глазная патология" представляет собой болезненное недомогание или состояние, которое поражает или затрагивает глаз или одну из частей или областей глаза. Глаз может включать глазное яблоко и ткани и жидкости, образующие глазное яблоко, периокулярную мускулатуру (такую как косые и прямые мышцы) и часть зрительного нерва, расположенную внутри, или примыкает к глазному яблоку.
"Патология передней части глаза" представляет собой болезнь, недомогание или состояние, которое поражает или охватывает переднюю (т.е. фронтальную) область или участок глаза, такие как периокулярная мышца, веко или ткань, или жидкость глазного яблока, расположенные перед задней стенкой капсулы хрусталика или цилиарных мышц. Таким образом, при патологии передней части глаза могут быть поражены или затронуты конъюнктива, роговица, передняя камера, радужная оболочка, задняя камера (расположенная позади сетчатки, но перед задней стенкой капсулы хрусталика), хрусталик или капсула хрусталика, а также кровеносные сосуды и нерв, которые васкуляризуют или иннервируют переднюю область или участок глаза.
"Патология задней части глаза" представляет собой болезнь, недомогание или состояние, которое главным образом поражает или охватывает заднюю область или участок глаза, в частности сосудистую оболочку или склеру (в положении позади плоскости, проходящей через заднюю стенку капсулы хрусталика), стекловидное тело, стекловидную камеру глазного яблока, сетчатку, зрительный нерв или сосок зрительного нерва, а также кровеносные сосуды и нервы, которые васкуляризуют или иннервируют заднюю область или участок глаза.
Таким образом, патология задней части глаза может включать, но не ограничивается следующими болезнями, недомоганиями или состояниями, такими как острая нейромакулопатия; болезнь Бехчета; географическая атрофия; хороидальная неоваскуляризация; диабетический увеит; гистоплазмоз; инфекции, в частности грибковые, бактериальные или вирусные инфекции; дегенерация желтого пятна, в частности острая дегенерация желтого пятна, неэкссудативная возрастная дегенерация желтого пятна и экссудативная возрастная дегенерация желтого пятна; отек, в частности макулярный отек, кистозный макулярный отек и диабетический макулярный отек; многоочаговый хориоидит; глазная травма с поражением участка или области задней части глаза; глазные опухоли; заболевания сетчатки, в частности окклюзия центральной вены сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию), пролиферативная витреоретинопатия (ПВР), окклюзионное поражение артерий сетчатки, отслоение сетчатки, увеальная болезнь сетчатки; симпатическая офтальмия; синдром Фогта-Коянаги-Харада (ФКХ); увеальная диффузия; патология задней части глаза, вызванная или связанная с лазерным лечением глаза; или патология задней части глаза, вызванная или связанная с фотодинамической терапией, фотокоагуляцией, лучевой терапией сетчатки, расстройствами эпиретинальной мембраны, окклюзией ответвления вены сетчатки, передней ишемической невропатией зрительного нерва, неретинопатическое диабетическое расстройство сетчатки, пигментный ретинит и глаукома. Глаукома может считаться патологией задней части глаза, потому что терапевтическая цель заключается в предотвращении потери или уменьшении потери зрения вследствие повреждения или утраты клеток сетчатки или клеток зрительного нерва (например, нейропротекции).
Термины "биоразлагаемый полимер" или "биоразрушаемый полимер" относятся к полимеру или полимерам, которые разлагаются in vivo, причем разрушение полимера или полимеров во времени происходит одновременно с и/или после высвобождения терапевтического агента. Биоразлагаемый полимер может быть гомополимером, сополимером или полимером, содержащим более двух полимерных звеньев. В некоторых вариантах реализации изобретения "биоразлагаемый полимер" может включать смесь двух или более гомополимеров или сополимеров.
Термины "лечить", "лечащий" или "лечение" в данном контексте относятся к уменьшению, или прекращению, или предотвращению глазной патологии, поражения или повреждения глаз, или к улучшению заживления пораженной или поврежденной глазной ткани.
Термин "терапевтически эффективное количество" в данном документе относится к уровню или количеству терапевтического агента, необходимого для лечения глазной патологии или уменьшения либо предотвращения поражения или повреждения глаз.
Специалистам в данной области техники будет понятно значение различных терминов мер, используемых в данном описании. Например, в используемом в данном документе значении, в контексте, относящемся к количеству (например, "около 6%"), термин "около" обозначает количество, близкое к и включающее указанное количество, достаточное для выполнения желательной функции или достижения желаемого результата, например "около 6%" может включать 6% и количества, близкие к 6%, которые являются достаточными для выполнения желательной функции или достижения желаемого результата. Например, термин "около" может относиться к количеству, отличающемуся менее чем на 10%, менее чем на 5%, менее чем на 0,1% или менее чем на 0,01% от указанного количества.
Внутриглазные имплантаты могут содержать терапевтический компонент и компонент или компоненты, контролирующие высвобождение лекарственного средства. Терапевтический агент может содержать или состоять в основном из агониста альфа-2 адренорецептора. Агонист альфа-2 адренорецептора может быть агонистом или агентом, который избирательно активирует альфа-2 адренорецепторы, например, путем связывания с альфа-2 адренорецептором, по сравнению с другими типами адренорецепторов, такими как альфа-1 адренорецепторы. Избирательная активация может быть достигнута в различных условиях, таких как условия человеческого глаза.
Агонист альфа-2 адренорецептора в имплантате, как правило, представляет собой агент, избирательно активирующий альфа-2 адренорецепторы, по сравнению с альфа-2 адренорецепторами. В некоторых имплантатах агонист альфа-2 адренорецептора избирательно активирует субтип альфа-2 адренорецепторов. Например, агонист может избирательно активировать один или несколько из альфа-2а, альфа-2b или альфа-2с рецепторов в определенных условиях, таких как физиологические условия. В других условиях агонист в имплантате может не проявлять избирательность по отношению к субтипам альфа-2 адренорецептора. Агонист может активировать рецепторы путем связывания с рецепторами посредством любого другого механиза.
Согласно некоторым вариантам реализации изобретения используемым антагонистом альфа-2 рецептора является бримонидин. Бримонидин представляет собой производное хиноксалина, имеющее структуру:
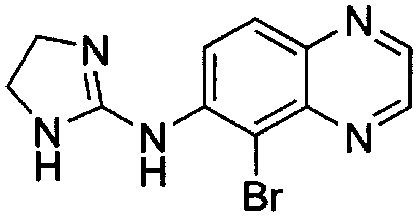
Бримонидин, органическое основание, является общедоступным в виде свободного основания бримонидина. Свободное основание бримонидина является в целом гидрофобным.
В некоторых вариантах реализации изобретения антагонист альфа-2 адренорецептора может быть фармацевтически приемлемой кислотно-аддитивной солью бримонидина. Одной такой солью может быть бримонидина тартрат (AGN 190342-F, 5-бром-6-(2-имидазолидинилиденамино)хиноксалина тартрат). Как свободное основание бримонидина, так и бримонидина тартрат являются химически стабильными и имеют температуру плавления выше 200°C.
Таким образом, внутриглазной имплантат может содержать, состоять из или состоять в основном из терапевтического агента, такого как агонист альфа-2 адренорецептора, такой как отдельно взятая соль бримонидина (такая как бримонидина тартрат), отдельно взятое свободное основание бримонидина или их смеси.
Использование свободного основания бримонидина в твердых композициях имплантата имеет несколько преимуществ по сравнению с бримонидина тартратом, таких как более низкая растворимость свободного основания бримонидина, снижающая потенциальный эффект начального неконтролируемого высвобождения лекарственного средства, и то, что эквивалентная доза лекарственного средства в форме свободного основания на имплантат может быть выше при одинаковом весе. Таким образом, согласно некоторым вариантам реализации изобретения внутриглазной имплантат не содержит бримонидина тартрата. Согласно некоторым вариантам реализации изобретения единственным терапевтическим агентом, используемым во внутриглазном имплантате, является свободное основание бримонидина.
Агонист альфа-2 адренорецептора может быть в форме дисперсного материала или порошка и может быть заключен в биоразлагаемую полимерную матрицу. Согласно варианту реализации изобретения агонист альфа-2 адренорецептора представляет собой свободное основание бримонидина, имеющее D90 размер частиц менее чем около 20 мкм. Согласно другому варианту реализации изобретения агонист альфа-2 адренорецептора представляет собой свободное основание бримонидина, имеющее D90 размер частиц менее чем около 10 мкм. Согласно другому варианту реализации изобретения, агонист альфа-2 адренорецептора представляет собой свободное основание бримонидина, имеющее D90 размер частиц в диапазоне от около 10 мкм до около 20 мкм.
Согласно некоторым вариантам реализации изобретения имплантаты могут быть составлены с частицами агента свободного основания бримонидина, диспергированными в биоразрушаемой полимерной матрице. Согласно некоторым вариантам реализации изобретения имплантаты могут быть монолитными с терапевтическим агентом, гомогенно распределенным в биоразрушаемой полимерной матрице или инкапсулированным, причем резервуар активного агента инкапсулирован полимерной матрицей. В некоторых вариантах реализации изобретения терапевтический агент может быть распределен негомогенным образом в биоразрушаемой полимерной матрице. Например, в варианте реализации изобретения имплантат может включать первую часть, имеющую более высокую концентрацию терапевтического агента (такого как свободное основание бримонидина) по сравнению со второй частью имплантата.
Агонист альфа-2 адренорецептора может присутствовать в имплантате в количестве в диапазоне от около 20% до около 70% от веса имплантата с учетом общего веса имплантата. В некоторых вариантах реализации изобретения агонист альфа-2 адренорецептора может присутствовать в имплантате в количестве в диапазоне от около 40% до около 60% от веса имплантата с учетом общего веса имплантата. В варианте реализации изобретения агонист альфа-2 адренорецептора может присутствовать в имплантате в количестве около 40% от веса имплантата с учетом общего веса имплантата. В другом варианте реализации изобретения агонист альфа-2 адренорецептора может присутствовать в имплантате в количестве около 50% от веса имплантата с учетом общего веса имплантата. В примере варианта реализации изобретения свободное основание бримонидина может присутствовать в имплантате в количестве около 50% от веса имплантата, около 55% от веса имплантата, около 60% от веса имплантата или около 70% от веса имплантата с учетом общего веса имплантата.
Полимерные материалы или композиции, пригодные для использования в имплантате, могут включать такие материалы, которые совместимы с глазом, чтобы не оказывать значительного влияния на функционирование или физиологию глаза. Такие материалы могут быть по меньшей мере частично или полностью биоразлагаемыми.
Примеры пригодных полимерных материалов для полимерной матрицы включают полиэфиры. Например, для полимерной матрицы могут быть использованы полимеры D-молочной кислоты, L-молочной кислоты, рацемической молочной кислоты, гликолевой кислоты, поликапролактона и их комбинации. В некоторых вариантах реализации изобретения полиэфир, в случае его использования, может быть гомополимером, сополимером или их смесью.
В некоторых имплантатах используются сополимеры гликолевой кислоты и молочной кислоты, причем скорость биоразложения может контролироваться, в некоторой степени, соотношением гликолевой кислоты и молочной кислоты. Молярное процентное содержание (% мол.) полимолочной кислоты в сополимере полимолочной кислоты - полигликолевой кислоты (PLGA) может составлять от 15% мол. до около 85% мол. В некоторых вариантах реализации изобретения молярное процентное содержание полимолочной кислоты в (PLGA)-сополимере составляет от около 35% мол. до около 65% мол. В некоторых вариантах реализации изобретения в полимерной матрице может быть использован PLGA-сополимер с 50% мол. полимолочной кислоты и 50% мол. полигликолевой кислоты.
Полимеры, составляющие полимерную матрицу, также могут быть выбраны на основании их молекулярной массы. Разные молекулярные массы одной и той же или разных полимерных композиций могут быть включены в имплантат для модулирования профиля высвобождения. В некоторых вариантах реализации изобретения на профиль высвобождения терапевтического агента и разложение полимера может влиять молекулярная масса одного или нескольких полимеров в полимерной матрице. В некоторых вариантах реализации изобретения молекулярная масса одного или нескольких поли(D,L-лактидных) компонентов может быть предпочтительно выбрана для обеспечения контроля высвобождения терапевтического агента и разложения полимера. Согласно некоторым вариантам реализации изобретения средняя молекулярная масса полимера, такого как поли(D,L-лактид), может быть "низкой". Согласно некоторым вариантам реализации изобретения средняя молекулярная масса полимера, такого как поли(D,L-лактид), может быть "средней". Согласно некоторым вариантам реализации изобретения в полимерную матрицу внутриглазного имплантата включают только низкомолекулярный поли(D,L-лактид). Согласно некоторым вариантам реализации изобретения поли(D,L-лактиды) с высокой молекулярной массой (Mw) не присутствуют в биоразлагаемой полимерной матрице или присутствуют только в незначительном количестве (около 0,1% от веса имплантата с учетом общего веса имплантата). Благодаря ограничению количества высокомолекулярного поли(D,L-лактида), присутствующего в имплантате, можно уменьшить продолжительность разрушения матрицы.
Некоторые примеры полимеров, которые могут быть использованы, отдельно или в комбинации, для образования полимерной матрицы включают перечисленные в Таблице A ниже, справочные листки технических данных коммерчески доступных полимеров в полном объеме включены посредством ссылки:
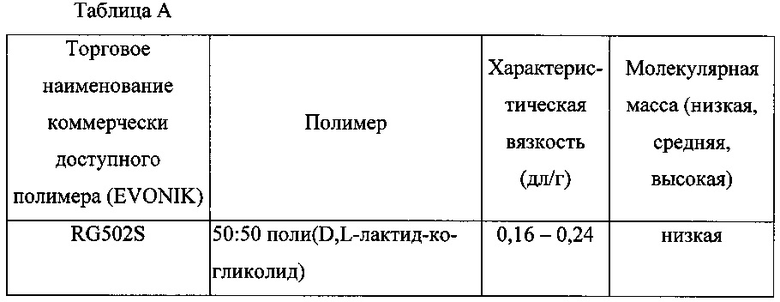
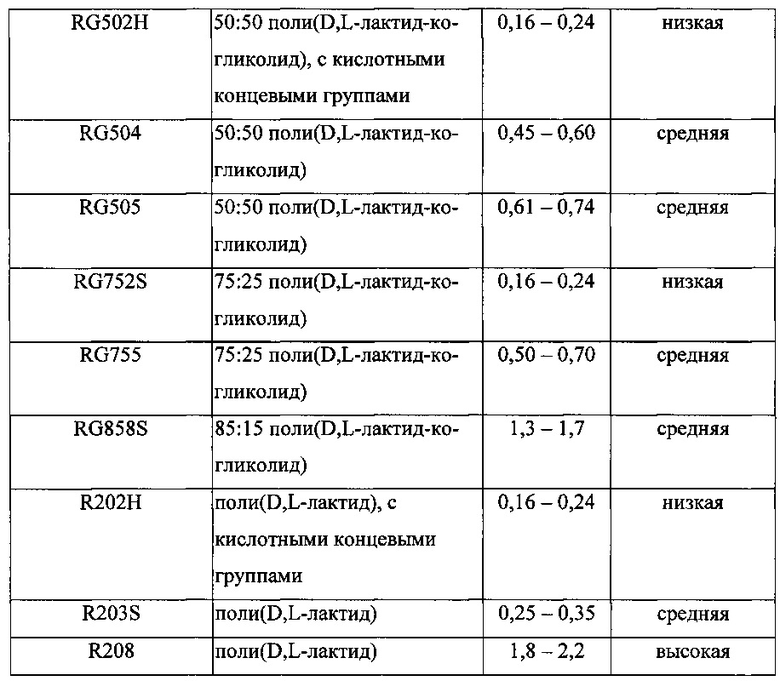
Биоразлагаемая полимерная матрица внутриглазного имплантата может содержать смесь двух или более биоразлагаемых полимеров. В некоторых вариантах реализации изобретения только один биоразлагаемый полимер из перечисленных выше используется в биоразлагаемой полимерной матрице. В некоторых вариантах реализации изобретения любой из биоразлагаемых полимеров, перечисленных в таблице выше, может быть использован в количестве в диапазоне от 12,5% масс./масс. до 70% масс./масс. каждого в системе доставки лекарственного средства или имплантате. В некоторых вариантах реализации изобретения любой из биоразлагаемых полимеров, перечисленных в таблице выше, может быть использован в количестве в диапазоне от 25% масс./масс. до 50% масс./масс. каждого в системе доставки лекарственного средства или имплантате. В некоторых вариантах реализации изобретения любой из биоразлагаемых полимеров, перечисленных в таблице выше, может быть использован в количестве в диапазоне от 20% масс./масс. до 40% масс./масс. каждого в системе доставки лекарственного средства или имплантате. В некоторых вариантах реализации изобретения любой из биоразлагаемых полимеров, перечисленных в таблице выше, может быть использован в количестве около 15% масс./масс., около 25% масс./масс., около 12,5% масс./масс., около 37,5% масс./масс., около 40% масс./масс., около 50% масс./масс. или около 60% масс./масс. каждого в системе доставки лекарственного средства или имплантате. Например, имплантат может содержать смесь первого биоразлагаемого полимера и отличного от него второго биоразлагаемого полимера. Один или несколько биоразлагаемых полимеров могут иметь концевые кислотные группы.
В некоторых вариантах реализации изобретения высвобождение терапевтического агента из биоразлагаемой полимерной матрицы во внутриглазном имплантате может быть следствием различных механизмов и факторов. Высвобождение агента может быть достигнуто путем разрушения биоразлагаемой полимерной матрицы с последующим взаимодействием ранее инкапсулированных частиц лекарственного средства со стекловидным телом глаза, в которое помещен имплантат, и растворением и высвобождением терапевтического агента. Кинетика высвобождения при такой форме высвобождения лекарственного средства отличается от композиций, высвобождающих агент в результате одного лишь набухания полимера, такого как гидрогель или метилцеллюлоза. Параметры, которые могут определять кинетику высвобождения, включают размер частиц лекарственного средства, растворимость лекарственного средства в воде, соотношение лекарственного средства и полимера, а также скорость разрушения полимеров.
Согласно некоторым вариантам реализации изобретения композиции и способы увеличивают длительность доставки свободного основания бримонидина в стекловидное тело при сопутствующей умеренной продолжительности разложения матрицы. Пролонгированная доставка лекарственного средства в глаз может быть достигнута путем составления композиции свободного основания бримонидина с правильно подобранной смесью биоразрушаемых поли(D,L-лактида) и/или поли(D,L-лактид-ко-гликолида).
Согласно некоторым примерам вариантов реализации изобретения система доставки лекарственного средства или имплантат могут содержать полимерную матрицу поли(D,L-лактид) с концевыми кислотными группами в количестве в диапазоне от 25% масс./масс. до около 50% масс./масс. Согласно некоторым примерам вариантов реализации изобретения, система доставки лекарственного средства или имплантат могут содержать полимерную матрицу 50:50 поли(D,L-лактид-ко-гликолид) с концевыми кислотными группами в количестве в диапазоне от около 25% масс./масс. до около 50% масс./масс. или от около 37,5% до около 50% масс./масс. имплантата. Согласно некоторым примерам вариантов реализации изобретения система доставки лекарственного средства или имплантат могут содержать полимерную матрицу 75:25 поли(D,L-лактид-ко-гликолида) с концевыми кислотными группами в количестве в диапазоне от около 25% масс./масс. до около 50% масс./масс. или от около 15% масс./масс. до около 50% масс./масс. имплантата. Согласно некоторым примерам вариантов реализации изобретения система доставки лекарственного средства или имплантат могут содержать полимерную матрицу 85:15 поли(D,L-лактид-ко-гликолида) с концевыми кислотными группами в количестве в диапазоне от около 25% масс./масс. до около 50% масс./масс. или от около 30% до около 60% масс./масс. имплантата.
Системы доставки лекарственных средств предназначены для высвобождения свободного основания бримонидина с терапевтическими уровнями в стекловидное тело в течение длительного периода времени (продолжительность доставки свободного основания бримонидина), а затем они разлагаются на протяжении периода времени в диапазоне от половины продолжительности доставки свободного основания бримонидина до времени, эквивалентного продолжительности доставки свободного основания бримонидина. Согласно другим вариантам реализации изобретения система доставки лекарственного средства, включающая полимерную матрицу, может разлагаться на протяжении периода времени от около четверти продолжительности доставки свободного основания бримонидина до около половины продолжительности доставки свободного основания бримонидина. Согласно другим вариантам реализации изобретения система доставки лекарственного средства, включающая полимерную матрицу, может разлагаться на протяжении периода времени от около трети продолжительности доставки свободного основания бримонидина до около половины продолжительности доставки свободного основания бримонидина. Согласно другим вариантам реализации изобретения система доставки лекарственного средства, включающая полимерную матрицу, может разлагаться на протяжении периода времени, эквивалентного от примерно продолжительности доставки свободного основания бримонидина до примерно удвоенной продолжительности доставки свободного основания бримонидина. Например, в варианте реализации изобретения внутриглазной имплантат может включать смесь свободного основания бримонидина и биоразлагаемой полимерной матрицы, которая высвобождает свободное основание бримонидина на протяжении трехмесячного периода времени, затем полимерная матрица разлагается на протяжении еще 2-месячного периода, пока имплантат не разложится полностью или почти полностью. Согласно некоторым вариантам реализации изобретения продолжительность доставки свободного основания бримонидина представляет собой период времени в диапазоне от около 1 месяца до около 6 месяцев, от около 1 месяца до около 5 месяцев, от около 1 месяца до около 3 месяцев, от около 1 месяца до около 4 месяцев, от около 2 месяцев до около 4 месяцев или от около 3 месяцев до около 6 месяцев. Согласно некоторым вариантам реализации изобретения время разложения полимерной матрицы для системы доставки лекарственного средства находится в пределах от около 1 месяца до около 7 месяцев, от около 1 месяца до около 6 месяцев, от около 3 месяцев до около 7 месяцев, от около 1 месяца до около 4 месяцев, от около 3 месяцев до около 4 месяцев, от около 4 месяцев до около 5 месяцев, от около 5 месяцев до около 7 месяцев или от около 3 месяцев до около 6 месяцев. Согласно некоторым вариантам реализации изобретения время разложения полимерной матрицы для системы доставки лекарственного средства составляет менее 10 недель, менее 8 недель, менее 6 недель или менее 4 недель.
Согласно одному примеру варианта реализации изобретения биоразлагаемый внутриглазной имплантат содержит свободное основание бримонидина, ассоциированное с биоразлагаемой полимерной матрицей, которая содержит смесь разных биоразлагаемых полимеров. Свободное основание бримонидина присутствует в имплантате в количестве 50% масс. с учетом общего веса имплантата. Первый биоразлагаемый полимер представляет собой поли(D,L-лактид) с кислотными концевыми группами, имеющий характеристическую вязкость от 0,16 дл/г до 0,24 дл/г и составляющий 25% от веса имплантата с учетом общего веса имплантата. Второй биоразлагаемый полимер представляет собой PLGA-сополимер, содержащий 75% мол. полимолочной кислоты и 25% мол. полигликолевой кислоты. PLGA-сополимер имеет характеристическую вязкость от 0,16 дл/г до 0,24 дл/г, и PLGA-сополимер составляет 25% от веса имплантата с учетом общего веса имплантата. Такая смесь эффективно обеспечивает высвобождение эффективного количества свободного основания бримонидина на протяжении периода доставки около трех месяцев, а затем разложение полимерной матрицы в течение еще одного-двух месяцев, что соответствует менее чем удвоенной продолжительности доставки свободного основания бримонидина.
Согласно другому примеру варианта реализации изобретения биоразлагаемый внутриглазной имплантат содержит свободное основание бримонидина, ассоциированное с биоразлагаемой полимерной матрицей, которая содержит один тип биоразлагаемого полимера. Свободное основание бримонидина присутствует в имплантате в количестве 50% масс. с учетом общего веса имплантата. В этом варианте реализации изобретения биоразлагаемая полимерная матрица изготовлена из PLGA-сополимера, содержащего 85% мол. полимолочной кислоты и 15% мол. полигликолевой кислоты. PLGA-сополимер имеет характеристическую вязкость от 1,3 дл/г до 1,7 дл/г, и PLGA-сополимер составляет 50% от веса имплантата с учетом общего веса имплантата. Такая смесь эффективно обеспечивает высвобождение эффективного количества свободного основания бримонидина на протяжении периода доставки, составляющего примерно три или четыре месяца, а затем разложение полимерной матрицы в течение еще одного-двух месяцев, что соответствует менее чем удвоенной продолжительности доставки свободного основания бримонидина.
Производство имплантатов
Согласно некоторым вариантам реализации изобретения внутриглазные имплантаты могут быть сформированы с помощью подходящих способов переработки полимеров. В одном из вариантов реализации изобретения смесь терапевтического агента (такого как свободное основание бримонидина) может быть смешана с PLA- (полимолочная кислота) и/или PLGA-полимерами в смесителе, таком как смеситель Turbula. В одном из вариантов реализации изобретения внутриглазные имплантаты формируются экструзией. Экструзия может быть осуществлена с помощью подходящего экструдера, такого как экструдер Haake. После смешивания терапевтического агента и полимерной матрицы они могут принудительно подаваться в экструдер и экструдироваться в волокна. Экструдированные волокна затем могут быть разрезаны на имплантаты с заданным весом. В некоторых вариантах реализации изобретения может быть отрезан имплантат 800 мкг для доставки около 300 мкг, 400 мкг или 500 мкг лекарственного средства за период доставки свободного основания бримонидина. Имплантаты затем могут быть загружены в устройство для инъекции, такое как аппликатор 25G, и стерилизованы. Согласно некоторым вариантам реализации изобретения экструдированные волокна разрезают на кусочки весом менее 1000 мкг, менее 800 мкг или менее 600 мкг. В некоторых вариантах реализации изобретения имплантаты могут быть стерилизованы гамма-излучением. Имплантаты могут быть стерилизованы гамма-излучением в таких дозах, как от 20 кГр до 60 кГр, от 25 кГр до 50 кГр, от 25 кГр до 40 кГр и т.п.
Способы лечения
Согласно одному из вариантов реализации изобретения способ лечения задней части глаза включает введение имплантата, такого как имплантаты, описанные в данном документе, в задний сегмент глаза человека или животного, предпочтительно живого человека или животного. В некоторых вариантах реализации изобретения способ лечения пациента может включать помещение имплантата непосредственно в заднюю камеру глаза. В некоторых вариантах реализации изобретения способ лечения пациента может включать введение имплантата пациенту с помощью по меньшей мере одной из таких инъекций, как интравитреальная инъекция, субконъюнктивальная инъекция, субтеноновая инъекция, ретробульбарная инъекция и супрахороидальная инъекция.
В по меньшей мере одном варианте реализации изобретения способ лечения пигментного ретинита, глаукомы, дегенерации желтого пятна и/или географической атрофии у пациента включает введение пациенту одного или нескольких имплантатов, содержащих свободное основание бримонидина, как описано в данном документе, с помощью по меньшей мере одной из таких инъекций, как интравитреальная инъекция, субконъюнктивальная инъекция, субтеноновая инъекция, ретробульбарная инъекция и супрахороидальная инъекция. Аппарат шприца, имеющего иглу соответствующего размера, например иглу 27 калибра или иглу 30 калибра, может быть эффективно использован для инъекции композиции в задний сегмент глаза человека или животного. Согласно некоторым вариантам реализации изобретения пациенту для лечения патологии делают не более одной инъекции. Согласно другим вариантам реализации изобретения, для лечения патологии пациенту делают несколько инъекций.
ПРИМЕРЫ
Примеры внутриглазных имплантатов, содержащих бримонидина тартрат или свободное основание бримонидина и биоразлагаемую полимерную матрицу, были изготовлены и испытаны с целью определения их характеристик высвобождения и разложения. Бримонидина тартрат или свободное основание бримонидина сначала взвешивают и смешивают с PLA- и/или PLGA-полимерами в смесителе Turbula в течение 30 минут. Полученную порошкообразную смесь затем подают в экструдер Haake с помощью питателя с принудительной подачей экструдированные волокна разрезают на имплантаты заданного веса, например 857 мкг или 800 мкг для доставки 300 мкг бримонидина тартрата или 400 мкг свободного основания бримонидина на имплантат. Имплантаты загружают в аппликаторы 25G и стерилизуют гамма-излучением дозой от 25 до 40 кГр. Содержание действующего вещества на имплантат подтверждают с помощью анализа методом ВЭЖХ.
Примеры и Сравнительные примеры рецептур композиций, содержащих в качестве лекарственного средства бримонидина тартрат (Сравнительные примеры 1-4) и свободное основание бримонидина (Примеры 1-4), приведены в Таблицах B и C, а их профили высвобождения лекарственного средства представлены на Фигурах 1 и 2 соответственно. На Фигурах 1 и 2 по оси x (y) откладывается число дней, а по оси y - процент (%) общего высвобождения. Для испытаний in vitro высвобождения лекарственного средства из экструдированных волокон вырезали случайным образом четыре имплантата на каждую композицию, стерилизовали гамма-излучением и инкубировали в 10 мл 0,01 М ФСБ, pH 7,4, на водяной бане со встряхиванием, установленной на 37°C и 50 об./мин. Образцы для определения высвобождения лекарственного средства отбирают в заданные моменты времени, и содержание лекарственного средства анализируют методом ВЭЖХ. При каждом отборе пробы среду для высвобождения полностью заменяют свежей средой. Константа скорости разложения k полимера Mw, определенная путем инкубации образцов имплантата в 0,01 М ФСБ, pH 7,4, при 25°C, и его Mw (молекулярная масса), определенная методом эксклюзионной хроматографии, также включены в Таблицы B и C.
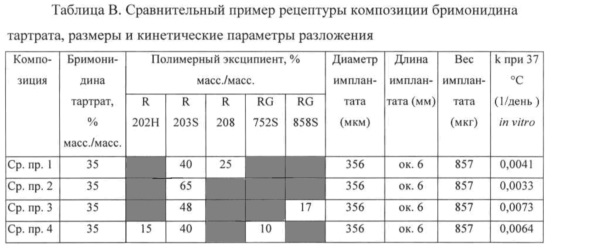
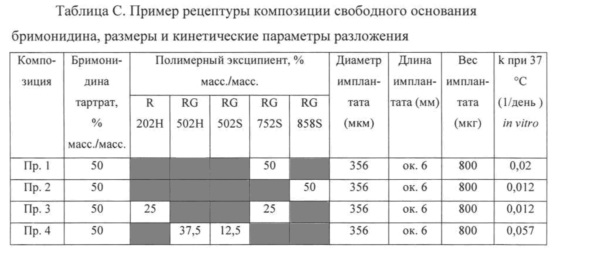
Разложение полимерной матрицы затем анализируют как in vitro, так и in vivo. При исследованиях in vitro используют константу скорости разложения к полимера Mw, как описано выше, для расчета времени разложения полимера Mw до 1000 Да t(1000) на основе предположения, что разложение описывается кинетическими уравнениями реакции первого порядка. При исследованиях in vivo разложение полимерной матрицы определяют посредством отбора образцов имплантатов, введенных путем инъекции в стекловидное тело новозеландского кролика. Результаты приведены в Таблице D.

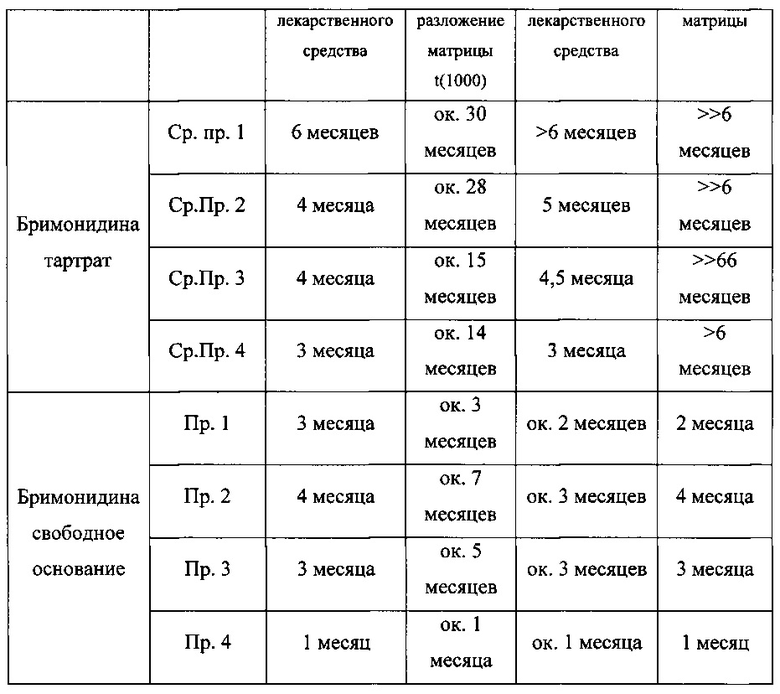
In vitro испытания внутриглазных имплантатов, содержащих бримонидин и биоразлагаемую полимерную матрицу
Исследования потери веса
Для исследования потери веса имплантата каждый имплантат сначала взвешивают, помещают в пластиковую кассету из микросетки и инкубируют в стеклянной банке, наполненной ФСБ (pH 7,4, 0,01 М), после чего помещают на водяную баню со встряхиванием, установленную на 37°C и 50 об/мин. Имплантаты собирают в заданные моменты времени и сушат под вакуумом. Регистрируют вес высушенных имплантатов и рассчитывают потерю веса имплантатов. Результаты приведены в Таблице E, они показывают, что имплантаты свободного основания бримонидина теряют вес быстрее, чем имплантаты бримонидина тартрата, указывая на и иллюстрируя различия в скорости разложения матрицы.
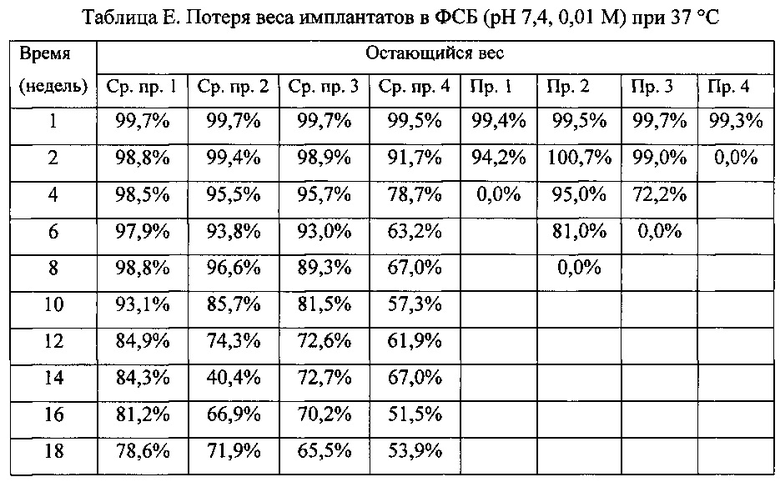
Набухание имплантата
Для исследования набухания имплантата каждый имплантат инкубируют в 20 мл ФСБ (pH 7,4, 0,01 М) в стеклянном сцинтилляционном флаконе и помещают на водяную баню со встряхиванием, установленную на 37 C и 50 об/мин. Регистрируют изображения имплантатов и сводят их в Таблицу F. Результаты показывают, что имплантаты свободного основания бримонидина набухают и разлагаются намного быстрее, чем имплантаты бримонидина тартрата.
In vivo испытания внутриглазных имплантатов, содержащих бримонидин и биоразлагаемую полимерную матрицу
Высвобождение лекарственного средства из композиций бримонидина тартрата в глазах кроликов и обезьян показано на Фигурах 3 и 4 соответственно. Высвобождение лекарственного средства из композиций свободного основания бримонидина в глазах кроликов и обезьян показано на Фигурах 5 и 6.
Профили in vivo высвобождения лекарственного средства были определены путем извлечения имплантатов из жидкости стекловидного тела в заданные моменты времени. Массу имплантата регистрируют до и после in vivo имплантации для определения оставшегося количества полимерной матрицы. Скорости высвобождения лекарственного средства в обеих животных моделях показывают, что Пример 4 имеет наибольшую скорость высвобождения, за ним следует Пример 1, затем Пример 3, и затем Пример 2, продемонстрировавший самое медленное высвобождение лекарственного средства.
Концентрация композиций лекарственного средства бримонидина тартрата в сетчатке (зрительном нерве) глаз кроликов-альбиносов показана на Фигуре 7. Все композиции поддерживали концентрацию бримонидина выше, чем для α2A EC90 человека (88 нМ, 25,7 нг/мл), на протяжении более 3 месяцев. Для композиций свободного основания бримонидина были определены концентрации лекарственного средства в сетчатке (зрительном нерве у кролика и желтом пятне у обезьяны), и результаты приведены на Фигурах 8 и 9 для кролика и обезьяны соответственно. Продолжительность периода, на протяжении которого концентрация бримонидина превышала концентрацию человеческого α2A EC90 в зрительном нерве кролика, составляла ≤3 месяца для всех композиций. В отличие от этого, период времени, на протяжении которого концентрация бримонидина превышала концентрацию человеческого α2A EC90 в желтом пятне обезьяны, составлял ≥4 месяца для всех композиций, за исключением Примера 4, для которого он составлял около одного месяца.
Разложение полимерной матрицы композиций бримонидина тартрата и свободного основания в глазах обезьян показано на Фигурах 10 и 11 соответственно. В случае композиций бримонидина тартрата менее 50% матрицы разложилось для композиций Сравнительного примера 1 и Сравнительного примера 2 за год, в то время как для Сравнительного примера 3 и Сравнительного примера 4 этот показатель достигал более 90%. В случае композиций свободного основания бримонидина все композиции уменьшались в размерах и становились неудобными для проведения манипуляций через месяц, за исключением Примера 2, для которого ожидаемое время разрушения полимерной матрицы составляло около шести месяцев. In vitro наблюдения разложения матрицы совпадали с результатами, полученными in vivo.
Разложение полимерной матрицы композиций бримонидина тартрата и свободного основания в глазах кроликов анализировали по фотографическим изображениям, и время разложения матрицы составляло более 6 месяцев для композиций бримонидина тартрата и менее 4 месяцев для композиций свободного основания бримонидина.
Полимеры, используемые в композициях, включают, без ограничения, поли(D,L-лактид) и поли(D,L-лактид-ко-гликолид). Сведения о них приведены в Таблице A.
Четыре композиции свободного основания бримонидина продемонстрировали имплантаты с контролируемым высвобождением лекарственного средства на протяжении от одного до четырех месяцев и полимерными матрицами, разрушающимися быстрее, чем за удвоенный период высвобождения лекарственного средства. В отличие от этого, композиции бримонидина тартрата доставляют лекарственное средство в течение периода времени, сопоставимого с композициями свободного основания бримонидина, но полимерная матрица сохраняется на протяжении периода, превышающего удвоенное время высвобождения лекарственного средства.
Хотя данное изобретение было раскрыто в контексте определенных предпочтительных вариантов реализации и примеров, специалистам в данной области техники будет понятно, что настоящее изобретение выходит за пределы конкретных описанных вариантов реализации, охватывая другие альтернативные варианты реализации и/или использования изобретения и его очевидные модификации и эквиваленты. В дополнение к этому, хотя ряд вариантов изобретения был продемонстрирован и подробно описан, другие модификации, входящие в объем данного изобретения, будут хорошо понятны специалистам в данной области техники на основании данного описания. Также предусматривается, что могут быть составлены различные комбинации или субкомбинации конкретных признаков и аспектов вариантов реализации изобретения, которые также входят в объем изобретения. Соответственно следует понимать, что различные признаки и аспекты описанных вариантов реализации изобретения можно объединять друг с другом, или замещать один другим, с целью осуществить различные способы реализации описанного изобретения. Таким образом, предполагается, что объем настоящего изобретения, описанного в данном документе, не должен ограничиваться конкретными вариантами реализации изобретения, описанными выше, и должен определяться только путем добросовестного прочтения формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА ВНУТРЬ ГЛАЗА | 2007 |
|
RU2440102C2 |
| ВНУТРИГЛАЗНЫЕ СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2532333C2 |
| ВНУТРИГЛАЗНЫЕ ИМПЛАНТАТЫ, СОДЕРЖАЩИЕ ПРОСТАМИД, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2650614C2 |
| БИОДЕГРАДИРУЕМЫЕ СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ДОЛГОВРЕМЕННОГО ВЫСВОБОЖДЕНИЯ БЕЛКОВ | 2013 |
|
RU2676102C2 |
| ВНУТРИГЛАЗНЫЕ ИМПЛАНТАТЫ, СОДЕРЖАЩИЕ ПРОСТАМИДЫ | 2014 |
|
RU2666603C2 |
| СПОСОБ ЛЕЧЕНИЯ ПОВЫШЕННОГО ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ С ПОМОЩЬЮ ВНУТРИГЛАЗНОЙ СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2014 |
|
RU2664686C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ГЛАЗА С ПОМОЩЬЮ ИМПЛАНТАТА С ДОЛГОВРЕМЕННОЙ ДОСТАВКОЙ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА | 2014 |
|
RU2690841C1 |
| БИОЛОГИЧЕСКИ РАЗЛАГАЕМЫЕ ИЛИ БИОЛОГИЧЕСКИ РАЗРУШАЕМЫЕ МИКРОСФЕРЫ ИЛИ МИКРОЧАСТИЦЫ ДЛИТЕЛЬНОГО ВЫСВОБОЖДЕНИЯ, СУСПЕНДИРОВАННЫЕ В ЗАТВЕРДЕВАЮЩЕМ ДЕПООБРАЗУЮЩЕМ ИНЪЕКЦИРУЕМОМ ЛЕКАРСТВЕННОМ СОСТАВЕ | 2013 |
|
RU2672596C2 |
| ВНУТРИКАМЕРНЫЕ ИМПЛАНТАТЫ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ ТЕРАПЕВТИЧЕСКОГО АГЕНТА | 2011 |
|
RU2565445C2 |
| КОМПОЗИЦИИ ДОСТАВКИ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБ СТАБИЛИЗАЦИИ БЕЛКОВ В ПРОЦЕССЕ ИЗГОТОВЛЕНИЯ | 2014 |
|
RU2720412C2 |
Изобретение относится к медицине, в частности к офтальмологии. Предлагается внутриглазной имплантат для лечения патологий задней части глаза у человека, содержащий биоразлагаемую полимерную матрицу, содержащую по меньшей мере один биоразлагаемый полимер, и свободное основание бримонидина. При этом имплантат предназначен для доставки свободного основания бримонидина в стекловидное тело глаза при продолжительности доставки до шести месяцев. Биоразлагаемая полимерная матрица рассчитана на полное или почти полное разложение после введения в стекловидное тело глаза в течение периода времени, составляющего примерно удвоенный период доставки свободного основания бримонидина или меньше. Имплантат обеспечивает замедленное или пролонгированное освобождение бримонидина для достижения терапевтических эффектов без дополнительного введения вещества в глаз, что улучшает комфортность лечения и минимизирует риск инфекции или других осложнений. 6 з.п. ф-лы, 4 пр., 6 табл., 11 ил.
1. Внутриглазной имплантат для лечения патологий задней части глаза у человека, содержащий:
биоразлагаемую полимерную матрицу, содержащую по меньшей мере один биоразлагаемый полимер; и
свободное основание бримонидина;
при этом имплантат предназначен для доставки свободного основания бримонидина в стекловидное тело глаза пациента, имеющего патологию задней части глаза, при продолжительности доставки свободного основания бримонидина до шести месяцев, и при этом биоразлагаемая полимерная матрица рассчитана на полное или почти полное разложение после введения в стекловидное тело глаза в течение периода времени, составляющего примерно удвоенный период доставки свободного основания бримонидина или меньше.
2. Имплантат по п. 1, отличающийся тем, что свободное основание бримонидина содержится в имплантате в количестве около 50% от веса имплантата с учетом общего веса имплантата.
3. Имплантат по п. 1, отличающийся тем, что имплантат дополнительно имеет стержнеобразную форму, причем стержнеобразная форма имеет диаметр стержня около 350 мкм и длину стержня около 6 мм.
4. Имплантат по п. 1, отличающийся тем, что свободное основание бримонидина равномерно диспергировано в биоразлагаемой полимерной матрице.
5. Имплантат по п. 1, отличающийся тем, что по меньшей мере один биоразлагаемый полимер содержит поли(D,L-лактид-ко-гликолид) и поли(D,L-лактид).
6. Имплантат по п. 1, отличающийся тем, что биоразлагаемая полимерная матрица содержит по меньшей мере один полимер, выбранный из группы, состоящей из поли(D,L-лактид-ко-гликолида) с концевыми кислотными группами и поли(D,L-лактида) с концевыми кислотными группами.
7. Имплантат по п. 1, отличающийся тем, что продолжительность доставки свободного основания бримонидина находится в диапазоне от около 1 месяца до около 6 месяцев.
| СПОСОБ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ ЗАДНЕГО ОТРЕЗКА ГЛАЗА | 2002 |
|
RU2199988C1 |
| US 20050244469 A1, 03.11.2005 | |||
| JAFFE GJ et al | |||
| Long-term follow-up results of a pilot trial of a fluocinolone acetonide implant to treat posterior uveitis | |||
| Ophthalmology | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| WHELER LA et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2018-01-17—Публикация
2014-02-14—Подача