Область изобретения
Настоящее изобретение относится к области стерильных и инъецируемых композиций, содержащих гиалуроновую кислоту или ее соли, и в особенности композиций наполнителя мягких тканей, в частности для аугментации и/или восстановления мягкой ткани, включая периодонт, и в особенности для лечения дефектов и несовершенств кератиновых материалов, таких как кожа. Изобретение также относится к связанным способам.
Описание области техники
Предпринимались попытки разработать композиции, полезные для корректирования дефектов кожи, таких как рубцы и морщины, или для аугментации ткани субъекта для улучшения внешнего вида кожи, в частности, кожи лица. Основной способ, используемый для корректирования таких дефектов, включает инъецирование композиции наполнителя в дермальный слой кожи в области предполагаемой или желаемой аугментации.
Гиалуроновая кислота представляет собой основной компонент внеклеточного матрикса (ECM - от англ. extracellular matrix). Поэтому она находится в больших количествах в основном в коже. Она также представляет собой основной физиологический компонент хрящевого матрикса сустава и в особенно большом количестве находится в синовиальной жидкости.
Соответственно, гиалуроновая кислота в своей кислотной форме или форме соли представляет собой биоматериал, широко используемый в качестве инъецируемого заполняющего материала для применения в тканевой инженерии и, в особенности, для аугментации кожной ткани или другой мягкой ткани, такой как десневая ткань.
Гиалуроновая кислота представляет собой линейный несульфатированный гликозаминогликан, состоящий из повторяющихся звеньев D-глюкуроновой кислоты и N-ацетил-D-глюкозамина (Tammi R., Agren U.M., Tuhkanen A.L, Tammi M. Hyaluronan metabolism in skin. Progress in Histochemistry & Cytochemistry 29 (2): 1. - 81, 1994).
В коже гиалуроновая кислота главным образом синтезируется дермальными фибробластами и эпидермальными кератиноцитами (Tammi R., цитированный выше). Посредством остатков, несущих отрицательный заряд, гилауроновая кислота действует как водяной насос для поддержания эластичности кожи.
Кроме того, ECM представляет собой динамическую структуру, обладающую структурной и регуляторной ролью для тканей. ECM состоит из коллагена и эластина, а также основного вещества, главным образом воды, неорганических веществ и протеогликанов. Данный матрикс придает коже тургор и механические свойства прочности, эластичности и тонуса.
В отношении кожи отмечается, что с возрастом количество гиалуроновой кислоты и степень ее полимеризации уменьшаются, приводя к уменьшению количества воды, удерживаемой в соединительной ткани.
В то же самое время компоненты ECM деградируют, в основном под действием ферментов эндопептидазного типа, называемых матриксными металлопротеиназами или MMP (от англ. matrix metalloproteinases).
Наконец, уменьшения клеточной защиты увеличивают повреждение и расстройства, вызываемые внешними стрессами, такими как окислительный стресс.
После этого кожа подвергается процессу старения, приводящему к проявлению дефектов и недостатков кератиновых веществ, в частности, кожи.
В области наполнителей для морщин гели, состоящие преимущественно из гиалуроновой кислоты, в данном случае химически перекрестно-сшитой, инъецируют внутрикожно для заполнения углубления, возникшего вследствие движения. Перекрестное сшивание может увеличить длительность нахождения продукта в дерме. Такие гели, основанные на гиалуроновой кислоте, при необходимости перекрестно сшитой, позволяют сокращать морщины за счет механического действия наполнителя, возникающего в результате вакуумной обработки кожных морщин.
Тем не менее, известно, что инъекция таких гелей часто приводит к болезненному ощущению у пациента, причем это ощущение тем больше усиливается, чем более вязким и/или эластичным является гель.
В настоящее время для преодоления данной технической проблемы большинство наполнителей, основанных на гиалуроновой кислоте, доступно с местным анестезирующим средством для обеспечения большего комфорта для пациента. Это местное анестезирующее средство представляет собой только лидокаин в дозе приблизительно 0,3%.
Тем не менее, известно, что лидокаин может демонстрировать недостаток, связанный с его сосудорасширяющими свойствами, заключающийся в слишком быстрой абсорбции организмом пациента и иногда появлением обостренных гематом, которых, по очевидным эстетическим причинам, следует насколько возможно избегать. Решение для преодоления вышеупомянутых проблем может заключаться во введении лидокаина совместно с сосудосуживающим средством, в частности, эпинефрином (J. Endod. 2013 May; 39(5): 597-9). Тем не менее, присутствие сосудосуживающего средства, такого как эпинефрин, может потребовать добавление консерванта, который не всегда является инертным для пациента и может приводить к аллергиям.
Таким образом, сохраняется потребность в разработке гелей, состоящих преимущественно из гиалуроновой кислоты, в данном случае химически перекрестно-сшитой, которые позволяют преодолеть вышеупомянутые технические проблемы болезненного ощущения для пациента во время инъекции, и которые также не приводят ни к каким-либо проблемам, связанным с аллергиями, ни к появлению обостренных гематом.
Краткое изложение сущности изобретения
В соответствии с первым аспектом изобретение относится к способу, включающему, по меньшей мере, введение путем инъекции пациенту, нуждающемуся в таком введении:
(а) по меньшей мере эффективного количества гиалуроновой кислоты или ее соли; и
(б) по меньшей мере эффективного количества мепивакаина или его соли в качестве анестезирующего средства,
где указанный мепивакаин вводят до или одновременно с гиалуроновой кислотой.
В соответствии с конкретным аспектом способ по изобретению предназначен для аугментации мягкой ткани.
Целевая ткань может представлять собой кожу, но также может представлять собой десневую ткань.
В частности, способ по настоящему изобретению может быть эффективно использован (1) для предупреждения и/или лечение внешнего вида поверхности кожи.
Таким образом, способ по настоящему изобретению может предпочтительно использоваться (2) для предупреждения и/или лечения симптомов возрастного старения кожи и/или старения, вызванного внешними факторами, такими как стресс, загрязнение воздуха, курение табака или продолжительное воздействие ультрафиолетового (УФ) излучения, (3) для предупреждения и/или лечения ухудшения внешнего вида поверхности кожи, (4) для предупреждения и/или лечения ухудшенных вязкоупругих или биомеханических свойств кожи и/или (5) для заполнения объемных дефектов кожи, и, в частности, заполнения морщин, на длительный срок.
Кроме того, способ по изобретению также может предпочтительно использоваться для лечения областей недостатков и дефектов структуры и контура десны и костной ткани, таких как возникающие при утрате зубов, увеличении возраста, периодонтального заболевания и расстройств, периодонтальной травмы и после установки зубных имплантатов, для улучшения посадки и функции зубных протезов, включающих, кроме прочего, имплантаты, коронки, мосты....
В соответствии с еще одним воплощением способ по изобретению также полезен для регенерации хряща.
В соответствии с еще одним воплощением способ по изобретению может быть использован в качестве способа лечения артрита.
Наконец, гиалуроновая кислота представляет собой густую прозрачную жидкость, схожую с естественной жидкостью, находящейся в глазах. Соответственно, она уже предложена для поддержания объема глазной жидкости во время хирургического вмешательства. Таким образом, способ по изобретению также полезен при большинстве офтальмологических внутриглазных операций, включающих удаление катаракты, вставку и удаление интраокулярных линз (ИОЛ), операции на роговице, антиглаукомные операции, операции при травмах, окулопластику и мышечную хирургию.
В соответствии со вторым аспектом изобретение относится к стерильной и инъецируемой композиции, в частности, к композиции наполнителя мягкой ткани, содержащей эффективное количество по меньшей мере гиалуроновой кислоты или ее соли и включающей эффективное количество по меньшей мере мепивакаина или его соли в качестве анестезирующего средства.
Наконец, в соответствии с еще одним своим аспектом изобретение относится к способу приготовления стерильной и инъецируемой композиции, в частности, композиции наполнителя мягкой ткани, где способ включает по меньшей мере стадии:
а) обеспечения по меньшей мере одного геля гиалуроновой кислоты или ее соли, где указанная гиалуроновая кислота выбрана из формы перекрестно-сшитой гиалуроновой кислоты, формы не перекрестно-сшитой гиалуроновой кислоты или их смеси;
б) добавления к указанному гелю гиалуроновой кислоты по меньшей мере мепивакаина или его соли в качестве анестезирующего средства; и
в) стерилизации смеси, полученной на стадии б).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с первым аспектом изобретение относится к способу, включающему по меньшей мере введение путем инъекции пациенту, нуждающемуся в таком введении:
(а) по меньшей мере эффективного количества гиалуроновой кислоты или ее соли; и
(б) по меньшей мере эффективного количества мепивакаина или его соли в качестве анестезирующего средства,
где указанный мепивакаин вводят до или одновременно с гиалуроновой кислотой.
Авторы изобретения действительно обнаружили, что способ по изобретению может составлять конкурентную альтернативу существующим в настоящее время способам, в частности способам предупреждения и/или лечения внешнего вида поверхности кожи, предполагающим введение гиалуроновой кислоты с лидокаином, а также (1) для лечения областей недостатков и дефектов структуры и контура десны и костной ткани, (2) для офтальмологических внутриглазных операций, (3) для регенерации хряща и (4) при лечении артрита.
Во-первых, в противоположность лидокаину мепивакаин не демонстрирует значительных сосудорасширяющих свойств, как лидокаин.
Кроме того, мепивакаин имеет pKa 7,6, тогда как лидокаин имеет pKa 7,9. Таким образом, мепивакаин, имеющий более низкий, чем у лидокаина, pKa, демонстрирует лучшую липидную растворимость, что улучшает его диффузию через липидные барьеры. Таким образом, вследствие того, что мепивакаин может абсорбироваться быстрее, чем лидокаин, он, таким образом, подходит для лучшего предупреждения болевых ощущений во время инъекции.
Но важнее всего то, что авторы изобретения неожиданно обнаружили, что композиции наполнителя в соответствии с изобретением, т.е. включающие мепивакаин в качестве анестезирующего средства, могут быть стерилизованы без значительного воздействия на стабильность геля гиалуроновой кислоты.
Действительно, известно, что гели гиалуроновой кислоты особенно чувствительны к термической обработке, такой как обработка, требуемая для их стерилизации, и что эта низкая стабильность может быть увеличена в присутствии дополнительных веществ, таких как анестезирующее средство. Неожиданно, это нежелательное явление значительно уменьшается при использовании мепивакаина по сравнению с лидокаином, как представлено в следующих примерах 1 и 2. Дополнительно, авторы изобретения продемонстрировали, что композиция в соответствии с изобретением дополнительно удовлетворяет требованиям стабильности во времени, как представлено далее в примере 3.
В соответствии с авторами изобретения описание этих вышеупомянутых благоприятных воздействий на композиции наполнителя мягкой ткани, содержащих гиалуроновую кислоту, не было известно.
Предпочтительно, гиалуроновую кислоту или ее соль вводят одновременно с мепивакаином или его солью.
Предпочтительно, введение путем инъекции представляет собой внутриэпидермальную и/или внутрикожную, и/или подкожную инъекцию. Тем не менее, она может быть также введена десневым, суставным и внутриглазным путем.
Гиалуроновая кислота
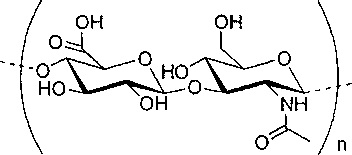
Как упомянуто выше, гиалуроновая кислота (также называемая гиалуронан или гиалуронат) представляет собой линейный несульфатированный гликозаминогликан, состоящий из повторяющихся звеньев D-глюкуроновой кислоты и N-ацетил-D-глюкозамина (Tammi R., Agren U.M., Tuhkanen A.L, Tammi M. Hyaluronan metabolism in skin. Progress in Histochemistry & Cytochemistry 29 (2): 1. - 81, 1994). В коже гиалуроновая кислота главным образом синтезируется дермальными фибробластами и эпидермальными кератиноцитами (Tammi R., цитированный выше). Посредством остатков, несущих отрицательный заряд, гилауроновая кислота действует как водяной насос для поддержания эластичности кожи.
Как упомянуто выше, в настоящем изобретении рассматривается введение как собственно гиалуроновой кислоты, так и ее соли.
Таким образом, гиалуроновая кислота в соответствии с изобретением может быть, в частности, выбрана из физиологически приемлемых солей, таких как натриевая соль, калиевая соль, соль цинка, соль серебра и их смеси, предпочтительно натриевой соли.
Предпочтительно, гиалуроновая кислота в соответствии с изобретением обладает высокой средней молекулярной массой, предпочтительно находящейся в диапазоне от 50000 до 10000000 дальтон, предпочтительно от 500000 до 4000000 дальтон.
Одной из особенно предпочтительных солей гиалуроновой кислоты является гиалуронат натрия (NaHA).
Как упомянуто выше, гиалуроновую кислоту вводят путем инъекции в эффективном количестве.
"Эффективным количеством" гиалуроновой кислоты является количество, необходимое для достижения желаемого технического результата, а именно для достижения видимого результата в отношении внешнего вида поверхности кожи. В частности, эффективным количеством гиалуроновой кислоты является количество гиалуроновой кислоты, необходимое для хорошего заполнения объемных дефектов кожи, и, в частности, заполнения морщин.
Корректировка количества гиалуроновой кислоты находится в компетенции специалиста в данной области техники.
Предпочтительно, гиалуроновая кислота или ее соли в способе в соответствии с изобретением находятся в растворе.
В этой связи эффективное количество гиалуроновой кислоты может находиться в диапазоне от 0,1 до 5 масс. %, предпочтительно от 1 до 3 масс. % относительно общей массы указанного раствора, содержащего гиалуроновую кислоту или ее соли.
В соответствии с конкретным воплощением гиалуроновая кислота может быть представлена в не перекрестно-сшитой форме.
В контексте настоящего изобретения термин "не перекрестно-сшитый" или "не сшитый перекрестно" обозначает гель гиалуроновой кислоты, который не является перекрестно-сшитым или незначительно перекрестно-сшит, то есть представляет собой гель, имеющий угол фазового сдвига δ, измеренный в динамических реологических условиях при 1 Гц, превышающий 40° при воздействии давления выше 1 Па.
В соответствии с еще одним конкретным воплощением гиалуроновая кислота может быть представлена в перекрестно-сшитой форме.
В соответствии с еще одним конкретным воплощением гиалуроновая кислота может быть представлена перекрестно-сшитой и не перекрестно-сшитой формах.
В этой связи массовое отношение "перекрестно-сшитая гиалуроновая кислота/не перекрестно-сшитая гиалуроновая кислота" предпочтительно больше чем 1.
В соответствии с конкретным воплощением раствор, содержащий гиалуроновую кислоту, и предназначенный для введения, может содержать:
- от 50 до 99 масс. %, более предпочтительно от 70 до 95 масс. % гиалуроновой кислоты, находящейся в форме перекрестно-сшитого геля,
- от 1 до 50 масс. %, предпочтительно от 5 до 30 масс. % гиалуроновой кислоты, находящейся в свободной форме, или ее физиологически приемлемой соли,
где отношение между массой геля перекрестно-сшитой гиалуроновой кислоты и массой свободной гиалуроновой кислоты составляет от 1:1 до 1:0,02.
Когда гиалуроновая кислота является перекрестно-сшитой, указанная перекрестно-сшитая гиалуроновая кислота предпочтительно имеет степень модификации, находящуюся в диапазоне от 0,1 до 20%, предпочтительно от 0,4 до 10%.
Под "степенью модификации" в контексте настоящего изобретения понимается отношение между количеством моль перекрестно-сшивающего агента, присоединенного к гиалуроновой кислоте, и количеством моль гиалуроновой кислоты, образующей указанный гель перекрестно-сшитой гиалуроновой кислоты. Данная величина может быть измерена при помощи анализа ЯМР (ядерного магнитного резонанса) 1D 1Н перекрестно-сшитого геля.
Под "количеством моль гиалуроновой кислоты" понимается количество моль повторяющихся дисахаридных звеньев гиалуроновой кислоты, где дисахаридное звено состоит из D-глюкуроновой кислоты и D-N-ацетилглюкозамина, сшитых вместе посредством чередующихся бета-1,4 и бета-1,3 гликозидных связей.
Эта степень модификации может быть в значительной степени оценена путем, раскрытым здесь далее.
Таким образом, определение степени модификации гиалуроновой кислоты осуществляют при помощи ЯМР спектроскопии (спектрометр Bruker Avance 1, функционирующий при 400 МГц (1Н)).
Для BDDE (1,4-бутандиол диглицидилового эфира) степень модификации получают путем интегрирования сигнала 1H ЯМР от N-ацетильной группы (δ≈2 млн-1), находящейся в гиалуроновой кислоте, и сигнала, получаемого от перекрестно-сшивающего агента (две группы -СН2-, δ ≈ 1,6 млн-1). Отношение интегралов этих двух сигналов (перекрестно-сшивающий агент/NaHA) относится к степени модификации после корректирования количества протонов, относящихся к каждому сигналу:
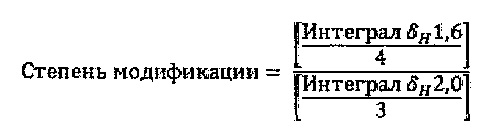
Перекрестно-сшивающий агент
Термин "перекрестно-сшивающий агент" понимается как любое соединение, способное осуществлять перекрестное сшивание между различными цепями гиалуроновой кислоты.
Выбор этого перекрестно-сшивающего агента очевидно находится в компетенции специалиста в данной области техники.
Перекрестно-сшивающий агент в соответствии с изобретением может быть выбран из бифункциональных или многофункциональных эпокси-перекрестно-сшивающих агентов, а также полиаминов, таких как, например гексаметилендиамин (HMDA) или эндогенные полиамины.
Под "эндогенным полиамином" в контексте настоящего изобретения понимается полиамин, естественным образом присутствующий в живых организмах и, в частности, в организме человека. В качестве представителей эндогенных полиаминов можно, в особенности, упомянуть полиамины, обнаруженные у эукариотических животных, такие как путресцин (или 1,4-диаминобутан), спермидин (или 1,8-диамино-5-азаоктан) и спермин (1,12-диамино-5,9-диазадодекан), предпочтительно спермин.
В частности, перекрестно-сшивающий агент в соответствии с настоящим изобретением может быть предпочтительно выбран из группы, состоящей из 1,4-бутандиол диглицидилового эфира (BDDE), 1,4-бис(2,3-эпоксипропокси)бутана, 1,4-бисглицидилоксибутана, 1,2-бис(2,3-эпоксипропокси)этилена и 1-(2,3-эпоксипропил)-2,3-эпоксицикогексана, эндогенного полиамина и их смесей.
Предпочтительно, перекрестно-сшивающий агент в соответствии с изобретением представляет собой 1,4-бутандиол диглицидиловый эфир (BDDE).
В конкретном воплощении, где перекрестно-сшивающий агент представляет собой полиамин, и, в частности, эндогенный полиамин, реакция взаимодействия с гиалуроновой кислотой может быть осуществлена в присутствии по меньшей мере одного активатора и, в данном случае, с по меньшей мере одним вспомогательным сшивающим агентом.
В этой связи активатор может быть выбран из водорастворимых карбодиимидов, таких как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), 1-этил-3-(3-25 триметиламинопропил)карбодиимида хлоргидрат (ETC), 1-циклогексил-3-(2-морфолиноэтил)карбодиимид (CMC) и их солей, и их смесей, предпочтительно активатор представляет собой EDC.
Вспомогательный сшивающий агент, когда он присутствует, может быть выбран из N-гидроксисукцинимида (NHS), N-гидроксибензотриазола (HOBt), 3,4-дигидро-3-гидрокси-4-оксо-1,2,3-бензотриазола (HOOBt), 1-гидрокси-7,7-азабензотриазола (HAt) и N-гидроксисульфосукцинимида (сульфо-NHS), и их смесей, предпочтительно он представляет собой HOBt.
Перекрестно-сшивающий агент вводят в эффективном количестве.
"Эффективным количеством" перекрестно-сшивающего агента является количество, необходимое для достижения нужной степени перекрестного сшивания гиалуроновой кислоты.
Корректирование количества перекрестно-сшивающего агента находится в компетенции специалиста в данной области техники.
Предпочтительно, эффективное количество перекрестно-сшивающего агента может находиться в диапазоне от 0,05 до 15 масс. % относительно общей массы гиалуроновой кислоты или ее соли.
Предпочтительно, когда гиалуроновая кислота является перекрестно-сшитой, и когда перекрестно-сшивающий агент представляет собой BDDE, тогда количество в виде мольного отношения nBDDE/n гиалуроновой кислоты может находиться в диапазоне от 0,01 до 0,5, предпочтительно от 0,04 до 0,25.
Анестезирующее средство
Анестезирующее средство в соответствии с настоящим изобретением обладает особым преимуществом уменьшения или устранения болевого ощущения, испытываемое пациентом во время и/или после инъекции.
Кроме того, анестезирующее средство в соответствии с настоящим изобретением выбрано из соединений, использование которых не приводит к риску несовместимости с другими соединениями, используемыми в композиции в соответствии с изобретением, в особенности с гиалуроновой кислотой.
Как упомянуто выше, анестезирующее средство в соответствии с настоящим изобретением представляет собой мепивакаин или его соль.
Мепивакаин представляет собой местное анестезирующее средство группы аминоамидов формулы (I):
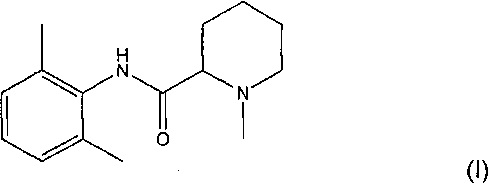
Мепивакаин продается главным образом под товарным знаком Carbocaine® от компании Cook-Waite.
Мепивакаин представляет собой молекулу, обладающую хорошей стабильностью. Основным продуктом ее распада является собой 2,6-диметиланилин. Мепивакаин представляет собой молекулу, содержащую хиральный центр (асимметрический атом углерода). Таким образом, существуют R и S энантиомеры. В следующих примерах рассматривается рацемическая смесь двух форм мепивакаина.
Предпочтительно, мепивакаин находится в форме соли, и, в частности, соль мепивакаина представляет собой хлоргидрат мепивакаина.
Как упомянуто выше, мепивакаин или его соль вводят путем инъекции в эффективном количестве.
"Эффективным количеством" мепивакаина или его соли является количество, необходимое для эффективного уменьшения или устранения болевого ощущения, испытываемого пациентом во время и/или после инъекции.
Корректирование количества мепивакаина или его соли находится в компетенции специалиста в данной области техники.
Предпочтительно, мепивакаин или его соли в способе в соответствии с изобретением находятся в растворе.
В этой связи эффективное количество мепивакаина или его соли может находиться в диапазоне от 0,05 до 3 масс. % относительно массы раствора, содержащего указанный мепивакаин или его соль.
Способ может дополнительно включать ведение, в данном случае совместно с мепивакаином, по меньшей мере одного дополнительного анестезирующего средства или его соли, отличного от мепивакаина.
Это дополнительное анестезирующее средство может быть, в частности, выбрано из амбукаина, амоланона, амилокаина, беноксината, бензокаина, бетоксикаина, бифенамина, бупивакаина, бутакаина, бутамбена, бутаниликаина, бутетамина, бутоксикаина, картикаина, хлорпрокаина, кокаэтилена, кокаина, циклометикаина, дибукаина, диметисоквина, диметокаина, диперодона, дициклонина, экгонидина, экгонина, этилхлорида, этидокаина, бета-эукаина, эупроцина, феналкомина, формокаина, гексилкаина, гидрокситетракаина, изобутил лара-аминобензоата, лейцинокаина мезилата, левоксадрола, лидокаина, меприлкаина, метабутоксикаина, метилхлорида, миртекаина, наепаина, октакаина, ортокаина, оксетазаина, парэтоксикаина, фенакаина, фенола, пиперокаина, пиридокаина, полидоканола, прамоксина, прилокаина, прокаина, пропанокаина, пропаракаина, пропипокаина, пропоксикаина, псевдококаина, пиррокаина, ропивакаина, салицилового спирта, тетракаина, толикаина, тримекаина, золамина и их солей, или их смеси.
Предпочтительно, это дополнительное анестезирующее средство представляет собой лидокаин или его соли.
В соответствии с первым воплощением дополнительное анестезирующее средство вводят отдельно, до гиалуроновой кислоты и мепивакаина или его соли.
В соответствии со вторым аспектом дополнительное анестезирующее средство вводят вместе с мепивакаином или его солью, до введения гиалуроновой кислоты или ее соли.
В соответствии с третьим воплощением дополнительное анестезирующее средство вводят вместе с мепивакаином или его солью и гиалуроновой кислотой или ее солью.
В конкретном воплощении, когда оба анестезирующих средства содержатся в одной и той же композиции, они могут быть представлены в ней в отношении "мепивакаин/лидокаин" 1:1, предпочтительно в отношении 1:0,1.
Сбалансированный солевой раствор
В соответствии с конкретным воплощением способ в соответствии с изобретением может дополнительно включать по меньшей мере стадию введения путем инъекции указанному пациенту по меньшей мере (в) сбалансированного солевого раствора одновременно с указанной гиалуроновой кислотой и/или мепивакаином, предпочтительно с мепивакаином.
Введение этого сбалансированного солевого раствора особенно интересно тем, что оно по-прежнему позволяет уменьшить боль от инъекции (см. Farley J.S. et al., Regional Anesthesia A., 1994, Vol.19: 48).
Предпочтительно, указанный сбалансированный солевой раствор представляет собой натрий-фосфатный буфер, и, в частности, представляет собой натрий-фосфатный буфер, и, в частности, солевой буфер KH2PO4/K2HPO4.
В соответствии с конкретным воплощением указанный сбалансированный солевой раствор может дополнительно содержать по меньшей мере одно соединение, выбранное из группы, состоящей из альфа-липоевой кислоты; N-ацетил-L-цистеина; восстановленного глутатиона; аминокислоты, такой как L-аргинин, L-изолейцин, L-лейцин, моногидрат L-лизина, глицин, L-валин, L-треонин, L-пролин; пиридоксина гидрохлорида; дегидрата ацетата цинка; пентагидрата сульфата меди и их смеси.
Композиция в соответствии с изобретением
Как упомянуто выше, настоящее изобретение также относится к стерильной и инъецируемой композиции, в частности, композиции мягкого наполнителя, содержащей эффективное количество по меньшей мере гиалуроновой кислоты или ее соли, и включающей эффективное количество по меньшей мере мепивакаина или его соли в качестве анестезирующего средства.
Под "стерильной" в контексте настоящего изобретения подразумевают окружающую среду, способную гарантировать рассматриваемым соединениям в композиции в соответствии с изобретением выполнение требований безопасности для таких путей введения, как вышеупомянутые пути, главным образом в или через кожу. Действительно, в силу очевидных причин принципиально важно, чтобы композиция в соответствии с изобретением была свободна от любых загрязнителей, способных инициировать нежелательную побочную реакцию в организме-хозяине.
Гиалуроновая кислота, перекрестно-сшивающий агент и анестезирующее(ие) средство(а) представляет(ют) собой такое(те) как вышеупомянутое(ые).
В отношении гиалуроновой кислоты композиция в соответствии с изобретением может содержать от 0,1 до 5 масс. %, предпочтительно от 1 до 3 масс. % гиалуроновой кислоты относительно общей массы указанной композиции.
В соответствии с конкретным воплощением, как упомянуто выше, гиалуроновая кислота может находиться в перекрестно-сшитой и не перекрестно-сшитой формах.
В этой связи отношение "перекрестно-сшитая гиалуроновая кислота/не перекрестно-сшитая гиалуроновая кислота" предпочтительно составляет больше чем 1.
В частности, композиция в соответствии с изобретением может содержать:
- от 50 до 99 масс. %, более предпочтительно от 70 до 95 масс. % гиалуроновой кислоты, находящейся в форме перекрестно-сшитого геля,
- от 1 до 50 масс. %, предпочтительно от 5 до 30 масс. % гиалуроновой кислоты, находящейся в не перекрестно-сшитой форме,
отношение между массой геля перекрестно-сшитой гиалуроновой кислоты и массой не перекрестно-сшитой гиалуроновой кислоты составляет от 1:1 до 1:0,02.
В отношении анестезирующего средства(в) композиция в соответствии с изобретением может содержать от 0,01 до 5 масс. %, предпочтительно от 0,05 до 3 масс. % обезболивающего(их) средства(в), основываясь на общей массе указанной композиции.
Вследствие свойства инъецируемости, композиция в соответствии с изобретением обязательно содержит физиологически приемлемую среду.
"Физиологически приемлемая среда" означает среду, лишенную токсичности, и совместимую с инъекцией и/или применением композиции, такой как рассматриваемая в настоящем изобретении.
Композиция может содержать растворитель или смесь физиологически приемлемых растворителей.
Композиция может содержать физиологически приемлемую водную среду.
В качестве водной среды, подходящей для изобретения, может, например, быть упомянута вода.
В качестве изотонических агентов, подходящих для приготовления композиции в соответствии с изобретением, можно упомянуть сахара и хлорид натрия.
В соответствии с конкретным воплощением композиция в соответствии с изобретением может дополнительно содержать по меньшей мере сбалансированный солевой раствор, такой как вышеупомянутый раствор.
В соответствии с конкретным воплощением композиция в соответствии с изобретением может дополнительно содержать по меньшей мере одно соединение, выбранное из группы, состоящей из альфа-липоевой кислоты; N-ацетил-L-цистеина; восстановленного глутатиона; аминокислоты, такой как L-аргинин, L-изолейцин, L-лейцин, моногидрат L-лизина, глицин, L-валин, L-треонин, L-пролин; пиридоксина гидрохлорида; дегидрата ацетата цинка; пентагидрата сульфата меди и их смеси.
Композиция в соответствии с изобретением может содержать дополнительно к вышеупомянутым соединениям по меньшей мере одно дополнительное соединение, подходящее к применению в области композиций наполнителя мягких тканей.
В этой связи дополнительные соединения, которые могут содержаться в композиции в соответствии с изобретением, могут быть выбраны из соли меди, альфа-липоевой кислоты, ацетилированного производного цистеина или их смеси.
Количества этих дополнительных соединений зависят от природы интересуемого соединения, желаемого действия и назначения композиции в соответствии с изобретением.
Эти параметры относятся к общим знаниям специалиста в данной области.
Композиция, дополнительно содержащая по меньшей мере одну соль меди, может предпочтительно содержать указанную соль меди в количестве, находящемся в диапазоне от 0,1 до 50 млн-1 на основе общей массы указанной композиции.
Композиция, дополнительно содержащая по меньшей мере одну альфа-липоевую кислоту, предпочтительно содержит указанную альфа-липоевую кислоту в количестве, находящемся в диапазоне от 0,5 до 10000 млн-1 предпочтительно от 5 до 100 млн-1 альфа-липоевой кислоты на основе общей массы указанной композиции.
Композиция, дополнительно содержащая по меньшей мере одно ацетилированное производное цистеина, предпочтительно содержит указанное ацетилированное производное цистеина в количестве, находящемся в диапазоне от 0,5 до 10000 млн-1 на основе общей массы указанной композиции.
Среди других дополнительных соединений, которые могут быть использованы в настоящем изобретении, можно упомянуть антиоксиданты, аминокислоты, витамины, неорганические соединения, нуклеиновые кислоты, коферменты, производные адреналина, и их смеси, где указанные дополнительные соединения отличаются от соединений, указанных выше.
В качестве антиоксиданта можно упомянуть глутатион, эллаговую кислоту, спермин, ресвератрол, ретинол, L-карнитин, полиолы, полифенолы, флавонолы, теафлавины, катехины, кофеин, убихинол, убихинон и их смесь.
В качестве аминокислоты можно упомянуть аргинин, изолейцин, лейцин, лизин, глицин, валин, треонин, пролин, метионин, гистидин, фенилаланин, триптофан и их смесь.
В качестве витаминов и их производных можно упомянуть витамины Е, А, С, В, в особенности витамины В6, В8, В4, В5, В9, В7, В12, и предпочтительно пиридоксин.
В качестве неорганических соединений можно упомянуть, в частности, соединения, образованные солями цинка, солями магния, солями кальция, солями калия, солями марганца, солями натрия и их смесями.
В качестве нуклеиновых кислот можно упомянуть, в частности, производные аденозина, цитидина, гуанозина, тимидина, цитодина и их смесь.
В качестве коферментов можно упомянуть кофермент Q10, СоА (коэнзим A), NAD (никотинамидадениндинуклеотид), NADP (никотинамидадениндинуклеотидфосфат) и их смеси.
В качестве адреналиновых производных можно упомянуть адреналин, норадреналин.
Кроме того, композиция в соответствии с изобретением может дополнительно содержать любой эксципиент, широко используемый в области техники, такой как, например моно- и/или дигидратированный дигидрофосфат натрия и хлорид натрия в физиологических концентрациях.
Количества дополнительных активных агентов и/или эксципиентов, безусловно, зависят от природы интересуемого соединения, желаемого действия и назначения композиции в соответствии с изобретением.
В соответствии с конкретным воплощением композиция в соответствии с изобретением может обладать комплексной вязкостью η* от приблизительно 5 Па*с до приблизительно 450 Па*с, измеренной при приблизительно 1 Гц.
В соответствии с конкретным воплощением композиция в соответствии с изобретением, приготовленная из перекрестно-сшитой гиалуроновой кислоты, может обладать вязкостью от 200 до 2000 Па⋅с, предпочтительно от 1000 до 1800 Па⋅с.
Вязкоупругие свойства композиции в соответствии с изобретением могут быть измерены с использованием реометра (в частности Haake RS6000) с геометрией конус/пластина (угол конуса 1°/диаметр пластины 35 мм). Осуществляют деформационное сканирование, и модуль упругости G' (в Па) и угол фазового сдвига δ (в°) измеряют для давления 5 Па.
Способ приготовления стерильной и инъецируемой композиции в соответствии с изобретением
В соответствии с вышеупомянутым настоящее изобретение также относится к способу приготовления стерильной и инъецируемой композиции, в частности, композиции наполнителя мягкой ткани, где способ включает по меньшей мере стадии:
а) обеспечения по меньшей мере одного геля гиалуроновой кислоты или ее соли, где указанная гиалуроновая кислота выбрана из перекрестно-сшитой формы гиалуроновой кислоты, не перекрестно-сшитой формы гиалуроновой кислоты или их смеси;
б) добавления к указанному гелю гиалуроновой кислоты по меньшей мере мепивакаина или его соли в качестве анестезирующего средства; и
в) стерилизации смеси, полученной на стадии б).
В соответствии с предпочтительным воплощением мепивакаин или его соль добавляют к инъецируемой форме гиалуроновой кислоты.
Другими словами, гель гиалуроновой кислоты, рассматриваемый на стадии а), уже демонстрирует концентрацию гиалуроновой кислоты, остатков перекрестно-сшивающего агента, если он присутствует, и физиологические условия и/или условия рН, совместимые с применением путем инъецирования, в частности в рассмотренных выше областях применения.
Таким образом, риски, оказывающие воздействие на стабильность гиалуроновой кислоты в смеси гиалуроновой кислоты и мепивакаина за счет введения дополнительных стадий очистки, таких как определенные выше, значительно уменьшаются.
Смесь, предпочтительно, претерпевает только одну стадию стерилизации. Эту стадию предпочтительно осуществляют для смеси, уже упакованной в устройстве для ее доставки, обычно в шприце, как определено здесь далее.
Предпочтительно, стадия стерилизации может быть осуществлена при помощи термических средств.
Предпочтительно, стерилизацию осуществляют при температуре, находящейся в диапазоне от 120 до 140°С.
В частности, стадия стерилизации может быть осуществлена в автоклаве (влажное тепло) Т°C больше или равна 121°C с получением F0 больше15 (показатель стерильности).
В этой связи и в соответствии с вышеупомянутым, композиция в соответствии с изобретением особенно преимущественна тем, что она демонстрирует очень интересную высокую устойчивость к этой стадии стерилизации.
Действительно, как представлено в примерах 1 и 2, потеря G' за счет стерилизации композиции в соответствии с изобретением меньше, чем для композиции, содержащей лидокаин вместо мепивакаина.
В соответствии с конкретным воплощением способ приготовления геля гиалуроновой кислоты в соответствии с изобретением может дополнительно включать стадию г), заключающуюся в добавлении дополнительного анестезирующего средства или его соли, отличной от мепивакаина или его соли, такого, как вышеупомянутые, предпочтительно лидокаина или его соли, где указанную стадию г) осуществляют до, одновременно и/или после стадии б).
Когда гель, рассматриваемый на стадии а), содержит перекрестно-сшитую форму гиалуроновой кислоты, тогда последняя может быть получена заблаговременно из не перекрестно-сшитой формы гиалуроновой кислоты.
Образование сетки может быть осуществлено традиционным путем при помощи по меньшей мере одного перекрестно-сшивающего агента, такого как вышеупомянутый.
Водную смесь, содержащую перекрестно-сшивающий агент и гиалуроновую кислоту для перекрестного сшивания, предпочтительно гомогенизируют до осуществления перекрестного сшивания.
Задача этой операции заключается в том, чтобы, в частности, гидратировать и превосходно гомогенизировать гиалуроновую кислоту или ее соль в водной среде и, таким образом, способствовать оптимизации ожидаемых свойств геля гиалуроновой кислоты. Эта стадия гомогенизации более важна в случае, когда гиалуроновая кислота имеет высокую молекулярную массу, поскольку гидратирование такого соединения имеет тенденцию приводить к образованию высоковязкого раствора, в котором обычно наблюдается появление агломератов.
Задача этой операции также направлена на превосходную гомогенизацию перекрестно-сшивающего агента в смеси для того, чтобы затем обеспечить гомогенную перекрестно-сшивающую реакцию.
Гомогенизацию рассматривают как удовлетворительную, когда полученный раствор однородно окрашен, не содержит агломератов, и обладает однородной вязкостью. Гомогенизация может предпочтительно осуществляться в умеренных рабочих условиях для предупреждения распада цепей гиалуроновой кислоты.
Длительность этой стадии гомогенизации зависит от природы гиалуроновой кислоты или ее соли, и, в частности, ее молекулярной массы и концентрации, от рабочих условий в водной среде и от используемого гомогенизирующего устройства, как правило, устройства, обеспечиваеющего мягкое механическое встряхивание.
Предпочтительно, стадия гомогенизации может осуществляться в течение периода времени, составляющего менее чем 200 минут, предпочтительно менее чем 150 минут, или даже от 15 до 100 минут.
Задача перекрестно-сшивающей реакции заключается в том, чтобы создавать мостиковые связи между цепями гиалуроновой кислоты, позволяя получать плотную твердую трехмерную сеть из вязкого раствора.
Конкретные условия, адаптированные для стимулирования реакции перекрестного сшивания, могут зависеть от молекулярной массы гиалуроновой кислоты, от водной среды и от природы перекрестно-сшивающего агента. В общем, это образование сетки может быть достигнуто путем приведения смеси, содержащей не перекрестно-сшитую гиалуроновую кислоту и по меньшей мере один вышеупомянутый перекрестно-сшивающий агент, с инициирующим элементом или стимулятором, таким как, например нагревание или воздействие УФ излучения, или даже путем приведения указанной смеси в контакт с материалом каталитического типа.
Выбор такого инициирующего элемента относится к общим знаниям специалиста в данной области.
В контексте настоящего изобретения этот запускающий элемент предпочтительно представлен увеличением температуры, применяемым к смеси "не перекрестно-сшитая гиалуроновая кислота/водная среда/перекрестно-сшивающий агент".
Особенно подходящая температура для реакции перекрестного сшивания составляет от 35°С до 60°C, предпочтительно от 45 до 55°С, и еще лучше от 48 до 52°С.
Степень перекрестного сшивания также зависит от времени перекрестного сшивания и температуры, примененной к смеси "не перекрестно-сшитая гиалуроновая кислота/водная среда/перекрестно-сшивающий агент". Чем дольше период, тем выше будет степень перекрестного сшивания, но при этом, оптимум не должен быть преодолен в связи с риском деградации гиалуроновой кислоты.
Таким образом, при температуре, находящейся в диапазоне от 35°С до 60°С, реакция перекрестного сшивания может быть осуществлена в течение времени, находящегося в диапазоне от 30 до 300 минут, предпочтительно от 100 до 200 минут, и еще лучше от 150 до 190 минут.
Предпочтительно, условия перекрестного сшивания скорректированы таким образом, чтобы достичь такой степени перекрестного сшивания, что образующийся гель перекрестно-сшитой гиалуроновой кислоты представляет собой вязкий, вязкоупругий или даже твердый гель.
Для остановки реакции перекрестного сшивания необходимо воздействие на перекрестно-сшитый гель или, во время перекрестного сшивания, даже содержащую его емкость, условий, подходящих для остановки перекрестного сшивания, или, иначе, условий, способных останавливать образование связей между различными цепями гиалуроновой кислоты.
Например, в отношении температурных условий, которые применяются для стимуляции процесса перекрестного сшивания, последнее может быть остановлено:
- путем простого удаления емкости из термостатируемой бани и ее охлаждения до тех пор, пока она остудится до комнатной температуры;
- путем помещения емкости в баню с холодной водой, предпочтительно при температуре ниже комнатной температуры, до тех пор, пока температура в указанной емкости не станет близкой к комнатной температуре; или даже
- путем извлечения геля из указанной емкости.
В соответствии с конкретным воплощением гомогенизация и перекрестное сшивание может быть осуществлены в герметичной полости, ограниченной по меньшей мере частично деформируемой стенкой, предпочтительно образованной деформируемым карманом, который может быть деформирован по меньшей мере вручную пальцами, такой как полость, описанная, в частности, в WO 2010/131175.
Гель, полученный в конце стадии перекрестного сшивания, не может, как правило, инъецироваться непосредственно, в частности из-за высокой концентрации в нем гиалуроновой кислоты и/или из-за возможного присутствия остатков перекрестно-сшивающего агента, или, иначе, из-за его физиологических условий и/или условий рН, не совместимых с применением в рассмотренных выше областях.
Кроме того, некоторые гели могут в особенности обладать слишком высокой густотой для того, чтобы их можно было инъецировать пациенту без дополнительной обработки. Таким образом, несколько дополнительных стадий, известных специалистам в данной области техники, могут быть осуществлены для получения инъецируемого гидрогеля. В частности, стадия нейтрализации и расширения этого геля требуется для придания ему качеств имплантата. Цепи сети гиалуроновой кислоты затем вытягивают и гидратируют, тогда как рН приводят к значению рН дермы.
Стадия защиты и повторного уплотнения геля также могут быть осуществлены для дополнительного улучшения качеств имплантата, в соответствии с уровнем знаний специалиста в данной области техники. Гель должен быть приготовлен так, чтобы быть физиологически приемлемым, посредством присутствия солей в количествах, эквивалентных количествам в инъецируемой среде.
Для еще более высокой чистоты также может быть осуществлена дополнительная стадия очистки.
Предпочтительно, мепивакаин или его соль и, в данном случае, дополнительное(ые) анестезирующее(ие) средство(а) добавляют в конце этого протокола приготовления инъецируемой формы гиалуроновой кислоты, непосредственно перед стадией стерилизации, такой как определенная выше.
В соответствии с конкретным воплощением гидрогель с добавленным мепивакаином и, возможно, дополнительным(и) анестезирующим(и) средства(ми), могут быть использованы для заполнения шприцев в условиях контролируемой окружающей среды, где указанные шприцы затем возможно претерпевают стадию стерилизации, предпочтительно стадию термической стерилизации, такую как определенная выше.
Введение композиции
Композиция в соответствии с изобретением может быть инъецирована с использованием любого способа, известного в области техники.
В частности, композиция по изобретению может быть введена при помощи инъецирующего устройства, подходящего для внутриэпидермальной и/или внутрикожной, и/или подкожной инъекции.
Композиция по изобретению также может быть введена при помощи инъецирующего устройства, подходящего для десневой, суставной и/или внутриглазной областей.
Инъецирующее устройство, в частности, когда композицию по изобретению вводят при помощи инъецирующего устройства, подходящего для внутриэпидермальной и/или внутрикожной, и/или подкожной инъекции, может быть выбрано из шприца, набора микрошприцев, лазерного устройства, гидравлического устройства, шприца-пистолета, устройства для безыгольной инъекции, валика с микроиглами.
Предпочтительно, инъецирующее устройство может быть выбрано из шприца или набора микрошприцев.
В альтернативном воплощении инъецирующее устройство может быть адаптировано к технике мезотерапии.
Мезотерапия представляет собой технику лечения путем внутриэпидермального и/или внутрикожного, и/или подкожного введения активного(ых) продукта(ов).
Внутриэпидермальное и/или внутрикожное, и/или подкожное введение в соответствии с изобретением относится к инъецированию композиции по изобретению в эпидермальную, дермо-эпидермальную и/или дермальную область.
Инъецирующее устройство может включать любой обычно используемый инъектор, такой как игла для подкожных инъекций или канюля.
Игла или канюля в соответствии с изобретением может иметь диаметр, находящийся в диапазоне от 18 до 34 G, предпочтительно от 25 до 32 G, и длину, варьирующую от 4 до 70 мм, предпочтительно от 4 до 25 мм.
Игла или канюля предпочтительно является одноразовой.
Предпочтительно, игла или канюля соединена со шприцом или другим устройством, способным доставлять через иглу или канюлю указанную инъецируемую композицию. В соответствии с одним из воплощений катетер может быть размещен между иглой/канюлей и шприцом.
Известным образом операции со шприцом может производить практикующий врач, или же они могут производиться посредством держателя для шприца, такого как пистолет.
Если не указано иное, в описании, включая формулу изобретения, выражение "содержащий" должно пониматься как синоним для "содержащий по меньшей мере один".
Если не указано иное, выражения "между… и…" и "находящийся в диапазоне от… до…" понимаются как обозначающие инклюзивные пределы.
Следующие примеры и графические материалы представлены путем не ограничивающих объем изобретения иллюстраций.
ПРИМЕРЫ:
Материал и способ:
Протокол, приведенный здесь ниже, относящийся к измерению вязкоупругих свойств композиции, применяется в отношении следующих примеров.
Вязкоупругие свойства композиции измеряют с использованием реометра (Haake RS6000) с геометрией конуса/пластины (угол конуса 1°/диаметр пластины 35 мм). Осуществляют деформационное сканирование, и модуль упругости G' (в Па) и угол фазового сдвига 6 (в°) измеряют для давления 5 Па.
Пример 1: Протокол приготовления композиции в соответствии с изобретением, содержащей не перекрестно-сшитую гиалуроновую кислоту, и анализ ее устойчивости к стерилизации
Смешивают 3 г гиалуроновой кислоты (1,5 мДа) и 197 г фосфатного буфера (как определено в FR 2979539).
Протокол приготовления заключается в следующем:
1. трехмерная гомогенизация смеси "гиалуроновая кислота+фосфатный буфер" при комнатной температуре в воздухонепроницаемом контейнере (Nalgene jar) в течение минимум 20 часов;
2. разделение полученного не перекрестно-сшитого геля на 2 эквивалентные фракции (назваемые далее как фракции А1 и А2);
3. в отношении фракции А1 добавление к гелю 1 масс. % раствора мепивакаина (30 масс. % в среде фосфатного буфера) и 0,4 масс. % 1% раствора NaOH; или
4. в отношении фракции А2, добавление к гелю 1 масс. % раствора лидокаина (30 масс. % в среде фосфатного буфера и 0,4 масс. % 1% раствора NaOH; и
5. гомогенизация, упаковка в шприцы объемом 1 мл для инъекции, и автоклавирование (F0 больше 15).
Результаты:
В нижеприведенных таблицах указаны значения для модулей упругости G' (в Па) полученных гидрогелей и силы экструзии F(N).
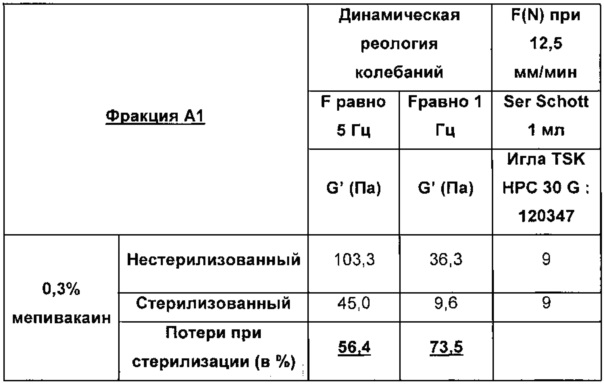
Потерю при стерилизации для G' при F=5 Гц рассчитывают следующим образом:
(103.3-45.01/103.3=56.4 (в %)
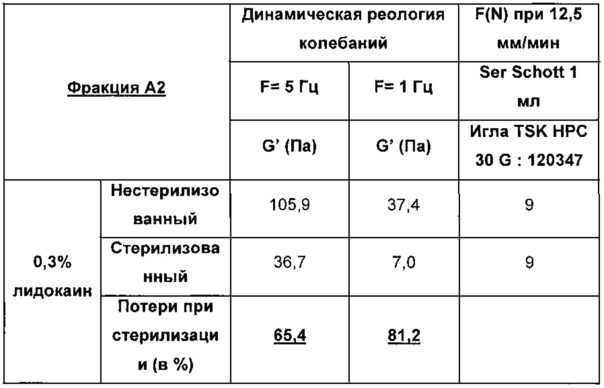
В свете вышеизложенного очевидно, что устойчивость к стадии стерилизации для композиции, содержащей не перекрестно-сшитую гиалуроновую кислоту, по меньшей мере эквивалентна с мепивакаином, нежели чем с лидокаином.
Результаты даже существенно лучше для мепивакаина.
Пример 2: протокол приготовления композиции в соответствии с изобретением, содержащую перекрестно-сшитую и не перекрестно-сшитую гиалуроновую кислоту, и анализ ее устойчивости к стерилизации
Обеспечивают 8 г гиалуроновой кислоты (4 мДа), 58,7 г 1% гидроксида натрия (NaOH) и 0,6 г бутандиола диглицидилового эфира (BDDE). Реакцию перекрестного сшивания инициируют путем инкубации в течение 3 часов при 52°С.
Протокол приготовления является следующим:
1. Гомогенизация смеси "гиалуроновая кислота + 1% NaOH'' при комнатной температуре в воздухонепроницаемом и деформируемом контейнере (карман, такой как рассматриваемый в заявке на патент WO 2010/131175) в течение приблизительно 1 ч30 с получением превосходно гомогенного вязкого раствора;
2. Добавление перекрестно-сшивающего агента (BDDE) в емкость, и новая гомогенизация при комнатной температуре в течение приблизительно 20 мин;
3. Инкубация в течение 3 часов при 52°С емкости, содержащей вязкий раствор "гиалуроновая кислота/1% гидроксид натрия/BDDE" для инициирования стадии перекрестного сшивания;
4. Нейтрализация, набухание и гомогенизация получающегося твердого вещества (раствор перекрестно-сшитой гиалуроновой кислоты) в фосфатном буфере (как определенный в FR 2979539), и добавление не перекрестно-сшитого геля, содержащего 4 г НА (гилауроновой кислоты) 4 мДа и 668 г дополненного фосфатного буфера с получением гидрогеля, имеющего 11 мг/г гиалуроновой кислоты при почти нейтральном рН;
5. Очистка путем диализа в течение 48 часов, и затем сбор полученного геля в емкость для гомогенизации;
6. Просеивание всего геля (230 мкм);
7. Разделение собранного геля на две фракции (Фракция В1 и 82);
8. Включение в гель 1 масс. % раствора мепивакаина (30 масс. % в среде фосфатного буфера) и 0,4 масс. % 1% раствора NaOH (равно фракции В1);
9. Включение в гель 1% по массе раствора лидокаина (30% по массе в среде фосфатного буфера) и 0,4% по массе раствора 1% NaOH (равно фракции B2);
10. Гомогенизация, упаковка в шприцы объемом 1 мл для инъекции и стерилизации.
Результаты:
В нижеприведенных таблицах указаны значения для модулей упругости G' (в Па) полученных гидрогелей и силы экструзии F(N).


Потери при стерилизации рассчитаны, как показано в примере 1.
В свете вышеизложенного очевидно, что устойчивость к стадии стерилизации композиции, содержащей перекрестно-сшитую и не перекрестно-сшитую гиалуроновую кислоту, по меньшей мере эквивалентна с мепивакаином, нежели чем с лидокаином.
Результаты даже существенно лучше для мепивакаина.
Пример 3: протокол приготовления композиции в соответствии с изобретением, содержащей перекрестно-сшитую и не перекрестно-сшитую гиалуроновую кислоту, и анализ ее стабильности со временем
Смешивают 10 г гиалуроновой кислоты (1,5 мДа), 73 г 1% гидроксида натрия и 0,9 г бутандиола диглицидилового эфира (BDDE). Затем инициируют реакцию перекрестного сшивания путем инкубации в течение 3 часов при 52°С.
Процедура приготовления заключается в следующем:
1. гомогенизация при комнатной температуре смеси "гиалуроновая кислота + 1% гидроксид натрия" в воздухонепроницаемом и деформируемом контейнере (кармане) в течение приблизительно 1 ч 30 с получением превосходно гомогенного вязкого раствора;
2. добавление в контейнер перекрестно-сшивающего агента (BDDE) и дополнительная гомогенизация при комнатной температуре в течение приблизительно 20 мин;
3. инкубация в течение 3 часов при 52°С емкости, содержащей вязкий раствор гиалуроновой кислоты/1% гидроксида натрия/BDDE для инициирования стадии перекрестного сшивания;
4. нейтрализация, набухание и гомогенизация получающегося твердого вещества (раствор перекрестно-сшитой гиалуроновой кислоты) в фосфатном буфере, содержащем 2 г не перекрестно-сшитой гиалуроновой кислоты (1,5 мДа), с получением гидрогеля, имеющего 25 мг/г гиалуроновой кислоты при рН, близком к нейтральному;
5. очистка путем диализа (в течение 48 часов) и затем сбор очищенного геля в дегазирующий сосуд/гомогенизация;
6. включение в гель 1 масс. % раствора мепивакаина (30 масс. % в среде фосфатного буфера) и 0,4 масс. % 1% раствора NaOH;
7. гомогенизация, дегазация, упаковка в шприцы объемом 1 мл для инъекции и стерилизации (F0 больше15).
Результаты:
В нижеприведенной таблице указаны значения для угла фазового сдвига 6 (°) и силы экструзии.
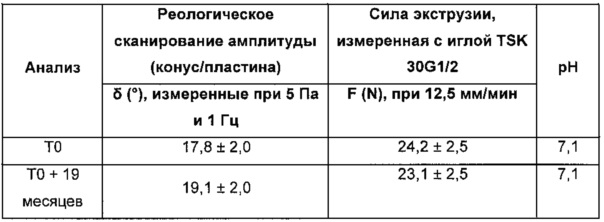
Результаты, полученные через 19 месяцев после даты изготовления геля, эквивалентны результатам, изначально полученным для геля, что, таким образом, демонстрирует стабильность геля.
Группа изобретений относится к медицине и может быть использована для предупреждения и/или лечения внешнего вида поверхности кожи. Для этого путем инъекции пациенту, нуждающемуся в таком введении, одновременно вводят стерильную композицию, содержащую эффективное количество гиалуроновой кислоты или ее соли; и эффективное количество хлоргидрата мепивакаина. Также предложены способ для лечения дефектов структуры, а также контура десны и костной ткани, стерильная инъецируемая композиция и способ приготовления стерильной инъецируемой композиции. Группа изобретений обеспечивает улучшенную стабильность при стерилизации указанной композиции, что в свою очередь обеспечивает сохранение оптимальных реологических свойств гиалуроновой кислоты, предотвращая возможное усиление болевого ощущения у пациента во время инъекции. 4 н. и 15 з.п. ф-лы, 5 табл., 3 пр.
1. Способ для предупреждения и/или лечения внешнего вида поверхности кожи, выбранного из симптомов возрастного старения кожи и/или старения, вызванного внешними факторами, такими как стресс, загрязнение воздуха, курение табака или продолжительное воздействие ультрафиолетового (УФ) излучения, ухудшения внешнего вида поверхности кожи, ухудшенных вязкоупругих или биомеханических свойств кожи и/или для заполнения объемных дефектов кожи на длительный срок, где указанный способ включает, по меньшей мере, введение путем инъекции пациенту, нуждающемуся в таком введении, стерильной композиции, содержащей:
(а) по меньшей мере, эффективное количество гиалуроновой кислоты или ее соли; и
(б) по меньшей мере, эффективное количество мепивакаина или его соли в качестве анестезирующего средства, при этом мепивакаин представляет собой хлоргидрат мепивакаина,
где (а) и (б) вводят одновременно.
2. Способ для лечения областей недостатков и дефектов структуры и контура десны и костной ткани, где указанный способ включает, по меньшей мере, введение путем инъекции пациенту, нуждающемуся в таком введении, стерильной композиции, содержащей:
(а) по меньшей мере, эффективное количество гиалуроновой кислоты или ее соли; и
(б) по меньшей мере, эффективное количество мепивакаина или его соли в качестве анестезирующего средства, при этом мепивакаин представляет собой хлоргидрат мепивакаина.
3. Способ по п. 1 или 2, где гиалуроновая кислота выбрана из группы, состоящей из перекрестно-сшитых гиалуроновых кислот, не перекрестно-сшитых гиалуроновых кислот и их смеси.
4. Способ по п. 1 или 2, где гиалуроновая кислота выбрана из смесей перекрестно-сшитой гиалуроновой кислоты и не перекрестно-сшитой гиалуроновой кислоты.
5. Способ по п. 1 или 2, где мепивакаин или его соль находится в растворе, эффективное количество мепивакаина или его соли находится в диапазоне от 0,05 до 3 мас.% относительно общей массы указанного раствора.
6. Способ по п. 1 или 2, где указанный способ дополнительно включает введение, по меньшей мере, лидокаина или его соли.
7. Стерильная и инъецируемая композиция, содержащая эффективное количество, по меньшей мере, гиалуроновой кислоты или ее соли и включающая эффективное количество, по меньшей мере, мепивакаина в качестве анестезирующего средства, при этом мепивакаин представляет собой хлоргидрат мепивакаина.
8. Композиция по п. 7, где гиалуроновая кислота имеет среднюю молекулярную массу, находящуюся в диапазоне от 50000 до 10000000 дальтон.
9. Композиция по п. 7, где гиалуроновая кислота выбрана из перекрестно-сшитых гиалуроновых кислот, не перекрестно-сшитых гиалуроновых кислот и их смеси.
10. Композиция по п. 7, где указанная композиция содержит от 0,1 до 5 мас.% гиалуроновой кислоты относительно общей массы указанной композиции.
11. Композиция по п. 7, где гиалуроновая кислота, когда она является перекрестно-сшитой, имеет степень модификации, находящуюся в диапазоне от 0,1 до 20%.
12. Композиция по п. 7, где указанная композиция содержит от 0,01 до 5 мас.% анестезирующего(их) средства(средств) на основе общей массы указанной композиции.
13. Композиция по п. 7, где указанная композиция дополнительно содержит, по меньшей мере, сбалансированный солевой раствор.
14. Композиция по п. 13, где сбалансированный солевой раствор представляет собой солевой буфер KH2PO4/K2HPO4.
15. Композиция по п. 7, где композиция дополнительно включает по меньшей мере одно соединение, выбранное из группы, состоящей из альфа-липоевой кислоты; N-ацетил-L-цистеина; восстановленного глутатиона; аминокислоты, такой как L-аргинин, L-изолейцин, L-лейцин, моногидрат L-лизина, глицин, L-валин, L-треонин, L-пролин; пиридоксина гидрохлорида; дегидрата ацетата цинка; пентагидрата сульфата меди и их смеси.
16. Способ приготовления стерильной и инъецируемой композиции, где способ включает, по меньшей мере, стадии:
а) обеспечения по меньшей мере одного геля гиалуроновой кислоты или ее соли, где указанная гиалуроновая кислота выбрана из формы перекрестно-сшитой гиалуроновой кислоты, формы не перекрестно-сшитой гиалуроновой кислоты или их смеси;
б) добавления к указанному гелю гиалуроновой кислоты, по меньшей мере, мепивакаина или его соли в качестве анестезирующего средства, при этом мепивакаин представляет собой хлоргидрат мепивакаина; и
в) стерилизации смеси, полученной на стадии б).
17. Способ по п. 16, где указанную стадию в) осуществляют при температуре, находящейся в диапазоне от 120 до 140°C.
18. Способ по п. 16, где гиалуроновая кислота имеет среднюю молекулярную массу, находящуюся в диапазоне от 50000 до 10000000 дальтон.
19. Способ по п. 16, где перекрестно-сшитая гиалуроновая кислота со стадии а) получена ранее путем перекрестного сшивания не перекрестно-сшитой гиалуроновой кислоты эффективным количеством по меньшей мере одного перекрестно-сшивающего агента, выбранного из группы, состоящей из 1,4-бутандиол диглицидилового эфира (BDDE), 1,4-бис(2,3-эпоксипропокси)бутана, 1,4-бисглицидилоксибутана, 1,2-бис(2,3-эпоксипропокси)этилена, 1-(2,3-эпоксипропил)-2,3-эпоксициклогексана, эндогенного полиамина и их смеси.
| FR 2979539 A1, 08.03.2013 | |||
| WO 2012104419 A1, 09.08.2012 | |||
| WO 2004032943 А1, 22.04.2004 | |||
| IANNITTI T at al., Short review on face rejuvenation procedures: focus on preoperative antiseptic and anesthetic delivery by JetPeel™-3 (a high pressure oxygen delivery device), Minerva Chir | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2018-10-24—Публикация
2014-07-29—Подача