Изобретение относится к области химической технологии кремнийорганических соединений и может найти промышленное применение при получении новых функциональных материалов, обладающих люминесцентными свойствами. Более конкретно, изобретение относится к новым линейным олигоарилсиланам.
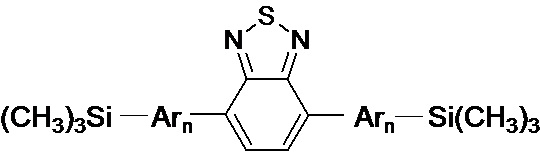
Под линейными олигоарилсиланами в рамках данного изобретения мы понимаем линейные олигомерные индивидуальные соединения, содержащие бензотиадиазольный фрагмент в центре и одинаковые или различные ариленовые или гетероариленовые фрагменты с триметилсилильными группами на периферии.
Интерес к олигомерам, содержащим бензотиадиазольные фрагменты, обусловлен уникальными оптическими и электрическими свойствами этих молекул. Такие олигомеры отличаются высокой термостойкостью, большим коэффициентом поглощения, подходящими для применения в органической фотонике и электронике значениями высшей заполненной и низшей свободной молекулярных орбиталей (ВЗМО и НСМО), а также сильным межмолекулярным π-π взаимодействием.
Известны различные полимеры и олигомеры, содержащие бензотиадиазольные фрагменты. Бензотиадиазольный фрагмент использовался при получении полимеров с узкой запрещенной зоной (J. Am. Chem. Soc. 2008, 130, 16144) и олигомеров (Synthetic Metals 2009. 159. 556-560) для эффективных солнечных батарей, полученных из растворов, а так же методом вакуумного напыления (Solar Energy Materials & Solar Cells 2010. 94. 2057-2063); люминесцентных солнечных концентраторов, содержащих дизамещенные бензотиадиазольные фрагменты (ЕР 2557606 А1, 2013); олигомеров для тонкопленочных полевых транзисторов, обладающих как электронной, так и дырочной проводимостью (р- и n-типа) (Australian Journal of Chemistry 2013. 66. 370-380, Chem. Mater. 2008. 20. 3184-3190); дихроичных флуоресцентных красителей для жидкокристаллических дисплеев (J. Mater. Chem., 2004. 14. 1901-1904); электролюминесцентных полимеров для органических светоизлучающих диодов (ОСИД) (WO 2006097711 А1) и др.
Линейные олигоарилсиланы, описываемые в рамках данного изобретения близки по строению к ароматическому олигомеру, состоящему из центрального бензотиазольного фрагмента и двух триметилсилилфенильных фрагментов (4,7-бис(4-триметилсилилфенил)-2,1,3-бензотиадиазол (Heterocycles, 1996. 42. 597-615). Однако его оптические свойства не описаны и можно предположить, что небольшая длина сопряжения такой структуры не позволит эффективно использовать ее в органической электронике.
Наиболее близкими по строению к заявляемым олигоарилсилановым люминофорам являются линейные олигомеры А, В (Chem. Commun., 2014, 50, 5600-5603) и С (Chem. Mater., 2008, 20, 3184-3190), имеющие следующие структурные формулы:
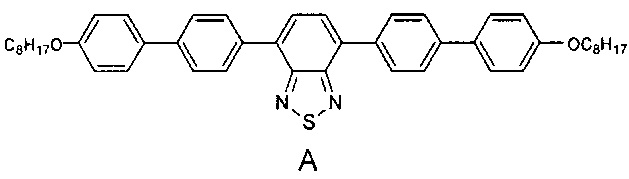
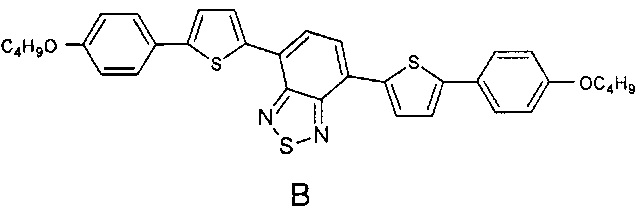
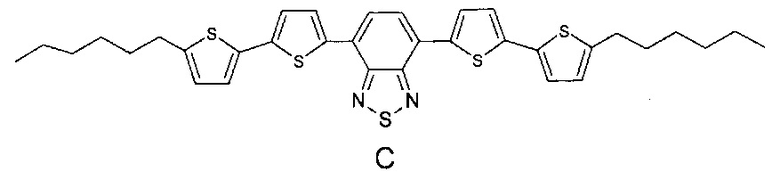
В структурах А, В и С к центральному бензотиадиазольному фрагменту присоединено по два диарильных фрагмента, состоящих из одинаковых или различных ариленовых групп, к каждому из которых присоединены либо эфирные либо алкильные группы. В отличие от олигомеров А, В и С, в рамках данного изобретения заявляются олигоарилсиланы, содержащие по два олигоарильных фрагмента, состоящих из одинаковых или различных ариленовых групп, к каждому из которых присоединены триметилсилильные группы, что придает им специфические оптические свойства. Кроме того, заявляемые соединения, в отличие от известных, обладают лучшей растворимостью и термостабильностыо.
Задачей заявляемого изобретения является синтез новых олигоарилсилановых люминофоров, обладающих набором физико-химических свойств, благодаря которым их можно использовать в качестве высокоэффективных люминесцентных материалов для органической электроники и фотоники.
К достигаемым техническим результатам следует отнести сочетание высокой эффективности люминесценции с коротким временем высвечивания, хорошей растворимостью и повышенной термостабильностью.
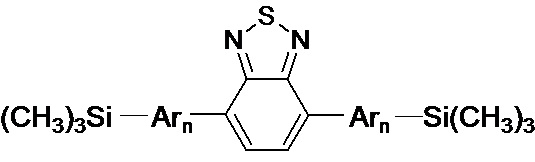
Обозначенные выше эффекты обусловлены тем, что получены новые олигоарилсилановые люминофоры общей формулы (I),
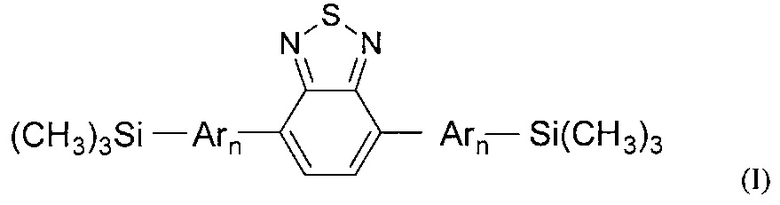
где Ar означает одинаковые или различные ариленовые или гетероариленовые радикалы, выбранные из ряда: замещенный или незамещенный тиенил-2,5-диил общей формулы (II-а) 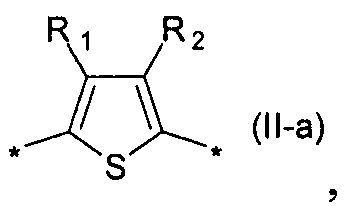 замещенный или незамещенный фенил-1,4-диил общей формулы (II-б)
замещенный или незамещенный фенил-1,4-диил общей формулы (II-б) 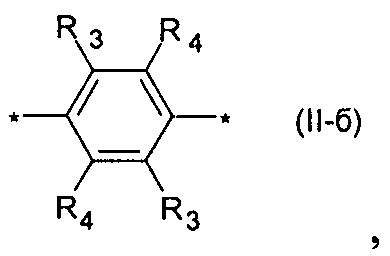 замещенный или незамещенный 1,3-оксазол-2,5-диил общей формулы (II-в)
замещенный или незамещенный 1,3-оксазол-2,5-диил общей формулы (II-в) 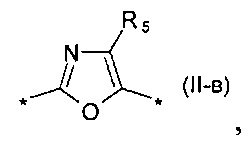 1,3,4-оксадиазол-2,5-диил общей формулы (II-г)
1,3,4-оксадиазол-2,5-диил общей формулы (II-г) 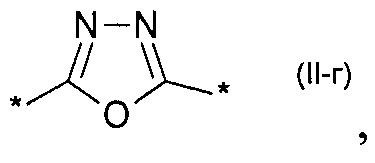 где R1, R2, R3, R4, R5, независимо друг от друга означают Н или заместитель из ряда: линейные или разветвленные С1-С20 алкильные группы; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом кислорода; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом серы; разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кремния.
где R1, R2, R3, R4, R5, независимо друг от друга означают Н или заместитель из ряда: линейные или разветвленные С1-С20 алкильные группы; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом кислорода; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом серы; разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кремния.
n означает целое число из ряда от 2 до 3.
Предпочтительными примерами Ar являются: незамещенный тиенил-2,5-диил общей формулы (II-а), где R1=R2=Н; замещенный тиенил-2,5-диил общей формулы (II-а), где R1=Н, в частности, 3-метилтиенил-2,5-диил, 3-этилтиенил-2,5-диил, 3-пропилтиенил-2,5-диил, 3-бутилтиенил-2,5-диил, 3-пентилтиенил-2,5-диил, 3-гексилтиенил-2,5-диил, 3-(2-этилгексил)тиенил-2,5-диил; незамещенный фенил-1,4-диил общей формулы (II-б), где R3=R4=Н; замещенный фенил-1,4-диил общей формулы (II-б), где R3=Н, в частности, (2,5-диметил)фенил-1,4-диил, (2,5-диэтил)фенил-1,4-диил, (2,5-дипропил)фенил-1,4-диил, (2,5-дибутил)фенил-1,4-диил, (2,5-дипентил)фенил-1,4-диил, (2,5-дигексил)фенил-1,4-диил, 2,5-бис(2-этилгексил)фенил-1,4-диил, (2,5-диметокси)фенил-1,4-диил, (2,5-диэтокси)фенил-1,4-диил, (2,5-дипроокси)фенил-1,4-диил, (2,5-диизопроокси)фенил-1,4-диил, (2,5-дибутокси)фенил-1,4-диил, (2,5-дипентилокси)фенил-1,4-диил, (2,5-дигексилокси)фенил-1,4-диил, 2,5-бис(2-этилгексилокси)фенил-1,4-диил. Наиболее предпочтительные примеры Ar: тиенил-2,5-диил, фенил-1,4-диил и (2,5-диметил)фенил-1,4-диил.
В контексте данного изобретения под Arn понимается любое сочетание из n звеньев одинаковых или различных Ar, выбранных из вышеприведенного ряда. Предпочтительными значениями такого сочетания являются n одинаковых незамещенных тиенил-2,5-диильных фрагментов, соединенных друг с другом в положениях 2 и 5, например, 2,2'-битиенил-2,5'-диил (II-а-1), 2,2':5',2''-тертиенил-2,5''-диил (II-а-2):
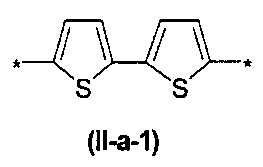
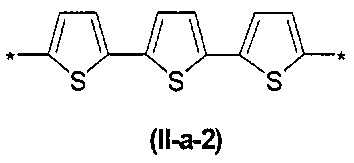
Другим предпочтительным значением такого сочетания являются комбинация различных незамещенных или 2,5-замещенных фенильных фрагментов, соединенных друг с другом в положениях 1 и 4, и различных незамещенных 1,3-оксазол-2,5-диильных фрагментов таким образом, что их общее количество равно n, например, при n равном 2 формула (II-б-1), при n равном 3 любая из формул (II-б-2), (II-б-3) или (II-б-4):
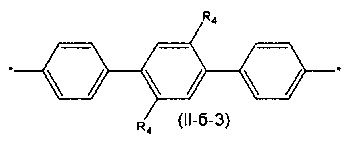
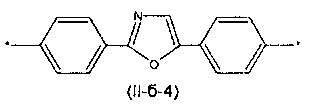
Другим предпочтительным значением такого сочетания являются комбинация различных незамещенных фенильных фрагментов, соединенных друг с другом в положениях 1 и 4, и незамещенных тиенил-2,5-диильных фрагментов, соединенных друг с другом в положениях 2 и 5, таким образом, что их общее количество равно n, например, при n равном 2 формула (II-в-1), при n равном 3 любая из формул (II-в-2), (II-в-3), II-в-4) или II-в-5):
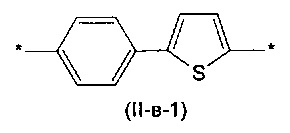
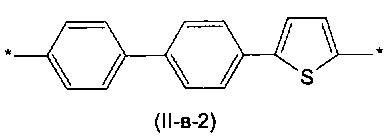
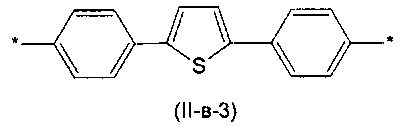
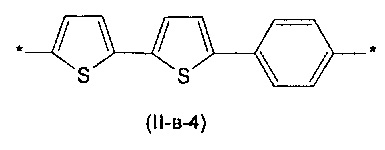
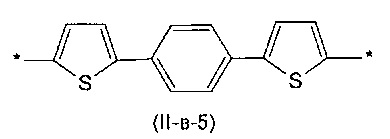
Предпочтительными значениями для R являются линейные или разветвленные С1-С20 алкильные группы, например, метил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, изо-бутил, втор-бутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1-этилпропил, 1,1-диметилпропил, 2,2-диметилпропил, н-гексил, н-гептил, н-октил, 2-этилгексил, н-нонил, н-децил, н-ундецил, н-додецил. Наиболее предпочтительные значения R: метил, этил, н-гексил, 2-этилгексил.
Представленные значения R, Ar, n, являются частными случаями и не исчерпывают все возможные значения и все возможные сочетания n значений Ar между собой.
В частности, в формуле (I) Ar может означать тиенил-2,5-диил, выбранный из ряда соединений формулы (II-а), тогда общая формула имеет следующий вид:
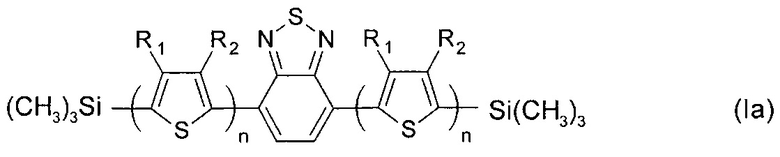
где R1, R2, n имеют вышеуказанные значения.
В частности, в формуле (I) Ar может означать фенил-1,4-диил, выбранный из ряда соединений формулы (II-б), тогда общая формула имеет следующий вид:
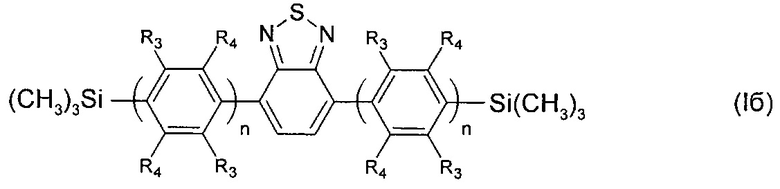
где R3, R4, n имеют вышеуказанные значения.
В частности, в формуле (I) n равно 2, тогда общая формула имеет следующий вид:
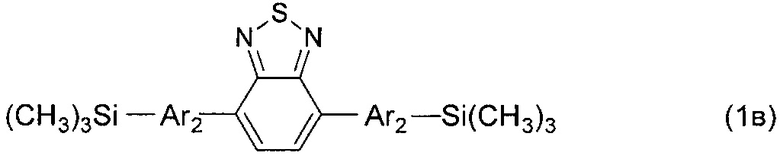
где Ar имеет вышеуказанные значения.
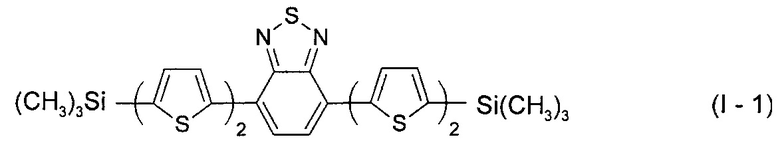
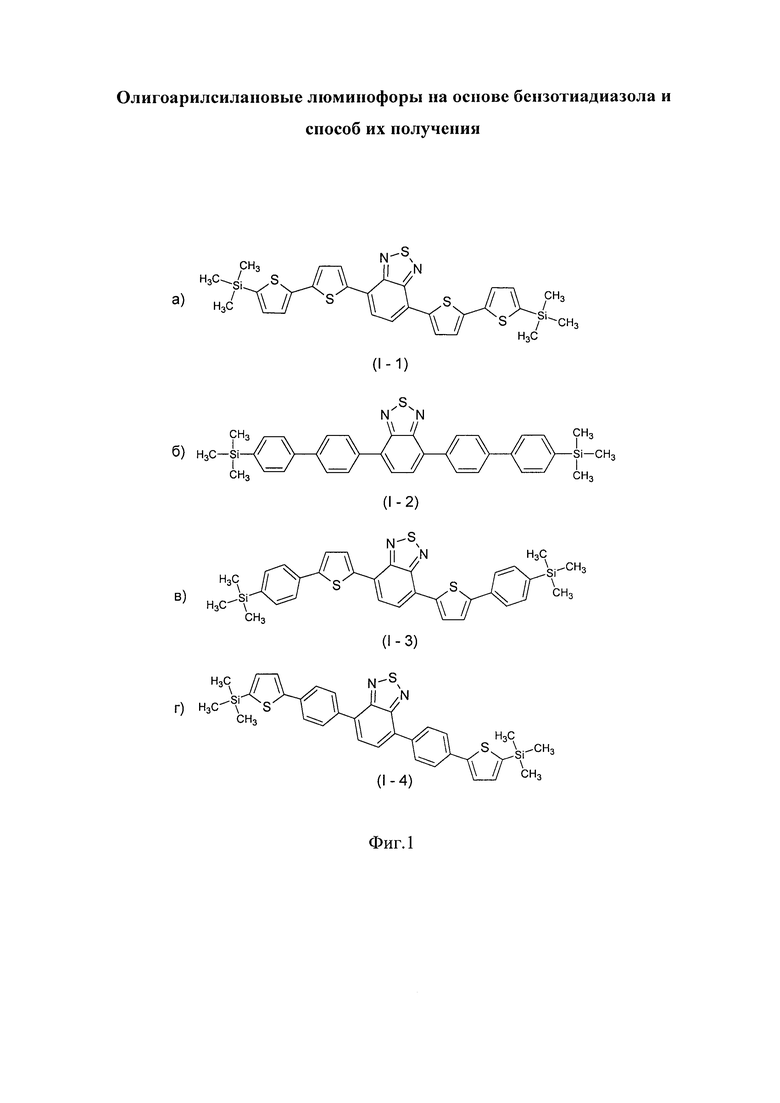
В этом случае, например, при Ar = незамещенный тиенил-2,5-диил новый линейный олигоарилсилан (Фиг. 1а) может быть представлен формулой (I-1):
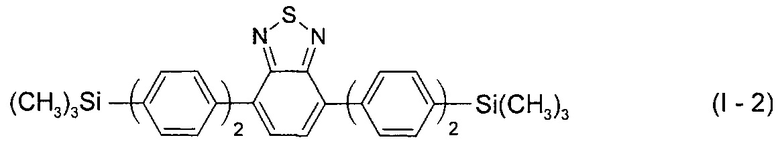
В этом случае, например, при Ar = незамещенный фенил-1,4-диил новый линейный олигоарилсилан (Фиг. 1б) может быть представлен формулой (I-2):
В этом случае, например, при Ar = незамещенный фенил-1,4-диил и незамещенный тиенил-2,5-диил новые линейные олигоарилсиланы (Фиг. 1в-1г) могут быть представлены формулами (I-3) - (I-4):
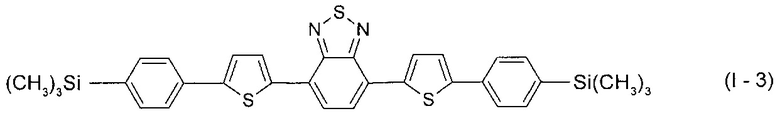
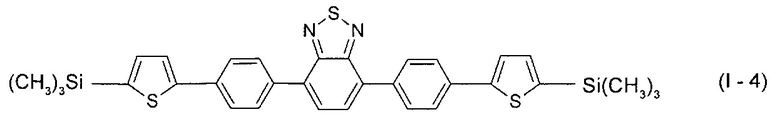
В частности, в формуле (I) n равно 3, тогда общая формула имеет следующий вид:
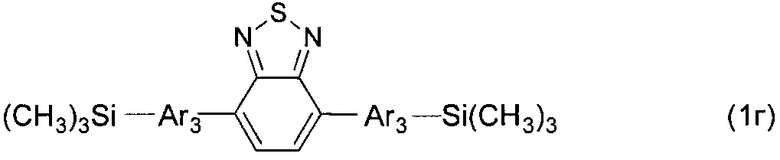
где Ar имеет вышеуказанные значения.
В этом случае, например, при Ar = незамещенный фенил-1,4-диил новый линейный олигоарилсилан (Фиг. 2а) может быть представлен формулой (I-5):
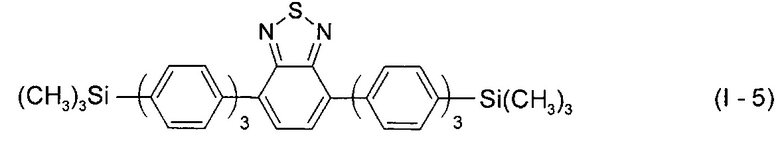
В этом случае, например, при Ar = незамещенный тиенил-2,5-диил новый линейный олигоарилсилан (Фиг. 2б) может быть представлен формулой (I-6):
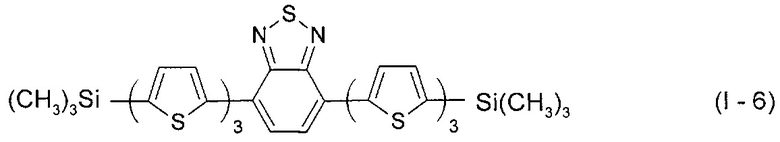
В этом случае, например, при Ar = незамещенный фенил-1,4-диил и незамещенный тиенил-2,5-диил новые линейные олигоарилсиланы (Фиг. 2в-2и) могут быть представлены формулами (I - 7) - (I - 12)
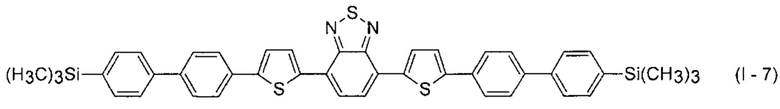
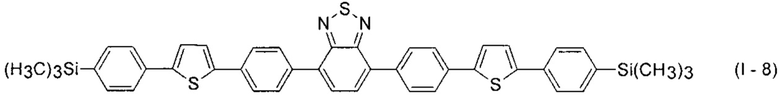
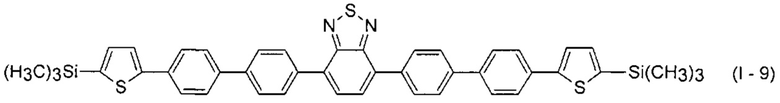
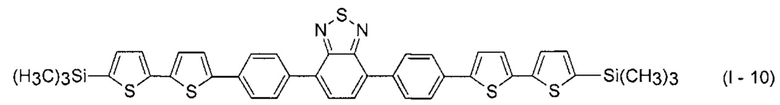
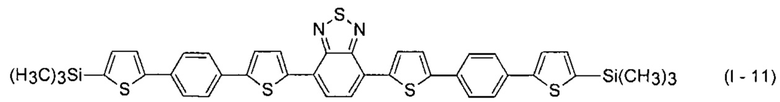
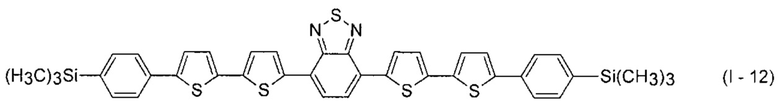
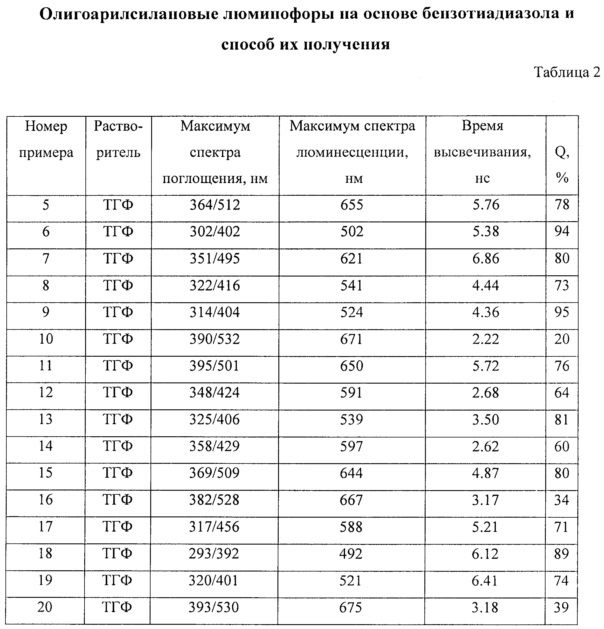
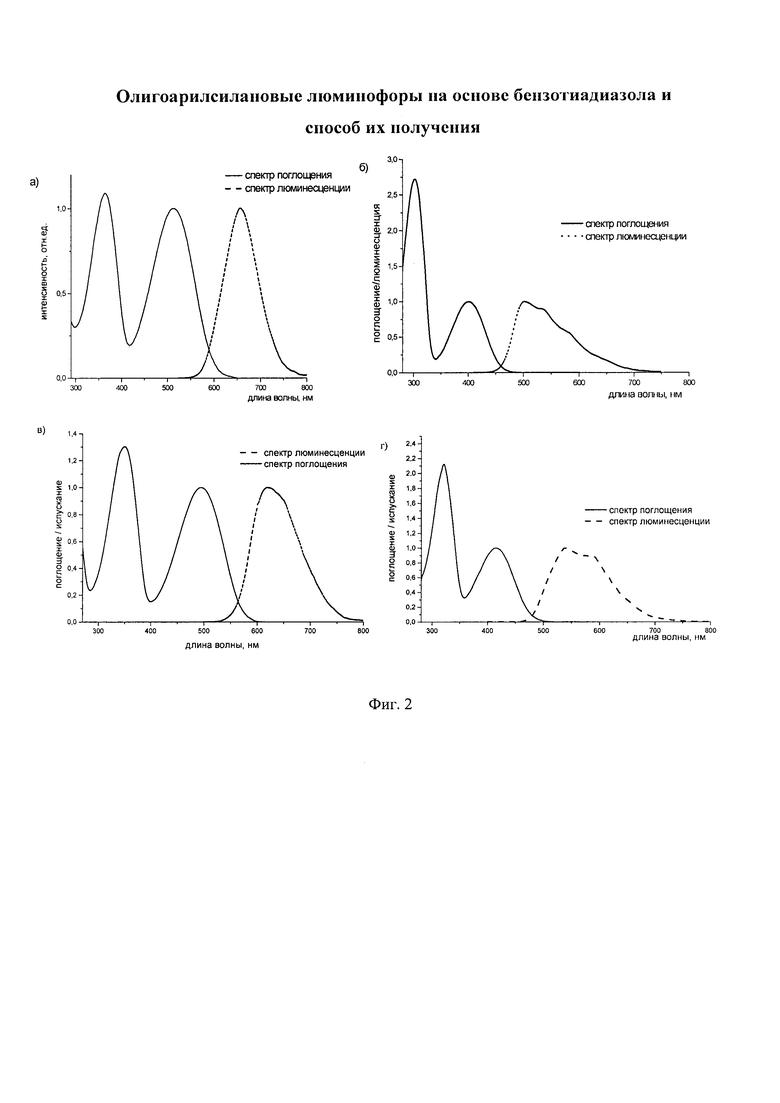
Заявленные новые линейные олигоарилсиланы на основе бензотиадиазола содержат одинаковые или различные арил- или гетероарилсилановые группировки. Оптические свойства новых линейных олигоарилсиланов могут варьироваться в широких пределах в зависимости от строения. Это может быть проиллюстрировано спектрами поглощения и люминесценции их разбавленных растворов (Фиг. 3). Оптические характеристики линейных олигоарилсиланов на основе бензотиадиазола представлены в таблице. Как видно из приведенных спектральных данных, заявленные новые линейные олигоарилсиланы обладают широким спектром поглощения, характеризующимся двумя максимумами, высоким квантовым выходом люминесценции, быстрым временем высвечивания. Под высоким квантовым выходом в рамках данного изобретения понимается квантовый выход люминесценции в разбавленном растворе не менее 20%, преимущественно не менее 50%. Приведенные данные являются только примерами, и ни в коей мере не ограничивают характеристик заявленных разветвленных олигоарилсиланов.
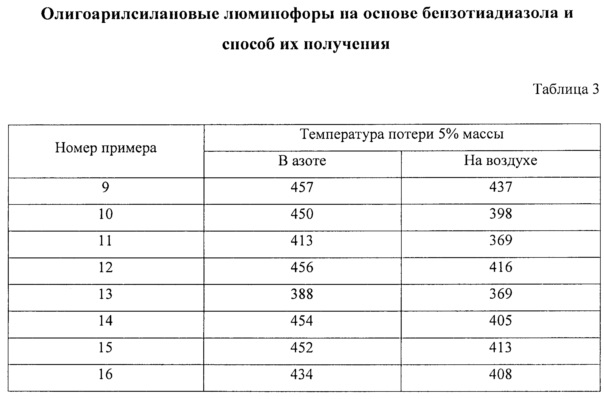
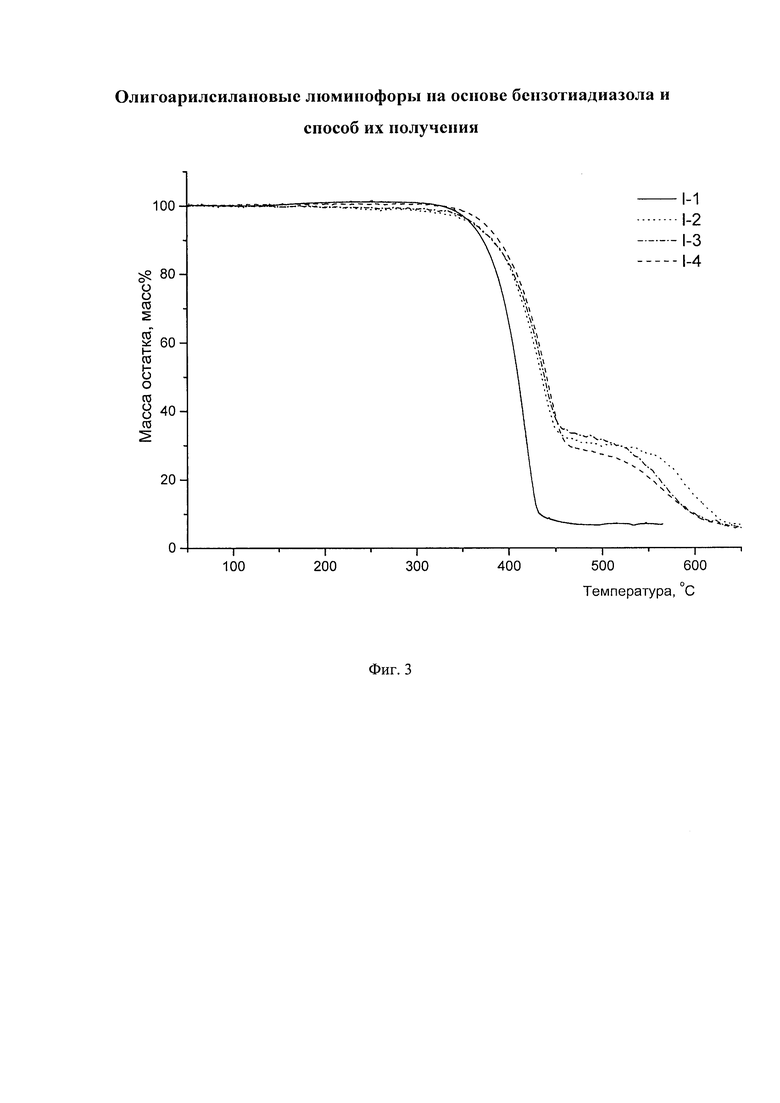
Отличительной особенностью заявленных олигоарилсиланов является их высокая термическая устойчивость, определяемая в рамках данного изобретения как температура 1% потери массы при нагревании вещества в аргоне. Данная температура для различных частных случаев составляет не менее 200°С, предпочтительно не менее 400°С. Данные термогравиметрического анализа (ТГА), иллюстрирующие высокую термостабильность заявленных олигоарилсиланов на основе бензотиадиазола на примере соединений I-1 (пример 5), I-2 (пример 6), I-3 (пример 7), I-4 (пример 8) приведены на Фиг. 3.
Задача решается также тем, что разработан способ получения новых линейных олигоарилсиланов общей формулы (I), заключающийся в том, что борорганическое производное реагирует с галогенпроизводным в условиях металлорганического синтеза в условиях Сузуки.
Под реакцией Сузуки подразумевается взаимодействие арил- или гетероарилгалогенида с арил- или гетероарилборорганическим соединением (Suzuki, Chem. Rev. 1995. V. 95. Р. 2457-2483) в присутствие основания и катализатора, содержащего металл VIII подгруппы. Как известно, для данной реакции в качестве основания могут выступать любые доступные основания, такие как гидроксиды, например, NaOH, KОН, LiOH, Ва(ОН)2, Са(ОН)2; алкоксиды, например, NaOEt, KOEt, LiOEt, NaOMe, KOMe, LiOMe; соли щелочных металлов угольной кислоты, например, карбонаты, гидрокарбонаты, ацетаты, цитраты, ацетилацетонаты, глицинаты натрия, калия, лития или карбонаты других металлов, например, Cs2CO3, Tl2CO3; фосфаты, например, фосфаты натрия, калия, лития. Предпочтительным основанием является карбонат натрия. Основания используются в виде водных растворов или суспензий в органических растворителях, таких как толуол, диоксан, этанол, диметилформамид или в их смесях. Предпочтительны водные растворы основания. Также в реакции Сузуки в качестве катализаторов могут использоваться любые подходящие соединения, содержащие металлы VIII подгруппы таблицы Менделеева. Предпочтительными металлами являются Pd, Ni, Pt. Наиболее предпочтительным металлом является Pd. Катализатор или катализаторы предпочтительно используются в количестве от 0,01 мол. % до 10 мол. %. Наиболее предпочтительное количество катализаторов от 0,5 мол. % до 5 мол. % по отношению к молярному количеству соединения с меньшей молярной массой, вступающего в реакцию. Наиболее доступными катализаторами являются комплексы металлов VIII подгруппы. В частности, стабильные на воздухе комплексы палладия (0), комплексы палладия, восстанавливающиеся непосредственно в реакционном сосуде металлоорганическими соединениями (алкил литиевыми или магнийорганическими соединениями) или фосфинами до палладия (0), такие как комплексы палладия (2) с трифенилфосфином или другими фосфинами. Например, PdCl2(PPh3)2, PdBr2(PPh3)2, Pd(OAc)2 или их смеси с трифенилфосфином. Предпочтительно использовать коммерчески доступный Pd(PPh3)4 с или без добавления дополнительных фосфинов. В качестве фосфинов предпочтительно использовать PPh3, PEtPh2, PMePh2, PEt2Ph, PEt3. Наиболее предпочтителен трифенилфосфин.
В частности, борорганическим производным является соединение общей формулы (III)
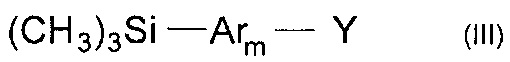
где Y означает остаток борной кислоты или ее эфира,
Ar, имеют вышеуказанные значения,
m означает целое число из ряда от 1 до 3.
В частности, галогенпроизводным является соединение общей формулы (IV)
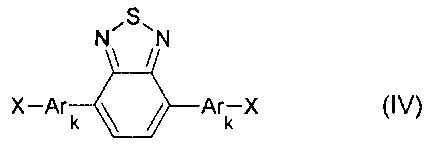
где X означает Br или I,
Ar, имеют вышеуказанные значения,
k означает целое число из ряда от 0 до 1, тогда общая схема процесса может быть представлена следующим образом:
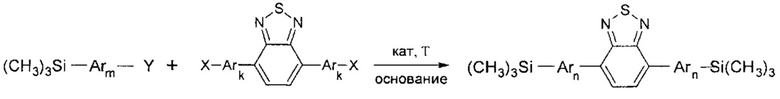
где Ar, m, k, n, Y и X имеют вышеуказанные значения.
В частности, Y в соединении формулы (III) может означать остаток циклического эфира борной кислоты - 4,4,5,5-тетраметил-1,3,2-диоксаборолан общей формулы (V) 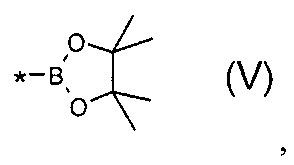 тогда линейный олигоарилсилан получают по следующей общей схеме:
тогда линейный олигоарилсилан получают по следующей общей схеме:
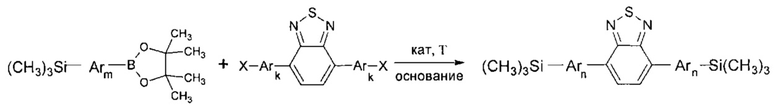
где Ar, m, k, n и X имеют вышеуказанные значения.
В частности, в соединении формулы (IV) X может означать Br, тогда линейный олигоарилсилан получают по следующей общей схеме:
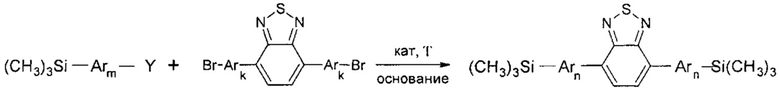
где Ar, m, k, n и Y имеют вышеуказанные значения.
В частности, в соединении формулы (III) m равно 2, в соединении формулы (IV) k равно 0, тогда линейный олигоарилсилан получают по следующей общей схеме:
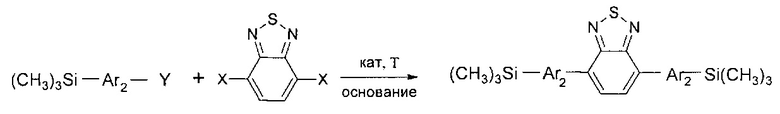
где Ar, Y, X имеют вышеуказанные значения.
В частности, в соединении формулы (III) m равно 2, в соединении формулы (IV) k равно 1, тогда линейный олигоарилсилан получают по следующей общей схеме:
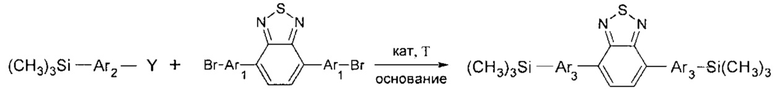
Вышеописанные взаимодействия можно проводить в органических растворителях или смесях растворителей, не взаимодействующих с реагирующими агентами. Например, реакцию можно проводить в среде органического растворителя, выбранного из ряда эфиров: тетрагидрофуран, диоксан, диметиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля; или из ряда ароматических соединений: бензол, толуол, ксилол, или из ряда алканов: пентан, гексан, гептан, или из ряда спиртов: метанол, этанол, изопропанол, бутанол, или из ряда апротонных полярных растворителей: диметилформамид, диметилсульфоксид. Смесь из двух или более растворителей так же может быть использована. Наиболее предпочтительные растворители - толуол, тетрагидрофуран, этанол, диметилформамид или их смесь. При этом взаимодействие исходных компонентов может проходить при температуре в пределах от +20°С до +200°С при стехиометрическом мольном соотношении функциональных групп исходных компонентов либо избытка одного из них. Предпочтительно взаимодействие проводят при температуре в пределах от +40°С до +150°С. Наиболее предпочтительно взаимодействие проводят при температуре в пределах от +60°С до +120°С.
После окончания реакции продукт выделяют по известным методикам. Например, добавляют воду и органический растворитель. Органическую фазу отделяют, промывают водой до нейтральной реакции и высушивают, после чего растворитель упаривают. В качестве органического растворителя может быть использован любой не смешивающийся или ограниченно смешивающийся с водой растворитель, например, выбранный из ряда эфиров: диэтиловый эфир, метилтретбутиловый эфир, или выбранный из ряда ароматических соединений: бензол, толуол, ксилол, или выбранный из ряда хлорорганиченских соединений: дихлорметан, хлороформ, четыреххлористый углерод, хлорбензол. Также для выделения могут использоваться смеси органических растворителей. Выделение продукта можно производить и без применения органических растворителей, например, отгонкой растворителей из реакционной смеси, отделением продукта от водного слоя фильтрованием, центрифугированием или любым другим известным методом.
Очистку сырого продукта проводят любым известным методом, например, препаративной хроматографией в адсорбционном или эксклюзионом режиме, перекристаллизацией, дробным осаждением, дробным растворением или их любой комбинацией.
Чистоту и строение синтезированных соединений подтверждают совокупностью данных физико-химического анализа, хорошо известных специалистам, таких как хроматографические, спектроскопические, масс-спектроскопические, элементного анализа. Наиболее предпочтительным подтверждением чистоты и структуры новых разветвленных олигоарилсиланов являются ЯМР-спектры на ядрах 1Н, 13С и 29Si, а также ГПХ (гель-проникающая хроматография).
На Фиг. 1 представлено схематическое изображение структурных формул новых линейных олигоарилсиланов: а) I-1 (по примеру 5), б) I-2 (по примеру 6), в) I-3 (по примеру 7) и I-4 (по примеру 8).
На Фиг. 2 представлены спектры поглощения и люминесценции разбавленных растворов новых линейных олигоарилсиланов в тетрагидрофуране: а) I-1 (по примеру 5), б) I-2 (по примеру 6), в) I-3 (по примеру 7), г) I-4 (по примеру 8).
На Фиг. 3. представлены ТГА кривые новых линейных олигоарилсиланов I-1 - I-4 на воздухе.
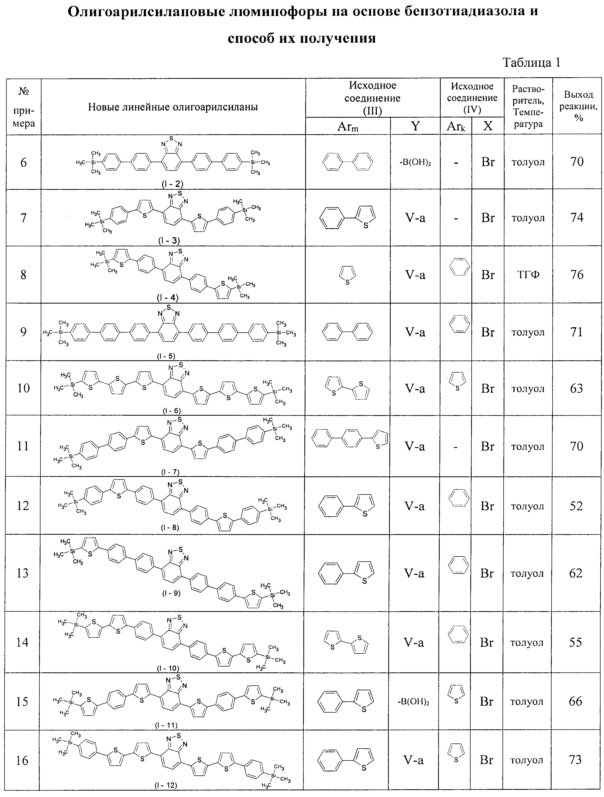
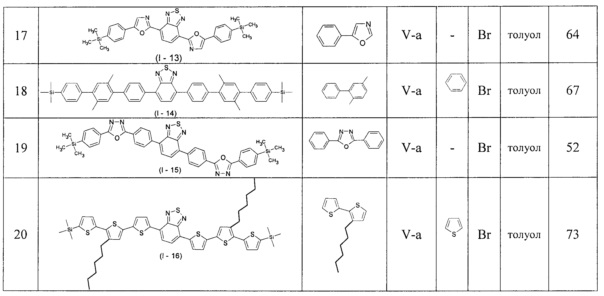
В таблице 1 приведены условия получения линейных олигоарилсиланов I-2 - I-12 по примерам 6-16.
В таблице 2 приведены оптические свойства линейных олигоарилсиланов в разбавленных растворах, в том числе максимумы спектров поглощения и люминесценции, время высвечивания и квантовый выход люминесценции, характеризующий ее эффективность.
В таблице 3 приведены температуры потери 5% массы новых линейных олигоарилсиланов I-5 - I-12, характеризующие термо- и термоокислительную стабильность.
Изобретение может быть проиллюстрировано нижеприведенными примерами. При этом использовали коммерчески доступные реагенты и растворители. Исходный реагент 5-триметилсилил-2,2'-битиофен получали по известным методикам (Е. Lukevics, et. al., J. Organomet. Chem., 636(1-2), 26-30; 2001). Исходный реагент 4-бромо-4'-триметилсилил-1,1'-бифенил получали по известным методикам (D. Hanss, О.S. Wenger, Eur. J. Inorg. Chem., 2009, 3778-3790). Исходный реагент 4,7-бис(5-бромотиен-2-ил)-2,1,3-бензотиадиазол получали по известным методикам (М. Svensson, F. Zhang, S. Veennstra, W. Verhess, J. Hummelen, J. Kroon, O. Inganas, M. Andersson., Adv. Mater., 2003, 15 (12), 988). Исходный реагент 4,7-бис(4-бромофенил)-2,1,3-бензотиадиазол получали по известным методикам (J. Liu, L. Bu, J. Dong, Q. Zhou, Y. Geng, D. Ma, L. Wang, X. Jing, F. Wang. J. Mater. Chem., 2007, 17, 2832-2838). Другие исходные соединения получали согласно нижеприведенным примерам. Все реакции проводили в безводных растворителях в атмосфере аргона.
Синтез исходных реагентов
Общая методика синтеза борорганических прекурсоров: к раствору 1,0 ммоль олигомера в ТГФ при температуре -78°С прибавляют 1,0 ммоль BuLi. Реакционную смесь перемешивают 30 мин при этой температуре и прибавляют 1,0 ммоль эфира борной кислоты. После нагрева до комнатной температуры продукт выделяют по известным методикам. Продукт используется без дополнительной очистки.
Пример 1. Синтез триметил[5'-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-2,2'-битиофен-5-ил]силана (III-1)
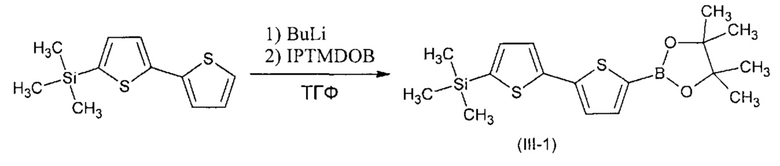
Триметил[5'-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-2,2'-битиофен-5-ил]силан (III-1) получали по общей методики из 3,0 г (12,6 ммоль) 5-триметилсилил-2,2'-битиофена, 5,0 мл (12,6 ммоль) 2,5 М раствора BuLi в гексане, 2,6 мл (12,6 ммоль) 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксиборолана и 60 мл ТГФ. После стандартного выделения реакции выход хроматографически чистого продукта составил 4,5 г (98% от теоретически возможного). 1Н ЯМР (δ в CDCl3, ТМС/м.д.): 0.33 (9Н, с), 1.5 (12Н, с), 7.02 (1Н, d, J1=5.5 Гц, J2=3.7 Гц), 7.21 (2Н, д, J=3.7 Гц), 7.70 (1Н, д, J=3.7 Гц).
Пример 2. Синтез триметил[4'-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-бифенил-4-ил]силана (III-2)
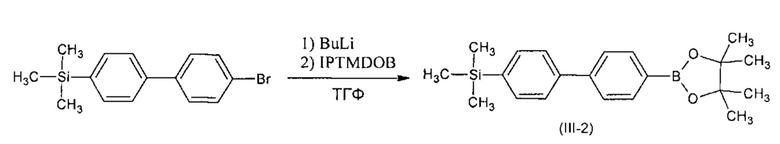
Триметил[4'-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-бифенил-4-ил]силан (III-2) получали по общей методики из 1,5 г. (4,9 ммоль) 4-бромо-4'-триметилсилил-1,1'-бифенил, 3,2 мл (5,2 ммоль) 1,6 М раствора BuLi в гексане, 1,05 мл (5,2 ммоль) 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксиборолана и 35 мл ТГФ. Получили 1,8 г (82% от теории) смеси, по ГПХ содержащей 87% искомого вещества. Продукт без дополнительной очистки использовали в последующем синтезе. 1Н ЯМР (δ в CDCl3, ТМС/м.д.): 0.32 (9Н, с), 1.38 (12Н, с), 7.60-7.66 (6Н, перекрывающиеся сигналы), 7.90 (1H, д, J=8.2 Гц).
Пример 3. Синтез триметил[4-(2-тиенил)фенил]силана
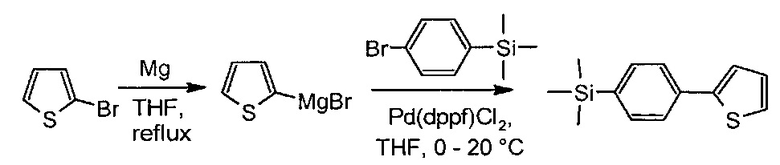
Раствор 2-бромтиофена (3.91 г, 24.0 ммоль) в безводном ТГФ (30 мл) прикапали к магнию (0.6 г, 25.1 ммоль). После кипячения в течении 1 часа, реакционную смесь охладили и прикапали к смеси (4-бромфенил)(триметил)силана (5.00 г, 21.8 ммоль) и Pd(dppf)Cl2 (0.127 г, 0.24 ммоль) в 50 мл безводного ТГФ при температуре от +5°С до +10°С. Затем охлаждение убрали и перемешивали реакционную смесь при комнатной температуре в течении 5 часов. После реакционную смесь вылили в 500 мл воды и экстрагировали с 400 мл диэтилового эфира. Органическую фазу отделили, высушили над безводным сульфатом натрия и упарили на роторном испарителе. Продукт пропустили через небольшой слой силикагеля в толуоле. Получили 5.04 г (99% от теоретически возможного) чистого триметил[4-(2-тиенил)фенил]силана. MALDI MS: найдено m/z 232.416; вычисление для [М]+ 232.040. 1H-NMR (300 MHz, CDCl3): δ (ppm),, 0.31 (с, 9Н), 7.09 (дд, J1=5.2, J2=3.6, 1H), 7.29 (дд, J1=5.2, J2=1.2, 1H), 7.35 (дд, J1=3.6, J2=1.2, 1Н), 7.56 (д, J=8.2Hz, 2Н), 7.63 (д, J=8.2 Hz, 2Н). 13C-NMR (125 MHz, CDCl3): δ 144.43, 139.66, 134.68, 133.86, 127.97, 125.17, 124.83, 123.11, -1.16. 29Si-NMR (60 MHz, CDCl3): δ -3.95.
Пример 4. Синтез триметил{4-[5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)тиофен-2-ил]фенил}силана (III-3).
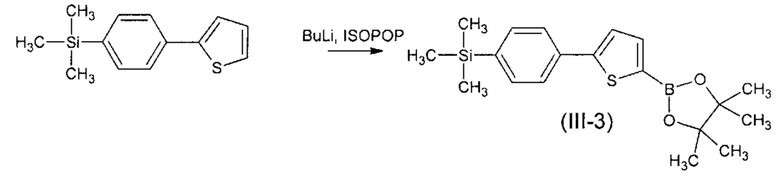
Триметил{4-[5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)тиофен-2-ил]фенил}силан (III-1) получали по общей методике из 1.5 г (6.45 ммоль) триметил[4-(2-тиенил)фенил]силана, 4 мл (6.45 ммоль) 1,6 М раствора BuLi в гексане, 1,2 г (6.45 ммоль) 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксиборолана и 40 мл ТГФ. Получили 2,27 г (90% от теории) смеси, по ГПХ содержащей 90% искомого вещества и 10% триметил[4-(2-тиенил)фенил]силана. Продукт без дополнительной очистки использовали в последующем синтезе. MALDI MS: найдено m/z 358.378; вычислено для [М]+ 358.205. 1Н-NMR(300 MHz, CDCl3): δ 0.31 (с, 9Н), 1.36 (с, 12Н), 7.40 (д, J=3.6, 1Н), 7.55 (д, J=8.2 Hz, 2Н), 7.61 (д, J=3.6 Hz, 1Н), 7.64 (д, J=8.2 Hz, 2H). 13C-NMR (75 MHz, CDCl3): δ 151.30, 140.28, 138.11, 134.45, 133.89, 133.84, 125.36, 124.82, 84.10, 24.73, -1.20. 29Si-NMR (60 MHz, CDCl3): δ -3.88.
Синтез новых линейных олигоарилсиланов.
Общая методика синтеза новых линейных олигоарилсиланов: к раствору 1.0 ммоль соединения III в толуоле прибавляют 0.45 ммоль соединения IV, 0.05 ммоль катализатора, содержащего металл VIII подгруппы таблицы Менделеева, и 3.0 ммоль водного раствора основания. Перемешивают в течение нескольких часов при температуре 80°С - 120°С. После окончания реакции продукт выделяют по известным методикам. Продукт очищают методом колоночной хроматографии на силикагеле или перекристаллизацией.
Пример 5. Синтез нового линейного олигоарилсилана (I-1)
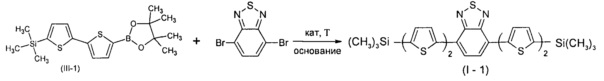
Линейный олигоарилсилан I-1 получали по общей методике синтеза из 1,49 г соединения III-1, 0,5 г 4,7-дибромо-2,1,3-бензотиадиазола, 0,095 г катализатора Pd(PPh3)4, 2 мл 2М раствора Na2CO3 в воде и 40 мл толуола. После выделения и очистки было получено 0,75 г (75% от теоретически возможного) чистого линейного олигоарилсилана (I-1). 1Н ЯМР (δ в CDCl3, ТМС/м.д.): 0.36 (18Н, с), 7.18 (2Н, д, J=3.5 Гц), 7.28 (2Н, д, J=3.9 Гц), 7.35 (2Н, д, J=3.5 Гц), 7.82 (2Н, с), 8.03 (2Н, д, J=3.9 Гц). 13С NMR (CDCl3): δ [ppm] -0.10, 124.70, 125.23, 125.37, 125.73, 128.42, 134.88, 138.26, 138.97, 140.63, 142.33, 152.63. 29Si NMR (CDCl3): δ [ppm] -6.40. Найдено для C28H28N2S5Si2 С 55.24%, Н 4.69%, N 4.73%, S 26.27%, Si 9.22%. Вычислено: С 55.22%, Н 4.63%, N 4.60%, S 26.32%, Si 9.22%
Примеры 6 - 16. Синтез новых линейных олигоарилсиланов (I-2 - I-12)
Синтез новых линейных олигоарилсиланов I-2 - I-12 проводился по общей методике из исходных реагентов и в условиях, приведенных в Таблице 1. При этом в качестве катализатора использовали Pd(PPh3)4, а в качестве основания - 2М раствора Na2CO3 в воде аналогично примеру 5.
Примечание: Q - квантовый выход люминесценции.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2396290C1 |
| РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ С РЕАКЦИОННОСПОСОБНЫМИ КОНЦЕВЫМИ ГРУППАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2544863C2 |
| РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ НА ОСНОВЕ ТЕТРАФЕНИЛБУТАДИЕНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2018 |
|
RU2716826C2 |
| НОВЫЕ РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2524960C1 |
| Способ получения разветвленных олигоарилсиланов на основе фенилоксазолов | 2016 |
|
RU2620088C1 |
| ДЕНДРОНИЗОВАННЫЕ ПОЛИАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2466156C2 |
| ПОЛИАРИЛСИЛАНОВЫЕ ДЕНДРИМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2353629C1 |
| ПОЛИАРИЛСИЛАНОВЫЕ МОНОДЕНДРОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2348657C1 |
| ПРОИЗВОДНЫЕ ФУРО[3,2-В]- И ТИЕНО[3,2-В]ПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ TBK1 И IKKε | 2013 |
|
RU2622034C2 |
| АЗАИНДОЛИЛПИРИДОНЫ И ДИАЗАИНДОЛИЛПИРИДОНЫ | 2018 |
|
RU2788659C2 |
Изобретение относится к новым функциональным материалам, обладающим люминесцентными свойствами. Предложены новые линейные олигоарилсиланы общей формулы (I), в которой Ar означает одинаковые или различные ариленовые или гетероариленовые радикалы, выбранные из ряда: замещенный или незамещенный тиенил-2,5-диил, замещенный или незамещенный фенил-1,4-диил, замещенный или незамещенный 1,3-оксазол-2,5-диил и замещенный или незамещенный 1,3,4-оксадиазол-2,5-диил; n означает целое число из ряда от 2 до 3. Предложен также способ получения указанных соединений. Технический результат – полученные соединения обладают высокой эффективностью люминесценции в сочетании с коротким временем высвечивания, повышенной термостабильностью. 2 н. и 14 з.п. ф-лы, 3 ил., 3 табл., 20 пр.
 (I)
(I)
1. Линейные олигоарилсиланы общей формулы (I)
 (I)
(I)
где Ar означает одинаковые или различные ариленовые или гетероариленовые радикалы, выбранные из ряда: замещенный или незамещенный тиенил-2,5-диил общей формулы (II-а) 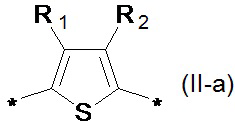 , замещенный или незамещенный фенил-1,4-диил общей формулы (II-б)
, замещенный или незамещенный фенил-1,4-диил общей формулы (II-б) 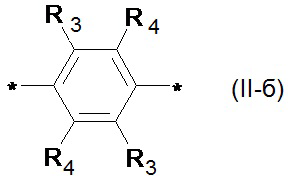 , замещенный или незамещенный 1,3-оксазол-2,5-диил общей формулы (II-в)
, замещенный или незамещенный 1,3-оксазол-2,5-диил общей формулы (II-в) 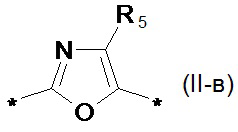 , 1,3,4-оксадиазол-2,5-диил общей формулы (II-г)
, 1,3,4-оксадиазол-2,5-диил общей формулы (II-г) 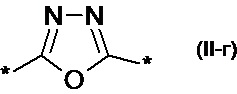 , где R1, R2, R3, R4, R5, независимо друг от друга означают H или заместитель из ряда: линейные или разветвленные С1-С20 алкильные группы; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом кислорода; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом серы; разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кремния;
, где R1, R2, R3, R4, R5, независимо друг от друга означают H или заместитель из ряда: линейные или разветвленные С1-С20 алкильные группы; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом кислорода; линейные или разветвленные С1-С20 алкильные группы, разделенные по крайней мере одним атомом серы; разветвленные С3-С20 алкильные группы, разделенные по крайней мере одним атомом кремния;
n означает целое число из ряда от 2 до 3.
2. Линейные олигоарилсиланы по п. 1, отличающиеся тем, что Ar означает тиенил-2,5-диил, выбранный из ряда соединений формулы (II-а).
3. Линейные олигоарилсиланы по п. 1, отличающиеся тем, что Ar означает фенил-1,4-диил, выбранный из ряда соединений формулы (II-б).
4. Линейные олигоарилсиланы по любому из пп. 1-3, отличающиеся тем, что n равно 2.
5. Линейные олигоарилсиланы по любому из пп. 1-3, отличающиеся тем, что n равно 3.
6. Линейные олигоарилсиланы по любому из пп. 1-3, отличающиеся тем, что они имеют квантовый выход люминесценции не менее 60%.
7. Линейные олигоарилсиланы по любому из пп. 1-3, отличающиеся тем, что они имеют время высвечивания не более 7 нс.
8. Линейные олигоарилсиланы по любому из пп. 1-3, отличающиеся тем, что они термостабильны до температуры не менее 200°C.
9. Способ получения линейных олигоарилсиланов по пп. 1-8, заключающийся в том, что борорганическое производное, содержащее остаток борной кислоты или ее эфира, реагирует с бром- или йодорганическим производным в условиях металлорганического синтеза в условиях Сузуки.
10. Способ по п. 9, отличающийся тем, что борорганическим производным является соединение общей формулы (III)
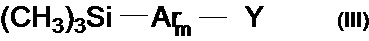
где Y означает остаток борной кислоты или её эфира,
Ar имеют значения, указанные в п.1,
m означает целое число из ряда от 1 до 3.
11. Способ по п. 9, отличающийся тем, что галогенпроизводным является соединение общей формулы (IV)
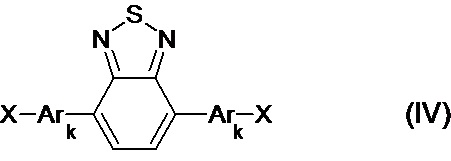
где X означает Br или I.,
Ar имеют значения, указанные в п.1,
k означает целое число из ряда от 0 до 1.
12. Способ по п. 10, отличающийся тем, что эфиром борной кислоты, является эфир, выбранный из ряда: 4,4,5,5-тетраметил-1,3,2-диоксаборолан общей формулы (V-а) 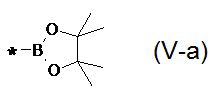 , 1,3,2-диоксаборолан общей формулы (V-б)
, 1,3,2-диоксаборолан общей формулы (V-б) 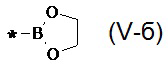 , 1,2,3-диоксаборинан общей формулы (V-в)
, 1,2,3-диоксаборинан общей формулы (V-в)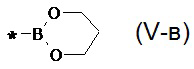 , 5,5-диметил-1,2,3-диоксаборинан общей формулы (V-г)
, 5,5-диметил-1,2,3-диоксаборинан общей формулы (V-г)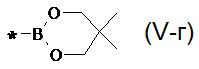 .
.
13. Способ по п. 11, отличающийся тем, что X в соединении формулы (IV) означает Br.
14. Способ по пп. 10, 11, отличающийся тем, что m равно 2, k равно 0.
15. Способ по пп. 10, 11, отличающийся тем, что m равно 2, k равно 1.
16. Способ по любому из пп. 9-13, отличающийся тем, что взаимодействие компонентов проводят в среде органического растворителя, выбранного из ряда: толуол, тетрагидрофуран, этанол, диоксан, диметилформамид или их смесей.
| НОВЫЕ РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2524960C1 |
| Yoshihiko Ito et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| HETEROCYCLES, 1996, vol.42, No.2, pp.597-615 | |||
| Prashant Sonar et al | |||
| High-Mobility Organic Thin Film Transistors Based on Benzothiadiazole-Sandwiched Dihexylquaterthiophenes | |||
| Chem.Mater., 2008, vol.20, pp.3184-3190 | |||
| Kaushik Balakrishnan et al | |||
| Tunable light emission from co-assembled structures of benzothiadiazole molecules | |||
| Chem | |||
| Commun., 2014, vol.50, pp.5600-5603 | |||
| ОРГАНИЧЕСКИЕ СВЕТОИЗЛУЧАЮЩИЕ ДИОДЫ С БЕЛЫМ СПЕКТРОМ ИЗЛУЧЕНИЯ | 2013 |
|
RU2555193C2 |
Авторы
Даты
2018-11-02—Публикация
2017-11-20—Подача