Настоящее изобретение относится к составу, содержащему циклические пероксиды кетона, способу получения таких составов, и использованию этих составов.
Составы циклических пероксидов кетонов сами по себе известны. Например, в патентном документе WO 96/03397 описываются составы циклического пероксида кетона, содержащего один или более циклических пероксидов кетона и один или более разбавителей. Однако описанные составы представляют собой серьезную угрозу безопасности, при хранении при температуре 0°C или ниже из-за образования взрывчатых кристаллов. Эти кристаллы могут взрываться спонтанно во время хранения и, поэтому представляют собой серьезную угрозу безопасности. Хотя эти вопросы безопасности могут быть решены с помощью сильного разбавления составов, что видно из патентного документа WO 96/03397, это было бы крайне нежелательно, так как это привело бы к составам со слишком низким содержанием активного кислорода, которое сделало бы эти составы неэффективными при их применении, и в тоже время привело бы к недопустимому загрязнению полимеров, производимых с этими пероксидными составами.
В патентном документе WO 2004/072059 авторы обращают внимание на риски, связанные с безопасностью, которые зависят от кристаллизации этих типов пероксидов, и на снижение этих рисков путем добавления одного или более диалкиловых пероксидов к составу циклического пероксида кетона. Диалкиловые пероксиды, однако, являются восприимчивыми к электростатическим разрядам и поэтому при работе с ними возникают трудности. Они также представляют собой потенциальную угрозу для здоровья.
В патентном документе WO 2004/052877 было предложено еще одно решение проблемы, которое заключается в добавлении совместно кристаллизующегося соединения, то есть соединения, которое затвердевает в составе при более высокой температуре, чем температура кристаллизации пероксида. Примером такого совместно кристаллизующегося соединения является парафиновый воск.
К сожалению, такие составы непригодны для использования во всех типах процессов полимеризации и в процессах модификации сополимеров. Например, в производстве полиэтилена низкой плотности (LDPE), совместно кристаллизующееся соединение затвердевает при применяемых условиях реакции высокого давления, что может приводить к созданию препятствия (дозирование пероксида) в трубопроводах с (трубчатой) системой реактора, которая используется. Кроме того, в большинстве областей применения совместно кристаллизующееся соединение оказывается в конечном продукте и, как правило, рассматривается, как нежелательное загрязняющее вещество.
Поэтому задачей настоящего изобретения является преодоление вышеописанных проблем и повышение безопасности и стабильности при хранении составов, содержащих циклические пероксиды кетона, без необходимости добавления совместно кристаллизующегося соединения или диалкилового пероксида.
Эта задача выполняется путем предоставления
состава, содержащего, по меньшей мере, два тримерных циклических пероксида кетона: тримерный циклический пероксид метилэтилкетона (3MEK-cp) формулы (I)
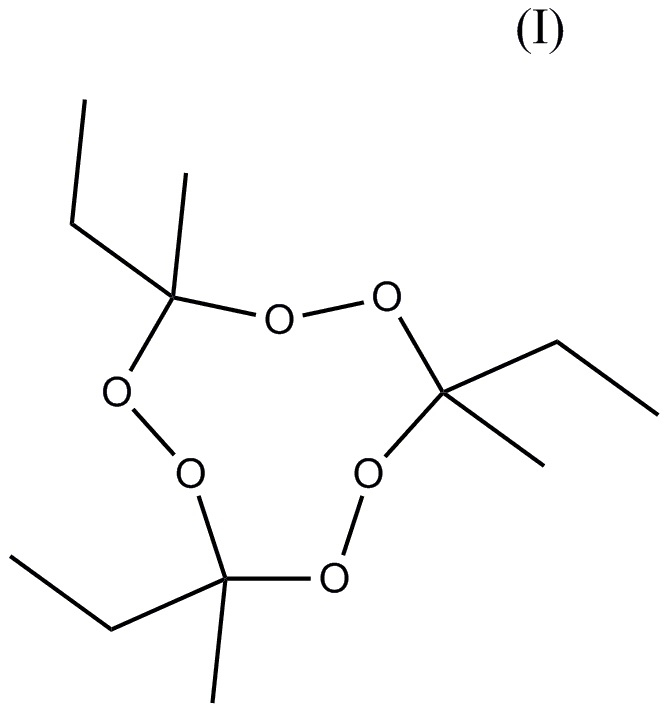
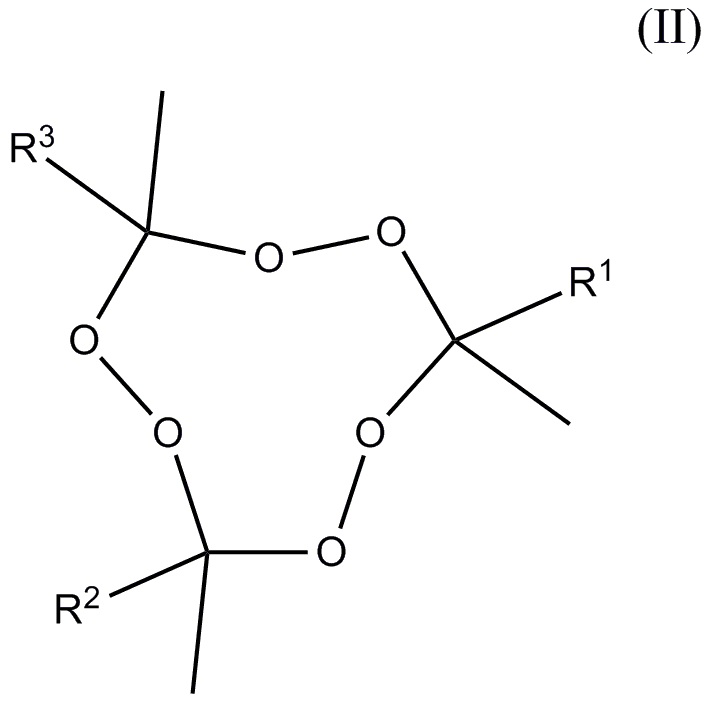
и, по меньшей мере, один пероксид удовлетворяющий формуле (II)
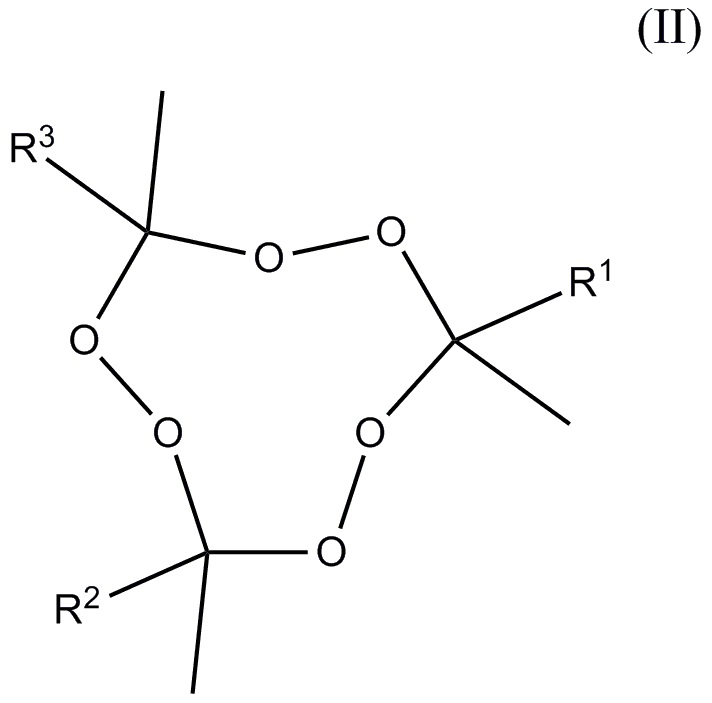
где R1-R3 независимо друг от друга отобраны из алкильных и aлкoксиалкильных групп, где упомянутые группы содержат от 2 до 5 атомов углерода, где общее число атомов углерода плюс атомов кислорода R1+R2+R3 находится в диапазоне 7-15, и молярное отношение 3MEK-cp к общему количеству пероксидов, удовлетворяющих формуле (II), находится в диапазоне от 10:90 до 80:20.
В данном описании термин «алкоксиалкильная группа» относится к группе, удовлетворяющей формуле -CnH2n-O-CmH2m+1, в которой оба значения n и m представляют собой, по меньшей мере, 1. Поскольку общее число атомов углерода указанной алкоксиалкильной группы находится в диапазоне от 2 до 5, тогда и n+m находится в диапазоне 2-5.
В предпочтительном варианте осуществления R1-R3 представляют собой алкильные группы, содержащие от 2 до 5 атомов углерода, причем общее число атомов углерода R1+R2+R3 находится в диапазоне 7-15.
В еще одном предпочтительном варианте осуществления указанные алкильные группы являются линейными алкильными группами.
В другом предпочтительном варианте осуществления молярное отношение 3MEK-cp к общему количеству пероксидов, удовлетворяющих формуле (II), находится в диапазоне от 20:80 до 80:20, более предпочтительно в диапазоне от 40:60 до 80:20, и наиболее предпочтительно в диапазоне от 50:50 до 80:20.
Количества различных пероксидов в составе может быть проанализировано с помощью реверсивной фазы HPLC, использующей C18 колонку и градиент мобильной фазы вода/ацетонитрил.
Состав в соответствии с настоящим изобретением считается безопасным, если температура кристаллизации находится ниже температуры -5°C, предпочтительно ниже температуры -15°C, более предпочтительно ниже температуры -25°C, и наиболее предпочтительно ниже температуры -40°C.
Температура кристаллизации состава определяется следующим образом: сначала состав охлаждается до определенной температуры T1. Если после 1 часа перемешивания при температуре T1, в составе образуются кристаллы, тогда состав нагревается до температуры (T2), которая на 3°C выше, чем T1. После перемешивания в течение приблизительно 6 часов, состав контролируют на предмет того, растворились кристаллы или нет. Если не все кристаллы растворились, тогда температура состава повышается еще на 3°C и перемешивается при этой температуре (T3) в течение 6 часов. Эти операции повторяются до тех пор, пока не будет достигнута конечная температура, при которой все кристаллы растворятся. Эта конечная температура определяется как температура кристаллизации состава. Однако если кристаллы не образуются после 1 часа перемешивания при T1, тогда очень небольшое количество (не более чем 0,05%, в расчете на количество циклического пероксида кетона в составе) чистого 3MEK-cp добавляется в состав в качестве зародыша кристаллизации. После добавления зародыша кристаллизации состав перемешивается в течение 24 часов, после чего он снова проверяется на присутствие кристаллов. Если кристаллы снова не образуются, тогда температура состава уменьшается на 10°C (T1 10°C), и опять вносится зародыш кристаллизации. Если кристаллы образуются после этого снижения температуры, тогда температура поднимается с интервалами 3°C в соответствии с описанной выше технологией до тех пор, пока все кристаллы не растворятся. Тем не менее, если никакие кристаллы не образуются, тогда температура состава понижается на следующие 10°C (T1 20°C) и очередное небольшое количество зародышей кристаллизации добавляется в состав. Этапы технологии повторяются (как описано выше) до тех пор, пока не определится температура кристаллизации состава.
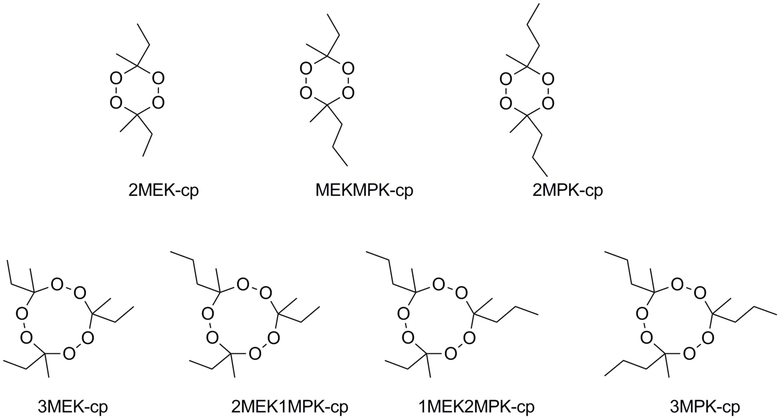
Предпочтительно, чтобы, по меньшей мере, один из пероксидов, удовлетворяющих формуле (II) являлся 3,6-диэтил -3,6,9-тримети-9-(н-пропил)-1,2,4,5,7,8-гексаоксананом (2MEK1MPK-cp). В еще одном более предпочтительном варианте осуществления также 3-этил-3,6,9-триметил-6,9-ди (н-пропил)-1,2,4,5,7,8-гексаоксанан (1MEK2MPK-cp) и/или 3,6,9-триметил-3,6,9-три (н-пропил)-1,2,4,5,7,8-гексаоксана(3MPK-cp) присутствует/присутствуют в составе.
Состав в соответствии с настоящим изобретением предпочтительно содержит разбавитель. Примерами подходящих разбавителей являются линейные и разветвленные углеводородные растворители. Примерами таких растворителей являются изододекан, тетрадекан, тридекан, коммерческие смеси таких углеводородов как Isopar® M, Isopar® L, Spirdane® D60, Exxsol® D80, Exxsol® D100, Exxsol® D100S, Soltrol® 145, Soltrol® 170, Varsol® 80, Varsol® 110, Shellsol® D100, Shellsol® D70, и Halpasol® i 235/265, и их смеси. Особенно предпочтительными разбавителями являются Isopar® M и Soltrol® 170. Примеры других подходящих разбавителей можно найти в патентном документе US 5808110. Хотя и менее предпочтительно, но также возможно использовать определенную фракцию олигомеров стирола, описанную в патентном документе WO 93/25615.
Предпочтительно, чтобы состав согласно настоящему изобретению содержал, по меньшей мере, 45 масс.%, более предпочтительно, по меньшей мере, 50 масс.%, и наиболее предпочтительно, по меньшей мере, 55 масс.% разбавителя, и предпочтительно не более 85 масс.%, более предпочтительно не более 80 масс.%, и наиболее предпочтительно не более 75 масс.% разбавителя в расчете на общую массу состава.
Состав по настоящему изобретению может необязательно содержать определенные добавки, при условии, что эти добавки не оказывают значительного подавления безопасности, транспортабельности и/или стабильности состава при хранении. Подходящими примерами таких добавок являются: антиозонанты, антиоксиданты, антидеграданты, УФ-стабилизаторы, соагенты, фунгициды, антистатические агенты, пигменты, красители, связующие вещества, диспергирующие добавки, вспенивающие вещества, смазывающие вещества, технологические масла, и присадки, облегчающие выемку изделий из формы. Эти добавки могут использоваться в их обычных количествах. Если используются такие добавки, то, как правило, они добавляются к составу циклического пероксида кетона незадолго до того, как состав используется в полимеризации или в процессе модификации сополимера.
Общее количество тримерных циклических пероксидов кетона в соответствии с формулами (I) и (II) в составе согласно настоящему изобретению составляет предпочтительно, по меньшей мере, 15 масс.%, более предпочтительно, по меньшей мере, 20 масс.%, и наиболее предпочтительно, по меньшей мере, 25 масс.%, и предпочтительно не более 55 масс.%, более предпочтительно не более 50 масс.%, и наиболее предпочтительно не более 45 масс.%.
Существует два способа получения составов циклического пероксида кетона, как описано выше. Первый способ включает смешивание 3MEK-cp с пероксидом (ми), удовлетворяющим формуле (II).
Второй способ, который является наиболее предпочтительным способом, включает реакцию пероксида водорода со смесью кетонов, содержащих метилэтилкетон (MEK) и, по меньшей мере, один кетон формулы CH3-C(=O)-R, в которой R является алкильной группой с 3-5 атомами углерода или алкоксиалкильной группой с 2-5 атомами углерода. Эта реакция требует присутствия кислоты.
Преимущество этого способа заключается в том, что требуется только одна реакция получения пероксида вместо двух.
Предпочтительные кетоны формулы CH3-C(=O)-R включают метил- н-пропилкетон (R=н-пропил), метилизопропилкетон (R=изопропил), метил-н-бутилкетон (R=н-бутил), метилизобутилкетон (R=изобутил), метиламилкетон (R=н-пентил), метилизоамилкетон (R=3-метилбутил), и метоксиацетон (R= -CH2-O-CH3).
Наиболее предпочтительным кетоном является метил-н-пропилкетон (R= н-пропил).
Молярное отношение метилэтилкетона к общему количеству кетонов формулы CH3-C(=O)-R, как определено выше для использования в этом процессе, находится предпочтительно в диапазоне от 25:75 до 95:5, более предпочтительно 30:70-70:30, еще более предпочтительно 40:60-70:30 и наиболее предпочтительно 50:50-70:30.
Реакция предпочтительно осуществляется в температурном интервале -5°-20°C, более предпочтительно 0°-10°C и наиболее предпочтительно 0-5°C. Повышенные температуры способствуют образованию димерных циклических пероксидов кетона; более низкие температуры замедляют скорость реакции и увеличивают образование линейных пероксидов.
Реакция осуществляется в присутствии кислоты. Предпочтительно, чтобы этой кислотой являлась сильная кислота. Наиболее предпочтительной кислотой является серная кислота. Предпочтительными растворами являются 78-85 масс.% растворы серной кислоты в воде. Более низкая концентрация кислоты понижает конверсию и скорость реакции; более высокая концентрация кислоты может создать проблемы безопасности и повышенное количество побочных продуктов.
Из соображений безопасности чрезвычайно желательно выполнять реакцию в присутствии разбавителя. Подходящими разбавителями являются те, которые были перечислены выше. Разбавитель предпочтительно смешивается со смесью кетона до добавления кислоты и пероксида водорода.
Кислота и пероксид водорода (отдельно или в смеси) предпочтительно медленно добавляются к смеси кетона. Более предпочтительно, чтобы добавление осуществлялось дозировано к указанной смеси в течение 30-90 минут, еще более предпочтительно 40-80 минут, наиболее предпочтительно 50-70 минут.
После добавления кислоты и пероксида водорода, реакционной смеси желательно предоставить возможность реагировать еще, по меньшей мере, в течение 60 минут, более предпочтительно, по меньшей мере, 70 минут.
В добавление к пероксидам формул (I) и (II), в этой реакции могут быть образованы некоторые линейные, а также некоторые димерные циклические структуры. Это также означает, что состав в соответствии с настоящим изобретением может содержать некоторое количество линейных и/или димерных циклических пероксидов кетона.
Состав пероксида в соответствии с настоящим изобретением может быть соответствующим образом использован в качестве добавки для дизельного топлива, как инициатор поперечной сшивки, для инициирования реакций (радикальной) (co)полимеризации (например, процессов полимеризации этилeна с получением полиэтилена низкой плотности при высоком давлении, полимеризации стирола и акрилатных полимеризаций) и процессов модификации сополимеров (например, модификация для прочности расплава полипропилена или модификация полимолочной кислоты и контролируемая реологией модификация изготовления полипропилена (CR-PP)).
Примеры
Пример 1
В 150 мл колбу Эрленмейера добавляли H2SO4-78% (27,8 г) с H2O2-70% (22,8 г) при температуре 0°C (заранее приготовленная смесь). Заранее приготовленная смесь хранилась при температуре 0°C до тех пор, пока не стала необходимой.
300 мл реактор, снабженный турбинной мешалкой, загружали Isopar M (38 г), метилэтилкетоном (MEK; 24,7 г, 343 ммоль), и метилпропилкетоном (MPK; 12,6 g, 147 ммоль). Молярное отношение MEK к MPK было 70:30. Полученную смесь перемешивали (1200 об/мин) и охлаждали до температуры 0°C. Заранее приготовленную смесь дозировано вводили в полученную смесь в течение периода времени 60 мин(0,650 мл/мин), при этом поддержали температуру в интервале от -1°C до +1°C. Реакция протекала при температуре 0°C в течение 75 минут после дозированной подачи реагентов. Реакцию резко подавляли путем добавления воды (13,8 г) и фазы разделяли. Водный слой (нижний) был удален.
HPLC показал формирование следующих соединений в количествах, указанных в таблице 1.
Образец из состава хранился при температуре -26°C в течение 12 дней в бане с изопропиловым спиртом. После 5 дней, общее содержание активного кислорода (аO) определяли путем титрования в соответствии со стандартом ASTM D2180-89(2008). Этот aO сравнивали с количеством кислорода из свежеприготовленного состава. Как до, так и после этого периода хранения содержание активного кислорода составляло 8 масс.%, а это означало, что никакого значительного разложения пероксида не произошло во время хранения.
После 12 дней хранения были взяты два образца. Один из них был проанализирован непосредственно с помощью HLPC; другому образцу позволяли нагреваться до комнатной температуры (20°C). Результаты испытаний представлены в таблице 1.
Таблица 1
cостав (масс%)
(масс.%)
В составе образца не было обнаружено заметных изменений, а это означало, что состав был химически стабилен в этих условиях.
Образец 2
Образец 1 был повторен с использованием MEK и MPK различных мольных соотношений, а температуры кристаллизации свежеприготовленных составов примеров 1 и 2 были определены способом, описанным выше.
Все тесты были выполнены в пробирке диаметром 28 мм. Образец в количестве приблизительно 25 мл был налит в пробирку, и пробирка была плотно закрыта резиновой пробкой. Первая температура (T1) была -15°C. В качестве зародыша кристаллизации использовали чистые 3MEK-cp кристаллы.
Таблица 2
1Никакой кристаллизации не наблюдалась при температуре -28°C
Пример 3:
Примеры 1 и 2 были повторены с использованием метилизобутилкетона (MiBK) вместо метил-н-пропилкетона. Результаты приведены в таблице 3.
Таблица 3
MEK:другой кетон(ы)
Пример 4:
Примеры 1 и 2 были повторены с использованием MEK, MPK и метилизопропилкетона (MiPK) в качестве кетонов, молярное отношение MEK:MPK:MiPK составляло 70:15:15. Температура кристаллизации полученной смеси, составляющая -23°C, и состав смеси показан в таблице 4.
Таблица 4
Пример 5
Примеры 1 и 2 повторяли, используя MEK, MPK и MiBK в качестве кетонов, молярное отношение MEK:MPK:MiBK составляло 70:27:3.
Часть полученного состава хранили в течение трех недель при температуре -40°C; другую часть хранили в течение трех недель при комнатной температуре.
Никакой кристаллизации не наблюдалось в образцах в течение этого периода хранения. Не осуществлялось хранение в течение одного дня при температуре -44°C, или хранение в течение двух дней при температуре -48°C, так как приводило к любой кристаллизации.
Кроме того, никакое увеличение опасности взрыва не наблюдалось после хранения при температуре -40°C по сравнению с хранением при комнатной температуре. Сила взрыва была в пять раз ниже, чем таковая у кристаллизованного образца, полученного из MEK в качестве единственного кетона, хранящегося при температуре -15°C (смотри таблицу 2).
Пример 6
Состав пероксида, следующий из примера 1, был использован для деградации полипропилена, и его эффективность сравнивали после этого с коммерческим: 41 масс.% 3MEK-cp в Isopar M (Trigonox® 301).
Деградация полипропилена (PP) была выполнена при двух различных температурах (190°C и 225°C) и при трех различных содержаниях активного кислорода (5,2 мг, 10,5 мг и 15,6 мг/100г PP).
Полипропилен (750 г) был экструдирован с использованием Polylab OS системы, оснащенной экструдером Haake PTW16 (двушнековое вращение в одном направлении). Температурные режимы: бункер при температуре 30°C, рабочая зона 1 при температуре 160°C и зоны 2-10 при температуре 225°C или 190°C.
Показатель текучести расплава (MFI), деградированного PP, был измерен, и, как показано в таблицах 5 и 6, оказалось, что у обеих составов пероксида была одна и та же эффективность разложения PP, при всех содержаниях активного кислорода и обеих температурах. Это показывает, что состав в соответствии с настоящим изобретением повышает уровень безопасности 3MEK-cp, не ослабляя его эффективность.
Таблица 5: PP разложение при температуре 190°C
Таблица 6: PP разложение при температуре 225°C
| название | год | авторы | номер документа |
|---|---|---|---|
| МАСТЕРБАТЧ, СОДЕРЖАЩИЙ ЦИКЛИЧЕСКИЙ ПЕРОКСИД КЕТОНА | 2013 |
|
RU2655322C2 |
| СОСТАВЫ С ЦИКЛИЧЕСКИМИ ПЕРОКСИДАМИ КЕТОНОВ, УЛУЧШЕННЫЕ СОСТАВЫ С ЦИКЛИЧЕСКИМИ ПЕРОКСИДАМИ КЕТОНОВ | 2003 |
|
RU2357954C2 |
| ПЕРОКСИДНАЯ МАТОЧНАЯ СМЕСЬ НА ОСНОВЕ БИОСМОЛЫ | 2013 |
|
RU2654025C2 |
| СТАБИЛЬНЫЕ ПРИ ХРАНЕНИИ КОМПОЗИЦИИ ЦИКЛИЧЕСКОГО ПЕРОКСИДА КЕТОНА | 2004 |
|
RU2351611C2 |
| СПОСОБ ГАЗОФАЗНОЙ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ | 2010 |
|
RU2535962C2 |
| СОСТАВ ДЛЯ ПОКРЫТИЯ НА ВОДНОЙ ОСНОВЕ И ИЗГОТОВЛЕНИЕ МНОГОСЛОЙНЫХ КРАСОЧНЫХ СИСТЕМ С ПРИМЕНЕНИЕМ УКАЗАННОГО СОСТАВА ДЛЯ ПОКРЫТИЯ | 2014 |
|
RU2677334C1 |
| УЛУЧШИТЕЛЬ ТЕКУЧЕСТИ НА ХОЛОДЕ, ИМЕЮЩИЙ ШИРОКУЮ ПРИМЕНИМОСТЬ В ДИЗЕЛЬНОМ МИНЕРАЛЬНОМ ТОПЛИВЕ, БИОДИЗЕЛЕ И ИХ СМЕСЯХ | 2014 |
|
RU2656213C2 |
| СОПОЛИМЕР И ЕГО ПРИМЕНЕНИЕ ДЛЯ УМЕНЬШЕНИЯ КРИСТАЛЛИЗАЦИИ КРИСТАЛЛОВ ПАРАФИНА В ТОПЛИВАХ | 2015 |
|
RU2690940C2 |
| СПОСОБ ОТВЕРЖДЕНИЯ (МЕТ)АКРИЛАТСОДЕРЖАЩЕЙ НЕНАСЫЩЕННОЙ ПОЛИЭФИРНОЙ ИЛИ ВИНИЛОВОЭФИРНОЙ СМОЛЫ | 2015 |
|
RU2689151C2 |
| МОЛЕКУЛЯРНО-КОМПЛЕКСНОЕ СОЕДИНЕНИЕ, ФОТОПОЛИМЕРИЗУЮЩИЙСЯ СОСТАВ И СПОСОБ ФОТОПОЛИМЕРИЗАЦИИ | 1997 |
|
RU2181726C2 |
Объектом изобретения является инициирующий состав, содержащий по меньшей мере два тримерных циклических пероксида кетона: тримерный циклический пероксид метилэтилкетона (3MEK-cp) формулы (I) и по меньшей мере один пероксид, удовлетворяющий формуле (II), в которой R1-R3представляют собой алкил, где указанные группы имеют от 2 до 5 атомов углерода, общее число атомов углерода R1+R2+R3 находится в диапазоне 7-15, и молярное соотношение 3MEK-cp и общего количества пероксидов, удовлетворяющих формуле (II), находится в диапазоне от 10:90 до 80:20. Изобретение также относится к способу получения этого состава. Технический результат – повышение безопасности и стабильности состава при хранении. 2 н. и 9 з.п. ф-лы, 6 табл., 6 пр.
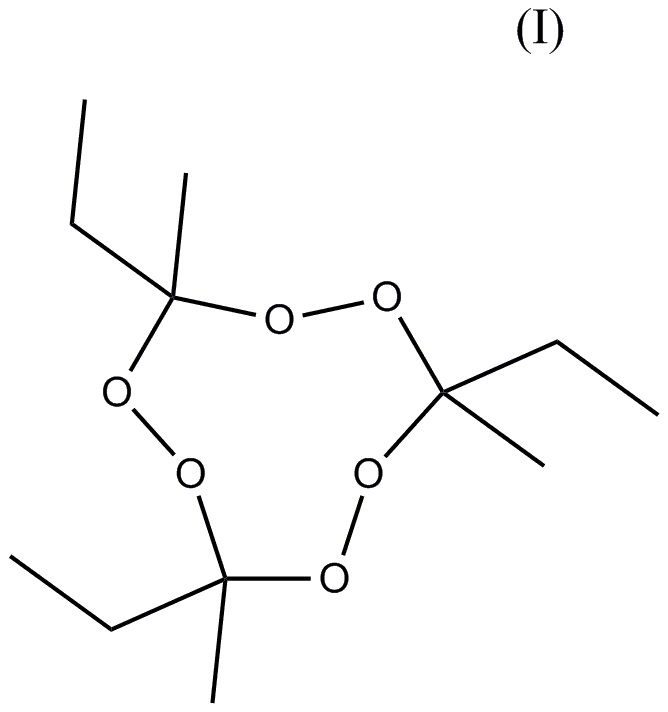
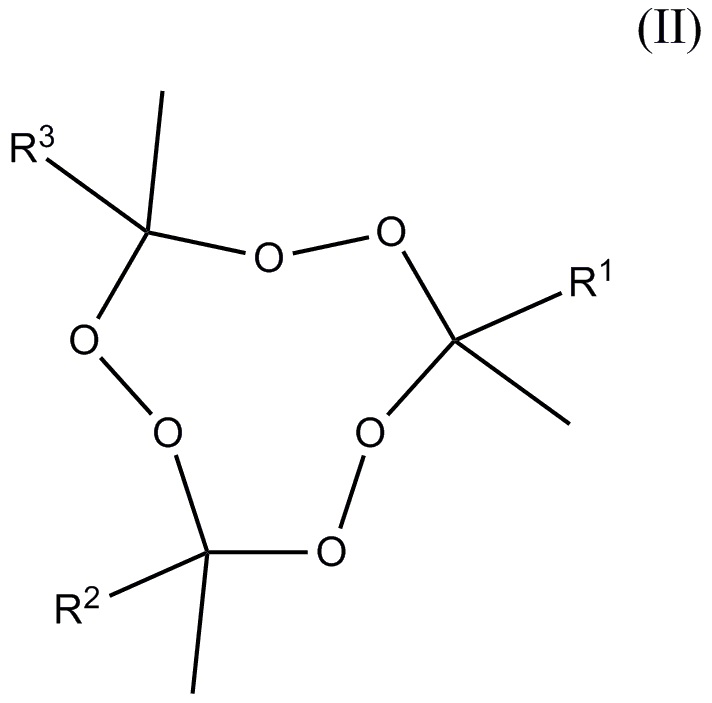
1. Инициирующий состав, содержащий по меньшей мере два тримерных циклических пероксидных кетона: тримерный циклический пероксид метилэтилкетона (3MEK-cp) формулы (I)
и по меньшей мере один пероксид, удовлетворяющий формуле (II)
 ,
,
в которой R1-R3 представляют собой алкил, где указанные группы имеют от 2 до 5 атомов углерода, общее число атомов углерода R1+R2+R3 находится в диапазоне 7-15, и молярное отношение 3MEK-cp к общему количеству пероксидов, удовлетворяющих формуле (II), находится в диапазоне от 10:90 до 80:20.
2. Состав по п.1, в котором алкильные группы являются линейными алкильными группами.
3. Состав по любому одному из предшествующих пунктов, в котором молярное соотношение 3MEK-cp и общего количества пероксидов, удовлетворяющих формуле (II), находится в диапазоне от 40:60 до 80:20.
4. Состав по любому одному из предшествующих пунктов, в котором состав дополнительно содержит разбавитель в количестве 45-85 мас.% в расчете на массу состава.
5. Состав по любому одному из предшествующих пунктов, в котором общее количество тримерных циклических пероксидов кетона согласно формулам (I) и (II) находится в диапазоне 15-55 мас.% в расчете на массу состава.
6. Состав по любому одному из предшествующих пунктов, в котором по меньшей мере один из пероксидов, удовлетворяющих формуле (II), является 3,6-диэтил-3,6,9-триметил-9-(н-пропил)-1,2,4,5,7,8-гексаоксананом.
7. Состав по любому одному из предшествующих пунктов, в котором по меньшей мере один из пероксидов, удовлетворяющих формуле (II), является 3-этил-3,6,9-триметил-6,9-ди(н-пропил)-1,2,4,5,7,8-гексаоксананом.
8. Состав по любому одному из предшествующих пунктов, в котором по меньшей мере один из пероксидов, удовлетворяющих формуле (II), является 3,6,9-три(н-пропил)-3,6,9-триметил-1,2,4,5,7,8-гексаоксананом.
9. Способ получения состава по любому из пп.1-8 путем взаимодействия в присутствии кислоты пероксида водорода со смесью кетонов, содержащих метилэтилкетон (MEK) и по меньшей мере один кетон формулы CH3-C(=O)-R, где R является алкильной группой, содержащей от 3 до 5 атомов углерода, и где молярное соотношение MEK и общего количества кетонов формулы CH3-C(=O)-R находится в диапазоне от 25:75 до 95:5.
10. Способ по п.9, в котором R является н-пропилом.
11. Способ по любому одному из пп. 9-10, в котором молярное соотношение MEK и общего количества кетонов формулы CH3-C(=O)-R находится в диапазоне от 50:50 до 70:30.
| КОМПОЗИЦИИ НА ОСНОВЕ ЦИКЛИЧЕСКИХ ПЕРЕКИСЕЙ КЕТОНА | 1995 |
|
RU2154649C2 |
| УЛУЧШЕННАЯ ФЛЕГМАТИЗАЦИЯ ЦИКЛИЧЕСКИХ ПЕРОКСИДОВ КЕТОНА | 1999 |
|
RU2224756C2 |
| СПОСОБ ПРОИЗВОДСТВА ТОНКИХ ХОЛОДНОКАТАНЫХ ПОЛОС ПОД МЕТАЛЛИЧЕСКИЕ ИЛИ ПОЛИМЕРНЫЕ ПОКРЫТИЯ | 2007 |
|
RU2351661C1 |
Авторы
Даты
2019-02-06—Публикация
2015-03-09—Подача