Область техники, к которой относится изобретение
Настоящее изобретение относится к лечению поражений хрящевой и хрящевой/костной ткани, остеоартрита и повреждения хряща, в частности. Более конкретно, оно относится к соединению FGF-18 для применения в соответствии с определенными схемами лечения. В частности, предложены схемы лечения, включающие введения соединения FGF-18 каждые 3 недели, 4 недели или 5 недель в течение курса лечения. Схема применения может дополнительно включать введение противовоспалительного средства, воздействующего на симптомы (боль и функция), такого как анакинра или диклофенак.
Уровень техники
Хрящ сформирован из хондроцитов (клеток, происходящих из мезенхимальных клеток), которые распределены в матриксе (твердом гелеобразном основном веществе). Хрящевой матрикс образован этими клетками и включает главным образом коллагеновые волокна II типа (кроме волокнистой хрящевой ткани, которая также содержит коллагеновые волокна I типа), протеогликаны и волокна эластина. Хрящевая ткань присутствует также в суставах, грудной клетке, ухе, носу, в горле, в трахее и в межпозвоночных дисках. Существует три основных типа хряща: гиалиновый, эластический и волокнистый хрящ, обладающие достаточно разными функциональными свойствами согласно их гистологической морфологии. Суставной хрящ, например, является гиалиновым хрящом, имеющим вязкоупругие свойства, и покрывает суставные поверхности костей. Главная функция суставного хряща состоит в обеспечении гладких поверхностей, чтобы гарантировать движение сочлененных костей почти без трения.
Поражения хряща в широком смысле относятся к заболеваниям, характеризующимся дегенерацией/разрушением хряща и нарушениями в соединительных тканях, которые проявляются в воспалении, боли, неподвижности и ограничении движения затронутых частей тела. Такие нарушения могут быть вызваны патологией или могут являться результатом травмы или повреждения. Зрелый хрящ имеет крайне ограниченную способность к ауторепарации, в особенности потому, что зрелые хондроциты обладают малым потенциалом для пролиферации вследствие ограниченного поступления питательных веществ, связанного с отсутствием кровеносных сосудов в хряще. Замена поврежденного хряща, в особенности суставного хряща, вследствие повреждения или болезни является основной проблемой для врачей, при этом доступные процедуры хирургического лечения считаются непредсказуемыми и эффективными лишь в течение ограниченного времени у больных в более раннем возрасте, не имеющих остеоартритных изменений. Поэтому большинство больных либо не обращаются за помощью, либо получают рекомендацию отложить лечение на как можно более длительный срок. Когда требуется лечение, стандартная процедура зависит от возраста и варьирует от полной или частичной замены сустава до трансплантации частей хряща или хондроцитов, или методики стимуляции костного мозга (такой как микрофрактурирование). Микрофрактурирование является недорогой и простой процедурой, которая включает перфорацию субхондральной кости с целью стимуляции отложения хряща из стволовых клеток костномозгового происхождения. Однако было показано, что такая методика не обеспечивает достаточного восстановления дефекта хряща, и новый сформировавшийся хрящ главным образом представляет собой волокнистый хрящ, что приводит к малой долговечности восстановленной ткани. Действительно, волокнистый хрящ не обладает такими биомеханическими свойствами, как гиалиновый суставной хрящ, и часто не имеет правильной латеральной интеграции в окружающий хрящ. По этой причине недавно образованный волокнистый хрящ может легче разрушаться (ожидаемый период времени: 5-10 лет).
Для больных остеоартритом (ОА) все эти методики восстановления хряща неэффективны. Остающееся консервативное лечение состоит исключительно из физиотерапии, изменения образа жизни (например, сокращение массы тела), поддерживающих устройств, лекарственных средств для приема внутрь (например, нестероидных противовоспалительных средств), инъекции лекарственных средств (например, гиалуроновой кислоты и кортикостероидов), а также биологически активных пищевых добавок. Все указанные способы лечения не способны остановить прогрессирование ОА. Если терапия боли также неудачна, хирургическая операция, такая как замена сустава или высокая остеотомия большеберцовой кости в случае коленного сустава, является оставшимся выбором для пациентов. Остеотомии большеберцовой или бедренной кости (с разрезом кости для ребалансировки изношенного сустава) могут уменьшать симптомы, способствуют поддержанию активного образа жизни и отсрочивают необходимость полной замены сустава. Полная замена сустава может обеспечить облегчение симптома запущенного остеоартрита, но обычно требует существенных изменений образа жизни и/или уровня активности больного.
Доступные в настоящее время лекарственные терапии главным образом направлены на снятие боли. На данный момент не существует никакого коммерчески доступного лечения, которое восстанавливает повреждения хряща (см. Lotz, 2010).
Интерлейкин-1 альфа (IL-1α) и интерлейкин-1 бета (IL-1β) являются природными агонистами рецептора IL-1 I типа (IL-1RA). Было показано, что чрезмерная экспрессия провоспалительных цитокинов, таких как IL-1, играет главную роль в патогенезе иммуновоспалительных заболеваний, таких как ревматоидный артрит (РА) (Bingham, 2002) или остеоартрит (ОА) (Lee et al., 2013). Клиническое применение антагонистических IL-1α и IL-1β при РА исследовали с анакинрой (Kineret™), рекомбинантным негликозилированным IL-1ra человека. Применение этого терапевтического белка привело к уменьшению частоты и тяжести повреждения суставов у больных РА (Bresnihan, 2002; St. Clair, 2002), а также к уменьшению боли (Mertens et al., 2009). Это соединение была одобрено в 2001 году для лечения некоторых типов РА. Хотя IL-1 также задействован при ОА, терапия анакинрой не связана в значительной степени с уменьшениями симптомов ОА по сравнению с плацебо, хотя была отмечена тенденция к уменьшению боли при применении 150 мг анакинры в сравнении с плацебо (Chevalier et al., 2009).
Фактор роста фибробластов 18 (FGF-18) является представителем семейства белков факторов роста фибробластов (FGF), близко родственным FGF-8 и FGF-17. Было показано, что FGF-18 вызывает пролиферацию хондроцитов и остеобластов (Ellsworth et al., 2002; Shimoaka et al., 2002). FGF-18 был предложен для лечения поражений хряща, таких как остеоартрит и повреждение хряща, отдельно (WO2008/023063) или в комбинации с гиалуроновой кислотой (WO2004/032849).
Для FGF18 были предложены различные схемы применения. Например, Moore et al. (2005) раскрыли введение два раза в неделю в течение 3 недель, и в WO2008/023063 описано введение один раз в неделю в течение 3 недель. Последнюю указанную схему применения исследовали в клинических исследованиях (для получения дополнительной информации см., например, NCT01033994, NCT00911469 и NCT01066871).
Хотя схема применения, описанная в WO2008023063, дает хорошие результаты в восстановлении суставного хряща, все еще существует риск развития острого синовита. Поэтому существует потребность в способе уменьшения риска развития острого синовита, связанного с проводимым лечением, а также в увеличении переносимости больным внутрисуставной инъекции с сохранением эффективности лечения поражения хряща, в особенности, посредством пролиферации хондроцитов и последующего восстановления хряща. Такой способ должен не только обеспечивать восстановление суставного хряща, возможно в отсутствии синовита, но также обеспечивать повторное образование нового хряща, обладающего хорошими свойствами (то есть главным образом гиалинового хряща). Фактически, образование указанного гиалинового хряща ценно как в терапевтических целях, так и в качестве компонента биологических матриц (Getgood et al., 2010). Существует также потребность в способе уменьшения боли/улучшения функции с одновременным сохранением эффективности лечения поражения хряща. Фактически, боль не только часто ассоциируется с поражениями хряща, но представляет также основной симптом для клинического обнаружения таких поражений.
Сущность изобретения
Цель настоящего изобретения состоит в предоставлении способа лечения больного с поражением хряща, включающего введение соединения FGF-18, где соединение FGF-18 вводят по меньшей мере два раза в течение курса лечения, при этом указанные введения разделены интервалом продолжительностью приблизительно 3-5 недель, предпочтительно месяц (ежемесячные введения). В предпочтительном варианте осуществления указанные введения разделены регулярным интервалом продолжительностью приблизительно 3, 4 или 5 недель каждый. Предпочтительно соединение FGF-18 вводят с регулярными интервалами один раз в месяц.
В настоящем изобретении также предложено соединение FGF-18 для применения в лечении больного с поражением хряща, где соединение FGF-18 нужно вводить по меньшей мере два раза в течение курса лечения, при этом указанные введения разделены интервалом продолжительностью приблизительно 3-5 недель, предпочтительно приблизительно один месяц (ежемесячные введения). В предпочтительном варианте осуществления указанные введения разделены регулярным интервалом продолжительностью приблизительно 3, 4 или 5 недель каждый. Предпочтительно соединение FGF-18 вводят с регулярными интервалами один раз в месяц.
Предпочтительно соединение FGF-18, которое будут вводить, является фрагментом FGF-18, указанным в настоящей заявке как trFGF-18 (или сприфермин), при этом цикл дозировки составляет 3-300 мкг на внутрисуставную инъекцию, раз в месяц в течение 3 последовательных месяцев (один курс лечения).
В рамках настоящего изобретения в целом, любое лечение (или любой способ лечения) соединением FGF-18 может дополнительно включать введение противовоспалительного средства, воздействующего на симптомы (боль и функция), такого как анакинра или диклофенак. Предпочтительно такое введение производят одновременно с введением соединения FGF-18. В случае необходимости противовоспалительного средства будет следовать, что указанное противовоспалительное средство нужно вводить параллельно с соединением FGF-18 по меньшей мере два раза в течение курса лечения, при этом указанные введения разделены интервалом продолжительностью приблизительно 3-5 недель, предпочтительно приблизительно один месяц (ежемесячные введения). Предпочтительно противовоспалительным средством является анакинра или диклофенак, при этом цикл дозировки составляет 0,01-500 мг на введение, раз в месяц в течение 3 последовательных месяцев (один курс лечения).
В предпочтительном варианте осуществления такой курс лечения (то есть соединением FGF-18 отдельно или в комбинации с противовоспалительным средством, воздействующим на симптомы (боль и функция)), может быть повторен через несколько месяцев после последней инъекции в предыдущем курсе лечения, например, через 2, 4 или 6 месяцев или даже через 1 год.
В предпочтительных вариантах осуществления изобретения поражение хряща, подвергаемое лечению, является артритом, таким как остеоартрит, или повреждением хряща с или без хирургического вмешательства, такого как микрофрактурирование. Неожиданно было обнаружено, что способы и применение настоящего изобретения заметно улучшают восстановление хряща и стимулируют пролиферацию хондроцитов, и при этом увеличивают переносимость больным внутрисуставной инъекции. Также было неожиданно обнаружено, что при совместном применении анакинры или диклофенака с FGF18, это позволяет эффективно восстанавливать пролиферативную активность соединения FGF-18. Другое преимущество настоящего изобретения состоит в том, что синовит снижается по сравнению с наблюдаемым при других схемах.
Определения
- Термин "соединение FGF-18" или "FGF-18", при использовании в настоящем описании, относится к белку, сохраняющему по меньшей мере одну биологическую активность человеческого белка FGF-18. FGF-18 может быть нативным, находиться в своей зрелой форме, рекомбинантной форме или усеченной форме. Биологические активности человеческого белка FGF-18 включают, в частности, увеличение пролиферации хондроцитов или остеобластов (см. WO98/16644) или формирования хряща (см. WO2008/023063). Нативный, или дикого типа, человеческий FGF-18 представляет собой белок, экспрессируемый хондроцитами суставного хряща. Человеческий FGF-18 сначала был обозначен как zFGF-5 и полностью описан в WO98/16644. SEQ ID NO:1 соответствует аминокислотной последовательности нативного человеческого FGF-18 с сигнальным пептидом, который состоит из аминокислотных остатков 1 (Met) - 27 (Ala). Зрелая форма человеческого FGF-18 соответствует аминокислотной последовательности от остатка 28 (Glu) до остатка 207 (Ala) SEQ ID NO: 1 (180 аминокислот).
FGF-18, в настоящем изобретении, может быть получен рекомбинантным способом, таким как способ, описанный в заявке WO2006/063362. В зависимости от систем экспрессии и условий, FGF-18 в настоящем изобретении экспрессируется в рекомбинантной клетке-хозяине с первым остатком метионина (Met) или с сигнальной последовательностью для секреции. При экспрессии в прокариотическом хозяине, например в E. coli, FGF-18 содержит дополнительный остаток Met на N-конце своей последовательности. Например, аминокислотная последовательность человеческого FGF-18, при экспрессии в E.coli, начинается с остатка Met на N-конце (положение 1), после которого следуют остатки 28 (Glu) - 207 (Ala) в SEQ ID NO: 1.
- Термин "усеченная форма" FGF18, при использовании в настоящем описании, относится к белку, который включает или состоит из остатков 28 (Glu) - 196 (Lys) SEQ ID NO: 1. Предпочтительно, усеченная форма белка FGF-18 является полипептидом, обозначенным как "trFGF-18" (170 аминокислот; также известный как rhFGF18 или сприфермин), который начинается с остатка Met (на N-конце) после которого следуют аминокислотные остатки 28 (Glu) - 196 (Lys) человеческого FGF-18 дикого типа. Аминокислотная последовательность trFGF-18 показана в SEQ ID NO:2 (аминокислотные остатки 2-170 в SEQ ID NO:2 соответствуют аминокислотным остаткам 28-196 в SEQ ID NO:1). trFGF-18 является рекомбинантной усеченной формой человеческого FGF-18, продуцированной в E.coli (см. WO2006/063362). Было показано, что trFGF-18 демонстрирует активности, аналогичные зрелому человеческому FGF-18, например, он повышает пролиферацию хондроцитов и отложение хряща, что приводит к восстановлению и реконструкции множества хрящевых тканей (см. WO2008/023063).
- Термины "противовоспалительное средство, воздействующее на симптомы (боль и функцию)" или "противовоспалительное средство", при использовании в настоящем описании, относятся к противовоспалительному средству, воздействующему на симптомы, связанные с поражениями хряща, которые подвергают лечению, такие как боль и функция. Предпочтительными "противовоспалительными средствами", которые будут применяться согласно настоящему изобретению, являются анакинра и диклофенак. Анакинра является рекомбинантной негликозилированной формой антагониста человеческого рецептора интерлейкина-1 (IL-1Ra). Его выпускают под наименованием Kineret®. Его последовательность соответствует SEQ ID NO:3. Диклофенак (то есть 2-(2,6-дихлоранилино)фенил-уксусная кислота) является лекарственным средством, хорошо известным благодаря уменьшению воспаления, а также как анальгетик, уменьшающий боль при некоторых состояниях. Его выпускают под различными торговыми наименованиями.
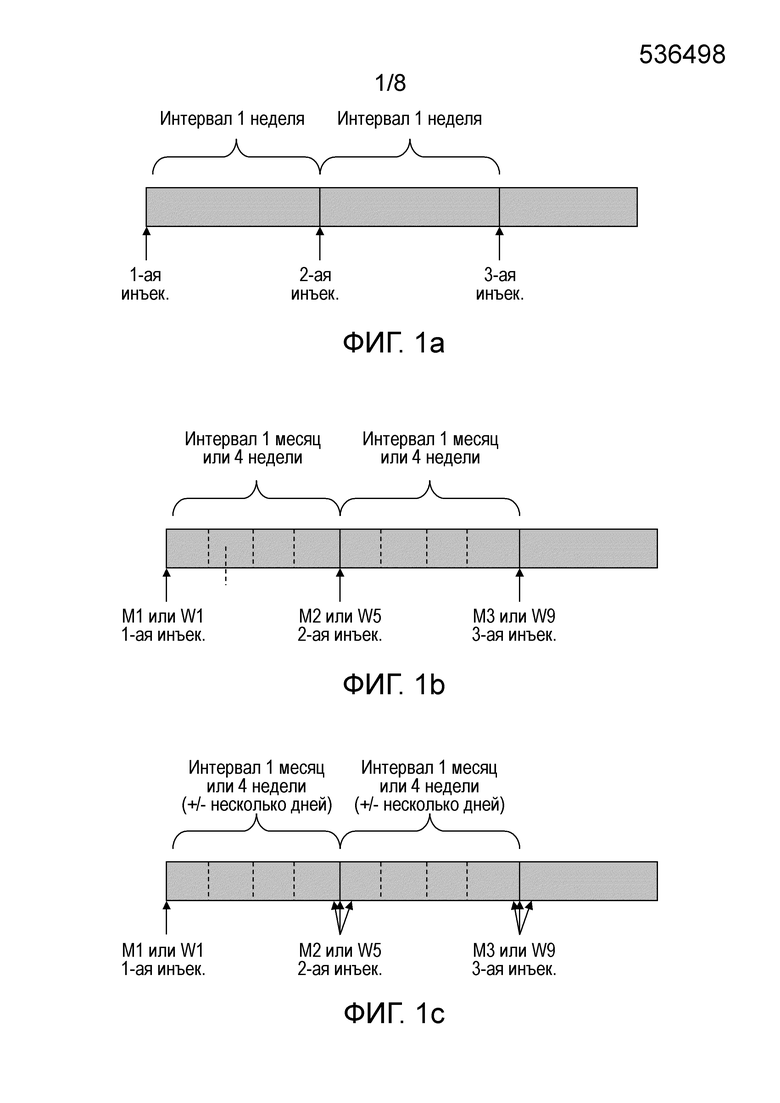
- Термин "приблизительно" в "приблизительно 3-5 недель" или "приблизительно один месяц" охватывает введения, разделенные интервалом от 3 недель (21 день) до 5 недель (35 дней) или одного месяца, а также введение, разделенное интервалом продолжительностью 3-5 недель +/- несколько дней или продолжительностью один месяц +/- несколько дней (например, +/-1, 2, 3, 4 дня). Фактически следует понимать, что, в особенности с практической точки зрения, введение соединения FGF-18, например trFGF-18, не всегда может выполняться с точными интервалами, например, точно через 4 недели (28 дней), день в день, после предыдущего введения. Поэтому в рамках изобретения 4 недели означает 28 дней, но может также быть через 24, 25, 26, 27, 28, 29, 30, 31 или 32 дня после предыдущего введения, для удобства больного. В рамках настоящего изобретения термин "4 недели" аналогичен термину "1 месяц", и они могут использоваться попеременно (Фигура 1). "4 недели", которые будут предпочтительно использоваться, должны соответствовать "дням" (например, 1-ая инъекция в понедельник, последующая инъекция в понедельник через 4 недели), а "месяц", который будет предпочтительно использоваться, должен соответствовать "дате" (например, 1-ая инъекция 1-ого августа, следующая инъекция 1-ого сентября).
- Термин "курс лечения" или "курс" соответствует периоду, в котором соединение FGF-18 дают каждые 3, 4 или 5 недель или каждый месяц (последовательные введения). Например, курс лечения может состоять из 3 инъекций с интервалом между ними 3 недели или может состоять из 3 инъекций с интервалом между ними 4 недели. Такой "курс лечения" может быть повторен. Например, второй "курс лечения" может быть выполнен через 3, 4, 5 или 6 месяцев после последней инъекции в предыдущем курсе. В альтернативе второй курс может быть также выполнен через 1 год или 2 года после первой инъекции в первом курсе. Например, после первого курса лечения, состоящего из 3 инъекций с интервалом между ними 4 недели, может следовать, через 3 месяца после последней инъекции указанного курса, второй курс лечения из 3 инъекций с интервалом между ними 4 недели.
- Термин "поражение хряща" при использовании в настоящем описании охватывает нарушения, возникающие в результате повреждений, таких как травматическое повреждение, хондропатия или артрит. Примеры поражений хряща, которые можно лечить путем применения соединения FGF-18, описанного в настоящей заявке, включают, без ограничения, артрит, такой как остеоартрит, и повреждение хряща. Дегенеративные заболевания/поражения хряща или сустава, такие как хондрокальциноз, полихондрит, рецидивирующий полихондрит, анкилозирующий спондилит или реберный хондрит также охвачены данным выражением. Международное общество по восстановлению хрящевой ткани (International Cartilage Repair Society) предложило артроскопическую шкалу для оценки тяжести дефекта хряща: оценка 0: (нормальный) здоровый хрящ, оценка 1: в хряще присутствует участок размягчения или пузыри, оценка 2: в хряще видны незначительные разрывы, оценка 3: поражения имеют глубокие трещины (затрагивают более 50% толщины слоя хряща) и оценка 4: разрыв хряща обнажает основную (субхондральную) кость (см. публикацию ICRS: http://www.cartilage.org/_files/contentmanagement/ICRS_evaluation.pdf, страница 13).
- Термин "артрит", при использовании в настоящем описании, охватывает такие нарушения как остеоартрит, ревматоидный артрит, ювенильный ревматоидный артрит, инфекционный артрит, псориатический артрит, болезнь Стилла (начало ювенильного ревматоидного артрита) или рассекающий остеохондрит. Это предпочтительно включает заболевания или нарушения, при которых хрящ поврежден.
- Термин "остеоартрит" или "ОА" используется для определения наиболее распространенной формы артрита. Термин "остеоартрит" охватывает первичный остеоартрит и вторичный остеоартрит (см., например, The Merck Manual, 17th edition, page 449). Остеоартрит может быть вызван разрушением хряща. Фрагменты хряща могут отрываться и вызывать боль и опухание в суставе между костями. С течением времени хрящ может полностью изнашиваться, и кости будут тереться друг о друга. Остеоартрит может поражать любой сустав, но обычно затрагивает руки, плечи и опорные суставы, такие как бедра, колени, ступни и позвоночник. В предпочтительном примере остеоартрит может быть остеоартритом коленного сустава или остеоартритом тазобедренного сустава. Данная формулировка охватывает, в частности, формы остеоартрита, которые классифицируют по тяжести от стадии 1 до стадии 4 или от степени 1 до степени 6 согласно системе классификации OARSI. Специалист имеет полное представление о классификациях остеоартрита, которые используются в уровне техники, в особенности указанная система исследования OARSI (также называемая OOCHAS; см. например Custers et al., 2007). Остеоартрит является одним из предпочтительных поражений хряща, которые можно лечить путем применения соединений FGF-18 согласно настоящему изобретению.
- Термин "повреждение хряща" при использовании в настоящем описании является поражением хряща или повреждением хряща, которые вызваны, в частности, травмой. Повреждения хряща могут происходить, в частности, после травматического механического разрушения, особенно после несчастного случая или хирургического вмешательства (например, микрофрактурирования). Данный термин "повреждение хряща" также включает хрящевую или костно-хрящевую трещину и повреждение мениска. Также в пределах данного определения рассматривают связанное со спортом повреждение или связанное со спортом изнашивание тканей сустава. Термин также включает микроповреждение или тупую травму, хрящевую трещину, костно-хрящевую трещину или повреждение мениска.
- В рамках настоящего изобретения "эффективность" лечения может быть измерена по изменениям толщины хряща, например толщины суставного хряща в суставе. Эта толщина может быть оценена, например, с помощью компьютерной томографии, магнитно-резонансной томографии (МРТ) или ультразвукового исследования.
Подробное описание изобретения
В настоящем изобретении предложены схемы применения для лечения различных поражений хряща, таких как остеоартрит и повреждение хряща, соединением FGF-18. Предпочтительно указанное соединение FGF-18 представляет собой trFGF-18, как определено выше. В рамках настоящего изобретения было показано, что соединения FGF-18 обладают оптимальным действием, обеспечивающим уменьшение тяжести заболевания или симптомов при поражениях хряща в случае введения согласно способам и применению, раскрытому в настоящей заявке. Неожиданно было обнаружено, что схемы применения согласно настоящему изобретению (то есть схемы применения с введением дозы реже, чем один раз в неделю, в течение трехнедельного курса лечения) обеспечивают состояние уменьшения воспаления (например, острого синовита) во время следующей инъекции, и поэтому можно наблюдать полную активность соединений FGF-18. Этот результат был неожиданным вследствие довольно короткого полупериода существования FGF-18 в суставе (меньше 24 часов).
В рамках настоящего изобретения в целом, любое лечение (или любой способ лечения) соединением FGF-18 может дополнительно включать введение противовоспалительного средства, воздействующего на симптомы (боль и функцию), такого как анакинра или диклофенак. Предпочтительно такое введение (или совместное введение) выполняют одновременно (то есть параллельно) с введением соединения FGF-18.
В одном варианте осуществления настоящего изобретения предложен способ лечения больного с поражением хряща, включающий введение соединения FGF-18, где соединение FGF-18 вводят по меньшей мере два раза в течение курса лечения, при этом указанные введения разделены интервалом продолжительностью приблизительно 3-5 недель, предпочтительно приблизительно 1 месяц. Предпочтительным соединением FGF-18 является trFGF-18. В предпочтительном варианте осуществления соединение FGF-18 вводят в течение 3 последовательных месяцев на курс лечения (то есть 3 раза за курс лечения, с регулярными интервалами, один раз в месяц или один раз каждые четыре недели). В альтернативе соединение FGF-18 можно вводить 3 раза за курс лечения, с регулярными интервалами продолжительностью 3 недели или 5 недель. Такое лечение может включать 1, 2 или 3 курса лечения ежегодно. Противовоспалительное средство, такое как анакинра или диклофенак, можно вводить одновременно с соединением FGF-18.
В другом аспекте настоящего изобретения предложено соединение FGF-18 для применения в лечении больного с поражением хряща, где соединение FGF-18 вводят по меньшей мере два раза за курс лечения, при этом указанные введения разделены интервалом продолжительностью приблизительно 3-5 недель, предпочтительно приблизительно 1 месяц. Предпочтительным соединением FGF-18 является trFGF-18. В предпочтительном варианте осуществления соединение FGF-18 вводят в течение 3 последовательных месяцев на курс лечения (то есть 3 раза за курс лечения, с регулярными интервалами, один раз в месяц или один раз каждые четыре недели). В альтернативе соединение FGF-18 можно вводить 3 раза за курс лечения, с регулярными интервалами продолжительностью 3 недели или 5 недель. Такое лечение может включать 1, 2 или 3 курса лечения ежегодно. Противовоспалительное средство, воздействующее на симптомы (боль и функцию), такое как анакинра или диклофенак, можно вводить одновременно с соединением FGF-18.
Согласно настоящему изобретению введение соединения FGF-18, отдельно или в комбинации с противовоспалительным средством, таким как анакинра или диклофенак, следует производить с регулярными интервалами, однако допускаются небольшие изменения +/- несколько дней (предпочтительно не больше 3 или 4 дней). Например, в тех случаях, когда введения разделены примерно 4 неделями, если первое введение в курсе производят во вторник, то второе введение может быть сделано во вторник через 4 недели после первого введения (регулярный интервал) или через несколько дней после или за несколько дней до (например, в понедельник до или в четверг после). Аналогично, в тех случаях, когда введения разделены приблизительно 1 месяцем, если первое введение производят, например, 1-ого августа, то второе введение может быть сделано 1-ого сентября (например, в четверг), т.е. через один месяц после первого введения (регулярный интервал) или через несколько дней после или за несколько дней до (например, в понедельник, вторник или в среду до 1-ого сентября, или в пятницу или в понедельник после 1-ого сентября). Такая гибкость позволяет быть схеме применения заметно менее ограничивающей и более удобной для пациента.
Предпочтительно введения выполняют на основе регулярных интервалов, например, каждые 3, 4 или 5 недель или каждый месяц. В конкретном варианте осуществления указанные введения разделены приблизительно 1 месяцем (или приблизительно 4 недель). В одном предпочтительном варианте осуществления они разделены 1 месяцем или 4 неделями (то есть ежемесячная инъекция). Предпочтительно соединение FGF-18 следует вводить с регулярными интервалами один раз в месяц (или один раз каждые четыре недели). В альтернативе соединение FGF-18 можно вводить с регулярными интервалами один раз каждые три недели или один раз каждые 5 недель.
В рамках настоящего изобретения в целом, соединение FGF-18 вводят по меньшей мере два раза за курс лечения. Его можно также вводить, например, по меньшей мере 3 раза или по меньшей мере 4 раза за курс лечения. Предпочтительно его вводят 3 раза или 4 раза за курс лечения.
В предпочтительном варианте осуществления соединение FGF-18, отдельно или в комбинации с противовоспалительным средством (таким как анакинра или диклофенак), следует вводить в течение по меньшей мере 2 последовательных месяцев, по меньшей мере 3 последовательных месяцев или по меньшей мере 4 последовательных месяцев на курс лечения. В другом предпочтительном варианте осуществления соединение FGF-18, отдельно или в комбинации с противовоспалительным средством (таким как анакинра или диклофенак), вводят в течение 2 последовательных месяцев, 3 последовательных месяцев или 4 последовательных месяцев на курс лечения. В еще одном предпочтительном варианте осуществления его вводят в течение 3 последовательных месяцев.
В рамках настоящего изобретения в целом, такое лечение может включать несколько курсов лечения ежегодно, например, 1, 2 или 3 курса лечения ежегодно. В одном предпочтительном варианте осуществления такое лечение включает 2 курса ежегодно. В качестве альтернативы лечение включает 1 курс ежегодно с повтором через 1 год или 2 года после начала первого курса лечения. Например, в случае, если лечение включает 1 курс, указанное лечение может состоять из 3 инъекций с интервалом по 3 недели или может состоять из 3 инъекций с интервалом по 4 недели. В качестве другого примера, в случае, если лечение включает по меньшей мере 2 курса, первый курс лечения, состоящий из 3 инъекций с интервалом по 3 недели между ними, может сопровождаться, через несколько месяцев после последней инъекции в указанном курсе, вторым курсом лечения из 3 инъекций с интервалом по 3 недели между ними; или первый курс лечения, состоящий из 3 инъекций с интервалом по 4 недели между ними, может сопровождаться, через несколько месяцев после последней инъекции в указанном курсе, вторым курсом лечения из 3 инъекций с интервалом по 4 недели между ними.
Соединение FGF-18 согласно изобретению предпочтительно выбрано из группы, состоящей из: a) полипептида, включающего или состоящего из зрелой формы человеческого FGF-18, включающего остатки 28-207 из SEQ ID NO:1, или b) полипептида, включающего или состоящего из FGF-18 (170AA) (SEQ ID NO:2). В частности, это соединение выбрано из человеческого зрелого FGF-18 дикого типа или trFGF-18. Указанное соединение увеличивает отложение хряща и обеспечивает репарацию хряща.
В другом предпочтительном варианте осуществления лечение включает введение соединения FGF-18 в дозе 3-600 микрограммов (мкг или μг), предпочтительно 3-300 мкг или предпочтительно 10-200 мкг, или более предпочтительно 30-150 мкг, или еще более предпочтительно 30-120 мкг на разовое внутрисуставное введение. В предпочтительном варианте осуществления лечение включает введение в дозе приблизительно 3, 10, 20, 30, 40, 50, 60, 90, 100, 120, 150, 180, 200, 240 или 300 мкг на разовое внутрисуставное введение соединения FGF-18. Предпочтительные дозы включают 10, 20, 30, 60, 90, 120, 180, 240 или 300 мкг на разовое внутрисуставное введение соединения FGF-18. Следует понимать, что вводимая доза соединения FGF-18 будет различной, если пациент, проходящий лечение, будет человеком или не относящимся к человеку млекопитающим. Например, для собак доза предпочтительно будет в 5 раз менее значительной, чем для человека. Например, если доза для человека составляет от 30 до 120 мкг на разовое внутрисуставное введение, доза для собаки может изменяться в пределах от 5 до 20 мкг на разовое внутрисуставное введение. Примеры дозы для крыс и кроликов можно найти в разделе примеров.
В рамках настоящего изобретения в целом, соединение FGF-18 может применяться в комбинации с противовоспалительным средством, воздействующим на симптомы (боль и функцию). Предпочтительным противовоспалительным средством является анакинра (см. SEQ ID NO:3) или диклофенак. В случае применения анакинры или диклофенака, лечение включает введение в дозе 0,01-500 миллиграммов (мг), предпочтительно 0,1-250 мг или более предпочтительно 0,5-150 мг на разовое введение, внутрисуставное (предпочтительный путь, например, для анакинры) или пероральное (предпочтительный путь, например, для диклофенака). В предпочтительном варианте осуществления лечение включает введение в дозе приблизительно 0,03, 0,1, 0,25, 0,3, 0,5, 1, 1.5, 2, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или 300 мг на разовое введение противовоспалительного средства. Предпочтительные дозы включают 0,5, 1, 5, 1,5, 10, 50, 100 и 150 мг на разовое введение. Следует понимать, что вводимая доза противовоспалительного средства будет различной, если пациент, проходящий лечение, будет человеком или не относящимся к человеку млекопитающим. Например, для собак доза будет предпочтительно в 6 раз менее значительной, чем для человека. Например, если доза анакинры для человека составляет 150 мг на разовое внутрисуставное введение, доза для собаки может составить 25 мг на разовое внутрисуставное введение. Врач адаптирует схему применения противовоспалительного средства индивидуально для каждого случая, в зависимости от пациента и от вводимого противовоспалительного средства. Например, в случае диклофенака, применяемого перорально, схема применения может включать 50 или 75 мг, два или три раза в день.
Соединения FGF-18 могут быть включены в фармацевтическую композицию, то есть вместе с фармацевтически приемлемым носителем, вспомогательными веществами или подобным. Определение "фармацевтически приемлемый" должно охватывать любой носитель, вспомогательные вещества или подобное, которые не снижают эффективность биологической активности действующего вещества и не являются токсичными для пациента, которому их вводят. Например, в случае парентерального введения, активный белок(ки) может быть включен в стандартную дозированную форму для инъекции в таких растворителях, как раствор хлорида натрия, раствор декстрозы, раствор сывороточного альбумина и раствор Рингера. Составы для внутрисуставного применения соответствуют большинству требований, которые также относятся к другим составам для инъекций, то есть они должны быть стерильными и совместимыми с физиологическими условиями на участке применения (например, коленный сустав, синовиальная жидкость). Вспомогательные вещества, используемые для внутрисуставной инъекции, также могут присутствовать в других составах формах для инъекций, например, для внутримышечного или подкожного применения. Такие составы соединений FGF-18, включающие по меньшей мере один дополнительный фармацевтически приемлемый носитель, вспомогательные вещества или подобное, в настоящем описании также указаны как "композиции FGF-18" или "составы FGF-18". Указанные "композиции FGF-18" или "составы FGF-18" также могут применяться в рамках настоящего изобретения.
Если противовоспалительное средство, такое как анакинра или диклофенак, применяется вместе с соединением FGF-18, оно может быть добавлено в состав соединения FGF-18 перед введением или введено совместно либо при использовании 2 разных шприцев/игл, либо при использовании 2 разных шприцев, но предпочтительно одной иглы, чтобы повысить удобство для пациента. В альтернативе противовоспалительное средство может быть введено перорально или любым другим путем введения.
Соединения FGF-18, такие как trFGF-18, и композиции, содержащие соединения FGF-18 ("композиции FGF-18"), могут применяться для лечения поражений хряща. В особенности они могут применяться для лечения дефектов суставных хрящей в синовиальных сочленениях, которые, например, вызваны поверхностной фибрилляцией (ранний остеоартрит), дегенерации хряща, вызванной остеоартритом, и хрящевых или костно-хрящевых дефектов, вызванных повреждением или болезнью. Соединения FGF-18 и композиции могут также применяться для лечения заболевания суставов, вызванных рассекающим остеохондритом и дегенеративными заболеваниями суставов. В области реконструктивной и пластической хирургии соединения FGF-18 и композиции могут применяться для выращивания и пересадки аутогенной или аллогенной хрящевой ткани для реконструкции обширных дефектов ткани. Композиции FGF-18 могут применяться для восстановления повреждений хряща в сочетании с лаважем сустава, стимуляцией костного мозга, абразивной артропластикой, субхондральным сверлением или микрофрактурированием субхондральной кости. Необязательное совместное применение с противовоспалительным средством, воздействующим на симптомы (боль и функцию), таким как анакинра или диклофенак, могло бы уменьшить боль, связанную с поражением хряща, которое подлежит лечению.
В предпочтительном варианте осуществления поражение хряща, которое подлежит лечению согласно изобретению, является остеоартритом, таким как остеоартрит коленного сустава или остеоартрит тазобедренного сустава. Остеоартрит, который подлежит лечению, может быть, например, и без ограничения, первичным остеоартритом или вторичным остеоартритом, а также остеоартритом, который классифицирован от стадии 1 до стадии 4 или от степени 1 до степени 6 согласно системе классификации OARSI.
В другом предпочтительном варианте осуществления поражение хряща, которое подлежит лечению согласно изобретению, является повреждением хряща с и без хирургических вмешательств, таких как микрофрактурирование. Дополнительно, после роста хряща в результате введения композиции FGF-18 (применяемой отдельно или в сочетании с противовоспалительным средством, таким как анакинра или диклофенак), хирургическое лечение может быть необходимым для надлежащей коррекции контура заново сформированной поверхности хряща.
В предпочтительном варианте осуществления лечение включает внутрисуставное введение соединения FGF-18 или композиции FGF-18, отдельно или в сочетании с противовоспалительным средством, воздействующим на симптомы (боль и функцию), таким как анакинра или диклофенак. Соединения FGF-18 или композиции FGF-18 могут быть введены, отдельно или в сочетании с противовоспалительным средством, таким как анакинра или диклофенак, путем прямой инъекции в синовиальную жидкость сустава или непосредственно в дефект, отдельно или в комплексе с подходящим носителем для замедленного высвобождения белка (например, лекарственные формы замедленного высвобождения) или ограниченного местного высвобождения. Предпочтительно способ введения соединения FGF-18, отдельно или в сочетании с противовоспалительным средством, таким как анакинра или диклофенак, описанный в настоящей заявке, выбран из группы, состоящей из: перисиновиального введения, интрасиновиального введения, околосуставного введения и внутрисуставного введения. В предпочтительном варианте осуществления соединение FGF-18, описанное в настоящей заявке, вводят, отдельно или в сочетании с противовоспалительным средством, таким как анакинра или диклофенак, предпочтительно внутрисуставно (введение в сустав). Противовоспалительное средство вводят предпочтительно внутрисуставно (предпочтительный путь для анакинры) или перорально (предпочтительный путь для диклофенака). Внутрисуставное введение производят в сустав, выбранный из сустава бедра, колена, локтя, запястья, лодыжки, позвоночника, стопы, пальца руки, пальца ноги, руки, плеча, ребер, лопаток, бедер, голеней, пяток и вдоль костных точек позвоночника. В еще одном предпочтительном варианте осуществления внутрисуставное введение осуществляют в тазобедренный или коленный сустав.
Описание фигур:
Фигура 1: Схема курса лечения. Фигура 1a: схема применения с введением один раз в неделю; Фигура 1b: схема применения с введением один раз в месяц (или каждые 4 недели); Фигура 1c: схема применения с введением один раз в месяц (или каждые 4 недели) +/- отклонения в несколько дней, допускаемые для удобства пациента.
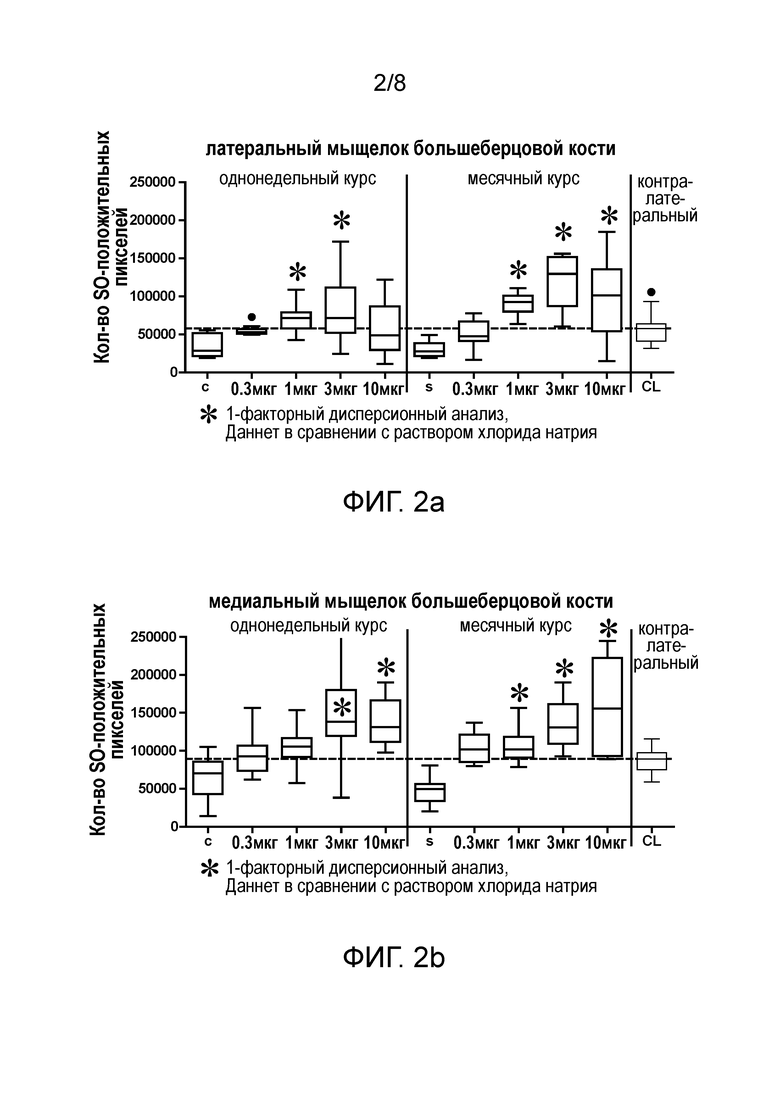
Фигура 2: Соединения FGF-18 вызывают дозозависимое отложение суставного матрикса в модели ОА на крысах, иллюстрируемое с помощью количественного определения при окрашивании сафранином O
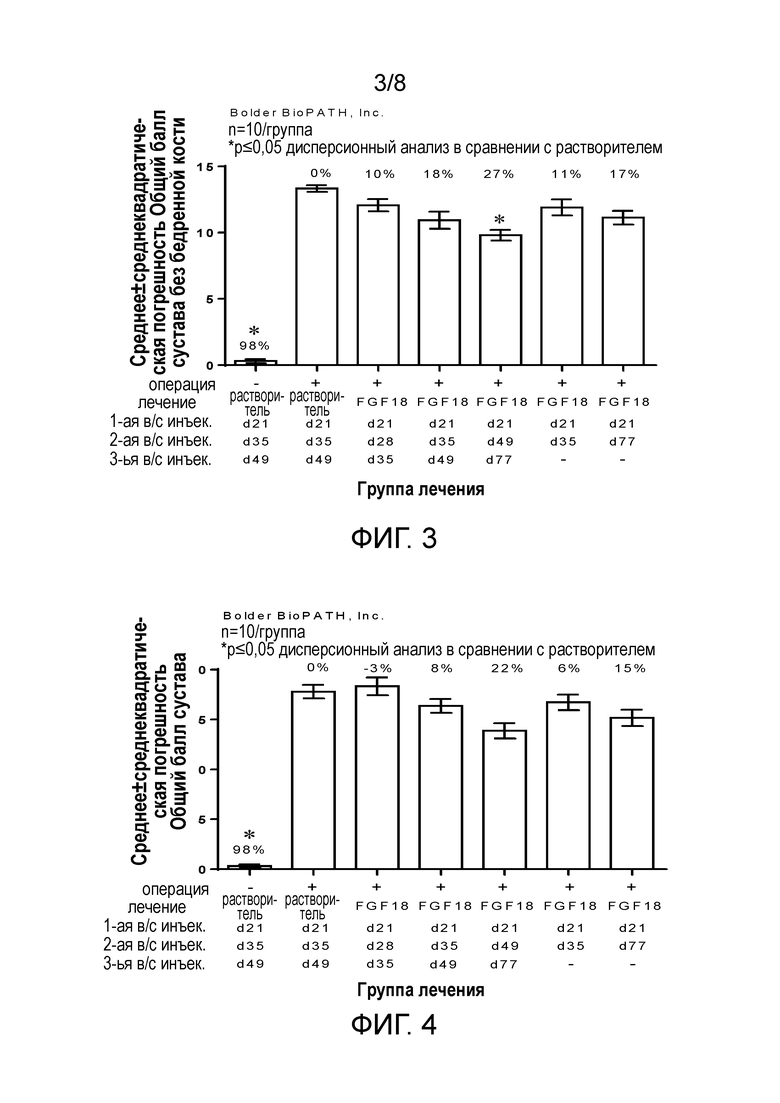
Фигура 3: Общая оценка сустава без бедренной кости
Фигура 4: Общая оценка сустава
Фигура 5: Ширина существенной дегенерации хряща большеберцовой кости
Фигура 6: Концентрация клеток после 8 дней культивирования хондроцитов свиньи, стимулируемых или не стимулируемых IL1α, стимулируемых или не стимулируемых IL1, дни культивирования (A) или после задержки на 6 часов (B), с 100 нг/мл rhFGF18 и/или 100 нг/мл Анакинры. N=4 для (A) и N=6 для (B).
Фигура 7: Уровни α2MG в сыворотке в зависимости от времени
Фигура 8: AUC (площадь под кривой) различия диаметра сустава в целевом колене (сустав с ОА) и контралатерального сустава (здоровое колено) в зависимости от времени
Фигура 9: Объем хряща (в мм3) на медиальном мыщелке большеберцовой кости
Описание последовательностей:
SEQ ID NO.1: Аминокислотная последовательность нативного человеческого FGF-18.
SEQ ID NO.2: Аминокислотная последовательность рекомбинантного усеченного FGF-18 (trFGF-18).
SEQ ID NO.3: Аминокислотная последовательность рекомбинантного антагониста рецептора IL-1 человека (анакинра).
Примеры
Материалы
Рекомбинантный усеченный FGF-18 (trFGF-18) в настоящих примерах был получен путем экспрессии в E.coli согласно методике, описанной в заявке WO2006/063362. В следующих примерах trFGF-18 и FGF-18 используются попеременно.
Рекомбинантный антагонист рецептора интерлейкина-1 человека (анакинра) был получен от Pharmacia.
Оценка суставов
После умерщвления правое колено удаляли и декальцинировали в 5% муравьиной кислоте в течение 4-6 дней перед разрезом пополам по фронтальной плоскости и заливкой в парафин. Три среза нарезали с шагом 200 мкм, окрашивали толуидиновым синим и исследовали с использованием программы ImagePro Plus™ (Media Cybernetics). При оценке трех срезов сустава наихудший вариант для этих двух половин на каждом стекле был определен для поражения хряща как ширина дегенерации хряща (мкм). Это отражает площади поражения хряща большеберцовой кости, при котором потеря хондроцитов и протеогликана превышает≥50% толщины хряща. Измерения производили по площади наиболее тяжелого поражения в каждой из этих трех зон через верхнюю поверхность большеберцовой кости.
Определяли среднее в группе лечения±среднеквадратическая погрешность для каждой оценки и измерения.
Данные анализировали с использованием однофакторного дисперсионного анализа (ANOVA) или (непараметрического) критерия Краскела-Уоллиса, наряду с апостериорным критерием множественного сравнения. Измерения правого колена штангенциркулем сравнивали с измерениями левого колена при использовании t-критерия Стьюдента. Если не указано, Bolder BioPATH, Inc. выполняли статистический анализ только необработанных (непреобразованных) данных. Статистические критерии дают определенные допущения относительно нормальности данных и однородности дисперсии, при этом дополнительный анализ может потребоваться, если проверка закончилась нарушениями этих допущений. Значимость для всех критериев была установлена на уровне p≤0,05. Сравнения проводили между каждой группой и контрольной группой, получавшей растворитель, а также между парами.
Пример 1
Метод : Модель неустойчивости, вызванной ОА, с рассечением передней крестообразной связки и резекцией медиального мениска (ACLT+tMx), получали на самцах крыс линии Льюис возрастом 10-15 недель. Кратко, под наркозом изофлураном обнажали суставную капсулу правого колена каждой крысы, переднюю крестообразную и фиксирующую мениск связки рассекали, мениск удаляли, а капсулу, мышцы и кожу закрывали швами. Животных рандомизированно распределяли в 10 групп, по n=10 в каждой. Исследовали следующие дозировки: 0, 0,3, 1, 3 и 10 мкг на внутрисуставную инъекцию. Группы 1-5 получали один курс из трех разовых инъекций с недельными интервалами, группа 6-10 - три разовых инъекции с месячными интервалами. Внутрисуставную терапию начинали через три недели после операции. В это время уже проявлялись патофизиологические изменения, например, потеря хрящевого матрикса. Животных усыпляли через 17 недель после операции и исследовали суставы.
Результаты : trFGF-18 вызывал дозозависимое образование новой хрящевой ткани, которое было значимым на латеральном мыщелке большеберцовой кости, при 1 мкг/сустав, независимо от схемы инъекции (см. Фигуру 2a). trFGF-18 вызвал дозозависимое образование новой хрящевой ткани, которое было значимым на медиальном мыщелке большеберцовой кости, при 1 мкг/сустав согласно схеме введения один раз в неделю и при 0,3 мкг/сустав согласно схеме введения один раз в месяц (см. Фигуру 2b).
Пример 2
Метод : Самцов крыс линии Льюис подвергали хирургической операции (под наркозом изофлураном) с целью произвести разрыв медиального мениска в правом коленном суставе. Животным в/с вводили растворитель или FGF-18 по одной из двух различных схем (см. таблицу ниже), затем умерщвляли в день 105. Колени измеряли штангенциркулем в начале эксперимента и в дни 21, 42, 56, 84 и 105. В сыворотке исследовали уровни α2макроглобулина в начале эксперимента и в дни 21 и 105, а также через одну неделю после введения последней дозы (день 42 или 84). Правые колени собирали для исследования гистопатологии.
Таблица 1: группы лечения
Результаты и выводы :
У всех животных возобновляли нагрузку на ноги сразу после операции, после пробуждения от наркоза. Все животные набрали массу в ходе исследования, при этом не было никаких значимых различий в изменении массы тела между группами.
Диаметры колена, измеренные с помощью штангенциркуля, и уровни a2MG в сыворотке увеличились после инъекций FGF-18, но при этом явного преимущества одной определенной схемы лечения по сравнению с другой в данном исследовании при использовании указанных параметров продемонстрировано не было. В то же время, структурный эффект был наиболее высоким в случае схемы с ежемесячными инъекциями (Фигуры 3, 4, 5).
В целом результаты данного исследования указывают, что лечение с применением FGF-18, независимо от схемы, значительно увеличивало опухание в обработанном колене после первой инъекции. Исследование гистопатологии показало, что лечение обычно увеличивало степень повреждения по поверхности сустава большеберцовой кости, в особенности с точки зрения повреждения коллагена, уменьшая при этом его тяжесть. Этот эффект был наиболее заметным в группах лечения, которые получали три дозы, а не две, и в группах, которые получали последнюю дозу в последней точке времени (день 77). Наблюдали несколько других побочных эффектов лечения, включая гипертрофию хряща, синовит и синовиальный фиброз. Эти изменения были самыми заметными и тяжелыми у животных, которые получали три дозы в быстрой последовательности (Группы 3 и 4), тогда как у животных, которые получали только две дозы (Группы 6 и 7) или получали дозы в течение более длительного периода (Группа 5), изменения были несколько менее тяжелыми.
Схема лечения, которая привела к лучшей общей морфологии, включала три инъекции, раз в месяц (Группа 5; инъекции в дни 21, 49 и 77), что указывает на то, что некоторое время на восстановление между введением доз было полезным.
Пример 3
Методы :
Для этого исследования использовали 60 взрослых, ранее не использованных в экспериментах, самцов Новозеландского Белого кролика. Животные имели возраст приблизительно 3-4 месяца. Кроликов подвергали операции для создания дефекта хряща правого колена. В суставном хряще трохлеарной выемки сделали дефект на всю толщину хряща, размером 2 мм на 6 мм. Микрофрактурирование выполняли при использовании игл 18 калибра, два микроперелома на глубину 3 мм были сделаны через субхондральную кость в основании дефекта, один проксимально и один дистально. Каждое отверстие микроперелома имело диаметр приблизительно 1,5 мм, при этом отверстия располагались на расстоянии 2 мм друг от друга.
Эксперимент состоял из следующих шести групп лечения, включавших по 10 животных, в общей сложности 60 кроликов (Таблица 2). Кролики в Группах 3, 4, 5 и 6 получали внутрисуставно rhFGF18 по схеме, включавшей либо один курс из трех еженедельных инъекций 100 мкг rhFGF18 (Группа 3 и 5), либо один курс из трех ежемесячных инъекций 100 мкг rhFGF18 (Группа 4 и 6). Всех животных усыпляли и вскрывали через 6 месяцев после операции.
Таблица 2: группы лечения
(n=10)
и схема
лечения
(1 раз/неделя в течение 3
недель
месяцев)
(1 раз/неделя в течение 3
недель
месяцев)
Результаты :
Результаты вскрытия : Общая сумма баллов хряща по шкале ICRS составила 1,9+/-0,3 SE для Группы 5 животных и 2,4+/-0,2 SE для Группы 6 животных, что указывает на то, что схема с ежемесячными инъекциями превосходила схему с еженедельными инъекциями. В Группе 6 животных межмыщелковая выемка у 3/10 животных была заполнена мелкозернистой или зернистой хрящевой тканью, у оставшихся 7/10 животных межмыщелковая выемка была заполнена на 50% или почти полностью зернистой или крупнозернистой хрящевой тканью. В итоге, инъекция rhFGF18, отдельно или в комбинации с микрофрактурированием, раз в неделю или раз в месяц, приводила к утолщению или увеличению области мыщелка бедренной кости и пролиферации грубого или крупнозернистого хряща при повреждении межмыщелковой выемки, и к стимуляции остеофитов на медиальном и латеральном трохлеарных гребнях, случайному формирование остеофитов на плато большеберцовой кости или аномальному росту хряща на надколеннике или рядом с надколенником в синовиальной жировой подушке.
Морфологическая патология без микрофрактурирования : Пораженные срезы правой бедренной кости животных, которые раз в месяц, в течение трех месяцев, получали rhFGF18, имели существенно увеличенный процент заполнения дефектов (48%), что привело к значительному 49% увеличению балла заполнения дефектов. Другие оценки незначительно увеличились на 20-23%. Общая ширина поражения выемки незначительно увеличилась на 36%, тогда как ширина поражения без жизнеспособного хряща значительно уменьшилась на 94%. Все срезы включали дегенерацию, которая варьировала от минимальной до тяжелой, в целом была очаговой и обычно наблюдалась в сочетании с волокнистым хрящом. Центральная толщина MFC значительно увеличилась на 120%.
Морфологическая патология с микрофрактурированием : На срезах области пораженного хряща не получавших лечения контрольных групп с микрофрактурированием наблюдалось общее умеренное восстановление костно-хрящевого сочленения, умеренно сниженное окрашивание матрикса и 50% заполнение дефектов. Морфология клеток главным образом соответствовала волокнистому хрящу.
На срезах пораженной области животных, которые раз в неделю, в течение трех недель, получали rhFGF18, присутствовали значительные увеличения на 44-69% (к нормальным значениям) всех оцениваемых параметров, а также процента заполнения дефектов. Суммированные баллы значительно увеличились на 53%. Общая ширина поражения выемки немного выросла на 5%, тогда как ширина поражения без жизнеспособного хряща уменьшилась (незначительно) на 59%. На всех срезах наблюдали гипертрофию хряща. Центральная толщина MFC на этих срезах значительно увеличилась на 112%.
На срезах пораженной области животных, которые раз в месяц, в течение трех месяцев, получали rhFGF18, присутствовали значительные увеличения на 61-97% (к нормальным значениям) всех оцениваемых параметров, а также процента заполнения дефектов. Суммированные баллы значительно увеличились на 76%. Общая ширина поражения выемки и ширина поражения без жизнеспособного хряща незначительно уменьшились на 19% и 69%, соответственно. На всех срезах наблюдали гипертрофию хряща. Центральная толщина MFC на этих срезах значительно увеличилась на 106%.
Выводы :
Патологические клинические симптомы были умеренными и соответствовали симптомам, обычно наблюдаемым у кроликов после операции на коленном суставе и/или в результате многократного забора проб, например, забора крови из латеральных ушных вен или забора синовиальной жидкости из коленного сустава. Сравнение восстановления межмыщелковой выемки у животных в Группе 1 и Группе 2 показало хорошее спонтанное заполнение выемки чем-то, сильно напоминающим хрящ. Имеется предположение, что микрофрактурирование может усиливать рост нового хряща в выемке, так как у 9/10 животных в Группе 2 выемка была заполнена хрящом по сравнению с 7/10 животными в Группе 1, но это различие является небольшим.
Аналогично, отсутствовало различие между баллами ICRS или остеофитов между этими двумя группами, таким образом, качество восстановления хряща было хорошим, при этом в каждой группе наблюдалась небольшая стимуляция образования восстановления. Что касается остальных групп, получавших rhFGF18, то создалось впечатление, что Группа 4 (межмыщелковая выемка и три ежемесячных внутрисуставных инъекции по 100 мкг rhFGF18) показала лучшую реакцию с 6/9 животными, у которых межмыщелковая выемка была заполнена хрящом, который казался от почти нормального до немного шероховатого или зернистого в общей картине. Кроме того, Группа 4 имела следующий после самого низкого балл ICRS хряща (2,1+/-0,3) из этих четырех групп, получавших rhFGF18, причем в этой группе был самый низкий балл остеофитов (3,8+/-0,8) из всех групп rhFGF18. Напротив, в Группе 6 (межмыщелковая выемка с микрофрактурированием и тремя ежемесячными внутрисуставными инъекциями 100 мкг rhFGF18) межмыщелковая выемка была заполнена только у 3/10 животных, балл ICRS был самым высоким из всех групп (2,4+/-0,2), и балл остеофитов был вторым после самого высокого (5,1+/-0,7) из всех групп, получавших rhFGF18. Аналогично, в Группе 5 (межмыщелковая выемка с микрофрактурированием и тремя еженедельными внутрисуставными инъекциями 100 мкг rhFGF18) был самый высокий балл остеофитов из всех групп (5,7+/-0,7).
Положительное воздействие было более сильным в том случае, когда лечение проводили в течение длительного периода времени (3 месяца или 3 недели), при этом воздействие было более заметным у кроликов с микрофрактурированием, чем у кроликов без микрофрактурирования.
Пример 4
Метод :
Свиные хондроциты выделяли из хряща головки бедренной кости из бедра свиньи (возраст свиньи составлял приблизительно один год). После диссекции суставов хрящ собирали и 45 минут обрабатывали 0,25% коллагеназой (1/10 разведение коллагеназы NBG4 2,5% в среде Хэма F12) при комнатной температуре. Отделившиеся клетки удаляли и хрящ далее оставляли на ночь с 0,1% коллагеназой (1/25 разведение коллагеназы NBG4 2,5% в среде Хэма F12) при 37°C для выделения хондроцитов. Для этого исследования хондроциты культивировали в монослое.
Первичные суставные хондроциты свиньи стимулировали 10 нг/мл IL1α или не стимулировали и обрабатывали сразу или через 6 часов 100 нг/мл анакинры и/или trFGF-18 100 нг/мл. Каждое условие выполняли в 4 или 6 повторениях. В качестве контроля клетки также культивировали отдельно с анакинрой, отдельно с trFGF-18 или без какой-либо обработки (среда).
Предварительное культивирование: После выделения клеток свиные хондроциты сеяли при плотности 20000 клеток/см2 и выращивали в течение одной недели в полной среде Хэма F12. Затем клетки собирали с использованием аккутазы, подсчитывали и использовали, как описано ниже.
Для клеток, которые обрабатывали непосредственно Анакинрой: Хондроциты высевали в 24-луночный планшет при плотности 15000 клеток/лунка в 0,5 мл полной среды Хэма F12. Затем к клеткам добавляли 0,25 мл trFGF-18 (400 нг/мл) и/или 0,25 мл Анакинры (400 нг/мл). В стимулируемых образцах, 10 мкл IL1α в концентрации 1000 нг/мл также добавляли к клеткам. trFGF-18, Анакинра и IL1α разводили в полной среде Хэма F12. Конечный объем в культуральном планшете доводили до 1 мл полной средой Хэма F12. Конечные концентрации составляли 10 нг/мл IL1α, 100 нг/мл trFGF-18 и 100 нг/мл Анакинры, при этом общее время культивирования составляло восемь дней. Через четыре дня производили замену полной среды. N=4.
Для клеток, которые обрабатывали Анакинрой и trFGF-18 через 6 часов после стимуляции IL1α: Хондроциты сеяли в 24-луночный планшет при плотности 15000 клеток/лунка в 1 мл полной среды Хэма F12, содержащей 10 нг/мл IL1α или не содержащей IL1α. Через 6 часов среду удаляли и меняли на 0,25 мл trFGF-18 (400 нг/мл) и/или 0,25 мл Анакинры (400 нг/мл). В стимулируемых образцах к клеткам также добавляли 0,25 мл IL1α при концентрации 40 нг/мл. trFGF-18, Анакинра и IL1α были разведены в полной среде Хэма F12. Конечный объем в культуральном планшете доводили до 1 мл полной средой Хэма F12. Конечные концентрации составляли 10 нг/мл IL1α, 100 нг/мл trFGF-18 и 100 нг/мл Анакинры, при этом общее время культивирования составляло восемь дней. Через четыре дня производили замену полной среды. N=6.
После восьми дней культивирования клетки собирали с использованием аккутазы и полученные суспензии клеток подвергали анализу на концентрацию и жизнеспособность клеток с помощью анализатора клеток ViCell™ (производства Beckman Coulter). Статистический анализ заключался в 1-факторном дисперсионном анализе, сопровождаемом апостериорным анализом Даннета.
Результаты и выводы :
Как ожидали, было обнаружено, что rhFGF18 увеличивал пролиферацию свиных хондроцитов в отсутствии IL1α. В обоих экспериментах по сравнению с контролем (среда, без IL1α) наблюдали 11,25- и 7,75-кратное увеличение количества клеток в присутствии 100 нг/мл rhFGF18 через 8 дней культивирования (Фигура 6). Однако в присутствии 10 нг/мл IL1α стимуляция пролиферации rhFGF18 составила лишь 2,38 и 2,44 раз, соответственно, по сравнению с контролем (среда, IL1α, 10 нг/мл) для обоих экспериментов. Как было показано, Анакинра в концентрации 100 нг/мл, как при прямой, так и при отсроченной терапии, полностью восстанавливала активность rhFGF18. Плотность клеток, культивируемых с rhFGF18 и без IL1α или стимулируемых IL1α, но обработанных Анакинра, не была статистически различной. Наконец, Анакинра в отдельности не оказывала никакого воздействия на пролиферацию хондроцитов.
В данном исследовании было показано, что Анакинра 100 нг/мл полностью блокировала ингибирующее действие IL1α в отношении пролиферативной активности rhFGF18. Это соответствует тому факту, что Анакинра является антагонистом рецептора IL1, блокируя передачу воспалительных сигналов, вызванную IL1. Было продемонстрировано, что анакинра восстанавливает пролиферативное действие rhFGF18 в хондроцитах свиньи, стимулированных IL1α.
Пример 5
Метод :
Самцов крыс линии Льюис подвергали операции с целью вызвать разрыв медиального мениска в правом коленном суставе. Животным в/с вводили FGF-18 (10 мкг/сустав) в дни 21, 28 и 35 и перорально вводили диклофенак (1 мг/кг или 3 мг/кг) или растворитель в дни 21-23, 28-30 и 35-37, затем умерщвляли в день 42 или день 63. Сыворотку собирали и исследовали на уровни альфа-2-макроглобулина (α2MG) в дни-3, 21, 42 и 63. α2MG является воспалительным биомаркером сыворотки. Связь между α2MG и воспалением уже была показана (Kuribayashi et al., 2013).
Результаты
Контрольные животные, получавшие FGF-18+растворитель, имели небольшую или умеренную припухлость в день 24, которая увеличивалась до тяжелой в день 36, хотя хромоты не наблюдали. Припухлость колена немного уменьшилась до заметной тяжести, начиная со дня 44. Измерения штангенциркулем подтверждали эти наблюдения, со значительными различиями между правым и левым коленями в день 21 и последующие точки времени, но не в начале исследования. Животные, получавшие 3 мг/кг диклофенака, показали значительное снижение баллов опухания в дни 24-29, 31 и 36-43, по сравнению с контрольными животными, получавшими растворитель. Измерения колена штангенциркулем значимо уменьшились в день 42, но не были значимо затронуты в другие точки времени. Животные, получавшие 1 мг/кг диклофенака, показали значительное снижение баллов опухания в дни 24-29, 31 и 36-43, по сравнению с контрольными животными, получавшими растворитель. Измерения колена штангенциркулем значимо уменьшились в день 42, но не были значимо затронуты в другие точки времени (данные не показаны).
Уровни α2MG были более высокими в день-3 (до операции), чем в день 21 после операции. Уровни у животных, получавших 3 мг/кг диклофенака, немного, но значимо, снизились по сравнению с уровнями контрольных животных, получавших растворитель, в точке времени до операции. Уровни в день 21, до лечения, были по существу одинаковыми во всех группах. В день 42 у больных контрольных животных заметно повысились уровни α2MG (приблизительно в четыре раза по сравнению с уровнями в день 21), что являлось значимым отличием от двух групп, получавших диклофенак. В день 63 уровни во всех группах снова были сопоставимыми (Фигура 7).
Выводы :
В целом, результаты данного исследования указывают, что введение 1 или 3 мг/кг диклофенака крысам с разрывом медиального мениска, которым также вводили FGF-18, значительно уменьшало опухание коленного сустава согласно клиническим наблюдениям и измерениям штангенциркулем. Эти эффекты были заметными в течение приблизительно одной недели после введения последней дозы диклофенака. Уровни α2MG в сыворотке наблюдали у контрольных животных, получавших растворитель, в дни 3, 21 и 63, однако резкое снижение отмечали в день 42 в результате сильного скачка в контрольных уровнях.
Пример 6
Метод :
Цель данного исследования состояла в оценке влияния разной частоты введения доз в течение курса одной и той же полной дозировки (3×1 мкг) сприфермина на объем хряща в модели ОА на крысах. Рассечение передней крестообразной связки (ACLT) с резекцией медиального мениска (tMx) было выполнено, как описано в примере 1. В данном исследовании использовали суставы самцов капюшонных крыс линии Листер (200-260 г, Charles River). Животных усыпляли через 18 недель после операции.
Изменения в суставе связывали с клиническими исследованиями при ОА (потеря хряща, остеофиты, субхондральный склероз). Один мкг сприфермина в растворе хлорида натрия вводили три раза еженедельно, либо через 2, через 3, через 4 или через 5 недель и сравнивали с подходящими группами, получавшими растворитель. Масса тела, диаметры суставов и клинические оценки состояния здоровья исследовали еженедельно.
Результаты
Результаты показали, что внутрисуставные инъекции не оказали никакого влияния на увеличение массы: Никакого значимого влияния лекарственного средства или схемы применения на прижизненные показатели не наблюдали. Однако группы, которым каждую вторую неделю вводили раствор хлорида натрия (n=4), показали в тенденции наибольшее прибавление массы (данные не показаны).
В случае инъекций на неделе 3, 4 и 5, диаметры суставов были значительно больше, чем после инъекций на неделе 3, 8 и 13 (см. Фигуру 8). Никакие значимые различия между инъекциями в каждую 2-ую, 3-ью или 4-ую неделю не были отмечены. При введении только каждую пятую неделю, AUC диаметров суставов была такой же, как в случае инъекций раствора хлорида натрия. Так, в тенденции AUC диаметра суставов уменьшалась при более низкой частоте инъекций.
Количественный гистологический анализ методом стереологии выявил тяжелые ОА-подобные изменения в пораженных суставах. rhFGF18 предотвращал более или менее полное обнажение хряща. Один мкг/сустав и инъекция один раз в каждую 3-ью неделю (в общей сложности три инъекции) приводили к фармакологически значимому и статистически значимому различию по сравнению с раствором хлорида натрия (конечный показатель: объем хряща на медиальном мыщелке большеберцовой кости, см. Фигуру 9).
Выводы :
Более низкая частота инъекций, чем один раз в неделю в течение трех недель, по-видимому, обеспечивает лучшее восстановление после опухания сустава после инъекции. Все группы, получавшие rhFGF18, показали структурное улучшение, иллюстрируемое более высокими значениями объема хряща по сравнению с плацебо. Однако при таких обстоятельствах фиксированного по времени исследования (одна и та же продолжительность исследования для всех животных) и фиксированной дозы, частота инъекций один раз каждую 3-ью неделю приводила к наиболее благоприятному структурному результату. В этом отношении можно предположить, что более длительные перерывы между инъекциями rhFGF18 более благоприятны вследствие лучшей трансформации пролиферации хондроцитов в продукцию внеклеточного матрикса по сравнению со схемой введения один раз в неделю в течение трех недель.
Полученная в результате колоколообразная кривая является стандартным наблюдением для результатов по эффективности факторов роста.
Список использованных источников
1. Ellsworth et al., 2002, Osteoarthritis and Cartilage, 10: 308-320.
2. Shimoaka et al., 2002, JBC 277(9):7493-7500.
3. WO2008023063
4. WO2004032849
5. WO9816644
6. WO2006063362
7. Custers et al., 2007, Osteoarthritis and Cartilage, 15:1241-1248
8. Lotz, 2010, Arthritis research therapy, 12:211.
9. Moore et al., 2005, Osteoarthritis and Cartilage, 13:623-631.
10. Arnaud-Dabernat et al., 2008, Journal of Cellular Physiology, 216:261-268.
11. The Merck manual, 17th edition, 1999
12. Getgood et al., 2010, P116, ICRS Meeting 2010, Barcelona.
13. ICRS publication: http://www.cartilage.org/ files/contentmanagement/ICRS_evaluation.pdf, page 13
14. Bingham, 2002, J. Rheumatol. 29: 3-9.
15. Lee et al., 2013, Gene, 527:440-447.
16. Bresnihan, 2002, Ann. Rheum. 61:ii74-ii77.
17. St. Clair, 2002, J. Rheumatol. 29:22-26.
18. Mertens et al., 2009,, J. Rheumatol., 36(6):1118-1125.
19. Chevalier et al., 2009, Arthritis & Rheumatism, 61(3):344-352.
20. Kuribayashi et al., 2013, Inflammation, 36(6): 1448-52.
SEQUENCE LISTING
<110> Merck Patent GmbH
<120> FGF-18 compound dosing regimen
<130> P 14/014
<150> EP14000600.8
<151> 20.02.2014
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 207
<212> Áåëîê
<213> Homo sapiens
<220>
<223> ÷åëîâå÷åñêèé FGF-18
<400> 1
Met Tyr Ser Ala Pro Ser Ala Cys Thr Cys Leu Cys Leu His Phe Leu
1. 5 10 15
Leu Leu Cys Phe Gln Val Gln Val Leu Val Ala Glu Glu Asn Val Asp
20 25 30
Phe Arg Ile His Val Glu Asn Gln Thr Arg Ala Arg Asp Asp Val Ser
35 40 45
Arg Lys Gln Leu Arg Leu Tyr Gln Leu Tyr Ser Arg Thr Ser Gly Lys
50 55 60
His Ile Gln Val Leu Gly Arg Arg Ile Ser Ala Arg Gly Glu Asp Gly
65 70 75 80
Asp Lys Tyr Ala Gln Leu Leu Val Glu Thr Asp Thr Phe Gly Ser Gln
85 90 95
Val Arg Ile Lys Gly Lys Glu Thr Glu Phe Tyr Leu Cys Met Asn Arg
100 105 110
Lys Gly Lys Leu Val Gly Lys Pro Asp Gly Thr Ser Lys Glu Cys Val
115 120 125
Phe Ile Glu Lys Val Leu Glu Asn Asn Tyr Thr Ala Leu Met Ser Ala
130 135 140
Lys Tyr Ser Gly Trp Tyr Val Gly Phe Thr Lys Lys Gly Arg Pro Arg
145 150 155 160
Lys Gly Pro Lys Thr Arg Glu Asn Gln Gln Asp Val His Phe Met Lys
165 170 175
Arg Tyr Pro Lys Gly Gln Pro Glu Leu Gln Lys Pro Phe Lys Tyr Thr
180 185 190
Thr Val Thr Lys Arg Ser Arg Arg Ile Arg Pro Thr His Pro Ala
195 200 205
<210> 2
<211> 170
<212> Áåëîê
<213> Èñêóññòâåííûé
<220>
<223> Ðåêîìáèíàíòíûé óñå÷åííûé FGF-18(trFGF-18)
<400> 2
Met Glu Glu Asn Val Asp Phe Arg Ile His Val Glu Asn Gln Thr Arg
1. 5 10 15
Ala Arg Asp Asp Val Ser Arg Lys Gln Leu Arg Leu Tyr Gln Leu Tyr
20 25 30
Ser Arg Thr Ser Gly Lys His Ile Gln Val Leu Gly Arg Arg Ile Ser
35 40 45
Ala Arg Gly Glu Asp Gly Asp Lys Tyr Ala Gln Leu Leu Val Glu Thr
50 55 60
Asp Thr Phe Gly Ser Gln Val Arg Ile Lys Gly Lys Glu Thr Glu Phe
65 70 75 80
Tyr Leu Cys Met Asn Arg Lys Gly Lys Leu Val Gly Lys Pro Asp Gly
85 90 95
Thr Ser Lys Glu Cys Val Phe Ile Glu Lys Val Leu Glu Asn Asn Tyr
100 105 110
Thr Ala Leu Met Ser Ala Lys Tyr Ser Gly Trp Tyr Val Gly Phe Thr
115 120 125
Lys Lys Gly Arg Pro Arg Lys Gly Pro Lys Thr Arg Glu Asn Gln Gln
130 135 140
Asp Val His Phe Met Lys Arg Tyr Pro Lys Gly Gln Pro Glu Leu Gln
145 150 155 160
Lys Pro Phe Lys Tyr Thr Thr Val Thr Lys
165 170
<210> 3
<211> 153
<212> Áåëîê
<213> Èñêóññòâåííûé
<220>
<223> Ðåêîìáèíàíòíûé àíòàãîíèñò ÷åëîâå÷åñêîãî ðåöåïòîðà èíòåðëåéêèíà-1 (àíàêèíðà)
<400> 3
Met Arg Pro Ser Gly Arg Lys Ser Ser Lys Met Gln Ala Phe Arg Ile
1. 5 10 15
Trp Asp Val Asn Gln Lys Thr Phe Tyr Leu Arg Asn Asn Gln Leu Val
20 25 30
Ala Gly Tyr Leu Gln Gly Pro Asn Val Asn Leu Glu Glu Lys Ile Asp
35 40 45
Val Val Pro Ile Glu Pro His Ala Leu Phe Leu Gly Ile His Gly Gly
50 55 60
Lys Met Cys Leu Ser Cys Val Lys Ser Gly Asp Glu Thr Arg Leu Gln
65 70 75 80
Leu Glu Ala Val Asn Ile Thr Asp Leu Ser Glu Asn Arg Lys Gln Asp
85 90 95
Lys Arg Phe Ala Phe Ile Arg Ser Asp Ser Gly Pro Thr Thr Ser Phe
100 105 110
Glu Ser Ala Ala Cys Pro Gly Trp Phe Leu Cys Thr Ala Met Glu Ala
115 120 125
Asp Gln Pro Val Ser Leu Thr Asn Met Pro Asp Glu Gly Val Met Val
130 135 140
Thr Lys Phe Tyr Phe Gln Glu Asp Glu
145 150





Изобретение относится к медицине, а именно к ортопедии и может быть использовано при лечении поражения хряща. Применение по изобретению включает введение соединения FGF-18 в течение по меньшей мере одного курса лечения, причем каждый курс лечения включает по меньшей мере 3 введения, указанные введения разделены по меньшей мере 3, 4 или 5 неделями. Использование изобретения позволяет уменьшить проявления синовита и снизить побочные эффекты за счет того, что при более длительных перерывах между инъекциями достигается лучшая трансформация пролиферации хондроцитов в продукцию внеклеточного матрикса. 19 з.п. ф-лы, 2 табл., 9 ил., 6 пр.
1. Применение соединения FGF-18 для лечения поражения хряща, где соединение FGF-18 следует вводить в течение по меньшей мере одного курса лечения, причем каждый курс лечения включает по меньшей мере 3 введения, указанные введения разделены по меньшей мере 3, 4 или 5 неделями.
2. Применение соединения FGF-18 по п.1, где указанные введения разделены 3 неделями или 4 неделями.
3. Применение соединения FGF-18 по п.1, где указанные введения разделены 1 месяцем.
4. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 следует вводить по меньшей мере 4 раза в течение курса лечения.
5. Применение соединения FGF-18 по любому из предыдущих пунктов, где курсы лечения повторяют через 2, 3, 4, 5 или 6 месяцев.
6. Применение соединения FGF-18 по любому из предыдущих пунктов, которое включает 1, 2 или 3 курса лечения ежегодно.
7. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 следует вводить внутрисуставно.
8. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 следует вводить в дозе 3-300 мкг или предпочтительно 10-200 мкг, или более предпочтительно 30-150 мкг, или еще более предпочтительно 30-120 мкг за разовое внутрисуставное введение.
9. Применение соединения FGF-18 по п.8, где соединение FGF-18 следует вводить в дозе 3, 10, 20, 30, 40, 50, 60, 90, 100, 120, 150, 180, 200, 240 или 300 мкг за разовое внутрисуставное введение соединения FGF-18.
10. Применение соединения FGF-18 по любому из предыдущих пунктов, где хрящ является суставным хрящом.
11. Применение соединения FGF-18 по любому из предыдущих пунктов, где поражением хряща является остеоартрит.
12. Применение соединения FGF-18 по любому из пунктов1-10, где поражением хряща является повреждение хряща.
13. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 выбрано из группы, состоящей из:
a) полипептида, включающего или состоящего из зрелой формы человеческого FGF-18, включающей остатки 28-207 в SEQ ID NO:1, или
b) полипептида, включающего или состоящего из SEQ ID NO:2.
14. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 следует вводить вместе с противовоспалительным средством.
15. Применение соединения FGF-18 по п.14, где противовоспалительным средством является анакинра или диклофенак.
16. Применение соединения FGF-18 по п.14 или 15, где противовоспалительное средство следует вводить в дозе 0,001-500 мг или предпочтительно 0,1-250 мг, или более предпочтительно 0,5-150 мг за разовое введение.
17. Применение соединения FGF-18 по п.16, где противовоспалительное средство следует вводить в дозе 0,03, 0,1, 0,25, 0,3, 0,5, 1, 1,5, 2, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или 300 мг за разовое введение.
18. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 следует вводить 3 раза в течение курса лечения, причем указанные введения разделены 3 неделями.
19. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 следует вводить 3 раза в течение курса лечения, причем указанные введения разделены 4 неделями.
20. Применение соединения FGF-18 по любому из предыдущих пунктов, где соединение FGF-18 следует вводить один раз в месяц в течение 3 последовательных месяцев.
| WO 2008023063, 28.02.2008 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| HORSHAM P.A.Simponi™ (Golimumab) Receives FDA Approval As First Once-Monthly Anti-TNF For Treatment Of Rheumatoid Arthritis, Psoriatic Arthritis//Apr 24, 2009. | |||
Авторы
Даты
2019-06-19—Публикация
2015-02-20—Подача