Предлагаемое изобретение относится к медицинской молекулярной диагностике, в частности, к диагностике онкологических заболеваний.
Рак молочной железы (РМЖ) и рак яичников (РЯ) занимают одно из первых мест в заболеваемости населения злокачественными опухолями. Каждый год определяется более 1 мин новых случаев РМЖ и РЯ, при этом около 500000 являются смертельными. Эта тяжелая ситуация связана с диагностикой, как правило, поздней стадии заболевания. Существующие на сегодняшний день инструментальные методы обследования и сопряженные с ними диагностические процедуры не являются совершенными.
Основными методами скрининга являются клинический осмотр и биопсия.
Биопсия, с одной стороны, предоставляет возможность определения типов клеток, подверженных пролиферации, выявления гистологических особенностей, генетических повреждений и другие особенности, связанные с онкологией. С другой стороны метод биопсийного исследования ограничен неопределенной интерпретацией результатов, связанных с различными индивидуальными особенностями строения молочной железы и яичников, неэффективен на ранней стадии заболевания, а также является инвазивным методом, который вызывает дискомфорт у пациента. В последнее время также находит применение magnetic resonance imaging (MRI), магнитно-резонансная томография, которую сложно использовать для ранней диагностики заболеваний, и, к тому же, эта система достаточно дорогая.
Поэтому, разработка новых методов диагностики РМЖ и РЯ на ранней стадии развития заболевания является актуальной.
Количество белковых маркеров, реально используемых и рекомендуемых международными организациями для диагностики и мониторинга рака молочной железы, весьма ограничено. Специфичность дифференциальной диагностики злокачественных опухолей с использованием белковых маркеров РСА и СА125 относительно доброкачественных заболеваний молочной железы составляет 95%, однако это не приводит к повышению чувствительности, которая составляет 31% для первичной диагностики и 71% в случае диагностики метастазирующей карциномы молочной железы [1].
В настоящее время идентифицировано более 400 перспективных протеомных маркеров рака молочной железы и рака яичников, но большинство идентифицированных белков не является продуктом опухолевых клеток, а относится к неспецифическим белкам воспаления [1]. Поэтому вопрос использования этих белков в качестве онкомаркеров является дискуссионным.
В последние годы определена новая группа потенциальных эпигенетических онкомаркеров -миРНК (микроРНК), представляющих собой некодирующие РНК длиной от 21 до 25 нуклеотидов. Использование микроРНК в качестве диагностических и прогностических маркеров имеет следующие преимущества. Большинство микроРНК консервативны [2]. Кроме того, уже на самых ранних стадиях развития канцерогенеза опухоли имеют уникальный профиль экспрессии микроРНК [3].
Известен способ выявления нуклеиновых кислот, определяемых в различных фракциях крови методом полимеразной цепной реакции (ПЦР). Однако этот способ также обладает серьезными недостатками, связанными с высокой чувствительностью ПЦР к контаминациям образца, что часто приводит к высокой вероятности ложноположительных результатов. При использовании способа ПЦР для диагностики заболеваний высока вероятность контаминации исследуемых образцов и громоздкость технологии [4].
Известен способ диагностики рака молочной железы путем измерения уровня РНК-интерлейкина IL-18 и/или IL-18 и сравнении уровня представленности РНК IL-8 и/или IL-18 с уровнем представленности референсных транскриптов. Для осуществления способа используют обратную транскрипцию и полимеразной цепной реакции в «реальном времени». В качестве референсных транскриптов используют РНК ABL и/или HPRT и/или IL lb. Результат исследования считается положительным при разнице уровней представленности РНКIL-8 и HPRT более десяти раз (RU 2451937, кл. G01N 33/50, опубл. 20.12.2011) [5].
В патенте RU 2522923, кл. G01N 33/533; G01N 33/574, опубл. 20.07.2014, [6]. описывается способ определения циркулирующих раковых клеток, чувствительных к адъювантной гормональной терапии, в крови больных раком молочной железы, и включает выделение и обогащение циркулирующих опухолевых клеток с использованием антител с магнитными метками, получение лизатов циркулирующих опухолевых клеток, получение кДНК, получение амплифицированной ДНК, определение экспрессии маркерных генов, при этом в случае наличия одного из маркеров GA 733-2, MUC-1, HER2 делается заключение о наличии циркулирующих опухолевых клеток, чувствительных к гормональной терапии.
Известен способ диагностики рака молочной железы, включающий сканирование молочной железы в реальном времени с помощью инфракрасной камеры. Полученные термограммы разбивают на квадратные ячейки 1 см2, в которых для каждого пикселя рассчитывают мультифрактальные спектры флуктуаций температуры во времени. Полученные спектры осредняют по каждой ячейке и аппроксимируют квадратным полиномом. Расчитывают долю ячеек со значением спектра менее 0,06 и формируют заключение о наличии злокачественной опухоли молочной железы при обнаружении не менее 25% ячеек с обозначенной шириной спектра (RU 2566214, кл. А61В 5/01, опубл. 20.10 2015) [7]. Данный способ сложен в клинической практики и длителен во времени.
Известен способ диагностики онкологических заболеваний с молекулярным анализом крови пациента с помощью ИК-спектрометра. Проба крови пациента в объеме 0,05 мл исследуется с помощью спектрального анализа в условии многократного нарушенного полного внутреннего отражения в инфраккрасной области спектра, с последующей идентификацией заболевания путем сравнения спектров крови пациента и здорового человека. Заболевания идентифицируют по появлению в спектре полос поглощения в диапазоне 1500-3000 см-1. При появлении в спектре полосы поглощения на частотена частоте 1625 см-1 идентифицируют рак крови, на частоте 1735 см-1 - рак молочной железы, на частоте 1580 см-1 - рак печени, на частоте 2864 см-1 идентифицируют лифогрануломатоз. (RU 2108577, кл. G01N 21/35; G01N 33/49, опубл. 27.03.1997 г.) [8].
Имеющиеся к настоящему времени другие способы диагностики онкологических заболеваний, как и приведенные выше, обладают сложностью в выполнении анализа и длительностью во времени.
Например, способ иммуноферментного анализа (ИФА) для белковой диагностики онкологических заболеваний имеет длительность постановки анализа (2-24 часа), отсутствие жесткого контроля качества тест-систем, неспецифичность анализа, т.к. основан на детекции маркеров воспалительных процессов.
В то же время метод обнаружения микроРНК при помощи оптического биосенсора [9] позволяет в реальном масштабе времени по мониторингу изменения коэффициента преломления проследить за кинетикой взаимодействия, рассчитать константу равновесия реакции лиганд/рецептор без использования меток и менее продолжителен по сроку выполнения анализа (до нескольких минут). Однако этот метод обладает пределом концентрационной чувствительности, не превышающей 10-12 М, сложностью осуществления контроля вклада в сигнал оптического биосенсора от неспецифических взаимодействий компонентов биологической жидкости.
Проблема диагностики онкологических заболеваний может быть решена при регистрации микроРНК с помощью молекулярных детекторов, в частности, нанопроводного детектора, который позволяет регистрировать единичные молекулы нуклеиновых кислот без их амплификации.
Методы на основе нанопроводной (НП-биосенсорной) детекции относятся к перспективному новому поколению методов, позволяющей регистрировать белковые маркеры в биологической жидкости при низких концентрациях (<10-13 М), когда патологический процесс находится на ранней стадии развития [9]. Кроме высокой чувствительности, эта система позволяет проводить анализ в реальном времени без использования меток.
Одним из основных факторов, определяющих высокую чувствительность диагностических устройств нового поколения, является использование сенсорных элементов, размеры которых соизмеримы с размерами детектируемых белков, т.е. наноразмерных сенсоров [10-15]. Теоретическая оценка предела детекции НП-биосенсора показала, что сигнал может быть зарегистрирован от единичной биомолекулы, сорбированной на нанопроводоном сенсорном элементе [16].
Прототипом настоящего изобретения является способ, продемонстрированный возможность специфичной детекции с помощью НП-биосенсора микроРНК-126 (маркера рака легких) в клеточной культуре в концентрации 10-16 М в работе Gao с сотр. [17]
Недостатком данного способа является определение микроРНК в клеточной структуре, что представляет неудобства проведения клинического анализа по определению циркулирующих нуклеиновых кислот [18].
Задача настоящего изобретения состоит в разработке способа диагностики рака молочной железы и яичника на ранней стадии заболевания.
Техническим результатом предлагаемого изобретения является повышение чувствительности регистрации циркулирующей в крови микроРНК и быстродействием диагностики на уровне нескольких минут.
Для достижения заявленного технического результата предлагается способ диагностики рака молочной железы и рака яичников, включающий регистрацию микроРНК, содержащихся в крови пациента с онкологическим заболеванием рака молочной железы и яичников, нанопроводным НП-чипом, на поверхности которого ковалентно иммобилизуют совокупность о-ДНК зондов, комплементарных к микроРНК ассоциированным с заболеванием рака молочной железы и яичников, затем инкубируют НП-чип с иммобилизированной на его поверхности совокупностью о-ДНК в образце, содержащем микроРНК, выделенных из крови пациента, и регистрируют изменение величины тока, протекающего через НП-чипа после его инкубации в образце, которое возникает при образовании комплексов между иммобилизованными о-ДНК зондами и микроРНК, специфическими к этим зондам и выделенными из крови пациента.
Принцип биоспецифической детекции микроРНК с помощью нанопроводного детектора заключается в измерении модуляции тока, проходящего через нанопровод с иммобилизованными молекулами о-ДНК - зондами при образовании с ними комплексов микроРНК.
В известных способах в качестве молекул-зондов используется олигонуклеотидные зонды, в частности РНК- или ДНК-фрагменты, которые наиболее распространены для производства диагностических систем. Однако РНК-зонды характеризуются невысокой стабильностью к воздействию внешних условий, в частности к процедуре отмывки поверхности чипа от молекул партнеров, в то время ДНК-зонды более стабильны.
Поэтому при изготовлении стабильных нанопроводных чипов, предназначенных для многоразового использования, вместо РНК-зондов, в предлагаемом способе используются ДНК-зонды (о-ДНК), поскольку о-ДНК обладают повышенной стабильностью к воздействию внешних условий.
В настоящем изобретении способе диагностики РМЖ и РЯ электрическую регистрацию сигнала от комплементарных зондами (о-ДНК) микроРНК осуществляют с помощью нанопроводного детектора на основе полевого нанотранзистора, обладающего высокой - чувствительностью на уровне субфемтомолярной, высоким быстродействием - порядка минут, пониженной чувствительностью к контаминациям.
Предлагаемый способ диагностики РМЖ и РЯ осуществляется в несколько этапов, включающих:
- ковалентную иммобилизацию о-ДНК на поверхности нанопровода НП-чипа;
- инкубацию НП-чипа в образце, содержащем циркулирующие микроРНК, выделенные из крови пациента
- регистрацию изменения тока, протекающего через нанопровод НП-чипа после инкубации его в образце, которое возникает за счет образования комплексов между иммобилизованным о-ДНК и микроРНК из образца, специфическими к этому о-ДНК.
После осуществления указанных выше этапов образованные биоспецифические комплексы с поверхности чипа удаляют с помощью специального отмывочного раствора.
Система диагностики обладает повышенной чувствительностью на уровне единичных молекул и быстродействием на уровне минут.
На поверхность НП-чипа по предлагаемому способу иммобилизуют молекулы-зонды различных типов, причем каждый тип молекул иммобилизуют в виде отдельных совокупностей, которые вместе формируют сенсорное поле, а регистрацию всех совокупностей проводят последовательно или одновременно. Это позволяет сократить время анализа за счет использования одной и той же подложки (поверхности НП-чипа) и уменьшения числа манипуляций.
Особенностью и существенными признаками предлагаемого способа диагностики рака РЖМ и РЯ является:
- использование в качестве макромолекул о-ДНК, что является необходимым условием проведения диагностики по предлагаемому способу;
- ковалентная иммобилизация о-ДНК на поверхности нанопровода НП-чипа;
- инкубация нанопровода НП-чипа после ковалентной иммобилизации о-ДНК на его поверхности нанопровода НП-чипа в образце, содержащем циркулирующие микроРНК, выделенные из крови пациента;
- регистрация сигналом биосенсера тока, протекающего через нанопроводный чип после инкубации его в образце, вызванного образованием комплексов между иммобилизованным о-ДНК и микроРНК из образца, выделенные из крови пациента, специфическими к этому о-ДНК;
- использование для регистрации образующихся комплексов нанопроводного детектора на основе полевого нанотранзистора.
Предлагаемая в настоящем изобретении диагностическая тест-система для выявления микроРНК, ассоциированного с онкозаболеванием, позволяет повысить чувствительность регистрации циркулирующей в крови микроРНК до уровня 10-15 М (и более эффективно без амплификации) и дает возможность определять одновременно несколько типов микроРНК, ассоциированных с различными заболеваниями.
Использование совокупности нанопроводов с иммобилизованными о-ДНК позволяет повысить быстроту анализа сразу нескольких заболеваний за счет одновременной регистрации сигнала в нескольких измерительных каналах до порядка десяти минут.
Проведенный анализ уровня техники показал, что в настоящее время не известны технические решения с указанной совокупностью существенных признаков в известных-диагностических тест-системах, т.е. предлагаемое решение, соответствует критерию «новизна».
При анализе известных аналогов не обнаружены предложения с совокупностью существенных признаков, изложенных в формуле изобретения, из чего следует, что для специалистов, занимающихся онкологией, оно явным образом не следует из уровня техники и, следовательно, соответствует критерию «изобретательский уровень».
Сущность предлагаемого способа ранней диагностики РМЖ и РЯ поясняется нижеследующими примерами, описанием, приведенными таблицами и графиками:
ПРИМЕР 1
Выявление; микроРНК, ассоциированных с РМЖ. в образцах крови пациентов с заболеванием РМЖ.
Для изготовления чипа проводилась ковалентная иммобилизация на поверхности на нопровода, изготовленного из структуры кремний на изоляторе (КНИ-НП) следующих о-ДНК-зондов, ассоциированных с РМЖ:
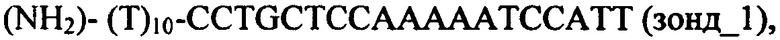
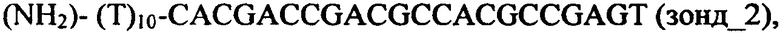
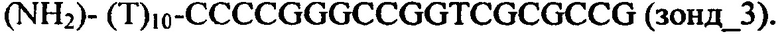
Перечисленные выше о-ДНК-зонды производятся в ООО Евроген (Россия) и доступны к приобретению в данной фирме.
Эти о-ДНК-зонды при осуществлении предлагаемого в изобретении способа были комплементарны, в соответствии с их нумерацией, к ДНК-олигонуклеотидам, которые использованы в качестве целевых молекул при анализе модельной системы как синтетические аналоги последовательностей, опубликованных в работе [3].
Комплементы о-ДНК и микроРНК представлены в нижеследующей табл. 1:

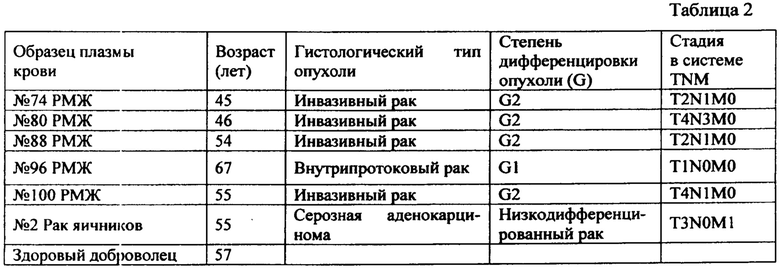
Далее были исследованы образцы плазмы пациенток с подтвержденным диагнозом РМЖ №74, 80, 88, 96, 100. В контрольных экспериментах использован образец плазмы крови здорового добровольца и пациентки с подтвержденным диагнозом рака яичника.
Клинико-морфологическая характеристика обследованных пациентов с выявленным онкологическим заболеванием приведена в нижеследующей табл. 2:
НП-чип к нанопроводному детектору для осуществления заявляемого способа был изготовлен с помощью CMOS (complementary metal-oxide-semiconductor) - технологии построения электронных схем со структурой металл-диэлектрик-полупроводник методом газофазного восстановления и литографии [11, 19].
о-ДНК-зонды (зонд_1, зонд_2, зонд_3) были ковалентно иммобилизованы на модифицированную поверхность, изготовленного КНИ-НП-чипа с помощью бифункционального кросс-линкера на основе сукцинимидного эфира.
Для модификации поверхности контрольных КНИ-НП использовались олигонуклеотиды, специфичные к маркеру гепатита С HCVcoreAg со следующей последовательностью:
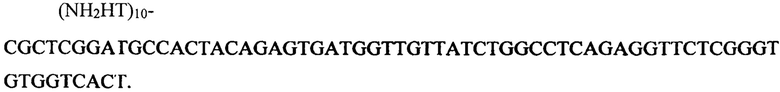
Растворы целевых о-ДНК с концентрациями в диапазоне от 10-14 М до 10-16 М были приготовлены из исходного раствора (100 мкМ в 50 мМ калий-фосфатного буфера (КФБ) с рН 7,4) с помощью последовательного десятикратного разбавления в рабочем буфером растворе (1 мМ КФБ, рН 7,4). На каждом этапе разбавления раствор выдерживался на шейкере в течение 30 мин при 10°С. Растворы готовились непосредственно перед измерениями.
Для выделения микроРНК из образцов плазмы крови использовался набор miRCURY™ RNA Isolation Kit - Biofluids.
Электрические измерения проводились с помощью пикоамперметра фирмы Keithley (model 6487, Keithley, http://www.keithley.com). Во время измерений поверхность структур КНИ-НП была использована в качестве управляющего электрода (затвора транзистора). Зависимость тока стока-истока от напряжения на затворе Ids (Vg), для КНИ-НП n-типа была получена при Vg=0÷70 V и Vds=0,2 V.
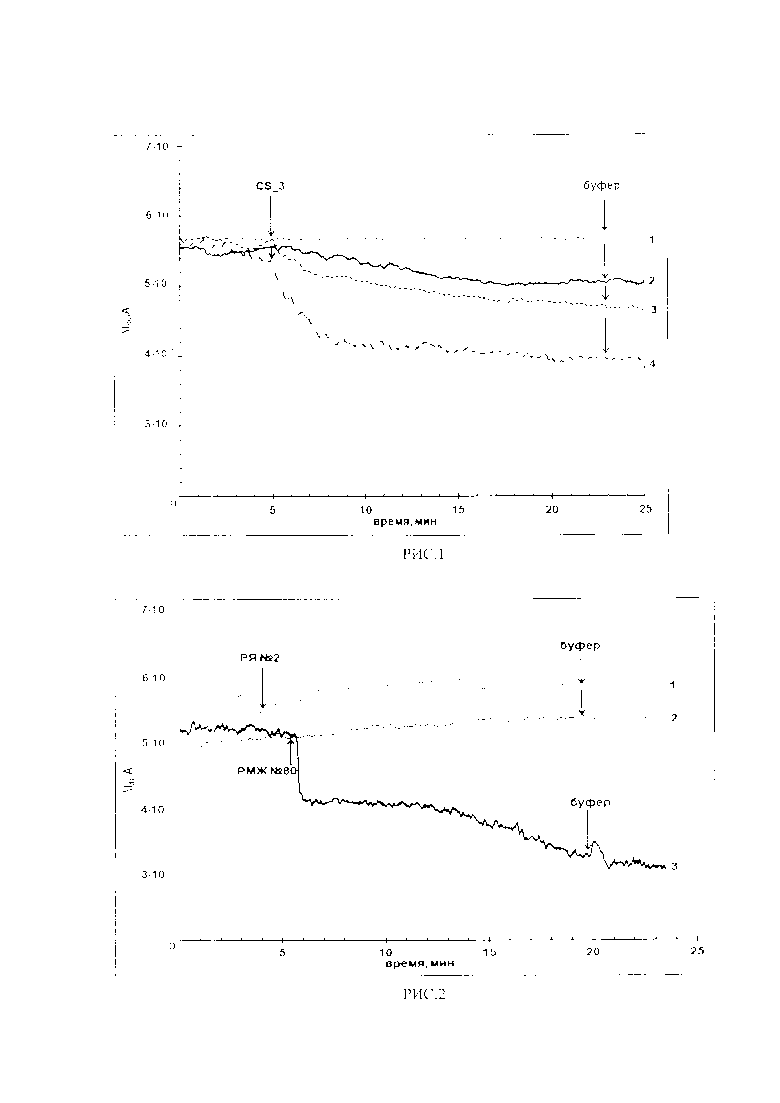
Для получения достоверного результата предлагаемого способа диагностики вначеле была исследована модельная система (рис. 1) - буферного раствора о-ДНК («cs_1», «cs_2», «cs_3») по следующей схеме. Анализируемый раствор (150 мкл в 1 мМ КФБ), содержащий один из типов о-ДНК при концентрации 10-14 М, 10-15 М, или 10-16 М, добавлялся в измерительную кювету, содержащую 300 мкл буферного раствора. Таким образом, исходная концентрация раствора уменьшалась в 3 раза. Контрольные эксперименты проводились в аналогичных условиях, но добавлялся только буфер, не содержащий о-ДНК.
При осуществлении предлагаемой диагностической системы (рис. 2) была использована следующая схема. Буферный раствор (7 мкл), содержащий микроРНК, выделенную из плазмы крови, добавлялся в измерительную кювету, содержащую 200 мкл буферного раствора и затем регистрировался ток, протекающий через нанопроводный НП-чип до и после его инкубации в образце.
Временные зависимости тока Ids(t) регистрировались при Vg=55 V и Vds=0,2 V в режиме реального времени. Для учета неспецифической сорбции целевых объектов на НП-чипе, содержащем рабочие сенсоры, присутствовала пара контрольных сенсоров, поверхность которых не была сенсибилизирована молекулами зонда. Полученные результаты представлены в виде зависимостей Ids(t), отражающих разностный сигнал между рабочим (с иммобилизованным олигонуклеотидами «зонд_1», «зонд_2» и «зонд_3») и контрольным НП-сенсором. Обнаружение ДНК-олигонуклеотидов и микроРНК проводилось в буфере, содержащем низкую концентрацию соли фосфата калия (1 мМ КР) для исключения влияния Дебаевского экранирования. При такой концентрации буферных растворов радиус Дебая (λD) составляет порядка 5 нм, что достаточно, чтобы регистрировать образование белковых комплексов на поверхности НП-структур.
Полученные результаты при условиях 1 мМ КФБ, Vg=55 В, Vds=0,2 В, объем 450 мкл; НП-сенсор с иммобилизованным олигонуклеотидным зондом «зонд_3» представлены на рис. 1, где показана для (cs_3)-буферного раствора о-ДНК зависимость Ids(t) от концентрации о-ДНК (cs_3). при: 1 мМ КФБ, Vg=55 В, Vds=0,2 В, объеме 450 мкл; НП-сенсоре с иммобилизованным олигонуклеотидным зондом «зонд_3» Конечная концентрация растворов «cs_3» в кювете: С=3.3*10-17 М, 3.3*10-16 М, 3.3*10-15 М.
Представленые на рис. 1 кривые показывают: на кривой 1 изменение сигнала биосенсора при добавлении анализируемого раствора с комплементарными ДНК-олигонуклеотида (оДНК) с минимальной концентрацией равной 3,3×10-17 М; на кривой 2 - изменение сигнала биосенсара при добавлении анализируемого раствора с концентрацией оДНК 3,3×10-16 М; на кривой 3 - изменение сигнала биосенсора при добавлении анализируемого раствора с концентрацией оДНК 3,3×10-15 М, на кривой 4 - изменение сигнала биосенсара при добавлении анализируемого раствора с концентрацией оДНК 3,3×10-14 М
Как видно из кривых, представленных на рис. 1, при добавлении анализируемого раствора с комплементарными о-ДНК наблюдается ожидаемое уменьшение проводимости КНИ-НП, обусловленное адсорбцией отрицательно заряженных молекул на поверхность нанопровода. Также видно, что величина сигнала биосенсора уменьшается при уменьшении концентрации добавляемой ДНК-олигонуклеотида от 10-14 до 10-16 М.
Минимальная концентрация ДНК-олигонуклеотида «cs_3», которую удалось зарегистрировать, составила 3,3×10-17 М (конечная концентрация в измерительной кювете). После замены раствора ДНК-олигонуклеотида на буферный раствор не наблюдалось существенного изменения уровня сигнала, что свидетельствует о том, что диссоциация комплексов «зонд_3/cs_3» очень медленная.
График на рис. 1 подтверждает, что предлагаемый в настоящем изобретении способ диагностики позволяет проводить регистрацию тестовых контрольных о-ДНК с высокой чувствительностью на уровне 10-17 М в реальном времени без меток.
ПРИМЕР 2.
Биоспецифическая детекция микроРНК. выделенной из плазмы крови.
Результаты исследования образцов, содержащих микроРНК, выделенных из плазмы крови людей, резюмированы в объединенной табл. 1, содержащих сравнительные данные, полученные при анализе растворов, содержащих о-ДНК (cs_1, cs_2; cs_3), и растворов, содержащих микроРНК, выделенные из плазмы крови пациентов с подтвержденным диагнозом РМЖ (№№74, 80, 88, 96, 100), здорового добровольца и с диагнозом «рак яичника» (РЯ №2) (строки 4-10).
Полученные зависимости Ids(t) приведены на графике, представленном на рис. 2, где 1 - образец, выделенный из плазмы крови пациента с диагнозом рак яичника; 2 - образец, выделенный из плазмы крови здорового добровольца; 3 - образец выделенный из плазмы крови пациента с диагнозом РМЖ (№80).
Детекция микроРНК, выделенной из клинических образцов, с помощью НП-биосенсора представленная на рис. 2 показывает, что, при добавлении раствора образца, содержащего микроРНК, выделенного из плазмы крови пациента с РМЖ (образец №80), также как и в случае обнаружения о-ДНК «cs_3» (рис. 1), наблюдается уменьшение проводимости КНИ-НП. Детекция микроРНК проводилась при следующих условиях: калий-фосфатный буфер (КФБ) при концентрации 1 мМ, Vg=55 B, Vds=0,2 B, объем 207 мкл; НП-сенсор с иммоблизованным олигонуклеотидным зондом «зонд_3».
Для четырех других образцов, выделенных из плазмы крови пациентов с подтвержденным диагнозом РМЖ (№74, 88, 96, 100), также как и для образца №80, наблюдалось понижение сигнала биосенсора после добавление в кювету анализируемого раствора (табл. 1, строки 4-8). При этом в контрольных экспериментах при добавлении образцов микроРНК, выделенных из плазмы крови здорового добровольца сигнал не изменялся (рис. 2, кривая 2).
В контрольных экспериментах с использованием образца, полученного из плазмы пациента с раком яичников, также не наблюдалось изменения сигнала при добавлении раствора в кювету (рис. 2, кривая 1).
ПРИМЕР 3
Выявление микроРНК ассоциированных с РЯ, в образцах крови пациентов с заболеванием РМЖ.
Для изготовления чипа проводилась ковалентная иммобилизация на поверхности КНИ-НП о-ДНК-зондов, ассоциированных с РЯ, последовательность которых приведена в нижеследующей табл. 3

Детекция проводилась аналогично методу, изложенному выше для РМЖ в Примере 1 при добавлении образцов, содержащих микроРНК от пациентов с РЯ. Для демонстации успешности реализации способа диагностики РЯ было проведено измерение на 15-и образцах и было показано, что во всех этих образцах обнаруживалась hsa-miR-21-5p, hsa-miR-141-5p и hsa-miR-200c.
Для повышения стабильности чипа на его поверхности размещается, диэлектрическое защитное покрытие на основе оксида алюминия или окисла гафния или их комбинции., так называемый h-k КНИ-чип. С использованием данного чипа были проведены диагностический анализ по выявлению микроРНК-21, ассоциированной с РЯ, из образцов крови пациентов с диагнозом РЯ, и показано, что он также позволяет диагностировать РЯ у пациентов с этим заболеванием.
Предлагаемый способ диагностики РМЖ и РЯ и проведенные измерения на 15-и образцах подтверждает осуществимость предлагаемого способа ранней диагностики РМЖ и РЯ с высокой чувствительностью на уровне 10-17 М в реальном времени без меток в течение нескольких минут, что позволяет утверждать достижение заявленного результата и практическую осуществимость заявляемого способа диагностики.
Сравнительные данные, полученные при анализе растворов, содержащих о-ДНК и растворов, содержащих микроРНК, выделенные из плазмы крови пациентов с подтвержденным диагнозом РМЖ или РЯ показаны в табл. 4
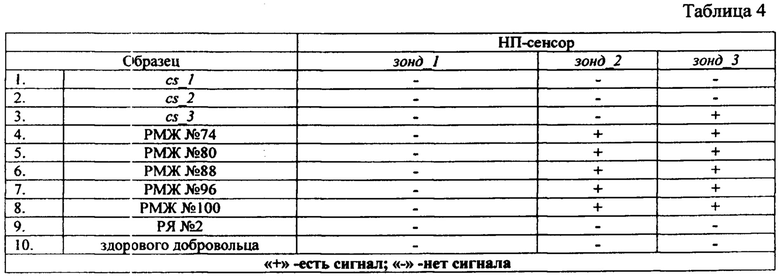
Как видно из табл. 4, при анализе образцов, полученных из плазмы крови, сигнал при добавлении растворов, содержащих микроРНК, выделенные из плазмы крови пациентов с РМЖ, зарегистрирован не только для канала с иммобилизованным олигонуклеотидным зондом "зонд_3", но и для другого канала - "зонд_2" (табл. 3 строки 4-8).
Таким образом, показано, что предлагаемый способ может быть использован для диагностики онкологических заболеваний пациентов на основе анализа содержания микроРНК в плазме крови, а НП-биосенсор позволяет регистрировать повышенный уровень микроРНК, ассоциированных с заболеванием РМЖ, у пациентов, с диагнозом РМЖ, по сравнению со здоровой контрольной группой и пациентами с диагнозом РЯ.
Список источников:
1. Turchinovich A. et al. Characterization of extracellular circulating microRNA // Nucleic acids research. - 2011. - T. 39. - №. 16. - C. 7223-7233.
2. Колесников H.H. и др. МикроРНК, эволюция и рак // Цитология. - 2013. - Т. 55. - №. 3. - С. 159-164.
3. Wu H., Mo Y.Y. Targeting miR-205 in breast cancer // Expert opinion on therapeutic targets. - 2009 - T. 13. - №. 12. - C. 1439-1448.
4. Чемерис А.В. и др. Как исключить появление ложно-позитивных результатов при проведении полимеразной цепной реакции // Вестник биотехнологии и физико-химической биологии. - 2012. - Т. 8. - С. 34-45.
5. RU 2451937, кл. G01N 33/50, опубл. 20.12.2011)
6. RU 2522923, кл. G01N 33/533; G01N 33/574, опубл. 20.07.2014
7. RU 2566214, кл. A61B 5/01, опубл. 20.10 2015
8. RU 2108577, кл. G01N 21/35; G01N 33/49, опубл. 27.03.1997 г.
9. Kodoyianni V. SPR principles // BioTechniques. - 2011. - Т. 50. - №. 1. - С. 32-40
10. Archakov A.I., Ivanov Y.D. Analytical nanobiotechnology for medicine diagnostics // Molecular Biosystems. - 2007. - T. 3. - №. 5. - C. 336-342.
11.. Ivanov Y.D. et al. SOI nanowire for the high-sensitive detection of HBsAg and α-fetoprotein // Lab on a Chip. - 2012. - T. 12. - №. 23. - C. 5104-5111.
12. Sim H.R., Wark A.W., Lee H.J. Attomolar detection of protein biomarkers using biofunctionalized gold nanorods with surface plasmon resonance // Analyst. - 2010. - T. 135. - №. 10. - C. 2528-2532.
13.  L. et al. Plasmonic nanosensors with inverse sensitivity by means of enzyme-guided crystal growth // Nature materials. - 2012. - Т. 11. - №. 7. - C. 604-607.
L. et al. Plasmonic nanosensors with inverse sensitivity by means of enzyme-guided crystal growth // Nature materials. - 2012. - Т. 11. - №. 7. - C. 604-607.
14. Zheng G. et al. Multiplexed electrical detection of cancer markers with nanowire sensor arrays // Nature biotechnology. - 2005. - T. 23. - №. 10. - C. 1294-1301.
15. Hahm J., Lieber С.M. Direct ultrasensitive electrical detection of DNA and DNA sequence variations using nanowire nanosensors // Nano letters. - 2004. - T. 4. - №. 1. - C. 51-54.
16.  N. et al. Surface charge sensitivity of silicon nanowires: Size dependence // Nano Letters. - 2007. - T. 7. - №. 9. - C. 2608-2612.
N. et al. Surface charge sensitivity of silicon nanowires: Size dependence // Nano Letters. - 2007. - T. 7. - №. 9. - C. 2608-2612.
17. Gao A. et al. Multiplexed detection of lung cancer biomarkers in patients serum with CMOS-compatible silicon nanowire arrays // Biosensors and Bioelectronics. - 2017. - T. 91. - C. 482-488.
18. Кондратова В.H. и др. Внеклеточные нуклеиновые кислоты как маркеры опухолевого роста // Российский биотерапевтический журнал. - 2013. - Т. 12. - №. 3.
19. Naumova О.V. et al. SOI nanowires as sensors for charge detection // Semiconductor Science and Technology. - 2010. - T. 25. - №. 5. - C. 055004.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ранней диагностики онкологического заболевания | 2022 |
|
RU2790290C1 |
| Способ ранней диагностики глиомы | 2021 |
|
RU2772193C1 |
| Способ дифференциальной диагностики рака яичников, кистозных образований яичника и рака тела матки | 2024 |
|
RU2836527C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И РАКА ЯИЧНИКОВ ПО УРОВНЮ мРНК ММР-9 В ПЛАЗМЕ КРОВИ | 2020 |
|
RU2745424C1 |
| МНОГОПАРАМЕТРИЧЕСКАЯ ДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ОБНАРУЖЕНИЯ И МОНИТОРИНГА ТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И РАКА ЯИЧНИКОВ, И СПОСОБ ПРОВЕДЕНИЯ АНАЛИЗА С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2014 |
|
RU2599890C2 |
| Способ прогнозирования риска развития рака молочной железы у женщин с ожирением | 2022 |
|
RU2795244C1 |
| Способ прогнозирования риска развития рака молочной железы у женщин без ожирения | 2023 |
|
RU2795726C1 |
| СПОСОБ ЭКСПРЕСС-АНАЛИЗА ГЕНЕТИЧЕСКОГО ПОЛИМОРФИЗМА ДЛЯ ВЫЯВЛЕНИЯ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАКУ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2617936C2 |
| Способ прогнозирования риска развития люминального подтипа рака молочной железы | 2023 |
|
RU2795720C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ РАКА ЯИЧНИКОВ | 2015 |
|
RU2599502C1 |
Изобретение относится к области биотехнологии. Предложен способ диагностики рака молочной железы и рака яичников. Способ включает регистрацию нанопроводным НП-чипом содержащихся в крови пациента с онкологическим заболеванием рака молочной железы и яичников микроРНК. На поверхности НП-чипа ковалентно иммобилизуют совокупность комплементарных к микроРНК ассоциированных с заболеванием рака молочной железы и яичников о-ДНК зондов, инкубируют НП-чип с иммобилизированной на его поверхности совокупностью о-ДНК в образце, содержащем выделенные из крови пациента микроРНК, регистрируют изменение величины протекающего через НП-чип тока. Причём изменение возникает при образовании комплексов между иммобилизованными о-ДНК зондами и микроРНК, специфическим к этим зондам. Изобретение обеспечивает раннюю диагностику рака молочной железы и рака яичников с высокой чувствительность 10-17 М в реальном времени без меток в течение нескольких минут. 2 ил., 4 табл., 3 пр.
Способ диагностики рака молочной железы и рака яичников, включающий регистрацию микроРНК, содержащихся в крови пациента с онкологическим заболеванием рака молочной железы и яичников, нанопроводным НП-чипом, на поверхности которого ковалентно иммобилизуют совокупность о-ДНК зондов, комплементарных к микроРНК ассоциированным с заболеванием рака молочной железы и яичников, затем инкубируют НП-чип с иммобилизированной на его поверхности совокупностью о-ДНК в образце, содержащем микроРНК, выделенные из крови пациента, и регистрируют изменение величины тока, протекающего через НП-чип после его инкубации в образце, которое возникает при образовании комплексов между иммобилизованными о-ДНК зондами и микроРНК, специфическими к этим зондам и выделенными из крови пациента.
| TRAN H.V., PIRO B | |||
| и др | |||
| Топливник с глухим подом | 1918 |
|
SU141A1 |
| КИСИЛЕВА Я.Ю | |||
| и др | |||
| Циркулирующие микроРНК как диагностические маркеры онкологических заболеваний // Биомедицина, 2015, 5, стр.79-85; D3: КИСЕЛЕВ Ф.Л | |||
| МикроРНК и РАК // Молекулярная биология, 2014, том 48, 2, стр.232-242 | |||
| СПОСОБ АНАЛИЗА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2492243C2 |
| US 20090086891 A1, 02.04.2009. | |||
Авторы
Даты
2019-07-31—Публикация
2017-12-27—Подача