Изобретение относится к медицине, а именно, к медицинской генетике и онкогинекологии, может быть использовано для прогнозирования риска развития рака яичников.
Рак яичников (РЯ) - злокачественное новообразование яичников. РЯ является ведущей причиной смертности от гинекологических раков у женщин, поскольку часто заболевание диагностируется на поздних стадиях развития (III или IV). Сложность диагностирования связана с бессимптомным течением болезни на ранних стадиях, а также тем, что РЯ является сложным гетерогенным заболеванием с несколькими гистологическими формами. В России ежегодно регистрируют более 12000 случаев патологии около половины, из которых заканчиваются смертельным исходом. В последнее десятилетие отмечается тенденция роста заболеваемости женщин в возрасте до 30 лет.
Известен способ прогнозирования риска возникновения РЯ, заключающийся в том, что пациенту проводят анализ экспрессии гена TUSC3 в биологическом образце (предпочтительно образец ткани) с последующим сравнением экспрессии данного маркера в образцах от здоровых доноров. При низком уровне экспрессии гена TUSC3 у обследуемого индивида прогнозируют риск развития заболевания по определенной формуле (Patent Application Publication №US 2009/0298068 A1, 2009). Недостатками этого метода являются его трудоемкость и необходимость дорогостоящих реактивов. Кроме того в данном способе не учитываются популяционные особенности регионов.
Известен способ прогнозирования риска развития РЯ, заключающийся в выявлении генетических вариантов в гене BRCA2 для определения предрасположенности к BRCA2-ассоциированным злокачественным новообразованиям, в частности к РМЖ и РЯ. Кроме того, описываемый способ позволяет прогнозировать течение заболеваний и определять ответ и эффективность лечения у пациентов (United States Patent №US 8,476,020 B1, 2013). Однако, данный способ не учитывает молекулярно-генетические особенности популяций. Так, например, для населения Волго-Уральского региона не характерно носительство мутаций в данном гене.
В целом, главным недостатком известных способов прогнозирования риска развития РЯ является то, что они не учитывают существенные различия в спектре и частоте мутаций между разными популяциями и регионами.
Наиболее близким аналогом является диссертационное исследование Прокофьевой Д.С.(Прокофьева Д.С.Изучение генетических факторов риска развития рака яичников. 2013, с. 190). В данной работе выявлены информативные маркеры риска развития РЯ (мутации c.5266dupC, c.181T>G в гене BRCA1 и del5395, p.R145W в гене CHEK2). Основными недостатками аналога являются трудоемкость и длительность анализа вследствие применения метода фенольно-хлороформной экстракции ДНК (занимающего 2 дня), а также детекции мутации c.5266dupC в гене BRCA1 с использованием метода полиморфизма длин рестрикционных фрагментов (занимающего также 2 дня).
Техническая задача - разработка способа прогнозирования риска развития рака яичников с помощью комплексной детекции мутаций c.5266dupC (BRCA1), c.181T>G (BRCA1), del5395 (CHEK2) и p.R145W (CHEK2) в течение 1 дня, что позволит достигнуть высокой точности прогноза риска развития РЯ и проводить у носителей мутаций профилактику онкологических заболеваний.
Технический результат изобретения - упрощение способа определения мутаций c.5266dupC, c.181T>G (BRCA1), del5395 и p.R145W (CHEK2).
Указанный технический результат достигается тем, что способ прогнозирования риска развития рака яичников включает в себя выделение ДНК из лимфоцитов периферической венозной крови наборами реагентов для выделения геномной ДНК из цельной крови, такими как GeneJET™ Mini, и комплексную детекцию мутаций c.5266dupC (BRCA1), c.181T>G (BRCA1), del5395 (CHEK2) и p.R145W (CHEK2) у одного пациента. При этом скрининг мутаций c.5266dupC в гене BRCA1 и p.R145W в гене CHEK2 проводят с помощью анализа кривых плавления с высокой разрешающей способностью (HRM), поиск мутации c.181T>G в гене BRCA1 выполняют с помощью аллель-специфичной ПЦР с последующим разделением в 2% агарозном геле и анализом при ультрафиолетовом освещении на трансиллюминаторе. Выявление мутации del5395 осуществляют по средствам мультиплексной ПЦР, с последующим разделением ПЦР-продуктов в 2% агарозном геле и анализом при ультрафиолетовом освещении на трансиллюминаторе. Ранее мутацию p.R145W (CHEK2) выявляли только у больных раком молочной железы, нами впервые было идентифицировано данное изменение у пациентов с раком яичников, проживающих в Республике Башкортостан.
Способ осуществляется следующим образом.
ДНК выделяют из лимфоцитов периферической крови. Непосредственный этап выделения ДНК проводят с помощью наборов реагентов для выделения геномной ДНК из цельной крови, согласно протоколу производителя. Полученную ДНК используют в качестве матрицы при проведения дальнейшего молекулярно-генетического анализа.
Детекцию мутации c.5266dupC в гене BRCA1 проводят с помощью HRM анализа. Специфические последовательности олигонуклеотидных праймеров представлены в работе Bogdanova N. (Bogdanova N. Genetic determinants of breast cancer susceptibility in the Byelorussian population. Dissertation dr. rer. nat. - 2008. - Vol. 193. - P. 1-193). Используются следующие последовательности олигонуклеотидов: (F) 5′-gggaatccaaattacacagc-3′, (R) 5′-ccaaagcgagcaagagaatctc-3′. Состав реакционной смеси для ПЦР общим объемом 17 µl включает в себя: 2 µl геномной ДНК (70 нг), 1.88 µl dNTPs, 4 µl MgCl2, 3,4 µl Q-solution, 1 µl смеси праймеров, 2.12 µl однократного буфера для Top-Tag полимеразы, 0.1 µl Top-Tag полимеразы, 0,8 µl EvaGreen и 1.7 µl воды высокой степени очистки. Режим амплификации: предварительная денатурация 7 минут при 95°С, затем 40 циклов со следующими параметрами - 95°С - 15 секунд, 60°С - 45 секунд, 72°С - 45 секунд. Плавление ПЦР-продукта проводят в диапазоне температур 55-95°С. Используют канал SYBR Green I, данные о кривых плавления анализируют в температурных пределах от 65°С до 95°С со скоростью линейного изменения 0,5°С в секунду.
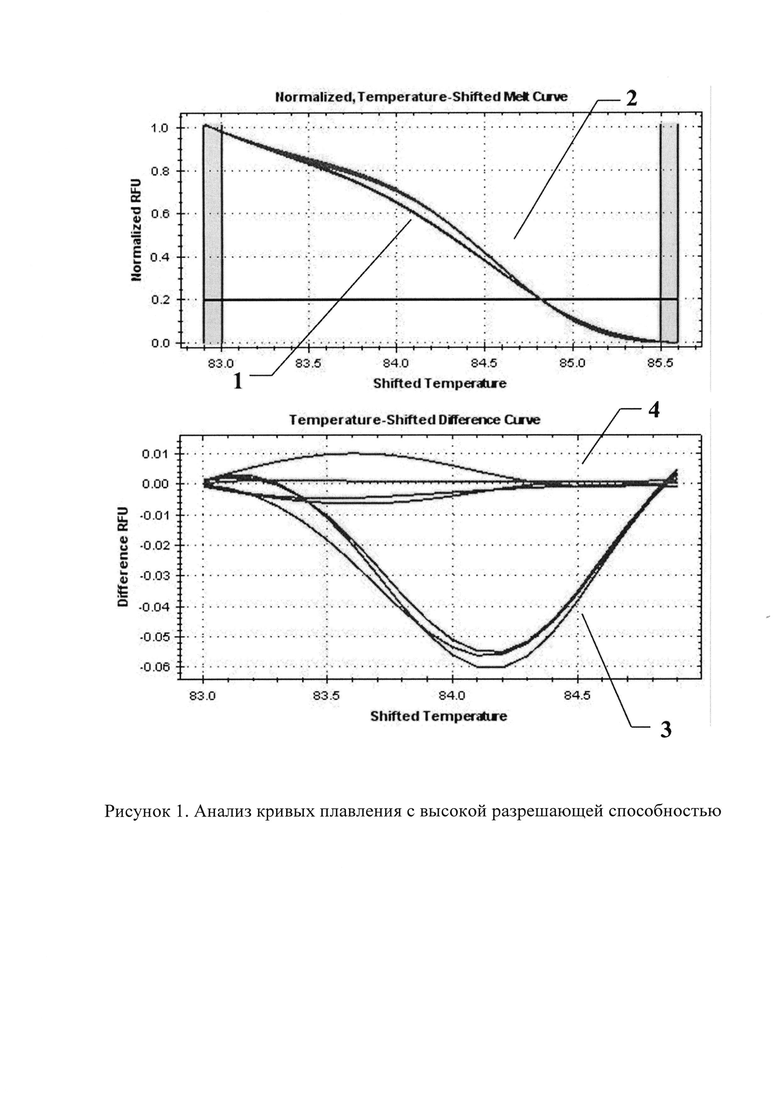
На рисунке 1 представлен анализ кривых плавления с высокой разрешающей способностью: а) нормированный график кривых HRM анализа образцов с мутацией c.5266dupC (1) и без мутации (2); б) кривые плавления образцов с мутацией c.5266dupC (3) и в норме (4).
Скрининг мутации c.181T>G в гене BRCA1 проводят с помощью аллель-специфичной ПЦР. Специфичные последовательности нуклеотидных праймеров представлены в работе Bogdanova N. (Bogdanova N. Genetic determinants of breast cancer susceptibility in the Byelorussian population. Dissertation dr. rer. nat. - 2008. - Vol. 193. - P. 1-193). Используются следующие последовательности олигонуклеотидов: (F) 5′-ccagaagaaagggccttcactgg-3′, (R) 5′-cctgtataaggcagatgtcc-3′ (аллель специфичные для мутации c.181T>G); (F) 5′-ctcttaagggcagttgtgag-3′ и (R) 5′-ttcctactgtggttgcttcc-3′ (для амплификации внутреннего контроля). Состав реакционной смеси для ПЦР объемом 20 µl включает в себя: 2 µl геномной ДНК (70 нг), 1.5 µl dNTPs, 1.5 µl MgCl2, 2 µl каждого праймера, 2 µl однократного буфера для полимеразы с горячим стартом, 0.08 µl HotStar полимеразы и 4.92 µl воды высокой степени очистки. Режим амплификации: предварительная денатурация 15 минуты при 95°С, затем 35 циклов со следующими параметрами - 94°С - 1 минута, 62°С - 1 минута, 72°С - 1 минута. После 35-го цикла проводят инкубацию при 72°С в течение 5 минут. Полученные ПЦР-продукты подвергают электрофорезу в 2% агарозном геле. Перед нанесением на гель пробы смешивают в соотношении 1:5 с краской, содержащей 0,25% бромфенолового синего, 0,25% ксиленцианола, 15% фикола. Электрофорез проводят при постоянном напряжении 10 вольт/см2.
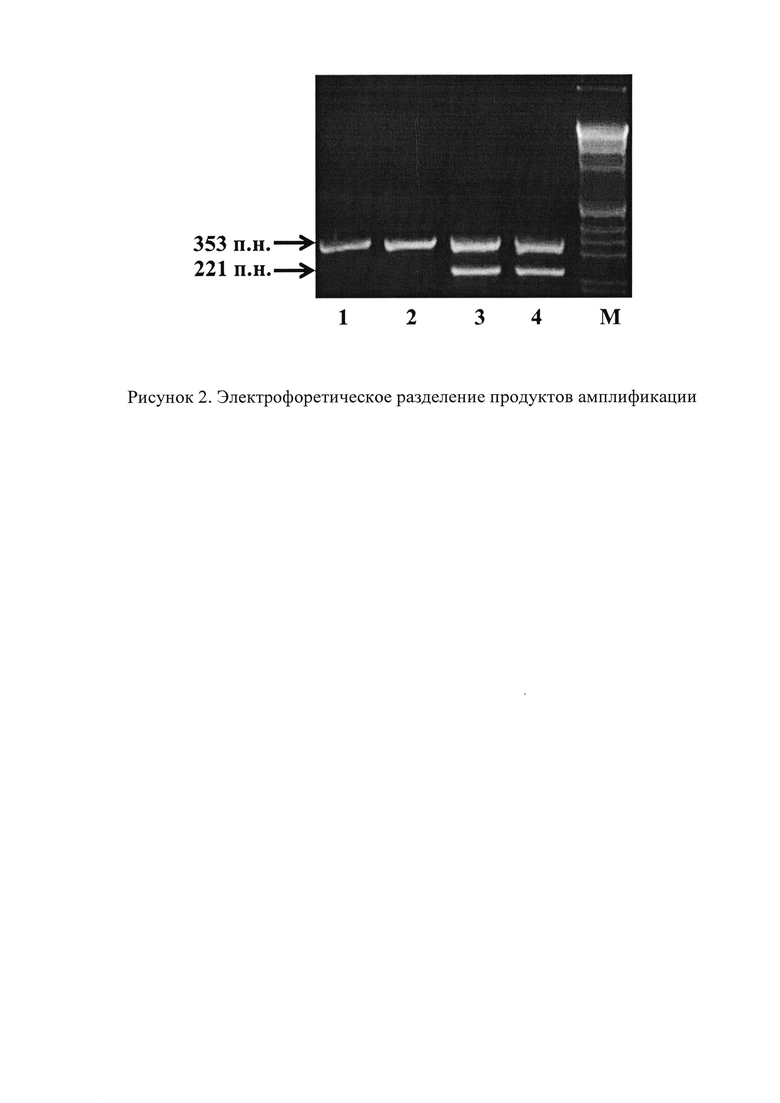
Детекцию результатов проводят путем визуализации в ультрафиолетовом свете на трансиллюминаторе. В результате ПЦР реакции амплифицируется продукт размером 221 п.н. В качестве внутреннего контроля синтезируют фрагмент гена MDC1 размером 353 п.н.
На рисунке 2 представлено электрофоретическое разделение продуктов амплификации: 1, 2 - образцы без мутации c.181T>G; 3, 4 - образцы с мутаций c.181T>G; М - маркер молекулярного веса 1 Kb.
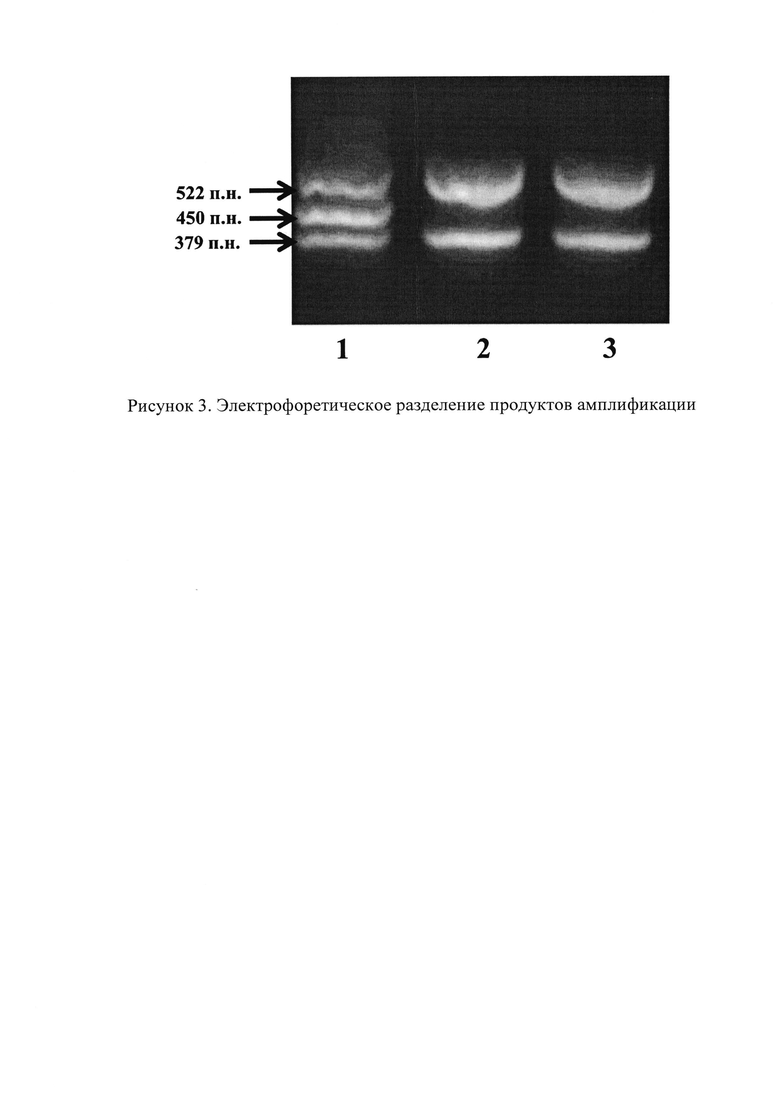
Поиск мутации del5395 в гене CHEK2 проводится с помощью аллель-специфичной дуплексной ПЦР. Последовательности двух пар специфичных праймеров, фланкирующих протяженную делецию из 5395 нуклеотидов, охватывающую 9 и 10 экзоны гена, представлены в работе Cybulski С.с соавт. (Cybulski С.et al. A deletion in CHEK2 of 5,395 bp predisposes to breast cancer in Poland. Breast cancer research and treatment. - 2007. - T. 102. - №. 1. -С.119-122). Используются следующие последовательности праймеров: (F) 5′-tgtaatgagctgagattgtgc-3′ и (R) 5′-cagaaatgagacaggaagtt-3′, фланкирующие точку разрыва в интроне 8; (F) 5′ctctgttgtgtacaagtgac-3′ и (R) 5′gtctcaaacttggctgcg-3′, фланкирующие точку разрыва в интроне 10. Состав реакционной смеси для ПЦР объемом 20 µl включает в себя: 2 µl геномной ДНК (70 нг), 1.5 µl dNTPs, 1.5 µl MgCl2, 2 µl каждого праймера, 2 µl однократного буфера для полимеразы с горячим стартом, 0.08 µl HotStar полимеразы и 4.92 µl воды высокой степени очистки. Режим амплификации: предварительная денатурация 10 минуты при 95°С, затем 9 циклов со следующими параметрами - 94°С - 25 секунд, 68°С - 25 секунд (понижение температуры на 1,4°С в каждом цикле (68°С первый цикл 55°С - 9-й цикл)), 72°С - 35 секунд. Затем 31 цикл со следующими параметрами - 94°С - 25 секунд, 55°С - 30 секунд, 72°С - 35 секунд. Полученные ПЦР-продукты подвергают электрофорезу в 2% агарозном геле. Перед нанесением на гель пробы смешивают в соотношении 1:5 с краской, содержащей 0,25% бромфенолового синего, 0,25% ксиленцианола, 15% фикола. Электрофорез проводят при постоянном напряжении 10 вольт/см2. Детекцию результатов проводят путем визуализации в ультрафиолетовом свете на трансиллюминаторе. В образцах, не содержащих мутации del5395, амплифицируются фрагменты размером 379 п.н. и 522 п.н. В случае наличия мутации амплифицируется дополнительный фрагмент размером 450 п.н.
На рисунке 3 представлено электрофоретическое разделение продуктов амплификации: 1 - образец с мутацией del5395; 2, 3 - образцы без мутации del5395.
Скрининг мутации p.R145W (с.433С>Т) в гене CHEK2 проводят с помощью анализа кривых плавления с высокой разрешающей способностью. Специфические последовательности олигонуклеотидных праймеров, фланкирующих область с возможным содержанием мутации с. 433С>Т и их оптимальные концентрации в реакционной смеси подобраны с помощью пакета биологических программ DNASTAR (Primer select 5.05 1993-2002). Используются следующие последовательности олигонуклеотидов: (F) 5′-ttgctttgatgaaccactgc-3′, (R) 5′-tgtttcagactttgaatagcagaga-3′. Состав реакционной смеси для ПЦР общим объемом 17 µl включает в себя: 2 µl геномной ДНК (70 нг), 1.88 µl dNTPs, 4 µl MgCl2, 3.4 µl Q-solution, 1 µl смеси праймеров, 2.12 µl однократного буфера для Top-Tag полимеразы, 0.1 µl Top-Tag полимеразы, 0.8 µl EvaGreen и 1.7 µl воды высокой степени очистки. Режим амплификации: предварительная денатурация 7 минуты при 95°С, затем 40 циклов со следующими параметрами - 95°С - 15 секунд, 57°С - 45 секунд, 72°С - 45 секунд. Плавление ПЦР-продукта проводят в диапазоне температур 55-95°С. Используют канал SYBR Green I, данные о кривых плавления анализируют в температурных пределах от 70°С до 85°С со скоростью линейного изменения 0,5°С в секунду.
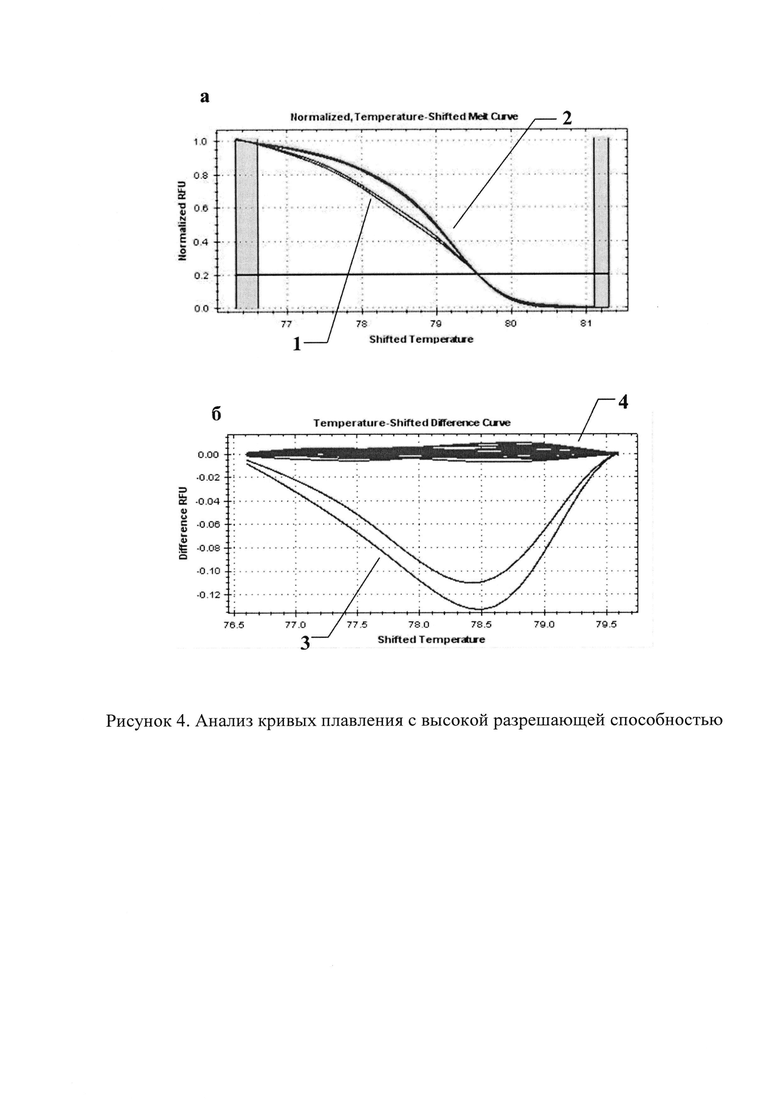
На рисунке 4 представлен анализ кривых плавления с высокой разрешающей способностью: а) нормированный график кривых HRM образцов с мутацией с. 433С>Т (1) и без мутации (2); б) кривые плавления образцов с мутацией с. 433С>Т (3) в норме (4).
Проводили анализ данных клинико-генетических исследований 187 женщин с установленным диагнозом «рак яичников» в возрасте от 17 года до 76 лет из Республики Башкортостан. По этническому происхождению обследуемая группа была неоднородна: русские -108 (58%), татары - 53 (28%), украинцы - 13 (7%), башкиры - 7 (4%) и чуваши - 6 (3%). Этническая принадлежность обследуемых определялась до третьего поколения путем личного опроса каждого человека. Материал собран в отделении гинекологии Клинического онкологического диспансера Министерства Здравоохранения Республики Башкортостан, (г. Уфа) и онкологического отделения Городской клинической больницы №1 (n=85) (г. Стерлитамак). Забор крови осуществлялся на базе вышеуказанных лечебных учреждений после осмотра исследуемых групп.
Контрольную группу составили 339 женщина без онкологических заболеваний на момент забора крови из Республики Башкортостан. По этническому составу контрольная группа соответствовала группе больных РЯ: русские - 49%, татары - 35%, башкиры - 9%, чуваши - 6% и украинцы - 1%. Средний возраст женщин из контрольной группы составил 41 год (18-69 лет).
Проведенный поиск мутации c.5266dupC в гене BRCA1 среди больных раком яичников и здоровых доноров позволил выявить 6,4% (12/187) пациенток и 0,6% (2/339) здоровых женщин с данным нарушением. Подобное распределение свидетельствует о широком распространении дупликации c.5266dupC в Республики Башкортостан и высоком риске развития рака яичников у носительниц данного изменения (OR: 11.6; 95% CI 2.6-52.2; р=0.0003).
Все позитивные случаи были подтверждены с помощью прямого секвенирования. Наличие мутации del5395 в гене CHEK2 подтверждали с помощью long-rang ПЦР.
Мутация c.181T>G была обнаружена у 1,6% (3/187) больных раком яичников. Для носительниц мутации c.181T>G отмечается более ранний возраст начала заболевания. В контрольной группе данного нарушения не идентифицировано.
Мутации del5395 и p.R145W в гене CHEK2 выявлены с частотой 1% (2/187). Среди здоровых доноров носителей не обнаружено.
В целом, у больных раком яичников из Республики Башкортостан с высокой частотой встречается мутация в гене c.5266dupC BRCA1. Также для пациенток характерны мутации c.181T>G в гене BRCA1, del5395 и p.R145W гене CHEK2. Полученные высокие значения частот изученных мутаций среди больных раком яичников свидетельствуют о важности определения этих нарушений в результате ДНК-диагностики с целью прогнозирования риска развития рака яичников.
Примеры прогнозирования риска рака яичников.
Пример 1. Пациентка Е.А., 1951 г.р., русского этнического происхождения. Имела случаи заболевания раком яичников в семье. Клинический диагноз - рак яичников.
Для выявления предрасположенности к развитию РЯ у пациентки был произведен забор крови объемом 5 мл с последующим выделением ДНК из периферических лимфоцитов с помощью наборов реагентов для выделения геномной ДНК из цельной крови. Комплексный скрининг мутаций проводили следующим образом: мутации c.5266dupC (BRCA1) и p.R145W (CHEK2) детектировали с помощью HRM анализа; мутацию c.181T>G (BRCA1) - аллель-специфичной ПЦР; мутацию del5395 (CHEK2) - аллель-специфичной дуплексной ПЦР. В результате у пациентки выявлена мутация c.5266dupC в гене BRCA1.
Пример 2. Пациентка М.Г., 1932 г.р., русского этнического происхождения. Клинический диагноз - рак яичников.
Для выявления предрасположенности к развитию РЯ у пациентки был произведен забор крови объемом 5 мл с последующим выделением ДНК из периферических лимфоцитов с помощью наборов реагентов для выделения геномной ДНК из цельной крови. Комплексный скрининг мутаций проводили следующим образом: мутации c.5266dupC (BRCA1) и p.R145W (CHEK2) детектировали с помощью HRM анализа; мутацию c.181T>G (BRCA1) - аллель-специфичной ПЦР; мутацию del5395 (CHEK2) - аллель-специфичной дуплексной ПЦР. В результате у пациентки выявлена мутация del5395 в гене CHEK2.
Пример 3. Пациентка P.P., 1951 г. р., татарского этнического происхождения. Имела случай заболевания раком молочной железы в семье. Клинический диагноз - рак яичников.
Для выявления предрасположенности к развитию РЯ у пациентки был произведен забор крови объемом 5 мл с последующим выделением ДНК из периферических лимфоцитов с помощью наборов реагентов для выделения геномной ДНК из цельной крови. Комплексный скрининг мутаций проводили следующим образом: мутации c.5266dupC (BRCA1) и p.R145W (CHEK2) детектировали с помощью HRM анализа; мутацию c.181T>G (BRCA1) - аллель-специфичной ПЦР; мутацию del5395 (CHEK2) - аллель-специфичной дуплексной ПЦР. В результате у пациентки выявлена мутация с.181Т>G в гене BRCA1.
Пример 4. Пациентка М.В., 1946 г. р., русского этнического происхождения. Клинический диагноз - рак яичников.
Для выявления предрасположенности к развитию РЯ у пациентки был произведен забор крови объемом 5 мл с последующим выделением ДНК из периферических лимфоцитов с помощью наборов реагентов для выделения геномной ДНК из цельной крови. Комплексный скрининг мутаций проводили следующим образом: мутации c.5266dupC (BRCA1) и p.R145W (CHEK2) детектировали с помощью HRM анализа; мутацию c.181T>G (BRCA1) - аллель-специфичной ПЦР; мутацию del5395 (CHEK2) - аллель-специфичной дуплексной ПЦР. В результате у пациентки выявлена мутация p.R145W в гене CHEK2.
Пример 5. Женщина из контрольной группы Г.А., 1967 г. р. русского этнического происхождения.
С целью выявления предрасположенности к развитию РЯ у здорового донора был произведен забор крови объемом 5 мл с последующим выделением ДНК из периферических лимфоцитов с помощью наборов реагентов для выделения геномной ДНК из цельной крови. Комплексный скрининг мутаций проводили следующим образом: мутации c.5266dupC (BRCA1) и p.R145W (CHEK2) детектировали с помощью HRM анализа; мутацию c.181T>G (BRCA1) - аллель-специфичной ПЦР; мутацию del5395 (CHEK2) - аллель-специфичной дуплексной ПЦР. В результате у обследованной женщины не выявлены не одна из исследуемых мутаций.
Обследование женщин, больных РЯ, и женщин из контрольной группы подтвердило высокую точность прогноза РЯ с применением предложенного способа, включающего в себя совместную детекцию четырех мутаций c.5266dupC (BRCA1), c.181T>G (BRCA1), del5395 (CHEK2) и p.R145W (CHEK2). Использование данного способа выявления мутаций в генах, ассоциированных с повышенным риском развития рака яичников, на доклинической стадии заболевания, позволило бы проводить у носителей мутаций профилактику онкологических заболеваний. Кроме того, предлагаемый способ предполагает сокращение времени исследования до 1 дня.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПРЕДЕЛЕНИЕ ПРЕДРАСПОЛОЖЕННОСТИ К РАКУ ПУТЕМ ИДЕНТИФИКАЦИИ ГЕНОТИПИЧЕСКИХ КОМБИНАЦИЙ СПЕЦИФИЧНЫХ ВАРИАНТОВ ГЕНОВ CYP1B1, BRCA2 И СНЕК2 | 2006 |
|
RU2470998C2 |
| Панель для первичного генетического тестирования наследственной формы рака молочной железы | 2024 |
|
RU2833074C1 |
| Способ прогнозирования низкого риска развития рака молочной железы у женщин с высокопенетратными мутациями в генах BRCA1 и CHEK2 | 2022 |
|
RU2798666C1 |
| Способ преимплатационного генетического тестирования рака молочной железы и яичников | 2021 |
|
RU2777091C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ И/ИЛИ ЯИЧНИКОВ У ПАЦИЕНТОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ПОЧКИ | 2023 |
|
RU2821583C1 |
| Способ оценки первичного ответа на проводимую комбинированную химиотерапию спорадического рака яичников III и IV стадий | 2021 |
|
RU2769543C2 |
| Способ молекулярно-генетической диагностики наследственных форм рака молочной железы | 2019 |
|
RU2702755C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ BRCA1 5382insC И СНЕК2 1100delC | 2011 |
|
RU2473700C2 |
| Способ определения нуклеотидных последовательностей экзонов генов BRCA1 и BRCA2 | 2015 |
|
RU2612894C1 |
| СПОСОБ ДИФФЕРЕНЦИРОВАННОГО ПРИМЕНЕНИЯ ДАННЫХ СЕКВЕНИРОВАНИЯ ДНК ДЛЯ ПАЦИЕНТОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ПОЧКИ | 2022 |
|
RU2803796C1 |
Изобретение относится к области медицины, в частности к медицинской генетике и онкогинекологии, и предназначено для прогнозирования риска развития рака яичников. Осуществляют выделение ДНК из лимфоцитов периферической венозной крови и комплексную детекцию мутаций c.5266dupC (BRCA1), c.181T>G (BRCA1), del5395 (CHEK2) и p.R145W (CHEK2) у одного пациента. Обнаружение одной из указанных мутаций свидетельствует о повышенном риске развития рака яичников. Изобретение обеспечивает упрощение способа определения мутаций c.5266dupC, c.181T>G (BRCA1), del5395 и p.R145W (CHEK2) и сокращение времени исследования до 1 дня. 4 ил., 5 пр.
Способ прогнозирования риска развития рака яичников, включающий выделение ДНК из лимфоцитов периферической венозной крови и комплексную детекцию мутаций c.5266dupC (BRCA1), c.181T>G (BRCA1), del5395 (CHEK2) и p.R145W (CHEK2) у одного пациента, при этом выделение ДНК из лимфоцитов периферической венозной крови проводят наборами реагентов для выделения геномной ДНК из цельной крови, а амплификацию участка ДНК, содержащего мутацию p.R145W (CHEK2), проводят с помощью последовательностей олигонуклеотидов: (F) 5′-ttgctttgatgaaccactgc-3′, (R) 5′-tgtttcagactttgaatagcagaga-3′ посредством анализа кривых плавления с высокой разрешающей способностью, и обнаружение хотя бы одной из мутаций c.5266dupC (BRCA1), c.181T>G (BRCA1), del5395 (CHEK2) и p.R145W (CHEK2) свидетельствует о повышенном риске развития рака яичников.
| ПРОКОФЬЕВА Д.С | |||
| Изучение генетических факторов риска развития рака яичников | |||
| Автореф | |||
| дисс | |||
| канд | |||
| биол | |||
| наук | |||
| Уфа, 2013, 24 с | |||
| US 5756294 A, 26.05.1998 STEGEL V | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| BMC Med Genet | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Найдено из Интернет: URL: | |||
Авторы
Даты
2016-10-10—Публикация
2015-06-01—Подача