Настоящее изобретение относится к фармацевтической композиции в форме эмульсии или микроэмульсии и ее применению в качестве вспомогательного вещества во время эндоскопических процедур, в которых она вводится в целевую ткань с целью формирования прокладки. Более подробно, изобретение относится к способу для выполнения эндоскопической процедуры, которая включает в себя инъецирование указанной фармацевтической композиции в форме эмульсии или микроэмульсии в целевую ткань пациента с целью формирования прокладки, при этом прокладка затем, необязательно, подвергается эндоскопической хирургической операции, такой как резекция.
УРОВЕНЬ ТЕХНИКИ
Эндоскопия представляет собой диагностическую и медицинскую процедуру, которая позволяет исследовать внутренность полого органа или полости тела посредством инструмента, называемого эндоскопом, без применения инвазивной хирургии. Эндоскопия обычно применяется в диагностических целях, но при этом незначительные неинвазивные хирургические и консервативные вмешательства могут быть выполнены во время эндоскопической процедуры. Как правило, указанные незначительные вмешательства включают в себя каутеризацию кровоточащего сосуда, расширение узкого пищевода, удаление полипов, аденом и малых опухолей, взятие биопсии или удаление инородного тела. Эндоскопия применяется специалистами для исследования, например, желудочно-кишечного тракта, дыхательных путей, уха, мочевыводящих путей, женской репродуктивной системы и, через малые разрезы, обычно закрытых полостей тела, таких как брюшная полость или полость таза (лапароскопия), внутренняя часть сустава (артроскопия) и органы груди (торакоскопия и медиастиноскопия). Эндоскоп представляет собой освещаемый трубчатый инструмент, обычно из гибкого или жесткого оптического волокна, для визуализации внутренности или части полого органа (такого как мочевой пузырь, пищевод, желудок или кишечник) в диагностических или терапевтических целях, который обычно имеет один или более рабочих каналов для обеспечения возможности прохода инструментов (таких как пинцет, электрохирургический нож, эндоскопические инъекционные иглы или ножницы) или облегчения удаления образцов биопсии. Он содержит подходящую лампу и устройство обработки изображений на своей дистальной части, и он может быть вставлен через естественные отверстия тела, такие как рот, задний проход, ухо, нос или через малые хирургические разрезы. Учитывая большое разнообразие органов или полостей тела, которые могут быть исследованы посредством эндоскопических процедур, существует несколько типов эндоскопов, такие как, например, ларингоскоп, торакоскоп, ангиоскоп, колоноскоп, энтероскоп, ректороманоскоп, ректоскоп, проктоскоп, аноскоп, артроскоп, риноскоп, лапароскоп, гистероскоп, энцефалоскоп, нефроскоп, эзофагоскоп, бронхоскоп, гастроскоп, амниоскоп, цистоскоп.
В частности, эндоскопические процедуры широко применяются в желудочно-кишечном тракте, как в диагностических целях, так и при малых вмешательствах. Благодаря успешному прогрессированию технологии визуализации, эндоскопические процедуры могут применяться для точного исследования слизистой, которая покрывает желудочно-кишечные полости, и обнаружения малых и больших патологических нарушений, таких как воспалительная ткань, полипы, псевдополипы, пилообразные поражения, аденомы, изъязвления, дисплазии, предраковые и неопластические образования, опухоли и т.п. Кроме того, эндоскопические процедуры в желудочно-кишечном тракте позволяют врачу выполнять незначительные хирургические или консервативные вмешательства, которые включают, например, взятие биопсии и удаление патологических нарушений (полипы, аденомы, дисплазии, дисплазия Барретта, предраковые и неопластические образования, опухоли). Хирургические вмешательства включают две эндоскопических процедуры резекции, обычно применяемые в желудочно-кишечной эндоскопии для удаления патологические нарушений: эндоскопическая резекция слизистой (EMR) и эндоскопическое подслизистое расслоение (ESD). Эти две методики предоставили новые альтернативы для минимально инвазивного лечения желудочно-кишечных полипов, аденом, дисплазий, дисплазии Барретта и рака на ранней стадии, которые имеют минимальный риск метастазов в лимфатических узлах. EMR представляет собой эндоскопическую методику, разработанную для удаления имеющих широкое основание прикрепления или плоских опухолей, ограниченных поверхностными слоями (слизистая и подслизистая) ЖК тракта. EMR обычно применяется для удаления поражений, меньших чем 2 см, или постепенного удаления больших поражений. EMR также играет важную роль в исследовании подвергнутых резекции образцов с целью точного определения стадии патологии. В отличие от полипэктомии, EMR включает подъем поражения с мышечного уровня посредством инъецирования жидкого средства, обычно, нормального солевого раствора (NS), в слой подслизистой. EMR также полезен для получения образцов для точного определения стадии гистопатологии с целью определения риска метастазов в лимфатических узлах. EMR облегчает полное удаление поврежденной слизистой посредством иссечения через среднюю или более глубокую часть подслизистой стенки кишки. Различные методики EMR были описаны, и обычно применяются четыре способа, включающие петельную резекцию: (1) способ инъецирования и разреза; (2) способ инъецирования, подъема и разреза; (3) EMR с помощью дистального колпачка (EMRC); и (4) EMR с перевязкой (EMRL). Методика инъецирования и разреза, также известная как инъекционная полипэктомия подслизистой, стала широко применяться в последние годы из-за своей простоты. Пораженную слизистую поднимают с мышечного уровня посредством создания подслизистой жидкой прокладки, захватывают, сжимают с использованием электрохирургической петли и затем подвергают резекции. Однако, инъецирование в тонкий слой подслизистой является тонким процессом, введенный раствор имеет тенденцию к быстрому рассеиванию, плоские и вогнутые поражения трудно захватить с помощью петли по сравнению с выступающими поражениями, и большие или расположенные в труднодоступных местах поражения может быть трудно удалить (Uraoka и соавт., Drug Design, Development and Therapy 2008:2 131-138). EMR с использованием инъецирования часто применяется для больших плоских полипов толстой кишки.
Эндоскопическое подслизистое расслоение (ESD), относительно новая эндоскопическая процедура резекции, было специально разработано для удаления больших поражений. Поражения иссекаются непосредственно вдоль слоя подслизистой с применением электрохирургического ножа, в результате чего достигается блочная резекция даже больших поражений. Было предсказано, что ESD заменит стандартную хирургию при лечении определенных стадий рака, но поскольку оно имеет более высокий уровень осложнений, связанных с перфорацией и кровотечением, чем стандартный EMR, то требуется более высокая степень эндоскопической квалификации и опыта, чем для EMR. Различные растворы для инъецирования в подслизистую были разработаны ранее, и было показано, что они являются удовлетворительными для применения во время EMR, но введение более длинной процедуры ESD потребовало дольше сохраняющегося раствора в целях способствования идентификации линии разреза во время рассечения слоя подслизистой (Uraoka и соавт., Drug Design, Development and Therapy 2008:2 131-138).
Применение инъецирования в подслизистую является существенным для успешной EMR, поскольку инъецирование жидкости в прокладку подслизистой способствует изоляции ткани, которая должна быть удалена, непосредственно перед захватом целевого поражения петлей, таким образом, уменьшая тепловое повреждение и риск перфорации и кровотечения, также облегчая блочную резекцию. Инъецирование в подслизистую, как считается, играет важную роль в процедуре EMR, и «идеальный» раствор для инъецирования в подслизистую должен быть долгосрочным в отношении длительности сохранения прокладки, и способным к образованию полусферической формы, чтобы способствовать набрасыванию петли. Кроме того, обеспечение достаточно высокого подъема подслизистой является важным для безопасного иссечения подслизистой во время процедуры ESD (Uraoka и соавт., Drug Design, Development and Therapy 2008:2 131-138).
Идеальный раствор для EMR с применением инъецирования должен быть безопасным, недорогим, нетоксичным, легкодоступным, должен легко инъецироваться, и, в особенности, он должен быть способен обеспечить высокую долговечную прокладку подслизистой. Ранозаживляющие характеристики также должны требоваться в целях способствования смыканию раны, создаваемой в результате удаления подвергнутой резекции слизистой, и также должно требоваться наличие красящего вещества (такого как краситель), чтобы обеспечить более легкое различение мышечной пластинки слизистой оболочки во избежание не являющейся необходимой перфорации во время ESD.
Физиологический раствор (NS) обычно использовался с этой целью, но является трудным произвести надлежащую подслизистую жидкую прокладку и обеспечить требуемую высоту, особенно для плоских приподнятых поражений, вследствие быстрого рассеяния раствора через слои слизистой и поглощения NS в окружающей ткани (Uraoka и соавт., Drug Design, Development and Therapy 2008:2 131-138). Поэтому в долго продолжающихся процедурах и при удалении больших поражений, таких как большие плоские полипы, требуется повторное инъецирование раствора в слой подслизистой, что впоследствии повышает сложность операции для персонала эндоскопического модуля.
Для того, чтобы преодолеть быстрое исчезновение прокладки, что представляет собой типичную проблему, с которой встречаются при использовании NS, в течение прошлого десятилетия было предложено и протестировано несколько типов растворов для применения в EMR с использованием растворов. Каждый тип растворов имеет свои преимущества и недостатки. Например, сообщалось, что растворы гиалуроновой кислоты (НА) являются лучшими средствами для инъекций в подслизистую. Растворы НА обеспечивают долговечные жидкие прокладки и позволяют обеспечить блочные резекции с высоким процентом успеха и низкими уровнями осложнений, связанным с перфорацией. Кроме того, НА является безопасной, биологически совместимой и нетоксичной, поскольку она является физиологическим компонентом внеклеточного матрикса. Основным недостатком НА является ее высокая стоимость, которая делает ее недоступной для большинства эндоскопических модулей. Были описаны и протестированы другие растворы, такие как гипертоническая декстроза и гидроксипропилметилцеллюлоза (НРМС), которые, однако, как сообщалось, вызывали повреждение ткани и воспаление. Другим недавно исследованным раствором для инъекций является смесь раствора фибриногена (FM), который имеет высокую вязкость и производит долгосрочный подъем подслизистой, таким образом, понижая число инъекций для поражения и сокращая время процедуры; кроме того, FM является недорогим. Основным недостатком FM является возможный риск передачи вирусов: поскольку FM получают посредством дробления белков коагуляции в человеческой сыворотке, возможно загрязнение вирусом гепатита или другими вирусами. Как проиллюстрировано выше, идеальный раствор для EMR и ESD еще не был разработан, и в этой области все еще продолжается множество исследований.
В идеальном случае, вязкие растворы, такие как растворы для НА или растворы НРМС, могли бы соответствовать требованиям процедур эндоскопической резекции, поскольку они могли бы обеспечить высокую и долговечную прокладку вследствие низкой тенденции воды, координируемой этими полимерами, к рассеиванию и распространению в тканях, окружающих поражение. Однако, использование вязких растворов, таких как растворы для НА или растворы НРМС, создает некоторые проблемы в процедуре вследствие трудностей перекачивания вязких растворов в инъекционные устройства. Фактически, в процедурах желудочно-кишечных EMR и ESD, инъекции формирующих прокладку растворов выполняются с применением эндоскопических инъекционных игл. Как хорошо известно в технике, эндоскопические инъекционные иглы представляют собой устройства, которые могут иметь длину около 230 см и которые включают относительно длинный катетер, в пределах которого внутренняя инъекционная трубка, имеющая на дальнем конце инъекционную иглу, размещается с возможностью скольжения. Ближняя ручка активации соединяется с катетером и инъекционной трубкой для перемещения друг относительно друга при необходимости. Доступ жидкости к инъекционной трубке обычно обеспечивается через наконечник шприца на ручке. Эндоскопические инъекционные игольные устройства обычно доставляются к месту инъекции через рабочий канал эндоскопа. Для того, чтобы защитить полость рабочего канала эндоскопа от повреждения, ручкой инфузионного игольного устройства манипулируют с целью извлечения дистальной инъекционной иглы в полость катетера до вставки устройства в эндоскоп. Это важно для предотвращения извлечения острой точки инъекционной иглы, когда устройство перемещается через полость эндоскопа. Когда дальний конец эндоскопического инъекционного игольного устройства
располагается в точке инъекции, его ручкой снова манипулируют с целью перемещения инъекционной иглы дистально из полости катетера. После продвижения к самому удаленному положению, длина извлеченной части инъекционной иглы составляет около 4-6 мм. После того, как точка инъекции была проколота, раствор, обычно содержащийся в шприце объемом от 5 мл до 10 мл, оборудованном фитингом с фиксатором Люэра, соединенным с ручкой инъекционной иглы, передается через инъекционную трубку и иглу в место инъекции.
Инъекционную иглу и другие принадлежности, обычно используемые во время эндоскопических процедур с фитингом с фиксатором Люэра, такие как петли для полипэктомии, зажимные устройства, пинцеты для биопсии и т.п., передают через один или более определенных каналов эндоскопа, обычно называемых рабочими каналами или операционными каналами. В зависимости от типа эндоскопа, используемого в гастроинтестинальной эндоскопии (например, гастроскоп, энтероскоп, колоноскоп, дуоденоскоп, ректороманоскоп и т.п.), внутренний диаметр рабочих каналов может изменяться значительно. Однако, наиболее распространенные эндоскопы, применяемые в гастроинтестинальной эндоскопии, имеют рабочие каналы с внутренним диаметром в диапазоне от около 2 мм до около 5 мм. Обычно производители эндоскопических принадлежностей производят принадлежности, имеющие наружные диаметры, которые позволяют им соответствовать всем рабочим каналам. В частности, что касается эндоскопических инъекционных игл, наружный диаметр катетера варьирует от 1,9 мм до 2,3 мм; таким образом, принимая во внимание, что внутренняя инъекционная трубка находится во внешнем катетере, ее внутренний диаметр обычно составляет 1 мм или меньше. Такой малый диаметр инъекционной трубки обеспечивает высокое динамическое сопротивление течению раствора; это является более корректным и важным, когда используется вязкий раствор. Поэтому вязкие растворы, используемые для EMR и ESD, часто должны разбавляться перед их использованием, для того, чтобы растворы могли протекать через инъекционную иглу, что приводит к потере их характеристик, обеспечивающих высокую и долговечную прокладку. WO 2011/103245 А1 описывает набор и способ для доставки инъецируемого раствора в место лечения ткани для применения в ESD. Указанный набор включает корпус, имеющий камеру, ближнюю часть и дальнюю часть. Инъецируемый раствор, имеющий вязкость, большую чем около 10000 сП, предоставляется в камере. Набор также включает поршень, подвижно размещаемый в пределах ближней части камеры, при этом поршень обеспечивает изоляцию в дистальной концевой части. Манометр также предоставляется в наборе. Ручка соединена с корпусом, и продвигающий поршень элемент, имеющий ручку поршня, соединен с ней. Продвигающий поршень элемент предоставляется отдельно от корпуса и включает в себя дистальную часть, сконфигурированную для функционального соединения с дистальной частью кожуха. Набор также включает внутренний штифт, поставляемый отдельно от корпуса и имеющий ближнюю концевую часть, сконфигурированную для функционального соединения с дистальной частью корпуса с целью получения инъецируемого раствора через нее, и дистальный конец, сконфигурированный для вставки в место лечения ткани. Как будет понятно специалисту в данной области техники, такое устройство позволяет врачу прилагать намного большее давление, чем при использовании обычного шприца, таким образом, позволяя высоковязкому раствору, имеющему вязкость 10000 сП или больше, течь в инъекционную трубку. Кроме того, WO 2011/103245 А1 раскрывает, что подходящие материалы для включения в инъецируемый раствор включают метилцеллюлозы, такие как карбоксилметилцеллюлоза (CMC) и гидроксипропилметилцеллюлоза (НРМС), белки внеклеточного матрикса, эластин, коллаген, желатин, фибрин, агарозу и альгинат, или смеси указанного. Однако, применение такого устройства создания "высокого давления" во время эндоскопического исследования, как известно, не очень благожелательно принимается экспертами в данной области, поскольку оно является громоздким, дополнительная работа требуется для его установки на место, им трудно управлять, и поэтому оно усложняет процедуры EMR и ESD.
Другая попытка преодоления этих проблем описывается в WO 2009/070793 А1, которая раскрывает применение очищенных инверсных термочувствительных полимеров в EMR. Как хорошо известно в технике, инверсные термочувствительные полимеры представляют собой полимеры, которые, после растворения в растворителях (таких как вода) в концентрации выше критической мицеллярной концентрации (CMC), имеют тенденцию формировать мицеллы. При концентрациях выше, чем критическая концентрация гелеобразования (CGC), эти мицеллы могут образовывать решетку; результатом является раствор, который демонстрирует инверсные характеристики вязкости, что означает, что указанный раствор демонстрирует увеличение своей вязкости с температурой. В конечном счете, когда температура поднимается выше критической температуры гелеобразования (CGT), образуется гель.
Гелеобразование происходит вследствие физического переплетения и упаковки мицеллярных структур, и является обратимым, таким образом, гель возвращается в жидкую форму, когда температура понижается ниже критической температуры гелеобразования. Полимеры этого типа известны в технике, и включают, в качестве примеров, полоксамеры (коммерциализированные BASF под зарегистрированным патентованным названием Kolliphor™) и полоксамины (коммерциализированные BASF под зарегистрированным патентованным названием Tetronic™). Водные растворы этих полимеров при концентрациях выше CGC могут быть жидкими при комнатной температуре и могут образовывать гель после нагревания до температуры тела (то есть, около 37°С). WO 2009/070793 А1 раскрывает применение композиции, содержащей очищенный инверсный термочувствительный полимер, в эндоскопической процедуре для резекции желудочно-кишечной слизистой. Указанная композиция, называемая LeGoo-endo™, представляет собой водный раствор очищенного полоксамера 237; раскрыто, что быстрый обратимый переход жидкости в гель, достигаемый в результате его очищенной природы, позволяет LeGoo-endo™ быть жидкостью при комнатной температуре и становиться гелем только после ее выхода из катетера в месте EMR, после нагревания до температуры тела. В WO 2009/070793 А1 изложено, что в целях получения указанного быстрого перехода из жидкости в гель, требовалось использование очищенного полоксамера, и что указанный очищенный полоксамер был получен посредством процесса очистки, направленного на получение очищенного полимера, характеризуемого более низкой полидисперсностью молекулярного веса. Кроме того, WO 2009/070793 А1 раскрывает, что было необходимо разработать способ инъецирования через катетер в кишечник или желудок раствора очищенного инверсного термочувствительного полимера, который переходит в гель при температуре тела. Среди преодоленных проблем был тот факт, что, поскольку катетер быстро достигает температуры тела при нахождении внутри тела, очищенный инверсный термочувствительный полимер может образовать гель внутри катетера до достижения требуемого места для EMR. WO 2009/070793 А1 раскрывает, что проблемы доставки были решены с помощью системы, включающей в себя игольчатый катетер высокого давления, соединенный со шприцем, заполненным раствором очищенного инверсного термочувствительного полимера, при этом указанный игольчатый катетер высокого давления содержался в пределах устройства введения (например, насоса шприца), которое создавало давление на поршень шприца через ручной (например, винтовой), электрический или основанный на сжатом газе механизм. Фактически, в примере в естественных условиях, WO 2009/070793 А1 раскрывает, что пять EMR выполнялись в толстой кишке 2 свиней с помощью LeGoo-endo™ с использованием иглы для склеротерапии калибра 23 со шприцем на 5 мл и насосом для баллонного расширения; LeGoo-endo™ хранился на льду во время вмешательства. Содержащие солевой раствор шприцы также хранились на льду в целях охлаждения катетера до инъекции полоксамера. Как будет понятно специалисту в данной области техники, рабочий процесс, раскрытый в WO 2009/070793 А1, является достаточно сложным по следующим причинам: требуется, чтобы очищенный раствор инверсного термочувствительного полимера хранился на льду во время вмешательства; требуется использование конкретного игольчатого катетера высокого давления; требуется, чтобы, непосредственно перед инъекцией раствора очищенного инверсного термочувствительного полимера, катетер был охлажден посредством инъецирования холодного физиологического раствора, хранящегося на льду; требуется устройство введения (например, шприцевой насос), которое создает давление на поршень шприца с целью введения раствора очищенного инверсного термочувствительного полимера.
В патенте США 7909809 изложен способ для выполнения оперативной эндоскопической процедуры в желудочно-кишечном тракте, такой как полипэктомия, эндоскопическая резекция слизистой (EMR) и эндоскопическое подслизистое расслоение (ESD), при этом указанный способ включает введение человеку увеличивающего объем или амортизирующего материала, который обладает характеристиками фазового перехода из маловязкого состояния (например, жидкой фазы) в высоковязкое состояние (например, гелевая фаза) в качестве реакции на предварительно заданную температуру (например, температуру тела).
Как указано выше, идеальная композиция для эндоскопической резекции слизистой (EMR) и эндоскопического подслизистого расслоения (ESD) еще не была разработана. Как сообщено выше, композиции в форме раствора, содержащего, например, НА (гиалуроновую кислоту) известны в технике: растворы НА (гиалуроновой кислоты) являются вязкими и способными к обеспечению долговечных подслизистых прокладок; кроме того, они являются безопасными и нетоксичными. Однако, они, как известно, являются очень дорогими.
Производные целлюлозы, такие как НРМС и CMC, являются дешевыми, и их растворы способны к обеспечению долговечных подслизистых прокладок; однако, вследствие их вязкости, требуется специфическое устройство, такое как шприцевой насос, для того, чтобы обеспечить их протекание через инъекционную иглу; таким образом, они известны тем, что их трудно и неудобно инъецировать.
Инверсные термочувствительные полимеры, такие как полоксамеры и полоксамины, являются дешевыми, и их растворы, ввиду их способности к образованию геля при температуре тела (то есть, около 37°С), способны к обеспечению долговечных подслизистых прокладок; однако в технике известно, что для достижения гелеобразования в растворах при температуре тела (то есть, около 37°С), такие полимеры должны содержаться в растворе в концентрации, равной или выше критической концентрации гелеобразования (CGC), которая представляет собой концентрацию, при которой фазовый переход из раствора в гель происходит после нагревания до или выше критической температуры гелеобразования (CGT). Соответственно, такие полимеры обычно содержатся в известных растворах в объеме, равном или превышающем критическую концентрацию гелеобразования (CGC). Аналогичные концентрации этих полимеров, однако, имеют несколько недостатков, такие как гелеобразование в растворах, содержащих их в инъекционной игле. Сложная процедура выполняется с целью избегания гелеобразования в растворе в инъекционной игле, а именно, хранение композиции на льду, охлаждение инъекционной иглы холодным NS (физиологический раствор), затем, применение шприцевого насоса для их введения, с очевидными недостатками для эндоскописта.
Следовательно, существует потребность в предоставлении композиции для применения в эндоскопической процедуре (особенно в EMR и ESD), которая может быть безопасной, недорогой, нетоксичной, легко доступной, легко инъецируемой, и одновременно способной к предоставлению высокой долговечной подслизистой прокладки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: первая прокладка, созданная посредством инъекции композиции согласно примеру 1 в слой подслизистой свиного желудка вне организма.
Фигура 2: вторая прокладка, созданная посредством инъекции композиции согласно примеру 1 в слой подслизистой свиного желудка вне организма.
Фигура 3: первая прокладка с фигуры 1 после отрезания непосредственно после инъекции; вязкий продукт с хорошей плотностью виден в слое подслизистой.
Фигура 4: образец слизистой первой прокладки с фигуры 1 после резекции, в котором видно, что продукт, сформированный посредством введенной композиции, остается прикрепленным к иссеченной части.
Фигура 5: вторая прокладка с фигуры 2 через 15 минут после инъекции.
Фигура 6: вторая прокладка с фигуры 2 после отрезания; вязкий продукт с хорошей плотностью, аналогичный продукту с фигуры 3, виден в слое подслизистой.
Фигура 7: образец слизистой второй прокладки с фигуры 2 после резекции, при этом видно, что продукт, сформированный инъецированной композицией, остается прикрепленным к иссеченной части.
Фигура 8: график, показывающий распределение размера частиц микроэмульсии по интенсивности, измеренное на композиции из примера 15 после этапа а) производственного процесса (см. также пример 9 и таблицу А из примера 17).
Фигура 9: график, показывающий распределение размера частиц микроэмульсии по интенсивности, измеренное на композиции из примера 15 после этапа d) производственного процесса (см. также пример 9 и таблицу В из примера 17).
Фигура 10: график с наложением, показывающий сравнение между распределением размера частиц микроэмульсии по интенсивности после этапа а) и после этапа d) производственного процесса, измеренными на композиции из примера 15 (см. также пример 9 и таблицу С из примера 17).
Фигура 11: график, показывающий распределение размера частиц микроэмульсии по интенсивности (три реплики одного и того же образца), измеренное на композиции из примера 15 после этапа е) производственного процесса (см. также пример 9 и таблицу D из примера 17).
Фигура 12: высота прокладки подслизистой, сформированной после инъекции подходящего объема композиции из примера 11, в момент времени 0 и после 60 минут.
Фигура 13: на изображении показана эндоскопия в желудке минипига (в естественных условиях для минипига из примера 21), и, в частности, эндоскопическая инъекционная игла, содержащаяся в рабочем канале эндоскопа, инъецирующая композицию из примера 5 в слой подслизистой.
Фигура 14: на изображении показана эндоскопия в желудке минипига (в естественных условиях для минипига из примера 21), и, в частности, подслизистая прокладка в конце введения. Область вмешательства имеет синий контрастный цвет по сравнению с окружающим пространством.
Фигура 15: на изображении показана эндоскопия в желудке минипига (в естественных условиях для минипига из примера 21) через 24 часа после введения композиции из примера 5. В области, где композиция была введена, подслизистая прокладка больше не видна. Слизистая желудка не показала больших макроскопических изменений вследствие введения композиции.
Фигура 16: график, показывающий реограмму вязкости в зависимости от температуры.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение, раскрытое в настоящем описании, предоставляет фармацевтическую композицию в форме эмульсии или микроэмульсии и ее применение в эндоскопических процедурах, предпочтительно, желудочно-кишечных эндоскопических процедурах.
Изобретение предоставляет фармацевтическую композицию в форме эмульсии или микроэмульсии для применения в эндоскопической процедуре, при этом указанная фармацевтическая композиция содержит по меньшей мере один инверсный термочувствительный полимер и, необязательно, по меньшей мере один физиологически приемлемый эксципиент. Предпочтительно, указанная эндоскопическая процедура включает введение указанной фармацевтической композиции человеку.
Изобретение, раскрытое в настоящем описании, предоставляет способ для выполнения эндоскопической процедуры, в котором указанная фармацевтическая композиция содержит по меньшей мере один инверсный термочувствительный полимер и, необязательно, меньшей мере один физиологически приемлемый эксципиент. Предпочтительно, указанный способ включает введение фармацевтической композиции в форме эмульсии или микроэмульсии человеку.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение, раскрытое в настоящем описании, предоставляет фармацевтическую композицию в форме эмульсии или микроэмульсии, при этом указанная фармацевтическая композиция содержит по меньшей мере один инверсный термочувствительный полимер в объеме меньше критической концентрации гелеобразования (CGC), и при этом указанная фармацевтическая композиция остается в жидкой фазе до температуры около 40°С в условиях лабораторного испытания, а также ее применение в эндоскопических процедурах. Предпочтительно, указанные эндоскопические процедуры представляют собой желудочно-кишечные эндоскопические процедуры. Более предпочтительно, указанные желудочно-кишечные эндоскопические процедуры выполняются в пищеводе, желудке и/или тонкой кишке (двенадцатиперстная кишка, тощая кишка, подвздошная кишка), в слепой кишке, в толстой кишке, в сигмовидной ободочной кишке и/или в прямой кишке.
Изобретение, раскрытое в настоящем описании, предоставляет фармацевтическую композицию в форме эмульсии или микроэмульсии для применения в эндоскопических процедурах, при этом указанная фармацевтическая композиция содержит по меньшей мере один инверсный термочувствительный полимер в объеме ниже критической концентрации гелеобразования (CGC) и при этом указанная фармацевтическая композиция остается в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Изобретение, раскрытое в настоящем описании, предоставляет способ для выполнения эндоскопической процедуры, при этом указанный способ включает введение фармацевтической композиции в форме эмульсии или микроэмульсии человеку, при этом указанная фармацевтическая композиция содержит по меньшей мере один инверсный термочувствительный полимер в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная фармацевтическая композиция остается в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно изобретению, указанная эндоскопическая процедура предпочтительно представляет собой эндоскопическую резекцию, выполняемую во время желудочно-кишечной эндоскопии, более предпочтительно, полипэктомию, эндоскопическую резекцию слизистой (EMR) и/или эндоскопическое подслизистое расслоение (ESD).
Согласно изобретению, указанная желудочно-кишечная эндоскопия предпочтительно выполняется в пищеводе, желудке и/или тонкой кишке (двенадцатиперстная кишка, тощая кишка, подвздошная кишка), в слепой кишке, в толстой кишке, в сигмовидной ободочной кишке и/или в прямой кишке.
Кроме того, изобретение, раскрытое в настоящем описании, предоставляет набор для применения в эндоскопической процедуре, при этом указанный набор содержит фармацевтическую композицию в форме эмульсии или микроэмульсии, эндоскопическую инъекционную иглу, шприц и инструкцию по их применению, при этом указанная фармацевтическая композиция в форме эмульсии или микроэмульсии содержит по меньшей мере один инверсный термочувствительный полимер, и при этом указанная эндоскопическая процедура предпочтительно представляет собой эндоскопическую резекцию слизистой, выполняемую во время желудочно-кишечной эндоскопии, более предпочтительно, полипэктомию, эндоскопическую резекцию слизистой (EMR) и/или эндоскопическое подслизистое расслоение (ESD).
Более подробно, фармацевтическая композиция в форме эмульсии или микроэмульсии вводится на целевую ткань с целью формирования прокладки, которая может быть затем, необязательно, подвергнута эндоскопической операции, такой как процедура резекции.
Все публикации, патенты и заявки на патент, процитированные выше или ниже в настоящем описании, включены в настоящее описание посредством ссылки во всей их полноте.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретатели пытались разработать инновационные фармацевтические композиции для применения в эндоскопических процедурах, предпочтительно, полипэктомии, эндоскопической резекции слизистой (EMR) и/или эндоскопическом подслизистом расслоении (ESD), которые воплощают характеристики, требуемые врачами-эндоскопистами, в особенности, безопасность, низкую цену, отсутствие токсических эффектов, легкость инъецирования и способность обеспечения высокой долговечной подслизистой прокладки.
Как ни удивительно, было обнаружено, что фармацевтические композиции в форме эмульсий или микроэмульсий, которые содержат по меньшей мере один инверсный термочувствительный полимер в объеме ниже критической концентрации гелеобразования (CGC) и остаются в жидкой фазе до температуры около 40°С в условиях лабораторного испытания, демонстрируют способность формировать высокую долговечную подслизистую прокладку, являющуюся в то же время безопасной, недорогой, нетоксической и легкой для инъецирования. Следовательно, является очевидным последующее улучшение, создаваемое этими композициями в эндоскопических процедурах, особенно в эндоскопической резекции во время желудочно-кишечной эндоскопии.
Высокая долговечная подслизистая прокладка, как ни удивительно, наблюдалась изобретателями после того, как композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, была инъецирована в слой подслизистой свиного желудка вне организма, который представляет собой известную модель человеческой желудочно-кишечной слизистой (Soo Hoon Eun и соавт. «Effectiveness of Sodium Alginate as a Submucosal Injection Material for Endoscopic Mucosal Resection in Animal», Gut and Liver, Vol. 1, №1, June 2007, pp 27-32).
Как хорошо известно в технике, инверсные термочувствительные полимеры представляют собой полимеры, которые, после растворения в воде в концентрации выше критической концентрации гелеобразования (CGC), обеспечивают растворы, которые демонстрируют инверсные характеристики вязкости, что означает, что указанные растворы демонстрируют увеличение своей вязкости с температурой. В частности, водные растворы указанных полимеров формируют гели выше критической концентрации гелеобразования (CGC), когда температура поднимается выше критической температуры гелеобразования (CGT). Гелеобразование происходит вследствие физического переплетения и упаковки мицеллярных структур, и является обратимым, таким образом, гель возвращается к жидкой форме, когда температура понижается ниже критической температуры гелеобразования. Полимеры такого типа хорошо известны в технике, и включают, в качестве примеров, полоксамеры (коммерциализированные BASF под зарегистрированным патентованным названием Kolliphor™) и полоксамины (коммерциализированные BASF под зарегистрированным патентованным названием Tetronic™). Как хорошо известно в технике, каждый вид полоксамера имеет характеристическую критическую концентрацию гелеобразования (CGC); среди полоксамеров полоксамер 407 имеет самую низкую CGC. Как сообщается в Evren Algin Yapar и соавт., Tropical Journal of Pharmaceutical Research October 2012; 11 (5): 855-866, для того, чтобы достигнуть относительно стабильных гелей, для данных приложений требуются концентрации полимеров, обычно составляющие 15% или более по весу относительно веса раствора. Кроме того, в работе J. J. Escobar-Chavez и соавт., Journal of Pharmacy & Pharmaceutical Sciences, 9(3):339-358, (2006) сообщается, что полоксамер 407 является особенно интересным, поскольку концентрированные растворы (>20% по весу) сополимера преобразуются из маловязких прозрачных растворов в твердые гели при нагревании до температуры тела. Как уже упомянуто, водные растворы указанных полимеров формируют гели выше критической концентрации гелеобразования (CGC), когда температура поднимается выше критической температуры гелеобразования (CGT). Критическая температура гелеобразования (CGT) может быть изменена посредством изменения концентрации инверсного термочувствительного полимера, что означает, что чем выше концентрация указанного полимера, тем ниже критическая температура гелеобразования (CGT). Как хорошо известно в технике, для способности к гелеобразованию растворов инверсных термочувствительных полимеров требуется, чтобы концентрация указанных полимеров в указанных растворах была равна или выше критической концентрации гелеобразования (CGC): если такие полимеры содержатся в объеме ниже CGC, растворы не переходят из жидкой фазы в гелевую фазу в качестве реакции на повышение температуры. В то время, когда изобретение было сделано, в технике считалось, что способность формировать гель после нагревания до температуры тела (то есть, около 37°С) в условиях лабораторного испытания водных растворов, содержащих некоторые виды инверсных термочувствительных полимеров в объеме, равном или превышающем критическую концентрацию гелеобразования (CGC), является важной характеристикой для обеспечения формирования долговечной подслизистой прокладки после того, как растворы были инъецированы в слой подслизистой желудочно-кишечного тракта. В сущности, считалось, что указанные растворы могут формировать долговечную подслизистую прокладку после инъецирования в слой подслизистой желудочно-кишечного тракта вследствие перехода в гелевую фазу в качестве реакции на повышение температуры (то есть, до температуры тела). Таким образом, в технике считалось, что способность водных растворов, содержащих инверсный термочувствительный полимер в объеме, равном или превышающем критическую концентрацию гелеобразования (CGC), формировать долговечную подслизистую прокладку после инъецирования в слой подслизистой желудочно-кишечного тракта, была связана с их способностью формировать гель после нагревания до температуры тела (то есть, около 37°С) в условиях лабораторного испытания. Другими словами, считалось, что для обеспечения формирования долговечной прокладки в слое подслизистой желудочно-кишечного тракта указанные растворы должны были содержать инверсный термочувствительный полимер в концентрации, равной или превышающей критическую концентрацию гелеобразования (CGC), так как только в этом случае указанные растворы будут в состоянии перейти из жидкой фазы в гелевую фазу в качестве реакции на повышение температуры (например, до температуры тела).
Теперь было обнаружено, что фармацевтические композиции в форме эмульсий или микроэмульсий по изобретению, раскрытому в настоящем описании, которые не обладают способностью формировать гель (то есть, остаются в жидкой фазе) до температуры около 40°С в условиях лабораторного испытания, предпочтительно, после нагревания до температуры тела (то есть, около 37°С), как ни удивительно, способны формировать высокую долговечную подслизистую прокладку после инъецирования в слой подслизистой свиного желудка (вне организма). В частности, в сравнительном анализе, предусматривающем инъецирование различных композиций в слой подслизистой свиного желудка, поддерживаемого при температуре около 37°С, было, как ни удивительно, обнаружено, что фармацевтические композиции в форме эмульсий или микроэмульсий по изобретению, раскрытому в настоящем описании, даже при том, что они не обладали способностью формировать гель после нагревания до температуры тела (то есть, около 37°С) в условиях лабораторного испытания, как ни удивительно, смогли сформировать высокую долговечную прокладку в указанном выше слое подслизистой (свиной желудок вне организма), аналогичную по высоте, форме и продолжительности прокладке, которую сформировали стандартные растворы, то есть, содержащие инверсный термочувствительный полимер в концентрации выше критической концентрации гелеобразования, которые смогли образовать гель после нагревания до температуры тела (то есть, около 37°С) в лабораторных условиях.
Таким образом, как ни удивительно, было обнаружено, что отсутствие гелеобразующих свойств, наблюдаемое в условиях лабораторного испытания для фармацевтических композиций в форме эмульсий или микроэмульсий по изобретению, раскрытому в настоящем описании, не было связано со способностью формирования подслизистой прокладки указанными фармацевтическими композициями, наблюдаемой в свином желудке (вне организма). Как будет понятно специалисту в данной области техники, такие результаты были неожиданными и неочевидными, а также обеспечивали значительное преимущество в эндоскопических процедурах. В технике, фактически, считалось, что способность формировать гели для растворов инверсных термочувствительных полимеров после нагревания до температуры тела (то есть, около 37°С) в лабораторных условиях была связана со способностью формировать гели указанных растворов для моделей ex vivo или in vivo процедур резекции желудочно-кишечной слизистой.
Изобретатели, как ни удивительно, обнаружили, что фармацевтические композиции в форме эмульсий или микроэмульсий согласно изобретению, раскрытому в настоящем описании, обладают способностью формирования подслизистой прокладки в моделях ех vivo и/или in vivo процедур резекции желудочно-кишечной слизистой, даже при том, что инверсные термочувствительные полимеры содержались в указанных фармацевтических композициях в такой концентрации, что их объем был меньше критической концентрации гелеобразования (CGC) и, следовательно, указанные фармацевтические композиции были неспособны образовать гель до температуры около 40°С, особенно после нагревания до температуры тела (то есть, около 37°С), в условиях лабораторного испытания.
Изобретение, раскрытое в настоящем описании, предоставляет фармацевтическую композицию в форме эмульсии или микроэмульсии, при этом указанная фармацевтическая композиция содержит по меньшей мере один инверсный термочувствительный полимер в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная фармацевтическая композиция остается в жидкой фазе до температуры около 40°С в условиях лабораторного испытания и ее применения в эндоскопических процедурах.
Изобретение, раскрытое в настоящем описании, предоставляет фармацевтическую композицию в форме эмульсии или микроэмульсии для применения в эндоскопической процедуре, при этом указанная композиция содержит по меньшей мере один инверсный термочувствительный полимер в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция остается в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно изобретению, указанная эндоскопическая процедура включает введение указанной фармацевтической композиции человеку.
Согласно изобретению указанная эндоскопическая процедура предпочтительно представляет собой желудочно-кишечную эндоскопическую процедуру, более предпочтительно, выполняемую в пищеводе, желудке, тонком кишечнике (двенадцатиперстная кишка, тощая кишка, подвздошная кишка), в слепой кишке, в толстой кишке, в сигмовидной ободочной кишке и/или в прямой кишке).
Более подробно, фармацевтическая композиция вводится в целевую ткань указанного человека с целью формирования прокладки, которая затем, необязательно, подвергается эндоскопической операции, такой как процедура резекции.
Изобретение, раскрытое в настоящем описании, таким образом, также предоставляет способ для выполнения эндоскопической процедуры, при этом указанный способ включает в себя введение фармацевтической композиции в форме эмульсии или микроэмульсии человеку, при этом указанная композиция содержит по меньшей мере один инверсный термочувствительный полимер в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция остается в жидкой фазе до температуры около 40°С в условиях лабораторного испытания. Более подробно, фармацевтическая композиция вводится в целевую ткань указанного человека с целью формирования прокладки, которая затем, необязательно, подвергается эндоскопической операции, такой как процедура резекции.
Согласно изобретению, фармацевтическая композиция в форме эмульсии или микроэмульсии предпочтительно остается в жидкой фазе при температуре, составляющей от около 5°С до около 40°С, более предпочтительно, при температуре около 5°С, около 20°С, около 25°С, около 30°С и/или около 37°С в условиях лабораторного испытания.
Согласно предпочтительному варианту осуществления изобретения, фармацевтическая композиция в форме эмульсии или микроэмульсии остается в жидкой фазе как при комнатной температуре (то есть, около 20-25°С), так и при температуре тела (то есть, около 37°С) в условиях лабораторного испытания.
Согласно другому предпочтительному варианту осуществления, фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению имеет вязкость ниже около 150 сП (сантипуаз), более предпочтительно, ниже около 100 сП (сантипуаз), намного более предпочтительно, ниже около 50 сП (сантипуаз). Согласно другому предпочтительному варианту осуществления, фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению имеет вязкость ниже около 20 сП (сантипуаз), более предпочтительно, ниже около 10 сП. Согласно изобретению, указанная вязкость предпочтительно измеряется при температуре около 25°С, около 30°С и/или около 37°С, более предпочтительно, с применением Brookfield LVDV-III Ultra Programmable Rheometer™, оборудованного устройством Brookfield Small Sample Adapter™ и с использованием шпинделя Brookfield™ N. 31.
Альтернативно, указанная вязкость измеряется с применением Brookfield LVDV-III Ultra Programmable Rheometer™, оборудованного устройством Brookfield Enhanced UL Adapter™ и с использованием шпинделя Brookfield™ N. 00.
Согласно другому предпочтительному варианту осуществления изобретения, указанная эндоскопическая процедура представляет собой эндоскопическую процедуру резекции, выполняемую во время желудочно-кишечной эндоскопии, предпочтительно, полипэктомию, эндоскопическую резекцию слизистой (EMR) и/или эндоскопическое подслизистое расслоение (ESD).
Согласно изобретению, указанная эндоскопическая процедура предпочтительно представляет собой желудочно-кишечную эндоскопическую процедуру, более предпочтительно, выполняемую в пищеводе, желудке, тонком кишечнике (двенадцатиперстная кишка, тощая кишка, подвздошная кишка), в слепой кишке, в толстой кишке, в сигмовидной ободочной кишке и/или в прямой кишке.
Согласно изобретению, указанная полипэктомия, эндоскопическая резекция слизистой (EMR) и/или указанное эндоскопическое подслизистое расслоение (ESD) применяется для удаления поражений слизистой, полипов, псевдополипов, плоских полипов, аденом, пилообразных поражений, дисплазий, дисплазии Барретта, предраковых образований, неопластических образований и/или опухолей во время желудочно-кишечной эндоскопии.
Согласно изобретению, указанная полипэктомия, эндоскопическая резекция слизистой (EMR) и/или указанное эндоскопическое подслизистое расслоение (ESD) также применяются для удаления патологической и/или диспластической ткани слизистой в случае эзофагита, эрозивного эзофагита, язвы Барретта (такой как в процедурах абляции), и/или желудочно-кишечные патологические гиперсекреторные состояния, такие как синдром Золлингера-Эллисона.
Согласно варианту осуществления, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии вводится человеку через инъекцию посредством эндоскопической инъекционной иглы, оборудованной выдвигающейся иглой, и посредством шприца.
Согласно изобретению, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии может предпочтительно представлять собой эмульсию или микроэмульсию типа "вода в масле", или эмульсию или микроэмульсию типа "масло в воде". Согласно предпочтительному варианту осуществления, фармацевтическая композиция в форме эмульсии или микроэмульсии представляет собой эмульсию или микроэмульсию типа "масло в воде".
Согласно варианту осуществления, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии для применения в эндоскопической процедуре содержит:
(a) водную фазу;
(b) масляную фазу;
(c) по меньшей мере одно поверхностно-активное вещество;
(d) по меньшей мере один инверсный термочувствительный полимер;
(e) необязательно, по меньшей мере один физиологически приемлемый эксципиент;
при этом указанный по меньшей мере один инверсный термочувствительный полимер содержится в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция находится в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно другому варианту осуществления, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии для применения в эндоскопической процедуре содержит:
(a) водную фазу;
(b) масляную фазу;
(c) по меньшей мере одно поверхностно-активное вещество;
(d) по меньшей мере один инверсный термочувствительный полимер;
(e) необязательно, по меньшей мере одно вспомогательное поверхностно-активное вещество;
(f) необязательно, по меньшей мере один физиологически приемлемый эксципиент;
при этом указанный по меньшей мере один инверсный термочувствительный полимер содержится в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция находится в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно другому варианту осуществления, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии для применения в эндоскопической процедуре содержит:
(a) водную фазу;
(b) масляную фазу;
(c) по меньшей мере одно поверхностно-активное вещество;
(d) по меньшей мере один инверсный термочувствительный полимер;
(e) необязательно, по меньшей мере одно вспомогательное поверхностно-активное вещество;
(f) по меньшей мере один краситель;
(g) необязательно, по меньшей мере один физиологически приемлемый эксципиент;
при этом указанный по меньшей мере один инверсный термочувствительный полимер содержится в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция находится в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно другому варианту осуществления, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии для применения в эндоскопической процедуре содержит:
(a) водную фазу;
(b) масляную фазу;
(c) по меньшей мере одно поверхностно-активное вещество;
(d) по меньшей мере один инверсный термочувствительный полимер;
(e) необязательно, по меньшей мере одно вспомогательное поверхностно-активное вещество;
(f) по меньшей мере один краситель;
(g) необязательно, по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой;
(h) необязательно, по меньшей мере один физиологически приемлемый эксципиент;
при этом указанный по меньшей мере один инверсный термочувствительный полимер содержится в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция находится в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно другому варианту осуществления, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии для применения в эндоскопической процедуре содержит:
(a) водную фазу;
(b) масляную фазу;
(c) по меньшей мере одно поверхностно-активное вещество;
(d) по меньшей мере один инверсный термочувствительный полимер;
(е) необязательно, по меньшей мере одно вспомогательное поверхностно-активное вещество;
(f) по меньшей мере один краситель;
(g) необязательно, по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой;
(h) необязательно, по меньшей мере одно терапевтическое средство;
(i) необязательно, по меньшей мере один физиологически приемлемый эксципиент;
при этом указанный по меньшей мере один инверсный термочувствительный полимер содержится в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция находится в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно другому варианту осуществления, настоящее изобретение относится к фармацевтической композиции в форме эмульсии или микроэмульсии, которая включает, состоит или по существу состоит из:
(a) водной фазы;
(b) масляной фазы;
(c) по меньшей мере одного поверхностно-активного вещества;
(d) по меньшей мере одного инверсного термочувствительного полимера;
(e) необязательно, по меньшей мере одного вспомогательного поверхностно-активного вещества;
(f) необязательно, по меньшей мере одного красителя;
(g) необязательно, по меньшей мере одного средства, характеризуемого наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой;
(h) необязательно, по меньшей мере одного терапевтического средства;
(i) необязательно, по меньшей мере одного физиологически приемлемого эксципиента;
при этом указанный по меньшей мере один инверсный термочувствительный полимер содержится в объеме ниже критической концентрации гелеобразования (CGC), и при этом указанная композиция находится в жидкой фазе до температуры около 40°С в условиях лабораторного испытания.
Согласно изобретению, фармацевтическая композиция в форме эмульсии или микроэмульсии предпочтительно остается в жидкой фазе при температуре, составляющей от около 5°С до около 40°С, более предпочтительно, при температуре около 5°С и/или около 20°С и/или около 25°С и/или около 30°С и/или около 37°С, в условиях лабораторного испытания.
Согласно изобретению, раскрытому в настоящем описании, основным компонентом водной фазы указанной фармацевтической композиции является вода для инъекций. Как хорошо известно в технике, вода для инъекций представляет собой высокоочищенную дистиллированную воду, не содержащую солей и углеродистых примесей, и не содержащую микроорганизмов и бактериальных эндотоксинов. Вода для инъекций представляет собой воду, очищенную посредством дистилляции или процесса очистки, который эквивалентен или лучше дистилляции в отношении удаления химикатов и микроорганизмов. В некоторых вариантах осуществления изобретения, раскрытого в настоящем описании, указанная водная фаза может содержать, в растворенной форме, одну или более неорганических солей, выбранных из группы, включающей в себя, но не ограничивающейся указанным: хлориды, бромиды, йодиды, фосфаты, карбонаты, бикарбонаты, сульфаты, нитраты и т.п. В некоторых вариантах осуществления указанная водная фаза может содержать, в растворенной форме, одну или более органических солей, выбранных из группы, включающей в себя, но не ограничивающейся указанным: цитраты, малеаты, фумараты, ацетаты, лактаты и т.п. Произвольная смесь указанных выше неорганических и органических солей может использоваться для формирования подходящей фармацевтической композиции, обычно, с целью буферизации рН композиции в подходящих биологически совместимых диапазонах или с целью достижения осмотического давления, требуемого биологической средой, в которую указанная фармацевтическая композиция должна быть инъецирована. В некоторых вариантах осуществления водная фаза фармацевтической композиции, раскрытой в настоящем описании, может содержать такой объем одной или более неорганических и/или органических солей или их смесей, чтобы итоговая фармацевтическая композиция была гипотонической. В некоторых вариантах осуществления водная фаза фармацевтической композиции, раскрытой в настоящем описании, может содержать такой объем одной или более неорганических и/или органических солей или их смесей, чтобы итоговая фармацевтическая композиция была изотонической. В некоторых вариантах осуществления водная фаза фармацевтической композиции, раскрытой в настоящем описании, может содержать такой объем одной или более неорганических и/или органических солей или их смесей, чтобы итоговая фармацевтическая композиция была гипертонической. Согласно изобретению, раскрытому в настоящем описании, указанные неорганические и/или органические соли или их смеси могут присутствовать в объеме, находящемся в диапазоне от 0% до 5% по весу относительно веса композиции, более предпочтительно, от 0,1% до 4% по весу относительно веса композиции, намного более предпочтительно, от 0,5% до 3% по весу относительно веса композиции. Согласно предпочтительному варианту осуществления, указанные неорганические и/или органические соли или их смеси могут присутствовать в объеме, находящемся в диапазоне от 0,3% до 0,7% по весу относительно веса композиции.
В предпочтительном варианте осуществления водная фаза указанной фармацевтической композиции содержит растворенный хлорид натрия. Согласно последнему варианту осуществления, указанный хлорид натрия присутствует в объеме, находящемся в диапазоне от около 0% до около 5% по весу относительно веса композиции, более предпочтительно, от около 0,1% до около 3% по весу относительно веса композиции, намного более предпочтительно, от около 0,5% до около 2% по весу относительно веса композиции.
Согласно предпочтительному варианту осуществления, указанный хлорид натрия может присутствовать в объеме, находящемся в диапазоне от 0,3% до 0,7% по весу относительно веса композиции. Более предпочтительно, указанный хлорид натрия присутствует в объеме около 0,44% по весу.
В некоторых вариантах осуществления водная фаза фармацевтической композиции, раскрытой в настоящем описании, содержит буфер. В некоторых вариантах осуществления указанный буфер представляет собой фосфорнокислый буфер. В некоторых вариантах осуществления указанный буфер представляет собой цитратный буфер. В некоторых вариантах осуществления указанный буфер представляет собой бикарбонатный буфер. В предпочтительном варианте осуществления указанный буфер представляет собой фосфатный буфер, добавленный с одной или более неорганическими солями, не способными буферизовать рН. Согласно последнему варианту осуществления, концентрации указанного фосфатного буфера и указанных неорганических солей, не способных буферизовать рН, являются такими, чтобы присутствовала водная фаза, которая представляет собой фосфатно-солевой буферный раствор (PBS). Как хорошо известно в технике, PBS представляет собой основанный на воде солевой раствор, содержащий хлорид натрия, и, необязательно, хлорид калия и фосфат калия; PBS для медицинских приложений представляет собой изотонический раствор, то есть, его осмолярность и его рН соответствуют значениям для человеческого тела. Несколько композиций и способов приготовления PBS известны в технике.
Согласно изобретению, раскрытому в настоящем описании, значение рН фармацевтической композиции в форме эмульсии или микроэмульсии находится в диапазоне от около 4,0 до около 9,0, более предпочтительно, от около 5,0 до около 8,0, намного более предпочтительно, от около 5,5 до около 7,5. Согласно изобретению, значение рН указанной фармацевтической композиции в форме эмульсии или микроэмульсии может быть настроено в пределах требуемого диапазона с помощью обычных методик, известных в технике, таких как, например, добавление физиологически приемлемых оснований и/или кислот.
Согласно изобретению, раскрытому в настоящем описании, указанная масляная фаза указанной фармацевтической композиции содержит по меньшей мере одно липофильное соединение. В некоторых вариантах осуществления указанное по меньшей мере одно липофильное соединение может быть выбрано из группы природных масел, включая, но не ограничиваясь указанным: миндальное масло, масло канолы, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, сафлоровое масло, кунжутное масло, соевое масло и т.п. В некоторых вариантах осуществления указанное по меньшей мере одно липофильное соединение может быть выбрано из группы сложных эфиров жирных кислот, включая, но не ограничиваясь указанным: изопропилпальмитат, изопропилмиристат, этилолеат и т.п. В некоторых вариантах осуществления указанное по меньшей мере одно липофильное соединение может быть выбрано из группы жирных спиртов, включая, но не ограничиваясь указанным: миристиновый спирт, олеиловый спирт и т.п. В некоторых вариантах осуществления указанное по меньшей мере одно липофильное соединение может быть выбрано из группы жирных кислот, включая, но не ограничиваясь указанным: миристиновая кислота, олеиловая кислота, пальмитиновая кислота и т.п. В некоторых вариантах осуществления указанное по меньшей мере одно липофильное соединение может быть выбрано из группы триглицеридов, таких как длинно- и/или среднецепочечные триглицериды и т.п. В некоторых вариантах осуществления указанное по меньшей мере одно липофильное соединение может быть выбрано из группы диглицеридов. В некоторых вариантах осуществления указанное по меньшей мере одно липофильное соединение может быть выбрано из группы моноглицеридов. Любая смесь указанных выше липофильных соединений может использоваться для формирования подходящей фармацевтической композиции. В одном из вариантов осуществления липофильное соединение указанной масляной фазы представляет собой кунжутное масло. В другом варианте осуществления липофильное соединение указанной масляной фазы представляет собой миндальное масло. В другом варианте осуществления липофильные соединения указанной масляной фазы представляют собой среднецепочечные триглицериды. В предпочтительном варианте осуществления липофильное соединение указанной масляной фазы представляет собой соевое масло.
Согласно изобретению, раскрытому в настоящем описании, масляная фаза указанной фармацевтической композиции находится в диапазоне от около 0,001% до 20% по весу относительно веса композиции, предпочтительно, от около 0,01% до около 2% по весу относительно веса композиции, более предпочтительно, от около 0,02% до около 1% по весу относительно веса композиции. Согласно предпочтительному варианту осуществления, указанная масляная фаза содержится в композиции по изобретению в количестве от около 0,01% по весу до около 0,5% по весу относительно веса композиции.
Более предпочтительно, масляная фаза содержится в композиции по изобретению в количестве около 0,08% по весу или около 0,16% по весу относительно веса композиции. Намного более предпочтительно, указанная масляная фаза содержится в композиции по изобретению в количестве около 0,02% по весу, или около 0,05% по весу, или около 0,1% по весу относительно веса композиции. Согласно изобретению, раскрытому в настоящем описании, фармацевтическая композиция в форме эмульсии или микроэмульсии содержит по меньшей мере один инверсный термочувствительный полимер в концентрации ниже критической концентрации гелеобразования (CGC). Соответственно, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии не может перейти из жидкой фазы в гелевую фазу в качестве реакции на повышение температуры до 40°С в условиях лабораторного испытания, например, от комнатной температуры (то есть около 20-25°С) до температуры тела (то есть, около 37°С). Таким образом, указанная фармацевтическая композиция в форме эмульсии или микроэмульсии согласно изобретению, раскрытому в настоящем описании, находится в жидкой фазе до температуры около 40°С, предпочтительно, как при комнатной температуре (то есть, около 20-25°С), так и при температуре тела (то есть, около 37°С) в условиях лабораторного испытания. Каждый тип инверсного термочувствительного полимера характеризуется определенной критической концентрацией гелеобразования (CGC); такие концентрации известны в технике и могут быть легко найдены в научной литературе. Согласно изобретению, раскрытому в настоящем описании, указанный по меньшей мере один инверсный термочувствительный полимер может быть выбран из группы, включающей в себя, но не ограничивающейся указанными: блочные сополимеры полиэтиленоксида-полиоксипропилена, такие как полоксамеры и т.п., при этом указанный полоксамер может быть выбран из группы, включающей в себя, но не ограничивающейся указанным: полоксамер 124, полоксамер 188, полоксамер 237, полоксамер 338, полоксамер 407 и т.п. Любая смесь указанных выше инверсных термочувствительных полимеров может использоваться для формирования подходящей фармацевтической композиции. В предпочтительном варианте осуществления, указанный по меньшей мере один инверсный термочувствительный полимер в указанной фармацевтической композиции является полоксамером 188. В предпочтительном варианте осуществления, указанный по меньшей мере один инверсный термочувствительный полимер в указанной фармацевтической композиции является полоксамером 407. Кроме того, в другом предпочтительном варианте осуществления указанный по меньшей мере один инверсный термочувствительный полимер является смесью полоксамера 188 и полоксамера 407.
Согласно изобретению, целесообразные инверсные термочувствительные полимеры покупают на рынке и используют без каких-либо этапов очистки.
Согласно изобретению, раскрытому в настоящем описании, указанный по меньшей мере один инверсный термочувствительный полимер присутствует в объеме ниже критической концентрации гелеобразования (CGC), предпочтительно, ниже около 15% по весу относительно веса фармацевтической композиции, более предпочтительно, между около 2% и около 14,5% по весу относительно веса фармацевтической композиции, намного более предпочтительно, между около 3% и около 12% по весу относительно веса фармацевтической композиции, кроме того, намного более предпочтительно между около 5% и около 11% по весу относительно веса фармацевтической композиции. Предпочтительно, указанный по меньшей мере один инверсный термочувствительный полимер присутствует в количестве около 7%, или около 8%, или около 9%, или около 10% по весу относительно веса композиции.
Согласно варианту осуществления, указанный по меньшей мере один инверсный термочувствительный полимер является полоксамером 407, и он содержится в количестве около 9% по весу относительно веса композиции.
Согласно другому варианту осуществления, указанный по меньшей мере один инверсный термочувствительный полимер является полоксамером 188, и он содержится в количестве около 10% по весу относительно веса композиции.
Согласно еще одному предпочтительному варианту осуществления, указанный по меньшей мере один инверсный термочувствительный полимер является смесью полоксамера 188 и полоксамера 407, и такая смесь содержится в количестве около 10% по весу относительно веса композиции.
Согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно поверхностно-активное вещество может быть выбрано из группы неионогенных поверхностно-активных веществ, включающей в себя, но не ограничивающейся указанным: поверхностно-активные вещества сложных моноэфиров жирных кислот и PEG, такие как PEG-15 гидроксистеарат, PEG-30 стеарат, PEG-40 лаурат, PEG-40 олеат и т.п.; поверхностно-активные вещества диэфиров моноэфиров жирных кислот и PEG, такие как PEG-32 диолеат, PEG-400 диолеат и т.п.; полиоксиэтиленовые эфиры сорбита и жирной кислоты, такие как полисорбат 20, полисорбат 60, полисорбат 80 и т.п.; алкиловые эфиры полиоксиэтелена, такие как PEG-20 цетостеариловый эфир, полиоксил 25 цетостеариловый эфир, цетомакрогол 1000 и т.п.; поверхностно-активные вещества сложных эфиров сорбита и жирной кислоты, такие как сорбитанмонолаурат, сорбитанмонопальмитат, сорбитанмоноолеат, и т.п.; пропиленгликолевые сложные эфиры жирных кислот; полиглицериновые сложные эфиры жирных кислот; производные полиоксиэтиленового касторового масла, такие как полиоксил 5 касторового масла, полиоксил 15 касторового масла, полиоксил 35 касторового масла, полиоксил 40 гидрогенизованного касторового масла и т.п.; каприлокаприл полиоксил-8 глицериды; полиоксилглицериды, такие как каприлокапроил полиоксилглицериды, лауроил полиоксилглицериды, олеоил полиоксилглицериды и т.п., цетеарет 16, цетеарет 20, стеарет 10, стеарет 20, цетет 20 и т.п. Любая смесь указанных выше неионогенных поверхностно-активных веществ может использоваться для формирования подходящей фармацевтической композиции. В одном из вариантов осуществления неионогенное поверхностно-активное вещество представляет собой полисорбат 80, В предпочтительном варианте осуществления неионогенное поверхностно-активное вещество представляет собой PEG-15 гидроксистеарат (также известный как полиоксил-15-гидроксистеарат).
Согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно поверхностно-активное вещество может быть выбрано из группы ионных поверхностно-активных веществ, включающей в себя, но не ограничивающейся указанным: яичный лецитин, гидрогенизированный фосфатидилхолин из яичного лецитина, соевый лецитин, гидрогенизированный соевый лецитин, глицерофосфохолин, соевый лизолецитин, фосфолипиды, гидрогенизированные фосфолипиды, лаурилсульфат натрия и т.п. Любая смесь указанных выше ионных поверхностно-активных веществ может использоваться для формирования подходящей фармацевтической композиции. Указанные выше ионные поверхностно-активные вещества коммерциализированы фирмой Lipoid под зарегистрированным патентованным названием Lipoid®. В одном из вариантов осуществления ионное поверхностно-активное вещество представляет собой яичный лецитин. В другом варианте осуществления ионное поверхностно-активное вещество представляет собой гидрогенизированный фосфатидилхолин из яичного лецитина. В другом варианте осуществления ионное поверхностно-активное вещество представляет собой соевый лецитин. Кроме того, в другом варианте осуществления, ионное поверхностно-активное вещество представляет собой гидрогенизированный соевый лецитин.
Согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно поверхностно-активное вещество содержится в количестве, которое находится в диапазоне от около 0,001% до около 10% по весу относительно веса фармацевтической композиции, предпочтительно, от около 0,005% до около 5% по весу относительно веса фармацевтической композиции, более предпочтительно, от около 0,01% до около 2% по весу относительно веса фармацевтической композиции. Согласно предпочтительному варианту осуществления, указанное по меньшей мере одно поверхностно-активное вещество содержится в количестве около 0,08%, или около 0,1%, или около 0,5%, или около 0,6% по весу относительно веса фармацевтической композиции.
Фармацевтическая композиция по изобретению, раскрытому в настоящем описании, может содержать по меньшей мере одно вспомогательное поверхностно-активное вещество. Добавление по меньшей мере одного вспомогательного поверхностно-активного вещества к смеси масляная фаза - поверхностно-активное вещество водная фаза является выгодным, поскольку вспомогательное поверхностно-активное вещество действует синергично с поверхностно-активным веществом в отношении снижения поверхностного натяжения капель дисперсной фазы эмульсии или микроэмульсии, оказывая стабилизирующее влияние на систему. При приготовлении фармацевтических композиций в форме эмульсий или микроэмульсий согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно вспомогательное поверхностно-активное вещество может быть выбрано из группы, включающей в себя, но не ограничивающейся указанным: коротко- и среднецепочечные спирты, такие как этанол, пропанол, изопропанол и т.п.; гликоли, такие как пропиленгликоль и т.п.; полиэтиленгликоли, такие как PEG-200, PEG-300, PEG-400 и т.п.; диметилсульфоксид; длинноцепочечные спирты, такие как цетиловый спирт, миристиловый спирт, олеиловый спирт и т.п.; глицерин; короткоцепочечные сложные эфиры, такие как этилацетат, этиллактат и т.п.; сложные эфиры жирных кислот, такие как этилолеат, изопропилмиристат, изопропилпальмитат и т.п.; жирные кислоты, такие как олеиновая кислота, миристиновая кислота и т.п.; соли жирных кислот, такие как олеат натрия, пальмитат натрия, стеарат натрия и т.п. Любая смесь указанных выше вспомогательных поверхностно-активных веществ может использоваться для формирования подходящей фармацевтической композиции. В одном из вариантов осуществления вспомогательное поверхностно-активное вещество представляет собой пропиленгликоль. В другом варианте осуществления вспомогательное поверхностно-активное вещество представляет собой глицерин. В другом варианте осуществления вспомогательное поверхностно-активное вещество представляет собой олеат натрия. В предпочтительном варианте осуществления вспомогательное поверхностно-активное вещество представляет собой смесь глицерина и олеата натрия.
Согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно вспомогательное поверхностно-активное вещество содержится в количестве, которое находится в диапазоне от около 0,00001% до около 1% по весу относительно веса фармацевтической композиции, предпочтительно, от около 0,00005% до около 0,05% по весу относительно веса фармацевтической композиции, более предпочтительно, от около 0,0001% до около 0,01% по весу относительно веса фармацевтической композиции.
Фармацевтическая композиция по изобретению, раскрытому в настоящем описании, может содержать по меньшей мере один краситель. Красители широко используются в композициях для эндоскопических процедур. В частности, в композициях для процедур EMR и/или ESD, красители полезны для демонстрации границ поражения, которое будет подвергнуто резекции, и физиологических структур, лежащих под слизистой; таким образом, эндоскопист может легко визуализировать поражение, которое он должен удалить, и он может выполнить процедуру с меньшим риском повреждения слоя подслизистой или мышечной ткани. Краситель имеет функцию сразу же делать видимым слой подслизистой для эндоскописта, с тем чтобы операция была более безопасной и присутствовал меньший риск повреждения структур под слизистой, таких как сам слой подслизистой и внешняя мышечная стенка.
При приготовлении фармацевтической композиции согласно изобретению, раскрытому в настоящем описании, указанный по меньшей мере один краситель может быть выбран из витальных красителей (или абсорбционных красителей), невитальных красителей (или контрастных красителей), и реактивных красителей. Витальные (или абсорбционные) красители, такие как раствор Люголя и метиленовый синий, идентифицируют определенные типы эпителиальных клеток посредством избирательного поглощения или диффузии через клеточную мембрану; невитальные (или контрастные) красители, такие как индигокармин, просачиваются через щели в слизистой и подчеркивают топографию поверхности и неравномерности слизистой; реактивные красители, такие как конго красный и феноловый красный, вступают в химические реакции с определенными компонентами клеток, что приводит к изменениям цвета, аналогичным рН-метру. Согласно изобретению, раскрытому в настоящем описании, указанный витальный (или абсорбционный) краситель может быть выбран из группы, включающей, но не ограничивающейся указанным: раствор Люголя, метиленовый синий, толуидиновый синий, кристаллический фиолетовый и т.п. Согласно изобретению, раскрытому в настоящем описании, указанный невитальный (или контрастный) краситель может быть выбран из группы, включающей, но не ограничивающейся указанным: индигокармин и т.п. Согласно изобретению, раскрытому в настоящем описании, указанный реактивный краситель может быть выбран из группы, включающей, но не ограничивающейся указанным: Конго красный, феноловый красный и т.п. Любая смесь указанных выше красок может использоваться для формирования подходящей фармацевтической композиции. Согласно предпочтительному варианту осуществления, указанный по меньшей мере один краситель представляет собой метиленовый синий. Согласно другому предпочтительному варианту осуществления, указанный по меньшей мере один краситель представляет собой индигокармин.
Согласно изобретению, раскрытому в настоящем описании, указанный по меньшей мере один краситель содержится в количестве, которое находится в диапазоне от около 0,0001% до около 0,2% по весу относительно веса фармацевтической композиции, предпочтительно, от около 0,0002% до около 0,05% по весу относительно веса фармацевтической композиции, более предпочтительно, от около 0,0005% до около 0,01% по весу относительно веса фармацевтической композиции. Намного более предпочтительно, указанный по меньшей мере один краситель содержится в композиции по изобретению в количестве около 0,001% по весу или около 0,002% по весу относительно веса композиции.
Фармацевтическая композиция по изобретению, раскрытому в настоящем описании, может содержать по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой. Трофические средства представляют собой вещества, которые могут способствовать росту, дифференциации и выживанию клеток. В желудочно-кишечной эндоскопии после процедур резекции, таких как полипэктомия, EMR и/или ESD, обычно не проводится зашивание. Другими словами, как только поражение было удалено посредством одной из указанных процедур, слизистая не зашивается, и рана оставляется открытой; таким образом, заживление раны должно происходить естественным образом. В этом смысле, включение в фармацевтические композиции по изобретению по меньшей мере одного средства, которое, как было доказано, обладает трофической активностью на эпителиальных клетках желудочно-кишечной слизистой оболочки, может быть выгодным, поскольку указанные фармацевтические композиции могли бы оказывать положительное, благоприятное воздействие на заживление ран, способствуя росту и дифференциации клеток с целью более быстрого смыкания и заживления раны, возникшей в результате хирургии.
При приготовлении фармацевтических композиций в форме эмульсий или микроэмульсий согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой, может быть выбрано из группы, включающей в себя, но не ограничивающейся указанным: аминокислоты и их соли, такие как аргинин, глютамин, глутаминовая кислота, цитруллин, пролин, цистеин и т.п.; короткоцепочечные жирные кислоты (SCFA) и их соли, такие как уксусная кислота и ее соли, пропионовая кислота и ее соли, масляная кислота и ее соли, и т.п.; углеводы, такие как глюкоза, фруктоза, галактоза, сахароза, солодовый сахар, лактоза и т.п.; полиамины и их соли, такие как путресцин, спермидин, спермин и т.п.; жирные кислоты и их соли, такие как олеиновая кислота и ее соли, линолевая кислота и ее соли, миристиновая кислота и ее соли, стеариновая кислота и ее соли и т.п.; витамины, такие как витамин А, витамин В2, витамин С, витамин D, и т.п. Любая смесь указанных выше средств, характеризуемых наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой, может использоваться для формирования подходящей фармацевтической композиции. В одном из вариантов осуществления по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой, представляет собой бутират натрия. В другом варианте осуществления по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой, представляет собой витамин В2 натрия. В предпочтительном варианте осуществления по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой, представляет собой глутаминовую кислоту.
Согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно средство, характеризуемое наличием трофической активности на эпителиальных клетках желудочно-кишечной слизистой, содержится в количестве, которое находится в диапазоне от около 0,01% до около 5% по весу относительно веса фармацевтической композиции, предпочтительно от около 0,05% до около 3% по весу относительно веса фармацевтической композиции, более предпочтительно от около 0,1% до около 2% по весу относительно веса фармацевтической композиции.
Фармацевтическая композиция по изобретению, раскрытому в настоящем описании, может содержать по меньшей мере одно терапевтическое средство. При приготовлении фармацевтических композиций в форме эмульсий или микроэмульсий согласно изобретению, раскрытому в настоящем описании, указанное по меньшей мере одно терапевтическое средство может быть выбрано из группы, включающей в себя, но не ограничивающейся указанным: антибиотики, такие как пенициллины, цефалоспорины, аминогликозиды, макролиды, рифамицины, метронидазол и т.п.; нестероидные противовоспалительные препараты, такие как кеторолак и его соли, индометацин, пироксикам, кетопрофен и их соли, и метамизол и его соли, и т.п.; стероидные противовоспалительные препараты, такие как кортизол, преднизолон и их сложные эфиры, метилпреднизолон и его сложные эфиры, триамцинолона ацетонид, бетаметазон и их сложные эфиры, и т.п.; местные обезболивающие, такие как лидокаин и его соли, мепивакаин и его соли, бупивакаин и его соли, и т.п.; сосудосуживающие препараты, такие как эпинефрин и его соли, норэпинефрин и его соли, и т.п. Любая смесь указанных выше терапевтических средств может использоваться для формирования подходящей фармацевтической композиции и достигать определенных терапевтических эффектов. В одном из вариантов осуществления указанное по меньшей мере одно терапевтическое средство представляет собой местное обезболивающее, такое как лидокаин. В другом варианте осуществления указанное по меньшей мере одно терапевтическое средство представляет собой сосудосуживающее лекарственное средство, такое как гидрохлорид эпинефрина. Кроме того, в другом варианте осуществления, фармацевтическая композиция согласно изобретению, раскрытому в настоящем описании, содержит местное обезболивающее и сосудосуживающее лекарственное средство, такое как гидрохлорид эпинефрина и лидокаин.
Дополнительно, по меньшей мере один физиологически приемлемый эксципиент может быть добавлен к фармацевтической композиции согласно изобретению, раскрытому в настоящем описании, с целью получения итоговой композиции для применения в эндоскопических процедурах, обеспечивающей подходящие характеристики и стабильность. В качестве примера, указанный по меньшей мере один физиологически приемлемый эксципиент может быть выбран из антиоксидантов, хелирующих средств, консервантов, бактерицидных добавок, полимеров, обладающих биоадгезивными свойствами, средств повышения вязкости, растворителей и т.п.
Фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, может быть упакована в основных упаковочных конфигурациях, известных в технике. Подходящие основные типы упаковки могут быть выбраны из группы, включающей в себя, но не ограниченной указанным: ампулы, пробирки, бутылки, предварительно заправленные шприцы и т.п. В одном из вариантов осуществления фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, упаковывается в 5 мл или 10 мл предварительно заправленные шприцы. В предпочтительном варианте осуществления фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, упаковывается в 10 мл, 20 мл или 50 мл пробирки. В другом предпочтительном варианте осуществления фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, упаковывается в 10 мл, 20 мл или 50 мл ампулы. Фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, вводится посредством эндоскопических инъекционных игл. Предпочтительно, композиция вводится вручную при комнатной температуре.
Другой аспект изобретения, раскрытого в настоящем описании, предоставляет набор для применения в эндоскопической процедуре, при этом указанный набор содержит:
a) фармацевтическую композицию в форме эмульсии или микроэмульсии согласно изобретению, раскрытому в настоящем описании;
b) эндоскопическую инъекционную иглу;
c) инструкцию по применению.
При подготовке указанного набора указанная фармацевтическая композиция в форме эмульсии или микроэмульсии согласно изобретению, раскрытому в настоящем описании, может быть упакована в основных упаковочных конфигурациях, известных в технике. Подходящие основные типы упаковки могут быть выбраны из группы, включающей в себя, но не ограниченной указанным: ампулы, пробирки, баллоны, предварительно заправленные шприцы и т.п. В варианте осуществления, в подготовке указанного набора, фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, упаковывается в 5 мл, или 10 мл предварительно заправленные шприцы. В предпочтительном варианте осуществления при подготовке указанного набора фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, упаковывается в 10 мл, 20 мл или 50 мл пробирки. В другом предпочтительном варианте осуществления при подготовке указанного набора фармацевтическая композиция в форме эмульсии или микроэмульсии по изобретению, раскрытому в настоящем описании, упаковывается в 10 мл, 20 мл или 50 мл ампулы. При подготовке указанного набора согласно изобретению, раскрытому в настоящем описании, подходящие эндоскопические инъекционные иглы могут иметь диаметр иглы в пределах от 12 калибра до 35 калибра, предпочтительно, от 15 калибра до 30 калибра, более предпочтительно, от 17 калибра до 28 калибра. При подготовке указанного набора согласно изобретению, раскрытому в настоящем описании, подходящие эндоскопические инъекционные иглы могут иметь длину в диапазоне от 100 см до 300 см, предпочтительно, от 120 см до 260 см, более предпочтительно, от 140 см до 250 см. При подготовке указанного набора согласно изобретению, раскрытому в настоящем описании, подходящие эндоскопические инъекционные иглы могут иметь наружный диаметр в диапазоне от 1,0 мм до 4,0 мм, предпочтительно, от 1,5 мм до 3,0 мм, более предпочтительно, от 1,8 мм до 2,5 мм. При подготовке указанного набора согласно изобретению, раскрытому в настоящем описании, подходящие эндоскопические инъекционные иглы могут состоять из материалов, выбранных из группы, включающей в себя, но не ограничивающейся указанным: полимеры или сополимеры, такие как полиэтилен (РЕ), полипропилен (РР), поливинилхлорид (PVC), поликарбонат (ОС), политетрафторэтилен (PTFE), полиэтилентерефталат (PET), полистирол (PS), полиамид (РА), эпоксидные смолы, полиуретан, полиэфир, полиметилметакрилат и т.п.; резиновые изделия, такие как силиконовый каучук, натуральный каучук и т.п.; металлы и металлические сплавы, такие как алюминий, титан, железо, хром, никель, молибден, нержавеющая сталь, и т.п. Любая комбинация указанных выше материалов может использоваться для формирования подходящих эндоскопических инъекционных игл. Эндоскопические инъекционные иглы, подходящие для подготовки набора согласно изобретению, раскрытому в настоящем описании, могут быть легко найдены на рынке; в качестве примера, подходящая инъекционная игла может быть выбрана из имеющихся на рынке инъекционных игл, включающих, но не ограничивающихся указанным, изменяемые иглы для инъекций Cook® AcuJect®, изменяемые иглы для инъекций Cook® Injectaflow®, катетеры с иглами для инъекционной терапии Boston Scientific® Interject®, иглы для инъекций G-Flex®, иглы для склеротерапии Endo-Flex®, иглы для инъекций ConMed™ Click-Tip™, иглы для инъекций Medi-Globe® Injectra®, Olympus® InjectorForce Max™, иглу для инъекций US Endoscopy™ Articulator™, иглу для инъекций US Endoscopy™ Vari-Safe™, игольчатые катетеры для инъекций Kimberly-Clarck™, и т.п.
В предпочтительном применении изобретения фармацевтическая композиция в форме эмульсии или микроэмульсии согласно изобретению, раскрытому в настоящем описании, применяется в эндоскопической процедуре резекции путем всасывания объема эмульсии из его первичной упаковки посредством шприца, инъецирования подходящего объема указанной эмульсии посредством эндоскопической инъекционной иглы, вставленной в рабочий канал эндоскопа непосредственно под поверхностным слоем подслизистой, с целью отложения объема жидкости в слое подслизистой, который становится прокладкой при нахождении в нужном месте: повышение поверхности слизистой позволяет эндоскописту легко выполнить резекцию поражения слизистой, найденного во время выполнения эндоскопической процедуры, даже если поражение является плоским и, таким образом, не выступает в кишечную, или пищеводную, или желудочную полость.
Согласно предпочтительному варианту осуществления изобретения, раскрытого в настоящем описании, фармацевтическая композиция в форме эмульсии или микроэмульсии находится в жидкой фазе как при комнатной температуре (то есть, около 20-25°С), так и при температуре тела (то есть, около 37°С). Согласно другому предпочтительному варианту осуществления, указанная композиция имеет вязкость ниже около 150 сП (сантипуаз), более предпочтительно, ниже около 100 сП (сантипуаз), намного более предпочтительно, ниже около 50 сП (сантипуаз). Согласно другому предпочтительному варианту осуществления, указанная композиция имеет вязкость ниже около 20 сП (сантипуаз), предпочтительно, ниже около 10 сП (сантипуаз).
Согласно изобретению, указанная вязкость измеряется при температуре около 25°С, около 30°С и/или около 37°С, предпочтительно, с применением Brookfield LVDV-III Ultra Programmable Rheometer™, оборудованного устройством Brookfield Small Sample Adapter™ и с использованием шпинделя Brookfield™ N. 31. Альтернативно, указанная вязкость измеряется с применением, Brookfield LVDV-III Ultra Programmable Rheometer™, оборудованного устройством Brookfield Enhanced UL Adapter™ и с использованием шпинделя Brookfield™ N. 00.
В предпочтительном варианте осуществления вязкость указанной фармацевтической композиции в форме эмульсии или микроэмульсии, измеренная при 25°С, ниже 150 сП, предпочтительно, ниже 100 сП, более предпочтительно, ниже 50 сП. В предпочтительном варианте осуществления вязкость указанной фармацевтической композиции в форме эмульсии или микроэмульсии, измеренная при 30°С, ниже 150 сП, предпочтительно, ниже 100 сП, более предпочтительно, ниже 50 сП. В предпочтительном варианте осуществления вязкость указанной фармацевтической композиции в форме эмульсии или микроэмульсии, измеренная при 37°С, ниже 150 сП, предпочтительно, ниже 100 сП, более предпочтительно, ниже 50 сП. В более предпочтительном варианте осуществления вязкость указанной фармацевтической композиции в форме эмульсии или микроэмульсии, измеренная при 25°С, при 30°С и/или при 37°С, ниже 20 сП, предпочтительно, ниже 10 сП.
Присутствие по меньшей мере одного красителя в прокладке помогает эндоскописту визуализировать структуры под слизистой (например, слой подслизистой и внешнюю мышечную стенку), таким образом, понижая риск того, что эндоскопист при выполнении процедуры резекции может вызвать повреждение указанных структур: фактически, краситель позволяет ему различить полость прокладки и основание слизистой. Удаление поражения с поверхности создает отверстие в основании, которое должно быть вылечено, и присутствие, в фармацевтической композиции согласно изобретению, раскрытому в настоящем описании, средства, характеризуемого трофической активностью на эпителиальных клетках желудочно-кишечной слизистой, имеет своей целью ускорение заживления раны на слизистой. Устойчивость прокладки, созданной инъецированным объемом фармацевтической композиции в форме эмульсии или микроэмульсии согласно изобретению, раскрытому в настоящем описании, является достаточно долгосрочной для того, чтобы обеспечить возможность выполнения процедуры резекции без необходимости повторного инъецирования указанной композиции каждые несколько минут, как это обычно происходит при использовании физиологического раствора.
Ввиду вышеизложенного, первое преимущество, обеспечиваемое композицией в форме эмульсии или микроэмульсии по изобретению, состоит в обеспечении возможности введения при комнатной температуре (20-25°С) без необходимости охлаждения композиции и/или эндоскопической инъекционной иглы.
Второе преимущество композиции по изобретению состоит в избегании какого-либо риска наличия нежелательного гелеобразования в эндоскопической инъекционной игле во время эндоскопической процедуры.
Еще одно преимущество композиции по изобретению состоит в способности обеспечить высокую и/или достаточно долговечную прокладку для того, чтобы обеспечить безопасное завершение эндоскопической процедуры резекции, такой как полипэктомия, EMR и/или ESD.
Еще одно преимущество состоит в возможности добавления по меньшей мере одного красителя, посредством чего достигается улучшение видимости слоя подслизистой для оператора, в результате чего повышается безопасность и снижается риск повреждения структур под слизистой.
Еще одно преимущество состоит в возможности добавления по меньшей мере одного трофического средства, посредством чего достигается улучшение заживления раны на слизистой, с поддержкой клеточного роста и соответствующей дифференциации.
ОПРЕДЕЛЕНИЯ
Ссылки в спецификации на «вариант осуществления», «один из вариантов осуществления» и т.п. указывают, что описанный вариант осуществления может включать конкретный аспект, свойство, структуру или характеристику. Кроме того, такие фразы могут, но не обязательно, относиться к одному и тому же варианту осуществления, указанному в других местах спецификации. Кроме того, когда конкретный аспект, свойство, структура или характеристика описываются в связи с вариантом осуществления, специалист в данной области техники может в пределах своей компетенции соединить или связать указанный аспект, свойство, структуру или характеристику с другими вариантами осуществления, независимо от того, описаны ли они в явном виде или нет.
Термины "содержащий", "имеющий", "включающий" и "охватывающий" должны рассматриваться как открытые термины (то есть, означающие «включающий, но не ограниченный указанным»), и должны рассматриваться как также поддерживающие такие термины, как «состоит по существу из», «состоящий по существу из», «состоит из» или «состоящий из».
Термины «состоит по существу из», «состоящий по существу из» должны рассматриваться как полузакрытые термины, означающие, что никакие другие ингредиенты, которые оказывают существенное влияние на базовые и новые характеристики (и, необязательно, физиологически приемлемые эксципиенты и/или адъюванты) по изобретению не будут включены.
Термины «состоит из», «состоящий из» должны рассматриваться как закрытые термины.
Формы единственного числа включают ссылки на множественное число, если контекст явным образом не указывает обратное. Таким образом, например, ссылка на «соединение» включает множество таких соединений. Также следует отметить, что пункты формулы изобретения могут быть построены таким образом, чтобы исключать любой необязательный элемент. Таким образом, данная формулировка предназначена, чтобы служить предпосылкой для применения исключающей терминологии, такой как "исключительно", "только", и т.п., в связи с изложением элементов пунктов формулы изобретения или применением "негативного" ограничения.
Термин "и/или" означает любые из элементов, любую комбинацию элементов или все элементы, с которыми связан этот термин.
Если в настоящем описании не указано другое, термин "около" предназначен для включения значений, например, процентов по весу, ближайших к указанному диапазону, которые являются эквивалентными с точки зрения функциональности отдельного ингредиента, композиции, или варианта осуществления.
Специалисту в данной области техники будет понятно, что для всех возможных целей, особенно с точки зрения предоставления письменного описания, все диапазоны, указанные в настоящем описании, также охватывают все возможные поддиапазоны и комбинации поддиапазонов, а также отдельные значения, составляющие диапазон, в частности, целочисленные значения. Указанный диапазон включает каждое конкретное значение, целое число, десятичное число, или единичный элемент в пределах диапазона.
Специалисту в данной области техники будет понятно, что, когда элементы группируются обычным образом, например, как в случае группы Маркуша, изобретение охватывает не только всю группу, указанную в целом, но и каждый элемент группы индивидуально и все возможные подгруппы основной группы. Дополнительно, для всех целей, изобретение охватывает не только основную группу, но также и основную группу, в которой отсутствуют один или более элементов группы. Изобретение, таким образом, предусматривает явное исключение любого одного или более элементов указанной группы. Соответственно, условия могут применяться к любой из раскрытых категорий или вариантов осуществления, при этом любой один или более указанных элементов, разновидностей или вариантов осуществления могут быть исключены из таких категорий или вариантов осуществления, например, при использовании в явном негативном ограничении.
Как хорошо известно в технике, термин "эмульсия" относится к гетерогенной композиции, состоящей из двух несмешивающихся жидкостей (условно описанных как масло и вода), одна из которых рассеивается в форме мелких капель равномерно по всей другой жидкости. Фаза, присутствующая в форме мелких капель, называется дисперсной, рассеянной или внутренней фазой, а поддерживающая жидкость называется дисперсионной средой или внешней фазой. Эмульсии удобно классифицируются как «масло в воде» (o/w) или «вода в масле» (w/o), в зависимости от того, является ли дисперсионная среда водной или масляной.
"Микроэмульсии" являются термодинамически стабильными, прозрачными (или просвечивающими) дисперсиями масла и воды, которые стабилизируются посредством граничной пленки молекул поверхностно-активного вещества. Поверхностно-активное вещество может быть чистым, являться смесью, или быть скомбинированным с вспомогательным поверхностно-активным веществом, таким как среднецепочечный спирт. Микроэмульсии легко отличают от нормальных эмульсий по их прозрачности, их низкой вязкости, и, более существенно, по их термодинамической стабильности и способности к спонтанному образованию. Однако, разделительная линия между размером раздутой мицеллы (~10-140 нм) и каплей тонкодисперсной эмульсии (~100-600 нм) не задана четко, несмотря на то, что микроэмульсии являются высоко лабильными системами, и микроэмульсионная капля может исчезнуть в пределах доли секунды, в то время как другая капля спонтанно образуется в другом месте в системе. Указанные выше определения "эмульсии" и "микроэмульсии" были взяты из Gillian М. Eccleston «Emulsion and Microemulsion» Encyclopedia of Pharmaceutical Technology, 2007, 3rd edition, Informa Healtcare.
Термин «эндоскопическая резекция слизистой» (EMR) относится к эндоскопической методике, разработанной для удаления прикрепленных или плоских новообразований, ограниченных поверхностными слоями (слизистая и подслизистая) ЖК тракта.
Термин «эндоскопическое расслоение слизистой» (ESD) относится к эндоскопической методике, разработанной специально для удаления больших поражений.
«Эндоскопические инъекционные иглы», также известные под названиями «инъекционные иглы», или «инъекционные игольчатые катетеры», или «эндоскопические инъекционные игольчатые катетеры», представляют собой устройства, которые могут иметь длину вплоть до около 230 см, и которые включают относительно длинный катетер, в пределах которого размещена с возможностью скольжения внутренняя инъекционная трубка, на дальнем конце которой находится инъекционная игла. Обычно, ближняя активизирующая ручка соединена с катетером и инъекционной трубкой с целью перемещения одного относительно другого при необходимости. Игла обычно является выдвижной. Жидкостный доступ к инъекционной трубке обычно обеспечивается через люэровский соединитель на ручке. Эндоскопические инъекционные игольные устройства обычно доставляются к месту инъекции через рабочий канал эндоскопа. Для того, чтобы защитить полость рабочего канала эндоскопа от повреждения, ручкой инфузионного игольного устройства манипулируют с целью извлечения дистальной инъекционной иглы в полость катетера до вставки устройства в эндоскоп. Это важно для предотвращения выставления острой точки инъекционной иглы, когда устройство перемещается через полость эндоскопа. Когда дальний конец эндоскопического инъекционного игольного устройства располагается в месте инъекции, его ручкой снова управляют, чтобы переместить инъекционную иглу дистально из полости катетера. При выдвижении в самое дальнее положение, длина выдвинутой части инъекционной иглы составляет около 4-6 мм.
«В условиях лабораторного испытания» или «в лабораторных условиях», или «в лабораторных тестах», при использовании в настоящем описании, относится к условиям in vitro, таким как способы, оборудование и инструменты, обычно применяемые в лабораторных испытаниях для выполнения физико-химической характеризации композиции. Термин относится к способам, оборудованию и инструментам, применяемым и выполняемым в лаборатории. В качестве примера, определение вязкости или анализ в климатической камере, описанные в примерах 6 и 7, приведенных ниже в настоящем описании и применяемые для проверки того, находится ли композиция в жидкой фазе или в фазе геля, представляют собой испытания, выполняемые в лаборатории, и таким образом, они выполняются в «условиях лабораторного испытания».
«До 40°С» или «температура до 40°С» относится к произвольной температуре, находящейся между 5°С и 40°С, предпочтительно, составляющей около 5°С, около 20°С, около 25°С, около 30°С и/или 37°С.
"Температура тела" относится к уровню тепла, произведенного и поддерживаемого посредством процессов, происходящих в организме. Тепло вырабатывается в пределах тела через метаболизм питательных веществ и теряется с поверхности тела через излучение, конвекцию и испарения потоотделения. Выработка и потеря тепла регулируются и управляются в гипоталамусе и стволовой области мозга. Нормальная температура тела взрослого человека, при пероральном измерении, составляет 37°С, при этом в течение дня обычно регистрируются небольшие ее изменения.
"Комнатная температура" (RT) обычно определяется как температура окружающего воздуха в любой окружающей среде, используемой для заданной процедуры. Более конкретно, она задается как 20-25°С, поскольку некоторые температуры окружающей среды, по своей природе, не попадают в этот диапазон. Обычно, протоколы, в которых указывается, чтобы шаги выполнялись при RT, требуют, чтобы температуры не падали ниже 18°С и не превышали 27°С.
«Критическая концентрация гелеобразования» (CGC), для композиции, содержащей инверсный термочувствительный полимер, представляет собой концентрацию указанного полимера, выше которой указанная композиция в состоянии перейти из жидкой фазы в гелевую фазу в качестве реакции на повышение температуры.
«Критическая температура гелеобразования» (CGT) представляет собой температуру, выше которой композиция, содержащая инверсный термочувствительный полимер в концентрации, равной или превышающей критическую концентрацию гелеобразования, переходит из жидкой фазы в гелевую фазу.
«Раствор Люголя»: раствор элементарного йода и йодида калия в воде.
"Вязкость" определяет сопротивление жидкости или полутвердой среды течению. Течение жидкостей или полутвердых сред описывается посредством вязкости, или, более точно, вязкости сдвига η. Вязкость сдвига жидкости выражает ее устойчивость к сдвиговому течению, когда смежные слои перемещаются параллельно друг другу с различными скоростями. Обычными единицами измерения вязкости являются паскаль-секунда (Па⋅с), пуаз (П) и сантипуаз («сП»). 1 пуаз (П) соответствует 0,1 паскаль-секунды (Па⋅с); 1 сантипуаз (сП) соответствует 1 миллипаскаль-секунде (мПа⋅с).
«Процент по весу относительно веса композиции (w/w)» и «процент по весу относительно объема композиции (w/v)»: определяет процентное количество компонента или вещества в композиции. Принимая во внимание, что плотность композиции в форме эмульсии или микроэмульсии эквивалентна плотности воды (1,0 г/мл), процент по весу относительно веса композиции (w/w) считают эквивалентным проценту по весу относительно объема композиции (w/v). Для целей настоящего изобретения эти два определения являются, таким образом, взаимозаменяемыми.
PEG: полиэтиленгликоль.
Приведенные ниже примеры включены с целью иллюстрации определенных аспектов и вариантов осуществления изобретения и не предназначены для ограничения изобретения.
ПРИМЕРЫ
Пример 1 - Эмульсия
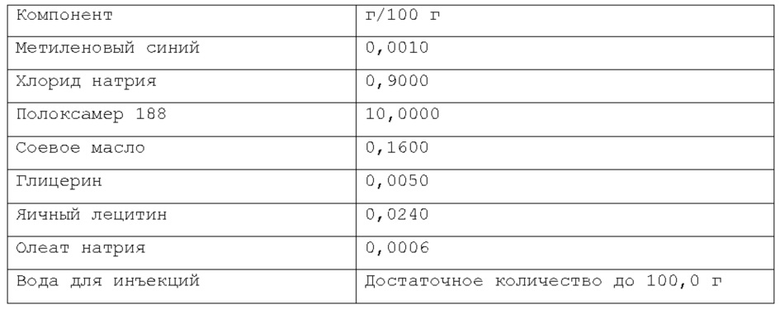
Производство композиции описывается ниже в настоящем описании (для 10,00 кг итоговой композиции):
а. В подходящий сосуд, оборудованный мешалкой, загружают 8600 мл воды для инъекций; затем добавляют 90,00 г хлорида натрия. Смесь перемешивают до достижения полного растворения. Полученный раствор охлаждают при температуре в диапазоне от 5°С до 10°С; затем 1000,00 г полоксамера 188 добавляют при помешивании. Смесь перемешивают до достижения полного растворения.
b. В подходящий сосуд, оборудованный мешалкой, загружают около 181 мл воды для инъекций; температура поднимается до 80°С. 2,40 г яичного лецитина, 0,50 г глицерина и 0,06 г олеата натрия добавляют при помешивании. Мешалка функционирует до полной гомогенизации; затем добавляют 16,00 г соевого масла. Смесь перемешивают при Т=80°С до получения гомогенной эмульсии. Эмульсию затем охлаждают при температуре ниже 30°С.
c. Эмульсию, полученную на шаге b), добавляют к смеси, полученной на шаге а), при помешивании. Затем 0,10 г метиленового синего добавляют при помешивании. Смесь продолжают перемешивать до гомогенности.
d. РН смеси шага с) измеряют, и он доводится, в случае необходимости, до значения в пределах диапазона 5,0-7,0,
e. Смесь доводится до итогового веса 10,00 кг посредством добавления воды для инъекций.
f. Итоговую композицию фильтруют через 0,45 мкм фильтр и упаковывают в 20 мл пробирки, запечатанные резиновыми колпачками и алюминиевыми кольцами. Пробирки стерилизуют при 121°С в течение 20 минут.
Пример 2 - Эмульсия
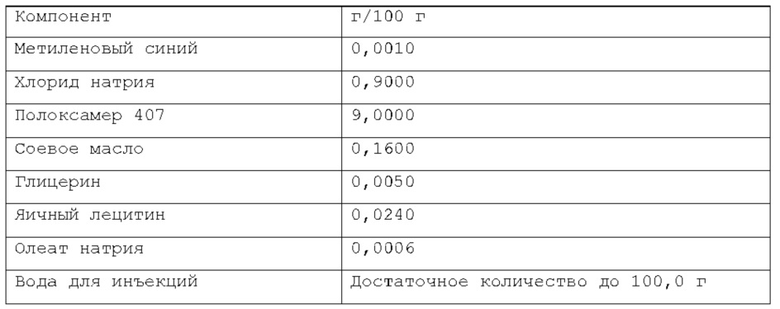
Композиция была получена посредством процесса, аналогичного описанному в примере 1.
Пример 3 - Эмульсия
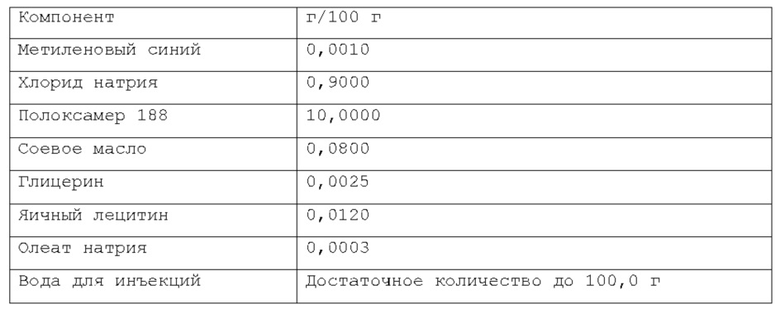
Композиция была получена посредством процесса, аналогичного описанному в примере 1.
Пример 4 - Эмульсия
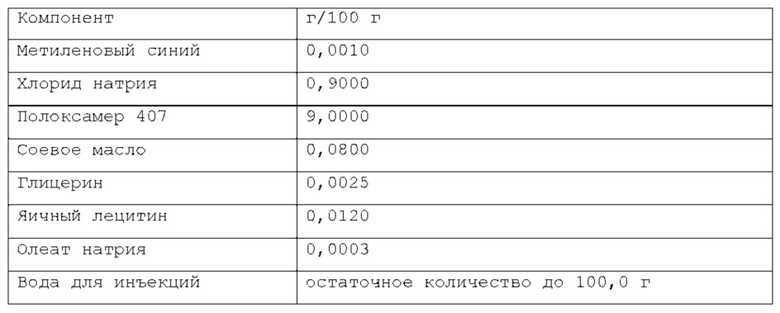
Композиция была получена посредством процесса, аналогичного описанному в примере 1.
Пример 5 - Эмульсия
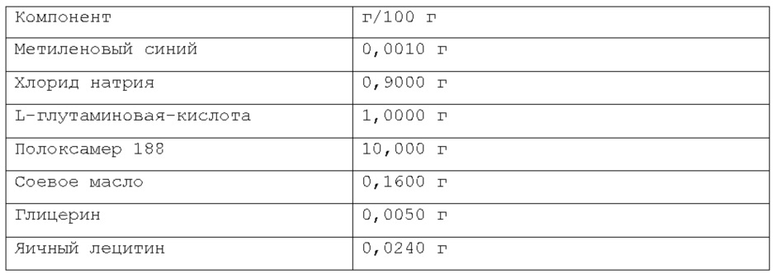

Производство композиции описано ниже (для 10,00 кг итоговой композиции):
a) В подходящий сосуд, оборудованный мешалкой, загружают 8600 мл воды для инъекций; затем добавляют 90,00 г хлорида натрия. Смесь перемешивают до достижения полного растворения. Полученный раствор охлаждают при температуре в диапазоне от 5°С до 10°С; затем 1000,00 г полоксамера 188 добавляют при помешивании. Смесь перемешивают до достижения полного растворения.
b) В подходящий сосуд, оборудованный мешалкой, загружают около 181 мл воды для инъекций; температура поднимается до 80°С. 2,40 г яичного лецитина, 0,50 г глицерина и 0,06 г олеата натрия добавляют при помешивании. Мешалка функционирует до полной гомогенизации; затем добавляют 16,00 г соевого масла. Смесь перемешивают при Т=80°С до получения гомогенной эмульсии. Эмульсию затем охлаждают при температуре ниже 30°С.
c) Эмульсию, полученную на шаге b), добавляют к смеси, полученной на шаге а), при помешивании. Затем, 0,10 г метиленового синего и 100,00 г L-глутаминовой-кислоты добавляют при помешивании. Смесь продолжают перемешивать до гомогенности.
d) РН смеси шага с) измеряют, и он доводится в пределах диапазона 5,0-7,0 посредством добавления 10% NaOH в воду для инъекций.
e) Смесь доводится до итогового веса 10,00 кг посредством добавления воды для инъекций.
f) Итоговую композицию фильтруют через 0,45 мкм фильтр и упаковывают в 20 мл пробирки, запечатанные резиновыми колпачками и алюминиевыми кольцами. Пробирки стерилизуют при 121°С в течение 20 минут.
Пример 6: измерение вязкости в лабораторном испытании
Вязкости фармацевтических композиций согласно примерам 1-4 были измерены в лабораторных условиях при трех различных температурах: Т=25°С, Т=30°С и Т=37°С. Измерения выполнялись с применением Brookfield LVDV-III Ultra Programmable Rheometer™, оборудованного устройством Brookfield Small Sample Adapter™. Adapter™ Brookfield Small Sample Adapter™ содержал камеру для образцов, которая вставлялась в кожух водяного охлаждения таким образом, чтобы точное регулирование температуры достигалось посредством циркуляции в термостатической водяной бане. Для измерений использовались два различных шпинделя, в зависимости от значения вязкости: для низких значений вязкости (зарегистрированных при Т=25°С, 30°С и 37°С для композиций согласно примерам 1-4 и при Т=25°С и 30°С для контроля), использовался шпиндель Brookfield™ N. 31; для высоких значений вязкости (зарегистрированных при Т=37°С для контроля), использовался шпиндель Brookfield™ N. 25.
Раствор полоксамера 407 в нормальном солевом растворе использовался в качестве контроля. Контроль был приготовлен посредством растворения полоксамера 407 в нормальном солевом растворе с целью получения итоговой концентрации полоксамера 407, равной его критической концентрации гелеобразования (около 15% по весу относительно суммарного веса раствора). Состав контрольного раствора приведен ниже в настоящем описании:
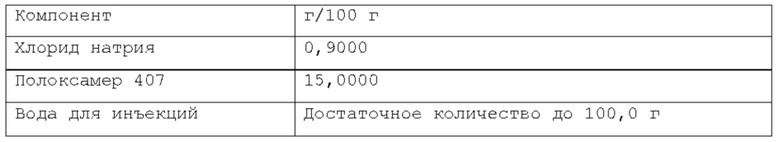
Вязкости композиций согласно примерам 1-4 приведены ниже в таблице относительно контрольного раствора:
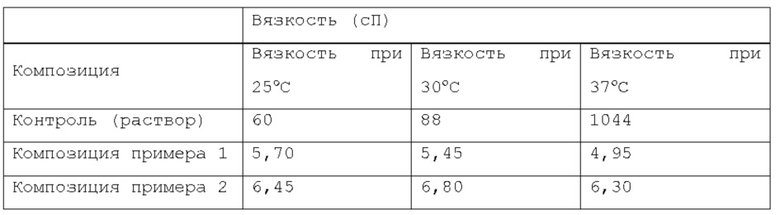

Контрольный раствор продемонстрировал гелеобразующую способность после нагревания от 25°С до температуры тела (то есть, 37°С) в лабораторных условиях, перейдя из жидкого состояния, имеющего вязкость около 60 сП, к гелеобразному состоянию, имеющему вязкость 1044 сП. Фармацевтические композиции согласно примерам 1-4 не продемонстрировали гелеобразующей способности, так как их вязкости оставались достаточно постоянными после нагревания от 25°С до температуры тела (то есть, 37°С).
Пример 7: исследование фазы посредством тестирования в климатической камере
Для того, чтобы охарактеризовать, находится ли композиция в форме эмульсии или микроэмульсии по изобретению в жидкой фазе или в фазе геля, тестирование в климатической камере выполнялось в дополнение к определению вязкости, описанному в примере 6. Фармацевтические композиции согласно примерам 1-4 и контрольный раствор, описанный в примере 6 (полоксамер 407 15% в нормальном солевом растворе), были упакованы в запечатанные пробирки, которые были затем помещены в климатическую камеру, термостатированную на 40°С. После двух часов фазу (жидкость или гель) указанных композиций было легко проверить путем переворачивания пробирок вверх дном: в случае композиций согласно примерам 1-4, имелся поток жидкости, когда пробирка переворачивалась вверх дном; напротив, в случае контрольного раствора (полоксамер 407 15% в нормальном солевом растворе), отсутствовал какой-либо поток жидкости в пробирке, и композиция в фазе геля оставалась наверху пробирки.
Пример 8: инъецирование композиции согласно примеру 1 в слой подслизистой свиного желудка вне организма
Свиной желудок вне организма был помещен на водяную баню, поддерживаемую при 37,0°С±0,5°С посредством откалиброванного термостата. Как только желудок достигал требуемой температуры (37°С±0,5°С), он помещался на смотровую кушетку. Композиция согласно примеру 1 была введена в слой подслизистой желудка посредством эндоскопической инъекционной иглы; введенный объем составлял 5,0 мл±0,5 мл с целью создания визуально адекватного подъема подслизистой. Выполнялись две инъекции; в обоих случаях созданные подслизистые прокладки (фигуры 1 и 2) смогли поднять стенку подходящим образом для обеспечения возможности выполнения обычной резекции полипов посредством петли или электроскальпеля, в соответствии с типичными эндоскопическими процедурами резекции, такими как EMR и ESD. Одна из прокладок была разрезана посредством скальпеля непосредственно после инъекции; после разреза композиция выглядела как обеспечивающая вязкий продукт в слое подслизистой, который имел хорошую однородность (фигура 3). Образец слизистой был резецирован и визуально исследован: продукт, который сформировала композиция согласно примеру 1, оставался присоединенным к иссеченной части (фигура 4). Другая прокладка удерживалась на месте в течение 15 минут после инъекции перед разрезанием. В течение этого времени прокладка не демонстрировала изменений в форме и в высоте (фигура 5). После 15 минут вторая прокладка была разрезана способом, аналогичным способом разрезания первой прокладки (фигура 6). Визуальное исследование образца после разрезания показало наличие вязкого продукта в слое подслизистой, который имел однородность, аналогичную полученной в первой прокладке (Фигура 7). Тест показал, что композиция согласно примеру 1, которая не смогла перейти из жидкой фазы в гелевую фазу после нагревания от 25°С до температуры тела (то есть, 37°С) в условиях лабораторного испытания (как сообщено в примерах 6 и 7), напротив, смогла создать высокую, долговечную подслизистую прокладку после инъецирования в слой подслизистой свиного желудка. Разрезание такой прокладки показало, что композиция согласно примеру 1, как ни удивительно, формировала вязкий продукт в слое подслизистой; после удаления образца слизистой из прокладки такой продукт оставался присоединенным к указанному образцу в течение 10 минут.
Пример 9 - Микроэмульсия
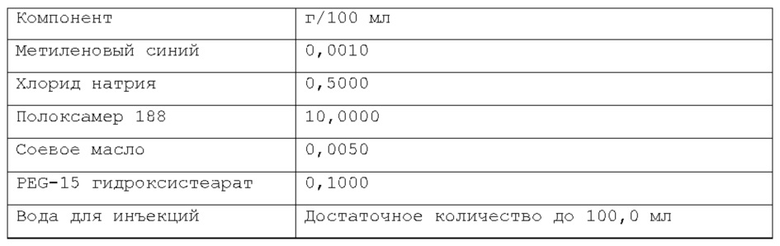
Производство композиции описано ниже в настоящем описании.
a. В подходящий сосуд, оборудованный мешалкой, загружаются липофильное соединение и неионогенное поверхностно-активное вещество, и они смешиваются; затем подходящее количество теплой воды для инъекций наливают в масляную фазу при помешивании. Смесь продолжают размешивать и нагревать, пока не будет получена микроэмульсия.
b. Во втором контейнере нагревают оставшийся объем воды для инъекций; затем микроэмульсию, подготовленную на шаге а), наливают по каплям в условиях помешивания.
c. Полимер добавляют к микроэмульсии шага b), и смесь продолжают перемешивать, пока не будет достигнуто полное растворение.
d. Хлорид натрия добавляют при помешивании, пока не будет достигнуто полное растворение.
e. Краситель добавляют при энергичном перемешивании, пока не будет достигнуто полное растворение.
f. Измеряют РН фактор смеси шага е) (спецификация: 5,0-7,5).
g. Смесь доводится до конечного объема посредством добавления воды для инъекций.
h. Итоговая композиция стерилизуется посредством стерилизующей фильтрации благодаря очень малому размеру капель (меньше 100 нм) микроэмульсии; таким образом, она фильтруется через фильтр 0,22 мкм и упаковывается посредством асептической обработки в пробирки, запечатанные резиновыми колпачками и алюминиевыми кольцами.
Пример 10 - микроэмульсия
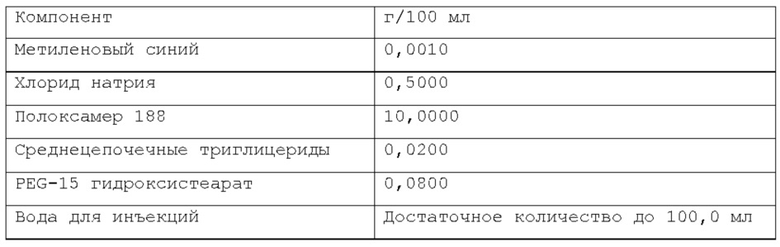
Композиция была получена посредством процесса, аналогичного описанному в примере 9.
Пример 11 - Микроэмульсия
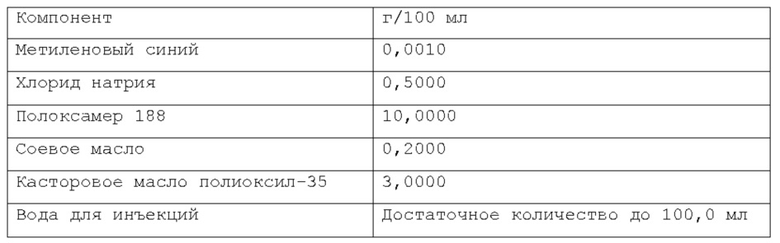
Композиция была получена посредством процесса, аналогичного описанному в примере 9.
Пример 12 - Микроэмульсия
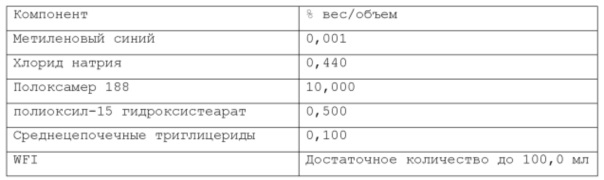
Композиция была получена посредством процесса, аналогичного описанному в примере 9.
Пример 13 - микроэмульсия
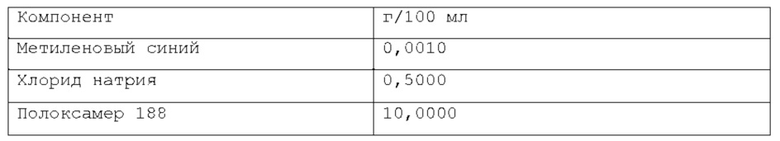
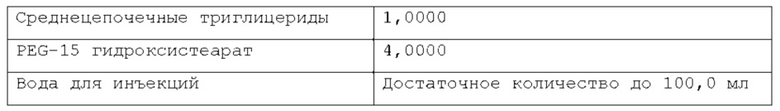
Композиция была получена посредством процесса, аналогичного описанному в примере 9.
Пример 14 - Микроэмульсия
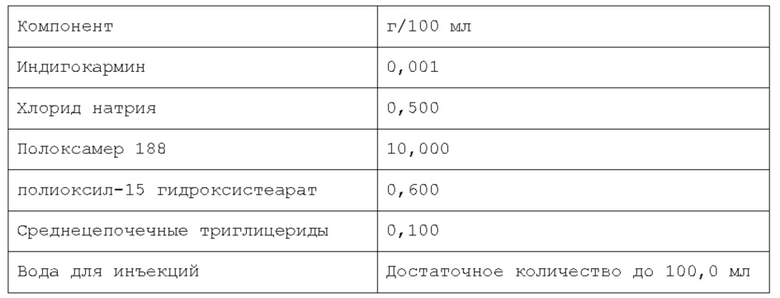
Композиция была получена посредством процесса, аналогичного описанному в примере 9.
Пример 15 - Микроэмульсия
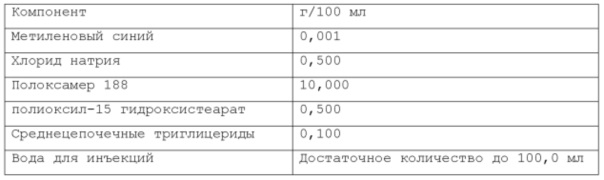
Композиция была получена посредством процесса, аналогичного описанному в примере 9.
Пример 16 - Микроэмульсия
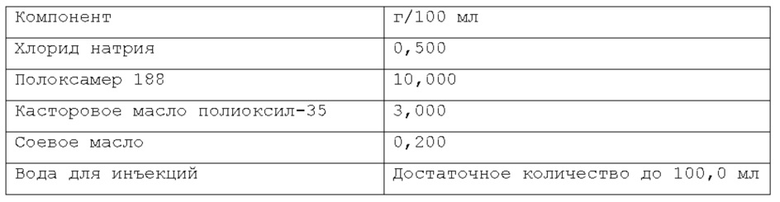
Композиция была получена посредством процесса, аналогичного описанному в примере 9, без шага е).
Пример 17 - Характеризация размера микроэмульсионной капли посредством измерения динамического рассеяния света (DLS)
Микроэмульсии типа «масло в воде» по настоящему изобретению являются термодинамически стабильными, могут быть приготовлены спонтанно, и являются прозрачными.
Методика динамического рассеяния света (DLS) применялась для характеризации размера капель микроэмульсии.
ИНСТРУМЕНТ: Zetasizer Nano® ZSP компании Malvern Instruments
ПОДГОТОВКА ОБРАЗЦА: отсутствует, образец не разбавлен
НАСТРОЙКИ ИЗМЕРЕНИЯ: Тип измерения: размер Образец:
ο Материал: не установлен (оптические свойства материала не требуются для основанного на интенсивности распределения),
ο Диспергирующий агент: вода с объемной вязкостью при 25°С
ο Общие параметры: использование вязкости диспергирующего агента в качестве вязкости образца
ο Температура: 25°С с временем установления равновесия, составляющим 60 сек
ο Ячейка: одноразовые кюветы DTS0012
ИЗМЕРЕНИЕ:
ο Угол измерения: 173° обратного рассеяния (значение по умолчанию NIBS)
ο Длительность измерения: автоматическая
ο Число измерений: по меньшей мере 3
□ Инструкции: отсутствуют
□ Продвинутые настройки:
ο Увеличение продолжительности для больших частиц: Нет
ο Способ позиционирования: поиск оптимального положения
ο Автоматический выбор затухания: Да
Ниже в настоящем описании показаны исследования DLS для микроэмульсии из примера 15.
Два образца были извлечены в конце шагов а) и d), и были затем проанализированы с использованием параметров инструмента, которые были указаны выше.
В приведенной ниже таблице А показаны результаты анализа DLS для образца с шага а). Соответствующий график показан на фигуре 8.
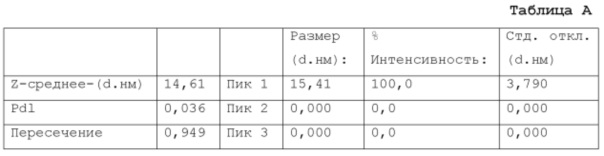
Результаты показывают распределение монодисперсных частиц с Z-средним около 14 нм и чрезвычайно низким коэффициентом полидисперсности.
В приведенной ниже таблице В показаны результаты анализа DLS для образца с шага d). Соответствующий график показан на фигуре 9.
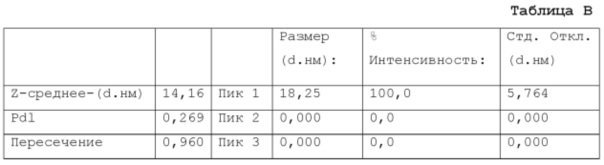
На диаграмме показано уникальное распределение частиц с Z-средним около 14 нм и низким коэффициентом полидисперсности. Измерения являются воспроизводимыми с хорошим пересечением функции корреляции (0,960).
В приведенной ниже таблице С показано сравнение между результатами, полученными на шаге а) и шаге d). Соответствующий график показан на фигуре 10,

На основании наложения распределений размеров частиц и двумерных данных, эти два образца эквивалентны: небольшие различия между ними не являются значимыми и могут быть отнесены к экспериментальной изменчивости. Таким образом, эти два образца эквивалентны и с точки зрения распределения, и с точки зрения Z-среднего.
В приведенной ниже таблице D показаны результаты DLS для образца с шага е). Соответствующий график показан на фигуре 11.
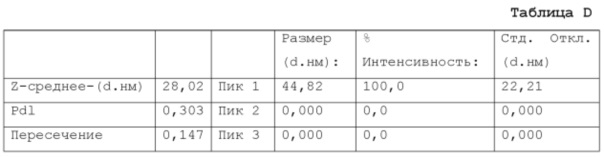
На графике показано единственное распределение частиц с Z-средним около 28 нм.
Анализы DLS микроэмульсии для образца с шага е) из примеров 11-13 и 14 показаны в приведенной ниже таблице Е:

Анализы DLS микроэмульсии для образца с шагов а), d) примера 12 показаны в приведенной ниже в таблице F.

Пример 18 - Цитотоксичность
Композиция согласно примеру 15 была подвергнута in vitro исследованию цитотоксичности на фибробластах млекопитающего АТСС BalbC 3Т3, согласно ISO 10993-5.
После 24 часов анализа были получены следующие результаты:
Сокращение жизнеспособности клеток в лунке композиции по примеру 15 составляло 14,68%, и композиция считалась не являющейся цитотоксической.
Пример 19 - Цитотоксичность
Композиция согласно Примеру 10 была подвергнута in vitro исследованию цитотоксичности фибробластов млекопитающего АТСС BalbC 3Т3, согласно ISO 10993-5.
После 24 часов анализа были получены следующие результаты:
Сокращение жизнеспособности клеток в лунке композиции по примеру составляло 6,22%, и композиция считалась не являющейся цитотоксической.
Пример 20 - тестирование на свиных желудках вне организма
Во время разработки продукта способность формирования прокладки различных составов-прототипов была оценена с применением нескольких анализов на свиных желудках вне организма. Свиной желудок был выбран в качестве испытательной системы, поскольку он является общепризнанной моделью человеческой желудочно-кишечной слизистой. Кроме того, в научной литературе множество опубликованных работ, относящихся к средствам инъецирования в подслизистую, описывают применение этой модели для оценки производительности различных средств с точки зрения высоты и продолжительности подслизистой прокладки.
Эффективность фармацевтических композиций согласно настоящему изобретению была оценена в анализе ex vivo с точки зрения высоты и продолжительности подслизистой прокладки после инъецирования подходящего объема.
Краткое описание способа приведено ниже.
Материалы
Замороженный свиной желудок
Плексигласовая подложка
Шприц с люэровским наконечником на 10 мл
Стандартная эндоскопическая инъекционная игла
Способ
Замороженный свиной желудок размораживался и затем хранился при 37°С в тепловом защитном слое. Желудок вскрывался с применением хирургического скальпеля, и внутренняя слизистая очищалась с использованием бумажных полотенец. Квадратная часть размером 10 см × 10 см вырезалась из желудка и размещалась на плексигласовой подложке. Подходящий объем фармацевтической композиции инъецировался через эндоскопическую инъекционную иглу в слой подслизистой резецированного квадратного образца свиного желудка. Когда формирование прокладки подслизистой завершалось, игла удалялась из образца. Высота и время стабильности полученной подслизистой прокладки оценивалось посредством визуального осмотра. Прокладка контролировалась каждые 15 минут вплоть до часа.
Результаты
Как изображено на фигуре 12, подслизистая прокладка, создаваемая после инъецирования подходящего количества композиции из примера 11, переходила от высоты 1,6 см к 1,4 см, таким образом, теряя только 0,2 см более чем через 1 час после инъекции.
Результаты для композиций из примеров 9, 11 и 13 показаны в приведенной ниже таблице G:

Пример 21 - Предварительное тестирование на минипиге in vivo
Предварительное исследование переносимости на минипиге проводилось для композиции согласно примеру 5.
Цель
Цель исследования состояла в исследовании переносимости продукта у минипига после введения в желудочную подслизистую.
Способы
Один самец геттингенского минипига, имевший вес около 20 кг и возраст около 10 месяцев, использовался в этом исследовании. Эндоскопическая процедура выполнялась с применением системы электронного видеоэндоскопа Fujinon EVE200 и электронного видеоэндоскопа для верхнего отдела желудочно-кишечного тракта EG-201FP. Средство для инъекции в подслизистую было доставлено посредством применения эндоскопа и эндоскопической инъекционной иглы. Животное подвергалось анестезии перед каждой эндоскопической процедурой. Тестовый элемент был введен (около 5 мл) посредством эндоскопической инъекции в подслизистую с применением эндоскопической инъекционной иглы (инъекционная игла Medwork®, 230 см × 2,3 мм, диаметр иглы 0,7 мм, каталожный номер INJ1-A1-07-5-23-230). Животному была введена одна доза посредством инъекции в подслизистую в течение около 55 секунд, после чего проводилось наблюдение в течение 24 часов. После введения слизистая в месте введения и окружающая необработанная слизистая непрерывно исследовались в течение 25 минут, в течение которых тестовый элемент вызывал адекватное растяжение с разъединением между слоями слизистой и подслизистой. Это разъединение все еще сохранялось через 25 минут после инъекции; дальнейшие исследования выполнялись через 60 минут и через 24 часа.
Последующее общее наблюдение за местом инъецирования в течение около 60 минут после инъекции показало сохранение видимых набуханий.
В 24-часовой период наблюдения набухания желудочной слизистой больше не присутствовали, и желудочная слизистая оболочка не демонстрировала связанных с тестовым элементом больших макроскопических изменений.
На фигурах 13, 14 и 15 показано введение тестового элемента, подслизистая прокладка и внешний вид места инъецирования через 24 часа после введения.
Пример 22 - Реология
Изменение вязкости как функция температуры было измерено на композиции из примера 16 с применением ротационного вискозиметра Kinexus pro+.
Kinexus pro+ представляет собой ротационный вискозиметр, который прилагает управляемую деформацию сдвига к образцу, и обычно он применяется для оценки и изучения реологической характеризации (вязкости) композиций, таких как эмульсии или микроэмульсии.
Для продолжения измерения композиция из примера 16 была оборудована конической пластиной СР60-20 с управляемым сдвигом и постоянным давлением 0,5 Па; диапазон температуры был установлен между 25°С и 50°С.
Как показано на графике с фигуры 16, реограмма вязкости в зависимости от температуры демонстрирует, что вязкость композиции уменьшается с увеличением температуры.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭМУЛЬСИИ ИЛИ МИКРОЭМУЛЬСИИ ДЛЯ ПРИМЕНЕНИЯ В ЭНДОСКОПИЧЕСКОЙ РЕЗЕКЦИИ СЛИЗИСТОЙ И/ИЛИ ЭНДОСКОПИЧЕСКОЙ ПОДСЛИЗИСТОЙ ДИССЕКЦИИ | 2014 |
|
RU2676278C1 |
| ЖИДКАЯ КОМПОЗИЦИЯ В ФОРМЕ ЭМУЛЬСИИ ИЛИ МИКРОЭМУЛЬСИИ ДЛЯ РЕКТАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ ПО МЕНЬШЕЙ МЕРЕ ОДИН КРАСИТЕЛЬ, И ЕЕ ПРИМЕНЕНИЕ В ДИАГНОСТИЧЕСКОЙ ПРОЦЕДУРЕ ЭНДОСКОПИИ СИГМОВИДНОЙ ОБОДОЧНОЙ КИШКИ И/ИЛИ ПРЯМОЙ КИШКИ | 2015 |
|
RU2712176C2 |
| ТВЕРДАЯ ПЕРОРАЛЬНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КРАСИТЕЛИ, ДЛЯ ПРИМЕНЕНИЯ В ЭНДОСКОПИЧЕСКОЙ ДИАГНОСТИКЕ | 2013 |
|
RU2649783C2 |
| СПОСОБ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ ПУЗЫРНО-МОЧЕТОЧНИКОВОГО РЕФЛЮКСА | 1997 |
|
RU2161446C2 |
| КОМПОЗИЦИИ ЛИНЕЗОЛИДА | 2018 |
|
RU2771279C2 |
| ГЕМОСТАТИЧЕСКОЕ СРЕДСТВО | 2019 |
|
RU2709816C1 |
| Способ гемостатического лифтинга тканей полых органов при эндоскопических хирургических вмешательствах | 2021 |
|
RU2781337C1 |
| СПОСОБ ЭНДОСКОПИЧЕСКОЙ ПОДСЛИЗИСТОЙ ДИССЕКЦИИ КОЛОРЕКТАЛЬНЫХ ОБРАЗОВАНИЙ | 2020 |
|
RU2756489C1 |
| СПОСОБ ЭНДОСКОПИЧЕСКОГО ГЕМОСТАЗА ПРИ ГАСТРОДУОДЕНАЛЬНЫХ КРОВОТЕЧЕНИЯХ | 2009 |
|
RU2410035C1 |
| ТВЕРДАЯ КОМПОЗИЦИЯ ДЛЯ ДОСТАВКИ | 2018 |
|
RU2812928C2 |
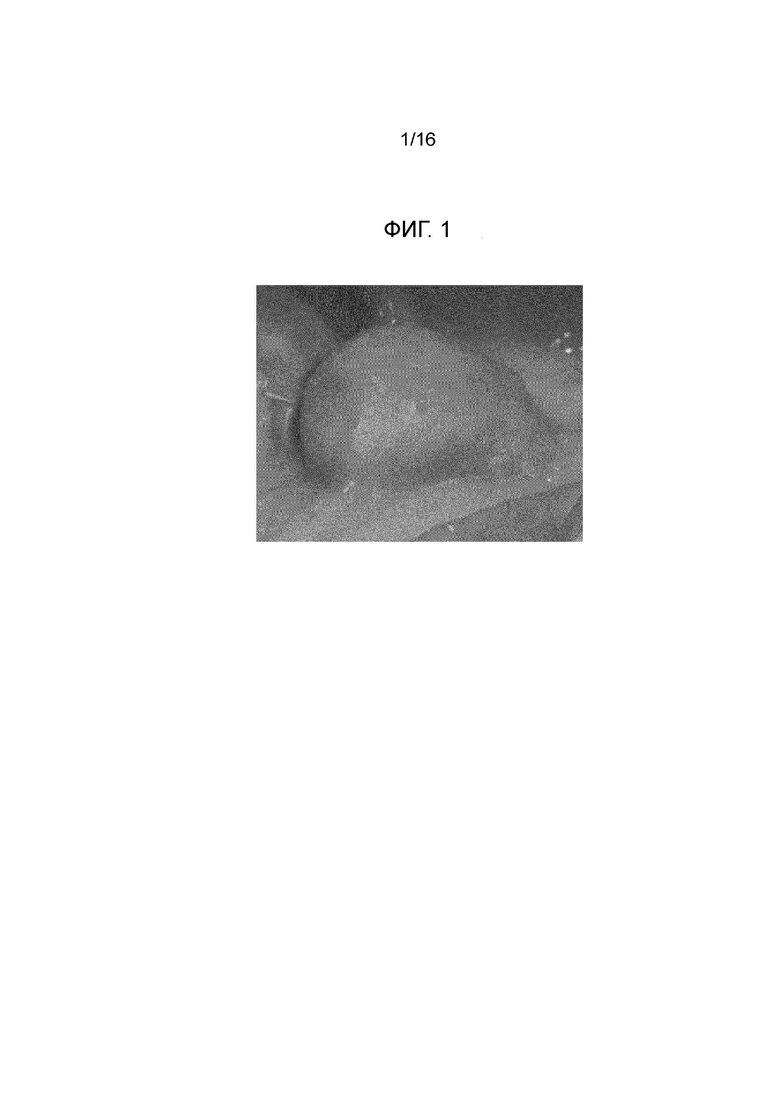
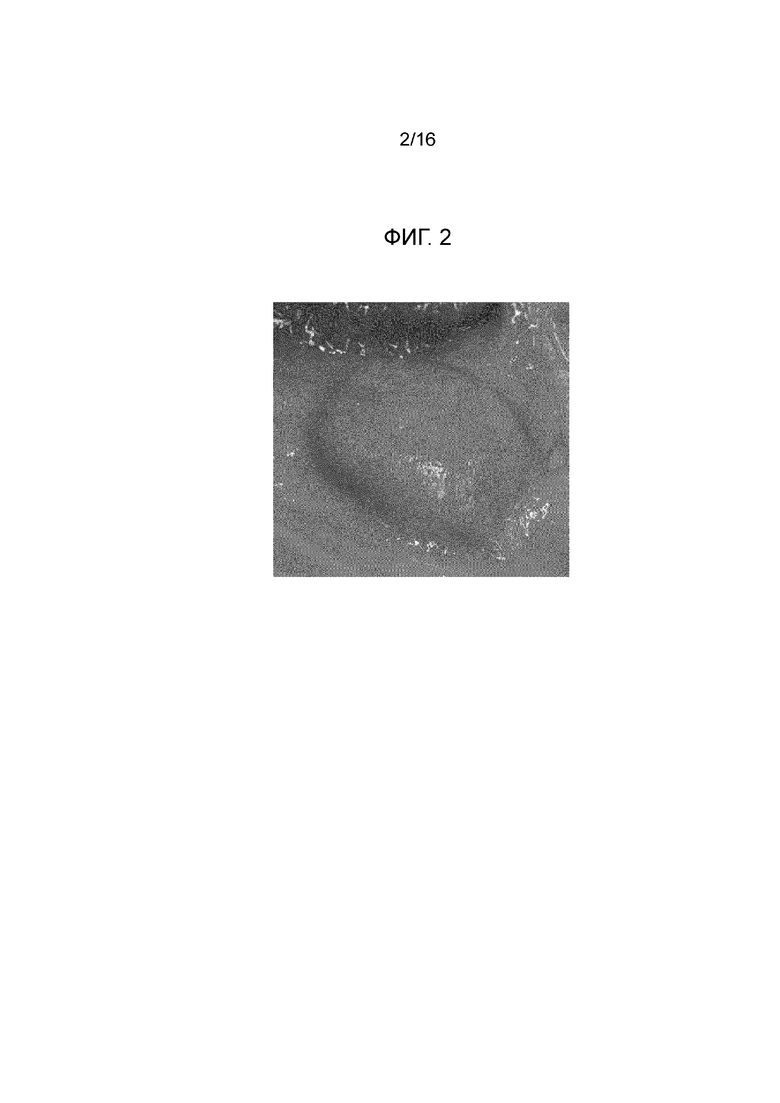
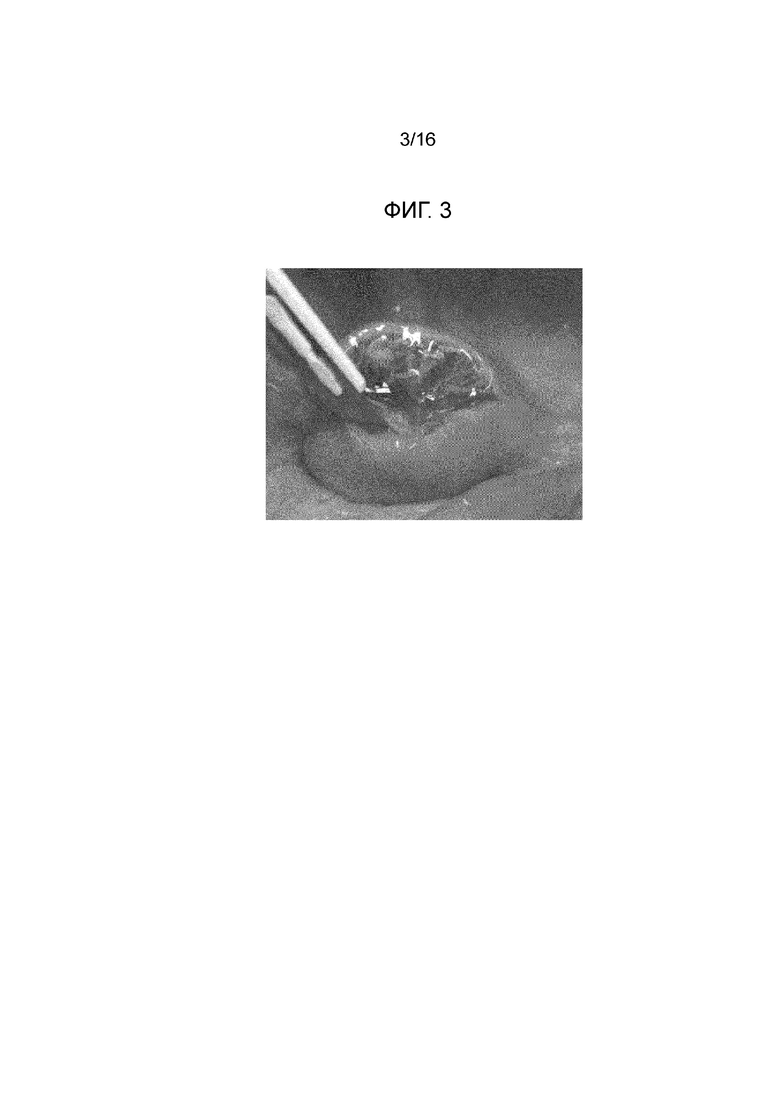

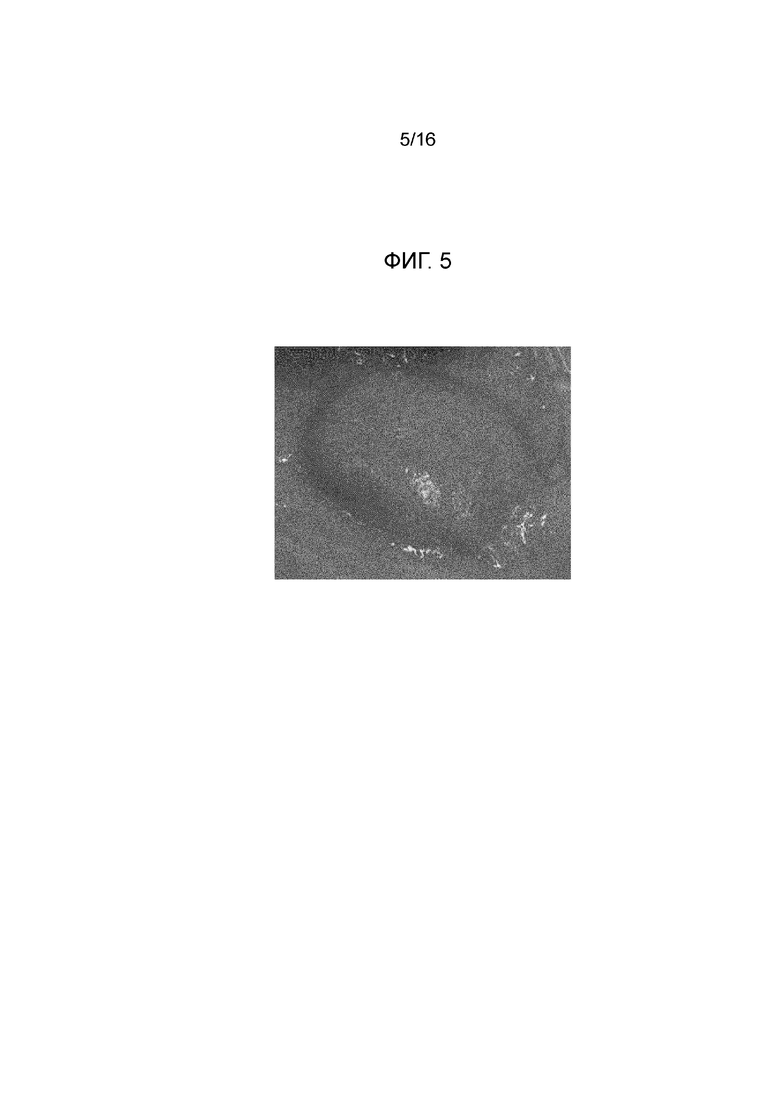
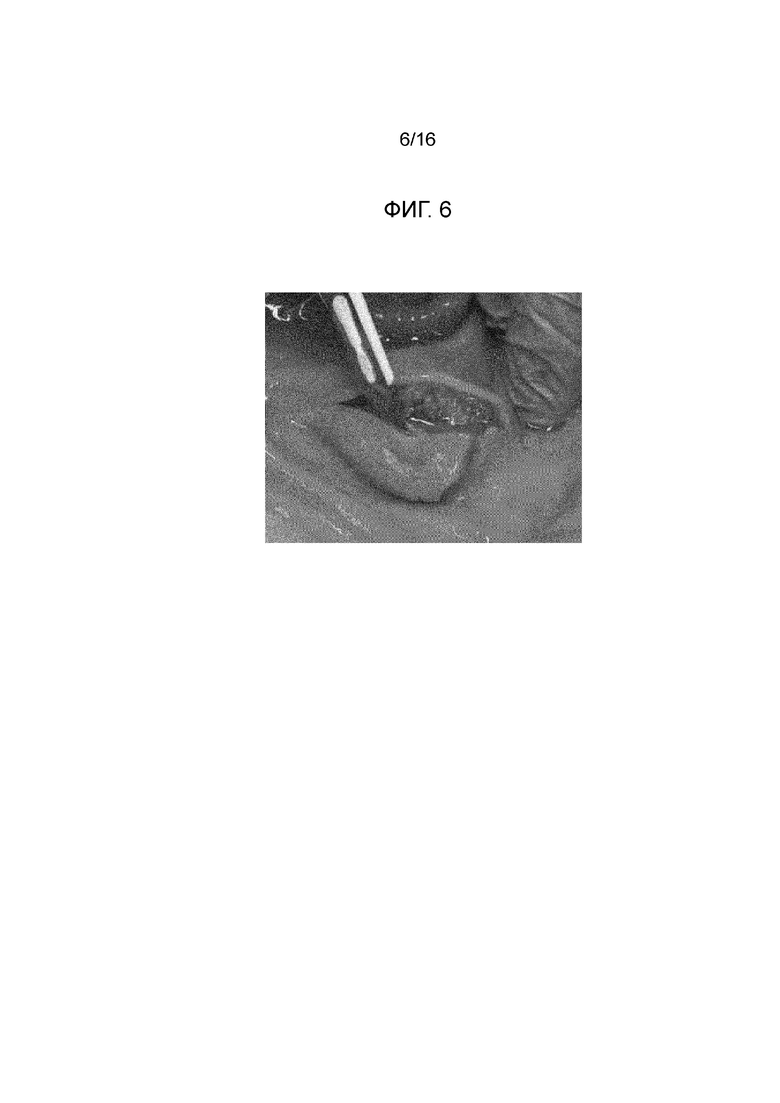

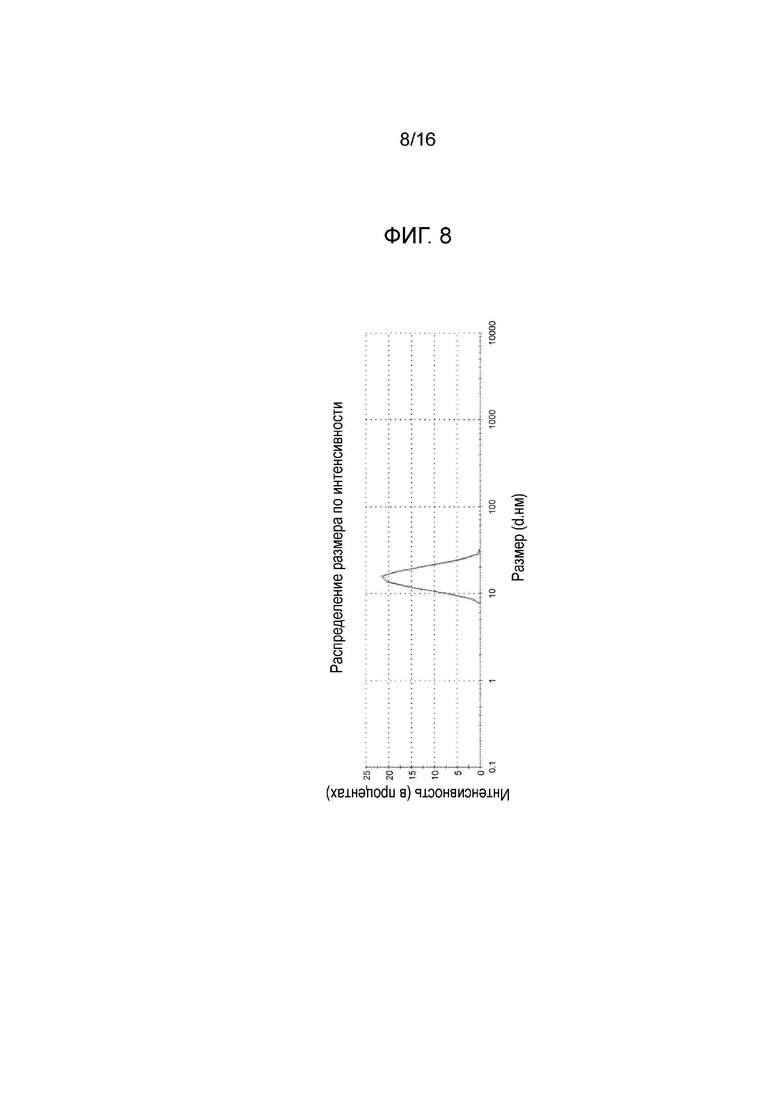
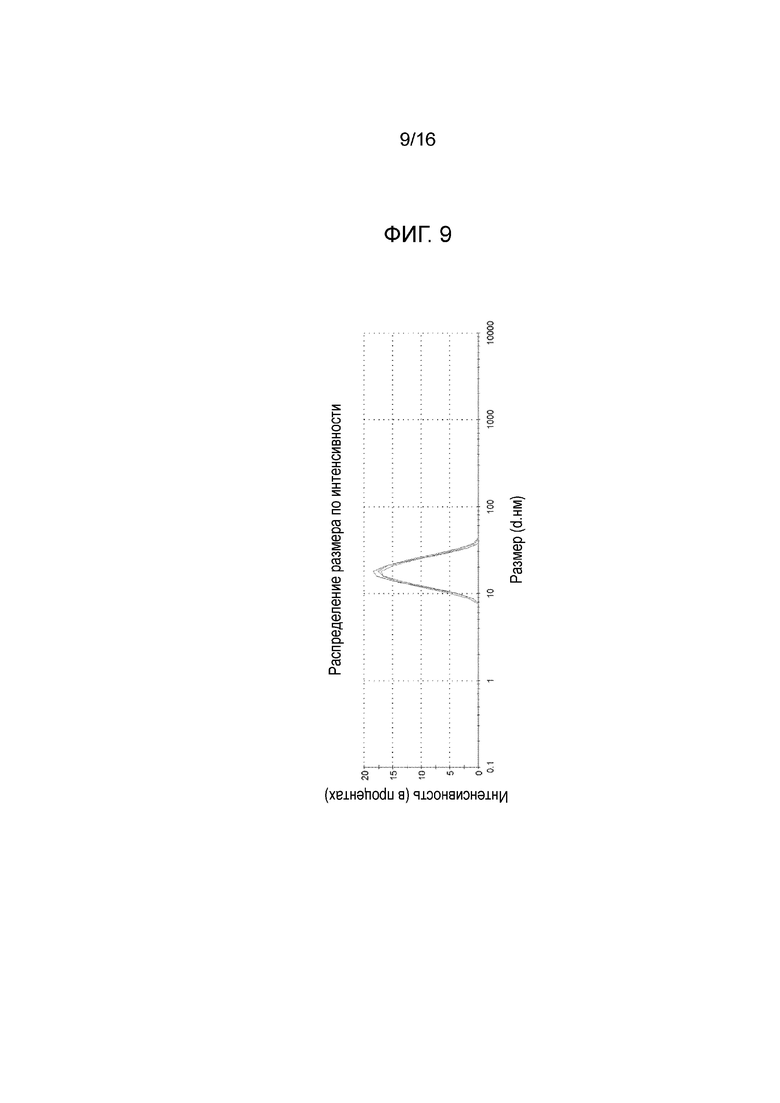
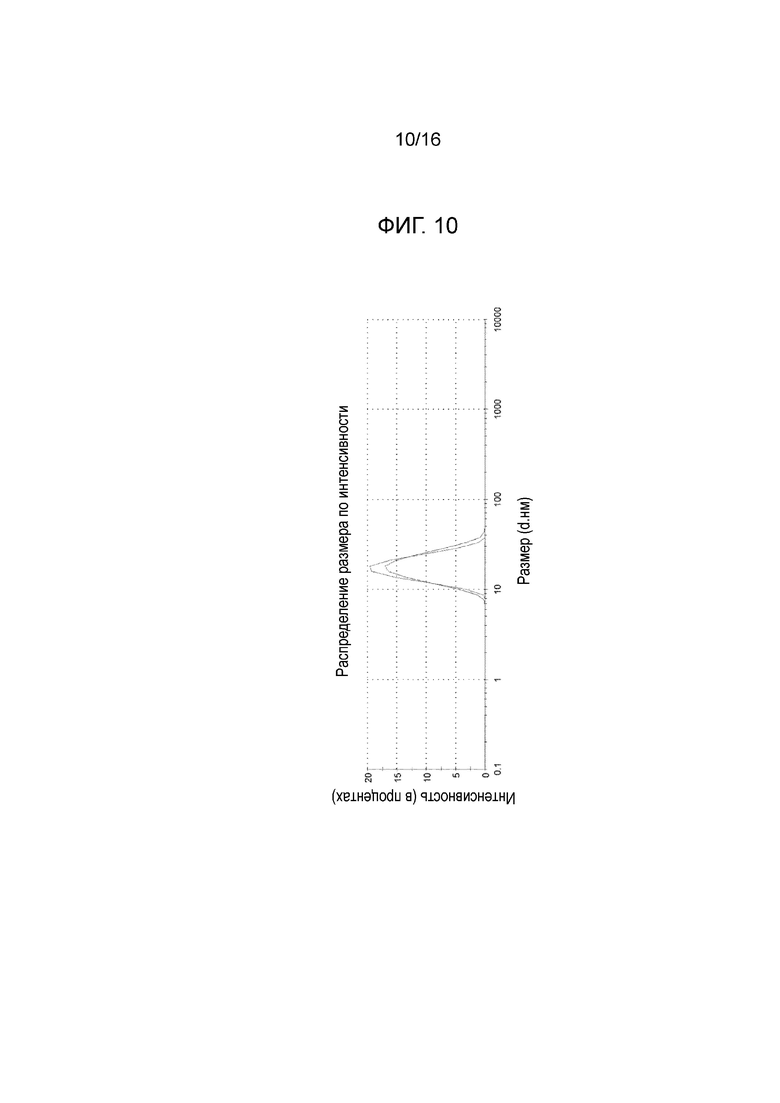
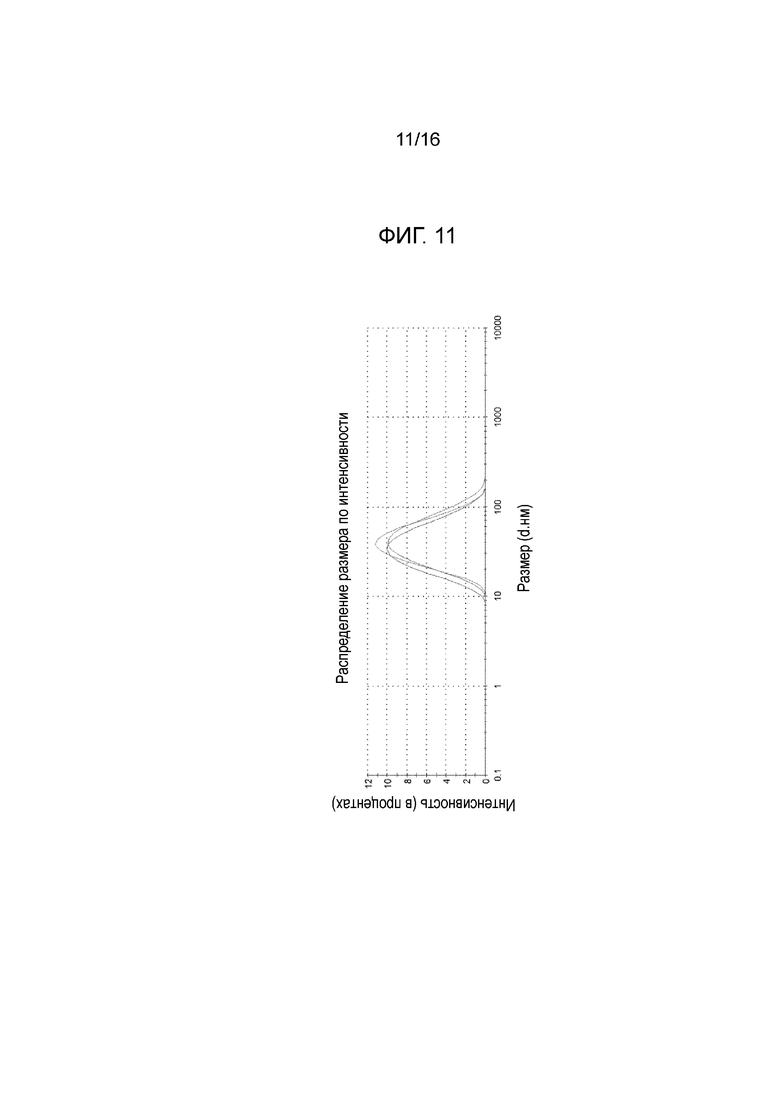

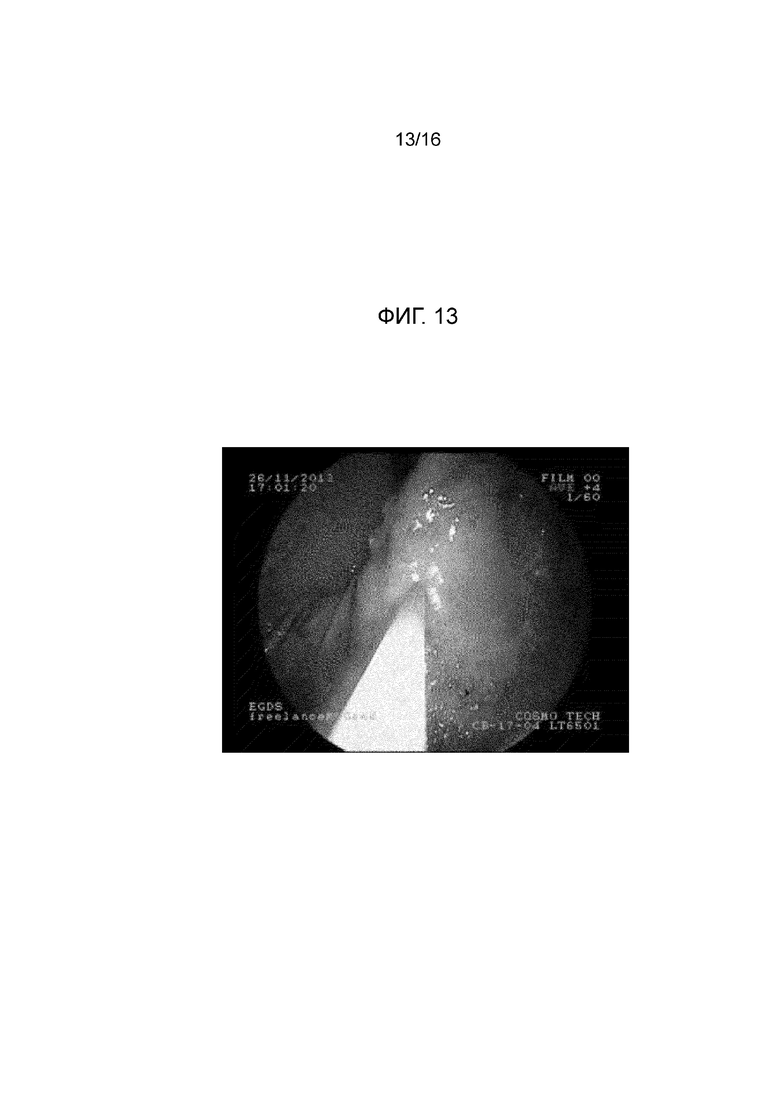
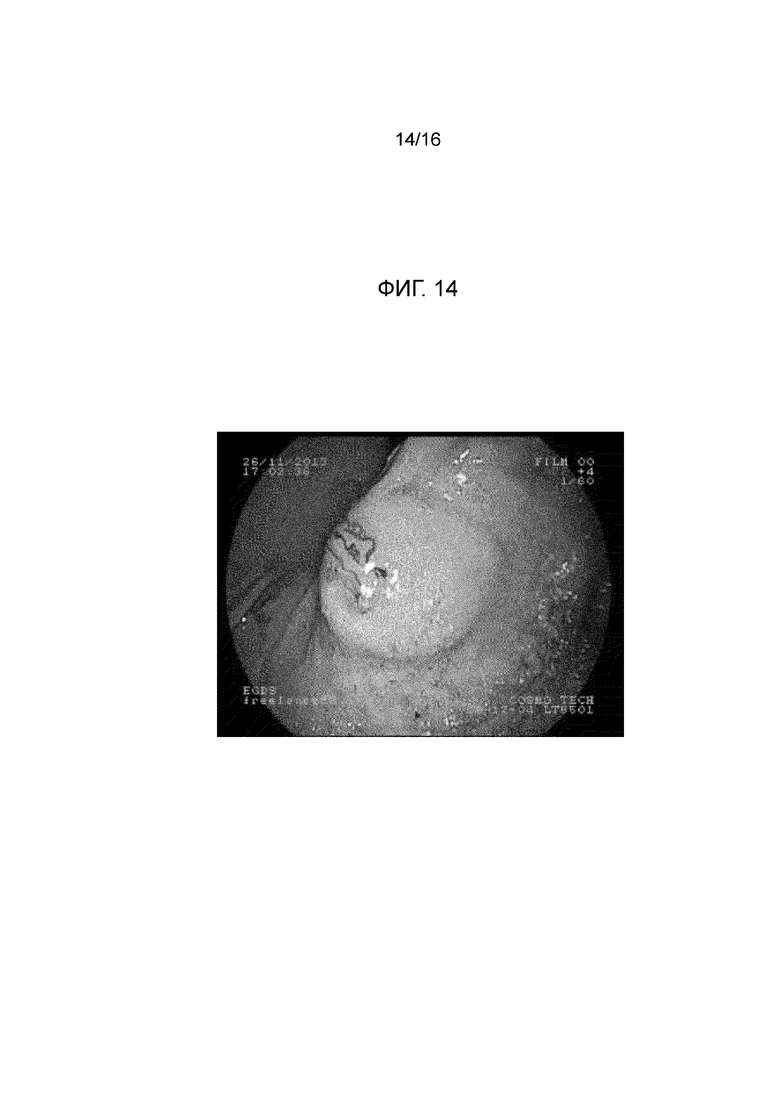
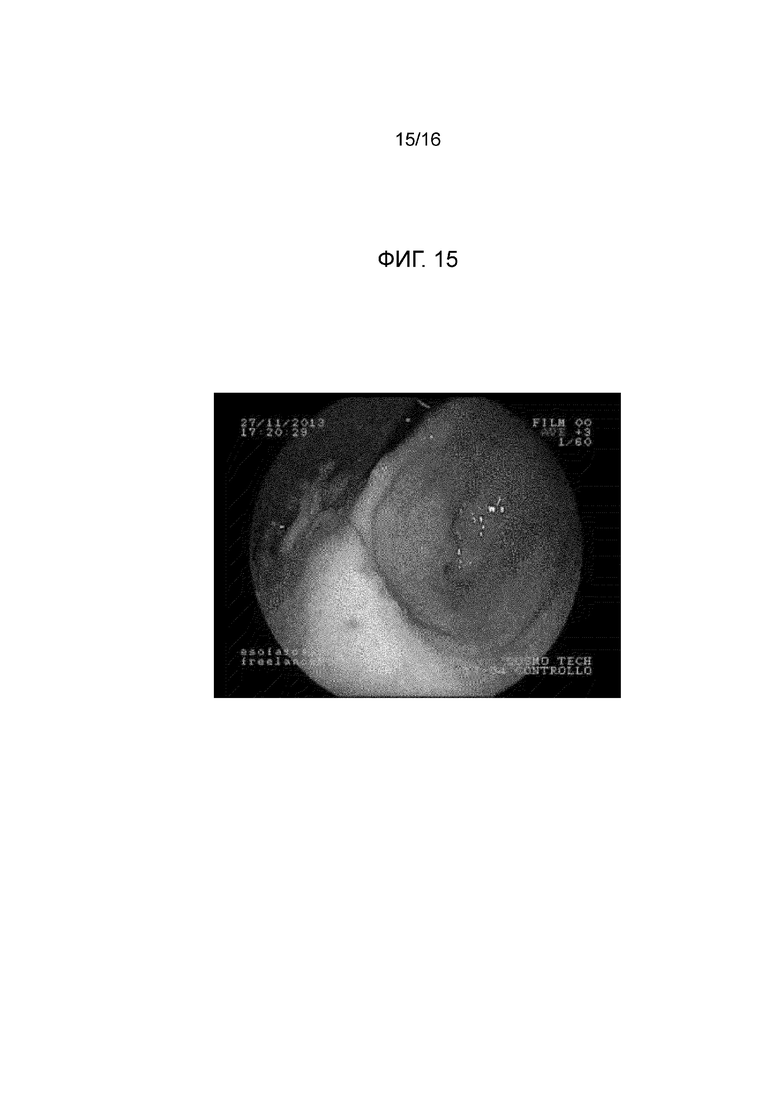
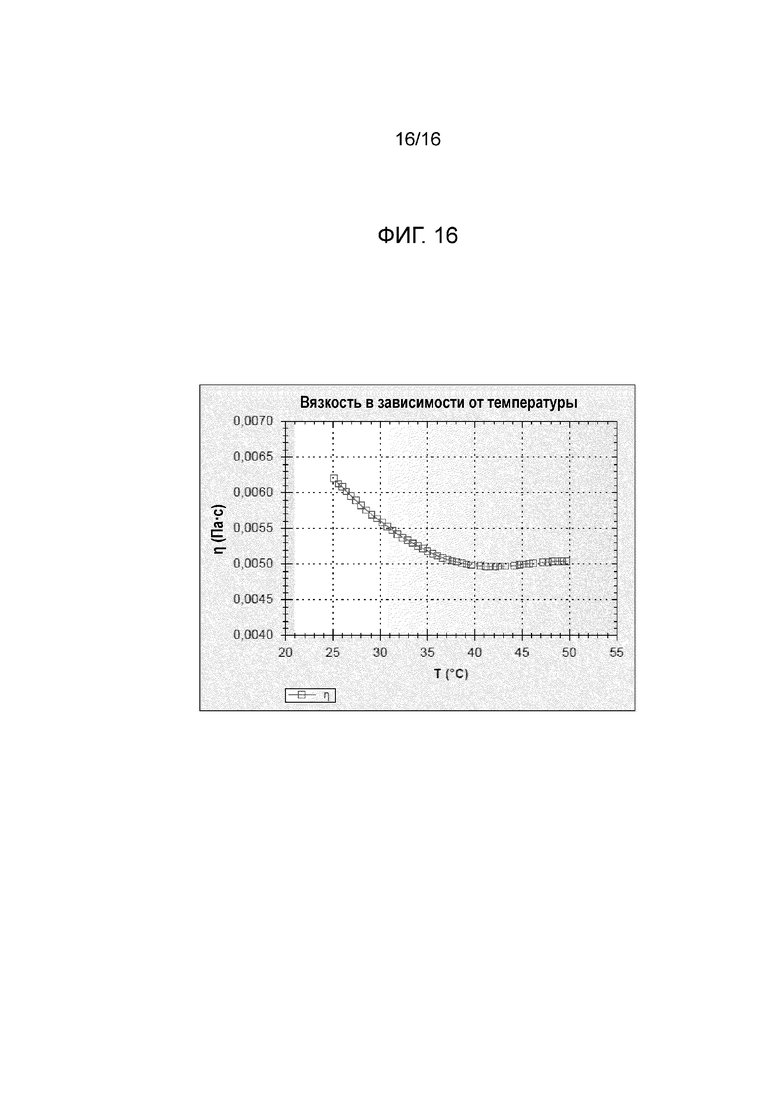
Группа изобретений относится к медицине и касается фармацевтической композиции в форме эмульсии или микроэмульсии, которая находится в жидкой фазе до температуры 40°C in vitro. Композиция содержит: a) водную фазу; b) масляную фазу; c) по меньшей мере одно поверхностно-активное вещество; d) по меньшей мере один инверсный термочувствительный полимер в количестве между 2% и 14,5% по весу и в объеме ниже критической концентрации гелеобразования (CGC); при этом указанная фармацевтическая композиция предназначена для применения в качестве вспомогательного вещества во время эндоскопических процедур, в которых она вводится в целевую ткань с целью формирования прокладки, которая вызывает разъединение между слоями слизистой и подслизистой на по меньшей мере 25 мин. Также предложена композиция, содержащая дополнительно краситель. Группа изобретений обеспечивает формирование прокладки во время эндоскопических процедур, которая вызывает разъединение между слоями слизистой и подслизистой по меньшей мере на 25 мин. 2 н. и 51 з.п. ф-лы, 16 ил., 7 табл., 22 пр.
1. Фармацевтическая композиция в форме эмульсии или микроэмульсии, которая находится в жидкой фазе до температуры 40°C in vitro, содержащая:
a) водную фазу;
b) масляную фазу;
c) по меньшей мере одно поверхностно-активное вещество;
d) по меньшей мере один инверсный термочувствительный полимер в количестве между 2% и 14,5% по весу и в объеме ниже критической концентрации гелеобразования (CGC);
при этом указанная фармацевтическая композиция предназначена для применения в качестве вспомогательного вещества во время эндоскопических процедур, в которых она вводится в целевую ткань с целью формирования прокладки, которая вызывает разъединение между слоями слизистой и подслизистой на по меньшей мере 25 минут.
2. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанная композиция представляет собой эмульсию или микроэмульсию типа "масло в воде".
3. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанная композиция имеет вязкость ниже 150 сП (сантипуаз), ниже 100 сП (сантипуаз), ниже 50 сП (сантипуаз) или ниже 20 сП (сантипуаз).
4. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 3, где указанная вязкость измеряется при температуре 25°C, 30°C и/или 37°C.
5. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанный по меньшей мере один инверсный термочувствительный полимер содержится в количестве между 3% и 12% по весу или между 5% и 11% по весу относительно веса композиции.
6. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанный по меньшей мере один инверсный термочувствительный полимер содержится в количестве 7%, 8%, 9% или 10% по весу относительно веса композиции.
7. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения согласно любому из предшествующих пунктов, где указанный по меньшей мере один инверсный термочувствительный полимер является блочным сополимером полиэтиленоксида-полиоксипропилена, полоксамером.
8. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 7, где указанный по меньшей мере один полоксамер выбирается из полоксамера 124, полоксамера 188, полоксамера 237, полоксамера 338 и полоксамера 407.
9. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 8, где указанный по меньшей мере один полоксамер представляет собой полоксамер 188, полоксамер 407 или смесь полоксамера 188 и полоксамера 407.
10. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 7, где указанный полоксамер представляет собой полоксамер 407, и он содержится в количестве 9% по весу относительно веса композиции.
11. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 7, где указанный полоксамер представляет собой полоксамер 188, и он содержится в количестве 10% по весу относительно веса композиции.
12. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 7, где указанный полоксамер представляет собой смесь полоксамера 188 и полоксамера 407, и такая смесь содержится в количестве 10% по весу относительно веса композиции.
13. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанная масляная фаза содержит по меньшей мере одно липофильное соединение.
14. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 13, где указанное по меньшей мере одно липофильное соединение выбирается из природных масел, таких как миндальное масло, масло канолы, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, сафлоровое масло, кунжутное масло, соевое масло; сложных эфиров жирных кислот, таких как изопропилпальмитат, изопропилмиристат, этилолеат; спиртов жирного ряда, таких как миристиновый спирт, олеиловый спирт; жирных кислот, таких как миристиновая кислота, олеиловая кислота, пальмитиновая кислота, триглицеридов, таких как длинно- и/или среднецепочечные триглицериды; диглицеридов и моноглицеридов.
15. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 13, где указанное по меньшей мере одно липофильное соединение представляет собой среднецепочечные триглицериды.
16. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 13, где указанное по меньшей мере одно липофильное соединение представляет собой природное масло, выбранное из кунжутного масла, миндального масла и соевого масла.
17. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанное по меньшей мере одно поверхностно-активное вещество представляет собой неионогенное поверхностно-активное вещество, ионное поверхностно-активное вещество или их смесь.
18. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 17, где указанное неионогенное поверхностно-активное вещество выбирается из полисорбата 80 и PEG-15 гидроксистеарата.
19. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 17, где указанное ионное поверхностно-активное вещество выбирается из яичного лецитина, гидрогенизированного фосфатидилхолина из яичного лецитина, соевого лецитина и гидрогенизированного соевого лецитина.
20. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, дополнительно содержащая по меньшей мере одно вспомогательное поверхностно-активное вещество.
21. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 20, где указанное по меньшей мере одно вспомогательное поверхностно-активное вещество выбирается из пропиленгликоля, глицерина и олеата натрия.
22. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 21, где указанное по меньшей мере одно вспомогательное поверхностно-активное вещество представляет собой смесь глицерина и олеата натрия.
23. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, дополнительно содержащая по меньшей мере один краситель.
24. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 23, где указанный по меньшей мере один краситель представляет собой витальный краситель, невитальный краситель, реактивный краситель или смесь указанного.
25. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 23, где указанный по меньшей мере один краситель выбирается из раствора Люголя, метиленового синего, толуидинового синего, кристаллического фиолетового, индигокармина, Конго красного и фенолового красного.
26. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 25, где указанный по меньшей мере один краситель представляет собой метиленовый синий или индигокармин.
27. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанная эндоскопическая процедура представляет собой эндоскопическую процедуру резекции, выполняемую во время желудочно-кишечной эндоскопии, полипэктомию, эндоскопическую резекцию слизистой (EMR) и/или эндоскопическое подслизистое расслоение (ESD).
28. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанная эндоскопическая процедура выполняется в пищеводе, желудке, тонкой кишке, слепой кишке, толстой кишке, сигмовидной ободочной кишке и/или прямой кишке.
29. Фармацевтическая композиция в форме эмульсии или микроэмульсии для применения по п. 1, где указанная эндоскопическая процедура включает введение указанной композиции человеку.
30. Фармацевтическая композиция в форме эмульсии или микроэмульсии, содержащая:
a) водную фазу;
b) масляную фазу;
c) по меньшей мере одно поверхностно-активное вещество;
d) по меньшей мере один инверсный термочувствительный полимер;
e) по меньшей мере один краситель;
при этом указанный по меньшей мере один инверсный термочувствительный полимер содержится в количестве между 2% и 14,5% по весу и в объеме ниже критической концентрации гелеобразования (CGC), при этом указанная композиция находится в жидкой фазе до температуры 40°C in vitro и указанная фармацевтическая композиция предназначена для применения в качестве вспомогательного вещества во время эндоскопических процедур, в которых она вводится в целевую ткань с целью формирования прокладки, которая вызывает разъединение между слоями слизистой и подслизистой на по меньшей мере 25 минут.
31. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанная композиция представляет собой эмульсию или микроэмульсию типа "масло в воде".
32. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанная композиция имеет вязкость ниже 150 сП (сантипуаз), ниже 100 сП (сантипуаз), ниже 50 сП (сантипуаз) или ниже 20 сП (сантипуаз).
33. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 32, где указанная вязкость измеряется при температуре 25°C, 30°C и/или 37°C.
34. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанный по меньшей мере один инверсный термочувствительный полимер содержится в количестве между 3% и 12% по весу или между 5% и 11% по весу относительно веса композиции.
35. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанный по меньшей мере один инверсный термочувствительный полимер содержится в количестве 7%, 8%, 9% или 10% по весу относительно веса композиции.
36. Фармацевтическая композиция в форме эмульсии или микроэмульсии по любому из пп. 30-35, где указанный по меньшей мере один инверсный термочувствительный полимер является блочным сополимером полиэтиленоксида-полиоксипропилена, полоксамером.
37. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 36, где указанный по меньшей мере один полоксамер выбирается из полоксамера 124, полоксамера 188, полоксамера 237, полоксамера 338 и полоксамера 407.
38. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 37, где указанный по меньшей мере один полоксамер представляет собой полоксамер 188, полоксамер 407 или смесь полоксамера 188 и полоксамера 407.
39. Фармацевтическая композиция в форме эмульсии или микроэмульсии по по п. 36, где указанный полоксамер представляет собой полоксамер 407, и он содержится в количестве 9% по весу относительно веса композиции.
40. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 36, где указанный полоксамер представляет собой полоксамер 188, и он содержится в количестве 10% по весу относительно веса композиции.
41. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 36, где указанный полоксамер представляет собой смесь полоксамера 188 и полоксамера 407, и такая смесь содержится в количестве 10% по весу относительно веса композиции.
42. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанная масляная фаза содержит по меньшей мере одно липофильное соединение.
43. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанное по меньшей мере одно липофильное соединение выбирается из природных масел, таких как миндальное масло, масло канолы, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, сафлоровое масло, кунжутное масло, соевое масло; сложных эфиров жирных кислот, таких как изопропилпальмитат, изопропилмиристат, этилолеат; спиртов жирного ряда, таких как миристиновый спирт, олеиловый спирт; жирных кислот, таких как миристиновая кислота, олеиловая кислота, пальмитиновая кислота; триглицеридов, таких как длинно- и/или среднецепочечные триглицериды; диглицеридов и моноглицеридов.
44. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 43, где указанное по меньшей мере одно липофильное соединение представляет собой природное масло, выбранное из кунжутного масла, миндального масла и соевого масла.
45. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 43, где указанное по меньшей мере одно поверхностно-активное вещество представляет собой неионогенное поверхностно-активное вещество, ионное поверхностно-активное вещество или их смесь.
46. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанное по меньшей мере одно поверхностно-активное вещество представляет собой неионогенное поверхностно-активное вещество, ионное поверхностно-активное вещество или их смесь.
47. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 46, где указанное неионогенное поверхностно-активное вещество выбирается из полисорбата 80 и PEG-15 гидроксистеарата.
48. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 46, где указанное ионное поверхностно-активное вещество выбирается из яичного лецитина, гидрогенизированного фосфатидилхолина из яичного лецитина, соевого лецитина и гидрогенизированного соевого лецитина.
49. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 1, дополнительно содержащая по меньшей мере одно вспомогательное поверхностно-активное вещество.
50. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 49, где указанное по меньшей мере одно вспомогательное поверхностно-активное вещество выбирается из пропиленгликоля, глицерина и олеата натрия.
51. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 50, где указанное по меньшей мере одно вспомогательное поверхностно-активное вещество представляет собой смесь глицерина и олеата натрия.
52. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 30, где указанный по меньшей мере один краситель выбирается из раствора Люголя, метиленового синего, толуидинового синего, кристаллического фиолетового, индигокармина, Конго красного и фенолового красного.
53. Фармацевтическая композиция в форме эмульсии или микроэмульсии по п. 51, где указанный по меньшей мере один краситель представляет собой метиленовый синий или индигокармин.
| WO 2009070793 A1, 04.06.2009 | |||
| WO1993018852 A1, 30.09.1993 | |||
| US 20050220831 A1, 06.10.2005 | |||
| WO 2011034465 А1, 24.03.2011 | |||
| FERNANDEZ-ESPARRACH G | |||
| et al: Efficacy of a reverse-phase polymer as a submucosal injection solution for EMR: a comparative study, Gastrointestinal endoscopy, ELSEVIER, NL, vol | |||
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ROLAND JEPPSSON et al | |||
| The Influence of Emulsifying Agents and of Lipid Soluble Drugs on the Fractional Removal Rate of Lipid Emulsions from the Blood Stream of the Rabbit, 31 August 1975 (1975-08-31), pages 134 - 144. | |||
Авторы
Даты
2019-08-01—Публикация
2014-11-18—Подача