ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Пептид генетически родственный кальцитонину (CGRP) - это природный пептид, состоящий из 37 аминокислотных остатков, который генерируется тканеспецифичным альтернативным процессингом матричной РНК кальцитонина и широко распространен в центральной и периферической нервной системе. Пептид генетически родственный кальцитонину (CGRP) -это мощный сосудорасширяющий нейромедиатор, который, как считается, играет ключевую роль в патофизиологии мигрени. Первоначальная клиническая валидация CGRP мишени на людях, проведенная Boehringer Ingelheim в 2003 году, показала, что состав IV, содержащий ольцегепант, был эффективен при купировании приступов мигрени, а механизм был подтвержден в исследовании с использованием тельцагепанта (CGRP антагонист) в виде лекарственного препарата для перорального приема.
Недавно разработанные CGRP-антагонисты, описанные в международной заявке номер WO 2012/064910, основаны на структуре Формулы I
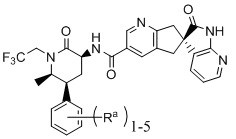
Формула I
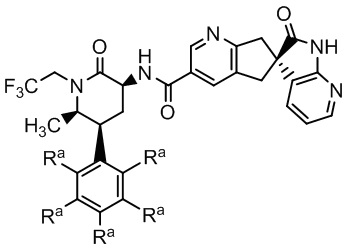
где Ra - различные заместители (например, где R - водород: (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2,-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид и, например, где в качестве трех заместителей Ra выбраны атомы фтора: (S)-N-(3S,5S,6R)-6-метил-2-оксо-1-(2,2,2,-трифторэтил)-5-(2,3,6-трифторфенил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид). Эти соединения подают надежды как хорошо переносимые, эффективные CGRP-антагонисты с низкой вероятностью побочных эффектов и метаболических осложнений. Однако данные соединения обладают низкой растворимостью и в целом не образуют соли, подходящие для приготовления стабильной лекарственной формы.
В первоначальном in vivo исследовании часто применяются плохо растворимые соединения класса II, представленные в виде жидкой лекарственной формы, например, в виде раствора с сорастворителем или липидом с использованием в качестве сорастворителя PEG400, или с другими необходимыми компонентами, для облегчения растворения и повышения всасывания после перорального приема. Несмотря на пригодность жидких лекарственных форм для клинических исследований, в целом коммерчески невыгодно поставлять жидкую лекарственную форму для пероральной доставки препаратов для использования в лечении острых или хронических состояний или при профилактике хронических заболеваний. Желательно, чтобы такие препараты были в твердой форме для перорального введения, например, в виде прессованной таблетке или капсулы, содержащей активный фармацевтический ингредиент (API). Однако препараты с низкой растворимостью в воде трудно доставлять в желудочно-кишечный тракт без усилителей растворимости или проницаемости, или обоих одновременно, присутствующих в месте всасывания.
Для повышения всасывания при пероральном приеме активных фармацевтических ингредиентов (APIs), плохо растворимых в воде, были использованы твердые дисперсии, в частности, твердые растворы, смотри, например, Ford, Pharm Acta Helv, 1986, 61:69-88. Твердые дисперсии и твердые растворы - это композиции, в которых API диспергирован или растворен в твердой матрице, обычно полимерной матрице. Твердые растворы и твердые дисперсии (в которых активный фармацевтический ингредиент образует гомогенное или близкое к гомогенному стекло в формообразующей матрице) представляют особый интерес при пероральной доставке соединений, плохо растворимых в воде. Считается, что эти материалы улучшают всасывание API, вводимых перорально, за счет: (i) улучшения смачивающей способности API; (II) образования кратковременного пересыщения API в месте всасывания по отношению к более низкоэнергетической фазе API (например, кристаллической); или (III) за счет обоих эффектов. В целом считается, что твердые растворы способствуют всасыванию препарата за счет повышения скорости и/или степени растворения, до которой препарат растворяется из матрицы.
Примером препарата класса II, изготовленным в виде твердого раствора, является позаконазол, как было описано в международной заявке на патент номер WO2009/129300, опубликованной 22 Октября, 2009 г. Такие композиции позаконазола были приготовлены путем формирования экструдата позаконазола в ацетат-сукцинате гидроксипропилметилцеллюлозы (HPMC-AS), твердую дисперсию которого впоследствии смешивали с микрокристаллической целлюлозой, дополнительным количеством HPMC-AS, гидроксипропилцеллюлозой и стеаратом магния. Эта смесь была таблетирована с целью создания биодоступной лекарственной формы позаконазола с целевыми значениями PK и биодоступности.
Другой пример использования полимеров для получения твердого раствора полимера и API представлен Goertz и др. в патенте США номер 4,801,460, где описаны твердые дисперсии, содержащие плохо растворимый препарат (на примере теофиллина) и сшитый сополимер винилпирролидона и винилацетата (PVP сополимер). В '460 патенте сообщаются времена высвобождения препарата в испытаниях, достигающие 8 часов, но не обсуждаются лекарственные средства немедленного высвобождения, содержащие такие твердые растворы с полимерной матрицей.
В международной заявке номер WO98/029137 (137 публикация), опубликованной 9 июля 1998 года, Takagi и др. описаны композиции, состоящие из API, растворенного в матрице, содержащей целлюлозный полимер, например, гидроксипропилметил-, гидроксиэтил- и гидроксипропилцеллюлозу, и соли, обладающие эндотермическим эффектом при растворении, например, бикарбонат натрия, который согласно сообщениям повышает скорость распада. В '137 публикации показано, что исследованные композиции аналогичны смесям, содержащим карбонатную или бикарбонатную соль в присутствии твердой, водорастворимой кислоты, которая способствует распаду при попадании в водную среду за счет шипучего действия.
Fry и др. описаны лекарственные формы для HER-2 ингибиторов, диспергированных в широком круге полимерных матриц, включая много различных производных целлюлозных полимеров (включая привитые сополимеры с целлюлозными фрагментами), поливинилспирты и поливинилпирролидоны. Смотри международную заявку номер WO2013/056108, опубликованную 18 апреля 2013 г. Согласно сообщению такие композиции понижают межиндивидуальные колебания PK.
Несмотря на растущее применение лекарственных форм в виде твердых растворов для эффективного всасывания препаратов при пероральном приеме, их разработка во многом остается предметом проб и ошибок. Успешное представление липофильных соединений в виде твердых дисперсий для повышения всасывания при пероральном приеме может оказаться выгодным благодаря сильному взаимодействию между API и полимером. Это вызвало интерес к полимерам с амфифильными свойствами, обладающим частичной растворимостью в воде, таким как ацетат-сукцинат гидроксипропилметилцеллюлозы (HPMCAS), в особенности, когда твердая дисперсия создается с помощью распылительной сушки. Смотри Friesen и др., Mol. Pharm., 2008, 5:1003-1019. Тогда как этот подход оказался успешным для многих потенциальных лекарственных препаратов, было предположено, что соединения с высокими температурами плавления (или большими соотношениями температуры плавления к температуре стеклования) и/или, в частности, липофильные соединения (например, соединения с высокими значениями logP) особенно проблематичны для успешного создания лекарственной формы в виде твердых растворов. Friesen и др. показано, что такие успешные рецептуры соединений, имеющих высокие температуры плавления, вероятно, будут ограничены относительно разбавленными концентрациями API в твердой дисперсии.
Из вышеупомянутого ясно, что желательно представлять соединения Формулы I в твердом виде для перорального введения через желудочно-кишечный тракт, тогда природа проводимой терапии может требовать, чтобы лекарственное средство позволяло сделать соединение формулы I немедленно доступным для пациента, которому оно назначается. В настоящее время существует нехватка лекарственных форм немедленного высвобождения, основанных на твердых дисперсиях или растворах API соединений класса II в полимерной матрице.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к таблетке, состоящей из:
(a) экструдата, содержащего:
(i) водорастворимую полимерную матрицу;
(ii) диспергатор; и
(iii) соединение Формулы I или его фармацевтически приемлемую соль
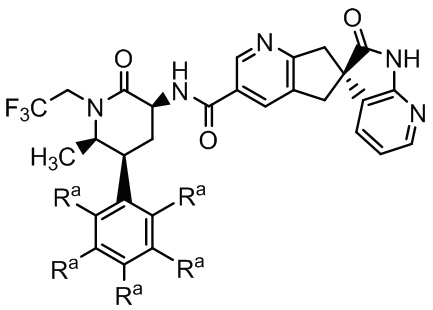
Формула I
где Ra независимо -H или -F, и где диспергатор и соединение Формулы I диспергированы в вышеупомянутой полимерной матрице; и
(b) системы, способствующей распаду,
где вышеуказанная таблетка имеет твердость от примерно 12 кГ до примерно 18 кГ, и где вышеуказанная таблетка полностью распадается менее чем за 5 минут в условиях стандартного испытания на распадаемость таблеток, соответствующего USP 31-NF26, глава 701, с использованием водного раствора HCl (pH 1.8) при 37°С.
В некоторых вариантах осуществления изобретения предпочтительно использовать в качестве водорастворимой полимерной матрицы для вышеупомянутого экструдата сополимер винилпирролидона и винилацетата (PVP-PA).
В некоторых вариантах осуществления изобретения предпочтительно, чтобы система, способствующая распаду, содержала порошкообразный хлорид натрия и кроскармеллозу натрия, и более предпочтительно в массовом соотношении 1:1.
В некоторых вариантах осуществления изобретения предпочтительно, чтобы таблетка имела твердость от примерно 12 кГ до примерно 16 кГ. В некоторых вариантах осуществления изобретения предпочтительно, чтобы таблетка имела предел прочности на разрыв примерно 1.75 МПа.
В некоторых вариантах осуществления изобретения предпочтительно, чтобы таблетка изобретения высвобождала, по меньшей мере, примерно 90 масс. % соединения Формулы I, содержащегося в ней, в условиях испытания на растворимость в соответствии с USP 30 NF25, глава 711, на аппарате номер 2, снабженном лопастями USP 2, работающем со скоростью 50 об/мин, в 900 мл искусственного желудочного сока (рН 1.8) при 37°С.
В некоторых вариантах осуществления изобретения предпочтительно, чтобы таблетка содержала систему, способствующую распаду, состоящую из:
(а) Порошкообразного Хлорида Натрия, где вышеупомянутый хлорид натрий характеризуется: (i) величиной d50 менее чем примерно 210 микронов; (b) величиной d10 менее чем примерно 50 микронов; и (iii) величиной d90 менее чем примерно 470 микронов; и
(b) кроскармеллозы натрия,
где вышеуказанный Порошкообразный Хлорид Натрия и вышеуказанная кроскармеллоза натрия присутствуют в массовом соотношении 1:1, и где количество экструдата, присутствующего в таблетке, выбирается таким образом, чтобы содержание соединения Формулы I, диспергированного в нем, составляло от примерно 9 масс. % до примерно 10 масс. %.
В некоторых вариантах осуществления изобретения предпочтительно, чтобы система, способствующая распаду, составляла примерно 20 масс. % таблетки. В некоторых вариантах осуществления изобретения предпочтительно, чтобы таблетка содержала примерно 50 масс. % экструдата.
В некоторых вариантах осуществления изобретения, рецептура таблетки изобретения включает (i) экструдат; (ii) систему, способствующую распаду; (iii) один или более разбавителей, в некоторых вариантах осуществления изобретения предпочтительно использовать в качестве разбавителей маннитол и микрокристаллическую целлюлозу; (iv) регулятор сыпучести, в некоторых вариантах осуществления изобретения предпочтительно использовать в качестве регулятора сыпучести коллоидный кремнезем; и (v), один или более смазочных веществ, в некоторых вариантах осуществления изобретения предпочтительно использовать в качестве смазочных веществ стеарилфумарат натрия.
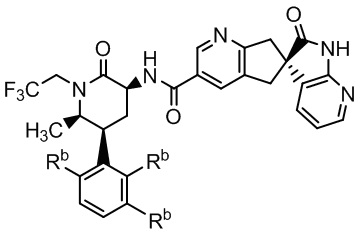
В некоторых вариантах осуществления предпочтительно, чтобы соединение Формулы I представляло собой соединение Формулы Ia или его соль:
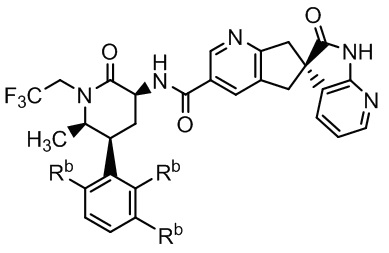
Формула Ia
где каждый заместитель Rb - это -H или каждый заместитель Rb - это -F.
В некоторых вариантах осуществления изобретения предпочтительно, чтобы водорастворимой полимерной матрицей вышеуказанного экструдата был водорастворимый сополимер винилпирролидона и винилацетата, предпочтительно сополимер винилпирролидона и винилацетата, полученный свободнорадикальной полимеризацией винилпирролидонового и винилацетатного мономеров в соотношении 6:4.
В некоторых вариантах осуществления изобретения, где соединение Формулы I - это соединение Формулы Ia, предпочтительно, чтобы соединение Формулы Ia присутствовало в экструдате в количестве от примерно 20 масс. % массы экструдата до примерно 22 масс. % массы экструдата.
В некоторых вариантах осуществления изобретения предпочтительно, чтобы экструдат содержал в качестве диспергатора полиэтиленгликольсукцинат α-токоферола (TPGS) в количестве, по меньшей мере, примерно 5 масс. % от массы конечного экструдата.
В некоторых вариантах осуществления изобретения предпочтительно, чтобы экструдат включал растворимый сополимер винилпирролидона и винилацетата в количестве, составляющем от примерно 50 масс. % экструдата до примерно 80 масс. % экструдата, предпочтительно от примерно 70 масс. % экструдата до примерно 75 масс. % экструдата.
В одном аспекте изобретение относится к лекарственной форме, подходящей для получения прессованной таблетки, которая включает:
a) композицию экструдата, состоящую из водорастворимой полимерной матрицы на основе сополимера винилпирролидона и винилацетата (PVP-VA сополимер) и диспергированных в ней:
(i) активного соединения Формулы Iа или его фармацевтически приемлемой соли:
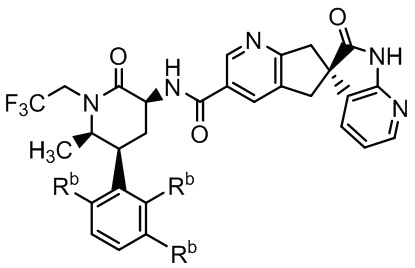
Формула Iа
где все заместители Rb или -H или -F; и
(ii) полиэтиленгликольсукцината токоферола (TPGS),
где вышеуказанное соединение Формулы Ia составляет от примерно 5 масс. % до примерно 23 масс. % вышеупомянутого экструдата, а TPGS составляет, по меньшей мере, примерно 5 масс. % вышеупомянутого экструдата; и
b) систему, способствующую распаду, состоящую из: (i) кроскармеллозы натрия; и (ii) Порошкообразного Хлорида Натрия,
где вышеуказанная система, способствующая распаду, составляет примерно 20 масс. % вышеуказанной лекарственной формы, и где вышеуказанная лекарственная форма отличается возможностью образования таблеток с твердостью от примерно 12 кГ до примерно 18 кГ, предпочтительно от примерно 12 кГ до примерно 16 кГ, таблетка которой в условиях испытания на растворимость в соответствии с USP 30 NF25, глава 711, на установке с лопастной мешалкой, снабженной лопастями USP 2, работающей со скоростью 50 об/мин, в 900 мл искусственного желудочного сока (рН 1,8) при 37°С высвобождает, по меньшей мере, примерно 90% соединения Формулы Ia, содержащегося в нем, менее чем за 20 мин.
В некоторых вариантах осуществления таблетка изобретения включает в дополнение к экструдату и системе, способствующей распаду: (i) маннитол, предпочтительно примерно 20 масс. % состава; (ii) микрокристаллическую целлюлозу, предпочтительно до примерно 20 масс. % состава; (iii) коллоидный кремнезем, предпочтительно примерно 0.25 масс. % состава; и (iv) стеарилфумарат натрия, предпочтительно примерно 0.75 масс. % состава. В некоторых вариантах осуществления изобретения предпочтительно, чтобы рецептура таблетки включала примерно 50 масс. % вышеупомянутого экструдата.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1. Схема технологического процесса, иллюстрирующая типовые операции общего метода приготовления дисперсии изобретения.
ФИГ. 2. Схема технологического процесса, иллюстрирующая типовые операции альтернативного общего метода приготовления дисперсии изобретения.
ФИГ. 3. Схема технологического процесса, иллюстрирующая типовые операции составления таблеток изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующая терминология, которая может быть использована здесь, используется в соответствии со следующими определениями.
Если прямо не указано обратное, все диапазоны, приведенные здесь, являются включающими; т.е. диапазон включает значения верхнего и нижнего пределов диапазона, а также все значения между ними. Например, диапазоны температур, процентного содержания, диапазоны эквивалентов и т.п., описанные здесь, включают верхний и нижний пределы диапазона и любое значение непрерывного множества между ними.
Термин ʺлекарственная формаʺ, используемый здесь, относится к смеси, агрегации, раствору или другой комбинации материалов, включающей активный фармацевтический ингредиент (API), состав которой приспособлен к определенному способу введения, например, лекарственная форма, подходящая для прессования в таблетки, предназначенная для перорального приема при лечении, ведении, профилактике и др. болезненного состояния пациента.
Термин ʺсубъектʺ, используемый здесь, относится к животному, предпочтительно млекопитающему, более предпочтительно к человеку, который является объектом лечения, наблюдения или эксперимента. Когда человек, страдающий от состояния, требующего лечения, вовлечен в мероприятия, альтернативно он именуется здесь пациентом.
Как отмечено выше, настоящее изобретение относится к экструдированной композиции (экструдату), содержащей растворимую полимерную матрицу и диспергированное или растворенное в ней соединение Формулы I или его фармацевтически приемлемую соль:
Формула I
где Ra независимо -Н или -F, и диспергатор, например, полиэтиленгликольсукцинат витамина Е (TPGS), экструдат которых используется в технологии приготовления лекарственного средства, включающего систему, способствующую распаду, состав которой подходит для получения таблеток с твердостью до 18 кГ, в некоторых вариантах осуществления изобретения предпочтительно 16 кГ, которые распадаются в течение примерно 5 минут в стандартных испытаниях на распадаемость.
Соединение Формулы I, подходящее для применения в композициях изобретения, может быть синтезировано по методике, описанной в WO 2012/064910. В некоторых вариантах осуществления предпочтительно кристаллизовать технический продукт соединения Формулы I, полученного по вышеупомянутой методике, из смеси этанол/вода, таким образом, получая кристаллическую тригидратную форму соединения, и измельчать кристаллический материал до размера частиц, обеспечивающего свободное движение порошка, который может быть загружен в экструдерную установку, используемую для приготовления дисперсии. Понятно, что упомянутые массы и соотношения для массовых содержаний, описанные для соединения Формулы I в лекарственных формах и таблетках, описанных здесь, скорректированы так, чтобы отражать массу эквивалентного количества 100% активного чистого соединения без кристаллизационного растворителя или инертного материала, которая будет учтена при приготовлении композиций, используя материалы, имеющие менее чем 100% активность.
Согласно Фиг. 1 и 2, экструдат, как правило, получают методом экструзии из горячего расплава (HME) соединения Формулы I и различных формообразующих наполнителей, которые могут быть подвержены или нет дополнительным операциям, чтобы привести их в состояние, подходящее для HME обработки.
Авторы изобретения с удивлением обнаружили, что в отличие от большинства случаев с фармацевтическими соединениями класса II, которые часто диспергированы в различных полимерах, как это было отмечено выше, соединения Формулы I склонны к термическому разложению при попытках включить их в матрицу, представляющую собой некоторые коммерчески доступные целлюлозные полимеры при использовании HME методологии. Например, применение HPMCAS в качестве полимерной матрицы приводит к образованию избыточных продуктов разложения в полученной дисперсии. В некоторых испытаниях использование целлюлозного полимера в качестве матрицы для приготовления дисперсий соединения Формулы I методом HME привело к 25 раз более интенсивному разложению API, чем при испытании отдельно API в аналогичных условиях превышения температуры.
Неожиданно авторы изобретения обнаружили, что одним из типов коммерчески доступных полимерных материалов, которые могут быть использованы для приготовления дисперсии соединения Формулы I без существенного термического разложения этого соединения, оказались коммерчески доступные водорастворимые полимеры, например, сополимеры винилпирролидона и винилацетата (PVP-VA полимеры). Было неожиданно обнаружено, что дисперсии, приготовленные по методологии HME с использованием водорастворимого полимера, например, PVP-VA и соединения Формулы I не привело к более существенному термическому разложению, чем испытание исходного соединения Формулы I отдельно в аналогичных условиях превышения температуры. Однородные смеси чистого соединения FIa-H (соединение Формулы Ia, где все заместители Rb - атомы -Н) или чистого соединения FIa-F (соединение Формулы Ia, где все заместители Rb - атомы -F) и одного из двух потенциальных матричных полимеров нагревали в течение 2 минут до 170°С на подложке TGA аппарата, затем охлаждали до комнатной температуры, после чего спектрально оценивали образование известных продуктов термического разложения. Эти данные обобщены в Таблице 1.
Таблица I
(аморфный материал)
Данные в Таблице 1 показывают, что некоторые коммерчески доступные целлюлозные полимеры усиливают термическое разложение как FIa-H, так и FIa-F соединений. Кроме того авторы изобретения обнаружили, что температуры обработки методом HME могут достигать 180°С, что приводит к еще большей потере соединения Формулы I в виде продуктов разложения. Так, исследователями неожиданно обнаружено, что диспергирование соединений Формулы I в растворимых сополимерах винилпирролидона и винилацетата (PVP-VA сополимер) путем экструзии из горячего расплава, проведенной в аналогичных условиях превышения температурных параметров, которые были использованы в случае с целлюлозным полимером, привела к снижению содержания продуктов разложения в экструдате. Обычно содержание продуктов разложения, наблюдаемое в таком экструдате, было не выше чем содержание продуктов разложения, наблюдаемое для образцов того же соединения Формулы I, подверженных таким же термическим перегрузкам, как и в HME процессе.
В соответствии с вышеизложенным, водорастворимыми полимерами, подходящими для использования в композициях изобретения, являются любые растворимые сополимеры PVP-VA, синтезированные путем свободнорадикальной полимеризации винилпирролидонового и винилацетатного мономеров в соотношении 6:4. Примером коммерчески доступного сополимера этого типа является сополимер винилпирролидона и винилацетата, продаваемый под торговой маркой Kollidon® 64 и его эквиваленты.
В дополнение к матричному полимеру и, по меньшей мере, одному соединению Формулы I, экструдат изобретения содержит некоторое количество формообразующего наполнителя, играющего роль диспергатора. Согласно используемой терминологии, диспергатор может уменьшать термическую энергию, необходимую для растворения соединения Формулы I в матричном полимере, и способствовать образованию дисперсии с еще меньшими потерями при разложении соединения Формулы I, диспергированного в матрице. Для экструдатов изобретения в некоторых вариантах осуществления изобретения предпочтительно использовать витамин Е в виде полиэтиленгликольсукцината (d-альфа-токоферил полиэтиленгликольсукцинат, или TPGS). Примером коммерчески доступного TPGS, подходящего для использования в экструдатах изобретения, является любой этерифицированный d-альфа-токоферилсукцинат с полиэтиленгликолем 1000, например, но не ограничиваясь, Витамин Е d-альфа-TPGS NF производства Eastman Chemical Company. В некоторых вариантах осуществления изобретения предпочтительно, чтобы TPGS был использован в качестве диспергатора и присутствовал в конечном экструдате в количестве, по меньшей мере, примерно 5 масс. % экструдированной композиции.
Понятно, что другие диспергаторы, например, полиэтоксизамещенное касторовое масло (например, кремофор), также могут быть использованы.
Относительные количества соединения Формулы I, матричного полимера и диспергатора, использованных в композициях изобретения, выраженные в масс. % от массы экструдированной композиции (экструдата) могут варьироваться, но все еще относятся к объему изобретения. Обычно матричный полимер присутствует в количестве, необходимом для сохранения баланса композиции после вычитания массового содержания API и диспергатора. Обычно количество матричного полимера составляет от примерно 70 масс. % до 75 масс. % конечного экструдата. В некоторых вариантах осуществления изобретения предпочтительно, чтобы композиции изобретения включали количество соединения Формулы I, поправленное на его относительную активность по сравнению с 100% чистым соединением Формулы I, эквивалентное не более 25 масс. % от 100% чистого соединения, содержащегося в конечной экструдированной композиции. В некоторых вариантах осуществления изобретения предпочтительно, чтобы количество соединения Формулы I в конечном экструдате было эквивалентно по активности от примерно 5 масс. % до примерно 22 масс. % от 100% чистого соединения в конечном экструдате, и более предпочтительно количество эквивалентное по активности, по меньшей мере, примерно 20 масс. % от 100% чистого соединения в конечном экструдате.
Композиции изобретения могут быть приготовлены по технологии, подходящей для получения дисперсии выбранного API (например, соединения Формулы Iа) в полимерной матрице, так чтобы препарат представлял собой в целом аморфную однородную дисперсию или раствор в полимере. Как правило, это требует некоторых методов нагревания и смешения компонентов целевой композиции и восстановления дисперсии или раствора в твердом виде. Несмотря на то, что ясно, что любые средства получения дисперсии могут быть использованы без отклонения от настоящего изобретения, в некоторых вариантах осуществления предпочтительно получение композиций изобретения путем Экструзии из Горячего Расплава (HME). Экструзия из горячего расплава (HME) -это метод, в котором экструдер, например, 27-мм двухшнековый экструдер Лейстрица применяется для смешения и нагревания полимера, лекарственного средства и диспергатора, до формирования конечной дисперсии или раствора композиции в виде пасты или другой удобной для обращения формы, которая может быть использована далее для обработки при приготовлении таблетированных лекарственных форм (экструдата).
При проведении таких операций некоторые или все компоненты могут быть предварительно смешены до их введения в экструдер, например, смешением сухих порошков или мокрым измельчением компонентов в процессе смешения или гранулирования для обеспечения тщательного перемешивания компонентов, что приводит к гомогенной смеси компонентов при загрузке в экструдер. В качестве альтернативы компоненты могут быть загружены в экструдер, используя независимые подающие потоки (смотри ʺЭкструзия Полимеровʺ, 4 издание, Chris Rauwendaal 2001, Hanser Gardner Publications, Inc., Cincinnati, OH или Schenck и др., (2010), ʺДостижение Проектных Решений для Экструзии из Горячего Расплава с Целью Получения Твердых Растворовʺ, в ʺХимическое Машиностроение в Фармацевтической Промышленности: от Исследований и Разработок до Производстваʺ (ред. D. J. am Ende), John Wiley & Sons, Inc.,Hoboken, NJ, USA). Несмотря на то, что для некоторых композиций изобретения предпочтительно использовать HME процесс для их приготовления, ясно, что композиции изобретения могут быть получены любым способом, подходящим для получения расплава в любом удобном аппарате, в котором смесь соединения Формулы I, матричного полимера и диспергатора могут быть нагреты, смешены, и восстановлены.
В целом при экструдировании материалов транспортировка материала через экструдер приводит к передаче материалу энергии, которая превращается в тепло в транспортируемом материале. Когда теплоотдача от экструдера, расходуемая на транспорт материала, недостаточна сама по себе для достижения температуры, необходимой для создания целевой дисперсии или раствора соединения Формулы I в полимерной матрице, как правило, цилиндр экструдера снабжается средствами для передачи дополнительного тепла материалу. Аналогичным образом различные детали цилиндра экструдера могут быть нагреты или охлаждены по мере необходимости, для поддержания необходимой температуры в пределах детали цилиндра экструдера или даже отводят тепло в другой части цилиндра экструдера, чтобы охладить проходящий материал. В целом температура экструдера, быстроходность и скорость транспорта экструдера устанавливаются таким образом, чтобы обеспечить минимальное отклонение температуры и время удерживания, необходимые для обеспечения получения гомогенной дисперсии или раствора, таким образом, уменьшая количество API, которое подвергается разрушению при обработке.
В целом экструдат, выходящий из экструдера, находится в вязко-текучем состоянии и твердеет на выходе из цилиндра из-за сброса давления и охлаждения. При этом переходе обычно экструдат имеет линейную форму, например, нити, рейки, цилиндры и др., и разделяется на куски удобной длины. Как только получены куски экструдата, они могут быть подвергнуты механической обработке для получения удобной формы для включения в лекарственную форму, например, измельчению, растиранию или просеиванию. Согласно используемой терминологии материал, выходящий из экструдера, и любая форма, в которую материал впоследствии переводится путем механической обработки, например, измельчением, растиранием, смешением, просеиванием или гранулированием называется ʺэкструдатʺ. Типовыми экструдерами являются экструдеры, поставляемые Leistritz, например, 27 мм двухшнековый экструдер Лейстрица и экструдеры, поставляемые Thermo-Fisher, например, 16 мм двухшнековый экструдер Thermo-Fisher. Это оборудование, как правило, снабжено средствами нагрева цилиндра экструдера, позволяющими использовать его в режиме экструзии из горячего расплава.
Как только экструдат переведен в удобную форму для дальнейшей обработки, он может быть включен в рецептуру для получения лекарственной формы, подходящей для перорального приема, например, рецептуру, приспособленную для прессования в таблетки или заливки в капсулы. Для достижения целевых значений по растворимости и распадаемости, необходимых для эффективного использования соединения Формулы I в терапии мигрени, готовится лекарственная форма, которая включает конечный экструдат, предпочтительно измельченный для получения порошкообразной формы, которая может быть легко смешена с другими компонентами состава, систему, способствующую распаду, и другие формообразующие наполнители, например, разбавитель и смазочное вещество, полезные при приготовлении лекарственной формы, подходящей для таблетирования. Для использования в рецептуре настоящего изобретения система, способствующая распаду, должна содержать обычный дезинтегрирующий агент, например, кроскармеллозу натрия или кросповидон и Порошкообразный Хлорид Натрия, где понятие ʺПорошкообразный Хлорид Натрияʺ имеет значение, представленное здесь.
При использовании по отношению к системе, способствующей распаду, настоящего изобретения, фраза ʺПорошкообразный Хлорид Натрияʺ означает хлорид натрия, который был обработан до состояния, имеющего распределение частиц, позволяющее получить следующие значения: (i) d50 менее чем примерно 210 микронов, например, 195 микронов; (ii) d10 менее чем примерно 50 микронов, например, между 43 и 44 микронами; (iii) d9 менее чем 470 микронов, например, примерно 460 микронов, и где материал демонстрирует средний объемный диаметр менее чем примерно 240 микронов, например, примерно 230 микронов. Пример такого типа коммерчески доступного хлорида натрия поставляется AvantorTM под торговой маркой Sodium Chloride, Powder, USP GenAR® product no. 7540.
Данные, представленные в Таблице II, показывают необходимость применения Порошкообразного Хлорида Натрия в системе, способствующей распаду, в рецептурах настоящего изобретения. Опытные образцы таблеток, содержащих экструдат изобретения (вышеупомянутый экструдат, включающий PVP-VA матрицу, соединение Формулы IA (FIa-H) и TPGS), разбавитель, представляющий собой микрокристаллическую целлюлозу, и систему, способствующую распаду, состоящую из кроскармеллозы натрия и соли, показанной в левой колонке Таблицы II, были подвергнуты испытанию на распадаемость в соответствии с USP 31-NF26, глава 701, в стандартной установке для испытаний на распадаемость (Pharamatron DT50), используя водный раствор HCl (pH 1.8) в качестве среды для распада при 37°С. Как показано в Таблице II, к удивлению только таблетка, приготовленная с использованием Порошкообразного Хлорида Натрия в системе, способствующей распаду, была способна соответствовать целевому времени на распад менее чем 5 минут (с контролируемым сжимающим усилием для получения таблеток с согласующимися значениями твердости и толщины для всех рецептур).
Таблица II
Кроме того, когда были приготовлены эквивалентные таблетки с использованием только Порошкообразного Хлорида Натрия без кроскармеллозы натрия, было обнаружено, что времена распада таблеток также превышают 5 минут. Таким образом, в некоторых вариантах осуществления изобретения предпочтительно, чтобы система, способствующая распаду, включала обычный дезинтегрирующий агент в сочетании с Порошкообразным Хлоридом Натрия, и более предпочтительно в массовом соотношении Порошкообразный Хлорид Натрия:Дезинтегрирующий агент 1:1. Без теоретического обоснования считается, что Порошкообразный Хлорид Натрия демонстрирует более быструю кинетику растворения, чем скорость гелеобразования полимерной матрицы, когда таблетка изобретения попадает в среду, предназначенную для растворения (желудочно-кишечный тракт человека). Без теоретического обоснования также считается, что Порошкообразный Хлорид Натрия в силу своего корпускулярного профиля обладает комбинацией желаемой кинетики растворения и способности образовывать с достаточным быстродействием (быстрее, чем скорость гелеобразования матричного полимера) локальный граничный слой достаточной ионной силы для подавления гелеобразования в матричном полимере, и, таким образом, способствует высвобождению соединения Формулы I из таблетированного состава, что в противном случае могло быть затруднено из-за гелеобразования в матричном полимере. Понятно, что другие соли, представленные в форме, демонстрирующей аналогичную комбинацию быстрой кинетики растворения и способности быстро образовывать локальный граничный слой достаточной ионной силы для подавления гелеобразования могут быть использованы в рецептуре изобретения без отклонения от объема настоящего изобретения, определенного здесь.
В рецептурах изобретения, подходящим дезинтегрирующим агентом для использования в системах, способствующих распаду, является например кроскармеллоза натрия (сшитая карбоксиметилцеллюлоза натрия), например, AC-Di-Sol® линейка полимеров, доступная от FMC. Понятно, что другие дезинтегрирующие агенты могут быть использованы для получения эффективной системы, способствующей распаду, например, кросповидон, если они используются в соответствии с другими аспектами системы, способствующей распаду, описанной здесь, и не отклоняются от объема содержания настоящего изобретения.
Соединения Формулы I предназначены для лечения мигрени, и вследствие этого, считается, что лекарственные формы быстрого высвобождения важны для обеспечения лечебного эффекта для пациентов, которым назначается такая таблетка.
Как известно, два качества таблетированной и капсульной лекарственных форм, важных с точки зрения высвобождения активного фармацевтического соединения, могут быть проявлены с помощью стандартных испытаний по измерению времени распада и/или времени растворения лекарственной формы. В испытании на распадаемость измеряется количество времени, необходимое для того, чтобы лекарственная форма визуально распалась и вымылась из стандартной корзинки, содержащейся в стандартном оборудовании при стандартных условиях работы. Стандартный тест на распадаемость описан для таблеток и капсул в USP 31-NF26, глава 701, начиная со стр. 266. Существуют также его эквиваленты, описанные, например, Европейской Фармакопеей и Японской Фармакопеей, стандартные испытания которых в целом признаются регулирующими законами большинства стран. Согласно используемой терминологии, в отношении лекарственных форм и таблеток настоящего изобретения ʺвремя распадаʺ означает величину, определенную из испытания в соответствии со стандартом, проведенном при 37°С, используя водный раствор HCl (pH 1.8) в качестве среды распада.
Лекарственные формы, предназначенные для перорального приема, могут быть также протестированы в испытаниях на растворимость, где зависящее от времени высвобождение количества терапевтического соединения, растворенного в стандартной среде в стандартной установке, измеряется после введения лекарственной формы в испытательную среду. Стандартное испытание на растворимость для таблеток и капсул описано, например, в USP 36, глава 711. Эквивалентные испытания описаны в Европейской Фармакопее и Японской фармакопее, и в руководстве от US FDA, например, в ʺРуководстве для Индустрии, Испытание на Растворимость для Твердых Пероральных Лекарственных Форм Немедленного Высвобожденияʺ, опубликованном в августе 1997 г. Департаментом Здравоохранения и Социального Обеспечения, Управлением по Контролю за Качеством Пищевых Продуктов и Лекарственных Средств, Центром для Оценки и Исследования Лекарств, США, стр. 1-13 и процитированные там ссылки. Согласно используемой терминологии, в отношении лекарственных форм и таблеток настоящего изобретения ʺвремя распадаʺ означает величину, определенную из испытания в соответствии с этим стандартом в стандартной установке для растворения, снабженной USP 2 лопастями, работающей на скорости 50 об/мин, в 900 мл искусственного желудочного сока (pH 1.8) при 37°С.
В одном из аспектов изобретение относится к лекарственной форме, приспособленной для приготовления таблеток, содержащих экструдат изобретения, систему, способствующую распаду, включающую Порошкообразный Хлорид Натрия и кроскармеллозу натрия, а также другие формообразующие наполнители, например, разбавители, регуляторы сыпучести и смазочные вещества, в количествах которые, как только лекарственная форма прессуется в таблетку, имеющую твердость от примерно 12 кГ до примерно 16 кГ, а в некоторых вариантах осуществления изобретения от 12 кГ до примерно 18 кГ, позволяет получить таблетку, высвобождающую более чем 90% API, содержащегося в ней, менее чем за 20 минут при испытании на растворимостье в стандартной установке для определения растворимости, снабженной USP 2 лопастями, работающей на скорости 50 об/мин, в 900 мл искусственного желудочного сока (рН 1,8) при 37°С, в соответствии с процедурами, описанными в ʺРуководстве для Индустрии, Испытание на Растворимость для Твердых Пероральных Лекарственных Форм Немедленного Высвобожденияʺ, опубликованном в августе 1997 г. Департаментом Здравоохранения и Социального Обеспечения, Управлением по Контролю за Качеством Пищевых Продуктов и Лекарственных Средств, Центром для Оценки и Исследования Лекарств, США, стр. 1-13 и процитированные там ссылки.
Понятие твердости таблетки используется здесь по отношению к таблетке с заданной массой 500 мг или к таблетке в форме капсулы с заданной массой 652.2. Соответственно, согласно используемой терминологии таблетки с твердостью в диапазоне от 12 кГ до 16 кГ имеют соответствующий предел прочности на разрыв примерно 1,75 МПа, а таблетки с твердостью в диапазоне от 19 кГ до 22 кГ имеют предел прочности на разрыв примерно 2,75 МПа.
Рецептуры изобретения, использованные при приготовлении пероральных лекарственных форм (например, таблеток или капсул), могут также содержать другие формообразующие наполнители. Например: типовая рецептура изобретения, предназначенная для приготовления прессованной таблетки, может содержать разбавитель (например, маннитол, рыночный товар, и/или микрокристаллическую целлюлозу, например, Avicel®); регулятор сыпучести (например, коллоидный кремнезем, например, Cab-O-Sil®); и смазочное вещество (например, стеарилфумарат натрия, рыночный товар). Понятно, что в лекарственных композициях настоящего изобретения, могут быть использованы другие разбавители, регуляторы сыпучести, и смазочные вещества для получения аналогичных рецептур.
Следующие определения относятся к формообразующим наполнителям, которые могут быть применены в рецептурах изобретения согласно используемой терминологии:
разбавитель - это формообразующее вещество, которое повышает объем лекарственной формы, обычно, где активный фармацевтический ингредиент в рецептуре слишком сильнодействующий, чтобы можно было проводить удобную обработку и введение лекарственной формы, не содержащей разбавитель, или где рецептура сама по себе без разбавителя затрудняет приготовление лекарственной формы (например, где аликвота рецептуры без разбавителя будет слишком маленького объема для превращения аликвоты в таблетку);
дезинтегрирующий агент - это вспомогательное вещество, которое набухает и/или растворятся при попадании в водную среду, например, желудочно-кишечный тракт, который способствует распаду таблетки на части и выделению активного фармацевтического ингредиента, содержащегося в таблетке;
система, способствующая распаду, это комбинация удобного дезинтегрирующего агента и быстро растворяющейся соли, которая обеспечивает выгодные противогелеобразующие эффекты при попадании в среду, где лекарственная форма, в которую включена система, способствующая распаду, разрушается, например, искусственный желудочный сок, желудочно-кишечный тракт субъекта или водный раствор HCl с рН 1.8;
регулятор сыпучести - это формообразующий наполнитель, например, коллоидный кремнезем, который повышает проходимость гранулированной смеси, уменьшая трение между частицами.
Фармацевтические составы, предназначенные для приготовления пероральных лекарственных форм (таблеток и капсул), могут также содержать один или несколько агентов, выбранных из группы подсластителей, ароматизаторов, красителей и консервантов, с целью получения фармацевтически элегантных и вкусных препаратов.
Приготовление лекарственных форм настоящего изобретения, подходящих для получения твердой пероральной лекарственной формы, представляющей собой композицию изобретения, может включать смешивание, вальцевание или мокрое гранулирование для уплотнения и/или уменьшения риска сегрегации компонентов во время последующего обращения (например, прессования в таблетки). Стадия гранулирования может быть также применена для уменьшения влияния вариативности свойств исходного материала (например, размера частиц формообразующих наполнителей) на последующую обработку (например, прессование в таблетки) и окончательный выпуск продукта. Смазывание обычно проводится перед вальцеванием и прессованием в таблетки с целью уменьшить склонность материала прилипать к поверхностям прессовочной установки (например, пресс-инструмента). Как правило, смазочные вещества являются производными стеариновой кислоты, например, стеарат магния или стеарилфумарат натрия. Известны методики и методы, которые могут быть использованы для приготовления лекарственных форм, например, методы, описанные в Ansel, ʺВведение в Фармацевтические Лекарственные Формыʺ, 7 издание, 1999 г.
В целом приготовление лекарственных форм для перорального приема из фармацевтических составов настоящего изобретения требует, чтобы фармацевтические составы изобретения (смесь формообразующих наполнителей, системы, способствующей распаду, и композиции изобретения) прессовались в таблетку или загружались в капсулу. Таблетки могут быть приготовлены в виде различных форм (эллипсоидной, капсульной, двояковыпуклого круга и др.). Порошок также может быть инкапсулирован в капсульную лекарственную форму (например, используя тяжелые желатиновые капсулы). Методики, подходящие для приготовления твердых лекарственных средств настоящего изобретения, описаны в Remington's Pharmaceutical Sciences, 18 издание, ред. A. R. Gennaro, 1990, глава 89 и в Remington - The Science and Practice of Pharmacy, 21 издание, 2005 г., глава 45. В некоторых вариантах осуществления изобретения предпочтительно готовить таблетку, имеющую твердость 16 кГ или меньше, где таблетка должна обеспечивать эквивалент 50 мг соединения Формулы Ia (100% чистого), помещая от 462.5 до 537.5 мг состава в пресс-инструмент с номером чертежа Elizabeth Carbide Die Company™ Р-14305-В, и сжимая ее в пресс-форме Korsch™.
Согласно Фиг. 3 в целом композиции изобретения получаются сухим смешением различных формообразующих наполнителей с измельченной дисперсией (растворимая полимерная матрица, содержащая активный фармацевтический ингредиент, диспергированный в ней) и прессованием смеси в таблетки.
Далее следует описание основных процессов, использованных при приготовлении экструдата, приготовлении таблеточной рецептуры, содержащей экструдат, и приготовлении таблеток изобретения. Следующие примеры способствуют только иллюстрации изобретения и его практического применения. Примеры не могут быть растолкованы как ограничения сущности и объема изобретения.
Пример I-Приготовление экструдата, содержащего Kollidon® 64, TPGS и (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2,-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид (FIa-H), таблеточной лекарственной формы и таблетки на ее основе
Согласно Фиг. 2 экструдат, содержащий водорастворимую полимерную матрицу и диспергированный в ней API, был приготовлен следующим образом:
(i) образование предварительной смеси FIa-H/матричный полимер сухим смешением навески кристаллического соединения FIa-H и сополимера винилпирролидона и винилацетата (матричный полимер) с целью получения предварительной смеси с массовым соотношением API:матричный полимер 1:3.75;
(ii) загрузка в экструдер навески предварительно приготовленной смеси API/матричный полимер и навески расплавленного пропиленгликольсукцианата альфа-токоферола (TPGS) с целью достижения массового соотношения предварительная смесь API:TPGS 19:1; и
(iii) поддерживание работы экструдера при таких значениях температуры цилиндра, скорости подачи и скорости вращения, чтобы обеспечить получение экструдата в виде твердого раствора API в матрице (сополимер винилпирролидона и винилацетата/TPGS), включающем примерно 20 масс. % активного API.
Соответственно, 1,318 кг тригидрата FIa-H (соединение Формулы Ia, где Rb - это -Н) смешивали с 4.382 кг матричного полимера. TPGS (0,300 кг) плавили и добавляли к смеси FIa-H и VA-64 в грануляторе с большим усилием сдвига. Смесь API, VA-64 и TPGS готовили в течение восьми проходов смешения, используя гранулятор Diosna с большим усилием сдвига с 6-литровой чашей, скоростью рабочего колеса 1000 об/мин и скоростью ножа (600) об/мин. В каждом проходе блендер работал в течение 1 мин для смешения FIa-H и матричного полимера, затем пипеткой добавляли расплавленный TPGS в течение 5 мин, поддерживая скорости рабочего колеса и ножа. После добавления TPGS смесь перемешивали дополнительно в течение 1 минуты, поддерживая скорости рабочего колеса и ножа.
Материал смеси загружали в 16-мм экструдер Thermo-Fischer, поддерживая температуру продукта в диапазоне от примерно 146°С до примерно 160°С, давление от примерно 1.4 МПа до примерно 1.6 МПа, и скорость подачи порошка от 30-52 г/мин, с целью получения 6.0 кг экструдата изобретения. Этот материал измельчали в мельнице Fitzmill, снабженной ситом с размером отверстий 0 (0.027ʺ), используя следующие условия работы: скорость рабочего колеса 2000-4500 об/мин, и воздействие: лезвие по направлению потока. Измельченный материал экструдата сортировали по размеру, пропуская через сито с размером отверстий 600 микронов, получая при этом порошок (интермедиат экструдата) с VMD примерно 195 микронов согласно QICPIC измерениям, для использования в приготовлении смеси для прессования в таблетки (таблеточная смесь).
Таблеточная смесь (6 кг) была приготовлена с использованием 3.6 кг интермедиата экструдата, содержащего эквивалент 200 мг/г 100% чистого FIa-H, 1.160 кг маннитола SD10, 0.600 кг порошка хлорида натрия, 0.600 кг кроскармеллозы натрия, 0.01500 кг коллоидного кремнезема, 0.09000 кг стеарилфумарата натрия и 0.5798 кг Avicel PH102. Скорость блендера составляла 25 об/мин, время смешения было 5 минут.
Таблеточную смесь разделяли на части по 1.250 кг, и таблетки с интервалами твердости 12-16 кГ, 19-22 кГ и 24-28 кГ были приготовлены прессованием аликвот из каждой порции таблеточной смеси на аппарате Korsch X1100, снабженном верхним и нижним инструментами с лицевым ящиком P14305-B, который представляет собой плоский овальный пресс-инструмент с измерениями 14.68 мм × 8.33 мм.
Таблетки с твердостью в диапазоне от 12 кГ до 16 кГ были испытаны в соответствии с USP 30 NF25, глава 711, на установке с лопастной мешалкой, снабженной USP 2 лопастями, работающей на скорости 50 об/мин, в 900 мл искусственного желудочного сока (рН 1.8) при 37°С; эти таблетки соответствовали целевому профилю выделения примерно 90% FIa-F, содержащегося в растворенной таблетке, менее чем за 20 минут.
Пример II-Приготовление экструдата, содержащего Kollidon® 64, TPGS и (S)-N-((3S,5S,6R)-6-метил-2-оксо-1-(2,2,2-трифтроэтил)-5-(2,3,6-трифтрофенил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид) (FIa-F)), таблеточной лекарственной формы и таблетки на ее основе
Используя основной метод приготовления, описанный в примере I, 1.421 кг FIa-F (соединение Формулы Ia, где все Rb - это F) смешивали с 4.320 кг матричного полимера в 25.0 литровом грануляторе Fielder, с установленными скоростями рабочего колеса на режим ʺбыстрыйʺ и ножа на режим ʺвысокийʺ. В гранулятор добавляли 0.300 кг TPGS в течение пяти минут, поддерживая постоянные значения скоростей рабочего колеса и ножа. Этот смешанный материал был экструдирован из горячего расплава на 16-мм экструдере Thermo-Fisher с заданными параметрами, обеспечивающими температуру продукта 158°С, скорость подачи порошка 20 г/минут и постоянное давление в диапазоне 0.2-0.4 МПа, что позволило получить 4.52 кг экструдата.
Экструдат, приготовленный таким образом (3.3 кг), был измельчен на мельнице Fitzmill с ситом с размером отверстий 000 (0.20ʺ), воздействием лезвий, направленных по направлению потока, и скоростью рабочего колеса, установленной до целевого значения 3000 об/мин (от 2000 об/мин до 6000 об/мин). Измельченный экструдат был пропущен через сито с размером отверстий 600 микронов, что позволило получить 3.01 кг просеянного экструдата. Порцию просеянного материала (3.0 кг) смешивали с стеарилфумаратом натрия (0.05625 кг), дикосидом кремния (0.01875 кг), микрокристаллической целлюлозой (0.9750 кг), Порошкообразным Хлоридом Натрия (0.750 кг) и маннитолом (1.950 кг), используя V-образный смеситель, работающий на скорости 24 об/мин.
Две аликвоты таблеточной смеси, приготовленной ранее (1.957 кг), прессовали в таблетки с диапазонами твердости 12 кГ-18 кГ и 20 кГ-26 кГ, соответственно, на таблеточном прессе Korsch X1100, снабженном верхним и нижним инструментами с лицевым ящиком P10165-B (плоский/плоский), представляющим собой овальный пресс-инструмент с измерениями 15.88 мм ×8.81 мм с целевой массой таблетки 652.2 мг.
Таблетки растворяли в аппарате для растворения с лопастной мешалкой, используя искусственный желудочный сок при 37°С, со скоростью лопастей 50 об/мин в соответствии с USP 30 NF25, глава 711, эти таблетки соответствовали целевому профилю выделения 90% FIa-F, содержащегося в растворенной таблетке, менее чем за 20 мин, и цели по полному разрушению менее чем за 5 минут при испытании на распадаемость в соответствии с USP 31-NF26, глава 701, на стандартной установке для испытания на распадаемость (Pharamatron DT50), используя водный раствор HCl (1.8) в качестве дезинтеграционной среды при 37°С.
В то время как вышеизложенная спецификация объясняет принципы настоящего изобретения с примерами, представленными в целях иллюстрации, практическое применение изобретения охватывает все обычные вариации, адаптации и/или модификации, которые относятся к содержанию следующих пунктов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМЕРНЫЕ КОМПОЗИЦИИ ИНГИБИТОРОВ СЕТР | 2007 |
|
RU2457841C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ИНГИБИТОРА ТИРОЗИНКИНАЗЫ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2007 |
|
RU2468788C2 |
| КОМПОЗИЦИЯ ПРОЛЕКАРСТВА ДЛЯ БОРЬБЫ С ВИРУСОМ ГЕПАТИТА С | 2006 |
|
RU2435592C2 |
| СОСТАВЫ ТВЕРДЫХ ДОЗИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ АНТАГОНИСТА ОРЕКСИНОВОГО РЕЦЕПТОРА | 2013 |
|
RU2759837C2 |
| Способ получения фармацевтической композиции с такролимусом (варианты) и фармацевтическая композиция, полученная указанными способами | 2022 |
|
RU2792098C1 |
| АНТИРЕТРОВИРУСНАЯ КОМБИНАЦИЯ | 2008 |
|
RU2531089C2 |
| СОСТАВЫ ТВЕРДЫХ ДОЗИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ АНТАГОНИСТА ОРЕКСИНОВОГО РЕЦЕПТОРА | 2013 |
|
RU2699358C2 |
| АНТИРЕТРОВИРУСНАЯ КОМБИНАЦИЯ | 2014 |
|
RU2675831C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ДОЗИРОВАННАЯ ФОРМА ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ ИНГИБИТОРА СЕМЕЙСТВА BCL-2 | 2010 |
|
RU2711359C2 |
| КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ФЕНОФИБРИНОВУЮ КИСЛОТУ ИЛИ ЕЕ ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМУЮ СОЛЬ, И КАПСУЛА, ВКЛЮЧАЮЩАЯ КОМПОЗИЦИЮ | 2008 |
|
RU2500398C2 |

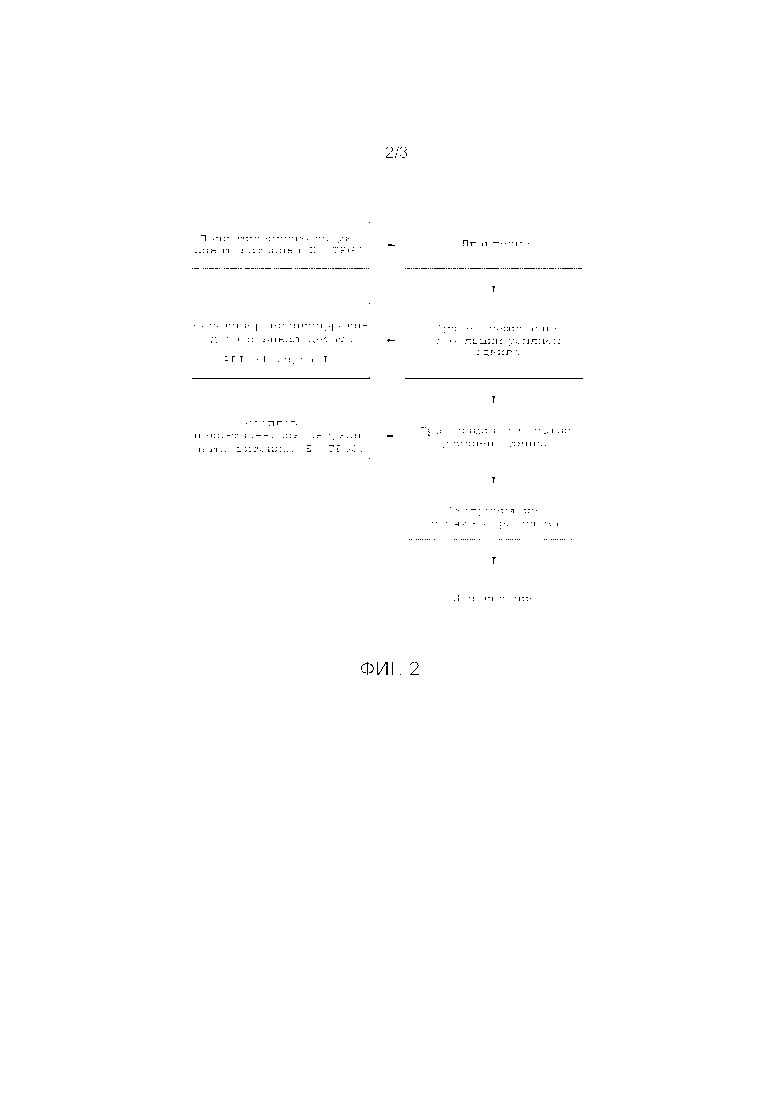
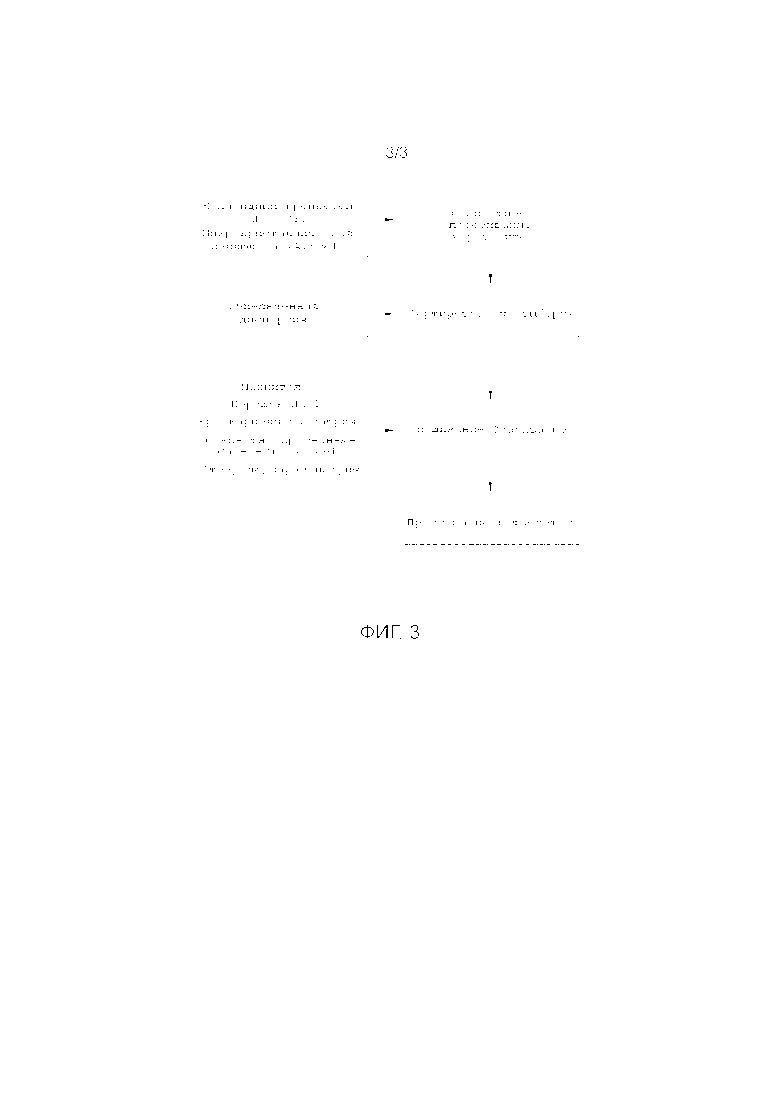
Группа изобретений относится к области фармацевтики. Первое изобретение представляет собой таблетку, содержащую: (a) экструдат, включающий: (i) полимерную матрицу, которая представляет собой водорастворимый сополимер винилпирролидона и винилацетата; (ii) диспергирующий агент; и (iii) соединение Формулы I или его фармацевтически приемлемую соль:
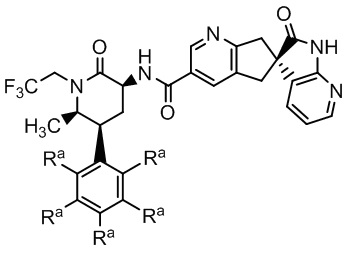 Формула I
Формула I
где Ra независимо -H или -F, при этом диспергирующий агент и соединение Формулы I диспергированы в вышеуказанной полимерной матрице; и (b) систему, способствующую распаду, включающую порошкообразный хлорид натрия и кроскармеллозу натрия. Второе изобретение представляет собой состав, подходящий для прессования в таблетку, а третье изобретение – таблетку с пределом прочности на разрыв 1,75 МПа, полученную прессованием указанного состава. 3 н. и 16 з.п. ф-лы, 3 ил., 2 табл., 2 пр.
1. Таблетка, содержащая:
(a) экструдат, включающий:
(i) полимерную матрицу, которая представляет собой водорастворимый сополимер винилпирролидона и винилацетата;
(ii) диспергирующий агент; и
(iii) соединение Формулы I или его фармацевтически приемлемую соль:
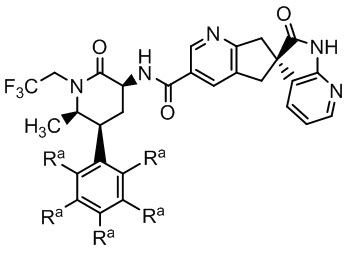
Формула I
где Ra независимо -H или -F,
при этом диспергирующий агент и соединение Формулы I диспергированы в вышеуказанной полимерной матрице; и
(b) систему, способствующую распаду, включающую порошкообразный хлорид натрия и кроскармеллозу натрия.
2. Таблетка по п.1, где таблетка имеет твердость от 12 до 18 кПа и где вышеуказанная таблетка полностью распадается менее чем за 5 минут в условиях стандартного испытания на распадаемость таблеток с использованием водного раствора HCl c pH 1,8 при 37°С.
3. Таблетка по п.1, где система, способствующая распаду, включает порошкообразный хлорид натрия и кроскармеллозу натрия в массовом соотношении 1:1.
4. Таблетка по п.1, где таблетка имеет твердость от 12 кГ до 18 кГ и где таблетка, подверженная испытанию на растворимость на установке с лопастной мешалкой, снабженной 2 лопастями, работающей со скоростью 50 об/мин, в 900 мл искусственного желудочного сока с рН 1,8 при 37°С, высвобождает, по меньшей мере, 90% соединения Формулы I, содержащегося в ней, менее чем за 20 мин.
5. Таблетка по п.1, где таблетка имеет предел прочности на разрыв 1.75 МПа и где вышеупомянутая таблетка, подверженная испытанию на растворимость на установке с лопастной мешалкой, снабженной USP 2 лопастями, работающей со скоростью 50 об/мин, в 900 мл искусственного желудочного сока (рН 1,8) при 37°С, высвобождает, по меньшей мере, 90% соединения Формулы I, содержащегося в ней, менее чем за 20 минут.
6. Таблетка по п. 1, где диспергирующим агентом в вышеуказанном экструдате является полиэтиленгликольсукцинат d-альфа-токоферола (TPGS).
7. Таблетка по п. 1, где соединение Формулы Iа - это соединение Формулы Ia или его соль:
Формула Ia
где каждый заместитель Rb это -H или каждый заместитель Rb - это -F.
8. Таблетка по п. 1, которая также содержит: (a) маннитол; (b) коллоидный кремнезем; (с) микрокристаллическую целлюлозу; и (d) стеарилфумарат натрия.
9. Таблетка по п.1, где соединение Формулы I представляет собой (S)-N-((3S,5S,6R)-6-метил-2-оксо-1-(2,2,2-трифторэтил)-5-(2,3,6-трифторфенил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3-пирроло[2,3-b]пиридин]-3-карбоксамид.
10. Таблетка по п.1, где соединение Формулы I представляет собой (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3-пирроло[2,3-b]пиридин]-3-карбоксамид.
11. Таблетка по п. 1, где вышеупомянутый экструдат занимает 50 мас. % указанной таблетки и содержит от 5 мас. % до 23 мас. % соединения Формулы I.
12. Таблетка по п. 1, где вышеупомянутый порошкообразный хлорид натрия имеет следующие параметры: (i) значение d50 менее чем 210 микронов; (ii) значение d10 менее чем 50 микронов; и (iii) значение d90 менее чем 470 микронов.
13. Таблетка по п. 1, где водорастворимая полимерная матрица вышеуказанного экструдата - это сополимер с соотношением мономерных звеньев винилпирролидон/винилацетат 6:4.
14. Состав, подходящий для прессования в таблетку, содержащий:
a) композицию экструдата, включающую водорастворимую матрицу на основе сополимерам винилпирролидона и винилацетата (PVP-VA сополимер) и диспергированные в ней:
(i) активное соединение Формулы Ia или его фармацевтически приемлемая соль

Формула Ia
где все заместители Rb - атомы -Н или все заместители Rb - это атомы -F; и
(ii) полиэтиленгликольсукцинат токоферола (TPGS),
где вышеупомянутое соединение Формулы Ia составляет от 5 мас. % до 23 мас. % указанного экструдата и TPGS составляет, по меньшей мере, 5 мас. % указанного экструдата; и
b) систему, способствующую распаду, включающую: (i) кроскармеллозу натрия; и (ii) порошкообразный хлорид натрия,
где вышеупомянутая система, способствующая распаду, составляет 20 мас. % указанного состава.
15. Состав по п.14, который также включает: (a) маннитол; (b) коллоидный кремнезем; (с) микрокристаллическую целлюлозу; и (d) стеарилфумарат натрия, при этом вышеуказанный порошкообразный хлорид натрия характеризуется: (i) значением d50 менее чем 210 микронов; (ii) значением d10 менее чем 50 микронов; и (iii) значением d90 менее чем 470 микронов.
16. Состав по п.14, где массовое соотношение порошкообразный хлорид натрия:кроскармеллоза натрия равно 1:1.
17. Состав по п.14, где вышеупомянутое соединение Формулы Ia - это (S)-N-((3S,5S,6R)-6-метил-2-оксо-1-(2,2,2-трифторэтил)-5-(2,3,6-трифторфенил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3-пирроло[2,3-b]пиридин]-3-карбоксамид или (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3-пирроло[2,3-b]пиридин]-3-карбоксамид.
18. Состав по п. 14, где вышеупомянутый экструдат присутствует в количестве 50 мас. % состава.
19. Таблетка, полученная прессованием состава по п. 14 на таблеточном прессе с целью получения таблетки с пределом прочности на разрыв 1,75 МПа.
| US 2012122899 A1, 17.05.2012 | |||
| US 20100227903 А1, 09.09.2010 | |||
| КОМПОЗИЦИИ СИМЕТИКОН-БЕЗВОДНЫЙ ФОСФАТ КАЛЬЦИЯ | 1998 |
|
RU2216317C2 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Бобылев и др., под ред | |||
| Л.А.Ивановой | |||
| - М.: Медицина, 1991 | |||
| Стрелочный замыкатель | 1922 |
|
SU544A1 |
| Вага для выталкивания костылей из шпал | 1920 |
|
SU161A1 |
| WO 2010114801 A1, 07.10.2010 | |||
| Способ обогащения дрожжевых затворов усвояемыми азотистыми веществами | 1926 |
|
SU13053A1 |
Авторы
Даты
2019-08-05—Публикация
2015-01-30—Подача