Область техники
Изобретение относится к области биотехнологии, микробиологии, экологии, охране окружающей среды и представляет собой микробный препарат для утилизации углеводородных загрязнений, содержащий психроактивные микроорганизмы: штамм Psychrobacter cibarius ARC 35 ВКПМ В-13081, штамм Pseudomonas extremaustralis ARC 38 ВКПМ В-13084, штамм Yarrowia lipolytica ARC 48 ВКПМ Y-4347. Изобретение позволяет осуществлять очистку от нефтяных загрязнений различных объектов морских акваторий в диапазоне температур от -2,5°С до +20°С, в том числе очистку поверхности воды от плавающих нефтепродуктов, льда и ледяной шуги от нефтепродуктов, толщи воды от растворенных углеводородов и береговой зоны водных объектов от осажденных нефтепродуктов.
Уровень техники
В настоящее время для ликвидации загрязнений нефтепродуктами, в том числе в условиях холодного климата, успешно применяют различные методы - физические (механический сбор, сжигание), химические (с использованием диспергентов) и биологические. Биологические подходы могут включать в себя как внесение биопрепаратов на основе нефтеокисляющих микроорганизмов (бактерий и реже грибов) - технологии биоаугментации, внесение органических и неорганических веществ, стимулирующих микробный рост - технологии биостимуляции, так и способы на основе комбинации двух описанных подходов. Биологические способы утилизации нефтепродуктов успешно применяются в регионах с теплым климатом (например, для очистки почвы), однако имеют ограниченные возможности для применения в регионах с холодным климатом, в особенности при наличии ледовых условий. Применение психроактивных штаммов позволяет расширить температурный диапазон применения биологических методов за счет адаптации используемых микроорганизмов к условиям низких температур.
Известен препарат для очистки водных поверхностей от нефтяного загрязнения, представляющий собой консорциум микроорганизмов Bacillus brevis ИБ ДТ 5-1 и Arthrobacter species ИБ ДТ 5-3 в виде культуральной жидкости (патент РФ №2241032, приоритет 03.12.2002, опубл. 27.11.2004). Недостатком данного препарата является то, что консорциум микроорганизмов применяется в виде культуральной жидкости, что не позволяет долговременно хранить консорциум. Также необходима барботация водоема с нефтяным загрязнением для осуществления нефтедеструкции.
Известен биопрепарат для очистки объектов окружающей среды от углеводородного загрязнения, способ его получения и применения, представляющий собой консорциум микроорганизмов, состоящий из следующих штаммов бактерий: Rhodococcus qingshengii БАК-ПАУ-1 ВКПМ АС-1946, Pusillimonas ginsegisoli БАК-ПАУ-2 ВКПМ В-11370, Shinella granuli БАК-ПАУ-3 ВКПМ В-11371, взятых в равных соотношениях (патент РФ №2535978, приоритет 15.03.2013, опубл. 20.12.2014). Недостатком препарата является то, что указанный биопрепарат эффективно работает при температурах не ниже +22°С.
Известен микробный препарат для утилизации углеводородных загрязнений в водной среде, содержащий биомассу психроактивных микроорганизмов: штамм Nocardia coeliaca ARC 1, штамм Cobetia marina ARC 11 и штамм Arthrobacter rhombi ARC 16, (ВКПМ Ac-1991, ВКПМ B-12350, ВКПМ Ac-1988 соответственно) в объемном соотношении 1:1:1 (патент РФ №2633690, приоритет 07.12.2015, опубл. 16.10.2017). Однако температурный диапазон работы данного препарата находится в области положительных температур - от +20 до +4°С и при солености не выше 30 г/л.
Известен способ очистки от нефти и нефтепродуктов солоноватоводных и морских объектов и экосистем, включающий контактирование подлежащих разложению углеводородов нефти с биопрепаратом, состоящим из смеси нефтеокисляющих штаммов культур Pseudomonas azotoformans ВКМ B-2762D, Microbacterium species ВКМ B-2615D, Rhodococcus erythropolis ВКМ Ac-2613D, взятых в соотношении 1:1:1, с титром клеток в готовом препарате не менее 1010 клеток на 1 г (патент РФ №2571180, приоритет 20.08.2013, опубл. 20.112014). Недостатком препарата является возможность его работы только в области положительных температур - от 0 до +25°С, а также, в случае использования биосорбента, его короткий период плавучести - от одного до 48 часов.
Ближайшим аналогом изобретения является препарат для разложения углеводородов нефти в полярных регионах, покрытых морским льдом, представляющим собой инокулят, включающий смесь адаптированных к холоду бактерий, состоящую из по меньшей мере следующих штаммов: Rhodococcus GH-1 (DSM 18943, DSMZ 22.12.2006), Dietzia GH-2 (DSM 18944, DSMZ 22.12.2006), Shewanella GH-4 (DSM 18946, DSMZ 22.12.2006), Marinobacter GH-9 (DSM 18951, DSMZ 22.12.2006), Pseudomonas GH-10 (DSM 18952, DSMZ 22.12.2006), Oleispira GH-11 (DSM 18953, DSMZ 22.12.2006) (патент РФ №2426698, приоритет 06.01.2008, опубл. 20.08.2011). К преимуществам препарата можно отнести активность микроорганизмов при температуре окружающей среды до -3°С. Однако, для препарата не указаны пределы солености, в которых он сохраняет активность. К недостаткам препарата можно отнести сложность его использования, а именно необходимость рекультивации в смеси морская вода - питательная среда (при этом состав сред различен для штаммов) и иммобилизации клеток на используемом носителе. Кроме того, для разложения углеводородов нефти к смеси бактерий необходимо внесение дополнительных питательных веществ и сорбирующих материалов, определяющих основное действие данного препарата как сорбирующее, и предполагающих локальную утилизацию углеводородов в зоне контакта с материалом препарата.
Раскрытие изобретения
Задачей настоящего изобретения является получение микробного препарата на основе психроактивных микроорганизмов для утилизации углеводородных загрязнений в водной среде при температуре от +20 до -2,5°С и солености 30±10 г/л в условиях бедных по питательным субстратам.
Поставленная задача решается тем, что предложен микробный препарат для очистки водной среды, включающий ассоциацию психроактивных нефтеокисляющих микроорганизмов: штамм Psychrobacter cibarius ARC 35 ВКПМ В-13081, штамм Pseudomonas extremaustralis ARC 38 ВКПМ В-13084, штамм Yarrowia lipolytica ARC 48 ВКПМ Y-4347 в объемном соотношении 1:1:1 с допустимой величиной отклонения от указанного значения не более 10%, способный утилизировать углеводородные загрязнения при температуре от +20 до -2,5°С и солености 30±10 г/л. При этом, препарат дополнительно может включать носитель, на котором иммобилизуют клетки микроорганизмов, на котором дополнительно иммобилизованы питательные вещества, стимулирующих микробный рост. Также препарат может представлять собой порошок, полученный путем высушивания биомассы перечисленных психроактивных микроорганизмов. При высушивании препарата в него может быть дополнительно внесен питательный премикс на основе различных органических компонентов в различных соотношениях, который может дополнительно включать неорганические вещества, стимулирующие микробный рост. Дополнительно сухой порошок может быть гранулирован с получением гранул размером 0,1-5 мм.
Преимуществом предлагаемого биопрепарата является то, что он способен утилизировать углеводородные загрязнения в условиях, бедных по питательным субстратам, при низких температурах и высокой солености среды. Эффективность работы биопрепарата в таких условиях позволяет его использовать для утилизации углеводородных загрязнений в условиях северных морей. Заявляемый препарат (консорциум) позволяет осуществлять очистку от нефтяных загрязнений различных объектов морских акваторий в указанном диапазоне температур, в том числе очистку поверхности воды от нефтепродуктов, льда и ледяной шуги от нефтепродуктов, толщи воды от растворенных углеводородов и береговой зоны водных объектов от осажденных нефтепродуктов.
Осуществление изобретения
Чистые культуры микроорганизмов выделены из нефтезагрязненных участков северных морей и депонированы во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИгенетика (ВКПМ, Москва, 1-й Дорожный пр., д.1).
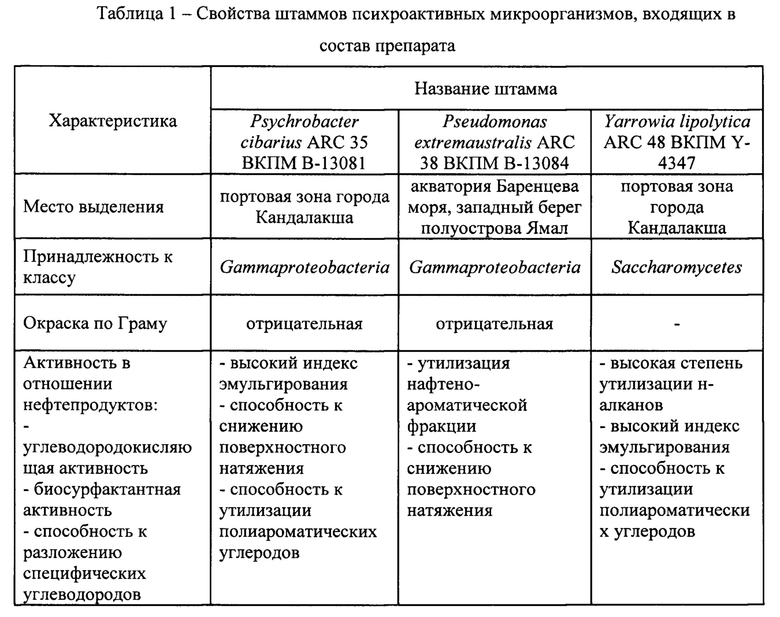
Штамм Psychrobacter cibarius ARC 35 ВКПМ В-13081. Колонии молочно-белые, округлые, блестящие, плоские, однородной структуры, мягкой консистенции, с ровным краем. Размеры колонии до 2,0 мм. Клетки округлые, размером 0,9-1,3×1,5-2,0 мкм, неподвижные. Окраска по Граму отрицательная. Штамм растет при температуре от +20 до -2,5°С, в аэробных условиях. Растет при рН 4,0-8,0. Растет на плотных и жидких питательных средах с высоким содержанием NaCl. Способен расти в жидкой среде с углеводородами в качестве единственного источника углерода и энергии.
Штамм Pseudomonas extremaustralis ARC 38 ВКПМ В-13084. Колонии бесцветные, блестящие, гладкие, круглые с небольшим валиком и волнистым краем. Консистенция мягкая, структура однородная, колония легко снимается с агара. Клетки палочковидные, небольшие, размером 2-3 мкм, подвижные. Окраска по Граму отрицательная. Штамм растет при температуре от +20 до -2,5°С, в аэробных условиях. Растет при рН 4,0-8,0. Растет на плотных и жидких питательных средах с высоким содержанием NaCl. Способен расти в жидкой среде с углеводородами в качестве единственного источника углерода и энергии.
Штамм Yarrowia lipolytica ARC 48 ВКПМ Y-4347. Колонии бесцветные, блестящие, бугристые, круглые с ризоидным краем, выпуклые, с однородной структурой. Клетки имеют овальную форму, длинной около 10 мкм. Штамм растет при температуре от +20 до -2,5°С, в аэробных условиях. Растет при рН 4,0-8,0. Растет на плотных и жидких питательных средах с высоким содержанием NaCl. Способен расти в жидкой среде с углеводородами в качестве единственного источника углерода и энергии.
Штаммы психроактивных микроорганизмов были выделены из образцов грунта и морской воды береговой линии. При отборе образцов в емкость отбирали максимально разнообразный материал в пределах точки отбора. Площадь отбора одной точки составляла от 30 до 100 квадратных сантиметров. Пробы в количестве нескольких десятков граммов материала или миллилитров воды с помощью стерильных пинцетов и шпателей помещали в стерильные пробирки объемом 50 и 15 мл с плотно завинчивающимися крышками. Для сохранения в пробе аэробных условий пробирки заполняли не более чем на 80% объема, оставляя 20% и более газовой фазы. Среди отобранных образцов присутствовали как смешанные (грунт, водоросли, вода из загрязненного участка), так и цельные пробы (морская вода).
Для получения накопительных культур психроактивных углеводородокисляющих микроорганизмов образцы массой 5±2 г вносили в 100 мл жидкой питательной среды №1 следующего состава (г/л): K2HPO4 - 1,5; KH2PO4 - 0,75; MgSO4 - 1,0; (NH4)2SO4 - 4,0; NaCl - 30; гидролизат казеина - 0,5; дрожжевой экстракт - 0,1; рН 7,0. Культивирование проводили при температуре +4°С на орбитальном шейкере (130 об/мин). Время культивирования 7 суток. Полученную накопительную культуру вносили в количестве 10 мл в 100 мл жидкой питательной среды №1. Было проведено не менее 30 пассажей накопительной культуры. Выделение штаммов из накопительной культуры проводили по стандартной методике (Нетрусов А.И., Егорова М.А., Захарчук Л.М. Практикум по микробиологии: учеб. пособие для студ. высш. учеб. заведений / Под ред. А.И. Нетрусова. - М.: Издательский центр «Академия», 2005. - 608 с.) на среде modPCA следующего состава (г/л): K2HPO4 - 1,5; KH2PO4 - 0,75; MgSO4 - 1,0; (NH4)2SO4 - 4,0; NaCl - 30; гидролизат казеина - 5,0; дрожжевой экстракт - 2,5; D-глюкоза - 1,0; агар - 14; рН 7,0. Культивирование полученных чистых культур штаммов микроорганизмов по отдельности ведется на среде выделения modPCA.
Идентификация штамма была осуществлена на основании изучения его культурально-морфологических и физиолого-биохимических характеристик, а также на основании изучения последовательности гена 16S рРНК. Выделение ДНК из биомассы бактерий проводили согласно методу (Булыгина Е.С., Кузнецов Б.Б., Марусина А.И., Кравченко И.К., Быкова С.А., Колганова Т.В., Гальченко В.Ф. Изучение нуклеотидных последовательностей nifH генов у представителей метанотрофных бактерий Микробиология 2002, 71, 4, 500-508). Для проведения полимеразной цепной реакции и дальнейшего секвенирования ПЦР- фрагментов гена 16S рРНК была использована универсальная праймерная система (Lane D. J. 16S/23S sequencing // In: Nucleic acid techniques in bacterial systematics / Stackebrandt E. a. Goodfellow M. (Eds.). - Chichester: John Wiley & Sons, Ltd., 1991. - P. 115-175). Секвенирование полученных ПЦР-фрагментов генов, кодирующих 16S рРНК, проводили по методу Сэнгера с соавт. (Sanger F., Nicklen S., Coulson A.R. 1977. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. USA. 84: 5463-5467), при этом для секвенирования использовали стандартные праймеры (Lane D. J. 16S/23S sequencing // In: Nucleic acid techniques in bacterial systematics / Stackebrandt E. a. Goodfellow M. (Eds.). - Chichester: John Wiley & Sons, Ltd., 1991. - P. 115-175), чтение проводили в двух направлениях. Анализ последовательностей 16S рРНК и поиск нуклеотидных последовательностей генов 16S рРНК, гомологичных соответствующим последовательностям изучаемых штаммов в базе данных GenBank проводили с помощью программного пакета BLAST (Camacho С, Coulouris G, Avagyan V, Ma N, Papadopoulos J, Bealer K, Madden TL. BLAST+: architecture and applications. BMC Bioinformatics. 2009 Dec 15; 10:421).
Для утилизации углеводородных загрязнений в водной среде препарат может быть использован как в жидком (например в среде культивирования, в солевом растворе, в морской воде, в их смеси и т.п.), так и в высушенном виде. Конечная концентрация клеток должна составлять от 106 на мл суспензии либо на грамм сухого препарата до максимального экономически и технологически оправданного титра. При использовании препарата в высушенном виде дополнительная активация препарата не требуется. Высушивание можно проводить разными методами, в частности лиофилизацией, распылительной сушкой, сушкой в псевдоожиженном слое, с сохранением жизнеспособности и активности в отношении углеводородов штаммов микроорганизмов, находящихся в составе препарата (Broeckx G., Vandenheuvel D., Claes I.J., Lebeer S., Kiekens F. Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics. Int J Pharm. 2016 May 30; 505(l-2):303-18.). Возможно проводить высушивание смеси культур, а также смешивать сухие препараты после высушивания каждой культуры отдельно, при этом соотношение культур может быть, как объемным, так и массовым. В зависимости от условий применения биопрепарата порошок может быть гранулирован с получением гранул размером 0,1-5 мм. Также клетки микроорганизмов могут быть иммобилизованы на различные носители, такие как торф, диоксид кремния, вспученный перлит, вермикулит, шелуха гречихи, опилки и пр.
Препарат дополнительно может содержать питательный премикс на основе различных органических компонентов в различных соотношениях (таких как сухое обезжиренное молоко, мука различных растительных культур, молочная сыворотка, меласса и т.п.), неорганические вещества, стимулирующие микробный рост - в первую очередь содержащие такие макроэлементы как азот и фосфор, железо и пр. (различные комплексные минеральные удобрения). Кроме того, в сухой форме препарат содержит защитные среды, использующиеся для увеличения выживаемости микроорганизмов при сушке, например растворы сахаров, сложные среды, такие как раствор сухого обезжиренного молока, сухие протеины и другие.
Степень утилизации углеводородных загрязнений в водной среде предлагаемого микробного препарата была показана в модельных экспериментах (пример 1).
Пример 1. Исследование нефтеокисляющей активности биопрепарата.
Исследование нефтеокисляющей активности биопрепарата и отдельных штаммов микроорганизмов, входящих в его состав, было проведено в модельных условиях при отрицательной температуре с использованием среды, следующего состава (г/л): K2HPO4 - 1,5; KH2PO4 - 0,75; MgSO4 - 1,0; (NH4)2SO4 - 4,0; NaCl - 30. В состав ассоциации микроорганизмов, используемой в составе препарата, входят описанные штаммы психроактивных нефтеокисляющих микроорганизмов Psychrobacter cibarius ARC 35 ВКПМ В-13081, Pseudomonas extremaustralis ARC 38 ВКПМ B-13084, Yarrowia lipolytica ARC 48 ВКПМ Y-4347 в объемном соотношении 1:1:1.
Для каждого из штаммов была проведена оценка убыли углеводородов, в ходе которой определяли следующие параметры: содержание средне- и высококипящей фракции н-алканов, содержание средне- и высококипящей нафтено-ароматической фракции, суммарное содержание нефтепродуктов.
Постановку опытных образцов осуществляли в двух вариантах: в одном случае в колбу дополнительно вносили лед для создания ледовой массы, во втором в колбе среда находилась в жидком агрегатном состоянии. Колбы со для охлаждения до температуры культивирования выдерживали в течение суток в термостатируемой камере, после чего в каждую стерильно вносили подготовленный посевной материал: биомассу микроорганизмов, выращенных на плотной питательной среде modPCA, смывали стерильным физраствором и оценивали оптическую плотность полученной суспензии на фотоэлектроколориметре при длине волны 680 нм. Далее доводили оптическую плотность до одинаковых значений, после чего вносили по 1 мл суспензии каждого штамма в среду культивирования. Затем в качестве основного источника углерода (углеводородного субстрата) вносили стерильную смесь товарной нефти Возейского месторождения (плотность 37,9°API, сернистость 0,66%, характеризуется как тяжелая, вязкая, с высоким содержанием смол и асфальтенов) и дизельного топлива в соотношении 1:1 по объему. Через двое суток после инокулирования проб в часть образцов асептически вносили фрагменты пресного льда, который служил точкой кристаллизации для инициации процесса формирования ледовой массы. Дополнительно в нескольких повторностях были поставлены контрольные образцы, которые не содержали биомассу микроорганизмов.
Культивирование проводили в термостатируемой камере при температуре -2,5°С в жидкой фазе в течение 30 суток, температура в опытных колбах фиксировалась с помощью дистанционных температурных датчиков (Thermochron iButton, США). Затем, для оценки убыли нефтепродуктов за счет углеводородокисляющей активности штаммов микроорганизмов в составе препарата, проводилась экстракция углеводородов гексаном согласно ГОСТ 31953-2012. Хроматографическая оценка убыли углеводородов проводилась на хроматографе Кристалл 2000 м (Хроматэк) с капиллярной колонкой DB-1 (Agilent, длина - 30 м, диаметр - 0,25 мм, толщина слоя - 0,25 мкм) с пламенно-ионизационным детектором (ПИД). Температура детектора - 350°С; температура испарителя - 300°С; газ-носитель - гелий; поток газа - 1,0 мл/мин; расход газа - 20,0 мл/мин; расход водорода - 20 мл/мин; расход воздуха - 200 мл/мин. Измерения проводят в условиях температурного градиента от 100 до 300°С со скоростью градиента 15,0°С/мин.
Для штаммов микроорганизмов, входящих в консорциум, были получены следующие результаты по убыли различных групп нефтепродуктов (в таблице 2 приведены значения убыли за указанный период эксперимента).
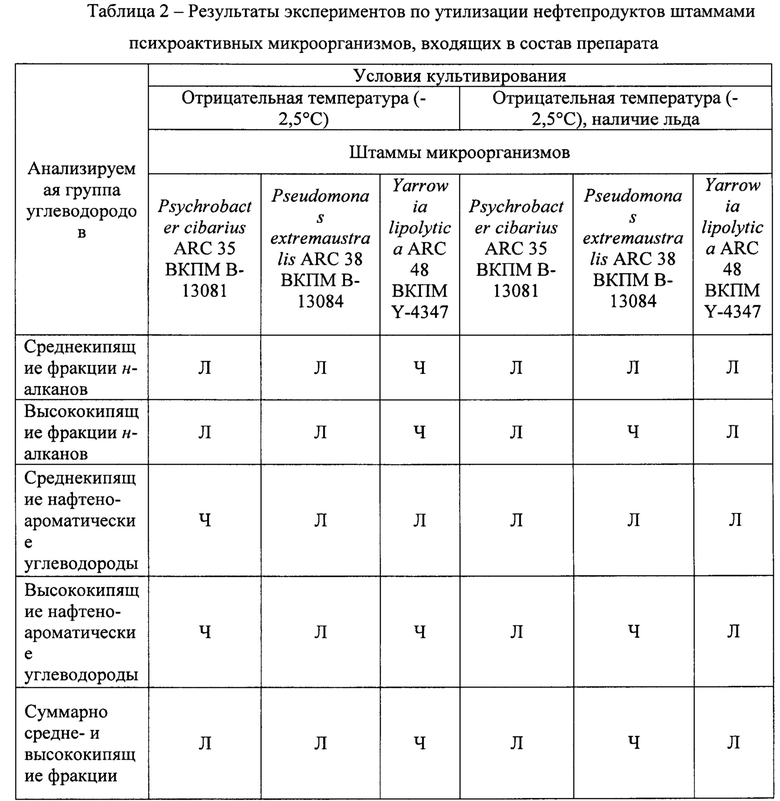
Степень утилизации: П - полное (98-100%), ЗН - значимое (50-98%), Ч - частичное (15-50%), Л - легкое (2-15%), О - утилизация отсутствует.
Для консорциума штаммов микроорганизмов были поставлены эксперименты по утилизации нефтепродуктов в аналогичных условиях отрицательной температуры и наличия ледовой обстановки. Суммарная убыль для среднекипящей и высококипящей фракции составляла не менее 30% за 30 суток культивирования при температуре -2,5°С. Увеличение суммарной убыли нефтепродуктов достигается за счет комбинирования микроорганизмов в составе данной ассоциации. За счет утилизации различных компонентов алкановой и нафтено-ароматической фракции с различной интенсивностью разными штаммами микроорганизмов достигается более полная деструкция нефтепродуктов в опытных образцах. Изменение соотношения микроорганизмов в препарате приведет к изменению соотношения утилизируемых фракций. Таким образом, в зависимости от состава загрязнения можно варьировать соотношение культур в препарате. Кроме того, в составе консорциума среди психроактивных углеводородокисляющих штаммов микроорганизмов присутствуют штаммы, активно продуцирующие биосурфактанты - эмульгирующие вещества микробной природы. Наличие биоэмульгаторов позволяет осуществлять более активное распределение нефтепродуктов в среде культивирования и обеспечивать более полную утилизацию нефтепродуктов за счет увеличения площади контакта молекул углеводородов с водной средой, и, соответственно, клетками микроорганизмов.
К росту при отрицательных температурах способны психрофильные и психротолерантные микроорганизмы, при этом их оптимум роста находится все же в области положительных температур, поэтому при температурах выше -2,5°С рост и утилизация нефтепродуктов будет идти не менее эффективно.
Пример 2. Способ производства препарата на основе штаммов Psychrobacter cibarius ARC 35 ВКПМ В-13081, Pseudomonas extremaustralis ARC 38 ВКПМ B-13084, Yarrowia lipolytica ARC 48 ВКПМ Y-4347.
Штаммы микроорганизмов вносят в питательную среду следующего состава (г/л): K2HPO4 - 1,5; KH2PO4 - 0,75; MgSO4 - 1,0; (NH4)2SO4 - 4,0; NaCl - 30; гидролизат казеина - 5,0; дрожжевой экстракт - 2,5; D-глюкоза - 1,0; рН 7,0. Далее культивируют при температуре +10°С - +20°С на орбитальном шейкере в течение 3 суток до получения суммарного конечного титра 109 КОЕ/мл. Каждый штамм культивируют по отдельности, в зависимости от требуемого объема может быть одна, две или три стадии культивирования биомассы. Первая стадия - наработка биомассы штамма из пробирки путем высева микробиологической петлей в колбы со стерильной средой, культивирование при температуре +10°С - +20°С на орбитальном шейкере; вторая - внесение полученной биомассы в инокуляторные ферментеры объемом до 300 л с готовой стерильной питательной средой; третья - внесение биомассы из инокуляторных ферментеров в промышленные ферментеры объемом до 60 м3 с готовой стерильной питательной средой и культивирование до получения суммарного конечного титра 109 КОЕ/мл.
Для изготовления готовой формы препарата в полученную суспензию клеток в питательной среде вносят защитную среду (сухое обезжиренное молоко в количестве 10 об. %). Далее полученную жидкую биомассу обезвоживают, например методом лиофилизации, распылительного высушивания, псевдоожиженного слоя. Полученную сухую биомассу микроорганизмов смешивают с питательным премиксом (сухое обезжиренное молоко) в различных соотношениях с конечным титром не менее 106 клеток на грамм препарата и фасуют в полиэтиленовые пакеты по 1-10 кг. Влажность готового высушенного препарата не должна превышать 20%. Биопрепарат используется в сухом виде в количестве, зависящем от степени и площади загрязнения. В зависимости от условий применения биопрепарата порошок может быть гранулирован с получением гранул размером 0,1-5 мм.
Таким образом, заявляемый микробный препарат (консорциум микроорганизмов) позволяет производить эффективную очистку акваторий водоемов и береговой линии от нефти и нефтепродуктов в условиях низких температур и высокой солености воды. За счет использования психроактивных штаммов микроорганизмов, способных к росту и утилизации углеводородов в том числе при отрицательных температурах (до -2,5°С), достигается повышение эффективности разложения углеводородов нефти в полярных регионах, в том числе в условиях наличия морского льда.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОБНЫЙ ПРЕПАРАТ ДЛЯ УТИЛИЗАЦИИ УГЛЕВОДОРОДНЫХ ЗАГРЯЗНЕНИЙ | 2018 |
|
RU2697317C1 |
| МИКРОБНЫЙ ПРЕПАРАТ ДЛЯ УТИЛИЗАЦИИ УГЛЕВОДОРОДНЫХ ЗАГРЯЗНЕНИЙ | 2018 |
|
RU2697377C1 |
| Микробный препарат для утилизации углеводородных загрязнений | 2016 |
|
RU2634399C2 |
| Микробный препарат для утилизации углеводородных загрязнений | 2016 |
|
RU2634396C2 |
| МИКРОБНЫЙ ПРЕПАРАТ ДЛЯ УТИЛИЗАЦИИ УГЛЕВОДОРОДНЫХ ЗАГРЯЗНЕНИЙ | 2018 |
|
RU2708959C1 |
| МИКРОБНЫЙ ПРЕПАРАТ ДЛЯ УТИЛИЗАЦИИ УГЛЕВОДОРОДНЫХ ЗАГРЯЗНЕНИЙ | 2018 |
|
RU2697278C1 |
| Микробный препарат для утилизации углеводородных загрязнений | 2016 |
|
RU2634403C2 |
| Микробный препарат для утилизации углеводородных загрязнений | 2016 |
|
RU2634397C2 |
| ШТАММ Psychrobacter cibarius ARC 35 ВКПМ В-13081 ДЕСТРУКТОР НЕФТИ И НЕФТЕПРОДУКТОВ | 2018 |
|
RU2699977C1 |
| Микробный препарат для утилизации углеводородных загрязнений | 2015 |
|
RU2633690C2 |
Изобретение относится к области биотехнологии. Предложен микробный препарат для утилизации углеводородных загрязнений в водной среде при температуре от +20 до -2,5°С, солености 30±10 г/л. Препарат содержит не менее 106 КОЕ на 1 мл суспензии или 1 г сухого порошка биомассы психроактивных микроорганизмов: штамм Psychrobacter cibarius ARC 35 ВКПМ В-13081, штамм Pseudomonas extremaustralis ARC 38 ВКПМ В-13084, штамм Yarrowia lipolytica ARC 48 ВКПМ Y-4347 в соотношении 1:1:1. Изобретение обеспечивает эффективную очистку акваторий водоемов и береговой линии от нефти и нефтепродуктов в условиях низких температур и высокой солености воды. 2 табл., 2 пр.
Микробный препарат для утилизации углеводородных загрязнений в водной среде при температуре от +20 до -2,5°С и солености 30±10 г/л, содержащий биомассу психроактивных микроорганизмов: штамм Psychrobacter cibarius ARC 35 ВКПМ В-13081, штамм Pseudomonas extremaustralis ARC 38 ВКПМ В-13084, штамм Yarrowia lipolytica ARC 48 ВКПМ Y-4347 в виде суспензии или высушенного порошка, взятых в соотношении 1:1:1 по объему или по массе, соответственно, с допустимой величиной отклонений от указанного значения не более 10% с концентрацией микробных клеток не менее 106 КОЕ на 1 мл суспензии или 1 г сухого порошка.
| Микробный препарат для утилизации углеводородных загрязнений | 2016 |
|
RU2634399C2 |
| КОНСОРЦИУМ ШТАММОВ БАКТЕРИЙ ACINETOBACTER CALCOACETICUS, PSEUDOMONAS FLUORESCENS, ALCALIGENES FAECALIS ДЛЯ ДЕСТРУКЦИИ НЕФТИ И НЕФТЕПРОДУКТОВ | 1996 |
|
RU2107722C1 |
| СПОСОБ ОЧИСТКИ ОТ НЕФТИ И НЕФТЕПРОДУКТОВ ПРЕСНОВОДНЫХ ЭКОСИСТЕМ В УСЛОВИЯХ ВЫСОКИХ ШИРОТ | 2015 |
|
RU2604788C1 |
Авторы
Даты
2019-08-13—Публикация
2018-11-15—Подача