Изобретение относится в целом к области биологии, преимущественно к области экологического мониторинга, более точно к способам определения сапробности гидробионтов для оценки экологического состояния преимущественно пресноводных водоемов посредством использования биоиндикации, однако при этом заявленный способ может быть использован для любых видов водоемов, в том числе морей и океанов, так как идея, реализованная в заявленном техническом решении, может быть беспрепятственно интерполирована на любые водные ресурсы [1].
Далее в тексте заявителем приведены термины, которые необходимы для облегчения однозначного понимания сущности заявленных материалов и исключения противоречий и/или спорных трактовок при выполнении экспертизы пот существу.
Индикаторные организмы (биоиндикаторы) — виды, группы видов или сообщества, по наличию, степени развития, изменению морфологических, структурно-функциональных, генетических характеристик которых судят о качестве воды и состоянии экосистем [1].
Сапробность — комплекс физиолого-биохимических свойств организма, обусловливающий его способность обитать в воде с тем или иным содержанием органических веществ, то есть с той или иной степенью загрязнения [2].
Для оценки степени загрязнения водоемов органическими веществами установлены пять основных зон загрязнения [3]:
- поли- (p-),
- альфа-мезо (a-),
- бета-мезо (b-),
-олигосапробная (o-);
- ксеносапробная (x-).
Сапробионты разделены на группы:
- организмы собственно сточных вод — полисапробионты (p-сапробы);
- организмы сильно загрязненных вод — мезосапробионты (две подгруппы — a-мезосапробы и b-мезосапробы);
- организмы слабозагрязненных вод — олигосапробионты (o-сапробы)
- организмы чистых вод – ксеносапробионты (х-сапробы).
Биота — исторически сложившаяся совокупность видов живых организмов, объединённых общей областью распространения в настоящее время или в прошедшие геологические эпохи [4].
Гидробионты – организмы, постоянно обитающие в водной среде [5].
Организм - живое тело, обладающее совокупностью свойств, отличающих его от неживой материи, в том числе обменом веществ, самоподдерживанием своего строения и организации, способностью воспроизводить их при размножении, сохраняя наследственные признаки [6].
Рыбы – обширная группа челюстноротых, для которых характерно жаберное дыхание на всех этапах развития организма, группа водных позвоночных животных [7].
Зоопланктон - водные животные, которые не могут противостоять течениям и пассивно переносятся вместе с водными массами [8].
Фитопланктон – совокупность свободно дрейфующих в толще воды морских и континентальных водоёмов организмов, которые могут осуществлять процесс фотосинтеза; фитопланктон является первичным продуцентом органического вещества в водоёме и служит пищей для зоопланктона и зообентоса [9].
rbcL (Рубиско) – фермент рибулозобисфосфаткарбоксилаза, которая является основным ферментом листьев растений и поэтому считается наиболее распространённым ферментом на Земле [10].
СО1 (Цитохром с-оксидаза субъединица 1) - присутствует во внутренней мембране митохондрий всех эукариот, а также в клеточной мембране многих аэробных бактерий [11].
Молекулярная филогения - способ установления родственных связей между живыми организмами на основании изучения структуры полимерных макромолекул - ДНК, РНК и белков. Результатом молекулярно-филогенетического анализа является построение филогенетического дерева живых организмов [12].
Филогенетическое дерево (эволюционное дерево, дерево жизни) — дерево, отражающее эволюционные взаимосвязи между различными видами или другими сущностями, имеющими общего предка [13].
Бутстреп метод - практический компьютерный метод исследования распределения статистик вероятностных распределений на базе имеющейся выборки [https://ru.wikipedia.org/wiki/бутстреп_(статистика)].
По мнению заявителя, следует обратить внимание на следующие описанные выше понятия, имеющие существенное значение для заявленного технического решения - индикаторные организмы и сапробность. Указанные понятия имеют различный смысл и различное назначение: сапробность - это способность организма обитать в воде с тем или иным содержанием органических веществ, то есть с той или иной степенью загрязнения, а индикаторные организмы характеризуют качество воды и экосистем, и могут существовать только в одной (или переходной) зоне сапробности.
Результативность природоохранных мер зависит от своевременного получения достоверных данных экологического мониторинга, используемых для оценки и диагностики экологического состояния водоемов.
Как известно из уровня техники, оценку экологического состояния водоемов выполняют различными способами с использованием различных методов, например, гидрофизических, гидрохимических, гидробиологических с использованием различных репрезентативных показателей среды. Одним из высокоинформативных способов оценки экологического состояния водоемов является способ биоиндикации, то есть выявление реакции живых организмов на изменение условий среды их обитания, например – загрязнение или очищение среды обитания [14]. Таким образом, представляется возможным сделать следующее логическое умозаключение: чем больше используется видов организмов с известной сапробностью, тем выше надежность и точнее результаты оценки экологического состояния водоемов.
Из исследованного уровня техники заявителем выявлен источник [15]. Краткой сущностью известного технического решения является идентификация гидробионтов в пробе по морфологическим (внешним) признакам, например, конфигурации организма, окрасу и т.д., визуально с использованием микроскопа путем выполняемых вручную манипуляций, как-то - извлечение организма из пробы в целом состоянии и его визуальная идентификация. При осуществлении этого способа определяют количество сапробных видов гидробионтов и рассчитывают индекс сапробности воды (S) по формуле 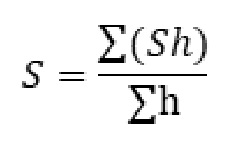 , где S - значение показателя сапробности отдельных организмов (справочные значения); h - относительная частота встречаемости видов. Расчетный индекс сапробности (S) показывает степень сапробности воды: ксено- (х-), олиго- (o-), бета-мезо- (b-), альфа-мезо- (a-) и поли- (p-) сапробные.
, где S - значение показателя сапробности отдельных организмов (справочные значения); h - относительная частота встречаемости видов. Расчетный индекс сапробности (S) показывает степень сапробности воды: ксено- (х-), олиго- (o-), бета-мезо- (b-), альфа-мезо- (a-) и поли- (p-) сапробные.
Сапробность устанавливается на основании многолетней регистрации сборов, сравнения их с химическими анализами и литературными данными. Детальная обработка проб требует много времени и квалифицированных специалистов по систематике водной фауны и флоры от 1 года и более.
Недостатком известного технического решения является высокая трудоемкость и сложность определения видов-индикаторов с одновременным использованием оптических приборов, справочников-определителей, необходимость привлечения специалистов высокой квалификации, что не позволяет с высокой эффективностью использовать его (известный способ) по назначению.
Высокая трудоемкость, по мнению заявителя, по сравнению с заявленным техническим решением, приводит к снижению технологичности, к увеличению материальных затрат, трудовых затрат, временных затрат для определения сапробности гидробионтов. То есть, низкая технологичность приводит к увеличению затрат, например, на индивидуальное выделение и идентификацию каждого вида индикаторного организма в пробе. При этом в заявленном техническом решении указанное действие отсутствует, заявитель проводит определение сапробности гидробионтов инструментальным способом, что приводит к более высокой технологичности, обеспечивая повышение эффективности при его использовании по назначению, что приводит фактически к более высокому техническому результату, что, по мнению заявителя, соответствует критерию «изобретательский уровень».
Из исследованного уровня техники заявителем выявлен источник - изобретение по патенту RU 2123533 «Способ определения степени сапробности воды пресных водоемов» [16]. Сущностью известного технического решения является способ микробиологического выделения микроводорослей, определение у них лизоцимной (ЛА) и антилизоцимной (АЛА) активности и показателя сапробности каждого вида. По рассчитанному индексу сапробности воды судят по его величине о степени сапробности воды и водоема. Индекс сапробности воды вычисляют как среднее значение показателей сапробности микроводорослей, обладающих ЛА и АЛА. Способ сужает исследования по определению степени сапробности воды до уровня лизоцим - антилизоцимной части альгосообщества и сокращает продолжительность исследований по определению индекса сапробности воды.
Недостатком известного способа, по сравнению с заявленным техническим решением, является наличие признака - проведение экспериментально-натурного изучения воздействия экологических факторов на лизоцим - антилизоцимные взаимоотношения водорослей, для чего использован искусственный водоем с изменяемыми физико-химическими показателями, такими, как например, PH и температура. Данный источник приведен для того, чтобы информировать пользователей о существовании способа, совпадающего с заявленным техническим решением исключительно по назначению, т.е. предназначен для определения степени сапробности воды пресных водоемов на основе микробиологического выделения микроводорослей, определение у них лизоцимной (ЛА) и антилизоцимной (АЛА) активности и показателя сапробности каждого вида. В то же время заявленное техническое решение базируется на другой идее, заключающейся в определении сапробности гидробионтов пресноводных водоемов и пополнении списков индикаторных видов [15] на основе молекулярной филогении [12].
Наиболее близким к заявляемому техническому решению, выбранному заявителем в качестве прототипа, является источник – «Выявление корреляции между сапробностью и митохондриальным белком COI индикаторных видов коловраток на основе молекулярной филогении» [17]. Сущностью известного технического решения является научное исследование по выявлению корреляции между сапробностью и митохондриальным белком СО1 индикаторных видов коловраток методом реконструкции молекулярных деревьев, результаты которого привели к новым знаниям о свойствах группировки коловраток по белку СО1 c одной или близкой сапробностью методом молекулярной филогении.
Недостатком прототипа, по сравнению с заявленным техническим решением, является то, что он на дату подачи заявки не используется для достижения утилитарных целей, а именно – для определения сапробности гидробионтов и пополнения списка индикаторных организмов для оценки экологического состояния водоемов.
Таким образом, известная научная статья, взятая заявителем в качестве прототипа, преследует исключительно научные цели, которые не носят утилитарный характер. Вследствие этого прототип не может быть применен для промышленного использования в силу его исключительно научной специфики. То есть прототип, вследствие отсутствия указанных целей по сравнению с заявленным техническим решением, по мнению заявителя, не предназначен для достижения практически-значимых утилитарных целей, заключающихся в определении сапробности гидробионтов и пополнении списка индикаторных организмов. Наличие же практических целей и достигнутого технического результата в заявленном техническом решении обеспечивает возможность в кратчайшие сроки создать полноценную базу данных по сапробности гидробионтов не только известных индикаторных организмов (количество видов-индикаторов по [15] составляет около 2 тысяч пресноводных гидробионтов, каждый из которых определялся во временном интервале от 1 года и более. Это совсем немного по сравнению с около 250 тысяч видов гидросферы нашей планеты [18]). В это же время заявленное техническое решение позволяет реализовать определение сапробности гидробионтов в достаточно короткое время – в пределах не более одних суток, при этом количество параллельных исследований не ограничено, т.е. за одно исследование можно определить сапробность от одного до десятков гидробионтов. Таким образом, за 1 год только силами одного исследователя возможно увеличить количество индикаторных гидробионтов до 3 тысяч и более, при этом количество параллельных исследований не ограничено. Таким образом, за короткий срок, используя заявленное техническое решение, представляется возможным реализовать глобальную практическую задачу по оценку экологического состояния водоемов. Данная информация подтверждена заявителем далее в примерах конкретного выполнения.
Основываясь на научных идеях, изложенных в прототипе, авторами которого являются представители заявителя, и принимая во внимание, что заявленное техническое решение характеризуется добавлением одного существенного признака, который в сухом остатке приводит фактически к увеличению количества индикаторных гидробионтов до 3 тысяч и более в год, выполненные силами одного исследователя, можно, по мнению заявителя, сделать логический вывод, что заявленное техническое решение соответствует критериям - мировая новизна и изобретательский уровень, предъявляемым к изобретениям.
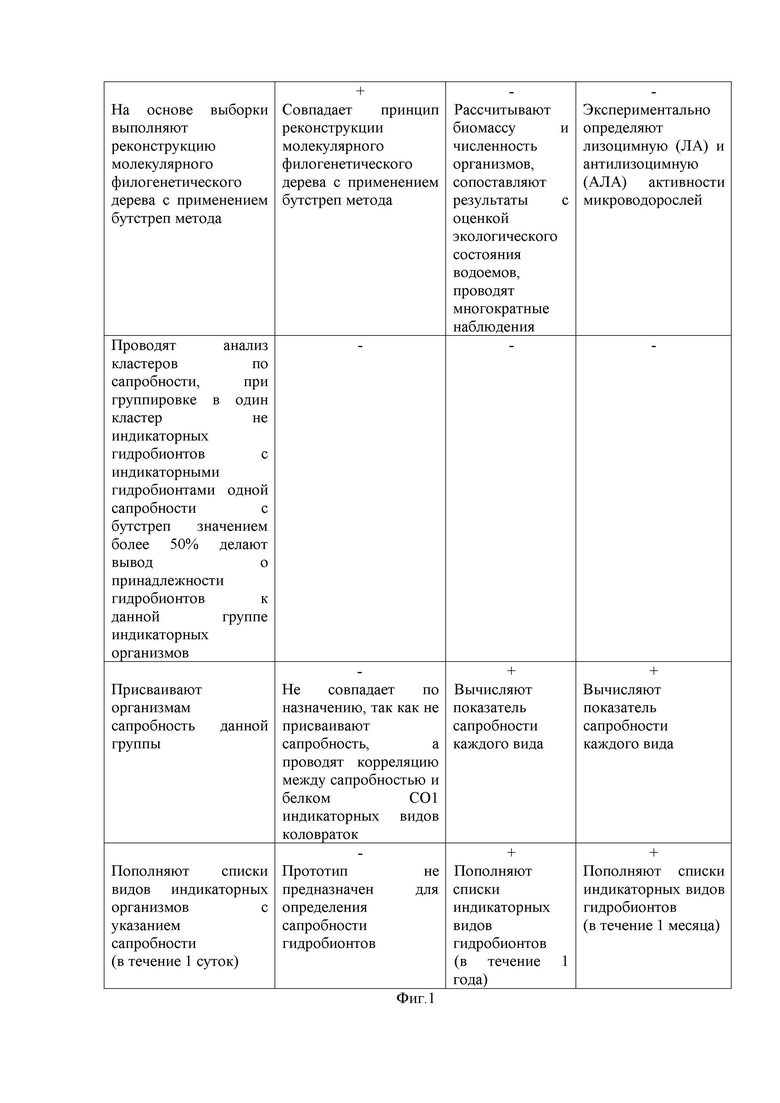
Доказательством указанного выше является детальный сопоставительный анализ источников и прототипа с заявленным техническим решением, который приведен в Таблице 1 на Фиг. 1.
Анализ Таблицы 1 сопоставительного анализа показывает, что заявленное техническое решение совпадает с прототипом исключительно тем, что в заявленном техническом решении использован метод молекулярной филогении; также частично совпадает по одному признаку - выборка аминокислотных последовательностей белков СО1 коловраток из международных баз данных для прототипа и выборка первичных последовательностей ДНК/РНК и белков гидробионтов, т.е. если по прототипу выборку проводят только для одного белка СО1 и для одной таксономической единицы – Rotifera, в заявленном техническом решении проводят выборку по любым генам и белкам и по любым видам гидробионтов. При этом целесообразно принять во внимание, что кроме изложенного выше, прототип не совпадает с заявленным техническим решением по цели, так как в прототипе заявленная цель - выявление корреляции между сапробностью и белком СО1 индикаторных видов коловраток, в то время как в заявленном техническом решении – определение сапробности гидробионтов для оценки экологического состояния водоемов и пополнение индикаторных списков.
В целом у заявленного технического решения по сравнению с прототипом при наличии общей утилитарной цели – определение сапробности гидробионтов для оценки экологического состояния водоемов - достигается более высокий технический результат. Исключена необходимость выполнения весьма трудоемкого и затратного процесса идентификации видового состава организмов, использования специальных вычислительных формул, на основе которых делаются заключения об индикаторной значимости вида, и, как следствие, медленное пополнение списка индикаторных организмов по сравнению с [Sladechek V. System of water quality from the biological point of view. Arch. Hydrobiol. Ergeb. Limnol, 1973. – Р.179-191] [15].
При этом из исследованного уровня техники не выявлена технология, позволяющая достигнуть такого высокого уровня результатов – определение сапробности гидробионтов для оценки экологического состояния водоемов и пополнение списка индикаторных организмов.
Заявленное техническое решение позволяет проводить определение сапробности гидробионтов, затрачивая при этом меньшее количество материальных средств, при этом повышается доступность заявленного технического решения при использовании по назначению, так как обеспечивается возможность снижения (на порядок) затрат при одновременном упрощении технологичности.
Так, при определении сапробности традиционным способом необходимо провести отбор проб, провести фиксацию организмов с использованием химических реагентов, идентифицировать организмы с использованием микроскопа, рассчитать биомассу и численность, сопоставить результаты с оценкой экологического состояния водоемов, провести многократные наблюдения и сделать выводы о принадлежности гидробионтов к определенной сапробности, что приводит к длительности процесса от 1 года и более.
При определение сапробности гидробионтов заявленным способом все вычисления проводятся с использованием компьютерной программы и известных международных баз данных по первичным последовательностям ДНК/РНК и белков, при этом получение результата возможно в течение одних суток. То есть, можно сделать доказательный вывод, что при применении традиционного способа [15] затраты составляют от 1 года и более по сравнению с одними сутками по заявленному техническому решению.
В заявленном техническом решении заявителю удалось обеспечить возможность определения сапробности гидробионтов за счет использования заявленной совокупности признаков, приведенных в независимом пункте формулы изобретения. В результате этого представляется возможность ускоренного определения сапробности гидробионтов (1 день вместо 1 года (и более) по традиционному способу [15]), в результате чего с помощью применения заявленного технического решения обеспечивается возможность более точной оценки экологического состояния водоемов. Таким образом, по мнению заявителя, заявленное техническое решение соответствует критерию «изобретательский уровень», так как не является очевидным для специалиста в данной области техники.
Таким образом, принимая во внимание выполненный выше анализ исследованного уровня техники, можно сделать доказательный вывод о том, что заявленное техническое решение не имеет аналогов по совпадающим признакам, т.к. из исследованного уровня техники не выявлены технические решения, имеющие заявленную совокупность признаков, представленных в независимом пункте формулы предполагаемого изобретения, в силу чего заявителем была составлена формула без ограничительной части.
Целью заявленного технического решения является разработка нового способа определения сапробности гидробионтов для оценки экологического состояния водоемов посредством использования заявленной совокупности признаков, обеспечивающих снижение трудоёмкости работ, сокращение сроков оценки экологического состояния, повышение точности и достоверности результатов экологического мониторинга, оценки экологического состояния водоемов и выполнение природоохранных мер посредством того, что вместо определения сапробности гидробионтов путем отбора проб, идентификации видового состава организмов под микроскопом, вычисления биомассы и численности, сопоставления с условиями окружающей среды по традиционному способу [15], заявитель проводит инструментальное определение сапробности гидробионтов с использованием молекулярного филогенетического анализа.
Техническим результатом заявленного технического решения является способ определения сапробности гидробионтов для оценки экологического состояния водоемов, в котором (способе) вместо идентификации и анализа видового состава организмов заявитель проводит определение сапробности гидробионтов инструментальным способом.
Сущностью заявленного технического решения является способ определения сапробности гидробионтов для оценки экологического состояния водоемов, характеризующийся тем, что проводят отбор проб гидробионтов из расположенного в исследуемом регионе водоема, определяют видовой состав организмов в пробе, экспериментально получают очищенную ДНК указанных организмов, получают нуклеотидные последовательности генов с последующей трансляцией в аминокислотные последовательности маркерных белков, пополняют экспериментально полученными первичными последовательностями генов и белков международные базы данных с последующей выборкой первичных последовательностей ДНК/РНК и белков гидробионтов водоемов, затем на основе выборки выполняют реконструкцию молекулярного филогенетического дерева с применением бутстреп метода, проводят анализ кластеров по сапробности, при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами одной сапробности с бутстреп значением более 50% делают вывод о принадлежности гидробионтов к данной группе индикаторных организмов, присваивая им сапробность данной группы - либо ксеносапробность (x), либо ксено-олигосапробность (х-o), либо олигосапробность (o), либо олиго-бета-сапробность (o-b), либо бета-олиго-сапробность (b-o), либо бета-мезосапробность (b), либо бета-альфа-мезосапробность (b-a), либо альфа-бета-мезосапробность (a-b), либо альфа-мезосапробность (a), либо поли-альфа-сапробность (p-a), либо поли-сапробность (p), далее пополняют списки видов индикаторных организмов с указанием сапробности:
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами ксеносапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение ксеносапробности (x) данной группы:
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами ксено-олигосапробности с бутстреп значением более50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение ксено-олигосапробности (x-o) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами олигосапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение олигосапробности (o) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами олиго-бета-сапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение олиго-бета-сапробности (o-b) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами бета-олиго-сапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение бета-олиго-сапробности (b-o) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами бета-мезосапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение бета-мезосапробности (b) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами бета-альфа-мезосапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение бета-альфа-мезосапробности (b-a) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами альфа-бета-мезосапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение альфа-бета-мезосапробности (a-b) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами альфа-мезосапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение альфа-мезосапробности (a) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами поли-альфа-сапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение поли-альфа-сапробности (p-a) данной группы;
- при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами поли-сапробности с бутстреп значением более 50% делают вывод о принадлежности не индикаторных гидробионтов к данной группе индикаторных организмов, присваивая им значение поли-сапробности (p) данной группы,
далее пополняют списки индикаторных организмов с указанием сапробности.
Заявленное техническое решение иллюстрируется Фиг.1 – Фиг.4:
- на Фиг.1 приведена Таблица 1 сопоставительного анализа прототипа с заявленным техническим решением;
- на Фиг.2 приведено филогенетическое дерево по гену rbcL фитопланктонных организмов водоемов;
- на Фиг.3 приведено филогенетическое дерево по гену СО1 рыб водоемов;
- на Фиг.4 приведено филогенетическое дерево по белку СО1 зоопланктонных организмов водоемов.
Далее заявителем приведен общий алгоритм действий, обеспечивающий возможность реализации заявленного технического решения.
Действие 1. Проводят отбор проб гидробионтов из расположенного в исследуемом регионе водоема, определяют видовой состав организмов в пробе.
Действие 2. Экспериментально получают очищенную ДНК указанных организмов, получают нуклеотидные последовательности генов с последующей трансляцией в аминокислотные последовательности маркерных белков.
Действие 3. Пополняют экспериментально полученными первичными последовательностями генов и белков международные базы данных с последующей выборкой первичных последовательностей ДНК/РНК и белков гидробионтов водоемов.
Действие 4. Проводят выборку первичных последовательностей ДНК/РНК и белков гидробионтов водоемов из международных баз данных, например, GenBank и GenPept на сайте NCBI (http://www.ncbi.nlm.nih.gov). В результате получают список последовательностей ДНК/РНК и белков гидробионтов для последующего выравнивания.
Действие 5. Проводят реконструкцию филогенетического дерева, например, методом присоединения соседей (Neighbour Joining), с применением бутстреп метода с помощью компьютерной программы, например, MEGA7. Получают молекулярное филогенетическое дерево для последующего анализа по кластерам.
Действие 6. Проводят анализ кластеров молекулярного филогенетического дерева. При попадании не индикаторных гидробионтов в один кластер с индикаторными гидробионтами одной сапробности с бутстреп значением более 50%, делают вывод о принадлежности гидробионтов к данной группе индикаторных организмов и присваивают им значение сапробности данной группы (кластера), от ксеносапробности (x) до полисапробности (p). В результате пополняют список индикаторных организмов.
Далее заявителем приведены Примеры осуществления заявленного технического решения в соответствии с описанными выше Действиями 1-3.
Всего заявителем рассмотрены 4 Примера определения сапробности гидробионтов для оценки экологического состояния водоемов, а именно:
- в Примере 1 рассмотрен случай определения сапробности фитопланктонных организмов по гену rbcL.
- в Примере 2 рассмотрен случай определения сапробности других (отличных от фитопланктона) организмов - рыб по другому (отличному от rbcL гена) гену СО1.
- в Примере 3 рассмотрен случай определения сапробности других (отличных от фитопланктона и рыб) зоопланктонных организмов другого (отличных от rbcL гена и СО1 гена) белка СО1.
- в Примере 4 рассмотрен случай, показывающий возможность экспериментального получения отсутствующих в базах данных нуклеотидных последовательностей генов и аминокислотных последовательностей белков гидробионтов с целью дальнейшего пополнения международных баз данных аминокислотных последовательностей, используемых в определении сапробности гидробионтов для оценки экологического состояния водоемов.
Пример 1. Определение сапробности фитопланктонных организмов по гену rbcL.
Действие 1. Проводят выборку нуклеотидных последовательностей rbcL фитопланктонных организмов водоемов из международных баз данных, например GenBank на сайте NCBI (http://www.ncbi.nlm.nih.gov). В результате получают список нуклеотидных последовательностей rbcL фитопланктонных организмов с указанием сапробности для индикаторных видов по [15] от x-сапробных (чистых) до а-мезосапробных (грязных): Achnanthidium coarctatum (x) HQ912458, Achnanthes minutissima (o-b) KY863484, Amphora ovalis (b-o) KC954577, Amphora pediculus var. pediculus (не индикатор) HQ912403, Anomoeoneis spherophora (b-o) KJ011795, Caloneis amphisbaena (b-a) KM084980, Cocconeis pediculus (b-o) KM084977, Cocconeis placentula (o-b) HQ912456, Cocconeis placentula var. euglypta (не индикатор) KT072907, Fragilaria capucina (b-o) KC736594, Fragilaria crotonensis (o-b) KF959640, Gomphonema acuminatum (b-o) KJ011853, Gomphonema angustatum (o) KJ011835, Gomphonema clevei (x) JQ354682, Gomphonema intricatum v. intricatum (o-x) KJ011840, Gomphonema intricatum v. pumilum (o) KC736599, Gomphonema parvulum (b) JQ354693, Gomphonema truncatum (не индикатор) AM710509, Gyrosigma acuminatum (b) KM999078, Melosira varians (b-o) KM999081, Navicula cryptocephala (a) HQ912467, Navicula tripunctata (b-o) KM084935, Navicula gregaria (b) KY320297, Navicula radiosa (b-o) KM084955, Nitzschia acicularis (a) KX889095, Nitzschia palea (a) FN557017, Rhoicosphenia abbreviate (b-o) KJ011854, Synedra ulna (b) HQ912454, Ulnaria delicatissima var. angustissima (o) KT072900.
Действие 2. Проводят реконструкцию филогенетического дерева по гену rbcL фитопланктонных организмов, например, методом присоединения соседей (Neighbour Joining) с применением бутстреп метода с помощью программного обеспечения, например, MEGA 7 (http://www.megasoftware.net/). Получают молекулярное филогенетическое дерево для последующего анализа по кластерам (Фиг.2).
Действие 3. Проводят анализ кластеров филогенетического дерева по гену rbcL фитопланктонных организмов. При попадании не индикаторных видов фитопланктонных организмов в один кластер с индикаторными видами фитопланктонных организмов одной сапробности с бутстреп значением более 50% делают вывод о принадлежности вида к данной группе индикаторных организмов и присваивают ему значение сапробности данной группы (кластера). В результате пополняют список индикаторных организмов по фитопланктону.
На филогенетическом дереве Фиг.2 видно, что три кластера 1-3 содержат индикаторные и не индикаторные организмы.
Кластер 1 с высокой вероятностью (бутстреп значение равно 100%) включает организм Amphora ovalis – индикатор b-o сапробности, и не индикаторный организм Amphora pediculus. Из этого делают вывод о принадлежности не индикаторного организма Amphora pediculus к данной группе b-o сапробности, включающей индикаторный организм Amphora ovalis b-o сапробности, и присваивают ему (Amphora pediculus) значение b-o сапробности.

Кластер 2 с высокой вероятностью (бутстреп значение равно 78%) включает организм Cocconeis pediculus – индикатор b-o сапробности, и не индикаторный организм Cocconeis placentula var. euglipta. Из этого делают вывод о принадлежности не индикаторного организма Cocconeis placentula var. euglipta к данной группе b-o сапробности, включающей индикаторный организм Cocconeis pediculus b-o сапробности, и присваивают ему (Cocconeis placentula var. euglipta) значение b-o сапробности.

Кластер 3 с высокой вероятностью (бутстреп значение равно 99%) включает организм Gomphonema capitatum – индикатор b-мезосапробности, и не индикаторный организм Gomphonema truncatum. Из этого делают вывод о принадлежности не индикаторного организма Gomphonema truncatum к данной группе b-мезосапробности, включающей индикаторный организм Gomphonema capitatum b-сапробности, и присваивают ему (Gomphonema truncatum) значение b-мезосапробности.

В результате пополняют список индикаторных видов фитопланктонных организмов:
Amphora pediculus b-o, Cocconeis placentula var. euglipta b-o, Gomphonema truncatum b.
Из данных, приведенных в Примере 1, видно, что за одно исследование одним исследователем в течение 1 суток определена сапробность трех видов фитопланктона – индикаторная значимость которых была не определена до настоящего времени: Amphora pediculus – b-o (бета-олигосапробионт), Cocconeis placentula var. euglipta – b-o (бета-олигосапробионт), Gomphonema truncatum – b (бетамезосапробионт).
При сравнении с [15], в котором индикаторная значимость организмов определяется минимум в течение 1 года (и более) можно сделать доказательный вывод о том, что в результате использования заявленного технического решения по определению сапробности гидробионтов для оценки экологического состояния водоемов представляется возможным сэкономить материальные, трудовые и временные затраты не менее чем в 365 раз (3 вида-индикатора фитопланктона по [15] за 1 год против 1 суток у заявленного технического решения).
Пример 2. Определение сапробности других организмов (отличных от фитопланктонных организмов) - рыб по другому (отличному от rbcL) гену СО1.
Действие 1. Проводят выборку нуклеотидных последовательностей СО1 рыб пресноводных водоемов из открытых международных баз данных, например GenBank на сайте NCBI (http://www.ncbi.nlm.nih.gov). В результате получают список нуклеотидных последовательностей СО1 рыб с указанием сапробности для индикаторных видов по [15] от x-сапробных (чистых) до b-а-мезосапробных (загрязненных): Abramis brama (b) KR476989, Alburnoides bipunctatus (о) KM286435, Alburnus alburnus (b) KM373683, Anguilla Anguilla (b-a) KM286458, Barbatula barbatula (b) KM373684, Barbus barbus (b) KM286499, Blicca bjoerkna (b-a) KR477008, Carassius carassius (b-a) KM286503, Carassius gibelio (не индикатор) HQ961090, Chondrostoma nasus (b-o) KM286519, Cobitis taenia (не индикатор) KM286531, Cottus gobio (о-х) KM373675, Cottus poecilopus (х) HQ961093, Cyprinus carpio (b) KM492736, Esox Lucius (b) HM563702, Gobio gobio (b-a) KM373667, Gymnocephalus cernua (b) KR477204, Leucaspius delineates (не индикатор) KP794948, Leuciscus idus (не индикатор) KX224116, Leuciscus leuciscus (b) KM286751, Lota lota (о-b) KM286761, Misgurnus fossilis (non-indicator) KM286765, Neogobius melanostomus (не индикатор) KX145236, Perca fluviatilis (b) KR477077, Percottus glenii (не индикатор) KX224184, Phoxinus phoxinus (о) KR477082, Rhodeus sericeus (b-a) HQ557338, Rutilus rutilus (b) KM287069, Salmo trutta fario (x-o) FJ907951, Sander lucioperca (о-b) KR477271, Scardinius erythrophthalmus (b) KJ554942, Silurus glanis (b) KP237865, Squalius cephalus (b) KM287150, Thymallus thymallus (о) KR477290, Tinca tinca (b-a) KR477138.
Действие 2. Проводят реконструкцию филогенетического дерева по гену СО1 рыб, например, методом присоединения соседей (Neighbour Joining), с применением бутстреп метода с помощью программного обеспечения, например, MEGA 7 (http://www.megasoftware.net/). Получают молекулярное филогенетическое дерево для последующего анализа по кластерам (Фиг.3).
Действие 3. Проводят анализ кластеров филогенетического дерева по гену СО1 рыб. При попадании не индикаторных видов рыб в один кластер с индикаторными видами рыб одной сапробности с высоким бутстреп значением, делают вывод о принадлежности вида к данной группе индикаторных организмов и присваивают ему значение сапробности данной группы (кластера). В результате пополняют список индикаторных организмов по рыбам.
На филогенетическом дереве Фиг.3 видно, что пять кластеров 1-5 содержат индикаторные и не индикаторные организмы.
Кластер 1 с высокой вероятностью (бутстреп значение равно 100%) включает организм Leuciscus leuciscus – индикатор b-мезосапробности, и не индикаторный организм Leuciscus idus. Из этого делают вывод о принадлежности не индикаторного организма Leuciscus idus к данной группе b-мезосапробности, включающей индикаторный организм Leuciscus leuciscus b-мезосапробности, и присваивают ему (Leuciscus idus) значение b- мезосапробности.
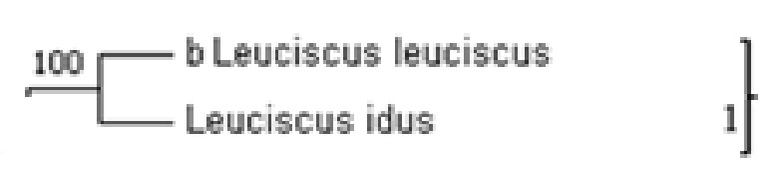
Кластер 2 с высокой вероятностью (бутстреп значение равно 81%) включает организмы Scardinius erythrophthalmus, Albumus albumus – индикаторы b-мезосапробности, и не индикаторный организм Leucaspius delineatus. Из этого делают вывод о принадлежности не индикаторного организма Leucaspius delineatus к данной группе b-мезосапробности, включающей индикаторные организмы Scardinius erythrophthalmus, Albumus albumus b-сапробности, и присваивают ему (Leucaspius delineatus) значение b- мезосапробности.

Кластер 3 с высокой вероятностью (бутстреп значение равно 100%) включает организм Carassius carassius – индикатор b-a-мезосапробности, и не индикаторный организм Carassius gibelio. Из этого делают вывод о принадлежности не индикаторного организма Carassius gibelio к данной группе b-a-мезосапробности, включающей индикаторный организм Carassius carassius b-a-мезосапробности, и присваивают ему (Carassius gibelio) значение b-a-мезосапробности.

Кластер 4 с высокой вероятностью (бутстреп значение равно 63% и 95%) включает организм Barbatula barbatula – индикатор b-мезосапробности, и не индикаторные организмы Cobitis taenia и Misgumus fossilis. Из этого делают вывод о принадлежности не индикаторных организмов Cobitis taenia и Misgumus fossilis к данной группе b-мезосапробности, включающей индикаторный организм Barbatula barbatula b-мезосапробности, и присваивают им (Cobitis taenia и Misgumus fossilis) значение b-мезосапробности.

Кластер 5 с высокой вероятностью (бутстреп значение равно 60%) включает организм Esox Lucius – индикатор b-мезосапробности, и не индикаторный организм Neogobius melanostomus. Из этого делают вывод о принадлежности не индикаторного организма Neogobius melanostomus к данной группе b-мезосапробности, включающей индикаторный организм Esox Lucius b-мезосапробности, и присваивают ему (Neogobius melanostomus) значение b-мезосапробности.

В результате пополняют список индикаторных видов рыб:
Leuciscus idus b, Leucaspius delineates b, Carassius gibelio b-a, Cobitis taenia b, Misgumus fossilis b, Neogobius melanostomus b.
Из данных, приведенных в Примере 2, видно, что за одно исследование одним исследователем в течение 1 суток определена сапробность шести видов рыб – индикаторная значимость которых была не определена до настоящего времени: Leuciscus idus – b (бетамезосапробионт), Leucaspius delineates – b (бетамезосапробионт), Carassius gibelio – b-a (бета-альфамезосапробионт), Cobitis taenia – b (бетамезосапробионт), Misgumus fossilis – b (бетамезосапробионт), Neogobius melanostomus – b (бетамезосапробионт).
При сравнении с [15], в котором индикаторная значимость организмов определяется минимум в течение 1 года (и более) можно сделать доказательный вывод о том, что в результате использования заявленного технического решения по определению сапробности гидробионтов для оценки экологического состояния водоемов представляется возможным сэкономить материальные, трудовые и временные затраты не менее, чем в 365 раз (6 видов-индикаторов рыб по [15] за 1 год против 1 суток у заявленного технического решения).
Пример 3. Определение сапробности других организмов (отличных от фитопланктонных организмов и рыб) - зоопланктонных организмов другого (отличного от rbcL гена и СО1 гена) белка СО1.
Действие 1. Проводят выборку аминокислотных последовательностей СО1 зоопланктонных организмов пресноводных водоемов из международных баз данных, например GenBank на сайте NCBI (http://www.ncbi.nlm.nih.gov). В результате получают список аминокислотных последовательностей СО1 зоопланктонных организмов с указанием сапробности для индикаторных видов по [11] от o-сапробных (чистых) до a-мезосапробных (загрязненных): Lecane hamata (o) ARU80111, Keratella cochlearis (o) AGO62847, Lepadella cf. ovalis MEG-2012 (o) AFQ31427, Brachionus sericus (o) AFP72876, Anuraeopsis fissa (o) ADO15509, Mytilina ventralis (o) ACD12406, Ploesoma hudsoni (o) ABC02140, Notommata allantois (o) ABC02137, Lecane elsa (o) ABC02129, Keratella hiemalis (o) AAP29621, Keratella cochlearis robusta (o) AAP29618, Lepadella patella (o-b) AFQ31429, Lecane quadridentata (o-b) AFQ31409, Lecane luna (o-b) AFQ31386, Lecane bulla (o-b) AFQ31309, Keratella valga (o-b) AFO72032, Cyrtonia tuba (o-b) AEO97414, Keratella quadrata (o-b) ADO15510, Polyarthra vulgaris (b) AHY24228, Platyias quadricornis (b) AFQ31469, Mytilina ventralis brevispina (b) AFQ31437, Lecane cornuta (b) AFQ31341, Lecane closterocerca (b) AFQ31338, Euchlanis dilatata (b) AFQ31265, (b), Brachionus diversicornis (b) AFO72004, Brachionus falcatus (b) AFQ31197, Brachionus bidentatus (b) AFQ31179, Brachionus sessilis (b) AIS72702, Epiphanes senta (a) AEO97545, Brachionus plicatilis (b) AAM47413, Brachionus calysiflorus (b-a) ADQ90206, Brachionus rubens (a) AIS72705, Brachionus rotundiformis (не индикатор) CBY44302, Brachionus caudatus (не индикатор) AQW38574, Keratella morenoi (не индикатор) AFQ31304, Keratella tropica (не индикатор) AFO72061, Keratella cochlearis tecta (не индикатор) AAP29631, Keratella cochlearis faluta (не индикатор) AAP29617.
Действие 2. Проводят реконструкцию филогенетического дерева по белку СО1 зоопланктонных организмов, например, методом присоединения соседей (Neighbour Joining) с применением бутстреп метода помощью программного обеспечения, например, MEGA 7 (http://www.megasoftware.net/). Получают молекулярное филогенетическое дерево для последующего анализа по кластерам (Фиг.4).
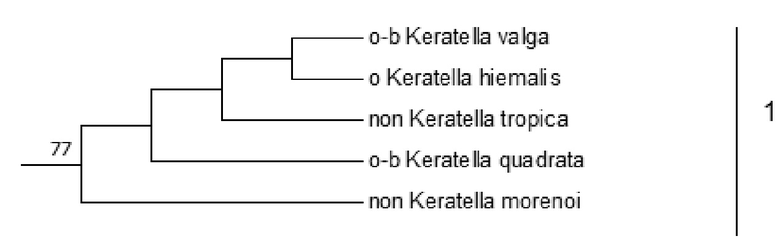
На филогенетическом дереве Фиг.4 видно, что четыре кластера 1-4 содержат индикаторные и не индикаторные организмы.
Кластер 1 с высокой вероятностью (бутстреп значение равно 77%) включает организмы Keratella valga (o-b), Keratella hiemalis (o), Keratella quadrata (o-b), Cyrtonia tuba (o-b) – большинство из которых индикаторы o-b-сапробности и не индикаторные организмы Keratella tropica, Keratella morenoi. Из этого делают вывод о принадлежности не индикаторных организмов Keratella tropica и Keratella morenoi к данной группе o-b-мезосапробности и присваивают им значение o-b- мезосапробности.
Кластер 2 с высокой вероятностью (бутстреп значение равно 99%) включает организмы Keratella cochlearis (o) и Keratella cochlearis robusta (o) - индикаторы o-сапробности и не индикаторные организмы Keratella cochlearis tecta и Keratella cochlearis faluta. Из этого делают вывод о принадлежности не индикаторных организмов Keratella cochlearis tecta и Keratella cochlearis faluta к данной группе o-сапробности и присваивают им значение o-сапробности.

Кластер 3 с высокой вероятностью (бутстреп значение равно 86%) включает организм Brachionus plicatilis (b) - индикатор b-мезосапробности и не индикаторный организм Brachionus rotundiformis. Из этого делают вывод о принадлежности не индикаторного организма Brachionus rotundiformis к данной группе b-мезосапробности и присваивают ему значение b-мезосапробности.

Кластер 4 с высокой вероятностью (бутстреп значение равно 51%) включает организмы Brachionus diversicornis (b) и Brachionus bidentatus (b) - индикаторы b-мезосапробности и не индикаторный организм Brachionus rotundiformis. Из этого делают вывод о принадлежности не индикаторного организма Brachionus caudatus к данной группе b-мезосапробности и присваивают ему значение b-мезосапробности.

В результате пополняют список индикаторных видов зоопланктонных организмов:
Keratella tropica o-b, Keratella morenoi o-b, Keratella cochlearis tecta o, Keratella cochlearis faluta o, Brachionus rotundiformis b, Brachionus caudatus b.
Из данных, приведенных в Примере 3, видно, что за одно исследование одним исследователем в течение 1 суток определена сапробность шести видов зоопланктонных организмов, индикаторная значимость которых была не определена до настоящего времени:
Brachionus rotundiformis – b (бетамезосапробионт), Brachionus caudatus – b (бетамезосапробионт), Keratella morenoi – o-b (олиго-бетасапробионт), Keratella tropica o-b (олиго-бетасапробионт), Keratella cochlearis tecta o (олигосапробионт), Keratella cochlearis faluta o (олигосапробионт).
При сравнении с [15], в котором индикаторная значимость организмов определяется минимум в течение 1 года, можно сделать доказательный вывод о том, что в результате использования заявленного технического решения по определению сапробности гидробионтов для оценки экологического состояния водоемов представляется возможным сэкономить материальные, трудовые и временные затраты не менее чем в 365 раз (6 видов-индикаторов зоопланктонных организмов по [15] за 1 год против 1 суток у заявленного технического решения).
Пример 4, показывающий возможность экспериментального получения отсутствующих в базах данных нуклеотидных последовательностей генов и аминокислотных последовательностей белков гидробионтов с целью дальнейшего пополнения международных баз данных нуклеотидных и аминокислотных последовательностей, используемых в определении сапробности гидробионтов для оценки экологического состояния водоемов.
На Примере 4 заявитель рассматривает возможность использования заявленного технического решения даже в случае, когда нуклеотидные последовательности генов и аминокислотные последовательности белков гидробионтов отсутствуют в международных базах данных, используемых в определении сапробности гидробионтов для оценки экологического состояния водоемов, путем их (нуклеотидных и аминокислотных последовательностей гидробионтов) экспериментального получения с целью дальнейшего пополнения международных баз данных, например – нуклеотидных последовательностей GenBank (http://www.ncbi.nlm.nih.gov) и аминокислотных последовательностей TrEMBL/SwissProt (http://www.uniprot.org/).
То есть в случае, рассматриваемом Примере 4, для определения сапробности гидробионтов с целью оценки экологического состояния водоемов необходимо сначала экспериментально получить нуклеотидные последовательности гена, например, СО1 гидробионтов с последующей трансляцией их в аминокислотные последовательности белка, например, СО1 организмов, используя следующие действия:
Действие 1. Отбирают пробу организмов из расположенного в исследуемом регионе водоема известным способом.
Действие 2. Определяют видовой состав организмов в пробе – например, по вариабельному митохондриальному гену цитохром с оксидаза субъединица 1 (далее по тексту – СО1), для чего выполняют следующие шаги:
- просматривают пробу организмов при увеличении, например – под микроскопом Axio Lab.A1(Carl Zeiss) и бинокуляром МБС–10, выделяют отдельный организм;
- каждый отдельный организм помещают в отдельную емкость, например – пробирку, содержащую, например – 50 микролитров 7% водного раствора ионообменной смолы Chelex и инкубируют, например – в течение 20 мин при температуре не менее плюс 90°С, например – при плюс 99°С. Получают очищенную ДНК в водном растворе.
Действие 3. Получают экспериментальную нуклеотидную последовательность гена, например, СО1 организмов, с последующей трансляцией в аминокислотную последовательность маркерного белка, например, СО1 организмов, для чего:
- выполняют центрифугирование содержимого емкости с отобранным организмом, например – в течение 5 мин при скорости 14 000 оборотов в минуту, получают ДНК-содержащий супернатант (надосадок).
Супернатант помещают в новую чистую пробирку, и дальнейшие процедуры проводят с ним (супернатантом):
- осуществляют полимеразную цепную реакцию (далее по тексту – ПЦР) с использованием супернатанта в качестве матрицы. ПЦР проводят, например – в 25 мкл реакционной смеси, содержащей 5-кратную реакционную смесь qPCRmix-HS (фирмы Евроген, Россия), бидистиллированную воду, 0,4 мМ прямого и обратного праймеров, например – 5'-ggtcaacaaatcataaagatattgg-3' и 5'-taaacttcagggtgaccaaaaaatca-3'. Амплификацию осуществляют, например, 35-кратным повторением стадий в следующей последовательности: денатурация (при плюс 95°С, 30 сек), отжиг (+59°С, 30 сек) и элонгация (полимеризация при +72°С, 120 сек), – используя известную комбинацию праймеров – 5'-ggtcaacaaatcataaagatattgg-3' и 5'-taaacttcagggtgaccaaaaaatca-3' [19]. Таким образом получают достаточное для дальнейших процедур количество определенного (конкретного) фрагмента ДНК митохондриального гена цитохром с оксидаза субъединица 1 (СО1).
Фрагмент ДНК, например – СО1, является уникальным (единственным в своем роде) фрагментом гена, свойственным каждому виду среди всех видов живых организмов, что обеспечивает высокодостоверное, с точностью 99,9%, определение конкретного организма до вида. При этом для практического использования достаточно определение организма с точностью не менее 90%, то есть определение организма по вариабельным фрагментам гена в полной мере обеспечивает потребную для промышленного применения достоверность результатов.
- продукты ПЦР детектируют и очищают, например – электрофорезом в горизонтальном 1% агарозном геле. В качестве электродного буферного раствора для электрофореза используют, например, однократный раствор 2-амино-2-гидроксиметилпропан-1,3-диола уксусной кислоты и этилендиаминтетраацетатной кислоты с рН 8,1 (далее по тексту – ТАЕ). Для нанесения проб используют буферный красящий раствор, например – состава: 10 mM Трис-HCl, pH 7,8, 50 mM ЭДTA, 0,03% бромфенолового синего, 0,03% ксилен цианолового, 15% глицерина. Пробу с красителем смешивают в соотношении 4:1 (8:2 мкл). Электрофорез проводят, например – при силе тока 50 мА, гель просматривают в ультрафиолетовом свете, например – на трансиллюминаторе Vilber Lourmat (Франция). Проявляют ДНК (полученную в результате ПЦР, пункт 1.2.1), добавляя в агарозу флуоресцирующий в ультрафиолетовом свете бромистый этидий в конечной концентрации 0,5 мкг/мл. Проявленная ДНК становится видимой в ультрафиолетовом свете, что подтверждает наличие ДНК в пробе.
- продукты ПЦР-амплификации выделяют из агарозного геля, например – с помощью набора реактивов фирмы Eurogen (Новосибирск, РФ) по методике производителя, путём добавления в 200 мкл лизирующего раствора (из набора) 200 мкг агарозного геля, содержащего определенный фрагмент ДНК, например – митохондриальный ген цитохром с оксидаза субъединица 1 (СО1). Смесь лизирующего раствора и агарозного геля инкубируют в водяной бане при температуре плюс 55°С до полного растворения геля. Полученный раствор переносят в фильтрующую колонку, вставленную в собирательную колонку (из набора Eurogen, Новосибирск, РФ), и инкубируют при комнатной температуре в течение 120 сек. После этого раствор центрифугируют 60 сек при скорости вращения 5000 об/мин и сливают содержимое собирательной колонки. После центрифугирования в фильтрующей колонке остается смесь фрагмента ДНК с посторонними веществами. Смесь (остаток) промывают буферным раствором, например – известным Wash buffer.
- для промывания смеси фильтрующую колонку вставляют обратно в собирательную колонку, затем в фильтрующую колонку добавляют 50 мкл промывочного раствора и центрифугируют, например – в течение 60 сек при 8 000 об/мин. Процедуру промывки повторяют не менее двух раз, до получения чистой ДНК. После промывания чистая ДНК остается на мембране фильтрующей колонки. Использованную собирательную колонку заменяют на чистую пробирку емкостью 1,5 мл. Фильтрующую колонку с чистой ДНК вставляют в чистую пробирку. Затем ДНК элюируют добавлением 30 мкл буферного раствора (из набора) для элюции в фильтрующую колонку и буферным раствором смывают ДНК в пробирку. После выполнения всех вышеописанных процедур в пробирке получают раствор, содержащий определенный фрагмент ДНК отдельного организма, например – митохондриальный ген цитохром с оксидаза субъединица 1 (СО1).
- далее с помощью операции секвенирования определяют нуклеотидную последовательность (порядок расположения нуклеотидов) фрагмента ДНК. Операцию проводят, например, в 20 мкл реакционной смеси, содержащей воду, ДНК, 5-кратный буферный раствор ТМS, 2,5-кратный Ready Reaction Premix и 3.3мМ праймеры. Операцию секвенирования осуществляют, например, 35-кратным повторением. Результат расшифровывают, например – с помощью автоматического генетического анализатора ABI Prism 310 Genetic Analyzer (Applied Biosystems, США) согласно инструкциям производителя [20]. Получают сиквенсные хроматограммы.
- результаты секвенирования обрабатывают, например – программным пакетом Lasergene 5.03 (DNA STAR, Inc., США) и программным пакетом SeqMan для анализа сиквенсных хроматограмм, получают нуклеотидную последовательность фрагмента ДНК отдельного организма, например – митохондриального гена цитохром с оксидаза субъединица 1 (СО1).
- проводят конвертацию (трансляцию) полученной нуклеотидной последовательности, например – гена СО1 организма, в аминокислотную последовательность белка, например – белка СО1 организма, с использованием стандартного генетического кода специализированной компьютерной программы, например – ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf).
Действие 4. Пополнение международных баз данных экспериментально-полученными первичными последовательностями генов и белков:
- вводят экспериментально полученную нуклеотидную последовательность гена и продукта гена – аминокислотную последовательность белка в международные базы данных, например - Genbank на сайте NCBI (http://www.ncbi.nlm.nih.gov/) и TrEMBL/SwissProt на сайте UniProt (http://www.uniprot.org/), для каждого гидробионта и используют для целей заявленного способа.
- далее проводят такие же действия (Действия 1-3), как в Примерах 1-3 по определению сапробности гидробионтов по гену или белку для оценки экологического состояния водоема.
Используя приведенную в Примере 4 Инструкцию производителя, возможно получать последовательности любых генов и любых белков любых гидробионтов.
На Примере 4 заявителем показана возможность использования заявленного технического решения даже в случае, когда нуклеотидные последовательности генов и аминокислотные последовательности белков гидробионтов отсутствуют в международных базах данных, используемых в определении сапробности гидробионтов для оценки экологического состояния водоемов, путем их (нуклеотидных и аминокислотных последовательностей) экспериментального получения с целью дальнейшего пополнения международных баз данных.
Из описанных в Примерах 1-4 результатов можно сделать следующие общие выводы.
Заявителем, по сравнению с прототипом и [15], достигнуты поставленные цели и заявленные технические результаты:
- разработан новый способ определения сапробности гидробионтов для оценки экологического состояния водоемов с использованием молекулярного филогенетического анализа, в котором (способе) вместо определения сапробности гидробионтов путем отбора проб, идентификации и анализа видового состава организмов, вычисления биомассы и численности и сопоставлениями с условиями окружающей среды заявитель инструментально проводит определение сапробности гидробионтов с использованием молекулярного филогенетического анализа. По заявленному способу определена сапробность гидробионтов, не имевших статус индикаторных до настоящего времени, в дополнение к существующему списку индикаторных видов для оценки экологического состояния водоемов (см. Примеры 1–4);
- снижена трудоёмкость работ, сокращены сроки определения сапробности гидробионтов для оценки экологического состояния водоемов – см. выводы в Примерах 1, 2, 3, повышена точность и достоверность результатов экологического мониторинга по сравнению с изобретениями, известными из уровня техники на дату подачи заявки. По результатам, изложенным в Примерах, можно сделать доказательный вывод о том, что в результате использования заявленного технического решения для определения сапробности гидробионтов для оценки экологического состояния водоемов представляется возможным сэкономить материальные, трудовые и временные затраты при использовании по назначению - в зависимости от определения количества сапробионтов – чем больше определено видов индикаторных организмов, тем больше эффект от снижения затрат. Так, затраты на определение сапробности гидробионтов по заявленному техническому решению ниже, чем затраты по [15], в 365 (и более) раз.
Исходя из сказанного, по мнению заявителя, способ определения сапробности гидробионтов для оценки экологического состояния водоемов с использованием молекулярного филогенетического анализа – универсален, не зависит от географического местонахождения объекта, обладает надежностью на уровне высших достижений молекулярной генетики и биоинформатики, а результаты применения способа – более достоверны по сравнению с изобретениями, известными из уровня техники на дату подачи заявки. Кроме того, идентификация гидробионтов по первичным последовательностям генов и белков имеет меньше ошибок по сравнению с идентификацией гидробионтов по морфологическим признакам. Определение сапробности гидробионтов на основе молекулярных деревьев занимает меньше времени, затрачивает меньше ресурсов, а следовательно и стоимость.
В заявленном техническом решении заявителю удалось повысить результативность при одновременном снижении количества действий и вытекающих из этого затрат. Это подтверждает изобретательский уровень заявленного технического решения, так как не является очевидным для специалиста в данной области техники.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, т.к. так как при определении уровня техники не обнаружено средство, которому присущи признаки, идентичные (то есть совпадающие по исполняемой ими функции и форме выполнения этих признаков) всем признакам, представленным в независимом пункте формулы изобретения, включая характеристику назначения, при достижении более высоких, по сравнению с прототипом, технических результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, поскольку не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками данного изобретения, и не установлена известность влияния отличительных признаков на указанный технический результат. При этом повышается доступность заявленного технического решения, так как его применение по назначению обеспечивает возможность снижения затрат при одновременном снижении технологичности.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, т.к. может быть реализовано в промышленных масштабах для природоохранной, сельскохозяйственной, рекреационной деятельности (организации отдыха), деятельности организаций здравоохранения, причем - посредством использования известных стандартных технических устройств и оборудования.
Использованные источники
1. https://ru.wikipedia.org/wiki/Биоиндикация.
2. https://ru.wikipedia.org/wiki/Сапробность.
3. Межгосударственный стандарт ГОСТ 17.1.2.04-77"Охрана природы. Гидросфера. Показатели состояния и правила таксации рыбохозяйственных водных объектов"(введен в действие постановлением Госстандарта СССР от 27 июня 1977 г. N 1609).
4. https://ru.wikipedia.org/wiki/Биота.
5. http://www.33cats.ru/guide/item/210-hydrobionty.html Гидробионты.
6. https://ru.wikipedia.org/wiki/ Организм.
7. http://wikiredia.ru/wiki/Рыбы
8. http://wikiredia.ru/wiki/Зоопланктон.
9. http://wikiredia.ru/wiki/Фитопланктон.
10. https://ru.wikipedia.org/wiki /рибулозобисфосфаткарбоксилаза.
11. https://ru.wikipedia.org/wiki/Цитохром с-оксидаза
12. https://dic.academic.ru/dic.nsf/ruwiki/403152 (Молекулярная филогения)
13. https://dic.academic.ru/dic.nsf/ruwiki/204730 (Филогенетическое дерево)
14.https://studbooks.net/842069/ekologiya/metody_otsenki_ekologicheskogo_sostoyaniya_okruzhayuschey_sredy Методы оценки экологического состояния окружающей среды.
15. Sladechek V. System of water quality from the biological point of view. Arch. Hydrobiol. Ergeb. Limnol, 1973. – Р.179-191.
16. Патент на изобретение RU 2123533.
17. Хусаинов А.М., Фролова Л.Л., Свердруп А.Э. Выявление корреляции между сапробностью и митохондриальным белком COI индикаторных видов коловраток на основе молекулярной филогении //Вест. технологического университета. - 2018.- Т.21, №2. - C. 228-233
18. Логинова Е.В., Лопух П.С. Гидроэкология: курс лекций, Минск: БГУ, 2011.-300с.
19. Folmer O. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates / O.Folmer, M.Black, W.Hoeh, R.Lutz, R.Vrijenhoek // Mol. Mar. Biol. Biotechnol. – 1994. – V.3. – P.294–299.
20. Watts D. Automated fluorescent DNA sequencing on the ABI PRISM 310 Genetic Analyzer / D. Watts, J.R. MacBeath // Methods Mol Biol. 2001. – Р. 167, 153–170.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ БИОИНДИКАЦИИ ВОДОЕМОВ | 2009 |
|
RU2420734C1 |
| Способ использования маркерных белков сапробных групп индикаторных организмов для оценки экологического состояния окружающей среды | 2018 |
|
RU2702852C1 |
| Способ применения маркерных белков для оценки экологического состояния окружающей среды | 2017 |
|
RU2661739C1 |
| СПОСОБ ОЦЕНКИ ЭКОЛОГИЧЕСКОГО СОСТОЯНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ | 2010 |
|
RU2451084C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ САПРОБНОСТИ ВОДЫ ПРЕСНЫХ ВОДОЕМОВ | 1996 |
|
RU2123533C1 |
| АНТИДОТ | 2002 |
|
RU2243653C2 |
| СПОСОБ САНИТАРНО-ГИГИЕНИЧЕСКОЙ ОЦЕНКИ СТЕПЕНИ ЗАГРЯЗНЕНИЯ ПРИРОДНЫХ ВОДОЕМОВ | 2009 |
|
RU2387992C1 |
| СПОСОБ КОНТРОЛЯ ТЕМПЕРАТУРНОГО РЕЖИМА ТЕПЛОВЫХ СБРОСОВ ГРЭС В ВОДОЕМЫ-ОХЛАДИТЕЛИ | 1996 |
|
RU2119163C1 |
| СПОСОБ ПРИВЕДЕНИЯ ЭКОЛОГИЧЕСКОЙ СИСТЕМЫ ОТКРЫТЫХ ВОДОЕМОВ К ЭКОЛОГИЧЕСКОМУ БАЛАНСУ | 2015 |
|
RU2611496C1 |
| Метод оценки негативного воздействия на состояние морской среды с применением системы стационарных биостанций в рамках производственного экологического мониторинга | 2019 |
|
RU2725752C1 |



Изобретение относится к области биотехнологии. Предложен способ определения сапробности гидробионтов для оценки экологического состояния водоемов, характеризующийся тем, что отбирают пробы гидробионтов из водоема, определяют видовой состав организмов в пробе, получают очищенную ДНК этих организмов, получают последовательности генов с последующей трансляцией в последовательности маркерных белков, пополняют полученными первичными последовательностями генов и белков международные базы данных с последующей выборкой первичных последовательностей ДНК/РНК и белков гидробионтов водоемов. На основе выборки выполняют реконструкцию молекулярного филогенетического дерева, применяя бутстреп метод. Проводят анализ кластеров по сапробности. При группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами одной сапробности с бутстреп значением более 50% делают вывод о принадлежности гидробионтов к данной группе индикаторных организмов, присваивая им сапробность данной группы, пополняют списки видов индикаторных организмов с указанием сапробности. Изобретение обеспечивает сокращение сроков, повышение точности и достоверности оценки экологического состояния водоема. 4 ил., 1 табл., 4 пр.
Способ определения сапробности гидробионтов для оценки экологического состояния водоемов, характеризующийся тем, что проводят отбор проб гидробионтов из расположенного в исследуемом регионе водоема, определяют видовой состав организмов в пробе, экспериментально получают очищенную ДНК указанных организмов, получают нуклеотидные последовательности генов с последующей трансляцией в аминокислотные последовательности маркерных белков, пополняют экспериментально полученными первичными последовательностями генов и белков международные базы данных с последующей выборкой первичных последовательностей ДНК/РНК и белков гидробионтов водоемов, затем на основе выборки выполняют реконструкцию молекулярного филогенетического дерева с применением бутстреп метода, проводят анализ кластеров по сапробности, при группировке в один кластер не индикаторных гидробионтов с индикаторными гидробионтами одной сапробности с бутстреп значением более 50% делают вывод о принадлежности гидробионтов к данной группе индикаторных организмов, присваивая им сапробность данной группы - либо ксеносапробность (x), либо ксено-олигосапробность (х-o), либо олигосапробность (o), либо олиго-бета-сапробность (o-b), либо бета-олиго-сапробность (b-o), либо бета-мезосапробность (b), либо бета-альфа-мезосапробность (b-a), либо альфа-бета-мезосапробность (a-b), либо альфа-мезосапробность (a), либо поли-альфа-сапробность (p-a), либо поли-сапробность (p), далее пополняют списки видов индикаторных организмов с указанием сапробности.
| ХУСАИНОВ А.М | |||
| и др., Выявление корреляции между сапробностью и митохондриальным белком COI индикаторных видов коловраток на основе молекулярной филогении, Вестник технологического университета, 2018, Т.21, N2, с.228-233 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ САПРОБНОСТИ ВОДЫ ПРЕСНЫХ ВОДОЕМОВ | 1996 |
|
RU2123533C1 |
| SLADECEK V., Rotifers as indicators of water quality, Hydrobiologia, 1983, vol.100(1), pp.169-201 | |||
| FROLOVA L.L | |||
| et al., The correlation between saprobity and mitochondrial genes of indicator fish species based on molecular phylogeny, International Journal of Green Pharmacy, 2017 (Suppl), vol.11(4), S856- S862 | |||
| СПОСОБ ОЦЕНКИ ЭКОЛОГИЧЕСКОГО СОСТОЯНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ | 2010 |
|
RU2451084C2 |
| СПОСОБ БИОИНДИКАЦИИ ВОДОЕМОВ | 2009 |
|
RU2420734C1 |
Авторы
Даты
2019-08-28—Публикация
2018-11-16—Подача